多糖類の製造方法
【課題】大きな規模で培養を行った場合にも一定の品質の高分子ヒアルロン酸を得ることができる方法を提供すること。
【解決手段】撹拌翼を備えた培養槽中で乳酸菌を培養することにより多糖類を製造する方法において、撹拌翼の先端とpH電極が最接近したときの、撹拌翼の先端からpH電極までの距離が0.1cm〜20cmとなるようにpH電極を設置して培養液のpHを測定し、測定したpHの値に応じて培養中の培養液のpHを調整することを特徴とする方法。
【解決手段】撹拌翼を備えた培養槽中で乳酸菌を培養することにより多糖類を製造する方法において、撹拌翼の先端とpH電極が最接近したときの、撹拌翼の先端からpH電極までの距離が0.1cm〜20cmとなるようにpH電極を設置して培養液のpHを測定し、測定したpHの値に応じて培養中の培養液のpHを調整することを特徴とする方法。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、多糖類の製造方法に関する。
【背景技術】
【0002】
乳酸菌は菌の体外に多糖類を生産することが知られており、菌の種類によって多種多様な多糖類を生産する。このような多糖類は、様々な物理化学的性質や生理機能を有していることから、食品、化粧品、医療等幅広い用途で用いられており、生産性を上げるための研究が盛んになされている。なかでも、ヒアルロン酸は、医療用途(例えば、関節炎治療薬)、化粧品用途(例えば、保湿剤等)、食品用途等、幅広く使用され、使用目的によって様々な平均分子量のものが求められている。
【0003】
ヒアルロン酸は、一定の品質の製品が得られ易いことから、多くの場合、培養法によって製造されている。培養法によってヒアルロン酸を製造する場合には、薬剤等を用いて、使用する微生物が本来有するヒアルロン酸分解酵素(ヒアルロニダーゼ)を発現しないようにした変異株を培養することにより、平均分子量の大きいヒアルロン酸を取得している(特許文献1〜3参照)。
【0004】
さらに、分子量低下を抑制して高分子量の製品を得る方法として、培養液から速やかに菌体を除去する方法、例えば、培養液を希釈して濾過により菌体を除去する方法(特許文献4参照)、培養液を10℃以下に冷却し、遠心分離により菌体を除去する方法(特許文献5参照)が知られている。
【0005】
しかしながら、培養規模の小さい(小さな容器を用いて培養を行う)場合は、容易に一定の品質の高分子ヒアルロン酸を得ることができるが、培養規模が大きい(大きな容器を用いて培養を行う)場合は、培養液の粘度の増加により一定の品質の高分子ヒアルロン酸を得ることは非常に困難であった。
【先行技術文献】
【特許文献】
【0006】
【特許文献1】特公平04−6356号公報
【特許文献2】特公平04−43637号公報
【特許文献3】特許第2547965号広報
【特許文献4】特開平01−67196号広報
【特許文献5】特許第2571908号広報
【発明の概要】
【発明が解決しようとする課題】
【0007】
本発明の主な目的は、大きな規模で培養を行った場合にも一定品質の高分子量の多糖類を得ることができる方法を提供することにある。
【課題を解決するための手段】
【0008】
本発明者らは、上記の課題を解決するために鋭意研究を重ねた結果、培養中に培養液の特定の場所におけるpHを測定して培養液のpHを制御(コントロール)することにより上記課題を達成することを見出し、本発明を完成させるに至った。
【0009】
すなわち、本発明は、撹拌翼を備えた培養槽中で乳酸菌を培養することにより多糖類を製造する方法において、撹拌翼の先端とpH電極が最接近したときの、撹拌翼の先端からの距離が0.1cm〜20cmの位置でpHを測定することにより、培養中のpHを調整することを特徴とする方法に係る。
【発明の効果】
【0010】
本発明によれば、培養規模が大きい場合でも、効率良く高分子量の多糖類を得ることができる。
【図面の簡単な説明】
【0011】
【図1】実施例1における培養中の培地のpHの経時変化を示す図である。
【図2】比較例1における培養中の培地のpHの経時変化を示す図である。
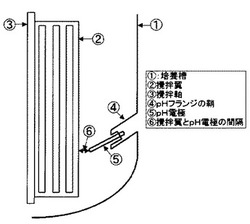
【図3】培養槽(培養装置)の一部を示す模式図である。
【発明を実施するための形態】
【0012】
本発明では、撹拌翼を備えた培養槽中で乳酸菌を培養することにより多糖類を製造する際に、培養液のpHを調整するためのpHを測定する場所が重要である。
【0013】
(1)培養槽
本発明で使用する培養槽の大きさは、多糖類が大規模で製造できれば限定されないが、例えば0.1m3(100L)〜100m3の大きさの培養槽を使用する場合に適している。培養槽の大きさは、好ましくは0.2〜80m3、より好ましくは0.5〜50m3である。
【0014】
培養槽の形状も限定されない。例えば、球状、カプセル状、円柱・円筒状の培養槽を挙げることができる。また、必要に応じて、バッフル、攪拌翼、スパージャーが取り付けてあり、さらに、温度調節のために、ジャケット、又は、内部コイルを取り付けたものが好ましいが、高分子量の多糖類が得られれば特に限定されない。
【0015】
培養槽の材質も、微生物が安定して培養でき、高粘度の多糖類が十分に得られれば限定されない。例えば、ステンレス製のものが好ましく、さらに槽内壁をSUS316、ガラス、テフロン(登録商標)、チタン等でコーティングしたものがより好ましい。
【0016】
(2)撹拌翼
当該培養槽は撹拌翼が備えられており、乳酸菌を培養する際に撹拌翼で培地を撹拌する。
【0017】
撹拌翼の形状としては、例えば、門型翼、マックスブレンド翼、スーパーミックス翼等を使用することができが、培養液中の多糖類の濃度が高くなって培養液の粘度が上昇しても、培養液が十分に撹拌されれば、特には限定されない。翼の数も粘度の高い培養液が十分に撹拌できれば限定されず、当業者が適宜選択することができる。
【0018】
撹拌翼の材質も、微生物が安定して培養でき、高粘度の多糖類が十分に得られれば限定されない。例えば、ステンレス製が好ましく、さらにガラス、テフロン(登録商標)、チタンでコーティングしたものや、SUS316のステンレス製がより好ましい。
【0019】
撹拌翼の大きさとしては、撹拌翼径(L)の培養槽の内径(D)に対する比(L/D)が0.3〜0.8であることが好ましく、より好ましくは0.35〜0.7、更に好ましくは0.45〜0.6の大きさである。L/Dを0.3以上とすることにより、多糖類の濃度が高くなって培養液が高い粘性を有するようになっても培養液全体を十分に撹拌することができる。L/Dを0.8以下とすることにより、撹拌軸への負担を軽減することができ、且つ、使用するモーター出力も軽減できる。
【0020】
「培養槽の内径」とは、培養槽内部の攪拌軸と垂直方向の最も長い直径をいう。例えば、上下の鏡部分(醗酵槽の上下部分の丸い部分)に挟まれた円筒部分から成る培養槽を使用する場合、当該円筒部分の槽内の直径をいう。「撹拌翼径」とは、撹拌軸の中心から撹拌翼の先端までの最も長い距離を2倍した径をいう。「撹拌翼の先端」とは、撹拌軸から垂直に測定した場合に最も遠い部分をいう。
【0021】
(3)pHの測定
本発明では、培養中の培養液のpHをpHメーターを用いて制御する。すなわち、pHメーターが培養液のpHの上昇を感知した場合は酸を添加してpHを下げ、逆に、pHの下降を感知した場合にはアルカリを添加してpHを上げるようにすればよい。当該pHの制御は手動で行っても良いが、自動制御が好ましい。制御装置の種類についは限定されず、市販のものを使用することも可能である。
【0022】
pHメーターの種類や大きさについては限定されず、市販のものを使用することができる。例えば、pH電極のような培養液に接触する部分(培養液に接触してpHを感知する部分)がオートクレーブに耐える材質でできていることが好ましい。
【0023】
ここで使用する、培養液のpHを調整するための酸及びアルカリの種類は、微生物の生育に影響を及ぼさず、また得られる多糖類の製品に悪影響を及ぼさなければ限定されない。酸としては、塩酸、硫酸、硝酸、燐酸、酢酸、クエン酸等を挙げることができる。これらの中でも、安価で、且つ、金属の腐食に影響しない硫酸が好ましい。アルカリとしては、水酸化ナトリウム、水酸化カリウム、アンモニア等を挙げることができる。これらの中でも、安価であることから、水酸化ナトリウムが好ましい。例えば、乳酸菌が産生する乳酸、且つ、多糖類が酸性の物質である場合は、培養を通してpHが低下し続けるので、pH制御はpHの下降を防止するために水酸化ナトリウムのみを用いることが可能である。
【0024】
pH電極は、撹拌翼の先端とpH電極が最接近したときの、撹拌翼の先端からの距離(攪拌翼先端とpH電極の間隔)が0.1cm〜20cmとなる位置にセットする。好ましくは0.2〜19cm、更に好ましくは0.5〜18cmの位置である(例えば、図3参照)。この間隔は(当該位置でpHを測定して培養液のpHを調整することにより)、粘性の高くなった培養液においてもpHのハンティング(pHの値が上下に大きく振れること)を防ぐことができるので、高分子量の多糖類を効率良く製造することができる。
【0025】
培養液のpHは、使用する微生物によって至適pHが異なるので、使用する微生物の種類等に応じて適宜選択することができる。例えば、Streptococcus属に属する微生物を使用する場合は、6.5〜8.5のpHが好ましく、より好ましくは7〜8.4、更に好ましくは7.2〜8.2の範囲である。当該範囲で微生物を培養することにより、高分子量の多糖類を効率よく得ることができる。
【0026】
(4)乳酸菌及び乳酸菌由来の多糖類
本発明における乳酸菌とは、通常の培養により菌体外に多糖類を生産することができる乳酸菌のことである。当該乳酸菌は多糖生産能を有していれば種類は限定されない。例えば、Lactobacillus属に属する微生物、Lactococcus属に属する微生物、Leuconostoc属に属する微生物、Pediococcus属に属する微生物及びStreptococcus属に属する微生物等を挙げることができる。
【0027】
乳酸菌の生産する乳酸菌由来の多糖類には、単一の糖からなるホモ多糖と、複数の単糖や単糖誘導体からなるヘテロ多糖がある。ホモ多糖には、グルコースからなるデキストリン、βグルカン、ムタン、アルテルナンとフルクトースからなるレバン、イヌリンとガラクトースからなるガラクタン等が知られている。
【0028】
デキストランを生産する乳酸菌としてLactobacillus hilgardii、Lactobacillus confusus、Lactobacillus viridescens、Leuconostoc mesenteriodes等、βグルカン生産乳酸菌としてPediococcus damnosus等、ムタン生産乳酸菌としてStreptococcus mutan、Streptococcus sobrius等、アルテルナン生産菌としてLeuconostoc mesenteriodes等、レバン生産乳酸菌としてStreptococcus mutan、Streptococcus salivarius等、イヌリン生産乳酸菌としてStreptococcus mutan等、ガラクタン生産乳酸菌としてLactococcus lactis等が挙げられる。
【0029】
ヘテロ多糖は、単糖のグルコース、ガラクトース、ラムノース、フコース、糖誘導体であるN−アセチルグルコサミン、N−アセチルガラクトサミン、グルクロン酸などが少なくとも2種類以上で構成されるユニットが連なったものである。
【0030】
代表的なヘテロ多糖はN−アセチルグルコサミンとグルクロン酸からなるヒアルロン酸、グルコースとガラクトースからなるケフィランが挙げられる。ヒアルロン酸生産乳酸菌としてStreptococcus equi、Streptococcus zooepidemicus、Streptococcus pyogenes、Streptococcus uberis、Streptococcus thermophilus等、ケフィラン生産乳酸菌としてLactobacillus kefiranofaciens等が挙げられる。
【0031】
ヘテロ多糖生産菌としてはLactobacillus paracasei、Lactobacillus rhamnosus、Lactobacillus delbrue subsp.bulgaricus、Lactobacillus sakei、Lactobacillus acidophilus、Lactobacillus helveticus、Lactobacillus kefiranofaciens、Lactococcus la ctis subsp.cremoris、Streptococcus thermophilus、Streptococcus macedonicus、Streptococcu equi、Streptococcus zooepidemicus、Streptococcus pyogenes、Streptococcus uberis等が挙げられる。
【0032】
本明細書では、これらの多糖類のうち、代表してヒアルロン酸について述べる。
【0033】
(5)ヒアルロン酸生産能を有する微生物
本発明では、ヒアルロン酸生産能を有する微生物としては、Streptococcus属に属する微生物が好ましい。ヒアルロン酸生産能を有するStreptococcus属に属する微生物は、一般に牛鼻腔粘膜、牛眼球に存在していることが知られている。本発明ではそこから単離された微生物を利用することも出来る。また、Streptococcus属に属しない微生物でも、通常の遺伝子工学的手法を用いてヒアルロン酸生産能を得た微生物も使用することが出来る。
【0034】
Streptococcus属に属する微生物としては、例えば、Streptococcus zooepidemicus、Streptococcus equi、Streptococcus pyogens等が挙げられる。その中でも、Streptococcus zooepidemicusがより好ましい。
【0035】
さらに、Streptococcus属の属する微生物等のヒアルロン酸生産能を有する微生物を、紫外線、NTG(Nーメチル-N´-ニトロ-Nーニトロソグアニジン)、メチルメタンスルホン酸等で処理することにより、ヒアルロニダーゼ非生産菌や非溶血性菌に改良することがより好ましい。人体または動物に悪影響を及ぼす可能性が低くなるからである。
【0036】
前記ヒアルロニダーゼ活性及び溶血性を欠損させた菌株としては、Streptococcus zooepidemicus NH−131(FERM P−7580)、Streptococcus zooepidemicus HA−116(ATCC39920)、Streptococcus zooepidemicus MK5(FERM P−21487)、Streptococcus zooepidemicus YTT2030(FERM BP−1305)が好ましく、その中でもStreptococcus zooepidemicus MK5(FERM P−21487)、Streptococcus zooepidemicus YTT2030(FERM BP−1305)が特に好ましい。
【0037】
これらのうち、FERM株については、独立行政法人産業技術総合研究所特許生物寄託センターより入手可能である。また、ATCC株については、American Type Culture Collectionから入手可能である。
【0038】
(6)微生物の培養
培地は、上記微生物がヒアルロン酸を生産できる培地であれば限定されず、微生物の種類に応じた公知の培地を用いることが出来る。例えば、炭素源としてグルコース、フルクトース等の単糖類、乳糖、スクロース、マルトース等の二糖類、オリゴ糖類等;窒素源としてポリペプトン、酵母エキス等の有機窒素源;アルギニン、グルタミン酸、グルタミン等の遊離アミノ酸;ビタミン;無機塩類等;タンニン等のフェノール性水酸基を有するヒアルロニダーゼ阻害剤を含む(水に溶解した)培地を使用することが出来る。
【0039】
当該培地は、加熱処理(加熱殺菌)を行った後に、微生物の培養に用いることが出来る。微生物が完全に殺菌されれば、加熱条件は限定されない。例えば、100〜130℃で5〜30分間、より好ましくは121℃〜125℃で15〜30分間という条件を挙げることが出来る。または、一部若しくは全部の成分を精密濾過による非加熱滅菌することにより使用することができる。
【0040】
培養条件も限定されるものではないが、培養液の温度を25〜42℃程度、好ましくは30〜40℃程度、より好ましくは32〜38℃程度に制御すればよい。また、必要に応じて、好気的に培養することも可能である。培養時間も限定されず、培養液の量、所望のヒアルロン酸の量に応じて適宜選択することができる。
【0041】
(7)その他
このようにして得られたヒアルロン酸は、公知の方法により精製等を行うことができる。例えば、培地を必要に応じて(好ましくは、ヒアルロン酸濃度が0.1〜5g/Lになるように)希釈した後、例えば遠心分離、濾過、カーボン、セライト、パーライト等を用いて菌体を除去し、さらに、菌体を除去した培地を活性炭と接触させればよい。
【0042】
得られたヒアルロン酸の平均分子量は、公知の方法により求めることができる。例えば、極限粘度測定法、分子量既知のプルランを用いたGPC液クロ(示差屈折計)による相対分子量測定法、GPC液クロ(示差屈折計)と光散乱検出器の組み合わせによる絶対分子量測定法等を使用することができる。
【実施例】
【0043】
以下、実施例、比較例により本発明をさらに詳細に説明する。
【0044】
<実施例1>
工程1.ストレプトコッカス・ズーエピデミカス(FERM P−21487)の培養
グルコース6(w/v)%、ポリペプトン−N(大日本製薬株式会社製)1.5(w/v)%、酵母エキス(オリエンタル酵母工業製)0.5%、硫酸マグネシウム7水塩0.01(w/v)%、リン酸水素2ナトリウム0.05(w/v)%、グルタミン酸ナトリウム0.05(w/v)%、アデカプルロニックL−61(旭電化工業製)0.01(w/v)%の組成の培地を1000Lのジャーファーメンター(培養槽)(株式会社丸菱製)に500L入れ、ジャケットにスチームを供給して121℃、20分間滅菌した。尚、グルコースは121℃、20分間別滅菌して、培養開始時に一度に添加した。
【0045】
前培養した該菌を1(v/v)%接種し、27(w/v)%水酸化ナトリウムにてpHを7.4に連続的に制御しながら温度37℃、攪拌数50rpm、通気量1vvmで24時間通気攪拌培養した。攪拌翼は、直径450mmの門型攪拌翼(株式会社高杉製作所製)(醗酵槽内径との比L/D=0.5)を使用した。攪拌翼先端とpH電極(メトラートレド社製 405−DPAS−SC−K8S−225:電極の長さ225mm)の間隔は120mmであった。培養中のpH経時変化を図−1に示した。
【0046】
工程2.培養液の処理
前記工程1で培養した培養液(ヒアルロン酸含有液)を、イオン交換水を用いて10倍に希釈し、その2.5L水溶液のpHを4に調整後、活性炭(武田薬品社製の白鷺RW50−T)を5g、パーライト(三井金属鉱業株式会社のロカヘルプ♯409)を30g添加して、1時間処理し、ヌッチェを用いて濾過した。
【0047】
工程3.ヒアルロン酸ナトリウム結晶の取得
前記工程2で調整したヒアルロン酸含有液1Lに、食塩3gを溶解、pH7に調整後、2−プロパノール6Lで析出を行い、40℃で真空乾燥し、ヒアルロン酸ナトリウム結晶を得た。
【0048】
ヒアルロン酸平均分子量の測定
ヒアルロン酸ナトリウム結晶約4mgを純水5mLに溶解し、分析用サンプルとしてGPCカラムを用いた液体クロマトグラフィ−(島津製作所社製)により相対平均分子量を算出した。
(i)使用機器
島津高速液体クロマトグラフProminenceGPCシステム
システムコントローラ:CBM−20A
液送ユニット:LC−20AD
オンラインデガッサ:DGU−20A3
オートサンプラ:SIL−20AC
カラムオーブン:CTO−20A
示差屈折率検出器:RID−10A
LCワークステーション:LCsolution Ver.1.24SP1+
(ii)分析条件
カラム:Shodex Ohpak SB−806M HQ
ガードカラム:Shodex Ohpak SP−G
溶離液:50mmol/L硫酸ナトリウム水溶液
流量:1.00ml/min
カラム温度:40.0℃
(iii)検量線作成用多糖類
平均分子量5900、9600、21100、47100、107000、200000、 375000、708000、のプルラン(Shodex STANDARD P−82 Lot No81001)を用いて検量線を作成した。
結果を表−1に示した。
【0049】
<実施例2>
直径450mmのマックスブレンド攪拌翼(株式会社高杉製作所製)(醗酵槽内径との比L/D=0.5)を使用した以外は、実施例1と同様の操作を実施した。攪拌翼先端とpH電極(メトラートレド社製 405−DPAS−SC−K8S−225:電極の長さ225mm)の間隔は120mmであった。結果を表−1に示した。
【0050】
<実施例3>
直径450mmのスーパーミックスMR203翼(佐竹化学機械工業株式会社製)(醗酵槽内径との比L/D=0.5)を使用した以外は、実施例1と同様の操作を実施した。攪拌翼先端とpH電極(メトラートレド社製 405−DPAS−SC−K8S−225:電極の長さ225mm)の間隔は120mmであった。結果を表−1に示した。
【0051】
<実施例4>
15000Lジャーファーメンター(培養槽)(小松川加工機株式会社製)に、直径1400mmの門型攪拌翼(株式会社高杉製作所製)(醗酵槽内径との比L/D=0.58)を取り付け、pH電極を、図−1に示したような鞘付きフランジ(深さ200mm)に取り付けた以外は、実施例1と同様の操作を実施した。攪拌翼先端とpH電極(メトラートレド社製 405−DPAS−SC−K8S−325:電極の長さ425mm)の間隔は150mmであった。結果を表−1に示した。
【0052】
<比較例1>
pH電極を、メトラートレド社製の405−DPAS−SC−K8S−120(電極の長さ120mm)を使用した以外は、実施例1と同様の操作を実施した。攪拌翼先端とpH電極の間隔は220mmであった。培養中のpH経時変化を図−1に示した。結果を表−1に示した。
【0053】
<比較例2>
pH電極を、メトラートレド社製の405−DPAS−SC−K8S−120(電極の長さ120mm)を使用した以外は、実施例2と同様の操作を実施した。攪拌翼先端とpH電極の間隔は220mmであった。結果を表−1に示した。
【0054】
<比較例3>
pH電極を、メトラートレド社製の405−DPAS−SC−K8S−120(電極の長さ120mm)を使用した以外は、実施例3と同様の操作を実施した。攪拌翼先端とpH電極の間隔は220mmであった。結果を表−1に示した。
【0055】
<比較例4>
鞘付きフランジを使用しなかった以外は、実施例4と同様の操作を実施した。攪拌翼先端とpH電極の間隔は400mmであった。pHは最大11まで上昇し、ヒアルロン酸の生産は培養14時間目に停止した。結果を表−1に示した。
【0056】
【表1】

【技術分野】
【0001】
本発明は、多糖類の製造方法に関する。
【背景技術】
【0002】
乳酸菌は菌の体外に多糖類を生産することが知られており、菌の種類によって多種多様な多糖類を生産する。このような多糖類は、様々な物理化学的性質や生理機能を有していることから、食品、化粧品、医療等幅広い用途で用いられており、生産性を上げるための研究が盛んになされている。なかでも、ヒアルロン酸は、医療用途(例えば、関節炎治療薬)、化粧品用途(例えば、保湿剤等)、食品用途等、幅広く使用され、使用目的によって様々な平均分子量のものが求められている。
【0003】
ヒアルロン酸は、一定の品質の製品が得られ易いことから、多くの場合、培養法によって製造されている。培養法によってヒアルロン酸を製造する場合には、薬剤等を用いて、使用する微生物が本来有するヒアルロン酸分解酵素(ヒアルロニダーゼ)を発現しないようにした変異株を培養することにより、平均分子量の大きいヒアルロン酸を取得している(特許文献1〜3参照)。
【0004】
さらに、分子量低下を抑制して高分子量の製品を得る方法として、培養液から速やかに菌体を除去する方法、例えば、培養液を希釈して濾過により菌体を除去する方法(特許文献4参照)、培養液を10℃以下に冷却し、遠心分離により菌体を除去する方法(特許文献5参照)が知られている。
【0005】
しかしながら、培養規模の小さい(小さな容器を用いて培養を行う)場合は、容易に一定の品質の高分子ヒアルロン酸を得ることができるが、培養規模が大きい(大きな容器を用いて培養を行う)場合は、培養液の粘度の増加により一定の品質の高分子ヒアルロン酸を得ることは非常に困難であった。
【先行技術文献】
【特許文献】
【0006】
【特許文献1】特公平04−6356号公報
【特許文献2】特公平04−43637号公報
【特許文献3】特許第2547965号広報
【特許文献4】特開平01−67196号広報
【特許文献5】特許第2571908号広報
【発明の概要】
【発明が解決しようとする課題】
【0007】
本発明の主な目的は、大きな規模で培養を行った場合にも一定品質の高分子量の多糖類を得ることができる方法を提供することにある。
【課題を解決するための手段】
【0008】
本発明者らは、上記の課題を解決するために鋭意研究を重ねた結果、培養中に培養液の特定の場所におけるpHを測定して培養液のpHを制御(コントロール)することにより上記課題を達成することを見出し、本発明を完成させるに至った。
【0009】
すなわち、本発明は、撹拌翼を備えた培養槽中で乳酸菌を培養することにより多糖類を製造する方法において、撹拌翼の先端とpH電極が最接近したときの、撹拌翼の先端からの距離が0.1cm〜20cmの位置でpHを測定することにより、培養中のpHを調整することを特徴とする方法に係る。
【発明の効果】
【0010】
本発明によれば、培養規模が大きい場合でも、効率良く高分子量の多糖類を得ることができる。
【図面の簡単な説明】
【0011】
【図1】実施例1における培養中の培地のpHの経時変化を示す図である。
【図2】比較例1における培養中の培地のpHの経時変化を示す図である。
【図3】培養槽(培養装置)の一部を示す模式図である。
【発明を実施するための形態】
【0012】
本発明では、撹拌翼を備えた培養槽中で乳酸菌を培養することにより多糖類を製造する際に、培養液のpHを調整するためのpHを測定する場所が重要である。
【0013】
(1)培養槽
本発明で使用する培養槽の大きさは、多糖類が大規模で製造できれば限定されないが、例えば0.1m3(100L)〜100m3の大きさの培養槽を使用する場合に適している。培養槽の大きさは、好ましくは0.2〜80m3、より好ましくは0.5〜50m3である。
【0014】
培養槽の形状も限定されない。例えば、球状、カプセル状、円柱・円筒状の培養槽を挙げることができる。また、必要に応じて、バッフル、攪拌翼、スパージャーが取り付けてあり、さらに、温度調節のために、ジャケット、又は、内部コイルを取り付けたものが好ましいが、高分子量の多糖類が得られれば特に限定されない。
【0015】
培養槽の材質も、微生物が安定して培養でき、高粘度の多糖類が十分に得られれば限定されない。例えば、ステンレス製のものが好ましく、さらに槽内壁をSUS316、ガラス、テフロン(登録商標)、チタン等でコーティングしたものがより好ましい。
【0016】
(2)撹拌翼
当該培養槽は撹拌翼が備えられており、乳酸菌を培養する際に撹拌翼で培地を撹拌する。
【0017】
撹拌翼の形状としては、例えば、門型翼、マックスブレンド翼、スーパーミックス翼等を使用することができが、培養液中の多糖類の濃度が高くなって培養液の粘度が上昇しても、培養液が十分に撹拌されれば、特には限定されない。翼の数も粘度の高い培養液が十分に撹拌できれば限定されず、当業者が適宜選択することができる。
【0018】
撹拌翼の材質も、微生物が安定して培養でき、高粘度の多糖類が十分に得られれば限定されない。例えば、ステンレス製が好ましく、さらにガラス、テフロン(登録商標)、チタンでコーティングしたものや、SUS316のステンレス製がより好ましい。
【0019】
撹拌翼の大きさとしては、撹拌翼径(L)の培養槽の内径(D)に対する比(L/D)が0.3〜0.8であることが好ましく、より好ましくは0.35〜0.7、更に好ましくは0.45〜0.6の大きさである。L/Dを0.3以上とすることにより、多糖類の濃度が高くなって培養液が高い粘性を有するようになっても培養液全体を十分に撹拌することができる。L/Dを0.8以下とすることにより、撹拌軸への負担を軽減することができ、且つ、使用するモーター出力も軽減できる。
【0020】
「培養槽の内径」とは、培養槽内部の攪拌軸と垂直方向の最も長い直径をいう。例えば、上下の鏡部分(醗酵槽の上下部分の丸い部分)に挟まれた円筒部分から成る培養槽を使用する場合、当該円筒部分の槽内の直径をいう。「撹拌翼径」とは、撹拌軸の中心から撹拌翼の先端までの最も長い距離を2倍した径をいう。「撹拌翼の先端」とは、撹拌軸から垂直に測定した場合に最も遠い部分をいう。
【0021】
(3)pHの測定
本発明では、培養中の培養液のpHをpHメーターを用いて制御する。すなわち、pHメーターが培養液のpHの上昇を感知した場合は酸を添加してpHを下げ、逆に、pHの下降を感知した場合にはアルカリを添加してpHを上げるようにすればよい。当該pHの制御は手動で行っても良いが、自動制御が好ましい。制御装置の種類についは限定されず、市販のものを使用することも可能である。
【0022】
pHメーターの種類や大きさについては限定されず、市販のものを使用することができる。例えば、pH電極のような培養液に接触する部分(培養液に接触してpHを感知する部分)がオートクレーブに耐える材質でできていることが好ましい。
【0023】
ここで使用する、培養液のpHを調整するための酸及びアルカリの種類は、微生物の生育に影響を及ぼさず、また得られる多糖類の製品に悪影響を及ぼさなければ限定されない。酸としては、塩酸、硫酸、硝酸、燐酸、酢酸、クエン酸等を挙げることができる。これらの中でも、安価で、且つ、金属の腐食に影響しない硫酸が好ましい。アルカリとしては、水酸化ナトリウム、水酸化カリウム、アンモニア等を挙げることができる。これらの中でも、安価であることから、水酸化ナトリウムが好ましい。例えば、乳酸菌が産生する乳酸、且つ、多糖類が酸性の物質である場合は、培養を通してpHが低下し続けるので、pH制御はpHの下降を防止するために水酸化ナトリウムのみを用いることが可能である。
【0024】
pH電極は、撹拌翼の先端とpH電極が最接近したときの、撹拌翼の先端からの距離(攪拌翼先端とpH電極の間隔)が0.1cm〜20cmとなる位置にセットする。好ましくは0.2〜19cm、更に好ましくは0.5〜18cmの位置である(例えば、図3参照)。この間隔は(当該位置でpHを測定して培養液のpHを調整することにより)、粘性の高くなった培養液においてもpHのハンティング(pHの値が上下に大きく振れること)を防ぐことができるので、高分子量の多糖類を効率良く製造することができる。
【0025】
培養液のpHは、使用する微生物によって至適pHが異なるので、使用する微生物の種類等に応じて適宜選択することができる。例えば、Streptococcus属に属する微生物を使用する場合は、6.5〜8.5のpHが好ましく、より好ましくは7〜8.4、更に好ましくは7.2〜8.2の範囲である。当該範囲で微生物を培養することにより、高分子量の多糖類を効率よく得ることができる。
【0026】
(4)乳酸菌及び乳酸菌由来の多糖類
本発明における乳酸菌とは、通常の培養により菌体外に多糖類を生産することができる乳酸菌のことである。当該乳酸菌は多糖生産能を有していれば種類は限定されない。例えば、Lactobacillus属に属する微生物、Lactococcus属に属する微生物、Leuconostoc属に属する微生物、Pediococcus属に属する微生物及びStreptococcus属に属する微生物等を挙げることができる。
【0027】
乳酸菌の生産する乳酸菌由来の多糖類には、単一の糖からなるホモ多糖と、複数の単糖や単糖誘導体からなるヘテロ多糖がある。ホモ多糖には、グルコースからなるデキストリン、βグルカン、ムタン、アルテルナンとフルクトースからなるレバン、イヌリンとガラクトースからなるガラクタン等が知られている。
【0028】
デキストランを生産する乳酸菌としてLactobacillus hilgardii、Lactobacillus confusus、Lactobacillus viridescens、Leuconostoc mesenteriodes等、βグルカン生産乳酸菌としてPediococcus damnosus等、ムタン生産乳酸菌としてStreptococcus mutan、Streptococcus sobrius等、アルテルナン生産菌としてLeuconostoc mesenteriodes等、レバン生産乳酸菌としてStreptococcus mutan、Streptococcus salivarius等、イヌリン生産乳酸菌としてStreptococcus mutan等、ガラクタン生産乳酸菌としてLactococcus lactis等が挙げられる。
【0029】
ヘテロ多糖は、単糖のグルコース、ガラクトース、ラムノース、フコース、糖誘導体であるN−アセチルグルコサミン、N−アセチルガラクトサミン、グルクロン酸などが少なくとも2種類以上で構成されるユニットが連なったものである。
【0030】
代表的なヘテロ多糖はN−アセチルグルコサミンとグルクロン酸からなるヒアルロン酸、グルコースとガラクトースからなるケフィランが挙げられる。ヒアルロン酸生産乳酸菌としてStreptococcus equi、Streptococcus zooepidemicus、Streptococcus pyogenes、Streptococcus uberis、Streptococcus thermophilus等、ケフィラン生産乳酸菌としてLactobacillus kefiranofaciens等が挙げられる。
【0031】
ヘテロ多糖生産菌としてはLactobacillus paracasei、Lactobacillus rhamnosus、Lactobacillus delbrue subsp.bulgaricus、Lactobacillus sakei、Lactobacillus acidophilus、Lactobacillus helveticus、Lactobacillus kefiranofaciens、Lactococcus la ctis subsp.cremoris、Streptococcus thermophilus、Streptococcus macedonicus、Streptococcu equi、Streptococcus zooepidemicus、Streptococcus pyogenes、Streptococcus uberis等が挙げられる。
【0032】
本明細書では、これらの多糖類のうち、代表してヒアルロン酸について述べる。
【0033】
(5)ヒアルロン酸生産能を有する微生物
本発明では、ヒアルロン酸生産能を有する微生物としては、Streptococcus属に属する微生物が好ましい。ヒアルロン酸生産能を有するStreptococcus属に属する微生物は、一般に牛鼻腔粘膜、牛眼球に存在していることが知られている。本発明ではそこから単離された微生物を利用することも出来る。また、Streptococcus属に属しない微生物でも、通常の遺伝子工学的手法を用いてヒアルロン酸生産能を得た微生物も使用することが出来る。
【0034】
Streptococcus属に属する微生物としては、例えば、Streptococcus zooepidemicus、Streptococcus equi、Streptococcus pyogens等が挙げられる。その中でも、Streptococcus zooepidemicusがより好ましい。
【0035】
さらに、Streptococcus属の属する微生物等のヒアルロン酸生産能を有する微生物を、紫外線、NTG(Nーメチル-N´-ニトロ-Nーニトロソグアニジン)、メチルメタンスルホン酸等で処理することにより、ヒアルロニダーゼ非生産菌や非溶血性菌に改良することがより好ましい。人体または動物に悪影響を及ぼす可能性が低くなるからである。
【0036】
前記ヒアルロニダーゼ活性及び溶血性を欠損させた菌株としては、Streptococcus zooepidemicus NH−131(FERM P−7580)、Streptococcus zooepidemicus HA−116(ATCC39920)、Streptococcus zooepidemicus MK5(FERM P−21487)、Streptococcus zooepidemicus YTT2030(FERM BP−1305)が好ましく、その中でもStreptococcus zooepidemicus MK5(FERM P−21487)、Streptococcus zooepidemicus YTT2030(FERM BP−1305)が特に好ましい。
【0037】
これらのうち、FERM株については、独立行政法人産業技術総合研究所特許生物寄託センターより入手可能である。また、ATCC株については、American Type Culture Collectionから入手可能である。
【0038】
(6)微生物の培養
培地は、上記微生物がヒアルロン酸を生産できる培地であれば限定されず、微生物の種類に応じた公知の培地を用いることが出来る。例えば、炭素源としてグルコース、フルクトース等の単糖類、乳糖、スクロース、マルトース等の二糖類、オリゴ糖類等;窒素源としてポリペプトン、酵母エキス等の有機窒素源;アルギニン、グルタミン酸、グルタミン等の遊離アミノ酸;ビタミン;無機塩類等;タンニン等のフェノール性水酸基を有するヒアルロニダーゼ阻害剤を含む(水に溶解した)培地を使用することが出来る。
【0039】
当該培地は、加熱処理(加熱殺菌)を行った後に、微生物の培養に用いることが出来る。微生物が完全に殺菌されれば、加熱条件は限定されない。例えば、100〜130℃で5〜30分間、より好ましくは121℃〜125℃で15〜30分間という条件を挙げることが出来る。または、一部若しくは全部の成分を精密濾過による非加熱滅菌することにより使用することができる。
【0040】
培養条件も限定されるものではないが、培養液の温度を25〜42℃程度、好ましくは30〜40℃程度、より好ましくは32〜38℃程度に制御すればよい。また、必要に応じて、好気的に培養することも可能である。培養時間も限定されず、培養液の量、所望のヒアルロン酸の量に応じて適宜選択することができる。
【0041】
(7)その他
このようにして得られたヒアルロン酸は、公知の方法により精製等を行うことができる。例えば、培地を必要に応じて(好ましくは、ヒアルロン酸濃度が0.1〜5g/Lになるように)希釈した後、例えば遠心分離、濾過、カーボン、セライト、パーライト等を用いて菌体を除去し、さらに、菌体を除去した培地を活性炭と接触させればよい。
【0042】
得られたヒアルロン酸の平均分子量は、公知の方法により求めることができる。例えば、極限粘度測定法、分子量既知のプルランを用いたGPC液クロ(示差屈折計)による相対分子量測定法、GPC液クロ(示差屈折計)と光散乱検出器の組み合わせによる絶対分子量測定法等を使用することができる。
【実施例】
【0043】
以下、実施例、比較例により本発明をさらに詳細に説明する。
【0044】
<実施例1>
工程1.ストレプトコッカス・ズーエピデミカス(FERM P−21487)の培養
グルコース6(w/v)%、ポリペプトン−N(大日本製薬株式会社製)1.5(w/v)%、酵母エキス(オリエンタル酵母工業製)0.5%、硫酸マグネシウム7水塩0.01(w/v)%、リン酸水素2ナトリウム0.05(w/v)%、グルタミン酸ナトリウム0.05(w/v)%、アデカプルロニックL−61(旭電化工業製)0.01(w/v)%の組成の培地を1000Lのジャーファーメンター(培養槽)(株式会社丸菱製)に500L入れ、ジャケットにスチームを供給して121℃、20分間滅菌した。尚、グルコースは121℃、20分間別滅菌して、培養開始時に一度に添加した。
【0045】
前培養した該菌を1(v/v)%接種し、27(w/v)%水酸化ナトリウムにてpHを7.4に連続的に制御しながら温度37℃、攪拌数50rpm、通気量1vvmで24時間通気攪拌培養した。攪拌翼は、直径450mmの門型攪拌翼(株式会社高杉製作所製)(醗酵槽内径との比L/D=0.5)を使用した。攪拌翼先端とpH電極(メトラートレド社製 405−DPAS−SC−K8S−225:電極の長さ225mm)の間隔は120mmであった。培養中のpH経時変化を図−1に示した。
【0046】
工程2.培養液の処理
前記工程1で培養した培養液(ヒアルロン酸含有液)を、イオン交換水を用いて10倍に希釈し、その2.5L水溶液のpHを4に調整後、活性炭(武田薬品社製の白鷺RW50−T)を5g、パーライト(三井金属鉱業株式会社のロカヘルプ♯409)を30g添加して、1時間処理し、ヌッチェを用いて濾過した。
【0047】
工程3.ヒアルロン酸ナトリウム結晶の取得
前記工程2で調整したヒアルロン酸含有液1Lに、食塩3gを溶解、pH7に調整後、2−プロパノール6Lで析出を行い、40℃で真空乾燥し、ヒアルロン酸ナトリウム結晶を得た。
【0048】
ヒアルロン酸平均分子量の測定
ヒアルロン酸ナトリウム結晶約4mgを純水5mLに溶解し、分析用サンプルとしてGPCカラムを用いた液体クロマトグラフィ−(島津製作所社製)により相対平均分子量を算出した。
(i)使用機器
島津高速液体クロマトグラフProminenceGPCシステム
システムコントローラ:CBM−20A
液送ユニット:LC−20AD
オンラインデガッサ:DGU−20A3
オートサンプラ:SIL−20AC
カラムオーブン:CTO−20A
示差屈折率検出器:RID−10A
LCワークステーション:LCsolution Ver.1.24SP1+
(ii)分析条件
カラム:Shodex Ohpak SB−806M HQ
ガードカラム:Shodex Ohpak SP−G
溶離液:50mmol/L硫酸ナトリウム水溶液
流量:1.00ml/min
カラム温度:40.0℃
(iii)検量線作成用多糖類
平均分子量5900、9600、21100、47100、107000、200000、 375000、708000、のプルラン(Shodex STANDARD P−82 Lot No81001)を用いて検量線を作成した。
結果を表−1に示した。
【0049】
<実施例2>
直径450mmのマックスブレンド攪拌翼(株式会社高杉製作所製)(醗酵槽内径との比L/D=0.5)を使用した以外は、実施例1と同様の操作を実施した。攪拌翼先端とpH電極(メトラートレド社製 405−DPAS−SC−K8S−225:電極の長さ225mm)の間隔は120mmであった。結果を表−1に示した。
【0050】
<実施例3>
直径450mmのスーパーミックスMR203翼(佐竹化学機械工業株式会社製)(醗酵槽内径との比L/D=0.5)を使用した以外は、実施例1と同様の操作を実施した。攪拌翼先端とpH電極(メトラートレド社製 405−DPAS−SC−K8S−225:電極の長さ225mm)の間隔は120mmであった。結果を表−1に示した。
【0051】
<実施例4>
15000Lジャーファーメンター(培養槽)(小松川加工機株式会社製)に、直径1400mmの門型攪拌翼(株式会社高杉製作所製)(醗酵槽内径との比L/D=0.58)を取り付け、pH電極を、図−1に示したような鞘付きフランジ(深さ200mm)に取り付けた以外は、実施例1と同様の操作を実施した。攪拌翼先端とpH電極(メトラートレド社製 405−DPAS−SC−K8S−325:電極の長さ425mm)の間隔は150mmであった。結果を表−1に示した。
【0052】
<比較例1>
pH電極を、メトラートレド社製の405−DPAS−SC−K8S−120(電極の長さ120mm)を使用した以外は、実施例1と同様の操作を実施した。攪拌翼先端とpH電極の間隔は220mmであった。培養中のpH経時変化を図−1に示した。結果を表−1に示した。
【0053】
<比較例2>
pH電極を、メトラートレド社製の405−DPAS−SC−K8S−120(電極の長さ120mm)を使用した以外は、実施例2と同様の操作を実施した。攪拌翼先端とpH電極の間隔は220mmであった。結果を表−1に示した。
【0054】
<比較例3>
pH電極を、メトラートレド社製の405−DPAS−SC−K8S−120(電極の長さ120mm)を使用した以外は、実施例3と同様の操作を実施した。攪拌翼先端とpH電極の間隔は220mmであった。結果を表−1に示した。
【0055】
<比較例4>
鞘付きフランジを使用しなかった以外は、実施例4と同様の操作を実施した。攪拌翼先端とpH電極の間隔は400mmであった。pHは最大11まで上昇し、ヒアルロン酸の生産は培養14時間目に停止した。結果を表−1に示した。
【0056】
【表1】

【特許請求の範囲】
【請求項1】
撹拌翼を備えた培養槽中で乳酸菌を培養することにより多糖類を製造する方法において、
撹拌翼の先端とpH電極が最接近したときの、撹拌翼の先端からpH電極までの距離が0.1cm〜20cmとなるようにpH電極を設置して培養液のpHを測定し、測定したpHの値に応じて培養中の培養液のpHを調整することを特徴とする方法。
【請求項2】
撹拌翼径(L)の培養槽の内径(D)に対する比(L/D)が0.3〜0.8である、請求項1記載の方法。
【請求項3】
培養中の培養液のpHが6.5〜8.5である、請求項1記載の方法。
【請求項4】
攪拌翼が門型翼、マックスブレンド翼又はスーパーミックス翼である請求項1又は2記載の方法。
【請求項5】
多糖類を産生する微生物が、Lactobacillus属に属する微生物、Lactococcus属に属する微生物、Leuconostoc属に属する微生物、Pediococcus属に属する微生物及びStreptococcus属に属する微生物からなる群から選ばれる少なくとも一種の乳酸菌である請求項1〜4のいずれかに記載の方法。
【請求項6】
乳酸菌が、ヒアルロン酸生産能を有する微生物である請求項5記載の方法。
【請求項7】
ヒアルロン酸生産能を有する微生物が、Streptococcus zooepidemicusである請求項6記載の方法。
【請求項8】
Streptococcus zooepidemicusが、Streptococcus zooepidemicus MK5(FERM P−21487)である請求項7記載の方法。
【請求項1】
撹拌翼を備えた培養槽中で乳酸菌を培養することにより多糖類を製造する方法において、
撹拌翼の先端とpH電極が最接近したときの、撹拌翼の先端からpH電極までの距離が0.1cm〜20cmとなるようにpH電極を設置して培養液のpHを測定し、測定したpHの値に応じて培養中の培養液のpHを調整することを特徴とする方法。
【請求項2】
撹拌翼径(L)の培養槽の内径(D)に対する比(L/D)が0.3〜0.8である、請求項1記載の方法。
【請求項3】
培養中の培養液のpHが6.5〜8.5である、請求項1記載の方法。
【請求項4】
攪拌翼が門型翼、マックスブレンド翼又はスーパーミックス翼である請求項1又は2記載の方法。
【請求項5】
多糖類を産生する微生物が、Lactobacillus属に属する微生物、Lactococcus属に属する微生物、Leuconostoc属に属する微生物、Pediococcus属に属する微生物及びStreptococcus属に属する微生物からなる群から選ばれる少なくとも一種の乳酸菌である請求項1〜4のいずれかに記載の方法。
【請求項6】
乳酸菌が、ヒアルロン酸生産能を有する微生物である請求項5記載の方法。
【請求項7】
ヒアルロン酸生産能を有する微生物が、Streptococcus zooepidemicusである請求項6記載の方法。
【請求項8】
Streptococcus zooepidemicusが、Streptococcus zooepidemicus MK5(FERM P−21487)である請求項7記載の方法。
【図1】


【図2】


【図3】




【図2】


【図3】


【公開番号】特開2011−244702(P2011−244702A)
【公開日】平成23年12月8日(2011.12.8)
【国際特許分類】
【出願番号】特願2010−118276(P2010−118276)
【出願日】平成22年5月24日(2010.5.24)
【出願人】(000006035)三菱レイヨン株式会社 (2,875)
【Fターム(参考)】
【公開日】平成23年12月8日(2011.12.8)
【国際特許分類】
【出願日】平成22年5月24日(2010.5.24)
【出願人】(000006035)三菱レイヨン株式会社 (2,875)
【Fターム(参考)】
[ Back to top ]

