多能性幹細胞を快速で効率的に誘導する新規無血清培地及びその使用方法
【課題】多能性幹細胞を快速で効率的に誘導する新規無血清培地及びその使用方法を提供する。
【解決手段】体細胞を快速で効率的に多能性幹細胞(induced Pluripotent stem
cell, iPS)に誘導してリプログラムする無血清培地、及び該無血清培地を使用して、フィーダーレイヤー無しに体細胞を誘導してリプログラムする方法を開示する。すべての誘導リプログラムの速度及び効率が大いに向上した。前記培地の、多能性幹細胞の誘導のための使用、並びに、化合物のスクリーニング方法、特に化合物の高処理スクリーニング方法における使用をさらに提供する。
【解決手段】体細胞を快速で効率的に多能性幹細胞(induced Pluripotent stem
cell, iPS)に誘導してリプログラムする無血清培地、及び該無血清培地を使用して、フィーダーレイヤー無しに体細胞を誘導してリプログラムする方法を開示する。すべての誘導リプログラムの速度及び効率が大いに向上した。前記培地の、多能性幹細胞の誘導のための使用、並びに、化合物のスクリーニング方法、特に化合物の高処理スクリーニング方法における使用をさらに提供する。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、体細胞を快速で効率的に多能性幹細胞(induced Pluripotent stem cell, iPS)に誘導してリプログラムする無血清培地、及び該無血清培地を使用して、フィーダーレイヤー無しに体細胞を誘導してリプログラムする方法に関する。すべての誘導リプログラムの速度及び効率が大いに向上した。また、本発明は、前記培地の、多能性幹細胞の誘導のための使用、並びに、化合物のスクリーニング方法、特に化合物の高処理スクリーニング方法における使用にさらに関する。
【背景技術】
【0002】
幹細胞(stem cells)は人体及びその各種組織細胞の最初のソースであり、そのもっとも顕著な生物学的特徴は、自己再生及び持続的増殖能力を有するばかりでなく、多方向分化の潜在能力もあることにある。ソースによって、幹細胞は体性幹細胞(somatic stem
cells)と胚性幹細胞(embryonic stem cells, ES細胞)とに分けられている。体性幹細胞は成体組織に存在する骨髄間葉系幹細胞、膵幹細胞、及び神経幹細胞などを含んでいる。
【0003】
1981年、ES細胞の分離と培養はマウスで初めて成功した。それは今までのところもっとも広く研究された成熟した幹細胞系である。その後、牛や羊などの大動物のES細胞の分離と培養も次々と成功した。
【0004】
hES細胞に係る研究は主に移植治療への応用を見通しとしている。組織工学分野において、hES細胞はシード細胞として、臨床上の細胞、組織又は器官の移植治療に大量の材料を提供することができる。hES細胞の分化培養環境への制御やES細胞の指向性分化を促進できる肝心な分子遺伝子のトランスフェクションなどの体外誘導分化策略を通して、特異的な組織細胞類型が得られる。この類型の細胞を移植治療に応用すると、糖尿病、パーキンソン病、脊髄損傷、白血病、心筋損傷、腎不全、肝硬変などの疾患の治療に新しい希望をもたらす。
【0005】
hES細胞に係る研究はずっと様々な問題と論争に直面したのであり、主に以下の面で表されている。即ち、(1)ドナー卵母細胞のソースの取得が難しく、hES細胞系の創立効率が低い。また、SCNT技術が不成熟であるため、必ずより多いヒト卵母細胞がさらにかかる。そのため、そのソースの取得を保証しかねる。(2)免疫排斥反応が発生する。SCNT技術を採用しない限り、患者はhES細胞から分化して得られた各種の細胞及び組織に対し依然として免疫排斥がある。(3)hES細胞は腫瘍形成性があり、受容体の体内に移植した後、腫瘍へと進展する可能性がある。SCNT技術を採用して、移植細胞に自殺遺伝子を配置するなどの対策を行ったとしても、この問題がうまく解決できるとは限らない(Reubinoff BE等、Embryonic stem cell lines from
human blastocysts: somatic differentiation in vitro. Nat Biotechnol 2000; 18:
399-404; Richards M等、Bongso A. Human feeders support
prolonged undifferentiated growth of human inner cell masses and embryonic stem
cells. Nat Biotechnol 2002; 20: 933-936; Burdon T等、cell
cycle and pluripotency in embryonic stem cells. Trends Cell Biol 2002; 12:
432-438)。(4)hES体外保持にリスクがある(Nakagawa M等、N, Yamanaka S. Generation of
induced pluripotent stem cells without Myc from mouse and human fibroblasts.
Nat Biotechnol 2008; 26: 101-106)。同様に、レンチウイルストランスフェクション技術も類似したリスクがあり得る。
【0006】
hES細胞と治療的クローン研究との倫理的論争を避けるため、ヒトの体細胞を直接的に多能性幹細胞に転換して、患者に「個性化された」自体幹細胞を提供する代案を探す必要がある。2003年、Gurdon研究グループは、完全に分化したマウスの胸腺細胞又は成人外周血リンパ細胞の細胞核をアフリカツメガエル(Xenopus laevis)の卵母細胞に注入した後、哺乳動物の細胞核の分化マーカーがなくなったのに対し、Oct4という哺乳動物の幹細胞中のもっとも特徴的なマーカーが高発現を呈したことを発見した。それで、哺乳動物の細胞核が直接的に両生動物の卵母細胞中の核内液胞に再構成されて、Oct4を発現することが可能であるとは示唆された(Byrne JA等、Nuclei of adult mammalian somatic cells are directly reprogrammed to
oct-4 stem cell gene expression by amphibian oocytes, Curr Biol 2003; 13:
1206-1213)。
【0007】
2006年、日本京都大学のYamanaka研究グループは、体外遺伝子トランスフェクション技術を採用して、24個の因子からOct4、Sox2、c-Myc、Klf4という4つの転写因子をスクリーニングした。レトロウイルスを通して上記4つの転写因子をマウス胎仔線維芽細胞又は成体マウスの尾部皮膚線維芽細胞に導入することにより、マウスのES細胞の培養条件でFbx15+の多能性幹細胞系が得られた。該細胞系は細胞形態、成長特性、表面マーカー、及びテラトーマの形成などの面でマウスのES細胞と非常に似ているが、遺伝子発現プロファイリング、DNAメチル化パターン、及びキメリック動物の生成の面でマウスのES細胞と異なっている。それで、該細胞系は人工多能性幹細胞(iPS細胞)と名づけられた(Takahashi K, Yamanaka S. Induction
of pluripotent stem cells from mouse embryonic and adult fibroblast cultures by
defined factors. Cell 2006; 126: 663-676)。
【0008】
2007年7月、Yamanaka研究グループは、さらにFbx15の代わりにNanogを用いてスクリーニングして、Nanog+のiPS細胞系を獲得した。該iPS細胞は、細胞形態、成長特性、マーカー発現、及びマウスの皮下に移植した後、三胚葉組織細胞構造を含むテラトーマの形成などの面でマウスのES細胞と非常に似ているだけでなく、DNAメチル化パターン、遺伝子発現プロファイリング、クロマチン状態、及びキメリック動物の生成等の面でもマウスのES細胞とほとんど完全に似ている。また、本研究において、原癌遺伝子c-Mycの再活性化がキメリック動物における腫瘍の形成の原因であり、トランスフェクションされた上記4つの遺伝子がiPS細胞に発現されていないとはさらに発見された。それで、これら遺伝子がただ誘導過程で機能し、iPS細胞の多能性状態を守る原因がNanog等の遺伝子のような内因性転写因子の発現であるとは表明された(Okita K, Ichisaka T 等、germline-competent
induced pluripotent stem cells. Nature 2007; 448: 313-317)。それと同時に発表されたアメリカ科学者からの論文も上記4つの転写因子ではマウス線維芽細胞を体外でマウスのES細胞に似ているiPS細胞に誘導再構成するのに十分であると実証した(Wernig M 等、In vitro reprogramming of fibroblasts into a pluripotent ES
cell-like state. Nature 2007; 448: 318-324)。
【0009】
最近、マウスの肝細胞と胃上皮細胞もiPS細胞に再構成されることが可能であるとは報告された。遺伝学細胞血統のトレーシング分析に表すように、iPS細胞は血統が固定された体細胞の直接再構成に由来する。レトロウイルスの、特定の遺伝子座位への整合が細胞核の再構成と関連するとは発見されていない(Aoi T 等、Generation of Pluripotent Stem Cells
from Adult Mouse Liver and Stomach Cells. Science 2008)。
【0010】
同一技術で上記の4つの転写因子をヒト皮膚線維芽細胞に導入してiPS細胞を得た研究者もいる。初代ヒト線維芽細胞様滑膜細胞も新生児線維芽細胞に由来する細胞系もiPS細胞に再構成できる。この種類のiPS細胞は、細胞形態、増殖能力、表面抗原マーカー、遺伝子発現プロファイリング、多能性幹細胞の特異的な遺伝子の後成の状態、及びテロメラーゼ活性などの面でhES細胞と似ている。そして、体外培養時及びマウスの体内テラトーマ形成際に共に3つの胚葉を有する異なる細胞類型に分化可能である(Takahashi K 等、Induction of pluripotent stem
cells from adult human fibroblasts by defined factors. Cell 2007; 131: 861-872)。それと同時に、Wisconsin大学のThomson研究グループも胎児線維芽細胞を誘導してhES細胞の基本特徴を有するヒトiPS細胞に転換することを報告した。相違する箇所は、彼らはレンチウイルスをベクターとして使用し、かつ形質導入のために14個の候補遺伝子からOct4、Sox2、Nanog、Lin28という4つの遺伝子を選択したことにある(Yu J 等、Induced pluripotent stem cell lines
derived from human somatic cells. Science 2007; 318: 1917-1920)。
【0011】
Park IH 等(Reprogramming of human somatic cells to pluripotency with defined
factors. Nature 2008; 451: 141-146)も胎児、新生児及び成人の皮膚又は肺からの初代線維芽細胞(そのうち、1名の健康な男性の皮膚生検による線維芽細胞を含む)を利用してYamanaka 研究グループの策略を採用して同一の結果を取得した。彼らはOct4と Sox2が iPS細胞に誘導再構成する過程において必須的であるとさらに発見した。この2つの転写因子のため、ヒトiPS細胞の多能性が維持された。Klf4とcMycはクロマチンの構造を変化させて、Oct4と Sox2との結合を促進することにより誘導の効率を向上させるためである。また、この研究の大切な意義は、皮膚生検による線維芽細胞をiPS細胞に誘導することにある。上記研究で表明したように、生検のヒト皮膚組織から体細胞を抽出して誘導することにより患者の特異的な幹細胞を製造するのは実行可能である。それで、細胞移植治療に存在する免疫排斥反応を解消する見込みがある。c-Myc遺伝子の導入はキメリックマウスの腫瘍発生率が20%に達する原因となり得るため、その将来の臨床応用を阻むことが可能である(Okita K, Ichisaka T, Yamanaka S. Generation of germline-competent
induced pluripotent stem cells. Nature 2007; 448: 313-317)。従って、Yamanaka研究グループの最近のレポートによれば、c-Myc以外の3つの遺伝子によってマウスとヒト皮膚線維芽細胞をトランスフェクションして培養条件を調整したらiPS細胞も得られる。c-Myc遺伝子を除外すると、将来の臨床応用の安全性が顕著に向上可能であるが、iPS細胞の生成効率が明らかに低減する(Nakagawa M 等、Generation of induced pluripotent stem cells without Myc from mouse
and human fibroblasts. Nat Biotechnol 2008; 26: 101-106)。
【0012】
しかしながら、大量のiPSに関する方法が既に開発されたが、iPSは今ウイルスを遺伝子ベクターとして使用する、効率が低い、及び癌遺伝子c-Mycを使用するなどの問題があるので、最適な方案としては、薬物を介して体細胞を直接にiPSに誘導して、化学成分が一定である培地に該過程及びその次の分化過程を進行させることにより、完全に安全な治療用細胞を得ることがある。だが、単に従来技術によってある薬物がある因子に取って代わることができると予知するのは不可能である。最適な方法としては、高処理スクリーニングが挙げられる。高処理スクリーニングを行うには、効率的で安定なiPS誘導システムが必要である。効率的にするのは孔径を低減して、同様なコストで処理を向上させるためである。安定にするのは、バッチ間の違いを解消するためである。百万種以上の薬物をスクリーニングする場合、反復可能性がとても重要である。
【0013】
しかし、現在のiPS誘導システムに用いられた培地はいずれも血清を必要としている。だが、血清に関しては、バッチ間の不安定さ以外、また大量の確定できない成分が存在し、かつ各成分の濃度は常に大幅な変化がある。それによって、血清は研究メカニズムにおいて生まれつきの劣勢がある。以上の理由で、出願人は無血清培地でiPSを誘導できるか否かを研究しようと考えられる。
【0014】
WO9830679は血清代替品( KnockOut Serum Replacement、KOSR)及びこの血清代替品を使用した無血清胚性幹細胞培地を報告した。しかし、この培地はiPSの増殖及び生成を支持できない。
【0015】
今まで、マウスの体細胞、特に取材しやすい線維芽細胞に全コースで血清無しにiPSを誘導することができると報告する文献がない。
【0016】
また、従来技術において、普通の多能性幹細胞の誘導方法は、ウシ胎児血清にフィーダーレイヤー細胞上で約14日間内、誘導率が約0.01〜0.5%である(Qin, D., Li, W., Zhang, J. & Pei, D. Direct generation of
ES-like cells from unmodified mouse embryonic fibroblasts by
Oct4/Sox2/Myc/Klf4. Cell Research 17,
959-962(2007)、Takahashi,K. & Yamanaka, S. Induction
of pluripotent stem cells from mouse embryonic and adult fibroblast cultures by
defined factors. Cell 126,
663-676(2006)、Meissner, A., Wernig, M.& Jaenisch,
R. Direct reprogramming of genetically unmodified fibroblasts into pluripotent
stem cells. Nature biotechnology 25,
1177-1181(2007)、Takahashi, K.等、Induction
of pluripotent stem cells from adult human fibroblasts by defined factors. Cell 131, 861-872(2007)、Yamanaka, S. Strategies and new developments in the generation of
patient-specific pluripotent stem cells. Cell
Stem Cell 1, 39-49(2007)参照)。
従って、本発明は、従来技術に比べて、より効率的で快速にフィーダーレイヤー細胞無しに多能性幹細胞を誘導する無血清培地を提供する。
【発明の概要】
【発明が解決しようとする課題】
【0017】
第一の方面において、本発明は基礎培地と、血清代替添加剤と、1種又は多種のチロシンキナーゼと、選択可能な他の成分とを含有する培養細胞の無血清培地を提供する。
【0018】
また、本発明による無血清培地は、さらに白血病抑制因子(LIF)を含有する。
【0019】
本発明の他方面において、前記無血清培地を使用して体細胞から多能性幹細胞を効率的に誘導する方法が提供される。それは、
(a) 1つ又は複数の幹細胞多能性因子を体細胞に導入するステップと、
(b) 本願に記載の無血清培地で細胞成長に適する条件で(a)中の導入された体細胞を培養することにより、体細胞を多能性幹細胞に誘導リプログラムするステップと、
(c) 誘導された細胞の多能性を検知・分析するステップと、
(d) 多能性を有する誘導された多能性幹細胞のナノクローンを選択するステップと、
(e) 胚性幹細胞の成長に適する条件で(d)中のナノクローン細胞を培養するステップと、
を備える。
【0020】
本発明はさらに多能性の誘導方法に関する。その方法は、上記(a)-(e)のステップ以外、レポーター遺伝子を体細胞に導入し、ステップ(c)の前にレポーター遺伝子を介して多能性幹細胞の生成を指示し、その生成効率を検知するステップをさらに有する。
【0021】
さらに他方面において、本発明は、本発明に記載の無血清培地の、体細胞を快速で効率的に誘導して多能性幹細胞にリプログラムするための使用に関する。
【0022】
最後、本発明は、さらに本発明に記載の培地の、iPSシステムに誘導された多能性幹細胞を用いて、化合物をスクリーニングし、特に高処理スクリーニングするための使用に関する。
【図面の簡単な説明】
【0023】
【図1】4つの因子(4F、Oct4、Sox2、Klf4、c-Myc)によって感染されたMEFはmKSR培地に成長することもできないし、iPSコロニーを生成することもできない。コントロールは既知の典型的な方法で血清培地(mES)に培養したiPS細胞である。スケール 100μM
【図2a】血清含有幹細胞培地より無血清iPS-SF1のほうがよりよくiPSの生成を支持することができる。MEFのFBS培地及びiPS-SF1培地における成長曲線(n=3)。
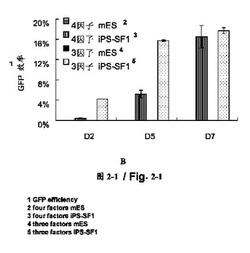
【図2b】4因子(4F、Oct4、Sox2、Klf4、c-Myc)又は3因子(3F、Oct4、Sox2、Klf4)によって感染されたMEF細胞上で異なる時点にOct4-GFP陽性細胞のFACS分析を行った。感染された細胞はそれぞれmES培地及びiPS-SF1培地に培養された。N=2、エラバーがs.dと指示された。
【図2c】4因子によって感染されたMEF細胞はそれぞれmES培地及びiPS-SF1培地に培養された。6日間後、細胞が多能性にリプログラムされたと指示するOct4-GFPが単にiPS-SF1に培養された細胞に発現され、かつクローン形態が形成されたのに対し、典型的な血清培地mESに培養されたMEF細胞にはOct4-GFPが発現されていないことが見える。スケール 100μM
【図3a】無血清培地iPS-SF1に由来する人工多能性幹細胞(iPS)系は多能性を有する。感染後、iPS-SF1によって培養して得られたiPS細胞系は典型的なマウス幹細胞と似ている隆起性のクローン形態を有し、かつ多能性を指示するOct4-GFPを強く発現した。
【図3b】感染後、iPS-SF1によって培養して得られたiPS細胞系は胞胚に注射した後にキメリックマウスを形成することができる。ドナー胞胚が白いICRマウスである。マウスの黒い毛髪から分かるように、メキリックが既に発生した。それで、iPS-SF1によって培養して樹立されたiPS細胞系は体内正常発育に参与する能力がある。
【図4】8つの異なる培養条件で、感染後の第7日、以上述べたように、4因子によって感染された時にOct4-GFP陽性細胞のパーセンテージを測定した。iPS-SF1サンプルの値を1に設定した。左側の4つのバーは3種の補充物をそれぞれiPS-SF1に添加したことによる積極作用を指示した。Mock培地には、10%KOSRを有するDMEMが補充された。右側の4つのバーはそれぞれiPS-SF1から各成分を解消したことによる消極作用を表明した。
【図5】血清はリプログラムの強抑制剤である。4因子によって感染されたMEF細胞に対して、感染後の第7日にOct4-GFP陽性細胞のパーセンテージを分析した。血清を異なる濃度でiPS-SF1に補充した。N=2、エラバーがs.dと指示された。
【図6】iPS-SF1がスクリーニングツールとして機能する。よく見られる各信号経路のターゲット化合物を選択した。破線はその値が1と設定されたコントロールサンプルの値を示した。n=2、エラバーがs.dと指示された。
【図7】Oct4/Sox2/Klf4の3因子に媒介されたiPS過程におけるNanogプロモーターのメチル化分析。3因子によって感染された線維芽細胞はそれぞれmES(血清含有培地)及びiPS-SF1に培養された。感染後の第2日と第6日のサンプルを取って重硫酸塩配列決定法でNanogプロモーターのメチル化状態を分析した。白丸はメチル化されていないCpGヌクレオチド対を表すのに対し、黒丸はメチル化されたCpGヌクレオチド対を表す。
【図8】異なる成長因子(チロシンキナーゼ及びエストロゲンを含む)のリプログラムにおける効果。それぞれ成長因子を有しないiPS-SF1に図面の成長因子を添加し、且つ感染後の第7日にOct4-GFPを分析した。そのうち、E2はエストロゲンであり、FBS培地はネガティブコントロールとして機能する。n=2、エラバーがs.dである。
【図9】異なる培地に培養された感染したMEFの代表的なFACS図。PE経路からの信号は自発蛍光のコントロールとして用いられた。そのうち、iPS-SF1は4因子及び3因子によって感染されたMEFにおいて、感染後の第7日にともにOct4-GFP群を顕著に改善した。
【発明を実施するための形態】
【0024】
定義と技術
他に明記しない限り、本発明の実践は分子生物学、微生物学、細胞生物学、免疫学及び組換DNAの伝統的な技術を採用する。それは本分野の技術範囲に属する。例えば、Sambrook、Fritsch、及び Maniatis、分子クローニング:実験マニュアル、第3版(2002); CURRENT PROTOCOLS IN MOLECULAR
BIOLOGY (F.M. Ausubel 等編著(1987)); METHODS IN ENZYMOLOGY
(Academic Press, Inc.): PCR 2: A PRACTICAL APPROACH
(M.J. MacPherson, B.D. Hames & G.R. Taylor 編著,(1995)
), Harlow & Lane編著, (1988) ANTIBODIES, A LABORATORY
MANUAL and ANIMAL CELL CULTURE (R.I. Freshney編著,
(1987)); W. French Anderson 等、 HANDBOOK OF STEM CELLS,
vol.2参照。
【0025】
他に説明しない限り、本発明で用いられる専門用語はいずれも当業者が通常に理解する意味がある。本発明を容易に理解するため、本文で用いられる専門用語の一部を下記のように定義する。
【0026】
明細書及び添付の特許請求の範囲中で使用される単数形の表現は文脈が明確に指示しない限り複数の指示対象を含む。従って、例えば、「細胞」は、複数のそのような細胞をも包含し、その混合物を包含する。
【0027】
数字表示、例えば、pH、温度、時間、濃度、及び分子量(範囲を含む)は、いずれも近似値である。いつも明瞭に記述するのではないが、すべての場合において、用語「約」によって修飾されていると理解されるべきである。いつも明瞭に記述するのではないが、本発明における試薬はただ例として挙げられるに過ぎなく、その等価物も本分野の既知のものであるとも理解されるべきである。
【0028】
本発明における「(人工)多能性幹細胞(iPS細胞)」とは体細胞のリプログラムを誘導する幹細胞多能性因子によって体細胞を体外で誘導変化させてなった細胞である。該iPS細胞はES細胞の培養条件で、細胞形態、成長特性、表面マーカー発現、及び皮下に移植した後、三胚葉組織細胞構造を含むテラトーマの形成などの面でマウスのES細胞と非常に似ているだけでなく、DNAメチル化パターン、遺伝子発現プロファイリング、クロマチン状態、及びキメリック動物の生成等の面でもマウスのES細胞とほとんど完全に似ている。
【0029】
本発明における「基礎培地」とはいずれの細胞成長を支持できる培地を指す。基礎培地は、亜鉛、鉄、マグネシウム、カルシウム、及びカリウムのような標準的な無機塩、及びビタミン、グルコース、バッファシステム、並びにキーアミノ酸を提供する。本発明に用いられる基礎培地は、Dulbecco’s Modified Eagle’s Medium (DMEM)、Minimal
Essential Medium (MEM)、Basal Medium Eagle (BME)、RPMI 1640、F-10、F-12、αMinimal Essential Medium (αMEM)、Glasgow’s
Minimal Essential Medium(G-MEM )、及びIscove’s Modified Dulbecco’s Mediumを含むが、それに限定されるものではない。当業者は、如何にして培養しようとする細胞に適する基礎培地を選択するかをよく知っている。好ましい実施形態において、基礎培地は、DMEMとF12との混合物(1:1)又は高グルコースのDMEMである。より好ましい実施形態において、基礎培地は高グルコース(例えば、4.5g/L)を有するDMEMである。
【0030】
本発明における「血清代替添加剤」とは細胞培養中で基礎培地に加えて、血清の細胞生存成長に対する支持作用に部分的に又は全部取って代わる添加剤を指す。一般的には、インスリン、トランスメタロプロテイン(transmetalloprotein)、微量元素、及びビタミンなどの因子を含む。これらの因子に関しては、一般的には、基礎培地に含まれるのではなく、通常に細胞培養用血清に提供されたのである。血清代替添加剤は、1つ又は複数のインスリン及びインスリン代替品、1つ又は複数のトランスメタロプロテイン及びトランスメタロプロテイン代替品、1つ又は複数の微量元素、1つ又は複数のビタミン、1つ又は複数のアミノ酸、1つ又は複数のホルモン及びホルモン様化合物、血清アルブミン又は血清アルブミン代替品、及び1つ又は複数の脂質からなる群より選ばれた少なくとも1種又は多種の細胞成長を支持する成分を含有する。多種市販の血清代替添加剤、例えば、KnockOut Serum Replacement (KOSR)、N2、B27、Insulin-Transferrin-Selenium Supplement
(ITS)、G5などが当業者にとって容易に得られるものである。これらの添加剤は成分が確実であるという特徴がある。そのため、その培地における割合によりその各成分の濃度を確定することができる。
【0031】
当業者は、従来技術によって、培養しようとする細胞の類型及び他の方面に基づいて血清代替添加剤を容易に調製することができる。好ましくは、本発明に用いられる血清代替添加剤がKOSR、N2、及び/又はB27を所定の割合で混合して得られた混合添加剤であり、より好ましくは、最終培地において、KOSRが5〜20%の濃度を有し、N2が0〜1%の濃度を有し、B27が0〜2%の濃度を有する。最も好ましくは、最終培地において、KOSRの濃度が10%であり、N2の濃度が0.5%である。
【0032】
本発明で用いられる受容体型チロシンキナーゼは、全ての鑑定された及びすぐ鑑定される受容体型チロシンキナーゼ性質を具備する全ての受容体型チロシンキナーゼ成長因子を含む。好ましくは、受容体型チロシンキナーゼがbFGF、EGF、IGF2、又はVEGFから選ばれる。最も好ましくは、受容体型チロシンキナーゼがbFGFである。当業者は、培養しようとする細胞の類型及び他の条件に基づいて、細胞成長を維持するのに十分な受容体型チロシンキナーゼの濃度を容易に確定できる。前記濃度を約3〜20ng/mlとすることが好ましく、約5〜15ng/mlとすることがより好ましく、約7ng/mlとすることが最も好ましい。好ましい実施形態において、本発明の培地は約5ng/mlのbFGF、10ng/mlの EGF、25ng/mlのIGF2、及び/又は10ng/mlの VEGFを包含してよい。最も好ましい実施形態において、本発明の培地は、約5ng/mlのbFGF を含む。
【0033】
本発明で用いられるLIFは白血病抑制因子を指す。それは本分野の既知の幹細胞培養に通常に添加された成長因子である。当業者は具体的な条件によって具体的な培地に用いられるLIFの濃度を調整することができる。本発明の培地において、濃度が500〜2000U/mLであるLIF を添加することが好ましく、濃度が700〜1400U/mLであるLIF を添加することがより好ましく、濃度が約1000U/mLであるLIF を添加することが最も好ましい。
【0034】
当業者に知られているように、細胞の成長を促進するため、培地に別の成分を選択的に添加することもできる。当業者は培養しようとする細胞及び他の条件に基づいて具体的な培地に添加しようとする別の成分、例えば、L-グルタミン、NEAA MEM、及び2-メルカプトエタノール等を選択することを知っている。
【0035】
本発明による無血清培地は当業者の知っている通常の技術、例えば、A LABORATORY MANUAL and ANIMAL CELL CULTURE (R.I. Freshney 編著, (1987)); W. French Anderson 等、HANDBOOK OF
STEM CELLSに記載の血清の混合調製技術と条件により製造されたのである。
【0036】
本発明における「体細胞」という専門用語は、「生殖細胞」と「胚性幹細胞」に対して提出される概念である。「体細胞」は、「胚性幹細胞」から分化して生成した多能性を有しなく、ある具体的な機能を有する細胞である。「体細胞」は「胚性幹細胞」から分化し、又は内細胞塊を引き続き発育させて生成した多能性を有しなく、一般的に具体的な機能を有する細胞である。一般的には、発育段階が胞胚期(マウスにとって、具体的には、受精後の第3.5日後)の後にある胎児マウス又は成体マウスから体細胞を取る。その取材時、一般的には、多能性を有する可能性がある生殖細胞およびそのソース(例えば、精原幹細胞や生殖隆起幹細胞等)を取らないようにする。本発明で用いられる体細胞に関して、好ましくは哺乳動物に由来し、より好ましくはヒト、サル、犬、猫、ラット、又はマウスに由来し、最も好ましくはマウスに由来する。本発明における体細胞は機体内の任意類型の体細胞であってよく、好ましくは線維芽細胞又は脳膜細胞である。
【0037】
本発明に言及の「体細胞のリプログラムを誘導する幹細胞多能性因子」とは幹細胞の多能性の維持に肝心な因子であり、体細胞に前記因子を導入することにより一定の条件で体細胞を誘導して胚性幹細胞にリプログラムすることができる。目の前、複数のこのようなリプログラムに用いられる因子を報告した文献がたくさんある。例えば、Qin, D., Li, W., Zhang, J. & Pei, D. Direct generation of
ES-like cells from unmodified mouse embryonic fibroblasts by
Oct4/Sox2/Myc/Klf4. Cell research 17,
959-962 (2007)、Okita, K.,
Ichisaka, T. & Yamanaka, S. Generation of germline-competent induced
pluripotent stem cells. Nature 448,
313-317 (2007)、Wernig, M.等のIn
vitro reprogramming of fibroblasts into a pluripotent ES-cell-like state. Nature 448, 318-324 (2007)、Yamanaka, S. Strategies and new developments in the generation of
patient-specific pluripotent stem cells. Cell
Stem Cell 1, 39-49 (2007)等参照。当業者はもう多種のこの用途の幹細胞多能性因子を知っている。前記多能性因子は、Oct4、Sox2(選択的には、Sox1)、C-myc(選択的には、L-Myc又はN-Myc)
、及びKlf4(選択的には、Klf5又はKlf2)、Esrrb、Nanog、及びLin28を包含することが好ましい。上記多能性因子はその導入しようとする細胞によって任意の起源から得られる。好ましくは、マウスの多能性因子及びその異形、例えば、Sox2(NCBI登録番号:NM_011443.3;マウスのSRY-ボックス含有遺伝子2)、Oct4(NCBI登録番号:NM_013633.2;マウスのPOUドメイン、5類、転写因子1(Pou5f1))、Klf4(NCBI登録番号:NM_010637.2(マウスのKruppel様因子4)、c-Myc(NCBI登録番号:NM_010849.4(マウスの髄細胞瘤病癌遺伝子)、Sox1(NCBI登録番号:NM_009233.3;マウスの含有遺伝子1SRY-ボックス)、Klf2(NCBI登録番号:NM_008452.2;マウスのKruppel様因子2(肺))、Klf5(NCBI登録番号:NM_009769.4;マウスのKruppel様因子5)、Nanog(NCBI登録番号:NM_028016)、又はLin28(NCBI登録番号:NM_145833)に由来する。C-Mycはさらにその突然変異体L-myc(登録番号:NM_008506.2;マウスのv-myc髄細胞瘤病ウイルス性癌遺伝子ホモログ1v、肺癌由来の(鳥類)((Mycl1))、またはN-Myc(登録番号:NM_008709.3;マウスのv-myc髄細胞瘤病ウイルスに関連する癌遺伝子、神経母細胞瘤誘導の(鳥類)(Mycn) に換えられる。
【0038】
本発明における「誘導(して)リプログラム」という専門用語(「誘導」と略される場合もある)とは、体細胞を多能性幹細胞に脱分化する過程を指す。好ましくは、幹細胞の多能性を維持するための多能性因子cDNAを体細胞に導入することにより、体細胞を多能性幹細胞に脱分化することが可能である(Takahashi
K, Yamanaka S. Cell. 2006; 126: 663-676; Werning M, Meissner A, Foreman R等、Nature. 2007; 448: 318-324; Yu J, Vodyanik MA, Smuga-Otto K 等、Science. 2007; 318: 1917-1920)。そのうち、前記多能性因子はOct4、Sox2(選択的には、Sox1)、C-myc(選択的には、L-Myc又はN-Myc)、Klf4(選択的には、Klf5又はKlf2)、Nanog、及びLin28からなる群から選ばれた1つまたは複数を包含することが好ましい。
【0039】
前記幹細胞多能性因子cDNAを体細胞に導入する方法は、当業者の熟知している多種技術(ウイルス感染、リポソームトランスフェクション、トランスポゾンによって媒介される挿入発現、膜貫通タンパク質、薬物誘導、電気穿孔、粒子衝撃等の各種の、DNAを細胞に導入する方法を含む)であってよい。cDNAを含むウイルスベクターを利用してトランスフェクションを行うことが好ましい。前記ウイルスベクターとしては、レンチウイルスベクターやレトロウイルスベクターなどの多種のウイルスベクターが挙げられる。実施例に述べるように、好ましくはレトロウイルスベクター(例えば、pMXベクター)である。
【0040】
本発明における「細胞成長に適する条件」とは、本分野の通常の幹細胞培養条件であり、各具体的な細胞系に適する、細胞の基本性質に影響を与えない修飾を含む。培養方法及び培養条件については、W. French Anderson等の HANDBOOK OF STEM CELLS, vol.2を参照。
【0041】
本発明におけるレポーター遺伝子は、細胞が既に外部誘導によって胚性幹細胞と類似する段階に転換されたことを指示できる遺伝子を指しており、トランスジーン又は相同組換えを介して蛍光タンパク質又は抵抗性を発現する配列の導入を包括する。当該配列は胚性幹細胞によって特異的に発現されるある遺伝子のプロモーターに制御されるため、細胞が胚性幹細胞の状態に達する場合、該蛍光タンパク質又は抵抗性遺伝子の発現を活性化することが可能である。それにより、この細胞は、ある検知可能な性状特徴(例えば、緑光を発する)を有しており、他の該状態にリプログラムされていない細胞と区分できる。本技術分野の慣用のレポーター遺伝子は、緑色蛍光タンパク質、アンピシリン抵抗性遺伝子のような抵抗性遺伝子を含む。当業者は細胞の培養条件と用途によって、各種実施例に適するレポーター遺伝子を選択することができる。例えば、Young II Yeom 等、Germline regulatory element
of Oct-4 specific for the totipotent cycle of embryonal cells, Development
122,000-000 (1996), Printed in Great Britain, The company of Biologists Limited
1996, P881-894; Shin-ya Hatano 等、Pluripotential
competence of cells associated with Nanog activation, Mechanisms of Development
122(2005), 67-79参照。
【0042】
本発明における細胞多能性の検知方法は当業者の熟知しているものである。例えば、Yamanaka, S.
Strategies and new developments in the generation of patient-specific
pluripotent stem cells. Cell Stem Cell 1, 39-49 (2007)等参照。前記方法は、多能性分子マーカーの発現の鑑定、細胞のメチル化状態の検知、胚様体EBの形成、テラトーマの形成、及び誘導された多能性幹細胞の応用によるキメリックマウスの生成などを含む。
【0043】
本発明における「キメリックマウス」は、当業者の熟知している「キメリックマウス」に係わる技術を通して実施されたのである。具体的には、胚性幹細胞又は本発明の技術によって得られたiPS細胞をマウスの胞胚に注射して、胞胚中の胚性細胞と混合させて、共に代理母としてのマウスの子宮に成長発育させる。出生後、マウスの全身の各組織は2種の胚性細胞を混合してなる(モサイクパターンのようである)。このようなマウスはキメリックマウスと称される(Evans M J等; The ability of EK cell to
form chimeras after selection of clones in G418 and some observation on the
integration of retroviral vector proviral DNA into EK cells [M]; Cold Spring
Harbor Symposia on Quantitative Biology; 1985; Xian MW, Wu BY, Hu XL, Shang KG,
Wu HL, 1996. Construction of chimeric mice of ES cells by microinjection
method. Hereditas (北京) 18(1): 7-10 (中国語))。iPSを利用してキメリックマウスを形成できるか否かは、iPSが胚性幹細胞と類似する性質を有するかどうかを検証する最も直接で肝心な証拠である。
【0044】
本発明における「化合物のスクリーニング」とは、指定した化合物庫において、レポーター遺伝子又は細胞自身の特性を検知することにより、(1)、iPS過程及び誘導条件に影響を及ぼす化合物と、(2).既知のiPS誘導過程に必要とするある乃至全部の因子に取って代わることができる化合物をスクリーニングすることを指す。当業者は、既にiPS過程を利用して化合物をスクリーニングする方法を開発した。例えば、Yan Shi 等、Induction of Pluripotent Stem Cells from Mouse
Embryonic Fibroblasts by Oct4 and Klf4 with Small-Molecule Compounds、 Cell Stem Cell 3、 568-574、2008年11月6日を参照。
【0045】
本発明における「高処理」スクリーニング方法は、当業者の知っているものであり、自動化器械設備及び比較的少ないサンプル使用量を利用して、短い期間内に1つの大きい文庫中の全ての個体が特定の実験モデルに果たす作用に対してスクリーニングを行うことを指す。例えば、Nil Emre等、A chemical approach to stem cell
biology、 Current Opinion in Chemical Biology 2007、 11: 252-258を参照。当該方法は大規模の化合物庫や天然物庫において、iPS過程に対する高処理スクリーニングに用いられるのである。
【実施例】
【0046】
以下、実施例を本発明のモードの例示として挙げて発明者の標準実験室の実践を説明するが、本発明はこれに限定されるものではない。本発明の開示及び当業者の普通のレベルにより、以下の実施例は単に例示として挙げられるに過ぎなく、本発明の範囲内に各種の変更、修飾及び改善を行うことが許容される。特に説明しない限り、それに係る技術はいずれも当業者の熟知している分子生物学、細胞生物学、生物化学等の分野における通常の技術である。
【0047】
本発明で使用される技術の概要:
特に説明しない限り、本発明に言及される各種物質は、全てInvitrogenに由来する。
【0048】
細胞培養:
マウス胚性線維芽細胞はOct-GFPトランスジーンアレル及びRosa26アレルの半接合のe13.5の胚に由来し、かつ10%FBS、L-グルタミン、及びNEAAを補充した、高グルコースのDMEMという線維芽細胞培地に培養された。iPS及びES細胞は、共に血清を含む培地(mES)及び無血清培地(mKSR)中のMEFフィーダーレイヤー上に培養された。各種培地の本発明における名称及び成分については、表1を参照。MEFフィーダーレイヤー細胞はマイトマシンCによって不活性にされた。
【0049】
【表1】

【0050】
レトロウイルスの生産及びiPS細胞の生成
AddgeneからマウスのOct4、Sox2、Klf4、c-Mycを含むDNAのレトロウイルスベクター(pMXs)を購買した。従来技術によって、ウイルスの生成及び感染を進行させた(Qin, D., Li, W., Zhang, J. &
Pei, D. Direct generation of ES-like cells from unmodified mouse embryonic
fibroblasts by Oct4/Sox2/Myc/Klf4. Cell
research 17, 959-962 (2007); Qin, D. 等のMouse meningiocytes express Sox2 and yield high
efficiency of chimeras after nuclear reprogramming with exogenous factors. J Biol Chem 283, 33730-33735 (2008))。要するに、通常の方法を利用してこれらのプラスミドをPlatE細胞にトランスフェクションした。その後、ウイルス上澄液を集め、48時間ろ過して、MEFを感染した。そのうち、ポリブレンが補充された。第2日、上記と同様の工程を繰り返した。ウイルス上澄液を除去した日を感染後の第0日と定義した。ウイルスによって感染された(つまり、Oct4、Sox2、Klf4、及び/又はc-Mycによってトランスフェクションされた;以下、特に説明しない限り、3因子感染はOct4、Sox2、Klf4による感染を表す;4因子感染はOct4、Sox2、Klf4、及びc-Mycによる感染を表す)線維芽細胞が本発明の培地に培養された。感染後の第10-15日、iPSコロニーを選択した。それはOct-GFP(つまり、蛍光顕微鏡で蛍光を発するコロニー)及び典型的なES形態に基づいて選択したのである。その後、ES細胞のようにその選択されたコロニーを拡張して保持した(上述のQin, D., Li, W., Zhang, J. & Pei, D, 2007; 及び Qin, D. 等, 2008)。
【0051】
リプログラムの効率に対する定量化
リプログラムの効率を定量化する主な方法は、Oct4-GFP陽性細胞に対するFACS分析である。タイミングプロセスの結果をもとに、感染後の第7日と第9日にトリプシンで感染されたMEF細胞を消化し、次に、FACSCaliburを通して分析した。GFP陽性の細胞はPE経路からの制御信号のゲートを受けて、少なくとも15000個のイベントを記録した。pMXs-FLAGによって感染された細胞をネガティブコントロールとして使用した。FACSによる分析の効率を実証するために、直接に蛍光顕微鏡で感染後の第14日のGFP-ポジティブコロニーをカウントした。
【0052】
iPS細胞の特徴づけ
アルカリホスファターゼ染色及び免疫蛍光染色を行った(上述のQin, D., Li, W., Zhang, J. & Pei, D, 2007; and Qin,
D. 等, 2008)。マウスanti-Oct4(Santa
Cruz)、マウスanti-SSEA1(Abcam)、及びマウスanti-Nanog(Abcam)という一次抗体を使用した。
【0053】
実施例1:伝統的なmKSR培地は、4つの因子によってトランスフェクションされたMEFの成長も維持できないし、iPSの形成も誘導できない。
【0054】
以上述べたように、4因子のウイルスを1:1:1:1の割合で混合した後(いずれも1ml)、6ウェルプレートの1つのウェル中の合計で3.5万個の線維芽細胞に感染し、且つ37°Cで5%CO2をもってそれぞれmKSRとmES培地に培養した。
【0055】
図1に示すように、mKSRに培養された4因子によってトランスフェクションされた線維芽細胞の成長が遅い。第12日にも依然として多能性細胞の細胞コロニー形態が形成されなかった。言い換えれば、mKSR培地はiPSコロニーを誘導して生成することができない。
【0056】
実施例2:iPS-SF1培地を応用することにより、iPSの誘導効率を極大に向上できる。
【0057】
A.MEFをそれぞれFBSとiPS-SF1培地に培養した。その成長曲線がほとんど同じである。それで、iPS-SF1がMEFの培養に影響を及ぼさないとは分かる。それに対して、mKSR中のMEFの成長は大体停止した(図2a)。
【0058】
それぞれ3つの因子(Oct4、Klf4、及びSox2)又は4つの因子(cMyc、Oct4、Klf4、及びSox2)によって線維芽細胞にトランスフェクションした後、前記トランスフェクション後の細胞をそれぞれiPS-SF1培地に培養した。トランスフェクション後の第2、5、7日に、上述したようにGFP陽性細胞の効率を測定した。観察した結果、4つの因子によってトランスフェクションされた細胞であれ、3つの因子によってトランスフェクションされた細胞であれ、両方は高い効率を表した(図2b)。第7日に、18%という高い効率に達成した。伝統的な方法(図面に示すmESコントロール)と比べて、非常に大きく向上した。
【0059】
対応するように、この過程において蛍光顕微鏡で直接に観察すると、iPS-SF1培地によって培養されたトランスフェクション後の細胞に関しては、トランスフェクション後の第6日にOct4-GFPを強く発現する胚性幹細胞様クローンが出現したとは発見できる。それに反して、伝統的な培地に形成したクローンは蛍光発現がない(図2c)。
【0060】
同様に、図9に示すように、第7日にそれぞれ3因子と4因子によって感染されたMEF細胞を収穫した後、それに対してFACS効率分析を行った。通常のmES培地(iPS-SF1 vs mES: 3因子: 0.07% vs 17.82%;4因子:0.10% vs 15.07%)よりもiPS-SF1における感染後のMEF細胞のiPSリプログラム効率(上述したようである;つまり、Oct4-GFP陽性細胞の総細胞に対するパーセンテージで表す)がはるかに高い。
【0061】
実施例3:iPS-SF1によって誘導されたiPSは多能性を有する。
【0062】
A 誘導して得られたiPS細胞系は胚性幹細胞と似ている細胞形態を有する。
【0063】
以上述べたように、3因子によって線維芽細胞を感染し、且つその後、線維芽細胞をずっとiPS-SF1培地に培養した。感染後の第12-14日、クローン形態及び蛍光発現により典型的なクローン集塊を選び取った。数代の安定なつながりを通して、均一のiPS細胞系を形成した。
【0064】
図3aに示すように、左図は正常の胚性幹細胞であり、右図は上記iPS細胞系である。これらの細胞系は胚性幹細胞と非常に似ている形態を有し、Oct4-GFPの緑色蛍光を強く発現した。
【0065】
B キメリックマウスの生成は誘導して得られたiPS細胞系が多能性を有することを実証した。
【0066】
キメリックマウスの生成
注射用胞胚は4週齢の過剰排卵ICR雌マウス(白色)から取ったのである。該雌マウスを同品種の雄マウスと同一のかごに入れた。腟栓が見られてから3.5日(当日、腟栓が見られてから0.5日がある)、子宮と輸卵管から胚胎を集め、パラフィンオイルが覆われたM16培養ドロップレットに移入して、37°Cで5%CO2 保育器内に培養した。
【0067】
注射前の3時間、キメリック用iPS細胞(つまり、上述したiPS細胞系)のため、改めて新鮮な培養液を用意し、かつトリプシンで消化した後で単細胞懸濁液に作製した。適当なiPS細胞懸濁液と胞胚期の胚胎をM2注射ドロップレットに移入し、顕微注射システムで保持ピペットによって胞胚を固定し、注射針でiPS細胞を吸い取って、内細胞塊から離れたフィーダー部位に挿入し、胞胚のそれぞれに細胞を10-12個注射した。注射後、胞胚腔がなくなった。培養液に放置して保育器内に1−3時間培養して胞胚腔を回復させた後、腟栓が見られてから2.5dがある擬似妊娠の雌マウスの子宮に移入して培養した。
【0068】
図3bは、本発明による方法を使用して得られたiPSによって構成したキメリックマウスを示した。そのうち、ナンキメリックマウスが純白色である。キメリックマウスは、注射されたiPS細胞が黒いOG2/Rosa26マウスに由来したため、白と黒が交互になっている体色を呈した。それは、本発明による方法で得られたiPS細胞は正常の体内発育に参与してキメリックマウスを生成することができると示唆したとともに、これらの細胞は発育上で胚性幹細胞とは相違がないと示唆した。
【0069】
実施例4:本発明の培地は、iPS誘導過程における多能性遺伝子のプロモーターの脱メチル化を加速した。
【0070】
mES培地と本発明のiPS-SF1培地に培養された、Oct4、Sox2、Klf4という3因子に感染された(上述のように製造された)細胞系からゲノムDNA(700ng)を獲得した。50.6%の亜硫酸水素ナトリウム(Sigma S-1516)と10mMヒドロキノン(Sigma H−9003)との混合物に一晩露出することにより、亜硫酸水素塩による修飾を行った。PCRを通して表2に記載のプライマー対を使用してNanogのプロモーター領域を拡張した。PCR産物をフラットpMD8-Tベクター(Takara)にクローニングして、DH5αに増殖すると共に配列決定した。
【0071】
【表2】

【0072】
iPS誘導過程において、最終的には、内在的に発現された多能性遺伝子を活性化して、外因性発現に依存せずにiPSの自己再生を自発に維持しなければならない。従って、リプログラムに伴って、多能性遺伝子のプロモーターは、脱メチル化過程を有する。当該実施例において、Oct4、Sox2、Klf4という3つのウイルス(1:1:1)によってMEFを感染し、かつそれぞれ伝統的なmES培地と本発明のiPS-SF1培地に培養した。感染後の第2日と第6日に細胞サンプルを受け取って、ゲノムDNAを抽出した。DNAaseで切断した後、重硫酸塩で処理した。一晩経過後、メチル化されていないCpG塩基対中のC(シトシン)をU(ウラシル)に変化させてから、ネステッドPCRを用いて拡張してNanogのプロモーターを出して、本分野の既知の配列決定会社(例えば、Invitrogen)に渡して配列を決定した。配列の決定結果に基づいて、iPS過程におけるNanogプロモーターのメチル化変化状態を分析した。
【0073】
図7に示すように、3因子によって感染されたMEFについて、mESにおいてNanogプロモーターの脱メチル化が緩やかに進行する(D2:33%、D6:41.7%)のに対し、本発明の培地(iPS-SF1)において迅速に進行した。具体的には、本発明の培地における脱メチル化は第2日に66.7%に達成し、引き続き進行した結果、第6日に既に80.9%に達成した。この結果は、Nanogプロモーター中の検知されたフラグメントは既に基本的に活性化されたことを示している。Nanog という典型的な幹細胞多能性因子の活性化は、iPSが誘導されたことを表している。
【0074】
上記の実施例を見て分かるように、本発明のiPS-SF1培地はiPSのリプログラムをうまく誘導できるばかりでなく、該誘導されたリプログラムは発癌性のc-Myc遺伝子による感染を避けることができる。そのうえ、リプログラムの効率や脱メチル化の速度の面で、iPS-SF1培地は既存のmES培地よりはるかに高い。
【0075】
実施例5:本発明の培地における各成分のiPSリプログラム効率に対する影響
【0076】
表1に列挙したiPS-SF1培地中のLIF、N2、及びbFGFをそれぞれ除去し、又はDMEM+10%KOSR(つまり、成長因子を含まずにNEAAやL-グルタミン等の成分を含む;以下、bKSRという)培地にそれぞれiPS-SF1に該当する濃度でN2とbFGFを加えることにより、LIF、N2、及びbFGFの4因子によってトランスフェクションされたMEF細胞のiPSリプログラム効率に対する影響を検知した。図4中の各表記の意味は以下の通りである。
Mock: bKSR
Mock + LIF: bKSR + LIF
Mock + N2: bKSR-LIF +
N2
Mock + bFGF: bKSR-LIF
+ bFGF
iPS-SF1−LIF: LIFフリーiPS-SF1
iPS-SF1−N2: N2フリーiPS-SF1
iPS-SF1−bFGF: bFGFフリーiPS-SF1
【0077】
これにて分かるように、本分野の既知のLIFよりもbFGFのほうがiPSリプログラム効率に大きな影響を与えた。
【0078】
実施例6:血清のiPS-SF1培地に培養されたiPS細胞のリプログラムに対する抑制作用
【0079】
図5に示すように、iPS-SF1培地に2%、4%、6%、8%、及び10%の血清をそれぞれ加えたとき、既知の従来技術と相違する箇所は、血清はiPSリプログラム効率を96%まで抑制したことにある。
【0080】
実施例7:他のチロシンキナーゼの本発明の培地に対する影響
【0081】
他のチロシンキナーゼ及びエストロゲンも本発明の培地にiPSリプログラムの誘導過程に作用を果たせるかどうかを調査するために、4因子のウイルスによってMEFを感染した後、以下の培地に換えた。そのうち、ブランクコントロールはbFGFを含有しないiPS-SF1であり、実験群は各種受容体型チロシンキナーゼ(塩基性線維芽成長因子bFGF、表皮成長因子EGF、血管内皮成長因子VEGF、インスリン様成長因子2 IGF2、及びエストラジオルを含む)が添加されたブランク培地(つまり、bFGFを含有しないiPS-SF1)である。血清培地(FBS)は該実験のネガティブコントロールとして挙げられたのである。
【0082】
図8に示すように、bFGFを除き、他のチロシンキナーゼ(例えば、EGF, IGF2、VEGF、及びエストロゲン)はいずれもiPSリプログラム過程に対する誘導になかなか大きい作用を果たした。
【0083】
実施例8:iPS-SF1培地中のiPS過程において化合物をスクリーニングした。
【0084】
MEF細胞20,000個を12ウェルプレートの各ウェルに植えた。iPS-SF1を培地とした。次に、上述したように、ウイルスによって細胞を感染して、4因子によるトランスフェクションを行った。図6に示す各種化合物をそれぞれ下記の濃度で培地に添加した:PD0325901 (1 μM)、CHIR99021 (3 μM)、SU5402 (2 μM, EMDbiosciences)、Y-27632 (10
μM)、ビタミン E (25 μM, Sigma)、ビタミン
A (1 μM, Sigma)、A83-01 (0.5 μM, EMD)、SB203580 (2 μM)、Dorspmorphin (3 μM, Sigma)、PFF-a (10 μM)、TSA (20 nM, Sigma)、VPA (1 mM, EMD)、JAK 抑制剤(0.3 μM, EMD)、5aza-DC (1 μM, Sigma)、BIX01294 (1 μM)、Bayk8644 (2 μM, EMD)。
【0085】
感染後の第7日に、上述したようにFACS分析のため細胞を集めて、相対的なGFP効率を測定した。明らかなように、TSAとVPAはiPSリプログラムの効率を顕著に向上させた(100%)。それに対して、本発明の培地を使用した場合、PD0325901、 CHIR99021、及びSU5402のような当初に報告されたマウス胚性幹細胞の自己再生に有利な化合物はiPSリプログラムの効率を低減した。
【技術分野】
【0001】
本発明は、体細胞を快速で効率的に多能性幹細胞(induced Pluripotent stem cell, iPS)に誘導してリプログラムする無血清培地、及び該無血清培地を使用して、フィーダーレイヤー無しに体細胞を誘導してリプログラムする方法に関する。すべての誘導リプログラムの速度及び効率が大いに向上した。また、本発明は、前記培地の、多能性幹細胞の誘導のための使用、並びに、化合物のスクリーニング方法、特に化合物の高処理スクリーニング方法における使用にさらに関する。
【背景技術】
【0002】
幹細胞(stem cells)は人体及びその各種組織細胞の最初のソースであり、そのもっとも顕著な生物学的特徴は、自己再生及び持続的増殖能力を有するばかりでなく、多方向分化の潜在能力もあることにある。ソースによって、幹細胞は体性幹細胞(somatic stem
cells)と胚性幹細胞(embryonic stem cells, ES細胞)とに分けられている。体性幹細胞は成体組織に存在する骨髄間葉系幹細胞、膵幹細胞、及び神経幹細胞などを含んでいる。
【0003】
1981年、ES細胞の分離と培養はマウスで初めて成功した。それは今までのところもっとも広く研究された成熟した幹細胞系である。その後、牛や羊などの大動物のES細胞の分離と培養も次々と成功した。
【0004】
hES細胞に係る研究は主に移植治療への応用を見通しとしている。組織工学分野において、hES細胞はシード細胞として、臨床上の細胞、組織又は器官の移植治療に大量の材料を提供することができる。hES細胞の分化培養環境への制御やES細胞の指向性分化を促進できる肝心な分子遺伝子のトランスフェクションなどの体外誘導分化策略を通して、特異的な組織細胞類型が得られる。この類型の細胞を移植治療に応用すると、糖尿病、パーキンソン病、脊髄損傷、白血病、心筋損傷、腎不全、肝硬変などの疾患の治療に新しい希望をもたらす。
【0005】
hES細胞に係る研究はずっと様々な問題と論争に直面したのであり、主に以下の面で表されている。即ち、(1)ドナー卵母細胞のソースの取得が難しく、hES細胞系の創立効率が低い。また、SCNT技術が不成熟であるため、必ずより多いヒト卵母細胞がさらにかかる。そのため、そのソースの取得を保証しかねる。(2)免疫排斥反応が発生する。SCNT技術を採用しない限り、患者はhES細胞から分化して得られた各種の細胞及び組織に対し依然として免疫排斥がある。(3)hES細胞は腫瘍形成性があり、受容体の体内に移植した後、腫瘍へと進展する可能性がある。SCNT技術を採用して、移植細胞に自殺遺伝子を配置するなどの対策を行ったとしても、この問題がうまく解決できるとは限らない(Reubinoff BE等、Embryonic stem cell lines from
human blastocysts: somatic differentiation in vitro. Nat Biotechnol 2000; 18:
399-404; Richards M等、Bongso A. Human feeders support
prolonged undifferentiated growth of human inner cell masses and embryonic stem
cells. Nat Biotechnol 2002; 20: 933-936; Burdon T等、cell
cycle and pluripotency in embryonic stem cells. Trends Cell Biol 2002; 12:
432-438)。(4)hES体外保持にリスクがある(Nakagawa M等、N, Yamanaka S. Generation of
induced pluripotent stem cells without Myc from mouse and human fibroblasts.
Nat Biotechnol 2008; 26: 101-106)。同様に、レンチウイルストランスフェクション技術も類似したリスクがあり得る。
【0006】
hES細胞と治療的クローン研究との倫理的論争を避けるため、ヒトの体細胞を直接的に多能性幹細胞に転換して、患者に「個性化された」自体幹細胞を提供する代案を探す必要がある。2003年、Gurdon研究グループは、完全に分化したマウスの胸腺細胞又は成人外周血リンパ細胞の細胞核をアフリカツメガエル(Xenopus laevis)の卵母細胞に注入した後、哺乳動物の細胞核の分化マーカーがなくなったのに対し、Oct4という哺乳動物の幹細胞中のもっとも特徴的なマーカーが高発現を呈したことを発見した。それで、哺乳動物の細胞核が直接的に両生動物の卵母細胞中の核内液胞に再構成されて、Oct4を発現することが可能であるとは示唆された(Byrne JA等、Nuclei of adult mammalian somatic cells are directly reprogrammed to
oct-4 stem cell gene expression by amphibian oocytes, Curr Biol 2003; 13:
1206-1213)。
【0007】
2006年、日本京都大学のYamanaka研究グループは、体外遺伝子トランスフェクション技術を採用して、24個の因子からOct4、Sox2、c-Myc、Klf4という4つの転写因子をスクリーニングした。レトロウイルスを通して上記4つの転写因子をマウス胎仔線維芽細胞又は成体マウスの尾部皮膚線維芽細胞に導入することにより、マウスのES細胞の培養条件でFbx15+の多能性幹細胞系が得られた。該細胞系は細胞形態、成長特性、表面マーカー、及びテラトーマの形成などの面でマウスのES細胞と非常に似ているが、遺伝子発現プロファイリング、DNAメチル化パターン、及びキメリック動物の生成の面でマウスのES細胞と異なっている。それで、該細胞系は人工多能性幹細胞(iPS細胞)と名づけられた(Takahashi K, Yamanaka S. Induction
of pluripotent stem cells from mouse embryonic and adult fibroblast cultures by
defined factors. Cell 2006; 126: 663-676)。
【0008】
2007年7月、Yamanaka研究グループは、さらにFbx15の代わりにNanogを用いてスクリーニングして、Nanog+のiPS細胞系を獲得した。該iPS細胞は、細胞形態、成長特性、マーカー発現、及びマウスの皮下に移植した後、三胚葉組織細胞構造を含むテラトーマの形成などの面でマウスのES細胞と非常に似ているだけでなく、DNAメチル化パターン、遺伝子発現プロファイリング、クロマチン状態、及びキメリック動物の生成等の面でもマウスのES細胞とほとんど完全に似ている。また、本研究において、原癌遺伝子c-Mycの再活性化がキメリック動物における腫瘍の形成の原因であり、トランスフェクションされた上記4つの遺伝子がiPS細胞に発現されていないとはさらに発見された。それで、これら遺伝子がただ誘導過程で機能し、iPS細胞の多能性状態を守る原因がNanog等の遺伝子のような内因性転写因子の発現であるとは表明された(Okita K, Ichisaka T 等、germline-competent
induced pluripotent stem cells. Nature 2007; 448: 313-317)。それと同時に発表されたアメリカ科学者からの論文も上記4つの転写因子ではマウス線維芽細胞を体外でマウスのES細胞に似ているiPS細胞に誘導再構成するのに十分であると実証した(Wernig M 等、In vitro reprogramming of fibroblasts into a pluripotent ES
cell-like state. Nature 2007; 448: 318-324)。
【0009】
最近、マウスの肝細胞と胃上皮細胞もiPS細胞に再構成されることが可能であるとは報告された。遺伝学細胞血統のトレーシング分析に表すように、iPS細胞は血統が固定された体細胞の直接再構成に由来する。レトロウイルスの、特定の遺伝子座位への整合が細胞核の再構成と関連するとは発見されていない(Aoi T 等、Generation of Pluripotent Stem Cells
from Adult Mouse Liver and Stomach Cells. Science 2008)。
【0010】
同一技術で上記の4つの転写因子をヒト皮膚線維芽細胞に導入してiPS細胞を得た研究者もいる。初代ヒト線維芽細胞様滑膜細胞も新生児線維芽細胞に由来する細胞系もiPS細胞に再構成できる。この種類のiPS細胞は、細胞形態、増殖能力、表面抗原マーカー、遺伝子発現プロファイリング、多能性幹細胞の特異的な遺伝子の後成の状態、及びテロメラーゼ活性などの面でhES細胞と似ている。そして、体外培養時及びマウスの体内テラトーマ形成際に共に3つの胚葉を有する異なる細胞類型に分化可能である(Takahashi K 等、Induction of pluripotent stem
cells from adult human fibroblasts by defined factors. Cell 2007; 131: 861-872)。それと同時に、Wisconsin大学のThomson研究グループも胎児線維芽細胞を誘導してhES細胞の基本特徴を有するヒトiPS細胞に転換することを報告した。相違する箇所は、彼らはレンチウイルスをベクターとして使用し、かつ形質導入のために14個の候補遺伝子からOct4、Sox2、Nanog、Lin28という4つの遺伝子を選択したことにある(Yu J 等、Induced pluripotent stem cell lines
derived from human somatic cells. Science 2007; 318: 1917-1920)。
【0011】
Park IH 等(Reprogramming of human somatic cells to pluripotency with defined
factors. Nature 2008; 451: 141-146)も胎児、新生児及び成人の皮膚又は肺からの初代線維芽細胞(そのうち、1名の健康な男性の皮膚生検による線維芽細胞を含む)を利用してYamanaka 研究グループの策略を採用して同一の結果を取得した。彼らはOct4と Sox2が iPS細胞に誘導再構成する過程において必須的であるとさらに発見した。この2つの転写因子のため、ヒトiPS細胞の多能性が維持された。Klf4とcMycはクロマチンの構造を変化させて、Oct4と Sox2との結合を促進することにより誘導の効率を向上させるためである。また、この研究の大切な意義は、皮膚生検による線維芽細胞をiPS細胞に誘導することにある。上記研究で表明したように、生検のヒト皮膚組織から体細胞を抽出して誘導することにより患者の特異的な幹細胞を製造するのは実行可能である。それで、細胞移植治療に存在する免疫排斥反応を解消する見込みがある。c-Myc遺伝子の導入はキメリックマウスの腫瘍発生率が20%に達する原因となり得るため、その将来の臨床応用を阻むことが可能である(Okita K, Ichisaka T, Yamanaka S. Generation of germline-competent
induced pluripotent stem cells. Nature 2007; 448: 313-317)。従って、Yamanaka研究グループの最近のレポートによれば、c-Myc以外の3つの遺伝子によってマウスとヒト皮膚線維芽細胞をトランスフェクションして培養条件を調整したらiPS細胞も得られる。c-Myc遺伝子を除外すると、将来の臨床応用の安全性が顕著に向上可能であるが、iPS細胞の生成効率が明らかに低減する(Nakagawa M 等、Generation of induced pluripotent stem cells without Myc from mouse
and human fibroblasts. Nat Biotechnol 2008; 26: 101-106)。
【0012】
しかしながら、大量のiPSに関する方法が既に開発されたが、iPSは今ウイルスを遺伝子ベクターとして使用する、効率が低い、及び癌遺伝子c-Mycを使用するなどの問題があるので、最適な方案としては、薬物を介して体細胞を直接にiPSに誘導して、化学成分が一定である培地に該過程及びその次の分化過程を進行させることにより、完全に安全な治療用細胞を得ることがある。だが、単に従来技術によってある薬物がある因子に取って代わることができると予知するのは不可能である。最適な方法としては、高処理スクリーニングが挙げられる。高処理スクリーニングを行うには、効率的で安定なiPS誘導システムが必要である。効率的にするのは孔径を低減して、同様なコストで処理を向上させるためである。安定にするのは、バッチ間の違いを解消するためである。百万種以上の薬物をスクリーニングする場合、反復可能性がとても重要である。
【0013】
しかし、現在のiPS誘導システムに用いられた培地はいずれも血清を必要としている。だが、血清に関しては、バッチ間の不安定さ以外、また大量の確定できない成分が存在し、かつ各成分の濃度は常に大幅な変化がある。それによって、血清は研究メカニズムにおいて生まれつきの劣勢がある。以上の理由で、出願人は無血清培地でiPSを誘導できるか否かを研究しようと考えられる。
【0014】
WO9830679は血清代替品( KnockOut Serum Replacement、KOSR)及びこの血清代替品を使用した無血清胚性幹細胞培地を報告した。しかし、この培地はiPSの増殖及び生成を支持できない。
【0015】
今まで、マウスの体細胞、特に取材しやすい線維芽細胞に全コースで血清無しにiPSを誘導することができると報告する文献がない。
【0016】
また、従来技術において、普通の多能性幹細胞の誘導方法は、ウシ胎児血清にフィーダーレイヤー細胞上で約14日間内、誘導率が約0.01〜0.5%である(Qin, D., Li, W., Zhang, J. & Pei, D. Direct generation of
ES-like cells from unmodified mouse embryonic fibroblasts by
Oct4/Sox2/Myc/Klf4. Cell Research 17,
959-962(2007)、Takahashi,K. & Yamanaka, S. Induction
of pluripotent stem cells from mouse embryonic and adult fibroblast cultures by
defined factors. Cell 126,
663-676(2006)、Meissner, A., Wernig, M.& Jaenisch,
R. Direct reprogramming of genetically unmodified fibroblasts into pluripotent
stem cells. Nature biotechnology 25,
1177-1181(2007)、Takahashi, K.等、Induction
of pluripotent stem cells from adult human fibroblasts by defined factors. Cell 131, 861-872(2007)、Yamanaka, S. Strategies and new developments in the generation of
patient-specific pluripotent stem cells. Cell
Stem Cell 1, 39-49(2007)参照)。
従って、本発明は、従来技術に比べて、より効率的で快速にフィーダーレイヤー細胞無しに多能性幹細胞を誘導する無血清培地を提供する。
【発明の概要】
【発明が解決しようとする課題】
【0017】
第一の方面において、本発明は基礎培地と、血清代替添加剤と、1種又は多種のチロシンキナーゼと、選択可能な他の成分とを含有する培養細胞の無血清培地を提供する。
【0018】
また、本発明による無血清培地は、さらに白血病抑制因子(LIF)を含有する。
【0019】
本発明の他方面において、前記無血清培地を使用して体細胞から多能性幹細胞を効率的に誘導する方法が提供される。それは、
(a) 1つ又は複数の幹細胞多能性因子を体細胞に導入するステップと、
(b) 本願に記載の無血清培地で細胞成長に適する条件で(a)中の導入された体細胞を培養することにより、体細胞を多能性幹細胞に誘導リプログラムするステップと、
(c) 誘導された細胞の多能性を検知・分析するステップと、
(d) 多能性を有する誘導された多能性幹細胞のナノクローンを選択するステップと、
(e) 胚性幹細胞の成長に適する条件で(d)中のナノクローン細胞を培養するステップと、
を備える。
【0020】
本発明はさらに多能性の誘導方法に関する。その方法は、上記(a)-(e)のステップ以外、レポーター遺伝子を体細胞に導入し、ステップ(c)の前にレポーター遺伝子を介して多能性幹細胞の生成を指示し、その生成効率を検知するステップをさらに有する。
【0021】
さらに他方面において、本発明は、本発明に記載の無血清培地の、体細胞を快速で効率的に誘導して多能性幹細胞にリプログラムするための使用に関する。
【0022】
最後、本発明は、さらに本発明に記載の培地の、iPSシステムに誘導された多能性幹細胞を用いて、化合物をスクリーニングし、特に高処理スクリーニングするための使用に関する。
【図面の簡単な説明】
【0023】
【図1】4つの因子(4F、Oct4、Sox2、Klf4、c-Myc)によって感染されたMEFはmKSR培地に成長することもできないし、iPSコロニーを生成することもできない。コントロールは既知の典型的な方法で血清培地(mES)に培養したiPS細胞である。スケール 100μM
【図2a】血清含有幹細胞培地より無血清iPS-SF1のほうがよりよくiPSの生成を支持することができる。MEFのFBS培地及びiPS-SF1培地における成長曲線(n=3)。
【図2b】4因子(4F、Oct4、Sox2、Klf4、c-Myc)又は3因子(3F、Oct4、Sox2、Klf4)によって感染されたMEF細胞上で異なる時点にOct4-GFP陽性細胞のFACS分析を行った。感染された細胞はそれぞれmES培地及びiPS-SF1培地に培養された。N=2、エラバーがs.dと指示された。
【図2c】4因子によって感染されたMEF細胞はそれぞれmES培地及びiPS-SF1培地に培養された。6日間後、細胞が多能性にリプログラムされたと指示するOct4-GFPが単にiPS-SF1に培養された細胞に発現され、かつクローン形態が形成されたのに対し、典型的な血清培地mESに培養されたMEF細胞にはOct4-GFPが発現されていないことが見える。スケール 100μM
【図3a】無血清培地iPS-SF1に由来する人工多能性幹細胞(iPS)系は多能性を有する。感染後、iPS-SF1によって培養して得られたiPS細胞系は典型的なマウス幹細胞と似ている隆起性のクローン形態を有し、かつ多能性を指示するOct4-GFPを強く発現した。
【図3b】感染後、iPS-SF1によって培養して得られたiPS細胞系は胞胚に注射した後にキメリックマウスを形成することができる。ドナー胞胚が白いICRマウスである。マウスの黒い毛髪から分かるように、メキリックが既に発生した。それで、iPS-SF1によって培養して樹立されたiPS細胞系は体内正常発育に参与する能力がある。
【図4】8つの異なる培養条件で、感染後の第7日、以上述べたように、4因子によって感染された時にOct4-GFP陽性細胞のパーセンテージを測定した。iPS-SF1サンプルの値を1に設定した。左側の4つのバーは3種の補充物をそれぞれiPS-SF1に添加したことによる積極作用を指示した。Mock培地には、10%KOSRを有するDMEMが補充された。右側の4つのバーはそれぞれiPS-SF1から各成分を解消したことによる消極作用を表明した。
【図5】血清はリプログラムの強抑制剤である。4因子によって感染されたMEF細胞に対して、感染後の第7日にOct4-GFP陽性細胞のパーセンテージを分析した。血清を異なる濃度でiPS-SF1に補充した。N=2、エラバーがs.dと指示された。
【図6】iPS-SF1がスクリーニングツールとして機能する。よく見られる各信号経路のターゲット化合物を選択した。破線はその値が1と設定されたコントロールサンプルの値を示した。n=2、エラバーがs.dと指示された。
【図7】Oct4/Sox2/Klf4の3因子に媒介されたiPS過程におけるNanogプロモーターのメチル化分析。3因子によって感染された線維芽細胞はそれぞれmES(血清含有培地)及びiPS-SF1に培養された。感染後の第2日と第6日のサンプルを取って重硫酸塩配列決定法でNanogプロモーターのメチル化状態を分析した。白丸はメチル化されていないCpGヌクレオチド対を表すのに対し、黒丸はメチル化されたCpGヌクレオチド対を表す。
【図8】異なる成長因子(チロシンキナーゼ及びエストロゲンを含む)のリプログラムにおける効果。それぞれ成長因子を有しないiPS-SF1に図面の成長因子を添加し、且つ感染後の第7日にOct4-GFPを分析した。そのうち、E2はエストロゲンであり、FBS培地はネガティブコントロールとして機能する。n=2、エラバーがs.dである。
【図9】異なる培地に培養された感染したMEFの代表的なFACS図。PE経路からの信号は自発蛍光のコントロールとして用いられた。そのうち、iPS-SF1は4因子及び3因子によって感染されたMEFにおいて、感染後の第7日にともにOct4-GFP群を顕著に改善した。
【発明を実施するための形態】
【0024】
定義と技術
他に明記しない限り、本発明の実践は分子生物学、微生物学、細胞生物学、免疫学及び組換DNAの伝統的な技術を採用する。それは本分野の技術範囲に属する。例えば、Sambrook、Fritsch、及び Maniatis、分子クローニング:実験マニュアル、第3版(2002); CURRENT PROTOCOLS IN MOLECULAR
BIOLOGY (F.M. Ausubel 等編著(1987)); METHODS IN ENZYMOLOGY
(Academic Press, Inc.): PCR 2: A PRACTICAL APPROACH
(M.J. MacPherson, B.D. Hames & G.R. Taylor 編著,(1995)
), Harlow & Lane編著, (1988) ANTIBODIES, A LABORATORY
MANUAL and ANIMAL CELL CULTURE (R.I. Freshney編著,
(1987)); W. French Anderson 等、 HANDBOOK OF STEM CELLS,
vol.2参照。
【0025】
他に説明しない限り、本発明で用いられる専門用語はいずれも当業者が通常に理解する意味がある。本発明を容易に理解するため、本文で用いられる専門用語の一部を下記のように定義する。
【0026】
明細書及び添付の特許請求の範囲中で使用される単数形の表現は文脈が明確に指示しない限り複数の指示対象を含む。従って、例えば、「細胞」は、複数のそのような細胞をも包含し、その混合物を包含する。
【0027】
数字表示、例えば、pH、温度、時間、濃度、及び分子量(範囲を含む)は、いずれも近似値である。いつも明瞭に記述するのではないが、すべての場合において、用語「約」によって修飾されていると理解されるべきである。いつも明瞭に記述するのではないが、本発明における試薬はただ例として挙げられるに過ぎなく、その等価物も本分野の既知のものであるとも理解されるべきである。
【0028】
本発明における「(人工)多能性幹細胞(iPS細胞)」とは体細胞のリプログラムを誘導する幹細胞多能性因子によって体細胞を体外で誘導変化させてなった細胞である。該iPS細胞はES細胞の培養条件で、細胞形態、成長特性、表面マーカー発現、及び皮下に移植した後、三胚葉組織細胞構造を含むテラトーマの形成などの面でマウスのES細胞と非常に似ているだけでなく、DNAメチル化パターン、遺伝子発現プロファイリング、クロマチン状態、及びキメリック動物の生成等の面でもマウスのES細胞とほとんど完全に似ている。
【0029】
本発明における「基礎培地」とはいずれの細胞成長を支持できる培地を指す。基礎培地は、亜鉛、鉄、マグネシウム、カルシウム、及びカリウムのような標準的な無機塩、及びビタミン、グルコース、バッファシステム、並びにキーアミノ酸を提供する。本発明に用いられる基礎培地は、Dulbecco’s Modified Eagle’s Medium (DMEM)、Minimal
Essential Medium (MEM)、Basal Medium Eagle (BME)、RPMI 1640、F-10、F-12、αMinimal Essential Medium (αMEM)、Glasgow’s
Minimal Essential Medium(G-MEM )、及びIscove’s Modified Dulbecco’s Mediumを含むが、それに限定されるものではない。当業者は、如何にして培養しようとする細胞に適する基礎培地を選択するかをよく知っている。好ましい実施形態において、基礎培地は、DMEMとF12との混合物(1:1)又は高グルコースのDMEMである。より好ましい実施形態において、基礎培地は高グルコース(例えば、4.5g/L)を有するDMEMである。
【0030】
本発明における「血清代替添加剤」とは細胞培養中で基礎培地に加えて、血清の細胞生存成長に対する支持作用に部分的に又は全部取って代わる添加剤を指す。一般的には、インスリン、トランスメタロプロテイン(transmetalloprotein)、微量元素、及びビタミンなどの因子を含む。これらの因子に関しては、一般的には、基礎培地に含まれるのではなく、通常に細胞培養用血清に提供されたのである。血清代替添加剤は、1つ又は複数のインスリン及びインスリン代替品、1つ又は複数のトランスメタロプロテイン及びトランスメタロプロテイン代替品、1つ又は複数の微量元素、1つ又は複数のビタミン、1つ又は複数のアミノ酸、1つ又は複数のホルモン及びホルモン様化合物、血清アルブミン又は血清アルブミン代替品、及び1つ又は複数の脂質からなる群より選ばれた少なくとも1種又は多種の細胞成長を支持する成分を含有する。多種市販の血清代替添加剤、例えば、KnockOut Serum Replacement (KOSR)、N2、B27、Insulin-Transferrin-Selenium Supplement
(ITS)、G5などが当業者にとって容易に得られるものである。これらの添加剤は成分が確実であるという特徴がある。そのため、その培地における割合によりその各成分の濃度を確定することができる。
【0031】
当業者は、従来技術によって、培養しようとする細胞の類型及び他の方面に基づいて血清代替添加剤を容易に調製することができる。好ましくは、本発明に用いられる血清代替添加剤がKOSR、N2、及び/又はB27を所定の割合で混合して得られた混合添加剤であり、より好ましくは、最終培地において、KOSRが5〜20%の濃度を有し、N2が0〜1%の濃度を有し、B27が0〜2%の濃度を有する。最も好ましくは、最終培地において、KOSRの濃度が10%であり、N2の濃度が0.5%である。
【0032】
本発明で用いられる受容体型チロシンキナーゼは、全ての鑑定された及びすぐ鑑定される受容体型チロシンキナーゼ性質を具備する全ての受容体型チロシンキナーゼ成長因子を含む。好ましくは、受容体型チロシンキナーゼがbFGF、EGF、IGF2、又はVEGFから選ばれる。最も好ましくは、受容体型チロシンキナーゼがbFGFである。当業者は、培養しようとする細胞の類型及び他の条件に基づいて、細胞成長を維持するのに十分な受容体型チロシンキナーゼの濃度を容易に確定できる。前記濃度を約3〜20ng/mlとすることが好ましく、約5〜15ng/mlとすることがより好ましく、約7ng/mlとすることが最も好ましい。好ましい実施形態において、本発明の培地は約5ng/mlのbFGF、10ng/mlの EGF、25ng/mlのIGF2、及び/又は10ng/mlの VEGFを包含してよい。最も好ましい実施形態において、本発明の培地は、約5ng/mlのbFGF を含む。
【0033】
本発明で用いられるLIFは白血病抑制因子を指す。それは本分野の既知の幹細胞培養に通常に添加された成長因子である。当業者は具体的な条件によって具体的な培地に用いられるLIFの濃度を調整することができる。本発明の培地において、濃度が500〜2000U/mLであるLIF を添加することが好ましく、濃度が700〜1400U/mLであるLIF を添加することがより好ましく、濃度が約1000U/mLであるLIF を添加することが最も好ましい。
【0034】
当業者に知られているように、細胞の成長を促進するため、培地に別の成分を選択的に添加することもできる。当業者は培養しようとする細胞及び他の条件に基づいて具体的な培地に添加しようとする別の成分、例えば、L-グルタミン、NEAA MEM、及び2-メルカプトエタノール等を選択することを知っている。
【0035】
本発明による無血清培地は当業者の知っている通常の技術、例えば、A LABORATORY MANUAL and ANIMAL CELL CULTURE (R.I. Freshney 編著, (1987)); W. French Anderson 等、HANDBOOK OF
STEM CELLSに記載の血清の混合調製技術と条件により製造されたのである。
【0036】
本発明における「体細胞」という専門用語は、「生殖細胞」と「胚性幹細胞」に対して提出される概念である。「体細胞」は、「胚性幹細胞」から分化して生成した多能性を有しなく、ある具体的な機能を有する細胞である。「体細胞」は「胚性幹細胞」から分化し、又は内細胞塊を引き続き発育させて生成した多能性を有しなく、一般的に具体的な機能を有する細胞である。一般的には、発育段階が胞胚期(マウスにとって、具体的には、受精後の第3.5日後)の後にある胎児マウス又は成体マウスから体細胞を取る。その取材時、一般的には、多能性を有する可能性がある生殖細胞およびそのソース(例えば、精原幹細胞や生殖隆起幹細胞等)を取らないようにする。本発明で用いられる体細胞に関して、好ましくは哺乳動物に由来し、より好ましくはヒト、サル、犬、猫、ラット、又はマウスに由来し、最も好ましくはマウスに由来する。本発明における体細胞は機体内の任意類型の体細胞であってよく、好ましくは線維芽細胞又は脳膜細胞である。
【0037】
本発明に言及の「体細胞のリプログラムを誘導する幹細胞多能性因子」とは幹細胞の多能性の維持に肝心な因子であり、体細胞に前記因子を導入することにより一定の条件で体細胞を誘導して胚性幹細胞にリプログラムすることができる。目の前、複数のこのようなリプログラムに用いられる因子を報告した文献がたくさんある。例えば、Qin, D., Li, W., Zhang, J. & Pei, D. Direct generation of
ES-like cells from unmodified mouse embryonic fibroblasts by
Oct4/Sox2/Myc/Klf4. Cell research 17,
959-962 (2007)、Okita, K.,
Ichisaka, T. & Yamanaka, S. Generation of germline-competent induced
pluripotent stem cells. Nature 448,
313-317 (2007)、Wernig, M.等のIn
vitro reprogramming of fibroblasts into a pluripotent ES-cell-like state. Nature 448, 318-324 (2007)、Yamanaka, S. Strategies and new developments in the generation of
patient-specific pluripotent stem cells. Cell
Stem Cell 1, 39-49 (2007)等参照。当業者はもう多種のこの用途の幹細胞多能性因子を知っている。前記多能性因子は、Oct4、Sox2(選択的には、Sox1)、C-myc(選択的には、L-Myc又はN-Myc)
、及びKlf4(選択的には、Klf5又はKlf2)、Esrrb、Nanog、及びLin28を包含することが好ましい。上記多能性因子はその導入しようとする細胞によって任意の起源から得られる。好ましくは、マウスの多能性因子及びその異形、例えば、Sox2(NCBI登録番号:NM_011443.3;マウスのSRY-ボックス含有遺伝子2)、Oct4(NCBI登録番号:NM_013633.2;マウスのPOUドメイン、5類、転写因子1(Pou5f1))、Klf4(NCBI登録番号:NM_010637.2(マウスのKruppel様因子4)、c-Myc(NCBI登録番号:NM_010849.4(マウスの髄細胞瘤病癌遺伝子)、Sox1(NCBI登録番号:NM_009233.3;マウスの含有遺伝子1SRY-ボックス)、Klf2(NCBI登録番号:NM_008452.2;マウスのKruppel様因子2(肺))、Klf5(NCBI登録番号:NM_009769.4;マウスのKruppel様因子5)、Nanog(NCBI登録番号:NM_028016)、又はLin28(NCBI登録番号:NM_145833)に由来する。C-Mycはさらにその突然変異体L-myc(登録番号:NM_008506.2;マウスのv-myc髄細胞瘤病ウイルス性癌遺伝子ホモログ1v、肺癌由来の(鳥類)((Mycl1))、またはN-Myc(登録番号:NM_008709.3;マウスのv-myc髄細胞瘤病ウイルスに関連する癌遺伝子、神経母細胞瘤誘導の(鳥類)(Mycn) に換えられる。
【0038】
本発明における「誘導(して)リプログラム」という専門用語(「誘導」と略される場合もある)とは、体細胞を多能性幹細胞に脱分化する過程を指す。好ましくは、幹細胞の多能性を維持するための多能性因子cDNAを体細胞に導入することにより、体細胞を多能性幹細胞に脱分化することが可能である(Takahashi
K, Yamanaka S. Cell. 2006; 126: 663-676; Werning M, Meissner A, Foreman R等、Nature. 2007; 448: 318-324; Yu J, Vodyanik MA, Smuga-Otto K 等、Science. 2007; 318: 1917-1920)。そのうち、前記多能性因子はOct4、Sox2(選択的には、Sox1)、C-myc(選択的には、L-Myc又はN-Myc)、Klf4(選択的には、Klf5又はKlf2)、Nanog、及びLin28からなる群から選ばれた1つまたは複数を包含することが好ましい。
【0039】
前記幹細胞多能性因子cDNAを体細胞に導入する方法は、当業者の熟知している多種技術(ウイルス感染、リポソームトランスフェクション、トランスポゾンによって媒介される挿入発現、膜貫通タンパク質、薬物誘導、電気穿孔、粒子衝撃等の各種の、DNAを細胞に導入する方法を含む)であってよい。cDNAを含むウイルスベクターを利用してトランスフェクションを行うことが好ましい。前記ウイルスベクターとしては、レンチウイルスベクターやレトロウイルスベクターなどの多種のウイルスベクターが挙げられる。実施例に述べるように、好ましくはレトロウイルスベクター(例えば、pMXベクター)である。
【0040】
本発明における「細胞成長に適する条件」とは、本分野の通常の幹細胞培養条件であり、各具体的な細胞系に適する、細胞の基本性質に影響を与えない修飾を含む。培養方法及び培養条件については、W. French Anderson等の HANDBOOK OF STEM CELLS, vol.2を参照。
【0041】
本発明におけるレポーター遺伝子は、細胞が既に外部誘導によって胚性幹細胞と類似する段階に転換されたことを指示できる遺伝子を指しており、トランスジーン又は相同組換えを介して蛍光タンパク質又は抵抗性を発現する配列の導入を包括する。当該配列は胚性幹細胞によって特異的に発現されるある遺伝子のプロモーターに制御されるため、細胞が胚性幹細胞の状態に達する場合、該蛍光タンパク質又は抵抗性遺伝子の発現を活性化することが可能である。それにより、この細胞は、ある検知可能な性状特徴(例えば、緑光を発する)を有しており、他の該状態にリプログラムされていない細胞と区分できる。本技術分野の慣用のレポーター遺伝子は、緑色蛍光タンパク質、アンピシリン抵抗性遺伝子のような抵抗性遺伝子を含む。当業者は細胞の培養条件と用途によって、各種実施例に適するレポーター遺伝子を選択することができる。例えば、Young II Yeom 等、Germline regulatory element
of Oct-4 specific for the totipotent cycle of embryonal cells, Development
122,000-000 (1996), Printed in Great Britain, The company of Biologists Limited
1996, P881-894; Shin-ya Hatano 等、Pluripotential
competence of cells associated with Nanog activation, Mechanisms of Development
122(2005), 67-79参照。
【0042】
本発明における細胞多能性の検知方法は当業者の熟知しているものである。例えば、Yamanaka, S.
Strategies and new developments in the generation of patient-specific
pluripotent stem cells. Cell Stem Cell 1, 39-49 (2007)等参照。前記方法は、多能性分子マーカーの発現の鑑定、細胞のメチル化状態の検知、胚様体EBの形成、テラトーマの形成、及び誘導された多能性幹細胞の応用によるキメリックマウスの生成などを含む。
【0043】
本発明における「キメリックマウス」は、当業者の熟知している「キメリックマウス」に係わる技術を通して実施されたのである。具体的には、胚性幹細胞又は本発明の技術によって得られたiPS細胞をマウスの胞胚に注射して、胞胚中の胚性細胞と混合させて、共に代理母としてのマウスの子宮に成長発育させる。出生後、マウスの全身の各組織は2種の胚性細胞を混合してなる(モサイクパターンのようである)。このようなマウスはキメリックマウスと称される(Evans M J等; The ability of EK cell to
form chimeras after selection of clones in G418 and some observation on the
integration of retroviral vector proviral DNA into EK cells [M]; Cold Spring
Harbor Symposia on Quantitative Biology; 1985; Xian MW, Wu BY, Hu XL, Shang KG,
Wu HL, 1996. Construction of chimeric mice of ES cells by microinjection
method. Hereditas (北京) 18(1): 7-10 (中国語))。iPSを利用してキメリックマウスを形成できるか否かは、iPSが胚性幹細胞と類似する性質を有するかどうかを検証する最も直接で肝心な証拠である。
【0044】
本発明における「化合物のスクリーニング」とは、指定した化合物庫において、レポーター遺伝子又は細胞自身の特性を検知することにより、(1)、iPS過程及び誘導条件に影響を及ぼす化合物と、(2).既知のiPS誘導過程に必要とするある乃至全部の因子に取って代わることができる化合物をスクリーニングすることを指す。当業者は、既にiPS過程を利用して化合物をスクリーニングする方法を開発した。例えば、Yan Shi 等、Induction of Pluripotent Stem Cells from Mouse
Embryonic Fibroblasts by Oct4 and Klf4 with Small-Molecule Compounds、 Cell Stem Cell 3、 568-574、2008年11月6日を参照。
【0045】
本発明における「高処理」スクリーニング方法は、当業者の知っているものであり、自動化器械設備及び比較的少ないサンプル使用量を利用して、短い期間内に1つの大きい文庫中の全ての個体が特定の実験モデルに果たす作用に対してスクリーニングを行うことを指す。例えば、Nil Emre等、A chemical approach to stem cell
biology、 Current Opinion in Chemical Biology 2007、 11: 252-258を参照。当該方法は大規模の化合物庫や天然物庫において、iPS過程に対する高処理スクリーニングに用いられるのである。
【実施例】
【0046】
以下、実施例を本発明のモードの例示として挙げて発明者の標準実験室の実践を説明するが、本発明はこれに限定されるものではない。本発明の開示及び当業者の普通のレベルにより、以下の実施例は単に例示として挙げられるに過ぎなく、本発明の範囲内に各種の変更、修飾及び改善を行うことが許容される。特に説明しない限り、それに係る技術はいずれも当業者の熟知している分子生物学、細胞生物学、生物化学等の分野における通常の技術である。
【0047】
本発明で使用される技術の概要:
特に説明しない限り、本発明に言及される各種物質は、全てInvitrogenに由来する。
【0048】
細胞培養:
マウス胚性線維芽細胞はOct-GFPトランスジーンアレル及びRosa26アレルの半接合のe13.5の胚に由来し、かつ10%FBS、L-グルタミン、及びNEAAを補充した、高グルコースのDMEMという線維芽細胞培地に培養された。iPS及びES細胞は、共に血清を含む培地(mES)及び無血清培地(mKSR)中のMEFフィーダーレイヤー上に培養された。各種培地の本発明における名称及び成分については、表1を参照。MEFフィーダーレイヤー細胞はマイトマシンCによって不活性にされた。
【0049】
【表1】

【0050】
レトロウイルスの生産及びiPS細胞の生成
AddgeneからマウスのOct4、Sox2、Klf4、c-Mycを含むDNAのレトロウイルスベクター(pMXs)を購買した。従来技術によって、ウイルスの生成及び感染を進行させた(Qin, D., Li, W., Zhang, J. &
Pei, D. Direct generation of ES-like cells from unmodified mouse embryonic
fibroblasts by Oct4/Sox2/Myc/Klf4. Cell
research 17, 959-962 (2007); Qin, D. 等のMouse meningiocytes express Sox2 and yield high
efficiency of chimeras after nuclear reprogramming with exogenous factors. J Biol Chem 283, 33730-33735 (2008))。要するに、通常の方法を利用してこれらのプラスミドをPlatE細胞にトランスフェクションした。その後、ウイルス上澄液を集め、48時間ろ過して、MEFを感染した。そのうち、ポリブレンが補充された。第2日、上記と同様の工程を繰り返した。ウイルス上澄液を除去した日を感染後の第0日と定義した。ウイルスによって感染された(つまり、Oct4、Sox2、Klf4、及び/又はc-Mycによってトランスフェクションされた;以下、特に説明しない限り、3因子感染はOct4、Sox2、Klf4による感染を表す;4因子感染はOct4、Sox2、Klf4、及びc-Mycによる感染を表す)線維芽細胞が本発明の培地に培養された。感染後の第10-15日、iPSコロニーを選択した。それはOct-GFP(つまり、蛍光顕微鏡で蛍光を発するコロニー)及び典型的なES形態に基づいて選択したのである。その後、ES細胞のようにその選択されたコロニーを拡張して保持した(上述のQin, D., Li, W., Zhang, J. & Pei, D, 2007; 及び Qin, D. 等, 2008)。
【0051】
リプログラムの効率に対する定量化
リプログラムの効率を定量化する主な方法は、Oct4-GFP陽性細胞に対するFACS分析である。タイミングプロセスの結果をもとに、感染後の第7日と第9日にトリプシンで感染されたMEF細胞を消化し、次に、FACSCaliburを通して分析した。GFP陽性の細胞はPE経路からの制御信号のゲートを受けて、少なくとも15000個のイベントを記録した。pMXs-FLAGによって感染された細胞をネガティブコントロールとして使用した。FACSによる分析の効率を実証するために、直接に蛍光顕微鏡で感染後の第14日のGFP-ポジティブコロニーをカウントした。
【0052】
iPS細胞の特徴づけ
アルカリホスファターゼ染色及び免疫蛍光染色を行った(上述のQin, D., Li, W., Zhang, J. & Pei, D, 2007; and Qin,
D. 等, 2008)。マウスanti-Oct4(Santa
Cruz)、マウスanti-SSEA1(Abcam)、及びマウスanti-Nanog(Abcam)という一次抗体を使用した。
【0053】
実施例1:伝統的なmKSR培地は、4つの因子によってトランスフェクションされたMEFの成長も維持できないし、iPSの形成も誘導できない。
【0054】
以上述べたように、4因子のウイルスを1:1:1:1の割合で混合した後(いずれも1ml)、6ウェルプレートの1つのウェル中の合計で3.5万個の線維芽細胞に感染し、且つ37°Cで5%CO2をもってそれぞれmKSRとmES培地に培養した。
【0055】
図1に示すように、mKSRに培養された4因子によってトランスフェクションされた線維芽細胞の成長が遅い。第12日にも依然として多能性細胞の細胞コロニー形態が形成されなかった。言い換えれば、mKSR培地はiPSコロニーを誘導して生成することができない。
【0056】
実施例2:iPS-SF1培地を応用することにより、iPSの誘導効率を極大に向上できる。
【0057】
A.MEFをそれぞれFBSとiPS-SF1培地に培養した。その成長曲線がほとんど同じである。それで、iPS-SF1がMEFの培養に影響を及ぼさないとは分かる。それに対して、mKSR中のMEFの成長は大体停止した(図2a)。
【0058】
それぞれ3つの因子(Oct4、Klf4、及びSox2)又は4つの因子(cMyc、Oct4、Klf4、及びSox2)によって線維芽細胞にトランスフェクションした後、前記トランスフェクション後の細胞をそれぞれiPS-SF1培地に培養した。トランスフェクション後の第2、5、7日に、上述したようにGFP陽性細胞の効率を測定した。観察した結果、4つの因子によってトランスフェクションされた細胞であれ、3つの因子によってトランスフェクションされた細胞であれ、両方は高い効率を表した(図2b)。第7日に、18%という高い効率に達成した。伝統的な方法(図面に示すmESコントロール)と比べて、非常に大きく向上した。
【0059】
対応するように、この過程において蛍光顕微鏡で直接に観察すると、iPS-SF1培地によって培養されたトランスフェクション後の細胞に関しては、トランスフェクション後の第6日にOct4-GFPを強く発現する胚性幹細胞様クローンが出現したとは発見できる。それに反して、伝統的な培地に形成したクローンは蛍光発現がない(図2c)。
【0060】
同様に、図9に示すように、第7日にそれぞれ3因子と4因子によって感染されたMEF細胞を収穫した後、それに対してFACS効率分析を行った。通常のmES培地(iPS-SF1 vs mES: 3因子: 0.07% vs 17.82%;4因子:0.10% vs 15.07%)よりもiPS-SF1における感染後のMEF細胞のiPSリプログラム効率(上述したようである;つまり、Oct4-GFP陽性細胞の総細胞に対するパーセンテージで表す)がはるかに高い。
【0061】
実施例3:iPS-SF1によって誘導されたiPSは多能性を有する。
【0062】
A 誘導して得られたiPS細胞系は胚性幹細胞と似ている細胞形態を有する。
【0063】
以上述べたように、3因子によって線維芽細胞を感染し、且つその後、線維芽細胞をずっとiPS-SF1培地に培養した。感染後の第12-14日、クローン形態及び蛍光発現により典型的なクローン集塊を選び取った。数代の安定なつながりを通して、均一のiPS細胞系を形成した。
【0064】
図3aに示すように、左図は正常の胚性幹細胞であり、右図は上記iPS細胞系である。これらの細胞系は胚性幹細胞と非常に似ている形態を有し、Oct4-GFPの緑色蛍光を強く発現した。
【0065】
B キメリックマウスの生成は誘導して得られたiPS細胞系が多能性を有することを実証した。
【0066】
キメリックマウスの生成
注射用胞胚は4週齢の過剰排卵ICR雌マウス(白色)から取ったのである。該雌マウスを同品種の雄マウスと同一のかごに入れた。腟栓が見られてから3.5日(当日、腟栓が見られてから0.5日がある)、子宮と輸卵管から胚胎を集め、パラフィンオイルが覆われたM16培養ドロップレットに移入して、37°Cで5%CO2 保育器内に培養した。
【0067】
注射前の3時間、キメリック用iPS細胞(つまり、上述したiPS細胞系)のため、改めて新鮮な培養液を用意し、かつトリプシンで消化した後で単細胞懸濁液に作製した。適当なiPS細胞懸濁液と胞胚期の胚胎をM2注射ドロップレットに移入し、顕微注射システムで保持ピペットによって胞胚を固定し、注射針でiPS細胞を吸い取って、内細胞塊から離れたフィーダー部位に挿入し、胞胚のそれぞれに細胞を10-12個注射した。注射後、胞胚腔がなくなった。培養液に放置して保育器内に1−3時間培養して胞胚腔を回復させた後、腟栓が見られてから2.5dがある擬似妊娠の雌マウスの子宮に移入して培養した。
【0068】
図3bは、本発明による方法を使用して得られたiPSによって構成したキメリックマウスを示した。そのうち、ナンキメリックマウスが純白色である。キメリックマウスは、注射されたiPS細胞が黒いOG2/Rosa26マウスに由来したため、白と黒が交互になっている体色を呈した。それは、本発明による方法で得られたiPS細胞は正常の体内発育に参与してキメリックマウスを生成することができると示唆したとともに、これらの細胞は発育上で胚性幹細胞とは相違がないと示唆した。
【0069】
実施例4:本発明の培地は、iPS誘導過程における多能性遺伝子のプロモーターの脱メチル化を加速した。
【0070】
mES培地と本発明のiPS-SF1培地に培養された、Oct4、Sox2、Klf4という3因子に感染された(上述のように製造された)細胞系からゲノムDNA(700ng)を獲得した。50.6%の亜硫酸水素ナトリウム(Sigma S-1516)と10mMヒドロキノン(Sigma H−9003)との混合物に一晩露出することにより、亜硫酸水素塩による修飾を行った。PCRを通して表2に記載のプライマー対を使用してNanogのプロモーター領域を拡張した。PCR産物をフラットpMD8-Tベクター(Takara)にクローニングして、DH5αに増殖すると共に配列決定した。
【0071】
【表2】

【0072】
iPS誘導過程において、最終的には、内在的に発現された多能性遺伝子を活性化して、外因性発現に依存せずにiPSの自己再生を自発に維持しなければならない。従って、リプログラムに伴って、多能性遺伝子のプロモーターは、脱メチル化過程を有する。当該実施例において、Oct4、Sox2、Klf4という3つのウイルス(1:1:1)によってMEFを感染し、かつそれぞれ伝統的なmES培地と本発明のiPS-SF1培地に培養した。感染後の第2日と第6日に細胞サンプルを受け取って、ゲノムDNAを抽出した。DNAaseで切断した後、重硫酸塩で処理した。一晩経過後、メチル化されていないCpG塩基対中のC(シトシン)をU(ウラシル)に変化させてから、ネステッドPCRを用いて拡張してNanogのプロモーターを出して、本分野の既知の配列決定会社(例えば、Invitrogen)に渡して配列を決定した。配列の決定結果に基づいて、iPS過程におけるNanogプロモーターのメチル化変化状態を分析した。
【0073】
図7に示すように、3因子によって感染されたMEFについて、mESにおいてNanogプロモーターの脱メチル化が緩やかに進行する(D2:33%、D6:41.7%)のに対し、本発明の培地(iPS-SF1)において迅速に進行した。具体的には、本発明の培地における脱メチル化は第2日に66.7%に達成し、引き続き進行した結果、第6日に既に80.9%に達成した。この結果は、Nanogプロモーター中の検知されたフラグメントは既に基本的に活性化されたことを示している。Nanog という典型的な幹細胞多能性因子の活性化は、iPSが誘導されたことを表している。
【0074】
上記の実施例を見て分かるように、本発明のiPS-SF1培地はiPSのリプログラムをうまく誘導できるばかりでなく、該誘導されたリプログラムは発癌性のc-Myc遺伝子による感染を避けることができる。そのうえ、リプログラムの効率や脱メチル化の速度の面で、iPS-SF1培地は既存のmES培地よりはるかに高い。
【0075】
実施例5:本発明の培地における各成分のiPSリプログラム効率に対する影響
【0076】
表1に列挙したiPS-SF1培地中のLIF、N2、及びbFGFをそれぞれ除去し、又はDMEM+10%KOSR(つまり、成長因子を含まずにNEAAやL-グルタミン等の成分を含む;以下、bKSRという)培地にそれぞれiPS-SF1に該当する濃度でN2とbFGFを加えることにより、LIF、N2、及びbFGFの4因子によってトランスフェクションされたMEF細胞のiPSリプログラム効率に対する影響を検知した。図4中の各表記の意味は以下の通りである。
Mock: bKSR
Mock + LIF: bKSR + LIF
Mock + N2: bKSR-LIF +
N2
Mock + bFGF: bKSR-LIF
+ bFGF
iPS-SF1−LIF: LIFフリーiPS-SF1
iPS-SF1−N2: N2フリーiPS-SF1
iPS-SF1−bFGF: bFGFフリーiPS-SF1
【0077】
これにて分かるように、本分野の既知のLIFよりもbFGFのほうがiPSリプログラム効率に大きな影響を与えた。
【0078】
実施例6:血清のiPS-SF1培地に培養されたiPS細胞のリプログラムに対する抑制作用
【0079】
図5に示すように、iPS-SF1培地に2%、4%、6%、8%、及び10%の血清をそれぞれ加えたとき、既知の従来技術と相違する箇所は、血清はiPSリプログラム効率を96%まで抑制したことにある。
【0080】
実施例7:他のチロシンキナーゼの本発明の培地に対する影響
【0081】
他のチロシンキナーゼ及びエストロゲンも本発明の培地にiPSリプログラムの誘導過程に作用を果たせるかどうかを調査するために、4因子のウイルスによってMEFを感染した後、以下の培地に換えた。そのうち、ブランクコントロールはbFGFを含有しないiPS-SF1であり、実験群は各種受容体型チロシンキナーゼ(塩基性線維芽成長因子bFGF、表皮成長因子EGF、血管内皮成長因子VEGF、インスリン様成長因子2 IGF2、及びエストラジオルを含む)が添加されたブランク培地(つまり、bFGFを含有しないiPS-SF1)である。血清培地(FBS)は該実験のネガティブコントロールとして挙げられたのである。
【0082】
図8に示すように、bFGFを除き、他のチロシンキナーゼ(例えば、EGF, IGF2、VEGF、及びエストロゲン)はいずれもiPSリプログラム過程に対する誘導になかなか大きい作用を果たした。
【0083】
実施例8:iPS-SF1培地中のiPS過程において化合物をスクリーニングした。
【0084】
MEF細胞20,000個を12ウェルプレートの各ウェルに植えた。iPS-SF1を培地とした。次に、上述したように、ウイルスによって細胞を感染して、4因子によるトランスフェクションを行った。図6に示す各種化合物をそれぞれ下記の濃度で培地に添加した:PD0325901 (1 μM)、CHIR99021 (3 μM)、SU5402 (2 μM, EMDbiosciences)、Y-27632 (10
μM)、ビタミン E (25 μM, Sigma)、ビタミン
A (1 μM, Sigma)、A83-01 (0.5 μM, EMD)、SB203580 (2 μM)、Dorspmorphin (3 μM, Sigma)、PFF-a (10 μM)、TSA (20 nM, Sigma)、VPA (1 mM, EMD)、JAK 抑制剤(0.3 μM, EMD)、5aza-DC (1 μM, Sigma)、BIX01294 (1 μM)、Bayk8644 (2 μM, EMD)。
【0085】
感染後の第7日に、上述したようにFACS分析のため細胞を集めて、相対的なGFP効率を測定した。明らかなように、TSAとVPAはiPSリプログラムの効率を顕著に向上させた(100%)。それに対して、本発明の培地を使用した場合、PD0325901、 CHIR99021、及びSU5402のような当初に報告されたマウス胚性幹細胞の自己再生に有利な化合物はiPSリプログラムの効率を低減した。
【特許請求の範囲】
【請求項1】
基礎培地と、血清代替添加剤と、1つ又は複数のチロシンキナーゼとを含む多能性幹細胞を誘導する無血清培地。
【請求項2】
白血病抑制因子(LIF)をさらに含む請求項1に記載の無血清培地。
【請求項3】
基礎培地はDulbecco’s Modified Eagle’s Medium (DMEM)、Minimal Essential Medium
(MEM)、Basal Medium Eagle (BME)、F-10、F-12、RPMI 1640、Glasgow’s
Minimal Essential Medium (GMEM)、a Minimal Essential Medium (aMEM)、Iscove’s Modified Dulbecco’s Medium及びM199を含むが、これらに限定されないことを特徴とする請求項1に記載の培地。
【請求項4】
血清代替添加剤は、1つ又は複数のインスリン及びインスリン代替品、1つ又は複数のトランスメタロプロテイン及びトランスメタロプロテイン代替品、1つ又は複数の微量元素、1つ又は複数のビタミン、1つ又は複数のアミノ酸、1つ又は複数のホルモン及びホルモン様化合物、血清アルブミン又は血清アルブミン代替品、及び1つ又は複数の脂質からなる群より選ばれた少なくとも1種又は多種の、細胞成長を支持する成分を含有することを特徴とする請求項1に記載の培地。
【請求項5】
血清代替添加剤はKnockOut
Serum Replacement (KOSR)、N2、B27、Insulin-Transferrin-Selenium Supplement (ITS)及び/又はG5から選ばれたことを特徴とする請求項1-4に記載の培地。
【請求項6】
血清代替添加剤はKnockOut
Serum Replacement (KOSR)、N2及び/又はB27から調製してなることを特徴とする請求項5に記載の培地。
【請求項7】
最終培地において、KOSRの濃度が5〜20%という範囲にあることを特徴とする請求項6に記載の培地。
【請求項8】
最終培地において、N2の濃度が0〜1%という範囲にあることを特徴とする請求項6又は7に記載の培地。
【請求項9】
最終培地において、B27の濃度が0〜2%という範囲にあることを特徴とする請求項6-8のいずれか一項に記載の培地。
【請求項10】
最終培地において、KOSRの濃度が5〜20%という範囲にあり、N2の濃度が0〜1%という範囲にあり、B27の濃度が0〜2%という範囲にあることを特徴とする請求項6に記載の培地。
【請求項11】
血清代替添加剤はKOSRとN2から調製してなることを特徴とする請求項5に記載の培地。
【請求項12】
最終培地において、KOSRの濃度が5〜20%という範囲にあり、N2の濃度が0〜1%という範囲にあることを特徴とする請求項11に記載の培地。
【請求項13】
最終培地において、KOSRの濃度が約10%であり、N2の濃度が約0.5%であることを特徴とする請求項12に記載の培地。
【請求項14】
チロシンキナーゼはbFGF、EGF、IGF2、又はVEGFから選ばれた少なくとも1種であることを特徴とする請求項1-13のいずれか一項に記載の培地。
【請求項15】
チロシンキナーゼがbFGFであることを特徴とする請求項14に記載の培地。
【請求項16】
最終培地において、bFGFの濃度が3〜20ng/mLという範囲にあることを特徴とする請求項15に記載の培地。
【請求項17】
最終培地において、bFGFの濃度が5〜15ng/mLという範囲にあることを特徴とする請求項15に記載の培地。
【請求項18】
最終培地において、bFGFの濃度が約5ng/mL又は約7ng/mLであることを特徴とする請求項17に記載の培地。
【請求項19】
チロシンキナーゼがEGFであることを特徴とする請求項14に記載の培地。
【請求項20】
最終培地において、EGFの濃度が約10ng/mLであることを特徴とする請求項19に記載の培地。
【請求項21】
チロシンキナーゼがIGF2であることを特徴とする請求項14に記載の培地。
【請求項22】
最終培地において、IGF2の濃度が約25ng/mLであることを特徴とする請求項21に記載の培地。
【請求項23】
チロシンキナーゼがVEGFであることを特徴とする請求項14に記載の培地。
【請求項24】
最終培地において、VEGFの濃度が約10ng/mLであることを特徴とする請求項23に記載の培地。
【請求項25】
前記培地は細胞成長に適する他の成分をさらに含むことを特徴とする請求項1-24のいずれか一項に記載の培地。
【請求項26】
他の成分はL-グルタミン、NEAA MEM、ピルビン酸ナトリウム及び2-メルカプトエタノールからなる群から選ばれたことを特徴とする請求項25に記載の培地。
【請求項27】
(a)1つ又は複数の幹細胞多能性因子を体細胞に導入するステップと、
(b)請求項1-26のいずれか一項に記載の培地で細胞成長に適する条件で(a)中の導入された体細胞を培養することにより、体細胞を多能性幹細胞に誘導するステップと、
(c)誘導された細胞の多能性を検知・分析するステップと、
(d)多能性を有する誘導された多能性幹細胞のナノクローンを選択するステップと、
(e)胚性幹細胞の成長に適する条件で胚性幹細胞培地に(d)中のナノクローン細胞を培養するステップと、
を備える体細胞から多能性幹細胞を効率的に誘導する方法。
【請求項28】
転写因子はOct4、Sox2、Klf4、c-Myc、Nanog、Esrrb及びLin28からなる群から選ばれたことを特徴とする請求項27に記載の方法。
【請求項29】
導入方法はウイルス感染、トランスフェクション、トランスポゾンによって媒介される挿入発現、膜貫通タンパク質、又は薬物誘導から選ばれたことを特徴とする請求項27に記載の方法。
【請求項30】
ウイルス感染はレトロウイルス又はレンチウイルスを使用することを特徴とする請求項29に記載の方法。
【請求項31】
前記体細胞は哺乳動物に由来することを特徴とする請求項27に記載の方法。
【請求項32】
前記体細胞はヒト、サル、豚、犬、猫、ラット、又はマウスに由来することを特徴とする請求項31に記載の方法。
【請求項33】
前記体細胞はマウスに由来することを特徴とする請求項32に記載の方法。
【請求項34】
前記体細胞が線維芽細胞又は脳膜細胞であることを特徴とする請求項27−33のいずれか一項に記載の方法。
【請求項35】
細胞多能性の検知方法は多能性分子マーカーの発現の鑑定、細胞のDNAメチル化状態の検知、胚様体EBの形成、テラトーマの形成、又は誘導された多能性幹細胞の応用によるキメリックマウスの生成を含むことを特徴とする請求項27-34のいずれか一項に記載の方法。
【請求項36】
請求項1-26のいずれか一項に記載の培地の、体細胞を効率的に誘導して多能性幹細胞を生成するための使用。
【請求項37】
前記体細胞は哺乳動物に由来することを特徴とする請求項36に記載の使用。
【請求項38】
前記体細胞はヒト、サル、犬、猫、ラット、又はマウスに由来することを特徴とする請求項37に記載の使用。
【請求項39】
前記体細胞はマウスに由来することを特徴とする請求項38に記載の使用。
【請求項40】
前記体細胞が線維芽細胞又は脳膜細胞であることを特徴とする請求項36-39のいずれか一項に記載の使用。
【請求項41】
(a)1つ又は複数の幹細胞多能性因子を体細胞に導入するステップと、
(b)請求項1-26のいずれか一項に記載の培地で細胞成長に適する条件で(a)中の導入された体細胞を培養することにより、体細胞を多能性幹細胞に誘導するステップと、
(c)誘導された細胞の多能性を検知・分析するステップと、
(d)多能性を有する誘導された多能性幹細胞のナノクローンを選択するステップと、
(e)胚性幹細胞の成長に適する条件で胚性幹細胞培地に(d)中のナノクローン細胞を培養するステップと、
(f)(d)に培養の誘導された多能性幹細胞を用いて化合物をスクリーニングするステップと、
を備える化合物をスクリーニングする方法。
【請求項42】
(f)中の化合物をスクリーニングするのは化合物を高処理スクリーニングするであることを特徴とする請求項41に記載の方法。
【請求項43】
前記体細胞は哺乳動物に由来することを特徴とする請求項41又は42に記載の方法。
【請求項44】
前記体細胞はヒト、サル、犬、猫、ラット、又はマウスに由来することを特徴とする請求項43に記載の方法。
【請求項45】
前記体細胞はマウスに由来することを特徴とする請求項44に記載の方法。
【請求項46】
前記体細胞が線維芽細胞又は脳膜細胞であることを特徴とする請求項41-45のいずれか一項に記載の方法。
【請求項47】
細胞多能性の検知方法は多能性分子マーカーの発現の鑑定、細胞のメチル化状態の検知、胚様体EBの形成、テラトーマの形成、又は誘導された多能性幹細胞の応用によるキメリックマウスの生成を含むことを特徴とする請求項41-46のいずれか一項に記載の方法。
【請求項1】
基礎培地と、血清代替添加剤と、1つ又は複数のチロシンキナーゼとを含む多能性幹細胞を誘導する無血清培地。
【請求項2】
白血病抑制因子(LIF)をさらに含む請求項1に記載の無血清培地。
【請求項3】
基礎培地はDulbecco’s Modified Eagle’s Medium (DMEM)、Minimal Essential Medium
(MEM)、Basal Medium Eagle (BME)、F-10、F-12、RPMI 1640、Glasgow’s
Minimal Essential Medium (GMEM)、a Minimal Essential Medium (aMEM)、Iscove’s Modified Dulbecco’s Medium及びM199を含むが、これらに限定されないことを特徴とする請求項1に記載の培地。
【請求項4】
血清代替添加剤は、1つ又は複数のインスリン及びインスリン代替品、1つ又は複数のトランスメタロプロテイン及びトランスメタロプロテイン代替品、1つ又は複数の微量元素、1つ又は複数のビタミン、1つ又は複数のアミノ酸、1つ又は複数のホルモン及びホルモン様化合物、血清アルブミン又は血清アルブミン代替品、及び1つ又は複数の脂質からなる群より選ばれた少なくとも1種又は多種の、細胞成長を支持する成分を含有することを特徴とする請求項1に記載の培地。
【請求項5】
血清代替添加剤はKnockOut
Serum Replacement (KOSR)、N2、B27、Insulin-Transferrin-Selenium Supplement (ITS)及び/又はG5から選ばれたことを特徴とする請求項1-4に記載の培地。
【請求項6】
血清代替添加剤はKnockOut
Serum Replacement (KOSR)、N2及び/又はB27から調製してなることを特徴とする請求項5に記載の培地。
【請求項7】
最終培地において、KOSRの濃度が5〜20%という範囲にあることを特徴とする請求項6に記載の培地。
【請求項8】
最終培地において、N2の濃度が0〜1%という範囲にあることを特徴とする請求項6又は7に記載の培地。
【請求項9】
最終培地において、B27の濃度が0〜2%という範囲にあることを特徴とする請求項6-8のいずれか一項に記載の培地。
【請求項10】
最終培地において、KOSRの濃度が5〜20%という範囲にあり、N2の濃度が0〜1%という範囲にあり、B27の濃度が0〜2%という範囲にあることを特徴とする請求項6に記載の培地。
【請求項11】
血清代替添加剤はKOSRとN2から調製してなることを特徴とする請求項5に記載の培地。
【請求項12】
最終培地において、KOSRの濃度が5〜20%という範囲にあり、N2の濃度が0〜1%という範囲にあることを特徴とする請求項11に記載の培地。
【請求項13】
最終培地において、KOSRの濃度が約10%であり、N2の濃度が約0.5%であることを特徴とする請求項12に記載の培地。
【請求項14】
チロシンキナーゼはbFGF、EGF、IGF2、又はVEGFから選ばれた少なくとも1種であることを特徴とする請求項1-13のいずれか一項に記載の培地。
【請求項15】
チロシンキナーゼがbFGFであることを特徴とする請求項14に記載の培地。
【請求項16】
最終培地において、bFGFの濃度が3〜20ng/mLという範囲にあることを特徴とする請求項15に記載の培地。
【請求項17】
最終培地において、bFGFの濃度が5〜15ng/mLという範囲にあることを特徴とする請求項15に記載の培地。
【請求項18】
最終培地において、bFGFの濃度が約5ng/mL又は約7ng/mLであることを特徴とする請求項17に記載の培地。
【請求項19】
チロシンキナーゼがEGFであることを特徴とする請求項14に記載の培地。
【請求項20】
最終培地において、EGFの濃度が約10ng/mLであることを特徴とする請求項19に記載の培地。
【請求項21】
チロシンキナーゼがIGF2であることを特徴とする請求項14に記載の培地。
【請求項22】
最終培地において、IGF2の濃度が約25ng/mLであることを特徴とする請求項21に記載の培地。
【請求項23】
チロシンキナーゼがVEGFであることを特徴とする請求項14に記載の培地。
【請求項24】
最終培地において、VEGFの濃度が約10ng/mLであることを特徴とする請求項23に記載の培地。
【請求項25】
前記培地は細胞成長に適する他の成分をさらに含むことを特徴とする請求項1-24のいずれか一項に記載の培地。
【請求項26】
他の成分はL-グルタミン、NEAA MEM、ピルビン酸ナトリウム及び2-メルカプトエタノールからなる群から選ばれたことを特徴とする請求項25に記載の培地。
【請求項27】
(a)1つ又は複数の幹細胞多能性因子を体細胞に導入するステップと、
(b)請求項1-26のいずれか一項に記載の培地で細胞成長に適する条件で(a)中の導入された体細胞を培養することにより、体細胞を多能性幹細胞に誘導するステップと、
(c)誘導された細胞の多能性を検知・分析するステップと、
(d)多能性を有する誘導された多能性幹細胞のナノクローンを選択するステップと、
(e)胚性幹細胞の成長に適する条件で胚性幹細胞培地に(d)中のナノクローン細胞を培養するステップと、
を備える体細胞から多能性幹細胞を効率的に誘導する方法。
【請求項28】
転写因子はOct4、Sox2、Klf4、c-Myc、Nanog、Esrrb及びLin28からなる群から選ばれたことを特徴とする請求項27に記載の方法。
【請求項29】
導入方法はウイルス感染、トランスフェクション、トランスポゾンによって媒介される挿入発現、膜貫通タンパク質、又は薬物誘導から選ばれたことを特徴とする請求項27に記載の方法。
【請求項30】
ウイルス感染はレトロウイルス又はレンチウイルスを使用することを特徴とする請求項29に記載の方法。
【請求項31】
前記体細胞は哺乳動物に由来することを特徴とする請求項27に記載の方法。
【請求項32】
前記体細胞はヒト、サル、豚、犬、猫、ラット、又はマウスに由来することを特徴とする請求項31に記載の方法。
【請求項33】
前記体細胞はマウスに由来することを特徴とする請求項32に記載の方法。
【請求項34】
前記体細胞が線維芽細胞又は脳膜細胞であることを特徴とする請求項27−33のいずれか一項に記載の方法。
【請求項35】
細胞多能性の検知方法は多能性分子マーカーの発現の鑑定、細胞のDNAメチル化状態の検知、胚様体EBの形成、テラトーマの形成、又は誘導された多能性幹細胞の応用によるキメリックマウスの生成を含むことを特徴とする請求項27-34のいずれか一項に記載の方法。
【請求項36】
請求項1-26のいずれか一項に記載の培地の、体細胞を効率的に誘導して多能性幹細胞を生成するための使用。
【請求項37】
前記体細胞は哺乳動物に由来することを特徴とする請求項36に記載の使用。
【請求項38】
前記体細胞はヒト、サル、犬、猫、ラット、又はマウスに由来することを特徴とする請求項37に記載の使用。
【請求項39】
前記体細胞はマウスに由来することを特徴とする請求項38に記載の使用。
【請求項40】
前記体細胞が線維芽細胞又は脳膜細胞であることを特徴とする請求項36-39のいずれか一項に記載の使用。
【請求項41】
(a)1つ又は複数の幹細胞多能性因子を体細胞に導入するステップと、
(b)請求項1-26のいずれか一項に記載の培地で細胞成長に適する条件で(a)中の導入された体細胞を培養することにより、体細胞を多能性幹細胞に誘導するステップと、
(c)誘導された細胞の多能性を検知・分析するステップと、
(d)多能性を有する誘導された多能性幹細胞のナノクローンを選択するステップと、
(e)胚性幹細胞の成長に適する条件で胚性幹細胞培地に(d)中のナノクローン細胞を培養するステップと、
(f)(d)に培養の誘導された多能性幹細胞を用いて化合物をスクリーニングするステップと、
を備える化合物をスクリーニングする方法。
【請求項42】
(f)中の化合物をスクリーニングするのは化合物を高処理スクリーニングするであることを特徴とする請求項41に記載の方法。
【請求項43】
前記体細胞は哺乳動物に由来することを特徴とする請求項41又は42に記載の方法。
【請求項44】
前記体細胞はヒト、サル、犬、猫、ラット、又はマウスに由来することを特徴とする請求項43に記載の方法。
【請求項45】
前記体細胞はマウスに由来することを特徴とする請求項44に記載の方法。
【請求項46】
前記体細胞が線維芽細胞又は脳膜細胞であることを特徴とする請求項41-45のいずれか一項に記載の方法。
【請求項47】
細胞多能性の検知方法は多能性分子マーカーの発現の鑑定、細胞のメチル化状態の検知、胚様体EBの形成、テラトーマの形成、又は誘導された多能性幹細胞の応用によるキメリックマウスの生成を含むことを特徴とする請求項41-46のいずれか一項に記載の方法。
【図1】


【図2a】


【図2b】


【図2c】


【図3a】


【図3b】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】




【図2a】


【図2b】


【図2c】


【図3a】


【図3b】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【公表番号】特表2012−524525(P2012−524525A)
【公表日】平成24年10月18日(2012.10.18)
【国際特許分類】
【出願番号】特願2012−506306(P2012−506306)
【出願日】平成21年9月30日(2009.9.30)
【国際出願番号】PCT/CN2009/074358
【国際公開番号】WO2010/121465
【国際公開日】平成22年10月28日(2010.10.28)
【出願人】(511255454)中国科学院広州生物医藥与健康研究院 (1)
【Fターム(参考)】
【公表日】平成24年10月18日(2012.10.18)
【国際特許分類】
【出願日】平成21年9月30日(2009.9.30)
【国際出願番号】PCT/CN2009/074358
【国際公開番号】WO2010/121465
【国際公開日】平成22年10月28日(2010.10.28)
【出願人】(511255454)中国科学院広州生物医藥与健康研究院 (1)
【Fターム(参考)】
[ Back to top ]

