多量体ペプチドコンジュゲートおよびその使用
本発明は、血液-脳関門(BBB)を通過するか、または特定の細胞型に効率的に進入することができる多量体(例えば、二量体、三量体)形態のペプチドベクターに関する。これらの多量体ペプチドベクターは、薬剤(例えば、治療剤)にコンジュゲートさせた場合、BBBを横断して、または特定の細胞型に該薬剤を輸送することができる。従って、これらの化合物は、神経疾患の治療において特に有用である。
Notice: Undefined index: DEJ in /mnt/www/gzt_disp.php on line 298
【特許請求の範囲】
【請求項1】
式:
【化1】

[式中、
nは1、2、3、4、5、6、7、8、9もしくは10であるか、または少なくとも1、2、3、4、5、6、7、8、9もしくは10であり;
mは2〜n+1の整数であり;
A1および各Amは、独立に配列番号1〜105および107〜117からなる群より選択される配列と実質的に同一であるアミノ酸配列またはその機能的断片を含むペプチドベクターであり;ならびに
各Xnは、独立に隣接するペプチドベクターに連結されたリンカーである]
を含む化合物。
【請求項2】
式:
【化2】

を含む、請求項1に記載の化合物。
【請求項3】
式:
【化3】

[式中、
A1、A2、各Aq、各Arおよび各Asは、独立に配列番号1〜105および107〜117からなる群より選択される配列と実質的に同一の配列またはその機能的断片を含むペプチドベクターであり;
A3は、配列番号1〜105および107〜117からなる群より選択される配列と実質的に同一の配列もしくはその機能的断片を含むペプチドベクターであるか、または存在せず;
X、各Xq、各Xrおよび各Xsは、独立にペプチドベクターを連結するリンカーであり;
m、nおよびpは、独立に0、1、2、3、4、5、6、7、8、9または10であり;
qは4〜m+3の整数であり;
rはm+4〜m+n+3の整数であり;ならびに
sはm+n+4〜m+n+p+3の整数である]
を含む化合物。
【請求項4】
前記化合物が、1個以上のリンカーまたは1個以上のペプチドベクターを介して、1種以上の薬剤にコンジュゲートされている、請求項1〜3のいずれか1項に記載の化合物。
【請求項5】
式:
【化4】

(式中、Bは薬剤であり、前記リンカーXにコンジュゲートされる)
を含む、請求項1または2に記載の化合物。
【請求項6】
式:
【化5】

[式中、
B1は薬剤であり、
B2およびB3は、独立に薬剤であるか、または存在せず、
Y1およびY2は、独立に、それぞれA1をB1に、およびA2をB2に連結するリンカーであり、
ここでB2が存在しない場合、Y2は存在しない]
を含む、請求項1または2に記載の化合物。
【請求項7】
式:
【化6】

を含む、請求項6に記載の化合物。
【請求項8】
(a)それぞれのペプチドベクターが独立に、配列番号1〜105および107〜117からなる群より選択される配列と実質的に同一のアミノ酸配列を含み、該ペプチドベクターがリンカーにより連結された、少なくとも2個のペプチドベクター;ならびに
(b)前記ペプチドベクターの少なくとも1個または前記リンカーにコンジュゲートされた薬剤、
を含む化合物。
【請求項9】
前記リンカーが、TMEA、β-[トリス(ヒドロキシメチル)ホスフィノ]プロピオン酸(THPP)、トリス-スクシンイミジルアミノトリアセテート(TSAT)、トリス-スクシンイミジル(6-アミノカプロイル)アミノトリアセテート(LC-TSAT)、トリス-スクシンイミジル-1,3,5-ベンゼントリカルボキシレート、マレイミド-3,5-ジスクシンイミジルイソフタレート(MDSI)、スクシンイミジル-3,5-ジマレイミドフェニルベンゾエート(SDMB)、テトラキス-(3-マレイミドプロピル)ペンタエリスリトール(Mal-4)、テトラキス-(N-スクシンイミジルカルボキシプロピル)ペンタエリスリトール)(NHS-4)からなる群より選択される、請求項1〜8のいずれか1項に記載の化合物。
【請求項10】
前記リンカーの少なくとも1個がマレイミド反応基を含む、請求項1〜8のいずれか1項に記載の化合物。
【請求項11】
前記リンカーが、トリス-(2-マレイミドエチル)アミン(TMEA)またはマレイミドプロピオン酸(MPA)、マレイミド-ベンゾイル-スクシンイミド(MBS)、γ-マレイミド-ブチリルオキシスクシンイミドエステル(GMBS)、マレイミドプロピオン酸(MPA)、マレイミドヘキサン酸(MHA)、およびマレイミドウンデカン酸(MUA)である、請求項10に記載の化合物。
【請求項12】
前記ペプチドベクターの少なくとも1個が、配列番号1〜105および107〜117からなる群より選択される配列と少なくとも85%同一であるアミノ酸配列を含む、請求項1〜11のいずれか1項に記載の化合物。
【請求項13】
前記ペプチドベクターの少なくとも1個が、配列番号1〜105および107〜117からなる群より選択されるアミノ酸配列を含む、請求項12に記載の化合物。
【請求項14】
前記ペプチドベクターの少なくとも1個が、Angiopep-1(配列番号67)、Angiopep-2(配列番号97)、cys-Angiopep-2(配列番号113)、Angiopep-2-cys(配列番号114)、および逆転Angiopep-2(配列番号117)からなる群より選択されるアミノ酸配列を含む、請求項13に記載の化合物。
【請求項15】
前記薬剤が治療剤である、請求項4〜14のいずれか1項に記載の化合物。
【請求項16】
前記治療剤が、抗癌剤、治療的核酸、GLP-1アゴニスト、レプチンもしくはレプチン類似体、ニューロテンシンもしくはニューロテンシン類似体、グリア由来神経栄養因子(GDNF)もしくはGDNF類似体、脳由来神経栄養因子(BDNF)もしくはBDNF類似体、および抗体からなる群より選択される、請求項15に記載の化合物。
【請求項17】
前記治療剤が抗癌剤である、請求項16に記載の化合物。
【請求項18】
前記抗癌剤が、パクリタキセル(Taxol)、ビンブラスチン、ビンクリスチン、エトポシド、ドキソルビシン、シクロホスファミド、ドセタキセル(Taxotere(登録商標))、メルファラン、およびクロラムブシル、アバレリックス、アルデスロイキン、アレムツズマブ、アリトレチノイン、アロプリノール、アルトレタミン、アミフォスチン、アナキンラ、アナストロゾール、三酸化ヒ素、アスパラギナーゼ、アザシチジン、生BCG、ベバクジマブ、ベキサロテン、ブレオマイシン、ボルテゾミブ、ブスルファン、カルステロン、カペシタビン、カルボプラチン、カルムスチン、セレコキシブ、セツキシマブ、シスプラチン、クラドリビン、クロファラビン、シタラビン、ダカルバジン、ダクチノマイシン、アクチノマイシンD、ダルテパリン、ダルベポエチンα、ダサチニブ、ダウノルビシン、ダウノマイシン、デシタビン、デニロイキン、デニロイキンジフチトックス、デキスラゾキサン、プロピオン酸ドロモスタノロン、エクリズマブ、エピルビシン、エポエチンα、エルロチニブ、エストラムスチン、エキセメスタン、フェンタニ、フィルグラスチム、フロキシウリジン、フルダラビン、フルオロウラシル、5-FU、フルベストラント、ゲフィチニブ、ゲンシタビン、ゲムツズマブオゾガミシン、ゴセレリン、ヒストレリン、ヒドロキシウレア、イブリツモマブチウキセタン、イダルビシン、イフォスファミド、イマチニブ、インターフェロンα-2b、イリノテカン、ラパチニブジトシラート、レナリドミド、レトロゾール、ロイコボリン、ロイプロリド、レバミソール、ロムスチン、CCNU、メクロレタミン(窒素マスタード)、メゲストロール、メルカプトプリン(6-MP)、メスナ、メトトレキサート、メトキサレン、マイトマイシンC、ミトタン、ミトキサントロン、ナンドロロンフェンプロピオネート、ネララビン、ノフェツモマブ、オプレルベキン、オキサリプラチン、パリフェルミン、パミドロナート、パニツムマブ、ペガデマーゼ、ペガスパルガーゼ、ペグフィルグラスチム、ペグインターフェロンα-2b、ペメトレキセド、ペントスタチン、ピポブロマン、プリカマイシン(ミトラマイシン)、ポルフィメル、プロカルバジン、キナクリン、ラスブリカーゼ、リツキシマブ、サルグラモスチム、ソラフェニブ、ストレプトゾシン、スニチニブ、タルク、タモキシフェン、テモゾロミド、テニポシド(VM-26)、テストラクトン、サリドマイド、チオグアニン(6-TG)、チオテパ、トポテカン、トレミフェン、トシツモマブ/I-131(トシツモマブ)、トラスツズマブ、トレチノイン(ATRA)、ウラシルマスタード、バルルビシン、ビノレルビン、ボリノスタット、ゾレドロナート、およびゾレドロン酸;またはその製薬上許容し得る塩からなる群より選択される、請求項17に記載の方法。
【請求項19】
前記抗癌剤がパクリタキセル、エトポシド、もしくはドキソルビシン、またはその類似体である、請求項16に記載の化合物。
【請求項20】
前記治療的核酸がRNAi剤である、請求項16に記載の化合物。
【請求項21】
前記RNAi剤がEGFRまたはVEGF発現を沈黙化させることができる、請求項20に記載の化合物。
【請求項22】
前記治療剤がGLP-1アゴニストである、請求項16に記載の化合物。
【請求項23】
前記GLP-1アゴニストがエキセンジン-4、またはGLP-1アゴニスト活性を有するその類似体もしくは断片である、請求項22に記載の化合物。
【請求項24】
前記GLP-1アゴニストがエキセンジン-4、[Lys39]エキセンジン-4、または[Cys32]エキセンジン-4である、請求項23に記載の化合物。
【請求項25】
前記治療剤がレプチンまたはレプチン類似体である、請求項16に記載の化合物。
【請求項26】
前記レプチンまたはレプチン類似体が、完全長ヒトレプチン、成熟ヒトレプチン(完全長ヒトレプチンのアミノ酸22〜167)、またはレプチン116-130である、請求項25に記載の化合物。
【請求項27】
前記治療剤がニューロテンシンまたはニューロテンシン類似体である、請求項16に記載の化合物。
【請求項28】
前記治療剤がヒトニューロテンシン、ヒトニューロテンシン(8-13)、またはpELYENKPRRPYIL-OH(式中、pEはL-ピログルタミン酸である)である、請求項27に記載の化合物。
【請求項29】
前記治療剤がGDNF、BDNF、またはその類似体である、請求項16に記載の化合物。
【請求項30】
前記薬剤が完全長GDNFまたはBDNF配列である、請求項29に記載の化合物。
【請求項31】
前記薬剤が成熟形態のGDNFもしくはBDNFであるか、またはヒトGDNF78-211である、請求項29に記載の化合物。
【請求項32】
前記抗体がモノクローナル抗体である、請求項16に記載の化合物。
【請求項33】
前記モノクローナル抗体がアミロイド-βタンパク質、またはその断片に特異的に結合する、請求項32に記載の化合物。
【請求項34】
前記モノクローナル抗体がR1450(Roche)、バピノイズマブ、ソラネズマブ(LY2062430; Eli Lilly)、BAN2401、PF-04360365(Pfizer)、およびGSK933776A(GlaxoSmithKline)からなる群より選択される、請求項33に記載の化合物。
【請求項35】
癌を有する被験体を治療するか、または予防的に治療する方法であって、前記癌を治療するのに十分な量の請求項17〜19および21のいずれか1項に記載の化合物を前記被験体に投与することを含む、前記方法。
【請求項36】
前記癌が、脳の癌、肝細胞癌、乳癌、マントル細胞リンパ腫、非ホジキンリンパ腫などの様々なリンパ腫を含む頭部および頸部の癌、アデノーマ、扁平細胞癌、咽頭癌、網膜の癌、食道の癌、多発性骨髄腫、卵巣癌、子宮癌、黒色腫、結腸直腸癌、膀胱癌、前立腺癌、肺癌(非小細胞肺癌を含む)、膵臓癌、頸部癌、頭部および頸部癌、皮膚癌、鼻咽頭癌、脂肪肉腫、上皮癌、腎細胞癌、胆嚢腺癌、耳下腺癌、子宮内膜肉腫、ならびに多剤耐性癌からなる群より選択される、請求項35に記載の方法。
【請求項37】
脳の癌が、星状細胞腫、毛様細胞性星状細胞腫、胚芽異形成性神経上皮腫瘍、乏突起膠腫、上衣腫、多形成グリア芽細胞腫、混合性神経膠腫、乏突起星細胞腫、髄芽腫、網膜芽腫、神経芽腫、胚細胞腫、および奇形腫からなる群より選択される、請求項36に記載の方法。
【請求項38】
代謝障害を有する被験体を治療するか、または予防的に治療する方法であって、該障害を治療するのに十分な量の請求項22〜28のいずれか1項に記載の化合物を前記被験体に投与することを含む、前記方法。
【請求項39】
前記代謝障害が糖尿病、肥満、肥満の結果としての糖尿病、高血糖症、脂質異常症、高トリグリセリド血症、X症候群、インスリン耐性、耐糖能異常(IGT)、糖尿病性脂質異常症、高脂血症、心血管疾患、または高血圧である、請求項38に記載の方法。
【請求項40】
前記障害が糖尿病である、請求項38に記載の方法。
【請求項41】
前記障害がII型糖尿病である、請求項40に記載の方法。
【請求項42】
前記障害が肥満である、請求項38に記載の方法。
【請求項43】
被験体による食物摂取を減少させるか、または被験体の体重を減少させる方法であって、食物摂取を減少させるか、または体重を減少させるのに十分な量の請求項22〜26のいずれか1項に記載の化合物を前記被験体に投与することを含む、前記方法。
【請求項44】
前記被験体が体重過多または肥満体である、請求項43に記載の方法。
【請求項45】
前記被験体が過食症患者である、請求項43に記載の方法。
【請求項46】
被験体における不安、運動障害、攻撃性、精神病、発作、パニック発作、ヒステリー、睡眠障害、アルツハイマー病、およびパーキンソン病からなる群より選択される障害を治療するか、または予防的に治療する方法であって、前記障害を治療するのに十分な量の請求項22〜24のいずれか1項に記載の化合物を前記被験体に投与することを含む、前記方法。
【請求項47】
被験体における神経発生を増加させる方法であって、有効量の請求項22〜24のいずれか1項に記載の化合物を前記被験体に投与することを含む、前記方法。
【請求項48】
前記被験体がパーキンソン病、アルツハイマー病、ハンチントン病、ALS、卒中、ADD、または神経精神症候群に罹患している、請求項47に記載の方法。
【請求項49】
神経発生の前記増加が、前記被験体における学習能力を改善するか、または神経保護を増強する、請求項47に記載の方法。
【請求項50】
被験体における肝臓の幹細胞/前駆細胞を機能的膵臓細胞に変換する方法;β細胞崩壊およびβ細胞増殖の刺激を防止する方法;肥満を治療する方法;食欲を抑制し、満腹感を誘導する方法;過敏性腸症候群を治療する方法;心筋梗塞および卒中に関連する罹患率および/もしくは死亡率を低下させる方法;Q波心筋梗塞が存在しないことを特徴とする急性冠症候群を治療する方法;術後の異化変化を弱める方法;冬眠心筋もしくは糖尿病性心筋症を治療する方法;ノルエピネフリンの血漿血液レベルを抑制する方法;尿中ナトリウム排出を増加させる方法、尿中カリウム濃度を減少させる方法;毒性循環血液量過多、腎不全、鬱血性心不全、ネフローゼ症候群、肝硬変、肺水腫、および高血圧と関連する症状もしくは障害を治療する方法;変力反応を誘導し、心筋収縮能を増加させる方法;多嚢胞性卵巣症候群を治療する方法;呼吸困難を治療する方法;非消化管経路を介する、すなわち、静脈内注射、皮下注射、筋肉内注射、腹腔内注射、もしくは他の注射または輸液を介する栄養摂取を改善する方法;腎症を治療する方法;左心室収縮機能障害(例えば、異常な左心室駆出率を伴う)を治療する方法;幽門洞十二指腸運動を阻害する方法(例えば、下痢、術後ダンピング症候群および過敏性腸症候群などの胃腸障害の治療もしくは予防のため、ならびに内視鏡手順における前投薬として);重症疾患多発性ニューロパシー(CIPN)および全身性炎症反応症候群(SIRS)を治療する方法;トリグリセリドレベルを調節し、脂質異常症を治療する方法;虚血後の血流の再かん流により引き起こされる器官組織損傷を治療する方法;または冠動脈性心疾患危険因子(CHDRF)症候群を治療する方法であって、有効量の請求項22〜24のいずれか1項に記載の化合物を前記被験体に投与することを含む、前記方法。
【請求項51】
被験体におけるGLP-1受容体活性を増加させる方法であって、GLP-1受容体活性を増加させるのに十分な量の請求項22〜24のいずれか1項に記載の化合物を前記被験体に投与することを含む、前記方法。
【請求項52】
被験体の体温を低下させる方法であって、体温を低下させるのに十分な量の請求項27または28に記載の化合物を前記被験体に投与することを含む、前記方法。
【請求項53】
前記被験体が脳虚血、心虚血、もしくは神経損傷に罹患しているか、または罹患した、請求項52に記載の方法。
【請求項54】
前記神経損傷が脊髄損傷である、請求項53に記載の方法。
【請求項55】
被験体における疼痛を治療するか、または疼痛を予防的に治療する方法であって、前記疼痛を治療するのに十分な量の請求項27または28に記載の化合物を前記被験体に投与することを含む、前記方法。
【請求項56】
前記疼痛が、機械的疼痛、熱疼痛、冷疼痛、虚血性疼痛、および化学誘導性疼痛からなる群より選択される急性疼痛である、請求項55に記載の方法。
【請求項57】
前記疼痛が、末梢もしくは中枢神経障害性疼痛、炎症性疼痛、片頭痛関連疼痛、頭痛関連疼痛、過敏性腸症候群関連疼痛、線維筋痛関連疼痛、関節炎痛、骨格痛、関節痛、胃腸痛、筋肉痛、狭心痛、顔面痛、骨盤痛、跛行、術後疼痛、外傷後疼痛、緊張型頭痛、分娩痛、婦人科痛、または化学療法誘導性疼痛である、請求項55に記載の方法。
【請求項58】
精神障害を有する被験体を治療するか、または予防的に治療する方法であって、前記障害を治療するのに十分な量の請求項27または28に記載の化合物を前記被験体に投与することを含む、前記方法。
【請求項59】
前記精神障害が統合失調症である、請求項58に記載の方法。
【請求項60】
被験体における薬物中毒または薬物乱用を治療する方法であって、前記中毒または乱用を治療するのに十分な量の請求項27または28に記載の化合物を前記被験体に投与することを含む、前記方法。
【請求項61】
前記薬物が精神刺激剤である、請求項60に記載の方法。
【請求項62】
前記精神刺激剤が、アンフェタミン、メタンフェタミン、3,4-メチレンジオキシメタンフェタミン、ニコチン、コカイン、メチルフェニダート、およびアレコリンからなる群より選択される、請求項61に記載の方法。
【請求項63】
被験体における神経障害を治療するか、または予防的に治療する方法であって、前記障害を治療するのに十分な量の請求項27または28に記載の化合物を前記被験体に投与することを含む、前記方法。
【請求項64】
前記神経障害が統合失調症である、請求項63に記載の方法。
【請求項65】
神経変性障害を有する被験体を治療するか、または予防的に治療する方法であって、前記障害を治療するのに十分な量の請求項29〜31のいずれか1項に記載の化合物を前記被験体に投与することを含む、前記方法。
【請求項66】
前記神経変性障害が、ポリグルタミン伸長障害、脆弱性X症候群、脆弱性XE精神遅滞、フリードライヒ失調症、筋強直性ジストロフィー、8型脊髄小脳失調症、および12型脊髄小脳失調症、アレキサンダー病、アルパース病、アルツハイマー病、筋萎縮性側索硬化症(ALS)、毛細血管拡張性運動失調症、バッテン病(シュピールマイヤー・フォークト・シェーグレン・バッテン病)、カナバン病、コケイン症候群、大脳皮質基底核変性症、クロイツフェルト・ヤコブ病、虚血性卒中、クラッベ病、レヴィー小体認知症、多発性硬化症、多系統萎縮症、パーキンソン病、ペリツェウス・メルツバッハー病、ピック病、原発性側索硬化症、レフサム病、サンドホフ病、シルダー病、脊髄損傷、脊髄性筋萎縮症、スティール・リチャードソン・オルスゼフスキー病、および脊髄癆からなる群より選択される、請求項65に記載の方法。
【請求項67】
前記ポリグルタミン反復疾患が、ハンチントン病(HD)、歯状核赤核淡蒼球ルイ体萎縮症、ケネディー病(球脊髄性筋萎縮症とも呼ばれる)、または1型、2型、3型(マチャド・ジョゼフ病)、6型、7型、および17型からなる群より選択される脊髄小脳失調症である、請求項66に記載の方法。
【請求項68】
神経損傷を有する被験体を治療するか、または予防的に治療する方法であって、前記損傷を治療するのに十分な量の請求項29〜31のいずれか1項に記載の化合物を前記被験体に投与することを含む、前記方法。
【請求項69】
前記神経損傷が虚血性卒中、出血性卒中、または脊髄損傷により引き起こされる、請求項68に記載の方法。
【請求項70】
鬱病を有する被験体を治療するか、または予防的に治療する方法であって、鬱病を治療するのに十分な量の請求項29〜31のいずれか1項に記載の化合物を前記被験体に投与することを含む、前記方法。
【請求項71】
統合失調症を有する被験体を治療するか、または予防的に治療する方法であって、統合失調症を治療するのに十分な量の請求項29〜31のいずれか1項に記載の化合物を前記被験体に投与することを含む、前記方法。
【請求項72】
アミロイドβに関連する疾患を有する被験体を治療するか、または予防的に治療する方法であって、前記疾患を治療するのに十分な量の請求項32〜34のいずれか1項に記載の化合物を前記被験体に投与することを含む、前記方法。
【請求項73】
前記疾患がアルツハイマー病または脳アミロイド血管症である、請求項72に記載の方法。
【請求項74】
前記被験体がヒトである、請求項35〜73のいずれか1項に記載の方法。
【請求項1】
式:
【化1】

[式中、
nは1、2、3、4、5、6、7、8、9もしくは10であるか、または少なくとも1、2、3、4、5、6、7、8、9もしくは10であり;
mは2〜n+1の整数であり;
A1および各Amは、独立に配列番号1〜105および107〜117からなる群より選択される配列と実質的に同一であるアミノ酸配列またはその機能的断片を含むペプチドベクターであり;ならびに
各Xnは、独立に隣接するペプチドベクターに連結されたリンカーである]
を含む化合物。
【請求項2】
式:
【化2】

を含む、請求項1に記載の化合物。
【請求項3】
式:
【化3】

[式中、
A1、A2、各Aq、各Arおよび各Asは、独立に配列番号1〜105および107〜117からなる群より選択される配列と実質的に同一の配列またはその機能的断片を含むペプチドベクターであり;
A3は、配列番号1〜105および107〜117からなる群より選択される配列と実質的に同一の配列もしくはその機能的断片を含むペプチドベクターであるか、または存在せず;
X、各Xq、各Xrおよび各Xsは、独立にペプチドベクターを連結するリンカーであり;
m、nおよびpは、独立に0、1、2、3、4、5、6、7、8、9または10であり;
qは4〜m+3の整数であり;
rはm+4〜m+n+3の整数であり;ならびに
sはm+n+4〜m+n+p+3の整数である]
を含む化合物。
【請求項4】
前記化合物が、1個以上のリンカーまたは1個以上のペプチドベクターを介して、1種以上の薬剤にコンジュゲートされている、請求項1〜3のいずれか1項に記載の化合物。
【請求項5】
式:
【化4】

(式中、Bは薬剤であり、前記リンカーXにコンジュゲートされる)
を含む、請求項1または2に記載の化合物。
【請求項6】
式:
【化5】

[式中、
B1は薬剤であり、
B2およびB3は、独立に薬剤であるか、または存在せず、
Y1およびY2は、独立に、それぞれA1をB1に、およびA2をB2に連結するリンカーであり、
ここでB2が存在しない場合、Y2は存在しない]
を含む、請求項1または2に記載の化合物。
【請求項7】
式:
【化6】

を含む、請求項6に記載の化合物。
【請求項8】
(a)それぞれのペプチドベクターが独立に、配列番号1〜105および107〜117からなる群より選択される配列と実質的に同一のアミノ酸配列を含み、該ペプチドベクターがリンカーにより連結された、少なくとも2個のペプチドベクター;ならびに
(b)前記ペプチドベクターの少なくとも1個または前記リンカーにコンジュゲートされた薬剤、
を含む化合物。
【請求項9】
前記リンカーが、TMEA、β-[トリス(ヒドロキシメチル)ホスフィノ]プロピオン酸(THPP)、トリス-スクシンイミジルアミノトリアセテート(TSAT)、トリス-スクシンイミジル(6-アミノカプロイル)アミノトリアセテート(LC-TSAT)、トリス-スクシンイミジル-1,3,5-ベンゼントリカルボキシレート、マレイミド-3,5-ジスクシンイミジルイソフタレート(MDSI)、スクシンイミジル-3,5-ジマレイミドフェニルベンゾエート(SDMB)、テトラキス-(3-マレイミドプロピル)ペンタエリスリトール(Mal-4)、テトラキス-(N-スクシンイミジルカルボキシプロピル)ペンタエリスリトール)(NHS-4)からなる群より選択される、請求項1〜8のいずれか1項に記載の化合物。
【請求項10】
前記リンカーの少なくとも1個がマレイミド反応基を含む、請求項1〜8のいずれか1項に記載の化合物。
【請求項11】
前記リンカーが、トリス-(2-マレイミドエチル)アミン(TMEA)またはマレイミドプロピオン酸(MPA)、マレイミド-ベンゾイル-スクシンイミド(MBS)、γ-マレイミド-ブチリルオキシスクシンイミドエステル(GMBS)、マレイミドプロピオン酸(MPA)、マレイミドヘキサン酸(MHA)、およびマレイミドウンデカン酸(MUA)である、請求項10に記載の化合物。
【請求項12】
前記ペプチドベクターの少なくとも1個が、配列番号1〜105および107〜117からなる群より選択される配列と少なくとも85%同一であるアミノ酸配列を含む、請求項1〜11のいずれか1項に記載の化合物。
【請求項13】
前記ペプチドベクターの少なくとも1個が、配列番号1〜105および107〜117からなる群より選択されるアミノ酸配列を含む、請求項12に記載の化合物。
【請求項14】
前記ペプチドベクターの少なくとも1個が、Angiopep-1(配列番号67)、Angiopep-2(配列番号97)、cys-Angiopep-2(配列番号113)、Angiopep-2-cys(配列番号114)、および逆転Angiopep-2(配列番号117)からなる群より選択されるアミノ酸配列を含む、請求項13に記載の化合物。
【請求項15】
前記薬剤が治療剤である、請求項4〜14のいずれか1項に記載の化合物。
【請求項16】
前記治療剤が、抗癌剤、治療的核酸、GLP-1アゴニスト、レプチンもしくはレプチン類似体、ニューロテンシンもしくはニューロテンシン類似体、グリア由来神経栄養因子(GDNF)もしくはGDNF類似体、脳由来神経栄養因子(BDNF)もしくはBDNF類似体、および抗体からなる群より選択される、請求項15に記載の化合物。
【請求項17】
前記治療剤が抗癌剤である、請求項16に記載の化合物。
【請求項18】
前記抗癌剤が、パクリタキセル(Taxol)、ビンブラスチン、ビンクリスチン、エトポシド、ドキソルビシン、シクロホスファミド、ドセタキセル(Taxotere(登録商標))、メルファラン、およびクロラムブシル、アバレリックス、アルデスロイキン、アレムツズマブ、アリトレチノイン、アロプリノール、アルトレタミン、アミフォスチン、アナキンラ、アナストロゾール、三酸化ヒ素、アスパラギナーゼ、アザシチジン、生BCG、ベバクジマブ、ベキサロテン、ブレオマイシン、ボルテゾミブ、ブスルファン、カルステロン、カペシタビン、カルボプラチン、カルムスチン、セレコキシブ、セツキシマブ、シスプラチン、クラドリビン、クロファラビン、シタラビン、ダカルバジン、ダクチノマイシン、アクチノマイシンD、ダルテパリン、ダルベポエチンα、ダサチニブ、ダウノルビシン、ダウノマイシン、デシタビン、デニロイキン、デニロイキンジフチトックス、デキスラゾキサン、プロピオン酸ドロモスタノロン、エクリズマブ、エピルビシン、エポエチンα、エルロチニブ、エストラムスチン、エキセメスタン、フェンタニ、フィルグラスチム、フロキシウリジン、フルダラビン、フルオロウラシル、5-FU、フルベストラント、ゲフィチニブ、ゲンシタビン、ゲムツズマブオゾガミシン、ゴセレリン、ヒストレリン、ヒドロキシウレア、イブリツモマブチウキセタン、イダルビシン、イフォスファミド、イマチニブ、インターフェロンα-2b、イリノテカン、ラパチニブジトシラート、レナリドミド、レトロゾール、ロイコボリン、ロイプロリド、レバミソール、ロムスチン、CCNU、メクロレタミン(窒素マスタード)、メゲストロール、メルカプトプリン(6-MP)、メスナ、メトトレキサート、メトキサレン、マイトマイシンC、ミトタン、ミトキサントロン、ナンドロロンフェンプロピオネート、ネララビン、ノフェツモマブ、オプレルベキン、オキサリプラチン、パリフェルミン、パミドロナート、パニツムマブ、ペガデマーゼ、ペガスパルガーゼ、ペグフィルグラスチム、ペグインターフェロンα-2b、ペメトレキセド、ペントスタチン、ピポブロマン、プリカマイシン(ミトラマイシン)、ポルフィメル、プロカルバジン、キナクリン、ラスブリカーゼ、リツキシマブ、サルグラモスチム、ソラフェニブ、ストレプトゾシン、スニチニブ、タルク、タモキシフェン、テモゾロミド、テニポシド(VM-26)、テストラクトン、サリドマイド、チオグアニン(6-TG)、チオテパ、トポテカン、トレミフェン、トシツモマブ/I-131(トシツモマブ)、トラスツズマブ、トレチノイン(ATRA)、ウラシルマスタード、バルルビシン、ビノレルビン、ボリノスタット、ゾレドロナート、およびゾレドロン酸;またはその製薬上許容し得る塩からなる群より選択される、請求項17に記載の方法。
【請求項19】
前記抗癌剤がパクリタキセル、エトポシド、もしくはドキソルビシン、またはその類似体である、請求項16に記載の化合物。
【請求項20】
前記治療的核酸がRNAi剤である、請求項16に記載の化合物。
【請求項21】
前記RNAi剤がEGFRまたはVEGF発現を沈黙化させることができる、請求項20に記載の化合物。
【請求項22】
前記治療剤がGLP-1アゴニストである、請求項16に記載の化合物。
【請求項23】
前記GLP-1アゴニストがエキセンジン-4、またはGLP-1アゴニスト活性を有するその類似体もしくは断片である、請求項22に記載の化合物。
【請求項24】
前記GLP-1アゴニストがエキセンジン-4、[Lys39]エキセンジン-4、または[Cys32]エキセンジン-4である、請求項23に記載の化合物。
【請求項25】
前記治療剤がレプチンまたはレプチン類似体である、請求項16に記載の化合物。
【請求項26】
前記レプチンまたはレプチン類似体が、完全長ヒトレプチン、成熟ヒトレプチン(完全長ヒトレプチンのアミノ酸22〜167)、またはレプチン116-130である、請求項25に記載の化合物。
【請求項27】
前記治療剤がニューロテンシンまたはニューロテンシン類似体である、請求項16に記載の化合物。
【請求項28】
前記治療剤がヒトニューロテンシン、ヒトニューロテンシン(8-13)、またはpELYENKPRRPYIL-OH(式中、pEはL-ピログルタミン酸である)である、請求項27に記載の化合物。
【請求項29】
前記治療剤がGDNF、BDNF、またはその類似体である、請求項16に記載の化合物。
【請求項30】
前記薬剤が完全長GDNFまたはBDNF配列である、請求項29に記載の化合物。
【請求項31】
前記薬剤が成熟形態のGDNFもしくはBDNFであるか、またはヒトGDNF78-211である、請求項29に記載の化合物。
【請求項32】
前記抗体がモノクローナル抗体である、請求項16に記載の化合物。
【請求項33】
前記モノクローナル抗体がアミロイド-βタンパク質、またはその断片に特異的に結合する、請求項32に記載の化合物。
【請求項34】
前記モノクローナル抗体がR1450(Roche)、バピノイズマブ、ソラネズマブ(LY2062430; Eli Lilly)、BAN2401、PF-04360365(Pfizer)、およびGSK933776A(GlaxoSmithKline)からなる群より選択される、請求項33に記載の化合物。
【請求項35】
癌を有する被験体を治療するか、または予防的に治療する方法であって、前記癌を治療するのに十分な量の請求項17〜19および21のいずれか1項に記載の化合物を前記被験体に投与することを含む、前記方法。
【請求項36】
前記癌が、脳の癌、肝細胞癌、乳癌、マントル細胞リンパ腫、非ホジキンリンパ腫などの様々なリンパ腫を含む頭部および頸部の癌、アデノーマ、扁平細胞癌、咽頭癌、網膜の癌、食道の癌、多発性骨髄腫、卵巣癌、子宮癌、黒色腫、結腸直腸癌、膀胱癌、前立腺癌、肺癌(非小細胞肺癌を含む)、膵臓癌、頸部癌、頭部および頸部癌、皮膚癌、鼻咽頭癌、脂肪肉腫、上皮癌、腎細胞癌、胆嚢腺癌、耳下腺癌、子宮内膜肉腫、ならびに多剤耐性癌からなる群より選択される、請求項35に記載の方法。
【請求項37】
脳の癌が、星状細胞腫、毛様細胞性星状細胞腫、胚芽異形成性神経上皮腫瘍、乏突起膠腫、上衣腫、多形成グリア芽細胞腫、混合性神経膠腫、乏突起星細胞腫、髄芽腫、網膜芽腫、神経芽腫、胚細胞腫、および奇形腫からなる群より選択される、請求項36に記載の方法。
【請求項38】
代謝障害を有する被験体を治療するか、または予防的に治療する方法であって、該障害を治療するのに十分な量の請求項22〜28のいずれか1項に記載の化合物を前記被験体に投与することを含む、前記方法。
【請求項39】
前記代謝障害が糖尿病、肥満、肥満の結果としての糖尿病、高血糖症、脂質異常症、高トリグリセリド血症、X症候群、インスリン耐性、耐糖能異常(IGT)、糖尿病性脂質異常症、高脂血症、心血管疾患、または高血圧である、請求項38に記載の方法。
【請求項40】
前記障害が糖尿病である、請求項38に記載の方法。
【請求項41】
前記障害がII型糖尿病である、請求項40に記載の方法。
【請求項42】
前記障害が肥満である、請求項38に記載の方法。
【請求項43】
被験体による食物摂取を減少させるか、または被験体の体重を減少させる方法であって、食物摂取を減少させるか、または体重を減少させるのに十分な量の請求項22〜26のいずれか1項に記載の化合物を前記被験体に投与することを含む、前記方法。
【請求項44】
前記被験体が体重過多または肥満体である、請求項43に記載の方法。
【請求項45】
前記被験体が過食症患者である、請求項43に記載の方法。
【請求項46】
被験体における不安、運動障害、攻撃性、精神病、発作、パニック発作、ヒステリー、睡眠障害、アルツハイマー病、およびパーキンソン病からなる群より選択される障害を治療するか、または予防的に治療する方法であって、前記障害を治療するのに十分な量の請求項22〜24のいずれか1項に記載の化合物を前記被験体に投与することを含む、前記方法。
【請求項47】
被験体における神経発生を増加させる方法であって、有効量の請求項22〜24のいずれか1項に記載の化合物を前記被験体に投与することを含む、前記方法。
【請求項48】
前記被験体がパーキンソン病、アルツハイマー病、ハンチントン病、ALS、卒中、ADD、または神経精神症候群に罹患している、請求項47に記載の方法。
【請求項49】
神経発生の前記増加が、前記被験体における学習能力を改善するか、または神経保護を増強する、請求項47に記載の方法。
【請求項50】
被験体における肝臓の幹細胞/前駆細胞を機能的膵臓細胞に変換する方法;β細胞崩壊およびβ細胞増殖の刺激を防止する方法;肥満を治療する方法;食欲を抑制し、満腹感を誘導する方法;過敏性腸症候群を治療する方法;心筋梗塞および卒中に関連する罹患率および/もしくは死亡率を低下させる方法;Q波心筋梗塞が存在しないことを特徴とする急性冠症候群を治療する方法;術後の異化変化を弱める方法;冬眠心筋もしくは糖尿病性心筋症を治療する方法;ノルエピネフリンの血漿血液レベルを抑制する方法;尿中ナトリウム排出を増加させる方法、尿中カリウム濃度を減少させる方法;毒性循環血液量過多、腎不全、鬱血性心不全、ネフローゼ症候群、肝硬変、肺水腫、および高血圧と関連する症状もしくは障害を治療する方法;変力反応を誘導し、心筋収縮能を増加させる方法;多嚢胞性卵巣症候群を治療する方法;呼吸困難を治療する方法;非消化管経路を介する、すなわち、静脈内注射、皮下注射、筋肉内注射、腹腔内注射、もしくは他の注射または輸液を介する栄養摂取を改善する方法;腎症を治療する方法;左心室収縮機能障害(例えば、異常な左心室駆出率を伴う)を治療する方法;幽門洞十二指腸運動を阻害する方法(例えば、下痢、術後ダンピング症候群および過敏性腸症候群などの胃腸障害の治療もしくは予防のため、ならびに内視鏡手順における前投薬として);重症疾患多発性ニューロパシー(CIPN)および全身性炎症反応症候群(SIRS)を治療する方法;トリグリセリドレベルを調節し、脂質異常症を治療する方法;虚血後の血流の再かん流により引き起こされる器官組織損傷を治療する方法;または冠動脈性心疾患危険因子(CHDRF)症候群を治療する方法であって、有効量の請求項22〜24のいずれか1項に記載の化合物を前記被験体に投与することを含む、前記方法。
【請求項51】
被験体におけるGLP-1受容体活性を増加させる方法であって、GLP-1受容体活性を増加させるのに十分な量の請求項22〜24のいずれか1項に記載の化合物を前記被験体に投与することを含む、前記方法。
【請求項52】
被験体の体温を低下させる方法であって、体温を低下させるのに十分な量の請求項27または28に記載の化合物を前記被験体に投与することを含む、前記方法。
【請求項53】
前記被験体が脳虚血、心虚血、もしくは神経損傷に罹患しているか、または罹患した、請求項52に記載の方法。
【請求項54】
前記神経損傷が脊髄損傷である、請求項53に記載の方法。
【請求項55】
被験体における疼痛を治療するか、または疼痛を予防的に治療する方法であって、前記疼痛を治療するのに十分な量の請求項27または28に記載の化合物を前記被験体に投与することを含む、前記方法。
【請求項56】
前記疼痛が、機械的疼痛、熱疼痛、冷疼痛、虚血性疼痛、および化学誘導性疼痛からなる群より選択される急性疼痛である、請求項55に記載の方法。
【請求項57】
前記疼痛が、末梢もしくは中枢神経障害性疼痛、炎症性疼痛、片頭痛関連疼痛、頭痛関連疼痛、過敏性腸症候群関連疼痛、線維筋痛関連疼痛、関節炎痛、骨格痛、関節痛、胃腸痛、筋肉痛、狭心痛、顔面痛、骨盤痛、跛行、術後疼痛、外傷後疼痛、緊張型頭痛、分娩痛、婦人科痛、または化学療法誘導性疼痛である、請求項55に記載の方法。
【請求項58】
精神障害を有する被験体を治療するか、または予防的に治療する方法であって、前記障害を治療するのに十分な量の請求項27または28に記載の化合物を前記被験体に投与することを含む、前記方法。
【請求項59】
前記精神障害が統合失調症である、請求項58に記載の方法。
【請求項60】
被験体における薬物中毒または薬物乱用を治療する方法であって、前記中毒または乱用を治療するのに十分な量の請求項27または28に記載の化合物を前記被験体に投与することを含む、前記方法。
【請求項61】
前記薬物が精神刺激剤である、請求項60に記載の方法。
【請求項62】
前記精神刺激剤が、アンフェタミン、メタンフェタミン、3,4-メチレンジオキシメタンフェタミン、ニコチン、コカイン、メチルフェニダート、およびアレコリンからなる群より選択される、請求項61に記載の方法。
【請求項63】
被験体における神経障害を治療するか、または予防的に治療する方法であって、前記障害を治療するのに十分な量の請求項27または28に記載の化合物を前記被験体に投与することを含む、前記方法。
【請求項64】
前記神経障害が統合失調症である、請求項63に記載の方法。
【請求項65】
神経変性障害を有する被験体を治療するか、または予防的に治療する方法であって、前記障害を治療するのに十分な量の請求項29〜31のいずれか1項に記載の化合物を前記被験体に投与することを含む、前記方法。
【請求項66】
前記神経変性障害が、ポリグルタミン伸長障害、脆弱性X症候群、脆弱性XE精神遅滞、フリードライヒ失調症、筋強直性ジストロフィー、8型脊髄小脳失調症、および12型脊髄小脳失調症、アレキサンダー病、アルパース病、アルツハイマー病、筋萎縮性側索硬化症(ALS)、毛細血管拡張性運動失調症、バッテン病(シュピールマイヤー・フォークト・シェーグレン・バッテン病)、カナバン病、コケイン症候群、大脳皮質基底核変性症、クロイツフェルト・ヤコブ病、虚血性卒中、クラッベ病、レヴィー小体認知症、多発性硬化症、多系統萎縮症、パーキンソン病、ペリツェウス・メルツバッハー病、ピック病、原発性側索硬化症、レフサム病、サンドホフ病、シルダー病、脊髄損傷、脊髄性筋萎縮症、スティール・リチャードソン・オルスゼフスキー病、および脊髄癆からなる群より選択される、請求項65に記載の方法。
【請求項67】
前記ポリグルタミン反復疾患が、ハンチントン病(HD)、歯状核赤核淡蒼球ルイ体萎縮症、ケネディー病(球脊髄性筋萎縮症とも呼ばれる)、または1型、2型、3型(マチャド・ジョゼフ病)、6型、7型、および17型からなる群より選択される脊髄小脳失調症である、請求項66に記載の方法。
【請求項68】
神経損傷を有する被験体を治療するか、または予防的に治療する方法であって、前記損傷を治療するのに十分な量の請求項29〜31のいずれか1項に記載の化合物を前記被験体に投与することを含む、前記方法。
【請求項69】
前記神経損傷が虚血性卒中、出血性卒中、または脊髄損傷により引き起こされる、請求項68に記載の方法。
【請求項70】
鬱病を有する被験体を治療するか、または予防的に治療する方法であって、鬱病を治療するのに十分な量の請求項29〜31のいずれか1項に記載の化合物を前記被験体に投与することを含む、前記方法。
【請求項71】
統合失調症を有する被験体を治療するか、または予防的に治療する方法であって、統合失調症を治療するのに十分な量の請求項29〜31のいずれか1項に記載の化合物を前記被験体に投与することを含む、前記方法。
【請求項72】
アミロイドβに関連する疾患を有する被験体を治療するか、または予防的に治療する方法であって、前記疾患を治療するのに十分な量の請求項32〜34のいずれか1項に記載の化合物を前記被験体に投与することを含む、前記方法。
【請求項73】
前記疾患がアルツハイマー病または脳アミロイド血管症である、請求項72に記載の方法。
【請求項74】
前記被験体がヒトである、請求項35〜73のいずれか1項に記載の方法。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9A】


【図9B】


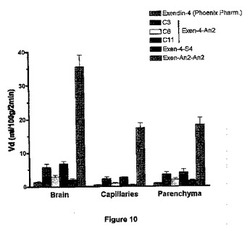
【図10】


【図11】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9A】


【図9B】


【図10】


【図11】


【公表番号】特表2012−531467(P2012−531467A)
【公表日】平成24年12月10日(2012.12.10)
【国際特許分類】
【出願番号】特願2012−518704(P2012−518704)
【出願日】平成22年6月30日(2010.6.30)
【国際出願番号】PCT/CA2010/001014
【国際公開番号】WO2011/000095
【国際公開日】平成23年1月6日(2011.1.6)
【出願人】(511093410)アンジオケム インコーポレーテッド (9)
【Fターム(参考)】
【公表日】平成24年12月10日(2012.12.10)
【国際特許分類】
【出願日】平成22年6月30日(2010.6.30)
【国際出願番号】PCT/CA2010/001014
【国際公開番号】WO2011/000095
【国際公開日】平成23年1月6日(2011.1.6)
【出願人】(511093410)アンジオケム インコーポレーテッド (9)
【Fターム(参考)】
[ Back to top ]

