大環状化合物
【課題】 らせん分子(らせん化合物:例えばオリゴペプチド)の立体化学構造を認識し光学活性体を分割する技術を提供する。
【解決手段】 右巻きおよび左巻きのらせん分子の混合物から右巻きまたは左巻きの一方のらせん分子を分離するのに用いられる環状化合物。右巻きまたは左巻きのいずれかで同一の巻き方向を持つ2つのらせん状支柱部分と、該支柱部分の間に介在しらせん分子の両末端と相互作用し得る部位とを含む環状構造体から成りらせん分子を取り込むことができる空孔を呈する。目的のらせん分子と該環状化合物との会合体を形成させ、後に解離させることにより光学分割を行なうことができる。
【解決手段】 右巻きおよび左巻きのらせん分子の混合物から右巻きまたは左巻きの一方のらせん分子を分離するのに用いられる環状化合物。右巻きまたは左巻きのいずれかで同一の巻き方向を持つ2つのらせん状支柱部分と、該支柱部分の間に介在しらせん分子の両末端と相互作用し得る部位とを含む環状構造体から成りらせん分子を取り込むことができる空孔を呈する。目的のらせん分子と該環状化合物との会合体を形成させ、後に解離させることにより光学分割を行なうことができる。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、光学分割の技術分野に属し、特に、らせん分子のバンドルを形成させることにより光学活性体を分離するのに用いることができる新規な大環状化合物に関する。
【背景技術】
【0002】
らせん構造は、一般に、ねじやドリルに見られる加工性・成形性、バネなどの柔軟性・変形性、コンベヤなどに見られる搬送性に関する技術に深く関わるものとして知られているが、分子レベルのナノテクノロジーにおいても、有機・無機化合物および生命体の高機能発現に深く関わるものとして注目を集めている。例えば、らせん構造は、DNAの二重らせんやコラーゲンの三重らせんなどの生体高分子に多く見られ高機能性の発現に寄与しており、また、分子マシンや分子デバイスの構造要素としての期待も大きく、人工分子によるらせん構造体の製造に関する試みが盛んになされている。らせん構造には右巻きと左巻きとが存在し、分子レベルでは異性体として区別される上、その化学的性質や光学的性質も異なる。したがって、らせん構造体の巻き方向をコントロールすることは、新機能発現の基盤技術として重要である。
【0003】
右巻きおよび左巻きのうちの一方のらせん構造を有するらせん分子(らせん化合物)を得るためにこれまでに知られている手段は、選択的製造と光学活性体の分割に大別される。
前者は、重合開始剤あるいはモノマー分子に不斉源を導入し、重合に際に一方巻きのらせん分子のみを製造するものである。この場合、用いることのできる分子、ひいては得られるらせん分子の構造には制限があり、より広範な一方巻きらせん分子の製造には、効率的な光学分割法の開拓が必要であると考えられる。しかしながら、現行の光学分割法は、キラルカラムクロマトグラフィーを用いて低分子光学活性化合物を分離することに留まっており、右巻きと左巻きの混合物から一方の巻き方向のらせん分子を得る技術は殆ど知られていない。
【非特許文献1】T. Nakano, Y. Okamoto, Chem. Rev.101, 4013-4038 (2001)
【発明の開示】
【発明が解決しようとする課題】
【0004】
本発明の目的は、らせん分子(らせん化合物)の立体化学構造を認識し光学活性体を分割する新しい技術を提供することにある。
【課題を解決するための手段】
【0005】
本発明者は、標的となるらせん分子とらせんバンドル構造を形成して会合体を形成することのできる新規な環状化合物の合成に成功し、その会合体形成挙動を検討したところ、立体選択的なバンドル構造形成により、ラセミ体のらせん分子の光学分割ができることを見出し、本発明に到達した。
【0006】
かくして、本発明は、右巻きおよび左巻きのらせん分子の混合物から右巻きまたは左巻きのうちの一方のらせん分子を分離するのに用いられる環状化合物であって、
右巻きまたは左巻きのいずれかで同一の巻き方向を持つ2つのらせん状支柱部分と、該支柱部分の間に介在し前記らせん分子の両末端と相互作用し得る部位とを含む環状構造体から成り、該環状構造体に該らせん分子を取り込むことができる空孔を呈することを特徴とする環状化合物を提供するものである。
【発明の効果】
【0007】
本発明の環状化合物を用いれば、特殊なキラルカラムクロマトグラフィーを用いることなく一般的な分離技術によって、右巻きおよび左巻きのらせん分子の混合物(例えば、α−アミノ酸から成るオリゴペプチドの混合物から、一方の巻き方向のらせん分子を効率的に分離することができる。
【発明を実施するための最良の形態】
【0008】
生体高分子においては、一方向の巻きのペプチドのらせん表面での相互作用によりらせん分子が数本集合した構造体が形成される。本発明は、このような生体高分子に見られるバンドル構造に着目し、合成環状化合物を利用し右巻きまたは左巻きのうちの一方のらせん分子と選択的にバンドルを形成し得るようにすることによって、らせん分子の光学分割を図るものである。
【0009】
このため、本発明の環状化合物は、右巻きまたは左巻きのいずれかで同一の巻き方向を持つ2つのらせん状支柱部分と、該支柱部分の間に介在し、らせん分子の両末端と相互作用し得る部位とを含む環状構造から成り、該環状構造内にらせん分子を取り込むことができるような大きさの空孔を呈する。
【0010】
<光学分割>
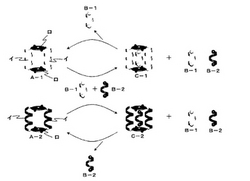
図1は、如上の本発明の環状化合物を用いて光学分割が行なわれる様子を模式的に示すものである。図に示されるように、環状化合物(図中、A−1およびA−2)は、2つのらせん状支柱部分(イ,イ)と、らせん分子の両末端と相互作用し得る部位(ロ,ロ)とを含む環状構造から成る。環状化合物(A−1)の2つのらせん状支柱部分(イ,イ)はいずれも右巻きであり、他方、環状化合物(A−2)の2つのらせん状支柱部分(イ,イ)はいずれも左巻きである。
【0011】
本発明の環状化合物を用いて、右巻きおよび左巻きのらせん分子の混合物から右巻きまたは左巻きのうちの一方のらせん分子を分離する(光学分割する)には、先ず、適当な溶媒を用いて前記混合物および環状化合物を溶解させて、該混合物を環状化合物と接触させる。この操作により、右巻きまたは左巻きのうちの一方のらせん分子と環状化合物との会合体が形成される(第1の工程)。
【0012】
すなわち、支柱部分として右巻きまたは左巻きのいずれか一方のらせん鎖を2本有する環状化合物の空孔内に、そのらせん鎖と同じ巻き方向をもつらせん鎖が選択的に取り込まれてそれらのらせん鎖との相互作用によりバンドル構造が形成され、該らせん分子/環状化合物会合体が構築されるものと考えられる。このとき、本発明の環状化合物の更なる特徴は、らせん状支柱部分の間に介在してらせん分子の両末端とも相互作用し得る部位を含むことにあり、この相互作用の存在により会合体の形成が確実となる。
【0013】
例えば、図1の上方に示す例では、右巻きのらせん状支柱部分(イ,イ)を有する環状化合物(A−1)の空孔内に、右巻きのらせん分子(B−1)と左巻きのらせん分子(B−2)のうち右巻きのらせん分子(B−1)が選択的に取り込まれて、支柱部分(イ,イ)と三重らせんのバンドル構造を形成し、この際、らせん分子(B−1)の両末端も環状化合物(A−1)の相互作用部位(ロ,ロ)の作用によりバンドル形成が確実となり、会合体(C−1)が形成され、未反応のらせん分子(B−1,B−2)は残存する。同様に、図2の下方に示す例では、環状化合物(A−2)の空孔内に左巻きのらせん分子(B−2)が選択的に取り込まれて、バンドル構造を含む会合体(C−2)が形成され、未反応らせん分子(B−1,B−2)が残存することになる。
【0014】
以上のようにして生成したらせん分子/環状化合物会合体を含む混合物(生成物)は、適当な手段、例えば、サイズ排除クロマトグラフィー(SEC)に供されることにより、該会合体を未反応の環状化合物および未反応のらせん分子から分離する(第2の工程)。この第2の工程で会合体から分離された未反応の環状化合物およびらせん分子は、必要に応じて、第1の工程に循環させることができる。
【0015】
本発明の方法においては、さらに、分離された前記会合体を環状化合物とらせん分子に解離させ、それらの環状化合物とらせん分子をそれぞれ分離回収する(第3の工程)。この工程は、一般に、会合体を溶解している溶媒を除去した後、会合体の形成を阻害するような別の溶媒を加えることによって行なわれる。この第3の工程で分離回収した環状化合物も必要に応じて第1の工程に循環させることができる。
【0016】
第1の工程で使用される溶媒は環状化合物と分割しようとするらせん分子の溶解度が高く、会合体の形成を阻害しないものが好ましい。第1の工程で用いられるのに好適な溶媒の例として、クロロホルム、塩化メチレン等が挙げられ、トルエン等は溶解性が乏しく、テトラヒドロフランは会合体形成を阻害するので好ましくない。テトラヒドロフランは、第3の工程で使用されるのに好適な溶媒の例である。
【0017】
本発明の環状化合物を用いる光学分割において、分割しようとするらせん分子と環状化合物との比率(右巻きまたは左巻きのらせん分子/環状化合物)は特に制限はなく、分割後の一方巻きのらせん分子の所望の光学純度と分割のためのプロセスの効率により選択すればよいが、比率が小さすぎると一回の分割操作(会合体形成)での選択性が悪く、また大きすぎると大量の未分割のらせん分子を循環させる必要があり、効率が悪いので、1〜20の範囲が好ましく、1〜10の範囲が更に好ましい。最も好ましくは2〜5の範囲である。
【0018】
分割しようとするらせん分子と環状化合物の濃度にも特に制限はなく、例えば、生成する会合体と未分割のらせん分子の分離および会合体の解離後のらせん分子と環状化合物の分離のプロセスの効率を考慮して選択すればよい。
会合体形成の温度にも制限はないが高すぎたり、低すぎたりすると設備が複雑になるので、通常、0〜100℃の範囲が好ましく、0〜50℃の範囲が更に好ましく、常温が最も好ましい。
【0019】
分割しようとするらせん分子の両末端は環状化合物の相互作用部位との相互作用を制御するために修飾することができる。例えば、相互作用部位がポルフィリンの場合、衷心金属に軸配位できる官能基、例えばピリジン基を持つように修飾することが好ましい。
【0020】
<環状化合物>
光学分割に用いることのできる本発明の環状化合物は、既述のように、分離すべきらせん分子の両末端と相互作用し得る部分を含む。この相互作用部位は、種々の相互作用、例えば、疎水性相互作用や配位結合性相互作用などによりらせん分子の両末端と相互作用し得る構造要素を有するものである。例えば、疎水性相互作用を供し得るものとしてシクロデキストリン構造を有するものなどが適用可能であるが、合成の容易さなどから特に好ましいのはポルフィリン骨格を持つものである。
かくして、本発明に従う好ましい環状化合物は下記の式1で表すことができる。
【0021】
【化1】

【0022】
式1において、A1およびA2は、右巻きまたは左巻きのいずれかで同一の巻き方向のらせん分子より支柱部分を表す。A1およびA2は、一般的には同一であるが、異なっていてもよい。
式1中、Y1、Y2、Y3およびY4は水素原子、または1個ないし12個の炭素原子を有するアルキル基もしくはアリール基もしくはアラルキル基を表し、それらはヘテロ原子で置換されまたは不飽和結合をもっていてもよく、また、互いに同一であるのが一般的であるが、異なっていてもよい。
X1、X2、X3およびX4は、水素原子、または1個ないし12個の炭素原子を有するアルキル基もしくはアルコキシ基を表し、互いに同一であるのが一般的であるが異なっていてもよい。
式1中、M1およびM2は、水素原子、第4もしくは第5周期の遷移金属イオン、または第VIII族の遷移金属イオンもしくはアンチモンイオンを表し、互いに同一であるのが一般的であるが、異なっていてもよい。
【0023】
本発明の環状化合物は、らせん構造を呈する種々のポリマーやオリゴマーの混合物から所望の巻き方向のらせん物質を分離するのに適用することができる。例えば、ポリシランやポリイソシアニドのようならせん分子の光学分割にも適用可能であり、このような場合には、式1のA1およびA2で表される支柱部分は、それぞれ、シラン鎖やイソシアニド鎖から成るらせん性分子を含むことになる。
【0024】
本発明の環状化合物は、オリゴペプチドの光学分割を行なうのに適しており、この場合、式1におけるA1およびA2が同一であって、少なくとも1つの不斉炭素原子を有するオリゴペプチド鎖を含む。かくして、本発明の環状化合物の特に好ましい態様は下記の式2で表されるものである。
【0025】
【化2】

【0026】
式2中、R1、R2、R3、R4、R5、R6、R7およびR8は、水素原子、1個ないし12個の炭素原子を有するアルキル基もしくはアリール基もしくはアラルキル基で置換されていてもよいエキソメチレン基、または1個ないし12個の炭素原子を有するアルキル基もしくはアリール基もしくはアラルキル基を表し、それらはヘテロ原子で置換されまたは不飽和結合をもっていてもよく、また、互いに同一でも異なっていてもよい。
【0027】
R1〜R8がエキソメチレン基の場合は、R1とR2、R3とR4、R5とR6、およびR7とR8の少なくとも1つ(一般的にR1とR2、および/またはR3とR4)がエキソメチレン基を構成し、好ましくは1個ないし8個(特に好ましくは1個ないし6個)の炭素原子を有するアルキル基またはアリール基またはアラルキル基(好ましくはフェニル基)で置換されているものである。R1〜R8が、アルキル基またはアリール基またはアラルキル基の場合、好ましくは1個ないし8個(特に好ましくは1個ないし6個)の炭素原子を有するアルキル基またはアリール基またはアラルキル基であり、好適な例はメチル基である。好ましい態様として、R1とR2およびR3とR4がそれぞれフェニル基で置換されたエキソメチレン基を構成し、R5、R6、R7およびR8がメチル基である場合や、R1、R2、R3、R4、R5、R6、R7およびR8のいずれもがメチル基である場合などが挙げられる。式2中、R9は1個ないし12個、好ましくは1個ないし8個(特に好ましくは1個ないし6個)の炭素原子を有するアルキル基またはアリール基またはアラルキル基を表し、それらはヘテロ原子または不飽和結合をもつ官能基または原子団で置換されていてもよい。好ましい態様として、R9が1個ないし6個の炭素原子を有するアルキル基である場合が挙げられる。
【0028】
既述のように、本発明の環状化合物の支柱部分を構成するらせん分子は少なくとも1つの不斉炭素原子を有するが、一般に、R9が結合している骨格の炭素原子は不斉炭素原子である。また、R1〜R8およびR9は、それらを含む支柱部分が、分離(光学分割)すべきらせん分子(オリゴペプチド)のペプチド鎖に同一または可及的に近似したペプチド構造を呈し且つ該らせん分子の長さと概ね等しいか近い長さになるよう各種のアミノ酸類(出発原料)を選択することにより決められる(後述の合成法参照)。
【0029】
式2において、n1およびn2はそれぞれ0〜20の自然数を表し、且つ、n1+n2≧2の関係を満たす。一般に、支柱部分が長くなると得られる環状化合物の溶解性が悪くなるので、n1+n2は好ましくは12以下(特に好ましくは8以下)である。
【0030】
式2において、X1、X2、X3およびX4は、式1に関して定義したものと同じ、すなわち、水素原子または1個ないし12個の炭素原子を有するアルキル基もしくはアルコキシ基を表し、互いに同一であるのが一般的であるが異なっていてもよい。原料の入手や合成の容易さ、および得られる環状化合物の溶解性などを考慮すると、X1〜X4として好ましいのは水素原子、または1個ないし8個の炭素原子を有するアルコキシ基である。
【0031】
式2中、Y1、Y2、Y3およびY4は、式1に関して定義したものと同じである。すなわち、Y1、Y2、Y3およびY4は、水素原子、または1個ないし12個の炭素原子を有するアルキル基もしくはアリール基もしくはアラルキル基を表し、それらはヘテロ原子で置換されまたは不飽和結合をもっていてもよく、また、互いに同一であるのが一般的であるが異なっていてもよい。Y1〜Y4も目的の環状化合物の原料の入手や合成の容易さ、および溶解性などを考慮して選ばれ、この点から特に好ましい例は、水素原子またはトリメチルフェニル基である。
【0032】
式2中、M1、M2は、式1に関して定義したものと同じであり、水素原子、第4もしくは第5周期の遷移金属イオン、または第VIII族の遷移金属イオンもしくはアンチモンイオンを表し、互いに同一であるのが一般的であるが異なっていてもよい。これらの金属イオンは、ポルフィリン環とともに、分離(光学分割)しようとするらせん分子の両末端と配位結合性の相互作用部位を構成して、らせん分子/環状化合物会合体の形成を確実にする。このような相互作用、および入手や合成の容易さを考慮して、M1およびM2として好ましいのは、Zn、Rh、Feなど金属イオンであり、特に好ましいのはZnイオンである。
【0033】
<環状化合物の合成>
本発明の環状化合物は種々の反応を工夫することによって合成することができる。図2および図3は、既述の式1ないしは式2で表される環状化合物に沿って、本発明の環状化合物の一般的合成法を示すものであり、概略次のように行なわれる。
【0034】
光学分割対象のらせん分子の末端と相互作用しうる構造要素(例えばポルフィリン)のビスアミノ体1当量に対し、カルボキシル末端を有するらせん性分子(例えばアミノ末端をBoc−基で保護したオリゴペプチド)2当量をDMFなどの適当な溶媒中、2当量の縮合剤(例えばフルオロ−N,N,N’,N’−テトラメチルホルムアミジニウムヘキサフルオロホスフェート:TFFH)および少量の添加剤(N−メチルモルホリン:NMM)を用いて室温で60時間程度撹拌して縮合させる。反応溶媒を減圧下で留去し、残渣をシリカゲルのクロマトグラフィーにより精製し、構造要素1分子に2分子のらせん性分子が結合した大環状化合物の前駆体を得る(図2のイ参照)。得られた大環状化合物の前駆体のアミノ末端を酸処理によって脱保護し、DMFなどの適当な溶媒を用いて1mM程度に希釈する(図2のロ参照)。
【0035】
一方、カルボキシル基を2個有するポルフィリンなどの構造要素1当量を、5当量の縮合剤(例えばO−(ベンゾトリアゾール−1−イル)−N,N,N’,N’−テトラメチルウロニウムテトラフルオロボレート:TBTU)および2当量のNMMとDMF中で混合し1mM程度に希釈する。これら2種類のDMF溶液を、NMM4当量を含む2倍量のDMF中に室温で激しく撹拌しながら8時間以上かけて同じ速度で滴下する。反応混合液を更に12時間反応させた後、減圧下で蒸発乾涸し、残渣をシリカゲルのクロマトグラフィーにより精製し大環状化合物を単離する(図3のハ参照)。ポルフィリンなどの構造要素中に亜鉛などの金属を導入する場合には、20当量の酢酸亜鉛とクロロホルム/メタノールなどの混合溶媒中、室温で一晩撹拌反応させる。反応液を減圧下で蒸発乾涸させて得られた残渣をシリカゲルクロマトグラフィーによって精製することで目的化合物を得る(図3のニ参照)。
【0036】
以下に、本発明の特徴をさらに具体的に明らかにするため実施例を示すが、本発明はこれらの実施例によって制限されるものではない。
なお、本明細書および図面に示す化学構造式においては、慣用的な表現法に従い炭素原子および水素原子を省略していることがある。
【実施例1】
【0037】
環状化合物の合成
(1)試薬等
アミノ酸類はすべて渡辺化学工業株式会社または東京化成工業株式会社から購入したものをそのまま用いた。ジシクロヘキシルカルボジイミド(DCC:和光純薬工業株式会社)、1−ヒドロキシベンゾトリアゾール(HOBt:ペプチド研究所)、およびO−(ベンゾトリアゾール−1−イル)−N,N,N’,N’−テトラメチルウロニウムテトラフルオロボレート:TBTU:東京化成工業株式会社)等のカップリング剤は試薬をそのまま用いた。
トリフルオロ酢酸(TFA:和光純薬工業株式会社)、ジイソプロピルエチルアミン(DIEA:和光純薬工業株式会社)およびN−メチルモルフォリン(NMM:ナカライテスク株式会社)は購入品をそのまま用いた。反応溶媒は市販品を脱水剤の存在下にアルゴン雰囲気で蒸留して用いるカーボンナノチューブ、和光純薬工業株式会社製または関東化学株式会社製の無水グレード品を用いた。
α−アミノイソ酪酸(Aib)のオリゴマーはMacromolecules
1985, 18, 895-902およびJ. Am. Chem.
Soc. 1999, 121, 6948-6949に記載の公知の液相法により合成した。
Aibと塩化ベンゾイルオキシカルボニル(Z−Cl)または炭酸ジターシャリーブチル(Boc2O)とを反応させてそれぞれ得たZ−Aib−OHまたはBoc−Aib−OHはJ. Org. Chem. 1991, 56, 2611-2641、J. Am. Chem. Soc. 1995, 117, 5401-5402およびLett. Peptide Sci. 1995, 2, 285-288に記載のHOBt−活性エステルを中間体とするDCC法または酸フルオライド法に従って次の鎖延長工程に用いた。
Z−およびBoc−保護基はそれぞれPd/Cを触媒とする接触水素化および酸化水分解により外した。
5,15−ビス(3−アミノフェニル)−10,20−ジメチルポルフィリンはTetrahedron 1994, 50, 11427-11440に記載の方法によりメソ−(メシチル)ジピロメタンと3−ニトロベンズアルデヒドを反応させた後、ニトロ基をNew J. Chem. 1999,
309-316に記載の方法に従い、SnCl2/HClで還元して合成した。同様に5,15−ビス(3‐カルボキシフェニル)−10,20−ジメチルポルフィリンハメソ−(メシチル)ジピロメタンと3−(メトキシカルボニル)ベンズアルデヒド反応させた後、エステル部分をアルカリ加水分解して合成した。
【0038】
(2)合成:その1
環状化合物として図4に示す化合物11を合成した。
<Boc−Leu−ΔPhe−Azlactone(6)の合成>
Boc−Leu−DL−Phe(β−OH)−OMeの合成:
Boc−Leu−OH(1.2g、4.8mmol)のジクロロメタン(20ml)溶液に0℃でHOBt(0.78g、5.8mmol)、DCC(1.2g、5.8mmol)、トリエチルアミン(1.4ml、10mmol)、およびHCl・H−DL−Phe(β−OH)−OMe(1.1g、4.8mmol)を少しずつ加えた後、室温で撹拌しながら24時間反応させた。反応混合物を5%の硫酸水素カリウム(KHSO4)水溶液に注ぎ、沈澱した無色の固体を濾別し、有機溶媒層を5%の炭酸水素ナトリウム(NaHCO3)と冷メタノールで洗浄した後、硫酸ナトリウムで乾燥し減圧下で乾涸した。残渣をシリカゲルのクロマトグラフにかけ、主留分を蒸発乾涸してBoc−Leu−DL−Phe(β−OH)−OMeを白色の粉末(1.96g)として定量的に得た。
Boc−Leu−DL−Phe(β−OH)の合成:
Boc−Leu−DL−Phe(β−OH)−OMeのメタノール溶液(20ml)に水酸化ナトリウム水溶液(1M;19ml)を室温で加え、撹拌下に3時間反応させた。反応液を濃縮して5%のKHSO4水溶液で処理した後、クロロホルムで抽出した。抽出液を硫酸ナトリウムで乾燥し、蒸発乾涸してBoc−Leu−DL−Phe(β−OH)−OH(1.9g)を白色の粉末として定量的に得た。
Boc−Leu−ΔPhe−Azlactone(6)の合成:
Boc−Leu−DL−Phe(β−OH)−OH(1.9g、4.8mmol)の無水酢酸(9.6ml)溶液に無水酢酸ナトリウム(0.47g、5.8mmol)を加え、室温で14時間反応させた。反応混合物を減圧下で蒸発乾涸した後、クロロホルムに溶かし、5%のNaHCO3水溶液で洗浄し、次いで10%の食塩水で洗浄した。洗浄後の溶液を硫酸ナトリウムで乾燥した後、蒸発乾涸して得た残渣をクロロホルム/ヘキサンの混合溶媒から再結晶して化合物6を白色結晶として収率68%(1.2g)で得た。
1H NMR(500MHz,CDCl3):δ=8.10-8.06(m,2H)、7.44-7.40(m,3H)、7.18(s,1H)、4.94-4.86(m,1H)、4.78-4.70(m,1H)、1.80-1.60(m,3H)、1.45(s,9H)、0.98(d,J=6.0Hz,6H)。ESI-TOF-MS:[M+Na]+(理論値381.18):測定値381.18。
【0039】
<Boc−Leu−ΔPhe−(Aib)3−OMe(7)の合成:
化合物6(0.75g、2.1mmol)とH−(Aib)3−OMe(0.50g、1.8mmol)を字メチルホルムアミド(10ml)に溶かし、室温で18時間撹拌した。反応混合液を減圧下に蒸発乾涸しジクロルメタン/メタノールを展開溶媒としてシリカゲルのクロマトグラフにかけ化合物7の白色粉末を91%(1.0g)の収率で得た。
1H NMR(500MHz,CDCl3):δ=7.56(br,s,1H)、7.42-7.30(m,6H)、7.22(br,s, 1H)、7.21(br,s,1H)、7.13(s,1H)、4.98(s,1H)、4.06-4.00(m,1H)、3.66(s,3H)、1.76-1.68(m,2H)、1.58-1.54(m,1H)、1.54(s,3H)、1.53(s,3H)、1.52(s,3H)、1.49(s,6H)、1.48(s,3H)、1.01(d, J=6.0Hz,3H)、0.98(d, J=6.0Hz, 3H)。ESI-TOF-MS:[M+Na]+(理論値668.36):測定値668.24。
【0040】
<Boc−(Aib)3−ΔPhe−Azlactone(8)の合成>
化合物6の合成と同様に手順でBoc−(Aib)3−OH(1.2g、1.7mmol)から3段階の反応で化合物8を総合収率83%(1.4g)で得た。
1H NMR(500MHz,CDCl3):δ=8.10-8.06(m,2H)、7.62(s,1H)、7.42-7.34(m,3H)、7.11(s,3H)、6.37(s,1H)、4.88(s,3H)、1.68(s,6H)、1.45(s,15H)、1.42(s,6H)。MALDI−TOF−MS:[M+Na]+(理論値523.58):測定値523.55。
【0041】
<Boc−(Aib)3−ΔPhe−Leu−ΔPhe−(Aib)3−OMe(9)の合成>
化合物7をTFAで加水分解することにより定量的に得られるTFA・H−Leu−ΔPhe−(Aib)3−OMe(0.85g、1.3mmol)と化合物8(0.72g、1.4mmol)をジメチルホルムアミド(12ml)に溶かし室温で90時間撹拌して反応させた。反応液を減圧下に蒸発乾涸し、残渣をクロロホルム/メタノールを展開液とするシリカゲルのクロマトグラフにかけ、化合物9を収率60%(0.82g)で白色粉末として得た。
1H NMR(500MHz,CDCl3):δ=8.99(s,1H)、8.89(s,1H)、8.03(br,s,1H)、7.99(s,1H)、7.59(br,s,1H)、7.55(s,1H)、7.54-7.50(s,1H)、7.54-7.50(m,2H)、7.50-7.46(m,2H)、7.34-7.20(m,9H)、6.72(br,s,1H)、5.36(br,s,1H)、4.38-4.32(m,1H)、3.64(s,3H)、1.98-1.88(m,2H)、1.78-1.72(m,1H)、1.56(s,3H)、1.54(s,6H)、1.52(s,3H)、1.51(s,3H)、1.48(s,3H)、1.44(s.9H)、1.42(s,6H)、1.36(s,3H)、1.21(br,s,3H)、1.18(br,s,3H)、1.00(br,s,3H)、1.00(d, J=6.5Hz,3H)、0.95(d,J=6.5Hz,3H)。MALDI−TOF−MS:[M+Na]+(理論値1068.57):測定値1068.96。
【0042】
<化合物10の合成>
Boc−(Aib)3−ΔPhe−Leu−ΔPhe−(Aib)3−OHの合成
化合物9を水酸化ナトリウム(1M)とメタノールの1:2の混合水溶液中でアルカリ加水分解して78%の収率で得た。
化合物10の合成:
フルオロ−N,N,N’,N’−テトラメチルホルムアミジニウムヘキサフルオロホスフェート(TFFH)(0.10g、0.38mmol)に5,15−ビス(3−アミノフェニル)−10,20−ジメシチルポルフィリン(0.11g、0.15mmol)とNMM(0.15ml)およびBoc−(Aib)3−ΔPhe−Leu−ΔPhe−(Aib)3−OH(0.39mg、0.38mmol)のジメチルホルムアミド溶液(10ml)を0℃で加えた後、室温で60時間撹拌して反応させた。反応液を減圧下で蒸発乾涸し、残渣をクロロホルム/メタノール(9/1)を展開液とするシリカゲルの分取薄層クロマトグラフにかけ、化合物10を72%(0.30g)の収率で得た。
MALDI−TOF−MS:[M+Na]+(理論値2758.4):測定値2758.6。
【0043】
<化合物11の合成>
5,15−ビス(3−カルボキシフェニル)−10.20−ジメチルポルフィリンのジナトリリウム塩(21mg、25μmol)とTBTU(40mg、125μmol)を、NMM(54μl)を含有するジメチルホルムアミド溶液(5ml)に溶かし、混合物を室温で25分間撹拌して反応させた。反応混合液をジメチルホルムアミドで20mlになるように希釈した。化合物10のN−末端の保護基をTFAで外した生成物(59mg、25μmol)を、20mlになるようにジメチルホルムアミドに溶解させた。これらの2種類のジメチルホルムアミド溶液を、室温でNMM(1.4μl)のDMF溶液(40ml)に激しく撹拌しながら8時間かけて、同じ速度で滴下した。反応混合物を室温で更に12時間反応させた後、減圧下に蒸発乾涸し、残渣をクロロホルム/メタノール(9/1)を展開液とするシリカゲルの分取薄層クロマトグラフにかけ、紫色の固体として遊離塩基ポルフィリン環状2量体を18%(16mg)の収率で得た。該ポルフィリンを酢酸亜鉛(Zn(OAc)2)のクロロホルム/メタノール(1/1容量比)溶液中に投入し、室温で一晩、撹拌反応させた。反応液を蒸発乾涸して得られた残渣を薄層クロマトグラフィーおよびサイズ排除クロマトグラフィー(SEC)にかけ、化合物11を定量的(16mg)に得た。MALDI−TOF−MS測定により化合物11の生成を確認した(図5参照)。
【0044】
(3)合成:その2
上記の化合物11の場合と同様にして、環状化合物として、図6および図7に示す化合物12〜化合物18を合成した。各環状化合物の同定はMALDI−TOF−MS測定により行った。以下にそれぞれの化合物についての[M+H]+の測定値を括弧内に示す。
化合物12(3194.8)、化合物13(3561.5)、化合物14(3226.5)、化合物15(3708.3)、化合物16(3857.1)、化合物17(3094.3)、化合物18(3776.7)。
【実施例2】
【0045】
環状化合物の特性試験
図8に示す右巻きらせんペプチド鎖を有する環状化合物(I)〔実施例1で合成した化合物11に相当〕のクロロホルム溶液(1.05×10−6M)に右巻きのペンタペプチド(II)のクロロホルム溶液(1.05×10−4M)を(II)/(I)がモル比で0、0.2、0.4、0.6、0.8、1.0、1.4、2.0、3.0、4.0、6.0および10になるように混合し25℃で紫外・可視スペクトルおよびCDスペクトルを測定した。
測定結果を図9および図10に示す。紫外・可視スペクトルおよびCDスペクトルのいずれにおいても、(II)/(I)のモル比が大きくなるに従い謙虚な変化が見られ、右巻きのらせん状支柱部分を有する環状化合物(I)が右巻きのペンタペプチドを取り込み会合体を形成していることが理解される。
【実施例3】
【0046】
環状化合物を用いる光学分割(その1)
図8に示す右巻きのらせんペプチド鎖を有する環状化合物(I)〔実施例1で合成した化合物11に相当〕0.30mg、およびラセミ体のペンタペプチド(II)0.70mgをそれぞれクロロホルム1.0ml、1.6mlに溶解した溶液を室温で混合した。
この混合物をサイズ排除クロマトグラフィー(SEC)にてクロロホルムを用いて展開し、化合物(I)とペプチド(II)からなる会合体を含む黄色フラクションを収集した。
収集した混合物よりクロロホルムを留去し、残渣にテトラヒドロフラン1mlを加えたところ、溶液は赤紫色に変化し、会合体の解離が起こったことが示された。
この混合物を次にテトラヒドロフランを用いて再びSECにて展開し、化合物(I)と(II)を分離した。それぞれテトラヒドロフランを留去することにより、78%の回収率でそれぞれ赤紫色固体(I)と無色固体(II)が単離された。
(II)のキラルカラムクロマトグラフィー(キラルカラム:ダイセル化学工業株式会社製、Chiralpak AD-H)による分析の結果を、ラセミ体のクロマトグラムとともに図10に示す。図10中、下方の実線で示すのが上記のように右巻きのらせんペプチド鎖を有する環状化合物(I)を用いて光学分割を行なった後のペプチド(II)のキラルカラムクロマトグラフィーのチャートである。比較のために、光学分割前の(II)のラセミ体のキラルカラムクロマトグラフィーのチャートを上方の破線で示している。図中の横軸は、保持時間(分)を示し、保持時間の短いフラクションは左巻き体、長いフラクションは右巻き体によるものである。この分析の結果、単離されたペプチド(II)は86:14で右巻き体が多く含まれていることがわかった。
【実施例4】
【0047】
環状化合物を用いる光学分割(その2)
図8に示す左巻きのらせんペプチド鎖を有する化合物(III)〔実施例1で合成した化合物11に相当〕0.29mg、およびラセミ体のペンタペプチド(II)0.65mgをそれぞれクロロホルム1.0ml、1.6mlに溶解した溶液を室温で混合した。
この混合物をサイズ排除クロマトグラフィー(SEC)にてクロロホルムを用いて展開し、化合物(III)とペプチド(II)からなる会合体を含む黄色フラクションを収集した。
収集した混合物よりクロロホルムを留去し、残渣にテトラヒドロフラン1mlを加えたところ、溶液は赤紫色に変化し、会合体の解離が起こったことが示された。
この混合物を次にテトラヒドロフランを用いて再びSECにて展開し、化合物(III)と(II)を分離した。それぞれテトラヒドロフランを留去することにより、78%の回収率でそれぞれ赤紫色固体(III)と無色固体(II)が単離された。
(II)のキラルカラムクロマトグラフィー(キラルカラム:ダイセル化学工業株式会社製、Chiralpak AD-H)による分析の結果を、ラセミ体のクロマトグラムとともに図12に示す。図13中、下方の実線で示すのが上記のように左巻きのらせんペプチド鎖を有する環状化合物(III)を用いて光学分割を行なった後のペプチド(II)のキラルカラムクロマトグラフィーのチャートである。比較のために、光学分割前の(II)のラセミ体のキラルカラムクロマトグラフィーのチャートを上方の破線で示している。図中の横軸は、保持時間(分)を示し、保持時間の短いフラクションは左巻き体、長いフラクションは右巻き体によるものである。この分析の結果、単離されたペプチド(II)は10:90で左巻き体が多く含まれていることがわかった。
【実施例5】
【0048】
環状化合物を用いる光学分割(その3)
実施例1で合成した右巻きのらせんペプチドを有する化合物18を用いて、実施例3と同様の操作によりラセミ体のペンタペプチド(II)の光学分割を行ない、キラルカラムクロマトグラフィーで分析したところ、単離されたペプチドは81:19で右巻き体が多く含まれていることがわかった。
【産業上の利用可能性】
【0049】
本発明は、一般的な分離技術によってオリゴペプチドなどの光学活性な分子(化合物)を分割する手段を提供するものであり、新しい機能性物質や医薬品などの開発に資する。
【図面の簡単な説明】
【0050】
【図1】本発明の環状化合物を用いて光学分割が行なわれる様子を模式的に示す。
【図2】本発明の環状化合物の一般的合成法を示す。
【図3】本発明の環状化合物の一般的合成法を示す。
【図4】実施例1に示す環状化合物の合成における反応スキーム、ならびに中間性生物及び生成物の化学構造式を示す。
【図5】実施例1で合成した環状化合物のMALDI−TOF−MSスペクトルを示す。
【図6】実施例1で合成した環状化合物の化学構造式を示す。
【図7】実施例1で合成した環状化合物の化学構造式を示す。
【図8】実施例2〜実施例5で用いた環状化合物およびオリゴペプチドの化学構造式を示す。
【図9】実施例2の特性試験の結果を示す紫外・可視スペクトルである。
【図10】実施例2の特性試験の結果を示すCD(円二色性)スペクトルである。
【図11】実施例3の光学分割により得られた単離物のキラルカラムクロマトグラムであり、比較のためにラセミ体のキラルカラムクロマトグラムを併せて示している。
【図12】実施例4の光学分割により得られた単離物のキラルカラムクロマトグラムであり、比較のためにラセミ体のキラルカラムクロマトグラムも併せて示している。
【技術分野】
【0001】
本発明は、光学分割の技術分野に属し、特に、らせん分子のバンドルを形成させることにより光学活性体を分離するのに用いることができる新規な大環状化合物に関する。
【背景技術】
【0002】
らせん構造は、一般に、ねじやドリルに見られる加工性・成形性、バネなどの柔軟性・変形性、コンベヤなどに見られる搬送性に関する技術に深く関わるものとして知られているが、分子レベルのナノテクノロジーにおいても、有機・無機化合物および生命体の高機能発現に深く関わるものとして注目を集めている。例えば、らせん構造は、DNAの二重らせんやコラーゲンの三重らせんなどの生体高分子に多く見られ高機能性の発現に寄与しており、また、分子マシンや分子デバイスの構造要素としての期待も大きく、人工分子によるらせん構造体の製造に関する試みが盛んになされている。らせん構造には右巻きと左巻きとが存在し、分子レベルでは異性体として区別される上、その化学的性質や光学的性質も異なる。したがって、らせん構造体の巻き方向をコントロールすることは、新機能発現の基盤技術として重要である。
【0003】
右巻きおよび左巻きのうちの一方のらせん構造を有するらせん分子(らせん化合物)を得るためにこれまでに知られている手段は、選択的製造と光学活性体の分割に大別される。
前者は、重合開始剤あるいはモノマー分子に不斉源を導入し、重合に際に一方巻きのらせん分子のみを製造するものである。この場合、用いることのできる分子、ひいては得られるらせん分子の構造には制限があり、より広範な一方巻きらせん分子の製造には、効率的な光学分割法の開拓が必要であると考えられる。しかしながら、現行の光学分割法は、キラルカラムクロマトグラフィーを用いて低分子光学活性化合物を分離することに留まっており、右巻きと左巻きの混合物から一方の巻き方向のらせん分子を得る技術は殆ど知られていない。
【非特許文献1】T. Nakano, Y. Okamoto, Chem. Rev.101, 4013-4038 (2001)
【発明の開示】
【発明が解決しようとする課題】
【0004】
本発明の目的は、らせん分子(らせん化合物)の立体化学構造を認識し光学活性体を分割する新しい技術を提供することにある。
【課題を解決するための手段】
【0005】
本発明者は、標的となるらせん分子とらせんバンドル構造を形成して会合体を形成することのできる新規な環状化合物の合成に成功し、その会合体形成挙動を検討したところ、立体選択的なバンドル構造形成により、ラセミ体のらせん分子の光学分割ができることを見出し、本発明に到達した。
【0006】
かくして、本発明は、右巻きおよび左巻きのらせん分子の混合物から右巻きまたは左巻きのうちの一方のらせん分子を分離するのに用いられる環状化合物であって、
右巻きまたは左巻きのいずれかで同一の巻き方向を持つ2つのらせん状支柱部分と、該支柱部分の間に介在し前記らせん分子の両末端と相互作用し得る部位とを含む環状構造体から成り、該環状構造体に該らせん分子を取り込むことができる空孔を呈することを特徴とする環状化合物を提供するものである。
【発明の効果】
【0007】
本発明の環状化合物を用いれば、特殊なキラルカラムクロマトグラフィーを用いることなく一般的な分離技術によって、右巻きおよび左巻きのらせん分子の混合物(例えば、α−アミノ酸から成るオリゴペプチドの混合物から、一方の巻き方向のらせん分子を効率的に分離することができる。
【発明を実施するための最良の形態】
【0008】
生体高分子においては、一方向の巻きのペプチドのらせん表面での相互作用によりらせん分子が数本集合した構造体が形成される。本発明は、このような生体高分子に見られるバンドル構造に着目し、合成環状化合物を利用し右巻きまたは左巻きのうちの一方のらせん分子と選択的にバンドルを形成し得るようにすることによって、らせん分子の光学分割を図るものである。
【0009】
このため、本発明の環状化合物は、右巻きまたは左巻きのいずれかで同一の巻き方向を持つ2つのらせん状支柱部分と、該支柱部分の間に介在し、らせん分子の両末端と相互作用し得る部位とを含む環状構造から成り、該環状構造内にらせん分子を取り込むことができるような大きさの空孔を呈する。
【0010】
<光学分割>
図1は、如上の本発明の環状化合物を用いて光学分割が行なわれる様子を模式的に示すものである。図に示されるように、環状化合物(図中、A−1およびA−2)は、2つのらせん状支柱部分(イ,イ)と、らせん分子の両末端と相互作用し得る部位(ロ,ロ)とを含む環状構造から成る。環状化合物(A−1)の2つのらせん状支柱部分(イ,イ)はいずれも右巻きであり、他方、環状化合物(A−2)の2つのらせん状支柱部分(イ,イ)はいずれも左巻きである。
【0011】
本発明の環状化合物を用いて、右巻きおよび左巻きのらせん分子の混合物から右巻きまたは左巻きのうちの一方のらせん分子を分離する(光学分割する)には、先ず、適当な溶媒を用いて前記混合物および環状化合物を溶解させて、該混合物を環状化合物と接触させる。この操作により、右巻きまたは左巻きのうちの一方のらせん分子と環状化合物との会合体が形成される(第1の工程)。
【0012】
すなわち、支柱部分として右巻きまたは左巻きのいずれか一方のらせん鎖を2本有する環状化合物の空孔内に、そのらせん鎖と同じ巻き方向をもつらせん鎖が選択的に取り込まれてそれらのらせん鎖との相互作用によりバンドル構造が形成され、該らせん分子/環状化合物会合体が構築されるものと考えられる。このとき、本発明の環状化合物の更なる特徴は、らせん状支柱部分の間に介在してらせん分子の両末端とも相互作用し得る部位を含むことにあり、この相互作用の存在により会合体の形成が確実となる。
【0013】
例えば、図1の上方に示す例では、右巻きのらせん状支柱部分(イ,イ)を有する環状化合物(A−1)の空孔内に、右巻きのらせん分子(B−1)と左巻きのらせん分子(B−2)のうち右巻きのらせん分子(B−1)が選択的に取り込まれて、支柱部分(イ,イ)と三重らせんのバンドル構造を形成し、この際、らせん分子(B−1)の両末端も環状化合物(A−1)の相互作用部位(ロ,ロ)の作用によりバンドル形成が確実となり、会合体(C−1)が形成され、未反応のらせん分子(B−1,B−2)は残存する。同様に、図2の下方に示す例では、環状化合物(A−2)の空孔内に左巻きのらせん分子(B−2)が選択的に取り込まれて、バンドル構造を含む会合体(C−2)が形成され、未反応らせん分子(B−1,B−2)が残存することになる。
【0014】
以上のようにして生成したらせん分子/環状化合物会合体を含む混合物(生成物)は、適当な手段、例えば、サイズ排除クロマトグラフィー(SEC)に供されることにより、該会合体を未反応の環状化合物および未反応のらせん分子から分離する(第2の工程)。この第2の工程で会合体から分離された未反応の環状化合物およびらせん分子は、必要に応じて、第1の工程に循環させることができる。
【0015】
本発明の方法においては、さらに、分離された前記会合体を環状化合物とらせん分子に解離させ、それらの環状化合物とらせん分子をそれぞれ分離回収する(第3の工程)。この工程は、一般に、会合体を溶解している溶媒を除去した後、会合体の形成を阻害するような別の溶媒を加えることによって行なわれる。この第3の工程で分離回収した環状化合物も必要に応じて第1の工程に循環させることができる。
【0016】
第1の工程で使用される溶媒は環状化合物と分割しようとするらせん分子の溶解度が高く、会合体の形成を阻害しないものが好ましい。第1の工程で用いられるのに好適な溶媒の例として、クロロホルム、塩化メチレン等が挙げられ、トルエン等は溶解性が乏しく、テトラヒドロフランは会合体形成を阻害するので好ましくない。テトラヒドロフランは、第3の工程で使用されるのに好適な溶媒の例である。
【0017】
本発明の環状化合物を用いる光学分割において、分割しようとするらせん分子と環状化合物との比率(右巻きまたは左巻きのらせん分子/環状化合物)は特に制限はなく、分割後の一方巻きのらせん分子の所望の光学純度と分割のためのプロセスの効率により選択すればよいが、比率が小さすぎると一回の分割操作(会合体形成)での選択性が悪く、また大きすぎると大量の未分割のらせん分子を循環させる必要があり、効率が悪いので、1〜20の範囲が好ましく、1〜10の範囲が更に好ましい。最も好ましくは2〜5の範囲である。
【0018】
分割しようとするらせん分子と環状化合物の濃度にも特に制限はなく、例えば、生成する会合体と未分割のらせん分子の分離および会合体の解離後のらせん分子と環状化合物の分離のプロセスの効率を考慮して選択すればよい。
会合体形成の温度にも制限はないが高すぎたり、低すぎたりすると設備が複雑になるので、通常、0〜100℃の範囲が好ましく、0〜50℃の範囲が更に好ましく、常温が最も好ましい。
【0019】
分割しようとするらせん分子の両末端は環状化合物の相互作用部位との相互作用を制御するために修飾することができる。例えば、相互作用部位がポルフィリンの場合、衷心金属に軸配位できる官能基、例えばピリジン基を持つように修飾することが好ましい。
【0020】
<環状化合物>
光学分割に用いることのできる本発明の環状化合物は、既述のように、分離すべきらせん分子の両末端と相互作用し得る部分を含む。この相互作用部位は、種々の相互作用、例えば、疎水性相互作用や配位結合性相互作用などによりらせん分子の両末端と相互作用し得る構造要素を有するものである。例えば、疎水性相互作用を供し得るものとしてシクロデキストリン構造を有するものなどが適用可能であるが、合成の容易さなどから特に好ましいのはポルフィリン骨格を持つものである。
かくして、本発明に従う好ましい環状化合物は下記の式1で表すことができる。
【0021】
【化1】

【0022】
式1において、A1およびA2は、右巻きまたは左巻きのいずれかで同一の巻き方向のらせん分子より支柱部分を表す。A1およびA2は、一般的には同一であるが、異なっていてもよい。
式1中、Y1、Y2、Y3およびY4は水素原子、または1個ないし12個の炭素原子を有するアルキル基もしくはアリール基もしくはアラルキル基を表し、それらはヘテロ原子で置換されまたは不飽和結合をもっていてもよく、また、互いに同一であるのが一般的であるが、異なっていてもよい。
X1、X2、X3およびX4は、水素原子、または1個ないし12個の炭素原子を有するアルキル基もしくはアルコキシ基を表し、互いに同一であるのが一般的であるが異なっていてもよい。
式1中、M1およびM2は、水素原子、第4もしくは第5周期の遷移金属イオン、または第VIII族の遷移金属イオンもしくはアンチモンイオンを表し、互いに同一であるのが一般的であるが、異なっていてもよい。
【0023】
本発明の環状化合物は、らせん構造を呈する種々のポリマーやオリゴマーの混合物から所望の巻き方向のらせん物質を分離するのに適用することができる。例えば、ポリシランやポリイソシアニドのようならせん分子の光学分割にも適用可能であり、このような場合には、式1のA1およびA2で表される支柱部分は、それぞれ、シラン鎖やイソシアニド鎖から成るらせん性分子を含むことになる。
【0024】
本発明の環状化合物は、オリゴペプチドの光学分割を行なうのに適しており、この場合、式1におけるA1およびA2が同一であって、少なくとも1つの不斉炭素原子を有するオリゴペプチド鎖を含む。かくして、本発明の環状化合物の特に好ましい態様は下記の式2で表されるものである。
【0025】
【化2】

【0026】
式2中、R1、R2、R3、R4、R5、R6、R7およびR8は、水素原子、1個ないし12個の炭素原子を有するアルキル基もしくはアリール基もしくはアラルキル基で置換されていてもよいエキソメチレン基、または1個ないし12個の炭素原子を有するアルキル基もしくはアリール基もしくはアラルキル基を表し、それらはヘテロ原子で置換されまたは不飽和結合をもっていてもよく、また、互いに同一でも異なっていてもよい。
【0027】
R1〜R8がエキソメチレン基の場合は、R1とR2、R3とR4、R5とR6、およびR7とR8の少なくとも1つ(一般的にR1とR2、および/またはR3とR4)がエキソメチレン基を構成し、好ましくは1個ないし8個(特に好ましくは1個ないし6個)の炭素原子を有するアルキル基またはアリール基またはアラルキル基(好ましくはフェニル基)で置換されているものである。R1〜R8が、アルキル基またはアリール基またはアラルキル基の場合、好ましくは1個ないし8個(特に好ましくは1個ないし6個)の炭素原子を有するアルキル基またはアリール基またはアラルキル基であり、好適な例はメチル基である。好ましい態様として、R1とR2およびR3とR4がそれぞれフェニル基で置換されたエキソメチレン基を構成し、R5、R6、R7およびR8がメチル基である場合や、R1、R2、R3、R4、R5、R6、R7およびR8のいずれもがメチル基である場合などが挙げられる。式2中、R9は1個ないし12個、好ましくは1個ないし8個(特に好ましくは1個ないし6個)の炭素原子を有するアルキル基またはアリール基またはアラルキル基を表し、それらはヘテロ原子または不飽和結合をもつ官能基または原子団で置換されていてもよい。好ましい態様として、R9が1個ないし6個の炭素原子を有するアルキル基である場合が挙げられる。
【0028】
既述のように、本発明の環状化合物の支柱部分を構成するらせん分子は少なくとも1つの不斉炭素原子を有するが、一般に、R9が結合している骨格の炭素原子は不斉炭素原子である。また、R1〜R8およびR9は、それらを含む支柱部分が、分離(光学分割)すべきらせん分子(オリゴペプチド)のペプチド鎖に同一または可及的に近似したペプチド構造を呈し且つ該らせん分子の長さと概ね等しいか近い長さになるよう各種のアミノ酸類(出発原料)を選択することにより決められる(後述の合成法参照)。
【0029】
式2において、n1およびn2はそれぞれ0〜20の自然数を表し、且つ、n1+n2≧2の関係を満たす。一般に、支柱部分が長くなると得られる環状化合物の溶解性が悪くなるので、n1+n2は好ましくは12以下(特に好ましくは8以下)である。
【0030】
式2において、X1、X2、X3およびX4は、式1に関して定義したものと同じ、すなわち、水素原子または1個ないし12個の炭素原子を有するアルキル基もしくはアルコキシ基を表し、互いに同一であるのが一般的であるが異なっていてもよい。原料の入手や合成の容易さ、および得られる環状化合物の溶解性などを考慮すると、X1〜X4として好ましいのは水素原子、または1個ないし8個の炭素原子を有するアルコキシ基である。
【0031】
式2中、Y1、Y2、Y3およびY4は、式1に関して定義したものと同じである。すなわち、Y1、Y2、Y3およびY4は、水素原子、または1個ないし12個の炭素原子を有するアルキル基もしくはアリール基もしくはアラルキル基を表し、それらはヘテロ原子で置換されまたは不飽和結合をもっていてもよく、また、互いに同一であるのが一般的であるが異なっていてもよい。Y1〜Y4も目的の環状化合物の原料の入手や合成の容易さ、および溶解性などを考慮して選ばれ、この点から特に好ましい例は、水素原子またはトリメチルフェニル基である。
【0032】
式2中、M1、M2は、式1に関して定義したものと同じであり、水素原子、第4もしくは第5周期の遷移金属イオン、または第VIII族の遷移金属イオンもしくはアンチモンイオンを表し、互いに同一であるのが一般的であるが異なっていてもよい。これらの金属イオンは、ポルフィリン環とともに、分離(光学分割)しようとするらせん分子の両末端と配位結合性の相互作用部位を構成して、らせん分子/環状化合物会合体の形成を確実にする。このような相互作用、および入手や合成の容易さを考慮して、M1およびM2として好ましいのは、Zn、Rh、Feなど金属イオンであり、特に好ましいのはZnイオンである。
【0033】
<環状化合物の合成>
本発明の環状化合物は種々の反応を工夫することによって合成することができる。図2および図3は、既述の式1ないしは式2で表される環状化合物に沿って、本発明の環状化合物の一般的合成法を示すものであり、概略次のように行なわれる。
【0034】
光学分割対象のらせん分子の末端と相互作用しうる構造要素(例えばポルフィリン)のビスアミノ体1当量に対し、カルボキシル末端を有するらせん性分子(例えばアミノ末端をBoc−基で保護したオリゴペプチド)2当量をDMFなどの適当な溶媒中、2当量の縮合剤(例えばフルオロ−N,N,N’,N’−テトラメチルホルムアミジニウムヘキサフルオロホスフェート:TFFH)および少量の添加剤(N−メチルモルホリン:NMM)を用いて室温で60時間程度撹拌して縮合させる。反応溶媒を減圧下で留去し、残渣をシリカゲルのクロマトグラフィーにより精製し、構造要素1分子に2分子のらせん性分子が結合した大環状化合物の前駆体を得る(図2のイ参照)。得られた大環状化合物の前駆体のアミノ末端を酸処理によって脱保護し、DMFなどの適当な溶媒を用いて1mM程度に希釈する(図2のロ参照)。
【0035】
一方、カルボキシル基を2個有するポルフィリンなどの構造要素1当量を、5当量の縮合剤(例えばO−(ベンゾトリアゾール−1−イル)−N,N,N’,N’−テトラメチルウロニウムテトラフルオロボレート:TBTU)および2当量のNMMとDMF中で混合し1mM程度に希釈する。これら2種類のDMF溶液を、NMM4当量を含む2倍量のDMF中に室温で激しく撹拌しながら8時間以上かけて同じ速度で滴下する。反応混合液を更に12時間反応させた後、減圧下で蒸発乾涸し、残渣をシリカゲルのクロマトグラフィーにより精製し大環状化合物を単離する(図3のハ参照)。ポルフィリンなどの構造要素中に亜鉛などの金属を導入する場合には、20当量の酢酸亜鉛とクロロホルム/メタノールなどの混合溶媒中、室温で一晩撹拌反応させる。反応液を減圧下で蒸発乾涸させて得られた残渣をシリカゲルクロマトグラフィーによって精製することで目的化合物を得る(図3のニ参照)。
【0036】
以下に、本発明の特徴をさらに具体的に明らかにするため実施例を示すが、本発明はこれらの実施例によって制限されるものではない。
なお、本明細書および図面に示す化学構造式においては、慣用的な表現法に従い炭素原子および水素原子を省略していることがある。
【実施例1】
【0037】
環状化合物の合成
(1)試薬等
アミノ酸類はすべて渡辺化学工業株式会社または東京化成工業株式会社から購入したものをそのまま用いた。ジシクロヘキシルカルボジイミド(DCC:和光純薬工業株式会社)、1−ヒドロキシベンゾトリアゾール(HOBt:ペプチド研究所)、およびO−(ベンゾトリアゾール−1−イル)−N,N,N’,N’−テトラメチルウロニウムテトラフルオロボレート:TBTU:東京化成工業株式会社)等のカップリング剤は試薬をそのまま用いた。
トリフルオロ酢酸(TFA:和光純薬工業株式会社)、ジイソプロピルエチルアミン(DIEA:和光純薬工業株式会社)およびN−メチルモルフォリン(NMM:ナカライテスク株式会社)は購入品をそのまま用いた。反応溶媒は市販品を脱水剤の存在下にアルゴン雰囲気で蒸留して用いるカーボンナノチューブ、和光純薬工業株式会社製または関東化学株式会社製の無水グレード品を用いた。
α−アミノイソ酪酸(Aib)のオリゴマーはMacromolecules
1985, 18, 895-902およびJ. Am. Chem.
Soc. 1999, 121, 6948-6949に記載の公知の液相法により合成した。
Aibと塩化ベンゾイルオキシカルボニル(Z−Cl)または炭酸ジターシャリーブチル(Boc2O)とを反応させてそれぞれ得たZ−Aib−OHまたはBoc−Aib−OHはJ. Org. Chem. 1991, 56, 2611-2641、J. Am. Chem. Soc. 1995, 117, 5401-5402およびLett. Peptide Sci. 1995, 2, 285-288に記載のHOBt−活性エステルを中間体とするDCC法または酸フルオライド法に従って次の鎖延長工程に用いた。
Z−およびBoc−保護基はそれぞれPd/Cを触媒とする接触水素化および酸化水分解により外した。
5,15−ビス(3−アミノフェニル)−10,20−ジメチルポルフィリンはTetrahedron 1994, 50, 11427-11440に記載の方法によりメソ−(メシチル)ジピロメタンと3−ニトロベンズアルデヒドを反応させた後、ニトロ基をNew J. Chem. 1999,
309-316に記載の方法に従い、SnCl2/HClで還元して合成した。同様に5,15−ビス(3‐カルボキシフェニル)−10,20−ジメチルポルフィリンハメソ−(メシチル)ジピロメタンと3−(メトキシカルボニル)ベンズアルデヒド反応させた後、エステル部分をアルカリ加水分解して合成した。
【0038】
(2)合成:その1
環状化合物として図4に示す化合物11を合成した。
<Boc−Leu−ΔPhe−Azlactone(6)の合成>
Boc−Leu−DL−Phe(β−OH)−OMeの合成:
Boc−Leu−OH(1.2g、4.8mmol)のジクロロメタン(20ml)溶液に0℃でHOBt(0.78g、5.8mmol)、DCC(1.2g、5.8mmol)、トリエチルアミン(1.4ml、10mmol)、およびHCl・H−DL−Phe(β−OH)−OMe(1.1g、4.8mmol)を少しずつ加えた後、室温で撹拌しながら24時間反応させた。反応混合物を5%の硫酸水素カリウム(KHSO4)水溶液に注ぎ、沈澱した無色の固体を濾別し、有機溶媒層を5%の炭酸水素ナトリウム(NaHCO3)と冷メタノールで洗浄した後、硫酸ナトリウムで乾燥し減圧下で乾涸した。残渣をシリカゲルのクロマトグラフにかけ、主留分を蒸発乾涸してBoc−Leu−DL−Phe(β−OH)−OMeを白色の粉末(1.96g)として定量的に得た。
Boc−Leu−DL−Phe(β−OH)の合成:
Boc−Leu−DL−Phe(β−OH)−OMeのメタノール溶液(20ml)に水酸化ナトリウム水溶液(1M;19ml)を室温で加え、撹拌下に3時間反応させた。反応液を濃縮して5%のKHSO4水溶液で処理した後、クロロホルムで抽出した。抽出液を硫酸ナトリウムで乾燥し、蒸発乾涸してBoc−Leu−DL−Phe(β−OH)−OH(1.9g)を白色の粉末として定量的に得た。
Boc−Leu−ΔPhe−Azlactone(6)の合成:
Boc−Leu−DL−Phe(β−OH)−OH(1.9g、4.8mmol)の無水酢酸(9.6ml)溶液に無水酢酸ナトリウム(0.47g、5.8mmol)を加え、室温で14時間反応させた。反応混合物を減圧下で蒸発乾涸した後、クロロホルムに溶かし、5%のNaHCO3水溶液で洗浄し、次いで10%の食塩水で洗浄した。洗浄後の溶液を硫酸ナトリウムで乾燥した後、蒸発乾涸して得た残渣をクロロホルム/ヘキサンの混合溶媒から再結晶して化合物6を白色結晶として収率68%(1.2g)で得た。
1H NMR(500MHz,CDCl3):δ=8.10-8.06(m,2H)、7.44-7.40(m,3H)、7.18(s,1H)、4.94-4.86(m,1H)、4.78-4.70(m,1H)、1.80-1.60(m,3H)、1.45(s,9H)、0.98(d,J=6.0Hz,6H)。ESI-TOF-MS:[M+Na]+(理論値381.18):測定値381.18。
【0039】
<Boc−Leu−ΔPhe−(Aib)3−OMe(7)の合成:
化合物6(0.75g、2.1mmol)とH−(Aib)3−OMe(0.50g、1.8mmol)を字メチルホルムアミド(10ml)に溶かし、室温で18時間撹拌した。反応混合液を減圧下に蒸発乾涸しジクロルメタン/メタノールを展開溶媒としてシリカゲルのクロマトグラフにかけ化合物7の白色粉末を91%(1.0g)の収率で得た。
1H NMR(500MHz,CDCl3):δ=7.56(br,s,1H)、7.42-7.30(m,6H)、7.22(br,s, 1H)、7.21(br,s,1H)、7.13(s,1H)、4.98(s,1H)、4.06-4.00(m,1H)、3.66(s,3H)、1.76-1.68(m,2H)、1.58-1.54(m,1H)、1.54(s,3H)、1.53(s,3H)、1.52(s,3H)、1.49(s,6H)、1.48(s,3H)、1.01(d, J=6.0Hz,3H)、0.98(d, J=6.0Hz, 3H)。ESI-TOF-MS:[M+Na]+(理論値668.36):測定値668.24。
【0040】
<Boc−(Aib)3−ΔPhe−Azlactone(8)の合成>
化合物6の合成と同様に手順でBoc−(Aib)3−OH(1.2g、1.7mmol)から3段階の反応で化合物8を総合収率83%(1.4g)で得た。
1H NMR(500MHz,CDCl3):δ=8.10-8.06(m,2H)、7.62(s,1H)、7.42-7.34(m,3H)、7.11(s,3H)、6.37(s,1H)、4.88(s,3H)、1.68(s,6H)、1.45(s,15H)、1.42(s,6H)。MALDI−TOF−MS:[M+Na]+(理論値523.58):測定値523.55。
【0041】
<Boc−(Aib)3−ΔPhe−Leu−ΔPhe−(Aib)3−OMe(9)の合成>
化合物7をTFAで加水分解することにより定量的に得られるTFA・H−Leu−ΔPhe−(Aib)3−OMe(0.85g、1.3mmol)と化合物8(0.72g、1.4mmol)をジメチルホルムアミド(12ml)に溶かし室温で90時間撹拌して反応させた。反応液を減圧下に蒸発乾涸し、残渣をクロロホルム/メタノールを展開液とするシリカゲルのクロマトグラフにかけ、化合物9を収率60%(0.82g)で白色粉末として得た。
1H NMR(500MHz,CDCl3):δ=8.99(s,1H)、8.89(s,1H)、8.03(br,s,1H)、7.99(s,1H)、7.59(br,s,1H)、7.55(s,1H)、7.54-7.50(s,1H)、7.54-7.50(m,2H)、7.50-7.46(m,2H)、7.34-7.20(m,9H)、6.72(br,s,1H)、5.36(br,s,1H)、4.38-4.32(m,1H)、3.64(s,3H)、1.98-1.88(m,2H)、1.78-1.72(m,1H)、1.56(s,3H)、1.54(s,6H)、1.52(s,3H)、1.51(s,3H)、1.48(s,3H)、1.44(s.9H)、1.42(s,6H)、1.36(s,3H)、1.21(br,s,3H)、1.18(br,s,3H)、1.00(br,s,3H)、1.00(d, J=6.5Hz,3H)、0.95(d,J=6.5Hz,3H)。MALDI−TOF−MS:[M+Na]+(理論値1068.57):測定値1068.96。
【0042】
<化合物10の合成>
Boc−(Aib)3−ΔPhe−Leu−ΔPhe−(Aib)3−OHの合成
化合物9を水酸化ナトリウム(1M)とメタノールの1:2の混合水溶液中でアルカリ加水分解して78%の収率で得た。
化合物10の合成:
フルオロ−N,N,N’,N’−テトラメチルホルムアミジニウムヘキサフルオロホスフェート(TFFH)(0.10g、0.38mmol)に5,15−ビス(3−アミノフェニル)−10,20−ジメシチルポルフィリン(0.11g、0.15mmol)とNMM(0.15ml)およびBoc−(Aib)3−ΔPhe−Leu−ΔPhe−(Aib)3−OH(0.39mg、0.38mmol)のジメチルホルムアミド溶液(10ml)を0℃で加えた後、室温で60時間撹拌して反応させた。反応液を減圧下で蒸発乾涸し、残渣をクロロホルム/メタノール(9/1)を展開液とするシリカゲルの分取薄層クロマトグラフにかけ、化合物10を72%(0.30g)の収率で得た。
MALDI−TOF−MS:[M+Na]+(理論値2758.4):測定値2758.6。
【0043】
<化合物11の合成>
5,15−ビス(3−カルボキシフェニル)−10.20−ジメチルポルフィリンのジナトリリウム塩(21mg、25μmol)とTBTU(40mg、125μmol)を、NMM(54μl)を含有するジメチルホルムアミド溶液(5ml)に溶かし、混合物を室温で25分間撹拌して反応させた。反応混合液をジメチルホルムアミドで20mlになるように希釈した。化合物10のN−末端の保護基をTFAで外した生成物(59mg、25μmol)を、20mlになるようにジメチルホルムアミドに溶解させた。これらの2種類のジメチルホルムアミド溶液を、室温でNMM(1.4μl)のDMF溶液(40ml)に激しく撹拌しながら8時間かけて、同じ速度で滴下した。反応混合物を室温で更に12時間反応させた後、減圧下に蒸発乾涸し、残渣をクロロホルム/メタノール(9/1)を展開液とするシリカゲルの分取薄層クロマトグラフにかけ、紫色の固体として遊離塩基ポルフィリン環状2量体を18%(16mg)の収率で得た。該ポルフィリンを酢酸亜鉛(Zn(OAc)2)のクロロホルム/メタノール(1/1容量比)溶液中に投入し、室温で一晩、撹拌反応させた。反応液を蒸発乾涸して得られた残渣を薄層クロマトグラフィーおよびサイズ排除クロマトグラフィー(SEC)にかけ、化合物11を定量的(16mg)に得た。MALDI−TOF−MS測定により化合物11の生成を確認した(図5参照)。
【0044】
(3)合成:その2
上記の化合物11の場合と同様にして、環状化合物として、図6および図7に示す化合物12〜化合物18を合成した。各環状化合物の同定はMALDI−TOF−MS測定により行った。以下にそれぞれの化合物についての[M+H]+の測定値を括弧内に示す。
化合物12(3194.8)、化合物13(3561.5)、化合物14(3226.5)、化合物15(3708.3)、化合物16(3857.1)、化合物17(3094.3)、化合物18(3776.7)。
【実施例2】
【0045】
環状化合物の特性試験
図8に示す右巻きらせんペプチド鎖を有する環状化合物(I)〔実施例1で合成した化合物11に相当〕のクロロホルム溶液(1.05×10−6M)に右巻きのペンタペプチド(II)のクロロホルム溶液(1.05×10−4M)を(II)/(I)がモル比で0、0.2、0.4、0.6、0.8、1.0、1.4、2.0、3.0、4.0、6.0および10になるように混合し25℃で紫外・可視スペクトルおよびCDスペクトルを測定した。
測定結果を図9および図10に示す。紫外・可視スペクトルおよびCDスペクトルのいずれにおいても、(II)/(I)のモル比が大きくなるに従い謙虚な変化が見られ、右巻きのらせん状支柱部分を有する環状化合物(I)が右巻きのペンタペプチドを取り込み会合体を形成していることが理解される。
【実施例3】
【0046】
環状化合物を用いる光学分割(その1)
図8に示す右巻きのらせんペプチド鎖を有する環状化合物(I)〔実施例1で合成した化合物11に相当〕0.30mg、およびラセミ体のペンタペプチド(II)0.70mgをそれぞれクロロホルム1.0ml、1.6mlに溶解した溶液を室温で混合した。
この混合物をサイズ排除クロマトグラフィー(SEC)にてクロロホルムを用いて展開し、化合物(I)とペプチド(II)からなる会合体を含む黄色フラクションを収集した。
収集した混合物よりクロロホルムを留去し、残渣にテトラヒドロフラン1mlを加えたところ、溶液は赤紫色に変化し、会合体の解離が起こったことが示された。
この混合物を次にテトラヒドロフランを用いて再びSECにて展開し、化合物(I)と(II)を分離した。それぞれテトラヒドロフランを留去することにより、78%の回収率でそれぞれ赤紫色固体(I)と無色固体(II)が単離された。
(II)のキラルカラムクロマトグラフィー(キラルカラム:ダイセル化学工業株式会社製、Chiralpak AD-H)による分析の結果を、ラセミ体のクロマトグラムとともに図10に示す。図10中、下方の実線で示すのが上記のように右巻きのらせんペプチド鎖を有する環状化合物(I)を用いて光学分割を行なった後のペプチド(II)のキラルカラムクロマトグラフィーのチャートである。比較のために、光学分割前の(II)のラセミ体のキラルカラムクロマトグラフィーのチャートを上方の破線で示している。図中の横軸は、保持時間(分)を示し、保持時間の短いフラクションは左巻き体、長いフラクションは右巻き体によるものである。この分析の結果、単離されたペプチド(II)は86:14で右巻き体が多く含まれていることがわかった。
【実施例4】
【0047】
環状化合物を用いる光学分割(その2)
図8に示す左巻きのらせんペプチド鎖を有する化合物(III)〔実施例1で合成した化合物11に相当〕0.29mg、およびラセミ体のペンタペプチド(II)0.65mgをそれぞれクロロホルム1.0ml、1.6mlに溶解した溶液を室温で混合した。
この混合物をサイズ排除クロマトグラフィー(SEC)にてクロロホルムを用いて展開し、化合物(III)とペプチド(II)からなる会合体を含む黄色フラクションを収集した。
収集した混合物よりクロロホルムを留去し、残渣にテトラヒドロフラン1mlを加えたところ、溶液は赤紫色に変化し、会合体の解離が起こったことが示された。
この混合物を次にテトラヒドロフランを用いて再びSECにて展開し、化合物(III)と(II)を分離した。それぞれテトラヒドロフランを留去することにより、78%の回収率でそれぞれ赤紫色固体(III)と無色固体(II)が単離された。
(II)のキラルカラムクロマトグラフィー(キラルカラム:ダイセル化学工業株式会社製、Chiralpak AD-H)による分析の結果を、ラセミ体のクロマトグラムとともに図12に示す。図13中、下方の実線で示すのが上記のように左巻きのらせんペプチド鎖を有する環状化合物(III)を用いて光学分割を行なった後のペプチド(II)のキラルカラムクロマトグラフィーのチャートである。比較のために、光学分割前の(II)のラセミ体のキラルカラムクロマトグラフィーのチャートを上方の破線で示している。図中の横軸は、保持時間(分)を示し、保持時間の短いフラクションは左巻き体、長いフラクションは右巻き体によるものである。この分析の結果、単離されたペプチド(II)は10:90で左巻き体が多く含まれていることがわかった。
【実施例5】
【0048】
環状化合物を用いる光学分割(その3)
実施例1で合成した右巻きのらせんペプチドを有する化合物18を用いて、実施例3と同様の操作によりラセミ体のペンタペプチド(II)の光学分割を行ない、キラルカラムクロマトグラフィーで分析したところ、単離されたペプチドは81:19で右巻き体が多く含まれていることがわかった。
【産業上の利用可能性】
【0049】
本発明は、一般的な分離技術によってオリゴペプチドなどの光学活性な分子(化合物)を分割する手段を提供するものであり、新しい機能性物質や医薬品などの開発に資する。
【図面の簡単な説明】
【0050】
【図1】本発明の環状化合物を用いて光学分割が行なわれる様子を模式的に示す。
【図2】本発明の環状化合物の一般的合成法を示す。
【図3】本発明の環状化合物の一般的合成法を示す。
【図4】実施例1に示す環状化合物の合成における反応スキーム、ならびに中間性生物及び生成物の化学構造式を示す。
【図5】実施例1で合成した環状化合物のMALDI−TOF−MSスペクトルを示す。
【図6】実施例1で合成した環状化合物の化学構造式を示す。
【図7】実施例1で合成した環状化合物の化学構造式を示す。
【図8】実施例2〜実施例5で用いた環状化合物およびオリゴペプチドの化学構造式を示す。
【図9】実施例2の特性試験の結果を示す紫外・可視スペクトルである。
【図10】実施例2の特性試験の結果を示すCD(円二色性)スペクトルである。
【図11】実施例3の光学分割により得られた単離物のキラルカラムクロマトグラムであり、比較のためにラセミ体のキラルカラムクロマトグラムを併せて示している。
【図12】実施例4の光学分割により得られた単離物のキラルカラムクロマトグラムであり、比較のためにラセミ体のキラルカラムクロマトグラムも併せて示している。
【特許請求の範囲】
【請求項1】
右巻きおよび左巻きのらせん分子の混合物から右巻きまたは左巻きのうちの一方のらせん分子を分離するのに用いられる環状化合物であって、
右巻きまたは左巻きのいずれかで同一の巻き方向を持つ2つのらせん状支柱部分と、該支柱部分の間に介在し前記らせん分子の両末端と相互作用し得る部位とを含む環状構造体から成り、該環状構造体に該らせん分子を取り込むことができる空孔を呈することを特徴とする環状化合物。
【請求項2】
下記の式で表わされることを特徴とする環状化合物。
【化1】

(式1中、A1およびA2は右巻きまたは左巻きのいずれかで同一の巻き方向のらせん性分子よりなる支柱部分を表し、互いに異なっていてもよく、X1、X2、X3およびX4は、水素原子、または1個ないし12個の炭素原子を有するアルキル基もしくはアルコキシ基を表し、互いに同一でも異なっていてもよく、Y1、Y2、Y3およびY4は水素原子、または1個ないし12個の炭素原子を有するアルキル基もしくはアリール基もしくはアラルキル基を表し、それらはヘテロ原子で置換されまたは不飽和結合をもっていてもよく、また、互いに同一でも異なっていてもよく、M1およびM2は、水素原子、第4もしくは第5周期の遷移金属イオン、または第VIII族の遷移金属イオンもしくはアンチモンイオンを表し、互いに同一でも異なっていてもよい。)
【請求項3】
式1におけるA1およびA2が同一であって、少なくとも1つの不斉炭素原子を有するオリゴペプチド鎖を含むことを特徴とする請求項2の環状化合物。
【請求項4】
下記の式2で表されることを特徴とする請求項3の環状化合物。
【化2】

(式2中、R1、R2、R3、R4、R5、R6、R7およびR8は、水素原子、1個ないし12個の炭素原子を有するアルキル基もしくはアリール基もしくはアラルキル基で置換されていてもよいエキソメチレン基、または1個ないし12個の炭素原子を有するアルキル基もしくはアリール基もしくはアラルキル基を表し、それらはヘテロ原子で置換されまたは不飽和結合をもっていてもよく、また、互いに同一でも異なっていてもよく、R9は1個ないし12個の炭素原子を有するアルキル基またはアリール基またはアラルキル基を表し、それらはヘテロ原子または不飽和結合をもつ官能基または原子団で置換されていてもよく、n1およびn2はそれぞれ0〜20の自然数を表すが、n1+n2≧2の関係を満たすものであり、X1、X2、X3およびX4、Y1、Y2、Y3およびY4、ならびにM1およびM2は式1に関して定義したものと同じである。)。
【請求項5】
R1とR2およびR3とR4がそれぞれフェニル基で置換されたエキソメチレン基を構成し、R5、R6、R7およびR8がメチル基であることを特徴とする請求項4の環状化合物。
【請求項6】
R1、R2、R3、R4、R5、R6、R7およびR8のいずれもがメチル基であることを特徴とする請求項4の環状化合物。
【請求項7】
R9が1個ないし6個の炭素原子を有するアルキル基であることを特徴とする請求項4の環状化合物。
【請求項8】
n1+n2が8以下であることを特徴とする請求項4の環状化合物。
【請求項9】
X1、X2、X3およびX4が、水素原子、または1個ないし8個の炭素原子を有するアルコキシ基であることを特徴とする請求項4の環状化合物。
【請求項10】
Y1、Y2、Y3およびY4が、水素原子またはトリメチルフェニル基であることを特徴とする請求項4の環状化合物。
【請求項11】
M1、M2が、Zn、RhまたはFeの金属イオンであることを特徴とする請求項4〜10のいずれかの環状化合物。
【請求項1】
右巻きおよび左巻きのらせん分子の混合物から右巻きまたは左巻きのうちの一方のらせん分子を分離するのに用いられる環状化合物であって、
右巻きまたは左巻きのいずれかで同一の巻き方向を持つ2つのらせん状支柱部分と、該支柱部分の間に介在し前記らせん分子の両末端と相互作用し得る部位とを含む環状構造体から成り、該環状構造体に該らせん分子を取り込むことができる空孔を呈することを特徴とする環状化合物。
【請求項2】
下記の式で表わされることを特徴とする環状化合物。
【化1】

(式1中、A1およびA2は右巻きまたは左巻きのいずれかで同一の巻き方向のらせん性分子よりなる支柱部分を表し、互いに異なっていてもよく、X1、X2、X3およびX4は、水素原子、または1個ないし12個の炭素原子を有するアルキル基もしくはアルコキシ基を表し、互いに同一でも異なっていてもよく、Y1、Y2、Y3およびY4は水素原子、または1個ないし12個の炭素原子を有するアルキル基もしくはアリール基もしくはアラルキル基を表し、それらはヘテロ原子で置換されまたは不飽和結合をもっていてもよく、また、互いに同一でも異なっていてもよく、M1およびM2は、水素原子、第4もしくは第5周期の遷移金属イオン、または第VIII族の遷移金属イオンもしくはアンチモンイオンを表し、互いに同一でも異なっていてもよい。)
【請求項3】
式1におけるA1およびA2が同一であって、少なくとも1つの不斉炭素原子を有するオリゴペプチド鎖を含むことを特徴とする請求項2の環状化合物。
【請求項4】
下記の式2で表されることを特徴とする請求項3の環状化合物。
【化2】

(式2中、R1、R2、R3、R4、R5、R6、R7およびR8は、水素原子、1個ないし12個の炭素原子を有するアルキル基もしくはアリール基もしくはアラルキル基で置換されていてもよいエキソメチレン基、または1個ないし12個の炭素原子を有するアルキル基もしくはアリール基もしくはアラルキル基を表し、それらはヘテロ原子で置換されまたは不飽和結合をもっていてもよく、また、互いに同一でも異なっていてもよく、R9は1個ないし12個の炭素原子を有するアルキル基またはアリール基またはアラルキル基を表し、それらはヘテロ原子または不飽和結合をもつ官能基または原子団で置換されていてもよく、n1およびn2はそれぞれ0〜20の自然数を表すが、n1+n2≧2の関係を満たすものであり、X1、X2、X3およびX4、Y1、Y2、Y3およびY4、ならびにM1およびM2は式1に関して定義したものと同じである。)。
【請求項5】
R1とR2およびR3とR4がそれぞれフェニル基で置換されたエキソメチレン基を構成し、R5、R6、R7およびR8がメチル基であることを特徴とする請求項4の環状化合物。
【請求項6】
R1、R2、R3、R4、R5、R6、R7およびR8のいずれもがメチル基であることを特徴とする請求項4の環状化合物。
【請求項7】
R9が1個ないし6個の炭素原子を有するアルキル基であることを特徴とする請求項4の環状化合物。
【請求項8】
n1+n2が8以下であることを特徴とする請求項4の環状化合物。
【請求項9】
X1、X2、X3およびX4が、水素原子、または1個ないし8個の炭素原子を有するアルコキシ基であることを特徴とする請求項4の環状化合物。
【請求項10】
Y1、Y2、Y3およびY4が、水素原子またはトリメチルフェニル基であることを特徴とする請求項4の環状化合物。
【請求項11】
M1、M2が、Zn、RhまたはFeの金属イオンであることを特徴とする請求項4〜10のいずれかの環状化合物。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【公開番号】特開2006−176459(P2006−176459A)
【公開日】平成18年7月6日(2006.7.6)
【国際特許分類】
【出願番号】特願2004−372757(P2004−372757)
【出願日】平成16年12月24日(2004.12.24)
【新規性喪失の例外の表示】特許法第30条第1項適用申請有り 平成16年9月1日 社団法人高分子学会発行の「高分子学会予稿集 53巻2号」に発表
【新規性喪失の例外の表示】特許法第30条第1項適用申請有り 平成16年9月17日 社団法人高分子学会主催の「第53回 高分子討論会」において文書をもって発表
【出願人】(503360115)独立行政法人科学技術振興機構 (1,734)
【Fターム(参考)】
【公開日】平成18年7月6日(2006.7.6)
【国際特許分類】
【出願日】平成16年12月24日(2004.12.24)
【新規性喪失の例外の表示】特許法第30条第1項適用申請有り 平成16年9月1日 社団法人高分子学会発行の「高分子学会予稿集 53巻2号」に発表
【新規性喪失の例外の表示】特許法第30条第1項適用申請有り 平成16年9月17日 社団法人高分子学会主催の「第53回 高分子討論会」において文書をもって発表
【出願人】(503360115)独立行政法人科学技術振興機構 (1,734)
【Fターム(参考)】
[ Back to top ]

