大腸がん肝転移マーカー、及び試料中の大腸がん肝転移マーカーの分析方法
【課題】大腸がん肝転移に対して特異性を有するマーカーを提供する。大腸がんの肝転移の有無を識別するための分析方法を提供する。さらに、大腸がん肝転移を治療するための薬物標的を提供する。
【解決手段】大腸がん肝転移患者の大腸組織から同定されたタンパク質を含むマーカー。当該マーカーは、肝転移がない大腸がん患者と比較して、大腸がん肝転移の患者において発現が有意に亢進する。試料中の当該大腸がん肝転移マーカーの発現レベルを測定し、前記大腸がん肝転移マーカーの基準レベルに基づき、前記発現レベルの高低に関する評価を行う、大腸がん肝転移マーカーの分析方法。当該タンパク質を含む大腸がん肝転移の治療標的分子。
【解決手段】大腸がん肝転移患者の大腸組織から同定されたタンパク質を含むマーカー。当該マーカーは、肝転移がない大腸がん患者と比較して、大腸がん肝転移の患者において発現が有意に亢進する。試料中の当該大腸がん肝転移マーカーの発現レベルを測定し、前記大腸がん肝転移マーカーの基準レベルに基づき、前記発現レベルの高低に関する評価を行う、大腸がん肝転移マーカーの分析方法。当該タンパク質を含む大腸がん肝転移の治療標的分子。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、臨床での診断・検診・経過観察の技術に関し、とりわけ、本発明は、大腸がんの肝転移の診断(経過観察、予後予測など)の技術に関する。具体的には、大腸がん肝転移マーカー及び試料中の大腸がん肝転移マーカーの分析方法に関する。
【背景技術】
【0002】
大腸がんは、がん疾患の中で世界3番目の罹患率と2番目の死亡率とを占めている。大腸がん患者の70%は外科的手術による治療を受けるが、そのうち30〜40%については再発や転移をすることが分かっている。大腸がんの転移としては、肝臓への転移(すなわち肝転移)によるものが最も多くみられる。肝転移を含む転移症例に対しては、5-フルオロウラシル(5-FU)などの化学療法や、分子標的治療薬の投与を行うことが一般的である。
【0003】
特開2008−14937号公報(特許文献1)においては、肝転移を伴わない大腸がん患者由来試料から同定されたマーカータンパク質が開示されている。
【0004】
培養細胞を用いた実験によりがん転移との関連性が示されているタンパク質として、GSN(Gelsolin)(非特許文献1:Litwin M et al., Gelsolin in human colon adenocarcinoma cells with different metastatic potential. Acta Biochim Pol. 2009;56:739-43.);及びHSP90AA1(Heat shock protein HSP 90-alpha)(非特許文献2:Moser C et al., Blocking heat shock protein-90 inhibits the invasive properties and hepatic growth of human colon cancer cells and improves the efficacy of oxaliplatin in p53-deficient colon cancer tumors in vivo. Mol Cancer Ther. 2007;6:2868-78.)が報告されている。しかしながら、これらのタンパク質は肝転移との直接的な関連性は示唆されていない。
【0005】
ヒト大腸がん組織を用いた免疫組織化学染色実験などにより大腸がん肝転移との関連性が示されているタンパク質として、Proteasome subunit type alpha 7 (PSMA7)が報告されている(非特許文献3:Hu XT et al., The proteasome subunit PSMA7 located on the 20q13 amplicon is overexpressed and asscociated with liver metastasis in colorectalcancer. Oncol Rep 2008; 19(2):441-446)。
【0006】
その一方で、ACTR2(Actin-related protein 2) については、同じがん細胞においてWAVE2と共発現することが大腸がん肝転移との関連性を示唆する旨が報告されている
(非特許文献4:Iwaya K et al. Correlation between liver metastasis of the colocalization of actin-related protein 2 and 3 complex and WAVE2 in colorectal carcinoma. Cancer Sci 2007;98:992-9.)。
【0007】
また、FN1(Fibronectin)は、TN (Tenascin)やFN1,TNに対するインテグリン受容体(α9β1、α5β1)と共に、その発現ががんの病勢と相関性があることは免疫組織化学実験により示されているが、肝転移との関連性は直接的には実証されていない(非特許文献5:Maya G et al. :Immunohistochemical assessment of fibronectin and tenascin and their integrin receptorsα9β1 and α5β1 in gastic and colorectal cancers with lymph node and liver metastases. Acta histochemica 2006; 108: 2-6)。
【0008】
CEAやCA19−9は大腸がん肝転移において発現が亢進することが報告されている(非特許文献6:Bakalakos EA et al. :Is carcino-embryonic antigen useful in the follow-up management of patients with colorectal liver metastases? Am J Surg 177:2-6, 1999)。
【先行技術文献】
【特許文献】
【0009】
【特許文献1】特開2008−14937号公報
【非特許文献】
【0010】
【非特許文献1】アクタ・バイオキミカ・ポロニカ(Acta Biochimica Polonica) 2009年、第56巻、p. 739-743.
【非特許文献2】モレキュラー・キャンサー・セラピューティクス(Molecular Cancer Therapeutics)、2007年、第6巻、p. 2868-2878.
【非特許文献3】オンコロジーレポーツ(Oncology Reports)、2008年 第19巻、p. 441-446)
【非特許文献4】キャンサー・サイエンス(Cancer Science)、2007年、第98巻、p. 992-999.
【非特許文献5】アクタ・ヒストケミカ(Acta Histochemica)、2006年 第108巻、 p. 25-35
【非特許文献6】アメリカン・ジャーナル・オブ・サージェリー(American Journal of Surgery)、1999年、第177巻、p. 2-6
【発明の概要】
【発明が解決しようとする課題】
【0011】
前述の肝転移を含む転移症例に対して行われる化学療法や分子標的治療法は、大腸がん肝転移に対する抑制効果、或いは延命効果が必ずしも十分とは言えないのが現状である。また、手術後の患者には肝転移の有無に関わらず抗がん剤投与をするなど、患者に経済的・精神的な負担を強いている問題がある。
【0012】
また、前述のACTR2、GSN、HSP90AA1及びFN1は、培養細胞などを試料として用いた実験により大腸がん肝転移との関連性が示されているが、非培養細胞、すなわち患者から採取した試料(組織など)におけるそれらタンパク質と大腸がん肝転移との関連性は示されていない。また、CEA及びCA19−9は、大腸がん肝転移の指標になりうるタンパク質として報告されているものであるが、大腸がん肝転移に対して特異性を有する(すなわち肝転移の有無を判断することができる)臨床マーカーとしては使用されていない。
【0013】
本発明は、大腸がん肝転移に対して特異性を有するバイオマーカーを提供することを目的とする。また本発明は、生体から採取した試料を用いて大腸がんの肝転移の有無を識別するための分析方法を提供することを目的とする。さらに、本発明は、大腸がんにおける転移性肝がんの治療標的及び創薬標的を提供することを目的とする。
【課題を解決するための手段】
【0014】
本発明者らは、鋭意検討の結果、肝転移がある大腸がん組織と肝転移がない大腸がん組織との間でその発現に有意差を示すタンパク質を見出し、本発明を完成するに至った。
【0015】
本発明は、以下の発明を含む。
以下は、大腸がん肝転移マーカー及びその分析方法に関する。
(1)
Serotransferrin、Vacuolar protein sorting-associated protein 13B、Zinc finger protein 445、Spectrin beta chain, brain 1, 2, 3、Signal recognition particle 9 kDa protein、GTP:AMP phosphotransferase mitochondrial、Protein disulfide-isomerase A4、Myosin-9、Cytochrome c1 heme protein, mitochondrial、26S proteasome subunit p40.5、Hyaluronan and proteoglycan link protein 4、Voltage-dependent anion-selective channel protein 1、Staphylococcal nuclease domain-containing protein 1、Choline O-acetyltransferase、Paraneoplastic antigen Ma2、及びUBA domain-containing proteinからなる群から選ばれる少なくとも1種のタンパク質を含む、大腸がん肝転移マーカー。
【0016】
上記のタンパク質は、大腸がん肝転移患者体内で基準レベルに比べて発現量が亢進するものである。
基準レベルは、大腸がん肝転移患者由来のがん性試料における上記タンパク質レベルの対照となるタンパク質レベルでありうる。
【0017】
(2)
生体試料中の、Serotransferrin、Vacuolar protein sorting-associated protein 13B、Zinc finger protein 445、Spectrin beta chain, brain 1, 2, 3、Signal recognition particle 9 kDa protein、GTP:AMP phosphotransferase mitochondrial、Protein disulfide-isomerase A4、Myosin-9、Cytochrome c1 heme protein, mitochondrial、26S proteasome subunit p40.5、Hyaluronan and proteoglycan link protein 4、Voltage-dependent anion-selective channel protein 1、Staphylococcal nuclease domain-containing protein 1、Choline O-acetyltransferase、Paraneoplastic antigen Ma2、及びUBA domain-containing proteinからなる群から選ばれる少なくとも1種の大腸がん肝転移マーカーの発現レベルを測定し、前記大腸がん肝転移マーカーの基準レベルに基づき、前記発現レベルの高低に関する評価を行う、大腸がん肝転移マーカーの分析方法。
【0018】
(3)
前記生体試料が免疫組織化学染色されるべき原発巣組織であり、前記発現レベルが前記組織におけるがん部位の染色強度であり、前記基準レベルが大腸がん肝転移患者の大腸組織におけるがん部位の染色強度である、(2)に記載の方法。
(4)
前記生体試料が破砕された組織を含むものであり、前記発現レベルが前記試料中において検出された測定濃度であり、前記基準レベルが前記大腸がん肝転移マーカーの基準濃度である、(2)に記載の方法。
前記(3)及び(4)の方法においては、前記組織としては、生検組織(組織生検材料)でありうる。生検組織は、検査・手術などで採取された組織である。生検組織としては、切除組織でありうる。切除組織は、手術で切除された組織である。
【0019】
前記生体試料が採血試料であり、前記大腸がん肝転移マーカーの発現レベル情報の取得を、生体特異的親和性に基づく検査による測定法を用いて行う、上記の方法。
上記方法において、前記採血試料は、生体内に戻されることなく破棄される。
【0020】
(5)
生体から採取した試料中の、Heat shock protein HSP 90-alpha、Actin-related protein 2及びGelsolinからなる群から選ばれる少なくとも1種の大腸がん転移マーカーの現レベルを取得し、前記大腸ガン肝転移マーカーの基準レベルに基づき、前記発現レベルの高低に関する評価を行う、大腸ガン肝転移マーカーの分析方法。
【0021】
上記(1)及び(5)のタンパク質は、大腸がんにおける転移性肝がんの治療のための治療標的分子、又は大腸がんの肝転移抑制や転移性肝がんの治療のための創薬標的分子となりうる。
上記治療標的分子又は創薬標的分子に基づき、以下の医薬候補分子が提供されうる。
【0022】
上記治療標的分子又は創薬標的分子への結合特異性を有する医薬候補分子。
上記治療標的分子又は創薬標的分子に特異的に結合する抗体を含む医薬候補分子。
上記医薬候補分子は、大腸がん細胞に対して供給されることによって、大腸がん細胞を死滅させ又は大腸がん細胞成長を抑制し、肝転移の抑制を促進する反応を惹起しうる。
【0023】
上記治療標的分子又は創薬標的分子を含む医薬候補分子。
上記医薬候補分子は、免疫刺激量で大腸がん細胞に対して供給されることによって、肝転移の抑制及び転移性の肝がん細胞の死滅、又は成長を抑制する免疫応答を惹起しうる。
【発明の効果】
【0024】
本発明により、生体内で大腸がん肝転移に対して特異性を有するマーカーが提供される。
また、本発明の大腸がん肝転移マーカーの提供により、生体から採取した試料を用いて大腸がんの肝転移の有無を識別するための分析方法を提供することができる。従って、本発明によると、大腸がんの肝転移診断や予後診断を評価する指標を提供することができる。
特に、本発明の大腸がんの肝転移マーカーによって大腸がん患者の予後予測を可能とすることは、外科的手術や化学治療といった治療法の選択を早期段階から行うことを可能とするものであり、患者への負担の軽減や医療費の削減をもたらすと考えられる。
【0025】
さらに、本発明の大腸がん肝転移マーカーは、大腸がんにおける転移性肝がんの新たな治療標的として提供することができる。
また、本発明の大腸がん肝転移マーカーは、大腸がん肝転移の治療・抑制をより効果的に達成するための新たな創薬標的として提供することができる。
特に、がん転移(すなわち肝転移)を治療目的とする創薬の開発は、がん治療において最も困難な課題の解決につながるものであり、治療成績の向上をもたらす。
【図面の簡単な説明】
【0026】
【図1】実施例1において行われた肝転移マーカー探索のためのNBS法によるプロテオーム解析の主な流れを示す。
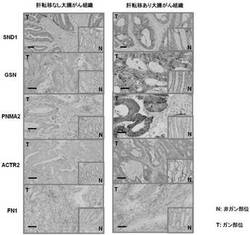
【図2】実施例2において行われた、臨床検体(肝転移がない大腸がん患者の大腸粘膜上皮組織のがん部及び非がん部、及び、肝転移がある大腸がん患者の大腸粘膜上皮組織のがん部及び非がん部)での免疫組織化学染色による肝転移関連蛋白質の発現確認の結果を示す。
【発明を実施するための形態】
【0027】
<大腸がん肝転移マーカー>
本発明は、大腸がん肝転移のマーカーを提供する。
本発明において大腸がん肝転移のマーカーとして提供するタンパク質は、肝転移がある大腸がん患者から採取された大腸粘膜上皮組織のがん部及び非がん部と、肝転移がない大腸がん患者から採取された大腸粘膜上皮組織のがん部及び非がん部とから抽出されたタンパク質試料から、2−ニトロベンゼンスルフェニルクロリド(NBSCl)を用いた同位体標識法(NBS法)によるプロテオーム解析技術によって同定された。NBS法は、2種類の状態のタンパク質試料(具体例として正常部位由来の試料及びがん部位由来の試料)のうち一方を重い試薬(2−ニトロ[13C6]ベンゼンスルフェニルクロリド)で修飾し、他方を軽い試薬(2−ニトロ[12C6]ベンゼンスルフェニルクロリド)で修飾し、得られたNBS修飾タンパク質試料双方を互いに混合し、トリプシン消化など当業者による適切な処理を行い、質量分析装置でペプチド量の違いを測定することにより、2種類の状態のタンパク質試料におけるタンパク質含有量の相対的な差を調べることができる方法である。NBS法は、Rapid Commun. Mass Spectrom., 2003, 17, 1642-1650及び国際公報第2004/002950号パンフレットなどに記載されている。
【0028】
これらのタンパク質は、当業者によって選択されるあらゆるタンパク質精製技術によって単離及び精製することができる。例えば、イオン交換、アフィニティ、及びサイズ排除カラムクロマトグラフィーなどのクロマトグラフィー、遠心分離、溶解度差、及び電気泳動などを含む技術を用いることができる。
【0029】
具体的に、本発明の大腸がん肝転移マーカーは、Serotransferrin、Vacuolar protein sorting-associated protein 13B、Zinc finger protein 445、Spectrin beta chain, brain 1, 2, 3、Signal recognition particle 9 kDa protein、GTP:AMP phosphotransferase mitochondrial、Protein disulfide-isomerase A4、Myosin-9、Cytochrome c1 heme protein, mitochondrial、26S proteasome subunit p40.5、Hyaluronan and proteoglycan link protein 4、Voltage-dependent anion-selective channel protein 1、Staphylococcal nuclease domain-containing protein 1、Choline O-acetyltransferase、Paraneoplastic antigen Ma2、及びUBA domain-containing protein;並びにHeat shock protein HSP 90-alpha、Actin-related protein 2、Gelsolin、及びFibronectinから選ばれるタンパク質を含む。
【0030】
上記タンパク質は、肝転移がある大腸がん患者由来のがん性試料と、肝転移がない大腸がん患者由来のがん性試料との2群間で、発現量の統計的有意差が認められる。すなわち、上記タンパク質は、肝転移がない大腸がん患者に比べ、肝転移がある大腸がん患者において有意に発現が亢進するものである。
【0031】
本発明の大腸がん肝転移マーカーは、例えば以下の用途で用いられる。組織中のマーカーの発現レベルを測定することによって、例えば、大腸がん患者の肝転移診断や予後診断を行うために用いられうる。また、PETなどの画像診断において用いられるプローブの標的として用いられうる。或いは、大腸がん肝転移の治療標的として用いられうる。
【0032】
<大腸ガン肝転移マーカーの分析方法>
本発明は、上記タンパク質群から選ばれる少なくとも1種のタンパク質を大腸がん肝転移マーカーとして使用することにより試料を分析する方法を提供する。本発明の方法においては、上述のタンパク質を、大腸がん肝転移患者体内で基準レベルに比べて発現量が亢進するマーカーとして用いられる。基準レベルは、大腸がん肝転移患者由来のがん性試料における上記大腸がん肝転移マーカーレベルの対照となるレベルでありうる。例えば、肝転移がない大腸がん患者由来のがん性試料などにおける上記大腸がん肝転移マーカーレベルが挙げられる。
【0033】
本発明の方法においては、分析に供されるべき試料を用意し、当該試料から、上記タンパク質群から選ばれる少なくとも1種の大腸がん肝転移マーカーの発現レベルを取得する。当該大腸がん肝転移マーカーの基準レベルに基づいて、取得した発現レベルの高低に関する評価を行う。発現レベルが基準レベルより高いとの評価をもって、当該試料が由来する個体が大腸がん肝転移に罹患している可能性が高いことの指標とすることができる。
【0034】
分析に供されるべき試料としては、大腸がん肝転移の罹患(大腸がんの肝転移)を識別すべき対象となる個人に由来する生体試料でありうる。
生体試料は、生体から採取した試料であることが好ましい。生体から採取した試料は、培養細胞株を除く意である。生体から採取した試料は、生体内での生命現象が直接反映されているものである。
分析に供されるべき試料としては、特に限定されない。例えば、細胞や組織、体液、及び組織抽出物などが挙げられる。
細胞や組織には、組織生検材料などが含まれる。組織生検材料には、生検組織が含まれ、検査・手術などで採取されうる。特に、手術で切除された組織が挙げられる。それら組織は、組織切片、組織破砕物又は後述の組織抽出物の態様で提供されてよい。当該組織は、原発巣である大腸に由来するものでありうる。大腸由来組織としては、粘膜上皮、粘膜固有層、粘膜筋板、粘膜下層、固有筋層、及び漿膜などが挙げられる。
体液としては、血液、尿、及び体分泌物などが含まれる。血液としては、全血、血漿、血清などが含まれる。
組織抽出物とは、当業者に公知の方法によってホモジネート又は可溶化された組織をいう。
【0035】
上記タンパク質の発現レベルの取得は、例えば、生体特異的親和性に基づく検査によって行われうる。生体特異的親和性に基づく検査は当業者に良く知られた方法であり、特に限定されないが、イムノアッセイが好ましい。具体的には、ウエスタンブロット、ラジオイムノアッセイ、ELISA、サンドイッチイムノアッセイ、免疫沈降法、沈降反応、免疫拡散法、免疫凝集測定、補体結合反応分析、免疫放射定量法、蛍光イムノアッセイ、プロテインAイムノアッセイなどの、競合及び非競合アッセイ系を含むイムノアッセイが含まれる。イムノアッセイにおいては、個体の試料中のマーカーに結合する抗体の存在を検出する。具体的には、アッセイ試料中において、測定すべきマーカータンパク質及び当該タンパク質の抗体からなる免疫複合体を形成しうる条件のもと、試料を当該抗体に接触させることによって行われる。より具体的なイムノアッセイプロトコルは、当業者であれば容易に選択することができる。
【0036】
或いは、上記タンパク質の発現レベルの取得は、上記の生体特異的親和性に基づく方法以外のタンパク質定量法によって測定することもできる。例えば、既に述べたNBS法は、定量性に優れた方法である。この場合、上記タンパク質を既知レベルで調製した試料や、正常試料などの適当な試料を対照試料として、分析対象試料との間における前記タンパク質の存在量の差を調べることによって、測定を行うことができる。
【0037】
本発明の方法が実施される態様の一例として、以下が挙げられる。
本態様においては、分析に供される試料として、手術などで切除を行ったがん組織(より具体的には原発巣組織)の切片が用いられる。この組織は免疫組織化学染色に供され、免疫組織化学染色によって生じた染色の強度、並びに染色の分布(単位面積当たりの染色割合)を併せてマーカーの発現レベルの指標とする。基準レベルは、肝転移なし大腸がん患者におけるがん部位の染色強度、並びに染色の分布(単位面積当たりの染色割合)を考慮したものでありうる。例えば、染色強度が基準レベルより強い領域が、分析に供された組織の30%以上の範囲に分布していることをもって、当該試料が由来する個体が大腸がん肝転移に罹患している可能性が高いことの指標とすることができる。
或いは、上記例においては、発現レベルの取得及び評価をマスイメージング法に基づいて行っても良い。
【0038】
本発明の方法が実施される態様の他の一例として、以下が挙げられる。
本態様においては、分析に供される試料として、生検組織などを破砕又は抽出に供して調製されたものが用いられる。この試料はマーカータンパク質の濃度測定に供され、得られた測定値が、マーカーの発現レベルの情報となる。基準レベルには、例えば、別の試料において得られた当該マーカーの測定値や、当該マーカーに固有の閾値が含まれる。この態様においては、測定値が基準レベルと比較され、測定値が基準レベルを超えていることをもって、当該試料が由来する個体が大腸がん肝転移に罹患している可能性が高いことの指標とすることができる。
或いは、上記他の一例においては、試料が採血試料であってよい。その場合、前記採血試料は、生体内に戻されることなく破棄される。
【0039】
本発明の方法において、本発明の大腸がん肝転移マーカーは単独で用いられてもよいし、他のいかなるマーカーと組み合わせて用いられてもよい。従って、本発明の方法は、本発明の大腸がん転移マーカーの発現レベル情報の取得と同様に他のマーカーの発現レベル情報を取得することを含んでいてよい。
【0040】
<治療標的分子及び創薬標的分子>
本発明の大腸がん肝転移マーカーは、大腸がんにおける転移性肝がんの治療のための治療標的分子、又は大腸がんの肝転移抑制や転移性肝がんの治療のための創薬標的分子となりうる。
大腸がん肝転移の治療には、肝転移した大腸がん細胞を死滅させることを含む。大腸がんの肝転移抑制には、大腸がん細胞の肝転移抑制、又は転移性肝がん細胞を死滅させることを含む。
本発明の大腸がん肝転移マーカーを治療標的分子又は創薬標的分子とすることにより、以下の医薬候補分子が提供されうる。
【0041】
当該医薬候補分子の一態様は、治療標的分子又は創薬標的分子に対する特異性を有するものである。より具体的には、治療標的分子又は創薬標的分子に免疫特異的に結合する抗体を含むものが挙げられる。抗体は、ポリクローナル抗体、モノクローナル抗体、及び、分子生物学的技術により調製した抗体を含む。ここで抗体とは、広く免疫特異的に結合する物質であればよく、抗体フラグメントや抗体融合タンパク質も用いられてよい。いずれの場合も、抗体の調製は、当業者に良く知られた方法によって行われる。また、抗体は、創薬分野における抗体工学技術によって通常なされる分子改変及び修飾が施されてよい。
上記医薬候補分子は、大腸がん細胞に対して供給されることによって、肝転移の抑制及び転移性の肝がん細胞の死滅、又は成長を抑制する反応を惹起しうる。
【0042】
医薬候補分子の他の一態様は、本発明の大腸がん肝転移の治療標的分子を含むものである。上記医薬候補分子は、免疫刺激量で大腸がん細胞に対して供給されることによって、肝転移の抑制および転移性の肝がん細胞の死滅、又は成長を抑制する免疫応答を惹起しうる。ここで、免疫刺激量とは、がんの処理のために所望する免疫反応を惹起することが可能な抗原の量をいい、当業者によって良く知られた方法で決定されるものである。この形態によると、いわゆるがんワクチン療法として知られている、当業者に良く知られた方法を用いてがんの処理が行われる。
【0043】
上記医薬候補分子は、自らを有効成分とし、薬剤として許容される希釈剤、担体、賦形剤などをさらに含むことによって薬剤組成物となりうる。上記薬剤組成物は、大腸がん肝転移の治療や大腸がんの肝転移抑制に用いられる潜在的な治療剤として特定されうる。或いは、上記薬剤組成物は、大腸がん肝転移の治療や大腸がんの肝転移抑制に用いられる治療剤として用いられうる。
【実施例】
【0044】
以下に実施例を示し、本発明を具体的に説明するが、本発明は下記の実施例に制限されるものではない。
【0045】
[実施例1]
大阪大学医学部の倫理規定に沿って同意が得られた患者(大腸がん患者n=23, このうち、肝転移がある症例10症例、肝転移がない症例13症例)の大腸がん組織を採取し、以下に示す手法により、NBS(2-nitrobenzenesulfenyl)法による定量プロテオーム解析に供した。本実施例で行われた肝転移マーカー探索のためのNBS法によるプロテオーム解析の主な流れを、図1に示す。
【0046】
採取されたそれぞれの組織を可溶化バッファーA(50 mM Tris-HCl(pH8.0),100 mM NaCl, 10 mM EDTA, プロテアーゼインヒビター(アプロチニン, PMSF, ロイペプシン)水溶液)中でホモジナイズし、100000×G (4℃, 1時間)で遠心分離した後、その上澄み液を可溶性画分として得た。次に、遠心で得られた沈殿に可溶化バッファーB(9M ウレア、2w/v% CHAPS、10 mM EDTA、プロテアーゼインヒビター(アプロチニン, PMSF, ロイペプシン)水溶液))中で再度ホモジナイズし、100000×G (4℃, 1時間)で遠心分離した後、その上澄み液を不溶性画分として得た。
【0047】
これら可溶性、および不溶性画分の抽出蛋白質をそれぞれNBS試薬により処理を行い、蛋白質の発現解析を行った。NBS試薬処理に関しては、13C NBS Stable Isotope Labeling Kit-N(島津製作所)の推奨プロトコルに従い、安定同位体標識を行った。具体的には、正常組織から抽出された蛋白質を12CNBS(Light NBS)でラベル化し、がん組織から抽出された蛋白質を13CNBS(Heavy NBS)でラベル化した。得られたそれぞれのラベル化蛋白質を混合し、キットの推奨プロトコルに従い、脱塩・還元・アルキル化、およびトリプシン消化を行った。次に、同キットのプロトコルに従い、ラベル化ペプチドを濃縮した。濃縮したラベル化ペプチドに関しては、引き続いてC18カラムを用いたμHPLCによる分離を行い、MSプレートに塗布した。このようにして準備したサンプルに関して質量分析装置Axima-CFR plus(島津製作所製)を用いて測定し、各蛋白質の相対定量解析を行った。
【0048】
各症例の相対定量解析の結果に基づくプロテオームデータ(Tumor(がん部位)/Normal(非がん部位): T/N比)を用いて、Mann-Whiteney U-testによる統計学的解析を行った。その結果、肝転移症例(n=10)と肝転移無し症例(n=13)の2群間で統計学的有意差(p< 0.05)が得られたピークについて、質量分析装置Axima-QIT(島津製作所製)を用いてMS/MS解析による蛋白質同定を行った。
【0049】
有意差が得られた46のペアピークのうち、22のペアピークについて配列が同定され、最終的に21種類の蛋白質が肝転移関連蛋白質として同定された。その結果を表1に示す。同定されたこれらのタンパク質のうち、Proteasome subunit alpha type 7は、従来文献において大腸がん組織を用いた免疫組織化学染色実験などにより大腸がん肝転移との関連性がすでに報告されているものであった。残りの20種類のタンパク質は、これまでに大腸がん組織において肝転移との関連性について報告がないものであった。さらに、上記残りの20種類のタンパク質のうち、Heat shock protein HSP 90-alpha、Actin-related protein 2及びGelsolinを除く17種類のタンパク質は、大腸がん肝転移との関連性自体が全く報告されていないものであった。
【0050】
【表1】

【0051】
[実施例2]
上記表1に記載の肝転移関連蛋白質について免疫組織化学染色によるバリデーションを行った。
<肝転移なし大腸がん患者と肝転移あり大腸がん患者における原発巣組織の比較>
肝転移がある大腸がん患者より採取した、正常組織(すなわち大腸粘膜上皮組織の非がん部)及びがん組織(すなわち大腸粘膜上皮組織のがん部)それぞれのパラフィン包埋切片(4 μm)を用意した。抗体としては、以下のものを用いた。
【0052】
一次抗体:
ウサギ抗ヒト PNMA2モノクローナル抗体(抗体希釈率1/200)
ウサギ抗ヒト SND1モノクローナル抗体(抗体希釈率1/200)
マウス抗ヒト GSN モノクローナル抗体(抗体希釈率1/200)
マウス抗ヒト ACTR2モノクローナル抗体(抗体希釈率1/200)
ウサギ抗ヒト FN1モノクローナル抗体 (抗体希釈率1/100)
【0053】
二次抗体:
ビオチンコンジュゲート-抗ウサギIgG抗体 (抗体希釈率 1/300)
ビオチンコンジュゲート-抗マウスIgG抗体 (抗体希釈率 1/300)
【0054】
パラフィン切片と一次抗体とを一時間室温にて反応させ、PBSバッファーで洗浄後、さらに上記二次抗体と20分間反応させた。更にPBSで洗浄後、ストレプトアビジン-ビオチンペルオキシダーゼコンプレックス(希釈率 1/300)と20分間反応させた。最終的に、発色溶液 (3,3’-ジアミノベンザイダインテトラヒドロクロリド、0.01% 過酸化ペルオキシダーゼ、 0.05 Mトリス水溶液(pH 7.6))と5分間反応させることにより、組織染色を行った。
【0055】
このバリデーションにおいては、組織中の細胞のうち、30%以上が染色された場合を高い発現(high)として、そうでない場合を低い発現(low)として判断した。図2は、肝転移関連蛋白質のうち、肝転移がない症例と比較して肝転移がある症例の大腸がんの原発巣での発現が亢進していることが確認されたことを、SND1、GSN、PNMA2、ACTR2、及びFN1について示したものである。なお、図2において、写真中に示されたバーのスケールは20μmである。
【0056】
表2に、PNMA2について、高い(high)発現を示した16症例と、低い(low)発現を示した7症例とについて:
・ 年齢(Age)の平均と範囲
・ がんの罹患部位(location)(具体的には結腸(colon)又は直腸(rectum))とその該当症例数、
・ 組織学的所見(Histology)(具体的には高分化腺癌(well (well differentiated adenocarcinoma))又は中分化腺癌(mod(moderately differentiated adenocarcinoma)),低分化腺癌(por(poorly differentiated adenocarcinoma)))とその該当症例数、
・ 浸潤度(invasion)(具体的にはがんの浸潤が固有筋層までにとどまっているもの(-mp(propria mucosae))又はがんの浸潤が固有筋層を超えているもの(ss-(subserosa)))とその症例数、
・ がんのリンパ節転移(Lymph node)の有(positive)無(negative)とその該当症例数、
・ がんの肝転移(liver metastasis)の有(positive)無(negative)とその該当症例数、
・ リンパ管浸襲(ly (lymphovascular invasion))の有(positive)無(negative)とその該当症例数、
・ 血管浸襲(v (vascular invasion))の有(positive)無(negative)とその該当症例数、及び
・ CEAのレベルの平均と範囲を示し、それぞれカイ二乗検定でのp値(p-value)を示した。
また、表3に、Gelsolinについて、高い(high)発現を示した9症例と、低い(low)発現を示した14症例とについて、年齢、及び各所見とその該当症例数等を、表2と同様に示した。
【0057】
表2及び表3が示すように、それぞれのタンパク質は、表中の様々な所見のうち、肝転移の有無において統計的有意差をもって(カイの二乗検定、p<0.05)発現することを確認した。具体的には、肝転移症例の大腸がん原発巣(liver metastasis positive)での発現が肝転移なし症例(liver metastasis negative)での発現に比べて統計学的有意(カイの二乗検定、p<0.05)に亢進していることを確認した。
【0058】
【表2】

【0059】
【表3】

【0060】
<肝転移なし症例と肝転移あり症例とにおける大腸がん組織の比較>
肝転移がない大腸がん患者より採取した正常組織(すなわち大腸粘膜上皮組織の非がん部)及びがん組織(すなわち大腸粘膜上皮組織のがん部)それぞれパラフィン包埋切片(4μm)を用意したことを除いては、上述と同様に免疫組織化学染色によるバリデーションを行った。
上記肝転移がある大腸がんの当該組織についての組織染色結果を、肝転移がない大腸がん症例の原発巣及び正常組織についてのものと比較した。図2は、肝転移関連蛋白質のうち、肝転移がない症例と比較して肝転移がある症例の大腸がんの原発巣での発現が亢進していることが確認されたことを、SND1、GSN、PNMA2、ACTR2、及びFN1について示したものである。なお、図2において、写真中に示されたバーのスケールは20μmであり、Tはがん部における染色結果、Nは非がん部における染色結果を示す。
【0061】
<総評>
図2が示すように、バリデーションに供した5つの蛋白質全てにつき、肝転移がある大腸がんの原発巣におけるがん細胞(もしくは、がん細胞を取り巻く間質細胞)での発現が亢進していることを確認した。すなわち、上記実施例1に示すNBS法による定量結果において、肝転移がない大腸がん症例の原発巣組織においてより、肝転移がある大腸がん症例の原発巣組織において発現亢進を示したタンパク質は、本実施例に示す免疫組織化学染色法による解析結果においても、実際に発現亢進を示していた。このように、NBS法による定量結果と、免疫組織化学染色法による解析結果とが、良い相関を示している。従って、これらの分子が大腸がん肝転移に関連するタンパク質であることが確認された。
【0062】
以上のことから、請求項1項に記載のタンパク質は、肝転移がない大腸がん組織においてよりも、肝転移がある大腸がん組織において有意に多く発現するものである。そして、これらのタンパク質は、大腸がん肝転移のマーカーとして使用できることが明らかである。これらのタンパク質を大腸がん肝転移のマーカーとし、肝転移の罹患が不明な大腸がん検体について、当該マーカーの分析を行う際は、上記実施例に記載の手法を用いることができる。
【技術分野】
【0001】
本発明は、臨床での診断・検診・経過観察の技術に関し、とりわけ、本発明は、大腸がんの肝転移の診断(経過観察、予後予測など)の技術に関する。具体的には、大腸がん肝転移マーカー及び試料中の大腸がん肝転移マーカーの分析方法に関する。
【背景技術】
【0002】
大腸がんは、がん疾患の中で世界3番目の罹患率と2番目の死亡率とを占めている。大腸がん患者の70%は外科的手術による治療を受けるが、そのうち30〜40%については再発や転移をすることが分かっている。大腸がんの転移としては、肝臓への転移(すなわち肝転移)によるものが最も多くみられる。肝転移を含む転移症例に対しては、5-フルオロウラシル(5-FU)などの化学療法や、分子標的治療薬の投与を行うことが一般的である。
【0003】
特開2008−14937号公報(特許文献1)においては、肝転移を伴わない大腸がん患者由来試料から同定されたマーカータンパク質が開示されている。
【0004】
培養細胞を用いた実験によりがん転移との関連性が示されているタンパク質として、GSN(Gelsolin)(非特許文献1:Litwin M et al., Gelsolin in human colon adenocarcinoma cells with different metastatic potential. Acta Biochim Pol. 2009;56:739-43.);及びHSP90AA1(Heat shock protein HSP 90-alpha)(非特許文献2:Moser C et al., Blocking heat shock protein-90 inhibits the invasive properties and hepatic growth of human colon cancer cells and improves the efficacy of oxaliplatin in p53-deficient colon cancer tumors in vivo. Mol Cancer Ther. 2007;6:2868-78.)が報告されている。しかしながら、これらのタンパク質は肝転移との直接的な関連性は示唆されていない。
【0005】
ヒト大腸がん組織を用いた免疫組織化学染色実験などにより大腸がん肝転移との関連性が示されているタンパク質として、Proteasome subunit type alpha 7 (PSMA7)が報告されている(非特許文献3:Hu XT et al., The proteasome subunit PSMA7 located on the 20q13 amplicon is overexpressed and asscociated with liver metastasis in colorectalcancer. Oncol Rep 2008; 19(2):441-446)。
【0006】
その一方で、ACTR2(Actin-related protein 2) については、同じがん細胞においてWAVE2と共発現することが大腸がん肝転移との関連性を示唆する旨が報告されている
(非特許文献4:Iwaya K et al. Correlation between liver metastasis of the colocalization of actin-related protein 2 and 3 complex and WAVE2 in colorectal carcinoma. Cancer Sci 2007;98:992-9.)。
【0007】
また、FN1(Fibronectin)は、TN (Tenascin)やFN1,TNに対するインテグリン受容体(α9β1、α5β1)と共に、その発現ががんの病勢と相関性があることは免疫組織化学実験により示されているが、肝転移との関連性は直接的には実証されていない(非特許文献5:Maya G et al. :Immunohistochemical assessment of fibronectin and tenascin and their integrin receptorsα9β1 and α5β1 in gastic and colorectal cancers with lymph node and liver metastases. Acta histochemica 2006; 108: 2-6)。
【0008】
CEAやCA19−9は大腸がん肝転移において発現が亢進することが報告されている(非特許文献6:Bakalakos EA et al. :Is carcino-embryonic antigen useful in the follow-up management of patients with colorectal liver metastases? Am J Surg 177:2-6, 1999)。
【先行技術文献】
【特許文献】
【0009】
【特許文献1】特開2008−14937号公報
【非特許文献】
【0010】
【非特許文献1】アクタ・バイオキミカ・ポロニカ(Acta Biochimica Polonica) 2009年、第56巻、p. 739-743.
【非特許文献2】モレキュラー・キャンサー・セラピューティクス(Molecular Cancer Therapeutics)、2007年、第6巻、p. 2868-2878.
【非特許文献3】オンコロジーレポーツ(Oncology Reports)、2008年 第19巻、p. 441-446)
【非特許文献4】キャンサー・サイエンス(Cancer Science)、2007年、第98巻、p. 992-999.
【非特許文献5】アクタ・ヒストケミカ(Acta Histochemica)、2006年 第108巻、 p. 25-35
【非特許文献6】アメリカン・ジャーナル・オブ・サージェリー(American Journal of Surgery)、1999年、第177巻、p. 2-6
【発明の概要】
【発明が解決しようとする課題】
【0011】
前述の肝転移を含む転移症例に対して行われる化学療法や分子標的治療法は、大腸がん肝転移に対する抑制効果、或いは延命効果が必ずしも十分とは言えないのが現状である。また、手術後の患者には肝転移の有無に関わらず抗がん剤投与をするなど、患者に経済的・精神的な負担を強いている問題がある。
【0012】
また、前述のACTR2、GSN、HSP90AA1及びFN1は、培養細胞などを試料として用いた実験により大腸がん肝転移との関連性が示されているが、非培養細胞、すなわち患者から採取した試料(組織など)におけるそれらタンパク質と大腸がん肝転移との関連性は示されていない。また、CEA及びCA19−9は、大腸がん肝転移の指標になりうるタンパク質として報告されているものであるが、大腸がん肝転移に対して特異性を有する(すなわち肝転移の有無を判断することができる)臨床マーカーとしては使用されていない。
【0013】
本発明は、大腸がん肝転移に対して特異性を有するバイオマーカーを提供することを目的とする。また本発明は、生体から採取した試料を用いて大腸がんの肝転移の有無を識別するための分析方法を提供することを目的とする。さらに、本発明は、大腸がんにおける転移性肝がんの治療標的及び創薬標的を提供することを目的とする。
【課題を解決するための手段】
【0014】
本発明者らは、鋭意検討の結果、肝転移がある大腸がん組織と肝転移がない大腸がん組織との間でその発現に有意差を示すタンパク質を見出し、本発明を完成するに至った。
【0015】
本発明は、以下の発明を含む。
以下は、大腸がん肝転移マーカー及びその分析方法に関する。
(1)
Serotransferrin、Vacuolar protein sorting-associated protein 13B、Zinc finger protein 445、Spectrin beta chain, brain 1, 2, 3、Signal recognition particle 9 kDa protein、GTP:AMP phosphotransferase mitochondrial、Protein disulfide-isomerase A4、Myosin-9、Cytochrome c1 heme protein, mitochondrial、26S proteasome subunit p40.5、Hyaluronan and proteoglycan link protein 4、Voltage-dependent anion-selective channel protein 1、Staphylococcal nuclease domain-containing protein 1、Choline O-acetyltransferase、Paraneoplastic antigen Ma2、及びUBA domain-containing proteinからなる群から選ばれる少なくとも1種のタンパク質を含む、大腸がん肝転移マーカー。
【0016】
上記のタンパク質は、大腸がん肝転移患者体内で基準レベルに比べて発現量が亢進するものである。
基準レベルは、大腸がん肝転移患者由来のがん性試料における上記タンパク質レベルの対照となるタンパク質レベルでありうる。
【0017】
(2)
生体試料中の、Serotransferrin、Vacuolar protein sorting-associated protein 13B、Zinc finger protein 445、Spectrin beta chain, brain 1, 2, 3、Signal recognition particle 9 kDa protein、GTP:AMP phosphotransferase mitochondrial、Protein disulfide-isomerase A4、Myosin-9、Cytochrome c1 heme protein, mitochondrial、26S proteasome subunit p40.5、Hyaluronan and proteoglycan link protein 4、Voltage-dependent anion-selective channel protein 1、Staphylococcal nuclease domain-containing protein 1、Choline O-acetyltransferase、Paraneoplastic antigen Ma2、及びUBA domain-containing proteinからなる群から選ばれる少なくとも1種の大腸がん肝転移マーカーの発現レベルを測定し、前記大腸がん肝転移マーカーの基準レベルに基づき、前記発現レベルの高低に関する評価を行う、大腸がん肝転移マーカーの分析方法。
【0018】
(3)
前記生体試料が免疫組織化学染色されるべき原発巣組織であり、前記発現レベルが前記組織におけるがん部位の染色強度であり、前記基準レベルが大腸がん肝転移患者の大腸組織におけるがん部位の染色強度である、(2)に記載の方法。
(4)
前記生体試料が破砕された組織を含むものであり、前記発現レベルが前記試料中において検出された測定濃度であり、前記基準レベルが前記大腸がん肝転移マーカーの基準濃度である、(2)に記載の方法。
前記(3)及び(4)の方法においては、前記組織としては、生検組織(組織生検材料)でありうる。生検組織は、検査・手術などで採取された組織である。生検組織としては、切除組織でありうる。切除組織は、手術で切除された組織である。
【0019】
前記生体試料が採血試料であり、前記大腸がん肝転移マーカーの発現レベル情報の取得を、生体特異的親和性に基づく検査による測定法を用いて行う、上記の方法。
上記方法において、前記採血試料は、生体内に戻されることなく破棄される。
【0020】
(5)
生体から採取した試料中の、Heat shock protein HSP 90-alpha、Actin-related protein 2及びGelsolinからなる群から選ばれる少なくとも1種の大腸がん転移マーカーの現レベルを取得し、前記大腸ガン肝転移マーカーの基準レベルに基づき、前記発現レベルの高低に関する評価を行う、大腸ガン肝転移マーカーの分析方法。
【0021】
上記(1)及び(5)のタンパク質は、大腸がんにおける転移性肝がんの治療のための治療標的分子、又は大腸がんの肝転移抑制や転移性肝がんの治療のための創薬標的分子となりうる。
上記治療標的分子又は創薬標的分子に基づき、以下の医薬候補分子が提供されうる。
【0022】
上記治療標的分子又は創薬標的分子への結合特異性を有する医薬候補分子。
上記治療標的分子又は創薬標的分子に特異的に結合する抗体を含む医薬候補分子。
上記医薬候補分子は、大腸がん細胞に対して供給されることによって、大腸がん細胞を死滅させ又は大腸がん細胞成長を抑制し、肝転移の抑制を促進する反応を惹起しうる。
【0023】
上記治療標的分子又は創薬標的分子を含む医薬候補分子。
上記医薬候補分子は、免疫刺激量で大腸がん細胞に対して供給されることによって、肝転移の抑制及び転移性の肝がん細胞の死滅、又は成長を抑制する免疫応答を惹起しうる。
【発明の効果】
【0024】
本発明により、生体内で大腸がん肝転移に対して特異性を有するマーカーが提供される。
また、本発明の大腸がん肝転移マーカーの提供により、生体から採取した試料を用いて大腸がんの肝転移の有無を識別するための分析方法を提供することができる。従って、本発明によると、大腸がんの肝転移診断や予後診断を評価する指標を提供することができる。
特に、本発明の大腸がんの肝転移マーカーによって大腸がん患者の予後予測を可能とすることは、外科的手術や化学治療といった治療法の選択を早期段階から行うことを可能とするものであり、患者への負担の軽減や医療費の削減をもたらすと考えられる。
【0025】
さらに、本発明の大腸がん肝転移マーカーは、大腸がんにおける転移性肝がんの新たな治療標的として提供することができる。
また、本発明の大腸がん肝転移マーカーは、大腸がん肝転移の治療・抑制をより効果的に達成するための新たな創薬標的として提供することができる。
特に、がん転移(すなわち肝転移)を治療目的とする創薬の開発は、がん治療において最も困難な課題の解決につながるものであり、治療成績の向上をもたらす。
【図面の簡単な説明】
【0026】
【図1】実施例1において行われた肝転移マーカー探索のためのNBS法によるプロテオーム解析の主な流れを示す。
【図2】実施例2において行われた、臨床検体(肝転移がない大腸がん患者の大腸粘膜上皮組織のがん部及び非がん部、及び、肝転移がある大腸がん患者の大腸粘膜上皮組織のがん部及び非がん部)での免疫組織化学染色による肝転移関連蛋白質の発現確認の結果を示す。
【発明を実施するための形態】
【0027】
<大腸がん肝転移マーカー>
本発明は、大腸がん肝転移のマーカーを提供する。
本発明において大腸がん肝転移のマーカーとして提供するタンパク質は、肝転移がある大腸がん患者から採取された大腸粘膜上皮組織のがん部及び非がん部と、肝転移がない大腸がん患者から採取された大腸粘膜上皮組織のがん部及び非がん部とから抽出されたタンパク質試料から、2−ニトロベンゼンスルフェニルクロリド(NBSCl)を用いた同位体標識法(NBS法)によるプロテオーム解析技術によって同定された。NBS法は、2種類の状態のタンパク質試料(具体例として正常部位由来の試料及びがん部位由来の試料)のうち一方を重い試薬(2−ニトロ[13C6]ベンゼンスルフェニルクロリド)で修飾し、他方を軽い試薬(2−ニトロ[12C6]ベンゼンスルフェニルクロリド)で修飾し、得られたNBS修飾タンパク質試料双方を互いに混合し、トリプシン消化など当業者による適切な処理を行い、質量分析装置でペプチド量の違いを測定することにより、2種類の状態のタンパク質試料におけるタンパク質含有量の相対的な差を調べることができる方法である。NBS法は、Rapid Commun. Mass Spectrom., 2003, 17, 1642-1650及び国際公報第2004/002950号パンフレットなどに記載されている。
【0028】
これらのタンパク質は、当業者によって選択されるあらゆるタンパク質精製技術によって単離及び精製することができる。例えば、イオン交換、アフィニティ、及びサイズ排除カラムクロマトグラフィーなどのクロマトグラフィー、遠心分離、溶解度差、及び電気泳動などを含む技術を用いることができる。
【0029】
具体的に、本発明の大腸がん肝転移マーカーは、Serotransferrin、Vacuolar protein sorting-associated protein 13B、Zinc finger protein 445、Spectrin beta chain, brain 1, 2, 3、Signal recognition particle 9 kDa protein、GTP:AMP phosphotransferase mitochondrial、Protein disulfide-isomerase A4、Myosin-9、Cytochrome c1 heme protein, mitochondrial、26S proteasome subunit p40.5、Hyaluronan and proteoglycan link protein 4、Voltage-dependent anion-selective channel protein 1、Staphylococcal nuclease domain-containing protein 1、Choline O-acetyltransferase、Paraneoplastic antigen Ma2、及びUBA domain-containing protein;並びにHeat shock protein HSP 90-alpha、Actin-related protein 2、Gelsolin、及びFibronectinから選ばれるタンパク質を含む。
【0030】
上記タンパク質は、肝転移がある大腸がん患者由来のがん性試料と、肝転移がない大腸がん患者由来のがん性試料との2群間で、発現量の統計的有意差が認められる。すなわち、上記タンパク質は、肝転移がない大腸がん患者に比べ、肝転移がある大腸がん患者において有意に発現が亢進するものである。
【0031】
本発明の大腸がん肝転移マーカーは、例えば以下の用途で用いられる。組織中のマーカーの発現レベルを測定することによって、例えば、大腸がん患者の肝転移診断や予後診断を行うために用いられうる。また、PETなどの画像診断において用いられるプローブの標的として用いられうる。或いは、大腸がん肝転移の治療標的として用いられうる。
【0032】
<大腸ガン肝転移マーカーの分析方法>
本発明は、上記タンパク質群から選ばれる少なくとも1種のタンパク質を大腸がん肝転移マーカーとして使用することにより試料を分析する方法を提供する。本発明の方法においては、上述のタンパク質を、大腸がん肝転移患者体内で基準レベルに比べて発現量が亢進するマーカーとして用いられる。基準レベルは、大腸がん肝転移患者由来のがん性試料における上記大腸がん肝転移マーカーレベルの対照となるレベルでありうる。例えば、肝転移がない大腸がん患者由来のがん性試料などにおける上記大腸がん肝転移マーカーレベルが挙げられる。
【0033】
本発明の方法においては、分析に供されるべき試料を用意し、当該試料から、上記タンパク質群から選ばれる少なくとも1種の大腸がん肝転移マーカーの発現レベルを取得する。当該大腸がん肝転移マーカーの基準レベルに基づいて、取得した発現レベルの高低に関する評価を行う。発現レベルが基準レベルより高いとの評価をもって、当該試料が由来する個体が大腸がん肝転移に罹患している可能性が高いことの指標とすることができる。
【0034】
分析に供されるべき試料としては、大腸がん肝転移の罹患(大腸がんの肝転移)を識別すべき対象となる個人に由来する生体試料でありうる。
生体試料は、生体から採取した試料であることが好ましい。生体から採取した試料は、培養細胞株を除く意である。生体から採取した試料は、生体内での生命現象が直接反映されているものである。
分析に供されるべき試料としては、特に限定されない。例えば、細胞や組織、体液、及び組織抽出物などが挙げられる。
細胞や組織には、組織生検材料などが含まれる。組織生検材料には、生検組織が含まれ、検査・手術などで採取されうる。特に、手術で切除された組織が挙げられる。それら組織は、組織切片、組織破砕物又は後述の組織抽出物の態様で提供されてよい。当該組織は、原発巣である大腸に由来するものでありうる。大腸由来組織としては、粘膜上皮、粘膜固有層、粘膜筋板、粘膜下層、固有筋層、及び漿膜などが挙げられる。
体液としては、血液、尿、及び体分泌物などが含まれる。血液としては、全血、血漿、血清などが含まれる。
組織抽出物とは、当業者に公知の方法によってホモジネート又は可溶化された組織をいう。
【0035】
上記タンパク質の発現レベルの取得は、例えば、生体特異的親和性に基づく検査によって行われうる。生体特異的親和性に基づく検査は当業者に良く知られた方法であり、特に限定されないが、イムノアッセイが好ましい。具体的には、ウエスタンブロット、ラジオイムノアッセイ、ELISA、サンドイッチイムノアッセイ、免疫沈降法、沈降反応、免疫拡散法、免疫凝集測定、補体結合反応分析、免疫放射定量法、蛍光イムノアッセイ、プロテインAイムノアッセイなどの、競合及び非競合アッセイ系を含むイムノアッセイが含まれる。イムノアッセイにおいては、個体の試料中のマーカーに結合する抗体の存在を検出する。具体的には、アッセイ試料中において、測定すべきマーカータンパク質及び当該タンパク質の抗体からなる免疫複合体を形成しうる条件のもと、試料を当該抗体に接触させることによって行われる。より具体的なイムノアッセイプロトコルは、当業者であれば容易に選択することができる。
【0036】
或いは、上記タンパク質の発現レベルの取得は、上記の生体特異的親和性に基づく方法以外のタンパク質定量法によって測定することもできる。例えば、既に述べたNBS法は、定量性に優れた方法である。この場合、上記タンパク質を既知レベルで調製した試料や、正常試料などの適当な試料を対照試料として、分析対象試料との間における前記タンパク質の存在量の差を調べることによって、測定を行うことができる。
【0037】
本発明の方法が実施される態様の一例として、以下が挙げられる。
本態様においては、分析に供される試料として、手術などで切除を行ったがん組織(より具体的には原発巣組織)の切片が用いられる。この組織は免疫組織化学染色に供され、免疫組織化学染色によって生じた染色の強度、並びに染色の分布(単位面積当たりの染色割合)を併せてマーカーの発現レベルの指標とする。基準レベルは、肝転移なし大腸がん患者におけるがん部位の染色強度、並びに染色の分布(単位面積当たりの染色割合)を考慮したものでありうる。例えば、染色強度が基準レベルより強い領域が、分析に供された組織の30%以上の範囲に分布していることをもって、当該試料が由来する個体が大腸がん肝転移に罹患している可能性が高いことの指標とすることができる。
或いは、上記例においては、発現レベルの取得及び評価をマスイメージング法に基づいて行っても良い。
【0038】
本発明の方法が実施される態様の他の一例として、以下が挙げられる。
本態様においては、分析に供される試料として、生検組織などを破砕又は抽出に供して調製されたものが用いられる。この試料はマーカータンパク質の濃度測定に供され、得られた測定値が、マーカーの発現レベルの情報となる。基準レベルには、例えば、別の試料において得られた当該マーカーの測定値や、当該マーカーに固有の閾値が含まれる。この態様においては、測定値が基準レベルと比較され、測定値が基準レベルを超えていることをもって、当該試料が由来する個体が大腸がん肝転移に罹患している可能性が高いことの指標とすることができる。
或いは、上記他の一例においては、試料が採血試料であってよい。その場合、前記採血試料は、生体内に戻されることなく破棄される。
【0039】
本発明の方法において、本発明の大腸がん肝転移マーカーは単独で用いられてもよいし、他のいかなるマーカーと組み合わせて用いられてもよい。従って、本発明の方法は、本発明の大腸がん転移マーカーの発現レベル情報の取得と同様に他のマーカーの発現レベル情報を取得することを含んでいてよい。
【0040】
<治療標的分子及び創薬標的分子>
本発明の大腸がん肝転移マーカーは、大腸がんにおける転移性肝がんの治療のための治療標的分子、又は大腸がんの肝転移抑制や転移性肝がんの治療のための創薬標的分子となりうる。
大腸がん肝転移の治療には、肝転移した大腸がん細胞を死滅させることを含む。大腸がんの肝転移抑制には、大腸がん細胞の肝転移抑制、又は転移性肝がん細胞を死滅させることを含む。
本発明の大腸がん肝転移マーカーを治療標的分子又は創薬標的分子とすることにより、以下の医薬候補分子が提供されうる。
【0041】
当該医薬候補分子の一態様は、治療標的分子又は創薬標的分子に対する特異性を有するものである。より具体的には、治療標的分子又は創薬標的分子に免疫特異的に結合する抗体を含むものが挙げられる。抗体は、ポリクローナル抗体、モノクローナル抗体、及び、分子生物学的技術により調製した抗体を含む。ここで抗体とは、広く免疫特異的に結合する物質であればよく、抗体フラグメントや抗体融合タンパク質も用いられてよい。いずれの場合も、抗体の調製は、当業者に良く知られた方法によって行われる。また、抗体は、創薬分野における抗体工学技術によって通常なされる分子改変及び修飾が施されてよい。
上記医薬候補分子は、大腸がん細胞に対して供給されることによって、肝転移の抑制及び転移性の肝がん細胞の死滅、又は成長を抑制する反応を惹起しうる。
【0042】
医薬候補分子の他の一態様は、本発明の大腸がん肝転移の治療標的分子を含むものである。上記医薬候補分子は、免疫刺激量で大腸がん細胞に対して供給されることによって、肝転移の抑制および転移性の肝がん細胞の死滅、又は成長を抑制する免疫応答を惹起しうる。ここで、免疫刺激量とは、がんの処理のために所望する免疫反応を惹起することが可能な抗原の量をいい、当業者によって良く知られた方法で決定されるものである。この形態によると、いわゆるがんワクチン療法として知られている、当業者に良く知られた方法を用いてがんの処理が行われる。
【0043】
上記医薬候補分子は、自らを有効成分とし、薬剤として許容される希釈剤、担体、賦形剤などをさらに含むことによって薬剤組成物となりうる。上記薬剤組成物は、大腸がん肝転移の治療や大腸がんの肝転移抑制に用いられる潜在的な治療剤として特定されうる。或いは、上記薬剤組成物は、大腸がん肝転移の治療や大腸がんの肝転移抑制に用いられる治療剤として用いられうる。
【実施例】
【0044】
以下に実施例を示し、本発明を具体的に説明するが、本発明は下記の実施例に制限されるものではない。
【0045】
[実施例1]
大阪大学医学部の倫理規定に沿って同意が得られた患者(大腸がん患者n=23, このうち、肝転移がある症例10症例、肝転移がない症例13症例)の大腸がん組織を採取し、以下に示す手法により、NBS(2-nitrobenzenesulfenyl)法による定量プロテオーム解析に供した。本実施例で行われた肝転移マーカー探索のためのNBS法によるプロテオーム解析の主な流れを、図1に示す。
【0046】
採取されたそれぞれの組織を可溶化バッファーA(50 mM Tris-HCl(pH8.0),100 mM NaCl, 10 mM EDTA, プロテアーゼインヒビター(アプロチニン, PMSF, ロイペプシン)水溶液)中でホモジナイズし、100000×G (4℃, 1時間)で遠心分離した後、その上澄み液を可溶性画分として得た。次に、遠心で得られた沈殿に可溶化バッファーB(9M ウレア、2w/v% CHAPS、10 mM EDTA、プロテアーゼインヒビター(アプロチニン, PMSF, ロイペプシン)水溶液))中で再度ホモジナイズし、100000×G (4℃, 1時間)で遠心分離した後、その上澄み液を不溶性画分として得た。
【0047】
これら可溶性、および不溶性画分の抽出蛋白質をそれぞれNBS試薬により処理を行い、蛋白質の発現解析を行った。NBS試薬処理に関しては、13C NBS Stable Isotope Labeling Kit-N(島津製作所)の推奨プロトコルに従い、安定同位体標識を行った。具体的には、正常組織から抽出された蛋白質を12CNBS(Light NBS)でラベル化し、がん組織から抽出された蛋白質を13CNBS(Heavy NBS)でラベル化した。得られたそれぞれのラベル化蛋白質を混合し、キットの推奨プロトコルに従い、脱塩・還元・アルキル化、およびトリプシン消化を行った。次に、同キットのプロトコルに従い、ラベル化ペプチドを濃縮した。濃縮したラベル化ペプチドに関しては、引き続いてC18カラムを用いたμHPLCによる分離を行い、MSプレートに塗布した。このようにして準備したサンプルに関して質量分析装置Axima-CFR plus(島津製作所製)を用いて測定し、各蛋白質の相対定量解析を行った。
【0048】
各症例の相対定量解析の結果に基づくプロテオームデータ(Tumor(がん部位)/Normal(非がん部位): T/N比)を用いて、Mann-Whiteney U-testによる統計学的解析を行った。その結果、肝転移症例(n=10)と肝転移無し症例(n=13)の2群間で統計学的有意差(p< 0.05)が得られたピークについて、質量分析装置Axima-QIT(島津製作所製)を用いてMS/MS解析による蛋白質同定を行った。
【0049】
有意差が得られた46のペアピークのうち、22のペアピークについて配列が同定され、最終的に21種類の蛋白質が肝転移関連蛋白質として同定された。その結果を表1に示す。同定されたこれらのタンパク質のうち、Proteasome subunit alpha type 7は、従来文献において大腸がん組織を用いた免疫組織化学染色実験などにより大腸がん肝転移との関連性がすでに報告されているものであった。残りの20種類のタンパク質は、これまでに大腸がん組織において肝転移との関連性について報告がないものであった。さらに、上記残りの20種類のタンパク質のうち、Heat shock protein HSP 90-alpha、Actin-related protein 2及びGelsolinを除く17種類のタンパク質は、大腸がん肝転移との関連性自体が全く報告されていないものであった。
【0050】
【表1】

【0051】
[実施例2]
上記表1に記載の肝転移関連蛋白質について免疫組織化学染色によるバリデーションを行った。
<肝転移なし大腸がん患者と肝転移あり大腸がん患者における原発巣組織の比較>
肝転移がある大腸がん患者より採取した、正常組織(すなわち大腸粘膜上皮組織の非がん部)及びがん組織(すなわち大腸粘膜上皮組織のがん部)それぞれのパラフィン包埋切片(4 μm)を用意した。抗体としては、以下のものを用いた。
【0052】
一次抗体:
ウサギ抗ヒト PNMA2モノクローナル抗体(抗体希釈率1/200)
ウサギ抗ヒト SND1モノクローナル抗体(抗体希釈率1/200)
マウス抗ヒト GSN モノクローナル抗体(抗体希釈率1/200)
マウス抗ヒト ACTR2モノクローナル抗体(抗体希釈率1/200)
ウサギ抗ヒト FN1モノクローナル抗体 (抗体希釈率1/100)
【0053】
二次抗体:
ビオチンコンジュゲート-抗ウサギIgG抗体 (抗体希釈率 1/300)
ビオチンコンジュゲート-抗マウスIgG抗体 (抗体希釈率 1/300)
【0054】
パラフィン切片と一次抗体とを一時間室温にて反応させ、PBSバッファーで洗浄後、さらに上記二次抗体と20分間反応させた。更にPBSで洗浄後、ストレプトアビジン-ビオチンペルオキシダーゼコンプレックス(希釈率 1/300)と20分間反応させた。最終的に、発色溶液 (3,3’-ジアミノベンザイダインテトラヒドロクロリド、0.01% 過酸化ペルオキシダーゼ、 0.05 Mトリス水溶液(pH 7.6))と5分間反応させることにより、組織染色を行った。
【0055】
このバリデーションにおいては、組織中の細胞のうち、30%以上が染色された場合を高い発現(high)として、そうでない場合を低い発現(low)として判断した。図2は、肝転移関連蛋白質のうち、肝転移がない症例と比較して肝転移がある症例の大腸がんの原発巣での発現が亢進していることが確認されたことを、SND1、GSN、PNMA2、ACTR2、及びFN1について示したものである。なお、図2において、写真中に示されたバーのスケールは20μmである。
【0056】
表2に、PNMA2について、高い(high)発現を示した16症例と、低い(low)発現を示した7症例とについて:
・ 年齢(Age)の平均と範囲
・ がんの罹患部位(location)(具体的には結腸(colon)又は直腸(rectum))とその該当症例数、
・ 組織学的所見(Histology)(具体的には高分化腺癌(well (well differentiated adenocarcinoma))又は中分化腺癌(mod(moderately differentiated adenocarcinoma)),低分化腺癌(por(poorly differentiated adenocarcinoma)))とその該当症例数、
・ 浸潤度(invasion)(具体的にはがんの浸潤が固有筋層までにとどまっているもの(-mp(propria mucosae))又はがんの浸潤が固有筋層を超えているもの(ss-(subserosa)))とその症例数、
・ がんのリンパ節転移(Lymph node)の有(positive)無(negative)とその該当症例数、
・ がんの肝転移(liver metastasis)の有(positive)無(negative)とその該当症例数、
・ リンパ管浸襲(ly (lymphovascular invasion))の有(positive)無(negative)とその該当症例数、
・ 血管浸襲(v (vascular invasion))の有(positive)無(negative)とその該当症例数、及び
・ CEAのレベルの平均と範囲を示し、それぞれカイ二乗検定でのp値(p-value)を示した。
また、表3に、Gelsolinについて、高い(high)発現を示した9症例と、低い(low)発現を示した14症例とについて、年齢、及び各所見とその該当症例数等を、表2と同様に示した。
【0057】
表2及び表3が示すように、それぞれのタンパク質は、表中の様々な所見のうち、肝転移の有無において統計的有意差をもって(カイの二乗検定、p<0.05)発現することを確認した。具体的には、肝転移症例の大腸がん原発巣(liver metastasis positive)での発現が肝転移なし症例(liver metastasis negative)での発現に比べて統計学的有意(カイの二乗検定、p<0.05)に亢進していることを確認した。
【0058】
【表2】

【0059】
【表3】

【0060】
<肝転移なし症例と肝転移あり症例とにおける大腸がん組織の比較>
肝転移がない大腸がん患者より採取した正常組織(すなわち大腸粘膜上皮組織の非がん部)及びがん組織(すなわち大腸粘膜上皮組織のがん部)それぞれパラフィン包埋切片(4μm)を用意したことを除いては、上述と同様に免疫組織化学染色によるバリデーションを行った。
上記肝転移がある大腸がんの当該組織についての組織染色結果を、肝転移がない大腸がん症例の原発巣及び正常組織についてのものと比較した。図2は、肝転移関連蛋白質のうち、肝転移がない症例と比較して肝転移がある症例の大腸がんの原発巣での発現が亢進していることが確認されたことを、SND1、GSN、PNMA2、ACTR2、及びFN1について示したものである。なお、図2において、写真中に示されたバーのスケールは20μmであり、Tはがん部における染色結果、Nは非がん部における染色結果を示す。
【0061】
<総評>
図2が示すように、バリデーションに供した5つの蛋白質全てにつき、肝転移がある大腸がんの原発巣におけるがん細胞(もしくは、がん細胞を取り巻く間質細胞)での発現が亢進していることを確認した。すなわち、上記実施例1に示すNBS法による定量結果において、肝転移がない大腸がん症例の原発巣組織においてより、肝転移がある大腸がん症例の原発巣組織において発現亢進を示したタンパク質は、本実施例に示す免疫組織化学染色法による解析結果においても、実際に発現亢進を示していた。このように、NBS法による定量結果と、免疫組織化学染色法による解析結果とが、良い相関を示している。従って、これらの分子が大腸がん肝転移に関連するタンパク質であることが確認された。
【0062】
以上のことから、請求項1項に記載のタンパク質は、肝転移がない大腸がん組織においてよりも、肝転移がある大腸がん組織において有意に多く発現するものである。そして、これらのタンパク質は、大腸がん肝転移のマーカーとして使用できることが明らかである。これらのタンパク質を大腸がん肝転移のマーカーとし、肝転移の罹患が不明な大腸がん検体について、当該マーカーの分析を行う際は、上記実施例に記載の手法を用いることができる。
【特許請求の範囲】
【請求項1】
Serotransferrin、Vacuolar protein sorting-associated protein 13B、Zinc finger protein 445、Spectrin beta chain, brain 1, 2, 3、Signal recognition particle 9 kDa protein、GTP:AMP phosphotransferase mitochondrial、Protein disulfide-isomerase A4、Myosin-9、Cytochrome c1 heme protein, mitochondrial、26S proteasome subunit p40.5、Hyaluronan and proteoglycan link protein 4、Voltage-dependent anion-selective channel protein 1、Staphylococcal nuclease domain-containing protein 1、Choline O-acetyltransferase、Paraneoplastic antigen Ma2、及びUBA domain-containing proteinからなる群から選ばれる少なくとも1種のタンパク質を含む、大腸がん肝転移マーカー。
【請求項2】
生体試料中の、Serotransferrin、Vacuolar protein sorting-associated protein 13B、Zinc finger protein 445、Spectrin beta chain, brain 1, 2, 3、Signal recognition particle 9 kDa protein、GTP:AMP phosphotransferase mitochondrial、Protein disulfide-isomerase A4、Myosin-9、Cytochrome c1 heme protein, mitochondrial、26S proteasome subunit p40.5、Hyaluronan and proteoglycan link protein 4、Voltage-dependent anion-selective channel protein 1、Staphylococcal nuclease domain-containing protein 1、Choline O-acetyltransferase、Paraneoplastic antigen Ma2、及びUBA domain-containing proteinからなる群から選ばれる少なくとも1種の大腸がん肝転移マーカーの発現レベルを取得し、前記大腸ガン肝転移マーカーの基準レベルに基づき、前記発現レベルの高低に関する評価を行う、大腸ガン肝転移マーカーの分析方法。
【請求項3】
前記生体試料が免疫組織化学染色されるべき原発巣組織であり、前記発現レベルが前記組織におけるがん部位の染色強度であり、大腸がん患者の大腸組織におけるがん部位の染色強度である、請求項2に記載の方法。
【請求項4】
前記生体試料が破砕された組織を含むものであり、前記発現レベルが前記試料中において検出された測定濃度であり、前記基準レベルが前記大腸がん肝転移マーカーの基準濃度である、請求項2に記載の方法。
【請求項5】
生体から採取した試料中の、Heat shock protein HSP 90-alpha、Actin-related protein 2、Gelsolin、及びFibronectinからなる群から選ばれる少なくとも1種の大腸がん転移マーカーの現レベルを取得し、前記大腸ガン肝転移マーカーの基準レベルに基づき、前記発現レベルの高低に関する評価を行う、大腸ガン肝転移マーカーの分析方法。
【請求項1】
Serotransferrin、Vacuolar protein sorting-associated protein 13B、Zinc finger protein 445、Spectrin beta chain, brain 1, 2, 3、Signal recognition particle 9 kDa protein、GTP:AMP phosphotransferase mitochondrial、Protein disulfide-isomerase A4、Myosin-9、Cytochrome c1 heme protein, mitochondrial、26S proteasome subunit p40.5、Hyaluronan and proteoglycan link protein 4、Voltage-dependent anion-selective channel protein 1、Staphylococcal nuclease domain-containing protein 1、Choline O-acetyltransferase、Paraneoplastic antigen Ma2、及びUBA domain-containing proteinからなる群から選ばれる少なくとも1種のタンパク質を含む、大腸がん肝転移マーカー。
【請求項2】
生体試料中の、Serotransferrin、Vacuolar protein sorting-associated protein 13B、Zinc finger protein 445、Spectrin beta chain, brain 1, 2, 3、Signal recognition particle 9 kDa protein、GTP:AMP phosphotransferase mitochondrial、Protein disulfide-isomerase A4、Myosin-9、Cytochrome c1 heme protein, mitochondrial、26S proteasome subunit p40.5、Hyaluronan and proteoglycan link protein 4、Voltage-dependent anion-selective channel protein 1、Staphylococcal nuclease domain-containing protein 1、Choline O-acetyltransferase、Paraneoplastic antigen Ma2、及びUBA domain-containing proteinからなる群から選ばれる少なくとも1種の大腸がん肝転移マーカーの発現レベルを取得し、前記大腸ガン肝転移マーカーの基準レベルに基づき、前記発現レベルの高低に関する評価を行う、大腸ガン肝転移マーカーの分析方法。
【請求項3】
前記生体試料が免疫組織化学染色されるべき原発巣組織であり、前記発現レベルが前記組織におけるがん部位の染色強度であり、大腸がん患者の大腸組織におけるがん部位の染色強度である、請求項2に記載の方法。
【請求項4】
前記生体試料が破砕された組織を含むものであり、前記発現レベルが前記試料中において検出された測定濃度であり、前記基準レベルが前記大腸がん肝転移マーカーの基準濃度である、請求項2に記載の方法。
【請求項5】
生体から採取した試料中の、Heat shock protein HSP 90-alpha、Actin-related protein 2、Gelsolin、及びFibronectinからなる群から選ばれる少なくとも1種の大腸がん転移マーカーの現レベルを取得し、前記大腸ガン肝転移マーカーの基準レベルに基づき、前記発現レベルの高低に関する評価を行う、大腸ガン肝転移マーカーの分析方法。
【図1】


【図2】




【図2】


【公開番号】特開2012−47565(P2012−47565A)
【公開日】平成24年3月8日(2012.3.8)
【国際特許分類】
【出願番号】特願2010−189408(P2010−189408)
【出願日】平成22年8月26日(2010.8.26)
【出願人】(000001993)株式会社島津製作所 (3,708)
【出願人】(504176911)国立大学法人大阪大学 (1,536)
【Fターム(参考)】
【公開日】平成24年3月8日(2012.3.8)
【国際特許分類】
【出願日】平成22年8月26日(2010.8.26)
【出願人】(000001993)株式会社島津製作所 (3,708)
【出願人】(504176911)国立大学法人大阪大学 (1,536)
【Fターム(参考)】
[ Back to top ]

