安定なアスタキサンチンとγ−シクロデキストリンとの包接化合物、並びにそれを含む飲食物、飼料及び医薬品
【課題】
安定なアスタキサンチン及び/又はそのエステルとγ−シクロデキストリンとの包接化合物、並びに該包接化合物の液剤、飲食物、飼料、医薬品及び化粧品用途を提供する。
【解決手段】
アスタキサンチン及び/又はそのエステルに対し、γ−シクロデキストリンを1:0.5〜1:100の割合で配合することを特徴とする安定なアスタキサンチン及び/又はそのエステルとγ−シクロデキストリンとの包接化合物法、並びに該包接化合物の液剤、飲食物、飼料、医薬品及び化粧品用途。
安定なアスタキサンチン及び/又はそのエステルとγ−シクロデキストリンとの包接化合物、並びに該包接化合物の液剤、飲食物、飼料、医薬品及び化粧品用途を提供する。
【解決手段】
アスタキサンチン及び/又はそのエステルに対し、γ−シクロデキストリンを1:0.5〜1:100の割合で配合することを特徴とする安定なアスタキサンチン及び/又はそのエステルとγ−シクロデキストリンとの包接化合物法、並びに該包接化合物の液剤、飲食物、飼料、医薬品及び化粧品用途。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、アスタキサンチンに対し、γ−シクロデキストリンを特定の割合で配合することを特徴とする安定なアスタキサンチンとγ−シクロデキストリンとの包接化合物及びその製造方法、並びに該包接化合物を含有する液剤、飲食物、動物用飼料、医薬品及び化粧品の用途に関する。
【背景技術】
【0002】
アスタキサンチンは動植物に含まれる代表的なカロテノイドであり、オキアミ、エビ、カニ等の甲殻類、マダイの体表や、サケの筋肉、イクラ等の魚卵に、また酵母や藻類等に分布する赤色カロテノイドとして知られていて、養殖魚介類の色調改善剤、色揚げ剤、食品添加物、化粧品の着色剤として利用されている。最近、アスタキサンチンが抗酸化剤等の作用を有することが報告され(清水延寿、幹渉、海洋生物のカロテノイド、幹渉編、恒星社厚生閣、平成5年)、さらには食品添加物等への応用も報告されている。しかしながら、アスタキサンチンは、他のカロテノイド色素と同様に脂溶性物質であることから、水溶性溶媒への溶解性や水溶性化合物に添加しようとすると、溶解性が悪いという問題があった。最近、アスタキサンチンはアスタキサンチン産生ヘマトコッカス藻の大量培養により大量且つ安価に入手することが可能になった。ところが、ヘマトコッカス等天然由来の抽出物に含まれるアスタキサンチンは、アスタキサンチンの遊離体、アスタキサンチン脂肪酸モノエステル及びアスタキサンチン脂肪酸ジエステルの他に夾雑物として、さらにモノグリセリド、ジグリセリド及びトリグリセリド等のグリセリド、遊離脂肪酸、又は該遊離脂肪酸に由来するエステル類等を含むため、従来の方法で粉末化しても、室温ではアスタキサンチンの赤色が褪色してしまい商品価値が低下するという問題があった。カロテノイドとシクロデキストリンとの包接体を調製する方法は多々報告されている例えば、(1)特開平9-124470号公報にはアスタキサンチン及び/又はそのエステルをシクロ(環状)デキストリン(α−シクロデキストリン、β−シクロデキストリン、γ−シクロデキストリン)を用いて包接することにより、水に可溶な粉末状の包接化合物を得ることができること、(2)特開平10-155459号公報にはアスタキサンチンエチルエステル含有ドリンク剤、滋養強壮強精剤が、また(3)特開2001-2569号公報にはシクロ(環状)デキストリン(α−シクロデキストリン、β−シクロデキストリン、γ−シクロデキストリン)を用いて包接することにより水に可溶な粉末状の包接物を得ることができることが記載されている。しかしながら、アスタキサンチンとシクロデキストリンを単に混合しても安定なアスタキサンチン−シクロデキストリン包接物が得られず、またアスタキサンチンをエタノールで溶解させ、水で希釈しただけでは安定なアスタキサンチンとγ−シクロデキストリンとの包接化合物は得られないことが分かった。安定なアスタキサンチンとγ−シクロデキストリンとの包接化合物及びその製造方法、並びに該包接化合物の液剤、特に該粉末を溶解させ安定且つ澄明な液剤を得る方法については未だ充分な方法がない。
【先行技術文献】
【特許文献】
【0003】
【特許文献1】特開平2−49091号公報
【特許文献2】特開2005−21098号公報
【特許文献3】特開2003−64360号公報
【発明の概要】
【発明が解決しようとする課題】
【0004】
本発明は、安定なアスタキサンチンとγ−シクロデキストリンとの包接化合物、並びにその包接化合物を含有する飲食物、動物用飼料、医薬品及び化粧品を提供することを目的とする。
【課題を解決するための手段】
【0005】
本発明は、アスタキサンチン1重量部に対し、γ−シクロデキストリン0.5〜100重量部の割合でアスタキサンチンとγ−シクロデキストリンからなる包接化合物である。
【発明の効果】
【0006】
本発明により安定なアスタキサンチンとシクロデキストリンとの包接化合物を提供できた。このものは加工が容易であり、飲食物、動物飼料、医薬品、健康食品等の分野での利用に有用である。また、本発明の包接化合物は水に容易に溶け易く且つ均一な溶液とすることができるので摂取又は服用する時に用時溶解して利用することができる。
【図面の簡単な説明】
【0007】
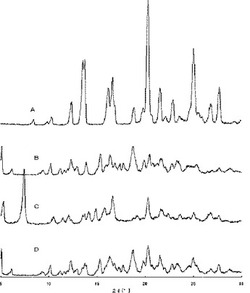
【図1】図中(A)はアスタキサンチン(遊離体、合成品)、(B)はγ−シクロデキストリン、(C)はアスタキサンチンとγ−シクロデキストリンをモル比1:3で混練処理した粉末、(D)はアスタキサンチンとγ−シクロデキストリンをモル比1:3で混合した粉末のXRDスペクトルである。上記(C)は包接化合物を形成している。
【図2】図中、(E)はアスタキサンチンとα−シクロデキストリンをモル比1:3で混練した粉末、(F)アスタキサンチンとα−シクロデキストリンをモル比1:3で混合した粉末、(G)はアスタキサンチンとβ−シクロデキストリンをモル比1:3で混練した粉末、(F)アスタキサンチンとβ−シクロデキストリンをモル比1:3で混合した粉末のXRDスペクトルである。包接化合物が形成されていないことを示す。
【発明を実施するための形態】
【0008】
この明細書において、アスタキサンチンとは、アスタキサンチンの遊離体、アスタキサンチン脂肪酸モノエステル、アスタキサンチン脂肪酸ジエステルの群から選ばれる少なくとも1種からなるものである。脂肪酸エステルとは、炭素数が2個以上の飽和脂肪酸又は不飽和脂肪酸の群から選ばれる少なくとも1種以上からなるものである。
【0009】
アスタキサンチンは、合成品及び/又は天然品であっても良いが、生体の安全性を考慮すると天然由来品、例えばヘマトコッカス藻体、ファフィア酵母又はオキアミ等から抽出されるアスタキサンチンが好ましく、さらに好ましくは工業的に大量且つ安定に入手できるヘマトコッカス藻体からの抽出アスタキサンチンである。
【0010】
アスタキサンチンとして、ヘマトコッカス由来のアスタキサンチンオイルを使用するときは、オイル中のアスタキサンチンの含量とその他の夾雑物(主な成分は、モノ、ジ、トリグリセリド)の成分の重量に基づいてγ−シクロデキストリンの使用量を設定することができる。具体的には、アスタキサンチン1重量部に対し、γ−シクロデキストリン0.5〜100重量部の範囲であり、好ましくは0.5〜50重量部の範囲、より好ましくは1〜50重量部の範囲である。
【0011】
本発明においては上記γ−シクロデキストリン以外にアスタキサンチンとγ−シクロデキストリンとの包接化合物の安定性と、水への溶解性を妨げない範囲でα−シクロデキストリン、β−シクロデキストリン、δ−シクロデキストリン及び公知の水溶性のシクロデキストリン誘導体を添加しても良い。
【0012】
水溶性のシクロデキストリン誘導体としては、例えば、ヒドロキシプロピル−β−シクロデキストリン、メチル−β−シクロデキストリン、モノアセチル−β−シクロデキストリン、トリアセチル−β−シクロデキストリン、モノクロロトリアジル−β−シクロデキストリン、スルホブチルエーテル−β−シクロデキストリン、ジ−O−メチル−β−シクロデキストリン、マルトシル−β−シクロデキストリン等を挙げることができる。
【0013】
本発明の安定なアスタキサンチンとシクロデキストリンとの包接化合物は、アスタキサンチンとγ−シクロデキストリンとの混合物に水と少なくとも1種以上の有機溶媒を特定割合で配合することにより製造することができる。
【0014】
用いる有機溶剤は、アスタキサンチン、アスタキサンチンオイルが溶解するものであれば特に制限はないが、好ましくは粉末化の最終段階で除去しやすいものであり、例えば、メタノール、エタノール、ブタノール、プロパノール等のアルコール類、酢酸エチル等のエステル類、ジクロロメタン、クロロホルム等のハロゲン化炭素水素、アセトン、エーテル等から選ばれる少なくとも1種である。より好ましくは短時間で包接化処理することができるエタノールとジクロロメタン又はクロロホルムの組合せである。
【0015】
包接化の方法としては、混練法、液相混合法、溶媒蒸発法、共沈法、凍結乾燥法等を例示することができる。好ましくは取扱が容易である混練法、液相混合法、溶媒蒸発法である。
【0016】
混練法は、例えば、混練機、乳鉢等を用いて、アスタキサンチン又はアスタキサンチンオイルとγ−シクロデキストリンとの混合物に水と前記有機溶媒の適量を加えて、すりつぶしながら、ペースト状になるまで練り混ぜる方法である。
【0017】
液相混合法は、例えばフラスコ、反応釜等の容器内にアスタキサンチン又はアスタキサンチンオイルとγ−シクロデキストリンとを前記有機溶媒及び水を加え水相中で激しく攪拌混合する方法である。
【0018】
溶媒蒸発法は、例えばロータリーエバポレーター等減圧可能な装置を用いて、アスタキサンチン又はアスタキサンチンオイルとγ−シクロデキストリンとの混合物に前記有機溶媒と水を添加した後、減圧下溶媒を留去する方法である。
【0019】
共沈法は、アスタキサンチン又はアスタキサンチンオイルを前記有機溶媒に溶解した溶液を、所望の濃度に調製したγ−シクロデキストリンの水溶液に、攪拌しながら、滴下する方法である。
【0020】
凍結乾燥法は、アスタキサンチン又はアスタキサンチンオイルとγ−シクロデキストリンに前記有機溶媒と水を添加し、混合後、凍結乾燥することにより、溶媒を留去する方法である。
【0021】
アスタキサンチンとγ−シクロデキストリンとの包接化合物の製造中にアスタキサンチンが分解及び/又は褪色するのを防ぐため、包接化合物を調製する温度範囲は80℃以下が好ましい。より好ましくは60℃以下、さらに好ましくは室温付近である。
【0022】
本発明の製法で得られた包接化合物は、充分に溶媒を除去した方がより安定な粉末として得られる。
【0023】
本発明の製法において、γ−シクロデキストリンを、予めγ−シクロデキストリン1重量部に対して水0.5〜10重量部を添加したものを用いるとより安定なアスタキサンチンとγ−シクロデキストリンとの包接化合物が得られる。
【0024】
アスタキサンチンオイルを用いて包接化合物を調製するときに、以下の方法で行うと、さらに安定性の高い粉末が得られる。具体的には、アスタキサンチンオイルに含まれるアスタキサンチン1重量部と、γ−シクロデキストリン0.5〜100重量部の混合物に、γ−シクロデキストリン1重量部に対して、メタノール、エタノール、プロパノール、ブタノール、アセトン、エーテル、酢酸エチル、ジクロロメタン、クロロホルムからなる群から選ばれる少なくとも1種の有機溶媒0.5〜10重量部と水1〜20重量部を添加し、生成した包接化合物を上記有機溶媒からなる群から選ばれる少なくとも1種の有機溶媒で洗浄し、乾燥し、さらに少量の水で洗浄後、乾燥する方法である。上記有機溶媒、水での洗浄により、アスタキサンチンの安定性に影響する微量成分が除去されるためと考えられる。
【0025】
本発明のアスタキサンチンとγ−シクロデキストリンの包接化合物には、安定な包接化合物の形成を阻害しない範囲で、粉体製造において、慣用の水溶性の甘味料、香料、着色料、でんぷん、アルギン酸ソーダ等の崩壊剤、ラクトース、グリコース、シュクロース、マニトール、エリスリトール等の賦形剤、ヒドロキシプロピルセルロース、ゼラチン等の結合剤、グリセリン等の可塑剤等を用いることができる。
【0026】
本発明の安定なアスタキサンチンとγ−シクロデキストリンとの包接化合物には、アスタキサンチン及び/又はそのエステルが空中で酸化分解されるのを防止するために、ブチルハイドキシトルエン、ブチルハイドロキシアニソール、ビタミンE類(トコフェロール及び、トコトリエノール又はその誘導体)、アスコルビン酸、L−アスコルビン酸パルミチン酸エステル、L−アスコルビン酸ステアリン酸エステル、アスコルビン酸ナトリウム、没食子酸、エトキシキン、グルタチオン、フィチン酸、カテキン類、ポリフェノール類、フラボノイド類、カロテノイド類、キサントフィル類、ゴマ抽出物、ローズマリー抽出物等の天然及び合成抗酸化剤を添加しても良い。
【0027】
本発明のアスタキサンチンとγ−シクロデキストリンとの包接化合物を含有する均一且つ透明な液剤は、該包接化合物を水に溶解させることにより、又は懸濁させた後不溶物を所望の孔径のフィルターを用いてろ過することにより、調製することができる。
【0028】
上記液剤には、さらに液剤の調製において、通常用いられる界面活性剤、溶解補助剤等を、包接化合物の溶解性に影響しない量を添加しても良い。界面活性剤としては、ショ糖脂肪酸エステル、プロピレングリコールエステル、グリセリン脂肪酸エステル、ソルビタン脂肪酸エステル、デキストリン、還元デキストリン等を挙げることができる。
【0029】
本発明の包接化合物を、飲食物、栄養補助食品又は機能性食品として用いる場合の形態は、通常の薬剤で用いられる形態に準拠したものであり、例えば、錠剤、散剤、顆粒剤、カプセル剤、ドリンク剤の形態が例示できる。栄養のバランスをとるため、常法に従って一般に使用されている賦形剤、増量剤、ビタミン類、繊維質、タンパク質、アミノ酸、ミネラル類、動植物性抽出エキス、甘味料、香料、安定化剤、色素等を添加することができる。
【0030】
飲食物の形態としては、加工乳、チーズ、バター、マーガリン、生クリーム、アイスクリーム、氷菓子、プリン、乳製品、ゼリー、キャンディー、ドロップ、飴、キャラメル、チューインガム、カステラ、ケーキ、ドーナッツ、ビスケット、クラッカー、スナック菓子、フライドポテト、ポテトチップ、ポップコーン、もち、団子、大福、スープ、ソーセージ、ハム、ベーコン、肉製品、カマボコ、チクワ、ハンペン、魚製品、スパッゲッティ、パスタ、グラタン、パエリア、カレー、ソース、ケチャップ、ドレッシング、漬け物、炭酸系飲料、果汁飲料、スポーツ飲料、茶、コーヒー、ココア、ビール、リキュール、カクテル、薬用酒等の一般食品の形態を上げることができる。また、安定で均一かつ澄明な赤色系の液剤として清涼感のある飲料として利用することができる。
【0031】
飼料として用いる場合は、そのまま飼料として用いてもよいが、一般に用いられる動物用、魚類用配合飼料の配合原料、例えば、トウモロコシ、マイロ、魚粉、ふすま、食塩、炭酸カルシウム、リン酸カルシウム、アミノ酸類、ビタミン類、微量ミネラル、既存の抗酸化剤等を配合しても良い。
【0032】
医薬品として用いるには、常法に従って、例えば、錠剤及び粉末のような固形投与形態、あるいはシロップのような液体投与形態で経口投与される。また非経口投与的に、例えば、貼付薬、軟膏、注射剤、座薬としても使用可能である。薬剤の調製自体は常法に従って行うことができる。
【0033】
化粧品の形態としては、特に限定されず、例えば、乳液、クリーム、化粧水、パック、洗浄料等のスキンケア化粧料、ファンデーション、アイシャドウ、マスカラ、口紅等のメーキャップ化粧料、分散液、軟膏、外用液剤、クリーム剤等の化粧料とすることができる。また、通常化粧品や医薬品等の皮膚外用剤に用いられる成分、例えば、水(アルカリ単純温泉水、深層水、精製水等を含む)、低級アルコール、多価アルコール、油脂、ロウ、鉱物油、脂肪酸、粉体、金属セッケン、pH調整剤、界面活性剤、増粘剤、色素、植物又は動物系原料由来の抽出物、ビタミン類、アミノ酸類、ホルモン類、殺菌・消毒剤、角質溶解剤、酵素、清涼剤、安定化剤、金属イオンキレート剤、血行促進剤、精油、消臭剤、保湿剤、収斂剤、抗脂漏剤、細胞賦活剤、香料等を添加しても良い。
【実施例】
【0034】
本発明を以下の参考例、実施例、比較例により詳細に説明する。
【0035】
参考例1 ヘマトコッカス藻からのアスタキサンチンオイルの調製:
公知の方法によりヘマトコッカス藻を培養し、アスタキサンチン含有ヘマトコッカス藻体を得た。藻体を培養液から分離、乾燥した後、アセトン抽出し、必要ならば不溶物を除去した後、エバポレーターで減圧下アセトンを留去することによりアスタキサンチン抽出物(以下アスタキサンチンオイル)を得た。このアスタキサンチンオイル中のアスタキサンチン含量は吸光度法(測定波長475nm、溶媒アセトン)にて定量した。オイル中の遊離体スタキサンチンとアスタキサンチン脂肪酸モノエステル及びアスタキサンチン脂肪酸ジエステルの合計の量はオイル全量に対して15重量%であった。アスタキサンチンオイル中のアスタキサンチンの組成は、遊離体アスタキサンチン(6重量%)、アスタキサンチン脂肪酸モノエステル(82重量%)及びアスタキサンチン脂肪酸ジエステル(12重量%)であった。その他の成分としてモノ−、ジ−、トリ−グリセリド類が50重量%であった。ただし、本発明に用いるアスタキサンチンオイルの組成、脂肪酸の種類は特にに限定されるものではない。
【0036】
実施例1アスタキサンチン(合成品、シグマ製)1.0g、粉末状のγ−シクロデキストリン(商品名デキシパールγ−100、塩水港精糖製)4.0g、エタノール−ジクロロメタン(容量比=1:1)混合溶液4ml及びイオン交換水4mlを乳鉢に入れ、乳棒でよく混合した。有機溶媒が揮発した後、再びエタノール−ジクロロメタン(容量比=1:1)混合溶液4mlを加え、再びよく混合し、この操作を3回繰り返しペースト状とした。最終段階で添加した溶媒を殆ど揮発させ、湿った粉体状物の残分を真空乾燥機にて減圧下1晩乾燥した。
【0037】
実施例2参考例1で得られたアスタキサンチンオイル1.0g、上記γ−シクロデキストリン2.0g、エタノール−ジクロロメタン(容量比=1:1)混合溶液2ml及びイオン交換水2mlを乳鉢に入れ、乳棒でよく混合した。有機溶媒が揮発した後、再びエタノール−ジクロロメタン(容量比=1:1)混合溶液2mlを加え、再びよく混合し、この操作を3回繰り返しペースト状とした。最終段階で添加した溶媒を殆ど揮発させ、湿った粉体状物の残分を真空乾燥機にて減圧下1晩乾燥した。
【0038】
実施例3上記γ−シクロデキストリン4.0gと水4.0mlを乳鉢に加え、良く混練した後、参考例1で得られたアスタキサンチンオイル1.0gとエタノール−ジクロロメタン(様良否=1:1)混合溶液4.0mlを加え、良く混練した。有機溶媒が揮発した後、再びエタノール−ジクロロメタン(容量比=1:1)混合溶液4mlを加え、再びよく混合し、この操作を3回繰り返しペースト状とした。最終段階で添加した溶媒を殆ど揮発させ、湿った粉体状物の残分を真空乾燥機にて減圧下1晩乾燥した。
【0039】
実施例4参考例1で得られたアスタキサンチンオイル1.0g、上記γ−シクロデキストリン4.0g、水10ml及びエタノール−ジクロロメタン(容量比=1:1)混合溶液10mlをナス型フラスコに入れ、60℃に加温してロータリーエバポレーターで減圧下有機溶媒を留去した。溶媒を留去した後再びエタノール−ジクロロメタン(容量比=1:1)混合溶液10mlを加え、60℃に加温して減圧下で有機溶媒を留去した。この操作を4回繰り返し、最後に水も完全に留去した後、真空乾燥機にて減圧下1晩乾燥した。
【0040】
実施例5参考例1で得られたアスタキサンチンオイル1.0g、上記γ−シクロデキストリン5.0g、水10ml及びエタノール−ジクロロメタン(容量比=1:1)混合溶液10mlをナス型フラスコに入れ、60℃に加温して、3時間還流した。遠心分離し、残分(固形分)をとり出し、真空乾燥機にて減圧下1晩乾燥した。
【0041】
実施例6参考例1で得られたアスタキサンチンオイル1.0g、上記γ−シクロデキストリン5.0g、水10ml及びエタノール−ジクロロメタン(容量比=1:1)混合溶液10mlをナス型フラスコに入れ、60℃に加温して、3時間還流した。エタノール10mlを添加後、遠心分離し、残分(固形分)をとり出した。この操作を2回繰り返した後、真空乾燥機にて減圧下1晩乾燥した。10mlの水を加え30分間振とうし、遠心分離した。再び同じ操作を行った後、真空乾燥機で減圧下1晩乾燥した。
【0042】
比較例1参考例1で得られたアスタキサンチンオイル1.0gと上記γ−シクロデキストリン2.0gを乳鉢に入れ、乳棒でよく混合した。
【0043】
比較例2参考例1で得られたアスタキサンチンオイル1.0g、上記γ−シクロデキストリン2.0g及び水2.0gを乳鉢に入れ、乳棒でよく混合した後、真空乾燥機にて減圧下1晩乾燥した。
【0044】
比較例3参考例1で得られたアスタキサンチンオイル1.0g、上記γ−シクロデキストリン2.0g、水2.0g及びエタノール2.0mlを乳鉢に入れ、乳棒でよく混合し、溶媒を殆ど揮発させた後、真空乾燥機にて減圧下1晩乾燥した。
【0045】
比較例4参考例1で得られたアスタキサンチンオイル1.0g、上記γ−シクロデキストリン2.0g、水2.0g及びジクロロメタン2.0mlを乳鉢に入れ、乳棒でよく混合し、溶媒を殆ど揮発させた後、真空乾燥機で減圧し1晩乾燥した。溶媒を変えて調製した。
【0046】
下記表1に上記実施例1〜6と比較例1〜3の方法により得られるアスタキサンチンとγ−シクロデキストリンとの粉体の調製方法、溶媒の種類、アスタキサンチンに対するγ−シクロデキストリン配合量、安定性試験の結果(残存率)を示す。なお、表中、γ−CDはγ−シクロデキストリン、ETはエタノール、DMはジクロロメタンを意味し、添加量は重量で示す。
【0047】
安定性比較試験は以下に示す方法で行った。各被験物質10mgをキャップ付き試験管(10ml)に入れ、酸素で置換し、封をした後、80℃で加温し、2時間及び4時間後のアスタキサンチン含量を測定した。なお、包接体中のアスタキサンチンの含量はクロロホルムで抽出後、吸光度法(測定長485nm、溶媒クロロホルム)にて測定した。
【0048】
【表1】

【0049】
上記表1の結果から本発明の製法で得られる包接化合物は、酸素置換下80℃4時間の過酷試験後もアスタキサンチンが83〜99%も残存し、極めて安定なものであった。これに対し、比較例1〜4の従来法で調製した粉体ではアスタキサンチンの4時間後の含量は極めて低くなり、不安定なものであった。図1と図2のXRDスペクトルより、本発明の包接化合物は、単なる混合物ではなく、アスタキサンチンとγ−シクロデキストリンの包接化合物を形成していることがわかる。
【0050】
本発明の包接化合物は、安定な粉末であり、又水に溶解し易い特長を有する。以下に本発明の包接化合物の水に対する溶解性と透明性について述べる。
【0051】
上記実施例1〜6で得られた包接化合物、及び比較例1〜4で得られた混合物の各試料の適量を所望の量の水に加え、攪拌機、超音波振とう機等で溶解させ、遠心分離後、上澄み液中のアスタキサンチン含量を測定し溶解性の比較試験を行った。
【0052】
試験例B1〜B10各試料20mgを水50mlに加え、超音波振とうを5分間行い、遠心分離後、上澄み液中のアスタキサンチン含量を測定した。その結果を表2に示す。表中、溶解性は、○は沈殿がない状態、△は少量沈殿が生じた状態、×は油滴が浮遊する状態であることを示す。
【0053】
【表2】

【0054】
上記表2の結果ら明らかな様に本発明の実施例1〜6の方法で得られたアスタキサンチンとγ−シクロデキストリンとの包接化合物は極めて容易に水に溶けることがわかる。これらの溶液を直射日光の当たらない場所に室温で1カ月放置したが褪色は見られなかった。
【0055】
一方、比較例1〜4の従来法で得られる粉末は、水を添加するとアスタキサンチンオイルが浮遊し、γ−シクロデキストリンのみが水に溶けた。
【0056】
以上の結果から本発明のアスタキサンチンに対し、γ−シクロデキストリンを特定の割合で配合することを特徴とする製法により得られるアスタキサンチンとγ−シクロデキストリンとの包接化合物は、熱に対し極めて安定であり、また該包接化合物が水に溶解し易いことがわかる。
【0057】
製造例1錠剤実施例6の包接化合物15gアビセル35g還元麦芽糖水飴15g部分α化デンプン10g軽質無水ケイ酸2g噴霧乳糖20gショ糖脂肪酸エステル3g上記各成分を常法に従って均一に混合し、1粒300mgの錠剤とした。
【0058】
製造例2カプセル剤ゼラチン70gグリセリン23gパラオキシ安息香酸プロピル1g水6g上記成分からなるソフトカプセル剤皮の中に、実施例6の包接化合物30重量%、ヤシ油70重量%からなる内容物充填し300mgのカプセル剤とした。
【0059】
製造例3ドリンク剤実施例6の包接化合物2gDL−酒石酸ナトリウム0.1g液糖800gクエン酸12gビタミンC10gビタミンE30g香料1.5g塩化カリウム0.1g硫酸マグネシウム0.5g上記の成分を配合し、水を加えて10Lとし、常法に従ってドリンク剤を調製した。
【0060】
製造例4クリーム実施例6の包接化合物1gグリセリンモノステリン酸7gプロピレングリコール5gスクワラン15gメチルパラオキシベンゼン0.1gプロピルパラオキシベンゼン0.1g上記の成分に水を加えて100gになるように配合し、常法に従って、クリームを調製した。
【0061】
製造例5清涼飲料水実施例6の包接化合物2g液糖1000gクエン酸16gアスコルビン酸2g香料15g上記の成分に水10Lを配合し、常法に従って、透明な清涼飲料水を調製した。
【0062】
製造例6クッキー実施例6の包接化合物2g牛乳630g砂糖130gコーンスターチ130g食塩10g上記の成分を配合し、常法に従って、クッキーを焼いた。
【0063】
製造例7実施例6の包接化合物2gトウモロコシ粉300g小麦粉300g魚粉50gアルファルファミール50gキャッサバミール50gフスマ50g大豆粉200g上記の成分を配合し、常法に従って、ペレット状にしニワトリ用飼料とした。
【技術分野】
【0001】
本発明は、アスタキサンチンに対し、γ−シクロデキストリンを特定の割合で配合することを特徴とする安定なアスタキサンチンとγ−シクロデキストリンとの包接化合物及びその製造方法、並びに該包接化合物を含有する液剤、飲食物、動物用飼料、医薬品及び化粧品の用途に関する。
【背景技術】
【0002】
アスタキサンチンは動植物に含まれる代表的なカロテノイドであり、オキアミ、エビ、カニ等の甲殻類、マダイの体表や、サケの筋肉、イクラ等の魚卵に、また酵母や藻類等に分布する赤色カロテノイドとして知られていて、養殖魚介類の色調改善剤、色揚げ剤、食品添加物、化粧品の着色剤として利用されている。最近、アスタキサンチンが抗酸化剤等の作用を有することが報告され(清水延寿、幹渉、海洋生物のカロテノイド、幹渉編、恒星社厚生閣、平成5年)、さらには食品添加物等への応用も報告されている。しかしながら、アスタキサンチンは、他のカロテノイド色素と同様に脂溶性物質であることから、水溶性溶媒への溶解性や水溶性化合物に添加しようとすると、溶解性が悪いという問題があった。最近、アスタキサンチンはアスタキサンチン産生ヘマトコッカス藻の大量培養により大量且つ安価に入手することが可能になった。ところが、ヘマトコッカス等天然由来の抽出物に含まれるアスタキサンチンは、アスタキサンチンの遊離体、アスタキサンチン脂肪酸モノエステル及びアスタキサンチン脂肪酸ジエステルの他に夾雑物として、さらにモノグリセリド、ジグリセリド及びトリグリセリド等のグリセリド、遊離脂肪酸、又は該遊離脂肪酸に由来するエステル類等を含むため、従来の方法で粉末化しても、室温ではアスタキサンチンの赤色が褪色してしまい商品価値が低下するという問題があった。カロテノイドとシクロデキストリンとの包接体を調製する方法は多々報告されている例えば、(1)特開平9-124470号公報にはアスタキサンチン及び/又はそのエステルをシクロ(環状)デキストリン(α−シクロデキストリン、β−シクロデキストリン、γ−シクロデキストリン)を用いて包接することにより、水に可溶な粉末状の包接化合物を得ることができること、(2)特開平10-155459号公報にはアスタキサンチンエチルエステル含有ドリンク剤、滋養強壮強精剤が、また(3)特開2001-2569号公報にはシクロ(環状)デキストリン(α−シクロデキストリン、β−シクロデキストリン、γ−シクロデキストリン)を用いて包接することにより水に可溶な粉末状の包接物を得ることができることが記載されている。しかしながら、アスタキサンチンとシクロデキストリンを単に混合しても安定なアスタキサンチン−シクロデキストリン包接物が得られず、またアスタキサンチンをエタノールで溶解させ、水で希釈しただけでは安定なアスタキサンチンとγ−シクロデキストリンとの包接化合物は得られないことが分かった。安定なアスタキサンチンとγ−シクロデキストリンとの包接化合物及びその製造方法、並びに該包接化合物の液剤、特に該粉末を溶解させ安定且つ澄明な液剤を得る方法については未だ充分な方法がない。
【先行技術文献】
【特許文献】
【0003】
【特許文献1】特開平2−49091号公報
【特許文献2】特開2005−21098号公報
【特許文献3】特開2003−64360号公報
【発明の概要】
【発明が解決しようとする課題】
【0004】
本発明は、安定なアスタキサンチンとγ−シクロデキストリンとの包接化合物、並びにその包接化合物を含有する飲食物、動物用飼料、医薬品及び化粧品を提供することを目的とする。
【課題を解決するための手段】
【0005】
本発明は、アスタキサンチン1重量部に対し、γ−シクロデキストリン0.5〜100重量部の割合でアスタキサンチンとγ−シクロデキストリンからなる包接化合物である。
【発明の効果】
【0006】
本発明により安定なアスタキサンチンとシクロデキストリンとの包接化合物を提供できた。このものは加工が容易であり、飲食物、動物飼料、医薬品、健康食品等の分野での利用に有用である。また、本発明の包接化合物は水に容易に溶け易く且つ均一な溶液とすることができるので摂取又は服用する時に用時溶解して利用することができる。
【図面の簡単な説明】
【0007】
【図1】図中(A)はアスタキサンチン(遊離体、合成品)、(B)はγ−シクロデキストリン、(C)はアスタキサンチンとγ−シクロデキストリンをモル比1:3で混練処理した粉末、(D)はアスタキサンチンとγ−シクロデキストリンをモル比1:3で混合した粉末のXRDスペクトルである。上記(C)は包接化合物を形成している。
【図2】図中、(E)はアスタキサンチンとα−シクロデキストリンをモル比1:3で混練した粉末、(F)アスタキサンチンとα−シクロデキストリンをモル比1:3で混合した粉末、(G)はアスタキサンチンとβ−シクロデキストリンをモル比1:3で混練した粉末、(F)アスタキサンチンとβ−シクロデキストリンをモル比1:3で混合した粉末のXRDスペクトルである。包接化合物が形成されていないことを示す。
【発明を実施するための形態】
【0008】
この明細書において、アスタキサンチンとは、アスタキサンチンの遊離体、アスタキサンチン脂肪酸モノエステル、アスタキサンチン脂肪酸ジエステルの群から選ばれる少なくとも1種からなるものである。脂肪酸エステルとは、炭素数が2個以上の飽和脂肪酸又は不飽和脂肪酸の群から選ばれる少なくとも1種以上からなるものである。
【0009】
アスタキサンチンは、合成品及び/又は天然品であっても良いが、生体の安全性を考慮すると天然由来品、例えばヘマトコッカス藻体、ファフィア酵母又はオキアミ等から抽出されるアスタキサンチンが好ましく、さらに好ましくは工業的に大量且つ安定に入手できるヘマトコッカス藻体からの抽出アスタキサンチンである。
【0010】
アスタキサンチンとして、ヘマトコッカス由来のアスタキサンチンオイルを使用するときは、オイル中のアスタキサンチンの含量とその他の夾雑物(主な成分は、モノ、ジ、トリグリセリド)の成分の重量に基づいてγ−シクロデキストリンの使用量を設定することができる。具体的には、アスタキサンチン1重量部に対し、γ−シクロデキストリン0.5〜100重量部の範囲であり、好ましくは0.5〜50重量部の範囲、より好ましくは1〜50重量部の範囲である。
【0011】
本発明においては上記γ−シクロデキストリン以外にアスタキサンチンとγ−シクロデキストリンとの包接化合物の安定性と、水への溶解性を妨げない範囲でα−シクロデキストリン、β−シクロデキストリン、δ−シクロデキストリン及び公知の水溶性のシクロデキストリン誘導体を添加しても良い。
【0012】
水溶性のシクロデキストリン誘導体としては、例えば、ヒドロキシプロピル−β−シクロデキストリン、メチル−β−シクロデキストリン、モノアセチル−β−シクロデキストリン、トリアセチル−β−シクロデキストリン、モノクロロトリアジル−β−シクロデキストリン、スルホブチルエーテル−β−シクロデキストリン、ジ−O−メチル−β−シクロデキストリン、マルトシル−β−シクロデキストリン等を挙げることができる。
【0013】
本発明の安定なアスタキサンチンとシクロデキストリンとの包接化合物は、アスタキサンチンとγ−シクロデキストリンとの混合物に水と少なくとも1種以上の有機溶媒を特定割合で配合することにより製造することができる。
【0014】
用いる有機溶剤は、アスタキサンチン、アスタキサンチンオイルが溶解するものであれば特に制限はないが、好ましくは粉末化の最終段階で除去しやすいものであり、例えば、メタノール、エタノール、ブタノール、プロパノール等のアルコール類、酢酸エチル等のエステル類、ジクロロメタン、クロロホルム等のハロゲン化炭素水素、アセトン、エーテル等から選ばれる少なくとも1種である。より好ましくは短時間で包接化処理することができるエタノールとジクロロメタン又はクロロホルムの組合せである。
【0015】
包接化の方法としては、混練法、液相混合法、溶媒蒸発法、共沈法、凍結乾燥法等を例示することができる。好ましくは取扱が容易である混練法、液相混合法、溶媒蒸発法である。
【0016】
混練法は、例えば、混練機、乳鉢等を用いて、アスタキサンチン又はアスタキサンチンオイルとγ−シクロデキストリンとの混合物に水と前記有機溶媒の適量を加えて、すりつぶしながら、ペースト状になるまで練り混ぜる方法である。
【0017】
液相混合法は、例えばフラスコ、反応釜等の容器内にアスタキサンチン又はアスタキサンチンオイルとγ−シクロデキストリンとを前記有機溶媒及び水を加え水相中で激しく攪拌混合する方法である。
【0018】
溶媒蒸発法は、例えばロータリーエバポレーター等減圧可能な装置を用いて、アスタキサンチン又はアスタキサンチンオイルとγ−シクロデキストリンとの混合物に前記有機溶媒と水を添加した後、減圧下溶媒を留去する方法である。
【0019】
共沈法は、アスタキサンチン又はアスタキサンチンオイルを前記有機溶媒に溶解した溶液を、所望の濃度に調製したγ−シクロデキストリンの水溶液に、攪拌しながら、滴下する方法である。
【0020】
凍結乾燥法は、アスタキサンチン又はアスタキサンチンオイルとγ−シクロデキストリンに前記有機溶媒と水を添加し、混合後、凍結乾燥することにより、溶媒を留去する方法である。
【0021】
アスタキサンチンとγ−シクロデキストリンとの包接化合物の製造中にアスタキサンチンが分解及び/又は褪色するのを防ぐため、包接化合物を調製する温度範囲は80℃以下が好ましい。より好ましくは60℃以下、さらに好ましくは室温付近である。
【0022】
本発明の製法で得られた包接化合物は、充分に溶媒を除去した方がより安定な粉末として得られる。
【0023】
本発明の製法において、γ−シクロデキストリンを、予めγ−シクロデキストリン1重量部に対して水0.5〜10重量部を添加したものを用いるとより安定なアスタキサンチンとγ−シクロデキストリンとの包接化合物が得られる。
【0024】
アスタキサンチンオイルを用いて包接化合物を調製するときに、以下の方法で行うと、さらに安定性の高い粉末が得られる。具体的には、アスタキサンチンオイルに含まれるアスタキサンチン1重量部と、γ−シクロデキストリン0.5〜100重量部の混合物に、γ−シクロデキストリン1重量部に対して、メタノール、エタノール、プロパノール、ブタノール、アセトン、エーテル、酢酸エチル、ジクロロメタン、クロロホルムからなる群から選ばれる少なくとも1種の有機溶媒0.5〜10重量部と水1〜20重量部を添加し、生成した包接化合物を上記有機溶媒からなる群から選ばれる少なくとも1種の有機溶媒で洗浄し、乾燥し、さらに少量の水で洗浄後、乾燥する方法である。上記有機溶媒、水での洗浄により、アスタキサンチンの安定性に影響する微量成分が除去されるためと考えられる。
【0025】
本発明のアスタキサンチンとγ−シクロデキストリンの包接化合物には、安定な包接化合物の形成を阻害しない範囲で、粉体製造において、慣用の水溶性の甘味料、香料、着色料、でんぷん、アルギン酸ソーダ等の崩壊剤、ラクトース、グリコース、シュクロース、マニトール、エリスリトール等の賦形剤、ヒドロキシプロピルセルロース、ゼラチン等の結合剤、グリセリン等の可塑剤等を用いることができる。
【0026】
本発明の安定なアスタキサンチンとγ−シクロデキストリンとの包接化合物には、アスタキサンチン及び/又はそのエステルが空中で酸化分解されるのを防止するために、ブチルハイドキシトルエン、ブチルハイドロキシアニソール、ビタミンE類(トコフェロール及び、トコトリエノール又はその誘導体)、アスコルビン酸、L−アスコルビン酸パルミチン酸エステル、L−アスコルビン酸ステアリン酸エステル、アスコルビン酸ナトリウム、没食子酸、エトキシキン、グルタチオン、フィチン酸、カテキン類、ポリフェノール類、フラボノイド類、カロテノイド類、キサントフィル類、ゴマ抽出物、ローズマリー抽出物等の天然及び合成抗酸化剤を添加しても良い。
【0027】
本発明のアスタキサンチンとγ−シクロデキストリンとの包接化合物を含有する均一且つ透明な液剤は、該包接化合物を水に溶解させることにより、又は懸濁させた後不溶物を所望の孔径のフィルターを用いてろ過することにより、調製することができる。
【0028】
上記液剤には、さらに液剤の調製において、通常用いられる界面活性剤、溶解補助剤等を、包接化合物の溶解性に影響しない量を添加しても良い。界面活性剤としては、ショ糖脂肪酸エステル、プロピレングリコールエステル、グリセリン脂肪酸エステル、ソルビタン脂肪酸エステル、デキストリン、還元デキストリン等を挙げることができる。
【0029】
本発明の包接化合物を、飲食物、栄養補助食品又は機能性食品として用いる場合の形態は、通常の薬剤で用いられる形態に準拠したものであり、例えば、錠剤、散剤、顆粒剤、カプセル剤、ドリンク剤の形態が例示できる。栄養のバランスをとるため、常法に従って一般に使用されている賦形剤、増量剤、ビタミン類、繊維質、タンパク質、アミノ酸、ミネラル類、動植物性抽出エキス、甘味料、香料、安定化剤、色素等を添加することができる。
【0030】
飲食物の形態としては、加工乳、チーズ、バター、マーガリン、生クリーム、アイスクリーム、氷菓子、プリン、乳製品、ゼリー、キャンディー、ドロップ、飴、キャラメル、チューインガム、カステラ、ケーキ、ドーナッツ、ビスケット、クラッカー、スナック菓子、フライドポテト、ポテトチップ、ポップコーン、もち、団子、大福、スープ、ソーセージ、ハム、ベーコン、肉製品、カマボコ、チクワ、ハンペン、魚製品、スパッゲッティ、パスタ、グラタン、パエリア、カレー、ソース、ケチャップ、ドレッシング、漬け物、炭酸系飲料、果汁飲料、スポーツ飲料、茶、コーヒー、ココア、ビール、リキュール、カクテル、薬用酒等の一般食品の形態を上げることができる。また、安定で均一かつ澄明な赤色系の液剤として清涼感のある飲料として利用することができる。
【0031】
飼料として用いる場合は、そのまま飼料として用いてもよいが、一般に用いられる動物用、魚類用配合飼料の配合原料、例えば、トウモロコシ、マイロ、魚粉、ふすま、食塩、炭酸カルシウム、リン酸カルシウム、アミノ酸類、ビタミン類、微量ミネラル、既存の抗酸化剤等を配合しても良い。
【0032】
医薬品として用いるには、常法に従って、例えば、錠剤及び粉末のような固形投与形態、あるいはシロップのような液体投与形態で経口投与される。また非経口投与的に、例えば、貼付薬、軟膏、注射剤、座薬としても使用可能である。薬剤の調製自体は常法に従って行うことができる。
【0033】
化粧品の形態としては、特に限定されず、例えば、乳液、クリーム、化粧水、パック、洗浄料等のスキンケア化粧料、ファンデーション、アイシャドウ、マスカラ、口紅等のメーキャップ化粧料、分散液、軟膏、外用液剤、クリーム剤等の化粧料とすることができる。また、通常化粧品や医薬品等の皮膚外用剤に用いられる成分、例えば、水(アルカリ単純温泉水、深層水、精製水等を含む)、低級アルコール、多価アルコール、油脂、ロウ、鉱物油、脂肪酸、粉体、金属セッケン、pH調整剤、界面活性剤、増粘剤、色素、植物又は動物系原料由来の抽出物、ビタミン類、アミノ酸類、ホルモン類、殺菌・消毒剤、角質溶解剤、酵素、清涼剤、安定化剤、金属イオンキレート剤、血行促進剤、精油、消臭剤、保湿剤、収斂剤、抗脂漏剤、細胞賦活剤、香料等を添加しても良い。
【実施例】
【0034】
本発明を以下の参考例、実施例、比較例により詳細に説明する。
【0035】
参考例1 ヘマトコッカス藻からのアスタキサンチンオイルの調製:
公知の方法によりヘマトコッカス藻を培養し、アスタキサンチン含有ヘマトコッカス藻体を得た。藻体を培養液から分離、乾燥した後、アセトン抽出し、必要ならば不溶物を除去した後、エバポレーターで減圧下アセトンを留去することによりアスタキサンチン抽出物(以下アスタキサンチンオイル)を得た。このアスタキサンチンオイル中のアスタキサンチン含量は吸光度法(測定波長475nm、溶媒アセトン)にて定量した。オイル中の遊離体スタキサンチンとアスタキサンチン脂肪酸モノエステル及びアスタキサンチン脂肪酸ジエステルの合計の量はオイル全量に対して15重量%であった。アスタキサンチンオイル中のアスタキサンチンの組成は、遊離体アスタキサンチン(6重量%)、アスタキサンチン脂肪酸モノエステル(82重量%)及びアスタキサンチン脂肪酸ジエステル(12重量%)であった。その他の成分としてモノ−、ジ−、トリ−グリセリド類が50重量%であった。ただし、本発明に用いるアスタキサンチンオイルの組成、脂肪酸の種類は特にに限定されるものではない。
【0036】
実施例1アスタキサンチン(合成品、シグマ製)1.0g、粉末状のγ−シクロデキストリン(商品名デキシパールγ−100、塩水港精糖製)4.0g、エタノール−ジクロロメタン(容量比=1:1)混合溶液4ml及びイオン交換水4mlを乳鉢に入れ、乳棒でよく混合した。有機溶媒が揮発した後、再びエタノール−ジクロロメタン(容量比=1:1)混合溶液4mlを加え、再びよく混合し、この操作を3回繰り返しペースト状とした。最終段階で添加した溶媒を殆ど揮発させ、湿った粉体状物の残分を真空乾燥機にて減圧下1晩乾燥した。
【0037】
実施例2参考例1で得られたアスタキサンチンオイル1.0g、上記γ−シクロデキストリン2.0g、エタノール−ジクロロメタン(容量比=1:1)混合溶液2ml及びイオン交換水2mlを乳鉢に入れ、乳棒でよく混合した。有機溶媒が揮発した後、再びエタノール−ジクロロメタン(容量比=1:1)混合溶液2mlを加え、再びよく混合し、この操作を3回繰り返しペースト状とした。最終段階で添加した溶媒を殆ど揮発させ、湿った粉体状物の残分を真空乾燥機にて減圧下1晩乾燥した。
【0038】
実施例3上記γ−シクロデキストリン4.0gと水4.0mlを乳鉢に加え、良く混練した後、参考例1で得られたアスタキサンチンオイル1.0gとエタノール−ジクロロメタン(様良否=1:1)混合溶液4.0mlを加え、良く混練した。有機溶媒が揮発した後、再びエタノール−ジクロロメタン(容量比=1:1)混合溶液4mlを加え、再びよく混合し、この操作を3回繰り返しペースト状とした。最終段階で添加した溶媒を殆ど揮発させ、湿った粉体状物の残分を真空乾燥機にて減圧下1晩乾燥した。
【0039】
実施例4参考例1で得られたアスタキサンチンオイル1.0g、上記γ−シクロデキストリン4.0g、水10ml及びエタノール−ジクロロメタン(容量比=1:1)混合溶液10mlをナス型フラスコに入れ、60℃に加温してロータリーエバポレーターで減圧下有機溶媒を留去した。溶媒を留去した後再びエタノール−ジクロロメタン(容量比=1:1)混合溶液10mlを加え、60℃に加温して減圧下で有機溶媒を留去した。この操作を4回繰り返し、最後に水も完全に留去した後、真空乾燥機にて減圧下1晩乾燥した。
【0040】
実施例5参考例1で得られたアスタキサンチンオイル1.0g、上記γ−シクロデキストリン5.0g、水10ml及びエタノール−ジクロロメタン(容量比=1:1)混合溶液10mlをナス型フラスコに入れ、60℃に加温して、3時間還流した。遠心分離し、残分(固形分)をとり出し、真空乾燥機にて減圧下1晩乾燥した。
【0041】
実施例6参考例1で得られたアスタキサンチンオイル1.0g、上記γ−シクロデキストリン5.0g、水10ml及びエタノール−ジクロロメタン(容量比=1:1)混合溶液10mlをナス型フラスコに入れ、60℃に加温して、3時間還流した。エタノール10mlを添加後、遠心分離し、残分(固形分)をとり出した。この操作を2回繰り返した後、真空乾燥機にて減圧下1晩乾燥した。10mlの水を加え30分間振とうし、遠心分離した。再び同じ操作を行った後、真空乾燥機で減圧下1晩乾燥した。
【0042】
比較例1参考例1で得られたアスタキサンチンオイル1.0gと上記γ−シクロデキストリン2.0gを乳鉢に入れ、乳棒でよく混合した。
【0043】
比較例2参考例1で得られたアスタキサンチンオイル1.0g、上記γ−シクロデキストリン2.0g及び水2.0gを乳鉢に入れ、乳棒でよく混合した後、真空乾燥機にて減圧下1晩乾燥した。
【0044】
比較例3参考例1で得られたアスタキサンチンオイル1.0g、上記γ−シクロデキストリン2.0g、水2.0g及びエタノール2.0mlを乳鉢に入れ、乳棒でよく混合し、溶媒を殆ど揮発させた後、真空乾燥機にて減圧下1晩乾燥した。
【0045】
比較例4参考例1で得られたアスタキサンチンオイル1.0g、上記γ−シクロデキストリン2.0g、水2.0g及びジクロロメタン2.0mlを乳鉢に入れ、乳棒でよく混合し、溶媒を殆ど揮発させた後、真空乾燥機で減圧し1晩乾燥した。溶媒を変えて調製した。
【0046】
下記表1に上記実施例1〜6と比較例1〜3の方法により得られるアスタキサンチンとγ−シクロデキストリンとの粉体の調製方法、溶媒の種類、アスタキサンチンに対するγ−シクロデキストリン配合量、安定性試験の結果(残存率)を示す。なお、表中、γ−CDはγ−シクロデキストリン、ETはエタノール、DMはジクロロメタンを意味し、添加量は重量で示す。
【0047】
安定性比較試験は以下に示す方法で行った。各被験物質10mgをキャップ付き試験管(10ml)に入れ、酸素で置換し、封をした後、80℃で加温し、2時間及び4時間後のアスタキサンチン含量を測定した。なお、包接体中のアスタキサンチンの含量はクロロホルムで抽出後、吸光度法(測定長485nm、溶媒クロロホルム)にて測定した。
【0048】
【表1】

【0049】
上記表1の結果から本発明の製法で得られる包接化合物は、酸素置換下80℃4時間の過酷試験後もアスタキサンチンが83〜99%も残存し、極めて安定なものであった。これに対し、比較例1〜4の従来法で調製した粉体ではアスタキサンチンの4時間後の含量は極めて低くなり、不安定なものであった。図1と図2のXRDスペクトルより、本発明の包接化合物は、単なる混合物ではなく、アスタキサンチンとγ−シクロデキストリンの包接化合物を形成していることがわかる。
【0050】
本発明の包接化合物は、安定な粉末であり、又水に溶解し易い特長を有する。以下に本発明の包接化合物の水に対する溶解性と透明性について述べる。
【0051】
上記実施例1〜6で得られた包接化合物、及び比較例1〜4で得られた混合物の各試料の適量を所望の量の水に加え、攪拌機、超音波振とう機等で溶解させ、遠心分離後、上澄み液中のアスタキサンチン含量を測定し溶解性の比較試験を行った。
【0052】
試験例B1〜B10各試料20mgを水50mlに加え、超音波振とうを5分間行い、遠心分離後、上澄み液中のアスタキサンチン含量を測定した。その結果を表2に示す。表中、溶解性は、○は沈殿がない状態、△は少量沈殿が生じた状態、×は油滴が浮遊する状態であることを示す。
【0053】
【表2】

【0054】
上記表2の結果ら明らかな様に本発明の実施例1〜6の方法で得られたアスタキサンチンとγ−シクロデキストリンとの包接化合物は極めて容易に水に溶けることがわかる。これらの溶液を直射日光の当たらない場所に室温で1カ月放置したが褪色は見られなかった。
【0055】
一方、比較例1〜4の従来法で得られる粉末は、水を添加するとアスタキサンチンオイルが浮遊し、γ−シクロデキストリンのみが水に溶けた。
【0056】
以上の結果から本発明のアスタキサンチンに対し、γ−シクロデキストリンを特定の割合で配合することを特徴とする製法により得られるアスタキサンチンとγ−シクロデキストリンとの包接化合物は、熱に対し極めて安定であり、また該包接化合物が水に溶解し易いことがわかる。
【0057】
製造例1錠剤実施例6の包接化合物15gアビセル35g還元麦芽糖水飴15g部分α化デンプン10g軽質無水ケイ酸2g噴霧乳糖20gショ糖脂肪酸エステル3g上記各成分を常法に従って均一に混合し、1粒300mgの錠剤とした。
【0058】
製造例2カプセル剤ゼラチン70gグリセリン23gパラオキシ安息香酸プロピル1g水6g上記成分からなるソフトカプセル剤皮の中に、実施例6の包接化合物30重量%、ヤシ油70重量%からなる内容物充填し300mgのカプセル剤とした。
【0059】
製造例3ドリンク剤実施例6の包接化合物2gDL−酒石酸ナトリウム0.1g液糖800gクエン酸12gビタミンC10gビタミンE30g香料1.5g塩化カリウム0.1g硫酸マグネシウム0.5g上記の成分を配合し、水を加えて10Lとし、常法に従ってドリンク剤を調製した。
【0060】
製造例4クリーム実施例6の包接化合物1gグリセリンモノステリン酸7gプロピレングリコール5gスクワラン15gメチルパラオキシベンゼン0.1gプロピルパラオキシベンゼン0.1g上記の成分に水を加えて100gになるように配合し、常法に従って、クリームを調製した。
【0061】
製造例5清涼飲料水実施例6の包接化合物2g液糖1000gクエン酸16gアスコルビン酸2g香料15g上記の成分に水10Lを配合し、常法に従って、透明な清涼飲料水を調製した。
【0062】
製造例6クッキー実施例6の包接化合物2g牛乳630g砂糖130gコーンスターチ130g食塩10g上記の成分を配合し、常法に従って、クッキーを焼いた。
【0063】
製造例7実施例6の包接化合物2gトウモロコシ粉300g小麦粉300g魚粉50gアルファルファミール50gキャッサバミール50gフスマ50g大豆粉200g上記の成分を配合し、常法に従って、ペレット状にしニワトリ用飼料とした。
【特許請求の範囲】
【請求項1】
アスタキサンチン及び/又はそのエステル1重量部に対し、γ−シクロデキストリン0.5〜100重量部の割合で配合することを特徴とするアスタキサンチン及び/又はそのエステルとγ−シクロデキストリンとの包接化合物。
【請求項2】
アスタキサンチンのエステルが、アスタキサンチン脂肪酸モノエステル、アスタキサンチン脂肪酸ジエステルの群から選ばれる少なくとも1種以上である請求項1に記載の包接化合物。
【請求項3】
アスタキサンチン及び/又はそのエステルがヘマトコッカス藻体から抽出したアスタキサンチン及び/又はそのエステルのオイルである請求項1または2に記載の包接化合物。
【請求項4】
アスタキサンチン及び/又はそのエステル1重量部に対し、γ−シクロデキストリン0.5〜50重量部の割合で配合する請求項1〜3のいずれか1項に記載の包接化合物。
【請求項5】
アスタキサンチン及び/又はそのエステル1重量部に対し、γ−シクロデキストリン1〜5重量部の割合で配合する請求項1〜3のいずれか1項に記載の包接化合物。
【請求項6】
請求項1〜5のいずれか1項に記載の包接化合物を含有する液剤。
【請求項7】
請求項1〜5のいずれか1項に包接化合物を含有する飲食物。
【請求項8】
請求項1〜5のいずれか1項に包接化合物を含有する化粧品。
【請求項1】
アスタキサンチン及び/又はそのエステル1重量部に対し、γ−シクロデキストリン0.5〜100重量部の割合で配合することを特徴とするアスタキサンチン及び/又はそのエステルとγ−シクロデキストリンとの包接化合物。
【請求項2】
アスタキサンチンのエステルが、アスタキサンチン脂肪酸モノエステル、アスタキサンチン脂肪酸ジエステルの群から選ばれる少なくとも1種以上である請求項1に記載の包接化合物。
【請求項3】
アスタキサンチン及び/又はそのエステルがヘマトコッカス藻体から抽出したアスタキサンチン及び/又はそのエステルのオイルである請求項1または2に記載の包接化合物。
【請求項4】
アスタキサンチン及び/又はそのエステル1重量部に対し、γ−シクロデキストリン0.5〜50重量部の割合で配合する請求項1〜3のいずれか1項に記載の包接化合物。
【請求項5】
アスタキサンチン及び/又はそのエステル1重量部に対し、γ−シクロデキストリン1〜5重量部の割合で配合する請求項1〜3のいずれか1項に記載の包接化合物。
【請求項6】
請求項1〜5のいずれか1項に記載の包接化合物を含有する液剤。
【請求項7】
請求項1〜5のいずれか1項に包接化合物を含有する飲食物。
【請求項8】
請求項1〜5のいずれか1項に包接化合物を含有する化粧品。
【図1】


【図2】




【図2】


【公開番号】特開2012−77087(P2012−77087A)
【公開日】平成24年4月19日(2012.4.19)
【国際特許分類】
【出願番号】特願2011−282512(P2011−282512)
【出願日】平成23年12月23日(2011.12.23)
【分割の表示】特願2001−157753(P2001−157753)の分割
【原出願日】平成13年5月25日(2001.5.25)
【出願人】(390011877)富士化学工業株式会社 (53)
【Fターム(参考)】
【公開日】平成24年4月19日(2012.4.19)
【国際特許分類】
【出願日】平成23年12月23日(2011.12.23)
【分割の表示】特願2001−157753(P2001−157753)の分割
【原出願日】平成13年5月25日(2001.5.25)
【出願人】(390011877)富士化学工業株式会社 (53)
【Fターム(参考)】
[ Back to top ]

