安定性が高められた変異型乳酸オキシダーゼ、ならびにそれに関連する生成物、方法および使用
【課題】安定性が高められた変異型乳酸オキシダーゼの提供
【解決手段】安定性が高められた変異型乳酸オキシダーゼ、このような変異型乳酸オキシダーゼをコードする核酸、このような核酸を含む発現ベクター、このような核酸または発現ベクターを含む宿主細胞、サンプル中の乳酸を測定する方法、乳酸を測定するためのこのような変異型乳酸オキシダーゼの使用、このような変異型乳酸オキシダーゼを用いたサンプル中の乳酸を測定するための装置、および、このような変異型乳酸オキシダーゼを含む乳酸を測定するためのキットに関する。
【解決手段】安定性が高められた変異型乳酸オキシダーゼ、このような変異型乳酸オキシダーゼをコードする核酸、このような核酸を含む発現ベクター、このような核酸または発現ベクターを含む宿主細胞、サンプル中の乳酸を測定する方法、乳酸を測定するためのこのような変異型乳酸オキシダーゼの使用、このような変異型乳酸オキシダーゼを用いたサンプル中の乳酸を測定するための装置、および、このような変異型乳酸オキシダーゼを含む乳酸を測定するためのキットに関する。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、安定性が高められた変異型乳酸オキシダーゼ、このような変異型乳酸オキシダーゼをコードする核酸、このような核酸を含む発現ベクター、このような核酸または発現ベクターを含む宿主細胞、サンプル中の乳酸(lactate)を測定する方法、乳酸を測定するためのこのような変異型乳酸オキシダーゼの使用、このような変異型乳酸オキシダーゼを用いたサンプル中の乳酸を測定するための装置、および、このような変異型乳酸オキシダーゼを含む乳酸を測定するためのキットに関する。
【背景技術】
【0002】
乳酸は、ミルクアシッド(milk acid)としても知られており、様々な生化学的なプロセスにおいて役割を果たす。乳酸は、C3H6O3という化学式で示されるアルファヒドロキシ酸である。乳酸は、溶液中ではイオンの形態で存在しており、すなわちCH3CH(OH)COO−で示される乳酸イオン(lactate)として存在している。乳酸はキラルであり、2種の光学異性体を有する。そのうち1種はL−(+)−乳酸または(S)−乳酸として知られており、他方は、D−(−)−乳酸または(R)−乳酸である。L−(+)−乳酸は生物学的に重要な異性体である。
【0003】
動物(人間も含む)において、L−乳酸は、正常な代謝および運動中に絶えず乳酸デヒドロゲナーゼ(LDH)という酵素を介してピルビン酸塩から生産される。通常、L−乳酸の濃度は、乳酸の生産速度が乳酸の除去速度を超えない限り増加することはなく、これは、モノカルボン酸輸送体、LDHの濃度および形態、ならびに組織の酸化許容量などの様々な要因によって支配されている。人間の場合、乳酸の血中濃度は、安静時で一般的に1〜2mmol/Lであるが、激しく活動している最中は20mmol/Lよりも高く上昇する可能性がある。
【0004】
乳酸濃度または乳酸のピルビン酸塩に対する比率は、酸化還元状態を反映している。それゆえに、乳酸レベルのモニタリングは、組織の酸素要求量と酸素利用とのバランスの優れた指標であり、これは、細胞および動物生理学の研究において有用である。従って、被検体または細胞の状態を研究またはモニターするために、例えば血清、血漿、血液、尿および唾液などの生体サンプル中の乳酸、または、細胞培養サンプル中の細胞内および細胞外の乳酸濃度がモニターされる可能性がある。
【0005】
血中の乳酸の測定は、競技スポーツ、フィットネスおよびリハビリにおいて頻繁に利用されており、それにより以下のことが可能になる:
・個人ごとの運動強度の評価、
・運動時と回復時の改善、
・過負荷やけがのリスクの減少。
【0006】
上記で詳述したように、特に長時間運動すると、嫌気的解糖によって血中の乳酸が著しく増加する。
医学分野では、乳酸の測定は、
・組織の低酸素状態を確認するため、
・乳酸レベルで反映される範囲で疾患および予後の重症度を確認するため、
に用いられる可能性がある。
【0007】
乳酸濃度は、例えば体が利用できる酸素量が減少し、乳酸の生産が増加したり、および/または、乳酸の排除が減少したりするようなあらゆる状態で、増加する可能性がある。これは、激しい運動による筋肉中での局所的な乳酸の増加から、生命を脅かすような全身性ショックまで様々であり得る。過量の乳酸は、様々な病気、感染、ならびに遺伝性の代謝およびミトコンドリアの異常において起こる可能性がある。高い血中の乳酸濃度の共通の原因は、ショック、肺炎およびうっ血性心不全のような状態の結果として起こる無酸素症である。また腎不全および白血病においては乳酸アシドーシスも起こる可能性がある。さらに、チアミン欠乏症および糖尿病性ケトアシドーシスも乳酸濃度の増加と関連がある。これらはまた、例えばメトホルミン(糖尿病で投与される)、および、イソニアジド(結核の治療のための)などのある種の薬物療法によって引き起こされる可能性もある。
【0008】
乳酸を測定するための試験は、当業界でよく知られている。近年、酵素的な乳酸濃度測定方法が開発されている。酵素的な方法は、測定方法において酵素の使用を含むものであり、一般的に簡単であり、より大きな特異性、精度および再現性を提供する。乳酸濃度測定について説明されている最初の酵素的な方法は、乳酸デヒドロゲナーゼによる乳酸からフェリシアン化カリウムへの水素の移動に基づくものであった。しかしながらこの手法は扱いにくく、広く受け入れられなかった。それに続く方法は、NADH形成のUV測定を含むものであった。1974年に、ピルビン酸の捕捉物質としてヒドラジンを用いて、乳酸デヒドロゲナーゼによって触媒された乳酸の酸化によって形成されたNADHを測定する乳酸測定法が説明されている。さらに、乳酸デヒドロゲナーゼの触媒作用に基づくその他の方法もあるが、この方法では、乳酸の変換によって形成されたピルビン酸塩をより迅速に除去するために反応混合物中にアラニントランスアミナーゼが含まれる。さらにその他の方法では、乳酸オキシダーゼを用いて乳酸をピルビン酸に変換するために酵素反応を使用する。続いてこの反応によって生産された過酸化水素は、有色色素を生成するための酵素反応に利用することができる。
【0009】
緑色アエロコッカス(Aerococcus viridans)由来の乳酸オキシダーゼは、例えば血中の乳酸を検出するためのバイオセンサーやインビトロでの試験で用いられることが多い。このようなバイオセンサーやインビトロでの試験は、主に例えば集中治療中の患者や運動選手のモニタリングに用いられる。このようなセンサーの寿命は、使用中や保存中に不活性化される乳酸オキシダーゼの安定性によって決定される。また、インビトロでの試験用の試薬の貯蔵期間と使用期間は、乳酸オキシダーゼの安定性の影響を受ける。それゆえに、バイオセンサーおよびインビトロでの試験の貯蔵期間と使用期間を延長するために乳酸オキシダーゼの安定性を高めることが、大きな関心を呼んでいる。従って、安定性が高められた乳酸オキシダーゼを提供することが、本発明の目的である。
【発明の概要】
【0010】
驚くべきことに、配列番号1で示される乳酸オキシダーゼのアミノ酸配列のの191位におけるチロシンの変異が、乳酸オキシダーゼの安定性を高めることが発見された。
センサーおよび試験の貯蔵期間と使用期間が限られているために、これらは、活性が技術上の許容レベルよりも低くなるため頻繁に交換しなればならなかった。センサーおよび試験装置の頻繁な交換は、消費者にとって使い勝手が悪く、資源の浪費であることは明らかであり、回避されるべきである。野生型乳酸オキシダーゼの安定性が低いために、乳酸オキシダーゼが関わる測定は通常、低温で行われる。乳酸オキシダーゼの安定性を高めることによるさらなる利点は、血液のガス分析(しばしば付随して行われる)は通常37℃で行われるために、血液解析のための装置内の乳酸測定の際に温度を25〜30℃に下げるためのサーモスタットを回避できるようになることであろう。従って、乳酸オキシダーゼがより安定になるために、装置の複雑さをかなり抑えられると思われる。これにより、例えばいわゆる新興成長市場においてとりわけ重要である低コストの装置の土台が提供されると思われる。
【0011】
従って、第一の形態において、本発明は、安定性が高められた変異型乳酸オキシダーゼを提供するものであり、本オキシダーゼは、以下のアミノ酸配列:
(i)配列番号1もしくは配列番号2のアミノ酸配列またはそれらの機能的に活性な変異体に少なくとも90%同一なアミノ酸配列;および、
(ii)配列番号1または配列番号2におけるTyr191の位置に相当する位置にアミノ酸置換を有するアミノ酸配列、
を含み、ここで機能的に活性な変異体は、配列番号1または配列番号2のGly36、Ala95、Thr103、Glu160、Val198、Asn212、Ala/Gly232およびPhe277からなる群より選択される位置に少なくとも1つの追加のアミノ酸置換を有する。
【0012】
一般的に、用語「乳酸オキシダーゼ」(国際生化学連合の酵素委員会によりEC1.1.3.15と分類されている)は、O2をH2O2に還元することによるL−乳酸のピルビン酸塩への酸化を触媒する酵素((S)−2−ヒドロキシ酸オキシダーゼ)を意味する。乳酸オキシダーゼは、FMN(フラビンモノヌクレオチド)依存性アルファヒドロキシ酸酸化酵素ファミリーのひとつである。これは、補因子としてフラビンモノヌクレオチド(FMN)を用いる。乳酸オキシダーゼ酵素は、ウイルスや細胞性生物でみられる。
【0013】
本発明によれば、このような変異型乳酸オキシダーゼは、191位に変異を有さない各乳酸オキシダーゼと比較して高い安定性を有する。驚くべきことに、191位における変異(ここでTyrは、その他のアミノ酸で置換されており、具体的には、非極性で、例えばフェニルアラニン、ロイシンおよびトリプトファンのようなやや大きい側基を有するアミノ酸で置換されている)は、野生型乳酸オキシダーゼに比べて、アルカリ性の環境下で酵素の安定性を高めることが見出された。特に培地の状態などの周囲条件に応じた酵素の安定性を研究するのに適した試験は、当業者によく知られている。適切で典型的な試験は以下の実施例でも説明されており、具体的には実施例1で説明されている。
【0014】
本発明の好ましい実施態様において、変異型乳酸オキシダーゼの、191位に変異を有さない各乳酸オキシダーゼと比べて高い安定性は、191位に変異を有さない各乳酸オキシダーゼの半減期(t1/2(野生型191))と比べた場合の、変異体(t1/2(変異型191))の半減期の増加として示される。このような酵素の半減期(t1/2)は、もとの活性(t=0の活性)の50%が失われ(また、さらなる説明として実施例1も参照)、その後に残った活性量が50%になる時間を示す。
【0015】
従って、高い安定性によって、191位に変異を有さない各乳酸オキシダーゼに比べて変異体の半減期は長くなる。半減期は、好ましくは少なくとも10%、20%、30%または40%、好ましくは少なくとも50%、75%または100%、さらにより好ましくは少なくとも125%、150%、175%または200%、特に250%、最も好ましくは300%長くなる。半減期の百分率で示される増加は、[t1/2(変異型191)/t1/2(野生型191)−1]×100で決定してもよい。
【0016】
本明細書で述べられている用語「配列番号1」は、配列番号1で示されるアミノ酸配列を意味しており、これは、カルボキシ末端が欠失しているがTyr191が変異していない緑色アエロコッカス由来の野生型乳酸オキシダーゼのアミノ酸配列を示す。緑色アエロコッカス由来の野生型乳酸オキシダーゼフラグメントは、276個のアミノ酸からなるタンパク質である。具体的に言えば、用語「配列番号1」は、以下に記載されるアミノ酸配列を意味する(上記で特定した置換部位は、アンダーラインで示され、さらに位置番号で特定されていることに留意されたい):
【0017】
【化1】

【0018】
本明細書で述べられている用語「配列番号2」は、配列番号2で示されるアミノ酸配列を意味しており、これは、Tyr191の変異を有さずカルボキシ末端の欠失がない緑色アエロコッカス由来の野生型乳酸オキシダーゼのアミノ酸配列を示す。全長の緑色アエロコッカス由来の野生型乳酸オキシダーゼは、374個のアミノ酸からなるタンパク質である。この配列は、UNIPROTデータベースからQ44467という受託番号で入手することもできる(上記で特定された置換部位は、アンダーラインで示され、さらに位置番号で特定されていることに留意されたい):
【0019】
【化2】

【0020】
配列番号1の配列と配列番号2の配列とは、それらの長さが異なるだけでなく、102位、163位、232位および255位のアミノ酸も異なることに留意されたい。本発明の文脈において、配列番号1または配列番号2からなるタンパク質は、緑色アエロコッカス由来の野生型乳酸オキシダーゼと称される。
【0021】
用語「変異型乳酸オキシダーゼ」は、アミノ酸配列が、緑色アエロコッカス由来乳酸オキシダーゼの野生型の配列(すなわち配列番号1または2)とは異なっている乳酸オキシダーゼを意味する。本発明の変異型乳酸オキシダーゼに関して、このような変異体は機能的に活性であることが知られている。これは、このような変異体は、その生物学的機能、すなわち乳酸オキシダーゼの酵素活性を維持していることを意味する。しかしながら、このような変異体の活性は、野生型に比べて減少したり、または、増加したりする可能性がある(実施例1も参照)。
【0022】
このような酵素の活性は、単位(U)で示される場合がある。1Uは、1分あたりの基質1マイクロモルの変換を触媒する酵素の量と定義される。その条件も、一般的に、37℃の温度およびpH値、および、最大の基質変換率が得られる基質濃度と定められる。当業者であれば当然のことながら、このような変異体は、最小の活性、好ましくは少なくとも5U/mg酵素の活性、より好ましくは20U/mg酵素の活性を維持していると予想される。
【0023】
好ましくは、生物学的機能の維持は、配列番号1または2で示される乳酸オキシダーゼの活性の少なくとも10%、20%、30%、または、特に50%、好ましくは少なくとも60%、より好ましくは少なくとも70%、80%または90%、さらにより好ましくは95%を有することと定義される。生物活性は当業者がよく知っているようにして測定してもよく、例えば実施例1および2で説明されているようにして測定してもよい。
【0024】
本発明に係る変異型乳酸オキシダーゼは特に、配列番号1または2におけるTyr191の位置に相当する位置にアミノ酸置換を有することを特徴とする。これは、配列番号1または2の191位におけるアミノ酸Tyrが、その他のアミノ酸で置換されていることを意味する。チロシン(または4−ヒドロキシフェニルアラニンとも称される)は、極性側基を有する。実施例において、Tyr191は、フェニルアラニンまたはロイシンで、すなわち非極性側基を有するアミノ酸で置換されている。フェニルアラニンとトリプトファン(これも非極性側鎖、疎水性側鎖、芳香族側鎖を有するアミノ酸である)との類似性、および、ロイシンとイソロイシンとの類似性のために、Tyr191をTrpまたはIleで置換しても、望ましい作用、すなわち安定性の増加をもたらすと結論付けられる。さらにこのことは、グリシン、アラニン、バリン、ロイシン、イソロイシン、プロリンおよびメチオニンのような非極性側基を有するその他のアミノ酸についても同じことが言える。なかでも特にイソロイシン、プロリンおよびメチオニンが、それらのサイズのために特に当てはまると予想される。
【0025】
用語「少なくとも90%同一な」または「少なくとも90%の配列同一性」は、本明細書で用いられる場合、本発明に係る変異型乳酸オキシダーゼの配列は、100個のアミノ酸からなるストレッチのうち少なくとも90個のアミノ酸残基が、それに対応する野生型の配列と同一であることを特徴とするアミノ酸配列を有することを意味する。本発明の好ましい実施態様において、このような変異体のアミノ酸配列は、配列番号1もしくは2のアミノ酸配列またはそれらの機能的に活性な変異体に少なくとも91%、92%、93%または94%同一であり、より好ましくは少なくとも95%または96%、さらにより好ましくは少なくとも97%または98%、特に99%同一である。本発明に係る配列同一性は、例えば、配列が比較できるような形態で配列を並べる方法によって確認することができる。配列を並べる方法は当業界公知であり、このような方法としては、例えば、例えばピアソン(Pearson)およびリップマン(Lipman)(“Improved tools for biological sequence comparison“, Proc Natl Acad Sci U S A. 1988 Apr;85(8):2444-8)で説明されている様々なプログラムおよびアライメントアルゴリズムが挙げられる。さらに、NCBIベーシック・ローカル・アライメント・サーチ・ツール(BLAST)が、いくつかの供給源から入手でき、このような供給源としては、国立バイオテクノロジー情報センター(NCBI, メリーランド州ベセスダ)が挙げられる。
【0026】
より好ましい実施態様において、このような変異体は、Tyr191の位置における変異以外において、さらに、任意にGly36、Ala95、Thr103、Glu160、Val198、Asn212、Ala/Gly232およびPhe277からなる群より選択される位置における少なくとも1つの追加のアミノ酸置換以外において、配列番号1または2で示される配列と100%同一である。最も好ましい実施態様において、このような変異体は、Tyr191の位置における変異(好ましくはTyr191PheまたはTyr191Leu)以外において、および、任意に追加で1つのAla95の位置におけるアミノ酸置換(好ましくはAla95Gly)以外において、配列番号1または2で示される配列と100%同一である。
【0027】
本発明の一実施態様において、本発明に係る変異型乳酸オキシダーゼは、1つまたはそれより多くのアミノ酸欠失を含んでもよく、具体的には小さい(例えばアミノ酸10個以下の)Nおよび/またはC末端の欠失を含んでもよい。
【0028】
一実施態様において、本発明に係る変異型乳酸オキシダーゼの配列は、配列番号1または2のTyr191の位置における置換に加えて、任意にGly36、Ala95、Thr103、Glu160、Val198、Asn212、Ala/Gly232およびPhe277からなる群より選択される位置における少なくとも1つの追加のアミノ酸置換に加えて、1つまたはそれより多くの追加のアミノ酸置換を含んでもよく、具体的には1つまたはそれより多くの保存的アミノ酸置換を含んでもよい。保存的アミノ酸置換の例としては、以下に列挙したものが挙げられる:
【0029】
【表1】

【0030】
本発明の一実施態様において、本発明に係る変異型乳酸オキシダーゼは、1つまたはそれより多くのアミノ酸付加、具体的には小さい(例えばアミノ酸10個以下の)内部アミノ酸付加を含んでもよい。
【0031】
その他の実施態様において、本発明に係る変異型乳酸オキシダーゼの配列は、配列番号1または2Tyr191の位置における置換に加えて、および、任意にGly36、Ala95、Thr103、Glu160、Val198、Asn212、Ala/Gly232およびPhe277からなる群より選択される位置における少なくとも1つの追加のアミノ酸置換に加えて、上記で定義された1つまたはそれより多くの欠失、置換または付加の組み合わせを含んでもよい。
【0032】
本発明の文脈において、配列番号1または2のアミノ酸配列の機能的に活性な変異体は、配列番号1または2の以下の位置:Gly36、Ala95、Thr103、Glu160、Val198、Asn212、Ala/Gly232およびPhe277に、少なくとも1つのアミノ酸置換、すなわち1、2、3、4、5、6、7または8つのアミノ酸置換を有することを特徴とする。具体的に言えば、上記で列挙したアミノ酸のいずれかが、それぞれ1つの代替のアミノ酸で置換される。配列番号1または2の変異体の説明に役立つ実例としては、以下に示す置換により、配列番号1または2のアミノ酸配列と異なる変異体が挙げられる:
− Ala95Gly、Thr103Ser、Glu160Gly、Val198Ile、Asn212Asp、および、Ala/Gly232Ser;
− Ala95Ser、Thr103Ser、Glu160Ala、Val198Leu、Asn212Glu、および、Ala/Gly232Thr;
− Gly36Ser、Ala95Gly、Ala/Gly232SerおよびPhe277Tyr;
− Ala95Gly、Thr103Ser、Glu160Gly、Val198Ile、Asn212Asp、Ala/Gly232SerおよびPhe277Tyr;
− Gly36Ser、Thr103Ser、Glu160Gly、Val198Ile、Asn212Asp、Ala/Gly232SerおよびPhe277Tyr; または
− Gly36Ser、Ala95Gly、Thr103Ser、Glu160Gly、Val198Ile、Asn212Asp、Ala/Gly232SerおよびPhe277Tyr。
【0033】
Gly36、Thr103、Glu160、Val198、Asn212、Ala/Gly232およびPhe277の位置における置換は、変異型乳酸オキシダーゼに高い熱安定性を付与することが示されている(米国特許第5,656,471号、米国特許第7,416,871号B2を参照)。従って、アルカリ性(すなわちpH値が7より大きい)条件に対する安定性(Tyr191の変異)と、高い熱安定性とを組み合わせることが有利である。
【0034】
Ala95の位置における置換は、基質特異性を改善することが示されている(Yorita et al., J. Biol. Chem., 1996, 45, 28300-28305、および、実施例2を参照)。従って、安定性(Tyr191の変異)、および、任意に高い熱安定性(Gly36、Thr103、Glu160、Val198、Asn212、Ala/Gly232および/またはPhe277)と、改善された基質特異性(Ala95の変異)とを組み合わせることが有利である。
【0035】
アミノ酸Phe277は配列番号2にしか存在しないため、Phe277のアミノ酸置換は配列番号2に関するものであることに留意されたい。
加えて、配列番号1および2の配列は、232位のアミノ酸において異なっており、すなわち、配列番号1および2は、その位置に、それぞれAlaおよびGlyを有する。従って、Ala/Gly232が配列番号1について述べられている場合、それは、232位のAlaが置換されていることを意味し、Ala/Gly232が配列番号2について述べられている場合それは、232位のGlyが置換されていることを意味する。
【0036】
従って、機能的に活性な変異体は、
(i)Tyr191の位置に相当する位置におけるアミノ酸置換;および、
(ii)以下に示す位置における1つまたはそれより多くのアミノ酸置換:
−Gly36、
−Ala95、
−Thr103、
−Glu160、
−Val198、
−Asn212、
−Ala/Gly232、
−Phe277、
−Gly36、および、Ala95、
−Gly36、および、Thr103、
−Gly36、および、Glu160、
−Gly36、および、Val198、
−Gly36、および、Asn212、
−Gly36、および、Ala/Gly232、
−Gly36およびPhe277、
−Ala95、および、Thr103、
−Ala95、および、Glu160、
−Ala95、および、Val198、
−Ala95、および、Asn212、
−Ala95、および、Ala/Gly232、
−Ala95およびPhe277、
−Thr103、および、Glu160、
−Thr103、および、Val198、
−Thr103、および、Asn212、
−Thr103、および、Ala/Gly232、
−Thr103およびPhe277、
−Glu160、および、Val198、
−Glu160、および、Asn212、
−Glu160、および、Ala/Gly232、
−Glu160およびPhe277、
−Val198、および、Asn212、
−Val198、および、Ala/Gly232、
−Val198およびPhe277、
−Asn212、および、Ala/Gly232、
−Asn212およびPhe277、
−Ala/Gly232およびPhe277、
−Gly36、Ala95、および、Thr103、
−Gly36、Ala95、および、Glu160、
−Gly36、Ala95、および、Val198、
−Gly36、Ala95、および、Asn212、
−Gly36、Ala95、および、Ala/Gly232、
−Gly36、Ala95およびPhe277、
−Gly36、Thr103、および、Glu160、
−Gly36、Thr103、および、Val198、
−Gly36、Thr103、および、Asn212、
−Gly36、Thr103、および、Ala/Gly232、
−Gly36、Thr103およびPhe277、
−Gly36、Glu160、および、Val198、
−Gly36、Glu160、および、Asn212、
−Gly36、Glu160、および、Ala/Gly232、
−Gly36、Glu160およびPhe277、
−Gly36、Val198、および、Asn212、
−Gly36、Val198、および、Ala/Gly232、
−Gly36、Val198およびPhe277、
−Gly36、Asn212、および、Ala/Gly232、
−Gly36、Asn212およびPhe277、
−Gly36、Ala/Gly232およびPhe277、
−Ala95、Thr103、および、Glu160、
−Ala95、Thr103、および、Val198、
−Ala95、Thr103、および、Asn212、
−Ala95、Thr103、および、Ala/Gly232、
−Ala95、Thr103およびPhe277、
−Ala95、Glu160、および、Val198、
−Ala95、Glu160、および、Asn212、
−Ala95、Glu160、および、Ala/Gly232、
−Ala95、Glu160およびPhe277、
−Ala95、Val198、および、Asn212、
−Ala95、Val198、および、Ala/Gly232、
−Ala95、Val198およびPhe277、
−Ala95、Asn212、および、Ala/Gly232、
−Ala95、Asn212およびPhe277、
−Ala95、Ala/Gly232およびPhe277、
−Thr103、Glu160、および、Val198、
−Thr103、Glu160、および、Asn212、
−Thr103、Glu160、および、Ala/Gly232、
−Thr103、Glu160およびPhe277、
−Thr103、Val198、および、Asn212、
−Thr103、Val198、および、Ala/Gly232、
−Thr103、Val198およびPhe277、
−Thr103、Asn212、および、Ala/Gly232、
−Thr103、Asn212およびPhe277、
−Thr103、Ala/Gly232およびPhe277、
−Glu160、Val198、および、Asn212、
−Glu160、Val198、および、Ala/Gly232、
−Glu160、Val198およびPhe277、
−Glu160、Asn212、および、Ala/Gly232、
−Glu160、Asn212およびPhe277、
−Glu160、Ala/Gly232およびPhe277、
−Val198、Asn212、および、Ala/Gly232、
−Val198、Asn212およびPhe277、
−Val198、Ala/Gly232およびPhe277、
−Asn212、Ala/Gly232およびPhe277、
−Gly36、Ala95、Thr103、および、Glu160、
−Gly36、Ala95、Thr103、および、Val198、
−Gly36、Ala95、Thr103、および、Asn212、
−Gly36、Ala95、Thr103、および、Ala/Gly232、
−Gly36、Ala95、Thr103およびPhe277、
−Gly36、Ala95、Glu160、および、Val198、
−Gly36、Ala95、Glu160、および、Asn212、
−Gly36、Ala95、Glu160、および、Ala/Gly232、
−Gly36、Ala95、Glu160およびPhe277、
−Gly36、Ala95、Val198、および、Asn212、
−Gly36、Ala95、Val198、および、Ala/Gly232、
−Gly36、Ala95、Val198およびPhe277、
−Gly36、Ala95、Asn212、および、Ala/Gly232、
−Gly36、Ala95、Asn212およびPhe277、
−Gly36、Ala95、Ala/Gly232およびPhe277、
−Gly36、Thr103、Glu160、および、Val198、
−Gly36、Thr103、Glu160、および、Asn212、
−Gly36、Thr103、Glu160、および、Ala/Gly232、
−Gly36、Thr103、Glu160およびPhe277、
−Gly36、Thr103、Val198、および、Asn212、
−Gly36、Thr103、Val198、および、Ala/Gly232、
−Gly36、Thr103、Val198およびPhe277、
−Gly36、Thr103、Asn212、および、Ala/Gly232、
−Gly36、Thr103、Asn212およびPhe277、
−Gly36、Thr103、Ala/Gly232およびPhe277、
−Gly36、Glu160、Val198、および、Asn212、
−Gly36、Glu160、Val198、および、Ala/Gly232、
−Gly36、Glu160、Val198およびPhe277、
−Gly36、Glu160、Asn212、および、Ala/Gly232、
−Gly36、Glu160、Asn212およびPhe277、
−Gly36、Glu160、Ala/Gly232およびPhe277、
−Gly36、Val198、Asn212、および、Ala/Gly232、
−Gly36、Val198、Asn212およびPhe277、
−Gly36、Val198、Ala/Gly232およびPhe277、
−Gly36、Asn212、Ala/Gly232およびPhe277、
−Ala95、Thr103、Glu160、および、Val198、
−Ala95、Thr103、Glu160、および、Asn212、
−Ala95、Thr103、Glu160、および、Ala/Gly232、
−Ala95、Thr103、Glu160およびPhe277、
−Ala95、Thr103、Val198、および、Asn212、
−Ala95、Thr103、Val198、および、Ala/Gly232、
−Ala95、Thr103、Val198およびPhe277、
−Ala95、Thr103、Asn212、および、Ala/Gly232、
−Ala95、Thr103、Asn212およびPhe277、
−Ala95、Thr103、Ala/Gly232およびPhe277、
−Ala95、Glu160、Val198、および、Asn212、
−Ala95、Glu160、Val198、および、Ala/Gly232、
−Ala95、Glu160、Val198およびPhe277、
−Ala95、Glu160、Asn212、および、Ala/Gly232、
−Ala95、Glu160、Asn212およびPhe277、
−Ala95、Glu160、Ala/Gly232およびPhe277、
−Ala95、Val198、Asn212、および、Ala/Gly232、
−Ala95、Val198、Asn212およびPhe277、
−Ala95、Val198、Ala/Gly232およびPhe277、
−Ala95、Asn212、Ala/Gly232およびPhe277、
−Thr103、Glu160、Val198、および、Asn212、
−Thr103、Glu160、Val198、および、Ala/Gly232、
−Thr103、Glu160、Val198およびPhe277、
−Thr103、Glu160、Asn212、および、Ala/Gly232、
−Thr103、Glu160、Asn212およびPhe277、
−Thr103、Glu160、Ala/Gly232およびPhe277、
−Thr103、Val198、Asn212、および、Ala/Gly232、
−Thr103、Val198、Asn212およびPhe277、
−Thr103、Val198、Ala/Gly232およびPhe277、
−Thr103、Asn212、Ala/Gly232およびPhe277、
−Glu160、Val198、Asn212、および、Ala/Gly232、
−Glu160、Val198、Asn212およびPhe277、
−Glu160、Val198、Ala/Gly232およびPhe277、
−Glu160、Asn212、Ala/Gly232およびPhe277、
−Val198、Asn212、Ala/Gly232およびPhe277、
−Gly36、Ala95、Thr103、Glu160、および、Val198、
−Gly36、Ala95、Thr103、Glu160、および、Asn212、
−Gly36、Ala95、Thr103、Glu160、および、Ala/Gly232、
−Gly36、Ala95、Thr103、Glu160およびPhe277、
−Gly36、Ala95、Thr103、Val198、および、Asn212、
−Gly36、Ala95、Thr103、Val198、および、Ala/Gly232、
−Gly36、Ala95、Thr103、Val198およびPhe277、
−Gly36、Ala95、Thr103、Asn212、および、Ala/Gly232、
−Gly36、Ala95、Thr103、Asn212およびPhe277、
−Gly36、Ala95、Thr103、Ala/Gly232およびPhe277、
−Gly36、Ala95、Glu160、Val198、および、Asn212、
−Gly36、Ala95、Glu160、Val198、および、Ala/Gly232、
−Gly36、Ala95、Glu160、Val198およびPhe277、
−Gly36、Ala95、Glu160、Asn212、および、Ala/Gly232、
−Gly36、Ala95、Glu160、Asn212およびPhe277、
−Gly36、Ala95、Glu160、Ala/Gly232およびPhe277、
−Gly36、Ala95、Val198、Asn212、および、Ala/Gly232、
−Gly36、Ala95、Val198、Asn212およびPhe277、
−Gly36、Ala95、Val198、Ala/Gly232およびPhe277、
−Gly36、Ala95、Asn212、Ala/Gly232およびPhe277、
−Gly36、Thr103、Glu160、Val198、および、Asn212、
−Gly36、Thr103、Glu160、Val198、および、Ala/Gly232、
−Gly36、Thr103、Glu160、Val198およびPhe277、
−Gly36、Thr103、Glu160、Asn212、および、Ala/Gly232、
−Gly36、Thr103、Glu160、Asn212およびPhe277、
−Gly36、Thr103、Glu160、Ala/Gly232およびPhe277、
−Gly36、Thr103、Val198、Asn212、および、Ala/Gly232、
−Gly36、Thr103、Val198、Asn212およびPhe277、
−Gly36、Thr103、Val198、Ala/Gly232およびPhe277、
−Gly36、Thr103、Asn212、Ala/Gly232およびPhe277、
−Gly36、Glu160、Val198、Asn212、および、Ala/Gly232、
−Gly36、Glu160、Val198、Asn212およびPhe277、
−Gly36、Glu160、Val198、Ala/Gly232およびPhe277、
−Gly36、Glu160、Asn212、Ala/Gly232およびPhe277、
−Gly36、Val198、Asn212、Ala/Gly232およびPhe277、
−Ala95、Thr103、Glu160、Val198、および、Asn212、
−Ala95、Thr103、Glu160、Val198、および、Ala/Gly232、
−Ala95、Thr103、Glu160、Val198およびPhe277、
−Ala95、Thr103、Glu160、Asn212、および、Ala/Gly232、
−Ala95、Thr103、Glu160、Asn212およびPhe277、
−Ala95、Thr103、Glu160、Ala/Gly232およびPhe277、
−Ala95、Thr103、Val198、Asn212、および、Ala/Gly232、
−Ala95、Thr103、Val198、Asn212およびPhe277、
−Ala95、Thr103、Val198、Ala/Gly232およびPhe277、
−Ala95、Thr103、Asn212、Ala/Gly232およびPhe277、
−Ala95、Glu160、Val198、Asn212、および、Ala/Gly232、
−Ala95、Glu160、Val198、Asn212およびPhe277、
−Ala95、Glu160、Val198、Ala/Gly232およびPhe277、
−Ala95、Glu160、Asn212、Ala/Gly232およびPhe277、
−Ala95、Val198、Asn212、Ala/Gly232およびPhe277、
−Thr103、Glu160、Val198、Asn212、および、Ala/Gly232、
−Thr103、Glu160、Val198、Asn212およびPhe277、
−Thr103、Glu160、Val198、Ala/Gly232およびPhe277、
−Thr103、Glu160、Asn212、Ala/Gly232およびPhe277、
−Thr103、Val198、Asn212、Ala/Gly232およびPhe277、
−Glu160、Val198、Asn212、Ala/Gly232およびPhe277、
−Gly36、Ala95、Thr103、Glu160、Val198、および、Asn212、
−Gly36、Ala95、Thr103、Glu160、Val198、および、Ala/Gly232、
−Gly36、Ala95、Thr103、Glu160、Val198およびPhe277、
−Gly36、Ala95、Thr103、Glu160、Asn212、および、Ala/Gly232、
−Gly36、Ala95、Thr103、Glu160、Asn212およびPhe277、
−Gly36、Ala95、Thr103、Glu160、Ala/Gly232およびPhe277、
−Gly36、Ala95、Thr103、Val198、Asn212、および、Ala/Gly232、
−Gly36、Ala95、Thr103、Val198、Asn212およびPhe277、
−Gly36、Ala95、Thr103、Val198、Ala/Gly232およびPhe277、
−Gly36、Ala95、Thr103、Asn212、Ala/Gly232およびPhe277、
−Gly36、Ala95、Glu160、Val198、Asn212、および、Ala/Gly232、
−Gly36、Ala95、Glu160、Val198、Asn212およびPhe277、
−Gly36、Ala95、Glu160、Val198、Ala/Gly232およびPhe277、
−Gly36、Ala95、Glu160、Asn212、Ala/Gly232およびPhe277、
−Gly36、Ala95、Val198、Asn212、Ala/Gly232およびPhe277、
−Gly36、Thr103、Glu160、Val198、Asn212、および、Ala/Gly232、
−Gly36、Thr103、Glu160、Val198、Asn212およびPhe277、
−Gly36、Thr103、Glu160、Val198、Ala/Gly232およびPhe277、
−Gly36、Thr103、Glu160、Asn212、Ala/Gly232およびPhe277、
−Gly36、Thr103、Val198、Asn212、Ala/Gly232およびPhe277、
−Gly36、Glu160、Val198、Asn212、Ala/Gly232およびPhe277、
−Ala95、Thr103、Glu160、Val198、Asn212、および、Ala/Gly232、
−Ala95、Thr103、Glu160、Val198、Asn212およびPhe277、
−Ala95、Thr103、Glu160、Val198、Ala/Gly232およびPhe277、
−Ala95、Thr103、Glu160、Asn212、Ala/Gly232およびPhe277、
−Ala95、Thr103、Val198、Asn212、Ala/Gly232およびPhe277、
−Ala95、Glu160、Val198、Asn212、Ala/Gly232およびPhe277、
−Thr103、Glu160、Val198、Asn212、Ala/Gly232およびPhe277、
−Gly36、Ala95、Thr103、Glu160、Val198、Asn212、および、Ala/Gly232、
−Gly36、Ala95、Thr103、Glu160、Val198、Asn212およびPhe277、
−Gly36、Ala95、Thr103、Glu160、Val198、Ala/Gly232およびPhe277、
−Gly36、Ala95、Thr103、Glu160、Asn212、Ala/Gly232およびPhe277、
−Gly36、Ala95、Thr103、Val198、Asn212、Ala/Gly232およびPhe277、
−Gly36、Ala95、Glu160、Val198、Asn212、Ala/Gly232およびPhe277、
−Gly36、Thr103、Glu160、Val198、Asn212、Ala/Gly232およびPhe277、
−Ala95、Thr103、Glu160、Val198、Asn212、Ala/Gly232およびPhe277、または
−Gly36、Ala95、Thr103、Glu160、Val198、Asn212、Ala/Gly232およびPhe277
を除いて、配列番号1または2と同一であることを特徴としていてもよい。
【0037】
注目すべきことに、変異体に関して、本発明に係る配列番号1または2のアミノ酸配列の変異体は、機能的に活性な変異体である。機能的に活性な変異体は、生物学的機能、例えば乳酸オキシダーゼの酵素活性が維持されている変異体である。生物学的機能の維持は、配列番号1または2で示される乳酸オキシダーゼの活性の好ましくは少なくとも10%、20%、30%または特に50%、好ましくは少なくとも60%、より好ましくは少なくとも70%、80%または90%、さらにより好ましくは95%またはそれより多くを有することと定義される。このような生物活性は、当業者によく知られているようにして測定することができ、例えば実施例1および2で説明されているようにして測定することができる。
【0038】
本発明によれば、安定性が高められた変異型乳酸オキシダーゼは、配列番号1もしくは2のアミノ酸配列またはそれらの機能的に活性な変異体に少なくとも90%同一なアミノ酸配列を含み;および、配列番号1または2におけるTyr191の位置に相当する位置にアミノ酸置換を有する。これは、変異型乳酸オキシダーゼは、上記で特定されたアミノ酸に加えて1つまたはそれより多くのさらなる要素を含み得ることを意味する。このような要素は、さらなるタンパク質成分、または、非タンパク質成分であり得る。タンパク質成分の場合、変異型乳酸オキシダーゼは、例えばタンパク質の単離、精製または同定に利用することができるマーカーを有する融合タンパク質であり得る。要素のさらなる例としては、リンカー(例えば酵素を支持体にカップリングするためのもの)、シグナル配列(タンパク質を標的に向かわせるためのもの)などが挙げられる。その一方で、変異型乳酸オキシダーゼは、上記で特定されたアミノ酸配列からなっていてもよい。
【0039】
好ましい実施態様において、変異型乳酸オキシダーゼは、191位におけるチロシンが実質的に非極性のアミノ酸で置換されていることを特徴とし、具体的には、このようなアミノ酸置換は、Tyr191Phe、Tyr191Leu、Tyr191Ile、Tyr191Met、および、Tyr191Trpからなる群より選択され、特に、このようなアミノ酸置換は、Tyr191Phe、または、Tyr191Leu、好ましくはTyr191Pheである。本明細書において詳述されているように、191位におけるTyr(極性のOH基を有する)の非極性アミノ酸(例えばフェニルアラニンまたはロイシン)での置換は、野生型に比べて乳酸オキシダーゼの安定性を高めることが示されている(実施例を参照)。従って、このような置換は好ましい。非極性側基を有するアミノ酸の例は、グリシン、アラニン、バリン、ロイシン、イソロイシン、および、プロリンである。比較的極性が低い側基を有するアミノ酸としては、フェニルアラニンおよびロイシンと高い類似性を有するメチオニンおよびトリプトファンが挙げられる(MetおよびTyrは、PheまたはLeuの保存的アミノ酸置換とみなされると予想される;上記のリストを参照)。
【0040】
本発明のその他の好ましい実施態様において、変異型乳酸オキシダーゼは、具体的には、191位における変異が、Tyr191Phe、Tyr191Leu、Tyr191Ile、Tyr191MetおよびTyr191Trpであり、特にアミノ酸置換が、Tyr191Phe、または、Tyr191Leu、好ましくはTyr191Pheである場合、少なくとも1つの追加のアミノ酸置換が、配列番号1または2のGly36Ser、Ala95Gly、Thr103Ser、Glu160Gly、Val198Ile、Asn212Asp、Ala/Gly232SerおよびPhe277Tyrからなる群より選択されることを特徴とする。Gly36Ser、Thr103Ser、Glu160Gly、Val198Ile、Asn212Asp、Ala/Gly232SerおよびPhe277Tyrの置換は、変異型乳酸オキシダーゼに高い熱安定性を付与することが示されている。従って、このような置換は好ましい。
【0041】
本発明のより好ましい実施態様において、変異型乳酸オキシダーゼは、少なくとも1つの追加のアミノ酸置換は、Ala95であり、具体的にはAla95Glyであることを特徴とする。Ala95Glyの置換は、基質特異性を改善することが示されている(実施例2を参照)。従って、95位におけるAlaは、Glyで置換されていることが好ましい。
【0042】
本発明によれば、変異型乳酸オキシダーゼは、高い安定性を有する。本発明の好ましい実施態様において、変異型乳酸オキシダーゼは、それに対応する野生型酵素と比較して少なくとも1.5倍高い安定性を有し、好ましくは少なくとも2倍高い安定性、好ましくは少なくとも2.5倍高い安定性、より好ましくは少なくとも3倍高い安定性を有する。高い安定性を測定するのに適した方法は、実施例で詳述されている。20mMのHEPES(pH8.1)、150mMのNaCl、20mMのNaHCO3、および、0.02〜1mg/mlの乳酸オキシダーゼを含む緩衝液中で安定性を測定した。
【0043】
本発明のより好ましい実施態様において、特に、変異型乳酸オキシダーゼが、A95の位置におけるアミノ酸置換、具体的にはAla95Glyを含む場合、変異型乳酸オキシダーゼのグリコール酸と比較した乳酸への選択性が、それに対応する野生型酵素と比較して少なくとも2倍高く、好ましくは少なくとも2.5倍高く、好ましくは少なくとも3倍高く、より好ましくは少なくとも3.5倍高く、最も好ましくは少なくとも4倍高いことを特徴とする。高い選択性を測定するのに適した方法は、実施例で詳述されている。
【0044】
さらなる形態において、本発明は、本発明の変異型乳酸オキシダーゼをコードする核酸に関する。
本明細書で用いられる用語「核酸」は、一般的に、本発明の変異型乳酸オキシダーゼをコードするあらゆるヌクレオチド分子に関し、これらのヌクレオチド分子は様々な長さを有していてもよい。本発明の核酸の例としては、これらに限定されないが、例えばイオン交換クロマトグラフィーなどの標準的な分子生物学的な手法によって単離することができるプラスミド、ベクター、または、あらゆる種類のDNAおよび/またはRNAフラグメントが挙げられる。本発明の核酸は、特定の細胞または生物のトランスフェクションまたは導入のために用いることができる。
【0045】
本発明の核酸分子は、mRNAまたはcRNAのようなRNAの形態であってもよく、または、例えばcDNAおよびゲノムDNAなどのDNAの形態であってもよく、例えばクローニングによって得られたもの、または、化学合成技術によって生産されたもの、または、それらの組み合わせによって生産されたものが挙げられる。DNAは、三本鎖でもよいし、二本鎖でもよいし、または、一本鎖でもよいし。一本鎖DNAは、コード鎖(また、センス鎖としても知られている)であってもよいし、または、非コード鎖(また、アンチセンス鎖とも称される)であってもよい。本明細書で用いられる核酸分子はまた、なかでも特に、その他の一本鎖および二本鎖DNAまたはRNA、一本鎖RNAと二本鎖RNAの混合物であるRNA、一本鎖領域と二本鎖領域の混合物であるRNA、DNAおよびRNAを含むハイブリッド分子(これらは一本鎖でもよいし、または、より典型的には二本鎖もしくは三本鎖である)、または、一本鎖および二本鎖領域の混合物も意味する。加えて、本明細書で用いられる核酸分子は、RNAまたはDNAを含む三本鎖領域、または、RNAとDNAの両方を含む三本鎖領域を意味する。
【0046】
加えて、上記核酸は、1つまたはそれより多くの修飾塩基を含んでいてもよい。このような核酸はまた、生理学的な環境におけるこのような分子の安定性と半減期を高めるために、例えばリボース−リン酸主鎖中に修飾を含んでいてもよい。従って、安定性のために、または、その他の理由のために主鎖が修飾されたDNAまたはRNAも、その特徴が本明細書において意図されたものである「核酸分子」である。さらに、2つ例を挙げれば、イノシンのような通常と異なる塩基、または、トリチル化塩基のような修飾塩基を含むDNAまたはRNAも、本発明の文脈において核酸分子である。当然のことながら、当業者によく知られた多くの有用な目的に役立つ多種多様の修飾が、DNAおよびRNAに施される。本明細書において用られる核酸分子という用語は、このような化学的、酵素的または代謝的に改変された核酸分子の形態を包含し、加えて、ウイルスおよび細胞(特に単細胞および複合細胞など)に特徴的なDNAおよびRNAの化学的な形態も包含する。
【0047】
さらに、本発明の変異型乳酸オキシダーゼをコードする核酸分子は、融合タンパク質を作製するために、標準的なクローニング技術などの標準的な技術を用いて、あらゆる望ましい調節配列、リーダー配列、異種のマーカー配列、または、異種のコード配列に機能的に連結させることができる。
【0048】
本発明の核酸は、インビトロで最初から形成されたものでもよいし、または、培養中に細胞内で形成されたものでもよく、これは、一般的に、エンドヌクレアーゼ、および/または、エキソヌクレアーゼ、および/または、ポリメラーゼ、および/または、リガーゼ、および/または、リコンビナーゼによる核酸の操作によって、または、熟練した核酸生成の技術者によく知られているその他の方法によってなされる。
【0049】
さらなる形態において、本発明は、本発明の核酸を含む発現ベクターに関し、ここで本核酸は、宿主細胞中で核酸の発現を促進することができるプロモーター配列に作動可能なように連結している。
【0050】
本明細書で用いられる用語「発現ベクター」は、一般的に、細胞中で対象のタンパク質を発現させるのに用いることができるあらゆる種類の核酸分子を意味する(また、上記の本発明の核酸についての詳細も参照)。具体的には、本発明の発現ベクターは、例えば哺乳動物細胞、細菌細胞および酵母細胞などの特定の宿主細胞中でタンパク質を発現させるのに適した、当業者によく知られたあらゆるプラスミドまたはベクターであり得る。また本発明の発現コンストラクトは、本発明の乳酸オキシダーゼをコードし、さらにその後の発現を確認するための各ベクターへのクローニングに利用される核酸でもあり得る。タンパク質発現のためのプラスミドおよびベクターは当業界公知であり、これらは、例えばプロメガ(Promega, 米国ウィスコンシン州マディソン)、キアゲン(Qiagen, ドイツ国ヒルデン)、インビトロジェン(Invitrogen, 米国カリフォルニア州カールスバッド)、または、MoBiTec(ドイツ)などの様々な供給元から商業的に購入することができる。タンパク質発現方法は当業者によく知られており、例えばSambrook et al., 2000 (Molecular Cloning: A laboratory manual, 第三版)によって説明されている方法がある。
【0051】
このようなベクターは、加えて、宿主細胞中での複製を可能にするような核酸配列、例えば複製起点、1種またはそれより多くの治療的な遺伝子、および/または、選択マーカー遺伝子、およびその他の当業界でよく知られている遺伝学的要素、例えばコードされたタンパク質の転写、翻訳および/または分泌に関する調節因子を含んでいてもよい。このようなベクターを用いて、細胞に導入され、形質転換または感染させ、それによって、細胞にとって天然型のもの以外の核酸および/またはタンパク質を細胞が発現するようにすることができる。このようなベクターは、任意に、例えばウイルス粒子、リポソーム、タンパク質コーティングまたは同種のものなどの、細胞への核酸の侵入を達成するのに役立つ物質を含んでいてもよい。標準的な分子生物学的な技術によるタンパク質発現に適した多数のタイプの発現ベクターが当業界でよく知られている。このようなベクターは、昆虫由来ベクターなどの従来のベクタータイプのなかでも特に、例えばバキュロウイルス発現系、または、酵母、真菌性、細菌もしくはウイルス発現系から選択される。その他の適切な発現ベクターについても多数のタイプが当業界でよく知られており、これらもこの目的のために使用することができる。このような発現ベクターを得る方法はよく知られている(例えば上記のSambrook et alを参照、)。
【0052】
上記で詳細に述べたように、本発明の変異型乳酸オキシダーゼをコードする核酸は、確実にタンパク質を発現させるために、宿主細胞中でのタンパク質発現に適した配列に作動可能に連結している。しかしながら、特許請求された発現コンストラクトが、その後、確実にタンパク質を発現させるために適切な発現ベクターにクローニングされる中間生成物を示す可能性がある場合でも、本発明の範囲内に包含される。本発明の発現ベクターは、例えば、これらに限定されないが、ポリアデニル化シグナル、スプライスドナーおよびスプライスアクセプターシグナル、介在配列、転写エンハンサー配列、翻訳エンハンサー配列、薬剤耐性遺伝子、またはこれらと同種のものなどのあらゆる種類の核酸配列をさらに含んでいてもよい。任意に、薬剤耐性遺伝子を内部リボソーム侵入部位(IRES)に作動可能に連結させてもよく、このような薬剤耐性遺伝子は、細胞周期に特異的でもよいし、または、細胞周期とは無関係でもよい。
【0053】
本明細書で用いられる用語「作動可能に連結した」は、一般的に、遺伝子エレメントが、それらが意図する目的に沿って機能するように配置されることを意味し、例えば、プロモーターによって転写が開始され、本発明のタンパク質をコードするDNA配列に沿って進行するように配置されることをいう。すなわち、RNAポリメラーゼは、融合タンパク質をコードする配列をmRNAに転写し、続いてこれをスプライシングし、タンパク質に翻訳する。
【0054】
本発明の文脈において用いられる用語「プロモーター配列」は、一般的に、下流のコード配列に作動可能に連結したあらゆる種類の調節DNA配列を意味し、ここで前記プロモーターは、細胞中でRNAポリメラーゼに結合し、コードされたオープンリーディングフレームの転写開始させることにより、前記下流のコード配列の発現を起こすことができる。本発明のプロモーター配列は、当業者によく知られたあらゆる種類のプロモーター配列であってよく、このようなプロモーター配列としては、これらに限定されないが、構成的プロモーター、誘導性プロモーター、細胞周期特異的なプロモーター、および、細胞型特異的なプロモーターが挙げられる。
【0055】
本発明の核酸または発現ベクターは、宿主細胞中に含まれていてもよい。従って、本発明のその他の形態は、本発明の核酸または発現ベクターを含む宿主細胞に関する。本発明の「宿主細胞」は、組換えDNA技術での使用に適したあらゆる種類の生物であってよく、このような生物としては、これらに限定されないが、1種またはそれより多くの組換えタンパク質の発現に適したあらゆる種類の細菌および酵母株が挙げられる。宿主細胞の例としては、例えば、様々な枯草菌(Bacillus subtilis)株、または、大腸菌(E. coli)株が挙げられる。様々な大腸菌の宿主細胞は当業者によく知られており、例えば、これらに限定されないが、例えばDH5−アルファ、HB101、MV1190、JM109、JM101またはXL−1ブルーのような株が挙げられ、これらは、例えばストラタジーン(Stratagene, 米国カリフォルニア州)、プロメガ(米国ウィスコンシン州)、または、キアゲン(ドイツ国ヒルデン)などの様々な供給元から商業的に購入することができる。特に適切な宿主細胞は、実施例でも説明されており、すなわち大腸菌(E. coli)BL21ゴールド細胞である。宿主細胞として用いられる可能性がある枯草菌株としては、例えば1012野生型:leuA8metB5trpC2hsdRM1、および、168マールブルグ:trpC2(Trp−)が挙げられ、これらは、例えばMoBiTec(ドイツ)から市販されている。
【0056】
本発明に係る宿主細胞の培養は、当業者によく知られた慣用的な手法である。すなわち、本発明の変異型乳酸オキシダーゼをコードする核酸を、組換え手段によってそれぞれのタンパク質を生産させるために、適切な宿主細胞に導入することができる。これらの宿主細胞は、あらゆる種類の適切な細胞であってよく、好ましくは、培地中で培養することができる大腸菌のような細菌細胞である。このアプローチは、第一工程において、各遺伝子の適切なプラスミドベクターへのクローニングを含んでいてもよい。プラスミドベクターは遺伝子クローニングに広く利用されており、これらは、一時的にDNAを透過させることができるようにした細菌細胞に容易に導入すること、すなわちトランスフェクションすることができる。各宿主細胞中でタンパク質を発現させた後に、細胞を回収することができ、これらは、対象のタンパク質を含む細胞抽出物製造の出発原料として役立つ。対象のタンパク質を含む細胞抽出物は、細胞を溶解させることにより得られる。化学的または機械的な細胞溶解のいずれかを用いた細胞抽出物の製造方法が当業者によく知られており、このような方法としては、これらに限定されないが、例えば低張性の塩での処理、ホモジナイズまたは超音波処理が挙げられる。本発明の変異型乳酸オキシダーゼを発現させるための宿主細胞の培養に適した方法の例は、実施例1および2で説明される。
【0057】
本発明のその他の形態は、サンプル中の乳酸を測定する方法に関し、本方法は、
a)サンプルを、乳酸オキシダーゼの活性を促進する条件下で本発明の変異型乳酸オキシダーゼと接触させること;および、
b)i)乳酸の存在下で変異型乳酸オキシダーゼによって生産されたピルビン酸塩および/またはH2O2、および/または
ii)乳酸の存在下で変異型乳酸オキシダーゼによって消費されたO2、
を測定することにより、乳酸を測定すること、
を含む。
【0058】
上記の方法は、乳酸オキシダーゼが、以下のスキームに従ってL-乳酸のピルビン酸塩への酸化を触媒するのに用いられる可能性があるということに基づく:
L−乳酸+O2→ピルビン酸塩+H2O2
本発明の方法の第一の工程において、サンプルを本発明の変異型乳酸オキシダーゼと接触させる。サンプルと変異型乳酸オキシダーゼとの接触は、直接なされてもよいし(例えば液体分析の場合)、または、間接的になされてもよい(例えばサンプルの分画(分析物を含む)だけが変異型乳酸オキシダーゼと接触するようなセンサーシステムの場合)。
【0059】
このような接触は、乳酸オキシダーゼの活性を促進する条件下で、すなわち酵素によって乳酸をピルビン酸塩に酸化させるようにする条件下で行われるべきであることは明らかである。インキュベート工程は、約5秒〜数時間の範囲で様々であってもよく、好ましくは約10秒〜約10分である。しかしながら、インキュベート時間は、分析様式、溶液の体積、濃度などに依存すると予想される。通常、このような分析は、周囲温度、または、付随して行われるその他の試験様式に必要な温度(例えば25℃〜38℃;例えば30℃または37℃)で行われると予想されるが、このような分析は、温度範囲を逸脱して(例えば10℃〜40℃で)行ってもよい。
【0060】
任意に、このような酵素は、分析を容易にするために、サンプルと接触させる前に支持層に定着または固定させてもよい。支持層の例としては、例えばマイクロタイタープレートの形態のガラスまたはプラスチック、ガラス製の顕微鏡スライドもしくはカバースリップ、スティック、ビーズもしくはマイクロビーズ、メンブレン(例えば試験ストリップで用いられるもの)、および、バイオセンサーの層が挙げられる。
【0061】
上記サンプルは、被検体からのサンプルなど、乳酸を含む疑いのあるサンプルであればどのようなサンプルでもよい。用語「被検体からのサンプル」は、あらゆる所定の被検体、具体的には人間から単離したあらゆる生体液、排泄物および組織を含む。本発明の文脈において、このようなサンプルとしては、これらに限定されないが、血液、血清、血漿、乳頭から吸引したもの、尿、精液、精液、精漿、前立腺液、排泄物、涙、唾液、汗、生検、腹水、髄液、乳汁、リンパ液、気管支などを洗浄した液のサンプル、または、組織抽出物サンプルが挙げられる。被検体は、好ましくは動物(人間を含む)、より好ましくは哺乳動物、さらにより好ましくは人間である。
【0062】
あるいは、乳酸を含む疑いのあるサンプルはまた、ヨーグルト、ケフィアまたは乳汁のような乳酸を含む食物または飲料サンプルであってもよく、加えて発酵または細胞培養培地であってもよい。
【0063】
典型的には、本発明の文脈における使用のためには、血液サンプルが好ましい試験サンプルである。これについて、血液は、通常ひじの内側または手の甲の静脈から採取される。具体的には、乳児または幼い子供の場合、皮膚を穿刺し出血させるために、ランセットと呼ばれるとがった用具が用いられる可能性がある。血液は、例えばピペットに回収してもよいし、または、スライドまたは試験ストリップ上に回収してもよい。
【0064】
接触させ乳酸を酸化させた後、乳酸の存在下で変異型乳酸オキシダーゼによって生産されたピルビン酸塩および/またはH2O2、および/または、乳酸の存在下で変異型乳酸オキシダーゼによって消費されたO2が存在する場合、それらが測定され、それによってサンプル中の乳酸が測定される。変異型乳酸オキシダーゼによって生産されたピルビン酸塩およびH2O2の量、および、変異型乳酸オキシダーゼによって消費されたO2の量は、サンプル中に存在する乳酸の量と明確な相関がある。
【0065】
ピルビン酸塩、H2O2および/またはO2を測定する様々な方法が当業界でよく知られており、それらのどれを用いてもよい。
ピルビン酸塩を測定する典型的な方法としては、比色法(例えば、340nmで乳酸デヒドロゲナーゼが介在するNADH/NAD+変換を測定することによる方法)、ガスクロマトグラフィー法、HPLC解析などが挙げられる。また、乳酸デヒドロゲナーゼとカルボキシル基を除去するピルビン酸オキシダーゼを含む方法が当業者によく知られている。
【0066】
H2O2を検出するための既知の方法としては、例えばH2O2が介在するCrO3のCrO(O2)2への変換を分析する典型的な方法、ヨウ化物とデンプンを用いる方法、光測定による分析法(以下も参照)、光学的な方法(任意に、しばしばホースラディッシュペルオキシダーゼが媒介する色素の酸化を利用してキュベット中またはセンサーを用いて行われる)、蛍光による方法、例えばH2O2によるペルオキシダーゼが介在する10−アセチル−3,7−ジヒドロキシフェノキサジンのレソルフィンへの酸化(590nmで読み取り)、発光測定法(例えばルミノールの化学発行を利用)、および、例えばH2O2による作用電極(例えばAgAgClに対して650mVにおける白金電極)の陽極酸化に基づく電流滴定法(ここでその結果得られた電流がH2O2の量を示す)が挙げられる。本発明の好ましい方法において、H2O2の測定にペルオキシダーゼという酵素が用いられる可能性がある。
【0067】
H2O2を測定する特に適切な方法を以下で説明する:H2O2を測定するために、ペルオキシダーゼ酵素が用いられる可能性がある。ペルオキシダーゼは、H2O2を使用した場合、有色の色素を生成させるのに特に有用である。この反応は、以下に示す通りである:
H2O2+Hドナー+クロモゲン前駆体→クロモゲン+2H2O
生じた色の強度は、L−乳酸濃度に直接的に比例し、吸光度の増加を測定することによって確認することができる。
【0068】
適切なクロモゲン前駆体(および読み出しに適切な波長)としては、
・ABTS:2,2’−アジノ−ジ−[3−エチルベンズチアゾリンスルホン酸塩(6)](410nmで読み出し)
・4−APP:4−アミノアンチピリン(510nmで読み出し)
・TMB:3,3’,5,5’−テトラメチルベンジジン(450nmで読み出し)、
が挙げられる。
【0069】
クロモゲン前駆体などの様々なペルオキシダーゼ基質は、例えばシグマ−アルドリッチ(Sigma-Aldrich, 米国ミズーリ州セントルイス)から市販されている。
ペルオキシダーゼのための多くの適切な発色性基質および発酵性基質があるが、蛍光性ペルオキシダーゼ基質が用いられることはほとんどない。ジヒドロフルオレセイン(また、フルオレセインとしても知られている)、ジヒドロローダミンおよびジヒドロエチジウム(ヒドロエチジン)のような蛍光性ペルオキシダーゼ基質は、酵素と過酸化水素の存在下で蛍光生成物に変換される。安定で高感度の蛍光発生基質の例は、10−アセチル−3,7−ジヒドロキシフェノキサジン(ADHP)である。
【0070】
このようなペルオキシダーゼは、H2O2の存在に応じてクロモゲン前駆体をクロモゲンに変換することができるあらゆるペルオキシダーゼであり得る。よく用いられるペルオキシダーゼは、ホースラディッシュペルオキシダーゼである。
【0071】
O2を測定する典型的な方法としては、ガスクロマトグラフィー、電流滴定法、例えばクラーク電極を用いた方法、または、蛍光による方法、例えばO2によって引き起こされる特定の色素の蛍光の消滅を利用した方法が挙げられる。O2の測定は、酸素オプトードを利用するものでもよい。オプトードまたはオプトロードは、一般的に化学的なトランスデューサーを用いて特定の物質(例えばO2)を光学的に測定する光学センサーデバイスである。
【0072】
乳酸オキシダーゼにより乳酸を酸化させるために、O2の代わりに媒介物質が用いられる可能性がある。そのような場合、O2ではなく媒介物質の濃度が測定されることがある。これは、試験ストリップにとって周囲環境にある酸素の影響を排除するためによく行われることである。
【0073】
本発明の方法によれば、乳酸は、乳酸の存在下で変異型乳酸オキシダーゼによって生産されたピルビン酸塩および/またはH2O2、および/または、乳酸の存在下で変異型乳酸オキシダーゼによって消費されたO2を測定することによって確認される。本方法は、変異型乳酸オキシダーゼによって生産されたピルビン酸塩および/またはH2O2の量が、サンプル中の乳酸の量に直接的に比例し、消費されたO2の量が、サンプル中の乳酸の量に相互に比例するように設計されている。従って、サンプル中の乳酸の量は、生産されたピルビン酸塩および/またはH2O2の量、および/または、消費されたO2の量から(例えば計算によって)導き出すことができる。このような計算の典型的な方法としては、標準曲線、較正などが挙げられる。
【0074】
本方法は、例えば診断分析として用いることができる。上記で詳細に述べたように、乳酸レベルの変化は、乳酸アシドーシス、すなわち乳酸/乳酸の蓄積に関連する可能性がある。乳酸レベルがコントロールまたは参照と比べて変化する場合、これは、例えば運動および/または病気による乳酸アシドーシスを示す可能性がある。
【0075】
診断方法において、測定されたサンプルの乳酸値は、参照値と比較してもよい。このような参照値は、健康な被検体からのサンプルであってもよいし、または、健康な被検体のグループから確認してもよい。あるいは、参照値は、既知の参照値であってもよい。ヒト血液サンプルおよびヒト血漿サンプルの場合、それぞれ0.5〜2.2mmol/L(好ましくは1.0〜1.8mmol/l)、および、0.9〜1.7mmol/Lの範囲の乳酸濃度が、一般的に正常とみなされる。トレーニングをモニタリングするために乳酸濃度測定を利用する場合、持久性トレーニング中の血中の乳酸濃度は、3〜4mmol/Lまでと予想される。より長時間のトレーニングセッション(45分より長い)中は、乳酸濃度は低ければ低いほど好ましい(約2mmol/L、または、2mmol/L未満)。持久性トレーニング中は、4mmol/Lより高い乳酸濃度は回避されるべきである。
【0076】
2つの値が互いに有意に異なるかどうかを評価するための当業者によく知られている統計手法としては、例えばスチューデントのt検定、または、χ2検定が挙げられる。さらに、当業者は、適切なコントロールをどのようにして選択するかについてよく知っている。
【0077】
本方法は、いわゆる液体または湿式試験(例えばキュベット中)で行ってもよいし、または、適切な試薬キャリアー上でいわゆる乾式試験として行ってもよく、このような場合、必要な試験試薬は固形キャリアー(好ましくは吸収性または膨潤性材料)中またはその上に存在する。
【0078】
好ましい実施態様において、H2O2の測定は、クロモゲンへの変換によって行ってもよく、具体的には、上述したようにペルオキシダーゼが介在する変換によるクロモゲンへの変換によって行ってもよい。
【0079】
その代わりに、またはそれに加えて、変異型乳酸オキシダーゼは、センサー、試験ストリップ、試験素子、試験ストリップ装置、または、液体試験の一部であってもよい。
センサーは、物理的/化学的な量を測定し、それを、オブザーバーまたは機器によって読取ることができるシグナルに変換するものである。本発明において、変異型乳酸オキシダーゼはセンサーの一部であってよく、ここでこのようなセンサーは、乳酸を、例えば例えばディスプレイまたはモニター上に表示された色または値の変化のようなシグナルに変換する。
【0080】
一実施態様において、乳酸センサーは、変異型乳酸オキシダーゼ、および、サンプルの過酸化水素を測定するための電流滴定装置で構成されていてもよい。また、サンプルまたは被検体中の乳酸を連続的にモニタリングするための、電気化学的なフローセルとカップリングされた微小透析システムを利用してもよい。フローセルの作用電極は、電極表面上の酸化還元ポリマーフィルムに固定された変異型乳酸オキシダーゼを用いて製造することができる。電気化学的な乳酸センサーを、微小透析と直接カップリングすることによって、サンプルアリコートを、カラム後にオキシダーゼ酵素反応器を備えた液体クロマトグラフィーシステムに移す必要がなくなる。微小透析プローブからの透析物中の乳酸は、その他の酸化可能な化学種からの有意な干渉をまったく受けずに酵素電極で選択的に検出することができる。さらに、当業界において酵素とカップリングされたバイオセンサーはすでに説明されている。それによれば、変異型乳酸オキシダーゼは、過酸化水素を電気化学的に検出するために、表面にカップリングしてもよい(例えば、変移型乳酸オキシダーゼ/グラファイト混合物を電気めっきしたグラファイトパッドにプリンティングすることによって、または、変異型乳酸オキシダーゼを炭素粒子、白金めっきした炭素粒子、炭素/二酸化マンガン粒子、ガラス状炭素に吸着または固定すること、または、それを炭素ペースト電極等と混合することによって)。
【0081】
試験ストリップまたは試験素子は、サンプル内の標的物質の存在および/または量を測定するのに用いられる分析装置または診断装置である。標準的な試験ストリップは、1つまたはそれより多くの異なる反応ゾーンまたはパッドを含んでもよく、これらのゾーンまたはパッドには、(例えばサンプル中に浸し、続いてそれから取り出すことによって)サンプルと接触させると反応する(例えば色を変化させる)試薬が含まれる。例えば欧州特許第262445号および米国特許第4816224号に記載された多くの実施態様において、試験ストリップはよく用いられている。試験ストリップ技術に基づく乳酸試験の市販品の例は、ロシュ・ダイアグノスティックス(Roche Diagnostics, ドイツ国マンハイム)のアキュトレンドメーター(Accutrend meter)で用いられるBM乳酸テスト(BM Lactate test)である。一般的によく知られているのは、このような測定法を実行するのに必要な1種またはそれより多くの試薬(例えば酵素)が固形キャリアー層上に、または、固形キャリアー層中に存在するものである。キャリアー層として、特に好ましくは、解析しようとするサンプルの液体で湿潤した吸収性および/または膨潤性材料である。このような材料としては、例えばゼラチン、セルロース、および、合成繊維のフリースの層が挙げられる。
【0082】
また変異型乳酸オキシダーゼも、液体試験の一部であってもよい。液体試験は、試験の構成要素が液状媒体中で反応する試験である。液体の乳酸試験の市販品の例は、ロシュ・ダイアグノスティックス(ドイツ国マンハイム)のコバス(cobas)c111装置のための乳酸試験である。通常、実験室での分析の分野において、液体試薬は、含まれる酵素の活性を提供するために、例えば緩衝化された塩溶液などの水をベースとしている。このような液体は、通常、特定の目的とする使用に応じて調製される。液体試験を行うために、全ての試験の構成要素を液体中に溶解させて一体化する(またはその逆も同様)。このような試験を行うための典型的な容器としては、バイアル、マルチウェルプレート、キュベット、うつわ、試薬カップ、チューブなどが挙げられる。
【0083】
本発明の一実施態様において、本発明の変異型乳酸オキシダーゼは、固定されていてもよい。典型的な固定方法としては、例えばメンブレンへの共有結合、ポリマー中への封入、支持マトリックスへの架橋、または、ゾル−ゲルマトリックス(例えばケイ酸塩ガラスのようなガラス)への固定、または、多孔質基質上への吸着が挙げられる。乳酸オキシダーゼのような酵素を固定するのに適した方法は当業界でよく知られている(例えばLillis et al., 2000, Sensors and Actuators B 68: 109-114を参照)。
【0084】
本発明のその他の形態は、乳酸を測定するための本発明の変異型乳酸オキシダーゼの使用に関する。乳酸を測定するための本発明の変異型乳酸オキシダーゼの使用を含む適切な方法は、上記で説明した通りである。
【0085】
その他の形態において、本発明は、サンプル中の乳酸を測定するための装置を提供するものであり、ここで本装置は、本発明に係る変異型乳酸オキシダーゼ、および、任意に追加の構成要素、例えば前記測定に必要なその他の試薬を含む。
【0086】
本発明の変異型乳酸オキシダーゼは、サンプル中の乳酸を測定するための装置の一部であってもよい。このような装置は、この目的のために適していればどのような装置でもよい。このような装置は、乳酸を測定するのに用いることができる機械または用具であり得る。このような装置は、好ましくはセンサーであり、好ましくは電気化学的なセンサーまたは試験ストリップである。典型的な装置は、上記および下記で説明される。
【0087】
このような装置は、センサー、例えばバイオセンサーであってもよく、このようなセンサーは、生物学的な構成要素(ここでは本発明に係る変異型乳酸オキシダーゼ)と検出器の構成要素、具体的には物理化学的な検出要素とが一緒になった分析物を検出するための分析装置である。
【0088】
バイオセンサーは、生体サンプル由来の、具体的には血液由来の様々な分析物(乳酸を含む)の濃度を測定するのに特に有用である。電気化学的な試験ストリップ様式をベースとした典型的なバイオセンサーが、米国特許第5,413,690号;5,762,770号、および、5,997,817号で説明されている。
【0089】
本発明の(バイオ)センサーにおいて、変異型乳酸オキシダーゼの存在下で乳酸およびO2がピルビン酸塩およびH2O2に変換されたら、生成物のどれかの増加または基質のどれかの減少をトランスデューサーまたは検出素子によってモニターすることができる。
【0090】
具体的には、乳酸センサーは、例えばグルコース、コレステロール、トリグリセリド、尿素、血液ガスまたは電解質などを測定するためのその他のセンサーと組み合わされる。本発明の変異型乳酸オキシダーゼは、このようなマルチ分析装置でも利用できることは明らかである。
【0091】
上記で詳細に述べたように、本センサーは、好ましくは電気化学的なセンサーである。電気化学的なセンサーは、化学シグナル(ここでは乳酸の存在)の電気信号(例えば電流)への翻訳に基づく。適切な電極は、乳酸オキシダーゼが介在する過酸化水素形成を電気信号として測定することができる。このようなシグナルは、過酸化水素から電極へのエレクトロンの移動の後に生産され、適切な条件下では、酵素触媒による電流は乳酸濃度に比例する。
【0092】
乳酸バイオセンサーのその他の市販品の例は、ロシュ・ダイアグノスティックス(ドイツ国マンハイム)のコバス(cobas)b123解析装置の多目的の乳酸センサーである。バイオセンサーを多目的で使用するためのバイオセンサーの2つの主要なグループが商品化されており、一つはメンブレンベースのセンサー(例えば、YSI、エッペンドルフ(Eppendorf)、ノヴァ・バイオケミカル(Nova Biomedical)、および、レディオメーター(Radiometer)製)であり、もう一つはバイエル(Bayer)またはロシュ製の厚膜バイオセンサーである。
【0093】
本発明の一実施態様において、本センサーは、電気非導電性の基質、作用電極、および、乳酸および酸素が電極を通過できるようにする作用電極を覆う半透膜を含む電気化学的なセンサーを提供する。作用電極は、基質の一部に付着した導電性材料、および、触媒活性を示す量の乳酸オキシダーゼを含む。このようなセンサーはさらに、非導電性基質の第二の部分に付着した第二の導電性材料を有する対電極を含んでいてもよい。半透膜は、酢酸セルロース、ポリウレタン、シリコーン化合物、および当業界でよく知られているその他の材料から形成することができる。本発明のその他の実施態様において、電気化学的なセンサーはさらに、参照電極を含んでいてもよい。
【0094】
その他の典型的な電気化学的なセンサーにおいて、変異型乳酸オキシダーゼは、酵素層中に(例えば自己架橋を形成するアクリレートポリマーを介して)固定される。化学シグナルの電子シグナルへの翻訳は、H2O2に反応性を有する二酸化マンガン層によって達成される。さらなる構成要素は、作用電極に加えて、参照電極である。典型的なセンサーはまた、Schaffar et al., 1999, Clinical Chemistry 45(9): 1678-1679でも説明されている。
【0095】
本発明の装置は、変異型乳酸オキシダーゼに加えて、1種またはそれより多くの追加の構成要素を含んでもよく、このような構成要素としては、例えば、前記測定に必要な、または、前記測定において有用なその他の試薬が挙げられる。このような構成要素は、本発明の方法および装置に関して説明されているもののいずれかであってもよい。加えて、このような構成要素としては、取扱説明書、ランセット装置、キャピラリーピペット、追加の酵素(例えばペルオキシダーゼ)、基質(例えばクロモゲン前駆体)、および/または、乳酸コントロール溶液などが挙げられる。
【0096】
さらにその他の形態において、本発明は、本発明に係る変異型乳酸オキシダーゼ、および、少なくとも1種の前記測定に必要な追加の物質を含む、乳酸を測定するためのキットを提供する。
【0097】
便宜上、本発明に係る変異型乳酸オキシダーゼは、キット中に供給されていてもよく、例えば、(診断)分析を行うために説明書で予め決められた量でパッケージ化された試薬の組み合わせ中に供給されていてもよい。必要に応じて、本キットは、基質、発色団の前駆体、追加の酵素(例えばペルオキシダーゼ)、および、酵素に必要な補因子を含むと予想される。本キット中のその他の添加剤が含まれていてもよく、このような添加剤としては、例えば安定剤、緩衝液(例えば、ブロッキング緩衝液、溶解緩衝液、または、希釈用緩衝液)などが挙げられる。本キット中に供給される様々な試薬の相対量は広範囲に様々であってよく、例えば、試薬溶液中の濃度が実質的に分析感度を最適化するような濃度になるような相対量である。このような試薬は、好ましくは乾燥粉末としてで提供されてもよく、このような乾燥粉末は、一般的には、凍結乾燥した状態であり、例えば賦形剤を含み、溶解時に適切な濃度を有する試薬溶液が提供されるようなものである。
【0098】
本発明は、本明細書において説明された特定の方法論、手順および試薬に限定されることはなく、それらは様々に変更することが可能である。さらに、本明細書において用いられる用語は、単に具体的な実施態様を説明するためだけのものであり、発明の範囲を限定することは目的としない。本明細書および添付の請求項で用いられるように、単数形を示す「a」、「an」および「the」は、文章中に明らかな他の指示がない限り、その対象物が複数である場合も包含する。加えて、「〜を含む(comprise)」、「〜を含む(contain)」および「〜を包含する(encompass)」という文言は、排他的ではなく包括的な意味で解釈されることとする。
【0099】
特に他の指定がない限り、本明細書において用いられる全ての専門用語や科学用語とあらゆる頭字語は、発明の分野における当業者によって一般的に理解されている意味と同じ意味を有する。好ましい方法および材料が本明細書において説明されているが、本発明の実施において、本明細書において説明される方法および材料と類似した、または、それらと同等であるあらゆる方法および材料が用いられる可能性がある。
【0100】
以下の図面および実施例は、本発明の様々な実施態様を説明することを目的とする。そのようなものとして、考察された特定の改変は、本発明の範囲を限定するものとして解釈されないこととする。当業者であれば当然のことながら、本発明の範囲から逸脱することなく様々な等価体、変化および改変を作製することができ、従って、このような等価な実施態様は本明細書に包含され得るものとして理解される。
【図面の簡単な説明】
【0101】
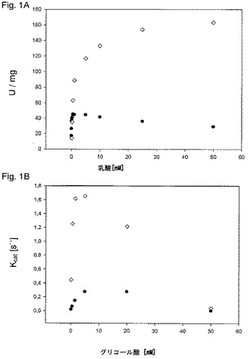
【図1】図1Aは、野生型乳酸オキシダーゼ(◇)および変異体Tyr191Phe(●)の反応速度論による特徴付けを示す。この実験は、実施例1で説明されている通りに行われた。図1Bは、野生型乳酸オキシダーゼ(◇)および変異体Ala95Gly(●)の反応速度論による特徴付けを示す。この実験は、実施例2で説明されている通りに行われた。
【図2】図2は、LOD野生型(◆)、Tyr191Phe(■)およびTry191Leu(▲)の安定性の分析を示す。これらの活性は、開始時の値に正規化された。測定された半減期の値は以下に示す通りである:野生型:4.5日;Tyr191Phe:9.8日、および、Try191Leu:7.4日。
【発明を実施するための形態】
【0102】
〔実施例〕
実施例1: 安定性が高められた乳酸オキシダーゼ
1.材料および方法
遺伝学
野生型乳酸オキシダーゼ(配列番号1で示される)を含むプラスミドを出発原料として用いた。このプラスミドは、tacプロモーターを有するp−LO1プラスミドである。従って、タンパク質発現は、IPTG(イソプロピルβ−D−1−チオガラクトピラノシド)より誘導することができる。さらにこのプラスミドはアンピシリン耐性遺伝子を有する。
【0103】
191位におけるアミノ酸のチロシンをフェニルアラニンで置換するために、以下のプライマーを用いた:
【0104】
【化3】

【0105】
191位におけるアミノ酸のチロシンをロイシンで置換するために、以下のプライマーを用いた:
【0106】
【化4】

【0107】
改変された核酸塩基は太字で示した。置換されたアミノ酸をコードするコドンはアンダーラインで示し、制限酵素PvuIの認識配列はイタリックフォントで示した。2工程PCRを、Wangおよび共著者によって公開されたプロトコール(Wang et al., Biotechniques, 1999, 26, 680-682)に従って行った。その後、PCR産物を37℃でDpnIと共に30分間インキュベートし、続いて大腸菌BL21ゴールド細胞に形質転換した。これらの細胞をLBアンピシリンプレート上に面線接種し、次の日それからプラスミドDNAを単離した。プラスミドをPvuI切断に基づく分析を用いて選択し、その後配列解析によって変異を確認した。
【0108】
培養および精製
上述した細胞をアンピシリン(100mg/l)を含むLB培地で30℃で培養し、595nmで0.8の光学密度に達したらIPTG(250μM)で発現を誘導した。30℃で4時間発現させた後、細胞を回収し、50mMのリン酸カリウム緩衝液(pH7.0;KPPと称される)に再懸濁し、フレンチプレスを用いて分離させた。超遠心分離法で細胞の死細胞片を除去し、タンパク質精製のために粗抽出物を用いた。
【0109】
そのために、1.5Mの(NH4)2SO4と共に撹拌しながら大腸菌のタンパク質の一部を沈殿させた。上清を、ハイトラップ・フェニル・FF(HiTrap Phenyl FF)疎水性相互作用クロマトグラフィー(HEC)カラム(内径:16mm;体積:64ml;タンパク質:30mg)に移した。その後、50mMのKPP(pH7.0)、1.5Mの(NH4)2SO4(緩衝液A)から50mMのKPP(pH7.0)(緩衝液B)への濃度勾配を用いて乳酸オキシダーゼを溶出させた(流速2.5ml/分)。緩衝液Bが70%の時点で乳酸オキシダーゼのピークを確認することができた。緩衝液を緩衝液Bに交換した後、10mgのタンパク質を陰イオン交換カラム(MonoQ)(内径:5mm;カラム体積:5ml)に移した。1MのKClを含む緩衝液B(緩衝液C)を用いて1.5ml/分の流速で段階的に溶出を行った。緩衝液Cが28%の時点で乳酸オキシダーゼが溶出した。緩衝液を緩衝液Bに交換した後、100μlのアリコートを採取し、凍結させた。
【0110】
活性の測定
シグマ・アルドリッチのプロトコールを用いて活性を測定し、ここで安定性評価のためにL−乳酸ストック溶液の濃度10〜50mMに下げ、反応液の体積を半分に減らした。
【0111】
シグマ・アルドリッチのプロトコールは、以下に示す通りである:
H2O2の存在下で、アミノアンチピリン(4−AAP)とN,N−ジメチルアニリン(DMA)との反応をペルオキシダーゼに触媒させ、キノンジイミン色素を得た。この試験は以下の条件:T=37℃、pH=6.5、A565nm、光路=1cmで行われ、以下の試薬が使用された:
A.37℃でpH6.5の200mMの3,3−ジメチルグルタル酸−NaOH緩衝液(DMGA)(シグマの商品番号D−4379の3,3−ジメチルグルタル酸を用いて脱イオン水で5mlに調製した。37℃でpHを1MのNaOHで6.5に調節)。
【0112】
B.15mMの4−アミノアンチピリン溶液(4−AAP)(シグマの商品番号A−4382の4−アミノアンチピリンの遊離塩基を用いて脱イオン水で1mlに調製した)。
C.500mMのL(+)乳酸溶液、37℃でpH6.5(乳酸)(シグマの商品番号L−1750のL(+)乳酸の遊離酸を用いて脱イオン水で1mlに調製した。1MのNaOHでpHを6.5に調節した)。
【0113】
D.ペルオキシダーゼ酵素溶液(POD)(使用直前に、冷たい脱イオン水中にシグマの商品番号P−8250のホースラディッシュ由来II型ペルオキシダーゼを50プルプロガリン単位/mlを含む溶液を調製した)。
【0114】
E.pH7.037℃で、0.010mMのフラビンアデニンジヌクレオチド(FAD)を含む10mMのリン酸カリウム緩衝液(酵素希釈剤)(シグマの商品番号P−5379のリン酸カリウムの一塩基性の無水物、および、シグマの商品番号F−6625のフラビンアデニンジヌクレオチド二ナトリウム塩を用いて、脱イオン水で50mlに調製した。37℃でpHを1MのNaOHで7.0に調節した。これを新しく調製した)。
【0115】
F.0.2%(体積/体積)N,N−ジメチルアニリン溶液(DMA)(シグマの商品番号D−8509のN,N−ジメチルアニリンを用いて、脱イオン水で10mlに調製した)。
【0116】
G.0.25%(質量/体積)ドデシルベンゼンスルホン酸溶液(DBS)(シグマの商品番号D−2525のドデシルベンゼンスルホン酸のナトリウム塩を用いて脱イオン水で5mlに製造した)。
【0117】
H.乳酸オキシダーゼ酵素溶液(LOX)(使用直前に、冷たい試薬E中に0.1〜0.2単位/mlの乳酸オキシダーゼを含む溶液を調製した)。
分析手順は、以下に示す通りである:
以下の試薬を適切な容器に(ミリリットルレベルで)ピペッティングすることによって反応カクテルを調製した:試薬A(DMGA)2.00、試薬D(POD)1.00、試薬B(4−AAP)1.00、試薬C(乳酸)1.00、脱イオン水3.00。転置することによって混合し、37℃で平衡化した。以下の試薬を適切なキュベットに(ミリリットル単位で)ピペッティングした:反応カクテル0.80、試薬G(DMA)0.20。転置することによって混合し、および、37℃で平衡化した。続いて、試験サンプルには試薬I(LOX)0.020、または、ブランクには試薬E(酵素希釈剤)を添加した。即座に転置することによって混合し、37℃で正確に10分間インキュベートした。続いて、試薬H(DBS)2.00を添加した。転置することによって混合し、適切な分光光度計を用いて、試験とブランクの両方についてA565nmを記録した。
【0118】
以下のようにして活性(U/mg酵素)を計算した:
【0119】
【数1】

【0120】
式中、
3.02=分析物の総体積
df=希釈係数
35.33=565nmにおけるキノンジイミン色素吸光係数(ミリモル)
0.5=1モルのH2O2が2分の1モルのキノンジイミン色素を生産することにに基づく換算係数
10=1単位ごとの分析時間(分)
0.02=用いられる酵素の体積(ミリリットル単位)
1.02mlの反応混合物において、それぞれの最終濃度は、以下に示す通りである:39mMの3,3−ジメチルグルタル酸、5単位のペルオキシダーゼ、1.5mMの4−アミノアンチピリン、49mMのL(+)乳酸、0.04%(体積/体積)、N,N−ジメチルアニリン、0.20mMのリン酸カリウム、0.20μmのFAD、および、0.002〜0.004単位の乳酸オキシダーゼ。
【0121】
1単位は、pH6.5で、37℃で、1.0μモルのL−乳酸をピルビン酸塩およびH2O2に酸化させる1分あたりの量と予想される。
得られたデータを以下の方程式に従ってフィッティングした:
基質阻害なし: v=vmax*[S]/(Km+[S])(方程式1)
基質阻害あり: v=vmax*[S]/(Km+[S]×(1+[S]/[I]))(方程式2)
ここでvは反応速度であり、vmaxは、最大速度であり、[S]は、基質濃度であり、Kmは、ミカエリス定数であり、[I]は、阻害剤濃度である。
【0122】
安定性の測定
不活性化をより詳細に調べるために、以下の条件:20mMのHEPES(pH8.1)、150mMのNaCl、20mMのNaHCO3、および、0.05mg/ml乳酸オキシダーゼを用いて安定性向上の測定を行った。活性を測定する前に、サンプルを遠心分離し、37℃でインキュベートした。
【0123】
2.結果
191位でチロシンがフェニルアラニンで置換された(Tyr191Pheと称される)またはロイシンで置換された(Try191Leuと称される)変異型乳酸オキシダーゼを発現させ、上述したように精製した。SDSゲルクロマトグラフィーを用いて純度を確認した。
【0124】
Tyr191Pheの場合、変異体の特異的な活性は23U/mgと測定された。野生型と比較すると、活性は8分の1に減少した。変異体Tyr191Pheの場合、ミカエリス定数または親和定数Kmは0.017mMであり、これは、野生型の値(0.897mM)よりも有意に低かった。さらにこのような変異体はまた、有意な基質阻害も示した(図1で示されるように、野生型と比較してIは48.4mMであった)。
【0125】
サンプルを定期的に採取し、サンプルの活性を測定することによって、変異体Tyr191Pheの安定性を3週間にわたり測定した。結果をt=0に合わせて正規化した。不活性化をより詳細に調べるために、周囲条件の変化により不活性化を促進することによって安定性向上の測定(上述した通り)を行った。選択された条件で、野生型(コントロール)は4.5日の半減期を有していた。それに対して、変異体Tyr191Pheは、これらの条件下でそれよりも有意に高い安定性を示し、9.8日後にもとの活性の50%になったが、これは、安定性の2.2倍の増加と同等である。
【0126】
Try191Leuの場合、変異体の特異的な活性は16U/mgと測定された。野生型と比較すると、活性は12分の1に減少した。変異体Try191Leuの場合、ミカエリス定数または親和定数Kmは1.065mMであり、これは、野生型(0.897mM)の値とほぼ同じであった。このような変異体Try191Leuは、有意な基質阻害を示さなかった。
【0127】
サンプルを定期的に採取し、サンプルの活性を測定することによって、変異体Try191Leuの安定性を3週間にわたり測定した。結果をt=0に合わせて正規化した。不活性化をより詳細に調べるために、周囲条件の変化により不活性化を促進することによって安定性向上の測定(上述した通り)を行った。選択された条件で、野生型(コントロール)は3.8日の半減期を有していた。それに対して、変異体Try191Leuは、これらの条件下でそれよりも有意に高い安定性を示し、7.4日後にもとの活性の50%になったが、これは、安定性の1.6倍の増加と同等である。
【0128】
変異体Tyr191PheおよびTry191Leuは、野生型と比較して安定性を有意に改善することから、センサーおよび試験の寿命を格段に延長することができると結論付けられる。
【0129】
実施例2:選択性が改善された乳酸オキシダーゼ
1.材料および方法
遺伝学
実施例1で説明されているような野生型乳酸オキシダーゼを含むプラスミドを出発原料として用いた。
【0130】
95位におけるアミノ酸のアラニンをグリシンで置換するために、以下のプライマーを用いた:
【0131】
【化5】

【0132】
改変された核酸塩基は太字で示した。置換されたアミノ酸をコードするコドンはアンダーラインで示し、制限酵素NcoIの認識配列はイタリックフォントで示した。2工程PCRを、Wangおよび共著者によって公開されたプロトコールに従って行った(上記のWang et al)。その後、PCR産物を37℃でDpnIと共に30分間インキュベートし、続いて大腸菌BL21ゴールド細胞に形質転換した。これらの細胞をLBアンピシリンプレート上に面線接種し、次の日それからプラスミドDNAを単離した。プラスミドをNcoI切断に基づく分析を用いて選択し、その後配列解析によって変異を確認した。
【0133】
培養および精製
上述した細胞をアンピシリン(100mg/l)を含むLB培地で30℃で培養し、595nmで0.8の光学密度に達したらIPTG(250μM)で発現を誘導した。30℃で4時間発現させた後、細胞を回収し、50mMのリン酸カリウム緩衝液(pH7.0;KPPと称される)に再懸濁し、フレンチプレスを用いて分離させた。超遠心分離法で細胞の死細胞片を除去し、タンパク質精製のために粗抽出物を用いた。
【0134】
そのために、1.5Mの(NH4)2SO4と共に氷上で撹拌しながら大腸菌のタンパク質の一部を沈殿させた。上清を、ハイトラップ・フェニル・FF疎水性相互作用クロマトグラフィー(HIC)カラム(内径:16mm;体積:64ml;タンパク質:30mg)に移した。その後、50mMのKPP(pH7.0)、1.5Mの(NH4)2SO4(緩衝液A)から50mMのKPP(pH7.0)(緩衝液B)への濃度勾配を用いて乳酸オキシダーゼを溶出させた(流速2.5ml/分)。緩衝液Bが70%の時点で乳酸オキシダーゼのピークを確認することができた。緩衝液を緩衝液Bに交換した後、10mgのタンパク質を陰イオン交換カラム(MonoQ)(内径:5mm;カラム体積:5ml)に移した。1MのKClを含む緩衝液B(緩衝液C)を用いて1.5ml/分の流速で段階的に溶出を行った。緩衝液Cが28%の時点で乳酸オキシダーゼが溶出した。緩衝液を緩衝液Bに交換した後、100μlのアリコートを採取し、凍結させた。
【0135】
活性の測定
シグマ・アルドリッチのプロトコールを用いて37℃で活性を測定した(実施例1を参照)。
【0136】
式:Rsel=[(Kcat,lac/Km,lac)/(Kcat,glyc/Km,glyc)]により、グリコール酸塩(glyc)に対する乳酸(lac)に関するそれぞれの触媒効率Kcat/Kmの比率を決定することによってL−乳酸に対する選択性(Rsel)を計算した。上記式中、Kcat(回転数)は、単位時間あたり酵素が生成物に変換することができる基質分子の最大数である。得られたデータを以下の方程式に従ってフィッティングした:
基質阻害なし:v=vmax*[S]/(Km+[S])(方程式1)
v=反応速度、vmax=最大速度、[S]=基質濃度、Km=ミカエリス定数。
【0137】
基質阻害を測定する際に、低い基質濃度における直線領域からのKcat/Km値を外挿した。
安定性の測定
不活性化をより詳細に調べるために、以下の条件:20mMのHEPES(pH8.1)、150mMのNaCl、20mMのNaHCO3、および、0.05mg/ml乳酸オキシダーゼを用いて安定性向上の測定を行った。活性を測定する前に、サンプルを遠心分離し、37℃でインキュベートした。
【0138】
2.結果
L−乳酸は、乳酸オキシダーゼの好ましい基質である。上記の精製プロトコールを用いて、44.5sec−1の活性が測定された。Km値は0.23mMと測定され、結果的に193.4sec−1mM−1の触媒効率が得られた。同じ条件下でグリコール酸塩の場合の触媒効率を測定した。高い基質阻害が観察されたことから、Kcat/Km(2.4sec−1mM−1)の測定には低い基質濃度における直線領域を用いた。上記の効率によれば、乳酸に対する選択性Rselは80.4であった。
【0139】
変異体Ala95Glyを上述のようにして製造し、均一になるまで精製した。これをSDSゲル電気泳動によって確認した。精製した酵素を野生型酵素として特徴付けた。乳酸に対するKm値(0.63mM)は野生型と比べて3倍増加し、その結果として、基質としての乳酸に対する活性が失われた(21.5sec−1)。より小さい基質のグリコール酸塩においても同様に強い基質阻害が示された。上記の方法を用いて、0.089sec−1mM−1の触媒効率Kcat/Kmが測定された。作用の組み合わせによって選択性の変更が起こり(触媒効率を比較することによって決定された)、これは、変異体Ala95Glyの場合、Rselは384であったことから決定することができる。選択性は、野生型と比較して4.8倍増加した(表1も参照)。
【0140】
【表2】

【0141】
野生型、加えて変異体Ala95Glyは、グリコール酸塩による基質阻害を示し(図2を参照)、それに対してL−乳酸は、これらの濃度(0〜50mM)において阻害をまったく示さなかった。また基質阻害は、予備的な測定で未精製の変異体Ala95Glyを用いた際に観察された有意に高い基質選択性を引き起こす可能性もある(データ示さず)。このような活性の測定は、強い阻害を伴う50mMの基質濃度で行われた。
【0142】
変異体の特徴付けが終わったら、その安定性も実施例1で説明されているようにして測定した。変異体Ala95Glyの安定性は、野生型(3.8日)と比較してわずかに低下した(2.3日)。
【0143】
まとめると、変異体Ala95Gly(これは、従来技術においてすでに知られている;Yorita et al., J. Biol. Chem., 1996, 45, 28300-28305を参照)において、L−乳酸に対する選択性はわずかに低下したが、乳酸に対する選択性は有意に改善されたことが示される。従って、変異Ala95Glyを有する変異体は、例えばバイオセンサーおよびインビトロでの試験における乳酸活性の測定で使用するための、興味深い候補である。
【技術分野】
【0001】
本発明は、安定性が高められた変異型乳酸オキシダーゼ、このような変異型乳酸オキシダーゼをコードする核酸、このような核酸を含む発現ベクター、このような核酸または発現ベクターを含む宿主細胞、サンプル中の乳酸(lactate)を測定する方法、乳酸を測定するためのこのような変異型乳酸オキシダーゼの使用、このような変異型乳酸オキシダーゼを用いたサンプル中の乳酸を測定するための装置、および、このような変異型乳酸オキシダーゼを含む乳酸を測定するためのキットに関する。
【背景技術】
【0002】
乳酸は、ミルクアシッド(milk acid)としても知られており、様々な生化学的なプロセスにおいて役割を果たす。乳酸は、C3H6O3という化学式で示されるアルファヒドロキシ酸である。乳酸は、溶液中ではイオンの形態で存在しており、すなわちCH3CH(OH)COO−で示される乳酸イオン(lactate)として存在している。乳酸はキラルであり、2種の光学異性体を有する。そのうち1種はL−(+)−乳酸または(S)−乳酸として知られており、他方は、D−(−)−乳酸または(R)−乳酸である。L−(+)−乳酸は生物学的に重要な異性体である。
【0003】
動物(人間も含む)において、L−乳酸は、正常な代謝および運動中に絶えず乳酸デヒドロゲナーゼ(LDH)という酵素を介してピルビン酸塩から生産される。通常、L−乳酸の濃度は、乳酸の生産速度が乳酸の除去速度を超えない限り増加することはなく、これは、モノカルボン酸輸送体、LDHの濃度および形態、ならびに組織の酸化許容量などの様々な要因によって支配されている。人間の場合、乳酸の血中濃度は、安静時で一般的に1〜2mmol/Lであるが、激しく活動している最中は20mmol/Lよりも高く上昇する可能性がある。
【0004】
乳酸濃度または乳酸のピルビン酸塩に対する比率は、酸化還元状態を反映している。それゆえに、乳酸レベルのモニタリングは、組織の酸素要求量と酸素利用とのバランスの優れた指標であり、これは、細胞および動物生理学の研究において有用である。従って、被検体または細胞の状態を研究またはモニターするために、例えば血清、血漿、血液、尿および唾液などの生体サンプル中の乳酸、または、細胞培養サンプル中の細胞内および細胞外の乳酸濃度がモニターされる可能性がある。
【0005】
血中の乳酸の測定は、競技スポーツ、フィットネスおよびリハビリにおいて頻繁に利用されており、それにより以下のことが可能になる:
・個人ごとの運動強度の評価、
・運動時と回復時の改善、
・過負荷やけがのリスクの減少。
【0006】
上記で詳述したように、特に長時間運動すると、嫌気的解糖によって血中の乳酸が著しく増加する。
医学分野では、乳酸の測定は、
・組織の低酸素状態を確認するため、
・乳酸レベルで反映される範囲で疾患および予後の重症度を確認するため、
に用いられる可能性がある。
【0007】
乳酸濃度は、例えば体が利用できる酸素量が減少し、乳酸の生産が増加したり、および/または、乳酸の排除が減少したりするようなあらゆる状態で、増加する可能性がある。これは、激しい運動による筋肉中での局所的な乳酸の増加から、生命を脅かすような全身性ショックまで様々であり得る。過量の乳酸は、様々な病気、感染、ならびに遺伝性の代謝およびミトコンドリアの異常において起こる可能性がある。高い血中の乳酸濃度の共通の原因は、ショック、肺炎およびうっ血性心不全のような状態の結果として起こる無酸素症である。また腎不全および白血病においては乳酸アシドーシスも起こる可能性がある。さらに、チアミン欠乏症および糖尿病性ケトアシドーシスも乳酸濃度の増加と関連がある。これらはまた、例えばメトホルミン(糖尿病で投与される)、および、イソニアジド(結核の治療のための)などのある種の薬物療法によって引き起こされる可能性もある。
【0008】
乳酸を測定するための試験は、当業界でよく知られている。近年、酵素的な乳酸濃度測定方法が開発されている。酵素的な方法は、測定方法において酵素の使用を含むものであり、一般的に簡単であり、より大きな特異性、精度および再現性を提供する。乳酸濃度測定について説明されている最初の酵素的な方法は、乳酸デヒドロゲナーゼによる乳酸からフェリシアン化カリウムへの水素の移動に基づくものであった。しかしながらこの手法は扱いにくく、広く受け入れられなかった。それに続く方法は、NADH形成のUV測定を含むものであった。1974年に、ピルビン酸の捕捉物質としてヒドラジンを用いて、乳酸デヒドロゲナーゼによって触媒された乳酸の酸化によって形成されたNADHを測定する乳酸測定法が説明されている。さらに、乳酸デヒドロゲナーゼの触媒作用に基づくその他の方法もあるが、この方法では、乳酸の変換によって形成されたピルビン酸塩をより迅速に除去するために反応混合物中にアラニントランスアミナーゼが含まれる。さらにその他の方法では、乳酸オキシダーゼを用いて乳酸をピルビン酸に変換するために酵素反応を使用する。続いてこの反応によって生産された過酸化水素は、有色色素を生成するための酵素反応に利用することができる。
【0009】
緑色アエロコッカス(Aerococcus viridans)由来の乳酸オキシダーゼは、例えば血中の乳酸を検出するためのバイオセンサーやインビトロでの試験で用いられることが多い。このようなバイオセンサーやインビトロでの試験は、主に例えば集中治療中の患者や運動選手のモニタリングに用いられる。このようなセンサーの寿命は、使用中や保存中に不活性化される乳酸オキシダーゼの安定性によって決定される。また、インビトロでの試験用の試薬の貯蔵期間と使用期間は、乳酸オキシダーゼの安定性の影響を受ける。それゆえに、バイオセンサーおよびインビトロでの試験の貯蔵期間と使用期間を延長するために乳酸オキシダーゼの安定性を高めることが、大きな関心を呼んでいる。従って、安定性が高められた乳酸オキシダーゼを提供することが、本発明の目的である。
【発明の概要】
【0010】
驚くべきことに、配列番号1で示される乳酸オキシダーゼのアミノ酸配列のの191位におけるチロシンの変異が、乳酸オキシダーゼの安定性を高めることが発見された。
センサーおよび試験の貯蔵期間と使用期間が限られているために、これらは、活性が技術上の許容レベルよりも低くなるため頻繁に交換しなればならなかった。センサーおよび試験装置の頻繁な交換は、消費者にとって使い勝手が悪く、資源の浪費であることは明らかであり、回避されるべきである。野生型乳酸オキシダーゼの安定性が低いために、乳酸オキシダーゼが関わる測定は通常、低温で行われる。乳酸オキシダーゼの安定性を高めることによるさらなる利点は、血液のガス分析(しばしば付随して行われる)は通常37℃で行われるために、血液解析のための装置内の乳酸測定の際に温度を25〜30℃に下げるためのサーモスタットを回避できるようになることであろう。従って、乳酸オキシダーゼがより安定になるために、装置の複雑さをかなり抑えられると思われる。これにより、例えばいわゆる新興成長市場においてとりわけ重要である低コストの装置の土台が提供されると思われる。
【0011】
従って、第一の形態において、本発明は、安定性が高められた変異型乳酸オキシダーゼを提供するものであり、本オキシダーゼは、以下のアミノ酸配列:
(i)配列番号1もしくは配列番号2のアミノ酸配列またはそれらの機能的に活性な変異体に少なくとも90%同一なアミノ酸配列;および、
(ii)配列番号1または配列番号2におけるTyr191の位置に相当する位置にアミノ酸置換を有するアミノ酸配列、
を含み、ここで機能的に活性な変異体は、配列番号1または配列番号2のGly36、Ala95、Thr103、Glu160、Val198、Asn212、Ala/Gly232およびPhe277からなる群より選択される位置に少なくとも1つの追加のアミノ酸置換を有する。
【0012】
一般的に、用語「乳酸オキシダーゼ」(国際生化学連合の酵素委員会によりEC1.1.3.15と分類されている)は、O2をH2O2に還元することによるL−乳酸のピルビン酸塩への酸化を触媒する酵素((S)−2−ヒドロキシ酸オキシダーゼ)を意味する。乳酸オキシダーゼは、FMN(フラビンモノヌクレオチド)依存性アルファヒドロキシ酸酸化酵素ファミリーのひとつである。これは、補因子としてフラビンモノヌクレオチド(FMN)を用いる。乳酸オキシダーゼ酵素は、ウイルスや細胞性生物でみられる。
【0013】
本発明によれば、このような変異型乳酸オキシダーゼは、191位に変異を有さない各乳酸オキシダーゼと比較して高い安定性を有する。驚くべきことに、191位における変異(ここでTyrは、その他のアミノ酸で置換されており、具体的には、非極性で、例えばフェニルアラニン、ロイシンおよびトリプトファンのようなやや大きい側基を有するアミノ酸で置換されている)は、野生型乳酸オキシダーゼに比べて、アルカリ性の環境下で酵素の安定性を高めることが見出された。特に培地の状態などの周囲条件に応じた酵素の安定性を研究するのに適した試験は、当業者によく知られている。適切で典型的な試験は以下の実施例でも説明されており、具体的には実施例1で説明されている。
【0014】
本発明の好ましい実施態様において、変異型乳酸オキシダーゼの、191位に変異を有さない各乳酸オキシダーゼと比べて高い安定性は、191位に変異を有さない各乳酸オキシダーゼの半減期(t1/2(野生型191))と比べた場合の、変異体(t1/2(変異型191))の半減期の増加として示される。このような酵素の半減期(t1/2)は、もとの活性(t=0の活性)の50%が失われ(また、さらなる説明として実施例1も参照)、その後に残った活性量が50%になる時間を示す。
【0015】
従って、高い安定性によって、191位に変異を有さない各乳酸オキシダーゼに比べて変異体の半減期は長くなる。半減期は、好ましくは少なくとも10%、20%、30%または40%、好ましくは少なくとも50%、75%または100%、さらにより好ましくは少なくとも125%、150%、175%または200%、特に250%、最も好ましくは300%長くなる。半減期の百分率で示される増加は、[t1/2(変異型191)/t1/2(野生型191)−1]×100で決定してもよい。
【0016】
本明細書で述べられている用語「配列番号1」は、配列番号1で示されるアミノ酸配列を意味しており、これは、カルボキシ末端が欠失しているがTyr191が変異していない緑色アエロコッカス由来の野生型乳酸オキシダーゼのアミノ酸配列を示す。緑色アエロコッカス由来の野生型乳酸オキシダーゼフラグメントは、276個のアミノ酸からなるタンパク質である。具体的に言えば、用語「配列番号1」は、以下に記載されるアミノ酸配列を意味する(上記で特定した置換部位は、アンダーラインで示され、さらに位置番号で特定されていることに留意されたい):
【0017】
【化1】

【0018】
本明細書で述べられている用語「配列番号2」は、配列番号2で示されるアミノ酸配列を意味しており、これは、Tyr191の変異を有さずカルボキシ末端の欠失がない緑色アエロコッカス由来の野生型乳酸オキシダーゼのアミノ酸配列を示す。全長の緑色アエロコッカス由来の野生型乳酸オキシダーゼは、374個のアミノ酸からなるタンパク質である。この配列は、UNIPROTデータベースからQ44467という受託番号で入手することもできる(上記で特定された置換部位は、アンダーラインで示され、さらに位置番号で特定されていることに留意されたい):
【0019】
【化2】

【0020】
配列番号1の配列と配列番号2の配列とは、それらの長さが異なるだけでなく、102位、163位、232位および255位のアミノ酸も異なることに留意されたい。本発明の文脈において、配列番号1または配列番号2からなるタンパク質は、緑色アエロコッカス由来の野生型乳酸オキシダーゼと称される。
【0021】
用語「変異型乳酸オキシダーゼ」は、アミノ酸配列が、緑色アエロコッカス由来乳酸オキシダーゼの野生型の配列(すなわち配列番号1または2)とは異なっている乳酸オキシダーゼを意味する。本発明の変異型乳酸オキシダーゼに関して、このような変異体は機能的に活性であることが知られている。これは、このような変異体は、その生物学的機能、すなわち乳酸オキシダーゼの酵素活性を維持していることを意味する。しかしながら、このような変異体の活性は、野生型に比べて減少したり、または、増加したりする可能性がある(実施例1も参照)。
【0022】
このような酵素の活性は、単位(U)で示される場合がある。1Uは、1分あたりの基質1マイクロモルの変換を触媒する酵素の量と定義される。その条件も、一般的に、37℃の温度およびpH値、および、最大の基質変換率が得られる基質濃度と定められる。当業者であれば当然のことながら、このような変異体は、最小の活性、好ましくは少なくとも5U/mg酵素の活性、より好ましくは20U/mg酵素の活性を維持していると予想される。
【0023】
好ましくは、生物学的機能の維持は、配列番号1または2で示される乳酸オキシダーゼの活性の少なくとも10%、20%、30%、または、特に50%、好ましくは少なくとも60%、より好ましくは少なくとも70%、80%または90%、さらにより好ましくは95%を有することと定義される。生物活性は当業者がよく知っているようにして測定してもよく、例えば実施例1および2で説明されているようにして測定してもよい。
【0024】
本発明に係る変異型乳酸オキシダーゼは特に、配列番号1または2におけるTyr191の位置に相当する位置にアミノ酸置換を有することを特徴とする。これは、配列番号1または2の191位におけるアミノ酸Tyrが、その他のアミノ酸で置換されていることを意味する。チロシン(または4−ヒドロキシフェニルアラニンとも称される)は、極性側基を有する。実施例において、Tyr191は、フェニルアラニンまたはロイシンで、すなわち非極性側基を有するアミノ酸で置換されている。フェニルアラニンとトリプトファン(これも非極性側鎖、疎水性側鎖、芳香族側鎖を有するアミノ酸である)との類似性、および、ロイシンとイソロイシンとの類似性のために、Tyr191をTrpまたはIleで置換しても、望ましい作用、すなわち安定性の増加をもたらすと結論付けられる。さらにこのことは、グリシン、アラニン、バリン、ロイシン、イソロイシン、プロリンおよびメチオニンのような非極性側基を有するその他のアミノ酸についても同じことが言える。なかでも特にイソロイシン、プロリンおよびメチオニンが、それらのサイズのために特に当てはまると予想される。
【0025】
用語「少なくとも90%同一な」または「少なくとも90%の配列同一性」は、本明細書で用いられる場合、本発明に係る変異型乳酸オキシダーゼの配列は、100個のアミノ酸からなるストレッチのうち少なくとも90個のアミノ酸残基が、それに対応する野生型の配列と同一であることを特徴とするアミノ酸配列を有することを意味する。本発明の好ましい実施態様において、このような変異体のアミノ酸配列は、配列番号1もしくは2のアミノ酸配列またはそれらの機能的に活性な変異体に少なくとも91%、92%、93%または94%同一であり、より好ましくは少なくとも95%または96%、さらにより好ましくは少なくとも97%または98%、特に99%同一である。本発明に係る配列同一性は、例えば、配列が比較できるような形態で配列を並べる方法によって確認することができる。配列を並べる方法は当業界公知であり、このような方法としては、例えば、例えばピアソン(Pearson)およびリップマン(Lipman)(“Improved tools for biological sequence comparison“, Proc Natl Acad Sci U S A. 1988 Apr;85(8):2444-8)で説明されている様々なプログラムおよびアライメントアルゴリズムが挙げられる。さらに、NCBIベーシック・ローカル・アライメント・サーチ・ツール(BLAST)が、いくつかの供給源から入手でき、このような供給源としては、国立バイオテクノロジー情報センター(NCBI, メリーランド州ベセスダ)が挙げられる。
【0026】
より好ましい実施態様において、このような変異体は、Tyr191の位置における変異以外において、さらに、任意にGly36、Ala95、Thr103、Glu160、Val198、Asn212、Ala/Gly232およびPhe277からなる群より選択される位置における少なくとも1つの追加のアミノ酸置換以外において、配列番号1または2で示される配列と100%同一である。最も好ましい実施態様において、このような変異体は、Tyr191の位置における変異(好ましくはTyr191PheまたはTyr191Leu)以外において、および、任意に追加で1つのAla95の位置におけるアミノ酸置換(好ましくはAla95Gly)以外において、配列番号1または2で示される配列と100%同一である。
【0027】
本発明の一実施態様において、本発明に係る変異型乳酸オキシダーゼは、1つまたはそれより多くのアミノ酸欠失を含んでもよく、具体的には小さい(例えばアミノ酸10個以下の)Nおよび/またはC末端の欠失を含んでもよい。
【0028】
一実施態様において、本発明に係る変異型乳酸オキシダーゼの配列は、配列番号1または2のTyr191の位置における置換に加えて、任意にGly36、Ala95、Thr103、Glu160、Val198、Asn212、Ala/Gly232およびPhe277からなる群より選択される位置における少なくとも1つの追加のアミノ酸置換に加えて、1つまたはそれより多くの追加のアミノ酸置換を含んでもよく、具体的には1つまたはそれより多くの保存的アミノ酸置換を含んでもよい。保存的アミノ酸置換の例としては、以下に列挙したものが挙げられる:
【0029】
【表1】

【0030】
本発明の一実施態様において、本発明に係る変異型乳酸オキシダーゼは、1つまたはそれより多くのアミノ酸付加、具体的には小さい(例えばアミノ酸10個以下の)内部アミノ酸付加を含んでもよい。
【0031】
その他の実施態様において、本発明に係る変異型乳酸オキシダーゼの配列は、配列番号1または2Tyr191の位置における置換に加えて、および、任意にGly36、Ala95、Thr103、Glu160、Val198、Asn212、Ala/Gly232およびPhe277からなる群より選択される位置における少なくとも1つの追加のアミノ酸置換に加えて、上記で定義された1つまたはそれより多くの欠失、置換または付加の組み合わせを含んでもよい。
【0032】
本発明の文脈において、配列番号1または2のアミノ酸配列の機能的に活性な変異体は、配列番号1または2の以下の位置:Gly36、Ala95、Thr103、Glu160、Val198、Asn212、Ala/Gly232およびPhe277に、少なくとも1つのアミノ酸置換、すなわち1、2、3、4、5、6、7または8つのアミノ酸置換を有することを特徴とする。具体的に言えば、上記で列挙したアミノ酸のいずれかが、それぞれ1つの代替のアミノ酸で置換される。配列番号1または2の変異体の説明に役立つ実例としては、以下に示す置換により、配列番号1または2のアミノ酸配列と異なる変異体が挙げられる:
− Ala95Gly、Thr103Ser、Glu160Gly、Val198Ile、Asn212Asp、および、Ala/Gly232Ser;
− Ala95Ser、Thr103Ser、Glu160Ala、Val198Leu、Asn212Glu、および、Ala/Gly232Thr;
− Gly36Ser、Ala95Gly、Ala/Gly232SerおよびPhe277Tyr;
− Ala95Gly、Thr103Ser、Glu160Gly、Val198Ile、Asn212Asp、Ala/Gly232SerおよびPhe277Tyr;
− Gly36Ser、Thr103Ser、Glu160Gly、Val198Ile、Asn212Asp、Ala/Gly232SerおよびPhe277Tyr; または
− Gly36Ser、Ala95Gly、Thr103Ser、Glu160Gly、Val198Ile、Asn212Asp、Ala/Gly232SerおよびPhe277Tyr。
【0033】
Gly36、Thr103、Glu160、Val198、Asn212、Ala/Gly232およびPhe277の位置における置換は、変異型乳酸オキシダーゼに高い熱安定性を付与することが示されている(米国特許第5,656,471号、米国特許第7,416,871号B2を参照)。従って、アルカリ性(すなわちpH値が7より大きい)条件に対する安定性(Tyr191の変異)と、高い熱安定性とを組み合わせることが有利である。
【0034】
Ala95の位置における置換は、基質特異性を改善することが示されている(Yorita et al., J. Biol. Chem., 1996, 45, 28300-28305、および、実施例2を参照)。従って、安定性(Tyr191の変異)、および、任意に高い熱安定性(Gly36、Thr103、Glu160、Val198、Asn212、Ala/Gly232および/またはPhe277)と、改善された基質特異性(Ala95の変異)とを組み合わせることが有利である。
【0035】
アミノ酸Phe277は配列番号2にしか存在しないため、Phe277のアミノ酸置換は配列番号2に関するものであることに留意されたい。
加えて、配列番号1および2の配列は、232位のアミノ酸において異なっており、すなわち、配列番号1および2は、その位置に、それぞれAlaおよびGlyを有する。従って、Ala/Gly232が配列番号1について述べられている場合、それは、232位のAlaが置換されていることを意味し、Ala/Gly232が配列番号2について述べられている場合それは、232位のGlyが置換されていることを意味する。
【0036】
従って、機能的に活性な変異体は、
(i)Tyr191の位置に相当する位置におけるアミノ酸置換;および、
(ii)以下に示す位置における1つまたはそれより多くのアミノ酸置換:
−Gly36、
−Ala95、
−Thr103、
−Glu160、
−Val198、
−Asn212、
−Ala/Gly232、
−Phe277、
−Gly36、および、Ala95、
−Gly36、および、Thr103、
−Gly36、および、Glu160、
−Gly36、および、Val198、
−Gly36、および、Asn212、
−Gly36、および、Ala/Gly232、
−Gly36およびPhe277、
−Ala95、および、Thr103、
−Ala95、および、Glu160、
−Ala95、および、Val198、
−Ala95、および、Asn212、
−Ala95、および、Ala/Gly232、
−Ala95およびPhe277、
−Thr103、および、Glu160、
−Thr103、および、Val198、
−Thr103、および、Asn212、
−Thr103、および、Ala/Gly232、
−Thr103およびPhe277、
−Glu160、および、Val198、
−Glu160、および、Asn212、
−Glu160、および、Ala/Gly232、
−Glu160およびPhe277、
−Val198、および、Asn212、
−Val198、および、Ala/Gly232、
−Val198およびPhe277、
−Asn212、および、Ala/Gly232、
−Asn212およびPhe277、
−Ala/Gly232およびPhe277、
−Gly36、Ala95、および、Thr103、
−Gly36、Ala95、および、Glu160、
−Gly36、Ala95、および、Val198、
−Gly36、Ala95、および、Asn212、
−Gly36、Ala95、および、Ala/Gly232、
−Gly36、Ala95およびPhe277、
−Gly36、Thr103、および、Glu160、
−Gly36、Thr103、および、Val198、
−Gly36、Thr103、および、Asn212、
−Gly36、Thr103、および、Ala/Gly232、
−Gly36、Thr103およびPhe277、
−Gly36、Glu160、および、Val198、
−Gly36、Glu160、および、Asn212、
−Gly36、Glu160、および、Ala/Gly232、
−Gly36、Glu160およびPhe277、
−Gly36、Val198、および、Asn212、
−Gly36、Val198、および、Ala/Gly232、
−Gly36、Val198およびPhe277、
−Gly36、Asn212、および、Ala/Gly232、
−Gly36、Asn212およびPhe277、
−Gly36、Ala/Gly232およびPhe277、
−Ala95、Thr103、および、Glu160、
−Ala95、Thr103、および、Val198、
−Ala95、Thr103、および、Asn212、
−Ala95、Thr103、および、Ala/Gly232、
−Ala95、Thr103およびPhe277、
−Ala95、Glu160、および、Val198、
−Ala95、Glu160、および、Asn212、
−Ala95、Glu160、および、Ala/Gly232、
−Ala95、Glu160およびPhe277、
−Ala95、Val198、および、Asn212、
−Ala95、Val198、および、Ala/Gly232、
−Ala95、Val198およびPhe277、
−Ala95、Asn212、および、Ala/Gly232、
−Ala95、Asn212およびPhe277、
−Ala95、Ala/Gly232およびPhe277、
−Thr103、Glu160、および、Val198、
−Thr103、Glu160、および、Asn212、
−Thr103、Glu160、および、Ala/Gly232、
−Thr103、Glu160およびPhe277、
−Thr103、Val198、および、Asn212、
−Thr103、Val198、および、Ala/Gly232、
−Thr103、Val198およびPhe277、
−Thr103、Asn212、および、Ala/Gly232、
−Thr103、Asn212およびPhe277、
−Thr103、Ala/Gly232およびPhe277、
−Glu160、Val198、および、Asn212、
−Glu160、Val198、および、Ala/Gly232、
−Glu160、Val198およびPhe277、
−Glu160、Asn212、および、Ala/Gly232、
−Glu160、Asn212およびPhe277、
−Glu160、Ala/Gly232およびPhe277、
−Val198、Asn212、および、Ala/Gly232、
−Val198、Asn212およびPhe277、
−Val198、Ala/Gly232およびPhe277、
−Asn212、Ala/Gly232およびPhe277、
−Gly36、Ala95、Thr103、および、Glu160、
−Gly36、Ala95、Thr103、および、Val198、
−Gly36、Ala95、Thr103、および、Asn212、
−Gly36、Ala95、Thr103、および、Ala/Gly232、
−Gly36、Ala95、Thr103およびPhe277、
−Gly36、Ala95、Glu160、および、Val198、
−Gly36、Ala95、Glu160、および、Asn212、
−Gly36、Ala95、Glu160、および、Ala/Gly232、
−Gly36、Ala95、Glu160およびPhe277、
−Gly36、Ala95、Val198、および、Asn212、
−Gly36、Ala95、Val198、および、Ala/Gly232、
−Gly36、Ala95、Val198およびPhe277、
−Gly36、Ala95、Asn212、および、Ala/Gly232、
−Gly36、Ala95、Asn212およびPhe277、
−Gly36、Ala95、Ala/Gly232およびPhe277、
−Gly36、Thr103、Glu160、および、Val198、
−Gly36、Thr103、Glu160、および、Asn212、
−Gly36、Thr103、Glu160、および、Ala/Gly232、
−Gly36、Thr103、Glu160およびPhe277、
−Gly36、Thr103、Val198、および、Asn212、
−Gly36、Thr103、Val198、および、Ala/Gly232、
−Gly36、Thr103、Val198およびPhe277、
−Gly36、Thr103、Asn212、および、Ala/Gly232、
−Gly36、Thr103、Asn212およびPhe277、
−Gly36、Thr103、Ala/Gly232およびPhe277、
−Gly36、Glu160、Val198、および、Asn212、
−Gly36、Glu160、Val198、および、Ala/Gly232、
−Gly36、Glu160、Val198およびPhe277、
−Gly36、Glu160、Asn212、および、Ala/Gly232、
−Gly36、Glu160、Asn212およびPhe277、
−Gly36、Glu160、Ala/Gly232およびPhe277、
−Gly36、Val198、Asn212、および、Ala/Gly232、
−Gly36、Val198、Asn212およびPhe277、
−Gly36、Val198、Ala/Gly232およびPhe277、
−Gly36、Asn212、Ala/Gly232およびPhe277、
−Ala95、Thr103、Glu160、および、Val198、
−Ala95、Thr103、Glu160、および、Asn212、
−Ala95、Thr103、Glu160、および、Ala/Gly232、
−Ala95、Thr103、Glu160およびPhe277、
−Ala95、Thr103、Val198、および、Asn212、
−Ala95、Thr103、Val198、および、Ala/Gly232、
−Ala95、Thr103、Val198およびPhe277、
−Ala95、Thr103、Asn212、および、Ala/Gly232、
−Ala95、Thr103、Asn212およびPhe277、
−Ala95、Thr103、Ala/Gly232およびPhe277、
−Ala95、Glu160、Val198、および、Asn212、
−Ala95、Glu160、Val198、および、Ala/Gly232、
−Ala95、Glu160、Val198およびPhe277、
−Ala95、Glu160、Asn212、および、Ala/Gly232、
−Ala95、Glu160、Asn212およびPhe277、
−Ala95、Glu160、Ala/Gly232およびPhe277、
−Ala95、Val198、Asn212、および、Ala/Gly232、
−Ala95、Val198、Asn212およびPhe277、
−Ala95、Val198、Ala/Gly232およびPhe277、
−Ala95、Asn212、Ala/Gly232およびPhe277、
−Thr103、Glu160、Val198、および、Asn212、
−Thr103、Glu160、Val198、および、Ala/Gly232、
−Thr103、Glu160、Val198およびPhe277、
−Thr103、Glu160、Asn212、および、Ala/Gly232、
−Thr103、Glu160、Asn212およびPhe277、
−Thr103、Glu160、Ala/Gly232およびPhe277、
−Thr103、Val198、Asn212、および、Ala/Gly232、
−Thr103、Val198、Asn212およびPhe277、
−Thr103、Val198、Ala/Gly232およびPhe277、
−Thr103、Asn212、Ala/Gly232およびPhe277、
−Glu160、Val198、Asn212、および、Ala/Gly232、
−Glu160、Val198、Asn212およびPhe277、
−Glu160、Val198、Ala/Gly232およびPhe277、
−Glu160、Asn212、Ala/Gly232およびPhe277、
−Val198、Asn212、Ala/Gly232およびPhe277、
−Gly36、Ala95、Thr103、Glu160、および、Val198、
−Gly36、Ala95、Thr103、Glu160、および、Asn212、
−Gly36、Ala95、Thr103、Glu160、および、Ala/Gly232、
−Gly36、Ala95、Thr103、Glu160およびPhe277、
−Gly36、Ala95、Thr103、Val198、および、Asn212、
−Gly36、Ala95、Thr103、Val198、および、Ala/Gly232、
−Gly36、Ala95、Thr103、Val198およびPhe277、
−Gly36、Ala95、Thr103、Asn212、および、Ala/Gly232、
−Gly36、Ala95、Thr103、Asn212およびPhe277、
−Gly36、Ala95、Thr103、Ala/Gly232およびPhe277、
−Gly36、Ala95、Glu160、Val198、および、Asn212、
−Gly36、Ala95、Glu160、Val198、および、Ala/Gly232、
−Gly36、Ala95、Glu160、Val198およびPhe277、
−Gly36、Ala95、Glu160、Asn212、および、Ala/Gly232、
−Gly36、Ala95、Glu160、Asn212およびPhe277、
−Gly36、Ala95、Glu160、Ala/Gly232およびPhe277、
−Gly36、Ala95、Val198、Asn212、および、Ala/Gly232、
−Gly36、Ala95、Val198、Asn212およびPhe277、
−Gly36、Ala95、Val198、Ala/Gly232およびPhe277、
−Gly36、Ala95、Asn212、Ala/Gly232およびPhe277、
−Gly36、Thr103、Glu160、Val198、および、Asn212、
−Gly36、Thr103、Glu160、Val198、および、Ala/Gly232、
−Gly36、Thr103、Glu160、Val198およびPhe277、
−Gly36、Thr103、Glu160、Asn212、および、Ala/Gly232、
−Gly36、Thr103、Glu160、Asn212およびPhe277、
−Gly36、Thr103、Glu160、Ala/Gly232およびPhe277、
−Gly36、Thr103、Val198、Asn212、および、Ala/Gly232、
−Gly36、Thr103、Val198、Asn212およびPhe277、
−Gly36、Thr103、Val198、Ala/Gly232およびPhe277、
−Gly36、Thr103、Asn212、Ala/Gly232およびPhe277、
−Gly36、Glu160、Val198、Asn212、および、Ala/Gly232、
−Gly36、Glu160、Val198、Asn212およびPhe277、
−Gly36、Glu160、Val198、Ala/Gly232およびPhe277、
−Gly36、Glu160、Asn212、Ala/Gly232およびPhe277、
−Gly36、Val198、Asn212、Ala/Gly232およびPhe277、
−Ala95、Thr103、Glu160、Val198、および、Asn212、
−Ala95、Thr103、Glu160、Val198、および、Ala/Gly232、
−Ala95、Thr103、Glu160、Val198およびPhe277、
−Ala95、Thr103、Glu160、Asn212、および、Ala/Gly232、
−Ala95、Thr103、Glu160、Asn212およびPhe277、
−Ala95、Thr103、Glu160、Ala/Gly232およびPhe277、
−Ala95、Thr103、Val198、Asn212、および、Ala/Gly232、
−Ala95、Thr103、Val198、Asn212およびPhe277、
−Ala95、Thr103、Val198、Ala/Gly232およびPhe277、
−Ala95、Thr103、Asn212、Ala/Gly232およびPhe277、
−Ala95、Glu160、Val198、Asn212、および、Ala/Gly232、
−Ala95、Glu160、Val198、Asn212およびPhe277、
−Ala95、Glu160、Val198、Ala/Gly232およびPhe277、
−Ala95、Glu160、Asn212、Ala/Gly232およびPhe277、
−Ala95、Val198、Asn212、Ala/Gly232およびPhe277、
−Thr103、Glu160、Val198、Asn212、および、Ala/Gly232、
−Thr103、Glu160、Val198、Asn212およびPhe277、
−Thr103、Glu160、Val198、Ala/Gly232およびPhe277、
−Thr103、Glu160、Asn212、Ala/Gly232およびPhe277、
−Thr103、Val198、Asn212、Ala/Gly232およびPhe277、
−Glu160、Val198、Asn212、Ala/Gly232およびPhe277、
−Gly36、Ala95、Thr103、Glu160、Val198、および、Asn212、
−Gly36、Ala95、Thr103、Glu160、Val198、および、Ala/Gly232、
−Gly36、Ala95、Thr103、Glu160、Val198およびPhe277、
−Gly36、Ala95、Thr103、Glu160、Asn212、および、Ala/Gly232、
−Gly36、Ala95、Thr103、Glu160、Asn212およびPhe277、
−Gly36、Ala95、Thr103、Glu160、Ala/Gly232およびPhe277、
−Gly36、Ala95、Thr103、Val198、Asn212、および、Ala/Gly232、
−Gly36、Ala95、Thr103、Val198、Asn212およびPhe277、
−Gly36、Ala95、Thr103、Val198、Ala/Gly232およびPhe277、
−Gly36、Ala95、Thr103、Asn212、Ala/Gly232およびPhe277、
−Gly36、Ala95、Glu160、Val198、Asn212、および、Ala/Gly232、
−Gly36、Ala95、Glu160、Val198、Asn212およびPhe277、
−Gly36、Ala95、Glu160、Val198、Ala/Gly232およびPhe277、
−Gly36、Ala95、Glu160、Asn212、Ala/Gly232およびPhe277、
−Gly36、Ala95、Val198、Asn212、Ala/Gly232およびPhe277、
−Gly36、Thr103、Glu160、Val198、Asn212、および、Ala/Gly232、
−Gly36、Thr103、Glu160、Val198、Asn212およびPhe277、
−Gly36、Thr103、Glu160、Val198、Ala/Gly232およびPhe277、
−Gly36、Thr103、Glu160、Asn212、Ala/Gly232およびPhe277、
−Gly36、Thr103、Val198、Asn212、Ala/Gly232およびPhe277、
−Gly36、Glu160、Val198、Asn212、Ala/Gly232およびPhe277、
−Ala95、Thr103、Glu160、Val198、Asn212、および、Ala/Gly232、
−Ala95、Thr103、Glu160、Val198、Asn212およびPhe277、
−Ala95、Thr103、Glu160、Val198、Ala/Gly232およびPhe277、
−Ala95、Thr103、Glu160、Asn212、Ala/Gly232およびPhe277、
−Ala95、Thr103、Val198、Asn212、Ala/Gly232およびPhe277、
−Ala95、Glu160、Val198、Asn212、Ala/Gly232およびPhe277、
−Thr103、Glu160、Val198、Asn212、Ala/Gly232およびPhe277、
−Gly36、Ala95、Thr103、Glu160、Val198、Asn212、および、Ala/Gly232、
−Gly36、Ala95、Thr103、Glu160、Val198、Asn212およびPhe277、
−Gly36、Ala95、Thr103、Glu160、Val198、Ala/Gly232およびPhe277、
−Gly36、Ala95、Thr103、Glu160、Asn212、Ala/Gly232およびPhe277、
−Gly36、Ala95、Thr103、Val198、Asn212、Ala/Gly232およびPhe277、
−Gly36、Ala95、Glu160、Val198、Asn212、Ala/Gly232およびPhe277、
−Gly36、Thr103、Glu160、Val198、Asn212、Ala/Gly232およびPhe277、
−Ala95、Thr103、Glu160、Val198、Asn212、Ala/Gly232およびPhe277、または
−Gly36、Ala95、Thr103、Glu160、Val198、Asn212、Ala/Gly232およびPhe277
を除いて、配列番号1または2と同一であることを特徴としていてもよい。
【0037】
注目すべきことに、変異体に関して、本発明に係る配列番号1または2のアミノ酸配列の変異体は、機能的に活性な変異体である。機能的に活性な変異体は、生物学的機能、例えば乳酸オキシダーゼの酵素活性が維持されている変異体である。生物学的機能の維持は、配列番号1または2で示される乳酸オキシダーゼの活性の好ましくは少なくとも10%、20%、30%または特に50%、好ましくは少なくとも60%、より好ましくは少なくとも70%、80%または90%、さらにより好ましくは95%またはそれより多くを有することと定義される。このような生物活性は、当業者によく知られているようにして測定することができ、例えば実施例1および2で説明されているようにして測定することができる。
【0038】
本発明によれば、安定性が高められた変異型乳酸オキシダーゼは、配列番号1もしくは2のアミノ酸配列またはそれらの機能的に活性な変異体に少なくとも90%同一なアミノ酸配列を含み;および、配列番号1または2におけるTyr191の位置に相当する位置にアミノ酸置換を有する。これは、変異型乳酸オキシダーゼは、上記で特定されたアミノ酸に加えて1つまたはそれより多くのさらなる要素を含み得ることを意味する。このような要素は、さらなるタンパク質成分、または、非タンパク質成分であり得る。タンパク質成分の場合、変異型乳酸オキシダーゼは、例えばタンパク質の単離、精製または同定に利用することができるマーカーを有する融合タンパク質であり得る。要素のさらなる例としては、リンカー(例えば酵素を支持体にカップリングするためのもの)、シグナル配列(タンパク質を標的に向かわせるためのもの)などが挙げられる。その一方で、変異型乳酸オキシダーゼは、上記で特定されたアミノ酸配列からなっていてもよい。
【0039】
好ましい実施態様において、変異型乳酸オキシダーゼは、191位におけるチロシンが実質的に非極性のアミノ酸で置換されていることを特徴とし、具体的には、このようなアミノ酸置換は、Tyr191Phe、Tyr191Leu、Tyr191Ile、Tyr191Met、および、Tyr191Trpからなる群より選択され、特に、このようなアミノ酸置換は、Tyr191Phe、または、Tyr191Leu、好ましくはTyr191Pheである。本明細書において詳述されているように、191位におけるTyr(極性のOH基を有する)の非極性アミノ酸(例えばフェニルアラニンまたはロイシン)での置換は、野生型に比べて乳酸オキシダーゼの安定性を高めることが示されている(実施例を参照)。従って、このような置換は好ましい。非極性側基を有するアミノ酸の例は、グリシン、アラニン、バリン、ロイシン、イソロイシン、および、プロリンである。比較的極性が低い側基を有するアミノ酸としては、フェニルアラニンおよびロイシンと高い類似性を有するメチオニンおよびトリプトファンが挙げられる(MetおよびTyrは、PheまたはLeuの保存的アミノ酸置換とみなされると予想される;上記のリストを参照)。
【0040】
本発明のその他の好ましい実施態様において、変異型乳酸オキシダーゼは、具体的には、191位における変異が、Tyr191Phe、Tyr191Leu、Tyr191Ile、Tyr191MetおよびTyr191Trpであり、特にアミノ酸置換が、Tyr191Phe、または、Tyr191Leu、好ましくはTyr191Pheである場合、少なくとも1つの追加のアミノ酸置換が、配列番号1または2のGly36Ser、Ala95Gly、Thr103Ser、Glu160Gly、Val198Ile、Asn212Asp、Ala/Gly232SerおよびPhe277Tyrからなる群より選択されることを特徴とする。Gly36Ser、Thr103Ser、Glu160Gly、Val198Ile、Asn212Asp、Ala/Gly232SerおよびPhe277Tyrの置換は、変異型乳酸オキシダーゼに高い熱安定性を付与することが示されている。従って、このような置換は好ましい。
【0041】
本発明のより好ましい実施態様において、変異型乳酸オキシダーゼは、少なくとも1つの追加のアミノ酸置換は、Ala95であり、具体的にはAla95Glyであることを特徴とする。Ala95Glyの置換は、基質特異性を改善することが示されている(実施例2を参照)。従って、95位におけるAlaは、Glyで置換されていることが好ましい。
【0042】
本発明によれば、変異型乳酸オキシダーゼは、高い安定性を有する。本発明の好ましい実施態様において、変異型乳酸オキシダーゼは、それに対応する野生型酵素と比較して少なくとも1.5倍高い安定性を有し、好ましくは少なくとも2倍高い安定性、好ましくは少なくとも2.5倍高い安定性、より好ましくは少なくとも3倍高い安定性を有する。高い安定性を測定するのに適した方法は、実施例で詳述されている。20mMのHEPES(pH8.1)、150mMのNaCl、20mMのNaHCO3、および、0.02〜1mg/mlの乳酸オキシダーゼを含む緩衝液中で安定性を測定した。
【0043】
本発明のより好ましい実施態様において、特に、変異型乳酸オキシダーゼが、A95の位置におけるアミノ酸置換、具体的にはAla95Glyを含む場合、変異型乳酸オキシダーゼのグリコール酸と比較した乳酸への選択性が、それに対応する野生型酵素と比較して少なくとも2倍高く、好ましくは少なくとも2.5倍高く、好ましくは少なくとも3倍高く、より好ましくは少なくとも3.5倍高く、最も好ましくは少なくとも4倍高いことを特徴とする。高い選択性を測定するのに適した方法は、実施例で詳述されている。
【0044】
さらなる形態において、本発明は、本発明の変異型乳酸オキシダーゼをコードする核酸に関する。
本明細書で用いられる用語「核酸」は、一般的に、本発明の変異型乳酸オキシダーゼをコードするあらゆるヌクレオチド分子に関し、これらのヌクレオチド分子は様々な長さを有していてもよい。本発明の核酸の例としては、これらに限定されないが、例えばイオン交換クロマトグラフィーなどの標準的な分子生物学的な手法によって単離することができるプラスミド、ベクター、または、あらゆる種類のDNAおよび/またはRNAフラグメントが挙げられる。本発明の核酸は、特定の細胞または生物のトランスフェクションまたは導入のために用いることができる。
【0045】
本発明の核酸分子は、mRNAまたはcRNAのようなRNAの形態であってもよく、または、例えばcDNAおよびゲノムDNAなどのDNAの形態であってもよく、例えばクローニングによって得られたもの、または、化学合成技術によって生産されたもの、または、それらの組み合わせによって生産されたものが挙げられる。DNAは、三本鎖でもよいし、二本鎖でもよいし、または、一本鎖でもよいし。一本鎖DNAは、コード鎖(また、センス鎖としても知られている)であってもよいし、または、非コード鎖(また、アンチセンス鎖とも称される)であってもよい。本明細書で用いられる核酸分子はまた、なかでも特に、その他の一本鎖および二本鎖DNAまたはRNA、一本鎖RNAと二本鎖RNAの混合物であるRNA、一本鎖領域と二本鎖領域の混合物であるRNA、DNAおよびRNAを含むハイブリッド分子(これらは一本鎖でもよいし、または、より典型的には二本鎖もしくは三本鎖である)、または、一本鎖および二本鎖領域の混合物も意味する。加えて、本明細書で用いられる核酸分子は、RNAまたはDNAを含む三本鎖領域、または、RNAとDNAの両方を含む三本鎖領域を意味する。
【0046】
加えて、上記核酸は、1つまたはそれより多くの修飾塩基を含んでいてもよい。このような核酸はまた、生理学的な環境におけるこのような分子の安定性と半減期を高めるために、例えばリボース−リン酸主鎖中に修飾を含んでいてもよい。従って、安定性のために、または、その他の理由のために主鎖が修飾されたDNAまたはRNAも、その特徴が本明細書において意図されたものである「核酸分子」である。さらに、2つ例を挙げれば、イノシンのような通常と異なる塩基、または、トリチル化塩基のような修飾塩基を含むDNAまたはRNAも、本発明の文脈において核酸分子である。当然のことながら、当業者によく知られた多くの有用な目的に役立つ多種多様の修飾が、DNAおよびRNAに施される。本明細書において用られる核酸分子という用語は、このような化学的、酵素的または代謝的に改変された核酸分子の形態を包含し、加えて、ウイルスおよび細胞(特に単細胞および複合細胞など)に特徴的なDNAおよびRNAの化学的な形態も包含する。
【0047】
さらに、本発明の変異型乳酸オキシダーゼをコードする核酸分子は、融合タンパク質を作製するために、標準的なクローニング技術などの標準的な技術を用いて、あらゆる望ましい調節配列、リーダー配列、異種のマーカー配列、または、異種のコード配列に機能的に連結させることができる。
【0048】
本発明の核酸は、インビトロで最初から形成されたものでもよいし、または、培養中に細胞内で形成されたものでもよく、これは、一般的に、エンドヌクレアーゼ、および/または、エキソヌクレアーゼ、および/または、ポリメラーゼ、および/または、リガーゼ、および/または、リコンビナーゼによる核酸の操作によって、または、熟練した核酸生成の技術者によく知られているその他の方法によってなされる。
【0049】
さらなる形態において、本発明は、本発明の核酸を含む発現ベクターに関し、ここで本核酸は、宿主細胞中で核酸の発現を促進することができるプロモーター配列に作動可能なように連結している。
【0050】
本明細書で用いられる用語「発現ベクター」は、一般的に、細胞中で対象のタンパク質を発現させるのに用いることができるあらゆる種類の核酸分子を意味する(また、上記の本発明の核酸についての詳細も参照)。具体的には、本発明の発現ベクターは、例えば哺乳動物細胞、細菌細胞および酵母細胞などの特定の宿主細胞中でタンパク質を発現させるのに適した、当業者によく知られたあらゆるプラスミドまたはベクターであり得る。また本発明の発現コンストラクトは、本発明の乳酸オキシダーゼをコードし、さらにその後の発現を確認するための各ベクターへのクローニングに利用される核酸でもあり得る。タンパク質発現のためのプラスミドおよびベクターは当業界公知であり、これらは、例えばプロメガ(Promega, 米国ウィスコンシン州マディソン)、キアゲン(Qiagen, ドイツ国ヒルデン)、インビトロジェン(Invitrogen, 米国カリフォルニア州カールスバッド)、または、MoBiTec(ドイツ)などの様々な供給元から商業的に購入することができる。タンパク質発現方法は当業者によく知られており、例えばSambrook et al., 2000 (Molecular Cloning: A laboratory manual, 第三版)によって説明されている方法がある。
【0051】
このようなベクターは、加えて、宿主細胞中での複製を可能にするような核酸配列、例えば複製起点、1種またはそれより多くの治療的な遺伝子、および/または、選択マーカー遺伝子、およびその他の当業界でよく知られている遺伝学的要素、例えばコードされたタンパク質の転写、翻訳および/または分泌に関する調節因子を含んでいてもよい。このようなベクターを用いて、細胞に導入され、形質転換または感染させ、それによって、細胞にとって天然型のもの以外の核酸および/またはタンパク質を細胞が発現するようにすることができる。このようなベクターは、任意に、例えばウイルス粒子、リポソーム、タンパク質コーティングまたは同種のものなどの、細胞への核酸の侵入を達成するのに役立つ物質を含んでいてもよい。標準的な分子生物学的な技術によるタンパク質発現に適した多数のタイプの発現ベクターが当業界でよく知られている。このようなベクターは、昆虫由来ベクターなどの従来のベクタータイプのなかでも特に、例えばバキュロウイルス発現系、または、酵母、真菌性、細菌もしくはウイルス発現系から選択される。その他の適切な発現ベクターについても多数のタイプが当業界でよく知られており、これらもこの目的のために使用することができる。このような発現ベクターを得る方法はよく知られている(例えば上記のSambrook et alを参照、)。
【0052】
上記で詳細に述べたように、本発明の変異型乳酸オキシダーゼをコードする核酸は、確実にタンパク質を発現させるために、宿主細胞中でのタンパク質発現に適した配列に作動可能に連結している。しかしながら、特許請求された発現コンストラクトが、その後、確実にタンパク質を発現させるために適切な発現ベクターにクローニングされる中間生成物を示す可能性がある場合でも、本発明の範囲内に包含される。本発明の発現ベクターは、例えば、これらに限定されないが、ポリアデニル化シグナル、スプライスドナーおよびスプライスアクセプターシグナル、介在配列、転写エンハンサー配列、翻訳エンハンサー配列、薬剤耐性遺伝子、またはこれらと同種のものなどのあらゆる種類の核酸配列をさらに含んでいてもよい。任意に、薬剤耐性遺伝子を内部リボソーム侵入部位(IRES)に作動可能に連結させてもよく、このような薬剤耐性遺伝子は、細胞周期に特異的でもよいし、または、細胞周期とは無関係でもよい。
【0053】
本明細書で用いられる用語「作動可能に連結した」は、一般的に、遺伝子エレメントが、それらが意図する目的に沿って機能するように配置されることを意味し、例えば、プロモーターによって転写が開始され、本発明のタンパク質をコードするDNA配列に沿って進行するように配置されることをいう。すなわち、RNAポリメラーゼは、融合タンパク質をコードする配列をmRNAに転写し、続いてこれをスプライシングし、タンパク質に翻訳する。
【0054】
本発明の文脈において用いられる用語「プロモーター配列」は、一般的に、下流のコード配列に作動可能に連結したあらゆる種類の調節DNA配列を意味し、ここで前記プロモーターは、細胞中でRNAポリメラーゼに結合し、コードされたオープンリーディングフレームの転写開始させることにより、前記下流のコード配列の発現を起こすことができる。本発明のプロモーター配列は、当業者によく知られたあらゆる種類のプロモーター配列であってよく、このようなプロモーター配列としては、これらに限定されないが、構成的プロモーター、誘導性プロモーター、細胞周期特異的なプロモーター、および、細胞型特異的なプロモーターが挙げられる。
【0055】
本発明の核酸または発現ベクターは、宿主細胞中に含まれていてもよい。従って、本発明のその他の形態は、本発明の核酸または発現ベクターを含む宿主細胞に関する。本発明の「宿主細胞」は、組換えDNA技術での使用に適したあらゆる種類の生物であってよく、このような生物としては、これらに限定されないが、1種またはそれより多くの組換えタンパク質の発現に適したあらゆる種類の細菌および酵母株が挙げられる。宿主細胞の例としては、例えば、様々な枯草菌(Bacillus subtilis)株、または、大腸菌(E. coli)株が挙げられる。様々な大腸菌の宿主細胞は当業者によく知られており、例えば、これらに限定されないが、例えばDH5−アルファ、HB101、MV1190、JM109、JM101またはXL−1ブルーのような株が挙げられ、これらは、例えばストラタジーン(Stratagene, 米国カリフォルニア州)、プロメガ(米国ウィスコンシン州)、または、キアゲン(ドイツ国ヒルデン)などの様々な供給元から商業的に購入することができる。特に適切な宿主細胞は、実施例でも説明されており、すなわち大腸菌(E. coli)BL21ゴールド細胞である。宿主細胞として用いられる可能性がある枯草菌株としては、例えば1012野生型:leuA8metB5trpC2hsdRM1、および、168マールブルグ:trpC2(Trp−)が挙げられ、これらは、例えばMoBiTec(ドイツ)から市販されている。
【0056】
本発明に係る宿主細胞の培養は、当業者によく知られた慣用的な手法である。すなわち、本発明の変異型乳酸オキシダーゼをコードする核酸を、組換え手段によってそれぞれのタンパク質を生産させるために、適切な宿主細胞に導入することができる。これらの宿主細胞は、あらゆる種類の適切な細胞であってよく、好ましくは、培地中で培養することができる大腸菌のような細菌細胞である。このアプローチは、第一工程において、各遺伝子の適切なプラスミドベクターへのクローニングを含んでいてもよい。プラスミドベクターは遺伝子クローニングに広く利用されており、これらは、一時的にDNAを透過させることができるようにした細菌細胞に容易に導入すること、すなわちトランスフェクションすることができる。各宿主細胞中でタンパク質を発現させた後に、細胞を回収することができ、これらは、対象のタンパク質を含む細胞抽出物製造の出発原料として役立つ。対象のタンパク質を含む細胞抽出物は、細胞を溶解させることにより得られる。化学的または機械的な細胞溶解のいずれかを用いた細胞抽出物の製造方法が当業者によく知られており、このような方法としては、これらに限定されないが、例えば低張性の塩での処理、ホモジナイズまたは超音波処理が挙げられる。本発明の変異型乳酸オキシダーゼを発現させるための宿主細胞の培養に適した方法の例は、実施例1および2で説明される。
【0057】
本発明のその他の形態は、サンプル中の乳酸を測定する方法に関し、本方法は、
a)サンプルを、乳酸オキシダーゼの活性を促進する条件下で本発明の変異型乳酸オキシダーゼと接触させること;および、
b)i)乳酸の存在下で変異型乳酸オキシダーゼによって生産されたピルビン酸塩および/またはH2O2、および/または
ii)乳酸の存在下で変異型乳酸オキシダーゼによって消費されたO2、
を測定することにより、乳酸を測定すること、
を含む。
【0058】
上記の方法は、乳酸オキシダーゼが、以下のスキームに従ってL-乳酸のピルビン酸塩への酸化を触媒するのに用いられる可能性があるということに基づく:
L−乳酸+O2→ピルビン酸塩+H2O2
本発明の方法の第一の工程において、サンプルを本発明の変異型乳酸オキシダーゼと接触させる。サンプルと変異型乳酸オキシダーゼとの接触は、直接なされてもよいし(例えば液体分析の場合)、または、間接的になされてもよい(例えばサンプルの分画(分析物を含む)だけが変異型乳酸オキシダーゼと接触するようなセンサーシステムの場合)。
【0059】
このような接触は、乳酸オキシダーゼの活性を促進する条件下で、すなわち酵素によって乳酸をピルビン酸塩に酸化させるようにする条件下で行われるべきであることは明らかである。インキュベート工程は、約5秒〜数時間の範囲で様々であってもよく、好ましくは約10秒〜約10分である。しかしながら、インキュベート時間は、分析様式、溶液の体積、濃度などに依存すると予想される。通常、このような分析は、周囲温度、または、付随して行われるその他の試験様式に必要な温度(例えば25℃〜38℃;例えば30℃または37℃)で行われると予想されるが、このような分析は、温度範囲を逸脱して(例えば10℃〜40℃で)行ってもよい。
【0060】
任意に、このような酵素は、分析を容易にするために、サンプルと接触させる前に支持層に定着または固定させてもよい。支持層の例としては、例えばマイクロタイタープレートの形態のガラスまたはプラスチック、ガラス製の顕微鏡スライドもしくはカバースリップ、スティック、ビーズもしくはマイクロビーズ、メンブレン(例えば試験ストリップで用いられるもの)、および、バイオセンサーの層が挙げられる。
【0061】
上記サンプルは、被検体からのサンプルなど、乳酸を含む疑いのあるサンプルであればどのようなサンプルでもよい。用語「被検体からのサンプル」は、あらゆる所定の被検体、具体的には人間から単離したあらゆる生体液、排泄物および組織を含む。本発明の文脈において、このようなサンプルとしては、これらに限定されないが、血液、血清、血漿、乳頭から吸引したもの、尿、精液、精液、精漿、前立腺液、排泄物、涙、唾液、汗、生検、腹水、髄液、乳汁、リンパ液、気管支などを洗浄した液のサンプル、または、組織抽出物サンプルが挙げられる。被検体は、好ましくは動物(人間を含む)、より好ましくは哺乳動物、さらにより好ましくは人間である。
【0062】
あるいは、乳酸を含む疑いのあるサンプルはまた、ヨーグルト、ケフィアまたは乳汁のような乳酸を含む食物または飲料サンプルであってもよく、加えて発酵または細胞培養培地であってもよい。
【0063】
典型的には、本発明の文脈における使用のためには、血液サンプルが好ましい試験サンプルである。これについて、血液は、通常ひじの内側または手の甲の静脈から採取される。具体的には、乳児または幼い子供の場合、皮膚を穿刺し出血させるために、ランセットと呼ばれるとがった用具が用いられる可能性がある。血液は、例えばピペットに回収してもよいし、または、スライドまたは試験ストリップ上に回収してもよい。
【0064】
接触させ乳酸を酸化させた後、乳酸の存在下で変異型乳酸オキシダーゼによって生産されたピルビン酸塩および/またはH2O2、および/または、乳酸の存在下で変異型乳酸オキシダーゼによって消費されたO2が存在する場合、それらが測定され、それによってサンプル中の乳酸が測定される。変異型乳酸オキシダーゼによって生産されたピルビン酸塩およびH2O2の量、および、変異型乳酸オキシダーゼによって消費されたO2の量は、サンプル中に存在する乳酸の量と明確な相関がある。
【0065】
ピルビン酸塩、H2O2および/またはO2を測定する様々な方法が当業界でよく知られており、それらのどれを用いてもよい。
ピルビン酸塩を測定する典型的な方法としては、比色法(例えば、340nmで乳酸デヒドロゲナーゼが介在するNADH/NAD+変換を測定することによる方法)、ガスクロマトグラフィー法、HPLC解析などが挙げられる。また、乳酸デヒドロゲナーゼとカルボキシル基を除去するピルビン酸オキシダーゼを含む方法が当業者によく知られている。
【0066】
H2O2を検出するための既知の方法としては、例えばH2O2が介在するCrO3のCrO(O2)2への変換を分析する典型的な方法、ヨウ化物とデンプンを用いる方法、光測定による分析法(以下も参照)、光学的な方法(任意に、しばしばホースラディッシュペルオキシダーゼが媒介する色素の酸化を利用してキュベット中またはセンサーを用いて行われる)、蛍光による方法、例えばH2O2によるペルオキシダーゼが介在する10−アセチル−3,7−ジヒドロキシフェノキサジンのレソルフィンへの酸化(590nmで読み取り)、発光測定法(例えばルミノールの化学発行を利用)、および、例えばH2O2による作用電極(例えばAgAgClに対して650mVにおける白金電極)の陽極酸化に基づく電流滴定法(ここでその結果得られた電流がH2O2の量を示す)が挙げられる。本発明の好ましい方法において、H2O2の測定にペルオキシダーゼという酵素が用いられる可能性がある。
【0067】
H2O2を測定する特に適切な方法を以下で説明する:H2O2を測定するために、ペルオキシダーゼ酵素が用いられる可能性がある。ペルオキシダーゼは、H2O2を使用した場合、有色の色素を生成させるのに特に有用である。この反応は、以下に示す通りである:
H2O2+Hドナー+クロモゲン前駆体→クロモゲン+2H2O
生じた色の強度は、L−乳酸濃度に直接的に比例し、吸光度の増加を測定することによって確認することができる。
【0068】
適切なクロモゲン前駆体(および読み出しに適切な波長)としては、
・ABTS:2,2’−アジノ−ジ−[3−エチルベンズチアゾリンスルホン酸塩(6)](410nmで読み出し)
・4−APP:4−アミノアンチピリン(510nmで読み出し)
・TMB:3,3’,5,5’−テトラメチルベンジジン(450nmで読み出し)、
が挙げられる。
【0069】
クロモゲン前駆体などの様々なペルオキシダーゼ基質は、例えばシグマ−アルドリッチ(Sigma-Aldrich, 米国ミズーリ州セントルイス)から市販されている。
ペルオキシダーゼのための多くの適切な発色性基質および発酵性基質があるが、蛍光性ペルオキシダーゼ基質が用いられることはほとんどない。ジヒドロフルオレセイン(また、フルオレセインとしても知られている)、ジヒドロローダミンおよびジヒドロエチジウム(ヒドロエチジン)のような蛍光性ペルオキシダーゼ基質は、酵素と過酸化水素の存在下で蛍光生成物に変換される。安定で高感度の蛍光発生基質の例は、10−アセチル−3,7−ジヒドロキシフェノキサジン(ADHP)である。
【0070】
このようなペルオキシダーゼは、H2O2の存在に応じてクロモゲン前駆体をクロモゲンに変換することができるあらゆるペルオキシダーゼであり得る。よく用いられるペルオキシダーゼは、ホースラディッシュペルオキシダーゼである。
【0071】
O2を測定する典型的な方法としては、ガスクロマトグラフィー、電流滴定法、例えばクラーク電極を用いた方法、または、蛍光による方法、例えばO2によって引き起こされる特定の色素の蛍光の消滅を利用した方法が挙げられる。O2の測定は、酸素オプトードを利用するものでもよい。オプトードまたはオプトロードは、一般的に化学的なトランスデューサーを用いて特定の物質(例えばO2)を光学的に測定する光学センサーデバイスである。
【0072】
乳酸オキシダーゼにより乳酸を酸化させるために、O2の代わりに媒介物質が用いられる可能性がある。そのような場合、O2ではなく媒介物質の濃度が測定されることがある。これは、試験ストリップにとって周囲環境にある酸素の影響を排除するためによく行われることである。
【0073】
本発明の方法によれば、乳酸は、乳酸の存在下で変異型乳酸オキシダーゼによって生産されたピルビン酸塩および/またはH2O2、および/または、乳酸の存在下で変異型乳酸オキシダーゼによって消費されたO2を測定することによって確認される。本方法は、変異型乳酸オキシダーゼによって生産されたピルビン酸塩および/またはH2O2の量が、サンプル中の乳酸の量に直接的に比例し、消費されたO2の量が、サンプル中の乳酸の量に相互に比例するように設計されている。従って、サンプル中の乳酸の量は、生産されたピルビン酸塩および/またはH2O2の量、および/または、消費されたO2の量から(例えば計算によって)導き出すことができる。このような計算の典型的な方法としては、標準曲線、較正などが挙げられる。
【0074】
本方法は、例えば診断分析として用いることができる。上記で詳細に述べたように、乳酸レベルの変化は、乳酸アシドーシス、すなわち乳酸/乳酸の蓄積に関連する可能性がある。乳酸レベルがコントロールまたは参照と比べて変化する場合、これは、例えば運動および/または病気による乳酸アシドーシスを示す可能性がある。
【0075】
診断方法において、測定されたサンプルの乳酸値は、参照値と比較してもよい。このような参照値は、健康な被検体からのサンプルであってもよいし、または、健康な被検体のグループから確認してもよい。あるいは、参照値は、既知の参照値であってもよい。ヒト血液サンプルおよびヒト血漿サンプルの場合、それぞれ0.5〜2.2mmol/L(好ましくは1.0〜1.8mmol/l)、および、0.9〜1.7mmol/Lの範囲の乳酸濃度が、一般的に正常とみなされる。トレーニングをモニタリングするために乳酸濃度測定を利用する場合、持久性トレーニング中の血中の乳酸濃度は、3〜4mmol/Lまでと予想される。より長時間のトレーニングセッション(45分より長い)中は、乳酸濃度は低ければ低いほど好ましい(約2mmol/L、または、2mmol/L未満)。持久性トレーニング中は、4mmol/Lより高い乳酸濃度は回避されるべきである。
【0076】
2つの値が互いに有意に異なるかどうかを評価するための当業者によく知られている統計手法としては、例えばスチューデントのt検定、または、χ2検定が挙げられる。さらに、当業者は、適切なコントロールをどのようにして選択するかについてよく知っている。
【0077】
本方法は、いわゆる液体または湿式試験(例えばキュベット中)で行ってもよいし、または、適切な試薬キャリアー上でいわゆる乾式試験として行ってもよく、このような場合、必要な試験試薬は固形キャリアー(好ましくは吸収性または膨潤性材料)中またはその上に存在する。
【0078】
好ましい実施態様において、H2O2の測定は、クロモゲンへの変換によって行ってもよく、具体的には、上述したようにペルオキシダーゼが介在する変換によるクロモゲンへの変換によって行ってもよい。
【0079】
その代わりに、またはそれに加えて、変異型乳酸オキシダーゼは、センサー、試験ストリップ、試験素子、試験ストリップ装置、または、液体試験の一部であってもよい。
センサーは、物理的/化学的な量を測定し、それを、オブザーバーまたは機器によって読取ることができるシグナルに変換するものである。本発明において、変異型乳酸オキシダーゼはセンサーの一部であってよく、ここでこのようなセンサーは、乳酸を、例えば例えばディスプレイまたはモニター上に表示された色または値の変化のようなシグナルに変換する。
【0080】
一実施態様において、乳酸センサーは、変異型乳酸オキシダーゼ、および、サンプルの過酸化水素を測定するための電流滴定装置で構成されていてもよい。また、サンプルまたは被検体中の乳酸を連続的にモニタリングするための、電気化学的なフローセルとカップリングされた微小透析システムを利用してもよい。フローセルの作用電極は、電極表面上の酸化還元ポリマーフィルムに固定された変異型乳酸オキシダーゼを用いて製造することができる。電気化学的な乳酸センサーを、微小透析と直接カップリングすることによって、サンプルアリコートを、カラム後にオキシダーゼ酵素反応器を備えた液体クロマトグラフィーシステムに移す必要がなくなる。微小透析プローブからの透析物中の乳酸は、その他の酸化可能な化学種からの有意な干渉をまったく受けずに酵素電極で選択的に検出することができる。さらに、当業界において酵素とカップリングされたバイオセンサーはすでに説明されている。それによれば、変異型乳酸オキシダーゼは、過酸化水素を電気化学的に検出するために、表面にカップリングしてもよい(例えば、変移型乳酸オキシダーゼ/グラファイト混合物を電気めっきしたグラファイトパッドにプリンティングすることによって、または、変異型乳酸オキシダーゼを炭素粒子、白金めっきした炭素粒子、炭素/二酸化マンガン粒子、ガラス状炭素に吸着または固定すること、または、それを炭素ペースト電極等と混合することによって)。
【0081】
試験ストリップまたは試験素子は、サンプル内の標的物質の存在および/または量を測定するのに用いられる分析装置または診断装置である。標準的な試験ストリップは、1つまたはそれより多くの異なる反応ゾーンまたはパッドを含んでもよく、これらのゾーンまたはパッドには、(例えばサンプル中に浸し、続いてそれから取り出すことによって)サンプルと接触させると反応する(例えば色を変化させる)試薬が含まれる。例えば欧州特許第262445号および米国特許第4816224号に記載された多くの実施態様において、試験ストリップはよく用いられている。試験ストリップ技術に基づく乳酸試験の市販品の例は、ロシュ・ダイアグノスティックス(Roche Diagnostics, ドイツ国マンハイム)のアキュトレンドメーター(Accutrend meter)で用いられるBM乳酸テスト(BM Lactate test)である。一般的によく知られているのは、このような測定法を実行するのに必要な1種またはそれより多くの試薬(例えば酵素)が固形キャリアー層上に、または、固形キャリアー層中に存在するものである。キャリアー層として、特に好ましくは、解析しようとするサンプルの液体で湿潤した吸収性および/または膨潤性材料である。このような材料としては、例えばゼラチン、セルロース、および、合成繊維のフリースの層が挙げられる。
【0082】
また変異型乳酸オキシダーゼも、液体試験の一部であってもよい。液体試験は、試験の構成要素が液状媒体中で反応する試験である。液体の乳酸試験の市販品の例は、ロシュ・ダイアグノスティックス(ドイツ国マンハイム)のコバス(cobas)c111装置のための乳酸試験である。通常、実験室での分析の分野において、液体試薬は、含まれる酵素の活性を提供するために、例えば緩衝化された塩溶液などの水をベースとしている。このような液体は、通常、特定の目的とする使用に応じて調製される。液体試験を行うために、全ての試験の構成要素を液体中に溶解させて一体化する(またはその逆も同様)。このような試験を行うための典型的な容器としては、バイアル、マルチウェルプレート、キュベット、うつわ、試薬カップ、チューブなどが挙げられる。
【0083】
本発明の一実施態様において、本発明の変異型乳酸オキシダーゼは、固定されていてもよい。典型的な固定方法としては、例えばメンブレンへの共有結合、ポリマー中への封入、支持マトリックスへの架橋、または、ゾル−ゲルマトリックス(例えばケイ酸塩ガラスのようなガラス)への固定、または、多孔質基質上への吸着が挙げられる。乳酸オキシダーゼのような酵素を固定するのに適した方法は当業界でよく知られている(例えばLillis et al., 2000, Sensors and Actuators B 68: 109-114を参照)。
【0084】
本発明のその他の形態は、乳酸を測定するための本発明の変異型乳酸オキシダーゼの使用に関する。乳酸を測定するための本発明の変異型乳酸オキシダーゼの使用を含む適切な方法は、上記で説明した通りである。
【0085】
その他の形態において、本発明は、サンプル中の乳酸を測定するための装置を提供するものであり、ここで本装置は、本発明に係る変異型乳酸オキシダーゼ、および、任意に追加の構成要素、例えば前記測定に必要なその他の試薬を含む。
【0086】
本発明の変異型乳酸オキシダーゼは、サンプル中の乳酸を測定するための装置の一部であってもよい。このような装置は、この目的のために適していればどのような装置でもよい。このような装置は、乳酸を測定するのに用いることができる機械または用具であり得る。このような装置は、好ましくはセンサーであり、好ましくは電気化学的なセンサーまたは試験ストリップである。典型的な装置は、上記および下記で説明される。
【0087】
このような装置は、センサー、例えばバイオセンサーであってもよく、このようなセンサーは、生物学的な構成要素(ここでは本発明に係る変異型乳酸オキシダーゼ)と検出器の構成要素、具体的には物理化学的な検出要素とが一緒になった分析物を検出するための分析装置である。
【0088】
バイオセンサーは、生体サンプル由来の、具体的には血液由来の様々な分析物(乳酸を含む)の濃度を測定するのに特に有用である。電気化学的な試験ストリップ様式をベースとした典型的なバイオセンサーが、米国特許第5,413,690号;5,762,770号、および、5,997,817号で説明されている。
【0089】
本発明の(バイオ)センサーにおいて、変異型乳酸オキシダーゼの存在下で乳酸およびO2がピルビン酸塩およびH2O2に変換されたら、生成物のどれかの増加または基質のどれかの減少をトランスデューサーまたは検出素子によってモニターすることができる。
【0090】
具体的には、乳酸センサーは、例えばグルコース、コレステロール、トリグリセリド、尿素、血液ガスまたは電解質などを測定するためのその他のセンサーと組み合わされる。本発明の変異型乳酸オキシダーゼは、このようなマルチ分析装置でも利用できることは明らかである。
【0091】
上記で詳細に述べたように、本センサーは、好ましくは電気化学的なセンサーである。電気化学的なセンサーは、化学シグナル(ここでは乳酸の存在)の電気信号(例えば電流)への翻訳に基づく。適切な電極は、乳酸オキシダーゼが介在する過酸化水素形成を電気信号として測定することができる。このようなシグナルは、過酸化水素から電極へのエレクトロンの移動の後に生産され、適切な条件下では、酵素触媒による電流は乳酸濃度に比例する。
【0092】
乳酸バイオセンサーのその他の市販品の例は、ロシュ・ダイアグノスティックス(ドイツ国マンハイム)のコバス(cobas)b123解析装置の多目的の乳酸センサーである。バイオセンサーを多目的で使用するためのバイオセンサーの2つの主要なグループが商品化されており、一つはメンブレンベースのセンサー(例えば、YSI、エッペンドルフ(Eppendorf)、ノヴァ・バイオケミカル(Nova Biomedical)、および、レディオメーター(Radiometer)製)であり、もう一つはバイエル(Bayer)またはロシュ製の厚膜バイオセンサーである。
【0093】
本発明の一実施態様において、本センサーは、電気非導電性の基質、作用電極、および、乳酸および酸素が電極を通過できるようにする作用電極を覆う半透膜を含む電気化学的なセンサーを提供する。作用電極は、基質の一部に付着した導電性材料、および、触媒活性を示す量の乳酸オキシダーゼを含む。このようなセンサーはさらに、非導電性基質の第二の部分に付着した第二の導電性材料を有する対電極を含んでいてもよい。半透膜は、酢酸セルロース、ポリウレタン、シリコーン化合物、および当業界でよく知られているその他の材料から形成することができる。本発明のその他の実施態様において、電気化学的なセンサーはさらに、参照電極を含んでいてもよい。
【0094】
その他の典型的な電気化学的なセンサーにおいて、変異型乳酸オキシダーゼは、酵素層中に(例えば自己架橋を形成するアクリレートポリマーを介して)固定される。化学シグナルの電子シグナルへの翻訳は、H2O2に反応性を有する二酸化マンガン層によって達成される。さらなる構成要素は、作用電極に加えて、参照電極である。典型的なセンサーはまた、Schaffar et al., 1999, Clinical Chemistry 45(9): 1678-1679でも説明されている。
【0095】
本発明の装置は、変異型乳酸オキシダーゼに加えて、1種またはそれより多くの追加の構成要素を含んでもよく、このような構成要素としては、例えば、前記測定に必要な、または、前記測定において有用なその他の試薬が挙げられる。このような構成要素は、本発明の方法および装置に関して説明されているもののいずれかであってもよい。加えて、このような構成要素としては、取扱説明書、ランセット装置、キャピラリーピペット、追加の酵素(例えばペルオキシダーゼ)、基質(例えばクロモゲン前駆体)、および/または、乳酸コントロール溶液などが挙げられる。
【0096】
さらにその他の形態において、本発明は、本発明に係る変異型乳酸オキシダーゼ、および、少なくとも1種の前記測定に必要な追加の物質を含む、乳酸を測定するためのキットを提供する。
【0097】
便宜上、本発明に係る変異型乳酸オキシダーゼは、キット中に供給されていてもよく、例えば、(診断)分析を行うために説明書で予め決められた量でパッケージ化された試薬の組み合わせ中に供給されていてもよい。必要に応じて、本キットは、基質、発色団の前駆体、追加の酵素(例えばペルオキシダーゼ)、および、酵素に必要な補因子を含むと予想される。本キット中のその他の添加剤が含まれていてもよく、このような添加剤としては、例えば安定剤、緩衝液(例えば、ブロッキング緩衝液、溶解緩衝液、または、希釈用緩衝液)などが挙げられる。本キット中に供給される様々な試薬の相対量は広範囲に様々であってよく、例えば、試薬溶液中の濃度が実質的に分析感度を最適化するような濃度になるような相対量である。このような試薬は、好ましくは乾燥粉末としてで提供されてもよく、このような乾燥粉末は、一般的には、凍結乾燥した状態であり、例えば賦形剤を含み、溶解時に適切な濃度を有する試薬溶液が提供されるようなものである。
【0098】
本発明は、本明細書において説明された特定の方法論、手順および試薬に限定されることはなく、それらは様々に変更することが可能である。さらに、本明細書において用いられる用語は、単に具体的な実施態様を説明するためだけのものであり、発明の範囲を限定することは目的としない。本明細書および添付の請求項で用いられるように、単数形を示す「a」、「an」および「the」は、文章中に明らかな他の指示がない限り、その対象物が複数である場合も包含する。加えて、「〜を含む(comprise)」、「〜を含む(contain)」および「〜を包含する(encompass)」という文言は、排他的ではなく包括的な意味で解釈されることとする。
【0099】
特に他の指定がない限り、本明細書において用いられる全ての専門用語や科学用語とあらゆる頭字語は、発明の分野における当業者によって一般的に理解されている意味と同じ意味を有する。好ましい方法および材料が本明細書において説明されているが、本発明の実施において、本明細書において説明される方法および材料と類似した、または、それらと同等であるあらゆる方法および材料が用いられる可能性がある。
【0100】
以下の図面および実施例は、本発明の様々な実施態様を説明することを目的とする。そのようなものとして、考察された特定の改変は、本発明の範囲を限定するものとして解釈されないこととする。当業者であれば当然のことながら、本発明の範囲から逸脱することなく様々な等価体、変化および改変を作製することができ、従って、このような等価な実施態様は本明細書に包含され得るものとして理解される。
【図面の簡単な説明】
【0101】
【図1】図1Aは、野生型乳酸オキシダーゼ(◇)および変異体Tyr191Phe(●)の反応速度論による特徴付けを示す。この実験は、実施例1で説明されている通りに行われた。図1Bは、野生型乳酸オキシダーゼ(◇)および変異体Ala95Gly(●)の反応速度論による特徴付けを示す。この実験は、実施例2で説明されている通りに行われた。
【図2】図2は、LOD野生型(◆)、Tyr191Phe(■)およびTry191Leu(▲)の安定性の分析を示す。これらの活性は、開始時の値に正規化された。測定された半減期の値は以下に示す通りである:野生型:4.5日;Tyr191Phe:9.8日、および、Try191Leu:7.4日。
【発明を実施するための形態】
【0102】
〔実施例〕
実施例1: 安定性が高められた乳酸オキシダーゼ
1.材料および方法
遺伝学
野生型乳酸オキシダーゼ(配列番号1で示される)を含むプラスミドを出発原料として用いた。このプラスミドは、tacプロモーターを有するp−LO1プラスミドである。従って、タンパク質発現は、IPTG(イソプロピルβ−D−1−チオガラクトピラノシド)より誘導することができる。さらにこのプラスミドはアンピシリン耐性遺伝子を有する。
【0103】
191位におけるアミノ酸のチロシンをフェニルアラニンで置換するために、以下のプライマーを用いた:
【0104】
【化3】

【0105】
191位におけるアミノ酸のチロシンをロイシンで置換するために、以下のプライマーを用いた:
【0106】
【化4】

【0107】
改変された核酸塩基は太字で示した。置換されたアミノ酸をコードするコドンはアンダーラインで示し、制限酵素PvuIの認識配列はイタリックフォントで示した。2工程PCRを、Wangおよび共著者によって公開されたプロトコール(Wang et al., Biotechniques, 1999, 26, 680-682)に従って行った。その後、PCR産物を37℃でDpnIと共に30分間インキュベートし、続いて大腸菌BL21ゴールド細胞に形質転換した。これらの細胞をLBアンピシリンプレート上に面線接種し、次の日それからプラスミドDNAを単離した。プラスミドをPvuI切断に基づく分析を用いて選択し、その後配列解析によって変異を確認した。
【0108】
培養および精製
上述した細胞をアンピシリン(100mg/l)を含むLB培地で30℃で培養し、595nmで0.8の光学密度に達したらIPTG(250μM)で発現を誘導した。30℃で4時間発現させた後、細胞を回収し、50mMのリン酸カリウム緩衝液(pH7.0;KPPと称される)に再懸濁し、フレンチプレスを用いて分離させた。超遠心分離法で細胞の死細胞片を除去し、タンパク質精製のために粗抽出物を用いた。
【0109】
そのために、1.5Mの(NH4)2SO4と共に撹拌しながら大腸菌のタンパク質の一部を沈殿させた。上清を、ハイトラップ・フェニル・FF(HiTrap Phenyl FF)疎水性相互作用クロマトグラフィー(HEC)カラム(内径:16mm;体積:64ml;タンパク質:30mg)に移した。その後、50mMのKPP(pH7.0)、1.5Mの(NH4)2SO4(緩衝液A)から50mMのKPP(pH7.0)(緩衝液B)への濃度勾配を用いて乳酸オキシダーゼを溶出させた(流速2.5ml/分)。緩衝液Bが70%の時点で乳酸オキシダーゼのピークを確認することができた。緩衝液を緩衝液Bに交換した後、10mgのタンパク質を陰イオン交換カラム(MonoQ)(内径:5mm;カラム体積:5ml)に移した。1MのKClを含む緩衝液B(緩衝液C)を用いて1.5ml/分の流速で段階的に溶出を行った。緩衝液Cが28%の時点で乳酸オキシダーゼが溶出した。緩衝液を緩衝液Bに交換した後、100μlのアリコートを採取し、凍結させた。
【0110】
活性の測定
シグマ・アルドリッチのプロトコールを用いて活性を測定し、ここで安定性評価のためにL−乳酸ストック溶液の濃度10〜50mMに下げ、反応液の体積を半分に減らした。
【0111】
シグマ・アルドリッチのプロトコールは、以下に示す通りである:
H2O2の存在下で、アミノアンチピリン(4−AAP)とN,N−ジメチルアニリン(DMA)との反応をペルオキシダーゼに触媒させ、キノンジイミン色素を得た。この試験は以下の条件:T=37℃、pH=6.5、A565nm、光路=1cmで行われ、以下の試薬が使用された:
A.37℃でpH6.5の200mMの3,3−ジメチルグルタル酸−NaOH緩衝液(DMGA)(シグマの商品番号D−4379の3,3−ジメチルグルタル酸を用いて脱イオン水で5mlに調製した。37℃でpHを1MのNaOHで6.5に調節)。
【0112】
B.15mMの4−アミノアンチピリン溶液(4−AAP)(シグマの商品番号A−4382の4−アミノアンチピリンの遊離塩基を用いて脱イオン水で1mlに調製した)。
C.500mMのL(+)乳酸溶液、37℃でpH6.5(乳酸)(シグマの商品番号L−1750のL(+)乳酸の遊離酸を用いて脱イオン水で1mlに調製した。1MのNaOHでpHを6.5に調節した)。
【0113】
D.ペルオキシダーゼ酵素溶液(POD)(使用直前に、冷たい脱イオン水中にシグマの商品番号P−8250のホースラディッシュ由来II型ペルオキシダーゼを50プルプロガリン単位/mlを含む溶液を調製した)。
【0114】
E.pH7.037℃で、0.010mMのフラビンアデニンジヌクレオチド(FAD)を含む10mMのリン酸カリウム緩衝液(酵素希釈剤)(シグマの商品番号P−5379のリン酸カリウムの一塩基性の無水物、および、シグマの商品番号F−6625のフラビンアデニンジヌクレオチド二ナトリウム塩を用いて、脱イオン水で50mlに調製した。37℃でpHを1MのNaOHで7.0に調節した。これを新しく調製した)。
【0115】
F.0.2%(体積/体積)N,N−ジメチルアニリン溶液(DMA)(シグマの商品番号D−8509のN,N−ジメチルアニリンを用いて、脱イオン水で10mlに調製した)。
【0116】
G.0.25%(質量/体積)ドデシルベンゼンスルホン酸溶液(DBS)(シグマの商品番号D−2525のドデシルベンゼンスルホン酸のナトリウム塩を用いて脱イオン水で5mlに製造した)。
【0117】
H.乳酸オキシダーゼ酵素溶液(LOX)(使用直前に、冷たい試薬E中に0.1〜0.2単位/mlの乳酸オキシダーゼを含む溶液を調製した)。
分析手順は、以下に示す通りである:
以下の試薬を適切な容器に(ミリリットルレベルで)ピペッティングすることによって反応カクテルを調製した:試薬A(DMGA)2.00、試薬D(POD)1.00、試薬B(4−AAP)1.00、試薬C(乳酸)1.00、脱イオン水3.00。転置することによって混合し、37℃で平衡化した。以下の試薬を適切なキュベットに(ミリリットル単位で)ピペッティングした:反応カクテル0.80、試薬G(DMA)0.20。転置することによって混合し、および、37℃で平衡化した。続いて、試験サンプルには試薬I(LOX)0.020、または、ブランクには試薬E(酵素希釈剤)を添加した。即座に転置することによって混合し、37℃で正確に10分間インキュベートした。続いて、試薬H(DBS)2.00を添加した。転置することによって混合し、適切な分光光度計を用いて、試験とブランクの両方についてA565nmを記録した。
【0118】
以下のようにして活性(U/mg酵素)を計算した:
【0119】
【数1】

【0120】
式中、
3.02=分析物の総体積
df=希釈係数
35.33=565nmにおけるキノンジイミン色素吸光係数(ミリモル)
0.5=1モルのH2O2が2分の1モルのキノンジイミン色素を生産することにに基づく換算係数
10=1単位ごとの分析時間(分)
0.02=用いられる酵素の体積(ミリリットル単位)
1.02mlの反応混合物において、それぞれの最終濃度は、以下に示す通りである:39mMの3,3−ジメチルグルタル酸、5単位のペルオキシダーゼ、1.5mMの4−アミノアンチピリン、49mMのL(+)乳酸、0.04%(体積/体積)、N,N−ジメチルアニリン、0.20mMのリン酸カリウム、0.20μmのFAD、および、0.002〜0.004単位の乳酸オキシダーゼ。
【0121】
1単位は、pH6.5で、37℃で、1.0μモルのL−乳酸をピルビン酸塩およびH2O2に酸化させる1分あたりの量と予想される。
得られたデータを以下の方程式に従ってフィッティングした:
基質阻害なし: v=vmax*[S]/(Km+[S])(方程式1)
基質阻害あり: v=vmax*[S]/(Km+[S]×(1+[S]/[I]))(方程式2)
ここでvは反応速度であり、vmaxは、最大速度であり、[S]は、基質濃度であり、Kmは、ミカエリス定数であり、[I]は、阻害剤濃度である。
【0122】
安定性の測定
不活性化をより詳細に調べるために、以下の条件:20mMのHEPES(pH8.1)、150mMのNaCl、20mMのNaHCO3、および、0.05mg/ml乳酸オキシダーゼを用いて安定性向上の測定を行った。活性を測定する前に、サンプルを遠心分離し、37℃でインキュベートした。
【0123】
2.結果
191位でチロシンがフェニルアラニンで置換された(Tyr191Pheと称される)またはロイシンで置換された(Try191Leuと称される)変異型乳酸オキシダーゼを発現させ、上述したように精製した。SDSゲルクロマトグラフィーを用いて純度を確認した。
【0124】
Tyr191Pheの場合、変異体の特異的な活性は23U/mgと測定された。野生型と比較すると、活性は8分の1に減少した。変異体Tyr191Pheの場合、ミカエリス定数または親和定数Kmは0.017mMであり、これは、野生型の値(0.897mM)よりも有意に低かった。さらにこのような変異体はまた、有意な基質阻害も示した(図1で示されるように、野生型と比較してIは48.4mMであった)。
【0125】
サンプルを定期的に採取し、サンプルの活性を測定することによって、変異体Tyr191Pheの安定性を3週間にわたり測定した。結果をt=0に合わせて正規化した。不活性化をより詳細に調べるために、周囲条件の変化により不活性化を促進することによって安定性向上の測定(上述した通り)を行った。選択された条件で、野生型(コントロール)は4.5日の半減期を有していた。それに対して、変異体Tyr191Pheは、これらの条件下でそれよりも有意に高い安定性を示し、9.8日後にもとの活性の50%になったが、これは、安定性の2.2倍の増加と同等である。
【0126】
Try191Leuの場合、変異体の特異的な活性は16U/mgと測定された。野生型と比較すると、活性は12分の1に減少した。変異体Try191Leuの場合、ミカエリス定数または親和定数Kmは1.065mMであり、これは、野生型(0.897mM)の値とほぼ同じであった。このような変異体Try191Leuは、有意な基質阻害を示さなかった。
【0127】
サンプルを定期的に採取し、サンプルの活性を測定することによって、変異体Try191Leuの安定性を3週間にわたり測定した。結果をt=0に合わせて正規化した。不活性化をより詳細に調べるために、周囲条件の変化により不活性化を促進することによって安定性向上の測定(上述した通り)を行った。選択された条件で、野生型(コントロール)は3.8日の半減期を有していた。それに対して、変異体Try191Leuは、これらの条件下でそれよりも有意に高い安定性を示し、7.4日後にもとの活性の50%になったが、これは、安定性の1.6倍の増加と同等である。
【0128】
変異体Tyr191PheおよびTry191Leuは、野生型と比較して安定性を有意に改善することから、センサーおよび試験の寿命を格段に延長することができると結論付けられる。
【0129】
実施例2:選択性が改善された乳酸オキシダーゼ
1.材料および方法
遺伝学
実施例1で説明されているような野生型乳酸オキシダーゼを含むプラスミドを出発原料として用いた。
【0130】
95位におけるアミノ酸のアラニンをグリシンで置換するために、以下のプライマーを用いた:
【0131】
【化5】

【0132】
改変された核酸塩基は太字で示した。置換されたアミノ酸をコードするコドンはアンダーラインで示し、制限酵素NcoIの認識配列はイタリックフォントで示した。2工程PCRを、Wangおよび共著者によって公開されたプロトコールに従って行った(上記のWang et al)。その後、PCR産物を37℃でDpnIと共に30分間インキュベートし、続いて大腸菌BL21ゴールド細胞に形質転換した。これらの細胞をLBアンピシリンプレート上に面線接種し、次の日それからプラスミドDNAを単離した。プラスミドをNcoI切断に基づく分析を用いて選択し、その後配列解析によって変異を確認した。
【0133】
培養および精製
上述した細胞をアンピシリン(100mg/l)を含むLB培地で30℃で培養し、595nmで0.8の光学密度に達したらIPTG(250μM)で発現を誘導した。30℃で4時間発現させた後、細胞を回収し、50mMのリン酸カリウム緩衝液(pH7.0;KPPと称される)に再懸濁し、フレンチプレスを用いて分離させた。超遠心分離法で細胞の死細胞片を除去し、タンパク質精製のために粗抽出物を用いた。
【0134】
そのために、1.5Mの(NH4)2SO4と共に氷上で撹拌しながら大腸菌のタンパク質の一部を沈殿させた。上清を、ハイトラップ・フェニル・FF疎水性相互作用クロマトグラフィー(HIC)カラム(内径:16mm;体積:64ml;タンパク質:30mg)に移した。その後、50mMのKPP(pH7.0)、1.5Mの(NH4)2SO4(緩衝液A)から50mMのKPP(pH7.0)(緩衝液B)への濃度勾配を用いて乳酸オキシダーゼを溶出させた(流速2.5ml/分)。緩衝液Bが70%の時点で乳酸オキシダーゼのピークを確認することができた。緩衝液を緩衝液Bに交換した後、10mgのタンパク質を陰イオン交換カラム(MonoQ)(内径:5mm;カラム体積:5ml)に移した。1MのKClを含む緩衝液B(緩衝液C)を用いて1.5ml/分の流速で段階的に溶出を行った。緩衝液Cが28%の時点で乳酸オキシダーゼが溶出した。緩衝液を緩衝液Bに交換した後、100μlのアリコートを採取し、凍結させた。
【0135】
活性の測定
シグマ・アルドリッチのプロトコールを用いて37℃で活性を測定した(実施例1を参照)。
【0136】
式:Rsel=[(Kcat,lac/Km,lac)/(Kcat,glyc/Km,glyc)]により、グリコール酸塩(glyc)に対する乳酸(lac)に関するそれぞれの触媒効率Kcat/Kmの比率を決定することによってL−乳酸に対する選択性(Rsel)を計算した。上記式中、Kcat(回転数)は、単位時間あたり酵素が生成物に変換することができる基質分子の最大数である。得られたデータを以下の方程式に従ってフィッティングした:
基質阻害なし:v=vmax*[S]/(Km+[S])(方程式1)
v=反応速度、vmax=最大速度、[S]=基質濃度、Km=ミカエリス定数。
【0137】
基質阻害を測定する際に、低い基質濃度における直線領域からのKcat/Km値を外挿した。
安定性の測定
不活性化をより詳細に調べるために、以下の条件:20mMのHEPES(pH8.1)、150mMのNaCl、20mMのNaHCO3、および、0.05mg/ml乳酸オキシダーゼを用いて安定性向上の測定を行った。活性を測定する前に、サンプルを遠心分離し、37℃でインキュベートした。
【0138】
2.結果
L−乳酸は、乳酸オキシダーゼの好ましい基質である。上記の精製プロトコールを用いて、44.5sec−1の活性が測定された。Km値は0.23mMと測定され、結果的に193.4sec−1mM−1の触媒効率が得られた。同じ条件下でグリコール酸塩の場合の触媒効率を測定した。高い基質阻害が観察されたことから、Kcat/Km(2.4sec−1mM−1)の測定には低い基質濃度における直線領域を用いた。上記の効率によれば、乳酸に対する選択性Rselは80.4であった。
【0139】
変異体Ala95Glyを上述のようにして製造し、均一になるまで精製した。これをSDSゲル電気泳動によって確認した。精製した酵素を野生型酵素として特徴付けた。乳酸に対するKm値(0.63mM)は野生型と比べて3倍増加し、その結果として、基質としての乳酸に対する活性が失われた(21.5sec−1)。より小さい基質のグリコール酸塩においても同様に強い基質阻害が示された。上記の方法を用いて、0.089sec−1mM−1の触媒効率Kcat/Kmが測定された。作用の組み合わせによって選択性の変更が起こり(触媒効率を比較することによって決定された)、これは、変異体Ala95Glyの場合、Rselは384であったことから決定することができる。選択性は、野生型と比較して4.8倍増加した(表1も参照)。
【0140】
【表2】

【0141】
野生型、加えて変異体Ala95Glyは、グリコール酸塩による基質阻害を示し(図2を参照)、それに対してL−乳酸は、これらの濃度(0〜50mM)において阻害をまったく示さなかった。また基質阻害は、予備的な測定で未精製の変異体Ala95Glyを用いた際に観察された有意に高い基質選択性を引き起こす可能性もある(データ示さず)。このような活性の測定は、強い阻害を伴う50mMの基質濃度で行われた。
【0142】
変異体の特徴付けが終わったら、その安定性も実施例1で説明されているようにして測定した。変異体Ala95Glyの安定性は、野生型(3.8日)と比較してわずかに低下した(2.3日)。
【0143】
まとめると、変異体Ala95Gly(これは、従来技術においてすでに知られている;Yorita et al., J. Biol. Chem., 1996, 45, 28300-28305を参照)において、L−乳酸に対する選択性はわずかに低下したが、乳酸に対する選択性は有意に改善されたことが示される。従って、変異Ala95Glyを有する変異体は、例えばバイオセンサーおよびインビトロでの試験における乳酸活性の測定で使用するための、興味深い候補である。
【特許請求の範囲】
【請求項1】
安定性が高められた変異型乳酸オキシダーゼであって、
(i)配列番号1もしくは配列番号2のアミノ酸配列に少なくとも90%同一である、またはそれらの機能的に活性な変異体である;および、
(ii)配列番号1または配列番号2におけるTyr191の位置に相当する位置にアミノ酸置換を有する、
アミノ酸配列を含み、ここで、機能的に活性な変異体は、配列番号1または配列番号2のGly36、Ala95、Thr103、Glu160、Val198、Asn212、Ala/Gly232およびPhe277からなる群より選択される位置に少なくとも1つの追加のアミノ酸置換を有する、上記オキシダーゼ。
【請求項2】
191位におけるチロシンが、非極性アミノ酸で置換されており、具体的には該アミノ酸置換は、Tyr191Phe、Tyr191Leu、Tyr191Ile、Tyr191Met、および、Tyr191Trpからなる群より選択され、特に該アミノ酸置換は、Tyr191PheまたはTyr191Leuであり、好ましくはTyr191Pheであることを特徴とする、請求項1に記載の変異型乳酸オキシダーゼ。
【請求項3】
前記少なくとも1つの追加のアミノ酸置換は、配列番号1または配列番号2のGly36Ser、Ala95Gly、Thr103Ser、Glu160Gly、Val198Ile、Asn212Asp、Ala/Gly232SerおよびPhe277Tyrからなる群より選択されることを特徴とする、請求項1または2に記載の変異型乳酸オキシダーゼ。
【請求項4】
前記少なくとも1つの追加のアミノ酸置換が、Ala95であり、具体的にはAla95Glyであることを特徴とする、請求項1〜3のいずれか一項に記載の変異型乳酸オキシダーゼ。
【請求項5】
前記変異型乳酸オキシダーゼは、それに対応する野生型酵素と比較して少なくとも1.5倍高い安定性を有し、好ましくは少なくとも2倍高い安定性、好ましくは少なくとも2.5倍高い安定性、より好ましくは少なくとも3倍高い安定性を有することを特徴とする、請求項1〜4のいずれか一項に記載の変異型乳酸オキシダーゼ、。
【請求項6】
前記変異型乳酸オキシダーゼのグリコール酸と比較した乳酸への選択性が、それに対応する野生型酵素と比較して少なくとも2倍高く、好ましくは少なくとも2.5倍高く、好ましくは少なくとも3倍高く、より好ましくは少なくとも3.5倍高く、最も好ましくは少なくとも4倍高いことを特徴とする、請求項4または5に記載の変異型乳酸オキシダーゼ。
【請求項7】
請求項1〜6のいずれか一項に記載の変異型乳酸オキシダーゼをコードする核酸。
【請求項8】
請求項7に記載の核酸を含み、該核酸が、宿主細胞中で核酸の発現を促進することができるプロモーター配列に作動可能に連結している、発現ベクター。
【請求項9】
請求項7に記載の核酸または請求項8に記載の発現ベクターを含む宿主細胞。
【請求項10】
サンプル中の乳酸を測定する方法であって、該方法は、
a)サンプルを、乳酸オキシダーゼの活性を誘導する条件下で請求項1〜6のいずれか一項に記載の変異型乳酸オキシダーゼと接触させること;および、
b)i)乳酸の存在下で変異型乳酸オキシダーゼによって生産されたピルビン酸塩および/またはH2O2、および/または
ii)乳酸の存在下で変異型乳酸オキシダーゼによって消費されたO2、
を測定することによって、乳酸を測定すること、
を含む、上記方法。
【請求項11】
a)H2O2の測定は、クロモゲンへの変換によって、具体的にはペルオキシダーゼが介在する変換によってなされ;および/または、
b)前記変異型乳酸オキシダーゼは、センサー、試験ストリップ、試験エレメント、試験ストリップ装置、または、液体試験の一部である、請求項10に記載の方法。
【請求項12】
乳酸を測定するための、請求項1〜6のいずれか一項に記載の変異型乳酸オキシダーゼの使用。
【請求項13】
請求項1〜6のいずれか一項に記載の変異型乳酸オキシダーゼ、および、任意に前記測定に必要な追加の構成要素を含む、サンプル中の乳酸を測定するための装置。
【請求項14】
前記装置が、センサー、好ましくは電気化学的なセンサー、または、光学センサー、または、試験ストリップを含むことを特徴とする、請求項13に記載の装置。
【請求項15】
請求項1〜6のいずれか一項に記載の変異型乳酸オキシダーゼ、および、少なくとも1種の前記測定に必要な追加の物質を含む、乳酸を測定するためのキット。
【請求項1】
安定性が高められた変異型乳酸オキシダーゼであって、
(i)配列番号1もしくは配列番号2のアミノ酸配列に少なくとも90%同一である、またはそれらの機能的に活性な変異体である;および、
(ii)配列番号1または配列番号2におけるTyr191の位置に相当する位置にアミノ酸置換を有する、
アミノ酸配列を含み、ここで、機能的に活性な変異体は、配列番号1または配列番号2のGly36、Ala95、Thr103、Glu160、Val198、Asn212、Ala/Gly232およびPhe277からなる群より選択される位置に少なくとも1つの追加のアミノ酸置換を有する、上記オキシダーゼ。
【請求項2】
191位におけるチロシンが、非極性アミノ酸で置換されており、具体的には該アミノ酸置換は、Tyr191Phe、Tyr191Leu、Tyr191Ile、Tyr191Met、および、Tyr191Trpからなる群より選択され、特に該アミノ酸置換は、Tyr191PheまたはTyr191Leuであり、好ましくはTyr191Pheであることを特徴とする、請求項1に記載の変異型乳酸オキシダーゼ。
【請求項3】
前記少なくとも1つの追加のアミノ酸置換は、配列番号1または配列番号2のGly36Ser、Ala95Gly、Thr103Ser、Glu160Gly、Val198Ile、Asn212Asp、Ala/Gly232SerおよびPhe277Tyrからなる群より選択されることを特徴とする、請求項1または2に記載の変異型乳酸オキシダーゼ。
【請求項4】
前記少なくとも1つの追加のアミノ酸置換が、Ala95であり、具体的にはAla95Glyであることを特徴とする、請求項1〜3のいずれか一項に記載の変異型乳酸オキシダーゼ。
【請求項5】
前記変異型乳酸オキシダーゼは、それに対応する野生型酵素と比較して少なくとも1.5倍高い安定性を有し、好ましくは少なくとも2倍高い安定性、好ましくは少なくとも2.5倍高い安定性、より好ましくは少なくとも3倍高い安定性を有することを特徴とする、請求項1〜4のいずれか一項に記載の変異型乳酸オキシダーゼ、。
【請求項6】
前記変異型乳酸オキシダーゼのグリコール酸と比較した乳酸への選択性が、それに対応する野生型酵素と比較して少なくとも2倍高く、好ましくは少なくとも2.5倍高く、好ましくは少なくとも3倍高く、より好ましくは少なくとも3.5倍高く、最も好ましくは少なくとも4倍高いことを特徴とする、請求項4または5に記載の変異型乳酸オキシダーゼ。
【請求項7】
請求項1〜6のいずれか一項に記載の変異型乳酸オキシダーゼをコードする核酸。
【請求項8】
請求項7に記載の核酸を含み、該核酸が、宿主細胞中で核酸の発現を促進することができるプロモーター配列に作動可能に連結している、発現ベクター。
【請求項9】
請求項7に記載の核酸または請求項8に記載の発現ベクターを含む宿主細胞。
【請求項10】
サンプル中の乳酸を測定する方法であって、該方法は、
a)サンプルを、乳酸オキシダーゼの活性を誘導する条件下で請求項1〜6のいずれか一項に記載の変異型乳酸オキシダーゼと接触させること;および、
b)i)乳酸の存在下で変異型乳酸オキシダーゼによって生産されたピルビン酸塩および/またはH2O2、および/または
ii)乳酸の存在下で変異型乳酸オキシダーゼによって消費されたO2、
を測定することによって、乳酸を測定すること、
を含む、上記方法。
【請求項11】
a)H2O2の測定は、クロモゲンへの変換によって、具体的にはペルオキシダーゼが介在する変換によってなされ;および/または、
b)前記変異型乳酸オキシダーゼは、センサー、試験ストリップ、試験エレメント、試験ストリップ装置、または、液体試験の一部である、請求項10に記載の方法。
【請求項12】
乳酸を測定するための、請求項1〜6のいずれか一項に記載の変異型乳酸オキシダーゼの使用。
【請求項13】
請求項1〜6のいずれか一項に記載の変異型乳酸オキシダーゼ、および、任意に前記測定に必要な追加の構成要素を含む、サンプル中の乳酸を測定するための装置。
【請求項14】
前記装置が、センサー、好ましくは電気化学的なセンサー、または、光学センサー、または、試験ストリップを含むことを特徴とする、請求項13に記載の装置。
【請求項15】
請求項1〜6のいずれか一項に記載の変異型乳酸オキシダーゼ、および、少なくとも1種の前記測定に必要な追加の物質を含む、乳酸を測定するためのキット。
【図1】


【図2】




【図2】


【公開番号】特開2013−66466(P2013−66466A)
【公開日】平成25年4月18日(2013.4.18)
【国際特許分類】
【外国語出願】
【出願番号】特願2012−205341(P2012−205341)
【出願日】平成24年9月19日(2012.9.19)
【出願人】(591003013)エフ.ホフマン−ラ ロシュ アーゲー (1,754)
【氏名又は名称原語表記】F. HOFFMANN−LA ROCHE AKTIENGESELLSCHAFT
【Fターム(参考)】
【公開日】平成25年4月18日(2013.4.18)
【国際特許分類】
【出願番号】特願2012−205341(P2012−205341)
【出願日】平成24年9月19日(2012.9.19)
【出願人】(591003013)エフ.ホフマン−ラ ロシュ アーゲー (1,754)
【氏名又は名称原語表記】F. HOFFMANN−LA ROCHE AKTIENGESELLSCHAFT
【Fターム(参考)】
[ Back to top ]

