完全縮合オリゴシルセスキオキサン及びそれらの製造方法
【課題】フェニル基にトリアルキルシリル基を有するPOSSの選択的合成と単離、及びニトロ化の提供。
【解決手段】トリアルキルシリルフェニル基を有する式(1)で表される完全縮合シルセスキオキサンを、トリアルキルシリルフェニル基を有するトリアルコキシシランから合成及び単離する。

トリアルキルシリル基をニトロ基に変換すれば、更に他の機能性官能基の導入を可能にする。
【解決手段】トリアルキルシリルフェニル基を有する式(1)で表される完全縮合シルセスキオキサンを、トリアルキルシリルフェニル基を有するトリアルコキシシランから合成及び単離する。

トリアルキルシリル基をニトロ基に変換すれば、更に他の機能性官能基の導入を可能にする。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、完全縮合オリゴシルセスキオキサン及びそれらの製造方法に関する。
【背景技術】
【0002】
ポリシルセスキオキサンは、無機シリカ[SiO2]と有機シリコーン[(R2SiO)n]の中間的な物質であり、[RSiO3/2]nで表される。シロキサン結合をもつ無機構造部分は、優れた透明性、耐熱性、硬度、絶縁性等、無機材料としての特性を担う。一方、有機構造部分は、ケイ素原子に直接結合した有機官能基からなり、無機構造だけでは不足しがちな有機材料への溶解性や分散安定性、屈折率や誘電率の調整、光硬化性付与などの特性を担う。このように、無機材料と有機材料の特性を兼ね備えるポリシルセスキオキサンは有機/無機ハイブリッド材料として注目されている。
【0003】
ポリシルセスキオキサンはその構造により、ランダム構造、多面体構造、ラダー構造が知られている。その中でも、Si−O結合が三次元的に閉環した構造である多面体オリゴシルセスキオキサン(POSS)は、その特異的な三次元的構造ゆえに耐熱性、耐酸化性、耐薬品性及び高い機械的強度、絶縁性等、多くの優れた特徴を持ち、電子材料や光学材料への応用の期待が高まっている。POSSの中でも立方体の頂点がケイ素原子でその間に酸素原子を持つ完全縮合オリゴシルセスキオキサンであるT8化合物([RSiO3/2]8;T構造とは、RSiO3/2を指す)は入手容易な為、これまでに多くの報告がなされ、新規機能の発現や機能性改善の研究に使用されている。
【0004】
これらPOSS合成については、T8構造だけでなく、T6、T10、T12、T14構造等についても近年報告されている(例えば、非特許文献1、非特許文献2)。
【化1】

【0005】
POSS誘導体に関して、側鎖([RSiO3/2]nのRに相当)が直鎖アルキル基である完全縮合のPOSS(完全縮合オリゴシルセスキオキサン)では低収率でしか得られないのが実情である(例えば、非特許文献3、非特許文献4)。また、フェニル基が側鎖の完全縮合オリゴシルセスキオキサンは、フェニルトリクロロシランやフェニルトリアルコキシシランを原料に加水分解で収率よく得られる事が報告されているが、溶解性の問題等から誘導体への展開は困難である(非特許文献4)。
【0006】
以上のように、POSSに官能基を導入して材料へ応用する場合、完全縮合オリゴシルセスキオキサンでは側鎖の置換基が水素以外は、官能基変換しにくいのが実情である。
【0007】
例えば、レイン氏らはPh8T8を発煙硝酸でフェニル基のパラ位にニトロ基の導入を行っているが、実施例の1H−NMRの積分比を見る限り、パラ位に選択的に導入されているとはいい難く、フェニル基のパラ位以外にも導入されていると示唆される(特許文献1、非特許文献5)。この様な化合物を材料に応用した場合、本来のパラ位置換のPh8T8の物性が得られず、目的とする精密材料等に必要な物性が得られない。また、この方法では鉄を使用するため、金属含量がppbオーダーを必要とする半導体材料等への応用も課題が多い。
【化2】

【0008】
側鎖の置換基全てが同じ、もしくは半分程度が同じT8化合物については、比較的容易に合成でき、報告もされている。また、T8構造の一つの頂点が欠けている不完全縮合型のT7と機能性官能基を有するクロロシラン等で閉環させた完全縮合オリゴシルセスキオキサンは、8つの置換基のうち7つが同じ種類となり、これを重合させる事でポリマーを合成した報告もある(例えば、非特許文献6、非特許文献7)。
【0009】
完全縮合オリゴシルセスキオキサンの中でも、Ph8T8に代表されるフェニル基を側鎖にもつ化合物は比較的収率よく合成可能であり、入手も容易で幅広く研究されている(例えば、非特許文献4)。完全縮合オリゴシルセスキオキサンのフェニル基側鎖に様々な官能基を導入できれば、不完全縮合オリゴシルセスキオキサンを用いなくても材料を合成する事が可能なだけでなく、材料への応用が期待できる為にPOSS材料の市場投入の機会を広げ産業上大きな効果が期待できる。
【先行技術文献】
【特許文献】
【0010】
【特許文献1】特表2004−529984号公報
【非特許文献】
【0011】
【非特許文献1】Journal of American Chemical Society 1997年,119巻,46号,11323〜11324頁
【非特許文献2】Chemistry Letters 2007年,6号,792〜793頁
【非特許文献3】Journal of American Chemical Society 1989年,111巻,18号,7288〜7289頁
【非特許文献4】Journal of American Chemical Society 1964年,86巻,6号,1120〜1125頁
【非特許文献5】Journal of American Chemical Society 2001年,123巻,49号,12416〜12417頁
【非特許文献6】Macromolecules 1996年,29巻,22号,7302〜7304頁
【非特許文献7】Macromolecules 2006年,39巻,10号,3473〜3475頁
【発明の概要】
【発明が解決しようとする課題】
【0012】
本発明は、上記の現状に鑑みてなされたものであり、完全縮合オリゴシルセスキオキサン誘導体及び新規な製造方法の提供にある。
【課題を解決するための手段】
【0013】
すなわち、本発明は、フェニル基にトリアルキルシリル基を有するT8、T10、T12構造の完全縮合オリゴシルセスキオキサンを合成及び単離し、トリアルキルシリル基をニトロ基で置換する事を特徴とする製造方法である。
【0014】
すなわち、本発明は、
一般式(1)又は一般式(2)
【化3】

【化4】

で表される完全縮合オリゴシルセスキオキサンであり、Rはトリアルキルシリルフェニル基(a)又はニトロフェニル基(b)
【化5】

(式中、Xは夫々独立してアルキル基、アリールアルキル基またはシクロアルキル基である。このアルキル基における炭素数は1から10であり、任意の水素原子はハロゲン原子または炭素数1から5のアルキル基で置き換えられてもよい。このアリールアルキル基における炭素数は7から10であり、任意の水素原子はハロゲン原子または炭素数1から10のアルキル基で置き換えられてもよい。このシクロアルキル基における炭素数は3から10であり、任意の水素原子はハロゲン原子または炭素数1から10のアルキル基で置き換えられてもよい。)
である事を特徴とする化合物(請求項1)。
【0015】
式(a)のXが炭素数1〜4の飽和脂肪族アルキル基である事を特徴とする請求項1に記載の一般式(1)又は一般式(2)で表される完全縮合オリゴシルセスキオキサン(請求項2)。
【0016】
式(a)のXがメチル基である事を特徴とする請求項1に記載の一般式(1)又は一般式(2)で表される完全縮合オリゴシルセスキオキサン(請求項3)。
【0017】
一般式(1)又は一般式(2)又は一般式(3)
【化6】

【化7】

【化8】

で示され、Rは式(a)
【化9】

(式中、Xは、請求項1の定義と同じ意味を表す。)
で表される基である事を特徴とする完全縮合オリゴシルセスキオキサンの製造方法であって、炭素数1から3のハロゲン化炭化水素溶媒及び水存在下、第4級アンモニウム塩触媒下で一般式(4)
【化10】

(式中、Xは前記と同様である。式中、Yは夫々独立してアルキル基、アリールアルキル基またはシクロアルキル基である。このアルキル基における炭素数は1から4であり、任意の水素原子はハロゲン原子または炭素数1から5のアルキル基で置き換えられてもよい。このアリールアルキル基における炭素数は7から10であり、任意の水素原子はハロゲン原子または炭素数1から10のアルキル基で置き換えられてもよい。このシクロアルキル基における炭素数は3から10であり、任意の水素原子はハロゲン原子または炭素数1から10のアルキル基で置き換えられてもよい。)
で表されるケイ素化合物を加水分解縮合させて得る製造方法(請求項4)。
【0018】
一般式(4)のX及びYが炭素数1〜4の飽和脂肪族アルキル基である事を特徴とする請求項4に記載の一般式(1)又は一般式(2)又は一般式(3)で表される完全縮合オリゴシルセスキオキサンの製造方法(請求項5)。
【0019】
一般式(4)のXがメチル基であり、Yがエチル基ある事を特徴とする請求項4乃至請求項5の何れかに記載の一般式(1)又は一般式(2)又は一般式(3)で表される完全縮合オリゴシルセスキオキサンの製造方法(請求項6)。
【0020】
第4級アンモニウム塩がテトラアルキルアンモニウムフロリドである事を特徴とする請求項4乃至請求項6の何れかに記載の一般式(1)又は一般式(2)又は一般式(3)で表される完全縮合オリゴシルセスキオキサンの製造方法(請求項7)。
【0021】
第4級アンモニウム塩がテトラブチルアンモニウムフロリドである事を特徴とする請求項4乃至請求項7の何れかに記載の一般式(1)又は一般式(2)又は一般式(3)で表される完全縮合オリゴシルセスキオキサンの製造方法(請求項8)。
【0022】
ハロゲン化炭化水素溶媒が、ジクロロメタン及び/又はクロロホルムである事を特徴とする請求項4乃至請求項8の何れかに記載の一般式(1)又は一般式(2)又は一般式(3)で表される完全縮合オリゴシルセスキオキサンの製造方法(請求項9)。
【0023】
一般式(1)又は一般式(2)又は一般式(3)
【化11】

【化12】

【化13】

で示され、Rは式(a)
【化14】

(式中、Xは、請求項1の定義と同じ意味を表す。)
で表される完全縮合オリゴシルセスキオキサンの混合物を再結晶処理により、一般式(1)及び一般式(2)及び一般式(3)で表される完全縮合オリゴシルセスキオキサンに単離する事を特徴とする製造方法(請求項10)。
【0024】
再結晶処理の溶媒が、炭素数5から10の飽和脂肪族炭化水素、ベンゼン、飽和アルキル基を含む炭素数7から12の芳香族炭化水素、炭素数1から4の飽和脂肪族アルコール、炭素数1から3の飽和脂肪族ニトリル、炭素数1から3のハロゲン化脂肪族炭化水素から少なくても一つ以上が選択される事を特徴とする請求項10に記載の完全縮合オリゴシルセスキオキサンの製造方法(請求項11)。
【0025】
再結晶処理の温度が、マイナス80℃から30℃までの間で選択される請求項9乃至請求項11の何れかに記載の完全縮合オリゴシルセスキオキサンの製造方法(請求項12)。
【0026】
一般式(1)又は一般式(2)又は一般式(3)
【化15】

【化16】

【化17】

で示され、Rは式(a)
【化18】

(式中、Xは前記と同様である。)
で表される完全縮合オリゴシルセスキオキサンを硝酸でニトロ化し、Rを式(a)から式(b)
【化19】

に変換する事を特徴とする完全縮合オリゴシルセスキオキサンの製造方法(請求項13)。
【0027】
反応温度が、マイナス80℃から0℃までの間で選択される請求項13に記載の完全縮合オリゴシルセスキオキサンの製造方法(請求項14)。
【発明の効果】
【0028】
本発明法によれば、トリアルキルシリルフェニル基を有する一般式(1)及び一般式(2)及び一般式(3)で表される完全縮合シルセスキオキサンを、トリアルキルシリルフェニル基を有するトリアルコキシシランから合成及び単離し、トリアルキルシリル基をニトロ化に変換する事が可能である。
ニトロ基はアミノ基等に変換すれば、炭素−炭素結合形成など他の官能基への変換が容易な官能基であり、重合性官能基等の機能性官能基の導入を可能にし、不完全縮合POSSを用いなくても材料を合成する事が可能である。
【図面の簡単な説明】
【0029】
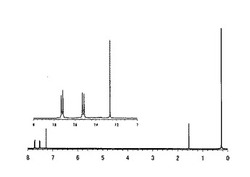
【図1】オクタキス(p−トリメチルシリルフェニル)シルセスキオキサンの1H−NMRスペクトル
【図2】オクタキス(p−トリメチルシリルフェニル)シルセスキオキサンの29Si−NMRスペクトル
【図3】デカキス(p−トリメチルシリルフェニル)シルセスキオキサンの1H−NMRスペクトル
【図4】デカキス(p−トリメチルシリルフェニル)シルセスキオキサンの29Si−NMRスペクトル
【図5】ドデカキス(p−トリメチルシリルフェニル)シルセスキオキサンの1H−NMRスペクトル
【図6】ドデカキス(p−トリメチルシリルフェニル)シルセスキオキサンの29Si−NMRスペクトル
【図7】オクタキス(p−ニトロフェニル)シルセスキオキサンの1H−NMRスペクトル
【図8】オクタキス(p−ニトロフェニル)シルセスキオキサンの29Si−NMRスペクトル
【図9】デカキス(p−ニトロフェニル)シルセスキオキサンの1H−NMRスペクトル
【図10】デカキス(p−ニトロフェニル)シルセスキオキサンの29Si−NMRスペクトル
【図11】ドデカキス(p−ニトロフェニル)シルセスキオキサンの1H−NMRスペクトル
【図12】ドデカキス(p−ニトロフェニル)シルセスキオキサンの29Si−NMRスペクトル
【発明を実施するための形態】
【0030】
以下、本発明を詳細に説明する。
【0031】
一般式(1)又は一般式(2)又は一般式(3)
【化20】

【化21】

【化22】

で表される完全縮合オリゴシルセスキオキサンであり、Rはトリアルキルシリルフェニル基(a)又はニトロフェニル基(b)
【化23】

(式中、Xは夫々独立してアルキル基、アリールアルキル基またはシクロアルキル基である。このアルキル基における炭素数は1から10であり、任意の水素原子はハロゲン原子または炭素数1から5のアルキル基で置き換えられてもよい。このアリールアルキル基における炭素数は7から10であり、任意の水素原子はハロゲン原子または炭素数1から10のアルキル基で置き換えられてもよい。このシクロアルキル基における炭素数は3から10であり、任意の水素原子はハロゲン原子または炭素数1から10のアルキル基で置き換えられてもよい。)
である事を特徴とする化合物である。
【0032】
一般式(1)又は一般式(2)におけるXとしては、アルキル基、アリールアルキル基、シクロアルキル基である。アルキル基の例としては、例えば、メチル基、エチル基、n−プロピル基、イソプロピル基、n−ブチル基、イソブチル基、sec−ブチル基、tert−ブチル基等の脂肪族アルキル基、アリールアルキル基の例としては、ベンジル基、フェネチル基等、シクロアルキル基の例としては、シクロプロピル基、シクロブチル基、シクロペンチル基、シクロヘキシル基等を挙げる事ができるが、これらに限定されるものではない。
【0033】
上記の具体的な化合物としては、Rがp−トリメチルシリルフェニル基である一般式(5)又は一般式(6)又は一般式(7)
【化24】

【化25】

【化26】

及び、Rがp−ニトロフェニル基である一般式(8)又は一般式(9)又は一般式(10)
【化27】

【化28】

【化29】

である。
【0034】
本発明における出発物質は、一般式(4)
【化30】

で表されるフェニル基にトリアルキルシリル基を有するトリアルコキシシランである。Xは、アルキル基、アリールアルキル基、シクロアルキル基である。アルキル基の例としては、例えば、メチル基、エチル基、n−プロピル基、イソプロピル基、n−ブチル基、イソブチル基、sec−ブチル基、tert−ブチル基等、アリールアルキル基の例としては、ベンジル基、フェネチル基等、シクロアルキル基の例としては、シクロプロピル基、シクロブチル基、シクロペンチル基、シクロヘキシル基等を挙げる事ができるが、これらに限定されるものではない。Yはメチル基、エチル基、n−プロピル基、イソプロピル基、n−ブチル基、イソブチル基、sec−ブチル基、tert−ブチル基等のアルキル基を挙げる事ができるが、これらに限定されるものではない。
【0035】
一般式(4)のより好ましい具体的な例として、フェニル基の2つの置換基はパラ位の関係であり、Xがメチル基、Yがエチル基である一般式(11)
【化31】

のp−トリメチルシリルフェニルトリエトキシシランであり、これをハロゲン化炭化水素溶媒中、第4級アンモニウム塩触媒下で加水分解縮合をさせ、トリメチルシリル基を有する一般式(5)及び一般式(6)及び一般式(7)で表される完全縮合オリゴシルセスキオキサンを合成し、再結晶させて単離する事を特徴とする。
【0036】
反応に用いる第4級アンモニウム塩としては、テトラアルキルアンモニウムハライド、テトラアルキルアンモニウムヒドロキシド等が挙げられ、テトラアンモニウムハライドが好ましく、より好ましくはテトラアルキルアンモニウムフロリドである。具体的な例としては、テトラメチルアンモニウムフロリド、テトラエチルアンモニウムフロリド、テトラプロピルアンモニウムフロリド、テトラブチルアンモニウムフロリド等を挙げる事ができるが、これらに限定されるものではない。反応に用いる第4級アンモニウム塩の使用量に関しては、適宜選択可能であるが、通常は原料のケイ素化合物1モルに対して0.1〜20モル%であり、好ましくは0.5〜10%である。
【0037】
反応に用いる溶媒は、炭素数1から3のハロゲン化炭化水素溶媒であり、具体的には、ジクロロメタンやクロロホルム及びこれらの混合物が挙げられるが、これらに限定されるものではない。また、上記、テトラブチルアンモニウムフロリドのテトラヒドロフラン(THF)溶液等を用いる場合は、共存していても良い。溶媒の使用量は、原料のp−トリメチルシリルフェニルトリエトキシシランに対して10〜200重量倍であり、好ましくは50〜150重量倍である。
【0038】
反応に用いる水に関しては、特に制限は無い。水の使用量は、原料のp−トリメチルシリルフェニルトリエトキシシランに対して1.0〜2.0重量倍であり、好ましくは1.0〜1.5重量倍、更に好ましくは1.0〜1.1重量倍である。
【0039】
反応温度に関しては、特に制限は無いが、より温和な条件である0℃から30℃までが好ましく、より好ましくは20℃から30℃である。
【0040】
反応の具体的な条件としては、ジクロロメタン溶媒中、テトラブチルアンモニウムフロリドのTHF溶液下で、一般式(11)で表させるp−トリメチルシリルフェニルトリエトキシシラン及び、それと等モルの水で加水分解縮合させる。テトラブチルアンモニウムフロリドの使用量は、原料のp−トリメチルシリルフェニルトリエトキシシランに対して5モル%である。
【0041】
本発明は、前述のとおり、再結晶処理によりPOSSを単離する事を特徴とする。ここで、該再結晶処理に用いられる溶媒としては、好ましくは、炭素数5から10の飽和脂肪族炭化水素、ベンゼン、飽和アルキル基を含む炭素数7から12の芳香族炭化水素、炭素数1から4の飽和脂肪族アルコール、炭素数1から3の飽和脂肪族ニトリル、炭素数1から3のハロゲン化脂肪族炭化水素から少なくても一つ以上が選択され、該再結晶処理に用いられる溶媒としては、具体的には、ヘキサン、エタノール、アセトニトリル、THF等であり、単独で用いられても良いし、2種類以上が併用されても良い。
【0042】
再結晶処理の温度は、好ましくはマイナス80℃から30℃までの間の温度から選択される。更に好ましくは、マイナス10℃から25℃である。
【0043】
再結晶溶媒の好ましい具体例としてはヘキサン、ヘキサン/エタノール混合溶媒、アセトニトリル/THF混合溶媒であり、再結晶温度が25℃付近である。
【0044】
次に、本発明は、トリアルキルシリル基を有する一般式(1)又は一般式(2)又は一般式(3)で表される完全縮合シルセスキオキサンそれぞれを硝酸でトリアルキルシリル基をニトロ基に変換する事を特徴とする製造方法である。
【0045】
より好ましい具体的な例としては、一般式(5)を一般式(8)に、一般式(6)を一般式(9)に、一般式(7)を一般式(10)に変換する事を特徴とする製造方法である。
【0046】
反応に用いるニトロ化剤としては、硝酸が挙げられ、より具体的には、発煙硝酸である。硝酸の使用量に関しては、適宜選択可能であるが、通常は原料のケイ素化合物1モルに対して10〜5000モルであり、好ましくは200〜1500モルである。
【0047】
反応温度に関しては、マイナス80℃から0℃までの範囲までが好ましく、より好ましくはマイナス50℃からマイナス10℃であり、更に好ましくはマイナス40℃マイナス20℃である。
【0048】
反応温度が上記範囲より高くなると、目的とするPOSSの収率が低下する。
【0049】
本発明で得られるPOSSは、半導体封止材、各種レジスト及びパターン形成材料、酸素吸収剤及び酸素吸収樹脂組成物、プラズマディスプレイパネルなどの用途の合成素子モノマーとして期待される。
【実施例】
【0050】
以下、本発明を実施伶により更に詳しく説明するが、本発明はこれらの実施例に限定されるものではない。
【0051】
[実施例1]かご型シルセスキオキサン(T8、T10、T12)の合成と単離
室温下、ジクロロメタン(230ml)、テトラブチルアンモニウムフロリド(1MのTHF溶液0.5ml)、水0.15g(10mmol)の混合溶液にp−トリメチルシリルフェニルトリエトキシシラン3.00g(9.6mmol)をゆっくり滴下した。室温で24時間攪拌後に分液し、有機層を硫酸ナトリウムで乾燥した。溶媒を溜去し、白色結晶を得た。この白色結晶は、T8、T10、T12構造を含むPOSSの混合物であった。
これをヘキサンで再結晶し、T8構造のオクタキス(p−トリメチルシリルフェニル)シルセスキオキサン0.21g(収率11%)を得た。ろ液にヘキサン/エタノール(v/v.3/1)で再結晶を行い、T12構造のドデカキス(p−トリメチルシリルフェニル)シルセスキオキサン0.14g(収率7%)を得た。ろ液にアセトニトリル/THF(v/v.1/3)で再結晶を行い、T10構造のデカキス(p−トリメチルシリルフェニル)シルセスキオキサン0.58g(収率30%)を得た。
(オクタキス(p−トリメチルシリルフェニル)シルセスキオキサンの同定結果)
1H−NMR δ(CDCl3,ppm):0.25(s,9H),7.52(d,2H),7.73(d,2H)
29Si−NMR δ(CDCl3,ppm):−78.4,−3.83
MALDI−TOF−MS(m/z):1631([M+Na]+, calc.1608)
1H−NMRスペクトルを図1、29Si−NMRスペクトルを図2に示す。
(デカキス(p−トリメチルシリルフェニル)シルセスキオキサンの同定結果)
1H−NMR δ(CDCl3,ppm):0.24(s,9H),7.40(d,2H),7.56(d,2H)
29Si−NMR δ(CDCl3,ppm):−79.6,−3.98
MALDI−TOF−MS(m/z):2033([M+Na]+, calc.2010)
1H−NMRスペクトルを図3、29Si−NMRスペクトルを図4に示す。
(ドデカキス(p−トリメチルシリルフェニル)シルセスキオキサンの同定結果)
1H−NMR δ(CDCl3,ppm):0.22(s,9H),7.32(d,2H),7.40(d,2H),7.46(d,2H),7.56(d,2H)
29Si−NMR δ(CDCl3,ppm):−81.5,−79.4,−4.13,−4.06
MALDI−TOF−MS(m/z):2438([M+Na]+, calc.2412)
1H−NMRスペクトルを図5、29Si−NMRスペクトルを図6に示す。
【0052】
[実施例2]オクタキス(p−ニトロフェニル)シルセスキオキサンの合成
−30℃下、実施例1で得たオクタキス(p−トリメチルシリルフェニル)シルセスキオキサン0.100g(0.062mmol)に発煙硝酸1.50g(23mmol)をゆっくり滴下した。滴下後、室温下で10時間攪拌した後、反応溶液を氷水中にゆっくり滴下した。生成した沈殿物をろ過し、目的物0.081gを得た(収率94%)。
1H−NMR δ(THF−d8,ppm):8.06(d,2H),8.31(d,2H)
29Si−NMR δ(アセトン−d6,ppm):−79.2
1H−NMRスペクトルを図7、29Si−NMRスペクトルを図8に示す。
【0053】
[実施例3]デカキス(p−ニトロフェニル)シルセスキオキサンの合 成
−30℃下、実施例1で得たデカキス(p−トリメチルシリルフェニル)シルセスキ−オキサン0.040g(0.020mmol)に発煙硝酸1.50g(23mmol)をゆっくり滴下した。滴下後、室温下で10時間攪拌した後、反応溶液を氷水中にゆっくり滴下した。生成した沈殿物をろ過し、目的物0.028gを得た(収率80%)。
1H−NMR δ(THF−d8,ppm):8.12(d,2H),8.23(d,2H)
29Si−NMR δ(アセトン−d6,ppm):−80.9
1H−NMRスペクトルを図9、29Si−NMRスペクトルを図10に示す。
【0054】
[実施例4]ドデカキス(p−ニトロフェニル)シルセスキオキサンの合成
−30℃下、実施例1で得たドデカキス(p−トリメチルシリルフェニル)シルセスキオキサン0.040g(0.017mmol)に発煙硝酸1.50g(23mmol)をゆっくり滴下した。滴下後、室温下で10時間攪拌した後、反応溶液を氷水中にゆっくり滴下した。生成した沈殿物をろ過し、目的物0.012gを得た(収率34%)。
1H−NMR δ(THF−d8,ppm):7.79(d,2H),7.92(d,2H),8.13(d,2H),8.21(d,2H)
29Si−NMR δ(アセトン−d6,ppm):−82.2,−80.3
1H−NMRスペクトルを図11、29Si−NMRスペクトルを図12に示す。
【化32】

【0055】
以上、実施例に示したように、本発明ではフェニル基に結合しているトリアルキルシリル基を100%選択的にニトロ化する事が可能である。更に、ニトロ基はアミノ基等に変換すれば、炭素−炭素結合形成など他の官能基への変換が容易な官能基であり、目的とする機能を有する分子構造そのものの物性が反映され、材料への応用が期待できる。
【技術分野】
【0001】
本発明は、完全縮合オリゴシルセスキオキサン及びそれらの製造方法に関する。
【背景技術】
【0002】
ポリシルセスキオキサンは、無機シリカ[SiO2]と有機シリコーン[(R2SiO)n]の中間的な物質であり、[RSiO3/2]nで表される。シロキサン結合をもつ無機構造部分は、優れた透明性、耐熱性、硬度、絶縁性等、無機材料としての特性を担う。一方、有機構造部分は、ケイ素原子に直接結合した有機官能基からなり、無機構造だけでは不足しがちな有機材料への溶解性や分散安定性、屈折率や誘電率の調整、光硬化性付与などの特性を担う。このように、無機材料と有機材料の特性を兼ね備えるポリシルセスキオキサンは有機/無機ハイブリッド材料として注目されている。
【0003】
ポリシルセスキオキサンはその構造により、ランダム構造、多面体構造、ラダー構造が知られている。その中でも、Si−O結合が三次元的に閉環した構造である多面体オリゴシルセスキオキサン(POSS)は、その特異的な三次元的構造ゆえに耐熱性、耐酸化性、耐薬品性及び高い機械的強度、絶縁性等、多くの優れた特徴を持ち、電子材料や光学材料への応用の期待が高まっている。POSSの中でも立方体の頂点がケイ素原子でその間に酸素原子を持つ完全縮合オリゴシルセスキオキサンであるT8化合物([RSiO3/2]8;T構造とは、RSiO3/2を指す)は入手容易な為、これまでに多くの報告がなされ、新規機能の発現や機能性改善の研究に使用されている。
【0004】
これらPOSS合成については、T8構造だけでなく、T6、T10、T12、T14構造等についても近年報告されている(例えば、非特許文献1、非特許文献2)。
【化1】

【0005】
POSS誘導体に関して、側鎖([RSiO3/2]nのRに相当)が直鎖アルキル基である完全縮合のPOSS(完全縮合オリゴシルセスキオキサン)では低収率でしか得られないのが実情である(例えば、非特許文献3、非特許文献4)。また、フェニル基が側鎖の完全縮合オリゴシルセスキオキサンは、フェニルトリクロロシランやフェニルトリアルコキシシランを原料に加水分解で収率よく得られる事が報告されているが、溶解性の問題等から誘導体への展開は困難である(非特許文献4)。
【0006】
以上のように、POSSに官能基を導入して材料へ応用する場合、完全縮合オリゴシルセスキオキサンでは側鎖の置換基が水素以外は、官能基変換しにくいのが実情である。
【0007】
例えば、レイン氏らはPh8T8を発煙硝酸でフェニル基のパラ位にニトロ基の導入を行っているが、実施例の1H−NMRの積分比を見る限り、パラ位に選択的に導入されているとはいい難く、フェニル基のパラ位以外にも導入されていると示唆される(特許文献1、非特許文献5)。この様な化合物を材料に応用した場合、本来のパラ位置換のPh8T8の物性が得られず、目的とする精密材料等に必要な物性が得られない。また、この方法では鉄を使用するため、金属含量がppbオーダーを必要とする半導体材料等への応用も課題が多い。
【化2】

【0008】
側鎖の置換基全てが同じ、もしくは半分程度が同じT8化合物については、比較的容易に合成でき、報告もされている。また、T8構造の一つの頂点が欠けている不完全縮合型のT7と機能性官能基を有するクロロシラン等で閉環させた完全縮合オリゴシルセスキオキサンは、8つの置換基のうち7つが同じ種類となり、これを重合させる事でポリマーを合成した報告もある(例えば、非特許文献6、非特許文献7)。
【0009】
完全縮合オリゴシルセスキオキサンの中でも、Ph8T8に代表されるフェニル基を側鎖にもつ化合物は比較的収率よく合成可能であり、入手も容易で幅広く研究されている(例えば、非特許文献4)。完全縮合オリゴシルセスキオキサンのフェニル基側鎖に様々な官能基を導入できれば、不完全縮合オリゴシルセスキオキサンを用いなくても材料を合成する事が可能なだけでなく、材料への応用が期待できる為にPOSS材料の市場投入の機会を広げ産業上大きな効果が期待できる。
【先行技術文献】
【特許文献】
【0010】
【特許文献1】特表2004−529984号公報
【非特許文献】
【0011】
【非特許文献1】Journal of American Chemical Society 1997年,119巻,46号,11323〜11324頁
【非特許文献2】Chemistry Letters 2007年,6号,792〜793頁
【非特許文献3】Journal of American Chemical Society 1989年,111巻,18号,7288〜7289頁
【非特許文献4】Journal of American Chemical Society 1964年,86巻,6号,1120〜1125頁
【非特許文献5】Journal of American Chemical Society 2001年,123巻,49号,12416〜12417頁
【非特許文献6】Macromolecules 1996年,29巻,22号,7302〜7304頁
【非特許文献7】Macromolecules 2006年,39巻,10号,3473〜3475頁
【発明の概要】
【発明が解決しようとする課題】
【0012】
本発明は、上記の現状に鑑みてなされたものであり、完全縮合オリゴシルセスキオキサン誘導体及び新規な製造方法の提供にある。
【課題を解決するための手段】
【0013】
すなわち、本発明は、フェニル基にトリアルキルシリル基を有するT8、T10、T12構造の完全縮合オリゴシルセスキオキサンを合成及び単離し、トリアルキルシリル基をニトロ基で置換する事を特徴とする製造方法である。
【0014】
すなわち、本発明は、
一般式(1)又は一般式(2)
【化3】

【化4】

で表される完全縮合オリゴシルセスキオキサンであり、Rはトリアルキルシリルフェニル基(a)又はニトロフェニル基(b)
【化5】

(式中、Xは夫々独立してアルキル基、アリールアルキル基またはシクロアルキル基である。このアルキル基における炭素数は1から10であり、任意の水素原子はハロゲン原子または炭素数1から5のアルキル基で置き換えられてもよい。このアリールアルキル基における炭素数は7から10であり、任意の水素原子はハロゲン原子または炭素数1から10のアルキル基で置き換えられてもよい。このシクロアルキル基における炭素数は3から10であり、任意の水素原子はハロゲン原子または炭素数1から10のアルキル基で置き換えられてもよい。)
である事を特徴とする化合物(請求項1)。
【0015】
式(a)のXが炭素数1〜4の飽和脂肪族アルキル基である事を特徴とする請求項1に記載の一般式(1)又は一般式(2)で表される完全縮合オリゴシルセスキオキサン(請求項2)。
【0016】
式(a)のXがメチル基である事を特徴とする請求項1に記載の一般式(1)又は一般式(2)で表される完全縮合オリゴシルセスキオキサン(請求項3)。
【0017】
一般式(1)又は一般式(2)又は一般式(3)
【化6】

【化7】

【化8】

で示され、Rは式(a)
【化9】

(式中、Xは、請求項1の定義と同じ意味を表す。)
で表される基である事を特徴とする完全縮合オリゴシルセスキオキサンの製造方法であって、炭素数1から3のハロゲン化炭化水素溶媒及び水存在下、第4級アンモニウム塩触媒下で一般式(4)
【化10】

(式中、Xは前記と同様である。式中、Yは夫々独立してアルキル基、アリールアルキル基またはシクロアルキル基である。このアルキル基における炭素数は1から4であり、任意の水素原子はハロゲン原子または炭素数1から5のアルキル基で置き換えられてもよい。このアリールアルキル基における炭素数は7から10であり、任意の水素原子はハロゲン原子または炭素数1から10のアルキル基で置き換えられてもよい。このシクロアルキル基における炭素数は3から10であり、任意の水素原子はハロゲン原子または炭素数1から10のアルキル基で置き換えられてもよい。)
で表されるケイ素化合物を加水分解縮合させて得る製造方法(請求項4)。
【0018】
一般式(4)のX及びYが炭素数1〜4の飽和脂肪族アルキル基である事を特徴とする請求項4に記載の一般式(1)又は一般式(2)又は一般式(3)で表される完全縮合オリゴシルセスキオキサンの製造方法(請求項5)。
【0019】
一般式(4)のXがメチル基であり、Yがエチル基ある事を特徴とする請求項4乃至請求項5の何れかに記載の一般式(1)又は一般式(2)又は一般式(3)で表される完全縮合オリゴシルセスキオキサンの製造方法(請求項6)。
【0020】
第4級アンモニウム塩がテトラアルキルアンモニウムフロリドである事を特徴とする請求項4乃至請求項6の何れかに記載の一般式(1)又は一般式(2)又は一般式(3)で表される完全縮合オリゴシルセスキオキサンの製造方法(請求項7)。
【0021】
第4級アンモニウム塩がテトラブチルアンモニウムフロリドである事を特徴とする請求項4乃至請求項7の何れかに記載の一般式(1)又は一般式(2)又は一般式(3)で表される完全縮合オリゴシルセスキオキサンの製造方法(請求項8)。
【0022】
ハロゲン化炭化水素溶媒が、ジクロロメタン及び/又はクロロホルムである事を特徴とする請求項4乃至請求項8の何れかに記載の一般式(1)又は一般式(2)又は一般式(3)で表される完全縮合オリゴシルセスキオキサンの製造方法(請求項9)。
【0023】
一般式(1)又は一般式(2)又は一般式(3)
【化11】

【化12】

【化13】

で示され、Rは式(a)
【化14】

(式中、Xは、請求項1の定義と同じ意味を表す。)
で表される完全縮合オリゴシルセスキオキサンの混合物を再結晶処理により、一般式(1)及び一般式(2)及び一般式(3)で表される完全縮合オリゴシルセスキオキサンに単離する事を特徴とする製造方法(請求項10)。
【0024】
再結晶処理の溶媒が、炭素数5から10の飽和脂肪族炭化水素、ベンゼン、飽和アルキル基を含む炭素数7から12の芳香族炭化水素、炭素数1から4の飽和脂肪族アルコール、炭素数1から3の飽和脂肪族ニトリル、炭素数1から3のハロゲン化脂肪族炭化水素から少なくても一つ以上が選択される事を特徴とする請求項10に記載の完全縮合オリゴシルセスキオキサンの製造方法(請求項11)。
【0025】
再結晶処理の温度が、マイナス80℃から30℃までの間で選択される請求項9乃至請求項11の何れかに記載の完全縮合オリゴシルセスキオキサンの製造方法(請求項12)。
【0026】
一般式(1)又は一般式(2)又は一般式(3)
【化15】

【化16】

【化17】

で示され、Rは式(a)
【化18】

(式中、Xは前記と同様である。)
で表される完全縮合オリゴシルセスキオキサンを硝酸でニトロ化し、Rを式(a)から式(b)
【化19】

に変換する事を特徴とする完全縮合オリゴシルセスキオキサンの製造方法(請求項13)。
【0027】
反応温度が、マイナス80℃から0℃までの間で選択される請求項13に記載の完全縮合オリゴシルセスキオキサンの製造方法(請求項14)。
【発明の効果】
【0028】
本発明法によれば、トリアルキルシリルフェニル基を有する一般式(1)及び一般式(2)及び一般式(3)で表される完全縮合シルセスキオキサンを、トリアルキルシリルフェニル基を有するトリアルコキシシランから合成及び単離し、トリアルキルシリル基をニトロ化に変換する事が可能である。
ニトロ基はアミノ基等に変換すれば、炭素−炭素結合形成など他の官能基への変換が容易な官能基であり、重合性官能基等の機能性官能基の導入を可能にし、不完全縮合POSSを用いなくても材料を合成する事が可能である。
【図面の簡単な説明】
【0029】
【図1】オクタキス(p−トリメチルシリルフェニル)シルセスキオキサンの1H−NMRスペクトル
【図2】オクタキス(p−トリメチルシリルフェニル)シルセスキオキサンの29Si−NMRスペクトル
【図3】デカキス(p−トリメチルシリルフェニル)シルセスキオキサンの1H−NMRスペクトル
【図4】デカキス(p−トリメチルシリルフェニル)シルセスキオキサンの29Si−NMRスペクトル
【図5】ドデカキス(p−トリメチルシリルフェニル)シルセスキオキサンの1H−NMRスペクトル
【図6】ドデカキス(p−トリメチルシリルフェニル)シルセスキオキサンの29Si−NMRスペクトル
【図7】オクタキス(p−ニトロフェニル)シルセスキオキサンの1H−NMRスペクトル
【図8】オクタキス(p−ニトロフェニル)シルセスキオキサンの29Si−NMRスペクトル
【図9】デカキス(p−ニトロフェニル)シルセスキオキサンの1H−NMRスペクトル
【図10】デカキス(p−ニトロフェニル)シルセスキオキサンの29Si−NMRスペクトル
【図11】ドデカキス(p−ニトロフェニル)シルセスキオキサンの1H−NMRスペクトル
【図12】ドデカキス(p−ニトロフェニル)シルセスキオキサンの29Si−NMRスペクトル
【発明を実施するための形態】
【0030】
以下、本発明を詳細に説明する。
【0031】
一般式(1)又は一般式(2)又は一般式(3)
【化20】

【化21】

【化22】

で表される完全縮合オリゴシルセスキオキサンであり、Rはトリアルキルシリルフェニル基(a)又はニトロフェニル基(b)
【化23】

(式中、Xは夫々独立してアルキル基、アリールアルキル基またはシクロアルキル基である。このアルキル基における炭素数は1から10であり、任意の水素原子はハロゲン原子または炭素数1から5のアルキル基で置き換えられてもよい。このアリールアルキル基における炭素数は7から10であり、任意の水素原子はハロゲン原子または炭素数1から10のアルキル基で置き換えられてもよい。このシクロアルキル基における炭素数は3から10であり、任意の水素原子はハロゲン原子または炭素数1から10のアルキル基で置き換えられてもよい。)
である事を特徴とする化合物である。
【0032】
一般式(1)又は一般式(2)におけるXとしては、アルキル基、アリールアルキル基、シクロアルキル基である。アルキル基の例としては、例えば、メチル基、エチル基、n−プロピル基、イソプロピル基、n−ブチル基、イソブチル基、sec−ブチル基、tert−ブチル基等の脂肪族アルキル基、アリールアルキル基の例としては、ベンジル基、フェネチル基等、シクロアルキル基の例としては、シクロプロピル基、シクロブチル基、シクロペンチル基、シクロヘキシル基等を挙げる事ができるが、これらに限定されるものではない。
【0033】
上記の具体的な化合物としては、Rがp−トリメチルシリルフェニル基である一般式(5)又は一般式(6)又は一般式(7)
【化24】

【化25】

【化26】

及び、Rがp−ニトロフェニル基である一般式(8)又は一般式(9)又は一般式(10)
【化27】

【化28】

【化29】

である。
【0034】
本発明における出発物質は、一般式(4)
【化30】

で表されるフェニル基にトリアルキルシリル基を有するトリアルコキシシランである。Xは、アルキル基、アリールアルキル基、シクロアルキル基である。アルキル基の例としては、例えば、メチル基、エチル基、n−プロピル基、イソプロピル基、n−ブチル基、イソブチル基、sec−ブチル基、tert−ブチル基等、アリールアルキル基の例としては、ベンジル基、フェネチル基等、シクロアルキル基の例としては、シクロプロピル基、シクロブチル基、シクロペンチル基、シクロヘキシル基等を挙げる事ができるが、これらに限定されるものではない。Yはメチル基、エチル基、n−プロピル基、イソプロピル基、n−ブチル基、イソブチル基、sec−ブチル基、tert−ブチル基等のアルキル基を挙げる事ができるが、これらに限定されるものではない。
【0035】
一般式(4)のより好ましい具体的な例として、フェニル基の2つの置換基はパラ位の関係であり、Xがメチル基、Yがエチル基である一般式(11)
【化31】

のp−トリメチルシリルフェニルトリエトキシシランであり、これをハロゲン化炭化水素溶媒中、第4級アンモニウム塩触媒下で加水分解縮合をさせ、トリメチルシリル基を有する一般式(5)及び一般式(6)及び一般式(7)で表される完全縮合オリゴシルセスキオキサンを合成し、再結晶させて単離する事を特徴とする。
【0036】
反応に用いる第4級アンモニウム塩としては、テトラアルキルアンモニウムハライド、テトラアルキルアンモニウムヒドロキシド等が挙げられ、テトラアンモニウムハライドが好ましく、より好ましくはテトラアルキルアンモニウムフロリドである。具体的な例としては、テトラメチルアンモニウムフロリド、テトラエチルアンモニウムフロリド、テトラプロピルアンモニウムフロリド、テトラブチルアンモニウムフロリド等を挙げる事ができるが、これらに限定されるものではない。反応に用いる第4級アンモニウム塩の使用量に関しては、適宜選択可能であるが、通常は原料のケイ素化合物1モルに対して0.1〜20モル%であり、好ましくは0.5〜10%である。
【0037】
反応に用いる溶媒は、炭素数1から3のハロゲン化炭化水素溶媒であり、具体的には、ジクロロメタンやクロロホルム及びこれらの混合物が挙げられるが、これらに限定されるものではない。また、上記、テトラブチルアンモニウムフロリドのテトラヒドロフラン(THF)溶液等を用いる場合は、共存していても良い。溶媒の使用量は、原料のp−トリメチルシリルフェニルトリエトキシシランに対して10〜200重量倍であり、好ましくは50〜150重量倍である。
【0038】
反応に用いる水に関しては、特に制限は無い。水の使用量は、原料のp−トリメチルシリルフェニルトリエトキシシランに対して1.0〜2.0重量倍であり、好ましくは1.0〜1.5重量倍、更に好ましくは1.0〜1.1重量倍である。
【0039】
反応温度に関しては、特に制限は無いが、より温和な条件である0℃から30℃までが好ましく、より好ましくは20℃から30℃である。
【0040】
反応の具体的な条件としては、ジクロロメタン溶媒中、テトラブチルアンモニウムフロリドのTHF溶液下で、一般式(11)で表させるp−トリメチルシリルフェニルトリエトキシシラン及び、それと等モルの水で加水分解縮合させる。テトラブチルアンモニウムフロリドの使用量は、原料のp−トリメチルシリルフェニルトリエトキシシランに対して5モル%である。
【0041】
本発明は、前述のとおり、再結晶処理によりPOSSを単離する事を特徴とする。ここで、該再結晶処理に用いられる溶媒としては、好ましくは、炭素数5から10の飽和脂肪族炭化水素、ベンゼン、飽和アルキル基を含む炭素数7から12の芳香族炭化水素、炭素数1から4の飽和脂肪族アルコール、炭素数1から3の飽和脂肪族ニトリル、炭素数1から3のハロゲン化脂肪族炭化水素から少なくても一つ以上が選択され、該再結晶処理に用いられる溶媒としては、具体的には、ヘキサン、エタノール、アセトニトリル、THF等であり、単独で用いられても良いし、2種類以上が併用されても良い。
【0042】
再結晶処理の温度は、好ましくはマイナス80℃から30℃までの間の温度から選択される。更に好ましくは、マイナス10℃から25℃である。
【0043】
再結晶溶媒の好ましい具体例としてはヘキサン、ヘキサン/エタノール混合溶媒、アセトニトリル/THF混合溶媒であり、再結晶温度が25℃付近である。
【0044】
次に、本発明は、トリアルキルシリル基を有する一般式(1)又は一般式(2)又は一般式(3)で表される完全縮合シルセスキオキサンそれぞれを硝酸でトリアルキルシリル基をニトロ基に変換する事を特徴とする製造方法である。
【0045】
より好ましい具体的な例としては、一般式(5)を一般式(8)に、一般式(6)を一般式(9)に、一般式(7)を一般式(10)に変換する事を特徴とする製造方法である。
【0046】
反応に用いるニトロ化剤としては、硝酸が挙げられ、より具体的には、発煙硝酸である。硝酸の使用量に関しては、適宜選択可能であるが、通常は原料のケイ素化合物1モルに対して10〜5000モルであり、好ましくは200〜1500モルである。
【0047】
反応温度に関しては、マイナス80℃から0℃までの範囲までが好ましく、より好ましくはマイナス50℃からマイナス10℃であり、更に好ましくはマイナス40℃マイナス20℃である。
【0048】
反応温度が上記範囲より高くなると、目的とするPOSSの収率が低下する。
【0049】
本発明で得られるPOSSは、半導体封止材、各種レジスト及びパターン形成材料、酸素吸収剤及び酸素吸収樹脂組成物、プラズマディスプレイパネルなどの用途の合成素子モノマーとして期待される。
【実施例】
【0050】
以下、本発明を実施伶により更に詳しく説明するが、本発明はこれらの実施例に限定されるものではない。
【0051】
[実施例1]かご型シルセスキオキサン(T8、T10、T12)の合成と単離
室温下、ジクロロメタン(230ml)、テトラブチルアンモニウムフロリド(1MのTHF溶液0.5ml)、水0.15g(10mmol)の混合溶液にp−トリメチルシリルフェニルトリエトキシシラン3.00g(9.6mmol)をゆっくり滴下した。室温で24時間攪拌後に分液し、有機層を硫酸ナトリウムで乾燥した。溶媒を溜去し、白色結晶を得た。この白色結晶は、T8、T10、T12構造を含むPOSSの混合物であった。
これをヘキサンで再結晶し、T8構造のオクタキス(p−トリメチルシリルフェニル)シルセスキオキサン0.21g(収率11%)を得た。ろ液にヘキサン/エタノール(v/v.3/1)で再結晶を行い、T12構造のドデカキス(p−トリメチルシリルフェニル)シルセスキオキサン0.14g(収率7%)を得た。ろ液にアセトニトリル/THF(v/v.1/3)で再結晶を行い、T10構造のデカキス(p−トリメチルシリルフェニル)シルセスキオキサン0.58g(収率30%)を得た。
(オクタキス(p−トリメチルシリルフェニル)シルセスキオキサンの同定結果)
1H−NMR δ(CDCl3,ppm):0.25(s,9H),7.52(d,2H),7.73(d,2H)
29Si−NMR δ(CDCl3,ppm):−78.4,−3.83
MALDI−TOF−MS(m/z):1631([M+Na]+, calc.1608)
1H−NMRスペクトルを図1、29Si−NMRスペクトルを図2に示す。
(デカキス(p−トリメチルシリルフェニル)シルセスキオキサンの同定結果)
1H−NMR δ(CDCl3,ppm):0.24(s,9H),7.40(d,2H),7.56(d,2H)
29Si−NMR δ(CDCl3,ppm):−79.6,−3.98
MALDI−TOF−MS(m/z):2033([M+Na]+, calc.2010)
1H−NMRスペクトルを図3、29Si−NMRスペクトルを図4に示す。
(ドデカキス(p−トリメチルシリルフェニル)シルセスキオキサンの同定結果)
1H−NMR δ(CDCl3,ppm):0.22(s,9H),7.32(d,2H),7.40(d,2H),7.46(d,2H),7.56(d,2H)
29Si−NMR δ(CDCl3,ppm):−81.5,−79.4,−4.13,−4.06
MALDI−TOF−MS(m/z):2438([M+Na]+, calc.2412)
1H−NMRスペクトルを図5、29Si−NMRスペクトルを図6に示す。
【0052】
[実施例2]オクタキス(p−ニトロフェニル)シルセスキオキサンの合成
−30℃下、実施例1で得たオクタキス(p−トリメチルシリルフェニル)シルセスキオキサン0.100g(0.062mmol)に発煙硝酸1.50g(23mmol)をゆっくり滴下した。滴下後、室温下で10時間攪拌した後、反応溶液を氷水中にゆっくり滴下した。生成した沈殿物をろ過し、目的物0.081gを得た(収率94%)。
1H−NMR δ(THF−d8,ppm):8.06(d,2H),8.31(d,2H)
29Si−NMR δ(アセトン−d6,ppm):−79.2
1H−NMRスペクトルを図7、29Si−NMRスペクトルを図8に示す。
【0053】
[実施例3]デカキス(p−ニトロフェニル)シルセスキオキサンの合 成
−30℃下、実施例1で得たデカキス(p−トリメチルシリルフェニル)シルセスキ−オキサン0.040g(0.020mmol)に発煙硝酸1.50g(23mmol)をゆっくり滴下した。滴下後、室温下で10時間攪拌した後、反応溶液を氷水中にゆっくり滴下した。生成した沈殿物をろ過し、目的物0.028gを得た(収率80%)。
1H−NMR δ(THF−d8,ppm):8.12(d,2H),8.23(d,2H)
29Si−NMR δ(アセトン−d6,ppm):−80.9
1H−NMRスペクトルを図9、29Si−NMRスペクトルを図10に示す。
【0054】
[実施例4]ドデカキス(p−ニトロフェニル)シルセスキオキサンの合成
−30℃下、実施例1で得たドデカキス(p−トリメチルシリルフェニル)シルセスキオキサン0.040g(0.017mmol)に発煙硝酸1.50g(23mmol)をゆっくり滴下した。滴下後、室温下で10時間攪拌した後、反応溶液を氷水中にゆっくり滴下した。生成した沈殿物をろ過し、目的物0.012gを得た(収率34%)。
1H−NMR δ(THF−d8,ppm):7.79(d,2H),7.92(d,2H),8.13(d,2H),8.21(d,2H)
29Si−NMR δ(アセトン−d6,ppm):−82.2,−80.3
1H−NMRスペクトルを図11、29Si−NMRスペクトルを図12に示す。
【化32】

【0055】
以上、実施例に示したように、本発明ではフェニル基に結合しているトリアルキルシリル基を100%選択的にニトロ化する事が可能である。更に、ニトロ基はアミノ基等に変換すれば、炭素−炭素結合形成など他の官能基への変換が容易な官能基であり、目的とする機能を有する分子構造そのものの物性が反映され、材料への応用が期待できる。
【特許請求の範囲】
【請求項1】
一般式(1)又は一般式(2)
【化1】

【化2】

で表される完全縮合オリゴシルセスキオキサンであり、Rはトリアルキルシリルフェニル基(a)又はニトロフェニル基(b)
【化3】

(式中、Xは夫々独立してアルキル基、アリールアルキル基またはシクロアルキル基である。このアルキル基における炭素数は1から10であり、任意の水素原子はハロゲン原子または炭素数1から5のアルキル基で置き換えられてもよい。このアリールアルキル基における炭素数は7から10であり、任意の水素原子はハロゲン原子または炭素数1から10のアルキル基で置き換えられてもよい。このシクロアルキル基における炭素数は3から10であり、任意の水素原子はハロゲン原子または炭素数1から10のアルキル基で置き換えられてもよい。)
である事を特徴とする化合物。
【請求項2】
式(a)のXが炭素数1〜4の飽和脂肪族アルキル基である事を特徴とする請求項1に記載の一般式(1)又は一般式(2)で表される完全縮合オリゴシルセスキオキサン。
【請求項3】
式(a)のXがメチル基である事を特徴とする請求項1に記載の一般式(1)又は一般式(2)で表される完全縮合オリゴシルセスキオキサン。
【請求項4】
一般式(1)又は一般式(2)又は一般式(3)
【化4】

【化5】

【化6】

で示され、Rは式(a)
【化7】

(式中、Xは、請求項1の定義と同じ意味を表す。)
で表される基である事を特徴とする完全縮合オリゴシルセスキオキサンの製造方法であって、炭素数1から3のハロゲン化炭化水素溶媒及び水存在下、第4級アンモニウム塩触媒下で一般式(4)
【化8】

(式中、Xは前記と同様である。式中、Yは夫々独立してアルキル基、アリールアルキル基またはシクロアルキル基である。このアルキル基における炭素数は1から4であり、任意の水素原子はハロゲン原子または炭素数1から5のアルキル基で置き換えられてもよい。このアリールアルキル基における炭素数は7から10であり、任意の水素原子はハロゲン原子または炭素数1から10のアルキル基で置き換えられてもよい。このシクロアルキル基における炭素数は3から10であり、任意の水素原子はハロゲン原子または炭素数1から10のアルキル基で置き換えられてもよい。)
で表されるケイ素化合物を加水分解縮合させて得る製造方法。
【請求項5】
一般式(4)のX及びYが炭素数1〜4の飽和脂肪族アルキル基である事を特徴とする請求項4に記載の一般式(1)又は一般式(2)又は一般式(3)で表される完全縮合オリゴシルセスキオキサンの製造方法。
【請求項6】
一般式(4)のXがメチル基であり、Yがエチル基ある事を特徴とする請求項4乃至請求項5の何れかに記載の一般式(1)又は一般式(2)又は一般式(3)で表される完全縮合オリゴシルセスキオキサンの製造方法。
【請求項7】
第4級アンモニウム塩がテトラアルキルアンモニウムフロリドである事を特徴とする請求項4乃至請求項6の何れかに記載の一般式(1)又は一般式(2)又は一般式(3)で表される完全縮合オリゴシルセスキオキサンの製造方法。
【請求項8】
第4級アンモニウム塩がテトラブチルアンモニウムフロリドである事を特徴とする請求項4乃至請求項7の何れかに記載の一般式(1)又は一般式(2)又は一般式(3)で表される完全縮合オリゴシルセスキオキサンの製造方法。
【請求項9】
ハロゲン化炭化水素溶媒が、ジクロロメタン及び/又はクロロホルムである事を特徴とする請求項4乃至請求項8の何れかに記載の一般式(1)又は一般式(2)又は一般式(3)で表される完全縮合オリゴシルセスキオキサンの製造方法。
【請求項10】
一般式(1)又は一般式(2)又は一般式(3)
【化9】

【化10】

【化11】

で示され、Rは式(a)
【化12】

(式中、Xは、請求項1の定義と同じ意味を表す。)
で表される完全縮合オリゴシルセスキオキサンの混合物を再結晶処理により、一般式(1)及び一般式(2)及び一般式(3)で表される完全縮合オリゴシルセスキオキサンに単離する事を特徴とする製造方法。
【請求項11】
再結晶処理の溶媒が、炭素数5から10の飽和脂肪族炭化水素、ベンゼン、飽和アルキル基を含む炭素数7から12の芳香族炭化水素、炭素数1から4の飽和脂肪族アルコール、炭素数1から3の飽和脂肪族ニトリル、炭素数1から3のハロゲン化脂肪族炭化水素から少なくても一つ以上が選択される事を特徴とする請求項10に記載の完全縮合オリゴシルセスキオキサンの製造方法。
【請求項12】
再結晶処理の温度が、マイナス80℃から30℃までの間で選択される請求項9乃至請求項11の何れかに記載の完全縮合オリゴシルセスキオキサンの製造方法。
【請求項13】
一般式(1)又は一般式(2)又は一般式(3)
【化13】

【化14】

【化15】

で示され、Rは式(a)
【化16】

(式中、Xは前記と同様である。)
で表される完全縮合オリゴシルセスキオキサンを硝酸でニトロ化し、Rを式(a)から式(b)
【化17】

に変換する事を特徴とする完全縮合オリゴシルセスキオキサンの製造方法。
【請求項14】
反応温度が、マイナス80℃から0℃までの間で選択される請求項13に記載の完全縮合オリゴシルセスキオキサンの製造方法。
【請求項1】
一般式(1)又は一般式(2)
【化1】

【化2】

で表される完全縮合オリゴシルセスキオキサンであり、Rはトリアルキルシリルフェニル基(a)又はニトロフェニル基(b)
【化3】

(式中、Xは夫々独立してアルキル基、アリールアルキル基またはシクロアルキル基である。このアルキル基における炭素数は1から10であり、任意の水素原子はハロゲン原子または炭素数1から5のアルキル基で置き換えられてもよい。このアリールアルキル基における炭素数は7から10であり、任意の水素原子はハロゲン原子または炭素数1から10のアルキル基で置き換えられてもよい。このシクロアルキル基における炭素数は3から10であり、任意の水素原子はハロゲン原子または炭素数1から10のアルキル基で置き換えられてもよい。)
である事を特徴とする化合物。
【請求項2】
式(a)のXが炭素数1〜4の飽和脂肪族アルキル基である事を特徴とする請求項1に記載の一般式(1)又は一般式(2)で表される完全縮合オリゴシルセスキオキサン。
【請求項3】
式(a)のXがメチル基である事を特徴とする請求項1に記載の一般式(1)又は一般式(2)で表される完全縮合オリゴシルセスキオキサン。
【請求項4】
一般式(1)又は一般式(2)又は一般式(3)
【化4】

【化5】

【化6】

で示され、Rは式(a)
【化7】

(式中、Xは、請求項1の定義と同じ意味を表す。)
で表される基である事を特徴とする完全縮合オリゴシルセスキオキサンの製造方法であって、炭素数1から3のハロゲン化炭化水素溶媒及び水存在下、第4級アンモニウム塩触媒下で一般式(4)
【化8】

(式中、Xは前記と同様である。式中、Yは夫々独立してアルキル基、アリールアルキル基またはシクロアルキル基である。このアルキル基における炭素数は1から4であり、任意の水素原子はハロゲン原子または炭素数1から5のアルキル基で置き換えられてもよい。このアリールアルキル基における炭素数は7から10であり、任意の水素原子はハロゲン原子または炭素数1から10のアルキル基で置き換えられてもよい。このシクロアルキル基における炭素数は3から10であり、任意の水素原子はハロゲン原子または炭素数1から10のアルキル基で置き換えられてもよい。)
で表されるケイ素化合物を加水分解縮合させて得る製造方法。
【請求項5】
一般式(4)のX及びYが炭素数1〜4の飽和脂肪族アルキル基である事を特徴とする請求項4に記載の一般式(1)又は一般式(2)又は一般式(3)で表される完全縮合オリゴシルセスキオキサンの製造方法。
【請求項6】
一般式(4)のXがメチル基であり、Yがエチル基ある事を特徴とする請求項4乃至請求項5の何れかに記載の一般式(1)又は一般式(2)又は一般式(3)で表される完全縮合オリゴシルセスキオキサンの製造方法。
【請求項7】
第4級アンモニウム塩がテトラアルキルアンモニウムフロリドである事を特徴とする請求項4乃至請求項6の何れかに記載の一般式(1)又は一般式(2)又は一般式(3)で表される完全縮合オリゴシルセスキオキサンの製造方法。
【請求項8】
第4級アンモニウム塩がテトラブチルアンモニウムフロリドである事を特徴とする請求項4乃至請求項7の何れかに記載の一般式(1)又は一般式(2)又は一般式(3)で表される完全縮合オリゴシルセスキオキサンの製造方法。
【請求項9】
ハロゲン化炭化水素溶媒が、ジクロロメタン及び/又はクロロホルムである事を特徴とする請求項4乃至請求項8の何れかに記載の一般式(1)又は一般式(2)又は一般式(3)で表される完全縮合オリゴシルセスキオキサンの製造方法。
【請求項10】
一般式(1)又は一般式(2)又は一般式(3)
【化9】

【化10】

【化11】

で示され、Rは式(a)
【化12】

(式中、Xは、請求項1の定義と同じ意味を表す。)
で表される完全縮合オリゴシルセスキオキサンの混合物を再結晶処理により、一般式(1)及び一般式(2)及び一般式(3)で表される完全縮合オリゴシルセスキオキサンに単離する事を特徴とする製造方法。
【請求項11】
再結晶処理の溶媒が、炭素数5から10の飽和脂肪族炭化水素、ベンゼン、飽和アルキル基を含む炭素数7から12の芳香族炭化水素、炭素数1から4の飽和脂肪族アルコール、炭素数1から3の飽和脂肪族ニトリル、炭素数1から3のハロゲン化脂肪族炭化水素から少なくても一つ以上が選択される事を特徴とする請求項10に記載の完全縮合オリゴシルセスキオキサンの製造方法。
【請求項12】
再結晶処理の温度が、マイナス80℃から30℃までの間で選択される請求項9乃至請求項11の何れかに記載の完全縮合オリゴシルセスキオキサンの製造方法。
【請求項13】
一般式(1)又は一般式(2)又は一般式(3)
【化13】

【化14】

【化15】

で示され、Rは式(a)
【化16】

(式中、Xは前記と同様である。)
で表される完全縮合オリゴシルセスキオキサンを硝酸でニトロ化し、Rを式(a)から式(b)
【化17】

に変換する事を特徴とする完全縮合オリゴシルセスキオキサンの製造方法。
【請求項14】
反応温度が、マイナス80℃から0℃までの間で選択される請求項13に記載の完全縮合オリゴシルセスキオキサンの製造方法。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【公開番号】特開2011−98939(P2011−98939A)
【公開日】平成23年5月19日(2011.5.19)
【国際特許分類】
【出願番号】特願2009−255943(P2009−255943)
【出願日】平成21年11月9日(2009.11.9)
【出願人】(391010895)小西化学工業株式会社 (19)
【Fターム(参考)】
【公開日】平成23年5月19日(2011.5.19)
【国際特許分類】
【出願日】平成21年11月9日(2009.11.9)
【出願人】(391010895)小西化学工業株式会社 (19)
【Fターム(参考)】
[ Back to top ]

