官能化された防汚化合物及びその使用
本発明は、α炭素上に置換アリールを含み、それによってその置換基がポリマーへの結合又はその中への組み込みのための手段を提供するα,α−二置換アミド化合物の誘導体に関する。驚くべきことに、アリール上でのそうした置換基の提供は、ポリマーへの結合又はその中への組み込みを可能にするだけでなく、有用な防汚活性の保持も可能にすることを見出した。複数の実施形態では、該置換基は、ヒドロキシル、エーテル、エステル、カルボキシル、アルキルシリル及びアルケニルから選択される。実験により、防汚活性が対応する非置換化合物と同等か又はそれ以上に良好であり、該置換化合物を含むか又はそれから形成されるように官能化されたポリマーを、沈降を低減させるのに使用できることを実証する。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、防汚活性及び/又は抗菌活性を示す官能化されたアミド小分子並びに海洋環境における細菌膜及び生物の増殖の制御におけるその使用に関する。
【背景技術】
【0002】
海洋汚損とは、水面下の人工物表面上における生物の沈降(settlement)及び増殖を指し、これは海洋の歴史始まって以来の問題である。水面下表面の海洋生物による集落形成はそうした表面が海洋環境に入って数日から数週間以内に起こり、長期に存在し続ける海洋構造物(水中ケーブル、発電機、パイプライン等)ではそうした集落形成は起こるのは当然である。汚損生物に対する戦いはますます重要な課題になってきている。海洋汚損を制御するための効果的な方法の必要性は、国際海運業界にとって最も重要なものである。
【0003】
防汚コーティングは一般に、有機スズや銅化合物などの広範な殺生物剤の作用で幼生汚損体を殺傷することによって海洋生物の沈降を防止する。著しく効果的ではあるが、有機スズ化合物の使用によってもたらされる環境劣化が非常に激しいので、船舶用塗料の企業は2003年にこれらの塗料を市場から自主的に引き上げており、IMOは2008年に有機スズ化合物の使用を禁止した(2008年9月17日に発効された船舶の有害な防汚システムの規制に関する国際条約(International Convention on the Control of Harmful Anti−fouling Systems on Ships))。銅及び殺生物剤ブースター含有塗料は依然として広く利用されているが、海洋環境において蓄積される可能性があるのでその使用は望ましくない(Voulvoulis、2006年)。
【0004】
現在市販されている海洋用コーティングは2つの部類に分けることができる:防汚コーティングと汚損放出コーティングである。防汚コーティングは、酸化によるか、又はより一般的には毒性金属イオンへの曝露によって汚損体を殺傷する広範な殺生物剤を使用する。汚損放出コーティングは主としてきれいにするのが簡単なシリコンベースのポリマーであるが、これらのうち最も好ましいものは、通常、生物を殺傷する添加剤や触媒も含有する。上記したように、コーティングにおいてトリブチルスズなどの毒性のある防汚剤は環境面で許容されないという結果の認識にもとづいた法律及び合意により、環境的に有害性のより少ない新規なコーティングの開発に対する関心が促進されてきた。
【0005】
Teoら(本出願の発明者)により米国特許第11/265,833号に報告されているアプローチは防汚剤としての薬剤の使用である。その薬剤は汚損生物の変態を破壊できることが実証されている。その公知の合成法、化学的特性並びに脊椎動物及びヒトにおける主要な作用機構と併せて、市販の薬剤は防汚剤の潜在的な供給源としてスクリーニングされた。有望な生物活性を有する8つの薬剤が報告されているが、これらの薬剤は海洋環境において蓄積され得るという問題が依然として残っている。さらに、これらの薬剤のいくつかには、海水中における難溶性に起因する送達の問題という課題がある。
【0006】
広範な殺生物剤に対する他の代替物は、海洋生物の沈降を阻害する生分解性の有機小分子である。そうした分子は環境において扱いにくいはずはなく、また「優しい設計(benign by design)」であるはずである。この目的を達成するために、Teoらは最近、フジツボ幼生及び細菌性生物膜に対する単純なα,α−二置換アミド(選択された例を以下に示す)のファミリーの防汚可能性を実証した(PCT/SG2009/000175)。これらの分子は、海洋環境において急速に分解すると予測される。
【化1】

【0007】
多くの有機殺生物剤が非スズ系塗料への添加剤として用いられているが、小分子をコーティング系の中に直接組み込むことによりいくつかの問題が提起されている。まず、定期的な乾ドックに先立つ船舶の再塗装のための要件を最少化するために、有機汚損防止剤の放出が数年間維持されなければならないことである。さらに、現在使用されている多くの有機汚損防止剤は海洋汚損体に対して毒性があり、これは使用量が増すと蓄積された場合に海洋生態系に悪影響を及ぼす可能性がある。有機汚損防止剤の物理的特性は市販のコーティング系の完全性に対しても大きな影響を及ぼす可能性があり、これにより、金属をベースとした結合剤の非存在下では、コーティング系の配合変更(reformulation)が必要となる可能性がある。
【0008】
極めて重要なことであるが、小分子がコーティング系に組み込まれる機構は、小分子の活性の保持を可能にするはずである。小分子の構造改変は活性に対して影響を及ぼすことが予想されるので、何らかの活性分子をコーティング系に組み込むことはチャレンジングな課題である。
【発明の概要】
【発明が解決しようとする課題】
【0009】
本発明者らは、コーティング系中に組み込むのに適した環境に優しい殺生物剤及びそうした殺生物剤を含むコーティング系を提供する課題に対処しようとするものである。
【課題を解決するための手段】
【0010】
最も一般的には、本発明は、特定のアリール含有α,α−二置換アミドが、その置換基がコーティング組成物のある成分、例えばあるポリマーと結合するのに適しているアリール上の1つ又は複数の選択された置換基を備えておくべきであると提案する。驚くべきことに、この特定の方法で改変されたアミド化合物は有用な活性を保持している。
【0011】
特に、PCT/SG2009/000175に記載されている小分子防汚添加剤の誘導体が本明細書で開示されており、その誘導体は、例えば自己研磨型コーティング系との共有結合を可能にする官能基を備えている。添加剤を既存のコーティング系と共有結合させることができるということは、その制御放出を容易にする、したがってコーティング寿命を延長し、防汚特性を高める潜在性を有している。さらなる研究によれば、生物学的効力をそれほど損なうことなくコーティング系と安定的に結合できるようにし、それによって既存の放出化学(pre−existing release chemistry)による生体活性分子の放出を可能にする構造的改変が確認されている。
【0012】
特に、本出願は、海洋用コーティング系との結合点として働く官能基を担持する一連のα−アリールアミドの合成及び生物学的試験について説明する。望ましい防汚特性を保持しており(フジツボキプリド(barnacle cyprid)の沈降に対する効力は高いが、毒性は低い)、同時に既存のコーティング系との共有結合を可能にするエステル又はエーテル結合を含むいくつかの分子について説明する。
【0013】
化合物
本発明は一般に、以下の一般的α,α−二置換構造:
【化2】

(式中、RAとRBの一方若しくはその両方はアリールであり、RC及びRDは独立に任意選択で置換されたアルキルを表すか、又は一緒になって環を形成している)
を有する、本明細書で「防汚アミド化合物」と称する1つの部類の化合物に関する。
【0014】
本発明は、そうした化合物のRAとRBの一方又はその両方のアリール基を、コーティング系(例えば、ポリマー)との連結が可能になるように調整された1つ又は複数の基で官能化すべきであると提案する。さらに、本発明は、そうした基のコーティング系(例えば、ポリマー)からの開裂の産物であるアリール置換基を有する化合物は有用な活性を保持できるということを提案する。
【0015】
本発明は殺生物特性又はバイオスタティック特性を示すそうした防汚アミド化合物に関する。したがって、防汚アミド化合物は、「殺生物性化合物」又は「バイオスタティック化合物」と称することもできる。
【0016】
本発明の実施形態は、既存の海洋用コーティング系の防汚特性を高める潜在性を有している。特に、実施形態は以下の利点、すなわちフジツボ沈降に対する高い効力、低い毒性、及び海洋環境において急速に分解しそうである(環境に優しい)ことの1つ又は複数を有することが好ましい。
【0017】
アリール基を異なる官能基で置換することを、異なるコーティング及び異なる用途のために特性を調整する結合点として用いることができる。
【0018】
この系の利点は、既存のコーティング系にこれらの分子を組み込める潜在性にあり、汚損防止剤の放出はコーティングの寿命と直結することになる。
【0019】
第1の態様では、本発明は、式(I)の化合物又はその塩:
【化3】

(式中、
R1及びR2はそれぞれ独立に、
(A)OH、RS1OH、ORS2、RS1ORS2、OC(O)H、OC(O)RS2、RS1OC(O)H、RS1OC(O)RS2、C(O)OH、C(O)ORS2、RS1C(O)OH、RS1C(O)ORS2、ORS1OH、ORS1ORS2、ORS1OC(O)H、ORS1OC(O)RS2、ORS1C(O)OH及びORS1C(O)ORS2の少なくとも1つで置換されたアリールであって、
存在する場合、各RS1が独立に、任意選択で置換されたC1〜C5アルキレンであり、
存在する場合、各RS2が独立に、任意選択で置換されたC1〜C5アルキル、C2〜C5アルケニル及びC1〜C5シリル−C1〜C5アルキレンから選択されるアリール、
(B)任意選択で置換されたC3〜C12アルキル
から選択され、
但し、R1及びR2の少なくとも1つは(A)であり、
R3及びR4はそれぞれ独立に、任意選択で置換されたC1〜C6アルキルであるか、又はR3とR4は一緒になって、それらが結合している窒素を組み込んだ任意選択で置換された5〜12員複素環を形成している)
を提供する。
【0020】
R1とR2の両方が(A)、すなわちアリールであることは可能であるが、R1とR2のうちの1つは(B)である、すなわちC3〜C12アルキルであることが好ましい。
【0021】
本明細書で説明するように、C3〜C12アルキルは、飽和及び不飽和の分岐状及び非分岐状C3〜C12アルキルを含む。いくつかの好ましい実施形態では、そのアルキルは不飽和アルキルである。特に、好ましくはR1及びR2の少なくとも1つは、不飽和C3〜C12アルキル、好ましくは不飽和C3〜C10アルキル、好ましくは不飽和C3〜C8アルキル、最も好ましくは不飽和C3〜C6アルキルである。したがって、好ましくは、R1及びR2の少なくとも1つは、C3〜C12アルケニル、より好ましくはC3〜C10アルケニル、より好ましくはC3〜C8アルケニル、最も好ましくはC3〜C6アルケニルである。実際、不飽和を加えると、飽和アルキルに匹敵する活性を提供することができる。
【0022】
そうした実施形態では、アルケニル中に1個の炭素−炭素二重結合、例えばC3〜C10アルケニル中に1個の炭素−炭素二重結合又はC3〜C6アルケニル中に1個の炭素−炭素二重結合が存在することが好ましい。炭素−炭素二重結合はアルケニル基の末端にある、すなわちCn炭素とCn−1炭素との間の末端炭素−炭素二重結合であることが適切である。C6アルケニルが特に好ましい。特に好ましいアルケニルはC6アルケニルであり、最も好ましくは5−ヘキセニル(−CH2−(CH2)3−CH=CH2)である。
【0023】
複数の実施形態では、R1及びR2の少なくとも1つはC3〜C5アルキルである。アリール上の指定された置換基の1つ又は複数と一緒に3〜5個の炭素原子を有するα炭素上のアルキル基、特に飽和アルキルは、防汚活性を提供するのに特に有用であり、同時に海水への望ましい溶解性及び分解性も示す。
【0024】
複数の実施形態では、R1及びR2の少なくとも1つはC4アルキル、より好ましくはn−ブチルである。α炭素上のC4アルキル基、特にn−ブチルは、アリール上の指定置換基の1つ又は複数と一緒になって驚くほど高いレベルの防汚活性を提供することができ、これは適切な速度で分解される。
【0025】
R1は、C3〜C8アルキル、好ましくはC3〜C6アルキル、より好ましくはC4〜C6アルキル、最も好ましくはC4アルキル又はC6アルキルであることが好ましい。R2は(A)であることが適切である。
【0026】
本明細書で説明するように、R1及びR2の一方は(A)、すなわちアリール(以下で論じるように好ましくはC5〜C15アリール、より好ましくはフェニル)であり、他方はC3〜C12アルキル(好ましくはC3〜C6アルキル、より好ましくはn−ブチル又は5−ヘキセニル)である。本発明者らが実施した試験は、アリール上の指定置換基の1つ又は複数と併せたこの置換パターンで望ましいレベルの防汚活性が可能であることを実証している。
【0027】
したがって、R1及びR2の1つは、飽和C3〜C5アルキル及びC3〜C10アルケニルから選択されることが好ましい。アルキル(飽和又は不飽和)は任意選択で置換されているが、それは置換されていないことが好ましい。
【0028】
適切には、(A)のアリールは、C5〜C15アリール、好ましくはC6〜C12アリール、より好ましくはC6〜C10アリール、最も好ましくはC6アリールである。アリールはカルボアリール又はヘテロアリールであってよいが、カルボアリールが好ましい。特に好ましいのはフェニルである。
【0029】
好ましくは、R1は(B)であり、R2は
【化4】

(式中、RA1、RA2、RA3、RA4及びRA5はそれぞれ独立に、OH、RS1OH、ORS2、RS1ORS2、OC(O)H、OC(O)RS2、RS1OC(O)H、RS1OC(O)RS2、C(O)OH、C(O)ORS2、RS1C(O)OH、RS1C(O)ORS2、ORS1OH、ORS1ORS2、ORS1OC(O)H、ORS1OC(O)RS2、ORS1C(O)OH、ORS1C(O)ORS2、H及びRS2から選択され、
存在する場合、各RS1は独立に、任意選択で置換されたC1〜C5アルキレンであり、
存在する場合、各RS2は独立に、任意選択で置換されたC1〜C5アルキル、C2〜C5アルケニル及びC1〜C5アルキルシリル−C1〜C5アルキレンから選択され、
但し、RA1、RA2、RA3、RA4及びRA5の少なくとも1つはHでもなくRS2でもない)
である。
【0030】
各RS1は独立に、任意選択で置換されたC1〜C3アルキレン、好ましくは任意選択で置換されたC1〜C2アルキレン、最も好ましくはメチレンから選択されることが適切である。RS1は置換されていないことが適切である。
【0031】
各RS2は独立に、任意選択で置換されたC1〜C3アルキル、C2〜C3アルケニル及びC1〜C3シリル−C1〜C3アルキレンから選択されることが適切である。疑念を回避するためであるが、本明細書で称するシリル−アルキレンは、Si(Me)3などのシリルで置換されたアルキレン(例えば、−CH2−CH2−)である。
【0032】
好ましくは、各RS2は独立に、任意選択で置換されたC1〜C2アルキル、C2〜C3アルケニル及びC1アルキルシリル−C1〜C3アルキレンから選択される。特に好ましいものは、各RS2が独立にメチル、CH2=CH−及び(Me)3Si−CH2−CH2−から選択されるものである。
【0033】
特に好ましい実施形態では、RA1、RA2、RA3、RA4及びRA5はそれぞれ独立に、OH、OMe、C(O)OH、CH2OH、CH2OAc、OC(O)CH3、OCH2C(O)OH、OCH2C(O)OCH3、OCH2CH2OH、OCH2CH2OC(O)CH3、OCH2CH2Si(Me)3、OC(O)CH=CH2及びHから選択される。但し、RA1、RA2、RA3、RA4及びRA5の少なくとも1つはHではない。
【0034】
特に好ましい実施形態では、RA1、RA2、RA3、RA4及びRA5はそれぞれ独立に、OH、OMe、CH2OH、OC(O)CH3、OCH2CH2OH、OCH2CH2Si(Me)3、OC(O)CH=CH2及びHから選択される。但し、RA1、RA2、RA3、RA4及びRA5の少なくとも1つはHではない。
【0035】
さらに好ましい実施形態では、RA1、RA2、RA3、RA4及びRA5はそれぞれ独立に、OH、OMe、OC(O)CH=CH2及びHから選択される。但し、RA1、RA2、RA3、RA4及びRA5の少なくとも1つはHではない。
【0036】
アリール上で複数の置換基が可能であるが、RA1、RA2、RA3、RA4及びRA5の少なくとも2つがHである、より好ましくはRA1、RA2、RA3、RA4及びRA5の少なくとも3つがHであることが好ましい。したがって、一置換及び二置換アリール(例えば、フェニル)が好ましい。
【0037】
置換基は1位〜5位のいずれか、すなわちオルト、メタ又はパラ置換基であってよい。しかし、3位(メタ)が好ましい。したがって、RA3はHではないことが適切である。
【0038】
R3とR4は一緒になって、任意選択で置換された5〜10員複素環、好ましくは5〜7員複素環、最も好ましくは6員複素環を形成していることが適切である。複素環はピペリジンであることが特に好ましい。
【0039】
特に好ましい実施形態では、R3とR4は一緒になって式(II):
【化5】

(式中、R5及びR6はそれぞれ独立に、ヒドロキシル、任意選択で置換されたC1〜C6アルキル、任意選択で置換されたフェニル及びHから選択される)
による、それらが結合している窒素を組み込んだ任意選択で置換された6員複素環を形成している。R5及びR6はそれぞれ独立に、ヒドロキシル、任意選択で置換されたC1〜C6アルキル及びHから選択されることが好ましい。R5及びR6はHであることが特に好ましい。
【0040】
他の実施形態では、R3及びR4はそれぞれ独立に、任意選択で置換されたC1〜C6アルキル、より好ましくはC1〜C3アルキルから選択される。
【0041】
R3及びR4は置換されていないことが適切である。R3及びR4のそれぞれが飽和アルキルであることも好ましい。
【0042】
R3及びR4は同じであっても異なっていてもよい。それらは同じであることが好ましい。
【0043】
複数の実施形態では、R3とR4はどちらもメチルである。
【0044】
その化合物は式(III)又は式(IV)の化合物
【化6】

(式中、RA1、RA2、RA3、RA4及びRA5はそれぞれ独立に、OH、RS1OH、ORS2、RS1ORS2、OC(O)H、OC(O)RS2、RS1OC(O)H、RS1OC(O)RS2、C(O)OH、C(O)ORS2、RS1C(O)OH、RS1C(O)ORS2、ORS1OH、ORS1ORS2、ORS1OC(O)H、ORS1OC(O)RS2、ORS1C(O)OH、ORS1C(O)ORS2、H及びRS2から選択され、
存在する場合、各RS1は独立に、任意選択で置換されたC1〜C5アルキレンであり、
存在する場合、各RS2は独立に、任意選択で置換されたC1〜C5アルキル、C2〜C5アルケニル及びC1〜C5アルキルシリル−C1〜C5アルキレンから選択され、
但し、RA1、RA2、RA3、RA4及びRA5の少なくとも1つはHでもなくRS2でもない)
であることが適切である。
【0045】
複数の実施形態では、存在する場合、各RS1は独立に任意選択で置換されたC1〜C3アルキレンであり、存在する場合、各RS2は独立に、任意選択で置換されたC1〜C3アルキル、C2〜C3アルケニル及びC1〜C3アルキルシリル−C1〜C3アルキレンから選択される。
【0046】
その化合物は化合物15.1、15.2、15.3、15.4、15.5、15.6、15.7、16.1、16.2、16.3、16.4、16.5、16.6、16.7、16.8、16.9、16.10、16.11、17.1、17.2、17.3、17.4、17.5、17.6、17.7、17.8及び17.9から選択されることが適切である。
【0047】
好ましくは、その化合物は化合物15.3、15.4、15.5、16.11、17.1、17.3、17.4、17.6、17.8、15.1、16.1、16.2、16.4、16.5、16.6、16.10及び17.5から選択される。より好ましくは、その化合物は化合物15.3、15.4、15.5、16.11、17.1、17.3、17.4、17.6及び17.8から選択される。
【0048】
好ましい実施形態では、これらの化合物(及び本明細書で説明するポリマー)を、それらが早発的な分解からは保護されるが所定の目標時間では放出され、その後、環境内の細菌によって分解されるような方法で、コーティング中に組み込む。当技術分野の読者は、この方法で分子を送達するのに、ポリマー/コーティング化学における最新技術により、その用途からの要求に応じて複数の方法が提供されることを認識しておられよう。
【0049】
好ましい実施形態では、これらの化合物(及び本明細書で説明するポリマー)を、海洋生物付着(marine growth)を防止するための防汚剤として従来の防汚コーティング中に組み込む。例えば、化合物を既存のアクリレート塗料中にブレンドすることができる。したがって、これらの化合物は、現在のコーティングの選択肢に対する実際的な代替手段である。特に、これらの化合物を、容易に分解しない既存のブースター殺生物剤の代わりとして、既存のコーティング配合物における既存ブースター殺生物剤の使用を低減する、及び/又は性能を向上させるのに既存のコーティング配合物を増大させるための環境的により安全な代替物として提示することができる。この関連では、いくつかの化合物は油状物であり、コーティング中、例えばシリコンベースの汚損除去コーティング中に組み込むのに適切なことに相溶性である。複数の実施形態では、この相溶性はそのコーティングの有効性を増大させ、それによってコーティングされた基材はさらなる保護性という利益を受けることができる。
【0050】
さらに、これらの化合物(及び本明細書で説明するポリマー)を、従来の防汚コーティング中に存在する銅/金属を低減するか又は置き換えるという方法で適用し、それによって防汚コーティングの環境影響を低減させることができる。
【0051】
これらの化合物(及び本明細書で説明するポリマー)を、バラスト水処理などの海水処理プロセスでの海洋生物の除去において使用することができ、また冷却水中及び脱塩プロセスにおける海洋物増殖の制御のために使用できることが適切である。これらの化合物(及び本明細書で説明するポリマー)は、環境汚損を防止するため、及びコンプライアンスの目的で、活性薬剤の迅速な分解/除去が必要なプロセスに特に適している。
【0052】
ポリマー
本発明は一般に、防汚アミド化合物を例えばペンダント基として含む、本明細書で「防汚ポリマー」と称するポリマーの部類にも関する。
【0053】
他の態様では、本発明は、第1の態様による防汚化合物から形成される少なくとも1つの繰り返し単位を含むポリマーを提供する。
【0054】
複数の実施形態では、その化合物を、フリーラジカル重合又はシリル含有基の重合によってポリマー中に組み込む。したがって、好ましくは、そのポリマーは、不飽和炭素−炭素結合を有する1つ若しくは複数のモノマー、例えばビニル又は(メタ)アクリレートモノマーから形成されるポリマー及びシリコーンポリマーから選択される。
【0055】
ポリマーは(メタ)アクリレートポリマーであることが適切である。ポリマーは、メチルメタクリレート(MMA)、ヒドロキシエチルアクリレート(HEA)及びビニルピロリジノン(VP)の1つ又は複数から誘導される繰り返し単位を含むことが適切である。好ましくは、そのポリマーはコポリマーである。
【0056】
複数の実施形態では、そのポリマーは式X
【化7】

(式中、
R1は任意選択で置換されたC3〜C12アルキルであり、
R3及びR4はそれぞれ独立に、任意選択で置換されたC1〜C6アルキルであるか、又はR3とR4は一緒になって、それらが結合している窒素を組み込んだ任意選択で置換された5〜12員複素環を形成しており、
各RAXは独立に、本明細書で説明するRA1〜RA5のいずれか1つについての選択肢から選択され、
nは0〜4の範囲の整数であり、
RLは連結基である)
によるペンダント基を含む。
【0057】
R1、R3及びR4の関連で任意選択の好ましい特徴は、第1の態様について上記した通りである。
【0058】
好ましくは、RLは1〜5個の原子鎖、好ましくは1〜3個の原子鎖、より好ましくは2個の原子鎖である。その鎖の原子はC及びOから選択されることが適切である。好ましくは、その連結基は−O−、−C(O)−及び−CH2−単位の1つ又は複数を含む。特に好ましいのは、構造:{[−O−]a[−C(O)]b[−CH2−]c}d(式中a、b、c及びdはそれぞれ独立に、0〜4、より好ましくは0〜2の範囲の整数から選択される)を有する連結基である。
【0059】
複数の実施形態では、RLは、−O−、RL1O、ORL2、RL1ORL2、OC(O)、OC(O)RL2、RL1OC(O)、RL1OC(O)RL2、C(O)O、C(O)ORL2、RL1C(O)O、RL1C(O)ORL2、ORL1O、ORL1ORL2、ORL1OC(O)、ORL1OC(O)RL2、ORL1C(O)O及びORL1C(O)ORL2から選択され、
存在する場合、各RL1は独立に、任意選択で置換されたC1〜C5アルキレンであり、
存在する場合、各RL2は独立に、任意選択で置換されたC1〜C5アルキレンである。
【0060】
したがって、連結基RLは、対応する「遊離」化合物の置換基RA1、RA2等に対応していてよい、例えばそれらから形成される基であってよい。
【0061】
好ましくは、RLは−OC(O)−である。
【0062】
適切には、nは0又は1であり、好ましくはnは0である(すなわち、そのアリールは他の置換基をもたない)。
【0063】
ペンダント基は、海洋環境においてポリマーから放出可能であることが適切である。特に、ペンダント基は加水分解によってポリマーから放出されることが好ましい。例えば、これは、ペンダント(生体活性)基が水性の環境で放出されるようにする。
【0064】
他の態様では、本発明は、式(XI):
【化8】

(式中、Polはポリマー主鎖であり、R1、R3、R4、RAX、n及びRLはそれぞれ式(X)に関して定義した通りである)
によるポリマーを提供する。
【0065】
ポリマーのTgは室温より高いことが好ましい。
【0066】
ポリマーの分子量は、GPCで測定して少なくとも5KDa、好ましくは少なくとも10KDaであることが好ましい。
【0067】
ポリマーは徐放性又は持続放出性のポリマーであり、それによって防汚化合物、好ましくは第1の態様の防汚化合物が使用の際にポリマーから放出されることが適切である。
【0068】
他の態様では、本発明は、ポリマーを製造する方法における式(I)の化合物又はその塩の使用を提供する。
【0069】
他の態様では、本発明は、式(I)の化合物又はその塩をコモノマーと共重合させることによって作製されるポリマーを提供する。好ましくは、コモノマーは(メタ)アクリレート及びビニルモノマーから選択される。
【0070】
他の態様では、本発明は、汚損を減少させる又は防止する方法における本明細書で説明するような化合物、ポリマー又はコーティング組成物の使用を提供する。
【0071】
汚損を減少させる又は防止する方法は、細菌、真菌、藻類及び原生動物の1つ又は複数による生物膜形成を減少させる又は防止する方法であることが適切である。
【0072】
他の態様では、本発明は、基材の汚損を防止する又は減少させる方法であって、本明細書で説明するような化合物、ポリマー又はコーティングをその基材に塗布するステップを含む方法を提供する。
【0073】
その防汚アミド化合物又はポリマーを、汚損を防止する又は減少させるのに効果的な量及び濃度で塗布することが適切である。防汚アミド化合物又はポリマーを標準濃度で提供することが好ましい。
【0074】
他の態様では、本発明は、本明細書で説明するような化合物又はポリマーを含むコーティング組成物を提供する。
【0075】
他の態様では、本発明は、本明細書で説明するような防汚アミド化合物又はポリマーを含む防汚組成物を提供する。
【0076】
他の態様では、本発明は、本明細書で説明するような防汚アミド化合物又はポリマーを含むコーティング組成物を提供する。そのコーティング組成物は慣用的な添加剤、例えば結合剤を含むことが適切である。コーティング組成物は塗料組成物であることが適切である。例えば、その組成物はアクリレート樹脂を含むことができる。コーティング組成物は自己研磨型塗料、好ましくはアクリル系自己研磨型塗料又はシリコーンコーティングであることが適切である。
【0077】
他の態様では、本発明は、本明細書で説明するような防汚アミド化合物を含むコーティングを提供する。
【0078】
他の態様では、本発明は、塗布されたコーティングを有する基材であって、そのコーティングが本明細書で説明するような防汚アミド化合物又はポリマーを含む基材を提供する。例えば、その基材は船舶、例えばボートであってよい。
【0079】
他の態様では、本発明は、本明細書で説明するような防汚アミド化合物又はポリマーを含む静菌性組成物を提供する。
【0080】
他の態様では、本発明は、本明細書で説明するような防汚アミド化合物又はポリマーを含む殺菌性組成物を提供する。
【0081】
他の態様では、本発明は、本明細書で説明するような防汚アミド化合物又はポリマーを含む殺生物性組成物を提供する。
【0082】
他の態様では、本発明は、本明細書で説明するような防汚アミド化合物又はポリマーを含むバイオスタティック組成物を提供する。
【0083】
他の態様では、本発明は、本明細書で説明するような防汚アミド化合物又はポリマーを含む汚損防止剤組成物を提供する。
【0084】
これらの態様のいずれかの任意選択で好ましい特徴の任意の1つ又は複数を、単独か又は組み合わせて、他の態様のいずれか1つに適用することができる。
【図面の簡単な説明】
【0085】
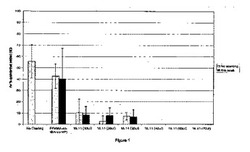
【図1】図1は、本発明の化合物(16.11)から誘導される繰り返し単位を含むポリマーでコーティングされたウェル中でのフジツボの沈降の平均パーセンテージを示す図である。対照コーティング上への沈降は、コーティングされていないポリスチレンについてと同様であった。これに対して、P(MMA−co−16.11−co−VP)の量を増大させると、フジツボの沈降は減少する結果となった。>40μlでの試験処理では沈降は認められなかった。
【発明を実施するための形態】
【0086】
化学用語
本明細書で用いる「飽和(の)」という用語は、炭素−炭素二重結合又は炭素−炭素三重結合を全くもたない化合物及び/又は基を指す(pertain)。
【0087】
本明細書で用いる「不飽和(の)」という用語は、少なくとも1つの炭素−炭素二重結合又は炭素−炭素三重結合を有する化合物及び/又は基を指す。化合物及び/又は基は、部分不飽和であっても完全不飽和であってもよい。
【0088】
本明細書で用いる「カルボ」、「カルビル」、「ヒドロカルボ」及び「ヒドロカルビル」という用語は、炭素及び水素原子だけを有する化合物及び/又は基を指す。
【0089】
本明細書で用いる「ヘテロ」という用語は、少なくとも1個のヘテロ原子、例えばホウ素、ケイ素、窒素、リン、酸素、硫黄及びセレン(より一般的には窒素、酸素及び硫黄)などの多価ヘテロ原子(これらは環ヘテロ原子としても適している)並びにフッ素、塩素、臭素及びヨウ素などの一価ヘテロ原子を有する化合物及び/又は基を指す。
【0090】
本明細書で用いる「任意選択で置換された」という語句は、置換されていても置換されていなくてもよい親基を指す。
【0091】
別段の指定のない限り、本明細書で用いる「置換された」という用語は、1つ又は複数の置換基を担持している親基を指す。「置換基」という用語は本明細書では慣用的な意味において用いられ、親基と共有結合しているか、又は適切な場合、それと縮合している化学部分を指す。様々な置換基が周知であり、その形成方法及び様々な親基への導入方法も周知である。
【0092】
アルキル:本明細書で用いる「アルキル」という用語は、1〜20個の炭素原子(別段の指定のない限り)を有する炭化水素化合物の炭素原子から水素原子を取り外すことによって得られる一価部分を指し、これは、脂肪族であっても脂環式であってもよく、飽和であっても不飽和(例えば、部分不飽和、完全不飽和)であってもよい。したがって、「アルキル」という用語は、以下で論じるアルケニル、アルキニル、シクロアルキル、シクロアルケニル、シクロアルキニル等の下位部類を含む。
【0093】
アルキル基の関連で、接頭辞(例えば、C1〜C4、C1〜C5等)は、炭素原子数又は炭素原子数の範囲を表す。例えば、本明細書で用いる「C1〜C4アルキル」という用語は、1〜4個の炭素原子を有するアルキル基を指す。アルキル基の群の例には、C1〜C4アルキル(「低級アルキル」)及びC2〜C6アルキルが含まれる。最初の接頭辞は、他の限定によって変わり得ることに留意されたい。例えば、不飽和アルキル基では最初の接頭辞は少なくとも2でなければならず、環状及び分岐状アルキル基では最初の接頭辞は少なくとも3でなければならない等である。
【0094】
(非置換)飽和アルキル基の例には、これらに限定されないが、メチル(C1)、エチル(C2)、プロピル(C3)、ブチル(C4)、ペンチル(C5)及びヘキシル(C6)が含まれる。
【0095】
(非置換)飽和直鎖状アルキル基の例には、これらに限定されないが、メチル(C1)、エチル(C2)、n−プロピル(C3)、n−ブチル(C4)、n−ペンチル(アミル)(C5)及びn−ヘキシル(C6)が含まれる。
【0096】
(非置換)飽和分岐状アルキル基の例には、イソプロピル(C3)、イソブチル(C4)、sec−ブチル(C4)、tert−ブチル(C4)、イソペンチル(C5)、及びネオペンチル(C5)が含まれる。
【0097】
アルケニル:本明細書で用いる「アルケニル」という用語は、1つ又は複数の炭素−炭素二重結合を有するアルキル基を指す。アルケニル基の群の例には、C2〜4アルケニル、C2〜7アルケニル、C2〜20アルケニルが含まれる。
【0098】
(非置換)不飽和アルケニル基の例には、これらに限定されないが、エテニル(ビニル、−CH=CH2)、1−プロペニル(−CH=CH−CH3)、2−プロペニル(アリル、−CH−CH=CH2)、イソプロペニル(1−メチルビニル、−C(CH3)=CH2)、ブテニル(C4)、ペンテニル(C5)及びヘキセニル(C6)が含まれる。
【0099】
ヒドロキシ−C1〜C6アルキル:本明細書で用いる「ヒドロキシ−C1〜C6アルキル」という用語は、少なくとも1個の水素原子(例えば、1個、2個、3個)がヒドロキシ基で置き換えられているC1〜C6アルキル基を指す。そうした基の例には、これらに限定されないが、−CH2OH、−CH2CH2OH及び−CH(OH)CH2OHが含まれる。
【0100】
水素:−H。特定の位置の置換基が水素である場合、その化合物又は基はその位置で「置換されていない」と呼ぶのが好都合であり得ることに留意されたい。
【0101】
アリール:本明細書で用いる「アリール」という用語は、芳香族化合物の芳香環原子から水素原子を取り外すことによって得られる一価部分を指し、この部分は3〜20個の環原子(別段の指定のない限り)を有する。各環は5〜7個の環原子を有することが好ましい。
【0102】
この関連で、接頭辞(例えば、C3〜20、C5〜7、C5〜6等)は、炭素原子か又はヘテロ原子である環原子の数又は環原子の数の範囲を表す。例えば、本明細書で用いる「C5〜6アリール」という用語は、5又は6個の環原子を有するアリール基を指す。アリール基の群の例には、C3〜20アリール、C5〜20アリール、C5〜15アリール、C5〜12アリール、C5〜10アリール、C5〜7アリール、C5〜6アリール、C5アリール及びC6アリールが含まれる。
【0103】
環原子は「カルボアリール基」の場合のようにすべて炭素原子であってよい。カルボアリール基の例には、C3〜20カルボアリール、C5〜20カルボアリール、C5〜15カルボアリール、C5〜12カルボアリール、C5〜10カルボアリール、C5〜7カルボアリール、C5〜6カルボアリール、C5カルボアリール及びC6カルボアリールが含まれる。
【0104】
カルボアリール基の例には、これらに限定されないが、ベンゼン(すなわち、フェニル)(C6)、ナフタレン(C10)、アズレン(C10)、アントラセン(C14)、フェナントレン(C14)、ナフタセン(C18)及びピレン(C16)から誘導されるものが含まれる。
【0105】
その少なくとも1つが芳香環である縮合環を含むアリール基の例には、これらに限定されないが、インダン(例えば、2,3−ジヒドロ−1H−インデン)(C9)、インデン(C9)、イソインデン(C9)、テトラリン(1,2,3,4−テトラヒドロナフタレン(C10)、アセナフテン(C12)、フルオレン(C13)、フェナレン(C13)、アセフェナントレン(C15)及びアセアントレン(C16)から誘導される基が含まれる。
【0106】
或いは、環原子は、「ヘテロアリール基」の場合のように1個又は複数のヘテロ原子を含むことができる。ヘテロアリール基の例には、C3〜20ヘテロアリール、C5〜20ヘテロアリール、C5〜15ヘテロアリール、C5〜12ヘテロアリール、C5〜10ヘテロアリール、C5〜7ヘテロアリール、C5〜6ヘテロアリール、C5ヘテロアリール及びC6ヘテロアリールが含まれる。
【0107】
ハロ(又はハロゲン):−F、−Cl、−Br及び−I。
【0108】
ヒドロキシ:−OH。
【0109】
シリル:−SiR3、ここでRはシリル置換基、例えば−H、C1〜7アルキル基、C3〜20ヘテロシクリル基又はC5〜20アリール基、好ましくは−H、C1〜7アルキル基又はC5〜20アリール基である。シリル基の例には、これらに限定されないが、−SiH3、−SiH2(CH3)、−SiH(CH3)2、−Si(CH3)3、−Si(Et)3、−Si(iPr)3、−Si(tBu)(CH3)2及び−Si(tBu)3が含まれる。
【0110】
オキシシリル:−Si(OR)3、ここでRはオキシシリル置換基、例えば−H、C1〜7アルキル基、C3〜20ヘテロシクリル基又はC5〜20アリール基、好ましくは−H、C1〜7アルキル基又はC5〜20アリール基である。オキシシリル基の例には、これらに限定されないが、−Si(OH)3、−Si(OMe)3、−Si(OEt)3及び−Si(OtBu)3が含まれる。
【0111】
シロキシ(シリルエーテル):−OSiR3、ここでSiR3は上記で論じたようなシリル基である。
【0112】
オキシシロキシ:−OSi(OR)3、ここでOSi(OR)3は上記で論じたようなオキシシリル基である。
【0113】
シリル−アルキレン:−アルキレン−SiR3、ここでRは上記で論じたようなシリル置換基である。例えば−CH2−CH2−Si(Me)3である。
【0114】
他の形態を含む
別段の指定のない限り、上記に含まれるものは、これらの置換基の周知のイオン、塩、溶媒和の形態及び保護された形態である。例えば、カルボン酸(−COOH)への言及はそのアニオン(カルボキシレート)形態(−COO−)、その塩又は溶媒和物並びに慣用的な保護形態も含む。同様に、アミノ基への言及はアミノ基のプロトン化形態(−N+HR1R2)、塩又は溶媒和物、例えばアミノ基の塩酸塩並びに慣用的な保護形態を含む。同様に、ヒドロキシル基への言及はそのアニオン形態(−O−)、その塩又は溶媒和物並びに慣用的な保護形態も含む。
【0115】
塩
活性化合物の対応する塩、例えば環境的に許容される塩を調製、精製及び/又は取り扱うことが好都合である又は望ましい場合がある。
【0116】
適切な塩の例は、Bergeら、1977年、「Pharmaceutically Acceptable Salts」、J.Pharm.Sci.、66巻、1〜19頁で論じられている。
【0117】
例えば、その化合物がアニオン性であるか、又はアニオン性であり得る(例えば、−COOHは−COO−であり得る)官能基を有する場合、塩は適切なカチオンで形成させることができる。適切な無機カチオンの例には、これらに限定されないが、Na+及びK+などのアルカリ金属イオン、Ca2+及びMg2+などのアルカリ土類カチオン、Al+3などの他のカチオンが含まれる。適切な有機カチオンの例には、これらに限定されないが、アンモニウムイオン(すなわち、NH4+)及び置換アンモニウムイオン(例えば、NH3R+、NH2R2+、NHR3+、NR4+)が含まれる。いくつかの適切な置換アンモニウムイオンの例は:エチルアミン、ジエチルアミン、ジシクロヘキシルアミン、トリエチルアミン、ブチルアミン、エチレンジアミン、エタノールアミン、ジエタノールアミン、ピペラジン、ベンジルアミン、フェニルベンジルアミン、コリン、メグルミン及びトロメタミン並びにリシン及びアルギニンなどのアミノ酸から誘導されるものである。一般的な第四アンモニウムイオンの例はN(CH3)4+である。
【0118】
その化合物がカチオン性であるか、又はカチオン性であり得る(例えば、−NH2は−NH3+であり得る)官能基を有する場合、塩は適切なアニオンで形成させることができる。適切な無機アニオンの例には、これらに限定されないが、以下の無機酸:塩酸、臭化水素酸、ヨウ化水素酸、硫酸、亜硫酸、硝酸、亜硝酸、リン酸及び亜リン酸から誘導されるものが含まれる。
【0119】
適切な有機アニオンの例には、これらに限定されないが、以下の有機酸:2−アセトキシ安息香酸、酢酸、アスコルビン酸、アスパラギン酸、安息香酸、カンファースルホン酸、桂皮酸、クエン酸、エデト酸、エタンジスルホン酸、エタンスルホン酸、フマル酸、グルコヘプトン酸、グルコン酸、グルタミン酸、グリコール酸、ヒドロキシマレイン酸、ヒドロキシナフタレンカルボン酸、イセチオン酸、乳酸、ラクトビオン酸、ラウリン酸、マレイン酸、リンゴ酸、メタンスルホン酸、粘液酸、オレイン酸、シュウ酸、パルミチン酸、パモン酸、パントテン酸、フェニル酢酸、フェニルスルホン酸、プロピオン酸、ピルビン酸、サリチル酸、ステアリン酸、コハク酸、スルファニル酸、酒石酸、トルエンスルホン酸及び吉草酸から誘導されるものが含まれる。適切なポリマー性有機アニオンの例には、これらに限定されないが、以下のポリマー酸:タンニン酸、カルボキシメチルセルロースから誘導されるものが含まれる。
【0120】
別段の指定のない限り、特定の化合物への言及はその塩形態も含む。
【0121】
溶媒和物
活性化合物の対応する溶媒和物を調製、精製及び/又は取り扱うことが好都合である又は望ましい場合がある。「溶媒和物」という用語は本明細書では、溶質(例えば、活性化合物、活性化合物の塩)と溶媒の錯体を指すという慣用的な意味で用いられる。溶媒が水である場合、溶媒和物は水和物、例えば一水和物、二水和物、三水和物等を指すことが好都合であり得る。
【0122】
別段の指定のない限り、特定の化合物への言及はその溶媒和された形態も含む。
【0123】
特定の好ましい置換基
1つの好ましい実施形態では、本明細書でしばしばRと称される置換基(複数可)は独立に:ハロ;ヒドロキシ;エーテル(例えば、C1〜7アルコキシ);ホルミル;アシル(例えば、C1〜7アルキルアシル、C5〜20アリールアシル);アシルハライド;カルボキシ;エステル;アシルオキシ;アミド;アシルアミド;チオアミド;テトラゾリル;アミノ;ニトロ;ニトロソ;アジド;シアノ;イソシアノ;シアナト;イソシアナト;チオシアノ;イソチオシアノ;スルフヒドリル;チオエーテル(例えば、C1〜7アルキルチオ);スルホン酸;スルホネート;スルホン;スルホニルオキシ;スルフィニルオキシ;スルファミノ;スルホンアミノ;スルフィンアミノ;スルファミル;スルホンアミド;C1〜7アルキル(例えば非置換C1〜7アルキル、C1〜7ハロアルキル、C1〜7ヒドロキシアルキル、C1〜7カルボキシアルキル、C1〜7アミノアルキル、C5〜20アリール−C1〜7アルキルを含む);C3〜20ヘテロシクリル;又はC5〜20アリール(例えばC5〜20カルボアリール、C5〜20ヘテロアリール、C1〜7アルキル−C5〜20アリール及びC5〜20ハロアリールを含む))から選択される。
【0124】
1つの好ましい実施形態では、本明細書でしばしばRと称される置換基(複数可)は独立に:
−F、−Cl、−Br及び−I;
−OH;
−OMe、−OEt、−O(tBu)及び−OCH2Ph;
−SH;
−SMe、−SEt、−S(tBu)及び−SCH2Ph;
−C(=O)H;
−C(=O)Me、−C(=O)Et、−C(=O)(tBu)及び−C(=O)Ph;
−C(=O)OH;
−C(=O)OMe、−C(=O)OEt及び−C(=O)O(tBu);
−C(=O)NH2、−C(=O)NHMe、−C(=O)NMe2及び−C(=O)NHEt;
−NHC(=O)Me、−NHC(=O)Et、−NHC(=O)Ph、スクシンイミジル及びマレイミジル;
−NH2、−NHMe、−NHEt、−NH(iPr)、−NH(nPr)、−NMe2、−NEt2、−N(iPr)2、−N(nPr)2、−N(nBu)2及び−N(tBu)2;
−CN;
−NO2;
−Me、−Et、−nPr、−iPr、−nBu、−tBu;
−CF3、−CHF2、−CH2F、−CCl3、−CBr3、−CH2CH2F、−CH2CHF2及び−CH2CF3;
−OCF3、−OCHF2、−OCH2F、−OCCl3、−OCBr3、−OCH2CH2F、−OCH2CHF2及び−OCH2CF3;
−CH2OH、−CH2CH2OH及び−CH(OH)CH2OH;
−CH2NH2、−CH2CH2NH2及び−CH2CH2NMe2;並びに
任意選択で置換されたフェニル
から選択される。
【0125】
1つの好ましい実施形態では、本明細書でしばしばRと称される置換基(複数可)は独立に:−F、−Cl、−Br、−I、−OH、−OMe、−OEt、−SH、−SMe、−SEt、−C(=O)Me、−C(=O)OH、−C(=O)OMe、−CONH2、−CONHMe、−NH2、−NMe2、−NEt2、−N(nPr)2、−N(iPr)2、−CN、−NO2、−Me、−Et、−CF3、−OCF3、−CH2OH、−CH2CH2OH、−CH2NH2、−CH2CH2NH2及び−Phから選択される。
【0126】
1つの好ましい実施形態では、本明細書でしばしばRと称される置換基(複数可)は独立に:ヒドロキシ;エーテル(例えば、C1〜7アルコキシ);エステル;アミド;アミノ;及びC1〜7アルキル(例えば非置換C1〜7アルキル、C1〜7ハロアルキル、C1〜7ヒドロキシアルキル、C1〜7カルボキシアルキル、C1〜7アミノアルキル、C5〜20アリール−C1〜7アルキルを含む)から選択される。
【0127】
1つの好ましい実施形態では、本明細書でしばしばRと称される置換基(複数可)は独立に:
−OH;
−OMe、−OEt、−O(tBu)及び−OCH2Ph;
−C(=O)OMe、−C(=O)OEt及び−C(=O)O(tBu);
−C(=O)NH2、−C(=O)NHMe、−C(=O)NMe2及び−C(=O)NHEt;
−NH2、−NHMe、−NHEt、−NH(iPr)、−NH(nPr)、−NMe2、−NEt2、−N(iPr)2、−N(nPr)2、−N(nBu)2及び−N(tBu)2;
−Me、−Et、−nPr、−iPr、−nBu、−tBu;
−CF3、−CHF2、−CH2F、−CCl3、−CBr3、−CH2CH2F、−CH2CHF2及び−CH2CF3;
−CH2OH、−CH2CH2OH及び−CH(OH)CH2OH;並びに
−CH2NH2、−CH2CH2NH2及び−CH2CH2NMe2
から選択される。
【0128】
他の用語
本明細書で用いる「汚損(fouling)」という用語は、液媒体、例えば水性媒体に曝露されるか又はそれに浸漬している基材への微生物及び小生物の付着及び増殖、並びに液媒体の容器中での微生物及び/又は小生物の数の増大を指す。
【0129】
したがって、「汚損体(foulers)」又は「微小汚損体(microfoulers)」は互換的に用いられ、基材を汚損する生物を指す。汚損は、新鮮な水並びに海水に曝露されるか又はそれに浸漬している構造物において発生し得る。特に、この用語は、海水に曝露されるか又はそれに浸漬している固体状の媒体又は基材を指すのに用いることができる。
【0130】
したがって、「防汚する(antifouling)」という用語は、汚損を防止、低減及び/又は排除する効果を指す。防汚剤又は防汚化合物は「汚損防止剤(antifoulants)」とも称される。
【0131】
汚損防止剤化合物は通常、その目的に効果的な濃度である標準濃度で施用される。したがって、標準濃度未満の濃度は、それが単独で使用された場合、汚損防止剤が効果的でない濃度である。
【0132】
本明細書で用いる「基材(substrate)」という用語は、液媒体に曝露されるか又はそれに浸漬している構造物又は船舶の表面などの固体媒体を指す。液媒体は、新鮮な水又は海水であってもよく、瓶、プール若しくはタンクなどの人工的容器中の水体(body of water)であってもよく、或いはその液体は外海の海水などの人工的容器に収容されていないものであってもよい。
【0133】
本明細書で用いる「構造物(structure)」は、自然の地質学的構造物又は人工的構造物、例えば橋脚又は石油掘削用リグを指し、「船舶(vessel)」という用語は、ボートや船などの水の中で使用される人工的乗り物を指す。
【0134】
本明細書で参照する「微生物(microorganisms)」はウイルス、細菌、真菌、藻類及び原生動物を含む。本明細書で参照する「小生物(small organisms)」は、新鮮な水又は海水に曝露されるか又はそれに浸漬している基材を通常汚損する生物、例えば甲殻類(crustaceans)、コケムシ(bryozoans)及び軟体動物(molluscs)、特に基材に付着するものを含むことができる。そうした小生物の例には、フジツボ及びイガイ(mussels)並びにそれらの幼生が含まれる。小生物は小動物(small animals)と称することもできる。本明細書で参照する「生物(organism)」はそれに応じて理解されるはずであり、これらには微生物及び小生物が含まれる。
【0135】
本明細書で用いる「海洋生物(marine organism)」という用語は、その自然生息地が海水である生物を指す。「海洋微生物(marine microorganism)」及び「海洋小生物(marine small organism)」という用語は、はそれに応じて理解されるはずである。
【0136】
さらに、「ミクロ汚損(microfouling)」という用語は微生物による汚損を指し、「マクロ汚損(macrofouling)」という用語は、上記に定義の小生物などの微生物より大きい生物による汚損を指す。
【0137】
「殺生物剤(biocide)」又は「殺生物性化合物(biocidal compound)」という用語は、それらを殺傷することによって微生物及び小生物の増殖を阻害する化合物を指す。「バイオスタティック(biostatic)」又は「バイオスタティック化合物(biostatic compound)」という用語は、必ずしも微生物又は小生物を殺傷することによってではなくそれらの生殖を阻害することによって、それらの増殖を阻害する化合物を指す。
【0138】
本明細書で用いる「分解(degradation)」という用語は、水、好ましくは海水の中における化合物の化学的な分解又は改変を指す。
【0139】
本明細書で用いる「増殖(growth)」という用語は、微生物や小生物の数の増加と、小生物の幼若期から成熟期への成長の両方を指す。したがって、殺生物剤及びバイオスタティクを、微生物及び小生物の増殖を阻害するために、液体本体又は基材表面への処理として施用することができる。したがって、殺生物剤及びバイオスタティクは汚損防止剤であってよく、生物膜形成を阻害、低減又は排除することができる。
【0140】
したがって、「殺菌性(bacteriocidal)」及び「静菌性(bacteriostatic)」という用語は細菌に対する化合物の効果を指す。
【0141】
本明細書で用いる「生物活性(bioactivity)」という用語は、生きた生物、特に微生物又は小生物に対する、殺生物性又はバイオスタティック化合物などの所与の薬剤又は化合物の効果を指す。
【0142】
「生物膜(biofilm)」は、保護性及び付着性のマトリックスの排出を特徴とする微生物、通常細菌又は真菌の複雑な凝集体である。生物膜はしばしば、表面付着、構造的不均一性、遺伝的多様性、複雑な群落相互作用(complex community interactions)及びポリマー性物質の細胞外マトリックスも特徴とする。生物膜はまた、マトリックスが存在するため、凝集していない細菌と比較して抗生物質に対してより耐性があることもある。
【0143】
使用、薬剤、化合物又は組成物に関連する場合、「医薬(pharmaceutical)」という用語は、ヒト又は動物の疾患又は障害の医学的治療を指す。したがって、医薬化合物はヒト又は動物の疾患又は障害の医学的治療のために使用される化合物である。
【0144】
本明細書で用いる「標準濃度(standard concentration)」という用語は、防汚用の薬剤又は化合物に関する場合、その薬剤又は化合物が単独で使用されるとき、その薬剤又は化合物がそれが対象としている微生物又は小生物に対して効果的である濃度を指す。したがって、「効果的(effective)」という用語は所望の効果を有することを意味し、「標準濃度未満(below standard concentration)」という用語は、単独で使用した場合、その薬剤又は化合物が効果的でないレベルを指す。
【実施例】
【0145】
実施例第1部
化合物
化合物の合成
本発明の化合物の化学的合成のためのいくつかの方法を本明細書で説明する。本発明の範囲内の他の化合物の合成を容易にするために、これら及び/又は他の周知の方法を公知の方法で改変する及び/又は適合させることができる。
【0146】
アミドは、以下の一般的手法にしたがって調製することができる。
【0147】
方法A
15シリーズの化合物などのアルコキシ化された置換化合物の合成は二段階のプロトコルをもとにしており、ここで、ピペリジンを用いて、市販のフェニル酢酸誘導体に、DCCによる媒介アミドの生成を施す(スキーム1)。続いて得られた2−アリールアセトアミドをアルキル化し、次いで標準的条件下でのLDA及びブロモブタンによる処理へと進む。
【化9】

【0148】
同じ手法を、ジアルキルアミドにも採用した。したがって、非置換親化合物のメトキシ及びヒドロキシアリール同類物の合成は三段階又は四段階のプロトコルをもとにしており、ここで、最初に市販のフェニル酢酸誘導体を、対応する酸クロリド又はベンゾトリアゾリルエステルによりピペリジンか又はジメチルアミドに転換させる。スキーム1.1に示すように、続く、1−ブロモブタンか又は6−ブロモ−1−ヘキセンを用いたLDA促進アルキル化により、所望のメトキシアリール化合物を低収率から良好な収率の範囲で得る。
【化10】

【0149】
選択されたメトキシアリール目的物の脱メチル化を、スキーム1.2に概要を示したようにしてジクロロメタン中の三臭化ホウ素を用いて実施した。これらの条件下での15.1、15.2、15.3及び17.2の処理はすべて順調に進み、対応するヒドロキシアリール誘導体を良好な収率と高い純度で得た。
【化11】

【0150】
方法B
ヒドロキシメチル化化合物及びアセチル化類似物の合成を、標準的な保護及びアルキル化プロトコルにしたがって、容易に合成されるアミドからアクセスした(スキーム2)。p−誘導体のアセチル化によって化合物を良好な単離収率で得た。
【化12】

【0151】
より具体的には、12.1のヒドロキシメチル化同類物及びその酢酸誘導体へのアクセスを得るために、フェニル酢酸誘導体の市場での入手可能性をもとにした異なる合成経路を用いる必要があった。p−ヒドロキシメチルフェニル酢酸は市販されておりピペリジンとのカップリング反応に直接使用することができたが、対応するo−ヒドロキシメチルフェニル酢酸は市場で入手することができなかった。そこで、ピペリジンを用いた市販のイソクロマノンの求核的開環により中程度の単離収率で必要なアミドにアクセスした(以下のスキーム2.1)。手元にあるo−及びp−ヒドロキシメチルアミドを用いて、イミダゾールの存在下、tert−ブチルジメチルシリル(TBS)クロリドで処理して対応するTBSエーテルを中程度の収率で得た。これらにアルキル化を施して16.1及び16.2をその保護形態で得た。TBSエーテルをTHF中のTBAFで処理し、TBS保護基を取り外して16.1及び16.2をほぼ定量的な収率で得た。次いで、16.2をピリジン中の無水酢酸で処理して化合物16.3を単離した。これをスキーム2の修正版である以下のスキーム2.1に示す。
【化13】

【0152】
16.2を直接17.9に転換させる手順は二段階の工程であり、そこでは、オキソン(Oxone)(登録商標)で処理する前に対応するアルデヒドへのスワーン酸化を実施した。所望の酸を中程度の総合収率で得た(スキーム3)。
【化14】

【0153】
12.1の残りの目的とする同類物はすべて、適切な求電子試薬で処理することによって、16.5の改変によりアクセスすることができた。すべての場合、中程度の収率から高い収率で目的化合物を得た。これらの反応のまとめをスキーム4に示す。
【化15】

【0154】
上記手法を用いて、以下の構造にもとづく化合物を合成した。これらは好ましい実施形態(参考化合物は除く)である:
【化16】

【表1】

【0155】
さらに、以下の化合物を合成した。これらは好ましい実施形態である。
【表2】

【0156】
さらに、以下の構造の化合物を合成した。これらは好ましい実施形態である。
【化17】

【表3】

【0157】
さらに、以下の構造の化合物を合成した。これらは好ましい実施形態である。
【化18】

【表4】

【0158】
さらに、以下の構造の化合物を合成した。これらは好ましい実施形態である。
【化19】

【表5】

【0159】
これらの化合物を、フジツボに対する生物活性について試験した。
選択されたアミド誘導体のための合成方法及びデータ
【0160】
特性評価
プロトン(1H)及び炭素(13C)NMRスペクトルを、1Hについて400MHzで、13Cについて75.4MHzで稼働させてBruker NMR分光計で記録した。別段の表示のない限り、溶媒として重水素化クロロホルム(CDCl3)を使用した。化学シフト(d)を、テトラメチルシラン(TMS、0.00ppm)からのパーツパーミリオン(ppm)でのシフトとして記録する。CDCl3で記録したNMRスペクトルを、1Hについて残留クロロホルム一重項(7.26ppm)、13CについてCDCl3三重項(77.00ppm)の中央ピークを基準とした。1H NMR分光分析データを以下の通り報告する:化学シフト(δ)、多重度(s:一重項、d:二重項、t:三重項、q:四重項、qt:五重項、m:多重項、dd:二重項の二重項等、br:幅広)、結合定数(JHz)及び相対積分(プロトン数)。可能な場合、13C分光分析データを化学シフト(δ)及び帰属として記録する。赤外スペクトルをBio−rad Excalibur Series TFS 3000MX FTIRで記録した。サンプルは、NaClプレート上の薄い液膜で実施した。IRスペクトルデータを以下の通り報告する:周波数(υmax cm−1)、強度(vs:非常に強い、s:強い、m:中程度、w:弱い)。高分解能電子衝撃(EI)質量スペクトルをThermo Finnigan MAT XP95質量分析計で記録した。分析用薄層クロマトグラフィー(tlc)を、シリカゲルF254(Merck)をコーティングしたアルミニウム板で実施した。クロマトグラムを254nmの波長(適切な場合)で分析した、及び/又は水の中の過マンガン酸カリウムの酸性溶液(5%H2SO4)を用いて展開させ、次いで加熱した。使用した溶媒はすべてARグレードのものであり、適切な場合、文献の手順により精製した(Armarego、2003年)。
【0161】
一般的手順−DCC媒介アミド結合形成
DMF(1.2mL/mmol)中のフェニル酢酸誘導体(1当量)の冷却(0℃)撹拌溶液に、DCC(1.1当量)及びHOBt(1.1当量)を加えた。得られた混合物を1時間撹拌し、その時点で無色の重い沈殿物が現れた。ピペリジン(1.1当量)を反応混合物に加え、撹拌をさらに2時間続行し、次いで反応混合物をろ過した。母液をEtOAcに取り、飽和NaHCO3及び水(×3、2.4mL/mmol)で順次洗浄した。有機層を脱水し(MgSO4)、真空下で濃縮して粗製アミドを得た。これを、指定された溶媒系を用いてフラッシュカラムクロマトグラフィーで精製した。
【0162】
一般的手順−酸クロリドによるアミド結合形成
DCM(0.4mL mmol−1)中のメトキシフェニル酢酸の冷却(0℃)撹拌溶液に塩化チオニル(0.4mL mmol−1)を加えた。得られた混合物を室温に加温し、50℃で2時間加熱し、次いで反応混合物を室温に冷却し、氷に注意深く注加した。有機層を脱水し(MgSO4)、真空下で濃縮して所望の酸クロリドを得た。これをさらに精製することなく使用した。
【0163】
ピペリジンアミドについては、適切な量の酸クロリド(1mol当量)を等量の無水CH2Cl2に溶解し、CH2Cl2(1mL mmol−1)中のピペリジン(2mol当量)の冷却(0℃)溶液に徐々に加えた。得られた混合物を室温に加温し、さらに2時間撹拌した。粗製反応混合物を水で洗浄し、有機層を脱水し(MgSO4)、真空下で濃縮して所望のアミドを得た。さらなる精製は必要でなかった。
【0164】
ジメチルアミドについては、適切な量の酸クロリドを、水(10mol当量)の中のジメチルアミンの冷却(0℃)40%溶液に徐々に加え、2時間撹拌し、次いで室温に加温した。CH2Cl2を反応混合物に加え、有機層を水で洗浄し、脱水し(MgSO4)、真空下で濃縮して所望のアミドを得た。
【0165】
一般的手順−αアルキル化
無水THF(2mL/mmol)中の新たに蒸留されたジイソプロピルアミド(1当量)の冷却(−78℃)撹拌溶液に、ヘキサン中のn−ブチルリチウム(1当量)を加えた。得られた反応混合物は淡黄色になり、これを−78℃で10〜15分間撹拌し、次いで所望のアミド(0.95当量)を注意深く加えた。得られた混合物を1時間撹拌し、その時点でブロモブタン(1当量)を加えた。得られた混合物を数時間(少なくとも3時間)かけて室温に加温し、撹拌をさらに13時間続行した(合計で16時間)。反応混合物に水を注意深く滴下して反応物をクエンチした。続いて、水を反応混合物に加え、水相を除去した。有機層を水で洗浄し、次いで塩水で洗浄し、脱水し(MgSO4)、減圧下で濃縮した。精製を、指定された溶媒系を用いてフラッシュカラムクロマトグラフィーで実施した。
【0166】
化合物15.1
2−(4−メトキシ)フェニル−1−(ピペリジン−1−イル)エタノン
【化20】

表題化合物を、アミド結合形成のための一般的手順にしたがって4−メトキシフェニル酢酸(1.0g、6.1mmol)から調製した。生成物を、フラッシュカラムクロマトグラフィー(EtOAc、Rf=0.5)による精製によって無色油状物(1.0g、65%)として単離した。1H NMR(400MHz,CDCl3)δ 1.35(m,2H);1.49(m,2H);1.57(m,2H);3.35(m,2H);3.55(m,2H);3.64(s,2H);3.77(s,3H);6.85(d,J=8.4Hz,2H);7.16(d,2J=8.4Hz 2H)。13C NMR(75MHz,CDCl3)δ24.47、25.52、26.25、40.26、42.90。47.25、55.28、114.08、127.47、129.61、158.27、169.60。HRMS(ESI+1イオン)m/z:C14H20NO2の計算値234.1489、実測値234.1496。
【0167】
2−(4−メトキシ)フェニル−(1−ピペリジン−1−イル)ヘキサノン
【化21】

表題化合物を、α−アルキル化のための一般的手順概要にしたがって2−(4−メトキシ)フェニル−1−(ピペリジン−1−イル)エタノン(740mg、3.41mmol)から調製した。表題化合物を、フラッシュカラムクロマトグラフィー(ヘキサン中に20%EtOAc、Rf=0.6)による精製によって淡黄色油状物(160mg、16%)として単離した。1H NMR(400MHz,CDCl3)δ 0.83(t,J=7Hz,3H);1.03(m,1H);1.14(m,1H);1.2〜1.6(多重線シグナル、8H);1.68(m,1H);2.05(m,1H);3.31〜3.45(2×m,3H);3.64(m,2H);3.78(s,3H);6.83(d,J=8.9Hz,2H);7.18(d,J=8.9Hz 2H)。13C NMR(75MHz,CDCl3)δ 14.05、22.74、24.60、25.60、26.16、30.07、34.81、43.15、46.64、47.78、55.24、113.98、128.29、133.03、158.34、171.67。HRMS(ESI+1イオン)m/z:C18H29NO2の計算値290.2115、実測値290.2130。
【0168】
化合物15.7
2−(2,4−ジメトキシ)フェニル−1−(ピペリジン−1−イル)エタノン
【化22】

表題化合物を、アミド結合形成のための一般的手順概要にしたがって2,4−ジメトキシフェニル酢酸(1.0g、4.7mmol)から調製した。生成物を、フラッシュカラムクロマトグラフィー(EtOAc、Rf=0.6)による精製によって黄色油状物(690mg、56%)として単離した。1H NMR(400MHz,CDCl3)δ 1.38(m,2H);1.52(m,2H);1.58(m,2H);3.36(m,2H);3.56(m,2H);3.20(s,2H);3.29(s,3H);3.81(s,3H);6.45(m,3H);7.13(d,J=8.6Hz)。13C NMR(75MHz,CDCl3)δ 24.46、25.56、26.26、40.72、40.77、42.94、47.27、111.24、111.70、120.66、127.97、147.80、149.07、169.45。HRMS(ESI+1イオン)m/z:C15H22NO3の計算値264.1594、実測値264.1605。
【0169】
2−ブチル−2−(2,4−ジメトキシ)フェニル−1−(ピペリジン−1−イル)ヘキサノン
表題化合物を、αアルキル化のための一般的手順概要にしたがって2−(2’,4’−ジメトキシ)フェニル−1−(ピペリジン−1−イル)エタノン(688mg、2.61mmol)から調製した。生成物を、フラッシュカラムクロマトグラフィー(ヘキサン中に50%EtOAc、Rf=0.7)による精製によって淡黄色油状物(380mg、45%)として単離した。1H NMR(400MHz,CDCl3)δ 0.87(t,J=7Hz,3H);0.973(m,1H);1.13(m,1H),1.23〜1.65(多重線シグナル、9H);2.01(m,1H);3.33(m,3H);3.7(m,1H);3.79(s,3H);3.82(s,3H);4.12(t,J=7Hz,1H);6.42(m,3H);7.20(d,J=8Hz)。13C NMR(75MHz,CDCl3)δ 14.06、22.79、24.73、25.67、26.16、29.92、34.04、39.21、43.11、46.19、55.32、55.50、98.26、104.66、121.93、128.56、156.79、159.38、172.45。HRMS(ESI+1イオン)m/z:C19H30NO3の計算値320.2220、実測値320.2229。
【0170】
化合物15.6
2−ブチル−2−(2,4−ジメトキシ)フェニル−1−(ピペリジン−1−イル)ヘキサノン
【化23】

表題化合物を、αアルキル化のための一般的手順概要にしたがって2−(2’,4’−ジメトキシ)フェニル−1−(ピペリジン−1−イル)エタノン(688mg、2.61mmol)から調製した。生成物を、フラッシュカラムクロマトグラフィー(ヘキサン中に50%EtOAc、Rf=0.7)による精製によって淡黄色油状物(380mg、45%)として単離した。1H NMR(400MHz,CDCl3)δ 0.87(t,J=7Hz,3H);0.97(m,1H);1.13(m,1H),1.23〜1.65(多重線シグナル、9H);2.01(m,1H);3.33(m,3H);3.7(m,1H);3.79(s,3H);3.82(s,3H);4.12(t,J=7Hz,1H);6.42(m,3H);7.20(d,J=8Hz)。13C NMR(75MHz,CDCl3)δ 14.06、22.79、24.73、25.67、26.16、29.92、34.04、39.21、43.11、46.19、55.32、55.50、98.26、104.66、121.93、128.56、156.79、159.38、172.45。HRMS(ESI+1イオン)m/z:C19H30NO3の計算値320.2220、実測値320.2229。
化合物16.2
【0171】
2−(4−ヒドロキシメチル)フェニル−1−(ピペリジン−1−イル)エタノン
表題化合物を、アミドカップリングのために概要を示した一般的手順にしたがって4−ヒドロキシメチルフェニル酢酸(1.0g、6.0mmol)から調製した。生成物を、フラッシュカラムクロマトグラフィー(EtOAc、Rf=0.5)による精製によって粘性の無色油状物(540mg、39%)として単離した。1H NMR(400MHz,CDCl3)δ 1.37(m,2H);1.52(m,2H);1.58(m,2H);3.36(m,2H);3.56(m,2H);3.71(s,2H);4.66(s,2H);7.23(d,J=8Hz,2H);7.31(d,J=8Hz,2H)。13C NMR(75MHz,CDCl3)δ 24.39、25.44、25.47、26.21、34.91、40.77、42.92、47.25、55.77、64.92、127.33、128.76、134.65、139.48、169.30。HRMS(ESI+1イオン)m/z:C14H20NO2の計算値234.1489、実測値234.1489。
【0172】
2−(4−tert−ブチルジメチルシリルオキシメチル)フェニル−1−(ピペリジン−1−イル)エタノン
無水DCM中の2−(4−ヒドロキシメチル)フェニル−1−(ピペリジン−1−イル)エタノン(540mg、2.32mmol)及びイミダゾール(97mg、1.4mmol)の冷却(0℃)溶液に、DCM(5mL)中のTBSCl(214mg、1.42mmol)の溶液を加えた。得られた反応混合物を2時間撹拌した。次いで、反応混合物を水(×2)及び塩水で順次洗浄し、有機層を脱水し(MgSO4)、真空下で濃縮した。表題化合物を、フラッシュカラムクロマトグラフィー(20%EtOAc、Rf=0.6)による精製によって無色油状物(420mg、53%)として得た。1H NMR(400MHz,CDCl3)δ 0.084(s,6H);0.929(s,9H);1.34(m,2H);1.52(m,2H);1.59(m,2H);3.43(m,2H);3.57(m,2H);3.71(s,2H);4.71(s,2H);7.20(d,J=8Hz,2H);7.25(d,J=8Hz,2H)。13C NMR(75MHz,CDCl3)δ −5.21、24.45、25.59、25.97、26.20、40.94、42.89、47.27、64.77、126.41、128.40、133.96、139.81、169.36。HRMS(ESI+1イオン)m/z:C20H34NO2Siの計算値348.2353、実測値348.2354。
【0173】
2−(4−tert−ブチルジメチルシリルオキシメチル)フェニル−1−(ピペリジン−1−イル)ヘキサノン
表題化合物を、αアルキル化のために概要を示した一般的手順にしたがって2−(4−tert−ブチルジメチルシリルオキシメチル)フェニル−1−(ピペリジン−1−イル)エタノン(420mg、1.21mmol)から調製した。生成物を、フラッシュカラムクロマトグラフィー(ヘキサン中に20%EtOAc、Rf=0.6)による精製によって無色油状物(260mg、53%)として得た。1H NMR(400MHz,CDCl3)δ 0.010(s,6H);0.087(t,J=7Hz,3H);0.94(s,9H);1.01(m,1H);1.14(m,1H);1.2〜1.6(多重線シグナル、8H);1.68(m,1H);2.10(m,1H);3.3〜3.5(m,3H);3.68(m,2H);4.72(s,2H);7.15(m,4H)。13C NMR(75MHz,CDCl3)δ −5.20、14.03、22.75、24.75、25.68、26.12、30.40、34.78、43.16、46.62、48.47、64.79、126.38、127.66、139.52、139.73、171.42。HRMS(ESI+1イオン)m/z:C24H42NO2Siの計算値404.2979、実測値404.2983。
【0174】
2−(4−ヒドロキシメチル)フェニル−1−(ピペリジン−1−イル)ヘキサノン
無水THF(5mL)中の2−(4−tert−ブチルジメチルシリルオキシメチル)フェニル−1−(ピペリジン−1−イル)ヘキサノン(260mg、0.64mmol)の溶液を、THF(1.29mmol)中のTBAFの溶液を入れたフラスコに加えた。得られた反応混合物を1時間撹拌し、その時点でtlc分析により、出発原料が残っていないことが示された。反応混合物を水(×2)、次いで塩水で洗浄し、有機層を脱水し(MgSO4)、真空下で濃縮して粗生成物を得た。表題化合物を、フラッシュカラムクロマトグラフィー(ヘキサン中に50%EtOAc、Rf=0.4)による精製によって無色油状物(142mg、76%)として単離した。1H NMR(400MHz,CDCl3)δ 0.87(t,J=7Hz,3H);1.04(m,1H);1.14(m,1H);1.9〜1.7(m,8H);1.71(m,1H);1.91(m,1H);3.34(m,2H);3.47(m,1H);3.63(m,1H);3.69(t,J=7Hz,1H);4.66(s,2H);7.25(d,J=8Hz,2H);7.30(d,J=8Hz,2H)。13C NMR(75MHz,CDCl3)δ 14.02、22.72、24.56、25.57、26.12、30.07、34.76、43.19、46.64、48.41、65.07、127.06、127.99、139.28、140.32、171.32。HRMS(ESI+1イオン)m/z:C18H28NO2の計算値290.2114、実測値289.2117。
化合物16.3
【0175】
2−(4−アセトキシメチル)フェニル−1−(ピペリジン−1−イル)ヘキサノン
DMAP(2mg)を入れた丸底フラスコに無水ジクロロメタン(2mL)中の2−(4−ヒドロキシメチル)フェニル−1−(ピペリジン−1−イル)ヘキサノン(30mg、0.10mmol)の溶液を加えた。得られた混合物に無水NEt3(208μL、1.5mmol)を加え、次いで無水酢酸(100μL、1.0mmol)を加えた。得られた混合物を3時間撹拌した。続いて、反応混合物を飽和NaHCO3、水で洗浄し、次いで塩水で洗浄し、有機相を脱水し(Na2SO4)、減圧下で濃縮した。表題化合物を、フラッシュカラムクロマトグラフィー(ヘキサン中に50%EtOAc、Rf=0.7)による精製によって無色油状物(20mg、60%)として得た。1H NMR(400MHz,CDCl3)δ 0.86(t,J=7Hz,3H);1.0〜1.2(2×m,2H);1.2〜1.5(多重線シグナル、8H);1.68(m,1H);4.53(m+s,4H);3.33(m,1H),3.39(m,1H);3.49(m,1H);3.60(m,1H);3.70(t,J=7Hz,1H);5.07(s,2H);7.72(m,4H)。13C NMR(75MHz,CDCl3)δ 14.01、21.08、22.72、24.57、25.60、26.20、30.09、34.77、43.20、46.66、48.38、66.07、128.03、128.58、134.24、141.02、171.09、171.17。
注記:化合物は静置すると加水分解する。HRMSによれば遊離アルコールのそれと一致する。
【0176】
化合物17.1
2−(4−メトキシオキシフェニル)−1−(ピペリジン−1−イル)オクタ−7−エン−1−オン
【化24】

表題化合物を、アルキル化のための一般的手順にしたがって2−(4−ヒドロキシフェニル)−1−(ピペリジン−1−イル)エタノン(100mg、0.43mmol)及び6−ブロモ−1−ヘキセン(70μL、0.47mmol)から調製した。精製された化合物を、フラッシュカラムクロマトグラフィー(ヘキサン中に20%EtOAc、Rf=0.5)による精製によって淡黄色油状物(26mg、26%)として単離した。1H NMR(400MHz,CDCl3)δ1.1〜1.5(多重線シグナル、10H);1.65(m,1H);2.01(m,3H);3.35,(m,3H);3.63(t,J=7Hz,1H);3.65(m,1H);3.78(s,3H);4.89(dm,J=10Hz,1H);4.95(dm,J=17Hz,1H);5.77(ddd,J=17,10,6.5Hz,1H);6.83(d,J=8.5Hz,2H);7.17(d,J=8.5Hz,2H)。13C NMR(75MHz,CDCl3)δ 24.69、25.70、26.25、27.46、29.07、33.79、35.02、43.27、46.75、47.88、55.35、114.13、114.34、278.08、128.89、133.05、139.19、158.38、171.69。HRMS(ESI+1イオン)m/z:C20H30NO2の計算値316.2271、実測値316.2265。
【0177】
化合物17.2
2−(4−メトキシフェニル)−N,N−ジメチルヘキサンアミド
【化25】

表題化合物を、アルキル化のための一般的手順にしたがって2−(4−ヒドロキシフェニル)−N,N−ジメチルアセトアミド(100mg、0.52mmol)及び1−ブロモブタン(70μL、0.57mmol)から調製した。精製された化合物を、フラッシュカラムクロマトグラフィー(EtOAc、Rf=0.7)による精製によって淡黄色油状物(120mg、60%)として単離した。1H NMR(400MHz,CDCl3)δ 0.85(t,J=7Hz,3H);1.14(m,1H);1.28(m,3H);1.68(m,1H);2.05(m,1H);2.93(s,3H);2.94(s,3H);3.63(t,J=7Hz,1H);3.78(s,3H);6.84(d,J=8.8Hz,2H);7.20(d,J=8.8Hz,2H)。13C NMR(75MHz,CDCl3)δ 14.16、22.84、35.03、36.02、37.30、48.09、55.37、114.14、129.04、132.64、158.50、173.75。HRMS(ESI+1イオン)m/z:C16H24NO2の計算値262.1802、実測値262.1795。
【0178】
化合物17.3
2−(4−メトキシフェニル)−N,N−ジメチルオクタ−7−エンアミド
【化26】

表題化合物を、アルキル化のための一般的手順にしたがって2−(4−ヒドロキシフェニル)−N,N−ジメチルアセトアミド(100mg、0.52mmol)及び6−ブロモ−1−ヘキセン(84μL、0.57mmol)から調製した。精製された化合物を、フラッシュカラムクロマトグラフィー(EtOAc、Rf=0.6)による精製によって淡黄色油状物(120mg、60%)として単離した。1H NMR(400MHz,CDCl3)δ1.1〜1.5(多重線シグナル、4H);1.66(m,1H);2.02(m,3H);2.93(2×s,6H);3.63(t,J=7Hz,1H);3.78(s,3H);4.90(dm,J=10Hz,1H);4.96(dm,J=17Hz,1H);5.77(ddd,J=17,10,6.5Hz,1H);6.85(d,J=8.8Hz,2H);7.19(d,J=8.8Hz,2H)。13C NMR(75MHz,CDCl3)δ 27.41、29.02、33.75、35.10、36.00、37.27、48.05、55.34、114.13、114.35、128.98、132.49、139.12、158.49、173.62。HRMS(ESI+1イオン)m/z:C17H26NO2の計算値276.1958、実測値276.1958。
【0179】
化合物16.5
2−(4−ヒドロキシフェニル)−1−(ピペリジン−1−イル)ヘキサン−1−オン
【化27】

無水DCM中の15.1(1g、3.46mmol)の冷却(−78℃)溶液に、DCM(10mL、10mmol)中の三臭化ホウ素の溶液を加えた。得られた混合物を数時間(少なくとも3時間)かけて室温に加温し、撹拌をさらに14時間続行した(合計17時間)。水酸化アンモニウムを反応混合物に注意深く滴下して(注意:0℃で反応混合物に徐々に加える)、反応物をクエンチした。次いで水を反応混合物に加え、水相を除去した。有機層を脱水し(MgSO4)、真空下で濃縮した。表題化合物を薄茶色固体(0.93g、97%)として得た。1H NMR(400MHz,CDCl3)δ 0.85(t,3H);1.29(m,10H);1.70(m,2H);2.04(m,1H);3.39(m,2H);3.63(t,1H);3.67(m,1H);6.77(d,J=8.5Hz,2H);7.12(d,J=8.5Hz,2H)。13C NMR(75MHz,CDCl3)δ 13.99、22.67、24.51、25.55、26.11、29.98、34.59、43.32、46.75、47.73、115.63、128.83、132.28、154.95、172.09。HRMS(ESI+1イオン)m/z:C17H26NO2の計算値276.1958、実測値276.1954。
【0180】
化合物17.7
2−(4−ヒドロキシフェニル)−N,N−ジメチルヘキサンアミド
【化28】

表題化合物を、17.2(12mg、0.048mmol)から、16.5について説明したのと同様の方法で淡黄色固体(6mg、53%)として得た。δ 0.85(t,J=7Hz,3H);1.1〜1.5(多重線シグナル、4H);1.65(m,1H);2.03(m,1H);2.94(s,3H);3.63(t,J=7Hz,1H);6.76(d,J=8.5Hz,2H);7.16(d,J=8.5Hz,2H)。13C NMR(75MHz,CDCl3)δ 14.15、22.82、30.14、31.10、34.96、48.05、115.61、129.22、132.53、154.65、173.87。HRMS(ESI+1イオン)m/z:C14H23NO2の計算値236.1645、実測値236.1644。
【0181】
化合物17.8
2−(4−ヒドロキシフェニル)−N,N−ジメチルオクタ−7−エンアミド
【化29】

無水CH2Cl2(1mL)中の17.3(25mg、0.09mmol)の冷却(−78℃)溶液にBBr3(CH2Cl2中の1M溶液、0.27mL、0.27mmol)を加えた。得られた混合物を室温に加温し、さらに30分間撹拌した。続いて、反応混合物を−78℃に冷却し、MeOH(2mL)を反応混合物に加えた。5分後、得られた混合物を水に注加し、さらに10mLのCH2Cl2を加えた。有機層を洗浄し脱水し、真空下で濃縮して粗生成物を淡黄色固体として得た。粗生成物を、フラッシュカラムクロマトグラフィー(50%EtOAc/ヘキサン、Rf=0.2)で精製して表題化合物を淡黄色油状物として得た。これは静置すると固化した(4mg、15%)。1H NMR(400MHz,CDCl3)δ1.1〜1.5(多重線シグナル、4H);1.67(m,1H);1.98(m,3H);2.93(s,3H);2.94(s,3H);3.62(t,J=7Hz,1H);4,84(s,1H ArOH);4.90(dm,J=10Hz,1H);4.95(dm,J=17Hz,1H);5.77(ddd,J=17,10,6.5Hz,1H);6.76(d,J=8.8Hz,2H);7.14(d,J=8.8Hz,2H)。13C NMR(75MHz,CDCl3)27.29、28.90、33.64、34.97、35.94、37.19、47.92、114.26、115.51、129.10、132.48、139.01、173.55。HRMS(ESI+1イオン)m/z:C16H24NO2の計算値262.1802、実測値262.1086。
【化30】

化合物17.6
2−(4−ヒドロキシフェニル)−1−(ピペリジン−1−イル)オクタ−7−エン−1−オン
【0182】
表題化合物を、17.8について説明したのと同様の方法で2−(4−メトキシオキシフェニル)−1−(ピペリジン−1−イル)オクタ−7−エン−1−オン(50mg、0.18mmol)から調製した。表題化合物を、フラッシュカラムクロマトグラフィー(50%EtOAc/ヘキサン、Rf=0.5)による精製によって無色の低融点固体(6mg、11%)として得た。1H NMR(400MHz,CDCl3)δ 1.0〜1.5(多重線シグナル、10H);1.66(m,1H);2.02(m,3H);3.38,(m,3H);3.62(t,J=7Hz,1H);3.65(m,1H);4.88(dm,J=10Hz,1H);4.95(dm,J=17Hz,1H);5.76(ddd,J=17,10,6.5Hz,1H);6.76(d,J=8.5Hz,2H);7.11(d,J=8.5Hz,2H)。13C NMR(75MHz,CDCl3)δ 24.54、25.58、26.12、27.31、28.91、33.66、34.79、43.27、46.72、47.72、114.24、115.59、128.92、132.59、139.04、154.64、171.80。HRMS(ESI+1イオン)m/z:C19H28NO2の計算値302.2115、実測値302.2120。
2−(4−ヒドロキシメチル)フェニル−1−(ピペリジン−1−イル)エタノン
【化31】

【0183】
表題化合物を、DCC媒介アミド形成のために概要を示した一般的手順にしたがって4−ヒドロキシメチルフェニル酢酸(1.0g、6.0mmol)から調製した。生成物を、フラッシュカラムクロマトグラフィー(EtOAc、Rf=0.5)による精製によって粘性の無色油状物(0.54g、39%)として単離した。1H NMR(400MHz,CDCl3)δ 1.37(m,2H);1.52(m,2H);1.58(m,2H);3.36(m,2H);3.56(m,2H);3.71(s,2H);4.66(s,2H);7.23(d,J=8Hz,2H);7.31(d,J=8Hz,2H)。13C NMR(75MHz,CDCl3)δ24.39、25.44、25.47、26.21、34.91、40.77、42.92、47.25、55.77、64.92、127.33、128.76、134.65、139.48、169.30。HRMS(ESI+1イオン)m/z:C14H20NO2の計算値234.1489、実測値234.1489。
【0184】
2−(4−tert−ブチルジメチルシリルオキシメチル)フェニル−1−(ピペリジン−1−イル)エタノン
【化32】

無水DCM中の2−(4−ヒドロキシメチル)フェニル−1−(ピペリジン−1−イル)エタノン(540mg、2.32mmol)及びイミダゾール(97mg、1.4mmol)の冷却(0℃)溶液に、DCM(5mL)中のTBSCl(214mg、1.42mmol)の溶液を加えた。得られた反応混合物を2時間撹拌した。続いて、反応混合物を、水(×2)及び塩水で順次洗浄し、有機層を脱水し(MgSO4)、真空下で濃縮した。表題化合物を、フラッシュカラムクロマトグラフィー(20%EtOAc、Rf=0.6)による精製によって無色油状物(420mg、53%)として得た。1H NMR(400MHz,CDCl3)δ 0.084(s,6H);0.929(s,9H);1.34(m,2H);1.52(m,2H);1.59(m,2H);3.43(m,2H);3.57(m,2H);3.71(s,2H);4.71(s,2H);7.20(d,J=8Hz,2H);7.25(d,J=8Hz,2H)。13C NMR(75MHz,CDCl3)δ −5.21、24.45、25.59、25.97、26.20、40.94、42.89、47.27、64.77、126.41、128.40、133.96、139.81、169.36。HRMS(ESI+1イオン)m/z:C20H34NO2Siの計算値348.2353、実測値348.2354。
【0185】
2−(4−tert−ブチルジメチルシリルオキシメチル)フェニル−1−(ピペリジン−1−イル)ヘキサノン
【化33】

表題化合物を、αアルキル化のために概要を示した一般的手順にしたがって2−(4−tert−ブチルジメチルシリルオキシメチル)フェニル−1−(ピペリジン−1−イル)エタノン(420mg、1.21mmol)から調製した。生成物を、フラッシュカラムクロマトグラフィー(ヘキサン中に20%EtOAc、Rf=0.6)による精製によって無色油状物(260mg、53%)として得た。1H NMR(400MHz,CDCl3)δ 0.010(s,6H);0.087(t,J=7Hz,3H);0.94(s,9H);1.01(m,1H);1.14(m,1H);1.2〜1.6(多重線シグナル、8H);1.68(m,1H);2.10(m,1H);3.3〜3.5(m,3H);3.68(m,2H);4.72(s,2H);7.15(m,4H)。13C NMR(75MHz,CDCl3)δ −5.20、14.03、22.75、24.75、25.68、26.12、30.40、34.78、43.16、46.62、48.47、64.79、126.38、127.66、139.52、139.73、171.42。HRMS(ESI+1イオン)m/z:C24H42NO2Siの計算値404.2979、実測値404.2983。
【0186】
化合物16.1
2−(4−ヒドロキシメチル)フェニル−1−(ピペリジン−1−イル)ヘキサノン
【化34】

無水THF(5mL)中の2−(4−tert−ブチルジメチルシリルオキシメチル)フェニル−1−(ピペリジン−1−イル)ヘキサノン(260mg、0.64mmol)の溶液を、THF(1.29mmol)中のTBAFの溶液を入れたフラスコに加えた。得られた反応混合物を1時間撹拌し、その時点でtlc分析により、出発原料が残っていないことが示された。反応混合物を水(×2)、次いで塩水で洗浄し、有機層を脱水し(MgSO4)、真空下で濃縮して粗生成物を得た。表題化合物を、フラッシュカラムクロマトグラフィー(ヘキサン中に50%EtOAc、Rf=0.4)による精製によって無色油状物(142mg、76%)として単離した。1H NMR(400MHz,CDCl3)δ 0.87(t,J=7Hz,3H);1.04(m,1H);1.14(m,1H);1.9〜1.7(m,8H);1.71(m,1H);1.91(m,1H);3.34(m,2H);3.47(m,1H);3.63(m,1H);3.69(t,J=7Hz,1H);4.66(s,2H);7.25(d,J=8Hz,2H);7.30(d,J=8Hz,2H)。13C NMR(75MHz,CDCl3)δ 14.02、22.72、24.56、25.57、26.12、30.07、34.76、43.19、46.64、48.41、65.07、127.06、127.99、139.28、140.32、171.32。HRMS(ESI+1イオン)m/z:C18H28NO2の計算値290.2114、実測値289.2117。
【0187】
化合物16.3
2−(4−アセトキシメチル)フェニル−1−(ピペリジン−1−イル)ヘキサノン
【化35】

DMAP(2mg)を入れた丸底フラスコに、無水CH2Cl2(2mL)中の2−(4−ヒドロキシメチル)フェニル−1−(ピペリジン−1−イル)ヘキサノン(30mg、0.10mmol)の溶液を加えた。得られた混合物に無水NEt3(208μL、1.5mmol)を加え、次いで無水酢酸(100μL、1.0mmol)を加えた。得られた混合物を3時間撹拌した。続いて、反応混合物を飽和NaHCO3、水で洗浄し、次いで塩水で洗浄し、有機相を脱水し(Na2SO4)、減圧下で濃縮した。表題化合物を、フラッシュカラムクロマトグラフィー(ヘキサン中に50%EtOAc、Rf=0.7)による精製によって無色油状物(20mg、60%)として得た。1H NMR(400MHz,CDCl3)δ 0.86(t,J=7Hz,3H);1.0〜1.2(2×m,2H);1.2〜1.5(多重線シグナル、8H);1.68(m,1H);4.53(m+s,4H);3.33(m,1H),3.39(m,1H);3.49(m,1H);3.60(m,1H);3.70(t,J=7Hz,1H);5.07(s,2H);7.72(m,4H)。13C NMR(75MHz,CDCl3)δ 14.01、21.08、22.72、24.57、25.60、26.20、30.09、34.77、43.20、46.66、48.38、66.07、128.03、128.58、134.24、141.02、171.09、171.17。
注記:化合物は静置すると加水分解する。HRMSによれば遊離アルコールのそれと一致する。
【0188】
化合物16.11
4−(1−オキソ−1−(ピペリジン−1−イル)ヘキサン−2−イル)フェニルアクリレート
【化36】

無水CH2Cl2(10mL)中の16.5(100mg、0.36mmol)及びトリエチルアミン(56μL、0.40mmol)の冷却(0℃)撹拌溶液に、塩化アクリロイル(33μL、0.40mmol)を加えた。得られた混合物を室温に加温し、さらに1時間撹拌し、その時点でtlc分析(50%EtOAc/ヘキサン)により、出発原料が完全に消費されていることが示された。続いて、反応混合物を真空下で濃縮し、フラッシュカラムクロマトグラフィー(50%EtOAc/ヘキサン、Rf=0.5)で精製して表題化合物を無色油状物(120mg、>95%)として得た。1H NMR(400MHz,CDCl3)δ 0.85(t,J=7Hz,3H);1.0〜1.6(多重線シグナル、10H);1.70(m,1H);2.05(m,1H);3.3〜3.5(2×m,3H);3.68(m,1H);3.70(t,J=7Hz,1H);5.99,(d,J=10Hz,1H);6.29(dd,J=17,10Hz,1H);6.57(d,J=17Hz,1H);7.06(d,J=8.4Hz,2H);7.28(d,J−8.4Hz,2H)。13C NMR(75MHz,CDCl3)δ 13.93、22.63、24.49、25.51、26.10、30.00、34.77、43.12、46.61、47.96、121.53、127.88、128.69、132.42、138.42、149.15、164.43、171.06。HRMS(ESI+1イオン)m/z:C20H28NO3の計算値330.1989、実測値330.2056。
【0189】
化合物16.4
4−(1−オキソ−1−(ピペリジン−1−イル)ヘキサン−2−イル)フェニルアセテート
【化37】

無水酢酸(38μL、0.40mmol)を、無水CH2Cl2(20mL)中の16.5(100mg、0.36mmol)及びピリジン(32μL、0.40mmol)の冷却(0℃)撹拌溶液に加えた。反応物を室温に加温し、撹拌をさらに18時間続行した。その時点で、tlc分析(50%EtOAc/ヘキサン)により、出発原料の消費が示された。粗製反応混合物を希薄(0.1M)HClで洗浄し、次いで水で洗浄した。有機層を脱水し(MgSO4)、真空下で濃縮し、得られた油性残留物を、フラッシュカラムクロマトグラフィー(50%EtOAc/ヘキサン、Rf=0.26)で精製して表題化合物を無色油状物(110mg、>95%)として得た。1H NMR(400MHz,CDCl3)δ 0.86(t,J=7Hz,3H);1.0〜1.7(多重線シグナル、11H);2.1(m,1H);2.28(s,3H);3.37(m,2H);3.48(m,1H);3.59(m,1H);3.72(t,J=7Hz,1H);7.04(d,J=8.4Hz,2H);7.28(d,J=8.4Hz,2H)。13C NMR(75MHz,CDCl3)δ 13.96、21.14、22.67、24.53、25.55、26.15、30.04、34.80、43.15、46.64、47.97、121.59、128.72、138.38、149.29、169.39、171.11。HRMS(ESI+1イオン)m/z:C19H28NO3の計算値318.2064、実測値318.2060。
【0190】
化合物16.6
2−(4−(2−ヒドロキシエトキシ)フェニル)−1−(ピペリジン−1−イル)ヘキサン−1−オン
【化38】

無水DMF(10mL)中の16.5(0.50g、1.8mmol)、エチレンカーボネート(176mg、2.00mmol)及びテトラエチルアンモニウムブロミド(20mg、0.09mmol)の溶液を油浴中、180℃で16時間加熱した。次いで冷水(50mL)を加え、得られた混合物をEtOAc(3×20ml)で抽出した。一緒にした有機層を水で洗浄し、脱水し(MgSO4)、真空下で濃縮した。粗生成物をフラッシュカラムクロマトグラフィー(CH2Cl2中に10%MeOH、Rf=0.4)で精製して表題化合物を無色油状物(200mg、34%)として得た。1H NMR(400MHz,CDCl3)δ 0.84(t,J=7Hz,3H);1.05(m,1H);1.17(m,1H);1.2〜1.6(多重線シグナル、8H);1.7(m,1H);2.08(m,1H);2.39(t,J=6Hz,1H(OH));3.35(m,3H);3.62(t,J=7Hz,1H);3.64(m,1H);3.92(m,2H);4.05(m,1H);6.83(d,J=8.4Hz,2H);7.16(d,J=8.4Hz,2H)。13C NMR(75MHz,CDCl3)δ 13.96、22.64、24.50、25.51、26.09、29.96、34.70、43.10、46.58、47.70、61.36、69.10、114.59、128.78、133.38、157.28、171.55。HRMS(ESI+1イオン)m/z:C19H30NO3の計算値320.2220、実測値320.2205。
【0191】
化合物16.8
2−(4−(1−オキソ−1−(ピペリジン−1−イル)ヘキサン−2−イル)フェノキシ)エチルアセテート
【化39】

無水CH2Cl2(20mL)中の16.6(100mg、0.31mmol)及びDMAP(85mg、0.34mmol)の冷却(0℃)撹拌溶液に、塩化アセチル(50μL、0.34mmol)を加えた。得られた反応混合物を還流下16時間撹拌し、この時点でtlc分析(50%EtOAc/ヘキサン)により、出発原料が完全に消費されていることが示された。反応混合物をHCl(0.1M)及び水で洗浄し、有機層を脱水し(MgSO4)、真空下で濃縮した。表題化合物を、フラッシュカラムクロマトグラフィー(50%EtOAc/ヘキサン、Rf=0.4)による精製によって無色油状物(110mg、>95%収率)として得た。1H NMR(400MHz,CDCl3)δ 0.85(t,J=7Hz,3H);1.05〜1.60(多重線シグナル、10H);1.7(m,1H);2.08(m,1H);2.10(s,3H);3.35〜3.45(m,3H);3.6〜3.7(m,2H);4.15(見かけt,J=5Hz,2H);4.40(見かけt,J=5Hz,2H);6.84(d,J=8.4Hz,2H);7.17(d,J=8.4Hz,2H)。13C NMR(75MHz,CDCl3)δ 13.99、20.89、22.69、24.55、25.56、26.15、30.11、34.77、43.11、46.61、47.74、62.86、65.88、114.68、128.85、133.61、157.13、171.00、171.55。HRMS(ESI+1イオン)m/z:C21H32NO4の計算値362.2326、実測値362.2320。
【0192】
化合物16.7
メチル2−(4−(1−オキソ−1−(ピペリジン−1−イル)ヘキサン−2−イル)フェノキシ)アセテート
【化40】

無水アセトニトリル(20mL)中の16.5(300mg、1.15mmol)及びK2CO3(400mg、2.87mmol)の撹拌溶液にメチルブロモアセテート(0.18g、1.2mmol)を加えた。得られた混合物を16時間還流させ、その時点でtlc分析(CH2Cl2中に5%MeOH)により、出発原料が残っていないことが示された。アセトニトリルを真空下で除去し、残留物をEtOAcに取り、水で洗浄した。有機層を脱水し(MgSO4)、真空下で濃縮し、表題化合物を、フラッシュカラムクロマトグラフィー(CH2Cl2中に5%MeOH、Rf=0.7)による精製によって無色油状物(300mg、72%)として得た。1H NMR(400MHz,CDCl3)δ 0.86(t,J=7Hz,3H);1.05〜1.60(多重線シグナル、10H);1.7(m,1H);2.05(m,1H);3.38(m,2H);3.42(m,1H),3.6〜3.7(m,2H);3.80(s,3H);4.61(s,2H);6.83(d,J=8.4Hz,2H);7.19(d,J−8.4Hz,2H)。13C NMR(75MHz,CDCl3)δ 14.02、22.72、24.59、25.60、26.18、30.06、34.78、43.15、46.65、47.73、52.26、65.45、114.80、128.94、134.29、156.51、169.44、171.48。HRMS(ESI+1イオン)m/z:C20H30NO4の計算値348.2169、実測値348.2157。
【0193】
化合物16.9
2−(4−(1−オキソ−1−(ピペリジン−1−イル)ヘキサン−2−イル)フェノキシ)酢酸
【化41】

粉末LiOH(72mg、3.0mmol)をTHF(10mL)中の16.7(100mg、0.30mmol)の溶液に加え、混合物を室温で16時間撹拌した。次いで反応混合物をHCl(0.1M)で酸性化し、EtOAc(3×20mL)で洗浄した。有機相を脱水し(MgSO4)、真空下で濃縮した。表題化合物を、フラッシュカラムクロマトグラフィー(CH2Cl2中に10%MeOH、Rf=0.5)による精製によって無色油状物(59mg、60%)として得た。1H NMR(400MHz,CDCl3)δ 0.84(t,J=7Hz,3H);1.05〜1.60(多重線シグナル、10H);1.68(m,1H);2.05(m,1H);3.37(m,2H);3.42(m,1H),3.66(m,2H);4.63(s,2H);6.85(d,J=8.4Hz,2H);7.18(d,J=8.4Hz,2H)。13C NMR(75MHz,CDCl3)δ 13.96、22.61、24.41、25.52、26.10、29.92、34.52、43.49、46.82、47.71、65.10、114.87、128.89、133.87、156.46、171.92、172.03。HRMS(ESI+1イオン)m/z:C19H28NO4の計算値334.2013、実測値334.2001。
【0194】
化合物16.10
1−(ピペリジン−1−イル)−2−(4−(2−(トリメチルシリル)エトキシ)フェニル)ヘキサン−1−オン
【化42】

無水THF(10mL)中の16.5(100mg、0.36mmol)、トリフェニルホスフィン(140mg、0.54mmol)及びトリメチルシリルエタノール(80μL、0.54mmol)の冷却(0℃)溶液にDIAD(110μL)を10分間かけて加えた。得られた反応混合物を室温に加温し、さらに16時間撹拌した。続いて、溶媒を真空下で除去し、残留物をEtOAcに取り、水で洗浄した。有機層を脱水し(MgSO4)、真空下で濃縮し、得られた残留物を、フラッシュカラムクロマトグラフィー(50%EtOAc/ヘキサン、Rf=0.7)で精製して表題化合物を淡黄色油状物(40mg、30%)として得た。1H NMR(400MHz,CDCl3)δ 0.07(s,9H);0.84(t,J=7Hz,3H);1.05(m,1H);1.17(m,1H);1.2〜1.6(多重線シグナル、10H;見かけt,J=6Hz,2H);1.7(m,1H);2.05(m,1H);3.25〜3.35(m,3H);3.62(t,J=7Hz,1H);3.65(m,1H);4.03(見かけt,J=6Hz,2H);4.05(m,1H);6.80(d,J=8.4Hz,2H);7.15(d,J=8.4Hz,2H)。13C NMR(75MHz,CDCl3)δ −1.33、14.01、17.75、22.71、24.58、25.57、26.11、30.03、34.77、43.11、46.60、47.80、65.31、114.59、128.70、132.75、157.59、171.67。HRMS(ESI+1イオン)m/z:C22H38NO2の計算値376.2672、実測値376.2666。
【0195】
4−(1−オキソ−1−(ピペリジン−1−イル)ヘキサン−2−イル)ベンズアルデヒド
【化43】

DMSO(0.20mL、2.8mmol)を、無水CH2Cl2(5mL)中の塩化オキサロイル(122μL、1.42mmol)の冷却(−78℃)撹拌溶液に加えた。5分後、16.2(300mg、1.29mmol)を加え、撹拌を15分間続行し、次いでトリエチルアミン(0.90mL、6.5mmol)を滴下した。さらに5分後、混合物を室温に加温した。反応混合物をHCl(0.1M)で洗浄し、有機層をさらに水で抽出し、脱水し(MgSO4)、真空下で濃縮した。表題化合物を無色油状物(222mg、59%)として得た。精製は必要でなかった。1H NMR(400MHz,CDCl3)δ 0.80(t,J=7Hz,3H);1.05(m,1H);1.15(m,1H);1.2〜1.6(多重線シグナル、8H);1.7(m,1H);2.05(m,1H);3.29(m,2H);3.36(m,1H),3.61(m,1H);3.71(t,J=7Hz,1H);7.39(d,J=8.4Hz,2H);7.76(d,J=8.4Hz,2H)。13C NMR(75MHz,CDCl3)δ 13.97、22.67、24.49、25.55、26.21、30.05、34.64、43.33、46.69、48.88、128.57、130.21、135.08、148.03、170.36、191.91。HRMS(ESI+1イオン)m/z:C18H26NO2の計算値288.1958、実測値288.1963。
【0196】
化合物17.9
4−(1−オキソ−1−(ピペリジン−1−イル)ヘキサン−2−イル)安息香酸
【化44】

オキソン(257mg、0.42mmol)をDMF(5mL)中の4−(1−オキソ−1−(ピペリジン−1−イル)ヘキサン−2−イル)ベンズアルデヒド(100mg、0.35mmol)の撹拌溶液に加え、得られた混合物を室温で16時間撹拌した。DMFを真空下で除去し、得られた残留物をフラッシュカラムクロマトグラフィー(50%EtOAc/ヘキサン、Rf=0.4)で精製して所望の化合物を淡黄色固体(68mg.64%)として得た。MP=142℃。1H NMR(400MHz,CDCl3)δ 0.86(t,J=7Hz,3H);1.05(m,1H);1.15(m,1H);1.2〜1.6(多重線シグナル、8H);1.71(m,1H);2.10(m,1H);3.33〜3.43(m,3H);3.69(m,1H);3.77(t,J=7Hz,1H);7.38(d,J=8.4Hz,2H);8.02(d,J=8.4Hz,2H)。13C NMR(75MHz,CDCl3)δ 13.98、22.68、24.50、25.55、26.16、30.04、34.60、43.32、46.68、48.82、128.04、130.50、153.75、170.59。HRMS(ESI+1イオン)m/z:C18H26NO3の計算値304.1907、実測値304.1917。
【0197】
残りの化合物を、出発原料を適切に変えて、上記した方法に対応する方法で作製した。
【0198】
実施例第2部
ポリマー系
防汚化合物16.5に相当するペンダント基を含むいくつかのポリマーを合成した。
【0199】
具体的には、モノマー16.11を用いて化合物16.5を、アクリレートをベースとしたポリマー中に組み込んだ。
【化45】

【0200】
ポリマーを、水性の環境において持続的な方法で(活性)化合物16.5を放出する能力に関して評価した。特に、ポリマー材料の防汚効力を、実験室及び現場でのアッセイで試験して防汚性能及び毒性を確認した。
ポリマーの合成
【0201】
海洋用コーティングにおける我々の発明の潜在的用途を例示するために、実施形態と同じポリマーを設計し合成した。しかし、これらの実施形態を限定的なものととるべきではない。
【0202】
放出可能な官能性単位として化合物16.5を含むポリマーを、適度な親水性を備え(水中での水和を確実にするために)、市販の海洋用塗料に適切な強度、溶解性及び相溶性を備えるように設計した。これらの要件を実現させるためには、ポリマーのTgを好ましくは室温より高くすべきであり、分子量は約10Kダルトンを目標とすべきである。
【0203】
そうしたポリマーを、フリーラジカル条件下で開始剤としてAIBN、ABCN又は過酸化ベンゾイルを用いてビニル含有化合物16.11を適切なビニルモノマーと重合させて合成した。
【0204】
ポリマーA
P(16.11−co−MMA−co−HEA)
化合物16.11とメチルメタクリレート(MMA)及びヒドロキシエチルアクリレート(HEA)のコポリマーを設計して官能性ポリマーを得た。そこで、16.11、メチルメタクリレート(MMA)及び(HEA)を混合し、標準的なフリーラジカル条件下で重合した。
【化46】

【0205】
質量比を、MMAがポリマーの主鎖の大部分を形成して機械的強度を付与しTgが確実に室温より高くなり、同時にHEAがポリマーの親水性を向上させ得る水素結合能力をもたらすように設計した。
【0206】
0.54gの官能性モノマー(16.11)(ヘビービスコースオイル(heavy viscose oil)様黄色液体)を、3mlのDMF中で2.0gのMMA、1.0gの2−ヒドロキシルエチルアクリレート(HEA)及び40mgのABCNと混合した。窒素を10minパージして混合物を脱ガスし、次いで70℃に温度設定した油浴中に16時間置いた。続いて、反応混合物を50mLのエーテルに注加した。沈殿物をろ取し、真空下、室温で乾燥して表題化合物を無色固体(2.5g、74%)として得た。
【0207】
IR分光法によるポリマー材料の分析によって、1621cm−1で検出された主要吸収と一緒に、約1730cm−1での予測されたエステルC=O伸縮吸収が明らかになった。そうした低周波C=O振動は第三アミドの特徴であり、したがってこのバンドは、重合した16.11のピペリジンアミド結合に割り当てられる。
【0208】
ポリマーB
P(16.11−co−MMA−co−VP)
ポリマーBをポリマーAと同様にして設計した。但し、ポリマーの親水性を増大させるためにHEAの代わりにビニルピロリジノン(VP)を使用した。ポリマーBを、ポリマーAで説明したのと同じモノマー比を用いてフリーラジカル条件下で合成した。ポリマーBの構造を以下に示す。
【化47】

【0209】
3mlのDMF中で0.5gの官能性モノマーを、2.0gのMMA、1.0gのビニルピロリドン(VP)及び40mgのABCNと混合し、窒素を10minパージして混合物を脱ガスした。次いで、混合物を70℃に温度設定した油浴中に16時間置いた。次いで生成物に5mlのDCMを加えると透明な溶液が生成した。溶液を、撹拌しながらヘキサンに注加した。精製された生成物を白色沈殿物として収集した。純粋な生成物を集め、空気中、室温で乾燥して表題化合物を無色固体(1.9g、54%)として得た。
【0210】
IR分光法によるポリマー材料の分析によって、先に割り当てた約1640cm−1でのピペリジンアミドカルボニル振動と一緒に、約1724cm−1での予測されたエステルカルボニル伸縮吸収が明らかになった。VPの組み込みは、IR分光法によりγ−ラクタムの存在と一致する約1660cm−1に現れた明瞭な吸収から明らかである。
【0211】
GPCは5300ダルトンのMWを示した。最後に、ポリマーの可溶性の特徴により、1H NMR分光法によるさらなる分析が可能となった。6.9〜7.2ppmでのシグナルを16.11単位のフェニル部分に割り当て、4.0ppm〜4.3ppmの幅広のピークをピロリジノン単位のN原子と隣接する環メチレンに割り当てた。3.5〜3.8ppmにおける大きな幅広シグナルをMMA単位のメチルエステルに割り当てた(Brar and Kumar、2002年)。0.9ppm〜2.5ppmのシグナルを、ポリマー主鎖のメチレン及びメチン基並びに16.11の側鎖のメチレン及びメチル基に帰属させる。
【0212】
ポリマーC
P(TBA−co−MMA−co−VP)
標準コポリマー(ポリマーC)も合成した。ここで、16.11をt−ブチルアクリレート(TBA)で置き換えた。そうしたポリマーを、コポリマー自体の機能として、何らかのバックグラウンド毒性又は沈降防止活性が存在するかどうかを確認するために合成した。
【化48】

【0213】
フリーラジカル重合を、ポリマーA及びBの場合と同じ質量比を用いて実施した。
【0214】
0.6gのtert−ブチルアクリレートを、3mlのDMF中で2.0gのMMA、1.0gのビニルピロリドン(VP)及び40mgのABCNと混合し、この混合物を、窒素を10minパージして混合物を脱ガスした。次いで混合物を、70℃に温度設定した油浴中に16時間置いた。次いでこの生成物に5mlのDCMを加えると透明な溶液が生成した。溶液を、撹拌しながらヘキサンに注加した。精製された生成物を白色沈殿物として収集した。純粋な生成物を集め、空気中、室温で乾燥して所望の化合物を無色固体(3.2g、89%)として得た。
【0215】
IR分光法によるポリマーの分析によって、1728cm−1及び1664cm−1での主要振動モードのエステル及びラクタムカルボニル基の存在が明らかになった。GPCにより、67000ダルトンの所望MWが達成されたことが示された。これは、ポリマーBで得られたMWよりずっと高いものであった。
【0216】
ポリマーの1H NMR分析により、1.4ppmで現れる、ポリマー中でのt−ブチル部分の存在が確認された。
【0217】
実施例第3部
化合物の生物学的検査
手法
生物学的アッセイをフジツボ幼生で実施した。フジツボは、海洋汚損群落の支配的で頑強なメンバーであり、しばしば、耐性のより小さい生物のための基材として作用する。したがって、これらは歴史的に防汚研究のためのモデル生物として用いられてきた。幼生の試験化合物に対する生物学的応答を判定するために、2つのバイオアッセイ:沈降(沈降段階のキプリドを用いて)及び毒性(ノープリウス(nauplii)を用いて)アッセイを実施した。手順は、Rittschofら(1992年)によって最初に記載されたこの分野の標準的な方法にしたがった。
【0218】
バイオアッセイ用のストック溶液の調製
各化合物のストック溶液を50mg/mlで作製した。純粋化合物をDMSOに希釈し、超音波処理した。ストック溶液を、4mlの琥珀色のねじぶたバイアル中、−20℃で使用するときまで貯蔵した。バイオアッセイのため、少量のストック溶液を1μmのろ過した海水に希釈した(ガラス製シンチレーションバイアル中に)。次いで溶液を10分間超音波処理した。所望の濃度域を得るために、試験溶液の連続希釈液を作製した。対照として、同等量の海水中へのDMSOの連続希釈液を使用した。
【0219】
毒性アッセイ
毒性アッセイでは、フジツボアンフィバラヌスアンフィトライト(Amphibalanus amphitrite)(以前はバラヌスアンフィトライト(Balanus amphitrite):Pitombo、2004年)のII期のノープリウス幼生を用いた。アッセイ手順はRittschofら(1992年)の手順を修正したものである。成体A.アンフィトライト(A.amphitrite)をシンガポールのクランジ(Kranji)マングローブ付近の潮間帯地域から採取した。幼生培養はRittschofら(1984年)をもとにした。採取に続いて、容器の一方の側部に光ファイバー光源を置き、得られたノープリウスの密な集まり(dense cloud)からピペッティングすることによって、ノープリウスをバイオアッセイで使用するために濃縮した。
【0220】
各化合物についてのLD50値を判定するために、化合物を0〜50μg/mlの濃度範囲にわたり試験した。各アッセイのため、各化合物を各濃度で、ノープリウスの単一バッチで3連で試験した。全部のアッセイを、異なるバッチのノープリウスを用いて2回実施した。各アッセイと一緒に2つの対照を実行した(3連で):ろ過海水だけ、及び1μg/mlのDMSO(試験化合物用の溶媒としてDMSOを使用したので、この濃度は、最も高い試験化合物濃度でのDMSOの濃度と同等である)。
【0221】
アッセイのため、約20のノープリウス(50μlろ過海水中に)を、2mlガラス製バイアル(ラファパック(La Pha Pack)(登録商標)PN11−14−0544)中の1mlの試験溶液又は対照に加えた。アッセイを25〜27℃で22〜24時間実行した。この後、Bogorovトレーを用いて生存ノープリウスと死滅ノープリウスの数を計数した。死にかけているノープリウスは死滅したものと勘定した。すべてのアッセイについてのデータを一緒にし、プロビット解析(Libermann、1983年)を用いてLD50を計算した(可能な場合)。プロビット解析を用いてLD50を計算できなかった場合、プロットしたデータをもとにして値を外挿した。
【0222】
沈降アッセイ
沈降アッセイ(フジツボキプリドを使用)はRittschofら(1992年)が記載している手法をもとにした。上記したようにしてノープリウスを培養し、次いで25℃で、テトラセルミススエシカ(Tetraselmis suecica)とカエトセロスムエレリ(Chaetoceros muelleri)の1:1v/vの藻類混合物(おおよそ5×105細胞/mlの密度)上で飼育した。これらの条件下で、ノープリウスは通常5日間でキプリドに変態する。キプリドを4℃で2日間エイジングした。エイジング後のろ過海水対照における沈降はおおよそ45〜70%である。
【0223】
沈降アッセイを、7ml中性ガラス製バイアル(サムコ(Samco)(登録商標)T103/V1;34×23mm径)中で実施した。アッセイのため、各溶液を所望最終濃度の2倍の濃度で作製した;0.5mlのこの溶液をバイアルに移した。各バイアルに、キプリドを、20〜40のエイジングしたキプリドを含む0.5mlろ過海水を移して加えた。毒性アッセイの場合のように:各化合物を各濃度で、単一バッチからのキプリドで3連で実行した;2つの対照(ろ過海水及びDMSO)を各アッセイと一緒に実行した;全部のアッセイを、2つの異なるバッチのキプリドを用いて2回実施した。
【0224】
アッセイを24時間実施し、次いで沈降したキプリドの数、自由に遊泳している(沈降していない)キプリドの数及び死滅したキプリドの数を、各バイアルについて計数した。変態した幼若フジツボと、沈降しているが(それ自体がバイアルに固着)変態はしていないキプリドの両方を「沈降している」と計数した。データを沈降率%で表した。すべてのアッセイについてのデータを一緒にし、ED50(対照と比較して沈降の50%減少を引き起こす濃度)を、(可能な場合)プロビット解析(Libermann、1983年)を用いて計算した。プロビット解析を用いてED50を計算できなかった場合、プロットしたデータをもとにして値を外挿した。
【0225】
結果
化合物についての生物学的活性を表1及び表2に示す。データは、幼生のバッチ(複数)を用い、バッチ当たり3連の各化合物を用いたアッセイによるものである。プロビット解析を用いてLD50又はED50を計算できなかった場合、値を、プロットしたデータから推定した。LD50値が高く(低い毒性)、しかしED50は低い(非常に高い効力)化合物は、防汚のために最も望ましいものである。試験したいくつかの化合物は、従来確認されている非官能化化合物(12.1及び12.2;PCT/SG2009/000175)以上の治療可能比を示す。
【0226】
【表6】

【0227】
【表7】

【0228】
したがって、生物学的スクリーニングは、官能化された分子が望ましい生物学的活性を保持するか又はそれを向上させる(フジツボキプリド沈降に対して効力は高いが毒性は低い)ことを示している。
【0229】
LD50値が高く(低い毒性)、しかしED50は低い(非常に高い効力)化合物は、防汚の目的に最も望ましいものである。すべての化合物が1より大きい治療可能比をもたらした。
【0230】
上記の結果は、これらの新規の有機小分子を環境に優しい防汚用添加剤として使用できることを実証している。これらの分子は、芳香環上の異なる置換基及び置換パターンにもかかわらず、効果的な沈降防止活性を保持している。実際、いくつかの化合物は、非置換親構造の生物活性に匹敵するか又はそれより良好な生物活性を示す。これらの新規な分子は、それらが防汚化合物を海洋用コーティング系につなぐ又はそれに固定するのに使用され得る官能基を支えることができるという点で親構造を改善する。
【0231】
これらの化合物は既存のアクリレート塗料中にブレンドすることができ、したがって、既存のコーティング選択肢に対する実行可能な代替案である。さらに、その単純な構造のため、これらの化合物は、海洋環境において細菌という手段によって分解される魅力的な候補品であり、蓄積する可能性は小さく、将来の健康上のリスクを引き起こすこともなさそうである。さらに、ジウロン(Diuron)(登録商標)やシーナイン(Sea−Nine)(登録商標)などの既存の有機殺生物剤は生物濃縮し、海洋環境において有害な影響を引き起こすことが分かっていることを考えれば、本発明の化合物は従来の金属をベースとした添加剤に対する価値ある代替物を代表するものである。
【0232】
実施例第4部
ポリマー系
放出試験
実験室アッセイのためのマルチウェルプレートの調製
2つのバッチのポリスチレン4×6マルチウェルプレート(ウェルの底部は2cm2)を実験室アッセイ用に調製した。50mgのP(MMA−co−16.11−co−VP)を1.0mlのエタノールに溶解してポリマーのストック溶液を作製した。プレートを所望量のストック溶液(10μL、20μL、30μL、40μL、50μL及び70μL)でコーティングし、空気中、27℃で6時間置いた。次いでこれらのウェルに脱イオン水を加えた。24時間後、ウェルから水を完全に除去し、さらなる分析用に保存した。次いでポリスチレンプレートを乾燥空気流下で乾燥した。その間、対照試料を、水に浸漬させずに同じ方法で調製した。
【0233】
沈降アッセイ
コーティングを、フジツボキプリド沈降アッセイを用いて防汚効果について試験した。キプリドを上記のようにして培養した。5日後キプリドを得、これらを4℃で2日間エイジングし、次いで沈降実験を行った。実験のため、キプリドを、20〜40のエイジングしたキプリドを含む1mlろ過海水を各ウェルに移して加えた。マルチウェルプレートを24時間インキュベートし、次いで、沈降したキプリドの数、自由に遊泳している(沈降していない)キプリドの数及び死滅キプリドの数を各ウェルについて計数した。
【0234】
アッセイの結果を図1に示す。すべての処理について、キプリド死滅率は10%未満であった。対照コーティング、P(MMA−co−tBA−co−VP)についての沈降は、コーティングしていないポリスチレンの場合と同様であった。P(MMA−co−16.11−co−VP)でコーティングされたウェルはキプリド沈降の減少を示しており、>40μlでの処理では、沈降は観察されなかった。
【0235】
HPLCによる定量化
24時間浸漬させた後に得られた一定分量の溶液を既知容積の内部標準と混合し、HPLC装置に直接注入し、226nmでモニターした。浸漬後に得られた溶液中へ放出された16.5の量を、放出速度の計算値と一緒に以下の表3に示す。それぞれの場合、放出された16.5の量は非常に狭い範囲内に入る(0.15〜0.45μg)。これは、それぞれの場合、ポリマーの量に関係なく、同じような表面積が水性環境に曝露されていることを表している。
【0236】
【表8】

【0237】
図1は、コーティングされたウェルにおけるフジツボの沈降の平均パーセンテージを示す。P(MMA−co−tBA−co−VP)を対照コーティングとして塗布した。このコーティング上への沈降は、コーティングされていないポリスチレンについてと同様であった。P(MMA−co−16.11−co−VP)の量を増大させると、フジツボ沈降は減少する結果となった。>40μlでの試験処理では沈降は認められなかった。すべての処理において、キプリド死滅率は10%未満であった。
【0238】
ポリマーからの活性化合物16.5の首尾よい放出に続いて、ポリマーから化合物16.11が加水分解されて、溶液中に化合物16.5を放出することについて分析を実施した。
【0239】
実験室分析のためのコーティングバイアルの調製
12mmの内径を有するガラス製バイアルの内側底部を粗いサンドペーパーでつや消し処理し、次いで、コポリマーの存在量がそれぞれ500μg及び2500μgのP(MMA−co−16.11−co−VP)となり、1.13cm2の表面積を覆うように、エタノール中のP(MMA−co−16.11−co−VP)のストック溶液を播種した。バイアルを終夜かけてキュアリングし、次いで2mLの脱イオン水を各ウェルに加えた。24時間後、水を除去し2mLの新鮮な脱イオン水で置き換えた。さらに24時間後、またさらに48時間後、すなわち1日、2日及び4日の時間的経過でこれを繰り返した。集めた溶液の一定分量を、226nmでの応答比をモニタリングしながら、内部標準(フェノール)に対して実行した。指定された時間点での得られた放出16.5の質量を表4に示す。
【0240】
それぞれの場合、水の中の16.5の存在が、分析用HPLC−ESIによる一定分量の分析により確認された。
【表9】

【0241】
最初の4日間での平均放出速度を表5に示す。500μgと2500μgをコーティングしたバイアルの1日目での際立った放出速度の差(それぞれ0.468μg cm2日−1及び0.045μg cm2日−1)は、放出試験開始時のコーティング表面粗度の差を反映している。1日目の後では、放出速度の収束が見られ、この放出レベルはこの後6日間にわたって同程度のレベルで維持されている。
【表10】

【0242】
参照
本発明、及び本発明が関係する現況技術をより完全に説明し開示するために、いくつかの特許及び出版物を上記に引用している。これらの文献の全引用を以下に示す。これらの文献のそれぞれを、それぞれの個別的参照が具体的且つ個別的に参照により組み込んで示されているかのように同じ程度に、全体として参照により本開示に組み込む。
Armarego, W.L.F.; C.L.L. Chai. 2003.Purification of Laboratory Chemicals; 5th ed.; Butterwortth-Heinemann: Sydney.
Brar, A. S. and R. Kumar. "Investigationof Microstructure of the A/-Vinyl-2-pyrrolidone/Methyl Methacrylate Copolymersby NMR Spectroscopy" Inc. J AppI Polym Sci 85: 1328-1336, 2002.
Libermann H. R. "Estimating LD50using the probit technique: a basic computer program" Drug Chem. Toxicol1983, 6, 1 11-1 16.
Pitombo F. B. 2004. Phylogenetic analysisof the Balanidae (Cirripedia, Balanomorpha). Zool. Scr. 33: 261-276.
Rittschof D.; Clare, A. S.; Gerhart, D. J.;Avelin, M. Sr.; Bonaventura, J. "Barnacle in-vitro assays for biologicallyactive substances: toxicity and settlement inhibition assays using masscultured Balanus amphitrite amphitrite Darwin" Biofouling 1992, 6, 115-122.
Rittschof D.; Branscomb, E.; Costlow, J. "Settlementand behavior in relation to flow and surface in larval barnacles, Balanusamphitrite Darwin" J. Exp. Mar. Biol. Ecol. 1984, 82, 131-146.
Teo, L. M. S., D. Rittschof, F. Jameson, C.Chai, C. L. Chen, S. C. Lee. Antifouling compounds for use in marineenvironment. PCT Int. Appl. (2009),
WO2009139729 A1 .
Voulvoulis, N. "Antifouling paintbooster biocides: occurrence and partitioning in water and sediments" In:Konstantinou, I. K. (ed). Antifouling Paint Biocides. The Handbook ofEnvironmental Chemistry, 2006, Volume 5, Part O, pp.155-170. Springer-VerlagBerlin-Heidelberg.
フォームの始まり
フォームの終わり
【技術分野】
【0001】
本発明は、防汚活性及び/又は抗菌活性を示す官能化されたアミド小分子並びに海洋環境における細菌膜及び生物の増殖の制御におけるその使用に関する。
【背景技術】
【0002】
海洋汚損とは、水面下の人工物表面上における生物の沈降(settlement)及び増殖を指し、これは海洋の歴史始まって以来の問題である。水面下表面の海洋生物による集落形成はそうした表面が海洋環境に入って数日から数週間以内に起こり、長期に存在し続ける海洋構造物(水中ケーブル、発電機、パイプライン等)ではそうした集落形成は起こるのは当然である。汚損生物に対する戦いはますます重要な課題になってきている。海洋汚損を制御するための効果的な方法の必要性は、国際海運業界にとって最も重要なものである。
【0003】
防汚コーティングは一般に、有機スズや銅化合物などの広範な殺生物剤の作用で幼生汚損体を殺傷することによって海洋生物の沈降を防止する。著しく効果的ではあるが、有機スズ化合物の使用によってもたらされる環境劣化が非常に激しいので、船舶用塗料の企業は2003年にこれらの塗料を市場から自主的に引き上げており、IMOは2008年に有機スズ化合物の使用を禁止した(2008年9月17日に発効された船舶の有害な防汚システムの規制に関する国際条約(International Convention on the Control of Harmful Anti−fouling Systems on Ships))。銅及び殺生物剤ブースター含有塗料は依然として広く利用されているが、海洋環境において蓄積される可能性があるのでその使用は望ましくない(Voulvoulis、2006年)。
【0004】
現在市販されている海洋用コーティングは2つの部類に分けることができる:防汚コーティングと汚損放出コーティングである。防汚コーティングは、酸化によるか、又はより一般的には毒性金属イオンへの曝露によって汚損体を殺傷する広範な殺生物剤を使用する。汚損放出コーティングは主としてきれいにするのが簡単なシリコンベースのポリマーであるが、これらのうち最も好ましいものは、通常、生物を殺傷する添加剤や触媒も含有する。上記したように、コーティングにおいてトリブチルスズなどの毒性のある防汚剤は環境面で許容されないという結果の認識にもとづいた法律及び合意により、環境的に有害性のより少ない新規なコーティングの開発に対する関心が促進されてきた。
【0005】
Teoら(本出願の発明者)により米国特許第11/265,833号に報告されているアプローチは防汚剤としての薬剤の使用である。その薬剤は汚損生物の変態を破壊できることが実証されている。その公知の合成法、化学的特性並びに脊椎動物及びヒトにおける主要な作用機構と併せて、市販の薬剤は防汚剤の潜在的な供給源としてスクリーニングされた。有望な生物活性を有する8つの薬剤が報告されているが、これらの薬剤は海洋環境において蓄積され得るという問題が依然として残っている。さらに、これらの薬剤のいくつかには、海水中における難溶性に起因する送達の問題という課題がある。
【0006】
広範な殺生物剤に対する他の代替物は、海洋生物の沈降を阻害する生分解性の有機小分子である。そうした分子は環境において扱いにくいはずはなく、また「優しい設計(benign by design)」であるはずである。この目的を達成するために、Teoらは最近、フジツボ幼生及び細菌性生物膜に対する単純なα,α−二置換アミド(選択された例を以下に示す)のファミリーの防汚可能性を実証した(PCT/SG2009/000175)。これらの分子は、海洋環境において急速に分解すると予測される。
【化1】

【0007】
多くの有機殺生物剤が非スズ系塗料への添加剤として用いられているが、小分子をコーティング系の中に直接組み込むことによりいくつかの問題が提起されている。まず、定期的な乾ドックに先立つ船舶の再塗装のための要件を最少化するために、有機汚損防止剤の放出が数年間維持されなければならないことである。さらに、現在使用されている多くの有機汚損防止剤は海洋汚損体に対して毒性があり、これは使用量が増すと蓄積された場合に海洋生態系に悪影響を及ぼす可能性がある。有機汚損防止剤の物理的特性は市販のコーティング系の完全性に対しても大きな影響を及ぼす可能性があり、これにより、金属をベースとした結合剤の非存在下では、コーティング系の配合変更(reformulation)が必要となる可能性がある。
【0008】
極めて重要なことであるが、小分子がコーティング系に組み込まれる機構は、小分子の活性の保持を可能にするはずである。小分子の構造改変は活性に対して影響を及ぼすことが予想されるので、何らかの活性分子をコーティング系に組み込むことはチャレンジングな課題である。
【発明の概要】
【発明が解決しようとする課題】
【0009】
本発明者らは、コーティング系中に組み込むのに適した環境に優しい殺生物剤及びそうした殺生物剤を含むコーティング系を提供する課題に対処しようとするものである。
【課題を解決するための手段】
【0010】
最も一般的には、本発明は、特定のアリール含有α,α−二置換アミドが、その置換基がコーティング組成物のある成分、例えばあるポリマーと結合するのに適しているアリール上の1つ又は複数の選択された置換基を備えておくべきであると提案する。驚くべきことに、この特定の方法で改変されたアミド化合物は有用な活性を保持している。
【0011】
特に、PCT/SG2009/000175に記載されている小分子防汚添加剤の誘導体が本明細書で開示されており、その誘導体は、例えば自己研磨型コーティング系との共有結合を可能にする官能基を備えている。添加剤を既存のコーティング系と共有結合させることができるということは、その制御放出を容易にする、したがってコーティング寿命を延長し、防汚特性を高める潜在性を有している。さらなる研究によれば、生物学的効力をそれほど損なうことなくコーティング系と安定的に結合できるようにし、それによって既存の放出化学(pre−existing release chemistry)による生体活性分子の放出を可能にする構造的改変が確認されている。
【0012】
特に、本出願は、海洋用コーティング系との結合点として働く官能基を担持する一連のα−アリールアミドの合成及び生物学的試験について説明する。望ましい防汚特性を保持しており(フジツボキプリド(barnacle cyprid)の沈降に対する効力は高いが、毒性は低い)、同時に既存のコーティング系との共有結合を可能にするエステル又はエーテル結合を含むいくつかの分子について説明する。
【0013】
化合物
本発明は一般に、以下の一般的α,α−二置換構造:
【化2】

(式中、RAとRBの一方若しくはその両方はアリールであり、RC及びRDは独立に任意選択で置換されたアルキルを表すか、又は一緒になって環を形成している)
を有する、本明細書で「防汚アミド化合物」と称する1つの部類の化合物に関する。
【0014】
本発明は、そうした化合物のRAとRBの一方又はその両方のアリール基を、コーティング系(例えば、ポリマー)との連結が可能になるように調整された1つ又は複数の基で官能化すべきであると提案する。さらに、本発明は、そうした基のコーティング系(例えば、ポリマー)からの開裂の産物であるアリール置換基を有する化合物は有用な活性を保持できるということを提案する。
【0015】
本発明は殺生物特性又はバイオスタティック特性を示すそうした防汚アミド化合物に関する。したがって、防汚アミド化合物は、「殺生物性化合物」又は「バイオスタティック化合物」と称することもできる。
【0016】
本発明の実施形態は、既存の海洋用コーティング系の防汚特性を高める潜在性を有している。特に、実施形態は以下の利点、すなわちフジツボ沈降に対する高い効力、低い毒性、及び海洋環境において急速に分解しそうである(環境に優しい)ことの1つ又は複数を有することが好ましい。
【0017】
アリール基を異なる官能基で置換することを、異なるコーティング及び異なる用途のために特性を調整する結合点として用いることができる。
【0018】
この系の利点は、既存のコーティング系にこれらの分子を組み込める潜在性にあり、汚損防止剤の放出はコーティングの寿命と直結することになる。
【0019】
第1の態様では、本発明は、式(I)の化合物又はその塩:
【化3】

(式中、
R1及びR2はそれぞれ独立に、
(A)OH、RS1OH、ORS2、RS1ORS2、OC(O)H、OC(O)RS2、RS1OC(O)H、RS1OC(O)RS2、C(O)OH、C(O)ORS2、RS1C(O)OH、RS1C(O)ORS2、ORS1OH、ORS1ORS2、ORS1OC(O)H、ORS1OC(O)RS2、ORS1C(O)OH及びORS1C(O)ORS2の少なくとも1つで置換されたアリールであって、
存在する場合、各RS1が独立に、任意選択で置換されたC1〜C5アルキレンであり、
存在する場合、各RS2が独立に、任意選択で置換されたC1〜C5アルキル、C2〜C5アルケニル及びC1〜C5シリル−C1〜C5アルキレンから選択されるアリール、
(B)任意選択で置換されたC3〜C12アルキル
から選択され、
但し、R1及びR2の少なくとも1つは(A)であり、
R3及びR4はそれぞれ独立に、任意選択で置換されたC1〜C6アルキルであるか、又はR3とR4は一緒になって、それらが結合している窒素を組み込んだ任意選択で置換された5〜12員複素環を形成している)
を提供する。
【0020】
R1とR2の両方が(A)、すなわちアリールであることは可能であるが、R1とR2のうちの1つは(B)である、すなわちC3〜C12アルキルであることが好ましい。
【0021】
本明細書で説明するように、C3〜C12アルキルは、飽和及び不飽和の分岐状及び非分岐状C3〜C12アルキルを含む。いくつかの好ましい実施形態では、そのアルキルは不飽和アルキルである。特に、好ましくはR1及びR2の少なくとも1つは、不飽和C3〜C12アルキル、好ましくは不飽和C3〜C10アルキル、好ましくは不飽和C3〜C8アルキル、最も好ましくは不飽和C3〜C6アルキルである。したがって、好ましくは、R1及びR2の少なくとも1つは、C3〜C12アルケニル、より好ましくはC3〜C10アルケニル、より好ましくはC3〜C8アルケニル、最も好ましくはC3〜C6アルケニルである。実際、不飽和を加えると、飽和アルキルに匹敵する活性を提供することができる。
【0022】
そうした実施形態では、アルケニル中に1個の炭素−炭素二重結合、例えばC3〜C10アルケニル中に1個の炭素−炭素二重結合又はC3〜C6アルケニル中に1個の炭素−炭素二重結合が存在することが好ましい。炭素−炭素二重結合はアルケニル基の末端にある、すなわちCn炭素とCn−1炭素との間の末端炭素−炭素二重結合であることが適切である。C6アルケニルが特に好ましい。特に好ましいアルケニルはC6アルケニルであり、最も好ましくは5−ヘキセニル(−CH2−(CH2)3−CH=CH2)である。
【0023】
複数の実施形態では、R1及びR2の少なくとも1つはC3〜C5アルキルである。アリール上の指定された置換基の1つ又は複数と一緒に3〜5個の炭素原子を有するα炭素上のアルキル基、特に飽和アルキルは、防汚活性を提供するのに特に有用であり、同時に海水への望ましい溶解性及び分解性も示す。
【0024】
複数の実施形態では、R1及びR2の少なくとも1つはC4アルキル、より好ましくはn−ブチルである。α炭素上のC4アルキル基、特にn−ブチルは、アリール上の指定置換基の1つ又は複数と一緒になって驚くほど高いレベルの防汚活性を提供することができ、これは適切な速度で分解される。
【0025】
R1は、C3〜C8アルキル、好ましくはC3〜C6アルキル、より好ましくはC4〜C6アルキル、最も好ましくはC4アルキル又はC6アルキルであることが好ましい。R2は(A)であることが適切である。
【0026】
本明細書で説明するように、R1及びR2の一方は(A)、すなわちアリール(以下で論じるように好ましくはC5〜C15アリール、より好ましくはフェニル)であり、他方はC3〜C12アルキル(好ましくはC3〜C6アルキル、より好ましくはn−ブチル又は5−ヘキセニル)である。本発明者らが実施した試験は、アリール上の指定置換基の1つ又は複数と併せたこの置換パターンで望ましいレベルの防汚活性が可能であることを実証している。
【0027】
したがって、R1及びR2の1つは、飽和C3〜C5アルキル及びC3〜C10アルケニルから選択されることが好ましい。アルキル(飽和又は不飽和)は任意選択で置換されているが、それは置換されていないことが好ましい。
【0028】
適切には、(A)のアリールは、C5〜C15アリール、好ましくはC6〜C12アリール、より好ましくはC6〜C10アリール、最も好ましくはC6アリールである。アリールはカルボアリール又はヘテロアリールであってよいが、カルボアリールが好ましい。特に好ましいのはフェニルである。
【0029】
好ましくは、R1は(B)であり、R2は
【化4】

(式中、RA1、RA2、RA3、RA4及びRA5はそれぞれ独立に、OH、RS1OH、ORS2、RS1ORS2、OC(O)H、OC(O)RS2、RS1OC(O)H、RS1OC(O)RS2、C(O)OH、C(O)ORS2、RS1C(O)OH、RS1C(O)ORS2、ORS1OH、ORS1ORS2、ORS1OC(O)H、ORS1OC(O)RS2、ORS1C(O)OH、ORS1C(O)ORS2、H及びRS2から選択され、
存在する場合、各RS1は独立に、任意選択で置換されたC1〜C5アルキレンであり、
存在する場合、各RS2は独立に、任意選択で置換されたC1〜C5アルキル、C2〜C5アルケニル及びC1〜C5アルキルシリル−C1〜C5アルキレンから選択され、
但し、RA1、RA2、RA3、RA4及びRA5の少なくとも1つはHでもなくRS2でもない)
である。
【0030】
各RS1は独立に、任意選択で置換されたC1〜C3アルキレン、好ましくは任意選択で置換されたC1〜C2アルキレン、最も好ましくはメチレンから選択されることが適切である。RS1は置換されていないことが適切である。
【0031】
各RS2は独立に、任意選択で置換されたC1〜C3アルキル、C2〜C3アルケニル及びC1〜C3シリル−C1〜C3アルキレンから選択されることが適切である。疑念を回避するためであるが、本明細書で称するシリル−アルキレンは、Si(Me)3などのシリルで置換されたアルキレン(例えば、−CH2−CH2−)である。
【0032】
好ましくは、各RS2は独立に、任意選択で置換されたC1〜C2アルキル、C2〜C3アルケニル及びC1アルキルシリル−C1〜C3アルキレンから選択される。特に好ましいものは、各RS2が独立にメチル、CH2=CH−及び(Me)3Si−CH2−CH2−から選択されるものである。
【0033】
特に好ましい実施形態では、RA1、RA2、RA3、RA4及びRA5はそれぞれ独立に、OH、OMe、C(O)OH、CH2OH、CH2OAc、OC(O)CH3、OCH2C(O)OH、OCH2C(O)OCH3、OCH2CH2OH、OCH2CH2OC(O)CH3、OCH2CH2Si(Me)3、OC(O)CH=CH2及びHから選択される。但し、RA1、RA2、RA3、RA4及びRA5の少なくとも1つはHではない。
【0034】
特に好ましい実施形態では、RA1、RA2、RA3、RA4及びRA5はそれぞれ独立に、OH、OMe、CH2OH、OC(O)CH3、OCH2CH2OH、OCH2CH2Si(Me)3、OC(O)CH=CH2及びHから選択される。但し、RA1、RA2、RA3、RA4及びRA5の少なくとも1つはHではない。
【0035】
さらに好ましい実施形態では、RA1、RA2、RA3、RA4及びRA5はそれぞれ独立に、OH、OMe、OC(O)CH=CH2及びHから選択される。但し、RA1、RA2、RA3、RA4及びRA5の少なくとも1つはHではない。
【0036】
アリール上で複数の置換基が可能であるが、RA1、RA2、RA3、RA4及びRA5の少なくとも2つがHである、より好ましくはRA1、RA2、RA3、RA4及びRA5の少なくとも3つがHであることが好ましい。したがって、一置換及び二置換アリール(例えば、フェニル)が好ましい。
【0037】
置換基は1位〜5位のいずれか、すなわちオルト、メタ又はパラ置換基であってよい。しかし、3位(メタ)が好ましい。したがって、RA3はHではないことが適切である。
【0038】
R3とR4は一緒になって、任意選択で置換された5〜10員複素環、好ましくは5〜7員複素環、最も好ましくは6員複素環を形成していることが適切である。複素環はピペリジンであることが特に好ましい。
【0039】
特に好ましい実施形態では、R3とR4は一緒になって式(II):
【化5】

(式中、R5及びR6はそれぞれ独立に、ヒドロキシル、任意選択で置換されたC1〜C6アルキル、任意選択で置換されたフェニル及びHから選択される)
による、それらが結合している窒素を組み込んだ任意選択で置換された6員複素環を形成している。R5及びR6はそれぞれ独立に、ヒドロキシル、任意選択で置換されたC1〜C6アルキル及びHから選択されることが好ましい。R5及びR6はHであることが特に好ましい。
【0040】
他の実施形態では、R3及びR4はそれぞれ独立に、任意選択で置換されたC1〜C6アルキル、より好ましくはC1〜C3アルキルから選択される。
【0041】
R3及びR4は置換されていないことが適切である。R3及びR4のそれぞれが飽和アルキルであることも好ましい。
【0042】
R3及びR4は同じであっても異なっていてもよい。それらは同じであることが好ましい。
【0043】
複数の実施形態では、R3とR4はどちらもメチルである。
【0044】
その化合物は式(III)又は式(IV)の化合物
【化6】

(式中、RA1、RA2、RA3、RA4及びRA5はそれぞれ独立に、OH、RS1OH、ORS2、RS1ORS2、OC(O)H、OC(O)RS2、RS1OC(O)H、RS1OC(O)RS2、C(O)OH、C(O)ORS2、RS1C(O)OH、RS1C(O)ORS2、ORS1OH、ORS1ORS2、ORS1OC(O)H、ORS1OC(O)RS2、ORS1C(O)OH、ORS1C(O)ORS2、H及びRS2から選択され、
存在する場合、各RS1は独立に、任意選択で置換されたC1〜C5アルキレンであり、
存在する場合、各RS2は独立に、任意選択で置換されたC1〜C5アルキル、C2〜C5アルケニル及びC1〜C5アルキルシリル−C1〜C5アルキレンから選択され、
但し、RA1、RA2、RA3、RA4及びRA5の少なくとも1つはHでもなくRS2でもない)
であることが適切である。
【0045】
複数の実施形態では、存在する場合、各RS1は独立に任意選択で置換されたC1〜C3アルキレンであり、存在する場合、各RS2は独立に、任意選択で置換されたC1〜C3アルキル、C2〜C3アルケニル及びC1〜C3アルキルシリル−C1〜C3アルキレンから選択される。
【0046】
その化合物は化合物15.1、15.2、15.3、15.4、15.5、15.6、15.7、16.1、16.2、16.3、16.4、16.5、16.6、16.7、16.8、16.9、16.10、16.11、17.1、17.2、17.3、17.4、17.5、17.6、17.7、17.8及び17.9から選択されることが適切である。
【0047】
好ましくは、その化合物は化合物15.3、15.4、15.5、16.11、17.1、17.3、17.4、17.6、17.8、15.1、16.1、16.2、16.4、16.5、16.6、16.10及び17.5から選択される。より好ましくは、その化合物は化合物15.3、15.4、15.5、16.11、17.1、17.3、17.4、17.6及び17.8から選択される。
【0048】
好ましい実施形態では、これらの化合物(及び本明細書で説明するポリマー)を、それらが早発的な分解からは保護されるが所定の目標時間では放出され、その後、環境内の細菌によって分解されるような方法で、コーティング中に組み込む。当技術分野の読者は、この方法で分子を送達するのに、ポリマー/コーティング化学における最新技術により、その用途からの要求に応じて複数の方法が提供されることを認識しておられよう。
【0049】
好ましい実施形態では、これらの化合物(及び本明細書で説明するポリマー)を、海洋生物付着(marine growth)を防止するための防汚剤として従来の防汚コーティング中に組み込む。例えば、化合物を既存のアクリレート塗料中にブレンドすることができる。したがって、これらの化合物は、現在のコーティングの選択肢に対する実際的な代替手段である。特に、これらの化合物を、容易に分解しない既存のブースター殺生物剤の代わりとして、既存のコーティング配合物における既存ブースター殺生物剤の使用を低減する、及び/又は性能を向上させるのに既存のコーティング配合物を増大させるための環境的により安全な代替物として提示することができる。この関連では、いくつかの化合物は油状物であり、コーティング中、例えばシリコンベースの汚損除去コーティング中に組み込むのに適切なことに相溶性である。複数の実施形態では、この相溶性はそのコーティングの有効性を増大させ、それによってコーティングされた基材はさらなる保護性という利益を受けることができる。
【0050】
さらに、これらの化合物(及び本明細書で説明するポリマー)を、従来の防汚コーティング中に存在する銅/金属を低減するか又は置き換えるという方法で適用し、それによって防汚コーティングの環境影響を低減させることができる。
【0051】
これらの化合物(及び本明細書で説明するポリマー)を、バラスト水処理などの海水処理プロセスでの海洋生物の除去において使用することができ、また冷却水中及び脱塩プロセスにおける海洋物増殖の制御のために使用できることが適切である。これらの化合物(及び本明細書で説明するポリマー)は、環境汚損を防止するため、及びコンプライアンスの目的で、活性薬剤の迅速な分解/除去が必要なプロセスに特に適している。
【0052】
ポリマー
本発明は一般に、防汚アミド化合物を例えばペンダント基として含む、本明細書で「防汚ポリマー」と称するポリマーの部類にも関する。
【0053】
他の態様では、本発明は、第1の態様による防汚化合物から形成される少なくとも1つの繰り返し単位を含むポリマーを提供する。
【0054】
複数の実施形態では、その化合物を、フリーラジカル重合又はシリル含有基の重合によってポリマー中に組み込む。したがって、好ましくは、そのポリマーは、不飽和炭素−炭素結合を有する1つ若しくは複数のモノマー、例えばビニル又は(メタ)アクリレートモノマーから形成されるポリマー及びシリコーンポリマーから選択される。
【0055】
ポリマーは(メタ)アクリレートポリマーであることが適切である。ポリマーは、メチルメタクリレート(MMA)、ヒドロキシエチルアクリレート(HEA)及びビニルピロリジノン(VP)の1つ又は複数から誘導される繰り返し単位を含むことが適切である。好ましくは、そのポリマーはコポリマーである。
【0056】
複数の実施形態では、そのポリマーは式X
【化7】

(式中、
R1は任意選択で置換されたC3〜C12アルキルであり、
R3及びR4はそれぞれ独立に、任意選択で置換されたC1〜C6アルキルであるか、又はR3とR4は一緒になって、それらが結合している窒素を組み込んだ任意選択で置換された5〜12員複素環を形成しており、
各RAXは独立に、本明細書で説明するRA1〜RA5のいずれか1つについての選択肢から選択され、
nは0〜4の範囲の整数であり、
RLは連結基である)
によるペンダント基を含む。
【0057】
R1、R3及びR4の関連で任意選択の好ましい特徴は、第1の態様について上記した通りである。
【0058】
好ましくは、RLは1〜5個の原子鎖、好ましくは1〜3個の原子鎖、より好ましくは2個の原子鎖である。その鎖の原子はC及びOから選択されることが適切である。好ましくは、その連結基は−O−、−C(O)−及び−CH2−単位の1つ又は複数を含む。特に好ましいのは、構造:{[−O−]a[−C(O)]b[−CH2−]c}d(式中a、b、c及びdはそれぞれ独立に、0〜4、より好ましくは0〜2の範囲の整数から選択される)を有する連結基である。
【0059】
複数の実施形態では、RLは、−O−、RL1O、ORL2、RL1ORL2、OC(O)、OC(O)RL2、RL1OC(O)、RL1OC(O)RL2、C(O)O、C(O)ORL2、RL1C(O)O、RL1C(O)ORL2、ORL1O、ORL1ORL2、ORL1OC(O)、ORL1OC(O)RL2、ORL1C(O)O及びORL1C(O)ORL2から選択され、
存在する場合、各RL1は独立に、任意選択で置換されたC1〜C5アルキレンであり、
存在する場合、各RL2は独立に、任意選択で置換されたC1〜C5アルキレンである。
【0060】
したがって、連結基RLは、対応する「遊離」化合物の置換基RA1、RA2等に対応していてよい、例えばそれらから形成される基であってよい。
【0061】
好ましくは、RLは−OC(O)−である。
【0062】
適切には、nは0又は1であり、好ましくはnは0である(すなわち、そのアリールは他の置換基をもたない)。
【0063】
ペンダント基は、海洋環境においてポリマーから放出可能であることが適切である。特に、ペンダント基は加水分解によってポリマーから放出されることが好ましい。例えば、これは、ペンダント(生体活性)基が水性の環境で放出されるようにする。
【0064】
他の態様では、本発明は、式(XI):
【化8】

(式中、Polはポリマー主鎖であり、R1、R3、R4、RAX、n及びRLはそれぞれ式(X)に関して定義した通りである)
によるポリマーを提供する。
【0065】
ポリマーのTgは室温より高いことが好ましい。
【0066】
ポリマーの分子量は、GPCで測定して少なくとも5KDa、好ましくは少なくとも10KDaであることが好ましい。
【0067】
ポリマーは徐放性又は持続放出性のポリマーであり、それによって防汚化合物、好ましくは第1の態様の防汚化合物が使用の際にポリマーから放出されることが適切である。
【0068】
他の態様では、本発明は、ポリマーを製造する方法における式(I)の化合物又はその塩の使用を提供する。
【0069】
他の態様では、本発明は、式(I)の化合物又はその塩をコモノマーと共重合させることによって作製されるポリマーを提供する。好ましくは、コモノマーは(メタ)アクリレート及びビニルモノマーから選択される。
【0070】
他の態様では、本発明は、汚損を減少させる又は防止する方法における本明細書で説明するような化合物、ポリマー又はコーティング組成物の使用を提供する。
【0071】
汚損を減少させる又は防止する方法は、細菌、真菌、藻類及び原生動物の1つ又は複数による生物膜形成を減少させる又は防止する方法であることが適切である。
【0072】
他の態様では、本発明は、基材の汚損を防止する又は減少させる方法であって、本明細書で説明するような化合物、ポリマー又はコーティングをその基材に塗布するステップを含む方法を提供する。
【0073】
その防汚アミド化合物又はポリマーを、汚損を防止する又は減少させるのに効果的な量及び濃度で塗布することが適切である。防汚アミド化合物又はポリマーを標準濃度で提供することが好ましい。
【0074】
他の態様では、本発明は、本明細書で説明するような化合物又はポリマーを含むコーティング組成物を提供する。
【0075】
他の態様では、本発明は、本明細書で説明するような防汚アミド化合物又はポリマーを含む防汚組成物を提供する。
【0076】
他の態様では、本発明は、本明細書で説明するような防汚アミド化合物又はポリマーを含むコーティング組成物を提供する。そのコーティング組成物は慣用的な添加剤、例えば結合剤を含むことが適切である。コーティング組成物は塗料組成物であることが適切である。例えば、その組成物はアクリレート樹脂を含むことができる。コーティング組成物は自己研磨型塗料、好ましくはアクリル系自己研磨型塗料又はシリコーンコーティングであることが適切である。
【0077】
他の態様では、本発明は、本明細書で説明するような防汚アミド化合物を含むコーティングを提供する。
【0078】
他の態様では、本発明は、塗布されたコーティングを有する基材であって、そのコーティングが本明細書で説明するような防汚アミド化合物又はポリマーを含む基材を提供する。例えば、その基材は船舶、例えばボートであってよい。
【0079】
他の態様では、本発明は、本明細書で説明するような防汚アミド化合物又はポリマーを含む静菌性組成物を提供する。
【0080】
他の態様では、本発明は、本明細書で説明するような防汚アミド化合物又はポリマーを含む殺菌性組成物を提供する。
【0081】
他の態様では、本発明は、本明細書で説明するような防汚アミド化合物又はポリマーを含む殺生物性組成物を提供する。
【0082】
他の態様では、本発明は、本明細書で説明するような防汚アミド化合物又はポリマーを含むバイオスタティック組成物を提供する。
【0083】
他の態様では、本発明は、本明細書で説明するような防汚アミド化合物又はポリマーを含む汚損防止剤組成物を提供する。
【0084】
これらの態様のいずれかの任意選択で好ましい特徴の任意の1つ又は複数を、単独か又は組み合わせて、他の態様のいずれか1つに適用することができる。
【図面の簡単な説明】
【0085】
【図1】図1は、本発明の化合物(16.11)から誘導される繰り返し単位を含むポリマーでコーティングされたウェル中でのフジツボの沈降の平均パーセンテージを示す図である。対照コーティング上への沈降は、コーティングされていないポリスチレンについてと同様であった。これに対して、P(MMA−co−16.11−co−VP)の量を増大させると、フジツボの沈降は減少する結果となった。>40μlでの試験処理では沈降は認められなかった。
【発明を実施するための形態】
【0086】
化学用語
本明細書で用いる「飽和(の)」という用語は、炭素−炭素二重結合又は炭素−炭素三重結合を全くもたない化合物及び/又は基を指す(pertain)。
【0087】
本明細書で用いる「不飽和(の)」という用語は、少なくとも1つの炭素−炭素二重結合又は炭素−炭素三重結合を有する化合物及び/又は基を指す。化合物及び/又は基は、部分不飽和であっても完全不飽和であってもよい。
【0088】
本明細書で用いる「カルボ」、「カルビル」、「ヒドロカルボ」及び「ヒドロカルビル」という用語は、炭素及び水素原子だけを有する化合物及び/又は基を指す。
【0089】
本明細書で用いる「ヘテロ」という用語は、少なくとも1個のヘテロ原子、例えばホウ素、ケイ素、窒素、リン、酸素、硫黄及びセレン(より一般的には窒素、酸素及び硫黄)などの多価ヘテロ原子(これらは環ヘテロ原子としても適している)並びにフッ素、塩素、臭素及びヨウ素などの一価ヘテロ原子を有する化合物及び/又は基を指す。
【0090】
本明細書で用いる「任意選択で置換された」という語句は、置換されていても置換されていなくてもよい親基を指す。
【0091】
別段の指定のない限り、本明細書で用いる「置換された」という用語は、1つ又は複数の置換基を担持している親基を指す。「置換基」という用語は本明細書では慣用的な意味において用いられ、親基と共有結合しているか、又は適切な場合、それと縮合している化学部分を指す。様々な置換基が周知であり、その形成方法及び様々な親基への導入方法も周知である。
【0092】
アルキル:本明細書で用いる「アルキル」という用語は、1〜20個の炭素原子(別段の指定のない限り)を有する炭化水素化合物の炭素原子から水素原子を取り外すことによって得られる一価部分を指し、これは、脂肪族であっても脂環式であってもよく、飽和であっても不飽和(例えば、部分不飽和、完全不飽和)であってもよい。したがって、「アルキル」という用語は、以下で論じるアルケニル、アルキニル、シクロアルキル、シクロアルケニル、シクロアルキニル等の下位部類を含む。
【0093】
アルキル基の関連で、接頭辞(例えば、C1〜C4、C1〜C5等)は、炭素原子数又は炭素原子数の範囲を表す。例えば、本明細書で用いる「C1〜C4アルキル」という用語は、1〜4個の炭素原子を有するアルキル基を指す。アルキル基の群の例には、C1〜C4アルキル(「低級アルキル」)及びC2〜C6アルキルが含まれる。最初の接頭辞は、他の限定によって変わり得ることに留意されたい。例えば、不飽和アルキル基では最初の接頭辞は少なくとも2でなければならず、環状及び分岐状アルキル基では最初の接頭辞は少なくとも3でなければならない等である。
【0094】
(非置換)飽和アルキル基の例には、これらに限定されないが、メチル(C1)、エチル(C2)、プロピル(C3)、ブチル(C4)、ペンチル(C5)及びヘキシル(C6)が含まれる。
【0095】
(非置換)飽和直鎖状アルキル基の例には、これらに限定されないが、メチル(C1)、エチル(C2)、n−プロピル(C3)、n−ブチル(C4)、n−ペンチル(アミル)(C5)及びn−ヘキシル(C6)が含まれる。
【0096】
(非置換)飽和分岐状アルキル基の例には、イソプロピル(C3)、イソブチル(C4)、sec−ブチル(C4)、tert−ブチル(C4)、イソペンチル(C5)、及びネオペンチル(C5)が含まれる。
【0097】
アルケニル:本明細書で用いる「アルケニル」という用語は、1つ又は複数の炭素−炭素二重結合を有するアルキル基を指す。アルケニル基の群の例には、C2〜4アルケニル、C2〜7アルケニル、C2〜20アルケニルが含まれる。
【0098】
(非置換)不飽和アルケニル基の例には、これらに限定されないが、エテニル(ビニル、−CH=CH2)、1−プロペニル(−CH=CH−CH3)、2−プロペニル(アリル、−CH−CH=CH2)、イソプロペニル(1−メチルビニル、−C(CH3)=CH2)、ブテニル(C4)、ペンテニル(C5)及びヘキセニル(C6)が含まれる。
【0099】
ヒドロキシ−C1〜C6アルキル:本明細書で用いる「ヒドロキシ−C1〜C6アルキル」という用語は、少なくとも1個の水素原子(例えば、1個、2個、3個)がヒドロキシ基で置き換えられているC1〜C6アルキル基を指す。そうした基の例には、これらに限定されないが、−CH2OH、−CH2CH2OH及び−CH(OH)CH2OHが含まれる。
【0100】
水素:−H。特定の位置の置換基が水素である場合、その化合物又は基はその位置で「置換されていない」と呼ぶのが好都合であり得ることに留意されたい。
【0101】
アリール:本明細書で用いる「アリール」という用語は、芳香族化合物の芳香環原子から水素原子を取り外すことによって得られる一価部分を指し、この部分は3〜20個の環原子(別段の指定のない限り)を有する。各環は5〜7個の環原子を有することが好ましい。
【0102】
この関連で、接頭辞(例えば、C3〜20、C5〜7、C5〜6等)は、炭素原子か又はヘテロ原子である環原子の数又は環原子の数の範囲を表す。例えば、本明細書で用いる「C5〜6アリール」という用語は、5又は6個の環原子を有するアリール基を指す。アリール基の群の例には、C3〜20アリール、C5〜20アリール、C5〜15アリール、C5〜12アリール、C5〜10アリール、C5〜7アリール、C5〜6アリール、C5アリール及びC6アリールが含まれる。
【0103】
環原子は「カルボアリール基」の場合のようにすべて炭素原子であってよい。カルボアリール基の例には、C3〜20カルボアリール、C5〜20カルボアリール、C5〜15カルボアリール、C5〜12カルボアリール、C5〜10カルボアリール、C5〜7カルボアリール、C5〜6カルボアリール、C5カルボアリール及びC6カルボアリールが含まれる。
【0104】
カルボアリール基の例には、これらに限定されないが、ベンゼン(すなわち、フェニル)(C6)、ナフタレン(C10)、アズレン(C10)、アントラセン(C14)、フェナントレン(C14)、ナフタセン(C18)及びピレン(C16)から誘導されるものが含まれる。
【0105】
その少なくとも1つが芳香環である縮合環を含むアリール基の例には、これらに限定されないが、インダン(例えば、2,3−ジヒドロ−1H−インデン)(C9)、インデン(C9)、イソインデン(C9)、テトラリン(1,2,3,4−テトラヒドロナフタレン(C10)、アセナフテン(C12)、フルオレン(C13)、フェナレン(C13)、アセフェナントレン(C15)及びアセアントレン(C16)から誘導される基が含まれる。
【0106】
或いは、環原子は、「ヘテロアリール基」の場合のように1個又は複数のヘテロ原子を含むことができる。ヘテロアリール基の例には、C3〜20ヘテロアリール、C5〜20ヘテロアリール、C5〜15ヘテロアリール、C5〜12ヘテロアリール、C5〜10ヘテロアリール、C5〜7ヘテロアリール、C5〜6ヘテロアリール、C5ヘテロアリール及びC6ヘテロアリールが含まれる。
【0107】
ハロ(又はハロゲン):−F、−Cl、−Br及び−I。
【0108】
ヒドロキシ:−OH。
【0109】
シリル:−SiR3、ここでRはシリル置換基、例えば−H、C1〜7アルキル基、C3〜20ヘテロシクリル基又はC5〜20アリール基、好ましくは−H、C1〜7アルキル基又はC5〜20アリール基である。シリル基の例には、これらに限定されないが、−SiH3、−SiH2(CH3)、−SiH(CH3)2、−Si(CH3)3、−Si(Et)3、−Si(iPr)3、−Si(tBu)(CH3)2及び−Si(tBu)3が含まれる。
【0110】
オキシシリル:−Si(OR)3、ここでRはオキシシリル置換基、例えば−H、C1〜7アルキル基、C3〜20ヘテロシクリル基又はC5〜20アリール基、好ましくは−H、C1〜7アルキル基又はC5〜20アリール基である。オキシシリル基の例には、これらに限定されないが、−Si(OH)3、−Si(OMe)3、−Si(OEt)3及び−Si(OtBu)3が含まれる。
【0111】
シロキシ(シリルエーテル):−OSiR3、ここでSiR3は上記で論じたようなシリル基である。
【0112】
オキシシロキシ:−OSi(OR)3、ここでOSi(OR)3は上記で論じたようなオキシシリル基である。
【0113】
シリル−アルキレン:−アルキレン−SiR3、ここでRは上記で論じたようなシリル置換基である。例えば−CH2−CH2−Si(Me)3である。
【0114】
他の形態を含む
別段の指定のない限り、上記に含まれるものは、これらの置換基の周知のイオン、塩、溶媒和の形態及び保護された形態である。例えば、カルボン酸(−COOH)への言及はそのアニオン(カルボキシレート)形態(−COO−)、その塩又は溶媒和物並びに慣用的な保護形態も含む。同様に、アミノ基への言及はアミノ基のプロトン化形態(−N+HR1R2)、塩又は溶媒和物、例えばアミノ基の塩酸塩並びに慣用的な保護形態を含む。同様に、ヒドロキシル基への言及はそのアニオン形態(−O−)、その塩又は溶媒和物並びに慣用的な保護形態も含む。
【0115】
塩
活性化合物の対応する塩、例えば環境的に許容される塩を調製、精製及び/又は取り扱うことが好都合である又は望ましい場合がある。
【0116】
適切な塩の例は、Bergeら、1977年、「Pharmaceutically Acceptable Salts」、J.Pharm.Sci.、66巻、1〜19頁で論じられている。
【0117】
例えば、その化合物がアニオン性であるか、又はアニオン性であり得る(例えば、−COOHは−COO−であり得る)官能基を有する場合、塩は適切なカチオンで形成させることができる。適切な無機カチオンの例には、これらに限定されないが、Na+及びK+などのアルカリ金属イオン、Ca2+及びMg2+などのアルカリ土類カチオン、Al+3などの他のカチオンが含まれる。適切な有機カチオンの例には、これらに限定されないが、アンモニウムイオン(すなわち、NH4+)及び置換アンモニウムイオン(例えば、NH3R+、NH2R2+、NHR3+、NR4+)が含まれる。いくつかの適切な置換アンモニウムイオンの例は:エチルアミン、ジエチルアミン、ジシクロヘキシルアミン、トリエチルアミン、ブチルアミン、エチレンジアミン、エタノールアミン、ジエタノールアミン、ピペラジン、ベンジルアミン、フェニルベンジルアミン、コリン、メグルミン及びトロメタミン並びにリシン及びアルギニンなどのアミノ酸から誘導されるものである。一般的な第四アンモニウムイオンの例はN(CH3)4+である。
【0118】
その化合物がカチオン性であるか、又はカチオン性であり得る(例えば、−NH2は−NH3+であり得る)官能基を有する場合、塩は適切なアニオンで形成させることができる。適切な無機アニオンの例には、これらに限定されないが、以下の無機酸:塩酸、臭化水素酸、ヨウ化水素酸、硫酸、亜硫酸、硝酸、亜硝酸、リン酸及び亜リン酸から誘導されるものが含まれる。
【0119】
適切な有機アニオンの例には、これらに限定されないが、以下の有機酸:2−アセトキシ安息香酸、酢酸、アスコルビン酸、アスパラギン酸、安息香酸、カンファースルホン酸、桂皮酸、クエン酸、エデト酸、エタンジスルホン酸、エタンスルホン酸、フマル酸、グルコヘプトン酸、グルコン酸、グルタミン酸、グリコール酸、ヒドロキシマレイン酸、ヒドロキシナフタレンカルボン酸、イセチオン酸、乳酸、ラクトビオン酸、ラウリン酸、マレイン酸、リンゴ酸、メタンスルホン酸、粘液酸、オレイン酸、シュウ酸、パルミチン酸、パモン酸、パントテン酸、フェニル酢酸、フェニルスルホン酸、プロピオン酸、ピルビン酸、サリチル酸、ステアリン酸、コハク酸、スルファニル酸、酒石酸、トルエンスルホン酸及び吉草酸から誘導されるものが含まれる。適切なポリマー性有機アニオンの例には、これらに限定されないが、以下のポリマー酸:タンニン酸、カルボキシメチルセルロースから誘導されるものが含まれる。
【0120】
別段の指定のない限り、特定の化合物への言及はその塩形態も含む。
【0121】
溶媒和物
活性化合物の対応する溶媒和物を調製、精製及び/又は取り扱うことが好都合である又は望ましい場合がある。「溶媒和物」という用語は本明細書では、溶質(例えば、活性化合物、活性化合物の塩)と溶媒の錯体を指すという慣用的な意味で用いられる。溶媒が水である場合、溶媒和物は水和物、例えば一水和物、二水和物、三水和物等を指すことが好都合であり得る。
【0122】
別段の指定のない限り、特定の化合物への言及はその溶媒和された形態も含む。
【0123】
特定の好ましい置換基
1つの好ましい実施形態では、本明細書でしばしばRと称される置換基(複数可)は独立に:ハロ;ヒドロキシ;エーテル(例えば、C1〜7アルコキシ);ホルミル;アシル(例えば、C1〜7アルキルアシル、C5〜20アリールアシル);アシルハライド;カルボキシ;エステル;アシルオキシ;アミド;アシルアミド;チオアミド;テトラゾリル;アミノ;ニトロ;ニトロソ;アジド;シアノ;イソシアノ;シアナト;イソシアナト;チオシアノ;イソチオシアノ;スルフヒドリル;チオエーテル(例えば、C1〜7アルキルチオ);スルホン酸;スルホネート;スルホン;スルホニルオキシ;スルフィニルオキシ;スルファミノ;スルホンアミノ;スルフィンアミノ;スルファミル;スルホンアミド;C1〜7アルキル(例えば非置換C1〜7アルキル、C1〜7ハロアルキル、C1〜7ヒドロキシアルキル、C1〜7カルボキシアルキル、C1〜7アミノアルキル、C5〜20アリール−C1〜7アルキルを含む);C3〜20ヘテロシクリル;又はC5〜20アリール(例えばC5〜20カルボアリール、C5〜20ヘテロアリール、C1〜7アルキル−C5〜20アリール及びC5〜20ハロアリールを含む))から選択される。
【0124】
1つの好ましい実施形態では、本明細書でしばしばRと称される置換基(複数可)は独立に:
−F、−Cl、−Br及び−I;
−OH;
−OMe、−OEt、−O(tBu)及び−OCH2Ph;
−SH;
−SMe、−SEt、−S(tBu)及び−SCH2Ph;
−C(=O)H;
−C(=O)Me、−C(=O)Et、−C(=O)(tBu)及び−C(=O)Ph;
−C(=O)OH;
−C(=O)OMe、−C(=O)OEt及び−C(=O)O(tBu);
−C(=O)NH2、−C(=O)NHMe、−C(=O)NMe2及び−C(=O)NHEt;
−NHC(=O)Me、−NHC(=O)Et、−NHC(=O)Ph、スクシンイミジル及びマレイミジル;
−NH2、−NHMe、−NHEt、−NH(iPr)、−NH(nPr)、−NMe2、−NEt2、−N(iPr)2、−N(nPr)2、−N(nBu)2及び−N(tBu)2;
−CN;
−NO2;
−Me、−Et、−nPr、−iPr、−nBu、−tBu;
−CF3、−CHF2、−CH2F、−CCl3、−CBr3、−CH2CH2F、−CH2CHF2及び−CH2CF3;
−OCF3、−OCHF2、−OCH2F、−OCCl3、−OCBr3、−OCH2CH2F、−OCH2CHF2及び−OCH2CF3;
−CH2OH、−CH2CH2OH及び−CH(OH)CH2OH;
−CH2NH2、−CH2CH2NH2及び−CH2CH2NMe2;並びに
任意選択で置換されたフェニル
から選択される。
【0125】
1つの好ましい実施形態では、本明細書でしばしばRと称される置換基(複数可)は独立に:−F、−Cl、−Br、−I、−OH、−OMe、−OEt、−SH、−SMe、−SEt、−C(=O)Me、−C(=O)OH、−C(=O)OMe、−CONH2、−CONHMe、−NH2、−NMe2、−NEt2、−N(nPr)2、−N(iPr)2、−CN、−NO2、−Me、−Et、−CF3、−OCF3、−CH2OH、−CH2CH2OH、−CH2NH2、−CH2CH2NH2及び−Phから選択される。
【0126】
1つの好ましい実施形態では、本明細書でしばしばRと称される置換基(複数可)は独立に:ヒドロキシ;エーテル(例えば、C1〜7アルコキシ);エステル;アミド;アミノ;及びC1〜7アルキル(例えば非置換C1〜7アルキル、C1〜7ハロアルキル、C1〜7ヒドロキシアルキル、C1〜7カルボキシアルキル、C1〜7アミノアルキル、C5〜20アリール−C1〜7アルキルを含む)から選択される。
【0127】
1つの好ましい実施形態では、本明細書でしばしばRと称される置換基(複数可)は独立に:
−OH;
−OMe、−OEt、−O(tBu)及び−OCH2Ph;
−C(=O)OMe、−C(=O)OEt及び−C(=O)O(tBu);
−C(=O)NH2、−C(=O)NHMe、−C(=O)NMe2及び−C(=O)NHEt;
−NH2、−NHMe、−NHEt、−NH(iPr)、−NH(nPr)、−NMe2、−NEt2、−N(iPr)2、−N(nPr)2、−N(nBu)2及び−N(tBu)2;
−Me、−Et、−nPr、−iPr、−nBu、−tBu;
−CF3、−CHF2、−CH2F、−CCl3、−CBr3、−CH2CH2F、−CH2CHF2及び−CH2CF3;
−CH2OH、−CH2CH2OH及び−CH(OH)CH2OH;並びに
−CH2NH2、−CH2CH2NH2及び−CH2CH2NMe2
から選択される。
【0128】
他の用語
本明細書で用いる「汚損(fouling)」という用語は、液媒体、例えば水性媒体に曝露されるか又はそれに浸漬している基材への微生物及び小生物の付着及び増殖、並びに液媒体の容器中での微生物及び/又は小生物の数の増大を指す。
【0129】
したがって、「汚損体(foulers)」又は「微小汚損体(microfoulers)」は互換的に用いられ、基材を汚損する生物を指す。汚損は、新鮮な水並びに海水に曝露されるか又はそれに浸漬している構造物において発生し得る。特に、この用語は、海水に曝露されるか又はそれに浸漬している固体状の媒体又は基材を指すのに用いることができる。
【0130】
したがって、「防汚する(antifouling)」という用語は、汚損を防止、低減及び/又は排除する効果を指す。防汚剤又は防汚化合物は「汚損防止剤(antifoulants)」とも称される。
【0131】
汚損防止剤化合物は通常、その目的に効果的な濃度である標準濃度で施用される。したがって、標準濃度未満の濃度は、それが単独で使用された場合、汚損防止剤が効果的でない濃度である。
【0132】
本明細書で用いる「基材(substrate)」という用語は、液媒体に曝露されるか又はそれに浸漬している構造物又は船舶の表面などの固体媒体を指す。液媒体は、新鮮な水又は海水であってもよく、瓶、プール若しくはタンクなどの人工的容器中の水体(body of water)であってもよく、或いはその液体は外海の海水などの人工的容器に収容されていないものであってもよい。
【0133】
本明細書で用いる「構造物(structure)」は、自然の地質学的構造物又は人工的構造物、例えば橋脚又は石油掘削用リグを指し、「船舶(vessel)」という用語は、ボートや船などの水の中で使用される人工的乗り物を指す。
【0134】
本明細書で参照する「微生物(microorganisms)」はウイルス、細菌、真菌、藻類及び原生動物を含む。本明細書で参照する「小生物(small organisms)」は、新鮮な水又は海水に曝露されるか又はそれに浸漬している基材を通常汚損する生物、例えば甲殻類(crustaceans)、コケムシ(bryozoans)及び軟体動物(molluscs)、特に基材に付着するものを含むことができる。そうした小生物の例には、フジツボ及びイガイ(mussels)並びにそれらの幼生が含まれる。小生物は小動物(small animals)と称することもできる。本明細書で参照する「生物(organism)」はそれに応じて理解されるはずであり、これらには微生物及び小生物が含まれる。
【0135】
本明細書で用いる「海洋生物(marine organism)」という用語は、その自然生息地が海水である生物を指す。「海洋微生物(marine microorganism)」及び「海洋小生物(marine small organism)」という用語は、はそれに応じて理解されるはずである。
【0136】
さらに、「ミクロ汚損(microfouling)」という用語は微生物による汚損を指し、「マクロ汚損(macrofouling)」という用語は、上記に定義の小生物などの微生物より大きい生物による汚損を指す。
【0137】
「殺生物剤(biocide)」又は「殺生物性化合物(biocidal compound)」という用語は、それらを殺傷することによって微生物及び小生物の増殖を阻害する化合物を指す。「バイオスタティック(biostatic)」又は「バイオスタティック化合物(biostatic compound)」という用語は、必ずしも微生物又は小生物を殺傷することによってではなくそれらの生殖を阻害することによって、それらの増殖を阻害する化合物を指す。
【0138】
本明細書で用いる「分解(degradation)」という用語は、水、好ましくは海水の中における化合物の化学的な分解又は改変を指す。
【0139】
本明細書で用いる「増殖(growth)」という用語は、微生物や小生物の数の増加と、小生物の幼若期から成熟期への成長の両方を指す。したがって、殺生物剤及びバイオスタティクを、微生物及び小生物の増殖を阻害するために、液体本体又は基材表面への処理として施用することができる。したがって、殺生物剤及びバイオスタティクは汚損防止剤であってよく、生物膜形成を阻害、低減又は排除することができる。
【0140】
したがって、「殺菌性(bacteriocidal)」及び「静菌性(bacteriostatic)」という用語は細菌に対する化合物の効果を指す。
【0141】
本明細書で用いる「生物活性(bioactivity)」という用語は、生きた生物、特に微生物又は小生物に対する、殺生物性又はバイオスタティック化合物などの所与の薬剤又は化合物の効果を指す。
【0142】
「生物膜(biofilm)」は、保護性及び付着性のマトリックスの排出を特徴とする微生物、通常細菌又は真菌の複雑な凝集体である。生物膜はしばしば、表面付着、構造的不均一性、遺伝的多様性、複雑な群落相互作用(complex community interactions)及びポリマー性物質の細胞外マトリックスも特徴とする。生物膜はまた、マトリックスが存在するため、凝集していない細菌と比較して抗生物質に対してより耐性があることもある。
【0143】
使用、薬剤、化合物又は組成物に関連する場合、「医薬(pharmaceutical)」という用語は、ヒト又は動物の疾患又は障害の医学的治療を指す。したがって、医薬化合物はヒト又は動物の疾患又は障害の医学的治療のために使用される化合物である。
【0144】
本明細書で用いる「標準濃度(standard concentration)」という用語は、防汚用の薬剤又は化合物に関する場合、その薬剤又は化合物が単独で使用されるとき、その薬剤又は化合物がそれが対象としている微生物又は小生物に対して効果的である濃度を指す。したがって、「効果的(effective)」という用語は所望の効果を有することを意味し、「標準濃度未満(below standard concentration)」という用語は、単独で使用した場合、その薬剤又は化合物が効果的でないレベルを指す。
【実施例】
【0145】
実施例第1部
化合物
化合物の合成
本発明の化合物の化学的合成のためのいくつかの方法を本明細書で説明する。本発明の範囲内の他の化合物の合成を容易にするために、これら及び/又は他の周知の方法を公知の方法で改変する及び/又は適合させることができる。
【0146】
アミドは、以下の一般的手法にしたがって調製することができる。
【0147】
方法A
15シリーズの化合物などのアルコキシ化された置換化合物の合成は二段階のプロトコルをもとにしており、ここで、ピペリジンを用いて、市販のフェニル酢酸誘導体に、DCCによる媒介アミドの生成を施す(スキーム1)。続いて得られた2−アリールアセトアミドをアルキル化し、次いで標準的条件下でのLDA及びブロモブタンによる処理へと進む。
【化9】

【0148】
同じ手法を、ジアルキルアミドにも採用した。したがって、非置換親化合物のメトキシ及びヒドロキシアリール同類物の合成は三段階又は四段階のプロトコルをもとにしており、ここで、最初に市販のフェニル酢酸誘導体を、対応する酸クロリド又はベンゾトリアゾリルエステルによりピペリジンか又はジメチルアミドに転換させる。スキーム1.1に示すように、続く、1−ブロモブタンか又は6−ブロモ−1−ヘキセンを用いたLDA促進アルキル化により、所望のメトキシアリール化合物を低収率から良好な収率の範囲で得る。
【化10】

【0149】
選択されたメトキシアリール目的物の脱メチル化を、スキーム1.2に概要を示したようにしてジクロロメタン中の三臭化ホウ素を用いて実施した。これらの条件下での15.1、15.2、15.3及び17.2の処理はすべて順調に進み、対応するヒドロキシアリール誘導体を良好な収率と高い純度で得た。
【化11】

【0150】
方法B
ヒドロキシメチル化化合物及びアセチル化類似物の合成を、標準的な保護及びアルキル化プロトコルにしたがって、容易に合成されるアミドからアクセスした(スキーム2)。p−誘導体のアセチル化によって化合物を良好な単離収率で得た。
【化12】

【0151】
より具体的には、12.1のヒドロキシメチル化同類物及びその酢酸誘導体へのアクセスを得るために、フェニル酢酸誘導体の市場での入手可能性をもとにした異なる合成経路を用いる必要があった。p−ヒドロキシメチルフェニル酢酸は市販されておりピペリジンとのカップリング反応に直接使用することができたが、対応するo−ヒドロキシメチルフェニル酢酸は市場で入手することができなかった。そこで、ピペリジンを用いた市販のイソクロマノンの求核的開環により中程度の単離収率で必要なアミドにアクセスした(以下のスキーム2.1)。手元にあるo−及びp−ヒドロキシメチルアミドを用いて、イミダゾールの存在下、tert−ブチルジメチルシリル(TBS)クロリドで処理して対応するTBSエーテルを中程度の収率で得た。これらにアルキル化を施して16.1及び16.2をその保護形態で得た。TBSエーテルをTHF中のTBAFで処理し、TBS保護基を取り外して16.1及び16.2をほぼ定量的な収率で得た。次いで、16.2をピリジン中の無水酢酸で処理して化合物16.3を単離した。これをスキーム2の修正版である以下のスキーム2.1に示す。
【化13】

【0152】
16.2を直接17.9に転換させる手順は二段階の工程であり、そこでは、オキソン(Oxone)(登録商標)で処理する前に対応するアルデヒドへのスワーン酸化を実施した。所望の酸を中程度の総合収率で得た(スキーム3)。
【化14】

【0153】
12.1の残りの目的とする同類物はすべて、適切な求電子試薬で処理することによって、16.5の改変によりアクセスすることができた。すべての場合、中程度の収率から高い収率で目的化合物を得た。これらの反応のまとめをスキーム4に示す。
【化15】

【0154】
上記手法を用いて、以下の構造にもとづく化合物を合成した。これらは好ましい実施形態(参考化合物は除く)である:
【化16】

【表1】

【0155】
さらに、以下の化合物を合成した。これらは好ましい実施形態である。
【表2】

【0156】
さらに、以下の構造の化合物を合成した。これらは好ましい実施形態である。
【化17】

【表3】

【0157】
さらに、以下の構造の化合物を合成した。これらは好ましい実施形態である。
【化18】

【表4】

【0158】
さらに、以下の構造の化合物を合成した。これらは好ましい実施形態である。
【化19】

【表5】

【0159】
これらの化合物を、フジツボに対する生物活性について試験した。
選択されたアミド誘導体のための合成方法及びデータ
【0160】
特性評価
プロトン(1H)及び炭素(13C)NMRスペクトルを、1Hについて400MHzで、13Cについて75.4MHzで稼働させてBruker NMR分光計で記録した。別段の表示のない限り、溶媒として重水素化クロロホルム(CDCl3)を使用した。化学シフト(d)を、テトラメチルシラン(TMS、0.00ppm)からのパーツパーミリオン(ppm)でのシフトとして記録する。CDCl3で記録したNMRスペクトルを、1Hについて残留クロロホルム一重項(7.26ppm)、13CについてCDCl3三重項(77.00ppm)の中央ピークを基準とした。1H NMR分光分析データを以下の通り報告する:化学シフト(δ)、多重度(s:一重項、d:二重項、t:三重項、q:四重項、qt:五重項、m:多重項、dd:二重項の二重項等、br:幅広)、結合定数(JHz)及び相対積分(プロトン数)。可能な場合、13C分光分析データを化学シフト(δ)及び帰属として記録する。赤外スペクトルをBio−rad Excalibur Series TFS 3000MX FTIRで記録した。サンプルは、NaClプレート上の薄い液膜で実施した。IRスペクトルデータを以下の通り報告する:周波数(υmax cm−1)、強度(vs:非常に強い、s:強い、m:中程度、w:弱い)。高分解能電子衝撃(EI)質量スペクトルをThermo Finnigan MAT XP95質量分析計で記録した。分析用薄層クロマトグラフィー(tlc)を、シリカゲルF254(Merck)をコーティングしたアルミニウム板で実施した。クロマトグラムを254nmの波長(適切な場合)で分析した、及び/又は水の中の過マンガン酸カリウムの酸性溶液(5%H2SO4)を用いて展開させ、次いで加熱した。使用した溶媒はすべてARグレードのものであり、適切な場合、文献の手順により精製した(Armarego、2003年)。
【0161】
一般的手順−DCC媒介アミド結合形成
DMF(1.2mL/mmol)中のフェニル酢酸誘導体(1当量)の冷却(0℃)撹拌溶液に、DCC(1.1当量)及びHOBt(1.1当量)を加えた。得られた混合物を1時間撹拌し、その時点で無色の重い沈殿物が現れた。ピペリジン(1.1当量)を反応混合物に加え、撹拌をさらに2時間続行し、次いで反応混合物をろ過した。母液をEtOAcに取り、飽和NaHCO3及び水(×3、2.4mL/mmol)で順次洗浄した。有機層を脱水し(MgSO4)、真空下で濃縮して粗製アミドを得た。これを、指定された溶媒系を用いてフラッシュカラムクロマトグラフィーで精製した。
【0162】
一般的手順−酸クロリドによるアミド結合形成
DCM(0.4mL mmol−1)中のメトキシフェニル酢酸の冷却(0℃)撹拌溶液に塩化チオニル(0.4mL mmol−1)を加えた。得られた混合物を室温に加温し、50℃で2時間加熱し、次いで反応混合物を室温に冷却し、氷に注意深く注加した。有機層を脱水し(MgSO4)、真空下で濃縮して所望の酸クロリドを得た。これをさらに精製することなく使用した。
【0163】
ピペリジンアミドについては、適切な量の酸クロリド(1mol当量)を等量の無水CH2Cl2に溶解し、CH2Cl2(1mL mmol−1)中のピペリジン(2mol当量)の冷却(0℃)溶液に徐々に加えた。得られた混合物を室温に加温し、さらに2時間撹拌した。粗製反応混合物を水で洗浄し、有機層を脱水し(MgSO4)、真空下で濃縮して所望のアミドを得た。さらなる精製は必要でなかった。
【0164】
ジメチルアミドについては、適切な量の酸クロリドを、水(10mol当量)の中のジメチルアミンの冷却(0℃)40%溶液に徐々に加え、2時間撹拌し、次いで室温に加温した。CH2Cl2を反応混合物に加え、有機層を水で洗浄し、脱水し(MgSO4)、真空下で濃縮して所望のアミドを得た。
【0165】
一般的手順−αアルキル化
無水THF(2mL/mmol)中の新たに蒸留されたジイソプロピルアミド(1当量)の冷却(−78℃)撹拌溶液に、ヘキサン中のn−ブチルリチウム(1当量)を加えた。得られた反応混合物は淡黄色になり、これを−78℃で10〜15分間撹拌し、次いで所望のアミド(0.95当量)を注意深く加えた。得られた混合物を1時間撹拌し、その時点でブロモブタン(1当量)を加えた。得られた混合物を数時間(少なくとも3時間)かけて室温に加温し、撹拌をさらに13時間続行した(合計で16時間)。反応混合物に水を注意深く滴下して反応物をクエンチした。続いて、水を反応混合物に加え、水相を除去した。有機層を水で洗浄し、次いで塩水で洗浄し、脱水し(MgSO4)、減圧下で濃縮した。精製を、指定された溶媒系を用いてフラッシュカラムクロマトグラフィーで実施した。
【0166】
化合物15.1
2−(4−メトキシ)フェニル−1−(ピペリジン−1−イル)エタノン
【化20】

表題化合物を、アミド結合形成のための一般的手順にしたがって4−メトキシフェニル酢酸(1.0g、6.1mmol)から調製した。生成物を、フラッシュカラムクロマトグラフィー(EtOAc、Rf=0.5)による精製によって無色油状物(1.0g、65%)として単離した。1H NMR(400MHz,CDCl3)δ 1.35(m,2H);1.49(m,2H);1.57(m,2H);3.35(m,2H);3.55(m,2H);3.64(s,2H);3.77(s,3H);6.85(d,J=8.4Hz,2H);7.16(d,2J=8.4Hz 2H)。13C NMR(75MHz,CDCl3)δ24.47、25.52、26.25、40.26、42.90。47.25、55.28、114.08、127.47、129.61、158.27、169.60。HRMS(ESI+1イオン)m/z:C14H20NO2の計算値234.1489、実測値234.1496。
【0167】
2−(4−メトキシ)フェニル−(1−ピペリジン−1−イル)ヘキサノン
【化21】

表題化合物を、α−アルキル化のための一般的手順概要にしたがって2−(4−メトキシ)フェニル−1−(ピペリジン−1−イル)エタノン(740mg、3.41mmol)から調製した。表題化合物を、フラッシュカラムクロマトグラフィー(ヘキサン中に20%EtOAc、Rf=0.6)による精製によって淡黄色油状物(160mg、16%)として単離した。1H NMR(400MHz,CDCl3)δ 0.83(t,J=7Hz,3H);1.03(m,1H);1.14(m,1H);1.2〜1.6(多重線シグナル、8H);1.68(m,1H);2.05(m,1H);3.31〜3.45(2×m,3H);3.64(m,2H);3.78(s,3H);6.83(d,J=8.9Hz,2H);7.18(d,J=8.9Hz 2H)。13C NMR(75MHz,CDCl3)δ 14.05、22.74、24.60、25.60、26.16、30.07、34.81、43.15、46.64、47.78、55.24、113.98、128.29、133.03、158.34、171.67。HRMS(ESI+1イオン)m/z:C18H29NO2の計算値290.2115、実測値290.2130。
【0168】
化合物15.7
2−(2,4−ジメトキシ)フェニル−1−(ピペリジン−1−イル)エタノン
【化22】

表題化合物を、アミド結合形成のための一般的手順概要にしたがって2,4−ジメトキシフェニル酢酸(1.0g、4.7mmol)から調製した。生成物を、フラッシュカラムクロマトグラフィー(EtOAc、Rf=0.6)による精製によって黄色油状物(690mg、56%)として単離した。1H NMR(400MHz,CDCl3)δ 1.38(m,2H);1.52(m,2H);1.58(m,2H);3.36(m,2H);3.56(m,2H);3.20(s,2H);3.29(s,3H);3.81(s,3H);6.45(m,3H);7.13(d,J=8.6Hz)。13C NMR(75MHz,CDCl3)δ 24.46、25.56、26.26、40.72、40.77、42.94、47.27、111.24、111.70、120.66、127.97、147.80、149.07、169.45。HRMS(ESI+1イオン)m/z:C15H22NO3の計算値264.1594、実測値264.1605。
【0169】
2−ブチル−2−(2,4−ジメトキシ)フェニル−1−(ピペリジン−1−イル)ヘキサノン
表題化合物を、αアルキル化のための一般的手順概要にしたがって2−(2’,4’−ジメトキシ)フェニル−1−(ピペリジン−1−イル)エタノン(688mg、2.61mmol)から調製した。生成物を、フラッシュカラムクロマトグラフィー(ヘキサン中に50%EtOAc、Rf=0.7)による精製によって淡黄色油状物(380mg、45%)として単離した。1H NMR(400MHz,CDCl3)δ 0.87(t,J=7Hz,3H);0.973(m,1H);1.13(m,1H),1.23〜1.65(多重線シグナル、9H);2.01(m,1H);3.33(m,3H);3.7(m,1H);3.79(s,3H);3.82(s,3H);4.12(t,J=7Hz,1H);6.42(m,3H);7.20(d,J=8Hz)。13C NMR(75MHz,CDCl3)δ 14.06、22.79、24.73、25.67、26.16、29.92、34.04、39.21、43.11、46.19、55.32、55.50、98.26、104.66、121.93、128.56、156.79、159.38、172.45。HRMS(ESI+1イオン)m/z:C19H30NO3の計算値320.2220、実測値320.2229。
【0170】
化合物15.6
2−ブチル−2−(2,4−ジメトキシ)フェニル−1−(ピペリジン−1−イル)ヘキサノン
【化23】

表題化合物を、αアルキル化のための一般的手順概要にしたがって2−(2’,4’−ジメトキシ)フェニル−1−(ピペリジン−1−イル)エタノン(688mg、2.61mmol)から調製した。生成物を、フラッシュカラムクロマトグラフィー(ヘキサン中に50%EtOAc、Rf=0.7)による精製によって淡黄色油状物(380mg、45%)として単離した。1H NMR(400MHz,CDCl3)δ 0.87(t,J=7Hz,3H);0.97(m,1H);1.13(m,1H),1.23〜1.65(多重線シグナル、9H);2.01(m,1H);3.33(m,3H);3.7(m,1H);3.79(s,3H);3.82(s,3H);4.12(t,J=7Hz,1H);6.42(m,3H);7.20(d,J=8Hz)。13C NMR(75MHz,CDCl3)δ 14.06、22.79、24.73、25.67、26.16、29.92、34.04、39.21、43.11、46.19、55.32、55.50、98.26、104.66、121.93、128.56、156.79、159.38、172.45。HRMS(ESI+1イオン)m/z:C19H30NO3の計算値320.2220、実測値320.2229。
化合物16.2
【0171】
2−(4−ヒドロキシメチル)フェニル−1−(ピペリジン−1−イル)エタノン
表題化合物を、アミドカップリングのために概要を示した一般的手順にしたがって4−ヒドロキシメチルフェニル酢酸(1.0g、6.0mmol)から調製した。生成物を、フラッシュカラムクロマトグラフィー(EtOAc、Rf=0.5)による精製によって粘性の無色油状物(540mg、39%)として単離した。1H NMR(400MHz,CDCl3)δ 1.37(m,2H);1.52(m,2H);1.58(m,2H);3.36(m,2H);3.56(m,2H);3.71(s,2H);4.66(s,2H);7.23(d,J=8Hz,2H);7.31(d,J=8Hz,2H)。13C NMR(75MHz,CDCl3)δ 24.39、25.44、25.47、26.21、34.91、40.77、42.92、47.25、55.77、64.92、127.33、128.76、134.65、139.48、169.30。HRMS(ESI+1イオン)m/z:C14H20NO2の計算値234.1489、実測値234.1489。
【0172】
2−(4−tert−ブチルジメチルシリルオキシメチル)フェニル−1−(ピペリジン−1−イル)エタノン
無水DCM中の2−(4−ヒドロキシメチル)フェニル−1−(ピペリジン−1−イル)エタノン(540mg、2.32mmol)及びイミダゾール(97mg、1.4mmol)の冷却(0℃)溶液に、DCM(5mL)中のTBSCl(214mg、1.42mmol)の溶液を加えた。得られた反応混合物を2時間撹拌した。次いで、反応混合物を水(×2)及び塩水で順次洗浄し、有機層を脱水し(MgSO4)、真空下で濃縮した。表題化合物を、フラッシュカラムクロマトグラフィー(20%EtOAc、Rf=0.6)による精製によって無色油状物(420mg、53%)として得た。1H NMR(400MHz,CDCl3)δ 0.084(s,6H);0.929(s,9H);1.34(m,2H);1.52(m,2H);1.59(m,2H);3.43(m,2H);3.57(m,2H);3.71(s,2H);4.71(s,2H);7.20(d,J=8Hz,2H);7.25(d,J=8Hz,2H)。13C NMR(75MHz,CDCl3)δ −5.21、24.45、25.59、25.97、26.20、40.94、42.89、47.27、64.77、126.41、128.40、133.96、139.81、169.36。HRMS(ESI+1イオン)m/z:C20H34NO2Siの計算値348.2353、実測値348.2354。
【0173】
2−(4−tert−ブチルジメチルシリルオキシメチル)フェニル−1−(ピペリジン−1−イル)ヘキサノン
表題化合物を、αアルキル化のために概要を示した一般的手順にしたがって2−(4−tert−ブチルジメチルシリルオキシメチル)フェニル−1−(ピペリジン−1−イル)エタノン(420mg、1.21mmol)から調製した。生成物を、フラッシュカラムクロマトグラフィー(ヘキサン中に20%EtOAc、Rf=0.6)による精製によって無色油状物(260mg、53%)として得た。1H NMR(400MHz,CDCl3)δ 0.010(s,6H);0.087(t,J=7Hz,3H);0.94(s,9H);1.01(m,1H);1.14(m,1H);1.2〜1.6(多重線シグナル、8H);1.68(m,1H);2.10(m,1H);3.3〜3.5(m,3H);3.68(m,2H);4.72(s,2H);7.15(m,4H)。13C NMR(75MHz,CDCl3)δ −5.20、14.03、22.75、24.75、25.68、26.12、30.40、34.78、43.16、46.62、48.47、64.79、126.38、127.66、139.52、139.73、171.42。HRMS(ESI+1イオン)m/z:C24H42NO2Siの計算値404.2979、実測値404.2983。
【0174】
2−(4−ヒドロキシメチル)フェニル−1−(ピペリジン−1−イル)ヘキサノン
無水THF(5mL)中の2−(4−tert−ブチルジメチルシリルオキシメチル)フェニル−1−(ピペリジン−1−イル)ヘキサノン(260mg、0.64mmol)の溶液を、THF(1.29mmol)中のTBAFの溶液を入れたフラスコに加えた。得られた反応混合物を1時間撹拌し、その時点でtlc分析により、出発原料が残っていないことが示された。反応混合物を水(×2)、次いで塩水で洗浄し、有機層を脱水し(MgSO4)、真空下で濃縮して粗生成物を得た。表題化合物を、フラッシュカラムクロマトグラフィー(ヘキサン中に50%EtOAc、Rf=0.4)による精製によって無色油状物(142mg、76%)として単離した。1H NMR(400MHz,CDCl3)δ 0.87(t,J=7Hz,3H);1.04(m,1H);1.14(m,1H);1.9〜1.7(m,8H);1.71(m,1H);1.91(m,1H);3.34(m,2H);3.47(m,1H);3.63(m,1H);3.69(t,J=7Hz,1H);4.66(s,2H);7.25(d,J=8Hz,2H);7.30(d,J=8Hz,2H)。13C NMR(75MHz,CDCl3)δ 14.02、22.72、24.56、25.57、26.12、30.07、34.76、43.19、46.64、48.41、65.07、127.06、127.99、139.28、140.32、171.32。HRMS(ESI+1イオン)m/z:C18H28NO2の計算値290.2114、実測値289.2117。
化合物16.3
【0175】
2−(4−アセトキシメチル)フェニル−1−(ピペリジン−1−イル)ヘキサノン
DMAP(2mg)を入れた丸底フラスコに無水ジクロロメタン(2mL)中の2−(4−ヒドロキシメチル)フェニル−1−(ピペリジン−1−イル)ヘキサノン(30mg、0.10mmol)の溶液を加えた。得られた混合物に無水NEt3(208μL、1.5mmol)を加え、次いで無水酢酸(100μL、1.0mmol)を加えた。得られた混合物を3時間撹拌した。続いて、反応混合物を飽和NaHCO3、水で洗浄し、次いで塩水で洗浄し、有機相を脱水し(Na2SO4)、減圧下で濃縮した。表題化合物を、フラッシュカラムクロマトグラフィー(ヘキサン中に50%EtOAc、Rf=0.7)による精製によって無色油状物(20mg、60%)として得た。1H NMR(400MHz,CDCl3)δ 0.86(t,J=7Hz,3H);1.0〜1.2(2×m,2H);1.2〜1.5(多重線シグナル、8H);1.68(m,1H);4.53(m+s,4H);3.33(m,1H),3.39(m,1H);3.49(m,1H);3.60(m,1H);3.70(t,J=7Hz,1H);5.07(s,2H);7.72(m,4H)。13C NMR(75MHz,CDCl3)δ 14.01、21.08、22.72、24.57、25.60、26.20、30.09、34.77、43.20、46.66、48.38、66.07、128.03、128.58、134.24、141.02、171.09、171.17。
注記:化合物は静置すると加水分解する。HRMSによれば遊離アルコールのそれと一致する。
【0176】
化合物17.1
2−(4−メトキシオキシフェニル)−1−(ピペリジン−1−イル)オクタ−7−エン−1−オン
【化24】

表題化合物を、アルキル化のための一般的手順にしたがって2−(4−ヒドロキシフェニル)−1−(ピペリジン−1−イル)エタノン(100mg、0.43mmol)及び6−ブロモ−1−ヘキセン(70μL、0.47mmol)から調製した。精製された化合物を、フラッシュカラムクロマトグラフィー(ヘキサン中に20%EtOAc、Rf=0.5)による精製によって淡黄色油状物(26mg、26%)として単離した。1H NMR(400MHz,CDCl3)δ1.1〜1.5(多重線シグナル、10H);1.65(m,1H);2.01(m,3H);3.35,(m,3H);3.63(t,J=7Hz,1H);3.65(m,1H);3.78(s,3H);4.89(dm,J=10Hz,1H);4.95(dm,J=17Hz,1H);5.77(ddd,J=17,10,6.5Hz,1H);6.83(d,J=8.5Hz,2H);7.17(d,J=8.5Hz,2H)。13C NMR(75MHz,CDCl3)δ 24.69、25.70、26.25、27.46、29.07、33.79、35.02、43.27、46.75、47.88、55.35、114.13、114.34、278.08、128.89、133.05、139.19、158.38、171.69。HRMS(ESI+1イオン)m/z:C20H30NO2の計算値316.2271、実測値316.2265。
【0177】
化合物17.2
2−(4−メトキシフェニル)−N,N−ジメチルヘキサンアミド
【化25】

表題化合物を、アルキル化のための一般的手順にしたがって2−(4−ヒドロキシフェニル)−N,N−ジメチルアセトアミド(100mg、0.52mmol)及び1−ブロモブタン(70μL、0.57mmol)から調製した。精製された化合物を、フラッシュカラムクロマトグラフィー(EtOAc、Rf=0.7)による精製によって淡黄色油状物(120mg、60%)として単離した。1H NMR(400MHz,CDCl3)δ 0.85(t,J=7Hz,3H);1.14(m,1H);1.28(m,3H);1.68(m,1H);2.05(m,1H);2.93(s,3H);2.94(s,3H);3.63(t,J=7Hz,1H);3.78(s,3H);6.84(d,J=8.8Hz,2H);7.20(d,J=8.8Hz,2H)。13C NMR(75MHz,CDCl3)δ 14.16、22.84、35.03、36.02、37.30、48.09、55.37、114.14、129.04、132.64、158.50、173.75。HRMS(ESI+1イオン)m/z:C16H24NO2の計算値262.1802、実測値262.1795。
【0178】
化合物17.3
2−(4−メトキシフェニル)−N,N−ジメチルオクタ−7−エンアミド
【化26】

表題化合物を、アルキル化のための一般的手順にしたがって2−(4−ヒドロキシフェニル)−N,N−ジメチルアセトアミド(100mg、0.52mmol)及び6−ブロモ−1−ヘキセン(84μL、0.57mmol)から調製した。精製された化合物を、フラッシュカラムクロマトグラフィー(EtOAc、Rf=0.6)による精製によって淡黄色油状物(120mg、60%)として単離した。1H NMR(400MHz,CDCl3)δ1.1〜1.5(多重線シグナル、4H);1.66(m,1H);2.02(m,3H);2.93(2×s,6H);3.63(t,J=7Hz,1H);3.78(s,3H);4.90(dm,J=10Hz,1H);4.96(dm,J=17Hz,1H);5.77(ddd,J=17,10,6.5Hz,1H);6.85(d,J=8.8Hz,2H);7.19(d,J=8.8Hz,2H)。13C NMR(75MHz,CDCl3)δ 27.41、29.02、33.75、35.10、36.00、37.27、48.05、55.34、114.13、114.35、128.98、132.49、139.12、158.49、173.62。HRMS(ESI+1イオン)m/z:C17H26NO2の計算値276.1958、実測値276.1958。
【0179】
化合物16.5
2−(4−ヒドロキシフェニル)−1−(ピペリジン−1−イル)ヘキサン−1−オン
【化27】

無水DCM中の15.1(1g、3.46mmol)の冷却(−78℃)溶液に、DCM(10mL、10mmol)中の三臭化ホウ素の溶液を加えた。得られた混合物を数時間(少なくとも3時間)かけて室温に加温し、撹拌をさらに14時間続行した(合計17時間)。水酸化アンモニウムを反応混合物に注意深く滴下して(注意:0℃で反応混合物に徐々に加える)、反応物をクエンチした。次いで水を反応混合物に加え、水相を除去した。有機層を脱水し(MgSO4)、真空下で濃縮した。表題化合物を薄茶色固体(0.93g、97%)として得た。1H NMR(400MHz,CDCl3)δ 0.85(t,3H);1.29(m,10H);1.70(m,2H);2.04(m,1H);3.39(m,2H);3.63(t,1H);3.67(m,1H);6.77(d,J=8.5Hz,2H);7.12(d,J=8.5Hz,2H)。13C NMR(75MHz,CDCl3)δ 13.99、22.67、24.51、25.55、26.11、29.98、34.59、43.32、46.75、47.73、115.63、128.83、132.28、154.95、172.09。HRMS(ESI+1イオン)m/z:C17H26NO2の計算値276.1958、実測値276.1954。
【0180】
化合物17.7
2−(4−ヒドロキシフェニル)−N,N−ジメチルヘキサンアミド
【化28】

表題化合物を、17.2(12mg、0.048mmol)から、16.5について説明したのと同様の方法で淡黄色固体(6mg、53%)として得た。δ 0.85(t,J=7Hz,3H);1.1〜1.5(多重線シグナル、4H);1.65(m,1H);2.03(m,1H);2.94(s,3H);3.63(t,J=7Hz,1H);6.76(d,J=8.5Hz,2H);7.16(d,J=8.5Hz,2H)。13C NMR(75MHz,CDCl3)δ 14.15、22.82、30.14、31.10、34.96、48.05、115.61、129.22、132.53、154.65、173.87。HRMS(ESI+1イオン)m/z:C14H23NO2の計算値236.1645、実測値236.1644。
【0181】
化合物17.8
2−(4−ヒドロキシフェニル)−N,N−ジメチルオクタ−7−エンアミド
【化29】

無水CH2Cl2(1mL)中の17.3(25mg、0.09mmol)の冷却(−78℃)溶液にBBr3(CH2Cl2中の1M溶液、0.27mL、0.27mmol)を加えた。得られた混合物を室温に加温し、さらに30分間撹拌した。続いて、反応混合物を−78℃に冷却し、MeOH(2mL)を反応混合物に加えた。5分後、得られた混合物を水に注加し、さらに10mLのCH2Cl2を加えた。有機層を洗浄し脱水し、真空下で濃縮して粗生成物を淡黄色固体として得た。粗生成物を、フラッシュカラムクロマトグラフィー(50%EtOAc/ヘキサン、Rf=0.2)で精製して表題化合物を淡黄色油状物として得た。これは静置すると固化した(4mg、15%)。1H NMR(400MHz,CDCl3)δ1.1〜1.5(多重線シグナル、4H);1.67(m,1H);1.98(m,3H);2.93(s,3H);2.94(s,3H);3.62(t,J=7Hz,1H);4,84(s,1H ArOH);4.90(dm,J=10Hz,1H);4.95(dm,J=17Hz,1H);5.77(ddd,J=17,10,6.5Hz,1H);6.76(d,J=8.8Hz,2H);7.14(d,J=8.8Hz,2H)。13C NMR(75MHz,CDCl3)27.29、28.90、33.64、34.97、35.94、37.19、47.92、114.26、115.51、129.10、132.48、139.01、173.55。HRMS(ESI+1イオン)m/z:C16H24NO2の計算値262.1802、実測値262.1086。
【化30】

化合物17.6
2−(4−ヒドロキシフェニル)−1−(ピペリジン−1−イル)オクタ−7−エン−1−オン
【0182】
表題化合物を、17.8について説明したのと同様の方法で2−(4−メトキシオキシフェニル)−1−(ピペリジン−1−イル)オクタ−7−エン−1−オン(50mg、0.18mmol)から調製した。表題化合物を、フラッシュカラムクロマトグラフィー(50%EtOAc/ヘキサン、Rf=0.5)による精製によって無色の低融点固体(6mg、11%)として得た。1H NMR(400MHz,CDCl3)δ 1.0〜1.5(多重線シグナル、10H);1.66(m,1H);2.02(m,3H);3.38,(m,3H);3.62(t,J=7Hz,1H);3.65(m,1H);4.88(dm,J=10Hz,1H);4.95(dm,J=17Hz,1H);5.76(ddd,J=17,10,6.5Hz,1H);6.76(d,J=8.5Hz,2H);7.11(d,J=8.5Hz,2H)。13C NMR(75MHz,CDCl3)δ 24.54、25.58、26.12、27.31、28.91、33.66、34.79、43.27、46.72、47.72、114.24、115.59、128.92、132.59、139.04、154.64、171.80。HRMS(ESI+1イオン)m/z:C19H28NO2の計算値302.2115、実測値302.2120。
2−(4−ヒドロキシメチル)フェニル−1−(ピペリジン−1−イル)エタノン
【化31】

【0183】
表題化合物を、DCC媒介アミド形成のために概要を示した一般的手順にしたがって4−ヒドロキシメチルフェニル酢酸(1.0g、6.0mmol)から調製した。生成物を、フラッシュカラムクロマトグラフィー(EtOAc、Rf=0.5)による精製によって粘性の無色油状物(0.54g、39%)として単離した。1H NMR(400MHz,CDCl3)δ 1.37(m,2H);1.52(m,2H);1.58(m,2H);3.36(m,2H);3.56(m,2H);3.71(s,2H);4.66(s,2H);7.23(d,J=8Hz,2H);7.31(d,J=8Hz,2H)。13C NMR(75MHz,CDCl3)δ24.39、25.44、25.47、26.21、34.91、40.77、42.92、47.25、55.77、64.92、127.33、128.76、134.65、139.48、169.30。HRMS(ESI+1イオン)m/z:C14H20NO2の計算値234.1489、実測値234.1489。
【0184】
2−(4−tert−ブチルジメチルシリルオキシメチル)フェニル−1−(ピペリジン−1−イル)エタノン
【化32】

無水DCM中の2−(4−ヒドロキシメチル)フェニル−1−(ピペリジン−1−イル)エタノン(540mg、2.32mmol)及びイミダゾール(97mg、1.4mmol)の冷却(0℃)溶液に、DCM(5mL)中のTBSCl(214mg、1.42mmol)の溶液を加えた。得られた反応混合物を2時間撹拌した。続いて、反応混合物を、水(×2)及び塩水で順次洗浄し、有機層を脱水し(MgSO4)、真空下で濃縮した。表題化合物を、フラッシュカラムクロマトグラフィー(20%EtOAc、Rf=0.6)による精製によって無色油状物(420mg、53%)として得た。1H NMR(400MHz,CDCl3)δ 0.084(s,6H);0.929(s,9H);1.34(m,2H);1.52(m,2H);1.59(m,2H);3.43(m,2H);3.57(m,2H);3.71(s,2H);4.71(s,2H);7.20(d,J=8Hz,2H);7.25(d,J=8Hz,2H)。13C NMR(75MHz,CDCl3)δ −5.21、24.45、25.59、25.97、26.20、40.94、42.89、47.27、64.77、126.41、128.40、133.96、139.81、169.36。HRMS(ESI+1イオン)m/z:C20H34NO2Siの計算値348.2353、実測値348.2354。
【0185】
2−(4−tert−ブチルジメチルシリルオキシメチル)フェニル−1−(ピペリジン−1−イル)ヘキサノン
【化33】

表題化合物を、αアルキル化のために概要を示した一般的手順にしたがって2−(4−tert−ブチルジメチルシリルオキシメチル)フェニル−1−(ピペリジン−1−イル)エタノン(420mg、1.21mmol)から調製した。生成物を、フラッシュカラムクロマトグラフィー(ヘキサン中に20%EtOAc、Rf=0.6)による精製によって無色油状物(260mg、53%)として得た。1H NMR(400MHz,CDCl3)δ 0.010(s,6H);0.087(t,J=7Hz,3H);0.94(s,9H);1.01(m,1H);1.14(m,1H);1.2〜1.6(多重線シグナル、8H);1.68(m,1H);2.10(m,1H);3.3〜3.5(m,3H);3.68(m,2H);4.72(s,2H);7.15(m,4H)。13C NMR(75MHz,CDCl3)δ −5.20、14.03、22.75、24.75、25.68、26.12、30.40、34.78、43.16、46.62、48.47、64.79、126.38、127.66、139.52、139.73、171.42。HRMS(ESI+1イオン)m/z:C24H42NO2Siの計算値404.2979、実測値404.2983。
【0186】
化合物16.1
2−(4−ヒドロキシメチル)フェニル−1−(ピペリジン−1−イル)ヘキサノン
【化34】

無水THF(5mL)中の2−(4−tert−ブチルジメチルシリルオキシメチル)フェニル−1−(ピペリジン−1−イル)ヘキサノン(260mg、0.64mmol)の溶液を、THF(1.29mmol)中のTBAFの溶液を入れたフラスコに加えた。得られた反応混合物を1時間撹拌し、その時点でtlc分析により、出発原料が残っていないことが示された。反応混合物を水(×2)、次いで塩水で洗浄し、有機層を脱水し(MgSO4)、真空下で濃縮して粗生成物を得た。表題化合物を、フラッシュカラムクロマトグラフィー(ヘキサン中に50%EtOAc、Rf=0.4)による精製によって無色油状物(142mg、76%)として単離した。1H NMR(400MHz,CDCl3)δ 0.87(t,J=7Hz,3H);1.04(m,1H);1.14(m,1H);1.9〜1.7(m,8H);1.71(m,1H);1.91(m,1H);3.34(m,2H);3.47(m,1H);3.63(m,1H);3.69(t,J=7Hz,1H);4.66(s,2H);7.25(d,J=8Hz,2H);7.30(d,J=8Hz,2H)。13C NMR(75MHz,CDCl3)δ 14.02、22.72、24.56、25.57、26.12、30.07、34.76、43.19、46.64、48.41、65.07、127.06、127.99、139.28、140.32、171.32。HRMS(ESI+1イオン)m/z:C18H28NO2の計算値290.2114、実測値289.2117。
【0187】
化合物16.3
2−(4−アセトキシメチル)フェニル−1−(ピペリジン−1−イル)ヘキサノン
【化35】

DMAP(2mg)を入れた丸底フラスコに、無水CH2Cl2(2mL)中の2−(4−ヒドロキシメチル)フェニル−1−(ピペリジン−1−イル)ヘキサノン(30mg、0.10mmol)の溶液を加えた。得られた混合物に無水NEt3(208μL、1.5mmol)を加え、次いで無水酢酸(100μL、1.0mmol)を加えた。得られた混合物を3時間撹拌した。続いて、反応混合物を飽和NaHCO3、水で洗浄し、次いで塩水で洗浄し、有機相を脱水し(Na2SO4)、減圧下で濃縮した。表題化合物を、フラッシュカラムクロマトグラフィー(ヘキサン中に50%EtOAc、Rf=0.7)による精製によって無色油状物(20mg、60%)として得た。1H NMR(400MHz,CDCl3)δ 0.86(t,J=7Hz,3H);1.0〜1.2(2×m,2H);1.2〜1.5(多重線シグナル、8H);1.68(m,1H);4.53(m+s,4H);3.33(m,1H),3.39(m,1H);3.49(m,1H);3.60(m,1H);3.70(t,J=7Hz,1H);5.07(s,2H);7.72(m,4H)。13C NMR(75MHz,CDCl3)δ 14.01、21.08、22.72、24.57、25.60、26.20、30.09、34.77、43.20、46.66、48.38、66.07、128.03、128.58、134.24、141.02、171.09、171.17。
注記:化合物は静置すると加水分解する。HRMSによれば遊離アルコールのそれと一致する。
【0188】
化合物16.11
4−(1−オキソ−1−(ピペリジン−1−イル)ヘキサン−2−イル)フェニルアクリレート
【化36】

無水CH2Cl2(10mL)中の16.5(100mg、0.36mmol)及びトリエチルアミン(56μL、0.40mmol)の冷却(0℃)撹拌溶液に、塩化アクリロイル(33μL、0.40mmol)を加えた。得られた混合物を室温に加温し、さらに1時間撹拌し、その時点でtlc分析(50%EtOAc/ヘキサン)により、出発原料が完全に消費されていることが示された。続いて、反応混合物を真空下で濃縮し、フラッシュカラムクロマトグラフィー(50%EtOAc/ヘキサン、Rf=0.5)で精製して表題化合物を無色油状物(120mg、>95%)として得た。1H NMR(400MHz,CDCl3)δ 0.85(t,J=7Hz,3H);1.0〜1.6(多重線シグナル、10H);1.70(m,1H);2.05(m,1H);3.3〜3.5(2×m,3H);3.68(m,1H);3.70(t,J=7Hz,1H);5.99,(d,J=10Hz,1H);6.29(dd,J=17,10Hz,1H);6.57(d,J=17Hz,1H);7.06(d,J=8.4Hz,2H);7.28(d,J−8.4Hz,2H)。13C NMR(75MHz,CDCl3)δ 13.93、22.63、24.49、25.51、26.10、30.00、34.77、43.12、46.61、47.96、121.53、127.88、128.69、132.42、138.42、149.15、164.43、171.06。HRMS(ESI+1イオン)m/z:C20H28NO3の計算値330.1989、実測値330.2056。
【0189】
化合物16.4
4−(1−オキソ−1−(ピペリジン−1−イル)ヘキサン−2−イル)フェニルアセテート
【化37】

無水酢酸(38μL、0.40mmol)を、無水CH2Cl2(20mL)中の16.5(100mg、0.36mmol)及びピリジン(32μL、0.40mmol)の冷却(0℃)撹拌溶液に加えた。反応物を室温に加温し、撹拌をさらに18時間続行した。その時点で、tlc分析(50%EtOAc/ヘキサン)により、出発原料の消費が示された。粗製反応混合物を希薄(0.1M)HClで洗浄し、次いで水で洗浄した。有機層を脱水し(MgSO4)、真空下で濃縮し、得られた油性残留物を、フラッシュカラムクロマトグラフィー(50%EtOAc/ヘキサン、Rf=0.26)で精製して表題化合物を無色油状物(110mg、>95%)として得た。1H NMR(400MHz,CDCl3)δ 0.86(t,J=7Hz,3H);1.0〜1.7(多重線シグナル、11H);2.1(m,1H);2.28(s,3H);3.37(m,2H);3.48(m,1H);3.59(m,1H);3.72(t,J=7Hz,1H);7.04(d,J=8.4Hz,2H);7.28(d,J=8.4Hz,2H)。13C NMR(75MHz,CDCl3)δ 13.96、21.14、22.67、24.53、25.55、26.15、30.04、34.80、43.15、46.64、47.97、121.59、128.72、138.38、149.29、169.39、171.11。HRMS(ESI+1イオン)m/z:C19H28NO3の計算値318.2064、実測値318.2060。
【0190】
化合物16.6
2−(4−(2−ヒドロキシエトキシ)フェニル)−1−(ピペリジン−1−イル)ヘキサン−1−オン
【化38】

無水DMF(10mL)中の16.5(0.50g、1.8mmol)、エチレンカーボネート(176mg、2.00mmol)及びテトラエチルアンモニウムブロミド(20mg、0.09mmol)の溶液を油浴中、180℃で16時間加熱した。次いで冷水(50mL)を加え、得られた混合物をEtOAc(3×20ml)で抽出した。一緒にした有機層を水で洗浄し、脱水し(MgSO4)、真空下で濃縮した。粗生成物をフラッシュカラムクロマトグラフィー(CH2Cl2中に10%MeOH、Rf=0.4)で精製して表題化合物を無色油状物(200mg、34%)として得た。1H NMR(400MHz,CDCl3)δ 0.84(t,J=7Hz,3H);1.05(m,1H);1.17(m,1H);1.2〜1.6(多重線シグナル、8H);1.7(m,1H);2.08(m,1H);2.39(t,J=6Hz,1H(OH));3.35(m,3H);3.62(t,J=7Hz,1H);3.64(m,1H);3.92(m,2H);4.05(m,1H);6.83(d,J=8.4Hz,2H);7.16(d,J=8.4Hz,2H)。13C NMR(75MHz,CDCl3)δ 13.96、22.64、24.50、25.51、26.09、29.96、34.70、43.10、46.58、47.70、61.36、69.10、114.59、128.78、133.38、157.28、171.55。HRMS(ESI+1イオン)m/z:C19H30NO3の計算値320.2220、実測値320.2205。
【0191】
化合物16.8
2−(4−(1−オキソ−1−(ピペリジン−1−イル)ヘキサン−2−イル)フェノキシ)エチルアセテート
【化39】

無水CH2Cl2(20mL)中の16.6(100mg、0.31mmol)及びDMAP(85mg、0.34mmol)の冷却(0℃)撹拌溶液に、塩化アセチル(50μL、0.34mmol)を加えた。得られた反応混合物を還流下16時間撹拌し、この時点でtlc分析(50%EtOAc/ヘキサン)により、出発原料が完全に消費されていることが示された。反応混合物をHCl(0.1M)及び水で洗浄し、有機層を脱水し(MgSO4)、真空下で濃縮した。表題化合物を、フラッシュカラムクロマトグラフィー(50%EtOAc/ヘキサン、Rf=0.4)による精製によって無色油状物(110mg、>95%収率)として得た。1H NMR(400MHz,CDCl3)δ 0.85(t,J=7Hz,3H);1.05〜1.60(多重線シグナル、10H);1.7(m,1H);2.08(m,1H);2.10(s,3H);3.35〜3.45(m,3H);3.6〜3.7(m,2H);4.15(見かけt,J=5Hz,2H);4.40(見かけt,J=5Hz,2H);6.84(d,J=8.4Hz,2H);7.17(d,J=8.4Hz,2H)。13C NMR(75MHz,CDCl3)δ 13.99、20.89、22.69、24.55、25.56、26.15、30.11、34.77、43.11、46.61、47.74、62.86、65.88、114.68、128.85、133.61、157.13、171.00、171.55。HRMS(ESI+1イオン)m/z:C21H32NO4の計算値362.2326、実測値362.2320。
【0192】
化合物16.7
メチル2−(4−(1−オキソ−1−(ピペリジン−1−イル)ヘキサン−2−イル)フェノキシ)アセテート
【化40】

無水アセトニトリル(20mL)中の16.5(300mg、1.15mmol)及びK2CO3(400mg、2.87mmol)の撹拌溶液にメチルブロモアセテート(0.18g、1.2mmol)を加えた。得られた混合物を16時間還流させ、その時点でtlc分析(CH2Cl2中に5%MeOH)により、出発原料が残っていないことが示された。アセトニトリルを真空下で除去し、残留物をEtOAcに取り、水で洗浄した。有機層を脱水し(MgSO4)、真空下で濃縮し、表題化合物を、フラッシュカラムクロマトグラフィー(CH2Cl2中に5%MeOH、Rf=0.7)による精製によって無色油状物(300mg、72%)として得た。1H NMR(400MHz,CDCl3)δ 0.86(t,J=7Hz,3H);1.05〜1.60(多重線シグナル、10H);1.7(m,1H);2.05(m,1H);3.38(m,2H);3.42(m,1H),3.6〜3.7(m,2H);3.80(s,3H);4.61(s,2H);6.83(d,J=8.4Hz,2H);7.19(d,J−8.4Hz,2H)。13C NMR(75MHz,CDCl3)δ 14.02、22.72、24.59、25.60、26.18、30.06、34.78、43.15、46.65、47.73、52.26、65.45、114.80、128.94、134.29、156.51、169.44、171.48。HRMS(ESI+1イオン)m/z:C20H30NO4の計算値348.2169、実測値348.2157。
【0193】
化合物16.9
2−(4−(1−オキソ−1−(ピペリジン−1−イル)ヘキサン−2−イル)フェノキシ)酢酸
【化41】

粉末LiOH(72mg、3.0mmol)をTHF(10mL)中の16.7(100mg、0.30mmol)の溶液に加え、混合物を室温で16時間撹拌した。次いで反応混合物をHCl(0.1M)で酸性化し、EtOAc(3×20mL)で洗浄した。有機相を脱水し(MgSO4)、真空下で濃縮した。表題化合物を、フラッシュカラムクロマトグラフィー(CH2Cl2中に10%MeOH、Rf=0.5)による精製によって無色油状物(59mg、60%)として得た。1H NMR(400MHz,CDCl3)δ 0.84(t,J=7Hz,3H);1.05〜1.60(多重線シグナル、10H);1.68(m,1H);2.05(m,1H);3.37(m,2H);3.42(m,1H),3.66(m,2H);4.63(s,2H);6.85(d,J=8.4Hz,2H);7.18(d,J=8.4Hz,2H)。13C NMR(75MHz,CDCl3)δ 13.96、22.61、24.41、25.52、26.10、29.92、34.52、43.49、46.82、47.71、65.10、114.87、128.89、133.87、156.46、171.92、172.03。HRMS(ESI+1イオン)m/z:C19H28NO4の計算値334.2013、実測値334.2001。
【0194】
化合物16.10
1−(ピペリジン−1−イル)−2−(4−(2−(トリメチルシリル)エトキシ)フェニル)ヘキサン−1−オン
【化42】

無水THF(10mL)中の16.5(100mg、0.36mmol)、トリフェニルホスフィン(140mg、0.54mmol)及びトリメチルシリルエタノール(80μL、0.54mmol)の冷却(0℃)溶液にDIAD(110μL)を10分間かけて加えた。得られた反応混合物を室温に加温し、さらに16時間撹拌した。続いて、溶媒を真空下で除去し、残留物をEtOAcに取り、水で洗浄した。有機層を脱水し(MgSO4)、真空下で濃縮し、得られた残留物を、フラッシュカラムクロマトグラフィー(50%EtOAc/ヘキサン、Rf=0.7)で精製して表題化合物を淡黄色油状物(40mg、30%)として得た。1H NMR(400MHz,CDCl3)δ 0.07(s,9H);0.84(t,J=7Hz,3H);1.05(m,1H);1.17(m,1H);1.2〜1.6(多重線シグナル、10H;見かけt,J=6Hz,2H);1.7(m,1H);2.05(m,1H);3.25〜3.35(m,3H);3.62(t,J=7Hz,1H);3.65(m,1H);4.03(見かけt,J=6Hz,2H);4.05(m,1H);6.80(d,J=8.4Hz,2H);7.15(d,J=8.4Hz,2H)。13C NMR(75MHz,CDCl3)δ −1.33、14.01、17.75、22.71、24.58、25.57、26.11、30.03、34.77、43.11、46.60、47.80、65.31、114.59、128.70、132.75、157.59、171.67。HRMS(ESI+1イオン)m/z:C22H38NO2の計算値376.2672、実測値376.2666。
【0195】
4−(1−オキソ−1−(ピペリジン−1−イル)ヘキサン−2−イル)ベンズアルデヒド
【化43】

DMSO(0.20mL、2.8mmol)を、無水CH2Cl2(5mL)中の塩化オキサロイル(122μL、1.42mmol)の冷却(−78℃)撹拌溶液に加えた。5分後、16.2(300mg、1.29mmol)を加え、撹拌を15分間続行し、次いでトリエチルアミン(0.90mL、6.5mmol)を滴下した。さらに5分後、混合物を室温に加温した。反応混合物をHCl(0.1M)で洗浄し、有機層をさらに水で抽出し、脱水し(MgSO4)、真空下で濃縮した。表題化合物を無色油状物(222mg、59%)として得た。精製は必要でなかった。1H NMR(400MHz,CDCl3)δ 0.80(t,J=7Hz,3H);1.05(m,1H);1.15(m,1H);1.2〜1.6(多重線シグナル、8H);1.7(m,1H);2.05(m,1H);3.29(m,2H);3.36(m,1H),3.61(m,1H);3.71(t,J=7Hz,1H);7.39(d,J=8.4Hz,2H);7.76(d,J=8.4Hz,2H)。13C NMR(75MHz,CDCl3)δ 13.97、22.67、24.49、25.55、26.21、30.05、34.64、43.33、46.69、48.88、128.57、130.21、135.08、148.03、170.36、191.91。HRMS(ESI+1イオン)m/z:C18H26NO2の計算値288.1958、実測値288.1963。
【0196】
化合物17.9
4−(1−オキソ−1−(ピペリジン−1−イル)ヘキサン−2−イル)安息香酸
【化44】

オキソン(257mg、0.42mmol)をDMF(5mL)中の4−(1−オキソ−1−(ピペリジン−1−イル)ヘキサン−2−イル)ベンズアルデヒド(100mg、0.35mmol)の撹拌溶液に加え、得られた混合物を室温で16時間撹拌した。DMFを真空下で除去し、得られた残留物をフラッシュカラムクロマトグラフィー(50%EtOAc/ヘキサン、Rf=0.4)で精製して所望の化合物を淡黄色固体(68mg.64%)として得た。MP=142℃。1H NMR(400MHz,CDCl3)δ 0.86(t,J=7Hz,3H);1.05(m,1H);1.15(m,1H);1.2〜1.6(多重線シグナル、8H);1.71(m,1H);2.10(m,1H);3.33〜3.43(m,3H);3.69(m,1H);3.77(t,J=7Hz,1H);7.38(d,J=8.4Hz,2H);8.02(d,J=8.4Hz,2H)。13C NMR(75MHz,CDCl3)δ 13.98、22.68、24.50、25.55、26.16、30.04、34.60、43.32、46.68、48.82、128.04、130.50、153.75、170.59。HRMS(ESI+1イオン)m/z:C18H26NO3の計算値304.1907、実測値304.1917。
【0197】
残りの化合物を、出発原料を適切に変えて、上記した方法に対応する方法で作製した。
【0198】
実施例第2部
ポリマー系
防汚化合物16.5に相当するペンダント基を含むいくつかのポリマーを合成した。
【0199】
具体的には、モノマー16.11を用いて化合物16.5を、アクリレートをベースとしたポリマー中に組み込んだ。
【化45】

【0200】
ポリマーを、水性の環境において持続的な方法で(活性)化合物16.5を放出する能力に関して評価した。特に、ポリマー材料の防汚効力を、実験室及び現場でのアッセイで試験して防汚性能及び毒性を確認した。
ポリマーの合成
【0201】
海洋用コーティングにおける我々の発明の潜在的用途を例示するために、実施形態と同じポリマーを設計し合成した。しかし、これらの実施形態を限定的なものととるべきではない。
【0202】
放出可能な官能性単位として化合物16.5を含むポリマーを、適度な親水性を備え(水中での水和を確実にするために)、市販の海洋用塗料に適切な強度、溶解性及び相溶性を備えるように設計した。これらの要件を実現させるためには、ポリマーのTgを好ましくは室温より高くすべきであり、分子量は約10Kダルトンを目標とすべきである。
【0203】
そうしたポリマーを、フリーラジカル条件下で開始剤としてAIBN、ABCN又は過酸化ベンゾイルを用いてビニル含有化合物16.11を適切なビニルモノマーと重合させて合成した。
【0204】
ポリマーA
P(16.11−co−MMA−co−HEA)
化合物16.11とメチルメタクリレート(MMA)及びヒドロキシエチルアクリレート(HEA)のコポリマーを設計して官能性ポリマーを得た。そこで、16.11、メチルメタクリレート(MMA)及び(HEA)を混合し、標準的なフリーラジカル条件下で重合した。
【化46】

【0205】
質量比を、MMAがポリマーの主鎖の大部分を形成して機械的強度を付与しTgが確実に室温より高くなり、同時にHEAがポリマーの親水性を向上させ得る水素結合能力をもたらすように設計した。
【0206】
0.54gの官能性モノマー(16.11)(ヘビービスコースオイル(heavy viscose oil)様黄色液体)を、3mlのDMF中で2.0gのMMA、1.0gの2−ヒドロキシルエチルアクリレート(HEA)及び40mgのABCNと混合した。窒素を10minパージして混合物を脱ガスし、次いで70℃に温度設定した油浴中に16時間置いた。続いて、反応混合物を50mLのエーテルに注加した。沈殿物をろ取し、真空下、室温で乾燥して表題化合物を無色固体(2.5g、74%)として得た。
【0207】
IR分光法によるポリマー材料の分析によって、1621cm−1で検出された主要吸収と一緒に、約1730cm−1での予測されたエステルC=O伸縮吸収が明らかになった。そうした低周波C=O振動は第三アミドの特徴であり、したがってこのバンドは、重合した16.11のピペリジンアミド結合に割り当てられる。
【0208】
ポリマーB
P(16.11−co−MMA−co−VP)
ポリマーBをポリマーAと同様にして設計した。但し、ポリマーの親水性を増大させるためにHEAの代わりにビニルピロリジノン(VP)を使用した。ポリマーBを、ポリマーAで説明したのと同じモノマー比を用いてフリーラジカル条件下で合成した。ポリマーBの構造を以下に示す。
【化47】

【0209】
3mlのDMF中で0.5gの官能性モノマーを、2.0gのMMA、1.0gのビニルピロリドン(VP)及び40mgのABCNと混合し、窒素を10minパージして混合物を脱ガスした。次いで、混合物を70℃に温度設定した油浴中に16時間置いた。次いで生成物に5mlのDCMを加えると透明な溶液が生成した。溶液を、撹拌しながらヘキサンに注加した。精製された生成物を白色沈殿物として収集した。純粋な生成物を集め、空気中、室温で乾燥して表題化合物を無色固体(1.9g、54%)として得た。
【0210】
IR分光法によるポリマー材料の分析によって、先に割り当てた約1640cm−1でのピペリジンアミドカルボニル振動と一緒に、約1724cm−1での予測されたエステルカルボニル伸縮吸収が明らかになった。VPの組み込みは、IR分光法によりγ−ラクタムの存在と一致する約1660cm−1に現れた明瞭な吸収から明らかである。
【0211】
GPCは5300ダルトンのMWを示した。最後に、ポリマーの可溶性の特徴により、1H NMR分光法によるさらなる分析が可能となった。6.9〜7.2ppmでのシグナルを16.11単位のフェニル部分に割り当て、4.0ppm〜4.3ppmの幅広のピークをピロリジノン単位のN原子と隣接する環メチレンに割り当てた。3.5〜3.8ppmにおける大きな幅広シグナルをMMA単位のメチルエステルに割り当てた(Brar and Kumar、2002年)。0.9ppm〜2.5ppmのシグナルを、ポリマー主鎖のメチレン及びメチン基並びに16.11の側鎖のメチレン及びメチル基に帰属させる。
【0212】
ポリマーC
P(TBA−co−MMA−co−VP)
標準コポリマー(ポリマーC)も合成した。ここで、16.11をt−ブチルアクリレート(TBA)で置き換えた。そうしたポリマーを、コポリマー自体の機能として、何らかのバックグラウンド毒性又は沈降防止活性が存在するかどうかを確認するために合成した。
【化48】

【0213】
フリーラジカル重合を、ポリマーA及びBの場合と同じ質量比を用いて実施した。
【0214】
0.6gのtert−ブチルアクリレートを、3mlのDMF中で2.0gのMMA、1.0gのビニルピロリドン(VP)及び40mgのABCNと混合し、この混合物を、窒素を10minパージして混合物を脱ガスした。次いで混合物を、70℃に温度設定した油浴中に16時間置いた。次いでこの生成物に5mlのDCMを加えると透明な溶液が生成した。溶液を、撹拌しながらヘキサンに注加した。精製された生成物を白色沈殿物として収集した。純粋な生成物を集め、空気中、室温で乾燥して所望の化合物を無色固体(3.2g、89%)として得た。
【0215】
IR分光法によるポリマーの分析によって、1728cm−1及び1664cm−1での主要振動モードのエステル及びラクタムカルボニル基の存在が明らかになった。GPCにより、67000ダルトンの所望MWが達成されたことが示された。これは、ポリマーBで得られたMWよりずっと高いものであった。
【0216】
ポリマーの1H NMR分析により、1.4ppmで現れる、ポリマー中でのt−ブチル部分の存在が確認された。
【0217】
実施例第3部
化合物の生物学的検査
手法
生物学的アッセイをフジツボ幼生で実施した。フジツボは、海洋汚損群落の支配的で頑強なメンバーであり、しばしば、耐性のより小さい生物のための基材として作用する。したがって、これらは歴史的に防汚研究のためのモデル生物として用いられてきた。幼生の試験化合物に対する生物学的応答を判定するために、2つのバイオアッセイ:沈降(沈降段階のキプリドを用いて)及び毒性(ノープリウス(nauplii)を用いて)アッセイを実施した。手順は、Rittschofら(1992年)によって最初に記載されたこの分野の標準的な方法にしたがった。
【0218】
バイオアッセイ用のストック溶液の調製
各化合物のストック溶液を50mg/mlで作製した。純粋化合物をDMSOに希釈し、超音波処理した。ストック溶液を、4mlの琥珀色のねじぶたバイアル中、−20℃で使用するときまで貯蔵した。バイオアッセイのため、少量のストック溶液を1μmのろ過した海水に希釈した(ガラス製シンチレーションバイアル中に)。次いで溶液を10分間超音波処理した。所望の濃度域を得るために、試験溶液の連続希釈液を作製した。対照として、同等量の海水中へのDMSOの連続希釈液を使用した。
【0219】
毒性アッセイ
毒性アッセイでは、フジツボアンフィバラヌスアンフィトライト(Amphibalanus amphitrite)(以前はバラヌスアンフィトライト(Balanus amphitrite):Pitombo、2004年)のII期のノープリウス幼生を用いた。アッセイ手順はRittschofら(1992年)の手順を修正したものである。成体A.アンフィトライト(A.amphitrite)をシンガポールのクランジ(Kranji)マングローブ付近の潮間帯地域から採取した。幼生培養はRittschofら(1984年)をもとにした。採取に続いて、容器の一方の側部に光ファイバー光源を置き、得られたノープリウスの密な集まり(dense cloud)からピペッティングすることによって、ノープリウスをバイオアッセイで使用するために濃縮した。
【0220】
各化合物についてのLD50値を判定するために、化合物を0〜50μg/mlの濃度範囲にわたり試験した。各アッセイのため、各化合物を各濃度で、ノープリウスの単一バッチで3連で試験した。全部のアッセイを、異なるバッチのノープリウスを用いて2回実施した。各アッセイと一緒に2つの対照を実行した(3連で):ろ過海水だけ、及び1μg/mlのDMSO(試験化合物用の溶媒としてDMSOを使用したので、この濃度は、最も高い試験化合物濃度でのDMSOの濃度と同等である)。
【0221】
アッセイのため、約20のノープリウス(50μlろ過海水中に)を、2mlガラス製バイアル(ラファパック(La Pha Pack)(登録商標)PN11−14−0544)中の1mlの試験溶液又は対照に加えた。アッセイを25〜27℃で22〜24時間実行した。この後、Bogorovトレーを用いて生存ノープリウスと死滅ノープリウスの数を計数した。死にかけているノープリウスは死滅したものと勘定した。すべてのアッセイについてのデータを一緒にし、プロビット解析(Libermann、1983年)を用いてLD50を計算した(可能な場合)。プロビット解析を用いてLD50を計算できなかった場合、プロットしたデータをもとにして値を外挿した。
【0222】
沈降アッセイ
沈降アッセイ(フジツボキプリドを使用)はRittschofら(1992年)が記載している手法をもとにした。上記したようにしてノープリウスを培養し、次いで25℃で、テトラセルミススエシカ(Tetraselmis suecica)とカエトセロスムエレリ(Chaetoceros muelleri)の1:1v/vの藻類混合物(おおよそ5×105細胞/mlの密度)上で飼育した。これらの条件下で、ノープリウスは通常5日間でキプリドに変態する。キプリドを4℃で2日間エイジングした。エイジング後のろ過海水対照における沈降はおおよそ45〜70%である。
【0223】
沈降アッセイを、7ml中性ガラス製バイアル(サムコ(Samco)(登録商標)T103/V1;34×23mm径)中で実施した。アッセイのため、各溶液を所望最終濃度の2倍の濃度で作製した;0.5mlのこの溶液をバイアルに移した。各バイアルに、キプリドを、20〜40のエイジングしたキプリドを含む0.5mlろ過海水を移して加えた。毒性アッセイの場合のように:各化合物を各濃度で、単一バッチからのキプリドで3連で実行した;2つの対照(ろ過海水及びDMSO)を各アッセイと一緒に実行した;全部のアッセイを、2つの異なるバッチのキプリドを用いて2回実施した。
【0224】
アッセイを24時間実施し、次いで沈降したキプリドの数、自由に遊泳している(沈降していない)キプリドの数及び死滅したキプリドの数を、各バイアルについて計数した。変態した幼若フジツボと、沈降しているが(それ自体がバイアルに固着)変態はしていないキプリドの両方を「沈降している」と計数した。データを沈降率%で表した。すべてのアッセイについてのデータを一緒にし、ED50(対照と比較して沈降の50%減少を引き起こす濃度)を、(可能な場合)プロビット解析(Libermann、1983年)を用いて計算した。プロビット解析を用いてED50を計算できなかった場合、プロットしたデータをもとにして値を外挿した。
【0225】
結果
化合物についての生物学的活性を表1及び表2に示す。データは、幼生のバッチ(複数)を用い、バッチ当たり3連の各化合物を用いたアッセイによるものである。プロビット解析を用いてLD50又はED50を計算できなかった場合、値を、プロットしたデータから推定した。LD50値が高く(低い毒性)、しかしED50は低い(非常に高い効力)化合物は、防汚のために最も望ましいものである。試験したいくつかの化合物は、従来確認されている非官能化化合物(12.1及び12.2;PCT/SG2009/000175)以上の治療可能比を示す。
【0226】
【表6】

【0227】
【表7】

【0228】
したがって、生物学的スクリーニングは、官能化された分子が望ましい生物学的活性を保持するか又はそれを向上させる(フジツボキプリド沈降に対して効力は高いが毒性は低い)ことを示している。
【0229】
LD50値が高く(低い毒性)、しかしED50は低い(非常に高い効力)化合物は、防汚の目的に最も望ましいものである。すべての化合物が1より大きい治療可能比をもたらした。
【0230】
上記の結果は、これらの新規の有機小分子を環境に優しい防汚用添加剤として使用できることを実証している。これらの分子は、芳香環上の異なる置換基及び置換パターンにもかかわらず、効果的な沈降防止活性を保持している。実際、いくつかの化合物は、非置換親構造の生物活性に匹敵するか又はそれより良好な生物活性を示す。これらの新規な分子は、それらが防汚化合物を海洋用コーティング系につなぐ又はそれに固定するのに使用され得る官能基を支えることができるという点で親構造を改善する。
【0231】
これらの化合物は既存のアクリレート塗料中にブレンドすることができ、したがって、既存のコーティング選択肢に対する実行可能な代替案である。さらに、その単純な構造のため、これらの化合物は、海洋環境において細菌という手段によって分解される魅力的な候補品であり、蓄積する可能性は小さく、将来の健康上のリスクを引き起こすこともなさそうである。さらに、ジウロン(Diuron)(登録商標)やシーナイン(Sea−Nine)(登録商標)などの既存の有機殺生物剤は生物濃縮し、海洋環境において有害な影響を引き起こすことが分かっていることを考えれば、本発明の化合物は従来の金属をベースとした添加剤に対する価値ある代替物を代表するものである。
【0232】
実施例第4部
ポリマー系
放出試験
実験室アッセイのためのマルチウェルプレートの調製
2つのバッチのポリスチレン4×6マルチウェルプレート(ウェルの底部は2cm2)を実験室アッセイ用に調製した。50mgのP(MMA−co−16.11−co−VP)を1.0mlのエタノールに溶解してポリマーのストック溶液を作製した。プレートを所望量のストック溶液(10μL、20μL、30μL、40μL、50μL及び70μL)でコーティングし、空気中、27℃で6時間置いた。次いでこれらのウェルに脱イオン水を加えた。24時間後、ウェルから水を完全に除去し、さらなる分析用に保存した。次いでポリスチレンプレートを乾燥空気流下で乾燥した。その間、対照試料を、水に浸漬させずに同じ方法で調製した。
【0233】
沈降アッセイ
コーティングを、フジツボキプリド沈降アッセイを用いて防汚効果について試験した。キプリドを上記のようにして培養した。5日後キプリドを得、これらを4℃で2日間エイジングし、次いで沈降実験を行った。実験のため、キプリドを、20〜40のエイジングしたキプリドを含む1mlろ過海水を各ウェルに移して加えた。マルチウェルプレートを24時間インキュベートし、次いで、沈降したキプリドの数、自由に遊泳している(沈降していない)キプリドの数及び死滅キプリドの数を各ウェルについて計数した。
【0234】
アッセイの結果を図1に示す。すべての処理について、キプリド死滅率は10%未満であった。対照コーティング、P(MMA−co−tBA−co−VP)についての沈降は、コーティングしていないポリスチレンの場合と同様であった。P(MMA−co−16.11−co−VP)でコーティングされたウェルはキプリド沈降の減少を示しており、>40μlでの処理では、沈降は観察されなかった。
【0235】
HPLCによる定量化
24時間浸漬させた後に得られた一定分量の溶液を既知容積の内部標準と混合し、HPLC装置に直接注入し、226nmでモニターした。浸漬後に得られた溶液中へ放出された16.5の量を、放出速度の計算値と一緒に以下の表3に示す。それぞれの場合、放出された16.5の量は非常に狭い範囲内に入る(0.15〜0.45μg)。これは、それぞれの場合、ポリマーの量に関係なく、同じような表面積が水性環境に曝露されていることを表している。
【0236】
【表8】

【0237】
図1は、コーティングされたウェルにおけるフジツボの沈降の平均パーセンテージを示す。P(MMA−co−tBA−co−VP)を対照コーティングとして塗布した。このコーティング上への沈降は、コーティングされていないポリスチレンについてと同様であった。P(MMA−co−16.11−co−VP)の量を増大させると、フジツボ沈降は減少する結果となった。>40μlでの試験処理では沈降は認められなかった。すべての処理において、キプリド死滅率は10%未満であった。
【0238】
ポリマーからの活性化合物16.5の首尾よい放出に続いて、ポリマーから化合物16.11が加水分解されて、溶液中に化合物16.5を放出することについて分析を実施した。
【0239】
実験室分析のためのコーティングバイアルの調製
12mmの内径を有するガラス製バイアルの内側底部を粗いサンドペーパーでつや消し処理し、次いで、コポリマーの存在量がそれぞれ500μg及び2500μgのP(MMA−co−16.11−co−VP)となり、1.13cm2の表面積を覆うように、エタノール中のP(MMA−co−16.11−co−VP)のストック溶液を播種した。バイアルを終夜かけてキュアリングし、次いで2mLの脱イオン水を各ウェルに加えた。24時間後、水を除去し2mLの新鮮な脱イオン水で置き換えた。さらに24時間後、またさらに48時間後、すなわち1日、2日及び4日の時間的経過でこれを繰り返した。集めた溶液の一定分量を、226nmでの応答比をモニタリングしながら、内部標準(フェノール)に対して実行した。指定された時間点での得られた放出16.5の質量を表4に示す。
【0240】
それぞれの場合、水の中の16.5の存在が、分析用HPLC−ESIによる一定分量の分析により確認された。
【表9】

【0241】
最初の4日間での平均放出速度を表5に示す。500μgと2500μgをコーティングしたバイアルの1日目での際立った放出速度の差(それぞれ0.468μg cm2日−1及び0.045μg cm2日−1)は、放出試験開始時のコーティング表面粗度の差を反映している。1日目の後では、放出速度の収束が見られ、この放出レベルはこの後6日間にわたって同程度のレベルで維持されている。
【表10】

【0242】
参照
本発明、及び本発明が関係する現況技術をより完全に説明し開示するために、いくつかの特許及び出版物を上記に引用している。これらの文献の全引用を以下に示す。これらの文献のそれぞれを、それぞれの個別的参照が具体的且つ個別的に参照により組み込んで示されているかのように同じ程度に、全体として参照により本開示に組み込む。
Armarego, W.L.F.; C.L.L. Chai. 2003.Purification of Laboratory Chemicals; 5th ed.; Butterwortth-Heinemann: Sydney.
Brar, A. S. and R. Kumar. "Investigationof Microstructure of the A/-Vinyl-2-pyrrolidone/Methyl Methacrylate Copolymersby NMR Spectroscopy" Inc. J AppI Polym Sci 85: 1328-1336, 2002.
Libermann H. R. "Estimating LD50using the probit technique: a basic computer program" Drug Chem. Toxicol1983, 6, 1 11-1 16.
Pitombo F. B. 2004. Phylogenetic analysisof the Balanidae (Cirripedia, Balanomorpha). Zool. Scr. 33: 261-276.
Rittschof D.; Clare, A. S.; Gerhart, D. J.;Avelin, M. Sr.; Bonaventura, J. "Barnacle in-vitro assays for biologicallyactive substances: toxicity and settlement inhibition assays using masscultured Balanus amphitrite amphitrite Darwin" Biofouling 1992, 6, 115-122.
Rittschof D.; Branscomb, E.; Costlow, J. "Settlementand behavior in relation to flow and surface in larval barnacles, Balanusamphitrite Darwin" J. Exp. Mar. Biol. Ecol. 1984, 82, 131-146.
Teo, L. M. S., D. Rittschof, F. Jameson, C.Chai, C. L. Chen, S. C. Lee. Antifouling compounds for use in marineenvironment. PCT Int. Appl. (2009),
WO2009139729 A1 .
Voulvoulis, N. "Antifouling paintbooster biocides: occurrence and partitioning in water and sediments" In:Konstantinou, I. K. (ed). Antifouling Paint Biocides. The Handbook ofEnvironmental Chemistry, 2006, Volume 5, Part O, pp.155-170. Springer-VerlagBerlin-Heidelberg.
フォームの始まり
フォームの終わり
【特許請求の範囲】
【請求項1】
式(I)の化合物、
【化1】

(式中、
R1及びR2はそれぞれ独立に、
(A)OH、RS1OH、ORS2、RS1ORS2、OC(O)H、OC(O)RS2、RS1OC(O)H、RS1OC(O)RS2、C(O)OH、C(O)ORS2、RS1C(O)OH、RS1C(O)ORS2、ORS1OH、ORS1ORS2、ORS1OC(O)H、ORS1OC(O)RS2、ORS1C(O)OH及びORS1C(O)ORS2の少なくとも1つで置換されたアリールであって、
存在する場合、各RS1が独立に、任意選択で置換されたC1〜C5アルキレンであり、
存在する場合、各RS2が独立に、任意選択で置換されたC1〜C5アルキル、C2〜C5アルケニル及びC1〜C5シリル−C1〜C5アルキレンから選択されるアリール、
(B)任意選択で置換されているC3〜C12アルキル
から選択され、
但し、R1及びR2の少なくとも1つは(A)であり、
R3及びR4はそれぞれ独立に、任意選択で置換されたC1〜C6アルキルであるか、又はR3とR4は一緒になって、それらが結合している窒素を組み込んだ任意選択で置換された5〜12員複素環を形成している)
又はその塩。
【請求項2】
(i)R3とR4が一緒になってそれらが結合している窒素を組み込んだ、式(II):
【化2】

(式中、R5及びR6は独立に、ヒドロキシル、任意選択で置換されたC1〜C6アルキル、任意選択で置換されたフェニル及びHから選択される)
による任意選択で置換された6員複素環を形成しているか、又は
(ii)R3及びR4のそれぞれが独立に任意選択で置換されたC1〜C6アルキルから選択される、
請求項1に記載の化合物。
【請求項3】
選択肢(i)に関してR5及びR6のそれぞれがHであり、選択肢(ii)に関してR3及びR4のそれぞれがMeである、請求項2に記載の化合物。
【請求項4】
R1が(B)であり、R2が
【化3】

(式中、
RA1、RA2、RA3、RA4及びRA5はそれぞれ独立に、OH、RS1OH、ORS2、RS1ORS2、OC(O)H、OC(O)RS2、RS1OC(O)H、RS1OC(O)RS2、C(O)OH、C(O)ORS2、RS1C(O)OH、RS1C(O)ORS2、ORS1OH、ORS1ORS2、ORS1OC(O)H、ORS1OC(O)RS2、ORS1C(O)OH、ORS1C(O)ORS2、H及びRS2から選択され、
存在する場合、各RS1は独立に、任意選択で置換されたC1〜C5アルキレンであり、
存在する場合、各RS2は独立に、任意選択で置換されたC1〜C5アルキル、C2〜C5アルケニル及びC1〜C5アルキルシリル−C1〜C5アルキレンから選択され、
但し、RA1、RA2、RA3、RA4及びRA5の少なくとも1つはHでもなくRS2でもない)
である、請求項1〜3のいずれか一項に記載の化合物。
【請求項5】
R1がC4アルキル又はC6アルキルである、請求項1〜4のいずれか一項に記載の化合物。
【請求項6】
前記化合物が式(III)又は式(IV)の化合物
【化4】

(式中、
RA1、RA2、RA3、RA4及びRA5はそれぞれ独立に、OH、RS1OH、ORS2、RS1ORS2、OC(O)H、OC(O)RS2、RS1OC(O)H、RS1OC(O)RS2、C(O)OH、C(O)ORS2、RS1C(O)OH、RS1C(O)ORS2、ORS1OH、ORS1ORS2、ORS1OC(O)H、ORS1OC(O)RS2、ORS1C(O)OH、ORS1C(O)ORS2、H及びRS2から選択され、
存在する場合、各RS1は独立に、任意選択で置換されたC1〜C5アルキレンであり、
存在する場合、各RS2は独立に、任意選択で置換されたC1〜C5アルキル、C2〜C5アルケニル及びC1〜C5アルキルシリル−C1〜C5アルキレンから選択され、
但し、RA1、RA2、RA3、RA4及びRA5の少なくとも1つはHでもなくRS2でもない)
である、請求項1〜3のいずれか一項に記載の化合物。
【請求項7】
存在する場合、各RS1が独立に、任意選択で置換されたC1〜C3アルキレンであり、存在する場合、各RS2が独立に、任意選択で置換されたC1〜C3アルキル、C2〜C3アルケニル及びC1〜C3アルキルシリル−C1〜C3アルキレンから選択される、請求項1〜6のいずれか一項に記載の化合物。
【請求項8】
R1が(B)であり、R2が
【化5】

(式中、RA1、RA2、RA3、RA4及びRA5はそれぞれ独立に、OH、OMe、C(O)OH、CH2OH、CH2OAc、OC(O)CH3、OCH2C(O)OH、OCH2C(O)OCH3、OCH2CH2OH、OCH2CH2OC(O)CH3、OCH2CH2Si(Me)3、OC(O)CH=CH2及びHから選択され、
但し、RA1、RA2、RA3、RA4及びRA5の少なくとも1つはHではない)
である、請求項1〜3のいずれか一項に記載の化合物。
【請求項9】
RA1、RA2、RA3、RA4及びRA5の少なくとも2つがHである、請求項8に記載の化合物。
【請求項10】
RA1、RA2、RA3、RA4及びRA5の少なくとも3つがHである、請求項8に記載の化合物。
【請求項11】
前記化合物が、化合物15.1、15.2、15.3、15.4、15.5、15.6、15.7、16.1、16.2、16.3、16.4、16.5、16.6、16.7、16.8、16.9、16.10、16.11、17.1、17.2、17.3、17.4、17.5、17.6、17.7、17.8及び17.9から選択される、請求項1に記載の化合物。
【請求項12】
請求項1〜11のいずれか一項に記載の化合物から形成された少なくとも1つの繰り返し単位を含むポリマー。
【請求項13】
前記ポリマーが、(メタ)アクリレートポリマー及びシリコーンポリマーから選択される、請求項12に記載のポリマー。
【請求項14】
前記ポリマーが(メタ)アクリレートポリマーであり、メチルメタクリレート(MMA)、ヒドロキシエチルアクリレート(HEA)及びビニルピロリジノン(VP)の1つ又は複数から誘導される繰り返し単位を含む、請求項13に記載のポリマー。
【請求項15】
式X
【化6】

(式中、
R1は任意選択で置換されたC3〜C12アルキルであり、
R3及びR4はそれぞれ独立に、任意選択で置換されたC1〜C6アルキルであるか、又はR3とR4は一緒になってそれらが結合している窒素を組み込んだ任意選択で置換された5〜12員複素環を形成しており、
各RAXは独立に、請求項1〜11のいずれか一項に記載のRA1〜RA5のいずれか1つのための選択肢から選択され、
nは0〜4の範囲の整数であり、
RLは連結基である)
によるペンダント基を含む、請求項12〜14のいずれか一項に記載のポリマー。
【請求項16】
RLが、−O−、RL1O、ORL2、RL1ORL2、OC(O)、OC(O)RL2、RL1OC(O)、RL1OC(O)RL2、C(O)O、C(O)ORL2、RL1C(O)O、RL1C(O)ORL2、ORL1O、ORL1ORL2、ORL1OC(O)、ORL1OC(O)RL2、ORL1C(O)O及びORL1C(O)ORL2から選択され、
存在する場合、各RL1は独立に、任意選択で置換されたC1〜C5アルキレンであり、
存在する場合、各RL2は独立に、任意選択で置換されたC1〜C5アルキレンである、
請求項15に記載のポリマー。
【請求項17】
請求項1〜16のいずれか一項に記載の化合物又はポリマーを含む防汚コーティング組成物。
【請求項18】
汚損を減少させる又は防止する方法における、請求項1〜17のいずれか一項に記載の化合物、ポリマー又はコーティング組成物の使用。
【請求項19】
汚損を減少させる又は防止する前記方法が、細菌、真菌、藻類及び原生動物の1つ又は複数による生物膜形成を減少させる又は防止する方法である、請求項18に記載の使用。
【請求項1】
式(I)の化合物、
【化1】

(式中、
R1及びR2はそれぞれ独立に、
(A)OH、RS1OH、ORS2、RS1ORS2、OC(O)H、OC(O)RS2、RS1OC(O)H、RS1OC(O)RS2、C(O)OH、C(O)ORS2、RS1C(O)OH、RS1C(O)ORS2、ORS1OH、ORS1ORS2、ORS1OC(O)H、ORS1OC(O)RS2、ORS1C(O)OH及びORS1C(O)ORS2の少なくとも1つで置換されたアリールであって、
存在する場合、各RS1が独立に、任意選択で置換されたC1〜C5アルキレンであり、
存在する場合、各RS2が独立に、任意選択で置換されたC1〜C5アルキル、C2〜C5アルケニル及びC1〜C5シリル−C1〜C5アルキレンから選択されるアリール、
(B)任意選択で置換されているC3〜C12アルキル
から選択され、
但し、R1及びR2の少なくとも1つは(A)であり、
R3及びR4はそれぞれ独立に、任意選択で置換されたC1〜C6アルキルであるか、又はR3とR4は一緒になって、それらが結合している窒素を組み込んだ任意選択で置換された5〜12員複素環を形成している)
又はその塩。
【請求項2】
(i)R3とR4が一緒になってそれらが結合している窒素を組み込んだ、式(II):
【化2】

(式中、R5及びR6は独立に、ヒドロキシル、任意選択で置換されたC1〜C6アルキル、任意選択で置換されたフェニル及びHから選択される)
による任意選択で置換された6員複素環を形成しているか、又は
(ii)R3及びR4のそれぞれが独立に任意選択で置換されたC1〜C6アルキルから選択される、
請求項1に記載の化合物。
【請求項3】
選択肢(i)に関してR5及びR6のそれぞれがHであり、選択肢(ii)に関してR3及びR4のそれぞれがMeである、請求項2に記載の化合物。
【請求項4】
R1が(B)であり、R2が
【化3】

(式中、
RA1、RA2、RA3、RA4及びRA5はそれぞれ独立に、OH、RS1OH、ORS2、RS1ORS2、OC(O)H、OC(O)RS2、RS1OC(O)H、RS1OC(O)RS2、C(O)OH、C(O)ORS2、RS1C(O)OH、RS1C(O)ORS2、ORS1OH、ORS1ORS2、ORS1OC(O)H、ORS1OC(O)RS2、ORS1C(O)OH、ORS1C(O)ORS2、H及びRS2から選択され、
存在する場合、各RS1は独立に、任意選択で置換されたC1〜C5アルキレンであり、
存在する場合、各RS2は独立に、任意選択で置換されたC1〜C5アルキル、C2〜C5アルケニル及びC1〜C5アルキルシリル−C1〜C5アルキレンから選択され、
但し、RA1、RA2、RA3、RA4及びRA5の少なくとも1つはHでもなくRS2でもない)
である、請求項1〜3のいずれか一項に記載の化合物。
【請求項5】
R1がC4アルキル又はC6アルキルである、請求項1〜4のいずれか一項に記載の化合物。
【請求項6】
前記化合物が式(III)又は式(IV)の化合物
【化4】

(式中、
RA1、RA2、RA3、RA4及びRA5はそれぞれ独立に、OH、RS1OH、ORS2、RS1ORS2、OC(O)H、OC(O)RS2、RS1OC(O)H、RS1OC(O)RS2、C(O)OH、C(O)ORS2、RS1C(O)OH、RS1C(O)ORS2、ORS1OH、ORS1ORS2、ORS1OC(O)H、ORS1OC(O)RS2、ORS1C(O)OH、ORS1C(O)ORS2、H及びRS2から選択され、
存在する場合、各RS1は独立に、任意選択で置換されたC1〜C5アルキレンであり、
存在する場合、各RS2は独立に、任意選択で置換されたC1〜C5アルキル、C2〜C5アルケニル及びC1〜C5アルキルシリル−C1〜C5アルキレンから選択され、
但し、RA1、RA2、RA3、RA4及びRA5の少なくとも1つはHでもなくRS2でもない)
である、請求項1〜3のいずれか一項に記載の化合物。
【請求項7】
存在する場合、各RS1が独立に、任意選択で置換されたC1〜C3アルキレンであり、存在する場合、各RS2が独立に、任意選択で置換されたC1〜C3アルキル、C2〜C3アルケニル及びC1〜C3アルキルシリル−C1〜C3アルキレンから選択される、請求項1〜6のいずれか一項に記載の化合物。
【請求項8】
R1が(B)であり、R2が
【化5】

(式中、RA1、RA2、RA3、RA4及びRA5はそれぞれ独立に、OH、OMe、C(O)OH、CH2OH、CH2OAc、OC(O)CH3、OCH2C(O)OH、OCH2C(O)OCH3、OCH2CH2OH、OCH2CH2OC(O)CH3、OCH2CH2Si(Me)3、OC(O)CH=CH2及びHから選択され、
但し、RA1、RA2、RA3、RA4及びRA5の少なくとも1つはHではない)
である、請求項1〜3のいずれか一項に記載の化合物。
【請求項9】
RA1、RA2、RA3、RA4及びRA5の少なくとも2つがHである、請求項8に記載の化合物。
【請求項10】
RA1、RA2、RA3、RA4及びRA5の少なくとも3つがHである、請求項8に記載の化合物。
【請求項11】
前記化合物が、化合物15.1、15.2、15.3、15.4、15.5、15.6、15.7、16.1、16.2、16.3、16.4、16.5、16.6、16.7、16.8、16.9、16.10、16.11、17.1、17.2、17.3、17.4、17.5、17.6、17.7、17.8及び17.9から選択される、請求項1に記載の化合物。
【請求項12】
請求項1〜11のいずれか一項に記載の化合物から形成された少なくとも1つの繰り返し単位を含むポリマー。
【請求項13】
前記ポリマーが、(メタ)アクリレートポリマー及びシリコーンポリマーから選択される、請求項12に記載のポリマー。
【請求項14】
前記ポリマーが(メタ)アクリレートポリマーであり、メチルメタクリレート(MMA)、ヒドロキシエチルアクリレート(HEA)及びビニルピロリジノン(VP)の1つ又は複数から誘導される繰り返し単位を含む、請求項13に記載のポリマー。
【請求項15】
式X
【化6】

(式中、
R1は任意選択で置換されたC3〜C12アルキルであり、
R3及びR4はそれぞれ独立に、任意選択で置換されたC1〜C6アルキルであるか、又はR3とR4は一緒になってそれらが結合している窒素を組み込んだ任意選択で置換された5〜12員複素環を形成しており、
各RAXは独立に、請求項1〜11のいずれか一項に記載のRA1〜RA5のいずれか1つのための選択肢から選択され、
nは0〜4の範囲の整数であり、
RLは連結基である)
によるペンダント基を含む、請求項12〜14のいずれか一項に記載のポリマー。
【請求項16】
RLが、−O−、RL1O、ORL2、RL1ORL2、OC(O)、OC(O)RL2、RL1OC(O)、RL1OC(O)RL2、C(O)O、C(O)ORL2、RL1C(O)O、RL1C(O)ORL2、ORL1O、ORL1ORL2、ORL1OC(O)、ORL1OC(O)RL2、ORL1C(O)O及びORL1C(O)ORL2から選択され、
存在する場合、各RL1は独立に、任意選択で置換されたC1〜C5アルキレンであり、
存在する場合、各RL2は独立に、任意選択で置換されたC1〜C5アルキレンである、
請求項15に記載のポリマー。
【請求項17】
請求項1〜16のいずれか一項に記載の化合物又はポリマーを含む防汚コーティング組成物。
【請求項18】
汚損を減少させる又は防止する方法における、請求項1〜17のいずれか一項に記載の化合物、ポリマー又はコーティング組成物の使用。
【請求項19】
汚損を減少させる又は防止する前記方法が、細菌、真菌、藻類及び原生動物の1つ又は複数による生物膜形成を減少させる又は防止する方法である、請求項18に記載の使用。
【図1】




【公表番号】特表2013−518877(P2013−518877A)
【公表日】平成25年5月23日(2013.5.23)
【国際特許分類】
【出願番号】特願2012−551951(P2012−551951)
【出願日】平成23年2月2日(2011.2.2)
【国際出願番号】PCT/SG2011/000052
【国際公開番号】WO2011/096897
【国際公開日】平成23年8月11日(2011.8.11)
【出願人】(503231882)エージェンシー フォー サイエンス,テクノロジー アンド リサーチ (179)
【出願人】(509034605)ナショナル ユニバーシティ オブ シンガポール (4)
【出願人】(510284059)
【Fターム(参考)】
【公表日】平成25年5月23日(2013.5.23)
【国際特許分類】
【出願日】平成23年2月2日(2011.2.2)
【国際出願番号】PCT/SG2011/000052
【国際公開番号】WO2011/096897
【国際公開日】平成23年8月11日(2011.8.11)
【出願人】(503231882)エージェンシー フォー サイエンス,テクノロジー アンド リサーチ (179)
【出願人】(509034605)ナショナル ユニバーシティ オブ シンガポール (4)
【出願人】(510284059)

【Fターム(参考)】
[ Back to top ]

