定量分析方法及び検出用カートリッジ
【課題】簡便に、比較的短い分析時間で、しかもバックグラウンドノイズを小さくして高い感度で生化学物質等の分析を可能とする定量分析方法を得る。
【解決手段】被検出物質を含む被検液が供給される主流路8と、該主流路8の途中に設けられた貯留部16と、前記主流路8において前記貯留部16よりも下流側に設けられた検出部18とを備える検出用カートリッジ1を用いた定量分析方法であって、前記貯留部16において、金属ナノ粒子で標識された分子認識試薬と前記被検出物質の会合体を濃縮するとともに、残液を検出部18に至らないように廃液する工程と、前記会合体に結合されている前記金属ナノ粒子を溶解し、金属イオン溶液を得る工程と、前記金属イオン溶液を前記検出部18に搬送する工程と、前記検出部18において、前記金属イオン濃度を測定し、金属イオン濃度に応じた前記被検出物質濃度を定量する工程とを備える、定量分析方法。
【解決手段】被検出物質を含む被検液が供給される主流路8と、該主流路8の途中に設けられた貯留部16と、前記主流路8において前記貯留部16よりも下流側に設けられた検出部18とを備える検出用カートリッジ1を用いた定量分析方法であって、前記貯留部16において、金属ナノ粒子で標識された分子認識試薬と前記被検出物質の会合体を濃縮するとともに、残液を検出部18に至らないように廃液する工程と、前記会合体に結合されている前記金属ナノ粒子を溶解し、金属イオン溶液を得る工程と、前記金属イオン溶液を前記検出部18に搬送する工程と、前記検出部18において、前記金属イオン濃度を測定し、金属イオン濃度に応じた前記被検出物質濃度を定量する工程とを備える、定量分析方法。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、イムノアッセイを利用し、抗原、抗体、アレルゲン、菌体、ウイルス、薬物、DNA付加体など様々な生化学的物質等を定量するのに用いられる定量分析方法に関し、より詳細には、微量の被検液が流される流路を有する検出用カートリッジを用いた定量分析方法、試薬及び検出用カートリッジに関する。
【背景技術】
【0002】
従来、様々なアレルゲンや生化学的物質を定量するに際し、これらの生化学的物質をより高い感度で定量することが強く求められている。例えば、数十fg/mL〜数百pg/mLのような非常に低濃度の被検液から被検出物質を測定する場合、次のようにするのが常套手段である。すなわち、先ず、被検液から被検出物質を固相抽出処理し、濃縮物を得る。次にこの濃縮物を、液体クロマトグラフィー装置または電気泳動装置に供給し定量する方法、あるいはこの濃縮物を用いてELISA法で定量する方法などが用いられている。しかしながら、これらの方法では固相抽出処理等の濃縮するための前処理に時間がかかり、全分析時間として数時間から数日と非常に長い時間を要した。
【0003】
他方、次々と発見されるバイオマーカーの展開医療における実用化のためには、被検出物質を高感度かつ迅速にその場で定量分析することが求められてきている。このようなニーズに応えるために、イムノクロマト法や比色法を利用した簡易定量検査チップが開発されている。しかしながら、この種の簡易定量検査チップの感度は、0.1ng/mL程度が限界であった。すなわち、より微量の被検出物質を高精度に測定することはできなかった。
【0004】
下記の特許文献1には、土壌からの水溶出液中の重金属のような微量成分を携帯可能なカートリッジ式検出装置を用いて高感度に検出する装置及び方法が開示されている。特許文献1に記載のカートリッジ式検出装置では、内部に流路が形成されている検出用カートリッジが用いられる。この検出用カートリッジ内において、流路の途中に貯留部が設けられており、貯留部より下流側に検出部が設けられている。被検液中の被検出物質を貯留部において貯留し、貯留部で一旦濃縮する。しかる後、濃縮された被検出物質を再度溶離液を用いて溶出させ、検出部に供給する。検出部において、改めて溶出された被検出物質の濃縮液に含まれる金属イオン濃度を測定することにより、土壌からの水溶出液中の重金属などの微量成分を1ppb程度の高感度で検出することが可能とされている。
【0005】
なお、特許文献1では、貯留部において、抗原または抗体が固定された構成についても言及されており、標識酵素による還元物質を検出部で測定してもよい旨が記載されている。これは、従来のELISA法と同様の方法を実現するための構成である。
【0006】
他方、下記の特許文献2には、例えば生物試料などの試料中の金属でラベルされた化学種の金属を可溶性の電気化学的に活性な錯体とし、該錯体を溶解し、錯イオンを電気化学的に測定し、金属ラベルされた化学種の存在または量を測定する方法が開示されている。特許文献2の実施例4では、ポリスチレン基板上に流路及び電極を有する検出部等が構成された装置が用いられている。ラテックスラベルされた抗体と銀ラベルされた抗体と抗原とを混合し、得られた混合物溶液を流路に供給し、流路の途中に設けたフィルタ領域に設けられたフィルタに導いている。このフィルタにおいて、ラテックスラベルされた抗体−分析物−銀ラベルされた抗体錯体が捕捉される。また、未結合の銀ラベルされた抗体がフィルタを通過する。次に、捕捉された化学種を洗浄し、残存する未結合の銀ラベルされた抗体を除き、捕捉された化学種を錯化剤を添加して錯イオン化する。このようにして得られた錯イオンの濃度が検出部により検出されている。ここでは、上記フィルタに化学種を捕捉させるに際し、上記混合物溶液をフィルタの面方向に供給している。
【先行技術文献】
【特許文献】
【0007】
【特許文献1】特許第4053081号公報
【特許文献2】WO2005/121792号公報
【特許文献3】WO2002/001178号公報
【発明の概要】
【発明が解決しようとする課題】
【0008】
特許文献1に開示されているカートリッジ式検出装置では、上記のように、被検出物質を酵素で標識し、標識酵素による還元物質を測定することにより、被検出物質が定量され得ると述べられている。しかしながら、酵素を利用したこのような増幅方法を用いた場合、酵素による反応が温度により影響を受けやすくまた、保管履歴により酵素の活性が変化しやすい。従って、測定温度のばらつきや保管履歴のばらつき等により、被検出物質を高精度に測定することはできなかった。
【0009】
特許文献2に記載の分析方法では、Agに錯化剤を添加し、Ag錯体を形成し、最終的にAg錯イオン濃度を計測している。Ag錯イオンは、Agイオンに比べて電気活性が高いため、バックグラウンドノイズが高くなるという問題がある。すなわち、SN比が低下し、感度を高めることができない。加えて、上記フィルタ領域においては、ストリップ状のフィルタの上面に該上面の面方向に混合物溶液が供給されるため、未反応成分や夾雑物が電極に付着し、それによってもSN比が低下するという問題がある。
【0010】
本発明の目的は、上述した従来技術の現状に鑑み、微量な被検出物質をより一層高い感度で、かつ比較的短い時間で定量することができ、しかも、測定温度の影響や保管履歴による影響を受け難い、定量分析方法、試薬及び検出用カートリッジを提供することにある。
【課題を解決するための手段】
【0011】
本発明によれば、上記課題を達成するために、被検出物質を含む被検液が供給される主流路と、該流路の途中に設けられた貯留部と、前記流路において前記貯留部よりも下流側に設けられた検出部とを備える検出用カートリッジを用いた定量分析方法であって、前記貯留部において、金属ナノ粒子で標識された分子認識試薬と前記被検出物質の会合体とを濃縮担持し、かつ残液を検出部に至らないように廃液する工程と、前記会合体に含まれる前記金属ナノ粒子を溶解し、金属イオン溶液を得る工程と、前記金属イオン溶液を前記検出部に搬送する工程と、前記検出部において、前記金属イオン濃度を測定し、金属イオン濃度に応じた前記被検出物質濃度を定量する工程とを備える、定量分析方法が提供される。
【0012】
本発明において、上記貯留部は、イムノアッセイに代表される分子特異的結合反応を短時間化するため並びに前記イムノアッセイに代表される分子特異的結合反応を通じて会合体に含まれる金属ナノ粒子の濃縮及び洗浄を行うための足場を与えるものである。
【0013】
分子特異的結合反応を短時間化することができるのは、イムノアッセイに代表される分子特異的結合反応が拡散律速であり、反応場がカートリッジの貯留部内においてマイクロ空間に限定されていて拡散距離が短いことによる。拡散律速反応においては、反応が飽和するまでに要する時間は、反応空間の距離の自乗に反比例する。例えば、4ミリのウェルと40μmの空間とでは、凡そ一万倍反応が早くなる。
【0014】
上記貯留部において、表面積が大きな多孔質上に被検出物質と分子認識試薬との会合体が濃縮される。更に、濃縮された会合体中の分子認識試薬を標識している金属ナノ粒子を溶解することにより、金属イオン溶液が得られる。この金属イオン溶液は、会合体が濃縮されたものである効果と、ひとつの金属ナノ粒子から数千数万のイオンを生じる効果とによって、もとの被検液中の被検出物質の濃度に比べて、100倍〜10000倍の濃度に変換された金属イオン溶液を与える。したがって、極低濃度の被検出物質濃度であっても、貯留部で濃縮された標識金属ナノ粒子由来の高濃度に変換された金属イオンが検出部において定量される。検出部で測定された金属イオン濃度は、被検液中の被検出物質の濃度に比例している。この金属イオン濃度を被検出物質の濃度に換算することにより、被検出物質を定量することができる。
【0015】
本発明のある特定の局面では、前記貯留部に、前記被検出物質に対して特異的に結合する特異的結合分子が予め固定されており、前記被検出物質を含む被検液を貯留部に導入することにより、前記被検出物質を前記特異的結合分子が会合し、前記貯留部において、前記被検出物質が濃縮され、前記金属ナノ粒子で標識された前記分子認識試薬が前記貯留部に導入されることにより、金属ナノ粒子で標識された前記分子認識試薬と前記被検出物質との会合体が、前記貯留部に濃縮貯留される工程が含まれる。この場合には、貯留部に上記特異的結合分子が予め固定されているので、被検出物質を含む被検液が貯留部に導入されると、被検出物質と特異的結合分子の会合体が貯留部に固定されることになる。従って、貯留部において、被検出物質が確実に濃縮される。従って、金属ナノ粒子で標識された分子認識試薬を貯留部に導入すれば、金属ナノ粒子で標識された分子認識試薬と上記被検出物質との会合体が貯留部に濃縮され、かつ貯留される。
【0016】
本発明の定量分析方法の他の特定の局面では、前記貯留部に多孔体が予め配置されており、前記濃縮貯留に際し、前記被検出物質を含む被検液と、前記金属ナノ粒子で標識された分子認識試薬と、前記被検出物質に対して特異的に結合する特異的結合分子が固定されたビーズ等を混合することにより得られた凝集物を含む懸濁液を前記流路を通じて前記貯留部に導入し、金属ナノ粒子で標識された前記分子認識試薬と前記被検出物質の会合体を含む凝集物を前記貯留部において濃縮貯留する工程とが含まれる。この場合には、被検出物質を含む被検液と、上記金属ナノ粒子で標識された分子認識試薬と、上記特異的結合分子が固定されたビーズとの混合物が懸濁液として貯留部に導かれるので、懸濁液中において各成分が速やかに拡散し、拡散律速である反応が早く簡潔することとなる。よって、分析時間をより一層短縮することができる。
【0017】
本発明に係る定量分析方法のさらに他の局面では、前記濃縮貯留後に、前記貯留部に洗浄液を導く工程がさらに備えられる。洗浄液の貯留部への導入により洗浄を行うことで、上記会合体に取り込まれていない未反応の分子認識試薬を除き、かつ、後続の金属イオンの検出において検出を邪魔する夾雑物を貯留部から容易に除去することができる。それによって、測定のバックグラウンドを下げることができ、有効な検出シグナルとノイズの比であるS/N比を高めることができる。
【0018】
また、本発明の定量分析方法のさらに別の特定の局面では、前記会合体に結合されている前記金属ナノ粒子を溶解し、金属イオン溶液を得る工程が、溶離液として酸を加える工程を含む。この場合には、酸を導入することにより、会合体に取り込まれている金属ナノ粒子を速やかに溶解し、被検出物質の濃度に応じた金属イオンを溶出し、金属イオン溶液として検出部に速やかに搬送することができる。
【0019】
本発明に係る定量分析方法のさらに別の特定の局面では、上記ビーズとして、ポリマー粒子が用いられる。ポリマー粒子として、上記貯留部に固定されている多孔体の網目よりも大きいポリマー粒子を用いたり、あるいは1つのポリマー粒子が複数の特異的結合分子を介して被検出物質並びに金属ナノ粒子で標識された分子認識試薬とネットワークを形成したりすることにより、濾過可能な会合体もしくは凝集体を与えることができる。すなわち、上記のようにポリマー粒子を用いることにより、濾過を効率良く行うことができる。
【0020】
もっとも、本発明においては、上記ビーズとして、少なくとも最表面が金属である粒子を用いてもよい。この場合には、金属ナノ粒子で標識された分子認識試薬以外にも、金属成分が測定系中に存在することとなるため、同じ貯留部を用いた場合において、より大きなシグナル増幅率を得ることができる。貯留部に、上記金属ナノ粒子よりも表面積が大きな、最表面が金属である粒子を用いた場合は、より大きな信号増幅率を得ることができる。最表面が金属である粒子の金属種は、金属ナノ粒子を構成する金属種と必ずしも同じでなくてもよい。還元電位が近くとも、検出部でアノーディック ストリッピング ボルタンメトリのような方法を用いることにより、それぞれを定量できる。
【0021】
本発明に係る定量分析方法のさらに他の特定の局面では、上記金属ナノ粒子として、カドミウムセレン(CdSe)、カドミウムテルル(CdTe)、または銀(Ag)からなる金属ナノ粒子が用いられる。ナノスケールのCdSe、CdTeやAgは、酸により速やかに溶解し、カドミウムイオン(Cd2+)及び銀イオン(Ag+)を与える。カドミウムイオン及び銀イオンは、比較的容易にかつ速やかに定量することができる。
【0022】
本発明に係る定量分析方法のさらに別の特定の局面では、前記検出部に、前記金属イオンを検出するための電気化学的電極が配置されており、金属イオン濃度の検出に際し、前記電気化学的電極上へ電気化学的に金属を析出させ、ついで、電位を掃引してストリッピング電流を測定する。このような電気化学的電極を含む検出部の場合には、嵩張る光学系が必要ないため、測定装置の小型化を進めることができる。また、電気化学的電極は、三極式、四極式または二極式のいずれであってもよいが、アノードに金属を析出させた状態で洗浄することにより、夾雑物の影響を低減することができる。また、電位を掃引しつつ電流を測定するため、電流のピーク位置により夾雑イオン種のシグナルと目的の金属イオンのシグナルとを区別することができる。従って、有意の測定シグナルとノイズの比であるS/N比をより一層高めることができる。
【0023】
本発明に係る定量分析方法のさらに別の特定の局面では、前記金属ナノ粒子が溶解された金属イオン溶液に硫化物イオンを加えることにより生じる非水溶性の硫化物塩の懸濁液を前記検出部において光学的に検出することにより、前記金属イオン濃度を定量する方法が用いられる。この場合には、光学的手段により、非接触で金属イオン濃度を容易にかつ速やかに定量することができる。従って、周知の吸光度測定法、反射光測定法あるいは光導波路を利用した測定法などを適用することにより、金属イオン濃度を速やかにかつ高精度に検出することができる。特に、カドミウムイオンや銀イオンのような重金属イオンの場合には、ローソン試薬やラヴェッソン試薬のような硫化剤を硫化イオンとして加え、非水溶性の硫化物塩として析出させて懸濁液とすることにより、光学的手法により、容易に金属イオン濃度を測定することができ好ましい。
【0024】
本発明に係る検出用カートリッジは、前記被検出物質を含む被検液が供給される主流路と、該主流路の途中に設けられた貯留部と、前記流路において前記貯留部よりも下流側に設けられた検出部と、前記第1の貯留部と前記検出部との間において前記主流路に接続されておりかつ前記検出部には接続されていない廃液流路とを備えるカートリッジ本体と、前記貯留部に設けられており、前記被検出物質と、金属ナノ粒子で標識された分子認識試薬との会合体を濃縮貯留する濃縮担持体と、前記検出部に設けられており、前記被検出物質の濃度に応じた金属イオン濃度を測定し、該金属イオン濃度に応じた被検出物質濃度を定量するための検出手段とを備える。
【0025】
本発明に係る検出用カートリッジのある特定の局面では、前記貯留部と前記検出部との間において前記主流路と前記廃液流路とに接続されており、かつ前記主流路の上流側から移動してきた液体を前記主流路の下流側または前記廃液流路に移動させるように流路を切り換えるバルブがさらに備えられている。この場合には、バルブにより上記のように流路を切り換えることにより、本発明の定量分析方法に従って分析を行うに際し、分子認識試薬と被検出物質の会合体を濃縮担持する工程において残液を検出部に至らないように廃液流路から廃液することができ、金属イオン濃度の測定に際しては、主流路の上流側から移動してきた液体を主流路の下流側に移動させるようにバルブにより流路を切り換えることにより、金属イオン濃度に応じた被検出物質濃度を高精度に定量することができる。好ましくは、前記主流路が、被検出物質及び前記分子認識試薬を流すための第1の流路部分と、前記金属イオン濃度を測定するための第2の流路部分とを有し、前記バルブが上流側に位置する前記第1の流路部分と、下流側に位置する前記第2の流路部分と、前記廃液流路とに接続されている。
【0026】
また、本発明に係る検出用カートリッジのさらに他の特定の局面では、前記バルブが外部からの刺激により流路接続状態を切り換えるバルブである。この場合には、外部からの刺激を与えるだけで、流路接続状態を容易に切り換えることができる。
【0027】
本発明に係る検出用カートリッジのさらに別の特定の局面では、前記濃縮担持体が、多孔性材料またはメッシュ状物である。この場合には、被検出物質を被検液を多孔性材料またはメッシュ状物に大きな面積で接触させることができ、測定感度を高めることができる。このような多孔性材料としては、好ましくは、スポンジ、織布、不織布、繊維、充填された複数の微粒子、多孔性焼結体及びモノリシック多孔質体からなる群から選択した少なくとも1種の多孔質材料が用いられる。
【0028】
本発明に係る検出用カートリッジのさらに別の特定の局面では、前記主流路を移動してきた液体が前記濃縮担持体中を上流側から下流側に向かって通過するように前記主流路及び前記濃縮担持体が設けられている。この場合には、液体が濃縮担持手段中を通過するため、濃縮担持手段と被検出物質を含む被検液との接触面積をより一層高めることができ、それによって測定感度を高めることができる。
【発明の効果】
【0029】
本発明に係る定量分析方法では、カートリッジ内において、金属ナノ粒子で標識された分子認識試薬と被検出物質との免疫反応を通じて被検出物質の濃度に応じた標識物質の濃縮が速やかに行われ、標識物質である金属ナノ粒子が溶出された金属イオン溶液中の金属イオン濃度が被検液中の被検出物質濃度と相関しており、しかも被検出物質に対して高濃度に変換された金属イオンが検出部でのシグナル検出を速やかにかつ非常に高い感度で可能にしている。すなわち、10pg/mL程度の高感度な定量分析を、例えば20分以内のような比較的短時間で完了することが可能となる。
【0030】
また、上記被検出物質と分子認識試薬との会合体を濃縮担持するにあたり、残液が検出部に至らないように廃棄されるため、未反応の試薬や夾雑物を検出部に至らないように廃棄することができる。よって、測定感度を高めることができる。
【0031】
しかも、本発明の定量分析方法では、酵素反応を利用した増幅等を用いておらず、用いる金属ナノ粒子により増幅倍率が明確であるため、測定温度による影響が少なく、また、分析試薬等の保管履歴による影響も受け難い。従って、測定の信頼性を高めることが可能となる。
【0032】
本発明に係る検出用カートリッジによれば、本発明に係る定量分析方法を該検出用カートリッジを用いて行うことができるので、本発明の定量分析方法をスペースに制限のある場所や屋外において容易に行うことができる。しかも、金属ナノ粒子で標識された分子認識試薬と被検出物質の会合体を濃縮担持するに際し、残液を検出部に至らないように廃液流路から廃液することができるので、未反応の試薬や夾雑物が検出部に至らない。従って、測定感度を高めることができる。
【図面の簡単な説明】
【0033】
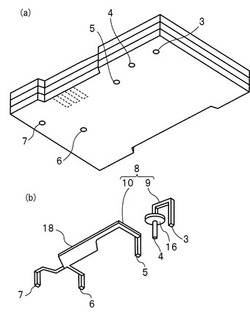
【図1】(a)は、本発明の一実施形態の検出用カートリッジの外観を示す斜視図及び(b)はカートリッジ本体内に構成されている流路と、貯留部及び検出部の関係を示す模式的斜視図である。
【図2】本発明の一実施形態において、検出用カートリッジ内に構成されている流路と、第1の貯留部、検出部等の関係を模式的に示す正面断面図である。
【図3】本発明の一実施形態の検出用カートリッジの分解斜視図である。
【図4】本発明の他の実施形態に係る検出用カートリッジの構造を説明するための分解斜視図である。
【図5】本発明の他の実施形態に係る検出用カートリッジにおける流路接続切り換え機構を説明するための模式図である。
【図6】本発明のさらに他の実施形態に係る検出用カートリッジにおける流路接続切り換え機構を説明するための模式図である。
【図7】(a)及び(b)は、本発明のさらに別の実施形態における検出用カートリッジの流路接続切り換え機構を説明するための各模式図である。
【図8】本発明の実施例1における被検出物質測定結果を示す図である。
【図9】CdSeナノ粒子を用いた実施例1の場合と、Agナノ粒子を用いた実施例2の場合と、電流密度測定結果を重ねて示す図である。
【図10】実施例3において、硝酸濃度を変化させた場合のAgのナノ粒子が溶解して生成したAgイオン由来のピーク電流値と硝酸濃度との関係を示す図である。
【図11】実施例4における被検出物質測定結果を示す図である。
【発明を実施するための形態】
【0034】
以下、本発明の具体的な実施形態を説明しつつ、本発明の詳細を明らかにする。
【0035】
本発明の定量分析方法では、主流路と、主流路の途中に設けられた貯留部と、主流路において貯留部よりを下流側に設けられた検出部とを備える定量分析用カートリッジを用いる。そして、少なくとも、金属ナノ粒子で標識された分子認識試薬と被検出物質との会合体が貯留部において濃縮貯留される工程と、上記会合体に含まれる金属ナノ粒子を溶解し、金属イオン溶液として検出部に搬送する工程とを備える。
【0036】
なお、主流路とは、被検出物質を含む被検液を流し、定量する一連の分析方法を実現する流路すなわち分析用流路を意味する。主流路と表現しているのは、後述の変形例で示す廃液流路と区別するためであることを指摘しておく。
【0037】
前記貯留部は、イムノアッセイに代表される分子特異的結合反応を短時間化すると同時に、濃縮、洗浄を行う足場を与える。拡散律速である分子特異的結合反応の反応場がマイクロ空間とされていることにより、反応平衡にいたる時間が短時間化される。また、前記貯留部に配置される表面が大きな多孔質上に前記被検出物質と前記分子認識試薬の会合体が濃縮される。前記貯留部で濃縮、洗浄された前記被検出物質と前記分子認識試薬の結合体に含まれる金属ナノ粒子は、酸などの適宜の溶離液の導入により、溶解して、金属イオン溶液を与える。金属イオンは、元となったひとつの金属ナノ粒子に対し、数千から数万の金属イオンとなるため、被検液中の被検出物質の濃度に比べて100倍〜10000倍の濃度になる。溶出された金属イオンは、検出部に搬送されて定量される。被検液中の被検出物質の濃度が極低濃度であっても、被検液中の被検出物質の濃度に比例する高濃度に変換された金属イオンを検出部で測定するため、検出部での金属イオン濃度の定量は容易になる。
【0038】
測定された金属イオン濃度は、被検出物質の濃度に換算される。このようにして、煩雑で数時間かかっていた濃縮及び分析を比較的短時間で、例えば20分以内で完了することができる。また、信号の増幅に酵素を用いていないため、測定温度の影響や保管履歴の影響を受け難い。本発明において、「検出」なる用語は、被検出物質の濃度に応じた金属イオン濃度を定量するための情報を収集することを広く意味する。また、被検液とは、検出対象である被検出物質を含む可能性がある限り、特に限定されるものではなく、例えば、生物学的試料[例えば、動物の体液(例えば、血液、血清、血漿、髄液、腹水、涙液、汗、膿、喀痰、または咽頭拭い液)若しくは排泄物(例えば、尿、糞便)、臓器、組織、又は動植物それ自体若しくはそれらの乾燥体]、あるいは、環境由来の試料(例えば、河川水、湖沼水、若しくは海水、又は土壌)、食品粉砕物、燃焼残渣および、これらからの抽出物を挙げることができる。
【0039】
検出用カートリッジにおける流路は、被検液、マスキング剤、洗浄液、溶離液等の種々の試薬の流れを確保し、液体を移送及び/又は貯蔵することができる限り、その形状、長さ、大きさ、数等は特に限定されず、例えば、数十μm〜数mmのオーダーの幅を有し、数十μm〜数百μmの深さを有する溝により形成されていることが適しており、例えば、流路の断面積は100μm2〜1mm2程度である。
【0040】
本発明において用いられる金属ナノ粒子で標識された分子認識試薬は、分子認識部分と、リンカー部分と、金属ナノ粒子とを有する。
【0041】
前記分子認識部分は、免疫学的検定法(イムノアッセイ)に用いられる抗体が好適に用いられる。特に、モノクローナル抗体は特異性が高いものも多く優れている。前記分子認識部分は、抗体に限られるものではなく、糖鎖、レクチン、セレクチン、DNA、RNA、ペブチド核酸、アプタマー、抗体断片Fab、抗体認識部位Fv、クラウンエーテル等の分子特異的結合能をもつ分子認識試薬を用いることができる。
【0042】
前記リンカー部分は、プロテインG、プロテインA、プロテインL、ビオチン−アビジンコンジュゲート、これらの誘導体、改変体からなる一群より選ばれる少なくとも一種を挙げることができる。
【0043】
標識に用いられる前記金属ナノ粒子としては、特に限定されないが、直径3nm〜30nmのカドミウムセレン(CdSe)ナノ粒子、カドミウムテルル(CdTe)ナノ粒子、銀(Ag)ナノ粒子が好適に用いられる。この範囲より小さいナノ粒子は安定に存在し難い。また、ナノ粒子が大きすぎると、沈降し、抗体試薬の標識としては不適となることがある。
【0044】
本発明において、上記貯留部は被検液に含まれる被検出物質と、金属ナノ粒子で標識された上記分子認識試薬とを会合させ、生成された会合体を濃縮し、保持する機能を有する。一方、会合体に取り込まれていない金属ナノ粒子を含む夾雑物を包含する分散媒、マスキング剤、または洗浄液などは貯留部を通過する。貯留部は、上記会合体を生成する反応場を増大し、かつ被検出物質を貯留/保持するために濃縮物を担持する担持手段を含むことが好ましい。
【0045】
従って、好ましくは、貯留部に担持手段として、多孔性材料もしくはメッシュ状物または微細加工表面を有する材料が好適に用いられる。多孔性材料やメッシュ状物は表面積が大きいため、特許文献2に記載のようなフィルタやメンブレンフィルタに比べ、多くの反応場を提供することができ、かつ上記会合体をより多く担持することができる。なお、多孔性材料は、材料自体が多数の孔を有するものに限らず、微粒子が凝集し、粒子間に大きくの孔が形成されているものをも含むものとする。
【0046】
上記担持手段を構成する材料は、上記多孔性材料もしくはメッシュ状物が好ましいが、より具体的には、スポンジ、織布、不織布、充填された微粒子、繊維、焼結体、モノリシック多孔質体のいずれかの様態、または、それらの組み合わせからなる様態をとる。微細加工表面としては、ナノインプリンティング法やスプレーデポジショニング法による構造表面が好適に用いられる。担持手段を構成する素材としては、例えば、セラミック、ガラス、合成繊維、植物繊維、動物性繊維、合成樹脂、セルロース系材料、金属なども用いてもよい。また、基材の表面に、被検出物質に対して化学反応を行う又は特異的結合能を有する分子や官能基で処理したものを用いてもよい。
【0047】
前記金属ナノ粒子標識された分子認識試薬から金属イオンを溶出する方法としては、酸を加える方法がとられる。ここで適当な酸としては、0.5〜3Nの硝酸が好適に使用できる。塩酸及び硫酸は、難水溶性の塩化物及び硫化物を生じるので望ましくない。
【0048】
溶出された金属イオンは、検出部へと輸送され、定量される。検出機構は、特に限定されることなく、被検出物質を検出することができる方法を実現し得る機構の全てを利用することができる。方法としては、電気化学分析法、光学分析法、他の原理を利用した分析が挙げられる。機構としては、特に限定されず、例えば、電気化学分析のための電極及び電流・電圧を印加又は読取る手段等、光学的分析法における光学セル、光源及び分光器等、又はその一部が、検出用カートリッジにおける検出区画を構成して搭載される。
【0049】
本発明の検出方法において用いられる電気化学分析法について、より具体的に記載するならば、例えば、リニアスイープボルタンメトリー(LSV)、クーロアンペロメトリー(CA)、クーロクロノメトリー(CC)、サイクリックボルタメトリー(CV)、又はアノーディック ストリッピング ボルタンメトリー(ASV)などを挙げることができる。電極構成は、三極式、四極式、二極式のいずれの方法も採用しうるが、精度と使い勝手との兼ね合いを考慮すると、三極式が望ましい。
【0050】
なお、本発明においては、上記検出部は貯留部よりも下流側に配置されているが、貯留部の下流側に連ねられて設けられ、両者が一体化されていてもよい。
【0051】
また、検出部において、被検出物質の濃度に応じた金属イオン濃度が検出されるが、この場合検出手段は、カートリッジ内またはカートリッジ上に設けられる必要は必ずしもない。もっとも、検出手段の少なくとも一部がカートリッジ内またはカートリッジ上に存在する場合には、小型化を進めることができる。
【0052】
また、検出手段の一部のみがカートリッジに設けられてもよい。例えば、光学式検出手段を用いる場合、カートリッジ内あるいはカートリッジ上に光学セルが検出部の一部として配置され、光学セルを透過してきた光を受光する受光手段を含む測定部分が、カートリッジ外の測定装置内に設けられてもよい。
【0053】
好ましくは、検出手段を構成する部材の内、濃縮カラムのように再生し難い部材や、測定前に煩雑な再生処理を要する部材、例えば電気化学的電極などはカートリッジ側に設けられることが好ましい。また、電気化学的電極分析に用いられる電極は、測定前に研磨したりしなければならないため、1回毎に、あるいは一定分析回数毎に廃棄されるカートリッジ側に設けられることが望ましい。
【0054】
他方、光学セルは、測定前に簡易な洗浄作業により再度使用することができるので、カートリッジ内に配置されてもよい。
【0055】
より具体的には、検出手段として電気化学的分析手段を用いる場合には、例えば、カートリッジ内の検出部に、作用電極、対極及び参照電極などの電極を配置し、処理ユニット内に、電流または電圧を印加もしくは読み取る手段を設ければよい。光学分析手段を用いる場合には、カートリッジ内に光学セルを設け、カートリッジ外に光源や受光手段を設ければよい。
【0056】
上記検出部における検出手段としての1つの好ましい態様は、溶出された金属イオンを含む可能性のある上記貯留部から溶出液と、金属イオンを含まない溶離液とを用い、電気化学的応答を対比する分析手段が挙げられる。
【0057】
また、別の好ましい検出手段としては、硫化物イオンを加えて生じる抵触懸濁物の濃度を光学的に検出手段が挙げられる。Cdイオン及びAgイオンは、非水溶性硫化物イオンとして、水溶液中に析出分散し、溶液を懸濁するとともに、特有の色を呈する。これを光学的手段により容易に測定することができる。透過光による吸光度を測定する方法を用いてもよく、反射光を利用する測定方法を用いてもよく、光導波路を用いた測定方法などのど様々な光学的測定方法を用いることができる。
【0058】
上記カートリッジと、カートリッジ外の測定装置との間で、液体を輸送する必要がある場合には、カートリッジの表面に液体供給及び液体排出用の複数のポートを設ければよい。複数のポートは、被検液または試薬等を導入または排出するために用いられるものであり、大きさ及び位置は特に限定されない。例えば、複数のポートは、貯留部の上流側において被検液を供給するため、貯留部と検出機構との間に、検出に用いられる溶液や洗浄液を供給するために、検出部の下流側などの適宜の位置に配置することができる。ポートの選択及び切り換えは、電磁バルブ等を用いた適宜のバルブ機構を用いて行えばよい。
【0059】
次に、本発明で用いられるカートリッジの具体的な構造例を、図面を参照しつつ説明する。
【0060】
図1(a)は本発明の一実施形態に係る検出用カートリッジの外観を示す斜視図であり、(b)はカートリッジ内に形成されている流路、及び貯留部の関係を示す模式的斜視図であり、図2はカートリッジ内に設けられている流路及び貯留部並びに検出部の関係を示す模式図である。また、図3は、本実施形態の検出用カートリッジの内部構造を示す分解斜視図である。
【0061】
図1に示すように、本実施形態の検出用カートリッジ1は、下方から第1〜第3のプレート11〜13を積層してなるカートリッジ本体2を有する。プレート11〜13は、例えば合成樹脂により形成される。各プレート11〜13は、典型的には35mm×50mmの矩形の平面形状を有し、1枚のプレートの厚みは1mm程度とされる。図1(a)では省略されているが、図3に示すように、第1〜第3のプレート11〜13は、粘着シート14,15を介して積層されている。従って、カートリッジ本体2は、約4mm程度の厚みを有する。
【0062】
図3においては、図示を容易とするために、また理解を容易とするために、第1のプレート11及び粘着シート14の向きと、残りの第2,第3のプレート12,13及び粘着シート15の向きを代えて図示している。
【0063】
カートリッジ本体2の下面には、第1〜第5のポート3〜7が形成されている。第1〜第5のポート3〜7は、カートリッジ本体2内に設けられている主流路8に接続されている。主流路8は、第1のプレート11,12間及び第2のプレート12及び第3のプレート13間のいずれかの内面に形成された溝及び/または第2のプレート12に設けられた貫通溝により形成されている。また、主流路8は、第1の流路部分9と第2の流路部分10とを有する。第1の流路部分9は、第1,第2のポート3,4を接続している。第1の流路部分9の途中に貯留部16が設けられている。また、第2の流路部分10は、第3のポート5〜第5のポート7を接続している。第2の流路部分10の途中には検出部18が設けられている。
【0064】
また、第2の流路部分10の下流側は図2には示されていない部分において、廃液貯留部19に接続されている。廃液貯留部19は、図3に示すように、第1のプレート11の上面において上方に向かって開いた凹部19a、第2のプレート12に設けられた大きな開口部19b及び第3のプレート13の下面において下方に向かって開いた凹部19cが組合わさって形成されている。
【0065】
他方、貯留部16は、第1のプレート11の上面において上方に向かって開いた凹部16aと、第2のプレート12に設けられた放射状の開口部16bとが積層されて形成されている。なお、第1のプレート11には、上記貯留部16に繋がるように前述した第2のポート4が形成されている。貯留部16内には、図2においては略図的に示すように、濃縮担持手段としての濃縮担持体21が収納されている。濃縮担持体21は、前述の適宜の担持材料により形成されている。
【0066】
この場合、図2に示されているように、第1の流路部分9が上下方向に延びる部分おいて、貯留部16が設けられているため、貯留部16内の濃縮担持体21には、上方から被検液が供給され、流路を流れる液体は濃縮担持体21を上下方向に通過する。従って、濃縮担持体21が、前述した多孔性材料もしくはメッシュ状物等からなる場合、金属ナノ粒子で標識された分子認識試薬と被検液中の被検出物質の会合体を生成する際の反応場を増大させることができる。前述した特許文献2では、ストリップ状フィルタの面方向に被検液が供給されるため、反応場が少ないのに対し、本実施形態では、濃縮担持体21を上下方向に通過するように被検液が供給されるため、反応場を著しく増大させることができる。従って、それによっても、検出感度を高めることが可能とされている。
【0067】
本実施形態では、貯留部16に、流路から被検液が供給される。この貯留部16において、金属ナノ粒子で標識された分子認識試薬と被検液中の被検出物質の会合体が生成し、濃縮される。この場合、流路に、上記被検液と上記分子認識試薬と適宜の液状媒体とを含む混合液を供給し、貯留部16に導いてもよく、あるいは、貯留部にまず被検液を供給し、しかる後分子認識試薬を貯留部16に導いてもよい。貯留部16において、上記分子認識試薬と被検出物質の会合体が濃縮される。
【0068】
他方、検出部18においては、化学電極としては、参照電極R、作用電極W及び対極Cが配置されている。ここでは、対極Cと、参照電極Rとの間の電圧及び作用電極Wと対極Cとの間の電圧に基づいて、金属イオンの析出と電位掃引アンペロメトリが行われ、金属イオン濃度が測定される。すなわち、貯留部16で会合体に取り込まれている金属ナノ粒子を、流路に金属ナノ粒子を溶解する溶離液を流し、会合体中の金属ナノ粒子を溶解することにより、金属イオン溶液が貯留部16から下流側に排出される。この金属イオン溶液中の金属イオン濃度が検出部18において検出される。
【0069】
なお、図3に示すように、第1〜第3のプレート11〜13は、粘着シート14,15を介して貼り合わされ、積層されている。粘着シート14,15は、上述した廃液貯留部19などを形成するため貫通孔を有する。また流路を接続するための複数の小さな貫通孔も有する。
【0070】
上記作用電極Wとしては、例えば、3.5mm×8.4mm×0.5mm程度の板状のカーボン電極を好適に用いることができる。対極C及び参照電極Rについても同様の寸法の板状の電極を用いることができ、対極Cは作用電極Wと同様に板状のカーボン電極を用いて作製することができる。また、参照電極Rについては、金属イオン種によって適宜最適なものが選ばれる。例えば、金属イオン種がカドミウムイオンの場合には、参照電極にアルミナ基材上に銀ペーストが塗布された電極を用いることができる。金属イオン種が銀イオンの場合には、金基財にフェロセンを固定した電極を用いることができる。
【0071】
もっとも、上記化学電極の寸法及び構造については特に限定されず、第1のプレート11上に適宜の電極材料を印刷することにより形成されてもよい。
【0072】
本実施形態では、プレート11の上面と化学電極の表面とが面一となるように、第1のプレート11の上面に凹部が形成され、該凹部を埋めるように電極材料が充填されている。
【0073】
従って、参照電極R、作用電極W及び対極Cの上面と、第1のプレート11の上面とは面一とされている。よって、第1のプレート11と第2のプレート12とを隙間を生じさせることなく容易に積層することができる。
【0074】
なお、粘着シート14には、上記参照電極R、作用電極W及び対極Cを露出させるための貫通孔14a〜14cがそれぞれ形成されている。
【0075】
これらの貫通孔14a〜14cを通して液体が参照電極R、作用電極W及び対極Cに接触されることになる。
【0076】
上記第1〜第5のポート3〜7の内、第1のポート3は、被検液や溶離液などを導入するためのポートであり、第1のプレート11に貫通孔として形成されている。なお、第2のプレート12においては、特に図示はしていないが、参照電極Rを活性化するための活性化液としての電解質溶液が貯留された電解質溶液室を設けてもよい。このような電解質溶液を上記第2の流路部分10に接続し、第2の流路部分に供給することにより、上記参照電極Rの活性化を容易に行うことができる。
【0077】
上記カートリッジにおける検出手段としては、化学電極を用いることが望ましい。より望ましくは、上記実施形態のように、カートリッジ本体2内に、化学電極としての参照電極R、作用電極Wなどが配置された検出区画が備えられていることが望ましい。化学電極を用いることにより検出手段の小型化を進めることができ、それによってカートリッジ全体の小型化を進めることができる。
【0078】
上記検出用カートリッジ1におけるカートリッジ本体2の構造は、上記貯留部及び検出部と、これらを接続する流路が形成される限り、図1〜図3に図示の構造に限定されるものではない。
【0079】
図4は、本発明の他の実施形態に係る検出用カートリッジを説明するための分解斜視図である。検出用カートリッジ51では、2枚のプレート52,53を接着剤等を用いて貼り合わすことにより構成されている。すなわち、プレート52,53を貼り合わせることによりカートリッジ本体が構成されている。
【0080】
なお、プレート52,53は、接着剤による貼り合わせに限らず、拡散接合、陽極接合、レーザー接合等の適宜の接合方法によって貼り合わすことができる。
【0081】
プレート52の下面に破線で示す多孔形状の凹部が設けられており、該蛇行形状の凹部により第1の流路部分9が形成されている。また、プレート52には、第1〜第4のポート3〜6を構成するための各貫通孔が形成されている。なお、図2の第5のポート7は記載されていない。
【0082】
プレート53の上面には、上記第1の流路部分9が形成される部分に、プレート52の下面に設けられた蛇行形状の凹部と重ねられ合う蛇行形状の凹部が設けられている。プレート52,53の蛇行形状の凹部が合体し、第1の流路部分9が形成される。また、プレート53の上面には、濃縮担持体21を含む凹部からなる第1の貯留部16が設けられている。第1の流路部分9の一端は第1のポート3に、他端は第2のポート4に接続されている。
【0083】
また、プレート53の上面には、第2の流路部分10が形成されており、第2の流路部分10の途中に、凹部からなる第2の貯留部17が設けられている。また、第2の貯留部17の下流側に、検出部18が設けられている。検出部18は、第1の実施形態と同様に構成されている。
【0084】
図5は、図1及び図4に示した検出用カートリッジに用いられる流路接続切り換え機構を説明するための模式図である。
【0085】
図1及び図4では、第1の流路部分9の下流側端部が第2のポート4に接続されており、第2の流路部分10の上流側端部が第3のポート5に接続されている。この第2のポート4と第3のポート5との間の流路を接続する切り換え機構としては、例えば図5に示す流路切り換え装置を用いる構造が挙げられる。ここでは、カートリッジ本体2の外部に流路切り換え装置として三方コック31が用意される。
【0086】
三方コック31は、第1〜第3のポート31a〜31cを有する公知の三方コックである。流路32が第2のポート4と三方コック31とに接続されており、流路33が三方コックと31と第3のポート5とを接続している。
【0087】
図5に示す状態では、第1のポート31aが流路32に接続されており、第2,第3のポート31b,31cは流路33に接続されていない。従って、第1の流路部分9から第2のポート4を経て流路32に流れ込んできた液体は、第1のポート31aから三方コック31内を通過し、第2のポート31bまたは31cから排出される。従って、第1の流路部分9から流れてきた残液を廃棄することができ、未反応の試薬等が第2の流路部分10に至ることはない。よって、この状態で第1のポート31aから洗浄液として緩衝液などを流し、濃縮担持体21及び第1の流路部分9を洗浄する。洗浄液も、三方コック31のポート31bまたは31cから洗浄液を排出することができる。
【0088】
次に、測定に際しては、三方コック31を回転し、流路32にポート31bを、流路33にポート31cを接続する。その状態で溶出液を第1のポート31aから注入し、金属ナノ粒子が溶解している溶出液を流路32、三方コック31及び流路33を介して第2の流路部分10に導き、検出部18で検出する。このように、三方コック31のような流路接続切り換え機構をカートリッジ本体2の外部に設けることにより、上記検出用カートリッジ1を用いて定量を行うことができる。
【0089】
また、図6は、本発明のさらに他の実施形態に係る検出用カートリッジにおける流路接続切り換え機構を説明するための模式図である。この流路接続切り換え機構は、カートリッジ本体2内に構成することができる。本実施形態では、カートリッジ本体2内において、第1の流路部分9と第2の流路部分10とが接続部Xにおいて接続されている。すなわち、第1の流路部分9の下流端が接続部Xに至っている。また、接続部Xと第2のポート4との間に廃液流路41が接続されている。
【0090】
言い換えれば、図2に示した構成において、第1の流路部分9の下流端に接続部Xを設け、接続部Xと第1のポート4との間を廃液流路41とした構成に相当する。第2の流路部分10の上流端は、上記のように接続部Xに接続されているため、図2に示す構造における第3のポート5は省略されることとなる。他方、第2の流路部分10の途中には検出部18が設けられており、下流端側にポート6が設けられており、図2のポート7は省略されている。ポート6は外部に開いている。
【0091】
使用に際しては、ポート6を閉じた状態で、第1のポート3から被検液及び試薬を導入する。濃縮担持体21において会合体が濃縮される。余剰の液体が廃液流路41を介して第2のポート4から排出される。ポート6が閉じられているため、第2の流路部分10においては空気の抜け道がないため、第2の流路部分10に液体は浸入しない。
【0092】
次に、第1のポート3から洗浄液を導入し、同じく洗浄後の洗浄液が第2のポート4から排出される。
【0093】
洗浄終了後、第1の流路部分9、第2の流路部分10及び廃液流路41の全体が空気で占められることになる。
【0094】
次に、第2のポート4を閉塞し、ポート6を開放する。この状態で、第1のポート3から溶出液を導入する。その結果、会合体に含まれている金属ナノ粒子が溶解し、金属ナノイオンを含む溶液が第2の流路部分10に流入し、検出部18によりイオン濃度を定量することができる。この場合、第2のポート4が閉塞されているので、溶液は選択的に第2の流路部分10に流れることになる。
【0095】
図7(a)及び(b)は、本発明のさらに他の実施形態の検出用カートリッジにおける各流路接続切り換え機構を説明するための模式図である。
【0096】
図7(a)では、図6の場合と同様に、接続部分Xにおいて、第1の流路部分9、第2の流路部分10及び廃液流路41が接続されている。異なるところは、第2の流路部分10において、検出部18よりも上流側にあって、接続部Xよりも下流側に流路を開閉するバルブ42が設けられていることにある。そして、第2の流路部分10の流動抵抗に比べて、廃液流路41における流体の流動抵抗が大きくなるように、流動抵抗増大部41aが廃液流路41に設けられていることにある。
【0097】
バルブ42を閉じた状態で、第1のポート3から被検液及び試薬を導入し、免疫会合体を濃縮担持体21で濃縮する。残液は、バルブ42が閉じられているので、第2のポート4から排出される。洗浄に際しても、同様に第1のポート3から洗浄液を導入し、第2のポート4から排出する。この場合も、バルブ42は閉じられているので、洗浄液は第2の流路部分10のバルブ42よりも下流側には至らない。
【0098】
定量に際しては、バルブ42を開状態とすればよい。その状態で、溶出液を第1のポート3から導入する。第2の流路部分10の流動抵抗が、廃液流路41における流動抵抗よりも低くされているため、金属ナノイオンを溶解した溶出液は、廃液流路41には至らず、バルブ42を介して第2の流路部分10に至る。従って、金属ナノイオン濃度を検出部18で測定することができる。
【0099】
なお、図7(b)に示すように、バルブ42は、検出部18の下流側において第2の流路部分10に設けられていてもよい。
【0100】
本発明の被検出物質の検出方法は、各種アレルゲン、例えば、卵黄、卵白、牛乳、落花生、エビ、カニ、魚、貝、大豆、マンゴーなどの食品、塵ダニ、羽毛、花粉、真菌、細菌、ゴキブリ、犬又は猫の毛が挙げられる。その他、内分泌撹乱物質、農薬、IgEもしくはIgG等の免疫グロブリン、ヒスタミン、遺伝子(RNA)、ストレスマーカー、各種タンパク質、人または動物の血液、血液成分、尿、唾液もしくは体液に含まれる抗原もしくは抗体、特定疾患を示す成分、アスベスト、血中薬物またはその他の抗体により検知可能な物質の検出に用いることができる。
【0101】
次に、本発明の検出用カートリッジを用いて、被検出物質を測定する具体的な実施例をより具体的に説明する。
【0102】
(実施例1)
まず、分析ターゲットとして、C反応性タンパク質(以下、CRPと表記する)を選定し、サンドイッチアッセイ可能な2種の抗体、すなわち、第1の抗CRPIgGと、第2の抗CRPIgGを用意した。第2の抗CRPIgGには、アダプターとしてのプロティンGを介してCdSeナノ粒子を結合し、CdSeナノ粒子標識抗体試薬とした。
【0103】
第1の抗CRPIgGは、ニトロセルロースメンブレンに物理感作させ、アルブミンでブロッキングしたのち乾燥させ、直径4ミリのディスク形状に打ち抜いて、CRPに対する濃縮担持体とした。
【0104】
次いで、図1に示したプレート11〜13を用意し、貯留部に上記濃縮担持体をセットした。さらに、検出部については前述した実施形態に従って、化学電極を配置した。
【0105】
第1〜第3のプレート11〜13としては、50mm×35mm×厚み1mmのポリメチルメタクリルプレートからなる樹脂プレートを用い、20μmの厚みの両面粘着テープを粘着シート14,15として用いた。
【0106】
上記のようにして得られた検出用カートリッジ1を用い、CRP濃度1μg/mLの標準試料を用意し、10pg/mL、50pg/mL、100pg/mLの各濃度の試料溶液を作製し、検出用カートリッジ1を用いて検量線を作成した。1つの試料溶液についての分析手順は以下の通りとした。
【0107】
まず、第1のポート3から1mLの試料溶液をマイクロシリンジを用いて主流路8の第1の流路部分9に導入し、貯留部16に導いた。
【0108】
次に、カートリッジ本体を測定装置にセットし、マイクロコンピューターで制御された送液システムにより、以下の洗浄液、抗体試薬及び洗浄液(2回目)、及び溶出液を前記貯留部に順次導いた。すなわち、まず、ポート3から第1の流路部分9を介して貯留部16に、洗浄液としてリン酸緩衝液を4mL、1mL/min.の速度で導入した。次に、抗体試薬として前記CdSeナノ粒子抗体試薬を、第1のポート3から、1.0mL、200μL/min.の流速で貯留部16に導いた。しかる後、洗浄液としてのリン酸緩衝液を、第1のポート3から、2mL、1mL/min.の速度で、貯留部16に導き、次に、標識を溶かしだす溶出液として1Nの硝酸水溶液を第1のポート3から、0.2mL及び50μL/min.の流速で貯留部16に導いた。
【0109】
次に、溶出された金属イオンが溶解している可能性がある溶出液を検査部に送液した。検査部において、リニアスイープボルタンメトリー(LSV)により、測定を行った。掃引速度は5mV/秒とし、200mVから700mVまで掃引し、電流値を測定した。結果を図8に示す。図8において、横軸は掃引電位であり、縦軸は、電流値である。−0.8Vから−0.6V近傍のハッチングしてある部分の面積が、標識由来の金属イオンの検出量である。夾雑イオン種は異なる電位にピークがあるので、目的の金属イオン種と明瞭に区別できる。参照電極に用いたAg/AgCl由来の銀の小さなピークが0V近傍にあるが、これとも区別できる。従って、上記リニアスイープボルタンメトリーを用いることにより、被検出物質の濃度を高精度に検出し得ることがわかる。
【0110】
(銀ナノ粒子を用いた実施例2)
上記CdSeナノ粒子を用いた実施例1と同様にして、ただし、CdSeナノ粒子に代えてAgナノ粒子を用い、上記実施例1と同様にして検出物質の濃度の検出を試みた。結果を図9に示す。図9においては、比較を容易とするために、上記CdSeナノ粒子を用いた実施例1の場合の結果も併せて示す。図9から明らかなように、Agナノ粒子を用いた場合の方が、CdSeナノ粒子を用いた場合よりも被検出物質濃度を高感度に検出し得ることが分かる。なお、実施例1でみられた参照電極に用いたAg/AgCl由来の銀の小さなピークは、Agナノ粒子由来の信号のバックグランドとして補正に用いる。
【0111】
(好ましい硝酸濃度についての実施例3)
上記実施例1及び実施例2において、金属ナノ粒子をイオン化する際の溶出液として硝酸を用いていたが、硝酸濃度の好ましい範囲につき検討した。粒径20nmのAgナノ粒子を、0.01N〜5Nの硝酸にて溶解し、10μmのAgイオン溶液を調製した。リニアスイープボルタンメトリー(LSV)により50mV/秒の挿入速度で、−0.5Vから0.8Vまで挿引し、電流値を測定した。その結果からピーク電流値と硝酸濃度との関係を求めた。結果を図10に示す。
【0112】
図10から明らかなように、硝酸濃度が0.5N〜3Nであれば、より好ましくは1N〜2Nの範囲であれば、Agイオンを高い感度で測定し得ることが分かる。なお、硝酸濃度が5Nの場合には、参照電極の銀塩化銀部分が変色し、電流が安定せず測定を行うことはできなかった。
【0113】
(実施例4)
被検出物質として、心疾患マーカーである脳性ナトリウム利尿ペプチド(以下、BNPと表記する)を選定し、一次抗体として、BNPを認識する抗BNP抗体を、二次抗体として、抗BNP抗体とBNPの複合体を認識する抗Fab24C5/BNP抗体を用いて、以下の手順で検出を行った。
【0114】
(1)水溶性銀ナノ粒子の作製
疎水性銀ナノ粒子(大研化学社製)15mgを800μLのエタノールに分散させた。ここにエタノールに溶解させたN−〔(S)−3−メルカプト−2−メチルプロピオニル〕−L−プロリン(シグマアルドリッチ社製)25mgを加え、NaOH水溶液を加え、分散液を調製した。
【0115】
ピンチコックされたキャピラリー流路(ピンチコック幅自動調整装置)を備える高圧液体反応装置であるAKICO社製「HPB−450」を用い、圧力35MPa、流速2.6mL/分で分散液を通液した。全量の処理に要した時間は、約10分間であった。この処理により、疎水性銀ナノ粒子の表面修飾剤が置換され、水溶性銀ナノ粒子が生成された。通液後の分散液をクロロホルム洗浄した後、限外濾過膜(Millipore社製、「Amicon Ultra−4」)及びセファデックスカラム(Amersham Biosciences社製、「MicroSpin G−25 Columns」)を用いて精製と濃縮を行い、精製した水溶液性銀ナノ粒子を得た。
【0116】
得られた銀ナノ粒子は、水に分散し、橙色の分散液を与える。動的光散乱法による粒径測定装置(Malvern社製、「ZETASIZER Nano Series Nano−ZS」)を用いて粒子径分布を測定した結果、ピーク粒子径は3.6nmであった。
【0117】
(2)水溶性銀ナノ粒子標識抗体の調製
上記の銀ナノ粒子水溶液を、同体積の100mMシステイン溶液に、100mMの1−エチル−3−(3−ジメチルアミノプロピル)カルボジイミド塩酸塩(EDC)及びヒドロキシスクシンイミド(NHS)カップリング剤(いずれもPierce Biotechnology社製)共存のもとで、4℃、1時間混合した。Nap−5カラム(Amersham Biosciences社製)を用いて遊離アミノ酸を除去した後、sulfo−SMCCカップリング剤(Pierce Biotechnology社製)を用いて、銀ナノ粒子に二次抗体を結合させ、4℃で2時間超音波分離させた。生成物をセファデックスカラム(Amersham Biosciences社製)で精製後、限外濾過後(NMWL 100kDa、Millipore社製)を用いて濃縮し、銀ナノ粒子表面に抗BNP抗体が結合した水溶性銀ナノ粒子標識抗体試薬を作製した。
【0118】
(3)ラテックス抗体試薬の作製
平均粒径0.087μmのポリスチレンラテックス(固形分10%(W/V))1容に、ラテックス希釈用緩衝液9容を添加してラテックスを希釈し、1.0%(W/V)ラテックス液とした。一次抗体を抗体希釈用緩衝液で希釈し、感作用の抗体液とした。1.0%(W/V)ラテックス液600μLを25℃のインキュベーター中でマグネチックスターラーで攪拌しながら、これに抗体液1200μLを素早く添加し、25℃にて1時間攪拌した。その後、ブロッキング用緩衝液を3.0mL添加し、25℃にて続けて2時間攪拌した。その後、15℃、15,000rpmにて15分間遠心分離した。得られた沈殿にブロッキング用緩衝液を4.0mL添加し、同様に遠心分離することにより、沈殿を洗浄した。洗浄操作は3回行った。この沈殿にブロッキング用緩衝液を1.8mL添加し、よく攪拌した後、超音波破砕機にて分散処理を行った。これにさらにブロッキング用緩衝液を1.8mL添加し、ラテックス抗体試薬とした。
【0119】
(4)水溶性銀ナノ粒子標識抗体を使用した分析例
BNP濃度2μg/mLの標準試料を用意し、0.01pg/mL、0.1pg/mL、1pg/mL、10pg/mL、100pg/mLの各濃度の試料溶液を作製した。これらの標準試料溶液それぞれ1mLに、(3)のラテックス抗体試薬20μLを加え攪拌した。ここに(2)の水溶性銀ナノ粒子標識抗体試薬30μLを加え、さらに攪拌した。この溶液を図1の検出用カートリッジに導入した。以下の操作は、実施例2と同様にしてピーク面積の測定を行った。結果を図11に示す。
【0120】
図11から明らかなように、実施例1と同様にリニアスイープボルタンメトリーを用いることにより被検出物の濃度を高精度に検出し得ることが分かる。
【符号の説明】
【0121】
1…検出用カートリッジ
2…カートリッジ本体
3〜7…第1〜第5のポート
8…主流路
9…第1の流路部分
10…第2の流路部分
11〜13…第1〜第3のプレート
14…粘着シート
14a〜14c…貫通孔
15…粘着シート
16,17…第1,第2の貯留部
16a…凹部
16b…開口部
18…検出部
19…廃液貯留部
19a…凹部
19b…開口部
19c…凹部
21…濃縮担持体
31a〜31c…第1〜第3のポート
32,33…流路
41…廃液流路
41a…流動抵抗増大部
42…バルブ
51…検出用カートリッジ
52,53…プレート
【技術分野】
【0001】
本発明は、イムノアッセイを利用し、抗原、抗体、アレルゲン、菌体、ウイルス、薬物、DNA付加体など様々な生化学的物質等を定量するのに用いられる定量分析方法に関し、より詳細には、微量の被検液が流される流路を有する検出用カートリッジを用いた定量分析方法、試薬及び検出用カートリッジに関する。
【背景技術】
【0002】
従来、様々なアレルゲンや生化学的物質を定量するに際し、これらの生化学的物質をより高い感度で定量することが強く求められている。例えば、数十fg/mL〜数百pg/mLのような非常に低濃度の被検液から被検出物質を測定する場合、次のようにするのが常套手段である。すなわち、先ず、被検液から被検出物質を固相抽出処理し、濃縮物を得る。次にこの濃縮物を、液体クロマトグラフィー装置または電気泳動装置に供給し定量する方法、あるいはこの濃縮物を用いてELISA法で定量する方法などが用いられている。しかしながら、これらの方法では固相抽出処理等の濃縮するための前処理に時間がかかり、全分析時間として数時間から数日と非常に長い時間を要した。
【0003】
他方、次々と発見されるバイオマーカーの展開医療における実用化のためには、被検出物質を高感度かつ迅速にその場で定量分析することが求められてきている。このようなニーズに応えるために、イムノクロマト法や比色法を利用した簡易定量検査チップが開発されている。しかしながら、この種の簡易定量検査チップの感度は、0.1ng/mL程度が限界であった。すなわち、より微量の被検出物質を高精度に測定することはできなかった。
【0004】
下記の特許文献1には、土壌からの水溶出液中の重金属のような微量成分を携帯可能なカートリッジ式検出装置を用いて高感度に検出する装置及び方法が開示されている。特許文献1に記載のカートリッジ式検出装置では、内部に流路が形成されている検出用カートリッジが用いられる。この検出用カートリッジ内において、流路の途中に貯留部が設けられており、貯留部より下流側に検出部が設けられている。被検液中の被検出物質を貯留部において貯留し、貯留部で一旦濃縮する。しかる後、濃縮された被検出物質を再度溶離液を用いて溶出させ、検出部に供給する。検出部において、改めて溶出された被検出物質の濃縮液に含まれる金属イオン濃度を測定することにより、土壌からの水溶出液中の重金属などの微量成分を1ppb程度の高感度で検出することが可能とされている。
【0005】
なお、特許文献1では、貯留部において、抗原または抗体が固定された構成についても言及されており、標識酵素による還元物質を検出部で測定してもよい旨が記載されている。これは、従来のELISA法と同様の方法を実現するための構成である。
【0006】
他方、下記の特許文献2には、例えば生物試料などの試料中の金属でラベルされた化学種の金属を可溶性の電気化学的に活性な錯体とし、該錯体を溶解し、錯イオンを電気化学的に測定し、金属ラベルされた化学種の存在または量を測定する方法が開示されている。特許文献2の実施例4では、ポリスチレン基板上に流路及び電極を有する検出部等が構成された装置が用いられている。ラテックスラベルされた抗体と銀ラベルされた抗体と抗原とを混合し、得られた混合物溶液を流路に供給し、流路の途中に設けたフィルタ領域に設けられたフィルタに導いている。このフィルタにおいて、ラテックスラベルされた抗体−分析物−銀ラベルされた抗体錯体が捕捉される。また、未結合の銀ラベルされた抗体がフィルタを通過する。次に、捕捉された化学種を洗浄し、残存する未結合の銀ラベルされた抗体を除き、捕捉された化学種を錯化剤を添加して錯イオン化する。このようにして得られた錯イオンの濃度が検出部により検出されている。ここでは、上記フィルタに化学種を捕捉させるに際し、上記混合物溶液をフィルタの面方向に供給している。
【先行技術文献】
【特許文献】
【0007】
【特許文献1】特許第4053081号公報
【特許文献2】WO2005/121792号公報
【特許文献3】WO2002/001178号公報
【発明の概要】
【発明が解決しようとする課題】
【0008】
特許文献1に開示されているカートリッジ式検出装置では、上記のように、被検出物質を酵素で標識し、標識酵素による還元物質を測定することにより、被検出物質が定量され得ると述べられている。しかしながら、酵素を利用したこのような増幅方法を用いた場合、酵素による反応が温度により影響を受けやすくまた、保管履歴により酵素の活性が変化しやすい。従って、測定温度のばらつきや保管履歴のばらつき等により、被検出物質を高精度に測定することはできなかった。
【0009】
特許文献2に記載の分析方法では、Agに錯化剤を添加し、Ag錯体を形成し、最終的にAg錯イオン濃度を計測している。Ag錯イオンは、Agイオンに比べて電気活性が高いため、バックグラウンドノイズが高くなるという問題がある。すなわち、SN比が低下し、感度を高めることができない。加えて、上記フィルタ領域においては、ストリップ状のフィルタの上面に該上面の面方向に混合物溶液が供給されるため、未反応成分や夾雑物が電極に付着し、それによってもSN比が低下するという問題がある。
【0010】
本発明の目的は、上述した従来技術の現状に鑑み、微量な被検出物質をより一層高い感度で、かつ比較的短い時間で定量することができ、しかも、測定温度の影響や保管履歴による影響を受け難い、定量分析方法、試薬及び検出用カートリッジを提供することにある。
【課題を解決するための手段】
【0011】
本発明によれば、上記課題を達成するために、被検出物質を含む被検液が供給される主流路と、該流路の途中に設けられた貯留部と、前記流路において前記貯留部よりも下流側に設けられた検出部とを備える検出用カートリッジを用いた定量分析方法であって、前記貯留部において、金属ナノ粒子で標識された分子認識試薬と前記被検出物質の会合体とを濃縮担持し、かつ残液を検出部に至らないように廃液する工程と、前記会合体に含まれる前記金属ナノ粒子を溶解し、金属イオン溶液を得る工程と、前記金属イオン溶液を前記検出部に搬送する工程と、前記検出部において、前記金属イオン濃度を測定し、金属イオン濃度に応じた前記被検出物質濃度を定量する工程とを備える、定量分析方法が提供される。
【0012】
本発明において、上記貯留部は、イムノアッセイに代表される分子特異的結合反応を短時間化するため並びに前記イムノアッセイに代表される分子特異的結合反応を通じて会合体に含まれる金属ナノ粒子の濃縮及び洗浄を行うための足場を与えるものである。
【0013】
分子特異的結合反応を短時間化することができるのは、イムノアッセイに代表される分子特異的結合反応が拡散律速であり、反応場がカートリッジの貯留部内においてマイクロ空間に限定されていて拡散距離が短いことによる。拡散律速反応においては、反応が飽和するまでに要する時間は、反応空間の距離の自乗に反比例する。例えば、4ミリのウェルと40μmの空間とでは、凡そ一万倍反応が早くなる。
【0014】
上記貯留部において、表面積が大きな多孔質上に被検出物質と分子認識試薬との会合体が濃縮される。更に、濃縮された会合体中の分子認識試薬を標識している金属ナノ粒子を溶解することにより、金属イオン溶液が得られる。この金属イオン溶液は、会合体が濃縮されたものである効果と、ひとつの金属ナノ粒子から数千数万のイオンを生じる効果とによって、もとの被検液中の被検出物質の濃度に比べて、100倍〜10000倍の濃度に変換された金属イオン溶液を与える。したがって、極低濃度の被検出物質濃度であっても、貯留部で濃縮された標識金属ナノ粒子由来の高濃度に変換された金属イオンが検出部において定量される。検出部で測定された金属イオン濃度は、被検液中の被検出物質の濃度に比例している。この金属イオン濃度を被検出物質の濃度に換算することにより、被検出物質を定量することができる。
【0015】
本発明のある特定の局面では、前記貯留部に、前記被検出物質に対して特異的に結合する特異的結合分子が予め固定されており、前記被検出物質を含む被検液を貯留部に導入することにより、前記被検出物質を前記特異的結合分子が会合し、前記貯留部において、前記被検出物質が濃縮され、前記金属ナノ粒子で標識された前記分子認識試薬が前記貯留部に導入されることにより、金属ナノ粒子で標識された前記分子認識試薬と前記被検出物質との会合体が、前記貯留部に濃縮貯留される工程が含まれる。この場合には、貯留部に上記特異的結合分子が予め固定されているので、被検出物質を含む被検液が貯留部に導入されると、被検出物質と特異的結合分子の会合体が貯留部に固定されることになる。従って、貯留部において、被検出物質が確実に濃縮される。従って、金属ナノ粒子で標識された分子認識試薬を貯留部に導入すれば、金属ナノ粒子で標識された分子認識試薬と上記被検出物質との会合体が貯留部に濃縮され、かつ貯留される。
【0016】
本発明の定量分析方法の他の特定の局面では、前記貯留部に多孔体が予め配置されており、前記濃縮貯留に際し、前記被検出物質を含む被検液と、前記金属ナノ粒子で標識された分子認識試薬と、前記被検出物質に対して特異的に結合する特異的結合分子が固定されたビーズ等を混合することにより得られた凝集物を含む懸濁液を前記流路を通じて前記貯留部に導入し、金属ナノ粒子で標識された前記分子認識試薬と前記被検出物質の会合体を含む凝集物を前記貯留部において濃縮貯留する工程とが含まれる。この場合には、被検出物質を含む被検液と、上記金属ナノ粒子で標識された分子認識試薬と、上記特異的結合分子が固定されたビーズとの混合物が懸濁液として貯留部に導かれるので、懸濁液中において各成分が速やかに拡散し、拡散律速である反応が早く簡潔することとなる。よって、分析時間をより一層短縮することができる。
【0017】
本発明に係る定量分析方法のさらに他の局面では、前記濃縮貯留後に、前記貯留部に洗浄液を導く工程がさらに備えられる。洗浄液の貯留部への導入により洗浄を行うことで、上記会合体に取り込まれていない未反応の分子認識試薬を除き、かつ、後続の金属イオンの検出において検出を邪魔する夾雑物を貯留部から容易に除去することができる。それによって、測定のバックグラウンドを下げることができ、有効な検出シグナルとノイズの比であるS/N比を高めることができる。
【0018】
また、本発明の定量分析方法のさらに別の特定の局面では、前記会合体に結合されている前記金属ナノ粒子を溶解し、金属イオン溶液を得る工程が、溶離液として酸を加える工程を含む。この場合には、酸を導入することにより、会合体に取り込まれている金属ナノ粒子を速やかに溶解し、被検出物質の濃度に応じた金属イオンを溶出し、金属イオン溶液として検出部に速やかに搬送することができる。
【0019】
本発明に係る定量分析方法のさらに別の特定の局面では、上記ビーズとして、ポリマー粒子が用いられる。ポリマー粒子として、上記貯留部に固定されている多孔体の網目よりも大きいポリマー粒子を用いたり、あるいは1つのポリマー粒子が複数の特異的結合分子を介して被検出物質並びに金属ナノ粒子で標識された分子認識試薬とネットワークを形成したりすることにより、濾過可能な会合体もしくは凝集体を与えることができる。すなわち、上記のようにポリマー粒子を用いることにより、濾過を効率良く行うことができる。
【0020】
もっとも、本発明においては、上記ビーズとして、少なくとも最表面が金属である粒子を用いてもよい。この場合には、金属ナノ粒子で標識された分子認識試薬以外にも、金属成分が測定系中に存在することとなるため、同じ貯留部を用いた場合において、より大きなシグナル増幅率を得ることができる。貯留部に、上記金属ナノ粒子よりも表面積が大きな、最表面が金属である粒子を用いた場合は、より大きな信号増幅率を得ることができる。最表面が金属である粒子の金属種は、金属ナノ粒子を構成する金属種と必ずしも同じでなくてもよい。還元電位が近くとも、検出部でアノーディック ストリッピング ボルタンメトリのような方法を用いることにより、それぞれを定量できる。
【0021】
本発明に係る定量分析方法のさらに他の特定の局面では、上記金属ナノ粒子として、カドミウムセレン(CdSe)、カドミウムテルル(CdTe)、または銀(Ag)からなる金属ナノ粒子が用いられる。ナノスケールのCdSe、CdTeやAgは、酸により速やかに溶解し、カドミウムイオン(Cd2+)及び銀イオン(Ag+)を与える。カドミウムイオン及び銀イオンは、比較的容易にかつ速やかに定量することができる。
【0022】
本発明に係る定量分析方法のさらに別の特定の局面では、前記検出部に、前記金属イオンを検出するための電気化学的電極が配置されており、金属イオン濃度の検出に際し、前記電気化学的電極上へ電気化学的に金属を析出させ、ついで、電位を掃引してストリッピング電流を測定する。このような電気化学的電極を含む検出部の場合には、嵩張る光学系が必要ないため、測定装置の小型化を進めることができる。また、電気化学的電極は、三極式、四極式または二極式のいずれであってもよいが、アノードに金属を析出させた状態で洗浄することにより、夾雑物の影響を低減することができる。また、電位を掃引しつつ電流を測定するため、電流のピーク位置により夾雑イオン種のシグナルと目的の金属イオンのシグナルとを区別することができる。従って、有意の測定シグナルとノイズの比であるS/N比をより一層高めることができる。
【0023】
本発明に係る定量分析方法のさらに別の特定の局面では、前記金属ナノ粒子が溶解された金属イオン溶液に硫化物イオンを加えることにより生じる非水溶性の硫化物塩の懸濁液を前記検出部において光学的に検出することにより、前記金属イオン濃度を定量する方法が用いられる。この場合には、光学的手段により、非接触で金属イオン濃度を容易にかつ速やかに定量することができる。従って、周知の吸光度測定法、反射光測定法あるいは光導波路を利用した測定法などを適用することにより、金属イオン濃度を速やかにかつ高精度に検出することができる。特に、カドミウムイオンや銀イオンのような重金属イオンの場合には、ローソン試薬やラヴェッソン試薬のような硫化剤を硫化イオンとして加え、非水溶性の硫化物塩として析出させて懸濁液とすることにより、光学的手法により、容易に金属イオン濃度を測定することができ好ましい。
【0024】
本発明に係る検出用カートリッジは、前記被検出物質を含む被検液が供給される主流路と、該主流路の途中に設けられた貯留部と、前記流路において前記貯留部よりも下流側に設けられた検出部と、前記第1の貯留部と前記検出部との間において前記主流路に接続されておりかつ前記検出部には接続されていない廃液流路とを備えるカートリッジ本体と、前記貯留部に設けられており、前記被検出物質と、金属ナノ粒子で標識された分子認識試薬との会合体を濃縮貯留する濃縮担持体と、前記検出部に設けられており、前記被検出物質の濃度に応じた金属イオン濃度を測定し、該金属イオン濃度に応じた被検出物質濃度を定量するための検出手段とを備える。
【0025】
本発明に係る検出用カートリッジのある特定の局面では、前記貯留部と前記検出部との間において前記主流路と前記廃液流路とに接続されており、かつ前記主流路の上流側から移動してきた液体を前記主流路の下流側または前記廃液流路に移動させるように流路を切り換えるバルブがさらに備えられている。この場合には、バルブにより上記のように流路を切り換えることにより、本発明の定量分析方法に従って分析を行うに際し、分子認識試薬と被検出物質の会合体を濃縮担持する工程において残液を検出部に至らないように廃液流路から廃液することができ、金属イオン濃度の測定に際しては、主流路の上流側から移動してきた液体を主流路の下流側に移動させるようにバルブにより流路を切り換えることにより、金属イオン濃度に応じた被検出物質濃度を高精度に定量することができる。好ましくは、前記主流路が、被検出物質及び前記分子認識試薬を流すための第1の流路部分と、前記金属イオン濃度を測定するための第2の流路部分とを有し、前記バルブが上流側に位置する前記第1の流路部分と、下流側に位置する前記第2の流路部分と、前記廃液流路とに接続されている。
【0026】
また、本発明に係る検出用カートリッジのさらに他の特定の局面では、前記バルブが外部からの刺激により流路接続状態を切り換えるバルブである。この場合には、外部からの刺激を与えるだけで、流路接続状態を容易に切り換えることができる。
【0027】
本発明に係る検出用カートリッジのさらに別の特定の局面では、前記濃縮担持体が、多孔性材料またはメッシュ状物である。この場合には、被検出物質を被検液を多孔性材料またはメッシュ状物に大きな面積で接触させることができ、測定感度を高めることができる。このような多孔性材料としては、好ましくは、スポンジ、織布、不織布、繊維、充填された複数の微粒子、多孔性焼結体及びモノリシック多孔質体からなる群から選択した少なくとも1種の多孔質材料が用いられる。
【0028】
本発明に係る検出用カートリッジのさらに別の特定の局面では、前記主流路を移動してきた液体が前記濃縮担持体中を上流側から下流側に向かって通過するように前記主流路及び前記濃縮担持体が設けられている。この場合には、液体が濃縮担持手段中を通過するため、濃縮担持手段と被検出物質を含む被検液との接触面積をより一層高めることができ、それによって測定感度を高めることができる。
【発明の効果】
【0029】
本発明に係る定量分析方法では、カートリッジ内において、金属ナノ粒子で標識された分子認識試薬と被検出物質との免疫反応を通じて被検出物質の濃度に応じた標識物質の濃縮が速やかに行われ、標識物質である金属ナノ粒子が溶出された金属イオン溶液中の金属イオン濃度が被検液中の被検出物質濃度と相関しており、しかも被検出物質に対して高濃度に変換された金属イオンが検出部でのシグナル検出を速やかにかつ非常に高い感度で可能にしている。すなわち、10pg/mL程度の高感度な定量分析を、例えば20分以内のような比較的短時間で完了することが可能となる。
【0030】
また、上記被検出物質と分子認識試薬との会合体を濃縮担持するにあたり、残液が検出部に至らないように廃棄されるため、未反応の試薬や夾雑物を検出部に至らないように廃棄することができる。よって、測定感度を高めることができる。
【0031】
しかも、本発明の定量分析方法では、酵素反応を利用した増幅等を用いておらず、用いる金属ナノ粒子により増幅倍率が明確であるため、測定温度による影響が少なく、また、分析試薬等の保管履歴による影響も受け難い。従って、測定の信頼性を高めることが可能となる。
【0032】
本発明に係る検出用カートリッジによれば、本発明に係る定量分析方法を該検出用カートリッジを用いて行うことができるので、本発明の定量分析方法をスペースに制限のある場所や屋外において容易に行うことができる。しかも、金属ナノ粒子で標識された分子認識試薬と被検出物質の会合体を濃縮担持するに際し、残液を検出部に至らないように廃液流路から廃液することができるので、未反応の試薬や夾雑物が検出部に至らない。従って、測定感度を高めることができる。
【図面の簡単な説明】
【0033】
【図1】(a)は、本発明の一実施形態の検出用カートリッジの外観を示す斜視図及び(b)はカートリッジ本体内に構成されている流路と、貯留部及び検出部の関係を示す模式的斜視図である。
【図2】本発明の一実施形態において、検出用カートリッジ内に構成されている流路と、第1の貯留部、検出部等の関係を模式的に示す正面断面図である。
【図3】本発明の一実施形態の検出用カートリッジの分解斜視図である。
【図4】本発明の他の実施形態に係る検出用カートリッジの構造を説明するための分解斜視図である。
【図5】本発明の他の実施形態に係る検出用カートリッジにおける流路接続切り換え機構を説明するための模式図である。
【図6】本発明のさらに他の実施形態に係る検出用カートリッジにおける流路接続切り換え機構を説明するための模式図である。
【図7】(a)及び(b)は、本発明のさらに別の実施形態における検出用カートリッジの流路接続切り換え機構を説明するための各模式図である。
【図8】本発明の実施例1における被検出物質測定結果を示す図である。
【図9】CdSeナノ粒子を用いた実施例1の場合と、Agナノ粒子を用いた実施例2の場合と、電流密度測定結果を重ねて示す図である。
【図10】実施例3において、硝酸濃度を変化させた場合のAgのナノ粒子が溶解して生成したAgイオン由来のピーク電流値と硝酸濃度との関係を示す図である。
【図11】実施例4における被検出物質測定結果を示す図である。
【発明を実施するための形態】
【0034】
以下、本発明の具体的な実施形態を説明しつつ、本発明の詳細を明らかにする。
【0035】
本発明の定量分析方法では、主流路と、主流路の途中に設けられた貯留部と、主流路において貯留部よりを下流側に設けられた検出部とを備える定量分析用カートリッジを用いる。そして、少なくとも、金属ナノ粒子で標識された分子認識試薬と被検出物質との会合体が貯留部において濃縮貯留される工程と、上記会合体に含まれる金属ナノ粒子を溶解し、金属イオン溶液として検出部に搬送する工程とを備える。
【0036】
なお、主流路とは、被検出物質を含む被検液を流し、定量する一連の分析方法を実現する流路すなわち分析用流路を意味する。主流路と表現しているのは、後述の変形例で示す廃液流路と区別するためであることを指摘しておく。
【0037】
前記貯留部は、イムノアッセイに代表される分子特異的結合反応を短時間化すると同時に、濃縮、洗浄を行う足場を与える。拡散律速である分子特異的結合反応の反応場がマイクロ空間とされていることにより、反応平衡にいたる時間が短時間化される。また、前記貯留部に配置される表面が大きな多孔質上に前記被検出物質と前記分子認識試薬の会合体が濃縮される。前記貯留部で濃縮、洗浄された前記被検出物質と前記分子認識試薬の結合体に含まれる金属ナノ粒子は、酸などの適宜の溶離液の導入により、溶解して、金属イオン溶液を与える。金属イオンは、元となったひとつの金属ナノ粒子に対し、数千から数万の金属イオンとなるため、被検液中の被検出物質の濃度に比べて100倍〜10000倍の濃度になる。溶出された金属イオンは、検出部に搬送されて定量される。被検液中の被検出物質の濃度が極低濃度であっても、被検液中の被検出物質の濃度に比例する高濃度に変換された金属イオンを検出部で測定するため、検出部での金属イオン濃度の定量は容易になる。
【0038】
測定された金属イオン濃度は、被検出物質の濃度に換算される。このようにして、煩雑で数時間かかっていた濃縮及び分析を比較的短時間で、例えば20分以内で完了することができる。また、信号の増幅に酵素を用いていないため、測定温度の影響や保管履歴の影響を受け難い。本発明において、「検出」なる用語は、被検出物質の濃度に応じた金属イオン濃度を定量するための情報を収集することを広く意味する。また、被検液とは、検出対象である被検出物質を含む可能性がある限り、特に限定されるものではなく、例えば、生物学的試料[例えば、動物の体液(例えば、血液、血清、血漿、髄液、腹水、涙液、汗、膿、喀痰、または咽頭拭い液)若しくは排泄物(例えば、尿、糞便)、臓器、組織、又は動植物それ自体若しくはそれらの乾燥体]、あるいは、環境由来の試料(例えば、河川水、湖沼水、若しくは海水、又は土壌)、食品粉砕物、燃焼残渣および、これらからの抽出物を挙げることができる。
【0039】
検出用カートリッジにおける流路は、被検液、マスキング剤、洗浄液、溶離液等の種々の試薬の流れを確保し、液体を移送及び/又は貯蔵することができる限り、その形状、長さ、大きさ、数等は特に限定されず、例えば、数十μm〜数mmのオーダーの幅を有し、数十μm〜数百μmの深さを有する溝により形成されていることが適しており、例えば、流路の断面積は100μm2〜1mm2程度である。
【0040】
本発明において用いられる金属ナノ粒子で標識された分子認識試薬は、分子認識部分と、リンカー部分と、金属ナノ粒子とを有する。
【0041】
前記分子認識部分は、免疫学的検定法(イムノアッセイ)に用いられる抗体が好適に用いられる。特に、モノクローナル抗体は特異性が高いものも多く優れている。前記分子認識部分は、抗体に限られるものではなく、糖鎖、レクチン、セレクチン、DNA、RNA、ペブチド核酸、アプタマー、抗体断片Fab、抗体認識部位Fv、クラウンエーテル等の分子特異的結合能をもつ分子認識試薬を用いることができる。
【0042】
前記リンカー部分は、プロテインG、プロテインA、プロテインL、ビオチン−アビジンコンジュゲート、これらの誘導体、改変体からなる一群より選ばれる少なくとも一種を挙げることができる。
【0043】
標識に用いられる前記金属ナノ粒子としては、特に限定されないが、直径3nm〜30nmのカドミウムセレン(CdSe)ナノ粒子、カドミウムテルル(CdTe)ナノ粒子、銀(Ag)ナノ粒子が好適に用いられる。この範囲より小さいナノ粒子は安定に存在し難い。また、ナノ粒子が大きすぎると、沈降し、抗体試薬の標識としては不適となることがある。
【0044】
本発明において、上記貯留部は被検液に含まれる被検出物質と、金属ナノ粒子で標識された上記分子認識試薬とを会合させ、生成された会合体を濃縮し、保持する機能を有する。一方、会合体に取り込まれていない金属ナノ粒子を含む夾雑物を包含する分散媒、マスキング剤、または洗浄液などは貯留部を通過する。貯留部は、上記会合体を生成する反応場を増大し、かつ被検出物質を貯留/保持するために濃縮物を担持する担持手段を含むことが好ましい。
【0045】
従って、好ましくは、貯留部に担持手段として、多孔性材料もしくはメッシュ状物または微細加工表面を有する材料が好適に用いられる。多孔性材料やメッシュ状物は表面積が大きいため、特許文献2に記載のようなフィルタやメンブレンフィルタに比べ、多くの反応場を提供することができ、かつ上記会合体をより多く担持することができる。なお、多孔性材料は、材料自体が多数の孔を有するものに限らず、微粒子が凝集し、粒子間に大きくの孔が形成されているものをも含むものとする。
【0046】
上記担持手段を構成する材料は、上記多孔性材料もしくはメッシュ状物が好ましいが、より具体的には、スポンジ、織布、不織布、充填された微粒子、繊維、焼結体、モノリシック多孔質体のいずれかの様態、または、それらの組み合わせからなる様態をとる。微細加工表面としては、ナノインプリンティング法やスプレーデポジショニング法による構造表面が好適に用いられる。担持手段を構成する素材としては、例えば、セラミック、ガラス、合成繊維、植物繊維、動物性繊維、合成樹脂、セルロース系材料、金属なども用いてもよい。また、基材の表面に、被検出物質に対して化学反応を行う又は特異的結合能を有する分子や官能基で処理したものを用いてもよい。
【0047】
前記金属ナノ粒子標識された分子認識試薬から金属イオンを溶出する方法としては、酸を加える方法がとられる。ここで適当な酸としては、0.5〜3Nの硝酸が好適に使用できる。塩酸及び硫酸は、難水溶性の塩化物及び硫化物を生じるので望ましくない。
【0048】
溶出された金属イオンは、検出部へと輸送され、定量される。検出機構は、特に限定されることなく、被検出物質を検出することができる方法を実現し得る機構の全てを利用することができる。方法としては、電気化学分析法、光学分析法、他の原理を利用した分析が挙げられる。機構としては、特に限定されず、例えば、電気化学分析のための電極及び電流・電圧を印加又は読取る手段等、光学的分析法における光学セル、光源及び分光器等、又はその一部が、検出用カートリッジにおける検出区画を構成して搭載される。
【0049】
本発明の検出方法において用いられる電気化学分析法について、より具体的に記載するならば、例えば、リニアスイープボルタンメトリー(LSV)、クーロアンペロメトリー(CA)、クーロクロノメトリー(CC)、サイクリックボルタメトリー(CV)、又はアノーディック ストリッピング ボルタンメトリー(ASV)などを挙げることができる。電極構成は、三極式、四極式、二極式のいずれの方法も採用しうるが、精度と使い勝手との兼ね合いを考慮すると、三極式が望ましい。
【0050】
なお、本発明においては、上記検出部は貯留部よりも下流側に配置されているが、貯留部の下流側に連ねられて設けられ、両者が一体化されていてもよい。
【0051】
また、検出部において、被検出物質の濃度に応じた金属イオン濃度が検出されるが、この場合検出手段は、カートリッジ内またはカートリッジ上に設けられる必要は必ずしもない。もっとも、検出手段の少なくとも一部がカートリッジ内またはカートリッジ上に存在する場合には、小型化を進めることができる。
【0052】
また、検出手段の一部のみがカートリッジに設けられてもよい。例えば、光学式検出手段を用いる場合、カートリッジ内あるいはカートリッジ上に光学セルが検出部の一部として配置され、光学セルを透過してきた光を受光する受光手段を含む測定部分が、カートリッジ外の測定装置内に設けられてもよい。
【0053】
好ましくは、検出手段を構成する部材の内、濃縮カラムのように再生し難い部材や、測定前に煩雑な再生処理を要する部材、例えば電気化学的電極などはカートリッジ側に設けられることが好ましい。また、電気化学的電極分析に用いられる電極は、測定前に研磨したりしなければならないため、1回毎に、あるいは一定分析回数毎に廃棄されるカートリッジ側に設けられることが望ましい。
【0054】
他方、光学セルは、測定前に簡易な洗浄作業により再度使用することができるので、カートリッジ内に配置されてもよい。
【0055】
より具体的には、検出手段として電気化学的分析手段を用いる場合には、例えば、カートリッジ内の検出部に、作用電極、対極及び参照電極などの電極を配置し、処理ユニット内に、電流または電圧を印加もしくは読み取る手段を設ければよい。光学分析手段を用いる場合には、カートリッジ内に光学セルを設け、カートリッジ外に光源や受光手段を設ければよい。
【0056】
上記検出部における検出手段としての1つの好ましい態様は、溶出された金属イオンを含む可能性のある上記貯留部から溶出液と、金属イオンを含まない溶離液とを用い、電気化学的応答を対比する分析手段が挙げられる。
【0057】
また、別の好ましい検出手段としては、硫化物イオンを加えて生じる抵触懸濁物の濃度を光学的に検出手段が挙げられる。Cdイオン及びAgイオンは、非水溶性硫化物イオンとして、水溶液中に析出分散し、溶液を懸濁するとともに、特有の色を呈する。これを光学的手段により容易に測定することができる。透過光による吸光度を測定する方法を用いてもよく、反射光を利用する測定方法を用いてもよく、光導波路を用いた測定方法などのど様々な光学的測定方法を用いることができる。
【0058】
上記カートリッジと、カートリッジ外の測定装置との間で、液体を輸送する必要がある場合には、カートリッジの表面に液体供給及び液体排出用の複数のポートを設ければよい。複数のポートは、被検液または試薬等を導入または排出するために用いられるものであり、大きさ及び位置は特に限定されない。例えば、複数のポートは、貯留部の上流側において被検液を供給するため、貯留部と検出機構との間に、検出に用いられる溶液や洗浄液を供給するために、検出部の下流側などの適宜の位置に配置することができる。ポートの選択及び切り換えは、電磁バルブ等を用いた適宜のバルブ機構を用いて行えばよい。
【0059】
次に、本発明で用いられるカートリッジの具体的な構造例を、図面を参照しつつ説明する。
【0060】
図1(a)は本発明の一実施形態に係る検出用カートリッジの外観を示す斜視図であり、(b)はカートリッジ内に形成されている流路、及び貯留部の関係を示す模式的斜視図であり、図2はカートリッジ内に設けられている流路及び貯留部並びに検出部の関係を示す模式図である。また、図3は、本実施形態の検出用カートリッジの内部構造を示す分解斜視図である。
【0061】
図1に示すように、本実施形態の検出用カートリッジ1は、下方から第1〜第3のプレート11〜13を積層してなるカートリッジ本体2を有する。プレート11〜13は、例えば合成樹脂により形成される。各プレート11〜13は、典型的には35mm×50mmの矩形の平面形状を有し、1枚のプレートの厚みは1mm程度とされる。図1(a)では省略されているが、図3に示すように、第1〜第3のプレート11〜13は、粘着シート14,15を介して積層されている。従って、カートリッジ本体2は、約4mm程度の厚みを有する。
【0062】
図3においては、図示を容易とするために、また理解を容易とするために、第1のプレート11及び粘着シート14の向きと、残りの第2,第3のプレート12,13及び粘着シート15の向きを代えて図示している。
【0063】
カートリッジ本体2の下面には、第1〜第5のポート3〜7が形成されている。第1〜第5のポート3〜7は、カートリッジ本体2内に設けられている主流路8に接続されている。主流路8は、第1のプレート11,12間及び第2のプレート12及び第3のプレート13間のいずれかの内面に形成された溝及び/または第2のプレート12に設けられた貫通溝により形成されている。また、主流路8は、第1の流路部分9と第2の流路部分10とを有する。第1の流路部分9は、第1,第2のポート3,4を接続している。第1の流路部分9の途中に貯留部16が設けられている。また、第2の流路部分10は、第3のポート5〜第5のポート7を接続している。第2の流路部分10の途中には検出部18が設けられている。
【0064】
また、第2の流路部分10の下流側は図2には示されていない部分において、廃液貯留部19に接続されている。廃液貯留部19は、図3に示すように、第1のプレート11の上面において上方に向かって開いた凹部19a、第2のプレート12に設けられた大きな開口部19b及び第3のプレート13の下面において下方に向かって開いた凹部19cが組合わさって形成されている。
【0065】
他方、貯留部16は、第1のプレート11の上面において上方に向かって開いた凹部16aと、第2のプレート12に設けられた放射状の開口部16bとが積層されて形成されている。なお、第1のプレート11には、上記貯留部16に繋がるように前述した第2のポート4が形成されている。貯留部16内には、図2においては略図的に示すように、濃縮担持手段としての濃縮担持体21が収納されている。濃縮担持体21は、前述の適宜の担持材料により形成されている。
【0066】
この場合、図2に示されているように、第1の流路部分9が上下方向に延びる部分おいて、貯留部16が設けられているため、貯留部16内の濃縮担持体21には、上方から被検液が供給され、流路を流れる液体は濃縮担持体21を上下方向に通過する。従って、濃縮担持体21が、前述した多孔性材料もしくはメッシュ状物等からなる場合、金属ナノ粒子で標識された分子認識試薬と被検液中の被検出物質の会合体を生成する際の反応場を増大させることができる。前述した特許文献2では、ストリップ状フィルタの面方向に被検液が供給されるため、反応場が少ないのに対し、本実施形態では、濃縮担持体21を上下方向に通過するように被検液が供給されるため、反応場を著しく増大させることができる。従って、それによっても、検出感度を高めることが可能とされている。
【0067】
本実施形態では、貯留部16に、流路から被検液が供給される。この貯留部16において、金属ナノ粒子で標識された分子認識試薬と被検液中の被検出物質の会合体が生成し、濃縮される。この場合、流路に、上記被検液と上記分子認識試薬と適宜の液状媒体とを含む混合液を供給し、貯留部16に導いてもよく、あるいは、貯留部にまず被検液を供給し、しかる後分子認識試薬を貯留部16に導いてもよい。貯留部16において、上記分子認識試薬と被検出物質の会合体が濃縮される。
【0068】
他方、検出部18においては、化学電極としては、参照電極R、作用電極W及び対極Cが配置されている。ここでは、対極Cと、参照電極Rとの間の電圧及び作用電極Wと対極Cとの間の電圧に基づいて、金属イオンの析出と電位掃引アンペロメトリが行われ、金属イオン濃度が測定される。すなわち、貯留部16で会合体に取り込まれている金属ナノ粒子を、流路に金属ナノ粒子を溶解する溶離液を流し、会合体中の金属ナノ粒子を溶解することにより、金属イオン溶液が貯留部16から下流側に排出される。この金属イオン溶液中の金属イオン濃度が検出部18において検出される。
【0069】
なお、図3に示すように、第1〜第3のプレート11〜13は、粘着シート14,15を介して貼り合わされ、積層されている。粘着シート14,15は、上述した廃液貯留部19などを形成するため貫通孔を有する。また流路を接続するための複数の小さな貫通孔も有する。
【0070】
上記作用電極Wとしては、例えば、3.5mm×8.4mm×0.5mm程度の板状のカーボン電極を好適に用いることができる。対極C及び参照電極Rについても同様の寸法の板状の電極を用いることができ、対極Cは作用電極Wと同様に板状のカーボン電極を用いて作製することができる。また、参照電極Rについては、金属イオン種によって適宜最適なものが選ばれる。例えば、金属イオン種がカドミウムイオンの場合には、参照電極にアルミナ基材上に銀ペーストが塗布された電極を用いることができる。金属イオン種が銀イオンの場合には、金基財にフェロセンを固定した電極を用いることができる。
【0071】
もっとも、上記化学電極の寸法及び構造については特に限定されず、第1のプレート11上に適宜の電極材料を印刷することにより形成されてもよい。
【0072】
本実施形態では、プレート11の上面と化学電極の表面とが面一となるように、第1のプレート11の上面に凹部が形成され、該凹部を埋めるように電極材料が充填されている。
【0073】
従って、参照電極R、作用電極W及び対極Cの上面と、第1のプレート11の上面とは面一とされている。よって、第1のプレート11と第2のプレート12とを隙間を生じさせることなく容易に積層することができる。
【0074】
なお、粘着シート14には、上記参照電極R、作用電極W及び対極Cを露出させるための貫通孔14a〜14cがそれぞれ形成されている。
【0075】
これらの貫通孔14a〜14cを通して液体が参照電極R、作用電極W及び対極Cに接触されることになる。
【0076】
上記第1〜第5のポート3〜7の内、第1のポート3は、被検液や溶離液などを導入するためのポートであり、第1のプレート11に貫通孔として形成されている。なお、第2のプレート12においては、特に図示はしていないが、参照電極Rを活性化するための活性化液としての電解質溶液が貯留された電解質溶液室を設けてもよい。このような電解質溶液を上記第2の流路部分10に接続し、第2の流路部分に供給することにより、上記参照電極Rの活性化を容易に行うことができる。
【0077】
上記カートリッジにおける検出手段としては、化学電極を用いることが望ましい。より望ましくは、上記実施形態のように、カートリッジ本体2内に、化学電極としての参照電極R、作用電極Wなどが配置された検出区画が備えられていることが望ましい。化学電極を用いることにより検出手段の小型化を進めることができ、それによってカートリッジ全体の小型化を進めることができる。
【0078】
上記検出用カートリッジ1におけるカートリッジ本体2の構造は、上記貯留部及び検出部と、これらを接続する流路が形成される限り、図1〜図3に図示の構造に限定されるものではない。
【0079】
図4は、本発明の他の実施形態に係る検出用カートリッジを説明するための分解斜視図である。検出用カートリッジ51では、2枚のプレート52,53を接着剤等を用いて貼り合わすことにより構成されている。すなわち、プレート52,53を貼り合わせることによりカートリッジ本体が構成されている。
【0080】
なお、プレート52,53は、接着剤による貼り合わせに限らず、拡散接合、陽極接合、レーザー接合等の適宜の接合方法によって貼り合わすことができる。
【0081】
プレート52の下面に破線で示す多孔形状の凹部が設けられており、該蛇行形状の凹部により第1の流路部分9が形成されている。また、プレート52には、第1〜第4のポート3〜6を構成するための各貫通孔が形成されている。なお、図2の第5のポート7は記載されていない。
【0082】
プレート53の上面には、上記第1の流路部分9が形成される部分に、プレート52の下面に設けられた蛇行形状の凹部と重ねられ合う蛇行形状の凹部が設けられている。プレート52,53の蛇行形状の凹部が合体し、第1の流路部分9が形成される。また、プレート53の上面には、濃縮担持体21を含む凹部からなる第1の貯留部16が設けられている。第1の流路部分9の一端は第1のポート3に、他端は第2のポート4に接続されている。
【0083】
また、プレート53の上面には、第2の流路部分10が形成されており、第2の流路部分10の途中に、凹部からなる第2の貯留部17が設けられている。また、第2の貯留部17の下流側に、検出部18が設けられている。検出部18は、第1の実施形態と同様に構成されている。
【0084】
図5は、図1及び図4に示した検出用カートリッジに用いられる流路接続切り換え機構を説明するための模式図である。
【0085】
図1及び図4では、第1の流路部分9の下流側端部が第2のポート4に接続されており、第2の流路部分10の上流側端部が第3のポート5に接続されている。この第2のポート4と第3のポート5との間の流路を接続する切り換え機構としては、例えば図5に示す流路切り換え装置を用いる構造が挙げられる。ここでは、カートリッジ本体2の外部に流路切り換え装置として三方コック31が用意される。
【0086】
三方コック31は、第1〜第3のポート31a〜31cを有する公知の三方コックである。流路32が第2のポート4と三方コック31とに接続されており、流路33が三方コックと31と第3のポート5とを接続している。
【0087】
図5に示す状態では、第1のポート31aが流路32に接続されており、第2,第3のポート31b,31cは流路33に接続されていない。従って、第1の流路部分9から第2のポート4を経て流路32に流れ込んできた液体は、第1のポート31aから三方コック31内を通過し、第2のポート31bまたは31cから排出される。従って、第1の流路部分9から流れてきた残液を廃棄することができ、未反応の試薬等が第2の流路部分10に至ることはない。よって、この状態で第1のポート31aから洗浄液として緩衝液などを流し、濃縮担持体21及び第1の流路部分9を洗浄する。洗浄液も、三方コック31のポート31bまたは31cから洗浄液を排出することができる。
【0088】
次に、測定に際しては、三方コック31を回転し、流路32にポート31bを、流路33にポート31cを接続する。その状態で溶出液を第1のポート31aから注入し、金属ナノ粒子が溶解している溶出液を流路32、三方コック31及び流路33を介して第2の流路部分10に導き、検出部18で検出する。このように、三方コック31のような流路接続切り換え機構をカートリッジ本体2の外部に設けることにより、上記検出用カートリッジ1を用いて定量を行うことができる。
【0089】
また、図6は、本発明のさらに他の実施形態に係る検出用カートリッジにおける流路接続切り換え機構を説明するための模式図である。この流路接続切り換え機構は、カートリッジ本体2内に構成することができる。本実施形態では、カートリッジ本体2内において、第1の流路部分9と第2の流路部分10とが接続部Xにおいて接続されている。すなわち、第1の流路部分9の下流端が接続部Xに至っている。また、接続部Xと第2のポート4との間に廃液流路41が接続されている。
【0090】
言い換えれば、図2に示した構成において、第1の流路部分9の下流端に接続部Xを設け、接続部Xと第1のポート4との間を廃液流路41とした構成に相当する。第2の流路部分10の上流端は、上記のように接続部Xに接続されているため、図2に示す構造における第3のポート5は省略されることとなる。他方、第2の流路部分10の途中には検出部18が設けられており、下流端側にポート6が設けられており、図2のポート7は省略されている。ポート6は外部に開いている。
【0091】
使用に際しては、ポート6を閉じた状態で、第1のポート3から被検液及び試薬を導入する。濃縮担持体21において会合体が濃縮される。余剰の液体が廃液流路41を介して第2のポート4から排出される。ポート6が閉じられているため、第2の流路部分10においては空気の抜け道がないため、第2の流路部分10に液体は浸入しない。
【0092】
次に、第1のポート3から洗浄液を導入し、同じく洗浄後の洗浄液が第2のポート4から排出される。
【0093】
洗浄終了後、第1の流路部分9、第2の流路部分10及び廃液流路41の全体が空気で占められることになる。
【0094】
次に、第2のポート4を閉塞し、ポート6を開放する。この状態で、第1のポート3から溶出液を導入する。その結果、会合体に含まれている金属ナノ粒子が溶解し、金属ナノイオンを含む溶液が第2の流路部分10に流入し、検出部18によりイオン濃度を定量することができる。この場合、第2のポート4が閉塞されているので、溶液は選択的に第2の流路部分10に流れることになる。
【0095】
図7(a)及び(b)は、本発明のさらに他の実施形態の検出用カートリッジにおける各流路接続切り換え機構を説明するための模式図である。
【0096】
図7(a)では、図6の場合と同様に、接続部分Xにおいて、第1の流路部分9、第2の流路部分10及び廃液流路41が接続されている。異なるところは、第2の流路部分10において、検出部18よりも上流側にあって、接続部Xよりも下流側に流路を開閉するバルブ42が設けられていることにある。そして、第2の流路部分10の流動抵抗に比べて、廃液流路41における流体の流動抵抗が大きくなるように、流動抵抗増大部41aが廃液流路41に設けられていることにある。
【0097】
バルブ42を閉じた状態で、第1のポート3から被検液及び試薬を導入し、免疫会合体を濃縮担持体21で濃縮する。残液は、バルブ42が閉じられているので、第2のポート4から排出される。洗浄に際しても、同様に第1のポート3から洗浄液を導入し、第2のポート4から排出する。この場合も、バルブ42は閉じられているので、洗浄液は第2の流路部分10のバルブ42よりも下流側には至らない。
【0098】
定量に際しては、バルブ42を開状態とすればよい。その状態で、溶出液を第1のポート3から導入する。第2の流路部分10の流動抵抗が、廃液流路41における流動抵抗よりも低くされているため、金属ナノイオンを溶解した溶出液は、廃液流路41には至らず、バルブ42を介して第2の流路部分10に至る。従って、金属ナノイオン濃度を検出部18で測定することができる。
【0099】
なお、図7(b)に示すように、バルブ42は、検出部18の下流側において第2の流路部分10に設けられていてもよい。
【0100】
本発明の被検出物質の検出方法は、各種アレルゲン、例えば、卵黄、卵白、牛乳、落花生、エビ、カニ、魚、貝、大豆、マンゴーなどの食品、塵ダニ、羽毛、花粉、真菌、細菌、ゴキブリ、犬又は猫の毛が挙げられる。その他、内分泌撹乱物質、農薬、IgEもしくはIgG等の免疫グロブリン、ヒスタミン、遺伝子(RNA)、ストレスマーカー、各種タンパク質、人または動物の血液、血液成分、尿、唾液もしくは体液に含まれる抗原もしくは抗体、特定疾患を示す成分、アスベスト、血中薬物またはその他の抗体により検知可能な物質の検出に用いることができる。
【0101】
次に、本発明の検出用カートリッジを用いて、被検出物質を測定する具体的な実施例をより具体的に説明する。
【0102】
(実施例1)
まず、分析ターゲットとして、C反応性タンパク質(以下、CRPと表記する)を選定し、サンドイッチアッセイ可能な2種の抗体、すなわち、第1の抗CRPIgGと、第2の抗CRPIgGを用意した。第2の抗CRPIgGには、アダプターとしてのプロティンGを介してCdSeナノ粒子を結合し、CdSeナノ粒子標識抗体試薬とした。
【0103】
第1の抗CRPIgGは、ニトロセルロースメンブレンに物理感作させ、アルブミンでブロッキングしたのち乾燥させ、直径4ミリのディスク形状に打ち抜いて、CRPに対する濃縮担持体とした。
【0104】
次いで、図1に示したプレート11〜13を用意し、貯留部に上記濃縮担持体をセットした。さらに、検出部については前述した実施形態に従って、化学電極を配置した。
【0105】
第1〜第3のプレート11〜13としては、50mm×35mm×厚み1mmのポリメチルメタクリルプレートからなる樹脂プレートを用い、20μmの厚みの両面粘着テープを粘着シート14,15として用いた。
【0106】
上記のようにして得られた検出用カートリッジ1を用い、CRP濃度1μg/mLの標準試料を用意し、10pg/mL、50pg/mL、100pg/mLの各濃度の試料溶液を作製し、検出用カートリッジ1を用いて検量線を作成した。1つの試料溶液についての分析手順は以下の通りとした。
【0107】
まず、第1のポート3から1mLの試料溶液をマイクロシリンジを用いて主流路8の第1の流路部分9に導入し、貯留部16に導いた。
【0108】
次に、カートリッジ本体を測定装置にセットし、マイクロコンピューターで制御された送液システムにより、以下の洗浄液、抗体試薬及び洗浄液(2回目)、及び溶出液を前記貯留部に順次導いた。すなわち、まず、ポート3から第1の流路部分9を介して貯留部16に、洗浄液としてリン酸緩衝液を4mL、1mL/min.の速度で導入した。次に、抗体試薬として前記CdSeナノ粒子抗体試薬を、第1のポート3から、1.0mL、200μL/min.の流速で貯留部16に導いた。しかる後、洗浄液としてのリン酸緩衝液を、第1のポート3から、2mL、1mL/min.の速度で、貯留部16に導き、次に、標識を溶かしだす溶出液として1Nの硝酸水溶液を第1のポート3から、0.2mL及び50μL/min.の流速で貯留部16に導いた。
【0109】
次に、溶出された金属イオンが溶解している可能性がある溶出液を検査部に送液した。検査部において、リニアスイープボルタンメトリー(LSV)により、測定を行った。掃引速度は5mV/秒とし、200mVから700mVまで掃引し、電流値を測定した。結果を図8に示す。図8において、横軸は掃引電位であり、縦軸は、電流値である。−0.8Vから−0.6V近傍のハッチングしてある部分の面積が、標識由来の金属イオンの検出量である。夾雑イオン種は異なる電位にピークがあるので、目的の金属イオン種と明瞭に区別できる。参照電極に用いたAg/AgCl由来の銀の小さなピークが0V近傍にあるが、これとも区別できる。従って、上記リニアスイープボルタンメトリーを用いることにより、被検出物質の濃度を高精度に検出し得ることがわかる。
【0110】
(銀ナノ粒子を用いた実施例2)
上記CdSeナノ粒子を用いた実施例1と同様にして、ただし、CdSeナノ粒子に代えてAgナノ粒子を用い、上記実施例1と同様にして検出物質の濃度の検出を試みた。結果を図9に示す。図9においては、比較を容易とするために、上記CdSeナノ粒子を用いた実施例1の場合の結果も併せて示す。図9から明らかなように、Agナノ粒子を用いた場合の方が、CdSeナノ粒子を用いた場合よりも被検出物質濃度を高感度に検出し得ることが分かる。なお、実施例1でみられた参照電極に用いたAg/AgCl由来の銀の小さなピークは、Agナノ粒子由来の信号のバックグランドとして補正に用いる。
【0111】
(好ましい硝酸濃度についての実施例3)
上記実施例1及び実施例2において、金属ナノ粒子をイオン化する際の溶出液として硝酸を用いていたが、硝酸濃度の好ましい範囲につき検討した。粒径20nmのAgナノ粒子を、0.01N〜5Nの硝酸にて溶解し、10μmのAgイオン溶液を調製した。リニアスイープボルタンメトリー(LSV)により50mV/秒の挿入速度で、−0.5Vから0.8Vまで挿引し、電流値を測定した。その結果からピーク電流値と硝酸濃度との関係を求めた。結果を図10に示す。
【0112】
図10から明らかなように、硝酸濃度が0.5N〜3Nであれば、より好ましくは1N〜2Nの範囲であれば、Agイオンを高い感度で測定し得ることが分かる。なお、硝酸濃度が5Nの場合には、参照電極の銀塩化銀部分が変色し、電流が安定せず測定を行うことはできなかった。
【0113】
(実施例4)
被検出物質として、心疾患マーカーである脳性ナトリウム利尿ペプチド(以下、BNPと表記する)を選定し、一次抗体として、BNPを認識する抗BNP抗体を、二次抗体として、抗BNP抗体とBNPの複合体を認識する抗Fab24C5/BNP抗体を用いて、以下の手順で検出を行った。
【0114】
(1)水溶性銀ナノ粒子の作製
疎水性銀ナノ粒子(大研化学社製)15mgを800μLのエタノールに分散させた。ここにエタノールに溶解させたN−〔(S)−3−メルカプト−2−メチルプロピオニル〕−L−プロリン(シグマアルドリッチ社製)25mgを加え、NaOH水溶液を加え、分散液を調製した。
【0115】
ピンチコックされたキャピラリー流路(ピンチコック幅自動調整装置)を備える高圧液体反応装置であるAKICO社製「HPB−450」を用い、圧力35MPa、流速2.6mL/分で分散液を通液した。全量の処理に要した時間は、約10分間であった。この処理により、疎水性銀ナノ粒子の表面修飾剤が置換され、水溶性銀ナノ粒子が生成された。通液後の分散液をクロロホルム洗浄した後、限外濾過膜(Millipore社製、「Amicon Ultra−4」)及びセファデックスカラム(Amersham Biosciences社製、「MicroSpin G−25 Columns」)を用いて精製と濃縮を行い、精製した水溶液性銀ナノ粒子を得た。
【0116】
得られた銀ナノ粒子は、水に分散し、橙色の分散液を与える。動的光散乱法による粒径測定装置(Malvern社製、「ZETASIZER Nano Series Nano−ZS」)を用いて粒子径分布を測定した結果、ピーク粒子径は3.6nmであった。
【0117】
(2)水溶性銀ナノ粒子標識抗体の調製
上記の銀ナノ粒子水溶液を、同体積の100mMシステイン溶液に、100mMの1−エチル−3−(3−ジメチルアミノプロピル)カルボジイミド塩酸塩(EDC)及びヒドロキシスクシンイミド(NHS)カップリング剤(いずれもPierce Biotechnology社製)共存のもとで、4℃、1時間混合した。Nap−5カラム(Amersham Biosciences社製)を用いて遊離アミノ酸を除去した後、sulfo−SMCCカップリング剤(Pierce Biotechnology社製)を用いて、銀ナノ粒子に二次抗体を結合させ、4℃で2時間超音波分離させた。生成物をセファデックスカラム(Amersham Biosciences社製)で精製後、限外濾過後(NMWL 100kDa、Millipore社製)を用いて濃縮し、銀ナノ粒子表面に抗BNP抗体が結合した水溶性銀ナノ粒子標識抗体試薬を作製した。
【0118】
(3)ラテックス抗体試薬の作製
平均粒径0.087μmのポリスチレンラテックス(固形分10%(W/V))1容に、ラテックス希釈用緩衝液9容を添加してラテックスを希釈し、1.0%(W/V)ラテックス液とした。一次抗体を抗体希釈用緩衝液で希釈し、感作用の抗体液とした。1.0%(W/V)ラテックス液600μLを25℃のインキュベーター中でマグネチックスターラーで攪拌しながら、これに抗体液1200μLを素早く添加し、25℃にて1時間攪拌した。その後、ブロッキング用緩衝液を3.0mL添加し、25℃にて続けて2時間攪拌した。その後、15℃、15,000rpmにて15分間遠心分離した。得られた沈殿にブロッキング用緩衝液を4.0mL添加し、同様に遠心分離することにより、沈殿を洗浄した。洗浄操作は3回行った。この沈殿にブロッキング用緩衝液を1.8mL添加し、よく攪拌した後、超音波破砕機にて分散処理を行った。これにさらにブロッキング用緩衝液を1.8mL添加し、ラテックス抗体試薬とした。
【0119】
(4)水溶性銀ナノ粒子標識抗体を使用した分析例
BNP濃度2μg/mLの標準試料を用意し、0.01pg/mL、0.1pg/mL、1pg/mL、10pg/mL、100pg/mLの各濃度の試料溶液を作製した。これらの標準試料溶液それぞれ1mLに、(3)のラテックス抗体試薬20μLを加え攪拌した。ここに(2)の水溶性銀ナノ粒子標識抗体試薬30μLを加え、さらに攪拌した。この溶液を図1の検出用カートリッジに導入した。以下の操作は、実施例2と同様にしてピーク面積の測定を行った。結果を図11に示す。
【0120】
図11から明らかなように、実施例1と同様にリニアスイープボルタンメトリーを用いることにより被検出物の濃度を高精度に検出し得ることが分かる。
【符号の説明】
【0121】
1…検出用カートリッジ
2…カートリッジ本体
3〜7…第1〜第5のポート
8…主流路
9…第1の流路部分
10…第2の流路部分
11〜13…第1〜第3のプレート
14…粘着シート
14a〜14c…貫通孔
15…粘着シート
16,17…第1,第2の貯留部
16a…凹部
16b…開口部
18…検出部
19…廃液貯留部
19a…凹部
19b…開口部
19c…凹部
21…濃縮担持体
31a〜31c…第1〜第3のポート
32,33…流路
41…廃液流路
41a…流動抵抗増大部
42…バルブ
51…検出用カートリッジ
52,53…プレート
【特許請求の範囲】
【請求項1】
被検出物質を含む被検液が供給される主流路と、該流路の途中に設けられた貯留部と、
前記流路において前記貯留部よりも下流側に設けられた検出部とを備える検出用カート
リッジを用いた定量分析方法であって、
前記貯留部において、金属ナノ粒子で標識された分子認識試薬と前記被検出物質の会合体を濃縮担持し、かつ残液を検出部に至らないように廃液する工程と、
前記会合体に結合されている前記金属ナノ粒子を溶解し、金属イオン溶液を得る工程と、
前記金属イオン溶液を前記検出部に搬送する工程と、
前記検出部において、前記金属イオン濃度を測定し、金属イオン濃度に応じた前記被検出物質濃度を定量する工程とを備える、定量分析方法。
【請求項2】
前記貯留部に、前記被検出物質に対して特異的に結合する特異的結合分子が予め固定されており、
前記被検出物質を含む被検液を貯留部に導入することにより、前記被検出物質と前記特異的結合分子とが会合し、前記貯留部において、前記被検出物質が濃縮され、
前記金属ナノ粒子で標識された前記分子認識試薬が前記貯留部に導入されることにより、金属ナノ粒子で標識された前記分子認識試薬と前記被検出物質との会合体が、前記貯留部に濃縮貯留される、請求項1に記載の定量分析方法。
【請求項3】
前記貯留部に多孔体が予め配置されており、
前記濃縮貯留に際し、前記被検出物質を含む被検液と、前記金属ナノ粒子で標識された分子認識試薬と、前記被検出物質に対して特異的に結合する特異的結合分子が固定されたビーズとを混合することにより得られた凝集物を含む懸濁液を前記流路を通じて前記貯留部に導入し、金属ナノ粒子で標識された前記分子認識試薬と前記被検出物質の会合体を含む凝集物を前記貯留部において濃縮貯留する、請求項1に記載の定量分析方法。
【請求項4】
前記金属ナノ粒子を溶解し、金属イオン溶液を得る工程が、溶離液として酸を加える工程を含む請求項1〜3のいずれか1項に記載の定量分析方法。
【請求項5】
前記ビーズとして、ポリマー粒子を用いる、請求項3に記載の定量分析方法。
【請求項6】
前記ビーズとして、少なくとも最表面の一部が、金属からなる粒子を用いる、請求項3または5に記載の定量分析方法。
【請求項7】
前記検出部に、前記金属イオンを検出するための電気化学的電極が配置されており、金属イオン濃度の定量に際し、前記電気化学的電極上へ電気化学的に金属を析出させた後、電位を掃引しつつ電流を測定する、請求項1〜6のいずれか1項に記載の定量分析方法。
【請求項8】
前記金属ナノ粒子が溶解された金属イオン溶液に硫化物イオンを加えることにより生じる非水溶性の硫化物塩が分散した懸濁液を前記検出部において光学的に検出することにより、前記金属イオン濃度を定量する、請求項1〜6のいずれか1項に記載の定量分析方法。
【請求項9】
前記被検出物質を含む被検液が供給される主流路と、該主流路の途中に設けられた貯留部と、前記流路において前記貯留部よりも下流側に設けられた検出部と、前記第1の貯留部と前記検出部との間において前記主流路に接続されておりかつ前記検出部には接続されていない廃液流路とを備えるカートリッジ本体と、
前記貯留部に設けられており、前記被検出物質と、金属ナノ粒子で標識された分子認識試薬との会合体を濃縮貯留する濃縮担持体と、
前記検出部に設けられており、前記被検出物質の濃度に応じた金属イオン濃度を測定し、該金属イオン濃度に応じた被検出物質濃度を定量するための検出手段とを備える、検出用カートリッジ。
【請求項10】
前記貯留部と前記検出部との間において前記主流路と前記廃液流路とに接続されており、かつ前記主流路の上流側から移動してきた液体を前記主流路の下流側または前記廃液流路に移動させるように流路を切り換えるバルブをさらに備える、請求項9に記載の検出用カートリッジ。
【請求項11】
前記主流路が、被検出物質及び前記分子認識試薬を流すための第1の流路部分と、前記金属イオン濃度を測定するための第2の流路部分とを有し、前記バルブが上流側に位置する前記第1の流路部分と、下流側に位置する前記第2の流路部分と、前記廃液流路とに接続されている、請求項10に記載の検出用カートリッジ。
【請求項12】
前記バルブが外部からの刺激により流路接続状態を切り換えるバルブである、請求項10または11に記載の検出用カートリッジ。
【請求項13】
前記濃縮担持体が、多孔性材料またはメッシュ状物である、請求項9〜12のいずれか1項に記載の検出用カートリッジ。
【請求項14】
前記多孔性材料が、スポンジ、織布、不織布、繊維、充填された複数の微粒子、多孔性焼結体及びモノリシック多孔質体からなる群から選択した少なくとも1種の多孔質材料からなる、請求項13に記載の検出用カートリッジ。
【請求項15】
前記主流路を移動してきた液体が前記濃縮担持体中を上流側から下流側に向かって通過するように前記主流路及び前記濃縮担持体が設けられている、請求項9〜14のいずれか1項に記載の検出用カートリッジ。
【請求項1】
被検出物質を含む被検液が供給される主流路と、該流路の途中に設けられた貯留部と、
前記流路において前記貯留部よりも下流側に設けられた検出部とを備える検出用カート
リッジを用いた定量分析方法であって、
前記貯留部において、金属ナノ粒子で標識された分子認識試薬と前記被検出物質の会合体を濃縮担持し、かつ残液を検出部に至らないように廃液する工程と、
前記会合体に結合されている前記金属ナノ粒子を溶解し、金属イオン溶液を得る工程と、
前記金属イオン溶液を前記検出部に搬送する工程と、
前記検出部において、前記金属イオン濃度を測定し、金属イオン濃度に応じた前記被検出物質濃度を定量する工程とを備える、定量分析方法。
【請求項2】
前記貯留部に、前記被検出物質に対して特異的に結合する特異的結合分子が予め固定されており、
前記被検出物質を含む被検液を貯留部に導入することにより、前記被検出物質と前記特異的結合分子とが会合し、前記貯留部において、前記被検出物質が濃縮され、
前記金属ナノ粒子で標識された前記分子認識試薬が前記貯留部に導入されることにより、金属ナノ粒子で標識された前記分子認識試薬と前記被検出物質との会合体が、前記貯留部に濃縮貯留される、請求項1に記載の定量分析方法。
【請求項3】
前記貯留部に多孔体が予め配置されており、
前記濃縮貯留に際し、前記被検出物質を含む被検液と、前記金属ナノ粒子で標識された分子認識試薬と、前記被検出物質に対して特異的に結合する特異的結合分子が固定されたビーズとを混合することにより得られた凝集物を含む懸濁液を前記流路を通じて前記貯留部に導入し、金属ナノ粒子で標識された前記分子認識試薬と前記被検出物質の会合体を含む凝集物を前記貯留部において濃縮貯留する、請求項1に記載の定量分析方法。
【請求項4】
前記金属ナノ粒子を溶解し、金属イオン溶液を得る工程が、溶離液として酸を加える工程を含む請求項1〜3のいずれか1項に記載の定量分析方法。
【請求項5】
前記ビーズとして、ポリマー粒子を用いる、請求項3に記載の定量分析方法。
【請求項6】
前記ビーズとして、少なくとも最表面の一部が、金属からなる粒子を用いる、請求項3または5に記載の定量分析方法。
【請求項7】
前記検出部に、前記金属イオンを検出するための電気化学的電極が配置されており、金属イオン濃度の定量に際し、前記電気化学的電極上へ電気化学的に金属を析出させた後、電位を掃引しつつ電流を測定する、請求項1〜6のいずれか1項に記載の定量分析方法。
【請求項8】
前記金属ナノ粒子が溶解された金属イオン溶液に硫化物イオンを加えることにより生じる非水溶性の硫化物塩が分散した懸濁液を前記検出部において光学的に検出することにより、前記金属イオン濃度を定量する、請求項1〜6のいずれか1項に記載の定量分析方法。
【請求項9】
前記被検出物質を含む被検液が供給される主流路と、該主流路の途中に設けられた貯留部と、前記流路において前記貯留部よりも下流側に設けられた検出部と、前記第1の貯留部と前記検出部との間において前記主流路に接続されておりかつ前記検出部には接続されていない廃液流路とを備えるカートリッジ本体と、
前記貯留部に設けられており、前記被検出物質と、金属ナノ粒子で標識された分子認識試薬との会合体を濃縮貯留する濃縮担持体と、
前記検出部に設けられており、前記被検出物質の濃度に応じた金属イオン濃度を測定し、該金属イオン濃度に応じた被検出物質濃度を定量するための検出手段とを備える、検出用カートリッジ。
【請求項10】
前記貯留部と前記検出部との間において前記主流路と前記廃液流路とに接続されており、かつ前記主流路の上流側から移動してきた液体を前記主流路の下流側または前記廃液流路に移動させるように流路を切り換えるバルブをさらに備える、請求項9に記載の検出用カートリッジ。
【請求項11】
前記主流路が、被検出物質及び前記分子認識試薬を流すための第1の流路部分と、前記金属イオン濃度を測定するための第2の流路部分とを有し、前記バルブが上流側に位置する前記第1の流路部分と、下流側に位置する前記第2の流路部分と、前記廃液流路とに接続されている、請求項10に記載の検出用カートリッジ。
【請求項12】
前記バルブが外部からの刺激により流路接続状態を切り換えるバルブである、請求項10または11に記載の検出用カートリッジ。
【請求項13】
前記濃縮担持体が、多孔性材料またはメッシュ状物である、請求項9〜12のいずれか1項に記載の検出用カートリッジ。
【請求項14】
前記多孔性材料が、スポンジ、織布、不織布、繊維、充填された複数の微粒子、多孔性焼結体及びモノリシック多孔質体からなる群から選択した少なくとも1種の多孔質材料からなる、請求項13に記載の検出用カートリッジ。
【請求項15】
前記主流路を移動してきた液体が前記濃縮担持体中を上流側から下流側に向かって通過するように前記主流路及び前記濃縮担持体が設けられている、請求項9〜14のいずれか1項に記載の検出用カートリッジ。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【公開番号】特開2010−107503(P2010−107503A)
【公開日】平成22年5月13日(2010.5.13)
【国際特許分類】
【出願番号】特願2009−224753(P2009−224753)
【出願日】平成21年9月29日(2009.9.29)
【出願人】(000002174)積水化学工業株式会社 (5,781)
【Fターム(参考)】
【公開日】平成22年5月13日(2010.5.13)
【国際特許分類】
【出願日】平成21年9月29日(2009.9.29)
【出願人】(000002174)積水化学工業株式会社 (5,781)
【Fターム(参考)】
[ Back to top ]

