宿主対移植片疾患の検査方法
【課題】 同種抗原認識を検出する方法,およびかかる方法に用いる検査薬を提供すること。
【解決手段】
同種抗原認識の成立とCCL8の発現量の増加とが有意に関連することが見いだされた。宿主対移植片疾患を検査するための方法であって,被験者または被検動物から得た試料中のCCL8蛋白質の量を測定し,得られた測定値を宿主対移植片疾患の診断または経過の指標とすることを特徴とする方法が開示される。また,抗CCL8抗体を含む宿主対移植片疾患の検査薬も提供される。
【解決手段】
同種抗原認識の成立とCCL8の発現量の増加とが有意に関連することが見いだされた。宿主対移植片疾患を検査するための方法であって,被験者または被検動物から得た試料中のCCL8蛋白質の量を測定し,得られた測定値を宿主対移植片疾患の診断または経過の指標とすることを特徴とする方法が開示される。また,抗CCL8抗体を含む宿主対移植片疾患の検査薬も提供される。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は,宿主対移植片疾患を検査するための方法および試薬に関する。
【背景技術】
【0002】
臓器移植は,他人の臓器,例えば,皮膚,腎臓,肝臓,心臓,肺,膵臓などを移植することにより,臓器の障害を治療する方法である。移植医療において,他人の臓器組織はすべて同種抗原(アロ抗原)として認識される。生物の細胞表面には自己と非自己を区別するための抗原(主要組織適合抗原:MHC)が発現しており,その違いによって非自己の細胞,すなわち自己と異なるMHCをもつ細胞を認識,攻撃,排除する自己防衛機構が備わっている。その中心的な役割を担っているのはCD4陽性リンパ球であり,非自己の細胞を認識すると活性化,増殖し,種々の生理活性物質(サイトカイン,ケモカインなど)の産生といった免疫反応を引き起こす。このため,移植医療においては,移植拒絶を防止するために,ドナーと宿主とのHLA抗原のタイプが一致するようにドナーを選択し,かつ,宿主に薬剤を投与してこれらの免疫反応を抑制することが必要である。しかしながら,HLA抗原にはきわめて多くのタイプがあり,完全に一致するドナーを見いだすことは非常に困難である。
【0003】
同種抗原認識には抗原提示細胞とリンパ球などの免疫担当細胞の二者が少なくとも必要であり,両者の間にMHCの不一致が存在することにより成立する。抗原提示細胞(樹状細胞:DCなど)が発現する組織適合抗原II(MHCクラスII)を同種CD4T細胞が認識することにより同種抗原認識が行われる。その結果,CD4陽性T細胞が活性化し,様々な生理活性物質(サイトカイン,ケモカイン)が産生される。それらの生理活性物質は宿主体内での炎症を惹起し,リンパ球,マクロファージなどの免疫担当細胞を増殖,活性化させる。
【0004】
体内で起こっている同種抗原認識を血清などでモニターできれば,臓器拒絶などの移植免疫状態を客観的に観察可能となり,診断治療に大きな貢献ができると考えられる。過去の研究では,同種抗原認識の際に腫瘍崩壊因子アルファ(TNF−α)やインターフェロンガンマ(IFN−γ)といったサイトカインが産生されることがわかっている。しかし,IFN−γは同種抗原認識の有無に関わらず,活性化されたリンパ球からも産生されるため,同種抗原認識の分子マーカーとしては不十分である。したがって,宿主対移植片疾患を早期に診断し,早期に治療を開始し,治療効果を客観的にモニターするために,同種抗原認識に特異的な分子マーカーを発見することが求められている。
【先行技術文献】
【特許文献】
【0005】
【特許文献1】WO2009/001545
【発明の概要】
【発明が解決しようとする課題】
【0006】
本発明は,同種抗原認識を検出する方法およびかかる方法に用いる検査薬を提供することを目的とする。
【課題を解決するための手段】
【0007】
本発明者らは,MHCの異なるマウスからの免疫細胞を混合培養して解析したところ,同種抗原認識の成立とCCL8の発現量の増加とが有意に関連することを発見して,本発明を完成した。
【0008】
すなわち,本発明は,宿主対移植片疾患(HVGD)を検査するための方法を提供する。この方法は,被験者または被検動物から得た試料中のCCL8蛋白質の量を測定し,得られた測定値を宿主対移植片疾患の診断または経過の指標とすることを特徴とする。
【0009】
好ましくは,CCL8蛋白質の量は,抗CCL8抗体を用いて測定される。また好ましくは,CCL8蛋白質の量は,質量分析計,高速液体クロマトグラフィーおよび2次元電気泳動からなる群より選択される方法を用いて測定される。
【0010】
別の観点においては,本発明は,抗CCL8抗体を含む宿主対移植片疾患の検査薬を提供する。
【0011】
さらに別の観点においては,本発明は,宿主対移植片疾患の治療薬の候補物質を選択する方法を提供する。この方法は,
宿主対移植片疾患のモデル動物に試験物質を投与し,
前記モデル動物から得た試料中のCCL8蛋白質の量を測定し,そして,
試験物質を投与したときに投与していないときと比較してCCL8蛋白質の量が低い場合に,その試験物質を宿主対移植片疾患の治療薬の候補物質として選択する,
の各工程を含む。
【発明の効果】
【0012】
本発明にしたがえば,臓器組織移植において,体内での移植臓器の同種抗原認識をモニターすることができ,宿主対移植片疾患の発症および進行を早期に診断することが可能となる。
【図面の簡単な説明】
【0013】
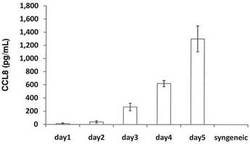
【図1】図1は,同種抗原認識におけるCCL8の発現を示す。
【図2】図2は,同種抗原認識における各種サイトカインの発現を示す。
【図3】図3は,中和抗体の存在下におけるCCL8の発現を示す。
【図4】図4は,樹状細胞と,CD4陽性T細胞および/またはマクロファージとの混合培養におけるCCL8の発現を示す。
【図5】図5は,樹状細胞と,CD4+T細胞またはCD8+T細胞との混合培養におけるCCL8の発現を示す。
【図6】図6は,CCL8の発現の用量応答性を示す。
【図7】図7は,同種抗原認識におけるIFNγの発現を示す。
【図8】図8は,インビボ同種移植実験の結果を示す。
【図9】図9は,同種抗原認識におけるCD4+T細胞の活性化およびCCL8発現を示す。
【発明を実施するための形態】
【0014】
本発明は,被験者の血液などの被検試料におけるCCL8の発現量を測定することにより,同種抗原認識を検出して,宿主対移植片疾患(HVGD)を診断し,経過をモニタリングする方法を特徴とする。下記の実施例に具体的に示されるように,同種アロ抗原認識によってCCL8が発現することが明らかとなった。すなわち,CCL8は同種抗原認識のバイオマーカーとして有用であることが明らかとなった。
【0015】
CCL8とは,ケモカイン・ファミリーに属する塩基性ヘパリン結合性分泌蛋白質であり,MCP−2とも称される(GenBank Accession No. NP_005614)。この蛋白質は,単球,線維芽細胞,上皮細胞などで産生され,レセプターとして,CCR2,CCR3,CCR5およびCCR11に結合することが知られている。CCL8は,CD4陽性T細胞,CD8陽性T細胞,単球,NK細胞,好酸球,好塩基球などを標的細胞とすることが明らかにされている。しかしながら,生体内におけるCCL8の役割や免疫系の調節におけるその意義は十分に解明されていない。
【0016】
本発明者らは先に,CCL8を指標として造血幹細胞移植により生ずる移植片対宿主疾患の発症および経過を診断することができることを見いだした(WO/2009/001545:特許文献1)。しかし,このCCL8の発現と移植片対宿主疾患との相関のメカニズムは不明であった。また,骨髄移植における拒絶反応(移植片対宿主疾患;GVHD)と,臓器移植における拒絶反応(宿主対移植片疾患;HVGD)とは,免疫学的には大きく異なることが知られているが,その免疫反応の詳細は明らかになっていない。本発明にしたがって,CCL8を同種抗原認識のバイオマーカーとして利用することにより,今後これらの免疫反応のメカニズムに関する研究が進むことが期待される。
【0017】
CCL8蛋白質の量を測定すべき被検試料としては,被験者または被検動物から得た体液,血液,血清,血漿などを用いることができる。また,被験者から採取された組織や細胞を用いてもよい。
【0018】
被験者から得た試料におけるCCL8蛋白質の量は,抗CCL8抗体を用いて,当該技術分野においてよく知られる免疫学的測定法を用いて測定することができる。抗CCL8抗体はポリクローナル抗体であってもモノクローナル抗体であってもよい。各種の抗CCL8ポリクローナル抗体およびモノクローナル抗体が市販されており,それらのいずれの抗体も本発明において用いることができる。
【0019】
あるいは,抗体は当該技術分野においてよく知られる方法により作成してもよい。CCL8に結合するポリクローナル抗体は,CCL8またはそのペプチド断片を感作抗原として用いて動物を免疫し,免疫した動物から抗体を含有する抗血清を単離し,ELISAアッセイ,ウエスタンブロット分析,またはラジオイムノアッセイ等の当該技術分野においてよく知られる方法を用いて,所望の特異性を有する抗体の存在を確認することにより得ることができる。
【0020】
CCL8に結合するモノクローナル抗体は,当該技術分野においてよく知られる方法にしたがって,CCL8またはそのペプチド断片を感作抗原として用いて動物を免疫し,得られる免疫細胞を取り出して骨髄腫細胞と融合させ,抗体を産生するハイブリドーマを選択してクローニングし,このハイブリドーマを培養することにより得ることができる。
【0021】
このようにして得られた抗体を用いて,免疫学的方法により,被験者または被検動物から得た試料中のCCL8蛋白質を測定する。測定は,定性的であっても定量的であってもよい。被験者から得たCCL8の発現の免疫学的測定は,例えば,ラジオイムノアッセイ,ELISA,免疫沈降法,免疫凝集法,ウエスタンブロット等を用いて行うことができる。
【0022】
例えば,典型的な例として,以下のようにしてサンドイッチELISAを行うことができる。被験者の末梢血を採血して血漿を調製し,これを抗CCL8抗体を固定化したプレートまたはチップに加え,適当な時間インキュベートする。プレートまたはチップを洗浄して未結合成分を除去した後,別の抗CCL8抗体を加える。この抗体は,酵素,蛍光色素,化学発光物質,ビオチン,放射線化合物等により検出可能なように標識することができる。適当な時間インキュベートした後,プレートまたはチップを洗浄し,蛍光,発光,放射活性等を測定することにより,標識を検出する。あるいは,抗CCL8抗体を結合させた後,二次抗体(例えばヤギ抗マウス抗体)を加えてシグナルを増強してもよい。二次抗体は,酵素,蛍光色素,化学発光物質,ビオチン,放射線化合物等により検出可能なように標識することができる。このようにして,被験者から得た血漿におけるCCL8蛋白質の量を測定することができる。
【0023】
別の態様においては,凝集反応を利用した検出方法を用いてCCL8蛋白質を検出することができる。この方法においては,抗CCL8抗体を結合させた担体,例えばラテックス粒子を用いてCCL8を検出することができる。抗CCL8抗体を結合させたラテックス粒子を試料と混合して一定時間インキュベートすると,試料中にCCL8が含まれる場合には粒子が凝集する。この凝集の程度を肉眼で観察するか,または分光光度計を用いて定量することにより,試料中のCCL8を検出することができる。
【0024】
別の態様においては,表面プラズモン共鳴現象を利用したバイオセンサーを用いてCCL8蛋白質を検出することができる。表面プラズモン共鳴現象を利用したバイオセンサーは,蛋白質−蛋白質間の相互作用を表面プラズモン共鳴シグナルとしてモニターすることが可能である。例えば,BIAcore(Pharmacia製)等のバイオセンサーを用いることにより,CCL8蛋白質と抗CCL8抗体の結合を検出することができる。具体的には,抗CCL8抗体を固定化したセンサーチップに,被検試料を接触させ,抗CCL8抗体に結合するCCL8蛋白質を共鳴シグナルの変化として検出することができる。
【0025】
あるいは,CCL8蛋白質は,被検試料を金属キレート剤やヘパリン等のアフィニティー担体を用いて粗精製(濃縮)した後に,MSにより検出および定量してもよい。また,HPLCにより検出および定量してもよく,2次元電気泳動をした後に銀染色により検出および定量してもよい。
【0026】
本発明はまた,抗CCL8抗体を含む宿主対移植片疾患検査薬を提供する。本発明の宿主対移植片疾患検査薬は,検査キットの形で提供することができる。検査キットは,CCL8の検出のための試薬,例えば,抗CCL8抗体を有効成分として含む。また,このキットは,測定に必要な適当な試薬類,例えば緩衝液,希釈液,反応停止液,洗浄液,コントロール標品などをさらに含んでいてもよい。
【0027】
本発明においては,このようにして測定されたCCL8蛋白質の量を指標として,宿主対移植片疾患の検査を行うことができる。本発明の方法にしたがえば,臨床症状の観察ではなく,CCL8蛋白質をマーカーとして,宿主対移植片疾患を客観的に診断することができ,宿主対移植片疾患の発症および経過をモニタリングすることができる。本発明の検査方法は,例えば,宿主対移植片疾患の発症前の診断(早期診断),発症の確定診断,重篤度の判定,疾患の経過のモニタリング,治療効果の判定,および予後の予測に有用である。
【0028】
さらに,本発明にしたがって,CCL8の発現量を指標として,宿主対移植片疾患の治療薬の有力な候補物質をスクリーニングすることが可能である。スクリーニングは,宿主対移植片疾患のモデル動物,例えば同種臓器移植を受けた動物に試験物質を投与し,モデル動物から得た試料中のCCL8蛋白質の量を測定することにより行う。試験物質としては,例えば,抗CCL8抗体を用いることができる。あるいは,試験物質は,種々の合成又は天然の化合物ライブラリー,コンビナトリアルライブラリー,オリゴヌクレオチドライブラリー,ペプチドライブラリー等のライブラリーから取得してもよい。また,細菌,真菌類,藻類,植物,動物等の天然物からの抽出物やその部分精製物を試験物質として用いてもよい。試験物質を投与したときに投与していないときと比較してCCL8蛋白質の量が低い場合には,その試験物質を宿主対移植片疾患の治療薬の候補物質として選択することができる。すなわち,本発明の検査方法は,宿主対移植片疾患の新規治療法開発におけるプラットフォームを提供するものである。
【0029】
以下に実施例により本発明をより詳細に説明するが,本発明はこれらの実施例により限定されるものではない。
【実施例】
【0030】
同種抗原認識におけるCCL8の発現
MHCの異なるマウスの組み合わせ(C57BL/6マウスとBalb/cマウス)を用いて,C57BL/6マウス脾臓細胞とBalb/cマウス樹状細胞とを生体外混合培養した。樹状細胞は,Balb/cマウスの脾臓細胞から磁気ビーズを用いて分離した。Balb/cマウスの抗原提示細胞として,1x105個の樹状細胞を96ウエルの培養プレートに播種し,C57BL/6マウスの脾臓有核細胞1x106個とともに混合培養した。培養開始後1,2,3,4,5日目の上清のCCL8濃度をELISAにより定量した。その結果,培養開始後3〜4日目には培養上清中にCCL8蛋白質が発現していることが確認された(図1)。対照として同系(syngenic)の細胞を用いた場合にはCCL8の発現は検出されなかった。
【0031】
同種抗原認識における各種サイトカインの発現
同種抗原認識状態におけるCCL8発現機構を解析するために,Balb/cマウスの抗原提示細胞として樹状細胞を1x105個と,種々の個数のC57BL/6マウスの脾臓有核細胞とを丸底96穴プレートで,10%ウシ胎児血清(FCS),2mmol/Lのグルタミン,100U/mLのペニシリンおよび100μ/mLのストレプトマイシンとを補充したRPMI1640中,37℃,5%CO2下で混合培養した。培養開始後6時間で細胞からmRNAを抽出し,リアルタイムPCR法にて各種サイトカインの発現を定量した。結果を図2に示す。図2のグラフでは,GAPDHに対して標準化した値を,同系抗原における発現のレベルを1とした相対値で表されている。IL−2,TNF−α,およびIFNγがCCL8に先立って発現することが見いだされた。
【0032】
次に,これらのサイトカインに対する中和抗体の存在下で,Balb/cマウス樹状細胞とC57BL/6マウス脾臓細胞を4日間混合培養し,培養上清におけるCCL8の濃度を定量した。抗IL−2抗体および抗IFNγ抗体の添加によりCCL8発現は低下し,抗TNFα抗体でもCCL8発現の減少が見られた(図3)。このことから,同種抗原認識におけるCCL8の発現には,MHCクラスII,INFγ,IL2,およびTNFαが関与していることがわかる。
【0033】
CCL8産生に関与する細胞の同定
CCL8産生に関与する細胞を明らかにする目的で,C57BL/6マウスの脾臓細胞を磁気ビーズ法を用いて選別し,CD4陽性T細胞およびマクロファージ(CD11b+)を単離して,Balb/cマウス樹状細胞と混合培養した。その結果,CD4陽性T細胞を用いたときに,脾細胞全体を用いた場合と同様のCCL8発現が見られた(図4)。またCD4陽性T細胞にマクロファージを等量混合した場合では,CCL8発現は2倍以上の高値を認めた。これらの結果より,抗原提示細胞とCD4陽性T細胞の間で同種抗原認識が成立するとCCL8が発現し,更にマクロファージの存在下ではCCL8の発現が増強することが明らかになった。このことから,CCL8はT細胞の同種抗原認識により初期発現し,同種抗原認識したCD4+T細胞から発現されたIFNγによりCD11b+細胞からの発現誘導が起こることがわかる。
【0034】
次に,CCL8産生のメカニズムを調べるために,細胞を同系または同種で混合して培養したときのCCL8濃度を測定した。Balb/cマウスの脾臓から樹状細胞を単離した。B6脾臓細胞はAuto MACS systemを用いて単離した。1x105個のBalb/cの樹状細胞を,1x106個のB6マウス脾臓由来の,全脾臓細胞,CD4+T細胞,CD8+T細胞または対照としてBalb/c(同系)マウスの脾臓細胞とともに4日間培養し,培養上清中のCCL8を定量した。
【0035】
図5に示されるように,Balb/c樹状細胞とB6 CD4+T細胞との混合培養において明らかなCCL8の発現が見られ,CCL8の濃度はB6 CD8+T細胞またはBalb/c脾臓細胞(同系)との混合培養の場合より有意に高かった(白色バー)。一方,混合培養開始時に抗マウスMHCクラスII抗体を添加すると,CCL8の発現レベルは顕著に低下し,この効果は,Balb/c樹状細胞およびB6 CD4+T細胞において有意であった(黒色バー)。このことから,CCL8の誘導はCD4+T細胞によるクラスII認識を介していることがわかる。
【0036】
さらに,上記と同じ系で,脾臓細胞/CD4+T細胞の数を変えて実験したところ,CCL8の発現は用量応答性を示し,CCL8の誘導が生物学的な反応であることが確認された(図6)。
【0037】
IFNγの発現の分析
培養プレートでBalb/c由来樹状細胞(DC)とC57BL/6脾臓細胞を混合培養し,継時的に培養上清のIFNγ値を測定した。結果を図7に示す。IFNγのレベルは第2日より上昇したが,第5日には,同種抗原認識反応が続いているにも関わらず低下していた。このことは,IFNγの発現レベルは同種抗原認識の指標としては不適当であることを示す。
【0038】
インビボ同種移植実験
4グレイの放射線を照射した拒絶モデルマウスの背部皮下に,同種脾臓由来B6 CD4+T細胞を移植し,血中CCL8濃度を測定した(図8)。白バーは0.1x107個のB6 CD4+T細胞を移植したときの,黒バーは1.0x107個を移植したときの,5日および7日後の平均CCL8濃度(ng/mL)を示す。*および**は,それぞれp値<0.05および<0.01を示す(n=4)。血漿CCL8濃度は1.0x107個の同種CD4+T細胞を移植した群において,0.1x107個の群より有意に高かった。移植されたCD4+T細胞の数とCCL8産生との間に明らかな用量依存性がみられた。一方,血漿CCL8濃度は第5日に上昇したが,移植されたCD4+T細胞数が拒絶反応によって減少する第7日までに急速に低下した。これらの結果は,血漿CCL8濃度が同種CD4+T細胞の数を忠実に反映していることを示す。
【0039】
TCRの関与の解析
CD4+T細胞はB6マウスの脾臓から単離し,同種樹状細胞はBalb/cマウスの脾臓から単離した。1x106個のB6 CD4+T細胞を,培養プレートで,バッファー(対照),抗CD3ε抗体および抗CD28抗体,またはBalb/cマウス樹状細胞の存在下で培養した。上清中のCCL8濃度を測定したところ,同種樹状細胞刺激についてのみCCL8の産生が認められた(図9A)。これらの結果は,CD3εおよびCD28のCD4+T細胞へのクロスリンクがインビトロでCCL8の発現を誘導しなかったことを示す。また,抗CD3ε抗体および抗CD28抗体または同種樹状細胞で刺激したCD4+T細胞において細胞増殖とIFN−γの分泌が認められた(図9B)。白色バーはミトコンドリア活性を反映する色素を用いて測定した細胞増殖(グラフ左数値)を,灰色バーはIFN−γの分泌量を表す(グラフ右数値)。同種抗原提示でもTCRのクロスリンクでも,いずれもCD4+T細胞の活性化が生じていることがわかる。
【0040】
以上の結果より,同種抗原認識の分子マーカーとしてのCCL8の発現機序は,
1. 抗原提示細胞によるMHCクラスIIを介した,CD4陽性T細胞に対する抗原提示ないしは活性化刺激;および
2. 同種抗原認識後のT細胞活性化に伴うIL−2,IFN−γの発現;
の両方が関与していると考えられる。
【産業上の利用可能性】
【0041】
本発明は,宿主対移植片疾患の診断および経過のモニタリング,ならびに治療に有用である。
【技術分野】
【0001】
本発明は,宿主対移植片疾患を検査するための方法および試薬に関する。
【背景技術】
【0002】
臓器移植は,他人の臓器,例えば,皮膚,腎臓,肝臓,心臓,肺,膵臓などを移植することにより,臓器の障害を治療する方法である。移植医療において,他人の臓器組織はすべて同種抗原(アロ抗原)として認識される。生物の細胞表面には自己と非自己を区別するための抗原(主要組織適合抗原:MHC)が発現しており,その違いによって非自己の細胞,すなわち自己と異なるMHCをもつ細胞を認識,攻撃,排除する自己防衛機構が備わっている。その中心的な役割を担っているのはCD4陽性リンパ球であり,非自己の細胞を認識すると活性化,増殖し,種々の生理活性物質(サイトカイン,ケモカインなど)の産生といった免疫反応を引き起こす。このため,移植医療においては,移植拒絶を防止するために,ドナーと宿主とのHLA抗原のタイプが一致するようにドナーを選択し,かつ,宿主に薬剤を投与してこれらの免疫反応を抑制することが必要である。しかしながら,HLA抗原にはきわめて多くのタイプがあり,完全に一致するドナーを見いだすことは非常に困難である。
【0003】
同種抗原認識には抗原提示細胞とリンパ球などの免疫担当細胞の二者が少なくとも必要であり,両者の間にMHCの不一致が存在することにより成立する。抗原提示細胞(樹状細胞:DCなど)が発現する組織適合抗原II(MHCクラスII)を同種CD4T細胞が認識することにより同種抗原認識が行われる。その結果,CD4陽性T細胞が活性化し,様々な生理活性物質(サイトカイン,ケモカイン)が産生される。それらの生理活性物質は宿主体内での炎症を惹起し,リンパ球,マクロファージなどの免疫担当細胞を増殖,活性化させる。
【0004】
体内で起こっている同種抗原認識を血清などでモニターできれば,臓器拒絶などの移植免疫状態を客観的に観察可能となり,診断治療に大きな貢献ができると考えられる。過去の研究では,同種抗原認識の際に腫瘍崩壊因子アルファ(TNF−α)やインターフェロンガンマ(IFN−γ)といったサイトカインが産生されることがわかっている。しかし,IFN−γは同種抗原認識の有無に関わらず,活性化されたリンパ球からも産生されるため,同種抗原認識の分子マーカーとしては不十分である。したがって,宿主対移植片疾患を早期に診断し,早期に治療を開始し,治療効果を客観的にモニターするために,同種抗原認識に特異的な分子マーカーを発見することが求められている。
【先行技術文献】
【特許文献】
【0005】
【特許文献1】WO2009/001545
【発明の概要】
【発明が解決しようとする課題】
【0006】
本発明は,同種抗原認識を検出する方法およびかかる方法に用いる検査薬を提供することを目的とする。
【課題を解決するための手段】
【0007】
本発明者らは,MHCの異なるマウスからの免疫細胞を混合培養して解析したところ,同種抗原認識の成立とCCL8の発現量の増加とが有意に関連することを発見して,本発明を完成した。
【0008】
すなわち,本発明は,宿主対移植片疾患(HVGD)を検査するための方法を提供する。この方法は,被験者または被検動物から得た試料中のCCL8蛋白質の量を測定し,得られた測定値を宿主対移植片疾患の診断または経過の指標とすることを特徴とする。
【0009】
好ましくは,CCL8蛋白質の量は,抗CCL8抗体を用いて測定される。また好ましくは,CCL8蛋白質の量は,質量分析計,高速液体クロマトグラフィーおよび2次元電気泳動からなる群より選択される方法を用いて測定される。
【0010】
別の観点においては,本発明は,抗CCL8抗体を含む宿主対移植片疾患の検査薬を提供する。
【0011】
さらに別の観点においては,本発明は,宿主対移植片疾患の治療薬の候補物質を選択する方法を提供する。この方法は,
宿主対移植片疾患のモデル動物に試験物質を投与し,
前記モデル動物から得た試料中のCCL8蛋白質の量を測定し,そして,
試験物質を投与したときに投与していないときと比較してCCL8蛋白質の量が低い場合に,その試験物質を宿主対移植片疾患の治療薬の候補物質として選択する,
の各工程を含む。
【発明の効果】
【0012】
本発明にしたがえば,臓器組織移植において,体内での移植臓器の同種抗原認識をモニターすることができ,宿主対移植片疾患の発症および進行を早期に診断することが可能となる。
【図面の簡単な説明】
【0013】
【図1】図1は,同種抗原認識におけるCCL8の発現を示す。
【図2】図2は,同種抗原認識における各種サイトカインの発現を示す。
【図3】図3は,中和抗体の存在下におけるCCL8の発現を示す。
【図4】図4は,樹状細胞と,CD4陽性T細胞および/またはマクロファージとの混合培養におけるCCL8の発現を示す。
【図5】図5は,樹状細胞と,CD4+T細胞またはCD8+T細胞との混合培養におけるCCL8の発現を示す。
【図6】図6は,CCL8の発現の用量応答性を示す。
【図7】図7は,同種抗原認識におけるIFNγの発現を示す。
【図8】図8は,インビボ同種移植実験の結果を示す。
【図9】図9は,同種抗原認識におけるCD4+T細胞の活性化およびCCL8発現を示す。
【発明を実施するための形態】
【0014】
本発明は,被験者の血液などの被検試料におけるCCL8の発現量を測定することにより,同種抗原認識を検出して,宿主対移植片疾患(HVGD)を診断し,経過をモニタリングする方法を特徴とする。下記の実施例に具体的に示されるように,同種アロ抗原認識によってCCL8が発現することが明らかとなった。すなわち,CCL8は同種抗原認識のバイオマーカーとして有用であることが明らかとなった。
【0015】
CCL8とは,ケモカイン・ファミリーに属する塩基性ヘパリン結合性分泌蛋白質であり,MCP−2とも称される(GenBank Accession No. NP_005614)。この蛋白質は,単球,線維芽細胞,上皮細胞などで産生され,レセプターとして,CCR2,CCR3,CCR5およびCCR11に結合することが知られている。CCL8は,CD4陽性T細胞,CD8陽性T細胞,単球,NK細胞,好酸球,好塩基球などを標的細胞とすることが明らかにされている。しかしながら,生体内におけるCCL8の役割や免疫系の調節におけるその意義は十分に解明されていない。
【0016】
本発明者らは先に,CCL8を指標として造血幹細胞移植により生ずる移植片対宿主疾患の発症および経過を診断することができることを見いだした(WO/2009/001545:特許文献1)。しかし,このCCL8の発現と移植片対宿主疾患との相関のメカニズムは不明であった。また,骨髄移植における拒絶反応(移植片対宿主疾患;GVHD)と,臓器移植における拒絶反応(宿主対移植片疾患;HVGD)とは,免疫学的には大きく異なることが知られているが,その免疫反応の詳細は明らかになっていない。本発明にしたがって,CCL8を同種抗原認識のバイオマーカーとして利用することにより,今後これらの免疫反応のメカニズムに関する研究が進むことが期待される。
【0017】
CCL8蛋白質の量を測定すべき被検試料としては,被験者または被検動物から得た体液,血液,血清,血漿などを用いることができる。また,被験者から採取された組織や細胞を用いてもよい。
【0018】
被験者から得た試料におけるCCL8蛋白質の量は,抗CCL8抗体を用いて,当該技術分野においてよく知られる免疫学的測定法を用いて測定することができる。抗CCL8抗体はポリクローナル抗体であってもモノクローナル抗体であってもよい。各種の抗CCL8ポリクローナル抗体およびモノクローナル抗体が市販されており,それらのいずれの抗体も本発明において用いることができる。
【0019】
あるいは,抗体は当該技術分野においてよく知られる方法により作成してもよい。CCL8に結合するポリクローナル抗体は,CCL8またはそのペプチド断片を感作抗原として用いて動物を免疫し,免疫した動物から抗体を含有する抗血清を単離し,ELISAアッセイ,ウエスタンブロット分析,またはラジオイムノアッセイ等の当該技術分野においてよく知られる方法を用いて,所望の特異性を有する抗体の存在を確認することにより得ることができる。
【0020】
CCL8に結合するモノクローナル抗体は,当該技術分野においてよく知られる方法にしたがって,CCL8またはそのペプチド断片を感作抗原として用いて動物を免疫し,得られる免疫細胞を取り出して骨髄腫細胞と融合させ,抗体を産生するハイブリドーマを選択してクローニングし,このハイブリドーマを培養することにより得ることができる。
【0021】
このようにして得られた抗体を用いて,免疫学的方法により,被験者または被検動物から得た試料中のCCL8蛋白質を測定する。測定は,定性的であっても定量的であってもよい。被験者から得たCCL8の発現の免疫学的測定は,例えば,ラジオイムノアッセイ,ELISA,免疫沈降法,免疫凝集法,ウエスタンブロット等を用いて行うことができる。
【0022】
例えば,典型的な例として,以下のようにしてサンドイッチELISAを行うことができる。被験者の末梢血を採血して血漿を調製し,これを抗CCL8抗体を固定化したプレートまたはチップに加え,適当な時間インキュベートする。プレートまたはチップを洗浄して未結合成分を除去した後,別の抗CCL8抗体を加える。この抗体は,酵素,蛍光色素,化学発光物質,ビオチン,放射線化合物等により検出可能なように標識することができる。適当な時間インキュベートした後,プレートまたはチップを洗浄し,蛍光,発光,放射活性等を測定することにより,標識を検出する。あるいは,抗CCL8抗体を結合させた後,二次抗体(例えばヤギ抗マウス抗体)を加えてシグナルを増強してもよい。二次抗体は,酵素,蛍光色素,化学発光物質,ビオチン,放射線化合物等により検出可能なように標識することができる。このようにして,被験者から得た血漿におけるCCL8蛋白質の量を測定することができる。
【0023】
別の態様においては,凝集反応を利用した検出方法を用いてCCL8蛋白質を検出することができる。この方法においては,抗CCL8抗体を結合させた担体,例えばラテックス粒子を用いてCCL8を検出することができる。抗CCL8抗体を結合させたラテックス粒子を試料と混合して一定時間インキュベートすると,試料中にCCL8が含まれる場合には粒子が凝集する。この凝集の程度を肉眼で観察するか,または分光光度計を用いて定量することにより,試料中のCCL8を検出することができる。
【0024】
別の態様においては,表面プラズモン共鳴現象を利用したバイオセンサーを用いてCCL8蛋白質を検出することができる。表面プラズモン共鳴現象を利用したバイオセンサーは,蛋白質−蛋白質間の相互作用を表面プラズモン共鳴シグナルとしてモニターすることが可能である。例えば,BIAcore(Pharmacia製)等のバイオセンサーを用いることにより,CCL8蛋白質と抗CCL8抗体の結合を検出することができる。具体的には,抗CCL8抗体を固定化したセンサーチップに,被検試料を接触させ,抗CCL8抗体に結合するCCL8蛋白質を共鳴シグナルの変化として検出することができる。
【0025】
あるいは,CCL8蛋白質は,被検試料を金属キレート剤やヘパリン等のアフィニティー担体を用いて粗精製(濃縮)した後に,MSにより検出および定量してもよい。また,HPLCにより検出および定量してもよく,2次元電気泳動をした後に銀染色により検出および定量してもよい。
【0026】
本発明はまた,抗CCL8抗体を含む宿主対移植片疾患検査薬を提供する。本発明の宿主対移植片疾患検査薬は,検査キットの形で提供することができる。検査キットは,CCL8の検出のための試薬,例えば,抗CCL8抗体を有効成分として含む。また,このキットは,測定に必要な適当な試薬類,例えば緩衝液,希釈液,反応停止液,洗浄液,コントロール標品などをさらに含んでいてもよい。
【0027】
本発明においては,このようにして測定されたCCL8蛋白質の量を指標として,宿主対移植片疾患の検査を行うことができる。本発明の方法にしたがえば,臨床症状の観察ではなく,CCL8蛋白質をマーカーとして,宿主対移植片疾患を客観的に診断することができ,宿主対移植片疾患の発症および経過をモニタリングすることができる。本発明の検査方法は,例えば,宿主対移植片疾患の発症前の診断(早期診断),発症の確定診断,重篤度の判定,疾患の経過のモニタリング,治療効果の判定,および予後の予測に有用である。
【0028】
さらに,本発明にしたがって,CCL8の発現量を指標として,宿主対移植片疾患の治療薬の有力な候補物質をスクリーニングすることが可能である。スクリーニングは,宿主対移植片疾患のモデル動物,例えば同種臓器移植を受けた動物に試験物質を投与し,モデル動物から得た試料中のCCL8蛋白質の量を測定することにより行う。試験物質としては,例えば,抗CCL8抗体を用いることができる。あるいは,試験物質は,種々の合成又は天然の化合物ライブラリー,コンビナトリアルライブラリー,オリゴヌクレオチドライブラリー,ペプチドライブラリー等のライブラリーから取得してもよい。また,細菌,真菌類,藻類,植物,動物等の天然物からの抽出物やその部分精製物を試験物質として用いてもよい。試験物質を投与したときに投与していないときと比較してCCL8蛋白質の量が低い場合には,その試験物質を宿主対移植片疾患の治療薬の候補物質として選択することができる。すなわち,本発明の検査方法は,宿主対移植片疾患の新規治療法開発におけるプラットフォームを提供するものである。
【0029】
以下に実施例により本発明をより詳細に説明するが,本発明はこれらの実施例により限定されるものではない。
【実施例】
【0030】
同種抗原認識におけるCCL8の発現
MHCの異なるマウスの組み合わせ(C57BL/6マウスとBalb/cマウス)を用いて,C57BL/6マウス脾臓細胞とBalb/cマウス樹状細胞とを生体外混合培養した。樹状細胞は,Balb/cマウスの脾臓細胞から磁気ビーズを用いて分離した。Balb/cマウスの抗原提示細胞として,1x105個の樹状細胞を96ウエルの培養プレートに播種し,C57BL/6マウスの脾臓有核細胞1x106個とともに混合培養した。培養開始後1,2,3,4,5日目の上清のCCL8濃度をELISAにより定量した。その結果,培養開始後3〜4日目には培養上清中にCCL8蛋白質が発現していることが確認された(図1)。対照として同系(syngenic)の細胞を用いた場合にはCCL8の発現は検出されなかった。
【0031】
同種抗原認識における各種サイトカインの発現
同種抗原認識状態におけるCCL8発現機構を解析するために,Balb/cマウスの抗原提示細胞として樹状細胞を1x105個と,種々の個数のC57BL/6マウスの脾臓有核細胞とを丸底96穴プレートで,10%ウシ胎児血清(FCS),2mmol/Lのグルタミン,100U/mLのペニシリンおよび100μ/mLのストレプトマイシンとを補充したRPMI1640中,37℃,5%CO2下で混合培養した。培養開始後6時間で細胞からmRNAを抽出し,リアルタイムPCR法にて各種サイトカインの発現を定量した。結果を図2に示す。図2のグラフでは,GAPDHに対して標準化した値を,同系抗原における発現のレベルを1とした相対値で表されている。IL−2,TNF−α,およびIFNγがCCL8に先立って発現することが見いだされた。
【0032】
次に,これらのサイトカインに対する中和抗体の存在下で,Balb/cマウス樹状細胞とC57BL/6マウス脾臓細胞を4日間混合培養し,培養上清におけるCCL8の濃度を定量した。抗IL−2抗体および抗IFNγ抗体の添加によりCCL8発現は低下し,抗TNFα抗体でもCCL8発現の減少が見られた(図3)。このことから,同種抗原認識におけるCCL8の発現には,MHCクラスII,INFγ,IL2,およびTNFαが関与していることがわかる。
【0033】
CCL8産生に関与する細胞の同定
CCL8産生に関与する細胞を明らかにする目的で,C57BL/6マウスの脾臓細胞を磁気ビーズ法を用いて選別し,CD4陽性T細胞およびマクロファージ(CD11b+)を単離して,Balb/cマウス樹状細胞と混合培養した。その結果,CD4陽性T細胞を用いたときに,脾細胞全体を用いた場合と同様のCCL8発現が見られた(図4)。またCD4陽性T細胞にマクロファージを等量混合した場合では,CCL8発現は2倍以上の高値を認めた。これらの結果より,抗原提示細胞とCD4陽性T細胞の間で同種抗原認識が成立するとCCL8が発現し,更にマクロファージの存在下ではCCL8の発現が増強することが明らかになった。このことから,CCL8はT細胞の同種抗原認識により初期発現し,同種抗原認識したCD4+T細胞から発現されたIFNγによりCD11b+細胞からの発現誘導が起こることがわかる。
【0034】
次に,CCL8産生のメカニズムを調べるために,細胞を同系または同種で混合して培養したときのCCL8濃度を測定した。Balb/cマウスの脾臓から樹状細胞を単離した。B6脾臓細胞はAuto MACS systemを用いて単離した。1x105個のBalb/cの樹状細胞を,1x106個のB6マウス脾臓由来の,全脾臓細胞,CD4+T細胞,CD8+T細胞または対照としてBalb/c(同系)マウスの脾臓細胞とともに4日間培養し,培養上清中のCCL8を定量した。
【0035】
図5に示されるように,Balb/c樹状細胞とB6 CD4+T細胞との混合培養において明らかなCCL8の発現が見られ,CCL8の濃度はB6 CD8+T細胞またはBalb/c脾臓細胞(同系)との混合培養の場合より有意に高かった(白色バー)。一方,混合培養開始時に抗マウスMHCクラスII抗体を添加すると,CCL8の発現レベルは顕著に低下し,この効果は,Balb/c樹状細胞およびB6 CD4+T細胞において有意であった(黒色バー)。このことから,CCL8の誘導はCD4+T細胞によるクラスII認識を介していることがわかる。
【0036】
さらに,上記と同じ系で,脾臓細胞/CD4+T細胞の数を変えて実験したところ,CCL8の発現は用量応答性を示し,CCL8の誘導が生物学的な反応であることが確認された(図6)。
【0037】
IFNγの発現の分析
培養プレートでBalb/c由来樹状細胞(DC)とC57BL/6脾臓細胞を混合培養し,継時的に培養上清のIFNγ値を測定した。結果を図7に示す。IFNγのレベルは第2日より上昇したが,第5日には,同種抗原認識反応が続いているにも関わらず低下していた。このことは,IFNγの発現レベルは同種抗原認識の指標としては不適当であることを示す。
【0038】
インビボ同種移植実験
4グレイの放射線を照射した拒絶モデルマウスの背部皮下に,同種脾臓由来B6 CD4+T細胞を移植し,血中CCL8濃度を測定した(図8)。白バーは0.1x107個のB6 CD4+T細胞を移植したときの,黒バーは1.0x107個を移植したときの,5日および7日後の平均CCL8濃度(ng/mL)を示す。*および**は,それぞれp値<0.05および<0.01を示す(n=4)。血漿CCL8濃度は1.0x107個の同種CD4+T細胞を移植した群において,0.1x107個の群より有意に高かった。移植されたCD4+T細胞の数とCCL8産生との間に明らかな用量依存性がみられた。一方,血漿CCL8濃度は第5日に上昇したが,移植されたCD4+T細胞数が拒絶反応によって減少する第7日までに急速に低下した。これらの結果は,血漿CCL8濃度が同種CD4+T細胞の数を忠実に反映していることを示す。
【0039】
TCRの関与の解析
CD4+T細胞はB6マウスの脾臓から単離し,同種樹状細胞はBalb/cマウスの脾臓から単離した。1x106個のB6 CD4+T細胞を,培養プレートで,バッファー(対照),抗CD3ε抗体および抗CD28抗体,またはBalb/cマウス樹状細胞の存在下で培養した。上清中のCCL8濃度を測定したところ,同種樹状細胞刺激についてのみCCL8の産生が認められた(図9A)。これらの結果は,CD3εおよびCD28のCD4+T細胞へのクロスリンクがインビトロでCCL8の発現を誘導しなかったことを示す。また,抗CD3ε抗体および抗CD28抗体または同種樹状細胞で刺激したCD4+T細胞において細胞増殖とIFN−γの分泌が認められた(図9B)。白色バーはミトコンドリア活性を反映する色素を用いて測定した細胞増殖(グラフ左数値)を,灰色バーはIFN−γの分泌量を表す(グラフ右数値)。同種抗原提示でもTCRのクロスリンクでも,いずれもCD4+T細胞の活性化が生じていることがわかる。
【0040】
以上の結果より,同種抗原認識の分子マーカーとしてのCCL8の発現機序は,
1. 抗原提示細胞によるMHCクラスIIを介した,CD4陽性T細胞に対する抗原提示ないしは活性化刺激;および
2. 同種抗原認識後のT細胞活性化に伴うIL−2,IFN−γの発現;
の両方が関与していると考えられる。
【産業上の利用可能性】
【0041】
本発明は,宿主対移植片疾患の診断および経過のモニタリング,ならびに治療に有用である。
【特許請求の範囲】
【請求項1】
宿主対移植片疾患を検査するための方法であって,被験者または被検動物から得た試料中のCCL8蛋白質の量を測定し,得られた測定値を宿主対移植片疾患の診断または経過の指標とすることを特徴とする方法。
【請求項2】
CCL8蛋白質の量が抗CCL8抗体を用いて測定される,請求項1に記載の方法。
【請求項3】
CCL8蛋白質の量が,質量分析計,高速液体クロマトグラフィーおよび2次元電気泳動からなる群より選択される方法を用いて測定される,請求項1または2に記載の方法。
【請求項4】
抗CCL8抗体を含む宿主対移植片疾患の検査薬。
【請求項5】
宿主対移植片疾患の治療薬の候補物質を選択する方法であって,
宿主対移植片疾患のモデル動物に試験物質を投与し,
前記モデル動物から得た試料中のCCL8蛋白質の量を測定し,そして,
試験物質を投与したときに投与していないときと比較してCCL8蛋白質の量が低い場合に,その試験物質を宿主対移植片疾患の治療薬の候補物質として選択する,
の各工程を含む方法。
【請求項1】
宿主対移植片疾患を検査するための方法であって,被験者または被検動物から得た試料中のCCL8蛋白質の量を測定し,得られた測定値を宿主対移植片疾患の診断または経過の指標とすることを特徴とする方法。
【請求項2】
CCL8蛋白質の量が抗CCL8抗体を用いて測定される,請求項1に記載の方法。
【請求項3】
CCL8蛋白質の量が,質量分析計,高速液体クロマトグラフィーおよび2次元電気泳動からなる群より選択される方法を用いて測定される,請求項1または2に記載の方法。
【請求項4】
抗CCL8抗体を含む宿主対移植片疾患の検査薬。
【請求項5】
宿主対移植片疾患の治療薬の候補物質を選択する方法であって,
宿主対移植片疾患のモデル動物に試験物質を投与し,
前記モデル動物から得た試料中のCCL8蛋白質の量を測定し,そして,
試験物質を投与したときに投与していないときと比較してCCL8蛋白質の量が低い場合に,その試験物質を宿主対移植片疾患の治療薬の候補物質として選択する,
の各工程を含む方法。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【公開番号】特開2012−233693(P2012−233693A)
【公開日】平成24年11月29日(2012.11.29)
【国際特許分類】
【出願番号】特願2009−195951(P2009−195951)
【出願日】平成21年8月26日(2009.8.26)
【国等の委託研究の成果に係る記載事項】(出願人による申告)平成20年度 文部科学省 科学技術試験研究委託事業「オール北海道先進医学・医療拠点形成」産業技術力強化法第19条の適用を受ける特許出願
【出願人】(307014555)北海道公立大学法人 札幌医科大学 (31)
【Fターム(参考)】
【公開日】平成24年11月29日(2012.11.29)
【国際特許分類】
【出願日】平成21年8月26日(2009.8.26)
【国等の委託研究の成果に係る記載事項】(出願人による申告)平成20年度 文部科学省 科学技術試験研究委託事業「オール北海道先進医学・医療拠点形成」産業技術力強化法第19条の適用を受ける特許出願
【出願人】(307014555)北海道公立大学法人 札幌医科大学 (31)
【Fターム(参考)】
[ Back to top ]

