密度勾配超遠心分離によるウイルスまたはウイルス抗原の精製
本発明は、少なくとも下記ステップを含む、ウイルスまたはそのウイルス抗原を精製するための方法に関する:
a)ウイルスまたはそのウイルス抗原を含む流体を得るステップ、および
b)少なくとも1つの密度勾配超遠心分離ステップにより流体を精製するステップであって、密度勾配容積に対する、流体中に存在するウイルスまたはそのウイルス抗原の量の比が1未満、0.8未満、0.6未満および0.4未満である、ステップ。
a)ウイルスまたはそのウイルス抗原を含む流体を得るステップ、および
b)少なくとも1つの密度勾配超遠心分離ステップにより流体を精製するステップであって、密度勾配容積に対する、流体中に存在するウイルスまたはそのウイルス抗原の量の比が1未満、0.8未満、0.6未満および0.4未満である、ステップ。
【発明の詳細な説明】
【技術分野】
【0001】
連邦政府支援研究に関する声明
本発明の態様は、保健社会福祉省の契約番号HHSO100200600011C号に基づく米国政府支援によりなされており、米国政府は本発明に特定の権利を有する場合がある。
【0002】
技術分野
本発明はウイルス、またはそのウイルス抗原を精製するための方法、より詳細には、細胞培養により生産されたウイルスまたはウイルス抗原の精製のための方法に関する。本発明はウイルス収率を改善するための精製方法を提供する。
【背景技術】
【0003】
ウイルスにより引き起こされる膨大な数の疾患のために、ウイルス学は集中的に研究されている分野となっている。ウイルスタンパク質を単離し、精製し、ワクチンを生産させるために、分析ツールを調製するために、または実験室検査のためにウイルスを提供するために、ウイルスを効率よく生産させることが常に要求されている。
【0004】
最近では、卵に基づく従来の生産系の代替として、細胞培養に基づく技術が開発されている。
【0005】
細胞培養系は、ワクチン調製の、特により単純で柔軟性があり一貫した好適な代替法と考えられており、ワクチン生産能力のスケールアップの可能性を向上させ、したがって必要に応じて、特に、大流行脅威またはテロ攻撃の場合に、大量のウイルス調達を可能にする。
【0006】
しかしながら、生産後、細胞培養により生産されたウイルスは、細胞培養物から回収され、適切な場合、精製される必要がある。ウイルスを精製するための方法は当技術分野において公知である。例えば、US6,008,036号は、細胞培養に基づくウイルスを精製するためのクロマトグラフィーマトリクスの使用を開示する。いくつかの他の方法もまた記載されている。例えば、1つの特定の好ましい方法は、ショ糖(スクロース)勾配遠心分離(US6,048,537号)を使用する。そのようなプロセスは、ウイルスまたはウイルス抗原、純度を増加させることができるが、ウイルス物質が途中で失われるので、低いウイルス収率を提供するという主な欠点を提示する。最近になって、改善され、最適化された密度勾配超遠心分離法に依存する方法が提供されている。例えば、US2008/0274138号は、異なる濃度の2つ以上の緩衝糖層の追加により確立された糖勾配上での遠心分離を用いるウイルス精製のための方法を開示する。国際公開第2008/073490号パンフレットは、直線逆グリセロール−酒石酸カリウム勾配での超遠心分離法によりウイルスを精製するための方法を提供する。これらの方法のどちらも、当技術分野で以前に知られている密度勾配よりもずっと複雑な特定の勾配の精緻化に依存している。
【0007】
そのため、実行するのが簡単な、ウイルス回収および精製のための代替改善法を提供することが依然として必要である。
【発明の概要】
【0008】
本発明による方法は、精製プロセス中に密度勾配超遠心分離ステップを実施する際のウイルス損失を制限し、よって、ウイルス収率を増加させる簡単な解決策を提供する。
【0009】
本発明の第1の態様では、少なくとも下記ステップを含む、ウイルスまたはそのウイルス抗原を精製するための方法が提供される:
a)ウイルスまたはそのウイルス抗原を含む流体を得るステップ、および
b)少なくとも1つの密度勾配超遠心分離ステップにより流体を精製するステップであって、密度勾配容積に対する、流体中に存在するウイルスまたはそのウイルス抗原の量の比が1未満、0.8未満、0.6未満および0.4未満である、ステップ。
【0010】
本発明の第2の態様では、密度勾配超遠心分離ステップの少なくとも1つのステップを含む、細胞培養により製造されるウイルスまたはそのウイルス抗原を精製するための方法であって、密度勾配容積に対する、ウイルスまたはそのウイルス抗原を含み、密度勾配上に負荷される流体中に存在するウイルスまたはそのウイルス抗原の量の比が1未満、0.8未満、0.6未満および0.4未満である方法が提供される。
【0011】
第3の態様では、本発明により得られたウイルスを薬学的に許容される担体と混合するステップを少なくとも含む、ワクチンを調製するための方法が提供される。
【図面の簡単な説明】
【0012】
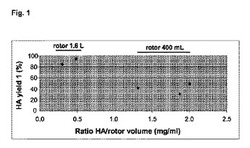
【図1】ショ糖(スクロース)勾配超遠心分離ステップ後のHA収率(%)に対するHA量/ローター容積比(mg/ml)の影響を示す図である。HA収率は、ショ糖勾配超遠心分離ステップ(示されたローターを用いて実施)後に回収されたHAの割合を表し、これは、SRDアッセイ法により、超遠心分離法前後でHA量を測定することにより計算した。HA収率値を、HA量/ローター容積比の値に対してプロットした。
【発明を実施するための形態】
【0013】
本発明は、小規模および大規模ウイルス生産の両方に適用することができる、ウイルス、特に細胞培養により生産されたウイルスを精製するための方法に関する。方法は、特に、より高いウイルス収率を達成することができる密度勾配超遠心分離の改善されたステップを含む。本発明の方法により得られたウイルス調製物は、ウイルス精製のために使用される標準技術を用いてさらに精製され得る。本発明により調製されたウイルスは、例えば、ウイルスタンパク質の精製、分析アッセイ法、宿主細胞の感染、診断目的または治療もしくは予防用途、例えばワクチン接種および臨床投与を含む任意の目的のために使用することができる。
【0014】
本発明によれば、前記勾配の容積に対する、勾配上に負荷される流体中に存在するウイルスまたはそのウイルス抗原の量の比は、考慮する必要のある重要な因子である。実際、本発明者等は、予想外に、ウイルス量を一定に保ちながら、勾配密度の容積を変動させると、より良好なウイルス収率が得られることを観察した。特に、密度勾配容積を2倍にすると、ウイルス収率が2倍増加する。
【0015】
したがって、本発明の1つの実施形態では、mlで表された密度勾配容積に対する、重量、例えばmgで表された流体中に存在するウイルスまたはそのウイルス抗原の量の比は、1未満、特に0.8未満、より特定的には0.6未満およびさらに、0.4mgのウイルス/mlの勾配未満である。ウイルス重量はまた、より高い単位、例えばg、またはより低い単位、例えばμgで表してもよい。勾配容積はまた、Lまたはμlで表してもよい。しかしながら、本発明による比計算は、等価単位すなわち、g/L、mg/mlまたはμg/μlで示される重量と容積に対する値を使用することに頼らなければならない。本発明の状況では、「等価」は、同じ指標であることが理解されるべきである。
【0016】
例えば、ローターがymlの容積用量を有する場合、前記ローター上に負荷させることができる勾配容積はymlである。ウイルス流体がxmgのウイルスを含む場合、本発明によれば、xmgのウイルス/ymlの勾配の比は、好適には、1未満、より好適には0.8未満、さらにより好適には0.6未満、さらには0.4mgのウイルス/mlの勾配未満である。
【0017】
特定の実施形態では、密度勾配超遠心分離後のウイルス収率、すなわち、超遠心分離後に回収される抗原の割合、特に、本発明の方法による比、例えば、0.4〜1の範囲の比を使用した場合に得られるインフルエンザウイルスからのHA抗原の収率は、SRD(一元放射免疫拡散)により測定されるように、50%より高く、特に60%より高く、好適には、70%より高く、より好適には80%より高く、さらに85%より高い。
【0018】
別の実施形態では、本発明の方法による、0.4〜1の範囲の比を使用した場合に得られるウイルス収率は、1を超える比、例えば1.3〜2の範囲の比を用いて得られる場合と比較して、少なくとも1.5、特に2、好適には2.5、より好適には3倍高い。
【0019】
1つの実施形態では、本発明の方法による比は、密度勾配の容積を増加させることにより調節される。
【0020】
ウイルスの量は、当技術分野の技術において知られているいずれによっても分析することができる。例えば、ウイルスの存在は、ウイルス構成物の1つ、好適には特異ウイルス抗原の検出をモニターし、測定することにより定量することができる。例示的な技術として、ウエスタンブロット分析による特異ウイルス抗原の分析が挙げられる。インフルエンザウイルスを考慮する場合、抗原HAは、抗HA抗体を用いるウエスタンブロット分析により検出、定量され得る。HAの量を測定するための別のアッセイ法は、SRD(一元放射免疫拡散)アッセイ法であり、これは、当業者によく知られて技術である(J.M. Wood et al.: An improved single radial immunodiffusion technique for the assay of influenza haemagglutinin antigen: adaptation for potency determination of inactivated whole virus and subunit vaccines. J. Biol. Stand. 5 (1977) 237-247; J. M. Wood et al., International collaborative study of single radial diffusion and immunoelectrophoresis techniques for the assay of haemagglutinin antigen of influenza virus. J. Biol. Stand. 9 (1981) 317-330))。
【0021】
密度勾配超遠心分離は、ウイルスを精製するために普通に使用される技術である。特にワクチン製造分野において使用される。ウイルスを含む流体が密度勾配上に負荷され、超遠心分離にかけられる場合、ウイルスは、それらの密度が勾配の密度と等価である勾配中の位置まで移動し、一方、夾雑物は勾配中で停止されず、沈殿する。沈殿は廃棄され、ウイルスを含む勾配画分のみが収集される。 使用されるローターの型によって、動的収集(遠心分離中)または勾配の再配向後の静的回収(停止時)が実施される。本発明によれば、密度勾配超遠心分離法はゾーンまたは等密度としてもよい。連続法、半連続法または逐次バッチで実施してもよい。
【0022】
本発明の方法により使用される密度勾配超遠心分離はいかなる点においても制限されず、本発明は任意の条件、例えば上記条件のいずれかにおける任意の型の超遠心分離を含む。例えば、特定の速度要求も、本発明の方法により強要されない。適切な遠心分離速度は、精製されるウイルス、遠心分離の型、ローターの型、ならびにローターの特徴によって設定することができる。ウイルスを勾配に入れ、勾配内のその密度に到達させることができれば、いずれの速度とすることもできる。例えば、目安にすぎないが、ショ糖(スクロース)勾配上でインフルエンザウイルスを精製したい場合、35000rpmで超遠心分離を実施することができる。
【0023】
本発明は特定の密度勾配の使用に依存しておらず、よって、任意の密度勾配に適用可能である。密度勾配構成要素の選択は、精製されるウイルスおよび得られた精製ウイルスに対し意図される用途に依存する。例えば、エンベロープウイルスは非エンベロープウイルスよりも密度が低い。これは当技術分野において公知である。具体的には、本方法により生産されるウイルス何の目的で調製されるかによって、ウイルス完全性またはその生物活性に影響しない構成要素が使用される。例えば、本発明の方法により調製されたウイルスがワクチン接種を対象とする場合、ウイルスまたはそのウイルス抗原の免疫原性を維持するために、構成要素が選択される。本発明によるプロセスにおいて使用するための密度勾配を生成させるために、糖溶液、特にショ糖(スクロース)が使用され得る。エンベロープウイルス、例えば、限定はされないがインフルエンザウイルスを精製するために、ショ糖が特に使用される。ショ糖は、ワクチン製造の分野においてしばしば使用される糖でもある。
【0024】
特定の実施形態では、本発明の方法により密度勾配を作製させるのに使用される糖はショ糖である。これは、安全性の配慮を留意する必要がある場合、ヒトに使用するための生成物の精製に有利である。しかしながら、本発明はまた、精製されるウイルスの型によって特定される密度を有する溶液を生成させるのに十分な水中溶解度を有するならば、他の糖類、例えばアルコール糖類、例えば、ソルビトール、または水素化糖類、直鎖糖類、および修飾糖類または任意の他の糖類の使用を企図する。また、勾配は酒石酸カリウムを用いて調製してもよく、これは、ショ糖勾配に比べ、より高い密度を有する勾配を達成するという利点を示す。したがって、酒石酸カリウム勾配は特に、非エンベロープウイルスを精製するために好適に使用される。
【0025】
本発明による密度勾配は糖勾配に限定されない。本発明はまた、他の例示的な例として、塩、例えば、塩化セシウム等の勾配の使用を企図し、これはエンベロープウイルスおよび非エンベロープウイルスの両方の精製に好適である。
【0026】
本発明は特定の濃度の密度勾配に限定されない。密度勾配の濃度範囲は、精製されるウイルスによって、特にウイルス密度によって決定されるべきである。
【0027】
密度勾配がショ糖勾配である場合、ウイルスを精製するための典型的な密度範囲は0〜55%(w/v)である。勾配内のある範囲での特定のウイルス抗原の存在は、タンパク質検出の標準技術、例えばウエスタンブロット分析により、ウイルス抗原に特異的な抗体を用い、モニターすることができる。インフルエンザウイルスの特定の場合、その表面抗原、HA抗原の量は、SRDアッセイ法によりモニターすることができる。
【0028】
本発明によれば、密度勾配は直線または不連続とすることができる。密度勾配はまた予め形成させてもよく、すなわち、遠心分離を開始する前に形成させてもよく、または、遠心分離中に形成させてもよい。
【0029】
特定の実施形態では、本発明の方法による密度勾配は、遠心分離中に好適に形成される直線勾配、特に直線ショ糖勾配0〜55%(v/w)であり、前記遠心分離は、例えば連続流操作として実施される。
【0030】
必須ではないが、密度勾配は、好適に、生理的濃度の塩を含む緩衝溶液、特に、クエン酸塩含有リン酸緩衝生理食塩水(PBS)溶液で調製されるが、この型の溶液は有利にウイルス凝集を阻止するからである。
【0031】
本発明によるウイルス精製法は、アデノウイルス、ヘパドナウイルス、ヘルペスウイルス、オルトミクソウイルス、パポバウイルス、パラミクソウイルス、ピコルナウイルス、ポックスウイルス、レオウイルスおよびレトロウイルスを含むがそれらに限定されない広範囲のウイルスに適している。特に、本発明の方法はミクソウイルス等のエンベロープウイルスに好適である。1つの実施形態では、本発明の方法により生産されるウイルスはオルトミクソウイルスファミリーに属しており、特にインフルエンザウイルスである。
【0032】
ウイルスまたはウイルス抗原は、インフルエンザウイルス等のオルトミクソウイルスに由来していてもよい。オルトミクソウイルス抗原は、赤血球凝集素(HA)、ノイラミニダーゼ(NA)、核タンパク質(NP)、マトリックスタンパク質(M1)、膜タンパク質(M2)、転写酵素(トランスクリプターゼ)(PB1、PB2、およびPA)の1つまたは複数を含むウイルスタンパク質の1つまたは複数から選択されてもよい。特に好適な抗原には、インフルエンザ亜型の抗原特異性を決定する2つの表面糖タンパク質であるHAおよびNAが含まれる。
【0033】
インフルエンザウイルスは、ヒトインフルエンザウイルス、トリインフルエンザウイルス、ウマインフルエンザウイルス、ブタ(例えば、豚)インフルエンザウイルス、ネコインフルエンザウイルスからなる群から選択される。より具体的には、インフルエンザウイルスは、A、B、およびC株から、好ましくはA株およびB株から選択される。
【0034】
インフルエンザウイルスまたはその抗原は、大流行間期(例年のまたは季節性の)インフルエンザ株に由来してもよい。あるいは、インフルエンザウイルスまたはその抗原は、大流行発生を引き起こす能力を有する株に由来してもよい(つまり、現在流行している株の赤血球凝集素と比較して新しい赤血球凝集素を有するインフルエンザ株、またはトリ対象体において病原性であり、ヒト集団中で水平伝染する可能性を有するインフルエンザ株、またはヒトに病原性であるインフルエンザ株)。特定の季節、およびワクチンに含まれている抗原の性質に応じて、インフルエンザウイルスまたはその抗原は、以下の赤血球凝集素亜型:H1、H2、H3、H4、H5、H6、H7、H8、H9、H10、H11、H12、H13、H14、H15、またはH16の1つまたは複数に由来してもよい。好ましくは、インフルエンザウイルスまたはその抗原は、H1、H2、H3、H5、H7、またはH9亜型に由来する。
【0035】
本発明との関連では、「ウイルスまたはそのウイルス抗原を含む流体」は、使用される生産系に関係なく、ウイルスまたはそのウイルス抗原を含む任意の調製物として理解されるべきである。非制限的な例は、細胞培養物、発育鶏卵に由来する流体、例えば、尿膜腔液、バキュロウイルス発現培地、または体液である。体液は、任意の種由来の、尿、血液、精液、髄液、肺流体、気管支肺胞洗浄液、または唾液としてもよい。
【0036】
本発明による方法で使用される細胞は、基本的には、細胞培養で培養することができ、ウイルス複製を支援することができる任意の所望の細胞タイプの細胞であり得る。それらは、接着して増殖する細胞であってもよく、または懸濁状態で増殖する細胞であってもどちらでもよい。それらは、初代細胞であってもよく、または連続細胞系のいずれであってもよい。遺伝学的に安定した細胞系が好ましい。
【0037】
哺乳動物細胞、例えばヒト、ハムスター、ウシ、サル、またはイヌ細胞が、特に好適である。
【0038】
多数の哺乳動物細胞系が当技術分野で公知であり、それらには、PER.C6、HEK細胞、ヒト胚腎臓細胞(293細胞)、HeLa細胞、CHO細胞、ベロ細胞、およびMDCK細胞が含まれる。
【0039】
好適なサル細胞は、例えば、ベロ細胞系のように腎臓細胞等のアフリカミドリザル細胞である。好適なイヌ細胞は、例えば、MDCK細胞系のように腎臓細胞である。
【0040】
インフルエンザウイルスを増殖させるのに好適な哺乳動物細胞系には、MDCK細胞、ベロ細胞、またはPER.C6細胞が含まれる。これら細胞系は全て、例えば、アメリカ合衆国培養細胞系統保存機関(ATCC)から広く入手可能である。
【0041】
特定の実施形態によると、本発明の方法では、MDCK細胞が使用される。元のMDCK細胞系は、CCL−34としてATCCから入手可能であるが、懸濁状態での増殖に適したMDCK細胞等の、この細胞系の誘導体も使用することができる(国際公開第1997/37000号パンフレット)。
【0042】
あるいは、本発明で使用するための細胞系は、ニワトリ、アヒル、ガチョウ、ウズラ、またはキジ等のトリ起源に由来していてもよい。トリ細胞系は、胚、ヒヨコ、および成体を含む様々な発生段階に由来してもよい。特に、細胞系は、胚線維芽細胞、生殖細胞等の胚細胞、またはニューロン、脳、網膜、腎臓、肝臓、心臓、筋肉を含む個々の器官、または胚外組織および胚を保護する膜に由来してもよい。ニワトリ胚線維芽細胞(CEF)を使用してもよい。トリ細胞系の例には、トリ胚幹細胞(国際公開第01/85938号パンフレット)およびアヒル網膜細胞(国際公開第05/042728号パンフレット)が含まれる。特に、アヒル胚幹細胞に由来するEB66(登録商標)細胞系が、本発明で企図される(国際公開第2008/129058号パンフレット)。他の好適なトリ胚幹細胞には、ニワトリ胚幹細胞、EB45、EB14、およびEB14−074に由来するEBx細胞系が含まれる(国際公開第2006/108846号パンフレット)。このEBx細胞系には、その樹立が天然的にもたらされ、いかなる遺伝的、化学的、またはウイルス性の修飾も必要としなかった、遺伝学的に安定した細胞系であるという利点がある。これらトリ細胞は、インフルエンザウイルスを増殖させるのに特に好適である。
【0043】
特定の実施形態によると、本発明の方法では、EB66(登録商標)細胞が使用される。
【0044】
細胞培養条件(温度、細胞密度、pH値等)は、使用される細胞の適合性に応じて非常に広い範囲にわたって変動し、特定のウイルスの詳細な増殖条件の要求に適応させることができる。細胞培養は、当技術分野において広範に文書化されているため、適切な培養条件を決定することは、当業者の能力内にある(例えば、Tissue Culture, Academic Press, Kruse and Paterson, editors (1973)、およびR.I. Freshney, Culture of animal cells: A manual of basic technique, fourth edition (Wiley-Liss Inc., 2000, ISBN 0-471-34889-9)を参照)。
【0045】
特定の実施形態では、本発明に記載の方法で使用される宿主細胞は、無血清および/または無タンパク質培地中で培養される。「無血清培地」(SFM)は、細胞生存および細胞増殖を可能にする血清添加を必要としない使用準備済の細胞培養培地を意味する。この培地は、必ずしも化学的に定義されていなくともよく、種々の由来、例えば植物由来の水解物を含有していてもよい。そのような無血清培地には、ウイルス、マイコプラズマ、または未知の伝染性因子による汚染を排除することができるという利点がある。「無タンパク質」とは、タンパク質、増殖因子、他のタンパク質添加物、および非血清タンパク質が除外されていても細胞増殖が生じる培養を意味するが、随意に、ウイルス増殖に必要な場合があるトリプシンまたは他のプロテアーゼ等のタンパク質を含んでいてもよいことが理解される。そのような培養で自然に増殖する細胞は、それら自体にタンパク質を含有している。
【0046】
無血清培地は、多数の供給業者、例えばVP SFM(Invitrogen社 カタログ番号11681−020)、Opti−Pro(Invitrogen社 カタログ番号12309−019)、またはEX−CELL(JHR Bioscience社)から商業的に入手可能である。
【0047】
細胞は、種々の方法で増殖させることができ、例えば懸濁状態で増殖させてもよく、またはマイクロキャリア上での増殖のように表面に接着させて増殖させてもよい。培養は、培養皿、フラスコ、ローラーボトル、またはバッチ、流加バッチ、灌流システム等の半連続型若しくは連続型システムを使用するバイオリアクター、またはそれらの組合せで実施することができる。典型的には、細胞は、主細胞バンクバイアルまたは作業用細胞バンクバイアルから、種々のサイズのフラスコまたはローラーボトルを介して、最終的にはバイオリアクターへとスケールアップされる。1つの実施形態では、本発明の方法により使用される細胞は、撹拌バイオリアクターの無血清培地中のマイクロキャリアビーズで培養され、培養培地は灌流により提供される。
【0048】
代替的な実施形態では、細胞は、バッチ法で懸濁状態で培養される。
【0049】
ウイルスによる感染に先立って、細胞は、約37℃、より好適には36.5℃で、6.7〜7.8の範囲のpH、好適には約6.8〜7.5、より好適には約7.2のpHで培養される。
【0050】
本発明の方法によると、細胞培養に基づくウイルス生産は、一般的に、生産しようとするウイルス株を培養細胞に接種するステップと、ウイルス複製を可能するために感染細胞を所望の期間培養するステップとを含む。
【0051】
大量の細胞産生ウイルスを生産するためには、細胞が高密度に達した時に、所望のウイルス株を細胞に接種することが好ましい。通常、細胞密度が、少なくとも約1.5×106細胞/ml、好適は約3×106細胞/ml、より好適には約5×106細胞/ml、または更により好適には7×106細胞/ml以上でさえある時に、接種を実施する。最大のウイルス生産を得るための最適な細胞密度は、ウイルス増殖に使用される細胞タイプにより異なる場合がある。
【0052】
接種は、約10−1〜10−7のMOI(感染多重度)、好適には約10−2〜10−6、およびより好適には約10−5のMOIで実施される。
【0053】
ウイルス感染の温度およびpH条件は、異なる場合がある。温度は、ウイルスタイプに応じて、32℃〜39℃の範囲であってもよい。インフルエンザウイルスを生産する場合は、細胞培養感染は、生産される菌株に応じて異なる場合がある。インフルエンザウイルス感染は、好適には、32℃〜35℃の範囲の温度で、好適には33℃で実施される。1つの実施形態では、ウイルス感染は33℃で行う。代替的な実施形態では、ウイルス感染は35℃で行う。ウイルス株に応じて、プロテアーゼ、典型的にはトリプシンを細胞培養に添加して、ウイルス複製を可能にすることができる。プロテアーゼは、培養中に任意の好適な段階で添加することができる。
【0054】
感染すると、細胞は、受動溶解とも呼ばれる宿主細胞の自然溶解により、新しく形成されたウイルス粒子を培養培地に放出することができる。したがって、1つの実施形態では、細胞に基づくウイルス回収物は、細胞培養培地または上清を収集することにより、ウイルス接種後の任意の時間で提供することができる。特定の実施形態では、細胞培養培地は灌流により収集される。ウイルス接種後の異なる時点で細胞に基づくウイルスを回収し、必要に応じてその異なる回収物を貯留することが所望の場合、この回収方法は特に好適である。
【0055】
あるいは、ウイルス感染後に、細胞に基づくウイルスは、能動溶解とも呼ばれる、宿主細胞を溶解するための外的因子を使用することにより回収することができる。しかしながら、前述のものとは対照的に、能動的な細胞溶解は細胞培養を直ちに終了させるため、そのような回収方法は、細胞に基づくウイルス回収物を単一の時点で収集することを必要とする。
【0056】
能動的細胞溶解に使用することができる方法は公知である。この点で有用な方法は、例えば、凍結融解、固体剪断、高浸透圧および/または低浸透圧溶解、液体剪断、高圧放出、界面活性剤による溶解、またはそれらの任意の組合せである。
【0057】
1つの実施形態によると、細胞に基づくウイルス回収物は、細胞培養培地または上清を収集すること、接種された細胞を溶解すること、またはその両方により、ウイルス接種後の任意の時間で提供することができる。
【0058】
本発明の意味では、ウイルス接種され、感染された細胞培養物に言及する場合、「細胞培養培地」または「培養培地」または「培地」という表現および「上清」という用語は同意語であると考えるべきである。感染された細胞培養物との関連では、「培地」および「上清」は、ウイルスまたはそのウイルス抗原を含む流体として理解すべきである。
【0059】
培養培地または上清を収集する前に、細胞感染を2〜10日間継続することができる。ウイルスまたはそのウイルス抗原を含む、細胞に基づく流体を収集するのに最適な時間は、感染のピークを決定することに基づく。例えば、CPE(細胞変性効果)は、細胞球状化、無定位性(disorientation)、膨潤または収縮、死滅、表面からの剥離を含む、ウイルス接種後に宿主細胞に生じる形態学的変化をモニターすることにより測定することができる。特定のウイルス抗原の検出は、ウエスタンブロット分析等のタンパク質検出の標準技術によりモニターすることができ、所望の検出レベルの達成時に、収集に進めることができる。インフルエンザウイルスの特定の場合では、HAの含有量は、SRDアッセイにより、上記のように、細胞にウイルスを接種した後の任意の時間でモニターすることができる。
【0060】
収集後、ウイルスは精製することができる。例えば、精製は、限外ろ過、超遠心分離(勾配超遠心分離を含む)、クロマトグラフィー(イオン交換クロマトグラフィー等)等の多くの様々なろ過、濃縮、および/または他の分離ステップ、並びに吸着ステップを様々な組合せで含むことができる。細胞性物質、夾雑物、特に浮遊完全細胞または細胞残屑からからウイルスを分離するために、清澄化ステップが要求され得る。
【0061】
そのため、本発明によるウイルスまたはそのウイルス抗原を含む流体は、粗流体に限定されず、部分的に精製されたウイルスを含む流体も企図する。本発明の意味では「粗」という用語は、ウイルスまたはそのウイルス抗原を含む流体に対し、その収集後、精製がなされておらず、よって、任意の種類の夾雑物を様々な程度まで含む可能性があることを意味する。非制限的な例として、ウイルスが、細胞に前記ウイルスを接種させることにより生産される場合、感染後、新たに形成されたウイルスが細胞培養培地または上清に放出される場合、ウイルスを含む前記培養培地は、粗流体の一例を示す。引用され得る粗流体の別の例は、発育鶏卵上へのウイルスの接種およびウイルス培養後に回収される尿膜腔液である。したがって、「部分的に精製された」という用語は、任意の中間精製状況、すなわち任意の精製ステップ、例えば、上記ステップのいずれかのそれぞれまたは任意の組みあわせの対象となっている流体を含む。
【0062】
1つの実施形態では、本発明による流体は、細胞を対象のウイルスで感染させた後に収集される培養培地である。
【0063】
別の好適な実施形態では、本発明による流体は清澄化される。この清澄化は濾過により実施してもよい。あるいは、遠心分離および/または濾過は、ウイルス調製の所望の清澄レベルを達成するために、任意の順に一緒に組み合わせてもよい。好適なフィルターには、セルロースフィルター、再生セルロースフィルター、無機ろ過助剤と組合せたセルロース繊維、無機ろ過助剤および有機樹脂と組合せたセルロースフィルター、またはそれらの任意の組合せ、およびポリマー性フィルターを使用することができる。必須ではないが、例えば、適切な公称細孔径を有するフィルター、特に減少する公称細孔径を有するフィルターを使用して、大きな沈殿物および細胞残屑の除去から始めることを可能にし、それらのサイズにより不純物を連続的におよび徐々に除去することを含む2段階または3段階等の多重ろ過プロセスを実施してもよい。加えて、比較的細かいフィルターまたは遠心分離を使用する単一段階作業を、清澄化に使用することもできる。より一般的には、これらに限定されないが、デッドエンドろ過(dead-end filtration)、デプスろ過(depth filtration)、精密ろ過、または遠心分離を含み、その後のステップで膜および/または樹脂を詰まらせない好適な清澄性のろ過液を提供する任意の清澄化手法が、本発明の清澄化ステップで使用に許容されるだろう。1つの特定の実施形態では、ウイルス清澄化ステップは、デプスろ過により、具体的には、例えば、5μm−0.5μm−0.2μmの公称多孔度を有する3つの異なるデプスフィルターで構成される3段階連続ろ過を使用して実施される。別の実施形態では、ウイルス回収物は、遠心分離により前清澄化され、その後デプスろ過、例えば、0.5μm−0.2μmの公称多孔度を有する2つの異なるフィルターで構成される連続ろ過を使用して清澄化される。
【0064】
要求はされないが、本発明による密度勾配上に負荷する前に、負荷させる流体容積を減少させるために、ウイルスまたはそのウイルス抗原を含む流体を濃縮することが好適であり得る。したがって、本発明はまた、密度勾配に負荷する前に濃縮されたウイルスまたはそのウイルス抗原を含む流体を企図する。そのためウイルスまたはそのウイルス抗原を含む流体は、ウイルスを濃縮するためにおよび/または緩衝液を交換するために、限外ろ過(緩衝液交換に使用される場合は、ダイアフィルトレーションと呼ばれる場合もある)に、例えば750kD膜上で、かけることができる。このステップは、接種後数日にわたって灌流により収集されたウイルス回収物を貯溜する場合のように、精製しようとするウイルスが希釈されている場合に特に有利である。本発明の方法によりウイルスを濃縮するために使用されるプロセスは、希釈液がウイルス懸濁液から除去されるが、ウイルスはフィルターを通り抜けることができず、それによりウイルス調製において濃縮形態を維持するように、希釈液を強制的にフィルターに通すことによりウイルスの濃度を増加させる任意のろ過プロセスを含むことができる。
【0065】
限外ろ過は、塩、糖、非水性溶媒の除去および交換、低分子量物質の除去、イオンおよび/またはpH環境の迅速な変化に理想的な方法であるダイアフィルトレーションを含んでもよい。微細溶質は、限外ろ過速度と等しい速度で、限外ろ過されている溶液に溶媒を添加することにより最も効率的に除去される。これにより、一定容積の溶液から微細種が洗浄され、保持されたウイルスが単離される。下流のステップが、最適な反応を得るために特定の緩衝液の使用を必要とする場合、ダイアフィルトレーションは特に有利である。ショ糖勾配超遠心分離後のショ糖、またはホルムアルデヒドによるウイルス不活性化ステップ後のホルムアルデヒド等の望ましくない化合物を除去することが求められる場合、濃縮およびダイアフィルトレーションを、精製プロセスの任意の好適なステップで実施することもできる。この系は、3つの別個のプロセス流:供給溶液(ウイルスを含む)、透過液、および濃縮液で構成される。応用に応じて、異なる細孔径を有するフィルターを使用することができる。フィルター組成は、これらに限定されないが、再生セルロース、ポリエーテルスルホン、ポリスルホン、またはそれらの誘導体であってもよい。膜は、平板(ファルトスクリーン(falt screen)とも呼ばれる)であってもよく、または中空繊維であってもよい。
【0066】
1つの実施形態では、ウイルスまたはそのウイルス抗原を含む流体は、限外ろ過/ダイアフィルトレーションにより、特に本発明の方法に従い実施される超遠心分離ステップの密度勾配上に負荷する前に、濃縮される。
【0067】
本発明による精製方法は、密度勾配容積上に負荷されるウイルスまたはそのウイルス抗原の量の特定の比に基づく、本明細書で主張されている密度勾配超遠心分離の最適化されたステップの他に、追加のステップを含んでもよい。これらのステップは、前記最適化された密度勾配超遠心分離ステップの前後で実施され得る。具体的に、本発明による密度勾配超遠心分離ステップを用いた後に得られたウイルス調製物は、前に言及されているウイルス精製技術のいずれか1つ、例えば、濾過、超遠心分離(勾配超遠心分離を含む)、クロマトグラフィー(イオン交換クロマトグラフィー等)吸着ステップを様々な組み合わせで実施することによりさらに精製してもよい。
【0068】
1つの実施形態では、本発明の方法は、濾過、超遠心分離/ダイアフィルトレーション、超遠心分離およびクロマトグラフィー、ならびに任意のそれらの組み合わせからなる群より選択される少なくとも1つのステップをさらに含む。所望される純度レベルによって、上記ステップは、いかようにも組み合わせ得る。
【0069】
1つの実施形態では、本発明の方法は、超遠心分離の第2のステップ、場合により密度勾配超遠心分離、具体的にはショ糖勾配超遠心分離をさらに含む。この追加の超遠心分離ステップは、本発明の最適化された密度勾配超遠心分離の前または後で起こりえる。
【0070】
特定の実施形態では、本発明の密度勾配超遠心分離により精製されたウイルスは、第2の超遠心分離ステップの対象であり、前記ステップは場合によりショ糖勾配超遠心分離ステップである。
【0071】
あるいは、陰イオン性または陽イオン性のイオン交換クロマトグラフィー、ゲルろ過またはゲル浸透等のサイズ排除クロマトグラフィー、疎水性相互作用クロマトグラフィー、ヒドロキシアパタイト、またはそれらの任意の組合せを含むクロマトグラフィーによりウイルスをさらに精製することも可能である。上記で言及したように、クロマトグラフィーステップは、密度勾配超遠心分離等の他の精製ステップと組合せて実施することができる。
【0072】
ウイルス精製段階の終わりで、ウイルス調製物は、好適にはろ過滅菌法にかけることができ、これは免疫原性組成物またはワクチン等の医薬品等級物質のプロセスと共通しており、当業者に公知である。そのようなろ過滅菌は例えば、好適には、0.22μmフィルターで調製物をろ過することにより実施することができる。無菌調製した後で、ウイルスまたはウイルス抗原は、所望であれば、臨床使用の準備ができている状態である。
【0073】
本発明は、本発明による方法により取得可能なウイルスに、本発明による方法により取得可能なウイルスまたはウイルス抗原を含む組成物に、および医学におけるそれらの使用にさらに関する。それらは、ヒトまたは動物に投与するためのワクチンをもたらす任意の公知の方法により製剤化することができる。したがって、このタイプのウイルスまたはウイルス抗原を含む、ワクチン等の免疫原性組成物も、本発明により企図される。
【0074】
免疫原性組成物、具体的にはワクチンは、一般的にはサブビリオン形態、例えば、脂質エンベロープが溶解されているかまたは分解されている分割ウイルスの形態で、または1つ若しくは複数の精製ウイルスタンパク質(サブユニットワクチン)の形態で製剤されるだろう。代案として、免疫原性組成物は、全ウイルス、例えば生菌弱毒化全ウイルス、または不活化全ウイルスを含んでいてもよい。
【0075】
したがって、ウイルスまたはそのウイルス抗原を含む流体は、本発明の意味では、生弱毒化かまたは不活化かに関わらず、全ウイルス、分割ウイルスおよび精製ウイルス抗原を含んでもよい。本発明による流体はまた、組換え発現されたウイルス抗原を含むことができる。
【0076】
本発明はまた、分割工程、本発明の精製方法中に、前記方法の工程(b)の前、中、または後に関係なく、いずれの時点でも実施されることを企図する。
【0077】
インフルエンザウイルス等のウイルスを分割する方法は、当技術分野で周知である(国際公開第02/28422号パンフレット)。ウイルスの分割は、分解濃度の分割剤を用いて、感染性(野生型または弱毒化)かまたは非感染性(不活化)かに関わらず、全ウイルスを分解または断片化することにより実施される。分割剤には、一般的に、脂質膜を分解および溶解可能な作用剤が含まれる。伝統的に、分割インフルエンザウイルスは、トリ−n−ブチルホスフェート、またはTween(商標)と組合せたジエチルエーテル(「Tween−エーテル」分割として知られている)等の溶媒/界面活性剤処理を使用して生産され、このプロセスは、幾つかの生産設備で未だに使用されている。現在使用されている他の分割剤には、界面活性剤またはタンパク質分解酵素または胆汁酸塩、例えばデオキシコール酸ナトリウムが含まれる。分割剤として使用することができる界面活性剤には、陽イオン性界面活性剤、例えばセチルトリメチル臭化アンモニウム(CTAB)、他のイオン性界面活性剤、例えばラウリル硫酸ナトリウム(SLS)、タウロデオキシコレート、またはTween若しくはトリトン(Triton)X−100等の非イオン性界面活性剤、または任意の2つ以上の界面活性剤の組合せが含まれる。
【0078】
1つの実施形態では、分割剤はデオキシコレートである。別の実施形態では、分割剤はトリトンX−100である。更なる実施形態では、本発明による方法では、分割剤としてトリトンX−100およびラウリル硫酸ナトリウムの組合せが使用される。
【0079】
分割プロセスは、バッチプロセス、連続プロセス、または半連続プロセスとして実施することができる。バッチで実施される場合、分割ウイルスは、クロマトグラフィーステップ等の、追加的精製ステップが必要とされる場合がある。
【0080】
1つの実施形態では、ウイルスまたはそのウイルス抗原を含む流体は、本発明による密度勾配超遠心分離により精製され、精製されたウイルスは随意に、第2の密度勾配超遠心分離によりさらに精製され、精製されたウイルスまたはそのウイルス抗原はバッチ法で、特にトリトンX−100を用いて分割される。
【0081】
別の精製ステップと同時に分割を実施することが可能であるため、分割ステップそれ自体は実施する必要はない。特に、分割剤は密度勾配に添加することができる。そのような実施形態は、ウイルスの精製および分割の両方を単一操作内で実施することが可能となるので、本発明の方法の総ステップ数を最小に抑えることが望ましい場合に特に好適である。このように、1つの実施形態では、ウイルスまたはそのウイルス抗原を含む流体を精製するための本発明の方法に従い使用される最適化された密度勾配超遠心分離ステップの濃度勾配、具体的にはショ糖勾配は、さらに分割剤を含む。
【0082】
あるいは、分割剤は、本発明の最適化された密度勾配超遠心分離に加えて、さらなる密度勾配超遠心分離が実施される場合、追加の超遠心分離ステップの密度勾配に添加され得る。
【0083】
ワクチンの安全性のため、精製プロセスの様々なステップにわたってウイルス懸濁液の感染力を低減することが必要とされる場合がある。ウイルスの感染力は、ウイルスが細胞系で複製する能力により決定される。したがって、本発明による方法は、随意に、任意の時に起こる少なくとも1つのウイルス不活化ステップを含む。不活化は、本方法の任意の好適なステップでBPL(β−プロピオラクトン)を使用することにより実施することができる。1つの実施形態では、本発明による方法は、少なくとも1つのBPL処理ステップをさらに含む。別の実施形態では、本発明による方法は、少なくとも1つのBPL処理ステップおよび少なくとも1つのホルムアルデヒド処理ステップをさらに含む。ホルムアルデヒドおよびBPLは、連続して任意の順序で使用することができ、例えばホルムアルデヒドは、BPLの後に使用される。
【0084】
ワクチンを含む本発明の免疫原性組成物は、随意にワクチン用に通例となっている添加剤、具体的には組成物を受容する患者に誘発される免疫応答を増加させる物質、つまりいわゆるアジュバントを含有することができる。
【0085】
1つの実施形態では、免疫原性組成物が企図され、これは好適な医薬担体と混合された本発明のウイルスまたはそのウイルス抗原を含む。特定の実施形態では、それらはアジュバントを含む。
【0086】
アジュバント組成物は、代謝可能な油および乳化剤を含む水中油型乳剤を含んでいてもよい。任意の水中油型組成物がヒト投与に好適であるためには、乳剤系の油相は、代謝可能な油を含む。代謝可能な油という用語の意味は、当技術分野で周知である。代謝可能とは、「代謝により変換することが可能である」と定義することができる(Dorland’s Illustrated Medical Dictionary, W.B. Sanders Company, 25th edition (1974))。油は、任意の植物油、魚油、動物油、または合成油であってもよく、受容者に毒性でなく、代謝により変換が可能である。ナッツ、種子、および穀物は、植物油の一般的供給源である。合成油も本発明の一部であり、NEOBEE(登録商標)等の市販の油が含まれていてもよい。
【0087】
特に好適な代謝可能な油は、スクアレンである。スクアレン(2,6,10,15,19,23−ヘキサメチル−2,6,10,14,18,22−テトラコサヘキサエン)は、鮫肝油中に多量に見出され、オリーブ油、麦芽油、米糠油、および酵母中により少量見出される不飽和油であり、本発明で使用するために特に好ましい油である。スクアレンは、コレステロール生合成の中間体であるという事実により、代謝可能な油である(メルクインデックス、第10版、エントリー番号8619)。本発明の更なる実施形態では、代謝可能な油は、免疫原性組成物中に、組成物の全容積の0.5%〜10%(容積/容積)の量で存在する。
【0088】
水中油型乳剤は、乳化剤をさらに含む。乳化剤は、好適にはポリオキシエチレンソルビタンモノオレアートであってもよい。さらに前記乳化剤は、好適には、ワクチンまたは免疫原性組成物中に、組成物の全容積の0.125〜4%(容積/容積)で存在する。
【0089】
本発明の水中油型乳剤は、随意にトコール含む。トコールは、当技術分野で周知であり、欧州特許第0382271号明細書に記述されている。好適には、トコールは、アルファ−トコフェロールまたはアルファ−トコフェロールスクシナート(ビタミンEスクシナートとしても知られている)等のその誘導体であってもよい。前記トコールは、好適にはアジュバント組成物中に、免疫原性組成物の全容積の0.25%〜10%(容積/容積)の量で存在する。
【0090】
水中油型乳剤を生成する方法は、当業者に周知である。一般的には、その方法は、油相(随意にトコールを含む)をPBS/TWEEN80(商標)(またはポリソルベート80)溶液等の界面活性剤と混合し、その後ホモジナイザーを使用して均質化することを含む。好適な方法は、少量の液体を均質化するために、混合物を注射器針に2回通すことを含む。あるいは、当業者であれば、マイクロ流動化器(microfluidiser)(M110Sマイクロ流体装置、最高50回通過、最大圧力入力6bar(約850barの出力圧力)で2分間)による乳化プロセスを応用して、より少量またはより大量の乳剤を生成することができるだろう。この応用は、要求直径の油滴で調製が達成されるまで、その結果生じる乳剤を測定することを含む日常的な実験作業により達成することができるだろう。
【0091】
水中油型乳剤では、油および乳化剤は水性担体中にあるべきである。水性担体は、例えばリン酸緩衝生理食塩水であってもよい。
【0092】
具体的には、本発明の水中油型乳剤系は、サブミクロン範囲の小さな油滴サイズを有する。好適には、液滴サイズは、直径が120〜750nmの範囲、より具体的には120〜600nmのサイズであろう。更により具体的には、水中油型乳剤は、強度で少なくとも70%が、500nm未満の直径であり、より具体的には強度で少なくとも80%が、300nm未満の直径であり、より具体的には強度で少なくとも90%が、120〜200nmの範囲の直径である油滴を含有する。
【0093】
油滴サイズ、つまり直径は、本発明によると、強度により与えられる。油滴サイズの直径を強度により決定するには幾つかの方法がある。強度は、サイズ測定装置、好適には、Malvern Zetasizer 4000または好適にはMalvern Zetasizer 3000HS等の動的光散乱を使用することにより測定される。詳細な手順は、実施例II.2に示されている。第1の可能性は、動的光散乱(PCS−光子相関分光法)によりz平均直径ZADを決定することであり、この方法では、多分散性指数(PDI)がさらにもたらされ、ZADおよびPDIは両方ともキュミュラントアルゴリズムで算出される。これらの値は、粒子屈折率に関する知識を必要としない。第2の手段は、別のアルゴリズム、Contin、またはNNLS、または自動化「Malvern」アルゴリズム(サイズ測定装置により提供される初期設定アルゴリズム)のいずれかにより全粒度分布を決定することにより、油滴の直径を計算することである。ほとんどの場合、複雑な組成物の粒子屈折率は未知であるため、強度分布のみが考慮され、必要に応じて、強度平均はこの分布からもたらされる。
【0094】
アジュバント組成物は、トール(Toll)様受容体(TLR)4アゴニストをさらに含んでいてもよい。「TLR4アゴニスト」とは、リガンドとして直接的に、または内在性若しくは外来性リガンドの生成により間接的にのいずれかで、TLR4シグナル伝達経路を介してシグナル伝達応答を引き起こすことが可能な成分を意味する。TLR4は、リピドA誘導体、具体的にはモノホスホリルリピドA、またはより具体的には3脱アシル化モノホスホリル(monophoshoryl)リピドA(3D−MPL)であってもよい。
【0095】
3D−MPLは、英国特許出願公開第2 220 211号明細書に開示されている方法により生成することができる。化学的には、これは、3−脱アシル化モノホスホリルリピドAと3、4、5、または6つのアシル化鎖との混合物である。具体的には、本発明のアジュバント組成物では、小粒子3D−MPLが使用される。小粒子3D−MPLは、0.22μmフィルターで滅菌ろ過することができるような粒子サイズを有する。そのような調製物は、国際公開第94/21292号パンフレットに記述されている。リピドAの合成誘導体は公知であり、TLR4アゴニストであると考えられており、これらに限定されないが、以下のものを含む:
OM174(2−デオキシ−6−o−[2−デオキシ−2−[(R)−3−ドデカノイルオキシテトラ−デカノイルアミノ]−4−o−ホスホノ−β−D−グルコピラノシル]−2−[(R)−3−ヒドロキシテトラデカノイルアミノ]−α−D−グルコピラノシルジヒドロゲンホスフェート)、(国際公開第95/14026号パンフレット);
OM294 DP (3S,9R)−3−[(R)−ドデカノイルオキシテトラデカノイルアミノ]−4−オキソ−5−アザ−9(R)−[(R)−3−ヒドロキシテトラデカノイルアミノ]デカノ−1,10−ジオール,1,10−ビス(ジヒドロゲノホスフェート)(国際公開第99/64301号パンフレットおよび国際公開第00/0462号パンフレット);
OM197 MP−Ac DP(3S−、9R)−3−[(R)−ドデカノイルオキシテトラデカノイルアミノ]−4−オキソ−5−アザ−9−[(R)−3−ヒドロキシテトラデカノイルアミノ]デカノ−1,10−ジオール,1−ジヒドロゲノホスフェート10−(6−アミノヘキサノアート)(国際公開第01/46127号パンフレット)。
【0096】
使用することができる他のTLR4リガンドは、国際公開第9850399号パンフレットまたは米国特許第6303347号明細書(AGPを調製するためのプロセスも開示されている)で開示されているもの等のアルキルグルコサミニドホスフェート(AGP)、または米国特許第6764840号明細書で開示されているようなAGPの薬学的に許容される塩である。幾つかのAGPは、TLR4アゴニストであり、幾つかは、TLR4アンタゴニストである。両方ともアジュバントとして有用であると考えられる。加えて、さらに好適なTLR−4アゴニストは、米国特許出願公開第2003/0153532号明細書および米国特許出願公開第2205/0164988号明細書で開示されている。
【0097】
本発明は、ワクチンを含むインフルエンザウイルス免疫原性組成物を調製するために特に好適である。種々の形態のインフルエンザウイルスが、現在入手可能である。それらは、一般的に、生ウイルスまたは不活化ウイルスのいずれかに基づく。不活化ワクチンは、全ビリオン、分割ビリオン、または精製された表面抗原(HAを含む)に基づいていてもよい。インフルエンザ抗原は、ビロソーム(無核酸のウイルス様リポソーム粒子)の形態で提示することもできる。
【0098】
ウイルス不活性化法および分割法は上述されており、インフルエンザウイルスに適用可能である。
【0099】
ワクチンに使用するためのインフルエンザウイルス株は、季節毎に変化する。現行の大流行間期では、ワクチンは、典型的には2つのインフルエンザA型株および1つのインフルエンザB型株を含んでいる。三価ワクチンが典型的であるが、4価等のより高い価数も本発明で企図される。本発明は、大流行株(つまりワクチン受容者および一般ヒト集団が免疫学的に未感作である菌株)に由来するHAを使用することもでき、大流行株のインフルエンザワクチンは一価であってもよく、大流行株で補完された通常の三価ワクチンに基づいていてもよい。
【0100】
本発明の組成物は、インフルエンザA型ウイルスおよび/またはインフルエンザB型ウイルスを含む、1つまたは複数のインフルエンザウイルス株に由来する抗原(複数可)を含んでいてもよい。具体的には、2つのインフルエンザA型ウイルス株および1つのインフルエンザB型ウイルス株に由来する抗原を含む三価ワクチンが、本発明により企図される。あるいは、2つのインフルエンザA型ウイルス株および2つのインフルエンザB型ウイルス株に由来する抗原を含む四価ワクチンもまた、本発明の範囲内にある。
【0101】
本発明の組成物は、つまり1つの菌株タイプのみ、つまり季節性株のみまたは大流行株のみを含む一価組成物に制限されない。本発明は、季節性株および大流行株の組合せを含む組成物も包含する。具体的には、3つの季節性株および1つの大流行株を含み、アジュバント化されていてもよい4価組成物は、本発明の範囲内にある。本発明の範囲内にある他の組成物は、H1N1、H3N2、およびB型株等の、2つのA型株および1つのB型株を含む三価組成物、並びにH1N1、H3N2、B/Victoria、およびB/Yamagata等の異なる系統の2つのA型株および2つのB型株を含む4価組成物である。
【0102】
HAは、現行の不活化インフルエンザワクチンの主な免疫原であり、ワクチン用量は、典型的にはSRDにより測定されるHAレベルを基準にすることにより正規化される。既存のワクチンは典型的には1株当たり約15μgのHAを含有していが、例えば、小児用には、または大流行の状況においては、またはアジュバントを使用する場合は、より低い用量を使用することができる。半量(つまり1株当たり7.5μgのHA)または4分の1量等の分割量が使用されており、同様により高い用量、具体的には3倍または9倍の用量も使用されている。したがって、本発明の免疫原性組成物は、1インフルエンザ株当たり0.1〜150μg、具体的には0.1〜50μg、例えば0.1〜20μg、0.1〜15μg、0.1〜10μg、0.1〜7.5μg、0.5〜5μg等のHAを含んでいてもよい。特定の用量には、1株当たり約15、約10、約7.5、約5μg、1株当たり約3.8μg、および1株当たり約1.9μgが含まれる。
【0103】
特定の株のインフルエンザウイルスが精製されれば、例えば、上述のような三価ワクチンを製作するために、他の株に由来するウイルスと混合することができる。ウイルスを混合し、DNAを分解し、多価性混合物からそれを精製するのではなく、各菌株を別々に処理し、一価性バルクを混合して、最終多価性混合物を得ることがより好適である。
【0104】
本発明は、下記の非限定的な実施例を参照することによりさらに説明される。
【実施例】
【0105】
実施例1:MDCK細胞でのインフルエンザウイルスの生産およびショ糖勾配超遠心分離による精製−ショ糖勾配の容積を増加させることによるHA収率の改善(実験JP104、JP115、JP125、EFC3APA001、EFC3APA002およびDFC3APA003)
1.ウイルス増殖
MDCK接着細胞を、36.5℃で、20リットルの撹拌バイオリアクター規模の灌流培養法でマイクロキャリア上で増殖させた。増殖段階の後、適切な細胞密度、5×106細胞/ml超(JP104、JP115、JP125およびEFC3APA001)または約2.5×106細胞/ml(EFC3APA002およびDFC3APA003)に到達したら、インフルエンザウイルス(1×10−5の感染多重度)、Jiangsu B株(JP104、JP115、JP125、EFC3APA001およびEFC3APA002)またはMalaysia B株(DFC3APA003)を灌流法で細胞に接種し、温度を33℃(Jiangsu B株)または35℃(Malaysia B株)に切替えた。Benzonaseをバイオリアクターに1.5単位/mlの終濃度で、接種後の3および4日目に添加した(JP125、EFC3APA001、EFC3APA002およびDFC3APA003)。実験JP115およびJP104ではBenzonaseを添加しなかった。ウイルスを、接種後の3および4日目(JP115)に、または接種後の3、4、および5日目(JP125、JP104、EFC3APA001、EFC3APA002およびDFC3APA003)に、灌流により回収した。灌流回収物を貯留し、さらに処理するまで2〜8℃の範囲の温度で保管した。
【0106】
2.ウイルス精製
a)全ての実験からのウイルス回収物を、5μm−0.5μm−0.2μmの公称多孔度を有する3つの異なるデプスフィルターで構成される連続ろ過で清澄化した。清澄化された回収物を、2〜8℃の範囲の温度で終夜保管した。
【0107】
b)その後、清澄化された回収物を、750kDの中空糸膜で限外ろ過することにより濃縮し約2リットルの最終容積となるようにし、125mMクエン酸および0.001%トリトンX−100−pH7.4を含有する5容積のPBSに対して、および10mMトリス、2mM MgCl2 pH8、100μM CaCl2、0.001%トリトンX−100−pH8の4容積に対してダイアフィルトレーションした。
【0108】
c)濃縮液を限外ろ過システムから取り出し、水浴で37℃まで暖めた。DNA分解を、Benzonase(商標)(Merck社製)を、270単位/ml(JP115)または135単位/ml(JP104)、または200単位/ml(JP125、EFC3APA001、EFC3APA002およびDFC3APA003)の終濃度で濃縮液に添加することにより実施し、混合物を37℃で1時間インキュベートした。
【0109】
d)次に、限外ろ過濃縮液をショ糖勾配超遠心分離にかけた。勾配容積を増加させる影響を評価するために、それぞれ、400mの容積用量を有するローターおよび1.6Lの容積用量を有するローターを用いて、いくつかの実験(JP104、JP115およびJP125)では、勾配容積を400mlとし、一方、他の実験(EFC3APA001、EFC3APA002およびDFC3APA003)では、勾配容積を1.6Lとした。遠心分離機は、PK3ローターと共に使用されるAlfa Wasserman製のPilot System PKII連続流超遠心分離機とした。125mMのクエン酸を含むPBS pH7.4中で調製したショ糖勾配溶液をローターに負荷し、その後、35000rpmの回転速度まで加速し、直線ショ糖勾配(0〜55%v/w)を形成させた。400mlローターでは1L/h、1.6Lローターでは4.1L/hのポンプ流速で、濃縮回収物(各実験で約2L)を用いて連続負荷した後、ローターを125mMのクエン酸洗浄緩衝液を含むPBS pH7.4で、連続してフラッシングし、勾配に入らなかった残留物質を除去した。フラッシング後、ローターを減速させ、超遠心分離機を停止させ、画分収集を実施した。
【0110】
精製させる容積を全て勾配に負荷したら、60分間の取扱時間で、ほとんどのウイルスが勾配内でその密度に到達させることが可能であった。ウイルス粒子を少数の画分内に濃縮した。産物画分は、125mMクエン酸およびショ糖を含有するPBS pH 7.4中だった。精製された全ビリオンを、およそ28%〜52%の範囲のショ糖のパーセントから貯留した。この範囲は、抗HAおよび抗MDCK抗体を使用して、SDS−PAGEおよびウエスタンブロット分析からのプロファイルに基づいて決定された。全ビリオンを貯留した画分を、2〜8℃の範囲の温度で保管し、その後PO4 66mM pH7.4(JP115およびJP104)またはPBS pH7.4(JP125、EFC3APA001、EFC3APA002およびDFC3APA003)中で9〜10倍に希釈した。
【0111】
e)ウイルスをさらに精製しながら、同時にウイルスを分割するために、第2のショ糖勾配超遠心分離を実施した。遠心分離は、ステップd)で記載されている条件と同じ条件で実施した。具体的には、全く同じローター、すなわち、実験JP104、JP115およびJP125に対しては400mlのローター、実験EFC3APA001、EFC3APA002およびDFC3APA003に対しては1.6Lのローターを使用した。PBS pH7.4中(JP125、EFC3APA001、EFC3APA002およびDFC3APA003)、またはPO4 66mM pH7.4中(JP104およびJP115)で調製したショ糖勾配溶液を、ローターに負荷し、その後、35000rpmの回転速度まで加速し、直線ショ糖勾配(0〜55%v/w)を形成させた。2%トリトンX−100(JP125、EFC3APA001、EFC3APA002およびDFC3APA003)、または1%トリトンX−100および1%ナトリウムデオキシコレートの組合せ(JP115およびJP104)をショ糖層に添加して、界面活性剤ミセル障壁を達成した。この界面活性剤障壁に進入する全ウイルスが分割された。ウイルス膜タンパク質赤血球凝集素(HA)およびノイラミニダーゼ(NA)を含有するウイルス断片は、ミセル密度部分に移動した。残りのビリオン、宿主細胞タンパク質夾雑物の幾つかおよびDNAは、ウイルスタンパク質と共に貯留されないより高いショ糖濃度画分に移動した。およそ18〜41%ショ糖の範囲の画分に存在するウイルスタンパク質を貯留する。この範囲は、抗HAおよび抗MDCK抗体を使用して、SDS−PAGEおよびウエスタンブロット分析からのプロファイルに基づいて決定された。ウイルスタンパク質を含有する画分貯留(プール)は、PO4 66mM pH7.4(JP104およびJP115)、またはPBS pH7.4(JP125、EFC3APA001、EFC3APA002およびDFC3APA003)中だった。その後、この貯留を全タンパク質含有量についてアッセイし、0.01%Tween80、アルファ−トコフェリル水素スクシナート0.1mM、および0.3% トリトンX−100 pH7.4を含有するPBS(JP125、EFC3APA001、EFC3APA002およびDFC3APA003)、または0.01%Tween80およびアルファ−トコフェリル水素スクシナート0.1mMを含むPO4 66mM pH7.4(JP104およびJP115)で約250μgタンパク質/mlに希釈した。
【0112】
第1の勾配上に負荷されるウイルス調製物、すなわち、濃縮され、Benzonase(商標)処理された回収物中に存在するHA量を、下記で記載されるSRDアッセイ法により測定した。HAの量はまた、各ショ糖勾配超遠心分離ステップ(ステップd)およびe))後に測定し、各ショ糖勾配超遠心分離ステップ後に得られる特異HA収率を計算した。したがって、HA収率1は、第1のショ糖勾配超遠心分離を実施した後の濃縮され、Benzonase(商標)処理された回収物から回収されたHAの割合に対応し、HA収率2は、第2のショ糖勾配超遠心分離を実施した後の、第1のショ糖勾配超遠心分離HA貯留から回収されたHAの割合に対応する。全体的なHA収率の行は、各精製プロセスの終わりで測定されたHA回収を表し、このように、両方のショ糖勾配超遠心分離ステップにより引き起こされた損失が考慮される。結果を表1で示す。表1の最終行で示されるように、HA/総タンパク質比もまた計算されており、これは各精製プロセスの終わりに得られる総タンパク質に対するHAの割合を表す。総タンパク質濃度は、古典的なLowry法により測定した。
【表1】

【0113】
*HA収率1およびHA収率2値は、実験EFC3APA002に対して得られなかった。代わりに、両方のショ糖勾配超遠心分離を実施した後に、濃縮回収物から回収したHAの割合を示す。
【0114】
結果−結論
図1に示されるように、表1のHA/ローター容積比(mg/ml)の行の値が、前記表の第1のショ糖勾配後のHA収率1(%)の行の値に対してプロットされており、ショ糖勾配の容積が増加すると、第1のショ糖勾配ステップにプラスの影響を有し、このステップのHA収率を少なくとも1.7倍および最大3倍まで増加させる(表1の行7も参照し、400mlのローターの列を1.6Lローターの列と比較されたい)。例えば、それぞれ、400mlのローターおよび1.6Lローターを使用する実験JP125およびDFC3APA003を比較する場合、第1のショ糖勾配上に負荷されるHAの量は非常に類似しており、それぞれ、529mgおよび571mgであり、増加係数は2である。また、表1の最後から2番目の列を調べると、全体的なHA収率は、第1のショ糖勾配超遠心分離中に1.6Lのローターを使用すると、400mlのローターを使用した場合に比べ、改善されることが観察できる。
【0115】
結論として、第1のショ糖勾配容積を4倍増加させると、このステップのHA収率が1.7〜3の範囲の係数まで改善され、インフルエンザウイルス精製プロセスの全体的なHA収率が少なくとも3の係数まで改善される。
【0116】
HA含有量を測定するために使用されたSRD法
ガラス板(12.4×10cm)を、NIBSCにより推奨されている濃度の抗インフルエンザHA血清を含有するアガロースゲルでコーティングする。ゲルをセットした後、72個の試料ウエル(直径3mm)をアガロースに打抜き、10μlの適切な希釈された参照および試料をウエルに負荷する。プレートを、室温(20〜25℃)の加湿チャンバー内で24時間インキュベートする。その後、プレートを、NaCl溶液に終夜浸漬し、蒸留水で短期間洗浄する。その後ゲルを圧迫して乾燥する。完全に乾燥したら、プレートをクーマシーブリリアントブルー溶液で10分間染色し、明らかにはっきりとした染色帯域が目に見えるようになるまで、メタノールおよび酢酸の混合物で2回脱染する。プレートを乾燥した後、抗原ウエルを取り囲む染色帯域の直径を、直角に交わる2つの方向で測定する。あるいは、表面を測定する機器を使用することができる。表面に対する抗原希釈物の用量反応曲線を構築し、結果は、標準傾斜比アッセイ法(standard slope-ratio assay method)に従って計算される(Finney, D.J. (1952) Statistical Methods in Biological Assay. London: Griffin, Quoted in: Wood, JM, et al (1977). J. Biol. Standard. 5, 237-247)。
【技術分野】
【0001】
連邦政府支援研究に関する声明
本発明の態様は、保健社会福祉省の契約番号HHSO100200600011C号に基づく米国政府支援によりなされており、米国政府は本発明に特定の権利を有する場合がある。
【0002】
技術分野
本発明はウイルス、またはそのウイルス抗原を精製するための方法、より詳細には、細胞培養により生産されたウイルスまたはウイルス抗原の精製のための方法に関する。本発明はウイルス収率を改善するための精製方法を提供する。
【背景技術】
【0003】
ウイルスにより引き起こされる膨大な数の疾患のために、ウイルス学は集中的に研究されている分野となっている。ウイルスタンパク質を単離し、精製し、ワクチンを生産させるために、分析ツールを調製するために、または実験室検査のためにウイルスを提供するために、ウイルスを効率よく生産させることが常に要求されている。
【0004】
最近では、卵に基づく従来の生産系の代替として、細胞培養に基づく技術が開発されている。
【0005】
細胞培養系は、ワクチン調製の、特により単純で柔軟性があり一貫した好適な代替法と考えられており、ワクチン生産能力のスケールアップの可能性を向上させ、したがって必要に応じて、特に、大流行脅威またはテロ攻撃の場合に、大量のウイルス調達を可能にする。
【0006】
しかしながら、生産後、細胞培養により生産されたウイルスは、細胞培養物から回収され、適切な場合、精製される必要がある。ウイルスを精製するための方法は当技術分野において公知である。例えば、US6,008,036号は、細胞培養に基づくウイルスを精製するためのクロマトグラフィーマトリクスの使用を開示する。いくつかの他の方法もまた記載されている。例えば、1つの特定の好ましい方法は、ショ糖(スクロース)勾配遠心分離(US6,048,537号)を使用する。そのようなプロセスは、ウイルスまたはウイルス抗原、純度を増加させることができるが、ウイルス物質が途中で失われるので、低いウイルス収率を提供するという主な欠点を提示する。最近になって、改善され、最適化された密度勾配超遠心分離法に依存する方法が提供されている。例えば、US2008/0274138号は、異なる濃度の2つ以上の緩衝糖層の追加により確立された糖勾配上での遠心分離を用いるウイルス精製のための方法を開示する。国際公開第2008/073490号パンフレットは、直線逆グリセロール−酒石酸カリウム勾配での超遠心分離法によりウイルスを精製するための方法を提供する。これらの方法のどちらも、当技術分野で以前に知られている密度勾配よりもずっと複雑な特定の勾配の精緻化に依存している。
【0007】
そのため、実行するのが簡単な、ウイルス回収および精製のための代替改善法を提供することが依然として必要である。
【発明の概要】
【0008】
本発明による方法は、精製プロセス中に密度勾配超遠心分離ステップを実施する際のウイルス損失を制限し、よって、ウイルス収率を増加させる簡単な解決策を提供する。
【0009】
本発明の第1の態様では、少なくとも下記ステップを含む、ウイルスまたはそのウイルス抗原を精製するための方法が提供される:
a)ウイルスまたはそのウイルス抗原を含む流体を得るステップ、および
b)少なくとも1つの密度勾配超遠心分離ステップにより流体を精製するステップであって、密度勾配容積に対する、流体中に存在するウイルスまたはそのウイルス抗原の量の比が1未満、0.8未満、0.6未満および0.4未満である、ステップ。
【0010】
本発明の第2の態様では、密度勾配超遠心分離ステップの少なくとも1つのステップを含む、細胞培養により製造されるウイルスまたはそのウイルス抗原を精製するための方法であって、密度勾配容積に対する、ウイルスまたはそのウイルス抗原を含み、密度勾配上に負荷される流体中に存在するウイルスまたはそのウイルス抗原の量の比が1未満、0.8未満、0.6未満および0.4未満である方法が提供される。
【0011】
第3の態様では、本発明により得られたウイルスを薬学的に許容される担体と混合するステップを少なくとも含む、ワクチンを調製するための方法が提供される。
【図面の簡単な説明】
【0012】
【図1】ショ糖(スクロース)勾配超遠心分離ステップ後のHA収率(%)に対するHA量/ローター容積比(mg/ml)の影響を示す図である。HA収率は、ショ糖勾配超遠心分離ステップ(示されたローターを用いて実施)後に回収されたHAの割合を表し、これは、SRDアッセイ法により、超遠心分離法前後でHA量を測定することにより計算した。HA収率値を、HA量/ローター容積比の値に対してプロットした。
【発明を実施するための形態】
【0013】
本発明は、小規模および大規模ウイルス生産の両方に適用することができる、ウイルス、特に細胞培養により生産されたウイルスを精製するための方法に関する。方法は、特に、より高いウイルス収率を達成することができる密度勾配超遠心分離の改善されたステップを含む。本発明の方法により得られたウイルス調製物は、ウイルス精製のために使用される標準技術を用いてさらに精製され得る。本発明により調製されたウイルスは、例えば、ウイルスタンパク質の精製、分析アッセイ法、宿主細胞の感染、診断目的または治療もしくは予防用途、例えばワクチン接種および臨床投与を含む任意の目的のために使用することができる。
【0014】
本発明によれば、前記勾配の容積に対する、勾配上に負荷される流体中に存在するウイルスまたはそのウイルス抗原の量の比は、考慮する必要のある重要な因子である。実際、本発明者等は、予想外に、ウイルス量を一定に保ちながら、勾配密度の容積を変動させると、より良好なウイルス収率が得られることを観察した。特に、密度勾配容積を2倍にすると、ウイルス収率が2倍増加する。
【0015】
したがって、本発明の1つの実施形態では、mlで表された密度勾配容積に対する、重量、例えばmgで表された流体中に存在するウイルスまたはそのウイルス抗原の量の比は、1未満、特に0.8未満、より特定的には0.6未満およびさらに、0.4mgのウイルス/mlの勾配未満である。ウイルス重量はまた、より高い単位、例えばg、またはより低い単位、例えばμgで表してもよい。勾配容積はまた、Lまたはμlで表してもよい。しかしながら、本発明による比計算は、等価単位すなわち、g/L、mg/mlまたはμg/μlで示される重量と容積に対する値を使用することに頼らなければならない。本発明の状況では、「等価」は、同じ指標であることが理解されるべきである。
【0016】
例えば、ローターがymlの容積用量を有する場合、前記ローター上に負荷させることができる勾配容積はymlである。ウイルス流体がxmgのウイルスを含む場合、本発明によれば、xmgのウイルス/ymlの勾配の比は、好適には、1未満、より好適には0.8未満、さらにより好適には0.6未満、さらには0.4mgのウイルス/mlの勾配未満である。
【0017】
特定の実施形態では、密度勾配超遠心分離後のウイルス収率、すなわち、超遠心分離後に回収される抗原の割合、特に、本発明の方法による比、例えば、0.4〜1の範囲の比を使用した場合に得られるインフルエンザウイルスからのHA抗原の収率は、SRD(一元放射免疫拡散)により測定されるように、50%より高く、特に60%より高く、好適には、70%より高く、より好適には80%より高く、さらに85%より高い。
【0018】
別の実施形態では、本発明の方法による、0.4〜1の範囲の比を使用した場合に得られるウイルス収率は、1を超える比、例えば1.3〜2の範囲の比を用いて得られる場合と比較して、少なくとも1.5、特に2、好適には2.5、より好適には3倍高い。
【0019】
1つの実施形態では、本発明の方法による比は、密度勾配の容積を増加させることにより調節される。
【0020】
ウイルスの量は、当技術分野の技術において知られているいずれによっても分析することができる。例えば、ウイルスの存在は、ウイルス構成物の1つ、好適には特異ウイルス抗原の検出をモニターし、測定することにより定量することができる。例示的な技術として、ウエスタンブロット分析による特異ウイルス抗原の分析が挙げられる。インフルエンザウイルスを考慮する場合、抗原HAは、抗HA抗体を用いるウエスタンブロット分析により検出、定量され得る。HAの量を測定するための別のアッセイ法は、SRD(一元放射免疫拡散)アッセイ法であり、これは、当業者によく知られて技術である(J.M. Wood et al.: An improved single radial immunodiffusion technique for the assay of influenza haemagglutinin antigen: adaptation for potency determination of inactivated whole virus and subunit vaccines. J. Biol. Stand. 5 (1977) 237-247; J. M. Wood et al., International collaborative study of single radial diffusion and immunoelectrophoresis techniques for the assay of haemagglutinin antigen of influenza virus. J. Biol. Stand. 9 (1981) 317-330))。
【0021】
密度勾配超遠心分離は、ウイルスを精製するために普通に使用される技術である。特にワクチン製造分野において使用される。ウイルスを含む流体が密度勾配上に負荷され、超遠心分離にかけられる場合、ウイルスは、それらの密度が勾配の密度と等価である勾配中の位置まで移動し、一方、夾雑物は勾配中で停止されず、沈殿する。沈殿は廃棄され、ウイルスを含む勾配画分のみが収集される。 使用されるローターの型によって、動的収集(遠心分離中)または勾配の再配向後の静的回収(停止時)が実施される。本発明によれば、密度勾配超遠心分離法はゾーンまたは等密度としてもよい。連続法、半連続法または逐次バッチで実施してもよい。
【0022】
本発明の方法により使用される密度勾配超遠心分離はいかなる点においても制限されず、本発明は任意の条件、例えば上記条件のいずれかにおける任意の型の超遠心分離を含む。例えば、特定の速度要求も、本発明の方法により強要されない。適切な遠心分離速度は、精製されるウイルス、遠心分離の型、ローターの型、ならびにローターの特徴によって設定することができる。ウイルスを勾配に入れ、勾配内のその密度に到達させることができれば、いずれの速度とすることもできる。例えば、目安にすぎないが、ショ糖(スクロース)勾配上でインフルエンザウイルスを精製したい場合、35000rpmで超遠心分離を実施することができる。
【0023】
本発明は特定の密度勾配の使用に依存しておらず、よって、任意の密度勾配に適用可能である。密度勾配構成要素の選択は、精製されるウイルスおよび得られた精製ウイルスに対し意図される用途に依存する。例えば、エンベロープウイルスは非エンベロープウイルスよりも密度が低い。これは当技術分野において公知である。具体的には、本方法により生産されるウイルス何の目的で調製されるかによって、ウイルス完全性またはその生物活性に影響しない構成要素が使用される。例えば、本発明の方法により調製されたウイルスがワクチン接種を対象とする場合、ウイルスまたはそのウイルス抗原の免疫原性を維持するために、構成要素が選択される。本発明によるプロセスにおいて使用するための密度勾配を生成させるために、糖溶液、特にショ糖(スクロース)が使用され得る。エンベロープウイルス、例えば、限定はされないがインフルエンザウイルスを精製するために、ショ糖が特に使用される。ショ糖は、ワクチン製造の分野においてしばしば使用される糖でもある。
【0024】
特定の実施形態では、本発明の方法により密度勾配を作製させるのに使用される糖はショ糖である。これは、安全性の配慮を留意する必要がある場合、ヒトに使用するための生成物の精製に有利である。しかしながら、本発明はまた、精製されるウイルスの型によって特定される密度を有する溶液を生成させるのに十分な水中溶解度を有するならば、他の糖類、例えばアルコール糖類、例えば、ソルビトール、または水素化糖類、直鎖糖類、および修飾糖類または任意の他の糖類の使用を企図する。また、勾配は酒石酸カリウムを用いて調製してもよく、これは、ショ糖勾配に比べ、より高い密度を有する勾配を達成するという利点を示す。したがって、酒石酸カリウム勾配は特に、非エンベロープウイルスを精製するために好適に使用される。
【0025】
本発明による密度勾配は糖勾配に限定されない。本発明はまた、他の例示的な例として、塩、例えば、塩化セシウム等の勾配の使用を企図し、これはエンベロープウイルスおよび非エンベロープウイルスの両方の精製に好適である。
【0026】
本発明は特定の濃度の密度勾配に限定されない。密度勾配の濃度範囲は、精製されるウイルスによって、特にウイルス密度によって決定されるべきである。
【0027】
密度勾配がショ糖勾配である場合、ウイルスを精製するための典型的な密度範囲は0〜55%(w/v)である。勾配内のある範囲での特定のウイルス抗原の存在は、タンパク質検出の標準技術、例えばウエスタンブロット分析により、ウイルス抗原に特異的な抗体を用い、モニターすることができる。インフルエンザウイルスの特定の場合、その表面抗原、HA抗原の量は、SRDアッセイ法によりモニターすることができる。
【0028】
本発明によれば、密度勾配は直線または不連続とすることができる。密度勾配はまた予め形成させてもよく、すなわち、遠心分離を開始する前に形成させてもよく、または、遠心分離中に形成させてもよい。
【0029】
特定の実施形態では、本発明の方法による密度勾配は、遠心分離中に好適に形成される直線勾配、特に直線ショ糖勾配0〜55%(v/w)であり、前記遠心分離は、例えば連続流操作として実施される。
【0030】
必須ではないが、密度勾配は、好適に、生理的濃度の塩を含む緩衝溶液、特に、クエン酸塩含有リン酸緩衝生理食塩水(PBS)溶液で調製されるが、この型の溶液は有利にウイルス凝集を阻止するからである。
【0031】
本発明によるウイルス精製法は、アデノウイルス、ヘパドナウイルス、ヘルペスウイルス、オルトミクソウイルス、パポバウイルス、パラミクソウイルス、ピコルナウイルス、ポックスウイルス、レオウイルスおよびレトロウイルスを含むがそれらに限定されない広範囲のウイルスに適している。特に、本発明の方法はミクソウイルス等のエンベロープウイルスに好適である。1つの実施形態では、本発明の方法により生産されるウイルスはオルトミクソウイルスファミリーに属しており、特にインフルエンザウイルスである。
【0032】
ウイルスまたはウイルス抗原は、インフルエンザウイルス等のオルトミクソウイルスに由来していてもよい。オルトミクソウイルス抗原は、赤血球凝集素(HA)、ノイラミニダーゼ(NA)、核タンパク質(NP)、マトリックスタンパク質(M1)、膜タンパク質(M2)、転写酵素(トランスクリプターゼ)(PB1、PB2、およびPA)の1つまたは複数を含むウイルスタンパク質の1つまたは複数から選択されてもよい。特に好適な抗原には、インフルエンザ亜型の抗原特異性を決定する2つの表面糖タンパク質であるHAおよびNAが含まれる。
【0033】
インフルエンザウイルスは、ヒトインフルエンザウイルス、トリインフルエンザウイルス、ウマインフルエンザウイルス、ブタ(例えば、豚)インフルエンザウイルス、ネコインフルエンザウイルスからなる群から選択される。より具体的には、インフルエンザウイルスは、A、B、およびC株から、好ましくはA株およびB株から選択される。
【0034】
インフルエンザウイルスまたはその抗原は、大流行間期(例年のまたは季節性の)インフルエンザ株に由来してもよい。あるいは、インフルエンザウイルスまたはその抗原は、大流行発生を引き起こす能力を有する株に由来してもよい(つまり、現在流行している株の赤血球凝集素と比較して新しい赤血球凝集素を有するインフルエンザ株、またはトリ対象体において病原性であり、ヒト集団中で水平伝染する可能性を有するインフルエンザ株、またはヒトに病原性であるインフルエンザ株)。特定の季節、およびワクチンに含まれている抗原の性質に応じて、インフルエンザウイルスまたはその抗原は、以下の赤血球凝集素亜型:H1、H2、H3、H4、H5、H6、H7、H8、H9、H10、H11、H12、H13、H14、H15、またはH16の1つまたは複数に由来してもよい。好ましくは、インフルエンザウイルスまたはその抗原は、H1、H2、H3、H5、H7、またはH9亜型に由来する。
【0035】
本発明との関連では、「ウイルスまたはそのウイルス抗原を含む流体」は、使用される生産系に関係なく、ウイルスまたはそのウイルス抗原を含む任意の調製物として理解されるべきである。非制限的な例は、細胞培養物、発育鶏卵に由来する流体、例えば、尿膜腔液、バキュロウイルス発現培地、または体液である。体液は、任意の種由来の、尿、血液、精液、髄液、肺流体、気管支肺胞洗浄液、または唾液としてもよい。
【0036】
本発明による方法で使用される細胞は、基本的には、細胞培養で培養することができ、ウイルス複製を支援することができる任意の所望の細胞タイプの細胞であり得る。それらは、接着して増殖する細胞であってもよく、または懸濁状態で増殖する細胞であってもどちらでもよい。それらは、初代細胞であってもよく、または連続細胞系のいずれであってもよい。遺伝学的に安定した細胞系が好ましい。
【0037】
哺乳動物細胞、例えばヒト、ハムスター、ウシ、サル、またはイヌ細胞が、特に好適である。
【0038】
多数の哺乳動物細胞系が当技術分野で公知であり、それらには、PER.C6、HEK細胞、ヒト胚腎臓細胞(293細胞)、HeLa細胞、CHO細胞、ベロ細胞、およびMDCK細胞が含まれる。
【0039】
好適なサル細胞は、例えば、ベロ細胞系のように腎臓細胞等のアフリカミドリザル細胞である。好適なイヌ細胞は、例えば、MDCK細胞系のように腎臓細胞である。
【0040】
インフルエンザウイルスを増殖させるのに好適な哺乳動物細胞系には、MDCK細胞、ベロ細胞、またはPER.C6細胞が含まれる。これら細胞系は全て、例えば、アメリカ合衆国培養細胞系統保存機関(ATCC)から広く入手可能である。
【0041】
特定の実施形態によると、本発明の方法では、MDCK細胞が使用される。元のMDCK細胞系は、CCL−34としてATCCから入手可能であるが、懸濁状態での増殖に適したMDCK細胞等の、この細胞系の誘導体も使用することができる(国際公開第1997/37000号パンフレット)。
【0042】
あるいは、本発明で使用するための細胞系は、ニワトリ、アヒル、ガチョウ、ウズラ、またはキジ等のトリ起源に由来していてもよい。トリ細胞系は、胚、ヒヨコ、および成体を含む様々な発生段階に由来してもよい。特に、細胞系は、胚線維芽細胞、生殖細胞等の胚細胞、またはニューロン、脳、網膜、腎臓、肝臓、心臓、筋肉を含む個々の器官、または胚外組織および胚を保護する膜に由来してもよい。ニワトリ胚線維芽細胞(CEF)を使用してもよい。トリ細胞系の例には、トリ胚幹細胞(国際公開第01/85938号パンフレット)およびアヒル網膜細胞(国際公開第05/042728号パンフレット)が含まれる。特に、アヒル胚幹細胞に由来するEB66(登録商標)細胞系が、本発明で企図される(国際公開第2008/129058号パンフレット)。他の好適なトリ胚幹細胞には、ニワトリ胚幹細胞、EB45、EB14、およびEB14−074に由来するEBx細胞系が含まれる(国際公開第2006/108846号パンフレット)。このEBx細胞系には、その樹立が天然的にもたらされ、いかなる遺伝的、化学的、またはウイルス性の修飾も必要としなかった、遺伝学的に安定した細胞系であるという利点がある。これらトリ細胞は、インフルエンザウイルスを増殖させるのに特に好適である。
【0043】
特定の実施形態によると、本発明の方法では、EB66(登録商標)細胞が使用される。
【0044】
細胞培養条件(温度、細胞密度、pH値等)は、使用される細胞の適合性に応じて非常に広い範囲にわたって変動し、特定のウイルスの詳細な増殖条件の要求に適応させることができる。細胞培養は、当技術分野において広範に文書化されているため、適切な培養条件を決定することは、当業者の能力内にある(例えば、Tissue Culture, Academic Press, Kruse and Paterson, editors (1973)、およびR.I. Freshney, Culture of animal cells: A manual of basic technique, fourth edition (Wiley-Liss Inc., 2000, ISBN 0-471-34889-9)を参照)。
【0045】
特定の実施形態では、本発明に記載の方法で使用される宿主細胞は、無血清および/または無タンパク質培地中で培養される。「無血清培地」(SFM)は、細胞生存および細胞増殖を可能にする血清添加を必要としない使用準備済の細胞培養培地を意味する。この培地は、必ずしも化学的に定義されていなくともよく、種々の由来、例えば植物由来の水解物を含有していてもよい。そのような無血清培地には、ウイルス、マイコプラズマ、または未知の伝染性因子による汚染を排除することができるという利点がある。「無タンパク質」とは、タンパク質、増殖因子、他のタンパク質添加物、および非血清タンパク質が除外されていても細胞増殖が生じる培養を意味するが、随意に、ウイルス増殖に必要な場合があるトリプシンまたは他のプロテアーゼ等のタンパク質を含んでいてもよいことが理解される。そのような培養で自然に増殖する細胞は、それら自体にタンパク質を含有している。
【0046】
無血清培地は、多数の供給業者、例えばVP SFM(Invitrogen社 カタログ番号11681−020)、Opti−Pro(Invitrogen社 カタログ番号12309−019)、またはEX−CELL(JHR Bioscience社)から商業的に入手可能である。
【0047】
細胞は、種々の方法で増殖させることができ、例えば懸濁状態で増殖させてもよく、またはマイクロキャリア上での増殖のように表面に接着させて増殖させてもよい。培養は、培養皿、フラスコ、ローラーボトル、またはバッチ、流加バッチ、灌流システム等の半連続型若しくは連続型システムを使用するバイオリアクター、またはそれらの組合せで実施することができる。典型的には、細胞は、主細胞バンクバイアルまたは作業用細胞バンクバイアルから、種々のサイズのフラスコまたはローラーボトルを介して、最終的にはバイオリアクターへとスケールアップされる。1つの実施形態では、本発明の方法により使用される細胞は、撹拌バイオリアクターの無血清培地中のマイクロキャリアビーズで培養され、培養培地は灌流により提供される。
【0048】
代替的な実施形態では、細胞は、バッチ法で懸濁状態で培養される。
【0049】
ウイルスによる感染に先立って、細胞は、約37℃、より好適には36.5℃で、6.7〜7.8の範囲のpH、好適には約6.8〜7.5、より好適には約7.2のpHで培養される。
【0050】
本発明の方法によると、細胞培養に基づくウイルス生産は、一般的に、生産しようとするウイルス株を培養細胞に接種するステップと、ウイルス複製を可能するために感染細胞を所望の期間培養するステップとを含む。
【0051】
大量の細胞産生ウイルスを生産するためには、細胞が高密度に達した時に、所望のウイルス株を細胞に接種することが好ましい。通常、細胞密度が、少なくとも約1.5×106細胞/ml、好適は約3×106細胞/ml、より好適には約5×106細胞/ml、または更により好適には7×106細胞/ml以上でさえある時に、接種を実施する。最大のウイルス生産を得るための最適な細胞密度は、ウイルス増殖に使用される細胞タイプにより異なる場合がある。
【0052】
接種は、約10−1〜10−7のMOI(感染多重度)、好適には約10−2〜10−6、およびより好適には約10−5のMOIで実施される。
【0053】
ウイルス感染の温度およびpH条件は、異なる場合がある。温度は、ウイルスタイプに応じて、32℃〜39℃の範囲であってもよい。インフルエンザウイルスを生産する場合は、細胞培養感染は、生産される菌株に応じて異なる場合がある。インフルエンザウイルス感染は、好適には、32℃〜35℃の範囲の温度で、好適には33℃で実施される。1つの実施形態では、ウイルス感染は33℃で行う。代替的な実施形態では、ウイルス感染は35℃で行う。ウイルス株に応じて、プロテアーゼ、典型的にはトリプシンを細胞培養に添加して、ウイルス複製を可能にすることができる。プロテアーゼは、培養中に任意の好適な段階で添加することができる。
【0054】
感染すると、細胞は、受動溶解とも呼ばれる宿主細胞の自然溶解により、新しく形成されたウイルス粒子を培養培地に放出することができる。したがって、1つの実施形態では、細胞に基づくウイルス回収物は、細胞培養培地または上清を収集することにより、ウイルス接種後の任意の時間で提供することができる。特定の実施形態では、細胞培養培地は灌流により収集される。ウイルス接種後の異なる時点で細胞に基づくウイルスを回収し、必要に応じてその異なる回収物を貯留することが所望の場合、この回収方法は特に好適である。
【0055】
あるいは、ウイルス感染後に、細胞に基づくウイルスは、能動溶解とも呼ばれる、宿主細胞を溶解するための外的因子を使用することにより回収することができる。しかしながら、前述のものとは対照的に、能動的な細胞溶解は細胞培養を直ちに終了させるため、そのような回収方法は、細胞に基づくウイルス回収物を単一の時点で収集することを必要とする。
【0056】
能動的細胞溶解に使用することができる方法は公知である。この点で有用な方法は、例えば、凍結融解、固体剪断、高浸透圧および/または低浸透圧溶解、液体剪断、高圧放出、界面活性剤による溶解、またはそれらの任意の組合せである。
【0057】
1つの実施形態によると、細胞に基づくウイルス回収物は、細胞培養培地または上清を収集すること、接種された細胞を溶解すること、またはその両方により、ウイルス接種後の任意の時間で提供することができる。
【0058】
本発明の意味では、ウイルス接種され、感染された細胞培養物に言及する場合、「細胞培養培地」または「培養培地」または「培地」という表現および「上清」という用語は同意語であると考えるべきである。感染された細胞培養物との関連では、「培地」および「上清」は、ウイルスまたはそのウイルス抗原を含む流体として理解すべきである。
【0059】
培養培地または上清を収集する前に、細胞感染を2〜10日間継続することができる。ウイルスまたはそのウイルス抗原を含む、細胞に基づく流体を収集するのに最適な時間は、感染のピークを決定することに基づく。例えば、CPE(細胞変性効果)は、細胞球状化、無定位性(disorientation)、膨潤または収縮、死滅、表面からの剥離を含む、ウイルス接種後に宿主細胞に生じる形態学的変化をモニターすることにより測定することができる。特定のウイルス抗原の検出は、ウエスタンブロット分析等のタンパク質検出の標準技術によりモニターすることができ、所望の検出レベルの達成時に、収集に進めることができる。インフルエンザウイルスの特定の場合では、HAの含有量は、SRDアッセイにより、上記のように、細胞にウイルスを接種した後の任意の時間でモニターすることができる。
【0060】
収集後、ウイルスは精製することができる。例えば、精製は、限外ろ過、超遠心分離(勾配超遠心分離を含む)、クロマトグラフィー(イオン交換クロマトグラフィー等)等の多くの様々なろ過、濃縮、および/または他の分離ステップ、並びに吸着ステップを様々な組合せで含むことができる。細胞性物質、夾雑物、特に浮遊完全細胞または細胞残屑からからウイルスを分離するために、清澄化ステップが要求され得る。
【0061】
そのため、本発明によるウイルスまたはそのウイルス抗原を含む流体は、粗流体に限定されず、部分的に精製されたウイルスを含む流体も企図する。本発明の意味では「粗」という用語は、ウイルスまたはそのウイルス抗原を含む流体に対し、その収集後、精製がなされておらず、よって、任意の種類の夾雑物を様々な程度まで含む可能性があることを意味する。非制限的な例として、ウイルスが、細胞に前記ウイルスを接種させることにより生産される場合、感染後、新たに形成されたウイルスが細胞培養培地または上清に放出される場合、ウイルスを含む前記培養培地は、粗流体の一例を示す。引用され得る粗流体の別の例は、発育鶏卵上へのウイルスの接種およびウイルス培養後に回収される尿膜腔液である。したがって、「部分的に精製された」という用語は、任意の中間精製状況、すなわち任意の精製ステップ、例えば、上記ステップのいずれかのそれぞれまたは任意の組みあわせの対象となっている流体を含む。
【0062】
1つの実施形態では、本発明による流体は、細胞を対象のウイルスで感染させた後に収集される培養培地である。
【0063】
別の好適な実施形態では、本発明による流体は清澄化される。この清澄化は濾過により実施してもよい。あるいは、遠心分離および/または濾過は、ウイルス調製の所望の清澄レベルを達成するために、任意の順に一緒に組み合わせてもよい。好適なフィルターには、セルロースフィルター、再生セルロースフィルター、無機ろ過助剤と組合せたセルロース繊維、無機ろ過助剤および有機樹脂と組合せたセルロースフィルター、またはそれらの任意の組合せ、およびポリマー性フィルターを使用することができる。必須ではないが、例えば、適切な公称細孔径を有するフィルター、特に減少する公称細孔径を有するフィルターを使用して、大きな沈殿物および細胞残屑の除去から始めることを可能にし、それらのサイズにより不純物を連続的におよび徐々に除去することを含む2段階または3段階等の多重ろ過プロセスを実施してもよい。加えて、比較的細かいフィルターまたは遠心分離を使用する単一段階作業を、清澄化に使用することもできる。より一般的には、これらに限定されないが、デッドエンドろ過(dead-end filtration)、デプスろ過(depth filtration)、精密ろ過、または遠心分離を含み、その後のステップで膜および/または樹脂を詰まらせない好適な清澄性のろ過液を提供する任意の清澄化手法が、本発明の清澄化ステップで使用に許容されるだろう。1つの特定の実施形態では、ウイルス清澄化ステップは、デプスろ過により、具体的には、例えば、5μm−0.5μm−0.2μmの公称多孔度を有する3つの異なるデプスフィルターで構成される3段階連続ろ過を使用して実施される。別の実施形態では、ウイルス回収物は、遠心分離により前清澄化され、その後デプスろ過、例えば、0.5μm−0.2μmの公称多孔度を有する2つの異なるフィルターで構成される連続ろ過を使用して清澄化される。
【0064】
要求はされないが、本発明による密度勾配上に負荷する前に、負荷させる流体容積を減少させるために、ウイルスまたはそのウイルス抗原を含む流体を濃縮することが好適であり得る。したがって、本発明はまた、密度勾配に負荷する前に濃縮されたウイルスまたはそのウイルス抗原を含む流体を企図する。そのためウイルスまたはそのウイルス抗原を含む流体は、ウイルスを濃縮するためにおよび/または緩衝液を交換するために、限外ろ過(緩衝液交換に使用される場合は、ダイアフィルトレーションと呼ばれる場合もある)に、例えば750kD膜上で、かけることができる。このステップは、接種後数日にわたって灌流により収集されたウイルス回収物を貯溜する場合のように、精製しようとするウイルスが希釈されている場合に特に有利である。本発明の方法によりウイルスを濃縮するために使用されるプロセスは、希釈液がウイルス懸濁液から除去されるが、ウイルスはフィルターを通り抜けることができず、それによりウイルス調製において濃縮形態を維持するように、希釈液を強制的にフィルターに通すことによりウイルスの濃度を増加させる任意のろ過プロセスを含むことができる。
【0065】
限外ろ過は、塩、糖、非水性溶媒の除去および交換、低分子量物質の除去、イオンおよび/またはpH環境の迅速な変化に理想的な方法であるダイアフィルトレーションを含んでもよい。微細溶質は、限外ろ過速度と等しい速度で、限外ろ過されている溶液に溶媒を添加することにより最も効率的に除去される。これにより、一定容積の溶液から微細種が洗浄され、保持されたウイルスが単離される。下流のステップが、最適な反応を得るために特定の緩衝液の使用を必要とする場合、ダイアフィルトレーションは特に有利である。ショ糖勾配超遠心分離後のショ糖、またはホルムアルデヒドによるウイルス不活性化ステップ後のホルムアルデヒド等の望ましくない化合物を除去することが求められる場合、濃縮およびダイアフィルトレーションを、精製プロセスの任意の好適なステップで実施することもできる。この系は、3つの別個のプロセス流:供給溶液(ウイルスを含む)、透過液、および濃縮液で構成される。応用に応じて、異なる細孔径を有するフィルターを使用することができる。フィルター組成は、これらに限定されないが、再生セルロース、ポリエーテルスルホン、ポリスルホン、またはそれらの誘導体であってもよい。膜は、平板(ファルトスクリーン(falt screen)とも呼ばれる)であってもよく、または中空繊維であってもよい。
【0066】
1つの実施形態では、ウイルスまたはそのウイルス抗原を含む流体は、限外ろ過/ダイアフィルトレーションにより、特に本発明の方法に従い実施される超遠心分離ステップの密度勾配上に負荷する前に、濃縮される。
【0067】
本発明による精製方法は、密度勾配容積上に負荷されるウイルスまたはそのウイルス抗原の量の特定の比に基づく、本明細書で主張されている密度勾配超遠心分離の最適化されたステップの他に、追加のステップを含んでもよい。これらのステップは、前記最適化された密度勾配超遠心分離ステップの前後で実施され得る。具体的に、本発明による密度勾配超遠心分離ステップを用いた後に得られたウイルス調製物は、前に言及されているウイルス精製技術のいずれか1つ、例えば、濾過、超遠心分離(勾配超遠心分離を含む)、クロマトグラフィー(イオン交換クロマトグラフィー等)吸着ステップを様々な組み合わせで実施することによりさらに精製してもよい。
【0068】
1つの実施形態では、本発明の方法は、濾過、超遠心分離/ダイアフィルトレーション、超遠心分離およびクロマトグラフィー、ならびに任意のそれらの組み合わせからなる群より選択される少なくとも1つのステップをさらに含む。所望される純度レベルによって、上記ステップは、いかようにも組み合わせ得る。
【0069】
1つの実施形態では、本発明の方法は、超遠心分離の第2のステップ、場合により密度勾配超遠心分離、具体的にはショ糖勾配超遠心分離をさらに含む。この追加の超遠心分離ステップは、本発明の最適化された密度勾配超遠心分離の前または後で起こりえる。
【0070】
特定の実施形態では、本発明の密度勾配超遠心分離により精製されたウイルスは、第2の超遠心分離ステップの対象であり、前記ステップは場合によりショ糖勾配超遠心分離ステップである。
【0071】
あるいは、陰イオン性または陽イオン性のイオン交換クロマトグラフィー、ゲルろ過またはゲル浸透等のサイズ排除クロマトグラフィー、疎水性相互作用クロマトグラフィー、ヒドロキシアパタイト、またはそれらの任意の組合せを含むクロマトグラフィーによりウイルスをさらに精製することも可能である。上記で言及したように、クロマトグラフィーステップは、密度勾配超遠心分離等の他の精製ステップと組合せて実施することができる。
【0072】
ウイルス精製段階の終わりで、ウイルス調製物は、好適にはろ過滅菌法にかけることができ、これは免疫原性組成物またはワクチン等の医薬品等級物質のプロセスと共通しており、当業者に公知である。そのようなろ過滅菌は例えば、好適には、0.22μmフィルターで調製物をろ過することにより実施することができる。無菌調製した後で、ウイルスまたはウイルス抗原は、所望であれば、臨床使用の準備ができている状態である。
【0073】
本発明は、本発明による方法により取得可能なウイルスに、本発明による方法により取得可能なウイルスまたはウイルス抗原を含む組成物に、および医学におけるそれらの使用にさらに関する。それらは、ヒトまたは動物に投与するためのワクチンをもたらす任意の公知の方法により製剤化することができる。したがって、このタイプのウイルスまたはウイルス抗原を含む、ワクチン等の免疫原性組成物も、本発明により企図される。
【0074】
免疫原性組成物、具体的にはワクチンは、一般的にはサブビリオン形態、例えば、脂質エンベロープが溶解されているかまたは分解されている分割ウイルスの形態で、または1つ若しくは複数の精製ウイルスタンパク質(サブユニットワクチン)の形態で製剤されるだろう。代案として、免疫原性組成物は、全ウイルス、例えば生菌弱毒化全ウイルス、または不活化全ウイルスを含んでいてもよい。
【0075】
したがって、ウイルスまたはそのウイルス抗原を含む流体は、本発明の意味では、生弱毒化かまたは不活化かに関わらず、全ウイルス、分割ウイルスおよび精製ウイルス抗原を含んでもよい。本発明による流体はまた、組換え発現されたウイルス抗原を含むことができる。
【0076】
本発明はまた、分割工程、本発明の精製方法中に、前記方法の工程(b)の前、中、または後に関係なく、いずれの時点でも実施されることを企図する。
【0077】
インフルエンザウイルス等のウイルスを分割する方法は、当技術分野で周知である(国際公開第02/28422号パンフレット)。ウイルスの分割は、分解濃度の分割剤を用いて、感染性(野生型または弱毒化)かまたは非感染性(不活化)かに関わらず、全ウイルスを分解または断片化することにより実施される。分割剤には、一般的に、脂質膜を分解および溶解可能な作用剤が含まれる。伝統的に、分割インフルエンザウイルスは、トリ−n−ブチルホスフェート、またはTween(商標)と組合せたジエチルエーテル(「Tween−エーテル」分割として知られている)等の溶媒/界面活性剤処理を使用して生産され、このプロセスは、幾つかの生産設備で未だに使用されている。現在使用されている他の分割剤には、界面活性剤またはタンパク質分解酵素または胆汁酸塩、例えばデオキシコール酸ナトリウムが含まれる。分割剤として使用することができる界面活性剤には、陽イオン性界面活性剤、例えばセチルトリメチル臭化アンモニウム(CTAB)、他のイオン性界面活性剤、例えばラウリル硫酸ナトリウム(SLS)、タウロデオキシコレート、またはTween若しくはトリトン(Triton)X−100等の非イオン性界面活性剤、または任意の2つ以上の界面活性剤の組合せが含まれる。
【0078】
1つの実施形態では、分割剤はデオキシコレートである。別の実施形態では、分割剤はトリトンX−100である。更なる実施形態では、本発明による方法では、分割剤としてトリトンX−100およびラウリル硫酸ナトリウムの組合せが使用される。
【0079】
分割プロセスは、バッチプロセス、連続プロセス、または半連続プロセスとして実施することができる。バッチで実施される場合、分割ウイルスは、クロマトグラフィーステップ等の、追加的精製ステップが必要とされる場合がある。
【0080】
1つの実施形態では、ウイルスまたはそのウイルス抗原を含む流体は、本発明による密度勾配超遠心分離により精製され、精製されたウイルスは随意に、第2の密度勾配超遠心分離によりさらに精製され、精製されたウイルスまたはそのウイルス抗原はバッチ法で、特にトリトンX−100を用いて分割される。
【0081】
別の精製ステップと同時に分割を実施することが可能であるため、分割ステップそれ自体は実施する必要はない。特に、分割剤は密度勾配に添加することができる。そのような実施形態は、ウイルスの精製および分割の両方を単一操作内で実施することが可能となるので、本発明の方法の総ステップ数を最小に抑えることが望ましい場合に特に好適である。このように、1つの実施形態では、ウイルスまたはそのウイルス抗原を含む流体を精製するための本発明の方法に従い使用される最適化された密度勾配超遠心分離ステップの濃度勾配、具体的にはショ糖勾配は、さらに分割剤を含む。
【0082】
あるいは、分割剤は、本発明の最適化された密度勾配超遠心分離に加えて、さらなる密度勾配超遠心分離が実施される場合、追加の超遠心分離ステップの密度勾配に添加され得る。
【0083】
ワクチンの安全性のため、精製プロセスの様々なステップにわたってウイルス懸濁液の感染力を低減することが必要とされる場合がある。ウイルスの感染力は、ウイルスが細胞系で複製する能力により決定される。したがって、本発明による方法は、随意に、任意の時に起こる少なくとも1つのウイルス不活化ステップを含む。不活化は、本方法の任意の好適なステップでBPL(β−プロピオラクトン)を使用することにより実施することができる。1つの実施形態では、本発明による方法は、少なくとも1つのBPL処理ステップをさらに含む。別の実施形態では、本発明による方法は、少なくとも1つのBPL処理ステップおよび少なくとも1つのホルムアルデヒド処理ステップをさらに含む。ホルムアルデヒドおよびBPLは、連続して任意の順序で使用することができ、例えばホルムアルデヒドは、BPLの後に使用される。
【0084】
ワクチンを含む本発明の免疫原性組成物は、随意にワクチン用に通例となっている添加剤、具体的には組成物を受容する患者に誘発される免疫応答を増加させる物質、つまりいわゆるアジュバントを含有することができる。
【0085】
1つの実施形態では、免疫原性組成物が企図され、これは好適な医薬担体と混合された本発明のウイルスまたはそのウイルス抗原を含む。特定の実施形態では、それらはアジュバントを含む。
【0086】
アジュバント組成物は、代謝可能な油および乳化剤を含む水中油型乳剤を含んでいてもよい。任意の水中油型組成物がヒト投与に好適であるためには、乳剤系の油相は、代謝可能な油を含む。代謝可能な油という用語の意味は、当技術分野で周知である。代謝可能とは、「代謝により変換することが可能である」と定義することができる(Dorland’s Illustrated Medical Dictionary, W.B. Sanders Company, 25th edition (1974))。油は、任意の植物油、魚油、動物油、または合成油であってもよく、受容者に毒性でなく、代謝により変換が可能である。ナッツ、種子、および穀物は、植物油の一般的供給源である。合成油も本発明の一部であり、NEOBEE(登録商標)等の市販の油が含まれていてもよい。
【0087】
特に好適な代謝可能な油は、スクアレンである。スクアレン(2,6,10,15,19,23−ヘキサメチル−2,6,10,14,18,22−テトラコサヘキサエン)は、鮫肝油中に多量に見出され、オリーブ油、麦芽油、米糠油、および酵母中により少量見出される不飽和油であり、本発明で使用するために特に好ましい油である。スクアレンは、コレステロール生合成の中間体であるという事実により、代謝可能な油である(メルクインデックス、第10版、エントリー番号8619)。本発明の更なる実施形態では、代謝可能な油は、免疫原性組成物中に、組成物の全容積の0.5%〜10%(容積/容積)の量で存在する。
【0088】
水中油型乳剤は、乳化剤をさらに含む。乳化剤は、好適にはポリオキシエチレンソルビタンモノオレアートであってもよい。さらに前記乳化剤は、好適には、ワクチンまたは免疫原性組成物中に、組成物の全容積の0.125〜4%(容積/容積)で存在する。
【0089】
本発明の水中油型乳剤は、随意にトコール含む。トコールは、当技術分野で周知であり、欧州特許第0382271号明細書に記述されている。好適には、トコールは、アルファ−トコフェロールまたはアルファ−トコフェロールスクシナート(ビタミンEスクシナートとしても知られている)等のその誘導体であってもよい。前記トコールは、好適にはアジュバント組成物中に、免疫原性組成物の全容積の0.25%〜10%(容積/容積)の量で存在する。
【0090】
水中油型乳剤を生成する方法は、当業者に周知である。一般的には、その方法は、油相(随意にトコールを含む)をPBS/TWEEN80(商標)(またはポリソルベート80)溶液等の界面活性剤と混合し、その後ホモジナイザーを使用して均質化することを含む。好適な方法は、少量の液体を均質化するために、混合物を注射器針に2回通すことを含む。あるいは、当業者であれば、マイクロ流動化器(microfluidiser)(M110Sマイクロ流体装置、最高50回通過、最大圧力入力6bar(約850barの出力圧力)で2分間)による乳化プロセスを応用して、より少量またはより大量の乳剤を生成することができるだろう。この応用は、要求直径の油滴で調製が達成されるまで、その結果生じる乳剤を測定することを含む日常的な実験作業により達成することができるだろう。
【0091】
水中油型乳剤では、油および乳化剤は水性担体中にあるべきである。水性担体は、例えばリン酸緩衝生理食塩水であってもよい。
【0092】
具体的には、本発明の水中油型乳剤系は、サブミクロン範囲の小さな油滴サイズを有する。好適には、液滴サイズは、直径が120〜750nmの範囲、より具体的には120〜600nmのサイズであろう。更により具体的には、水中油型乳剤は、強度で少なくとも70%が、500nm未満の直径であり、より具体的には強度で少なくとも80%が、300nm未満の直径であり、より具体的には強度で少なくとも90%が、120〜200nmの範囲の直径である油滴を含有する。
【0093】
油滴サイズ、つまり直径は、本発明によると、強度により与えられる。油滴サイズの直径を強度により決定するには幾つかの方法がある。強度は、サイズ測定装置、好適には、Malvern Zetasizer 4000または好適にはMalvern Zetasizer 3000HS等の動的光散乱を使用することにより測定される。詳細な手順は、実施例II.2に示されている。第1の可能性は、動的光散乱(PCS−光子相関分光法)によりz平均直径ZADを決定することであり、この方法では、多分散性指数(PDI)がさらにもたらされ、ZADおよびPDIは両方ともキュミュラントアルゴリズムで算出される。これらの値は、粒子屈折率に関する知識を必要としない。第2の手段は、別のアルゴリズム、Contin、またはNNLS、または自動化「Malvern」アルゴリズム(サイズ測定装置により提供される初期設定アルゴリズム)のいずれかにより全粒度分布を決定することにより、油滴の直径を計算することである。ほとんどの場合、複雑な組成物の粒子屈折率は未知であるため、強度分布のみが考慮され、必要に応じて、強度平均はこの分布からもたらされる。
【0094】
アジュバント組成物は、トール(Toll)様受容体(TLR)4アゴニストをさらに含んでいてもよい。「TLR4アゴニスト」とは、リガンドとして直接的に、または内在性若しくは外来性リガンドの生成により間接的にのいずれかで、TLR4シグナル伝達経路を介してシグナル伝達応答を引き起こすことが可能な成分を意味する。TLR4は、リピドA誘導体、具体的にはモノホスホリルリピドA、またはより具体的には3脱アシル化モノホスホリル(monophoshoryl)リピドA(3D−MPL)であってもよい。
【0095】
3D−MPLは、英国特許出願公開第2 220 211号明細書に開示されている方法により生成することができる。化学的には、これは、3−脱アシル化モノホスホリルリピドAと3、4、5、または6つのアシル化鎖との混合物である。具体的には、本発明のアジュバント組成物では、小粒子3D−MPLが使用される。小粒子3D−MPLは、0.22μmフィルターで滅菌ろ過することができるような粒子サイズを有する。そのような調製物は、国際公開第94/21292号パンフレットに記述されている。リピドAの合成誘導体は公知であり、TLR4アゴニストであると考えられており、これらに限定されないが、以下のものを含む:
OM174(2−デオキシ−6−o−[2−デオキシ−2−[(R)−3−ドデカノイルオキシテトラ−デカノイルアミノ]−4−o−ホスホノ−β−D−グルコピラノシル]−2−[(R)−3−ヒドロキシテトラデカノイルアミノ]−α−D−グルコピラノシルジヒドロゲンホスフェート)、(国際公開第95/14026号パンフレット);
OM294 DP (3S,9R)−3−[(R)−ドデカノイルオキシテトラデカノイルアミノ]−4−オキソ−5−アザ−9(R)−[(R)−3−ヒドロキシテトラデカノイルアミノ]デカノ−1,10−ジオール,1,10−ビス(ジヒドロゲノホスフェート)(国際公開第99/64301号パンフレットおよび国際公開第00/0462号パンフレット);
OM197 MP−Ac DP(3S−、9R)−3−[(R)−ドデカノイルオキシテトラデカノイルアミノ]−4−オキソ−5−アザ−9−[(R)−3−ヒドロキシテトラデカノイルアミノ]デカノ−1,10−ジオール,1−ジヒドロゲノホスフェート10−(6−アミノヘキサノアート)(国際公開第01/46127号パンフレット)。
【0096】
使用することができる他のTLR4リガンドは、国際公開第9850399号パンフレットまたは米国特許第6303347号明細書(AGPを調製するためのプロセスも開示されている)で開示されているもの等のアルキルグルコサミニドホスフェート(AGP)、または米国特許第6764840号明細書で開示されているようなAGPの薬学的に許容される塩である。幾つかのAGPは、TLR4アゴニストであり、幾つかは、TLR4アンタゴニストである。両方ともアジュバントとして有用であると考えられる。加えて、さらに好適なTLR−4アゴニストは、米国特許出願公開第2003/0153532号明細書および米国特許出願公開第2205/0164988号明細書で開示されている。
【0097】
本発明は、ワクチンを含むインフルエンザウイルス免疫原性組成物を調製するために特に好適である。種々の形態のインフルエンザウイルスが、現在入手可能である。それらは、一般的に、生ウイルスまたは不活化ウイルスのいずれかに基づく。不活化ワクチンは、全ビリオン、分割ビリオン、または精製された表面抗原(HAを含む)に基づいていてもよい。インフルエンザ抗原は、ビロソーム(無核酸のウイルス様リポソーム粒子)の形態で提示することもできる。
【0098】
ウイルス不活性化法および分割法は上述されており、インフルエンザウイルスに適用可能である。
【0099】
ワクチンに使用するためのインフルエンザウイルス株は、季節毎に変化する。現行の大流行間期では、ワクチンは、典型的には2つのインフルエンザA型株および1つのインフルエンザB型株を含んでいる。三価ワクチンが典型的であるが、4価等のより高い価数も本発明で企図される。本発明は、大流行株(つまりワクチン受容者および一般ヒト集団が免疫学的に未感作である菌株)に由来するHAを使用することもでき、大流行株のインフルエンザワクチンは一価であってもよく、大流行株で補完された通常の三価ワクチンに基づいていてもよい。
【0100】
本発明の組成物は、インフルエンザA型ウイルスおよび/またはインフルエンザB型ウイルスを含む、1つまたは複数のインフルエンザウイルス株に由来する抗原(複数可)を含んでいてもよい。具体的には、2つのインフルエンザA型ウイルス株および1つのインフルエンザB型ウイルス株に由来する抗原を含む三価ワクチンが、本発明により企図される。あるいは、2つのインフルエンザA型ウイルス株および2つのインフルエンザB型ウイルス株に由来する抗原を含む四価ワクチンもまた、本発明の範囲内にある。
【0101】
本発明の組成物は、つまり1つの菌株タイプのみ、つまり季節性株のみまたは大流行株のみを含む一価組成物に制限されない。本発明は、季節性株および大流行株の組合せを含む組成物も包含する。具体的には、3つの季節性株および1つの大流行株を含み、アジュバント化されていてもよい4価組成物は、本発明の範囲内にある。本発明の範囲内にある他の組成物は、H1N1、H3N2、およびB型株等の、2つのA型株および1つのB型株を含む三価組成物、並びにH1N1、H3N2、B/Victoria、およびB/Yamagata等の異なる系統の2つのA型株および2つのB型株を含む4価組成物である。
【0102】
HAは、現行の不活化インフルエンザワクチンの主な免疫原であり、ワクチン用量は、典型的にはSRDにより測定されるHAレベルを基準にすることにより正規化される。既存のワクチンは典型的には1株当たり約15μgのHAを含有していが、例えば、小児用には、または大流行の状況においては、またはアジュバントを使用する場合は、より低い用量を使用することができる。半量(つまり1株当たり7.5μgのHA)または4分の1量等の分割量が使用されており、同様により高い用量、具体的には3倍または9倍の用量も使用されている。したがって、本発明の免疫原性組成物は、1インフルエンザ株当たり0.1〜150μg、具体的には0.1〜50μg、例えば0.1〜20μg、0.1〜15μg、0.1〜10μg、0.1〜7.5μg、0.5〜5μg等のHAを含んでいてもよい。特定の用量には、1株当たり約15、約10、約7.5、約5μg、1株当たり約3.8μg、および1株当たり約1.9μgが含まれる。
【0103】
特定の株のインフルエンザウイルスが精製されれば、例えば、上述のような三価ワクチンを製作するために、他の株に由来するウイルスと混合することができる。ウイルスを混合し、DNAを分解し、多価性混合物からそれを精製するのではなく、各菌株を別々に処理し、一価性バルクを混合して、最終多価性混合物を得ることがより好適である。
【0104】
本発明は、下記の非限定的な実施例を参照することによりさらに説明される。
【実施例】
【0105】
実施例1:MDCK細胞でのインフルエンザウイルスの生産およびショ糖勾配超遠心分離による精製−ショ糖勾配の容積を増加させることによるHA収率の改善(実験JP104、JP115、JP125、EFC3APA001、EFC3APA002およびDFC3APA003)
1.ウイルス増殖
MDCK接着細胞を、36.5℃で、20リットルの撹拌バイオリアクター規模の灌流培養法でマイクロキャリア上で増殖させた。増殖段階の後、適切な細胞密度、5×106細胞/ml超(JP104、JP115、JP125およびEFC3APA001)または約2.5×106細胞/ml(EFC3APA002およびDFC3APA003)に到達したら、インフルエンザウイルス(1×10−5の感染多重度)、Jiangsu B株(JP104、JP115、JP125、EFC3APA001およびEFC3APA002)またはMalaysia B株(DFC3APA003)を灌流法で細胞に接種し、温度を33℃(Jiangsu B株)または35℃(Malaysia B株)に切替えた。Benzonaseをバイオリアクターに1.5単位/mlの終濃度で、接種後の3および4日目に添加した(JP125、EFC3APA001、EFC3APA002およびDFC3APA003)。実験JP115およびJP104ではBenzonaseを添加しなかった。ウイルスを、接種後の3および4日目(JP115)に、または接種後の3、4、および5日目(JP125、JP104、EFC3APA001、EFC3APA002およびDFC3APA003)に、灌流により回収した。灌流回収物を貯留し、さらに処理するまで2〜8℃の範囲の温度で保管した。
【0106】
2.ウイルス精製
a)全ての実験からのウイルス回収物を、5μm−0.5μm−0.2μmの公称多孔度を有する3つの異なるデプスフィルターで構成される連続ろ過で清澄化した。清澄化された回収物を、2〜8℃の範囲の温度で終夜保管した。
【0107】
b)その後、清澄化された回収物を、750kDの中空糸膜で限外ろ過することにより濃縮し約2リットルの最終容積となるようにし、125mMクエン酸および0.001%トリトンX−100−pH7.4を含有する5容積のPBSに対して、および10mMトリス、2mM MgCl2 pH8、100μM CaCl2、0.001%トリトンX−100−pH8の4容積に対してダイアフィルトレーションした。
【0108】
c)濃縮液を限外ろ過システムから取り出し、水浴で37℃まで暖めた。DNA分解を、Benzonase(商標)(Merck社製)を、270単位/ml(JP115)または135単位/ml(JP104)、または200単位/ml(JP125、EFC3APA001、EFC3APA002およびDFC3APA003)の終濃度で濃縮液に添加することにより実施し、混合物を37℃で1時間インキュベートした。
【0109】
d)次に、限外ろ過濃縮液をショ糖勾配超遠心分離にかけた。勾配容積を増加させる影響を評価するために、それぞれ、400mの容積用量を有するローターおよび1.6Lの容積用量を有するローターを用いて、いくつかの実験(JP104、JP115およびJP125)では、勾配容積を400mlとし、一方、他の実験(EFC3APA001、EFC3APA002およびDFC3APA003)では、勾配容積を1.6Lとした。遠心分離機は、PK3ローターと共に使用されるAlfa Wasserman製のPilot System PKII連続流超遠心分離機とした。125mMのクエン酸を含むPBS pH7.4中で調製したショ糖勾配溶液をローターに負荷し、その後、35000rpmの回転速度まで加速し、直線ショ糖勾配(0〜55%v/w)を形成させた。400mlローターでは1L/h、1.6Lローターでは4.1L/hのポンプ流速で、濃縮回収物(各実験で約2L)を用いて連続負荷した後、ローターを125mMのクエン酸洗浄緩衝液を含むPBS pH7.4で、連続してフラッシングし、勾配に入らなかった残留物質を除去した。フラッシング後、ローターを減速させ、超遠心分離機を停止させ、画分収集を実施した。
【0110】
精製させる容積を全て勾配に負荷したら、60分間の取扱時間で、ほとんどのウイルスが勾配内でその密度に到達させることが可能であった。ウイルス粒子を少数の画分内に濃縮した。産物画分は、125mMクエン酸およびショ糖を含有するPBS pH 7.4中だった。精製された全ビリオンを、およそ28%〜52%の範囲のショ糖のパーセントから貯留した。この範囲は、抗HAおよび抗MDCK抗体を使用して、SDS−PAGEおよびウエスタンブロット分析からのプロファイルに基づいて決定された。全ビリオンを貯留した画分を、2〜8℃の範囲の温度で保管し、その後PO4 66mM pH7.4(JP115およびJP104)またはPBS pH7.4(JP125、EFC3APA001、EFC3APA002およびDFC3APA003)中で9〜10倍に希釈した。
【0111】
e)ウイルスをさらに精製しながら、同時にウイルスを分割するために、第2のショ糖勾配超遠心分離を実施した。遠心分離は、ステップd)で記載されている条件と同じ条件で実施した。具体的には、全く同じローター、すなわち、実験JP104、JP115およびJP125に対しては400mlのローター、実験EFC3APA001、EFC3APA002およびDFC3APA003に対しては1.6Lのローターを使用した。PBS pH7.4中(JP125、EFC3APA001、EFC3APA002およびDFC3APA003)、またはPO4 66mM pH7.4中(JP104およびJP115)で調製したショ糖勾配溶液を、ローターに負荷し、その後、35000rpmの回転速度まで加速し、直線ショ糖勾配(0〜55%v/w)を形成させた。2%トリトンX−100(JP125、EFC3APA001、EFC3APA002およびDFC3APA003)、または1%トリトンX−100および1%ナトリウムデオキシコレートの組合せ(JP115およびJP104)をショ糖層に添加して、界面活性剤ミセル障壁を達成した。この界面活性剤障壁に進入する全ウイルスが分割された。ウイルス膜タンパク質赤血球凝集素(HA)およびノイラミニダーゼ(NA)を含有するウイルス断片は、ミセル密度部分に移動した。残りのビリオン、宿主細胞タンパク質夾雑物の幾つかおよびDNAは、ウイルスタンパク質と共に貯留されないより高いショ糖濃度画分に移動した。およそ18〜41%ショ糖の範囲の画分に存在するウイルスタンパク質を貯留する。この範囲は、抗HAおよび抗MDCK抗体を使用して、SDS−PAGEおよびウエスタンブロット分析からのプロファイルに基づいて決定された。ウイルスタンパク質を含有する画分貯留(プール)は、PO4 66mM pH7.4(JP104およびJP115)、またはPBS pH7.4(JP125、EFC3APA001、EFC3APA002およびDFC3APA003)中だった。その後、この貯留を全タンパク質含有量についてアッセイし、0.01%Tween80、アルファ−トコフェリル水素スクシナート0.1mM、および0.3% トリトンX−100 pH7.4を含有するPBS(JP125、EFC3APA001、EFC3APA002およびDFC3APA003)、または0.01%Tween80およびアルファ−トコフェリル水素スクシナート0.1mMを含むPO4 66mM pH7.4(JP104およびJP115)で約250μgタンパク質/mlに希釈した。
【0112】
第1の勾配上に負荷されるウイルス調製物、すなわち、濃縮され、Benzonase(商標)処理された回収物中に存在するHA量を、下記で記載されるSRDアッセイ法により測定した。HAの量はまた、各ショ糖勾配超遠心分離ステップ(ステップd)およびe))後に測定し、各ショ糖勾配超遠心分離ステップ後に得られる特異HA収率を計算した。したがって、HA収率1は、第1のショ糖勾配超遠心分離を実施した後の濃縮され、Benzonase(商標)処理された回収物から回収されたHAの割合に対応し、HA収率2は、第2のショ糖勾配超遠心分離を実施した後の、第1のショ糖勾配超遠心分離HA貯留から回収されたHAの割合に対応する。全体的なHA収率の行は、各精製プロセスの終わりで測定されたHA回収を表し、このように、両方のショ糖勾配超遠心分離ステップにより引き起こされた損失が考慮される。結果を表1で示す。表1の最終行で示されるように、HA/総タンパク質比もまた計算されており、これは各精製プロセスの終わりに得られる総タンパク質に対するHAの割合を表す。総タンパク質濃度は、古典的なLowry法により測定した。
【表1】

【0113】
*HA収率1およびHA収率2値は、実験EFC3APA002に対して得られなかった。代わりに、両方のショ糖勾配超遠心分離を実施した後に、濃縮回収物から回収したHAの割合を示す。
【0114】
結果−結論
図1に示されるように、表1のHA/ローター容積比(mg/ml)の行の値が、前記表の第1のショ糖勾配後のHA収率1(%)の行の値に対してプロットされており、ショ糖勾配の容積が増加すると、第1のショ糖勾配ステップにプラスの影響を有し、このステップのHA収率を少なくとも1.7倍および最大3倍まで増加させる(表1の行7も参照し、400mlのローターの列を1.6Lローターの列と比較されたい)。例えば、それぞれ、400mlのローターおよび1.6Lローターを使用する実験JP125およびDFC3APA003を比較する場合、第1のショ糖勾配上に負荷されるHAの量は非常に類似しており、それぞれ、529mgおよび571mgであり、増加係数は2である。また、表1の最後から2番目の列を調べると、全体的なHA収率は、第1のショ糖勾配超遠心分離中に1.6Lのローターを使用すると、400mlのローターを使用した場合に比べ、改善されることが観察できる。
【0115】
結論として、第1のショ糖勾配容積を4倍増加させると、このステップのHA収率が1.7〜3の範囲の係数まで改善され、インフルエンザウイルス精製プロセスの全体的なHA収率が少なくとも3の係数まで改善される。
【0116】
HA含有量を測定するために使用されたSRD法
ガラス板(12.4×10cm)を、NIBSCにより推奨されている濃度の抗インフルエンザHA血清を含有するアガロースゲルでコーティングする。ゲルをセットした後、72個の試料ウエル(直径3mm)をアガロースに打抜き、10μlの適切な希釈された参照および試料をウエルに負荷する。プレートを、室温(20〜25℃)の加湿チャンバー内で24時間インキュベートする。その後、プレートを、NaCl溶液に終夜浸漬し、蒸留水で短期間洗浄する。その後ゲルを圧迫して乾燥する。完全に乾燥したら、プレートをクーマシーブリリアントブルー溶液で10分間染色し、明らかにはっきりとした染色帯域が目に見えるようになるまで、メタノールおよび酢酸の混合物で2回脱染する。プレートを乾燥した後、抗原ウエルを取り囲む染色帯域の直径を、直角に交わる2つの方向で測定する。あるいは、表面を測定する機器を使用することができる。表面に対する抗原希釈物の用量反応曲線を構築し、結果は、標準傾斜比アッセイ法(standard slope-ratio assay method)に従って計算される(Finney, D.J. (1952) Statistical Methods in Biological Assay. London: Griffin, Quoted in: Wood, JM, et al (1977). J. Biol. Standard. 5, 237-247)。
【特許請求の範囲】
【請求項1】
少なくとも下記ステップを含む、ウイルスまたはそのウイルス抗原を精製するための方法:
a)前記ウイルスまたはそのウイルス抗原を含む流体を得るステップ、および
b)少なくとも1つの密度勾配超遠心分離ステップにより前記流体を精製するステップであって、密度勾配容積に対する、流体中に存在するウイルスまたはそのウイルス抗原の量の比が1未満、0.8未満、0.6未満および0.4未満である、ステップ。
【請求項2】
少なくとも1つの密度勾配超遠心分離ステップを含む、細胞培養により生産されたウイルスまたはそのウイルス抗原を精製するための方法であって、密度勾配容積に対する、ウイルスまたはそのウイルス抗原を含み、前記密度勾配上に負荷される流体中に存在するウイルスまたはそのウイルス抗原の量の比が1未満、0.8未満、0.6未満および0.4未満である、前記方法。
【請求項3】
前記密度勾配はショ糖勾配である、請求項1または2記載の方法。
【請求項4】
前記ウイルスまたはそのウイルス抗原を含む流体は、細胞をウイルスで感染させた後に収集された細胞培養培地である、請求項1〜3のいずれか1項に記載の方法。
【請求項5】
前記ウイルスまたはそのウイルス抗原を含む流体は、前記少なくとも1つの密度勾配超遠心分離ステップを受ける前に部分的に精製される、請求項1〜4のいずれか1項に記載の方法。
【請求項6】
前記ウイルスまたはそのウイルス抗原を含む流体は、清澄化される、請求項5記載の方法。
【請求項7】
前記清澄化は、濾過、遠心分離または両方により実施される、請求項6記載の方法。
【請求項8】
前記ウイルスまたはそのウイルス抗原を含む流体は、前記密度勾配上に負荷される前に濃縮されている、請求項1〜7のいずれか1項に記載の方法。
【請求項9】
前記少なくとも1つの密度勾配超遠心分離は、連続法で実施される、請求項1〜8のいずれか1項に記載の方法。
【請求項10】
追加の超遠心分離ステップをさらに含む、請求項1〜9のいずれか1項に記載の方法。
【請求項11】
前記追加の超遠心分離ステップは、前記少なくとも1つの密度勾配超遠心分離ステップ後に行う、請求項10記載の方法。
【請求項12】
前記追加の超遠心分離ステップは、密度勾配超遠心分離ステップである、請求項10または11記載の方法。
【請求項13】
分割ステップをさらに含む、請求項1〜12のいずれか1項に記載の方法。
【請求項14】
分割剤が、前記少なくとも1つの密度勾配超遠心分離ステップに添加される、請求項1〜13のいずれか1項に記載の方法。
【請求項15】
分割剤が、前記追加の密度勾配に添加される、請求項12記載の方法。
【請求項16】
前記分割ステップはバッチ法で行う、請求項13記載の方法。
【請求項17】
前記分割ステップは前記少なくとも1つの密度勾配超遠心分離ステップ後に行う、請求項16記載の方法。
【請求項18】
前記分割剤はトリトンX−100である、請求項13〜17のいずれか1項に記載の方法。
【請求項19】
少なくとも1つのウイルス不活性化ステップをさらに含む、請求項1〜18のいずれか1項に記載の方法。
【請求項20】
前記ウイルスは細胞培養により生産される、請求項1および3〜19のいずれか1項に記載の方法。
【請求項21】
前記細胞は哺乳動物細胞である、請求項2または20記載の方法。
【請求項22】
前記細胞はMDCK細胞である、請求項21記載の方法。
【請求項23】
前記細胞はEB66(登録商標)細胞である、請求項2または20記載の方法。
【請求項24】
前記ウイルスがインフルエンザウイルスである、請求項1〜23のいずれか1項に記載の方法。
【請求項25】
少なくとも、請求項1〜24のいずれか1項に記載の方法により得られたウイルスを薬学的に許容される担体と混合するステップを含む、ワクチンを調製するための方法。
【請求項1】
少なくとも下記ステップを含む、ウイルスまたはそのウイルス抗原を精製するための方法:
a)前記ウイルスまたはそのウイルス抗原を含む流体を得るステップ、および
b)少なくとも1つの密度勾配超遠心分離ステップにより前記流体を精製するステップであって、密度勾配容積に対する、流体中に存在するウイルスまたはそのウイルス抗原の量の比が1未満、0.8未満、0.6未満および0.4未満である、ステップ。
【請求項2】
少なくとも1つの密度勾配超遠心分離ステップを含む、細胞培養により生産されたウイルスまたはそのウイルス抗原を精製するための方法であって、密度勾配容積に対する、ウイルスまたはそのウイルス抗原を含み、前記密度勾配上に負荷される流体中に存在するウイルスまたはそのウイルス抗原の量の比が1未満、0.8未満、0.6未満および0.4未満である、前記方法。
【請求項3】
前記密度勾配はショ糖勾配である、請求項1または2記載の方法。
【請求項4】
前記ウイルスまたはそのウイルス抗原を含む流体は、細胞をウイルスで感染させた後に収集された細胞培養培地である、請求項1〜3のいずれか1項に記載の方法。
【請求項5】
前記ウイルスまたはそのウイルス抗原を含む流体は、前記少なくとも1つの密度勾配超遠心分離ステップを受ける前に部分的に精製される、請求項1〜4のいずれか1項に記載の方法。
【請求項6】
前記ウイルスまたはそのウイルス抗原を含む流体は、清澄化される、請求項5記載の方法。
【請求項7】
前記清澄化は、濾過、遠心分離または両方により実施される、請求項6記載の方法。
【請求項8】
前記ウイルスまたはそのウイルス抗原を含む流体は、前記密度勾配上に負荷される前に濃縮されている、請求項1〜7のいずれか1項に記載の方法。
【請求項9】
前記少なくとも1つの密度勾配超遠心分離は、連続法で実施される、請求項1〜8のいずれか1項に記載の方法。
【請求項10】
追加の超遠心分離ステップをさらに含む、請求項1〜9のいずれか1項に記載の方法。
【請求項11】
前記追加の超遠心分離ステップは、前記少なくとも1つの密度勾配超遠心分離ステップ後に行う、請求項10記載の方法。
【請求項12】
前記追加の超遠心分離ステップは、密度勾配超遠心分離ステップである、請求項10または11記載の方法。
【請求項13】
分割ステップをさらに含む、請求項1〜12のいずれか1項に記載の方法。
【請求項14】
分割剤が、前記少なくとも1つの密度勾配超遠心分離ステップに添加される、請求項1〜13のいずれか1項に記載の方法。
【請求項15】
分割剤が、前記追加の密度勾配に添加される、請求項12記載の方法。
【請求項16】
前記分割ステップはバッチ法で行う、請求項13記載の方法。
【請求項17】
前記分割ステップは前記少なくとも1つの密度勾配超遠心分離ステップ後に行う、請求項16記載の方法。
【請求項18】
前記分割剤はトリトンX−100である、請求項13〜17のいずれか1項に記載の方法。
【請求項19】
少なくとも1つのウイルス不活性化ステップをさらに含む、請求項1〜18のいずれか1項に記載の方法。
【請求項20】
前記ウイルスは細胞培養により生産される、請求項1および3〜19のいずれか1項に記載の方法。
【請求項21】
前記細胞は哺乳動物細胞である、請求項2または20記載の方法。
【請求項22】
前記細胞はMDCK細胞である、請求項21記載の方法。
【請求項23】
前記細胞はEB66(登録商標)細胞である、請求項2または20記載の方法。
【請求項24】
前記ウイルスがインフルエンザウイルスである、請求項1〜23のいずれか1項に記載の方法。
【請求項25】
少なくとも、請求項1〜24のいずれか1項に記載の方法により得られたウイルスを薬学的に許容される担体と混合するステップを含む、ワクチンを調製するための方法。
【図1】




【公表番号】特表2012−516692(P2012−516692A)
【公表日】平成24年7月26日(2012.7.26)
【国際特許分類】
【出願番号】特願2011−548681(P2011−548681)
【出願日】平成22年2月4日(2010.2.4)
【国際出願番号】PCT/EP2010/051340
【国際公開番号】WO2010/089339
【国際公開日】平成22年8月12日(2010.8.12)
【出願人】(305060279)グラクソスミスクライン バイオロジカルズ ソシエテ アノニム (169)
【Fターム(参考)】
【公表日】平成24年7月26日(2012.7.26)
【国際特許分類】
【出願日】平成22年2月4日(2010.2.4)
【国際出願番号】PCT/EP2010/051340
【国際公開番号】WO2010/089339
【国際公開日】平成22年8月12日(2010.8.12)
【出願人】(305060279)グラクソスミスクライン バイオロジカルズ ソシエテ アノニム (169)
【Fターム(参考)】
[ Back to top ]

