対象組換えポリペプチドの産生方法
本発明は、対象組換えポリペプチドの産生方法、前記方法により得られるポリペプチド、組換えポリヌクレオチド、発現ベクター、発現コンストラクトに関し、並びに特定のシグナルペプチドの、及び前記特定のシグナルペプチドをコードするポリヌクレオチドの、対象組換えポリペプチドを産生するための使用に関する。
【発明の詳細な説明】
【発明の詳細な説明】
【0001】
[発明の分野]
本発明は、対象組換えポリペプチドの産生方法、前記方法により得られるポリペプチド、組換えポリヌクレオチド、発現ベクター、発現コンストラクトに関し、並びに特定のシグナルペプチドの、及び前記特定のシグナルペプチドをコードするポリヌクレオチドの、対象組換えポリペプチドを産生するための使用に関する。
【0002】
[発明の背景]
糸状菌宿主細胞における組換えポリペプチドの産生は、当該技術分野において公知である。現在のポリペプチド産生は、様々な方法で実施されている。
【0003】
当該分野の技術水準における組換えポリペプチドの産生方法は、発現コンストラクトを含む宿主細胞の発酵を用いるものであり、前記発現コンストラクトは、とりわけ対象ポリペプチドをコードするポリヌクレオチドに作動可能に連結されたプロモーターを含む。対象ポリペプチドを宿主細胞の分泌経路に誘導するため、対象ポリペプチドはシグナル配列を含む。Broekhuijsenらにおいては(Journal of Biotechnology、31(1993年)135〜145頁、Broekhuijsenら;「アスペルギルス・ニガー(Aspergillus niger)による異種タンパク質の分泌:プロテアーゼ欠損変異株におけるグルコアミラーゼ−hIL6融合タンパク質のKEX2様プロセシングによる活性ヒトインターロイキン−6の産生(Secretion of heterologous proteins by Aspergillus niger:Production of active human interleukin−6 in a protease deficient mutant by KEX2−like processing of a glucoamylase−hIL6 fusion protein)」)、分泌ポリペプチドのグルコアミラーゼのシグナル配列を用いてアスペルギルス・ニガー(Aspergillus niger)内で組換えタンパク質を発現させている。
【0004】
工業的な文脈では、高収率のポリペプチド産生が要求される。
【0005】
対象組換えポリペプチドの産生収率は、分泌効率を増加させることにより高まり得る。
【0006】
結果的に、対象ポリペプチドの産生収率を高めるためには、分泌効率を向上させる必要がある。
【0007】
本発明の目的は、組換えポリペプチドの改良された産生方法を提供することである。
【図面の簡単な説明】
【0008】
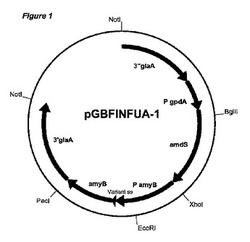
【図1】発現ベクターpGBFINFUA−1(国際公開第2008/000632号パンフレットに記載される)のプラスミドマップを示す。pGBFINFUA−1はまた、プラスミドpGBFINFUA−3及びpGBFINFUA−21を代表する。amyBプロモーターと、変異シグナル配列が導入されたα−アミラーゼをコードするA.ニガー(A.niger)amyB cDNA配列との配列に対するglaAフランキング領域を示す。A.ニガー(A.niger)株を形質転換する前に、制限酵素NotIで消化することにより大腸菌(E.coli)DNAを取り除くことができる。
【図2】発現ベクターpGBFINFUA−6(実施例1に記載される構築物)のプラスミドマップを示す。pGBFINFUA−6はまた、プラスミドpGBFINFUA−8、pGBFINFUA−11、pGBFINFUA−12、pGBFINFUA−13、pGBFINFUA−15、pGBFINFUA−16及びpGBFINFUA−18を代表する。glaAプロモーターと、変異シグナル配列が導入されたα−アミラーゼをコードするA.ニガー(A.niger)amyB cDNA配列との配列に対するglaAフランキング領域を示す。A.ニガー(A.niger)株を形質転換する前に、制限酵素NotIで消化することにより大腸菌(E.coli)DNAを取り除くことができる。
【図3】単一相同組換えによる組込みの概略図を示す。発現ベクターは、選択可能なamdSマーカーと、変異シグナル配列を含むamyB遺伝子に接続されたプロモーターとを含む。これらの機構にglaA遺伝子座の相同領域(それぞれ3’glaA及び3”glaA)が隣接し、glaAゲノム遺伝子座における組込みを誘導する。
【図4】いずれもglaAプロモーターの制御下にある種々のamyBコンストラクトを発現するA.ニガー(A.niger)株の培養ブロスにおけるα−アミラーゼ活性を示す。amyBコンストラクトを発現するA.ニガー(A.niger)株の培養ブロスにおけるα−アミラーゼ活性を示し、ここで種々のコンストラクトにおいてシグナル配列は修飾されている。種々のコンストラクトに関する詳細は、表1に見ることができる。α−アミラーゼ活性は相対α−アミラーゼ単位[AU]で示され、3日目における3株のFUA6群のFUA−6 1コピー株の平均を100%に設定した。示される全ての形質転換体株について、3個の形質転換体を単離し、独立して培養した。
【図5】双方ともamyBプロモーターの制御下で2つの異なるamyBコンストラクトを発現するA.ニガー(A.niger)株の培養ブロスにおけるα−アミラーゼ活性を示す。天然amyBコンストラクト(pGBFINFUA−3)を発現するA.ニガー(A.niger)株の培養ブロスにおけるα−アミラーゼ活性を示し、ここでamyBシグナル配列は、本発明の方法に従い、コドン最適化pmeAシグナル配列(pGBFINFUA−21)となるよう修飾された。2個のコンストラクトに関する詳細は、表2に見ることができる。α−アミラーゼ活性は相対α−アミラーゼ単位[AU]で示され、3日目における3株のFUA3群のFUA−3−1 1コピー株の平均を100%に設定した。示される2個の形質転換体群について、3個の形質転換体を単離し、独立して培養した。
【図6】双方ともglaAプロモーターの制御下でP.クリソゲナム(P.chrysogenum)グルコースオキシダーゼGoxAをコードする2つの異なるコンストラクトを発現するA.ニガー(A.niger)株の培養ブロスにおけるグルコースオキシダーゼ活性を示す。天然goxAコンストラクト(GOX−1−#)を発現するA.ニガー(A.niger)株の培養ブロスにおけるグルコースオキシダーゼ活性を示し、ここでコドン最適化goxAシグナル配列は、本発明の方法に従い、コドン最適化pmeAシグナル配列(GOX−2−#)となるよう修飾された。グルコースオキシダーゼ活性は相対グルコースオキシダーゼ単位[AU]で示される。示される2個の形質転換体群について、5個の形質転換体を単離し、独立して培養した。
【0009】
[本発明の詳細な説明]
意外にも、特定のシグナル配列を使用することにより対象組換えポリペプチドの産生を改良できることが確立された。従って、本発明の第1の態様では、対象組換えポリペプチドの産生方法であって、
(i)前記ポリペプチドの産生をもたらす条件下における糸状菌宿主細胞の培養であって、前記糸状菌宿主細胞が翻訳リーディングフレーム内で第2のポリヌクレオチドに連結された第1のポリヌクレオチドを含み、前記第2のポリヌクレオチドが対象ポリペプチドをコードし、前記第1のポリヌクレオチドが、
a)配列番号25、
b)少なくとも8アミノ酸が対応位置における配列番号25の最初の10アミノ酸と同じである、15〜23アミノ酸の配列番号25の変異体、
c)1位のアミノ酸がMetであり、且つ2位のアミノ酸がVal又はLysであり、及び10アミノ酸の連続ストレッチがAla又はLeuから選択される少なくとも5アミノ酸を含む、15〜23アミノ酸の配列番号25の変異体、
d)配列番号39、
e)少なくとも8アミノ酸が対応位置における配列番号39の最初の10アミノ酸と同じである、15〜23アミノ酸の配列番号39の変異体、
f)1位のアミノ酸がMetであり、且つ2位のアミノ酸がVal又はLysであり、及び10アミノ酸の連続ストレッチがAla又はLeuから選択される少なくとも5アミノ酸を含む、15〜23アミノ酸の配列番号39の変異体、
g)配列番号44、
h)少なくとも8アミノ酸が対応位置における配列番号44の最初の10アミノ酸と同じである、15〜23アミノ酸の配列番号44の変異体、
i)1位のアミノ酸がMetであり、且つ2位のアミノ酸がVal又はLysであり、及び10アミノ酸の連続ストレッチがAla又はLeuから選択される少なくとも5アミノ酸を含む、15〜23アミノ酸の配列番号44の変異体、
j)配列番号34、
k)少なくとも8アミノ酸が対応位置における配列番号34の最初の10アミノ酸と同じである、15〜23アミノ酸の配列番号34の変異体、
l)1位のアミノ酸がMetであり、且つ2位のアミノ酸がVal又はLysであり、及び10アミノ酸の連続ストレッチがAla又はLeuから選択される少なくとも5アミノ酸を含む、15〜23アミノ酸の配列番号34の変異体、
からなる群から選択されるシグナルペプチドをコードする、培養と、
(ii)場合により、培養培地からの前記ポリペプチドの単離と、
を含む方法が提供される。
【0010】
以上に記載される方法は、本明細書では本発明に係る方法と称される。
【0011】
ある実施形態によれば、本発明の方法において、シグナルペプチドは配列番号25である。
【0012】
別の実施形態によれば、本発明の方法において、シグナルペプチドは、15〜23アミノ酸の配列番号25の変異体であって、少なくとも8アミノ酸が対応位置における配列番号25の最初の10アミノ酸と同じである変異体である。
【0013】
別の実施形態によれば、本発明の方法において、シグナルペプチドは、15〜23アミノ酸の配列番号25の変異体であって、1位のアミノ酸がMetであり、且つ2位のアミノ酸がVal又はLysであり、及び10アミノ酸の連続ストレッチがAla又はLeuから選択される少なくとも5アミノ酸を含む変異体である。
【0014】
別の実施形態によれば、本発明の方法において、シグナルペプチドは配列番号39である。
【0015】
別の実施形態によれば、本発明の方法において、シグナルペプチドは、15〜23アミノ酸の配列番号39の変異体であって、少なくとも8アミノ酸が対応位置における配列番号39の最初の10アミノ酸と同じである変異体である。
【0016】
別の実施形態によれば、本発明の方法において、シグナルペプチドは、15〜23アミノ酸の配列番号39の変異体であって、1位のアミノ酸がMetであり、且つ2位のアミノ酸がVal又はLysであり、及び10アミノ酸の連続ストレッチがAla又はLeuから選択される少なくとも5アミノ酸を含む変異体である。
【0017】
別の実施形態によれば、本発明の方法において、シグナルペプチドは配列番号44である。
【0018】
別の実施形態によれば、本発明の方法において、シグナルペプチドは、15〜23アミノ酸の配列番号44の変異体であって、少なくとも8アミノ酸が対応位置における配列番号44の最初の10アミノ酸と同じである変異体である。
【0019】
別の実施形態によれば、本発明の方法において、シグナルペプチドは、15〜23アミノ酸の配列番号44の変異体であって、1位のアミノ酸がMetであり、且つ2位のアミノ酸がVal又はLysであり、及び10アミノ酸の連続ストレッチがAla又はLeuから選択される少なくとも5アミノ酸を含む変異体である。
【0020】
別の実施形態によれば、本発明の方法において、シグナルペプチドは配列番号34である。
【0021】
別の実施形態によれば、本発明の方法において、シグナルペプチドは、15〜23アミノ酸の配列番号34の変異体であって、少なくとも8アミノ酸が対応位置における配列番号34の最初の10アミノ酸と同じである変異体である。
【0022】
別の実施形態によれば、本発明の方法において、シグナルペプチドは、15〜23アミノ酸の配列番号34の変異体であって、1位のアミノ酸がMetであり、且つ2位のアミノ酸がVal又はLysであり、及び10アミノ酸の連続ストレッチがAla又はLeuから選択される少なくとも5アミノ酸を含む変異体である。
【0023】
好ましくは、本発明に係る方法において、シグナルペプチドが、
(a):配列番号25、
(b):少なくとも8アミノ酸が対応位置における配列番号25の最初の10アミノ酸と同じである、15〜23アミノ酸の配列番号25の変異体、又は
(c)1位のアミノ酸がMetであり、且つ2位のアミノ酸がVal又はLysであり、及び10アミノ酸の連続ストレッチがAla又はLeuから選択される少なくとも5アミノ酸を含む、15〜23アミノ酸の配列番号25の変異体、
であるとき、対象ポリペプチドはペクチンメチルエステラーゼではなく、より好ましくは、対象ポリペプチドはエルウィニア・クリサンテミ(Erwinia chrysanthemi)由来のペクチンメチルエステラーゼではない。より好ましくは、シグナルペプチドが(b)又は(c)であるとき、対象ポリペプチドはペクチンメチルエステラーゼではなく、さらにより好ましくは、対象ポリペプチドはエルウィニア・クリサンテミ(Erwinia chrysanthemi)由来のペクチンメチルエステラーゼではない。
【0024】
好ましくは、配列番号25をコードするときの第1のポリヌクレオチドは、配列番号29に係るポリヌクレオチドである。好ましくは、配列番号39をコードするときの第1のポリヌクレオチドは、配列番号38に係るポリヌクレオチドである。好ましくは、配列番号44をコードするときの第1のポリヌクレオチドは、配列番号43に係るポリヌクレオチドである。好ましくは、配列番号34をコードするときの第1のポリヌクレオチドは、配列番号33に係るポリヌクレオチドである。
【0025】
好ましくは、15〜23アミノ酸の配列番号25の変異体であって、少なくとも8アミノ酸が対応位置における配列番号25の最初の10アミノ酸と同じである変異体は、少なくとも9アミノ酸が対応位置における配列番号25の最初の10アミノ酸と同じである変異体である。より好ましくは、10アミノ酸が対応位置における配列番号25の最初の10アミノ酸と同じである。
【0026】
好ましくは、15〜23アミノ酸の配列番号25の変異体であって、1位のアミノ酸がMetであり、且つ2位のアミノ酸がVal又はLysであり、及び10アミノ酸の連続ストレッチがAla又はLeuから選択される少なくとも5アミノ酸を含む変異体は、
a)1位のアミノ酸がMetであり、2、3及び/又は4位のアミノ酸がVal又はLysであり、及び10アミノ酸の連続ストレッチがAla又はLeuから選択される少なくとも5アミノ酸を含む、15〜23アミノ酸の配列番号25の変異体、
b)1位のアミノ酸がMetであり、2位のアミノ酸がValであり、且つ3位のアミノ酸がLysであり、及び10アミノ酸の連続ストレッチがAla又はLeuから選択される少なくとも5アミノ酸を含む、15〜23アミノ酸の配列番号25の変異体、
c)1位のアミノ酸がMetであり、2、3及び/又は4位のアミノ酸がVal又はLysであり、及び10アミノ酸の連続ストレッチがAla又はLeuから選択される少なくとも5アミノ酸を含み、及び変異体の最後の3つの位置のアミノ酸がAla、Leu及びAlaである、15〜23アミノ酸の配列番号25の変異体、
d)1位のアミノ酸がMetであり、2位のアミノ酸がValであり、且つ3位のアミノ酸がLysであり、及び10アミノ酸の連続ストレッチがAla又はLeuから選択される少なくとも5アミノ酸を含み、及び変異体の最後の3つの位置のアミノ酸がAla、Leu及びAlaである、15〜23アミノ酸の配列番号25の変異体、
の群から選択されるものである。
【0027】
好ましくは、15〜23アミノ酸の配列番号39の変異体であって、少なくとも8アミノ酸が対応位置における配列番号39の最初の10アミノ酸と同じである変異体は、少なくとも9アミノ酸が対応位置における配列番号39の最初の10アミノ酸と同じである変異体である。より好ましくは、10アミノ酸が対応位置における配列番号39の最初の10アミノ酸と同じである。
【0028】
好ましくは、15〜23アミノ酸の配列番号39の変異体であって、1位のアミノ酸がMetであり、且つ2位のアミノ酸がVal又はLysであり、及び10アミノ酸の連続ストレッチがAla又はLeuから選択される少なくとも5アミノ酸を含む変異体は、
a)1位のアミノ酸がMetであり、2、3及び/又は5位のアミノ酸がVal又はLysであり、及び10アミノ酸の連続ストレッチがAla又はLeuから選択される少なくとも5アミノ酸を含む、15〜23アミノ酸の配列番号39の変異体、
b)1位のアミノ酸がMetであり、2位のアミノ酸がValであり、且つ5位のアミノ酸がLysであり、及び10アミノ酸の連続ストレッチがAla又はLeuから選択される少なくとも5アミノ酸を含む、15〜23アミノ酸の配列番号39の変異体、
の群から選択されるものである。
【0029】
好ましくは、15〜23アミノ酸の配列番号44の変異体であって、少なくとも8アミノ酸が対応位置における配列番号44の最初の10アミノ酸と同じである変異体は、少なくとも9アミノ酸が対応位置における配列番号44の最初の10アミノ酸と同じである変異体である。より好ましくは、10アミノ酸が対応位置における配列番号44の最初の10アミノ酸と同じである。
【0030】
好ましくは、15〜23アミノ酸の配列番号44の変異体であって、1位のアミノ酸がMetであり、且つ2位のアミノ酸がVal又はLysであり、及び10アミノ酸の連続ストレッチがAla又はLeuから選択される少なくとも5アミノ酸を含む変異体は、
a)1位のアミノ酸がMetであり、2、3及び/又は4位のアミノ酸がVal又はLysであり、及び10アミノ酸の連続ストレッチがAla又はLeuから選択される少なくとも5アミノ酸を含む、15〜23アミノ酸の配列番号44の変異体、
b)1位のアミノ酸がMetであり、2位のアミノ酸がValであり、且つ4位のアミノ酸がLysであり、及び10アミノ酸の連続ストレッチがAla又はLeuから選択される少なくとも5アミノ酸を含む、15〜23アミノ酸の配列番号44の変異体、
の群から選択されるものである。
【0031】
好ましくは、15〜23アミノ酸の配列番号34の変異体であって、少なくとも8アミノ酸が対応位置における配列番号34の最初の10アミノ酸と同じである変異体は、少なくとも9アミノ酸が対応位置における配列番号34の最初の10アミノ酸と同じである変異体である。より好ましくは、10アミノ酸が対応位置における配列番号34の最初の10アミノ酸と同じである。
【0032】
好ましくは、15〜23アミノ酸の配列番号34の変異体であって、1位のアミノ酸がMetであり、且つ2位のアミノ酸がVal又はLysであり、及び10アミノ酸の連続ストレッチがAla又はLeuから選択される少なくとも5アミノ酸を含む変異体は、
a)1位のアミノ酸がMetであり、2、3及び/又は4位のアミノ酸がLysであり、及び10アミノ酸の連続ストレッチがAla又はLeuから選択される少なくとも5アミノ酸を含む、15〜23アミノ酸の配列番号34の変異体、
b)1位のアミノ酸がMetであり、2位のアミノ酸がLysであり、且つ3及び/又は4位のアミノ酸がLysであり、及び10アミノ酸の連続ストレッチがAla又はLeuから選択される少なくとも5アミノ酸を含む、15〜23アミノ酸の配列番号34の変異体、
c)1位のアミノ酸がMetであり、2、3及び/又は4位のアミノ酸がLysであり、及び10アミノ酸の連続ストレッチがAla又はLeuから選択される少なくとも5アミノ酸を含み、及び変異体の最後の3つの位置のアミノ酸がAla、Leu及びAlaである、15〜23アミノ酸の配列番号34の変異体、
d)1位のアミノ酸がMetであり、2位のアミノ酸がLysであり、且つ3及び/又は4位のアミノ酸がLysであり、及び10アミノ酸の連続ストレッチがAla又はLeuから選択される少なくとも5アミノ酸を含み、及び変異体の最後の3つの位置のアミノ酸がAla、Leu及びAlaである、15〜23アミノ酸の配列番号34の変異体、
e)1位のアミノ酸がMetであり、2位のアミノ酸がValであり、及び10アミノ酸の連続ストレッチがAla又はLeuから選択される少なくとも5アミノ酸を含む、15〜23アミノ酸の配列番号34の変異体、
f)1位のアミノ酸がMetであり、2位のアミノ酸がValであり、及び10アミノ酸の連続ストレッチがAla又はLeuから選択される少なくとも5アミノ酸を含み、及び変異体の最後の3つの位置のアミノ酸がAla、Leu及びAlaである、15〜23アミノ酸の配列番号34の変異体、
g)1位のアミノ酸がMetであり、2位のアミノ酸がValであり、及び10アミノ酸の連続ストレッチがAla又はLeuから選択される少なくとも5アミノ酸を含み、及び変異体の最後の3つの位置におけるアミノ酸がAla、Leu、Alaである、15〜23アミノ酸の配列番号34の変異体、
h)1位のアミノ酸がMetであり、2位のアミノ酸がValであり、及び10アミノ酸の連続ストレッチが少なくとも5個のAlaを含む、15〜23アミノ酸の配列番号34の変異体、
i)1位のアミノ酸がMetであり、2位のアミノ酸がValであり、及び10アミノ酸の連続ストレッチが少なくとも4個のAlaと1個のLeuとを含む、15〜23アミノ酸の配列番号34の変異体、
j)1位のアミノ酸がMetであり、2位のアミノ酸がValであり、及び10アミノ酸の連続ストレッチが少なくとも3個のAlaと2個のLeuとを含む、15〜23アミノ酸の配列番号34の変異体、
k)1位のアミノ酸がMetであり、2位のアミノ酸がValであり、及び10アミノ酸の連続ストレッチが少なくとも2個のAlaと3個のLeuとを含む、15〜23アミノ酸の配列番号34の変異体、
l)1位のアミノ酸がMetであり、2位のアミノ酸がValであり、及び10アミノ酸の連続ストレッチが少なくとも1個のAlaと4個のLeuとを含む、15〜23アミノ酸の配列番号34の変異体、
m)1位のアミノ酸がMetであり、2位のアミノ酸がValであり、及び10アミノ酸の連続ストレッチが少なくとも5個のLeuを含む、15〜23アミノ酸の配列番号34の変異体、
n)1位のアミノ酸がMetであり、2位のアミノ酸がLysであり、及び10アミノ酸の連続ストレッチがAla又はLeuから選択される少なくとも5アミノ酸を含む、15〜23アミノ酸の配列番号34の変異体、
o)1位のアミノ酸がMetであり、2位のアミノ酸がLysであり、及び10アミノ酸の連続ストレッチがAla又はLeuから選択される少なくとも5アミノ酸を含み、及び変異体の最後の3つの位置におけるアミノ酸がAla、Leu、Alaである、15〜23アミノ酸の配列番号34の変異体、
p)1位のアミノ酸がMetであり、2位のアミノ酸がLysであり、及び10アミノ酸の連続ストレッチが少なくとも5個のAlaを含む、15〜23アミノ酸の配列番号34の変異体、
q)1位のアミノ酸がMetであり、2位のアミノ酸がLysであり、及び10アミノ酸の連続ストレッチが少なくとも4個のAlaと1個のLeuとを含む、15〜23アミノ酸の配列番号34の変異体、
r)1位のアミノ酸がMetであり、2位のアミノ酸がLysであり、及び10アミノ酸の連続ストレッチが少なくとも3個のAlaと2個のLeuとを含む、15〜23アミノ酸の配列番号34の変異体、
s)1位のアミノ酸がMetであり、2位のアミノ酸がLysであり、及び10アミノ酸の連続ストレッチが少なくとも2個のAlaと3個のLeuとを含む、15〜23アミノ酸の配列番号34の変異体、
t)1位のアミノ酸がMetであり、2位のアミノ酸がLysであり、及び10アミノ酸の連続ストレッチが少なくとも1個のAlaと4個のLeuとを含む、15〜23アミノ酸の配列番号34の変異体、
u)1位のアミノ酸がMetであり、2位のアミノ酸がLysであり、及び10アミノ酸の連続ストレッチが少なくとも5個のLeuを含む、15〜23アミノ酸の配列番号34の変異体、
の群から選択されるものである。
【0033】
以上の配列番号25の(a)〜(d)、配列番号39の(a)及び(b)、配列番号44の(a)及び(b)並びに配列番号34の(a)〜(u)の変異体において、連続ストレッチは、好ましくは10アミノ酸、より好ましくは9アミノ酸、さらにより好ましくは8アミノ酸、及び最も好ましくは7アミノ酸である。
【0034】
以上の配列番号25の(a)〜(d)、配列番号39の(a)及び(b)、配列番号44の(a)及び(b)並びに配列番号34の(a)〜(u)の変異体において、アミノ酸の連続ストレッチは、好ましくはAla又はLeuから選択される少なくとも5アミノ酸、より好ましくはAla又はLeuから選択される少なくとも6アミノ酸、及び最も好ましくはAla又はLeuから選択される少なくとも7アミノ酸を含む。
【0035】
15〜23アミノ酸の配列番号25、配列番号39、配列番号44、又は配列番号34の変異体は、15アミノ酸、17アミノ酸、18アミノ酸、19アミノ酸、20アミノ酸、21アミノ酸、22アミノ酸又は23アミノ酸を含んでもよい。
【0036】
以上に記載される第1のポリヌクレオチドによりコードされるシグナルペプチドは、本明細書では本発明に係るシグナルペプチドと称される。
【0037】
「ペプチド」又は「オリゴペプチド」は、本明細書では、直鎖状に構成され、且つ隣接するアミノ酸残基のカルボキシル基とアミノ基との間のペプチド結合により互いにつなぎ合わされた少なくとも2個のアミノ酸からなる分子を指す。用語「ペプチド」及び「オリゴペプチド」は(一般に認識されるとおり)同義語と見なされ、文脈上の必要に応じて各用語を代替的に使用することができる。「ポリペプチド」は、本明細書では、少なくとも40アミノ酸を含む分子を指す。
【0038】
本発明との関連において、用語「シグナルペプチド」は、本明細書では、ポリペプチドを宿主細胞の分泌経路に導くペプチドとして定義される。シグナル配列は、必ずしもそうとは限らないものの通常は、ポリペプチドのアミノ末端に存在し、ポリペプチドにインフレームで融合される。シグナルペプチドとポリペプチドのアミノ末端との間には、プロペプチドが存在し得る。シグナル配列は、必ずしもそうとは限らないものの通常は、分泌過程でポリペプチドから切断され、成熟ポリペプチドをもたらす。当業者には、シグナル配列の同定方法は公知である。様々なツール及び充実した文献が利用可能である。本発明の限定として解釈されてはならない例としては、
「シグナル配列の切断部位を予測するための新規方法(A new method for predicting signal sequence cleavage sites)」von Heijne G. Nucleic Acids Res.1986年6月11日号;14(11):4683〜90頁
「原核生物及び真核生物シグナルペプチドの同定並びにその切断部位の予測(Identification of prokaryotic and eukaryotic signal peptides and prediction of their cleavage sites)」Henrik Nielsen、Jacob Engelbrecht、Soren Brunak及びGunnar von Heijne、Protein Engineering、10:1〜6頁、1997年
「TargetP、SignalP、及び関連ツールを使用した細胞内のタンパク質位置決定(Locating proteins in the cell using TargetP,SignalP,and related tools)」Olof Emanuelsson、Soren Brunak、Gunnar von Heijne、Henrik Nielsen、Nature Protocols 2、953〜971頁(2007年)
ウェブサイト:http://www.cbs.dtu.dk/services/SignalP/
である。
【0039】
用語「プロペプチド」は、本明細書では、ポリペプチドのアミノ末端にインフレームで融合したペプチドとして定義される。得られるポリペプチドはプロポリペプチドとして知られ、プロポリペプチドからのプロペプチドの自己触媒的切断の触媒により成熟ポリペプチドに変換され得る。
【0040】
シグナルペプチド及びプロペプチドは、本明細書では合わせて「プレプロペプチド」と称され、シグナル配列がプロペプチドにインフレームで融合し、及びプロペプチドがポリペプチドのアミノ末端にインフレームで融合する。
【0041】
シグナルペプチド、プロペプチド及びプレプロペプチドは、当該技術分野では「リーダー配列」と称されることもある。
【0042】
用語「成熟ポリペプチド」は、本明細書では、翻訳、翻訳後修飾、例えばN末端プロセシング、C末端プロセシング、グリコシル化、リン酸化及び任意選択での切断によるリーダー配列の除去を経たその最終形態にあるポリペプチドとして定義される。
【0043】
本発明との関連において用語「ポリペプチド」及び「タンパク質」は同じであり、本発明の記載全体を通じ、同義的に読まれ得る。
【0044】
本発明との関連において、用語「組換え」は、宿主細胞がランダム突然変異誘発に供されることによって誘導される天然に存在するプロセス及び/又は遺伝子修飾のみが関与すのではない任意の遺伝子修飾を指す。結果的に、組換えのプロセス及び/又は遺伝子修飾と、宿主細胞がランダム突然変異誘発に供されることによって誘導される天然に存在するプロセス及び/又は遺伝子修飾との組み合わせは、組換えとして解釈される。好ましくは、組換え遺伝子修飾には、宿主細胞がランダム突然変異誘発に供されることにより誘導される天然に存在するプロセス及び/又は遺伝子修飾が関与しない。
【0045】
用語「作動可能に連結された」は、本明細書では、制御配列がコード配列の発現を誘導するように、制御配列がコード配列に対して適切な位置に配置される構成として定義される。
【0046】
本明細書に定義されるとおりの用語「コード配列」は、mRNAに転写され、本発明に係るポリペプチドに翻訳される配列である。コード配列の境界は、概してmRNAの5’側でATG又は他の開始コドンにより、及びmRNAの3’側でオープンリーディングフレームの終端となる翻訳終止コドン配列により決定される。コード配列としては、限定はされないが、DNA、cDNA、及び組換え核酸配列が挙げられる。
【0047】
用語「変異ペプチド」又は「変異ポリペプチド」は、本明細書では、それぞれペプチド又はポリペプチド内の1つ又は複数の特定の位置に1つ又は複数の特定のアミノ酸残基の置換、挿入、欠失及び/又は切断などの1つ又は複数の改変を含むそれぞれペプチド又はポリペプチドとして定義される。従って、変異シグナルペプチドは、シグナルペプチド内の1つ又は複数の特定の位置に1つ又は複数の特定のアミノ酸残基の置換、挿入、欠失及び/又は切断などの1つ又は複数の改変を含むシグナルペプチドである。
【0048】
本発明に係る変異シグナルペプチドの対応位置は、シグナルペプチドの配列番号25、配列番号39、配列番号44、又は配列番号34などの参照配列に対するアラインメントにより決定される。適用可能な場合には、ペプチド、ポリペプチド又はポリヌクレオチドのアラインメント又はマルチアラインメントを、当該技術分野において公知の方法を用いて行うことができる。かかる方法としては、限定はされないが、ClustalW(Thompsonら、1994年、Nucleic Acid Research 22、4673〜4680頁)、BLAST、GAP、MAP、MultiBLAST、及びスミス・ウォーターマンが挙げられる。
【0049】
用語「ポリヌクレオチド」は用語「核酸分子」と同じであり、本明細書では同義的に読まれ得る。この用語は、一本鎖又は二本鎖のいずれかであるリボ核酸(RNA)又はデオキシリボ核酸(DNA)分子であるポリヌクレオチド分子を指す。ポリヌクレオチドは、単離された形態で存在してもよく、又は組換え核酸分子又はベクター中に含まれてもよく、又は宿主細胞中に含まれてもよい。
【0050】
用語「変異ポリヌクレオチド」は、本明細書では、ポリヌクレオチド内の1つ又は複数の特定の位置に1つ又は複数のヌクレオチドの置換、挿入、欠失及び/又は切断などの1つ又は複数の改変を含むポリヌクレオチドとして定義される。
【0051】
本発明に係るシグナルペプチドは、第2のポリヌクレオチドによりコードされる対象ポリペプチドと天然に関係を有するものであってもよく、又は第2のポリヌクレオチドによりコードされる対象ポリペプチドにとって外来性であってもよい。好ましくは、本発明に係るシグナルペプチドは、第2のポリヌクレオチドによりコードされる対象ポリペプチドにとって外来性である。変異シグナルペプチドは、本明細書では、第2のポリヌクレオチドによりコードされる対象ポリペプチドにとって外来性のものとして定義される。
【0052】
対象ポリペプチドと天然に関係を有するシグナルペプチドは、当該技術分野において公知の標準的な分子クローニング技法を用いて、天然に関係を有するシグナルペプチドをコードするポリヌクレオチドを本発明に係るシグナルペプチドに物理的に置き換えることにより、本発明に係るシグナルペプチドに置き換えてもよい。かかる方法は、Sambrook及びRussell、「Molecular Cloning:A Laboratory Manual」第3版、CSHL Press、Cold Spring Harbor、NY、2001年;及びAusubelら、「Current Protocols in Molecular Biology」、Wiley InterScience、NY、1995年に広範な記載がなされている。
【0053】
或いは、対象ポリペプチドと天然に関係を有するシグナルペプチドは、公知の方法を用いた、天然に関係を有するシグナルペプチドをコードするポリヌクレオチドの部位特異的突然変異誘発により、本発明に係るシグナルペプチドに変換されてもよい(例えばSambrook及びRussel、上記を参照のこと)。
【0054】
本発明に係るシグナルペプチドは、糸状菌宿主細胞にとって天然であっても、又は外来性であってもよい。好ましくは、本発明に係るシグナルペプチドは糸状菌宿主細胞にとって天然である。
【0055】
好ましくは、本発明に係る方法は、翻訳リーディングフレーム内でその天然シグナルペプチドをコードするポリヌクレオチドと連結された第2のポリヌクレオチドによりコードされる対象ポリペプチドと比較したとき、同一条件下での培養時に、翻訳リーディングフレーム内で本発明に係るシグナルペプチドをコードする第1のポリヌクレオチドと連結された第2のポリヌクレオチドによりコードされる対象組換えポリペプチドを少なくとも10%多く、より好ましくは少なくとも25%多く、さらにより好ましくは少なくとも50%多く、さらにより好ましくは少なくとも75%多く、さらにより好ましくは少なくとも100%多く、さらにより好ましくは少なくとも200%多く、最も好ましくは少なくとも500%多く産生する。
【0056】
対象ポリペプチドをコードする第2のポリヌクレオチドは、当業者に公知の一般的な方法により提供され得る。かかる方法は、Sambrook及びRussell、上記に広範な記載がなされている。前記方法の例は以下のとおりである。第2のポリヌクレオチドの配列が既知である場合、又はコードされる対象ポリペプチドの配列が既知である場合、ポリヌクレオチドは、そのポリヌクレオチドを天然に発現する宿主細胞から単離されてもよい。或いは、ポリヌクレオチドは化学的に合成されてもよい。例えば本明細書において以下に記載されるとおりのコドン最適化方法を用いて、選択した宿主細胞のコドン使用を適合させてもよい。ポリペプチドの配列が未知である場合、初めに当該技術分野において公知の方法を用いてその配列が決定され得る(Sambrook及びRussel、上記)。
【0057】
本明細書において組み合わされる、又は単独でのポリヌクレオチドは(すなわち、翻訳リーディングフレーム内で第2のポリヌクレオチドに連結された第1のポリヌクレオチドであって、前記第2のポリヌクレオチドが対象ポリペプチドをコードし、前記第1のポリヌクレオチドがシグナルペプチドをコードするもの;又は第1のポリヌクレオチド単独又は第2のポリヌクレオチド単独)、合成ポリヌクレオチドであってもよい。合成ポリヌクレオチドは、好ましくは、参照により本明細書に援用される国際公開第2006/077258号パンフレット及び/又はPCT/EP2007/055943号明細書に記載される方法により、コドン使用が最適化されてもよい。PCT/EP2007/055943号明細書はコドン対最適化を取り上げている。コドン対最適化は、ポリペプチドをコードするヌクレオチド配列がそのコドン使用頻度、特に使用されるコドン対に関して修飾されており、それによりポリペプチドをコードするヌクレオチド配列の発現の向上及び/又はコードされたポリペプチドの産生の向上が達成される方法である。コドン対は、コード配列内の2つの連続するトリプレット(コドン)の組として定義される。
【0058】
本明細書において組み合わされる、又は単独でのポリヌクレオチドは(すなわち、翻訳リーディングフレーム内で第2のポリヌクレオチドに連結された第1のポリヌクレオチドであって、前記第2のポリヌクレオチドが対象ポリペプチドをコードし、前記第1のポリヌクレオチドがシグナルペプチドをコードするもの;又は第1のポリヌクレオチド単独又は第2のポリヌクレオチド単独)、1つ又は複数のイントロンを含んでもよい。
【0059】
翻訳リーディングフレーム内でポリヌクレオチドを互いに連結する方法は、当該技術分野では一般的なクローニング技法として公知である(Sambrook及びRussell、上記)。例は、消化、ライゲーション、PCR、化学合成等である。従って、第1のポリヌクレオチドは、かかる当該技術分野において公知の方法により翻訳リーディングフレーム内で第2のポリヌクレオチドに連結することができる。
【0060】
翻訳リーディングフレーム内で第2のポリヌクレオチドに連結された第1のポリヌクレオチドを含む糸状菌宿主細胞であって、前記第2のポリヌクレオチドが対象ポリペプチドをコードし、前記第1のポリヌクレオチドが本発明に係るシグナルペプチドをコードする糸状菌宿主細胞は、当該技術分野において公知の方法を用いて構築することができる。好ましくは、前記糸状菌宿主細胞は、
− 好適な糸状菌宿主細胞を提供するステップと、
− 翻訳リーディングフレーム内で前記第2のポリヌクレオチドに連結された前記第1のポリヌクレオチドにより前記宿主細胞を形質転換するステップと、
を含む方法により構築される。
【0061】
ポリヌクレオチド、発現ベクター又は核酸コンストラクトを細胞に導入することによる宿主細胞の形質転換は、好ましくは当該技術分野において公知の技法により実施される(Sambrook及びRussell;Ausubel、上記を参照のこと)。形質転換には、それ自体公知の方法によるプロトプラスト形成、プロトプラストの形質転換、及び細胞壁の再生からなるプロセスが関与する。アスペルギルス属(Aspergillus)細胞の形質転換に好適な手順が、欧州特許第238 023号明細書及びYeltonら、1984年、Proceedings of the National Academy of Sciences USA 81:1470〜1474頁に記載されている。アグロバクテリウム・ツメファシエンス(Agrobacterium tumefaciens)を使用するアスペルギルス属(Aspergillus)及び他の糸状菌宿主細胞の形質転換に好適な手順が、例えばDe Grootら、「アグロバクテリウム・ツメファシエンス(Agrobacterium tumefaciens)の媒介による糸状菌の形質転換(Agrobacterium tumefaciens−mediated transformation of filamentous fungi)」、Nat Biotechnol.1998、16:839〜842頁、訂正記事:Nat Biotechnol 1998 16:1074頁に記載されている。フザリウム属(Fusarium)種を形質転換する好適な方法が、Malardierら、1989年、Gene 78:147156頁又は国際公開第96/00787号パンフレットに記載されている。Christiansenら、「偏性植物病原真菌の微粒子銃形質転換(Biolistic transformation of the obligate plant pathogenic fungus)」、Erysiphe graminis f.sp.hordei.1995年、Curr Genet.29:100〜102頁に記載されるとおりの微粒子銃形質転換を用いる方法など、他の方法を適用することもできる。酵母は、Becker及びGuarente、Abelson,J.N.及びSimon,M.I.編、「Guide to Yeast Genetics and Molecular Biology,Methods in Enzymology」所収、第194巻、182〜187頁、Academic Press,Inc.、New York;Itoら、1983年、Journal of Bacteriology 153:163頁;及びHinnenら、1978年、Proceedings of the National Academy of Sciences USA 75:1920頁により記載される手順を用いて形質転換されてもよい。
【0062】
本発明に係る糸状菌宿主細胞は、当該技術分野において公知の方法を用いた対象組換えポリペプチドの産生に好適な栄養培地において培養される。例えば、細胞は、好適な培地中、且つポリペプチドの発現及び/又は単離を可能にする条件下で、振盪フラスコ培養法、実験室又は工業用発酵槽内での小規模又は大規模発酵法(連続、バッチ、フェドバッチ、又は固体発酵を含む)により培養されてもよい。培養は、当該技術分野において公知の手順を用いて、炭素源及び窒素源並びに無機塩類を含む好適な栄養培地中で行われる(例えば、Bennett,J.W.及びLaSure,L.編、「More Gene Manipulations in Fungi」、Academic Press、CA、1991年を参照のこと)。好適な培地は供給業者から入手可能であり、又は公表されている組成物(例えば、American Type Culture Collectionのカタログにある)を使用して調製されてもよい。ポリペプチドが栄養培地中に分泌される場合、ポリペプチドは、培養培地から直接回収することができる。ポリペプチドが分泌されない場合、それは細胞溶解物から回収される。
【0063】
産生される対象組換えポリペプチドは、当該技術分野において公知の方法により培養培地から回収され得る。例えば、ポリペプチドは、限定はされないが、遠心、ろ過、抽出、噴霧乾燥、蒸発、又は沈殿を含めた従来の手順により培養培地から回収されてもよい。
【0064】
対象組換えポリペプチドは、限定はされないが、クロマトグラフィー(例えば、イオン交換、親和性、疎水性、クロマトフォーカシング、及びサイズ排除)、電気泳動法による手順(例えば、分取等電点電気泳動法)、溶解度差(例えば、硫酸アンモニウム沈殿)、SDS−PAGE、又は抽出を含む当該技術分野において公知の様々な手順により精製されてもよい(例えば、「Protein Purification」、編者J.−C.Janson及びLars Ryden、VCH Publishers、New York、1989年を参照のこと)。
【0065】
対象組換えポリペプチドは、ポリペプチドに特異的な当該技術分野において公知の方法を用いて検出されてもよい。これらの検出方法としては、特異的抗体の使用、高速液体クロマトグラフィー、キャピラリークロマトグラフィー、電気泳動法、酵素産物の形成、又は酵素基質の消失を挙げることができる。
【0066】
本発明に係る宿主細胞は糸状菌宿主細胞である。「糸状菌」は、あらゆる糸状の形態の真菌(Eumycota)及び卵菌(Oomycota)亜門(Hawksworthら、「Ainsworth and Bisby’s Dictionary of The Fungi」第8版、1995年、CAB International、University Press、Cambridge、英国により定義されるとおり)を含む。糸状菌は、キチン、セルロース、グルカン、キトサン、マンナン、及び他の複合多糖類からなる菌糸壁によって特徴付けられる。栄養成長は菌糸伸長により、及び炭素異化は絶対好気性である。糸状菌株としては、限定はされないが、アクレモニウム属(Acremonium)、アガリクス属(Agaricus)、アスペルギルス属(Aspergillus)、アウレオバシジウム属(Aureobasidium)、クリソスポリウム属(Chrysosporium)、コプリナス属(Coprinus)、クリプトコッカス属(Cryptococcus)、フィリバシジウム属(Filibasidium)、フザリウム属(Fusarium)、フミコラ属(Humicola)、マグナポルテ属(Magnaporthe)、ムコール属(Mucor)、ミセリオフトラ属(Myceliophthora)、ネオカリマスティクス属(Neocallimastix)、ニューロスポラ属(Neurospora)、ペシロミセス属(Paecilomyces)、ペニシリウム属(Penicillium)、ピロミセス属(Piromyces)、パネロカエテ属(Panerochaete)、プレウロタス属(Pleurotus)、スポロトリクム属(Sporotrichum)、シゾフィラム属(Schizophyllum)、タラロミセス属(Talaromyces)、サーモアスカス属(Thermoascus)、チエラビア属(Thielavia)、トリポクラジウム属(Tolypocladium)、及びトリコデルマ属(Trichoderma)の株が挙げられる。
【0067】
好ましい糸状菌細胞は、アクレモニウム属(Acremonium)、アスペルギルス属(Aspergillus)、クリソスポリウム属(Chrysosporium)、ミセリオフトラ属(Myceliophthora)、ペニシリウム属(Penicillium)、スポロトリクム属(Sporotrichum)、タラロミセス属(Talaromyces)、チエラビア属(Thielavia)又はトリコデルマ属(Trichoderma)の種、及び最も好ましくは、アクレモニウム・アラバメンシス(Acremonium alabamensis)、アスペルギルス・ニガー(Aspergillus niger)、アスペルギルス・アワモリ(Aspergillus awamori)、アスペルギルス・フォエティダス(Aspergillus foetidus)、アスペルギルス・ソジャエ(Aspergillus sojae)、アスペルギルス・フミガツス(Aspergillus fumigatus)、アスペルギルス・オリゼ(Aspergillus oryzae)、クリソスポリウム・ルクノウェンセ(Chrysosporium lucknowense)、ミセリオフトラ・サーモフィラ(Myceliophthora thermophila)、スポロトリクム・セルロフィルム(Sporotrichum cellulophilum)、チエラビア・テレストリス(Thielavia terrestris)、トリコデルマ・リーゼイ(Trichoderma reesei)、タラロミセス・エメルソニイ(Talaromyces emersonii)又はペニシリウム・クリソゲナム(Penicillium chrysogenum)の種に属する。
【0068】
糸状菌のいくつかの株、アスペルギルス・ニガー(Aspergillus niger)CBS513.88、アスペルギルス・オリゼ(Aspergillus oryzae)ATCC 20423、IFO 4177、ATCC 1011、ATCC 9576、ATCC14488−14491、ATCC 11601、ATCC12892、P.クリソゲナム(P.chrysogenum)CBS 455.95、ペニシリウム・シトリナム(Penicillium citrinum)ATCC 38065、ペニシリウム・クリソゲナム(Penicillium chrysogenum)P2、アクレモニウム・クリソゲナム(Acremonium chrysogenum)ATCC 36225又はATCC 48272、トリコデルマ・リーゼイ(Trichoderma reesei)ATCC 26921又はATCC 56765又はATCC 26921、アスペルギルス・ソーヤ(Aspergillus sojae)ATCC11906、クリソスポリウム・ルクノウェンセ(Chrysosporium lucknowense)ATCC44006、タラロミセス・エメルソニイ(Talaromyces emersonii)CBS393.64又はCBS814.70及びそれらの誘導体は、American Type Culture Collection(ATCC)、Deutsche Sammlung von Mikroorganismen und Zellkulturen GmbH(DSM)、Centraalbureau Voor Schimmelcultures(CBS)、及びAgricultural Research Service Patent Culture Collection、Northern Regional Research Center(NRRL)などの数多くのカルチャーコレクションにおいて一般に容易に入手可能である。
【0069】
場合により、宿主細胞は、対象ポリペプチドの産生能を亢進させるため、野生型細胞と比較して高い小胞体ストレス応答(UPR)を含む。UPRは、米国特許出願公開第2004/0186070A1号明細書及び/又は米国特許出願公開第2001/0034045A1号明細書及び/又は国際公開第01/72783A2号パンフレット及び/又は国際公開第2005/123763号パンフレットに記載される技法により増加させ得る。より具体的には、高いUPRを有する宿主細胞が得られるようHAC1及び/又はIRE1及び/又はPTC2のタンパク質レベルが調節されているか、及び/又はSEC61タンパク質が操作されている。
【0070】
それに代えて、又は高いUPRとの組み合わせで、宿主細胞は、対象ポリペプチドの産生能を亢進させるため、野生型細胞と比較してより低いプロテアーゼ発現及び/又はプロテアーゼ分泌を呈する表現型を得るように遺伝子修飾される。かかる表現型は、プロテアーゼの発現の転写制御因子を欠失及び/又は修飾及び/又は不活化させることによって得てもよい。かかる転写制御因子は、例えばprtTである。prtTを調節することによるプロテアーゼの発現の低下は、米国特許出願公開第2004/0191864A1号明細書に記載される技法により実施され得る。
【0071】
それに代えて、又は高いUPR及び/又はより低いプロテアーゼ発現及び/又はプロテアーゼ分泌を呈する表現型との組み合わせで、宿主細胞は対象ポリペプチドの産生収率を亢進させるためシュウ酸欠損表現型を呈する。シュウ酸欠損表現型は、国際公開第2004/070022A2号パンフレットに記載される技法により得てもよい。
【0072】
それに代えて、又は高いUPR及び/又は高いUPR及び/又はより低いプロテアーゼ発現及び/又はプロテアーゼ分泌を呈する表現型及び/又はシュウ酸欠損との組み合わせで、宿主細胞は、対象ポリペプチドの産生収率を亢進させるため、野生型細胞と比較して表現型の違いの組み合わせを呈する。これらの違いとしては、限定はされないが、グルコアミラーゼ及び/又は中性α−アミラーゼA及び/又は中性α−アミラーゼB、プロテアーゼ、及びシュウ酸ヒドロラーゼの発現の低下を挙げることができる。宿主細胞が呈する前記表現型の違いは、米国特許出願公開第2004/0191864A1号明細書に記載される技法に係る遺伝子修飾によって得てもよい。
【0073】
それに代えて、又は対象ポリペプチドの産生収率を亢進させるための野生型細胞との比較における高いUPR及び/又はより低いプロテアーゼ発現及び/又はプロテアーゼ分泌を呈する表現型及び/又はシュウ酸欠損及び表現型の違いの組み合わせとの組み合わせで、宿主細胞は毒素遺伝子の欠損を呈し、糸状菌宿主細胞の毒素発現能力が無効にされる。かかる毒素としては、限定はされないが、オクラトキシン、フモニシン、シクラピアゾン酸(cyclapiazonic acid)、3−ニトロプロピオン酸、エモジン、マルフォルミン、アフラトキシン及びセカロン酸が挙げられる。かかる欠損は、好ましくは国際公開第2000/039322号パンフレットに記載されるようなものである。
【0074】
対象ポリペプチドは、対象の生物活性を有する任意のポリペプチドであってよい。ポリペプチドは天然であっても、又は宿主細胞にとって異種であってもよい。異種ポリペプチドは、本明細書では、宿主細胞にとって天然ではないポリペプチド、又はポリペプチドを改変するよう構造的な修飾が加えられた天然ポリペプチドとして定義される。ポリペプチドはコラーゲン若しくはゼラチンであっても、又はその変異体若しくはハイブリッドであってもよい。ポリペプチドは、抗体若しくはその一部、抗原、凝固因子、酵素、ホルモン若しくはホルモン変異体、受容体若しくはその一部、調節タンパク質、構造タンパク質、レポーター、又は輸送タンパク質、分泌過程に天然に関与するタンパク質、フォールディング過程に関与するタンパク質、シャペロン、ペプチドアミノ酸トランスポーター、グリコシル化因子、転写因子、オリゴペプチド、天然の細胞内タンパク質であってもよい。天然の細胞内タンパク質は、プロテアーゼ、セラミダーゼ、エポキシドヒドロラーゼ、アミノペプチダーゼ、アシラーゼ、アルドラーゼ、ヒドロキシラーゼ、アミノペプチダーゼ、リパーゼなどの酵素であってもよい。対象組換えポリペプチドは、好ましくは細胞外で分泌される酵素である。かかる酵素は、オキシドレダクターゼ、トランスフェラーゼ、ヒドロラーゼ、リアーゼ、イソメラーゼ、リガーゼ、カタラーゼ、セルラーゼ、キチナーゼ、クチナーゼ、デオキシリボヌクレアーゼ、デキストラナーゼ、エステラーゼの群に属し得る。酵素は、カルボヒドラーゼ、例えば、エンドグルカナーゼ、β−グルカナーゼ、セロビオヒドロラーゼ又はβ−グルコシダーゼなどのセルラーゼ、ヘミセルラーゼ、又はペクチン分解酵素、例えば、キシラナーゼ、キシロシダーゼ、マンナナーゼ、ガラクタナーゼ、ガラクトシダーゼ、ペクチンメチルエステラーゼ、ペクチンリアーゼ、ペクチン酸リアーゼ、エンドポリガラクツロナーゼ、エキソポリガラクツロナーゼ、ラムノガラクツロナーゼ、アラバナーゼ、アラビノフラノシダーゼ、アラビノキシランヒドロラーゼ、ガラクツロナーゼ、リアーゼ、又はデンプン分解酵素;ヒドロラーゼ、イソメラーゼ、又はリガーゼ、フィターゼなどのホスファターゼ、リパーゼなどのエステラーゼ、タンパク質分解酵素、オキシダーゼなどのオキシドレダクターゼ、トランスフェラーゼ、又はイソメラーゼであってもよい。酵素はフィターゼであってよい。酵素は、アスパラギナーゼ、アミノペプチダーゼ、アミラーゼ、カルボヒドラーゼ、カルボキシペプチダーゼ、エンドプロテアーゼ、メタロプロテアーゼ、セリンプロテアーゼカタラーゼ、キチナーゼ、クチナーゼ、シクロデキストリングリコシルトランスフェラーゼ、デオキシリボヌクレアーゼ、エステラーゼ、α−ガラクトシダーゼ、β−ガラクトシダーゼ、グルコアミラーゼ、α−グルコシダーゼ、β−グルコシダーゼ、ハロペルオキシダーゼ、タンパク質分解酵素、インベルターゼ、ラッカーゼ、リパーゼ、マンノシダーゼ、ミュータン分解酵素、オキシダーゼ、ペクチン分解酵素、ペルオキシダーゼ、ホスホリパーゼ、ポリフェノールオキシダーゼ、リボヌクレアーゼ、トランスグルタミナーゼ、又はグルコースオキシダーゼ、ヘキソースオキシダーゼ、モノオキシゲナーゼであってもよい。
【0075】
ポリペプチドは、上述のポリペプチドの天然に存在する対立遺伝子の変異体及び操作された変異体をさらに含む。
【0076】
本発明によれば、対象ポリペプチドはまた、別のポリペプチドがそのポリペプチド又はその断片のN末端又はC末端に融合された融合又はハイブリッドポリペプチドであってもよい。融合ポリペプチドは、あるポリペプチドをコードする核酸配列(又はその一部分)を、別のポリペプチドをコードする核酸配列(又はその一部分)と融合することにより産生される。
【0077】
ハイブリッドポリペプチドは、1つ又は複数が宿主細胞にとって異種であってもよい少なくとも2つの異なるポリペプチドから得られた部分的又は完全なポリペプチド配列の組み合わせを含んでもよい。
【0078】
本発明に係る方法は、好都合には対象組換えポリペプチドの産生に用いられる。
【0079】
従って、第2の態様において本発明は、本発明の第1の態様に係る方法により産生される対象組換えポリペプチドに関する。好ましくは、前記ポリペプチドは、以上に記載されるとおりの酵素である。
【0080】
本発明はさらに、中間産物、すなわち、翻訳リーディングフレーム内で第2のポリヌクレオチドに連結された第1のポリヌクレオチドによりコードされる対象ポリペプチドであって、前記第2のポリヌクレオチドが対象ポリペプチドをコードし、前記第1のポリヌクレオチドが本発明に係るシグナルペプチドをコードする、対象ポリペプチドに関する。対象ポリペプチドは、好ましくは本発明の第1の態様に記載される対象ポリペプチドである。
【0081】
好ましくは、シグナルペプチドは、
a)配列番号25、
b)少なくとも8アミノ酸が対応位置における配列番号25の最初の10アミノ酸と同じである、15〜23アミノ酸の配列番号25の変異体、
c)1位のアミノ酸がMetであり、且つ2位のアミノ酸がVal又はLysであり、及び10アミノ酸の連続ストレッチがAla又はLeuから選択される少なくとも5アミノ酸を含む、15〜23アミノ酸の配列番号25の変異体、
d)配列番号39、
e)少なくとも8アミノ酸が対応位置における配列番号39の最初の10アミノ酸と同じである、15〜23アミノ酸の配列番号39の変異体、
f)1位のアミノ酸がMetであり、且つ2位のアミノ酸がVal又はLysであり、及び10アミノ酸の連続ストレッチがAla又はLeuから選択される少なくとも5アミノ酸を含む、15〜23アミノ酸の配列番号39の変異体、
g)配列番号44、
h)少なくとも8アミノ酸が対応位置における配列番号44の最初の10アミノ酸と同じである、15〜23アミノ酸の配列番号44の変異体、
i)1位のアミノ酸がMetであり、且つ2位のアミノ酸がVal又はLysであり、及び10アミノ酸の連続ストレッチがAla又はLeuから選択される少なくとも5アミノ酸を含む、15〜23アミノ酸の配列番号44の変異体、
j)配列番号34、
k)少なくとも8アミノ酸が対応位置における配列番号34の最初の10アミノ酸と同じである、15〜23アミノ酸の配列番号34の変異体、
l)1位のアミノ酸がMetであり、且つ2位のアミノ酸がVal又はLysであり、及び10アミノ酸の連続ストレッチがAla又はLeuから選択される少なくとも5アミノ酸を含む、15〜23アミノ酸の配列番号34の変異体、
からなる群から選択されるものである。
【0082】
ある実施形態によれば、中間産物において、シグナルペプチドは配列番号25である。
【0083】
別の実施形態によれば、中間産物において、シグナルペプチドは、15〜23アミノ酸の配列番号25の変異体であって、少なくとも8アミノ酸が対応位置における配列番号25の最初の10アミノ酸と同じである変異体である。
【0084】
別の実施形態によれば、中間産物において、シグナルペプチドは、15〜23アミノ酸の配列番号25の変異体であって、1位のアミノ酸がMetであり、且つ2位のアミノ酸がVal又はLysであり、及び10アミノ酸の連続ストレッチがAla又はLeuから選択される少なくとも5アミノ酸を含む変異体である。
【0085】
別の実施形態によれば、中間産物において、シグナルペプチドは配列番号39である。
【0086】
別の実施形態によれば、中間産物において、シグナルペプチドは、15〜23アミノ酸の配列番号39の変異体であって、少なくとも8アミノ酸が対応位置における配列番号39の最初の10アミノ酸と同じである変異体である。
【0087】
別の実施形態によれば、中間産物において、シグナルペプチドは、15〜23アミノ酸の配列番号39の変異体であって、1位のアミノ酸がMetであり、且つ2位のアミノ酸がVal又はLysであり、及び10アミノ酸の連続ストレッチがAla又はLeuから選択される少なくとも5アミノ酸を含む変異体である。
【0088】
別の実施形態によれば、中間産物において、シグナルペプチドは配列番号44である。
【0089】
別の実施形態によれば、中間産物において、シグナルペプチドは、15〜23アミノ酸の配列番号44の変異体であって、少なくとも8アミノ酸が対応位置における配列番号44の最初の10アミノ酸と同じである変異体である。
【0090】
別の実施形態によれば、中間産物において、シグナルペプチドは、15〜23アミノ酸の配列番号44の変異体であって、1位のアミノ酸がMetであり、且つ2位のアミノ酸がVal又はLysであり、及び10アミノ酸の連続ストレッチがAla又はLeuから選択される少なくとも5アミノ酸を含む変異体である。
【0091】
別の実施形態によれば、中間産物において、シグナルペプチドは配列番号34である。
【0092】
別の実施形態によれば、中間産物において、シグナルペプチドは、15〜23アミノ酸の配列番号34の変異体であって、少なくとも8アミノ酸が対応位置における配列番号34の最初の10アミノ酸と同じである変異体である。
【0093】
別の実施形態によれば、中間産物において、シグナルペプチドは、15〜23アミノ酸の配列番号34の変異体であって、1位のアミノ酸がMetであり、且つ2位のアミノ酸がVal又はLysであり、及び10アミノ酸の連続ストレッチがAla又はLeuから選択される少なくとも5アミノ酸を含む変異体である。
【0094】
好ましくは、中間産物において、シグナルペプチドが
(a):配列番号25、
(b):少なくとも8アミノ酸が対応位置における配列番号25の最初の10アミノ酸と同じである、15〜23アミノ酸の配列番号25の変異体、又は
(c)1位のアミノ酸がMetであり、且つ2位のアミノ酸がVal又はLysであり、及び10アミノ酸の連続ストレッチがAla又はLeuから選択される少なくとも5アミノ酸を含む、15〜23アミノ酸の配列番号25の変異体、
であるとき、対象ポリペプチドはペクチンメチルエステラーゼではなく、より好ましくは、対象ポリペプチドはエルウィニア・クリサンテミ(Erwinia chrysanthemi)由来のペクチンメチルエステラーゼではない。より好ましくは、シグナルペプチドが(b)又は(c)であるとき、対象ポリペプチドはペクチンメチルエステラーゼではなく、さらにより好ましくは、対象ポリペプチドはエルウィニア・クリサンテミ(Erwinia chrysanthemi)由来のペクチンメチルエステラーゼではない。
【0095】
好ましくは、配列番号25をコードするときの第1のポリヌクレオチドは、配列番号29に係るポリヌクレオチドである。好ましくは、配列番号39をコードするときの第1のポリヌクレオチドは、配列番号38に係るポリヌクレオチドである。好ましくは、配列番号44をコードするときの第1のポリヌクレオチドは、配列番号43に係るポリヌクレオチドである。好ましくは、配列番号34をコードするときの第1のポリヌクレオチドは、配列番号33に係るポリヌクレオチドである。
【0096】
好ましくは、15〜23アミノ酸の配列番号25の変異体であって、少なくとも8アミノ酸が対応位置における配列番号25の最初の10アミノ酸と同じである変異体は、少なくとも9アミノ酸が対応位置における配列番号25の最初の10アミノ酸と同じである変異体である。より好ましくは、10アミノ酸が対応位置における配列番号25の最初の10アミノ酸と同じである。
【0097】
好ましくは、15〜23アミノ酸の配列番号25の変異体であって、1位のアミノ酸がMetであり、且つ2位のアミノ酸がVal又はLysであり、及び10アミノ酸の連続ストレッチがAla又はLeuから選択される少なくとも5アミノ酸を含む変異体は、
a)1位のアミノ酸がMetであり、2、3及び/又は4位のアミノ酸がVal又はLysであり、及び10アミノ酸の連続ストレッチがAla又はLeuから選択される少なくとも5アミノ酸を含む、15〜23アミノ酸の配列番号25の変異体、
b)1位のアミノ酸がMetであり、2位のアミノ酸がValであり、且つ3位のアミノ酸がLysであり、及び10アミノ酸の連続ストレッチがAla又はLeuから選択される少なくとも5アミノ酸を含む、15〜23アミノ酸の配列番号25の変異体、
c)1位のアミノ酸がMetであり、2、3及び/又は4位のアミノ酸がVal又はLysであり、及び10アミノ酸の連続ストレッチがAla又はLeuから選択される少なくとも5アミノ酸を含み、及び変異体の最後の3つの位置のアミノ酸がAla、Leu及びAlaである、15〜23アミノ酸の配列番号25の変異体、
d)1位のアミノ酸がMetであり、2位のアミノ酸がValであり、且つ3位のアミノ酸がLysであり、及び10アミノ酸の連続ストレッチがAla又はLeuから選択される少なくとも5アミノ酸を含み、及び変異体の最後の3つの位置のアミノ酸がAla、Leu及びAlaである、15〜23アミノ酸の配列番号25の変異体、
の群から選択されるものである。
【0098】
好ましくは、15〜23アミノ酸の配列番号39の変異体であって、少なくとも8アミノ酸が対応位置における配列番号39の最初の10アミノ酸と同じである変異体は、少なくとも9アミノ酸が対応位置における配列番号39の最初の10アミノ酸と同じである変異体である。より好ましくは、10アミノ酸が対応位置における配列番号39の最初の10アミノ酸と同じである。
【0099】
好ましくは、15〜23アミノ酸の配列番号39の変異体であって、1位のアミノ酸がMetであり、且つ2位のアミノ酸がVal又はLysであり、及び10アミノ酸の連続ストレッチがAla又はLeuから選択される少なくとも5アミノ酸を含む変異体は、
a)1位のアミノ酸がMetであり、2、3及び/又は5位のアミノ酸がVal又はLysであり、及び10アミノ酸の連続ストレッチがAla又はLeuから選択される少なくとも5アミノ酸を含む、15〜23アミノ酸の配列番号39の変異体、
b)1位のアミノ酸がMetであり、2位のアミノ酸がValであり、且つ5位のアミノ酸がLysであり、及び10アミノ酸の連続ストレッチがAla又はLeuから選択される少なくとも5アミノ酸を含む、15〜23アミノ酸の配列番号39の変異体、
の群から選択されるものである。
【0100】
好ましくは、15〜23アミノ酸の配列番号44の変異体であって、少なくとも8アミノ酸が対応位置における配列番号44の最初の10アミノ酸と同じである変異体は、少なくとも9アミノ酸が対応位置における配列番号44の最初の10アミノ酸と同じである変異体である。より好ましくは、10アミノ酸が対応位置における配列番号44の最初の10アミノ酸と同じである。
【0101】
好ましくは、15〜23アミノ酸の配列番号44の変異体であって、1位のアミノ酸がMetであり、且つ2位のアミノ酸がVal又はLysであり、及び10アミノ酸の連続ストレッチがAla又はLeuから選択される少なくとも5アミノ酸を含む変異体は、
a)1位のアミノ酸がMetであり、2、3及び/又は4位のアミノ酸がVal又はLysであり、及び10アミノ酸の連続ストレッチがAla又はLeuから選択される少なくとも5アミノ酸を含む、15〜23アミノ酸の配列番号44の変異体、
b)1位のアミノ酸がMetであり、2位のアミノ酸がValであり、且つ4位のアミノ酸がLysであり、及び10アミノ酸の連続ストレッチがAla又はLeuから選択される少なくとも5アミノ酸を含む、15〜23アミノ酸の配列番号44の変異体、
の群から選択されるものである。
【0102】
好ましくは、15〜23アミノ酸の配列番号34の変異体であって、少なくとも8アミノ酸が対応位置における配列番号34の最初の10アミノ酸と同じである変異体は、少なくとも9アミノ酸が対応位置における配列番号34の最初の10アミノ酸と同じである変異体である。より好ましくは、10アミノ酸が対応位置における配列番号34の最初の10アミノ酸と同じである。
【0103】
好ましくは、15〜23アミノ酸の配列番号34の変異体であって、1位のアミノ酸がMetであり、且つ2位のアミノ酸がVal又はLysであり、及び10アミノ酸の連続ストレッチがAla又はLeuから選択される少なくとも5アミノ酸を含む変異体は、
a)1位のアミノ酸がMetであり、2、3及び/又は4位のアミノ酸がLysであり、及び10アミノ酸の連続ストレッチがAla又はLeuから選択される少なくとも5アミノ酸を含む、15〜23アミノ酸の配列番号34の変異体、
b)1位のアミノ酸がMetであり、2位のアミノ酸がLysであり、且つ3及び/又は4位のアミノ酸がLysであり、及び10アミノ酸の連続ストレッチがAla又はLeuから選択される少なくとも5アミノ酸を含む、15〜23アミノ酸の配列番号34の変異体、
c)1位のアミノ酸がMetであり、2、3及び/又は4位のアミノ酸がLysであり、及び10アミノ酸の連続ストレッチがAla又はLeuから選択される少なくとも5アミノ酸を含み、及び変異体の最後の3つの位置のアミノ酸がAla、Leu及びAlaである、15〜23アミノ酸の配列番号34の変異体、
d)1位のアミノ酸がMetであり、2位のアミノ酸がLysであり、且つ3及び/又は4位のアミノ酸がLysであり、及び10アミノ酸の連続ストレッチがAla又はLeuから選択される少なくとも5アミノ酸を含み、及び変異体の最後の3つの位置のアミノ酸がAla、Leu及びAlaである、15〜23アミノ酸の配列番号34の変異体、
e)1位のアミノ酸がMetであり、2位のアミノ酸がValであり、及び10アミノ酸の連続ストレッチがAla又はLeuから選択される少なくとも5アミノ酸を含む、15〜23アミノ酸の配列番号34の変異体、
f)1位のアミノ酸がMetであり、2位のアミノ酸がValであり、及び10アミノ酸の連続ストレッチがAla又はLeuから選択される少なくとも5アミノ酸を含み、及び変異体の最後の3つの位置のアミノ酸がAla、Leu及びAlaである、15〜23アミノ酸の配列番号34の変異体、
g)1位のアミノ酸がMetであり、2位のアミノ酸がValであり、及び10アミノ酸の連続ストレッチがAla又はLeuから選択される少なくとも5アミノ酸を含み、及び変異体の最後の3つの位置におけるアミノ酸がAla、Leu、Alaである、15〜23アミノ酸の配列番号34の変異体、
h)1位のアミノ酸がMetであり、2位のアミノ酸がValであり、及び10アミノ酸の連続ストレッチが少なくとも5個のAlaを含む、15〜23アミノ酸の配列番号34の変異体、
i)1位のアミノ酸がMetであり、2位のアミノ酸がValであり、及び10アミノ酸の連続ストレッチが少なくとも4個のAlaと1個のLeuとを含む、15〜23アミノ酸の配列番号34の変異体、
j)1位のアミノ酸がMetであり、2位のアミノ酸がValであり、及び10アミノ酸の連続ストレッチが少なくとも3個のAlaと2個のLeuとを含む、15〜23アミノ酸の配列番号34の変異体、
k)1位のアミノ酸がMetであり、2位のアミノ酸がValであり、及び10アミノ酸の連続ストレッチが少なくとも2個のAlaと3個のLeuとを含む、15〜23アミノ酸の配列番号34の変異体、
l)1位のアミノ酸がMetであり、2位のアミノ酸がValであり、及び10アミノ酸の連続ストレッチが少なくとも1個のAlaと4個のLeuとを含む、15〜23アミノ酸の配列番号34の変異体、
m)1位のアミノ酸がMetであり、2位のアミノ酸がValであり、及び10アミノ酸の連続ストレッチが少なくとも5個のLeuを含む、15〜23アミノ酸の配列番号34の変異体、
n)1位のアミノ酸がMetであり、2位のアミノ酸がLysであり、及び10アミノ酸の連続ストレッチがAla又はLeuから選択される少なくとも5アミノ酸を含む、15〜23アミノ酸の配列番号34の変異体、
o)1位のアミノ酸がMetであり、2位のアミノ酸がLysであり、及び10アミノ酸の連続ストレッチがAla又はLeuから選択される少なくとも5アミノ酸を含み、及び変異体の最後の3つの位置におけるアミノ酸がAla、Leu、Alaである、15〜23アミノ酸の配列番号34の変異体、
p)1位のアミノ酸がMetであり、2位のアミノ酸がLysであり、及び10アミノ酸の連続ストレッチが少なくとも5個のAlaを含む、15〜23アミノ酸の配列番号34の変異体、
q)1位のアミノ酸がMetであり、2位のアミノ酸がLysであり、及び10アミノ酸の連続ストレッチが少なくとも4個のAlaと1個のLeuとを含む、15〜23アミノ酸の配列番号34の変異体、
r)1位のアミノ酸がMetであり、2位のアミノ酸がLysであり、及び10アミノ酸の連続ストレッチが少なくとも3個のAlaと2個のLeuとを含む、15〜23アミノ酸の配列番号34の変異体、
s)1位のアミノ酸がMetであり、2位のアミノ酸がLysであり、及び10アミノ酸の連続ストレッチが少なくとも2個のAlaと3個のLeuとを含む、15〜23アミノ酸の配列番号34の変異体、
t)1位のアミノ酸がMetであり、2位のアミノ酸がLysであり、及び10アミノ酸の連続ストレッチが少なくとも1個のAlaと4個のLeuとを含む、15〜23アミノ酸の配列番号34の変異体、
u)1位のアミノ酸がMetであり、2位のアミノ酸がLysであり、及び10アミノ酸の連続ストレッチが少なくとも5個のLeuを含む、15〜23アミノ酸の配列番号34の変異体、
の群から選択されるものである。
【0104】
以上の配列番号25の(a)〜(d)、配列番号39の(a)及び(b)、配列番号44の(a)及び(b)並びに配列番号34の(a)〜(u)の変異体において、連続ストレッチは、好ましくは10アミノ酸、より好ましくは9アミノ酸、さらにより好ましくは8アミノ酸、及び最も好ましくは7アミノ酸である。
【0105】
以上の配列番号25の(a)〜(d)、配列番号39の(a)及び(b)、配列番号44の(a)及び(b)並びに配列番号34の(a)〜(u)の変異体において、アミノ酸の連続ストレッチは、好ましくはAla又はLeuから選択される少なくとも5アミノ酸、より好ましくはAla又はLeuから選択される少なくとも6アミノ酸、及び最も好ましくはAla又はLeuから選択される少なくとも7アミノ酸を含む。
【0106】
15〜23アミノ酸の配列番号25、配列番号39、配列番号44、又は配列番号34の変異体は、15アミノ酸、16アミノ酸、17アミノ酸、18アミノ酸、19アミノ酸、20アミノ酸、21アミノ酸、22アミノ酸又は23アミノ酸を含んでもよい。
【0107】
第3の態様において、本発明は、翻訳リーディングフレーム内で第2のポリヌクレオチドに連結された第1のポリヌクレオチドを含む組換え発現コンストラクトであって、前記第2のポリヌクレオチドが対象ポリペプチドをコードし、前記第1のポリヌクレオチドが本発明に係るシグナルペプチドをコードする、発現コンストラクトに関する。対象ポリペプチドは、好ましくは本発明の第1の態様に記載される対象ポリペプチドである。好ましくは、シグナルペプチドが、
(a):配列番号25、
(b):少なくとも8アミノ酸が対応位置における配列番号25の最初の10アミノ酸と同じである、15〜23アミノ酸の配列番号25の変異体、又は
(c)1位のアミノ酸がMetであり、且つ2位のアミノ酸がVal又はLysであり、及び10アミノ酸の連続ストレッチがAla又はLeuから選択される少なくとも5アミノ酸を含む、15〜23アミノ酸の配列番号25の変異体、
であるとき、対象ポリペプチドはペクチンメチルエステラーゼではなく、より好ましくは、対象ポリペプチドはエルウィニア・クリサンテミ(Erwinia chrysanthemi)由来のペクチンメチルエステラーゼではない。より好ましくは、シグナルペプチドが(b)又は(c)であるとき、対象ポリペプチドはペクチンメチルエステラーゼではなく、さらにより好ましくは、対象ポリペプチドはエルウィニア・クリサンテミ(Erwinia chrysanthemi)由来のペクチンメチルエステラーゼではない。
【0108】
好ましくは、配列番号25をコードするときの第1のポリヌクレオチドは、配列番号29に係るポリヌクレオチドである。好ましくは、配列番号39をコードするときの第1のポリヌクレオチドは、配列番号38に係るポリヌクレオチドである。好ましくは、配列番号44をコードするときの第1のポリヌクレオチドは、配列番号43に係るポリヌクレオチドである。好ましくは、配列番号34をコードするときの第1のポリヌクレオチドは、配列番号33に係るポリヌクレオチドである。
【0109】
本発明はさらに、翻訳リーディングフレーム内で第2のポリヌクレオチドに連結された第1のポリヌクレオチドに作動可能に連結されたプロモーターをさらに含む前記組換え発現コンストラクトであって、前記第2のポリヌクレオチドが対象ポリペプチドをコードし、前記第1のポリヌクレオチドが本発明に係るシグナルペプチドをコードする、発現コンストラクトに関する。対象ポリペプチドは、好ましくは本発明の第1の態様に記載される対象ポリペプチドである。
【0110】
本発明はさらに、以上に記載される発現コンストラクトを含む組換え発現ベクターに関する。
【0111】
用語「核酸コンストラクト」は、本明細書では、一本鎖又は二本鎖のいずれかの核酸分子を指し、これは、天然に存在する遺伝子から単離されるか、又は別の場合であれば天然には存在しないであろう形で組み合わされて並ぶ核酸のセグメントを含むように修飾されている。用語の核酸コンストラクトは、核酸コンストラクトがコード配列の発現に必要な全ての制御配列を含むとき用語「発現カセット」と同義語であり、ここで前記制御配列は前記コード配列に作動可能に連結される。
【0112】
用語「制御配列」は、本明細書では、インビトロ又は宿主細胞中のいずれかでのmRNA及び/又はポリペプチドの発現に必要又は有利なあらゆる構成要素を含むように定義される。各制御配列は、ポリペプチドをコードする核酸配列にとって天然であっても、又は外来性であってもよい。かかる制御配列としては、限定はされないが、シャイン−ダルガノ配列、最適翻訳開始配列(Kozak、1991年、J.Biol.Chem.266:19867〜19870頁に記載されるとおり)、ポリアデニル化配列、プロモーター、及び転写ターミネーターが挙げられる。最小限として、制御配列は、プロモーター、並びに転写及び翻訳停止シグナルを含む。制御配列は、その特定の目的に対して最適化されてもよい。好ましくは、DNAコンストラクトは、プロモーターDNA配列、前記プロモーターDNA配列及び制御配列と作動可能に連係したコード配列、例えば:
− 以下の配列リストから選択される5’から3’方向に向く一つの翻訳終結配列:TAAG、TAGA及びTAAA、好ましくはTAAA、及び/又は
− 以下の配列リストから選択される5’から3’方向に向く一つの翻訳開始コード配列:GCTACCCCC;GCTACCTCC;GCTACCCTC;GCTACCTTC;GCTCCCCCC;GCTCCCTCC;GCTCCCCTC;GCTCCCTTC;GCTGCCCCC;GCTGCCTCC;GCTGCCCTC;GCTGCCTTC;GCTTCCCCC;GCTTCCTCC;GCTTCCCTC;及びGCTTCCTTC、好ましくはGCT TCC TTC、及び/又は
− 以下の配列リストから選択される一つの翻訳イニシエーター配列:5’−mwChkyCAAA−3’;5’−mwChkyCACA−3’又は5’−mwChkyCAAG−3’、ヌクレオチドにアンビギュイティーコード:m(A/C);w(A/T);y(C/T);k(G/T);h(A/C/T)を使用、好ましくは5’−CACCGTCAAA−3’又は5’−CGCAGTCAAG−3’
を含む。
【0113】
本発明との関連において、用語「翻訳イニシエーターコード配列」は、DNAコード配列のオープンリーディングフレームのイニシエーター又は開始コドンの直ちに下流にある9個のヌクレオチドとして定義される。イニシエーター又は開始コドンはAAメチオニンをコードする。イニシエーターコドンは典型的にはATGであるが、GTGなどの任意の機能的な開始コドンであってもよい。
【0114】
本発明との関連において、用語「翻訳終結配列」は、オープンリーディングフレーム又はヌクレオチドコード配列の3’末端の翻訳終止コドンを始端として5’から3’方向に向く4個のヌクレオチドとして定義される。
【0115】
本発明との関連において、用語「翻訳イニシエーター配列」は、ポリペプチドをコードするDNA配列のオープンリーディングフレームのイニシエーター又は開始コドンの直ちに上流にある10個のヌクレオチドとして定義される。イニシエーター又は開始コドンはAAメチオニンをコードする。イニシエーターコドンは典型的にはATGであるが、GTGなどの任意の機能的な開始コドンであってもよい。RNAにおいてウラシルUがデオキシヌクレオチドチミンTに代わることは当該技術分野において公知である。
【0116】
制御配列は、ポリペプチドをコードする核酸配列のコード領域との制御配列のライゲーションを促進する特定の制限部位の導入を目的として、リンカーを備えてもよい。制御配列は、適切なプロモーター配列、すなわち核酸配列の発現が宿主細胞によって認識される核酸配列であってもよい。プロモーター配列は転写制御配列を含み、それがポリペプチドの発現を媒介する。プロモーターは、突然変異体プロモーター、トランケート型プロモーター、及びハイブリッドプロモーターを含め、細胞中で転写活性を示す任意の核酸配列であってよく、細胞と同種又は異種の細胞外又は細胞内ポリペプチドをコードする遺伝子から得ることができる。
【0117】
制御配列はまた、好適な転写ターミネーター配列、すなわち糸状菌細胞によって転写の終結が認識される配列であってもよい。転写ターミネーター配列は、ポリペプチドをコードする核酸配列の3’末端に作動可能に連結される。本発明では、細胞内で機能する任意のターミネーターを使用することができる。
【0118】
糸状菌細胞に好ましいターミネーターは、A.オリゼ(A.oryzae)タカアミラーゼ、A.ニガー(A.niger)グルコアミラーゼ(glaA)、A.ニデュランス(A.nidulans)アントラニル酸シンターゼ、A.ニガー(A.niger)α−グルコシダーゼ、trpC遺伝子及びフザリウム・オキシスポラム(Fusarium oxysporum)トリプシン様プロテアーゼをコードする遺伝子から得られる。
【0119】
制御配列はまた、ポリアデニル化配列、すなわち核酸配列の3’末端に作動可能に連結され、且つ転写されると、転写mRNAにポリアデノシン残基を付加するシグナルとして糸状菌細胞により認識される配列であってもよい。本発明では、細胞内で機能する任意のポリアデニル化配列を使用することができる。
【0120】
糸状菌細胞に好ましいポリアデニル化配列は、A.オリゼ(A.oryzae)タカアミラーゼ、A.ニガー(A.niger)グルコアミラーゼ、A.ニデュランス(A.nidulans)アントラニル酸シンターゼ、フザリウム・オキシスポラム(Fusarium oxysporum)トリプシン様プロテアーゼ及びA.ニガー(A.niger)α−グルコシダーゼをコードする遺伝子から得られる。
【0121】
用語「プロモーター」は、本明細書では、RNAポリメラーゼを結合し、且つ生物学的化合物をコードする核酸配列の正しい下流の転写開始部位へとポリメラーゼを誘導して転写を開始させるDNA配列として定義される。RNAポリメラーゼは、コード領域の適切なDNA鎖と相補的なメッセンジャーRNAの構築を有効に触媒する。用語「プロモーター」はまた、mRNAに転写された後の翻訳のための5’−非コード領域(プロモーターと翻訳開始点の間)、エンハンサーなどのシス作用転写制御エレメント、及び転写因子と相互作用することが可能な他のヌクレオチド配列を含むようにも理解され得る。プロモーターは、突然変異プロモーター、トランケート型プロモーター、及びハイブリッドプロモーターを含め、真核又は原核宿主細胞に好適な、転写活性を示す任意の適切なプロモーター配列であってもよく、細胞と同種(天然)又は異種(外来性)のいずれかである細胞外又は細胞内ポリペプチドをコードする遺伝子から得てもよい。プロモーターは、構成的又は誘導性プロモーターであってもよい。使用することのできる誘導性プロモーターの例は、デンプン誘導性、銅誘導性、オレイン酸誘導性プロモーターである。プロモーターは、限定はされないが、A.オリゼ(A.oryzae)タカアミラーゼ、リゾムコール・ミエヘイ(Rhizomucor miehei)アスパラギン酸プロテイナーゼ、A.ニガー(A.niger)中性α−アミラーゼ、A.ニガー(A.niger)酸安定性α−アミラーゼ、A.ニガー(A.niger)又はA.アワモリ(A.awamori)グルコアミラーゼ(glaA)、R.ミエヘイ(R.miehei)リパーゼ、A.オリゼ(A.oryzae)アルカリプロテアーゼ、A.オリゼ(A.oryzae)トリオースリン酸イソメラーゼ、A.ニデュランス(A.nidulans)アセトアミダーゼをコードする遺伝子から得られるプロモーター、NA2−tpiプロモーター(A.ニガー(A.niger)中性α−アミラーゼ及びA.オリゼ(A.oryzae)トリオースリン酸イソメラーゼをコードする遺伝子由来のプロモーターのハイブリッド)、及びそれらの突然変異プロモーター、トランケート型プロモーター、及びハイブリッドプロモーターを含む群から選択されてもよい。糸状菌細胞における使用に特に好ましいプロモーターは、プロテアーゼ遺伝子由来;例えば、F.オキシスポラム(F.oxysporum)トリプシン様プロテアーゼ遺伝子(米国特許第4,288,627号明細書)、A.オリゼ(A.oryzae)アルカリプロテアーゼ遺伝子(alp)、A.ニガー(A.niger)pacA遺伝子、A.オリゼ(A.oryzae)アルカリプロテアーゼ遺伝子、A.オリゼ(A.oryzae)中性メタロプロテアーゼ遺伝子、A.ニガー(A.niger)アスペルギロペプシンプロテアーゼpepA遺伝子、又はF.ベネナツム(F.venenatum)トリプシン遺伝子、A.ニガー(A.niger)アスパラギン酸プロテアーゼpepB遺伝子由来のプロモーター、又はその機能部分である。他の好ましいプロモーターは、参照により本明細書に援用される国際公開第2006/092396号パンフレット及び国際公開第2005/100573号パンフレットに記載されるプロモーターである。
【0122】
対象組換えポリペプチドが、2個以上のポリペプチド(の部分)からなるキメラポリペプチドであるとき、当業者には、当該技術分野において公知の方法を用いてそれらの及び他のキメラポリヌクレオチドコンストラクトを構築する方法は周知である。
【0123】
発現及び/又は翻訳を促進するため、本発明に係るポリヌクレオチド又は核酸コンストラクトは、本発明のポリヌクレオチドがインビトロでの、又は原核若しくは真核宿主細胞中での発現及び/又は翻訳に適切な制御配列に作動可能に連結されるように発現ベクター中に含まれてもよい。
【0124】
組換え発現ベクターは、好都合に組換えDNA手順に供することができ、且つポリペプチドをコードする核酸配列の発現をもたらすことのできる任意のベクター(例えば、プラスミド又はウイルス)であってもよい。ベクターの選択は、典型的にはベクターを導入する宿主細胞とのベクターの適合性に依存し得る。ベクターは直鎖状プラスミドであっても、又は閉環状プラスミドであってもよい。ベクターは自己複製ベクター、すなわち染色体外エンティティとして存在し、その複製が染色体の複製とは独立しているベクター、例えば、プラスミド、染色体外エレメント、ミニ染色体、又は人工染色体であってもよい。自己維持されるクローニングベクターは、AMA1配列を含み得る(例えばAleksenko及びClutterbuck(1997年)、Fungal Genet.Biol.21:373〜397頁を参照のこと)。
【0125】
或いは、ベクターは、宿主細胞に導入されるとゲノムに組み込まれ、それが組み込まれた1つ又は複数の染色体と共に複製されるものであってもよい。組込みクローニングベクターは、宿主細胞の染色体においてランダムに、又は所定の標的遺伝子座に組み込まれ得る。本発明の好ましい実施形態において、組込みクローニングベクターは、所定の遺伝子座へのクローニングベクターの組込みが標的化されるよう宿主細胞のゲノム内の所定の標的遺伝子座にDNA配列と相同なDNA断片を含む。標的組込みを促進するため、クローニングベクターは好ましくは細胞の形質転換前に直鎖化される。直鎖化は、好ましくは、クローニングベクターの少なくとも一方、但し好ましくは両側に標的遺伝子座と相同な配列が隣接するように実施される。標的遺伝子座が隣接する相同配列の長さは、好ましくは少なくとも30bp、好ましくは少なくとも50bp、好ましくは少なくとも0.1kb、さらに好ましくは少なくとも0.2kb、より好ましくは少なくとも0.5kb、さらにより好ましくは少なくとも1kb、最も好ましくは少なくとも2kbである。好ましくは、宿主細胞のゲノムへの標的組込み、すなわち所定の標的遺伝子座における組込みの効率は、宿主細胞の相同組換え能力を増強することにより高められる。細胞のかかる表現型には、好ましくは、国際公開第2005/095624号パンフレットに記載されるとおりの欠損したku70遺伝子が関与する。国際公開第2005/095624号パンフレットは、高効率の標的組込みを含む糸状菌細胞を得るための好ましい方法を開示している。好ましくは、標的遺伝子座と相同なクローニングベクター中の相同フランキングDNA配列は、高度に発現する遺伝子座から誘導され、これは、配列が宿主細胞中での高発現レベルが可能な遺伝子から誘導されることを意味する。高発現レベルが可能な遺伝子、すなわち高度に発現する遺伝子は、本明細書では、例えば誘導条件下でそのmRNAが全細胞mRNAの少なくとも0.5%(w/w)を構成し得る遺伝子か、或いは、その遺伝子産物が全細胞タンパク質の少なくとも1%(w/w)を構成できるか、若しくは分泌遺伝子産物の場合、少なくとも0.1g/lのレベルまで分泌される可能性のある遺伝子として定義される(欧州特許第357 127 B1号明細書に記載されるとおり)。いくつもの好ましい高度に発現する真菌遺伝子が、例として挙げられる:アスペルギルス属(Aspergillus)又はトリコデルマ属(Trichoderma)由来のアミラーゼ、グルコアミラーゼ、アルコールデヒドロゲナーゼ、キシラナーゼ、グリセルアルデヒドリン酸デヒドロゲナーゼ又はセロビオヒドロラーゼ(cbh)遺伝子。こうした目的に最も好ましい高度に発現する遺伝子は、グルコアミラーゼ遺伝子、好ましくはA.ニガー(A.niger)グルコアミラーゼ遺伝子、A.オリゼ(A.oryzae)タカアミラーゼ遺伝子、A.ニデュランス(A.nidulans)gpdA遺伝子、トリコデルマ・リーゼイ(Trichoderma reesei)cbh遺伝子、好ましくはcbh1である。
【0126】
遺伝子産物の産生を増加させるため、1個より多い核酸配列コピーが細胞に挿入されてもよい。これは、好ましくはDNA配列のそのゲノムコピーへの組込みにより、より好ましくは前段落に定義した高度に発現する遺伝子座の1つにおけるDNA配列の組込みを標的化することにより行われ得る。或いは、これは、核酸配列と共に増幅可能な選択可能マーカー遺伝子を含めることにより行うことができ、ここでは選択可能マーカー遺伝子の増幅されたコピー、従って核酸配列のさらなるコピーを含む細胞を、適切な選択可能薬剤の存在下で細胞を培養することにより選択することができる。DNA配列のコピー数をさらに増加させて過剰発現させるには、国際公開第98/46772号パンフレットに記載されるとおりの遺伝子変換の技法を用いることができる。
【0127】
ベクター系は、単一のベクター若しくはプラスミド、又は宿主細胞のゲノムに導入される全DNAを一体として含む2個以上のベクター若しくはプラスミド、又はトランスポゾンであってもよい。
【0128】
ベクターは、好ましくは1つ又は複数の選択可能マーカーを含み、それにより形質転換細胞の容易な選択が可能となる。選択可能マーカーは、産物が殺生物剤又はウイルス耐性、重金属耐性、栄養要求体に対して原栄養性などを提供する遺伝子である。糸状菌細胞において使用される選択可能マーカーは、限定はされないが、amdS(アセトアミダーゼ)、argB(オルニチンカルバモイルトランスフェラーゼ)、bar(ホスフィノトリシンアセチルトランスフェラーゼ)、bleA(フレオマイシン結合)、hygB(ハイグロマイシンホスホトランスフェラーゼ)、niaD(硝酸レダクターゼ)、pyrG(オロチジン−5’リン酸デカルボキシラーゼ)、sC(硫酸アデニルトランスフェラーゼ)、及びtrpC(アントラニル酸シンターゼ)、並びに他の種由来の均等物を含む群から選択されてもよい。アスペルギルス属(Aspergillus)及びペニシリウム属(Penicillium)細胞における使用においては、A.ニデュランス(A.nidulans)又はA.オリゼ(A.oryzae)のamdS(欧州特許第635574 B1号明細書、国際公開第97/06261号パンフレット)及びpyrG遺伝子及びストレプトマイセス・ハイグロスコピカス(Streptomyces hygroscopicus)のbar遺伝子が好ましい。より好ましくは、amdS遺伝子が使用され、さらにより好ましくはA.ニデュランス(A.nidulans)又はA.ニガー(A.niger)由来のamdS遺伝子が使用される。最も好ましい選択マーカー遺伝子は、A.ニデュランス(A.nidulans)gpdAプロモーターに融合したA.ニデュランス(A.nidulans)amdSコード配列である(欧州特許第635574 B1号明細書を参照のこと)。他の好ましいAmdSマーカーは、国際公開第2006/040358号パンフレットに記載されるものである。他の糸状菌由来のAmdS遺伝子もまた使用することができる(国際公開第97/06261号パンフレット)。
【0129】
上記に記載されるエレメントをライゲートして本発明の組換え発現ベクターを構築するために用いられる手順は、当業者に公知である(例えばSambrook及びRussell、上記を参照のこと)。
【0130】
第4の態様において、本発明は、本発明の第3の態様に係る発現コンストラクトを含むか、又は本発明の第3の態様に係る発現ベクターを含む組換え糸状菌宿主細胞に関する。前記糸状菌宿主細胞は、好ましくは本明細書において先述したとおりの細胞である。前記糸状菌宿主細胞は、当該技術分野において公知の方法を用いて構築することができる。好ましくは、前記糸状菌宿主細胞は、
− 好適な糸状菌宿主細胞を提供するステップと、
− 本発明の第3の態様に係る発現コンストラクトにより、又は本発明の第3の態様に係る発現ベクターにより、前記宿主細胞を形質転換するステップと、
を含む方法により構築される。
【0131】
糸状菌宿主細胞の形質転換は、好ましくは本明細書において先述したとおり実施される。
【0132】
第5の態様において、本発明は、対象組換えポリペプチドを産生するための本発明に係るシグナルペプチドの使用に関する。
【0133】
従って、シグナルペプチドは、好ましくは
a)配列番号25、
b)少なくとも8アミノ酸が対応位置における配列番号25の最初の10アミノ酸と同じである、15〜23アミノ酸の配列番号25の変異体、
c)1位のアミノ酸がMetであり、且つ2位のアミノ酸がVal又はLysであり、及び10アミノ酸の連続ストレッチがAla又はLeuから選択される少なくとも5アミノ酸を含む、15〜23アミノ酸の配列番号25の変異体、
d)配列番号39、
e)少なくとも8アミノ酸が対応位置における配列番号39の最初の10アミノ酸と同じである、15〜23アミノ酸の配列番号39の変異体、
f)1位のアミノ酸がMetであり、且つ2位のアミノ酸がVal又はLysであり、及び10アミノ酸の連続ストレッチがAla又はLeuから選択される少なくとも5アミノ酸を含む、15〜23アミノ酸の配列番号39の変異体、
g)配列番号44、
h)少なくとも8アミノ酸が対応位置における配列番号44の最初の10アミノ酸と同じである、15〜23アミノ酸の配列番号44の変異体、
i)1位のアミノ酸がMetであり、且つ2位のアミノ酸がVal又はLysであり、及び10アミノ酸の連続ストレッチがAla又はLeuから選択される少なくとも5アミノ酸を含む、15〜23アミノ酸の配列番号44の変異体、
j)配列番号34、
k)少なくとも8アミノ酸が対応位置における配列番号34の最初の10アミノ酸と同じである、15〜23アミノ酸の配列番号34の変異体、
l)1位のアミノ酸がMetであり、且つ2位のアミノ酸がVal又はLysであり、及び10アミノ酸の連続ストレッチがAla又はLeuから選択される少なくとも5アミノ酸を含む、15〜23アミノ酸の配列番号34の変異体、
からなる群から選択される。
【0134】
ある実施形態によれば、シグナルペプチドは配列番号25である。
【0135】
別の実施形態によれば、中間産物において、シグナルペプチドは、15〜23アミノ酸の配列番号25の変異体であって、少なくとも8アミノ酸が対応位置における配列番号25の最初の10アミノ酸と同じである変異体である。
【0136】
別の実施形態によれば、シグナルペプチドは、15〜23アミノ酸の配列番号25の変異体であって、1位のアミノ酸がMetであり、且つ2位のアミノ酸がVal又はLysであり、及び10アミノ酸の連続ストレッチがAla又はLeuから選択される少なくとも5アミノ酸を含む変異体である。
【0137】
別の実施形態によれば、シグナルペプチドは配列番号39である。
【0138】
別の実施形態によれば、シグナルペプチドは、15〜23アミノ酸の配列番号39の変異体であって、少なくとも8アミノ酸が対応位置における配列番号39の最初の10アミノ酸と同じである変異体である。
【0139】
別の実施形態によれば、シグナルペプチドは、15〜23アミノ酸の配列番号39の変異体であって、1位のアミノ酸がMetであり、且つ2位のアミノ酸がVal又はLysであり、及び10アミノ酸の連続ストレッチがAla又はLeuから選択される少なくとも5アミノ酸を含む変異体である。
【0140】
別の実施形態によれば、シグナルペプチドは配列番号44である。
【0141】
別の実施形態によれば、シグナルペプチドは、15〜23アミノ酸の配列番号44の変異体であって、少なくとも8アミノ酸が対応位置における配列番号44の最初の10アミノ酸と同じである変異体である。
【0142】
別の実施形態によれば、シグナルペプチドは、15〜23アミノ酸の配列番号44の変異体であって、1位のアミノ酸がMetであり、且つ2位のアミノ酸がVal又はLysであり、及び10アミノ酸の連続ストレッチがAla又はLeuから選択される少なくとも5アミノ酸を含む変異体である。
【0143】
別の実施形態によれば、シグナルペプチドは配列番号34である。
【0144】
別の実施形態によれば、シグナルペプチドは、15〜23アミノ酸の配列番号34の変異体であって、少なくとも8アミノ酸が対応位置における配列番号34の最初の10アミノ酸と同じである変異体である。
【0145】
別の実施形態によれば、シグナルペプチドは、15〜23アミノ酸の配列番号34の変異体であって、1位のアミノ酸がMetであり、且つ2位のアミノ酸がVal又はLysであり、及び10アミノ酸の連続ストレッチがAla又はLeuから選択される少なくとも5アミノ酸を含む変異体である。
【0146】
好ましくは、シグナルペプチドが
(a):配列番号25、
(b):少なくとも8アミノ酸が対応位置における配列番号25の最初の10アミノ酸と同じである、15〜23アミノ酸の配列番号25の変異体、又は
(c)1位のアミノ酸がMetであり、且つ2位のアミノ酸がVal又はLysであり、及び10アミノ酸の連続ストレッチがAla又はLeuから選択される少なくとも5アミノ酸を含む、15〜23アミノ酸の配列番号25の変異体、
であるとき、対象ポリペプチドはペクチンメチルエステラーゼではなく、より好ましくは、対象ポリペプチドはエルウィニア・クリサンテミ(Erwinia chrysanthemi)由来のペクチンメチルエステラーゼではない。より好ましくは、シグナルペプチドが(b)又は(c)であるとき、対象ポリペプチドはペクチンメチルエステラーゼではなく、さらにより好ましくは、対象ポリペプチドはエルウィニア・クリサンテミ(Erwinia chrysanthemi)由来のペクチンメチルエステラーゼではない。
【0147】
好ましくは、15〜23アミノ酸の配列番号25の変異体であって、少なくとも8アミノ酸が対応位置における配列番号25の最初の10アミノ酸と同じである変異体は、少なくとも9アミノ酸が対応位置における配列番号25の最初の10アミノ酸と同じである変異体である。より好ましくは、10アミノ酸が対応位置における配列番号25の最初の10アミノ酸と同じである。
【0148】
好ましくは、15〜23アミノ酸の配列番号25の変異体であって、1位のアミノ酸がMetであり、且つ2位のアミノ酸がVal又はLysであり、及び10アミノ酸の連続ストレッチがAla又はLeuから選択される少なくとも5アミノ酸を含む変異体は、
a)1位のアミノ酸がMetであり、2、3及び/又は4位のアミノ酸がVal又はLysであり、及び10アミノ酸の連続ストレッチがAla又はLeuから選択される少なくとも5アミノ酸を含む、15〜23アミノ酸の配列番号25の変異体、
b)1位のアミノ酸がMetであり、2位のアミノ酸がValであり、且つ3位のアミノ酸がLysであり、及び10アミノ酸の連続ストレッチがAla又はLeuから選択される少なくとも5アミノ酸を含む、15〜23アミノ酸の配列番号25の変異体、
c)1位のアミノ酸がMetであり、2、3及び/又は4位のアミノ酸がVal又はLysであり、及び10アミノ酸の連続ストレッチがAla又はLeuから選択される少なくとも5アミノ酸を含み、及び変異体の最後の3つの位置のアミノ酸がAla、Leu及びAlaである、15〜23アミノ酸の配列番号25の変異体、
d)1位のアミノ酸がMetであり、2位のアミノ酸がValであり、且つ3位のアミノ酸がLysであり、及び10アミノ酸の連続ストレッチがAla又はLeuから選択される少なくとも5アミノ酸を含み、及び変異体の最後の3つの位置のアミノ酸がAla、Leu及びAlaである、15〜23アミノ酸の配列番号25の変異体、
の群から選択されるものである。
【0149】
好ましくは、15〜23アミノ酸の配列番号39の変異体であって、少なくとも8アミノ酸が対応位置における配列番号39の最初の10アミノ酸と同じである変異体は、少なくとも9アミノ酸が対応位置における配列番号39の最初の10アミノ酸と同じである変異体である。より好ましくは、10アミノ酸が対応位置における配列番号39の最初の10アミノ酸と同じである。
【0150】
好ましくは、15〜23アミノ酸の配列番号39の変異体であって、1位のアミノ酸がMetであり、且つ2位のアミノ酸がVal又はLysであり、及び10アミノ酸の連続ストレッチがAla又はLeuから選択される少なくとも5アミノ酸を含む変異体は、
a)1位のアミノ酸がMetであり、2、3及び/又は5位のアミノ酸がVal又はLysであり、及び10アミノ酸の連続ストレッチがAla又はLeuから選択される少なくとも5アミノ酸を含む、15〜23アミノ酸の配列番号39の変異体、
b)1位のアミノ酸がMetであり、2位のアミノ酸がValであり、且つ5位のアミノ酸がLysであり、及び10アミノ酸の連続ストレッチがAla又はLeuから選択される少なくとも5アミノ酸を含む、15〜23アミノ酸の配列番号39の変異体、
の群から選択されるものである。
【0151】
好ましくは、15〜23アミノ酸の配列番号44の変異体であって、少なくとも8アミノ酸が対応位置における配列番号44の最初の10アミノ酸と同じである変異体は、少なくとも9アミノ酸が対応位置における配列番号44の最初の10アミノ酸と同じである変異体である。より好ましくは、10アミノ酸が対応位置における配列番号44の最初の10アミノ酸と同じである。
【0152】
好ましくは、15〜23アミノ酸の配列番号44の変異体であって、1位のアミノ酸がMetであり、且つ2位のアミノ酸がVal又はLysであり、及び10アミノ酸の連続ストレッチがAla又はLeuから選択される少なくとも5アミノ酸を含む変異体は、
a)1位のアミノ酸がMetであり、2、3及び/又は4位のアミノ酸がVal又はLysであり、及び10アミノ酸の連続ストレッチがAla又はLeuから選択される少なくとも5アミノ酸を含む、15〜23アミノ酸の配列番号44の変異体、
b)1位のアミノ酸がMetであり、2位のアミノ酸がValであり、且つ4位のアミノ酸がLysであり、及び10アミノ酸の連続ストレッチがAla又はLeuから選択される少なくとも5アミノ酸を含む、15〜23アミノ酸の配列番号44の変異体、
の群から選択されるものである。
【0153】
好ましくは、15〜23アミノ酸の配列番号34の変異体であって、少なくとも8アミノ酸が対応位置における配列番号34の最初の10アミノ酸と同じである変異体は、少なくとも9アミノ酸が対応位置における配列番号34の最初の10アミノ酸と同じである変異体である。より好ましくは、10アミノ酸が対応位置における配列番号34の最初の10アミノ酸と同じである。
【0154】
好ましくは、15〜23アミノ酸の配列番号34の変異体であって、1位のアミノ酸がMetであり、且つ2位のアミノ酸がVal又はLysであり、及び10アミノ酸の連続ストレッチがAla又はLeuから選択される少なくとも5アミノ酸を含む変異体は、
a)1位のアミノ酸がMetであり、2、3及び/又は4位のアミノ酸がLysであり、及び10アミノ酸の連続ストレッチがAla又はLeuから選択される少なくとも5アミノ酸を含む、15〜23アミノ酸の配列番号34の変異体、
b)1位のアミノ酸がMetであり、2位のアミノ酸がLysであり、且つ3及び/又は4位のアミノ酸がLysであり、及び10アミノ酸の連続ストレッチがAla又はLeuから選択される少なくとも5アミノ酸を含む、15〜23アミノ酸の配列番号34の変異体、
c)1位のアミノ酸がMetであり、2、3及び/又は4位のアミノ酸がLysであり、及び10アミノ酸の連続ストレッチがAla又はLeuから選択される少なくとも5アミノ酸を含み、及び変異体の最後の3つの位置のアミノ酸がAla、Leu及びAlaである、15〜23アミノ酸の配列番号34の変異体、
d)1位のアミノ酸がMetであり、2位のアミノ酸がLysであり、且つ3及び/又は4位のアミノ酸がLysであり、及び10アミノ酸の連続ストレッチがAla又はLeuから選択される少なくとも5アミノ酸を含み、及び変異体の最後の3つの位置のアミノ酸がAla、Leu及びAlaである、15〜23アミノ酸の配列番号34の変異体、
e)1位のアミノ酸がMetであり、2位のアミノ酸がValであり、及び10アミノ酸の連続ストレッチがAla又はLeuから選択される少なくとも5アミノ酸を含む、15〜23アミノ酸の配列番号34の変異体、
f)1位のアミノ酸がMetであり、2位のアミノ酸がValであり、及び10アミノ酸の連続ストレッチがAla又はLeuから選択される少なくとも5アミノ酸を含み、及び変異体の最後の3つの位置のアミノ酸がAla、Leu及びAlaである、15〜23アミノ酸の配列番号34の変異体、
g)1位のアミノ酸がMetであり、2位のアミノ酸がValであり、及び10アミノ酸の連続ストレッチがAla又はLeuから選択される少なくとも5アミノ酸を含み、及び変異体の最後の3つの位置におけるアミノ酸がAla、Leu、Alaである、15〜23アミノ酸の配列番号34の変異体、
h)1位のアミノ酸がMetであり、2位のアミノ酸がValであり、及び10アミノ酸の連続ストレッチが少なくとも5個のAlaを含む、15〜23アミノ酸の配列番号34の変異体、
i)1位のアミノ酸がMetであり、2位のアミノ酸がValであり、及び10アミノ酸の連続ストレッチが少なくとも4個のAlaと1個のLeuとを含む、15〜23アミノ酸の配列番号34の変異体、
j)1位のアミノ酸がMetであり、2位のアミノ酸がValであり、及び10アミノ酸の連続ストレッチが少なくとも3個のAlaと2個のLeuとを含む、15〜23アミノ酸の配列番号34の変異体、
k)1位のアミノ酸がMetであり、2位のアミノ酸がValであり、及び10アミノ酸の連続ストレッチが少なくとも2個のAlaと3個のLeuとを含む、15〜23アミノ酸の配列番号34の変異体、
l)1位のアミノ酸がMetであり、2位のアミノ酸がValであり、及び10アミノ酸の連続ストレッチが少なくとも1個のAlaと4個のLeuとを含む、15〜23アミノ酸の配列番号34の変異体、
m)1位のアミノ酸がMetであり、2位のアミノ酸がValであり、及び10アミノ酸の連続ストレッチが少なくとも5個のLeuを含む、15〜23アミノ酸の配列番号34の変異体、
n)1位のアミノ酸がMetであり、2位のアミノ酸がLysであり、及び10アミノ酸の連続ストレッチがAla又はLeuから選択される少なくとも5アミノ酸を含む、15〜23アミノ酸の配列番号34の変異体、
o)1位のアミノ酸がMetであり、2位のアミノ酸がLysであり、及び10アミノ酸の連続ストレッチがAla又はLeuから選択される少なくとも5アミノ酸を含み、及び変異体の最後の3つの位置におけるアミノ酸がAla、Leu、Alaである、15〜23アミノ酸の配列番号34の変異体、
p)1位のアミノ酸がMetであり、2位のアミノ酸がLysであり、及び10アミノ酸の連続ストレッチが少なくとも5個のAlaを含む、15〜23アミノ酸の配列番号34の変異体、
q)1位のアミノ酸がMetであり、2位のアミノ酸がLysであり、及び10アミノ酸の連続ストレッチが少なくとも4個のAlaと1個のLeuとを含む、15〜23アミノ酸の配列番号34の変異体、
r)1位のアミノ酸がMetであり、2位のアミノ酸がLysであり、及び10アミノ酸の連続ストレッチが少なくとも3個のAlaと2個のLeuとを含む、15〜23アミノ酸の配列番号34の変異体、
s)1位のアミノ酸がMetであり、2位のアミノ酸がLysであり、及び10アミノ酸の連続ストレッチが少なくとも2個のAlaと3個のLeuとを含む、15〜23アミノ酸の配列番号34の変異体、
t)1位のアミノ酸がMetであり、2位のアミノ酸がLysであり、及び10アミノ酸の連続ストレッチが少なくとも1個のAlaと4個のLeuとを含む、15〜23アミノ酸の配列番号34の変異体、
u)1位のアミノ酸がMetであり、2位のアミノ酸がLysであり、及び10アミノ酸の連続ストレッチが少なくとも5個のLeuを含む、15〜23アミノ酸の配列番号34の変異体、
の群から選択されるものである。
【0155】
以上の配列番号25の(a)〜(d)、配列番号39の(a)及び(b)、配列番号44の(a)及び(b)並びに配列番号34の(a)〜(u)の変異体において、連続ストレッチは、好ましくは10アミノ酸、より好ましくは9アミノ酸、さらにより好ましくは8アミノ酸、及び最も好ましくは7アミノ酸である。
【0156】
以上の配列番号25の(a)〜(d)、配列番号39の(a)及び(b)、配列番号44の(a)及び(b)並びに配列番号34の(a)〜(u)の変異体において、アミノ酸の連続ストレッチは、好ましくはAla又はLeuから選択される少なくとも5アミノ酸、より好ましくはAla又はLeuから選択される少なくとも6アミノ酸、及び最も好ましくはAla又はLeuから選択される少なくとも7アミノ酸を含む。
【0157】
15〜23アミノ酸の配列番号25、配列番号39、配列番号44、又は配列番号34の変異体は、15アミノ酸、16アミノ酸、17アミノ酸、18アミノ酸、19アミノ酸、20アミノ酸、21アミノ酸、22アミノ酸又は23アミノ酸を含み得る。
【0158】
第6の態様において、本発明は、対象組換えポリペプチドを産生するための本発明に係るシグナルペプチドをコードするポリヌクレオチドの使用に関する。従って、シグナルペプチドは、好ましくは
a)配列番号25、
b)少なくとも8アミノ酸が対応位置における配列番号25の最初の10アミノ酸と同じである、15〜23アミノ酸の配列番号25の変異体、
c)1位のアミノ酸がMetであり、且つ2位のアミノ酸がVal又はLysであり、及び10アミノ酸の連続ストレッチがAla又はLeuから選択される少なくとも5アミノ酸を含む、15〜23アミノ酸の配列番号25の変異体、
d)配列番号39、
e)少なくとも8アミノ酸が対応位置における配列番号39の最初の10アミノ酸と同じである、15〜23アミノ酸の配列番号39の変異体、
f)1位のアミノ酸がMetであり、且つ2位のアミノ酸がVal又はLysであり、及び10アミノ酸の連続ストレッチがAla又はLeuから選択される少なくとも5アミノ酸を含む、15〜23アミノ酸の配列番号39の変異体、
g)配列番号44、
h)少なくとも8アミノ酸が対応位置における配列番号44の最初の10アミノ酸と同じである、15〜23アミノ酸の配列番号44の変異体、
i)1位のアミノ酸がMetであり、且つ2位のアミノ酸がVal又はLysであり、及び10アミノ酸の連続ストレッチがAla又はLeuから選択される少なくとも5アミノ酸を含む、15〜23アミノ酸の配列番号44の変異体、
j)配列番号34、
k)少なくとも8アミノ酸が対応位置における配列番号34の最初の10アミノ酸と同じである、15〜23アミノ酸の配列番号34の変異体、
l)1位のアミノ酸がMetであり、且つ2位のアミノ酸がVal又はLysであり、及び10アミノ酸の連続ストレッチがAla又はLeuから選択される少なくとも5アミノ酸を含む、15〜23アミノ酸の配列番号34の変異体、
からなる群から選択される。
【0159】
ある実施形態によれば、シグナルペプチドは配列番号25である。
【0160】
別の実施形態によれば、中間産物において、シグナルペプチドは、15〜23アミノ酸の配列番号25の変異体であって、少なくとも8アミノ酸が対応位置における配列番号25の最初の10アミノ酸と同じである変異体である。
【0161】
別の実施形態によれば、シグナルペプチドは、15〜23アミノ酸の配列番号25の変異体であって、1位のアミノ酸がMetであり、且つ2位のアミノ酸がVal又はLysであり、及び10アミノ酸の連続ストレッチがAla又はLeuから選択される少なくとも5アミノ酸を含む変異体である。
【0162】
別の実施形態によれば、シグナルペプチドは配列番号39である。
【0163】
別の実施形態によれば、シグナルペプチドは、15〜23アミノ酸の配列番号39の変異体であって、少なくとも8アミノ酸が対応位置における配列番号39の最初の10アミノ酸と同じである変異体である。
【0164】
別の実施形態によれば、シグナルペプチドは、15〜23アミノ酸の配列番号39の変異体であって、1位のアミノ酸がMetであり、且つ2位のアミノ酸がVal又はLysであり、及び10アミノ酸の連続ストレッチがAla又はLeuから選択される少なくとも5アミノ酸を含む変異体である。
【0165】
別の実施形態によれば、シグナルペプチドは配列番号44である。
【0166】
別の実施形態によれば、シグナルペプチドは、15〜23アミノ酸の配列番号44の変異体であって、少なくとも8アミノ酸が対応位置における配列番号44の最初の10アミノ酸と同じである変異体である。
【0167】
別の実施形態によれば、シグナルペプチドは、15〜23アミノ酸の配列番号44の変異体であって、1位のアミノ酸がMetであり、且つ2位のアミノ酸がVal又はLysであり、及び10アミノ酸の連続ストレッチがAla又はLeuから選択される少なくとも5アミノ酸を含む変異体である。
【0168】
別の実施形態によれば、シグナルペプチドは配列番号34である。
【0169】
別の実施形態によれば、シグナルペプチドは、15〜23アミノ酸の配列番号34の変異体であって、少なくとも8アミノ酸が対応位置における配列番号34の最初の10アミノ酸と同じである変異体である。
【0170】
別の実施形態によれば、シグナルペプチドは、15〜23アミノ酸の配列番号34の変異体であって、1位のアミノ酸がMetであり、且つ2位のアミノ酸がVal又はLysであり、及び10アミノ酸の連続ストレッチがAla又はLeuから選択される少なくとも5アミノ酸を含む変異体である。
【0171】
好ましくは、シグナルペプチドが
(a):配列番号25、
(b):少なくとも8アミノ酸が対応位置における配列番号25の最初の10アミノ酸と同じである、15〜23アミノ酸の配列番号25の変異体、又は
(c)1位のアミノ酸がMetであり、且つ2位のアミノ酸がVal又はLysであり、及び10アミノ酸の連続ストレッチがAla又はLeuから選択される少なくとも5アミノ酸を含む、15〜23アミノ酸の配列番号25の変異体、
であるとき、対象ポリペプチドはペクチンメチルエステラーゼではなく、より好ましくは、対象ポリペプチドはエルウィニア・クリサンテミ(Erwinia chrysanthemi)由来のペクチンメチルエステラーゼではない。より好ましくは、シグナルペプチドが(b)又は(c)であるとき、対象ポリペプチドはペクチンメチルエステラーゼではなく、さらにより好ましくは、対象ポリペプチドはエルウィニア・クリサンテミ(Erwinia chrysanthemi)由来のペクチンメチルエステラーゼではない。
【0172】
好ましくは、配列番号25をコードするときの第1のポリヌクレオチドは、配列番号29に係るポリヌクレオチドである。好ましくは、配列番号39をコードするときの第1のポリヌクレオチドは、配列番号38に係るポリヌクレオチドである。好ましくは、配列番号44をコードするときの第1のポリヌクレオチドは、配列番号43に係るポリヌクレオチドである。好ましくは、配列番号34をコードするときの第1のポリヌクレオチドは、配列番号33に係るポリヌクレオチドである。
【0173】
好ましくは、15〜23アミノ酸の配列番号25の変異体であって、少なくとも8アミノ酸が対応位置における配列番号25の最初の10アミノ酸と同じである変異体は、少なくとも9アミノ酸が対応位置における配列番号25の最初の10アミノ酸と同じである変異体である。より好ましくは、10アミノ酸が対応位置における配列番号25の最初の10アミノ酸と同じである。
【0174】
好ましくは、15〜23アミノ酸の配列番号25の変異体であって、1位のアミノ酸がMetであり、且つ2位のアミノ酸がVal又はLysであり、及び10アミノ酸の連続ストレッチがAla又はLeuから選択される少なくとも5アミノ酸を含む変異体は、
a)1位のアミノ酸がMetであり、2、3及び/又は4位のアミノ酸がVal又はLysであり、及び10アミノ酸の連続ストレッチがAla又はLeuから選択される少なくとも5アミノ酸を含む、15〜23アミノ酸の配列番号25の変異体、
b)1位のアミノ酸がMetであり、2位のアミノ酸がValであり、且つ3位のアミノ酸がLysであり、及び10アミノ酸の連続ストレッチがAla又はLeuから選択される少なくとも5アミノ酸を含む、15〜23アミノ酸の配列番号25の変異体、
c)1位のアミノ酸がMetであり、2、3及び/又は4位のアミノ酸がVal又はLysであり、及び10アミノ酸の連続ストレッチがAla又はLeuから選択される少なくとも5アミノ酸を含み、及び変異体の最後の3つの位置のアミノ酸がAla、Leu及びAlaである、15〜23アミノ酸の配列番号25の変異体、
d)1位のアミノ酸がMetであり、2位のアミノ酸がValであり、且つ3位のアミノ酸がLysであり、及び10アミノ酸の連続ストレッチがAla又はLeuから選択される少なくとも5アミノ酸を含み、及び変異体の最後の3つの位置のアミノ酸がAla、Leu及びAlaである、15〜23アミノ酸の配列番号25の変異体、
の群から選択されるものである。
【0175】
好ましくは、15〜23アミノ酸の配列番号39の変異体であって、少なくとも8アミノ酸が対応位置における配列番号39の最初の10アミノ酸と同じである変異体は、少なくとも9アミノ酸が対応位置における配列番号39の最初の10アミノ酸と同じである変異体である。より好ましくは、10アミノ酸が対応位置における配列番号39の最初の10アミノ酸と同じである。
【0176】
好ましくは、15〜23アミノ酸の配列番号39の変異体であって、1位のアミノ酸がMetであり、且つ2位のアミノ酸がVal又はLysであり、及び10アミノ酸の連続ストレッチがAla又はLeuから選択される少なくとも5アミノ酸を含む変異体は、
a)1位のアミノ酸がMetであり、2、3及び/又は5位のアミノ酸がVal又はLysであり、及び10アミノ酸の連続ストレッチがAla又はLeuから選択される少なくとも5アミノ酸を含む、15〜23アミノ酸の配列番号39の変異体、
b)1位のアミノ酸がMetであり、2位のアミノ酸がValであり、且つ5位のアミノ酸がLysであり、及び10アミノ酸の連続ストレッチがAla又はLeuから選択される少なくとも5アミノ酸を含む、15〜23アミノ酸の配列番号39の変異体、
の群から選択されるものである。
【0177】
好ましくは、15〜23アミノ酸の配列番号44の変異体であって、少なくとも8アミノ酸が対応位置における配列番号44の最初の10アミノ酸と同じである変異体は、少なくとも9アミノ酸が対応位置における配列番号44の最初の10アミノ酸と同じである変異体である。より好ましくは、10アミノ酸が対応位置における配列番号44の最初の10アミノ酸と同じである。
【0178】
好ましくは、15〜23アミノ酸の配列番号44の変異体であって、1位のアミノ酸がMetであり、且つ2位のアミノ酸がVal又はLysであり、及び10アミノ酸の連続ストレッチがAla又はLeuから選択される少なくとも5アミノ酸を含む変異体は、
a)1位のアミノ酸がMetであり、2、3及び/又は4位のアミノ酸がVal又はLysであり、及び10アミノ酸の連続ストレッチがAla又はLeuから選択される少なくとも5アミノ酸を含む、15〜23アミノ酸の配列番号44の変異体、
b)1位のアミノ酸がMetであり、2位のアミノ酸がValであり、且つ4位のアミノ酸がLysであり、及び10アミノ酸の連続ストレッチがAla又はLeuから選択される少なくとも5アミノ酸を含む、15〜23アミノ酸の配列番号44の変異体、
の群から選択されるものである。
【0179】
好ましくは、15〜23アミノ酸の配列番号34の変異体であって、少なくとも8アミノ酸が対応位置における配列番号34の最初の10アミノ酸と同じである変異体は、少なくとも9アミノ酸が対応位置における配列番号34の最初の10アミノ酸と同じである変異体である。より好ましくは、10アミノ酸が対応位置における配列番号34の最初の10アミノ酸と同じである。
【0180】
好ましくは、15〜23アミノ酸の配列番号34の変異体であって、1位のアミノ酸がMetであり、且つ2位のアミノ酸がVal又はLysであり、及び10アミノ酸の連続ストレッチがAla又はLeuから選択される少なくとも5アミノ酸を含む変異体は、
a)1位のアミノ酸がMetであり、2、3及び/又は4位のアミノ酸がLysであり、及び10アミノ酸の連続ストレッチがAla又はLeuから選択される少なくとも5アミノ酸を含む、15〜23アミノ酸の配列番号34の変異体、
b)1位のアミノ酸がMetであり、2位のアミノ酸がLysであり、且つ3及び/又は4位のアミノ酸がLysであり、及び10アミノ酸の連続ストレッチがAla又はLeuから選択される少なくとも5アミノ酸を含む、15〜23アミノ酸の配列番号34の変異体、
c)1位のアミノ酸がMetであり、2、3及び/又は4位のアミノ酸がLysであり、及び10アミノ酸の連続ストレッチがAla又はLeuから選択される少なくとも5アミノ酸を含み、及び変異体の最後の3つの位置のアミノ酸がAla、Leu及びAlaである、15〜23アミノ酸の配列番号34の変異体、
d)1位のアミノ酸がMetであり、2位のアミノ酸がLysであり、且つ3及び/又は4位のアミノ酸がLysであり、及び10アミノ酸の連続ストレッチがAla又はLeuから選択される少なくとも5アミノ酸を含み、及び変異体の最後の3つの位置のアミノ酸がAla、Leu及びAlaである、15〜23アミノ酸の配列番号34の変異体、
e)1位のアミノ酸がMetであり、2位のアミノ酸がValであり、及び10アミノ酸の連続ストレッチがAla又はLeuから選択される少なくとも5アミノ酸を含む、15〜23アミノ酸の配列番号34の変異体、
f)1位のアミノ酸がMetであり、2位のアミノ酸がValであり、及び10アミノ酸の連続ストレッチがAla又はLeuから選択される少なくとも5アミノ酸を含み、及び変異体の最後の3つの位置のアミノ酸がAla、Leu及びAlaである、15〜23アミノ酸の配列番号34の変異体、
g)1位のアミノ酸がMetであり、2位のアミノ酸がValであり、及び10アミノ酸の連続ストレッチがAla又はLeuから選択される少なくとも5アミノ酸を含み、及び変異体の最後の3つの位置におけるアミノ酸がAla、Leu、Alaである、15〜23アミノ酸の配列番号34の変異体、
h)1位のアミノ酸がMetであり、2位のアミノ酸がValであり、及び10アミノ酸の連続ストレッチが少なくとも5個のAlaを含む、15〜23アミノ酸の配列番号34の変異体、
i)1位のアミノ酸がMetであり、2位のアミノ酸がValであり、及び10アミノ酸の連続ストレッチが少なくとも4個のAlaと1個のLeuとを含む、15〜23アミノ酸の配列番号34の変異体、
j)1位のアミノ酸がMetであり、2位のアミノ酸がValであり、及び10アミノ酸の連続ストレッチが少なくとも3個のAlaと2個のLeuとを含む、15〜23アミノ酸の配列番号34の変異体、
k)1位のアミノ酸がMetであり、2位のアミノ酸がValであり、及び10アミノ酸の連続ストレッチが少なくとも2個のAlaと3個のLeuとを含む、15〜23アミノ酸の配列番号34の変異体、
l)1位のアミノ酸がMetであり、2位のアミノ酸がValであり、及び10アミノ酸の連続ストレッチが少なくとも1個のAlaと4個のLeuとを含む、15〜23アミノ酸の配列番号34の変異体、
m)1位のアミノ酸がMetであり、2位のアミノ酸がValであり、及び10アミノ酸の連続ストレッチが少なくとも5個のLeuを含む、15〜23アミノ酸の配列番号34の変異体、
n)1位のアミノ酸がMetであり、2位のアミノ酸がLysであり、及び10アミノ酸の連続ストレッチがAla又はLeuから選択される少なくとも5アミノ酸を含む、15〜23アミノ酸の配列番号34の変異体、
o)1位のアミノ酸がMetであり、2位のアミノ酸がLysであり、及び10アミノ酸の連続ストレッチがAla又はLeuから選択される少なくとも5アミノ酸を含み、及び変異体の最後の3つの位置におけるアミノ酸がAla、Leu、Alaである、15〜23アミノ酸の配列番号34の変異体、
p)1位のアミノ酸がMetであり、2位のアミノ酸がLysであり、及び10アミノ酸の連続ストレッチが少なくとも5個のAlaを含む、15〜23アミノ酸の配列番号34の変異体、
q)1位のアミノ酸がMetであり、2位のアミノ酸がLysであり、及び10アミノ酸の連続ストレッチが少なくとも4個のAlaと1個のLeuとを含む、15〜23アミノ酸の配列番号34の変異体、
r)1位のアミノ酸がMetであり、2位のアミノ酸がLysであり、及び10アミノ酸の連続ストレッチが少なくとも3個のAlaと2個のLeuとを含む、15〜23アミノ酸の配列番号34の変異体、
s)1位のアミノ酸がMetであり、2位のアミノ酸がLysであり、及び10アミノ酸の連続ストレッチが少なくとも2個のAlaと3個のLeuとを含む、15〜23アミノ酸の配列番号34の変異体、
t)1位のアミノ酸がMetであり、2位のアミノ酸がLysであり、及び10アミノ酸の連続ストレッチが少なくとも1個のAlaと4個のLeuとを含む、15〜23アミノ酸の配列番号34の変異体、
u)1位のアミノ酸がMetであり、2位のアミノ酸がLysであり、及び10アミノ酸の連続ストレッチが少なくとも5個のLeuを含む、15〜23アミノ酸の配列番号34の変異体、
の群から選択されるものである。
【0181】
以上の配列番号25の(a)〜(d)、配列番号39の(a)及び(b)、配列番号44の(a)及び(b)並びに配列番号34の(a)〜(u)の変異体において、連続ストレッチは、好ましくは10アミノ酸、より好ましくは9アミノ酸、さらにより好ましくは8アミノ酸、及び最も好ましくは7アミノ酸である。
【0182】
以上の配列番号25の(a)〜(d)、配列番号39の(a)及び(b)、配列番号44の(a)及び(b)並びに配列番号34の(a)〜(u)の変異体において、アミノ酸の連続ストレッチは、好ましくはAla又はLeuから選択される少なくとも5アミノ酸、より好ましくはAla又はLeuから選択される少なくとも6アミノ酸、及び最も好ましくはAla又はLeuから選択される少なくとも7アミノ酸を含む。
【0183】
15〜23アミノ酸の配列番号25、配列番号39、配列番号44、又は配列番号34の変異体は、15アミノ酸、16アミノ酸、17アミノ酸、18アミノ酸、19アミノ酸、20アミノ酸、21アミノ酸、22アミノ酸又は23アミノ酸を含んでもよい。
【0184】
本明細書に提供されるとおりの配列情報は、誤って同定された塩基の包含を必要とするほど狭義に解釈されてはならない。本明細書に開示される特定の配列は、簡単にそれぞれの宿主細胞からの完全な遺伝子の単離に使用することができ、次に容易にそれをさらなる配列解析に供することによって配列決定の誤りを特定することができる。
【0185】
特に指示されない限り、本明細書においてDNA分子を配列決定することにより決定される全てのヌクレオチド配列は、自動DNAシーケンサーを使用して決定したものであり、及び本明細書において決定されるDNA分子によりコードされるポリペプチドの全てのアミノ酸配列は、上記のとおり決定された核酸配列の翻訳により予測した。従って、この自動化された手法により決定される任意のDNA配列について当該技術分野で公知のとおり、本明細書において決定される任意のヌクレオチド配列が、いくらかの誤りを含み得る。自動化により決定されるヌクレオチド配列は、配列決定されたDNA分子の実際のヌクレオチド配列と典型的には少なくとも約90%同一であり、より典型的には少なくとも約95%〜少なくとも約99.9%同一である。実際の配列は、当該技術分野において公知の手動によるDNA配列決定方法を含めた他の手法により、より正確に決定することができる。同様に当該技術分野において公知のとおり、決定されたヌクレオチド配列に実際の配列と比較して単一の挿入又は欠失があると、ヌクレオチド配列の翻訳においてフレームシフトが起こることがあり、従って決定されたヌクレオチド配列によりコードされる予想アミノ酸配列は、かかる挿入又は欠失を起点として、配列決定されたDNA分子により実際にコードされるアミノ酸配列と全く異なり得る。
【0186】
当業者は、かかる誤って同定された塩基を特定することができ、及びかかる誤りの修正方法を知っている。
【0187】
本明細書に含まれる具体的な実施形態は本発明のいくつかの態様の例示として意図されるため、それらの実施形態によって本明細書に記載及び特許請求される本発明の範囲が限定されるものではない。任意の均等な実施形態が、本発明の範囲内にあることが意図される。実際、本明細書に図示及び記載されるものに加え、本発明の様々な変形例が、前述の説明から当業者には明らかとなるであろう。かかる変形例もまた、添付の特許請求の範囲の範囲内に含まれることが意図される。対立がある場合、定義を含む本開示が指針とみなされる。
【0188】
本発明を以下の実施例によりさらに説明する。
【0189】
[実施例]
[株]
WT 1:このA.ニガー(A.niger)株は野生型株として使用する。この株は、寄託番号CBS 513.88としてCBS Instituteに寄託されている。
【0190】
WT 2:このA.ニガー(A.niger)株は、グルコアミラーゼ(glaA)をコードする遺伝子の欠失を含むWT 1株である。WT 2は、欧州特許第0 635 574 B1号明細書に記載されるとおりの「マーカー遺伝子フリー」手法を用いることにより構築した。この特許には、CBS 513.88のゲノム中のglaA特異的DNA配列を欠失させる方法についての広範な記載がなされている。この手順により、最終的には外来DNA配列を一切有しないマーカー遺伝子フリーΔglaA組換えA.ニガー(A.niger)CBS 513.88株が得られた。
【0191】
WT 3:このA.ニガー(A.niger)株は、シュウ酸欠損A.ニガー(A.niger)株をもたらす欠失を含むWT 2株である。WT 3は、欧州特許第1157100号明細書及び米国特許第6,936,438号明細書に記載されるとおりの方法を用いることにより構築し、ここでシュウ酸欠損株は、オキサロ酢酸ヒドロラーゼをコードするoahA遺伝子を欠失させることにより得られ、WT 3株はWT 2株バックグラウンドにおいてoahA遺伝子が不活化された代表株として選択した。或いは、欧州特許第1590444号明細書には、シュウ酸欠損突然変異A.ニガー(A.niger)株のスクリーニング方法について広範な記載がなされている。欧州特許第1590444号明細書の実施例1及び2の後に、WT 2のシュウ酸欠損突然変異株をどのように得ることができるかが記載されている。
【0192】
WT 4:このA.ニガー(A.niger)株は、3つの連続するステップでα−アミラーゼをコードする3個の遺伝子(amyB、amyBI及びamyBII)の欠失を含むWT 3株である。これらの3個の遺伝子の欠失ベクター及びゲノム欠失の構築については、国際公開第2005095624号パンフレットに詳細に記載されている。国際公開第2005095624号パンフレットに記載されるベクターpDEL−AMYA、pDEL−AMYBI及びpDEL−AMYBIIは、欧州特許第0 635 574 B1号明細書に記載されるとおりの「マーカー遺伝子フリー」手法に従い使用されている。上記の手順により、最終的には外来DNA配列を一切有しないシュウ酸欠損マーカー遺伝子フリーΔglaA、ΔamyA、ΔamyBI及びΔamyBIIアミラーゼ陰性組換えA.ニガー(A.niger)CBS 513.88株が得られた。従って、WT 4はアミラーゼバックグラウンドが低く、WT 1と比較してα−アミラーゼ発現及び発現検出に対してより最適化されている。
【0193】
[分子生物学的技法]
これらの株において、当業者に公知の分子生物学的技法を用いて(Sambrook及びRussell、「Molecular Cloning:A Laboratory Manual」、第3版、CSHL Press、Cold Spring Harbor、NY、2001年を参照のこと)、いくつかの遺伝子を過剰発現させ、他の遺伝子は以下に記載されるとおり下方制御した。遺伝子過剰発現用の発現ベクター及び下方制御用の破壊ベクターの一般的な設計、形質転換、マーカー及び選択培地の使用の例は、国際公開第199846772号パンフレット、国際公開第199932617号パンフレット、国際公開第2001121779号パンフレット、国際公開第2005095624号パンフレット、欧州特許第635574B号明細書及び国際公開第2005100573号パンフレットに見ることができる。
【0194】
[A.ニガー(A.niger)振盪フラスコ発酵]
国際公開第99/32617号パンフレットの実施例「アスペルギルス・ニガー(Aspergillus niger)振盪フラスコ発酵」の節に記載されるとおり、A.ニガー(A.niger)株を20mlの前培養培地中で前培養する。一晩増殖させた後、この培養物の10mlを発酵培地(FM)に移す。
【0195】
発酵培地(FM)は1リットル当たり以下を含む:82.5gのグルコース.1H2O、25gのMaldex 15(Boom Meppel、オランダ)、2gのクエン酸、4.5gのNaH2PO4.1H2O、9gのKH2PO4、15gの(NH4)2SO4、0.02gのZnCl2、0.1gのMnSO4.1H2O、0.015gのCuSO4.5H2O、0.015gのCoCl2.6H2O、1gのMgSO4.7H2O、0.1gのCaCl2.2H2O、0.3gのFeSO4.7H2O、30gのMES(2−[N−モルホリノ]エタンスルホン酸)、pH=6。
【0196】
FM中での発酵は、概して国際公開第99/32617号パンフレットに記載されるとおり、100mlの発酵ブロスを含む500mlのバッフル付きフラスコ内において34℃及び170rpmで指示される日数にわたり実施する。
【0197】
[真菌α−アミラーゼ活性]
A.ニガー(A.niger)培養ブロス中のα−アミラーゼ活性を決定するため、Megazyme穀物α−アミラーゼキットを供給業者のプロトコルに従い使用する(Megazyme、CERALPHA αアミラーゼアッセイキット、カタログ参照番号K−CERA、2000〜2001年)。計測される活性は、過剰なグルコアミラーゼ及びα−グルコシダーゼの存在下における非還元末端がブロックされたρ−ニトロフェニルマルトヘプタオシドの加水分解に基づく。形成されたρ−ニトロフェノールの量が、試料中に存在するα−アミラーゼ活性の尺度となる。
【0198】
[グルコースオキシダーゼ活性]
A.ニガー(A.niger)培養ブロス中のグルコースオキシダーゼ活性を決定するため、Witteveenら 1990年(「アスペルギルス・ニガー(Aspergillus niger)のグルコースオキシダーゼ過剰発現及びネガティブ変異体(Glucose oxidase overproducing and negative mutants of Aspergillus niger)」、App1.Microbiol.Biotechnol 33:683〜686頁)により記載されるとおりο−ジアニシジンを使用した450nmでの分光測定によりグルコースオキシダーゼを計測した。
【0199】
[実施例1.A.ニガー(A.niger)α−アミラーゼAmyB及びP.クリソゲナム(P.chrysogenum)グルコースオキシダーゼgoxAについての修飾アスペルギルス属(Aspergillus)発現コンストラクトの構築]
α−アミラーゼタンパク質をコードするamyB遺伝子のDNA配列は、EMBLヌクレオチド配列データベース(http://www.ebi.ac.uk/embl/index.html)から受託番号XM_001395712.1、XM_001390741.1又はCAK46324に基づき検索することができる。天然A.ニガー(A.niger)amyB遺伝子のゲノム配列は、配列番号1として示される。対応するamyBのコード配列又はcDNA配列は、配列番号2として示される。配列番号2の翻訳配列は配列番号3として指定され、A.ニガー(A.niger)α−アミラーゼタンパク質AmyBを表す。この配列はまた、A.オリゼ(A.oryzae)α−アミラーゼタンパク質と100%の類似度を有する(Wirsel S.、Lachmund A.、Wildhardt G.、Ruttkowski E.、「アスペルギルス・オリゼ(Aspergillus oryzae)の3個のα−アミラーゼ遺伝子は同一のイントロン−エクソン構成を示す(Three alpha−amylase genes of Aspergillus oryzae exhibit identical intron−exon organization)」(1989年)Mol.Microbiol.3:314頁)。天然の分泌A.ニガー(A.niger)成熟α−アミラーゼペプチドは、配列番号4として指定される。本発明の方法による最適化は、以下に詳述するとおり最適化amyB cDNA配列及び改良型発現ベクターにより実施している。
【0200】
A.ニガー(A.niger)amyBコンストラクトの変異体のアスペルギルス属(Aspergillus)種における発現解析のため、amyBコード配列は、α−アミラーゼをコードするamyB遺伝子に対するコドン最適化(CO)コード配列を含んだ(国際公開第2008/000632号パンフレットに詳細に記載されるとおり)。強力なA.ニガー(A.niger)グルコアミラーゼglaAプロモーター及びα−アミラーゼamyBプロモーターの双方を、pGBFINベースの発現コンストラクトを使用したA.ニガー(A.niger)におけるαアミラーゼ酵素の過剰発現に適用した(国際公開第1999/32617号パンフレット及び国際公開第2006/077258号パンフレットに記載されるとおり)。グルコアミラーゼglaA及びα−アミラーゼamyBプロモーターの翻訳開始配列は、続いて生成される全てのamyB発現コンストラクトにおいて5’−CACCGTCAAA ATG−3’となるよう修飾している(同様に国際公開第2006/077258号パンフレットに詳述されるとおり)。天然α−アミラーゼamyBプロモーターに存在するBstXI部位(5’CCANNNNN/NTGG−3’)は、一部のベクターではシグナル配列変異体のクローニングを促進するため取り除いた。加えて、最適な翻訳終結配列を使用し、従って全ての発現コンストラクトで野生型amyB 5’−TGA−3’翻訳終結配列を5’−TAAA−3’に置き換えた(国際公開第2006/077258号パンフレットに詳述されるとおり)。
【0201】
適切な制限部位を両末端に導入し、発現ベクターにおけるクローニングを可能にした。5’末端にXhoI部位を導入し、3’末端にPacI部位を導入した。修飾ゲノムglaA又はamyBプロモーターと最適化amyB cDNA配列とを含む参照コンストラクトのDNA断片を完全に合成し、サブクローニングし、配列解析により配列を確認した。2つの合成断片の末端にあるXhoI−PacI制限部位を使用して、大型ベクター断片のXhoI及びPacI消化pGBFINFUA−1発現ベクターにおけるクローニングを可能にし(pGBFINFUA−1ベクターはまた、国際公開第2006/077258号パンフレット及び国際公開第2008/000632号パンフレットにも記載があり、ベクターの概略的なレイアウトについては図1を参照のこと)、それぞれpGBFINFUA−6及びpGBFINFUA−3を生成した。
【0202】
本発明の方法に係るシグナル配列が特に異なる、修飾AmyB配列の全てのDNA断片を設計し、EcoRI−PacI断片又はEcoRI−BstXI断片として完全に合成し、サブクローニングして配列を確認した。全ての合成断片の末端にあるEcoRI−PacI/BstXI制限部位を使用して、大型ベクター断片のEcoRI及びPacI/BstXI消化pGBFINFUA−3又はEcoRI及びPacI消化pGBFINFUA−6発現ベクターにおけるクローニングを可能にし、変異体pGBFINFUA発現ベクターを生成した。それぞれのベクターの配列を確認した後、変異発現コンストラクトを以下の表1及び表2に記載するとおり命名した。全てのpGBFINFUAコンストラクトの全ての特徴及びそれぞれの配列に対する参照は、表1及び表2から推定され得る。
【0203】
【表1】

【0204】
本明細書における実施例1の全ての表中では、全てのpGBFINプラスミドのEcoRI−PacI部分の配列が「配列番号」に示され、完全な遺伝子コード配列及びそのコード配列の翻訳配列が、それぞれ「コード配列の配列番号」及び「タンパク質の配列番号」に示されるとおりのアミノ酸配列に従い、及び使用されるシグナル配列のヌクレオチド及び翻訳されたアミノ酸配列が、「シグナル配列コード配列の配列番号」及び「アミノ酸シグナル配列の配列番号」に示される。pGBFINFUA−6及び誘導されたベクターの概略レイアウトは図2に見ることができ、一方、ベクターpGBFINFUA−1、pGBFINFUA−3及びpGBFINFUA−21のレイアウトは図1に見ることができる。
【0205】
【表2】

【0206】
遺伝子コードPc20g09560の、ペニシリウム・クリソゲナム(Penicillium chrysogenum)グルコースオキシダーゼタンパク質をコードするgoxA遺伝子のDNA配列は、EMBLヌクレオチド配列データベース(http://www.ebi.ac.uk/embl/index.html)から受託番号AM920435.1に基づき検索することができる。Pc20g09560の翻訳配列は配列番号49として指定され、これはP.クリソゲナム(P.chrysogenum)グルコースオキシダーゼタンパク質GoxAに相当する。
【0207】
上記に詳述したとおりの改良型発現ベクターによりgoxA遺伝子又は遺伝子断片の発現を実施したとともに、配列番号48として特定され得るコドン対最適化goxA cDNA配列により本発明の方法に係る最適化を実施している。
【0208】
本発明の方法に係るシグナル配列が特に異なり、且つglaAプロモーターの部分及び最適化GoxA cDNA配列を特に含む、修飾GoxAコンストラクトの2個のDNA断片を設計し、EcoRI−PacI断片として完全に合成し、サブクローニングして配列を確認した。合成断片の末端にあるEcoRI−PacI制限部位を使用して大型ベクター断片のEcoRI及びPacI消化pGBFINFUA−6発現ベクターにおけるクローニングを可能にし、変異体pGBFINGOX発現ベクターを生成した。それぞれのベクターの配列を確認した後、変異発現コンストラクトを以下の表3に記載するとおり命名した。2個のpGBFINGOXコンストラクトの全ての特徴及びそれぞれの配列に対する参照は、表3から推定され得る。
【0209】
【表3】

【0210】
[実施例2.A.ニガー(A.niger)におけるA.ニガー(A.niger)α−アミラーゼ及びP.クリソゲナム(P.chrysogenum)グルコースオキシダーゼについての野生型及び修飾発現コンストラクトの発現]
実施例1(上記)で調製したpGBFINFUA及びpGBFFINGOX発現コンストラクトを、以下に記載されるとおりの形質転換により、及び図3に図示される戦略に従い、A.ニガー(A.niger)に導入した。
【0211】
異なるpGBFINFUAベクター(表1及び表2)及び2つの異なるpGBFINGOXベクター(表3)をWT 4に導入するため、国際公開第1998/46772号パンフレット及び国際公開第1999/32617号パンフレットに記載されるとおり形質転換及び続く形質転換体の選択を行った。要約すれば、pGBFINFUA及びpGBFINGOXコンストラクトの直鎖状DNAを単離し、それを使用してA.ニガー(A.niger)WT4を形質転換した。形質転換体をアセトアミド培地上で選択し、標準的手順に従いコロニーを精製した。コロニーは、glaA遺伝子座における組込み及びコピー数についてPCRを用いて診断した。同様の推定コピー数(推定単一コピー)を有する各pGBFINFUAコンストラクトの3個の独立した形質転換体を選択し、形質転換プラスミドの番号を用いて、例えばそれぞれFUA−3−1、FUA−3−2、FUA−3−3、FUA−6−1等のように命名した。
【0212】
同様に、同様の推定コピー数(推定単一コピー)を有する各pGBFINGOXコンストラクトの5個の独立した形質転換体を選択し、形質転換プラスミドの番号を用いて、例えばそれぞれGOX−1−1、GOX−1−2、GOX−1−3、...、GOX−2−1、GOX−2−2、GOX−2−3等のように命名した。
【0213】
選択したFUA株及びGOX株及びA.ニガー(A.niger)WT 1及びWT 4を使用して、500mlのバッフル付き振盪フラスコを用いるインキュベーターシェーカーにおいて上記に記載したとおりの100mlの培地中、34℃及び170rpmで振盪フラスコ実験を実施した。発酵の3日目及び4日目又は4日目及び5日目の後、試料を採取し、それぞれα−アミラーゼ活性又はグルコースオキシダーゼ活性を決定した。
【0214】
異なるコンストラクトを含む異なるA.ニガー(A.niger)FUA形質転換体の形質転換体により産生されるα−アミラーゼの産生を、培養上清中で計測した。コドン対最適化を伴う、若しくは伴わない内因性amyBシグナル配列の使用、又は最適化グルコアミラーゼシグナル配列の使用については、α−アミラーゼ産生及び発現に対する正の効果を認めることはできなかった。意外にも、グルコアミラーゼプロモーターを使用するとき、図4で確認することができるとおりα−アミラーゼ産生に対する本発明の修飾及び最適化されたシグナル配列の使用の明らかな正の効果が観察された。本発明の複数の最適シグナル配列がα−アミラーゼの産生に対して正の効果を示し、ペクチンメチルエステラーゼ(すなわちpGBFINFUA−12/13におけるpmeA)が最良である。図5においても、同様にα−アミラーゼ産生に対する本発明のpmeAシグナル配列の使用の明らかな正の効果が、α−アミラーゼAmyBプロモーターとの組み合わせで観察された。
【0215】
P.クリソゲナム(P.chrysogenum)グルコースオキシダーゼGoxAの産生を、2つの異なるA.ニガー(A.niger)GOX形質転換体の5個の形質転換体において計測した。ここでもまた、図6で確認することができるとおり、グルコースオキシダーゼ産生に対する本発明のシグナル配列(すなわちpmeA)の使用の明らかな正の効果が観察された。
【0216】
このように、強力なα−アミラーゼAmyB及びグルコアミラーゼglaAプロモーターとの組み合わせで、本発明の方法に係る最適シグナル配列及びより具体的にはpmeAシグナル配列の使用についての正の効果が認められた。また、goxAグルコースオキシダーゼをコードする酵素と融合した本発明の方法に係るpmeAシグナル配列は、細胞外GoxA酵素産生の明らかな増加をもたらした。加えて、本発明の方法を修飾翻訳開始部位、コドン最適化コード配列及び/又は翻訳終結配列と組み合わせることのα−アミラーゼ産生に対する正の効果が観察された。これらの結果は、明らかに、発現コンストラクトについて特定される他の配列最適化との本発明の修飾の相加的効果を示している。
【0217】
明らかにこれらの実施例は、どのように本発明の方法、例えば天然α−アミラーゼ又はグルコースオキシダーゼ配列と融合したpmeAシグナル配列を用いて、A.ニガー(A.niger)におけるα−アミラーゼ又はグルコースオキシダーゼ又は糸状菌における任意の他の対象タンパク質の分泌及び産生を改良することができるかを示す。加えて、これらの結果は、本発明の方法が宿主におけるタンパク質発現の改良に広範に適用できることを示すものであり、但し発現コンストラクト及び宿主は、例えば強力なプロモーター、改良された翻訳開始配列、改良された翻訳終結配列、最適化されたコドン及びコドン対使用頻度及び/又は改良されたタンパク質発現用宿主など、既にいくつかの他の最適化を有する。
【発明の詳細な説明】
【0001】
[発明の分野]
本発明は、対象組換えポリペプチドの産生方法、前記方法により得られるポリペプチド、組換えポリヌクレオチド、発現ベクター、発現コンストラクトに関し、並びに特定のシグナルペプチドの、及び前記特定のシグナルペプチドをコードするポリヌクレオチドの、対象組換えポリペプチドを産生するための使用に関する。
【0002】
[発明の背景]
糸状菌宿主細胞における組換えポリペプチドの産生は、当該技術分野において公知である。現在のポリペプチド産生は、様々な方法で実施されている。
【0003】
当該分野の技術水準における組換えポリペプチドの産生方法は、発現コンストラクトを含む宿主細胞の発酵を用いるものであり、前記発現コンストラクトは、とりわけ対象ポリペプチドをコードするポリヌクレオチドに作動可能に連結されたプロモーターを含む。対象ポリペプチドを宿主細胞の分泌経路に誘導するため、対象ポリペプチドはシグナル配列を含む。Broekhuijsenらにおいては(Journal of Biotechnology、31(1993年)135〜145頁、Broekhuijsenら;「アスペルギルス・ニガー(Aspergillus niger)による異種タンパク質の分泌:プロテアーゼ欠損変異株におけるグルコアミラーゼ−hIL6融合タンパク質のKEX2様プロセシングによる活性ヒトインターロイキン−6の産生(Secretion of heterologous proteins by Aspergillus niger:Production of active human interleukin−6 in a protease deficient mutant by KEX2−like processing of a glucoamylase−hIL6 fusion protein)」)、分泌ポリペプチドのグルコアミラーゼのシグナル配列を用いてアスペルギルス・ニガー(Aspergillus niger)内で組換えタンパク質を発現させている。
【0004】
工業的な文脈では、高収率のポリペプチド産生が要求される。
【0005】
対象組換えポリペプチドの産生収率は、分泌効率を増加させることにより高まり得る。
【0006】
結果的に、対象ポリペプチドの産生収率を高めるためには、分泌効率を向上させる必要がある。
【0007】
本発明の目的は、組換えポリペプチドの改良された産生方法を提供することである。
【図面の簡単な説明】
【0008】
【図1】発現ベクターpGBFINFUA−1(国際公開第2008/000632号パンフレットに記載される)のプラスミドマップを示す。pGBFINFUA−1はまた、プラスミドpGBFINFUA−3及びpGBFINFUA−21を代表する。amyBプロモーターと、変異シグナル配列が導入されたα−アミラーゼをコードするA.ニガー(A.niger)amyB cDNA配列との配列に対するglaAフランキング領域を示す。A.ニガー(A.niger)株を形質転換する前に、制限酵素NotIで消化することにより大腸菌(E.coli)DNAを取り除くことができる。
【図2】発現ベクターpGBFINFUA−6(実施例1に記載される構築物)のプラスミドマップを示す。pGBFINFUA−6はまた、プラスミドpGBFINFUA−8、pGBFINFUA−11、pGBFINFUA−12、pGBFINFUA−13、pGBFINFUA−15、pGBFINFUA−16及びpGBFINFUA−18を代表する。glaAプロモーターと、変異シグナル配列が導入されたα−アミラーゼをコードするA.ニガー(A.niger)amyB cDNA配列との配列に対するglaAフランキング領域を示す。A.ニガー(A.niger)株を形質転換する前に、制限酵素NotIで消化することにより大腸菌(E.coli)DNAを取り除くことができる。
【図3】単一相同組換えによる組込みの概略図を示す。発現ベクターは、選択可能なamdSマーカーと、変異シグナル配列を含むamyB遺伝子に接続されたプロモーターとを含む。これらの機構にglaA遺伝子座の相同領域(それぞれ3’glaA及び3”glaA)が隣接し、glaAゲノム遺伝子座における組込みを誘導する。
【図4】いずれもglaAプロモーターの制御下にある種々のamyBコンストラクトを発現するA.ニガー(A.niger)株の培養ブロスにおけるα−アミラーゼ活性を示す。amyBコンストラクトを発現するA.ニガー(A.niger)株の培養ブロスにおけるα−アミラーゼ活性を示し、ここで種々のコンストラクトにおいてシグナル配列は修飾されている。種々のコンストラクトに関する詳細は、表1に見ることができる。α−アミラーゼ活性は相対α−アミラーゼ単位[AU]で示され、3日目における3株のFUA6群のFUA−6 1コピー株の平均を100%に設定した。示される全ての形質転換体株について、3個の形質転換体を単離し、独立して培養した。
【図5】双方ともamyBプロモーターの制御下で2つの異なるamyBコンストラクトを発現するA.ニガー(A.niger)株の培養ブロスにおけるα−アミラーゼ活性を示す。天然amyBコンストラクト(pGBFINFUA−3)を発現するA.ニガー(A.niger)株の培養ブロスにおけるα−アミラーゼ活性を示し、ここでamyBシグナル配列は、本発明の方法に従い、コドン最適化pmeAシグナル配列(pGBFINFUA−21)となるよう修飾された。2個のコンストラクトに関する詳細は、表2に見ることができる。α−アミラーゼ活性は相対α−アミラーゼ単位[AU]で示され、3日目における3株のFUA3群のFUA−3−1 1コピー株の平均を100%に設定した。示される2個の形質転換体群について、3個の形質転換体を単離し、独立して培養した。
【図6】双方ともglaAプロモーターの制御下でP.クリソゲナム(P.chrysogenum)グルコースオキシダーゼGoxAをコードする2つの異なるコンストラクトを発現するA.ニガー(A.niger)株の培養ブロスにおけるグルコースオキシダーゼ活性を示す。天然goxAコンストラクト(GOX−1−#)を発現するA.ニガー(A.niger)株の培養ブロスにおけるグルコースオキシダーゼ活性を示し、ここでコドン最適化goxAシグナル配列は、本発明の方法に従い、コドン最適化pmeAシグナル配列(GOX−2−#)となるよう修飾された。グルコースオキシダーゼ活性は相対グルコースオキシダーゼ単位[AU]で示される。示される2個の形質転換体群について、5個の形質転換体を単離し、独立して培養した。
【0009】
[本発明の詳細な説明]
意外にも、特定のシグナル配列を使用することにより対象組換えポリペプチドの産生を改良できることが確立された。従って、本発明の第1の態様では、対象組換えポリペプチドの産生方法であって、
(i)前記ポリペプチドの産生をもたらす条件下における糸状菌宿主細胞の培養であって、前記糸状菌宿主細胞が翻訳リーディングフレーム内で第2のポリヌクレオチドに連結された第1のポリヌクレオチドを含み、前記第2のポリヌクレオチドが対象ポリペプチドをコードし、前記第1のポリヌクレオチドが、
a)配列番号25、
b)少なくとも8アミノ酸が対応位置における配列番号25の最初の10アミノ酸と同じである、15〜23アミノ酸の配列番号25の変異体、
c)1位のアミノ酸がMetであり、且つ2位のアミノ酸がVal又はLysであり、及び10アミノ酸の連続ストレッチがAla又はLeuから選択される少なくとも5アミノ酸を含む、15〜23アミノ酸の配列番号25の変異体、
d)配列番号39、
e)少なくとも8アミノ酸が対応位置における配列番号39の最初の10アミノ酸と同じである、15〜23アミノ酸の配列番号39の変異体、
f)1位のアミノ酸がMetであり、且つ2位のアミノ酸がVal又はLysであり、及び10アミノ酸の連続ストレッチがAla又はLeuから選択される少なくとも5アミノ酸を含む、15〜23アミノ酸の配列番号39の変異体、
g)配列番号44、
h)少なくとも8アミノ酸が対応位置における配列番号44の最初の10アミノ酸と同じである、15〜23アミノ酸の配列番号44の変異体、
i)1位のアミノ酸がMetであり、且つ2位のアミノ酸がVal又はLysであり、及び10アミノ酸の連続ストレッチがAla又はLeuから選択される少なくとも5アミノ酸を含む、15〜23アミノ酸の配列番号44の変異体、
j)配列番号34、
k)少なくとも8アミノ酸が対応位置における配列番号34の最初の10アミノ酸と同じである、15〜23アミノ酸の配列番号34の変異体、
l)1位のアミノ酸がMetであり、且つ2位のアミノ酸がVal又はLysであり、及び10アミノ酸の連続ストレッチがAla又はLeuから選択される少なくとも5アミノ酸を含む、15〜23アミノ酸の配列番号34の変異体、
からなる群から選択されるシグナルペプチドをコードする、培養と、
(ii)場合により、培養培地からの前記ポリペプチドの単離と、
を含む方法が提供される。
【0010】
以上に記載される方法は、本明細書では本発明に係る方法と称される。
【0011】
ある実施形態によれば、本発明の方法において、シグナルペプチドは配列番号25である。
【0012】
別の実施形態によれば、本発明の方法において、シグナルペプチドは、15〜23アミノ酸の配列番号25の変異体であって、少なくとも8アミノ酸が対応位置における配列番号25の最初の10アミノ酸と同じである変異体である。
【0013】
別の実施形態によれば、本発明の方法において、シグナルペプチドは、15〜23アミノ酸の配列番号25の変異体であって、1位のアミノ酸がMetであり、且つ2位のアミノ酸がVal又はLysであり、及び10アミノ酸の連続ストレッチがAla又はLeuから選択される少なくとも5アミノ酸を含む変異体である。
【0014】
別の実施形態によれば、本発明の方法において、シグナルペプチドは配列番号39である。
【0015】
別の実施形態によれば、本発明の方法において、シグナルペプチドは、15〜23アミノ酸の配列番号39の変異体であって、少なくとも8アミノ酸が対応位置における配列番号39の最初の10アミノ酸と同じである変異体である。
【0016】
別の実施形態によれば、本発明の方法において、シグナルペプチドは、15〜23アミノ酸の配列番号39の変異体であって、1位のアミノ酸がMetであり、且つ2位のアミノ酸がVal又はLysであり、及び10アミノ酸の連続ストレッチがAla又はLeuから選択される少なくとも5アミノ酸を含む変異体である。
【0017】
別の実施形態によれば、本発明の方法において、シグナルペプチドは配列番号44である。
【0018】
別の実施形態によれば、本発明の方法において、シグナルペプチドは、15〜23アミノ酸の配列番号44の変異体であって、少なくとも8アミノ酸が対応位置における配列番号44の最初の10アミノ酸と同じである変異体である。
【0019】
別の実施形態によれば、本発明の方法において、シグナルペプチドは、15〜23アミノ酸の配列番号44の変異体であって、1位のアミノ酸がMetであり、且つ2位のアミノ酸がVal又はLysであり、及び10アミノ酸の連続ストレッチがAla又はLeuから選択される少なくとも5アミノ酸を含む変異体である。
【0020】
別の実施形態によれば、本発明の方法において、シグナルペプチドは配列番号34である。
【0021】
別の実施形態によれば、本発明の方法において、シグナルペプチドは、15〜23アミノ酸の配列番号34の変異体であって、少なくとも8アミノ酸が対応位置における配列番号34の最初の10アミノ酸と同じである変異体である。
【0022】
別の実施形態によれば、本発明の方法において、シグナルペプチドは、15〜23アミノ酸の配列番号34の変異体であって、1位のアミノ酸がMetであり、且つ2位のアミノ酸がVal又はLysであり、及び10アミノ酸の連続ストレッチがAla又はLeuから選択される少なくとも5アミノ酸を含む変異体である。
【0023】
好ましくは、本発明に係る方法において、シグナルペプチドが、
(a):配列番号25、
(b):少なくとも8アミノ酸が対応位置における配列番号25の最初の10アミノ酸と同じである、15〜23アミノ酸の配列番号25の変異体、又は
(c)1位のアミノ酸がMetであり、且つ2位のアミノ酸がVal又はLysであり、及び10アミノ酸の連続ストレッチがAla又はLeuから選択される少なくとも5アミノ酸を含む、15〜23アミノ酸の配列番号25の変異体、
であるとき、対象ポリペプチドはペクチンメチルエステラーゼではなく、より好ましくは、対象ポリペプチドはエルウィニア・クリサンテミ(Erwinia chrysanthemi)由来のペクチンメチルエステラーゼではない。より好ましくは、シグナルペプチドが(b)又は(c)であるとき、対象ポリペプチドはペクチンメチルエステラーゼではなく、さらにより好ましくは、対象ポリペプチドはエルウィニア・クリサンテミ(Erwinia chrysanthemi)由来のペクチンメチルエステラーゼではない。
【0024】
好ましくは、配列番号25をコードするときの第1のポリヌクレオチドは、配列番号29に係るポリヌクレオチドである。好ましくは、配列番号39をコードするときの第1のポリヌクレオチドは、配列番号38に係るポリヌクレオチドである。好ましくは、配列番号44をコードするときの第1のポリヌクレオチドは、配列番号43に係るポリヌクレオチドである。好ましくは、配列番号34をコードするときの第1のポリヌクレオチドは、配列番号33に係るポリヌクレオチドである。
【0025】
好ましくは、15〜23アミノ酸の配列番号25の変異体であって、少なくとも8アミノ酸が対応位置における配列番号25の最初の10アミノ酸と同じである変異体は、少なくとも9アミノ酸が対応位置における配列番号25の最初の10アミノ酸と同じである変異体である。より好ましくは、10アミノ酸が対応位置における配列番号25の最初の10アミノ酸と同じである。
【0026】
好ましくは、15〜23アミノ酸の配列番号25の変異体であって、1位のアミノ酸がMetであり、且つ2位のアミノ酸がVal又はLysであり、及び10アミノ酸の連続ストレッチがAla又はLeuから選択される少なくとも5アミノ酸を含む変異体は、
a)1位のアミノ酸がMetであり、2、3及び/又は4位のアミノ酸がVal又はLysであり、及び10アミノ酸の連続ストレッチがAla又はLeuから選択される少なくとも5アミノ酸を含む、15〜23アミノ酸の配列番号25の変異体、
b)1位のアミノ酸がMetであり、2位のアミノ酸がValであり、且つ3位のアミノ酸がLysであり、及び10アミノ酸の連続ストレッチがAla又はLeuから選択される少なくとも5アミノ酸を含む、15〜23アミノ酸の配列番号25の変異体、
c)1位のアミノ酸がMetであり、2、3及び/又は4位のアミノ酸がVal又はLysであり、及び10アミノ酸の連続ストレッチがAla又はLeuから選択される少なくとも5アミノ酸を含み、及び変異体の最後の3つの位置のアミノ酸がAla、Leu及びAlaである、15〜23アミノ酸の配列番号25の変異体、
d)1位のアミノ酸がMetであり、2位のアミノ酸がValであり、且つ3位のアミノ酸がLysであり、及び10アミノ酸の連続ストレッチがAla又はLeuから選択される少なくとも5アミノ酸を含み、及び変異体の最後の3つの位置のアミノ酸がAla、Leu及びAlaである、15〜23アミノ酸の配列番号25の変異体、
の群から選択されるものである。
【0027】
好ましくは、15〜23アミノ酸の配列番号39の変異体であって、少なくとも8アミノ酸が対応位置における配列番号39の最初の10アミノ酸と同じである変異体は、少なくとも9アミノ酸が対応位置における配列番号39の最初の10アミノ酸と同じである変異体である。より好ましくは、10アミノ酸が対応位置における配列番号39の最初の10アミノ酸と同じである。
【0028】
好ましくは、15〜23アミノ酸の配列番号39の変異体であって、1位のアミノ酸がMetであり、且つ2位のアミノ酸がVal又はLysであり、及び10アミノ酸の連続ストレッチがAla又はLeuから選択される少なくとも5アミノ酸を含む変異体は、
a)1位のアミノ酸がMetであり、2、3及び/又は5位のアミノ酸がVal又はLysであり、及び10アミノ酸の連続ストレッチがAla又はLeuから選択される少なくとも5アミノ酸を含む、15〜23アミノ酸の配列番号39の変異体、
b)1位のアミノ酸がMetであり、2位のアミノ酸がValであり、且つ5位のアミノ酸がLysであり、及び10アミノ酸の連続ストレッチがAla又はLeuから選択される少なくとも5アミノ酸を含む、15〜23アミノ酸の配列番号39の変異体、
の群から選択されるものである。
【0029】
好ましくは、15〜23アミノ酸の配列番号44の変異体であって、少なくとも8アミノ酸が対応位置における配列番号44の最初の10アミノ酸と同じである変異体は、少なくとも9アミノ酸が対応位置における配列番号44の最初の10アミノ酸と同じである変異体である。より好ましくは、10アミノ酸が対応位置における配列番号44の最初の10アミノ酸と同じである。
【0030】
好ましくは、15〜23アミノ酸の配列番号44の変異体であって、1位のアミノ酸がMetであり、且つ2位のアミノ酸がVal又はLysであり、及び10アミノ酸の連続ストレッチがAla又はLeuから選択される少なくとも5アミノ酸を含む変異体は、
a)1位のアミノ酸がMetであり、2、3及び/又は4位のアミノ酸がVal又はLysであり、及び10アミノ酸の連続ストレッチがAla又はLeuから選択される少なくとも5アミノ酸を含む、15〜23アミノ酸の配列番号44の変異体、
b)1位のアミノ酸がMetであり、2位のアミノ酸がValであり、且つ4位のアミノ酸がLysであり、及び10アミノ酸の連続ストレッチがAla又はLeuから選択される少なくとも5アミノ酸を含む、15〜23アミノ酸の配列番号44の変異体、
の群から選択されるものである。
【0031】
好ましくは、15〜23アミノ酸の配列番号34の変異体であって、少なくとも8アミノ酸が対応位置における配列番号34の最初の10アミノ酸と同じである変異体は、少なくとも9アミノ酸が対応位置における配列番号34の最初の10アミノ酸と同じである変異体である。より好ましくは、10アミノ酸が対応位置における配列番号34の最初の10アミノ酸と同じである。
【0032】
好ましくは、15〜23アミノ酸の配列番号34の変異体であって、1位のアミノ酸がMetであり、且つ2位のアミノ酸がVal又はLysであり、及び10アミノ酸の連続ストレッチがAla又はLeuから選択される少なくとも5アミノ酸を含む変異体は、
a)1位のアミノ酸がMetであり、2、3及び/又は4位のアミノ酸がLysであり、及び10アミノ酸の連続ストレッチがAla又はLeuから選択される少なくとも5アミノ酸を含む、15〜23アミノ酸の配列番号34の変異体、
b)1位のアミノ酸がMetであり、2位のアミノ酸がLysであり、且つ3及び/又は4位のアミノ酸がLysであり、及び10アミノ酸の連続ストレッチがAla又はLeuから選択される少なくとも5アミノ酸を含む、15〜23アミノ酸の配列番号34の変異体、
c)1位のアミノ酸がMetであり、2、3及び/又は4位のアミノ酸がLysであり、及び10アミノ酸の連続ストレッチがAla又はLeuから選択される少なくとも5アミノ酸を含み、及び変異体の最後の3つの位置のアミノ酸がAla、Leu及びAlaである、15〜23アミノ酸の配列番号34の変異体、
d)1位のアミノ酸がMetであり、2位のアミノ酸がLysであり、且つ3及び/又は4位のアミノ酸がLysであり、及び10アミノ酸の連続ストレッチがAla又はLeuから選択される少なくとも5アミノ酸を含み、及び変異体の最後の3つの位置のアミノ酸がAla、Leu及びAlaである、15〜23アミノ酸の配列番号34の変異体、
e)1位のアミノ酸がMetであり、2位のアミノ酸がValであり、及び10アミノ酸の連続ストレッチがAla又はLeuから選択される少なくとも5アミノ酸を含む、15〜23アミノ酸の配列番号34の変異体、
f)1位のアミノ酸がMetであり、2位のアミノ酸がValであり、及び10アミノ酸の連続ストレッチがAla又はLeuから選択される少なくとも5アミノ酸を含み、及び変異体の最後の3つの位置のアミノ酸がAla、Leu及びAlaである、15〜23アミノ酸の配列番号34の変異体、
g)1位のアミノ酸がMetであり、2位のアミノ酸がValであり、及び10アミノ酸の連続ストレッチがAla又はLeuから選択される少なくとも5アミノ酸を含み、及び変異体の最後の3つの位置におけるアミノ酸がAla、Leu、Alaである、15〜23アミノ酸の配列番号34の変異体、
h)1位のアミノ酸がMetであり、2位のアミノ酸がValであり、及び10アミノ酸の連続ストレッチが少なくとも5個のAlaを含む、15〜23アミノ酸の配列番号34の変異体、
i)1位のアミノ酸がMetであり、2位のアミノ酸がValであり、及び10アミノ酸の連続ストレッチが少なくとも4個のAlaと1個のLeuとを含む、15〜23アミノ酸の配列番号34の変異体、
j)1位のアミノ酸がMetであり、2位のアミノ酸がValであり、及び10アミノ酸の連続ストレッチが少なくとも3個のAlaと2個のLeuとを含む、15〜23アミノ酸の配列番号34の変異体、
k)1位のアミノ酸がMetであり、2位のアミノ酸がValであり、及び10アミノ酸の連続ストレッチが少なくとも2個のAlaと3個のLeuとを含む、15〜23アミノ酸の配列番号34の変異体、
l)1位のアミノ酸がMetであり、2位のアミノ酸がValであり、及び10アミノ酸の連続ストレッチが少なくとも1個のAlaと4個のLeuとを含む、15〜23アミノ酸の配列番号34の変異体、
m)1位のアミノ酸がMetであり、2位のアミノ酸がValであり、及び10アミノ酸の連続ストレッチが少なくとも5個のLeuを含む、15〜23アミノ酸の配列番号34の変異体、
n)1位のアミノ酸がMetであり、2位のアミノ酸がLysであり、及び10アミノ酸の連続ストレッチがAla又はLeuから選択される少なくとも5アミノ酸を含む、15〜23アミノ酸の配列番号34の変異体、
o)1位のアミノ酸がMetであり、2位のアミノ酸がLysであり、及び10アミノ酸の連続ストレッチがAla又はLeuから選択される少なくとも5アミノ酸を含み、及び変異体の最後の3つの位置におけるアミノ酸がAla、Leu、Alaである、15〜23アミノ酸の配列番号34の変異体、
p)1位のアミノ酸がMetであり、2位のアミノ酸がLysであり、及び10アミノ酸の連続ストレッチが少なくとも5個のAlaを含む、15〜23アミノ酸の配列番号34の変異体、
q)1位のアミノ酸がMetであり、2位のアミノ酸がLysであり、及び10アミノ酸の連続ストレッチが少なくとも4個のAlaと1個のLeuとを含む、15〜23アミノ酸の配列番号34の変異体、
r)1位のアミノ酸がMetであり、2位のアミノ酸がLysであり、及び10アミノ酸の連続ストレッチが少なくとも3個のAlaと2個のLeuとを含む、15〜23アミノ酸の配列番号34の変異体、
s)1位のアミノ酸がMetであり、2位のアミノ酸がLysであり、及び10アミノ酸の連続ストレッチが少なくとも2個のAlaと3個のLeuとを含む、15〜23アミノ酸の配列番号34の変異体、
t)1位のアミノ酸がMetであり、2位のアミノ酸がLysであり、及び10アミノ酸の連続ストレッチが少なくとも1個のAlaと4個のLeuとを含む、15〜23アミノ酸の配列番号34の変異体、
u)1位のアミノ酸がMetであり、2位のアミノ酸がLysであり、及び10アミノ酸の連続ストレッチが少なくとも5個のLeuを含む、15〜23アミノ酸の配列番号34の変異体、
の群から選択されるものである。
【0033】
以上の配列番号25の(a)〜(d)、配列番号39の(a)及び(b)、配列番号44の(a)及び(b)並びに配列番号34の(a)〜(u)の変異体において、連続ストレッチは、好ましくは10アミノ酸、より好ましくは9アミノ酸、さらにより好ましくは8アミノ酸、及び最も好ましくは7アミノ酸である。
【0034】
以上の配列番号25の(a)〜(d)、配列番号39の(a)及び(b)、配列番号44の(a)及び(b)並びに配列番号34の(a)〜(u)の変異体において、アミノ酸の連続ストレッチは、好ましくはAla又はLeuから選択される少なくとも5アミノ酸、より好ましくはAla又はLeuから選択される少なくとも6アミノ酸、及び最も好ましくはAla又はLeuから選択される少なくとも7アミノ酸を含む。
【0035】
15〜23アミノ酸の配列番号25、配列番号39、配列番号44、又は配列番号34の変異体は、15アミノ酸、17アミノ酸、18アミノ酸、19アミノ酸、20アミノ酸、21アミノ酸、22アミノ酸又は23アミノ酸を含んでもよい。
【0036】
以上に記載される第1のポリヌクレオチドによりコードされるシグナルペプチドは、本明細書では本発明に係るシグナルペプチドと称される。
【0037】
「ペプチド」又は「オリゴペプチド」は、本明細書では、直鎖状に構成され、且つ隣接するアミノ酸残基のカルボキシル基とアミノ基との間のペプチド結合により互いにつなぎ合わされた少なくとも2個のアミノ酸からなる分子を指す。用語「ペプチド」及び「オリゴペプチド」は(一般に認識されるとおり)同義語と見なされ、文脈上の必要に応じて各用語を代替的に使用することができる。「ポリペプチド」は、本明細書では、少なくとも40アミノ酸を含む分子を指す。
【0038】
本発明との関連において、用語「シグナルペプチド」は、本明細書では、ポリペプチドを宿主細胞の分泌経路に導くペプチドとして定義される。シグナル配列は、必ずしもそうとは限らないものの通常は、ポリペプチドのアミノ末端に存在し、ポリペプチドにインフレームで融合される。シグナルペプチドとポリペプチドのアミノ末端との間には、プロペプチドが存在し得る。シグナル配列は、必ずしもそうとは限らないものの通常は、分泌過程でポリペプチドから切断され、成熟ポリペプチドをもたらす。当業者には、シグナル配列の同定方法は公知である。様々なツール及び充実した文献が利用可能である。本発明の限定として解釈されてはならない例としては、
「シグナル配列の切断部位を予測するための新規方法(A new method for predicting signal sequence cleavage sites)」von Heijne G. Nucleic Acids Res.1986年6月11日号;14(11):4683〜90頁
「原核生物及び真核生物シグナルペプチドの同定並びにその切断部位の予測(Identification of prokaryotic and eukaryotic signal peptides and prediction of their cleavage sites)」Henrik Nielsen、Jacob Engelbrecht、Soren Brunak及びGunnar von Heijne、Protein Engineering、10:1〜6頁、1997年
「TargetP、SignalP、及び関連ツールを使用した細胞内のタンパク質位置決定(Locating proteins in the cell using TargetP,SignalP,and related tools)」Olof Emanuelsson、Soren Brunak、Gunnar von Heijne、Henrik Nielsen、Nature Protocols 2、953〜971頁(2007年)
ウェブサイト:http://www.cbs.dtu.dk/services/SignalP/
である。
【0039】
用語「プロペプチド」は、本明細書では、ポリペプチドのアミノ末端にインフレームで融合したペプチドとして定義される。得られるポリペプチドはプロポリペプチドとして知られ、プロポリペプチドからのプロペプチドの自己触媒的切断の触媒により成熟ポリペプチドに変換され得る。
【0040】
シグナルペプチド及びプロペプチドは、本明細書では合わせて「プレプロペプチド」と称され、シグナル配列がプロペプチドにインフレームで融合し、及びプロペプチドがポリペプチドのアミノ末端にインフレームで融合する。
【0041】
シグナルペプチド、プロペプチド及びプレプロペプチドは、当該技術分野では「リーダー配列」と称されることもある。
【0042】
用語「成熟ポリペプチド」は、本明細書では、翻訳、翻訳後修飾、例えばN末端プロセシング、C末端プロセシング、グリコシル化、リン酸化及び任意選択での切断によるリーダー配列の除去を経たその最終形態にあるポリペプチドとして定義される。
【0043】
本発明との関連において用語「ポリペプチド」及び「タンパク質」は同じであり、本発明の記載全体を通じ、同義的に読まれ得る。
【0044】
本発明との関連において、用語「組換え」は、宿主細胞がランダム突然変異誘発に供されることによって誘導される天然に存在するプロセス及び/又は遺伝子修飾のみが関与すのではない任意の遺伝子修飾を指す。結果的に、組換えのプロセス及び/又は遺伝子修飾と、宿主細胞がランダム突然変異誘発に供されることによって誘導される天然に存在するプロセス及び/又は遺伝子修飾との組み合わせは、組換えとして解釈される。好ましくは、組換え遺伝子修飾には、宿主細胞がランダム突然変異誘発に供されることにより誘導される天然に存在するプロセス及び/又は遺伝子修飾が関与しない。
【0045】
用語「作動可能に連結された」は、本明細書では、制御配列がコード配列の発現を誘導するように、制御配列がコード配列に対して適切な位置に配置される構成として定義される。
【0046】
本明細書に定義されるとおりの用語「コード配列」は、mRNAに転写され、本発明に係るポリペプチドに翻訳される配列である。コード配列の境界は、概してmRNAの5’側でATG又は他の開始コドンにより、及びmRNAの3’側でオープンリーディングフレームの終端となる翻訳終止コドン配列により決定される。コード配列としては、限定はされないが、DNA、cDNA、及び組換え核酸配列が挙げられる。
【0047】
用語「変異ペプチド」又は「変異ポリペプチド」は、本明細書では、それぞれペプチド又はポリペプチド内の1つ又は複数の特定の位置に1つ又は複数の特定のアミノ酸残基の置換、挿入、欠失及び/又は切断などの1つ又は複数の改変を含むそれぞれペプチド又はポリペプチドとして定義される。従って、変異シグナルペプチドは、シグナルペプチド内の1つ又は複数の特定の位置に1つ又は複数の特定のアミノ酸残基の置換、挿入、欠失及び/又は切断などの1つ又は複数の改変を含むシグナルペプチドである。
【0048】
本発明に係る変異シグナルペプチドの対応位置は、シグナルペプチドの配列番号25、配列番号39、配列番号44、又は配列番号34などの参照配列に対するアラインメントにより決定される。適用可能な場合には、ペプチド、ポリペプチド又はポリヌクレオチドのアラインメント又はマルチアラインメントを、当該技術分野において公知の方法を用いて行うことができる。かかる方法としては、限定はされないが、ClustalW(Thompsonら、1994年、Nucleic Acid Research 22、4673〜4680頁)、BLAST、GAP、MAP、MultiBLAST、及びスミス・ウォーターマンが挙げられる。
【0049】
用語「ポリヌクレオチド」は用語「核酸分子」と同じであり、本明細書では同義的に読まれ得る。この用語は、一本鎖又は二本鎖のいずれかであるリボ核酸(RNA)又はデオキシリボ核酸(DNA)分子であるポリヌクレオチド分子を指す。ポリヌクレオチドは、単離された形態で存在してもよく、又は組換え核酸分子又はベクター中に含まれてもよく、又は宿主細胞中に含まれてもよい。
【0050】
用語「変異ポリヌクレオチド」は、本明細書では、ポリヌクレオチド内の1つ又は複数の特定の位置に1つ又は複数のヌクレオチドの置換、挿入、欠失及び/又は切断などの1つ又は複数の改変を含むポリヌクレオチドとして定義される。
【0051】
本発明に係るシグナルペプチドは、第2のポリヌクレオチドによりコードされる対象ポリペプチドと天然に関係を有するものであってもよく、又は第2のポリヌクレオチドによりコードされる対象ポリペプチドにとって外来性であってもよい。好ましくは、本発明に係るシグナルペプチドは、第2のポリヌクレオチドによりコードされる対象ポリペプチドにとって外来性である。変異シグナルペプチドは、本明細書では、第2のポリヌクレオチドによりコードされる対象ポリペプチドにとって外来性のものとして定義される。
【0052】
対象ポリペプチドと天然に関係を有するシグナルペプチドは、当該技術分野において公知の標準的な分子クローニング技法を用いて、天然に関係を有するシグナルペプチドをコードするポリヌクレオチドを本発明に係るシグナルペプチドに物理的に置き換えることにより、本発明に係るシグナルペプチドに置き換えてもよい。かかる方法は、Sambrook及びRussell、「Molecular Cloning:A Laboratory Manual」第3版、CSHL Press、Cold Spring Harbor、NY、2001年;及びAusubelら、「Current Protocols in Molecular Biology」、Wiley InterScience、NY、1995年に広範な記載がなされている。
【0053】
或いは、対象ポリペプチドと天然に関係を有するシグナルペプチドは、公知の方法を用いた、天然に関係を有するシグナルペプチドをコードするポリヌクレオチドの部位特異的突然変異誘発により、本発明に係るシグナルペプチドに変換されてもよい(例えばSambrook及びRussel、上記を参照のこと)。
【0054】
本発明に係るシグナルペプチドは、糸状菌宿主細胞にとって天然であっても、又は外来性であってもよい。好ましくは、本発明に係るシグナルペプチドは糸状菌宿主細胞にとって天然である。
【0055】
好ましくは、本発明に係る方法は、翻訳リーディングフレーム内でその天然シグナルペプチドをコードするポリヌクレオチドと連結された第2のポリヌクレオチドによりコードされる対象ポリペプチドと比較したとき、同一条件下での培養時に、翻訳リーディングフレーム内で本発明に係るシグナルペプチドをコードする第1のポリヌクレオチドと連結された第2のポリヌクレオチドによりコードされる対象組換えポリペプチドを少なくとも10%多く、より好ましくは少なくとも25%多く、さらにより好ましくは少なくとも50%多く、さらにより好ましくは少なくとも75%多く、さらにより好ましくは少なくとも100%多く、さらにより好ましくは少なくとも200%多く、最も好ましくは少なくとも500%多く産生する。
【0056】
対象ポリペプチドをコードする第2のポリヌクレオチドは、当業者に公知の一般的な方法により提供され得る。かかる方法は、Sambrook及びRussell、上記に広範な記載がなされている。前記方法の例は以下のとおりである。第2のポリヌクレオチドの配列が既知である場合、又はコードされる対象ポリペプチドの配列が既知である場合、ポリヌクレオチドは、そのポリヌクレオチドを天然に発現する宿主細胞から単離されてもよい。或いは、ポリヌクレオチドは化学的に合成されてもよい。例えば本明細書において以下に記載されるとおりのコドン最適化方法を用いて、選択した宿主細胞のコドン使用を適合させてもよい。ポリペプチドの配列が未知である場合、初めに当該技術分野において公知の方法を用いてその配列が決定され得る(Sambrook及びRussel、上記)。
【0057】
本明細書において組み合わされる、又は単独でのポリヌクレオチドは(すなわち、翻訳リーディングフレーム内で第2のポリヌクレオチドに連結された第1のポリヌクレオチドであって、前記第2のポリヌクレオチドが対象ポリペプチドをコードし、前記第1のポリヌクレオチドがシグナルペプチドをコードするもの;又は第1のポリヌクレオチド単独又は第2のポリヌクレオチド単独)、合成ポリヌクレオチドであってもよい。合成ポリヌクレオチドは、好ましくは、参照により本明細書に援用される国際公開第2006/077258号パンフレット及び/又はPCT/EP2007/055943号明細書に記載される方法により、コドン使用が最適化されてもよい。PCT/EP2007/055943号明細書はコドン対最適化を取り上げている。コドン対最適化は、ポリペプチドをコードするヌクレオチド配列がそのコドン使用頻度、特に使用されるコドン対に関して修飾されており、それによりポリペプチドをコードするヌクレオチド配列の発現の向上及び/又はコードされたポリペプチドの産生の向上が達成される方法である。コドン対は、コード配列内の2つの連続するトリプレット(コドン)の組として定義される。
【0058】
本明細書において組み合わされる、又は単独でのポリヌクレオチドは(すなわち、翻訳リーディングフレーム内で第2のポリヌクレオチドに連結された第1のポリヌクレオチドであって、前記第2のポリヌクレオチドが対象ポリペプチドをコードし、前記第1のポリヌクレオチドがシグナルペプチドをコードするもの;又は第1のポリヌクレオチド単独又は第2のポリヌクレオチド単独)、1つ又は複数のイントロンを含んでもよい。
【0059】
翻訳リーディングフレーム内でポリヌクレオチドを互いに連結する方法は、当該技術分野では一般的なクローニング技法として公知である(Sambrook及びRussell、上記)。例は、消化、ライゲーション、PCR、化学合成等である。従って、第1のポリヌクレオチドは、かかる当該技術分野において公知の方法により翻訳リーディングフレーム内で第2のポリヌクレオチドに連結することができる。
【0060】
翻訳リーディングフレーム内で第2のポリヌクレオチドに連結された第1のポリヌクレオチドを含む糸状菌宿主細胞であって、前記第2のポリヌクレオチドが対象ポリペプチドをコードし、前記第1のポリヌクレオチドが本発明に係るシグナルペプチドをコードする糸状菌宿主細胞は、当該技術分野において公知の方法を用いて構築することができる。好ましくは、前記糸状菌宿主細胞は、
− 好適な糸状菌宿主細胞を提供するステップと、
− 翻訳リーディングフレーム内で前記第2のポリヌクレオチドに連結された前記第1のポリヌクレオチドにより前記宿主細胞を形質転換するステップと、
を含む方法により構築される。
【0061】
ポリヌクレオチド、発現ベクター又は核酸コンストラクトを細胞に導入することによる宿主細胞の形質転換は、好ましくは当該技術分野において公知の技法により実施される(Sambrook及びRussell;Ausubel、上記を参照のこと)。形質転換には、それ自体公知の方法によるプロトプラスト形成、プロトプラストの形質転換、及び細胞壁の再生からなるプロセスが関与する。アスペルギルス属(Aspergillus)細胞の形質転換に好適な手順が、欧州特許第238 023号明細書及びYeltonら、1984年、Proceedings of the National Academy of Sciences USA 81:1470〜1474頁に記載されている。アグロバクテリウム・ツメファシエンス(Agrobacterium tumefaciens)を使用するアスペルギルス属(Aspergillus)及び他の糸状菌宿主細胞の形質転換に好適な手順が、例えばDe Grootら、「アグロバクテリウム・ツメファシエンス(Agrobacterium tumefaciens)の媒介による糸状菌の形質転換(Agrobacterium tumefaciens−mediated transformation of filamentous fungi)」、Nat Biotechnol.1998、16:839〜842頁、訂正記事:Nat Biotechnol 1998 16:1074頁に記載されている。フザリウム属(Fusarium)種を形質転換する好適な方法が、Malardierら、1989年、Gene 78:147156頁又は国際公開第96/00787号パンフレットに記載されている。Christiansenら、「偏性植物病原真菌の微粒子銃形質転換(Biolistic transformation of the obligate plant pathogenic fungus)」、Erysiphe graminis f.sp.hordei.1995年、Curr Genet.29:100〜102頁に記載されるとおりの微粒子銃形質転換を用いる方法など、他の方法を適用することもできる。酵母は、Becker及びGuarente、Abelson,J.N.及びSimon,M.I.編、「Guide to Yeast Genetics and Molecular Biology,Methods in Enzymology」所収、第194巻、182〜187頁、Academic Press,Inc.、New York;Itoら、1983年、Journal of Bacteriology 153:163頁;及びHinnenら、1978年、Proceedings of the National Academy of Sciences USA 75:1920頁により記載される手順を用いて形質転換されてもよい。
【0062】
本発明に係る糸状菌宿主細胞は、当該技術分野において公知の方法を用いた対象組換えポリペプチドの産生に好適な栄養培地において培養される。例えば、細胞は、好適な培地中、且つポリペプチドの発現及び/又は単離を可能にする条件下で、振盪フラスコ培養法、実験室又は工業用発酵槽内での小規模又は大規模発酵法(連続、バッチ、フェドバッチ、又は固体発酵を含む)により培養されてもよい。培養は、当該技術分野において公知の手順を用いて、炭素源及び窒素源並びに無機塩類を含む好適な栄養培地中で行われる(例えば、Bennett,J.W.及びLaSure,L.編、「More Gene Manipulations in Fungi」、Academic Press、CA、1991年を参照のこと)。好適な培地は供給業者から入手可能であり、又は公表されている組成物(例えば、American Type Culture Collectionのカタログにある)を使用して調製されてもよい。ポリペプチドが栄養培地中に分泌される場合、ポリペプチドは、培養培地から直接回収することができる。ポリペプチドが分泌されない場合、それは細胞溶解物から回収される。
【0063】
産生される対象組換えポリペプチドは、当該技術分野において公知の方法により培養培地から回収され得る。例えば、ポリペプチドは、限定はされないが、遠心、ろ過、抽出、噴霧乾燥、蒸発、又は沈殿を含めた従来の手順により培養培地から回収されてもよい。
【0064】
対象組換えポリペプチドは、限定はされないが、クロマトグラフィー(例えば、イオン交換、親和性、疎水性、クロマトフォーカシング、及びサイズ排除)、電気泳動法による手順(例えば、分取等電点電気泳動法)、溶解度差(例えば、硫酸アンモニウム沈殿)、SDS−PAGE、又は抽出を含む当該技術分野において公知の様々な手順により精製されてもよい(例えば、「Protein Purification」、編者J.−C.Janson及びLars Ryden、VCH Publishers、New York、1989年を参照のこと)。
【0065】
対象組換えポリペプチドは、ポリペプチドに特異的な当該技術分野において公知の方法を用いて検出されてもよい。これらの検出方法としては、特異的抗体の使用、高速液体クロマトグラフィー、キャピラリークロマトグラフィー、電気泳動法、酵素産物の形成、又は酵素基質の消失を挙げることができる。
【0066】
本発明に係る宿主細胞は糸状菌宿主細胞である。「糸状菌」は、あらゆる糸状の形態の真菌(Eumycota)及び卵菌(Oomycota)亜門(Hawksworthら、「Ainsworth and Bisby’s Dictionary of The Fungi」第8版、1995年、CAB International、University Press、Cambridge、英国により定義されるとおり)を含む。糸状菌は、キチン、セルロース、グルカン、キトサン、マンナン、及び他の複合多糖類からなる菌糸壁によって特徴付けられる。栄養成長は菌糸伸長により、及び炭素異化は絶対好気性である。糸状菌株としては、限定はされないが、アクレモニウム属(Acremonium)、アガリクス属(Agaricus)、アスペルギルス属(Aspergillus)、アウレオバシジウム属(Aureobasidium)、クリソスポリウム属(Chrysosporium)、コプリナス属(Coprinus)、クリプトコッカス属(Cryptococcus)、フィリバシジウム属(Filibasidium)、フザリウム属(Fusarium)、フミコラ属(Humicola)、マグナポルテ属(Magnaporthe)、ムコール属(Mucor)、ミセリオフトラ属(Myceliophthora)、ネオカリマスティクス属(Neocallimastix)、ニューロスポラ属(Neurospora)、ペシロミセス属(Paecilomyces)、ペニシリウム属(Penicillium)、ピロミセス属(Piromyces)、パネロカエテ属(Panerochaete)、プレウロタス属(Pleurotus)、スポロトリクム属(Sporotrichum)、シゾフィラム属(Schizophyllum)、タラロミセス属(Talaromyces)、サーモアスカス属(Thermoascus)、チエラビア属(Thielavia)、トリポクラジウム属(Tolypocladium)、及びトリコデルマ属(Trichoderma)の株が挙げられる。
【0067】
好ましい糸状菌細胞は、アクレモニウム属(Acremonium)、アスペルギルス属(Aspergillus)、クリソスポリウム属(Chrysosporium)、ミセリオフトラ属(Myceliophthora)、ペニシリウム属(Penicillium)、スポロトリクム属(Sporotrichum)、タラロミセス属(Talaromyces)、チエラビア属(Thielavia)又はトリコデルマ属(Trichoderma)の種、及び最も好ましくは、アクレモニウム・アラバメンシス(Acremonium alabamensis)、アスペルギルス・ニガー(Aspergillus niger)、アスペルギルス・アワモリ(Aspergillus awamori)、アスペルギルス・フォエティダス(Aspergillus foetidus)、アスペルギルス・ソジャエ(Aspergillus sojae)、アスペルギルス・フミガツス(Aspergillus fumigatus)、アスペルギルス・オリゼ(Aspergillus oryzae)、クリソスポリウム・ルクノウェンセ(Chrysosporium lucknowense)、ミセリオフトラ・サーモフィラ(Myceliophthora thermophila)、スポロトリクム・セルロフィルム(Sporotrichum cellulophilum)、チエラビア・テレストリス(Thielavia terrestris)、トリコデルマ・リーゼイ(Trichoderma reesei)、タラロミセス・エメルソニイ(Talaromyces emersonii)又はペニシリウム・クリソゲナム(Penicillium chrysogenum)の種に属する。
【0068】
糸状菌のいくつかの株、アスペルギルス・ニガー(Aspergillus niger)CBS513.88、アスペルギルス・オリゼ(Aspergillus oryzae)ATCC 20423、IFO 4177、ATCC 1011、ATCC 9576、ATCC14488−14491、ATCC 11601、ATCC12892、P.クリソゲナム(P.chrysogenum)CBS 455.95、ペニシリウム・シトリナム(Penicillium citrinum)ATCC 38065、ペニシリウム・クリソゲナム(Penicillium chrysogenum)P2、アクレモニウム・クリソゲナム(Acremonium chrysogenum)ATCC 36225又はATCC 48272、トリコデルマ・リーゼイ(Trichoderma reesei)ATCC 26921又はATCC 56765又はATCC 26921、アスペルギルス・ソーヤ(Aspergillus sojae)ATCC11906、クリソスポリウム・ルクノウェンセ(Chrysosporium lucknowense)ATCC44006、タラロミセス・エメルソニイ(Talaromyces emersonii)CBS393.64又はCBS814.70及びそれらの誘導体は、American Type Culture Collection(ATCC)、Deutsche Sammlung von Mikroorganismen und Zellkulturen GmbH(DSM)、Centraalbureau Voor Schimmelcultures(CBS)、及びAgricultural Research Service Patent Culture Collection、Northern Regional Research Center(NRRL)などの数多くのカルチャーコレクションにおいて一般に容易に入手可能である。
【0069】
場合により、宿主細胞は、対象ポリペプチドの産生能を亢進させるため、野生型細胞と比較して高い小胞体ストレス応答(UPR)を含む。UPRは、米国特許出願公開第2004/0186070A1号明細書及び/又は米国特許出願公開第2001/0034045A1号明細書及び/又は国際公開第01/72783A2号パンフレット及び/又は国際公開第2005/123763号パンフレットに記載される技法により増加させ得る。より具体的には、高いUPRを有する宿主細胞が得られるようHAC1及び/又はIRE1及び/又はPTC2のタンパク質レベルが調節されているか、及び/又はSEC61タンパク質が操作されている。
【0070】
それに代えて、又は高いUPRとの組み合わせで、宿主細胞は、対象ポリペプチドの産生能を亢進させるため、野生型細胞と比較してより低いプロテアーゼ発現及び/又はプロテアーゼ分泌を呈する表現型を得るように遺伝子修飾される。かかる表現型は、プロテアーゼの発現の転写制御因子を欠失及び/又は修飾及び/又は不活化させることによって得てもよい。かかる転写制御因子は、例えばprtTである。prtTを調節することによるプロテアーゼの発現の低下は、米国特許出願公開第2004/0191864A1号明細書に記載される技法により実施され得る。
【0071】
それに代えて、又は高いUPR及び/又はより低いプロテアーゼ発現及び/又はプロテアーゼ分泌を呈する表現型との組み合わせで、宿主細胞は対象ポリペプチドの産生収率を亢進させるためシュウ酸欠損表現型を呈する。シュウ酸欠損表現型は、国際公開第2004/070022A2号パンフレットに記載される技法により得てもよい。
【0072】
それに代えて、又は高いUPR及び/又は高いUPR及び/又はより低いプロテアーゼ発現及び/又はプロテアーゼ分泌を呈する表現型及び/又はシュウ酸欠損との組み合わせで、宿主細胞は、対象ポリペプチドの産生収率を亢進させるため、野生型細胞と比較して表現型の違いの組み合わせを呈する。これらの違いとしては、限定はされないが、グルコアミラーゼ及び/又は中性α−アミラーゼA及び/又は中性α−アミラーゼB、プロテアーゼ、及びシュウ酸ヒドロラーゼの発現の低下を挙げることができる。宿主細胞が呈する前記表現型の違いは、米国特許出願公開第2004/0191864A1号明細書に記載される技法に係る遺伝子修飾によって得てもよい。
【0073】
それに代えて、又は対象ポリペプチドの産生収率を亢進させるための野生型細胞との比較における高いUPR及び/又はより低いプロテアーゼ発現及び/又はプロテアーゼ分泌を呈する表現型及び/又はシュウ酸欠損及び表現型の違いの組み合わせとの組み合わせで、宿主細胞は毒素遺伝子の欠損を呈し、糸状菌宿主細胞の毒素発現能力が無効にされる。かかる毒素としては、限定はされないが、オクラトキシン、フモニシン、シクラピアゾン酸(cyclapiazonic acid)、3−ニトロプロピオン酸、エモジン、マルフォルミン、アフラトキシン及びセカロン酸が挙げられる。かかる欠損は、好ましくは国際公開第2000/039322号パンフレットに記載されるようなものである。
【0074】
対象ポリペプチドは、対象の生物活性を有する任意のポリペプチドであってよい。ポリペプチドは天然であっても、又は宿主細胞にとって異種であってもよい。異種ポリペプチドは、本明細書では、宿主細胞にとって天然ではないポリペプチド、又はポリペプチドを改変するよう構造的な修飾が加えられた天然ポリペプチドとして定義される。ポリペプチドはコラーゲン若しくはゼラチンであっても、又はその変異体若しくはハイブリッドであってもよい。ポリペプチドは、抗体若しくはその一部、抗原、凝固因子、酵素、ホルモン若しくはホルモン変異体、受容体若しくはその一部、調節タンパク質、構造タンパク質、レポーター、又は輸送タンパク質、分泌過程に天然に関与するタンパク質、フォールディング過程に関与するタンパク質、シャペロン、ペプチドアミノ酸トランスポーター、グリコシル化因子、転写因子、オリゴペプチド、天然の細胞内タンパク質であってもよい。天然の細胞内タンパク質は、プロテアーゼ、セラミダーゼ、エポキシドヒドロラーゼ、アミノペプチダーゼ、アシラーゼ、アルドラーゼ、ヒドロキシラーゼ、アミノペプチダーゼ、リパーゼなどの酵素であってもよい。対象組換えポリペプチドは、好ましくは細胞外で分泌される酵素である。かかる酵素は、オキシドレダクターゼ、トランスフェラーゼ、ヒドロラーゼ、リアーゼ、イソメラーゼ、リガーゼ、カタラーゼ、セルラーゼ、キチナーゼ、クチナーゼ、デオキシリボヌクレアーゼ、デキストラナーゼ、エステラーゼの群に属し得る。酵素は、カルボヒドラーゼ、例えば、エンドグルカナーゼ、β−グルカナーゼ、セロビオヒドロラーゼ又はβ−グルコシダーゼなどのセルラーゼ、ヘミセルラーゼ、又はペクチン分解酵素、例えば、キシラナーゼ、キシロシダーゼ、マンナナーゼ、ガラクタナーゼ、ガラクトシダーゼ、ペクチンメチルエステラーゼ、ペクチンリアーゼ、ペクチン酸リアーゼ、エンドポリガラクツロナーゼ、エキソポリガラクツロナーゼ、ラムノガラクツロナーゼ、アラバナーゼ、アラビノフラノシダーゼ、アラビノキシランヒドロラーゼ、ガラクツロナーゼ、リアーゼ、又はデンプン分解酵素;ヒドロラーゼ、イソメラーゼ、又はリガーゼ、フィターゼなどのホスファターゼ、リパーゼなどのエステラーゼ、タンパク質分解酵素、オキシダーゼなどのオキシドレダクターゼ、トランスフェラーゼ、又はイソメラーゼであってもよい。酵素はフィターゼであってよい。酵素は、アスパラギナーゼ、アミノペプチダーゼ、アミラーゼ、カルボヒドラーゼ、カルボキシペプチダーゼ、エンドプロテアーゼ、メタロプロテアーゼ、セリンプロテアーゼカタラーゼ、キチナーゼ、クチナーゼ、シクロデキストリングリコシルトランスフェラーゼ、デオキシリボヌクレアーゼ、エステラーゼ、α−ガラクトシダーゼ、β−ガラクトシダーゼ、グルコアミラーゼ、α−グルコシダーゼ、β−グルコシダーゼ、ハロペルオキシダーゼ、タンパク質分解酵素、インベルターゼ、ラッカーゼ、リパーゼ、マンノシダーゼ、ミュータン分解酵素、オキシダーゼ、ペクチン分解酵素、ペルオキシダーゼ、ホスホリパーゼ、ポリフェノールオキシダーゼ、リボヌクレアーゼ、トランスグルタミナーゼ、又はグルコースオキシダーゼ、ヘキソースオキシダーゼ、モノオキシゲナーゼであってもよい。
【0075】
ポリペプチドは、上述のポリペプチドの天然に存在する対立遺伝子の変異体及び操作された変異体をさらに含む。
【0076】
本発明によれば、対象ポリペプチドはまた、別のポリペプチドがそのポリペプチド又はその断片のN末端又はC末端に融合された融合又はハイブリッドポリペプチドであってもよい。融合ポリペプチドは、あるポリペプチドをコードする核酸配列(又はその一部分)を、別のポリペプチドをコードする核酸配列(又はその一部分)と融合することにより産生される。
【0077】
ハイブリッドポリペプチドは、1つ又は複数が宿主細胞にとって異種であってもよい少なくとも2つの異なるポリペプチドから得られた部分的又は完全なポリペプチド配列の組み合わせを含んでもよい。
【0078】
本発明に係る方法は、好都合には対象組換えポリペプチドの産生に用いられる。
【0079】
従って、第2の態様において本発明は、本発明の第1の態様に係る方法により産生される対象組換えポリペプチドに関する。好ましくは、前記ポリペプチドは、以上に記載されるとおりの酵素である。
【0080】
本発明はさらに、中間産物、すなわち、翻訳リーディングフレーム内で第2のポリヌクレオチドに連結された第1のポリヌクレオチドによりコードされる対象ポリペプチドであって、前記第2のポリヌクレオチドが対象ポリペプチドをコードし、前記第1のポリヌクレオチドが本発明に係るシグナルペプチドをコードする、対象ポリペプチドに関する。対象ポリペプチドは、好ましくは本発明の第1の態様に記載される対象ポリペプチドである。
【0081】
好ましくは、シグナルペプチドは、
a)配列番号25、
b)少なくとも8アミノ酸が対応位置における配列番号25の最初の10アミノ酸と同じである、15〜23アミノ酸の配列番号25の変異体、
c)1位のアミノ酸がMetであり、且つ2位のアミノ酸がVal又はLysであり、及び10アミノ酸の連続ストレッチがAla又はLeuから選択される少なくとも5アミノ酸を含む、15〜23アミノ酸の配列番号25の変異体、
d)配列番号39、
e)少なくとも8アミノ酸が対応位置における配列番号39の最初の10アミノ酸と同じである、15〜23アミノ酸の配列番号39の変異体、
f)1位のアミノ酸がMetであり、且つ2位のアミノ酸がVal又はLysであり、及び10アミノ酸の連続ストレッチがAla又はLeuから選択される少なくとも5アミノ酸を含む、15〜23アミノ酸の配列番号39の変異体、
g)配列番号44、
h)少なくとも8アミノ酸が対応位置における配列番号44の最初の10アミノ酸と同じである、15〜23アミノ酸の配列番号44の変異体、
i)1位のアミノ酸がMetであり、且つ2位のアミノ酸がVal又はLysであり、及び10アミノ酸の連続ストレッチがAla又はLeuから選択される少なくとも5アミノ酸を含む、15〜23アミノ酸の配列番号44の変異体、
j)配列番号34、
k)少なくとも8アミノ酸が対応位置における配列番号34の最初の10アミノ酸と同じである、15〜23アミノ酸の配列番号34の変異体、
l)1位のアミノ酸がMetであり、且つ2位のアミノ酸がVal又はLysであり、及び10アミノ酸の連続ストレッチがAla又はLeuから選択される少なくとも5アミノ酸を含む、15〜23アミノ酸の配列番号34の変異体、
からなる群から選択されるものである。
【0082】
ある実施形態によれば、中間産物において、シグナルペプチドは配列番号25である。
【0083】
別の実施形態によれば、中間産物において、シグナルペプチドは、15〜23アミノ酸の配列番号25の変異体であって、少なくとも8アミノ酸が対応位置における配列番号25の最初の10アミノ酸と同じである変異体である。
【0084】
別の実施形態によれば、中間産物において、シグナルペプチドは、15〜23アミノ酸の配列番号25の変異体であって、1位のアミノ酸がMetであり、且つ2位のアミノ酸がVal又はLysであり、及び10アミノ酸の連続ストレッチがAla又はLeuから選択される少なくとも5アミノ酸を含む変異体である。
【0085】
別の実施形態によれば、中間産物において、シグナルペプチドは配列番号39である。
【0086】
別の実施形態によれば、中間産物において、シグナルペプチドは、15〜23アミノ酸の配列番号39の変異体であって、少なくとも8アミノ酸が対応位置における配列番号39の最初の10アミノ酸と同じである変異体である。
【0087】
別の実施形態によれば、中間産物において、シグナルペプチドは、15〜23アミノ酸の配列番号39の変異体であって、1位のアミノ酸がMetであり、且つ2位のアミノ酸がVal又はLysであり、及び10アミノ酸の連続ストレッチがAla又はLeuから選択される少なくとも5アミノ酸を含む変異体である。
【0088】
別の実施形態によれば、中間産物において、シグナルペプチドは配列番号44である。
【0089】
別の実施形態によれば、中間産物において、シグナルペプチドは、15〜23アミノ酸の配列番号44の変異体であって、少なくとも8アミノ酸が対応位置における配列番号44の最初の10アミノ酸と同じである変異体である。
【0090】
別の実施形態によれば、中間産物において、シグナルペプチドは、15〜23アミノ酸の配列番号44の変異体であって、1位のアミノ酸がMetであり、且つ2位のアミノ酸がVal又はLysであり、及び10アミノ酸の連続ストレッチがAla又はLeuから選択される少なくとも5アミノ酸を含む変異体である。
【0091】
別の実施形態によれば、中間産物において、シグナルペプチドは配列番号34である。
【0092】
別の実施形態によれば、中間産物において、シグナルペプチドは、15〜23アミノ酸の配列番号34の変異体であって、少なくとも8アミノ酸が対応位置における配列番号34の最初の10アミノ酸と同じである変異体である。
【0093】
別の実施形態によれば、中間産物において、シグナルペプチドは、15〜23アミノ酸の配列番号34の変異体であって、1位のアミノ酸がMetであり、且つ2位のアミノ酸がVal又はLysであり、及び10アミノ酸の連続ストレッチがAla又はLeuから選択される少なくとも5アミノ酸を含む変異体である。
【0094】
好ましくは、中間産物において、シグナルペプチドが
(a):配列番号25、
(b):少なくとも8アミノ酸が対応位置における配列番号25の最初の10アミノ酸と同じである、15〜23アミノ酸の配列番号25の変異体、又は
(c)1位のアミノ酸がMetであり、且つ2位のアミノ酸がVal又はLysであり、及び10アミノ酸の連続ストレッチがAla又はLeuから選択される少なくとも5アミノ酸を含む、15〜23アミノ酸の配列番号25の変異体、
であるとき、対象ポリペプチドはペクチンメチルエステラーゼではなく、より好ましくは、対象ポリペプチドはエルウィニア・クリサンテミ(Erwinia chrysanthemi)由来のペクチンメチルエステラーゼではない。より好ましくは、シグナルペプチドが(b)又は(c)であるとき、対象ポリペプチドはペクチンメチルエステラーゼではなく、さらにより好ましくは、対象ポリペプチドはエルウィニア・クリサンテミ(Erwinia chrysanthemi)由来のペクチンメチルエステラーゼではない。
【0095】
好ましくは、配列番号25をコードするときの第1のポリヌクレオチドは、配列番号29に係るポリヌクレオチドである。好ましくは、配列番号39をコードするときの第1のポリヌクレオチドは、配列番号38に係るポリヌクレオチドである。好ましくは、配列番号44をコードするときの第1のポリヌクレオチドは、配列番号43に係るポリヌクレオチドである。好ましくは、配列番号34をコードするときの第1のポリヌクレオチドは、配列番号33に係るポリヌクレオチドである。
【0096】
好ましくは、15〜23アミノ酸の配列番号25の変異体であって、少なくとも8アミノ酸が対応位置における配列番号25の最初の10アミノ酸と同じである変異体は、少なくとも9アミノ酸が対応位置における配列番号25の最初の10アミノ酸と同じである変異体である。より好ましくは、10アミノ酸が対応位置における配列番号25の最初の10アミノ酸と同じである。
【0097】
好ましくは、15〜23アミノ酸の配列番号25の変異体であって、1位のアミノ酸がMetであり、且つ2位のアミノ酸がVal又はLysであり、及び10アミノ酸の連続ストレッチがAla又はLeuから選択される少なくとも5アミノ酸を含む変異体は、
a)1位のアミノ酸がMetであり、2、3及び/又は4位のアミノ酸がVal又はLysであり、及び10アミノ酸の連続ストレッチがAla又はLeuから選択される少なくとも5アミノ酸を含む、15〜23アミノ酸の配列番号25の変異体、
b)1位のアミノ酸がMetであり、2位のアミノ酸がValであり、且つ3位のアミノ酸がLysであり、及び10アミノ酸の連続ストレッチがAla又はLeuから選択される少なくとも5アミノ酸を含む、15〜23アミノ酸の配列番号25の変異体、
c)1位のアミノ酸がMetであり、2、3及び/又は4位のアミノ酸がVal又はLysであり、及び10アミノ酸の連続ストレッチがAla又はLeuから選択される少なくとも5アミノ酸を含み、及び変異体の最後の3つの位置のアミノ酸がAla、Leu及びAlaである、15〜23アミノ酸の配列番号25の変異体、
d)1位のアミノ酸がMetであり、2位のアミノ酸がValであり、且つ3位のアミノ酸がLysであり、及び10アミノ酸の連続ストレッチがAla又はLeuから選択される少なくとも5アミノ酸を含み、及び変異体の最後の3つの位置のアミノ酸がAla、Leu及びAlaである、15〜23アミノ酸の配列番号25の変異体、
の群から選択されるものである。
【0098】
好ましくは、15〜23アミノ酸の配列番号39の変異体であって、少なくとも8アミノ酸が対応位置における配列番号39の最初の10アミノ酸と同じである変異体は、少なくとも9アミノ酸が対応位置における配列番号39の最初の10アミノ酸と同じである変異体である。より好ましくは、10アミノ酸が対応位置における配列番号39の最初の10アミノ酸と同じである。
【0099】
好ましくは、15〜23アミノ酸の配列番号39の変異体であって、1位のアミノ酸がMetであり、且つ2位のアミノ酸がVal又はLysであり、及び10アミノ酸の連続ストレッチがAla又はLeuから選択される少なくとも5アミノ酸を含む変異体は、
a)1位のアミノ酸がMetであり、2、3及び/又は5位のアミノ酸がVal又はLysであり、及び10アミノ酸の連続ストレッチがAla又はLeuから選択される少なくとも5アミノ酸を含む、15〜23アミノ酸の配列番号39の変異体、
b)1位のアミノ酸がMetであり、2位のアミノ酸がValであり、且つ5位のアミノ酸がLysであり、及び10アミノ酸の連続ストレッチがAla又はLeuから選択される少なくとも5アミノ酸を含む、15〜23アミノ酸の配列番号39の変異体、
の群から選択されるものである。
【0100】
好ましくは、15〜23アミノ酸の配列番号44の変異体であって、少なくとも8アミノ酸が対応位置における配列番号44の最初の10アミノ酸と同じである変異体は、少なくとも9アミノ酸が対応位置における配列番号44の最初の10アミノ酸と同じである変異体である。より好ましくは、10アミノ酸が対応位置における配列番号44の最初の10アミノ酸と同じである。
【0101】
好ましくは、15〜23アミノ酸の配列番号44の変異体であって、1位のアミノ酸がMetであり、且つ2位のアミノ酸がVal又はLysであり、及び10アミノ酸の連続ストレッチがAla又はLeuから選択される少なくとも5アミノ酸を含む変異体は、
a)1位のアミノ酸がMetであり、2、3及び/又は4位のアミノ酸がVal又はLysであり、及び10アミノ酸の連続ストレッチがAla又はLeuから選択される少なくとも5アミノ酸を含む、15〜23アミノ酸の配列番号44の変異体、
b)1位のアミノ酸がMetであり、2位のアミノ酸がValであり、且つ4位のアミノ酸がLysであり、及び10アミノ酸の連続ストレッチがAla又はLeuから選択される少なくとも5アミノ酸を含む、15〜23アミノ酸の配列番号44の変異体、
の群から選択されるものである。
【0102】
好ましくは、15〜23アミノ酸の配列番号34の変異体であって、少なくとも8アミノ酸が対応位置における配列番号34の最初の10アミノ酸と同じである変異体は、少なくとも9アミノ酸が対応位置における配列番号34の最初の10アミノ酸と同じである変異体である。より好ましくは、10アミノ酸が対応位置における配列番号34の最初の10アミノ酸と同じである。
【0103】
好ましくは、15〜23アミノ酸の配列番号34の変異体であって、1位のアミノ酸がMetであり、且つ2位のアミノ酸がVal又はLysであり、及び10アミノ酸の連続ストレッチがAla又はLeuから選択される少なくとも5アミノ酸を含む変異体は、
a)1位のアミノ酸がMetであり、2、3及び/又は4位のアミノ酸がLysであり、及び10アミノ酸の連続ストレッチがAla又はLeuから選択される少なくとも5アミノ酸を含む、15〜23アミノ酸の配列番号34の変異体、
b)1位のアミノ酸がMetであり、2位のアミノ酸がLysであり、且つ3及び/又は4位のアミノ酸がLysであり、及び10アミノ酸の連続ストレッチがAla又はLeuから選択される少なくとも5アミノ酸を含む、15〜23アミノ酸の配列番号34の変異体、
c)1位のアミノ酸がMetであり、2、3及び/又は4位のアミノ酸がLysであり、及び10アミノ酸の連続ストレッチがAla又はLeuから選択される少なくとも5アミノ酸を含み、及び変異体の最後の3つの位置のアミノ酸がAla、Leu及びAlaである、15〜23アミノ酸の配列番号34の変異体、
d)1位のアミノ酸がMetであり、2位のアミノ酸がLysであり、且つ3及び/又は4位のアミノ酸がLysであり、及び10アミノ酸の連続ストレッチがAla又はLeuから選択される少なくとも5アミノ酸を含み、及び変異体の最後の3つの位置のアミノ酸がAla、Leu及びAlaである、15〜23アミノ酸の配列番号34の変異体、
e)1位のアミノ酸がMetであり、2位のアミノ酸がValであり、及び10アミノ酸の連続ストレッチがAla又はLeuから選択される少なくとも5アミノ酸を含む、15〜23アミノ酸の配列番号34の変異体、
f)1位のアミノ酸がMetであり、2位のアミノ酸がValであり、及び10アミノ酸の連続ストレッチがAla又はLeuから選択される少なくとも5アミノ酸を含み、及び変異体の最後の3つの位置のアミノ酸がAla、Leu及びAlaである、15〜23アミノ酸の配列番号34の変異体、
g)1位のアミノ酸がMetであり、2位のアミノ酸がValであり、及び10アミノ酸の連続ストレッチがAla又はLeuから選択される少なくとも5アミノ酸を含み、及び変異体の最後の3つの位置におけるアミノ酸がAla、Leu、Alaである、15〜23アミノ酸の配列番号34の変異体、
h)1位のアミノ酸がMetであり、2位のアミノ酸がValであり、及び10アミノ酸の連続ストレッチが少なくとも5個のAlaを含む、15〜23アミノ酸の配列番号34の変異体、
i)1位のアミノ酸がMetであり、2位のアミノ酸がValであり、及び10アミノ酸の連続ストレッチが少なくとも4個のAlaと1個のLeuとを含む、15〜23アミノ酸の配列番号34の変異体、
j)1位のアミノ酸がMetであり、2位のアミノ酸がValであり、及び10アミノ酸の連続ストレッチが少なくとも3個のAlaと2個のLeuとを含む、15〜23アミノ酸の配列番号34の変異体、
k)1位のアミノ酸がMetであり、2位のアミノ酸がValであり、及び10アミノ酸の連続ストレッチが少なくとも2個のAlaと3個のLeuとを含む、15〜23アミノ酸の配列番号34の変異体、
l)1位のアミノ酸がMetであり、2位のアミノ酸がValであり、及び10アミノ酸の連続ストレッチが少なくとも1個のAlaと4個のLeuとを含む、15〜23アミノ酸の配列番号34の変異体、
m)1位のアミノ酸がMetであり、2位のアミノ酸がValであり、及び10アミノ酸の連続ストレッチが少なくとも5個のLeuを含む、15〜23アミノ酸の配列番号34の変異体、
n)1位のアミノ酸がMetであり、2位のアミノ酸がLysであり、及び10アミノ酸の連続ストレッチがAla又はLeuから選択される少なくとも5アミノ酸を含む、15〜23アミノ酸の配列番号34の変異体、
o)1位のアミノ酸がMetであり、2位のアミノ酸がLysであり、及び10アミノ酸の連続ストレッチがAla又はLeuから選択される少なくとも5アミノ酸を含み、及び変異体の最後の3つの位置におけるアミノ酸がAla、Leu、Alaである、15〜23アミノ酸の配列番号34の変異体、
p)1位のアミノ酸がMetであり、2位のアミノ酸がLysであり、及び10アミノ酸の連続ストレッチが少なくとも5個のAlaを含む、15〜23アミノ酸の配列番号34の変異体、
q)1位のアミノ酸がMetであり、2位のアミノ酸がLysであり、及び10アミノ酸の連続ストレッチが少なくとも4個のAlaと1個のLeuとを含む、15〜23アミノ酸の配列番号34の変異体、
r)1位のアミノ酸がMetであり、2位のアミノ酸がLysであり、及び10アミノ酸の連続ストレッチが少なくとも3個のAlaと2個のLeuとを含む、15〜23アミノ酸の配列番号34の変異体、
s)1位のアミノ酸がMetであり、2位のアミノ酸がLysであり、及び10アミノ酸の連続ストレッチが少なくとも2個のAlaと3個のLeuとを含む、15〜23アミノ酸の配列番号34の変異体、
t)1位のアミノ酸がMetであり、2位のアミノ酸がLysであり、及び10アミノ酸の連続ストレッチが少なくとも1個のAlaと4個のLeuとを含む、15〜23アミノ酸の配列番号34の変異体、
u)1位のアミノ酸がMetであり、2位のアミノ酸がLysであり、及び10アミノ酸の連続ストレッチが少なくとも5個のLeuを含む、15〜23アミノ酸の配列番号34の変異体、
の群から選択されるものである。
【0104】
以上の配列番号25の(a)〜(d)、配列番号39の(a)及び(b)、配列番号44の(a)及び(b)並びに配列番号34の(a)〜(u)の変異体において、連続ストレッチは、好ましくは10アミノ酸、より好ましくは9アミノ酸、さらにより好ましくは8アミノ酸、及び最も好ましくは7アミノ酸である。
【0105】
以上の配列番号25の(a)〜(d)、配列番号39の(a)及び(b)、配列番号44の(a)及び(b)並びに配列番号34の(a)〜(u)の変異体において、アミノ酸の連続ストレッチは、好ましくはAla又はLeuから選択される少なくとも5アミノ酸、より好ましくはAla又はLeuから選択される少なくとも6アミノ酸、及び最も好ましくはAla又はLeuから選択される少なくとも7アミノ酸を含む。
【0106】
15〜23アミノ酸の配列番号25、配列番号39、配列番号44、又は配列番号34の変異体は、15アミノ酸、16アミノ酸、17アミノ酸、18アミノ酸、19アミノ酸、20アミノ酸、21アミノ酸、22アミノ酸又は23アミノ酸を含んでもよい。
【0107】
第3の態様において、本発明は、翻訳リーディングフレーム内で第2のポリヌクレオチドに連結された第1のポリヌクレオチドを含む組換え発現コンストラクトであって、前記第2のポリヌクレオチドが対象ポリペプチドをコードし、前記第1のポリヌクレオチドが本発明に係るシグナルペプチドをコードする、発現コンストラクトに関する。対象ポリペプチドは、好ましくは本発明の第1の態様に記載される対象ポリペプチドである。好ましくは、シグナルペプチドが、
(a):配列番号25、
(b):少なくとも8アミノ酸が対応位置における配列番号25の最初の10アミノ酸と同じである、15〜23アミノ酸の配列番号25の変異体、又は
(c)1位のアミノ酸がMetであり、且つ2位のアミノ酸がVal又はLysであり、及び10アミノ酸の連続ストレッチがAla又はLeuから選択される少なくとも5アミノ酸を含む、15〜23アミノ酸の配列番号25の変異体、
であるとき、対象ポリペプチドはペクチンメチルエステラーゼではなく、より好ましくは、対象ポリペプチドはエルウィニア・クリサンテミ(Erwinia chrysanthemi)由来のペクチンメチルエステラーゼではない。より好ましくは、シグナルペプチドが(b)又は(c)であるとき、対象ポリペプチドはペクチンメチルエステラーゼではなく、さらにより好ましくは、対象ポリペプチドはエルウィニア・クリサンテミ(Erwinia chrysanthemi)由来のペクチンメチルエステラーゼではない。
【0108】
好ましくは、配列番号25をコードするときの第1のポリヌクレオチドは、配列番号29に係るポリヌクレオチドである。好ましくは、配列番号39をコードするときの第1のポリヌクレオチドは、配列番号38に係るポリヌクレオチドである。好ましくは、配列番号44をコードするときの第1のポリヌクレオチドは、配列番号43に係るポリヌクレオチドである。好ましくは、配列番号34をコードするときの第1のポリヌクレオチドは、配列番号33に係るポリヌクレオチドである。
【0109】
本発明はさらに、翻訳リーディングフレーム内で第2のポリヌクレオチドに連結された第1のポリヌクレオチドに作動可能に連結されたプロモーターをさらに含む前記組換え発現コンストラクトであって、前記第2のポリヌクレオチドが対象ポリペプチドをコードし、前記第1のポリヌクレオチドが本発明に係るシグナルペプチドをコードする、発現コンストラクトに関する。対象ポリペプチドは、好ましくは本発明の第1の態様に記載される対象ポリペプチドである。
【0110】
本発明はさらに、以上に記載される発現コンストラクトを含む組換え発現ベクターに関する。
【0111】
用語「核酸コンストラクト」は、本明細書では、一本鎖又は二本鎖のいずれかの核酸分子を指し、これは、天然に存在する遺伝子から単離されるか、又は別の場合であれば天然には存在しないであろう形で組み合わされて並ぶ核酸のセグメントを含むように修飾されている。用語の核酸コンストラクトは、核酸コンストラクトがコード配列の発現に必要な全ての制御配列を含むとき用語「発現カセット」と同義語であり、ここで前記制御配列は前記コード配列に作動可能に連結される。
【0112】
用語「制御配列」は、本明細書では、インビトロ又は宿主細胞中のいずれかでのmRNA及び/又はポリペプチドの発現に必要又は有利なあらゆる構成要素を含むように定義される。各制御配列は、ポリペプチドをコードする核酸配列にとって天然であっても、又は外来性であってもよい。かかる制御配列としては、限定はされないが、シャイン−ダルガノ配列、最適翻訳開始配列(Kozak、1991年、J.Biol.Chem.266:19867〜19870頁に記載されるとおり)、ポリアデニル化配列、プロモーター、及び転写ターミネーターが挙げられる。最小限として、制御配列は、プロモーター、並びに転写及び翻訳停止シグナルを含む。制御配列は、その特定の目的に対して最適化されてもよい。好ましくは、DNAコンストラクトは、プロモーターDNA配列、前記プロモーターDNA配列及び制御配列と作動可能に連係したコード配列、例えば:
− 以下の配列リストから選択される5’から3’方向に向く一つの翻訳終結配列:TAAG、TAGA及びTAAA、好ましくはTAAA、及び/又は
− 以下の配列リストから選択される5’から3’方向に向く一つの翻訳開始コード配列:GCTACCCCC;GCTACCTCC;GCTACCCTC;GCTACCTTC;GCTCCCCCC;GCTCCCTCC;GCTCCCCTC;GCTCCCTTC;GCTGCCCCC;GCTGCCTCC;GCTGCCCTC;GCTGCCTTC;GCTTCCCCC;GCTTCCTCC;GCTTCCCTC;及びGCTTCCTTC、好ましくはGCT TCC TTC、及び/又は
− 以下の配列リストから選択される一つの翻訳イニシエーター配列:5’−mwChkyCAAA−3’;5’−mwChkyCACA−3’又は5’−mwChkyCAAG−3’、ヌクレオチドにアンビギュイティーコード:m(A/C);w(A/T);y(C/T);k(G/T);h(A/C/T)を使用、好ましくは5’−CACCGTCAAA−3’又は5’−CGCAGTCAAG−3’
を含む。
【0113】
本発明との関連において、用語「翻訳イニシエーターコード配列」は、DNAコード配列のオープンリーディングフレームのイニシエーター又は開始コドンの直ちに下流にある9個のヌクレオチドとして定義される。イニシエーター又は開始コドンはAAメチオニンをコードする。イニシエーターコドンは典型的にはATGであるが、GTGなどの任意の機能的な開始コドンであってもよい。
【0114】
本発明との関連において、用語「翻訳終結配列」は、オープンリーディングフレーム又はヌクレオチドコード配列の3’末端の翻訳終止コドンを始端として5’から3’方向に向く4個のヌクレオチドとして定義される。
【0115】
本発明との関連において、用語「翻訳イニシエーター配列」は、ポリペプチドをコードするDNA配列のオープンリーディングフレームのイニシエーター又は開始コドンの直ちに上流にある10個のヌクレオチドとして定義される。イニシエーター又は開始コドンはAAメチオニンをコードする。イニシエーターコドンは典型的にはATGであるが、GTGなどの任意の機能的な開始コドンであってもよい。RNAにおいてウラシルUがデオキシヌクレオチドチミンTに代わることは当該技術分野において公知である。
【0116】
制御配列は、ポリペプチドをコードする核酸配列のコード領域との制御配列のライゲーションを促進する特定の制限部位の導入を目的として、リンカーを備えてもよい。制御配列は、適切なプロモーター配列、すなわち核酸配列の発現が宿主細胞によって認識される核酸配列であってもよい。プロモーター配列は転写制御配列を含み、それがポリペプチドの発現を媒介する。プロモーターは、突然変異体プロモーター、トランケート型プロモーター、及びハイブリッドプロモーターを含め、細胞中で転写活性を示す任意の核酸配列であってよく、細胞と同種又は異種の細胞外又は細胞内ポリペプチドをコードする遺伝子から得ることができる。
【0117】
制御配列はまた、好適な転写ターミネーター配列、すなわち糸状菌細胞によって転写の終結が認識される配列であってもよい。転写ターミネーター配列は、ポリペプチドをコードする核酸配列の3’末端に作動可能に連結される。本発明では、細胞内で機能する任意のターミネーターを使用することができる。
【0118】
糸状菌細胞に好ましいターミネーターは、A.オリゼ(A.oryzae)タカアミラーゼ、A.ニガー(A.niger)グルコアミラーゼ(glaA)、A.ニデュランス(A.nidulans)アントラニル酸シンターゼ、A.ニガー(A.niger)α−グルコシダーゼ、trpC遺伝子及びフザリウム・オキシスポラム(Fusarium oxysporum)トリプシン様プロテアーゼをコードする遺伝子から得られる。
【0119】
制御配列はまた、ポリアデニル化配列、すなわち核酸配列の3’末端に作動可能に連結され、且つ転写されると、転写mRNAにポリアデノシン残基を付加するシグナルとして糸状菌細胞により認識される配列であってもよい。本発明では、細胞内で機能する任意のポリアデニル化配列を使用することができる。
【0120】
糸状菌細胞に好ましいポリアデニル化配列は、A.オリゼ(A.oryzae)タカアミラーゼ、A.ニガー(A.niger)グルコアミラーゼ、A.ニデュランス(A.nidulans)アントラニル酸シンターゼ、フザリウム・オキシスポラム(Fusarium oxysporum)トリプシン様プロテアーゼ及びA.ニガー(A.niger)α−グルコシダーゼをコードする遺伝子から得られる。
【0121】
用語「プロモーター」は、本明細書では、RNAポリメラーゼを結合し、且つ生物学的化合物をコードする核酸配列の正しい下流の転写開始部位へとポリメラーゼを誘導して転写を開始させるDNA配列として定義される。RNAポリメラーゼは、コード領域の適切なDNA鎖と相補的なメッセンジャーRNAの構築を有効に触媒する。用語「プロモーター」はまた、mRNAに転写された後の翻訳のための5’−非コード領域(プロモーターと翻訳開始点の間)、エンハンサーなどのシス作用転写制御エレメント、及び転写因子と相互作用することが可能な他のヌクレオチド配列を含むようにも理解され得る。プロモーターは、突然変異プロモーター、トランケート型プロモーター、及びハイブリッドプロモーターを含め、真核又は原核宿主細胞に好適な、転写活性を示す任意の適切なプロモーター配列であってもよく、細胞と同種(天然)又は異種(外来性)のいずれかである細胞外又は細胞内ポリペプチドをコードする遺伝子から得てもよい。プロモーターは、構成的又は誘導性プロモーターであってもよい。使用することのできる誘導性プロモーターの例は、デンプン誘導性、銅誘導性、オレイン酸誘導性プロモーターである。プロモーターは、限定はされないが、A.オリゼ(A.oryzae)タカアミラーゼ、リゾムコール・ミエヘイ(Rhizomucor miehei)アスパラギン酸プロテイナーゼ、A.ニガー(A.niger)中性α−アミラーゼ、A.ニガー(A.niger)酸安定性α−アミラーゼ、A.ニガー(A.niger)又はA.アワモリ(A.awamori)グルコアミラーゼ(glaA)、R.ミエヘイ(R.miehei)リパーゼ、A.オリゼ(A.oryzae)アルカリプロテアーゼ、A.オリゼ(A.oryzae)トリオースリン酸イソメラーゼ、A.ニデュランス(A.nidulans)アセトアミダーゼをコードする遺伝子から得られるプロモーター、NA2−tpiプロモーター(A.ニガー(A.niger)中性α−アミラーゼ及びA.オリゼ(A.oryzae)トリオースリン酸イソメラーゼをコードする遺伝子由来のプロモーターのハイブリッド)、及びそれらの突然変異プロモーター、トランケート型プロモーター、及びハイブリッドプロモーターを含む群から選択されてもよい。糸状菌細胞における使用に特に好ましいプロモーターは、プロテアーゼ遺伝子由来;例えば、F.オキシスポラム(F.oxysporum)トリプシン様プロテアーゼ遺伝子(米国特許第4,288,627号明細書)、A.オリゼ(A.oryzae)アルカリプロテアーゼ遺伝子(alp)、A.ニガー(A.niger)pacA遺伝子、A.オリゼ(A.oryzae)アルカリプロテアーゼ遺伝子、A.オリゼ(A.oryzae)中性メタロプロテアーゼ遺伝子、A.ニガー(A.niger)アスペルギロペプシンプロテアーゼpepA遺伝子、又はF.ベネナツム(F.venenatum)トリプシン遺伝子、A.ニガー(A.niger)アスパラギン酸プロテアーゼpepB遺伝子由来のプロモーター、又はその機能部分である。他の好ましいプロモーターは、参照により本明細書に援用される国際公開第2006/092396号パンフレット及び国際公開第2005/100573号パンフレットに記載されるプロモーターである。
【0122】
対象組換えポリペプチドが、2個以上のポリペプチド(の部分)からなるキメラポリペプチドであるとき、当業者には、当該技術分野において公知の方法を用いてそれらの及び他のキメラポリヌクレオチドコンストラクトを構築する方法は周知である。
【0123】
発現及び/又は翻訳を促進するため、本発明に係るポリヌクレオチド又は核酸コンストラクトは、本発明のポリヌクレオチドがインビトロでの、又は原核若しくは真核宿主細胞中での発現及び/又は翻訳に適切な制御配列に作動可能に連結されるように発現ベクター中に含まれてもよい。
【0124】
組換え発現ベクターは、好都合に組換えDNA手順に供することができ、且つポリペプチドをコードする核酸配列の発現をもたらすことのできる任意のベクター(例えば、プラスミド又はウイルス)であってもよい。ベクターの選択は、典型的にはベクターを導入する宿主細胞とのベクターの適合性に依存し得る。ベクターは直鎖状プラスミドであっても、又は閉環状プラスミドであってもよい。ベクターは自己複製ベクター、すなわち染色体外エンティティとして存在し、その複製が染色体の複製とは独立しているベクター、例えば、プラスミド、染色体外エレメント、ミニ染色体、又は人工染色体であってもよい。自己維持されるクローニングベクターは、AMA1配列を含み得る(例えばAleksenko及びClutterbuck(1997年)、Fungal Genet.Biol.21:373〜397頁を参照のこと)。
【0125】
或いは、ベクターは、宿主細胞に導入されるとゲノムに組み込まれ、それが組み込まれた1つ又は複数の染色体と共に複製されるものであってもよい。組込みクローニングベクターは、宿主細胞の染色体においてランダムに、又は所定の標的遺伝子座に組み込まれ得る。本発明の好ましい実施形態において、組込みクローニングベクターは、所定の遺伝子座へのクローニングベクターの組込みが標的化されるよう宿主細胞のゲノム内の所定の標的遺伝子座にDNA配列と相同なDNA断片を含む。標的組込みを促進するため、クローニングベクターは好ましくは細胞の形質転換前に直鎖化される。直鎖化は、好ましくは、クローニングベクターの少なくとも一方、但し好ましくは両側に標的遺伝子座と相同な配列が隣接するように実施される。標的遺伝子座が隣接する相同配列の長さは、好ましくは少なくとも30bp、好ましくは少なくとも50bp、好ましくは少なくとも0.1kb、さらに好ましくは少なくとも0.2kb、より好ましくは少なくとも0.5kb、さらにより好ましくは少なくとも1kb、最も好ましくは少なくとも2kbである。好ましくは、宿主細胞のゲノムへの標的組込み、すなわち所定の標的遺伝子座における組込みの効率は、宿主細胞の相同組換え能力を増強することにより高められる。細胞のかかる表現型には、好ましくは、国際公開第2005/095624号パンフレットに記載されるとおりの欠損したku70遺伝子が関与する。国際公開第2005/095624号パンフレットは、高効率の標的組込みを含む糸状菌細胞を得るための好ましい方法を開示している。好ましくは、標的遺伝子座と相同なクローニングベクター中の相同フランキングDNA配列は、高度に発現する遺伝子座から誘導され、これは、配列が宿主細胞中での高発現レベルが可能な遺伝子から誘導されることを意味する。高発現レベルが可能な遺伝子、すなわち高度に発現する遺伝子は、本明細書では、例えば誘導条件下でそのmRNAが全細胞mRNAの少なくとも0.5%(w/w)を構成し得る遺伝子か、或いは、その遺伝子産物が全細胞タンパク質の少なくとも1%(w/w)を構成できるか、若しくは分泌遺伝子産物の場合、少なくとも0.1g/lのレベルまで分泌される可能性のある遺伝子として定義される(欧州特許第357 127 B1号明細書に記載されるとおり)。いくつもの好ましい高度に発現する真菌遺伝子が、例として挙げられる:アスペルギルス属(Aspergillus)又はトリコデルマ属(Trichoderma)由来のアミラーゼ、グルコアミラーゼ、アルコールデヒドロゲナーゼ、キシラナーゼ、グリセルアルデヒドリン酸デヒドロゲナーゼ又はセロビオヒドロラーゼ(cbh)遺伝子。こうした目的に最も好ましい高度に発現する遺伝子は、グルコアミラーゼ遺伝子、好ましくはA.ニガー(A.niger)グルコアミラーゼ遺伝子、A.オリゼ(A.oryzae)タカアミラーゼ遺伝子、A.ニデュランス(A.nidulans)gpdA遺伝子、トリコデルマ・リーゼイ(Trichoderma reesei)cbh遺伝子、好ましくはcbh1である。
【0126】
遺伝子産物の産生を増加させるため、1個より多い核酸配列コピーが細胞に挿入されてもよい。これは、好ましくはDNA配列のそのゲノムコピーへの組込みにより、より好ましくは前段落に定義した高度に発現する遺伝子座の1つにおけるDNA配列の組込みを標的化することにより行われ得る。或いは、これは、核酸配列と共に増幅可能な選択可能マーカー遺伝子を含めることにより行うことができ、ここでは選択可能マーカー遺伝子の増幅されたコピー、従って核酸配列のさらなるコピーを含む細胞を、適切な選択可能薬剤の存在下で細胞を培養することにより選択することができる。DNA配列のコピー数をさらに増加させて過剰発現させるには、国際公開第98/46772号パンフレットに記載されるとおりの遺伝子変換の技法を用いることができる。
【0127】
ベクター系は、単一のベクター若しくはプラスミド、又は宿主細胞のゲノムに導入される全DNAを一体として含む2個以上のベクター若しくはプラスミド、又はトランスポゾンであってもよい。
【0128】
ベクターは、好ましくは1つ又は複数の選択可能マーカーを含み、それにより形質転換細胞の容易な選択が可能となる。選択可能マーカーは、産物が殺生物剤又はウイルス耐性、重金属耐性、栄養要求体に対して原栄養性などを提供する遺伝子である。糸状菌細胞において使用される選択可能マーカーは、限定はされないが、amdS(アセトアミダーゼ)、argB(オルニチンカルバモイルトランスフェラーゼ)、bar(ホスフィノトリシンアセチルトランスフェラーゼ)、bleA(フレオマイシン結合)、hygB(ハイグロマイシンホスホトランスフェラーゼ)、niaD(硝酸レダクターゼ)、pyrG(オロチジン−5’リン酸デカルボキシラーゼ)、sC(硫酸アデニルトランスフェラーゼ)、及びtrpC(アントラニル酸シンターゼ)、並びに他の種由来の均等物を含む群から選択されてもよい。アスペルギルス属(Aspergillus)及びペニシリウム属(Penicillium)細胞における使用においては、A.ニデュランス(A.nidulans)又はA.オリゼ(A.oryzae)のamdS(欧州特許第635574 B1号明細書、国際公開第97/06261号パンフレット)及びpyrG遺伝子及びストレプトマイセス・ハイグロスコピカス(Streptomyces hygroscopicus)のbar遺伝子が好ましい。より好ましくは、amdS遺伝子が使用され、さらにより好ましくはA.ニデュランス(A.nidulans)又はA.ニガー(A.niger)由来のamdS遺伝子が使用される。最も好ましい選択マーカー遺伝子は、A.ニデュランス(A.nidulans)gpdAプロモーターに融合したA.ニデュランス(A.nidulans)amdSコード配列である(欧州特許第635574 B1号明細書を参照のこと)。他の好ましいAmdSマーカーは、国際公開第2006/040358号パンフレットに記載されるものである。他の糸状菌由来のAmdS遺伝子もまた使用することができる(国際公開第97/06261号パンフレット)。
【0129】
上記に記載されるエレメントをライゲートして本発明の組換え発現ベクターを構築するために用いられる手順は、当業者に公知である(例えばSambrook及びRussell、上記を参照のこと)。
【0130】
第4の態様において、本発明は、本発明の第3の態様に係る発現コンストラクトを含むか、又は本発明の第3の態様に係る発現ベクターを含む組換え糸状菌宿主細胞に関する。前記糸状菌宿主細胞は、好ましくは本明細書において先述したとおりの細胞である。前記糸状菌宿主細胞は、当該技術分野において公知の方法を用いて構築することができる。好ましくは、前記糸状菌宿主細胞は、
− 好適な糸状菌宿主細胞を提供するステップと、
− 本発明の第3の態様に係る発現コンストラクトにより、又は本発明の第3の態様に係る発現ベクターにより、前記宿主細胞を形質転換するステップと、
を含む方法により構築される。
【0131】
糸状菌宿主細胞の形質転換は、好ましくは本明細書において先述したとおり実施される。
【0132】
第5の態様において、本発明は、対象組換えポリペプチドを産生するための本発明に係るシグナルペプチドの使用に関する。
【0133】
従って、シグナルペプチドは、好ましくは
a)配列番号25、
b)少なくとも8アミノ酸が対応位置における配列番号25の最初の10アミノ酸と同じである、15〜23アミノ酸の配列番号25の変異体、
c)1位のアミノ酸がMetであり、且つ2位のアミノ酸がVal又はLysであり、及び10アミノ酸の連続ストレッチがAla又はLeuから選択される少なくとも5アミノ酸を含む、15〜23アミノ酸の配列番号25の変異体、
d)配列番号39、
e)少なくとも8アミノ酸が対応位置における配列番号39の最初の10アミノ酸と同じである、15〜23アミノ酸の配列番号39の変異体、
f)1位のアミノ酸がMetであり、且つ2位のアミノ酸がVal又はLysであり、及び10アミノ酸の連続ストレッチがAla又はLeuから選択される少なくとも5アミノ酸を含む、15〜23アミノ酸の配列番号39の変異体、
g)配列番号44、
h)少なくとも8アミノ酸が対応位置における配列番号44の最初の10アミノ酸と同じである、15〜23アミノ酸の配列番号44の変異体、
i)1位のアミノ酸がMetであり、且つ2位のアミノ酸がVal又はLysであり、及び10アミノ酸の連続ストレッチがAla又はLeuから選択される少なくとも5アミノ酸を含む、15〜23アミノ酸の配列番号44の変異体、
j)配列番号34、
k)少なくとも8アミノ酸が対応位置における配列番号34の最初の10アミノ酸と同じである、15〜23アミノ酸の配列番号34の変異体、
l)1位のアミノ酸がMetであり、且つ2位のアミノ酸がVal又はLysであり、及び10アミノ酸の連続ストレッチがAla又はLeuから選択される少なくとも5アミノ酸を含む、15〜23アミノ酸の配列番号34の変異体、
からなる群から選択される。
【0134】
ある実施形態によれば、シグナルペプチドは配列番号25である。
【0135】
別の実施形態によれば、中間産物において、シグナルペプチドは、15〜23アミノ酸の配列番号25の変異体であって、少なくとも8アミノ酸が対応位置における配列番号25の最初の10アミノ酸と同じである変異体である。
【0136】
別の実施形態によれば、シグナルペプチドは、15〜23アミノ酸の配列番号25の変異体であって、1位のアミノ酸がMetであり、且つ2位のアミノ酸がVal又はLysであり、及び10アミノ酸の連続ストレッチがAla又はLeuから選択される少なくとも5アミノ酸を含む変異体である。
【0137】
別の実施形態によれば、シグナルペプチドは配列番号39である。
【0138】
別の実施形態によれば、シグナルペプチドは、15〜23アミノ酸の配列番号39の変異体であって、少なくとも8アミノ酸が対応位置における配列番号39の最初の10アミノ酸と同じである変異体である。
【0139】
別の実施形態によれば、シグナルペプチドは、15〜23アミノ酸の配列番号39の変異体であって、1位のアミノ酸がMetであり、且つ2位のアミノ酸がVal又はLysであり、及び10アミノ酸の連続ストレッチがAla又はLeuから選択される少なくとも5アミノ酸を含む変異体である。
【0140】
別の実施形態によれば、シグナルペプチドは配列番号44である。
【0141】
別の実施形態によれば、シグナルペプチドは、15〜23アミノ酸の配列番号44の変異体であって、少なくとも8アミノ酸が対応位置における配列番号44の最初の10アミノ酸と同じである変異体である。
【0142】
別の実施形態によれば、シグナルペプチドは、15〜23アミノ酸の配列番号44の変異体であって、1位のアミノ酸がMetであり、且つ2位のアミノ酸がVal又はLysであり、及び10アミノ酸の連続ストレッチがAla又はLeuから選択される少なくとも5アミノ酸を含む変異体である。
【0143】
別の実施形態によれば、シグナルペプチドは配列番号34である。
【0144】
別の実施形態によれば、シグナルペプチドは、15〜23アミノ酸の配列番号34の変異体であって、少なくとも8アミノ酸が対応位置における配列番号34の最初の10アミノ酸と同じである変異体である。
【0145】
別の実施形態によれば、シグナルペプチドは、15〜23アミノ酸の配列番号34の変異体であって、1位のアミノ酸がMetであり、且つ2位のアミノ酸がVal又はLysであり、及び10アミノ酸の連続ストレッチがAla又はLeuから選択される少なくとも5アミノ酸を含む変異体である。
【0146】
好ましくは、シグナルペプチドが
(a):配列番号25、
(b):少なくとも8アミノ酸が対応位置における配列番号25の最初の10アミノ酸と同じである、15〜23アミノ酸の配列番号25の変異体、又は
(c)1位のアミノ酸がMetであり、且つ2位のアミノ酸がVal又はLysであり、及び10アミノ酸の連続ストレッチがAla又はLeuから選択される少なくとも5アミノ酸を含む、15〜23アミノ酸の配列番号25の変異体、
であるとき、対象ポリペプチドはペクチンメチルエステラーゼではなく、より好ましくは、対象ポリペプチドはエルウィニア・クリサンテミ(Erwinia chrysanthemi)由来のペクチンメチルエステラーゼではない。より好ましくは、シグナルペプチドが(b)又は(c)であるとき、対象ポリペプチドはペクチンメチルエステラーゼではなく、さらにより好ましくは、対象ポリペプチドはエルウィニア・クリサンテミ(Erwinia chrysanthemi)由来のペクチンメチルエステラーゼではない。
【0147】
好ましくは、15〜23アミノ酸の配列番号25の変異体であって、少なくとも8アミノ酸が対応位置における配列番号25の最初の10アミノ酸と同じである変異体は、少なくとも9アミノ酸が対応位置における配列番号25の最初の10アミノ酸と同じである変異体である。より好ましくは、10アミノ酸が対応位置における配列番号25の最初の10アミノ酸と同じである。
【0148】
好ましくは、15〜23アミノ酸の配列番号25の変異体であって、1位のアミノ酸がMetであり、且つ2位のアミノ酸がVal又はLysであり、及び10アミノ酸の連続ストレッチがAla又はLeuから選択される少なくとも5アミノ酸を含む変異体は、
a)1位のアミノ酸がMetであり、2、3及び/又は4位のアミノ酸がVal又はLysであり、及び10アミノ酸の連続ストレッチがAla又はLeuから選択される少なくとも5アミノ酸を含む、15〜23アミノ酸の配列番号25の変異体、
b)1位のアミノ酸がMetであり、2位のアミノ酸がValであり、且つ3位のアミノ酸がLysであり、及び10アミノ酸の連続ストレッチがAla又はLeuから選択される少なくとも5アミノ酸を含む、15〜23アミノ酸の配列番号25の変異体、
c)1位のアミノ酸がMetであり、2、3及び/又は4位のアミノ酸がVal又はLysであり、及び10アミノ酸の連続ストレッチがAla又はLeuから選択される少なくとも5アミノ酸を含み、及び変異体の最後の3つの位置のアミノ酸がAla、Leu及びAlaである、15〜23アミノ酸の配列番号25の変異体、
d)1位のアミノ酸がMetであり、2位のアミノ酸がValであり、且つ3位のアミノ酸がLysであり、及び10アミノ酸の連続ストレッチがAla又はLeuから選択される少なくとも5アミノ酸を含み、及び変異体の最後の3つの位置のアミノ酸がAla、Leu及びAlaである、15〜23アミノ酸の配列番号25の変異体、
の群から選択されるものである。
【0149】
好ましくは、15〜23アミノ酸の配列番号39の変異体であって、少なくとも8アミノ酸が対応位置における配列番号39の最初の10アミノ酸と同じである変異体は、少なくとも9アミノ酸が対応位置における配列番号39の最初の10アミノ酸と同じである変異体である。より好ましくは、10アミノ酸が対応位置における配列番号39の最初の10アミノ酸と同じである。
【0150】
好ましくは、15〜23アミノ酸の配列番号39の変異体であって、1位のアミノ酸がMetであり、且つ2位のアミノ酸がVal又はLysであり、及び10アミノ酸の連続ストレッチがAla又はLeuから選択される少なくとも5アミノ酸を含む変異体は、
a)1位のアミノ酸がMetであり、2、3及び/又は5位のアミノ酸がVal又はLysであり、及び10アミノ酸の連続ストレッチがAla又はLeuから選択される少なくとも5アミノ酸を含む、15〜23アミノ酸の配列番号39の変異体、
b)1位のアミノ酸がMetであり、2位のアミノ酸がValであり、且つ5位のアミノ酸がLysであり、及び10アミノ酸の連続ストレッチがAla又はLeuから選択される少なくとも5アミノ酸を含む、15〜23アミノ酸の配列番号39の変異体、
の群から選択されるものである。
【0151】
好ましくは、15〜23アミノ酸の配列番号44の変異体であって、少なくとも8アミノ酸が対応位置における配列番号44の最初の10アミノ酸と同じである変異体は、少なくとも9アミノ酸が対応位置における配列番号44の最初の10アミノ酸と同じである変異体である。より好ましくは、10アミノ酸が対応位置における配列番号44の最初の10アミノ酸と同じである。
【0152】
好ましくは、15〜23アミノ酸の配列番号44の変異体であって、1位のアミノ酸がMetであり、且つ2位のアミノ酸がVal又はLysであり、及び10アミノ酸の連続ストレッチがAla又はLeuから選択される少なくとも5アミノ酸を含む変異体は、
a)1位のアミノ酸がMetであり、2、3及び/又は4位のアミノ酸がVal又はLysであり、及び10アミノ酸の連続ストレッチがAla又はLeuから選択される少なくとも5アミノ酸を含む、15〜23アミノ酸の配列番号44の変異体、
b)1位のアミノ酸がMetであり、2位のアミノ酸がValであり、且つ4位のアミノ酸がLysであり、及び10アミノ酸の連続ストレッチがAla又はLeuから選択される少なくとも5アミノ酸を含む、15〜23アミノ酸の配列番号44の変異体、
の群から選択されるものである。
【0153】
好ましくは、15〜23アミノ酸の配列番号34の変異体であって、少なくとも8アミノ酸が対応位置における配列番号34の最初の10アミノ酸と同じである変異体は、少なくとも9アミノ酸が対応位置における配列番号34の最初の10アミノ酸と同じである変異体である。より好ましくは、10アミノ酸が対応位置における配列番号34の最初の10アミノ酸と同じである。
【0154】
好ましくは、15〜23アミノ酸の配列番号34の変異体であって、1位のアミノ酸がMetであり、且つ2位のアミノ酸がVal又はLysであり、及び10アミノ酸の連続ストレッチがAla又はLeuから選択される少なくとも5アミノ酸を含む変異体は、
a)1位のアミノ酸がMetであり、2、3及び/又は4位のアミノ酸がLysであり、及び10アミノ酸の連続ストレッチがAla又はLeuから選択される少なくとも5アミノ酸を含む、15〜23アミノ酸の配列番号34の変異体、
b)1位のアミノ酸がMetであり、2位のアミノ酸がLysであり、且つ3及び/又は4位のアミノ酸がLysであり、及び10アミノ酸の連続ストレッチがAla又はLeuから選択される少なくとも5アミノ酸を含む、15〜23アミノ酸の配列番号34の変異体、
c)1位のアミノ酸がMetであり、2、3及び/又は4位のアミノ酸がLysであり、及び10アミノ酸の連続ストレッチがAla又はLeuから選択される少なくとも5アミノ酸を含み、及び変異体の最後の3つの位置のアミノ酸がAla、Leu及びAlaである、15〜23アミノ酸の配列番号34の変異体、
d)1位のアミノ酸がMetであり、2位のアミノ酸がLysであり、且つ3及び/又は4位のアミノ酸がLysであり、及び10アミノ酸の連続ストレッチがAla又はLeuから選択される少なくとも5アミノ酸を含み、及び変異体の最後の3つの位置のアミノ酸がAla、Leu及びAlaである、15〜23アミノ酸の配列番号34の変異体、
e)1位のアミノ酸がMetであり、2位のアミノ酸がValであり、及び10アミノ酸の連続ストレッチがAla又はLeuから選択される少なくとも5アミノ酸を含む、15〜23アミノ酸の配列番号34の変異体、
f)1位のアミノ酸がMetであり、2位のアミノ酸がValであり、及び10アミノ酸の連続ストレッチがAla又はLeuから選択される少なくとも5アミノ酸を含み、及び変異体の最後の3つの位置のアミノ酸がAla、Leu及びAlaである、15〜23アミノ酸の配列番号34の変異体、
g)1位のアミノ酸がMetであり、2位のアミノ酸がValであり、及び10アミノ酸の連続ストレッチがAla又はLeuから選択される少なくとも5アミノ酸を含み、及び変異体の最後の3つの位置におけるアミノ酸がAla、Leu、Alaである、15〜23アミノ酸の配列番号34の変異体、
h)1位のアミノ酸がMetであり、2位のアミノ酸がValであり、及び10アミノ酸の連続ストレッチが少なくとも5個のAlaを含む、15〜23アミノ酸の配列番号34の変異体、
i)1位のアミノ酸がMetであり、2位のアミノ酸がValであり、及び10アミノ酸の連続ストレッチが少なくとも4個のAlaと1個のLeuとを含む、15〜23アミノ酸の配列番号34の変異体、
j)1位のアミノ酸がMetであり、2位のアミノ酸がValであり、及び10アミノ酸の連続ストレッチが少なくとも3個のAlaと2個のLeuとを含む、15〜23アミノ酸の配列番号34の変異体、
k)1位のアミノ酸がMetであり、2位のアミノ酸がValであり、及び10アミノ酸の連続ストレッチが少なくとも2個のAlaと3個のLeuとを含む、15〜23アミノ酸の配列番号34の変異体、
l)1位のアミノ酸がMetであり、2位のアミノ酸がValであり、及び10アミノ酸の連続ストレッチが少なくとも1個のAlaと4個のLeuとを含む、15〜23アミノ酸の配列番号34の変異体、
m)1位のアミノ酸がMetであり、2位のアミノ酸がValであり、及び10アミノ酸の連続ストレッチが少なくとも5個のLeuを含む、15〜23アミノ酸の配列番号34の変異体、
n)1位のアミノ酸がMetであり、2位のアミノ酸がLysであり、及び10アミノ酸の連続ストレッチがAla又はLeuから選択される少なくとも5アミノ酸を含む、15〜23アミノ酸の配列番号34の変異体、
o)1位のアミノ酸がMetであり、2位のアミノ酸がLysであり、及び10アミノ酸の連続ストレッチがAla又はLeuから選択される少なくとも5アミノ酸を含み、及び変異体の最後の3つの位置におけるアミノ酸がAla、Leu、Alaである、15〜23アミノ酸の配列番号34の変異体、
p)1位のアミノ酸がMetであり、2位のアミノ酸がLysであり、及び10アミノ酸の連続ストレッチが少なくとも5個のAlaを含む、15〜23アミノ酸の配列番号34の変異体、
q)1位のアミノ酸がMetであり、2位のアミノ酸がLysであり、及び10アミノ酸の連続ストレッチが少なくとも4個のAlaと1個のLeuとを含む、15〜23アミノ酸の配列番号34の変異体、
r)1位のアミノ酸がMetであり、2位のアミノ酸がLysであり、及び10アミノ酸の連続ストレッチが少なくとも3個のAlaと2個のLeuとを含む、15〜23アミノ酸の配列番号34の変異体、
s)1位のアミノ酸がMetであり、2位のアミノ酸がLysであり、及び10アミノ酸の連続ストレッチが少なくとも2個のAlaと3個のLeuとを含む、15〜23アミノ酸の配列番号34の変異体、
t)1位のアミノ酸がMetであり、2位のアミノ酸がLysであり、及び10アミノ酸の連続ストレッチが少なくとも1個のAlaと4個のLeuとを含む、15〜23アミノ酸の配列番号34の変異体、
u)1位のアミノ酸がMetであり、2位のアミノ酸がLysであり、及び10アミノ酸の連続ストレッチが少なくとも5個のLeuを含む、15〜23アミノ酸の配列番号34の変異体、
の群から選択されるものである。
【0155】
以上の配列番号25の(a)〜(d)、配列番号39の(a)及び(b)、配列番号44の(a)及び(b)並びに配列番号34の(a)〜(u)の変異体において、連続ストレッチは、好ましくは10アミノ酸、より好ましくは9アミノ酸、さらにより好ましくは8アミノ酸、及び最も好ましくは7アミノ酸である。
【0156】
以上の配列番号25の(a)〜(d)、配列番号39の(a)及び(b)、配列番号44の(a)及び(b)並びに配列番号34の(a)〜(u)の変異体において、アミノ酸の連続ストレッチは、好ましくはAla又はLeuから選択される少なくとも5アミノ酸、より好ましくはAla又はLeuから選択される少なくとも6アミノ酸、及び最も好ましくはAla又はLeuから選択される少なくとも7アミノ酸を含む。
【0157】
15〜23アミノ酸の配列番号25、配列番号39、配列番号44、又は配列番号34の変異体は、15アミノ酸、16アミノ酸、17アミノ酸、18アミノ酸、19アミノ酸、20アミノ酸、21アミノ酸、22アミノ酸又は23アミノ酸を含み得る。
【0158】
第6の態様において、本発明は、対象組換えポリペプチドを産生するための本発明に係るシグナルペプチドをコードするポリヌクレオチドの使用に関する。従って、シグナルペプチドは、好ましくは
a)配列番号25、
b)少なくとも8アミノ酸が対応位置における配列番号25の最初の10アミノ酸と同じである、15〜23アミノ酸の配列番号25の変異体、
c)1位のアミノ酸がMetであり、且つ2位のアミノ酸がVal又はLysであり、及び10アミノ酸の連続ストレッチがAla又はLeuから選択される少なくとも5アミノ酸を含む、15〜23アミノ酸の配列番号25の変異体、
d)配列番号39、
e)少なくとも8アミノ酸が対応位置における配列番号39の最初の10アミノ酸と同じである、15〜23アミノ酸の配列番号39の変異体、
f)1位のアミノ酸がMetであり、且つ2位のアミノ酸がVal又はLysであり、及び10アミノ酸の連続ストレッチがAla又はLeuから選択される少なくとも5アミノ酸を含む、15〜23アミノ酸の配列番号39の変異体、
g)配列番号44、
h)少なくとも8アミノ酸が対応位置における配列番号44の最初の10アミノ酸と同じである、15〜23アミノ酸の配列番号44の変異体、
i)1位のアミノ酸がMetであり、且つ2位のアミノ酸がVal又はLysであり、及び10アミノ酸の連続ストレッチがAla又はLeuから選択される少なくとも5アミノ酸を含む、15〜23アミノ酸の配列番号44の変異体、
j)配列番号34、
k)少なくとも8アミノ酸が対応位置における配列番号34の最初の10アミノ酸と同じである、15〜23アミノ酸の配列番号34の変異体、
l)1位のアミノ酸がMetであり、且つ2位のアミノ酸がVal又はLysであり、及び10アミノ酸の連続ストレッチがAla又はLeuから選択される少なくとも5アミノ酸を含む、15〜23アミノ酸の配列番号34の変異体、
からなる群から選択される。
【0159】
ある実施形態によれば、シグナルペプチドは配列番号25である。
【0160】
別の実施形態によれば、中間産物において、シグナルペプチドは、15〜23アミノ酸の配列番号25の変異体であって、少なくとも8アミノ酸が対応位置における配列番号25の最初の10アミノ酸と同じである変異体である。
【0161】
別の実施形態によれば、シグナルペプチドは、15〜23アミノ酸の配列番号25の変異体であって、1位のアミノ酸がMetであり、且つ2位のアミノ酸がVal又はLysであり、及び10アミノ酸の連続ストレッチがAla又はLeuから選択される少なくとも5アミノ酸を含む変異体である。
【0162】
別の実施形態によれば、シグナルペプチドは配列番号39である。
【0163】
別の実施形態によれば、シグナルペプチドは、15〜23アミノ酸の配列番号39の変異体であって、少なくとも8アミノ酸が対応位置における配列番号39の最初の10アミノ酸と同じである変異体である。
【0164】
別の実施形態によれば、シグナルペプチドは、15〜23アミノ酸の配列番号39の変異体であって、1位のアミノ酸がMetであり、且つ2位のアミノ酸がVal又はLysであり、及び10アミノ酸の連続ストレッチがAla又はLeuから選択される少なくとも5アミノ酸を含む変異体である。
【0165】
別の実施形態によれば、シグナルペプチドは配列番号44である。
【0166】
別の実施形態によれば、シグナルペプチドは、15〜23アミノ酸の配列番号44の変異体であって、少なくとも8アミノ酸が対応位置における配列番号44の最初の10アミノ酸と同じである変異体である。
【0167】
別の実施形態によれば、シグナルペプチドは、15〜23アミノ酸の配列番号44の変異体であって、1位のアミノ酸がMetであり、且つ2位のアミノ酸がVal又はLysであり、及び10アミノ酸の連続ストレッチがAla又はLeuから選択される少なくとも5アミノ酸を含む変異体である。
【0168】
別の実施形態によれば、シグナルペプチドは配列番号34である。
【0169】
別の実施形態によれば、シグナルペプチドは、15〜23アミノ酸の配列番号34の変異体であって、少なくとも8アミノ酸が対応位置における配列番号34の最初の10アミノ酸と同じである変異体である。
【0170】
別の実施形態によれば、シグナルペプチドは、15〜23アミノ酸の配列番号34の変異体であって、1位のアミノ酸がMetであり、且つ2位のアミノ酸がVal又はLysであり、及び10アミノ酸の連続ストレッチがAla又はLeuから選択される少なくとも5アミノ酸を含む変異体である。
【0171】
好ましくは、シグナルペプチドが
(a):配列番号25、
(b):少なくとも8アミノ酸が対応位置における配列番号25の最初の10アミノ酸と同じである、15〜23アミノ酸の配列番号25の変異体、又は
(c)1位のアミノ酸がMetであり、且つ2位のアミノ酸がVal又はLysであり、及び10アミノ酸の連続ストレッチがAla又はLeuから選択される少なくとも5アミノ酸を含む、15〜23アミノ酸の配列番号25の変異体、
であるとき、対象ポリペプチドはペクチンメチルエステラーゼではなく、より好ましくは、対象ポリペプチドはエルウィニア・クリサンテミ(Erwinia chrysanthemi)由来のペクチンメチルエステラーゼではない。より好ましくは、シグナルペプチドが(b)又は(c)であるとき、対象ポリペプチドはペクチンメチルエステラーゼではなく、さらにより好ましくは、対象ポリペプチドはエルウィニア・クリサンテミ(Erwinia chrysanthemi)由来のペクチンメチルエステラーゼではない。
【0172】
好ましくは、配列番号25をコードするときの第1のポリヌクレオチドは、配列番号29に係るポリヌクレオチドである。好ましくは、配列番号39をコードするときの第1のポリヌクレオチドは、配列番号38に係るポリヌクレオチドである。好ましくは、配列番号44をコードするときの第1のポリヌクレオチドは、配列番号43に係るポリヌクレオチドである。好ましくは、配列番号34をコードするときの第1のポリヌクレオチドは、配列番号33に係るポリヌクレオチドである。
【0173】
好ましくは、15〜23アミノ酸の配列番号25の変異体であって、少なくとも8アミノ酸が対応位置における配列番号25の最初の10アミノ酸と同じである変異体は、少なくとも9アミノ酸が対応位置における配列番号25の最初の10アミノ酸と同じである変異体である。より好ましくは、10アミノ酸が対応位置における配列番号25の最初の10アミノ酸と同じである。
【0174】
好ましくは、15〜23アミノ酸の配列番号25の変異体であって、1位のアミノ酸がMetであり、且つ2位のアミノ酸がVal又はLysであり、及び10アミノ酸の連続ストレッチがAla又はLeuから選択される少なくとも5アミノ酸を含む変異体は、
a)1位のアミノ酸がMetであり、2、3及び/又は4位のアミノ酸がVal又はLysであり、及び10アミノ酸の連続ストレッチがAla又はLeuから選択される少なくとも5アミノ酸を含む、15〜23アミノ酸の配列番号25の変異体、
b)1位のアミノ酸がMetであり、2位のアミノ酸がValであり、且つ3位のアミノ酸がLysであり、及び10アミノ酸の連続ストレッチがAla又はLeuから選択される少なくとも5アミノ酸を含む、15〜23アミノ酸の配列番号25の変異体、
c)1位のアミノ酸がMetであり、2、3及び/又は4位のアミノ酸がVal又はLysであり、及び10アミノ酸の連続ストレッチがAla又はLeuから選択される少なくとも5アミノ酸を含み、及び変異体の最後の3つの位置のアミノ酸がAla、Leu及びAlaである、15〜23アミノ酸の配列番号25の変異体、
d)1位のアミノ酸がMetであり、2位のアミノ酸がValであり、且つ3位のアミノ酸がLysであり、及び10アミノ酸の連続ストレッチがAla又はLeuから選択される少なくとも5アミノ酸を含み、及び変異体の最後の3つの位置のアミノ酸がAla、Leu及びAlaである、15〜23アミノ酸の配列番号25の変異体、
の群から選択されるものである。
【0175】
好ましくは、15〜23アミノ酸の配列番号39の変異体であって、少なくとも8アミノ酸が対応位置における配列番号39の最初の10アミノ酸と同じである変異体は、少なくとも9アミノ酸が対応位置における配列番号39の最初の10アミノ酸と同じである変異体である。より好ましくは、10アミノ酸が対応位置における配列番号39の最初の10アミノ酸と同じである。
【0176】
好ましくは、15〜23アミノ酸の配列番号39の変異体であって、1位のアミノ酸がMetであり、且つ2位のアミノ酸がVal又はLysであり、及び10アミノ酸の連続ストレッチがAla又はLeuから選択される少なくとも5アミノ酸を含む変異体は、
a)1位のアミノ酸がMetであり、2、3及び/又は5位のアミノ酸がVal又はLysであり、及び10アミノ酸の連続ストレッチがAla又はLeuから選択される少なくとも5アミノ酸を含む、15〜23アミノ酸の配列番号39の変異体、
b)1位のアミノ酸がMetであり、2位のアミノ酸がValであり、且つ5位のアミノ酸がLysであり、及び10アミノ酸の連続ストレッチがAla又はLeuから選択される少なくとも5アミノ酸を含む、15〜23アミノ酸の配列番号39の変異体、
の群から選択されるものである。
【0177】
好ましくは、15〜23アミノ酸の配列番号44の変異体であって、少なくとも8アミノ酸が対応位置における配列番号44の最初の10アミノ酸と同じである変異体は、少なくとも9アミノ酸が対応位置における配列番号44の最初の10アミノ酸と同じである変異体である。より好ましくは、10アミノ酸が対応位置における配列番号44の最初の10アミノ酸と同じである。
【0178】
好ましくは、15〜23アミノ酸の配列番号44の変異体であって、1位のアミノ酸がMetであり、且つ2位のアミノ酸がVal又はLysであり、及び10アミノ酸の連続ストレッチがAla又はLeuから選択される少なくとも5アミノ酸を含む変異体は、
a)1位のアミノ酸がMetであり、2、3及び/又は4位のアミノ酸がVal又はLysであり、及び10アミノ酸の連続ストレッチがAla又はLeuから選択される少なくとも5アミノ酸を含む、15〜23アミノ酸の配列番号44の変異体、
b)1位のアミノ酸がMetであり、2位のアミノ酸がValであり、且つ4位のアミノ酸がLysであり、及び10アミノ酸の連続ストレッチがAla又はLeuから選択される少なくとも5アミノ酸を含む、15〜23アミノ酸の配列番号44の変異体、
の群から選択されるものである。
【0179】
好ましくは、15〜23アミノ酸の配列番号34の変異体であって、少なくとも8アミノ酸が対応位置における配列番号34の最初の10アミノ酸と同じである変異体は、少なくとも9アミノ酸が対応位置における配列番号34の最初の10アミノ酸と同じである変異体である。より好ましくは、10アミノ酸が対応位置における配列番号34の最初の10アミノ酸と同じである。
【0180】
好ましくは、15〜23アミノ酸の配列番号34の変異体であって、1位のアミノ酸がMetであり、且つ2位のアミノ酸がVal又はLysであり、及び10アミノ酸の連続ストレッチがAla又はLeuから選択される少なくとも5アミノ酸を含む変異体は、
a)1位のアミノ酸がMetであり、2、3及び/又は4位のアミノ酸がLysであり、及び10アミノ酸の連続ストレッチがAla又はLeuから選択される少なくとも5アミノ酸を含む、15〜23アミノ酸の配列番号34の変異体、
b)1位のアミノ酸がMetであり、2位のアミノ酸がLysであり、且つ3及び/又は4位のアミノ酸がLysであり、及び10アミノ酸の連続ストレッチがAla又はLeuから選択される少なくとも5アミノ酸を含む、15〜23アミノ酸の配列番号34の変異体、
c)1位のアミノ酸がMetであり、2、3及び/又は4位のアミノ酸がLysであり、及び10アミノ酸の連続ストレッチがAla又はLeuから選択される少なくとも5アミノ酸を含み、及び変異体の最後の3つの位置のアミノ酸がAla、Leu及びAlaである、15〜23アミノ酸の配列番号34の変異体、
d)1位のアミノ酸がMetであり、2位のアミノ酸がLysであり、且つ3及び/又は4位のアミノ酸がLysであり、及び10アミノ酸の連続ストレッチがAla又はLeuから選択される少なくとも5アミノ酸を含み、及び変異体の最後の3つの位置のアミノ酸がAla、Leu及びAlaである、15〜23アミノ酸の配列番号34の変異体、
e)1位のアミノ酸がMetであり、2位のアミノ酸がValであり、及び10アミノ酸の連続ストレッチがAla又はLeuから選択される少なくとも5アミノ酸を含む、15〜23アミノ酸の配列番号34の変異体、
f)1位のアミノ酸がMetであり、2位のアミノ酸がValであり、及び10アミノ酸の連続ストレッチがAla又はLeuから選択される少なくとも5アミノ酸を含み、及び変異体の最後の3つの位置のアミノ酸がAla、Leu及びAlaである、15〜23アミノ酸の配列番号34の変異体、
g)1位のアミノ酸がMetであり、2位のアミノ酸がValであり、及び10アミノ酸の連続ストレッチがAla又はLeuから選択される少なくとも5アミノ酸を含み、及び変異体の最後の3つの位置におけるアミノ酸がAla、Leu、Alaである、15〜23アミノ酸の配列番号34の変異体、
h)1位のアミノ酸がMetであり、2位のアミノ酸がValであり、及び10アミノ酸の連続ストレッチが少なくとも5個のAlaを含む、15〜23アミノ酸の配列番号34の変異体、
i)1位のアミノ酸がMetであり、2位のアミノ酸がValであり、及び10アミノ酸の連続ストレッチが少なくとも4個のAlaと1個のLeuとを含む、15〜23アミノ酸の配列番号34の変異体、
j)1位のアミノ酸がMetであり、2位のアミノ酸がValであり、及び10アミノ酸の連続ストレッチが少なくとも3個のAlaと2個のLeuとを含む、15〜23アミノ酸の配列番号34の変異体、
k)1位のアミノ酸がMetであり、2位のアミノ酸がValであり、及び10アミノ酸の連続ストレッチが少なくとも2個のAlaと3個のLeuとを含む、15〜23アミノ酸の配列番号34の変異体、
l)1位のアミノ酸がMetであり、2位のアミノ酸がValであり、及び10アミノ酸の連続ストレッチが少なくとも1個のAlaと4個のLeuとを含む、15〜23アミノ酸の配列番号34の変異体、
m)1位のアミノ酸がMetであり、2位のアミノ酸がValであり、及び10アミノ酸の連続ストレッチが少なくとも5個のLeuを含む、15〜23アミノ酸の配列番号34の変異体、
n)1位のアミノ酸がMetであり、2位のアミノ酸がLysであり、及び10アミノ酸の連続ストレッチがAla又はLeuから選択される少なくとも5アミノ酸を含む、15〜23アミノ酸の配列番号34の変異体、
o)1位のアミノ酸がMetであり、2位のアミノ酸がLysであり、及び10アミノ酸の連続ストレッチがAla又はLeuから選択される少なくとも5アミノ酸を含み、及び変異体の最後の3つの位置におけるアミノ酸がAla、Leu、Alaである、15〜23アミノ酸の配列番号34の変異体、
p)1位のアミノ酸がMetであり、2位のアミノ酸がLysであり、及び10アミノ酸の連続ストレッチが少なくとも5個のAlaを含む、15〜23アミノ酸の配列番号34の変異体、
q)1位のアミノ酸がMetであり、2位のアミノ酸がLysであり、及び10アミノ酸の連続ストレッチが少なくとも4個のAlaと1個のLeuとを含む、15〜23アミノ酸の配列番号34の変異体、
r)1位のアミノ酸がMetであり、2位のアミノ酸がLysであり、及び10アミノ酸の連続ストレッチが少なくとも3個のAlaと2個のLeuとを含む、15〜23アミノ酸の配列番号34の変異体、
s)1位のアミノ酸がMetであり、2位のアミノ酸がLysであり、及び10アミノ酸の連続ストレッチが少なくとも2個のAlaと3個のLeuとを含む、15〜23アミノ酸の配列番号34の変異体、
t)1位のアミノ酸がMetであり、2位のアミノ酸がLysであり、及び10アミノ酸の連続ストレッチが少なくとも1個のAlaと4個のLeuとを含む、15〜23アミノ酸の配列番号34の変異体、
u)1位のアミノ酸がMetであり、2位のアミノ酸がLysであり、及び10アミノ酸の連続ストレッチが少なくとも5個のLeuを含む、15〜23アミノ酸の配列番号34の変異体、
の群から選択されるものである。
【0181】
以上の配列番号25の(a)〜(d)、配列番号39の(a)及び(b)、配列番号44の(a)及び(b)並びに配列番号34の(a)〜(u)の変異体において、連続ストレッチは、好ましくは10アミノ酸、より好ましくは9アミノ酸、さらにより好ましくは8アミノ酸、及び最も好ましくは7アミノ酸である。
【0182】
以上の配列番号25の(a)〜(d)、配列番号39の(a)及び(b)、配列番号44の(a)及び(b)並びに配列番号34の(a)〜(u)の変異体において、アミノ酸の連続ストレッチは、好ましくはAla又はLeuから選択される少なくとも5アミノ酸、より好ましくはAla又はLeuから選択される少なくとも6アミノ酸、及び最も好ましくはAla又はLeuから選択される少なくとも7アミノ酸を含む。
【0183】
15〜23アミノ酸の配列番号25、配列番号39、配列番号44、又は配列番号34の変異体は、15アミノ酸、16アミノ酸、17アミノ酸、18アミノ酸、19アミノ酸、20アミノ酸、21アミノ酸、22アミノ酸又は23アミノ酸を含んでもよい。
【0184】
本明細書に提供されるとおりの配列情報は、誤って同定された塩基の包含を必要とするほど狭義に解釈されてはならない。本明細書に開示される特定の配列は、簡単にそれぞれの宿主細胞からの完全な遺伝子の単離に使用することができ、次に容易にそれをさらなる配列解析に供することによって配列決定の誤りを特定することができる。
【0185】
特に指示されない限り、本明細書においてDNA分子を配列決定することにより決定される全てのヌクレオチド配列は、自動DNAシーケンサーを使用して決定したものであり、及び本明細書において決定されるDNA分子によりコードされるポリペプチドの全てのアミノ酸配列は、上記のとおり決定された核酸配列の翻訳により予測した。従って、この自動化された手法により決定される任意のDNA配列について当該技術分野で公知のとおり、本明細書において決定される任意のヌクレオチド配列が、いくらかの誤りを含み得る。自動化により決定されるヌクレオチド配列は、配列決定されたDNA分子の実際のヌクレオチド配列と典型的には少なくとも約90%同一であり、より典型的には少なくとも約95%〜少なくとも約99.9%同一である。実際の配列は、当該技術分野において公知の手動によるDNA配列決定方法を含めた他の手法により、より正確に決定することができる。同様に当該技術分野において公知のとおり、決定されたヌクレオチド配列に実際の配列と比較して単一の挿入又は欠失があると、ヌクレオチド配列の翻訳においてフレームシフトが起こることがあり、従って決定されたヌクレオチド配列によりコードされる予想アミノ酸配列は、かかる挿入又は欠失を起点として、配列決定されたDNA分子により実際にコードされるアミノ酸配列と全く異なり得る。
【0186】
当業者は、かかる誤って同定された塩基を特定することができ、及びかかる誤りの修正方法を知っている。
【0187】
本明細書に含まれる具体的な実施形態は本発明のいくつかの態様の例示として意図されるため、それらの実施形態によって本明細書に記載及び特許請求される本発明の範囲が限定されるものではない。任意の均等な実施形態が、本発明の範囲内にあることが意図される。実際、本明細書に図示及び記載されるものに加え、本発明の様々な変形例が、前述の説明から当業者には明らかとなるであろう。かかる変形例もまた、添付の特許請求の範囲の範囲内に含まれることが意図される。対立がある場合、定義を含む本開示が指針とみなされる。
【0188】
本発明を以下の実施例によりさらに説明する。
【0189】
[実施例]
[株]
WT 1:このA.ニガー(A.niger)株は野生型株として使用する。この株は、寄託番号CBS 513.88としてCBS Instituteに寄託されている。
【0190】
WT 2:このA.ニガー(A.niger)株は、グルコアミラーゼ(glaA)をコードする遺伝子の欠失を含むWT 1株である。WT 2は、欧州特許第0 635 574 B1号明細書に記載されるとおりの「マーカー遺伝子フリー」手法を用いることにより構築した。この特許には、CBS 513.88のゲノム中のglaA特異的DNA配列を欠失させる方法についての広範な記載がなされている。この手順により、最終的には外来DNA配列を一切有しないマーカー遺伝子フリーΔglaA組換えA.ニガー(A.niger)CBS 513.88株が得られた。
【0191】
WT 3:このA.ニガー(A.niger)株は、シュウ酸欠損A.ニガー(A.niger)株をもたらす欠失を含むWT 2株である。WT 3は、欧州特許第1157100号明細書及び米国特許第6,936,438号明細書に記載されるとおりの方法を用いることにより構築し、ここでシュウ酸欠損株は、オキサロ酢酸ヒドロラーゼをコードするoahA遺伝子を欠失させることにより得られ、WT 3株はWT 2株バックグラウンドにおいてoahA遺伝子が不活化された代表株として選択した。或いは、欧州特許第1590444号明細書には、シュウ酸欠損突然変異A.ニガー(A.niger)株のスクリーニング方法について広範な記載がなされている。欧州特許第1590444号明細書の実施例1及び2の後に、WT 2のシュウ酸欠損突然変異株をどのように得ることができるかが記載されている。
【0192】
WT 4:このA.ニガー(A.niger)株は、3つの連続するステップでα−アミラーゼをコードする3個の遺伝子(amyB、amyBI及びamyBII)の欠失を含むWT 3株である。これらの3個の遺伝子の欠失ベクター及びゲノム欠失の構築については、国際公開第2005095624号パンフレットに詳細に記載されている。国際公開第2005095624号パンフレットに記載されるベクターpDEL−AMYA、pDEL−AMYBI及びpDEL−AMYBIIは、欧州特許第0 635 574 B1号明細書に記載されるとおりの「マーカー遺伝子フリー」手法に従い使用されている。上記の手順により、最終的には外来DNA配列を一切有しないシュウ酸欠損マーカー遺伝子フリーΔglaA、ΔamyA、ΔamyBI及びΔamyBIIアミラーゼ陰性組換えA.ニガー(A.niger)CBS 513.88株が得られた。従って、WT 4はアミラーゼバックグラウンドが低く、WT 1と比較してα−アミラーゼ発現及び発現検出に対してより最適化されている。
【0193】
[分子生物学的技法]
これらの株において、当業者に公知の分子生物学的技法を用いて(Sambrook及びRussell、「Molecular Cloning:A Laboratory Manual」、第3版、CSHL Press、Cold Spring Harbor、NY、2001年を参照のこと)、いくつかの遺伝子を過剰発現させ、他の遺伝子は以下に記載されるとおり下方制御した。遺伝子過剰発現用の発現ベクター及び下方制御用の破壊ベクターの一般的な設計、形質転換、マーカー及び選択培地の使用の例は、国際公開第199846772号パンフレット、国際公開第199932617号パンフレット、国際公開第2001121779号パンフレット、国際公開第2005095624号パンフレット、欧州特許第635574B号明細書及び国際公開第2005100573号パンフレットに見ることができる。
【0194】
[A.ニガー(A.niger)振盪フラスコ発酵]
国際公開第99/32617号パンフレットの実施例「アスペルギルス・ニガー(Aspergillus niger)振盪フラスコ発酵」の節に記載されるとおり、A.ニガー(A.niger)株を20mlの前培養培地中で前培養する。一晩増殖させた後、この培養物の10mlを発酵培地(FM)に移す。
【0195】
発酵培地(FM)は1リットル当たり以下を含む:82.5gのグルコース.1H2O、25gのMaldex 15(Boom Meppel、オランダ)、2gのクエン酸、4.5gのNaH2PO4.1H2O、9gのKH2PO4、15gの(NH4)2SO4、0.02gのZnCl2、0.1gのMnSO4.1H2O、0.015gのCuSO4.5H2O、0.015gのCoCl2.6H2O、1gのMgSO4.7H2O、0.1gのCaCl2.2H2O、0.3gのFeSO4.7H2O、30gのMES(2−[N−モルホリノ]エタンスルホン酸)、pH=6。
【0196】
FM中での発酵は、概して国際公開第99/32617号パンフレットに記載されるとおり、100mlの発酵ブロスを含む500mlのバッフル付きフラスコ内において34℃及び170rpmで指示される日数にわたり実施する。
【0197】
[真菌α−アミラーゼ活性]
A.ニガー(A.niger)培養ブロス中のα−アミラーゼ活性を決定するため、Megazyme穀物α−アミラーゼキットを供給業者のプロトコルに従い使用する(Megazyme、CERALPHA αアミラーゼアッセイキット、カタログ参照番号K−CERA、2000〜2001年)。計測される活性は、過剰なグルコアミラーゼ及びα−グルコシダーゼの存在下における非還元末端がブロックされたρ−ニトロフェニルマルトヘプタオシドの加水分解に基づく。形成されたρ−ニトロフェノールの量が、試料中に存在するα−アミラーゼ活性の尺度となる。
【0198】
[グルコースオキシダーゼ活性]
A.ニガー(A.niger)培養ブロス中のグルコースオキシダーゼ活性を決定するため、Witteveenら 1990年(「アスペルギルス・ニガー(Aspergillus niger)のグルコースオキシダーゼ過剰発現及びネガティブ変異体(Glucose oxidase overproducing and negative mutants of Aspergillus niger)」、App1.Microbiol.Biotechnol 33:683〜686頁)により記載されるとおりο−ジアニシジンを使用した450nmでの分光測定によりグルコースオキシダーゼを計測した。
【0199】
[実施例1.A.ニガー(A.niger)α−アミラーゼAmyB及びP.クリソゲナム(P.chrysogenum)グルコースオキシダーゼgoxAについての修飾アスペルギルス属(Aspergillus)発現コンストラクトの構築]
α−アミラーゼタンパク質をコードするamyB遺伝子のDNA配列は、EMBLヌクレオチド配列データベース(http://www.ebi.ac.uk/embl/index.html)から受託番号XM_001395712.1、XM_001390741.1又はCAK46324に基づき検索することができる。天然A.ニガー(A.niger)amyB遺伝子のゲノム配列は、配列番号1として示される。対応するamyBのコード配列又はcDNA配列は、配列番号2として示される。配列番号2の翻訳配列は配列番号3として指定され、A.ニガー(A.niger)α−アミラーゼタンパク質AmyBを表す。この配列はまた、A.オリゼ(A.oryzae)α−アミラーゼタンパク質と100%の類似度を有する(Wirsel S.、Lachmund A.、Wildhardt G.、Ruttkowski E.、「アスペルギルス・オリゼ(Aspergillus oryzae)の3個のα−アミラーゼ遺伝子は同一のイントロン−エクソン構成を示す(Three alpha−amylase genes of Aspergillus oryzae exhibit identical intron−exon organization)」(1989年)Mol.Microbiol.3:314頁)。天然の分泌A.ニガー(A.niger)成熟α−アミラーゼペプチドは、配列番号4として指定される。本発明の方法による最適化は、以下に詳述するとおり最適化amyB cDNA配列及び改良型発現ベクターにより実施している。
【0200】
A.ニガー(A.niger)amyBコンストラクトの変異体のアスペルギルス属(Aspergillus)種における発現解析のため、amyBコード配列は、α−アミラーゼをコードするamyB遺伝子に対するコドン最適化(CO)コード配列を含んだ(国際公開第2008/000632号パンフレットに詳細に記載されるとおり)。強力なA.ニガー(A.niger)グルコアミラーゼglaAプロモーター及びα−アミラーゼamyBプロモーターの双方を、pGBFINベースの発現コンストラクトを使用したA.ニガー(A.niger)におけるαアミラーゼ酵素の過剰発現に適用した(国際公開第1999/32617号パンフレット及び国際公開第2006/077258号パンフレットに記載されるとおり)。グルコアミラーゼglaA及びα−アミラーゼamyBプロモーターの翻訳開始配列は、続いて生成される全てのamyB発現コンストラクトにおいて5’−CACCGTCAAA ATG−3’となるよう修飾している(同様に国際公開第2006/077258号パンフレットに詳述されるとおり)。天然α−アミラーゼamyBプロモーターに存在するBstXI部位(5’CCANNNNN/NTGG−3’)は、一部のベクターではシグナル配列変異体のクローニングを促進するため取り除いた。加えて、最適な翻訳終結配列を使用し、従って全ての発現コンストラクトで野生型amyB 5’−TGA−3’翻訳終結配列を5’−TAAA−3’に置き換えた(国際公開第2006/077258号パンフレットに詳述されるとおり)。
【0201】
適切な制限部位を両末端に導入し、発現ベクターにおけるクローニングを可能にした。5’末端にXhoI部位を導入し、3’末端にPacI部位を導入した。修飾ゲノムglaA又はamyBプロモーターと最適化amyB cDNA配列とを含む参照コンストラクトのDNA断片を完全に合成し、サブクローニングし、配列解析により配列を確認した。2つの合成断片の末端にあるXhoI−PacI制限部位を使用して、大型ベクター断片のXhoI及びPacI消化pGBFINFUA−1発現ベクターにおけるクローニングを可能にし(pGBFINFUA−1ベクターはまた、国際公開第2006/077258号パンフレット及び国際公開第2008/000632号パンフレットにも記載があり、ベクターの概略的なレイアウトについては図1を参照のこと)、それぞれpGBFINFUA−6及びpGBFINFUA−3を生成した。
【0202】
本発明の方法に係るシグナル配列が特に異なる、修飾AmyB配列の全てのDNA断片を設計し、EcoRI−PacI断片又はEcoRI−BstXI断片として完全に合成し、サブクローニングして配列を確認した。全ての合成断片の末端にあるEcoRI−PacI/BstXI制限部位を使用して、大型ベクター断片のEcoRI及びPacI/BstXI消化pGBFINFUA−3又はEcoRI及びPacI消化pGBFINFUA−6発現ベクターにおけるクローニングを可能にし、変異体pGBFINFUA発現ベクターを生成した。それぞれのベクターの配列を確認した後、変異発現コンストラクトを以下の表1及び表2に記載するとおり命名した。全てのpGBFINFUAコンストラクトの全ての特徴及びそれぞれの配列に対する参照は、表1及び表2から推定され得る。
【0203】
【表1】

【0204】
本明細書における実施例1の全ての表中では、全てのpGBFINプラスミドのEcoRI−PacI部分の配列が「配列番号」に示され、完全な遺伝子コード配列及びそのコード配列の翻訳配列が、それぞれ「コード配列の配列番号」及び「タンパク質の配列番号」に示されるとおりのアミノ酸配列に従い、及び使用されるシグナル配列のヌクレオチド及び翻訳されたアミノ酸配列が、「シグナル配列コード配列の配列番号」及び「アミノ酸シグナル配列の配列番号」に示される。pGBFINFUA−6及び誘導されたベクターの概略レイアウトは図2に見ることができ、一方、ベクターpGBFINFUA−1、pGBFINFUA−3及びpGBFINFUA−21のレイアウトは図1に見ることができる。
【0205】
【表2】

【0206】
遺伝子コードPc20g09560の、ペニシリウム・クリソゲナム(Penicillium chrysogenum)グルコースオキシダーゼタンパク質をコードするgoxA遺伝子のDNA配列は、EMBLヌクレオチド配列データベース(http://www.ebi.ac.uk/embl/index.html)から受託番号AM920435.1に基づき検索することができる。Pc20g09560の翻訳配列は配列番号49として指定され、これはP.クリソゲナム(P.chrysogenum)グルコースオキシダーゼタンパク質GoxAに相当する。
【0207】
上記に詳述したとおりの改良型発現ベクターによりgoxA遺伝子又は遺伝子断片の発現を実施したとともに、配列番号48として特定され得るコドン対最適化goxA cDNA配列により本発明の方法に係る最適化を実施している。
【0208】
本発明の方法に係るシグナル配列が特に異なり、且つglaAプロモーターの部分及び最適化GoxA cDNA配列を特に含む、修飾GoxAコンストラクトの2個のDNA断片を設計し、EcoRI−PacI断片として完全に合成し、サブクローニングして配列を確認した。合成断片の末端にあるEcoRI−PacI制限部位を使用して大型ベクター断片のEcoRI及びPacI消化pGBFINFUA−6発現ベクターにおけるクローニングを可能にし、変異体pGBFINGOX発現ベクターを生成した。それぞれのベクターの配列を確認した後、変異発現コンストラクトを以下の表3に記載するとおり命名した。2個のpGBFINGOXコンストラクトの全ての特徴及びそれぞれの配列に対する参照は、表3から推定され得る。
【0209】
【表3】

【0210】
[実施例2.A.ニガー(A.niger)におけるA.ニガー(A.niger)α−アミラーゼ及びP.クリソゲナム(P.chrysogenum)グルコースオキシダーゼについての野生型及び修飾発現コンストラクトの発現]
実施例1(上記)で調製したpGBFINFUA及びpGBFFINGOX発現コンストラクトを、以下に記載されるとおりの形質転換により、及び図3に図示される戦略に従い、A.ニガー(A.niger)に導入した。
【0211】
異なるpGBFINFUAベクター(表1及び表2)及び2つの異なるpGBFINGOXベクター(表3)をWT 4に導入するため、国際公開第1998/46772号パンフレット及び国際公開第1999/32617号パンフレットに記載されるとおり形質転換及び続く形質転換体の選択を行った。要約すれば、pGBFINFUA及びpGBFINGOXコンストラクトの直鎖状DNAを単離し、それを使用してA.ニガー(A.niger)WT4を形質転換した。形質転換体をアセトアミド培地上で選択し、標準的手順に従いコロニーを精製した。コロニーは、glaA遺伝子座における組込み及びコピー数についてPCRを用いて診断した。同様の推定コピー数(推定単一コピー)を有する各pGBFINFUAコンストラクトの3個の独立した形質転換体を選択し、形質転換プラスミドの番号を用いて、例えばそれぞれFUA−3−1、FUA−3−2、FUA−3−3、FUA−6−1等のように命名した。
【0212】
同様に、同様の推定コピー数(推定単一コピー)を有する各pGBFINGOXコンストラクトの5個の独立した形質転換体を選択し、形質転換プラスミドの番号を用いて、例えばそれぞれGOX−1−1、GOX−1−2、GOX−1−3、...、GOX−2−1、GOX−2−2、GOX−2−3等のように命名した。
【0213】
選択したFUA株及びGOX株及びA.ニガー(A.niger)WT 1及びWT 4を使用して、500mlのバッフル付き振盪フラスコを用いるインキュベーターシェーカーにおいて上記に記載したとおりの100mlの培地中、34℃及び170rpmで振盪フラスコ実験を実施した。発酵の3日目及び4日目又は4日目及び5日目の後、試料を採取し、それぞれα−アミラーゼ活性又はグルコースオキシダーゼ活性を決定した。
【0214】
異なるコンストラクトを含む異なるA.ニガー(A.niger)FUA形質転換体の形質転換体により産生されるα−アミラーゼの産生を、培養上清中で計測した。コドン対最適化を伴う、若しくは伴わない内因性amyBシグナル配列の使用、又は最適化グルコアミラーゼシグナル配列の使用については、α−アミラーゼ産生及び発現に対する正の効果を認めることはできなかった。意外にも、グルコアミラーゼプロモーターを使用するとき、図4で確認することができるとおりα−アミラーゼ産生に対する本発明の修飾及び最適化されたシグナル配列の使用の明らかな正の効果が観察された。本発明の複数の最適シグナル配列がα−アミラーゼの産生に対して正の効果を示し、ペクチンメチルエステラーゼ(すなわちpGBFINFUA−12/13におけるpmeA)が最良である。図5においても、同様にα−アミラーゼ産生に対する本発明のpmeAシグナル配列の使用の明らかな正の効果が、α−アミラーゼAmyBプロモーターとの組み合わせで観察された。
【0215】
P.クリソゲナム(P.chrysogenum)グルコースオキシダーゼGoxAの産生を、2つの異なるA.ニガー(A.niger)GOX形質転換体の5個の形質転換体において計測した。ここでもまた、図6で確認することができるとおり、グルコースオキシダーゼ産生に対する本発明のシグナル配列(すなわちpmeA)の使用の明らかな正の効果が観察された。
【0216】
このように、強力なα−アミラーゼAmyB及びグルコアミラーゼglaAプロモーターとの組み合わせで、本発明の方法に係る最適シグナル配列及びより具体的にはpmeAシグナル配列の使用についての正の効果が認められた。また、goxAグルコースオキシダーゼをコードする酵素と融合した本発明の方法に係るpmeAシグナル配列は、細胞外GoxA酵素産生の明らかな増加をもたらした。加えて、本発明の方法を修飾翻訳開始部位、コドン最適化コード配列及び/又は翻訳終結配列と組み合わせることのα−アミラーゼ産生に対する正の効果が観察された。これらの結果は、明らかに、発現コンストラクトについて特定される他の配列最適化との本発明の修飾の相加的効果を示している。
【0217】
明らかにこれらの実施例は、どのように本発明の方法、例えば天然α−アミラーゼ又はグルコースオキシダーゼ配列と融合したpmeAシグナル配列を用いて、A.ニガー(A.niger)におけるα−アミラーゼ又はグルコースオキシダーゼ又は糸状菌における任意の他の対象タンパク質の分泌及び産生を改良することができるかを示す。加えて、これらの結果は、本発明の方法が宿主におけるタンパク質発現の改良に広範に適用できることを示すものであり、但し発現コンストラクト及び宿主は、例えば強力なプロモーター、改良された翻訳開始配列、改良された翻訳終結配列、最適化されたコドン及びコドン対使用頻度及び/又は改良されたタンパク質発現用宿主など、既にいくつかの他の最適化を有する。
【特許請求の範囲】
【請求項1】
対象組換えポリペプチドの産生方法であって、
(i)前記ポリペプチドの産生をもたらす条件下における糸状菌宿主細胞の培養であって、前記糸状菌宿主細胞が翻訳リーディングフレーム内で第2のポリヌクレオチドに連結された第1のポリヌクレオチドを含み、前記第2のポリヌクレオチドが対象ポリペプチドをコードし、前記第1のポリヌクレオチドが、
a)配列番号25、
b)少なくとも8アミノ酸が対応位置における配列番号25の最初の10アミノ酸と同じである、15〜23アミノ酸の配列番号25の変異体、
c)1位のアミノ酸がMetであり、且つ2位のアミノ酸がVal又はLysであり、及び10アミノ酸の連続ストレッチがAla又はLeuから選択される少なくとも5アミノ酸を含む、15〜23アミノ酸の配列番号25の変異体、
d)配列番号39、
e)少なくとも8アミノ酸が対応位置における配列番号39の最初の10アミノ酸と同じである、15〜23アミノ酸の配列番号39の変異体、
f)1位のアミノ酸がMetであり、且つ2位のアミノ酸がVal又はLysであり、及び10アミノ酸の連続ストレッチがAla又はLeuから選択される少なくとも5アミノ酸を含む、15〜23アミノ酸の配列番号39の変異体、
g)配列番号44、
h)少なくとも8アミノ酸が対応位置における配列番号44の最初の10アミノ酸と同じである、15〜23アミノ酸の配列番号44の変異体、
i)1位のアミノ酸がMetであり、且つ2位のアミノ酸がVal又はLysであり、及び10アミノ酸の連続ストレッチがAla又はLeuから選択される少なくとも5アミノ酸を含む、15〜23アミノ酸の配列番号44の変異体、
j)配列番号34、
k)少なくとも8アミノ酸が対応位置における配列番号34の最初の10アミノ酸と同じである、15〜23アミノ酸の配列番号34の変異体、
l)1位のアミノ酸がMetであり、且つ2位のアミノ酸がVal又はLysであり、及び10アミノ酸の連続ストレッチがAla又はLeuから選択される少なくとも5アミノ酸を含む、15〜23アミノ酸の配列番号34の変異体、
からなる群から選択されるシグナルペプチドをコードする、培養と、
(ii)場合により、培養培地からの前記ポリペプチドの単離と、
を含み、但し前記シグナルペプチドが(b)又は(c)であるとき、前記対象ポリペプチドはエルウィニア・クリサンテミ(Erwinia chrysanthemi)由来のペクチンメチルエステラーゼではない、方法。
【請求項2】
請求項1に記載の方法により得られるポリペプチド。
【請求項3】
翻訳リーディングフレーム内で第2のポリヌクレオチドに連結された第1のポリヌクレオチドによりコードされる組換えポリペプチドであって、前記第2のポリヌクレオチドが対象ポリペプチドをコードし、前記第1のポリヌクレオチドが、
a)配列番号25、
b)少なくとも8アミノ酸が対応位置における配列番号25の最初の10アミノ酸と同じである、15〜23アミノ酸の配列番号25の変異体、
c)1位のアミノ酸がMetであり、且つ2位のアミノ酸がVal又はLysであり、及び10アミノ酸の連続ストレッチがAla又はLeuから選択される少なくとも5アミノ酸を含む、15〜23アミノ酸の配列番号25の変異体、
d)配列番号39、
e)少なくとも8アミノ酸が対応位置における配列番号39の最初の10アミノ酸と同じである、15〜23アミノ酸の配列番号39の変異体、
f)1位のアミノ酸がMetであり、且つ2位のアミノ酸がVal又はLysであり、及び10アミノ酸の連続ストレッチがAla又はLeuから選択される少なくとも5アミノ酸を含む、15〜23アミノ酸の配列番号39の変異体、
g)配列番号44、
h)少なくとも8アミノ酸が対応位置における配列番号44の最初の10アミノ酸と同じである、15〜23アミノ酸の配列番号44の変異体、
i)1位のアミノ酸がMetであり、且つ2位のアミノ酸がVal又はLysであり、及び10アミノ酸の連続ストレッチがAla又はLeuから選択される少なくとも5アミノ酸を含む、15〜23アミノ酸の配列番号44の変異体、
j)配列番号34、
k)少なくとも8アミノ酸が対応位置における配列番号34の最初の10アミノ酸と同じである、15〜23アミノ酸の配列番号34の変異体、
l)1位のアミノ酸がMetであり、且つ2位のアミノ酸がVal又はLysであり、及び10アミノ酸の連続ストレッチがAla又はLeuから選択される少なくとも5アミノ酸を含む、15〜23アミノ酸の配列番号34の変異体、
からなる群から選択されるシグナルペプチドをコードし、
但し前記シグナルペプチドが(b)又は(c)であるとき、前記対象ポリペプチドはエルウィニア・クリサンテミ(Erwinia chrysanthemi)由来のペクチンメチルエステラーゼではない、組換えポリペプチド。
【請求項4】
翻訳リーディングフレーム内で第2のポリヌクレオチドに連結された第1のポリヌクレオチドを含む組換え発現コンストラクトであって、前記第2のポリヌクレオチドが対象ポリペプチドをコードし、前記第1のポリヌクレオチドが、
a)配列番号25、
b)少なくとも8アミノ酸が対応位置における配列番号25の最初の10アミノ酸と同じである、15〜23アミノ酸の配列番号25の変異体、
c)1位のアミノ酸がMetであり、且つ2位のアミノ酸がVal又はLysであり、及び10アミノ酸の連続ストレッチがAla又はLeuから選択される少なくとも5アミノ酸を含む、15〜23アミノ酸の配列番号25の変異体、
d)配列番号39、
e)少なくとも8アミノ酸が対応位置における配列番号39の最初の10アミノ酸と同じである、15〜23アミノ酸の配列番号39の変異体、
f)1位のアミノ酸がMetであり、且つ2位のアミノ酸がVal又はLysであり、及び10アミノ酸の連続ストレッチがAla又はLeuから選択される少なくとも5アミノ酸を含む、15〜23アミノ酸の配列番号39の変異体、
g)配列番号44、
h)少なくとも8アミノ酸が対応位置における配列番号44の最初の10アミノ酸と同じである、15〜23アミノ酸の配列番号44の変異体、
i)1位のアミノ酸がMetであり、且つ2位のアミノ酸がVal又はLysであり、及び10アミノ酸の連続ストレッチがAla又はLeuから選択される少なくとも5アミノ酸を含む、15〜23アミノ酸の配列番号44の変異体、
j)配列番号34、
k)少なくとも8アミノ酸が対応位置における配列番号34の最初の10アミノ酸と同じである、15〜23アミノ酸の配列番号34の変異体、
l)1位のアミノ酸がMetであり、且つ2位のアミノ酸がVal又はLysであり、及び10アミノ酸の連続ストレッチがAla又はLeuから選択される少なくとも5アミノ酸を含む、15〜23アミノ酸の配列番号34の変異体、
からなる群から選択されるシグナルペプチドをコードし、
但し前記シグナルペプチドが(b)又は(c)であるとき、前記対象ポリペプチドはエルウィニア・クリサンテミ(Erwinia chrysanthemi)由来のペクチンメチルエステラーゼではない、発現コンストラクト。
【請求項5】
前記第1及び第2のポリヌクレオチドに作動可能に連結されたプロモーターをさらに含む、請求項3に記載の発現コンストラクト。
【請求項6】
請求項4又は5に記載の発現コンストラクトを含む組換え発現ベクター。
【請求項7】
請求項4又は5に記載の発現コンストラクトを含む、又は請求項6に記載の発現ベクターを含む組換え糸状菌宿主細胞。
【請求項8】
a)配列番号25、
b)少なくとも8アミノ酸が対応位置における配列番号25の最初の10アミノ酸と同じである、15〜23アミノ酸の配列番号25の変異体、
c)1位のアミノ酸がMetであり、且つ2位のアミノ酸がVal又はLysであり、及び10アミノ酸の連続ストレッチがAla又はLeuから選択される少なくとも5アミノ酸を含む、15〜23アミノ酸の配列番号25の変異体、
d)配列番号39、
e)少なくとも8アミノ酸が対応位置における配列番号39の最初の10アミノ酸と同じである、15〜23アミノ酸の配列番号39の変異体、
f)1位のアミノ酸がMetであり、且つ2位のアミノ酸がVal又はLysであり、及び10アミノ酸の連続ストレッチがAla又はLeuから選択される少なくとも5アミノ酸を含む、15〜23アミノ酸の配列番号39の変異体、
g)配列番号44、
h)少なくとも8アミノ酸が対応位置における配列番号44の最初の10アミノ酸と同じである、15〜23アミノ酸の配列番号44の変異体、
i)1位のアミノ酸がMetであり、且つ2位のアミノ酸がVal又はLysであり、及び10アミノ酸の連続ストレッチがAla又はLeuから選択される少なくとも5アミノ酸を含む、15〜23アミノ酸の配列番号44の変異体、
j)配列番号34、
k)少なくとも8アミノ酸が対応位置における配列番号34の最初の10アミノ酸と同じである、15〜23アミノ酸の配列番号34の変異体、
l)1位のアミノ酸がMetであり、且つ2位のアミノ酸がVal又はLysであり、及び10アミノ酸の連続ストレッチがAla又はLeuから選択される少なくとも5アミノ酸を含む、15〜23アミノ酸の配列番号34の変異体、
からなる群から選択されるシグナルペプチドの、対象組換えポリペプチドを産生するための使用であって、但し前記シグナルペプチドが(b)又は(c)であるとき、前記対象ポリペプチドはエルウィニア・クリサンテミ(Erwinia chrysanthemi)由来のペクチンメチルエステラーゼではない、使用。
【請求項9】
a)配列番号25、
b)少なくとも8アミノ酸が対応位置における配列番号25の最初の10アミノ酸と同じである、15〜23アミノ酸の配列番号25の変異体、
c)1位のアミノ酸がMetであり、且つ2位のアミノ酸がVal又はLysであり、及び10アミノ酸の連続ストレッチがAla又はLeuから選択される少なくとも5アミノ酸を含む、15〜23アミノ酸の配列番号25の変異体、
d)配列番号39、
e)少なくとも8アミノ酸が対応位置における配列番号39の最初の10アミノ酸と同じである、15〜23アミノ酸の配列番号39の変異体、
f)1位のアミノ酸がMetであり、且つ2位のアミノ酸がVal又はLysであり、及び10アミノ酸の連続ストレッチがAla又はLeuから選択される少なくとも5アミノ酸を含む、15〜23アミノ酸の配列番号39の変異体、
g)配列番号44、
h)少なくとも8アミノ酸が対応位置における配列番号44の最初の10アミノ酸と同じである、15〜23アミノ酸の配列番号44の変異体、
i)1位のアミノ酸がMetであり、且つ2位のアミノ酸がVal又はLysであり、及び10アミノ酸の連続ストレッチがAla又はLeuから選択される少なくとも5アミノ酸を含む、15〜23アミノ酸の配列番号44の変異体、
j)配列番号34、
k)少なくとも8アミノ酸が対応位置における配列番号34の最初の10アミノ酸と同じである、15〜23アミノ酸の配列番号34の変異体、
l)1位のアミノ酸がMetであり、且つ2位のアミノ酸がVal又はLysであり、及び10アミノ酸の連続ストレッチがAla又はLeuから選択される少なくとも5アミノ酸を含む、15〜23アミノ酸の配列番号34の変異体、
からなる群から選択されるシグナルペプチドをコードするポリヌクレオチドの、対象組換えポリペプチドを産生するための使用であって、但し前記シグナルペプチドが(b)又は(c)であるとき、前記対象ポリペプチドはエルウィニア・クリサンテミ(Erwinia chrysanthemi)由来のペクチンメチルエステラーゼではない、使用。
【請求項1】
対象組換えポリペプチドの産生方法であって、
(i)前記ポリペプチドの産生をもたらす条件下における糸状菌宿主細胞の培養であって、前記糸状菌宿主細胞が翻訳リーディングフレーム内で第2のポリヌクレオチドに連結された第1のポリヌクレオチドを含み、前記第2のポリヌクレオチドが対象ポリペプチドをコードし、前記第1のポリヌクレオチドが、
a)配列番号25、
b)少なくとも8アミノ酸が対応位置における配列番号25の最初の10アミノ酸と同じである、15〜23アミノ酸の配列番号25の変異体、
c)1位のアミノ酸がMetであり、且つ2位のアミノ酸がVal又はLysであり、及び10アミノ酸の連続ストレッチがAla又はLeuから選択される少なくとも5アミノ酸を含む、15〜23アミノ酸の配列番号25の変異体、
d)配列番号39、
e)少なくとも8アミノ酸が対応位置における配列番号39の最初の10アミノ酸と同じである、15〜23アミノ酸の配列番号39の変異体、
f)1位のアミノ酸がMetであり、且つ2位のアミノ酸がVal又はLysであり、及び10アミノ酸の連続ストレッチがAla又はLeuから選択される少なくとも5アミノ酸を含む、15〜23アミノ酸の配列番号39の変異体、
g)配列番号44、
h)少なくとも8アミノ酸が対応位置における配列番号44の最初の10アミノ酸と同じである、15〜23アミノ酸の配列番号44の変異体、
i)1位のアミノ酸がMetであり、且つ2位のアミノ酸がVal又はLysであり、及び10アミノ酸の連続ストレッチがAla又はLeuから選択される少なくとも5アミノ酸を含む、15〜23アミノ酸の配列番号44の変異体、
j)配列番号34、
k)少なくとも8アミノ酸が対応位置における配列番号34の最初の10アミノ酸と同じである、15〜23アミノ酸の配列番号34の変異体、
l)1位のアミノ酸がMetであり、且つ2位のアミノ酸がVal又はLysであり、及び10アミノ酸の連続ストレッチがAla又はLeuから選択される少なくとも5アミノ酸を含む、15〜23アミノ酸の配列番号34の変異体、
からなる群から選択されるシグナルペプチドをコードする、培養と、
(ii)場合により、培養培地からの前記ポリペプチドの単離と、
を含み、但し前記シグナルペプチドが(b)又は(c)であるとき、前記対象ポリペプチドはエルウィニア・クリサンテミ(Erwinia chrysanthemi)由来のペクチンメチルエステラーゼではない、方法。
【請求項2】
請求項1に記載の方法により得られるポリペプチド。
【請求項3】
翻訳リーディングフレーム内で第2のポリヌクレオチドに連結された第1のポリヌクレオチドによりコードされる組換えポリペプチドであって、前記第2のポリヌクレオチドが対象ポリペプチドをコードし、前記第1のポリヌクレオチドが、
a)配列番号25、
b)少なくとも8アミノ酸が対応位置における配列番号25の最初の10アミノ酸と同じである、15〜23アミノ酸の配列番号25の変異体、
c)1位のアミノ酸がMetであり、且つ2位のアミノ酸がVal又はLysであり、及び10アミノ酸の連続ストレッチがAla又はLeuから選択される少なくとも5アミノ酸を含む、15〜23アミノ酸の配列番号25の変異体、
d)配列番号39、
e)少なくとも8アミノ酸が対応位置における配列番号39の最初の10アミノ酸と同じである、15〜23アミノ酸の配列番号39の変異体、
f)1位のアミノ酸がMetであり、且つ2位のアミノ酸がVal又はLysであり、及び10アミノ酸の連続ストレッチがAla又はLeuから選択される少なくとも5アミノ酸を含む、15〜23アミノ酸の配列番号39の変異体、
g)配列番号44、
h)少なくとも8アミノ酸が対応位置における配列番号44の最初の10アミノ酸と同じである、15〜23アミノ酸の配列番号44の変異体、
i)1位のアミノ酸がMetであり、且つ2位のアミノ酸がVal又はLysであり、及び10アミノ酸の連続ストレッチがAla又はLeuから選択される少なくとも5アミノ酸を含む、15〜23アミノ酸の配列番号44の変異体、
j)配列番号34、
k)少なくとも8アミノ酸が対応位置における配列番号34の最初の10アミノ酸と同じである、15〜23アミノ酸の配列番号34の変異体、
l)1位のアミノ酸がMetであり、且つ2位のアミノ酸がVal又はLysであり、及び10アミノ酸の連続ストレッチがAla又はLeuから選択される少なくとも5アミノ酸を含む、15〜23アミノ酸の配列番号34の変異体、
からなる群から選択されるシグナルペプチドをコードし、
但し前記シグナルペプチドが(b)又は(c)であるとき、前記対象ポリペプチドはエルウィニア・クリサンテミ(Erwinia chrysanthemi)由来のペクチンメチルエステラーゼではない、組換えポリペプチド。
【請求項4】
翻訳リーディングフレーム内で第2のポリヌクレオチドに連結された第1のポリヌクレオチドを含む組換え発現コンストラクトであって、前記第2のポリヌクレオチドが対象ポリペプチドをコードし、前記第1のポリヌクレオチドが、
a)配列番号25、
b)少なくとも8アミノ酸が対応位置における配列番号25の最初の10アミノ酸と同じである、15〜23アミノ酸の配列番号25の変異体、
c)1位のアミノ酸がMetであり、且つ2位のアミノ酸がVal又はLysであり、及び10アミノ酸の連続ストレッチがAla又はLeuから選択される少なくとも5アミノ酸を含む、15〜23アミノ酸の配列番号25の変異体、
d)配列番号39、
e)少なくとも8アミノ酸が対応位置における配列番号39の最初の10アミノ酸と同じである、15〜23アミノ酸の配列番号39の変異体、
f)1位のアミノ酸がMetであり、且つ2位のアミノ酸がVal又はLysであり、及び10アミノ酸の連続ストレッチがAla又はLeuから選択される少なくとも5アミノ酸を含む、15〜23アミノ酸の配列番号39の変異体、
g)配列番号44、
h)少なくとも8アミノ酸が対応位置における配列番号44の最初の10アミノ酸と同じである、15〜23アミノ酸の配列番号44の変異体、
i)1位のアミノ酸がMetであり、且つ2位のアミノ酸がVal又はLysであり、及び10アミノ酸の連続ストレッチがAla又はLeuから選択される少なくとも5アミノ酸を含む、15〜23アミノ酸の配列番号44の変異体、
j)配列番号34、
k)少なくとも8アミノ酸が対応位置における配列番号34の最初の10アミノ酸と同じである、15〜23アミノ酸の配列番号34の変異体、
l)1位のアミノ酸がMetであり、且つ2位のアミノ酸がVal又はLysであり、及び10アミノ酸の連続ストレッチがAla又はLeuから選択される少なくとも5アミノ酸を含む、15〜23アミノ酸の配列番号34の変異体、
からなる群から選択されるシグナルペプチドをコードし、
但し前記シグナルペプチドが(b)又は(c)であるとき、前記対象ポリペプチドはエルウィニア・クリサンテミ(Erwinia chrysanthemi)由来のペクチンメチルエステラーゼではない、発現コンストラクト。
【請求項5】
前記第1及び第2のポリヌクレオチドに作動可能に連結されたプロモーターをさらに含む、請求項3に記載の発現コンストラクト。
【請求項6】
請求項4又は5に記載の発現コンストラクトを含む組換え発現ベクター。
【請求項7】
請求項4又は5に記載の発現コンストラクトを含む、又は請求項6に記載の発現ベクターを含む組換え糸状菌宿主細胞。
【請求項8】
a)配列番号25、
b)少なくとも8アミノ酸が対応位置における配列番号25の最初の10アミノ酸と同じである、15〜23アミノ酸の配列番号25の変異体、
c)1位のアミノ酸がMetであり、且つ2位のアミノ酸がVal又はLysであり、及び10アミノ酸の連続ストレッチがAla又はLeuから選択される少なくとも5アミノ酸を含む、15〜23アミノ酸の配列番号25の変異体、
d)配列番号39、
e)少なくとも8アミノ酸が対応位置における配列番号39の最初の10アミノ酸と同じである、15〜23アミノ酸の配列番号39の変異体、
f)1位のアミノ酸がMetであり、且つ2位のアミノ酸がVal又はLysであり、及び10アミノ酸の連続ストレッチがAla又はLeuから選択される少なくとも5アミノ酸を含む、15〜23アミノ酸の配列番号39の変異体、
g)配列番号44、
h)少なくとも8アミノ酸が対応位置における配列番号44の最初の10アミノ酸と同じである、15〜23アミノ酸の配列番号44の変異体、
i)1位のアミノ酸がMetであり、且つ2位のアミノ酸がVal又はLysであり、及び10アミノ酸の連続ストレッチがAla又はLeuから選択される少なくとも5アミノ酸を含む、15〜23アミノ酸の配列番号44の変異体、
j)配列番号34、
k)少なくとも8アミノ酸が対応位置における配列番号34の最初の10アミノ酸と同じである、15〜23アミノ酸の配列番号34の変異体、
l)1位のアミノ酸がMetであり、且つ2位のアミノ酸がVal又はLysであり、及び10アミノ酸の連続ストレッチがAla又はLeuから選択される少なくとも5アミノ酸を含む、15〜23アミノ酸の配列番号34の変異体、
からなる群から選択されるシグナルペプチドの、対象組換えポリペプチドを産生するための使用であって、但し前記シグナルペプチドが(b)又は(c)であるとき、前記対象ポリペプチドはエルウィニア・クリサンテミ(Erwinia chrysanthemi)由来のペクチンメチルエステラーゼではない、使用。
【請求項9】
a)配列番号25、
b)少なくとも8アミノ酸が対応位置における配列番号25の最初の10アミノ酸と同じである、15〜23アミノ酸の配列番号25の変異体、
c)1位のアミノ酸がMetであり、且つ2位のアミノ酸がVal又はLysであり、及び10アミノ酸の連続ストレッチがAla又はLeuから選択される少なくとも5アミノ酸を含む、15〜23アミノ酸の配列番号25の変異体、
d)配列番号39、
e)少なくとも8アミノ酸が対応位置における配列番号39の最初の10アミノ酸と同じである、15〜23アミノ酸の配列番号39の変異体、
f)1位のアミノ酸がMetであり、且つ2位のアミノ酸がVal又はLysであり、及び10アミノ酸の連続ストレッチがAla又はLeuから選択される少なくとも5アミノ酸を含む、15〜23アミノ酸の配列番号39の変異体、
g)配列番号44、
h)少なくとも8アミノ酸が対応位置における配列番号44の最初の10アミノ酸と同じである、15〜23アミノ酸の配列番号44の変異体、
i)1位のアミノ酸がMetであり、且つ2位のアミノ酸がVal又はLysであり、及び10アミノ酸の連続ストレッチがAla又はLeuから選択される少なくとも5アミノ酸を含む、15〜23アミノ酸の配列番号44の変異体、
j)配列番号34、
k)少なくとも8アミノ酸が対応位置における配列番号34の最初の10アミノ酸と同じである、15〜23アミノ酸の配列番号34の変異体、
l)1位のアミノ酸がMetであり、且つ2位のアミノ酸がVal又はLysであり、及び10アミノ酸の連続ストレッチがAla又はLeuから選択される少なくとも5アミノ酸を含む、15〜23アミノ酸の配列番号34の変異体、
からなる群から選択されるシグナルペプチドをコードするポリヌクレオチドの、対象組換えポリペプチドを産生するための使用であって、但し前記シグナルペプチドが(b)又は(c)であるとき、前記対象ポリペプチドはエルウィニア・クリサンテミ(Erwinia chrysanthemi)由来のペクチンメチルエステラーゼではない、使用。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】




【図2】


【図3】


【図4】


【図5】


【図6】


【公表番号】特表2012−524530(P2012−524530A)
【公表日】平成24年10月18日(2012.10.18)
【国際特許分類】
【出願番号】特願2012−506445(P2012−506445)
【出願日】平成22年4月14日(2010.4.14)
【国際出願番号】PCT/EP2010/054890
【国際公開番号】WO2010/121933
【国際公開日】平成22年10月28日(2010.10.28)
【出願人】(503220392)ディーエスエム アイピー アセッツ ビー.ブイ. (873)
【Fターム(参考)】
【公表日】平成24年10月18日(2012.10.18)
【国際特許分類】
【出願日】平成22年4月14日(2010.4.14)
【国際出願番号】PCT/EP2010/054890
【国際公開番号】WO2010/121933
【国際公開日】平成22年10月28日(2010.10.28)
【出願人】(503220392)ディーエスエム アイピー アセッツ ビー.ブイ. (873)
【Fターム(参考)】
[ Back to top ]

