小児固形腫瘍または食道癌素因の評価方法及び評価キット、並びに、その薬剤及びその選択方法
【課題】小児固形腫瘍または食道癌の素因を評価する方法及び評価キット、また、その薬剤及びその選択方法を提供すること。
【解決手段】 小児固形腫瘍または食道癌を生じ得る素因を有するか否かを評価する方法において、被験者のヒト遺伝子を含む試料を用い、ALK遺伝子の変異を検知する工程を有する。ALK遺伝子変異の検知としては、そのSNPまたはそれと連鎖不均衡の関係にある遺伝子多型を検知し、特に、A1280V、R1192G、A876Tのいずれかのアミノ酸変異を生じさせるSNPがある場合に、小児固形腫瘍または食道癌を生じ得る素因を有すると評価してもよい。
【解決手段】 小児固形腫瘍または食道癌を生じ得る素因を有するか否かを評価する方法において、被験者のヒト遺伝子を含む試料を用い、ALK遺伝子の変異を検知する工程を有する。ALK遺伝子変異の検知としては、そのSNPまたはそれと連鎖不均衡の関係にある遺伝子多型を検知し、特に、A1280V、R1192G、A876Tのいずれかのアミノ酸変異を生じさせるSNPがある場合に、小児固形腫瘍または食道癌を生じ得る素因を有すると評価してもよい。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、小児固形腫瘍または食道癌素因の評価方法及び評価キット、また、その薬剤及びその選択方法に関する。
【背景技術】
【0002】
ユーイング肉腫ファミリー(Ewing sarcoma family of tumours:ESFT)は、骨や軟組織の小円形細胞腫瘍であり、骨ユーイング腫瘍、骨外性ユーイング腫瘍、末梢神経上皮腫(peripheral neuroepithelioma:PNET)、アスキン腫瘍(胸壁のPNET)が含まれる(非特許文献1)。十代の若者に多く、さらに5年生存率が50%以下とその予後は不良である(非特許文献2)。
【0003】
ESFTの遺伝子の際立った特徴は、その多くにEWS-FLI-1または他の関連融合遺伝子が存在することであり、ESFTの成長におけるその重要な役割を強調している(非特許文献3)。実際、未分化マウス骨髄細胞にEWS-FLI-1融合遺伝子を形質導入するとESFTに似た腫瘍が再生され、ESFTにおけるこの融合が果たす病因的役割を裏付けている(非特許文献4)。
しかし、ESFTの成長及び/またはESFT素質に他の共同する遺伝子的変化が関与しているかどうかは、依然として不明である。
【0004】
未分化リンパ腫キナーゼ(anaplastic lymphoma kinase:ALK)は、未分化大細胞リンパ腫(anaplastic large cell lymphoma:ALCL)内でのt(2;5)(p23;q35)転座により生成されたNPM-ALK融合キナーゼとして同定された受容体チロシンキナーゼの一つである(非特許文献5、6)。ALKはまた、ALCLに加え炎症性筋線維芽細胞腫瘍内でも異なる融合キナーゼの生成にも関与していて(非特許文献7)、inv(2)(p21p23)により別の融合キナーゼ(EML4-ALK)を生成する一部の非小細胞肺癌の病因である(非特許文献8)。
【0005】
また、最近になって、大部分の家族性神経芽腫症例における神経芽腫素質の主な原因が、複数の生殖細胞系ALK変異であることが証明されている。さらに、本発明者らによって、散発性神経芽腫症例の約8%において体細胞機能獲得型変異またはALK遺伝子増幅が起こっていることを報告している(非特許文献9〜12)。
【0006】
ESFTと神経芽腫は、全く異なる臨床病理学的特徴及び分子遺伝学的特徴を有してはいるが、両腫瘍はさまざまな神経分化度を示し、両腫瘍の神経堤起原の可能性を示す報告がある(非特許文献13、14)。さらに、近年の分子免疫組織化学的研究により、ESFT及び神経芽腫ではALKが頻繁に発現されていることが立証され(非特許文献15、16)、これにより、ESFT由来細胞株に加え、多数の原発性ESFT症例におけるALKの変異状態の研究も促された。
【0007】
しかし、ALKの変異状態と、小児固形腫瘍または食道癌との関係については、知見がなかった。
【先行技術文献】
【非特許文献】
【0008】
【非特許文献1】CristWM, Kun LE. Common solid tumors of childhood. N Engl J Med1991;324(7):461-71
【非特許文献2】Maygarden SJ, Askin FB, SiegalGP, et al. Ewing sarcoma of bone in infants and toddlers. A clinicopathologicreport from the Intergroup Ewing's Study. Cancer 1993;71(6):2109-18
【非特許文献3】Kovar H. Progress in themolecular biology of ewing tumors. Sarcoma 1998;2(1):3-17
【非特許文献4】Castillero-Trejo Y, Eliazer S,Xiang L, Richardson JA, Ilaria RL, Jr. Expression of the EWS/FLI-1 oncogene inmurine primary bone-derived cells Results in EWS/FLI-1-dependent, ewingsarcoma-like tumors. Cancer Res 2005;65(19):8698-705
【非特許文献5】Morris SW, Kirstein MN, ValentineMB, et al. Fusion of a kinase gene, ALK, to a nucleolar protein gene, NPM, innon-Hodgkin's lymphoma. Science 1994;263(5151):1281-4
【非特許文献6】Shiota M, Nakamura S,Ichinohasama R, et al. Anaplastic large cell lymphomas expressing the novelchimeric protein p80NPM/ALK: a distinct clinicopathologic entity. Blood1995;86(5):1954-60
【非特許文献7】Lawrence B, Perez-Atayde A,Hibbard MK, et al. TPM3-ALK and TPM4-ALK oncogenes in inflammatory myofibroblastictumors. Am J Pathol 2000;157(2):377-84
【非特許文献8】Soda M, Choi YL, Enomoto M, etal. Identification of the transforming EML4-ALK fusion gene in non-small-celllung cancer. Nature 2007;448(7153):561-6
【非特許文献9】Chen Y, Takita J, Choi YL, et al.Oncogenic mutations of ALK kinase in neuroblastoma. Nature 2008;455(7215):971-4
【非特許文献10】Mosse YP, Laudenslager M, LongoL, et al. Identification of ALK as a major familial neuroblastomapredisposition gene. Nature 2008;455(7215):930-5
【非特許文献11】Janoueix-Lerosey I, Lequin D,Brugieres L, et al. Somatic and germline activating mutations of the ALK kinasereceptor in neuroblastoma. Nature 2008;455(7215):967-70
【非特許文献12】George RE, Sanda T, Hanna M, etal. Activating mutations in ALK provide a therapeutic target in neuroblastoma.Nature 2008;455(7215):975-8
【非特許文献13】Joshi VV, Silverman JF. Pathologyof neuroblastic tumors. Semin Diagn Pathol 1994;11(2):107-17
【非特許文献14】Rorie CJ, Thomas VD, Chen P,Pierce HH, O'Bryan JP, Weissman BE. The Ews/Fli-1 fusion gene switches thedifferentiation program of neuroblastomas to Ewing sarcoma/peripheral primitiveneuroectodermal tumors. Cancer Res 2004;64(4):1266-77
【非特許文献15】Dirks WG, Fahnrich S, Lis Y,Becker E, MacLeod RA, Drexler HG. Expression and functional analysis of theanaplastic lymphoma kinase (ALK) gene in tumor cell lines. Int J Cancer2002;100(1):49-56
【非特許文献16】Willoughby V, Sonawala A,Werlang-Perurena A, Donner LR. A comparative immunohistochemical analysis ofsmall round cell tumors of childhood: utility of peripherin andalpha-internexin as markers for neuroblastomas. Appl Immunohistochem MolMorphol 2008;16(4):344-8
【非特許文献17】McDermott U, Iafrate AJ,Gray NS, et al. Genomic alterations of anaplastic lymphomakinase may sensitize tumors to anaplastic lymphoma kinase inhibitors. CancerRes 2008;68(9):3389-95
【非特許文献18】Caren H, Abel F, Kogner P,Martinsson T. High incidence of DNA mutations and gene amplifications of theALK gene in advanced sporadic neuroblastoma tumours. Biochem J 2008;416(2):153-9
【非特許文献19】James C, Ugo V, Le Couedic JP, etal. A unique clonal JAK2 mutation leading to constitutive signalling causespolycythaemia vera. Nature 2005;434(7037):1144-8
【非特許文献20】Mahooti S, Wakely PE, Jr.Cytopathologic features of olfactory neuroblastoma. Cancer 2006;108(2):86-92
【発明の概要】
【発明が解決しようとする課題】
【0009】
そこで、本発明は、小児固形腫瘍または食道癌の素因を評価する方法及び評価キット、また、その薬剤及びその選択方法を提供することを課題とする。
【課題を解決するための手段】
【0010】
本発明の小児固形腫瘍または食道癌の素因の評価方法は、小児固形腫瘍または食道癌を生じ得る素因を有するか否かを評価する方法であって、被験者のヒト遺伝子を含む試料を用い、ALK遺伝子の変異を検知する工程を有することを特徴とする。
【0011】
小児固形腫瘍としては、神経芽腫以外の腫瘍が好適に対象となる。
【0012】
ALK遺伝子変異の検知としては、そのSNPまたはそれと連鎖不均衡の関係にある遺伝子多型の検知が有用である。SNPに変異があれば素因があると評価し、逆に、SNPに変異がなければ素因がない可能性があると間接的に評価してもよい。
【0013】
少なくとも、A1280V、R1192G、A876Tのいずれかのアミノ酸変異を生じさせるSNPがある場合に、小児固形腫瘍または食道癌を生じ得る素因を有すると評価してもよい。
【0014】
特に、A1280Vの変異が、GCGからGTGへの変異であるか、R1192Gの変異が、CGGからGGGへの変異であるか、A876Tの変異が、GCCからACCへの変異であることを指標としてもよい。
【0015】
遺伝子多型の検知には、ダイレクトシークエンス法、BACアレイCGH法、FISH法、RFLP法、PCR−SSCP法、アレル特異的オリゴヌクレオチドハイブリダイゼーション法、TaqMan PCR法、インベーダー法、HRM法、SmartAmp法、Q−probe法(QP法)、MALDI−TOF/MS法、モレキュラービーコン法、RCA法、UCAN法、DNAチップまたはDNAマイクロアレイを用いた核酸ハイブリダイゼーション法のいずれかが利用可能である。
【0016】
本発明の小児固形腫瘍または食道癌の素因の評価キットは、小児固形腫瘍または食道癌を生じ得る素因を有するか否かを評価するキットであって、被験者のヒト遺伝子を含む試料を用い、ALK遺伝子のA1280V、R1192G、A876Tの少なくともいずれかにおけるSNP、またはそれと連鎖不均衡の関係にある遺伝子多型を検知する手段を備えることを特徴とする。
【0017】
本発明の小児固形腫瘍または食道癌の薬剤候補物質選定方法は、小児固形腫瘍または食道癌の治療薬、またはその疾患を生じ得る素因を低減する薬剤の候補物質を選定する方法であって、試験物質の存在下及び非存在下において哺乳動物細胞を培養する工程と、それぞれの細胞においてチロシンキナーゼの酵素活性の上昇度を測定する工程と、その酵素活性の上昇を抑制する効果を有する試験物質を候補物質として選定する工程を含むことを特徴とする。
【0018】
本発明の小児固形腫瘍または食道癌の薬剤は、小児固形腫瘍または食道癌、またはその疾患を生じ得る素因を低減する薬剤であって、チロシンキナーゼの酵素活性の上昇を抑制する効果を有することを特徴とする。
【発明の効果】
【0019】
本発明によると、小児固形腫瘍や食道癌の早期治療や予防に寄与する。
【図面の簡単な説明】
【0020】
【図1】ALKのタンパク構造を示す説明図
【図2】Ewing肉腫の症例で検出されたALK変異を示す説明図
【図3】細胞系変異ALKを有する患者の臨床病理学的所見を示す表
【図4】各ALK変異タンパクの自己リン酸化を示すウェスタンブロット分析の写真
【図5】神経芽腫及びユーイング肉腫ファミリー由来細胞株において、ALK阻害剤TAE684の影響を示すグラフ
【図6】siRNAによるALKノックダウンによるUTP-ES1細胞成長の阻害を示すブロット写真及びグラフ
【発明を実施するための最良の形態】
【0021】
以下に、本発明の実施形態を説明する。実施形態は、前記特許文献など従来公知の技術を援用して適宜設計変更可能であり、また、薬剤の製造方法及び装置についても従来公知の技術を適宜適用可能である。
【0022】
本研究では、東京大学倫理委員会の承認の上(承認番号:1598)、総数で80の匿名化された原発性ESFT保存検体を東京大学倫理委員会の規定に従って解析した。原発性腫瘍は全て1993年11月から2008年12月の間に共同研究病院において手術または生検により取得した。EWS-FLI1、EWS-ERG、EWS-ETV1またはEWS-FEV融合転写産物の存在が、良質なRNA検体が得られた44検体で、逆転写ポリメラーゼ連鎖反応により確認された。本研究には、17のESFT由来細胞株も含まれる。UTP-ES1、ALK変異ESFT細胞株、SCMC-ES1の樹立、SJES系、SK系及びES-1-OT以外の細胞株は、the Japanese Cancer Resource Cell Bank(http://cellbank.nibio.go.jp/wwwjcrbj.htm)から入手した。これら細胞株は全て、ウシ胎仔血清10%を添加したRPMI1640培地(GIBCO RLB,Grand Island,NY,USA)中で培養した。
【0023】
まず、ESFT検体中におけるALKの変異及び発現の分析を行った。
ALK遺伝子のエクソン20から28をゲノム遺伝子からPCR増幅し、DNAへテロ二本鎖分析及び/または直接塩基配列決定法により変異について調査した。PCRの条件及びプライマーは非特許文献9の通りである。ALK発現の逆転写ポリメラーゼ連鎖反応分析は、症例9、症例35及びUTP-ES1について行った。ALK変異検体のゲノムコピー数の解析は、GeneChip単一ヌクレオチド多型(single nucleotide polymorphism:SNP)遺伝子決定マイクロアレイ(Affymetrix GeneChip 250K NspI;Santa Clara,CA,USA)及び非特許文献9のCNAG/AsCNARを使用して行った。
【0024】
次に、変異ALKの機能解析を行った。
ALKWT-FLAG及びALKF1174L-FLAGは、それぞれ、野生型ALKのFLAGタグ付きcDNA及びそのF1174L変異体である(非特許文献9)。A1280V変異体のFLAGタグ付きcDNA(ALKA1280V-FLAG)は、腫瘍検体の全RNAからハイフィディリティPCRにより単離した。再配列解析後、各cDNAを発現プラスミドpcDNA3に組み込み、EffecteneTMトランスフェクション試薬(QIAGEN,Tokyo,Japan)を使ってNIH3T3細胞に遺伝子導入した。
変異ALKキナーゼのウェスタンブロット分析及びインビトロキナーゼ測定は非特許文献9の方法により行った。ALK変異ESFT細胞株、UTP-ES1以外に、ESFT(SJES-7及びSJES-6)及び神経芽腫(SK-N-SH)細胞株もALK阻害剤TAE684(非特許文献17)の濃度を変えながら培養し、それぞれの細胞の成長をCellTiter-GloTMLuminescent Cell Viability Assay
(Promega,Tokyo,Japan)を使って測定した。コントロールとしてNIH3T3細胞を使用した。UTP-ES1に対するTAE684のIC50値は、GrapfPad Prism 5 software(GraphPad,La Jolla,CA,USA)を使用して非線形回帰により算出した。同じ細胞株をALK特異的siRNAまたは非特異的siRNAでトランスフェクトし、細胞成長に対する効果を既報(9)のようにCellTiter-GloTMを使用して生存細胞数を測定することにより評価した。
【0025】
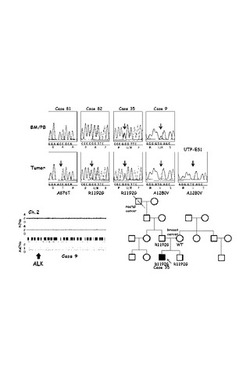
図1は、ALKのタンパク構造を示す説明図であり、図2は、Ewing肉腫の症例で検出されたALK変異を示す説明図である。
ESFTにおけるALK異常については、原発性ESFT80検体及びEFST由来17細胞株について、DNAへテロ二本鎖形成分析及び/またはALKのALK膜近傍ドメイン及びキナーゼドメインを包含するPCR増幅されたALKエクソンの直接塩基配列決定により、ALK変異をスクリーニングしたところ、3つの腫瘍検体、症例9のA1280V、症例9から樹立されたUTP-ES1及び症例35のR1192Gのキナーゼドメイン内に2つのヌクレオチドミスセンス変化が見出された。両変化はまた、それらの対応正常DNAにも存在し、生殖細胞系由来であることが確認された。腫瘍検体における変異ALKの発現は両症例において認められた。
【0026】
これらのヌクレオチド変化は50人の健常ボランティアには同定されず、dbSNPデータベース(http://www.ncbi.nlm.nih.gov/projects/SNP/)にも登録されていなかった。さらに、これらの変化は、これまで家族性及び/または散発性神経芽腫(非特許文献9〜12、18)について報告された14のアミノ酸位置での20の変異のいずれにも一致せず、したがって、非機能的な一塩基型多型というよりはむしろ新規生殖細胞系変異を意味していると考えられる。
対応正常DNAは、この位置に明確にヘテロ接合体クロマトグラムを示したのに対して、症例9及びUTP-ES1腫瘍検体だけが変異(1280V)対立遺伝子を含有していた。このことに一致して、SNPアレイ分析により、野生型対立遺伝子が変異対立遺伝子の複製による染色体の誤分離により失われたと思われる第2染色体全体の獲得片親ダイソミー(aUPD)が明らかにされた。機能獲得対立遺伝子を選択するaUPDは、骨髄増殖性疾患におけるJAK2変異に対して十分に立証されていて(非特許文献19)、神経芽腫細胞株においても報告されている(非特許文献9)。ALK発現は、ALK変異を有する症例9、症例35、UTP-ES1検体に検出された。
【0027】
図3は、生殖細胞系変異ALKを有する患者の臨床病理学的所見を示す表である。
症例9は、前月から持続性の右頭痛のために収容された9歳の少年である。臨床検査及び頭部のコンピュータ断層撮影により、副鼻腔を含む右鼻腔に固形腫瘍を有することが明らかになった。リンパ節腫脹や転移の兆候は見られなかった。腫瘍は、過色素性の核と少量の細胞質を有する小円形細胞から成っていた。腫瘍細胞は、ビメンチン、CD99 (MIC2)、CD56、S-100及び神経特異的エノラーゼ(NSE)陽性であったが、ミオグロビン、デスミン、ケラチン及び白血球共通抗原(LCA)陰性であった。腫瘍検体中にEWS-FLI1融合転写産物が検出された。患者は多剤化学療法による治療を受けたが、最初の診断から12ヶ月後に死亡した。
症例35は、左の斜視、眼球突出及び鼻出血を有する6歳の少年である。CTスキャンにより、左鼻気道及び副鼻腔を含む大きな小葉腫瘤が検出された。転移の兆候は見られなかった。腫瘍は、少量の細胞質を有する小円形細胞から成っていて、ビメンチン、CD99、CD56、及びNSE陽性、S-100及びCD57弱陽性であった。ミオシン、デスミン及びHHF35は陰性であった。細胞発生学的検討は、t(2;22)(q35;q11)を示し、EWS-FEV融合転写産物が患者の腫瘍中に検出された。患者は、放射線化学療法及びタンデム自家末梢血幹細胞移植後、完全に寛解した。
【0028】
2つの生殖細胞系変異は、異なる種にわたり、かつ分子進化を通して高度に保存されているキナーゼドメイン内のアミノ酸を伴っていたので、これら変異のALKキナーゼ活性に対する効果を詳細に検討した。
FLAGタグ付きALK変異、ALKA1280VをFLAGタグ付き野生型ALK及び神経芽腫由来ALK変異体ALKF1174Lと共にNIH3T3細胞内で過渡的に発現させ(非特許文献9)、免疫沈降したALKタンパク質のインビトロにおけるチロシンキナーゼ活性をpoly-GluTyrペプチドを基質に使用して測定した。
【0029】
図4は、各ALK変異タンパクの自己リン酸化を示すウェスタンブロット分析の写真である。
ALK変異体、ALKA1280Vは、ALKF1174L と同様、自己リン酸化を示し、インビトロチロシンキナーゼ活性も野生型ALKに比較して上昇していた。予想されるように、Akt、Stat3及びErkのリン酸化の増大によって証明されるように、変異を形質導入したNIH3T3細胞の下流ALKシグナル伝達経路のリン酸化が増進されていて、ALKA1280V変異体の上昇したチロシンキナーゼ活性は、変異導入されたNIH3T3細胞内においてALKのシグナル伝達経路の下流を活性化した。
【0030】
図5は、神経芽腫及びユーイング肉腫ファミリー(ESFT)由来細胞株において、ALK阻害剤TAE684の影響を示すグラフである。ALK変異を有する(UTP-ES1)または有さない(SJES-6及びSJES-7)場合の細胞成長に対するALK阻害剤TAE684の影響を、三重試験の平均細胞数±S.D.をプロットして示す。ALK変異神経芽腫由来細胞株SK-N-SH及びNIH3T3細胞に対する、成長阻害のプロフィールを合わせて示す。
図6は、siRNAによるALKノックダウンによるUTP-ES1細胞成長の阻害を示すブロット写真及びグラフである。非特異的バンドは、ローディング・コントロールを示す。
ALK阻害剤TAE684及びsiRNAによるALKノックダウンを使用して、ALK変異ESFT細胞株及びUTP-ES1の細胞増殖に対するALK阻害の効果を検討した。UTP-ES1の細胞増殖は、76.1nMのIC50でTAE684により効果的に阻害された。これは、SK-N-SH(48.7nM)、ALK変異体及びTAE684感受性神経芽腫細胞株に対するIC50とほぼ同じである(非特許文献17)が、ALK発現のないNIH3T3細胞のIC50(341nM)より実質的に低い値である。
同様に、変異ALKをsiRNAによりノックダウンしたUTP-ES1では、非特異的siRNAでトランスフェクトしたコントロールに比較して、細胞増殖が顕著に抑制された。
【0031】
新規ALK生殖細胞系変異を有する2つの症例で、ESFTを発現した他の家族は知られていなく、そのゲノムDNAを入手できなかったので、変異の同時分離やESFT発生の確認または変異が新たな変異であるのか親から遺伝されたものであるのかを決定することはできなかった。しかし、キナーゼドメイン(β4のR1192及び活性化ループのA1280)内の高保存アミノ酸の置換後、下流シグナル伝達経路の構成的活性化と同様、ALKA1280V変異のキナーゼ活性が上昇する。TAE684またはsiRNA仲介遺伝子ノックアウトによる変異ALKの阻害は、ALKA1280Vを有するUTP-ES1の増殖を抑制した。一方、R1192G変異は、3つの異なる家族性神経芽腫家系でプロリンに変異していた(R1192P)アミノ酸と同じアミノ酸に起こっていた(非特許文献10)。以上のように、症例9及び症例35に見られたこれら新規の生殖細胞系変異は、ESFTの発生の素因となっていた。
【0032】
神経芽腫及びESFTの両腫瘍は類似した組織構造を示し、どちらも神経堤細胞から生じると推測されるので、生殖細胞系ALK変異の神経芽腫及びESFTの両者との関連については、さらに検討する必要がある。生殖細胞系ALK変異の活性化はそのキャリアに神経芽腫を生じさせやすくするが、その浸透度は不完全であり、家族性神経芽腫の発生には他の遺伝子の関与が必要であることは明らかである。予想されるように、今回のESFTの2症例はまた、EWS-FLI1及びEWS-FEV融合を形成するEWS関連転座を有し、ESFTの病因にこれらの融合が果たす明確な役割の根拠となっている。しかし、ESFTの発生にはEWS融合だけでは十分でなく、さらに遺伝子の変化が必要である可能性が、ALK抑制剤及びALK特異的siRNAによるALK変異ESFT細胞成長の抑制により示唆された。ALK変異神経芽腫細胞株LAN-5におけるEWS-FLI1の異種発現が、神経芽腫細胞に類似の遺伝子発現プロフィールと同様に、神経芽腫特異的マーカー及びESFT特異的マーカーの新たな発現を抑制したことは興味深い(非特許文献14)。また、この2症例におけるESFT腫瘍が、ESFTの発症部位としては比較的稀であるが、嗅神経芽腫にも関与している鼻腔または副鼻腔に発生したことは注目すべきである(非特許文献20)。ESFTと神経芽腫との間の病原性のつながりの可能性についてさらに研究する必要がある。
結論として、ALK生殖細胞系変異は、家族性神経芽腫だけでなく、一部のESFT症例の発生に関与していることを示唆するものであった。低分子量化合物による変異キナーゼの抑制は、一部のESFTの治療効果を有する可能性がある。
【0033】
以上の知見から、ALK遺伝子の変異を検知することによって、神経芽腫以外の小児固形腫瘍または食道癌の素因を評価できることが明らかとなった。
ALK遺伝子変異の検知としては、そのSNPまたはそれと連鎖不均衡の関係にある遺伝子多型の検知が有用である。SNPに変異があれば素因があると評価し、逆に、SNPに変異がなければ素因がない可能性があると間接的に評価できる。
【0034】
特に、A1280V、R1192G、A876Tのいずれかのアミノ酸変異を生じさせるSNPに注目し、A1280Vの変異が、GCGからGTGへの変異であるか、R1192Gの変異が、CGGからGGGへの変異であるか、A876Tの変異が、GCCからACCへの変異であることを指標としてもよい。
【0035】
なお、AALK遺伝子には、ヒト由来cDNAや、相補的な塩基配列からなるDNAとストリンジェントな条件下でハイブリダイズし、尿酸輸送能を有するポリペプチドをコードするヒト由来の同質遺伝子、哺乳動物におけるそれらの相同物も含まれる。
【0036】
遺伝子多型を決定するには、ヒト血液または組織を材料として、ダイレクトシークエンス法や、BACアレイCGH法、FISH法、RFLP法、PCR−SSCP法、アレル特異的オリゴヌクレオチドハイブリダイゼーション法、TaqMan PCR法、インベーダー法、HRM法、SmartAmp法、Q-probe法(QP法)、MALDI−TOF/MS法、モレキュラービーコン法、RCA法、UCAN法、DNAチップまたはDNAマイクロアレイを用いた核酸ハイブリダイゼーション法などが利用できる。
【0037】
ダイレクトシークエンシング法などによると、ゲノムDNAから直接SNPを検出することができる。
また、クローンや、PCR法、LCR法、SDA法、RCK法、LAMP法、NASBA法などにより、特定のゲノムDNA領域を増幅した後に、少なくとも多型部位を含む対立遺伝子の一部の塩基配列の決定、多型部位に特異的にハイブリダイズするプローブによる検出、多型部位を含む遺伝子断片の分子量の測定を行ったりしてもよい。
増幅産物は、塩基配列の決定、MALDI−TOF質量分析法等による分子量の測定、制限酵素断片長の解析、SSCPによる検出、電気泳動などによって、SNPを決定することができる。
【0038】
例えば、TaqMan法は、アレル特異的なオリゴヌクレオチドと鋳型とのハイブリダイゼーションとPCR法を同時に行い、蛍光エネルギー移動現象を用いてSNPを検出する方法である。蛍光色素と消光物質により標識したアレル特異的プローブを標的部位にハイブリダイズさせて、この部位を含む領域を増幅するように設計したプライマーでPCRを行うと、プライマーからの伸長反応が進むと同時に、Taqポリメラーゼの5'ヌクレアーゼ活性によりハイブリダイズしたプローブが切断される。蛍光色素が消光物質と離れると蛍光が生じ、またPCR反応により鋳型が増幅するため、蛍光強度は指数関数的に増強する。2種類のアレルに特異的なプローブを異なる蛍光色素で標識しておけば、1回のアッセイでホモ接合体とヘテロ接合体とを区別することもできる。
【0039】
インベーダー法は、2種類のオリゴヌクレオチドを用い、これらのプローブが鋳型DNAと形成する特異的な構造を認識して切断する酵素反応に基づく方法である。目的塩基配列の第1の部位に実質的に相補的なインベーダープローブと、3'末端側が目的塩基配列の第2の部位と実質的に相補的であり5'末端側には鋳型と非相補的で一本鎖を形成するフラップを含むアレルプローブとの2種類の異なるプローブで、目的とする塩基配列を認識する。これらのプローブが鋳型の隣接する領域にハイブリダイズすると、SNP部位にインベーダープローブの3'末端が侵入し、この構造が酵素により切断されてフラップが遊離する。遊離したフラップはあらかじめ標識しておくことにより定量することができる。フラップ−FRETプローブを2組用意し、異なる蛍光色素で標識することにより、1回のアッセイで各ホモ接合体とヘテロ接合体とを区別することができる。
【0040】
MALDI−TOF質量分析法は、SNP部位に隣接するプライマーを作製し、PCR増幅させた試料DNAを鋳型として、ddNTPを用いて1塩基分だけプライマー伸長反応を行い、伸長反応生成物の質量分析により、付加したddNTPを識別する方法である。プライマーの蛍光標識を必要とすることなく、短時間で大量の試料を処理することができる。
【0041】
RCA法は、環状の一本鎖DNAを鋳型として、DNAポリメラーゼがその上を移動しながら長い相補鎖DNAを合成していくDNA増幅手段を、SNPタイピングに応用した方法である。SNPの識別をRCA法による増幅の有無で行う。すなわち、ゲノムDNAとアニールし、環状になりうる一本鎖プローブをゲノムDNAにハイブリダイズさせて連鎖反応を行う。プローブの端を識別したいSNPの部位としておけば、その部位がマッチしていれば連結され環状となってRCAによる増幅が起こるが、ミスマッチであれば連結されず環状とならないためRCA増幅は起こらない。この2種類の増幅反応を識別することによってSNPを決定することができる。
【0042】
DNAチップ法は、多型部位を含むオリゴヌクレオチドプローブをマイクロアレイ上に配置したDNAチップを用いて、PCR増幅させた蛍光標識cDNAやcRNAとハイブリダイゼーションする方法である。多くのSNPを迅速に検出することができる。
【0043】
アミノ酸配列の多型を決定する方法には、例えば、二次元電気泳動法やマイクロフルーイディクス法によるプロテオーム解析、質量分析装置を用いたペプチドマッピングとアミノ酸配列分析、プロテインシークエンサーによるアミノ酸配列分析、プロテインチップを用いてポリペプチドとリガンドとの相互作用を検出する方法などが利用できる。
【0044】
例えば、二次元電気泳動法は、一般的には、一次元目に等電点電気泳動を、二次元目にSDS−PAGEを行うものであり、1枚のゲルで数千のタンパク質を分離することができる。等電点電気泳動には、両性担体や固定化pH勾配ゲルストリップを用いる。SDS−PAGEには、1種類のpHの緩衝液を用いる連続緩衝液系と、複数のpHの緩衝液を用いる不連続緩衝液系とがある。また、分離するタンパク質の種類によって、低BIS濃度ゲル電気泳動、濃度勾配ゲル電気泳動、トリシン−SDS−PAGEなどを用いることができる。分離されたタンパク質は、クーマシーブルー染色や銀染色や蛍光試薬を用いてゲル上で感度よく検出できる。また、ALKポリペプチドに対する抗体を用いたウエスタンブロッティング法も利用可能である。
【0045】
質量分析方法の一つであるMALDI−TOF/MS法は、タンパク質試料とシナピン酸等のレーザー光を吸収するマトリクスとの混合、乾燥後に強力なパルスレーザー光を照射し、マトリクスからのエネルギー移動によるタンパク質試料のイオン化を行い、初期加速による試料分子イオンの飛行時間差でイオンの分子量を分析する方法である。ペプチドを質量分析計内部で断片化し、断片の質量解析からアミノ酸配列やアミノ酸組成などを得るためには、質量分離部を複数連結したタンデム質量分析法が利用され、エレクトロスプレーイオン化法を用いた三連四重極型やハイブリッド型やイオントラップ型分析計等も用いられる。
【0046】
プロテインチップ法は、基板上に並べたタンパク質や、ペプチド、抗体、発現タンパク質などと試料との相互作用を、包括的かつ迅速に行うことができる。
【0047】
本発明による評価キットは、小児固形腫瘍または食道癌を生じ得る素因を有するか否かを評価するキットであって、被験者のヒト遺伝子を含む試料を用い、ALK遺伝子のA1280V、R1192G、A876Tの少なくともいずれかにおけるSNP、またはそれと連鎖不均衡の関係にある遺伝子多型を検知する手段を備える。
すなわち、ALK遺伝子多型を含むポリヌクレオチド、または多型を含むDNA断片を増幅するためのプライマー対、多型を検出するためのポリヌクレオチドとして提供してもよい。
【0048】
なお、ポリヌクレオチドとは、ポリリボヌクレオチドとポリデオキシリボヌクレオチドの双方を含み、それらは非修飾RNAまたはDNA、修飾RNAまたはDNAであってもよく、例えばDNA、cDNA、ゲノムDNA、mRNA、未プロセッシングRNA、それらの断片などが挙げられる。
また、ポリペプチドとは、2以上のアミノ酸がペプチド結合で連結されたものであり、比較的短鎖のペプチドまたはオリゴペプチドと呼ばれるものからタンパク質と呼ばれる長鎖のものまでを含む。ポリペプチドには、遺伝的にコードされている20種類のアミノ酸以外のアミノ酸や、修飾されたアミノ酸を含んでもよい。その修飾には、ペプチド結合の主鎖、アミノ酸側鎖、アミノ末端、カルボキシル末端において、アセチル化、アシル化、ADPリボシル化、アミド化、ビオチン化、脂質や脂質誘導体との共有結合、架橋結合の生成、ジスルフィド結合、糖鎖の付加、GPIアンカーの付加、リン酸化及びプレニル化などが挙げられる。
【0049】
本発明の小児固形腫瘍または食道癌の薬剤候補物質選定方法は、小児固形腫瘍または食道癌の治療薬、またはその疾患を生じ得る素因を低減する薬剤の候補物質を選定する方法であって、試験物質の存在下及び非存在下において哺乳動物細胞を培養する工程と、それぞれの細胞においてチロシンキナーゼの酵素活性の上昇度を測定する工程と、その酵素活性の上昇を抑制する効果を有する試験物質を候補物質として選定する工程を含む。
【0050】
哺乳動物としては、マウスなどが挙げられ、その生体を構成している組織や細胞も含む。また、試料としては、生物に由来するポリヌクレオチドを含有するものであって、組織や細胞から採取される体液、皮膚、毛根、粘膜、内臓、胎盤、臍帯血等を含む。
同様に、ヒトALK遺伝子または非ヒトALK遺伝子を過剰発現させた非ヒト動物、A1280V、R1192G、A876Tのうちの少なくともいずれかの変異を含むヒトALK遺伝子または非ヒトALK遺伝子を過剰発現させた非ヒト動物、ALK遺伝子を欠損させた非ヒト細胞株またはヒト細胞株、ヒトALK遺伝子または非ヒトALK遺伝子を過剰発現させた非ヒト細胞株またはヒト細胞株、A1280V、R1192G、A876Tのうちの少なくともいずれかの変異を含むヒトALK遺伝子または非ヒトALK遺伝子を過剰発現させた非ヒト細胞株またはヒト細胞株、或いはそれら細胞株より調製した細胞膜小胞を用いてもよい。
【0051】
本発明の小児固形腫瘍または食道癌の薬剤は、小児固形腫瘍または食道癌、またはその疾患を生じ得る素因を低減する薬剤であって、チロシンキナーゼの酵素活性の上昇を抑制する効果を有する。
【0052】
また、本発明の小児固形腫瘍または食道癌の薬剤は、小児固形腫瘍または食道癌、またはその疾患を生じ得る素因を低減する薬剤であって、ALKタンパク質をコードするポリヌクレオチドを細胞内に導入可能な形態で有するか、または、ALKタンパク質に相当するポリペプチドを細胞内に導入可能な形態で有するものとしても提供可能である。前者によると、長期間にわたって安定に尿酸輸送を改善させることができ、後者によると、注射等の投与によって簡便に尿酸輸送を改善させることができる。
【0053】
なお、ポリヌクレオチドを細胞内に導入可能な形態とは、ポリヌクレオチドが細胞内に導入され、細胞内のALK遺伝子がALKを発現するようにコードされているALKを発現すること可能とする形態を意味する。同様に、ポリペプチドを細胞内に導入可能な状態とは、ポリペプチドが細胞内に導入され、細胞内のALKと同様な機能を発揮することを可能とする形態を意味する。
【0054】
ALKポリヌクレオチドは、既知のヌクレオチド配列に基づいて作製したオリゴヌクレオチドプローブを用いて既存のcDNAライブラリーをスクリーニングする方法や、オリゴヌクレオチドプライマーを用いたRT-PCR等の方法によって取得することができる。
【0055】
A1280V、R1192G、A876TのいずれにもSNPのないALKが好ましく、そのポリヌクレオチドを細胞内に導入可能な状態にするためには、例えば、むき出しDNAとする方法や、組換えウイルスベクターの形態で製剤化する方法が用いられる。ウイルスベクターには、バキョロウイルス科、パルボウイルス科、ピコルノウイルス科、ヘルペスウイルス科、ポックスウイルス科、アデノウイルス科、ピコルナウイルス科などのウイルスのゲノムに由来するものが利用できる。
【0056】
また、生体より取り出した組織または細胞にポリヌクレオチド発現ベクターを導入した後に、生体に戻すようにしてもよい。そのような場合は、ポリヌクレオチドを組込んだ発現ベクターを、例えばマイクロインジェクション法やエレクトロポーレーション法などのトランスフェクションにより細胞内に導入する方法が利用できる。
【0057】
ウイルスベクターや発現ベクターにおけるポリヌクレオチドは、全身性または組織特異的に発現するプロモーター支配下に連結してもよい。また、ウイルスベクターを腎臓特異的に感染させる場合には、経皮的に動脈にカテーテルを挿入して、X線でカテーテルの位置を確認しながら腎臓動脈にカテーテルを挿入して組換えベクターを導入することが可能である。
【0058】
ALKポリペプチドは、前記のALKポリヌクレオチドを用いた遺伝子工学的方法により作成することができる。すなわち、ポリヌクレオチドを有するベクターからインビトロ転写によってRNAを調製し、これを鋳型としてインビトロ翻訳を行うことによりインビトロでALKポリペプチドを得ることができる。また、ポリヌクレオチドを発現ベクターに組換えれば、大腸菌や枯草菌等の原核細胞や、酵母や、昆虫細胞、哺乳動物細胞等の真核細胞の発現産物としてALKポリペプチドを得ることができる。
また、ALKポリペプチドは、公知の化学合成法に準じて合成することもできる。
【0059】
ALKポリペプチドは、ペプチド誘導体として提供してもよい。この誘導体には、合成や精製を促進するための修飾、物理、化学的安定化を促進するための修飾、生体内の代謝に対する安定性と不安定性、条件付けの等の活性化修飾などを含む。
ペプチド誘導体におけるその他の修飾には、アセチル化、アシル化、ADP−リボシル化、アミド化、フラビンの共有結合、ヘム部分の共有結合、ヌクレオチドまたはヌクレオチド誘導体の共有結合、脂質または脂質誘導体の共有結合、ホスファチジルイノシトールの共有結合、交差架橋、環化、ジスルフィド結合、脱メチル化、交差架橋共有結合形成、シスチン形成、ピログルタメート形成、ホルミル化、ガンマーカルボキシル化、グリコシル化、GPIアンカー形成、水酸化、ヨウ素化、メチル化、ミリストイル化、酸化、タンパク質加水分解プロセッシング、リン酸化、プレニル化、ラセミ化、脂質結合、硫酸化、セレノイル化などが含まれる。より具体的には、ペプチド誘導体は、ALKポリペプチドの活性を破壊せず、またこれを含有する組成物に毒性を与えない範囲において、残基の側鎖またはN末端基もしくはC末端基として生じる機能性基として調製することができる。例えば、体液中でポリペプチドの残存を延長するポリエチレングリコール側鎖を含む誘導体、カルボキシル基の脂肪族エステル、アンモニアまたはアミンと反応することによるカルボキシル基のアミド、アシル部分と形成されるアミノ酸残基の遊離アミノ基のN−アシル誘導体またはアシル部分と形成される遊離の水酸基のO−アシル誘導体などが挙げられる。
【0060】
ALKポリペプチドはまた、薬理学的に許容し得る塩として提供してもよい。この塩には、ポリペプチドのカルボキシル基の塩とアミノ基の酸付加塩の双方を含む。
カルボキシル基の塩は、例えば、ナトリウム、カルシウム、アンモニウム、鉄、亜鉛などの無機塩や、トリエタノールアミン、アルギニン、リジン、ピペリジン、プロカインなどのアミンを用いて形成された有機塩基との塩が挙げられる。酸付加塩としては、例えば塩酸や硫酸などの鉱酸との塩、酢酸やシュウ酸などの有機酸との塩が挙げられる。
【0061】
このようなALKポリペプチドを細胞内に導入可能な形態に製剤化するには、例えば、ポリペプチドのN末端側に細胞膜通過ペプチドを連結させた融合ポリペプチドの利用が挙げられる。細胞膜通過ペプチドとしては、HIV-1・TATのPTDや、ショウジョウバエのホメオボックスタンパク質アンテナペディアのPTDを使用することができる。融合ポリペプチドは、例えば、ALKポリヌクレオチドとPTDポリヌクレオチドとを連結して作製した融合ポリヌクレオチドを用いて、遺伝子工学的に作製することができる。また、EDCやβ−アラニン等の架橋剤を介して、ポリペプチドとPTDペプチドを結合させる方法によって細胞膜通過ペプチドを連結した融合ポリペプチドを作成することもできる。このような融合ポリペプチドは、経皮的に動脈にカテーテルを挿入して、X線でカテーテルの位置を確認しながら腎臓動脈にカテーテルを挿入して組換えベクターを導入することが可能である。
【産業上の利用可能性】
【0062】
本発明によると、小児固形腫瘍や食道癌の早期治療や予防に有効であり、産業上有用である。
【技術分野】
【0001】
本発明は、小児固形腫瘍または食道癌素因の評価方法及び評価キット、また、その薬剤及びその選択方法に関する。
【背景技術】
【0002】
ユーイング肉腫ファミリー(Ewing sarcoma family of tumours:ESFT)は、骨や軟組織の小円形細胞腫瘍であり、骨ユーイング腫瘍、骨外性ユーイング腫瘍、末梢神経上皮腫(peripheral neuroepithelioma:PNET)、アスキン腫瘍(胸壁のPNET)が含まれる(非特許文献1)。十代の若者に多く、さらに5年生存率が50%以下とその予後は不良である(非特許文献2)。
【0003】
ESFTの遺伝子の際立った特徴は、その多くにEWS-FLI-1または他の関連融合遺伝子が存在することであり、ESFTの成長におけるその重要な役割を強調している(非特許文献3)。実際、未分化マウス骨髄細胞にEWS-FLI-1融合遺伝子を形質導入するとESFTに似た腫瘍が再生され、ESFTにおけるこの融合が果たす病因的役割を裏付けている(非特許文献4)。
しかし、ESFTの成長及び/またはESFT素質に他の共同する遺伝子的変化が関与しているかどうかは、依然として不明である。
【0004】
未分化リンパ腫キナーゼ(anaplastic lymphoma kinase:ALK)は、未分化大細胞リンパ腫(anaplastic large cell lymphoma:ALCL)内でのt(2;5)(p23;q35)転座により生成されたNPM-ALK融合キナーゼとして同定された受容体チロシンキナーゼの一つである(非特許文献5、6)。ALKはまた、ALCLに加え炎症性筋線維芽細胞腫瘍内でも異なる融合キナーゼの生成にも関与していて(非特許文献7)、inv(2)(p21p23)により別の融合キナーゼ(EML4-ALK)を生成する一部の非小細胞肺癌の病因である(非特許文献8)。
【0005】
また、最近になって、大部分の家族性神経芽腫症例における神経芽腫素質の主な原因が、複数の生殖細胞系ALK変異であることが証明されている。さらに、本発明者らによって、散発性神経芽腫症例の約8%において体細胞機能獲得型変異またはALK遺伝子増幅が起こっていることを報告している(非特許文献9〜12)。
【0006】
ESFTと神経芽腫は、全く異なる臨床病理学的特徴及び分子遺伝学的特徴を有してはいるが、両腫瘍はさまざまな神経分化度を示し、両腫瘍の神経堤起原の可能性を示す報告がある(非特許文献13、14)。さらに、近年の分子免疫組織化学的研究により、ESFT及び神経芽腫ではALKが頻繁に発現されていることが立証され(非特許文献15、16)、これにより、ESFT由来細胞株に加え、多数の原発性ESFT症例におけるALKの変異状態の研究も促された。
【0007】
しかし、ALKの変異状態と、小児固形腫瘍または食道癌との関係については、知見がなかった。
【先行技術文献】
【非特許文献】
【0008】
【非特許文献1】CristWM, Kun LE. Common solid tumors of childhood. N Engl J Med1991;324(7):461-71
【非特許文献2】Maygarden SJ, Askin FB, SiegalGP, et al. Ewing sarcoma of bone in infants and toddlers. A clinicopathologicreport from the Intergroup Ewing's Study. Cancer 1993;71(6):2109-18
【非特許文献3】Kovar H. Progress in themolecular biology of ewing tumors. Sarcoma 1998;2(1):3-17
【非特許文献4】Castillero-Trejo Y, Eliazer S,Xiang L, Richardson JA, Ilaria RL, Jr. Expression of the EWS/FLI-1 oncogene inmurine primary bone-derived cells Results in EWS/FLI-1-dependent, ewingsarcoma-like tumors. Cancer Res 2005;65(19):8698-705
【非特許文献5】Morris SW, Kirstein MN, ValentineMB, et al. Fusion of a kinase gene, ALK, to a nucleolar protein gene, NPM, innon-Hodgkin's lymphoma. Science 1994;263(5151):1281-4
【非特許文献6】Shiota M, Nakamura S,Ichinohasama R, et al. Anaplastic large cell lymphomas expressing the novelchimeric protein p80NPM/ALK: a distinct clinicopathologic entity. Blood1995;86(5):1954-60
【非特許文献7】Lawrence B, Perez-Atayde A,Hibbard MK, et al. TPM3-ALK and TPM4-ALK oncogenes in inflammatory myofibroblastictumors. Am J Pathol 2000;157(2):377-84
【非特許文献8】Soda M, Choi YL, Enomoto M, etal. Identification of the transforming EML4-ALK fusion gene in non-small-celllung cancer. Nature 2007;448(7153):561-6
【非特許文献9】Chen Y, Takita J, Choi YL, et al.Oncogenic mutations of ALK kinase in neuroblastoma. Nature 2008;455(7215):971-4
【非特許文献10】Mosse YP, Laudenslager M, LongoL, et al. Identification of ALK as a major familial neuroblastomapredisposition gene. Nature 2008;455(7215):930-5
【非特許文献11】Janoueix-Lerosey I, Lequin D,Brugieres L, et al. Somatic and germline activating mutations of the ALK kinasereceptor in neuroblastoma. Nature 2008;455(7215):967-70
【非特許文献12】George RE, Sanda T, Hanna M, etal. Activating mutations in ALK provide a therapeutic target in neuroblastoma.Nature 2008;455(7215):975-8
【非特許文献13】Joshi VV, Silverman JF. Pathologyof neuroblastic tumors. Semin Diagn Pathol 1994;11(2):107-17
【非特許文献14】Rorie CJ, Thomas VD, Chen P,Pierce HH, O'Bryan JP, Weissman BE. The Ews/Fli-1 fusion gene switches thedifferentiation program of neuroblastomas to Ewing sarcoma/peripheral primitiveneuroectodermal tumors. Cancer Res 2004;64(4):1266-77
【非特許文献15】Dirks WG, Fahnrich S, Lis Y,Becker E, MacLeod RA, Drexler HG. Expression and functional analysis of theanaplastic lymphoma kinase (ALK) gene in tumor cell lines. Int J Cancer2002;100(1):49-56
【非特許文献16】Willoughby V, Sonawala A,Werlang-Perurena A, Donner LR. A comparative immunohistochemical analysis ofsmall round cell tumors of childhood: utility of peripherin andalpha-internexin as markers for neuroblastomas. Appl Immunohistochem MolMorphol 2008;16(4):344-8
【非特許文献17】McDermott U, Iafrate AJ,Gray NS, et al. Genomic alterations of anaplastic lymphomakinase may sensitize tumors to anaplastic lymphoma kinase inhibitors. CancerRes 2008;68(9):3389-95
【非特許文献18】Caren H, Abel F, Kogner P,Martinsson T. High incidence of DNA mutations and gene amplifications of theALK gene in advanced sporadic neuroblastoma tumours. Biochem J 2008;416(2):153-9
【非特許文献19】James C, Ugo V, Le Couedic JP, etal. A unique clonal JAK2 mutation leading to constitutive signalling causespolycythaemia vera. Nature 2005;434(7037):1144-8
【非特許文献20】Mahooti S, Wakely PE, Jr.Cytopathologic features of olfactory neuroblastoma. Cancer 2006;108(2):86-92
【発明の概要】
【発明が解決しようとする課題】
【0009】
そこで、本発明は、小児固形腫瘍または食道癌の素因を評価する方法及び評価キット、また、その薬剤及びその選択方法を提供することを課題とする。
【課題を解決するための手段】
【0010】
本発明の小児固形腫瘍または食道癌の素因の評価方法は、小児固形腫瘍または食道癌を生じ得る素因を有するか否かを評価する方法であって、被験者のヒト遺伝子を含む試料を用い、ALK遺伝子の変異を検知する工程を有することを特徴とする。
【0011】
小児固形腫瘍としては、神経芽腫以外の腫瘍が好適に対象となる。
【0012】
ALK遺伝子変異の検知としては、そのSNPまたはそれと連鎖不均衡の関係にある遺伝子多型の検知が有用である。SNPに変異があれば素因があると評価し、逆に、SNPに変異がなければ素因がない可能性があると間接的に評価してもよい。
【0013】
少なくとも、A1280V、R1192G、A876Tのいずれかのアミノ酸変異を生じさせるSNPがある場合に、小児固形腫瘍または食道癌を生じ得る素因を有すると評価してもよい。
【0014】
特に、A1280Vの変異が、GCGからGTGへの変異であるか、R1192Gの変異が、CGGからGGGへの変異であるか、A876Tの変異が、GCCからACCへの変異であることを指標としてもよい。
【0015】
遺伝子多型の検知には、ダイレクトシークエンス法、BACアレイCGH法、FISH法、RFLP法、PCR−SSCP法、アレル特異的オリゴヌクレオチドハイブリダイゼーション法、TaqMan PCR法、インベーダー法、HRM法、SmartAmp法、Q−probe法(QP法)、MALDI−TOF/MS法、モレキュラービーコン法、RCA法、UCAN法、DNAチップまたはDNAマイクロアレイを用いた核酸ハイブリダイゼーション法のいずれかが利用可能である。
【0016】
本発明の小児固形腫瘍または食道癌の素因の評価キットは、小児固形腫瘍または食道癌を生じ得る素因を有するか否かを評価するキットであって、被験者のヒト遺伝子を含む試料を用い、ALK遺伝子のA1280V、R1192G、A876Tの少なくともいずれかにおけるSNP、またはそれと連鎖不均衡の関係にある遺伝子多型を検知する手段を備えることを特徴とする。
【0017】
本発明の小児固形腫瘍または食道癌の薬剤候補物質選定方法は、小児固形腫瘍または食道癌の治療薬、またはその疾患を生じ得る素因を低減する薬剤の候補物質を選定する方法であって、試験物質の存在下及び非存在下において哺乳動物細胞を培養する工程と、それぞれの細胞においてチロシンキナーゼの酵素活性の上昇度を測定する工程と、その酵素活性の上昇を抑制する効果を有する試験物質を候補物質として選定する工程を含むことを特徴とする。
【0018】
本発明の小児固形腫瘍または食道癌の薬剤は、小児固形腫瘍または食道癌、またはその疾患を生じ得る素因を低減する薬剤であって、チロシンキナーゼの酵素活性の上昇を抑制する効果を有することを特徴とする。
【発明の効果】
【0019】
本発明によると、小児固形腫瘍や食道癌の早期治療や予防に寄与する。
【図面の簡単な説明】
【0020】
【図1】ALKのタンパク構造を示す説明図
【図2】Ewing肉腫の症例で検出されたALK変異を示す説明図
【図3】細胞系変異ALKを有する患者の臨床病理学的所見を示す表
【図4】各ALK変異タンパクの自己リン酸化を示すウェスタンブロット分析の写真
【図5】神経芽腫及びユーイング肉腫ファミリー由来細胞株において、ALK阻害剤TAE684の影響を示すグラフ
【図6】siRNAによるALKノックダウンによるUTP-ES1細胞成長の阻害を示すブロット写真及びグラフ
【発明を実施するための最良の形態】
【0021】
以下に、本発明の実施形態を説明する。実施形態は、前記特許文献など従来公知の技術を援用して適宜設計変更可能であり、また、薬剤の製造方法及び装置についても従来公知の技術を適宜適用可能である。
【0022】
本研究では、東京大学倫理委員会の承認の上(承認番号:1598)、総数で80の匿名化された原発性ESFT保存検体を東京大学倫理委員会の規定に従って解析した。原発性腫瘍は全て1993年11月から2008年12月の間に共同研究病院において手術または生検により取得した。EWS-FLI1、EWS-ERG、EWS-ETV1またはEWS-FEV融合転写産物の存在が、良質なRNA検体が得られた44検体で、逆転写ポリメラーゼ連鎖反応により確認された。本研究には、17のESFT由来細胞株も含まれる。UTP-ES1、ALK変異ESFT細胞株、SCMC-ES1の樹立、SJES系、SK系及びES-1-OT以外の細胞株は、the Japanese Cancer Resource Cell Bank(http://cellbank.nibio.go.jp/wwwjcrbj.htm)から入手した。これら細胞株は全て、ウシ胎仔血清10%を添加したRPMI1640培地(GIBCO RLB,Grand Island,NY,USA)中で培養した。
【0023】
まず、ESFT検体中におけるALKの変異及び発現の分析を行った。
ALK遺伝子のエクソン20から28をゲノム遺伝子からPCR増幅し、DNAへテロ二本鎖分析及び/または直接塩基配列決定法により変異について調査した。PCRの条件及びプライマーは非特許文献9の通りである。ALK発現の逆転写ポリメラーゼ連鎖反応分析は、症例9、症例35及びUTP-ES1について行った。ALK変異検体のゲノムコピー数の解析は、GeneChip単一ヌクレオチド多型(single nucleotide polymorphism:SNP)遺伝子決定マイクロアレイ(Affymetrix GeneChip 250K NspI;Santa Clara,CA,USA)及び非特許文献9のCNAG/AsCNARを使用して行った。
【0024】
次に、変異ALKの機能解析を行った。
ALKWT-FLAG及びALKF1174L-FLAGは、それぞれ、野生型ALKのFLAGタグ付きcDNA及びそのF1174L変異体である(非特許文献9)。A1280V変異体のFLAGタグ付きcDNA(ALKA1280V-FLAG)は、腫瘍検体の全RNAからハイフィディリティPCRにより単離した。再配列解析後、各cDNAを発現プラスミドpcDNA3に組み込み、EffecteneTMトランスフェクション試薬(QIAGEN,Tokyo,Japan)を使ってNIH3T3細胞に遺伝子導入した。
変異ALKキナーゼのウェスタンブロット分析及びインビトロキナーゼ測定は非特許文献9の方法により行った。ALK変異ESFT細胞株、UTP-ES1以外に、ESFT(SJES-7及びSJES-6)及び神経芽腫(SK-N-SH)細胞株もALK阻害剤TAE684(非特許文献17)の濃度を変えながら培養し、それぞれの細胞の成長をCellTiter-GloTMLuminescent Cell Viability Assay
(Promega,Tokyo,Japan)を使って測定した。コントロールとしてNIH3T3細胞を使用した。UTP-ES1に対するTAE684のIC50値は、GrapfPad Prism 5 software(GraphPad,La Jolla,CA,USA)を使用して非線形回帰により算出した。同じ細胞株をALK特異的siRNAまたは非特異的siRNAでトランスフェクトし、細胞成長に対する効果を既報(9)のようにCellTiter-GloTMを使用して生存細胞数を測定することにより評価した。
【0025】
図1は、ALKのタンパク構造を示す説明図であり、図2は、Ewing肉腫の症例で検出されたALK変異を示す説明図である。
ESFTにおけるALK異常については、原発性ESFT80検体及びEFST由来17細胞株について、DNAへテロ二本鎖形成分析及び/またはALKのALK膜近傍ドメイン及びキナーゼドメインを包含するPCR増幅されたALKエクソンの直接塩基配列決定により、ALK変異をスクリーニングしたところ、3つの腫瘍検体、症例9のA1280V、症例9から樹立されたUTP-ES1及び症例35のR1192Gのキナーゼドメイン内に2つのヌクレオチドミスセンス変化が見出された。両変化はまた、それらの対応正常DNAにも存在し、生殖細胞系由来であることが確認された。腫瘍検体における変異ALKの発現は両症例において認められた。
【0026】
これらのヌクレオチド変化は50人の健常ボランティアには同定されず、dbSNPデータベース(http://www.ncbi.nlm.nih.gov/projects/SNP/)にも登録されていなかった。さらに、これらの変化は、これまで家族性及び/または散発性神経芽腫(非特許文献9〜12、18)について報告された14のアミノ酸位置での20の変異のいずれにも一致せず、したがって、非機能的な一塩基型多型というよりはむしろ新規生殖細胞系変異を意味していると考えられる。
対応正常DNAは、この位置に明確にヘテロ接合体クロマトグラムを示したのに対して、症例9及びUTP-ES1腫瘍検体だけが変異(1280V)対立遺伝子を含有していた。このことに一致して、SNPアレイ分析により、野生型対立遺伝子が変異対立遺伝子の複製による染色体の誤分離により失われたと思われる第2染色体全体の獲得片親ダイソミー(aUPD)が明らかにされた。機能獲得対立遺伝子を選択するaUPDは、骨髄増殖性疾患におけるJAK2変異に対して十分に立証されていて(非特許文献19)、神経芽腫細胞株においても報告されている(非特許文献9)。ALK発現は、ALK変異を有する症例9、症例35、UTP-ES1検体に検出された。
【0027】
図3は、生殖細胞系変異ALKを有する患者の臨床病理学的所見を示す表である。
症例9は、前月から持続性の右頭痛のために収容された9歳の少年である。臨床検査及び頭部のコンピュータ断層撮影により、副鼻腔を含む右鼻腔に固形腫瘍を有することが明らかになった。リンパ節腫脹や転移の兆候は見られなかった。腫瘍は、過色素性の核と少量の細胞質を有する小円形細胞から成っていた。腫瘍細胞は、ビメンチン、CD99 (MIC2)、CD56、S-100及び神経特異的エノラーゼ(NSE)陽性であったが、ミオグロビン、デスミン、ケラチン及び白血球共通抗原(LCA)陰性であった。腫瘍検体中にEWS-FLI1融合転写産物が検出された。患者は多剤化学療法による治療を受けたが、最初の診断から12ヶ月後に死亡した。
症例35は、左の斜視、眼球突出及び鼻出血を有する6歳の少年である。CTスキャンにより、左鼻気道及び副鼻腔を含む大きな小葉腫瘤が検出された。転移の兆候は見られなかった。腫瘍は、少量の細胞質を有する小円形細胞から成っていて、ビメンチン、CD99、CD56、及びNSE陽性、S-100及びCD57弱陽性であった。ミオシン、デスミン及びHHF35は陰性であった。細胞発生学的検討は、t(2;22)(q35;q11)を示し、EWS-FEV融合転写産物が患者の腫瘍中に検出された。患者は、放射線化学療法及びタンデム自家末梢血幹細胞移植後、完全に寛解した。
【0028】
2つの生殖細胞系変異は、異なる種にわたり、かつ分子進化を通して高度に保存されているキナーゼドメイン内のアミノ酸を伴っていたので、これら変異のALKキナーゼ活性に対する効果を詳細に検討した。
FLAGタグ付きALK変異、ALKA1280VをFLAGタグ付き野生型ALK及び神経芽腫由来ALK変異体ALKF1174Lと共にNIH3T3細胞内で過渡的に発現させ(非特許文献9)、免疫沈降したALKタンパク質のインビトロにおけるチロシンキナーゼ活性をpoly-GluTyrペプチドを基質に使用して測定した。
【0029】
図4は、各ALK変異タンパクの自己リン酸化を示すウェスタンブロット分析の写真である。
ALK変異体、ALKA1280Vは、ALKF1174L と同様、自己リン酸化を示し、インビトロチロシンキナーゼ活性も野生型ALKに比較して上昇していた。予想されるように、Akt、Stat3及びErkのリン酸化の増大によって証明されるように、変異を形質導入したNIH3T3細胞の下流ALKシグナル伝達経路のリン酸化が増進されていて、ALKA1280V変異体の上昇したチロシンキナーゼ活性は、変異導入されたNIH3T3細胞内においてALKのシグナル伝達経路の下流を活性化した。
【0030】
図5は、神経芽腫及びユーイング肉腫ファミリー(ESFT)由来細胞株において、ALK阻害剤TAE684の影響を示すグラフである。ALK変異を有する(UTP-ES1)または有さない(SJES-6及びSJES-7)場合の細胞成長に対するALK阻害剤TAE684の影響を、三重試験の平均細胞数±S.D.をプロットして示す。ALK変異神経芽腫由来細胞株SK-N-SH及びNIH3T3細胞に対する、成長阻害のプロフィールを合わせて示す。
図6は、siRNAによるALKノックダウンによるUTP-ES1細胞成長の阻害を示すブロット写真及びグラフである。非特異的バンドは、ローディング・コントロールを示す。
ALK阻害剤TAE684及びsiRNAによるALKノックダウンを使用して、ALK変異ESFT細胞株及びUTP-ES1の細胞増殖に対するALK阻害の効果を検討した。UTP-ES1の細胞増殖は、76.1nMのIC50でTAE684により効果的に阻害された。これは、SK-N-SH(48.7nM)、ALK変異体及びTAE684感受性神経芽腫細胞株に対するIC50とほぼ同じである(非特許文献17)が、ALK発現のないNIH3T3細胞のIC50(341nM)より実質的に低い値である。
同様に、変異ALKをsiRNAによりノックダウンしたUTP-ES1では、非特異的siRNAでトランスフェクトしたコントロールに比較して、細胞増殖が顕著に抑制された。
【0031】
新規ALK生殖細胞系変異を有する2つの症例で、ESFTを発現した他の家族は知られていなく、そのゲノムDNAを入手できなかったので、変異の同時分離やESFT発生の確認または変異が新たな変異であるのか親から遺伝されたものであるのかを決定することはできなかった。しかし、キナーゼドメイン(β4のR1192及び活性化ループのA1280)内の高保存アミノ酸の置換後、下流シグナル伝達経路の構成的活性化と同様、ALKA1280V変異のキナーゼ活性が上昇する。TAE684またはsiRNA仲介遺伝子ノックアウトによる変異ALKの阻害は、ALKA1280Vを有するUTP-ES1の増殖を抑制した。一方、R1192G変異は、3つの異なる家族性神経芽腫家系でプロリンに変異していた(R1192P)アミノ酸と同じアミノ酸に起こっていた(非特許文献10)。以上のように、症例9及び症例35に見られたこれら新規の生殖細胞系変異は、ESFTの発生の素因となっていた。
【0032】
神経芽腫及びESFTの両腫瘍は類似した組織構造を示し、どちらも神経堤細胞から生じると推測されるので、生殖細胞系ALK変異の神経芽腫及びESFTの両者との関連については、さらに検討する必要がある。生殖細胞系ALK変異の活性化はそのキャリアに神経芽腫を生じさせやすくするが、その浸透度は不完全であり、家族性神経芽腫の発生には他の遺伝子の関与が必要であることは明らかである。予想されるように、今回のESFTの2症例はまた、EWS-FLI1及びEWS-FEV融合を形成するEWS関連転座を有し、ESFTの病因にこれらの融合が果たす明確な役割の根拠となっている。しかし、ESFTの発生にはEWS融合だけでは十分でなく、さらに遺伝子の変化が必要である可能性が、ALK抑制剤及びALK特異的siRNAによるALK変異ESFT細胞成長の抑制により示唆された。ALK変異神経芽腫細胞株LAN-5におけるEWS-FLI1の異種発現が、神経芽腫細胞に類似の遺伝子発現プロフィールと同様に、神経芽腫特異的マーカー及びESFT特異的マーカーの新たな発現を抑制したことは興味深い(非特許文献14)。また、この2症例におけるESFT腫瘍が、ESFTの発症部位としては比較的稀であるが、嗅神経芽腫にも関与している鼻腔または副鼻腔に発生したことは注目すべきである(非特許文献20)。ESFTと神経芽腫との間の病原性のつながりの可能性についてさらに研究する必要がある。
結論として、ALK生殖細胞系変異は、家族性神経芽腫だけでなく、一部のESFT症例の発生に関与していることを示唆するものであった。低分子量化合物による変異キナーゼの抑制は、一部のESFTの治療効果を有する可能性がある。
【0033】
以上の知見から、ALK遺伝子の変異を検知することによって、神経芽腫以外の小児固形腫瘍または食道癌の素因を評価できることが明らかとなった。
ALK遺伝子変異の検知としては、そのSNPまたはそれと連鎖不均衡の関係にある遺伝子多型の検知が有用である。SNPに変異があれば素因があると評価し、逆に、SNPに変異がなければ素因がない可能性があると間接的に評価できる。
【0034】
特に、A1280V、R1192G、A876Tのいずれかのアミノ酸変異を生じさせるSNPに注目し、A1280Vの変異が、GCGからGTGへの変異であるか、R1192Gの変異が、CGGからGGGへの変異であるか、A876Tの変異が、GCCからACCへの変異であることを指標としてもよい。
【0035】
なお、AALK遺伝子には、ヒト由来cDNAや、相補的な塩基配列からなるDNAとストリンジェントな条件下でハイブリダイズし、尿酸輸送能を有するポリペプチドをコードするヒト由来の同質遺伝子、哺乳動物におけるそれらの相同物も含まれる。
【0036】
遺伝子多型を決定するには、ヒト血液または組織を材料として、ダイレクトシークエンス法や、BACアレイCGH法、FISH法、RFLP法、PCR−SSCP法、アレル特異的オリゴヌクレオチドハイブリダイゼーション法、TaqMan PCR法、インベーダー法、HRM法、SmartAmp法、Q-probe法(QP法)、MALDI−TOF/MS法、モレキュラービーコン法、RCA法、UCAN法、DNAチップまたはDNAマイクロアレイを用いた核酸ハイブリダイゼーション法などが利用できる。
【0037】
ダイレクトシークエンシング法などによると、ゲノムDNAから直接SNPを検出することができる。
また、クローンや、PCR法、LCR法、SDA法、RCK法、LAMP法、NASBA法などにより、特定のゲノムDNA領域を増幅した後に、少なくとも多型部位を含む対立遺伝子の一部の塩基配列の決定、多型部位に特異的にハイブリダイズするプローブによる検出、多型部位を含む遺伝子断片の分子量の測定を行ったりしてもよい。
増幅産物は、塩基配列の決定、MALDI−TOF質量分析法等による分子量の測定、制限酵素断片長の解析、SSCPによる検出、電気泳動などによって、SNPを決定することができる。
【0038】
例えば、TaqMan法は、アレル特異的なオリゴヌクレオチドと鋳型とのハイブリダイゼーションとPCR法を同時に行い、蛍光エネルギー移動現象を用いてSNPを検出する方法である。蛍光色素と消光物質により標識したアレル特異的プローブを標的部位にハイブリダイズさせて、この部位を含む領域を増幅するように設計したプライマーでPCRを行うと、プライマーからの伸長反応が進むと同時に、Taqポリメラーゼの5'ヌクレアーゼ活性によりハイブリダイズしたプローブが切断される。蛍光色素が消光物質と離れると蛍光が生じ、またPCR反応により鋳型が増幅するため、蛍光強度は指数関数的に増強する。2種類のアレルに特異的なプローブを異なる蛍光色素で標識しておけば、1回のアッセイでホモ接合体とヘテロ接合体とを区別することもできる。
【0039】
インベーダー法は、2種類のオリゴヌクレオチドを用い、これらのプローブが鋳型DNAと形成する特異的な構造を認識して切断する酵素反応に基づく方法である。目的塩基配列の第1の部位に実質的に相補的なインベーダープローブと、3'末端側が目的塩基配列の第2の部位と実質的に相補的であり5'末端側には鋳型と非相補的で一本鎖を形成するフラップを含むアレルプローブとの2種類の異なるプローブで、目的とする塩基配列を認識する。これらのプローブが鋳型の隣接する領域にハイブリダイズすると、SNP部位にインベーダープローブの3'末端が侵入し、この構造が酵素により切断されてフラップが遊離する。遊離したフラップはあらかじめ標識しておくことにより定量することができる。フラップ−FRETプローブを2組用意し、異なる蛍光色素で標識することにより、1回のアッセイで各ホモ接合体とヘテロ接合体とを区別することができる。
【0040】
MALDI−TOF質量分析法は、SNP部位に隣接するプライマーを作製し、PCR増幅させた試料DNAを鋳型として、ddNTPを用いて1塩基分だけプライマー伸長反応を行い、伸長反応生成物の質量分析により、付加したddNTPを識別する方法である。プライマーの蛍光標識を必要とすることなく、短時間で大量の試料を処理することができる。
【0041】
RCA法は、環状の一本鎖DNAを鋳型として、DNAポリメラーゼがその上を移動しながら長い相補鎖DNAを合成していくDNA増幅手段を、SNPタイピングに応用した方法である。SNPの識別をRCA法による増幅の有無で行う。すなわち、ゲノムDNAとアニールし、環状になりうる一本鎖プローブをゲノムDNAにハイブリダイズさせて連鎖反応を行う。プローブの端を識別したいSNPの部位としておけば、その部位がマッチしていれば連結され環状となってRCAによる増幅が起こるが、ミスマッチであれば連結されず環状とならないためRCA増幅は起こらない。この2種類の増幅反応を識別することによってSNPを決定することができる。
【0042】
DNAチップ法は、多型部位を含むオリゴヌクレオチドプローブをマイクロアレイ上に配置したDNAチップを用いて、PCR増幅させた蛍光標識cDNAやcRNAとハイブリダイゼーションする方法である。多くのSNPを迅速に検出することができる。
【0043】
アミノ酸配列の多型を決定する方法には、例えば、二次元電気泳動法やマイクロフルーイディクス法によるプロテオーム解析、質量分析装置を用いたペプチドマッピングとアミノ酸配列分析、プロテインシークエンサーによるアミノ酸配列分析、プロテインチップを用いてポリペプチドとリガンドとの相互作用を検出する方法などが利用できる。
【0044】
例えば、二次元電気泳動法は、一般的には、一次元目に等電点電気泳動を、二次元目にSDS−PAGEを行うものであり、1枚のゲルで数千のタンパク質を分離することができる。等電点電気泳動には、両性担体や固定化pH勾配ゲルストリップを用いる。SDS−PAGEには、1種類のpHの緩衝液を用いる連続緩衝液系と、複数のpHの緩衝液を用いる不連続緩衝液系とがある。また、分離するタンパク質の種類によって、低BIS濃度ゲル電気泳動、濃度勾配ゲル電気泳動、トリシン−SDS−PAGEなどを用いることができる。分離されたタンパク質は、クーマシーブルー染色や銀染色や蛍光試薬を用いてゲル上で感度よく検出できる。また、ALKポリペプチドに対する抗体を用いたウエスタンブロッティング法も利用可能である。
【0045】
質量分析方法の一つであるMALDI−TOF/MS法は、タンパク質試料とシナピン酸等のレーザー光を吸収するマトリクスとの混合、乾燥後に強力なパルスレーザー光を照射し、マトリクスからのエネルギー移動によるタンパク質試料のイオン化を行い、初期加速による試料分子イオンの飛行時間差でイオンの分子量を分析する方法である。ペプチドを質量分析計内部で断片化し、断片の質量解析からアミノ酸配列やアミノ酸組成などを得るためには、質量分離部を複数連結したタンデム質量分析法が利用され、エレクトロスプレーイオン化法を用いた三連四重極型やハイブリッド型やイオントラップ型分析計等も用いられる。
【0046】
プロテインチップ法は、基板上に並べたタンパク質や、ペプチド、抗体、発現タンパク質などと試料との相互作用を、包括的かつ迅速に行うことができる。
【0047】
本発明による評価キットは、小児固形腫瘍または食道癌を生じ得る素因を有するか否かを評価するキットであって、被験者のヒト遺伝子を含む試料を用い、ALK遺伝子のA1280V、R1192G、A876Tの少なくともいずれかにおけるSNP、またはそれと連鎖不均衡の関係にある遺伝子多型を検知する手段を備える。
すなわち、ALK遺伝子多型を含むポリヌクレオチド、または多型を含むDNA断片を増幅するためのプライマー対、多型を検出するためのポリヌクレオチドとして提供してもよい。
【0048】
なお、ポリヌクレオチドとは、ポリリボヌクレオチドとポリデオキシリボヌクレオチドの双方を含み、それらは非修飾RNAまたはDNA、修飾RNAまたはDNAであってもよく、例えばDNA、cDNA、ゲノムDNA、mRNA、未プロセッシングRNA、それらの断片などが挙げられる。
また、ポリペプチドとは、2以上のアミノ酸がペプチド結合で連結されたものであり、比較的短鎖のペプチドまたはオリゴペプチドと呼ばれるものからタンパク質と呼ばれる長鎖のものまでを含む。ポリペプチドには、遺伝的にコードされている20種類のアミノ酸以外のアミノ酸や、修飾されたアミノ酸を含んでもよい。その修飾には、ペプチド結合の主鎖、アミノ酸側鎖、アミノ末端、カルボキシル末端において、アセチル化、アシル化、ADPリボシル化、アミド化、ビオチン化、脂質や脂質誘導体との共有結合、架橋結合の生成、ジスルフィド結合、糖鎖の付加、GPIアンカーの付加、リン酸化及びプレニル化などが挙げられる。
【0049】
本発明の小児固形腫瘍または食道癌の薬剤候補物質選定方法は、小児固形腫瘍または食道癌の治療薬、またはその疾患を生じ得る素因を低減する薬剤の候補物質を選定する方法であって、試験物質の存在下及び非存在下において哺乳動物細胞を培養する工程と、それぞれの細胞においてチロシンキナーゼの酵素活性の上昇度を測定する工程と、その酵素活性の上昇を抑制する効果を有する試験物質を候補物質として選定する工程を含む。
【0050】
哺乳動物としては、マウスなどが挙げられ、その生体を構成している組織や細胞も含む。また、試料としては、生物に由来するポリヌクレオチドを含有するものであって、組織や細胞から採取される体液、皮膚、毛根、粘膜、内臓、胎盤、臍帯血等を含む。
同様に、ヒトALK遺伝子または非ヒトALK遺伝子を過剰発現させた非ヒト動物、A1280V、R1192G、A876Tのうちの少なくともいずれかの変異を含むヒトALK遺伝子または非ヒトALK遺伝子を過剰発現させた非ヒト動物、ALK遺伝子を欠損させた非ヒト細胞株またはヒト細胞株、ヒトALK遺伝子または非ヒトALK遺伝子を過剰発現させた非ヒト細胞株またはヒト細胞株、A1280V、R1192G、A876Tのうちの少なくともいずれかの変異を含むヒトALK遺伝子または非ヒトALK遺伝子を過剰発現させた非ヒト細胞株またはヒト細胞株、或いはそれら細胞株より調製した細胞膜小胞を用いてもよい。
【0051】
本発明の小児固形腫瘍または食道癌の薬剤は、小児固形腫瘍または食道癌、またはその疾患を生じ得る素因を低減する薬剤であって、チロシンキナーゼの酵素活性の上昇を抑制する効果を有する。
【0052】
また、本発明の小児固形腫瘍または食道癌の薬剤は、小児固形腫瘍または食道癌、またはその疾患を生じ得る素因を低減する薬剤であって、ALKタンパク質をコードするポリヌクレオチドを細胞内に導入可能な形態で有するか、または、ALKタンパク質に相当するポリペプチドを細胞内に導入可能な形態で有するものとしても提供可能である。前者によると、長期間にわたって安定に尿酸輸送を改善させることができ、後者によると、注射等の投与によって簡便に尿酸輸送を改善させることができる。
【0053】
なお、ポリヌクレオチドを細胞内に導入可能な形態とは、ポリヌクレオチドが細胞内に導入され、細胞内のALK遺伝子がALKを発現するようにコードされているALKを発現すること可能とする形態を意味する。同様に、ポリペプチドを細胞内に導入可能な状態とは、ポリペプチドが細胞内に導入され、細胞内のALKと同様な機能を発揮することを可能とする形態を意味する。
【0054】
ALKポリヌクレオチドは、既知のヌクレオチド配列に基づいて作製したオリゴヌクレオチドプローブを用いて既存のcDNAライブラリーをスクリーニングする方法や、オリゴヌクレオチドプライマーを用いたRT-PCR等の方法によって取得することができる。
【0055】
A1280V、R1192G、A876TのいずれにもSNPのないALKが好ましく、そのポリヌクレオチドを細胞内に導入可能な状態にするためには、例えば、むき出しDNAとする方法や、組換えウイルスベクターの形態で製剤化する方法が用いられる。ウイルスベクターには、バキョロウイルス科、パルボウイルス科、ピコルノウイルス科、ヘルペスウイルス科、ポックスウイルス科、アデノウイルス科、ピコルナウイルス科などのウイルスのゲノムに由来するものが利用できる。
【0056】
また、生体より取り出した組織または細胞にポリヌクレオチド発現ベクターを導入した後に、生体に戻すようにしてもよい。そのような場合は、ポリヌクレオチドを組込んだ発現ベクターを、例えばマイクロインジェクション法やエレクトロポーレーション法などのトランスフェクションにより細胞内に導入する方法が利用できる。
【0057】
ウイルスベクターや発現ベクターにおけるポリヌクレオチドは、全身性または組織特異的に発現するプロモーター支配下に連結してもよい。また、ウイルスベクターを腎臓特異的に感染させる場合には、経皮的に動脈にカテーテルを挿入して、X線でカテーテルの位置を確認しながら腎臓動脈にカテーテルを挿入して組換えベクターを導入することが可能である。
【0058】
ALKポリペプチドは、前記のALKポリヌクレオチドを用いた遺伝子工学的方法により作成することができる。すなわち、ポリヌクレオチドを有するベクターからインビトロ転写によってRNAを調製し、これを鋳型としてインビトロ翻訳を行うことによりインビトロでALKポリペプチドを得ることができる。また、ポリヌクレオチドを発現ベクターに組換えれば、大腸菌や枯草菌等の原核細胞や、酵母や、昆虫細胞、哺乳動物細胞等の真核細胞の発現産物としてALKポリペプチドを得ることができる。
また、ALKポリペプチドは、公知の化学合成法に準じて合成することもできる。
【0059】
ALKポリペプチドは、ペプチド誘導体として提供してもよい。この誘導体には、合成や精製を促進するための修飾、物理、化学的安定化を促進するための修飾、生体内の代謝に対する安定性と不安定性、条件付けの等の活性化修飾などを含む。
ペプチド誘導体におけるその他の修飾には、アセチル化、アシル化、ADP−リボシル化、アミド化、フラビンの共有結合、ヘム部分の共有結合、ヌクレオチドまたはヌクレオチド誘導体の共有結合、脂質または脂質誘導体の共有結合、ホスファチジルイノシトールの共有結合、交差架橋、環化、ジスルフィド結合、脱メチル化、交差架橋共有結合形成、シスチン形成、ピログルタメート形成、ホルミル化、ガンマーカルボキシル化、グリコシル化、GPIアンカー形成、水酸化、ヨウ素化、メチル化、ミリストイル化、酸化、タンパク質加水分解プロセッシング、リン酸化、プレニル化、ラセミ化、脂質結合、硫酸化、セレノイル化などが含まれる。より具体的には、ペプチド誘導体は、ALKポリペプチドの活性を破壊せず、またこれを含有する組成物に毒性を与えない範囲において、残基の側鎖またはN末端基もしくはC末端基として生じる機能性基として調製することができる。例えば、体液中でポリペプチドの残存を延長するポリエチレングリコール側鎖を含む誘導体、カルボキシル基の脂肪族エステル、アンモニアまたはアミンと反応することによるカルボキシル基のアミド、アシル部分と形成されるアミノ酸残基の遊離アミノ基のN−アシル誘導体またはアシル部分と形成される遊離の水酸基のO−アシル誘導体などが挙げられる。
【0060】
ALKポリペプチドはまた、薬理学的に許容し得る塩として提供してもよい。この塩には、ポリペプチドのカルボキシル基の塩とアミノ基の酸付加塩の双方を含む。
カルボキシル基の塩は、例えば、ナトリウム、カルシウム、アンモニウム、鉄、亜鉛などの無機塩や、トリエタノールアミン、アルギニン、リジン、ピペリジン、プロカインなどのアミンを用いて形成された有機塩基との塩が挙げられる。酸付加塩としては、例えば塩酸や硫酸などの鉱酸との塩、酢酸やシュウ酸などの有機酸との塩が挙げられる。
【0061】
このようなALKポリペプチドを細胞内に導入可能な形態に製剤化するには、例えば、ポリペプチドのN末端側に細胞膜通過ペプチドを連結させた融合ポリペプチドの利用が挙げられる。細胞膜通過ペプチドとしては、HIV-1・TATのPTDや、ショウジョウバエのホメオボックスタンパク質アンテナペディアのPTDを使用することができる。融合ポリペプチドは、例えば、ALKポリヌクレオチドとPTDポリヌクレオチドとを連結して作製した融合ポリヌクレオチドを用いて、遺伝子工学的に作製することができる。また、EDCやβ−アラニン等の架橋剤を介して、ポリペプチドとPTDペプチドを結合させる方法によって細胞膜通過ペプチドを連結した融合ポリペプチドを作成することもできる。このような融合ポリペプチドは、経皮的に動脈にカテーテルを挿入して、X線でカテーテルの位置を確認しながら腎臓動脈にカテーテルを挿入して組換えベクターを導入することが可能である。
【産業上の利用可能性】
【0062】
本発明によると、小児固形腫瘍や食道癌の早期治療や予防に有効であり、産業上有用である。
【特許請求の範囲】
【請求項1】
小児固形腫瘍または食道癌を生じ得る素因を有するか否かを評価する方法であって、
被験者のヒト遺伝子を含む試料を用い、ALK遺伝子の変異を検知する工程を有する
ことを特徴とする小児固形腫瘍または食道癌の素因の評価方法。
【請求項2】
小児固形腫瘍が、神経芽腫以外の腫瘍である
請求項1に記載の小児固形腫瘍の素因の評価方法。
【請求項3】
ALK遺伝子変異の検知が、
SNPまたはそれと連鎖不均衡の関係にある遺伝子多型の検知である
請求項1または2に記載の小児固形腫瘍または食道癌の素因の評価方法。
【請求項4】
少なくとも、A1280V、R1192G、A876Tのいずれかのアミノ酸変異を生じさせるSNPがある場合に、小児固形腫瘍または食道癌を生じ得る素因を有すると評価する
請求項1ないし3のいずれかに記載の小児固形腫瘍または食道癌の素因の評価方法。
【請求項5】
A1280Vの変異が、GCGからGTGへの変異であるか、R1192Gの変異が、CGGからGGGへの変異であるか、A876Tの変異が、GCCからACCへの変異である
請求項4に記載の小児固形腫瘍または食道癌の素因の評価方法。
【請求項6】
遺伝子多型の検知に、ダイレクトシークエンス法、BACアレイCGH法、FISH法、RFLP法、PCR−SSCP法、アレル特異的オリゴヌクレオチドハイブリダイゼーション法、TaqMan PCR法、インベーダー法、HRM法、SmartAmp法、Q−probe法(QP法)、MALDI−TOF/MS法、モレキュラービーコン法、RCA法、UCAN法、DNAチップまたはDNAマイクロアレイを用いた核酸ハイブリダイゼーション法のいずれかを用いる
請求項1ないし5のいずれかに記載の小児固形腫瘍または食道癌の素因の評価方法。
【請求項7】
小児固形腫瘍または食道癌を生じ得る素因を有するか否かを評価するキットであって、
被験者のヒト遺伝子を含む試料を用い、ALK遺伝子のA1280V、R1192G、A876T
の少なくともいずれかにおけるSNP、またはそれと連鎖不均衡の関係にある遺伝子多型を検知する手段を備える
ことを特徴とする小児固形腫瘍または食道癌の素因の評価キット。
【請求項8】
小児固形腫瘍または食道癌の治療薬、またはその疾患を生じ得る素因を低減する薬剤の候補物質を選定する方法であって、
試験物質の存在下及び非存在下において哺乳動物細胞を培養する工程と、それぞれの細胞においてチロシンキナーゼの酵素活性の上昇度を測定する工程と、
その酵素活性の上昇を抑制する効果を有する試験物質を候補物質として選定する工程を含む
ことを特徴とする小児固形腫瘍または食道癌の薬剤候補物質選定方法。
【請求項9】
小児固形腫瘍または食道癌、またはその疾患を生じ得る素因を低減する薬剤であって、
チロシンキナーゼの酵素活性の上昇を抑制する効果を有する
ことを特徴とする小児固形腫瘍または食道癌の薬剤。
【請求項1】
小児固形腫瘍または食道癌を生じ得る素因を有するか否かを評価する方法であって、
被験者のヒト遺伝子を含む試料を用い、ALK遺伝子の変異を検知する工程を有する
ことを特徴とする小児固形腫瘍または食道癌の素因の評価方法。
【請求項2】
小児固形腫瘍が、神経芽腫以外の腫瘍である
請求項1に記載の小児固形腫瘍の素因の評価方法。
【請求項3】
ALK遺伝子変異の検知が、
SNPまたはそれと連鎖不均衡の関係にある遺伝子多型の検知である
請求項1または2に記載の小児固形腫瘍または食道癌の素因の評価方法。
【請求項4】
少なくとも、A1280V、R1192G、A876Tのいずれかのアミノ酸変異を生じさせるSNPがある場合に、小児固形腫瘍または食道癌を生じ得る素因を有すると評価する
請求項1ないし3のいずれかに記載の小児固形腫瘍または食道癌の素因の評価方法。
【請求項5】
A1280Vの変異が、GCGからGTGへの変異であるか、R1192Gの変異が、CGGからGGGへの変異であるか、A876Tの変異が、GCCからACCへの変異である
請求項4に記載の小児固形腫瘍または食道癌の素因の評価方法。
【請求項6】
遺伝子多型の検知に、ダイレクトシークエンス法、BACアレイCGH法、FISH法、RFLP法、PCR−SSCP法、アレル特異的オリゴヌクレオチドハイブリダイゼーション法、TaqMan PCR法、インベーダー法、HRM法、SmartAmp法、Q−probe法(QP法)、MALDI−TOF/MS法、モレキュラービーコン法、RCA法、UCAN法、DNAチップまたはDNAマイクロアレイを用いた核酸ハイブリダイゼーション法のいずれかを用いる
請求項1ないし5のいずれかに記載の小児固形腫瘍または食道癌の素因の評価方法。
【請求項7】
小児固形腫瘍または食道癌を生じ得る素因を有するか否かを評価するキットであって、
被験者のヒト遺伝子を含む試料を用い、ALK遺伝子のA1280V、R1192G、A876T
の少なくともいずれかにおけるSNP、またはそれと連鎖不均衡の関係にある遺伝子多型を検知する手段を備える
ことを特徴とする小児固形腫瘍または食道癌の素因の評価キット。
【請求項8】
小児固形腫瘍または食道癌の治療薬、またはその疾患を生じ得る素因を低減する薬剤の候補物質を選定する方法であって、
試験物質の存在下及び非存在下において哺乳動物細胞を培養する工程と、それぞれの細胞においてチロシンキナーゼの酵素活性の上昇度を測定する工程と、
その酵素活性の上昇を抑制する効果を有する試験物質を候補物質として選定する工程を含む
ことを特徴とする小児固形腫瘍または食道癌の薬剤候補物質選定方法。
【請求項9】
小児固形腫瘍または食道癌、またはその疾患を生じ得る素因を低減する薬剤であって、
チロシンキナーゼの酵素活性の上昇を抑制する効果を有する
ことを特徴とする小児固形腫瘍または食道癌の薬剤。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】




【図2】


【図3】


【図4】


【図5】


【図6】


【公開番号】特開2012−80791(P2012−80791A)
【公開日】平成24年4月26日(2012.4.26)
【国際特許分類】
【出願番号】特願2010−227613(P2010−227613)
【出願日】平成22年10月7日(2010.10.7)
【出願人】(504137912)国立大学法人 東京大学 (1,942)
【Fターム(参考)】
【公開日】平成24年4月26日(2012.4.26)
【国際特許分類】
【出願日】平成22年10月7日(2010.10.7)
【出願人】(504137912)国立大学法人 東京大学 (1,942)
【Fターム(参考)】
[ Back to top ]

