小型マイクロ波温熱治療システム
【課題】MR温度画像により空間的温度分布をモニターするための、小型マイクロ波温熱治療システムの提供。
【解決手段】悪性腫瘍の温熱療法装置システムであって、温度増加をMR温度画像で検知するために、7Tの静磁場強度を使い、42-43℃での温熱療法のモニタリングを可能にし、2.45GHzのマイクロ波ジェネレーターでマイクロ波を照射し、目標領域を目標とされたレベルの温度にコントロールするために、電源スイッチを断続的にオン&オフを繰り返えす機能を担持しする悪性腫瘍の温熱療法装置システム。
【解決手段】悪性腫瘍の温熱療法装置システムであって、温度増加をMR温度画像で検知するために、7Tの静磁場強度を使い、42-43℃での温熱療法のモニタリングを可能にし、2.45GHzのマイクロ波ジェネレーターでマイクロ波を照射し、目標領域を目標とされたレベルの温度にコントロールするために、電源スイッチを断続的にオン&オフを繰り返えす機能を担持しする悪性腫瘍の温熱療法装置システム。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、MR温度画像により空間的温度分布をモニターするための、小型マイクロ波温熱治療システムに関するものである。
【背景技術】
【0002】
最近、様々な最小の侵襲性の治療手段が癌治療に利用可能になり、温熱治療はこれらの治療手段のうちの1つである。しかしながら、そのような療法単独では、すべての癌腫で、必ずしも有効ではなく、集学的治療が必要である。温熱治療は、放射線療法または化学療法の効果を増強するために使用される(非特許文献1)。ランダム化比較試験では、温熱治療は、放射線療法または化学療法との併用において効果的な癌治療として報告されている(非特許文献2)(非特許文献3)(非特許文献4)(非特許文献5)(非特許文献6)。加温技術および温度のモニタリングはこの治療の主な課題である。正確に生体内温度測を測定する事は非常に難しい。生体における温度分布は、一般的に不均一で予測不能である。しかしながら、臨床の正確性および安全性のためには、温熱治療中の温度モニタリングは不可欠である。関心領域だけでなく予測不能のホット・スポット(それらは重大な副作用を引き起こすかもしれない)を回避するために周辺の領域の温度を測定することも重要である。温度測定法には2つのタイプの測温法があり侵襲的・非侵襲的な測温法がある。侵襲的な測温(温度プローブは組織へ刺入される)は多くの問題を引き起こす場合がある。目標部位へのセンサーの正確な刺入は困難であり、プローブの刺入は患者に侵襲的である。また、刺入は腫瘍の出血あるいは播種を引き起こす場合がある(非特許文献7)(非特許文献8)。更に、侵襲的な測温で、多くのポイントで温度の情報を得ることはほとんどできない。1つあるいは限られたいくつかのポイントの温度の情報で、個々の治療計画の立案は困難である。
非侵襲的な測温法として、磁気共鳴(MR)温度画像は有望である。非侵襲的なMR温度画像は、2-次元の画像上の温度変化を示すことができる。MRでの温度モニタリングのためのいくつかの方法がある(非特許文献9)。スピン格子緩和時間(T1)、拡散係数、組織水のプロトン共鳴周波数(PRF)およびスペクトロスコピーイメージングを使用する方法である。温熱治療中のMR温度モニタリングに最もふさわしい方法は、量的で、敏感で、正確であるのでPRF方法である(非特許文献10)。我々は、先に、0.5TのオープンMRシステムで、肝臓腫瘍に対して、MRガイド下マイクロ波熱凝固治療を開発した(非特許文献11)(非特許文献12)(非特許文献13)(非特許文献14)。マイクロ波の照射は、MR画像に影響を与えず、リアルタイムMR温度画像で治療効果をモニターすることができた。MR画像とマイクロ波は相性がよいことが分かった。
【非特許文献1】van der Zee, J. Heating the patient: a promising approach? Ann Oncol 13: 1173-1184, 2002.
【非特許文献2】Overgaard, J., Gonzalez Gonzalez, D., Hulshof, M. C., Arcangeli, G., Dahl, O., Mella, O., and Bentzen, S. M. Randomised trial of hyperthermia as adjuvant to radiotherapy for recurrent or metastatic malignant melanoma. European Society for Hyperthermic Oncology. Lancet 345: 540-543, 1995.
【非特許文献3】van der Zee, J., Gonzalez Gonzalez, D., van Rhoon, G. C., van Dijk, J. D., van Putten, W. L., and Hart, A. A. Comparison of radiotherapy alone with radiotherapy plus hyperthermia in locally advanced pelvic tumours: a prospective, randomised, multicentre trial. Dutch Deep Hyperthermia Group. Lancet 355: 1119-1125, 2000.
【非特許文献4】Vernon, C. C., Hand, J. W., Field, S. B., Machin, D., Whaley, J. B., van der Zee, J., van Putten, W. L., van Rhoon, G. C., van Dijk, J. D., Gonzalez Gonzalez, D., Liu, F. F., Goodman, P., and Sherar, M. Radiotherapy with or without hyperthermia in the treatment of superficial localized breast cancer: results from five randomized controlled trials. International Collaborative Hyperthermia Group. Int J Radiat Oncol Biol Phys 35: 731-744, 1996.
【非特許文献5】Sneed, P. K., Stauffer, P. R., McDermott, M. W., Diederich, C. J., Lamborn, K. R., Prados, M. D., Chang, S., Weaver, K. A., Spry, L., Malec, M. K., Lamb, S. A., Voss, B., Davis, R. L., Wara, W. M., Larson, D. A., Phillips, T. L., and Gutin, P. H. Survival benefit of hyperthermia in a prospective randomized trial of brachytherapy boost +/- hyperthermia for glioblastoma multiforme. Int J Radiat Oncol Biol Phys 40: 287-295, 1998.
【非特許文献6】Kitamura, K., Kuwano, H., Watanabe, M., Nozoe, T., Yasuda, M., Sumiyoshi, K., Saku, M., and Sugimachi, K. Prospective randomized study of hyperthermia combined with chemoradiotherapy for esophageal carcinoma. J Surg Oncol 60: 55-58, 1995.
【非特許文献7】Kato, H., Koyama, T., Nikawa, Y., and Saito, M. Research and development of hyperthermia machines for present and future clinical needs. Int J Hyperthermia 14: 1-11, 1998.
【非特許文献8】Wust, P., Gellermann, J., Harder, C., Tilly, W., Rau, B., Dinges, S., Schlag, P., Budach, V., and Felix, R. Rationale for using invasive thermometry for regional hyperthermia of pelvic tumors. Int J Radiat Oncol Biol Phys 41: 1129-1137, 1998.
【非特許文献9】Quesson, B., de Zwart, J. A., and Moonen, C. T. Magnetic resonance temperature imaging for guidance of thermotherapy. J Magn Reson Imaging 12: 525-533, 2000.
【非特許文献10】Wlodarczyk, W., Hentschel, M., Wust, P., Noeske, R., Hosten, N., Rinneberg, H., and Felix, R. Comparison of four magnetic resonance methods for mapping small temperature changes. Phys Med Biol 44: 607-624, 1999.
【非特許文献11】Morikawa, S., Inubushi, T., Kurumi, Y., Naka, S., Sato, K., Tani, T., Yamamoto, I., and Fujimura, M. MR-guided microwave thermocoagulation therapy of liver tumors: initial clinical experiences using a 0.5 T open MR system. J Magn Reson Imaging 16: 576-583, 2002.
【非特許文献12】Morikawa, S., Inubushi, T., Kurumi, Y., Naka, S., Sato, K., Tani, T., Haque, H. A., Tokuda, J., and Hata, N. New assistive devices for MR-guided microwave thermocoagulation of liver tumors. Acad Radiol 10: 180-188, 2003.
【非特許文献13】Morikawa, S., Inubushi, T., Kurumi, Y., Naka, S., Sato, K., Demura, K., Tani, T., Haque, H. A., Tokuda, J., and Hata, N. Advanced computer assistance for magnetic resonance-guided microwave thermocoagulation of liver tumors. Acad Radiol 10: 1442-1449, 2003.
【非特許文献14】Abe, H., Kurumi, Y., Naka, S., Shiomi, H., Umeda, T., Naitoh, H., Endo, Y., Hanasawa, K., Morikawa, S., and Tani, T. Open-configuration MR-guided microwave thermocoagulation therapy for metastatic liver tumors from breast cancer. Breast Cancer 12: 26-31, 2005.
【非特許文献15】Peters,R.D.,Hinks,R.S.,andHenkelman,R.M.Exvivotissue-typeindependenceinproton-resonancefrequencyshiftMRthermometry.MagnResonMed40:454-459,1998.
【非特許文献16】Bland,J.M.,andAltman,D.G.Statisticalmethodsforassessingagreementbetweentwomethodsofclinicalmeasurement.Lancet1:307-310,1986.
【非特許文献17】Morikawa,S.,Inubushi,T.,Kurumi,Y.,andNaka,S.FesibilityofmicrowaveablationforMR-Guidedinterstitialthermaltherapy:anexperimentalstudyusing2TMRsystem.JpnJMagnResonMed21:79-84,2001.
【非特許文献18】Oleson,J.R.,Samulski,T.V.,Leopold,K.A.,Clegg,S.T.,Dewhirst,M.W.,Dodge,R.K.,andGeorge,S.L.Sensitivityofhyperthermiatrialoutcomestotemperatureandtime:implicationsforthermalgoalsoftreatment.IntJRadiatOncolBiolPhys25:289-297,1993.
【非特許文献19】Kapp,D.S.,andCox,R.S.Thermaltreatmentparametersaremostpredictiveofoutcomeinpatientswithsingletumornodulespertreatmentfieldinrecurrentadenocarcinomaofthebreast.IntJRadiatOncolBiolPhys33:887-899,1995.
【非特許文献20】Engin,K.,Leeper,D.B.,Tupchong,L.,andWaterman,F.M.Thermoradiotherapyinthemanagementofsuperficialmalignanttumors.ClinCancerRes1:139-145,1995.
【非特許文献21】Leopold,K.A.,Dewhirst,M.W.,Samulski,T.V.,Dodge,R.K.,George,S.L.,Blivin,J.L.,Prosnitz,L.R.,andOleson,J.R.CumulativeminuteswithT90greaterthanTempindexispredictiveofresponseofsuperficialmalignanciestohyperthermiaandradiation.IntJRadiatOncolBiolPhys25:841-847,1993.
【非特許文献23】Delannoy,J.,LeBihan,D.,Hoult,D.I.,andLevin,R.L.Hyperthermiasystemcombinedwithamagneticresonanceimagingunit.MedPhys17:855-860,1990.23.Fajardo,L.F.Pathologicaleffectsofhyperthermiainnormaltissues.CancerRes44:4826s-4835s,1984.
【非特許文献24】Wondergem,J.,Haveman,J.,Rusman,V.,Sminia,P.,andVanDijk,J.D.Effectsoflocalhyperthermiaonthemotorfunctionoftheratsciaticnerve.IntJRadiatBiolRelatStudPhysChemMed53:429-438,1988.
【非特許文献25】Fenn,A.J.,Wolf,G.L.,andFogle,R.M.Anadaptivemicrowavephasedarrayfortargetedheatingofdeeptumoursinintactbreast:animalstudyresults.IntJHyperthermia15:45-61,1999.
【非特許文献26】Hamazoe,R.,Maeta,M.,andKaibara,N.Intraperitonealthermochemotherapyforpreventionofperitonealrecurrenceofgastriccancer.Finalresultsofarandomizedcontrolledstudy.Cancer73:2048-2052,1994.
【非特許文献27】Zanon,C.,Clara,R.,Bortolini,M.,Malossi,A.,Moscato,R.,Celoria,P.,deAndrea,M.,Rizzo,M.,Chiappino,I.,GraziaSciuto,M.,andMussa,A.Chemohyperthermiaforadvancedabdominalmalignancies:anewprocedurewithclosedabdomenandpreviouslyperformedanastomosis.IntJHyperthermia17:456-464,2001.
【非特許文献28】Yonemura,Y.,deAretxabala,X.,Fujimura,T.,Fushida,S.,Katayama,K.,Bandou,E.,Sugiyama,K.,Kawamura,T.,Kinoshita,K.,Endou,Y.,andSasaki,T.Intraoperativechemohyperthermicperitonealperfusionasanadjuvanttogastriccancer:finalresultsofarandomizedcontrolledstudy.Hepatogastroenterology48:1776-1782,2001.
【非特許文献29】Yonemura,Y.,Fujimura,T.,Nishimura,G.,FallaR,Sawa,T.,Katayama,K.,Tsugawa,K.,Fushida,S.,Miyazaki,I.,Tanaka,M.,Endou,Y.,andSasaki,T.Effectsofintraoperativechemohyperthermiainpatientswithgastriccancerwithperitonealdissemination.Surgery119:437-444,1996.
【非特許文献30】Yonemura,Y.,Fujimura,T.,Fushida,S.,Takegawa,S.,Kamata,T.,Katayama,K.,Kosaka,T.,Yamaguchi,A.,Miwa,K.,andMiyazaki,I.Hyperthermo-chemotherapycombinedwithcytoreductivesurgeryforthetreatmentofgastriccancerwithperitonealdissemination.WorldJSurg15:530-535;discussion535-536,1991.
【発明の開示】
【発明が解決しようとする課題】
【0003】
温熱療法は癌における集学的治療の一つとして、用いられてきた。そして、無作為化された、比較試験において、温熱療法は効果的な癌治療であることを確認した。しかしながら、臨床の正確性および安全性のためには、治療中の温度モニタリングは不可欠である。我々は、その効果と安全性を改善するために、空間的リアルタイム温度モニタリングを使った簡便なマイクロ波温熱治療システムを開発した。
【課題を解決するための手段】
【0004】
MR対応の照射型マイクロ波アプリケータを使い、寒天ファントム、ウサギの大腿筋肉およびウサギの皮下VX2腫瘍に対して、非侵襲性のMR温度画像を利用して加熱した。MR温度計算については、プロトン共鳴周波数を用いた位相差法を使用した。温度係数の決定、およびMR温度測定の正確性の評価の後、時間経過によるマイクロ波加熱によるの温度分布を各対象について検討した。ファントム、ウサギ筋肉およびVX2腫瘍の温度係数は、それぞれ-0.00977、-0.00976および-0.01027ppm/℃であった。3つの対象におけるMRと光学温度計の95%信頼区間は、それぞれ+0.318℃/0.339℃、+0.693℃/0.661℃および+0.564℃/0.526℃であった。VX2腫瘍に関して、平均腫瘍温度は42.60℃±0.14℃であった。また、皮膚の表面は60分の実験において43.27℃±0.45℃であった。
【発明の効果】
【0005】
この使用簡便なマイクロ波温熱治療システムで、効果的な温熱治療が、ファントム及び生動物で、MR温度画像を利用して施行された。
【発明を実施するための最良の形態】
【0006】
本発明は、悪性腫瘍の温熱療法装置システムである。本発明の特徴は、悪性腫瘍の温熱療法を行うための加熱装置と加熱による温度変化をモニタリングする装置を合体したことにある。加熱による温度変化をモニタリングする装置は、温度増加をMR温度画像で検知することが可能な手段を含み、磁場の強さは、0.5〜9T、好ましくは1.5〜9T、より好ましくは6〜9Tの静磁場強度を備えた装置である。これにより42-43℃での温熱療法のモニタリングを可能にした。加熱は、マイクロ波ジェネレーターでマイクロ波を照射して行う。0.4〜3GHz、好ましくは1.0〜2.8GHz、より好ましくは1.5〜2.5GHzのマイクロ波ジェネレーターでマイクロ波を照射する。照射は、連続的に行うのではなく、断続的に行う。これにより、目標領域を目標とされたレベルの温度にコントロールすることが達成可能である。断続的に加温するために、電源スイッチを断続的にオン&オフを繰り返えす機能をマイクロ波ジェネレーターは担持する。
【実施例】
【0007】
材料と方法
対象
実験のプロトコルは、滋賀医科大学動物実験委員会によって検討され承認された。ファントム実験において、寒天ファントム(120×120×50mm3)は、2%の寒天、0.25mMGd-DTPA、0.9%NaClおよび0.05%NaN3で調製された。動物実験において、10羽のオスのNew Zealand White rabbitsが利用された。6羽のウサギに対し、0.4mLリン酸緩衝液溶液中5.0×106VX2腫瘍細胞を、大腿に皮下注射した。腫瘍は、2週間で直径10-20mmまで成長した。寒天ファントム、未処理ウサギ大腿筋肉、及び大腿皮下腫瘍腫瘍が、実験に使用された。温度係数値を決定、かつMR温度画像の正確さを評価するために、各グループ(大腿筋肉および皮下腫瘍)で一匹の動物が使用された。また、他の動物はマイクロ波温熱治療中に温度分布の検討に使用された。
【0008】
装置の調製
2種類のMR-対応照射タイプのマイクロ波アプリケータは非磁性体を使用して作成した。通常では、100×100×70mm3反射板(ダイポールタイプ(図1A))の中に半波長(60mm)の双極アンテナをセットされたものを使用した。アンテナと反射器の間の距離は定在波比(SWR)を最小化するために最適化された。局所的な小さな領域を温熱化するためには、60×90mm2のスロット・アンテナを備えたアプリケータ(スロット・タイプ(図1B))を作成した。アプリケータは、長さ4mの同軸ケーブルを用いMR室の隣に設置した0.4〜3GHz(2.45)GHzのマイクロ波ジェネレーターMicrotazeOT110M(AlfresaPharma、大阪(日本))に接続された(非特許文献11)。このマイクロ波ジェネレーターは、連続的および間欠モードで利用可能である。間欠モードでは、2秒の電源オンおよび2秒の電源オフが、交互に繰り返される。温熱治療のためには、通常、60-110Wの出力で間欠的に適用された。対象の絶対温度を測定するために、光学温度計、モデル3100(Luxtron、サンタクララ(CA))が使用された。直径0.3mmの温度計が20Gのテフロン(登録商標)針によって刺入された。40cmの開口径をもつ超伝導電磁石〔0.5〜9T/400mm(7.0T/400mm)の/SS(JASTEC、神戸(日本))〕と、0.5〜9T(7.0T)のMRスキャナー〔UnityInova(バリアン(パロアルト(CA)))〕を用い、グラディエントエコー・シーケンスを用いたMRデータを収集した。相対的な温度変化は温度依存性の水の信号のケミカルシフトから計算される(非特許文献9)。グラディエントエコーを用いると、echo時間の間に位相差によって生じるケミカルシフトが生じる。
温度係数αは、約-0.01ppm/℃であると報告されているが、対象に依存して変わりうる(非特許文献15)。寒天ファントム、ウサギ大腿筋肉および皮下の腫瘍に対する温度係数(α)の値は、光学温度計での温度、およびサーマル・プローブのまわりの5×5ピクセル中の1HMR信号の平均の位相シフトと比較することにより個々に決定された。2つの値のピアソンの積率相関係数によって評価された。個々の温度係数で、MR温度画像は計算された。光学温度計のMR温度画像への95%信頼区間は、Bland-Altman plotで平均±1.96SDと定義された(非特許文献16)。
【0009】
ファントム実験
ダイポールタイプ・マイクロ波アプリケータは、磁石中の寒天ファントムに設置された。ファントムのグラディエントエコー・イメージは、20ミリセカンドの繰り返し時間(TR)、8ミリセカンドのエコー時間(TE)、20°フリップ角および3mmのスライス厚さ、視界域150×150mm2(FOV)、128×128マトリックスおよび積算回数1回で得られた。1つのイメージの所要時間はデータの保存のための時間を含め4.8秒であった。温度増加は寒天ファントムのα値を使い計算され、リアルタイムMR温度画像は、外部コンピューターに表示された。ベース・ライン温度(室温)は体温(36.5℃)より低かったが、深さ10mmのエリアでの温度増加は5.5℃から6.5℃までの範囲でコントロールされた。それは動物の42-43℃に相当する。我々は、マイクロ波ジェネレーターの電源スイッチのオン&オフの時期を決めるためにMR温度画像を参照した。
【0010】
未処理大腿筋肉に関する動物実験
動物は、自発呼吸を保ったまま、フェースマスクによって、50%O2および50%N2の3%isofluraneで麻酔処置をした。ウサギの大腿の毛を剃った。温度計は体表面からの深さ10mmの領域へ刺入された。ダイポールタイプ・マイクロ波アプリケータは大腿に設置された。体温を維持するために、他の身体各部は毛布で覆った。ウサギ大腿筋肉のグラディエントエコー・イメージは、20ミリセカンドのTR、8ミリセカンドのTE、20°フリップ角、3mmのスライス厚さ、200×200mm2FOV、256×256マトリックスおよび積算回数1回で得られた。1つのイメージの所要時間はデータの保存のための時間を含み8.2秒であった。温度は、ファントム実験と同様に、筋肉のα値を使い計算された。目標の温度増加は、温度計によるベースライン絶対温度から、42-43℃の差から決定された。マイクロ波ジェネレーターは、MR温度画像中の深さ10mmのエリアでの温度増加を参照することにより調節された。
【0011】
皮下注入のVX2腫瘍に関する動物実験
動物は未処置大腿筋肉の実験と同様に準備された。本実験では、スロット・タイプ・アプリケータは局所的な腫瘍領域だけを熱するために使用された。光学温度計は腫瘍の中心に刺入された。腫瘍の1HMR信号レベルが、大腿筋肉での獲得パラメーターのように低かったので、腫瘍のグラディエントエコー・イメージは、40ミリセカンドのTR、6ミリセカンドのTE、40°フリップ角、3mmのスライス厚さ、150×150mm2FOV、128×128マトリックスおよび積算回数2回で得られた。1つのイメージの獲得時間はデータの保存のための時間を含み12.5秒であった。マイクロ波ジェネレーターは、MR温度画像中の腫瘍での温度増加を参照することによりコントロールされた。他の実験条件は未処置大腿筋肉用のものと同じであった。
【0012】
結果
ファントム実験
マイクロ波放射中に、MRイメージにはノイズは出現しなかった。光学温度計で測定された温度変化とグラディエントエコー・イメージの位相シフトの関係は、図2Aで示した。2つの値の間の相関性は良かった(相関係数(r)=0.997、P<0.0001)。また、回帰直線の傾斜は8ミリセカンドのTEで、-8.444°位相シフト/℃であり、それは温度係数、α、-0.00977ppm/℃に相当した。このα値を使用して計算されたMR温度画像による温度増加を、光学温度計による温度増加と比較した。2つの測定方法のBland-Altman plotsを図2Bに示した。2つの測定法の平均誤差は-0.0106±0.168℃(平均±SD)であり、また、95%信頼区間は+0.318/‐0.339℃であった。Bland-Altman plotsは、典型的な系統的なバイアスのパターンにはあてはまらなかった。
MR温度画像の正確さおよび信頼度の評価の後、ダイポールタイプ・マイクロ波アプリケータによるマイクロ波加熱の様々な条件を検討した。最初に、ファントムは連続モードの中で110Wで加熱された。表面は速く加熱されたが、深い部分は加熱されなかった。深さ10mmのエリアの温度増加が5.5-6.5℃で維持された時、表面は15℃以上で加熱された。また、深さ20mmのエリアは3℃未満に加熱された。その後、出力パワーは連続モードで30Wにまで減少させた。しかし、表面の最高温度増加は、なお11℃であった。60Wの間欠モードでは、深さ10mmのエリアで目標温度に達するのにおよそ10分必要であった。しかし、表面での温度は8℃以内に抑えられた。また、深さ20mmのエリアは4℃以上であった。この条件を使用して、加熱した寒天ファントムのMR温度画像は、図3に示した。目標領域から温度差が1℃未満の領域は、横断方向で約60mmおよび垂直方向に約20mmであった。加熱中心のまわりで、放射状に1℃単位で広がる温度の空間分布が、明白に示された。
【0013】
未処置大腿筋肉に関する動物実験
ファントム実験の結果と同様に、光学温度計で測定された温度変化とグラディエントエコー・イメージの位相シフト間の関係を、未処置ウサギ大腿筋肉で検討した(図2C)。2つの間の相関性は重要であった(r=0.966、P<0.0001)。また、回帰直線の傾斜は8ミリセカンドのTEで-8.435°位相シフト/℃であった。それは温度係数、α、-0.00976ppm/℃に相当した。このα値を使用する温度計算の結果は、Bland-Altman plot(図2D)を使用する、光学温度計による値と比較した。2つの測定での平均差は+0.0160±0.345℃であった。95%信頼区間は+0.693/‐0.661℃であった。大腿筋肉は間欠モードを使用して、80Wで加熱された。大腿筋肉の代表的な温度画像は図4に示した。3匹のウサギを使い、中央の位置の表面、深さ10mmのエリアおよび深さ20mmのエリア、および、中央から20mm離れた表面の温度変化(5分ごとの平均±SD)を図5に示した。深さ10mmのエリアで、42-43℃の目標温度への増加は5分で達成された。表面の温度は、44℃未満で維持され、ほぼ深さ1cmのエリアより1℃高かった。深さ20mmのエリアでの温度は、表面および深さ10mmのエリアの温度が定常状態にあった時でも、徐々に高くなっていった。10mmおよび20mmのエリア間の温度差は、30分間の実験時間の終わりで1℃未満であった。
【0014】
皮下注入VX2腫瘍に関する動物実験
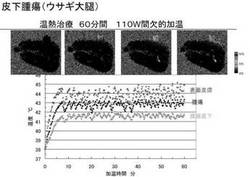
スロット・タイプ・マイクロ波アプリケータを、皮下VX2腫瘍を加熱するために使用した。光学温度計で測定された温度変化とグラディエントエコー・イメージの位相シフトの間の相関性は良かった(r=0.887、P<0.0001)(図2E)。また、回帰直線の傾斜は6ミリセカンドのTEで-6.658°位相シフト/℃であった。それは温度係数、α、-0.01027ppm/℃に相当した。Bland-Altman plot(図2F)は、2つの測定での平均差が、+0.0192±0.272℃であることを示した。また、95%信頼区間は+0.564/‐0.526℃であった。5羽のウサギの腫瘍に対して、間欠モードを使用して、110Wで加熱された。また、腫瘍の温度は、42-43℃に1時間維持された。加熱の間の代表的な温度画像は、図6に示した。腫瘍の領域だけが選択的に加熱された。1羽のウサギの腫瘍領域と同様に腫瘍の下部及び表面上の温度変化を、図7に示した。腫瘍の大部分の温度は、1時間の実験中、ほぼ目標温度に維持された。5羽のウサギの腫瘍全体の温度評価をするため、様々な温度域での経過時間、そして、目標温度レベルに達した後に、腫瘍の平均、最大、最小温度を表1に要約した。腫瘍の温度は、治療の期間の80%以上の間、42-43℃に維持された。他方、表2に示すように、表面の温度は60分の実験において8.7分間だけ44℃を超過した。皮膚の明らかな熱傷はいずれのウサギでも観察されなかった。
【表1】

【表2】

【0015】
発明の効果
温熱療法中の、小さな温度増加をMR温度画像で検知するために、本検討は0.5〜9T(7T)の静磁場強度をもつMRで実験された。それは臨床のMRスキャナよりもはるかに高い静磁場強度である。7Tにおける1H信号の共鳴周波数は300MHzである。高磁場のシステムは、よい信号対ノイズ比をもつMR信号を得ることができる。また、高い共鳴周波数は温度依存の位相シフトを検知するのに有利である。寒天ファントム、ウサギ大腿筋肉および皮下腫瘍において、光学温度計で測定された温度変化と、グラディエントエコー・イメージの位相シフトは、非常によく相関した。これらの対象の、測定された温度係数価値、α(温度依存の水の化学シフト)は、以前の報告と矛盾のない値であった(非特許文献15)。光学温度計とMR検温の間の95%信頼区間は、Bland-Altman plotによって、それぞれファントム、未処置筋肉および皮下腫瘍において、+0.318/‐0.339℃、+0.693/‐0.661℃および+0.564/‐0.526℃であった。7Tの静磁場での温度測定の正確さおよび信頼度は、42-43℃の温熱療法のモニタリングにおいて十分であった。そして、我々は先の0.5Tでの結果(非特許文献11)(非特許文献13)及び2TMRシステムでの結果(非特許文献17)よりよい結果をえた。しかしながら、生動物での、MR温度画像の正確性は、ファントムでの場合よりわずかに低かった。PRF法でのMR温度計算は様々な要因に影響されるかもしれない。それらの中でも、温度は加温中のイメージとベース・ライン・イメージとの差によって計算されるので、対象物の移動は重要である。本検討では、10℃未満の温度変化は、MR信号の位相シフトのわずかな差から計算された。動物の動きは、イメージ平面での動きだけでなく他の部分の動きでも、イメージ平面上の静磁場に影響するかもしれないので、問題を引き起こす場合がある。
温熱治療中の温度モニタリングは有効で安全な治療を遂行するために必要不可欠な問題である。温熱凝固療法と凍結療法のような他の熱治療手段と異なって、温熱療法は、組織の熱反応を直ちに引き起こさない。医者は意図した反応を見ることができず、重大な副作用を見逃すかもしれない。腫瘍が内部の数点の測定ポイントだけでさえ、より正確に加熱された時、治療結果がよかったことが報告されている(非特許文献8)(非特許文献18)(非特許文献19)(非特許文献20)(非特許文献21)。したがって、腫瘍全体の非侵襲性で信頼できる温度モニタリングは、この治療効果の改善において重要な役割を果たす。加藤ら(非特許文献7)は、±2℃誤差での腫瘍の温度測定は、臨床医が温熱療法の状態をモニターするのに有用であることを報告した。この観点から、MR温度モニタリングは十分にこの治療を支援することができる。
0.4〜3GHz(2.45GHz)のマイクロ波ジェネレーターは、照射中においてさえフィルタあるいは特別な回路を使用せずとも、300MHzで受信したMR画像に影響をあたえなかった。目標とされたレベルに温度をコントロールするために、電源スイッチを断続的にオン&オフを繰り返したが、ノイズはMR画像に現われず、スイッチのオン&オフでイメージを区別できなかった。他方で、温熱治療においてラジオ波(RF)加温は、マイクロ波加熱よりポピュラーである。しかしながら、RF照射は、MR画像に重大な影響を与える。通常RF温熱治療とMR温度測定を同時施行するためには、タイムシェアする回路か周波数フィルタのような装置が必要である(非特許文献22)。マイクロ波加熱はMR温度画像を用いる場合、RF温熱治療より適していると思われた。
我々は、マイクロ波加熱のために2つのタイプのアプリケータを作成した。これらのアプリケータで、深さ10mmのエリアでの温熱治療のための効果的な加熱が得られた。温度は、MR温度画像のモニターにより目標レベルによく維持された。皮膚の熱傷を回避するために皮膚表面の温度をモニターしなければならない。深さ10mmのエリアでの寒天ファントムを、連続モードで、5.5-5.6℃に加熱すると、表面温度は高温になりすぎた。間欠モードを使用すると、表面を加熱しすぎることなく、より深いエリアは加熱することができる。熱は、より深いエリアへ熱分散し、また、マイクロ波放射のオフの間、表面が冷却される。
標準のダイポールタイプ・アプリケータを用いると、大腿筋肉の深さ10mmのエリアを、42-43℃に維持しても、表面温度は44℃以下に維持された。スロット・タイプ・アプリケータでは、直径10-20mmの腫瘍の領域が選択的に加温された。断続的なマイクロ波照射での60分間治療の約45分間の間、腫瘍の温度は約42-43℃に維持された。他方、表面の温度はほとんど44℃以下であった。そして、44℃以上の時間は、60minの治療期間の9分間であった。皮膚を含むほとんどの正常組織は、44℃以下では1h間加温されても損傷を受けない、と報告がある(非特許文献23)。より熱に敏感な神経系に関して、44℃での30分以上の末梢神経の加温(あるいは等価な「加温」)は、一時的な機能障害をおこすが、それは4週間以内に回復する(非特許文献24)。皮膚表面の過剰加熱は、冷却剤によって防止できる。しかし、厚い冷却剤は、深い組織へのマイクロ波による加熱を妨害する。水を循環させると、MR温度測定の正確さを減少させる。気流による冷却は本発明のシステムに有効であるかも知れない(非特許文献25)。
加熱のための我々のマイクロ波アプリケータは従来の温熱療法システムと比較して小さく手軽である。局所的な温熱治療は乳癌などで行なわれてきた。我々は、このシステムを手術時の温熱治療療法に使用する可能性を考慮している。持続温熱腹膜潅流法は、今はいくつかの設備で行なわれている。ほとんどの場合、それは化学療法と併用して使用されている。それは、腹膜播種にはある程度まで有効である(非特許文献26)(非特許文献27)(非特許文献28)。しかし、2mmを超える病変には効果はわずかである(非特許文献29)。循環水の温度はコントロールされるが、組織の実際の温度増加はモニターされていない。腹膜の表面から1あるいは2mmのみのエリアを加熱することはできるかもしれない(非特許文献30)。組織が正確に加熱される場合は、術中温熱治療は遺残腫瘍にも有効かもしれない。マイクロ波加熱では、より多くの水を含んでいる腫瘍細胞は脂肪組織以上に加熱されるので、脂肪組織にうもれている腫瘍細胞に有効かもしれない。さらなる検討は必要であるが、MR温度画像により空間的温度分布をモニターする小型マイクロ波温熱治療システムは、低侵襲治療において有望な治療法になるかもしれない。
【図面の簡単な説明】
【0016】
【図1】MR・互換・放射タイプの・マイクロ波アプリケータ、双極子タイプ(A)およびスロット・タイプ(B)。(A)長さ60mmのダイポールアンテナは反射器に位置する。(B)60×90mmの2スロット・アンテナは反射器で構築した。
【図2A】寒天ファントムでの光学温度計で測定された温度変化と、グラディエントエコー・イメージ中の1H信号の位相シフトの間の線形回帰ラインを備えた散布図。
【図2B】寒天ファントムでの光学温度計およびMR温度計で測定された温度のBland-Altman plot。Y軸は、2つの方法(MR-光学温度計)間の違いを示す。また、X軸は、2つの中間を示す。平均差は点線で示した。また、95%信頼区間は固体のラインで示した。
【図2C】ウサギ大腿筋での光学温度計で測定された温度変化と、グラディエントエコー・イメージ中の1H信号の位相シフトの間の線形回帰ラインを備えた散布図。
【図2D】ウサギ大腿筋での光学温度計およびMR温度計で測定された温度のBland-Altman plot。Y軸は、2つの方法(MR-光学温度計)間の違いを示す。また、X軸は、2つの中間を示す。平均差は点線で示した。また、95%信頼区間は固体のラインで示した。
【図2E】皮下腫瘍での光学温度計で測定された温度変化と、グラディエントエコー・イメージ中の1H信号の位相シフトの間の線形回帰ラインを備えた散布図。
【図2F】皮下腫瘍での光学温度計およびMR温度計で測定された温度のBland-Altman plot。Y軸は、2つの方法(MR-光学温度計)間の違いを示す。また、X軸は、2つの中間を示す。平均差は点線で示した。また、95%信頼区間は固体のラインで示した。
【図3A】双極子タイプ・アプリケータで熱した寒天ファントムの代表的なMR温度画像。温度増加は右側の色分けされた目盛りの中で示した。アローは、アプリケータから熱くなる方向を示す。
【図3B】寒天ファントムでの実験(マイクロ波出力 110W 連続加温での加温時間と上昇温度の各部位で結果(表面、深部1cm、深部2cm、深部3cm、表面3cm横、表面2cm横)
【図3C】寒天ファントムでの実験(マイクロ波出力 30W 連続加温での加温時間と上昇温度の各部位で結果(表面、深部1cm、深部2cm、深部3cm、表面3cm横、表面2cm横)
【図3D】寒天ファントムでの実験(マイクロ波出力 60W 間欠加温(2秒オン、2秒オフ)での加温時間と上昇温度の各部位で結果(表面、深部1cm、深部2cm、深部3cm、表面3cm横、表面2cm横)
【図4】大腿筋肉の代表的なMR画像および温度画像は双極子タイプ・アプリケータで熱くなった。加熱の温度増加および方向は図3と同様に示した。マイクロ波出力 80W 30分間 間欠加温(2秒オン、2秒オフ)での加温時間と上昇温度の各部位で結果(表面中心、中心深部1cm、中心深部2cm、表面横2cm)
【図5】中央の位置の表面(×)、深さ10mm(◆)および深さ(□)20mmのエリア、そして中心(○)から20mm離れた表面の温度の連続変化。3羽のウサギ(A)、(B)、そして(C)について調べた。値は5分ごとに平均±SDで示した。
【図6】VX2の皮下の腫瘍の代表的なMR画像および温度画像は、スロット・タイプ・アプリケータで熱くなった。暖房の温度増加および方向は図3と同様に示した。
【図7】ウサギの腫瘍(◆)、表面(×)、及びの腫瘍直下(□)の温度の連続変化(表1および2の実験1)。出力パワーは、腫瘍(◆)の温度を42-43℃に維持するようにコントロールされた。
【技術分野】
【0001】
本発明は、MR温度画像により空間的温度分布をモニターするための、小型マイクロ波温熱治療システムに関するものである。
【背景技術】
【0002】
最近、様々な最小の侵襲性の治療手段が癌治療に利用可能になり、温熱治療はこれらの治療手段のうちの1つである。しかしながら、そのような療法単独では、すべての癌腫で、必ずしも有効ではなく、集学的治療が必要である。温熱治療は、放射線療法または化学療法の効果を増強するために使用される(非特許文献1)。ランダム化比較試験では、温熱治療は、放射線療法または化学療法との併用において効果的な癌治療として報告されている(非特許文献2)(非特許文献3)(非特許文献4)(非特許文献5)(非特許文献6)。加温技術および温度のモニタリングはこの治療の主な課題である。正確に生体内温度測を測定する事は非常に難しい。生体における温度分布は、一般的に不均一で予測不能である。しかしながら、臨床の正確性および安全性のためには、温熱治療中の温度モニタリングは不可欠である。関心領域だけでなく予測不能のホット・スポット(それらは重大な副作用を引き起こすかもしれない)を回避するために周辺の領域の温度を測定することも重要である。温度測定法には2つのタイプの測温法があり侵襲的・非侵襲的な測温法がある。侵襲的な測温(温度プローブは組織へ刺入される)は多くの問題を引き起こす場合がある。目標部位へのセンサーの正確な刺入は困難であり、プローブの刺入は患者に侵襲的である。また、刺入は腫瘍の出血あるいは播種を引き起こす場合がある(非特許文献7)(非特許文献8)。更に、侵襲的な測温で、多くのポイントで温度の情報を得ることはほとんどできない。1つあるいは限られたいくつかのポイントの温度の情報で、個々の治療計画の立案は困難である。
非侵襲的な測温法として、磁気共鳴(MR)温度画像は有望である。非侵襲的なMR温度画像は、2-次元の画像上の温度変化を示すことができる。MRでの温度モニタリングのためのいくつかの方法がある(非特許文献9)。スピン格子緩和時間(T1)、拡散係数、組織水のプロトン共鳴周波数(PRF)およびスペクトロスコピーイメージングを使用する方法である。温熱治療中のMR温度モニタリングに最もふさわしい方法は、量的で、敏感で、正確であるのでPRF方法である(非特許文献10)。我々は、先に、0.5TのオープンMRシステムで、肝臓腫瘍に対して、MRガイド下マイクロ波熱凝固治療を開発した(非特許文献11)(非特許文献12)(非特許文献13)(非特許文献14)。マイクロ波の照射は、MR画像に影響を与えず、リアルタイムMR温度画像で治療効果をモニターすることができた。MR画像とマイクロ波は相性がよいことが分かった。
【非特許文献1】van der Zee, J. Heating the patient: a promising approach? Ann Oncol 13: 1173-1184, 2002.
【非特許文献2】Overgaard, J., Gonzalez Gonzalez, D., Hulshof, M. C., Arcangeli, G., Dahl, O., Mella, O., and Bentzen, S. M. Randomised trial of hyperthermia as adjuvant to radiotherapy for recurrent or metastatic malignant melanoma. European Society for Hyperthermic Oncology. Lancet 345: 540-543, 1995.
【非特許文献3】van der Zee, J., Gonzalez Gonzalez, D., van Rhoon, G. C., van Dijk, J. D., van Putten, W. L., and Hart, A. A. Comparison of radiotherapy alone with radiotherapy plus hyperthermia in locally advanced pelvic tumours: a prospective, randomised, multicentre trial. Dutch Deep Hyperthermia Group. Lancet 355: 1119-1125, 2000.
【非特許文献4】Vernon, C. C., Hand, J. W., Field, S. B., Machin, D., Whaley, J. B., van der Zee, J., van Putten, W. L., van Rhoon, G. C., van Dijk, J. D., Gonzalez Gonzalez, D., Liu, F. F., Goodman, P., and Sherar, M. Radiotherapy with or without hyperthermia in the treatment of superficial localized breast cancer: results from five randomized controlled trials. International Collaborative Hyperthermia Group. Int J Radiat Oncol Biol Phys 35: 731-744, 1996.
【非特許文献5】Sneed, P. K., Stauffer, P. R., McDermott, M. W., Diederich, C. J., Lamborn, K. R., Prados, M. D., Chang, S., Weaver, K. A., Spry, L., Malec, M. K., Lamb, S. A., Voss, B., Davis, R. L., Wara, W. M., Larson, D. A., Phillips, T. L., and Gutin, P. H. Survival benefit of hyperthermia in a prospective randomized trial of brachytherapy boost +/- hyperthermia for glioblastoma multiforme. Int J Radiat Oncol Biol Phys 40: 287-295, 1998.
【非特許文献6】Kitamura, K., Kuwano, H., Watanabe, M., Nozoe, T., Yasuda, M., Sumiyoshi, K., Saku, M., and Sugimachi, K. Prospective randomized study of hyperthermia combined with chemoradiotherapy for esophageal carcinoma. J Surg Oncol 60: 55-58, 1995.
【非特許文献7】Kato, H., Koyama, T., Nikawa, Y., and Saito, M. Research and development of hyperthermia machines for present and future clinical needs. Int J Hyperthermia 14: 1-11, 1998.
【非特許文献8】Wust, P., Gellermann, J., Harder, C., Tilly, W., Rau, B., Dinges, S., Schlag, P., Budach, V., and Felix, R. Rationale for using invasive thermometry for regional hyperthermia of pelvic tumors. Int J Radiat Oncol Biol Phys 41: 1129-1137, 1998.
【非特許文献9】Quesson, B., de Zwart, J. A., and Moonen, C. T. Magnetic resonance temperature imaging for guidance of thermotherapy. J Magn Reson Imaging 12: 525-533, 2000.
【非特許文献10】Wlodarczyk, W., Hentschel, M., Wust, P., Noeske, R., Hosten, N., Rinneberg, H., and Felix, R. Comparison of four magnetic resonance methods for mapping small temperature changes. Phys Med Biol 44: 607-624, 1999.
【非特許文献11】Morikawa, S., Inubushi, T., Kurumi, Y., Naka, S., Sato, K., Tani, T., Yamamoto, I., and Fujimura, M. MR-guided microwave thermocoagulation therapy of liver tumors: initial clinical experiences using a 0.5 T open MR system. J Magn Reson Imaging 16: 576-583, 2002.
【非特許文献12】Morikawa, S., Inubushi, T., Kurumi, Y., Naka, S., Sato, K., Tani, T., Haque, H. A., Tokuda, J., and Hata, N. New assistive devices for MR-guided microwave thermocoagulation of liver tumors. Acad Radiol 10: 180-188, 2003.
【非特許文献13】Morikawa, S., Inubushi, T., Kurumi, Y., Naka, S., Sato, K., Demura, K., Tani, T., Haque, H. A., Tokuda, J., and Hata, N. Advanced computer assistance for magnetic resonance-guided microwave thermocoagulation of liver tumors. Acad Radiol 10: 1442-1449, 2003.
【非特許文献14】Abe, H., Kurumi, Y., Naka, S., Shiomi, H., Umeda, T., Naitoh, H., Endo, Y., Hanasawa, K., Morikawa, S., and Tani, T. Open-configuration MR-guided microwave thermocoagulation therapy for metastatic liver tumors from breast cancer. Breast Cancer 12: 26-31, 2005.
【非特許文献15】Peters,R.D.,Hinks,R.S.,andHenkelman,R.M.Exvivotissue-typeindependenceinproton-resonancefrequencyshiftMRthermometry.MagnResonMed40:454-459,1998.
【非特許文献16】Bland,J.M.,andAltman,D.G.Statisticalmethodsforassessingagreementbetweentwomethodsofclinicalmeasurement.Lancet1:307-310,1986.
【非特許文献17】Morikawa,S.,Inubushi,T.,Kurumi,Y.,andNaka,S.FesibilityofmicrowaveablationforMR-Guidedinterstitialthermaltherapy:anexperimentalstudyusing2TMRsystem.JpnJMagnResonMed21:79-84,2001.
【非特許文献18】Oleson,J.R.,Samulski,T.V.,Leopold,K.A.,Clegg,S.T.,Dewhirst,M.W.,Dodge,R.K.,andGeorge,S.L.Sensitivityofhyperthermiatrialoutcomestotemperatureandtime:implicationsforthermalgoalsoftreatment.IntJRadiatOncolBiolPhys25:289-297,1993.
【非特許文献19】Kapp,D.S.,andCox,R.S.Thermaltreatmentparametersaremostpredictiveofoutcomeinpatientswithsingletumornodulespertreatmentfieldinrecurrentadenocarcinomaofthebreast.IntJRadiatOncolBiolPhys33:887-899,1995.
【非特許文献20】Engin,K.,Leeper,D.B.,Tupchong,L.,andWaterman,F.M.Thermoradiotherapyinthemanagementofsuperficialmalignanttumors.ClinCancerRes1:139-145,1995.
【非特許文献21】Leopold,K.A.,Dewhirst,M.W.,Samulski,T.V.,Dodge,R.K.,George,S.L.,Blivin,J.L.,Prosnitz,L.R.,andOleson,J.R.CumulativeminuteswithT90greaterthanTempindexispredictiveofresponseofsuperficialmalignanciestohyperthermiaandradiation.IntJRadiatOncolBiolPhys25:841-847,1993.
【非特許文献23】Delannoy,J.,LeBihan,D.,Hoult,D.I.,andLevin,R.L.Hyperthermiasystemcombinedwithamagneticresonanceimagingunit.MedPhys17:855-860,1990.23.Fajardo,L.F.Pathologicaleffectsofhyperthermiainnormaltissues.CancerRes44:4826s-4835s,1984.
【非特許文献24】Wondergem,J.,Haveman,J.,Rusman,V.,Sminia,P.,andVanDijk,J.D.Effectsoflocalhyperthermiaonthemotorfunctionoftheratsciaticnerve.IntJRadiatBiolRelatStudPhysChemMed53:429-438,1988.
【非特許文献25】Fenn,A.J.,Wolf,G.L.,andFogle,R.M.Anadaptivemicrowavephasedarrayfortargetedheatingofdeeptumoursinintactbreast:animalstudyresults.IntJHyperthermia15:45-61,1999.
【非特許文献26】Hamazoe,R.,Maeta,M.,andKaibara,N.Intraperitonealthermochemotherapyforpreventionofperitonealrecurrenceofgastriccancer.Finalresultsofarandomizedcontrolledstudy.Cancer73:2048-2052,1994.
【非特許文献27】Zanon,C.,Clara,R.,Bortolini,M.,Malossi,A.,Moscato,R.,Celoria,P.,deAndrea,M.,Rizzo,M.,Chiappino,I.,GraziaSciuto,M.,andMussa,A.Chemohyperthermiaforadvancedabdominalmalignancies:anewprocedurewithclosedabdomenandpreviouslyperformedanastomosis.IntJHyperthermia17:456-464,2001.
【非特許文献28】Yonemura,Y.,deAretxabala,X.,Fujimura,T.,Fushida,S.,Katayama,K.,Bandou,E.,Sugiyama,K.,Kawamura,T.,Kinoshita,K.,Endou,Y.,andSasaki,T.Intraoperativechemohyperthermicperitonealperfusionasanadjuvanttogastriccancer:finalresultsofarandomizedcontrolledstudy.Hepatogastroenterology48:1776-1782,2001.
【非特許文献29】Yonemura,Y.,Fujimura,T.,Nishimura,G.,FallaR,Sawa,T.,Katayama,K.,Tsugawa,K.,Fushida,S.,Miyazaki,I.,Tanaka,M.,Endou,Y.,andSasaki,T.Effectsofintraoperativechemohyperthermiainpatientswithgastriccancerwithperitonealdissemination.Surgery119:437-444,1996.
【非特許文献30】Yonemura,Y.,Fujimura,T.,Fushida,S.,Takegawa,S.,Kamata,T.,Katayama,K.,Kosaka,T.,Yamaguchi,A.,Miwa,K.,andMiyazaki,I.Hyperthermo-chemotherapycombinedwithcytoreductivesurgeryforthetreatmentofgastriccancerwithperitonealdissemination.WorldJSurg15:530-535;discussion535-536,1991.
【発明の開示】
【発明が解決しようとする課題】
【0003】
温熱療法は癌における集学的治療の一つとして、用いられてきた。そして、無作為化された、比較試験において、温熱療法は効果的な癌治療であることを確認した。しかしながら、臨床の正確性および安全性のためには、治療中の温度モニタリングは不可欠である。我々は、その効果と安全性を改善するために、空間的リアルタイム温度モニタリングを使った簡便なマイクロ波温熱治療システムを開発した。
【課題を解決するための手段】
【0004】
MR対応の照射型マイクロ波アプリケータを使い、寒天ファントム、ウサギの大腿筋肉およびウサギの皮下VX2腫瘍に対して、非侵襲性のMR温度画像を利用して加熱した。MR温度計算については、プロトン共鳴周波数を用いた位相差法を使用した。温度係数の決定、およびMR温度測定の正確性の評価の後、時間経過によるマイクロ波加熱によるの温度分布を各対象について検討した。ファントム、ウサギ筋肉およびVX2腫瘍の温度係数は、それぞれ-0.00977、-0.00976および-0.01027ppm/℃であった。3つの対象におけるMRと光学温度計の95%信頼区間は、それぞれ+0.318℃/0.339℃、+0.693℃/0.661℃および+0.564℃/0.526℃であった。VX2腫瘍に関して、平均腫瘍温度は42.60℃±0.14℃であった。また、皮膚の表面は60分の実験において43.27℃±0.45℃であった。
【発明の効果】
【0005】
この使用簡便なマイクロ波温熱治療システムで、効果的な温熱治療が、ファントム及び生動物で、MR温度画像を利用して施行された。
【発明を実施するための最良の形態】
【0006】
本発明は、悪性腫瘍の温熱療法装置システムである。本発明の特徴は、悪性腫瘍の温熱療法を行うための加熱装置と加熱による温度変化をモニタリングする装置を合体したことにある。加熱による温度変化をモニタリングする装置は、温度増加をMR温度画像で検知することが可能な手段を含み、磁場の強さは、0.5〜9T、好ましくは1.5〜9T、より好ましくは6〜9Tの静磁場強度を備えた装置である。これにより42-43℃での温熱療法のモニタリングを可能にした。加熱は、マイクロ波ジェネレーターでマイクロ波を照射して行う。0.4〜3GHz、好ましくは1.0〜2.8GHz、より好ましくは1.5〜2.5GHzのマイクロ波ジェネレーターでマイクロ波を照射する。照射は、連続的に行うのではなく、断続的に行う。これにより、目標領域を目標とされたレベルの温度にコントロールすることが達成可能である。断続的に加温するために、電源スイッチを断続的にオン&オフを繰り返えす機能をマイクロ波ジェネレーターは担持する。
【実施例】
【0007】
材料と方法
対象
実験のプロトコルは、滋賀医科大学動物実験委員会によって検討され承認された。ファントム実験において、寒天ファントム(120×120×50mm3)は、2%の寒天、0.25mMGd-DTPA、0.9%NaClおよび0.05%NaN3で調製された。動物実験において、10羽のオスのNew Zealand White rabbitsが利用された。6羽のウサギに対し、0.4mLリン酸緩衝液溶液中5.0×106VX2腫瘍細胞を、大腿に皮下注射した。腫瘍は、2週間で直径10-20mmまで成長した。寒天ファントム、未処理ウサギ大腿筋肉、及び大腿皮下腫瘍腫瘍が、実験に使用された。温度係数値を決定、かつMR温度画像の正確さを評価するために、各グループ(大腿筋肉および皮下腫瘍)で一匹の動物が使用された。また、他の動物はマイクロ波温熱治療中に温度分布の検討に使用された。
【0008】
装置の調製
2種類のMR-対応照射タイプのマイクロ波アプリケータは非磁性体を使用して作成した。通常では、100×100×70mm3反射板(ダイポールタイプ(図1A))の中に半波長(60mm)の双極アンテナをセットされたものを使用した。アンテナと反射器の間の距離は定在波比(SWR)を最小化するために最適化された。局所的な小さな領域を温熱化するためには、60×90mm2のスロット・アンテナを備えたアプリケータ(スロット・タイプ(図1B))を作成した。アプリケータは、長さ4mの同軸ケーブルを用いMR室の隣に設置した0.4〜3GHz(2.45)GHzのマイクロ波ジェネレーターMicrotazeOT110M(AlfresaPharma、大阪(日本))に接続された(非特許文献11)。このマイクロ波ジェネレーターは、連続的および間欠モードで利用可能である。間欠モードでは、2秒の電源オンおよび2秒の電源オフが、交互に繰り返される。温熱治療のためには、通常、60-110Wの出力で間欠的に適用された。対象の絶対温度を測定するために、光学温度計、モデル3100(Luxtron、サンタクララ(CA))が使用された。直径0.3mmの温度計が20Gのテフロン(登録商標)針によって刺入された。40cmの開口径をもつ超伝導電磁石〔0.5〜9T/400mm(7.0T/400mm)の/SS(JASTEC、神戸(日本))〕と、0.5〜9T(7.0T)のMRスキャナー〔UnityInova(バリアン(パロアルト(CA)))〕を用い、グラディエントエコー・シーケンスを用いたMRデータを収集した。相対的な温度変化は温度依存性の水の信号のケミカルシフトから計算される(非特許文献9)。グラディエントエコーを用いると、echo時間の間に位相差によって生じるケミカルシフトが生じる。
温度係数αは、約-0.01ppm/℃であると報告されているが、対象に依存して変わりうる(非特許文献15)。寒天ファントム、ウサギ大腿筋肉および皮下の腫瘍に対する温度係数(α)の値は、光学温度計での温度、およびサーマル・プローブのまわりの5×5ピクセル中の1HMR信号の平均の位相シフトと比較することにより個々に決定された。2つの値のピアソンの積率相関係数によって評価された。個々の温度係数で、MR温度画像は計算された。光学温度計のMR温度画像への95%信頼区間は、Bland-Altman plotで平均±1.96SDと定義された(非特許文献16)。
【0009】
ファントム実験
ダイポールタイプ・マイクロ波アプリケータは、磁石中の寒天ファントムに設置された。ファントムのグラディエントエコー・イメージは、20ミリセカンドの繰り返し時間(TR)、8ミリセカンドのエコー時間(TE)、20°フリップ角および3mmのスライス厚さ、視界域150×150mm2(FOV)、128×128マトリックスおよび積算回数1回で得られた。1つのイメージの所要時間はデータの保存のための時間を含め4.8秒であった。温度増加は寒天ファントムのα値を使い計算され、リアルタイムMR温度画像は、外部コンピューターに表示された。ベース・ライン温度(室温)は体温(36.5℃)より低かったが、深さ10mmのエリアでの温度増加は5.5℃から6.5℃までの範囲でコントロールされた。それは動物の42-43℃に相当する。我々は、マイクロ波ジェネレーターの電源スイッチのオン&オフの時期を決めるためにMR温度画像を参照した。
【0010】
未処理大腿筋肉に関する動物実験
動物は、自発呼吸を保ったまま、フェースマスクによって、50%O2および50%N2の3%isofluraneで麻酔処置をした。ウサギの大腿の毛を剃った。温度計は体表面からの深さ10mmの領域へ刺入された。ダイポールタイプ・マイクロ波アプリケータは大腿に設置された。体温を維持するために、他の身体各部は毛布で覆った。ウサギ大腿筋肉のグラディエントエコー・イメージは、20ミリセカンドのTR、8ミリセカンドのTE、20°フリップ角、3mmのスライス厚さ、200×200mm2FOV、256×256マトリックスおよび積算回数1回で得られた。1つのイメージの所要時間はデータの保存のための時間を含み8.2秒であった。温度は、ファントム実験と同様に、筋肉のα値を使い計算された。目標の温度増加は、温度計によるベースライン絶対温度から、42-43℃の差から決定された。マイクロ波ジェネレーターは、MR温度画像中の深さ10mmのエリアでの温度増加を参照することにより調節された。
【0011】
皮下注入のVX2腫瘍に関する動物実験
動物は未処置大腿筋肉の実験と同様に準備された。本実験では、スロット・タイプ・アプリケータは局所的な腫瘍領域だけを熱するために使用された。光学温度計は腫瘍の中心に刺入された。腫瘍の1HMR信号レベルが、大腿筋肉での獲得パラメーターのように低かったので、腫瘍のグラディエントエコー・イメージは、40ミリセカンドのTR、6ミリセカンドのTE、40°フリップ角、3mmのスライス厚さ、150×150mm2FOV、128×128マトリックスおよび積算回数2回で得られた。1つのイメージの獲得時間はデータの保存のための時間を含み12.5秒であった。マイクロ波ジェネレーターは、MR温度画像中の腫瘍での温度増加を参照することによりコントロールされた。他の実験条件は未処置大腿筋肉用のものと同じであった。
【0012】
結果
ファントム実験
マイクロ波放射中に、MRイメージにはノイズは出現しなかった。光学温度計で測定された温度変化とグラディエントエコー・イメージの位相シフトの関係は、図2Aで示した。2つの値の間の相関性は良かった(相関係数(r)=0.997、P<0.0001)。また、回帰直線の傾斜は8ミリセカンドのTEで、-8.444°位相シフト/℃であり、それは温度係数、α、-0.00977ppm/℃に相当した。このα値を使用して計算されたMR温度画像による温度増加を、光学温度計による温度増加と比較した。2つの測定方法のBland-Altman plotsを図2Bに示した。2つの測定法の平均誤差は-0.0106±0.168℃(平均±SD)であり、また、95%信頼区間は+0.318/‐0.339℃であった。Bland-Altman plotsは、典型的な系統的なバイアスのパターンにはあてはまらなかった。
MR温度画像の正確さおよび信頼度の評価の後、ダイポールタイプ・マイクロ波アプリケータによるマイクロ波加熱の様々な条件を検討した。最初に、ファントムは連続モードの中で110Wで加熱された。表面は速く加熱されたが、深い部分は加熱されなかった。深さ10mmのエリアの温度増加が5.5-6.5℃で維持された時、表面は15℃以上で加熱された。また、深さ20mmのエリアは3℃未満に加熱された。その後、出力パワーは連続モードで30Wにまで減少させた。しかし、表面の最高温度増加は、なお11℃であった。60Wの間欠モードでは、深さ10mmのエリアで目標温度に達するのにおよそ10分必要であった。しかし、表面での温度は8℃以内に抑えられた。また、深さ20mmのエリアは4℃以上であった。この条件を使用して、加熱した寒天ファントムのMR温度画像は、図3に示した。目標領域から温度差が1℃未満の領域は、横断方向で約60mmおよび垂直方向に約20mmであった。加熱中心のまわりで、放射状に1℃単位で広がる温度の空間分布が、明白に示された。
【0013】
未処置大腿筋肉に関する動物実験
ファントム実験の結果と同様に、光学温度計で測定された温度変化とグラディエントエコー・イメージの位相シフト間の関係を、未処置ウサギ大腿筋肉で検討した(図2C)。2つの間の相関性は重要であった(r=0.966、P<0.0001)。また、回帰直線の傾斜は8ミリセカンドのTEで-8.435°位相シフト/℃であった。それは温度係数、α、-0.00976ppm/℃に相当した。このα値を使用する温度計算の結果は、Bland-Altman plot(図2D)を使用する、光学温度計による値と比較した。2つの測定での平均差は+0.0160±0.345℃であった。95%信頼区間は+0.693/‐0.661℃であった。大腿筋肉は間欠モードを使用して、80Wで加熱された。大腿筋肉の代表的な温度画像は図4に示した。3匹のウサギを使い、中央の位置の表面、深さ10mmのエリアおよび深さ20mmのエリア、および、中央から20mm離れた表面の温度変化(5分ごとの平均±SD)を図5に示した。深さ10mmのエリアで、42-43℃の目標温度への増加は5分で達成された。表面の温度は、44℃未満で維持され、ほぼ深さ1cmのエリアより1℃高かった。深さ20mmのエリアでの温度は、表面および深さ10mmのエリアの温度が定常状態にあった時でも、徐々に高くなっていった。10mmおよび20mmのエリア間の温度差は、30分間の実験時間の終わりで1℃未満であった。
【0014】
皮下注入VX2腫瘍に関する動物実験
スロット・タイプ・マイクロ波アプリケータを、皮下VX2腫瘍を加熱するために使用した。光学温度計で測定された温度変化とグラディエントエコー・イメージの位相シフトの間の相関性は良かった(r=0.887、P<0.0001)(図2E)。また、回帰直線の傾斜は6ミリセカンドのTEで-6.658°位相シフト/℃であった。それは温度係数、α、-0.01027ppm/℃に相当した。Bland-Altman plot(図2F)は、2つの測定での平均差が、+0.0192±0.272℃であることを示した。また、95%信頼区間は+0.564/‐0.526℃であった。5羽のウサギの腫瘍に対して、間欠モードを使用して、110Wで加熱された。また、腫瘍の温度は、42-43℃に1時間維持された。加熱の間の代表的な温度画像は、図6に示した。腫瘍の領域だけが選択的に加熱された。1羽のウサギの腫瘍領域と同様に腫瘍の下部及び表面上の温度変化を、図7に示した。腫瘍の大部分の温度は、1時間の実験中、ほぼ目標温度に維持された。5羽のウサギの腫瘍全体の温度評価をするため、様々な温度域での経過時間、そして、目標温度レベルに達した後に、腫瘍の平均、最大、最小温度を表1に要約した。腫瘍の温度は、治療の期間の80%以上の間、42-43℃に維持された。他方、表2に示すように、表面の温度は60分の実験において8.7分間だけ44℃を超過した。皮膚の明らかな熱傷はいずれのウサギでも観察されなかった。
【表1】

【表2】

【0015】
発明の効果
温熱療法中の、小さな温度増加をMR温度画像で検知するために、本検討は0.5〜9T(7T)の静磁場強度をもつMRで実験された。それは臨床のMRスキャナよりもはるかに高い静磁場強度である。7Tにおける1H信号の共鳴周波数は300MHzである。高磁場のシステムは、よい信号対ノイズ比をもつMR信号を得ることができる。また、高い共鳴周波数は温度依存の位相シフトを検知するのに有利である。寒天ファントム、ウサギ大腿筋肉および皮下腫瘍において、光学温度計で測定された温度変化と、グラディエントエコー・イメージの位相シフトは、非常によく相関した。これらの対象の、測定された温度係数価値、α(温度依存の水の化学シフト)は、以前の報告と矛盾のない値であった(非特許文献15)。光学温度計とMR検温の間の95%信頼区間は、Bland-Altman plotによって、それぞれファントム、未処置筋肉および皮下腫瘍において、+0.318/‐0.339℃、+0.693/‐0.661℃および+0.564/‐0.526℃であった。7Tの静磁場での温度測定の正確さおよび信頼度は、42-43℃の温熱療法のモニタリングにおいて十分であった。そして、我々は先の0.5Tでの結果(非特許文献11)(非特許文献13)及び2TMRシステムでの結果(非特許文献17)よりよい結果をえた。しかしながら、生動物での、MR温度画像の正確性は、ファントムでの場合よりわずかに低かった。PRF法でのMR温度計算は様々な要因に影響されるかもしれない。それらの中でも、温度は加温中のイメージとベース・ライン・イメージとの差によって計算されるので、対象物の移動は重要である。本検討では、10℃未満の温度変化は、MR信号の位相シフトのわずかな差から計算された。動物の動きは、イメージ平面での動きだけでなく他の部分の動きでも、イメージ平面上の静磁場に影響するかもしれないので、問題を引き起こす場合がある。
温熱治療中の温度モニタリングは有効で安全な治療を遂行するために必要不可欠な問題である。温熱凝固療法と凍結療法のような他の熱治療手段と異なって、温熱療法は、組織の熱反応を直ちに引き起こさない。医者は意図した反応を見ることができず、重大な副作用を見逃すかもしれない。腫瘍が内部の数点の測定ポイントだけでさえ、より正確に加熱された時、治療結果がよかったことが報告されている(非特許文献8)(非特許文献18)(非特許文献19)(非特許文献20)(非特許文献21)。したがって、腫瘍全体の非侵襲性で信頼できる温度モニタリングは、この治療効果の改善において重要な役割を果たす。加藤ら(非特許文献7)は、±2℃誤差での腫瘍の温度測定は、臨床医が温熱療法の状態をモニターするのに有用であることを報告した。この観点から、MR温度モニタリングは十分にこの治療を支援することができる。
0.4〜3GHz(2.45GHz)のマイクロ波ジェネレーターは、照射中においてさえフィルタあるいは特別な回路を使用せずとも、300MHzで受信したMR画像に影響をあたえなかった。目標とされたレベルに温度をコントロールするために、電源スイッチを断続的にオン&オフを繰り返したが、ノイズはMR画像に現われず、スイッチのオン&オフでイメージを区別できなかった。他方で、温熱治療においてラジオ波(RF)加温は、マイクロ波加熱よりポピュラーである。しかしながら、RF照射は、MR画像に重大な影響を与える。通常RF温熱治療とMR温度測定を同時施行するためには、タイムシェアする回路か周波数フィルタのような装置が必要である(非特許文献22)。マイクロ波加熱はMR温度画像を用いる場合、RF温熱治療より適していると思われた。
我々は、マイクロ波加熱のために2つのタイプのアプリケータを作成した。これらのアプリケータで、深さ10mmのエリアでの温熱治療のための効果的な加熱が得られた。温度は、MR温度画像のモニターにより目標レベルによく維持された。皮膚の熱傷を回避するために皮膚表面の温度をモニターしなければならない。深さ10mmのエリアでの寒天ファントムを、連続モードで、5.5-5.6℃に加熱すると、表面温度は高温になりすぎた。間欠モードを使用すると、表面を加熱しすぎることなく、より深いエリアは加熱することができる。熱は、より深いエリアへ熱分散し、また、マイクロ波放射のオフの間、表面が冷却される。
標準のダイポールタイプ・アプリケータを用いると、大腿筋肉の深さ10mmのエリアを、42-43℃に維持しても、表面温度は44℃以下に維持された。スロット・タイプ・アプリケータでは、直径10-20mmの腫瘍の領域が選択的に加温された。断続的なマイクロ波照射での60分間治療の約45分間の間、腫瘍の温度は約42-43℃に維持された。他方、表面の温度はほとんど44℃以下であった。そして、44℃以上の時間は、60minの治療期間の9分間であった。皮膚を含むほとんどの正常組織は、44℃以下では1h間加温されても損傷を受けない、と報告がある(非特許文献23)。より熱に敏感な神経系に関して、44℃での30分以上の末梢神経の加温(あるいは等価な「加温」)は、一時的な機能障害をおこすが、それは4週間以内に回復する(非特許文献24)。皮膚表面の過剰加熱は、冷却剤によって防止できる。しかし、厚い冷却剤は、深い組織へのマイクロ波による加熱を妨害する。水を循環させると、MR温度測定の正確さを減少させる。気流による冷却は本発明のシステムに有効であるかも知れない(非特許文献25)。
加熱のための我々のマイクロ波アプリケータは従来の温熱療法システムと比較して小さく手軽である。局所的な温熱治療は乳癌などで行なわれてきた。我々は、このシステムを手術時の温熱治療療法に使用する可能性を考慮している。持続温熱腹膜潅流法は、今はいくつかの設備で行なわれている。ほとんどの場合、それは化学療法と併用して使用されている。それは、腹膜播種にはある程度まで有効である(非特許文献26)(非特許文献27)(非特許文献28)。しかし、2mmを超える病変には効果はわずかである(非特許文献29)。循環水の温度はコントロールされるが、組織の実際の温度増加はモニターされていない。腹膜の表面から1あるいは2mmのみのエリアを加熱することはできるかもしれない(非特許文献30)。組織が正確に加熱される場合は、術中温熱治療は遺残腫瘍にも有効かもしれない。マイクロ波加熱では、より多くの水を含んでいる腫瘍細胞は脂肪組織以上に加熱されるので、脂肪組織にうもれている腫瘍細胞に有効かもしれない。さらなる検討は必要であるが、MR温度画像により空間的温度分布をモニターする小型マイクロ波温熱治療システムは、低侵襲治療において有望な治療法になるかもしれない。
【図面の簡単な説明】
【0016】
【図1】MR・互換・放射タイプの・マイクロ波アプリケータ、双極子タイプ(A)およびスロット・タイプ(B)。(A)長さ60mmのダイポールアンテナは反射器に位置する。(B)60×90mmの2スロット・アンテナは反射器で構築した。
【図2A】寒天ファントムでの光学温度計で測定された温度変化と、グラディエントエコー・イメージ中の1H信号の位相シフトの間の線形回帰ラインを備えた散布図。
【図2B】寒天ファントムでの光学温度計およびMR温度計で測定された温度のBland-Altman plot。Y軸は、2つの方法(MR-光学温度計)間の違いを示す。また、X軸は、2つの中間を示す。平均差は点線で示した。また、95%信頼区間は固体のラインで示した。
【図2C】ウサギ大腿筋での光学温度計で測定された温度変化と、グラディエントエコー・イメージ中の1H信号の位相シフトの間の線形回帰ラインを備えた散布図。
【図2D】ウサギ大腿筋での光学温度計およびMR温度計で測定された温度のBland-Altman plot。Y軸は、2つの方法(MR-光学温度計)間の違いを示す。また、X軸は、2つの中間を示す。平均差は点線で示した。また、95%信頼区間は固体のラインで示した。
【図2E】皮下腫瘍での光学温度計で測定された温度変化と、グラディエントエコー・イメージ中の1H信号の位相シフトの間の線形回帰ラインを備えた散布図。
【図2F】皮下腫瘍での光学温度計およびMR温度計で測定された温度のBland-Altman plot。Y軸は、2つの方法(MR-光学温度計)間の違いを示す。また、X軸は、2つの中間を示す。平均差は点線で示した。また、95%信頼区間は固体のラインで示した。
【図3A】双極子タイプ・アプリケータで熱した寒天ファントムの代表的なMR温度画像。温度増加は右側の色分けされた目盛りの中で示した。アローは、アプリケータから熱くなる方向を示す。
【図3B】寒天ファントムでの実験(マイクロ波出力 110W 連続加温での加温時間と上昇温度の各部位で結果(表面、深部1cm、深部2cm、深部3cm、表面3cm横、表面2cm横)
【図3C】寒天ファントムでの実験(マイクロ波出力 30W 連続加温での加温時間と上昇温度の各部位で結果(表面、深部1cm、深部2cm、深部3cm、表面3cm横、表面2cm横)
【図3D】寒天ファントムでの実験(マイクロ波出力 60W 間欠加温(2秒オン、2秒オフ)での加温時間と上昇温度の各部位で結果(表面、深部1cm、深部2cm、深部3cm、表面3cm横、表面2cm横)
【図4】大腿筋肉の代表的なMR画像および温度画像は双極子タイプ・アプリケータで熱くなった。加熱の温度増加および方向は図3と同様に示した。マイクロ波出力 80W 30分間 間欠加温(2秒オン、2秒オフ)での加温時間と上昇温度の各部位で結果(表面中心、中心深部1cm、中心深部2cm、表面横2cm)
【図5】中央の位置の表面(×)、深さ10mm(◆)および深さ(□)20mmのエリア、そして中心(○)から20mm離れた表面の温度の連続変化。3羽のウサギ(A)、(B)、そして(C)について調べた。値は5分ごとに平均±SDで示した。
【図6】VX2の皮下の腫瘍の代表的なMR画像および温度画像は、スロット・タイプ・アプリケータで熱くなった。暖房の温度増加および方向は図3と同様に示した。
【図7】ウサギの腫瘍(◆)、表面(×)、及びの腫瘍直下(□)の温度の連続変化(表1および2の実験1)。出力パワーは、腫瘍(◆)の温度を42-43℃に維持するようにコントロールされた。
【特許請求の範囲】
【請求項1】
悪性腫瘍の温熱療法装置システムであって、温度増加をMR温度画像で検知するために、0.5〜9Tの静磁場強度を使い、42-43℃での温熱療法のモニタリングを可能にし、0.4〜3GHzのマイクロ波ジェネレーターでマイクロ波を照射し、目標領域を目標とされたレベルの温度にコントロールするために、電源スイッチを断続的にオン&オフを繰り返えす機能を担持する悪性腫瘍の温熱療法装置システム。
【請求項1】
悪性腫瘍の温熱療法装置システムであって、温度増加をMR温度画像で検知するために、0.5〜9Tの静磁場強度を使い、42-43℃での温熱療法のモニタリングを可能にし、0.4〜3GHzのマイクロ波ジェネレーターでマイクロ波を照射し、目標領域を目標とされたレベルの温度にコントロールするために、電源スイッチを断続的にオン&オフを繰り返えす機能を担持する悪性腫瘍の温熱療法装置システム。
【図1】


【図2A】


【図2B】


【図2C】


【図2D】


【図2E】


【図2F】


【図3A】


【図3B】


【図3C】


【図3D】


【図4】


【図5】


【図6】


【図7】




【図2A】


【図2B】


【図2C】


【図2D】


【図2E】


【図2F】


【図3A】


【図3B】


【図3C】


【図3D】


【図4】


【図5】


【図6】


【図7】


【公開番号】特開2008−86525(P2008−86525A)
【公開日】平成20年4月17日(2008.4.17)
【国際特許分類】
【出願番号】特願2006−270075(P2006−270075)
【出願日】平成18年9月29日(2006.9.29)
【新規性喪失の例外の表示】特許法第30条第1項適用申請有り 2006年3月31日、電気通信回線を通じて発表
【国等の委託研究の成果に係る記載事項】(出願人による申告)国等の委託研究の成果に関わる特許出願(平成18年度文部科学省科学技術総合研究委託業務「産学官共同研究の効果的な推進MR画像対応手術支援マイクロ波機器の開発」産業活力再生特別措置法第30条の適用をうけるもの)
【出願人】(504177284)国立大学法人滋賀医科大学 (41)
【Fターム(参考)】
【公開日】平成20年4月17日(2008.4.17)
【国際特許分類】
【出願日】平成18年9月29日(2006.9.29)
【新規性喪失の例外の表示】特許法第30条第1項適用申請有り 2006年3月31日、電気通信回線を通じて発表
【国等の委託研究の成果に係る記載事項】(出願人による申告)国等の委託研究の成果に関わる特許出願(平成18年度文部科学省科学技術総合研究委託業務「産学官共同研究の効果的な推進MR画像対応手術支援マイクロ波機器の開発」産業活力再生特別措置法第30条の適用をうけるもの)
【出願人】(504177284)国立大学法人滋賀医科大学 (41)
【Fターム(参考)】
[ Back to top ]

