局所的脂肪組織処置のための徐放性増強脂肪分解処方物
【課題】局所性脂肪沈着物を処置するための組成物、処方物、方法およびシステムを提供すること。
【解決手段】局所性脂肪沈着物を処置するための組成物、処方物、方法およびシステムは、標的脂肪沈着物を、長期作用性β−2アドレナリン受容体アゴニストを含む組成物、および長期作用性β−2アドレナリン受容体アゴニストに対するこの標的組織の脱感作を減少させる化合物(例えば、グルココルチコステロイドおよび/またはケトチフェン)に接触させることを含む。組成物の実施形態は、例えば、注射により、および/または経皮的に投与される。
【解決手段】局所性脂肪沈着物を処置するための組成物、処方物、方法およびシステムは、標的脂肪沈着物を、長期作用性β−2アドレナリン受容体アゴニストを含む組成物、および長期作用性β−2アドレナリン受容体アゴニストに対するこの標的組織の脱感作を減少させる化合物(例えば、グルココルチコステロイドおよび/またはケトチフェン)に接触させることを含む。組成物の実施形態は、例えば、注射により、および/または経皮的に投与される。
【発明の詳細な説明】
【技術分野】
【0001】
(関連出願の引用)
本出願は、米国特許法第119条(e)項の下で、2005年7月14日出願の米国仮出願第60/699,155号;2005年10月24日出願の米国仮出願第60/729,531号および2005年11月3日出願の米国仮出願第60/732,981号に対する優先権を主張する。これらの内容の全体は、本明細書中に参考として援用され、本明細書の一部とされる。
【0002】
(発明の背景)
(発明の分野)
本開示は、一般的には医療処置に、およびより具体的には脂肪沈着物の処置に関する。
【背景技術】
【0003】
(関連技術の説明)
脂肪組織は、体の主要なエネルギー貯蔵組織である。脂肪細胞または脂肪細胞は、このエネルギーをトリグリセリドの形態で貯蔵する。トリグリセリドを貯蔵脂肪から動員し、トリグリセリド加水分解のホルモン誘起を介して体内に熱量エネルギーを与える。このプロセスでは、他の体内組織に使用するために遊離または非エステル化脂肪酸およびグリセロールを血液に放出する。貯蔵脂肪からのトリグリセリドの分解は、脂肪分解と呼ばれる。また、新しい脂肪細胞の成長も生じており、これは脂肪生成と呼ばれる。
【0004】
運動を伴う減量プログラムは、アドレナリンの刺激を介して脂肪分解を刺激することができ、その結果、脂肪の減少が生じる。体内の脂肪分解を調節する1次ホルモンおよび神経伝達物質は、カテコールアミンである。脂肪組織は、β−1,2および3アドレナリン受容体およびα−2アドレナリン受容体を有する。βアゴニストが脂肪組織内のβ受容体に結合することで、脂肪細胞の脂肪分解が生じるのに対して、α受容体アゴニストが結合すると脂肪分解が阻害される可能性がある。β受容体活性化はまた、脂肪生成を阻害する可能性もある。ヒトにおいて、β−2受容体は、多くの場合、脂肪細胞表面に最も多く存在し、β受容体刺激性脂肪分解の第1の媒介物質である。βアゴニストによる脂肪分解の刺激は、アデニル酸シクラーゼが媒介し、環状アデノシン一リン酸(サイクリックAMP(cAMP))の形成を増加させる。
【0005】
貯蔵脂肪の蓄積は、体内に不均一に生じる可能性がある。例えば、脂肪を主に腹腔内に蓄積する者もいれば、主に皮下組織に蓄積する者もいる。性差も認められる場合があり、女性は大腿および側臀部に、男性は腰部に脂肪を蓄積する場合がある。女性は大腿に脂肪沈着物を蓄積する場合がある。これはしわが入っていたり、「オレンジの皮」のような外観をしており、セルライトと呼ばれる状態となる。セルライトは、皮下脂肪のヘルニア形成を招く皮膚構造物に関連しており、脂肪乳頭と呼ばれることもある。セルライトに関連する場合があるその他の因子には、結合組織性中隔の変化および/または減少、体液の蓄積につながる血管およびリンパの変化、ならびに炎症が含まれる。脂肪組織はまた、脂肪腫として知られる線維性脂肪沈着の形態で蓄積する場合もある。
【0006】
同様に、貯蔵脂肪の利用は不均一に生じる場合もある。実質的に体重が減少した人は、不健康な極端な減量を行わない限り、依然として減量に耐性のある局所性の脂肪蓄積嚢を有する場合がある。運動は皮下貯蔵脂肪に様々に影響を及ぼし、深部組織は脂肪分解に応答し、表皮貯蔵はより耐性を有する場合がある。セルライトは減量しても尚存在する場合もあり、脂肪腫は一般的に減量の影響を受けない。
【0007】
貯蔵脂肪の種々の利用は、一部にアドレナリン受容体の活性による場合がある。従って、特定の領域では、β−2受容体に比べてα−2受容体の活性が高いか、α−2受容体の数が多い場合があり、脂肪分解の低下につながる。幾つかの試験では、網、皮下腹部、大腿それぞれの脂肪組織におけるβアドレナリン受容体の刺激に対する脂肪分解活性の差が示されており、網が最も活性が高く、大腿が最も活性が低い結果となった。脂肪分解活性の差は、α−2受容体拮抗薬を添加することで除外することができ、これは、種々の脂肪組織領域において、過度のα−2受容体活性が、アドレナリン刺激に対する脂肪分解反応を低下させる原因であることを示唆している。
【0008】
皮下組織へのアドレナリン有効成分、即ちβアゴニストおよびα−2拮抗薬の送達は、既に提唱されており、局所性脂肪の減少が生じて、局所性脂肪蓄積物の外観が改善されることが示されている。例えば、イソプロテレノール11およびヨヒンビン8は、女性の大腿周囲径を減少させることが示されている。これらの試験では、大腿部に複数箇所、週に3〜5回βアゴニストを皮下投与することが必要であった。これは、局所性脂肪減少の市販製品としては実用的でなく、患者にかなりの不快感を与えている。これらの脂肪分解剤、特にβアゴニストは、短期作用型であり、脂肪組織から急速に排出される場合があることから、脂肪分解が注射後の極短時間にしか生じていなかった可能性があり、それにより複数回注射しても、潜在的な効果の程度が狭まっていた可能性がある。さらに、脂肪細胞にβアゴニストを長期間曝露すると、受容体の脱感作および下方制御ならびに脂肪分解活性の低下を生じる。これらの受容体に対する影響を減少または予防する手段は、治療法を改善する場合もある。
【発明の概要】
【課題を解決するための手段】
【0009】
(発明の要旨)
局所性脂肪沈着物を処置するための組成物、処方物、方法およびシステムは、標的脂肪沈着物を、長期作用性β−2アドレナリン受容体アゴニストを含む組成物、および長期作用性β−2アドレナリン受容体アゴニストに対する標的組織の脱感作を減少させる化合物、例えば、グルココルチコステロイドおよび/またはケトチフェンに接触させることを含む。本組成物の実施形態は、例えば、注射によりおよび/または経皮的に投与される。
【0010】
幾つかの実施形態は、脂肪組織の蓄積のための注射可能処方物であって、長期作用性選択的β−2アドレナリン受容体アゴニスト;β−アドレナリン受容体アゴニストに対する脂肪組織の脱感作を減少させる化合物;および液体担体を含む、処方物を提供する。
【0011】
幾つかの実施形態において、長期作用性選択的β−2アドレナリン受容体アゴニストは、親油性である。幾つかの実施形態において、長期作用性選択的β−2アドレナリン受容体アゴニストは、サルメテロール、フォルモテロール、それらの塩、およびそれらの溶媒和物のうちの少なくとも1種を含む。
【0012】
幾つかの実施形態において、β−アドレナリン受容体アゴニストに対する標的組織の脱感作を減少させる化合物は、グルココルチコステロイドを含む。幾つかの実施形態において、β−アドレナリン受容体アゴニストに対する標的組織の脱感作を減少させる化合物は、抗ヒスタミン剤を含む。幾つかの実施形態において、β−アドレナリン受容体アゴニストに対する標的組織の脱感作を減少させる化合物は、グルココルチコステロイドおよび抗ヒスタミン剤を含む。幾つかの実施形態において、β−アドレナリン受容体アゴニストに対する標的組織の脱感作を減少させる化合物は、デキサメタゾン、プレドニゾロン、プロピオン酸フルチカゾン、ブデソニド、ケトチフェン、およびそれらの類似体のうちの少なくとも1種を含む。
【0013】
幾つかの実施形態において、液体担体は、親油性液体担体を含む。
【0014】
幾つかの実施形態においては、長期作用性選択的β−2アドレナリン受容体アゴニスト、および脱感作を減少させる化合物のうちの少なくとも1種が、徐放性剤に添加される。幾つかの実施形態において、徐放性剤は、生分解性ポリマー、生分解性コポリマー、ヒドロゲルおよびリポソームのうちの少なくとも1種を含む。幾つかの実施形態において、徐放性剤は、ポリ(ラクチドグリコリド)を含む。幾つかの実施形態において、ポリ(ラクチドグリコリド)に添加する有効成分は、約75%までである。
【0015】
幾つかの実施形態は、サルメテロール、その塩およびその溶媒和物のうちの少なくとも1種;ならびにフルチカゾンを含む。
【0016】
幾つかの実施形態は、フォルモテロール、その塩およびその溶媒和物のうちの少なくとも1種;ならびにブデソニドを含む。幾つかの実施形態は、サルメテロール、フォルモテロール、それらの塩およびそれらの溶媒和物のうちの少なくとも1種;ならびにケトチフェンを含む。
【0017】
他の実施形態は、脂肪蓄積を処置するための注射可能処方物であって、少なくとも1種の長期作用性選択的β−2アドレナリン受容体アゴニスト;β−アドレナリン受容体アゴニストに対する標的組織の脱感作を減少させるための手段;および液体担体を含む、処方物を提供する。幾つかの実施形態において、少なくとも1種の長期作用性選択的β−2アドレナリン受容体アゴニストは、サルメテロール、フォルモテロール、それらの塩およびそれらの溶媒和物のうちの少なくとも1種を含む。
【0018】
他の実施形態は、脂肪蓄積物を処置する方法であって、脂肪蓄積物を薬学的有効量の長期作用性選択的β−2アドレナリン受容体アゴニストに接触させる;および脂肪蓄積物をβ−アドレナリン受容体アゴニストに対する標的組織の脱感作を減少させる薬学的有効量の化合物に接触させることを含む。
【0019】
幾つかの実施形態において、長期作用性選択的β−2アドレナリン受容体アゴニストは、サルメテロール、フォルモテロール、それらの塩およびそれらの溶媒和物のうちの少なくとも1種を含む。
【0020】
幾つかの実施形態において、β−アドレナリン受容体アゴニストに対する標的組織の脱感作を減少させる化合物は、グルココルチコステロイド、デキサメタゾン、プレドニゾロン、プロピオン酸フルチカゾン、ブデソニドおよびケトチフェンのうちの少なくとも1種を含む。
【0021】
幾つかの実施形態においては、長期作用性選択的β−2アドレナリン受容体アゴニスト、および脱感作を減少させる化合物のうちの少なくとも1種が、徐放性剤に添加される。
【0022】
幾つかの実施形態において、長期作用性選択的β−2アゴニストは、サルメテロールを含み、サルメテロールの薬学的有効量は、約100μg/日までである。幾つかの実施形態において、長期作用性選択的β−2アゴニストは、フォルモテロールを含み、フォルモテロールの薬学的有効量は、約50μg/日までである。
【0023】
幾つかの実施形態において、長期作用性選択的β−2アドレナリン受容体アゴニスト、および脱感作を減少させる化合物は、実質的に同時に送達される。幾つかの実施形態において、長期作用性選択的β−2アドレナリン受容体アゴニスト、および脱感作を減少させる化合物のうちの少なくとも1種は、単針注射により送達される。幾つかの実施形態において、長期作用性選択的β−2アドレナリン受容体アゴニスト、および脱感作を減少させる化合物のうちの少なくとも1種は、無針注射により送達される。幾つかの実施形態において、長期作用性選択的β−2アドレナリン受容体アゴニスト、および脱感作を減少させる化合物のうちの少なくとも1種は、経皮的に送達される。
【0024】
他の実施形態は、脂肪組織を減少させる方法であって、脂肪組織の領域においてβ−2アドレナリン受容体を増加させる薬学的有効量の化合物を投与する;および薬学的有効量の長期作用性選択的β−2受容体アゴニストを脂肪組織の領域に投与し、それによって脂肪組織の領域が脂肪分解および脂肪生成阻害の少なくとも1つを呈するようにすることを含む、方法を提供する。
【0025】
幾つかの実施形態においては、化合物の投与およびβ−2アドレナリン受容体アゴニストの投与のうちの少なくとも1つが、1日1回よりも低い頻度で行われる。
【0026】
他の実施形態は、局所性脂肪蓄積またはセルライトを処置する方法であって、局所性脂肪蓄積またはセルライトに、長期作用性選択的β−2アゴニスト;ならびにグルココルチコステロイドおよびケトチフェンのうちの少なくとも1種を含む組成物を投与することを含み、該組成物が持続性の脂肪分解活性を呈し、それによって局所性脂肪蓄積物またはセルライトの脂肪分解を促進する、方法を提供する。
【0027】
幾つかの実施形態において、長期作用性選択的β−2アゴニストは、サルメテロール、フォルモテロール、それらの塩およびそれらの溶媒和物のうちの少なくとも1種を含む。
【0028】
幾つかの実施形態は、定時間放出性(controlled release)担体、長期作用性選択的β−2アドレナリン受容体アゴニストおよびグルココルチコステロイドを含む定時間放出性処方物を提供する。定時間放出性担体は、局所性脂肪蓄積の処置において脂肪を減少させる。幾つかの実施形態において、長期作用性選択的β−2アゴニストは、サルメテロールおよび/またはフォルモテロールである。幾つかの実施形態において、定時間放出性担体は、生分解性ポリマーである。幾つかの実施形態において、生分解性ポリマーは、ラクチドおよびグリコリドを含む。幾つかの実施形態において、生分解性ポリマーは、微粒子として配合される。幾つかの実施形態において、グルココルチコイドは、フルチカゾン、ブデソニドおよび/またはデキサメタゾンである。幾つかの実施形態において、少なくとも1部の処方物は、無針注射デバイスを介して脂肪蓄積物に送達される。さらなる実施形態において、無針注射デバイスは、脂肪蓄積物における処方物の外拡散を促進する。
【0029】
幾つかの実施形態は、脂肪の一領域を処置することにより脂肪組織を減少させる方法であって、薬学的有効量のグルココルチコステロイドまたはケトチフェンを脂肪の一領域に投与することを含む方法を提供する。グルココルチコステロイドまたはケトチフェンは、脂肪領域中の脂肪細胞のβ−2アドレナリン受容体を増加させ、それにより局所性脂肪蓄積物に共投与した長期作用性選択的β−2受容体アゴニストの脂肪分解活性および/または脂肪生成阻害を向上させる。
【0030】
幾つかの実施形態において、長期作用性選択的β−2アゴニストは、サルメテロールである。幾つかの実施形態において、サルメテロールの薬学的有効量は、約100μg/日までである。幾つかの実施形態において、長期作用性選択的β−2アゴニストは、フォルモテロールである。幾つかの実施形態において、フォルモテロールの薬学的有効量は、約50μg/日までである。
【0031】
幾つかの実施形態は、脂肪の一領域を処置する方法であって、脂肪組織における持続性アドレナリン活性を有する親油性の実質的に選択的なβ−2受容体アゴニストを含む薬学的に有効な処方物を投与し、それによって持続性の脂肪分解を生じさせることを含む、方法を提供する。本方法の幾つかの実施形態はさらに、1日1回よりも低い頻度で処方物を投与することも含む。
【0032】
幾つかの実施形態は、局所性脂肪蓄積物またはセルライトを処置する方法であって、長期作用性の実質的に選択的なβ−2アゴニスト、およびグルココルチコステロイドまたはケトチフェンを含む組成物を投与することを含む、方法を提供する。本方法の実施形態は、耐性を有する脂肪組織における脂肪分解を促進し、持続性脂肪分解活性を呈し、それによって局所性脂肪蓄積を減少させ、セルライトの外観を改善する。
本発明は例えば、以下の項目を提供する。
(項目1)
脂肪組織の蓄積のための注射可能処方物であって、
長期作用性選択的β−2アドレナリン受容体アゴニスト;
β−アドレナリン受容体アゴニストに対する脂肪組織の脱感作を減少させるための化合物;および
液体担体
を含む、処方物。
(項目2)
長期作用性選択的β−2アドレナリン受容体アゴニストが親油性である、項目1に記載の処方物。
(項目3)
長期作用性選択的β−2アドレナリン受容体アゴニストが、サルメテロール、フォルモテロール、それらの塩およびそれらの溶媒和物のうちの少なくとも1種を含む、項目1に記載の処方物。
(項目4)
β−アドレナリン受容体アゴニストに対する標的組織の脱感作を減少させるための化合物が、グルココルチコステロイドを含む、項目1に記載の処方物。
(項目5)
β−アドレナリン受容体アゴニストに対する標的組織の脱感作を減少させるための化合物が、抗ヒスタミン剤を含む、項目1に記載の処方物。
(項目6)
β−アドレナリン受容体アゴニストに対する標的組織の脱感作を減少させるための化合物が、グルココルチコステロイドおよび抗ヒスタミン剤を含む、項目1に記載の処方物。
(項目7)
β−アドレナリン受容体アゴニストに対する標的組織の脱感作を減少させるための化合物が、デキサメタゾン、プレドニゾロン、プロピオン酸フルチカゾン、ブデソニド、ケトチフェンおよびそれらの類似体のうちの少なくとも1種を含む、項目1に記載の処方物。
(項目8)
液体担体が親油性液体担体を含む、項目1に記載の処方物。
(項目9)
長期作用性選択的β−2アドレナリン受容体アゴニストおよび脱感作を減少させるための化合物のうちの少なくとも1種が、徐放性剤に添加される、項目1に記載の処方物。
(項目10)
徐放性剤が、生分解性ポリマー、生分解性コポリマー、ヒドロゲルおよびリポソームのうちの少なくとも1種を含む、項目9に記載の処方物。
(項目11)
徐放性剤がポリ(ラクチドグリコリド)を含む、項目10に記載の処方物。
(項目12)
ポリ(ラクチドグリコリド)への有効成分添加量が約75%までである、項目11に記載の処方物。
(項目13)
サルメテロール、その塩およびその溶媒和物のうちの少なくとも1種;ならびに
フルチカゾン
を含む、項目1に記載の処方物。
(項目14)
フォルモテロール、その塩およびその溶媒和物のうちの少なくとも1種;ならびに
ブデソニド
を含む、項目1に記載の処方物。
(項目15)
サルメテロール、フォルモテロール、それらの塩およびそれらの溶媒和物のうちの少なくとも1種;ならびに
ケトチフェン
を含む、項目1に記載の処方物。
(項目16)
脂肪蓄積を処置するための注射可能処方物であって、
少なくとも1種の長期作用性選択的β−2アドレナリン受容体アゴニスト;
β−アドレナリン受容体アゴニストに対する標的組織の脱感作を減少させるための手段;および
液体担体
を含む、処方物。
(項目17)
少なくとも1種の長期作用性選択的β−2アドレナリン受容体アゴニストが、サルメテロール、フォルモテロール、それらの塩およびそれらの溶媒和物のうちの少なくとも1種を含む、項目16に記載の処方物。
(項目18)
脂肪蓄積物を処置するための方法であって、
脂肪蓄積物を薬学的有効量の長期作用性選択的β−2アドレナリン受容体アゴニストに接触させること;および
脂肪蓄積物をβ−アドレナリン受容体アゴニストに対する標的組織の脱感作を減少させるための薬学的有効量の化合物に接触させること
を含む、方法。
(項目19)
長期作用性選択的β−2アドレナリン受容体アゴニストが、サルメテロール、フォルモテロール、それらの塩およびそれらの溶媒和物のうちの少なくとも1種を含む、項目16に記載の方法。
(項目20)
β−アドレナリン受容体アゴニストに対する標的組織の脱感作を減少させるための化合物が、グルココルチコステロイド、デキサメタゾン、プレドニゾロン、プロピオン酸フルチカゾン、ブデソニドおよびケトチフェンのうちの少なくとも1種を含む、項目16に記載の方法。
(項目21)
長期作用性選択的β−2アドレナリン受容体アゴニストおよび脱感作を減少させるための化合物のうちの少なくとも1種が、徐放性剤に添加される、項目16に記載の方法。
(項目22)
長期作用性選択的β−2アゴニストがサルメテロールを含み、サルメテロールの薬学的有効量が約100μg/日までである、項目21に記載の方法。
(項目23)
長期作用性選択的β−2アゴニストがフォルモテロールを含み、フォルモテロールの薬学的有効量が約50μg/日までである、項目21に記載の方法。
(項目24)
長期作用性選択的β−2アドレナリン受容体アゴニストおよび脱感作を減少させるための化合物が、実質的に同時に送達される、項目16に記載の方法。
(項目25)
長期作用性選択的β−2アドレナリン受容体アゴニストおよび脱感作を減少させるための化合物のうちの少なくとも1種が、単針注射により送達される、項目16に記載の方法。
(項目26)
長期作用性選択的β−2アドレナリン受容体アゴニストおよび脱感作を減少させるための化合物のうちの少なくとも1種が、無針注射により送達される、項目16に記載の方法。
(項目27)
長期作用性選択的β−2アドレナリン受容体アゴニストおよび脱感作を減少させるための化合物のうちの少なくとも1種が、経皮的に送達される、項目16に記載の方法。
(項目28)
脂肪組織を減少させるための方法であって、
薬学的有効量の化合物を投与することであって、この化合物は、脂肪組織の領域におけるβ−2アドレナリン受容体を増加させる、こと;および
脂肪組織の領域に薬学的有効量の長期作用性選択的β−2受容体アゴニストを投与し、それによって脂肪組織の領域が脂肪分解および脂肪生成阻害のうちの少なくとも1つを呈すること
を含む、方法。
(項目29)
化合物の投与およびβ−2受容体アゴニストの投与のうちの少なくとも1つが、1日1回よりも低い頻度で行われる、項目28に記載の方法。
(項目30)
局所性脂肪蓄積物またはセルライトを処置するための方法であって、
局所性脂肪蓄積物またはセルライトに、
長期作用性選択的β−2アゴニスト;および、
グルココルチコステロイドおよびケトチフェンのうちの少なくとも1種
を含む組成物を投与することを含み、
組成物が徐放性の脂肪分解活性を呈し、それによって局所性脂肪蓄積物またはセルライトの脂肪分解を促進する、方法。
(項目31)
長期作用性選択的β−2アゴニストが、サルメテロール、フォルモテロール、それらの塩およびそれらの溶媒和物のうちの少なくとも1種を含む、項目30に記載の方法。
【図面の簡単な説明】
【0033】
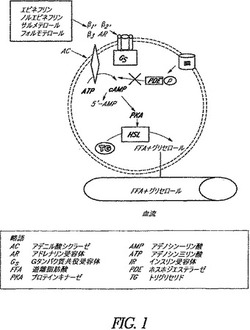
【図1】図1は、脂肪細胞の脂肪分解の概略図を示す。
【発明を実施するための形態】
【0034】
(好ましい実施形態の詳細な説明)
薬学的組成物、処方物、方法およびシステムの実施形態は、アドレナリン系調節を介して局所性脂肪、脂肪組織および脂肪細胞を減少させる療法を行う。本明細書で使用および/または引用される「調節」という用語は、通常その一般的な意味において使用され、より具体的には、アドレナリン受容体の作動作用、アドレナリン受容体の拮抗作用および/または受容体シグナル伝達経路の変化を指す。受容体シグナル伝達経路の変化の一例には、例えば、図1に概略図を示す通り、サイクリックAMPの増加がある。幾つかの実施形態において、調節は、受容体の上方制御若しくはアドレナリン受容体数の増加、受容体非活性化若しくは隔離の低下、受容体活性の変化(例えば、活性の増加)、および/または受容体親和性の変化を指す。
脂肪組織のアドレナリン受容体の持続調節の幾つかの実施形態は、持続性脂肪分解、脂肪細胞の脂質含量の減少、脂肪細胞のサイズの縮小、脂肪組織量若しくは脂肪蓄積の減少および/または美容的外観の改善の中の幾つかの組み合わせを生じると考えられる。幾つかの実施形態は、持続性アドレナリン調節を介してセルライト等の脂肪組織および脂肪細胞の局所性および/または皮下蓄積物の選択的減少を提供する。幾つかの実施形態において、持続性アドレナリン調節は、脂肪細胞増殖(脂肪生成)の持続性阻害を生じる。幾つかの実施形態において、本組成物は、セルライト脂肪蓄積および/または脂肪腫の処置に有用である。
【0035】
開示する薬学的組成物の実施形態は、1つ以上の化合物を組み合わせた1つ以上の長期作用性選択的β−2アドレナリン受容体アゴニストを含み、これらの化合物は、β−アドレナリン受容体アゴニスト、例えばグルココルチコステロイドまたはケトチフェンあるいはその類似体に対する標的組織の脱感作を減少させる。脱感作とは、短期間の脱感作(タキフィラキシー)および長期間の脱感作の両方ならびにそれ以外の期間の脱感作を含む。本明細書において、β−2アドレナリン受容体アゴニストもまた、「β−2アゴニスト」および「β−2受容体アゴニスト」と呼ばれる。また、特に明記しない限り、β−2アドレナリン受容体アゴニストの言及には、当該技術分野で既知のその類似体、生理学的に許容される塩および/または溶媒和物が含まれる。本組成物の幾つかの実施形態は、約100:1〜約1:100の長期作用性選択的β−2アゴニスト対グルココルチコステロイドを含む。
【0036】
上述の通り、脂肪分解活性および脂肪細胞増殖阻害は、脂肪組織および/または脂肪細胞におけるアドレナリン受容体の調節が媒介すると考えられる。幾つかの実施形態において、減量療法は、当該技術分野で既知の1つ以上のアドレナリン受容体アゴニストおよび/または受容体経路を刺激する化合物、例えばカテコールアミン、βアゴニスト、α拮抗薬、フォルスコリン、アミノフィリン、その類似体またはそれらの組み合わせの長期曝露または持続性活性により強化される。
【0037】
幾つかの実施形態は、1つ以上の実質的に選択的な長期作用性β−2受容体アゴニストを含む薬学的組成物の使用を介して持続性アドレナリン調節を提供する。持続活性を有する薬学的組成物の幾つかの実施形態は、当該技術分野で既知の1つ以上の好適な長期作用性選択的β−2アゴニスト、例えば、サルメテロール1、フォルモテロール2、バンブテロール3、それらの生理学的に許容される塩または溶媒和物、あるいはそれらの組み合わせを含む。
【0038】
【化1】

持続性アドレナリン調節は、アドレナリン化合物が一般的に血液および/またはリンパを通って脂肪組織から急速に除去されるため、一般的なアドレナリン組成物の皮下送達において認められない。さらに、アドレナリン剤、特にβ受容体アゴニストを脂肪組織への長時間曝露は、受容体リン酸化反応および隔離を介して受容体脱感作を生じると考えられる。これらの影響は、アドレナリン調節組成物の脂肪組織処理能を制限し、所望の脂肪分解および抗脂肪生成の効果に対して、初回用量投与後のアゴニストに対する身体の反応が急速に減少する状態であるタキフィラキシーを生じる。従って、処置の効果は短時間であり、頻繁な投与を必要とする。
【0039】
短期作用性β−2アゴニストは、多くの場合、上述の通りタキフィラキシーを生じる。しかし、長期作用性選択的β−2アゴニストの好ましい実施形態が、実質的に選択的なβ−2受容体の活性および高親油性を有することから、長期作用性β−2アゴニストの活性が短期作用性β−2アゴニストに比べて、脂肪組織内でより長時間継続する。部分的なβ−2受容体拮抗薬活性は、完全なアドレナリンアゴニストを脂肪細胞に継続的に曝露すると生じる可能性がある脱感作を予防する。従って、長期作用性選択的β−2アゴニストでは、タキフィラキシーが減少する。短期作用性β−2アゴニストに比べると、長期作用性選択的β−2アゴニストの方がより長い半減期を有することから、投与後より長い時間にわたり脂肪分解を行う。より長い半減期および活性を組み合わせることで、薬学的組成物の投与の回数を減少させる。従って、幾つかの実施形態において、本組成物の毎日の投与は必要とされない。さらに、長期作用性選択的β−2アゴニストの好ましい実施形態はまた、β−2受容体の選択性がより高くなり、これにより低用量の短期作用性β−2アゴニストを有する化合物と実質的に同様の治療効果を可能にする。
【0040】
上述の通り、脂肪分解および/または脂肪生成阻害は、β−1、2または3受容体サブタイプにより刺激される。従って、この1つ、2つおよび/または3つ全ての受容体に対するアゴニストは、脂肪分解および/または脂肪生成阻害を刺激することができる。ヒトにおいて、β−2受容体活性は、特に抗炎症性ステロイドまたはグルココルチコステロイドの存在下において、脂肪分解を刺激することはより重要であると考えられている。
【0041】
長期作用性選択的β−2アゴニスト、例えば、サルメテロール1(±2−(ヒドロキシメチル)−4−[1−ヒドロキシ−2−[6−(4−フェニルブトキシ)ヘキシルアミノ]エチル]−フェノール、CAS登録番号94749−08−3)およびフォルモテロール2(±N−[2−ヒドロキシ−5−[1−ヒドロキシ−2−[1−(4−メトキシフェニル)プロパン−2−イルアミノ]エチル]−フェニル]メタンアミド、CAS登録番号73573−87−2)は、幾つかの実施形態において好ましい。本組成物の幾つかの実施形態は、当該技術分野で既知の生理学的に許容される塩または溶媒和物として1つ以上の長期作用性選択的β−2アゴニスト、例えば、キシナホ酸サルメテロールおよび/またはフマル酸フォルモテロールを含む。当業者であれば、多くの場合、β−2アゴニストの塩および/または溶媒和物が所望の活性を有することを理解するであろう。従って、特に明記しない限り、有効成分、例えばサルメテロール1、フォルモテロール2、イソプロテレノール4、アルブテロール5、フェノテロールおよびフォルスコリンの言及には、それら自体の化合物、ならびに生理学的に許容されるそれらの類似体、塩および/または溶媒和物、あるいはそれらの組み合わせが含まれる。
【0042】
【化2】

幾つかの好ましい長期作用性βアゴニストは、内因性アデニル酸シクラーゼ活性が高く、これによりcAMP合成が増加する。例えば、幾つかの実施形態は、長期作用性選択的β−2アゴニストとしてフォルモテロール2を含み、これはより高い潜在性、低い全身性効果、高い内因性アデニル酸シクラーゼ活性化の幾つかを組み合わせを呈し、および/または脂肪分解の媒介物質であるサイクリックAMPを増加させる。
【0043】
幾つかの好ましい実施形態において、フォルモテロール2は、その生理学的に許容される塩および/または溶媒和物として存在する。フォルモテロール2の好適な生理学的に許容される塩は、当該技術分野で既知であり、例えば、無機および有機酸由来の酸付加塩、例えば、塩酸塩、臭化水素酸塩、硫酸塩、リン酸塩、マレイン酸塩、フマル酸塩、酒石酸塩、クエン酸塩、安息香酸塩、4−メトキシベンゾエート、2−ヒドロキシベンゾエート、4−ヒドロキシベンゾエート、4−クロロベンゾエート、p−トルエンスルホネート、メタンスルホネート、アスコルビン酸塩、サリチル酸塩、酢酸塩、コハク酸塩、乳酸塩、グルタル酸塩、グルコン酸塩、トリカルバリル酸塩、ヒドロキシナフタレンカルボキシレート、オレイン酸塩、それらの組み合わせ等がある。好ましい実施形態は、そのフマル酸塩および/または二水和物としてフォルモテロール2を含む。脂肪組織処置に好適なフォルモテロール2の組織濃度は、約1pM〜約100μM、より好ましくは、約10pM〜約100nMである。
【0044】
幾つかの好ましい実施形態は、長期作用性β−2アゴニストとしてサルメテロール1を含む。サルメテロール1は、部分的アゴニスト活性を呈し、これは、受容体脱感作を減少させると考えられる。幾つかの好ましい実施形態において、サルメテロール1は、その生理学的に許容されるその塩および/または溶媒和物として存在する。サルメテロール1の好適な生理学的に許容される塩は、当該技術分野で既知であり、例えば、無機および有機酸由来の酸付加塩、例えば、塩酸塩、臭化水素酸塩、硫酸塩、リン酸塩、マレイン酸塩、酒石酸塩、クエン酸塩、安息香酸塩、4−メトキシベンゾエート、2−ヒドロキシベンゾエート、4−ヒドロキシベンゾエート、4−クロロベンゾエート、p−トルエンスルホネート、メタンスルホネート、アスコルビン酸塩、サリチル酸塩、酢酸塩、フマル酸塩、コハク酸塩、乳酸塩、グルタル酸塩、グルコン酸塩、トリカルバリル酸塩、ヒドロキシナフタレンカルボキシレート、1−ヒドロキシ−2−ナフタレンカルボキシレート、3−ヒドロキシ−2−ナフタレンカルボキシレート、オレイン酸塩、その組み合わせ等がある。幾つかの好ましい実施形態は、1−ヒドロキシ−2−ナフタレンカルボキシレート塩(ヒドロキシナフトアート)としてサルメテロール1を含む。脂肪組織処置に好適なサルメテロール1の組織濃度は、約1pM〜約100μM、好ましくは約10nM〜約10μMである。
【0045】
幾つかの実施形態は、βアドレナリンアゴニストの光学的に純粋な異性体を含み、これは、脂肪分解および脂肪生成阻害を高め、潜在的副作用を減少させる。幾つかの実施形態において、これらの光学的に純粋な異性体は、例えば、生理学的効果がない、生理学的効果が少ない、負の効果を有する、および/または未確定の生理学的効果を有する1つ以上の異性体を排除することにより、より添加量が多い有効成分を処方物に含むことができる。望ましくないラセミ混合物の結合を除去することにより活性異性体またはユートマーを分離し、それによって不活性成分を除去することにより、より多くのユートマーを処方物に添加することができる。
【0046】
分子中の2つの立体中心は、一般的に2個のジアステレオマーを生成し、これは、本明細書において(R*,R*)および(R*,S*)ならびにその鏡像異性体と呼ばれている。ジアステレオマーは、鏡像異性体ではない立体異性体であり、即ち、1個のジアステレオマーの鏡像は、他のジアステレオマーに重ねることができない。鏡像異性体は、互いの鏡像である立体異性体である。ラセミ体は、鏡像異性体の1:1の混合物である。(R*,R*)ジアステレオマーの鏡像異性体は、(R,R)および(S,S)鏡像異性体と呼ばれ、これは互いの鏡像であり、それゆえ、幾つかの化学的および物理的特性、例えば、融点を共有する。同様に、(R,S)および(S,R)異性体は、(R*,S*)鏡像異性体の鏡像異性体である。例えば、フォルモテロール2は、1:1の(R,R)および(S,S)異性体のラセミ体、一般的にはフマル酸塩の二水和物として利用可能である。幾つかの好ましい実施形態は、(R,R)鏡像異性体、(R,R)フォルモテロールを含み、これは、長期作用性β−2アゴニストとしてより高い活性を示す。幾つかの実施形態は、他のβ−2アゴニスト、例えば(R)−サルメテロールの光学的に純粋な異性体を含む。
【0047】
さらに、薬学的組成物の幾つかの実施形態において、少なくとも1つの長期作用性選択的β−2アゴニストは、親油性が高く、それにより脂肪組織において持続活性を有する薬学的組成物を提供する。高い脂質溶解性は、脂肪組織内のβ−2アゴニストの滞留時間を延長し、それによって幾つかの実施形態における徐放性および/または定時間放出性担体の必要性を排除または減少すると考えられる。徐放性および/または定時間放出性担体の排除により、処方物の簡易化、費用の削減および/または安全性の向上の幾つか組み合わせを提供する。徐放性担体、例えば徐放性ポリマーを含む処方物において、以下でさらに詳述する通り、β−2アゴニストの親油性が高いと、徐放性担体への取込みが容易になる。
【0048】
サルメテロール1およびフォルモテロール2は、脂質溶解性が高く、これは脂肪組織および/または1つ以上の脂肪細胞中の滞留時間を延長する。本組成物の幾つかの実施形態は、親油性の高いβアゴニストを含み、これは、脂肪組織内の分配および隔離による徐放性または定時間放出性担体の必要性を少なくするか排除し、それによって処理効果が長く持続する。幾つかの実施形態において、少なくとも約1,000または少なくとも約10,000〜1の油水分配係数を有するβアゴニストが好ましい。例えば、サルメテロール1は、短期作用性親水性βアゴニストであるアルブテロール5の少なくとも10000倍以上の親油性を有する。さらに、サルメテロール1およびフォルモテロール2は、抗炎症性特性を有し、以下に考察する通りセルライトの処置に使用される。幾つかの実施形態において、これらはまた、細胞外マトリックスの好ましい変化を促進し、液体蓄積を減少させ、これによりセルライトおよび局所性脂肪蓄積の処置を向上させる。
【0049】
持続活性は、上述の通り、アドレナリンアゴニストを脂肪細胞に継続的に曝露する恐れが生じる脱感作(タキフィラキシー)を予防することによりさらに強化される。β−アドレナリン受容体アゴニストに対する標的組織の脱感作を減少させる化合物は、一般的に「グルココルチコステロイド」と呼ばれるが、この用語には、グルココルチコステロイドおよび好適な抗ヒスタミン剤、例えば、ケトチフェン等のβ−アドレナリン受容体アゴニストに対する標的組織の耐性を減少させる全ての好適な化合物を包含する。また、本明細書において、グルココルチコステロイドは、「抗炎症性ステロイド」、「グルココルチコイド」および/または「コルチコステロイド」と呼ばれる。グルココルチコイドは、β−2受容体数を増加させることにより耐性を持つ脂肪蓄積を感作することから、脂肪の蓄積よりも脂肪分解または脂肪の減少に好都合であると考えられる。グルココルチコイドはまた、α−2受容体数を減少させるとも考えられる。エストロゲンは、女性の皮下脂肪組織内のα−2アドレナリン受容体の発現を誘発することができ、α−2受容体に対するβ−2受容体の比率1未満が生じる。α−2受容体に対するβ−2受容体の約1を超える比率は、脂肪細胞の脂肪蓄積よりむしろ脂肪の減少を生じさせると考えられる。1つ以上のグルココルチコステロイドを含む組成物の幾つかの実施形態は、脂肪分解または脂肪生成阻害、例えば、特に女性の皮下脂肪組織のβアドレナリン刺激に耐性がある、β−2受容体数の減少、またはα−2受容体数の増加を含む脂肪の領域処置に有効である。
【0050】
グルココルチコステロイドは、βアゴニスト曝露の間の脂肪分解、脂肪生成阻害および/または局所性脂肪減少を高めると考えられる。幾つかの実施形態において、脂肪分解活性を増加させるグルココルチコステロイドによる脂肪細胞の処置は、標的組織内の脂肪分解活性およびβ−受容体数を維持および/または増加させる。好適なコルチコステロイドの例には、デキサメタゾン6、プレドニゾロン、プロピオン酸フルチカゾン7、ブデソニド8およびこれらの類似体が含まれる。幾つかの好ましい実施形態において、グルココルチコイドは、デキサメタゾン6(9−フルオロ−11,17−ジヒドロキシ−17−(2−ヒドロキシアセチル)−10,13,16−トリメチル−6,7,8,11,12,14,15,16−オクタヒドロシクロペンタ[a]フェナントレン−3−オン、CAS登録番号50−02−2)および/またはプロピオン酸フルチカゾン7である。上で考察した通り、脱感作を減少させる他の好ましい化合物は、ケトチフェン9である。これは抗ヒスタミン剤としても有用である。本組成物の幾つかの実施形態は、β−2アゴニストに対する脂肪組織の脱感作を減少させる1種の化合物を含む。他の実施形態は、複数の脱感作する化合物、例えば、複数のグルココルチコステロイドを含む。幾つかの好ましい実施形態は、少なくとも1種のグルココルチコステロイドおよび抗ヒスタミン剤のケトチフェンを含む。グルココルチコステロイドおよびケトチフェンの組み合わせは、ケトチフェンがβ−受容体隔離を予防する一方、グルココルチコステロイドがβ−受容体数を増加させ、それによりβ−受容体の全体的な効果を相乗的に増強するため、脱感作を減少させる場合により効果的であると考えられる。ケトチフェンの類似体も好適である。
【0051】
【化3】

幾つかの実施形態において、β−2受容体活性または密度の少なくとも1つは、特にβアゴニストの存在下において、抗炎症ステロイド剤またはケトチフェン投与に反応してヒト皮下脂肪細胞中で増加する。幾つかの実施形態においては、β−2受容体活性および/または密度を高めることにより、長時間および短期作用性β−2アゴニストの効果が増強される。さらに、幾つかの実施形態において、グルココルチコステロイドの曝露は、抗脂肪分解α−2アドレナリン受容体を下方制御し、これは多くの場合、例えばこれらの受容体数が多い皮下脂肪において特に有利である。従って、幾つかの実施形態において、グルココルチコステロイドは、β−2受容体刺激、脂肪分解、脂肪生成阻害および/またはアポトーシスの影響に対して皮下脂肪を感作および/またはα−2アドレナリン受容体に対するβ−2アドレナリン受容体の比率を増加させ、それにより脂肪蓄積から脂肪消失に脂肪組織のバランスをシフトさせる。
【0052】
本組成物の幾つかの実施形態は、さらに任意の成分を含む。例えば、セルライトおよび脂肪腫等の一定の脂肪蓄積は、線維性結合組織を含む。幾つかの状況においては、この線維性結合組織を分解する、例えば、覆っている皮膚の外観を改善することが有利である。本組成物の幾つかの実施形態は、線維性結合組織内のコラーゲンを分解するコラゲナーゼ等の酵素を含む。
【0053】
当該技術分野で既知の1つ以上の抗脂肪分解遮断薬、例えば、フェントラミン10(CAS登録番号73−05−2)またはヨヒンビン11(CAS登録番号146−48−5)等の選択的α−2受容体拮抗薬を含む本組成物の幾つかの実施形態は、局所性脂肪蓄積において抗脂肪分解効果を遮断する。脂肪細胞および脂肪組織の抗脂肪分解効果は、一般的に皮下および局所性の脂肪蓄積の範囲において認められる。例えば、βアゴニストに曝露した場合、皮下脂肪は、内臓脂肪に比べて脂肪分解速度が遅い。皮下脂肪を抗脂肪分解遮断薬に曝露することにより、幾つかの実施形態の脂肪分解活性を高める。
【0054】
【化4】

本組成物の幾つかの実施形態は、長期作用性選択的β2−アゴニストの効果を高めるその他のアドレナリン剤を含む。例えば、アミノフィリン12(1,3−ジメチル−7H−プリン−2,6−ジオン、ジエチルアミン CAS登録番号317−34−0)およびテオフィリン13(CAS登録番号58−55−9)は、サイクリックAMPの分解を遮断する脂肪分解剤である。
【0055】
【化5】

その他の任意の成分は、βアゴニスト結合により作成される二次信号を増加させる。例えば、幾つかの実施形態において、フォルスコリン14(CAS登録番号66575−29−9)を含む組成物は、アデニル酸シクラーゼを刺激し、それによって長時間作用するβアゴニストにより開始するサイクリックAMPの合成を増加する。サイクリックAMPの濃度の増加は、脂肪分解活性の維持に役立つ。
【0056】
【化6】

本組成物の幾つかの実施形態は、長期作用性βアゴニストおよびグルココルチコステロイドと組み合わせて成長ホルモンを含み、これは脂肪分解を刺激すると考えられる。
【0057】
本組成物の他の実施形態は、1つ以上の非選択的βアゴニスト、例えば、イソプロテレノール4および/または短期作用性選択的β−2アゴニスト、例えば、テルブタリンをさらに含む。幾つかの組成物は、α−2拮抗薬、またはその生理学的に許容される塩あるいは溶媒和物のうちの少なくとも1種を含む。
【0058】
本組成物の実施形態は、例えば、Remington: The Science And Practice Of Pharmacy(21st ed., Lippincott Williams & Wilkins)に記載されるような、当該技術分野で既知の何れかの好適な方法を使用して投与するために配合される。幾つかの実施形態において、本組成物は、処置が必要な範囲、例えば皮下脂肪沈着物の注射用に配合される。
【0059】
注射可能処方物に好適な賦形剤は、当該技術分野で既知である。幾つかの実施形態において、1つ以上のβ−2受容体アゴニストまたはグルココルチコステロイドは、液体担体に、例えば、溶液、懸濁液、ゲルおよび/または乳液として配合される。幾つかの実施形態は、当該技術分野で既知の好適な幾つかの親油性賦形剤、例えば、変性油(例えば、Cremophor(登録商標) BASF)、大豆油、プロピレングリコール、ポリエチレングリコール、誘導体化ポリエーテル、それらの組み合わせ等を含む。幾つかの実施形態は、以下でさらに詳述する通り、β−2受容体アゴニストおよび/またはグルココルチコステロイドのうちの少なくとも1種において微粒子および/またはナノ粒子担体を含む。幾つかの実施形態は、1つ以上の徐放性若しくは定時間放出性担体または剤、例えば、ポリマーミクロスフェアを含む。
【0060】
注射可能処方物は、当該技術分野で既知の幾つかの手段、例えば、単針、複針および/または無針注射デバイスを使用して投与される。幾つかの実施形態において、組織負荷量の有効成分は、注射により送達される好適な担体に配合される。幾つかの実施形態において、送達は単針注射を含む。幾つかの実施形態において、送達は、複針アレイを使用する注射を含み、これは、幾つかの実施形態において、標的組織内に処方物を広く分散させる。幾つかの実施形態において、処方物は、局所性脂肪減少を所望する範囲、例えば、顎下領域、腰部/臀部、側臀部若しくは大腿または眼窩周囲脂肪領域の適当な皮下脂肪層に分散させる様式で注射される。幾つかの実施形態において、処方物は、約0.5mL〜約1.0mLの一定分量にて注射する。幾つかの実施形態において、一定分量の処方物を約10cm2〜約20cm2の範囲全体に注射される。
【0061】
別の送達様態は、無針加圧注射デバイスを含む。幾つかの実施形態において、処方物は、これらのデバイスの内、例えば、ヘリウムまたは二酸化炭素等の気体を使用して機械的または空気圧により加圧後、小さなオリフィスを通って体組織に強制的に送達され、それにより処方物を皮下に送達される。無針注射に好適な処方物は、当該技術分野で既知であり、例えば液体、溶液、懸濁液、ゲル、コロイド、乳液および乾燥粉末がある。このシステムの有利な点は、一般的な針注射システムと比べて分散域が広いことである。適当な圧力下の無針注射は、処方物をより平面的な送達パターンに強制的に送達し、これは処方物の筋(finger)が最も抵抗の少ない経路に続いて放射状に広がる。それに対し、一般的な針注射による送達は、処方物を球形で送達することになる。無針注射もまた、注射圧およびオリフィスのサイズを調整することにより浸透の深さを正確に調整することができる。従って、無針注射は、表層脂肪蓄積を処置する処方物を皮下注射するための好ましい送達方法であり、これは、例えば、脂肪により生じた肌の窪みを滑らかにするのに有用である。幾つかの実施形態において、無針注射はまた、より深部の脂肪蓄積を標的とするより深部の、皮下の、筋膜下注射に使用する。無針デバイスはまた、側部に大きく広がる規定の領域全体に処方物を容易および簡便に複数回注射することを提供する。
【0062】
幾つかの実施形態において、β−2アゴニストおよび脱感作を減少させる化合物は、別々に投与され、例えば個別の処方物として注射される。β−2アゴニストと脱感作を減少させる化合物の共投与は、幾つかの実施形態において好ましいが、これは、幾つかの場合、β−2の存在下においてのみ減少した脱感作が認められるためである。
【0063】
本処方物の幾つかの実施形態は、徐放性若しくは定時間放出性のβ−2アゴニストおよび/またはグルココルチコステロイドを提供するための当該技術分野で既知の1つ以上の徐放性若しくは定時間放出性剤を含み、これらは、例えば徐放性若しくは定時間放出性剤または担体を封入、結合および/または抱合する。幾つかの実施形態において、生体適合性、生分解性、徐放性若しくは定時間放出性の処方物は、数週間から数ヶ月間にわたり局所の組織活性を提供する。好適な徐放性若しくは定時間放出性剤または担体は、当該技術分野で既知であり、例えば、ポリマー、巨大分子、有効成分抱合体、ヒドロゲル、その混成物等がある。徐放性担体の幾つかの実施形態は、脂肪、例えばリポソームを標的とする。好ましくは、徐放性材料は、単位時間当たり、特に少なくとも約3日間にわたり、より具体的には少なくとも約4日間から1年以内またはそれを超えて実質的に等量の有効物質の送達が容易になるように選択される。徐放性処方物の注射を数回、単一範囲を処置するために時間をかけて行うことができる。
【0064】
幾つかの実施形態において、徐放性剤は、ポリマー、例えば、ポリラクチド、ポリグリコリド、ポリ(ラクチドグリコリド)ポリ乳酸、ポリグリコール酸、ポリ無水物、ポリオルトエステル、ポリエーテルエステル、ポリカプロラクトン、ポリエステルアミド、ポリカーボネート、ポリシアノアクリレート、ポリウレタン、ポリアクリレートおよび上記の混和物、混合物またはコポリマーを含み、これらは、有効成分(例えばβアゴニストおよび/またはグルココルチコステロイド)を封入、結合または抱合するために使用される。徐放性ポリマーの幾つかの好ましい実施形態は、ポリエチレングリコール基を含み、これに1つ以上の有効成分を抱合する。幾つかの好ましい実施形態において、徐放性剤は、ポリ(ラクチドグリコリド)(PLGA、即ちポリ(乳酸−co−グリコール酸))コポリマー15を含む。
【0065】
【化7】

徐放性剤の幾つかの実施形態は、当該技術分野で既知の1つ以上のヒドロゲル、例えば、修飾アルギナートを含む。好適な修飾アルギナートの例には、WO98/12228に開示されるものが含まれる。徐放性剤の幾つかの実施形態は、アルブミン系ナノ粒子担体または賦形剤を含む。
【0066】
幾つかの実施形態において、プレポリマー溶液を含む処方物は、標的組織部位に注射され、次いで、インビボで重合化(例えば、光重合)または(例えば、温度感受性ゲル化材料を使用することにより)凝固化される。
【0067】
幾つかの実施形態において、定時間放出性材料は、組織減少の特定の用途のために作成した特性をここで放つ。幾つかの実施形態において、徐放性または定時間放出性剤を、微粒子、例えば、ミクロスフェアに形成し、これを注射溶液および/またはゲルとして配合する。幾つかの実施形態において、微粒子は、直径約10μm〜約100μmであり、一般的に大きさは均一である。例えば、幾つかの実施形態において、アルギナートおよび/またはポリ(ラクチド−co−グリコリド)15を含む処方物は、注射ゲルとして提供されるか、または当該技術分野で既知の方法を使用してミクロスフェアに加工される。微粒子処方物に好適な生分解性、生体適合性注射材料のその他の例には、キトサン、デキストラン、ヒドロキシアパタイトおよびケイ素が含まれる。
【0068】
ミクロスフェアおよび/または微粒子は、当該技術分野で既知の幾つかの方法、例えば、溶媒蒸発および/または乳化重合により形成される。幾つかの実施形態において、ミクロスフェアは、平均直径約5μm〜約60μm、好ましくは約20μmを有する。幾つかの実施形態において、PLGAは、所望する速度の有効成分の放出により決定する種々のラクチド対グリコリドの比率にて製造される。このコポリマーの分解速度がその結晶性および処方物中のグリコリドの比率に比例していることから、ラクチドおよび/またはグリコリドの非ラセミ体混合物は、結晶性を増加させ、分解速度を緩徐にする。グリコリドの比率が高いと、分解速度は向上する。幾つかの実施形態において、ラクチド約65〜75%対グリコリド約25%〜35%の比率により、約2週間〜約45日以上放出する有効成分が提供される。他の実施形態において、ラクチド対グリコリドの比率は、約0:100〜約100:0であり、それにより他の放出速度を提供する。
【0069】
ミクロスフェアまたは微粒子の幾つかの実施形態は、中空および/または多孔性内部を含む。幾つかの実施形態において、ミクロスフェアは、固体または多孔性外殻を含む。多孔性外殻および/またはミクロスフェアを含む処方物の幾つかの実施形態は、有効成分の二相性放出特性を呈し、この特性は、最初に有効成分を爆発的に放出し、続いてポリマーミクロスフェアの分解に関連する徐放性を有する。最初の爆発的な放出で組織に有効成分の脂肪分解/脂肪生成阻害の有効濃度を添加し、その後のより緩徐な放出により、所望の濃度を維持する。幾つかの実施形態において、種々のミクロスフェア構造および有効成分放出特性は、アドレナリン受容体調節により脂肪組織および脂肪細胞の処置効果を最適化する。幾つかの好ましい実施形態において、長期作用性選択的β−2アドレナリン剤、例えば、サルメテロール1および/またはフォルモテロール2の局所の組織濃度は、約10pM〜約10μMで持続する。
【0070】
幾つかの実施形態において、1つ以上の有効成分は、ポリマーミクロスフェアに比べて約10〜12質量%の比にてポリマーに封入、結合および/または抱合される。本明細書において、担体(例えば微粒子またはミクロスフェア)の質量パーセントとしての有効成分量は、「有効成分添加量」と呼ばれる。本明細書で使用される「添加される」および「添加する」とは、有効成分が担体に実質的に封入、結合および/または抱合されることを指す。幾つかの実施形態において、有効成分添加量は、約75%までである。従って、幾つかの好ましい処方物は、1つ以上のβ−2アドレナリン有効成分、例えば、サルメテロール1、フォルモテロール2および/またはそれらの生理学的に許容される塩および溶媒和物を含み、ポリマー約10〜約200mg当たり有効成分約1mg〜約20mgにてポリマーミクロスフェアに添加される。幾つかの実施形態において、この有効成分添加量を有する処方物は、脂肪分解および/または脂肪生成阻害の生成に好適な濃度の有効成分放出を約15日〜約45日間提供するのに十分である。
【0071】
幾つかの実施形態においては、2種以上の有効成分が、例えばリポソーム内の同じミクロスフェアに添加される。従って、幾つかの実施形態において、アドレナリン化合物中のグルココルチコステロイドを封入するポリマーは、脂肪組織に同時に送達される。あるいは、2種の有効成分が個別のミクロスフェアに添加される。次いで、2つの型のミクロスフェアが混合されて、所望の割合のβ−受容体アゴニストおよびグルココルチコステロイドを有する処方物を得た後、同時に投与される。あるいは、2つの型のミクロスフェアが連続して投与される。
【0072】
有効成分を含むミクロスフェアは、適当な生理学的に許容される液体担体約10mL〜20mLに懸濁される。有効成分の個別のミクロスフェアを使用する幾つかの実施形態において、ミクロスフェアは液体担体に一緒に混合される。他の実施形態において、各型のミクロスフェアは別々に液体担体と混合される。幾つかの実施形態において、ミクロスフェア懸濁液は次いで、例えば、セルライト処置のために、ミクロスフェア懸濁液1mL当たり約2.0cm2の範囲に広がるように、1.0mLの一定分量が真皮の真下に皮下注射される。幾つかの実施形態において、約10〜約20回の注射は、約20cm2〜約40cm2の範囲に広がるように投与される。他の実施形態においては、より広い範囲および/またはより狭い範囲が処置される。あるいは、ボーラス注射1.0mL〜10.0mLが、脂肪蓄積物、例えば、眼窩周囲領域、顎下領域、側臀部および臀部に注射される。あるいは、上記のような注射は、各有効成分を封入する2種のミクロスフェア処方物を使用して、同じ位置に別々におよび連続して実施される。
【0073】
無針注射を使用する幾つかの実施形態において、微粒子処方物は、懸濁液または粉末負荷微粒子として、即ち、液体担体を使用せずに注射される。
【0074】
幾つかの実施形態において、グルココルチコステロイド、例えば、デキサメタゾン6、ブデソニド8および/またはプロピオン酸フルチカゾン7もまた、抗炎症剤として作用し、それにより処方物の投与、例えば、徐放性処方物中のポリマー、ポリマーミクロスフェアおよび/またはリポソームにより生じる炎症を減少させる。
【0075】
PLGA15ミクロスフィアは、親水性化合物に比べて、疎水性化合物をより封入しやすい。幾つかの実施形態において、親水性有効成分の添加量を増やすため、ミクロスフェアを上述の通りポリエチレングリコール単位で修飾する。一定のサイズのミクロスフェアは、実質的に血液へ吸収されず、またはリンパによる除去はなく、それにより所望の位置に有効成分の放出を提供する。例えば、幾つかの実施形態において、ミクロスフェアは、直径約20μm〜約200μmである。幾つかの実施形態において、ミクロスフェアのサイズはまた、組織内の有効成分の放出特性に影響を及ぼす。一般的に、より大きなミクロスフェアは、より長く、より均一な放出特性を提供する傾向にある。
【0076】
徐放性処方物の例は、サルメテロール1および/またはフォルモテロール2約0.5mg〜約7.5mgおよびデキサメタゾン6、プロピオン酸フルチカゾン7および/またはブデソニド8約1.5mg〜約7.5mgを含み、これらは、約70ラクチド:30グリコリドの比率にてポリラクチドグリコリド(PLGA)15コポリマーミクロスフェア約100mgに封入される。幾つかの実施形態において、コポリマー比および有効成分封入は、約30日まででコポリマー約1mg当たり、サルメテロール1約1.0μg/日までおよび/またはフォルモテロール約0.5μgまでならびにフルチカゾンおよび/またはブデソニド6 5μg/日までを送達する。
【0077】
幾つかの実施形態は、非徐放性処方物を含む。幾つかの実施形態において、単回投与後の非徐放性処方物の長期作用性選択的β−2アゴニストの活性期間は、約4時間より長く、そして好ましくは約12または約24時間までである。それに対し、同様の条件下において、短期作用性選択的β−2アゴニストは、約4時間未満の活性を有し、約1時間未満である。非徐放性注射可能処方物の例には、脂質系賦形剤、例えば、Cremophor(登録商標)または等価物約10mLまでに配合した、キシナホ酸サルメテロール約100μg〜約250μgおよびプロピオン酸フルチカゾン7約500μg〜約1000μgが含まれる。
【0078】
幾つかの実施形態において、処方物は、当該技術分野で既知の好適な幾つかの方法、例えば、局所的に塗布するクリームまたはパッチを使用して経皮的に送達される。あるいは、当該技術分野で既知のその他の経皮的送達手段、例えば、電気的手段も有用である。特に長期作用性β−2アゴニスト、例えばフォルモテロール2、サルメテロール1またはバンブテロール3およびグルココルチコステロイドは、疎水性のため、皮膚への局所的塗布に適している。経皮的に送達可能な処方物の徐放性の実施形態は、当該技術分野で既知の通り、例えば、上述の通り、生分解性、生体適合性有効成分ポリマー処方物またはリポソーム処方物を使用して提供される。
【0079】
以上において特定の実施形態を記載してきたが、これらの実施形態は、単なる例として提示したものであり、本開示内容の適用範囲を限定することを目的としていない。当業者であれば、本明細書に記載した処方物、方法およびシステムがその他種々の形態で具体化される場合があることを理解するであろう。さらに、本明細書に記載した処方物、方法およびシステムの形態の種々の省略、置換および変更が、本開示内容の趣旨から逸脱することなく行われ得る。添付の特許請求の範囲およびその等価物は、このような形態または改変を包含することが企図される。
【技術分野】
【0001】
(関連出願の引用)
本出願は、米国特許法第119条(e)項の下で、2005年7月14日出願の米国仮出願第60/699,155号;2005年10月24日出願の米国仮出願第60/729,531号および2005年11月3日出願の米国仮出願第60/732,981号に対する優先権を主張する。これらの内容の全体は、本明細書中に参考として援用され、本明細書の一部とされる。
【0002】
(発明の背景)
(発明の分野)
本開示は、一般的には医療処置に、およびより具体的には脂肪沈着物の処置に関する。
【背景技術】
【0003】
(関連技術の説明)
脂肪組織は、体の主要なエネルギー貯蔵組織である。脂肪細胞または脂肪細胞は、このエネルギーをトリグリセリドの形態で貯蔵する。トリグリセリドを貯蔵脂肪から動員し、トリグリセリド加水分解のホルモン誘起を介して体内に熱量エネルギーを与える。このプロセスでは、他の体内組織に使用するために遊離または非エステル化脂肪酸およびグリセロールを血液に放出する。貯蔵脂肪からのトリグリセリドの分解は、脂肪分解と呼ばれる。また、新しい脂肪細胞の成長も生じており、これは脂肪生成と呼ばれる。
【0004】
運動を伴う減量プログラムは、アドレナリンの刺激を介して脂肪分解を刺激することができ、その結果、脂肪の減少が生じる。体内の脂肪分解を調節する1次ホルモンおよび神経伝達物質は、カテコールアミンである。脂肪組織は、β−1,2および3アドレナリン受容体およびα−2アドレナリン受容体を有する。βアゴニストが脂肪組織内のβ受容体に結合することで、脂肪細胞の脂肪分解が生じるのに対して、α受容体アゴニストが結合すると脂肪分解が阻害される可能性がある。β受容体活性化はまた、脂肪生成を阻害する可能性もある。ヒトにおいて、β−2受容体は、多くの場合、脂肪細胞表面に最も多く存在し、β受容体刺激性脂肪分解の第1の媒介物質である。βアゴニストによる脂肪分解の刺激は、アデニル酸シクラーゼが媒介し、環状アデノシン一リン酸(サイクリックAMP(cAMP))の形成を増加させる。
【0005】
貯蔵脂肪の蓄積は、体内に不均一に生じる可能性がある。例えば、脂肪を主に腹腔内に蓄積する者もいれば、主に皮下組織に蓄積する者もいる。性差も認められる場合があり、女性は大腿および側臀部に、男性は腰部に脂肪を蓄積する場合がある。女性は大腿に脂肪沈着物を蓄積する場合がある。これはしわが入っていたり、「オレンジの皮」のような外観をしており、セルライトと呼ばれる状態となる。セルライトは、皮下脂肪のヘルニア形成を招く皮膚構造物に関連しており、脂肪乳頭と呼ばれることもある。セルライトに関連する場合があるその他の因子には、結合組織性中隔の変化および/または減少、体液の蓄積につながる血管およびリンパの変化、ならびに炎症が含まれる。脂肪組織はまた、脂肪腫として知られる線維性脂肪沈着の形態で蓄積する場合もある。
【0006】
同様に、貯蔵脂肪の利用は不均一に生じる場合もある。実質的に体重が減少した人は、不健康な極端な減量を行わない限り、依然として減量に耐性のある局所性の脂肪蓄積嚢を有する場合がある。運動は皮下貯蔵脂肪に様々に影響を及ぼし、深部組織は脂肪分解に応答し、表皮貯蔵はより耐性を有する場合がある。セルライトは減量しても尚存在する場合もあり、脂肪腫は一般的に減量の影響を受けない。
【0007】
貯蔵脂肪の種々の利用は、一部にアドレナリン受容体の活性による場合がある。従って、特定の領域では、β−2受容体に比べてα−2受容体の活性が高いか、α−2受容体の数が多い場合があり、脂肪分解の低下につながる。幾つかの試験では、網、皮下腹部、大腿それぞれの脂肪組織におけるβアドレナリン受容体の刺激に対する脂肪分解活性の差が示されており、網が最も活性が高く、大腿が最も活性が低い結果となった。脂肪分解活性の差は、α−2受容体拮抗薬を添加することで除外することができ、これは、種々の脂肪組織領域において、過度のα−2受容体活性が、アドレナリン刺激に対する脂肪分解反応を低下させる原因であることを示唆している。
【0008】
皮下組織へのアドレナリン有効成分、即ちβアゴニストおよびα−2拮抗薬の送達は、既に提唱されており、局所性脂肪の減少が生じて、局所性脂肪蓄積物の外観が改善されることが示されている。例えば、イソプロテレノール11およびヨヒンビン8は、女性の大腿周囲径を減少させることが示されている。これらの試験では、大腿部に複数箇所、週に3〜5回βアゴニストを皮下投与することが必要であった。これは、局所性脂肪減少の市販製品としては実用的でなく、患者にかなりの不快感を与えている。これらの脂肪分解剤、特にβアゴニストは、短期作用型であり、脂肪組織から急速に排出される場合があることから、脂肪分解が注射後の極短時間にしか生じていなかった可能性があり、それにより複数回注射しても、潜在的な効果の程度が狭まっていた可能性がある。さらに、脂肪細胞にβアゴニストを長期間曝露すると、受容体の脱感作および下方制御ならびに脂肪分解活性の低下を生じる。これらの受容体に対する影響を減少または予防する手段は、治療法を改善する場合もある。
【発明の概要】
【課題を解決するための手段】
【0009】
(発明の要旨)
局所性脂肪沈着物を処置するための組成物、処方物、方法およびシステムは、標的脂肪沈着物を、長期作用性β−2アドレナリン受容体アゴニストを含む組成物、および長期作用性β−2アドレナリン受容体アゴニストに対する標的組織の脱感作を減少させる化合物、例えば、グルココルチコステロイドおよび/またはケトチフェンに接触させることを含む。本組成物の実施形態は、例えば、注射によりおよび/または経皮的に投与される。
【0010】
幾つかの実施形態は、脂肪組織の蓄積のための注射可能処方物であって、長期作用性選択的β−2アドレナリン受容体アゴニスト;β−アドレナリン受容体アゴニストに対する脂肪組織の脱感作を減少させる化合物;および液体担体を含む、処方物を提供する。
【0011】
幾つかの実施形態において、長期作用性選択的β−2アドレナリン受容体アゴニストは、親油性である。幾つかの実施形態において、長期作用性選択的β−2アドレナリン受容体アゴニストは、サルメテロール、フォルモテロール、それらの塩、およびそれらの溶媒和物のうちの少なくとも1種を含む。
【0012】
幾つかの実施形態において、β−アドレナリン受容体アゴニストに対する標的組織の脱感作を減少させる化合物は、グルココルチコステロイドを含む。幾つかの実施形態において、β−アドレナリン受容体アゴニストに対する標的組織の脱感作を減少させる化合物は、抗ヒスタミン剤を含む。幾つかの実施形態において、β−アドレナリン受容体アゴニストに対する標的組織の脱感作を減少させる化合物は、グルココルチコステロイドおよび抗ヒスタミン剤を含む。幾つかの実施形態において、β−アドレナリン受容体アゴニストに対する標的組織の脱感作を減少させる化合物は、デキサメタゾン、プレドニゾロン、プロピオン酸フルチカゾン、ブデソニド、ケトチフェン、およびそれらの類似体のうちの少なくとも1種を含む。
【0013】
幾つかの実施形態において、液体担体は、親油性液体担体を含む。
【0014】
幾つかの実施形態においては、長期作用性選択的β−2アドレナリン受容体アゴニスト、および脱感作を減少させる化合物のうちの少なくとも1種が、徐放性剤に添加される。幾つかの実施形態において、徐放性剤は、生分解性ポリマー、生分解性コポリマー、ヒドロゲルおよびリポソームのうちの少なくとも1種を含む。幾つかの実施形態において、徐放性剤は、ポリ(ラクチドグリコリド)を含む。幾つかの実施形態において、ポリ(ラクチドグリコリド)に添加する有効成分は、約75%までである。
【0015】
幾つかの実施形態は、サルメテロール、その塩およびその溶媒和物のうちの少なくとも1種;ならびにフルチカゾンを含む。
【0016】
幾つかの実施形態は、フォルモテロール、その塩およびその溶媒和物のうちの少なくとも1種;ならびにブデソニドを含む。幾つかの実施形態は、サルメテロール、フォルモテロール、それらの塩およびそれらの溶媒和物のうちの少なくとも1種;ならびにケトチフェンを含む。
【0017】
他の実施形態は、脂肪蓄積を処置するための注射可能処方物であって、少なくとも1種の長期作用性選択的β−2アドレナリン受容体アゴニスト;β−アドレナリン受容体アゴニストに対する標的組織の脱感作を減少させるための手段;および液体担体を含む、処方物を提供する。幾つかの実施形態において、少なくとも1種の長期作用性選択的β−2アドレナリン受容体アゴニストは、サルメテロール、フォルモテロール、それらの塩およびそれらの溶媒和物のうちの少なくとも1種を含む。
【0018】
他の実施形態は、脂肪蓄積物を処置する方法であって、脂肪蓄積物を薬学的有効量の長期作用性選択的β−2アドレナリン受容体アゴニストに接触させる;および脂肪蓄積物をβ−アドレナリン受容体アゴニストに対する標的組織の脱感作を減少させる薬学的有効量の化合物に接触させることを含む。
【0019】
幾つかの実施形態において、長期作用性選択的β−2アドレナリン受容体アゴニストは、サルメテロール、フォルモテロール、それらの塩およびそれらの溶媒和物のうちの少なくとも1種を含む。
【0020】
幾つかの実施形態において、β−アドレナリン受容体アゴニストに対する標的組織の脱感作を減少させる化合物は、グルココルチコステロイド、デキサメタゾン、プレドニゾロン、プロピオン酸フルチカゾン、ブデソニドおよびケトチフェンのうちの少なくとも1種を含む。
【0021】
幾つかの実施形態においては、長期作用性選択的β−2アドレナリン受容体アゴニスト、および脱感作を減少させる化合物のうちの少なくとも1種が、徐放性剤に添加される。
【0022】
幾つかの実施形態において、長期作用性選択的β−2アゴニストは、サルメテロールを含み、サルメテロールの薬学的有効量は、約100μg/日までである。幾つかの実施形態において、長期作用性選択的β−2アゴニストは、フォルモテロールを含み、フォルモテロールの薬学的有効量は、約50μg/日までである。
【0023】
幾つかの実施形態において、長期作用性選択的β−2アドレナリン受容体アゴニスト、および脱感作を減少させる化合物は、実質的に同時に送達される。幾つかの実施形態において、長期作用性選択的β−2アドレナリン受容体アゴニスト、および脱感作を減少させる化合物のうちの少なくとも1種は、単針注射により送達される。幾つかの実施形態において、長期作用性選択的β−2アドレナリン受容体アゴニスト、および脱感作を減少させる化合物のうちの少なくとも1種は、無針注射により送達される。幾つかの実施形態において、長期作用性選択的β−2アドレナリン受容体アゴニスト、および脱感作を減少させる化合物のうちの少なくとも1種は、経皮的に送達される。
【0024】
他の実施形態は、脂肪組織を減少させる方法であって、脂肪組織の領域においてβ−2アドレナリン受容体を増加させる薬学的有効量の化合物を投与する;および薬学的有効量の長期作用性選択的β−2受容体アゴニストを脂肪組織の領域に投与し、それによって脂肪組織の領域が脂肪分解および脂肪生成阻害の少なくとも1つを呈するようにすることを含む、方法を提供する。
【0025】
幾つかの実施形態においては、化合物の投与およびβ−2アドレナリン受容体アゴニストの投与のうちの少なくとも1つが、1日1回よりも低い頻度で行われる。
【0026】
他の実施形態は、局所性脂肪蓄積またはセルライトを処置する方法であって、局所性脂肪蓄積またはセルライトに、長期作用性選択的β−2アゴニスト;ならびにグルココルチコステロイドおよびケトチフェンのうちの少なくとも1種を含む組成物を投与することを含み、該組成物が持続性の脂肪分解活性を呈し、それによって局所性脂肪蓄積物またはセルライトの脂肪分解を促進する、方法を提供する。
【0027】
幾つかの実施形態において、長期作用性選択的β−2アゴニストは、サルメテロール、フォルモテロール、それらの塩およびそれらの溶媒和物のうちの少なくとも1種を含む。
【0028】
幾つかの実施形態は、定時間放出性(controlled release)担体、長期作用性選択的β−2アドレナリン受容体アゴニストおよびグルココルチコステロイドを含む定時間放出性処方物を提供する。定時間放出性担体は、局所性脂肪蓄積の処置において脂肪を減少させる。幾つかの実施形態において、長期作用性選択的β−2アゴニストは、サルメテロールおよび/またはフォルモテロールである。幾つかの実施形態において、定時間放出性担体は、生分解性ポリマーである。幾つかの実施形態において、生分解性ポリマーは、ラクチドおよびグリコリドを含む。幾つかの実施形態において、生分解性ポリマーは、微粒子として配合される。幾つかの実施形態において、グルココルチコイドは、フルチカゾン、ブデソニドおよび/またはデキサメタゾンである。幾つかの実施形態において、少なくとも1部の処方物は、無針注射デバイスを介して脂肪蓄積物に送達される。さらなる実施形態において、無針注射デバイスは、脂肪蓄積物における処方物の外拡散を促進する。
【0029】
幾つかの実施形態は、脂肪の一領域を処置することにより脂肪組織を減少させる方法であって、薬学的有効量のグルココルチコステロイドまたはケトチフェンを脂肪の一領域に投与することを含む方法を提供する。グルココルチコステロイドまたはケトチフェンは、脂肪領域中の脂肪細胞のβ−2アドレナリン受容体を増加させ、それにより局所性脂肪蓄積物に共投与した長期作用性選択的β−2受容体アゴニストの脂肪分解活性および/または脂肪生成阻害を向上させる。
【0030】
幾つかの実施形態において、長期作用性選択的β−2アゴニストは、サルメテロールである。幾つかの実施形態において、サルメテロールの薬学的有効量は、約100μg/日までである。幾つかの実施形態において、長期作用性選択的β−2アゴニストは、フォルモテロールである。幾つかの実施形態において、フォルモテロールの薬学的有効量は、約50μg/日までである。
【0031】
幾つかの実施形態は、脂肪の一領域を処置する方法であって、脂肪組織における持続性アドレナリン活性を有する親油性の実質的に選択的なβ−2受容体アゴニストを含む薬学的に有効な処方物を投与し、それによって持続性の脂肪分解を生じさせることを含む、方法を提供する。本方法の幾つかの実施形態はさらに、1日1回よりも低い頻度で処方物を投与することも含む。
【0032】
幾つかの実施形態は、局所性脂肪蓄積物またはセルライトを処置する方法であって、長期作用性の実質的に選択的なβ−2アゴニスト、およびグルココルチコステロイドまたはケトチフェンを含む組成物を投与することを含む、方法を提供する。本方法の実施形態は、耐性を有する脂肪組織における脂肪分解を促進し、持続性脂肪分解活性を呈し、それによって局所性脂肪蓄積を減少させ、セルライトの外観を改善する。
本発明は例えば、以下の項目を提供する。
(項目1)
脂肪組織の蓄積のための注射可能処方物であって、
長期作用性選択的β−2アドレナリン受容体アゴニスト;
β−アドレナリン受容体アゴニストに対する脂肪組織の脱感作を減少させるための化合物;および
液体担体
を含む、処方物。
(項目2)
長期作用性選択的β−2アドレナリン受容体アゴニストが親油性である、項目1に記載の処方物。
(項目3)
長期作用性選択的β−2アドレナリン受容体アゴニストが、サルメテロール、フォルモテロール、それらの塩およびそれらの溶媒和物のうちの少なくとも1種を含む、項目1に記載の処方物。
(項目4)
β−アドレナリン受容体アゴニストに対する標的組織の脱感作を減少させるための化合物が、グルココルチコステロイドを含む、項目1に記載の処方物。
(項目5)
β−アドレナリン受容体アゴニストに対する標的組織の脱感作を減少させるための化合物が、抗ヒスタミン剤を含む、項目1に記載の処方物。
(項目6)
β−アドレナリン受容体アゴニストに対する標的組織の脱感作を減少させるための化合物が、グルココルチコステロイドおよび抗ヒスタミン剤を含む、項目1に記載の処方物。
(項目7)
β−アドレナリン受容体アゴニストに対する標的組織の脱感作を減少させるための化合物が、デキサメタゾン、プレドニゾロン、プロピオン酸フルチカゾン、ブデソニド、ケトチフェンおよびそれらの類似体のうちの少なくとも1種を含む、項目1に記載の処方物。
(項目8)
液体担体が親油性液体担体を含む、項目1に記載の処方物。
(項目9)
長期作用性選択的β−2アドレナリン受容体アゴニストおよび脱感作を減少させるための化合物のうちの少なくとも1種が、徐放性剤に添加される、項目1に記載の処方物。
(項目10)
徐放性剤が、生分解性ポリマー、生分解性コポリマー、ヒドロゲルおよびリポソームのうちの少なくとも1種を含む、項目9に記載の処方物。
(項目11)
徐放性剤がポリ(ラクチドグリコリド)を含む、項目10に記載の処方物。
(項目12)
ポリ(ラクチドグリコリド)への有効成分添加量が約75%までである、項目11に記載の処方物。
(項目13)
サルメテロール、その塩およびその溶媒和物のうちの少なくとも1種;ならびに
フルチカゾン
を含む、項目1に記載の処方物。
(項目14)
フォルモテロール、その塩およびその溶媒和物のうちの少なくとも1種;ならびに
ブデソニド
を含む、項目1に記載の処方物。
(項目15)
サルメテロール、フォルモテロール、それらの塩およびそれらの溶媒和物のうちの少なくとも1種;ならびに
ケトチフェン
を含む、項目1に記載の処方物。
(項目16)
脂肪蓄積を処置するための注射可能処方物であって、
少なくとも1種の長期作用性選択的β−2アドレナリン受容体アゴニスト;
β−アドレナリン受容体アゴニストに対する標的組織の脱感作を減少させるための手段;および
液体担体
を含む、処方物。
(項目17)
少なくとも1種の長期作用性選択的β−2アドレナリン受容体アゴニストが、サルメテロール、フォルモテロール、それらの塩およびそれらの溶媒和物のうちの少なくとも1種を含む、項目16に記載の処方物。
(項目18)
脂肪蓄積物を処置するための方法であって、
脂肪蓄積物を薬学的有効量の長期作用性選択的β−2アドレナリン受容体アゴニストに接触させること;および
脂肪蓄積物をβ−アドレナリン受容体アゴニストに対する標的組織の脱感作を減少させるための薬学的有効量の化合物に接触させること
を含む、方法。
(項目19)
長期作用性選択的β−2アドレナリン受容体アゴニストが、サルメテロール、フォルモテロール、それらの塩およびそれらの溶媒和物のうちの少なくとも1種を含む、項目16に記載の方法。
(項目20)
β−アドレナリン受容体アゴニストに対する標的組織の脱感作を減少させるための化合物が、グルココルチコステロイド、デキサメタゾン、プレドニゾロン、プロピオン酸フルチカゾン、ブデソニドおよびケトチフェンのうちの少なくとも1種を含む、項目16に記載の方法。
(項目21)
長期作用性選択的β−2アドレナリン受容体アゴニストおよび脱感作を減少させるための化合物のうちの少なくとも1種が、徐放性剤に添加される、項目16に記載の方法。
(項目22)
長期作用性選択的β−2アゴニストがサルメテロールを含み、サルメテロールの薬学的有効量が約100μg/日までである、項目21に記載の方法。
(項目23)
長期作用性選択的β−2アゴニストがフォルモテロールを含み、フォルモテロールの薬学的有効量が約50μg/日までである、項目21に記載の方法。
(項目24)
長期作用性選択的β−2アドレナリン受容体アゴニストおよび脱感作を減少させるための化合物が、実質的に同時に送達される、項目16に記載の方法。
(項目25)
長期作用性選択的β−2アドレナリン受容体アゴニストおよび脱感作を減少させるための化合物のうちの少なくとも1種が、単針注射により送達される、項目16に記載の方法。
(項目26)
長期作用性選択的β−2アドレナリン受容体アゴニストおよび脱感作を減少させるための化合物のうちの少なくとも1種が、無針注射により送達される、項目16に記載の方法。
(項目27)
長期作用性選択的β−2アドレナリン受容体アゴニストおよび脱感作を減少させるための化合物のうちの少なくとも1種が、経皮的に送達される、項目16に記載の方法。
(項目28)
脂肪組織を減少させるための方法であって、
薬学的有効量の化合物を投与することであって、この化合物は、脂肪組織の領域におけるβ−2アドレナリン受容体を増加させる、こと;および
脂肪組織の領域に薬学的有効量の長期作用性選択的β−2受容体アゴニストを投与し、それによって脂肪組織の領域が脂肪分解および脂肪生成阻害のうちの少なくとも1つを呈すること
を含む、方法。
(項目29)
化合物の投与およびβ−2受容体アゴニストの投与のうちの少なくとも1つが、1日1回よりも低い頻度で行われる、項目28に記載の方法。
(項目30)
局所性脂肪蓄積物またはセルライトを処置するための方法であって、
局所性脂肪蓄積物またはセルライトに、
長期作用性選択的β−2アゴニスト;および、
グルココルチコステロイドおよびケトチフェンのうちの少なくとも1種
を含む組成物を投与することを含み、
組成物が徐放性の脂肪分解活性を呈し、それによって局所性脂肪蓄積物またはセルライトの脂肪分解を促進する、方法。
(項目31)
長期作用性選択的β−2アゴニストが、サルメテロール、フォルモテロール、それらの塩およびそれらの溶媒和物のうちの少なくとも1種を含む、項目30に記載の方法。
【図面の簡単な説明】
【0033】
【図1】図1は、脂肪細胞の脂肪分解の概略図を示す。
【発明を実施するための形態】
【0034】
(好ましい実施形態の詳細な説明)
薬学的組成物、処方物、方法およびシステムの実施形態は、アドレナリン系調節を介して局所性脂肪、脂肪組織および脂肪細胞を減少させる療法を行う。本明細書で使用および/または引用される「調節」という用語は、通常その一般的な意味において使用され、より具体的には、アドレナリン受容体の作動作用、アドレナリン受容体の拮抗作用および/または受容体シグナル伝達経路の変化を指す。受容体シグナル伝達経路の変化の一例には、例えば、図1に概略図を示す通り、サイクリックAMPの増加がある。幾つかの実施形態において、調節は、受容体の上方制御若しくはアドレナリン受容体数の増加、受容体非活性化若しくは隔離の低下、受容体活性の変化(例えば、活性の増加)、および/または受容体親和性の変化を指す。
脂肪組織のアドレナリン受容体の持続調節の幾つかの実施形態は、持続性脂肪分解、脂肪細胞の脂質含量の減少、脂肪細胞のサイズの縮小、脂肪組織量若しくは脂肪蓄積の減少および/または美容的外観の改善の中の幾つかの組み合わせを生じると考えられる。幾つかの実施形態は、持続性アドレナリン調節を介してセルライト等の脂肪組織および脂肪細胞の局所性および/または皮下蓄積物の選択的減少を提供する。幾つかの実施形態において、持続性アドレナリン調節は、脂肪細胞増殖(脂肪生成)の持続性阻害を生じる。幾つかの実施形態において、本組成物は、セルライト脂肪蓄積および/または脂肪腫の処置に有用である。
【0035】
開示する薬学的組成物の実施形態は、1つ以上の化合物を組み合わせた1つ以上の長期作用性選択的β−2アドレナリン受容体アゴニストを含み、これらの化合物は、β−アドレナリン受容体アゴニスト、例えばグルココルチコステロイドまたはケトチフェンあるいはその類似体に対する標的組織の脱感作を減少させる。脱感作とは、短期間の脱感作(タキフィラキシー)および長期間の脱感作の両方ならびにそれ以外の期間の脱感作を含む。本明細書において、β−2アドレナリン受容体アゴニストもまた、「β−2アゴニスト」および「β−2受容体アゴニスト」と呼ばれる。また、特に明記しない限り、β−2アドレナリン受容体アゴニストの言及には、当該技術分野で既知のその類似体、生理学的に許容される塩および/または溶媒和物が含まれる。本組成物の幾つかの実施形態は、約100:1〜約1:100の長期作用性選択的β−2アゴニスト対グルココルチコステロイドを含む。
【0036】
上述の通り、脂肪分解活性および脂肪細胞増殖阻害は、脂肪組織および/または脂肪細胞におけるアドレナリン受容体の調節が媒介すると考えられる。幾つかの実施形態において、減量療法は、当該技術分野で既知の1つ以上のアドレナリン受容体アゴニストおよび/または受容体経路を刺激する化合物、例えばカテコールアミン、βアゴニスト、α拮抗薬、フォルスコリン、アミノフィリン、その類似体またはそれらの組み合わせの長期曝露または持続性活性により強化される。
【0037】
幾つかの実施形態は、1つ以上の実質的に選択的な長期作用性β−2受容体アゴニストを含む薬学的組成物の使用を介して持続性アドレナリン調節を提供する。持続活性を有する薬学的組成物の幾つかの実施形態は、当該技術分野で既知の1つ以上の好適な長期作用性選択的β−2アゴニスト、例えば、サルメテロール1、フォルモテロール2、バンブテロール3、それらの生理学的に許容される塩または溶媒和物、あるいはそれらの組み合わせを含む。
【0038】
【化1】

持続性アドレナリン調節は、アドレナリン化合物が一般的に血液および/またはリンパを通って脂肪組織から急速に除去されるため、一般的なアドレナリン組成物の皮下送達において認められない。さらに、アドレナリン剤、特にβ受容体アゴニストを脂肪組織への長時間曝露は、受容体リン酸化反応および隔離を介して受容体脱感作を生じると考えられる。これらの影響は、アドレナリン調節組成物の脂肪組織処理能を制限し、所望の脂肪分解および抗脂肪生成の効果に対して、初回用量投与後のアゴニストに対する身体の反応が急速に減少する状態であるタキフィラキシーを生じる。従って、処置の効果は短時間であり、頻繁な投与を必要とする。
【0039】
短期作用性β−2アゴニストは、多くの場合、上述の通りタキフィラキシーを生じる。しかし、長期作用性選択的β−2アゴニストの好ましい実施形態が、実質的に選択的なβ−2受容体の活性および高親油性を有することから、長期作用性β−2アゴニストの活性が短期作用性β−2アゴニストに比べて、脂肪組織内でより長時間継続する。部分的なβ−2受容体拮抗薬活性は、完全なアドレナリンアゴニストを脂肪細胞に継続的に曝露すると生じる可能性がある脱感作を予防する。従って、長期作用性選択的β−2アゴニストでは、タキフィラキシーが減少する。短期作用性β−2アゴニストに比べると、長期作用性選択的β−2アゴニストの方がより長い半減期を有することから、投与後より長い時間にわたり脂肪分解を行う。より長い半減期および活性を組み合わせることで、薬学的組成物の投与の回数を減少させる。従って、幾つかの実施形態において、本組成物の毎日の投与は必要とされない。さらに、長期作用性選択的β−2アゴニストの好ましい実施形態はまた、β−2受容体の選択性がより高くなり、これにより低用量の短期作用性β−2アゴニストを有する化合物と実質的に同様の治療効果を可能にする。
【0040】
上述の通り、脂肪分解および/または脂肪生成阻害は、β−1、2または3受容体サブタイプにより刺激される。従って、この1つ、2つおよび/または3つ全ての受容体に対するアゴニストは、脂肪分解および/または脂肪生成阻害を刺激することができる。ヒトにおいて、β−2受容体活性は、特に抗炎症性ステロイドまたはグルココルチコステロイドの存在下において、脂肪分解を刺激することはより重要であると考えられている。
【0041】
長期作用性選択的β−2アゴニスト、例えば、サルメテロール1(±2−(ヒドロキシメチル)−4−[1−ヒドロキシ−2−[6−(4−フェニルブトキシ)ヘキシルアミノ]エチル]−フェノール、CAS登録番号94749−08−3)およびフォルモテロール2(±N−[2−ヒドロキシ−5−[1−ヒドロキシ−2−[1−(4−メトキシフェニル)プロパン−2−イルアミノ]エチル]−フェニル]メタンアミド、CAS登録番号73573−87−2)は、幾つかの実施形態において好ましい。本組成物の幾つかの実施形態は、当該技術分野で既知の生理学的に許容される塩または溶媒和物として1つ以上の長期作用性選択的β−2アゴニスト、例えば、キシナホ酸サルメテロールおよび/またはフマル酸フォルモテロールを含む。当業者であれば、多くの場合、β−2アゴニストの塩および/または溶媒和物が所望の活性を有することを理解するであろう。従って、特に明記しない限り、有効成分、例えばサルメテロール1、フォルモテロール2、イソプロテレノール4、アルブテロール5、フェノテロールおよびフォルスコリンの言及には、それら自体の化合物、ならびに生理学的に許容されるそれらの類似体、塩および/または溶媒和物、あるいはそれらの組み合わせが含まれる。
【0042】
【化2】

幾つかの好ましい長期作用性βアゴニストは、内因性アデニル酸シクラーゼ活性が高く、これによりcAMP合成が増加する。例えば、幾つかの実施形態は、長期作用性選択的β−2アゴニストとしてフォルモテロール2を含み、これはより高い潜在性、低い全身性効果、高い内因性アデニル酸シクラーゼ活性化の幾つかを組み合わせを呈し、および/または脂肪分解の媒介物質であるサイクリックAMPを増加させる。
【0043】
幾つかの好ましい実施形態において、フォルモテロール2は、その生理学的に許容される塩および/または溶媒和物として存在する。フォルモテロール2の好適な生理学的に許容される塩は、当該技術分野で既知であり、例えば、無機および有機酸由来の酸付加塩、例えば、塩酸塩、臭化水素酸塩、硫酸塩、リン酸塩、マレイン酸塩、フマル酸塩、酒石酸塩、クエン酸塩、安息香酸塩、4−メトキシベンゾエート、2−ヒドロキシベンゾエート、4−ヒドロキシベンゾエート、4−クロロベンゾエート、p−トルエンスルホネート、メタンスルホネート、アスコルビン酸塩、サリチル酸塩、酢酸塩、コハク酸塩、乳酸塩、グルタル酸塩、グルコン酸塩、トリカルバリル酸塩、ヒドロキシナフタレンカルボキシレート、オレイン酸塩、それらの組み合わせ等がある。好ましい実施形態は、そのフマル酸塩および/または二水和物としてフォルモテロール2を含む。脂肪組織処置に好適なフォルモテロール2の組織濃度は、約1pM〜約100μM、より好ましくは、約10pM〜約100nMである。
【0044】
幾つかの好ましい実施形態は、長期作用性β−2アゴニストとしてサルメテロール1を含む。サルメテロール1は、部分的アゴニスト活性を呈し、これは、受容体脱感作を減少させると考えられる。幾つかの好ましい実施形態において、サルメテロール1は、その生理学的に許容されるその塩および/または溶媒和物として存在する。サルメテロール1の好適な生理学的に許容される塩は、当該技術分野で既知であり、例えば、無機および有機酸由来の酸付加塩、例えば、塩酸塩、臭化水素酸塩、硫酸塩、リン酸塩、マレイン酸塩、酒石酸塩、クエン酸塩、安息香酸塩、4−メトキシベンゾエート、2−ヒドロキシベンゾエート、4−ヒドロキシベンゾエート、4−クロロベンゾエート、p−トルエンスルホネート、メタンスルホネート、アスコルビン酸塩、サリチル酸塩、酢酸塩、フマル酸塩、コハク酸塩、乳酸塩、グルタル酸塩、グルコン酸塩、トリカルバリル酸塩、ヒドロキシナフタレンカルボキシレート、1−ヒドロキシ−2−ナフタレンカルボキシレート、3−ヒドロキシ−2−ナフタレンカルボキシレート、オレイン酸塩、その組み合わせ等がある。幾つかの好ましい実施形態は、1−ヒドロキシ−2−ナフタレンカルボキシレート塩(ヒドロキシナフトアート)としてサルメテロール1を含む。脂肪組織処置に好適なサルメテロール1の組織濃度は、約1pM〜約100μM、好ましくは約10nM〜約10μMである。
【0045】
幾つかの実施形態は、βアドレナリンアゴニストの光学的に純粋な異性体を含み、これは、脂肪分解および脂肪生成阻害を高め、潜在的副作用を減少させる。幾つかの実施形態において、これらの光学的に純粋な異性体は、例えば、生理学的効果がない、生理学的効果が少ない、負の効果を有する、および/または未確定の生理学的効果を有する1つ以上の異性体を排除することにより、より添加量が多い有効成分を処方物に含むことができる。望ましくないラセミ混合物の結合を除去することにより活性異性体またはユートマーを分離し、それによって不活性成分を除去することにより、より多くのユートマーを処方物に添加することができる。
【0046】
分子中の2つの立体中心は、一般的に2個のジアステレオマーを生成し、これは、本明細書において(R*,R*)および(R*,S*)ならびにその鏡像異性体と呼ばれている。ジアステレオマーは、鏡像異性体ではない立体異性体であり、即ち、1個のジアステレオマーの鏡像は、他のジアステレオマーに重ねることができない。鏡像異性体は、互いの鏡像である立体異性体である。ラセミ体は、鏡像異性体の1:1の混合物である。(R*,R*)ジアステレオマーの鏡像異性体は、(R,R)および(S,S)鏡像異性体と呼ばれ、これは互いの鏡像であり、それゆえ、幾つかの化学的および物理的特性、例えば、融点を共有する。同様に、(R,S)および(S,R)異性体は、(R*,S*)鏡像異性体の鏡像異性体である。例えば、フォルモテロール2は、1:1の(R,R)および(S,S)異性体のラセミ体、一般的にはフマル酸塩の二水和物として利用可能である。幾つかの好ましい実施形態は、(R,R)鏡像異性体、(R,R)フォルモテロールを含み、これは、長期作用性β−2アゴニストとしてより高い活性を示す。幾つかの実施形態は、他のβ−2アゴニスト、例えば(R)−サルメテロールの光学的に純粋な異性体を含む。
【0047】
さらに、薬学的組成物の幾つかの実施形態において、少なくとも1つの長期作用性選択的β−2アゴニストは、親油性が高く、それにより脂肪組織において持続活性を有する薬学的組成物を提供する。高い脂質溶解性は、脂肪組織内のβ−2アゴニストの滞留時間を延長し、それによって幾つかの実施形態における徐放性および/または定時間放出性担体の必要性を排除または減少すると考えられる。徐放性および/または定時間放出性担体の排除により、処方物の簡易化、費用の削減および/または安全性の向上の幾つか組み合わせを提供する。徐放性担体、例えば徐放性ポリマーを含む処方物において、以下でさらに詳述する通り、β−2アゴニストの親油性が高いと、徐放性担体への取込みが容易になる。
【0048】
サルメテロール1およびフォルモテロール2は、脂質溶解性が高く、これは脂肪組織および/または1つ以上の脂肪細胞中の滞留時間を延長する。本組成物の幾つかの実施形態は、親油性の高いβアゴニストを含み、これは、脂肪組織内の分配および隔離による徐放性または定時間放出性担体の必要性を少なくするか排除し、それによって処理効果が長く持続する。幾つかの実施形態において、少なくとも約1,000または少なくとも約10,000〜1の油水分配係数を有するβアゴニストが好ましい。例えば、サルメテロール1は、短期作用性親水性βアゴニストであるアルブテロール5の少なくとも10000倍以上の親油性を有する。さらに、サルメテロール1およびフォルモテロール2は、抗炎症性特性を有し、以下に考察する通りセルライトの処置に使用される。幾つかの実施形態において、これらはまた、細胞外マトリックスの好ましい変化を促進し、液体蓄積を減少させ、これによりセルライトおよび局所性脂肪蓄積の処置を向上させる。
【0049】
持続活性は、上述の通り、アドレナリンアゴニストを脂肪細胞に継続的に曝露する恐れが生じる脱感作(タキフィラキシー)を予防することによりさらに強化される。β−アドレナリン受容体アゴニストに対する標的組織の脱感作を減少させる化合物は、一般的に「グルココルチコステロイド」と呼ばれるが、この用語には、グルココルチコステロイドおよび好適な抗ヒスタミン剤、例えば、ケトチフェン等のβ−アドレナリン受容体アゴニストに対する標的組織の耐性を減少させる全ての好適な化合物を包含する。また、本明細書において、グルココルチコステロイドは、「抗炎症性ステロイド」、「グルココルチコイド」および/または「コルチコステロイド」と呼ばれる。グルココルチコイドは、β−2受容体数を増加させることにより耐性を持つ脂肪蓄積を感作することから、脂肪の蓄積よりも脂肪分解または脂肪の減少に好都合であると考えられる。グルココルチコイドはまた、α−2受容体数を減少させるとも考えられる。エストロゲンは、女性の皮下脂肪組織内のα−2アドレナリン受容体の発現を誘発することができ、α−2受容体に対するβ−2受容体の比率1未満が生じる。α−2受容体に対するβ−2受容体の約1を超える比率は、脂肪細胞の脂肪蓄積よりむしろ脂肪の減少を生じさせると考えられる。1つ以上のグルココルチコステロイドを含む組成物の幾つかの実施形態は、脂肪分解または脂肪生成阻害、例えば、特に女性の皮下脂肪組織のβアドレナリン刺激に耐性がある、β−2受容体数の減少、またはα−2受容体数の増加を含む脂肪の領域処置に有効である。
【0050】
グルココルチコステロイドは、βアゴニスト曝露の間の脂肪分解、脂肪生成阻害および/または局所性脂肪減少を高めると考えられる。幾つかの実施形態において、脂肪分解活性を増加させるグルココルチコステロイドによる脂肪細胞の処置は、標的組織内の脂肪分解活性およびβ−受容体数を維持および/または増加させる。好適なコルチコステロイドの例には、デキサメタゾン6、プレドニゾロン、プロピオン酸フルチカゾン7、ブデソニド8およびこれらの類似体が含まれる。幾つかの好ましい実施形態において、グルココルチコイドは、デキサメタゾン6(9−フルオロ−11,17−ジヒドロキシ−17−(2−ヒドロキシアセチル)−10,13,16−トリメチル−6,7,8,11,12,14,15,16−オクタヒドロシクロペンタ[a]フェナントレン−3−オン、CAS登録番号50−02−2)および/またはプロピオン酸フルチカゾン7である。上で考察した通り、脱感作を減少させる他の好ましい化合物は、ケトチフェン9である。これは抗ヒスタミン剤としても有用である。本組成物の幾つかの実施形態は、β−2アゴニストに対する脂肪組織の脱感作を減少させる1種の化合物を含む。他の実施形態は、複数の脱感作する化合物、例えば、複数のグルココルチコステロイドを含む。幾つかの好ましい実施形態は、少なくとも1種のグルココルチコステロイドおよび抗ヒスタミン剤のケトチフェンを含む。グルココルチコステロイドおよびケトチフェンの組み合わせは、ケトチフェンがβ−受容体隔離を予防する一方、グルココルチコステロイドがβ−受容体数を増加させ、それによりβ−受容体の全体的な効果を相乗的に増強するため、脱感作を減少させる場合により効果的であると考えられる。ケトチフェンの類似体も好適である。
【0051】
【化3】

幾つかの実施形態において、β−2受容体活性または密度の少なくとも1つは、特にβアゴニストの存在下において、抗炎症ステロイド剤またはケトチフェン投与に反応してヒト皮下脂肪細胞中で増加する。幾つかの実施形態においては、β−2受容体活性および/または密度を高めることにより、長時間および短期作用性β−2アゴニストの効果が増強される。さらに、幾つかの実施形態において、グルココルチコステロイドの曝露は、抗脂肪分解α−2アドレナリン受容体を下方制御し、これは多くの場合、例えばこれらの受容体数が多い皮下脂肪において特に有利である。従って、幾つかの実施形態において、グルココルチコステロイドは、β−2受容体刺激、脂肪分解、脂肪生成阻害および/またはアポトーシスの影響に対して皮下脂肪を感作および/またはα−2アドレナリン受容体に対するβ−2アドレナリン受容体の比率を増加させ、それにより脂肪蓄積から脂肪消失に脂肪組織のバランスをシフトさせる。
【0052】
本組成物の幾つかの実施形態は、さらに任意の成分を含む。例えば、セルライトおよび脂肪腫等の一定の脂肪蓄積は、線維性結合組織を含む。幾つかの状況においては、この線維性結合組織を分解する、例えば、覆っている皮膚の外観を改善することが有利である。本組成物の幾つかの実施形態は、線維性結合組織内のコラーゲンを分解するコラゲナーゼ等の酵素を含む。
【0053】
当該技術分野で既知の1つ以上の抗脂肪分解遮断薬、例えば、フェントラミン10(CAS登録番号73−05−2)またはヨヒンビン11(CAS登録番号146−48−5)等の選択的α−2受容体拮抗薬を含む本組成物の幾つかの実施形態は、局所性脂肪蓄積において抗脂肪分解効果を遮断する。脂肪細胞および脂肪組織の抗脂肪分解効果は、一般的に皮下および局所性の脂肪蓄積の範囲において認められる。例えば、βアゴニストに曝露した場合、皮下脂肪は、内臓脂肪に比べて脂肪分解速度が遅い。皮下脂肪を抗脂肪分解遮断薬に曝露することにより、幾つかの実施形態の脂肪分解活性を高める。
【0054】
【化4】

本組成物の幾つかの実施形態は、長期作用性選択的β2−アゴニストの効果を高めるその他のアドレナリン剤を含む。例えば、アミノフィリン12(1,3−ジメチル−7H−プリン−2,6−ジオン、ジエチルアミン CAS登録番号317−34−0)およびテオフィリン13(CAS登録番号58−55−9)は、サイクリックAMPの分解を遮断する脂肪分解剤である。
【0055】
【化5】

その他の任意の成分は、βアゴニスト結合により作成される二次信号を増加させる。例えば、幾つかの実施形態において、フォルスコリン14(CAS登録番号66575−29−9)を含む組成物は、アデニル酸シクラーゼを刺激し、それによって長時間作用するβアゴニストにより開始するサイクリックAMPの合成を増加する。サイクリックAMPの濃度の増加は、脂肪分解活性の維持に役立つ。
【0056】
【化6】

本組成物の幾つかの実施形態は、長期作用性βアゴニストおよびグルココルチコステロイドと組み合わせて成長ホルモンを含み、これは脂肪分解を刺激すると考えられる。
【0057】
本組成物の他の実施形態は、1つ以上の非選択的βアゴニスト、例えば、イソプロテレノール4および/または短期作用性選択的β−2アゴニスト、例えば、テルブタリンをさらに含む。幾つかの組成物は、α−2拮抗薬、またはその生理学的に許容される塩あるいは溶媒和物のうちの少なくとも1種を含む。
【0058】
本組成物の実施形態は、例えば、Remington: The Science And Practice Of Pharmacy(21st ed., Lippincott Williams & Wilkins)に記載されるような、当該技術分野で既知の何れかの好適な方法を使用して投与するために配合される。幾つかの実施形態において、本組成物は、処置が必要な範囲、例えば皮下脂肪沈着物の注射用に配合される。
【0059】
注射可能処方物に好適な賦形剤は、当該技術分野で既知である。幾つかの実施形態において、1つ以上のβ−2受容体アゴニストまたはグルココルチコステロイドは、液体担体に、例えば、溶液、懸濁液、ゲルおよび/または乳液として配合される。幾つかの実施形態は、当該技術分野で既知の好適な幾つかの親油性賦形剤、例えば、変性油(例えば、Cremophor(登録商標) BASF)、大豆油、プロピレングリコール、ポリエチレングリコール、誘導体化ポリエーテル、それらの組み合わせ等を含む。幾つかの実施形態は、以下でさらに詳述する通り、β−2受容体アゴニストおよび/またはグルココルチコステロイドのうちの少なくとも1種において微粒子および/またはナノ粒子担体を含む。幾つかの実施形態は、1つ以上の徐放性若しくは定時間放出性担体または剤、例えば、ポリマーミクロスフェアを含む。
【0060】
注射可能処方物は、当該技術分野で既知の幾つかの手段、例えば、単針、複針および/または無針注射デバイスを使用して投与される。幾つかの実施形態において、組織負荷量の有効成分は、注射により送達される好適な担体に配合される。幾つかの実施形態において、送達は単針注射を含む。幾つかの実施形態において、送達は、複針アレイを使用する注射を含み、これは、幾つかの実施形態において、標的組織内に処方物を広く分散させる。幾つかの実施形態において、処方物は、局所性脂肪減少を所望する範囲、例えば、顎下領域、腰部/臀部、側臀部若しくは大腿または眼窩周囲脂肪領域の適当な皮下脂肪層に分散させる様式で注射される。幾つかの実施形態において、処方物は、約0.5mL〜約1.0mLの一定分量にて注射する。幾つかの実施形態において、一定分量の処方物を約10cm2〜約20cm2の範囲全体に注射される。
【0061】
別の送達様態は、無針加圧注射デバイスを含む。幾つかの実施形態において、処方物は、これらのデバイスの内、例えば、ヘリウムまたは二酸化炭素等の気体を使用して機械的または空気圧により加圧後、小さなオリフィスを通って体組織に強制的に送達され、それにより処方物を皮下に送達される。無針注射に好適な処方物は、当該技術分野で既知であり、例えば液体、溶液、懸濁液、ゲル、コロイド、乳液および乾燥粉末がある。このシステムの有利な点は、一般的な針注射システムと比べて分散域が広いことである。適当な圧力下の無針注射は、処方物をより平面的な送達パターンに強制的に送達し、これは処方物の筋(finger)が最も抵抗の少ない経路に続いて放射状に広がる。それに対し、一般的な針注射による送達は、処方物を球形で送達することになる。無針注射もまた、注射圧およびオリフィスのサイズを調整することにより浸透の深さを正確に調整することができる。従って、無針注射は、表層脂肪蓄積を処置する処方物を皮下注射するための好ましい送達方法であり、これは、例えば、脂肪により生じた肌の窪みを滑らかにするのに有用である。幾つかの実施形態において、無針注射はまた、より深部の脂肪蓄積を標的とするより深部の、皮下の、筋膜下注射に使用する。無針デバイスはまた、側部に大きく広がる規定の領域全体に処方物を容易および簡便に複数回注射することを提供する。
【0062】
幾つかの実施形態において、β−2アゴニストおよび脱感作を減少させる化合物は、別々に投与され、例えば個別の処方物として注射される。β−2アゴニストと脱感作を減少させる化合物の共投与は、幾つかの実施形態において好ましいが、これは、幾つかの場合、β−2の存在下においてのみ減少した脱感作が認められるためである。
【0063】
本処方物の幾つかの実施形態は、徐放性若しくは定時間放出性のβ−2アゴニストおよび/またはグルココルチコステロイドを提供するための当該技術分野で既知の1つ以上の徐放性若しくは定時間放出性剤を含み、これらは、例えば徐放性若しくは定時間放出性剤または担体を封入、結合および/または抱合する。幾つかの実施形態において、生体適合性、生分解性、徐放性若しくは定時間放出性の処方物は、数週間から数ヶ月間にわたり局所の組織活性を提供する。好適な徐放性若しくは定時間放出性剤または担体は、当該技術分野で既知であり、例えば、ポリマー、巨大分子、有効成分抱合体、ヒドロゲル、その混成物等がある。徐放性担体の幾つかの実施形態は、脂肪、例えばリポソームを標的とする。好ましくは、徐放性材料は、単位時間当たり、特に少なくとも約3日間にわたり、より具体的には少なくとも約4日間から1年以内またはそれを超えて実質的に等量の有効物質の送達が容易になるように選択される。徐放性処方物の注射を数回、単一範囲を処置するために時間をかけて行うことができる。
【0064】
幾つかの実施形態において、徐放性剤は、ポリマー、例えば、ポリラクチド、ポリグリコリド、ポリ(ラクチドグリコリド)ポリ乳酸、ポリグリコール酸、ポリ無水物、ポリオルトエステル、ポリエーテルエステル、ポリカプロラクトン、ポリエステルアミド、ポリカーボネート、ポリシアノアクリレート、ポリウレタン、ポリアクリレートおよび上記の混和物、混合物またはコポリマーを含み、これらは、有効成分(例えばβアゴニストおよび/またはグルココルチコステロイド)を封入、結合または抱合するために使用される。徐放性ポリマーの幾つかの好ましい実施形態は、ポリエチレングリコール基を含み、これに1つ以上の有効成分を抱合する。幾つかの好ましい実施形態において、徐放性剤は、ポリ(ラクチドグリコリド)(PLGA、即ちポリ(乳酸−co−グリコール酸))コポリマー15を含む。
【0065】
【化7】

徐放性剤の幾つかの実施形態は、当該技術分野で既知の1つ以上のヒドロゲル、例えば、修飾アルギナートを含む。好適な修飾アルギナートの例には、WO98/12228に開示されるものが含まれる。徐放性剤の幾つかの実施形態は、アルブミン系ナノ粒子担体または賦形剤を含む。
【0066】
幾つかの実施形態において、プレポリマー溶液を含む処方物は、標的組織部位に注射され、次いで、インビボで重合化(例えば、光重合)または(例えば、温度感受性ゲル化材料を使用することにより)凝固化される。
【0067】
幾つかの実施形態において、定時間放出性材料は、組織減少の特定の用途のために作成した特性をここで放つ。幾つかの実施形態において、徐放性または定時間放出性剤を、微粒子、例えば、ミクロスフェアに形成し、これを注射溶液および/またはゲルとして配合する。幾つかの実施形態において、微粒子は、直径約10μm〜約100μmであり、一般的に大きさは均一である。例えば、幾つかの実施形態において、アルギナートおよび/またはポリ(ラクチド−co−グリコリド)15を含む処方物は、注射ゲルとして提供されるか、または当該技術分野で既知の方法を使用してミクロスフェアに加工される。微粒子処方物に好適な生分解性、生体適合性注射材料のその他の例には、キトサン、デキストラン、ヒドロキシアパタイトおよびケイ素が含まれる。
【0068】
ミクロスフェアおよび/または微粒子は、当該技術分野で既知の幾つかの方法、例えば、溶媒蒸発および/または乳化重合により形成される。幾つかの実施形態において、ミクロスフェアは、平均直径約5μm〜約60μm、好ましくは約20μmを有する。幾つかの実施形態において、PLGAは、所望する速度の有効成分の放出により決定する種々のラクチド対グリコリドの比率にて製造される。このコポリマーの分解速度がその結晶性および処方物中のグリコリドの比率に比例していることから、ラクチドおよび/またはグリコリドの非ラセミ体混合物は、結晶性を増加させ、分解速度を緩徐にする。グリコリドの比率が高いと、分解速度は向上する。幾つかの実施形態において、ラクチド約65〜75%対グリコリド約25%〜35%の比率により、約2週間〜約45日以上放出する有効成分が提供される。他の実施形態において、ラクチド対グリコリドの比率は、約0:100〜約100:0であり、それにより他の放出速度を提供する。
【0069】
ミクロスフェアまたは微粒子の幾つかの実施形態は、中空および/または多孔性内部を含む。幾つかの実施形態において、ミクロスフェアは、固体または多孔性外殻を含む。多孔性外殻および/またはミクロスフェアを含む処方物の幾つかの実施形態は、有効成分の二相性放出特性を呈し、この特性は、最初に有効成分を爆発的に放出し、続いてポリマーミクロスフェアの分解に関連する徐放性を有する。最初の爆発的な放出で組織に有効成分の脂肪分解/脂肪生成阻害の有効濃度を添加し、その後のより緩徐な放出により、所望の濃度を維持する。幾つかの実施形態において、種々のミクロスフェア構造および有効成分放出特性は、アドレナリン受容体調節により脂肪組織および脂肪細胞の処置効果を最適化する。幾つかの好ましい実施形態において、長期作用性選択的β−2アドレナリン剤、例えば、サルメテロール1および/またはフォルモテロール2の局所の組織濃度は、約10pM〜約10μMで持続する。
【0070】
幾つかの実施形態において、1つ以上の有効成分は、ポリマーミクロスフェアに比べて約10〜12質量%の比にてポリマーに封入、結合および/または抱合される。本明細書において、担体(例えば微粒子またはミクロスフェア)の質量パーセントとしての有効成分量は、「有効成分添加量」と呼ばれる。本明細書で使用される「添加される」および「添加する」とは、有効成分が担体に実質的に封入、結合および/または抱合されることを指す。幾つかの実施形態において、有効成分添加量は、約75%までである。従って、幾つかの好ましい処方物は、1つ以上のβ−2アドレナリン有効成分、例えば、サルメテロール1、フォルモテロール2および/またはそれらの生理学的に許容される塩および溶媒和物を含み、ポリマー約10〜約200mg当たり有効成分約1mg〜約20mgにてポリマーミクロスフェアに添加される。幾つかの実施形態において、この有効成分添加量を有する処方物は、脂肪分解および/または脂肪生成阻害の生成に好適な濃度の有効成分放出を約15日〜約45日間提供するのに十分である。
【0071】
幾つかの実施形態においては、2種以上の有効成分が、例えばリポソーム内の同じミクロスフェアに添加される。従って、幾つかの実施形態において、アドレナリン化合物中のグルココルチコステロイドを封入するポリマーは、脂肪組織に同時に送達される。あるいは、2種の有効成分が個別のミクロスフェアに添加される。次いで、2つの型のミクロスフェアが混合されて、所望の割合のβ−受容体アゴニストおよびグルココルチコステロイドを有する処方物を得た後、同時に投与される。あるいは、2つの型のミクロスフェアが連続して投与される。
【0072】
有効成分を含むミクロスフェアは、適当な生理学的に許容される液体担体約10mL〜20mLに懸濁される。有効成分の個別のミクロスフェアを使用する幾つかの実施形態において、ミクロスフェアは液体担体に一緒に混合される。他の実施形態において、各型のミクロスフェアは別々に液体担体と混合される。幾つかの実施形態において、ミクロスフェア懸濁液は次いで、例えば、セルライト処置のために、ミクロスフェア懸濁液1mL当たり約2.0cm2の範囲に広がるように、1.0mLの一定分量が真皮の真下に皮下注射される。幾つかの実施形態において、約10〜約20回の注射は、約20cm2〜約40cm2の範囲に広がるように投与される。他の実施形態においては、より広い範囲および/またはより狭い範囲が処置される。あるいは、ボーラス注射1.0mL〜10.0mLが、脂肪蓄積物、例えば、眼窩周囲領域、顎下領域、側臀部および臀部に注射される。あるいは、上記のような注射は、各有効成分を封入する2種のミクロスフェア処方物を使用して、同じ位置に別々におよび連続して実施される。
【0073】
無針注射を使用する幾つかの実施形態において、微粒子処方物は、懸濁液または粉末負荷微粒子として、即ち、液体担体を使用せずに注射される。
【0074】
幾つかの実施形態において、グルココルチコステロイド、例えば、デキサメタゾン6、ブデソニド8および/またはプロピオン酸フルチカゾン7もまた、抗炎症剤として作用し、それにより処方物の投与、例えば、徐放性処方物中のポリマー、ポリマーミクロスフェアおよび/またはリポソームにより生じる炎症を減少させる。
【0075】
PLGA15ミクロスフィアは、親水性化合物に比べて、疎水性化合物をより封入しやすい。幾つかの実施形態において、親水性有効成分の添加量を増やすため、ミクロスフェアを上述の通りポリエチレングリコール単位で修飾する。一定のサイズのミクロスフェアは、実質的に血液へ吸収されず、またはリンパによる除去はなく、それにより所望の位置に有効成分の放出を提供する。例えば、幾つかの実施形態において、ミクロスフェアは、直径約20μm〜約200μmである。幾つかの実施形態において、ミクロスフェアのサイズはまた、組織内の有効成分の放出特性に影響を及ぼす。一般的に、より大きなミクロスフェアは、より長く、より均一な放出特性を提供する傾向にある。
【0076】
徐放性処方物の例は、サルメテロール1および/またはフォルモテロール2約0.5mg〜約7.5mgおよびデキサメタゾン6、プロピオン酸フルチカゾン7および/またはブデソニド8約1.5mg〜約7.5mgを含み、これらは、約70ラクチド:30グリコリドの比率にてポリラクチドグリコリド(PLGA)15コポリマーミクロスフェア約100mgに封入される。幾つかの実施形態において、コポリマー比および有効成分封入は、約30日まででコポリマー約1mg当たり、サルメテロール1約1.0μg/日までおよび/またはフォルモテロール約0.5μgまでならびにフルチカゾンおよび/またはブデソニド6 5μg/日までを送達する。
【0077】
幾つかの実施形態は、非徐放性処方物を含む。幾つかの実施形態において、単回投与後の非徐放性処方物の長期作用性選択的β−2アゴニストの活性期間は、約4時間より長く、そして好ましくは約12または約24時間までである。それに対し、同様の条件下において、短期作用性選択的β−2アゴニストは、約4時間未満の活性を有し、約1時間未満である。非徐放性注射可能処方物の例には、脂質系賦形剤、例えば、Cremophor(登録商標)または等価物約10mLまでに配合した、キシナホ酸サルメテロール約100μg〜約250μgおよびプロピオン酸フルチカゾン7約500μg〜約1000μgが含まれる。
【0078】
幾つかの実施形態において、処方物は、当該技術分野で既知の好適な幾つかの方法、例えば、局所的に塗布するクリームまたはパッチを使用して経皮的に送達される。あるいは、当該技術分野で既知のその他の経皮的送達手段、例えば、電気的手段も有用である。特に長期作用性β−2アゴニスト、例えばフォルモテロール2、サルメテロール1またはバンブテロール3およびグルココルチコステロイドは、疎水性のため、皮膚への局所的塗布に適している。経皮的に送達可能な処方物の徐放性の実施形態は、当該技術分野で既知の通り、例えば、上述の通り、生分解性、生体適合性有効成分ポリマー処方物またはリポソーム処方物を使用して提供される。
【0079】
以上において特定の実施形態を記載してきたが、これらの実施形態は、単なる例として提示したものであり、本開示内容の適用範囲を限定することを目的としていない。当業者であれば、本明細書に記載した処方物、方法およびシステムがその他種々の形態で具体化される場合があることを理解するであろう。さらに、本明細書に記載した処方物、方法およびシステムの形態の種々の省略、置換および変更が、本開示内容の趣旨から逸脱することなく行われ得る。添付の特許請求の範囲およびその等価物は、このような形態または改変を包含することが企図される。
【特許請求の範囲】
【請求項1】
薬学的調製物または美容的調製物として処方された注射可能処方物であって、該処方物は:
サルメテロール、フォルモテロール、およびそれらの塩からなる群から選択される、有効量の長期作用性β−2アドレナリン受容体アゴニスト;
デキサメタゾン、プレドニゾロン、フルチカゾン、ブデソニドおよびそれらの塩からなる群から選択される、有効量のグルココルチコステロイド;
液体担体;ならびに
薬学的に許容される賦形剤;
から本質的になり、該サルメテロール、フォルモテロール、およびそれらの塩、該グルココルチコステロイド、該液体担体、ならびに該薬学的に許容される賦形剤は、該処方物の注射を必要とするヒトの皮下脂肪層への注射のために処方される、処方物。
【請求項2】
(a)前記サルメテロール、フォルモテロール、およびそれらの塩、ならびに(b)前記グルココルチコステロイドの、顎下領域、腰部、臀部、側臀部もしくは大腿から選択される局所性脂肪部位の皮下脂肪層への分散を可能にする、請求項1に記載の処方物。
【請求項3】
前記サルメテロールは塩として存在する、請求項1に記載の処方物。
【請求項4】
前記グルココルチコステロイドは、プロピオン酸フルチカゾンである、請求項1に記載の処方物。
【請求項5】
前記液体担体は、親油性液体担体である、請求項1に記載の処方物。
【請求項1】
薬学的調製物または美容的調製物として処方された注射可能処方物であって、該処方物は:
サルメテロール、フォルモテロール、およびそれらの塩からなる群から選択される、有効量の長期作用性β−2アドレナリン受容体アゴニスト;
デキサメタゾン、プレドニゾロン、フルチカゾン、ブデソニドおよびそれらの塩からなる群から選択される、有効量のグルココルチコステロイド;
液体担体;ならびに
薬学的に許容される賦形剤;
から本質的になり、該サルメテロール、フォルモテロール、およびそれらの塩、該グルココルチコステロイド、該液体担体、ならびに該薬学的に許容される賦形剤は、該処方物の注射を必要とするヒトの皮下脂肪層への注射のために処方される、処方物。
【請求項2】
(a)前記サルメテロール、フォルモテロール、およびそれらの塩、ならびに(b)前記グルココルチコステロイドの、顎下領域、腰部、臀部、側臀部もしくは大腿から選択される局所性脂肪部位の皮下脂肪層への分散を可能にする、請求項1に記載の処方物。
【請求項3】
前記サルメテロールは塩として存在する、請求項1に記載の処方物。
【請求項4】
前記グルココルチコステロイドは、プロピオン酸フルチカゾンである、請求項1に記載の処方物。
【請求項5】
前記液体担体は、親油性液体担体である、請求項1に記載の処方物。
【図1】




【公開番号】特開2011−132262(P2011−132262A)
【公開日】平成23年7月7日(2011.7.7)
【国際特許分類】
【外国語出願】
【出願番号】特願2011−83171(P2011−83171)
【出願日】平成23年4月4日(2011.4.4)
【分割の表示】特願2008−521646(P2008−521646)の分割
【原出願日】平成18年7月13日(2006.7.13)
【出願人】(508011728)リセラ,インコーポレイテッド (3)
【Fターム(参考)】
【公開日】平成23年7月7日(2011.7.7)
【国際特許分類】
【出願番号】特願2011−83171(P2011−83171)
【出願日】平成23年4月4日(2011.4.4)
【分割の表示】特願2008−521646(P2008−521646)の分割
【原出願日】平成18年7月13日(2006.7.13)
【出願人】(508011728)リセラ,インコーポレイテッド (3)
【Fターム(参考)】
[ Back to top ]

