局所眼科用ペプチド製剤
ペプチドの局所眼科用製剤、並びに眼の疾病、好ましくは眼球後区の疾病の治療及び/又は局所的な予防のためのそれらの使用。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は医薬の分野に属し、具体的には、ソマトスタチン及びソマトスタチンアナログの局所眼科用組成物の形態である医薬製剤に関する。
【背景技術】
【0002】
網膜及び硝子体の疾病は、失明の主な原因であり、それらの中でも糖尿病性網膜症及び加齢黄斑変性は特に目立っている。
【0003】
眼球後区の疾病におけるソマトスタチン受容体の過剰発現のエビデンスに基づき、これらの疾患の治療におけるソマトスタチン及びアナログの潜在的な使用が従来技術において言及されているが、治療効果の明確な例は全くない。
【0004】
ヒトの眼の種々の部分における内在性のソマトスタチン及びソマトスタチン受容体の存在が最近記載されている。したがって、例えば、ソマトスタチン受容体sstr1、sstr2、及びsstr5は、涙腺、結膜、角膜、及び鼻涙管に検出されている[Minsel et al.,Endocrinology,2009,150(5):2254−2263]。眼球後区において、健常なヒトの眼の網膜、毛様体、及び脈絡膜におけるソマトスタチン受容体sstr1、sstr2、sstr3、sstr4、及びsstr5に対応する遺伝子の存在が記載されており[Klisovic et al.,Investigative Ophthalmology & Visual Science,2001,42(10):2193−2201]、網膜におけるsstr2及びsstr3のmRNAの存在が[van Hagen et al.,European Journal of Endocrinology,2000,143:S43−S51;Cervia et al.,Molecular and Cellular Endocrinology,2008,286:112−122]、硝子体液及び網膜における内在性ソマトスタチンの存在も[Simo et al.,Diabetes Care,2002,25(12):2282−2286]記載されている。おそらくは網膜神経変性に関連する糖尿病性網膜症の第1期の網膜においてソマトスタチンの発現が低下することも従来技術において知られている[Carrasco et al.,Diabetes Care,2007,30(11):1−7]。
【0005】
全身性、局所、眼内、及び眼球周囲の投与など、眼球後区の疾病の治療のための薬物の、異なる投与経路がある。
【0006】
文書国際公開第02/09739A1号パンフレットは、眼疾患の治療又は予防のためのソマトスタチン又はそのアナログの使用を記載している。この文書中で挙げられた投与経路のうち、好ましい経路は、皮下又は筋肉内の全身性の非経口投与であり、ソマトスタチン又はそのアナログの投与のための点眼剤の形態の製剤は、前記文書に全く示されていない。しかし、全身性投与の場合、眼への薬物の透過を制限する血管網膜関門により、眼球後区において治療濃度に達するのは困難である。全身性投与の他の一般的な欠点には、その効果が局所的でなく、眼球後区にのみには向けられないことがある。さらに、ソマトスタチンの場合、血中で不安定なため、高い投与量が必要であろう。アナログであるオクトレオチドの場合、その結果が明らかな治療効果を示さないとしても、異なる臨床試験により全身性皮下投与によるその効果が評価されている[Wegewitz et al.,Current Pharmaceutical Design,2005,11:2311−2330;Palii et al.,Investigative Ophthalmology & Visual Science,2008,49(11):5094−5102]。
【0007】
眼球後区における全身性投与経路の低いアベイラビリティに代わるものとして、眼内注射並びに結膜下、テノン嚢下、及び球後注射などの眼球周囲の注射又は眼球後区への結膜下インプラントによる、この部分への局所投与がある[Geroski et al.,Investigative Ophthalmology & Visual Science,2000,41(5):961−964;Kiagiadaki et al.Investigative Ophthalmology & Visual Science,2008,49(7):3080−3089]。しかし、これらの投与形態は患者にとって快適でなく、繰り返し実施されると頻度が増す二次作用を呈する。さらに、インプラントの場合、外科的処置が伴う。これらの種類の治療は前臨床試験において有効であると示されているが、それらは定期的な注射の実施を必要とし、場合によっては、網膜剥離、白内障、皮膚潮紅、又は眼内炎などの二次作用を有する[Geroski et al.,Investigative Ophthalmology & Visual Science,2000,41(5):961−964;Herrero−Vanrell et al,Journal of Drug Delivery Science and Technology,2007,17(1):11−17;Robertson et al.,Journal of Ocular Pharmacology and Therapeutics,1997,13(2):171−177]。
【0008】
眼に薬物を投与する前述の経路に代わる他の経路として、局所眼投与がある。しかし、標的が眼球後区にある薬物の投与経路としての局所眼チャネル(local ocular channel)は、後区に到達できる作用物質のパーセンテージが大多数の場合にほとんどないという評価により、現在まで制限されてきた[Andres−Guerrero et al.,Archivos de la Sociedad Espanola de Oftalmologia,2008,83:683−686]。
【0009】
従来技術の中で、ソマトスタチン及びアナログの局所眼投与の選択肢がいくつか言及されてきた。従って、例えば、文書米国特許出願公開第2005/074497A1号明細書は、眼球後区の疾病の治療のためのオクトレオチドなどの血管新生阻害剤を含むヒドロゲルを記載している。オクトレオチドは、この特許出願において、莫大な薬物リストの中に開示されている。さらに、オクトレオチド又は他の薬物の例はこの文書に全く記載されていない。ヒドロゲルは、コンタクトレンズを使用して眼に接触して配置されているか、或いは、それは接着剤の使用又は外科的処置により眼に取り付けられる。点眼剤による投与は、この文書中では明白に除外されている。しかし、コンタクトレンズを使用する投与は、眼が病原体に感染するリスクを伴い、さらに、眼内圧が増加した患者には許容されない。
【0010】
他の可能性は、瞼の内側への軟膏又は油薬の形態の局所投与である。しかし、軟膏剤は不快になりやすく、その過度な粘性及び吸収の遅さのため視力を下げる。
【0011】
国際公開第99/24019A1号パンフレットは、溶液中に再構成され眼科用点眼剤として投与される、種々の薬物、とりわけソマトスタチンからできている乾燥固体製剤も記載している。しかし、この文書は、ソマトスタチンの製剤の例も、点眼剤を使用して適用される眼球後区に到達するこの薬物又は他の薬物の適応症も与えていない。
【0012】
その一方で、米国特許第5182258A号明細書は、鼻涙系により全身性投与に使用される点眼剤の形態の製剤であって、投与される有効成分が他の多くの薬物の中でもソマトスタチンになり得る製剤を記載している。しかし、眼球後区の疾病の治療のためのこの成分又は他の有効成分の投与については、この文書には何も言われていない。従来技術における他の製剤で同じことが起こっており、眼球後区の疾病の治療及び/又は予防のための可能な用途が示されなずに、局所経路によりオクトレオチドが投与されている[Danesi et al.,Clinical Cancer Research,1997,3:265−272;Demir et al.Documenta Ophthalmologica,2003,107:87−92]。
【0013】
したがって、患者の不快感の問題及び薬学的に許容できる製剤における低い治療利用可能性の問題の両方を解決する、眼球後区の疾病の局所的な治療及び/又は予防のためのソマトスタチン又はそのアナログの局所眼投与の形態を見いだす必要が従来技術にある。
【0014】
本発明の目的は、眼球後区に到達し、そこに存在するソマトスタチン受容体に結合し、ソマトスタチン又はそのアナログのソマトスタチン受容体への結合から利益を得る眼球後区の疾病の治療及び/又は予防のために適用される、ソマトスタチン又はそのアナログの局所眼科用組成物、眼に局所投与される液体医薬製剤である。本発明は、ペプチド、特にソマトスタチン又はそのアナログの局所眼科用投与における前例のない打開策を提供する。
【発明の概要】
【0015】
驚くべきことに、本発明は、先に記載された問題を解決する。第一の態様において、本発明は、ペプチドを含む局所眼科用組成物において、治療上有効な量のこのペプチドが眼球後区に到達することを特徴とする組成物に関する。特定の実施形態において、局所眼科用組成物は、点眼剤、軟膏剤、及び油薬の群から選択される。さらなる態様において、本発明は、ペプチドを含む点眼剤において、治療上有効な量のこのペプチドが眼球後区に到達することを特徴とする点眼剤に関する。
【0016】
本発明の文脈において、「点眼剤」という用語は、眼の外部表面に液滴の形態で投与され眼球後区に局所作用を有する液体医薬製剤に関する。
【0017】
本発明の文脈において、「眼球後区」という用語は、脈絡膜、網膜色素上皮、網膜、黄斑、中心窩、視神経、及び硝子体液を含む。
【0018】
特定の実施形態において、ペプチドは、ソマトスタチン又はソマトスタチンアナログから選択され、好ましくは、ソマトスタチン又はソマトスタチンアナログは、ソマトスタチン−28、ソマトスタチン−14、ソマトスタチン−13、プロソマトスタチン、オクトレオチド、ランレオチド、バプレオチド、パシレオチド、セグリチド、コルチスタチン、及びそれらの薬学的に許容できる塩により形成される群から選択される。
【0019】
他の特定の実施形態において、ソマトスタチン又はソマトスタチンアナログは、アシル基又はポリエチレングリコール部分により置換されている。好ましくは、アシル基は、アセチル、tert−ブタノイル、ヘキサノイル、2−メチルヘキサノイル、シクロヘキサンカルボキシル、オクタノイル、デカノイル、ラウロイル、ミリストイル、パルミトイル、ステアロイル、オレオイル、及びリノレオイルからなる群から選択される。好ましくは、ポリエチレングリコール部分は、分子量が、200から35,000ダルトンである。
【0020】
他の特定の実施形態において、ペプチド、好ましくは、ソマトスタチン又はソマトスタチンアナログの濃度は、0.1μg/mLから100mg/mL、好ましくは1μg/mLから10mg/mL、より好ましくは10μg/mLから1mg/mLである。
【0021】
他の特定の実施形態において、点眼剤のpHは、3から8、好ましくは4から7である。点眼剤のpHを調整するために、当業者に公知である酸及び/又は塩基が加えられて、先のpH値に達するだろう。
【0022】
他の特定の実施形態において、本発明における点眼剤ビヒクルは、塩化ナトリウム又はホウ酸の等張溶液などの水性等張液であるか、又はポリ(ビニルアルコール)水溶液又はこれらの混合物である。
【0023】
他の特定の実施形態において、本発明の組成物のペプチドは、リポソーム、混合リポソーム、ニオソーム、エトソーム、ナノ粒子、固体脂質ナノ粒子、ナノ構造脂質キャリア、ミセル、界面活性剤の混合ミセル、界面活性剤−リン脂質混合ミセル、ナノスフィア、リポスフィア、及びナノカプセルに組み込むこともできる。
【0024】
他の特定の実施形態において、本発明の点眼剤は、場合により保存剤を含んでよい。当業者は、塩化ベンザルコニウム、安息香酸、アルキルパラベン、安息香酸アルキル、クロロブタノール、クロロクレゾール、セチルアルコール、ヘキサデシルアルコールなどの脂肪族アルコール、酢酸塩、硝酸フェニル水銀、又はホウ酸塩などの水銀の有機金属化合物、ジアゾリジニル尿素、アジピン酸ジイソプロピル、ジメチルポリシロキサン、EDTAの塩、ビタミンE、及びその混合物などの従来技術の保存剤を認識する。
【0025】
他の特定の実施形態において、本発明の点眼剤は、ペプチド、好ましくはペプチドソマトスタチン又はソマトスタチンアナログの眼球後区への透過性を増大させる薬剤を場合により含んでよい。好ましくは、透過性を増大させる薬剤は、とりわけ、塩化ベンザルコニウム、サポニン、脂肪酸、ポリオキシエチレン脂肪族エーテル、脂肪酸のアルキルエステル、ピロリドン、ポリビニルピロリドン、ピルビン酸、ピログルタミン酸、及びこれらの混合物により形成される群から選択される。
【0026】
第二の態様において、本発明は、眼球後区の疾病の治療及び/又は予防のための本発明の点眼剤に関する。好ましくは、眼球後区の疾病の治療及び/又は予防は、ソマトスタチン又はそのアナログのソマトスタチン受容体への結合から利益を得る。より好ましくは、眼球後区の疾病は、非増殖性糖尿病性網膜症、増殖性糖尿病性網膜症、加齢黄斑変性、網膜の血管新生の疾病、虚血誘導性網膜症、未熟児網膜症、鎌状赤血球網膜症、網膜静脈閉塞症、色素性網膜炎、脈絡膜血管新生、ブドウ膜炎、黄斑浮腫、嚢胞様黄斑浮腫により形成される群から選択される。ソマトスタチンの場合、血清中の半減期に対して眼球後区の硝子体液におけるその安定性が高いので、先に言及された眼球後区の疾病の治療及び/又は予防のための局所レベルでのその作用に好都合である。
【0027】
第三の態様において、本発明は、眼球後区の疾病の治療及び/又は予防の方法であって、点眼剤、軟膏剤、及び油薬からなる群から選択される局所眼科用組成物による、治療上有効な量のペプチドの局所投与を含む方法に関する。
【0028】
特定の実施形態において、ペプチドは、ソマトスタチン又はソマトスタチンアナログから選択され、好ましくは、ソマトスタチン又はソマトスタチンアナログは、ソマトスタチン−28、ソマトスタチン−14、ソマトスタチン−13、プロソマトスタチン、オクトレオチド、ランレオチド、バプレオチド、パシレオチド、セグリチド、コルチスタチン、及びそれらの薬学的に許容できる塩により形成される群から選択される。
【0029】
他の特定の実施形態において、投与の頻度は、各対象の必要性、及び治療又は予防すべき疾病の重症度により大きく変わることがあり、週に1回から1日10回の投与範囲、好ましくは週に3回から1日3回、さらにより好ましくは1日に1回又は2回の投与範囲が推奨される。
【0030】
他の特定の実施形態において、治療及び/又は予防の方法は、眼球後区の疾病の治療及び/又は予防のための他の治療剤の投与をさらに含む。眼球後区の治療及び/又は予防のための治療剤には、例えば、非限定的に、抗血管内皮細胞成長因子(VEGF)、プロスタグランジンアナログ、βアドレナリン受容体アンタゴニスト、アルファ−2−アドレナリンアゴニスト、炭酸脱水酵素阻害薬、縮瞳薬、モノクローナル抗体、コルチコステロイド、グルココルチコイド、キナーゼ阻害剤、毛様体筋麻痺薬、又は代謝拮抗剤の群から選択される薬剤がある。眼球後区の疾病の治療及び/又は予防のためのこれらの治療剤の投与は、局所経路でも、経口経路でも、非経口経路でもよい。本発明の文脈において、「非経口」という用語は、硝子体内、眼内、角膜内、皮下、皮内、静脈内などの血管内注射、筋肉内、及び他の類似の注射若しくは注入技術を含む。
【0031】
本明細書で提供される以下の具体的な実施例は、本発明の本質を説明するのに役立つ。これらの実施例は説明の目的のためだけに含められ、本明細書に特許請求される本発明に対する制限として理解されるべきでない。
【図面の簡単な説明】
【0032】
【図1】図1は、右眼(+)にソマトスタチンを、左眼(−)にプラセボを受け取った2匹のマウス(1及び2)の網膜を示す。
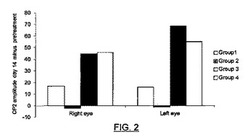
【図2】図2は、対照ラット(1群);糖尿病ラット(2群);ソマトスタチンにより治療された糖尿病ラット(3群)及びオクトレオチドにより治療された糖尿病ラット(4群)の第2のOPの振幅の差を示す。
【図3】図3は、共焦点顕微鏡画像を示す。40倍の共焦点GFAP免疫組織化学。STZ誘発糖尿病ラット(2群)の神経節細胞層において、はるかに高いGFAP発現(一番明るい標識)が観察された。ソマトスタチン(3群)又はオクトレオチド(4群)による治療は、対照(1群)に類似のGFAPレベルと相関するグリア細胞活性化を予防した。
【図4】図4は、共焦点顕微鏡画像を示す。40倍のタネルの共焦点画像。網膜変性は、特に、STZ誘発糖尿病ラット(2群)に観察されるONLにおける、多数のアポトーシス細胞(最も明るい標識はタネル陽性であることを意味する)と相関した。ソマトスタチン(3群)及びオクトレオチド(4群)による治療は網膜変性を予防し、健常な対照ラット(1群)に見られるのと類似な細胞数を示した。
【実施例】
【0033】
実施例1:ソマトスタチン−14を含む点眼剤
125μLの0.9%塩化ナトリウムを5mgのソマトスタチン−14に加えることにより、ソマトスタチンの医薬組成物を点眼剤の形態で調製した。
【0034】
実施例2:網膜における局所眼科用ソマトスタチンの濃度の評価
8週齢のC57BL/6マウスを使用した。動物の取扱い及び管理は、Institut de Recerca del Hospital Universitari Vall d’Hebronプロトコル並びに欧州経済共同体及びA.R.V.O.(視覚と眼科学研究協会)の国際指針(86/609/CEE指令)に従って実施した。動物を、12時間続く一定の明暗周期下で、温度(20°)及び湿度(60%)を制御した動物施設の個別ケージ内に飼育し、飼料及び水を適宜与えた。実施例1のソマトスタチン−14の点眼剤(5μLの一滴)を右眼に投与し、プラセボ(食塩水)を左眼に投与した。1滴を朝に、もう1滴を夕方に、1日2滴を、5日間投与した。最後の投与の2時間後に、麻酔下で頸椎脱臼により動物を安楽死させた。直後に、眼球を取り出し、取扱いまで−80°で凍結させた。拡大鏡の下で眼球を切開することにより、眼球後区(網膜及び硝子体液)を眼球の残りの部分から分離した。網膜中のソマトスタチン−14の量をウェスタンブロットにより測定した。Complete(商標)プロテアーゼ阻害剤カクテルを含む、50mMのTris−HCl、pH 7.9、300mMのKCl、1.5mMのMgCl2、0.1%のノニデットP−40、及び20%のグリセロールの4℃の溶液でタンパク質を12時間抽出した。その後、試料を10分間遠心分離した(4℃で12,000rpm)。ソマトスタチン−14に対するウサギ抗体(ab53165, abcam)により、タンパク質にウェスタンブロットを実施した。得られたソマトスタチン−14の濃度を規格化するために、□−アクチンを対照として使用した。特異的な抗体抗原複合体を、HRPによりマーキングされたウサギIgGに対するヤギ抗体又はヤギIgGに対するウサギ抗体を化学発光基質(Pierce Biotechnology Inc.,Rockfort,Illinois,USA)と共に使用して、X線写真フィルムに露光することにより確認した。濃度測定分析を実施し(Densitometer GS−800、Bio−Rad Laboratories、Hercules,California,USA)、結果を任意単位として表示する。図1は、右眼(+)にソマトスタチンを、左眼(−)にプラセボを受け取った2匹のマウス(1及び2)の網膜を示す。分かるとおり、ソマトスタチンの量は、両動物において治療された眼において多かった。両方の眼にプラセボを受け取った対照マウスでは、両眼でソマトスタチンの濃度に差は検出されなかった。
【0035】
実施例3:ヒト硝子体液及びヒト血清におけるソマトスタチンの安定性
ソマトスタチンを、90%でヒト血清又はヒト硝子体液と共に37℃でインキュベートした。異なるインキュベーション時間でアリコートを抜き取った。アセトニトリルを加えて、血清タンパク質を沈殿させ、遠心分離して、上清を濾過し、RP−HPLC(勾配:30分で20−80%のB、B=アセトニトリル中0.07%TFA)に注入した。初期の生成物の消失を、初期の生成物に対応する面積を利用して分析し、半減期を計算した。ソマトスタチンの半減期は、血清中で2.7時間、硝子体液中で64時間であった。
【0036】
実施例4:ソマトスタチン−14を含む点眼剤
1mLの0.9%塩化ナトリウム水溶液を10mgのソマトスタチン−14に加えることにより、ソマトスタチンの医薬組成物を点眼剤の形態で調製した。最後に、溶液を0.22μmの滅菌フィルターに通して濾過した。
【0037】
実施例5:オクトレオチドを含む点眼剤
1mLの0.9%塩化ナトリウム水溶液を10mgのオクトレオチドに加えることにより、オクトレオチドの医薬組成物を点眼剤の形態で調製した。最後に、溶液を0.22μmの滅菌フィルターに通して濾過した。
【0038】
実施例6:バプレオチドを含む点眼剤
1mLの0.9%塩化ナトリウム水溶液を10mgのバプレオチドに加えることにより、バプレオチドの医薬組成物を点眼剤の形態で調製した。最後に、溶液を0.22μmの滅菌フィルターに通して濾過した。
【0039】
実施例7:コルチスタチンを含む点眼剤
1mLの0.9%塩化ナトリウム水溶液を10mgのコルチスタチンに加えることにより、コルチスタチンの医薬組成物を点眼剤の形態で調製した。最後に、溶液を0.22μmの滅菌フィルターに通して濾過した。
【0040】
実施例8:ソマトスタチン−14を含む点眼剤
1mLの0.9%塩化ナトリウム及び1.4%のポリ(ビニルアルコール)水溶液を0.27mgのソマトスタチン−14に加えることにより、ソマトスタチンの医薬組成物を点眼剤の形態で調製した。最後に、溶液を0.22μmの滅菌フィルターに通して濾過した。
【0041】
実施例9:ソマトスタチン−28を含む点眼剤
1mLの0.9%塩化ナトリウム水溶液を0.05mgのソマトスタチン−28に加えることにより、ソマトスタチンの医薬組成物を点眼剤の形態で調製した。最後に、溶液を0.22μmの滅菌フィルターに通して濾過した。
【0042】
実施例10:ソマトスタチン−14、ヒドロキシベンゾエート、及びポリオキシエチレン脂肪族エーテルを含む点眼剤
1mLの0.9%塩化ナトリウム水溶液を、50μgの4−ヒドロキシ安息香酸メチル、100μgの4−ヒドロキシ安息香酸プロピル、50μgのポリオキシエチレン−20−ステアリルエーテル(Brij−78)、及び1mgのソマトスタチン−14に加えることにより、ソマトスタチンの医薬組成物を点眼剤の形態で調製した。最後に、溶液を0.22μmの滅菌フィルターに通して濾過した。
【0043】
実施例11:ソマトスタチン−14のリポソームを含む点眼剤
ソマトスタチンの医薬組成物を、mLあたり20mgのホスファチジルコリン及び2.7mgのソマトスタチン−14を含む0.9%塩化ナトリウムに調製した。簡単に述べると、ホスファチジルコリンを、ソマトスタチン−14を含む0.9%塩化ナトリウム水溶液に、攪拌しながらゆっくりと加えた。リポソーム懸濁液が形成されるまで、組成物を15分間さらに攪拌した。次いで、細孔径400nmのポリカーボネートフィルターに通し、細孔径200nmのフィルターに通し、最後に細孔径100nmのフィルターに10回通して、リポソームを段階的に押し出した。最後に、リポソーム溶液を0.22μm滅菌フィルターに通して濾過した。
【0044】
実施例12:ソマトスタチン−14のナノカプセルを含む点眼剤
分子量5000、1gのポリ乳酸−コ−グリコール酸(50:50)コポリマーの10%ジクロロメタン溶液を調製した。ソマトスタチン−14(100mg)を1mLの水に溶かした。ソマトスタチン溶液をポリマー溶液に加え、1つの超音波プローブを使用して乳化した。次いで、ナノエマルションを0.22μmの滅菌フィルターに通して濾過した。次いで、得られたナノエマルションを、超音波プローブを使用してポリ(ビニルアルコール)1%水溶液に分散させて、ナノエマルションが得られるまで粒径を低下させた。ナノカプセルを40%エタノール水溶液に抽出し、タンジェント流限外濾過により精製した。
【0045】
最後に、ソマトスタチン(16mg)を含む70mgのナノカプセルを、100mLのポリ(ビニルアルコール)1.4%水溶液に分散させた。
【0046】
実施例13:ソマトスタチン−14を含む眼科用軟膏
50mLの米国薬局方白色ワセリンを200mgのソマトスタチン−14に加えることにより、ソマトスタチンの医薬組成物を眼科用軟膏の形態で調製した。
【0047】
実施例14:糖尿病ラットの網膜神経変性の予防におけるソマトスタチン及びオクトレオチドによる局所的な眼の治療の効果
ストレプトゾトシン(STZ)、60mg/Kgを、Sprague Dawleyラットに投与した。表1に詳述されるとおり、動物を4群に分けた。
【0048】

【0049】
STZ投与の2日後、動物を、1日あたり、1滴又は2滴のビヒクル(2群)、実施例4の点眼剤(3群)、又は実施例5の点眼剤(4群)によりさらに14日治療した。健常な対照動物は、1日あたり1滴又は2滴のビヒクル(1群)のみにより処理した。
【0050】
網膜電図記録法は、糖尿病性網膜症における網膜機能の評価に臨床的に利用される技術である。いくつかのパラメーターが、その疾病の初期の段階において影響を受けることがある:陰的時間(implicit time)、振幅、及び振動電位[Tzekov et al.,Survey of Ophthalmology,1999,44(1):53−60]。陰的時間の増加及び振動電位(OP)の振幅の減弱は、ストレプトゾトシン誘発糖尿病ラットにも観察される[Hancok et al.,Investigative Ophthalmology & Visual Science,2004,45(3):1002−1008]。
【0051】
網膜電図記録法の結果は、14日の治療後、0dbでのb波の陰的時間が、糖尿病性群(2群)における治療前に比較して著しく増加し(右眼15,5;左眼15,2)、対照群(1群)(右眼−2,3;左眼−7,5)及び実施例4のソマトスタチン組成物により治療された群(3群)(右眼9,0;左眼4,9)又は実施例5のオクトレオチド組成物により治療された群(4群)(右眼8,8;左眼1,1)において有意な増加を受けなかったことを示す。
【0052】
振幅に関して、ソマトスタチンは、糖尿病性群に比べて−30db、−10db、及び0dbでのb波振幅の減弱を防止し、オクトレオチドは−30dbでのb波振幅の減弱を防止したが、−10db及び0dbでは最高投与量でのみ有効であった。
【0053】
0dbでのb波の振動電位(OP)の分析は、ソマトスタチン及びオクトレオチドが正の効果を呈し、第2のOP(OP2)の振幅の減弱を防止したことを示す。この効果は第8日に既に観察され、第14日まで保たれた。図2は、対照ラット(1群:右眼17,0;左眼15,9);糖尿病ラット(2群:右眼−2,5;左眼−1,2);ソマトスタチンで治療された糖尿病ラット(3群:右眼44,8;左眼68,7)、及びオクトレオチドで治療された糖尿病ラット(4群:右眼45,5;左眼55,1)の第2のOPの振幅の差を示す。
【0054】
第14日に、動物を屠殺し、眼組織をパラフィン処理した。グリア活性化及びアポトーシス細胞の数を、糖尿病性網膜症:網膜神経変性の進行の第1段階のマーカーとして評価した[Carrasco et al.,Diabetes Care,2007,30(11):1−7]。
【0055】
グリア活性化は、グリア原線維タンパク質(GFAP)免疫蛍光を共焦点顕微鏡により分析して決定した。厚さ7μmの眼の切片を、高接着カバースリップ(Visionbiosystems、Newcastle Upon Tyne, UK)に固定した。それらを脱パラフィンし、再水和し、リン酸緩衝食塩液(PBS)中で洗浄した。試料を、PBS1%BSA(ウシ血清アルブミン)0.5%Triton X−100中で1時間インキュベートして、非特異的な結合を妨げた。その後、ブロッキングバッファに希釈した一次ウサギ抗ヒトGFAP抗体(Sigma、Madrid,Spain)(1:100)を4℃で36時間インキュベートした。PBSで3回5分間洗浄後、切片を、Alexa Fluor(登録商標)488(Invitrogen、Eugene, OR)により標識された二次抗体抗IgGヒトと共に室温で1時間インキュベートした。標識された切片を洗浄し、細胞核染色用の4,6−ジアミジノ−2−フェニルインドール(DAPI)(Vector Laboratories、Burlingame,CA)を含む蛍光媒体と共に載せた。GFAP陽性切片を共焦点顕微鏡(FV1000、Olympus、Hamburg,Germany)でとらえ、Alexa 488用には488nmレーザーで、DAPI用には405nmレーザーで光学的切片を得た。GFAP蛍光は、Fluoview ASW 1.4ソフトウェア(Olympus、Hamburg, Germany)により、各画像中で定量化した。結果を、分析した面積(21705.33μm2)に対して規格化した。図3は、共焦点顕微鏡画像を示す。STZ誘発糖尿病ラット(2群)の神経節細胞層において、より高いGFAP発現(最も明るい標識)が観察された。ソマトスタチン(3群)又はオクトレオチド(4群)による治療は、対照(1群)に類似のGFAPレベルと相関するグリア細胞活性化を予防した。
【0056】
糖尿病により惹起されたグリア活性化の予防における、ソマトスタチン(3群)及びオクトレオチド(4群)による局所的な眼の治療の効能は、グリア活性化の指標である、GFAP蛍光値により決定した。GFAP蛍光値は、健常な対照群1で2095±26;2群で6871±159;3群で2514±90、及び4群で1696±48であった。
【0057】
14日間の治療の後の網膜のアポトーシスの程度の評価は、タネル(「ターミナルトランスフェラーゼdUTPニック末端標識」)技術により実施した。In Situ Cell Death Detection Kit(Roche Diagnostics、Mannheim,Germany)を使用した。眼の切片を、脱パラフィンし、再水和し、PBS中で洗浄した。317,13μm×317,13μmの表面に対応する3つの共焦点画像(40倍)を各切片に対して得た。核の総数及びタネルに陽性な核を、Image Jソフトウェア(http://rsbweb.nih.gov/ij)により定量化した。核の形態を調べるためにヨウ化プロピジウム(PI)による染色を実施し、偽陽性を廃棄した。図4は、共焦点顕微鏡画像を示す。網膜変性は、ストレプトゾトシン誘発糖尿病ラット(2群)に観察される、より多数のアポトーシス細胞(最も明るい標識はタネル陽性を意味する)と相関していた。ソマトスタチン(3群)及びオクトレオチド(4群)による治療は、網膜変性を予防し、健常な対照ラット(1群)に見られる類似な細胞数を示した。
【0058】
表2は、網膜色素上皮(RPE)、外顆粒層(ONL)、内顆粒層(INL)、及び神経節細胞層(GCL)などの異なる網膜層における細胞の総数に対する、アポトーシス細胞のパーセンテージを示す。アポトーシス細胞のパーセンテージの増加は糖尿病ラット(2群)において有意であった。ソマトスタチン(3群)又はオクトレオチド(4群)による局所的な眼の治療は、対照レベル(1群)までアポトーシス細胞の数を減らした。
【0059】

【0060】
網膜細胞の神経変性は、糖尿病性網膜症の進行の第1段階の1つである。網膜電図記録法、グリア活性化、及びアポトーシスの結果は、ソマトスタチン又はオクトレオチドの14日間の局所的な眼への投与が、ストレプトゾトシン誘発糖尿病ラットにおける網膜変性を予防したことを示した。
【技術分野】
【0001】
本発明は医薬の分野に属し、具体的には、ソマトスタチン及びソマトスタチンアナログの局所眼科用組成物の形態である医薬製剤に関する。
【背景技術】
【0002】
網膜及び硝子体の疾病は、失明の主な原因であり、それらの中でも糖尿病性網膜症及び加齢黄斑変性は特に目立っている。
【0003】
眼球後区の疾病におけるソマトスタチン受容体の過剰発現のエビデンスに基づき、これらの疾患の治療におけるソマトスタチン及びアナログの潜在的な使用が従来技術において言及されているが、治療効果の明確な例は全くない。
【0004】
ヒトの眼の種々の部分における内在性のソマトスタチン及びソマトスタチン受容体の存在が最近記載されている。したがって、例えば、ソマトスタチン受容体sstr1、sstr2、及びsstr5は、涙腺、結膜、角膜、及び鼻涙管に検出されている[Minsel et al.,Endocrinology,2009,150(5):2254−2263]。眼球後区において、健常なヒトの眼の網膜、毛様体、及び脈絡膜におけるソマトスタチン受容体sstr1、sstr2、sstr3、sstr4、及びsstr5に対応する遺伝子の存在が記載されており[Klisovic et al.,Investigative Ophthalmology & Visual Science,2001,42(10):2193−2201]、網膜におけるsstr2及びsstr3のmRNAの存在が[van Hagen et al.,European Journal of Endocrinology,2000,143:S43−S51;Cervia et al.,Molecular and Cellular Endocrinology,2008,286:112−122]、硝子体液及び網膜における内在性ソマトスタチンの存在も[Simo et al.,Diabetes Care,2002,25(12):2282−2286]記載されている。おそらくは網膜神経変性に関連する糖尿病性網膜症の第1期の網膜においてソマトスタチンの発現が低下することも従来技術において知られている[Carrasco et al.,Diabetes Care,2007,30(11):1−7]。
【0005】
全身性、局所、眼内、及び眼球周囲の投与など、眼球後区の疾病の治療のための薬物の、異なる投与経路がある。
【0006】
文書国際公開第02/09739A1号パンフレットは、眼疾患の治療又は予防のためのソマトスタチン又はそのアナログの使用を記載している。この文書中で挙げられた投与経路のうち、好ましい経路は、皮下又は筋肉内の全身性の非経口投与であり、ソマトスタチン又はそのアナログの投与のための点眼剤の形態の製剤は、前記文書に全く示されていない。しかし、全身性投与の場合、眼への薬物の透過を制限する血管網膜関門により、眼球後区において治療濃度に達するのは困難である。全身性投与の他の一般的な欠点には、その効果が局所的でなく、眼球後区にのみには向けられないことがある。さらに、ソマトスタチンの場合、血中で不安定なため、高い投与量が必要であろう。アナログであるオクトレオチドの場合、その結果が明らかな治療効果を示さないとしても、異なる臨床試験により全身性皮下投与によるその効果が評価されている[Wegewitz et al.,Current Pharmaceutical Design,2005,11:2311−2330;Palii et al.,Investigative Ophthalmology & Visual Science,2008,49(11):5094−5102]。
【0007】
眼球後区における全身性投与経路の低いアベイラビリティに代わるものとして、眼内注射並びに結膜下、テノン嚢下、及び球後注射などの眼球周囲の注射又は眼球後区への結膜下インプラントによる、この部分への局所投与がある[Geroski et al.,Investigative Ophthalmology & Visual Science,2000,41(5):961−964;Kiagiadaki et al.Investigative Ophthalmology & Visual Science,2008,49(7):3080−3089]。しかし、これらの投与形態は患者にとって快適でなく、繰り返し実施されると頻度が増す二次作用を呈する。さらに、インプラントの場合、外科的処置が伴う。これらの種類の治療は前臨床試験において有効であると示されているが、それらは定期的な注射の実施を必要とし、場合によっては、網膜剥離、白内障、皮膚潮紅、又は眼内炎などの二次作用を有する[Geroski et al.,Investigative Ophthalmology & Visual Science,2000,41(5):961−964;Herrero−Vanrell et al,Journal of Drug Delivery Science and Technology,2007,17(1):11−17;Robertson et al.,Journal of Ocular Pharmacology and Therapeutics,1997,13(2):171−177]。
【0008】
眼に薬物を投与する前述の経路に代わる他の経路として、局所眼投与がある。しかし、標的が眼球後区にある薬物の投与経路としての局所眼チャネル(local ocular channel)は、後区に到達できる作用物質のパーセンテージが大多数の場合にほとんどないという評価により、現在まで制限されてきた[Andres−Guerrero et al.,Archivos de la Sociedad Espanola de Oftalmologia,2008,83:683−686]。
【0009】
従来技術の中で、ソマトスタチン及びアナログの局所眼投与の選択肢がいくつか言及されてきた。従って、例えば、文書米国特許出願公開第2005/074497A1号明細書は、眼球後区の疾病の治療のためのオクトレオチドなどの血管新生阻害剤を含むヒドロゲルを記載している。オクトレオチドは、この特許出願において、莫大な薬物リストの中に開示されている。さらに、オクトレオチド又は他の薬物の例はこの文書に全く記載されていない。ヒドロゲルは、コンタクトレンズを使用して眼に接触して配置されているか、或いは、それは接着剤の使用又は外科的処置により眼に取り付けられる。点眼剤による投与は、この文書中では明白に除外されている。しかし、コンタクトレンズを使用する投与は、眼が病原体に感染するリスクを伴い、さらに、眼内圧が増加した患者には許容されない。
【0010】
他の可能性は、瞼の内側への軟膏又は油薬の形態の局所投与である。しかし、軟膏剤は不快になりやすく、その過度な粘性及び吸収の遅さのため視力を下げる。
【0011】
国際公開第99/24019A1号パンフレットは、溶液中に再構成され眼科用点眼剤として投与される、種々の薬物、とりわけソマトスタチンからできている乾燥固体製剤も記載している。しかし、この文書は、ソマトスタチンの製剤の例も、点眼剤を使用して適用される眼球後区に到達するこの薬物又は他の薬物の適応症も与えていない。
【0012】
その一方で、米国特許第5182258A号明細書は、鼻涙系により全身性投与に使用される点眼剤の形態の製剤であって、投与される有効成分が他の多くの薬物の中でもソマトスタチンになり得る製剤を記載している。しかし、眼球後区の疾病の治療のためのこの成分又は他の有効成分の投与については、この文書には何も言われていない。従来技術における他の製剤で同じことが起こっており、眼球後区の疾病の治療及び/又は予防のための可能な用途が示されなずに、局所経路によりオクトレオチドが投与されている[Danesi et al.,Clinical Cancer Research,1997,3:265−272;Demir et al.Documenta Ophthalmologica,2003,107:87−92]。
【0013】
したがって、患者の不快感の問題及び薬学的に許容できる製剤における低い治療利用可能性の問題の両方を解決する、眼球後区の疾病の局所的な治療及び/又は予防のためのソマトスタチン又はそのアナログの局所眼投与の形態を見いだす必要が従来技術にある。
【0014】
本発明の目的は、眼球後区に到達し、そこに存在するソマトスタチン受容体に結合し、ソマトスタチン又はそのアナログのソマトスタチン受容体への結合から利益を得る眼球後区の疾病の治療及び/又は予防のために適用される、ソマトスタチン又はそのアナログの局所眼科用組成物、眼に局所投与される液体医薬製剤である。本発明は、ペプチド、特にソマトスタチン又はそのアナログの局所眼科用投与における前例のない打開策を提供する。
【発明の概要】
【0015】
驚くべきことに、本発明は、先に記載された問題を解決する。第一の態様において、本発明は、ペプチドを含む局所眼科用組成物において、治療上有効な量のこのペプチドが眼球後区に到達することを特徴とする組成物に関する。特定の実施形態において、局所眼科用組成物は、点眼剤、軟膏剤、及び油薬の群から選択される。さらなる態様において、本発明は、ペプチドを含む点眼剤において、治療上有効な量のこのペプチドが眼球後区に到達することを特徴とする点眼剤に関する。
【0016】
本発明の文脈において、「点眼剤」という用語は、眼の外部表面に液滴の形態で投与され眼球後区に局所作用を有する液体医薬製剤に関する。
【0017】
本発明の文脈において、「眼球後区」という用語は、脈絡膜、網膜色素上皮、網膜、黄斑、中心窩、視神経、及び硝子体液を含む。
【0018】
特定の実施形態において、ペプチドは、ソマトスタチン又はソマトスタチンアナログから選択され、好ましくは、ソマトスタチン又はソマトスタチンアナログは、ソマトスタチン−28、ソマトスタチン−14、ソマトスタチン−13、プロソマトスタチン、オクトレオチド、ランレオチド、バプレオチド、パシレオチド、セグリチド、コルチスタチン、及びそれらの薬学的に許容できる塩により形成される群から選択される。
【0019】
他の特定の実施形態において、ソマトスタチン又はソマトスタチンアナログは、アシル基又はポリエチレングリコール部分により置換されている。好ましくは、アシル基は、アセチル、tert−ブタノイル、ヘキサノイル、2−メチルヘキサノイル、シクロヘキサンカルボキシル、オクタノイル、デカノイル、ラウロイル、ミリストイル、パルミトイル、ステアロイル、オレオイル、及びリノレオイルからなる群から選択される。好ましくは、ポリエチレングリコール部分は、分子量が、200から35,000ダルトンである。
【0020】
他の特定の実施形態において、ペプチド、好ましくは、ソマトスタチン又はソマトスタチンアナログの濃度は、0.1μg/mLから100mg/mL、好ましくは1μg/mLから10mg/mL、より好ましくは10μg/mLから1mg/mLである。
【0021】
他の特定の実施形態において、点眼剤のpHは、3から8、好ましくは4から7である。点眼剤のpHを調整するために、当業者に公知である酸及び/又は塩基が加えられて、先のpH値に達するだろう。
【0022】
他の特定の実施形態において、本発明における点眼剤ビヒクルは、塩化ナトリウム又はホウ酸の等張溶液などの水性等張液であるか、又はポリ(ビニルアルコール)水溶液又はこれらの混合物である。
【0023】
他の特定の実施形態において、本発明の組成物のペプチドは、リポソーム、混合リポソーム、ニオソーム、エトソーム、ナノ粒子、固体脂質ナノ粒子、ナノ構造脂質キャリア、ミセル、界面活性剤の混合ミセル、界面活性剤−リン脂質混合ミセル、ナノスフィア、リポスフィア、及びナノカプセルに組み込むこともできる。
【0024】
他の特定の実施形態において、本発明の点眼剤は、場合により保存剤を含んでよい。当業者は、塩化ベンザルコニウム、安息香酸、アルキルパラベン、安息香酸アルキル、クロロブタノール、クロロクレゾール、セチルアルコール、ヘキサデシルアルコールなどの脂肪族アルコール、酢酸塩、硝酸フェニル水銀、又はホウ酸塩などの水銀の有機金属化合物、ジアゾリジニル尿素、アジピン酸ジイソプロピル、ジメチルポリシロキサン、EDTAの塩、ビタミンE、及びその混合物などの従来技術の保存剤を認識する。
【0025】
他の特定の実施形態において、本発明の点眼剤は、ペプチド、好ましくはペプチドソマトスタチン又はソマトスタチンアナログの眼球後区への透過性を増大させる薬剤を場合により含んでよい。好ましくは、透過性を増大させる薬剤は、とりわけ、塩化ベンザルコニウム、サポニン、脂肪酸、ポリオキシエチレン脂肪族エーテル、脂肪酸のアルキルエステル、ピロリドン、ポリビニルピロリドン、ピルビン酸、ピログルタミン酸、及びこれらの混合物により形成される群から選択される。
【0026】
第二の態様において、本発明は、眼球後区の疾病の治療及び/又は予防のための本発明の点眼剤に関する。好ましくは、眼球後区の疾病の治療及び/又は予防は、ソマトスタチン又はそのアナログのソマトスタチン受容体への結合から利益を得る。より好ましくは、眼球後区の疾病は、非増殖性糖尿病性網膜症、増殖性糖尿病性網膜症、加齢黄斑変性、網膜の血管新生の疾病、虚血誘導性網膜症、未熟児網膜症、鎌状赤血球網膜症、網膜静脈閉塞症、色素性網膜炎、脈絡膜血管新生、ブドウ膜炎、黄斑浮腫、嚢胞様黄斑浮腫により形成される群から選択される。ソマトスタチンの場合、血清中の半減期に対して眼球後区の硝子体液におけるその安定性が高いので、先に言及された眼球後区の疾病の治療及び/又は予防のための局所レベルでのその作用に好都合である。
【0027】
第三の態様において、本発明は、眼球後区の疾病の治療及び/又は予防の方法であって、点眼剤、軟膏剤、及び油薬からなる群から選択される局所眼科用組成物による、治療上有効な量のペプチドの局所投与を含む方法に関する。
【0028】
特定の実施形態において、ペプチドは、ソマトスタチン又はソマトスタチンアナログから選択され、好ましくは、ソマトスタチン又はソマトスタチンアナログは、ソマトスタチン−28、ソマトスタチン−14、ソマトスタチン−13、プロソマトスタチン、オクトレオチド、ランレオチド、バプレオチド、パシレオチド、セグリチド、コルチスタチン、及びそれらの薬学的に許容できる塩により形成される群から選択される。
【0029】
他の特定の実施形態において、投与の頻度は、各対象の必要性、及び治療又は予防すべき疾病の重症度により大きく変わることがあり、週に1回から1日10回の投与範囲、好ましくは週に3回から1日3回、さらにより好ましくは1日に1回又は2回の投与範囲が推奨される。
【0030】
他の特定の実施形態において、治療及び/又は予防の方法は、眼球後区の疾病の治療及び/又は予防のための他の治療剤の投与をさらに含む。眼球後区の治療及び/又は予防のための治療剤には、例えば、非限定的に、抗血管内皮細胞成長因子(VEGF)、プロスタグランジンアナログ、βアドレナリン受容体アンタゴニスト、アルファ−2−アドレナリンアゴニスト、炭酸脱水酵素阻害薬、縮瞳薬、モノクローナル抗体、コルチコステロイド、グルココルチコイド、キナーゼ阻害剤、毛様体筋麻痺薬、又は代謝拮抗剤の群から選択される薬剤がある。眼球後区の疾病の治療及び/又は予防のためのこれらの治療剤の投与は、局所経路でも、経口経路でも、非経口経路でもよい。本発明の文脈において、「非経口」という用語は、硝子体内、眼内、角膜内、皮下、皮内、静脈内などの血管内注射、筋肉内、及び他の類似の注射若しくは注入技術を含む。
【0031】
本明細書で提供される以下の具体的な実施例は、本発明の本質を説明するのに役立つ。これらの実施例は説明の目的のためだけに含められ、本明細書に特許請求される本発明に対する制限として理解されるべきでない。
【図面の簡単な説明】
【0032】
【図1】図1は、右眼(+)にソマトスタチンを、左眼(−)にプラセボを受け取った2匹のマウス(1及び2)の網膜を示す。
【図2】図2は、対照ラット(1群);糖尿病ラット(2群);ソマトスタチンにより治療された糖尿病ラット(3群)及びオクトレオチドにより治療された糖尿病ラット(4群)の第2のOPの振幅の差を示す。
【図3】図3は、共焦点顕微鏡画像を示す。40倍の共焦点GFAP免疫組織化学。STZ誘発糖尿病ラット(2群)の神経節細胞層において、はるかに高いGFAP発現(一番明るい標識)が観察された。ソマトスタチン(3群)又はオクトレオチド(4群)による治療は、対照(1群)に類似のGFAPレベルと相関するグリア細胞活性化を予防した。
【図4】図4は、共焦点顕微鏡画像を示す。40倍のタネルの共焦点画像。網膜変性は、特に、STZ誘発糖尿病ラット(2群)に観察されるONLにおける、多数のアポトーシス細胞(最も明るい標識はタネル陽性であることを意味する)と相関した。ソマトスタチン(3群)及びオクトレオチド(4群)による治療は網膜変性を予防し、健常な対照ラット(1群)に見られるのと類似な細胞数を示した。
【実施例】
【0033】
実施例1:ソマトスタチン−14を含む点眼剤
125μLの0.9%塩化ナトリウムを5mgのソマトスタチン−14に加えることにより、ソマトスタチンの医薬組成物を点眼剤の形態で調製した。
【0034】
実施例2:網膜における局所眼科用ソマトスタチンの濃度の評価
8週齢のC57BL/6マウスを使用した。動物の取扱い及び管理は、Institut de Recerca del Hospital Universitari Vall d’Hebronプロトコル並びに欧州経済共同体及びA.R.V.O.(視覚と眼科学研究協会)の国際指針(86/609/CEE指令)に従って実施した。動物を、12時間続く一定の明暗周期下で、温度(20°)及び湿度(60%)を制御した動物施設の個別ケージ内に飼育し、飼料及び水を適宜与えた。実施例1のソマトスタチン−14の点眼剤(5μLの一滴)を右眼に投与し、プラセボ(食塩水)を左眼に投与した。1滴を朝に、もう1滴を夕方に、1日2滴を、5日間投与した。最後の投与の2時間後に、麻酔下で頸椎脱臼により動物を安楽死させた。直後に、眼球を取り出し、取扱いまで−80°で凍結させた。拡大鏡の下で眼球を切開することにより、眼球後区(網膜及び硝子体液)を眼球の残りの部分から分離した。網膜中のソマトスタチン−14の量をウェスタンブロットにより測定した。Complete(商標)プロテアーゼ阻害剤カクテルを含む、50mMのTris−HCl、pH 7.9、300mMのKCl、1.5mMのMgCl2、0.1%のノニデットP−40、及び20%のグリセロールの4℃の溶液でタンパク質を12時間抽出した。その後、試料を10分間遠心分離した(4℃で12,000rpm)。ソマトスタチン−14に対するウサギ抗体(ab53165, abcam)により、タンパク質にウェスタンブロットを実施した。得られたソマトスタチン−14の濃度を規格化するために、□−アクチンを対照として使用した。特異的な抗体抗原複合体を、HRPによりマーキングされたウサギIgGに対するヤギ抗体又はヤギIgGに対するウサギ抗体を化学発光基質(Pierce Biotechnology Inc.,Rockfort,Illinois,USA)と共に使用して、X線写真フィルムに露光することにより確認した。濃度測定分析を実施し(Densitometer GS−800、Bio−Rad Laboratories、Hercules,California,USA)、結果を任意単位として表示する。図1は、右眼(+)にソマトスタチンを、左眼(−)にプラセボを受け取った2匹のマウス(1及び2)の網膜を示す。分かるとおり、ソマトスタチンの量は、両動物において治療された眼において多かった。両方の眼にプラセボを受け取った対照マウスでは、両眼でソマトスタチンの濃度に差は検出されなかった。
【0035】
実施例3:ヒト硝子体液及びヒト血清におけるソマトスタチンの安定性
ソマトスタチンを、90%でヒト血清又はヒト硝子体液と共に37℃でインキュベートした。異なるインキュベーション時間でアリコートを抜き取った。アセトニトリルを加えて、血清タンパク質を沈殿させ、遠心分離して、上清を濾過し、RP−HPLC(勾配:30分で20−80%のB、B=アセトニトリル中0.07%TFA)に注入した。初期の生成物の消失を、初期の生成物に対応する面積を利用して分析し、半減期を計算した。ソマトスタチンの半減期は、血清中で2.7時間、硝子体液中で64時間であった。
【0036】
実施例4:ソマトスタチン−14を含む点眼剤
1mLの0.9%塩化ナトリウム水溶液を10mgのソマトスタチン−14に加えることにより、ソマトスタチンの医薬組成物を点眼剤の形態で調製した。最後に、溶液を0.22μmの滅菌フィルターに通して濾過した。
【0037】
実施例5:オクトレオチドを含む点眼剤
1mLの0.9%塩化ナトリウム水溶液を10mgのオクトレオチドに加えることにより、オクトレオチドの医薬組成物を点眼剤の形態で調製した。最後に、溶液を0.22μmの滅菌フィルターに通して濾過した。
【0038】
実施例6:バプレオチドを含む点眼剤
1mLの0.9%塩化ナトリウム水溶液を10mgのバプレオチドに加えることにより、バプレオチドの医薬組成物を点眼剤の形態で調製した。最後に、溶液を0.22μmの滅菌フィルターに通して濾過した。
【0039】
実施例7:コルチスタチンを含む点眼剤
1mLの0.9%塩化ナトリウム水溶液を10mgのコルチスタチンに加えることにより、コルチスタチンの医薬組成物を点眼剤の形態で調製した。最後に、溶液を0.22μmの滅菌フィルターに通して濾過した。
【0040】
実施例8:ソマトスタチン−14を含む点眼剤
1mLの0.9%塩化ナトリウム及び1.4%のポリ(ビニルアルコール)水溶液を0.27mgのソマトスタチン−14に加えることにより、ソマトスタチンの医薬組成物を点眼剤の形態で調製した。最後に、溶液を0.22μmの滅菌フィルターに通して濾過した。
【0041】
実施例9:ソマトスタチン−28を含む点眼剤
1mLの0.9%塩化ナトリウム水溶液を0.05mgのソマトスタチン−28に加えることにより、ソマトスタチンの医薬組成物を点眼剤の形態で調製した。最後に、溶液を0.22μmの滅菌フィルターに通して濾過した。
【0042】
実施例10:ソマトスタチン−14、ヒドロキシベンゾエート、及びポリオキシエチレン脂肪族エーテルを含む点眼剤
1mLの0.9%塩化ナトリウム水溶液を、50μgの4−ヒドロキシ安息香酸メチル、100μgの4−ヒドロキシ安息香酸プロピル、50μgのポリオキシエチレン−20−ステアリルエーテル(Brij−78)、及び1mgのソマトスタチン−14に加えることにより、ソマトスタチンの医薬組成物を点眼剤の形態で調製した。最後に、溶液を0.22μmの滅菌フィルターに通して濾過した。
【0043】
実施例11:ソマトスタチン−14のリポソームを含む点眼剤
ソマトスタチンの医薬組成物を、mLあたり20mgのホスファチジルコリン及び2.7mgのソマトスタチン−14を含む0.9%塩化ナトリウムに調製した。簡単に述べると、ホスファチジルコリンを、ソマトスタチン−14を含む0.9%塩化ナトリウム水溶液に、攪拌しながらゆっくりと加えた。リポソーム懸濁液が形成されるまで、組成物を15分間さらに攪拌した。次いで、細孔径400nmのポリカーボネートフィルターに通し、細孔径200nmのフィルターに通し、最後に細孔径100nmのフィルターに10回通して、リポソームを段階的に押し出した。最後に、リポソーム溶液を0.22μm滅菌フィルターに通して濾過した。
【0044】
実施例12:ソマトスタチン−14のナノカプセルを含む点眼剤
分子量5000、1gのポリ乳酸−コ−グリコール酸(50:50)コポリマーの10%ジクロロメタン溶液を調製した。ソマトスタチン−14(100mg)を1mLの水に溶かした。ソマトスタチン溶液をポリマー溶液に加え、1つの超音波プローブを使用して乳化した。次いで、ナノエマルションを0.22μmの滅菌フィルターに通して濾過した。次いで、得られたナノエマルションを、超音波プローブを使用してポリ(ビニルアルコール)1%水溶液に分散させて、ナノエマルションが得られるまで粒径を低下させた。ナノカプセルを40%エタノール水溶液に抽出し、タンジェント流限外濾過により精製した。
【0045】
最後に、ソマトスタチン(16mg)を含む70mgのナノカプセルを、100mLのポリ(ビニルアルコール)1.4%水溶液に分散させた。
【0046】
実施例13:ソマトスタチン−14を含む眼科用軟膏
50mLの米国薬局方白色ワセリンを200mgのソマトスタチン−14に加えることにより、ソマトスタチンの医薬組成物を眼科用軟膏の形態で調製した。
【0047】
実施例14:糖尿病ラットの網膜神経変性の予防におけるソマトスタチン及びオクトレオチドによる局所的な眼の治療の効果
ストレプトゾトシン(STZ)、60mg/Kgを、Sprague Dawleyラットに投与した。表1に詳述されるとおり、動物を4群に分けた。
【0048】

【0049】
STZ投与の2日後、動物を、1日あたり、1滴又は2滴のビヒクル(2群)、実施例4の点眼剤(3群)、又は実施例5の点眼剤(4群)によりさらに14日治療した。健常な対照動物は、1日あたり1滴又は2滴のビヒクル(1群)のみにより処理した。
【0050】
網膜電図記録法は、糖尿病性網膜症における網膜機能の評価に臨床的に利用される技術である。いくつかのパラメーターが、その疾病の初期の段階において影響を受けることがある:陰的時間(implicit time)、振幅、及び振動電位[Tzekov et al.,Survey of Ophthalmology,1999,44(1):53−60]。陰的時間の増加及び振動電位(OP)の振幅の減弱は、ストレプトゾトシン誘発糖尿病ラットにも観察される[Hancok et al.,Investigative Ophthalmology & Visual Science,2004,45(3):1002−1008]。
【0051】
網膜電図記録法の結果は、14日の治療後、0dbでのb波の陰的時間が、糖尿病性群(2群)における治療前に比較して著しく増加し(右眼15,5;左眼15,2)、対照群(1群)(右眼−2,3;左眼−7,5)及び実施例4のソマトスタチン組成物により治療された群(3群)(右眼9,0;左眼4,9)又は実施例5のオクトレオチド組成物により治療された群(4群)(右眼8,8;左眼1,1)において有意な増加を受けなかったことを示す。
【0052】
振幅に関して、ソマトスタチンは、糖尿病性群に比べて−30db、−10db、及び0dbでのb波振幅の減弱を防止し、オクトレオチドは−30dbでのb波振幅の減弱を防止したが、−10db及び0dbでは最高投与量でのみ有効であった。
【0053】
0dbでのb波の振動電位(OP)の分析は、ソマトスタチン及びオクトレオチドが正の効果を呈し、第2のOP(OP2)の振幅の減弱を防止したことを示す。この効果は第8日に既に観察され、第14日まで保たれた。図2は、対照ラット(1群:右眼17,0;左眼15,9);糖尿病ラット(2群:右眼−2,5;左眼−1,2);ソマトスタチンで治療された糖尿病ラット(3群:右眼44,8;左眼68,7)、及びオクトレオチドで治療された糖尿病ラット(4群:右眼45,5;左眼55,1)の第2のOPの振幅の差を示す。
【0054】
第14日に、動物を屠殺し、眼組織をパラフィン処理した。グリア活性化及びアポトーシス細胞の数を、糖尿病性網膜症:網膜神経変性の進行の第1段階のマーカーとして評価した[Carrasco et al.,Diabetes Care,2007,30(11):1−7]。
【0055】
グリア活性化は、グリア原線維タンパク質(GFAP)免疫蛍光を共焦点顕微鏡により分析して決定した。厚さ7μmの眼の切片を、高接着カバースリップ(Visionbiosystems、Newcastle Upon Tyne, UK)に固定した。それらを脱パラフィンし、再水和し、リン酸緩衝食塩液(PBS)中で洗浄した。試料を、PBS1%BSA(ウシ血清アルブミン)0.5%Triton X−100中で1時間インキュベートして、非特異的な結合を妨げた。その後、ブロッキングバッファに希釈した一次ウサギ抗ヒトGFAP抗体(Sigma、Madrid,Spain)(1:100)を4℃で36時間インキュベートした。PBSで3回5分間洗浄後、切片を、Alexa Fluor(登録商標)488(Invitrogen、Eugene, OR)により標識された二次抗体抗IgGヒトと共に室温で1時間インキュベートした。標識された切片を洗浄し、細胞核染色用の4,6−ジアミジノ−2−フェニルインドール(DAPI)(Vector Laboratories、Burlingame,CA)を含む蛍光媒体と共に載せた。GFAP陽性切片を共焦点顕微鏡(FV1000、Olympus、Hamburg,Germany)でとらえ、Alexa 488用には488nmレーザーで、DAPI用には405nmレーザーで光学的切片を得た。GFAP蛍光は、Fluoview ASW 1.4ソフトウェア(Olympus、Hamburg, Germany)により、各画像中で定量化した。結果を、分析した面積(21705.33μm2)に対して規格化した。図3は、共焦点顕微鏡画像を示す。STZ誘発糖尿病ラット(2群)の神経節細胞層において、より高いGFAP発現(最も明るい標識)が観察された。ソマトスタチン(3群)又はオクトレオチド(4群)による治療は、対照(1群)に類似のGFAPレベルと相関するグリア細胞活性化を予防した。
【0056】
糖尿病により惹起されたグリア活性化の予防における、ソマトスタチン(3群)及びオクトレオチド(4群)による局所的な眼の治療の効能は、グリア活性化の指標である、GFAP蛍光値により決定した。GFAP蛍光値は、健常な対照群1で2095±26;2群で6871±159;3群で2514±90、及び4群で1696±48であった。
【0057】
14日間の治療の後の網膜のアポトーシスの程度の評価は、タネル(「ターミナルトランスフェラーゼdUTPニック末端標識」)技術により実施した。In Situ Cell Death Detection Kit(Roche Diagnostics、Mannheim,Germany)を使用した。眼の切片を、脱パラフィンし、再水和し、PBS中で洗浄した。317,13μm×317,13μmの表面に対応する3つの共焦点画像(40倍)を各切片に対して得た。核の総数及びタネルに陽性な核を、Image Jソフトウェア(http://rsbweb.nih.gov/ij)により定量化した。核の形態を調べるためにヨウ化プロピジウム(PI)による染色を実施し、偽陽性を廃棄した。図4は、共焦点顕微鏡画像を示す。網膜変性は、ストレプトゾトシン誘発糖尿病ラット(2群)に観察される、より多数のアポトーシス細胞(最も明るい標識はタネル陽性を意味する)と相関していた。ソマトスタチン(3群)及びオクトレオチド(4群)による治療は、網膜変性を予防し、健常な対照ラット(1群)に見られる類似な細胞数を示した。
【0058】
表2は、網膜色素上皮(RPE)、外顆粒層(ONL)、内顆粒層(INL)、及び神経節細胞層(GCL)などの異なる網膜層における細胞の総数に対する、アポトーシス細胞のパーセンテージを示す。アポトーシス細胞のパーセンテージの増加は糖尿病ラット(2群)において有意であった。ソマトスタチン(3群)又はオクトレオチド(4群)による局所的な眼の治療は、対照レベル(1群)までアポトーシス細胞の数を減らした。
【0059】

【0060】
網膜細胞の神経変性は、糖尿病性網膜症の進行の第1段階の1つである。網膜電図記録法、グリア活性化、及びアポトーシスの結果は、ソマトスタチン又はオクトレオチドの14日間の局所的な眼への投与が、ストレプトゾトシン誘発糖尿病ラットにおける網膜変性を予防したことを示した。
【特許請求の範囲】
【請求項1】
ペプチドを含む点眼剤、軟膏剤、及び油薬の群から選択される局所眼科用組成物において、治療上有効な量のこのペプチドが眼球後区に到達することを特徴とする局所眼科用組成物。
【請求項2】
請求項1に記載の局所眼科用組成物において、前記眼科用組成物が点眼剤組成物であることを特徴とする、局所眼科用組成物。
【請求項3】
請求項1及び2に記載の局所眼科用組成物において、前記ペプチドが、ソマトスタチン又はソマトスタチンアナログから選択されることを特徴とする局所眼科用組成物。
【請求項4】
請求項3に記載の局所眼科用組成物において、前記ソマトスタチン又はソマトスタチンアナログが、ソマトスタチン−28、ソマトスタチン−14、ソマトスタチン−13、プロソマトスタチン、オクトレオチド、ランレオチド、バプレオチド、パシレオチド、セグリチド、コルチスタチン、及びこれらの薬学的に許容できる塩により形成される群から選択されることを特徴とする局所眼科用組成物。
【請求項5】
請求項3に記載の局所眼科用組成物において、前記ソマトスタチン又はソマトスタチンアナログが、アシル基又はポリエチレングリコール部分により置換されていることを特徴とする局所眼科用組成物。
【請求項6】
請求項1又は2に記載の局所眼科用組成物において、前記ペプチドの濃度が、0.1μg/mLから100mg/mLの範囲であることを特徴とする局所眼科用組成物。
【請求項7】
請求項6に記載の局所眼科用組成物において、前記濃度が、1μg/mLから10mg/mLの範囲であることを特徴とする局所眼科用組成物。
【請求項8】
請求項2に記載の局所眼科用組成物において、前記点眼剤のpHが3から8であることを特徴とする局所眼科用組成物。
【請求項9】
請求項2に記載の局所眼科用組成物において、前記点眼剤ビヒクルが、等張性水溶液、ポリ(ビニルアルコール)水溶液、又はこれらの混合物であることを特徴とする局所眼科用組成物。
【請求項10】
請求項1又は2に記載の局所眼科用組成物において、前記眼科用組成物が保存剤を含むことを特徴とする局所眼科用組成物。
【請求項11】
請求項1又は2に記載の局所眼科用組成物において、前記眼科用組成物が、このペプチドの透過性を増す薬剤を含むことを特徴とする局所眼科用組成物。
【請求項12】
請求項1又は2に記載の局所眼科用組成物において、眼球後区の疾病の治療及び/又は予防のための局所眼科用組成物。
【請求項13】
請求項12に記載の局所眼科用組成物において、前記治療及び/又は予防が、ソマトスタチン又はソマトスタチンアナログのソマトスタチン受容体への結合から利益を得ることを特徴とする局所眼科用組成物。
【請求項14】
前記眼球後区の疾病が、非増殖性糖尿病性網膜症、増殖性糖尿病性網膜症、加齢黄斑変性、網膜血管新生、虚血誘導性網膜症、未熟児網膜症、鎌状赤血球網膜症、網膜静脈閉塞症、色素性網膜炎、脈絡膜血管新生、ブドウ膜炎、黄斑浮腫、嚢胞様黄斑浮腫により形成される群から選択されることを特徴とする、請求項12に記載の局所眼科用組成物。
【請求項1】
ペプチドを含む点眼剤、軟膏剤、及び油薬の群から選択される局所眼科用組成物において、治療上有効な量のこのペプチドが眼球後区に到達することを特徴とする局所眼科用組成物。
【請求項2】
請求項1に記載の局所眼科用組成物において、前記眼科用組成物が点眼剤組成物であることを特徴とする、局所眼科用組成物。
【請求項3】
請求項1及び2に記載の局所眼科用組成物において、前記ペプチドが、ソマトスタチン又はソマトスタチンアナログから選択されることを特徴とする局所眼科用組成物。
【請求項4】
請求項3に記載の局所眼科用組成物において、前記ソマトスタチン又はソマトスタチンアナログが、ソマトスタチン−28、ソマトスタチン−14、ソマトスタチン−13、プロソマトスタチン、オクトレオチド、ランレオチド、バプレオチド、パシレオチド、セグリチド、コルチスタチン、及びこれらの薬学的に許容できる塩により形成される群から選択されることを特徴とする局所眼科用組成物。
【請求項5】
請求項3に記載の局所眼科用組成物において、前記ソマトスタチン又はソマトスタチンアナログが、アシル基又はポリエチレングリコール部分により置換されていることを特徴とする局所眼科用組成物。
【請求項6】
請求項1又は2に記載の局所眼科用組成物において、前記ペプチドの濃度が、0.1μg/mLから100mg/mLの範囲であることを特徴とする局所眼科用組成物。
【請求項7】
請求項6に記載の局所眼科用組成物において、前記濃度が、1μg/mLから10mg/mLの範囲であることを特徴とする局所眼科用組成物。
【請求項8】
請求項2に記載の局所眼科用組成物において、前記点眼剤のpHが3から8であることを特徴とする局所眼科用組成物。
【請求項9】
請求項2に記載の局所眼科用組成物において、前記点眼剤ビヒクルが、等張性水溶液、ポリ(ビニルアルコール)水溶液、又はこれらの混合物であることを特徴とする局所眼科用組成物。
【請求項10】
請求項1又は2に記載の局所眼科用組成物において、前記眼科用組成物が保存剤を含むことを特徴とする局所眼科用組成物。
【請求項11】
請求項1又は2に記載の局所眼科用組成物において、前記眼科用組成物が、このペプチドの透過性を増す薬剤を含むことを特徴とする局所眼科用組成物。
【請求項12】
請求項1又は2に記載の局所眼科用組成物において、眼球後区の疾病の治療及び/又は予防のための局所眼科用組成物。
【請求項13】
請求項12に記載の局所眼科用組成物において、前記治療及び/又は予防が、ソマトスタチン又はソマトスタチンアナログのソマトスタチン受容体への結合から利益を得ることを特徴とする局所眼科用組成物。
【請求項14】
前記眼球後区の疾病が、非増殖性糖尿病性網膜症、増殖性糖尿病性網膜症、加齢黄斑変性、網膜血管新生、虚血誘導性網膜症、未熟児網膜症、鎌状赤血球網膜症、網膜静脈閉塞症、色素性網膜炎、脈絡膜血管新生、ブドウ膜炎、黄斑浮腫、嚢胞様黄斑浮腫により形成される群から選択されることを特徴とする、請求項12に記載の局所眼科用組成物。
【図1】


【図2】


【図3】


【図4】




【図2】


【図3】


【図4】


【公表番号】特表2013−515687(P2013−515687A)
【公表日】平成25年5月9日(2013.5.9)
【国際特許分類】
【出願番号】特願2012−545144(P2012−545144)
【出願日】平成22年12月17日(2010.12.17)
【国際出願番号】PCT/EP2010/007737
【国際公開番号】WO2011/076368
【国際公開日】平成23年6月30日(2011.6.30)
【出願人】(511020221)
【氏名又は名称原語表記】BCN PEPTIDES,S.A.
【Fターム(参考)】
【公表日】平成25年5月9日(2013.5.9)
【国際特許分類】
【出願日】平成22年12月17日(2010.12.17)
【国際出願番号】PCT/EP2010/007737
【国際公開番号】WO2011/076368
【国際公開日】平成23年6月30日(2011.6.30)
【出願人】(511020221)

【氏名又は名称原語表記】BCN PEPTIDES,S.A.
【Fターム(参考)】
[ Back to top ]

