局所麻酔薬を含む術後疼痛を処置する方法および組成物
本発明は、術後疼痛の処置を必要としている患者の術後疼痛を減少させる、予防するまたは処置するのに有用な埋め込み可能ドラッグデポーであって、ポリマーおよび治療的有効量の局所麻酔薬またはその薬学的に許容しうる塩を含み、ここにおいて、該ドラッグデポーは、術後疼痛を減少させる、予防するまたは処置するために皮膚下部位に埋め込み可能であり、そして該ドラッグデポーは、(i)皮膚下部位にボーラス用量の局所麻酔薬またはその薬学的に許容しうる塩を、そして(ii)少なくとも4日間にわたって徐放性用量の有効量の局所麻酔薬またはその薬学的に許容しうる塩を放出することができる埋め込み可能ドラッグデポーに関する。
【発明の詳細な説明】
【技術分野】
【0001】
[0001] 本出願は、2009年4月8日出願の「Methods and Compositions for Treating Post-Operative Pain Comprising a Local Anesthetic」と称する米国特許出願第12/420,177号、および2008年4月18日出願の「Methods and Compositions for Treating Post-Operative Pain Comprising a Local Anesthetic」と称する仮出願第61/046,343号の出願日の恩典を主張し、これらは、本明細書に援用される。
【背景技術】
【0002】
[0002] 疼痛軽減は、外科手術を受けた患者を処置しているだれにとっても最も重要である。適当な疼痛軽減は、有意の生理学的および心理学的利益を患者に与える。有効な疼痛軽減とは、医療/外科手術/外来患者施設からの一層早い退院を伴う、より平穏で一層好ましい術後経過(例えば、気分、睡眠、生活の質等)を意味するのみならず、慢性疼痛症候群(例えば、線維筋痛症、筋肉痛等)の発症を減少させることもありうる。
【0003】
[0003] 疼痛は、生理学的機能を果たす。それは、しばしば、体内の損傷または疾患の存在のシグナルを与え、そしてしばしば、炎症(発赤、腫脹および/または灼熱)を伴う。術後疼痛の場合、それは、外科手術または他の処置、例えば、熱傷または非外科的外傷後の急性疼痛の管理などの結果であるかもしれない。術後疼痛管理の目的は、副作用を全くまたは最小限にしか引き起こさない投薬法で疼痛および不快感を減少させるまたは排除することである。
【0004】
[0004] 外科手術部位は、患者が苦しむことがありうる術後疼痛の程度対して、重大な作用を有する。一般に、胸郭および上腹部への手術は、下腹部への手術よりも有痛性であり、それは、四肢への末梢手術より有痛性である。しかしながら、体腔、大関節表面、脊椎または深部組織に関係した手術はいずれも、有痛性と考えるべきである。特に、胸部および上腹部への手術は、肺機能の広範囲の変化、腹筋緊張の増加、および関連した横隔膜機能低下を生じるかもしれない。その結果は、咳および分泌物の除去ができなくなることであろうが、それは、肺虚脱および肺炎をもたらすかもしれない。長期の疼痛は、身体活動を減少させ、そして静脈うっ血および増加した深部静脈血栓症リスク、およびその結果、肺塞栓症をもたらすことがありうる。更に、消化管および尿路の運動性への広範囲の作用が存在しうるが、それは、術後イレウス、悪心、嘔吐および尿停滞をもたらすかもしれない。これらの問題は、患者にとって不快であり、入院を長引かせるかもしれない。中程度〜重症の術後疼痛、外傷後疼痛および熱傷痛を経験している大部分の患者は、しばしば、外傷または外科手術後、少なくとも最初の3日間中に疼痛管理を必要とする。
【0005】
[0005] 術後疼痛を処置する一つの既知のクラスの医薬品は、オピオイドである。このクラスの化合物は、術後疼痛を制御する最も有効なタイプの薬剤の一つであると十分に認識されている。残念ながら、オピオイドは、全身投与されるので、患者を無能力にすること、呼吸器系を機能低下させること、便秘、および鎮静および多幸症などの精神活性作用を含めた関連の副作用が、有意の問題を引き起こし、それによって、回復および取り戻した可動性にハードルが設けられる。更に、これら副作用ゆえに、医師は、典型的に、オピオイドの投与を、術後最初の24時間以内に限定する。したがって、手術部位に直接的な限局疼痛管理を送達する非麻薬性薬剤を用いることが好ましいと考えられる。
【0006】
[0006] 医学専門職に知られている一つの医薬品は、ブピバカインであり、それは、浸潤、神経ブロック、硬膜外および髄腔内投与のための局所麻酔薬として広く認められている。一般に、ブピバカインは、1-ブチル-N-(2,6-ジメチルフェニル)ピペリジン-2-カルボキサミド(C18H28N2O)とも称され、次の構造:
【0007】
【化1】

【0008】
によって表すことができる。
【発明の概要】
【発明が解決しようとする課題】
【0009】
[0007] 術後疼痛についての独特の症状発現および比較的予測可能なリスクゆえに、術後疼痛および/または炎症を軽減するおよび/または処置する方法および組成物を含めた、術後疼痛および/または炎症に有効な処置への要求が存在する。
【課題を解決するための手段】
【0010】
[0008] 術後疼痛および/または炎症を有効に予防する、処置するかまたは減少させる、新しい組成物および方法を提供する。様々な態様において、単一薬剤デポーまたは多数薬剤デポー中で少なくとも4日間にわたる長時間作用性の鎮痛および抗炎症作用を有する組成物および方法を提供する。患者への身体的および心理的外傷を最小限して、鎮痛薬を包含する薬剤デポーの正確そして精密な埋め込みを容易に可能にすることができる、新しい組成物および方法を提供する。その薬剤デポーは、現在、標的組織部位(例えば、腹部、滑膜性関節、脊柱またはその付近等)に容易に送達され、そして疼痛を少なくとも4〜10日間軽減するおよび/または処置することができる。この方法において、最小限に侵襲性の手順での薬剤デポーの正確そして精密な埋め込みを達成することができる。
【0011】
[0009] 一つの例示的な態様において、術後疼痛または炎症の処置を必要としている患者の術後疼痛または炎症を減少させ、予防し、または処置するのに有用な埋め込み可能薬剤デポーを提供する。その埋め込み可能薬剤デポーは、治療的有効量の鎮痛薬またはその薬学的に許容しうる塩を含み、そしてデポーは、術後疼痛を減少させ、予防し、または処置するために皮膚下部位に埋め込み可能である。その薬剤デポーは、有効量の鎮痛薬またはその薬学的に許容しうる塩を少なくとも4日間にわたって放出することができる。上の態様における薬剤デポーは、(i)皮膚下部位にボーラス用量の鎮痛薬または局所麻酔薬またはその薬学的に許容しうる塩、そして(ii)少なくとも4日間にわたって徐放性用量の有効量の鎮痛薬または局所麻酔薬またはその薬学的に許容しうる塩、を放出することができることがありうる。その薬剤デポーは、ポリ(ラクチド-コ-グリコリド)、ポリラクチド、ポリグリコリド、ポリオルトエステル、D-ラクチド、D,L-ラクチド、ポリ(D,L-ラクチド)、L-ラクチド、ポリ(D,L-ラクチド-コ-カプロラクトン)、ポリ(D,L-ラクチド-コ-グリコリド-コ-カプロラクトン)、ポリカプロラクトンまたはこれらの組合せの一つまたは複数のものを含むポリマーを含んでよい。そのポリマーは、生物分解性であってよい。薬剤デポーは、局所麻酔薬を少なくとも4日間にわたって放出するリボン様ストリップまたはファイバーでありうる。薬剤デポーは、局所麻酔薬を少なくとも4日間にわたって放出するゲル製剤でもありうる。
【0012】
[0010] 別の例示的な態様において、埋め込み可能薬剤デポーを製造する方法を提供する。その方法は、生体適合性ポリマーおよび治療的有効量の局所麻酔薬またはその薬学的に許容しうる塩を組合せ、そしてこれらの組合せから埋め込み可能薬剤デポーを成形することを含む。
【0013】
[0011] また別の例示的な態様において、術後疼痛または炎症の処置を必要としている患者の術後疼痛または炎症を処置するかまたは予防する方法を提供する。その方法は、治療的有効量の鎮痛薬またはその薬学的に許容しうる塩を含む一つまたは複数の生物分解性薬剤デポーを、皮膚下の標的組織部位へ投与することを含み、ここにおいて、その薬剤デポーは、有効量の鎮痛薬またはその薬学的に許容しうる塩を少なくとも4日間にわたって放出する。その薬剤デポーは、(i)皮膚下部位にボーラス用量の鎮痛薬または局所麻酔薬またはその薬学的に許容しうる塩、そして(ii)少なくとも4日間にわたって徐放性用量の有効量の鎮痛薬または局所麻酔薬またはその薬学的に許容しうる塩、を放出することができることがありうる。その薬剤デポーは、ポリ(ラクチド-コ-グリコリド)、ポリラクチド、ポリグリコリド、ポリオルトエステル、D-ラクチド、D,L-ラクチド、ポリ(D,L-ラクチド)、L-ラクチド、ポリ(D,L-ラクチド-コ-カプロラクトン)、ポリ(D,L-ラクチド-コ-グリコリド-コ-カプロラクトン)、ポリカプロラクトンまたはこれらの組合せの一つまたは複数のものを含むポリマーを含んでよい。そのポリマーは、生物分解性であってよい。薬剤デポーは、局所麻酔薬を少なくとも4日間にわたって放出するリボン様ストリップでありうる。薬剤デポーは、局所麻酔薬を少なくとも4日間にわたって放出するゲル製剤でもありうる。
【0014】
[0012] また更に別の例示的な態様において、術後疼痛の処置を必要としている患者の術後疼痛を減少させる方法を提供する。その方法は、治療的有効量のブピバカインまたはその薬学的に許容しうる塩を含む一つまたは複数の生物分解性薬剤デポーを、外科手術前、中または後に、皮膚下の標的組織部位へ送達することを含み、ここにおいて、その薬剤デポーは、皮膚下部位に初期ボーラス用量の有効量のブピバカインまたはその薬学的に許容しうる塩を放出後、4〜30日間、4〜10日間、または5〜7日間にわたって徐放性用量の有効量のブピバカインまたはその薬学的に許容しうる塩を放出することができる。その薬剤デポーは、ポリマーを含んでよく、そしてそのポリマーは、ポリ(ラクチド-コ-グリコリド)、ポリラクチド、ポリグリコリド、ポリオルトエステル、D-ラクチド、D,L-ラクチド、ポリ(D,L-ラクチド)、L-ラクチド、ポリ(D,L-ラクチド-コ-カプロラクトン)、ポリ(D,L-ラクチド-コ-グリコリド-コ-カプロラクトン)、ポリカプロラクトンまたはこれらの組合せの一つまたは複数のものを含んでよい。ブピバカインは、塩の形および/または塩基の形であってよい。ポリマーは、生物分解性であってよい。薬剤デポーは、リボン様ストリップであってよい。薬剤デポーは、その薬剤デポー中に負荷されたブピバカインまたはその薬学的に許容しうる塩の全量に相対して、約40〜90%のブピバカインまたはその薬学的に許容しうる塩を、標的組織部位に薬剤デポーを投与後4〜10日間にわたって放出することができる。
【0015】
[0013] また別の例示的な態様において、術後疼痛の処置を必要としている患者の術後疼痛を減少させる、予防するかまたは処置するのに有用な埋め込み可能薬剤デポーを提供する。その埋め込み可能薬剤デポーは、治療的有効量のブピバカインまたはその薬学的に許容しうる塩およびポリマーを含む。そのデポーは、術後疼痛を減少させる、予防するかまたは処置するために皮膚下部位に埋め込み可能である。デポーは、(i)その薬剤デポー中に負荷されたブピバカインまたはその薬学的に許容しうる塩の全量に相対して、約2%〜約50%のブピバカインまたはその薬学的に許容しうる塩を、最初の48時間まで、最初の24時間まで、または最初の約24〜48時間にわたって放出し、そして(ii)その薬剤デポー中に負荷されたブピバカインまたはその薬学的に許容しうる塩の全量に相対して、約50%〜約98%のブピバカインまたはその薬学的に許容しうる塩を、引き続く3〜30日間、2〜10日間、または3〜10日間までにわたって放出することができる。そのポリマーは、ポリ(ラクチド-コ-グリコリド)、ポリラクチド、ポリグリコリド、ポリオルトエステル、D-ラクチド、D,L-ラクチド、ポリ(D,L-ラクチド)、L-ラクチド、ポリ(D,L-ラクチド-コ-カプロラクトン)、ポリ(D,L-ラクチド-コ-グリコリド-コ-カプロラクトン)、ポリカプロラクトンまたはこれらの組合せの一つまたは複数のものを含む。ポリマーは、生物分解性であってよい。様々な態様において、最初の期間が24時間まで、または約24〜48時間である場合、デポーは、約2%〜約40%のブピバカインまたはその薬学的に許容しうる塩を放出することができる。
【0016】
[0014] 別の例示的な態様において、埋め込み可能薬剤デポーを提供する。その埋め込み可能薬剤デポーは、(i)治療的有効量のブピバカインまたはその薬学的に許容しうる塩;および(ii)ポリマー、を含む。そのデポーは、皮膚下部位に初期ボーラス用量のブピバカインまたはその薬学的に許容しうる塩を放出することができ、そしてデポーは、引き続き4〜30日間、または4〜10日間にわたって徐放性用量の有効量のブピバカインまたはその薬学的に許容しうる塩を放出することができる。薬剤デポーは、その薬剤デポー中に負荷されたブピバカインの全量に相対して、約40%〜約70%のブピバカインまたはその薬学的に許容しうる塩を、薬剤デポーの投与後4〜30日間、または4〜10日間の徐放性期間にわたって放出することができる。そのポリマーは、ポリ(ラクチド-コ-グリコリド)、ポリラクチド、ポリグリコリド、ポリオルトエステル、D-ラクチド、D,L-ラクチド、ポリ(D,L-ラクチド)、L-ラクチド、ポリ(D,L-ラクチド-コ-カプロラクトン)、ポリ(D,L-ラクチド-コ-グリコリド-コ-カプロラクトン)、ポリカプロラクトンまたはこれらの組合せの一つまたは複数のものを含む。
【0017】
[0015] 様々な態様において、鎮痛薬は、局所麻酔薬またはその薬学的に許容しうる塩であってよく、そして局所麻酔薬は、ブピバカイン、ロピバカイン、メピバカイン、エチドカイン(etidocaine)、レボブピバカイン、トリメカイン(trimecaine)、カルチカイン(carticaine)またはアルチカイン(articaine)の少なくとも一つであってよい。ブピバカインは、塩の形および/または塩基の形であってよい。局所麻酔薬またはその薬学的に許容しうる塩は、ゲル中に懸濁されたミクロパーティクル、ミクロスフェア、マイクロカプセルおよび/またはミクロファイバーを含む複数のデポー中に被包されていてよい。
【0018】
[0016] 様々な態様において、薬剤デポーは、ポリマーと、更には賦形剤を含んでよい。具体的には、薬剤デポーは、約30〜約90重量パーセント(wt.%)の量の局所麻酔薬;約10〜約80 wt.%のポリマー;および約0.5〜約20 wt.%の賦形剤を含んでよい。例えば、薬剤デポーは、埋め込み可能薬剤デポーの約30〜約90 wt.%の量の局所麻酔薬;約10〜約80 wt.%のPLGA;および約0.5〜約20 wt.%のmPEGを包含することができる。
【0019】
[0017] 様々な態様における薬剤デポーは、有効量の鎮痛薬またはその薬学的に許容しうる塩を少なくとも4日間にわたって放出することができる。例えば、薬剤デポーは、その薬剤デポー中に負荷された鎮痛薬または局所麻酔薬の全量に相対して、約40〜約70%の鎮痛薬または局所麻酔薬またはその薬学的に許容しうる塩を、標的組織部位への薬剤デポーの投与後4〜10日間にわたって放出することができる。鎮痛薬または局所麻酔薬は、50〜800 mg/日の量で、この4〜10日の間中放出される。薬剤デポーは、しかしながら、薬剤デポーのその部位への投与後、はるかに長期間、例えば、少なくとも7日間にわたって、および7〜30日の範囲内で、有効量の鎮痛薬または局所麻酔薬またはその薬学的に許容しうる塩を放出することができる。
【0020】
[0018] 様々な態様における一つまたは複数のポリマーは、薬剤デポーの全wt.%の約10%〜約70%、または薬剤デポーの全wt.%の約15%〜約55%を構成してよい。その一つまたは複数のポリマーは、薬剤デポーのその部位への埋め込み後30日またはそれ未満で分解することができるかまたは分解する。
【0021】
[0019] 様々な態様における薬剤デポーは、ラジオグラフィー画像化を助けるように適合されたラジオグラフィー用マーカーを含んでよい。そのラジオグラフィー用マーカーは、バリウム、リン酸カルシウムおよび/または金属ビーズを含んでよい。
【0022】
[0020] 様々な態様における薬剤デポーは、少なくとも一つの追加の抗炎症薬または鎮痛薬、少なくとも一つのアナボリック増殖因子または抗異化増殖因子、またはこれらの組合せを含んでよい。
【0023】
[0021] 薬剤デポーは、術後疼痛を減少させるために、0.5〜1,000 mg/日のブピバカインまたはその薬学的に許容しうる塩を含めた鎮痛薬または局所麻酔薬を放出することができるかまたは放出する。
【0024】
[0022] 様々な態様において、ブピバカインは、塩または塩基の形であってよい。更に、ブピバカインまたはその薬学的に許容しうる塩は、ゲル中に懸濁されたミクロパーティクル、ミクロスフェア、マイクロカプセルおよび/またはミクロファイバーを含む複数のデポー中に被包されていてよい。その薬剤デポーは、リボン様ストリップまたはゲル製剤であってよい。
【0025】
[0023] 標的組織部位は、少なくとも一つの筋肉、靱帯、腱、軟骨、椎間板、脊髄神経根付近の椎間孔空間(spinal foraminal space)、椎間または滑膜性関節、または脊椎管を含む。
【0026】
[0024] 疼痛は、ヘルニア修復、整形外科手術または脊椎手術またはこれらの組合せに関連していてよい。外科手術は、関節鏡視下手術、腫瘍の切除(a excision of a mass)、ヘルニア修復、脊椎固定、胸部、頸部または腰部の外科手術、骨盤手術またはこれらの組合せであってよい。
【0027】
[0025] 本発明の一つまたは複数の薬剤デポーは、関節リウマチ、変形性関節症、坐骨神経痛、手根管症候群、腰痛、下肢痛、上肢痛、癌、組織痛、および頸部、胸部および/または腰部の椎骨または椎間円板、回旋腱板、関節(articular joint)、TMJ、腱、靱帯、筋肉または類似のものの傷害または修復に関連した疼痛を含めた、慢性状態の疼痛および/または炎症の状態を処置するのに用いることができる。
【0028】
[0026] 様々な態様の追加の特徴および利点は、一部分は、以下の説明に示されるであろうし、そして一部分は、その説明から明らかであろうし、または様々な態様の実施によって習得することができる。様々な態様の目的および他の利点は、本明細書および添付の請求の範囲に具体的に指摘された要素および組合せによって理解されそして達成されるであろう。
【図面の簡単な説明】
【0029】
[0027] 部分的には、それら態様の他の側面、特徴、恩典および利点は、以下の説明、請求の範囲および添付の図面に関して明らかであろう。
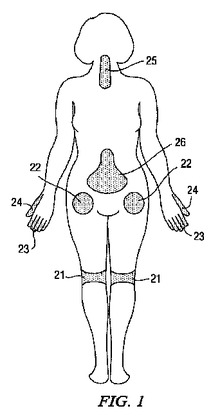
【図1】[0028] 図1は、外科手術が行われる部位でありうる患者の多数の一般的な場所、および鎮痛薬または局所麻酔薬を含有する薬剤デポーを投与することができる場所を示す。
【図2】[0029] 図2は、鎮痛薬または局所麻酔薬を含有する薬剤デポーを投与することができる部位および脊椎の背側略図を示す。
【図3】[0030] 図3は、実施例1によるブピバカイン製剤の平均累積放出百分率のグラフによる図示である。
【図4】[0031] 図4は、実施例1によるブピバカイン製剤についてのミリグラムでの平均累積1日放出のグラフによる図示である。
【図5】[0032] 図5は、実施例1によるブピバカイン製剤のin vivo試験による効力データのグラフによる図示である。
【図6】[0033] 図6は、実施例1によるブピバカイン製剤のin vivo試験による効力データのグラフによる図示である。
【図7】[0034] 図7は、実施例2に記載のブピバカイン滅菌済みPOP埋込み剤のugでの平均累積放出研究のグラフによる図示である(POPは、術後疼痛を意味する)。
【図8】[0035] 図8は、実施例2に記載の滅菌済みブピバカインPOP埋込み剤の平均累積放出百分率の研究のグラフによる図示である。
【図9】[0036] 図9は、実施例2によるブピバカイン埋込み剤についての術後日数によるグラムあたりの温熱性足引っ込め閾値のグラフによる図示である。
【図10】[0037] 図10は、実施例4に記載の研究によるブピバカイン製剤についての平均累積in vitro放出プロフィールのグラフによる図示である。
【図11】[0038] 図11は、実施例4に記載の研究によるブピバカイン製剤についての平均累積in vitro放出プロフィールのグラフによる図示である。
【図12】[0039] 図12は、実施例4に記載の研究による別のブピバカイン製剤についての平均累積in vitro放出プロフィールのグラフによる図示である。
【図13】[0040] 図13は、実施例5に記載の研究によるブピバカイン埋込み剤についての平均累積in vitro放出プロフィールのグラフによる図示である。
【図14】[0041] 図14は、実施例5に記載の研究によるブピバカイン埋込み剤についての平均累積in vitro放出プロフィールのグラフによる図示である。
【図15A】[0042] 図15Aは、実施例6に記載の研究による三つのブピバカインストリップについての累積放出百分率のグラフによる図示である。
【図15B】[0043] 図15Bは、図15Aに示されるブピバカインストリップについての平均累積放出百分率のグラフによる図示である。
【図16A】[0044] 図16Aは、実施例6に記載の三つのブピバカインストリップについてのugでの累積in vitro放出のグラフによる図示である。
【図16B】[0045] 図16Bは、図16Bに示されるブピバカインストリップについてのugでの平均累積in vitro放出のグラフによる図示である。
【図17】[0046] 図17は、外科的切開術後に埋め込まれたブピバカインデポーの痛覚スコアのグラフによる図示である。
【0030】
[0047] これら図面が、均等縮尺で描かれているのではないということは理解されるはずである。更に、図中の対象間の関係は、均等縮尺ではないことがありうるし、そして実際に、サイズに関して逆関係を有することがありうる。図面は、示されている各々の対象の構造を理解させそして明確化するためのものであり、したがって、いくつかの特徴は、ある構造の具体的な特徴を示すために誇張されていることがありうる。
【発明を実施するための形態】
【0031】
[0048] 本明細書および添付の請求の範囲の目的について、特に断らない限り、本明細書および請求の範囲において用いられる成分の量、材料の百分率または比率、反応条件および他の数値を表している全ての数字は、いずれの場合も、「約」という用語で修飾されると理解されるべきである。したがって、そうではないと示されない限り、以下の明細書および添付の請求の範囲に示される数値パラメーターは、本発明によって得られるように求められる所望の性質に依存して異なることがありうる近似値である。きわめて少なくとも、そして請求の範囲の範囲への均等の原則の適用を限定する試みとしてではなく、各々の数値パラメーターは、少なくとも、報告されている有効数字の数に照らして、および普通の丸め法を適用することによって解釈されるべきである。
【0032】
[0049] 本発明の広い範囲を示している数値範囲およびパラメーターが、近似値であるということにもかかわらず、具体的な実施例に示されている数値は、できるだけ精密に報告されている。しかしながら、いずれの数値も、本質的には、それらのそれぞれの試験測定値に見出される標準偏差によって必然的に生じる一定の誤差を含有する。更に、本明細書中に開示の範囲は全て、そこに包含されるいずれかおよび全ての部分範囲を包含すると理解されるはずである。例えば、「1〜10」の範囲には、最小値の1および最大値の10の間の(それらを含めた)いずれかおよび全ての部分範囲、すなわち、1に等しいまたはそれより大の最小値および10に等しいまたはそれ未満の最大値を有するいずれかおよび全ての部分範囲、例えば、5.5〜10が含まれる。
【0033】
[0050] 本明細書および請求の範囲に用いられる単数形(a、anおよびthe)は、はっきりとそして明確に一つの意味に限定されない限り、複数の意味を包含するということが留意される。したがって、例えば、「薬剤デポー」の意味には、一つ、二つ、三つまたはそれを超える薬剤デポーが含まれる。
【0034】
[0051] ここで、本発明の特定の態様に詳細に言及するが、それらの例は、添付の図面に詳しく示されている。本発明を、詳しく示されている態様と一緒に記載するが、それらが、本発明をそれらの態様に限定するものではないということは理解されるであろう。反対に、本発明は、請求の範囲によって定義される発明の範囲内に包含されうる全ての変更、修飾および均等物を包含するものである。
【0035】
[0052] 下の見出しは、いずれにせよ、本開示を限定するためのものではなく;いずれか一つの見出し下の態様は、いずれか他の見出し下の態様と一緒に用いることができる。
【0036】
[0053] 術後疼痛または炎症を有効に予防する、処置するかまたは減少させる新しい組成物および方法を提供する。様々な態様において、単一薬剤デポーまたは複数の薬剤デポー中で少なくとも4日間にわたる長時間作用性の鎮痛および抗炎症作用を有する組成物および方法を提供する。新しい鎮痛性組成物および方法を提供するが、それは、患者への身体的および心理的外傷を最小限にして、ブピバカインなどの鎮痛薬を包含する薬剤デポーの正確そして精密な埋め込みを容易に可能にすることができる。その薬剤デポーは、現在、標的組織部位(例えば、腹部、滑膜性関節、脊柱またはその付近等)に容易に送達され、そして疼痛を少なくとも4〜10日間軽減するおよび/または処置することができる。この方法において、最小限に侵襲性の手順並びに開放手順での薬剤デポーの正確そして精密な埋め込みを達成することができる。
【0037】
ブピバカイン
[0054] ブピバカインまたは別の局所麻酔薬は、薬剤デポー中に含有されてよい。薬剤デポーは、所望の部位(例えば、滑膜性関節、椎間腔、脊椎管、腹部、患者の組織等)における埋め込みおよび保持を容易にする物理的構造を含む。薬剤デポーは、更に、薬剤を含む。本明細書中で用いられる「薬剤」という用語は、一般に、患者の生理を変化させるいずれかの物質を意味するものである。「薬剤」という用語は、本明細書中において、「治療薬」、「治療的有効量」および「活性な医薬成分(active pharmaceutical ingredient)」または「API」と同じ意味に用いることかできる。「薬剤」製剤には、二つ以上の治療薬が含まれてよく、ここにおいて、治療薬の代表的な組合せには、二つまたはそれを超える薬剤の組合せが含まれるということは理解されるであろう。薬剤デポーは、部位への送達のための治療薬の濃度勾配を与える。様々な態様において、薬剤デポーは、埋込み剤部位から約1 cm〜約10までの距離で治療薬の最適薬剤濃度勾配を与える。
【0038】
[0055] 「治療的有効量」または「有効量」は、投与時に、薬剤が、例えば、炎症の抑制、疼痛の減少または軽減、状態の改善等のような生物学的活性の変更をもたらすようなことである。様々な態様において、ブピバカインの治療的有効量は、約0.5 mg/日〜1,000 mg/日を含む。いくつかの態様において、治療的有効量のブピバカインは、1日につき約0.1 mg〜800 mgのブピバカインを含む。いくつかの態様において、治療的有効量のブピバカインは、1日につき約50 mg〜800 mgのブピバカイン、または1日につき約200 mg〜800 mgのブピバカインを含む。いくつかの態様において、治療的有効量のブピバカインは、1日につき約0.5 mg、100 mg、200 mg、300 mg、400 mg、500 mg、600 mg、700 mg、800 mg、900 mgまたは1,000 mgおよびその間の全ての部分範囲のブピバカインを含む。いくつかの態様において、治療的有効量のブピバカインは、1日につき0.5 mg、0.6 mg、0.7 mg、0.8 mg、0.9 mg、1 mg、1.1 mg、1.2 mg、1.3 mg、1.4 mg、1.5 mg、1.6 mg、1.7 mg、1.8 mg、1.9 mg、2 mg、3 mg、4 mg、5 mg、6 mg、7 mg、8 mg、9 mg、10 mg、11 mg、12 mg、13 mg、14 mg、15 mg、16 mg、17 mg、18 mg、19 mg、20 mg、21 mg、22 mg、23 mg、24 mg、25 mg、30 mg、35 mgまたは40 mgのブピバカインを含む。一つの態様において、ヒトへの投薬量は、1日につき400 mg〜600 mgのブピバカインである。患者に投与される投薬量が、投与される薬剤の薬物動態学的性質、投与経路、患者の状態および特徴(性別、年齢、体重、健康状態、体格等)、症状の程度、同時処置、処置頻度、および所望の作用を含めた様々な因子に依存して、単一デポーまたは複数デポーとして存在しうるということは理解されるであろう。例えば、オピオイド(例えば、モルフィン)との同時処置が存在する場合、より少ない1日用量のブピバカインが要求されることがありうるし、或いは、術後疼痛を制御するためにオピオイド(例えば、モルフィン)の投薬量を減少させるまたは排除するにつれて、患者は、より多い用量のブピバカインを必要とすることがありうる。
【0039】
[0056] 様々な態様において、治療的有効量のブピバカインを与えて、術後疼痛を抑制する、処置するおよび/または予防する。一般に、ブピバカインの化学名は、1-ブチル-N-(2,6-ジメチルフェニル)ピペリジン-2-カルボキサミドである。ブピバカインは、288.43の分子量を有し、そして次の一般的な構造を示す。
【0040】
【化2】

【0041】
[0057] ブピバカインには、(+/-)-1-ブチル-N-(2,6-ジメチルフェニル)ピペリジン-2-カルボキサミドまたはその薬学的に許容しうる無毒性エステルまたは塩が含まれるが、これらに限定されるわけではない。ブピバカインには、ブピバカインのラセミ混合物((+)-Rおよび(-)-S鏡像異性体)またはデキストロ(dextro)異性体およびレボ(levo)異性体各々が個々に含まれる。ブピバカインには、遊離酸、更には、前述のいずれか一つのいずれか他の薬学的に許容しうる塩が含まれる。ブピバカインは、更に、長時間作用性活性のためにペグ化されてもよい。
【0042】
[0058] ブピバカインの薬学的に許容しうるエステルには、1〜約12個の炭素原子を有する分岐鎖または直鎖の炭化水素から誘導されるアルキルエステルが含まれるが、これらに限定されるわけではない。このようなエステルの例は、メチルエステル、エチルエステル、プロピルエステル、イソプロピルエステル、ブチルエステル、t-ブチルエステル、イソアミルエステル、ペンチルエステル、イソペンチルエステル、ヘキシルエステル、オクチルエステル、ノニルエステル、イソデシルエステル、6-メチルデシルエステルまたはドデシルエステルである。
【0043】
[0059] ブピバカインの薬学的に許容しうる塩には、無機塩基かまたは有機塩基から誘導される塩が含まれる。無機塩基から誘導される塩には、ナトリウム塩、カリウム塩、リチウム塩、アンモニウム塩、カルシウム塩、マグネシウム塩、第一鉄塩、亜鉛塩、銅塩、マンガン塩、アルミニウム塩、第二鉄塩、マンガン酸塩等が含まれるが、これらに限定されるわけではない。薬学的に許容しうる有機無毒性塩基から誘導される塩には、第一級、第二級または第三級アミン、天然に存在する置換アミンを含めた置換アミンまたは環状アミン、または塩基性イオン交換樹脂であって、イソプロピルアミン、トリメチルアミン、ジエチルアミン、トリエチルアミン、トリプロピルアミン、エタノールアミン、2-ジメチルアミノエタノール、2-ジエチルアミノエタノール、トロメタミン、ジシクロヘキシルアミン、リシン、アルギニン、ヒスチジン、カフェイン、プロカイン、ヒドラバミン(hydrabamine)、コリン、ベタイン、エチレンジアミン、グルコサミン、メチルグルカミン、テオブロミン、プリン、ピペラジン、ピペリジン、N-エチルピペリジン、ポリアミンの樹脂などのもの等の塩が含まれるが、これらに限定されるわけではない。
【0044】
[0060] ブピバカインに加えて、薬剤デポーは、一つまたは複数の追加の治療薬を含んでよい。治療薬の例には、可溶性腫瘍壊死因子α受容体、いずれかのペグ化可溶性腫瘍壊死因子α受容体、モノクローナル抗体またはポリクローナル抗体または抗体フラグメントまたはこれらの組合せが含まれるがこれらに限定されるわけではないTNF-αおよびIL-1などの前炎症性サイトカインの直接作用性および局所作用性モジュレーターであるものが含まれる。適する治療薬の例には、受容体アンタゴニスト;標的分子への結合について受容体と拮抗する分子;アンチセンスポリヌクレオチド;および標的タンパク質をコードしているDNAの転写阻害剤が含まれる。適する例には、Adalimumab、Infliximab、Etanercept、Pegsunercept(PEG sTNF-R1)、sTNF-R1、CDP-870、CDP-571、CNI-1493、RDP58、ISIS 104838、1→3-β-D-グルカン、Lenercept、PEG-sTNFRII Fc Mutein、D2E7、Afelimomabおよびこれらの組合せが含まれるが、これらに限定されるわけではない。他の態様において、治療薬には、メタロプロテアーゼ阻害剤;グルタメートアンタゴニスト;グリア細胞由来神経栄養因子(glial cell-derived neurotropic factors)(GDNF);B2受容体アンタゴニスト;カプサイシンおよびシバミド(civamide)などのサブスタンスP受容体(NK1)アンタゴニスト;下流調節要素アンタゴニストモジュレーター(downstream regulatory element antagonistic modulator)(DREAM);iNOS;テトロドトキシン(TTX)抵抗性Na+チャンネル受容体サブタイプPN3およびSNS2の阻害剤;IL-1、IL-6およびIL-8などのインターロイキンの阻害剤;および抗炎症性サイトカイン、TNF結合タンパク質、オネルセプト(onercept)(r-hTBP-1)、阻害剤、エンハンサー、増強剤(potentiators)または中和剤をコードしている組換えアデノ関連ウイルス(rAAV)ベクター、抗体であって、天然に存在するかまたは合成の二本鎖、一本鎖またはそのフラグメントが含まれるがこれらに限定されるわけではないものが含まれる。例えば、適する治療薬には、NanobodiesTM(Ablynx, Ghent Belgium)と称される一本鎖抗体に基づく分子であって、天然に存在する単一ドメイン抗体の最小の機能性フラグメントとして定義されるものが含まれる。或いは、治療薬には、キナーゼに作用する物質および/または細胞シグナリングマイトジェン活性化プロテインキナーゼ(MAPK)、p38MAPK、Srcまたはプロテインチロシンキナーゼ(PTK)を阻害する物質が含まれる。治療薬には、キナーゼ阻害剤、例えば、Gleevec、Herceptin、Iressa、イマチニブ(STI571)、ヘルビマイシンA(herbimycin A)、チルホスチン47(tyrphostin 47)、エルブスタチン(erbstatin)、ゲニステイン、スタウロスポリン(staurosporine)、PD98059、SB203580、CNI-1493、VX-50/702(Vertex/Kissei)、SB203580、BIRB796(Boehringer Ingelheim)、Glaxo P38 MAP Kinase阻害剤、RWJ67657(J&J)、UO126、Gd、SCIO-469(Scios)、RO3201195(Roche)、Semipimod(Cytokine PharmaSciences)またはその誘導体などが含まれる。
【0045】
[0061] 治療薬は、様々な態様において、炎症カスケードにおけるTNF-αまたは他のタンパク質の転写または翻訳をブロックする。適する治療薬には、インテグリンアンタゴニスト、α4β7インテグリンアンタゴニスト、細胞接着阻害剤、インターフェロンγアンタゴニスト、CTLA4-Igアゴニスト/アンタゴニスト(BMS-188667)、CD40リガンドアンタゴニスト、ヒト化抗IL-6 mAb(MRA, Tocilizumab, Chugai)、HMGB-1 mAb(Critical Therapeutics Inc.)、抗IL2R抗体(ダクリズマブ(daclizumab)、バシリシマブ(basilicimab))、ABX(抗IL-8抗体)、組換えヒトIL-10またはHuMax IL-15(抗IL15抗体)が含まれるが、これらに限定されるわけではない。
【0046】
[0062] 他の適する治療薬には、組換え非グリコシル化形のヒトインターロイキン1受容体アンタゴニスト(IL-1Ra)であるKineret(登録商標)(アナキンラ(anakinra));またはIL-1の作用をブロックするモノクローナル抗体であるAMG108のような、IL-1阻害剤が含まれる。治療薬には、更に、グルタメートおよびアスパルテートなどの興奮性アミノ酸;NMDA受容体、AMPA受容体および/またはカイネート受容体へのグルタメート結合のアンタゴニストまたは阻害剤が含まれる。例えば、インターロイキン1受容体アンタゴニスト、サリドマイド(TNF-α放出阻害剤)、サリドマイド類似体(マクロファージによってTNF-α生産を減少させるもの)、骨形成タンパク質(BMP)2型およびBMP-4(TNF-αアクチベーターであるカスパーゼ8の阻害剤)、キナプリル(quinapril)(TNF-αをアップレギュレーションするアンギオテンシンIIの阻害剤)、IL-11などのインターフェロン(TNF-α受容体発現をモジュレーションするもの)、およびオーリントリカルボン酸(TNF-αを阻害するもの)も、炎症を減少させる治療薬として有用でありうる。所望の場合、上のペグ化形を用いてよいと考えられる。他の治療薬の例には、グルココルチコイド、クロニジンなどのNFκB阻害剤;ジチオカルバメートなどの抗酸化剤;および他の化合物、例えば、スルファサラジンなどが含まれる。
【0047】
[0063] 使用に適する治療薬の具体的な例には、抗炎症薬、鎮痛薬または骨誘導性(osteoinductive)増殖因子、またはこれらの組合せが含まれるが、これらに限定されるわけではない。抗炎症薬には、サリシレート、ジフルニサル、スルファサラジン、インドメタシン、イブプロフェン、ナプロキセン、トルメチン、ジクロフェナク、ケトプロフェン、フェナメート(fenamates)(メフェナム酸、メクロフェナム酸)、エノール酸(ピロキシカム、メロキシカム(meloxicam))、ナブメトン(nabumetone)、セレコキシブ(celecoxib)、エトドラク(etodolac)、ニメスリド(nimesulide)、アパゾン(apazone)、金、スリンダクまたはテポキサリン(tepoxalin);ジチオカルバメートなどの抗酸化剤;およびスルファサラジン[2-ヒドロキシ-5-[-4-[C2-ピリジニルアミノ)スルホニル]アゾ]安息香酸]などの他の化合物;フルオシノロン、コルチゾール、コルチゾン、ヒドロコルチゾン、フルドロコルチゾン(fludrocortisone)、プレドニゾン、プレドニゾロン、メチルプレドニゾロン、トリアムシノロン、ベタメタゾン、デキサメタゾン、ベクロメタゾン、フルチカゾン(fluticasone)などのステロイド類、またはこれらの組合せが含まれるが、これらに限定されるわけではない。
【0048】
[0064] 適するアナボリック増殖因子または抗異化増殖因子には、骨形成タンパク質、成長分化因子、LIM鉱化作用タンパク質、CDMPまたは前駆細胞、またはこれらの組合せが含まれるが、これらに限定されるわけではない。
【0049】
[0065] 追加の鎮痛薬も、デポー中に包含されてよい。適する鎮痛薬には、アセトアミノフェン、リドカイン、オピオイド鎮痛薬であって、ブプレノルフィン、ブトルファノール、デキストロモラミド(dextromoramide)、デゾシン(dezocine)、デキストロプロポキシフェン(dextropropoxyphene)、ジアモルフィン(diamorphine)、フェンタニール、アルフェンタニル(alfentanil)、スフェンタニル(sufentanil)、ヒドロコドン、ヒドロモルホン、ケトベミドン(ketobemidone)、レボメタジル(levomethadyl)、メピリジン(mepiridine)、メタドン、モルフィン、ナルブフィン(nalbuphine)、オピウム、オキシコドン、パパベレタム、ペンタゾシン、ペチジン、フェノペリジン(phenoperidine)、ピリトラミド(piritramide)、デキストロプロポキシフェン、レミフェンタニル、チリジン(tilidine)、トラマドール、コデイン、ジヒドロコデイン、メプタジノール、デゾシン(dezocine)、エプタゾシン(eptazocine)、フルピルチン(flupirtine)などのもの、またはこれらの組合せが含まれるが、これらに限定されるわけではない。
【0050】
[0066] 適する鎮痛薬には、更に、鎮痛性を有する物質、例えば、アミトリプチリン、カルバマゼピン、ガバペンチン(gabapentin)、プレガバリン(pregabalin)、クロニジン、またはこれらの組合せなどが含まれる。
【0051】
[0067] デポーは、筋弛緩薬を含有してよい。代表的な筋弛緩薬には、例としてそして限定としてではなく、塩化アルクロニウム、アトラクリウムベシレート(atracurium bescylate)、バクロフェン、カルボロニウム(carbolonium)、カリソプロドール、カルバミン酸クロルフェネシン、クロルゾキサゾン、シクロベンザプリン(cyclobenzaprine)、ダントロレン、臭化デカメトニウム(decamethonium bromide)、ファザジニウム(fazadinium)、ガラミントリエチオダイド、ヘキサフルオレニウム、メラドラジン(meladrazine)、メフェネシン(mephensin)、メタキサロン(metaxalone)、メトカルバモール、ヨウ化メトクリン(metocurine iodide)、パンクロニウム、プリジノールメシレート、スチラメート、スキサメトニウム、スキセトニウム(suxethonium)、チオコルヒコシド(thiocolchicoside)、チザニジン、トルペリゾン、ツボクラリン(tubocuarine)、ベクロニウムまたはこれらの組合せが含まれる。
【0052】
[0068] デポーは、一つまたは複数の治療薬を含み、そして更に、他の非活性成分を含有してよい。これら非活性成分は、一つまたは複数の治療薬の担持、安定化およびその放出の制御を含めた多機能目的を有することができる。例えば、徐放性過程は、溶液拡散機構によってもよいし、またはそれは、侵食持続過程(erosion-sustained process)によって支配されてもよい。典型的に、デポーは、生物分解性であってもよい生体適合性材料を含んで成る固形または半固形製剤であろう。「固形」という用語は、非ゲル様材料を意味するものであるが、「半固形」は、ある程度の流動性を有することで、デポーを折り曲げそして周囲組織必要条件に適合させるゲル様材料を意味するものである。「ゲル」という用語は、外科手術部位へのその適用のいずれの点でも、軟質そして変形性である材料を意味するものである。
【0053】
[0069] 様々な態様において、デポー材料は、計画された薬剤送達期間と同様の時間(生物分解性成分について)またはそれより長い時間(非生物分解性成分について)、組織部位内で耐久性であろう。例えば、デポー材料は、体温に近いかまたはそれより高いが、治療薬の脱組成物(decomposition)または分解(degradation)温度より低い融点またはガラス転移温度を有してよい。しかしながら、デポー材料の所定の侵食を用いて、負荷された一つまたは複数の治療薬の遅い放出をもたらすこともできる。
【0054】
[0070] 様々な態様において、薬剤デポーは、in vivo埋め込み後、一定の引金点(例えば、温度、pH等)に達した時に、ブピバカインなどの局所麻酔薬を放出するように設計することができる。例えば、薬剤デポーは、具体的には、薬剤が解熱性を有する場合、例えば、体温が102°Fより高くなると、より多くの薬剤を放出しうるポリマーを含んでよい。様々な態様において、埋め込み部位に依存して、薬剤デポーは、一定のpHに達すると、多かれ少なかれ薬剤を放出することができる。例えば、薬剤デポーは、一定のpHを有する体液(例えば、約7.35〜約7.70のpHを有するCSF、約7.29〜約7.45のpHを有する滑液;約4.6〜約8.0のpHを有する尿、約7.2〜約7.4のpHを有する胸膜液、約7.35〜約7.45のpHを有する血液等)が薬剤デポーに接触すると、薬剤を放出するように設計することができる。
【0055】
[0071] 様々な態様において、デポーは、ブピバカインなどの局所麻酔薬および/または他の治療薬が、デポーの約5〜99 wt.%、またはデポーの30〜95 wt.%、デポーの30〜90 wt.%、またはデポーの50〜75 wt.%、またはデポーの55〜65 wt.%を構成するような高い薬剤負荷量を有してよい。様々な態様において、ブピバカインおよび/または他の治療薬の量は、デポー中に、デポー重量で約40%〜約80%の範囲内(40%、41%、42%、43%、44%、45%、46%、47%、48%、49%、50%、51%、52%、53%、54%、55%、56%、57%、58%、59%、60%、61%、62%、63%、64%、65%、66%、67%、68%、69%、70%、71%、72%、73%、74%、75%、76%、77%、78%、79%、80%およびこれらのいずれか二点間のいずれかの範囲、例えば、40.1〜50%、50〜60%および60〜70%等も含めた範囲)で存在する。
【0056】
[0072] 様々な態様において、薬剤デポーは、1日につき0.1 mg、0.2 mg、0.3 mg、0.4 mg、0.5 mg、0.6 mg、0.7 mg、0.8 mg、0.9 mg、1 mg、1.1 mg、1.2 mg、1.3 mg、1.4 mg、1.5 mg、1.6 mg、1.7 mg、1.8 mg、1.9 mg、2 mg、3 mg、4 mg、5 mg、6 mg、7 mg、8 mg、9 mg、10 mg、11 mg、12 mg、13 mg、14 mg、15 mg、16 mg、17 mg、18 mg、19 mg、20 mg、21 mg、22 mg、23 mg、24 mg、25 mg、30 mg、35 mgまたは40 mg、45 mg、50 mg、55 mg、60 mg、65 mg、70 mg、75 mg、75 mg、80 mg、85 mg、90 mg、95 mg、100 mg、105 mg、110 mg、115 mg、120 mg、125 mg、130 mg、135 mg、140 mg、145 mg、150 mg、155 mg、160 mg、165 mg、170 mg、175 mg、180 mg、185 mg、190 mg、195 mg、200 mg、300 mg、400 mg、500 mg、600 mg、700 mg、800 mg、900 mgまたは1,000 mgおよびその間の全ての部分範囲のブピバカインを、合計で少なくとも4日間、少なくとも7日間、少なくとも8日間、4〜30日間、4〜10日間、4〜8日間、5〜7日間、または7〜10日間放出することができる。様々な態様において、薬剤デポーは、0.5 mg/時〜20 mg/時のブピバカインを、合計で少なくとも4日間、4〜10日間、5〜7日間、または7〜10日間放出して、術後疼痛を減少させ、処置し、または予防することができる。様々な態様において、薬剤デポーは、標的組織部位に薬剤デポーを投与後、5%、10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%、99%または100%のブピバカインを、3〜10日間、4〜10日間または5〜7日間にわたって放出する。薬剤デポーは、所定の時間単位にわたって放出される活性成分の百分率を意味する「放出速度プロフィール」、例えば、mg/時、mg/日、10%/10日間等を有することができる。当業者は、放出速度プロフィールが、必ずしも直線的である必要はないかもしれないと承知している。限定的ではない例として、薬剤デポーは、ブピバカインを一定時間にわたって放出するストリップまたはリボン様ストリップまたはファイバーであってよい。
【0057】
[0073] 様々な態様において、薬剤デポーは、約40重量%〜80重量%のブピバカイン、15重量%〜55重量%のポリマー、および5重量%〜15重量%の賦形剤を含む。mPEGは、得られた製剤に展性を与えるので、ポリマーのための賦形剤または可塑剤として用いることができる。PEG 300も、賦形剤として用いることができる。更に、PEG 300およびNMPの組合せは、賦形剤として用いることができる。
【0058】
[0074] 生物分解性ポリマーに加えて、ブピバカインと一緒に製剤化することができる代表的な賦形剤には、MgO(例えば、1 wt.%)、5050 DLG 6E、5050 DLG 1A、mPEG、TBO-Ac、mPEG、Span-65、Span-85、プルロニク(pluronic)F127、TBO-Ac、ソルビタル(sorbital)、シクロデキストリン、マルトデキストリンおよびこれらの組合せが含まれるが、これらに限定されるわけではない。いくつかの態様において、一つまたは複数の賦形剤は、製剤の約0.001 wt.%〜約50 wt.%を構成してよい。いくつかの態様において、一つまたは複数の賦形剤は、製剤の約0.001 wt.%〜約40 wt.%を構成してよい。いくつかの態様において、一つまたは複数の賦形剤は、製剤の約0.001 wt.%〜約30 wt.%を構成してよい。いくつかの態様において、一つまたは複数の賦形剤は、製剤の約0.001 wt.%〜約20 wt.%を構成してよい。いくつかの態様において、一つまたは複数の賦形剤は、製剤の約0.5 wt.%〜約20 wt.%を構成してよい。いくつかの態様において、一つまたは複数の賦形剤は、製剤の約0.001 wt.%〜約10 wt.%を構成してよい。いくつかの態様において、一つまたは複数の賦形剤は、製剤の約0.001 wt.%〜約2 wt.%を構成してよい。
【0059】
[0075] いくつかの態様において、薬剤デポーは、生物分解性でなくてよい。例えば、薬剤デポーは、ポリウレタン、ポリ尿素、ポリエーテル(アミド)、PEBA、熱可塑性エラストマー性オレフィン、コポリエステル、およびスチレン系熱可塑性エラストマー、鋼、アルミニウム、ステンレス鋼、チタン、高い非鉄金属含有量および低い相対比率の鉄を含む金属アロイ、炭素繊維、ガラス繊維、プラスチック、セラミックス、またはこれらの組合せを含んでよい。典型的に、これらタイプの薬剤デポーは、一定時間後に除去される必要がありうる。
【0060】
[0076] いくつかの場合、使用後に薬剤デポーを除去する必要がないことが望まれることがありうる。それらの場合、薬剤デポーは、生物分解性材料を含んでよい。この目的に利用可能なそして標的組織にまたはその付近に配置された時に長時間にわたって分解するかまたは崩壊することができる特性を有する材料が多数存在する。生物分解性材料の化学の関数として、分解過程の機構は、本来の加水分解性または酵素作用性またはこれら双方でありうる。様々な態様において、分解は、表面で(不均一侵食または表面侵食)かまたは薬剤送達システムデポーの至る所で一様に(均一侵食またはバルク侵食)起こることがありうる。
【0061】
[0077] 薬剤デポーは、ポリマー性材料または非ポリマー性材料、更には、合成のまたは天然に存在する材料、またはこれらの組合せを含んでよい。非ポリマー性材料には、例えば、コレステロール、スチグマステロール、グリセロール、エストラジオール、スクロース、ジステアラート、ソルビタン、ソルビタンモノオレアート、ソルビタンモノパルミテート、ソルビタントリステアラート等が含まれる。
【0062】
[0078] 様々な態様において、薬剤デポーは、ポリマーを含み、そしてそのポリマーは、1年未満の間にわたってin vivo分解して、少なくとも50%のポリマーが6か月以内またはそれ未満で分解するであろう。いくつかの態様において、ポリマーは、2か月、1か月またはそれ未満で分解することができるかまたは分解するであろう。いくつかの態様において、ポリマーは、1か月以内に有意に分解して、少なくとも50%のポリマーが、体内で除去される無毒性残基へと分解するであろうし、そして100%の薬剤が2週間以内に放出されるであろう。ポリマーは、更に、バルク侵食によるよりもむしろ、表面侵食による加水分解によって分解するはずであるので、放出は、持続するのみならず、直線的である。この判定基準を満たすポリマーには、いくつかのポリ無水物;乳酸およびグリコール酸のコポリマーであって、乳酸対グリコール酸の重量比が4:1以下(すなわち、80重量%またはそれ未満の乳酸対20重量%またはそれを超えるグルコール酸)であるもの;および例えば、少なくとも1重量%の無水マレイン酸などの無水物触媒を含有する触媒または分解促進性化合物を含有するポリオルトエステルが含まれる。他のポリマーには、ゼラチンおよびフィブリンなどのタンパク質ポリマー;およびヒアルロン酸などの多糖が含まれる。
【0063】
[0079] 「デポー」には、カプセル、ミクロスフェア、ミクロパーティクル、マイクロカプセル、ミクロファイバー、粒子、ナノスフェア、ナノパーティクル、コーティング、マトリックス、ウェファー、ピル、ペレット、エマルジョン、リポソーム、ミセル、シート、ストリップ、リボン様ストリップまたはファイバー、メッシュ、ペースト、スラブ、ペレット、ゲルまたは他の医薬送達組成物が含まれるが、これらに限定されるわけではない。理想的には、デポーに適する材料は、好ましくは、FDA承認材料またはGRAS材料である薬剤的に許容しうる生物分解性材料および/またはいずれかの生体吸収性材料である。これら材料は、ポリマー性または非ポリマー性でありうる、更には、合成でありうるまたは天然に存在しうる、またはこれらの組合せでありうる。
【0064】
[0080] 「生物分解性」という用語には、薬剤デポーの全部または一部分が、酵素の作用によって、加水分解作用によって、および/またはヒト体内の他の同様の機構によって、時間経過とともに分解するであろうということが含まれる。様々な態様において、「生物分解性」は、デポー(例えば、ミクロパーティクル、ミクロスフェア、ゲル等)が、体内において、治療薬が放出された後にまたは放出されている間に、無毒性成分へと崩壊する(break down)または分解する(degrade)ことができるということを包含する。「生物侵食性」により、デポーおよび/またはゲルは、少なくとも一部分は、周囲組織中に見出される物質、体液との接触のために、または細胞性作用によって、時間経過で侵食するかまたは分解するであろうということを意味する。「生体吸収性」により、デポーは、ヒト体内で、例えば、細胞または組織によって崩壊されそして吸収されるであろうということを意味する。「生体適合性」は、デポーが、標的組織部位において実質的な組織刺激または壊死を引き起こさないであろうということを意味する。
【0065】
[0081] 様々な態様において、デポーは、薬剤の即時放出、徐放性または制御放出をもたらすことができる生体吸収性、生体吸収性および/または生物分解性のバイオポリマーを含んでよい。適する徐放性バイオポリマーの例には、ポリ(α-ヒドロキシ酸)、ポリ(ラクチド-コ-グリコリド)(PLGAまたはDLG)(ポリ(ラクチド-コ-グリコリド)、ポリ(D-ラクチド-コ-グリコリド)、ポリ(L-ラクチド-コ-グリコリド)およびポリ(D,L-ラクチド-コ-グリコリド)が含まれるもの)、ポリラクチド(PLA)、ポリグリコリド(PG)、ポリオルトエステル(類)(POE)、ポリエチレングリコール(PEG)、PEG 200、PEG 300、PEG 400、PEG 500、PEG 550、PEG 600、PEG 700、PEG 800、PEG 900、PEG 1000、PEG 1450、PEG 3350、PEG 4500、PEG 8000、ポリ(α-ヒドロキシ酸)のコンジュゲート、ポリアスピリン、ポリホスファゼン(polyphosphazenes)、コラーゲン、デンプン、α化(pre-gelatinized)デンプン、ヒアルロン酸、キトサン、ゼラチン、アルギネート、アルブミン、フィブリン、ビタミンE類似体であって、αトコフェリルアセテート、d-αトコフェリルスクシネートなどのもの、D-ラクチド、D,L-ラクチド、L-ラクチド、D,L-ラクチド-カプロラクトン(DL-CL)、D,L-ラクチド-グリコリド-カプロラクトン(DL-G-CL)、デキストラン、ビニルピロリドン、ポリビニルアルコール(PVA)、PVA-g-PLGA、PEGT-PBTコポリマー(多活性)、メタクリレート、ポリ(N-イソプロピルアクリルアミド)、PEO-PPO-PEO(プルロニック)、PEO-PPO-PAAコポリマー、PLGA-PEO-PLGA、PEG-PLG、PLA-PLGA、ポロキサマー407、PEG-PLGA-PEGトリブロックコポリマー、SAIB(スクロースアセテートイソブチラート)、ヒドロキシプロピルセルロース、ヒドロキシプロピルメチルセルロース、ヒドロキシエチルメチルセルロース、カルボキシメチルセルロースまたはその塩、Carbopol、ポリ(ヒドロキシエチルメタクリレート)、ポリ(メトキシエチルメタクリレート)、ポリ(メトキシエトキシ-エチルメタクリレート)、ポリメチルメタクリレート(PMMA)、メチルメタクリレート(MMA)、ゼラチン、ポリビニルアルコール、プロピレングリコールまたはこれらの組合せが含まれるが、これらに限定されるわけではない。
【0066】
[0082] 様々な態様において、ポリマーの分子量は、広範囲の値でありうる。ポリマーの平均分子量は、約1000〜約10,000,000;または約1,000〜約1,000,000;または約5,000〜約500,000;または約10,000〜約100,000;または約20,000〜50,000でありうる。
【0067】
[0083] いくつかの態様において、ポリマーは、PLGAまたはPOEまたはこれらの組合せを含む。PLGAは、ポリグリコリドおよびポリラクチドの混合物を含んでよく、いくつかの態様において、その混合物中には、ポリグリコリドより多くのポリラクチドが存在する。様々な態様において、PLGAは、100%のポリラクチドおよび0%のポリグリコリド;95%のポリラクチドおよび5%のポリグリコリド;90%のポリラクチドおよび10%のポリグリコリド;85%のポリラクチドおよび15%のポリグリコリド;80%のポリラクチドおよび20%のポリグリコリド;75%のポリラクチドおよび25%のポリグリコリド;70%のポリラクチドおよび30%のポリグリコリド;65%のポリラクチドおよび35%のポリグリコリド;60%のポリラクチドおよび40%のポリグリコリド;55%のポリラクチドおよび45%のポリグリコリド;50%のポリラクチドおよび50%のポリグリコリド;45%のポリラクチドおよび55%のポリグリコリド;40%のポリラクチドおよび60%のポリグリコリド;35%のポリラクチドおよび65%のポリグリコリド;30%のポリラクチドおよび70%のポリグリコリド;25%のポリラクチドおよび75%のポリグリコリド;20%のポリラクチドおよび80%のポリグリコリド;15%のポリラクチドおよび85%のポリグリコリド;10%のポリラクチドおよび90%のポリグリコリド;5%のポリラクチドおよび95%のポリグリコリド;または0%のポリラクチドおよび100%のポリグリコリドを含んでよい。
【0068】
[0084] ポリラクチドおよびポリグリコリド双方を含む様々な態様において、少なくとも95%のポリラクチド;少なくとも90%のポリラクチド;少なくとも85%のポリラクチド;少なくとも80%のポリラクチド;少なくとも75%のポリラクチド;少なくとも70%のポリラクチド;少なくとも65%のポリラクチド;少なくとも60%のポリラクチド;少なくとも55%;少なくとも50%のポリラクチド;少なくとも45%のポリラクチド;少なくとも40%のポリラクチド;少なくとも35%のポリラクチド;少なくとも30%のポリラクチド;少なくとも25%のポリラクチド;少なくとも20%のポリラクチド;少なくとも15%のポリラクチド;少なくとも10%のポリラクチド;または少なくとも5%のポリラクチドが存在し;そしてバイオポリマーの残り部分は、ポリグリコリドである。
【0069】
[0085] 様々な態様において、薬剤デポーがポリマーを含む場合、それは、薬剤デポーの重量に基づき、約10 wt.%〜約90 wt.%、約10 wt.%〜約80 wt.%、約10 wt.%〜約70 wt.%、約10 wt.%〜約50 wt.%、または約20 wt.%〜約40 wt.%で用いられる。
【0070】
[0086] いくつかの態様において、少なくとも75%の粒子は、約1マイクロメートル〜約200マイクロメートルのサイズを有する。いくつかの態様において、少なくとも85%の粒子は、約1マイクロメートル〜約200マイクロメートルのサイズを有する。いくつかの態様において、少なくとも95%の粒子は、約1マイクロメートル〜約200マイクロメートルのサイズを有する。いくつかの態様において、粒子は全て、約1マイクロメートル〜約200マイクロメートルのサイズを有する。
【0071】
[0087] いくつかの態様において、少なくとも75%の粒子は、約20マイクロメートル〜約100マイクロメートルのサイズを有する。いくつかの態様において、少なくとも85%の粒子は、約20マイクロメートル〜約100マイクロメートルのサイズを有する。いくつかの態様において、少なくとも95%の粒子は、約20マイクロメートル〜約100マイクロメートルのサイズを有する。いくつかの態様において、粒子は全て、約20マイクロメートル〜約100マイクロメートルのサイズを有する。
【0072】
[0088] いくつかの態様において、ポリマーは、DL-CLまたはこれらの組合せを含む。DL-CLは、ラクチドおよびカプロラクトンの混合物を含んでよい。ラクチド対カプロラクトンのモル比は、10:90〜90:10およびその間の全ての部分範囲(例えば、20:80、30:70、45:55、65:35、67:33、89:11等)でありうる。
【0073】
[0089] いくつかの態様において、ポリマーは、DL-G-CLまたはこれらの組合せを含む。DL-G-CLは、ラクチド、グリコリドおよびカプロラクトンの混合物を含んでよい。いくつかの態様において、ラクチド対グリコリド対カプロラクトンのモル比は、30:20:50であってよい。いくつかの態様において、その混合物は、5〜50%のラクチド、5〜50%のグリコリドおよび20〜80%のカプロラクトンを含んでよい。
【0074】
[0090] 様々な態様において、薬剤デポーがポリマーを含む場合、それは、薬剤デポーの重量に基づき、約10 wt.%〜約90 wt.%、約15 wt.%〜約55 wt.%、約25 wt.%〜約45 wt.%、または約30 wt.%〜約35 wt.%で用いられてよい。
【0075】
[0091] デポーは、重炭酸カリウム、炭酸カリウム、水酸化カリウム、酢酸ナトリウム、ホウ酸ナトリウム、重炭酸ナトリウム、炭酸ナトリウム、水酸化ナトリウムまたはリン酸ナトリウムなどの緩衝剤およびpH調整剤;分解/放出改変剤;薬剤放出調整剤;乳化剤;塩化ベンザルコニウム、クロロブタノール、酢酸フェニル第二水銀および硝酸フェニル第二水銀、重亜硫酸ナトリウム、重硫酸ナトリウム、チオ硫酸ナトリウム、チメロサール、メチルパラベンおよび他のパラベン、ポリビニルアルコールおよびフェニルエチルアルコールなどの保存剤;溶解度調整剤;安定剤;および/または凝集改変剤などの不活性物質を含有してもよい。典型的に、このような不活性物質はいずれも、0〜75 wt.%の範囲内で、より典型的には、0〜30 wt.%の範囲内で存在するであろう。デポーが、脊椎部位または関節部位に置かれる予定である場合、様々な態様において、デポーは、保存剤不含の滅菌材料を含んでよい。
【0076】
[0092] デポーは、異なったサイズ、形状および立体配置でありうる。薬剤デポーのサイズ、形状および立体配置を決定する場合に考慮することができるいくつかの因子が存在する。例えば、サイズおよび形状は双方とも、埋め込み部位または注射部位として選択される標的組織部位に薬剤デポーを配置する場合の容易さを可能にすることができる。更に、そのシステムの形状およびサイズは、薬剤デポーが、埋め込みまたは注射後に移動するのを最小限にするかまたは妨げるように選択される。様々な態様において、薬剤デポーは、球形、ロッドまたはファイバーなどの円筒形、ディスク、薄膜、リボン、ストリップまたはシートなどの平面、ペースト、スラブ、ミクロパーティクル、ナノパーティクル、ペレット、メッシュ等のような形状でありうる。融通性は、薬剤デポーの配置を容易にするための考慮事項でありうる。様々な態様において、薬剤デポーは、異なったサイズでありうるが、例えば、薬剤デポーは、約0.5 mm〜100 mmの長さであってよいし、そして約0.01 mm〜約5 mmの直径または厚みを有してよい。様々な態様において、薬剤デポーは、約0.005 mm〜5.0 mm、例えば、0.05〜2.0 mmなどの層厚を有してよい。いくつかの態様において、その形状は、スリップまたはリボン様ストリップであってよく、そのスリップまたはリボン様ストリップは、2〜20またはそれを超える範囲内の幅対厚みの比率を有する。
【0077】
[0093] ラジオグラフィー用マーカーは、薬剤デポー上または中に包含されて、使用者が、患者の標的部位中に正確にデポーを配置するのを可能にすることができる。これらラジオグラフィー用マーカーは、更に、使用者が、その部位におけるデポーの移動および分解を時間経過で追跡するのを可能にするであろう。この態様において、使用者は、多数の画像診断手順のいずれかを用いて、デポーをその部位に正確に配置することができる。このような画像診断手順には、例えば、X線画像化または蛍光透視法が含まれる。このようなラジオグラフィー用マーカーの例には、バリウム、カルシウムおよび/または金属ビーズまたは粒子が含まれるが、これらに限定されるわけではない。存在する場合、ラジオグラフィー用マーカーは、典型的に、約10%〜約40%の(10%、11%、12%、13%、14%、15%、16%、17%、18%、19%、20%、21%、22%、23%、24%、25%、26%、27%、28%、29%、30%、31%、32%、33%、34%、35%、36%、37%、38%、39%および40%、更には、これらのいずれか二つの値の間の範囲、例えば、10〜15%、15〜20%、20〜25%、25〜30%、30〜35%、35〜40%等が含まれ、15〜30%がより典型的であるが、なお一層典型的には、20〜25%を含めた)量で存在する。様々な態様において、ラジオグラフィー用マーカーは、球状形、またはデポーを囲む環状でありうると考えられる。
【0078】
[0094] いくつかの態様において、薬剤デポーは、デポーからの薬剤の放出を可能にする細孔を有する。その薬剤デポーは、デポー中において体液が薬剤と置き代わるのを可能にするであろう。しかしながら、デポー中への細胞浸潤は、デポーの細孔サイズによって妨げられるであろう。この方法で、いくつかの態様において、デポーは、組織骨格として機能することはないし、組織成長を可能にすることもない。むしろ、薬剤デポーは、薬剤送達に利用されるだけであろう。いくつかの態様において、薬剤デポー中の細孔は、250〜500ミクロン未満であろう。この細孔サイズは、細胞が薬剤デポーに浸潤することおよび骨格形成する細胞を蓄えることを妨げるであろう。したがって、この態様において、薬剤は、体液が薬剤デポーに入るにつれて薬剤デポーから溶出するであろうが、細胞が入ることは妨げられるであろう。細孔がほとんどまたは全く存在しないいくつかの態様において、薬剤は、酵素の作用によって、加水分解作用によって、および/またはヒト体内の他の同様の機構によって薬剤デポーから溶出するであろう。他の態様において、薬剤デポーは、細胞の流入および薬剤放出を可能にする約500ミクロンを超える細孔サイズを有してよく、そしてこの態様において、薬剤デポーは、組織骨格として機能することができる。
【0079】
[0095] 一つの例示的な態様において、患者の皮膚下の標的組織部位へ治療薬を送達するための薬剤デポーであって、有効量のブピバカインを含み、ここにおいて、標的組織部位が、少なくとも一つの筋肉、靱帯、腱、軟骨、椎間板、脊髄神経根付近の椎間孔空間、椎間または滑膜性関節、または脊椎管を含む薬剤デポーを提供する。
【0080】
[0096] 様々な態様において、薬剤デポーは、ゲルを含むが、それには、室温においてゼラチン、ゼリー様またはコロイドの性質を有する物質が含まれる。ゲルは、様々な態様において、その至る所に分散したまたはゲル中に懸濁したブピバカイン、および場合により、一つまたは複数の追加の治療薬を有してよい。治療薬の分散は、ゲル中に均一であってよい。或いは、治療薬の濃度は、その至る所で異なってよい。ゲルまたは薬剤デポーの生物分解性材料が、その部位で分解されると、治療薬は放出される。
【0081】
[0097] 薬剤デポーがゲルである場合、低粘性ポリマーを典型的に用いる噴霧可能ゲルとは対照的に、より高い粘度を有するゲルは、他の用途に望ましいことがありうる、例えば、パテ様粘稠度を有するゲルは、骨再生用途に一層好ましいことがありうる。ポリマーがゲル中で用いられる様々な態様において、そのポリマー性組成物には、約10 wt.%〜約50 wt.%または約15 wt.%〜約30 wt.%のポリマーが含まれる。
【0082】
[0098] 別の例示的な態様において、ゲルは、一つまたは複数の薬剤デポーを負荷されている粘稠な形(例えば、治療薬を負荷されたミクロスフェア)であり、ここにおいて、粘稠なゲルは、対象の滑膜性関節、椎間腔、脊椎管または脊椎管周囲の軟組織中に配置される。ゲルは、更に、様々な態様において、組織を密封するかまたは修復するのに用いることができる。また別の例示的な態様において、ゲルは、注射可能ゲル、および/または組織との接触で凝固する接着性ゲルである。例えば、ゲルは、標的組織部位においてin situでゲル化する液体として投与することができる。様々な態様において、ゲルは、二成分系を含むことができるが、この場合、液体を投与後、ゲル化剤を加えて、その液体をゲル化または硬化させる。
【0083】
[0099] 様々な態様において、ゲルは、硬化性ゲルであり、この場合、ゲルを標的部位に適用後、それは硬化し、そして薬剤は、体液がゲルに接触すると、放出されうる。
【0084】
[00100] 様々な態様において、薬剤デポーは、ブピバカインおよび場合により、一つまたは複数の追加の治療薬を負荷され、そして所望の標的組織部位(例えば、外科手術創傷部位、炎症組織、変性組織等)へ送達されるが、様々な態様において、薬剤デポーは、縫合、さかとげ(barb)、ステープル、接着用ゲル等によって適所に保持することができ、それで、薬剤デポーが静脈体循環によってその部位から除去されるのを、またはそれ以外に、広く分散しすぎて、所望の治療的作用を減少させるのを妨げる。例えば、何時間かまたは何日か後、薬剤デポーは、分解することで、それら薬剤デポー(例えば、ストリップ、リボン様ストリップ等)が治療薬を放出することを可能にすることができる。それらストリップは、不溶性または不活性な物質であるが、それが標的組織部位と一度接触すると可溶性または活性な物質から成形することができる。同様に、薬剤デポーは、組織内で溶解するかまたは分散する物質を含んでよい。薬剤デポーが、何時間か〜何日か以内に溶解し始めると、それら薬剤デポー(例えば、ストリップ)は、体液に暴露され、そしてそれらの内容物を放出し始める。薬剤デポーは、薬剤デポーの暴露時間および薬剤デポーからの治療薬の放出を最適にするように製剤化することができる。
【0085】
[00101] 様々な態様において、薬剤デポー(例えば、ゲル)は、流動性であり、そして標的組織部位へ、上にまたは中に注射し、噴霧し、滴加しおよび/または分散させることができる。「流動性」とは、ゲル製剤が、操作するのに容易であり、そしてそれが凝固するように、標的組織部位またはその付近にブラッシング、噴霧、点滴、塗布、注射、造形および/または成形することができるということを意味する。「流動性」には、低粘度または水様粘稠度を有する製剤〜ペースト様材料などの高粘度を有するものが含まれる。様々な態様において、製剤の流動性は、組織部位における不規則、隙間、狭隙および/または空隙にそれを適合させる。例えば、様々な態様において、ゲルは、骨溶解性病変における一つまたは複数の空隙を満たすのに用いることができる。
【0086】
[00102] 様々な態様において、薬剤デポーは、ポリ(α-ヒドロキシ酸)、PLGA、D,L-ラクチド-グリコリド-ε-カプロラクトン、PLA、PG、ポリ(α-ヒドロキシ酸)のポリエチレングリコールコンジュゲート、ポリオルトエステル、ポリ(乳酸-コ-リシン)、ポリ(ラクチド-コ-ウレタン)、ポリ(エステル-コ-アミド)、ポリアスピリン、ポリホスファゼン、ポリ無水物;ポリケタール、コラーゲン、デンプン、α化(pre-gelatinized)デンプン、ヒアルロン酸、キトサン、ゼラチン、アルギネート、アルブミン、フィブリン、ビタミンE類似体であって、αトコフェリルアセテート、d-αトコフェリルスクシネートなどのもの、D,L-ラクチド、D-ラクチド、L-ラクチド、D,L-ラクチド-カプロラクトン、D,L-ラクチド-グリコリド-カプロラクトン、デキストラン、ビニルピロリドン、ポリビニルアルコール(PVA)、PVA-g-PLGA、PEGT-PBTコポリマー(多活性)、メタクリレート、ポリ(N-イソプロピルアクリルアミド)、PEO-PPO-PEO(プルロニック)、PEO-PPO-PAAコポリマー、PLGA-PEO-PLGA、PEG-PLG、PEG-PLG(ポリ(d,l-ラクチド-コ-グリコリド)、PLA-PLGA、ポロキサマー407、PEG-PLGA-PEGトリブロックコポリマー、SAIB(スクロースアセテートイソブチラート)またはこれらの組合せを含む。これら一つまたは複数の成分は、治療薬が薬剤デポーから制御方式および/または持続方式で放出されるのを可能にする。例えば、治療薬およびポリマーマトリックスを含有する薬剤デポーは、標的組織部位に注射することができ、そしてそのポリマーマトリックスは、標的組織部位中において時間経過とともに(例えば、何時間か、何日か)崩壊して、ブピバカインおよび場合により追加の治療薬を放出する。したがって、薬剤デポーの投与は、限局させそして一定時間(例えば、少なくとも1日〜約2日、3日、4日、5日、6日、7日、8日、9日、10日、11日、12日、13日、14日、15日、16日、17日、18日、19日、20日、21日、22日、23日、24日、25日、26日、27日、28日、29日および30日)にわたって行うことができる。
【0087】
[00103] 「徐放性放出(sustained release)」または「持続放出(sustain release)」(長期放出または制御放出とも称される)という用語は、本明細書中において、ヒトまたは他の哺乳動物体内に導入され、そして一つまたは複数の治療薬の流れを、所定の時間にわたって、しかもその所定の時間中ずっと所望の治療的作用を達成するのに十分な治療的レベルで連続的に放出する、一つまたは複数の治療薬を意味するのに用いられる。連続的放出流の言及は、薬剤デポーまたはそのマトリックスまたは成分のin vivoでの生物分解の結果として、または一つまたは複数の治療薬または一つまたは複数の治療薬のコンジュゲートの代謝性変換または溶解の結果として起こる、放出を包含するものである。
【0088】
[00104] 「即時放出」という句は、本明細書中において、体内に導入される一つまたは複数の治療薬であって、薬剤の溶解または吸収を遅らせるまたは延長することを意図することなく、それが投与される場所において溶解することまたはその場所で吸収された状態になることを可能にする治療薬を意味するのに用いられる。
【0089】
[00105] それら二つのタイプの製剤(持続放出および即時放出)は、一緒に用いることができる。徐放性放出および即時放出は、同じデポー中であってよい。様々な態様において、徐放性放出および即時放出は、別々のデポーの一部分であってよい。例えば、ブピバカインのボーラスまたは即時放出製剤は、標的部位またはその付近に置くことができ、そして持続放出製剤も、同じ部位またはその付近に置くことができる。したがって、ボーラスが完全に利用可能になった後でも、持続放出製剤は、意図する組織に活性成分を与え続けると考えられる。
【0090】
[00106] 様々な態様において、薬剤デポーは、埋め込み後最初の48時間または24時間以内に初期バースト用量の治療薬を生ずるように設計される。「初期バースト」または「バースト作用」または「ボーラス用量」は、薬剤デポーと水性液(例えば、滑液、脳脊髄液等)との接触後の最初の48時間または24時間中の薬剤デポーからの治療薬の放出を意味する。いくつかの態様において、薬剤デポーは、この初期バースト作用を回避するように設計される。
【0091】
[00107] 様々な態様において、薬剤デポーは、ボーラス用量のブピバカインまたはその薬学的に許容しうる塩を(例えば、皮膚下の標的部位で100 mg〜800 mg、400〜800 mgまたは100 mg〜200 mg)放出する一つまたは複数の異なった放出層;および有効量のブピバカインまたはその薬学的に許容しうる塩を3〜30日間、3〜10日間または7〜10日間にわたって放出する一つまたは複数の持続放出層を含有する。様々な態様において、その一つまたは複数の即時放出層は、PLGAを含み、それは、PLGAより遅い速度で分解するPLAを含む一つまたは複数の持続放出層よりもより速く分解する。
【0092】
[00108] 様々な態様において、薬剤デポーがゲルを含む場合、そのゲルは、約1〜約500センチポアズ(cps)、1〜約200 cps、または1〜約100 cpsの範囲内の投与前粘度を有してよい。ゲルを標的部位に投与後、そのゲルの粘度は増加するであろう。
【0093】
[00109] 一つの態様において、ゲルは、接着性ゲルであってよく、それは、ゲル中に一様に分布している治療薬を含む。ゲルは、前に示されているような、いずれか適するタイプのものであってよく、そしていったん配置された標的送達部位からゲルが移動するのを妨げるように十分に粘稠であるべきである;ゲルは、実際上、標的組織部位に「粘着」または接着するはずである。ゲルは、例えば、標的組織と接触時にまたは標的送達システムから配置後に凝固することができる。標的送達システムは、例えば、シリンジ、カテーテル、針またはカニューレ、またはいずれ他の適する装置であってよい。標的送達システムは、標的組織部位中にまたは上にゲルを注射するかまたは噴霧することができる。治療薬は、標的組織部位にゲルを配置させる前に、そのゲル中に混合することができる。様々な態様において、ゲルは、二成分送達システムの一部分であってよく、そして二つの成分が混合された時に、化学的過程は、ゲルを形成するようにそして標的組織にそれを粘着または接着させるように活性化する。
【0094】
[00110] 様々な態様において、ポリマーを含有するそれらゲル製剤について、ポリマー濃度は、ゲルが硬化する速度に影響することがありうる(例えば、より高濃度のポリマーを含むゲルは、より低濃度のポリマーを有するゲルよりも速やかに凝固することができる)。様々な態様において、ゲルが硬化する場合、得られたマトリックスは、固形であるが、組織の不規則表面(例えば、骨の陥凹部および/または突出部)に適合することもできる。
【0095】
[00111] ゲル中に存在するポリマーの百分率も、ポリマー性組成物の粘度に影響することがありうる。例えば、より高い重量百分率のポリマーを有する組成物は、典型的に、より低い重量百分率のポリマーを有する組成物よりも濃厚そして粘稠である。より粘稠な組成物は、一層ゆっくりと流動する傾向がある。したがって、より低い粘度を有する組成物は、いくつかの場合、例えば、製剤をスプレーによって適用する場合、好適でありうる。
【0096】
[00112] 様々な態様において、ゲルの分子量は、当該技術分野において知られている多くの方法によって変化させることができる。分子量を変化させる方法の選択は、典型的に、ゲルの組成(例えば、ポリマー対非ポリマー)によって決定される。例えば、様々な態様において、ゲルが、一つまたは複数のポリマーを含む場合、重合度は、ポリマー開始剤(例えば、過酸化ベンゾイル)、有機溶媒または活性剤(例えば、DMPT)、架橋剤、重合剤の量、および/または反応時間を変えることによって制御することができる。
【0097】
[00113] 適するゲルポリマーは、有機溶媒中に可溶性であってよい。溶媒へのポリマーの溶解度は、そのポリマーの結晶化度、疎水性、水素結合性および分子量に依存して変化する。より低い分子量のポリマーは、通常は、高分子量ポリマーよりも容易に、有機溶媒中に溶解するであろう。高分子量ポリマーが含まれるポリマー性ゲルは、低分子量ポリマーが含まれるポリマー性組成物よりも速やかに凝固するかまたは固化する傾向がある。高分子量ポリマーが含まれるポリマー性ゲル製剤は、更に、低分子量ポリマーが含まれるポリマー性ゲルよりも高い溶液粘度を有する傾向がある。
【0098】
[00114] 様々な態様において、ゲルは、固有粘度(「I.V.」と略語で示され、単位は、デシリットル/グラムである)を有するが、それは、ゲルの分子量および分解時間の尺度である(例えば、高い固有粘度を有するゲルは、より高い分子量およびより長い分解時間を有する)。典型的に、高分子量を有するゲルは、より強いマトリックスをもたらし、そしてそのマトリックスは、分解するのにより多く時間を要する。対照的に、低分子量を有するゲルは、より速やかに分解し、そしてより軟質のマトリックスをもたらす。様々な態様において、ゲルは、約0.10 dL/g〜約1.2 dL/gまたは約0.10 dL/g〜約0.40 dL/gの固有粘度によって示されるような分子量を有する。他のIV範囲には、約0.05〜約0.15 dL/g、約0.10〜約0.20 dL/g、約0.15〜約0.25 dL/g、約0.20〜約0.30 dL/g、約0.25〜約0.35 dL/g、約0.30〜約0.35 dL/g、約0.35〜約0.45 dL/g、約0.40〜約0.45 dL/g、約0.45〜約0.50 dL/g、約0.50〜約0.70 dL/g、約0.60〜約0.80 dL/g、約0.70〜約0.90 dL/gおよび約0.80〜約1.00 dL/gが含まれるが、これらに限定されるわけではない。
【0099】
[00115] 様々な態様において、ゲルは、約300〜約5,000センチポアズ(cp)の粘度を有することができる。他の態様において、ゲルは、室温において約5〜約300 cps、約10 cps〜約50 cps、約15 cps〜約75 cpsの粘度を有することができるが、それは、標的部位またはその付近にそれを噴霧することを可能にする。
【0100】
[00116] 様々な態様において、薬剤デポーは、粘度を増強しそして薬剤の放出を制御する物質を含んでよい。このような物質には、例えば、ヒドロキシプロピルセルロース、ヒドロキシプロピルメチルセルロース、ヒドロキシエチルメチルセルロース、カルボキシメチルセルロースおよびそれらの塩、Carbopol、ポリ(ヒドロキシエチルメタクリレート)、ポリ(メトキシエチルメタクリレート)、ポリ(メトキシエトキシ-エチルメタクリレート)、ポリメチルメタクリレート(PMMA)、メチルメタクリレート(MMA)、ゼラチン、ポリビニルアルコール、プロピレングリコール、PEG 200、PEG 300、PEG 400、PEG 500、PEG 550、PEG 600、PEG 700、PEG 800、PEG 900、PEG 1000、PEG 1450、PEG 3350、PEG 4500、PEG 8000またはこれらの組合せが含まれてよい。例えば、様々な態様において、薬剤デポーは、約25重量%〜75重量%のブピバカイン、約15重量%〜75重量%のD,L-ラクチド-グリコリド-カプロラクトン、および約5重量%〜10重量%のPEG 300を含む。薬剤デポーは、更に、約1%〜15%のNMPを含むことができる。
【0101】
[00117] 薬剤デポー放出プロフィールは、特に、薬剤デポーの成分の粒子サイズ分布を制御することによって制御することもできる。様々な態様において、薬剤デポーの成分(例えば、ブピバカイン、ゲル等)の粒子サイズ分布は、約10μM〜200μMの範囲内であってよいので、薬剤デポーは、注射、噴霧、点滴等によって標的部位へまたは部位にまたはその付近に容易に送達することができる。様々な態様において、粒子サイズは、10μM、13μM、85μM、100μM、151μM、200μMおよびその間の全ての部分範囲であってよい。
【0102】
[00118] 様々な態様において、薬剤デポーは、合成または天然由来の高分子量生体適合性エラストマー性ポリマーから作られるヒドロゲルを含んでよい。ヒドロゲルが有することが望まれる性質は、ヒト体内における機械的ストレス、具体的には、剪断および荷重に速やかに応答する能力である。
【0103】
[00119] 天然源から得られるヒドロゲルは、in vivo用途について生物分解性でそして生体適合性である可能性があるので、特に興味をそそる。適するヒドロゲルには、天然ヒドロゲル、例えば、ゼラチン、コラーゲン、絹、エラスチン、フィブリンおよび多糖由来ポリマー様アガロースなどのもの、およびキトサン、グルコマンナンゲル、ヒアルロン酸、架橋カルボキシル含有多糖類などの多糖類、またはこれらの組合せが含まれる。合成ヒドロゲルには、ポリビニルアルコールから形成されるもの;ポリアクリル酸およびポリ(アクリロニトリルアクリル酸)などのアクリルアミド;ポリウレタン;ポリエチレングリコール(例えば、PEG 3350、PEG 4500、PEG 8000);シリコーン;ポリイソブチレンおよびポリイソプレンなどのポリオレフィン;シリコーンおよびポリウレタンのコポリマー;ネオプレン;ニトリル;加硫ゴム;ポリ(N-ビニル-2-ピロリドン);ポリ(2-ヒドロキシエチルメタクリレート)などのアクリレート;およびアクリレートとN-ビニルピロリドンとのコポリマー;N-ビニルラクタム;ポリアクリロニトリル;またはこれらの組合せが含まれるが、これらに限定されるわけではない。それらヒドロゲル材料は、更に架橋されて、必要とされる強度を更に与えることができる。異なったタイプのポリウレタンの例には、熱可塑性または熱硬化性ポリウレタン、脂肪族または芳香族ポリウレタン、ポリエーテル-ウレタン、ポリカーボネート-ウレタンまたはシリコーンポリエーテル-ウレタン、またはこれらの組合せが含まれる。
【0104】
[00120] 様々な態様において、治療薬をゲル中に直接的に混合するよりもむしろ、ブピバカインを負荷されているミクロスフェアを、ゲル中に分散させることができる。一つの態様において、それらミクロスフェアは、ブピバカインの徐放性放出をもたらす。また別の態様において、生物分解性であるゲルは、ミクロスフェアがブピバカインを放出するのを妨げる;したがって、ミクロスフェアは、それらがゲルから放出されるまで、ブピバカインを放出することはない。例えば、ゲルは、標的組織部位(例えば、神経根)のまわりに配置することができる。ゲル中に分散しているのは、所望の治療薬を被包している複数のミクロスフェアである。特定のこれらミクロスフェアは、一度ゲルから放出されると分解し、したがって、ブピバカインを放出する。
【0105】
[00121] ミクロスフェアは、ほぼ流体のように、周囲の組織タイプに依存して、比較的速やかに分散することができ、したがって、ブピバカインを分散させることができる。いくつかの場合、これは、望ましいことがありうる;他の場合、ブピバカインを明確な標的部位にしっかりと拘束された状態で保持することが一層望ましいことがありうる。本発明は、更に、治療薬の分散をそのように拘束する接着性ゲルの使用を企図する。これらゲルは、例えば、椎間腔、脊椎管または周囲組織中に配置することができる。
【0106】
薬剤送達
[00122] デポーを、薬剤送達装置(例えば、シリンジ、ガン薬剤送達装置、または標的器官または標的解剖学的部分への薬剤の適用に適するいずれかの医療装置)の一部分でありうる「カニューレ」または「針」を用いて標的部位に投与することができるということは、当業者に理解されるであろう。薬剤デポー装置のカニューレまたは針は、患者にとって最小限の身体的および心理的外傷となるように設計される。
【0107】
[00123] カニューレまたは針には、例えば、ポリウレタン、ポリ尿素、ポリエーテル(アミド)、PEBA、熱可塑性エラストマー性オレフィン、コポリエステル、およびスチレン系熱可塑性エラストマー、鋼、アルミニウム、ステンレス鋼、チタン、高い非鉄金属含有量および低い相対比率の鉄を有する金属アロイ、炭素繊維、ガラス繊維、プラスチック、セラミックス、またはこれらの組合せなどの材料から作ることができるチューブが含まれる。カニューレまたは針は、一つまたは複数のテーパー付き領域を包含してもよい。様々な態様において、カニューレまたは針は、面取りされていてよい。カニューレまたは針は、更に、埋め込み部位に依存して、患者の正確な処置に不可欠なチップスタイル(tip style)を有してよい。チップスタイルの例には、例えば、Trephine、Cournand、Veress、Huber、Seldinger、Chiba、Francine、Bias、Crawford、撓みチップ(deflected tips)、Hustead、LancetまたはTuoheyが含まれる。様々な態様において、カニューレまたは針は、ノンコアリングであってもよく、そして望ましくない針穿刺を免れるためにそれを覆う外装を有してよい。
【0108】
[00124] 中空カニューレまたは針の寸法は、特に、埋め込み部位に依存するであろう。例えば、硬膜外空間の幅は、胸部については僅か約3〜5 mm、そして腰部については約5〜7 mmである。したがって、様々な態様において、針またはカニューレは、これら特定の部位について設計することができる。様々な態様において、カニューレまたは針は、椎間孔空間中の経孔(transforaminal)アプローチを用いて、例えば、炎症を起こした神経根に沿って挿入することができ、そして薬剤デポーをその状態を処置するためにこの部位に埋め込むことができる。典型的に、その経孔アプローチは、椎間孔を介して椎間空間に接近することを必要とする。
【0109】
[00125] カニューレまたは針の長さについてのいくつかの例には、約50〜150 mmの長さ、例えば、硬膜外小児科使用には約65 mm、標準的な成人には約85 mm、および肥満成人患者には約110 mmが含まれてよいが、これらに限定されるわけではない。カニューレまたは針の太さも、埋め込み部位に依存するであろう。様々な態様において、その太さには、約0.05〜約1.655が含まれるが、これらに限定されるわけではない。カニューレまたは針のゲージは、ヒトまたは動物体内への挿入用に、最大幅または最小の直径、または中間の直径であってよい。最大幅直径は、典型的に、約14ゲージであるが、最小直径は、約22ゲージである。様々な態様において、針またはカニューレのゲージは、約18〜約22ゲージである。
【0110】
[00126] 様々な態様において、薬剤デポーおよび/またはゲルのように、カニューレまたは針には、皮膚下部位またはその付近の場所を示す線量ラジオグラフィー用マーカーが含まれるので、使用者は、多数の画像診断手順のいずれかを用いて、その部位またはその付近にデポーを正確に配置することができる。このような画像診断手順には、例えば、X線画像化または蛍光透視法が含まれる。このようなラジオグラフィー用マーカーの例には、バリウム、カルシウムおよび/または金属ビーズまたは粒子が含まれるが、これらに限定されるわけではない。
【0111】
[00127] 様々な態様において、針またはカニューレには、超音波、蛍光透視法、X線または他の画像化法によって可視化することができる透明または半透明部分が含まれてよい。このような態様において、透明または半透明部分には、放射線不透過性材料または超音波応答性トポグラフィー(topography)が含まれてよく、それが、その材料またはトポグラフィーの不存在に相対する針またはカニューレのコントラストを増加させる。
【0112】
[00128] 薬剤を投与するための薬剤デポーおよび/または医療装置は、滅菌可能であってよい。様々な態様において、薬剤を投与するための薬剤デポーおよび/または医療装置の一つまたは複数の成分は、最終包装での最終的滅菌工程において放射線によって滅菌される。製品の最終的滅菌は、個々の製品成分を別々に滅菌しそして最終パッケージを無菌環境で組み立てることを必要とする無菌操作などの操作によるよりも無菌の確信性を高める。
【0113】
[00129] 典型的に、様々な態様において、γ線は、最終的滅菌工程において用いられるが、それは、装置中に深く透過するγ線からのイオン化エネルギーを利用することを必要とする。γ線は、微生物を死滅させる場合にきわめて有効であり、それらは、残留物を残さないし、装置に放射能を与えるような十分なエネルギーも有していない。γ線は、装置がパッケージ中にある時に用いることができるし、しかもγ滅菌は、高圧または真空状態を必要としないので、パッケージシールおよび他の成分にストレスを加えることがない。更に、γ線は、透過性包装材料への要求を排除する。
【0114】
[00130] 様々な態様において、電子ビーム(e-ビーム)線は、一つまたは複数の装置成分を滅菌するのに用いることができる。e-ビーム線は、一般に、低透過率および高線量率を特徴とするイオン化エネルギーの形を含む。e-ビーム線は、それが、微生物の再生性細胞を含めた、接触についての様々な化学結合および分子結合を変化させるという点で、γ処理に似ている。e-ビーム滅菌用に生成されるビームは、電気の加速および変換によって発生する集中した高荷電の電子流である。e-ビーム滅菌は、例えば、薬剤デポーがゲル中に包含されている場合に用いることができる。
【0115】
[00131] 他の方法も、デポーおよび/または一つまたは複数の装置成分を滅菌するのに用いることができ、それには、例えば、酸化エチレンでのようなガス滅菌、または蒸気滅菌が含まれるが、これらに限定されるわけではない。
【0116】
[00132] 様々な態様において、薬剤デポー(例えば、リボン様ストリップ)を埋め込むのに用いられるように一緒に組み合わされた薬剤デポーおよび/または医療装置と一緒に追加の部分を包含してよいキットを提供する。そのキットには、第一区画に薬剤デポー装置が含まれてよい。第二区画には、薬剤デポーを保持するキャニスターと、限局薬剤送達に必要ないずれか他の器具が含まれてよい。第三区画には、グローブ、ドレープ、創傷包帯、および埋め込み操作の無菌性を維持するための他の手順供給、更には、取扱説明書が含まれてよい。第四区画には、追加のカニューレおよび/または針が含まれてよい。各々の器具は、放射線滅菌されるプラスチックパウチ中に別々に包装されていてよい。キットのカバーには、埋め込み手順の図解が含まれてよく、そして透明プラスチックカバーを、それら区画の上に置いて、無菌性を維持することができる。
【0117】
[00133] 様々な態様において、患者の標的組織部位中にブピバカインを送達する方法を提供する。その方法は、標的組織部位またはその付近にカニューレまたは針を挿入し、そしてブピバカインを含有する薬剤デポーを患者の皮膚下標的部位に埋め込むことを含む。様々な態様において、所望の部位へ薬剤デポーを投与するには、最初に、カニューレまたは針を、皮膚および軟組織を介して下の標的組織部位へ挿入し、そして薬剤デポーを標的部位またはその付近に投与(例えば、注射、埋め込み、点滴、噴霧等)することができる。薬剤デポーがゲルとは別個の場合の態様において、最初に、カニューレまたは針を、皮膚および軟組織を介して下の注射部位へ挿入することができ、そして一つまたは複数のゲル基層を、標的部位に投与することができる。一つまたは複数の基層の投与後、薬剤デポーを、その一つまたは複数の基層上または中に埋め込むことができるので、ゲルは、そのデポーを適所に保持するかまたは移動を減少させることができる。必要ならば、引き続く一つまたは複数のゲル層を、薬剤デポー上に適用して、デポーを取り囲み、そして更に、それを適所に保持することができる。或いは、薬剤デポーを、最初に埋め込みまたは注射後、薬剤デポーのまわりにゲルを置いて(例えば、ブラッシング、点滴、注射または塗布等)、それを適所に保持することができる。ゲルを用いることにより、薬剤デポーの正確なそして精密な埋め込みは、患者にとって最小限の身体的および心理的外傷で達成することができる。様々な態様において、薬剤デポーは、標的部位に縫合することができるし、または或いは、薬剤デポーは、縫合することなく埋め込みすることができる。例えば、様々な態様において、薬剤デポーは、ストリップ形またはリボン形のデポーであってもよく、そして外科手術前、中または後に、標的部位に置くことができる。別の例として、薬剤デポーは、ゲルの形でシリンジまたは他の注射可能送達によって外科手術前、中または後に標的部位に直接的に送達することができる。
【0118】
[00134] 様々な態様において、標的組織部位が脊椎部分を含む場合、体液の一部分(例えば、脊髄液等)を、最初に、標的部位からカニューレまたは針を介して抜き取り後、デポーを投与(例えば、配置、点滴、注射または埋め込み等)することができる。その標的部位は、再水和(例えば、体液の再充満)するであろうし、そしてこの水性環境は、薬剤をデポーから放出させるであろう。
【0119】
[00135] 疾患または状態の処置または処置することは、疾患の徴候または症状を軽減する努力において、一つまたは複数の薬剤を患者(ヒト、他の典型的なものまたはそれ以外)に投与することが含まれてよいプロトコルを実行することを意味する。軽減は、疾患または状態の徴候または症状が現れる前に、更には、それらの出現後に起こることがありうる。したがって、「処置すること」または「処置」には、疾患または望ましくない状態を「予防すること」または「予防」が含まれてよい。更に、「処置すること」または「処置」は、徴候または症状の完全な軽減を必要としないし、治癒を必要としないし、そして具体的には、患者への最低限の作用しかないプロトコルを包含する。「疼痛を減少させること」には、疼痛の低減が含まれ、そして疼痛徴候または症状の完全な軽減を必要としないし、しかも治癒を必要としない。様々な態様において、疼痛を減少させることもは、最低限の疼痛低減も含まれる。例として、一つまたは複数の有効投薬量のブピバカインの投与は、外科手術に付随的な術後疼痛の症状を予防する、処置するかまたは緩和するのに用いることができる。
【0120】
[00136] 「限局」送達には、一つまたは複数の薬剤を、組織内、組織またはその付近に貯留する送達が含まれる。例えば、限局送達には、神経系の神経根への、または脳部分への、またはそれにきわめて接近した状態(約10 cm以内、または好ましくは、例えば、約5 cm以内)での送達が含まれる。「標的送達システム」は、外科手術に付随的な疼痛および/または炎症の処置に必要とされるような、標的組織部位またはその付近に貯留することができる一定量の治療薬を有する一つまたは複数の薬剤デポー(例えば、ゲルまたはゲル中に分散したデポー等)の送達をもたらす。
【0121】
[00137] 図1は、患者の外科手術が行われる部位でありうる多数の一般的な場所を示す。図1に示されている場所が、外科手術が行われる患者の位置でありうる多数の異なった場所を単に代表するものであるということは理解されるであろう。例えば、外科手術は、患者の膝21、股関節部22、手指23、親指24、頸部25および脊椎26に必要とされる場合がある。したがって、これら外科手術中または後に、患者は、術後疼痛および/または炎症を経験することがありうる。
【0122】
[00138] 「疼痛」という用語には、侵害受容および疼痛感覚が含まれるが、それらは双方とも、当該技術分野において周知の疼痛スコアおよび他の方法を用いて、客観的にそして主観的に評価することができる。様々な態様において、疼痛には、異痛症(例えば、普通の非有害刺激への増加した応答)または痛覚過敏(例えば、普通の有害または不快刺激への増加した応答)が含まれてよいが、それは、順次、本来は温熱性または機械的(触覚)でありうる。いくつかの態様において、疼痛は、温熱感受性、機械的感受性および/または休息痛を特徴とする。他の態様において、疼痛は、機械的に誘発される疼痛または休息痛を含む。更に他の態様において、疼痛は、休息痛を含む。疼痛は、当該技術分野において周知のように、一次疼痛または二次疼痛でありうる。本明細書中で開示の方法および組成物によって減少可能、予防可能または処置可能な疼痛の代表的なタイプには、術後疼痛、例えば、腰背部(腰痛)または頸部(頸痛)から、下肢痛、根性痛(腰部手術により腰部および下肢に、頸部手術により頸部および上腕に経験する)、または腹部手術による腹痛、および上腕、頸部、背部、腰部、下肢のニューロパシー性疼痛、および椎間板または脊椎手術に起因する関連疼痛分布が含まれるが、これらに限定されることはない。ニューロパシー性疼痛には、神経根、背髄神経節または末梢神経への手術に由来する疼痛が含まれてよい。
【0123】
[00139] 様々な態様において、疼痛は、「外科手術後疼痛」または「術後疼痛」または「外科手術に誘発される疼痛」に起因するが、それらは、本明細書中で同じ意味に用いられ、そして外科的処置(例えば、ヘルニア修復、整形外科手術または脊椎手術等)後の秒単位、分単位、時間単位、日数単位または週間単位の回復期間に生じる疼痛を意味する。外科手術手順には、皮膚下に貫入し、そして患者に疼痛および/または炎症を引き起こすいずれの手順も含まれる。外科手術手順には、更に、関節鏡視下手術、腫瘍の切除、脊椎固定、胸部、頸部または腰部外科手術、骨盤手術またはこれらの組合せが含まれる。
【0124】
[00140] 「疼痛管理投薬」という用語には、疼痛を減少させ、予防し、軽減しまたは完全に除去するために投与される一つまたは複数の治療薬が含まれる。これらには、抗炎症薬、筋弛緩薬、鎮痛薬、麻酔薬、麻薬等またはこれらの組合せが含まれる。
【0125】
[00141] 様々な態様において、外科手術後疼痛または術後疼痛または外科手術に誘発される疼痛は、炎症を伴う。炎症は、外傷または外科手術への急性応答でありうる。組織が損傷した時、TNF-αが、細胞に結合して、細胞に炎症を引き起こす他のサイトカインを放出させる。炎症カスケードの目的は、損傷した組織の治癒を促すことであるが、組織がいったん治癒すると炎症過程が終わるとは限らない。抑制されていない状態のままにすると、これは、周囲組織の変性および関連疼痛をもたらすことがありうる。したがって、疼痛は、それ自体で疾患状態になりうる。すなわち、この経路が活性化された場合、炎症および疼痛が起こる。しばしば、傷害、炎症および疼痛の悪性でそして表面的には終わりのない循環が起こる。
【0126】
[00142] デポーが、疼痛管理および/または炎症管理(例えば、術後の疼痛管理および/または炎症管理)に用いるのに適している一つの例示的な態様を、図2に示す。図2に図式的に示されているのは、脊椎30と、皮膚34の下の脊椎部位32(例えば、椎間板空間、脊椎管、脊椎周囲の軟組織、神経根等)へシリンジ、カニューレまたは針を用いて薬剤デポーを挿入することができる部位の背面図であり、一つまたは複数の薬剤デポー28および32は、脊椎に沿った様々な部位に送達される。この方法で、数種類の薬剤デポーを埋め込む場合、それらは、場所、正確な間隔および薬剤分布を最適にする方法で埋め込まれる。
【0127】
[00143] 上記のように、脊椎部位が示されているが、薬剤デポーは、少なくとも一つの筋肉、靱帯、腱、軟骨、椎間板、椎間孔空間、脊髄神経根付近または脊椎管が含まれるがこれらに限定されるわけではない、いずれの皮膚下部位にも送達することができる。様々な態様において、ブピバカインを含有する薬剤デポーは、患者に、手術中、静脈内、筋肉内、連続的または間欠的注入、腹腔内、胸骨内、皮下、髄腔内、椎間板内、椎間板周囲、硬膜外、脊椎周囲、関節内注射、非経口またはこれらの組合せによって投与することができる。いくつかの態様において、注射は、髄腔内であるが、それは、脊椎管(脊髄周囲の髄腔内空間)中への注射を意味する。注射は、更に、筋肉または他の組織中へであってよい。
【0128】
[00144] いくつかの態様において、ブピバカインを、望ましくない作用に対抗するアンタゴニストと一緒に共投与することが好ましい。代表的なアンタゴニストには、フェントラミン、ヨヒンビン、トラゾリンおよびピペロキサン(piperoxane)が含まれるが、これらに限定されるわけではない。更に、5-フルオロデオキシウリジン(FUDR)および3,4デヒドロプロレン(dehydroprolene)などの化合物も含まれてよい。これら化合物は、いくつかのタイプの外科手術に関連したグリア瘢痕形成および線維芽細胞瘢痕形成を予防するかまたは減少させることができる。
【0129】
[00145] 本出願のブピバカインに基づく製剤は、医薬調製物の形の薬剤として用いることができる。それら調製物は、固形または液体であってよくおよび有機または無機であってよい適する医薬担体と一緒の投与において形成され、そして所望の非経口または他の投与に適当な形で置くことができる。当業者は、既知の担体には、水、ゼラチン、ラクトース、デンプン、ステアリン酸、ステアリン酸マグネシウム、シカリルアルコール(sicaryl alcohol)、タルク、植物油、ベンジルアルコール、ガム、ロウ、プロピレングリコール、ポリアルキレングリコールおよび他の既知の薬剤用担体が含まれるが、これらに限定されるわけではないと承知している。
【0130】
[00146] 更に、非経口投与には、例えば、カテーテルを介して脊椎または一つまたは複数の炎症を起こした関節付近に医薬組成物(例えば、麻酔薬および抗炎症薬組合せ)を投与する注入ポンプ;標的部位またはその付近に挿入することができる埋め込み可能ミニポンプ;1時間につき一定量のスタチンをまたは間欠的ボーラス用量で放出することができる埋め込み可能な制御放出装置または徐放性送達システムが含まれてよい。使用に適するポンプの一例は、SynchroMed(登録商標)(Medtronic, Minneapolis, Minnesota)ポンプである。このポンプは、三つの密封チャンバを有する。一つには、電子モジュールおよび電池が入っている。二つ目には、蠕動ポンプおよび薬剤レザバーが入っている。三つ目には、医薬組成物を蠕動ポンプ中に押し込むのに必要な圧力を与える不活性ガスが入っている。ポンプに充填するために、医薬組成物は、レザバー充填口を介して膨張可能レザバーに注入される。不活性ガスは、レザバー上で圧力を生じ、そしてその圧力が、フィルターを介して、ポンプチャンバ中へと医薬組成物を押し込む。次に、医薬組成物を、ポンプチャンバから、カテーテル中へと装置外にポンプ輸送し、それを標的部位に貯留させるであろう。医薬組成物の送達速度は、マイクロプロセッサーによって制御される。これは、使用されるポンプを、デリバリー間で同様の量または異なった量の医薬組成物を連続的に、特定の時点に、または設定間隔で送達するのに用いることを可能にする。
【0131】
[00147] 様々な態様において、標的組織部位が血管を含む場合、血管収縮薬を、薬剤デポー中に用いることができる。血管収縮薬が放出された場合、それは、麻酔応答の持続期間を延長しそして麻酔薬の全身取込みを減少させる。麻酔薬は、例えば、ブピバカインであってよく、そして血管収縮薬は、例えば、エピネフリンまたはフェニレフリンであってよい。
【0132】
[00148] 「患者」という用語は、「哺乳類」という分類学クラスからの生物を意味し、ヒト、他の霊長類であって、チンパンジー、類人猿、オランウータンおよびサルなど、ラット、マウス、ネコ、イヌ、ウシ、ウマ等が含まれるがこれらに限定されるわけではない。
【0133】
ブピバカインデポーを製造する方法
[00149] 様々な態様において、ブピバカインを含む薬剤デポーは、生体適合性ポリマーおよび治療的有効量のブピバカインまたはその薬学的に許容しうる塩を一緒にし、そしてこれらの組合せから埋め込み可能薬剤デポーを成形することによって製造することができる。
【0134】
[00150] 薬剤デポーの少なくとも一部分を、一つまたは複数の生体適合性ポリマー、一つまたは複数の治療薬および任意の材料から成形するために、溶液加工技術および/または熱可塑性加工技術を含めた様々な技術が利用可能である。溶液加工技術を用いる場合、典型的に、一つまたは複数の溶媒種を含有する溶媒系を選択する。その溶媒系は、一般に、目的の少なくとも一つの成分、例えば、生体適合性ポリマーおよび/または治療薬に対して良好な溶媒である。溶媒系を調製する具体的な溶媒種は、乾燥速度および表面張力を含めた他の特性に基づいて選択することもできる。
【0135】
[00151] 溶液加工技術には、溶媒流延技術、スピンコーティング技術、ウェブコーティング技術、溶媒噴霧技術、浸漬技術、空気懸濁を含めた機械的懸濁によるコーティングを行う技術(例えば、流動コーティング)、インクジェット技術および静電技術が含まれる。適切な場合、上に挙げたものなどの技術を繰り返してまたは組み合わせて、デポーを蓄積させて(build up)、所望の放出速度および所望の厚みを得ることができる。
【0136】
[00152] 様々な態様において、溶媒を含有する溶液および生体適合性ポリマーを一緒にし、そして所望のサイズおよび形状の型に入れる。この方法で、バリアー層、潤滑層等を含めたポリマー性領域を成形することができる。所望ならば、その溶液は、更に、一つまたは複数の次のもの、すなわち、ブピバカインおよび他の一つまたは複数の治療薬、および一つまたは複数のラジオグラフィー用物質などの他の任意の添加剤等を、溶解した形または分散した形で含むことができる。これは、溶媒除去後に、これらの種を含有するポリマー性マトリックス領域を生じる。他の態様において、溶解したかまたは分散した治療薬を含む溶媒を含有する溶液を、先在するポリマー性領域に適用し、これを、溶液加工技術および熱可塑性加工技術を含めた様々な技術を用いて成形することができ、そこで、治療薬をポリマー性領域中に吸収させる。
【0137】
[00153] デポーまたはその一部分を成形するための熱可塑性加工技術には、成形技術(例えば、射出成形、回転成形等)、押出技術(例えば、押出、同時押出、多層押出等)および流延が含まれる。
【0138】
[00154] 様々な態様による熱可塑性加工は、一つまたは複数の段階において、一つまたは複数の生体適合性ポリマーおよび一つまたは複数の次のもの、すなわち、ブピバカイン、一つまたは複数の任意の追加の治療薬、一つまたは複数のラジオグラフィー用物質等を混合することまたは配合することを含む。次に、得られた混合物を成形して、埋め込み可能薬剤デポーにする。その混合および成形作業は、このような目的について当該技術分野において知られているいずれかの慣用的な装置を用いて行うことができる。
【0139】
[00155] 熱可塑性加工中に、例えば、このような加工に関連している高温および/または機械的剪断ゆえに、一つまたは複数の治療薬が分解する可能性が存在する。例えば、ブピバカインは、通常の熱可塑性加工条件下において実質的に分解することがありうる。したがって、加工は、好ましくは、一つまたは複数の治療薬の実質的な分解を妨げる改変条件下で行われる。いくらかの分解は、熱可塑性加工中に不可避であるかもしれないということは理解されるが、分解は、一般に、10%またはそれ未満に限られる。一つまたは複数の治療薬の実質的な分解を免れるように加工中に制御することができる加工条件の中には、温度、加えられる剪断速度、加えられる剪断応力、治療薬を含有する混合物の滞留時間、およびポリマー性材料および一つまたは複数の治療薬を混合する技術がある。
【0140】
[00156] 生体適合性ポリマーを一つまたは複数の治療薬およびいずれかの追加の添加剤と混合してまたは配合して、それらの実質的に均一な混合物を形成することは、当該技術分野において知られておりそしてポリマー性材料を添加剤と混合するのに慣用的に用いられるいずれかの装置で行ってもよい。
【0141】
[00157] 熱可塑性材料が用いられる場合、ポリマーメルトは、生体適合性ポリマーを加熱することによって形成することができ、それを、様々な添加剤(例えば、一つまたは複数の治療薬、不活性成分等)と混合して、混合物を形成することができる。それを行う一般的な方法は、一つまたは複数の生体適合性ポリマーおよび一つまたは複数の添加剤の混合物に機械的剪断を加えることである。一つまたは複数の生体適合性ポリマーおよび一つまたは複数の添加剤を、この様式で混合することができる装置には、一軸スクリュー押出機、二軸スクリュー押出機、バンバリーミキサー、高速ミキサー、ロスケトル(ross kettles)等のような装置が含まれる。
【0142】
[00158] 一つまたは複数の生体適合性ポリマーおよび様々な添加剤はいずれも、所望ならば(例えば、他の理由の中でも、治療薬の実質的な分解を妨げるために)、最終の熱可塑性混合工程および成形工程の前に予備混合することができる。
【0143】
[00159] 例えば、様々な態様において、生体適合性ポリマーは、治療薬が存在していた場合にそれの実質的な分解を引き起こすと考えられる温度および機械的剪断の条件下において、ラジオグラフィー用物質(例えば、放射線不透過性剤)と予備配合される。次に、この予備配合された材料を、より低い温度および機械的剪断の条件下において治療薬と混合し、そして得られた混合物を、ブピバカイン含有薬剤デポーに成形する。逆に、別の態様において、生体適合性ポリマーは、低減した温度および機械的剪断の条件下において治療薬と予備配合することができる。次に、この予備配合された材料を、例えば、放射線不透過性剤と、同じく低減した温度および機械的剪断の条件下で混合し、そして得られた混合物を、薬剤デポーに成形する。
【0144】
[00160] 生体適合性ポリマーおよび治療薬および他の添加剤の混合物を達成するのに用いられる条件は、例えば、用いられる具体的な一つまたは複数の生体適合性ポリマーおよび一つまたは複数の添加剤、更には、用いられる混合装置のタイプを含めた多数の因子に依存するであろう。
【0145】
[00161] 例として、異なった生体適合性ポリマーは、典型的に、軟化して、異なった温度での混合を容易にするであろう。例えば、デポーが、PLGAまたはPLAポリマー、放射線不透過性剤(例えば、次炭酸ビスマス)、および熱および/または機械的剪断によって分解しやすい治療薬を含んで成形される場合、様々な態様において、PGLAまたはPLAは、放射線不透過性剤と、例えば、約150℃〜170℃の温度で予備混合することができる。次に、治療薬を、その予備混合された組成物と一緒にし、そしてPGLAまたはPLA組成物に典型的であるよりも実質的に低い温度および機械的剪断の条件下で、追加の熱可塑性加工を行う。例えば、押出機を用いる場合、バレル温度、容量出力は、典型的に、剪断を制限するように、したがって、一つまたは複数の治療薬の実質的な分解を妨げるように制御される。例えば、治療薬および予備混合された組成物は、二軸スクリュー押出機を用いて、実質的により低い温度(例えば、100〜105℃)で、および実質的に低減した容量出力(一般に、200 cc/分未満の容量出力に相当する、例えば、全容量の30%未満)を用いて、混合/配合することができる。この加工温度は、ブピバカインの融点より十分に低いということが注目される。というのも、融点温度またはそれより高い温度での加工が、実質的な治療薬分解を引き起こすであろうという理由のためである。更に、特定の態様において、加工温度は、治療薬を含めた、組成物中の全ての生物活性化合物の融点より低いであろうということが注目される。配合後、得られたデポーを、同様に低減した温度および剪断の条件下で、所望の形に成形する。
【0146】
[00162] 他の態様において、一つまたは複数の生物分解性ポリマーおよび一つまたは複数の治療薬を、非熱可塑性技術を用いて予備混合する。例えば、生体適合性ポリマーは、一つまたは複数の溶媒種を含有する溶媒系中に溶解させることができる。所望の物質(例えば、放射線不透過性剤、治療薬、または放射線不透過性剤および治療薬双方)はいずれも、その溶媒系中に溶解または分散させることもできる。次に、溶媒を、得られた溶液/分散液から除去して、固形材料を形成させる。次に、得られた固形材料は、所望ならば、追加の熱可塑性加工(例えば、押出)用に造粒することができる。
【0147】
[00163] 別の例として、治療薬は、溶媒系中に溶解または分散させることができ、次に、それを、先在する薬剤デポーに適用し(先在する薬剤デポーは、溶液および熱可塑性加工技術を含めた様々な技術を用いて成形することができ、そしてそれは、放射線不透過性剤および/または粘度増強剤を含めた様々な添加剤を含むことができる)、そこで、治療薬を薬剤デポー上または中に吸収させる。上のように、次に、得られた固形材料は、所望ならば、追加の加工用に造粒することができる。
【0148】
[00164] 典型的に、押出法は、一つまたは複数の生体適合性ポリマー、一つまたは複数の治療薬および一つまたは複数の放射線不透過性剤を含む薬剤デポーを成形するのに用いることができる。同時押出を用いてもよく、それは、同じまたは異なった層または領域を含む薬剤デポー(例えば、即時および/または持続薬剤放出を可能にする体液透過性を有する一つまたは複数のポリマー性マトリックス層または領域を含む構造)を製造するのに用いることができる成形法である。多領域デポーも、同時射出または逐次射出成形技術などの他の加工および成形技術によって成形することができる。
【0149】
[00165] 様々な態様において、熱可塑性加工から出現することができるデポー(例えば、リボン、ペレット、ストリップ等)を冷却する。冷却法の例には、空気冷却および/または冷却浴中浸漬が含まれる。いくつかの態様において、水浴を用いて、押出デポーを冷却する。しかしながら、治療薬が水溶性である場合、浸漬時間は、浴中への治療薬の不必要な減少を免れるように最小限にするべきである。
【0150】
[00166] 様々な態様において、浴から出した後に周囲温または温エアジェットの使用による水または水分の即時除去も、デポー表面上の薬剤の再結晶を妨げるであろうし、したがって、埋め込みまたは挿入時の高薬剤用量「初期バースト」または「ボーラス用量」を、これが望まれない放出プロフィールである場合、制御するかまたは最小限にするであろう。
【0151】
[00167] 様々な態様において、薬剤デポーは、薬剤にポリマーを混合または噴霧後、デポーを所望の形状に成形することによって製造することができる。様々な態様において、ブピバカインを用い、そしてPLGA、ポリ(D,L-ラクチド-カプロラクトン)ポリマーおよび/またはポリ(D,L-ラクチド-グリコリド-カプロラクトン)ポリマーを混合または噴霧し、そして得られたデポーを、押出によって成形し、乾燥させることができる。
【0152】
[00168] いくつかの例示的な製剤中には、55〜65%のブピバカイン、25〜35%のPLGAおよび5〜15%のmPEGが存在してよい。これら製剤のいくつかは、10〜30%の活性成分を1日目に放出し、そして全てのまたは実質的に全ての活性成分を10日目までに放出するであろう。これら製剤のいくつかは、15〜25%の活性成分を1日目に放出し、そして全てまたは実質的に全ての製品を10日目までに放出するであろう。
【0153】
[00169] 更に他の例示的な製剤中には、55〜65%のブピバカイン、25〜35%のDL-G-CL、6%のPEG 300および13%のNMPが存在してよい。いくつかのこれら製剤は、10〜30%の活性成分を1日目に放出し、そして全てのまたは実質的に全ての活性成分を10日目までに放出するであろう。これら製剤のいくつかは、10〜15%の活性成分を1日目に放出し、そして全てまたは実質的に全ての製品を10日目までに放出するであろう。
【0154】
[00170] 別の例示的な態様において、術後疼痛の処置を必要としている患者の術後疼痛を減少させ、予防しまたは処置するのに有用な埋め込み可能薬剤デポーを提供する。その埋め込み可能薬剤デポーは、治療的有効量のブピバカインまたはその薬学的に許容しうる塩を含む。そのデポーは、術後疼痛を減少させ、予防しまたは処置するために皮膚下部位に埋め込み可能であり、ここにおいて、薬剤デポーは、(i)その薬剤デポー中に負荷されたブピバカインまたはその薬学的に許容しうる塩の全量に相対して約5%〜約50%のブピバカインまたはその薬学的に許容しうる塩を、最初の48時間まで、最初の24時間まで、または最初の約24〜48時間にわたって放出することができる一つまたは複数の即時放出層、および(ii)その薬剤デポー中に負荷されたブピバカインまたはその薬学的に許容しうる塩の全量に相対して約50%〜約95%のブピバカインまたはその薬学的に許容しうる塩を、その後の4〜30日間または4〜10日間までにわたって放出することができる一つまたは複数の持続放出層、を含む。一つまたは複数の即時放出層は、ポリ(ラクチド-コ-グリコリド)、ポリラクチド、ポリグリコリド、ポリオルトエステル、D-ラクチド、D,L-ラクチド、ポリ(D,L-ラクチド)、L-ラクチド、ポリ(D,L-ラクチド-コ-カプロラクトン)、ポリ(D,L-ラクチド-コ-グリコリド-コ-カプロラクトン)、ポリカプロラクトンまたはこれらの組合せの一つまたは複数のものを含み、そして一つまたは複数の持続放出層は、ポリ(ラクチド-コ-グリコリド)、ポリラクチド、ポリグリコリド、ポリオルトエステル、D-ラクチド、D,L-ラクチド、ポリ(D,L-ラクチド)、L-ラクチド、ポリ(D,L-ラクチド-コ-カプロラクトン)、ポリ(D,L-ラクチド-コ-グリコリド-コ-カプロラクトン)、ポリカプロラクトンまたはこれらの組合せの一つまたは複数のものを含む。
【0155】
[00171] また別の例示的な態様において、埋め込み可能薬剤デポーを提供する。その埋め込み可能薬剤デポーは、(i)治療的有効量のブピバカインまたはその薬学的に許容しうる塩;(ii)ボーラス用量のブピバカインまたはその薬学的に許容しうる塩を皮膚下部位に放出することができる一つまたは複数の即時放出層;および(iii)有効量のブピバカインまたはその薬学的に許容しうる塩を4〜30日間、4〜10日間または5〜7日間にわたって放出することができる一つまたは複数の持続放出層を含む。一つまたは複数の即時放出層は、ポリ(ラクチド-コ-グリコリド)、ポリラクチド、ポリグリコリド、ポリオルトエステル、D-ラクチド、D,L-ラクチド、ポリ(D,L-ラクチド)、L-ラクチド、ポリ(D,L-ラクチド-コ-カプロラクトン)、ポリ(D,L-ラクチド-コ-グリコリド-コ-カプロラクトン)、ポリカプロラクトンまたはこれらの組合せの一つまたは複数のものを含み、そして一つまたは複数の持続放出層は、ポリ(ラクチド-コ-グリコリド)、ポリラクチド、ポリグリコリド、ポリオルトエステル、D-ラクチド、D,L-ラクチド、ポリ(D,L-ラクチド)、L-ラクチド、ポリ(D,L-ラクチド-コ-カプロラクトン)、ポリ(D,L-ラクチド-コ-グリコリド-コ-カプロラクトン)、ポリカプロラクトンまたはこれらの組合せの一つまたは複数のものを含む。その薬剤デポーは、薬剤デポー中に負荷されたブピバカインの全量に相対して約40%〜約70%のブピバカインまたはその薬学的に許容しうる塩を徐放性放出期間のあいだ放出することができる。
【0156】
[00172] ここに、本発明を概ね記載してきたが、それは、以下の実施例への以下の参照によって一層容易に理解することができるが、それらは、詳しく説明するために与えられており、断らない限り、本発明を限定するためのものではない。
【実施例】
【0157】
実施例1
[00173] ブピバカインを含む埋込み剤を、次の手順にしたがって製造した。
【0158】
[00174] 材料:25:75のラクチド対カプロラクトンモル比(25:75 DL-CL)、0.8 dL/gの固有粘度数、および95 kDaの分子量を有するポリ(D,L-ラクチド-コ-カプロラクトン)を、Lakeshore Biomaterials(Birmingham, Alabama)より購入した。30:20:50のラクチド対グリコリド対カプロラクトンモル比(30:20:50 DL-G-CL)、0.05 dL/g〜0.15 dL/gの固有粘度数、および10 kDaの分子量を有するポリ(D,L-ラクチド-コ-グリコリド-コ-カプロラクトン)は、Lakeshore Biomaterials(Birmingham, Alabama)より購入した。ブピバカイン塩基は、Orgamol(スイス)より購入した。300〜400 g/molの平均分子量を有するポリエチレングリコール(PEG)は、Spectrum Chemicalsより購入し、99 g/molの平均分子量を有するn-メチルピロリドン(NMP)は、Fisherより購入し、そして更に、アセトンを、Sigma-Aldrichより購入した。
【0159】
[00175] 方法:
[00176] ブピバカイン塩基/25:75 DL-CLストリップ埋込み剤の製造:25:75 DL-CLポリマーを、ガラス製バイアルに加え、そして100℃(薬剤溶融温度より低く)かまたは110℃(薬剤溶融温度より高く)に加熱した。ブピバカイン塩基を、その溶融したポリマーに加え、そして目視によって均一になるまで、スパチュラで混合した。得られたブレンドを、ガラス製バイアルから取り出し、Carver Pressを用いてプレスして、薄膜(0.4〜0.6 mm厚)にした。Carver Pressは、45℃および6000〜8000 psi圧力で操作した。その薄膜を、鋭利なブレードで切断して、所望の寸法のストリップを成形した。埋込み剤の寸法は、9 mm長、0.4〜1 mm厚および1.5〜3 mm幅であった。埋込み剤の寸法は、Brennanラット術後疼痛モデルでのin vivo試験用に選択した。
【0160】
[00177] ブピバカイン塩基/30:20:50 DL-G-CL注射可能ペースト/ゲル製剤の製造:ポリマー(318 mg)、PEG 300(92 mg)およびNMP(199 mg)を、ガラス製バイアルに加え、そして93℃に約10分間加熱した。ブピバカイン(911 mg)を、その混合物に加え、そして93℃で撹拌しながら/旋回させながら20分間維持して、薬剤を溶解させた。バイアル(Vail)を熱から外し、その混合物を、それが室温にまで冷却するように撹拌した。製剤を、バイアルから集め、そして1 mLシリンジに加えた。その混合物は、40℃に加熱した時に、シリンジ(針無装着)から容易に排出した。
【0161】
[00178] ブピバカイン塩基/25:75 DL-CLリボン埋込み剤およびブピバカイン塩基/30:20:50 DL-G-CL注射可能ゲル製剤のin vitro薬剤溶離試験:この手順の目的は、ポリマー埋込み剤およびゲル製剤から受容液(receiving fluid)PBS緩衝液pH7.4中へのブピバカインの放出を測定することであった。そのin vitro放出手順は、受容液が入っている装置中に既知の質量の埋込み剤またはゲルを入れることから成った。in vitro放出装置は、60 mlガラスビンから成った。30 mlの量の受容液を、各々の試料ビンに加えた。放出研究中に、その装置は、37±2℃で維持されたインキュベーター中に入れた。所定の間隔で、受容液の試料を取り出し、そしてブピバカイン濃度についてHPLCによって分析した。
【0162】
[00179] 溶離プロフィールおよびin vivoデータ:これらブピバカイン製剤の埋込み剤を、Brennanラットにおいて調べて、それらのin vitro溶離およびin vivo性能を決定した。図3および図4は、これらブピバカイン製剤の平均累積放出プロフィールを示す。更に、これら製剤についての溶離プロフィールおよびin vivoデータを、下の表1に要約する。
【0163】
【表1】

【0164】
[00180] DL-CLは、ポリ(DL-ラクチド-コ-カプロラクトン)ポリマーの略語である。
【0165】
[00181] 図5および図6は、ブピバカイン1および2製剤についてのin vivo試験の効力データを示す。図5および図6において、「n」は、評価された動物の数を示す。図6には、4群(外科手術、対照ペースト、ブピバカインペーストおよびブピバカインポリマー)各々について、八時点を与える。それら時点は、左から右へと、ベースライン、外科手術後1日目、外科手術後2日目、外科手術後3日目、外科手術後4日目、外科手術後7日目、外科手術後8日目、および外科手術後10日目である。
【0166】
[00182] ブピバカイン1製剤には、コポリマーが、6〜8か月までに完全分解することがありうるという問題があった。ブピバカインは、それをポリマーと混合する前に溶融したので、賦形剤は不必要であった。展性は、ストリップまたはリボン剤形への押出を可能にする十分な融通性を有した。予備評価として、この製剤の効力を、Brennanラット術後疼痛モデルで調べた。機械的異痛症を、これら製剤で処置後の動物モデルにおける疼痛の存在/不存在を評価する行動終点として用いた。Brennanラット切開は、ラット足底面上に行った。切開の深さおよび長さは、このモデルにおいて、埋込み剤サイズが、切り口にはやや大きくそして埋め込み後のラット足内でかさ高になるため、制限因子であった。これは、次に、創傷治癒に影響した。いくつかの埋込み剤は、投与後の様々な時点で、切開された足から失われた。この問題ゆえに、いくつかの被験動物を、埋込み剤の損失のために研究から除外したので、研究に残った少数のラットのみでのこれら製剤の効力の完全な評価は不可能であった。しかしながら、研究を続行した少数のラットについて、ブピバカイン1製剤の投与後に機械的異痛症を逆転させる若干の効力が認められた。
【0167】
[00183] ブピバカイン2製剤について、ポリマーの分解は、1か月未満であった。ブピバカイン2製剤の作用は、注射可能製剤の取扱特性が、投与の時点で変化するという事実ゆえに、示すことができなかった。製剤安定性は、輸送中に影響を受けた。in vivo試験において、(ブピバカイン1製剤の場合のように)若干の効力だけが認められたが、Brennanラットモデルにおいて、効力は、モデルの切り口に適合するように切断された製剤ストリップ寸法中における有効薬剤用量の不存在で影響を受けるということは理解される。
【0168】
実施例2
[00184] ブピバカインを含む多数の埋込み剤を、次の手順にしたがって製造した。
【0169】
[00185] 材料:50:50のラクチド対グリコリドモル比(PLGA50501A)、0.12の固有粘度数、および酸末端付きポリマー鎖末端を有するポリ(D,L-ラクチド-コ-グリコリド)を、Lakeshore Biomaterials(Birmingham, Alabama)より購入した。ブピバカイン塩基を、Orgamol(スイス)より購入した。ブピバカインHClを、Spectrum Chemicals(Gardena, CA)より購入した。550の平均分子量を有するメトキシポリエチレングリコール(mPEG)を、Sigma-Aldrichより購入した。メタノールおよびアセトンも、Sigma-Aldrichより購入した。
【0170】
[00186] 方法:
[00187] 噴霧乾燥ブピバカイン塩基/PLGA50501Aの製造:ブピバカイン塩基およびPLGA50501Aを、双方ともアセトン中に溶解させて、10%(w/w)溶液を生じた。65.2%のブピバカイン塩基溶液および34.8%のPLGA50501A溶液の混合物を、Buchi Spray Dryer中で噴霧乾燥させた。加工パラメーターは、次のように設定した。すなわち、入口温度(70℃)、アスピレーター(80%)、窒素入口(50 mm)、噴霧流量(80 mL/時)および超音波発生器(0.8ワット)。噴霧乾燥粉末を集め、そして30℃および15 mmHg真空で更に24時間乾燥させた。
【0171】
[00188] 噴霧乾燥ブピバカインHClの製造:ブピバカインHClを、メタノール中に溶解させて、10%(w/w)溶液を生じ、その溶液を、Buchi Spray Dryer中で噴霧乾燥させた。加工パラメーターは、次のように設定した。すなわち、入口温度(70℃)、アスピレーター(80%)、窒素入口(50 mm)、噴霧流量(80 mL/時)および超音波発生器(0.8ワット)。噴霧乾燥粉末を集め、そして70℃および15 mmHg真空で更に24時間乾燥させた。
【0172】
[00189] 溶融押出ロッドの製造:3種類の製剤を、溶融押出用に調製した。3種類の製剤は全て、80マイクロメートル篩フィルターを有するRetsch(Retsch GmbH, ドイツ)ローターミルを用いて粉末へと粉砕されたPLGA50501Aを含有した。第一のこのような製剤は、30%(w/w)PLGA50501A粉末、60%(w/w)噴霧乾燥ブピバカインHCl、および10%(w/w)mPEGを含有した(60%ブピバカインHCl)。第二の製剤は、90%(w/w)噴霧乾燥ブピバカイン塩基/PLGA50501Aおよび10%(w/w)mPEGを含有した(60%ブピバカイン塩基)。最後の製剤は、90%(w/w)PLGA50501A粉末および10%(w/w)mPEGを含有した(ビヒクルポリマー)。最後の製剤は、検査しなかった。
【0173】
[00190] 最初の二つの製剤を、スパチュラで乾式混合後、Haake Mini-Lab二軸スクリュー押出機(Thermo Fischer Scientific, Waltham, MA)中に供給した。押出機設定は、次のようであった。すなわち、60%ブピバカインHCl製剤について、105℃および30 RPM、そして60%ブピバカイン塩基製剤について、85℃および30 RPM。最初の二つの製剤を、1.5 mm直径ダイから押出した。
【0174】
[00191] ストリップ製造:押出製剤を、50℃に設定されたCarver Laboratory Heat Press(Carver, Inc., Wabash, IN)を用いてプレスして、所望の厚みのシートにした。それらシートを、レーザーブレードで切断して、所望の寸法のストリップ(またはリボン)または埋込み剤を成形した。各々の埋込み剤の寸法は、次のようであった(長さ×幅×高さまたはL×W×H);すなわち、60%ブピバカイン塩基製剤について、埋込み剤は、9 mm×3 mm×1 mmであり、そして60%ブピバカインHCl製剤について、埋込み剤は、9 mm×3 mm×1 mmであった。
【0175】
[00192] in vitro薬剤溶離試験:各々のストリップまたは埋込み剤を、薬剤溶離試験について三重反復試験で調べ、20 mLシンチレーションバイアル中に入れた。60%ブピバカインHClおよび60%ブピバカイン塩基のストリップ(またはリボン)を、0.5%(w/w)ドデシル硫酸ナトリウムを含む10 mLのリン酸緩衝液pH7.4中において37℃で穏やかに撹拌しながらインキュベートした。予め選択された時点で、緩衝液を分析用に取り出し、新しい緩衝液基剤で置き換えた。薬剤含有量を、Molecular Devices SpectraMax M2(Sunnyvale, CA)プレートリーダーによって、ブピバカインについて260 nmで定量した。
【0176】
[00193] 溶離プロフィールおよびin vivoデータ:ブピバカインの埋込み剤を、Brennanラットにおいて調べて、それらのin vitro溶離およびin vivo性能を決定した。図7および図8は、表2によるブピバカイン3埋込み剤(図中にはブピバカインHClと標識されている)およびブピバカイン4埋込み剤(図中にはブピバカイン塩基と標識されている)の平均放出速度をマイクログラムおよび百分率で示す。図9は、ブピバカイン3および4埋込み剤について、温熱性足引っ込め(thermal paw withdrawal)閾値を術後日数につきグラムで示す。それら結果を、下の表2にも要約する。
【0177】
【表2】

【0178】
[00194] ブピバカイン3および4埋込み剤について、ポリマーは、1か月未満で分解した。取扱適性は、ストリップ様(リボン)剤形へと押出されうる展性でそして成形可能な製剤製品を可能にする性質を有した。予備評価として、これら埋込み剤製剤の効力を、切開術後疼痛のBrennanラットモデルで調べた。機械的痛覚過敏を、これら薬剤製剤で処置後の動物モデルにおける疼痛の存在/不存在を評価する行動終点として用いた。Brennanラット切開は、ラット足底面上に行った。埋込み剤が、切り口より僅かに大きくそして埋め込み後のラット足内でかさ高になるために、切開の深さおよび長さは、このモデルにおいて、制限因子であった。これは、順次、創傷治癒に影響した。いくつかの埋込み剤は、投与後の様々な時点で、切開された足から失われた。この問題ゆえに、いくつかの被験動物を、埋込み剤の損失が原因で研究から除外し、そして研究に残った少数のラットでのこれら埋込み剤の効力の完全な評価は行うことができなかった。しかしながら、研究を続行した少数のラットのうち、ブピバカイン4埋込み剤の投与後、外科手術後2日目に機械的痛覚過敏の統計的に有意の減少が認められ、ブピバカイン3埋込み剤の投与では、統計的作用は存在しなかった。
【0179】
[00195] ブピバカイン5埋込み剤について、ポリマーの分解は、少なくとも数か月を要した。
【0180】
実施例3
[00196] ブピバカイン塩基を含む多数の埋込み剤を製造し、そしてそれらの累積in vitro放出プロフィールを測定した。
【0181】
[00197] 材料:25:75のラクチド対カプロラクトンモル比(25:75 DL-CL)、0.8 dL/gの固有粘度数、および95 kDaの分子量を有するポリ(D,L-ラクチド-コ-カプロラクトン)を、Lakeshore Biomaterials(Birmingham, Alabama)より購入した。30:20:50のラクチド対グリコリド対カプロラクトンモル比(30:20:50 DL-G-CL)、0.05 dL/g〜0.15 dL/gの固有粘度数、および10 kDaの分子量を有するポリ(D,L-ラクチド-コ-グリコリド-コ-カプロラクトン)を、Lakeshore Biomaterials(Birmingham, Alabama)より購入した。ブピバカイン塩基は、Orgamol(スイス)より購入した。300、1,500および8,000の平均分子量を有するPEGポリマーは、Spectrum Chemicalsより購入し、99 g/molの平均分子量を有するn-メチルピロリドン(NMP)は、Fisherより購入し、そして更に、アセトンを、Sigma-Aldrichより購入した。PEG-8カプリル酸/カプリン酸グリセリドから成るLabrosolは、Gattefosse, USA(Paramus, NJ)より購入した。324 g/molの平均分子量を有するTrehaloseは、Sigma-Aldrich(St. Louis, MO)より購入した。
【0182】
[00198] 方法:
[00199] ブピバカイン塩基/DL-CLストリップ埋込み剤の製造:10:90、25:75または65:35のDL-CLポリマーを各々、ガラス製バイアルに加え、そして100℃(薬剤溶融温度より低く)かまたは110℃(薬剤溶融温度より高く)に加熱した。ブピバカイン塩基を、その溶融したポリマーに加え、そして目視によって均一になるまで、スパチュラで混合した。得られたブレンドを、ガラス製バイアルから取り出し、Carver Pressを用いてプレスして、薄膜(0.4〜0.6 mm厚み)にした。Carver Pressは、45℃および6000〜8000 psi圧力で操作した。その薄膜を、鋭ブレードで切断して、所望の寸法のストリップ(リボン)を成形した。埋込み剤の寸法は、9 mm長さ、1.5〜3 mm幅および0.5〜1 mm厚みであった。
【0183】
[00200] ブピバカイン塩基/25:75 DL-CLリボン埋込み剤のin vitro薬剤溶離試験:この手順の目的は、ポリマー埋込み剤製剤から受容液PBS緩衝液pH7.4中へのブピバカインの放出を測定することであった。そのin vitro放出手順は、受容液が入っている装置中に既知の質量の埋込み剤またはゲルを入れることから成った。in vitro放出装置は、60 mlガラスビンから成った。30 mlの量の受容液を、各々の試料ビンに加えた。放出研究中に、その装置は、37±2℃で維持されたインキュベーター中に入れた。所定の間隔で、受容液の試料を取り出し、そしてブピバカイン濃度についてHPLCによって分析した。これら埋込み剤の薬剤負荷量を、下の表3に要約する。更に、表3は、これらブピバカイン埋込み剤の各々の説明を与える。
【0184】
【表3】

【0185】
実施例4
[00201] いくつかのブピバカインゲル製剤を製造した。
【0186】
[00202] PLAゲルの製造:ドデカノールでのポリ乳酸の解重合
[00203] ポリ乳酸(5.71の固有粘度数および15.0グラムの重量)、4-ジメチルアミノピリジン(9.16グラムの重量)およびドデカノール(5.59の重量)を、100 mL丸底フラスコ中に加え、装填し、ゴム隔膜でキャップし、そして油浴中に140℃で入れた。それら材料を、その温度で、全てが溶融後30分間加熱し、そしてマグネチックスターバーで自由に撹拌した。冷却後、15 mLのテトラヒドロフランをフラスコ中に加えて、材料を溶解させ、そしてヘプタンを加えることによって沈殿させた。溶媒をデカントして除去後、材料をクロロホルム(30 mL)中に溶解させ、塩酸塩で洗浄し(1モル、20 mL、3回)、そしてブライン処理を1回行った。その溶液を、無水硫酸ナトリウム上で乾燥させた。溶媒をロタエバポレーションによって除去後、黄色油状物を得た(H-NMRでの末端基分析により約800 g/molのMn)。
【0187】
[00204] ブピバカインゲル製剤の製造方法:製剤は、70%(w/w)PLAゲルおよび30%(w/w)噴霧乾燥ブピバカインを含有するように製造した。各々の製剤について、それら二つの成分を、2 ccトランスファーカップに加え、そしてFlacktek, Inc. Speedmixer DAC150FVZ中で2分間混合した。次に、混合された製剤を各々、18G 1.5インチ鈍端針を有する1 mLのBDシリンジ中に負荷し戻した。
【0188】
[00205] in vitro薬剤溶離試験:各100μLのゲル製剤を、薬剤溶離試験のために、20 mLシンチレーションバイアル中に注射した。それら製剤を各々、三重反復試験で調べ、そして0.5%(w/w)ドデシル硫酸ナトリウムを含む10 mLのリン酸緩衝液pH7.4中において37℃で穏やかに撹拌しながらインキュベートした。予め選択された時点で、緩衝液を分析用に取り出し、新しい緩衝液で置き換えた。薬剤含有量を、Molecular Devices SpectraMax M2(Sunnyvale, CA)プレートリーダーによって、ブピバカインについて定量した。得られた製剤は、30%のブピバカインを包含した。図10〜12は、下の表4に挙げられている製剤について、ブピバカインの1日当たりの平均in vitro累積放出百分率を示す。
【0189】
【表4】

【0190】
実施例5
[00206] ブピバカインを含む多数の埋込み剤を、次の手順にしたがって製造した。
【0191】
[00207] 材料:50:50のラクチド対グリコリドモル比(DLG50501A)、0.12の固有粘度数、および酸末端付きポリマー鎖末端を有するポリ(D,L-ラクチド-コ-グリコリド)を、Lakeshore Biomaterials(Birmingham, Alabama)より購入した。ブピバカイン塩基を、Orgamol(スイス)より購入した。550の平均分子量を有するメトキシポリエチレングリコール(mPEG)を、Sigma-Aldrichより購入した。メタノールおよびアセトンも、Sigma-Aldrichより購入した。
【0192】
[00208] 方法:
[00209] 噴霧乾燥ブピバカイン塩基/DLG 50501Aの製造:ブピバカイン塩基およびDLG 50501Aを、双方ともアセトン中に溶解させて、10%(w/w)溶液を生じた。65.2%のブピバカイン塩基溶液および34.8%のDLG 50501A溶液の混合物を、Buchi Spray Dryer中で噴霧乾燥させた。加工パラメーターは、次のように設定した。すなわち、入口温度(70℃)、アスピレーター(80%)、窒素入口(50 mm)、噴霧流量(80 mL/時)および超音波発生器(0.8ワット)。噴霧乾燥粉末を集め、そして30℃および15 mmHg減圧下で更に24時間乾燥させた。
【0193】
[00210] 溶融押出ロッドの製造:いくつかの製剤を、溶融押出用に調製した。製剤は全て、80マイクロメートル篩フィルターを有するRetsch(Retsch GmbH, ドイツ)ローターミルを用いて粉末へと粉砕されたDLG 50501Aを含有した。製剤は全て、60%(w/w)噴霧乾燥ブピバカイン塩基/PLGA 50501Aを含有した。
【0194】
[00211] それら製剤を各々、スパチュラで乾式混合後、Haake Mini-Lab二軸スクリュー押出機(Thermo Fischer Scientific, Waltham, MA)中に供給した。押出機設定は、次のようであった。すなわち、60%ブピバカインHCl製剤について、105℃および30 RPM、そして60%ブピバカイン塩基製剤について、85℃および30 RPM。それら製剤を、1.5 mm直径ダイから押出した。
【0195】
[00212] ストリップ製造:押出製剤を、50℃に設定されたCarver Laboratory Heat Press(Carver, Inc., Wabash, IN)を用いてプレスして、所望の厚みのシートにした。それらシートを、レーザーブレードで切断して、所望の寸法のストリップを成形した。各々の埋込み剤またはストリップの寸法は、9 mm長さ×3 mm幅×1 mm高さであった。
【0196】
[00213] in vitro薬剤溶離試験:各々のストリップまたは埋込み剤を、薬剤溶離試験について三重反復試験で調べ、20 mLシンチレーションバイアル中に入れた。60%ブピバカイン塩基ストリップ(またはリボン)を、0.5%(w/w)ドデシル硫酸ナトリウムを含む10 mLのリン酸緩衝液pH7.4中において37℃で穏やかに撹拌しながらインキュベートした。予め選択された時点で、緩衝液を分析用に取り出し、新しい緩衝液基剤で置き換えた。薬剤含有量を、Molecular Devices SpectraMax M2(Sunnyvale, CA)プレートリーダーによって、ブピバカインについて260 nmで定量した。図13および図14は、下の表5に挙げられている埋込み剤について、ブピバカインの1日当たりの平均in vitro累積放出百分率を示す。
【0197】
【表5】

【0198】
実施例6
[00214] ブピバカイン埋込み剤を、上の実施例5に記載の手順にしたがって製造した。埋込み剤を製造するのに用いられる製剤を、下の表6に記載する。具体的には、その製剤は、50 wt%のブピバカイン塩基、42 wt.%の5050 DLG 1Aおよび8 wt.%のmPEGを含有した。5050DLGの固有粘度は、0.05〜0.15であり、それは、酸末端基を有した。
【0199】
【表6】

【0200】
[00215] in vitro累積および1日放出プロフィールを、表6に記載の製剤からの三つのストリップ埋込み剤を用いて、滅菌前に調べた。図15Aおよび図15Bは、三つの滅菌済みブピバカインストリップのin vitro累積放出百分率のグラフによる図示である。これら図面で容易に明らかであるように、各々の製剤は、65%〜85%のブピバカインを14日間にわたって放出し、平均して5%〜10%の薬剤を毎日放出した。三つのストリップの平均累積薬剤放出を、図15Bに示すが、この場合、75%の薬剤が14日で放出された。
【0201】
[00216] 図16Aおよび図16Bは、三つの滅菌済みブピバカインストリップのin vitroでの1日放出プロフィールおよびマイクログラム/日でのそれらの累積平均1日放出のグラフによる図示である。これら図面で容易に明らかであるように、各々の薬剤デポーは、2日以内に約3500 mcgの用量でのブピバカイン放出で初期バースト作用を有した。2日後、各々の薬剤デポーは、14日目に薬剤デポーが枯渇するまで、約500〜1000 mcg/日を放出した。
【0202】
実施例7:ブタ外科手術モデルにおけるブピバカイン埋込み剤のin vivo効力評価
[00217] 仔ブタにおける術後疼痛の誘導:仔ブタを、フェイスマスクを介して送達されたイソフルレン/酸素混合物で麻酔した。5 cm長さの皮膚・筋膜切開を、右大腿鼡径部鼡径部に行って、筋肉を無傷のまま保持した。皮膚切り口を、金属製鉗子で閉じた。麻酔持続期間は、10分未満で保持した。切開直後に、それら被験動物の切り口空間中に、対照かまたは薬剤埋込み剤を投与した。モルフィン(Mor)を、陽性対照としてのモルフィン群の被験動物に皮下投与した。
【0203】
[00218] 痛覚脱失評価:ブピバカイン埋込み剤の鎮痛作用を、疼痛行動スコアリングを用いて評価した。疼痛スコアリングシステムは、次の3つの主要カテゴリーの合計であった。
【0204】
1. 被験動物単独動作性(歩行および発声)
2. 被験動物社会的行動
3. ブタがスリング上にとどまった時間長さ。
【0205】
[00219] 全ての被験動物を、ベースライン(外科手術前3日)および外科手術後1時間および3時間(研究0日目)の時点で観察した。次に、疼痛行動を、更に4日間毎日評価した(研究1日目、2日目、3日目および4日目)。埋込み剤を、研究0日目の正に手術直後に、手術創傷床中に投与した。モルフィンは、モルフィン群(Mor)の被験動物に、疼痛評価前1時間に投与した。
【0206】
[00220] 結果:図17は、外科手術後1時間、3時間、1日、2日、3日および4日に疼痛スコアによって測定されるブピバカイン高用量(250 mcgをデポー中に負荷し、25 mcg/日を放出するように設計された)製剤およびブピバカイン低用量(125 mcgをデポー中に負荷し、12.5 mcg/日を放出するように設計された)製剤のin vivo効力評価を示す。疼痛行動スコアの増加は、研究0日目の外科手術後3時間にピークに達した(対照群:7.83±0.9ポイント)。対照で処置された被験動物の高平均群疼痛スコアは、研究1日目にも認められた。研究2日目に、疼痛行動の自発的回復を認め、そして外科手術後4日には、疼痛行動スコアは、ベースライン値と統計的に異なることはなかった。
【0207】
[00221] 高レベル用量を用いたブピバカイン埋込み剤での処置は、外科手術後3時間および外科手術後1日に疼痛を減少させるのに有効であった。この作用は、用量関連性ではなかった。
【0208】
[00222] 結論:この研究の条件下で得られたそしてインライフ(in-life)データに限られた知見を考えると、高レベルのブピバカイン埋込み剤での処置は、ブタの術後疼痛を減少させるのに有効であった。
【0209】
[00223] 本明細書中に記載の様々な態様に、本明細書中の教示の精神または範囲から逸脱することなく、様々な修飾および変更を行うことができるということは、当業者に明らかであろう。したがって、様々な態様は、本教示の範囲内の様々な態様の他の修飾および変更を包含するものである。
【技術分野】
【0001】
[0001] 本出願は、2009年4月8日出願の「Methods and Compositions for Treating Post-Operative Pain Comprising a Local Anesthetic」と称する米国特許出願第12/420,177号、および2008年4月18日出願の「Methods and Compositions for Treating Post-Operative Pain Comprising a Local Anesthetic」と称する仮出願第61/046,343号の出願日の恩典を主張し、これらは、本明細書に援用される。
【背景技術】
【0002】
[0002] 疼痛軽減は、外科手術を受けた患者を処置しているだれにとっても最も重要である。適当な疼痛軽減は、有意の生理学的および心理学的利益を患者に与える。有効な疼痛軽減とは、医療/外科手術/外来患者施設からの一層早い退院を伴う、より平穏で一層好ましい術後経過(例えば、気分、睡眠、生活の質等)を意味するのみならず、慢性疼痛症候群(例えば、線維筋痛症、筋肉痛等)の発症を減少させることもありうる。
【0003】
[0003] 疼痛は、生理学的機能を果たす。それは、しばしば、体内の損傷または疾患の存在のシグナルを与え、そしてしばしば、炎症(発赤、腫脹および/または灼熱)を伴う。術後疼痛の場合、それは、外科手術または他の処置、例えば、熱傷または非外科的外傷後の急性疼痛の管理などの結果であるかもしれない。術後疼痛管理の目的は、副作用を全くまたは最小限にしか引き起こさない投薬法で疼痛および不快感を減少させるまたは排除することである。
【0004】
[0004] 外科手術部位は、患者が苦しむことがありうる術後疼痛の程度対して、重大な作用を有する。一般に、胸郭および上腹部への手術は、下腹部への手術よりも有痛性であり、それは、四肢への末梢手術より有痛性である。しかしながら、体腔、大関節表面、脊椎または深部組織に関係した手術はいずれも、有痛性と考えるべきである。特に、胸部および上腹部への手術は、肺機能の広範囲の変化、腹筋緊張の増加、および関連した横隔膜機能低下を生じるかもしれない。その結果は、咳および分泌物の除去ができなくなることであろうが、それは、肺虚脱および肺炎をもたらすかもしれない。長期の疼痛は、身体活動を減少させ、そして静脈うっ血および増加した深部静脈血栓症リスク、およびその結果、肺塞栓症をもたらすことがありうる。更に、消化管および尿路の運動性への広範囲の作用が存在しうるが、それは、術後イレウス、悪心、嘔吐および尿停滞をもたらすかもしれない。これらの問題は、患者にとって不快であり、入院を長引かせるかもしれない。中程度〜重症の術後疼痛、外傷後疼痛および熱傷痛を経験している大部分の患者は、しばしば、外傷または外科手術後、少なくとも最初の3日間中に疼痛管理を必要とする。
【0005】
[0005] 術後疼痛を処置する一つの既知のクラスの医薬品は、オピオイドである。このクラスの化合物は、術後疼痛を制御する最も有効なタイプの薬剤の一つであると十分に認識されている。残念ながら、オピオイドは、全身投与されるので、患者を無能力にすること、呼吸器系を機能低下させること、便秘、および鎮静および多幸症などの精神活性作用を含めた関連の副作用が、有意の問題を引き起こし、それによって、回復および取り戻した可動性にハードルが設けられる。更に、これら副作用ゆえに、医師は、典型的に、オピオイドの投与を、術後最初の24時間以内に限定する。したがって、手術部位に直接的な限局疼痛管理を送達する非麻薬性薬剤を用いることが好ましいと考えられる。
【0006】
[0006] 医学専門職に知られている一つの医薬品は、ブピバカインであり、それは、浸潤、神経ブロック、硬膜外および髄腔内投与のための局所麻酔薬として広く認められている。一般に、ブピバカインは、1-ブチル-N-(2,6-ジメチルフェニル)ピペリジン-2-カルボキサミド(C18H28N2O)とも称され、次の構造:
【0007】
【化1】

【0008】
によって表すことができる。
【発明の概要】
【発明が解決しようとする課題】
【0009】
[0007] 術後疼痛についての独特の症状発現および比較的予測可能なリスクゆえに、術後疼痛および/または炎症を軽減するおよび/または処置する方法および組成物を含めた、術後疼痛および/または炎症に有効な処置への要求が存在する。
【課題を解決するための手段】
【0010】
[0008] 術後疼痛および/または炎症を有効に予防する、処置するかまたは減少させる、新しい組成物および方法を提供する。様々な態様において、単一薬剤デポーまたは多数薬剤デポー中で少なくとも4日間にわたる長時間作用性の鎮痛および抗炎症作用を有する組成物および方法を提供する。患者への身体的および心理的外傷を最小限して、鎮痛薬を包含する薬剤デポーの正確そして精密な埋め込みを容易に可能にすることができる、新しい組成物および方法を提供する。その薬剤デポーは、現在、標的組織部位(例えば、腹部、滑膜性関節、脊柱またはその付近等)に容易に送達され、そして疼痛を少なくとも4〜10日間軽減するおよび/または処置することができる。この方法において、最小限に侵襲性の手順での薬剤デポーの正確そして精密な埋め込みを達成することができる。
【0011】
[0009] 一つの例示的な態様において、術後疼痛または炎症の処置を必要としている患者の術後疼痛または炎症を減少させ、予防し、または処置するのに有用な埋め込み可能薬剤デポーを提供する。その埋め込み可能薬剤デポーは、治療的有効量の鎮痛薬またはその薬学的に許容しうる塩を含み、そしてデポーは、術後疼痛を減少させ、予防し、または処置するために皮膚下部位に埋め込み可能である。その薬剤デポーは、有効量の鎮痛薬またはその薬学的に許容しうる塩を少なくとも4日間にわたって放出することができる。上の態様における薬剤デポーは、(i)皮膚下部位にボーラス用量の鎮痛薬または局所麻酔薬またはその薬学的に許容しうる塩、そして(ii)少なくとも4日間にわたって徐放性用量の有効量の鎮痛薬または局所麻酔薬またはその薬学的に許容しうる塩、を放出することができることがありうる。その薬剤デポーは、ポリ(ラクチド-コ-グリコリド)、ポリラクチド、ポリグリコリド、ポリオルトエステル、D-ラクチド、D,L-ラクチド、ポリ(D,L-ラクチド)、L-ラクチド、ポリ(D,L-ラクチド-コ-カプロラクトン)、ポリ(D,L-ラクチド-コ-グリコリド-コ-カプロラクトン)、ポリカプロラクトンまたはこれらの組合せの一つまたは複数のものを含むポリマーを含んでよい。そのポリマーは、生物分解性であってよい。薬剤デポーは、局所麻酔薬を少なくとも4日間にわたって放出するリボン様ストリップまたはファイバーでありうる。薬剤デポーは、局所麻酔薬を少なくとも4日間にわたって放出するゲル製剤でもありうる。
【0012】
[0010] 別の例示的な態様において、埋め込み可能薬剤デポーを製造する方法を提供する。その方法は、生体適合性ポリマーおよび治療的有効量の局所麻酔薬またはその薬学的に許容しうる塩を組合せ、そしてこれらの組合せから埋め込み可能薬剤デポーを成形することを含む。
【0013】
[0011] また別の例示的な態様において、術後疼痛または炎症の処置を必要としている患者の術後疼痛または炎症を処置するかまたは予防する方法を提供する。その方法は、治療的有効量の鎮痛薬またはその薬学的に許容しうる塩を含む一つまたは複数の生物分解性薬剤デポーを、皮膚下の標的組織部位へ投与することを含み、ここにおいて、その薬剤デポーは、有効量の鎮痛薬またはその薬学的に許容しうる塩を少なくとも4日間にわたって放出する。その薬剤デポーは、(i)皮膚下部位にボーラス用量の鎮痛薬または局所麻酔薬またはその薬学的に許容しうる塩、そして(ii)少なくとも4日間にわたって徐放性用量の有効量の鎮痛薬または局所麻酔薬またはその薬学的に許容しうる塩、を放出することができることがありうる。その薬剤デポーは、ポリ(ラクチド-コ-グリコリド)、ポリラクチド、ポリグリコリド、ポリオルトエステル、D-ラクチド、D,L-ラクチド、ポリ(D,L-ラクチド)、L-ラクチド、ポリ(D,L-ラクチド-コ-カプロラクトン)、ポリ(D,L-ラクチド-コ-グリコリド-コ-カプロラクトン)、ポリカプロラクトンまたはこれらの組合せの一つまたは複数のものを含むポリマーを含んでよい。そのポリマーは、生物分解性であってよい。薬剤デポーは、局所麻酔薬を少なくとも4日間にわたって放出するリボン様ストリップでありうる。薬剤デポーは、局所麻酔薬を少なくとも4日間にわたって放出するゲル製剤でもありうる。
【0014】
[0012] また更に別の例示的な態様において、術後疼痛の処置を必要としている患者の術後疼痛を減少させる方法を提供する。その方法は、治療的有効量のブピバカインまたはその薬学的に許容しうる塩を含む一つまたは複数の生物分解性薬剤デポーを、外科手術前、中または後に、皮膚下の標的組織部位へ送達することを含み、ここにおいて、その薬剤デポーは、皮膚下部位に初期ボーラス用量の有効量のブピバカインまたはその薬学的に許容しうる塩を放出後、4〜30日間、4〜10日間、または5〜7日間にわたって徐放性用量の有効量のブピバカインまたはその薬学的に許容しうる塩を放出することができる。その薬剤デポーは、ポリマーを含んでよく、そしてそのポリマーは、ポリ(ラクチド-コ-グリコリド)、ポリラクチド、ポリグリコリド、ポリオルトエステル、D-ラクチド、D,L-ラクチド、ポリ(D,L-ラクチド)、L-ラクチド、ポリ(D,L-ラクチド-コ-カプロラクトン)、ポリ(D,L-ラクチド-コ-グリコリド-コ-カプロラクトン)、ポリカプロラクトンまたはこれらの組合せの一つまたは複数のものを含んでよい。ブピバカインは、塩の形および/または塩基の形であってよい。ポリマーは、生物分解性であってよい。薬剤デポーは、リボン様ストリップであってよい。薬剤デポーは、その薬剤デポー中に負荷されたブピバカインまたはその薬学的に許容しうる塩の全量に相対して、約40〜90%のブピバカインまたはその薬学的に許容しうる塩を、標的組織部位に薬剤デポーを投与後4〜10日間にわたって放出することができる。
【0015】
[0013] また別の例示的な態様において、術後疼痛の処置を必要としている患者の術後疼痛を減少させる、予防するかまたは処置するのに有用な埋め込み可能薬剤デポーを提供する。その埋め込み可能薬剤デポーは、治療的有効量のブピバカインまたはその薬学的に許容しうる塩およびポリマーを含む。そのデポーは、術後疼痛を減少させる、予防するかまたは処置するために皮膚下部位に埋め込み可能である。デポーは、(i)その薬剤デポー中に負荷されたブピバカインまたはその薬学的に許容しうる塩の全量に相対して、約2%〜約50%のブピバカインまたはその薬学的に許容しうる塩を、最初の48時間まで、最初の24時間まで、または最初の約24〜48時間にわたって放出し、そして(ii)その薬剤デポー中に負荷されたブピバカインまたはその薬学的に許容しうる塩の全量に相対して、約50%〜約98%のブピバカインまたはその薬学的に許容しうる塩を、引き続く3〜30日間、2〜10日間、または3〜10日間までにわたって放出することができる。そのポリマーは、ポリ(ラクチド-コ-グリコリド)、ポリラクチド、ポリグリコリド、ポリオルトエステル、D-ラクチド、D,L-ラクチド、ポリ(D,L-ラクチド)、L-ラクチド、ポリ(D,L-ラクチド-コ-カプロラクトン)、ポリ(D,L-ラクチド-コ-グリコリド-コ-カプロラクトン)、ポリカプロラクトンまたはこれらの組合せの一つまたは複数のものを含む。ポリマーは、生物分解性であってよい。様々な態様において、最初の期間が24時間まで、または約24〜48時間である場合、デポーは、約2%〜約40%のブピバカインまたはその薬学的に許容しうる塩を放出することができる。
【0016】
[0014] 別の例示的な態様において、埋め込み可能薬剤デポーを提供する。その埋め込み可能薬剤デポーは、(i)治療的有効量のブピバカインまたはその薬学的に許容しうる塩;および(ii)ポリマー、を含む。そのデポーは、皮膚下部位に初期ボーラス用量のブピバカインまたはその薬学的に許容しうる塩を放出することができ、そしてデポーは、引き続き4〜30日間、または4〜10日間にわたって徐放性用量の有効量のブピバカインまたはその薬学的に許容しうる塩を放出することができる。薬剤デポーは、その薬剤デポー中に負荷されたブピバカインの全量に相対して、約40%〜約70%のブピバカインまたはその薬学的に許容しうる塩を、薬剤デポーの投与後4〜30日間、または4〜10日間の徐放性期間にわたって放出することができる。そのポリマーは、ポリ(ラクチド-コ-グリコリド)、ポリラクチド、ポリグリコリド、ポリオルトエステル、D-ラクチド、D,L-ラクチド、ポリ(D,L-ラクチド)、L-ラクチド、ポリ(D,L-ラクチド-コ-カプロラクトン)、ポリ(D,L-ラクチド-コ-グリコリド-コ-カプロラクトン)、ポリカプロラクトンまたはこれらの組合せの一つまたは複数のものを含む。
【0017】
[0015] 様々な態様において、鎮痛薬は、局所麻酔薬またはその薬学的に許容しうる塩であってよく、そして局所麻酔薬は、ブピバカイン、ロピバカイン、メピバカイン、エチドカイン(etidocaine)、レボブピバカイン、トリメカイン(trimecaine)、カルチカイン(carticaine)またはアルチカイン(articaine)の少なくとも一つであってよい。ブピバカインは、塩の形および/または塩基の形であってよい。局所麻酔薬またはその薬学的に許容しうる塩は、ゲル中に懸濁されたミクロパーティクル、ミクロスフェア、マイクロカプセルおよび/またはミクロファイバーを含む複数のデポー中に被包されていてよい。
【0018】
[0016] 様々な態様において、薬剤デポーは、ポリマーと、更には賦形剤を含んでよい。具体的には、薬剤デポーは、約30〜約90重量パーセント(wt.%)の量の局所麻酔薬;約10〜約80 wt.%のポリマー;および約0.5〜約20 wt.%の賦形剤を含んでよい。例えば、薬剤デポーは、埋め込み可能薬剤デポーの約30〜約90 wt.%の量の局所麻酔薬;約10〜約80 wt.%のPLGA;および約0.5〜約20 wt.%のmPEGを包含することができる。
【0019】
[0017] 様々な態様における薬剤デポーは、有効量の鎮痛薬またはその薬学的に許容しうる塩を少なくとも4日間にわたって放出することができる。例えば、薬剤デポーは、その薬剤デポー中に負荷された鎮痛薬または局所麻酔薬の全量に相対して、約40〜約70%の鎮痛薬または局所麻酔薬またはその薬学的に許容しうる塩を、標的組織部位への薬剤デポーの投与後4〜10日間にわたって放出することができる。鎮痛薬または局所麻酔薬は、50〜800 mg/日の量で、この4〜10日の間中放出される。薬剤デポーは、しかしながら、薬剤デポーのその部位への投与後、はるかに長期間、例えば、少なくとも7日間にわたって、および7〜30日の範囲内で、有効量の鎮痛薬または局所麻酔薬またはその薬学的に許容しうる塩を放出することができる。
【0020】
[0018] 様々な態様における一つまたは複数のポリマーは、薬剤デポーの全wt.%の約10%〜約70%、または薬剤デポーの全wt.%の約15%〜約55%を構成してよい。その一つまたは複数のポリマーは、薬剤デポーのその部位への埋め込み後30日またはそれ未満で分解することができるかまたは分解する。
【0021】
[0019] 様々な態様における薬剤デポーは、ラジオグラフィー画像化を助けるように適合されたラジオグラフィー用マーカーを含んでよい。そのラジオグラフィー用マーカーは、バリウム、リン酸カルシウムおよび/または金属ビーズを含んでよい。
【0022】
[0020] 様々な態様における薬剤デポーは、少なくとも一つの追加の抗炎症薬または鎮痛薬、少なくとも一つのアナボリック増殖因子または抗異化増殖因子、またはこれらの組合せを含んでよい。
【0023】
[0021] 薬剤デポーは、術後疼痛を減少させるために、0.5〜1,000 mg/日のブピバカインまたはその薬学的に許容しうる塩を含めた鎮痛薬または局所麻酔薬を放出することができるかまたは放出する。
【0024】
[0022] 様々な態様において、ブピバカインは、塩または塩基の形であってよい。更に、ブピバカインまたはその薬学的に許容しうる塩は、ゲル中に懸濁されたミクロパーティクル、ミクロスフェア、マイクロカプセルおよび/またはミクロファイバーを含む複数のデポー中に被包されていてよい。その薬剤デポーは、リボン様ストリップまたはゲル製剤であってよい。
【0025】
[0023] 標的組織部位は、少なくとも一つの筋肉、靱帯、腱、軟骨、椎間板、脊髄神経根付近の椎間孔空間(spinal foraminal space)、椎間または滑膜性関節、または脊椎管を含む。
【0026】
[0024] 疼痛は、ヘルニア修復、整形外科手術または脊椎手術またはこれらの組合せに関連していてよい。外科手術は、関節鏡視下手術、腫瘍の切除(a excision of a mass)、ヘルニア修復、脊椎固定、胸部、頸部または腰部の外科手術、骨盤手術またはこれらの組合せであってよい。
【0027】
[0025] 本発明の一つまたは複数の薬剤デポーは、関節リウマチ、変形性関節症、坐骨神経痛、手根管症候群、腰痛、下肢痛、上肢痛、癌、組織痛、および頸部、胸部および/または腰部の椎骨または椎間円板、回旋腱板、関節(articular joint)、TMJ、腱、靱帯、筋肉または類似のものの傷害または修復に関連した疼痛を含めた、慢性状態の疼痛および/または炎症の状態を処置するのに用いることができる。
【0028】
[0026] 様々な態様の追加の特徴および利点は、一部分は、以下の説明に示されるであろうし、そして一部分は、その説明から明らかであろうし、または様々な態様の実施によって習得することができる。様々な態様の目的および他の利点は、本明細書および添付の請求の範囲に具体的に指摘された要素および組合せによって理解されそして達成されるであろう。
【図面の簡単な説明】
【0029】
[0027] 部分的には、それら態様の他の側面、特徴、恩典および利点は、以下の説明、請求の範囲および添付の図面に関して明らかであろう。
【図1】[0028] 図1は、外科手術が行われる部位でありうる患者の多数の一般的な場所、および鎮痛薬または局所麻酔薬を含有する薬剤デポーを投与することができる場所を示す。
【図2】[0029] 図2は、鎮痛薬または局所麻酔薬を含有する薬剤デポーを投与することができる部位および脊椎の背側略図を示す。
【図3】[0030] 図3は、実施例1によるブピバカイン製剤の平均累積放出百分率のグラフによる図示である。
【図4】[0031] 図4は、実施例1によるブピバカイン製剤についてのミリグラムでの平均累積1日放出のグラフによる図示である。
【図5】[0032] 図5は、実施例1によるブピバカイン製剤のin vivo試験による効力データのグラフによる図示である。
【図6】[0033] 図6は、実施例1によるブピバカイン製剤のin vivo試験による効力データのグラフによる図示である。
【図7】[0034] 図7は、実施例2に記載のブピバカイン滅菌済みPOP埋込み剤のugでの平均累積放出研究のグラフによる図示である(POPは、術後疼痛を意味する)。
【図8】[0035] 図8は、実施例2に記載の滅菌済みブピバカインPOP埋込み剤の平均累積放出百分率の研究のグラフによる図示である。
【図9】[0036] 図9は、実施例2によるブピバカイン埋込み剤についての術後日数によるグラムあたりの温熱性足引っ込め閾値のグラフによる図示である。
【図10】[0037] 図10は、実施例4に記載の研究によるブピバカイン製剤についての平均累積in vitro放出プロフィールのグラフによる図示である。
【図11】[0038] 図11は、実施例4に記載の研究によるブピバカイン製剤についての平均累積in vitro放出プロフィールのグラフによる図示である。
【図12】[0039] 図12は、実施例4に記載の研究による別のブピバカイン製剤についての平均累積in vitro放出プロフィールのグラフによる図示である。
【図13】[0040] 図13は、実施例5に記載の研究によるブピバカイン埋込み剤についての平均累積in vitro放出プロフィールのグラフによる図示である。
【図14】[0041] 図14は、実施例5に記載の研究によるブピバカイン埋込み剤についての平均累積in vitro放出プロフィールのグラフによる図示である。
【図15A】[0042] 図15Aは、実施例6に記載の研究による三つのブピバカインストリップについての累積放出百分率のグラフによる図示である。
【図15B】[0043] 図15Bは、図15Aに示されるブピバカインストリップについての平均累積放出百分率のグラフによる図示である。
【図16A】[0044] 図16Aは、実施例6に記載の三つのブピバカインストリップについてのugでの累積in vitro放出のグラフによる図示である。
【図16B】[0045] 図16Bは、図16Bに示されるブピバカインストリップについてのugでの平均累積in vitro放出のグラフによる図示である。
【図17】[0046] 図17は、外科的切開術後に埋め込まれたブピバカインデポーの痛覚スコアのグラフによる図示である。
【0030】
[0047] これら図面が、均等縮尺で描かれているのではないということは理解されるはずである。更に、図中の対象間の関係は、均等縮尺ではないことがありうるし、そして実際に、サイズに関して逆関係を有することがありうる。図面は、示されている各々の対象の構造を理解させそして明確化するためのものであり、したがって、いくつかの特徴は、ある構造の具体的な特徴を示すために誇張されていることがありうる。
【発明を実施するための形態】
【0031】
[0048] 本明細書および添付の請求の範囲の目的について、特に断らない限り、本明細書および請求の範囲において用いられる成分の量、材料の百分率または比率、反応条件および他の数値を表している全ての数字は、いずれの場合も、「約」という用語で修飾されると理解されるべきである。したがって、そうではないと示されない限り、以下の明細書および添付の請求の範囲に示される数値パラメーターは、本発明によって得られるように求められる所望の性質に依存して異なることがありうる近似値である。きわめて少なくとも、そして請求の範囲の範囲への均等の原則の適用を限定する試みとしてではなく、各々の数値パラメーターは、少なくとも、報告されている有効数字の数に照らして、および普通の丸め法を適用することによって解釈されるべきである。
【0032】
[0049] 本発明の広い範囲を示している数値範囲およびパラメーターが、近似値であるということにもかかわらず、具体的な実施例に示されている数値は、できるだけ精密に報告されている。しかしながら、いずれの数値も、本質的には、それらのそれぞれの試験測定値に見出される標準偏差によって必然的に生じる一定の誤差を含有する。更に、本明細書中に開示の範囲は全て、そこに包含されるいずれかおよび全ての部分範囲を包含すると理解されるはずである。例えば、「1〜10」の範囲には、最小値の1および最大値の10の間の(それらを含めた)いずれかおよび全ての部分範囲、すなわち、1に等しいまたはそれより大の最小値および10に等しいまたはそれ未満の最大値を有するいずれかおよび全ての部分範囲、例えば、5.5〜10が含まれる。
【0033】
[0050] 本明細書および請求の範囲に用いられる単数形(a、anおよびthe)は、はっきりとそして明確に一つの意味に限定されない限り、複数の意味を包含するということが留意される。したがって、例えば、「薬剤デポー」の意味には、一つ、二つ、三つまたはそれを超える薬剤デポーが含まれる。
【0034】
[0051] ここで、本発明の特定の態様に詳細に言及するが、それらの例は、添付の図面に詳しく示されている。本発明を、詳しく示されている態様と一緒に記載するが、それらが、本発明をそれらの態様に限定するものではないということは理解されるであろう。反対に、本発明は、請求の範囲によって定義される発明の範囲内に包含されうる全ての変更、修飾および均等物を包含するものである。
【0035】
[0052] 下の見出しは、いずれにせよ、本開示を限定するためのものではなく;いずれか一つの見出し下の態様は、いずれか他の見出し下の態様と一緒に用いることができる。
【0036】
[0053] 術後疼痛または炎症を有効に予防する、処置するかまたは減少させる新しい組成物および方法を提供する。様々な態様において、単一薬剤デポーまたは複数の薬剤デポー中で少なくとも4日間にわたる長時間作用性の鎮痛および抗炎症作用を有する組成物および方法を提供する。新しい鎮痛性組成物および方法を提供するが、それは、患者への身体的および心理的外傷を最小限にして、ブピバカインなどの鎮痛薬を包含する薬剤デポーの正確そして精密な埋め込みを容易に可能にすることができる。その薬剤デポーは、現在、標的組織部位(例えば、腹部、滑膜性関節、脊柱またはその付近等)に容易に送達され、そして疼痛を少なくとも4〜10日間軽減するおよび/または処置することができる。この方法において、最小限に侵襲性の手順並びに開放手順での薬剤デポーの正確そして精密な埋め込みを達成することができる。
【0037】
ブピバカイン
[0054] ブピバカインまたは別の局所麻酔薬は、薬剤デポー中に含有されてよい。薬剤デポーは、所望の部位(例えば、滑膜性関節、椎間腔、脊椎管、腹部、患者の組織等)における埋め込みおよび保持を容易にする物理的構造を含む。薬剤デポーは、更に、薬剤を含む。本明細書中で用いられる「薬剤」という用語は、一般に、患者の生理を変化させるいずれかの物質を意味するものである。「薬剤」という用語は、本明細書中において、「治療薬」、「治療的有効量」および「活性な医薬成分(active pharmaceutical ingredient)」または「API」と同じ意味に用いることかできる。「薬剤」製剤には、二つ以上の治療薬が含まれてよく、ここにおいて、治療薬の代表的な組合せには、二つまたはそれを超える薬剤の組合せが含まれるということは理解されるであろう。薬剤デポーは、部位への送達のための治療薬の濃度勾配を与える。様々な態様において、薬剤デポーは、埋込み剤部位から約1 cm〜約10までの距離で治療薬の最適薬剤濃度勾配を与える。
【0038】
[0055] 「治療的有効量」または「有効量」は、投与時に、薬剤が、例えば、炎症の抑制、疼痛の減少または軽減、状態の改善等のような生物学的活性の変更をもたらすようなことである。様々な態様において、ブピバカインの治療的有効量は、約0.5 mg/日〜1,000 mg/日を含む。いくつかの態様において、治療的有効量のブピバカインは、1日につき約0.1 mg〜800 mgのブピバカインを含む。いくつかの態様において、治療的有効量のブピバカインは、1日につき約50 mg〜800 mgのブピバカイン、または1日につき約200 mg〜800 mgのブピバカインを含む。いくつかの態様において、治療的有効量のブピバカインは、1日につき約0.5 mg、100 mg、200 mg、300 mg、400 mg、500 mg、600 mg、700 mg、800 mg、900 mgまたは1,000 mgおよびその間の全ての部分範囲のブピバカインを含む。いくつかの態様において、治療的有効量のブピバカインは、1日につき0.5 mg、0.6 mg、0.7 mg、0.8 mg、0.9 mg、1 mg、1.1 mg、1.2 mg、1.3 mg、1.4 mg、1.5 mg、1.6 mg、1.7 mg、1.8 mg、1.9 mg、2 mg、3 mg、4 mg、5 mg、6 mg、7 mg、8 mg、9 mg、10 mg、11 mg、12 mg、13 mg、14 mg、15 mg、16 mg、17 mg、18 mg、19 mg、20 mg、21 mg、22 mg、23 mg、24 mg、25 mg、30 mg、35 mgまたは40 mgのブピバカインを含む。一つの態様において、ヒトへの投薬量は、1日につき400 mg〜600 mgのブピバカインである。患者に投与される投薬量が、投与される薬剤の薬物動態学的性質、投与経路、患者の状態および特徴(性別、年齢、体重、健康状態、体格等)、症状の程度、同時処置、処置頻度、および所望の作用を含めた様々な因子に依存して、単一デポーまたは複数デポーとして存在しうるということは理解されるであろう。例えば、オピオイド(例えば、モルフィン)との同時処置が存在する場合、より少ない1日用量のブピバカインが要求されることがありうるし、或いは、術後疼痛を制御するためにオピオイド(例えば、モルフィン)の投薬量を減少させるまたは排除するにつれて、患者は、より多い用量のブピバカインを必要とすることがありうる。
【0039】
[0056] 様々な態様において、治療的有効量のブピバカインを与えて、術後疼痛を抑制する、処置するおよび/または予防する。一般に、ブピバカインの化学名は、1-ブチル-N-(2,6-ジメチルフェニル)ピペリジン-2-カルボキサミドである。ブピバカインは、288.43の分子量を有し、そして次の一般的な構造を示す。
【0040】
【化2】

【0041】
[0057] ブピバカインには、(+/-)-1-ブチル-N-(2,6-ジメチルフェニル)ピペリジン-2-カルボキサミドまたはその薬学的に許容しうる無毒性エステルまたは塩が含まれるが、これらに限定されるわけではない。ブピバカインには、ブピバカインのラセミ混合物((+)-Rおよび(-)-S鏡像異性体)またはデキストロ(dextro)異性体およびレボ(levo)異性体各々が個々に含まれる。ブピバカインには、遊離酸、更には、前述のいずれか一つのいずれか他の薬学的に許容しうる塩が含まれる。ブピバカインは、更に、長時間作用性活性のためにペグ化されてもよい。
【0042】
[0058] ブピバカインの薬学的に許容しうるエステルには、1〜約12個の炭素原子を有する分岐鎖または直鎖の炭化水素から誘導されるアルキルエステルが含まれるが、これらに限定されるわけではない。このようなエステルの例は、メチルエステル、エチルエステル、プロピルエステル、イソプロピルエステル、ブチルエステル、t-ブチルエステル、イソアミルエステル、ペンチルエステル、イソペンチルエステル、ヘキシルエステル、オクチルエステル、ノニルエステル、イソデシルエステル、6-メチルデシルエステルまたはドデシルエステルである。
【0043】
[0059] ブピバカインの薬学的に許容しうる塩には、無機塩基かまたは有機塩基から誘導される塩が含まれる。無機塩基から誘導される塩には、ナトリウム塩、カリウム塩、リチウム塩、アンモニウム塩、カルシウム塩、マグネシウム塩、第一鉄塩、亜鉛塩、銅塩、マンガン塩、アルミニウム塩、第二鉄塩、マンガン酸塩等が含まれるが、これらに限定されるわけではない。薬学的に許容しうる有機無毒性塩基から誘導される塩には、第一級、第二級または第三級アミン、天然に存在する置換アミンを含めた置換アミンまたは環状アミン、または塩基性イオン交換樹脂であって、イソプロピルアミン、トリメチルアミン、ジエチルアミン、トリエチルアミン、トリプロピルアミン、エタノールアミン、2-ジメチルアミノエタノール、2-ジエチルアミノエタノール、トロメタミン、ジシクロヘキシルアミン、リシン、アルギニン、ヒスチジン、カフェイン、プロカイン、ヒドラバミン(hydrabamine)、コリン、ベタイン、エチレンジアミン、グルコサミン、メチルグルカミン、テオブロミン、プリン、ピペラジン、ピペリジン、N-エチルピペリジン、ポリアミンの樹脂などのもの等の塩が含まれるが、これらに限定されるわけではない。
【0044】
[0060] ブピバカインに加えて、薬剤デポーは、一つまたは複数の追加の治療薬を含んでよい。治療薬の例には、可溶性腫瘍壊死因子α受容体、いずれかのペグ化可溶性腫瘍壊死因子α受容体、モノクローナル抗体またはポリクローナル抗体または抗体フラグメントまたはこれらの組合せが含まれるがこれらに限定されるわけではないTNF-αおよびIL-1などの前炎症性サイトカインの直接作用性および局所作用性モジュレーターであるものが含まれる。適する治療薬の例には、受容体アンタゴニスト;標的分子への結合について受容体と拮抗する分子;アンチセンスポリヌクレオチド;および標的タンパク質をコードしているDNAの転写阻害剤が含まれる。適する例には、Adalimumab、Infliximab、Etanercept、Pegsunercept(PEG sTNF-R1)、sTNF-R1、CDP-870、CDP-571、CNI-1493、RDP58、ISIS 104838、1→3-β-D-グルカン、Lenercept、PEG-sTNFRII Fc Mutein、D2E7、Afelimomabおよびこれらの組合せが含まれるが、これらに限定されるわけではない。他の態様において、治療薬には、メタロプロテアーゼ阻害剤;グルタメートアンタゴニスト;グリア細胞由来神経栄養因子(glial cell-derived neurotropic factors)(GDNF);B2受容体アンタゴニスト;カプサイシンおよびシバミド(civamide)などのサブスタンスP受容体(NK1)アンタゴニスト;下流調節要素アンタゴニストモジュレーター(downstream regulatory element antagonistic modulator)(DREAM);iNOS;テトロドトキシン(TTX)抵抗性Na+チャンネル受容体サブタイプPN3およびSNS2の阻害剤;IL-1、IL-6およびIL-8などのインターロイキンの阻害剤;および抗炎症性サイトカイン、TNF結合タンパク質、オネルセプト(onercept)(r-hTBP-1)、阻害剤、エンハンサー、増強剤(potentiators)または中和剤をコードしている組換えアデノ関連ウイルス(rAAV)ベクター、抗体であって、天然に存在するかまたは合成の二本鎖、一本鎖またはそのフラグメントが含まれるがこれらに限定されるわけではないものが含まれる。例えば、適する治療薬には、NanobodiesTM(Ablynx, Ghent Belgium)と称される一本鎖抗体に基づく分子であって、天然に存在する単一ドメイン抗体の最小の機能性フラグメントとして定義されるものが含まれる。或いは、治療薬には、キナーゼに作用する物質および/または細胞シグナリングマイトジェン活性化プロテインキナーゼ(MAPK)、p38MAPK、Srcまたはプロテインチロシンキナーゼ(PTK)を阻害する物質が含まれる。治療薬には、キナーゼ阻害剤、例えば、Gleevec、Herceptin、Iressa、イマチニブ(STI571)、ヘルビマイシンA(herbimycin A)、チルホスチン47(tyrphostin 47)、エルブスタチン(erbstatin)、ゲニステイン、スタウロスポリン(staurosporine)、PD98059、SB203580、CNI-1493、VX-50/702(Vertex/Kissei)、SB203580、BIRB796(Boehringer Ingelheim)、Glaxo P38 MAP Kinase阻害剤、RWJ67657(J&J)、UO126、Gd、SCIO-469(Scios)、RO3201195(Roche)、Semipimod(Cytokine PharmaSciences)またはその誘導体などが含まれる。
【0045】
[0061] 治療薬は、様々な態様において、炎症カスケードにおけるTNF-αまたは他のタンパク質の転写または翻訳をブロックする。適する治療薬には、インテグリンアンタゴニスト、α4β7インテグリンアンタゴニスト、細胞接着阻害剤、インターフェロンγアンタゴニスト、CTLA4-Igアゴニスト/アンタゴニスト(BMS-188667)、CD40リガンドアンタゴニスト、ヒト化抗IL-6 mAb(MRA, Tocilizumab, Chugai)、HMGB-1 mAb(Critical Therapeutics Inc.)、抗IL2R抗体(ダクリズマブ(daclizumab)、バシリシマブ(basilicimab))、ABX(抗IL-8抗体)、組換えヒトIL-10またはHuMax IL-15(抗IL15抗体)が含まれるが、これらに限定されるわけではない。
【0046】
[0062] 他の適する治療薬には、組換え非グリコシル化形のヒトインターロイキン1受容体アンタゴニスト(IL-1Ra)であるKineret(登録商標)(アナキンラ(anakinra));またはIL-1の作用をブロックするモノクローナル抗体であるAMG108のような、IL-1阻害剤が含まれる。治療薬には、更に、グルタメートおよびアスパルテートなどの興奮性アミノ酸;NMDA受容体、AMPA受容体および/またはカイネート受容体へのグルタメート結合のアンタゴニストまたは阻害剤が含まれる。例えば、インターロイキン1受容体アンタゴニスト、サリドマイド(TNF-α放出阻害剤)、サリドマイド類似体(マクロファージによってTNF-α生産を減少させるもの)、骨形成タンパク質(BMP)2型およびBMP-4(TNF-αアクチベーターであるカスパーゼ8の阻害剤)、キナプリル(quinapril)(TNF-αをアップレギュレーションするアンギオテンシンIIの阻害剤)、IL-11などのインターフェロン(TNF-α受容体発現をモジュレーションするもの)、およびオーリントリカルボン酸(TNF-αを阻害するもの)も、炎症を減少させる治療薬として有用でありうる。所望の場合、上のペグ化形を用いてよいと考えられる。他の治療薬の例には、グルココルチコイド、クロニジンなどのNFκB阻害剤;ジチオカルバメートなどの抗酸化剤;および他の化合物、例えば、スルファサラジンなどが含まれる。
【0047】
[0063] 使用に適する治療薬の具体的な例には、抗炎症薬、鎮痛薬または骨誘導性(osteoinductive)増殖因子、またはこれらの組合せが含まれるが、これらに限定されるわけではない。抗炎症薬には、サリシレート、ジフルニサル、スルファサラジン、インドメタシン、イブプロフェン、ナプロキセン、トルメチン、ジクロフェナク、ケトプロフェン、フェナメート(fenamates)(メフェナム酸、メクロフェナム酸)、エノール酸(ピロキシカム、メロキシカム(meloxicam))、ナブメトン(nabumetone)、セレコキシブ(celecoxib)、エトドラク(etodolac)、ニメスリド(nimesulide)、アパゾン(apazone)、金、スリンダクまたはテポキサリン(tepoxalin);ジチオカルバメートなどの抗酸化剤;およびスルファサラジン[2-ヒドロキシ-5-[-4-[C2-ピリジニルアミノ)スルホニル]アゾ]安息香酸]などの他の化合物;フルオシノロン、コルチゾール、コルチゾン、ヒドロコルチゾン、フルドロコルチゾン(fludrocortisone)、プレドニゾン、プレドニゾロン、メチルプレドニゾロン、トリアムシノロン、ベタメタゾン、デキサメタゾン、ベクロメタゾン、フルチカゾン(fluticasone)などのステロイド類、またはこれらの組合せが含まれるが、これらに限定されるわけではない。
【0048】
[0064] 適するアナボリック増殖因子または抗異化増殖因子には、骨形成タンパク質、成長分化因子、LIM鉱化作用タンパク質、CDMPまたは前駆細胞、またはこれらの組合せが含まれるが、これらに限定されるわけではない。
【0049】
[0065] 追加の鎮痛薬も、デポー中に包含されてよい。適する鎮痛薬には、アセトアミノフェン、リドカイン、オピオイド鎮痛薬であって、ブプレノルフィン、ブトルファノール、デキストロモラミド(dextromoramide)、デゾシン(dezocine)、デキストロプロポキシフェン(dextropropoxyphene)、ジアモルフィン(diamorphine)、フェンタニール、アルフェンタニル(alfentanil)、スフェンタニル(sufentanil)、ヒドロコドン、ヒドロモルホン、ケトベミドン(ketobemidone)、レボメタジル(levomethadyl)、メピリジン(mepiridine)、メタドン、モルフィン、ナルブフィン(nalbuphine)、オピウム、オキシコドン、パパベレタム、ペンタゾシン、ペチジン、フェノペリジン(phenoperidine)、ピリトラミド(piritramide)、デキストロプロポキシフェン、レミフェンタニル、チリジン(tilidine)、トラマドール、コデイン、ジヒドロコデイン、メプタジノール、デゾシン(dezocine)、エプタゾシン(eptazocine)、フルピルチン(flupirtine)などのもの、またはこれらの組合せが含まれるが、これらに限定されるわけではない。
【0050】
[0066] 適する鎮痛薬には、更に、鎮痛性を有する物質、例えば、アミトリプチリン、カルバマゼピン、ガバペンチン(gabapentin)、プレガバリン(pregabalin)、クロニジン、またはこれらの組合せなどが含まれる。
【0051】
[0067] デポーは、筋弛緩薬を含有してよい。代表的な筋弛緩薬には、例としてそして限定としてではなく、塩化アルクロニウム、アトラクリウムベシレート(atracurium bescylate)、バクロフェン、カルボロニウム(carbolonium)、カリソプロドール、カルバミン酸クロルフェネシン、クロルゾキサゾン、シクロベンザプリン(cyclobenzaprine)、ダントロレン、臭化デカメトニウム(decamethonium bromide)、ファザジニウム(fazadinium)、ガラミントリエチオダイド、ヘキサフルオレニウム、メラドラジン(meladrazine)、メフェネシン(mephensin)、メタキサロン(metaxalone)、メトカルバモール、ヨウ化メトクリン(metocurine iodide)、パンクロニウム、プリジノールメシレート、スチラメート、スキサメトニウム、スキセトニウム(suxethonium)、チオコルヒコシド(thiocolchicoside)、チザニジン、トルペリゾン、ツボクラリン(tubocuarine)、ベクロニウムまたはこれらの組合せが含まれる。
【0052】
[0068] デポーは、一つまたは複数の治療薬を含み、そして更に、他の非活性成分を含有してよい。これら非活性成分は、一つまたは複数の治療薬の担持、安定化およびその放出の制御を含めた多機能目的を有することができる。例えば、徐放性過程は、溶液拡散機構によってもよいし、またはそれは、侵食持続過程(erosion-sustained process)によって支配されてもよい。典型的に、デポーは、生物分解性であってもよい生体適合性材料を含んで成る固形または半固形製剤であろう。「固形」という用語は、非ゲル様材料を意味するものであるが、「半固形」は、ある程度の流動性を有することで、デポーを折り曲げそして周囲組織必要条件に適合させるゲル様材料を意味するものである。「ゲル」という用語は、外科手術部位へのその適用のいずれの点でも、軟質そして変形性である材料を意味するものである。
【0053】
[0069] 様々な態様において、デポー材料は、計画された薬剤送達期間と同様の時間(生物分解性成分について)またはそれより長い時間(非生物分解性成分について)、組織部位内で耐久性であろう。例えば、デポー材料は、体温に近いかまたはそれより高いが、治療薬の脱組成物(decomposition)または分解(degradation)温度より低い融点またはガラス転移温度を有してよい。しかしながら、デポー材料の所定の侵食を用いて、負荷された一つまたは複数の治療薬の遅い放出をもたらすこともできる。
【0054】
[0070] 様々な態様において、薬剤デポーは、in vivo埋め込み後、一定の引金点(例えば、温度、pH等)に達した時に、ブピバカインなどの局所麻酔薬を放出するように設計することができる。例えば、薬剤デポーは、具体的には、薬剤が解熱性を有する場合、例えば、体温が102°Fより高くなると、より多くの薬剤を放出しうるポリマーを含んでよい。様々な態様において、埋め込み部位に依存して、薬剤デポーは、一定のpHに達すると、多かれ少なかれ薬剤を放出することができる。例えば、薬剤デポーは、一定のpHを有する体液(例えば、約7.35〜約7.70のpHを有するCSF、約7.29〜約7.45のpHを有する滑液;約4.6〜約8.0のpHを有する尿、約7.2〜約7.4のpHを有する胸膜液、約7.35〜約7.45のpHを有する血液等)が薬剤デポーに接触すると、薬剤を放出するように設計することができる。
【0055】
[0071] 様々な態様において、デポーは、ブピバカインなどの局所麻酔薬および/または他の治療薬が、デポーの約5〜99 wt.%、またはデポーの30〜95 wt.%、デポーの30〜90 wt.%、またはデポーの50〜75 wt.%、またはデポーの55〜65 wt.%を構成するような高い薬剤負荷量を有してよい。様々な態様において、ブピバカインおよび/または他の治療薬の量は、デポー中に、デポー重量で約40%〜約80%の範囲内(40%、41%、42%、43%、44%、45%、46%、47%、48%、49%、50%、51%、52%、53%、54%、55%、56%、57%、58%、59%、60%、61%、62%、63%、64%、65%、66%、67%、68%、69%、70%、71%、72%、73%、74%、75%、76%、77%、78%、79%、80%およびこれらのいずれか二点間のいずれかの範囲、例えば、40.1〜50%、50〜60%および60〜70%等も含めた範囲)で存在する。
【0056】
[0072] 様々な態様において、薬剤デポーは、1日につき0.1 mg、0.2 mg、0.3 mg、0.4 mg、0.5 mg、0.6 mg、0.7 mg、0.8 mg、0.9 mg、1 mg、1.1 mg、1.2 mg、1.3 mg、1.4 mg、1.5 mg、1.6 mg、1.7 mg、1.8 mg、1.9 mg、2 mg、3 mg、4 mg、5 mg、6 mg、7 mg、8 mg、9 mg、10 mg、11 mg、12 mg、13 mg、14 mg、15 mg、16 mg、17 mg、18 mg、19 mg、20 mg、21 mg、22 mg、23 mg、24 mg、25 mg、30 mg、35 mgまたは40 mg、45 mg、50 mg、55 mg、60 mg、65 mg、70 mg、75 mg、75 mg、80 mg、85 mg、90 mg、95 mg、100 mg、105 mg、110 mg、115 mg、120 mg、125 mg、130 mg、135 mg、140 mg、145 mg、150 mg、155 mg、160 mg、165 mg、170 mg、175 mg、180 mg、185 mg、190 mg、195 mg、200 mg、300 mg、400 mg、500 mg、600 mg、700 mg、800 mg、900 mgまたは1,000 mgおよびその間の全ての部分範囲のブピバカインを、合計で少なくとも4日間、少なくとも7日間、少なくとも8日間、4〜30日間、4〜10日間、4〜8日間、5〜7日間、または7〜10日間放出することができる。様々な態様において、薬剤デポーは、0.5 mg/時〜20 mg/時のブピバカインを、合計で少なくとも4日間、4〜10日間、5〜7日間、または7〜10日間放出して、術後疼痛を減少させ、処置し、または予防することができる。様々な態様において、薬剤デポーは、標的組織部位に薬剤デポーを投与後、5%、10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%、99%または100%のブピバカインを、3〜10日間、4〜10日間または5〜7日間にわたって放出する。薬剤デポーは、所定の時間単位にわたって放出される活性成分の百分率を意味する「放出速度プロフィール」、例えば、mg/時、mg/日、10%/10日間等を有することができる。当業者は、放出速度プロフィールが、必ずしも直線的である必要はないかもしれないと承知している。限定的ではない例として、薬剤デポーは、ブピバカインを一定時間にわたって放出するストリップまたはリボン様ストリップまたはファイバーであってよい。
【0057】
[0073] 様々な態様において、薬剤デポーは、約40重量%〜80重量%のブピバカイン、15重量%〜55重量%のポリマー、および5重量%〜15重量%の賦形剤を含む。mPEGは、得られた製剤に展性を与えるので、ポリマーのための賦形剤または可塑剤として用いることができる。PEG 300も、賦形剤として用いることができる。更に、PEG 300およびNMPの組合せは、賦形剤として用いることができる。
【0058】
[0074] 生物分解性ポリマーに加えて、ブピバカインと一緒に製剤化することができる代表的な賦形剤には、MgO(例えば、1 wt.%)、5050 DLG 6E、5050 DLG 1A、mPEG、TBO-Ac、mPEG、Span-65、Span-85、プルロニク(pluronic)F127、TBO-Ac、ソルビタル(sorbital)、シクロデキストリン、マルトデキストリンおよびこれらの組合せが含まれるが、これらに限定されるわけではない。いくつかの態様において、一つまたは複数の賦形剤は、製剤の約0.001 wt.%〜約50 wt.%を構成してよい。いくつかの態様において、一つまたは複数の賦形剤は、製剤の約0.001 wt.%〜約40 wt.%を構成してよい。いくつかの態様において、一つまたは複数の賦形剤は、製剤の約0.001 wt.%〜約30 wt.%を構成してよい。いくつかの態様において、一つまたは複数の賦形剤は、製剤の約0.001 wt.%〜約20 wt.%を構成してよい。いくつかの態様において、一つまたは複数の賦形剤は、製剤の約0.5 wt.%〜約20 wt.%を構成してよい。いくつかの態様において、一つまたは複数の賦形剤は、製剤の約0.001 wt.%〜約10 wt.%を構成してよい。いくつかの態様において、一つまたは複数の賦形剤は、製剤の約0.001 wt.%〜約2 wt.%を構成してよい。
【0059】
[0075] いくつかの態様において、薬剤デポーは、生物分解性でなくてよい。例えば、薬剤デポーは、ポリウレタン、ポリ尿素、ポリエーテル(アミド)、PEBA、熱可塑性エラストマー性オレフィン、コポリエステル、およびスチレン系熱可塑性エラストマー、鋼、アルミニウム、ステンレス鋼、チタン、高い非鉄金属含有量および低い相対比率の鉄を含む金属アロイ、炭素繊維、ガラス繊維、プラスチック、セラミックス、またはこれらの組合せを含んでよい。典型的に、これらタイプの薬剤デポーは、一定時間後に除去される必要がありうる。
【0060】
[0076] いくつかの場合、使用後に薬剤デポーを除去する必要がないことが望まれることがありうる。それらの場合、薬剤デポーは、生物分解性材料を含んでよい。この目的に利用可能なそして標的組織にまたはその付近に配置された時に長時間にわたって分解するかまたは崩壊することができる特性を有する材料が多数存在する。生物分解性材料の化学の関数として、分解過程の機構は、本来の加水分解性または酵素作用性またはこれら双方でありうる。様々な態様において、分解は、表面で(不均一侵食または表面侵食)かまたは薬剤送達システムデポーの至る所で一様に(均一侵食またはバルク侵食)起こることがありうる。
【0061】
[0077] 薬剤デポーは、ポリマー性材料または非ポリマー性材料、更には、合成のまたは天然に存在する材料、またはこれらの組合せを含んでよい。非ポリマー性材料には、例えば、コレステロール、スチグマステロール、グリセロール、エストラジオール、スクロース、ジステアラート、ソルビタン、ソルビタンモノオレアート、ソルビタンモノパルミテート、ソルビタントリステアラート等が含まれる。
【0062】
[0078] 様々な態様において、薬剤デポーは、ポリマーを含み、そしてそのポリマーは、1年未満の間にわたってin vivo分解して、少なくとも50%のポリマーが6か月以内またはそれ未満で分解するであろう。いくつかの態様において、ポリマーは、2か月、1か月またはそれ未満で分解することができるかまたは分解するであろう。いくつかの態様において、ポリマーは、1か月以内に有意に分解して、少なくとも50%のポリマーが、体内で除去される無毒性残基へと分解するであろうし、そして100%の薬剤が2週間以内に放出されるであろう。ポリマーは、更に、バルク侵食によるよりもむしろ、表面侵食による加水分解によって分解するはずであるので、放出は、持続するのみならず、直線的である。この判定基準を満たすポリマーには、いくつかのポリ無水物;乳酸およびグリコール酸のコポリマーであって、乳酸対グリコール酸の重量比が4:1以下(すなわち、80重量%またはそれ未満の乳酸対20重量%またはそれを超えるグルコール酸)であるもの;および例えば、少なくとも1重量%の無水マレイン酸などの無水物触媒を含有する触媒または分解促進性化合物を含有するポリオルトエステルが含まれる。他のポリマーには、ゼラチンおよびフィブリンなどのタンパク質ポリマー;およびヒアルロン酸などの多糖が含まれる。
【0063】
[0079] 「デポー」には、カプセル、ミクロスフェア、ミクロパーティクル、マイクロカプセル、ミクロファイバー、粒子、ナノスフェア、ナノパーティクル、コーティング、マトリックス、ウェファー、ピル、ペレット、エマルジョン、リポソーム、ミセル、シート、ストリップ、リボン様ストリップまたはファイバー、メッシュ、ペースト、スラブ、ペレット、ゲルまたは他の医薬送達組成物が含まれるが、これらに限定されるわけではない。理想的には、デポーに適する材料は、好ましくは、FDA承認材料またはGRAS材料である薬剤的に許容しうる生物分解性材料および/またはいずれかの生体吸収性材料である。これら材料は、ポリマー性または非ポリマー性でありうる、更には、合成でありうるまたは天然に存在しうる、またはこれらの組合せでありうる。
【0064】
[0080] 「生物分解性」という用語には、薬剤デポーの全部または一部分が、酵素の作用によって、加水分解作用によって、および/またはヒト体内の他の同様の機構によって、時間経過とともに分解するであろうということが含まれる。様々な態様において、「生物分解性」は、デポー(例えば、ミクロパーティクル、ミクロスフェア、ゲル等)が、体内において、治療薬が放出された後にまたは放出されている間に、無毒性成分へと崩壊する(break down)または分解する(degrade)ことができるということを包含する。「生物侵食性」により、デポーおよび/またはゲルは、少なくとも一部分は、周囲組織中に見出される物質、体液との接触のために、または細胞性作用によって、時間経過で侵食するかまたは分解するであろうということを意味する。「生体吸収性」により、デポーは、ヒト体内で、例えば、細胞または組織によって崩壊されそして吸収されるであろうということを意味する。「生体適合性」は、デポーが、標的組織部位において実質的な組織刺激または壊死を引き起こさないであろうということを意味する。
【0065】
[0081] 様々な態様において、デポーは、薬剤の即時放出、徐放性または制御放出をもたらすことができる生体吸収性、生体吸収性および/または生物分解性のバイオポリマーを含んでよい。適する徐放性バイオポリマーの例には、ポリ(α-ヒドロキシ酸)、ポリ(ラクチド-コ-グリコリド)(PLGAまたはDLG)(ポリ(ラクチド-コ-グリコリド)、ポリ(D-ラクチド-コ-グリコリド)、ポリ(L-ラクチド-コ-グリコリド)およびポリ(D,L-ラクチド-コ-グリコリド)が含まれるもの)、ポリラクチド(PLA)、ポリグリコリド(PG)、ポリオルトエステル(類)(POE)、ポリエチレングリコール(PEG)、PEG 200、PEG 300、PEG 400、PEG 500、PEG 550、PEG 600、PEG 700、PEG 800、PEG 900、PEG 1000、PEG 1450、PEG 3350、PEG 4500、PEG 8000、ポリ(α-ヒドロキシ酸)のコンジュゲート、ポリアスピリン、ポリホスファゼン(polyphosphazenes)、コラーゲン、デンプン、α化(pre-gelatinized)デンプン、ヒアルロン酸、キトサン、ゼラチン、アルギネート、アルブミン、フィブリン、ビタミンE類似体であって、αトコフェリルアセテート、d-αトコフェリルスクシネートなどのもの、D-ラクチド、D,L-ラクチド、L-ラクチド、D,L-ラクチド-カプロラクトン(DL-CL)、D,L-ラクチド-グリコリド-カプロラクトン(DL-G-CL)、デキストラン、ビニルピロリドン、ポリビニルアルコール(PVA)、PVA-g-PLGA、PEGT-PBTコポリマー(多活性)、メタクリレート、ポリ(N-イソプロピルアクリルアミド)、PEO-PPO-PEO(プルロニック)、PEO-PPO-PAAコポリマー、PLGA-PEO-PLGA、PEG-PLG、PLA-PLGA、ポロキサマー407、PEG-PLGA-PEGトリブロックコポリマー、SAIB(スクロースアセテートイソブチラート)、ヒドロキシプロピルセルロース、ヒドロキシプロピルメチルセルロース、ヒドロキシエチルメチルセルロース、カルボキシメチルセルロースまたはその塩、Carbopol、ポリ(ヒドロキシエチルメタクリレート)、ポリ(メトキシエチルメタクリレート)、ポリ(メトキシエトキシ-エチルメタクリレート)、ポリメチルメタクリレート(PMMA)、メチルメタクリレート(MMA)、ゼラチン、ポリビニルアルコール、プロピレングリコールまたはこれらの組合せが含まれるが、これらに限定されるわけではない。
【0066】
[0082] 様々な態様において、ポリマーの分子量は、広範囲の値でありうる。ポリマーの平均分子量は、約1000〜約10,000,000;または約1,000〜約1,000,000;または約5,000〜約500,000;または約10,000〜約100,000;または約20,000〜50,000でありうる。
【0067】
[0083] いくつかの態様において、ポリマーは、PLGAまたはPOEまたはこれらの組合せを含む。PLGAは、ポリグリコリドおよびポリラクチドの混合物を含んでよく、いくつかの態様において、その混合物中には、ポリグリコリドより多くのポリラクチドが存在する。様々な態様において、PLGAは、100%のポリラクチドおよび0%のポリグリコリド;95%のポリラクチドおよび5%のポリグリコリド;90%のポリラクチドおよび10%のポリグリコリド;85%のポリラクチドおよび15%のポリグリコリド;80%のポリラクチドおよび20%のポリグリコリド;75%のポリラクチドおよび25%のポリグリコリド;70%のポリラクチドおよび30%のポリグリコリド;65%のポリラクチドおよび35%のポリグリコリド;60%のポリラクチドおよび40%のポリグリコリド;55%のポリラクチドおよび45%のポリグリコリド;50%のポリラクチドおよび50%のポリグリコリド;45%のポリラクチドおよび55%のポリグリコリド;40%のポリラクチドおよび60%のポリグリコリド;35%のポリラクチドおよび65%のポリグリコリド;30%のポリラクチドおよび70%のポリグリコリド;25%のポリラクチドおよび75%のポリグリコリド;20%のポリラクチドおよび80%のポリグリコリド;15%のポリラクチドおよび85%のポリグリコリド;10%のポリラクチドおよび90%のポリグリコリド;5%のポリラクチドおよび95%のポリグリコリド;または0%のポリラクチドおよび100%のポリグリコリドを含んでよい。
【0068】
[0084] ポリラクチドおよびポリグリコリド双方を含む様々な態様において、少なくとも95%のポリラクチド;少なくとも90%のポリラクチド;少なくとも85%のポリラクチド;少なくとも80%のポリラクチド;少なくとも75%のポリラクチド;少なくとも70%のポリラクチド;少なくとも65%のポリラクチド;少なくとも60%のポリラクチド;少なくとも55%;少なくとも50%のポリラクチド;少なくとも45%のポリラクチド;少なくとも40%のポリラクチド;少なくとも35%のポリラクチド;少なくとも30%のポリラクチド;少なくとも25%のポリラクチド;少なくとも20%のポリラクチド;少なくとも15%のポリラクチド;少なくとも10%のポリラクチド;または少なくとも5%のポリラクチドが存在し;そしてバイオポリマーの残り部分は、ポリグリコリドである。
【0069】
[0085] 様々な態様において、薬剤デポーがポリマーを含む場合、それは、薬剤デポーの重量に基づき、約10 wt.%〜約90 wt.%、約10 wt.%〜約80 wt.%、約10 wt.%〜約70 wt.%、約10 wt.%〜約50 wt.%、または約20 wt.%〜約40 wt.%で用いられる。
【0070】
[0086] いくつかの態様において、少なくとも75%の粒子は、約1マイクロメートル〜約200マイクロメートルのサイズを有する。いくつかの態様において、少なくとも85%の粒子は、約1マイクロメートル〜約200マイクロメートルのサイズを有する。いくつかの態様において、少なくとも95%の粒子は、約1マイクロメートル〜約200マイクロメートルのサイズを有する。いくつかの態様において、粒子は全て、約1マイクロメートル〜約200マイクロメートルのサイズを有する。
【0071】
[0087] いくつかの態様において、少なくとも75%の粒子は、約20マイクロメートル〜約100マイクロメートルのサイズを有する。いくつかの態様において、少なくとも85%の粒子は、約20マイクロメートル〜約100マイクロメートルのサイズを有する。いくつかの態様において、少なくとも95%の粒子は、約20マイクロメートル〜約100マイクロメートルのサイズを有する。いくつかの態様において、粒子は全て、約20マイクロメートル〜約100マイクロメートルのサイズを有する。
【0072】
[0088] いくつかの態様において、ポリマーは、DL-CLまたはこれらの組合せを含む。DL-CLは、ラクチドおよびカプロラクトンの混合物を含んでよい。ラクチド対カプロラクトンのモル比は、10:90〜90:10およびその間の全ての部分範囲(例えば、20:80、30:70、45:55、65:35、67:33、89:11等)でありうる。
【0073】
[0089] いくつかの態様において、ポリマーは、DL-G-CLまたはこれらの組合せを含む。DL-G-CLは、ラクチド、グリコリドおよびカプロラクトンの混合物を含んでよい。いくつかの態様において、ラクチド対グリコリド対カプロラクトンのモル比は、30:20:50であってよい。いくつかの態様において、その混合物は、5〜50%のラクチド、5〜50%のグリコリドおよび20〜80%のカプロラクトンを含んでよい。
【0074】
[0090] 様々な態様において、薬剤デポーがポリマーを含む場合、それは、薬剤デポーの重量に基づき、約10 wt.%〜約90 wt.%、約15 wt.%〜約55 wt.%、約25 wt.%〜約45 wt.%、または約30 wt.%〜約35 wt.%で用いられてよい。
【0075】
[0091] デポーは、重炭酸カリウム、炭酸カリウム、水酸化カリウム、酢酸ナトリウム、ホウ酸ナトリウム、重炭酸ナトリウム、炭酸ナトリウム、水酸化ナトリウムまたはリン酸ナトリウムなどの緩衝剤およびpH調整剤;分解/放出改変剤;薬剤放出調整剤;乳化剤;塩化ベンザルコニウム、クロロブタノール、酢酸フェニル第二水銀および硝酸フェニル第二水銀、重亜硫酸ナトリウム、重硫酸ナトリウム、チオ硫酸ナトリウム、チメロサール、メチルパラベンおよび他のパラベン、ポリビニルアルコールおよびフェニルエチルアルコールなどの保存剤;溶解度調整剤;安定剤;および/または凝集改変剤などの不活性物質を含有してもよい。典型的に、このような不活性物質はいずれも、0〜75 wt.%の範囲内で、より典型的には、0〜30 wt.%の範囲内で存在するであろう。デポーが、脊椎部位または関節部位に置かれる予定である場合、様々な態様において、デポーは、保存剤不含の滅菌材料を含んでよい。
【0076】
[0092] デポーは、異なったサイズ、形状および立体配置でありうる。薬剤デポーのサイズ、形状および立体配置を決定する場合に考慮することができるいくつかの因子が存在する。例えば、サイズおよび形状は双方とも、埋め込み部位または注射部位として選択される標的組織部位に薬剤デポーを配置する場合の容易さを可能にすることができる。更に、そのシステムの形状およびサイズは、薬剤デポーが、埋め込みまたは注射後に移動するのを最小限にするかまたは妨げるように選択される。様々な態様において、薬剤デポーは、球形、ロッドまたはファイバーなどの円筒形、ディスク、薄膜、リボン、ストリップまたはシートなどの平面、ペースト、スラブ、ミクロパーティクル、ナノパーティクル、ペレット、メッシュ等のような形状でありうる。融通性は、薬剤デポーの配置を容易にするための考慮事項でありうる。様々な態様において、薬剤デポーは、異なったサイズでありうるが、例えば、薬剤デポーは、約0.5 mm〜100 mmの長さであってよいし、そして約0.01 mm〜約5 mmの直径または厚みを有してよい。様々な態様において、薬剤デポーは、約0.005 mm〜5.0 mm、例えば、0.05〜2.0 mmなどの層厚を有してよい。いくつかの態様において、その形状は、スリップまたはリボン様ストリップであってよく、そのスリップまたはリボン様ストリップは、2〜20またはそれを超える範囲内の幅対厚みの比率を有する。
【0077】
[0093] ラジオグラフィー用マーカーは、薬剤デポー上または中に包含されて、使用者が、患者の標的部位中に正確にデポーを配置するのを可能にすることができる。これらラジオグラフィー用マーカーは、更に、使用者が、その部位におけるデポーの移動および分解を時間経過で追跡するのを可能にするであろう。この態様において、使用者は、多数の画像診断手順のいずれかを用いて、デポーをその部位に正確に配置することができる。このような画像診断手順には、例えば、X線画像化または蛍光透視法が含まれる。このようなラジオグラフィー用マーカーの例には、バリウム、カルシウムおよび/または金属ビーズまたは粒子が含まれるが、これらに限定されるわけではない。存在する場合、ラジオグラフィー用マーカーは、典型的に、約10%〜約40%の(10%、11%、12%、13%、14%、15%、16%、17%、18%、19%、20%、21%、22%、23%、24%、25%、26%、27%、28%、29%、30%、31%、32%、33%、34%、35%、36%、37%、38%、39%および40%、更には、これらのいずれか二つの値の間の範囲、例えば、10〜15%、15〜20%、20〜25%、25〜30%、30〜35%、35〜40%等が含まれ、15〜30%がより典型的であるが、なお一層典型的には、20〜25%を含めた)量で存在する。様々な態様において、ラジオグラフィー用マーカーは、球状形、またはデポーを囲む環状でありうると考えられる。
【0078】
[0094] いくつかの態様において、薬剤デポーは、デポーからの薬剤の放出を可能にする細孔を有する。その薬剤デポーは、デポー中において体液が薬剤と置き代わるのを可能にするであろう。しかしながら、デポー中への細胞浸潤は、デポーの細孔サイズによって妨げられるであろう。この方法で、いくつかの態様において、デポーは、組織骨格として機能することはないし、組織成長を可能にすることもない。むしろ、薬剤デポーは、薬剤送達に利用されるだけであろう。いくつかの態様において、薬剤デポー中の細孔は、250〜500ミクロン未満であろう。この細孔サイズは、細胞が薬剤デポーに浸潤することおよび骨格形成する細胞を蓄えることを妨げるであろう。したがって、この態様において、薬剤は、体液が薬剤デポーに入るにつれて薬剤デポーから溶出するであろうが、細胞が入ることは妨げられるであろう。細孔がほとんどまたは全く存在しないいくつかの態様において、薬剤は、酵素の作用によって、加水分解作用によって、および/またはヒト体内の他の同様の機構によって薬剤デポーから溶出するであろう。他の態様において、薬剤デポーは、細胞の流入および薬剤放出を可能にする約500ミクロンを超える細孔サイズを有してよく、そしてこの態様において、薬剤デポーは、組織骨格として機能することができる。
【0079】
[0095] 一つの例示的な態様において、患者の皮膚下の標的組織部位へ治療薬を送達するための薬剤デポーであって、有効量のブピバカインを含み、ここにおいて、標的組織部位が、少なくとも一つの筋肉、靱帯、腱、軟骨、椎間板、脊髄神経根付近の椎間孔空間、椎間または滑膜性関節、または脊椎管を含む薬剤デポーを提供する。
【0080】
[0096] 様々な態様において、薬剤デポーは、ゲルを含むが、それには、室温においてゼラチン、ゼリー様またはコロイドの性質を有する物質が含まれる。ゲルは、様々な態様において、その至る所に分散したまたはゲル中に懸濁したブピバカイン、および場合により、一つまたは複数の追加の治療薬を有してよい。治療薬の分散は、ゲル中に均一であってよい。或いは、治療薬の濃度は、その至る所で異なってよい。ゲルまたは薬剤デポーの生物分解性材料が、その部位で分解されると、治療薬は放出される。
【0081】
[0097] 薬剤デポーがゲルである場合、低粘性ポリマーを典型的に用いる噴霧可能ゲルとは対照的に、より高い粘度を有するゲルは、他の用途に望ましいことがありうる、例えば、パテ様粘稠度を有するゲルは、骨再生用途に一層好ましいことがありうる。ポリマーがゲル中で用いられる様々な態様において、そのポリマー性組成物には、約10 wt.%〜約50 wt.%または約15 wt.%〜約30 wt.%のポリマーが含まれる。
【0082】
[0098] 別の例示的な態様において、ゲルは、一つまたは複数の薬剤デポーを負荷されている粘稠な形(例えば、治療薬を負荷されたミクロスフェア)であり、ここにおいて、粘稠なゲルは、対象の滑膜性関節、椎間腔、脊椎管または脊椎管周囲の軟組織中に配置される。ゲルは、更に、様々な態様において、組織を密封するかまたは修復するのに用いることができる。また別の例示的な態様において、ゲルは、注射可能ゲル、および/または組織との接触で凝固する接着性ゲルである。例えば、ゲルは、標的組織部位においてin situでゲル化する液体として投与することができる。様々な態様において、ゲルは、二成分系を含むことができるが、この場合、液体を投与後、ゲル化剤を加えて、その液体をゲル化または硬化させる。
【0083】
[0099] 様々な態様において、ゲルは、硬化性ゲルであり、この場合、ゲルを標的部位に適用後、それは硬化し、そして薬剤は、体液がゲルに接触すると、放出されうる。
【0084】
[00100] 様々な態様において、薬剤デポーは、ブピバカインおよび場合により、一つまたは複数の追加の治療薬を負荷され、そして所望の標的組織部位(例えば、外科手術創傷部位、炎症組織、変性組織等)へ送達されるが、様々な態様において、薬剤デポーは、縫合、さかとげ(barb)、ステープル、接着用ゲル等によって適所に保持することができ、それで、薬剤デポーが静脈体循環によってその部位から除去されるのを、またはそれ以外に、広く分散しすぎて、所望の治療的作用を減少させるのを妨げる。例えば、何時間かまたは何日か後、薬剤デポーは、分解することで、それら薬剤デポー(例えば、ストリップ、リボン様ストリップ等)が治療薬を放出することを可能にすることができる。それらストリップは、不溶性または不活性な物質であるが、それが標的組織部位と一度接触すると可溶性または活性な物質から成形することができる。同様に、薬剤デポーは、組織内で溶解するかまたは分散する物質を含んでよい。薬剤デポーが、何時間か〜何日か以内に溶解し始めると、それら薬剤デポー(例えば、ストリップ)は、体液に暴露され、そしてそれらの内容物を放出し始める。薬剤デポーは、薬剤デポーの暴露時間および薬剤デポーからの治療薬の放出を最適にするように製剤化することができる。
【0085】
[00101] 様々な態様において、薬剤デポー(例えば、ゲル)は、流動性であり、そして標的組織部位へ、上にまたは中に注射し、噴霧し、滴加しおよび/または分散させることができる。「流動性」とは、ゲル製剤が、操作するのに容易であり、そしてそれが凝固するように、標的組織部位またはその付近にブラッシング、噴霧、点滴、塗布、注射、造形および/または成形することができるということを意味する。「流動性」には、低粘度または水様粘稠度を有する製剤〜ペースト様材料などの高粘度を有するものが含まれる。様々な態様において、製剤の流動性は、組織部位における不規則、隙間、狭隙および/または空隙にそれを適合させる。例えば、様々な態様において、ゲルは、骨溶解性病変における一つまたは複数の空隙を満たすのに用いることができる。
【0086】
[00102] 様々な態様において、薬剤デポーは、ポリ(α-ヒドロキシ酸)、PLGA、D,L-ラクチド-グリコリド-ε-カプロラクトン、PLA、PG、ポリ(α-ヒドロキシ酸)のポリエチレングリコールコンジュゲート、ポリオルトエステル、ポリ(乳酸-コ-リシン)、ポリ(ラクチド-コ-ウレタン)、ポリ(エステル-コ-アミド)、ポリアスピリン、ポリホスファゼン、ポリ無水物;ポリケタール、コラーゲン、デンプン、α化(pre-gelatinized)デンプン、ヒアルロン酸、キトサン、ゼラチン、アルギネート、アルブミン、フィブリン、ビタミンE類似体であって、αトコフェリルアセテート、d-αトコフェリルスクシネートなどのもの、D,L-ラクチド、D-ラクチド、L-ラクチド、D,L-ラクチド-カプロラクトン、D,L-ラクチド-グリコリド-カプロラクトン、デキストラン、ビニルピロリドン、ポリビニルアルコール(PVA)、PVA-g-PLGA、PEGT-PBTコポリマー(多活性)、メタクリレート、ポリ(N-イソプロピルアクリルアミド)、PEO-PPO-PEO(プルロニック)、PEO-PPO-PAAコポリマー、PLGA-PEO-PLGA、PEG-PLG、PEG-PLG(ポリ(d,l-ラクチド-コ-グリコリド)、PLA-PLGA、ポロキサマー407、PEG-PLGA-PEGトリブロックコポリマー、SAIB(スクロースアセテートイソブチラート)またはこれらの組合せを含む。これら一つまたは複数の成分は、治療薬が薬剤デポーから制御方式および/または持続方式で放出されるのを可能にする。例えば、治療薬およびポリマーマトリックスを含有する薬剤デポーは、標的組織部位に注射することができ、そしてそのポリマーマトリックスは、標的組織部位中において時間経過とともに(例えば、何時間か、何日か)崩壊して、ブピバカインおよび場合により追加の治療薬を放出する。したがって、薬剤デポーの投与は、限局させそして一定時間(例えば、少なくとも1日〜約2日、3日、4日、5日、6日、7日、8日、9日、10日、11日、12日、13日、14日、15日、16日、17日、18日、19日、20日、21日、22日、23日、24日、25日、26日、27日、28日、29日および30日)にわたって行うことができる。
【0087】
[00103] 「徐放性放出(sustained release)」または「持続放出(sustain release)」(長期放出または制御放出とも称される)という用語は、本明細書中において、ヒトまたは他の哺乳動物体内に導入され、そして一つまたは複数の治療薬の流れを、所定の時間にわたって、しかもその所定の時間中ずっと所望の治療的作用を達成するのに十分な治療的レベルで連続的に放出する、一つまたは複数の治療薬を意味するのに用いられる。連続的放出流の言及は、薬剤デポーまたはそのマトリックスまたは成分のin vivoでの生物分解の結果として、または一つまたは複数の治療薬または一つまたは複数の治療薬のコンジュゲートの代謝性変換または溶解の結果として起こる、放出を包含するものである。
【0088】
[00104] 「即時放出」という句は、本明細書中において、体内に導入される一つまたは複数の治療薬であって、薬剤の溶解または吸収を遅らせるまたは延長することを意図することなく、それが投与される場所において溶解することまたはその場所で吸収された状態になることを可能にする治療薬を意味するのに用いられる。
【0089】
[00105] それら二つのタイプの製剤(持続放出および即時放出)は、一緒に用いることができる。徐放性放出および即時放出は、同じデポー中であってよい。様々な態様において、徐放性放出および即時放出は、別々のデポーの一部分であってよい。例えば、ブピバカインのボーラスまたは即時放出製剤は、標的部位またはその付近に置くことができ、そして持続放出製剤も、同じ部位またはその付近に置くことができる。したがって、ボーラスが完全に利用可能になった後でも、持続放出製剤は、意図する組織に活性成分を与え続けると考えられる。
【0090】
[00106] 様々な態様において、薬剤デポーは、埋め込み後最初の48時間または24時間以内に初期バースト用量の治療薬を生ずるように設計される。「初期バースト」または「バースト作用」または「ボーラス用量」は、薬剤デポーと水性液(例えば、滑液、脳脊髄液等)との接触後の最初の48時間または24時間中の薬剤デポーからの治療薬の放出を意味する。いくつかの態様において、薬剤デポーは、この初期バースト作用を回避するように設計される。
【0091】
[00107] 様々な態様において、薬剤デポーは、ボーラス用量のブピバカインまたはその薬学的に許容しうる塩を(例えば、皮膚下の標的部位で100 mg〜800 mg、400〜800 mgまたは100 mg〜200 mg)放出する一つまたは複数の異なった放出層;および有効量のブピバカインまたはその薬学的に許容しうる塩を3〜30日間、3〜10日間または7〜10日間にわたって放出する一つまたは複数の持続放出層を含有する。様々な態様において、その一つまたは複数の即時放出層は、PLGAを含み、それは、PLGAより遅い速度で分解するPLAを含む一つまたは複数の持続放出層よりもより速く分解する。
【0092】
[00108] 様々な態様において、薬剤デポーがゲルを含む場合、そのゲルは、約1〜約500センチポアズ(cps)、1〜約200 cps、または1〜約100 cpsの範囲内の投与前粘度を有してよい。ゲルを標的部位に投与後、そのゲルの粘度は増加するであろう。
【0093】
[00109] 一つの態様において、ゲルは、接着性ゲルであってよく、それは、ゲル中に一様に分布している治療薬を含む。ゲルは、前に示されているような、いずれか適するタイプのものであってよく、そしていったん配置された標的送達部位からゲルが移動するのを妨げるように十分に粘稠であるべきである;ゲルは、実際上、標的組織部位に「粘着」または接着するはずである。ゲルは、例えば、標的組織と接触時にまたは標的送達システムから配置後に凝固することができる。標的送達システムは、例えば、シリンジ、カテーテル、針またはカニューレ、またはいずれ他の適する装置であってよい。標的送達システムは、標的組織部位中にまたは上にゲルを注射するかまたは噴霧することができる。治療薬は、標的組織部位にゲルを配置させる前に、そのゲル中に混合することができる。様々な態様において、ゲルは、二成分送達システムの一部分であってよく、そして二つの成分が混合された時に、化学的過程は、ゲルを形成するようにそして標的組織にそれを粘着または接着させるように活性化する。
【0094】
[00110] 様々な態様において、ポリマーを含有するそれらゲル製剤について、ポリマー濃度は、ゲルが硬化する速度に影響することがありうる(例えば、より高濃度のポリマーを含むゲルは、より低濃度のポリマーを有するゲルよりも速やかに凝固することができる)。様々な態様において、ゲルが硬化する場合、得られたマトリックスは、固形であるが、組織の不規則表面(例えば、骨の陥凹部および/または突出部)に適合することもできる。
【0095】
[00111] ゲル中に存在するポリマーの百分率も、ポリマー性組成物の粘度に影響することがありうる。例えば、より高い重量百分率のポリマーを有する組成物は、典型的に、より低い重量百分率のポリマーを有する組成物よりも濃厚そして粘稠である。より粘稠な組成物は、一層ゆっくりと流動する傾向がある。したがって、より低い粘度を有する組成物は、いくつかの場合、例えば、製剤をスプレーによって適用する場合、好適でありうる。
【0096】
[00112] 様々な態様において、ゲルの分子量は、当該技術分野において知られている多くの方法によって変化させることができる。分子量を変化させる方法の選択は、典型的に、ゲルの組成(例えば、ポリマー対非ポリマー)によって決定される。例えば、様々な態様において、ゲルが、一つまたは複数のポリマーを含む場合、重合度は、ポリマー開始剤(例えば、過酸化ベンゾイル)、有機溶媒または活性剤(例えば、DMPT)、架橋剤、重合剤の量、および/または反応時間を変えることによって制御することができる。
【0097】
[00113] 適するゲルポリマーは、有機溶媒中に可溶性であってよい。溶媒へのポリマーの溶解度は、そのポリマーの結晶化度、疎水性、水素結合性および分子量に依存して変化する。より低い分子量のポリマーは、通常は、高分子量ポリマーよりも容易に、有機溶媒中に溶解するであろう。高分子量ポリマーが含まれるポリマー性ゲルは、低分子量ポリマーが含まれるポリマー性組成物よりも速やかに凝固するかまたは固化する傾向がある。高分子量ポリマーが含まれるポリマー性ゲル製剤は、更に、低分子量ポリマーが含まれるポリマー性ゲルよりも高い溶液粘度を有する傾向がある。
【0098】
[00114] 様々な態様において、ゲルは、固有粘度(「I.V.」と略語で示され、単位は、デシリットル/グラムである)を有するが、それは、ゲルの分子量および分解時間の尺度である(例えば、高い固有粘度を有するゲルは、より高い分子量およびより長い分解時間を有する)。典型的に、高分子量を有するゲルは、より強いマトリックスをもたらし、そしてそのマトリックスは、分解するのにより多く時間を要する。対照的に、低分子量を有するゲルは、より速やかに分解し、そしてより軟質のマトリックスをもたらす。様々な態様において、ゲルは、約0.10 dL/g〜約1.2 dL/gまたは約0.10 dL/g〜約0.40 dL/gの固有粘度によって示されるような分子量を有する。他のIV範囲には、約0.05〜約0.15 dL/g、約0.10〜約0.20 dL/g、約0.15〜約0.25 dL/g、約0.20〜約0.30 dL/g、約0.25〜約0.35 dL/g、約0.30〜約0.35 dL/g、約0.35〜約0.45 dL/g、約0.40〜約0.45 dL/g、約0.45〜約0.50 dL/g、約0.50〜約0.70 dL/g、約0.60〜約0.80 dL/g、約0.70〜約0.90 dL/gおよび約0.80〜約1.00 dL/gが含まれるが、これらに限定されるわけではない。
【0099】
[00115] 様々な態様において、ゲルは、約300〜約5,000センチポアズ(cp)の粘度を有することができる。他の態様において、ゲルは、室温において約5〜約300 cps、約10 cps〜約50 cps、約15 cps〜約75 cpsの粘度を有することができるが、それは、標的部位またはその付近にそれを噴霧することを可能にする。
【0100】
[00116] 様々な態様において、薬剤デポーは、粘度を増強しそして薬剤の放出を制御する物質を含んでよい。このような物質には、例えば、ヒドロキシプロピルセルロース、ヒドロキシプロピルメチルセルロース、ヒドロキシエチルメチルセルロース、カルボキシメチルセルロースおよびそれらの塩、Carbopol、ポリ(ヒドロキシエチルメタクリレート)、ポリ(メトキシエチルメタクリレート)、ポリ(メトキシエトキシ-エチルメタクリレート)、ポリメチルメタクリレート(PMMA)、メチルメタクリレート(MMA)、ゼラチン、ポリビニルアルコール、プロピレングリコール、PEG 200、PEG 300、PEG 400、PEG 500、PEG 550、PEG 600、PEG 700、PEG 800、PEG 900、PEG 1000、PEG 1450、PEG 3350、PEG 4500、PEG 8000またはこれらの組合せが含まれてよい。例えば、様々な態様において、薬剤デポーは、約25重量%〜75重量%のブピバカイン、約15重量%〜75重量%のD,L-ラクチド-グリコリド-カプロラクトン、および約5重量%〜10重量%のPEG 300を含む。薬剤デポーは、更に、約1%〜15%のNMPを含むことができる。
【0101】
[00117] 薬剤デポー放出プロフィールは、特に、薬剤デポーの成分の粒子サイズ分布を制御することによって制御することもできる。様々な態様において、薬剤デポーの成分(例えば、ブピバカイン、ゲル等)の粒子サイズ分布は、約10μM〜200μMの範囲内であってよいので、薬剤デポーは、注射、噴霧、点滴等によって標的部位へまたは部位にまたはその付近に容易に送達することができる。様々な態様において、粒子サイズは、10μM、13μM、85μM、100μM、151μM、200μMおよびその間の全ての部分範囲であってよい。
【0102】
[00118] 様々な態様において、薬剤デポーは、合成または天然由来の高分子量生体適合性エラストマー性ポリマーから作られるヒドロゲルを含んでよい。ヒドロゲルが有することが望まれる性質は、ヒト体内における機械的ストレス、具体的には、剪断および荷重に速やかに応答する能力である。
【0103】
[00119] 天然源から得られるヒドロゲルは、in vivo用途について生物分解性でそして生体適合性である可能性があるので、特に興味をそそる。適するヒドロゲルには、天然ヒドロゲル、例えば、ゼラチン、コラーゲン、絹、エラスチン、フィブリンおよび多糖由来ポリマー様アガロースなどのもの、およびキトサン、グルコマンナンゲル、ヒアルロン酸、架橋カルボキシル含有多糖類などの多糖類、またはこれらの組合せが含まれる。合成ヒドロゲルには、ポリビニルアルコールから形成されるもの;ポリアクリル酸およびポリ(アクリロニトリルアクリル酸)などのアクリルアミド;ポリウレタン;ポリエチレングリコール(例えば、PEG 3350、PEG 4500、PEG 8000);シリコーン;ポリイソブチレンおよびポリイソプレンなどのポリオレフィン;シリコーンおよびポリウレタンのコポリマー;ネオプレン;ニトリル;加硫ゴム;ポリ(N-ビニル-2-ピロリドン);ポリ(2-ヒドロキシエチルメタクリレート)などのアクリレート;およびアクリレートとN-ビニルピロリドンとのコポリマー;N-ビニルラクタム;ポリアクリロニトリル;またはこれらの組合せが含まれるが、これらに限定されるわけではない。それらヒドロゲル材料は、更に架橋されて、必要とされる強度を更に与えることができる。異なったタイプのポリウレタンの例には、熱可塑性または熱硬化性ポリウレタン、脂肪族または芳香族ポリウレタン、ポリエーテル-ウレタン、ポリカーボネート-ウレタンまたはシリコーンポリエーテル-ウレタン、またはこれらの組合せが含まれる。
【0104】
[00120] 様々な態様において、治療薬をゲル中に直接的に混合するよりもむしろ、ブピバカインを負荷されているミクロスフェアを、ゲル中に分散させることができる。一つの態様において、それらミクロスフェアは、ブピバカインの徐放性放出をもたらす。また別の態様において、生物分解性であるゲルは、ミクロスフェアがブピバカインを放出するのを妨げる;したがって、ミクロスフェアは、それらがゲルから放出されるまで、ブピバカインを放出することはない。例えば、ゲルは、標的組織部位(例えば、神経根)のまわりに配置することができる。ゲル中に分散しているのは、所望の治療薬を被包している複数のミクロスフェアである。特定のこれらミクロスフェアは、一度ゲルから放出されると分解し、したがって、ブピバカインを放出する。
【0105】
[00121] ミクロスフェアは、ほぼ流体のように、周囲の組織タイプに依存して、比較的速やかに分散することができ、したがって、ブピバカインを分散させることができる。いくつかの場合、これは、望ましいことがありうる;他の場合、ブピバカインを明確な標的部位にしっかりと拘束された状態で保持することが一層望ましいことがありうる。本発明は、更に、治療薬の分散をそのように拘束する接着性ゲルの使用を企図する。これらゲルは、例えば、椎間腔、脊椎管または周囲組織中に配置することができる。
【0106】
薬剤送達
[00122] デポーを、薬剤送達装置(例えば、シリンジ、ガン薬剤送達装置、または標的器官または標的解剖学的部分への薬剤の適用に適するいずれかの医療装置)の一部分でありうる「カニューレ」または「針」を用いて標的部位に投与することができるということは、当業者に理解されるであろう。薬剤デポー装置のカニューレまたは針は、患者にとって最小限の身体的および心理的外傷となるように設計される。
【0107】
[00123] カニューレまたは針には、例えば、ポリウレタン、ポリ尿素、ポリエーテル(アミド)、PEBA、熱可塑性エラストマー性オレフィン、コポリエステル、およびスチレン系熱可塑性エラストマー、鋼、アルミニウム、ステンレス鋼、チタン、高い非鉄金属含有量および低い相対比率の鉄を有する金属アロイ、炭素繊維、ガラス繊維、プラスチック、セラミックス、またはこれらの組合せなどの材料から作ることができるチューブが含まれる。カニューレまたは針は、一つまたは複数のテーパー付き領域を包含してもよい。様々な態様において、カニューレまたは針は、面取りされていてよい。カニューレまたは針は、更に、埋め込み部位に依存して、患者の正確な処置に不可欠なチップスタイル(tip style)を有してよい。チップスタイルの例には、例えば、Trephine、Cournand、Veress、Huber、Seldinger、Chiba、Francine、Bias、Crawford、撓みチップ(deflected tips)、Hustead、LancetまたはTuoheyが含まれる。様々な態様において、カニューレまたは針は、ノンコアリングであってもよく、そして望ましくない針穿刺を免れるためにそれを覆う外装を有してよい。
【0108】
[00124] 中空カニューレまたは針の寸法は、特に、埋め込み部位に依存するであろう。例えば、硬膜外空間の幅は、胸部については僅か約3〜5 mm、そして腰部については約5〜7 mmである。したがって、様々な態様において、針またはカニューレは、これら特定の部位について設計することができる。様々な態様において、カニューレまたは針は、椎間孔空間中の経孔(transforaminal)アプローチを用いて、例えば、炎症を起こした神経根に沿って挿入することができ、そして薬剤デポーをその状態を処置するためにこの部位に埋め込むことができる。典型的に、その経孔アプローチは、椎間孔を介して椎間空間に接近することを必要とする。
【0109】
[00125] カニューレまたは針の長さについてのいくつかの例には、約50〜150 mmの長さ、例えば、硬膜外小児科使用には約65 mm、標準的な成人には約85 mm、および肥満成人患者には約110 mmが含まれてよいが、これらに限定されるわけではない。カニューレまたは針の太さも、埋め込み部位に依存するであろう。様々な態様において、その太さには、約0.05〜約1.655が含まれるが、これらに限定されるわけではない。カニューレまたは針のゲージは、ヒトまたは動物体内への挿入用に、最大幅または最小の直径、または中間の直径であってよい。最大幅直径は、典型的に、約14ゲージであるが、最小直径は、約22ゲージである。様々な態様において、針またはカニューレのゲージは、約18〜約22ゲージである。
【0110】
[00126] 様々な態様において、薬剤デポーおよび/またはゲルのように、カニューレまたは針には、皮膚下部位またはその付近の場所を示す線量ラジオグラフィー用マーカーが含まれるので、使用者は、多数の画像診断手順のいずれかを用いて、その部位またはその付近にデポーを正確に配置することができる。このような画像診断手順には、例えば、X線画像化または蛍光透視法が含まれる。このようなラジオグラフィー用マーカーの例には、バリウム、カルシウムおよび/または金属ビーズまたは粒子が含まれるが、これらに限定されるわけではない。
【0111】
[00127] 様々な態様において、針またはカニューレには、超音波、蛍光透視法、X線または他の画像化法によって可視化することができる透明または半透明部分が含まれてよい。このような態様において、透明または半透明部分には、放射線不透過性材料または超音波応答性トポグラフィー(topography)が含まれてよく、それが、その材料またはトポグラフィーの不存在に相対する針またはカニューレのコントラストを増加させる。
【0112】
[00128] 薬剤を投与するための薬剤デポーおよび/または医療装置は、滅菌可能であってよい。様々な態様において、薬剤を投与するための薬剤デポーおよび/または医療装置の一つまたは複数の成分は、最終包装での最終的滅菌工程において放射線によって滅菌される。製品の最終的滅菌は、個々の製品成分を別々に滅菌しそして最終パッケージを無菌環境で組み立てることを必要とする無菌操作などの操作によるよりも無菌の確信性を高める。
【0113】
[00129] 典型的に、様々な態様において、γ線は、最終的滅菌工程において用いられるが、それは、装置中に深く透過するγ線からのイオン化エネルギーを利用することを必要とする。γ線は、微生物を死滅させる場合にきわめて有効であり、それらは、残留物を残さないし、装置に放射能を与えるような十分なエネルギーも有していない。γ線は、装置がパッケージ中にある時に用いることができるし、しかもγ滅菌は、高圧または真空状態を必要としないので、パッケージシールおよび他の成分にストレスを加えることがない。更に、γ線は、透過性包装材料への要求を排除する。
【0114】
[00130] 様々な態様において、電子ビーム(e-ビーム)線は、一つまたは複数の装置成分を滅菌するのに用いることができる。e-ビーム線は、一般に、低透過率および高線量率を特徴とするイオン化エネルギーの形を含む。e-ビーム線は、それが、微生物の再生性細胞を含めた、接触についての様々な化学結合および分子結合を変化させるという点で、γ処理に似ている。e-ビーム滅菌用に生成されるビームは、電気の加速および変換によって発生する集中した高荷電の電子流である。e-ビーム滅菌は、例えば、薬剤デポーがゲル中に包含されている場合に用いることができる。
【0115】
[00131] 他の方法も、デポーおよび/または一つまたは複数の装置成分を滅菌するのに用いることができ、それには、例えば、酸化エチレンでのようなガス滅菌、または蒸気滅菌が含まれるが、これらに限定されるわけではない。
【0116】
[00132] 様々な態様において、薬剤デポー(例えば、リボン様ストリップ)を埋め込むのに用いられるように一緒に組み合わされた薬剤デポーおよび/または医療装置と一緒に追加の部分を包含してよいキットを提供する。そのキットには、第一区画に薬剤デポー装置が含まれてよい。第二区画には、薬剤デポーを保持するキャニスターと、限局薬剤送達に必要ないずれか他の器具が含まれてよい。第三区画には、グローブ、ドレープ、創傷包帯、および埋め込み操作の無菌性を維持するための他の手順供給、更には、取扱説明書が含まれてよい。第四区画には、追加のカニューレおよび/または針が含まれてよい。各々の器具は、放射線滅菌されるプラスチックパウチ中に別々に包装されていてよい。キットのカバーには、埋め込み手順の図解が含まれてよく、そして透明プラスチックカバーを、それら区画の上に置いて、無菌性を維持することができる。
【0117】
[00133] 様々な態様において、患者の標的組織部位中にブピバカインを送達する方法を提供する。その方法は、標的組織部位またはその付近にカニューレまたは針を挿入し、そしてブピバカインを含有する薬剤デポーを患者の皮膚下標的部位に埋め込むことを含む。様々な態様において、所望の部位へ薬剤デポーを投与するには、最初に、カニューレまたは針を、皮膚および軟組織を介して下の標的組織部位へ挿入し、そして薬剤デポーを標的部位またはその付近に投与(例えば、注射、埋め込み、点滴、噴霧等)することができる。薬剤デポーがゲルとは別個の場合の態様において、最初に、カニューレまたは針を、皮膚および軟組織を介して下の注射部位へ挿入することができ、そして一つまたは複数のゲル基層を、標的部位に投与することができる。一つまたは複数の基層の投与後、薬剤デポーを、その一つまたは複数の基層上または中に埋め込むことができるので、ゲルは、そのデポーを適所に保持するかまたは移動を減少させることができる。必要ならば、引き続く一つまたは複数のゲル層を、薬剤デポー上に適用して、デポーを取り囲み、そして更に、それを適所に保持することができる。或いは、薬剤デポーを、最初に埋め込みまたは注射後、薬剤デポーのまわりにゲルを置いて(例えば、ブラッシング、点滴、注射または塗布等)、それを適所に保持することができる。ゲルを用いることにより、薬剤デポーの正確なそして精密な埋め込みは、患者にとって最小限の身体的および心理的外傷で達成することができる。様々な態様において、薬剤デポーは、標的部位に縫合することができるし、または或いは、薬剤デポーは、縫合することなく埋め込みすることができる。例えば、様々な態様において、薬剤デポーは、ストリップ形またはリボン形のデポーであってもよく、そして外科手術前、中または後に、標的部位に置くことができる。別の例として、薬剤デポーは、ゲルの形でシリンジまたは他の注射可能送達によって外科手術前、中または後に標的部位に直接的に送達することができる。
【0118】
[00134] 様々な態様において、標的組織部位が脊椎部分を含む場合、体液の一部分(例えば、脊髄液等)を、最初に、標的部位からカニューレまたは針を介して抜き取り後、デポーを投与(例えば、配置、点滴、注射または埋め込み等)することができる。その標的部位は、再水和(例えば、体液の再充満)するであろうし、そしてこの水性環境は、薬剤をデポーから放出させるであろう。
【0119】
[00135] 疾患または状態の処置または処置することは、疾患の徴候または症状を軽減する努力において、一つまたは複数の薬剤を患者(ヒト、他の典型的なものまたはそれ以外)に投与することが含まれてよいプロトコルを実行することを意味する。軽減は、疾患または状態の徴候または症状が現れる前に、更には、それらの出現後に起こることがありうる。したがって、「処置すること」または「処置」には、疾患または望ましくない状態を「予防すること」または「予防」が含まれてよい。更に、「処置すること」または「処置」は、徴候または症状の完全な軽減を必要としないし、治癒を必要としないし、そして具体的には、患者への最低限の作用しかないプロトコルを包含する。「疼痛を減少させること」には、疼痛の低減が含まれ、そして疼痛徴候または症状の完全な軽減を必要としないし、しかも治癒を必要としない。様々な態様において、疼痛を減少させることもは、最低限の疼痛低減も含まれる。例として、一つまたは複数の有効投薬量のブピバカインの投与は、外科手術に付随的な術後疼痛の症状を予防する、処置するかまたは緩和するのに用いることができる。
【0120】
[00136] 「限局」送達には、一つまたは複数の薬剤を、組織内、組織またはその付近に貯留する送達が含まれる。例えば、限局送達には、神経系の神経根への、または脳部分への、またはそれにきわめて接近した状態(約10 cm以内、または好ましくは、例えば、約5 cm以内)での送達が含まれる。「標的送達システム」は、外科手術に付随的な疼痛および/または炎症の処置に必要とされるような、標的組織部位またはその付近に貯留することができる一定量の治療薬を有する一つまたは複数の薬剤デポー(例えば、ゲルまたはゲル中に分散したデポー等)の送達をもたらす。
【0121】
[00137] 図1は、患者の外科手術が行われる部位でありうる多数の一般的な場所を示す。図1に示されている場所が、外科手術が行われる患者の位置でありうる多数の異なった場所を単に代表するものであるということは理解されるであろう。例えば、外科手術は、患者の膝21、股関節部22、手指23、親指24、頸部25および脊椎26に必要とされる場合がある。したがって、これら外科手術中または後に、患者は、術後疼痛および/または炎症を経験することがありうる。
【0122】
[00138] 「疼痛」という用語には、侵害受容および疼痛感覚が含まれるが、それらは双方とも、当該技術分野において周知の疼痛スコアおよび他の方法を用いて、客観的にそして主観的に評価することができる。様々な態様において、疼痛には、異痛症(例えば、普通の非有害刺激への増加した応答)または痛覚過敏(例えば、普通の有害または不快刺激への増加した応答)が含まれてよいが、それは、順次、本来は温熱性または機械的(触覚)でありうる。いくつかの態様において、疼痛は、温熱感受性、機械的感受性および/または休息痛を特徴とする。他の態様において、疼痛は、機械的に誘発される疼痛または休息痛を含む。更に他の態様において、疼痛は、休息痛を含む。疼痛は、当該技術分野において周知のように、一次疼痛または二次疼痛でありうる。本明細書中で開示の方法および組成物によって減少可能、予防可能または処置可能な疼痛の代表的なタイプには、術後疼痛、例えば、腰背部(腰痛)または頸部(頸痛)から、下肢痛、根性痛(腰部手術により腰部および下肢に、頸部手術により頸部および上腕に経験する)、または腹部手術による腹痛、および上腕、頸部、背部、腰部、下肢のニューロパシー性疼痛、および椎間板または脊椎手術に起因する関連疼痛分布が含まれるが、これらに限定されることはない。ニューロパシー性疼痛には、神経根、背髄神経節または末梢神経への手術に由来する疼痛が含まれてよい。
【0123】
[00139] 様々な態様において、疼痛は、「外科手術後疼痛」または「術後疼痛」または「外科手術に誘発される疼痛」に起因するが、それらは、本明細書中で同じ意味に用いられ、そして外科的処置(例えば、ヘルニア修復、整形外科手術または脊椎手術等)後の秒単位、分単位、時間単位、日数単位または週間単位の回復期間に生じる疼痛を意味する。外科手術手順には、皮膚下に貫入し、そして患者に疼痛および/または炎症を引き起こすいずれの手順も含まれる。外科手術手順には、更に、関節鏡視下手術、腫瘍の切除、脊椎固定、胸部、頸部または腰部外科手術、骨盤手術またはこれらの組合せが含まれる。
【0124】
[00140] 「疼痛管理投薬」という用語には、疼痛を減少させ、予防し、軽減しまたは完全に除去するために投与される一つまたは複数の治療薬が含まれる。これらには、抗炎症薬、筋弛緩薬、鎮痛薬、麻酔薬、麻薬等またはこれらの組合せが含まれる。
【0125】
[00141] 様々な態様において、外科手術後疼痛または術後疼痛または外科手術に誘発される疼痛は、炎症を伴う。炎症は、外傷または外科手術への急性応答でありうる。組織が損傷した時、TNF-αが、細胞に結合して、細胞に炎症を引き起こす他のサイトカインを放出させる。炎症カスケードの目的は、損傷した組織の治癒を促すことであるが、組織がいったん治癒すると炎症過程が終わるとは限らない。抑制されていない状態のままにすると、これは、周囲組織の変性および関連疼痛をもたらすことがありうる。したがって、疼痛は、それ自体で疾患状態になりうる。すなわち、この経路が活性化された場合、炎症および疼痛が起こる。しばしば、傷害、炎症および疼痛の悪性でそして表面的には終わりのない循環が起こる。
【0126】
[00142] デポーが、疼痛管理および/または炎症管理(例えば、術後の疼痛管理および/または炎症管理)に用いるのに適している一つの例示的な態様を、図2に示す。図2に図式的に示されているのは、脊椎30と、皮膚34の下の脊椎部位32(例えば、椎間板空間、脊椎管、脊椎周囲の軟組織、神経根等)へシリンジ、カニューレまたは針を用いて薬剤デポーを挿入することができる部位の背面図であり、一つまたは複数の薬剤デポー28および32は、脊椎に沿った様々な部位に送達される。この方法で、数種類の薬剤デポーを埋め込む場合、それらは、場所、正確な間隔および薬剤分布を最適にする方法で埋め込まれる。
【0127】
[00143] 上記のように、脊椎部位が示されているが、薬剤デポーは、少なくとも一つの筋肉、靱帯、腱、軟骨、椎間板、椎間孔空間、脊髄神経根付近または脊椎管が含まれるがこれらに限定されるわけではない、いずれの皮膚下部位にも送達することができる。様々な態様において、ブピバカインを含有する薬剤デポーは、患者に、手術中、静脈内、筋肉内、連続的または間欠的注入、腹腔内、胸骨内、皮下、髄腔内、椎間板内、椎間板周囲、硬膜外、脊椎周囲、関節内注射、非経口またはこれらの組合せによって投与することができる。いくつかの態様において、注射は、髄腔内であるが、それは、脊椎管(脊髄周囲の髄腔内空間)中への注射を意味する。注射は、更に、筋肉または他の組織中へであってよい。
【0128】
[00144] いくつかの態様において、ブピバカインを、望ましくない作用に対抗するアンタゴニストと一緒に共投与することが好ましい。代表的なアンタゴニストには、フェントラミン、ヨヒンビン、トラゾリンおよびピペロキサン(piperoxane)が含まれるが、これらに限定されるわけではない。更に、5-フルオロデオキシウリジン(FUDR)および3,4デヒドロプロレン(dehydroprolene)などの化合物も含まれてよい。これら化合物は、いくつかのタイプの外科手術に関連したグリア瘢痕形成および線維芽細胞瘢痕形成を予防するかまたは減少させることができる。
【0129】
[00145] 本出願のブピバカインに基づく製剤は、医薬調製物の形の薬剤として用いることができる。それら調製物は、固形または液体であってよくおよび有機または無機であってよい適する医薬担体と一緒の投与において形成され、そして所望の非経口または他の投与に適当な形で置くことができる。当業者は、既知の担体には、水、ゼラチン、ラクトース、デンプン、ステアリン酸、ステアリン酸マグネシウム、シカリルアルコール(sicaryl alcohol)、タルク、植物油、ベンジルアルコール、ガム、ロウ、プロピレングリコール、ポリアルキレングリコールおよび他の既知の薬剤用担体が含まれるが、これらに限定されるわけではないと承知している。
【0130】
[00146] 更に、非経口投与には、例えば、カテーテルを介して脊椎または一つまたは複数の炎症を起こした関節付近に医薬組成物(例えば、麻酔薬および抗炎症薬組合せ)を投与する注入ポンプ;標的部位またはその付近に挿入することができる埋め込み可能ミニポンプ;1時間につき一定量のスタチンをまたは間欠的ボーラス用量で放出することができる埋め込み可能な制御放出装置または徐放性送達システムが含まれてよい。使用に適するポンプの一例は、SynchroMed(登録商標)(Medtronic, Minneapolis, Minnesota)ポンプである。このポンプは、三つの密封チャンバを有する。一つには、電子モジュールおよび電池が入っている。二つ目には、蠕動ポンプおよび薬剤レザバーが入っている。三つ目には、医薬組成物を蠕動ポンプ中に押し込むのに必要な圧力を与える不活性ガスが入っている。ポンプに充填するために、医薬組成物は、レザバー充填口を介して膨張可能レザバーに注入される。不活性ガスは、レザバー上で圧力を生じ、そしてその圧力が、フィルターを介して、ポンプチャンバ中へと医薬組成物を押し込む。次に、医薬組成物を、ポンプチャンバから、カテーテル中へと装置外にポンプ輸送し、それを標的部位に貯留させるであろう。医薬組成物の送達速度は、マイクロプロセッサーによって制御される。これは、使用されるポンプを、デリバリー間で同様の量または異なった量の医薬組成物を連続的に、特定の時点に、または設定間隔で送達するのに用いることを可能にする。
【0131】
[00147] 様々な態様において、標的組織部位が血管を含む場合、血管収縮薬を、薬剤デポー中に用いることができる。血管収縮薬が放出された場合、それは、麻酔応答の持続期間を延長しそして麻酔薬の全身取込みを減少させる。麻酔薬は、例えば、ブピバカインであってよく、そして血管収縮薬は、例えば、エピネフリンまたはフェニレフリンであってよい。
【0132】
[00148] 「患者」という用語は、「哺乳類」という分類学クラスからの生物を意味し、ヒト、他の霊長類であって、チンパンジー、類人猿、オランウータンおよびサルなど、ラット、マウス、ネコ、イヌ、ウシ、ウマ等が含まれるがこれらに限定されるわけではない。
【0133】
ブピバカインデポーを製造する方法
[00149] 様々な態様において、ブピバカインを含む薬剤デポーは、生体適合性ポリマーおよび治療的有効量のブピバカインまたはその薬学的に許容しうる塩を一緒にし、そしてこれらの組合せから埋め込み可能薬剤デポーを成形することによって製造することができる。
【0134】
[00150] 薬剤デポーの少なくとも一部分を、一つまたは複数の生体適合性ポリマー、一つまたは複数の治療薬および任意の材料から成形するために、溶液加工技術および/または熱可塑性加工技術を含めた様々な技術が利用可能である。溶液加工技術を用いる場合、典型的に、一つまたは複数の溶媒種を含有する溶媒系を選択する。その溶媒系は、一般に、目的の少なくとも一つの成分、例えば、生体適合性ポリマーおよび/または治療薬に対して良好な溶媒である。溶媒系を調製する具体的な溶媒種は、乾燥速度および表面張力を含めた他の特性に基づいて選択することもできる。
【0135】
[00151] 溶液加工技術には、溶媒流延技術、スピンコーティング技術、ウェブコーティング技術、溶媒噴霧技術、浸漬技術、空気懸濁を含めた機械的懸濁によるコーティングを行う技術(例えば、流動コーティング)、インクジェット技術および静電技術が含まれる。適切な場合、上に挙げたものなどの技術を繰り返してまたは組み合わせて、デポーを蓄積させて(build up)、所望の放出速度および所望の厚みを得ることができる。
【0136】
[00152] 様々な態様において、溶媒を含有する溶液および生体適合性ポリマーを一緒にし、そして所望のサイズおよび形状の型に入れる。この方法で、バリアー層、潤滑層等を含めたポリマー性領域を成形することができる。所望ならば、その溶液は、更に、一つまたは複数の次のもの、すなわち、ブピバカインおよび他の一つまたは複数の治療薬、および一つまたは複数のラジオグラフィー用物質などの他の任意の添加剤等を、溶解した形または分散した形で含むことができる。これは、溶媒除去後に、これらの種を含有するポリマー性マトリックス領域を生じる。他の態様において、溶解したかまたは分散した治療薬を含む溶媒を含有する溶液を、先在するポリマー性領域に適用し、これを、溶液加工技術および熱可塑性加工技術を含めた様々な技術を用いて成形することができ、そこで、治療薬をポリマー性領域中に吸収させる。
【0137】
[00153] デポーまたはその一部分を成形するための熱可塑性加工技術には、成形技術(例えば、射出成形、回転成形等)、押出技術(例えば、押出、同時押出、多層押出等)および流延が含まれる。
【0138】
[00154] 様々な態様による熱可塑性加工は、一つまたは複数の段階において、一つまたは複数の生体適合性ポリマーおよび一つまたは複数の次のもの、すなわち、ブピバカイン、一つまたは複数の任意の追加の治療薬、一つまたは複数のラジオグラフィー用物質等を混合することまたは配合することを含む。次に、得られた混合物を成形して、埋め込み可能薬剤デポーにする。その混合および成形作業は、このような目的について当該技術分野において知られているいずれかの慣用的な装置を用いて行うことができる。
【0139】
[00155] 熱可塑性加工中に、例えば、このような加工に関連している高温および/または機械的剪断ゆえに、一つまたは複数の治療薬が分解する可能性が存在する。例えば、ブピバカインは、通常の熱可塑性加工条件下において実質的に分解することがありうる。したがって、加工は、好ましくは、一つまたは複数の治療薬の実質的な分解を妨げる改変条件下で行われる。いくらかの分解は、熱可塑性加工中に不可避であるかもしれないということは理解されるが、分解は、一般に、10%またはそれ未満に限られる。一つまたは複数の治療薬の実質的な分解を免れるように加工中に制御することができる加工条件の中には、温度、加えられる剪断速度、加えられる剪断応力、治療薬を含有する混合物の滞留時間、およびポリマー性材料および一つまたは複数の治療薬を混合する技術がある。
【0140】
[00156] 生体適合性ポリマーを一つまたは複数の治療薬およびいずれかの追加の添加剤と混合してまたは配合して、それらの実質的に均一な混合物を形成することは、当該技術分野において知られておりそしてポリマー性材料を添加剤と混合するのに慣用的に用いられるいずれかの装置で行ってもよい。
【0141】
[00157] 熱可塑性材料が用いられる場合、ポリマーメルトは、生体適合性ポリマーを加熱することによって形成することができ、それを、様々な添加剤(例えば、一つまたは複数の治療薬、不活性成分等)と混合して、混合物を形成することができる。それを行う一般的な方法は、一つまたは複数の生体適合性ポリマーおよび一つまたは複数の添加剤の混合物に機械的剪断を加えることである。一つまたは複数の生体適合性ポリマーおよび一つまたは複数の添加剤を、この様式で混合することができる装置には、一軸スクリュー押出機、二軸スクリュー押出機、バンバリーミキサー、高速ミキサー、ロスケトル(ross kettles)等のような装置が含まれる。
【0142】
[00158] 一つまたは複数の生体適合性ポリマーおよび様々な添加剤はいずれも、所望ならば(例えば、他の理由の中でも、治療薬の実質的な分解を妨げるために)、最終の熱可塑性混合工程および成形工程の前に予備混合することができる。
【0143】
[00159] 例えば、様々な態様において、生体適合性ポリマーは、治療薬が存在していた場合にそれの実質的な分解を引き起こすと考えられる温度および機械的剪断の条件下において、ラジオグラフィー用物質(例えば、放射線不透過性剤)と予備配合される。次に、この予備配合された材料を、より低い温度および機械的剪断の条件下において治療薬と混合し、そして得られた混合物を、ブピバカイン含有薬剤デポーに成形する。逆に、別の態様において、生体適合性ポリマーは、低減した温度および機械的剪断の条件下において治療薬と予備配合することができる。次に、この予備配合された材料を、例えば、放射線不透過性剤と、同じく低減した温度および機械的剪断の条件下で混合し、そして得られた混合物を、薬剤デポーに成形する。
【0144】
[00160] 生体適合性ポリマーおよび治療薬および他の添加剤の混合物を達成するのに用いられる条件は、例えば、用いられる具体的な一つまたは複数の生体適合性ポリマーおよび一つまたは複数の添加剤、更には、用いられる混合装置のタイプを含めた多数の因子に依存するであろう。
【0145】
[00161] 例として、異なった生体適合性ポリマーは、典型的に、軟化して、異なった温度での混合を容易にするであろう。例えば、デポーが、PLGAまたはPLAポリマー、放射線不透過性剤(例えば、次炭酸ビスマス)、および熱および/または機械的剪断によって分解しやすい治療薬を含んで成形される場合、様々な態様において、PGLAまたはPLAは、放射線不透過性剤と、例えば、約150℃〜170℃の温度で予備混合することができる。次に、治療薬を、その予備混合された組成物と一緒にし、そしてPGLAまたはPLA組成物に典型的であるよりも実質的に低い温度および機械的剪断の条件下で、追加の熱可塑性加工を行う。例えば、押出機を用いる場合、バレル温度、容量出力は、典型的に、剪断を制限するように、したがって、一つまたは複数の治療薬の実質的な分解を妨げるように制御される。例えば、治療薬および予備混合された組成物は、二軸スクリュー押出機を用いて、実質的により低い温度(例えば、100〜105℃)で、および実質的に低減した容量出力(一般に、200 cc/分未満の容量出力に相当する、例えば、全容量の30%未満)を用いて、混合/配合することができる。この加工温度は、ブピバカインの融点より十分に低いということが注目される。というのも、融点温度またはそれより高い温度での加工が、実質的な治療薬分解を引き起こすであろうという理由のためである。更に、特定の態様において、加工温度は、治療薬を含めた、組成物中の全ての生物活性化合物の融点より低いであろうということが注目される。配合後、得られたデポーを、同様に低減した温度および剪断の条件下で、所望の形に成形する。
【0146】
[00162] 他の態様において、一つまたは複数の生物分解性ポリマーおよび一つまたは複数の治療薬を、非熱可塑性技術を用いて予備混合する。例えば、生体適合性ポリマーは、一つまたは複数の溶媒種を含有する溶媒系中に溶解させることができる。所望の物質(例えば、放射線不透過性剤、治療薬、または放射線不透過性剤および治療薬双方)はいずれも、その溶媒系中に溶解または分散させることもできる。次に、溶媒を、得られた溶液/分散液から除去して、固形材料を形成させる。次に、得られた固形材料は、所望ならば、追加の熱可塑性加工(例えば、押出)用に造粒することができる。
【0147】
[00163] 別の例として、治療薬は、溶媒系中に溶解または分散させることができ、次に、それを、先在する薬剤デポーに適用し(先在する薬剤デポーは、溶液および熱可塑性加工技術を含めた様々な技術を用いて成形することができ、そしてそれは、放射線不透過性剤および/または粘度増強剤を含めた様々な添加剤を含むことができる)、そこで、治療薬を薬剤デポー上または中に吸収させる。上のように、次に、得られた固形材料は、所望ならば、追加の加工用に造粒することができる。
【0148】
[00164] 典型的に、押出法は、一つまたは複数の生体適合性ポリマー、一つまたは複数の治療薬および一つまたは複数の放射線不透過性剤を含む薬剤デポーを成形するのに用いることができる。同時押出を用いてもよく、それは、同じまたは異なった層または領域を含む薬剤デポー(例えば、即時および/または持続薬剤放出を可能にする体液透過性を有する一つまたは複数のポリマー性マトリックス層または領域を含む構造)を製造するのに用いることができる成形法である。多領域デポーも、同時射出または逐次射出成形技術などの他の加工および成形技術によって成形することができる。
【0149】
[00165] 様々な態様において、熱可塑性加工から出現することができるデポー(例えば、リボン、ペレット、ストリップ等)を冷却する。冷却法の例には、空気冷却および/または冷却浴中浸漬が含まれる。いくつかの態様において、水浴を用いて、押出デポーを冷却する。しかしながら、治療薬が水溶性である場合、浸漬時間は、浴中への治療薬の不必要な減少を免れるように最小限にするべきである。
【0150】
[00166] 様々な態様において、浴から出した後に周囲温または温エアジェットの使用による水または水分の即時除去も、デポー表面上の薬剤の再結晶を妨げるであろうし、したがって、埋め込みまたは挿入時の高薬剤用量「初期バースト」または「ボーラス用量」を、これが望まれない放出プロフィールである場合、制御するかまたは最小限にするであろう。
【0151】
[00167] 様々な態様において、薬剤デポーは、薬剤にポリマーを混合または噴霧後、デポーを所望の形状に成形することによって製造することができる。様々な態様において、ブピバカインを用い、そしてPLGA、ポリ(D,L-ラクチド-カプロラクトン)ポリマーおよび/またはポリ(D,L-ラクチド-グリコリド-カプロラクトン)ポリマーを混合または噴霧し、そして得られたデポーを、押出によって成形し、乾燥させることができる。
【0152】
[00168] いくつかの例示的な製剤中には、55〜65%のブピバカイン、25〜35%のPLGAおよび5〜15%のmPEGが存在してよい。これら製剤のいくつかは、10〜30%の活性成分を1日目に放出し、そして全てのまたは実質的に全ての活性成分を10日目までに放出するであろう。これら製剤のいくつかは、15〜25%の活性成分を1日目に放出し、そして全てまたは実質的に全ての製品を10日目までに放出するであろう。
【0153】
[00169] 更に他の例示的な製剤中には、55〜65%のブピバカイン、25〜35%のDL-G-CL、6%のPEG 300および13%のNMPが存在してよい。いくつかのこれら製剤は、10〜30%の活性成分を1日目に放出し、そして全てのまたは実質的に全ての活性成分を10日目までに放出するであろう。これら製剤のいくつかは、10〜15%の活性成分を1日目に放出し、そして全てまたは実質的に全ての製品を10日目までに放出するであろう。
【0154】
[00170] 別の例示的な態様において、術後疼痛の処置を必要としている患者の術後疼痛を減少させ、予防しまたは処置するのに有用な埋め込み可能薬剤デポーを提供する。その埋め込み可能薬剤デポーは、治療的有効量のブピバカインまたはその薬学的に許容しうる塩を含む。そのデポーは、術後疼痛を減少させ、予防しまたは処置するために皮膚下部位に埋め込み可能であり、ここにおいて、薬剤デポーは、(i)その薬剤デポー中に負荷されたブピバカインまたはその薬学的に許容しうる塩の全量に相対して約5%〜約50%のブピバカインまたはその薬学的に許容しうる塩を、最初の48時間まで、最初の24時間まで、または最初の約24〜48時間にわたって放出することができる一つまたは複数の即時放出層、および(ii)その薬剤デポー中に負荷されたブピバカインまたはその薬学的に許容しうる塩の全量に相対して約50%〜約95%のブピバカインまたはその薬学的に許容しうる塩を、その後の4〜30日間または4〜10日間までにわたって放出することができる一つまたは複数の持続放出層、を含む。一つまたは複数の即時放出層は、ポリ(ラクチド-コ-グリコリド)、ポリラクチド、ポリグリコリド、ポリオルトエステル、D-ラクチド、D,L-ラクチド、ポリ(D,L-ラクチド)、L-ラクチド、ポリ(D,L-ラクチド-コ-カプロラクトン)、ポリ(D,L-ラクチド-コ-グリコリド-コ-カプロラクトン)、ポリカプロラクトンまたはこれらの組合せの一つまたは複数のものを含み、そして一つまたは複数の持続放出層は、ポリ(ラクチド-コ-グリコリド)、ポリラクチド、ポリグリコリド、ポリオルトエステル、D-ラクチド、D,L-ラクチド、ポリ(D,L-ラクチド)、L-ラクチド、ポリ(D,L-ラクチド-コ-カプロラクトン)、ポリ(D,L-ラクチド-コ-グリコリド-コ-カプロラクトン)、ポリカプロラクトンまたはこれらの組合せの一つまたは複数のものを含む。
【0155】
[00171] また別の例示的な態様において、埋め込み可能薬剤デポーを提供する。その埋め込み可能薬剤デポーは、(i)治療的有効量のブピバカインまたはその薬学的に許容しうる塩;(ii)ボーラス用量のブピバカインまたはその薬学的に許容しうる塩を皮膚下部位に放出することができる一つまたは複数の即時放出層;および(iii)有効量のブピバカインまたはその薬学的に許容しうる塩を4〜30日間、4〜10日間または5〜7日間にわたって放出することができる一つまたは複数の持続放出層を含む。一つまたは複数の即時放出層は、ポリ(ラクチド-コ-グリコリド)、ポリラクチド、ポリグリコリド、ポリオルトエステル、D-ラクチド、D,L-ラクチド、ポリ(D,L-ラクチド)、L-ラクチド、ポリ(D,L-ラクチド-コ-カプロラクトン)、ポリ(D,L-ラクチド-コ-グリコリド-コ-カプロラクトン)、ポリカプロラクトンまたはこれらの組合せの一つまたは複数のものを含み、そして一つまたは複数の持続放出層は、ポリ(ラクチド-コ-グリコリド)、ポリラクチド、ポリグリコリド、ポリオルトエステル、D-ラクチド、D,L-ラクチド、ポリ(D,L-ラクチド)、L-ラクチド、ポリ(D,L-ラクチド-コ-カプロラクトン)、ポリ(D,L-ラクチド-コ-グリコリド-コ-カプロラクトン)、ポリカプロラクトンまたはこれらの組合せの一つまたは複数のものを含む。その薬剤デポーは、薬剤デポー中に負荷されたブピバカインの全量に相対して約40%〜約70%のブピバカインまたはその薬学的に許容しうる塩を徐放性放出期間のあいだ放出することができる。
【0156】
[00172] ここに、本発明を概ね記載してきたが、それは、以下の実施例への以下の参照によって一層容易に理解することができるが、それらは、詳しく説明するために与えられており、断らない限り、本発明を限定するためのものではない。
【実施例】
【0157】
実施例1
[00173] ブピバカインを含む埋込み剤を、次の手順にしたがって製造した。
【0158】
[00174] 材料:25:75のラクチド対カプロラクトンモル比(25:75 DL-CL)、0.8 dL/gの固有粘度数、および95 kDaの分子量を有するポリ(D,L-ラクチド-コ-カプロラクトン)を、Lakeshore Biomaterials(Birmingham, Alabama)より購入した。30:20:50のラクチド対グリコリド対カプロラクトンモル比(30:20:50 DL-G-CL)、0.05 dL/g〜0.15 dL/gの固有粘度数、および10 kDaの分子量を有するポリ(D,L-ラクチド-コ-グリコリド-コ-カプロラクトン)は、Lakeshore Biomaterials(Birmingham, Alabama)より購入した。ブピバカイン塩基は、Orgamol(スイス)より購入した。300〜400 g/molの平均分子量を有するポリエチレングリコール(PEG)は、Spectrum Chemicalsより購入し、99 g/molの平均分子量を有するn-メチルピロリドン(NMP)は、Fisherより購入し、そして更に、アセトンを、Sigma-Aldrichより購入した。
【0159】
[00175] 方法:
[00176] ブピバカイン塩基/25:75 DL-CLストリップ埋込み剤の製造:25:75 DL-CLポリマーを、ガラス製バイアルに加え、そして100℃(薬剤溶融温度より低く)かまたは110℃(薬剤溶融温度より高く)に加熱した。ブピバカイン塩基を、その溶融したポリマーに加え、そして目視によって均一になるまで、スパチュラで混合した。得られたブレンドを、ガラス製バイアルから取り出し、Carver Pressを用いてプレスして、薄膜(0.4〜0.6 mm厚)にした。Carver Pressは、45℃および6000〜8000 psi圧力で操作した。その薄膜を、鋭利なブレードで切断して、所望の寸法のストリップを成形した。埋込み剤の寸法は、9 mm長、0.4〜1 mm厚および1.5〜3 mm幅であった。埋込み剤の寸法は、Brennanラット術後疼痛モデルでのin vivo試験用に選択した。
【0160】
[00177] ブピバカイン塩基/30:20:50 DL-G-CL注射可能ペースト/ゲル製剤の製造:ポリマー(318 mg)、PEG 300(92 mg)およびNMP(199 mg)を、ガラス製バイアルに加え、そして93℃に約10分間加熱した。ブピバカイン(911 mg)を、その混合物に加え、そして93℃で撹拌しながら/旋回させながら20分間維持して、薬剤を溶解させた。バイアル(Vail)を熱から外し、その混合物を、それが室温にまで冷却するように撹拌した。製剤を、バイアルから集め、そして1 mLシリンジに加えた。その混合物は、40℃に加熱した時に、シリンジ(針無装着)から容易に排出した。
【0161】
[00178] ブピバカイン塩基/25:75 DL-CLリボン埋込み剤およびブピバカイン塩基/30:20:50 DL-G-CL注射可能ゲル製剤のin vitro薬剤溶離試験:この手順の目的は、ポリマー埋込み剤およびゲル製剤から受容液(receiving fluid)PBS緩衝液pH7.4中へのブピバカインの放出を測定することであった。そのin vitro放出手順は、受容液が入っている装置中に既知の質量の埋込み剤またはゲルを入れることから成った。in vitro放出装置は、60 mlガラスビンから成った。30 mlの量の受容液を、各々の試料ビンに加えた。放出研究中に、その装置は、37±2℃で維持されたインキュベーター中に入れた。所定の間隔で、受容液の試料を取り出し、そしてブピバカイン濃度についてHPLCによって分析した。
【0162】
[00179] 溶離プロフィールおよびin vivoデータ:これらブピバカイン製剤の埋込み剤を、Brennanラットにおいて調べて、それらのin vitro溶離およびin vivo性能を決定した。図3および図4は、これらブピバカイン製剤の平均累積放出プロフィールを示す。更に、これら製剤についての溶離プロフィールおよびin vivoデータを、下の表1に要約する。
【0163】
【表1】

【0164】
[00180] DL-CLは、ポリ(DL-ラクチド-コ-カプロラクトン)ポリマーの略語である。
【0165】
[00181] 図5および図6は、ブピバカイン1および2製剤についてのin vivo試験の効力データを示す。図5および図6において、「n」は、評価された動物の数を示す。図6には、4群(外科手術、対照ペースト、ブピバカインペーストおよびブピバカインポリマー)各々について、八時点を与える。それら時点は、左から右へと、ベースライン、外科手術後1日目、外科手術後2日目、外科手術後3日目、外科手術後4日目、外科手術後7日目、外科手術後8日目、および外科手術後10日目である。
【0166】
[00182] ブピバカイン1製剤には、コポリマーが、6〜8か月までに完全分解することがありうるという問題があった。ブピバカインは、それをポリマーと混合する前に溶融したので、賦形剤は不必要であった。展性は、ストリップまたはリボン剤形への押出を可能にする十分な融通性を有した。予備評価として、この製剤の効力を、Brennanラット術後疼痛モデルで調べた。機械的異痛症を、これら製剤で処置後の動物モデルにおける疼痛の存在/不存在を評価する行動終点として用いた。Brennanラット切開は、ラット足底面上に行った。切開の深さおよび長さは、このモデルにおいて、埋込み剤サイズが、切り口にはやや大きくそして埋め込み後のラット足内でかさ高になるため、制限因子であった。これは、次に、創傷治癒に影響した。いくつかの埋込み剤は、投与後の様々な時点で、切開された足から失われた。この問題ゆえに、いくつかの被験動物を、埋込み剤の損失のために研究から除外したので、研究に残った少数のラットのみでのこれら製剤の効力の完全な評価は不可能であった。しかしながら、研究を続行した少数のラットについて、ブピバカイン1製剤の投与後に機械的異痛症を逆転させる若干の効力が認められた。
【0167】
[00183] ブピバカイン2製剤について、ポリマーの分解は、1か月未満であった。ブピバカイン2製剤の作用は、注射可能製剤の取扱特性が、投与の時点で変化するという事実ゆえに、示すことができなかった。製剤安定性は、輸送中に影響を受けた。in vivo試験において、(ブピバカイン1製剤の場合のように)若干の効力だけが認められたが、Brennanラットモデルにおいて、効力は、モデルの切り口に適合するように切断された製剤ストリップ寸法中における有効薬剤用量の不存在で影響を受けるということは理解される。
【0168】
実施例2
[00184] ブピバカインを含む多数の埋込み剤を、次の手順にしたがって製造した。
【0169】
[00185] 材料:50:50のラクチド対グリコリドモル比(PLGA50501A)、0.12の固有粘度数、および酸末端付きポリマー鎖末端を有するポリ(D,L-ラクチド-コ-グリコリド)を、Lakeshore Biomaterials(Birmingham, Alabama)より購入した。ブピバカイン塩基を、Orgamol(スイス)より購入した。ブピバカインHClを、Spectrum Chemicals(Gardena, CA)より購入した。550の平均分子量を有するメトキシポリエチレングリコール(mPEG)を、Sigma-Aldrichより購入した。メタノールおよびアセトンも、Sigma-Aldrichより購入した。
【0170】
[00186] 方法:
[00187] 噴霧乾燥ブピバカイン塩基/PLGA50501Aの製造:ブピバカイン塩基およびPLGA50501Aを、双方ともアセトン中に溶解させて、10%(w/w)溶液を生じた。65.2%のブピバカイン塩基溶液および34.8%のPLGA50501A溶液の混合物を、Buchi Spray Dryer中で噴霧乾燥させた。加工パラメーターは、次のように設定した。すなわち、入口温度(70℃)、アスピレーター(80%)、窒素入口(50 mm)、噴霧流量(80 mL/時)および超音波発生器(0.8ワット)。噴霧乾燥粉末を集め、そして30℃および15 mmHg真空で更に24時間乾燥させた。
【0171】
[00188] 噴霧乾燥ブピバカインHClの製造:ブピバカインHClを、メタノール中に溶解させて、10%(w/w)溶液を生じ、その溶液を、Buchi Spray Dryer中で噴霧乾燥させた。加工パラメーターは、次のように設定した。すなわち、入口温度(70℃)、アスピレーター(80%)、窒素入口(50 mm)、噴霧流量(80 mL/時)および超音波発生器(0.8ワット)。噴霧乾燥粉末を集め、そして70℃および15 mmHg真空で更に24時間乾燥させた。
【0172】
[00189] 溶融押出ロッドの製造:3種類の製剤を、溶融押出用に調製した。3種類の製剤は全て、80マイクロメートル篩フィルターを有するRetsch(Retsch GmbH, ドイツ)ローターミルを用いて粉末へと粉砕されたPLGA50501Aを含有した。第一のこのような製剤は、30%(w/w)PLGA50501A粉末、60%(w/w)噴霧乾燥ブピバカインHCl、および10%(w/w)mPEGを含有した(60%ブピバカインHCl)。第二の製剤は、90%(w/w)噴霧乾燥ブピバカイン塩基/PLGA50501Aおよび10%(w/w)mPEGを含有した(60%ブピバカイン塩基)。最後の製剤は、90%(w/w)PLGA50501A粉末および10%(w/w)mPEGを含有した(ビヒクルポリマー)。最後の製剤は、検査しなかった。
【0173】
[00190] 最初の二つの製剤を、スパチュラで乾式混合後、Haake Mini-Lab二軸スクリュー押出機(Thermo Fischer Scientific, Waltham, MA)中に供給した。押出機設定は、次のようであった。すなわち、60%ブピバカインHCl製剤について、105℃および30 RPM、そして60%ブピバカイン塩基製剤について、85℃および30 RPM。最初の二つの製剤を、1.5 mm直径ダイから押出した。
【0174】
[00191] ストリップ製造:押出製剤を、50℃に設定されたCarver Laboratory Heat Press(Carver, Inc., Wabash, IN)を用いてプレスして、所望の厚みのシートにした。それらシートを、レーザーブレードで切断して、所望の寸法のストリップ(またはリボン)または埋込み剤を成形した。各々の埋込み剤の寸法は、次のようであった(長さ×幅×高さまたはL×W×H);すなわち、60%ブピバカイン塩基製剤について、埋込み剤は、9 mm×3 mm×1 mmであり、そして60%ブピバカインHCl製剤について、埋込み剤は、9 mm×3 mm×1 mmであった。
【0175】
[00192] in vitro薬剤溶離試験:各々のストリップまたは埋込み剤を、薬剤溶離試験について三重反復試験で調べ、20 mLシンチレーションバイアル中に入れた。60%ブピバカインHClおよび60%ブピバカイン塩基のストリップ(またはリボン)を、0.5%(w/w)ドデシル硫酸ナトリウムを含む10 mLのリン酸緩衝液pH7.4中において37℃で穏やかに撹拌しながらインキュベートした。予め選択された時点で、緩衝液を分析用に取り出し、新しい緩衝液基剤で置き換えた。薬剤含有量を、Molecular Devices SpectraMax M2(Sunnyvale, CA)プレートリーダーによって、ブピバカインについて260 nmで定量した。
【0176】
[00193] 溶離プロフィールおよびin vivoデータ:ブピバカインの埋込み剤を、Brennanラットにおいて調べて、それらのin vitro溶離およびin vivo性能を決定した。図7および図8は、表2によるブピバカイン3埋込み剤(図中にはブピバカインHClと標識されている)およびブピバカイン4埋込み剤(図中にはブピバカイン塩基と標識されている)の平均放出速度をマイクログラムおよび百分率で示す。図9は、ブピバカイン3および4埋込み剤について、温熱性足引っ込め(thermal paw withdrawal)閾値を術後日数につきグラムで示す。それら結果を、下の表2にも要約する。
【0177】
【表2】

【0178】
[00194] ブピバカイン3および4埋込み剤について、ポリマーは、1か月未満で分解した。取扱適性は、ストリップ様(リボン)剤形へと押出されうる展性でそして成形可能な製剤製品を可能にする性質を有した。予備評価として、これら埋込み剤製剤の効力を、切開術後疼痛のBrennanラットモデルで調べた。機械的痛覚過敏を、これら薬剤製剤で処置後の動物モデルにおける疼痛の存在/不存在を評価する行動終点として用いた。Brennanラット切開は、ラット足底面上に行った。埋込み剤が、切り口より僅かに大きくそして埋め込み後のラット足内でかさ高になるために、切開の深さおよび長さは、このモデルにおいて、制限因子であった。これは、順次、創傷治癒に影響した。いくつかの埋込み剤は、投与後の様々な時点で、切開された足から失われた。この問題ゆえに、いくつかの被験動物を、埋込み剤の損失が原因で研究から除外し、そして研究に残った少数のラットでのこれら埋込み剤の効力の完全な評価は行うことができなかった。しかしながら、研究を続行した少数のラットのうち、ブピバカイン4埋込み剤の投与後、外科手術後2日目に機械的痛覚過敏の統計的に有意の減少が認められ、ブピバカイン3埋込み剤の投与では、統計的作用は存在しなかった。
【0179】
[00195] ブピバカイン5埋込み剤について、ポリマーの分解は、少なくとも数か月を要した。
【0180】
実施例3
[00196] ブピバカイン塩基を含む多数の埋込み剤を製造し、そしてそれらの累積in vitro放出プロフィールを測定した。
【0181】
[00197] 材料:25:75のラクチド対カプロラクトンモル比(25:75 DL-CL)、0.8 dL/gの固有粘度数、および95 kDaの分子量を有するポリ(D,L-ラクチド-コ-カプロラクトン)を、Lakeshore Biomaterials(Birmingham, Alabama)より購入した。30:20:50のラクチド対グリコリド対カプロラクトンモル比(30:20:50 DL-G-CL)、0.05 dL/g〜0.15 dL/gの固有粘度数、および10 kDaの分子量を有するポリ(D,L-ラクチド-コ-グリコリド-コ-カプロラクトン)を、Lakeshore Biomaterials(Birmingham, Alabama)より購入した。ブピバカイン塩基は、Orgamol(スイス)より購入した。300、1,500および8,000の平均分子量を有するPEGポリマーは、Spectrum Chemicalsより購入し、99 g/molの平均分子量を有するn-メチルピロリドン(NMP)は、Fisherより購入し、そして更に、アセトンを、Sigma-Aldrichより購入した。PEG-8カプリル酸/カプリン酸グリセリドから成るLabrosolは、Gattefosse, USA(Paramus, NJ)より購入した。324 g/molの平均分子量を有するTrehaloseは、Sigma-Aldrich(St. Louis, MO)より購入した。
【0182】
[00198] 方法:
[00199] ブピバカイン塩基/DL-CLストリップ埋込み剤の製造:10:90、25:75または65:35のDL-CLポリマーを各々、ガラス製バイアルに加え、そして100℃(薬剤溶融温度より低く)かまたは110℃(薬剤溶融温度より高く)に加熱した。ブピバカイン塩基を、その溶融したポリマーに加え、そして目視によって均一になるまで、スパチュラで混合した。得られたブレンドを、ガラス製バイアルから取り出し、Carver Pressを用いてプレスして、薄膜(0.4〜0.6 mm厚み)にした。Carver Pressは、45℃および6000〜8000 psi圧力で操作した。その薄膜を、鋭ブレードで切断して、所望の寸法のストリップ(リボン)を成形した。埋込み剤の寸法は、9 mm長さ、1.5〜3 mm幅および0.5〜1 mm厚みであった。
【0183】
[00200] ブピバカイン塩基/25:75 DL-CLリボン埋込み剤のin vitro薬剤溶離試験:この手順の目的は、ポリマー埋込み剤製剤から受容液PBS緩衝液pH7.4中へのブピバカインの放出を測定することであった。そのin vitro放出手順は、受容液が入っている装置中に既知の質量の埋込み剤またはゲルを入れることから成った。in vitro放出装置は、60 mlガラスビンから成った。30 mlの量の受容液を、各々の試料ビンに加えた。放出研究中に、その装置は、37±2℃で維持されたインキュベーター中に入れた。所定の間隔で、受容液の試料を取り出し、そしてブピバカイン濃度についてHPLCによって分析した。これら埋込み剤の薬剤負荷量を、下の表3に要約する。更に、表3は、これらブピバカイン埋込み剤の各々の説明を与える。
【0184】
【表3】

【0185】
実施例4
[00201] いくつかのブピバカインゲル製剤を製造した。
【0186】
[00202] PLAゲルの製造:ドデカノールでのポリ乳酸の解重合
[00203] ポリ乳酸(5.71の固有粘度数および15.0グラムの重量)、4-ジメチルアミノピリジン(9.16グラムの重量)およびドデカノール(5.59の重量)を、100 mL丸底フラスコ中に加え、装填し、ゴム隔膜でキャップし、そして油浴中に140℃で入れた。それら材料を、その温度で、全てが溶融後30分間加熱し、そしてマグネチックスターバーで自由に撹拌した。冷却後、15 mLのテトラヒドロフランをフラスコ中に加えて、材料を溶解させ、そしてヘプタンを加えることによって沈殿させた。溶媒をデカントして除去後、材料をクロロホルム(30 mL)中に溶解させ、塩酸塩で洗浄し(1モル、20 mL、3回)、そしてブライン処理を1回行った。その溶液を、無水硫酸ナトリウム上で乾燥させた。溶媒をロタエバポレーションによって除去後、黄色油状物を得た(H-NMRでの末端基分析により約800 g/molのMn)。
【0187】
[00204] ブピバカインゲル製剤の製造方法:製剤は、70%(w/w)PLAゲルおよび30%(w/w)噴霧乾燥ブピバカインを含有するように製造した。各々の製剤について、それら二つの成分を、2 ccトランスファーカップに加え、そしてFlacktek, Inc. Speedmixer DAC150FVZ中で2分間混合した。次に、混合された製剤を各々、18G 1.5インチ鈍端針を有する1 mLのBDシリンジ中に負荷し戻した。
【0188】
[00205] in vitro薬剤溶離試験:各100μLのゲル製剤を、薬剤溶離試験のために、20 mLシンチレーションバイアル中に注射した。それら製剤を各々、三重反復試験で調べ、そして0.5%(w/w)ドデシル硫酸ナトリウムを含む10 mLのリン酸緩衝液pH7.4中において37℃で穏やかに撹拌しながらインキュベートした。予め選択された時点で、緩衝液を分析用に取り出し、新しい緩衝液で置き換えた。薬剤含有量を、Molecular Devices SpectraMax M2(Sunnyvale, CA)プレートリーダーによって、ブピバカインについて定量した。得られた製剤は、30%のブピバカインを包含した。図10〜12は、下の表4に挙げられている製剤について、ブピバカインの1日当たりの平均in vitro累積放出百分率を示す。
【0189】
【表4】

【0190】
実施例5
[00206] ブピバカインを含む多数の埋込み剤を、次の手順にしたがって製造した。
【0191】
[00207] 材料:50:50のラクチド対グリコリドモル比(DLG50501A)、0.12の固有粘度数、および酸末端付きポリマー鎖末端を有するポリ(D,L-ラクチド-コ-グリコリド)を、Lakeshore Biomaterials(Birmingham, Alabama)より購入した。ブピバカイン塩基を、Orgamol(スイス)より購入した。550の平均分子量を有するメトキシポリエチレングリコール(mPEG)を、Sigma-Aldrichより購入した。メタノールおよびアセトンも、Sigma-Aldrichより購入した。
【0192】
[00208] 方法:
[00209] 噴霧乾燥ブピバカイン塩基/DLG 50501Aの製造:ブピバカイン塩基およびDLG 50501Aを、双方ともアセトン中に溶解させて、10%(w/w)溶液を生じた。65.2%のブピバカイン塩基溶液および34.8%のDLG 50501A溶液の混合物を、Buchi Spray Dryer中で噴霧乾燥させた。加工パラメーターは、次のように設定した。すなわち、入口温度(70℃)、アスピレーター(80%)、窒素入口(50 mm)、噴霧流量(80 mL/時)および超音波発生器(0.8ワット)。噴霧乾燥粉末を集め、そして30℃および15 mmHg減圧下で更に24時間乾燥させた。
【0193】
[00210] 溶融押出ロッドの製造:いくつかの製剤を、溶融押出用に調製した。製剤は全て、80マイクロメートル篩フィルターを有するRetsch(Retsch GmbH, ドイツ)ローターミルを用いて粉末へと粉砕されたDLG 50501Aを含有した。製剤は全て、60%(w/w)噴霧乾燥ブピバカイン塩基/PLGA 50501Aを含有した。
【0194】
[00211] それら製剤を各々、スパチュラで乾式混合後、Haake Mini-Lab二軸スクリュー押出機(Thermo Fischer Scientific, Waltham, MA)中に供給した。押出機設定は、次のようであった。すなわち、60%ブピバカインHCl製剤について、105℃および30 RPM、そして60%ブピバカイン塩基製剤について、85℃および30 RPM。それら製剤を、1.5 mm直径ダイから押出した。
【0195】
[00212] ストリップ製造:押出製剤を、50℃に設定されたCarver Laboratory Heat Press(Carver, Inc., Wabash, IN)を用いてプレスして、所望の厚みのシートにした。それらシートを、レーザーブレードで切断して、所望の寸法のストリップを成形した。各々の埋込み剤またはストリップの寸法は、9 mm長さ×3 mm幅×1 mm高さであった。
【0196】
[00213] in vitro薬剤溶離試験:各々のストリップまたは埋込み剤を、薬剤溶離試験について三重反復試験で調べ、20 mLシンチレーションバイアル中に入れた。60%ブピバカイン塩基ストリップ(またはリボン)を、0.5%(w/w)ドデシル硫酸ナトリウムを含む10 mLのリン酸緩衝液pH7.4中において37℃で穏やかに撹拌しながらインキュベートした。予め選択された時点で、緩衝液を分析用に取り出し、新しい緩衝液基剤で置き換えた。薬剤含有量を、Molecular Devices SpectraMax M2(Sunnyvale, CA)プレートリーダーによって、ブピバカインについて260 nmで定量した。図13および図14は、下の表5に挙げられている埋込み剤について、ブピバカインの1日当たりの平均in vitro累積放出百分率を示す。
【0197】
【表5】

【0198】
実施例6
[00214] ブピバカイン埋込み剤を、上の実施例5に記載の手順にしたがって製造した。埋込み剤を製造するのに用いられる製剤を、下の表6に記載する。具体的には、その製剤は、50 wt%のブピバカイン塩基、42 wt.%の5050 DLG 1Aおよび8 wt.%のmPEGを含有した。5050DLGの固有粘度は、0.05〜0.15であり、それは、酸末端基を有した。
【0199】
【表6】

【0200】
[00215] in vitro累積および1日放出プロフィールを、表6に記載の製剤からの三つのストリップ埋込み剤を用いて、滅菌前に調べた。図15Aおよび図15Bは、三つの滅菌済みブピバカインストリップのin vitro累積放出百分率のグラフによる図示である。これら図面で容易に明らかであるように、各々の製剤は、65%〜85%のブピバカインを14日間にわたって放出し、平均して5%〜10%の薬剤を毎日放出した。三つのストリップの平均累積薬剤放出を、図15Bに示すが、この場合、75%の薬剤が14日で放出された。
【0201】
[00216] 図16Aおよび図16Bは、三つの滅菌済みブピバカインストリップのin vitroでの1日放出プロフィールおよびマイクログラム/日でのそれらの累積平均1日放出のグラフによる図示である。これら図面で容易に明らかであるように、各々の薬剤デポーは、2日以内に約3500 mcgの用量でのブピバカイン放出で初期バースト作用を有した。2日後、各々の薬剤デポーは、14日目に薬剤デポーが枯渇するまで、約500〜1000 mcg/日を放出した。
【0202】
実施例7:ブタ外科手術モデルにおけるブピバカイン埋込み剤のin vivo効力評価
[00217] 仔ブタにおける術後疼痛の誘導:仔ブタを、フェイスマスクを介して送達されたイソフルレン/酸素混合物で麻酔した。5 cm長さの皮膚・筋膜切開を、右大腿鼡径部鼡径部に行って、筋肉を無傷のまま保持した。皮膚切り口を、金属製鉗子で閉じた。麻酔持続期間は、10分未満で保持した。切開直後に、それら被験動物の切り口空間中に、対照かまたは薬剤埋込み剤を投与した。モルフィン(Mor)を、陽性対照としてのモルフィン群の被験動物に皮下投与した。
【0203】
[00218] 痛覚脱失評価:ブピバカイン埋込み剤の鎮痛作用を、疼痛行動スコアリングを用いて評価した。疼痛スコアリングシステムは、次の3つの主要カテゴリーの合計であった。
【0204】
1. 被験動物単独動作性(歩行および発声)
2. 被験動物社会的行動
3. ブタがスリング上にとどまった時間長さ。
【0205】
[00219] 全ての被験動物を、ベースライン(外科手術前3日)および外科手術後1時間および3時間(研究0日目)の時点で観察した。次に、疼痛行動を、更に4日間毎日評価した(研究1日目、2日目、3日目および4日目)。埋込み剤を、研究0日目の正に手術直後に、手術創傷床中に投与した。モルフィンは、モルフィン群(Mor)の被験動物に、疼痛評価前1時間に投与した。
【0206】
[00220] 結果:図17は、外科手術後1時間、3時間、1日、2日、3日および4日に疼痛スコアによって測定されるブピバカイン高用量(250 mcgをデポー中に負荷し、25 mcg/日を放出するように設計された)製剤およびブピバカイン低用量(125 mcgをデポー中に負荷し、12.5 mcg/日を放出するように設計された)製剤のin vivo効力評価を示す。疼痛行動スコアの増加は、研究0日目の外科手術後3時間にピークに達した(対照群:7.83±0.9ポイント)。対照で処置された被験動物の高平均群疼痛スコアは、研究1日目にも認められた。研究2日目に、疼痛行動の自発的回復を認め、そして外科手術後4日には、疼痛行動スコアは、ベースライン値と統計的に異なることはなかった。
【0207】
[00221] 高レベル用量を用いたブピバカイン埋込み剤での処置は、外科手術後3時間および外科手術後1日に疼痛を減少させるのに有効であった。この作用は、用量関連性ではなかった。
【0208】
[00222] 結論:この研究の条件下で得られたそしてインライフ(in-life)データに限られた知見を考えると、高レベルのブピバカイン埋込み剤での処置は、ブタの術後疼痛を減少させるのに有効であった。
【0209】
[00223] 本明細書中に記載の様々な態様に、本明細書中の教示の精神または範囲から逸脱することなく、様々な修飾および変更を行うことができるということは、当業者に明らかであろう。したがって、様々な態様は、本教示の範囲内の様々な態様の他の修飾および変更を包含するものである。
【特許請求の範囲】
【請求項1】
術後疼痛の処置を必要としている患者の術後疼痛を減少させる、予防するまたは処置するのに有用な埋め込み可能ドラッグデポーであって、ポリマーおよび治療的有効量の局所麻酔薬またはその薬学的に許容しうる塩を含み、術後疼痛を減少させる、予防するまたは処置するために皮膚下部位に埋め込み可能であるデポーであり、ここにおいて、該ドラッグデポーが、(i)皮膚下部位にボーラス用量の局所麻酔薬またはその薬学的に許容しうる塩を、そして(ii)少なくとも4日間にわたって徐放性用量の有効量の局所麻酔薬またはその薬学的に許容しうる塩を放出することができる埋め込み可能ドラッグデポー。
【請求項2】
局所麻酔薬が、ブピバカイン、ロピバカイン、メピバカイン、エチドカイン(etidocaine)、レボブピバカイン、トリメカイン(trimecaine)、カルチカイン(carticaine)またはアルチカイン(articaine)の少なくとも一つである、請求項1に記載の埋め込み可能ドラッグデポー。
【請求項3】
局所麻酔薬が、ブピバカインであり、そしてブピバカインが、塩の形である、請求項1に記載の埋め込み可能ドラッグデポー。
【請求項4】
局所麻酔薬が、ブピバカインであり、そしてブピバカインが、塩基の形である、請求項1に記載の埋め込み可能ドラッグデポー。
【請求項5】
ポリマーが、ポリ(ラクチドコグリコリド)、ポリラクチド、ポリグリコリド、ポリオルトエステル、D-ラクチド、D,L-ラクチド、ポリ(D,L-ラクチド)、L-ラクチド、ポリ(D,L-ラクチドコカプロラクトン)、ポリ(D,L-ラクチドコグリコリドコカプロラクトン)、ポリカプロラクトンまたはその組合せの一つまたはそれを超えるものを含む、請求項1に記載の埋め込み可能ドラッグデポー。
【請求項6】
ポリマーが、ドラッグデポーを部位に埋め込み後30日またはそれ未満で分解することができる、請求項1に記載の埋め込み可能ドラッグデポー。
【請求項7】
局所麻酔薬を、50〜800 mg/日の量で4〜10日間放出する、請求項1に記載の埋め込み可能ドラッグデポー。
【請求項8】
局所麻酔薬が、埋め込み可能ドラッグデポーの約30〜約90 wt.%の量で存在し、そしてポリマーが、該デポーの約10〜約80 wt.%の量で存在し、そして該デポーが、約0.5〜約20 wt.%の賦形剤を更に含む、請求項1に記載の埋め込み可能ドラッグデポー。
【請求項9】
術後疼痛の処置を必要としている患者の術後疼痛を処置するまたは予防する方法であって、治療的有効量の局所麻酔薬またはその薬学的に許容しうる塩を含む一つまたはそれを超える生物分解性ドラッグデポーを、外科手術前、中または後に、皮膚下の標的組織部位へ投与することを含み、ここにおいて、該ドラッグデポーが、皮膚下部位に初期ボーラス用量の局所麻酔薬またはその薬学的に許容しうる塩を放出後、少なくとも4日間にわたって徐放性用量の有効量の局所麻酔薬またはその薬学的に許容しうる塩を放出することができる方法。
【請求項10】
局所麻酔薬が、ブピバカイン、ロピバカイン、メピバカイン、エチドカイン、レボブピバカイン、トリメカイン、カルチカインまたはアルチカインの少なくとも一つである、請求項9に記載の術後疼痛を処置するまたは予防する方法。
【請求項11】
ドラッグデポーが、該ドラッグデポー中に負荷された局所麻酔薬の全量に相対して約40%〜約70%の局所麻酔薬またはその薬学的に許容しうる塩を、標的組織部位に該ドラッグデポーを投与後4〜10日間にわたって放出することができる、請求項9に記載の術後疼痛を処置するまたは予防する方法。
【請求項12】
ドラッグデポーが、50〜800 mg/日の局所麻酔薬またはその薬学的に許容しうる塩を4〜10日間放出することができる、請求項9に記載の術後疼痛を処置するまたは予防する方法。
【請求項13】
ドラッグデポーが、ポリ(ラクチドコグリコリド)、ポリラクチド、ポリグリコリド、ポリオルトエステル、D-ラクチド、D,L-ラクチド、ポリ(D,L-ラクチド)、L-ラクチド、ポリ(D,L-ラクチドコカプロラクトン)、ポリ(D,L-ラクチドコグリコリドコカプロラクトン)、ポリカプロラクトンまたはその組合せの一つまたはそれを超えるものを含むポリマーを含む、請求項9に記載の術後疼痛を処置するまたは予防する方法。
【請求項14】
術後疼痛の処置を必要としている患者の術後疼痛を減少させる、予防するまたは処置するのに有用な埋め込み可能ドラッグデポーであって、治療的有効量のブピバカインまたはその薬学的に許容しうる塩およびポリマーを含み;ここにおいて、該デポーは、術後疼痛を減少させる、予防するまたは処置するために皮膚下部位に埋め込み可能であり、そして該デポーは、(i)該ドラッグデポー中に負荷されたブピバカインまたはその薬学的に許容しうる塩の全量に相対して約2%〜約50%のブピバカインまたはその薬学的に許容しうる塩を、最初の48時間までにわたって、そして(ii)該ドラッグデポー中に負荷されたブピバカインまたはその薬学的に許容しうる塩の全量に相対して約50%〜約98%のブピバカインまたはその薬学的に許容しうる塩を、引き続き3〜10日間までにわたって放出することができる埋め込み可能ドラッグデポー。
【請求項15】
ポリマーが、ポリ(ラクチドコグリコリド)、ポリラクチド、ポリグリコリド、ポリオルトエステル、D-ラクチド、D,L-ラクチド、ポリ(D,L-ラクチド)、L-ラクチド、ポリ(D,L-ラクチドコカプロラクトン)、ポリ(D,L-ラクチドコグリコリドコカプロラクトン)、ポリカプロラクトンまたはその組合せの一つまたはそれを超えるものを含む、請求項14に記載の埋め込み可能ドラッグデポー。
【請求項16】
ポリマーが、ドラッグデポーの全wt.%の約15%〜約55%を構成する、請求項14に記載の埋め込み可能ドラッグデポー。
【請求項17】
ドラッグデポーが、50〜800 mg/日のブピバカインまたはその薬学的に許容しうる塩を放出することができる、請求項14に記載の埋め込み可能ドラッグデポー。
【請求項18】
ポリマーが、ドラッグデポーを部位に埋め込み後30日またはそれ未満で分解することができる、請求項14に記載の埋め込み可能ドラッグデポー。
【請求項19】
請求項14に記載の埋め込み可能ドラッグデポーを製造する方法であって、生体適合性ポリマーおよび治療的有効量のブピバカインまたはその薬学的に許容しうる塩を一緒にし、そしてその組合せから埋め込み可能ドラッグデポーを成形することを含む方法。
【請求項1】
術後疼痛の処置を必要としている患者の術後疼痛を減少させる、予防するまたは処置するのに有用な埋め込み可能ドラッグデポーであって、ポリマーおよび治療的有効量の局所麻酔薬またはその薬学的に許容しうる塩を含み、術後疼痛を減少させる、予防するまたは処置するために皮膚下部位に埋め込み可能であるデポーであり、ここにおいて、該ドラッグデポーが、(i)皮膚下部位にボーラス用量の局所麻酔薬またはその薬学的に許容しうる塩を、そして(ii)少なくとも4日間にわたって徐放性用量の有効量の局所麻酔薬またはその薬学的に許容しうる塩を放出することができる埋め込み可能ドラッグデポー。
【請求項2】
局所麻酔薬が、ブピバカイン、ロピバカイン、メピバカイン、エチドカイン(etidocaine)、レボブピバカイン、トリメカイン(trimecaine)、カルチカイン(carticaine)またはアルチカイン(articaine)の少なくとも一つである、請求項1に記載の埋め込み可能ドラッグデポー。
【請求項3】
局所麻酔薬が、ブピバカインであり、そしてブピバカインが、塩の形である、請求項1に記載の埋め込み可能ドラッグデポー。
【請求項4】
局所麻酔薬が、ブピバカインであり、そしてブピバカインが、塩基の形である、請求項1に記載の埋め込み可能ドラッグデポー。
【請求項5】
ポリマーが、ポリ(ラクチドコグリコリド)、ポリラクチド、ポリグリコリド、ポリオルトエステル、D-ラクチド、D,L-ラクチド、ポリ(D,L-ラクチド)、L-ラクチド、ポリ(D,L-ラクチドコカプロラクトン)、ポリ(D,L-ラクチドコグリコリドコカプロラクトン)、ポリカプロラクトンまたはその組合せの一つまたはそれを超えるものを含む、請求項1に記載の埋め込み可能ドラッグデポー。
【請求項6】
ポリマーが、ドラッグデポーを部位に埋め込み後30日またはそれ未満で分解することができる、請求項1に記載の埋め込み可能ドラッグデポー。
【請求項7】
局所麻酔薬を、50〜800 mg/日の量で4〜10日間放出する、請求項1に記載の埋め込み可能ドラッグデポー。
【請求項8】
局所麻酔薬が、埋め込み可能ドラッグデポーの約30〜約90 wt.%の量で存在し、そしてポリマーが、該デポーの約10〜約80 wt.%の量で存在し、そして該デポーが、約0.5〜約20 wt.%の賦形剤を更に含む、請求項1に記載の埋め込み可能ドラッグデポー。
【請求項9】
術後疼痛の処置を必要としている患者の術後疼痛を処置するまたは予防する方法であって、治療的有効量の局所麻酔薬またはその薬学的に許容しうる塩を含む一つまたはそれを超える生物分解性ドラッグデポーを、外科手術前、中または後に、皮膚下の標的組織部位へ投与することを含み、ここにおいて、該ドラッグデポーが、皮膚下部位に初期ボーラス用量の局所麻酔薬またはその薬学的に許容しうる塩を放出後、少なくとも4日間にわたって徐放性用量の有効量の局所麻酔薬またはその薬学的に許容しうる塩を放出することができる方法。
【請求項10】
局所麻酔薬が、ブピバカイン、ロピバカイン、メピバカイン、エチドカイン、レボブピバカイン、トリメカイン、カルチカインまたはアルチカインの少なくとも一つである、請求項9に記載の術後疼痛を処置するまたは予防する方法。
【請求項11】
ドラッグデポーが、該ドラッグデポー中に負荷された局所麻酔薬の全量に相対して約40%〜約70%の局所麻酔薬またはその薬学的に許容しうる塩を、標的組織部位に該ドラッグデポーを投与後4〜10日間にわたって放出することができる、請求項9に記載の術後疼痛を処置するまたは予防する方法。
【請求項12】
ドラッグデポーが、50〜800 mg/日の局所麻酔薬またはその薬学的に許容しうる塩を4〜10日間放出することができる、請求項9に記載の術後疼痛を処置するまたは予防する方法。
【請求項13】
ドラッグデポーが、ポリ(ラクチドコグリコリド)、ポリラクチド、ポリグリコリド、ポリオルトエステル、D-ラクチド、D,L-ラクチド、ポリ(D,L-ラクチド)、L-ラクチド、ポリ(D,L-ラクチドコカプロラクトン)、ポリ(D,L-ラクチドコグリコリドコカプロラクトン)、ポリカプロラクトンまたはその組合せの一つまたはそれを超えるものを含むポリマーを含む、請求項9に記載の術後疼痛を処置するまたは予防する方法。
【請求項14】
術後疼痛の処置を必要としている患者の術後疼痛を減少させる、予防するまたは処置するのに有用な埋め込み可能ドラッグデポーであって、治療的有効量のブピバカインまたはその薬学的に許容しうる塩およびポリマーを含み;ここにおいて、該デポーは、術後疼痛を減少させる、予防するまたは処置するために皮膚下部位に埋め込み可能であり、そして該デポーは、(i)該ドラッグデポー中に負荷されたブピバカインまたはその薬学的に許容しうる塩の全量に相対して約2%〜約50%のブピバカインまたはその薬学的に許容しうる塩を、最初の48時間までにわたって、そして(ii)該ドラッグデポー中に負荷されたブピバカインまたはその薬学的に許容しうる塩の全量に相対して約50%〜約98%のブピバカインまたはその薬学的に許容しうる塩を、引き続き3〜10日間までにわたって放出することができる埋め込み可能ドラッグデポー。
【請求項15】
ポリマーが、ポリ(ラクチドコグリコリド)、ポリラクチド、ポリグリコリド、ポリオルトエステル、D-ラクチド、D,L-ラクチド、ポリ(D,L-ラクチド)、L-ラクチド、ポリ(D,L-ラクチドコカプロラクトン)、ポリ(D,L-ラクチドコグリコリドコカプロラクトン)、ポリカプロラクトンまたはその組合せの一つまたはそれを超えるものを含む、請求項14に記載の埋め込み可能ドラッグデポー。
【請求項16】
ポリマーが、ドラッグデポーの全wt.%の約15%〜約55%を構成する、請求項14に記載の埋め込み可能ドラッグデポー。
【請求項17】
ドラッグデポーが、50〜800 mg/日のブピバカインまたはその薬学的に許容しうる塩を放出することができる、請求項14に記載の埋め込み可能ドラッグデポー。
【請求項18】
ポリマーが、ドラッグデポーを部位に埋め込み後30日またはそれ未満で分解することができる、請求項14に記載の埋め込み可能ドラッグデポー。
【請求項19】
請求項14に記載の埋め込み可能ドラッグデポーを製造する方法であって、生体適合性ポリマーおよび治療的有効量のブピバカインまたはその薬学的に許容しうる塩を一緒にし、そしてその組合せから埋め込み可能ドラッグデポーを成形することを含む方法。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【図15A】


【図15B】


【図16A】


【図16B】


【図17】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【図15A】


【図15B】


【図16A】


【図16B】


【図17】


【公表番号】特表2011−518187(P2011−518187A)
【公表日】平成23年6月23日(2011.6.23)
【国際特許分類】
【出願番号】特願2011−505246(P2011−505246)
【出願日】平成21年4月17日(2009.4.17)
【国際出願番号】PCT/US2009/041039
【国際公開番号】WO2009/129509
【国際公開日】平成21年10月22日(2009.10.22)
【出願人】(591007804)メドトロニック,インコーポレイテッド (243)
【住所又は居所原語表記】710Medtronic Parkway,Minneapolis,Minnesota 55432,U.S.A
【Fターム(参考)】
【公表日】平成23年6月23日(2011.6.23)
【国際特許分類】
【出願日】平成21年4月17日(2009.4.17)
【国際出願番号】PCT/US2009/041039
【国際公開番号】WO2009/129509
【国際公開日】平成21年10月22日(2009.10.22)
【出願人】(591007804)メドトロニック,インコーポレイテッド (243)
【住所又は居所原語表記】710Medtronic Parkway,Minneapolis,Minnesota 55432,U.S.A
【Fターム(参考)】
[ Back to top ]

