希少アルカリ金属イオンの選択的回収方法
【課題】通常のアルカリ金属イオンに対して、リチウムイオンなどの希少アルカリ金属塩イオンの選択的分離を達成する回収方法を提供する。
【解決手段】リチウムイオンなどの希少アルカリ金属塩イオンと、ナトリウムイオンなどのアルカリ金属塩イオンとを含むアルカリ金属イオン混合物水溶液と、リン酸ジアルキルからなるアルカリ金属イオン抽出剤とを、炭化水素の存在下に接触させ、水相と油相を形成させる工程Aと、水相と油相とを分離する工程Bと、工程Bで分離された油相を、水の存在下に、酸と接触させることにより、水相と油相を形成させる工程Cと、水相と油相とを分離する工程Dと、水相から希少アルカリ金属塩イオンを回収する工程Eより、希少アルカリ金属イオンを回収する。
【解決手段】リチウムイオンなどの希少アルカリ金属塩イオンと、ナトリウムイオンなどのアルカリ金属塩イオンとを含むアルカリ金属イオン混合物水溶液と、リン酸ジアルキルからなるアルカリ金属イオン抽出剤とを、炭化水素の存在下に接触させ、水相と油相を形成させる工程Aと、水相と油相とを分離する工程Bと、工程Bで分離された油相を、水の存在下に、酸と接触させることにより、水相と油相を形成させる工程Cと、水相と油相とを分離する工程Dと、水相から希少アルカリ金属塩イオンを回収する工程Eより、希少アルカリ金属イオンを回収する。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、アルカリ金属イオンを含む混合物からリチウム、ルビジウム、セシウムなどの希少アルカリ金属イオンの選択的回収方法に関し、さらには、たとえば使用済みのリチウムイオン電池等から分離されたアルカリ金属イオンを含む混合物からリチウムなどの希少アルカリ金属イオンを抽出法により選択的に回収する方法に関する。
【背景技術】
【0002】
2次電池としてリチウムイオン電池が多く利用されているが、リチウムのリサイクルはまだ実用的なものがない。正極物質を構成する金属の回収において、ニッケルやコバルト等の遷移金属は乾式処理方法等によって回収されているが、リチウムについては乾式処理での回収が困難であるため、これまで廃棄処理されてきたのが実情である。
【0003】
また、湿式処理回収についても、電池から分離した正極活物質を酸性溶液に溶解した後、化学的処理によりニッケルやコバルト等の遷移重金属を回収している。この湿式処理においても、ニッケルやコバルト等の回収は可能であるが、リチウムについては十分な回収が困難であり、廃棄処理されてきた。
【0004】
例えば、特許文献1には、使用済みリチウムイオン電池から金属を回収する方法として、電解によりニッケルとコバルトを回収し、不純物を水酸化物として除去した後、リチウムを炭酸塩として回収する方法が記載されている。しかし、リチウム以外の不純物を除去した後の水溶液はリチウムイオン濃度が低いことが多く、リチウムの回収率が低いとう問題があった。
【0005】
特許文献2には、海水中等からリチウムを採取するために、リチウム吸着剤を用いてリチウムを濃縮する方法が記載されている。しかし、この方法では固体吸着剤を用いるために、連続的な抽出と逆抽出が困難である。本来、この方法は多量の海水に含まれる微量のリチウムの濃縮を目的とする方法であり、リチウム量が多い電池のリサイクルにおいては実用的な方法ではない。
【0006】
非特許文献1、非特許文献2、非特許文献3、非特許文献4および非特許文献5には、リチウム含有水溶液からリチウムを分離、回収する方法として、抽出法が用いられている。リチウムを分離・回収するための抽出剤としては、これまで種々のβ‐ジケトンと中性有機リン酸との混合物が使用されている。
【0007】
また、特許文献3には、リチウム含有水溶液中のリチウムを抽出するに当り、抽出剤としてα‐ペルフルオロアルカノイル‐m‐ドデシルアセトフェノンとリン酸トリ‐n‐ブチルとの混合物を用いるリチウムの分離回収方法が開示されている。しかし、抽出の際に平衡に到達する速度が遅く、効率的な抽出を行うことはできない。また、この方法では、ナトリウム、カリウムに対するリチウムの抽出選択性はある程度高いが、ナトリウム、カリウムに対するルビジウム、セシウムの抽出選択性は低く、ルビジウム、セシウム等の希少アルカリ金属を回収することはできないという欠点もある。また、抽出剤としてリン酸トリ‐n‐ブチルを使用して本件発明の方法を実施しても、本件発明にくらべて希少アルカリ金属イオンの抽出選択率が格段に低いという欠点がある。
【0008】
さらに、特許文献4には、リチウムイオンを含む水溶液をp H 4 .0 以上に調整し、酸性系溶媒抽出剤と接触させてリチウムイオンを抽出した後、その溶媒抽出剤をpH 3 .0 以下の水溶液と接触させてリチウムイオンを逆抽出し、得られた高濃度リチウムイオン水溶液を60 ℃ 以上に保った状態で水溶性炭酸塩と混合することにより、リチウムイオンを固体の炭酸リチウムとして回収する方法が開示されている。しかし、この方法でも、抽出の際に平衡に到達する速度が遅く、効率的な抽出を行うことはできない。
【先行技術文献】
【特許文献】
【0009】
【特許文献1】特開2003−157193号公報
【特許文献2】特開2003−245542号公報
【特許文献3】特開平6-279883号公報
【特許文献4】特開2006-57142号公報
【非特許文献】
【0010】
【非特許文献1】分析化学、第1506ページ(1974年)
【非特許文献2】日本金属学会誌、第82ページ(1975年)
【非特許文献3】化学工学論文集」第857ページ(1989年)
【非特許文献4】化学工学論文集」第504ページ(1989年)]
【非特許文献5】化学工学会第41回秋期大会講演予稿集B305(2009年9月18日)
【発明の概要】
【発明が解決しようとする課題】
【0011】
従来の抽出法においては、同族のアルカリ金属イオン、とりわけナトリウムイオン、カリウムイオンなどの通常のアルカリ金属イオンに対して、リチウムイオン、ルビジウムイオン、セシウムイオンなどの希少アルカリ金属塩イオンの選択的分離が困難であり、希少アルカリ金属イオンを選択的に回収することができないことの他に、抽出速度が遅く、工業的に適用するには至っていないという欠点があった。本発明では、ナトリウムイオン、カリウムイオンなどの通常のアルカリ金属イオンに対して、リチウムイオン、ルビジウムイオン、セシウムイオンなどの希少アルカリ金属塩イオンの選択的分離を達成し、かつ抽出速度が速く、工業的に適用することのできる選択的な回収方法を提供することを目的とするものである。
【課題を解決するための手段】
【0012】
本発明者らは、ナトリウムイオンおよびカリウムイオンなどの通常のアルカリ金属塩イオンと、リチウムイオン、ルビジウムイオン、セシウムイオンなどの希少アルカリ金属塩イオンとを含むアルカリ金属イオン混合物から、抽出法により、希少アルカリ金属イオンの選択的回収方法について検討したところ、リン酸ジアルキルからなるアルカリ金属イオン抽出剤を炭化水素の存在下に接触させた後、抽出液を分離して得られる油相を酸で逆抽出することにより、希少アルカリ金属イオンをきわめて選択的かつ効率よく回収できることを見いだし、本発明に到達した。
【0013】
本発明の概要は次のとおりである。
[1]リチウムイオン、ルビジウムイオンおよびセシウムイオンからなる群から選ばれた少なくとも1種の希少アルカリ金属イオン(a1)と、ナトリウムイオンおよびカリウムイオンからなる群から選ばれた少なくとも1種のアルカリ金属イオン(a2)とを含むアルカリ金属イオン混合物水溶液(a3)と、リン酸ジアルキルからなるアルカリ金属イオン抽出剤(b)とを、炭化水素(c)の存在下に接触させ、水相(d)と油相(e)を形成させる工程Aと、
前記水相(d)と前記油相(e)とを分離する工程Bと、
前記工程Bで分離された前記油相(e)を、水の存在下に酸(f)と接触させることにより、水相(g)と油相(h)を形成させる工程Cと、
前記水相(g)と前記油相(h)とを分離する工程Dと、
前記水相(g)から希少アルカリ金属塩イオン(a1)を回収する工程Eとを、
含むことを特徴とする希少アルカリ金属イオンの選択的回収方法。
[2]前記アルカリ金属イオン抽出剤(b)が、リン酸ジ(2−エチルヘキシル)である[1]に記載の希少アルカリ金イオンの選択的回収方法。
[3]前記アルカリ金属イオン抽出剤(b)の使用量が、前記アルカリ金属イオン混合物水溶液(a1)100重量部に対して10〜100重量部である[1]または[2]に記載の希少アルカリ金属イオンの選択的回収方法。
[4]前記炭化水素(c)が、炭素数5〜12の脂環式炭化水素、脂肪族炭化水素および芳香族炭化水素からなる群から選ばれた少なくとも1種の炭化水素である[1]〜[3]のいずれかに記載の希少アルカリ金属イオンの選択的回収方法。
[5]前記工程Aの接触を、スラグ流を形成するマイクロ流路接触装置により行う項1〜4のいずれかに記載の希少アルカリ金属イオンの選択的回収方法。
[6]前記工程Cの接触を、スラグ流を形成するマイクロ流路接触装置により行う[1]〜[5]のいずれかに記載の希少アルカリ金属イオンの選択的回収方法。
[7]前記工程Aの接触温度が、5〜60℃である[1]〜[6]のいずれかに記載の希少アルカリ金属イオンの選択的回収方法。
[8]前記酸(f)が塩酸または硫酸である[1]〜[7]のいずれかに記載の希少アルカリ金属イオンの選択的回収方法。
[9]前記工程Aの水相(d)のpHを6.5〜12に調製することを特徴とする[1]〜[8]のいずれかに記載の希少アルカリ金属イオンの選択的回収方法。
[10]前記工程Cの水相(g)のpHを0.1〜4に調製することを特徴とする[1]〜[9]のいずれかに記載の希少アルカリ金属イオンの選択的回収方法。
【発明の効果】
【0014】
本発明によれば、ナトリウムイオン、カリウムイオンなどの通常のアルカリ金属イオンに対して、リチウムイオン、ルビジウムイオン、セシウムイオンなどの希少アルカリ金属塩イオンの選択的な分離を達成することができる。本発明によれば、ナトリウムイオン、カリウムイオンなどの通常のアルカリ金属イオンに対して、リチウムイオンのみならず、ルビジウムイオン、セシウムイオンの選択的抽出が達成できるという特徴がある。したがって、本発明によれば、リチウムイオンのみならず、ルビジウムイオン、セシウムイオンを選択的に抽出できるという特徴を有している。また、本発明によれば、希少アルカリ金属イオン抽出速度が速く、工業的に適用できる選択的な回収方法が可能となる。
【図面の簡単な説明】
【0015】
【図1】実施例および比較例で使用した実験装置(マイクロ流路接触装置およびセトラー)の構造を示した。
【図2】実施例1および実施例2の工程Aの抽出結果を示した。
【図3】実施例3および実施例4の工程C〜Eの抽出結果を示した。
【図4】実施例5のD2EHPAシクロヘキサン溶液の再利用による抽出結果を示した。
【図5】実施例6のリチウムイオン、セシウムイオン、ルビジウムイオンの抽出結果を示した。
【図6】実施例7のリチウム、セシウム、ルビジウム、ナトリウムおよびカリウムの混合物の抽出結果を示した。
【図7】実施例8のシェルゾール100、シェルゾール150を使用した抽出結果を示した。
【図8】比較例1のPTBを抽出剤として使用したときのリチウムイオンの抽出結果を実施例1のD2EHPAと対比して示した。
【発明を実施するための形態】
【0016】
−希少アルカリ金属塩イオン(a1)−
本発明において、選択的に抽出される希少アルカリ金属塩イオン(a1)は、リチウムイオン、ルビジウムイオンおよびセシウムイオンからなる群から選ばれた少なくとも1種の希少アルカリ金属塩イオンである。リチウムイオン、ルビジウムイオン、セシウムイオンのいずれか1種のみであってもよいし、リチウムイオン、ルビジウムイオン、セシウムイオンのうちの2種または3種のいずれであってもよい。
【0017】
−アルカリ金属塩イオン(a2)−
本発明において、選択的に抽出される希少アルカリ金属塩イオン(a1)から分離されるアルカリ金属塩イオン(a2)は、ナトリウムイオンおよびカリウムイオンからなる群から選ばれた少なくとも1種のアルカリ金属塩イオンであり、ナトリウムイオンまたはカリウムイオンのいずれか単独であってもよいし、ナトリウムイオンおよびカリウムイオンの両方であってもよい。
【0018】
−アルカリ金属イオン混合物水溶液(a3)−
本発明において、スラグ流を形成するマイクロ流路接触装置に供給されるアルカリ金属イオン混合物水溶液(a3)は、リチウムイオン、ルビジウムイオンおよびセシウムイオンからなる群から選ばれた少なくとも1種の前記希少アルカリ金属塩イオン(a1)と、ナトリウムイオンおよびカリウムイオンからなる群から選ばれた少なくとも1種の前記アルカリ金属塩イオン(a2)とを含むアルカリ金属イオン混合物水溶液である。アルカリ金属イオン混合物水溶液(a3)のpHは6.5〜12、好ましくは7〜11である。
【0019】
このアルカリ金属イオン混合物水溶液(a3)として具体的には、たとえば、リチウムイオン電池もしくはリチウムイオンキャパシタから発生する資源リサイクル材料からコバルト、ニッケル、マンガンなどの遷移金属を回収した後の混合物に起因するものであってもよいし、その他の工業材料に起因する混合物であってもよい。また、セシウムに関しては原子力関連の廃液処理にも適用が予想される。
【0020】
−希少アルカリ金属イオンの選択的回収−
本発明において、ナトリウムイオン、カリウムイオンなどの通常のアルカリ金属イオンに対して、リチウムイオン、ルビジウムイオン、セシウムイオンなどの希少アルカリ金属塩イオンの選択的分離回収を達成することができる。本発明において、ナトリウムイオン、カリウムイオンなどの通常のアルカリ金属イオンに対して、とりわけリチウムイオンのみならず、ルビジウムイオン、セシウムイオンの選択的分離回収が達成できる。したがって、本発明において、リチウムイオンと同時に、ルビジウムイオン、セシウムイオンを選択的分離回収ができる。
【0021】
−アルカリ金属イオン抽出剤(b)−
本発明において使用されるアルカリ金属イオン抽出剤(b)は、リン酸ジアルキルからなる抽出剤であり、さらに具体的には、リン酸ジ(n−へキシル)、リン酸ジ(ジシクロへキシル)、リン酸ジ(2−エチルヘキシル)、リン酸ジ(n−オクチル)、リン酸ジ(n−デシル)などが例できる。これらの中では、リン酸ジ(2−エチルヘキシル)がとくに好ましい。アルカリ金属イオン抽出剤(b)の使用量は、前記アルカリ金属イオン混合物水溶液(a3)100重量部に対して10〜100重量部、好ましくは30〜70重量部である。
【0022】
−炭化水素(c)−
本発明において使用される炭化水素(c)は炭素数5〜12の炭化水素であり、抽出工程において油相を形成するものであり、具体的にはヘキサン、へプタン、オクタン、デカンなどの脂肪族炭化水素、シクロヘキサン、メチルシクロヘキサン、シクロオクタン、シクロデカン、シクロドデカンなどの脂環式炭化水素、ベンゼン、トルエン、キシレン、シメンなどの芳香族炭化水素などを例示することができる。これらの炭化水素のなかでは、シクロヘキサン、メチルシクロヘキサン、シクロオクタン、シクロデカン、シクロドデカンなどの炭素数5〜12の脂環式炭化水素が好ましい。炭化水素(c)の使用量は、前記アルカリ金属イオン混合物水溶液(a3)100重量部に対して30〜300重量部、好ましくは50〜200重量部である。
【0023】
−マイクロ流路接触装置−
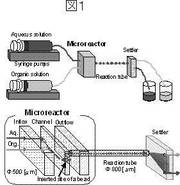
本発明の後記工程Aにおいて、前記希少アルカリ金属塩イオン(a1)と前記アルカリ金属塩イオン(a2)とを含む前記アルカリ金属イオン混合物水溶液(a3)は、リン酸ジアルキルからなるアルカリ金属イオン抽出剤(b)と炭化水素(c)の存在下に接触させることにより、希少アルカリ金属塩イオン(a1)を炭化水素(c)に選択的に抽出することができる。この接触には、槽型攪拌槽を採用することもできるし、スラグ流を形成するマイクロ流路接触装置を採用することもできる。抽出効果と抽出速度の点から、スラグ流を形成するマイクロ流路接触装置を採用することが好ましい。スラグ流を形成するマイクロ流路接触装置は、図1に示すように、2つのマイクロシリンジポンプにより、前記アルカリ金属イオン混合物水溶液(a3)と、前記アルカリ金属イオン抽出剤(b)と前記炭化水素(c)混合溶液が2つの流路から供給され、スラグ流が形成されて2液が接触されるように設計されている。
【0024】
また、本発明の後記工程Cにおいて、後記工程Bで分離された油相(e)を、水の存在下に、酸(f)と接触させることにより、水相(g)と油相(h)が形成され、希少アルカリ金属塩イオン(a1)を水相(g)に選択的に抽出することができる。この接触には、槽型攪拌槽を採用することもできるし、スラグ流を形成するマイクロ流路接触装置を採用することもできる。抽出効果と抽出速度の点から、スラグ流を形成するマイクロ流路接触装置を採用することが好ましい。スラグ流を形成するマイクロ流路接触装置は、図1に示すように、2つのマイクロシリンジポンプにより、工程Bで分離された油相(e)と酸(f)との混合物が2つの流路から供給され、スラグ流が形成されて2液が水の存在下に接触するように設計されている。
【0025】
本発明において実施例で使用されたマイクロ流路接触装置とセトラーの組み合わせを図1に示した。マイクロ流路接触装置は試作品である。
【0026】
−工程A−
本発明の工程Aでは、前記希少アルカリ金属塩イオン(a1)と前記アルカリ金属塩イオン(a2)とを含むアルカリ金属イオン混合物水溶液(a3)が、前記アルカリ金属イオン抽出剤(b)と炭化水素(c)の存在下に接触させることにより、水相(d)と油相(e)が形成される。この接触には、槽型攪拌槽を採用することもできるし、スラグ流を形成するマイクロ流路接触装置を採用することもできる。抽出効果と抽出速度の点から、スラグ流を形成するマイクロ流路接触装置を採用することが好ましい。接触の際のpHは6.5〜12、好ましくは7〜11である。接触の際の温度は5〜60℃、好ましくは10〜40℃である。また、接触の際の線速度は0.001〜3m/sec、好ましくは 0.01 〜0.35m/secである。
【0027】
−工程B−
本発明の工程Bでは、前記工程Aにおいて形成された前記水相(d)と前記油相(e)からなる混合物を、通常は流出物を静置することにより、前記水相(d)と前記油相(e)とを分液することにより達成できる。前記水相(d)には前記アルカリ金属塩イオン(a2)が選択的に抽出され、前記油相(e)には希少アルカリ金属塩イオン(a1)が選択的に抽出される。
【0028】
−工程C−
本発明の工程Cでは、前記工程Bで分離された前記油相(e)を、水の存在下に酸(f)と接触させることにより、水相(g)と油相(h)を形成させる。この接触には、槽型攪拌槽を採用することもできるし、前記スラグ流を形成するマイクロ流路接触装置を採用することもできる。抽出効果と抽出速度の点から、前記スラグ流を形成するマイクロ流路接触装置を採用することが好ましい。酸(f)としては、塩酸、硫酸、リン酸、炭酸などが使用されるが、塩酸または硫酸が好ましい。この接触の際のpHは0.1〜4、好ましくは0.1〜1である。接触の際の温度は10〜50℃、好ましくは15〜40℃である。また、接触の際の線速度は0.001〜3m/sec、好ましくは 0.01 〜0.35m/secである。
【0029】
−工程D−
本発明の工程Dでは、前記工程Cで形成された前記水相(g)と前記油相(h)とを分離する。通常は静置することにより、前記水相(g)と前記油相(h)とを分液することができる。前記水相(g)から希少アルカリ金属塩イオン(a1)が選択的に得られる。前記水相(g)から希少アルカリ金属塩イオン(a1)は前記工程Cで使用される酸(f)の陰イオンと塩を形成しており、たとえばリチウムイオン、ルビジウムイオン、セシウムイオンなどの希少アルカリ金属イオン(a1)の化合物として回収される。たとえば、前記工程Cで使用される酸(f)が塩酸である場合には、希少アルカリ金属の塩化物として回収され、前記工程Cで使用される酸(f)が硫酸である場合には、希少アルカリ金属の硫酸塩として回収され、前記工程Cで使用される酸(f)が炭酸である場合には、希少アルカリ金属の炭酸塩として回収される。
【実施例】
【0030】
実施例1
リチウムイオンの正抽出(工程A〜B)
図1にしめすマイクロ流路装置およびセトラーを組み合わせた装置を実験に使用した。マイクロ流路接触装置はアクリル製の導入、流路および吐出プレートによって構成される。油相および水相溶液はそれぞれシリンジポンプを用いて、導入プレートから等流量で供給され、Y字型合流部にて合流し、チャネル内(i.d.500μm)を流れる。2液はビーズ挿入部(i.d.2.0mm)でスラグ流を発生し、吐出プレートからポリテトラフルオロエチレン(PTFE)チューブ(i.d.800μm、長さ100mm)内へ供給され、セトラーに達する。その後スラグ流は油相と水相に迅速に分離され、別々の出口から連続的に回収される。
0.01mol/L の硝酸リチウム水溶液および1.0mol/LのD2EHPAのシクロヘキサン溶液をシリンジポンプで、同じ流量で所定流量(2.3〜5.8mL/h、接触時間:40〜100秒)で、25℃で抽出および分離操作を連続して行った。炎光分析で抽出後の水相中のリチウムイオン濃度を測定し、(1)式より抽出百分率E(Extraction efficiency)を算出した。
E = (Ca0-Ca1) / Ca0 x 100 (1)
Ca0: 供給する水溶液のリチウムイオンの濃度
Ca1: 抽出操作後の水溶液に残存するリチウムイオンの濃度
その結果を図2に示した。図2に示すように、接触時間が40秒で、抽出平衡に至ることが明らかになった。
【0031】
実施例2
0.01mol/L の硝酸リチウム水溶液および1.0mol/LのD2EHPAをフラスコ内に4mLずつ瞬時に接触開始し、マイクロ流路接触装置を使用することなく、槽型攪拌槽を使用して400rpmで激しく攪拌して抽出操作を行ったところ、図2に示すように接触時間が100秒で抽出率は65%、抽出平衡に至るには約1000秒を要した。マイクロ流路接触装置の抽出速度が速いことを示している。
【0032】
実施例3
リチウムイオンの逆抽出(工程C〜E)
正抽出(0.01M LiNO3+2M D2EHPA)で平衡に達した溶液(Liの濃度:9x 10−2mol/L)と1mol/Lの塩酸を、工程A〜Bと同じ方法で同じ流量で所定流量(2.3〜5.8mL/h、接触時間:40〜100秒)で、25℃で逆抽出および分離(回収)操作を連続して行った。
炎光分析で逆抽出後の水相のアルカリ金属イオン濃度を測定し、(2)式より逆抽出百分率Eb(Back extraction efficiency)を算出した。その結果を図3に示した。
Eb = (Ca2/Co2) × 100 (2)
Ca2: 塩酸中に逆抽出されたリチウムイオンの濃度
Co2: 供給するシクロヘキサン中のリチウムイオンの濃度
図3に示すように、接触時間が40秒で、完全な逆抽出(100%)に至り、回収にも成功した。
【0033】
実施例4
同じ溶液を4mLずつ瞬時に接触開始し、マイクロ流路接触装置を使用することなく、槽型攪拌槽を用いて400rpmで激しく攪拌して抽出操作を行ったところ、図3に示すように接触時間が100秒で抽出率は40%、抽出平衡に至るには約1000秒を要した。逆抽出においてもマイクロ流路接触装置の抽出速度が速いことを示唆している。
【0034】
実施例5
実施例3の逆抽出後のD2EHPAシクロヘキサン溶液を再び、実施例1の抽出溶液として繰り返し使用したところ、抽出量および速度に変化がなかった。3回の繰り返し実験を行ったところ、図4に示すようにD2EHPAシクロヘキサン溶液の抽出液としての性能は劣化せず、マイクロ流路接触装置を用いる工程A〜Eについて最適であることが示している。
【0035】
実施例6
実施例1のリチウムイオンと場合と同様に、セシウム、ルビジウムについても抽出実験を行った結果を図5に示す。
この場合もマイクロ流路接触装置の抽出速度が槽型攪拌槽よりも早いいことを示唆している。また、金属の種類により抽出率が、リチウム、セシウム、ルビジウムの順に小さくなることがわかった。このことはD2EHPAシクロヘキサン溶液がアルカリ金属イオンの抽出に対して選択性分離を可能であることを示唆している。
【0036】
実施例7
選択性を確認するために、リチウム、セシウム、ルビジウムに加えてナトリウムおよびカリウムの5種類について、実施例1と同じ条件でD2EHPAシクロヘキサン溶液の抽出実験を行った。実験は各イオンが単独に水溶液に溶解している場合、およびすべてのイオンが溶解している場合について実施した。図6に各イオンの抽出率の結果を示す。
単独のイオンが溶解しているときの抽出率は、リチウム、セシウム、ルビジウム、カリウム、ナトリウムの順でカリウムおよびナトリウムの抽出率は他の金属イオンの抽出率より格段に低かった。この傾向は混合用液の場合も変わらず、このことはリチウム、セシウム、ルビジウムの選択回収に、D2EHPAシクロヘキサン溶液が適していることを示している。
【0037】
実施例8〜9
実施例1において、シクロヘキサンの代わりに、シェルゾール100、シェルゾール150を使用したほか、実施例1と同様に抽出実験を行った。その結果を、シクロヘキサン(実施例1)と対比して図7に示す。
【0038】
比較例1
実施例1において、抽出剤としてリン酸ジ(2−エチルヘキシル)(D2EHPA)に代えてリン酸トリ‐n‐ブチル(PTB)を使用し、実施例1と同様に実験を行った。その結果を実施例1と対比して図8に示す。
【技術分野】
【0001】
本発明は、アルカリ金属イオンを含む混合物からリチウム、ルビジウム、セシウムなどの希少アルカリ金属イオンの選択的回収方法に関し、さらには、たとえば使用済みのリチウムイオン電池等から分離されたアルカリ金属イオンを含む混合物からリチウムなどの希少アルカリ金属イオンを抽出法により選択的に回収する方法に関する。
【背景技術】
【0002】
2次電池としてリチウムイオン電池が多く利用されているが、リチウムのリサイクルはまだ実用的なものがない。正極物質を構成する金属の回収において、ニッケルやコバルト等の遷移金属は乾式処理方法等によって回収されているが、リチウムについては乾式処理での回収が困難であるため、これまで廃棄処理されてきたのが実情である。
【0003】
また、湿式処理回収についても、電池から分離した正極活物質を酸性溶液に溶解した後、化学的処理によりニッケルやコバルト等の遷移重金属を回収している。この湿式処理においても、ニッケルやコバルト等の回収は可能であるが、リチウムについては十分な回収が困難であり、廃棄処理されてきた。
【0004】
例えば、特許文献1には、使用済みリチウムイオン電池から金属を回収する方法として、電解によりニッケルとコバルトを回収し、不純物を水酸化物として除去した後、リチウムを炭酸塩として回収する方法が記載されている。しかし、リチウム以外の不純物を除去した後の水溶液はリチウムイオン濃度が低いことが多く、リチウムの回収率が低いとう問題があった。
【0005】
特許文献2には、海水中等からリチウムを採取するために、リチウム吸着剤を用いてリチウムを濃縮する方法が記載されている。しかし、この方法では固体吸着剤を用いるために、連続的な抽出と逆抽出が困難である。本来、この方法は多量の海水に含まれる微量のリチウムの濃縮を目的とする方法であり、リチウム量が多い電池のリサイクルにおいては実用的な方法ではない。
【0006】
非特許文献1、非特許文献2、非特許文献3、非特許文献4および非特許文献5には、リチウム含有水溶液からリチウムを分離、回収する方法として、抽出法が用いられている。リチウムを分離・回収するための抽出剤としては、これまで種々のβ‐ジケトンと中性有機リン酸との混合物が使用されている。
【0007】
また、特許文献3には、リチウム含有水溶液中のリチウムを抽出するに当り、抽出剤としてα‐ペルフルオロアルカノイル‐m‐ドデシルアセトフェノンとリン酸トリ‐n‐ブチルとの混合物を用いるリチウムの分離回収方法が開示されている。しかし、抽出の際に平衡に到達する速度が遅く、効率的な抽出を行うことはできない。また、この方法では、ナトリウム、カリウムに対するリチウムの抽出選択性はある程度高いが、ナトリウム、カリウムに対するルビジウム、セシウムの抽出選択性は低く、ルビジウム、セシウム等の希少アルカリ金属を回収することはできないという欠点もある。また、抽出剤としてリン酸トリ‐n‐ブチルを使用して本件発明の方法を実施しても、本件発明にくらべて希少アルカリ金属イオンの抽出選択率が格段に低いという欠点がある。
【0008】
さらに、特許文献4には、リチウムイオンを含む水溶液をp H 4 .0 以上に調整し、酸性系溶媒抽出剤と接触させてリチウムイオンを抽出した後、その溶媒抽出剤をpH 3 .0 以下の水溶液と接触させてリチウムイオンを逆抽出し、得られた高濃度リチウムイオン水溶液を60 ℃ 以上に保った状態で水溶性炭酸塩と混合することにより、リチウムイオンを固体の炭酸リチウムとして回収する方法が開示されている。しかし、この方法でも、抽出の際に平衡に到達する速度が遅く、効率的な抽出を行うことはできない。
【先行技術文献】
【特許文献】
【0009】
【特許文献1】特開2003−157193号公報
【特許文献2】特開2003−245542号公報
【特許文献3】特開平6-279883号公報
【特許文献4】特開2006-57142号公報
【非特許文献】
【0010】
【非特許文献1】分析化学、第1506ページ(1974年)
【非特許文献2】日本金属学会誌、第82ページ(1975年)
【非特許文献3】化学工学論文集」第857ページ(1989年)
【非特許文献4】化学工学論文集」第504ページ(1989年)]
【非特許文献5】化学工学会第41回秋期大会講演予稿集B305(2009年9月18日)
【発明の概要】
【発明が解決しようとする課題】
【0011】
従来の抽出法においては、同族のアルカリ金属イオン、とりわけナトリウムイオン、カリウムイオンなどの通常のアルカリ金属イオンに対して、リチウムイオン、ルビジウムイオン、セシウムイオンなどの希少アルカリ金属塩イオンの選択的分離が困難であり、希少アルカリ金属イオンを選択的に回収することができないことの他に、抽出速度が遅く、工業的に適用するには至っていないという欠点があった。本発明では、ナトリウムイオン、カリウムイオンなどの通常のアルカリ金属イオンに対して、リチウムイオン、ルビジウムイオン、セシウムイオンなどの希少アルカリ金属塩イオンの選択的分離を達成し、かつ抽出速度が速く、工業的に適用することのできる選択的な回収方法を提供することを目的とするものである。
【課題を解決するための手段】
【0012】
本発明者らは、ナトリウムイオンおよびカリウムイオンなどの通常のアルカリ金属塩イオンと、リチウムイオン、ルビジウムイオン、セシウムイオンなどの希少アルカリ金属塩イオンとを含むアルカリ金属イオン混合物から、抽出法により、希少アルカリ金属イオンの選択的回収方法について検討したところ、リン酸ジアルキルからなるアルカリ金属イオン抽出剤を炭化水素の存在下に接触させた後、抽出液を分離して得られる油相を酸で逆抽出することにより、希少アルカリ金属イオンをきわめて選択的かつ効率よく回収できることを見いだし、本発明に到達した。
【0013】
本発明の概要は次のとおりである。
[1]リチウムイオン、ルビジウムイオンおよびセシウムイオンからなる群から選ばれた少なくとも1種の希少アルカリ金属イオン(a1)と、ナトリウムイオンおよびカリウムイオンからなる群から選ばれた少なくとも1種のアルカリ金属イオン(a2)とを含むアルカリ金属イオン混合物水溶液(a3)と、リン酸ジアルキルからなるアルカリ金属イオン抽出剤(b)とを、炭化水素(c)の存在下に接触させ、水相(d)と油相(e)を形成させる工程Aと、
前記水相(d)と前記油相(e)とを分離する工程Bと、
前記工程Bで分離された前記油相(e)を、水の存在下に酸(f)と接触させることにより、水相(g)と油相(h)を形成させる工程Cと、
前記水相(g)と前記油相(h)とを分離する工程Dと、
前記水相(g)から希少アルカリ金属塩イオン(a1)を回収する工程Eとを、
含むことを特徴とする希少アルカリ金属イオンの選択的回収方法。
[2]前記アルカリ金属イオン抽出剤(b)が、リン酸ジ(2−エチルヘキシル)である[1]に記載の希少アルカリ金イオンの選択的回収方法。
[3]前記アルカリ金属イオン抽出剤(b)の使用量が、前記アルカリ金属イオン混合物水溶液(a1)100重量部に対して10〜100重量部である[1]または[2]に記載の希少アルカリ金属イオンの選択的回収方法。
[4]前記炭化水素(c)が、炭素数5〜12の脂環式炭化水素、脂肪族炭化水素および芳香族炭化水素からなる群から選ばれた少なくとも1種の炭化水素である[1]〜[3]のいずれかに記載の希少アルカリ金属イオンの選択的回収方法。
[5]前記工程Aの接触を、スラグ流を形成するマイクロ流路接触装置により行う項1〜4のいずれかに記載の希少アルカリ金属イオンの選択的回収方法。
[6]前記工程Cの接触を、スラグ流を形成するマイクロ流路接触装置により行う[1]〜[5]のいずれかに記載の希少アルカリ金属イオンの選択的回収方法。
[7]前記工程Aの接触温度が、5〜60℃である[1]〜[6]のいずれかに記載の希少アルカリ金属イオンの選択的回収方法。
[8]前記酸(f)が塩酸または硫酸である[1]〜[7]のいずれかに記載の希少アルカリ金属イオンの選択的回収方法。
[9]前記工程Aの水相(d)のpHを6.5〜12に調製することを特徴とする[1]〜[8]のいずれかに記載の希少アルカリ金属イオンの選択的回収方法。
[10]前記工程Cの水相(g)のpHを0.1〜4に調製することを特徴とする[1]〜[9]のいずれかに記載の希少アルカリ金属イオンの選択的回収方法。
【発明の効果】
【0014】
本発明によれば、ナトリウムイオン、カリウムイオンなどの通常のアルカリ金属イオンに対して、リチウムイオン、ルビジウムイオン、セシウムイオンなどの希少アルカリ金属塩イオンの選択的な分離を達成することができる。本発明によれば、ナトリウムイオン、カリウムイオンなどの通常のアルカリ金属イオンに対して、リチウムイオンのみならず、ルビジウムイオン、セシウムイオンの選択的抽出が達成できるという特徴がある。したがって、本発明によれば、リチウムイオンのみならず、ルビジウムイオン、セシウムイオンを選択的に抽出できるという特徴を有している。また、本発明によれば、希少アルカリ金属イオン抽出速度が速く、工業的に適用できる選択的な回収方法が可能となる。
【図面の簡単な説明】
【0015】
【図1】実施例および比較例で使用した実験装置(マイクロ流路接触装置およびセトラー)の構造を示した。
【図2】実施例1および実施例2の工程Aの抽出結果を示した。
【図3】実施例3および実施例4の工程C〜Eの抽出結果を示した。
【図4】実施例5のD2EHPAシクロヘキサン溶液の再利用による抽出結果を示した。
【図5】実施例6のリチウムイオン、セシウムイオン、ルビジウムイオンの抽出結果を示した。
【図6】実施例7のリチウム、セシウム、ルビジウム、ナトリウムおよびカリウムの混合物の抽出結果を示した。
【図7】実施例8のシェルゾール100、シェルゾール150を使用した抽出結果を示した。
【図8】比較例1のPTBを抽出剤として使用したときのリチウムイオンの抽出結果を実施例1のD2EHPAと対比して示した。
【発明を実施するための形態】
【0016】
−希少アルカリ金属塩イオン(a1)−
本発明において、選択的に抽出される希少アルカリ金属塩イオン(a1)は、リチウムイオン、ルビジウムイオンおよびセシウムイオンからなる群から選ばれた少なくとも1種の希少アルカリ金属塩イオンである。リチウムイオン、ルビジウムイオン、セシウムイオンのいずれか1種のみであってもよいし、リチウムイオン、ルビジウムイオン、セシウムイオンのうちの2種または3種のいずれであってもよい。
【0017】
−アルカリ金属塩イオン(a2)−
本発明において、選択的に抽出される希少アルカリ金属塩イオン(a1)から分離されるアルカリ金属塩イオン(a2)は、ナトリウムイオンおよびカリウムイオンからなる群から選ばれた少なくとも1種のアルカリ金属塩イオンであり、ナトリウムイオンまたはカリウムイオンのいずれか単独であってもよいし、ナトリウムイオンおよびカリウムイオンの両方であってもよい。
【0018】
−アルカリ金属イオン混合物水溶液(a3)−
本発明において、スラグ流を形成するマイクロ流路接触装置に供給されるアルカリ金属イオン混合物水溶液(a3)は、リチウムイオン、ルビジウムイオンおよびセシウムイオンからなる群から選ばれた少なくとも1種の前記希少アルカリ金属塩イオン(a1)と、ナトリウムイオンおよびカリウムイオンからなる群から選ばれた少なくとも1種の前記アルカリ金属塩イオン(a2)とを含むアルカリ金属イオン混合物水溶液である。アルカリ金属イオン混合物水溶液(a3)のpHは6.5〜12、好ましくは7〜11である。
【0019】
このアルカリ金属イオン混合物水溶液(a3)として具体的には、たとえば、リチウムイオン電池もしくはリチウムイオンキャパシタから発生する資源リサイクル材料からコバルト、ニッケル、マンガンなどの遷移金属を回収した後の混合物に起因するものであってもよいし、その他の工業材料に起因する混合物であってもよい。また、セシウムに関しては原子力関連の廃液処理にも適用が予想される。
【0020】
−希少アルカリ金属イオンの選択的回収−
本発明において、ナトリウムイオン、カリウムイオンなどの通常のアルカリ金属イオンに対して、リチウムイオン、ルビジウムイオン、セシウムイオンなどの希少アルカリ金属塩イオンの選択的分離回収を達成することができる。本発明において、ナトリウムイオン、カリウムイオンなどの通常のアルカリ金属イオンに対して、とりわけリチウムイオンのみならず、ルビジウムイオン、セシウムイオンの選択的分離回収が達成できる。したがって、本発明において、リチウムイオンと同時に、ルビジウムイオン、セシウムイオンを選択的分離回収ができる。
【0021】
−アルカリ金属イオン抽出剤(b)−
本発明において使用されるアルカリ金属イオン抽出剤(b)は、リン酸ジアルキルからなる抽出剤であり、さらに具体的には、リン酸ジ(n−へキシル)、リン酸ジ(ジシクロへキシル)、リン酸ジ(2−エチルヘキシル)、リン酸ジ(n−オクチル)、リン酸ジ(n−デシル)などが例できる。これらの中では、リン酸ジ(2−エチルヘキシル)がとくに好ましい。アルカリ金属イオン抽出剤(b)の使用量は、前記アルカリ金属イオン混合物水溶液(a3)100重量部に対して10〜100重量部、好ましくは30〜70重量部である。
【0022】
−炭化水素(c)−
本発明において使用される炭化水素(c)は炭素数5〜12の炭化水素であり、抽出工程において油相を形成するものであり、具体的にはヘキサン、へプタン、オクタン、デカンなどの脂肪族炭化水素、シクロヘキサン、メチルシクロヘキサン、シクロオクタン、シクロデカン、シクロドデカンなどの脂環式炭化水素、ベンゼン、トルエン、キシレン、シメンなどの芳香族炭化水素などを例示することができる。これらの炭化水素のなかでは、シクロヘキサン、メチルシクロヘキサン、シクロオクタン、シクロデカン、シクロドデカンなどの炭素数5〜12の脂環式炭化水素が好ましい。炭化水素(c)の使用量は、前記アルカリ金属イオン混合物水溶液(a3)100重量部に対して30〜300重量部、好ましくは50〜200重量部である。
【0023】
−マイクロ流路接触装置−
本発明の後記工程Aにおいて、前記希少アルカリ金属塩イオン(a1)と前記アルカリ金属塩イオン(a2)とを含む前記アルカリ金属イオン混合物水溶液(a3)は、リン酸ジアルキルからなるアルカリ金属イオン抽出剤(b)と炭化水素(c)の存在下に接触させることにより、希少アルカリ金属塩イオン(a1)を炭化水素(c)に選択的に抽出することができる。この接触には、槽型攪拌槽を採用することもできるし、スラグ流を形成するマイクロ流路接触装置を採用することもできる。抽出効果と抽出速度の点から、スラグ流を形成するマイクロ流路接触装置を採用することが好ましい。スラグ流を形成するマイクロ流路接触装置は、図1に示すように、2つのマイクロシリンジポンプにより、前記アルカリ金属イオン混合物水溶液(a3)と、前記アルカリ金属イオン抽出剤(b)と前記炭化水素(c)混合溶液が2つの流路から供給され、スラグ流が形成されて2液が接触されるように設計されている。
【0024】
また、本発明の後記工程Cにおいて、後記工程Bで分離された油相(e)を、水の存在下に、酸(f)と接触させることにより、水相(g)と油相(h)が形成され、希少アルカリ金属塩イオン(a1)を水相(g)に選択的に抽出することができる。この接触には、槽型攪拌槽を採用することもできるし、スラグ流を形成するマイクロ流路接触装置を採用することもできる。抽出効果と抽出速度の点から、スラグ流を形成するマイクロ流路接触装置を採用することが好ましい。スラグ流を形成するマイクロ流路接触装置は、図1に示すように、2つのマイクロシリンジポンプにより、工程Bで分離された油相(e)と酸(f)との混合物が2つの流路から供給され、スラグ流が形成されて2液が水の存在下に接触するように設計されている。
【0025】
本発明において実施例で使用されたマイクロ流路接触装置とセトラーの組み合わせを図1に示した。マイクロ流路接触装置は試作品である。
【0026】
−工程A−
本発明の工程Aでは、前記希少アルカリ金属塩イオン(a1)と前記アルカリ金属塩イオン(a2)とを含むアルカリ金属イオン混合物水溶液(a3)が、前記アルカリ金属イオン抽出剤(b)と炭化水素(c)の存在下に接触させることにより、水相(d)と油相(e)が形成される。この接触には、槽型攪拌槽を採用することもできるし、スラグ流を形成するマイクロ流路接触装置を採用することもできる。抽出効果と抽出速度の点から、スラグ流を形成するマイクロ流路接触装置を採用することが好ましい。接触の際のpHは6.5〜12、好ましくは7〜11である。接触の際の温度は5〜60℃、好ましくは10〜40℃である。また、接触の際の線速度は0.001〜3m/sec、好ましくは 0.01 〜0.35m/secである。
【0027】
−工程B−
本発明の工程Bでは、前記工程Aにおいて形成された前記水相(d)と前記油相(e)からなる混合物を、通常は流出物を静置することにより、前記水相(d)と前記油相(e)とを分液することにより達成できる。前記水相(d)には前記アルカリ金属塩イオン(a2)が選択的に抽出され、前記油相(e)には希少アルカリ金属塩イオン(a1)が選択的に抽出される。
【0028】
−工程C−
本発明の工程Cでは、前記工程Bで分離された前記油相(e)を、水の存在下に酸(f)と接触させることにより、水相(g)と油相(h)を形成させる。この接触には、槽型攪拌槽を採用することもできるし、前記スラグ流を形成するマイクロ流路接触装置を採用することもできる。抽出効果と抽出速度の点から、前記スラグ流を形成するマイクロ流路接触装置を採用することが好ましい。酸(f)としては、塩酸、硫酸、リン酸、炭酸などが使用されるが、塩酸または硫酸が好ましい。この接触の際のpHは0.1〜4、好ましくは0.1〜1である。接触の際の温度は10〜50℃、好ましくは15〜40℃である。また、接触の際の線速度は0.001〜3m/sec、好ましくは 0.01 〜0.35m/secである。
【0029】
−工程D−
本発明の工程Dでは、前記工程Cで形成された前記水相(g)と前記油相(h)とを分離する。通常は静置することにより、前記水相(g)と前記油相(h)とを分液することができる。前記水相(g)から希少アルカリ金属塩イオン(a1)が選択的に得られる。前記水相(g)から希少アルカリ金属塩イオン(a1)は前記工程Cで使用される酸(f)の陰イオンと塩を形成しており、たとえばリチウムイオン、ルビジウムイオン、セシウムイオンなどの希少アルカリ金属イオン(a1)の化合物として回収される。たとえば、前記工程Cで使用される酸(f)が塩酸である場合には、希少アルカリ金属の塩化物として回収され、前記工程Cで使用される酸(f)が硫酸である場合には、希少アルカリ金属の硫酸塩として回収され、前記工程Cで使用される酸(f)が炭酸である場合には、希少アルカリ金属の炭酸塩として回収される。
【実施例】
【0030】
実施例1
リチウムイオンの正抽出(工程A〜B)
図1にしめすマイクロ流路装置およびセトラーを組み合わせた装置を実験に使用した。マイクロ流路接触装置はアクリル製の導入、流路および吐出プレートによって構成される。油相および水相溶液はそれぞれシリンジポンプを用いて、導入プレートから等流量で供給され、Y字型合流部にて合流し、チャネル内(i.d.500μm)を流れる。2液はビーズ挿入部(i.d.2.0mm)でスラグ流を発生し、吐出プレートからポリテトラフルオロエチレン(PTFE)チューブ(i.d.800μm、長さ100mm)内へ供給され、セトラーに達する。その後スラグ流は油相と水相に迅速に分離され、別々の出口から連続的に回収される。
0.01mol/L の硝酸リチウム水溶液および1.0mol/LのD2EHPAのシクロヘキサン溶液をシリンジポンプで、同じ流量で所定流量(2.3〜5.8mL/h、接触時間:40〜100秒)で、25℃で抽出および分離操作を連続して行った。炎光分析で抽出後の水相中のリチウムイオン濃度を測定し、(1)式より抽出百分率E(Extraction efficiency)を算出した。
E = (Ca0-Ca1) / Ca0 x 100 (1)
Ca0: 供給する水溶液のリチウムイオンの濃度
Ca1: 抽出操作後の水溶液に残存するリチウムイオンの濃度
その結果を図2に示した。図2に示すように、接触時間が40秒で、抽出平衡に至ることが明らかになった。
【0031】
実施例2
0.01mol/L の硝酸リチウム水溶液および1.0mol/LのD2EHPAをフラスコ内に4mLずつ瞬時に接触開始し、マイクロ流路接触装置を使用することなく、槽型攪拌槽を使用して400rpmで激しく攪拌して抽出操作を行ったところ、図2に示すように接触時間が100秒で抽出率は65%、抽出平衡に至るには約1000秒を要した。マイクロ流路接触装置の抽出速度が速いことを示している。
【0032】
実施例3
リチウムイオンの逆抽出(工程C〜E)
正抽出(0.01M LiNO3+2M D2EHPA)で平衡に達した溶液(Liの濃度:9x 10−2mol/L)と1mol/Lの塩酸を、工程A〜Bと同じ方法で同じ流量で所定流量(2.3〜5.8mL/h、接触時間:40〜100秒)で、25℃で逆抽出および分離(回収)操作を連続して行った。
炎光分析で逆抽出後の水相のアルカリ金属イオン濃度を測定し、(2)式より逆抽出百分率Eb(Back extraction efficiency)を算出した。その結果を図3に示した。
Eb = (Ca2/Co2) × 100 (2)
Ca2: 塩酸中に逆抽出されたリチウムイオンの濃度
Co2: 供給するシクロヘキサン中のリチウムイオンの濃度
図3に示すように、接触時間が40秒で、完全な逆抽出(100%)に至り、回収にも成功した。
【0033】
実施例4
同じ溶液を4mLずつ瞬時に接触開始し、マイクロ流路接触装置を使用することなく、槽型攪拌槽を用いて400rpmで激しく攪拌して抽出操作を行ったところ、図3に示すように接触時間が100秒で抽出率は40%、抽出平衡に至るには約1000秒を要した。逆抽出においてもマイクロ流路接触装置の抽出速度が速いことを示唆している。
【0034】
実施例5
実施例3の逆抽出後のD2EHPAシクロヘキサン溶液を再び、実施例1の抽出溶液として繰り返し使用したところ、抽出量および速度に変化がなかった。3回の繰り返し実験を行ったところ、図4に示すようにD2EHPAシクロヘキサン溶液の抽出液としての性能は劣化せず、マイクロ流路接触装置を用いる工程A〜Eについて最適であることが示している。
【0035】
実施例6
実施例1のリチウムイオンと場合と同様に、セシウム、ルビジウムについても抽出実験を行った結果を図5に示す。
この場合もマイクロ流路接触装置の抽出速度が槽型攪拌槽よりも早いいことを示唆している。また、金属の種類により抽出率が、リチウム、セシウム、ルビジウムの順に小さくなることがわかった。このことはD2EHPAシクロヘキサン溶液がアルカリ金属イオンの抽出に対して選択性分離を可能であることを示唆している。
【0036】
実施例7
選択性を確認するために、リチウム、セシウム、ルビジウムに加えてナトリウムおよびカリウムの5種類について、実施例1と同じ条件でD2EHPAシクロヘキサン溶液の抽出実験を行った。実験は各イオンが単独に水溶液に溶解している場合、およびすべてのイオンが溶解している場合について実施した。図6に各イオンの抽出率の結果を示す。
単独のイオンが溶解しているときの抽出率は、リチウム、セシウム、ルビジウム、カリウム、ナトリウムの順でカリウムおよびナトリウムの抽出率は他の金属イオンの抽出率より格段に低かった。この傾向は混合用液の場合も変わらず、このことはリチウム、セシウム、ルビジウムの選択回収に、D2EHPAシクロヘキサン溶液が適していることを示している。
【0037】
実施例8〜9
実施例1において、シクロヘキサンの代わりに、シェルゾール100、シェルゾール150を使用したほか、実施例1と同様に抽出実験を行った。その結果を、シクロヘキサン(実施例1)と対比して図7に示す。
【0038】
比較例1
実施例1において、抽出剤としてリン酸ジ(2−エチルヘキシル)(D2EHPA)に代えてリン酸トリ‐n‐ブチル(PTB)を使用し、実施例1と同様に実験を行った。その結果を実施例1と対比して図8に示す。
【特許請求の範囲】
【請求項1】
リチウムイオン、ルビジウムイオンおよびセシウムイオンからなる群から選ばれた少なくとも1種の希少アルカリ金属塩イオン(a1)と、ナトリウムイオンおよびカリウムイオンからなる群から選ばれた少なくとも1種のアルカリ金属塩イオン(a2)とを含むアルカリ金属イオン混合物水溶液(a3)と、リン酸ジアルキルからなるアルカリ金属イオン抽出剤(b)とを、炭化水素(c)の存在下に接触させ、水相(d)と油相(e)を形成させる工程Aと、
前記水相(d)と前記油相(e)とを分離する工程Bと、
前記工程Bで分離された前記油相(e)を、水の存在下に酸(f)と接触させることにより、水相(g)と油相(h)を形成させる工程Cと、
前記水相(g)と前記油相(h)とを分離する工程Dと、
前記水相(g)から希少アルカリ金属塩イオン(a1)を回収する工程Eとを、
含むことを特徴とする希少アルカリ金属イオンの選択的回収方法。
【請求項2】
前記アルカリ金属イオン抽出剤(b)が、リン酸ジ(2−エチルヘキシル)である請求項1に記載の希少アルカリ金属イオンの選択的回収方法。
【請求項3】
前記アルカリ金属イオン抽出剤(b)の使用量が、前記アルカリ金属イオン混合物水溶液(a1)100重量部に対して10〜100重量部である請求項1または2に記載の希少アルカリイオンの選択的回収方法。
【請求項4】
前記炭化水素(c)が、炭素数5〜12の脂環式炭化水素、脂肪族炭化水素および芳香族炭化水素からなる群から選ばれた少なくとも1種の炭化水素である請求項1〜3のいずれかに記載の希少アルカリ金属イオンの選択的回収方法。
【請求項5】
前記工程Aの接触を、スラグ流を形成するマイクロ流路接触装置により行う請求項1〜4のいずれかに記載の希少アルカリ金属イオンの選択的回収方法。
【請求項6】
前記工程Cの接触を、スラグ流を形成するマイクロ流路接触装置により行う請求項1〜5のいずれかに記載の希少アルカリ金属イオンの選択的回収方法。
【請求項7】
前記工程Aの接触温度が、5〜60℃である請求項1〜6のいずれかに記載の希少アルカリ金属イオンの選択的回収方法。
【請求項8】
前記酸(f)が塩酸または硫酸である請求項1〜7のいずれかに記載の希少アルカリ金属イオンの選択的回収方法。
【請求項9】
前記工程Aの水相(d)のpHを6.5〜12に調製することを特徴とする請求項1〜8のいずれかに記載の希少アルカリ金属イオンの選択的回収方法。
【請求項10】
前記工程Cの水相(g)のpHを0.1〜4に調製することを特徴とする請求項1〜9のいずれかに記載の希少アルカリ金属イオンの選択的回収方法。
【請求項1】
リチウムイオン、ルビジウムイオンおよびセシウムイオンからなる群から選ばれた少なくとも1種の希少アルカリ金属塩イオン(a1)と、ナトリウムイオンおよびカリウムイオンからなる群から選ばれた少なくとも1種のアルカリ金属塩イオン(a2)とを含むアルカリ金属イオン混合物水溶液(a3)と、リン酸ジアルキルからなるアルカリ金属イオン抽出剤(b)とを、炭化水素(c)の存在下に接触させ、水相(d)と油相(e)を形成させる工程Aと、
前記水相(d)と前記油相(e)とを分離する工程Bと、
前記工程Bで分離された前記油相(e)を、水の存在下に酸(f)と接触させることにより、水相(g)と油相(h)を形成させる工程Cと、
前記水相(g)と前記油相(h)とを分離する工程Dと、
前記水相(g)から希少アルカリ金属塩イオン(a1)を回収する工程Eとを、
含むことを特徴とする希少アルカリ金属イオンの選択的回収方法。
【請求項2】
前記アルカリ金属イオン抽出剤(b)が、リン酸ジ(2−エチルヘキシル)である請求項1に記載の希少アルカリ金属イオンの選択的回収方法。
【請求項3】
前記アルカリ金属イオン抽出剤(b)の使用量が、前記アルカリ金属イオン混合物水溶液(a1)100重量部に対して10〜100重量部である請求項1または2に記載の希少アルカリイオンの選択的回収方法。
【請求項4】
前記炭化水素(c)が、炭素数5〜12の脂環式炭化水素、脂肪族炭化水素および芳香族炭化水素からなる群から選ばれた少なくとも1種の炭化水素である請求項1〜3のいずれかに記載の希少アルカリ金属イオンの選択的回収方法。
【請求項5】
前記工程Aの接触を、スラグ流を形成するマイクロ流路接触装置により行う請求項1〜4のいずれかに記載の希少アルカリ金属イオンの選択的回収方法。
【請求項6】
前記工程Cの接触を、スラグ流を形成するマイクロ流路接触装置により行う請求項1〜5のいずれかに記載の希少アルカリ金属イオンの選択的回収方法。
【請求項7】
前記工程Aの接触温度が、5〜60℃である請求項1〜6のいずれかに記載の希少アルカリ金属イオンの選択的回収方法。
【請求項8】
前記酸(f)が塩酸または硫酸である請求項1〜7のいずれかに記載の希少アルカリ金属イオンの選択的回収方法。
【請求項9】
前記工程Aの水相(d)のpHを6.5〜12に調製することを特徴とする請求項1〜8のいずれかに記載の希少アルカリ金属イオンの選択的回収方法。
【請求項10】
前記工程Cの水相(g)のpHを0.1〜4に調製することを特徴とする請求項1〜9のいずれかに記載の希少アルカリ金属イオンの選択的回収方法。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【公開番号】特開2012−87358(P2012−87358A)
【公開日】平成24年5月10日(2012.5.10)
【国際特許分類】
【出願番号】特願2010−234866(P2010−234866)
【出願日】平成22年10月19日(2010.10.19)
【出願人】(710011785)
【Fターム(参考)】
【公開日】平成24年5月10日(2012.5.10)
【国際特許分類】
【出願日】平成22年10月19日(2010.10.19)
【出願人】(710011785)

【Fターム(参考)】
[ Back to top ]

