干渉を伴わない糖類ワクチンの分析
【課題】髄膜炎菌の混合性結合体ワクチン内の個々の結合体を測定するために使用され得る方法を提供し、したがってワクチンの品質管理および一貫性における改良を提供する。
【解決手段】本発明は、複数の血清群に由来する混合した髄膜炎菌の糖類の分析を、これらの血清群が単糖類単位を共有するにもかかわらず可能にする方法に基づく。血清群C由来、血清群W135由来および血清群Y由来の糖類の組み合わせに関して、本発明は、シアル酸含有量、グルコース含有量およびガラクトース含有量を分析する。このグルコースの結果およびガラクトースの結果が使用されて、血清群Y由来および血清群W135由来の糖類が、それぞれ直接定量化され、そしてこのグルコースおよびガラクトースの合わせた含有量は、このシアル酸含有量から減じられて、血清群C由来の糖類が定量化される。
【解決手段】本発明は、複数の血清群に由来する混合した髄膜炎菌の糖類の分析を、これらの血清群が単糖類単位を共有するにもかかわらず可能にする方法に基づく。血清群C由来、血清群W135由来および血清群Y由来の糖類の組み合わせに関して、本発明は、シアル酸含有量、グルコース含有量およびガラクトース含有量を分析する。このグルコースの結果およびガラクトースの結果が使用されて、血清群Y由来および血清群W135由来の糖類が、それぞれ直接定量化され、そしてこのグルコースおよびガラクトースの合わせた含有量は、このシアル酸含有量から減じられて、血清群C由来の糖類が定量化される。
【発明の詳細な説明】
【技術分野】
【0001】
本明細書中に引用される全ての文献は、その全体が参考として援用される。
【0002】
(技術分野)
本発明は、ワクチンの分析および品質管理の分野にあり、このワクチンは、細菌の莢膜糖類を含み、そして特に、この糖類がキャリアに結合体化される糖類を含む。
【背景技術】
【0003】
(背景技術)
キャリアタンパク質に結合体化された莢膜糖類抗原を含む免疫原は、当該分野において周知である。結合体化は、T細胞非依存性抗原をT細胞依存性抗原に変換し、それによって記憶応答(memory response)を増強し、そして防御免疫を発生させ、そして原型の結合体ワクチンは、Haemophilus influenzaeタイプb(Hib)に対するものであった(例えば、非特許文献1の第14章を参照のこと)。Hibワクチン以来、Neisseria meningitidis(髄膜炎菌)およびStreptococcus pneumoniae(肺炎球菌)に対して保護するための結合型糖類ワクチンが、開発された。結合体ワクチンが目的とする他の生物は、Streptococcus agalactiae(B群連鎖球菌)(非特許文献2)、Pseudomonas aeruginosa(非特許文献3)およびStaphylococcus aureus(非特許文献4)である。
【0004】
N.meningitidisの血清群Cに対する結合体ワクチンは、ヒトに対する使用が認可され、そしてこれらとしては、MenjugateTM(非特許文献5)、MeningitecTMおよびNeisVac−CTMが挙げられる。血清群A、血清群C、血清群W135および血清群Yの各々からの結合体の混合物が、報告され(例えば、特許文献1、特許文献2、非特許文献6および非特許文献7)、これらとしては、MenactraTM製品が挙げられる。結合型抗原の他の混合物としては、以下が挙げられる:(i)髄膜炎菌性のA/Cの混合物(非特許文献8、非特許文献9);(ii)7つの肺炎球菌の結合体を含むPrevNarTM製品(非特許文献10);(iii)髄膜炎菌およびHibの混合した結合体(非特許文献11、非特許文献12);および(iv)髄膜炎菌、肺炎球菌およびHibの合わせた結合体(非特許文献13)。
【0005】
結合体ワクチンを取り扱う工程が安定性およびバッチ間の一貫性を含む場合を示す。例えば、Hibワクチンにおいて、糖類の触媒性解重合が、報告され(非特許文献14)、そして血清群Aの髄膜炎菌莢膜の結合体は、容易に加水分解される(特許文献3)。結合体の不安定性は、望ましくない、長期にわたる免疫原性結合体の有効量の減少、バッチ間の変動を生じ、そして特徴付けられない分解産物のレベルを増加させる。非特許文献15および非特許文献16は、Hib結合体ワクチンの安定性試験に関する問題を議論する。
【0006】
定量的な複合糖質の分析は代表的に、糖類の加水分解の第1の工程を包含し、その後この分析は、遊離した単糖類に基づく分析を伴う。この分析は、単一の結合体に対して、相対的に分かりやすい(例えば、アニオン交換クロマトグラフィー法は、Hibの加水分解された結合体(非特許文献17)および血清群Aの髄膜炎菌の加水分解された結合体(非特許文献18)を分析するために使用されてきた)のに対して、この状況は、特に異なる糖類が単糖類単位を共有する場合、ワクチンの組み合わせにおいて、より複雑である。例えば、髄膜炎菌の血清群C、血清群W135および血清群Yの莢膜糖類は、全てシアル酸を含み、したがって、遊離したシアル酸の測定に基づく任意の方法は、この3種の血清群を区別し得ない。
【先行技術文献】
【特許文献】
【0007】
【特許文献1】国際公開第02/058737号パンフレット
【特許文献2】国際公開第03/007985号パンフレット
【特許文献3】国際公開第03/080678号パンフレット
【非特許文献】
【0008】
【非特許文献1】Plotkinら編、「Vaccines」、第4版、ISBNコード0721696880
【非特許文献2】Bakerら、「J Infect Dis」、2003年、第188巻、p.66−73
【非特許文献3】Theilackerら、「Infect Immun」、2003年、第71巻、p.3875−84
【非特許文献4】Anonymous、「Drugs R D」、2003年、第4巻、p.383−5
【非特許文献5】Jones、「Curr Opin Investig Drugs」、2001年、第2巻、p.47−49
【非特許文献6】Rennelsら、「Pediatr Infect Dis J」、2002年、第21巻、p.978−979
【非特許文献7】Campbellら、「J Infect Dis」、2002年、第186巻、p.1848−1851
【非特許文献8】Costantinoら、「Vaccine」、1992年、第10巻、p.691−698
【非特許文献9】Liebermanら、「JAMA」、1996年、第275巻、p.1499−1503
【非特許文献10】DarkesおよびPlosker、「Paediatr Drugs」、2002年、第4巻、p.609−630
【非特許文献11】Ugozzoli、「J Infect Dis」、2002年、第186巻、p.1358−61
【非特許文献12】Granoffら、「Infect Immun」、1997年、第65巻、p.1710−5
【非特許文献13】ParadisoおよびLindberg、「Dev Biol Stand」、1996年、第87巻、p.269−275
【非特許文献14】Corbel、「Dev Biol Stand」、1996年、第87巻、p.113−124
【非特許文献15】Klug、「Dev Biol Stand」、1996年、第87巻、p.263−267
【非特許文献16】PlumbおよびYost、「Vaccine」、1996年、第14巻、p.399−404
【非特許文献17】Tsaiら、「Vaccine」、1994年、第12巻、p.700−706
【非特許文献18】Ricciら、「Vaccine」、2001年、第19巻、p.1989−1997
【発明の概要】
【発明が解決しようとする課題】
【0009】
安定性および完全性を評価するための結合体ワクチン中の糖類の定量的評価における改良を提供することは、本発明の目的である。特に、髄膜炎菌の混合性結合体ワクチン内の個々の結合体を測定するために使用され得る方法を提供し、したがってワクチンの品質管理および一貫性における改良を提供することが、目的である。
【課題を解決するための手段】
【0010】
(発明の開示)
本発明は、複数の血清群に由来する混合した髄膜炎菌の糖類の分析を、これらの糖類が単糖類単位を共有するにもかかわらず可能にする方法に基づく。したがって、本発明は、組成物の糖類含有量を分析するためのプロセスであって、ここで:
(a)この組成物が、血清群CのNeisseria meningitidis由来の莢膜糖類、ならびに(i)血清群W135のNeisseria meningitidis由来の莢膜糖類;および/または(ii)血清群YのNeisseria meningitidis由来の莢膜糖類の一方もしくは両方を含有し;
(b)このプロセスが、この組成物のシアル酸含有量を分析する工程を包含し、そして:(i)この組成物が、血清群W135の糖類を含有する場合、この組成物のガラクトース含有量を分析する工程を包含し;(ii)この組成物が、血清群Yの糖類を含有する場合、この組成物のグルコース含有量を分析する工程を包含し;
(c)この組成物が、血清群W135の糖類を含有する場合、この組成物中の血清群W135の糖類の含有量が、工程(b)から得たガラクトース分析の結果によって決定され;
(d)この組成物が、血清群Yの糖類を含有する場合、この組成物中の血清群Yの糖類の含有量が、工程(b)から得たグルコース分析の結果によって決定され;そして
(e)この組成物中の血清群Cの糖類の含有量が、シアル酸分析の結果を:(i)この組成物が、血清群W135の糖類を含有するが、血清群Yの糖類を含有しない場合には工程(b)から得たガラクトース分析の結果;(ii)この組成物が、血清群Yの糖類を含有するが、血清群W135の糖類を含有しない場合には工程(b)から得たグルコース分析の結果;または(iii)この組成物が、血清群W135の糖類および血清群Yの糖類両方を含有する場合には工程(b)から得たグルコース分析およびガラクトース分析の合わせた結果と比較することによって決定されるプロセスを提供する。
【0011】
したがって、血清群C由来、血清群W135由来および血清群Y由来の糖類の組み合わせに関して、本発明は、シアル酸含有量、グルコース含有量およびガラクトース含有量を分析する。このグルコースの結果およびガラクトースの結果が使用されて、血清群Y由来および血清群W135由来の糖類が、それぞれ直接定量化され、そしてこのグルコースおよびガラクトースの合わせた含有量は、このシアル酸含有量から減じられて、血清群C由来の糖類が定量化される。したがって、この3種の血清群は、これらの単糖類の含有量が重複するにもかかわらず決定され得る。本発明者らは、この3種の異なる単糖類の分析が、これらの単糖類の間の干渉および上記組成物中の任意の他の糖類物質(例えば、凍結乾燥安定剤)による干渉を伴わずに同じ材料に対して行われ得ることを有利に見出した。本方法が使用されて、結合体ワクチン中の全糖類および遊離糖類が分析され、そして複数の血清群の莢膜糖類を含むワクチンの品質管理が単純化される。
【0012】
干渉を伴わずにアルドース、ヘキソサミンおよびシアル酸の混合物を分析するための方法が記載される[22]が、これは酵素的処理および化学的誘導体化に依存する。対照的に、本発明のプロセスは、このような工程を必要とせず、したがって、より迅速かつ容易に実施される。さらに、参考文献22中で扱われる状況は、共通の単糖類単位を共有する異なる糖類を分解を分離しなければならないという固有の問題に苦しむ。
【0013】
本発明はまた、本発明のプロセスを実施するのに適合されるコンピューター装置を提供する。特に、本発明は、上記に定義されるような組成物の糖類含有量を分析するためのコンピュータープログラムであって、(a)サンプルのシアル酸含有量、ならびにグルコース含有量および/またはガラクトース含有量についてのデータを受容し;そして(b)このデータから、血清群C由来の莢膜糖類の含有量、ならびに血清群W135由来の莢膜糖類の含有量および/または血清群Yの莢膜糖類の含有量を計算するためのプログラムモジュールを備えるコンピュータープログラムを提供する。本発明はまた、コンピューターが読み込み可能な記憶媒体を備えるコンピュータープログラム製品を提供し、この記憶媒体は、本発明のコンピュータープログラムを記憶する。
本発明はまた、以下の項目を提供する。
(項目1)
組成物の糖類含有量を分析するためのプロセスであって、ここで以下:
(a)該組成物が、血清群CのNeisseria meningitidis由来の莢膜糖類、ならびに:(i)血清群W135のNeisseria meningitidis由来の莢膜糖類;および/または(ii)血清群YのNeisseria meningitidis由来の莢膜糖類の一方もしくは両方を含有し;
(b)該プロセスが、該組成物のシアル酸含有量を分析する工程を包含し、そして:(i)該組成物が、血清群W135の糖類を含有する場合、該組成物のガラクトース含有量を分析する工程を包含し;(ii)該組成物が、血清群Yの糖類を含有する場合、該組成物のグルコース含有量を分析する工程を包含し;
(c)該組成物が、血清群W135の糖類を含有する場合、該組成物中の血清群W135の糖類含有量が、工程(b)から得た該ガラクトース分析の結果によって決定され;
(d)該組成物が、血清群Yの糖類を含有する場合、該組成物中の血清群Yの糖類含有量が、工程(b)から得た該グルコース分析の結果によって決定され;そして
(e)該組成物中の血清群Cの糖類含有量が、該シアル酸分析の結果を:(i)該組成物が、血清群W135の糖類を含有するが、血清群Yの糖類を含有しない場合には工程(b)から得た該ガラクトース分析の結果;(ii)該組成物が、血清群Yの糖類を含有するが、血清群W135の糖類を含有しない場合には工程(b)から得た該グルコース分析の結果;または(iii)該組成物が、血清群W135の糖類および血清群Yの糖類両方を含有する場合には工程(b)から得た該グルコース分析および該ガラクトース分析の合わせた結果と比較することによって決定される、
プロセス。
(項目2)
上記組成物が、血清群CのNeisseria meningitidis、血清群W135のNeisseria meningitidisおよび血清群YのNeisseria meningitidisの3種全てに由来する莢膜糖類を含有する、項目1に記載のプロセス。
(項目3)
上記組成物が、1種以上のさらなる莢膜糖類を含有する、項目2に記載のプロセス。
(項目4)
上記1種以上のさらなる莢膜糖類が、血清群AのN.meningitidis由来の莢膜糖類;およびHaemophilus influenzae b由来の莢膜糖類からなる群より選択される、項目3に記載のプロセス。
(項目5)
項目1〜4のいずれかに記載のプロセスであって、上記莢膜糖類を解重合して、その構成単糖類を提供するために上記組成物を処理する工程を包含する、プロセス。
(項目6)
シアル酸含有量、グルコース含有量および/またはガラクトース含有量が、必要に応じてアンペロメトリック電気化学検出を伴う、高速アニオン交換クロマトグラフィーによって測定される、項目1〜5のいずれかに記載のプロセス。
(項目7)
項目1〜6のいずれかに記載のプロセスであって、以下:
重量オスモル濃度、pH、個々の糖類または結合体の重合度、タンパク質含有量、アルミニウム含有量、洗浄剤含有量、および保存剤含有量、
の構成要素または特性の1つ以上が分析される工程をまた包含する、プロセス。
(項目8)
上記莢膜糖類が、糖類−タンパク質結合体に由来する、項目1〜7のいずれかに記載のプロセス。
(項目9)
上記結合体中のタンパク質が、細菌毒素または細菌トキソイドである、項目8に記載のプロセス。
(項目10)
上記毒素またはトキソイドが、ジフテリアトキソイド;破傷風トキソイド;CRM197ジフテリア毒素誘導体;およびH.influenzae由来のプロテインDからなる群より選択される、項目9に記載のプロセス。
(項目11)
組成物を分析するためのプロセスであって、以下:
(a)該組成物が、血清群CのNeisseria meningitidis由来の莢膜糖類の結合体、ならびに:(i)血清群W135のNeisseria meningitidis由来の莢膜糖類の結合体;および/または(ii)血清群YのNeisseria meningitidis由来の莢膜糖類の結合体の一方もしくは両方を含有し;
(b)該組成物が、非結合型の形態である該莢膜糖類を含有し得;
(c)任意の非結合型莢膜糖類の含有量が、項目1〜7のいずれか1項に記載のプロセスによって決定され;
(d)結合型莢膜糖類の含有量が、項目1〜7のいずれか1項に記載のプロセスによって決定され;そして、必要に応じて
(e)該組成物中の、結合型糖類:非結合型糖類の比が、該莢膜糖類の1種以上について計算される、
プロセス。
(項目12)
少なくとも2種の異なる髄膜炎菌の血清群由来の莢膜糖類の混合物内の、個々の血清群由来の糖類を定量化するためのプロセスであって、ここで:(a)該異なる血清群が、血清群C、ならびに:(i)血清群W135および/または(ii)血清群Yの一方または両方を含み;(b)該プロセスが、該混合物内の該莢膜糖類を解重合して、解重合した混合物を提供する工程を包含し;そして(c)該異なる血清群が、該解重合した混合物の単糖類の組成を比較することによって定量化される、プロセス。
(項目13)
医師による使用のためのワクチンを販売するための方法であって、(a)血清群CのNeisseria meningitidis由来の莢膜糖類の結合体、ならびに:(i)血清群W135のNeisseria meningitidis由来の莢膜糖類の結合体;および/または(ii)血清群YのNeisseria meningitidis由来の莢膜糖類の結合体の一方もしくは両方を含むワクチンを製造する工程;(b)該莢膜糖類の各々についての該ワクチン中の、結合型糖類および/または非結合型糖類の量を分析する工程を包含し;そして工程(b)から得た結果が、臨床使用において受容可能な糖類含有量を示す場合、(c)医師による使用のための該ワクチンを販売する工程を包含する、方法。
(項目14)
ワクチンの2つのバッチであって、ここで以下:
(a)ワクチンの該バッチの各々が、血清群CのNeisseria meningitidis由来の莢膜糖類の結合体、ならびに:(i)血清群W135のNeisseria meningitidis由来の莢膜糖類の結合体;および/または(ii)血清群YのNeisseria meningitidis由来の莢膜糖類の結合体の一方もしくは両方を含み;
(b)該第1のバッチ中の血清群Cの結合型糖類の濃度が、C1であり;
(c)該第2のバッチ中の血清群Cの結合型糖類の濃度が、C2であり;
適用可能な場合、(d)該第1のバッチ中の血清群W135の結合型糖類の濃度が、W1であり;
適用可能な場合、(e)該第2のバッチ中の血清群W135の結合型糖類の濃度が、W2であり;
適用可能な場合、(f)該第1のバッチ中の血清群Yの結合型糖類の濃度が、Y1であり;
適用可能な場合、(g)該第2のバッチ中の血清群Yの結合型糖類の濃度が、Y2であり;
そしてここで(h)C1/C2、W1/W2およびY1/Y2の比が、それぞれ0.90と1.10との間である、
バッチ。
(項目15)
項目14に記載のバッチであって、ここで:(i)上記第1のバッチ中の血清群Cの非結合型糖類の濃度が、C3であり;(j)上記第2のバッチ中の血清群Cの非結合型糖類の濃度が、C4であり;適用可能な場合、(k)該第1のバッチ中の血清群W135の非結合型糖類の濃度が、W3であり;適用可能な場合、(l)該第2のバッチ中の血清群W135の非結合型糖類の濃度が、W4であり;適用可能な場合、(m)該第1のバッチ中の血清群Yの非結合型糖類の濃度が、Y3であり;適用可能な場合、(n)該第2のバッチ中の血清群Yの非結合型糖類の濃度が、Y4であり;(o)C3/C4、W3/W4およびY3/Y4の比が、それぞれ0.90と1.10との間であり、そして好ましくはそれぞれ0.95と1.05との間である、バッチ。
(項目16)
項目15に記載のバッチであって、(p)C3/C1、C4/C2、W3/W1、W4/W2、Y3/Y1およびY4/Y2の比が、それぞれ0.20未満である、バッチ
(項目17)
項目1〜12のいずれか1項に記載のプロセスを実施するのに適合されるコンピューター装置。
(項目18)
項目1に定義されるような組成物の糖類含有量を分析するためのコンピュータープログラムであって、(a)サンプルのシアル酸含有量、ならびにグルコース含有量および/またはガラクトース含有量についてのデータを受容し;そして(b)該データから、血清群C由来の莢膜糖類含有量、ならびに血清群W135由来の莢膜糖類含有量および/または血清群Yの莢膜糖類含有量を計算するためのプログラムモジュールを備える、コンピュータープログラム。
【0014】
(血清群C、血清群W135および血清群Yの莢膜糖類)
本発明の方法は、髄膜炎菌の莢膜糖類の混合物を分析するための方法である。この混合物は、(i)血清群C由来の莢膜糖類、ならびに(ii)血清群W135由来および血清群Y由来の莢膜糖類のいずれかまたは両方(すなわち、C+W135、C+Y、またはC+W135+Y)を含む。さらなる糖類がまた、存在し得る。
【0015】
上記血清群Cの莢膜糖類は、(α2→9)結合型シアル酸(N−アセチルノイラミン酸、または「NeuNAc」)のホモポリマーである。ほとんどの血清群C株は、シアル酸残基のC−7および/またはC−8にO−アセチル基を有するが、約15%の臨床単離体は、これらのO−アセチル基を欠く[23、24]。このアセチル化は、保護性の効力に影響しないようである(例えば、MenjugateTM製品とは違って、NeisVac−CTM製品は、脱O−アセチル化糖類を使用するが、両方のワクチンは、有効である)。この糖類の構造は、図13に示され、そして以下:
【0016】
【化1】

のように記述される。
【0017】
血清群W135の糖類は、シアル酸−ガラクトースの二糖類単位のポリマーである。血清群Cの糖類のように、血清群W135の糖類は、可変のO−アセチル化を有する(但し、シアル酸の7位および9位において)[25]。この構造は、図14に示され、そして以下:
【0018】
【化2】

のように記述される。
【0019】
血清群Yの糖類は、二糖類の反復単位がガラクトースの代わりにグルコースを含むことを除いて、血清群W135の糖類と同様である(図16を参照のこと)。血清群W135の糖類のように、血清群Yの糖類は、シアル酸の7位および9位に可変のO−アセチル化を有する[25]。血清群Yの構造は、図15に示され、そして以下:
【0020】
【化3】

のように記述される。
【0021】
したがって、血清群C由来、血清群W135由来および血清群Y由来の莢膜糖類を含有する組成物中に、3種の異なる構成モノマー(グルコース、ガラクトース、およびシアル酸)が存在し、そしてこれらの3種のモノマーは、加水分解後の混合物中に存在する。このような混合物中のグルコースモノマーの量は、最初の組成物中の血清群Yの糖類の量に直接関連し、ガラクトースモノマーの量は、W135の糖類の量に直接関連する。しかし、血清群Cに関して、この状況は、より複雑であり:シアル酸は、血清群Cの糖類を定量化するのに利用可能な唯一のモノマーであるが、上記混合物中のシアル酸の含量のあらゆる測定は、血清群W135の糖類および血清群Yの糖類に由来するモノマーを含む。本発明は、ガラクトース、グルコースおよびシアル酸の各々の混合物中の含有量を(別々におよび/または同時に)測定し、次いで(a)ガラクトース含有量を使用して、加水分解前の血清群W135含有量を定量化し;(b)グルコース含有量を使用して加水分解前の血清群Y含有量を定量化し;(b)シアル酸含有量とグルコースおよびガラクトースの合わせた含有量との間の差を使用して、加水分解前の血清群C含有量を定量化する(すなわち、血清群Cのモル濃度量は、シアル酸のモル濃度量から(グルコース+ガラクトース)のモル濃度量を差し引くことによって計算される)ことによってこの分析の複雑性を克服する。シアル酸のモル濃度含有量からの、グルコースのモル濃度含有量およびガラクトースのモル濃度含有量の減算は、血清群W135および血清群Yによる干渉を補正し、そして血清群Cからのシアル酸のみを残す。
【0022】
本発明が使用されて、種々の長さの莢膜糖類が分析され得る。例えば、MenjugateTMおよびMeningitecTMが、血清群Cの完全長ポリ糖類からのサイズを選択したフラグメント(オリゴ糖)を含有するのに対して、NeisVac−CTMは、完全長のポリ糖類を使用する。本発明は、オリゴ糖および/または完全長ポリ糖類と共に使用され得る。オリゴ糖は、細菌中に存在するネイティブな莢膜ポリ糖類において見出される重合度(DP)より小さい重合度を有し、そして30未満(例えば、10と25との間)の平均DPを有し得る。DPは、イオン交換クロマトグラフィーまたは比色定量アッセイによって簡便に測定され得る[26]。
【0023】
(単糖類含有量の分析)
本発明のプロセスは、シアル酸の含有量、ガラクトースの含有量(血清群W135が存在する場合)、およびグルコースの含有量(血清群Yが存在する場合)を分析する工程を包含する。プロセスが、組成物中の単糖類単位の存在をモニタリングするため(例えば、単に、生成の初期段階からの残留単糖類をモニタリングためか、または結合体からのモノマーの可能な加水分解性の遊離をモニタリングするため)に実施される場合、このプロセスは、この組成物に対して直接実施され得る。しかし、代表的に、このプロセスは、組成物の糖類の総含有量を測定するために使用され、しがたってこの組成物は、この分析前に単糖類まで加水分解される。したがって、本発明のプロセスは、代表的に、莢膜糖類を解重合してそれらの構成単糖類を得るために、組成物を処理する工程を包含する。その後、シアル酸含有量ならびにガラクトース含有量および/またはグルコース含有量の分析は、解重合された混合物の遊離した単糖類に対して進められ得る。
【0024】
莢膜糖類をそれらの構成単糖類まで解重合するための条件は、当該分野において公知である。例えば、血清群Cの糖類は、糖類の総含有量の分析のために100mM HClによる80℃で2時間の処理によって加水分解され得る[27]。トリフルオロ酢酸(TFA)を使用する酸加水分解は、血清群Cのシアル酸の分解を避けるために、血清群Cについて好ましいわずかに低いインキュベーション温度(100℃よりもむしろ90℃)によって、血清群C、血清群W135および血清群Yの全てを加水分解するために使用され得る。代表的なTFA処理は、TFAを2Mの最終濃度まで添加し、次いで90分間、90℃〜100℃に加熱する工程を包含する。解重合の後、糖類加水分解物は、例えば、減圧乾燥器(vacuum drier)を使用して乾燥され得る。
【0025】
解重合の後、組成物は、血清群Cならびに血清群W135および/または血清群Yに由来する混合した単糖類を含む。この混合物中のこれらの単糖類の量は、加水分解前の本来の組成物中の糖類の含量に直接関係し、したがって最初の糖類の含量は、上記のように決定され得る。量は、分子の数(例えば、モル)、質量、比または濃度の項目について決定され得る。シアル酸が、グルコース/ガラクトースと異なる分子量を有する場合、モルを用いることが代表的であるが、これらの測定値のいずれかが、上記混合物の糖類含有量を評価するために使用され、そして置き換えられ得る。定量的な測定のために、分析結果は、特定の糖類の公知の含有量を用いる基準と比較され得る。
【0026】
上記解重合された混合物は、好ましくは単糖類まで完全に加水分解される。本発明者らは、ときとし不完全な加水分解が起こり、二糖類のフラグメント(すなわち、MenW135に対するGal−NeuNAc、およびMenYに対するGlc−NeuNAc)が存在する混合物を与えることを見出した。しかし、上記単糖類は、正確な理論上の比で遊離し、そして上記二糖類は、この単糖類の分析を干渉しないので、二糖類の存在は、困難性をもたらし得ない。
【0027】
解重合の進行は、(例えば、オリゴ糖への部分的加水分解よりもむしろ、単糖類への完全な加水分解を確認するために)公知の技術(例えば、NMR、質量分析など)を使用して、混合物中の重合度(DP)を測定することによって確認され得る。
【0028】
グルコース、ガラクトースおよびシアル酸単糖類を定量化するための方法は、当該分野において周知である。方法は、直接的または間接的であり得る。(例えば、これらの方法は、その単糖類を誘導体化し、次いで本来の単糖類含有量と相関する分析を実施することを包含し得る)。方法は、2種/3種の異なる単糖類を互いから分離し、次いで別個に分析することを包含し、そしてこのような場合において、単糖類含有量の実際の測定は、この分離に起因する特異性を有するそれぞれの事例において同一であり得る。しかし、それらが分析前に互いから分離される必要がないように、互いの存在下においてこの糖類を分析し得る方法を使用することが好ましい。さらに、方法は、結合型糖類に対して使用され得、この結合型糖類において、キャリアおよび糖類は、解重合の後に分けられる必要がない。1つの好ましい方法は、アニオンクロマトグラフィーであり、そして特に、通常はアンペロメトリック電気化学検出(PAD)を備える、高速アニオン交換クロマトグラフィー(HPAEC)である[28、29]。HPAEC−PADシステムは、DionexTM Corporation(Sunnyvale,CA)によって提供され(例えば、BioLCTMシステム)、これは、PA1[ジビニルベンゼンと2%架橋し、第四級アンモニウム官能性化(functionalized)ラテックスの500nm MicroBeadと凝塊形成した(5%架橋した)、直径10μmのポリスチレン担体]またはPA10[ジビニルベンゼンと55%架橋し、二官能性第四級アンモニウムイオンの460nm MicroBeadと凝塊形成した(5%架橋した)、直径10μmのエチレンビニルベンゼン担体]のようなカラムを用いる。これらのシステムは、誘導体化または分析前の分離を必要とせずに、混合物内の個々の糖類を定量的に分析し得る。糖類の分析のために、上記カラムへの流入前に他の化合物を濾過することが望まれ得、そしてDionexTMは、前置カラムトラップ(例えば、アミノ酸を除去するアミノトラップ、ホウ酸トラップなど)を形成し、そしてこの目的を保護する。
【0029】
解重合された混合物内の、グルコース、ガラクトースおよびシアル酸である単糖類を定量化するための代替的方法は、核磁気共鳴(NMR)である。しかし、使用の容易さおよび高い感度のために、本発明のクロマトグラフ法が、好ましい。
【0030】
シアル酸含有量ならびにグルコース含有量および/またはガラクトース含有量が、一旦決定されると、上記混合物中の各単糖類のモル量を比較し、それによって最初の組成物中の莢膜糖類の量を計算することは、簡単である。
【0031】
本発明のプロセスは、代表的には破壊性である。したがって、完全な組成物に対してこのプロセスを実施するよりもむしろ、目的の組成物からサンプルを採取し、次いでこのサンプルに対して分析を行うことが、より代表的である。
【0032】
(結合体)
本発明は、ワクチンの糖類含有量を分析するために有用であり、そして特に、結合型糖類を含むワクチンに対して有用である。共有結合が使用されて、糖類を、T細胞非依存性抗原からT細胞依存性抗原に変換し、したがって免疫記憶のための初回刺激が可能になることによって、この糖類の免疫原性が増強される。結合体は、小児用ワクチンに関して特に有用であり、そしてこれは、周知の技術である[例えば、参考文献30〜39に概説される]。糖類は、キャリアと直接連結され得る[40、41]が、リンカーまたはスペーサー(例えば、アジピン酸、β−プロピオンアミド[42]、ニトロフェニル−エチルアミン[43]、ハロアシルハライド[44]、グリコシド連結[45]、6−アミノカプロン酸[46]、ADH[47]、C4〜C12部分(moities)[48]など)は、一般的に使用される。
【0033】
結合体中の代表的なキャリアタンパク質は、細菌の毒度またはトキソイド(例えば、ジフテリアトキソイドまたは破傷風トキソイド)である。CRM197ジフテリア毒素誘導体[49〜51]は、MenjugateTMおよびMeningitecTM中のキャリアタンパク質であり、一方で、破傷風トキソイドは、NeisVacTMに使用される。ジフテリアトキソイドは、MenactraTM中のキャリアとして使用される。他の公知であるキャリアタンパク質としては、N.meningitidisの外膜タンパク質[52]、合成ペプチド[53、54]、熱ショックタンパク質[55、56]、百日咳タンパク質[57、58]、サイトカイン[59]、リンフォカイン[59]、ホルモン[59]、成長因子[59]、種々の病原体由来抗原から得た複数のヒトCD4+ T細胞のエピトープを含む人工タンパク質[60]、H.influenzae由来のプロテインD[61、62]、肺炎球菌の表面タンパク質PspA[63]、鉄取込みタンパク質[64]、C.difficile由来の毒素Aまたは毒素B[65]などが挙げられる。組成物は、例えば、キャリア抑制のリスクを減少するために1種より多いキャリアタンパク質を使用し得、そして単一のキャリアタンパク質は、1種より多い糖類抗原を保有し得る[66]。結合体は、一般的に、1:5(すなわち、タンパク質過剰)と5:1(すなわち、糖類過剰)との間の、糖類:タンパク質比(w/w)を有する。組成物は、上記結合体に加えて、遊離キャリアタンパク質を含有し得る[67]。
【0034】
一般的に、結合型糖類を含有する組成物は、本発明を使用して2つの手段で分析され得る。第1に、組成物中の各血清群について、糖類の総濃度は、例えば、ワクチンの販売前(規制または品質管理の目的のため)か、または結合体が混合された後に濃度を確認する前に測定され得る。第2に、組成物中の遊離の非結合型糖類は、例えば、不完全な結合体化について確認するためか、または長期にわたって増加する遊離糖類をモニタリングすることによって結合体の加水分解を追跡するために測定され得る。両方の型の分析を行うことによって、全糖類に対する遊離糖類の比は、規制または品質管理の目的のために使用され得る、各血清群について評価され得る。一般的に、ワクチンが25%未満(例えば、20%未満、15%未満、10%未満など)の各糖類を遊離形態で含むことを保証することが、望ましい。高レベルの遊離糖類は、結合体のより低い免疫原性用量を意味する。
【0035】
したがって本発明は、組成物を分析するための方法であって、ここで:
(a)この組成物が、血清群CのNeisseria meningitidis由来の莢膜糖類の結合体、ならびに(i)血清群W135のNeisseria meningitidis由来の莢膜糖類の結合体;および/または(ii)血清群YのNeisseria meningitidis由来の莢膜糖類の結合体の一方もしくは両方を含有し;
(b)この組成物が、非結合型の形態である莢膜糖類を含有し得;
(c)任意の非結合型莢膜糖類の含有量が、上記の通り、本発明のプロセスによって決定され;
(d)結合型莢膜糖類の含有量が、上記の通り、本発明のプロセスによって決定され;
そして、必要に応じて:
(e)結合型糖類:非結合型糖類の比が、この莢膜糖類の1種以上について計算される方法を提供する。
【0036】
工程(c)および工程(d)は、いずれかの順番で行われても同時に行われてもよい。
【0037】
本発明はまた、医師による使用のためのワクチンを販売するための方法であって、(a)血清群CのNeisseria meningitidis由来の莢膜糖類の結合体、ならびに(i)血清群W135のNeisseria meningitidis由来の莢膜糖類の結合体;および/または(ii)血清群YのNeisseria meningitidis由来の莢膜糖類の結合体の一方もしくは両方を含むワクチンを製造する工程;(b)上記莢膜糖類の各々についてのワクチン中の、結合型糖類および/または非結合型糖類の量を分析する工程を包含し;そして工程(b)から得た結果が、臨床使用において受容可能な糖類含有量を示す場合、(c)医師による使用のためのワクチンを販売する工程を包含する方法を提供する。工程(b)は、糖類の最小濃度(例えば、1種の血清群あたり1μg〜20μgの間の全糖類)の評価、非結合型糖類:結合型糖類の比(例えば、20重量%以下の非結合型糖類、好ましくは10重量%以下または5重量%以下の非結合型糖類)の評価などに関し得る。工程(b)は、パッケージ化されたワクチンに対して行われても、パッケージ化の前にバルクのワクチンに対して行われてもよい。
【0038】
結合型糖類および非結合型糖類を別個に評価するために、これらは分離されなければならない。水性組成物中の遊離(すなわち、非結合型)の糖類は、種々の手段で結合型糖類から分離され得る。結合体化の反応は、上記糖類についての虫食い状(carious)の化学的パラメーターおよび物理的パラメーターを変化させ、そしてこの違いは、分離のために活用され得る。例えば、この結合型物質がキャリアタンパク質に起因して、より高い質量を有する場合、サイズ分離が、遊離糖類および結合型糖類を分離するために使用され得る。限外濾過は、好ましいサイズ分離法であり、そして遊離糖類は、適切なカットオフ(例えば、CRM197キャリアに対して30kDa)を有する限外濾過膜を通過し得る一方で、結合体は保持される。代替的方法は、結合体を保持するが、遊離糖類を溶出物として通過させる、カラムまたは膜を使用する固相抽出(SPE)を用いることである。SPEは、より迅速であり、そしてより一貫した傾向にあるが、サイズ分離は、より普遍的に適用可能である。さらなる代替的方法として、結合体がアジュバントに吸着された場合、遠心分離は、加水分解後に脱着する遊離糖類(上清)から、吸着された結合体(ペレット)を分離する。
【0039】
したがって遊離糖類は、全糖類から分離され得、そして別個に分析され得、それによって組成物中の非結合型物質の量の決定を可能にする。この遊離の量を全量と比較することは、特にこの結合型物質が分離の間に支持体上に保持される場合、分離後の2つのプールを別個に分析することより容易である。
【0040】
(さらなる莢膜糖類成分)
本発明は、N.meningitidisの血清群C由来ならびに血清群W135由来および/または血清群Y由来の莢膜糖類を含有する組成物の分析を可能にする。本発明はまた、さらなる莢膜糖類(例えば、N.meningitidisの血清群A由来の莢膜糖類、H.influenzae b由来の莢膜糖類など)を含有する組成物の分析のために使用され得る。
【0041】
血清群Aの髄膜炎菌の莢膜糖類は、C3位およびC4位に部分的O−アセチル化を伴う、(α1→6)結合型のN−アセチル−D−マンノサミン−1−ホスフェートのホモポリマーである(図17)。これらのアセチル基は、加水分解を防ぐために封鎖基で置換され得[17]、そしてこのような改変糖類は、本発明の意味において、不活性(still)な血清群Aの糖類である。血清群Aの莢膜糖類の解重合条件は、公知である(例えば、他の血清群について上記されるようなTFAによる100℃での加水分解)[21]。代替的方法は、Dowex 50H+の後に、100℃で1時間加熱する工程を包含する[68]。遊離したマンノサミンホスフェートモノマーは、例えば、HPAEC−PADによって、グルコース、ガラクトースおよびシアル酸と並行して分析され得る[21]。
【0042】
Hibの莢膜糖類は、リボースとリビトールとホスフェートとのポリマーである。この糖類は、「PRP」(ポリ−3−β−D−リボース−(1,1)−D−リビトール−5−ホスフェート)として公知であり、そして図18に示される。HPAEC−PAD分析または31P−NMR分析のためにPRPを単糖類まで解重合するための方法は、公知である(例えば、室温で一晩のNaOHとのインキュベーションによる)[20]。遊離したリボースおよびリビトールは、グルコース、ガラクトースおよびシアル酸と並行して分析され得る。
【0043】
血清群Cの莢膜ポリ糖類は、α2→9結合型のシアル酸(コロミン酸としても知られる)のホモポリマーである。本発明によって分析される組成物は、シアル酸の他のいずれのホモポリマー(例えば、血清群Bの髄膜炎菌の莢膜糖類(α2→8結合型のシアル酸)、またはE.coli K12の莢膜糖類(α2→8結合およびα2→9結合を有する))も含有しないことが好ましい。より一般的に、分析されるべき組成物が、グルコース、ガラクトースまたはシアル酸であるモノマーを含む莢膜糖類を含有する場合、この莢膜糖類はまた、混合性の分析を容易にするために、その糖類に固有(その混合物内で)である、さらなるモノマーまたは複数のモノマーを含むことが好ましい。モノマーが糖類の間で共有される場合でさえ、固有のモノマーの存在は、異なる糖類を、髄膜炎菌の血清群C、血清群W135および血清群Yを解析するために記載されたものと同じ原理を使用して、並行して分析することを可能にする。
【0044】
(非莢膜糖類成分)
本発明が、分析下における組成物に由来する混合物の単糖類の分析に依存する場合、この組成物は、(莢膜糖類の加水分解に由来する任意のバックグラウンドの単糖類以外の)遊離形態の単糖類を含有しないことが好ましい。例えば、分析されるべき組成物中に遊離シアル酸を含有することは、血清群Cの含有量の過大評価を生じ得る。同じ原理は、二糖類などが含まれ、次いで加水分解される場合に適用する(例えば、血清群Yの過大評価を与え得るスクロース(グルコース+フルクトース)の存在またはマルトースもしくはトレハロース(両方ともジ−グルコース)の存在、および血清群W135および血清群Yの過大評価(ならびに血清群Cの過小評価)を与え得るラクトース(グルコース+ガラクトース)の存在)。
【0045】
しかし、このような糖類は、多くの場合、ワクチン処方物中で使用され(例えば、安定剤として[69、70])、そしてこれらの干渉の問題が最小化されるかまたは回避され得る2つの一般的手段が存在する。第1に、これらの成分の最初のレベルが、測定され、次いで解重合された混合物において測定されたレベルから差し引かれ得る。第2に、これらの成分が、例えば、濾過または透析によって分析前に上記組成物から除去され得る。限外濾過膜が使用されて、低分子量成分が除去され得る(例えば、スクロース(MW:360)を除去する1K膜)。
【0046】
分析される莢膜糖類中にも見出されない単糖類の存在は、通常は干渉の問題を生じない。例えば、糖アルコールは、凍結乾燥安定剤としてワクチンに含まれ得る[71]が、HPAEC−AEDは、単一の単糖類と対応するポリオールの単糖類との間(例えば、マンノース単糖類(Aerobacter aerogenesの莢膜中に見出されるような[72])とマンニトール単糖類(安定剤)との間、およびリボースとリビトールとの間[73])を区別し得る。
【0047】
(非糖類成分の分析)
組成物中の糖類の含有量を分析する工程と同様に、上記プロセスは、他の成分または特性(例えば、重量モル濃度、pH、個々の糖類または結合体についての重合度、タンパク質含有量(特にキャリアタンパク質について)、アルミニウム含有量、洗浄剤含有量、保存剤含有量など)の分析を包含し得る。
【0048】
本発明は、ワクチン組成物を調製するための方法を提供し、この方法は、pHを測定し、次いでこの組成物のpHを所望の値(例えば、6と8との間、または約7)に調整する工程を含む、本発明にしたがって組成物を分析する工程を包含する。
【0049】
本発明は、ワクチンをパッケージ化するための方法であって、以下の工程を包含する方法を提供する:(a)血清群CのNeisseria meningitidis由来の莢膜糖類の結合体、ならびに(i)血清群W135のNeisseria meningitidis由来の莢膜糖類の結合体および/または(ii)血清群YのNeisseria meningitidis由来の莢膜糖類の結合体の一方または両方を含むバルクのワクチンを製造する工程;(b)このバルクのワクチン中の結合型糖類および/または非結合型糖類の量を莢膜糖類の各々について分析する工程;(c)必要に応じて、pHおよび/または他の特性についてこのバルクのワクチンを分析する工程;そして工程(b)および工程(c)から得た結果が、このバルクのワクチンが臨床上の使用について受容可能であることを示す場合に、(d)このバルクからヒトに対する使用のためのワクチンを調製し、そしてパッケージ化する工程。工程(c)は、糖類の最小濃度の評価、非結合型糖類:結合型糖類の比の評価などを包含する(上記を参照のこと)。工程(d)は、単位用量形態または複数用量形態(例えば、バイアルまたはシリンジ)にパッケージ化する工程を包含し得る。注射についての代表的なヒトの用量は、0.5mlの容量を有する。
【0050】
工程(c)および/または工程(d)は、上記バルクのワクチンと1種以上のさらなる抗原とを混合することによって進められ得、これらの抗原としては、以下が挙げられる:−血清群AのN.meningitidis由来の莢膜糖類抗原;
−血清群BのN.meningitidis由来のタンパク質抗原;
−N.meningitidis血清群Bの微小胞[74]、「ネイティブOMV」[75]、ブレブまたは外膜小胞[例えば、参考文献76〜81など];
−Haemophilus influenzaeタイプb由来の糖類抗原;
−多価結合型糖類抗原のようなStreptococcus pneumoniae由来の抗原[例えば、参考文献82〜84];
−不活化ウイルスのようなA型肝炎ウイルス由来の抗原[例えば、85、86];
−表面抗原および/またはコア抗原のようなB型肝炎ウイルス由来の抗原[例えば、86、87];
−必要に応じてペルタクチンならびに/または凝集原2および凝集原3[例えば、参考文献88および89]とも組み合わせられる、百日咳完全毒素(PT)およびB.pertussis由来の線維状赤血球凝集素(FHA)のようなBordetella pertussis由来の抗原(細胞性百日咳抗原が使用され得る);
−ジフテリアトキソイドのようなジフテリア抗原[例えば、参考文献1の第13章](例えば、CRM197変異体[例えば、90]);
−破傷風トキソイドのような破傷風抗原[例えば、参考文献1の第27章];
−IPVのようなポリオ抗原[例えば、91,92]。
このような抗原が、アルミニウム塩アジュバント(例えば、水酸化物またはリン酸塩)に吸着され得る。好ましくは、任意のさらなる糖類が、結合体として挙げられる。
【0051】
(バッチ間の一貫性)
ヒト用ワクチンの製造に関して、結合型糖類は、結合体化の前(例えば、糖類とキャリアタンパク質)、結合体化の後、処方の後および混合の後に品質管理に供されるべきである。干渉が、シアル酸の複数の供給源を有することによって引き起こされるので、単糖類の分析に基づく先行技術の方法が使用されて、髄膜炎菌の血清群C由来、血清群W135由来および血清群Y由来の莢膜糖類を、これらが混合された後に区別し得ない。しかし、本発明によって、単糖類の分析が使用されて、混合した結合体が分析され得る。さらに、本発明のプロセスは、信頼性および一貫性があり、したがってこれが先行技術の方法では不可能であった、混合した結合体に関する異なるバッチの妥当な比較を可能にする。したがって、混合した結合体ワクチンの異なるバッチが、調製され、アッセイされ、次いでほとんど一貫したバッチが、販売および使用のために選択され得る一方で、異常なバッチは、拒絶され得る。
【0052】
本発明は、少なくとも2種の異なる髄膜炎菌の血清群由来の莢膜糖類の混合物内の、個々の血清群由来の糖類を定量化するためのプロセスであって、ここで:(a)この異なる血清群が、血清群C、ならびに:(i)血清群W135および/または(ii)血清群Yの一方または両方を含み;(b)このプロセスが、この混合物内の莢膜糖類を解重合して、解重合した混合物を提供する工程を包含し;そして(c)この異なる血清群が、この解重合した混合物の単糖類の組成を比較することによって定量化されるプロセスを提供する。
【0053】
本発明はまた、ワクチンのn個のバッチであって、ここで:(a)ワクチンのn個のバッチの各々が、血清群CのNeisseria meningitidis由来の莢膜糖類の結合体、ならびに(i)血清群W135のNeisseria meningitidis由来の莢膜糖類の結合体;および/または(ii)血清群YのNeisseria meningitidis由来の莢膜糖類の結合体の一方もしくは両方を含み;(b)第1のバッチ中の血清群Cの結合型糖類の濃度が、C1であり;(c)第2のバッチ中の血清群Cの結合型糖類の濃度が、C2であり;適用可能な場合、(d)第1のバッチ中の血清群W135の結合型糖類の濃度が、W1であり;適用可能な場合、(e)第2のバッチ中の血清群W135の結合型糖類の濃度が、W2であり;適用可能な場合、(f)第1のバッチ中の血清群Yの結合型糖類の濃度が、Y1であり;適用可能な場合、(g)第2のバッチ中の血清群Yの結合型糖類の濃度が、Y2であり;(h)C1/C2、W1/W2およびY1/Y2の比が、それぞれ0.90と1.10との間であり、そして好ましくはそれぞれ0.95と1.05との間であり;そして(i)このnの値は、2(例えば、2、3、4、5、6、7、8、9、10、11、12、13、14、15以上)以上であるバッチを提供する。
【0054】
(h)において特定される比は、比較される各バッチからの単一のサンプルに基づき得るが、代表的には各バッチの複数のサンプルから得た平均の値(例えば、平均値)に基づき得る。したがって、n個のバッチの各々は、複数のサンプリングに供され得、そして各サンプルは、次いで各バッチについて計算される平均値および必要な比を計算するために使用される平均値による、C1、C2、W1、W2、Y1およびY2の複数の測定値に従い得る。
【0055】
ワクチンの各バッチ(またはロット)は、別個に調製された。例えば、2つの異なるバッチは、同じバルクの単一結合体を別々に混合(separate mixing)するか、または別個に調製されたバルクの単一結合体を混合することによって作製され得る。同じバルクの混合物の異なるサンプルは、異なるバッチではなく、これらのサンプルは、異なる結合体の混合物を調製するときに生じる違いに起因するバッチ間の変動に従わない。
【0056】
上記で特定されるような特徴(a)〜(i)に加えて、上記n個のバッチは、以下によってさらに特徴付けられ得る:(j)上記第1のバッチ中の血清群Cの非結合型糖類の濃度が、C3であり;(k)上記第2のバッチ中の血清群Cの非結合型糖類の濃度が、C4であり;適用可能な場合、(l)この第1のバッチ中の血清群W135の非結合型糖類の濃度が、W3であり;適用可能な場合、(m)この第2のバッチ中の血清群W135の非結合型糖類の濃度が、W4であり;適用可能な場合、(n)この第1のバッチ中の血清群Yの非結合型糖類の濃度が、Y3であり;適用可能な場合、(o)この第2のバッチ中の血清群Yの非結合型糖類の濃度が、Y4であり;(p)C3/C4、W3/W4およびY3/Y4の比が、それぞれ0.90と1.10との間であり、そして好ましくはそれぞれ0.95と1.05との間である。このバッチはまた、以下によって特徴付けられ得る:(q)C3/C1、C4/C2、W3/W1、W4/W2、Y3/Y1およびY4/Y2の比が、それぞれ0.20未満(例えば、0.15未満、0.10未満、0.05未満、0.02未満、0)である。
【0057】
(一般)
用語「含む(comprising)」は、「含む(including)」および「からなる(consisting)」を包含する。例えば、Xを「含む(comprising)」組成物は、Xのみからなっても、さらに何かを含んでも(例えば、X+Y)よい。
【0058】
言葉「実質的に」は、「完全に」を除外しない。例えば、Yから「実質的に遊離(substantially free)する」組成物は、Yからから完全に遊離であり得る。必要な場合、言葉「実質的に」は、本発明の定義から除かれ得る。
【0059】
数値xとの関係において用語「約」は、例えば、x±10%を意味する。
【0060】
糖の環が開いた形態および閉じた形態で存在し得、閉じた形態が本明細書中の構造式において示される一方で、開いた形態はまた、本発明に包含されることが理解される。
【図面の簡単な説明】
【0061】
【図1】図1は、マンニトール安定剤を使用して凍結乾燥された髄膜炎菌の血清群Aの結合体のHPAEC−PAD分析を示す。
【図2】図2は、マンニトール安定剤を使用して凍結乾燥された髄膜炎菌の血清群Aの結合体のHPAEC−PAD分析を示す。
【図3】図3は、スクロースが安定剤として使用された場合の、凍結乾燥された髄膜炎菌の血清群Aの結合体のHPAEC−PAD分析を示す。
【図4】図4は、スクロースが安定剤として使用された場合の、凍結乾燥された髄膜炎菌の血清群Aの結合体のHPAEC−PAD分析を示す。
【図5】図5は、凍結乾燥されなかった血清群Yの結合体に対する、髄膜炎菌の血清群Aの結合体のHPAEC−PAD分析を示す。
【図6】図6は、凍結乾燥されなかった血清群Yの結合体に対する、髄膜炎菌の血清群Aの結合体のHPAEC−PAD分析を示す。
【図7】図7は、凍結乾燥されなかった血清群W135の結合体に対する、髄膜炎菌の血清群Aの結合体のHPAEC−PAD分析を示す。
【図8】図8は、凍結乾燥されなかった血清群W135の結合体に対する、髄膜炎菌の血清群Aの結合体のHPAEC−PAD分析を示す。
【図9】図9は、血清群C、血清群W135および血清群Yから得た混合した結合体のHPAEC−PAD分析を示す。
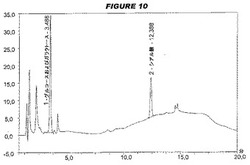
【図10】図10は、血清群C、血清群W135および血清群Yから得た混合した結合体のHPAEC−PAD分析を示す。
【図11】図11は、血清群C、血清群W135および血清群Yから得た混合した結合体のHPAEC−PAD分析を示す。
【図12】図12は、血清群C、血清群W135および血清群Yから得た混合した結合体のHPAEC−PAD分析を示す。
【図13】図13〜15は、髄膜炎菌の血清群Cの莢膜糖類(13)、血清群W135の莢膜糖類(14)、および血清群Yの莢膜糖類(15)についての構造式を示す。
【図14】図13〜15は、髄膜炎菌の血清群Cの莢膜糖類(13)、血清群W135の莢膜糖類(14)、および血清群Yの莢膜糖類(15)についての構造式を示す。
【図15】図13〜15は、髄膜炎菌の血清群Cの莢膜糖類(13)、血清群W135の莢膜糖類(14)、および血清群Yの莢膜糖類(15)についての構造式を示す。
【図16】図16は、血清群W135と血清群Yとの間の違いを示す。
【図17】図17は、血清群Aの髄膜炎菌由来の莢膜糖類の構造式を示す。
【図18】図18は、H.influenzaeタイプb由来の莢膜糖類の構造式を示す。
【図19】図19は、血清群Cの結合体(黒菱形)、血清群W135の結合体(黒四角)および血清群Yの結合体(黒三角)を合わせた、6つの時点に対する遊離糖類の変化(%)を示す。
【発明を実施するための形態】
【0062】
(発明を実施するための形態)
(結合体生成およびクロマトグラフ法)
莢膜糖類抗原は、Neisseria meningitidisの血清群A、血清群C、血清群W135および血清群Yから調製され、そして参考文献7に記載されるように、CRM197に結合体化された。
【0063】
上記4種の結合体が組み合わされて、水性「MenACWY」組成物が提供された。
【0064】
分離作業において、血清群Aの結合体は、スクロースまたはマンニトールのどちらかの存在下で凍結乾燥され、そして血清群Cの結合体と血清群W135の結合体と血清群Yの結合体との混合物(「MenCWY」)が、調製された。
【0065】
糖類含有量の分析は、製造業者の説明書に従ってDionexTM HPAEC−PADクロマトグラフィーシステム上で行われた。この器具は、グラジエントポンプモジュール(GP40またはGP50)およびアンペロメトリック電気化学検出器(ED40またはED50)およびオートサンプラー(AS3500またはAS50)を有した。糖類は、金作用電極(Ag/AgCl参照電極を伴う)の表面での糖類の酸化により生じた電流を測定することによって検出される。三重ポテンシャル波形は、以下の設定を使用して適用された:E1=0.05V;tl=400ms;E2=0.75V;t2=200ms;E3=−0.15V;t3=400ms。統合は、E1の適用の間の200ms〜400msで起きた。このクロマトグラフィーのデータは、PeakNet 6.4データ整理ソフトウェアを使用して積分され、そして処理された。
【0066】
(血清群A)
血清群Aの糖類のマンニトール−凍結乾燥処方物は、4℃にて3ヶ月間保存された後にHPAEC−PADによって試験された。結合体含有組成物は、C4固相抽出(SPE)カラムを使用して遊離糖類から分離された。この遊離糖類を含む溶液は、TFAを使用する100℃にて2時間の酸加水分解に供された。次いで、この混合物は、マンノサミン−6−ホスフェートの検出のために、PA1保護、勾配溶離およびPAD検出を使用するDionexTM CarboPac PA1カラムに適用された。結果は、図1に示される。
【0067】
遊離糖類のSPE分離を伴わずに、同じ分析が行われた。この分析の結果は、図2に示される。図1と図2との比較(図1の分析に1:2の希釈を使用し、そして図2の分析に1:5の希釈を使用したことに注意する)は、マンノサミン−6−ホスフェートのピークが、図1において非常に低いことを示し、この組成物中の遊離糖類の低いレベルを示す。定量分析は、1バイアルあたり3.7%の遊離糖類を含む10.7μgの全糖類を示す。
【0068】
スクロース−凍結乾燥物質は、1バイアルあたり600μlの水で再構成され、次いで1回の分析あたり2〜3ml提供されるようにサンプルがプールされた後に、同じ方法で分析された。しかし、SPE C4の前に、この組成物は、1K膜を使用する限外濾過に供された(2mlの水で洗浄し、2mlのサンプル溶液をロードし、その度ごとに2mlの水で3サイクル洗浄し、保持物(retentate)を回収し、そして1mlまで容量を調整し、SPEにロードするために1:1に希釈して0.9%の最終NaCl濃度を与える)。図3は、この組成物中にごくわずかな遊離糖類が存在するが、結合型物質に対応する大きなピークが存在することを示す(図4)。
【0069】
(血清群W135および血清群Y)
他の結合体と組み合わせる前に、バルクの血清群Yの結合体は、分析された。この結合体は、30kDaの限外濾過膜を使用して遊離糖類から分離された。分析されるべき物質は、TFAによって100℃にて加水分解され、次いで製造業者の説明書に従って、CarboPac PA1カラム、AminoTrap、定組成溶離および再生工程、ならびにPAD検出を使用するDionexTM装置上で、グルコースについて定量分析された。CRM197キャリアは、このカラムへの上記加水分解物の適用前に除去されることを必要としなかった。非結合型物質は、検出可能であった(図5)が、全グルコースより豊富ではなかった(図6)。異なる希釈に注目すると、これらの図の分析から、1.8%の遊離糖類画分が提供される。
【0070】
バルクの血清群W135物質は、同じ方法で処理され、そして分析されたが、この方法は、グルコースの検出よりもむしろガラクトースの検出を伴った(図7および図8)。異なる希釈に注目すると、これらの図の分析から、6%の遊離糖類画分が提供される。
【0071】
(混合した結合体)
血清群A、血清群C、血清群W135および血清群Yついての結合体は、参考文献7に記載されるように、リン酸アルミニウムアジュバントと組み合わされた。4℃にて2週間保存されたMenCWY結合体の組み合わせが使用されて、凍結乾燥したMenA結合体が再構成され、そして48時間後に、結合体からこのアジュバントを分離するための遠心分離を伴って分析された。この混合した結合体は、30kDaの膜を使用する2サイクルの限外濾過によって遊離糖類から分離された。第2のサイクルは、ときとして第1のサイクルの透過物中に通り抜けることが見出される複合糖質による汚染を減少させた。糖類は、限外濾過の前および後における、TFAを使用する90℃/100℃での酸加水分解により、次いで2つを別個に、DionexTM CarboPac PA1カラムを使用してHPAEC−PAD分析することによって分析された。
【0072】
血清群Cの分析のために、カラムは、CarboPac PA1保護を有し、そして勾配溶離工程を使用した。このカラムは、この方法のより迅速な様式として、グルコースとガラクトースとが分解されない様式において実行された。結果は、図9および図10に示される。血清群W135および血清群Yに関して、このカラムは、AminoTrapを有し、そしてグルコースおよびガラクトースを分解する定組成溶離および再生を使用した。結果は、図11および図12に示される。
【0073】
それぞれの異なる糖類の量を計算するために、図9/10の分析におけるシアル酸の量は、グルコースおよびガラクトースの合わせた量を差し引くことによって干渉について補正される。この値は、MenCの濃度を与える。その後、図11/12の分析におけるガラクトースおよびグルコースの量は、血清群W135および血清群Yを定量化するために使用される。不完全な加水分解に起因して、図11/12から得たグルコースおよびガラクトースの合わせた量は、上記されるように、図9/10から取得された量と一致し得ないが、このような矛盾は、全体の分析に影響を与えない。量は、グルコース、ガラクトースおよびシアル酸の公知の量を含む基準と比較することによって計算された。
【0074】
結合体中の全MenC糖類および遊離MenC糖類の代表的な2つ組(duplicate)の分析は、これらの結果を与えた:
【0075】
【表1】

したがって、血清群Cの糖類を定量化するための固有な糖類の欠如にかかわらず、本発明は、この物質が血清群W135の糖類および血清群Yの糖類のバックグラウンドにおいて定量的にアッセイされることを可能にする。
【0076】
図9および図11の類似する分析は、MenACWY組成物中のそれぞれの遊離糖類の量を示し、そして遊離糖類をこの組成物中の全糖類の%として示すことを可能にする。この分析は、1用量あたり10μg(すなわち20μg/ml)の各糖類を含むように処方されたMenCWYの組み合わせ対して、1年間にわたる種々の時点において行われた。結果は、以下:
【0077】
【表2】

の通りであった。
6つの時点における遊離糖類の%の変動は、図19に示される。
【0078】
第2の系列の実験において、ワクチンは、これまでの実験に対して半分(1用量あたり5μgの各糖類)および4分の1の用量(2.5μg)で処方された。本発明のプロセスは、この組み合わせの中から異なる糖類を解析するために使用され、そして結果は、以下:
【0079】
【表3】

の通りであった。
【0080】
本発明が例の手段によってのみ記載され、そして改変が、本発明の範囲および精神内にありつつなされ得ることが理解される。
【0081】
【化4】

【0082】
【化5】

【技術分野】
【0001】
本明細書中に引用される全ての文献は、その全体が参考として援用される。
【0002】
(技術分野)
本発明は、ワクチンの分析および品質管理の分野にあり、このワクチンは、細菌の莢膜糖類を含み、そして特に、この糖類がキャリアに結合体化される糖類を含む。
【背景技術】
【0003】
(背景技術)
キャリアタンパク質に結合体化された莢膜糖類抗原を含む免疫原は、当該分野において周知である。結合体化は、T細胞非依存性抗原をT細胞依存性抗原に変換し、それによって記憶応答(memory response)を増強し、そして防御免疫を発生させ、そして原型の結合体ワクチンは、Haemophilus influenzaeタイプb(Hib)に対するものであった(例えば、非特許文献1の第14章を参照のこと)。Hibワクチン以来、Neisseria meningitidis(髄膜炎菌)およびStreptococcus pneumoniae(肺炎球菌)に対して保護するための結合型糖類ワクチンが、開発された。結合体ワクチンが目的とする他の生物は、Streptococcus agalactiae(B群連鎖球菌)(非特許文献2)、Pseudomonas aeruginosa(非特許文献3)およびStaphylococcus aureus(非特許文献4)である。
【0004】
N.meningitidisの血清群Cに対する結合体ワクチンは、ヒトに対する使用が認可され、そしてこれらとしては、MenjugateTM(非特許文献5)、MeningitecTMおよびNeisVac−CTMが挙げられる。血清群A、血清群C、血清群W135および血清群Yの各々からの結合体の混合物が、報告され(例えば、特許文献1、特許文献2、非特許文献6および非特許文献7)、これらとしては、MenactraTM製品が挙げられる。結合型抗原の他の混合物としては、以下が挙げられる:(i)髄膜炎菌性のA/Cの混合物(非特許文献8、非特許文献9);(ii)7つの肺炎球菌の結合体を含むPrevNarTM製品(非特許文献10);(iii)髄膜炎菌およびHibの混合した結合体(非特許文献11、非特許文献12);および(iv)髄膜炎菌、肺炎球菌およびHibの合わせた結合体(非特許文献13)。
【0005】
結合体ワクチンを取り扱う工程が安定性およびバッチ間の一貫性を含む場合を示す。例えば、Hibワクチンにおいて、糖類の触媒性解重合が、報告され(非特許文献14)、そして血清群Aの髄膜炎菌莢膜の結合体は、容易に加水分解される(特許文献3)。結合体の不安定性は、望ましくない、長期にわたる免疫原性結合体の有効量の減少、バッチ間の変動を生じ、そして特徴付けられない分解産物のレベルを増加させる。非特許文献15および非特許文献16は、Hib結合体ワクチンの安定性試験に関する問題を議論する。
【0006】
定量的な複合糖質の分析は代表的に、糖類の加水分解の第1の工程を包含し、その後この分析は、遊離した単糖類に基づく分析を伴う。この分析は、単一の結合体に対して、相対的に分かりやすい(例えば、アニオン交換クロマトグラフィー法は、Hibの加水分解された結合体(非特許文献17)および血清群Aの髄膜炎菌の加水分解された結合体(非特許文献18)を分析するために使用されてきた)のに対して、この状況は、特に異なる糖類が単糖類単位を共有する場合、ワクチンの組み合わせにおいて、より複雑である。例えば、髄膜炎菌の血清群C、血清群W135および血清群Yの莢膜糖類は、全てシアル酸を含み、したがって、遊離したシアル酸の測定に基づく任意の方法は、この3種の血清群を区別し得ない。
【先行技術文献】
【特許文献】
【0007】
【特許文献1】国際公開第02/058737号パンフレット
【特許文献2】国際公開第03/007985号パンフレット
【特許文献3】国際公開第03/080678号パンフレット
【非特許文献】
【0008】
【非特許文献1】Plotkinら編、「Vaccines」、第4版、ISBNコード0721696880
【非特許文献2】Bakerら、「J Infect Dis」、2003年、第188巻、p.66−73
【非特許文献3】Theilackerら、「Infect Immun」、2003年、第71巻、p.3875−84
【非特許文献4】Anonymous、「Drugs R D」、2003年、第4巻、p.383−5
【非特許文献5】Jones、「Curr Opin Investig Drugs」、2001年、第2巻、p.47−49
【非特許文献6】Rennelsら、「Pediatr Infect Dis J」、2002年、第21巻、p.978−979
【非特許文献7】Campbellら、「J Infect Dis」、2002年、第186巻、p.1848−1851
【非特許文献8】Costantinoら、「Vaccine」、1992年、第10巻、p.691−698
【非特許文献9】Liebermanら、「JAMA」、1996年、第275巻、p.1499−1503
【非特許文献10】DarkesおよびPlosker、「Paediatr Drugs」、2002年、第4巻、p.609−630
【非特許文献11】Ugozzoli、「J Infect Dis」、2002年、第186巻、p.1358−61
【非特許文献12】Granoffら、「Infect Immun」、1997年、第65巻、p.1710−5
【非特許文献13】ParadisoおよびLindberg、「Dev Biol Stand」、1996年、第87巻、p.269−275
【非特許文献14】Corbel、「Dev Biol Stand」、1996年、第87巻、p.113−124
【非特許文献15】Klug、「Dev Biol Stand」、1996年、第87巻、p.263−267
【非特許文献16】PlumbおよびYost、「Vaccine」、1996年、第14巻、p.399−404
【非特許文献17】Tsaiら、「Vaccine」、1994年、第12巻、p.700−706
【非特許文献18】Ricciら、「Vaccine」、2001年、第19巻、p.1989−1997
【発明の概要】
【発明が解決しようとする課題】
【0009】
安定性および完全性を評価するための結合体ワクチン中の糖類の定量的評価における改良を提供することは、本発明の目的である。特に、髄膜炎菌の混合性結合体ワクチン内の個々の結合体を測定するために使用され得る方法を提供し、したがってワクチンの品質管理および一貫性における改良を提供することが、目的である。
【課題を解決するための手段】
【0010】
(発明の開示)
本発明は、複数の血清群に由来する混合した髄膜炎菌の糖類の分析を、これらの糖類が単糖類単位を共有するにもかかわらず可能にする方法に基づく。したがって、本発明は、組成物の糖類含有量を分析するためのプロセスであって、ここで:
(a)この組成物が、血清群CのNeisseria meningitidis由来の莢膜糖類、ならびに(i)血清群W135のNeisseria meningitidis由来の莢膜糖類;および/または(ii)血清群YのNeisseria meningitidis由来の莢膜糖類の一方もしくは両方を含有し;
(b)このプロセスが、この組成物のシアル酸含有量を分析する工程を包含し、そして:(i)この組成物が、血清群W135の糖類を含有する場合、この組成物のガラクトース含有量を分析する工程を包含し;(ii)この組成物が、血清群Yの糖類を含有する場合、この組成物のグルコース含有量を分析する工程を包含し;
(c)この組成物が、血清群W135の糖類を含有する場合、この組成物中の血清群W135の糖類の含有量が、工程(b)から得たガラクトース分析の結果によって決定され;
(d)この組成物が、血清群Yの糖類を含有する場合、この組成物中の血清群Yの糖類の含有量が、工程(b)から得たグルコース分析の結果によって決定され;そして
(e)この組成物中の血清群Cの糖類の含有量が、シアル酸分析の結果を:(i)この組成物が、血清群W135の糖類を含有するが、血清群Yの糖類を含有しない場合には工程(b)から得たガラクトース分析の結果;(ii)この組成物が、血清群Yの糖類を含有するが、血清群W135の糖類を含有しない場合には工程(b)から得たグルコース分析の結果;または(iii)この組成物が、血清群W135の糖類および血清群Yの糖類両方を含有する場合には工程(b)から得たグルコース分析およびガラクトース分析の合わせた結果と比較することによって決定されるプロセスを提供する。
【0011】
したがって、血清群C由来、血清群W135由来および血清群Y由来の糖類の組み合わせに関して、本発明は、シアル酸含有量、グルコース含有量およびガラクトース含有量を分析する。このグルコースの結果およびガラクトースの結果が使用されて、血清群Y由来および血清群W135由来の糖類が、それぞれ直接定量化され、そしてこのグルコースおよびガラクトースの合わせた含有量は、このシアル酸含有量から減じられて、血清群C由来の糖類が定量化される。したがって、この3種の血清群は、これらの単糖類の含有量が重複するにもかかわらず決定され得る。本発明者らは、この3種の異なる単糖類の分析が、これらの単糖類の間の干渉および上記組成物中の任意の他の糖類物質(例えば、凍結乾燥安定剤)による干渉を伴わずに同じ材料に対して行われ得ることを有利に見出した。本方法が使用されて、結合体ワクチン中の全糖類および遊離糖類が分析され、そして複数の血清群の莢膜糖類を含むワクチンの品質管理が単純化される。
【0012】
干渉を伴わずにアルドース、ヘキソサミンおよびシアル酸の混合物を分析するための方法が記載される[22]が、これは酵素的処理および化学的誘導体化に依存する。対照的に、本発明のプロセスは、このような工程を必要とせず、したがって、より迅速かつ容易に実施される。さらに、参考文献22中で扱われる状況は、共通の単糖類単位を共有する異なる糖類を分解を分離しなければならないという固有の問題に苦しむ。
【0013】
本発明はまた、本発明のプロセスを実施するのに適合されるコンピューター装置を提供する。特に、本発明は、上記に定義されるような組成物の糖類含有量を分析するためのコンピュータープログラムであって、(a)サンプルのシアル酸含有量、ならびにグルコース含有量および/またはガラクトース含有量についてのデータを受容し;そして(b)このデータから、血清群C由来の莢膜糖類の含有量、ならびに血清群W135由来の莢膜糖類の含有量および/または血清群Yの莢膜糖類の含有量を計算するためのプログラムモジュールを備えるコンピュータープログラムを提供する。本発明はまた、コンピューターが読み込み可能な記憶媒体を備えるコンピュータープログラム製品を提供し、この記憶媒体は、本発明のコンピュータープログラムを記憶する。
本発明はまた、以下の項目を提供する。
(項目1)
組成物の糖類含有量を分析するためのプロセスであって、ここで以下:
(a)該組成物が、血清群CのNeisseria meningitidis由来の莢膜糖類、ならびに:(i)血清群W135のNeisseria meningitidis由来の莢膜糖類;および/または(ii)血清群YのNeisseria meningitidis由来の莢膜糖類の一方もしくは両方を含有し;
(b)該プロセスが、該組成物のシアル酸含有量を分析する工程を包含し、そして:(i)該組成物が、血清群W135の糖類を含有する場合、該組成物のガラクトース含有量を分析する工程を包含し;(ii)該組成物が、血清群Yの糖類を含有する場合、該組成物のグルコース含有量を分析する工程を包含し;
(c)該組成物が、血清群W135の糖類を含有する場合、該組成物中の血清群W135の糖類含有量が、工程(b)から得た該ガラクトース分析の結果によって決定され;
(d)該組成物が、血清群Yの糖類を含有する場合、該組成物中の血清群Yの糖類含有量が、工程(b)から得た該グルコース分析の結果によって決定され;そして
(e)該組成物中の血清群Cの糖類含有量が、該シアル酸分析の結果を:(i)該組成物が、血清群W135の糖類を含有するが、血清群Yの糖類を含有しない場合には工程(b)から得た該ガラクトース分析の結果;(ii)該組成物が、血清群Yの糖類を含有するが、血清群W135の糖類を含有しない場合には工程(b)から得た該グルコース分析の結果;または(iii)該組成物が、血清群W135の糖類および血清群Yの糖類両方を含有する場合には工程(b)から得た該グルコース分析および該ガラクトース分析の合わせた結果と比較することによって決定される、
プロセス。
(項目2)
上記組成物が、血清群CのNeisseria meningitidis、血清群W135のNeisseria meningitidisおよび血清群YのNeisseria meningitidisの3種全てに由来する莢膜糖類を含有する、項目1に記載のプロセス。
(項目3)
上記組成物が、1種以上のさらなる莢膜糖類を含有する、項目2に記載のプロセス。
(項目4)
上記1種以上のさらなる莢膜糖類が、血清群AのN.meningitidis由来の莢膜糖類;およびHaemophilus influenzae b由来の莢膜糖類からなる群より選択される、項目3に記載のプロセス。
(項目5)
項目1〜4のいずれかに記載のプロセスであって、上記莢膜糖類を解重合して、その構成単糖類を提供するために上記組成物を処理する工程を包含する、プロセス。
(項目6)
シアル酸含有量、グルコース含有量および/またはガラクトース含有量が、必要に応じてアンペロメトリック電気化学検出を伴う、高速アニオン交換クロマトグラフィーによって測定される、項目1〜5のいずれかに記載のプロセス。
(項目7)
項目1〜6のいずれかに記載のプロセスであって、以下:
重量オスモル濃度、pH、個々の糖類または結合体の重合度、タンパク質含有量、アルミニウム含有量、洗浄剤含有量、および保存剤含有量、
の構成要素または特性の1つ以上が分析される工程をまた包含する、プロセス。
(項目8)
上記莢膜糖類が、糖類−タンパク質結合体に由来する、項目1〜7のいずれかに記載のプロセス。
(項目9)
上記結合体中のタンパク質が、細菌毒素または細菌トキソイドである、項目8に記載のプロセス。
(項目10)
上記毒素またはトキソイドが、ジフテリアトキソイド;破傷風トキソイド;CRM197ジフテリア毒素誘導体;およびH.influenzae由来のプロテインDからなる群より選択される、項目9に記載のプロセス。
(項目11)
組成物を分析するためのプロセスであって、以下:
(a)該組成物が、血清群CのNeisseria meningitidis由来の莢膜糖類の結合体、ならびに:(i)血清群W135のNeisseria meningitidis由来の莢膜糖類の結合体;および/または(ii)血清群YのNeisseria meningitidis由来の莢膜糖類の結合体の一方もしくは両方を含有し;
(b)該組成物が、非結合型の形態である該莢膜糖類を含有し得;
(c)任意の非結合型莢膜糖類の含有量が、項目1〜7のいずれか1項に記載のプロセスによって決定され;
(d)結合型莢膜糖類の含有量が、項目1〜7のいずれか1項に記載のプロセスによって決定され;そして、必要に応じて
(e)該組成物中の、結合型糖類:非結合型糖類の比が、該莢膜糖類の1種以上について計算される、
プロセス。
(項目12)
少なくとも2種の異なる髄膜炎菌の血清群由来の莢膜糖類の混合物内の、個々の血清群由来の糖類を定量化するためのプロセスであって、ここで:(a)該異なる血清群が、血清群C、ならびに:(i)血清群W135および/または(ii)血清群Yの一方または両方を含み;(b)該プロセスが、該混合物内の該莢膜糖類を解重合して、解重合した混合物を提供する工程を包含し;そして(c)該異なる血清群が、該解重合した混合物の単糖類の組成を比較することによって定量化される、プロセス。
(項目13)
医師による使用のためのワクチンを販売するための方法であって、(a)血清群CのNeisseria meningitidis由来の莢膜糖類の結合体、ならびに:(i)血清群W135のNeisseria meningitidis由来の莢膜糖類の結合体;および/または(ii)血清群YのNeisseria meningitidis由来の莢膜糖類の結合体の一方もしくは両方を含むワクチンを製造する工程;(b)該莢膜糖類の各々についての該ワクチン中の、結合型糖類および/または非結合型糖類の量を分析する工程を包含し;そして工程(b)から得た結果が、臨床使用において受容可能な糖類含有量を示す場合、(c)医師による使用のための該ワクチンを販売する工程を包含する、方法。
(項目14)
ワクチンの2つのバッチであって、ここで以下:
(a)ワクチンの該バッチの各々が、血清群CのNeisseria meningitidis由来の莢膜糖類の結合体、ならびに:(i)血清群W135のNeisseria meningitidis由来の莢膜糖類の結合体;および/または(ii)血清群YのNeisseria meningitidis由来の莢膜糖類の結合体の一方もしくは両方を含み;
(b)該第1のバッチ中の血清群Cの結合型糖類の濃度が、C1であり;
(c)該第2のバッチ中の血清群Cの結合型糖類の濃度が、C2であり;
適用可能な場合、(d)該第1のバッチ中の血清群W135の結合型糖類の濃度が、W1であり;
適用可能な場合、(e)該第2のバッチ中の血清群W135の結合型糖類の濃度が、W2であり;
適用可能な場合、(f)該第1のバッチ中の血清群Yの結合型糖類の濃度が、Y1であり;
適用可能な場合、(g)該第2のバッチ中の血清群Yの結合型糖類の濃度が、Y2であり;
そしてここで(h)C1/C2、W1/W2およびY1/Y2の比が、それぞれ0.90と1.10との間である、
バッチ。
(項目15)
項目14に記載のバッチであって、ここで:(i)上記第1のバッチ中の血清群Cの非結合型糖類の濃度が、C3であり;(j)上記第2のバッチ中の血清群Cの非結合型糖類の濃度が、C4であり;適用可能な場合、(k)該第1のバッチ中の血清群W135の非結合型糖類の濃度が、W3であり;適用可能な場合、(l)該第2のバッチ中の血清群W135の非結合型糖類の濃度が、W4であり;適用可能な場合、(m)該第1のバッチ中の血清群Yの非結合型糖類の濃度が、Y3であり;適用可能な場合、(n)該第2のバッチ中の血清群Yの非結合型糖類の濃度が、Y4であり;(o)C3/C4、W3/W4およびY3/Y4の比が、それぞれ0.90と1.10との間であり、そして好ましくはそれぞれ0.95と1.05との間である、バッチ。
(項目16)
項目15に記載のバッチであって、(p)C3/C1、C4/C2、W3/W1、W4/W2、Y3/Y1およびY4/Y2の比が、それぞれ0.20未満である、バッチ
(項目17)
項目1〜12のいずれか1項に記載のプロセスを実施するのに適合されるコンピューター装置。
(項目18)
項目1に定義されるような組成物の糖類含有量を分析するためのコンピュータープログラムであって、(a)サンプルのシアル酸含有量、ならびにグルコース含有量および/またはガラクトース含有量についてのデータを受容し;そして(b)該データから、血清群C由来の莢膜糖類含有量、ならびに血清群W135由来の莢膜糖類含有量および/または血清群Yの莢膜糖類含有量を計算するためのプログラムモジュールを備える、コンピュータープログラム。
【0014】
(血清群C、血清群W135および血清群Yの莢膜糖類)
本発明の方法は、髄膜炎菌の莢膜糖類の混合物を分析するための方法である。この混合物は、(i)血清群C由来の莢膜糖類、ならびに(ii)血清群W135由来および血清群Y由来の莢膜糖類のいずれかまたは両方(すなわち、C+W135、C+Y、またはC+W135+Y)を含む。さらなる糖類がまた、存在し得る。
【0015】
上記血清群Cの莢膜糖類は、(α2→9)結合型シアル酸(N−アセチルノイラミン酸、または「NeuNAc」)のホモポリマーである。ほとんどの血清群C株は、シアル酸残基のC−7および/またはC−8にO−アセチル基を有するが、約15%の臨床単離体は、これらのO−アセチル基を欠く[23、24]。このアセチル化は、保護性の効力に影響しないようである(例えば、MenjugateTM製品とは違って、NeisVac−CTM製品は、脱O−アセチル化糖類を使用するが、両方のワクチンは、有効である)。この糖類の構造は、図13に示され、そして以下:
【0016】
【化1】

のように記述される。
【0017】
血清群W135の糖類は、シアル酸−ガラクトースの二糖類単位のポリマーである。血清群Cの糖類のように、血清群W135の糖類は、可変のO−アセチル化を有する(但し、シアル酸の7位および9位において)[25]。この構造は、図14に示され、そして以下:
【0018】
【化2】

のように記述される。
【0019】
血清群Yの糖類は、二糖類の反復単位がガラクトースの代わりにグルコースを含むことを除いて、血清群W135の糖類と同様である(図16を参照のこと)。血清群W135の糖類のように、血清群Yの糖類は、シアル酸の7位および9位に可変のO−アセチル化を有する[25]。血清群Yの構造は、図15に示され、そして以下:
【0020】
【化3】

のように記述される。
【0021】
したがって、血清群C由来、血清群W135由来および血清群Y由来の莢膜糖類を含有する組成物中に、3種の異なる構成モノマー(グルコース、ガラクトース、およびシアル酸)が存在し、そしてこれらの3種のモノマーは、加水分解後の混合物中に存在する。このような混合物中のグルコースモノマーの量は、最初の組成物中の血清群Yの糖類の量に直接関連し、ガラクトースモノマーの量は、W135の糖類の量に直接関連する。しかし、血清群Cに関して、この状況は、より複雑であり:シアル酸は、血清群Cの糖類を定量化するのに利用可能な唯一のモノマーであるが、上記混合物中のシアル酸の含量のあらゆる測定は、血清群W135の糖類および血清群Yの糖類に由来するモノマーを含む。本発明は、ガラクトース、グルコースおよびシアル酸の各々の混合物中の含有量を(別々におよび/または同時に)測定し、次いで(a)ガラクトース含有量を使用して、加水分解前の血清群W135含有量を定量化し;(b)グルコース含有量を使用して加水分解前の血清群Y含有量を定量化し;(b)シアル酸含有量とグルコースおよびガラクトースの合わせた含有量との間の差を使用して、加水分解前の血清群C含有量を定量化する(すなわち、血清群Cのモル濃度量は、シアル酸のモル濃度量から(グルコース+ガラクトース)のモル濃度量を差し引くことによって計算される)ことによってこの分析の複雑性を克服する。シアル酸のモル濃度含有量からの、グルコースのモル濃度含有量およびガラクトースのモル濃度含有量の減算は、血清群W135および血清群Yによる干渉を補正し、そして血清群Cからのシアル酸のみを残す。
【0022】
本発明が使用されて、種々の長さの莢膜糖類が分析され得る。例えば、MenjugateTMおよびMeningitecTMが、血清群Cの完全長ポリ糖類からのサイズを選択したフラグメント(オリゴ糖)を含有するのに対して、NeisVac−CTMは、完全長のポリ糖類を使用する。本発明は、オリゴ糖および/または完全長ポリ糖類と共に使用され得る。オリゴ糖は、細菌中に存在するネイティブな莢膜ポリ糖類において見出される重合度(DP)より小さい重合度を有し、そして30未満(例えば、10と25との間)の平均DPを有し得る。DPは、イオン交換クロマトグラフィーまたは比色定量アッセイによって簡便に測定され得る[26]。
【0023】
(単糖類含有量の分析)
本発明のプロセスは、シアル酸の含有量、ガラクトースの含有量(血清群W135が存在する場合)、およびグルコースの含有量(血清群Yが存在する場合)を分析する工程を包含する。プロセスが、組成物中の単糖類単位の存在をモニタリングするため(例えば、単に、生成の初期段階からの残留単糖類をモニタリングためか、または結合体からのモノマーの可能な加水分解性の遊離をモニタリングするため)に実施される場合、このプロセスは、この組成物に対して直接実施され得る。しかし、代表的に、このプロセスは、組成物の糖類の総含有量を測定するために使用され、しがたってこの組成物は、この分析前に単糖類まで加水分解される。したがって、本発明のプロセスは、代表的に、莢膜糖類を解重合してそれらの構成単糖類を得るために、組成物を処理する工程を包含する。その後、シアル酸含有量ならびにガラクトース含有量および/またはグルコース含有量の分析は、解重合された混合物の遊離した単糖類に対して進められ得る。
【0024】
莢膜糖類をそれらの構成単糖類まで解重合するための条件は、当該分野において公知である。例えば、血清群Cの糖類は、糖類の総含有量の分析のために100mM HClによる80℃で2時間の処理によって加水分解され得る[27]。トリフルオロ酢酸(TFA)を使用する酸加水分解は、血清群Cのシアル酸の分解を避けるために、血清群Cについて好ましいわずかに低いインキュベーション温度(100℃よりもむしろ90℃)によって、血清群C、血清群W135および血清群Yの全てを加水分解するために使用され得る。代表的なTFA処理は、TFAを2Mの最終濃度まで添加し、次いで90分間、90℃〜100℃に加熱する工程を包含する。解重合の後、糖類加水分解物は、例えば、減圧乾燥器(vacuum drier)を使用して乾燥され得る。
【0025】
解重合の後、組成物は、血清群Cならびに血清群W135および/または血清群Yに由来する混合した単糖類を含む。この混合物中のこれらの単糖類の量は、加水分解前の本来の組成物中の糖類の含量に直接関係し、したがって最初の糖類の含量は、上記のように決定され得る。量は、分子の数(例えば、モル)、質量、比または濃度の項目について決定され得る。シアル酸が、グルコース/ガラクトースと異なる分子量を有する場合、モルを用いることが代表的であるが、これらの測定値のいずれかが、上記混合物の糖類含有量を評価するために使用され、そして置き換えられ得る。定量的な測定のために、分析結果は、特定の糖類の公知の含有量を用いる基準と比較され得る。
【0026】
上記解重合された混合物は、好ましくは単糖類まで完全に加水分解される。本発明者らは、ときとし不完全な加水分解が起こり、二糖類のフラグメント(すなわち、MenW135に対するGal−NeuNAc、およびMenYに対するGlc−NeuNAc)が存在する混合物を与えることを見出した。しかし、上記単糖類は、正確な理論上の比で遊離し、そして上記二糖類は、この単糖類の分析を干渉しないので、二糖類の存在は、困難性をもたらし得ない。
【0027】
解重合の進行は、(例えば、オリゴ糖への部分的加水分解よりもむしろ、単糖類への完全な加水分解を確認するために)公知の技術(例えば、NMR、質量分析など)を使用して、混合物中の重合度(DP)を測定することによって確認され得る。
【0028】
グルコース、ガラクトースおよびシアル酸単糖類を定量化するための方法は、当該分野において周知である。方法は、直接的または間接的であり得る。(例えば、これらの方法は、その単糖類を誘導体化し、次いで本来の単糖類含有量と相関する分析を実施することを包含し得る)。方法は、2種/3種の異なる単糖類を互いから分離し、次いで別個に分析することを包含し、そしてこのような場合において、単糖類含有量の実際の測定は、この分離に起因する特異性を有するそれぞれの事例において同一であり得る。しかし、それらが分析前に互いから分離される必要がないように、互いの存在下においてこの糖類を分析し得る方法を使用することが好ましい。さらに、方法は、結合型糖類に対して使用され得、この結合型糖類において、キャリアおよび糖類は、解重合の後に分けられる必要がない。1つの好ましい方法は、アニオンクロマトグラフィーであり、そして特に、通常はアンペロメトリック電気化学検出(PAD)を備える、高速アニオン交換クロマトグラフィー(HPAEC)である[28、29]。HPAEC−PADシステムは、DionexTM Corporation(Sunnyvale,CA)によって提供され(例えば、BioLCTMシステム)、これは、PA1[ジビニルベンゼンと2%架橋し、第四級アンモニウム官能性化(functionalized)ラテックスの500nm MicroBeadと凝塊形成した(5%架橋した)、直径10μmのポリスチレン担体]またはPA10[ジビニルベンゼンと55%架橋し、二官能性第四級アンモニウムイオンの460nm MicroBeadと凝塊形成した(5%架橋した)、直径10μmのエチレンビニルベンゼン担体]のようなカラムを用いる。これらのシステムは、誘導体化または分析前の分離を必要とせずに、混合物内の個々の糖類を定量的に分析し得る。糖類の分析のために、上記カラムへの流入前に他の化合物を濾過することが望まれ得、そしてDionexTMは、前置カラムトラップ(例えば、アミノ酸を除去するアミノトラップ、ホウ酸トラップなど)を形成し、そしてこの目的を保護する。
【0029】
解重合された混合物内の、グルコース、ガラクトースおよびシアル酸である単糖類を定量化するための代替的方法は、核磁気共鳴(NMR)である。しかし、使用の容易さおよび高い感度のために、本発明のクロマトグラフ法が、好ましい。
【0030】
シアル酸含有量ならびにグルコース含有量および/またはガラクトース含有量が、一旦決定されると、上記混合物中の各単糖類のモル量を比較し、それによって最初の組成物中の莢膜糖類の量を計算することは、簡単である。
【0031】
本発明のプロセスは、代表的には破壊性である。したがって、完全な組成物に対してこのプロセスを実施するよりもむしろ、目的の組成物からサンプルを採取し、次いでこのサンプルに対して分析を行うことが、より代表的である。
【0032】
(結合体)
本発明は、ワクチンの糖類含有量を分析するために有用であり、そして特に、結合型糖類を含むワクチンに対して有用である。共有結合が使用されて、糖類を、T細胞非依存性抗原からT細胞依存性抗原に変換し、したがって免疫記憶のための初回刺激が可能になることによって、この糖類の免疫原性が増強される。結合体は、小児用ワクチンに関して特に有用であり、そしてこれは、周知の技術である[例えば、参考文献30〜39に概説される]。糖類は、キャリアと直接連結され得る[40、41]が、リンカーまたはスペーサー(例えば、アジピン酸、β−プロピオンアミド[42]、ニトロフェニル−エチルアミン[43]、ハロアシルハライド[44]、グリコシド連結[45]、6−アミノカプロン酸[46]、ADH[47]、C4〜C12部分(moities)[48]など)は、一般的に使用される。
【0033】
結合体中の代表的なキャリアタンパク質は、細菌の毒度またはトキソイド(例えば、ジフテリアトキソイドまたは破傷風トキソイド)である。CRM197ジフテリア毒素誘導体[49〜51]は、MenjugateTMおよびMeningitecTM中のキャリアタンパク質であり、一方で、破傷風トキソイドは、NeisVacTMに使用される。ジフテリアトキソイドは、MenactraTM中のキャリアとして使用される。他の公知であるキャリアタンパク質としては、N.meningitidisの外膜タンパク質[52]、合成ペプチド[53、54]、熱ショックタンパク質[55、56]、百日咳タンパク質[57、58]、サイトカイン[59]、リンフォカイン[59]、ホルモン[59]、成長因子[59]、種々の病原体由来抗原から得た複数のヒトCD4+ T細胞のエピトープを含む人工タンパク質[60]、H.influenzae由来のプロテインD[61、62]、肺炎球菌の表面タンパク質PspA[63]、鉄取込みタンパク質[64]、C.difficile由来の毒素Aまたは毒素B[65]などが挙げられる。組成物は、例えば、キャリア抑制のリスクを減少するために1種より多いキャリアタンパク質を使用し得、そして単一のキャリアタンパク質は、1種より多い糖類抗原を保有し得る[66]。結合体は、一般的に、1:5(すなわち、タンパク質過剰)と5:1(すなわち、糖類過剰)との間の、糖類:タンパク質比(w/w)を有する。組成物は、上記結合体に加えて、遊離キャリアタンパク質を含有し得る[67]。
【0034】
一般的に、結合型糖類を含有する組成物は、本発明を使用して2つの手段で分析され得る。第1に、組成物中の各血清群について、糖類の総濃度は、例えば、ワクチンの販売前(規制または品質管理の目的のため)か、または結合体が混合された後に濃度を確認する前に測定され得る。第2に、組成物中の遊離の非結合型糖類は、例えば、不完全な結合体化について確認するためか、または長期にわたって増加する遊離糖類をモニタリングすることによって結合体の加水分解を追跡するために測定され得る。両方の型の分析を行うことによって、全糖類に対する遊離糖類の比は、規制または品質管理の目的のために使用され得る、各血清群について評価され得る。一般的に、ワクチンが25%未満(例えば、20%未満、15%未満、10%未満など)の各糖類を遊離形態で含むことを保証することが、望ましい。高レベルの遊離糖類は、結合体のより低い免疫原性用量を意味する。
【0035】
したがって本発明は、組成物を分析するための方法であって、ここで:
(a)この組成物が、血清群CのNeisseria meningitidis由来の莢膜糖類の結合体、ならびに(i)血清群W135のNeisseria meningitidis由来の莢膜糖類の結合体;および/または(ii)血清群YのNeisseria meningitidis由来の莢膜糖類の結合体の一方もしくは両方を含有し;
(b)この組成物が、非結合型の形態である莢膜糖類を含有し得;
(c)任意の非結合型莢膜糖類の含有量が、上記の通り、本発明のプロセスによって決定され;
(d)結合型莢膜糖類の含有量が、上記の通り、本発明のプロセスによって決定され;
そして、必要に応じて:
(e)結合型糖類:非結合型糖類の比が、この莢膜糖類の1種以上について計算される方法を提供する。
【0036】
工程(c)および工程(d)は、いずれかの順番で行われても同時に行われてもよい。
【0037】
本発明はまた、医師による使用のためのワクチンを販売するための方法であって、(a)血清群CのNeisseria meningitidis由来の莢膜糖類の結合体、ならびに(i)血清群W135のNeisseria meningitidis由来の莢膜糖類の結合体;および/または(ii)血清群YのNeisseria meningitidis由来の莢膜糖類の結合体の一方もしくは両方を含むワクチンを製造する工程;(b)上記莢膜糖類の各々についてのワクチン中の、結合型糖類および/または非結合型糖類の量を分析する工程を包含し;そして工程(b)から得た結果が、臨床使用において受容可能な糖類含有量を示す場合、(c)医師による使用のためのワクチンを販売する工程を包含する方法を提供する。工程(b)は、糖類の最小濃度(例えば、1種の血清群あたり1μg〜20μgの間の全糖類)の評価、非結合型糖類:結合型糖類の比(例えば、20重量%以下の非結合型糖類、好ましくは10重量%以下または5重量%以下の非結合型糖類)の評価などに関し得る。工程(b)は、パッケージ化されたワクチンに対して行われても、パッケージ化の前にバルクのワクチンに対して行われてもよい。
【0038】
結合型糖類および非結合型糖類を別個に評価するために、これらは分離されなければならない。水性組成物中の遊離(すなわち、非結合型)の糖類は、種々の手段で結合型糖類から分離され得る。結合体化の反応は、上記糖類についての虫食い状(carious)の化学的パラメーターおよび物理的パラメーターを変化させ、そしてこの違いは、分離のために活用され得る。例えば、この結合型物質がキャリアタンパク質に起因して、より高い質量を有する場合、サイズ分離が、遊離糖類および結合型糖類を分離するために使用され得る。限外濾過は、好ましいサイズ分離法であり、そして遊離糖類は、適切なカットオフ(例えば、CRM197キャリアに対して30kDa)を有する限外濾過膜を通過し得る一方で、結合体は保持される。代替的方法は、結合体を保持するが、遊離糖類を溶出物として通過させる、カラムまたは膜を使用する固相抽出(SPE)を用いることである。SPEは、より迅速であり、そしてより一貫した傾向にあるが、サイズ分離は、より普遍的に適用可能である。さらなる代替的方法として、結合体がアジュバントに吸着された場合、遠心分離は、加水分解後に脱着する遊離糖類(上清)から、吸着された結合体(ペレット)を分離する。
【0039】
したがって遊離糖類は、全糖類から分離され得、そして別個に分析され得、それによって組成物中の非結合型物質の量の決定を可能にする。この遊離の量を全量と比較することは、特にこの結合型物質が分離の間に支持体上に保持される場合、分離後の2つのプールを別個に分析することより容易である。
【0040】
(さらなる莢膜糖類成分)
本発明は、N.meningitidisの血清群C由来ならびに血清群W135由来および/または血清群Y由来の莢膜糖類を含有する組成物の分析を可能にする。本発明はまた、さらなる莢膜糖類(例えば、N.meningitidisの血清群A由来の莢膜糖類、H.influenzae b由来の莢膜糖類など)を含有する組成物の分析のために使用され得る。
【0041】
血清群Aの髄膜炎菌の莢膜糖類は、C3位およびC4位に部分的O−アセチル化を伴う、(α1→6)結合型のN−アセチル−D−マンノサミン−1−ホスフェートのホモポリマーである(図17)。これらのアセチル基は、加水分解を防ぐために封鎖基で置換され得[17]、そしてこのような改変糖類は、本発明の意味において、不活性(still)な血清群Aの糖類である。血清群Aの莢膜糖類の解重合条件は、公知である(例えば、他の血清群について上記されるようなTFAによる100℃での加水分解)[21]。代替的方法は、Dowex 50H+の後に、100℃で1時間加熱する工程を包含する[68]。遊離したマンノサミンホスフェートモノマーは、例えば、HPAEC−PADによって、グルコース、ガラクトースおよびシアル酸と並行して分析され得る[21]。
【0042】
Hibの莢膜糖類は、リボースとリビトールとホスフェートとのポリマーである。この糖類は、「PRP」(ポリ−3−β−D−リボース−(1,1)−D−リビトール−5−ホスフェート)として公知であり、そして図18に示される。HPAEC−PAD分析または31P−NMR分析のためにPRPを単糖類まで解重合するための方法は、公知である(例えば、室温で一晩のNaOHとのインキュベーションによる)[20]。遊離したリボースおよびリビトールは、グルコース、ガラクトースおよびシアル酸と並行して分析され得る。
【0043】
血清群Cの莢膜ポリ糖類は、α2→9結合型のシアル酸(コロミン酸としても知られる)のホモポリマーである。本発明によって分析される組成物は、シアル酸の他のいずれのホモポリマー(例えば、血清群Bの髄膜炎菌の莢膜糖類(α2→8結合型のシアル酸)、またはE.coli K12の莢膜糖類(α2→8結合およびα2→9結合を有する))も含有しないことが好ましい。より一般的に、分析されるべき組成物が、グルコース、ガラクトースまたはシアル酸であるモノマーを含む莢膜糖類を含有する場合、この莢膜糖類はまた、混合性の分析を容易にするために、その糖類に固有(その混合物内で)である、さらなるモノマーまたは複数のモノマーを含むことが好ましい。モノマーが糖類の間で共有される場合でさえ、固有のモノマーの存在は、異なる糖類を、髄膜炎菌の血清群C、血清群W135および血清群Yを解析するために記載されたものと同じ原理を使用して、並行して分析することを可能にする。
【0044】
(非莢膜糖類成分)
本発明が、分析下における組成物に由来する混合物の単糖類の分析に依存する場合、この組成物は、(莢膜糖類の加水分解に由来する任意のバックグラウンドの単糖類以外の)遊離形態の単糖類を含有しないことが好ましい。例えば、分析されるべき組成物中に遊離シアル酸を含有することは、血清群Cの含有量の過大評価を生じ得る。同じ原理は、二糖類などが含まれ、次いで加水分解される場合に適用する(例えば、血清群Yの過大評価を与え得るスクロース(グルコース+フルクトース)の存在またはマルトースもしくはトレハロース(両方ともジ−グルコース)の存在、および血清群W135および血清群Yの過大評価(ならびに血清群Cの過小評価)を与え得るラクトース(グルコース+ガラクトース)の存在)。
【0045】
しかし、このような糖類は、多くの場合、ワクチン処方物中で使用され(例えば、安定剤として[69、70])、そしてこれらの干渉の問題が最小化されるかまたは回避され得る2つの一般的手段が存在する。第1に、これらの成分の最初のレベルが、測定され、次いで解重合された混合物において測定されたレベルから差し引かれ得る。第2に、これらの成分が、例えば、濾過または透析によって分析前に上記組成物から除去され得る。限外濾過膜が使用されて、低分子量成分が除去され得る(例えば、スクロース(MW:360)を除去する1K膜)。
【0046】
分析される莢膜糖類中にも見出されない単糖類の存在は、通常は干渉の問題を生じない。例えば、糖アルコールは、凍結乾燥安定剤としてワクチンに含まれ得る[71]が、HPAEC−AEDは、単一の単糖類と対応するポリオールの単糖類との間(例えば、マンノース単糖類(Aerobacter aerogenesの莢膜中に見出されるような[72])とマンニトール単糖類(安定剤)との間、およびリボースとリビトールとの間[73])を区別し得る。
【0047】
(非糖類成分の分析)
組成物中の糖類の含有量を分析する工程と同様に、上記プロセスは、他の成分または特性(例えば、重量モル濃度、pH、個々の糖類または結合体についての重合度、タンパク質含有量(特にキャリアタンパク質について)、アルミニウム含有量、洗浄剤含有量、保存剤含有量など)の分析を包含し得る。
【0048】
本発明は、ワクチン組成物を調製するための方法を提供し、この方法は、pHを測定し、次いでこの組成物のpHを所望の値(例えば、6と8との間、または約7)に調整する工程を含む、本発明にしたがって組成物を分析する工程を包含する。
【0049】
本発明は、ワクチンをパッケージ化するための方法であって、以下の工程を包含する方法を提供する:(a)血清群CのNeisseria meningitidis由来の莢膜糖類の結合体、ならびに(i)血清群W135のNeisseria meningitidis由来の莢膜糖類の結合体および/または(ii)血清群YのNeisseria meningitidis由来の莢膜糖類の結合体の一方または両方を含むバルクのワクチンを製造する工程;(b)このバルクのワクチン中の結合型糖類および/または非結合型糖類の量を莢膜糖類の各々について分析する工程;(c)必要に応じて、pHおよび/または他の特性についてこのバルクのワクチンを分析する工程;そして工程(b)および工程(c)から得た結果が、このバルクのワクチンが臨床上の使用について受容可能であることを示す場合に、(d)このバルクからヒトに対する使用のためのワクチンを調製し、そしてパッケージ化する工程。工程(c)は、糖類の最小濃度の評価、非結合型糖類:結合型糖類の比の評価などを包含する(上記を参照のこと)。工程(d)は、単位用量形態または複数用量形態(例えば、バイアルまたはシリンジ)にパッケージ化する工程を包含し得る。注射についての代表的なヒトの用量は、0.5mlの容量を有する。
【0050】
工程(c)および/または工程(d)は、上記バルクのワクチンと1種以上のさらなる抗原とを混合することによって進められ得、これらの抗原としては、以下が挙げられる:−血清群AのN.meningitidis由来の莢膜糖類抗原;
−血清群BのN.meningitidis由来のタンパク質抗原;
−N.meningitidis血清群Bの微小胞[74]、「ネイティブOMV」[75]、ブレブまたは外膜小胞[例えば、参考文献76〜81など];
−Haemophilus influenzaeタイプb由来の糖類抗原;
−多価結合型糖類抗原のようなStreptococcus pneumoniae由来の抗原[例えば、参考文献82〜84];
−不活化ウイルスのようなA型肝炎ウイルス由来の抗原[例えば、85、86];
−表面抗原および/またはコア抗原のようなB型肝炎ウイルス由来の抗原[例えば、86、87];
−必要に応じてペルタクチンならびに/または凝集原2および凝集原3[例えば、参考文献88および89]とも組み合わせられる、百日咳完全毒素(PT)およびB.pertussis由来の線維状赤血球凝集素(FHA)のようなBordetella pertussis由来の抗原(細胞性百日咳抗原が使用され得る);
−ジフテリアトキソイドのようなジフテリア抗原[例えば、参考文献1の第13章](例えば、CRM197変異体[例えば、90]);
−破傷風トキソイドのような破傷風抗原[例えば、参考文献1の第27章];
−IPVのようなポリオ抗原[例えば、91,92]。
このような抗原が、アルミニウム塩アジュバント(例えば、水酸化物またはリン酸塩)に吸着され得る。好ましくは、任意のさらなる糖類が、結合体として挙げられる。
【0051】
(バッチ間の一貫性)
ヒト用ワクチンの製造に関して、結合型糖類は、結合体化の前(例えば、糖類とキャリアタンパク質)、結合体化の後、処方の後および混合の後に品質管理に供されるべきである。干渉が、シアル酸の複数の供給源を有することによって引き起こされるので、単糖類の分析に基づく先行技術の方法が使用されて、髄膜炎菌の血清群C由来、血清群W135由来および血清群Y由来の莢膜糖類を、これらが混合された後に区別し得ない。しかし、本発明によって、単糖類の分析が使用されて、混合した結合体が分析され得る。さらに、本発明のプロセスは、信頼性および一貫性があり、したがってこれが先行技術の方法では不可能であった、混合した結合体に関する異なるバッチの妥当な比較を可能にする。したがって、混合した結合体ワクチンの異なるバッチが、調製され、アッセイされ、次いでほとんど一貫したバッチが、販売および使用のために選択され得る一方で、異常なバッチは、拒絶され得る。
【0052】
本発明は、少なくとも2種の異なる髄膜炎菌の血清群由来の莢膜糖類の混合物内の、個々の血清群由来の糖類を定量化するためのプロセスであって、ここで:(a)この異なる血清群が、血清群C、ならびに:(i)血清群W135および/または(ii)血清群Yの一方または両方を含み;(b)このプロセスが、この混合物内の莢膜糖類を解重合して、解重合した混合物を提供する工程を包含し;そして(c)この異なる血清群が、この解重合した混合物の単糖類の組成を比較することによって定量化されるプロセスを提供する。
【0053】
本発明はまた、ワクチンのn個のバッチであって、ここで:(a)ワクチンのn個のバッチの各々が、血清群CのNeisseria meningitidis由来の莢膜糖類の結合体、ならびに(i)血清群W135のNeisseria meningitidis由来の莢膜糖類の結合体;および/または(ii)血清群YのNeisseria meningitidis由来の莢膜糖類の結合体の一方もしくは両方を含み;(b)第1のバッチ中の血清群Cの結合型糖類の濃度が、C1であり;(c)第2のバッチ中の血清群Cの結合型糖類の濃度が、C2であり;適用可能な場合、(d)第1のバッチ中の血清群W135の結合型糖類の濃度が、W1であり;適用可能な場合、(e)第2のバッチ中の血清群W135の結合型糖類の濃度が、W2であり;適用可能な場合、(f)第1のバッチ中の血清群Yの結合型糖類の濃度が、Y1であり;適用可能な場合、(g)第2のバッチ中の血清群Yの結合型糖類の濃度が、Y2であり;(h)C1/C2、W1/W2およびY1/Y2の比が、それぞれ0.90と1.10との間であり、そして好ましくはそれぞれ0.95と1.05との間であり;そして(i)このnの値は、2(例えば、2、3、4、5、6、7、8、9、10、11、12、13、14、15以上)以上であるバッチを提供する。
【0054】
(h)において特定される比は、比較される各バッチからの単一のサンプルに基づき得るが、代表的には各バッチの複数のサンプルから得た平均の値(例えば、平均値)に基づき得る。したがって、n個のバッチの各々は、複数のサンプリングに供され得、そして各サンプルは、次いで各バッチについて計算される平均値および必要な比を計算するために使用される平均値による、C1、C2、W1、W2、Y1およびY2の複数の測定値に従い得る。
【0055】
ワクチンの各バッチ(またはロット)は、別個に調製された。例えば、2つの異なるバッチは、同じバルクの単一結合体を別々に混合(separate mixing)するか、または別個に調製されたバルクの単一結合体を混合することによって作製され得る。同じバルクの混合物の異なるサンプルは、異なるバッチではなく、これらのサンプルは、異なる結合体の混合物を調製するときに生じる違いに起因するバッチ間の変動に従わない。
【0056】
上記で特定されるような特徴(a)〜(i)に加えて、上記n個のバッチは、以下によってさらに特徴付けられ得る:(j)上記第1のバッチ中の血清群Cの非結合型糖類の濃度が、C3であり;(k)上記第2のバッチ中の血清群Cの非結合型糖類の濃度が、C4であり;適用可能な場合、(l)この第1のバッチ中の血清群W135の非結合型糖類の濃度が、W3であり;適用可能な場合、(m)この第2のバッチ中の血清群W135の非結合型糖類の濃度が、W4であり;適用可能な場合、(n)この第1のバッチ中の血清群Yの非結合型糖類の濃度が、Y3であり;適用可能な場合、(o)この第2のバッチ中の血清群Yの非結合型糖類の濃度が、Y4であり;(p)C3/C4、W3/W4およびY3/Y4の比が、それぞれ0.90と1.10との間であり、そして好ましくはそれぞれ0.95と1.05との間である。このバッチはまた、以下によって特徴付けられ得る:(q)C3/C1、C4/C2、W3/W1、W4/W2、Y3/Y1およびY4/Y2の比が、それぞれ0.20未満(例えば、0.15未満、0.10未満、0.05未満、0.02未満、0)である。
【0057】
(一般)
用語「含む(comprising)」は、「含む(including)」および「からなる(consisting)」を包含する。例えば、Xを「含む(comprising)」組成物は、Xのみからなっても、さらに何かを含んでも(例えば、X+Y)よい。
【0058】
言葉「実質的に」は、「完全に」を除外しない。例えば、Yから「実質的に遊離(substantially free)する」組成物は、Yからから完全に遊離であり得る。必要な場合、言葉「実質的に」は、本発明の定義から除かれ得る。
【0059】
数値xとの関係において用語「約」は、例えば、x±10%を意味する。
【0060】
糖の環が開いた形態および閉じた形態で存在し得、閉じた形態が本明細書中の構造式において示される一方で、開いた形態はまた、本発明に包含されることが理解される。
【図面の簡単な説明】
【0061】
【図1】図1は、マンニトール安定剤を使用して凍結乾燥された髄膜炎菌の血清群Aの結合体のHPAEC−PAD分析を示す。
【図2】図2は、マンニトール安定剤を使用して凍結乾燥された髄膜炎菌の血清群Aの結合体のHPAEC−PAD分析を示す。
【図3】図3は、スクロースが安定剤として使用された場合の、凍結乾燥された髄膜炎菌の血清群Aの結合体のHPAEC−PAD分析を示す。
【図4】図4は、スクロースが安定剤として使用された場合の、凍結乾燥された髄膜炎菌の血清群Aの結合体のHPAEC−PAD分析を示す。
【図5】図5は、凍結乾燥されなかった血清群Yの結合体に対する、髄膜炎菌の血清群Aの結合体のHPAEC−PAD分析を示す。
【図6】図6は、凍結乾燥されなかった血清群Yの結合体に対する、髄膜炎菌の血清群Aの結合体のHPAEC−PAD分析を示す。
【図7】図7は、凍結乾燥されなかった血清群W135の結合体に対する、髄膜炎菌の血清群Aの結合体のHPAEC−PAD分析を示す。
【図8】図8は、凍結乾燥されなかった血清群W135の結合体に対する、髄膜炎菌の血清群Aの結合体のHPAEC−PAD分析を示す。
【図9】図9は、血清群C、血清群W135および血清群Yから得た混合した結合体のHPAEC−PAD分析を示す。
【図10】図10は、血清群C、血清群W135および血清群Yから得た混合した結合体のHPAEC−PAD分析を示す。
【図11】図11は、血清群C、血清群W135および血清群Yから得た混合した結合体のHPAEC−PAD分析を示す。
【図12】図12は、血清群C、血清群W135および血清群Yから得た混合した結合体のHPAEC−PAD分析を示す。
【図13】図13〜15は、髄膜炎菌の血清群Cの莢膜糖類(13)、血清群W135の莢膜糖類(14)、および血清群Yの莢膜糖類(15)についての構造式を示す。
【図14】図13〜15は、髄膜炎菌の血清群Cの莢膜糖類(13)、血清群W135の莢膜糖類(14)、および血清群Yの莢膜糖類(15)についての構造式を示す。
【図15】図13〜15は、髄膜炎菌の血清群Cの莢膜糖類(13)、血清群W135の莢膜糖類(14)、および血清群Yの莢膜糖類(15)についての構造式を示す。
【図16】図16は、血清群W135と血清群Yとの間の違いを示す。
【図17】図17は、血清群Aの髄膜炎菌由来の莢膜糖類の構造式を示す。
【図18】図18は、H.influenzaeタイプb由来の莢膜糖類の構造式を示す。
【図19】図19は、血清群Cの結合体(黒菱形)、血清群W135の結合体(黒四角)および血清群Yの結合体(黒三角)を合わせた、6つの時点に対する遊離糖類の変化(%)を示す。
【発明を実施するための形態】
【0062】
(発明を実施するための形態)
(結合体生成およびクロマトグラフ法)
莢膜糖類抗原は、Neisseria meningitidisの血清群A、血清群C、血清群W135および血清群Yから調製され、そして参考文献7に記載されるように、CRM197に結合体化された。
【0063】
上記4種の結合体が組み合わされて、水性「MenACWY」組成物が提供された。
【0064】
分離作業において、血清群Aの結合体は、スクロースまたはマンニトールのどちらかの存在下で凍結乾燥され、そして血清群Cの結合体と血清群W135の結合体と血清群Yの結合体との混合物(「MenCWY」)が、調製された。
【0065】
糖類含有量の分析は、製造業者の説明書に従ってDionexTM HPAEC−PADクロマトグラフィーシステム上で行われた。この器具は、グラジエントポンプモジュール(GP40またはGP50)およびアンペロメトリック電気化学検出器(ED40またはED50)およびオートサンプラー(AS3500またはAS50)を有した。糖類は、金作用電極(Ag/AgCl参照電極を伴う)の表面での糖類の酸化により生じた電流を測定することによって検出される。三重ポテンシャル波形は、以下の設定を使用して適用された:E1=0.05V;tl=400ms;E2=0.75V;t2=200ms;E3=−0.15V;t3=400ms。統合は、E1の適用の間の200ms〜400msで起きた。このクロマトグラフィーのデータは、PeakNet 6.4データ整理ソフトウェアを使用して積分され、そして処理された。
【0066】
(血清群A)
血清群Aの糖類のマンニトール−凍結乾燥処方物は、4℃にて3ヶ月間保存された後にHPAEC−PADによって試験された。結合体含有組成物は、C4固相抽出(SPE)カラムを使用して遊離糖類から分離された。この遊離糖類を含む溶液は、TFAを使用する100℃にて2時間の酸加水分解に供された。次いで、この混合物は、マンノサミン−6−ホスフェートの検出のために、PA1保護、勾配溶離およびPAD検出を使用するDionexTM CarboPac PA1カラムに適用された。結果は、図1に示される。
【0067】
遊離糖類のSPE分離を伴わずに、同じ分析が行われた。この分析の結果は、図2に示される。図1と図2との比較(図1の分析に1:2の希釈を使用し、そして図2の分析に1:5の希釈を使用したことに注意する)は、マンノサミン−6−ホスフェートのピークが、図1において非常に低いことを示し、この組成物中の遊離糖類の低いレベルを示す。定量分析は、1バイアルあたり3.7%の遊離糖類を含む10.7μgの全糖類を示す。
【0068】
スクロース−凍結乾燥物質は、1バイアルあたり600μlの水で再構成され、次いで1回の分析あたり2〜3ml提供されるようにサンプルがプールされた後に、同じ方法で分析された。しかし、SPE C4の前に、この組成物は、1K膜を使用する限外濾過に供された(2mlの水で洗浄し、2mlのサンプル溶液をロードし、その度ごとに2mlの水で3サイクル洗浄し、保持物(retentate)を回収し、そして1mlまで容量を調整し、SPEにロードするために1:1に希釈して0.9%の最終NaCl濃度を与える)。図3は、この組成物中にごくわずかな遊離糖類が存在するが、結合型物質に対応する大きなピークが存在することを示す(図4)。
【0069】
(血清群W135および血清群Y)
他の結合体と組み合わせる前に、バルクの血清群Yの結合体は、分析された。この結合体は、30kDaの限外濾過膜を使用して遊離糖類から分離された。分析されるべき物質は、TFAによって100℃にて加水分解され、次いで製造業者の説明書に従って、CarboPac PA1カラム、AminoTrap、定組成溶離および再生工程、ならびにPAD検出を使用するDionexTM装置上で、グルコースについて定量分析された。CRM197キャリアは、このカラムへの上記加水分解物の適用前に除去されることを必要としなかった。非結合型物質は、検出可能であった(図5)が、全グルコースより豊富ではなかった(図6)。異なる希釈に注目すると、これらの図の分析から、1.8%の遊離糖類画分が提供される。
【0070】
バルクの血清群W135物質は、同じ方法で処理され、そして分析されたが、この方法は、グルコースの検出よりもむしろガラクトースの検出を伴った(図7および図8)。異なる希釈に注目すると、これらの図の分析から、6%の遊離糖類画分が提供される。
【0071】
(混合した結合体)
血清群A、血清群C、血清群W135および血清群Yついての結合体は、参考文献7に記載されるように、リン酸アルミニウムアジュバントと組み合わされた。4℃にて2週間保存されたMenCWY結合体の組み合わせが使用されて、凍結乾燥したMenA結合体が再構成され、そして48時間後に、結合体からこのアジュバントを分離するための遠心分離を伴って分析された。この混合した結合体は、30kDaの膜を使用する2サイクルの限外濾過によって遊離糖類から分離された。第2のサイクルは、ときとして第1のサイクルの透過物中に通り抜けることが見出される複合糖質による汚染を減少させた。糖類は、限外濾過の前および後における、TFAを使用する90℃/100℃での酸加水分解により、次いで2つを別個に、DionexTM CarboPac PA1カラムを使用してHPAEC−PAD分析することによって分析された。
【0072】
血清群Cの分析のために、カラムは、CarboPac PA1保護を有し、そして勾配溶離工程を使用した。このカラムは、この方法のより迅速な様式として、グルコースとガラクトースとが分解されない様式において実行された。結果は、図9および図10に示される。血清群W135および血清群Yに関して、このカラムは、AminoTrapを有し、そしてグルコースおよびガラクトースを分解する定組成溶離および再生を使用した。結果は、図11および図12に示される。
【0073】
それぞれの異なる糖類の量を計算するために、図9/10の分析におけるシアル酸の量は、グルコースおよびガラクトースの合わせた量を差し引くことによって干渉について補正される。この値は、MenCの濃度を与える。その後、図11/12の分析におけるガラクトースおよびグルコースの量は、血清群W135および血清群Yを定量化するために使用される。不完全な加水分解に起因して、図11/12から得たグルコースおよびガラクトースの合わせた量は、上記されるように、図9/10から取得された量と一致し得ないが、このような矛盾は、全体の分析に影響を与えない。量は、グルコース、ガラクトースおよびシアル酸の公知の量を含む基準と比較することによって計算された。
【0074】
結合体中の全MenC糖類および遊離MenC糖類の代表的な2つ組(duplicate)の分析は、これらの結果を与えた:
【0075】
【表1】

したがって、血清群Cの糖類を定量化するための固有な糖類の欠如にかかわらず、本発明は、この物質が血清群W135の糖類および血清群Yの糖類のバックグラウンドにおいて定量的にアッセイされることを可能にする。
【0076】
図9および図11の類似する分析は、MenACWY組成物中のそれぞれの遊離糖類の量を示し、そして遊離糖類をこの組成物中の全糖類の%として示すことを可能にする。この分析は、1用量あたり10μg(すなわち20μg/ml)の各糖類を含むように処方されたMenCWYの組み合わせ対して、1年間にわたる種々の時点において行われた。結果は、以下:
【0077】
【表2】

の通りであった。
6つの時点における遊離糖類の%の変動は、図19に示される。
【0078】
第2の系列の実験において、ワクチンは、これまでの実験に対して半分(1用量あたり5μgの各糖類)および4分の1の用量(2.5μg)で処方された。本発明のプロセスは、この組み合わせの中から異なる糖類を解析するために使用され、そして結果は、以下:
【0079】
【表3】

の通りであった。
【0080】
本発明が例の手段によってのみ記載され、そして改変が、本発明の範囲および精神内にありつつなされ得ることが理解される。
【0081】
【化4】

【0082】
【化5】

【特許請求の範囲】
【請求項1】
明細書中に記載の発明。
【請求項1】
明細書中に記載の発明。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【図15】


【図16】


【図17】


【図18】


【図19】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【図15】


【図16】


【図17】


【図18】


【図19】


【公開番号】特開2011−13226(P2011−13226A)
【公開日】平成23年1月20日(2011.1.20)
【国際特許分類】
【出願番号】特願2010−183515(P2010−183515)
【出願日】平成22年8月18日(2010.8.18)
【分割の表示】特願2007−503446(P2007−503446)の分割
【原出願日】平成17年3月17日(2005.3.17)
【出願人】(592243793)カイロン ソチエタ ア レスポンサビリタ リミタータ (107)
【Fターム(参考)】
【公開日】平成23年1月20日(2011.1.20)
【国際特許分類】
【出願日】平成22年8月18日(2010.8.18)
【分割の表示】特願2007−503446(P2007−503446)の分割
【原出願日】平成17年3月17日(2005.3.17)
【出願人】(592243793)カイロン ソチエタ ア レスポンサビリタ リミタータ (107)
【Fターム(参考)】
[ Back to top ]

