平滑筋細胞増殖を阻害するための医療装置及び方法
本発明は、一般に、細胞増殖及び/又は遊走と関連する疾患又は健康状態を予防又は治療するのに有用な量の、1以上の治療薬、好ましくはパクリタクセルを含む、医療装置、好ましくは、ステントに関する。特に、本発明は、細胞を殺さずに、そのG1/S期において平滑筋細胞を静止するのに効果的である、細胞分裂を停止する量のパクリタクセルを放出することのできる医療装置に関する。該医療装置は、また、予め決められた速度でパクリタクセルを放出することができる。該医療装置の製造方法及び使用方法も提供される。
【発明の詳細な説明】
【技術分野】
【0001】
本出願は、2003年6月30日に出願された、米国仮出願第60/483,820号の優先権の利益を請求し、2001年9月24日に出願された、米国仮出願第60/324,095号の優先権の利益を請求する、2002年9月24日に出願された、米国出願第10/252,848号の一部継続出願であり、全ては、本明細書において完全に参考文献として組み込まれる。
【0002】
本発明は、一般に、低濃度のパクリタクセル等の抗増殖性薬剤に細胞をさらすことにより、細胞周期のG1/S期における平滑筋細胞を静止する方法に関する。また、本発明は、細胞をG1/S期において静止することによって、平滑筋細胞の増殖及び/又は遊走を阻害するために効果的な量で、一定期間にわたり、1以上の治療薬、好ましくはパクリタクセルの持続性放出を提供することを可能にする薬物溶出医療装置に関する。1つの実施態様においては、上記医療装置は、パクリタクセルを取り込んだ高分子材料を含む表面コーティングでコーティングされているか、又は覆われている。好ましくは、高分子材料は生物学的安定であり、任意に1以上の生物学的に活性な物質、好ましくは、平滑筋細胞阻害剤及び/又は抗生物質を含有する。また、本発明は、上記薬物溶出医用装置を製造する方法及び利用する方法に関する。更に、本発明は、パクリタクセルの細胞分裂停止のために必要な量を患者に投与することによる、再狭窄、狭窄症、乾癬、皮膚炎、肝臓硬化症又は前立腺肥大症等の増殖性疾患の予防又は治療方法に関する。
【背景技術】
【0003】
循環器疾患は、先進国において主要な死因である。このような疾患を有する患者は、通常、1以上の動脈において狭小化又は閉鎖(狭窄症)を有する。循環器疾患に治療における薬物の使用は公知である。ステントは、通常、管腔の範囲内で治療域に収縮した状態で配送され、次いで膨張される。バルーン膨張性ステント(balloon-expandablestents)は、ステントの管腔内で膨張するバルーンによってステントボディー上に与えられる力に応じて変形することによって、収縮した状態から膨張する。一旦、体管腔中で拡張されると、ステントは、その拡張された直径を維持するために、体管腔(body lumen wass)によって与えられるいかなる収縮する力に抵抗するのに十分なほど強い。それと比較し、自己膨張性ステントは、圧縮される時、放射状膨張力を与える弾性体を有する。体管腔中で展開する、自己膨張性ステントは、放射状膨張力に等しいステントに対する圧縮力を与える体管腔壁まで膨張する。
【0004】
しかし、バルーン膨張性及び自己膨張ステントの使用は、ステントの展開により、体管腔に心的外傷の原因となる不都合を有する。通常は、ステントは、ステントの直径が体管腔の直径よりも大きくなるように、体管腔内で膨張する。結果として、ステントの末端の縁が体管腔の壁内で圧縮され、更なる心的外傷を引き起こす位置に強調され、すなわち、体管腔壁を切断するか引き裂く。この心的外傷は、最終的に、血管平滑筋細胞(SMC)の増殖のために、最初にステントの断片中冠動脈の再狭小化である、再狭窄を誘導する。再狭窄は、平均して、ステントを受け入れた患者の25%で生じる(Kuntz R.E.らの論文、冠動脈の再狭窄の予防:放射線療法のための進化している証拠の根拠、Circulation. 2000 May 9;101(18):2130-3)。
【0005】
最近、再狭窄を更に予防するために、種々のタイプの薬物を被覆したステントが、体管腔の壁に対し、薬物配送の局在化のために用いられてきた。SMC増幅を予防するために最近用いられている1つの戦略は、シロリムス(Sousa J.Eらの論文、ヒト冠状動脈における、シロリムス溶出ステントの移植後の、2年間の、血管造影、血管内超音波追跡、Circulation. 2003 Jan 28;107(3):381-3)及びパクリタクセル(Axel D.I.らの論文、パクリタクセルは、局所性薬物配送を用いた、インビトロ及びインビボにおいて、動脈性平滑筋細胞の増殖及び遊走を阻害する、Circulation. 1997 Jul 15;96(2):636-45;Garza L.らの論文、我々はステント内の再狭窄を予防できるか?Curr Opin Cardiol. 2002 Sep;17(5):518-25;Grube E.らの論文、TAXUS I:新規な冠状動脈の障害のための遅放出型パクリタクセル溶出ステントにおける無作為、二重盲検試験からの6ヶ月及び12ヶ月の結果、Circulation. 2003 Jan 7;107(1):38-42;Ferguson J.E.らの論文、血管増殖性疾患の予防における細胞周期の調整の役割、Cell Cycle. 2003 May-Jun;2(3):211-9;Park S.J.らの論文、冠状動脈再狭窄の予防のためのパクリタクセル溶出ステント、N Engl J Med. 2003 Apr 17;348(16):1537-45)。
【0006】
パクリタクセルは、広範囲の悪性腫瘍において高い有効性を示す、抗腫瘍性薬物タキソール(登録商標)の活性成分である(Rowinsky E.K.らの論文、パクリタクセル(タキソール)、N Engl J Med. 1995 Apr 13;332(15):1044-14;Rowinsky E.K.の論文、臨床試験におけるパクリタクセルの抗腫瘍活性の最新情報、Ann Pharmacother. 1994 May;28(5 Suppl):S18-22;Blagosklonny M.V.の論文、微小管阻害薬、Cncer Handbook. Nature Publishing Group, 2002;(編集:Alison M.R.)。タキソール(登録商標)は、現在、進行性卵巣ガン、リンパ節転移陽性乳ガンのアジュバント治療、転移性疾患の組み合わせ化学療法の失敗後の乳ガン、アジュバント化学療法の6ヶ月以内の再発、非小細胞肺ガン(シスプラチンと併用)、及びエイズに関連するカポジ肉腫を含む、種々の適応症に対し、FDAに承認されている。
【0007】
抗腫瘍治療に対して適用可能なレベルの濃度で、パクリタクセルの作用モードは、抗腫瘍治療に対して適用可能なレベルの濃度で、長期の核分裂停止、それに続くアポトーシスの導入への誘導、ヒト骨髄性白血病における迅速なプログラムされた細胞死の構築による干渉に寄与する(Bhalla K.らの論文、タキソールは、ヒト骨髄性白血病細胞におけるプログラムされた細胞死と関連するヌクレオソーム間のDNA断片化を誘導する、Leukemia. 1993 Apr;7(4):563-8; Li X.らの論文、白血病の治療の際の細胞のアポトーシス死、Leuk Lymphoma. 1994;13 Suppl 1:65-70; Perkins C.L.らの論文、アポトーシスの際の、エトポサイド又はパクリタクセルが誘導するミトコンドリアの事象におけるApaf-1、キャスパーゼ-9及びビッドプロテインの役割、Blagosklonny M.V. らの論文、有糸分裂促進剤が活性化するプロテインキナーゼ経路は、白血病細胞中において、微小管が活性化する薬物が誘導する、Raf-1/Bcl-2リン酸化反応及びアポトーシスに不必要である、Leukemia. 1999 Ju1;13(7):1028-36)。このような高濃度におけるパクリタクセルに関連する細胞死のために、それは腫瘍学の分野における細胞障害性薬物と考えられる。
【0008】
治療薬の効果が、細胞のタイプ、薬物濃度、薬物への露出時間、及び標的細胞集団の微小環境によって広く変化し得ることを考慮すると、抗狭窄/再狭窄薬(例えばパクリタクセル)の効果が、他の病状におけるその使用から得られる推定される結果よりもむしろ、病理学に関連する細胞集団において調査されることが必要である。薬物を溶出するステントテクノロジーの迅速な採択は、この理解を展開することをいっそう重大なものとし、その結果、臨床的な終点は、細胞レベルで、潜在的な薬物の影響と効果的に連関する。
【発明の開示】
【発明が解決しようとする課題】
【0009】
本発明者らは、冠状ステント移植に続く再狭窄の治療のためのパクリタクセルの作用の新規なメカニズムを発見した。特に、本発明者らは、相対的に低濃度のパクリタクセルにさらした時、アポトーシス経路を引き起こさずに、細胞周期のG1/S期で、平滑筋細胞を静止することを発見した。これは、冠状動脈においてパクリタクセルを溶出するステントの配置に続く、平滑筋細胞の増殖を阻害するための新規な細胞分裂停止メカニズムを提供する。
【0010】
特定の実施態様においては、本発明は、約0.001ng/ml〜約10,000ng/ml、好ましくは約0.01ng/ml〜約1,000ng/ml、又は約60ng/ml〜約6,000ng/ml濃度のパクリタクセルに細胞をさらすことにより、G1/S期において平滑筋細胞を静止させる方法に関する。特定の実施態様においては、平滑筋細胞のほとんど(すなわち、約80%以上、好ましくは約90%〜約100%)が、低濃度のパクリタクセルにさらされた時、細胞周期のG1/S期で静止する。
【0011】
特定の実施態様においては、本発明は、平滑筋細胞を含む体管腔に挿入又は移植し得る、パクリタクセル溶出医療装置に関する。該医療装置は、表面、及び、パクリタクセルを取り込む高分子材料を含有する表面コーティングを含む。好ましい実施態様においては、医療装置の表面は、該表面の表面積に対し、約0.5μg/mm2〜約5μg/mm2のパクリタクセルを含有する、高分子材料でコーティングされている。更に好ましい実施態様においては、該医療装置の表面は、該表面の表面mm当り、約1μgのパクリタクセルを含有する、高分子材料でコーティングされている。
【0012】
他の好ましい実施態様においては、医療装置の表面をコーティングするために用いられる高分子材料は生物学的に安定である。他の好ましい実施態様においては、医療装置の表面をコーティングするために用いられる高分子材料はスチレン−イソブチレン共重合体を含有する。他の好ましい実施態様においては、該医療装置の表面をコーティングするために用いられる高分子材料は、パクリタクセルに加え、生物学的に活性な物質を含有する。
【0013】
特定の実施態様においては、該医療装置は、表面コーティングの高分子材料に取り込まれた、パクリタクセルの特定量、すなわち細胞周期のG1/S期において放出されたパクリタクセルにさらされたほとんどの平滑筋細胞を静止するために有効な量を放出することができる。好ましく、パクリタクセルにさらされた平滑筋細胞の約90%〜約100%が静止する。
【0014】
他の実施態様においては、該医療装置は、該表面の表面積mm当り、約0.001μg〜約20μgのパクリタクセルを、約1週間〜約8週間に渡り溶出することができる。好ましい実施態様においては、該医療装置は、該表面の表面積mm当り、約0.01μg〜約0.1μgのパクリタクセルを、約4週間に渡り溶出することができる。他の好ましい実施態様においては、該医療装置は、高分子材料に取り込まれたパクリタクセルの0.1%〜約35%、更に好ましくは1%〜約15%を、約1週間〜約8週間に渡り放出することができる。好ましくは、該医療装置は、パクリタクセルを、4週間に渡り連続的に放出することができる。
【0015】
1つの実施態様においては、該医療装置によって放出される、パクリタクセルの量は、該平滑筋細胞を、約0.001ng/ml〜約10,000ng/mlであり、好ましくは約0.01ng/ml〜約1,000ng/mlであり、又は約60ng/ml〜約6,000ng/mlであるパクリタクセルの濃度にさらすものである。
【0016】
本明細書に開示される医療装置は、患者における狭窄症又は再狭窄の予防又は治療に用いることができる。好ましくは、患者はヒトである。
特定の実施態様においては、治療に効果的な量のパクリタクセルを、治療が必要な患者に投与することにより、増殖性疾患を治療するための方法に関する。好ましい実施態様においては、治療に効果的な量は、約0.001ng/ml〜約10,000ng/mlである。更に好ましい実施態様においては、治療に効果的な量は、約0.01ng/ml〜約1,000ng/mlである。好ましい実施態様においては、治療に効果的な量は、約60ng/ml〜約6,000ng/mlである。
【0017】
該パクリタクセルは、非経口的、皮下、筋肉内、眼窩内、関節内、脊髄内、胸骨内、静脈内、皮内、腹腔内、門脈内、動脈内、くも膜下腔内、関節内、経粘膜、胸膜内、経皮、局所、硬膜外、粘膜、鼻腔内注射又は注入、又は経口、吸入、肺又は直腸投与によって、患者に投与することができる。特定の実施態様においては、パクリタクセルは、平滑筋細胞を含有する患者の体管腔に直接投与される。好ましくは、パクリタクセルの治療に効果的な量は、細胞周期のG1/S期に体管腔の平滑筋細胞を静止するのに効果的なものである。
該方法は、再狭窄、狭窄、乾癬、皮膚炎、肝臓硬化症及び前立腺肥大症の治療に有用であるが、限定されない。
【発明を実施するための最良の形態】
【0018】
本発明は、一般に、細胞周期のG1/S期に平滑筋細胞を静止させる方法に関する。さらに、本発明は、G1/S期において、放出された治療薬にさらされた細胞のほとんどが静止することにより、平滑筋細胞の増殖及び/又は遊走を阻害するのに効果的な量の1以上の治療薬を放出することのできる、薬物放出医療装置に関する。特定の実施態様においては、該医療装置は、1以上の治療薬が取り込まれた、1以上の高分子材料を含有する、1以上の薬物放出コーティングでコーティング又は覆われている。他の特定の実施態様においては、該医療装置は、1以上の治療薬が取り込まれた1以上の高分子材料を含有する、1以上の薬物放出高分子混合物で製造される。
【0019】
1つの実施態様においては、該医療装置は、パクリタクセルが取り込まれた高分子材料を含有する表面コーティングを有する。特定の実施態様においては、該医療装置は、該医療装置の表面の表面積cm当り、約0.5μg〜約5μgのパクリタクセルを含有する表面コーティングでコーティングされているか又は覆われている。好ましい実施態様においては、該医療装置は、該医療装置の表面の表面積mm当り、約1μgのパクリタクセルを含む、表面コーティングでコーティングされているか又は覆われている。
【0020】
他の実施態様においては、該医療装置は、一定期間にわたり該表面コーティングを構成する高分子材料中に取り込まれているパクリタクセルを細胞分裂静止のための量又は割合で放出することができる。本明細書中で用いられているように、「細胞分裂停止」のための量は、タンパク質合成を阻害するよりも、細胞を殺し及び/又はDNA合成を阻害する量を意味するが、これに限定されない。
【0021】
さらなる他の実施態様においては、該表面の表面積mm当り、約0.001μg〜約20μgのパクリタクセルを約1週間〜約8週間に渡り放出することができる。好ましい実施態様においては、該医療装置は、該表面の表面積mm当り、約0.01μg〜約0.1μgのパクリタクセルを約4週間放出することができる。他の好ましい実施態様においては、該医療装置は、表面コーティングを構成する高分子材料に取り込まれたパクリタクセルの約0.1%〜約35%を放出することができる。好ましくは、該医療装置は、インビトロ環境において、約0.1%〜約15%のパクリタクセルを10日間以上放出することができる。
好ましくは、放出されたパクリタクセルの循環するレベルが約0.001ng/ml〜約10,000ng/mlに約1週間〜約8週間に渡り維持されるような量のパクリタクセルを放出することができる。
【0022】
好ましくは、標的細胞は、ほとんどの細胞がG1/S期で静止し得るパクリタクセルの濃度にさらされる。好ましくは、細胞がさらされるパクリタクセルの濃度はアポトーシス性細胞死を誘導しないものである。好ましくは、細胞がさらされるパクリタクセルの濃度は、約0.001ng/ml〜約10,000ng/mlである。更に好ましくは、細胞がさらされるパクリタクセルの濃度は、約0.01ng/ml〜約1,000ng/mlである。好ましくは、細胞がさらされるパクリタクセルの濃度は、約60ng/ml〜約6,000ng/mlである。本明細書で用いられるように、「パクリタクセル」は、パクリタクセル、その類似体及びその誘導体を意味する。
【0023】
また、本発明は、薬物放出医療装置を、それを必要とする患者に挿入又は移植することにより、狭窄症又は再狭窄を治療又は予防する方法に関する。更に、本発明は、それを必要とする患者に治療に効果的な量のパクリタクセルを投与することにより、再狭窄、狭窄症、乾癬、皮膚炎、肝臓硬化症及び前立腺肥大症等の細胞増殖及び/又は遊走(増殖性疾患)に関連する疾患又は状態を治療又は予防する方法に関する。特に、パクリタクセルの治療に効果的な量は、アポトーシス性細胞死を誘発せずに、細胞周期のG1/S期において、ほとんどの(すなわち、80%以上)、好ましくは約90%〜約100%の平滑筋細胞を静止させる、細胞分裂停止のための量である。
開示の明瞭のため、限定的でないが、本発明の詳細な説明を以下のサブセクションに分けた。
【0024】
(5.1医療装置の製造方法)
(5.1.1薬物放出コーティング)
本発明の装置のためにコーティングを形成するのに適当なコーティング組成物は、下記セクション5.1.2に記載するような1以上の治療薬、下記セクション5.1.3に記載するような1以上の高分子材料を含有する。特定の実施態様においては、コーティング組成物は、1、2、3、4、5又はそれ以上の高分子材料を含有する。特定の実施態様においては、高分子材料は、1、2、3、4、5又はそれ以上の治療薬を含有する。
【0025】
1つの実施態様においては、コーティング組成物は、治療薬、好ましくはパクリタクセルを取り込む高分子材料を含有する。該高分子材料は、パクリタクセル又は治療薬を混合することによって、パクリタクセル又は他の治療薬を取り込み、例えば、高分子材料は少なくともいくつかのパクリタクセル又は治療薬を取り囲むものである。任意には、コーティングは1以上の付加的な治療薬を含有する。1つの実施態様においては、コーティングは、第1の治療薬を含有する第1の高分子材料、及び第2の治療薬を含有する第2の高分子材料を含む。特定の実施態様においては、第1及び第2の治療薬は同じ、例えばパクリタクセルである。他の特定の実施態様においては、第1及び第2の治療薬薬は異なり、例えばパクリタクセル及びラパマイシンである。
【0026】
コーティング組成物を調製するため、成分、例えば、高分子、パクリタクセル及び任意に付加的な治療薬は、溶媒に懸濁され、及び/又は溶解される。好ましくは、溶媒は、用いられる治療薬の治療特性を変化させないか、逆に影響を与えない。例えば、パクリタクセルのための有用な溶媒は、クレモホール(登録商標)EL溶液等のポリエトキシル化されたヒマシ油を含む。コーティング組成物中の高分子材料及びパクリタクセルの含有は、高分子材料がパクリタクセルを取り込んだコーティングを形成する。
【0027】
特定の実施態様においては、コーティング組成物は、少なくとも約5重量%、少なくとも約10重量%、少なくとも約20重量%、少なくとも約30重量%、少なくとも約40重量%、少なくとも約50重量%、少なくとも約60重量%、少なくとも約70重量%、少なくとも約80重量%、少なくとも約90重量%、少なくとも約95重量%、少なくとも約97重量%、少なくとも約99重量%又はそれ以上の高分子材料を含有する。特定の実施態様においては、コーティング組成物は、少なくとも約5重量%、少なくとも約10重量%、少なくとも約20重量%、少なくとも約30重量%、少なくとも約40重量%、少なくとも約50重量%、少なくとも約60重量%、少なくとも約70重量%、少なくとも約80重量%、少なくとも約90重量%、少なくとも約95重量%、少なくとも約97重量%、少なくとも約99重量%又はそれ以上の(第一の)治療薬、好ましくはパクリタクセルを含有する。特定の実施態様においては、少なくとも約5重量%、少なくとも約10重量%、少なくとも約20重量%、少なくとも約30重量%、少なくとも約40重量%、少なくとも約50重量%、少なくとも約60重量%、少なくとも約70重量%、少なくとも約80重量%、少なくとも約90重量%、少なくとも約95重量%、少なくとも約97重量%、少なくとも約99重量%又はそれ以上の付加的な(第二、第三、第四又は第五の)治療薬を含有する。
【0028】
特定の実施態様においては、コーティング組成物は、約0.001μg、約0.01μg、約0.1μg、約1μg、5μg、約10μg、約15μg、約20μg、約25μg、約30μg、約35μg、約40μg、約45μg、約50μg、約60μg、約70μg、約80μg、約90μg、約100μg、約110μg、約120μg、約130μg、約140μg、約150μg、約200μg、約250μg、約300μg、約350μg、約400μg、約500μg、約600μg、約700μg、約800μg、約900μg、約1,000μg、約2,000μg又はそれ以上の治療薬を含有する。好ましくは、コーティング組成物は、約50μg〜約200μgのパクリタクセルを含有する。
【0029】
他の特定の実施態様においては、コーティング組成物は、該医療装置の表面の表面積mm当り、約0.001μg、約0.01μg、約0.1μg、約0.5μg、約1.0μg、約2.0μg、約3.0μg、約4.0μg、約5.0μg、約6.0μg、約7.0μg、約8.0μg、約9.0μg、約10.0μg、約15.0μg、約20.0μg又はそれ以上の治療薬を含有する。好ましくは、コーティング組成物は、該医療装置の表面の表面積mm当り、約0.5μg〜約5μgのパクリタクセルを含有する。
【0030】
特定の実施態様においては、コーティング組成物は、細胞をG1/S期に静止させるのに有効な細胞分裂静止をさせる量の治療薬を放出することができる。
1つの実施態様においては、該コーティング組成物は、高分子材料に取り込まれたパクリタクセルの約0.1%、約1%、約5%、約10%、約15%、約20%、約25%、約30%、約35%、約40%、約45%、約50%、約55%、約60%、約65%、約70%、約75%、約80%、約90%、約95%、又はそれ以上を、約30分、1時間、2時間、6時間、約12時間、約24時間、約2日、約3日、約4日、約5日、約6日、約1週間、約2週間、約3週間、約1ヶ月、約2ヶ月、約3ヶ月、約4ヶ月、約5ヶ月、約6ヶ月、約1年、約2年、約5年に渡り放出する。好ましくは、高分子材料に取り込まれたパクリタクセルの約0.1%〜約35%を、約1週間〜約8週間に渡り放出することができる。更に好ましくは、コーティング組成物は、高分子材料に取り込まれたパクリタクセルの約1%〜約15%を、約4週間に渡り放出することができる。
【0031】
他の実施態様においては、該コーティング組成物は、約0.001μg、約0.01μg、約0.1μg、約1μg、5μg、約10μg、約15μg、約20μg、約25μg、約30μg、約35μg、約40μg、約45μg、約50μg、約60μg、約70μg、約80μg、約90μg、約100μg、約110μg、約120μg、約130μg、約140μg、約150μg、約200μg、約250μg、約300μg、約350μg、約400μg、約500μg、約600μg、約700μg、約800μg、約900μg、約1,000μg、約2,000μgまたはそれ以上の治療薬を、約30分、1時間、2時間、6時間、約12時間、約24時間、約2日、約3日、約4日、約5日、約6日、約1週間、約2週間、約3週間、約1ヶ月、約2ヶ月、約3ヶ月、約4ヶ月、約5ヶ月、約6ヶ月、約1年、約2年、約5年に渡り放出する。好ましくは、該コーティング組成物は、高分子材料中に取り込まれた約50μg〜約200μgのパクリタクセルを、約1週間〜約8週間放出することができる。
【0032】
他の実施態様においては、該コーティング組成物は、該医療装置の表面の表面積mm当り、約0.001μg、約0.01μg、約0.1μg、約0.5μg、約1.0μg、約2.0μg、約3.0μg、約4.0μg、約5.0μg、約6.0μg、約7.0μg、約8.0μg、約9.0μg、約10.0μg、約15.0μg、約20.0μg又はそれ以上の治療薬を、約30分、1時間、2時間、6時間、約12時間、約24時間、約2日、約3日、約4日、約5日、約6日、約1週間、約2週間、約3週間、約1ヶ月、約2ヶ月、約3ヶ月、約4ヶ月、約5ヶ月、約6ヶ月、約1年、約2年、約5年に渡り放出する。好ましくは、該コーティング組成物は、高分子材料中に取り込まれた、約0.01μg〜約0.1μgのパクリタクセルを約1週間〜約8週間に渡り放出することができる。
【0033】
特定の他の実施態様においては、コーティング組成物は、長期間にわたり、治療薬を連続的に放出することができ、それによって、該細胞が、G1/S期で細胞が静止するのに有効な濃度の治療薬にさらされる。好ましくは、細胞がさらされる治療薬の濃度は、約0.0001ng/ml、約0.001ng/ml、約0.01ng/ml、約0.1ng/ml、約1.0ng/ml、約10ng/ml、約20ng/ml、約30ng/ml、約40ng/ml、約50ng/ml、約100ng/ml、約200ng/ml、約300ng/ml、約400ng/ml、約500ng/ml、約600ng/ml、約700ng/ml、約800ng/ml、約900ng/ml、約1,000ng/ml、約2,000ng/ml、約3,000ng/ml、約4,000ng/ml、約5,000ng/ml、約10,000ng/ml又はそれ以上の治療薬である。好ましくは、細胞がさらされる治療薬の濃度は、約0.001ng/ml〜10,000ng/mlのパクリタクセルである。更に好ましくは、細胞がさらされる治療薬の濃度は、約0.01ng/ml〜1,000ng/mlのパクリタクセルである。好ましくは、細胞がさらされる治療薬の濃度は、約60ng/ml〜約6,000ng/mlである。
【0034】
(5.1.2治療薬/生物学的に活性な物質)
本発明において用いられる、「治療薬」なる用語は、薬物、遺伝物質及び生体物質を含み、「生物学的に活性な物質」と置き換えて用いることができる。適当な治療薬の非限定的な例は、ヘパリン、ヘパリン誘導体、ウロキナーゼ、デキストロフェニルアラニンプロリンアルギニンクロロメチルケトン(PPack)、エノキサプリン、アンギオペプチン、ヒルジン、アセチルサリチル酸、タクロリムス、エバロリムス、ラパマシシン(シロリムス)、アムロジピン、ドキサゾシン、グルココルチコイド、ベタメタゾン、デキサメタゾン、プレドニゾロン、コルチコステロン、ブデゾニド、スルファサラジン、ロジグリタゾン、ミコフェノール酸、メサラミン、パクリタクセル、5−フルオロウラシル、シスプラチン、ビンブラスチン、ビンクリスチン、エポチロン、メトトレキセート、アザチオプリン、アドリアマイシン、ムタマイシン、エンドスタチン、アンジオスタチン、チミジンキナーゼ阻害剤、クラドリビン、リドカイン、ブピバカイン、ロピバカイン、D-Phe-Pro-Argクロロメチルケトン、血小板受容体拮抗剤、抗トロンビン抗体、抗血小板受容体抗体、アスピリン、ジピリダモール、プロタミン、ヒルジン、プロスタグランジン阻害剤、血小板阻害剤、トラピジル、リプロスチン、マダニ抗血小板ペプチド、5−アザシチジン、血管内皮成長因子、成長因子受容体、転写活性剤、翻訳プロモーター、抗増殖薬、成長因子阻害剤、成長因子受容体拮抗剤、転写抑制剤、翻訳抑制剤、複製阻害剤、抑制性抗体、成長因子に対する抗体、成長因子及び細胞毒素を含む二官能性分子、抗体及び細胞毒素を含む二官能性分子、コレステロール低下剤、血管拡張剤、内在性血管作用メカニズムを妨害する薬剤、抗酸化薬、プロブコール、抗生物質、ペニシリン、セホキシチン、オキサシリン、トブラマイシン、血管形成物質、線維芽細胞成長因子、エストロゲン、エストラジオール(E2)、エストリオール(E3)、17−βエストラジオール、ジゴキシン、β遮断剤、カプトプリル、エナロプリル、スタチン、ステロイド、ビタミン類、タキソール、パクリタクセル、2’−スクシニル−タキソール、2’−スクシニルタキソールトリエタノールアミン、2’−グルタリル−タキソール、2’−グルタリル−タキソールトリエタノールアミン塩、N−(ジメチルアミノエチル)グルタミンを有する2’−O−エステル、N−(ジメチルアミノエチル)グルタミド塩酸塩を有する2’−O−エステル、ニトログリセリン、亜酸化窒素、一酸化窒素、抗生物質、アスピリン、ジギタリス、エストロゲン、エストラジオール及びグリコシドを含む。1つの実施態様においては、治療薬は平滑筋細胞阻害剤又は抗生物質である。好ましい実施態様においては、治療薬はタキソール(例えば、タキソール(登録商標))、又はその類似物又は誘導体である。他の好ましい実施態様においては、治療薬はパクリタクセル、又はその類似物又は誘導体である。さらなる他の好ましい実施態様においては、治療薬は、エリスロマイシン、アンホテリシン、ラパマイシン、アドリアマイシン等の抗生物質である。
【0035】
「遺伝物質」なる用語は、限定的でなく、DNA又はRNAを意味し、以下に示す有用なタンパク質をコードするDNA/RNAを含み、ウィルスベクター及び非ウィルスベクターを含むヒト身体に挿入されることを意図する。
【0036】
「生体物質」なる用語は、細胞、酵母、細菌、タンパク質、ペプチド、サイトカイン及びホルモンを含む。ペプチド及びタンパク質の例は、血管内皮成長因子(VEGF)、トランスフォーミング成長因子(TGF)、線維芽細胞成長因子(FGF)、上皮細胞成長因子(EGF)、軟骨成長因子(CGF)、神経成長因子(NGF)、ケラチノサイト成長因子(KGF)、骨格成長因子(SGF)、骨芽細胞由来成長因子(BDGF)、肝細胞成長(HGF)、インシュリン様成長因子(IGF)、サイトカイン成長因子(CGF)、血小板由来成長因子(PDGF)、低酸素誘導性因子−1(HIF−1)、幹細胞由来因子(SDF)、幹細胞因子(SCF)、内皮細胞成長サプリメント(ECGS)、顆粒球マクロファージコロニー刺激因子(GM−CSF)、成長分化因子(GDF)、インテグリン調整因子(IMF)、カルモジュリン(CaM)、チミジンキナーゼ(TK)、腫瘍壊死因子(TNF)、成長ホルモン(GH)、骨形態形成蛋白質(BMP)(例えば、BMP−2、BMP−3、BMP−4、BMP−5、BMP−6(Vgr−1)、BMP−7(PO−1)、BMP−8、BMP−9、BMP−10、BMP−11、BMP−12、BMP−14、BMP−15、BMP−16等)、マトリックスメタロプロテイナーゼ(MMP)、マトリックスメタロプロテイナーゼの組織阻害剤(TIMP)、サイトカイン、インターロイキン(例えば、IL−1、IL−2、IL−3、IL−4、IL−5、IL−6、IL−7、IL−8、IL−9、IL−10、IL−11、IL−12、IL−15等)、リンホカイン、インターフェロン、インテグリン、コラーゲン(全てのタイプ)、エラスチン、フィブリリン、フィブロネクチン、ビトロネクチン、ラミニン、グリコサミノグリカン、プロテオグリカン、トランスフェリン、サイトタクチン、細胞結合性ドメイン(例えば、RGD)及びテネイシンを含む。現在好ましいBMPはBMP−2、BMP−3、BMP−4、BMP−5、BMP−6、BMP−7である。二量体タンパク質が、ホモダイマー、ヘテロダイマー又はそれらの混合物として、単独又は他の分子とともに提供される。細胞は、ヒト起源(自家性又は異質遺伝子)又は動物起源(異種間)、遺伝的に設計され、所望であれば、移植部位において興味のあるタンパク質が配送される。細胞は、前駆体細胞(例えば、内皮前駆体細胞)、幹細胞、未分化細胞、繊維芽細胞、マクロファージ及びサテライト細胞を含む。
【0037】
他の非遺伝的治療薬には、下記のものがある;
・ヘパリン、ヘパリン誘導体、ウロキナーゼ及びPPack(デキストロフェニルアラニンプロリンアルギニンクロロメチルケトン)等の抗血栓形成性治療薬;
・エノキサプリン、アンギオペプチン又は平滑筋細胞増殖をブロックし得るモノクローナル抗体、ヒルジン、アセチルサリチル酸、タクロリムス、エベロリムス、アムロジピン及びドキサゾシン等の増殖性薬;
・グルココルチコイド、ベタメタゾン、デキサメタゾン、プレドニゾロン、コルチコステロン、ブデゾニド、エストロゲン、スルファサラジン、ロシグリタゾン、ミコフェノール酸及びメサラミン等の抗炎症薬;
・パクリタクセル、5−フルオロウラシル、シスプラチン、ビンブラスチン、ビンクリスチン、エポチロン、メトトレキセート、アザチオプリン、アドリアマイシン及びムタマイシン;エンドスタチン、アンギオスタチン及びチミジンキナーゼ阻害剤、クラドリビン、タキソール及びその類似物又は誘導体等の抗腫瘍/抗増殖性/抗縮瞳薬;
・リドカイン、ブピバカイン及びロピバカイン等の麻酔薬;
・D-Phe-Pro-Argクロロメチルケトン、RGDペプチド含有化合物、ヘパリン、抗トロンビン化合物、血小板受容体拮抗剤、抗トロンビン抗体、抗血小板受容体抗体、アスピリン(アスピリンは、鎮痛薬、解熱剤及び抗炎症薬として分類される)、ジピリダモール、プロタミン、ヒルジン、プロスタグランジン阻害剤、血小板阻害剤、トラピジル又はリプロスチン及びマダニ抗血小板ペプチド等の抗血液凝固薬;
・特定の癌細胞中で細胞増殖を阻害し、アポトーシスを誘導する、RNA又はDNA代謝物として分類される、5−アザシチジン等のDNA脱メチル化剤;
・増殖因子、血管内皮増殖因子(VEGF、VEGF−2を含む全てのタイプ)、増殖因子受容体、転写活性化剤及び翻訳プロモーター等の血管細胞増殖プロモーター;
・抗増殖薬、増殖因子阻害剤、増殖因子受容体拮抗剤、転写レプレッサー、翻訳レプレッサー、複製阻害剤、遮断抗体、増殖因子に対する抗体、増殖因子及び細胞毒を含む二官能性分子、抗体及び細胞毒を含む二官能性分子等の血管細胞増殖阻害剤;
・コレステロール低下剤、血管拡張剤、及び内在性血管拡張メカニズムを妨害する薬物;
・プロブコール等の抗酸化剤;
・ペニシリン、セホキシチン、オキサシリン、トブラマイシン、ラパマイシン(シロリムス)等の抗生物質;
・酸性及び塩基性繊維芽細胞増殖因子、エストラジオール(E2)、エストリオール(E3)及び17−βエストラジオールを含むエストロゲン等の血管形成物質;
・ジゴキシン、β遮断剤、カプトプリル及びエナロプリルを含むアンギオテンシン変換酵素(ACE)阻害剤、スタチン及び関連化合物等の心不全のための薬物;
・シロリムス又はエバロリムス等のマクロライドである。
【0038】
好ましい生体物質は、ステロイド、ビタミン、及び再狭窄阻害薬等の抗増殖薬を含む。好ましい、再狭窄阻害剤は、タキソール(登録商標)、パクリタクセル(すなわち、パクリタクセル類似体、又はパクリタクセル誘導体、及びそれらの混合物)等の微小管安定剤を含む。本発明で用いるの適した誘導体は、2’−スクシニル−タキソール、2’−スクシニルタキソールトリエタノールアミン、2’−グルタリル−タキソール、2’−グルタリル−タキソールトリエタノールアミン塩、N−(ジメチルアミノエチル)グルタミンを有する2’−O−エステル、及びN−(ジメチルアミノエチル)グルタミド塩酸塩を有する2’−O−エステルを含む。
【0039】
他の適当な治療薬は、タクロリムス、ハロフギノン、ゲルダマイシン等のHSP90熱ショックタンパク質の阻害剤、エポチロンD等の微小管安定化剤、クリオスタゾール等のホスホジエステラーゼ阻害剤を含む。
他の好ましい治療薬は、ニトログリセリン、亜酸化窒素、一酸化窒素、アスピリン、ジギタリス、エストラジオール及びグリコシド等のエストロゲン誘導体を含む。
1つの実施態様においては、治療薬は、タンパク質合成、DNA合成、紡錐糸形成、細胞増殖、細胞移動、微小管形成、微小繊維形成、細胞外基質合成、細胞外基質分泌、又は細胞容積の増加等の、細胞の代謝を変化するか、細胞の活性を阻害することができる。
特定の実施態様においては、本発明の医療装置に用いられる治療薬は、当業者に公知の方法によって合成することができる。また、治療薬は、化学又は製薬会社から購入することができる。
【0040】
(5.1.3高分子材料)
本発明の薬物放出コーティングを製造するのに用いるのに適当な高分子材料は、生体適合性であり、身体への炎症を回避する材料であるべきである。該高分子材料は、生物学的に安定であり、生物吸収性であることができる。好ましくは、該高分子材料は生物学的に安定である。好ましくは、本発明のコーティング組成物に用いられる高分子材料は下記から選択される:ポリウレタン、シリコーン(例えば、ポリシロキサン及び置換ポリシロキサン)、及びポリエステルである。また、高分子材料としては好ましくはスチレン−イソブチレン共重合体である。用い得る他のポリマーは、溶解することができ、医療装置、又は生物学的に活性な物質と配合することができる、相対的に低い融点を有する高分子上で硬化又は重合される。さらなる適当なポリマーは、通常、熱可塑性エラストマー、ポリオレフィン、ポリイソブチレン、エチレン−アルファオレフィン共重合体、アクリル重合体又は共重合体、ポリ(ラクチド−グリコリド共重合体)(poly(lactide-co-glycoide))(PLGA)、ポリビニルアルコール(PVA)、ポリ(L−ラクチド)(PLLA)、ポリ酸無水物、ポリホスファゼン、ポリカプロラクトン(PCL)、ポリ塩化ビニル等のハロゲン化ビニル重合体及び共重合体、ポリビニルメチルエステル等のポリビニルエステル、ポリフッ化ビニリデン及びポリ塩化ビニリデン等のポリハロゲン化ビニリデン、ポリアクリロニトリル、ポリビニルケトン、ポリスチレン等のポリ芳香族ビニル、ポリ酢酸ビニル等のポリビニルエステル、ビニル単量体の共重合体、エチレン−メチルメタクリレート共重合体、アクリロニトリル−スチレン共重合体、ABS(アクリロニトリル−ブタジエン−スチレン)樹脂、エチレン−酢酸ビニル共重合体等の、ビニル単量体及びオレフィンの共重合体、ナイロン66及びポリカプロラクトン等のポリアミド、アルキド樹脂、ポリカーボネート、ポリオキシメチレン、ポリイミド、ポリエーテル、エポキシ樹脂、レーヨン−トリアセテート、セルロース、酢酸セルロース、ブチル化セルロース、ブチル化酢酸セルロース、セロファン、ニトロセルロース、プロピオン酸セルロース、セルロースエーテル、カルボキシメチルセルロース、コラーゲン、キチン、ポリ乳酸(PLA)、ポリグリコール酸(PGA)、ポリエチレンオキシド(PEO)、ポリ乳酸−ポリエチレンオキシド共重合体、EPDM(エチレン−プロピレン−ジエン)ゴム、フッ化シリコン、ポリエチレングリコール(PEG)、ポリアルキレングリコール(PAG)、多糖類、リン脂質及び上記の組み合わせを含む。
【0041】
特定の実施態様においては、高分子材料は親水性(例えば、PVA、PLLA、PLGA、PEG及びPAG)である。特定の実施態様においては、高分子材料は疎水性(例えば、PLA、PGA、ポリ酸無水物、ポリホスファゼン及びPCL)である。
機械的挑戦(mechanical challenge)、例えば、膨張及び収縮を起こす医療装置にとって更に好ましくは、高分子材料は、シリコーン(例えば、ポロシロキサン及び置換ポリシロキサン)、ポリウレタン、熱可塑性エラストマー、エチレン酢酸ビニル共重合体、ポリオレフィンエラストマー及びEPDMゴム等の弾性重合体であるべきである。上記高分子の弾性特性のため、コーティング組成物は、装置が力、応力又は機械的挑戦にさらされる時に、降伏点下で変形を受け得る。
【0042】
いくつかの実施態様においては、高分子材料は生分解性である。生分解性高分子材料は、高分子鎖が生物学的に許容され、進行的により小さい化合物に加水分解される結果として、分解される。1つの実施態様においては、高分子材料は、ポリラクチド、ポリグリコリド又はそれらの共重合体を含む。ポリラクチド、ポリグリコリド及びそれらの共重合体は、乳酸及びグリコール酸に分解され、クレブス回路に解離、更に二酸化炭素及び水に分解される。
【0043】
高分子材料は、大量加水分解を通じて分解され、高分子は、マトリックスを通じて完全に均一な方法で分解される。いくつかの新規な分解性高分子、最も特にポリ酸無水物及びポリオルトエーテルは、分解は高分子の表面でのみ起こり、結果として、治療薬及び/又は高分子/治療薬混合物の表面積に比例する放出速度となる。PLGA等の親水性高分子材料は大量の方法で腐食されるだろう。コーティング組成物を製造するために、種々の商業的に入手可能なPLGAが用いられる。例えば、ポリ(d,l-乳酸−グリコール酸共重合体)が商業的に入手可能である。好ましい、商業的に入手可能な製品は、50%ラクチド及び50%グリコリドのモル%組成を有する、50:50ポリ(d,l-乳酸−グリコール酸共重合体)(d.l-PLA)である。他の適当な商業的に入手可能な製品は、65:35、75:25及び85:15ポリ(d,l-乳酸−グリコリド酸共重合体)である。例えば、ポリ(d,l-ラクチド−グリコリド共重合体)は、ベーリンガーインゲルハイム(ドイツ)から、商標Resomer(登録商標)、例えば、PLGA 50:50(レゾマーRG 502)、PLGA75:25(レゾマーRG 752)及びd,l-PLA(レゾマーRG 206)及びバーミンガムポリマー(バーミンガム、アラバマ州)から得られる。上記共重合体は、広い範囲の分子量及び乳酸及びグリコール酸の比で得られる。
【0044】
1つの実施態様においては、コーティンは、所望の親水性/疎水性層相互作用を有する共重合体を含む(例えば、非直線性親水性−疎水性マルチブロック挙油重合体のナノ粒子及び微小粒子を開示し、本明細書に参考文献によって完全に取り込まれる、米国特許第6,007,845号明細書を参照)。特定の実施態様においては、コーティングは、PLG由来の生分解性Aブロック及びPEO由来の親水性BブロックからなるABAトリブロック共重合体を含む。
【0045】
(5.1.4医療装置のタイプ)
本発明において用いられる医療装置は、天然高分子、合成高分子、セラミック及び金属を含有するが、これらに限定されない、一般に医療装置に適したいずれかの生体適合性材料から製造することができる。金属材料が更に好ましい。適当な金属材料は、チタンをベースとする(ニチノール、ニッケルチタン合金、熱記憶合金材料)金属及び合金、ステンレス鋼、タンタル、ニッケル−クロム、又はElgiloy(登録商標)及びPhynox(登録商標)等のコバルト−クロミウム−ニッケル合金を含む、特定のコバルト合金を含む。また、金属材料は、WO94/16646に開示されたようなクラッド複合型フィラメントを含む。
【0046】
金属材料は伸張されたメンバー又はワイヤ様成分にされ、次いで折られて金属メッシュのネットワークを形成する。また、高分子フィラメントは、金属メッシュを形成するための伸張された金属メンバー、又はワイヤ様エレメントと共に用いられる。ネットワークが金属で製造されると、交差は溶接され、よじられ、湾曲され、接着され、結われ(縫合と共に)、お互いにヒートシールされ、又は当業界で公知の方法で接続される。
【0047】
医療装置を形成するのに有用な高分子は、生体適合性であり、身体組織に対する炎症を回避するものであるべきである。それらは、生物学的に安定であるか生体吸収性である。適当な高分子材料は、ポリウレタン及びその共重合体、シリコーン及びその共重合体、エチレンビニル−酢酸、ポリエチレンテレフタレート、熱可塑性エラストマー、ポリ塩化ビニル、ポリオレフィン、セルロース誘導体、ポリアミド、ポリエステル、ポリスルホン、ポリテトラフルオロエチレン、ポリカーボネート、アクリロニトリルブタジエンスチレン共重合体、アクリル、ポリ乳酸、ポリグリコール酸、ポリカプロラクトン、ポリ乳酸−ポリエチレンオキシド共重合体、セルロース、コラーゲン及びキチンを含むが限定されない。
【0048】
本発明の医療装置のための材料として有用である他の高分子は、ダクロンポリエステル、ポリ(エチレンテレフタレート)、ポリカーボネート、ポリメチルメタクリレート、ポリプロピレン、ポリアルキレンオキサレート、ポリ塩化ビニル、ポリウレタン、ポリシロキサン、ナイロン、ポリ(ジメチルシロキサン)、ポリシアノアクリレート、ポリホスファゼン、ポリ(アミノ酸)、エチレングリコールIジメタクリレート、ポリ(メチルメタクリレート)、ポリ(2−ヒドロキシエチルメタクリレート)、ポリテトラフルオロエチレンポリ(HEMA)、ポリヒドロキシアルカノエート、ポリテトラフルオロエチレン、ポリカーボネート、ポリ(グリコリド−ラクチド)共重合体、ポリ乳酸、ポリ(ε−カプロラクトン)、ポリ(β−ヒドロキシブチレート)、ポリジオキサン、ポリ(γ−グルタミン酸エチル)、ポリイミノカルボネート、ポリ(オルトエーテル)、ポリ酸無水物、アルギン酸塩、デキストラン、キチン、綿、ポリグリコール酸、ポリウレタン、又はそれらの誘導体、すなわち、例えば、高分子は、高分子が、タンパク質、核酸等の分子と結合するのを許容する間、構造的完全性を維持するように、例えば、Arg-Gly-Asp(RGD)等の結合部位又は架橋基、を含むように修飾されている誘導体を含むが限定されない。
【0049】
高分子は、その機械的強度を上昇させるために乾燥される。次いで、高分子は、医療装置の全て又は一部を形成するための基本の材料として用いられる。
更に、本発明は、医療装置を形成するために1つのタイプの高分子を用いることによって実施されるが、高分子の種々の組み合わせを用いることができる。医療装置に取り込まれた時に、所望の効果を与えるために、高分子の適当な混合物が調製される。
【0050】
特定の好ましい実施態様においては、上記セクション5.1.2に記載された治療薬が高分子に混合される。このような混合物は、医療装置又はその一部を形成するために用いることができる。特定の実施態様においては、治療薬は、医療装置を形成するために用いられる高分子組成物の、少なくとも約5重量%、少なくとも約10重量%、少なくとも約20重量%、少なくとも約30重量%、少なくとも約40重量%、少なくとも約50重量%、少なくとも約60重量%、少なくとも約70重量%、少なくとも約80重量%、少なくとも約90重量%、少なくとも約95重量%、少なくとも約97重量%、少なくとも約99重量%又はそれ以上を構成する。
【0051】
特定の実施態様においては、医療装置は、少なくとも約5重量%、少なくとも約10重量%、少なくとも約20重量%、少なくとも約30重量%、少なくとも約40重量%、少なくとも約50重量%、少なくとも約60重量%、少なくとも約70重量%、少なくとも約80重量%、少なくとも約90重量%、少なくとも約95重量%、少なくとも約97重量%、少なくとも約99重量%又はそれ以上の高分子材料を含有する。特定の実施態様においては、医療装置は、少なくとも約5重量%、少なくとも約10重量%、少なくとも約20重量%、少なくとも約30重量%、少なくとも約40重量%、少なくとも約50重量%、少なくとも約60重量%、少なくとも約70重量%、少なくとも約80重量%、少なくとも約90重量%、少なくとも約95重量%、少なくとも約97重量%、少なくとも約99重量%又はそれ以上の(第一の)治療薬、好ましくはパクリタクセルを含有する。特定の実施態様においては、医療装置は、少なくとも約5重量%、少なくとも約10重量%、少なくとも約20重量%、少なくとも約30重量%、少なくとも約40重量%、少なくとも約50重量%、少なくとも約60重量%、少なくとも約70重量%、少なくとも約80重量%、少なくとも約90重量%、少なくとも約95重量%、少なくとも約97重量%、少なくとも約99重量%又はそれ以上の付加的な(第二、第三、第四又は第五の)治療薬を含有する。
【0052】
好ましい実施態様においては、医療承知は、約0.001μg、約0.01μg、約0.1μ、約1μg、約5μg、約10μg、約15μg、約20μg、約25μg、約30μg、約35μg、約40μg、約45μg、約50μg、約60μg、約70μg、約80μg、約90μg、約100μg、約110μg、約120μg、約130μg、約140μg、約150μg、約200μg、約250μg、約300μg、約350μg、約400μg、約500μg、約600μg、約700μg、約800μg、約900μg、約1,000μg、約2,000μg又はそれ以上の治療薬を含有する。好ましくは、医療装置は、約50μg〜約200μgのパクリタクセルを含有する。
【0053】
他の特定の実施態様においては、該医療装置は、該医療装置表面の表面積mm当り、約0.001μg、約0.01μg、約0.1μg、約0.5μg、約1.0μg、約2.0μg、約3.0μg、約4.0μg、約5.0μg、約6.0μg、約7.0μg、約8.0μg、約9.0μg、約10.0μg、約15.0μg、約20.0μg又はそれ以上の治療薬を含有する。好ましくは、該医療装置は、医療装置表面の表面積mm当り、約0.5μg〜約5μgのパクリタクセルを含有する。
特定の実施態様においては、医療装置は、G1/S期で細胞を静止するのに効果的な治療薬の細胞分裂静止のための量を放出することができる。
【0054】
1つの実施態様において、該医療装置は、高分子材料に取り込まれたパクリタクセルの約0.1%、約1%、約5%、約10%、約15%、約20%、約25%、約30%、約35%、約40%、約45%、約50%、約55%、約60%、約65%、約70%、約75%、約80%、約90%、約95%又はそれ以上を、約30分、1時間、2時間、6時間、約12時間、約24時間、約2日、約3日、約4日、約5日、約6日、約1週間、約2週間、約3週間、約1ヶ月、約2ヶ月、約3ヶ月、約4ヶ月、約5ヶ月、約6ヶ月、約1年、約2年、約5年に渡り放出する。好ましくは、該医療装置は、高分子材料に取り込まれたパクリタクセルの約0.1%〜約35%の量を、約1週間〜約8週間に渡り放出することができる。更に好ましくは、該医療装置は、高分子材料に取り込まれたパクリタクセルの約1%〜約15%を約4週間に渡り放出することができる。
【0055】
他の実施態様においては、該医療装置は、約0.001μg、約0.01μg、約0.1μg、約1μg、5μg、約10μg、約15μg、約20μg、約25μg、約30μg、約35μg、約40μg、約45μg、約50μg、約60μg、約70μg、約80μg、約90μg、約100μg、約110μg、約120μg、約130μg、約140μg、約150μg、約200μg、約250μg、約300μg、約350μg、約400μg、約500μg、約600μg、約700μg、約800μg、約900μmg、約1,000μg、約2,000μg又はそれ以上の治療薬を、約30分、1時間、2時間、6時間、約12時間、約24時間、約2日、約3日、約4日、約5日、約6日、約1週間、約2週間、約3週間、約1ヶ月、約2ヶ月、約3ヶ月、約4ヶ月、約5ヶ月、約6ヶ月、約1年、約2年、約5年に渡り放出する。好ましくは、該医療装置は、高分子材料に取り込まれた約50μg〜約200μのパクリタクセルを約1週間〜約8週間に渡り放出することができる。
【0056】
更なる他の実施態様においては、該医療装置は、医療装置表面の表面積mm当り、約0.001μg、約0.01μg、約0.1μg、約0.5μg、約1.0μg、約2.0μg、約3.0μg、約4.0μg、約5.0μg、約6.0μg、約7.0μg、約8.0μg、約9.0μg、約10.0μg、約15.0μg、約20.0μg又はそれ以上の治療薬を、約30分、1時間、2時間、6時間、約12時間、約24時間、約2日、約3日、約4日、約5日、約6日、約1週間、約2週間、約3週間、約1ヶ月、約2ヶ月、約3ヶ月、約4ヶ月、約5ヶ月、約6ヶ月、約1年、約2年、約5年に渡り放出する。好ましくは、該医療装置は、高分子材料中に取り込まれたパクリタクセルの約0.01μg〜約0.1μgを、約1週間〜約8週間に渡り放出することができる。
【0057】
特定の実施態様においては、該医療装置は、長時間、治療薬を放出することができ、その結果、G1/S期内で細胞を凍結するのに効果的な治療薬濃度に細胞がさらされる。好ましくは、該細胞がさらされる治療薬の濃度は、約0.0001ng/ml、約0.001ng/ml、約0.01ng/ml、約0.1ng/ml、約1.0ng/ml、約10ng/ml、約20ng/ml、約30ng/ml、約40ng/ml、約50ng/ml、約100ng/ml、約200ng/ml、約300ng/ml、約400ng/ml、約500ng/ml、約600ng/ml、約700ng/ml、約800ng/ml、約900ng/ml、約1,000ng/ml、約2,000ng/ml、約3,000ng/ml、約4,000ng/ml、約5,000ng/ml、約10,000ng/ml又はそれ以上の治療薬である。好ましくは、該細胞がさらされる治療薬の濃度は、約0.001ng/ml〜10,000ng/mlである。更に好ましくは、該細胞がさらされる治療薬の濃度は、約0.01ng/ml〜1,000ng/mlのパクリタクセルである。好ましくは、該細胞がさらされる治療薬の濃度は、約60ng/ml〜約6,000ng/mlである。
【0058】
本発明に適当な医療装置の例は、ステント、外科用止め金、カテーテル(例えば、中心静脈カテーテル及び動脈カテーテル)、ガイドワイヤ、カニューレ、心臓ペースメーカーリード又はリードチップ、心臓除細動器リード又はリードチップ、移植可能な血管アクセスポート、血液保存バッグ、血液チューブ、血管又は他の移植片、大動脈内バルーンポンプ、心臓弁、心臓血管縫合糸、全人工心臓及心室性の心臓、及び心室性のアシストポンプ、血液酸素化装置、血液フィルター、血液透析ユニットの単位、血液灌流単位、及び血漿分離単位等の実体のない装置を含むが、限定されない。好ましい実施態様においては、該医療装置はステントである。
【0059】
本発明の医療装置は、管状又は円柱状部分を有する医療装置を含む。該医療装置の管状部分は、完全に円柱状である必要はない。例えば、管状部分の横断面は、長方形、三角形等のいかなる形状であり得、ちょうど円形ではない。このような装置は、ステント及び移植片を含むが限定されない。また、分岐したステントが、本発明の方法によって製造された医療装置内に含まれる。
【0060】
本発明に特に適した医療装置は、当業者に公知である医療目的のためのいずれかの種類のステントを含む。例えば、適当なステントは、自己膨張性ステントバルーン膨張性ステント等の血管性ステントを含む。好ましくは、ステントは側壁に開口を有する。本発明において有用な自己膨張性ステントの例は、Wallstenらに発行された米国特許第4,655,771号明細書及び第4,954,126号明細書、及びWallstenらに発行された米国特許第5,061,275号明細書に説明されている。適当なバルーン膨張性ステントの例は、Pinchasikらに発行された米国特許第5,449,373号明細書に説明されている。
【0061】
(5.1.5医療装置のコーティング法)
本発明においては、先に述べたセクション5.1.1に記載されたコーティング組成物が、医療装置表面にいずれかの方法によって塗布され、コーティングが形成される。適当な方法は、噴霧法、積層、圧迫法、ブラッシング、塗布、浸漬、横転、静電蒸着及び表面に生体分子を固定化する現代の化学的方法である。好ましくは、コーティング組成物は、噴霧法、横転、積層及び圧迫法によって医療装置表面に塗布される。本発明の1つの実施態様においては、医療装置を製造するために1以上のコーティング法を用いることができる。
【0062】
更に、コーティング組成物を塗布する前に、コーティングする表面がデプレッションを含まない実施態様において、任意に、該医療装置の表面を、粗面化、(roughening)、酸化、スパッタリング、プラズマ蒸着又は下塗り(primming)等の前処理してもよい。スパッタリングは、ガス放電を通して陽イオン照射によって陰極から原子を除去することによる表面上の原子の蒸着である。また、該装置表面へのプライマーの露出は、前処理の可能な方法である。
【0063】
特定の実施態様において、本発明の医療装置は1つのコーティング層で覆われている。他の特定の実施態様においては、本発明の医療装置は、1以上のコーティング層で覆われている。好ましい実施態様においては、該医療装置は、異なるコーティング組成物から製造されるコーティング層で覆われている。すなわち、コーティング組成物の1つは、他のコーティング組成物から製造されない成分の少なくとも1つの成分又は量を有している。例えば、コーティングは、異なる生物学的活性物質を含む、第1及び第2の層を含有している。また、第1の層及び第2の層は、異なる濃度を有する、同一の生物学的活性物質を含有する。他の実施態様においては、コーティングは、異なる治療薬を含有する第1の層及び第2の層を含有する。さらなる他の実施態様においては、第1の層又は第2の層のいずれかが生物学的活性物質を含まない。
【0064】
(5.2治療的使用)
本発明は、上述のセクション5.1.2に記載されたように、一般に、医薬組成物及び薬物放出医療装置の、患者における、細胞増殖及び/又は遊走と関連する、疾病又は健康状態の予防、治療又は管理のための治療的使用に関する。
本明細書で用いられるように、「患者」及び「病人」は交換可能に用いられる。
該患者とは、動物、好ましくは非霊長類(例えば、雌ウシ、ブタ、馬、猫、犬、ラット及びマウス)及び霊長類(例えば、カニクイザル、チンパンジー及びヒト)を含むほ乳類であり、更に好ましくはヒトである。1つの実施態様においては、患者は治療法(例えば、血管形成術として知られる経皮経管冠動脈拡張術(PTCA)、及び大動脈冠動脈バイパス術移植(CABG)手術)を受けた患者であり得る。
【0065】
特定の実施態様においては、該医薬組成物及び薬物放出医療装置は、脳、頸部、目、口、咽頭、食道、胸部、骨、靱帯、軟骨、腱、肺、大腸、直腸、胃、前立腺、乳房、卵巣、ファローピウス管、子宮、頚部、精巣又は他の生殖器官、毛嚢、皮膚、横隔膜、甲状腺、血液、骨、骨髄、心臓、リンパ節、血管、動脈、毛細血管、結腸、小腸、腎臓、肝臓、膵臓、大脳、脊髄、及び中枢神経系の増殖及び/又は遊走を阻害するために用いられる。該医薬組成物及び医療装置は、体組織、例えば、上皮細胞、結合組織、筋組織及び神経組織の増殖及び/又は遊走を阻害するために用いられる。上皮組織は、体内部又は外側で、全ての身体表面をカバーするか、身体表面に沿って並ぶ。上皮組織の具体例は、皮膚、上皮、真皮、粘膜、漿膜、体腔、及び心臓、肺、肝臓、腎臓、腸、膀胱、子宮等の内臓を含むが限定されない。該結合組織は、全ての組織に豊富に広く分布している。結合組織の具体例は、維管束組織(例えば、動脈、静脈、毛細血管)、血液(例えば、赤血球、血小板、白血球)、リンパ、脂肪、線維、軟骨、靭帯、腱、骨、網、腹膜、腸間膜、半月板、結膜、硬膜、へその緒等であるが限定されない。該筋組織は、総体重のほぼ3分の1を占めて、3つの異なった亜類型、横紋(骨格)筋、平滑(内臓)筋、及び心筋からなる。筋組織の具体例は、心筋(心臓筋肉)、骨格、腸壁等を含むが限定されない。第四の主要な組織のタイプは神経組織である。神経組織は、脳、脊髄、及び付随的な神経に見られる。神経組織は、ニューロン(神経細胞)及び神経こう細胞又は具リア細胞と呼ばれる特殊化細胞からなる。
【0066】
1つの実施態様においては、該医薬組成物及び医療装置は、血管平滑筋細胞、腫瘍細胞、間質細胞、血管平滑筋細胞又は免疫系エフェクター細胞の周囲の間質細胞の増殖及び/又は遊走を阻害するのに有用である。他の実施態様においては、医薬組成物及び医療装置は、必要とする患者に、パクリタクセルの細胞分裂停止の量を投与することにより、再狭窄、狭窄症、乾癬、皮膚炎、肝臓硬化症、又は前立腺肥大症等の増殖性疾患を予防又は治療することができる。さらなる他の実施形態においては、該医薬組成物及び医療装置は、平滑筋細胞の細胞周期のG1/S期において平滑筋細胞の大部分を静止させることができる。
【0067】
特定の実施形態においては、該医薬組成物及び医療装置は、治療薬、好ましくはパクリタクセルをさらされた細胞における細胞増殖及び/又は遊走の少なくとも約5%、少なくとも約10%、少なくとも約20%、少なくとも約30%、少なくとも約40%、少なくとも約50%、少なくとも約60%、少なくとも約70%、少なくとも約80%、少なくとも約90%、少なくとも約95%、少なくとも約97%、少なくとも約99%又は約100%(完全)を阻害することができる。
【0068】
他の特定の実施形態においては、該医薬組成物及び医療装置は、患者において、病状/重症度/再狭窄、狭窄症、感染、皮膚炎、肝臓硬化症又は前立腺肥大症の程度の少なくとも約5%、少なくとも約10%、少なくとも約20%、少なくとも約30%、少なくとも約40%、少なくとも約50%、少なくとも約60%、少なくとも約70%、少なくとも約80%、少なくとも約90%、少なくとも約95%、少なくとも約97%、少なくとも約99%、又は約100%(完全)を減少することができる。
【0069】
さらなる他の特定の実施形態においては、該医薬組成物及び医療装置は、平滑筋の細胞周期のG1/S期において平滑筋細胞の少なくとも約5%、少なくとも約10%、少なくとも約20%、少なくとも約30%、少なくとも約40%、少なくとも約50%、少なくとも約60%、少なくとも約70%、少なくとも約80%、少なくとも約90%、少なくとも約95%、少なくとも約97%、少なくとも約99%、又は約100%(全て)を静止することができる。
【0070】
(5.2.1医薬組成物)
該治療薬を、投与に適した医薬組成物に取り込むことができる。1つの実施態様においては、該組成物は、少なくとも2種の異なる治療薬、又は高分子/治療薬混合物を含む。好ましくは、該組成物はパクリタクセルを含む。
該医薬組成物は、通常の混合、溶解、造粒、糖衣錠製造、研和、乳化、カプセル封入、包括又は凍結乾燥工程によって製造される。このような組成物は、典型的には、1以上の治療薬、及び任意に薬学的に許容される担体を含む。
【0071】
特定の実施形態においては、「薬学的に許容」は、連邦政府又は州政府の調整局によって承認されるか、米国薬局方又は一般的に動物、特にヒトにおいて用いられるヒトにおいて用いられる一般に認識された薬局方に収載されていることを意味する。「担体」なる用語は、治療薬と共に投与される希釈剤、アジュバント(例えば、フロイントのアジュバント(完全及び不完全)賦形剤、又は媒体を意味する。このような薬学的に許容される担体は、水、塩溶液、アルコール、シリコーン、ワックス、ワセリン、植物油、ピーナッツ油、大豆油、鉱油、ゴマ油、ポリエチレングリコール、プロピレングリコール、リポソーム、糖、ゼラチン;乳糖、アミラーゼ、ステアリン酸マグネシウム、タルク、界面活性剤、珪酸、粘性パラフィン、香油、脂肪酸モノグリセリド及びジグリセリド、石油エーテル(petroethral)脂肪酸エステル、ヒドロキシメチルセルロース、ポリビニルピロリドン等を含む。適当な賦形剤は、デンプン、グルコース、乳糖、ショ糖、ゼラチン、麦芽、米、小麦粉、チョーク、シリカゲル、ステアリン酸ナトリウム、グリセロールモノステアレート、タルク、塩化ナトリウム、脱脂粉乳、グリセロール、プロピレン、グリコール、水、及びエタノール等を含む。
【0072】
また、補充的な活性化合物を組成物中に取り込むことができる。1つの実施形態においては、該組成物は、更に、微量の湿潤剤、乳化剤、又は塩酸又は水酸化ナトリウム等のpH緩衝剤を含む。
該組成物は、意図すると投与経由に依存し、溶液、懸濁液、エマルジョン、錠剤、丸薬、カプセル、粉末、徐放薬製剤等の形態をとり得る。投与経路の具体例は、非経口的(例えば、皮下、筋肉内、眼窩内、関節内、脊髄内、層内、静脈内、皮内、腹腔内、門脈内、動脈内、くも膜下腔内、粘膜内、動脈内、及び胸膜内)、経皮的(すなわち、局所)、及び粘膜(例えば、鼻腔内)注射又は注入と同様、経口投与、吸入、肺及び直腸投与を含む。
【0073】
非経口投与のために、該組成物は1以上の下記成分を含有する:注射用水、生理食塩水、固定油、ポリエチレングリコール、グリセリン、プロピレングリコール又はその他の合成溶媒等の滅菌希釈剤;ベンジルアルコール又はメチルパラベン等の抗菌剤;アスコルビン酸又は亜硫酸水素ナトリウム等の酸化防止剤;エチレンジアミンテトラ酢酸等のキレート剤;酢酸塩、クエン酸塩又はリン酸塩等の緩衝液、及び塩化ナトリウム又はデキストラン等の緊張度を調整するための試薬である。該非経口的製剤は、ガラス又はプラスチックで製造された、アンプル、使い捨ての注射器又は多人数用バイアルに封入される。
【0074】
局所投与のためには、該治療薬は、当業界で公知の溶液、ゲル、軟膏、クリーム、懸濁液等に製造される。
注射のためには、該治療薬は、水溶液、好ましくは、ハンクス溶液、リンガー溶液又は生理食塩水等の生理学的に適合性の緩衝液中で製造される。該溶液は、懸濁、安定化及び/又は分散剤等の配合剤を含んでもよい。好ましい実施態様においては、該治療薬は滅菌水溶液中で製剤化される。
【0075】
静脈内投与のためには、適当なキャリアは、生理食塩水、静菌水、Cremophor(登録商標)EL(BASF,パーシッパニー、ニュージャージー)又は、生理食塩水化リン酸緩衝液を含む。全てのケースにおいて、該組成物は無菌でなければならず、注射器で注射可能な程度まで流動的であるべきである。製造及び貯蔵条件下で安定でなければならず、細菌及び真菌等の微生物の汚染作用に対して保存可能であるべきである。担体は、例えば、水、エタノール、ポリオール(例えば、グリセロール、プロピレングリコール及び液体ポリエチレングリコール等)、及びそれらの適当な混合物を含む、溶剤又は分散媒である。例えばレシチン等のコーティングを用いることにより、分散液の場合、要求される粒子サイズを維持することにより、及び界面活性剤の使用により、適切な流動性が維持される。微生物の作用の予防は、種々の抗菌薬、抗真菌剤、例えば、パラベン、クロロブタノール、フェノール、アスコルビン酸、及びチメロサール等によって達成することができる。多くのケースにおいて、それは、組成物中に、好ましくは、糖、マンニトール、ソルビトールのようなポリアルコール、塩化ナトリウムの等張剤を含有する。該組成物中に、例えば、モノステアリン酸アルミニウム及びゼラチン等の、吸収を遅延させる薬剤を含ませることにより、注射可能な組成物の長期間の吸収がもたらされる。
【0076】
粘膜投与のために、浸透されるバリアに適当な浸透剤が該組成物中に用いられる。このような浸透剤は一般に当業界において公知であり、例えば、粘膜投与、界面活性剤、胆汁酸塩、フシジン酸誘導体を含有する。粘膜投与は、鼻スプレー又は座薬を用いることにより達成される。
粘膜投与のために、該治療薬は、当業界で公知の軟膏剤、軟膏、ゲル又はクリームに製造される。該化合物は、座薬(例えば、ココアバター及び他のグリセリド等の通常の座薬基剤を用いた)、直腸配送のための貯留浣腸の形態で製造される。
【0077】
先に述べた製剤に加え、該治療薬はデポ製剤として製造される。このような長く作用する製剤は、移植(例えば、皮下又は筋肉内)又は筋肉内注射によって投与される。従って、例えば、該治療薬は、適切な高分子材料又は疎水性材料(例えば、受け入れられる油のエマルジョンとして)、又はイオン交換樹脂によって、又は、例えば、倹約して(sparingly)可溶塩としての可溶可溶塩誘導体として製剤化される。
【0078】
更に、該治療薬は、該治療薬を含有する固体重合体の半浸透性物質等の徐放薬システムを用いて配送される。徐放薬物質の種々の形態が確立されており、当業者に公知である。徐放性カプセルは、それらの化学的性質に依存し、治療薬を、数時間、数日、数週間、数ヶ月、100日間に渡り放出する。該治療薬の化学的性質及び生物学的安定性に依存し、安定化のための付加的な戦略が用いられる。
【0079】
本発明の治療薬が荷電した側鎖又は末端を含むと、それらは、上述した製剤において、遊離酸又は塩基又は薬学的に許容される塩として含まれる。薬学的に許容される塩は、遊離塩基の生物学的活性を実質的に保持し、無機酸との反応によって製造される。薬学的塩は、対応する遊離塩基の形態よりも、水及び他のプロトン性溶媒に可溶の経口がある。特定の実施態様においては、化合物は中性又は塩形態として製造される。薬学的に許容される塩は、塩酸、リン酸、酢酸、シュウ酸、酒石酸等から由来するアニオンで形成される塩、及びナトリウム、カリウム、アンモニウム、カルシウム、水酸化第二鉄、イソプロピルアミン、トリエチルアミン、2−エチルアミノエタノール、ヒスチジン、プロカイン等から由来するカチオンで形成される塩を含む。
【0080】
本発明の組成物は、一般に、意図する目的を達成するために効果的な量で用いられる。増殖性疾患を治療又は予防するための使用のために、該組成物の治療的に有効な量が、病気又は健康状態と関連する症状を回復又は予防し、過剰増殖する細胞の成長を阻害又は減少し、治療される患者の生存を延長するために投与される。特定の実施態様においては、過剰増殖する細胞の増殖及び/又は数が、約5%、約10%、約20%、約30%、約40%、約50%、約60%、約70%、約80%、約90%、約95%、約96%、約97%、約98%、約99%、又は約100%減少する。
【0081】
本明細書で用いられるように、「治療上有効な量」とは、治療薬、好ましくはパクリタクセルが細胞増殖、収縮、遊走、機能亢進を阻害するか、他の健康状態を述べるのに十分な量を意味する。治療上有効な量は、不利な効果の発生、及び細胞増殖、収縮、遊走、機能亢進と関連する症状を遅らせるか、最小化するのに十分治療薬の量を意味する。治療上有効な量は、再狭窄、狭窄症、乾癬、皮膚炎、肝臓硬化症、又は前立腺肥大症及び/又は増殖性疾患に関連する症状等の疾病の予防、治療又は管理に利益を与える治療薬の量を意味する。該治療上有効な量の決定は、特に、本明細書によって提供される詳細な開示に照らして、当業者の能力の範囲内である。
【0082】
特定の実施態様においては、該治療薬の治療上有効な量は細胞分裂停止の量であり、すなわち、G1/S期中の細胞の好ましくは大部分を静止させる量、又はアポトーシス細胞死を誘導しない量である。特定の実施態様においては、パクリタクセルの治療上有効な量とは、約0.001μg、約0.01μg、約0.1μg、約1μg、約5μg、約10μg、約15μg、約20μg、約25μg、約30μg、約35μg、約40μg、約45μg、約50μg、約60μg、約70μg、約80μg、約90μg、約100μg、約110μg、約120μg、約130μg、約140μg、約150μg、約200μg、約250μg、約300μg、約350μg、約400μg、約500μg、約600μg、約700μg、約800μg、約900μg、約1,000μg、約2,000μg及びそれ以上の治療薬である。好ましくは、パクリタクセルの治療上有効な量は、約50μg〜約200μgのパクリタクセルである。
【0083】
1つの実施態様においては、パクリタクセルの治療上有効な量は、平滑筋細胞の細胞周期のG1/S期における体組織(パクリタクセルにさらされる)の平滑筋細胞の大部分を静止させるのに有効な量である。放出されるパクリタクセルの量は、パクリタクセルにさらされる平滑筋細胞の少なくとも約5%、少なくとも約10%、少なくとも約15%、少なくとも約20%、少なくとも約25%、少なくとも約30%、少なくとも約35%、少なくとも約40%、少なくとも約45%、少なくとも約50%、少なくとも約55%、少なくとも約60%、少なくとも約65%、少なくとも約70%、少なくとも約75%、少なくとも約80%、少なくとも約90%、少なくとも約95%、少なくとも約96%、少なくとも約97%、少なくとも約98%、少なくとも約99%、又は約100%(全て)を静止させる。
【0084】
特定の実施態様においては、治療上有効な量とは、該細胞を、約0.0001ng/ml、約0.001ng/ml、約0.01ng/ml、約0.1ng/ml、約1.0ng/ml、約10ng/ml、約20ng/ml、約30ng/ml、約40ng/ml、約50ng/ml、約100ng/ml、約200ng/ml、約300ng/ml、約400ng/ml、約500ng/ml、約600ng/ml、約700ng/ml、約800ng/ml、約900ng/ml、約1,000ng/ml、約2,000ng/ml、約3,000ng/ml、約4,000ng/ml、約5,000ng/ml、約10,000ng/ml又はそれ以上の濃度の治療薬にさらされるようにするものである。該細胞は、約0.001ng/ml〜1,000ng/mlの濃度のパクリタクセルとさらされるのが好ましい。更に好ましくは、該細胞は、約0.01ng/ml〜1,000ng/ml濃度のパクリタクセルとさらされる。好ましくは、該細胞は、約60ng/ml〜約6,000ng/mlの濃度のパクリタクセルとさらされる。
【0085】
特定の実施態様においては、前記治療上有効な量から、該治療薬の約5%、約10%、約20%、約30%、約40%、約50%、約60%、約70%、約80%、約90%、約95%又はそれ以上の治療薬が、約30分、1時間、2時間、6時間、約12時間、約24時間、約2日、約3日、約4日、約5日、約6日、約1週間、約2週間、約3週間、約1ヶ月、約2ヶ月、約3ヶ月、約4ヶ月、約5ヶ月、約6ヶ月、約1年、約2年、約5年に渡り、放出される。好ましくは、治療上有効な量の約0.1%〜約35%が、約1週間〜約8週間放出されることである。更に好ましくは、治療上有効な量の約1%〜約15%が、約4週間以上放出されることである。
【0086】
投与される組成物の量は変化する。当業者は、疾病又は疾患の重傷度、以前の治療、一般的な健康及び/又は患者の年齢、もし、他の病気がある場合、投与方法及び処方した医師の判断を含むが限定されない、特定の因子が、患者を効果的に治療するのに要求される投与量に影響を及ぼすことを認める。治療は、単一の治療又は連続の治療である。症状が検出される間、又は症状が検出されなくたった時でも、治療は断続的に繰り返してよい。治療に用いられる核酸分子の有効投与量が、特定の治療の過程の間、上昇するか又は減少するかもしれないことが認識されるだろう。本明細書に記載されたように、投与量の変化が起こり、診断及び監視アッセイの結果から明らかとなる。
【0087】
全身の投与のために、治療上有効な投与量を、インビトロアッセイから最初に計算することができる。例えば、該投与量は、細胞培養において決定されたように、IC50を含む循環濃度範囲を達成するため、動物モデルにおいて定式化される。
最初の投与量は、インビボデータ、例えば、動物モデルから、当業界で公知の技術によって計算することができる。このような組成物の投与量は、好ましくは毒性わずかに有するか、有しない、ED50を含む循環濃度の範囲内にある。当業者は、動物のデータに基づき、容易にヒトの投与量を最適化することができる。
【0088】
投与量及び間隔は、治療効果を維持するのに十分なタンパク質の血漿中濃度を提供するため、個々に調整される。血漿中レベルは、例えば、高速液体クロマトグラフィーによって測定することができる。
注射による投与のための通常の患者の投与量は、約0.01〜30mg/kg/日、好ましくは約0.1〜10mg/kg/日、更に好ましくは0.1〜1mg/kg体重である。治療に有効な血清中濃度は、各々の日に、複数投与することによって達成される。該有効投与量は、インビトロ又は動物モデル試験システムから由来する用量反応曲線から推定される。
【0089】
いずれかの特定の患者及び健康状態のために投与経路及び投与量を最適化することができるので、記載された投与経路及び投与量はガイドとしてのみ意図される。
また、本発明は、必要な患者に、パクリタクセルからなるか、パクリタクセルでコーティング又は覆われている、該医療装置を挿入又は移植することによる、狭窄症、再狭窄又は平滑筋細胞増殖が関与する他の健康状態の治療又は予防方法を提供する。特定の実施態様においては、本発明は、平滑筋細胞、好ましくは血管性平滑筋細胞を含む身体管腔内へ挿入又は移植するために医療装置に関する。
【0090】
特定の実施態様においては、該医療装置は、コーティングの高分子材料に取り込まれた治療薬の特定の量又は割合を放出することができる。1つの実施態様においては、該医療装置は、タンパク質合成、DNA合成、紡錐糸形成、細胞増殖、細胞遊走、微小管形成、微小繊維形成、細胞外マトリックス合成、細胞外マトリックス分泌、又は細胞容積の上昇等の細胞の活性を阻害することのできる、治療薬の量を放出する。1つの実施態様においては、該放出量は、細胞代謝及び/又は細胞増殖の阻害及び/又は遊走を変化することができる。好ましくは、該細胞は、血管性平滑筋細胞、腫瘍細胞、間質細胞、血管性平滑筋細胞周囲の間質性マトリックス、又は免疫系エフェクター細胞である。1つの実施態様においては、放出される量は、細胞修復及びマトリックス生産を許容する。好ましくは、放出される量は細胞分裂を停止し、細胞を殺さないものである(アポトーシス又はネクローシス経路)。更に好ましくは、放出される量は、細胞を殺さずに、細胞周期のG1/S期において平滑筋細胞の大部分を静止することができる。
【0091】
(5.2.3併用療法)
本発明は、単独又は他の治療様式と組み合わせとしても有用である。本発明の医薬組成物及び医療装置は、過剰増殖細胞と関連する疾患又は健康状態の治療又は予防のための手術、標準及び実験的化学療法、ホルモン療法、生物学的療法、免疫療法、放射線療法、塞栓形成術及び/又は化学塞栓形成療法と共に、連続して又は同時に患者に施すことができる。
【0092】
本発明の医薬組成物及び医療装置は、また、治療薬と同じであるか又は異なる、さらなる治療薬と共に、連続して又は同時に患者に投与することができる。1つの実施態様においては、さらなる治療薬は、HERCEPTIN(登録商標)、RITUXAN(登録商標)、OVAREX(登録商標)、PANOREX(登録商標)、BEC2、IMC−C225、VITAXIN(登録商標)、CAMPATH(登録商標)I/H、スマートMI95、LYMPHOCIDE(登録商標)、スマートID10、ONCOLYM(登録商標)、リツキシマブ、ゲムツズマブ、トラスツズマブを含むが限定されない、抗体及び免疫調整剤等の1以上の免疫療法剤である。
【実施例】
【0093】
(6.実施例)
(6.1材料及び方法)
(6.1.1細胞系及び試薬)
ヒト大動脈平滑筋細胞(hSMC)は、キャンブレックス社(CC-2571、サンディエゴ、カリフォルニア)から購入した。細胞を、SmGM-2(登録商標)−平滑筋増殖培地-3(キャンブレックス社、サンディエゴ、カリフォルニア)中で培養した。ヒト白血病細胞系である、ジャーカット細胞を、アメリカンタイプカルチャーコレクション(マナッセス、バージニア)から得、コントロールとして提供した。パクリタクセルは、2つの形態、パクリタクセル(PTX)(Hauser, Boulder社)及びCremophor(登録商標)EL中のTaxol(登録商標)(ブリストルマイヤーズスクイブ社、プリンストン、ニュージャージー)を研究した。前者をエタノールに溶解し、使用液は新鮮なSmGM-2培地中で調製した。Taxol(登録商標)の使用は、細胞計測アッセイに限界があり、パクリタクセル及びタキソールは療法とも同等の効果がある。ドキソルビシン(DOX)(Adriamycin(登録商標))及び酢酸ミリスチン酸ホルボール(PMA)はシグマ(セントルイス、ミズーリ)から得、2mg/ml原液としてDMSOに溶解した。
【0094】
(6.1.2細胞増殖のためのMTTアッセイ)
96穴ウェルの平底プレートにウェルあたり2,000細胞を入れ、次いで、0.04〜100ng/mlの濃度でパクリタクセル(PTX)にさらした。3又は4日のいずれかの後に、5mg/mlのMTT(3,〔34,5−ジメチルチアゾール−2−イル〕−2,5−ジフェニルテトラゾリウムブロマイド、シグマ、セントルイス)を20μL、各ウェルに4時間加えた。培地を除去した後、170μLのジメチルスルホキシド(DMSO)を各ウェルに加え、MTTから形成したホルマザン結晶を溶解した。540nmの吸光度を、バイオキネティクスプレートリーダー(バイオテックインストラメント社、ウィヌースキ、バーモント)を用いて、既に開示したようにして(Giannakakou P.らの論文、低濃度のパクリタクセルは、核分裂停止の変わりに、細胞タイプ依存性p53、p21及びG1/G2停止を誘導する。パクリタクセルが誘導する細胞毒性の分子決定、Oncogene. 2001 Jun 28:20(29):3806-13)測定した。各条件について3つのウェルで試験を行い、標準偏差を求めた。PTX処理なしの細胞をコントロールとして供給した。
【0095】
(6.1.3細胞計測及び生存アッセイ)
1mlのSmGM-2(登録商標)培地中のヒト平滑筋細胞(104〜2×104細胞)を24穴ウェルに入れ、PTXで8時間まで処理を行った。PTXの能動は0.1〜5000ng/mlの範囲である。示されたインキュベーション時間の後に、細胞を0.25%トリプシン(ギブコBRL)による5分間のトリプシン処理によって細胞を集め、3つのウェルについて、コールターZ1細胞カウンター(Hialeah、フロリダ、米国)により計測した。PTX処理なしの細胞をコントロールとして供給した。更に、細胞をトリパンブルーと共にインキュベーションし、青い(死んだ)細胞及び透明な(生きている)細胞を、血球計算版中で計測した。データは、溶媒のみ(示された時間ポイント)又は時間=0である、コントロールに関して、生きている細胞の割合として報告した。hSMC増殖におけるパクリタクセルの効果を研究するための以下の調査において、hSMC増殖の最大に近い阻害を扱う、8日間、2及び12ng/mlのPTX濃度を用いた。
【0096】
(6.1.4細胞周期解析のためのフローサイトメトリー)
ヒト平滑筋細胞を、2、6、12及び60ng/ml濃度のPTXに、2日間さらした。次いで、細胞をトリプシン処理によって集め、PBSで洗浄し、PBS中の75%エタノールに再懸濁し、4℃に少なくとも30分間維持した。解析前に、細胞を再びPBSで洗浄し、再懸濁して、以前に開示したように(Giannakakou P.らの論文、低濃度のパクリタクセルは、核分裂停止の変わりに、細胞タイプ依存性p53、p21及びG1/G2停止を誘導する。パクリタクセルが誘導する細胞毒性の分子決定、Oncogene. 2001 Jun 28:20(29):3806-13)、1mg/mlのRNAseA及び0.05mg/mlヨウ化プロピジウム(シグマ社、セントルイス)を含むヨウ化プロピジウム染色溶液中で30分間インキュベートした。次いで懸濁液を、ベクトンディキンソン社FACScanで解析した。
【0097】
DNA含有量は、FACScanフローサイトメーター(ベクトンディキンソン社、免疫細胞数測定システム、サンホセ、コスタリカ)を用いて測定した。細胞周期に関する細胞の割合を計算するために、DNA含有量ヒストグラムをマルチサイクルソフトウェア(フェニックスフローシステム、サンディエゴ、カリフォルニア)を用いて脱重畳積した。
【0098】
(6.1.5細胞周期及びアポトーシスマーカーのイムノブロット解析)
先に記載したように(Blagosklonny M.V.らの論文、有糸分裂促進剤が活性化するプロテインキナーゼ経路は、微小管が活性化する、薬物が誘導するRaf-1/Bc-2リン酸化及び白血病におけるアポトーシスに必要ではない。Leukemia 1999;13:1028-1036)、細胞を溶解し、可溶性タンパク質を、プロテアーゼ阻害剤を含有するTNES緩衝液(50mMトリス塩酸pH7.5、100mM NaCl, 2mM EDTA,1mM オルトバナジン酸ナトリウム及び1%(V/V)NP40、シグマ、セントルイス、ミズーリ)に集めた。タンパク質を、製造者の説明書に従い、MOPSランニングバッファー(ノベックス、サンディエゴ、カリフォルニア)を有するSDS-PAGE又はNuPAGE4〜12%ビス−トリスゲルに溶解した。イムノブロッティングは、ウサギポリクローナル抗−PARP及びモノクローナルマウス抗−キャスパーゼ−9(アップステートバイオテクノロジー、レークプラシッド、ニューヨーク)、モノクローナルマウス抗−p21及び抗−p53(オンコジーンリサーチ、カルビオケム)、モノクローナルマウス抗ヒトチューブリン及びアクチン(シグマ、セントルイス、ミズーリ)、モノクローナルマウス抗−ヒトキャスパーゼ−8(ファーミンゲン、サンジエゴ、カリフォルニア)及びキャスパーゼ3(トランスダクションラボラトリーズ、レキシントン、ケンタッキー)、89KDa切断されたPARP断片に対するポリクローナル抗体(プロメガ、マジソン、ウィスコンシン)、及び抗−GAPDH抗体(シグマ、セントルイス)を用いて、等量の積載を確認して用いた。p53の強力なインデューサーである、ドキソルビシン(DOX)を陽性コントロールとして用いた。ホルボール12−ミリステート13−アセテート(PMA)(シグマ、セントルイス、ミズーリ)を、p53誘導の陰性コントロールとして用いた。
【0099】
(6.1.6分裂指数)
該細胞を2、6、12及び60mg/mlのPTXと2日間インキュベートした。次いで、先に記載されたように(An W.Gらの論文、プロテアーゼ阻害剤が誘導するアポトーシス:wtp53、p21WAF1/CIP1の蓄積、及びアポトーシスの誘導は、プロテアソーム阻害の非依存性マーカーである。Leukemia. 2000 Jul;14(7):1276-83)、該細胞をトリプシン処理し、PBSで洗浄し、細胞遠心機中のスライドグラスにペレット化し、90%エタノール/10%氷酢酸で固定し、DAPI(4,6−ジアミジノ−2−フェニルインドール、モレキュラーブローブス、オイゲン、オレゴン)で染色した。停止期及び有糸分裂期における細胞を確認するために、UV顕微鏡により、核を可視化した。
【0100】
(6.1.7該細胞及び核の形態)
hSMCの形態を解析するため、該細胞を2、6及び60ng/mのPTXで21日までインキュベートした。該細胞を細胞遠心し、食塩加リン酸緩衝液(PBS)中の1%ホルムアルデヒドで固定し、PBS中の1g/mlのDAPI(モレキュラープローブス、ユージーン、オレゴン)及び20μg/mlのスルホロダミン101(モレキュラープローブス)で染色し、UV顕微鏡(ニコンマイクロフォト顕微鏡)の下で、hSMCの典型的な紡錘型形態及び核の形態におけるPTXの影響を決定するため、MN細胞について検査した。また、DNAをローダミン(赤)で、細胞質タンパク質をFITC(緑)で染色した。該細胞を、レーザー−スキャンニングサイトメーター(LSC)、顕微鏡をベースとするサイトフルオロメーターを用いて、赤(核)及び緑(細胞質)で可視化した。画像は、顕微鏡スライド上の蛍光化された細胞から放射されるレーザー励起された蛍光の中で捉えられた。
【0101】
(6.2結果)
(6.2.1PTXによるSMCの増殖の阻害)
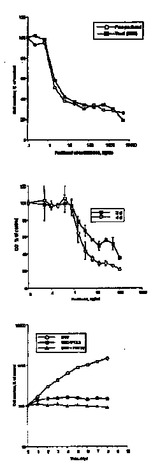
MTT及びセルカウンティングアッセイを用いて、PTXの1ng/mlのように低い濃度で、媒体コントロールの60%までhSMCの増殖を5日まで阻害した(図1A及び1B)。2種の異なるPTXの製剤(エタノール中のPTX及びCremophor(登録商標)EL中のTaxol(登録商標))で、同一の結果が得られた(図1A)。PTXによるhSMCの成長阻害は、12ng/ml(低濃度)まで濃度に依存的であり、5000ng/mlまで付加的な阻害は生じなかった。
【0102】
それに続く、2及び12ng/mlのPTXを用いた8日の研究において、細胞増殖は、コントロールと対比して12ng/mlで完全に遮断された。トリパン−ブルー染色によって細胞死は観察されず、一定に残存する細胞の数は、PTXがhSMCの増殖を停止するが細胞を殺さないことを示す。
【0103】
(6.2.2パクリタクセルによるSMCにおける主要なG1静止の誘導)
コントロールの未処理hSMCにおけるDNAのDAPI染色は、有糸分裂像(細胞の1〜3%、図2A、上段)を有する正常な停止期核(97〜99%)を示し、MN細胞を示さない。12ng/mlPTXの2日間の存在において、有糸核分裂細胞が形成され、丸くなり、プラスチックから剥離する。しかし、次いで、前記細胞の再付着は、有糸分裂の存在を示し、上記細胞の30〜40%はMNであった(図2A、下段)。
【0104】
低濃度のPTXでのSMCにおける腫瘍なG1静止は、2及び12ng/ml(図2)におけるフローサイトメトリーによって証明され、ここで最大の増殖阻害は達成された(図1)。高濃度(60ng/ml)のPTXにおいて、フローサイトメトリーによって測定されるような4Cピークにおける上昇があった。このピークは、G2/M静止又はMN細胞後有糸分裂の存在の形成のいずれかを示す。G1で静止する細胞の大きな集団があり、細胞周期分布が、見たところ落ち着いていることを考えると、フローサイトメトリーのピークは、細胞がMNであって、G2で静止しているのではないことを示す(図2B)。
【0105】
(6.2.3PTXが誘導する2C及び4CMN細胞)
低い(6ng/ml)又は高い濃度(60ng/ml)のPTX、MN細胞の同じ割合及び4C細胞の広く異なる割合による処理が観察された(図3)。60ng/mlのPTX濃度において、4C DNA細胞(フローサイトメトリーによる)及びMN細胞(核染色による)の割合は一致し、細胞質分裂なしで、SMCにMN 4CDNA細胞を形成するための有糸分裂が存在する。6ng/mlのPTXによる処理の後、MN細胞は2CDNA含有量を有し、細胞分裂を示す。異常な有糸分裂の間、MN細胞が4C細胞からのみ形成されることを考えると、これは、細胞が分裂し、図3Bに示すように、2CDNA含有量及び多核形態を導くことを示す。微小核(青い矢印)はDNA(赤い矢印)を引き、2CDNA(正常DNA含有量)MN細胞を形成する。娘細胞中のDNA含有量は、各娘細胞(2N±)のわずかに2C以上又は2C未満であり得た。次のPTX(図2及び3)により処理されたフローサイトメトリー2CDNAピークで観察された拡大は、細胞分裂の間、染色体の偏在による。
【0106】
(6.2.4PTXへの露出後の正常なSMCの形態の維持)
SMCは、光学顕微鏡下で見られるように、伸張した突起を有する、典型的な紡錘状形態を有している。PTX処理は、SMC細胞の外観を変化させないが、いくつかの細胞は、以下の3日間のPTX処理PTX処理を検出する(図3A、60ng/mlPTX)。高い拡大率の下、上記細胞の核の解析は、60〜70%の細胞が間期で静止し、30〜40%の細胞がMNであり、有糸分裂停止の後に有糸分裂が出て行くことを示す。微小核は、細胞の細胞形質小体内に分布していた(図3B).試験した最も低い濃度のPTX(2ng/ml)は、浅裂の核の出現を引き起こし、それは、有糸分裂の機能障害の現れである。
【0107】
(6.2.5PTXによるp53及びp21の誘導)
高濃度のPTXによる処理の1日後に、hSMCで処理したPTXにおいて、p53及びp21のレベルの濃度依存的上昇が見られた(図5)。最も高い濃度、20及び60ng/mlのPTXにより検出レベルは、p53及びp21の誘導のための陽性コントロールである、400ng/mlのドキソルビシンで見られるのと同じである。p21が、G1/S移行に必要である、サイクリン依存的キナーゼ(ddks)を阻害することを考えると、この発見は、PTXによるhSMCのG1停止のための陽性メカニズムとしてのp21−が媒介するcdksの阻害を示唆する。
【0108】
(6.2.6PTXへのSMCの後露出におけるアポトーシスの欠如)
有糸分裂の間に静止する長く伸びた細胞はアポトーシスを誘導する。我々の研究において示されるMN細胞の存在は、成功した有糸分裂を表し、アポトーシス回避の標識である。hSMC中のアポトーシスの欠如は、PTX処理の2日後でさえ、PARP及びキャスパーゼ-3、-9、-8の切断の欠如により更に確認された。PARPの切断、及びキャスパーゼ3、8、9の活性は、アポトーシス細胞を表す。12ng/mlのPTXで16時間処理された、コントロールのジャーカット細胞は、キャスパーゼ-3、-8及び-9バンドの消失(活性)、及びPARPの切断、85kDa断片の出現を示した(図6)。それと比較し、SMCは低レベルのキャスパーゼを表した。この発見は、300ng/mlのような高濃度のPTXへの持続した露出がhSMCのアポトーシスを生じないことを更に確認した。
【0109】
(6.2.7SMCの長期生存)
60mg/mlのPTXで21日処理した後、SMC細胞は生存可能であり、プラスチックに付着した(図7)。短時間の処理で見られる数と比較し、MN細胞又は2Cのいずれの数に変化はなかった(図2及び3)。細胞培養の解析は、ほとんどの細胞が2CDNA含量を有することを示す(図7)。
【0110】
(6.3考察)
アポトーシス細胞死は、PTXを含む、いくつかの抗腫瘍性薬剤についての細胞性阻害の主要なメカニズムであると考えられる。しかし、特定の腫瘍細胞系において、PTXはアポトーシスを引き起こさないが、むしろ、細胞のタイプ及びパクリタクセルの濃度に依存するいくつかの他のメカニズムによって増殖を阻害する(Giannakakouらの論文、上記2001;Panvichian R.らの論文、パクリタクセルの関連するマルチ微小核形成は、キャスパーゼの活性の阻害によって可能となる:薬剤耐性における可能な早い段階、Cancer Res.1998 Oct 15;58(29):4667-72;Merlin J.L.らの論文、パクリタクセルに対する耐性は、時間遅延多核形成及びMCF−7ヒト胸部腺がん細胞における大きな断片への断片化、Anticancer Drugs. 2000 Apr;11(4):295-302;Broker L.E.らの論文、アポトーシス経路の遅い活性化は、非小細胞肺ガンにおけるディスコダーモリド及びエポチロンBの細胞毒性効果を媒介するごくわずかな役割を果たす、Cancer Res. 2002 Jul 15;62(14):4081-8;Bragosklonny M.V.らの論文、上述、2002;Roberts J.R.らの論文、インビトロにおける、タキソールに耐性のあるヒト白血病細胞における倍数体化の開発、Cancer Res. 1990 Feb 1;50(3):710-6;Weitzel D.H.らの論文、ヒト肺腺ガン細胞における差異のある紡錘状組み立てチェックポイント反応、Cell Tissue Res. 2000 Apr;300(1):57-65;Lanzi C.らの論文、前立腺ガン細胞におけるパクリタクセルに対する細胞周期チェックポイント効率及び細胞性応答、Prostate.2001 Sep 15;48(4):254-64)。この研究は、1,000ng/mlのような高濃度におけるPTXが、細胞死を引き起こさずにSMCの増殖を阻害することを証明した。この、細胞毒性の欠如は、この高濃度のPTXがチューブリン重合を引き起こすけれども、hSMCが、1μg/mlのPTXと8日間インキュベーションした後に生存可能であるという、以前に公開された結果と同じである(Axelらの論文、局所性薬物送達を用いた、インビボにおける動脈平滑筋細胞増殖及び遊走、Circulation 1997;96:636-645)。
【0111】
最近の研究において、局所にステントをベースとする配送に関連するPTXの投与量によって引き起こされるhSMCの増殖阻害の詳細なメカニズムが研究された。PTXに曝された後、hSMCは一時的な有糸分裂停止を起こし、有糸分裂から離れ、生存可能なMN細胞を形成し、処理の21日後に生存可能性が残存している。該細胞培養物は、2種のタイプの細胞:第二の有糸分裂後の停止と一致するMN細胞、及び一つの核が主要なG1静止と一致する、2CDNAを有する大きな集団(図2及び3)を誘導する。該PTXは、また、hSMC中のp53及びp21を誘導する。P21の誘導は、微小管機能障害によって引き起こされるG1静止に必須であり(Cross S.M.らの論文、p53に依存的なマウス紡錘状チェックポイント、Science. 1995 Mar 3;267(5202):1353-6;Lanni J.S.らの論文、紡錘体の破壊に続く、p53に依存的な油脂分裂後のチェックポイントの特徴づけ、Mol Cell Biol. 1998 Feb;18(2):1055-64;Mantel C.R.らの論文、P21waf-1-Chk1経路はG1期微小管統合性を観察し、制限ポイント移行に重要である、Cell Cycle. 2002 Sep-Oct;1(5):327-36)。更に、p21は、有糸分裂から出ることを加速するのと同様(Barboule N.らの論文、MCF-7胸部腺ガン細胞系におけるパクリタクセル処理後の有糸分裂から出ることにおけるP21の関与、Oncogene. 1997 Dec 4;15(23):2867-75)、有糸分裂に入ることを阻害することによって細胞を保護する(Li W.らの論文、p21(waf1)の過剰発現は、G2-M停止を減少し、P53及び機能的Rbタンパク質の欠乏によるヒト肉腫細胞においてパクリタクセルによってアポトーシスが誘導される、Mol Pharmacol. 1999 Jun;55(6):1088-93)。本研究に見られるように、有糸分裂から出て、第一の及び第二のG1静止は、PTXが誘導するアポトーシスに対するhSMCの耐性を説明し得るものである。
【0112】
ジャーカット細胞等のアポトーシスを起こしやすい細胞において、PTXは、キャスパーゼ-9、キャスパーゼ-3、及びキャスパーゼ-8の活性化、及びPARPの切断、アポトーシスのマーカーを引き起こす(図6)。対照的に、PTXはhSMC中でアポトーシスを誘導しなかった。この発見は、2つのメカニズムにより説明することができる。第一に、恒常的に低レベルのプロ−キャスパーゼを発現するため、hSMCはアポトーシスを起こさない。第二に、長期間の有糸分裂の停止がアポトーシスを誘導するので、本研究で示された有糸分裂を出ること、及び第二のG1静止がアポトーシスを起こすことを防止する。同じ現象は、キャスパーゼ阻害剤である、PTX及びz-VAD-fmkを同時に処理したHeLa細胞中で証明され、PTX耐性、キャスパーゼ活性の欠如、及びMN現象の関係が確立された(Panvichian R.らの論文、PTXと関連するマルチ微小核形成は、キャスパーゼ活性の阻害によって可能となる:薬剤耐性における可能な早期段階、Cancer Res 1998;58:4667-4672;Roberts J.R.らの論文、インビトロにおける、タキソール耐性ヒト白血病細胞中の倍数体化、Cancer Res 1990;50:710-716;Weitzel D.H.らの論文、ヒト肺腺ガン細胞における差異のある紡錘状組み立てチェックポイント反応、Cell Tissue Res. 2000 Apr;300:57-65;Lanzi C.らの論文、前立腺ガン細胞におけるパクリタクセルに対する細胞周期チェックポイント効率及び細胞性応答、Prostate.2001 Sep 15;48:254-64)。従って、低いキャスパーゼレベルを有する、hSMCが有糸分裂停止を克服し、続くPTX処理後にアポトーシスを起こさないことは驚くことではない。
【0113】
染色体分離なしで、細胞が有糸分裂から出る時、それらは染色体の各グループの周りに核膜を形成し、微小核として表される。PTXで処理された後に得られるMN細胞が、DNA(4C)の四倍体量を含有することが本研究によって確立された。種々のPTX濃度における2C、4C及びMN細胞の分布を研究する時、我々は興味のある現象を観察した。MN細胞は、低濃度(6ng/ml)及び高濃度(60ng/ml)のPTX、いずれによっても生産されるが、高濃度のみが4C細胞を産生した。低濃度PTXにおいては、大部分のMN細胞が2CDNAを有する。これは、適当な染色体分離がなくても、細胞が分裂されることを示唆する。これは、2CDNA及びマルチ微小核形態を誘導する。細胞が、遺伝子及び染色体の2つのコピーを有することを考えると、1つのコピーの欠失又は獲得は、細胞の生存に影響を及ぼさない。
【0114】
DNA含量の増加は、静止SMC中で自然に起こり(Hixon M.L.の論文、血管平滑筋倍数体化:有糸分裂チェックポイントから高血圧、Cell Cycle 2003;2:105-110)、細胞死又は腫瘍のいずれをも引き起こさない。最終分化心筋細胞、非最終分化肝細胞、及び平滑筋細胞等の種々のタイプの細胞の肥大において、倍数性は通常に見られる(Devlin A.M.らの論文、発作誘発性の自発的な高血圧症ラットにおける、平滑筋細胞倍数性についてのペリンドプリルの影響、J Hypertens 1995;13:211-218; Engelmann G.らの論文、自発性高血圧症ラットから分離した心筋細胞における、倍数性のレベル及び生化学的パラメーターの年齢と関連する変化、Circ Res 1986;58:137-147;Brodsky W.らの論文、細胞の倍数性:組織成長及び機能の関係、Int Rev Cytol 1977;50:275-332;Owens G.K.の論文、血管平滑筋の過形成性増殖に対する肥大症の調整、Am J Physiol. 1989;257:H1755-H1765)。患者の年齢に依存するhSMC集団の1〜7%の範囲のヒト動脈壁平滑筋細胞における倍数性、Proc Natl Acad Sci USA 1983;80:882-885)。倍数性は、酵母中で遺伝子発現の変化を誘導する(Galitski T.らの論文、遺伝子発現の倍数性制御、Science 1999;285:251-254)が、倍数性の機能的重要性はhSMC中では知られていない。この分野におけるさらなる研究は、hSMC中の倍数性の重要性の良好な理解に寄与するだろう。
【0115】
(6.4結論)
インビトロにおける研究は、パクリタクセルが、アポトーシスを誘導せずに、hSMCの増殖を効率的に阻害することを証明した。また、試験を行った全ての濃度におけるパクリタクセルが、hSMCにおいて初期及び有糸分裂後のG1停止を起こすことを初めて見出した。細胞は、21日までのパクリタクセルへの露出後であっても生存可能性を維持した。これらの知見の全ては、抗狭窄症薬の配送をベースとするステントと関連する濃度において、パクリタクセルが細胞よりも、むしろ細胞分裂停止であることを示唆する。
【0116】
(7.実施例)
(7.1方法)
異なる長さ(16mm及び32mm)のステントを、ステント表面積mm2当り、1μgのパクリタクセルをコーティングした。タイプ1のステントは、8.8重量%のパクリタクセル、及び91.2重量%のスチレン−イソブチレン共重合体からなるコーティングを有していた。タイプ2のステントは、25重量%のパクリタクセル、及び75重量%のスチレン−イソブチレン共重合体からなるコーティングを有していた。
ステントを、リン酸緩衝された放出媒体中でインキュベートし、ステントから放出され、蓄積されたパクリタクセルの量を、2、4、7及び10日目に、HPLC法を用いて測定した。
【0117】
(7.2結果)
2、4、7及び10日目に測定された、媒体中に放出されたパクリタクセルの量を、表1及び3に示す。
2、4、7及び10日目に測定された、放出されたパクリタクセルの割合を、下記式を用いて計算し、表2及び4に示す。
放出されたPTX蓄積割合=放出されたPTX蓄積/積載した量
【0118】
【表1】

【0119】
【表2】

【0120】
【表3】

【0121】
【表4】

【0122】
(8.同等物)
本発明は、本発明の個々の側面の単一の例示によって意図される、特定の実施態様による範囲に限定されるべきでなく、機能的に同等な方法及び成分は本発明の範囲内である。実際は、本発明の種々の修飾は、本明細書に示され、記載された修飾に加え、おきまりの実験を用いることなく、上述した記載及び付随した図面から当業者に明らかであろう。このような修飾及び同等物は、添付した請求の範囲の範囲内であることが意図される。
あたかも各々の個々の刊行、特許または特許出願が、特に、そして、個々に、本願明細書に引用したものとすることを示されるかのように、刊行物、特許および特許出願がこの明細書において言及した全ては同じ範囲に本願明細書において引用したものとする。
本明細書における文献の引用または考察は、それらが本発明に対する先行技術であることの承認として、解釈されてはならない。
【図面の簡単な説明】
【0123】
【図1】ヒト動脈SMC増殖に関するPTXの影響 図1A ヒト動脈平滑筋細胞(hSMC)を、表示された濃度(0.001〜10,000ng/ml)のパクリタクセル(PTX)又はTaxol(登録商標)で5日間処理し、次いで計測した。結果は、未処理のコントロール細胞で得られた値の割合として計算された。 図1B ヒト動脈平滑筋細胞を、表示された濃度のPTXと3及び4日間処理した。MTT(3−(4,5−ジメチルチアゾール−2−イル)−2,5−ジフェニルテトラゾリウムブロマイド)細胞増殖アッセイを、セクション6に記載されたようにして行った。結果は、未処理細胞で得られた値の割合として計算され、平均±標準偏差(SD)で表した。 図1C ヒト平滑筋細胞を、2又は12ng/mlのPTXとインキュベートするか、又は未処理のまま残した(コントロール)。表示された日に、コントロールに対する生存細胞の割合を、セクション6の方法によって、トリパンブルー排除を用いて計算した。
【図2】静止期細胞、有糸分裂細胞(M)、マルチ各形成(MN)細胞及びDNA分布 ヒト平滑筋細胞を、表示したように、0、2、12、60ng/mlのPTXで2日間処理し、DAPI(4’−6−ジアミジノ−2−フェニルインドール)染色(図2A)及びフローサイトメトリー(図2B)を、セクション6の方法に記載されたように行った。
【図3】PTX処理後のhSMCの細胞及び核の形態 ヒト平滑筋細胞をスライド上で培養し、表示された濃度のPTX(6ng/ml、60ng/ml、又は未処理)で処理した。24時間後、細胞を固定し、セクション6の方法に記載されたように、核(赤/黄)及び細胞質(緑)を染色した(ローダミン/FITC)。顕微鏡写真は、処理していない細胞における正常平滑筋細胞の形態、及び6及び60ng/mlのパクリタクセルで処理した細胞を示す。図3B 核の画像は、パクリタクセル処理を行っていない正常な核、及び6及び60ng/mlのパクリタクセルで処理したマルチ核を示す。 図3C 2週間後、フローサイトメトリー(DNA含量)及びDAPI染色により細胞を解析した。
【図4】分裂するMN細胞のDNA ヒト平滑筋細胞をスライド上で培養し、6ng/mlのPTXで処理した。1日後、細胞を固定し、DNAを、方法に記載したように染色した(赤)。核の写真は200倍である。
【図5】p53及びp21レベル上のPTXの影響 ヒト平滑筋細胞を、表示された濃度のPTX、400ng/mlのドキソルビシン(DOX)(陽性コントロール)、又は100ng/mlのホルボール12−ミリステート13−アセテート(PMA)(p53についての陰性コントロール)と処理した。24時間後、細胞を溶解し、p21及びp53をフラクション6に記載されたような免疫ブロットにより決定した(p53について、上の及び第二のパネルは、異なったフィルム露出時間を有する同様なブロットである)。
【図6】キャスパーゼ切断におけるPTXの影響(アポトーシス) ヒト平滑筋細胞及びジャーカット細胞を、表示された濃度のPTXとインキュベートした。16及び48時間後、ジャーカット細胞及びヒト平滑筋細胞(それぞれ)を溶解し、ポリ(ADP−リボース)ポリメラーゼ(PARP)、PARP89kDaフラグメント、プロキャスパーゼ−8,−9及び−3を、セクション6の方法に記載された免疫ブロットにより同定した。グリセルアルデヒドホスフェートデヒドロゲナーゼ(GAPDH)免疫ブロット解析及びゲル染色を積載したコントロールとして実施した。
【図7】SMCの長期生存 ヒト平滑筋細胞を、60ng/mlのPTXと21日間インキュベートし、核染色(上のパネル)及びフローサイトメトリー(下のパネル)により解析した。
【図8】PTX露出後のSMCの運命 図8A 細胞周期停止のポイント。全てのヒト平滑筋細胞を、最終的にG1で静止した。G1においてPTX露出した時のヒト平滑筋細胞を、G1で静止させた(初期G1静止)。全ての多のヒト平滑筋細胞は、細胞周期を続け有糸分裂に入る。以上な有糸分裂を出た後、マルチ核形成したヒト平滑筋細胞をG1で静止させた。 図8B 有糸分裂の後に出て、ヒト平滑筋細胞は、PTX濃度に依存し、2C(正常)細胞、2Cマルチ核形成又は単一の核細胞又はマルチ各形成4C細胞を形成した。
【技術分野】
【0001】
本出願は、2003年6月30日に出願された、米国仮出願第60/483,820号の優先権の利益を請求し、2001年9月24日に出願された、米国仮出願第60/324,095号の優先権の利益を請求する、2002年9月24日に出願された、米国出願第10/252,848号の一部継続出願であり、全ては、本明細書において完全に参考文献として組み込まれる。
【0002】
本発明は、一般に、低濃度のパクリタクセル等の抗増殖性薬剤に細胞をさらすことにより、細胞周期のG1/S期における平滑筋細胞を静止する方法に関する。また、本発明は、細胞をG1/S期において静止することによって、平滑筋細胞の増殖及び/又は遊走を阻害するために効果的な量で、一定期間にわたり、1以上の治療薬、好ましくはパクリタクセルの持続性放出を提供することを可能にする薬物溶出医療装置に関する。1つの実施態様においては、上記医療装置は、パクリタクセルを取り込んだ高分子材料を含む表面コーティングでコーティングされているか、又は覆われている。好ましくは、高分子材料は生物学的安定であり、任意に1以上の生物学的に活性な物質、好ましくは、平滑筋細胞阻害剤及び/又は抗生物質を含有する。また、本発明は、上記薬物溶出医用装置を製造する方法及び利用する方法に関する。更に、本発明は、パクリタクセルの細胞分裂停止のために必要な量を患者に投与することによる、再狭窄、狭窄症、乾癬、皮膚炎、肝臓硬化症又は前立腺肥大症等の増殖性疾患の予防又は治療方法に関する。
【背景技術】
【0003】
循環器疾患は、先進国において主要な死因である。このような疾患を有する患者は、通常、1以上の動脈において狭小化又は閉鎖(狭窄症)を有する。循環器疾患に治療における薬物の使用は公知である。ステントは、通常、管腔の範囲内で治療域に収縮した状態で配送され、次いで膨張される。バルーン膨張性ステント(balloon-expandablestents)は、ステントの管腔内で膨張するバルーンによってステントボディー上に与えられる力に応じて変形することによって、収縮した状態から膨張する。一旦、体管腔中で拡張されると、ステントは、その拡張された直径を維持するために、体管腔(body lumen wass)によって与えられるいかなる収縮する力に抵抗するのに十分なほど強い。それと比較し、自己膨張性ステントは、圧縮される時、放射状膨張力を与える弾性体を有する。体管腔中で展開する、自己膨張性ステントは、放射状膨張力に等しいステントに対する圧縮力を与える体管腔壁まで膨張する。
【0004】
しかし、バルーン膨張性及び自己膨張ステントの使用は、ステントの展開により、体管腔に心的外傷の原因となる不都合を有する。通常は、ステントは、ステントの直径が体管腔の直径よりも大きくなるように、体管腔内で膨張する。結果として、ステントの末端の縁が体管腔の壁内で圧縮され、更なる心的外傷を引き起こす位置に強調され、すなわち、体管腔壁を切断するか引き裂く。この心的外傷は、最終的に、血管平滑筋細胞(SMC)の増殖のために、最初にステントの断片中冠動脈の再狭小化である、再狭窄を誘導する。再狭窄は、平均して、ステントを受け入れた患者の25%で生じる(Kuntz R.E.らの論文、冠動脈の再狭窄の予防:放射線療法のための進化している証拠の根拠、Circulation. 2000 May 9;101(18):2130-3)。
【0005】
最近、再狭窄を更に予防するために、種々のタイプの薬物を被覆したステントが、体管腔の壁に対し、薬物配送の局在化のために用いられてきた。SMC増幅を予防するために最近用いられている1つの戦略は、シロリムス(Sousa J.Eらの論文、ヒト冠状動脈における、シロリムス溶出ステントの移植後の、2年間の、血管造影、血管内超音波追跡、Circulation. 2003 Jan 28;107(3):381-3)及びパクリタクセル(Axel D.I.らの論文、パクリタクセルは、局所性薬物配送を用いた、インビトロ及びインビボにおいて、動脈性平滑筋細胞の増殖及び遊走を阻害する、Circulation. 1997 Jul 15;96(2):636-45;Garza L.らの論文、我々はステント内の再狭窄を予防できるか?Curr Opin Cardiol. 2002 Sep;17(5):518-25;Grube E.らの論文、TAXUS I:新規な冠状動脈の障害のための遅放出型パクリタクセル溶出ステントにおける無作為、二重盲検試験からの6ヶ月及び12ヶ月の結果、Circulation. 2003 Jan 7;107(1):38-42;Ferguson J.E.らの論文、血管増殖性疾患の予防における細胞周期の調整の役割、Cell Cycle. 2003 May-Jun;2(3):211-9;Park S.J.らの論文、冠状動脈再狭窄の予防のためのパクリタクセル溶出ステント、N Engl J Med. 2003 Apr 17;348(16):1537-45)。
【0006】
パクリタクセルは、広範囲の悪性腫瘍において高い有効性を示す、抗腫瘍性薬物タキソール(登録商標)の活性成分である(Rowinsky E.K.らの論文、パクリタクセル(タキソール)、N Engl J Med. 1995 Apr 13;332(15):1044-14;Rowinsky E.K.の論文、臨床試験におけるパクリタクセルの抗腫瘍活性の最新情報、Ann Pharmacother. 1994 May;28(5 Suppl):S18-22;Blagosklonny M.V.の論文、微小管阻害薬、Cncer Handbook. Nature Publishing Group, 2002;(編集:Alison M.R.)。タキソール(登録商標)は、現在、進行性卵巣ガン、リンパ節転移陽性乳ガンのアジュバント治療、転移性疾患の組み合わせ化学療法の失敗後の乳ガン、アジュバント化学療法の6ヶ月以内の再発、非小細胞肺ガン(シスプラチンと併用)、及びエイズに関連するカポジ肉腫を含む、種々の適応症に対し、FDAに承認されている。
【0007】
抗腫瘍治療に対して適用可能なレベルの濃度で、パクリタクセルの作用モードは、抗腫瘍治療に対して適用可能なレベルの濃度で、長期の核分裂停止、それに続くアポトーシスの導入への誘導、ヒト骨髄性白血病における迅速なプログラムされた細胞死の構築による干渉に寄与する(Bhalla K.らの論文、タキソールは、ヒト骨髄性白血病細胞におけるプログラムされた細胞死と関連するヌクレオソーム間のDNA断片化を誘導する、Leukemia. 1993 Apr;7(4):563-8; Li X.らの論文、白血病の治療の際の細胞のアポトーシス死、Leuk Lymphoma. 1994;13 Suppl 1:65-70; Perkins C.L.らの論文、アポトーシスの際の、エトポサイド又はパクリタクセルが誘導するミトコンドリアの事象におけるApaf-1、キャスパーゼ-9及びビッドプロテインの役割、Blagosklonny M.V. らの論文、有糸分裂促進剤が活性化するプロテインキナーゼ経路は、白血病細胞中において、微小管が活性化する薬物が誘導する、Raf-1/Bcl-2リン酸化反応及びアポトーシスに不必要である、Leukemia. 1999 Ju1;13(7):1028-36)。このような高濃度におけるパクリタクセルに関連する細胞死のために、それは腫瘍学の分野における細胞障害性薬物と考えられる。
【0008】
治療薬の効果が、細胞のタイプ、薬物濃度、薬物への露出時間、及び標的細胞集団の微小環境によって広く変化し得ることを考慮すると、抗狭窄/再狭窄薬(例えばパクリタクセル)の効果が、他の病状におけるその使用から得られる推定される結果よりもむしろ、病理学に関連する細胞集団において調査されることが必要である。薬物を溶出するステントテクノロジーの迅速な採択は、この理解を展開することをいっそう重大なものとし、その結果、臨床的な終点は、細胞レベルで、潜在的な薬物の影響と効果的に連関する。
【発明の開示】
【発明が解決しようとする課題】
【0009】
本発明者らは、冠状ステント移植に続く再狭窄の治療のためのパクリタクセルの作用の新規なメカニズムを発見した。特に、本発明者らは、相対的に低濃度のパクリタクセルにさらした時、アポトーシス経路を引き起こさずに、細胞周期のG1/S期で、平滑筋細胞を静止することを発見した。これは、冠状動脈においてパクリタクセルを溶出するステントの配置に続く、平滑筋細胞の増殖を阻害するための新規な細胞分裂停止メカニズムを提供する。
【0010】
特定の実施態様においては、本発明は、約0.001ng/ml〜約10,000ng/ml、好ましくは約0.01ng/ml〜約1,000ng/ml、又は約60ng/ml〜約6,000ng/ml濃度のパクリタクセルに細胞をさらすことにより、G1/S期において平滑筋細胞を静止させる方法に関する。特定の実施態様においては、平滑筋細胞のほとんど(すなわち、約80%以上、好ましくは約90%〜約100%)が、低濃度のパクリタクセルにさらされた時、細胞周期のG1/S期で静止する。
【0011】
特定の実施態様においては、本発明は、平滑筋細胞を含む体管腔に挿入又は移植し得る、パクリタクセル溶出医療装置に関する。該医療装置は、表面、及び、パクリタクセルを取り込む高分子材料を含有する表面コーティングを含む。好ましい実施態様においては、医療装置の表面は、該表面の表面積に対し、約0.5μg/mm2〜約5μg/mm2のパクリタクセルを含有する、高分子材料でコーティングされている。更に好ましい実施態様においては、該医療装置の表面は、該表面の表面mm当り、約1μgのパクリタクセルを含有する、高分子材料でコーティングされている。
【0012】
他の好ましい実施態様においては、医療装置の表面をコーティングするために用いられる高分子材料は生物学的に安定である。他の好ましい実施態様においては、医療装置の表面をコーティングするために用いられる高分子材料はスチレン−イソブチレン共重合体を含有する。他の好ましい実施態様においては、該医療装置の表面をコーティングするために用いられる高分子材料は、パクリタクセルに加え、生物学的に活性な物質を含有する。
【0013】
特定の実施態様においては、該医療装置は、表面コーティングの高分子材料に取り込まれた、パクリタクセルの特定量、すなわち細胞周期のG1/S期において放出されたパクリタクセルにさらされたほとんどの平滑筋細胞を静止するために有効な量を放出することができる。好ましく、パクリタクセルにさらされた平滑筋細胞の約90%〜約100%が静止する。
【0014】
他の実施態様においては、該医療装置は、該表面の表面積mm当り、約0.001μg〜約20μgのパクリタクセルを、約1週間〜約8週間に渡り溶出することができる。好ましい実施態様においては、該医療装置は、該表面の表面積mm当り、約0.01μg〜約0.1μgのパクリタクセルを、約4週間に渡り溶出することができる。他の好ましい実施態様においては、該医療装置は、高分子材料に取り込まれたパクリタクセルの0.1%〜約35%、更に好ましくは1%〜約15%を、約1週間〜約8週間に渡り放出することができる。好ましくは、該医療装置は、パクリタクセルを、4週間に渡り連続的に放出することができる。
【0015】
1つの実施態様においては、該医療装置によって放出される、パクリタクセルの量は、該平滑筋細胞を、約0.001ng/ml〜約10,000ng/mlであり、好ましくは約0.01ng/ml〜約1,000ng/mlであり、又は約60ng/ml〜約6,000ng/mlであるパクリタクセルの濃度にさらすものである。
【0016】
本明細書に開示される医療装置は、患者における狭窄症又は再狭窄の予防又は治療に用いることができる。好ましくは、患者はヒトである。
特定の実施態様においては、治療に効果的な量のパクリタクセルを、治療が必要な患者に投与することにより、増殖性疾患を治療するための方法に関する。好ましい実施態様においては、治療に効果的な量は、約0.001ng/ml〜約10,000ng/mlである。更に好ましい実施態様においては、治療に効果的な量は、約0.01ng/ml〜約1,000ng/mlである。好ましい実施態様においては、治療に効果的な量は、約60ng/ml〜約6,000ng/mlである。
【0017】
該パクリタクセルは、非経口的、皮下、筋肉内、眼窩内、関節内、脊髄内、胸骨内、静脈内、皮内、腹腔内、門脈内、動脈内、くも膜下腔内、関節内、経粘膜、胸膜内、経皮、局所、硬膜外、粘膜、鼻腔内注射又は注入、又は経口、吸入、肺又は直腸投与によって、患者に投与することができる。特定の実施態様においては、パクリタクセルは、平滑筋細胞を含有する患者の体管腔に直接投与される。好ましくは、パクリタクセルの治療に効果的な量は、細胞周期のG1/S期に体管腔の平滑筋細胞を静止するのに効果的なものである。
該方法は、再狭窄、狭窄、乾癬、皮膚炎、肝臓硬化症及び前立腺肥大症の治療に有用であるが、限定されない。
【発明を実施するための最良の形態】
【0018】
本発明は、一般に、細胞周期のG1/S期に平滑筋細胞を静止させる方法に関する。さらに、本発明は、G1/S期において、放出された治療薬にさらされた細胞のほとんどが静止することにより、平滑筋細胞の増殖及び/又は遊走を阻害するのに効果的な量の1以上の治療薬を放出することのできる、薬物放出医療装置に関する。特定の実施態様においては、該医療装置は、1以上の治療薬が取り込まれた、1以上の高分子材料を含有する、1以上の薬物放出コーティングでコーティング又は覆われている。他の特定の実施態様においては、該医療装置は、1以上の治療薬が取り込まれた1以上の高分子材料を含有する、1以上の薬物放出高分子混合物で製造される。
【0019】
1つの実施態様においては、該医療装置は、パクリタクセルが取り込まれた高分子材料を含有する表面コーティングを有する。特定の実施態様においては、該医療装置は、該医療装置の表面の表面積cm当り、約0.5μg〜約5μgのパクリタクセルを含有する表面コーティングでコーティングされているか又は覆われている。好ましい実施態様においては、該医療装置は、該医療装置の表面の表面積mm当り、約1μgのパクリタクセルを含む、表面コーティングでコーティングされているか又は覆われている。
【0020】
他の実施態様においては、該医療装置は、一定期間にわたり該表面コーティングを構成する高分子材料中に取り込まれているパクリタクセルを細胞分裂静止のための量又は割合で放出することができる。本明細書中で用いられているように、「細胞分裂停止」のための量は、タンパク質合成を阻害するよりも、細胞を殺し及び/又はDNA合成を阻害する量を意味するが、これに限定されない。
【0021】
さらなる他の実施態様においては、該表面の表面積mm当り、約0.001μg〜約20μgのパクリタクセルを約1週間〜約8週間に渡り放出することができる。好ましい実施態様においては、該医療装置は、該表面の表面積mm当り、約0.01μg〜約0.1μgのパクリタクセルを約4週間放出することができる。他の好ましい実施態様においては、該医療装置は、表面コーティングを構成する高分子材料に取り込まれたパクリタクセルの約0.1%〜約35%を放出することができる。好ましくは、該医療装置は、インビトロ環境において、約0.1%〜約15%のパクリタクセルを10日間以上放出することができる。
好ましくは、放出されたパクリタクセルの循環するレベルが約0.001ng/ml〜約10,000ng/mlに約1週間〜約8週間に渡り維持されるような量のパクリタクセルを放出することができる。
【0022】
好ましくは、標的細胞は、ほとんどの細胞がG1/S期で静止し得るパクリタクセルの濃度にさらされる。好ましくは、細胞がさらされるパクリタクセルの濃度はアポトーシス性細胞死を誘導しないものである。好ましくは、細胞がさらされるパクリタクセルの濃度は、約0.001ng/ml〜約10,000ng/mlである。更に好ましくは、細胞がさらされるパクリタクセルの濃度は、約0.01ng/ml〜約1,000ng/mlである。好ましくは、細胞がさらされるパクリタクセルの濃度は、約60ng/ml〜約6,000ng/mlである。本明細書で用いられるように、「パクリタクセル」は、パクリタクセル、その類似体及びその誘導体を意味する。
【0023】
また、本発明は、薬物放出医療装置を、それを必要とする患者に挿入又は移植することにより、狭窄症又は再狭窄を治療又は予防する方法に関する。更に、本発明は、それを必要とする患者に治療に効果的な量のパクリタクセルを投与することにより、再狭窄、狭窄症、乾癬、皮膚炎、肝臓硬化症及び前立腺肥大症等の細胞増殖及び/又は遊走(増殖性疾患)に関連する疾患又は状態を治療又は予防する方法に関する。特に、パクリタクセルの治療に効果的な量は、アポトーシス性細胞死を誘発せずに、細胞周期のG1/S期において、ほとんどの(すなわち、80%以上)、好ましくは約90%〜約100%の平滑筋細胞を静止させる、細胞分裂停止のための量である。
開示の明瞭のため、限定的でないが、本発明の詳細な説明を以下のサブセクションに分けた。
【0024】
(5.1医療装置の製造方法)
(5.1.1薬物放出コーティング)
本発明の装置のためにコーティングを形成するのに適当なコーティング組成物は、下記セクション5.1.2に記載するような1以上の治療薬、下記セクション5.1.3に記載するような1以上の高分子材料を含有する。特定の実施態様においては、コーティング組成物は、1、2、3、4、5又はそれ以上の高分子材料を含有する。特定の実施態様においては、高分子材料は、1、2、3、4、5又はそれ以上の治療薬を含有する。
【0025】
1つの実施態様においては、コーティング組成物は、治療薬、好ましくはパクリタクセルを取り込む高分子材料を含有する。該高分子材料は、パクリタクセル又は治療薬を混合することによって、パクリタクセル又は他の治療薬を取り込み、例えば、高分子材料は少なくともいくつかのパクリタクセル又は治療薬を取り囲むものである。任意には、コーティングは1以上の付加的な治療薬を含有する。1つの実施態様においては、コーティングは、第1の治療薬を含有する第1の高分子材料、及び第2の治療薬を含有する第2の高分子材料を含む。特定の実施態様においては、第1及び第2の治療薬は同じ、例えばパクリタクセルである。他の特定の実施態様においては、第1及び第2の治療薬薬は異なり、例えばパクリタクセル及びラパマイシンである。
【0026】
コーティング組成物を調製するため、成分、例えば、高分子、パクリタクセル及び任意に付加的な治療薬は、溶媒に懸濁され、及び/又は溶解される。好ましくは、溶媒は、用いられる治療薬の治療特性を変化させないか、逆に影響を与えない。例えば、パクリタクセルのための有用な溶媒は、クレモホール(登録商標)EL溶液等のポリエトキシル化されたヒマシ油を含む。コーティング組成物中の高分子材料及びパクリタクセルの含有は、高分子材料がパクリタクセルを取り込んだコーティングを形成する。
【0027】
特定の実施態様においては、コーティング組成物は、少なくとも約5重量%、少なくとも約10重量%、少なくとも約20重量%、少なくとも約30重量%、少なくとも約40重量%、少なくとも約50重量%、少なくとも約60重量%、少なくとも約70重量%、少なくとも約80重量%、少なくとも約90重量%、少なくとも約95重量%、少なくとも約97重量%、少なくとも約99重量%又はそれ以上の高分子材料を含有する。特定の実施態様においては、コーティング組成物は、少なくとも約5重量%、少なくとも約10重量%、少なくとも約20重量%、少なくとも約30重量%、少なくとも約40重量%、少なくとも約50重量%、少なくとも約60重量%、少なくとも約70重量%、少なくとも約80重量%、少なくとも約90重量%、少なくとも約95重量%、少なくとも約97重量%、少なくとも約99重量%又はそれ以上の(第一の)治療薬、好ましくはパクリタクセルを含有する。特定の実施態様においては、少なくとも約5重量%、少なくとも約10重量%、少なくとも約20重量%、少なくとも約30重量%、少なくとも約40重量%、少なくとも約50重量%、少なくとも約60重量%、少なくとも約70重量%、少なくとも約80重量%、少なくとも約90重量%、少なくとも約95重量%、少なくとも約97重量%、少なくとも約99重量%又はそれ以上の付加的な(第二、第三、第四又は第五の)治療薬を含有する。
【0028】
特定の実施態様においては、コーティング組成物は、約0.001μg、約0.01μg、約0.1μg、約1μg、5μg、約10μg、約15μg、約20μg、約25μg、約30μg、約35μg、約40μg、約45μg、約50μg、約60μg、約70μg、約80μg、約90μg、約100μg、約110μg、約120μg、約130μg、約140μg、約150μg、約200μg、約250μg、約300μg、約350μg、約400μg、約500μg、約600μg、約700μg、約800μg、約900μg、約1,000μg、約2,000μg又はそれ以上の治療薬を含有する。好ましくは、コーティング組成物は、約50μg〜約200μgのパクリタクセルを含有する。
【0029】
他の特定の実施態様においては、コーティング組成物は、該医療装置の表面の表面積mm当り、約0.001μg、約0.01μg、約0.1μg、約0.5μg、約1.0μg、約2.0μg、約3.0μg、約4.0μg、約5.0μg、約6.0μg、約7.0μg、約8.0μg、約9.0μg、約10.0μg、約15.0μg、約20.0μg又はそれ以上の治療薬を含有する。好ましくは、コーティング組成物は、該医療装置の表面の表面積mm当り、約0.5μg〜約5μgのパクリタクセルを含有する。
【0030】
特定の実施態様においては、コーティング組成物は、細胞をG1/S期に静止させるのに有効な細胞分裂静止をさせる量の治療薬を放出することができる。
1つの実施態様においては、該コーティング組成物は、高分子材料に取り込まれたパクリタクセルの約0.1%、約1%、約5%、約10%、約15%、約20%、約25%、約30%、約35%、約40%、約45%、約50%、約55%、約60%、約65%、約70%、約75%、約80%、約90%、約95%、又はそれ以上を、約30分、1時間、2時間、6時間、約12時間、約24時間、約2日、約3日、約4日、約5日、約6日、約1週間、約2週間、約3週間、約1ヶ月、約2ヶ月、約3ヶ月、約4ヶ月、約5ヶ月、約6ヶ月、約1年、約2年、約5年に渡り放出する。好ましくは、高分子材料に取り込まれたパクリタクセルの約0.1%〜約35%を、約1週間〜約8週間に渡り放出することができる。更に好ましくは、コーティング組成物は、高分子材料に取り込まれたパクリタクセルの約1%〜約15%を、約4週間に渡り放出することができる。
【0031】
他の実施態様においては、該コーティング組成物は、約0.001μg、約0.01μg、約0.1μg、約1μg、5μg、約10μg、約15μg、約20μg、約25μg、約30μg、約35μg、約40μg、約45μg、約50μg、約60μg、約70μg、約80μg、約90μg、約100μg、約110μg、約120μg、約130μg、約140μg、約150μg、約200μg、約250μg、約300μg、約350μg、約400μg、約500μg、約600μg、約700μg、約800μg、約900μg、約1,000μg、約2,000μgまたはそれ以上の治療薬を、約30分、1時間、2時間、6時間、約12時間、約24時間、約2日、約3日、約4日、約5日、約6日、約1週間、約2週間、約3週間、約1ヶ月、約2ヶ月、約3ヶ月、約4ヶ月、約5ヶ月、約6ヶ月、約1年、約2年、約5年に渡り放出する。好ましくは、該コーティング組成物は、高分子材料中に取り込まれた約50μg〜約200μgのパクリタクセルを、約1週間〜約8週間放出することができる。
【0032】
他の実施態様においては、該コーティング組成物は、該医療装置の表面の表面積mm当り、約0.001μg、約0.01μg、約0.1μg、約0.5μg、約1.0μg、約2.0μg、約3.0μg、約4.0μg、約5.0μg、約6.0μg、約7.0μg、約8.0μg、約9.0μg、約10.0μg、約15.0μg、約20.0μg又はそれ以上の治療薬を、約30分、1時間、2時間、6時間、約12時間、約24時間、約2日、約3日、約4日、約5日、約6日、約1週間、約2週間、約3週間、約1ヶ月、約2ヶ月、約3ヶ月、約4ヶ月、約5ヶ月、約6ヶ月、約1年、約2年、約5年に渡り放出する。好ましくは、該コーティング組成物は、高分子材料中に取り込まれた、約0.01μg〜約0.1μgのパクリタクセルを約1週間〜約8週間に渡り放出することができる。
【0033】
特定の他の実施態様においては、コーティング組成物は、長期間にわたり、治療薬を連続的に放出することができ、それによって、該細胞が、G1/S期で細胞が静止するのに有効な濃度の治療薬にさらされる。好ましくは、細胞がさらされる治療薬の濃度は、約0.0001ng/ml、約0.001ng/ml、約0.01ng/ml、約0.1ng/ml、約1.0ng/ml、約10ng/ml、約20ng/ml、約30ng/ml、約40ng/ml、約50ng/ml、約100ng/ml、約200ng/ml、約300ng/ml、約400ng/ml、約500ng/ml、約600ng/ml、約700ng/ml、約800ng/ml、約900ng/ml、約1,000ng/ml、約2,000ng/ml、約3,000ng/ml、約4,000ng/ml、約5,000ng/ml、約10,000ng/ml又はそれ以上の治療薬である。好ましくは、細胞がさらされる治療薬の濃度は、約0.001ng/ml〜10,000ng/mlのパクリタクセルである。更に好ましくは、細胞がさらされる治療薬の濃度は、約0.01ng/ml〜1,000ng/mlのパクリタクセルである。好ましくは、細胞がさらされる治療薬の濃度は、約60ng/ml〜約6,000ng/mlである。
【0034】
(5.1.2治療薬/生物学的に活性な物質)
本発明において用いられる、「治療薬」なる用語は、薬物、遺伝物質及び生体物質を含み、「生物学的に活性な物質」と置き換えて用いることができる。適当な治療薬の非限定的な例は、ヘパリン、ヘパリン誘導体、ウロキナーゼ、デキストロフェニルアラニンプロリンアルギニンクロロメチルケトン(PPack)、エノキサプリン、アンギオペプチン、ヒルジン、アセチルサリチル酸、タクロリムス、エバロリムス、ラパマシシン(シロリムス)、アムロジピン、ドキサゾシン、グルココルチコイド、ベタメタゾン、デキサメタゾン、プレドニゾロン、コルチコステロン、ブデゾニド、スルファサラジン、ロジグリタゾン、ミコフェノール酸、メサラミン、パクリタクセル、5−フルオロウラシル、シスプラチン、ビンブラスチン、ビンクリスチン、エポチロン、メトトレキセート、アザチオプリン、アドリアマイシン、ムタマイシン、エンドスタチン、アンジオスタチン、チミジンキナーゼ阻害剤、クラドリビン、リドカイン、ブピバカイン、ロピバカイン、D-Phe-Pro-Argクロロメチルケトン、血小板受容体拮抗剤、抗トロンビン抗体、抗血小板受容体抗体、アスピリン、ジピリダモール、プロタミン、ヒルジン、プロスタグランジン阻害剤、血小板阻害剤、トラピジル、リプロスチン、マダニ抗血小板ペプチド、5−アザシチジン、血管内皮成長因子、成長因子受容体、転写活性剤、翻訳プロモーター、抗増殖薬、成長因子阻害剤、成長因子受容体拮抗剤、転写抑制剤、翻訳抑制剤、複製阻害剤、抑制性抗体、成長因子に対する抗体、成長因子及び細胞毒素を含む二官能性分子、抗体及び細胞毒素を含む二官能性分子、コレステロール低下剤、血管拡張剤、内在性血管作用メカニズムを妨害する薬剤、抗酸化薬、プロブコール、抗生物質、ペニシリン、セホキシチン、オキサシリン、トブラマイシン、血管形成物質、線維芽細胞成長因子、エストロゲン、エストラジオール(E2)、エストリオール(E3)、17−βエストラジオール、ジゴキシン、β遮断剤、カプトプリル、エナロプリル、スタチン、ステロイド、ビタミン類、タキソール、パクリタクセル、2’−スクシニル−タキソール、2’−スクシニルタキソールトリエタノールアミン、2’−グルタリル−タキソール、2’−グルタリル−タキソールトリエタノールアミン塩、N−(ジメチルアミノエチル)グルタミンを有する2’−O−エステル、N−(ジメチルアミノエチル)グルタミド塩酸塩を有する2’−O−エステル、ニトログリセリン、亜酸化窒素、一酸化窒素、抗生物質、アスピリン、ジギタリス、エストロゲン、エストラジオール及びグリコシドを含む。1つの実施態様においては、治療薬は平滑筋細胞阻害剤又は抗生物質である。好ましい実施態様においては、治療薬はタキソール(例えば、タキソール(登録商標))、又はその類似物又は誘導体である。他の好ましい実施態様においては、治療薬はパクリタクセル、又はその類似物又は誘導体である。さらなる他の好ましい実施態様においては、治療薬は、エリスロマイシン、アンホテリシン、ラパマイシン、アドリアマイシン等の抗生物質である。
【0035】
「遺伝物質」なる用語は、限定的でなく、DNA又はRNAを意味し、以下に示す有用なタンパク質をコードするDNA/RNAを含み、ウィルスベクター及び非ウィルスベクターを含むヒト身体に挿入されることを意図する。
【0036】
「生体物質」なる用語は、細胞、酵母、細菌、タンパク質、ペプチド、サイトカイン及びホルモンを含む。ペプチド及びタンパク質の例は、血管内皮成長因子(VEGF)、トランスフォーミング成長因子(TGF)、線維芽細胞成長因子(FGF)、上皮細胞成長因子(EGF)、軟骨成長因子(CGF)、神経成長因子(NGF)、ケラチノサイト成長因子(KGF)、骨格成長因子(SGF)、骨芽細胞由来成長因子(BDGF)、肝細胞成長(HGF)、インシュリン様成長因子(IGF)、サイトカイン成長因子(CGF)、血小板由来成長因子(PDGF)、低酸素誘導性因子−1(HIF−1)、幹細胞由来因子(SDF)、幹細胞因子(SCF)、内皮細胞成長サプリメント(ECGS)、顆粒球マクロファージコロニー刺激因子(GM−CSF)、成長分化因子(GDF)、インテグリン調整因子(IMF)、カルモジュリン(CaM)、チミジンキナーゼ(TK)、腫瘍壊死因子(TNF)、成長ホルモン(GH)、骨形態形成蛋白質(BMP)(例えば、BMP−2、BMP−3、BMP−4、BMP−5、BMP−6(Vgr−1)、BMP−7(PO−1)、BMP−8、BMP−9、BMP−10、BMP−11、BMP−12、BMP−14、BMP−15、BMP−16等)、マトリックスメタロプロテイナーゼ(MMP)、マトリックスメタロプロテイナーゼの組織阻害剤(TIMP)、サイトカイン、インターロイキン(例えば、IL−1、IL−2、IL−3、IL−4、IL−5、IL−6、IL−7、IL−8、IL−9、IL−10、IL−11、IL−12、IL−15等)、リンホカイン、インターフェロン、インテグリン、コラーゲン(全てのタイプ)、エラスチン、フィブリリン、フィブロネクチン、ビトロネクチン、ラミニン、グリコサミノグリカン、プロテオグリカン、トランスフェリン、サイトタクチン、細胞結合性ドメイン(例えば、RGD)及びテネイシンを含む。現在好ましいBMPはBMP−2、BMP−3、BMP−4、BMP−5、BMP−6、BMP−7である。二量体タンパク質が、ホモダイマー、ヘテロダイマー又はそれらの混合物として、単独又は他の分子とともに提供される。細胞は、ヒト起源(自家性又は異質遺伝子)又は動物起源(異種間)、遺伝的に設計され、所望であれば、移植部位において興味のあるタンパク質が配送される。細胞は、前駆体細胞(例えば、内皮前駆体細胞)、幹細胞、未分化細胞、繊維芽細胞、マクロファージ及びサテライト細胞を含む。
【0037】
他の非遺伝的治療薬には、下記のものがある;
・ヘパリン、ヘパリン誘導体、ウロキナーゼ及びPPack(デキストロフェニルアラニンプロリンアルギニンクロロメチルケトン)等の抗血栓形成性治療薬;
・エノキサプリン、アンギオペプチン又は平滑筋細胞増殖をブロックし得るモノクローナル抗体、ヒルジン、アセチルサリチル酸、タクロリムス、エベロリムス、アムロジピン及びドキサゾシン等の増殖性薬;
・グルココルチコイド、ベタメタゾン、デキサメタゾン、プレドニゾロン、コルチコステロン、ブデゾニド、エストロゲン、スルファサラジン、ロシグリタゾン、ミコフェノール酸及びメサラミン等の抗炎症薬;
・パクリタクセル、5−フルオロウラシル、シスプラチン、ビンブラスチン、ビンクリスチン、エポチロン、メトトレキセート、アザチオプリン、アドリアマイシン及びムタマイシン;エンドスタチン、アンギオスタチン及びチミジンキナーゼ阻害剤、クラドリビン、タキソール及びその類似物又は誘導体等の抗腫瘍/抗増殖性/抗縮瞳薬;
・リドカイン、ブピバカイン及びロピバカイン等の麻酔薬;
・D-Phe-Pro-Argクロロメチルケトン、RGDペプチド含有化合物、ヘパリン、抗トロンビン化合物、血小板受容体拮抗剤、抗トロンビン抗体、抗血小板受容体抗体、アスピリン(アスピリンは、鎮痛薬、解熱剤及び抗炎症薬として分類される)、ジピリダモール、プロタミン、ヒルジン、プロスタグランジン阻害剤、血小板阻害剤、トラピジル又はリプロスチン及びマダニ抗血小板ペプチド等の抗血液凝固薬;
・特定の癌細胞中で細胞増殖を阻害し、アポトーシスを誘導する、RNA又はDNA代謝物として分類される、5−アザシチジン等のDNA脱メチル化剤;
・増殖因子、血管内皮増殖因子(VEGF、VEGF−2を含む全てのタイプ)、増殖因子受容体、転写活性化剤及び翻訳プロモーター等の血管細胞増殖プロモーター;
・抗増殖薬、増殖因子阻害剤、増殖因子受容体拮抗剤、転写レプレッサー、翻訳レプレッサー、複製阻害剤、遮断抗体、増殖因子に対する抗体、増殖因子及び細胞毒を含む二官能性分子、抗体及び細胞毒を含む二官能性分子等の血管細胞増殖阻害剤;
・コレステロール低下剤、血管拡張剤、及び内在性血管拡張メカニズムを妨害する薬物;
・プロブコール等の抗酸化剤;
・ペニシリン、セホキシチン、オキサシリン、トブラマイシン、ラパマイシン(シロリムス)等の抗生物質;
・酸性及び塩基性繊維芽細胞増殖因子、エストラジオール(E2)、エストリオール(E3)及び17−βエストラジオールを含むエストロゲン等の血管形成物質;
・ジゴキシン、β遮断剤、カプトプリル及びエナロプリルを含むアンギオテンシン変換酵素(ACE)阻害剤、スタチン及び関連化合物等の心不全のための薬物;
・シロリムス又はエバロリムス等のマクロライドである。
【0038】
好ましい生体物質は、ステロイド、ビタミン、及び再狭窄阻害薬等の抗増殖薬を含む。好ましい、再狭窄阻害剤は、タキソール(登録商標)、パクリタクセル(すなわち、パクリタクセル類似体、又はパクリタクセル誘導体、及びそれらの混合物)等の微小管安定剤を含む。本発明で用いるの適した誘導体は、2’−スクシニル−タキソール、2’−スクシニルタキソールトリエタノールアミン、2’−グルタリル−タキソール、2’−グルタリル−タキソールトリエタノールアミン塩、N−(ジメチルアミノエチル)グルタミンを有する2’−O−エステル、及びN−(ジメチルアミノエチル)グルタミド塩酸塩を有する2’−O−エステルを含む。
【0039】
他の適当な治療薬は、タクロリムス、ハロフギノン、ゲルダマイシン等のHSP90熱ショックタンパク質の阻害剤、エポチロンD等の微小管安定化剤、クリオスタゾール等のホスホジエステラーゼ阻害剤を含む。
他の好ましい治療薬は、ニトログリセリン、亜酸化窒素、一酸化窒素、アスピリン、ジギタリス、エストラジオール及びグリコシド等のエストロゲン誘導体を含む。
1つの実施態様においては、治療薬は、タンパク質合成、DNA合成、紡錐糸形成、細胞増殖、細胞移動、微小管形成、微小繊維形成、細胞外基質合成、細胞外基質分泌、又は細胞容積の増加等の、細胞の代謝を変化するか、細胞の活性を阻害することができる。
特定の実施態様においては、本発明の医療装置に用いられる治療薬は、当業者に公知の方法によって合成することができる。また、治療薬は、化学又は製薬会社から購入することができる。
【0040】
(5.1.3高分子材料)
本発明の薬物放出コーティングを製造するのに用いるのに適当な高分子材料は、生体適合性であり、身体への炎症を回避する材料であるべきである。該高分子材料は、生物学的に安定であり、生物吸収性であることができる。好ましくは、該高分子材料は生物学的に安定である。好ましくは、本発明のコーティング組成物に用いられる高分子材料は下記から選択される:ポリウレタン、シリコーン(例えば、ポリシロキサン及び置換ポリシロキサン)、及びポリエステルである。また、高分子材料としては好ましくはスチレン−イソブチレン共重合体である。用い得る他のポリマーは、溶解することができ、医療装置、又は生物学的に活性な物質と配合することができる、相対的に低い融点を有する高分子上で硬化又は重合される。さらなる適当なポリマーは、通常、熱可塑性エラストマー、ポリオレフィン、ポリイソブチレン、エチレン−アルファオレフィン共重合体、アクリル重合体又は共重合体、ポリ(ラクチド−グリコリド共重合体)(poly(lactide-co-glycoide))(PLGA)、ポリビニルアルコール(PVA)、ポリ(L−ラクチド)(PLLA)、ポリ酸無水物、ポリホスファゼン、ポリカプロラクトン(PCL)、ポリ塩化ビニル等のハロゲン化ビニル重合体及び共重合体、ポリビニルメチルエステル等のポリビニルエステル、ポリフッ化ビニリデン及びポリ塩化ビニリデン等のポリハロゲン化ビニリデン、ポリアクリロニトリル、ポリビニルケトン、ポリスチレン等のポリ芳香族ビニル、ポリ酢酸ビニル等のポリビニルエステル、ビニル単量体の共重合体、エチレン−メチルメタクリレート共重合体、アクリロニトリル−スチレン共重合体、ABS(アクリロニトリル−ブタジエン−スチレン)樹脂、エチレン−酢酸ビニル共重合体等の、ビニル単量体及びオレフィンの共重合体、ナイロン66及びポリカプロラクトン等のポリアミド、アルキド樹脂、ポリカーボネート、ポリオキシメチレン、ポリイミド、ポリエーテル、エポキシ樹脂、レーヨン−トリアセテート、セルロース、酢酸セルロース、ブチル化セルロース、ブチル化酢酸セルロース、セロファン、ニトロセルロース、プロピオン酸セルロース、セルロースエーテル、カルボキシメチルセルロース、コラーゲン、キチン、ポリ乳酸(PLA)、ポリグリコール酸(PGA)、ポリエチレンオキシド(PEO)、ポリ乳酸−ポリエチレンオキシド共重合体、EPDM(エチレン−プロピレン−ジエン)ゴム、フッ化シリコン、ポリエチレングリコール(PEG)、ポリアルキレングリコール(PAG)、多糖類、リン脂質及び上記の組み合わせを含む。
【0041】
特定の実施態様においては、高分子材料は親水性(例えば、PVA、PLLA、PLGA、PEG及びPAG)である。特定の実施態様においては、高分子材料は疎水性(例えば、PLA、PGA、ポリ酸無水物、ポリホスファゼン及びPCL)である。
機械的挑戦(mechanical challenge)、例えば、膨張及び収縮を起こす医療装置にとって更に好ましくは、高分子材料は、シリコーン(例えば、ポロシロキサン及び置換ポリシロキサン)、ポリウレタン、熱可塑性エラストマー、エチレン酢酸ビニル共重合体、ポリオレフィンエラストマー及びEPDMゴム等の弾性重合体であるべきである。上記高分子の弾性特性のため、コーティング組成物は、装置が力、応力又は機械的挑戦にさらされる時に、降伏点下で変形を受け得る。
【0042】
いくつかの実施態様においては、高分子材料は生分解性である。生分解性高分子材料は、高分子鎖が生物学的に許容され、進行的により小さい化合物に加水分解される結果として、分解される。1つの実施態様においては、高分子材料は、ポリラクチド、ポリグリコリド又はそれらの共重合体を含む。ポリラクチド、ポリグリコリド及びそれらの共重合体は、乳酸及びグリコール酸に分解され、クレブス回路に解離、更に二酸化炭素及び水に分解される。
【0043】
高分子材料は、大量加水分解を通じて分解され、高分子は、マトリックスを通じて完全に均一な方法で分解される。いくつかの新規な分解性高分子、最も特にポリ酸無水物及びポリオルトエーテルは、分解は高分子の表面でのみ起こり、結果として、治療薬及び/又は高分子/治療薬混合物の表面積に比例する放出速度となる。PLGA等の親水性高分子材料は大量の方法で腐食されるだろう。コーティング組成物を製造するために、種々の商業的に入手可能なPLGAが用いられる。例えば、ポリ(d,l-乳酸−グリコール酸共重合体)が商業的に入手可能である。好ましい、商業的に入手可能な製品は、50%ラクチド及び50%グリコリドのモル%組成を有する、50:50ポリ(d,l-乳酸−グリコール酸共重合体)(d.l-PLA)である。他の適当な商業的に入手可能な製品は、65:35、75:25及び85:15ポリ(d,l-乳酸−グリコリド酸共重合体)である。例えば、ポリ(d,l-ラクチド−グリコリド共重合体)は、ベーリンガーインゲルハイム(ドイツ)から、商標Resomer(登録商標)、例えば、PLGA 50:50(レゾマーRG 502)、PLGA75:25(レゾマーRG 752)及びd,l-PLA(レゾマーRG 206)及びバーミンガムポリマー(バーミンガム、アラバマ州)から得られる。上記共重合体は、広い範囲の分子量及び乳酸及びグリコール酸の比で得られる。
【0044】
1つの実施態様においては、コーティンは、所望の親水性/疎水性層相互作用を有する共重合体を含む(例えば、非直線性親水性−疎水性マルチブロック挙油重合体のナノ粒子及び微小粒子を開示し、本明細書に参考文献によって完全に取り込まれる、米国特許第6,007,845号明細書を参照)。特定の実施態様においては、コーティングは、PLG由来の生分解性Aブロック及びPEO由来の親水性BブロックからなるABAトリブロック共重合体を含む。
【0045】
(5.1.4医療装置のタイプ)
本発明において用いられる医療装置は、天然高分子、合成高分子、セラミック及び金属を含有するが、これらに限定されない、一般に医療装置に適したいずれかの生体適合性材料から製造することができる。金属材料が更に好ましい。適当な金属材料は、チタンをベースとする(ニチノール、ニッケルチタン合金、熱記憶合金材料)金属及び合金、ステンレス鋼、タンタル、ニッケル−クロム、又はElgiloy(登録商標)及びPhynox(登録商標)等のコバルト−クロミウム−ニッケル合金を含む、特定のコバルト合金を含む。また、金属材料は、WO94/16646に開示されたようなクラッド複合型フィラメントを含む。
【0046】
金属材料は伸張されたメンバー又はワイヤ様成分にされ、次いで折られて金属メッシュのネットワークを形成する。また、高分子フィラメントは、金属メッシュを形成するための伸張された金属メンバー、又はワイヤ様エレメントと共に用いられる。ネットワークが金属で製造されると、交差は溶接され、よじられ、湾曲され、接着され、結われ(縫合と共に)、お互いにヒートシールされ、又は当業界で公知の方法で接続される。
【0047】
医療装置を形成するのに有用な高分子は、生体適合性であり、身体組織に対する炎症を回避するものであるべきである。それらは、生物学的に安定であるか生体吸収性である。適当な高分子材料は、ポリウレタン及びその共重合体、シリコーン及びその共重合体、エチレンビニル−酢酸、ポリエチレンテレフタレート、熱可塑性エラストマー、ポリ塩化ビニル、ポリオレフィン、セルロース誘導体、ポリアミド、ポリエステル、ポリスルホン、ポリテトラフルオロエチレン、ポリカーボネート、アクリロニトリルブタジエンスチレン共重合体、アクリル、ポリ乳酸、ポリグリコール酸、ポリカプロラクトン、ポリ乳酸−ポリエチレンオキシド共重合体、セルロース、コラーゲン及びキチンを含むが限定されない。
【0048】
本発明の医療装置のための材料として有用である他の高分子は、ダクロンポリエステル、ポリ(エチレンテレフタレート)、ポリカーボネート、ポリメチルメタクリレート、ポリプロピレン、ポリアルキレンオキサレート、ポリ塩化ビニル、ポリウレタン、ポリシロキサン、ナイロン、ポリ(ジメチルシロキサン)、ポリシアノアクリレート、ポリホスファゼン、ポリ(アミノ酸)、エチレングリコールIジメタクリレート、ポリ(メチルメタクリレート)、ポリ(2−ヒドロキシエチルメタクリレート)、ポリテトラフルオロエチレンポリ(HEMA)、ポリヒドロキシアルカノエート、ポリテトラフルオロエチレン、ポリカーボネート、ポリ(グリコリド−ラクチド)共重合体、ポリ乳酸、ポリ(ε−カプロラクトン)、ポリ(β−ヒドロキシブチレート)、ポリジオキサン、ポリ(γ−グルタミン酸エチル)、ポリイミノカルボネート、ポリ(オルトエーテル)、ポリ酸無水物、アルギン酸塩、デキストラン、キチン、綿、ポリグリコール酸、ポリウレタン、又はそれらの誘導体、すなわち、例えば、高分子は、高分子が、タンパク質、核酸等の分子と結合するのを許容する間、構造的完全性を維持するように、例えば、Arg-Gly-Asp(RGD)等の結合部位又は架橋基、を含むように修飾されている誘導体を含むが限定されない。
【0049】
高分子は、その機械的強度を上昇させるために乾燥される。次いで、高分子は、医療装置の全て又は一部を形成するための基本の材料として用いられる。
更に、本発明は、医療装置を形成するために1つのタイプの高分子を用いることによって実施されるが、高分子の種々の組み合わせを用いることができる。医療装置に取り込まれた時に、所望の効果を与えるために、高分子の適当な混合物が調製される。
【0050】
特定の好ましい実施態様においては、上記セクション5.1.2に記載された治療薬が高分子に混合される。このような混合物は、医療装置又はその一部を形成するために用いることができる。特定の実施態様においては、治療薬は、医療装置を形成するために用いられる高分子組成物の、少なくとも約5重量%、少なくとも約10重量%、少なくとも約20重量%、少なくとも約30重量%、少なくとも約40重量%、少なくとも約50重量%、少なくとも約60重量%、少なくとも約70重量%、少なくとも約80重量%、少なくとも約90重量%、少なくとも約95重量%、少なくとも約97重量%、少なくとも約99重量%又はそれ以上を構成する。
【0051】
特定の実施態様においては、医療装置は、少なくとも約5重量%、少なくとも約10重量%、少なくとも約20重量%、少なくとも約30重量%、少なくとも約40重量%、少なくとも約50重量%、少なくとも約60重量%、少なくとも約70重量%、少なくとも約80重量%、少なくとも約90重量%、少なくとも約95重量%、少なくとも約97重量%、少なくとも約99重量%又はそれ以上の高分子材料を含有する。特定の実施態様においては、医療装置は、少なくとも約5重量%、少なくとも約10重量%、少なくとも約20重量%、少なくとも約30重量%、少なくとも約40重量%、少なくとも約50重量%、少なくとも約60重量%、少なくとも約70重量%、少なくとも約80重量%、少なくとも約90重量%、少なくとも約95重量%、少なくとも約97重量%、少なくとも約99重量%又はそれ以上の(第一の)治療薬、好ましくはパクリタクセルを含有する。特定の実施態様においては、医療装置は、少なくとも約5重量%、少なくとも約10重量%、少なくとも約20重量%、少なくとも約30重量%、少なくとも約40重量%、少なくとも約50重量%、少なくとも約60重量%、少なくとも約70重量%、少なくとも約80重量%、少なくとも約90重量%、少なくとも約95重量%、少なくとも約97重量%、少なくとも約99重量%又はそれ以上の付加的な(第二、第三、第四又は第五の)治療薬を含有する。
【0052】
好ましい実施態様においては、医療承知は、約0.001μg、約0.01μg、約0.1μ、約1μg、約5μg、約10μg、約15μg、約20μg、約25μg、約30μg、約35μg、約40μg、約45μg、約50μg、約60μg、約70μg、約80μg、約90μg、約100μg、約110μg、約120μg、約130μg、約140μg、約150μg、約200μg、約250μg、約300μg、約350μg、約400μg、約500μg、約600μg、約700μg、約800μg、約900μg、約1,000μg、約2,000μg又はそれ以上の治療薬を含有する。好ましくは、医療装置は、約50μg〜約200μgのパクリタクセルを含有する。
【0053】
他の特定の実施態様においては、該医療装置は、該医療装置表面の表面積mm当り、約0.001μg、約0.01μg、約0.1μg、約0.5μg、約1.0μg、約2.0μg、約3.0μg、約4.0μg、約5.0μg、約6.0μg、約7.0μg、約8.0μg、約9.0μg、約10.0μg、約15.0μg、約20.0μg又はそれ以上の治療薬を含有する。好ましくは、該医療装置は、医療装置表面の表面積mm当り、約0.5μg〜約5μgのパクリタクセルを含有する。
特定の実施態様においては、医療装置は、G1/S期で細胞を静止するのに効果的な治療薬の細胞分裂静止のための量を放出することができる。
【0054】
1つの実施態様において、該医療装置は、高分子材料に取り込まれたパクリタクセルの約0.1%、約1%、約5%、約10%、約15%、約20%、約25%、約30%、約35%、約40%、約45%、約50%、約55%、約60%、約65%、約70%、約75%、約80%、約90%、約95%又はそれ以上を、約30分、1時間、2時間、6時間、約12時間、約24時間、約2日、約3日、約4日、約5日、約6日、約1週間、約2週間、約3週間、約1ヶ月、約2ヶ月、約3ヶ月、約4ヶ月、約5ヶ月、約6ヶ月、約1年、約2年、約5年に渡り放出する。好ましくは、該医療装置は、高分子材料に取り込まれたパクリタクセルの約0.1%〜約35%の量を、約1週間〜約8週間に渡り放出することができる。更に好ましくは、該医療装置は、高分子材料に取り込まれたパクリタクセルの約1%〜約15%を約4週間に渡り放出することができる。
【0055】
他の実施態様においては、該医療装置は、約0.001μg、約0.01μg、約0.1μg、約1μg、5μg、約10μg、約15μg、約20μg、約25μg、約30μg、約35μg、約40μg、約45μg、約50μg、約60μg、約70μg、約80μg、約90μg、約100μg、約110μg、約120μg、約130μg、約140μg、約150μg、約200μg、約250μg、約300μg、約350μg、約400μg、約500μg、約600μg、約700μg、約800μg、約900μmg、約1,000μg、約2,000μg又はそれ以上の治療薬を、約30分、1時間、2時間、6時間、約12時間、約24時間、約2日、約3日、約4日、約5日、約6日、約1週間、約2週間、約3週間、約1ヶ月、約2ヶ月、約3ヶ月、約4ヶ月、約5ヶ月、約6ヶ月、約1年、約2年、約5年に渡り放出する。好ましくは、該医療装置は、高分子材料に取り込まれた約50μg〜約200μのパクリタクセルを約1週間〜約8週間に渡り放出することができる。
【0056】
更なる他の実施態様においては、該医療装置は、医療装置表面の表面積mm当り、約0.001μg、約0.01μg、約0.1μg、約0.5μg、約1.0μg、約2.0μg、約3.0μg、約4.0μg、約5.0μg、約6.0μg、約7.0μg、約8.0μg、約9.0μg、約10.0μg、約15.0μg、約20.0μg又はそれ以上の治療薬を、約30分、1時間、2時間、6時間、約12時間、約24時間、約2日、約3日、約4日、約5日、約6日、約1週間、約2週間、約3週間、約1ヶ月、約2ヶ月、約3ヶ月、約4ヶ月、約5ヶ月、約6ヶ月、約1年、約2年、約5年に渡り放出する。好ましくは、該医療装置は、高分子材料中に取り込まれたパクリタクセルの約0.01μg〜約0.1μgを、約1週間〜約8週間に渡り放出することができる。
【0057】
特定の実施態様においては、該医療装置は、長時間、治療薬を放出することができ、その結果、G1/S期内で細胞を凍結するのに効果的な治療薬濃度に細胞がさらされる。好ましくは、該細胞がさらされる治療薬の濃度は、約0.0001ng/ml、約0.001ng/ml、約0.01ng/ml、約0.1ng/ml、約1.0ng/ml、約10ng/ml、約20ng/ml、約30ng/ml、約40ng/ml、約50ng/ml、約100ng/ml、約200ng/ml、約300ng/ml、約400ng/ml、約500ng/ml、約600ng/ml、約700ng/ml、約800ng/ml、約900ng/ml、約1,000ng/ml、約2,000ng/ml、約3,000ng/ml、約4,000ng/ml、約5,000ng/ml、約10,000ng/ml又はそれ以上の治療薬である。好ましくは、該細胞がさらされる治療薬の濃度は、約0.001ng/ml〜10,000ng/mlである。更に好ましくは、該細胞がさらされる治療薬の濃度は、約0.01ng/ml〜1,000ng/mlのパクリタクセルである。好ましくは、該細胞がさらされる治療薬の濃度は、約60ng/ml〜約6,000ng/mlである。
【0058】
本発明に適当な医療装置の例は、ステント、外科用止め金、カテーテル(例えば、中心静脈カテーテル及び動脈カテーテル)、ガイドワイヤ、カニューレ、心臓ペースメーカーリード又はリードチップ、心臓除細動器リード又はリードチップ、移植可能な血管アクセスポート、血液保存バッグ、血液チューブ、血管又は他の移植片、大動脈内バルーンポンプ、心臓弁、心臓血管縫合糸、全人工心臓及心室性の心臓、及び心室性のアシストポンプ、血液酸素化装置、血液フィルター、血液透析ユニットの単位、血液灌流単位、及び血漿分離単位等の実体のない装置を含むが、限定されない。好ましい実施態様においては、該医療装置はステントである。
【0059】
本発明の医療装置は、管状又は円柱状部分を有する医療装置を含む。該医療装置の管状部分は、完全に円柱状である必要はない。例えば、管状部分の横断面は、長方形、三角形等のいかなる形状であり得、ちょうど円形ではない。このような装置は、ステント及び移植片を含むが限定されない。また、分岐したステントが、本発明の方法によって製造された医療装置内に含まれる。
【0060】
本発明に特に適した医療装置は、当業者に公知である医療目的のためのいずれかの種類のステントを含む。例えば、適当なステントは、自己膨張性ステントバルーン膨張性ステント等の血管性ステントを含む。好ましくは、ステントは側壁に開口を有する。本発明において有用な自己膨張性ステントの例は、Wallstenらに発行された米国特許第4,655,771号明細書及び第4,954,126号明細書、及びWallstenらに発行された米国特許第5,061,275号明細書に説明されている。適当なバルーン膨張性ステントの例は、Pinchasikらに発行された米国特許第5,449,373号明細書に説明されている。
【0061】
(5.1.5医療装置のコーティング法)
本発明においては、先に述べたセクション5.1.1に記載されたコーティング組成物が、医療装置表面にいずれかの方法によって塗布され、コーティングが形成される。適当な方法は、噴霧法、積層、圧迫法、ブラッシング、塗布、浸漬、横転、静電蒸着及び表面に生体分子を固定化する現代の化学的方法である。好ましくは、コーティング組成物は、噴霧法、横転、積層及び圧迫法によって医療装置表面に塗布される。本発明の1つの実施態様においては、医療装置を製造するために1以上のコーティング法を用いることができる。
【0062】
更に、コーティング組成物を塗布する前に、コーティングする表面がデプレッションを含まない実施態様において、任意に、該医療装置の表面を、粗面化、(roughening)、酸化、スパッタリング、プラズマ蒸着又は下塗り(primming)等の前処理してもよい。スパッタリングは、ガス放電を通して陽イオン照射によって陰極から原子を除去することによる表面上の原子の蒸着である。また、該装置表面へのプライマーの露出は、前処理の可能な方法である。
【0063】
特定の実施態様において、本発明の医療装置は1つのコーティング層で覆われている。他の特定の実施態様においては、本発明の医療装置は、1以上のコーティング層で覆われている。好ましい実施態様においては、該医療装置は、異なるコーティング組成物から製造されるコーティング層で覆われている。すなわち、コーティング組成物の1つは、他のコーティング組成物から製造されない成分の少なくとも1つの成分又は量を有している。例えば、コーティングは、異なる生物学的活性物質を含む、第1及び第2の層を含有している。また、第1の層及び第2の層は、異なる濃度を有する、同一の生物学的活性物質を含有する。他の実施態様においては、コーティングは、異なる治療薬を含有する第1の層及び第2の層を含有する。さらなる他の実施態様においては、第1の層又は第2の層のいずれかが生物学的活性物質を含まない。
【0064】
(5.2治療的使用)
本発明は、上述のセクション5.1.2に記載されたように、一般に、医薬組成物及び薬物放出医療装置の、患者における、細胞増殖及び/又は遊走と関連する、疾病又は健康状態の予防、治療又は管理のための治療的使用に関する。
本明細書で用いられるように、「患者」及び「病人」は交換可能に用いられる。
該患者とは、動物、好ましくは非霊長類(例えば、雌ウシ、ブタ、馬、猫、犬、ラット及びマウス)及び霊長類(例えば、カニクイザル、チンパンジー及びヒト)を含むほ乳類であり、更に好ましくはヒトである。1つの実施態様においては、患者は治療法(例えば、血管形成術として知られる経皮経管冠動脈拡張術(PTCA)、及び大動脈冠動脈バイパス術移植(CABG)手術)を受けた患者であり得る。
【0065】
特定の実施態様においては、該医薬組成物及び薬物放出医療装置は、脳、頸部、目、口、咽頭、食道、胸部、骨、靱帯、軟骨、腱、肺、大腸、直腸、胃、前立腺、乳房、卵巣、ファローピウス管、子宮、頚部、精巣又は他の生殖器官、毛嚢、皮膚、横隔膜、甲状腺、血液、骨、骨髄、心臓、リンパ節、血管、動脈、毛細血管、結腸、小腸、腎臓、肝臓、膵臓、大脳、脊髄、及び中枢神経系の増殖及び/又は遊走を阻害するために用いられる。該医薬組成物及び医療装置は、体組織、例えば、上皮細胞、結合組織、筋組織及び神経組織の増殖及び/又は遊走を阻害するために用いられる。上皮組織は、体内部又は外側で、全ての身体表面をカバーするか、身体表面に沿って並ぶ。上皮組織の具体例は、皮膚、上皮、真皮、粘膜、漿膜、体腔、及び心臓、肺、肝臓、腎臓、腸、膀胱、子宮等の内臓を含むが限定されない。該結合組織は、全ての組織に豊富に広く分布している。結合組織の具体例は、維管束組織(例えば、動脈、静脈、毛細血管)、血液(例えば、赤血球、血小板、白血球)、リンパ、脂肪、線維、軟骨、靭帯、腱、骨、網、腹膜、腸間膜、半月板、結膜、硬膜、へその緒等であるが限定されない。該筋組織は、総体重のほぼ3分の1を占めて、3つの異なった亜類型、横紋(骨格)筋、平滑(内臓)筋、及び心筋からなる。筋組織の具体例は、心筋(心臓筋肉)、骨格、腸壁等を含むが限定されない。第四の主要な組織のタイプは神経組織である。神経組織は、脳、脊髄、及び付随的な神経に見られる。神経組織は、ニューロン(神経細胞)及び神経こう細胞又は具リア細胞と呼ばれる特殊化細胞からなる。
【0066】
1つの実施態様においては、該医薬組成物及び医療装置は、血管平滑筋細胞、腫瘍細胞、間質細胞、血管平滑筋細胞又は免疫系エフェクター細胞の周囲の間質細胞の増殖及び/又は遊走を阻害するのに有用である。他の実施態様においては、医薬組成物及び医療装置は、必要とする患者に、パクリタクセルの細胞分裂停止の量を投与することにより、再狭窄、狭窄症、乾癬、皮膚炎、肝臓硬化症、又は前立腺肥大症等の増殖性疾患を予防又は治療することができる。さらなる他の実施形態においては、該医薬組成物及び医療装置は、平滑筋細胞の細胞周期のG1/S期において平滑筋細胞の大部分を静止させることができる。
【0067】
特定の実施形態においては、該医薬組成物及び医療装置は、治療薬、好ましくはパクリタクセルをさらされた細胞における細胞増殖及び/又は遊走の少なくとも約5%、少なくとも約10%、少なくとも約20%、少なくとも約30%、少なくとも約40%、少なくとも約50%、少なくとも約60%、少なくとも約70%、少なくとも約80%、少なくとも約90%、少なくとも約95%、少なくとも約97%、少なくとも約99%又は約100%(完全)を阻害することができる。
【0068】
他の特定の実施形態においては、該医薬組成物及び医療装置は、患者において、病状/重症度/再狭窄、狭窄症、感染、皮膚炎、肝臓硬化症又は前立腺肥大症の程度の少なくとも約5%、少なくとも約10%、少なくとも約20%、少なくとも約30%、少なくとも約40%、少なくとも約50%、少なくとも約60%、少なくとも約70%、少なくとも約80%、少なくとも約90%、少なくとも約95%、少なくとも約97%、少なくとも約99%、又は約100%(完全)を減少することができる。
【0069】
さらなる他の特定の実施形態においては、該医薬組成物及び医療装置は、平滑筋の細胞周期のG1/S期において平滑筋細胞の少なくとも約5%、少なくとも約10%、少なくとも約20%、少なくとも約30%、少なくとも約40%、少なくとも約50%、少なくとも約60%、少なくとも約70%、少なくとも約80%、少なくとも約90%、少なくとも約95%、少なくとも約97%、少なくとも約99%、又は約100%(全て)を静止することができる。
【0070】
(5.2.1医薬組成物)
該治療薬を、投与に適した医薬組成物に取り込むことができる。1つの実施態様においては、該組成物は、少なくとも2種の異なる治療薬、又は高分子/治療薬混合物を含む。好ましくは、該組成物はパクリタクセルを含む。
該医薬組成物は、通常の混合、溶解、造粒、糖衣錠製造、研和、乳化、カプセル封入、包括又は凍結乾燥工程によって製造される。このような組成物は、典型的には、1以上の治療薬、及び任意に薬学的に許容される担体を含む。
【0071】
特定の実施形態においては、「薬学的に許容」は、連邦政府又は州政府の調整局によって承認されるか、米国薬局方又は一般的に動物、特にヒトにおいて用いられるヒトにおいて用いられる一般に認識された薬局方に収載されていることを意味する。「担体」なる用語は、治療薬と共に投与される希釈剤、アジュバント(例えば、フロイントのアジュバント(完全及び不完全)賦形剤、又は媒体を意味する。このような薬学的に許容される担体は、水、塩溶液、アルコール、シリコーン、ワックス、ワセリン、植物油、ピーナッツ油、大豆油、鉱油、ゴマ油、ポリエチレングリコール、プロピレングリコール、リポソーム、糖、ゼラチン;乳糖、アミラーゼ、ステアリン酸マグネシウム、タルク、界面活性剤、珪酸、粘性パラフィン、香油、脂肪酸モノグリセリド及びジグリセリド、石油エーテル(petroethral)脂肪酸エステル、ヒドロキシメチルセルロース、ポリビニルピロリドン等を含む。適当な賦形剤は、デンプン、グルコース、乳糖、ショ糖、ゼラチン、麦芽、米、小麦粉、チョーク、シリカゲル、ステアリン酸ナトリウム、グリセロールモノステアレート、タルク、塩化ナトリウム、脱脂粉乳、グリセロール、プロピレン、グリコール、水、及びエタノール等を含む。
【0072】
また、補充的な活性化合物を組成物中に取り込むことができる。1つの実施形態においては、該組成物は、更に、微量の湿潤剤、乳化剤、又は塩酸又は水酸化ナトリウム等のpH緩衝剤を含む。
該組成物は、意図すると投与経由に依存し、溶液、懸濁液、エマルジョン、錠剤、丸薬、カプセル、粉末、徐放薬製剤等の形態をとり得る。投与経路の具体例は、非経口的(例えば、皮下、筋肉内、眼窩内、関節内、脊髄内、層内、静脈内、皮内、腹腔内、門脈内、動脈内、くも膜下腔内、粘膜内、動脈内、及び胸膜内)、経皮的(すなわち、局所)、及び粘膜(例えば、鼻腔内)注射又は注入と同様、経口投与、吸入、肺及び直腸投与を含む。
【0073】
非経口投与のために、該組成物は1以上の下記成分を含有する:注射用水、生理食塩水、固定油、ポリエチレングリコール、グリセリン、プロピレングリコール又はその他の合成溶媒等の滅菌希釈剤;ベンジルアルコール又はメチルパラベン等の抗菌剤;アスコルビン酸又は亜硫酸水素ナトリウム等の酸化防止剤;エチレンジアミンテトラ酢酸等のキレート剤;酢酸塩、クエン酸塩又はリン酸塩等の緩衝液、及び塩化ナトリウム又はデキストラン等の緊張度を調整するための試薬である。該非経口的製剤は、ガラス又はプラスチックで製造された、アンプル、使い捨ての注射器又は多人数用バイアルに封入される。
【0074】
局所投与のためには、該治療薬は、当業界で公知の溶液、ゲル、軟膏、クリーム、懸濁液等に製造される。
注射のためには、該治療薬は、水溶液、好ましくは、ハンクス溶液、リンガー溶液又は生理食塩水等の生理学的に適合性の緩衝液中で製造される。該溶液は、懸濁、安定化及び/又は分散剤等の配合剤を含んでもよい。好ましい実施態様においては、該治療薬は滅菌水溶液中で製剤化される。
【0075】
静脈内投与のためには、適当なキャリアは、生理食塩水、静菌水、Cremophor(登録商標)EL(BASF,パーシッパニー、ニュージャージー)又は、生理食塩水化リン酸緩衝液を含む。全てのケースにおいて、該組成物は無菌でなければならず、注射器で注射可能な程度まで流動的であるべきである。製造及び貯蔵条件下で安定でなければならず、細菌及び真菌等の微生物の汚染作用に対して保存可能であるべきである。担体は、例えば、水、エタノール、ポリオール(例えば、グリセロール、プロピレングリコール及び液体ポリエチレングリコール等)、及びそれらの適当な混合物を含む、溶剤又は分散媒である。例えばレシチン等のコーティングを用いることにより、分散液の場合、要求される粒子サイズを維持することにより、及び界面活性剤の使用により、適切な流動性が維持される。微生物の作用の予防は、種々の抗菌薬、抗真菌剤、例えば、パラベン、クロロブタノール、フェノール、アスコルビン酸、及びチメロサール等によって達成することができる。多くのケースにおいて、それは、組成物中に、好ましくは、糖、マンニトール、ソルビトールのようなポリアルコール、塩化ナトリウムの等張剤を含有する。該組成物中に、例えば、モノステアリン酸アルミニウム及びゼラチン等の、吸収を遅延させる薬剤を含ませることにより、注射可能な組成物の長期間の吸収がもたらされる。
【0076】
粘膜投与のために、浸透されるバリアに適当な浸透剤が該組成物中に用いられる。このような浸透剤は一般に当業界において公知であり、例えば、粘膜投与、界面活性剤、胆汁酸塩、フシジン酸誘導体を含有する。粘膜投与は、鼻スプレー又は座薬を用いることにより達成される。
粘膜投与のために、該治療薬は、当業界で公知の軟膏剤、軟膏、ゲル又はクリームに製造される。該化合物は、座薬(例えば、ココアバター及び他のグリセリド等の通常の座薬基剤を用いた)、直腸配送のための貯留浣腸の形態で製造される。
【0077】
先に述べた製剤に加え、該治療薬はデポ製剤として製造される。このような長く作用する製剤は、移植(例えば、皮下又は筋肉内)又は筋肉内注射によって投与される。従って、例えば、該治療薬は、適切な高分子材料又は疎水性材料(例えば、受け入れられる油のエマルジョンとして)、又はイオン交換樹脂によって、又は、例えば、倹約して(sparingly)可溶塩としての可溶可溶塩誘導体として製剤化される。
【0078】
更に、該治療薬は、該治療薬を含有する固体重合体の半浸透性物質等の徐放薬システムを用いて配送される。徐放薬物質の種々の形態が確立されており、当業者に公知である。徐放性カプセルは、それらの化学的性質に依存し、治療薬を、数時間、数日、数週間、数ヶ月、100日間に渡り放出する。該治療薬の化学的性質及び生物学的安定性に依存し、安定化のための付加的な戦略が用いられる。
【0079】
本発明の治療薬が荷電した側鎖又は末端を含むと、それらは、上述した製剤において、遊離酸又は塩基又は薬学的に許容される塩として含まれる。薬学的に許容される塩は、遊離塩基の生物学的活性を実質的に保持し、無機酸との反応によって製造される。薬学的塩は、対応する遊離塩基の形態よりも、水及び他のプロトン性溶媒に可溶の経口がある。特定の実施態様においては、化合物は中性又は塩形態として製造される。薬学的に許容される塩は、塩酸、リン酸、酢酸、シュウ酸、酒石酸等から由来するアニオンで形成される塩、及びナトリウム、カリウム、アンモニウム、カルシウム、水酸化第二鉄、イソプロピルアミン、トリエチルアミン、2−エチルアミノエタノール、ヒスチジン、プロカイン等から由来するカチオンで形成される塩を含む。
【0080】
本発明の組成物は、一般に、意図する目的を達成するために効果的な量で用いられる。増殖性疾患を治療又は予防するための使用のために、該組成物の治療的に有効な量が、病気又は健康状態と関連する症状を回復又は予防し、過剰増殖する細胞の成長を阻害又は減少し、治療される患者の生存を延長するために投与される。特定の実施態様においては、過剰増殖する細胞の増殖及び/又は数が、約5%、約10%、約20%、約30%、約40%、約50%、約60%、約70%、約80%、約90%、約95%、約96%、約97%、約98%、約99%、又は約100%減少する。
【0081】
本明細書で用いられるように、「治療上有効な量」とは、治療薬、好ましくはパクリタクセルが細胞増殖、収縮、遊走、機能亢進を阻害するか、他の健康状態を述べるのに十分な量を意味する。治療上有効な量は、不利な効果の発生、及び細胞増殖、収縮、遊走、機能亢進と関連する症状を遅らせるか、最小化するのに十分治療薬の量を意味する。治療上有効な量は、再狭窄、狭窄症、乾癬、皮膚炎、肝臓硬化症、又は前立腺肥大症及び/又は増殖性疾患に関連する症状等の疾病の予防、治療又は管理に利益を与える治療薬の量を意味する。該治療上有効な量の決定は、特に、本明細書によって提供される詳細な開示に照らして、当業者の能力の範囲内である。
【0082】
特定の実施態様においては、該治療薬の治療上有効な量は細胞分裂停止の量であり、すなわち、G1/S期中の細胞の好ましくは大部分を静止させる量、又はアポトーシス細胞死を誘導しない量である。特定の実施態様においては、パクリタクセルの治療上有効な量とは、約0.001μg、約0.01μg、約0.1μg、約1μg、約5μg、約10μg、約15μg、約20μg、約25μg、約30μg、約35μg、約40μg、約45μg、約50μg、約60μg、約70μg、約80μg、約90μg、約100μg、約110μg、約120μg、約130μg、約140μg、約150μg、約200μg、約250μg、約300μg、約350μg、約400μg、約500μg、約600μg、約700μg、約800μg、約900μg、約1,000μg、約2,000μg及びそれ以上の治療薬である。好ましくは、パクリタクセルの治療上有効な量は、約50μg〜約200μgのパクリタクセルである。
【0083】
1つの実施態様においては、パクリタクセルの治療上有効な量は、平滑筋細胞の細胞周期のG1/S期における体組織(パクリタクセルにさらされる)の平滑筋細胞の大部分を静止させるのに有効な量である。放出されるパクリタクセルの量は、パクリタクセルにさらされる平滑筋細胞の少なくとも約5%、少なくとも約10%、少なくとも約15%、少なくとも約20%、少なくとも約25%、少なくとも約30%、少なくとも約35%、少なくとも約40%、少なくとも約45%、少なくとも約50%、少なくとも約55%、少なくとも約60%、少なくとも約65%、少なくとも約70%、少なくとも約75%、少なくとも約80%、少なくとも約90%、少なくとも約95%、少なくとも約96%、少なくとも約97%、少なくとも約98%、少なくとも約99%、又は約100%(全て)を静止させる。
【0084】
特定の実施態様においては、治療上有効な量とは、該細胞を、約0.0001ng/ml、約0.001ng/ml、約0.01ng/ml、約0.1ng/ml、約1.0ng/ml、約10ng/ml、約20ng/ml、約30ng/ml、約40ng/ml、約50ng/ml、約100ng/ml、約200ng/ml、約300ng/ml、約400ng/ml、約500ng/ml、約600ng/ml、約700ng/ml、約800ng/ml、約900ng/ml、約1,000ng/ml、約2,000ng/ml、約3,000ng/ml、約4,000ng/ml、約5,000ng/ml、約10,000ng/ml又はそれ以上の濃度の治療薬にさらされるようにするものである。該細胞は、約0.001ng/ml〜1,000ng/mlの濃度のパクリタクセルとさらされるのが好ましい。更に好ましくは、該細胞は、約0.01ng/ml〜1,000ng/ml濃度のパクリタクセルとさらされる。好ましくは、該細胞は、約60ng/ml〜約6,000ng/mlの濃度のパクリタクセルとさらされる。
【0085】
特定の実施態様においては、前記治療上有効な量から、該治療薬の約5%、約10%、約20%、約30%、約40%、約50%、約60%、約70%、約80%、約90%、約95%又はそれ以上の治療薬が、約30分、1時間、2時間、6時間、約12時間、約24時間、約2日、約3日、約4日、約5日、約6日、約1週間、約2週間、約3週間、約1ヶ月、約2ヶ月、約3ヶ月、約4ヶ月、約5ヶ月、約6ヶ月、約1年、約2年、約5年に渡り、放出される。好ましくは、治療上有効な量の約0.1%〜約35%が、約1週間〜約8週間放出されることである。更に好ましくは、治療上有効な量の約1%〜約15%が、約4週間以上放出されることである。
【0086】
投与される組成物の量は変化する。当業者は、疾病又は疾患の重傷度、以前の治療、一般的な健康及び/又は患者の年齢、もし、他の病気がある場合、投与方法及び処方した医師の判断を含むが限定されない、特定の因子が、患者を効果的に治療するのに要求される投与量に影響を及ぼすことを認める。治療は、単一の治療又は連続の治療である。症状が検出される間、又は症状が検出されなくたった時でも、治療は断続的に繰り返してよい。治療に用いられる核酸分子の有効投与量が、特定の治療の過程の間、上昇するか又は減少するかもしれないことが認識されるだろう。本明細書に記載されたように、投与量の変化が起こり、診断及び監視アッセイの結果から明らかとなる。
【0087】
全身の投与のために、治療上有効な投与量を、インビトロアッセイから最初に計算することができる。例えば、該投与量は、細胞培養において決定されたように、IC50を含む循環濃度範囲を達成するため、動物モデルにおいて定式化される。
最初の投与量は、インビボデータ、例えば、動物モデルから、当業界で公知の技術によって計算することができる。このような組成物の投与量は、好ましくは毒性わずかに有するか、有しない、ED50を含む循環濃度の範囲内にある。当業者は、動物のデータに基づき、容易にヒトの投与量を最適化することができる。
【0088】
投与量及び間隔は、治療効果を維持するのに十分なタンパク質の血漿中濃度を提供するため、個々に調整される。血漿中レベルは、例えば、高速液体クロマトグラフィーによって測定することができる。
注射による投与のための通常の患者の投与量は、約0.01〜30mg/kg/日、好ましくは約0.1〜10mg/kg/日、更に好ましくは0.1〜1mg/kg体重である。治療に有効な血清中濃度は、各々の日に、複数投与することによって達成される。該有効投与量は、インビトロ又は動物モデル試験システムから由来する用量反応曲線から推定される。
【0089】
いずれかの特定の患者及び健康状態のために投与経路及び投与量を最適化することができるので、記載された投与経路及び投与量はガイドとしてのみ意図される。
また、本発明は、必要な患者に、パクリタクセルからなるか、パクリタクセルでコーティング又は覆われている、該医療装置を挿入又は移植することによる、狭窄症、再狭窄又は平滑筋細胞増殖が関与する他の健康状態の治療又は予防方法を提供する。特定の実施態様においては、本発明は、平滑筋細胞、好ましくは血管性平滑筋細胞を含む身体管腔内へ挿入又は移植するために医療装置に関する。
【0090】
特定の実施態様においては、該医療装置は、コーティングの高分子材料に取り込まれた治療薬の特定の量又は割合を放出することができる。1つの実施態様においては、該医療装置は、タンパク質合成、DNA合成、紡錐糸形成、細胞増殖、細胞遊走、微小管形成、微小繊維形成、細胞外マトリックス合成、細胞外マトリックス分泌、又は細胞容積の上昇等の細胞の活性を阻害することのできる、治療薬の量を放出する。1つの実施態様においては、該放出量は、細胞代謝及び/又は細胞増殖の阻害及び/又は遊走を変化することができる。好ましくは、該細胞は、血管性平滑筋細胞、腫瘍細胞、間質細胞、血管性平滑筋細胞周囲の間質性マトリックス、又は免疫系エフェクター細胞である。1つの実施態様においては、放出される量は、細胞修復及びマトリックス生産を許容する。好ましくは、放出される量は細胞分裂を停止し、細胞を殺さないものである(アポトーシス又はネクローシス経路)。更に好ましくは、放出される量は、細胞を殺さずに、細胞周期のG1/S期において平滑筋細胞の大部分を静止することができる。
【0091】
(5.2.3併用療法)
本発明は、単独又は他の治療様式と組み合わせとしても有用である。本発明の医薬組成物及び医療装置は、過剰増殖細胞と関連する疾患又は健康状態の治療又は予防のための手術、標準及び実験的化学療法、ホルモン療法、生物学的療法、免疫療法、放射線療法、塞栓形成術及び/又は化学塞栓形成療法と共に、連続して又は同時に患者に施すことができる。
【0092】
本発明の医薬組成物及び医療装置は、また、治療薬と同じであるか又は異なる、さらなる治療薬と共に、連続して又は同時に患者に投与することができる。1つの実施態様においては、さらなる治療薬は、HERCEPTIN(登録商標)、RITUXAN(登録商標)、OVAREX(登録商標)、PANOREX(登録商標)、BEC2、IMC−C225、VITAXIN(登録商標)、CAMPATH(登録商標)I/H、スマートMI95、LYMPHOCIDE(登録商標)、スマートID10、ONCOLYM(登録商標)、リツキシマブ、ゲムツズマブ、トラスツズマブを含むが限定されない、抗体及び免疫調整剤等の1以上の免疫療法剤である。
【実施例】
【0093】
(6.実施例)
(6.1材料及び方法)
(6.1.1細胞系及び試薬)
ヒト大動脈平滑筋細胞(hSMC)は、キャンブレックス社(CC-2571、サンディエゴ、カリフォルニア)から購入した。細胞を、SmGM-2(登録商標)−平滑筋増殖培地-3(キャンブレックス社、サンディエゴ、カリフォルニア)中で培養した。ヒト白血病細胞系である、ジャーカット細胞を、アメリカンタイプカルチャーコレクション(マナッセス、バージニア)から得、コントロールとして提供した。パクリタクセルは、2つの形態、パクリタクセル(PTX)(Hauser, Boulder社)及びCremophor(登録商標)EL中のTaxol(登録商標)(ブリストルマイヤーズスクイブ社、プリンストン、ニュージャージー)を研究した。前者をエタノールに溶解し、使用液は新鮮なSmGM-2培地中で調製した。Taxol(登録商標)の使用は、細胞計測アッセイに限界があり、パクリタクセル及びタキソールは療法とも同等の効果がある。ドキソルビシン(DOX)(Adriamycin(登録商標))及び酢酸ミリスチン酸ホルボール(PMA)はシグマ(セントルイス、ミズーリ)から得、2mg/ml原液としてDMSOに溶解した。
【0094】
(6.1.2細胞増殖のためのMTTアッセイ)
96穴ウェルの平底プレートにウェルあたり2,000細胞を入れ、次いで、0.04〜100ng/mlの濃度でパクリタクセル(PTX)にさらした。3又は4日のいずれかの後に、5mg/mlのMTT(3,〔34,5−ジメチルチアゾール−2−イル〕−2,5−ジフェニルテトラゾリウムブロマイド、シグマ、セントルイス)を20μL、各ウェルに4時間加えた。培地を除去した後、170μLのジメチルスルホキシド(DMSO)を各ウェルに加え、MTTから形成したホルマザン結晶を溶解した。540nmの吸光度を、バイオキネティクスプレートリーダー(バイオテックインストラメント社、ウィヌースキ、バーモント)を用いて、既に開示したようにして(Giannakakou P.らの論文、低濃度のパクリタクセルは、核分裂停止の変わりに、細胞タイプ依存性p53、p21及びG1/G2停止を誘導する。パクリタクセルが誘導する細胞毒性の分子決定、Oncogene. 2001 Jun 28:20(29):3806-13)測定した。各条件について3つのウェルで試験を行い、標準偏差を求めた。PTX処理なしの細胞をコントロールとして供給した。
【0095】
(6.1.3細胞計測及び生存アッセイ)
1mlのSmGM-2(登録商標)培地中のヒト平滑筋細胞(104〜2×104細胞)を24穴ウェルに入れ、PTXで8時間まで処理を行った。PTXの能動は0.1〜5000ng/mlの範囲である。示されたインキュベーション時間の後に、細胞を0.25%トリプシン(ギブコBRL)による5分間のトリプシン処理によって細胞を集め、3つのウェルについて、コールターZ1細胞カウンター(Hialeah、フロリダ、米国)により計測した。PTX処理なしの細胞をコントロールとして供給した。更に、細胞をトリパンブルーと共にインキュベーションし、青い(死んだ)細胞及び透明な(生きている)細胞を、血球計算版中で計測した。データは、溶媒のみ(示された時間ポイント)又は時間=0である、コントロールに関して、生きている細胞の割合として報告した。hSMC増殖におけるパクリタクセルの効果を研究するための以下の調査において、hSMC増殖の最大に近い阻害を扱う、8日間、2及び12ng/mlのPTX濃度を用いた。
【0096】
(6.1.4細胞周期解析のためのフローサイトメトリー)
ヒト平滑筋細胞を、2、6、12及び60ng/ml濃度のPTXに、2日間さらした。次いで、細胞をトリプシン処理によって集め、PBSで洗浄し、PBS中の75%エタノールに再懸濁し、4℃に少なくとも30分間維持した。解析前に、細胞を再びPBSで洗浄し、再懸濁して、以前に開示したように(Giannakakou P.らの論文、低濃度のパクリタクセルは、核分裂停止の変わりに、細胞タイプ依存性p53、p21及びG1/G2停止を誘導する。パクリタクセルが誘導する細胞毒性の分子決定、Oncogene. 2001 Jun 28:20(29):3806-13)、1mg/mlのRNAseA及び0.05mg/mlヨウ化プロピジウム(シグマ社、セントルイス)を含むヨウ化プロピジウム染色溶液中で30分間インキュベートした。次いで懸濁液を、ベクトンディキンソン社FACScanで解析した。
【0097】
DNA含有量は、FACScanフローサイトメーター(ベクトンディキンソン社、免疫細胞数測定システム、サンホセ、コスタリカ)を用いて測定した。細胞周期に関する細胞の割合を計算するために、DNA含有量ヒストグラムをマルチサイクルソフトウェア(フェニックスフローシステム、サンディエゴ、カリフォルニア)を用いて脱重畳積した。
【0098】
(6.1.5細胞周期及びアポトーシスマーカーのイムノブロット解析)
先に記載したように(Blagosklonny M.V.らの論文、有糸分裂促進剤が活性化するプロテインキナーゼ経路は、微小管が活性化する、薬物が誘導するRaf-1/Bc-2リン酸化及び白血病におけるアポトーシスに必要ではない。Leukemia 1999;13:1028-1036)、細胞を溶解し、可溶性タンパク質を、プロテアーゼ阻害剤を含有するTNES緩衝液(50mMトリス塩酸pH7.5、100mM NaCl, 2mM EDTA,1mM オルトバナジン酸ナトリウム及び1%(V/V)NP40、シグマ、セントルイス、ミズーリ)に集めた。タンパク質を、製造者の説明書に従い、MOPSランニングバッファー(ノベックス、サンディエゴ、カリフォルニア)を有するSDS-PAGE又はNuPAGE4〜12%ビス−トリスゲルに溶解した。イムノブロッティングは、ウサギポリクローナル抗−PARP及びモノクローナルマウス抗−キャスパーゼ−9(アップステートバイオテクノロジー、レークプラシッド、ニューヨーク)、モノクローナルマウス抗−p21及び抗−p53(オンコジーンリサーチ、カルビオケム)、モノクローナルマウス抗ヒトチューブリン及びアクチン(シグマ、セントルイス、ミズーリ)、モノクローナルマウス抗−ヒトキャスパーゼ−8(ファーミンゲン、サンジエゴ、カリフォルニア)及びキャスパーゼ3(トランスダクションラボラトリーズ、レキシントン、ケンタッキー)、89KDa切断されたPARP断片に対するポリクローナル抗体(プロメガ、マジソン、ウィスコンシン)、及び抗−GAPDH抗体(シグマ、セントルイス)を用いて、等量の積載を確認して用いた。p53の強力なインデューサーである、ドキソルビシン(DOX)を陽性コントロールとして用いた。ホルボール12−ミリステート13−アセテート(PMA)(シグマ、セントルイス、ミズーリ)を、p53誘導の陰性コントロールとして用いた。
【0099】
(6.1.6分裂指数)
該細胞を2、6、12及び60mg/mlのPTXと2日間インキュベートした。次いで、先に記載されたように(An W.Gらの論文、プロテアーゼ阻害剤が誘導するアポトーシス:wtp53、p21WAF1/CIP1の蓄積、及びアポトーシスの誘導は、プロテアソーム阻害の非依存性マーカーである。Leukemia. 2000 Jul;14(7):1276-83)、該細胞をトリプシン処理し、PBSで洗浄し、細胞遠心機中のスライドグラスにペレット化し、90%エタノール/10%氷酢酸で固定し、DAPI(4,6−ジアミジノ−2−フェニルインドール、モレキュラーブローブス、オイゲン、オレゴン)で染色した。停止期及び有糸分裂期における細胞を確認するために、UV顕微鏡により、核を可視化した。
【0100】
(6.1.7該細胞及び核の形態)
hSMCの形態を解析するため、該細胞を2、6及び60ng/mのPTXで21日までインキュベートした。該細胞を細胞遠心し、食塩加リン酸緩衝液(PBS)中の1%ホルムアルデヒドで固定し、PBS中の1g/mlのDAPI(モレキュラープローブス、ユージーン、オレゴン)及び20μg/mlのスルホロダミン101(モレキュラープローブス)で染色し、UV顕微鏡(ニコンマイクロフォト顕微鏡)の下で、hSMCの典型的な紡錘型形態及び核の形態におけるPTXの影響を決定するため、MN細胞について検査した。また、DNAをローダミン(赤)で、細胞質タンパク質をFITC(緑)で染色した。該細胞を、レーザー−スキャンニングサイトメーター(LSC)、顕微鏡をベースとするサイトフルオロメーターを用いて、赤(核)及び緑(細胞質)で可視化した。画像は、顕微鏡スライド上の蛍光化された細胞から放射されるレーザー励起された蛍光の中で捉えられた。
【0101】
(6.2結果)
(6.2.1PTXによるSMCの増殖の阻害)
MTT及びセルカウンティングアッセイを用いて、PTXの1ng/mlのように低い濃度で、媒体コントロールの60%までhSMCの増殖を5日まで阻害した(図1A及び1B)。2種の異なるPTXの製剤(エタノール中のPTX及びCremophor(登録商標)EL中のTaxol(登録商標))で、同一の結果が得られた(図1A)。PTXによるhSMCの成長阻害は、12ng/ml(低濃度)まで濃度に依存的であり、5000ng/mlまで付加的な阻害は生じなかった。
【0102】
それに続く、2及び12ng/mlのPTXを用いた8日の研究において、細胞増殖は、コントロールと対比して12ng/mlで完全に遮断された。トリパン−ブルー染色によって細胞死は観察されず、一定に残存する細胞の数は、PTXがhSMCの増殖を停止するが細胞を殺さないことを示す。
【0103】
(6.2.2パクリタクセルによるSMCにおける主要なG1静止の誘導)
コントロールの未処理hSMCにおけるDNAのDAPI染色は、有糸分裂像(細胞の1〜3%、図2A、上段)を有する正常な停止期核(97〜99%)を示し、MN細胞を示さない。12ng/mlPTXの2日間の存在において、有糸核分裂細胞が形成され、丸くなり、プラスチックから剥離する。しかし、次いで、前記細胞の再付着は、有糸分裂の存在を示し、上記細胞の30〜40%はMNであった(図2A、下段)。
【0104】
低濃度のPTXでのSMCにおける腫瘍なG1静止は、2及び12ng/ml(図2)におけるフローサイトメトリーによって証明され、ここで最大の増殖阻害は達成された(図1)。高濃度(60ng/ml)のPTXにおいて、フローサイトメトリーによって測定されるような4Cピークにおける上昇があった。このピークは、G2/M静止又はMN細胞後有糸分裂の存在の形成のいずれかを示す。G1で静止する細胞の大きな集団があり、細胞周期分布が、見たところ落ち着いていることを考えると、フローサイトメトリーのピークは、細胞がMNであって、G2で静止しているのではないことを示す(図2B)。
【0105】
(6.2.3PTXが誘導する2C及び4CMN細胞)
低い(6ng/ml)又は高い濃度(60ng/ml)のPTX、MN細胞の同じ割合及び4C細胞の広く異なる割合による処理が観察された(図3)。60ng/mlのPTX濃度において、4C DNA細胞(フローサイトメトリーによる)及びMN細胞(核染色による)の割合は一致し、細胞質分裂なしで、SMCにMN 4CDNA細胞を形成するための有糸分裂が存在する。6ng/mlのPTXによる処理の後、MN細胞は2CDNA含有量を有し、細胞分裂を示す。異常な有糸分裂の間、MN細胞が4C細胞からのみ形成されることを考えると、これは、細胞が分裂し、図3Bに示すように、2CDNA含有量及び多核形態を導くことを示す。微小核(青い矢印)はDNA(赤い矢印)を引き、2CDNA(正常DNA含有量)MN細胞を形成する。娘細胞中のDNA含有量は、各娘細胞(2N±)のわずかに2C以上又は2C未満であり得た。次のPTX(図2及び3)により処理されたフローサイトメトリー2CDNAピークで観察された拡大は、細胞分裂の間、染色体の偏在による。
【0106】
(6.2.4PTXへの露出後の正常なSMCの形態の維持)
SMCは、光学顕微鏡下で見られるように、伸張した突起を有する、典型的な紡錘状形態を有している。PTX処理は、SMC細胞の外観を変化させないが、いくつかの細胞は、以下の3日間のPTX処理PTX処理を検出する(図3A、60ng/mlPTX)。高い拡大率の下、上記細胞の核の解析は、60〜70%の細胞が間期で静止し、30〜40%の細胞がMNであり、有糸分裂停止の後に有糸分裂が出て行くことを示す。微小核は、細胞の細胞形質小体内に分布していた(図3B).試験した最も低い濃度のPTX(2ng/ml)は、浅裂の核の出現を引き起こし、それは、有糸分裂の機能障害の現れである。
【0107】
(6.2.5PTXによるp53及びp21の誘導)
高濃度のPTXによる処理の1日後に、hSMCで処理したPTXにおいて、p53及びp21のレベルの濃度依存的上昇が見られた(図5)。最も高い濃度、20及び60ng/mlのPTXにより検出レベルは、p53及びp21の誘導のための陽性コントロールである、400ng/mlのドキソルビシンで見られるのと同じである。p21が、G1/S移行に必要である、サイクリン依存的キナーゼ(ddks)を阻害することを考えると、この発見は、PTXによるhSMCのG1停止のための陽性メカニズムとしてのp21−が媒介するcdksの阻害を示唆する。
【0108】
(6.2.6PTXへのSMCの後露出におけるアポトーシスの欠如)
有糸分裂の間に静止する長く伸びた細胞はアポトーシスを誘導する。我々の研究において示されるMN細胞の存在は、成功した有糸分裂を表し、アポトーシス回避の標識である。hSMC中のアポトーシスの欠如は、PTX処理の2日後でさえ、PARP及びキャスパーゼ-3、-9、-8の切断の欠如により更に確認された。PARPの切断、及びキャスパーゼ3、8、9の活性は、アポトーシス細胞を表す。12ng/mlのPTXで16時間処理された、コントロールのジャーカット細胞は、キャスパーゼ-3、-8及び-9バンドの消失(活性)、及びPARPの切断、85kDa断片の出現を示した(図6)。それと比較し、SMCは低レベルのキャスパーゼを表した。この発見は、300ng/mlのような高濃度のPTXへの持続した露出がhSMCのアポトーシスを生じないことを更に確認した。
【0109】
(6.2.7SMCの長期生存)
60mg/mlのPTXで21日処理した後、SMC細胞は生存可能であり、プラスチックに付着した(図7)。短時間の処理で見られる数と比較し、MN細胞又は2Cのいずれの数に変化はなかった(図2及び3)。細胞培養の解析は、ほとんどの細胞が2CDNA含量を有することを示す(図7)。
【0110】
(6.3考察)
アポトーシス細胞死は、PTXを含む、いくつかの抗腫瘍性薬剤についての細胞性阻害の主要なメカニズムであると考えられる。しかし、特定の腫瘍細胞系において、PTXはアポトーシスを引き起こさないが、むしろ、細胞のタイプ及びパクリタクセルの濃度に依存するいくつかの他のメカニズムによって増殖を阻害する(Giannakakouらの論文、上記2001;Panvichian R.らの論文、パクリタクセルの関連するマルチ微小核形成は、キャスパーゼの活性の阻害によって可能となる:薬剤耐性における可能な早い段階、Cancer Res.1998 Oct 15;58(29):4667-72;Merlin J.L.らの論文、パクリタクセルに対する耐性は、時間遅延多核形成及びMCF−7ヒト胸部腺がん細胞における大きな断片への断片化、Anticancer Drugs. 2000 Apr;11(4):295-302;Broker L.E.らの論文、アポトーシス経路の遅い活性化は、非小細胞肺ガンにおけるディスコダーモリド及びエポチロンBの細胞毒性効果を媒介するごくわずかな役割を果たす、Cancer Res. 2002 Jul 15;62(14):4081-8;Bragosklonny M.V.らの論文、上述、2002;Roberts J.R.らの論文、インビトロにおける、タキソールに耐性のあるヒト白血病細胞における倍数体化の開発、Cancer Res. 1990 Feb 1;50(3):710-6;Weitzel D.H.らの論文、ヒト肺腺ガン細胞における差異のある紡錘状組み立てチェックポイント反応、Cell Tissue Res. 2000 Apr;300(1):57-65;Lanzi C.らの論文、前立腺ガン細胞におけるパクリタクセルに対する細胞周期チェックポイント効率及び細胞性応答、Prostate.2001 Sep 15;48(4):254-64)。この研究は、1,000ng/mlのような高濃度におけるPTXが、細胞死を引き起こさずにSMCの増殖を阻害することを証明した。この、細胞毒性の欠如は、この高濃度のPTXがチューブリン重合を引き起こすけれども、hSMCが、1μg/mlのPTXと8日間インキュベーションした後に生存可能であるという、以前に公開された結果と同じである(Axelらの論文、局所性薬物送達を用いた、インビボにおける動脈平滑筋細胞増殖及び遊走、Circulation 1997;96:636-645)。
【0111】
最近の研究において、局所にステントをベースとする配送に関連するPTXの投与量によって引き起こされるhSMCの増殖阻害の詳細なメカニズムが研究された。PTXに曝された後、hSMCは一時的な有糸分裂停止を起こし、有糸分裂から離れ、生存可能なMN細胞を形成し、処理の21日後に生存可能性が残存している。該細胞培養物は、2種のタイプの細胞:第二の有糸分裂後の停止と一致するMN細胞、及び一つの核が主要なG1静止と一致する、2CDNAを有する大きな集団(図2及び3)を誘導する。該PTXは、また、hSMC中のp53及びp21を誘導する。P21の誘導は、微小管機能障害によって引き起こされるG1静止に必須であり(Cross S.M.らの論文、p53に依存的なマウス紡錘状チェックポイント、Science. 1995 Mar 3;267(5202):1353-6;Lanni J.S.らの論文、紡錘体の破壊に続く、p53に依存的な油脂分裂後のチェックポイントの特徴づけ、Mol Cell Biol. 1998 Feb;18(2):1055-64;Mantel C.R.らの論文、P21waf-1-Chk1経路はG1期微小管統合性を観察し、制限ポイント移行に重要である、Cell Cycle. 2002 Sep-Oct;1(5):327-36)。更に、p21は、有糸分裂から出ることを加速するのと同様(Barboule N.らの論文、MCF-7胸部腺ガン細胞系におけるパクリタクセル処理後の有糸分裂から出ることにおけるP21の関与、Oncogene. 1997 Dec 4;15(23):2867-75)、有糸分裂に入ることを阻害することによって細胞を保護する(Li W.らの論文、p21(waf1)の過剰発現は、G2-M停止を減少し、P53及び機能的Rbタンパク質の欠乏によるヒト肉腫細胞においてパクリタクセルによってアポトーシスが誘導される、Mol Pharmacol. 1999 Jun;55(6):1088-93)。本研究に見られるように、有糸分裂から出て、第一の及び第二のG1静止は、PTXが誘導するアポトーシスに対するhSMCの耐性を説明し得るものである。
【0112】
ジャーカット細胞等のアポトーシスを起こしやすい細胞において、PTXは、キャスパーゼ-9、キャスパーゼ-3、及びキャスパーゼ-8の活性化、及びPARPの切断、アポトーシスのマーカーを引き起こす(図6)。対照的に、PTXはhSMC中でアポトーシスを誘導しなかった。この発見は、2つのメカニズムにより説明することができる。第一に、恒常的に低レベルのプロ−キャスパーゼを発現するため、hSMCはアポトーシスを起こさない。第二に、長期間の有糸分裂の停止がアポトーシスを誘導するので、本研究で示された有糸分裂を出ること、及び第二のG1静止がアポトーシスを起こすことを防止する。同じ現象は、キャスパーゼ阻害剤である、PTX及びz-VAD-fmkを同時に処理したHeLa細胞中で証明され、PTX耐性、キャスパーゼ活性の欠如、及びMN現象の関係が確立された(Panvichian R.らの論文、PTXと関連するマルチ微小核形成は、キャスパーゼ活性の阻害によって可能となる:薬剤耐性における可能な早期段階、Cancer Res 1998;58:4667-4672;Roberts J.R.らの論文、インビトロにおける、タキソール耐性ヒト白血病細胞中の倍数体化、Cancer Res 1990;50:710-716;Weitzel D.H.らの論文、ヒト肺腺ガン細胞における差異のある紡錘状組み立てチェックポイント反応、Cell Tissue Res. 2000 Apr;300:57-65;Lanzi C.らの論文、前立腺ガン細胞におけるパクリタクセルに対する細胞周期チェックポイント効率及び細胞性応答、Prostate.2001 Sep 15;48:254-64)。従って、低いキャスパーゼレベルを有する、hSMCが有糸分裂停止を克服し、続くPTX処理後にアポトーシスを起こさないことは驚くことではない。
【0113】
染色体分離なしで、細胞が有糸分裂から出る時、それらは染色体の各グループの周りに核膜を形成し、微小核として表される。PTXで処理された後に得られるMN細胞が、DNA(4C)の四倍体量を含有することが本研究によって確立された。種々のPTX濃度における2C、4C及びMN細胞の分布を研究する時、我々は興味のある現象を観察した。MN細胞は、低濃度(6ng/ml)及び高濃度(60ng/ml)のPTX、いずれによっても生産されるが、高濃度のみが4C細胞を産生した。低濃度PTXにおいては、大部分のMN細胞が2CDNAを有する。これは、適当な染色体分離がなくても、細胞が分裂されることを示唆する。これは、2CDNA及びマルチ微小核形態を誘導する。細胞が、遺伝子及び染色体の2つのコピーを有することを考えると、1つのコピーの欠失又は獲得は、細胞の生存に影響を及ぼさない。
【0114】
DNA含量の増加は、静止SMC中で自然に起こり(Hixon M.L.の論文、血管平滑筋倍数体化:有糸分裂チェックポイントから高血圧、Cell Cycle 2003;2:105-110)、細胞死又は腫瘍のいずれをも引き起こさない。最終分化心筋細胞、非最終分化肝細胞、及び平滑筋細胞等の種々のタイプの細胞の肥大において、倍数性は通常に見られる(Devlin A.M.らの論文、発作誘発性の自発的な高血圧症ラットにおける、平滑筋細胞倍数性についてのペリンドプリルの影響、J Hypertens 1995;13:211-218; Engelmann G.らの論文、自発性高血圧症ラットから分離した心筋細胞における、倍数性のレベル及び生化学的パラメーターの年齢と関連する変化、Circ Res 1986;58:137-147;Brodsky W.らの論文、細胞の倍数性:組織成長及び機能の関係、Int Rev Cytol 1977;50:275-332;Owens G.K.の論文、血管平滑筋の過形成性増殖に対する肥大症の調整、Am J Physiol. 1989;257:H1755-H1765)。患者の年齢に依存するhSMC集団の1〜7%の範囲のヒト動脈壁平滑筋細胞における倍数性、Proc Natl Acad Sci USA 1983;80:882-885)。倍数性は、酵母中で遺伝子発現の変化を誘導する(Galitski T.らの論文、遺伝子発現の倍数性制御、Science 1999;285:251-254)が、倍数性の機能的重要性はhSMC中では知られていない。この分野におけるさらなる研究は、hSMC中の倍数性の重要性の良好な理解に寄与するだろう。
【0115】
(6.4結論)
インビトロにおける研究は、パクリタクセルが、アポトーシスを誘導せずに、hSMCの増殖を効率的に阻害することを証明した。また、試験を行った全ての濃度におけるパクリタクセルが、hSMCにおいて初期及び有糸分裂後のG1停止を起こすことを初めて見出した。細胞は、21日までのパクリタクセルへの露出後であっても生存可能性を維持した。これらの知見の全ては、抗狭窄症薬の配送をベースとするステントと関連する濃度において、パクリタクセルが細胞よりも、むしろ細胞分裂停止であることを示唆する。
【0116】
(7.実施例)
(7.1方法)
異なる長さ(16mm及び32mm)のステントを、ステント表面積mm2当り、1μgのパクリタクセルをコーティングした。タイプ1のステントは、8.8重量%のパクリタクセル、及び91.2重量%のスチレン−イソブチレン共重合体からなるコーティングを有していた。タイプ2のステントは、25重量%のパクリタクセル、及び75重量%のスチレン−イソブチレン共重合体からなるコーティングを有していた。
ステントを、リン酸緩衝された放出媒体中でインキュベートし、ステントから放出され、蓄積されたパクリタクセルの量を、2、4、7及び10日目に、HPLC法を用いて測定した。
【0117】
(7.2結果)
2、4、7及び10日目に測定された、媒体中に放出されたパクリタクセルの量を、表1及び3に示す。
2、4、7及び10日目に測定された、放出されたパクリタクセルの割合を、下記式を用いて計算し、表2及び4に示す。
放出されたPTX蓄積割合=放出されたPTX蓄積/積載した量
【0118】
【表1】

【0119】
【表2】

【0120】
【表3】

【0121】
【表4】

【0122】
(8.同等物)
本発明は、本発明の個々の側面の単一の例示によって意図される、特定の実施態様による範囲に限定されるべきでなく、機能的に同等な方法及び成分は本発明の範囲内である。実際は、本発明の種々の修飾は、本明細書に示され、記載された修飾に加え、おきまりの実験を用いることなく、上述した記載及び付随した図面から当業者に明らかであろう。このような修飾及び同等物は、添付した請求の範囲の範囲内であることが意図される。
あたかも各々の個々の刊行、特許または特許出願が、特に、そして、個々に、本願明細書に引用したものとすることを示されるかのように、刊行物、特許および特許出願がこの明細書において言及した全ては同じ範囲に本願明細書において引用したものとする。
本明細書における文献の引用または考察は、それらが本発明に対する先行技術であることの承認として、解釈されてはならない。
【図面の簡単な説明】
【0123】
【図1】ヒト動脈SMC増殖に関するPTXの影響 図1A ヒト動脈平滑筋細胞(hSMC)を、表示された濃度(0.001〜10,000ng/ml)のパクリタクセル(PTX)又はTaxol(登録商標)で5日間処理し、次いで計測した。結果は、未処理のコントロール細胞で得られた値の割合として計算された。 図1B ヒト動脈平滑筋細胞を、表示された濃度のPTXと3及び4日間処理した。MTT(3−(4,5−ジメチルチアゾール−2−イル)−2,5−ジフェニルテトラゾリウムブロマイド)細胞増殖アッセイを、セクション6に記載されたようにして行った。結果は、未処理細胞で得られた値の割合として計算され、平均±標準偏差(SD)で表した。 図1C ヒト平滑筋細胞を、2又は12ng/mlのPTXとインキュベートするか、又は未処理のまま残した(コントロール)。表示された日に、コントロールに対する生存細胞の割合を、セクション6の方法によって、トリパンブルー排除を用いて計算した。
【図2】静止期細胞、有糸分裂細胞(M)、マルチ各形成(MN)細胞及びDNA分布 ヒト平滑筋細胞を、表示したように、0、2、12、60ng/mlのPTXで2日間処理し、DAPI(4’−6−ジアミジノ−2−フェニルインドール)染色(図2A)及びフローサイトメトリー(図2B)を、セクション6の方法に記載されたように行った。
【図3】PTX処理後のhSMCの細胞及び核の形態 ヒト平滑筋細胞をスライド上で培養し、表示された濃度のPTX(6ng/ml、60ng/ml、又は未処理)で処理した。24時間後、細胞を固定し、セクション6の方法に記載されたように、核(赤/黄)及び細胞質(緑)を染色した(ローダミン/FITC)。顕微鏡写真は、処理していない細胞における正常平滑筋細胞の形態、及び6及び60ng/mlのパクリタクセルで処理した細胞を示す。図3B 核の画像は、パクリタクセル処理を行っていない正常な核、及び6及び60ng/mlのパクリタクセルで処理したマルチ核を示す。 図3C 2週間後、フローサイトメトリー(DNA含量)及びDAPI染色により細胞を解析した。
【図4】分裂するMN細胞のDNA ヒト平滑筋細胞をスライド上で培養し、6ng/mlのPTXで処理した。1日後、細胞を固定し、DNAを、方法に記載したように染色した(赤)。核の写真は200倍である。
【図5】p53及びp21レベル上のPTXの影響 ヒト平滑筋細胞を、表示された濃度のPTX、400ng/mlのドキソルビシン(DOX)(陽性コントロール)、又は100ng/mlのホルボール12−ミリステート13−アセテート(PMA)(p53についての陰性コントロール)と処理した。24時間後、細胞を溶解し、p21及びp53をフラクション6に記載されたような免疫ブロットにより決定した(p53について、上の及び第二のパネルは、異なったフィルム露出時間を有する同様なブロットである)。
【図6】キャスパーゼ切断におけるPTXの影響(アポトーシス) ヒト平滑筋細胞及びジャーカット細胞を、表示された濃度のPTXとインキュベートした。16及び48時間後、ジャーカット細胞及びヒト平滑筋細胞(それぞれ)を溶解し、ポリ(ADP−リボース)ポリメラーゼ(PARP)、PARP89kDaフラグメント、プロキャスパーゼ−8,−9及び−3を、セクション6の方法に記載された免疫ブロットにより同定した。グリセルアルデヒドホスフェートデヒドロゲナーゼ(GAPDH)免疫ブロット解析及びゲル染色を積載したコントロールとして実施した。
【図7】SMCの長期生存 ヒト平滑筋細胞を、60ng/mlのPTXと21日間インキュベートし、核染色(上のパネル)及びフローサイトメトリー(下のパネル)により解析した。
【図8】PTX露出後のSMCの運命 図8A 細胞周期停止のポイント。全てのヒト平滑筋細胞を、最終的にG1で静止した。G1においてPTX露出した時のヒト平滑筋細胞を、G1で静止させた(初期G1静止)。全ての多のヒト平滑筋細胞は、細胞周期を続け有糸分裂に入る。以上な有糸分裂を出た後、マルチ核形成したヒト平滑筋細胞をG1で静止させた。 図8B 有糸分裂の後に出て、ヒト平滑筋細胞は、PTX濃度に依存し、2C(正常)細胞、2Cマルチ核形成又は単一の核細胞又はマルチ各形成4C細胞を形成した。
【特許請求の範囲】
【請求項1】
平滑筋細胞を有する体管腔に移植するための医療装置であって、表面及び該表面に配置されたコーティングを含み、該コーティングはパクリタクセルを取り込む高分子材料を含み;かつ平滑筋細胞の細胞周期のG1/S期における、該パクリタクセルに曝された体管腔の平滑筋細胞を静止するのに効果的な量の高分子材料中に取り込まれたパクリタクセルを放出し得る、前記医療装置。
【請求項2】
平滑筋細胞の約90%〜約100%が、G1/S期で静止する、請求項1に記載の医療装置。
【請求項3】
高分子材料に取り込まれたパクリタクセルの量が、該表面の表面積mm2当り、約0.5μg〜約5μgである、請求項1に記載の医療装置。
【請求項4】
高分子材料に取り込まれたパクリタクセルの量が、該表面の表面積cm2当り、約1μgである、請求項3に記載の医療装置。
【請求項5】
放出されたパクリタクセルの量が、該細胞を約0.001ng/ml〜約10,000ng/mlの濃度にさらすものである、請求項1に記載の医療装置。
【請求項6】
放出されたパクリタクセルの量が、該細胞を約0.01ng/ml〜約1,000ng/mlの濃度にさらすものである、請求項5に記載の医療装置。
【請求項7】
放出されたパクリタクセルの量が、該細胞を約60ng/ml〜約6,000ng/mlの濃度にさらすものである、請求項5に記載の医療装置。
【請求項8】
高分子材料が生物学的に安定である、請求項1に記載の医療装置。
【請求項9】
高分子材料が、スチレン−イソブチレン共重合体を含む、請求項1に記載の医療装置。
【請求項10】
ステントである、請求項1に記載の医療装置。
【請求項11】
高分子材料が、生物学的に活性な物質を更に含有する、請求項1に記載の医療装置。
【請求項12】
請求項1に記載の医療装置を患者に挿入又は移植することを含む、狭窄症又は再狭窄の治療方法。
【請求項13】
平滑筋細胞を含む、体管腔に移植するための医療装置であって、該医療装置は表面及び該表面に配置されたコーティングを有し、該コーティングが、パクリタクセルを取り込んだ高分子材料を含み、該コーティングが、該表面の表面積mm2に当り、約0.001μg〜約20μgの高分子材料に取り込まれたパクリタクセルを、約1週間〜約8週間に渡り放出し得る、前記医療装置。
【請求項14】
該コーティングが、該表面の表面積mm当り、約0.01μg〜約0.1μgの高分子材料に取り込まれたパクリタクセルを、約4週間に渡り放出し得る、請求項13に記載の医療装置。
【請求項15】
該コーティングから放出されるパクリタクセルの量が、細胞周期のG1/S期においてパクリタクセルにさらされた平滑筋細胞を静止するのに効果的なものである、請求項13に記載の医療装置。
【請求項16】
約90%〜約100%の平滑筋細胞がG1/S期で静止する、請求項15に記載の医療装置。
【請求項17】
高分子材料に取り込まれたパクリタクセルの量が、該表面の表面積mm当り、約0.5μg〜約5μgである、請求項13に記載の医療装置。
【請求項18】
高分子材料に取り込まれたパクリタクセルの量が、該表面の表面積cm当り、約1μgである、請求項17に記載の医療装置。
【請求項19】
放出されるパクリタクセルの量が、該細胞を約0.001ng/ml〜約10,000ng/mlのパクルタクセル濃度にさらすものである、請求項13に記載の医療装置。
【請求項20】
放出されるパクリタクセルの量が、該細胞を約0.01ng/ml〜約1,000ng/mlのパクルタクセル濃度に曝すものである、請求項19に記載の医療装置。
【請求項21】
放出されるパクリタクセルの量が、該細胞を約60ng/ml〜約6,000ng/mlのパクルタクセル濃度にさらすものである、請求項19に記載の医療装置。
【請求項22】
高分子材料が生物学的に安定である、請求項13に記載の医療装置。
【請求項23】
高分子材料が、スチレン−イソブチレン共重合体を含む、請求項13に記載の医療装置。
【請求項24】
ステントである、請求項13に記載の医療装置。
【請求項25】
高分子材料が、さらに生物学的に活性な物質を含む、請求項13に記載の医療装置。
【請求項26】
請求項13に記載の医療装置を患者に挿入又は移植することを含む、狭窄症又は再狭窄の治療方法。
【請求項27】
平滑筋細胞を含む体管腔に移植するための医療装置であって、該表面及び該表面に配置されたコーティングを有し;
該コーティングが、パクリタクセルの特定量を取り込んだ高分子材料を含み;
該コーティングが、高分子材料に取り込まれたパクリタクセルの特定量の約0.1%〜約35%を、約1週間〜約8週間に渡り放出し得る、前記医療装置。
【請求項28】
該コーティングが、高分子材料に取り込まれたパクリタクセルの特定量の約1%〜約15%を、約4週間に渡り放出し得る、請求項27に記載の医療装置。
【請求項29】
該コーティングから放出されるパクリタクセルの量が、細胞周期のG1/S期においてパクリタクセルに平滑筋細胞を静止するのに効果的なものである、請求項27に記載の医療装置。
【請求項30】
平滑筋細胞の約90%〜約100%が、細胞周期のG1/S期で静止する、請求項29に記載の医療装置。
【請求項31】
高分子材料に取り込まれたパクリタクセルの量が、該表面の表面積mm当り、約0.5μg〜約5μgである、請求項27に記載の医療装置。
【請求項32】
高分子材料に取り込まれたパクリタクセルの量が、該表面の表面積cm当り、約1μgである、請求項31に記載の医療装置。
【請求項33】
放出されるパクリタクセルの量が、該細胞を約0.001ng/ml〜約10,000ng/mlのパクルタクセル濃度にさらすものである、請求項27に記載の医療装置。
【請求項34】
放出されるパクリタクセルの量が、約0.01ng/ml〜約1,000ng/mlのパクルタクセル濃度にさらすものである、請求項33に記載の医療装置。
【請求項35】
放出されるパクリタクセルの量が、約60ng/ml〜約6,000ng/mlのパクルタクセル濃度にさらすものである、請求項33に記載の医療装置。
【請求項36】
高分子材料が生物学的に安定である、請求項27に記載の医療装置。
【請求項37】
高分子材料が、スチレン−イソブチレン共重合体を含む、請求項27に記載の医療装置。
【請求項38】
ステントである、請求項27に記載の医療装置。
【請求項39】
高分子材料が、さらに生物学的に活性な物質を含む、請求項27に記載の医療装置。
【請求項40】
請求項27に記載の医療装置を患者に挿入又は移植することを含む、狭窄症又は再狭窄の治療方法。
【請求項41】
平滑筋細胞を含む患者の体管腔に、パクリタクセルの治療的有効量を投与することを含む、患者における増殖性疾患の治療方法であって、
パクリタクセルの該治療的有効量が、細胞周期のG1/S期における体管腔の平滑筋細胞を静止するのに有効な量である、前記治療方法。
【請求項42】
平滑筋細胞の約90%〜約100%が、細胞周期のG1/S期で静止する、請求項41に記載の治療方法
【請求項43】
パクリタクセルの治療的有効量が、該細胞を約0.001ng/ml〜約10,000ng/mlのパクルタクセル濃度にさらすものである、請求項41に記載の治療方法。
【請求項44】
放出されるパクリタクセルの量が、該細胞を約0.01ng/ml〜約1,000ng/mlのパクルタクセル濃度にさらすものである、請求項43に記載の治療方法。
【請求項45】
放出されるパクリタクセルの量が、該細胞を約60ng/ml〜約6,000ng/mlのパクルタクセル濃度にさらすものである、請求項43に記載の治療方法。
【請求項46】
上記増殖性疾患が、再狭窄、狭窄症、乾癬、皮膚炎、肝臓硬化症又は前立腺肥大症である、請求項41に記載の治療方法。
【請求項47】
該パクリタクセルが、非経口的、皮下、筋肉内、眼窩内、関節内、脊髄内、胸骨内、静脈内、皮内、腹腔内、門脈内、動脈内、くも膜下腔内、関節内、経粘膜、胸膜内、経皮、局所、硬膜外、粘膜、鼻腔内注射又は注入、又は経口、吸入、肺又は直腸投与によって患者に投与される、請求項41に記載の治療方法。
【請求項48】
約0.001ng/ml〜約10,000ng/mlの濃度のパクリタクセルに該細胞に、さらすことを含む、G1/S期における平滑筋細胞を静止させる方法。
【請求項49】
前記細胞を、約0.01ng/ml〜約1,000ng/mlの濃度のパクリタクセルにさらす、請求項48に記載の方法。
【請求項50】
前記細胞を、約60ng/ml〜約6,000ng/mlの濃度のパクリタクセルにさらす、請求項48に記載の方法。
【請求項51】
平滑筋細胞の約90%〜約100%が、細胞周期のG1/S期で静止する、請求項48に記載の方法。
【請求項1】
平滑筋細胞を有する体管腔に移植するための医療装置であって、表面及び該表面に配置されたコーティングを含み、該コーティングはパクリタクセルを取り込む高分子材料を含み;かつ平滑筋細胞の細胞周期のG1/S期における、該パクリタクセルに曝された体管腔の平滑筋細胞を静止するのに効果的な量の高分子材料中に取り込まれたパクリタクセルを放出し得る、前記医療装置。
【請求項2】
平滑筋細胞の約90%〜約100%が、G1/S期で静止する、請求項1に記載の医療装置。
【請求項3】
高分子材料に取り込まれたパクリタクセルの量が、該表面の表面積mm2当り、約0.5μg〜約5μgである、請求項1に記載の医療装置。
【請求項4】
高分子材料に取り込まれたパクリタクセルの量が、該表面の表面積cm2当り、約1μgである、請求項3に記載の医療装置。
【請求項5】
放出されたパクリタクセルの量が、該細胞を約0.001ng/ml〜約10,000ng/mlの濃度にさらすものである、請求項1に記載の医療装置。
【請求項6】
放出されたパクリタクセルの量が、該細胞を約0.01ng/ml〜約1,000ng/mlの濃度にさらすものである、請求項5に記載の医療装置。
【請求項7】
放出されたパクリタクセルの量が、該細胞を約60ng/ml〜約6,000ng/mlの濃度にさらすものである、請求項5に記載の医療装置。
【請求項8】
高分子材料が生物学的に安定である、請求項1に記載の医療装置。
【請求項9】
高分子材料が、スチレン−イソブチレン共重合体を含む、請求項1に記載の医療装置。
【請求項10】
ステントである、請求項1に記載の医療装置。
【請求項11】
高分子材料が、生物学的に活性な物質を更に含有する、請求項1に記載の医療装置。
【請求項12】
請求項1に記載の医療装置を患者に挿入又は移植することを含む、狭窄症又は再狭窄の治療方法。
【請求項13】
平滑筋細胞を含む、体管腔に移植するための医療装置であって、該医療装置は表面及び該表面に配置されたコーティングを有し、該コーティングが、パクリタクセルを取り込んだ高分子材料を含み、該コーティングが、該表面の表面積mm2に当り、約0.001μg〜約20μgの高分子材料に取り込まれたパクリタクセルを、約1週間〜約8週間に渡り放出し得る、前記医療装置。
【請求項14】
該コーティングが、該表面の表面積mm当り、約0.01μg〜約0.1μgの高分子材料に取り込まれたパクリタクセルを、約4週間に渡り放出し得る、請求項13に記載の医療装置。
【請求項15】
該コーティングから放出されるパクリタクセルの量が、細胞周期のG1/S期においてパクリタクセルにさらされた平滑筋細胞を静止するのに効果的なものである、請求項13に記載の医療装置。
【請求項16】
約90%〜約100%の平滑筋細胞がG1/S期で静止する、請求項15に記載の医療装置。
【請求項17】
高分子材料に取り込まれたパクリタクセルの量が、該表面の表面積mm当り、約0.5μg〜約5μgである、請求項13に記載の医療装置。
【請求項18】
高分子材料に取り込まれたパクリタクセルの量が、該表面の表面積cm当り、約1μgである、請求項17に記載の医療装置。
【請求項19】
放出されるパクリタクセルの量が、該細胞を約0.001ng/ml〜約10,000ng/mlのパクルタクセル濃度にさらすものである、請求項13に記載の医療装置。
【請求項20】
放出されるパクリタクセルの量が、該細胞を約0.01ng/ml〜約1,000ng/mlのパクルタクセル濃度に曝すものである、請求項19に記載の医療装置。
【請求項21】
放出されるパクリタクセルの量が、該細胞を約60ng/ml〜約6,000ng/mlのパクルタクセル濃度にさらすものである、請求項19に記載の医療装置。
【請求項22】
高分子材料が生物学的に安定である、請求項13に記載の医療装置。
【請求項23】
高分子材料が、スチレン−イソブチレン共重合体を含む、請求項13に記載の医療装置。
【請求項24】
ステントである、請求項13に記載の医療装置。
【請求項25】
高分子材料が、さらに生物学的に活性な物質を含む、請求項13に記載の医療装置。
【請求項26】
請求項13に記載の医療装置を患者に挿入又は移植することを含む、狭窄症又は再狭窄の治療方法。
【請求項27】
平滑筋細胞を含む体管腔に移植するための医療装置であって、該表面及び該表面に配置されたコーティングを有し;
該コーティングが、パクリタクセルの特定量を取り込んだ高分子材料を含み;
該コーティングが、高分子材料に取り込まれたパクリタクセルの特定量の約0.1%〜約35%を、約1週間〜約8週間に渡り放出し得る、前記医療装置。
【請求項28】
該コーティングが、高分子材料に取り込まれたパクリタクセルの特定量の約1%〜約15%を、約4週間に渡り放出し得る、請求項27に記載の医療装置。
【請求項29】
該コーティングから放出されるパクリタクセルの量が、細胞周期のG1/S期においてパクリタクセルに平滑筋細胞を静止するのに効果的なものである、請求項27に記載の医療装置。
【請求項30】
平滑筋細胞の約90%〜約100%が、細胞周期のG1/S期で静止する、請求項29に記載の医療装置。
【請求項31】
高分子材料に取り込まれたパクリタクセルの量が、該表面の表面積mm当り、約0.5μg〜約5μgである、請求項27に記載の医療装置。
【請求項32】
高分子材料に取り込まれたパクリタクセルの量が、該表面の表面積cm当り、約1μgである、請求項31に記載の医療装置。
【請求項33】
放出されるパクリタクセルの量が、該細胞を約0.001ng/ml〜約10,000ng/mlのパクルタクセル濃度にさらすものである、請求項27に記載の医療装置。
【請求項34】
放出されるパクリタクセルの量が、約0.01ng/ml〜約1,000ng/mlのパクルタクセル濃度にさらすものである、請求項33に記載の医療装置。
【請求項35】
放出されるパクリタクセルの量が、約60ng/ml〜約6,000ng/mlのパクルタクセル濃度にさらすものである、請求項33に記載の医療装置。
【請求項36】
高分子材料が生物学的に安定である、請求項27に記載の医療装置。
【請求項37】
高分子材料が、スチレン−イソブチレン共重合体を含む、請求項27に記載の医療装置。
【請求項38】
ステントである、請求項27に記載の医療装置。
【請求項39】
高分子材料が、さらに生物学的に活性な物質を含む、請求項27に記載の医療装置。
【請求項40】
請求項27に記載の医療装置を患者に挿入又は移植することを含む、狭窄症又は再狭窄の治療方法。
【請求項41】
平滑筋細胞を含む患者の体管腔に、パクリタクセルの治療的有効量を投与することを含む、患者における増殖性疾患の治療方法であって、
パクリタクセルの該治療的有効量が、細胞周期のG1/S期における体管腔の平滑筋細胞を静止するのに有効な量である、前記治療方法。
【請求項42】
平滑筋細胞の約90%〜約100%が、細胞周期のG1/S期で静止する、請求項41に記載の治療方法
【請求項43】
パクリタクセルの治療的有効量が、該細胞を約0.001ng/ml〜約10,000ng/mlのパクルタクセル濃度にさらすものである、請求項41に記載の治療方法。
【請求項44】
放出されるパクリタクセルの量が、該細胞を約0.01ng/ml〜約1,000ng/mlのパクルタクセル濃度にさらすものである、請求項43に記載の治療方法。
【請求項45】
放出されるパクリタクセルの量が、該細胞を約60ng/ml〜約6,000ng/mlのパクルタクセル濃度にさらすものである、請求項43に記載の治療方法。
【請求項46】
上記増殖性疾患が、再狭窄、狭窄症、乾癬、皮膚炎、肝臓硬化症又は前立腺肥大症である、請求項41に記載の治療方法。
【請求項47】
該パクリタクセルが、非経口的、皮下、筋肉内、眼窩内、関節内、脊髄内、胸骨内、静脈内、皮内、腹腔内、門脈内、動脈内、くも膜下腔内、関節内、経粘膜、胸膜内、経皮、局所、硬膜外、粘膜、鼻腔内注射又は注入、又は経口、吸入、肺又は直腸投与によって患者に投与される、請求項41に記載の治療方法。
【請求項48】
約0.001ng/ml〜約10,000ng/mlの濃度のパクリタクセルに該細胞に、さらすことを含む、G1/S期における平滑筋細胞を静止させる方法。
【請求項49】
前記細胞を、約0.01ng/ml〜約1,000ng/mlの濃度のパクリタクセルにさらす、請求項48に記載の方法。
【請求項50】
前記細胞を、約60ng/ml〜約6,000ng/mlの濃度のパクリタクセルにさらす、請求項48に記載の方法。
【請求項51】
平滑筋細胞の約90%〜約100%が、細胞周期のG1/S期で静止する、請求項48に記載の方法。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【公表番号】特表2007−527265(P2007−527265A)
【公表日】平成19年9月27日(2007.9.27)
【国際特許分類】
【出願番号】特願2006−518745(P2006−518745)
【出願日】平成16年6月30日(2004.6.30)
【国際出願番号】PCT/US2004/021079
【国際公開番号】WO2005/004946
【国際公開日】平成17年1月20日(2005.1.20)
【出願人】(305011097)ボストン サイエンティフィック リミテッド (7)
【Fターム(参考)】
【公表日】平成19年9月27日(2007.9.27)
【国際特許分類】
【出願日】平成16年6月30日(2004.6.30)
【国際出願番号】PCT/US2004/021079
【国際公開番号】WO2005/004946
【国際公開日】平成17年1月20日(2005.1.20)
【出願人】(305011097)ボストン サイエンティフィック リミテッド (7)
【Fターム(参考)】
[ Back to top ]

