弱酸性および/または弱塩基性化合物の結晶化方法
【課題】 現在知られている結晶化方法の限界および不利な点を克服することである。
【解決手段】 非荷電形および少なくとも1つの荷電形を有する弱酸性および/または弱塩基性化合物の結晶化方法であって、
a)溶媒中の前記化合物の溶液を、初期pH値および前記化合物の初期全濃度を有し、前記初期pH値は前記化合物が前記溶液中で主に前記荷電形で存在するように選択され、前記初期全濃度が前記非荷電形の固有溶解度より高く選択されるよう準備するステップと、
b)前記溶液のpH値を、前記溶液が実質的に飽和状態であり前記非荷電形の濃度が実質的に前記固有溶解度に等しくなる予め決定した目標pH値に到達するまで前記化合物の溶解度の減少に導く方向に徐々に変化させるステップ、および
c)前記化合物の結晶形成をさせながら前記溶液を実質的に飽和状態に維持するステップを含む。
【解決手段】 非荷電形および少なくとも1つの荷電形を有する弱酸性および/または弱塩基性化合物の結晶化方法であって、
a)溶媒中の前記化合物の溶液を、初期pH値および前記化合物の初期全濃度を有し、前記初期pH値は前記化合物が前記溶液中で主に前記荷電形で存在するように選択され、前記初期全濃度が前記非荷電形の固有溶解度より高く選択されるよう準備するステップと、
b)前記溶液のpH値を、前記溶液が実質的に飽和状態であり前記非荷電形の濃度が実質的に前記固有溶解度に等しくなる予め決定した目標pH値に到達するまで前記化合物の溶解度の減少に導く方向に徐々に変化させるステップ、および
c)前記化合物の結晶形成をさせながら前記溶液を実質的に飽和状態に維持するステップを含む。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は弱酸性および/または弱塩基性化合物の結晶化方法およびその方法を実施するための装置に関する。
【背景技術】
【0002】
結晶化は、各種の商業プロセス、例えばバイオテクノロジー、選鉱、排水処理、エネルギー貯蔵、新素材および電子科学部品における重要な精製および分離技術である。結晶化は溶液中、気体または融体から生じることができる。化学工業における大抵のプロセスは溶液からの結晶化を用い、その出発点は飽和溶液を作りだすことにある。しかしながら、現在知られている方法では、飽和溶液の形成には時間がかかることが多い。通常、化合物の溶解性および不溶解性の形間の平衡が達成されるまで数日かかる。それゆえ、飽和溶液の代わりに、結晶化の出発点として過飽和溶液がほとんどの場合用いられる。しかしながら、そのような場合、結晶化に適切な過飽和は化合物ごとに異なり、化合物の結晶化能力に依存するので、過飽和のレベルを知ることが重要である。一般的に、過飽和のレベルを下げると、結晶成長は遅くなり、結晶の質は向上する。
【0003】
ウォン(Wang)はニコチン酸ナトリウム水溶液に塩酸を添加してニコチン酸の極度に高い過飽和を得ようとしている(Wang, F. and Berglund, KA.「弱めた全反射フーリエ変換赤外線分光分析を用いたニコチン酸pH振動結晶化の監視」(“Monitoring pH swing crystallization of nicotinic acid by the use of attenuated total reflection Fourier transform infrared spectrometry”), Industrial & Engineering Chemistry Research 39(6), 2000, p.2101-2104、非特許文献1)。そのとき最高過飽和点がニコチン酸の結晶化の出発点として用いられた。
【0004】
他の例は、シュー(Zhu)によって開発されたpH変動による管理されたバッチ結晶化である(Zhu, J. and Garside, J.「pH変動による管理されたバッチ結晶化」(“Controlled batch crystallization by pH variation”, Jubilee Research Event, a Two-Day Symposium, Nottingham, UK, Apr.8-9, 1997, 1, p.449-452、非特許文献2)。シューによれば、過飽和の短いパルスが結晶化を初動し、全結晶化工程の間、一定のレベルの過飽和を維持するためpHの変化を用いる。さらにシューは操作時間を短縮するためできるだけ高い過飽和レベルに高めるのを試みた。
【0005】
しかしながら、過飽和は非晶質材料の形成および結晶欠陥の発生のリスクとみなされる。それゆえ、過飽和溶液に依存する現在知られている結晶化のための方法では、結晶化速度と形成される結晶の質間の妥協を見つけようと、それぞれのケースに適切なレベルの過飽和を確立しなければならない。
【非特許文献1】(Wang, F. and Berglund, KA.「弱めた全反射フーリエ変換赤外線分光分析を用いたニコチン酸pH振動結晶化の監視」(“Monitoring pH swing crystallization of nicotinic acid by the use of attenuated total reflection Fourier transform infrared spectrometry”), Industrial & Engineering Chemistry Research 39(6), 2000, p. 2101-2104)
【非特許文献2】(Zhu, J. and Garside, J.「pH変動による管理されたバッチ結晶化」(“Controlled batch crystallization by pH variation”, Jubilee Research Event, a Two-Day Symposium, Nottingham, UK, Apr.8-9, 1997, 1, p.449-452)
【発明の開示】
【発明が解決しようとする課題】
【0006】
本発明の主な目的は現在知られている結晶化方法の限界および不利な点を克服することである。
【課題を解決するための手段】
【0007】
上記のおよびさらなる目的は本発明の方法および装置によって達成される。
【0008】
本発明の1つの局面によると、それは弱酸性および/または弱塩基性化合物の結晶化方法であって、前記化合物が非荷電形および少なくとも1つの荷電形を有し、前記方法は、
a)溶媒中の前記化合物の溶液を、初期pH値および前記化合物の初期全濃度を有し、前記初期pH値は前記化合物が前記溶液中で主に前記荷電形で存在するよう選択され、前記初期全濃度が前記非荷電形の固有溶解度より高く選択されるよう準備するステップと、
b)前記溶液のpH値を、前記溶液が実質的に飽和状態であり前記非荷電形の濃度が実質的に前記固有溶解度と等しくなる予め決定した目標pH値に到達するまで前記化合物の溶解度の減少に導く方向へ徐々に変化させるステップ、および
c)前記化合物の結晶形成をさせながら前記溶液を実質的に飽和状態に維持するステップを含むことを特徴とする、弱酸性および/または弱塩基性化合物の結晶化方法である。
【0009】
この手順において、目的の化合物の飽和溶液でなく比較的に高濃度溶液、すなわち非荷電形の固有溶解度よりも高い全濃度で開始する。溶液のpH値を前記化合物の溶解度の減少に導く方向へ徐々に変化させることにより、溶液が実質的に飽和状態にある状況に急速に進行する。溶液を実質的に飽和状態に維持することにより、結晶化が最も望ましい条件下で実施され、特に過飽和の状態から結晶化に伴う欠点を避けることができる。
【0010】
本発明の方法は、各種溶媒に適用される。特に溶媒は水または水系混合溶媒であってもよい。適用の前提は、目的の化合物が前記溶媒中で弱酸性および/または弱塩基性として作用することである。本発明の文脈において、弱酸はpK値が2乃至7の化合物、一方、弱塩基性はpK値が7乃至12の化合物として理解されるべきである。本方法はまた1pK値を超える化合物にも適用できる。
【0011】
2つ以上の形を有す1つの化合物の全濃度は溶液中に存在する全ての化合物の形の濃度の合計として定義される。平衡状態では、この全濃度は化合物の有効溶解度に等しい。
【0012】
与えられた溶媒中の化合物の固有溶解度は、非荷電形の沈殿物が存在する平衡状況で達成できる非荷電形の最大濃度として定義される。したがって、弱酸性および/または弱塩基性の固有溶解度は実質的にすべての化合物が非荷電形で存在する条件下でその化合物の平衡全濃度に等しい。そのような条件は弱酸性および/または弱塩基性化合物に対してpH値の適切な調整によって達成されるかもしれない。固有溶解度を決定する方法は当該技術で公知である(例えばAvdeef, A.「pH分析溶解度、1.ビヨラムプロットからの溶解度−pHプロフィール、Gibbs緩衝液および固体状態でのpKA(“pH-metric solubility. 1. Solubility-pH profiles from Bjerrum plots. Gibbs buffer and pKA in the solid state”), Pharmacy and Pharmacology Communications 4(3), 1998, p.165-178参照)。
【0013】
本発明の有利な実施態様は従属する請求の範囲で定義される。
【0014】
1つの実施態様において、上記のステップb)はさらに前記化合物の全濃度を高めることを含む。このことは、特にpH値を前記目標のpH値に調整した後に前記溶媒の蒸発を遅らせることにより有利に達成される。
【0015】
さらに1つの実施態様において、前記溶液を実質的に飽和状態に維持するステップは前記溶媒の蒸発を遅く生じさせながらpH値を実質的に一定に保持することを含む。
【0016】
他の実施態様において、前記溶液を実質的に飽和状態に維持するステップは前記非荷電形の濃度を前記固有溶解度より上の予め規定した許容範囲内に保持するよう、前記非荷電形の濃度の監視およびpH値の規制を含む。実際に、このことは非荷電形の濃度を連続的に、または時々監視する必要がある。もし前記濃度が前記予め規定された許容範囲外の値に達する場合、少量の強酸または強塩基、例えば、それぞれ塩酸または水酸化カリウムを非荷電形の濃度が許容範囲内に戻るまでその溶液に添加される。
【0017】
さらに他の実施態様において、前記溶液を実質的に飽和状態に維持するステップは、前記化合物の全濃度を予め決定した全溶解度プロフィールより上の予め規定した許容範囲内に保持するよう前記化合物の全濃度の監視およびpH値の規制を含む。実際には、このことは全濃度を連続的に、または時々監視する必要がある。さらに、前記化合物の全濃度の以前に決定されたプロフィールをpH値の関数として、少なくとも目的のpHの範囲においてアクセスする必要があろう。そのような溶解度プロフィールの決定方法は当該技術で公知である(例えばAvdeef, A.「物理化学のプロファイリング(溶解度、浸透性および荷電状態)」(“Physicochemical profiling (solubility, permeability and charge state.”), Current Topics in Medicinal Chemistry (Hilversum, NL) 1 (4), 2001, p.277-351参照)。もしある時点のpH値で化合物の全濃度が前記の全溶解度プロフィールから前記予め規定した許容範囲を超えて異なる場合、少量の強酸または強塩基、例えば、それぞれ塩酸または水酸化カリウムをそのpH値での全濃度が許容範囲内に戻るまでその溶液に加えられる。
【0018】
本発明の他の局面によれば、以下に提供される、弱酸性および/または弱塩基性化合物の結晶化を実施するための装置であって、
a)前記溶液用の容器と、
b)前記溶液のpH値を測定するプローブと、
c)前記溶液に管理された量の酸および塩基を添加するための投与手段と、
d)溶液中に存在する少なくとも1つの化合物の形の濃度を測定するためのセンサー、および
e)前記pHプローブおよび前記センサー手段から受け取った信号に応答して、前記投与手段が予め規定したプロフィールに合致するよう前記pH値を規制するようにプログラムされる前記投与手段に作用するコントロール手段を含む装置である。
【発明を実施するための最良の形態】
【0019】
上記および他の特徴、本発明の目的およびそれらを達成する方法はより明らかになり、本発明自体が付随した図面と併せて本発明の各種の実施態様の以下の説明を参照することでよりよく理解されるであろう。
【実施例】
【0020】
実施例として、ジクロフェナク、ファモチジン、フルルビプロフェン、フロセミド、ヒドロクロロチアジド、ケトプロフェン、プロパノロールおよびキニーネを用いた。これらの化合物は市販されている。これらの化合物のすべては弱酸、弱塩基または一般的に2〜10の範囲のpK値を有する両性電解質である。
【0021】
弱塩基および/または弱酸の溶解度
図1は弱塩基Bの溶解度プロフィールを有効な溶解度SをpH値の関数として示している。有効な溶解度Sは平衡での化合物の全濃度と等しい。そのようなプロフィールは「溶解度−pHプロフィール」としても扱われるであろう。当面、塩基Bの溶液とその溶液に接触する相当量の固体とが平衡状況にあると仮定される。非常に高いpH値(領域a)で、化合物のすべてが実質的に非荷電形Bとして存在し、自由塩基形とも称される。非常に低いpH値(領域d)で、化合物のすべてが実質的にプロトンと化した形のBH+として存在する。中間のpH値で、非荷電形とプロトン化した形とがpH値に依存する比率で共存する。有効な溶解度Sは平衡でのBとBH+の濃度の合計に等しい。図1から分かるように、非荷電形の溶解度は、固有溶解度S0とも称されるが、塩溶解度とも称せられる、プロトン形溶解度のS+よりも小さい。
【0022】
領域aを再度考察してみると、有効な溶解度Sは実質的にpHに依存しないことが分かる。このことは、非常に高いpH値でのpHにおけるわずかな変化は非荷電形とプロトン化した形との間の比率に実質的に影響を与えず、その比率が大きいためである。したがって、有効な溶解度Sは実質的に固有溶解度S0に等しい。
【0023】
さて、幾分低いpH値の状況(図1の領域bを参照)を考察すると、化合物の幾分かはプロトン化した形BH+である。ここで有効な溶解度Sはそれぞれ非荷電形およびプロトン化した形の寄与を反映する2つの項を含む。領域bにおいて、pH値を低下することは有効溶解度の増加を伴う。基盤となす平衡は以下のように表現されるかもしれない。
【化1】

【0024】
つまり、溶液中の非荷電形Bは溶液中の荷電した対象BH+および非荷電の固体形B(S)と平衡にある。
【0025】
領域bにおいて、pHを低下することはBのプロトン化をBH+へ誘導し、それが「失った」Bと取って代わるために固体形B(S)の溶解を誘発する。
B(S)→B
B+H+→BH+
【0026】
このプロセスはいわゆる「完全」緩衝系に到達するまで続くであろう(例えば上掲Avdeef, A.、2001参照)。その点で、即ち、図1の点2で固体の自由塩基B(S)およびその固体の共役酸BH+(S)が共存し、それによってpHおよび有効溶解度を、2つの相互に変換する固体が存在する限り、一定にするように働く。この特異なpH点がギブスのpKa(pKaGIBBS)として呼ばれている。この現象に伴う平衡式は以下であり、
【化2】

付随する平衡定数は以下で与えられる。
【数1】

【0027】
点2の有効溶解度は固有溶解度と塩の溶解度の合計で与えられる。
S=S0+Si
【0028】
点2からさらに、固体相がプロトン化した形BH+(S)だけからなる低いpH値(即ち、領域c)へ移動すると、BH+の濃度は一定になり塩の溶解度と等しくなる。BのBH+(S)へのプロトン化はさらにプロトン化した固体形成および溶液中の成分Bの損失を導く。
B+H+→BH+
BH+→BH+(S)
【0029】
それゆえ、有効溶解度は、領域dに達するまで減少する。領域dにおいて、BH+に変換されるBがなくなり、支配的な平衡は以下に記載される。
【化3】

【0030】
弱塩基Bの代わりに弱酸性化合物HAを取り扱う場合、関係する溶解度プロフィールは図2に示される一般的外観を有する。ここで非電荷形HAは遊離酸形とも称され、低pH値で優位を占め、一方、より高いpH値では脱プロトン化が増加し負に荷電した形A−となる。1pK値よりも大きな化合物を扱う場合、溶解度プロフィールは酸性条件下で正に荷電し塩基性条件化で負に荷電する物質となって図1と2で示したプロフィールを組み合わせた外観を有する。
【0031】
溶解度の決定
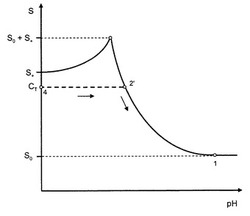
上述した滴定、例えば弱塩基Bの高いpH値から低いpH値に滴定が、いわゆる「pSol法」にしたがって溶解度プロフィールの電位差決定が用いられる(例えば上掲Avdeef, A.、1998参照)。しかしながら、pSol滴定において、「完全」緩衝系の現象は、よい滴定結果を得るため研究においてごく少量の化合物しか用いないのがよいとされる理由から、頻繁には生じない。このことは、図1の点2に対応する最大の有効濃度に達する前に化合物の全量が溶解する状況に至る。このことは図3に例示されており、pH値の減少が溶解度プロフィールに沿って、図3の2’として表示された点に到達するまで導く。この点で化合物は完全に溶解し、溶液中のその量は、図3の水平の破線で示されるようにpH値をさらに減少させても変化しない。それゆえ、化合物の全濃度は一定でCT値である。
【0032】
溶解度−pHプロフィールの測定は「pSol」装置で実施された(例えば上掲Avdeef, A.、2001参照)。pSol装置を用いた電位差溶解度測定では入力因子として前記化合物の重量、溶液の体積、測定されたpKaおよび測定された(または計算された)オクタノール/水の分配係数、logPを必要とする。後者の因子は固有溶解度、S0を評価するのに用い、ハンシュ(Hansch)型の式を用いて
logS0=1.17−1.38*logP
または、適度な親油性のイオン化できる分子に対する改良された式を用いる。
logS0=−2.17−0.0082logP−0.134(logP)2
【0033】
前記化合物の重量、溶液の体積、pKaおよび予想されたS0を用いて、評価前に全滴定曲線を数値処理しシミュレートする。シミュレートされた曲線は滴定経路中の個々のpH測定値を収集するため機器のテンプレートとして役立つ。沈殿を含むpHドメインはそのシミュレーションから明らかである。サンプル懸濁液の滴定が溶解の方向に、最終的に完全溶解点を十分通過してなされる。固体の溶解速度は、古典的なNoyes−Whitney式で記述されるが、機器で考慮にいれる数多くの因子に依存する。例えば機器が、追加の固体を十分溶解するのに必要な時間が増大する完全溶解点に接近するにつれてpHデータの速度が遅くなる。沈殿が完全に溶解した後でのみ、機器は残りのデータを迅速に収集する。典型的には、完全平衡溶解度データ採取には3乃至10時間を要する。化合物がより不溶解性であると(テンプレートに基づいて)予測されるほど、より長い評価時間となる。
【0034】
ビヨラム(Bjerrum)プロット
分析化学で一般的に知られているように、ビヨラムプロットはnH対pHからなるプロットであり、nHは物質の分子中の結合した水素の平均数である。ビヨラムプロットはいかなるpKa値もnHの半積分位置で、pH値で表す。各種の関連した平衡の上記の説明から理解されるように、沈殿の存在によってビヨラムプロットの移動を生じさせ、pKaAppとして表示される見掛けのpKa値を与え、酸に対してはより高い値、塩基に対してはより低い値に移動させる。このことが(a)ケトプロフェン(弱酸として作用する)、(b)プロパノロール(弱塩基として作用する)、(c)エナラプリル(両性電解質として作用する)の飽和溶液に対して図4に示される。
【0035】
固有溶解度S0は以下の関係式を適用して曲線の検討から推論でき、
logS0=log(C/2)−|pKaApp−pKa|
式中、Cはサンプル濃度である。
【0036】
溶解度―pHプロフィールおよびビヨラムプロットの他に、pSol法から得られる他のタイプのプロフィールは流量因子プロフィール(Flux Factor Profiles)である(例えば上掲Avdeef, A.、1998参照)。流量因子プロフィールは化合物のすべての種の濃度分率をpHの関数として示す図である。
【0037】
結晶化方法
結晶を得るために、図3に関して記載して前述した滴定の方向を逆にする。弱塩基化合物Bの場合、図5で示したように点4の手段によって低初期pH値で化合物の不飽和溶液から開始する。換言すれば、初期pH値および初期全濃度CTを、溶液中の化合物が主として、または全体的に荷電したBH+が存在するように選ばれる。図5から分かるように、初期全濃度CTは非電荷形Bの固有溶解度S0よりも大きい。
【0038】
その後、pH値が徐々に増加される。このことによりBH+のBへの脱プロトン化の増加に導くが、初期には固相の沈殿はない。点2’に到達すると滴定を止める。この目標点2’で、非電荷形の濃度が最大値[B]maxに達し、それは固有溶解度S0に等しい。それゆえ、目標の化合物の飽和溶液が到達され、実質的に飽和条件下で結晶化の実施に役立つことができる。
【0039】
目標点2’は、目標点2’で全濃度が図5に示すようにS0とS0+S+の間にある限り、溶解度−pHプロフィール上のいかなる場所で選べるであろう。例えば、ほぼ飽和の溶液、即ち、塩の溶解度S+の極わずか下の初期全濃度CTから開始し、溶解度−pHプロフィール上の関係する交点2’に到達するまで徐々にpH値を増加させる。
【0040】
しかしながら、実際上の制限によって、目標点2’に非常に正確に到達するのは困難かもしれない。もしあまりにも大量の塩基が添加されると、pH値が点2’に対応する目標pH値を超えて、過飽和溶液が形成される可能性がある。それゆえ、滴定は、わずかに不飽和溶液に対応する溶解度−pHプロフィールに極めて近い点で通常止められる。蓋のない瓶の中で溶液を保持し、溶媒の蒸発を遅くさせることにより、溶液の濃度がゆっくり増加し、実質的に飽和状態に到達する。これが結晶化の出発点である。以下、より詳細に論議するように、実質的に飽和条件下での結晶化には溶液系を常にできるかぎり溶解度−pHプロフィールに近づけるように保持する適切な手段を講じる必要がある。
【0041】
弱塩基の代わりに弱酸性化合物HAを取り扱う場合、適切な溶解度プロフィールは図2に示される一般的な外観を有する。それゆえ、上記の結晶化手順を弱酸に適応させる場合、一般的に高pH値での不飽和溶液から出発して溶解度−pHプロフィールの目標点に達するまでpH値を徐々に減少させる必要がある。
【0042】
両性電解質を取り扱う場合、原理的には極めて高いまたは極めて低いpH値から出発して溶解度−pHプロフィールの対応する部分の目標pH値に向かって移動する。
【0043】
沈殿のない状態で滴定のためビヨラムプロットを参照曲線として用いるのは役に立つ。この参照曲線を役立てて、溶解度プロフィールの点1および2’をビヨラムプロットで定義することができる。これをファモチジン、比較的低pH値での塩基としての挙動とみなす両性電解質に対して図6に示す。図6の実線は沈殿のない参照状況を表し、丸印は低いpH値から高いpH値に滴定によって得られたデータを示す。実験曲線は2つの異なる点で参照曲線と一致する。最初の点は溶解度プロフィールの点2’と同じである。それは溶液中の非電荷形の最大濃度の到達を示唆する。この点で、荷電形の濃度は依然高いままだが、非電荷形はその最大濃度に既に到達している。より不溶解形が得られる方向にpH値を変化させるために滴定を続けると、イオン形の濃度は下がるのが観察される。H+の損失とともに益々BH+は沈殿、B(s)に移行され、一方、非電荷形の濃度は一定に留まる。このことは実験および参照曲線の他の交点に到達するまで続く。この交点が溶解度プロフィールの点1と同じである。この点で、沈殿は完了し、イオン形はその最小濃度に到達し、ほぼ非電荷形のみが溶液中に存在する。点2’と点1の間で化合物は沈殿の存在のため、見かけのpKa値(即ち、pKaAPP)を示す。上述したように、pKaAPPは酸に対してより高い値、塩基に対してより低い値に移動する。
【0044】
実際上の考慮
飽和溶液で、即ち過飽和を避けて結晶化を実施することで、非晶質固体を形成するリスクが大きく減少する。それゆえ、飽和溶液を形成するために化合物の傾向を検討する方法があることは役に立つ。これは溶解度−pHプロフィールまたは得られたビヨラムプロットを滴定の逆方向を用いるpSol法と比較してなされるかもしれない。これはファモチジンを例として用い図6に示したビヨラムプロットを参照して説明される。図6の実験曲線は、不溶解形が主要である比較的高いpH値約11から出発して得られた。上記で既に説明したように、実験曲線が点1と点2’の間の範囲で参照曲線から逸脱するのは、沈殿の存在のためである。より高いpH値からより低いpH値に滴定することにより過飽和はない。
【0045】
もし滴定の方向が逆の場合、即ちファモチジンがその溶解性から不溶解形にpH値を増加して滴定される場合、実験的に決定されたビヨラム曲線は他の滴定方向で得られた実験的なビヨラム曲線からの一般的な逸脱を示すであろう。具体的には、過飽和によって生じる沈殿が目標点2’では開始せず、幾分高いpH値の点2”で開始するであろう。つまり、低いpH値から高いpH値への滴定に対する実験データは点2”に達するまで参照曲線に従うであろう。さらに、沈殿が開始する点2”で結晶化速度は非常に大きいので非晶質固体を形成する十分な可能性がある。
【0046】
従って、良好な結晶化結果を得るために、溶液中の非荷電化合物濃度をその固有溶解値に等しく保持するべきである。
【0047】
最も単純な方法において、目標点2’に近づき、それから前記溶媒の蒸発を遅らせながら、pH値を実質的に一定に単純に保持するだけで十分である。これは溶解した化合物の量が結晶の形態で収集される固体の量より十分大きい場合機能する。つまり、比較的大量の溶液を用い、比較的に少量の結晶を収集する必要がある。そこで結晶化は基本的に目標点2’でのみ実施されるだろう。
【0048】
しかしながら、大抵の状況では、できるだけ多くの結晶を収集することが望まれるであろう。このことは目標点2’に達した後、系は図5に示されるように溶解度プロフィールに沿って進展するであろうことを意味する。従って、pH値を濃度の変化に適合させる、またはその逆も同様である。
【0049】
実際に、これは非荷電形の濃度を固有溶解度より上の予め規定された範囲内で維持されるように、非荷電形の濃度を監視しpH値を規制することにより達成されるかもしれない。別な方法として、全濃度を予め決定した全溶解度プロフィールより上の予め規定された範囲内に維持するには化合物の全濃度を監視し、pH値を規制するかもしれない。
【0050】
これは電位差溶解度測定に用いられているように装置の適切な適合によってなされるかもしれない。溶液用の容器および前記溶液のpH値を測定するための適当なプローブに加えて、装置は管理された量の酸および塩基を前記溶液に添加する投与手段を含む。さらに、装置は溶液中に存在する少なくとも1つの化合物の形の濃度を測定するためのセンサー装置、およびpHプローブおよびセンサー手段から受け取った信号に応答して投与手段に作用するコントロールユニットを含む。投与手段は予め規定したプロフィールに合致するようpH値を規制するようにプログラムされる。
【0051】
好ましくは、容器はガラス製で磁気攪拌機のような攪拌手段を備える。当技術で知られる他のプローブが用いられるかもしれないが、pH値を測定するプローブは従来のガラス電極でよい。管理された量の酸および塩基溶液、例えば1NのHCl、NaOHまたはKOH溶液を添加する投与手段は、容器の中に導く分配ガラスチューブおよび適当な投与ユニットを含む。センサー手段は一般的に検出される種の同定に依存し、例えば、これらはUVまたは可視光測光的なプローブシステムでよい。コントロール手段は一般的に多くの信号入力チャネル、即ちpHプローブからの信号入力用でよく、センサー手段および他の監視装置、例えば温度装置を含む。さらに、コントロール手段はプログラム可能ユニット、要求された仕様を負荷する入力手段、特に溶解度プロフィールおよび特定の作業者指令の入力用手段を含むであろう。
【0052】
濃度効果
結晶化の間に蒸発させる際、得られる濃度変化は以下の式により、見かけのpKa値の移動を生じさせるであろう。
【数2】

【0053】
濃度の10倍の変化が約1対数単位分pKa値の見かけ移動に導く。これは図7に例証されるが、添加されたサンプルの異なる量での一連のビヨラムプロットを示す。弱酸(A)および弱塩基(B)、いずれも分子量300で固有溶解度が5μg/mL(pS0=4.8)および塩の溶解度75mg/mL(pSA,pSBH=0.6)。サンプル濃度は、(a)0.02mg/mL、(b)0.1mg/mL、(c)1.0mg/mL、(d)10mg/mL、(e)100mg/mLであった。図7に見られるように、サンプル濃度の増加につれて曲線は弱酸に対するpKaから上方に、弱塩基に対してpKaから下方に移動する。
【0054】
つまり、溶解度−pHプロフィールは見かけのpKa値、または化合物の全濃度に依存する。それゆえ、溶解度−pHプロフィールはpH値、化合物の全濃度を測定すること、適当な補正を適用することにより連続的に書き換えられるべきであり、弱塩基の場合には以下の式で与えられる。
【数3】

および
【数4】

【0055】
しかしながら、図7はある条件下、見かけのpKa値、または溶解度−pHプロフィール上の化合物の全濃度の影響が制限されることを示している。実際、濃度の変化は約5倍未満にすべきである。図8に示すように、滴定用に全濃度が約58mg/mLのコデインを用いる場合、沈殿はpH約7で始まる。滴定用に全濃度が約13mg/mLのコデインを用いる場合、沈殿はpH約8で始まる。それにもかかわらず、2つの溶解度−pHプロフィールは高pH値で重なるのが見られる。上記でさらに説明した結晶化手順において、溶解度−pHプロフィール上の目標点2’に非常に近い点でpH滴定を止めているので、溶液の全濃度は通常、開始から結晶が生じるまで5倍を超える変化はしない。これらの条件下、溶解度−pHプロフィールは溶液の濃度にほとんど依存しないとみなすことができる。
【図面の簡単な説明】
【0056】
【図1】弱塩基Bの溶解度−pHプロフィールを示す。
【図2】弱酸HAの溶解度−pHプロフィールを示す。
【図3】飽和溶液および適度な固体の量から始めて、高pH値から低pH値に滴定の経路に沿って図1による弱塩基の溶解度−pHプロフィールを示す。
【図4】(a)ケトプロフェン(酸性)、(b)プロパノロール(塩基性)、(c)エナラプリル(両性電解質)の飽和溶液のビヨラムプロットを示す。
【図5】不飽和溶液で低pH値から高pH値に滴定の経路に沿って図1による弱塩基の溶解−pHプロフィールを示す。
【図6】沈殿のない参照状況を示す実線と、丸印は低pH値から高pH値に滴定によって得られたデータであるファモチジンのビヨラムプロットを示す。
【図7】弱酸(A)および弱塩基(B)に対する(a)0.02mgL/mL、(b)0.1mg/mL、(c)1.0mg/mL、(d)10mg/mL、(e)100mg/mLの異なる物質濃度の一連のビヨラムプロットを示す。
【図8】異なる出発濃度を有するコデインの溶解度−pHプロフィールを示す。
【技術分野】
【0001】
本発明は弱酸性および/または弱塩基性化合物の結晶化方法およびその方法を実施するための装置に関する。
【背景技術】
【0002】
結晶化は、各種の商業プロセス、例えばバイオテクノロジー、選鉱、排水処理、エネルギー貯蔵、新素材および電子科学部品における重要な精製および分離技術である。結晶化は溶液中、気体または融体から生じることができる。化学工業における大抵のプロセスは溶液からの結晶化を用い、その出発点は飽和溶液を作りだすことにある。しかしながら、現在知られている方法では、飽和溶液の形成には時間がかかることが多い。通常、化合物の溶解性および不溶解性の形間の平衡が達成されるまで数日かかる。それゆえ、飽和溶液の代わりに、結晶化の出発点として過飽和溶液がほとんどの場合用いられる。しかしながら、そのような場合、結晶化に適切な過飽和は化合物ごとに異なり、化合物の結晶化能力に依存するので、過飽和のレベルを知ることが重要である。一般的に、過飽和のレベルを下げると、結晶成長は遅くなり、結晶の質は向上する。
【0003】
ウォン(Wang)はニコチン酸ナトリウム水溶液に塩酸を添加してニコチン酸の極度に高い過飽和を得ようとしている(Wang, F. and Berglund, KA.「弱めた全反射フーリエ変換赤外線分光分析を用いたニコチン酸pH振動結晶化の監視」(“Monitoring pH swing crystallization of nicotinic acid by the use of attenuated total reflection Fourier transform infrared spectrometry”), Industrial & Engineering Chemistry Research 39(6), 2000, p.2101-2104、非特許文献1)。そのとき最高過飽和点がニコチン酸の結晶化の出発点として用いられた。
【0004】
他の例は、シュー(Zhu)によって開発されたpH変動による管理されたバッチ結晶化である(Zhu, J. and Garside, J.「pH変動による管理されたバッチ結晶化」(“Controlled batch crystallization by pH variation”, Jubilee Research Event, a Two-Day Symposium, Nottingham, UK, Apr.8-9, 1997, 1, p.449-452、非特許文献2)。シューによれば、過飽和の短いパルスが結晶化を初動し、全結晶化工程の間、一定のレベルの過飽和を維持するためpHの変化を用いる。さらにシューは操作時間を短縮するためできるだけ高い過飽和レベルに高めるのを試みた。
【0005】
しかしながら、過飽和は非晶質材料の形成および結晶欠陥の発生のリスクとみなされる。それゆえ、過飽和溶液に依存する現在知られている結晶化のための方法では、結晶化速度と形成される結晶の質間の妥協を見つけようと、それぞれのケースに適切なレベルの過飽和を確立しなければならない。
【非特許文献1】(Wang, F. and Berglund, KA.「弱めた全反射フーリエ変換赤外線分光分析を用いたニコチン酸pH振動結晶化の監視」(“Monitoring pH swing crystallization of nicotinic acid by the use of attenuated total reflection Fourier transform infrared spectrometry”), Industrial & Engineering Chemistry Research 39(6), 2000, p. 2101-2104)
【非特許文献2】(Zhu, J. and Garside, J.「pH変動による管理されたバッチ結晶化」(“Controlled batch crystallization by pH variation”, Jubilee Research Event, a Two-Day Symposium, Nottingham, UK, Apr.8-9, 1997, 1, p.449-452)
【発明の開示】
【発明が解決しようとする課題】
【0006】
本発明の主な目的は現在知られている結晶化方法の限界および不利な点を克服することである。
【課題を解決するための手段】
【0007】
上記のおよびさらなる目的は本発明の方法および装置によって達成される。
【0008】
本発明の1つの局面によると、それは弱酸性および/または弱塩基性化合物の結晶化方法であって、前記化合物が非荷電形および少なくとも1つの荷電形を有し、前記方法は、
a)溶媒中の前記化合物の溶液を、初期pH値および前記化合物の初期全濃度を有し、前記初期pH値は前記化合物が前記溶液中で主に前記荷電形で存在するよう選択され、前記初期全濃度が前記非荷電形の固有溶解度より高く選択されるよう準備するステップと、
b)前記溶液のpH値を、前記溶液が実質的に飽和状態であり前記非荷電形の濃度が実質的に前記固有溶解度と等しくなる予め決定した目標pH値に到達するまで前記化合物の溶解度の減少に導く方向へ徐々に変化させるステップ、および
c)前記化合物の結晶形成をさせながら前記溶液を実質的に飽和状態に維持するステップを含むことを特徴とする、弱酸性および/または弱塩基性化合物の結晶化方法である。
【0009】
この手順において、目的の化合物の飽和溶液でなく比較的に高濃度溶液、すなわち非荷電形の固有溶解度よりも高い全濃度で開始する。溶液のpH値を前記化合物の溶解度の減少に導く方向へ徐々に変化させることにより、溶液が実質的に飽和状態にある状況に急速に進行する。溶液を実質的に飽和状態に維持することにより、結晶化が最も望ましい条件下で実施され、特に過飽和の状態から結晶化に伴う欠点を避けることができる。
【0010】
本発明の方法は、各種溶媒に適用される。特に溶媒は水または水系混合溶媒であってもよい。適用の前提は、目的の化合物が前記溶媒中で弱酸性および/または弱塩基性として作用することである。本発明の文脈において、弱酸はpK値が2乃至7の化合物、一方、弱塩基性はpK値が7乃至12の化合物として理解されるべきである。本方法はまた1pK値を超える化合物にも適用できる。
【0011】
2つ以上の形を有す1つの化合物の全濃度は溶液中に存在する全ての化合物の形の濃度の合計として定義される。平衡状態では、この全濃度は化合物の有効溶解度に等しい。
【0012】
与えられた溶媒中の化合物の固有溶解度は、非荷電形の沈殿物が存在する平衡状況で達成できる非荷電形の最大濃度として定義される。したがって、弱酸性および/または弱塩基性の固有溶解度は実質的にすべての化合物が非荷電形で存在する条件下でその化合物の平衡全濃度に等しい。そのような条件は弱酸性および/または弱塩基性化合物に対してpH値の適切な調整によって達成されるかもしれない。固有溶解度を決定する方法は当該技術で公知である(例えばAvdeef, A.「pH分析溶解度、1.ビヨラムプロットからの溶解度−pHプロフィール、Gibbs緩衝液および固体状態でのpKA(“pH-metric solubility. 1. Solubility-pH profiles from Bjerrum plots. Gibbs buffer and pKA in the solid state”), Pharmacy and Pharmacology Communications 4(3), 1998, p.165-178参照)。
【0013】
本発明の有利な実施態様は従属する請求の範囲で定義される。
【0014】
1つの実施態様において、上記のステップb)はさらに前記化合物の全濃度を高めることを含む。このことは、特にpH値を前記目標のpH値に調整した後に前記溶媒の蒸発を遅らせることにより有利に達成される。
【0015】
さらに1つの実施態様において、前記溶液を実質的に飽和状態に維持するステップは前記溶媒の蒸発を遅く生じさせながらpH値を実質的に一定に保持することを含む。
【0016】
他の実施態様において、前記溶液を実質的に飽和状態に維持するステップは前記非荷電形の濃度を前記固有溶解度より上の予め規定した許容範囲内に保持するよう、前記非荷電形の濃度の監視およびpH値の規制を含む。実際に、このことは非荷電形の濃度を連続的に、または時々監視する必要がある。もし前記濃度が前記予め規定された許容範囲外の値に達する場合、少量の強酸または強塩基、例えば、それぞれ塩酸または水酸化カリウムを非荷電形の濃度が許容範囲内に戻るまでその溶液に添加される。
【0017】
さらに他の実施態様において、前記溶液を実質的に飽和状態に維持するステップは、前記化合物の全濃度を予め決定した全溶解度プロフィールより上の予め規定した許容範囲内に保持するよう前記化合物の全濃度の監視およびpH値の規制を含む。実際には、このことは全濃度を連続的に、または時々監視する必要がある。さらに、前記化合物の全濃度の以前に決定されたプロフィールをpH値の関数として、少なくとも目的のpHの範囲においてアクセスする必要があろう。そのような溶解度プロフィールの決定方法は当該技術で公知である(例えばAvdeef, A.「物理化学のプロファイリング(溶解度、浸透性および荷電状態)」(“Physicochemical profiling (solubility, permeability and charge state.”), Current Topics in Medicinal Chemistry (Hilversum, NL) 1 (4), 2001, p.277-351参照)。もしある時点のpH値で化合物の全濃度が前記の全溶解度プロフィールから前記予め規定した許容範囲を超えて異なる場合、少量の強酸または強塩基、例えば、それぞれ塩酸または水酸化カリウムをそのpH値での全濃度が許容範囲内に戻るまでその溶液に加えられる。
【0018】
本発明の他の局面によれば、以下に提供される、弱酸性および/または弱塩基性化合物の結晶化を実施するための装置であって、
a)前記溶液用の容器と、
b)前記溶液のpH値を測定するプローブと、
c)前記溶液に管理された量の酸および塩基を添加するための投与手段と、
d)溶液中に存在する少なくとも1つの化合物の形の濃度を測定するためのセンサー、および
e)前記pHプローブおよび前記センサー手段から受け取った信号に応答して、前記投与手段が予め規定したプロフィールに合致するよう前記pH値を規制するようにプログラムされる前記投与手段に作用するコントロール手段を含む装置である。
【発明を実施するための最良の形態】
【0019】
上記および他の特徴、本発明の目的およびそれらを達成する方法はより明らかになり、本発明自体が付随した図面と併せて本発明の各種の実施態様の以下の説明を参照することでよりよく理解されるであろう。
【実施例】
【0020】
実施例として、ジクロフェナク、ファモチジン、フルルビプロフェン、フロセミド、ヒドロクロロチアジド、ケトプロフェン、プロパノロールおよびキニーネを用いた。これらの化合物は市販されている。これらの化合物のすべては弱酸、弱塩基または一般的に2〜10の範囲のpK値を有する両性電解質である。
【0021】
弱塩基および/または弱酸の溶解度
図1は弱塩基Bの溶解度プロフィールを有効な溶解度SをpH値の関数として示している。有効な溶解度Sは平衡での化合物の全濃度と等しい。そのようなプロフィールは「溶解度−pHプロフィール」としても扱われるであろう。当面、塩基Bの溶液とその溶液に接触する相当量の固体とが平衡状況にあると仮定される。非常に高いpH値(領域a)で、化合物のすべてが実質的に非荷電形Bとして存在し、自由塩基形とも称される。非常に低いpH値(領域d)で、化合物のすべてが実質的にプロトンと化した形のBH+として存在する。中間のpH値で、非荷電形とプロトン化した形とがpH値に依存する比率で共存する。有効な溶解度Sは平衡でのBとBH+の濃度の合計に等しい。図1から分かるように、非荷電形の溶解度は、固有溶解度S0とも称されるが、塩溶解度とも称せられる、プロトン形溶解度のS+よりも小さい。
【0022】
領域aを再度考察してみると、有効な溶解度Sは実質的にpHに依存しないことが分かる。このことは、非常に高いpH値でのpHにおけるわずかな変化は非荷電形とプロトン化した形との間の比率に実質的に影響を与えず、その比率が大きいためである。したがって、有効な溶解度Sは実質的に固有溶解度S0に等しい。
【0023】
さて、幾分低いpH値の状況(図1の領域bを参照)を考察すると、化合物の幾分かはプロトン化した形BH+である。ここで有効な溶解度Sはそれぞれ非荷電形およびプロトン化した形の寄与を反映する2つの項を含む。領域bにおいて、pH値を低下することは有効溶解度の増加を伴う。基盤となす平衡は以下のように表現されるかもしれない。
【化1】

【0024】
つまり、溶液中の非荷電形Bは溶液中の荷電した対象BH+および非荷電の固体形B(S)と平衡にある。
【0025】
領域bにおいて、pHを低下することはBのプロトン化をBH+へ誘導し、それが「失った」Bと取って代わるために固体形B(S)の溶解を誘発する。
B(S)→B
B+H+→BH+
【0026】
このプロセスはいわゆる「完全」緩衝系に到達するまで続くであろう(例えば上掲Avdeef, A.、2001参照)。その点で、即ち、図1の点2で固体の自由塩基B(S)およびその固体の共役酸BH+(S)が共存し、それによってpHおよび有効溶解度を、2つの相互に変換する固体が存在する限り、一定にするように働く。この特異なpH点がギブスのpKa(pKaGIBBS)として呼ばれている。この現象に伴う平衡式は以下であり、
【化2】

付随する平衡定数は以下で与えられる。
【数1】

【0027】
点2の有効溶解度は固有溶解度と塩の溶解度の合計で与えられる。
S=S0+Si
【0028】
点2からさらに、固体相がプロトン化した形BH+(S)だけからなる低いpH値(即ち、領域c)へ移動すると、BH+の濃度は一定になり塩の溶解度と等しくなる。BのBH+(S)へのプロトン化はさらにプロトン化した固体形成および溶液中の成分Bの損失を導く。
B+H+→BH+
BH+→BH+(S)
【0029】
それゆえ、有効溶解度は、領域dに達するまで減少する。領域dにおいて、BH+に変換されるBがなくなり、支配的な平衡は以下に記載される。
【化3】

【0030】
弱塩基Bの代わりに弱酸性化合物HAを取り扱う場合、関係する溶解度プロフィールは図2に示される一般的外観を有する。ここで非電荷形HAは遊離酸形とも称され、低pH値で優位を占め、一方、より高いpH値では脱プロトン化が増加し負に荷電した形A−となる。1pK値よりも大きな化合物を扱う場合、溶解度プロフィールは酸性条件下で正に荷電し塩基性条件化で負に荷電する物質となって図1と2で示したプロフィールを組み合わせた外観を有する。
【0031】
溶解度の決定
上述した滴定、例えば弱塩基Bの高いpH値から低いpH値に滴定が、いわゆる「pSol法」にしたがって溶解度プロフィールの電位差決定が用いられる(例えば上掲Avdeef, A.、1998参照)。しかしながら、pSol滴定において、「完全」緩衝系の現象は、よい滴定結果を得るため研究においてごく少量の化合物しか用いないのがよいとされる理由から、頻繁には生じない。このことは、図1の点2に対応する最大の有効濃度に達する前に化合物の全量が溶解する状況に至る。このことは図3に例示されており、pH値の減少が溶解度プロフィールに沿って、図3の2’として表示された点に到達するまで導く。この点で化合物は完全に溶解し、溶液中のその量は、図3の水平の破線で示されるようにpH値をさらに減少させても変化しない。それゆえ、化合物の全濃度は一定でCT値である。
【0032】
溶解度−pHプロフィールの測定は「pSol」装置で実施された(例えば上掲Avdeef, A.、2001参照)。pSol装置を用いた電位差溶解度測定では入力因子として前記化合物の重量、溶液の体積、測定されたpKaおよび測定された(または計算された)オクタノール/水の分配係数、logPを必要とする。後者の因子は固有溶解度、S0を評価するのに用い、ハンシュ(Hansch)型の式を用いて
logS0=1.17−1.38*logP
または、適度な親油性のイオン化できる分子に対する改良された式を用いる。
logS0=−2.17−0.0082logP−0.134(logP)2
【0033】
前記化合物の重量、溶液の体積、pKaおよび予想されたS0を用いて、評価前に全滴定曲線を数値処理しシミュレートする。シミュレートされた曲線は滴定経路中の個々のpH測定値を収集するため機器のテンプレートとして役立つ。沈殿を含むpHドメインはそのシミュレーションから明らかである。サンプル懸濁液の滴定が溶解の方向に、最終的に完全溶解点を十分通過してなされる。固体の溶解速度は、古典的なNoyes−Whitney式で記述されるが、機器で考慮にいれる数多くの因子に依存する。例えば機器が、追加の固体を十分溶解するのに必要な時間が増大する完全溶解点に接近するにつれてpHデータの速度が遅くなる。沈殿が完全に溶解した後でのみ、機器は残りのデータを迅速に収集する。典型的には、完全平衡溶解度データ採取には3乃至10時間を要する。化合物がより不溶解性であると(テンプレートに基づいて)予測されるほど、より長い評価時間となる。
【0034】
ビヨラム(Bjerrum)プロット
分析化学で一般的に知られているように、ビヨラムプロットはnH対pHからなるプロットであり、nHは物質の分子中の結合した水素の平均数である。ビヨラムプロットはいかなるpKa値もnHの半積分位置で、pH値で表す。各種の関連した平衡の上記の説明から理解されるように、沈殿の存在によってビヨラムプロットの移動を生じさせ、pKaAppとして表示される見掛けのpKa値を与え、酸に対してはより高い値、塩基に対してはより低い値に移動させる。このことが(a)ケトプロフェン(弱酸として作用する)、(b)プロパノロール(弱塩基として作用する)、(c)エナラプリル(両性電解質として作用する)の飽和溶液に対して図4に示される。
【0035】
固有溶解度S0は以下の関係式を適用して曲線の検討から推論でき、
logS0=log(C/2)−|pKaApp−pKa|
式中、Cはサンプル濃度である。
【0036】
溶解度―pHプロフィールおよびビヨラムプロットの他に、pSol法から得られる他のタイプのプロフィールは流量因子プロフィール(Flux Factor Profiles)である(例えば上掲Avdeef, A.、1998参照)。流量因子プロフィールは化合物のすべての種の濃度分率をpHの関数として示す図である。
【0037】
結晶化方法
結晶を得るために、図3に関して記載して前述した滴定の方向を逆にする。弱塩基化合物Bの場合、図5で示したように点4の手段によって低初期pH値で化合物の不飽和溶液から開始する。換言すれば、初期pH値および初期全濃度CTを、溶液中の化合物が主として、または全体的に荷電したBH+が存在するように選ばれる。図5から分かるように、初期全濃度CTは非電荷形Bの固有溶解度S0よりも大きい。
【0038】
その後、pH値が徐々に増加される。このことによりBH+のBへの脱プロトン化の増加に導くが、初期には固相の沈殿はない。点2’に到達すると滴定を止める。この目標点2’で、非電荷形の濃度が最大値[B]maxに達し、それは固有溶解度S0に等しい。それゆえ、目標の化合物の飽和溶液が到達され、実質的に飽和条件下で結晶化の実施に役立つことができる。
【0039】
目標点2’は、目標点2’で全濃度が図5に示すようにS0とS0+S+の間にある限り、溶解度−pHプロフィール上のいかなる場所で選べるであろう。例えば、ほぼ飽和の溶液、即ち、塩の溶解度S+の極わずか下の初期全濃度CTから開始し、溶解度−pHプロフィール上の関係する交点2’に到達するまで徐々にpH値を増加させる。
【0040】
しかしながら、実際上の制限によって、目標点2’に非常に正確に到達するのは困難かもしれない。もしあまりにも大量の塩基が添加されると、pH値が点2’に対応する目標pH値を超えて、過飽和溶液が形成される可能性がある。それゆえ、滴定は、わずかに不飽和溶液に対応する溶解度−pHプロフィールに極めて近い点で通常止められる。蓋のない瓶の中で溶液を保持し、溶媒の蒸発を遅くさせることにより、溶液の濃度がゆっくり増加し、実質的に飽和状態に到達する。これが結晶化の出発点である。以下、より詳細に論議するように、実質的に飽和条件下での結晶化には溶液系を常にできるかぎり溶解度−pHプロフィールに近づけるように保持する適切な手段を講じる必要がある。
【0041】
弱塩基の代わりに弱酸性化合物HAを取り扱う場合、適切な溶解度プロフィールは図2に示される一般的な外観を有する。それゆえ、上記の結晶化手順を弱酸に適応させる場合、一般的に高pH値での不飽和溶液から出発して溶解度−pHプロフィールの目標点に達するまでpH値を徐々に減少させる必要がある。
【0042】
両性電解質を取り扱う場合、原理的には極めて高いまたは極めて低いpH値から出発して溶解度−pHプロフィールの対応する部分の目標pH値に向かって移動する。
【0043】
沈殿のない状態で滴定のためビヨラムプロットを参照曲線として用いるのは役に立つ。この参照曲線を役立てて、溶解度プロフィールの点1および2’をビヨラムプロットで定義することができる。これをファモチジン、比較的低pH値での塩基としての挙動とみなす両性電解質に対して図6に示す。図6の実線は沈殿のない参照状況を表し、丸印は低いpH値から高いpH値に滴定によって得られたデータを示す。実験曲線は2つの異なる点で参照曲線と一致する。最初の点は溶解度プロフィールの点2’と同じである。それは溶液中の非電荷形の最大濃度の到達を示唆する。この点で、荷電形の濃度は依然高いままだが、非電荷形はその最大濃度に既に到達している。より不溶解形が得られる方向にpH値を変化させるために滴定を続けると、イオン形の濃度は下がるのが観察される。H+の損失とともに益々BH+は沈殿、B(s)に移行され、一方、非電荷形の濃度は一定に留まる。このことは実験および参照曲線の他の交点に到達するまで続く。この交点が溶解度プロフィールの点1と同じである。この点で、沈殿は完了し、イオン形はその最小濃度に到達し、ほぼ非電荷形のみが溶液中に存在する。点2’と点1の間で化合物は沈殿の存在のため、見かけのpKa値(即ち、pKaAPP)を示す。上述したように、pKaAPPは酸に対してより高い値、塩基に対してより低い値に移動する。
【0044】
実際上の考慮
飽和溶液で、即ち過飽和を避けて結晶化を実施することで、非晶質固体を形成するリスクが大きく減少する。それゆえ、飽和溶液を形成するために化合物の傾向を検討する方法があることは役に立つ。これは溶解度−pHプロフィールまたは得られたビヨラムプロットを滴定の逆方向を用いるpSol法と比較してなされるかもしれない。これはファモチジンを例として用い図6に示したビヨラムプロットを参照して説明される。図6の実験曲線は、不溶解形が主要である比較的高いpH値約11から出発して得られた。上記で既に説明したように、実験曲線が点1と点2’の間の範囲で参照曲線から逸脱するのは、沈殿の存在のためである。より高いpH値からより低いpH値に滴定することにより過飽和はない。
【0045】
もし滴定の方向が逆の場合、即ちファモチジンがその溶解性から不溶解形にpH値を増加して滴定される場合、実験的に決定されたビヨラム曲線は他の滴定方向で得られた実験的なビヨラム曲線からの一般的な逸脱を示すであろう。具体的には、過飽和によって生じる沈殿が目標点2’では開始せず、幾分高いpH値の点2”で開始するであろう。つまり、低いpH値から高いpH値への滴定に対する実験データは点2”に達するまで参照曲線に従うであろう。さらに、沈殿が開始する点2”で結晶化速度は非常に大きいので非晶質固体を形成する十分な可能性がある。
【0046】
従って、良好な結晶化結果を得るために、溶液中の非荷電化合物濃度をその固有溶解値に等しく保持するべきである。
【0047】
最も単純な方法において、目標点2’に近づき、それから前記溶媒の蒸発を遅らせながら、pH値を実質的に一定に単純に保持するだけで十分である。これは溶解した化合物の量が結晶の形態で収集される固体の量より十分大きい場合機能する。つまり、比較的大量の溶液を用い、比較的に少量の結晶を収集する必要がある。そこで結晶化は基本的に目標点2’でのみ実施されるだろう。
【0048】
しかしながら、大抵の状況では、できるだけ多くの結晶を収集することが望まれるであろう。このことは目標点2’に達した後、系は図5に示されるように溶解度プロフィールに沿って進展するであろうことを意味する。従って、pH値を濃度の変化に適合させる、またはその逆も同様である。
【0049】
実際に、これは非荷電形の濃度を固有溶解度より上の予め規定された範囲内で維持されるように、非荷電形の濃度を監視しpH値を規制することにより達成されるかもしれない。別な方法として、全濃度を予め決定した全溶解度プロフィールより上の予め規定された範囲内に維持するには化合物の全濃度を監視し、pH値を規制するかもしれない。
【0050】
これは電位差溶解度測定に用いられているように装置の適切な適合によってなされるかもしれない。溶液用の容器および前記溶液のpH値を測定するための適当なプローブに加えて、装置は管理された量の酸および塩基を前記溶液に添加する投与手段を含む。さらに、装置は溶液中に存在する少なくとも1つの化合物の形の濃度を測定するためのセンサー装置、およびpHプローブおよびセンサー手段から受け取った信号に応答して投与手段に作用するコントロールユニットを含む。投与手段は予め規定したプロフィールに合致するようpH値を規制するようにプログラムされる。
【0051】
好ましくは、容器はガラス製で磁気攪拌機のような攪拌手段を備える。当技術で知られる他のプローブが用いられるかもしれないが、pH値を測定するプローブは従来のガラス電極でよい。管理された量の酸および塩基溶液、例えば1NのHCl、NaOHまたはKOH溶液を添加する投与手段は、容器の中に導く分配ガラスチューブおよび適当な投与ユニットを含む。センサー手段は一般的に検出される種の同定に依存し、例えば、これらはUVまたは可視光測光的なプローブシステムでよい。コントロール手段は一般的に多くの信号入力チャネル、即ちpHプローブからの信号入力用でよく、センサー手段および他の監視装置、例えば温度装置を含む。さらに、コントロール手段はプログラム可能ユニット、要求された仕様を負荷する入力手段、特に溶解度プロフィールおよび特定の作業者指令の入力用手段を含むであろう。
【0052】
濃度効果
結晶化の間に蒸発させる際、得られる濃度変化は以下の式により、見かけのpKa値の移動を生じさせるであろう。
【数2】

【0053】
濃度の10倍の変化が約1対数単位分pKa値の見かけ移動に導く。これは図7に例証されるが、添加されたサンプルの異なる量での一連のビヨラムプロットを示す。弱酸(A)および弱塩基(B)、いずれも分子量300で固有溶解度が5μg/mL(pS0=4.8)および塩の溶解度75mg/mL(pSA,pSBH=0.6)。サンプル濃度は、(a)0.02mg/mL、(b)0.1mg/mL、(c)1.0mg/mL、(d)10mg/mL、(e)100mg/mLであった。図7に見られるように、サンプル濃度の増加につれて曲線は弱酸に対するpKaから上方に、弱塩基に対してpKaから下方に移動する。
【0054】
つまり、溶解度−pHプロフィールは見かけのpKa値、または化合物の全濃度に依存する。それゆえ、溶解度−pHプロフィールはpH値、化合物の全濃度を測定すること、適当な補正を適用することにより連続的に書き換えられるべきであり、弱塩基の場合には以下の式で与えられる。
【数3】

および
【数4】

【0055】
しかしながら、図7はある条件下、見かけのpKa値、または溶解度−pHプロフィール上の化合物の全濃度の影響が制限されることを示している。実際、濃度の変化は約5倍未満にすべきである。図8に示すように、滴定用に全濃度が約58mg/mLのコデインを用いる場合、沈殿はpH約7で始まる。滴定用に全濃度が約13mg/mLのコデインを用いる場合、沈殿はpH約8で始まる。それにもかかわらず、2つの溶解度−pHプロフィールは高pH値で重なるのが見られる。上記でさらに説明した結晶化手順において、溶解度−pHプロフィール上の目標点2’に非常に近い点でpH滴定を止めているので、溶液の全濃度は通常、開始から結晶が生じるまで5倍を超える変化はしない。これらの条件下、溶解度−pHプロフィールは溶液の濃度にほとんど依存しないとみなすことができる。
【図面の簡単な説明】
【0056】
【図1】弱塩基Bの溶解度−pHプロフィールを示す。
【図2】弱酸HAの溶解度−pHプロフィールを示す。
【図3】飽和溶液および適度な固体の量から始めて、高pH値から低pH値に滴定の経路に沿って図1による弱塩基の溶解度−pHプロフィールを示す。
【図4】(a)ケトプロフェン(酸性)、(b)プロパノロール(塩基性)、(c)エナラプリル(両性電解質)の飽和溶液のビヨラムプロットを示す。
【図5】不飽和溶液で低pH値から高pH値に滴定の経路に沿って図1による弱塩基の溶解−pHプロフィールを示す。
【図6】沈殿のない参照状況を示す実線と、丸印は低pH値から高pH値に滴定によって得られたデータであるファモチジンのビヨラムプロットを示す。
【図7】弱酸(A)および弱塩基(B)に対する(a)0.02mgL/mL、(b)0.1mg/mL、(c)1.0mg/mL、(d)10mg/mL、(e)100mg/mLの異なる物質濃度の一連のビヨラムプロットを示す。
【図8】異なる出発濃度を有するコデインの溶解度−pHプロフィールを示す。
【特許請求の範囲】
【請求項1】
弱酸性および/または弱塩基性化合物の結晶化方法であって、前記化合物が非荷電形および少なくとも1つの荷電形を有し、前記方法は、
a)溶媒中の前記化合物の溶液を、初期pH値および前記化合物の初期全濃度を有し、前記初期pH値は前記化合物が前記溶液中で主に前記荷電形で存在するように選択され、前記初期全濃度が前記非荷電形の固有溶解度より高く選択されるよう準備するステップと、
b)前記溶液のpH値を、前記溶液が実質的に飽和状態であり前記非荷電形の濃度が実質的に前記固有溶解度と等しくなる予め決定した目標pH値に到達するまで前記化合物の溶解度の減少に導く方向へ徐々に変化させるステップ、および
c)前記化合物の結晶形成をさせながら前記溶液を実質的に飽和状態に維持するステップを含むことを特徴とする、弱酸性および/または弱塩基性化合物の結晶化方法。
【請求項2】
前記ステップb)がさらに前記化合物の全濃度を高めることを含む、請求項1に記載の方法。
【請求項3】
前記ステップc)が前記溶媒の蒸発を遅らせながらpH値を実質的に一定に保持することを含む、請求項1に記載の方法。
【請求項4】
前記ステップc)が、前記非荷電形の濃度を前記固有溶解度より上の予め規定した許容範囲内に保持するよう前記非荷電形の濃度の監視およびpH値の規制を含む、請求項1に記載の方法。
【請求項5】
前記ステップc)が、前記化合物の全濃度を予め決定した全溶解度プロフィールより上の予め規定した許容範囲内に保持するよう前記化合物の全濃度の監視およびpH値の規制を含む、請求項1に記載の方法。
【請求項6】
請求項4または5に従った方法を実施する装置であって、
a)前記溶液用の容器と、
b)前記溶液のpH値を測定するプローブと、
c)前記溶液に管理された量の酸および塩基を添加するための投与手段と、
d)溶液中に存在する少なくとも1つの化合物の形の濃度を測定するためのセンサー、および
e)前記pHプローブおよび前記センサーから受け取った信号に応答して、前記投与手段が予め規定したプロフィールに合致するよう前記pH値を規制するようにプログラムされる前記投与手段に作用するコントロール手段を含むことを特徴とする装置。
【請求項1】
弱酸性および/または弱塩基性化合物の結晶化方法であって、前記化合物が非荷電形および少なくとも1つの荷電形を有し、前記方法は、
a)溶媒中の前記化合物の溶液を、初期pH値および前記化合物の初期全濃度を有し、前記初期pH値は前記化合物が前記溶液中で主に前記荷電形で存在するように選択され、前記初期全濃度が前記非荷電形の固有溶解度より高く選択されるよう準備するステップと、
b)前記溶液のpH値を、前記溶液が実質的に飽和状態であり前記非荷電形の濃度が実質的に前記固有溶解度と等しくなる予め決定した目標pH値に到達するまで前記化合物の溶解度の減少に導く方向へ徐々に変化させるステップ、および
c)前記化合物の結晶形成をさせながら前記溶液を実質的に飽和状態に維持するステップを含むことを特徴とする、弱酸性および/または弱塩基性化合物の結晶化方法。
【請求項2】
前記ステップb)がさらに前記化合物の全濃度を高めることを含む、請求項1に記載の方法。
【請求項3】
前記ステップc)が前記溶媒の蒸発を遅らせながらpH値を実質的に一定に保持することを含む、請求項1に記載の方法。
【請求項4】
前記ステップc)が、前記非荷電形の濃度を前記固有溶解度より上の予め規定した許容範囲内に保持するよう前記非荷電形の濃度の監視およびpH値の規制を含む、請求項1に記載の方法。
【請求項5】
前記ステップc)が、前記化合物の全濃度を予め決定した全溶解度プロフィールより上の予め規定した許容範囲内に保持するよう前記化合物の全濃度の監視およびpH値の規制を含む、請求項1に記載の方法。
【請求項6】
請求項4または5に従った方法を実施する装置であって、
a)前記溶液用の容器と、
b)前記溶液のpH値を測定するプローブと、
c)前記溶液に管理された量の酸および塩基を添加するための投与手段と、
d)溶液中に存在する少なくとも1つの化合物の形の濃度を測定するためのセンサー、および
e)前記pHプローブおよび前記センサーから受け取った信号に応答して、前記投与手段が予め規定したプロフィールに合致するよう前記pH値を規制するようにプログラムされる前記投与手段に作用するコントロール手段を含むことを特徴とする装置。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【公開番号】特開2007−69208(P2007−69208A)
【公開日】平成19年3月22日(2007.3.22)
【国際特許分類】
【出願番号】特願2006−233790(P2006−233790)
【出願日】平成18年8月30日(2006.8.30)
【出願人】(504412406)エフ.ホフマン−ラ・ロッヒェ・アクチェンゲゼルシャフト (4)
【氏名又は名称原語表記】F.HOFFMANN−LA ROCHE AG
【Fターム(参考)】
【公開日】平成19年3月22日(2007.3.22)
【国際特許分類】
【出願日】平成18年8月30日(2006.8.30)
【出願人】(504412406)エフ.ホフマン−ラ・ロッヒェ・アクチェンゲゼルシャフト (4)
【氏名又は名称原語表記】F.HOFFMANN−LA ROCHE AG
【Fターム(参考)】
[ Back to top ]

