強心配糖体を用いた癌の化学療法における治療応答の確率を求める方法
予後アッセイ及びキット並びにその使用方法が供される。キット及びアッセイは、過剰な細胞増殖に関連した病因を有する疾病において、疾病にかかった細胞又は組織が、強心配糖体を用いる治療に対する治療応答を有する可能性を求めるために使用される。キット及びアッセイは、疾病にかかった細胞又は組織から得られるNa、K−ATPアーゼのα−サブユニットのアイソフォーム比を求めるために使用される。キットは、対象物における癌又は腫瘍の、強心配糖体を用いた治療に対する治療応答を予測するために使用できる。キット及びアッセイは、過剰な細胞増殖に関連した病因を有する疾病又は疾患を、強心配糖体を含む組成物を用いて治療する方法中に組みむことができる。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、強心配糖体を用いた癌の化学療法における予後を決定する方法に関する。特に、本発明は過剰な細胞増殖に関連した病因を有する、インビトロの又はインビボの細胞の疾病又は疾患が、強心配糖体を用いた治療に治療応答性であるか否かの確率を求める方法に関する。
【背景技術】
【0002】
過剰な細胞増殖に関連した病因を有する多くの疾病又は疾患は命にかかわる。これらの最も共通的なものが癌及び腫瘍である。しかしながら、癌ではない増殖性疾患も生命を脅かすものであり得て、又は生活の質の低下に繋がり得る。これらには、例えば:1)抗原誘発性の関節炎及びアレルギー性脳脊髄炎などの自己免疫疾患、2)関節リュウマチ、全身発症型若年性慢性関節炎、骨粗鬆症及び乾癬などの慢性炎症性増殖性疾患、3)線維嚢胞性疾患を含む乳房の増殖性疾患、4)良性前立腺肥大症(BPH)を含む前立腺の増殖性疾患、5)増殖性糖尿病性網膜症を含む目の増殖性疾患、及び6)アテローム性動脈硬化症及び冠動脈狭窄を含む血管増殖性疾患が挙げられる。これらの疾病又は疾患に対する治癒的な又は改善的な療法を開発するために多くの努力がなされてきた;しかしながら、種々の異なる癌、腫瘍及び他のタイプの増殖性疾患に対して有効であると証明されてきた多くの化学療法的方法があるものの、包括的又は万能的な治癒的療法は全く開発されていない。
【0003】
化学療法剤は、個々の患者のニーズに合わせる療法を開発する試みにおいて、臨床医によって個々に又は組み合わされて処方される。そうではあっても、これらのオーダーメードの療法の開発に向けた主要な障害物は、特定の癌又は腫瘍の発現型に対する化学療法剤の有効性の非予測性である。臨床医は、行き当たりばったりのやり方を使用することによって、これらの命にかかわる疾病に対処することを強いられる。彼らは、特定の化学療法剤の認められた又は指示された使用の歴史的レビューに頼り、そして次に、特定の単一化学療法剤又は化学療法剤の組み合わせが、臨床医が治癒を試みている癌又は腫瘍に対して治療上有効であろうか否かについて思索又は推定をせざるを得ない。そのような従来法は病院において限られた成功しか収めていない。
【0004】
臨床医は、特定の癌又は腫瘍の表現型が、特定の単一化学療法剤又は化学療法剤の組み合わせに対して治療応答性があるか否かを、幾つかの合理的なレベルの確実性で予測し得る予後アッセイを必要としている。このタイプの予後アッセイは、臨床環境に登場したばかりのものなどの、限られた使用の歴史しか有しない化学療法剤に対して極めて有用である。一つ又はそれ以上のそのような化学療法剤に対してそのような予後アッセイを有することは、臨床医によって極めて便益があるあろう。
【0005】
患者のデータの前臨床試験及び遡及検査によって、例えば、乳房、肺、前立線及び白血病を含む種々の癌の治療において、強心配糖体(例えば、ブファリン、ジゴキシン、ジギトキシン、ウアバイン及びオレアンドリン)の潜在的価値が示唆されている。
【0006】
強心配糖体の作用の薬理学的メカニズムの一つには、イオン交換ポンプであるNa、K−ATPアーゼに対する結合能力、及びこの特定の酵素の活性の阻害能力が挙げられる。細胞膜を横切ってNa+及びK+の活発な輸送を触媒する膜貫通蛋白質であるNa、K−ATPアーゼは、強心配糖体に対するよく確立された薬理学的レセプターである。この酵素はATPを加水分解し、そしてその電気化学的勾配に抗して細胞内へのK+、細胞外へのNa+の輸送を駆動するために自由エネルギーを用いる(非特許文献1)。
【0007】
Na、K−ATPアーゼは二つのヘテロ二量体サブユニット、触媒的α−サブユニット及びグリコシル化β−サブユニットから構成されている。γサブユニットもあるが、それは詳細には研究されていない。α−サブユニットは、ATP、Na+、K+及び強心配糖体に対する結合部位を有する。β−サブユニットは触媒的α−サブユニットを安定化するよう機能し、そして調節的役割も果たし得る。四つの異なるαアイソフォーム(α1、α2、α3、α4)及び三つの異なるβサブユニット(β1、β2、β3)が哺乳類の細胞において同定されている。各々のタイプの相対的発現は、正常な状態及び疾病の状態において著しく変わる。αアイソフォームの発現は、組織のタイプに特異的であり、そして齧歯動物及びヒトの組織の間で変わる(非特許文献2)。腎臓、肺、肝細胞、及び結腸などのヒトの癌におけるNa、K−ATPアーゼアイソフォームの変化した発現も、対応する正常な組織におけるそれらと対照させて報告されている(非特許文献3;非特許文献4;非特許文献5;非特許文献6)。加えるに、異なるαアイソフォームに対する強心配糖体の見かけの親和性は非常に異なる。α1アイソフォームに対する強心配糖体の結合は、このタイプの薬剤による阻害に対して250倍又はそれより高い感度があるα2及びα3アイソフォームと一緒に生じるそれよりも少ない(非特許文献7)。(非特許文献8)には、正常な結腸直腸細胞と比べ、ヒトの結腸直腸癌細胞においてα3サブユニットアイソフォームの発現が増加することが報告されている。
【0008】
オレアンドリン及びオレアンドリゲニンは、少なくとも部分的に、Na、K−ATPアーゼの阻害を介する細胞内Ca2+の増加のせいであるアポトーシスの誘発を通して、ヒトの前立腺癌細胞の増殖を阻害する(非特許文献9)。オレアンドリン及びオレアンドリゲニンは、膜相互作用及びNa、K−ATPアーゼ活性の阻害を通した線維芽細胞増殖因子−2の搬出も阻害する(非特許文献10)。
【0009】
α1β1複合体は「ハウスキーピング」遺伝子と考えられる故に、Na、K−ATPアーゼサブユニットα1は多くの組織中に存在する一方、α3は励起され得る組織、腎皮質、髄質、及び乳頭、並びに神経組織において主として検出される。
【0010】
Nerium oleanderは、亜熱帯アジア、米国南西部及び地中海において広く分布している観賞植物である。その医学的及び毒物学的な性質は長い間、認識されてきた。それは、例えば、痔、潰瘍、ハンセン病、ヘビ咬傷の治療、及び流産の誘発においてさえも使用されてきた。セイヨウキョウチクトウの抽出物の重要な成分であるオレアンドリンは、ヒト腫瘍細胞の増殖の強力な阻害剤である(非特許文献11)。オレアンドリンに仲介される細胞死はカルシウムの流入、ミトコンドリアからのシトクロムCの放出、カスパーゼ8及び3の蛋白分解プロセス、ポリ(ADP−リボース)ポリメラーゼの切断、及びDNAの断片化と関連する。
【0011】
オレアンドリンはNerium oleanderの主要な細胞毒成分であることが示されている(非特許文献12)。オレアンドリンは、外因性であり、そして通常、体の中に存在しない強心配糖体である。オレアンドリンはヒトにおいてアポトーシスを誘発するが、マウスでは腫瘍細胞株ではなく(非特許文献13)、NF−κBの活性化を阻害し(非特許文献14)、そして部分的にカルシウムに媒介されたシトクロムCの放出を通して細胞死を媒介する(非特許文献15)。最近、セイヨウキョウチクトウの熱水抽出物(すなわち、Anvirzel(商標))のフェーズIトライアルが完了した(非特許文献16)。セイヨウキョウチクトウ抽出物は1.2ml/m2/dまでの用量で安全に投与できると結論付けられた。用量制限毒性は全く見出されなかった。
【0012】
体に対して内因性の強心配糖体であるウアバインが、A549ヒト肺腺癌細胞のインビトロの放射線感受性を向上させるが、正常なヒトの肺線維芽細胞の放射線応答の改質においては効果がないことが報告された(非特許文献17)。続いて、ウアバインは、扁平上皮癌及びメラノーマを含む、異なる組織学タイプのヒト腫瘍細胞を放射線増感させることが示された(非特許文献18)。強心配糖体レアンドリンも、イオン化放射の細胞毒作用に対する細胞の感度を向上させる能力を有する((特許文献1)及び(非特許文献19))。(特許文献2)は、オレアンドリンの投与による癌の治療における放射線治療の向上を開示している。
【0013】
非特許文献20は、ウアバイン及びジギタリスのような強心配糖体が、Na+、K+−ATPアーゼ阻害剤及びERアンタゴニストの両方として、抗乳癌薬の開発に向けて有用であろうと示唆している。
【0014】
非特許文献21は、ANVIRZEL及びその主要な強心配糖体成分オレアンドリンが腫瘍増殖因子である線維芽細胞増殖因子−2(FGF−2)の、前立腺癌細胞株PC3及びDU145からの搬出を阻害することを報告している。
【0015】
非特許文献22は、オレアンドリンを用いたヒト悪性メラノーマBRO細胞のインキュベーションによって、ミトコンドリアの損傷、細胞グルタチオン(GSH)プールの損失、及び最終的には腫瘍細胞死を媒介する活性酸素種であるスーパーオキシドアニオンラジカルの時間依存性形成がもたらされることを報告している。
【0016】
ネリウム(Nerium)種の植物からのグリコシドの抽出により、ネリウム オレアンダー(Nerium oleander)からの薬理学的に/治療的に活性な成分が供されてきた。これらの中には、オレアンドリン、ネリネ、及び他の強心配糖体化合物がある。植物抽出物は動物における細胞増殖性疾患の治療において有用である。ネリウム オレアンダー(Nerium oleander)の熱水抽出によって得られる、商標ANVIRZEL(商標)として販売されているオレアンドリン抽出物は、市販品として入手可能であり、そしてネリウム オレアンダー(Nerium oleander)の熱水抽出の濃縮形態又は粉末化された形態を含む。
【0017】
Huachansuは、ヒキガエルの皮膚から得られる抽出物であり、そしてそれは強心配糖体であるブファリンのようなブファジェノリドを含む。HuaChanSuは、中国において癌の治療に対して承認薬である。それは、肝臓、胃、肺、皮膚及び食道癌を含む種々の癌を治療するために使用されてきた。
【0018】
細胞増殖に関連した病因を有する疾病又は疾患の治療における強心配糖体の重要な有用性に鑑み、強心配糖体に対する疾病又は疾患の治療応答を予測する方法の必要性が残っている。そのような方法は、従来技術によって全く開示されても示唆されてもいない。
【先行技術文献】
【特許文献】
【0019】
【特許文献1】米国特許出願 第10/957,875号公報、Newmanら
【特許文献2】米国特許付与前出願公告第20050112059号公報、Newmanら
【非特許文献】
【0020】
【非特許文献1】Hauptman, P. J., Garg, R.,及びKelly, R.A.「次の千年における強心配糖体」(Cardiac glycosides in the next millieum)、 Prog. Cardiovasc. Dis. 41: 247-254, 1999
【非特許文献2】Blanco, G. 及びMercer, R.W.「Na、K−ATPアーゼのイソザイム:構造における不均一性、機能における多様性」(Isozymes of the Na, K-ATPアーゼ: heterogeneity in structure, diversity in function)、 Am. J. Physiol. 275 (Renal Physiol. 44): F633-F650, 1998
【非特許文献3】Rajasekaran, S.A., Ball, W.J., Bander, N.H., Pardee, J.D.及びRajasekaran, AK.「ヒトの正常細胞、腎臓細胞癌腫におけるNa、K−ATPアーゼのβ サブユニットの低下した発現」(Reduced expression of beta subuniからf Na/K-APTアーゼ in human clear cell renal cell carcinoma)、 J. Urol. 162: 574-580, 1999
【非特許文献4】Avila, J., Lecuona, E., Morales, M., Soriano, A., Alonso, T.及びMartin-Vasallo, P.「胃及び結腸の腺癌におけるヒトNa、K−ATPアーゼのβ−1アイソフォームの逆の発現パターン」(Opposite expression pattern of the human Na/K-ATPアーゼ beta-1 isoform in stomach 及び colon adenocarcinomas)、 Ann. N. Y. Acad. Sci. 834: 633-635, 1997
【非特許文献5】Espineda, C., Seligson, D.B., Ball, W.J., Rao, J., Palotie, A., Horvath, S., Huang, Y., Shi. T及びRajasekaran, A.K.「組織マイクロ配列を用いた膀胱癌のNa、K−ATPアーゼのα−及びβ−サブユニット発現プロファイルの分析」(Analysis of the Na, K-ATPアーゼ α- 及びβ-subunit expression profiles of bladder cancer using tissue microarrays)、Cancer 97: 1851868, 2003
【非特許文献6】Jung, M.H., Kim,S.C., Jeon, G.A., Kim, S.H., Kim, Y., Choi, K.S., Park, S.I., Joe, M.K.,及びKimm, K.「正常及び腫瘍のヒト胃組織において差動的に発現された遺伝子の同定」(Identification of differentially expressed genes in normal 及び tumor human gastric tissue)、 Genomics 69: 281-286, 2000
【非特許文献7】Blanco, G.及びMercer, R.W.「Na、K−ATPアーゼのイソザイム:構造における不均一性、機能における多様性」(Isozymes of the Na, K-ATPアーゼ: heterogeneity in structure, diversity in function)、 Am. J. Physiol. 275 (Renal Physiol. 44): F633-F650, 1998
【非特許文献8】Sakaiら、(FEBS Letters 563: 151-154, 2004)
【非特許文献9】McConkey, D.J., Lin, Y., Nutt, L.K., Ozel, H.Z.,及びNewman, R.A.「強心配糖体が、アンドロゲンに依存しない、転移性ヒト前立腺腺癌細胞におけるCa2+の増加及びアポトーシスを刺激する」(Cardiac glycosides stimulate Ca2+ increアーゼs and apoptosis in androgen-independent, metastatic human prostate adenocarcinoma cells)、 Cancer Res. 60: 3807-3812, 2000
【非特許文献10】Smith, J.A., Madden, T., Vijjeswarapu, M.,及びNewman, R.A.「Anvirzel及びその強心配糖体成分であるオレアンドリンによる、前立腺癌細胞株PC3及びDU145からの線維芽細胞増殖因子−2(EGF−1)の搬出の阻害」(Inhibition of export of fibroblast growth factor-2 (EGF-1) from the prostate cancer cell lines PC3 and DU145 by Anvirzel and its cardiac glycoside component, oleandrin)、 Biochem. Pharmacol. 62: 469-472, 2001
【非特許文献11】Afaq F et al, Toxicol. Appl. Pharmacol. 195:361-369, 2004
【非特許文献12】Newman et al, J. Herbal Pharmacotherapy, vol. 13, pp. 1-15, 2001
【非特許文献13】Pathak et al、 Anti-Cancer Drugs, vol. 11, pp. 455-463, 2000
【非特許文献14】Mannaら、Cancer Res., vol. 60, pp. 3838-3847, 2000
【非特許文献15】McConkeyら、Cancer Res., vol. 60, pp. 3807-3812, 2000
【非特許文献16】Mekhail et al、 Am. Soc. Clin. Oncol., vol. 20, p. 82b, 2001
【非特許文献17】Lawrence, Int. J. Radiaからncol. Biol. Phys., vol. 15, pp. 953-958, 1988
【非特許文献18】Verheye-Dua et al、 Strahlenther. Onkol., vol. 176, pp. 186-191, 2000
【非特許文献19】Nasu et al, Cancer Lett. Vol 185, pp.145-151, 2002
【非特許文献20】Chen et al, Breast Cancer Research and Treatment、 (2006), 96, 1-15
【非特許文献21】Smith et al,Biochemical Pharmacology (2000), 62, 1-4
【非特許文献22】Newman et al,J. Experimental Therapeutics and Oncology (2006), 5, 167-181
【発明の概要】
【発明が解決しようとする課題】
【0021】
本発明は、過剰な細胞増殖に関連した病因を有する疾病又は疾患の特別な表現型に対して、強心配糖体の、又は強心配糖体を含有する組成物の有効性を予測する方法を供する。本発明者らは、そのような疾病又は疾患の、強心配糖体を用いる治療に対する感度又は治療応答が、疾病又は増殖性疾患を有する細胞又は組織中の、Na、K−ATPアーゼサブユニットのα1アイソフォーム発現に対するα3アイソフォームの比に依存することを見出した。一般に、細胞又は組織において、Na、K−ATPアーゼのα1アイソフォーム発現に対するα3アイソフォームの比が高いほど、それらの細胞が強心配糖体に対してより敏感(治療応答性)になる。つまり、α1(薬剤感受性でない)アイソフォームに対するα3アイソフォーム(薬剤感受性)の比がより高いほど、細胞又は組織が強心配糖体による増殖の阻害に対してより敏感になるであろう。
【課題を解決するための手段】
【0022】
本発明の一つの態様は、強心配糖体又は強心配糖体を含む組成物を用いる治療に対する、過剰な細胞増殖に関連した病因を有する疾病又は疾患のインビボの治療応答性を予測するために有用なインビトロの予後アッセイを供することであり、
該アッセイが:
過剰な細胞増殖に関連した病因を有する疾病又は疾患を持つ対象物の疾病にかかったインビボの細胞組織から直接的に又は間接的に得られるサンプル中のNa、K−ATPアーゼのα−サブユニットのα1アイソフォームに対するα3アイソフォームの比を求めること、ここでサンプルはNa、K−ATPアーゼのαサブユニットの一つ又はそれ以上のアイソフォームを含む;及び
対象物が強心配糖体の治療上適切な用量を用いて治療されるとして、対象物における治療応答の確率を求めることを含む。
【0023】
幾つかの実施態様において:1)アッセイは、もし、比が少なくとも1以上であれば、細胞組織が、強心配糖体を用いた治療に対して治療的に応答性であろうと予測することを更に含む;2)アッセイは、もし、比が0.5から1.0の範囲内であれば、細胞組織が、強心配糖体を用いた治療に対して治療的に少なくとも部分的に応答性であろうと予測することを更に含む;3)アッセイは、もし、比が0.3未満であれば、細胞組織が、強心配糖体を用いた治療に対して実質的に治療的に非応答性であろうと予測することを更に含む;4)アッセイは、1から100の範囲内のα−サブユニットアイソフォーム比を有する疾病にかかった組織が、1未満のα−サブユニットアイソフォーム比を有するものよりも治療的により応答性であろうと予測することも更に含む;5)アッセイは、検出できるα3アイソフォームのみを有し、そして検出できるα1アイソフォームを有しないそれらの組織が、強心配糖体に最も治療的に応答性であろうと予測することを更に含む;及び/又は6)アッセイは、もし、比が≧2、≧3、≧4、≧5、≧7、≧9、≧10、≧15、≧20、≧25、≧40、≧50、≧75、又は≧100であれば、細胞組織が、強心配糖体を用いた治療に対して治療的に少なくとも部分的に応答性であろうと予測することを更に含む。
【0024】
幾つかの実施態様において、治療応答があるであろう確率が、下表に記載のNa、K−ATPアーゼのα1アイソフォームに対するα3アイソフォームの比と関連する:
【表1】

【0025】
上の表において、治療応答は部分的又は完全な治療応答又は進行までの遅延時間であり得る。
【0026】
幾つかの実施態様において:1)比を求める工程は、インビトロのサンプル又は生検標本中のNa、K−ATPアーゼのα3サブユニットアイソフォーム及びNa、K−ATPアーゼのα1サブユニットアイソフォーム各々の発現レベルを定量すること、並びにその比を計算することを含む;2)比を求める工程は、インビトロのサンプル中のNa、K−ATPアーゼのα1サブユニットアイソフォームの量に対する、Na、K−ATPアーゼの各α3サブユニットアイソフォームの量を求めること、並びにその比を計算することを含む;3)アッセイは、それから比が求められるデータについて統計解析を実行することを更に含む;4)サンプルは、細胞組織、細胞の塊、細胞溶解物、これらから調製された膜標本、又はそれらの固定された組織病理学スライドである;5)サンプルは、インビトロのサンプルである;6)サンプルは、Na、K−ATPアーゼのαサブユニットの少なくとも二つのアイソフォームを含む;7)サンプルは、少なくともNa、K−ATPアーゼのαサブユニットのα1及びα3アイソフォームを含む;8)本法は、細胞、組織又は生検標本を溶解又は破壊すること;又はサンプルを形成するために、疾病にかかったインビボの細胞組織から組織病理学的検査のために組織切片を固定することを更に含む;9)本法は、サンプル中のNa、K−ATPアーゼのα1サブユニットアイソフォームに対する、Na、K−ATPアーゼのα3サブユニットアイソフォームの量及び相対的発現を求めるために、サンプルについてウエスタンブロット法及び/又は免疫組織化学染色法を実施すること、及びその比を計算することを含む;10)本法は、サンプル中のNa、K−ATPアーゼのα1サブユニットアイソフォームの含量に対する、Na、K−ATPアーゼのα3サブユニットアイソフォームの含量を求めるために、ゲルの放射分析又は濃度分析を行うことを更に含む;11)本法は、サンプル中のNa、K−ATPアーゼのα1サブユニットアイソフォームの及び、Na、K−ATPアーゼのα3サブユニットアイソフォームの存在を検出しそして含量を定量するために、ゲルの放射分析又は濃度分析を行うことを含む;12)ポジティブコントロールサンプル及び/又はネガティブコントロールサンプル中の、Na、K−ATPアーゼのα3サブユニットアイソフォームの及び/又はNa、K−ATPアーゼのα1サブユニットアイソフォームの含有量に対する、サンプル中のNa、K−ATPアーゼのα3サブユニットアイソフォームの及びNa、K−ATPアーゼのα1サブユニットアイソフォームの含有量を比較すること;及び/又は13)コントロールとして、α3サブユニット及びα1サブユニットのただ一つの発現が生じることが知られている組織サンプル中の、Na、K−ATPアーゼのα3サブユニットアイソフォームの及びNa、K−ATPアーゼのα1サブユニットアイソフォームの含有量を比較すること。
【0027】
幾つかの実施態様において:1)疾病にかかった細胞組織は、哺乳動物のような対象物から得られる;2)疾病にかかった細胞組織は、商業的価値の有無に拘わらず、ヒト、牛、犬、猫、馬、豚又は他の家畜から得られる;3)過剰な細胞増殖に関連した病因を有する疾病又は疾患は、癌若しくは腫瘍、又はヒト若しくは動物の生活の質に悪影響を及ぼす他の増殖性疾患である;及び/又は4)癌又は腫瘍は、結腸直腸癌、頭頚部癌、副腎皮質癌、肛門癌、胆管癌、膀胱癌、骨癌、骨転移、骨肉腫、脳腫瘍、乳癌、子宮頸癌、非ホジキンリンパ腫、直腸癌、食道癌、目の癌、胆嚢癌、消化管カルチノイド、妊娠性絨毛性疾患、ホジキン病、カポジ肉腫、腎癌、喉頭癌及び下咽頭癌、肝癌、肺癌(非小細胞癌及び小細胞癌の両方)、肺カルチノイド腫瘍、悪性中皮腫、転移性癌、多発性骨髄腫、骨髄異形成症候群、鼻腔癌及び副鼻腔癌、鼻咽頭癌、神経芽細胞腫、中枢神経系の新生物、口腔癌及び中咽頭癌、骨肉腫、卵巣癌、膵臓癌、陰茎癌、下垂体癌、前立腺癌、網膜芽細胞腫、唾液腺癌、肉腫、皮膚癌、胃癌、精巣癌、胸腺癌、甲状腺腫瘍、尿管癌;子宮肉腫、膣癌、外陰癌又はウィルムス腫瘍から成るグループから選ばれる。
【0028】
幾つかの実施態様において:1)本法は、過剰な細胞増殖に関連した病因を有する疾病又は疾患を持つ対象物を同定することを更に含む;2)本法は、対象物から疾病にかかった細胞のサンプルを得ることを更に含む;3)本法は、Na、K−ATPアーゼのα−サブユニットのα1アイソフォーム及びα3アイソフォームに対するアッセイを如何に実行するかを特定する情報を供することを含む;及び/又は4)本法は、予後データを如何に解釈するかを詳細に示す情報を供することを含む。
【0029】
幾つかの実施態様において、増殖性疾患は、制限されるものではないが:1)抗原誘発性の関節炎及びアレルギー性脳脊髄炎などの自己免疫疾患;2)関節リュウマチ、全身発症型若年性慢性関節炎、骨粗鬆症及び乾癬などの慢性炎症性増殖性疾患;3)線維嚢胞性疾患を含む乳房の増殖性疾患;4)良性前立腺肥大症(BPH)を含む前立腺の増殖性疾患;5)増殖性糖尿病性網膜症を含む目の増殖性疾患;及び6)アテローム性動脈硬化症及び冠動脈狭窄を含む血管増殖性疾患から成るグループから選ばれる。幾つかの実施態様において、二つ又はそれ以上の増殖性疾患が同時に治療されている。
【0030】
ヒト腫瘍細胞株を用いた実験室での研究に基づいて、強心配糖体を用いた治療に特に応答すると信じられる癌には、前立腺癌、肺癌、 乳癌、膀胱癌、骨肉腫、脳腫瘍 (多形神経膠芽腫)及び結腸癌が挙げられる。これらの癌はヒト、非ヒトつまり動物に由来するものであり得る。
【0031】
幾つかの実施態様において:1)強心配糖体は、オレアンドリン、ウアバイン、ブファリン、ジギトキシン、ジゴキシン、シノブファタリン(cynobufatalin)、シノブファギン(cynobufagin)及びレジブフォゲニンから成るグループから選ばれる;2)植物若しくは動物源の抽出を通して得られるもの、合成されるもの又は入手可能な強心配糖体の化学的改質(例えば、誘導体化)を通して製造されるものかに拘わらず、強心配糖体は純粋な形態で存在する;3)強心配糖体は、抽出物中に存在する;4)強心配糖体は製剤処方又は組成物中に存在する;5)強心配糖体はセイヨウキョウチクトウ植物群から得られる;6)セイヨウキョウチクトウ植物群は、Nerium oleanderなどのNerium種、又はThevetia nerifolia(別名、yellow oleanderとして知られている)などのThevetia種を含む;及び/又は7)強心配糖体抽出物は、場合によりモディファイヤーの存在下で、超臨界流体(SCF)抽出によって製造される。
【0032】
幾つかの実施態様において:1)SCF抽出物は、強心配糖体とは別に、少なくとも一つの他の薬理学的活性剤を更に含む;2)抽出物が対象物に投与されるときに、他の活性剤は強心配糖体の治療効果に寄与し得る;3)他の活性剤は、強心配糖体の治療効果に寄与するために追加的に又は相乗的に機能する;及び/又は4)抽出物はヒキガエルの皮膚又はそれから由来する分泌物から得られる。
【0033】
本発明の別の態様は、本発明の予後アッセイを実行する際に使用するのに適しているキットを供する。キットは: a)Na、K−ATPアーゼのα3サブユニットアイソフォームに対する結合親和性を有する第一の一次抗体;及びb)Na、K−ATPアーゼのα1サブユニットアイソフォームに対する結合親和性を有する第二の一次抗体;を含む。キットは、ウエスタンブロットゲル電気泳動分析を実施する際の使用に及び/又は免疫組織化学染色法を実施するために適応され得る。
【0034】
キットは場合によりa)溶解組成物;b)Na、K−ATPアーゼのα3サブユニットアイソフォームを含むポジティブコントロールサンプル;c)Na、K−ATPアーゼのα3サブユニットアイソフォーム及びNa、K−ATPアーゼのα1サブユニットアイソフォームを含むポジティブコントロールサンプル;d)Na、K−ATPアーゼのα1サブユニットアイソフォームを含み、そしてNa、K−ATPアーゼのα3サブユニットアイソフォームを含まないネガティブコントロールサンプル;e)第二抗体、ヤギの抗マウスIgG−HRP(これは、例えば、関心ある蛋白質の可視化のために使用され得る);f)ゲル電気泳動分析に適しているゲル形成材料;g)放射線標識マーカー;h)キットの使用及び予後アッセイの性能に対する指示;i)濃度計及び線量計;j)水系液体培地;k)ゲル/膜製造キット;l)ブロッキング溶液;m)洗浄緩衝液;n)ウェスタンブロット解析キットを含む材料;又はo)それらの組み合わせ;を更に含む。
【0035】
キットの幾つかの実施態様において:a)第一の一次抗体は、Na、K−ATPアーゼのα3サブユニットアイソフォームに対して特異的結合親和性を有する;b)第二の一次抗体は、Na、K−ATPアーゼのα1サブユニットアイソフォームに対して特異的結合親和性を有する;c)第二抗体は、ヤギαマウスIgG西洋ワサビペルオキシダーゼであり、又は西洋ワサビペルオキシダーゼのような適切なマーカーを付けられたマウスIgGに抗して産生されたマウス以外の種からの他の第二抗体を含む;及び/又はd)一次抗体は、モノクロナール抗体である。
【0036】
幾つかの実施態様において、免疫組織化学染色法キットは:a)抗原アンマスキング溶液;b)緩衝液;c)内因性ペルオキシド活性のクエンチング物質;d)抗Na、K−ATPアーゼのα3サブユニットアイソフォーム抗体、及び抗Na、K−ATPアーゼのα1サブユニットアイソフォーム抗体;e)非免疫性マウスIgGI抗体;f)抗ウサギIgG及び抗マウスIgGの試薬の混合物を含むユニバーサル抗体試薬;g)ジアミノベンジジンのような主要な化学的染色剤;h)ヘマトキシリンまたはエオシンのような一般的な化学的でない染色剤;i)核を染色するために使用するもの(例えば、臭化エチジウム、ビスベンズイミダゾール又は硫酸アルミニウムカリウム)又はミトコンドリア(例えば、Mito tracker red、10−ノニルアクリジンオレンジ)のような特定細胞小器官染色剤;j)免疫組織化学的染色キットを含む材料;又はk)それらの二つ又はそれ以上の組み合わせ;を含む。組織又は細胞の隣接切片を用いて、α1サブユニットのアイソフォームの染色が、そこにおいてα1サブユニットのアイソフォーム及びα3サブユニットのアイソフォームに対する適切な特定の一次抗体が使用される、α3サブユニットのアイソフォームの染色に対して使用されたものと同様の方法で実施され得る。本明細書において使用されるように、特定細胞小器官染色剤は、細胞(ヒト、非ヒト、つまり動物)における小器官(ミトコンドリア、核、核小体、ゴルジ装置、空胞等)の特別なタイプを特異的に染色するために使用される試薬、又は試薬の組み合わせである。
【0037】
幾つかの実施態様において、免疫組織化学染色法は:a)哺乳動物の組織のサンプルを供すること;b)サンプル中に存在するNa、K−ATPアーゼのα−サブユニットのα3アイソフォーム及びα1アイソフォームを免疫化学的に染色すること;c)サンプル中のNa、K−ATPアーゼのα3アイソフォームの含有量及びNa、K−ATPアーゼのα1アイソフォームの含有量を求めること;及び d)サンプル中に存在するα1アイソフォームに対するα3アイソフォームの比を求めること;の工程を含む。
【0038】
幾つかの実施態様において、免疫組織化学染色法は:a)哺乳類の組織のサンプルを供する;b)組織について抗原検索手順を実施する;c)組織における内因性ペルオキシド活性をクエンチングする;d)クエンチングされた組織を抗Na、K−ATPアーゼのα3サブユニットアイソフォーム及び/又は抗Na、K−ATPアーゼのα1サブユニットアイソフォームの一次抗体に曝露する;e)抗体処理された組織を第二抗ウサギIrG、抗マウスIrGの抗体、又はそれらの組み合わせに曝露する;f)IgG処理された組織を主要染色剤に曝露する;g)免疫組織化学的に染色された組織を形成するために、染色された組織を対比染色剤に曝露する;h)免疫組織化学的に染色された組織を目視又は写真手段によって分析する;及びi)哺乳類の組織中に存在するα3及び/又はα1アイソフォームの量を定量する工程を含む。例えば、もし第二抗体がビオチン化されていれば、アイソフォーム抗体の染色の定量がなされ得る。次いで、Vectastatin ABC染色剤が追加され、そして30分間、インキュベーションされ得る。染色された切片の洗浄に続いて、適切な染色レベルを展開するために、それらは次にジアミノベンジジン基材を用いてインキュベーションされる。次いで、染色された組織の定量は、染色の強度をグレード付けすることによって手動で、又は関心分野のコンピュータ画像取り込み及びデジタルスキャンを用いて電子的に実施され得る。定量化は、市販のデジタル画像ソフトウエアを用いて更に容易にし得る。幾つかの実施態様において、アッセイは更に:j)工程a)から得られる組織を洗浄する;k)工程c)から得られる組織を洗浄する;l)「非一次」コントロールとしてネガティブコントロール切片(腫瘍又は癌を有しないもの)を供する;m)非免疫性マウスIgGI抗体を持ったネガティブコントロール切片をに曝露する;n)工程e)から得られる組織を洗浄する;o)工程f)から得られる組織を洗浄する;及び/又は工程g)から得られる組織を洗浄する工程を含む。洗浄は、水、緩衝水、及び/又はTBS(約50mMのトリス HCl、約300mMのNaCl、約0.1%のツイーン−20、約7.6のpH)を用いて実施され得る。
【0039】
ポジティブコントロールサンプルは、生検又は他の外科的切除手段を通して得ることができる組織、細胞の塊、細胞溶解物、及びこれらから調製された膜標本であり得る。ネガティブコントロールサンプルは、組織、細胞の塊、細胞溶解物、及びNa、K−ATPアーゼのα−サブユニットのα3アイソフォームを含まないことが事前の分析を通して知られているこれらから調製された膜標本であり得る。幾つかの実施態様において、ネガティブコントロールは、齧歯動物(マウス若しくはラット)腫瘍組織の細胞の塊、又はインビトロの成長させたマウス若しくはラットの細胞の塊から成る。
【0040】
α1アイソフォームに対するα3のアイソフォームの比を求めるために、相対的なNa、K−ATPアーゼのα−サブユニットアイソフォームの組成及び比を決定する代替手段である分析方法が本発明に従って採用され得る。これらは、例えば、ELISA(酵素結合免疫吸着法)における適切な抗体、又は蛋白質組織又は細胞溶解物配列の使用から成る。代替法として、異なるNa、K−ATPアーゼのαサブユニットアイソフォームに対するmRNAの測定のためのノーザンブロット分析及び関連技法(例えば、rtPCR、リアルタイムポリメラーゼ連鎖反応)の使用が可能である。サンプル中に存在するα−サブユニットのα3アイソフォーム及びα1アイソフォームの量を定量するために、免疫組織化学染色法も使用され得る。
【0041】
本発明の別の態様は、過剰な細胞増殖に関連した病因を有する疾病又は疾患を、強心配糖体を含む組成物を用いて、対象物において治療する方法を供し、該方法が:過剰な細胞増殖に関連した病因を有する疾病又は疾患を持つ対象物の疾病にかかったインビボの細胞組織から直接的に又は間接的に得られるサンプル中のNa、K−ATPアーゼのα−サブユニットのα1アイソフォームに対するα3アイソフォームの比を求めること、ここでサンプルはNa、K−ATPアーゼのαサブユニットの一つ又はそれ以上のアイソフォームを含む;及びもし、比が0.3以上、0.5以上、1以上又は10以上であれば、強心配糖体を含む組成物の投与を対象物に指示することを含む。
【0042】
本発明の更に別の態様は、過剰な細胞増殖に関連した病因を有する疾病又は疾患を、強心配糖体を含む組成物を用いて、対象物において治療する方法を供し、該方法が:対象物から疾病にかかった組織のサンプルを得ること、ここで疾病は過剰な細胞増殖に関連した病因を有し、そしてサンプルはNa、K−ATPアーゼのα−サブユニットの一つ又はそれ以上のアイソフォームを含む;サンプル中のNa、K−ATPアーゼのα−サブユニットのα1アイソフォームに対するα3アイソフォームの比が求められるよう要求すること;及び、もし、比が0.3以上、0.5以上、1以上又は10以上であれば、強心配糖体を含む組成物の投与を対象物に指示することを含む。
【0043】
本発明の幾つかの実施態様は以下のことを含む:1)対象物は、強心配糖体を含む組成物の治療上適切な用量を処方されそして投与される;2)対象物は、所定の投与処方に従って、強心配糖体を含む組成物を投与される;3)対象物は、強心配糖体を含む抽出物を含む組成物を投与される;4)抽出物は、一つ又はそれ以上の他の治療的に有効な成分を更に含む;5)組成物は、一つ又はそれ以上の他の治療的に有効な成分を更に含む;6)対象物は、一日当たり2mgから22.5mgの強心配糖体を含む植物又は動物源の熱水抽出物;又は7)0.6から4.8mgの範囲の強心配糖体の植物又は動物源の濃縮抽出物(例えば、超臨界CO2抽出物);又は8)10から500ugの範囲の強心配糖体の純粋な単独薬物形態が対象物に投与される。
【0044】
本発明の方法の個々の工程は、別々の施設で又は同じ施設内で実行され得る。
【0045】
本発明は、本明細書に開示された本発明の態様、実施態様及びサブ実施態様の全ての組み合わせを含む。
【0046】
以下の図は、本明細書の部分を形成し、そして請求された発明の例示的実施様を記述する。これらの図及び本明細書の記述を考慮すると、当業者は不当な実験設定でなければ本発明を実行し得るであろう。
【図面の簡単な説明】
【0047】
【図1A】Na、K−ATPアーゼのα−サブユニットのα1アイソフォーム及びα3アイソフォームの相対的定量に対して、ヒト及びマウスの細胞株のウェスタンブロット解析の部分として得られるゲル電気泳動図の関連バンドの写真を描写している。
【図1B】ヒト及びマウスの腫瘍に対する細胞増殖抑制のパーセントに対するオレアンドリンの濃度(nM)のプロットを描写している。
【図2】正常及び悪性のヒト結腸細胞のウェスタンブロット解析の部分として得られるゲル電気泳動図の関連バンドの写真を描写している。
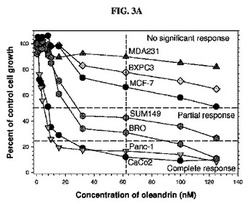
【図3A】Na、K−ATPアーゼのα1アイソフォーム及びα3アイソフォームの相対的出現が異なっている種々の異なる腫瘍細胞株に対する細胞増殖抑制のパーセントに対するオレアンドリンの濃度(nM)のプロットを描写している。
【図3B】腫瘍細胞株の二つの異なるグループ:1よりも大きいα1に対するα3のサブユニットアイソフォーム比を有する第一グループ:及び1よりも小さいα1に対するα3のサブユニットアイソフォーム比を有する第二グループ、における、細胞増殖抑制に対するオレアンドリンの平均IC50の棒グラフを描写している。
【図4A】トランスフェクトされていない及びトランスフェクトされているヒト腫瘍細胞のウエスタンブロット法の部分として得られるゲル電気泳動図の関連するバンドの写真を描写している。
【図4B】図4Aのトランスフェクトされていない及びトランスフェクトされている細胞中の、α3アイソフォームの相対的出現を示す棒グラフである。
【図4C】図4Aの細胞に対して、癌細胞増殖抑制のパーセントに対するオレアンドリンの濃度(nM)のプロットを描写している。
【図5A】トランスフェクトされていない及びトランスフェクトされているPanc−1細胞のウエスタンブロット法の部分として得られるゲル電気泳動図の関連するバンドの写真を描写している。
【図5B】図5Aのトランスフェクトされていない及びトランスフェクトされている細胞中の、α3アイソフォームの相対的出現を示す棒グラフである。
【図5C】図5Aの細胞に対して、癌細胞増殖抑制のパーセントに対するオレアンドリンの濃度(nM)のプロットを描写している。
【図6】DI13782からの免疫組織化学的に染色された正常な皮膚細胞の写真を描写している。
【図7】A〜Hは免疫組織化学的に染色されたメラノーマ皮膚細胞の写真を描写している;A−BはDI15041細胞を描写している;C−DはDI1582細胞を描写している;E−FはDI15833細胞を描写している;G−7HはDI15834細胞を描写している。
【発明を実施するための最良の形態】
【0048】
本発明は、過剰な細胞増殖に関連した病因を有する疾病又は疾患を患っている対象物が、強心配糖体含有組成物を用いた対象物の処置によって、その疾病又は疾患に対して臨床的便益を受けるであろうか否かを予測する方法を供する。本方法は、対象物における疾病又は疾患が、強心配糖体含有組成物を用いた処置に対して治療応答性であろうか否かを定めるために使用される。言い換えれば、本方法は、一つ又はそれ以上の強心配糖体の治療上適切な用量(又は有効量)を用いたその治療に記載の、対象物における治療応答の確率を求めるために使用される。
【0049】
要するに、サンプルは対象物における疾病にかかった組織から得られる。本サンプルは、疾病にかかった組織からのNa、K−ATPアーゼのαサブユニットの一つ又はそれ以上のアイソフォームを含み、そして、Na、K−ATPアーゼのαサブユニットのα3アイソフォーム及びα1アイソフォームの相対量又は濃度を求めるために、本明細書に記載されている通りにアッセイされる。次いで、相対量又は濃度の比が計算される。もし、α1アイソフォームに対するα3アイソフォームの比が0.3以上であれば、本方法は、疾病又は疾患が強心配糖体を用いた治療に対して治療応答性であろう増加した確率を予測する。例えば、もしこの比が0.3〜0.45±0.05であれば、疾病又は疾患が強心配糖体を用いた治療に対して応答するであろう、少なくとも20%又は20%から30%未満の確率がある。もし、この比が0.2未満又は0.3未満であれば、本方法は、疾病又は疾患が強心配糖体を用いた治療に対して治療応答性であろう20%未満の確率を予測する。一般に、この比が高いほど治療応答の確率がより大きい。例えば、もし、この比が0.5〜0.95±0.05であれば、疾病又は疾患が強心配糖体を用いた治療に対して応答するであろう少なくとも30%又は30%から50%の確率がある。もし、この比が1±0.05以上であれば、疾病又は疾患が強心配糖体を用いた治療に対して応答するであろう少なくとも50%の確率がある。もし、この比が10±0.05よりも大きければ、疾病又は疾患が強心配糖体を用いた治療に対して応答するであろう少なくとも75%の確率がある。
【0050】
「治療応答性である」は、疾病又は疾患を患っている対象物が、強心配糖体を用いた治療の結果として、以下の臨床的便益の少なくとも一つを享受するであろうことを意味する:疾病又は疾患の寛解、疾病又は疾患に関連する症状の発生の減少、疾病又は疾患の部分的緩解、疾病又は疾患の完全な緩解、又は増殖抑制期間の増加。言い換えれば、治療応答は完全な又は部分的な治療応答であり得て、そして本方法は、それが完全な又は部分的な応答か否かに拘わらず、治療応答の確率を求めるために使用される。
【0051】
本明細書では、「増殖抑制期間」は、疾病が診断された(又は治療された)後から、(腫瘍が成長を始めるか継続するなど)疾病が悪化し始めるまでの時間の期間、長さ又は継続である。それは、その間に疾病のレベルが疾病の更なる進展なしで維持される時間の期間、そして疾病が再び進展し始める時に終わる時間の期間である。疾病の進行は、治療の前に又は開始時に、細胞増殖性疾患を患っている対象物の「疾病分類」によって求められる。例えば、対象物が有する腫瘍のサイズ、場所及び数が、治療の前に又は開始時に求められる。次いで、対象物は強心配糖体を用いて治療され、そして腫瘍のサイズ及び数が周期的にモニターされる。いくらか後になった時点で、腫瘍のサイズ及び/又は数が増加し得て、そのように疾病の進展及び「増殖抑制期間」の終了が印される。その間に疾病が進展しなかった、又はその間に疾病のレベル又は重篤さが悪化しなかった時間の期間が「増殖抑制期間」である。
【0052】
尚、治療応答は、対象物への治療上適切な用量での完全な又は部分的な応答であり得る。言い換えれば、強心配糖体が投入される対象物に対して致命的ではないであろう用量で、予想される治療応答のレベルが求められる。従って、治療上適切な用量は、そこで強心配糖体を用いた治療に対して疾病又は疾患の治療応答が観察され、そしてそこで過剰な量の望まれない又は有害な副作用無しで、対象物が強心配糖体を投与される治療上の用量である。それが患者においてある副作用を引き起こすかもしれないが、治療上適切な用量は対象物に対して致死的ではない。それは、そこで強心配糖体を投与されている対象物に対する臨床的便益のレベルが、強心配糖体の投与に起因して、対象物によって経験される有害な副作用のレベルを上回る用量である。治療上適切な用量は、多様な確立された薬理学的、薬力学的及び薬物動態的な原理に従って、対象物毎に変わるであろう。しかしながら、治療上適切な用量(例えば、オレアンドリンに対して)は一般的には一日当たりで25、100、250、500、又は1000ミリグラムの強心配糖体を超えないであろうし、又は一日当たりで25〜500又は25〜1000ミリグラムの強心配糖体の範囲にあり得る。従って、本発明の方法は、対象物が治療上適切な用量を投与されたときに、疾病又は疾患の治療応答を予測するために使用される。対象物において目標の治療結果を供するために要求される薬の実際の量が、薬学の基本原理に従って、対象物毎に変わり得ることが当業技術においては知られている。
【0053】
治療上適切な用量は、過剰な細胞増殖に関連した病因を有する疾病又は疾患の治療において一般的に使用される如何なる投与処方に従っても投与され得る。治療上適切な用量は一日に一回、二回、三回又はそれより多く投与され得る。それは一日おきに、二日おきに、三日おきに、週二回、毎週、一週間おきに、二週間おきに、三週間おきに、毎月、一月おきに、月二回、二月おきに、三月おきに、年二回、毎年、又は上記の如何なる組み合わせに従っても投与され得る。例えば、治療上適切な用量は毎日一回、一週間又はそれより長い間、投与され得る。
【0054】
「溶解組成物」は、細胞溶解物を形成するために、又は細胞内容物を完全に溶解するために、細胞膜を溶解させ得る一つ又はそれ以上の試薬を意味する。溶解組成物は一つ又はそれ以上の以下のものを含み得る:水系液体培地、緩衝剤、塩、キレート化剤、界面活性剤、消泡剤、プロテアーゼ阻害剤並びにフォスファターゼ及びATPアーゼ阻害剤。
【0055】
キットに関係して本明細書では、「ポジティブコントロールサンプル」はNa、K−ATPアーゼのα3サブユニットアイソフォームを含む。ポジティブコントロールは、Na、K−ATPアーゼのα1サブユニットアイソフォームを更に含む。各サブユニットアイソフォームの量又は濃度は独立に事前に求められ得るか既知であり得る。サブユニットアイソフォームの量又は濃度は、それに対してそれがポジティブコントロールであるアッセイにおいて使用される特別な方法に従って求められた通りのサブユニットアイソフォームの存在に対してポジティブな応答を供するために十分であろう。例えば、ウエスタンブロット法において、ポジティブコントロール中のサブユニットアイソフォームの量又は濃度は、サブユニットの存在が、例えば、濃度測定又は放射測定によって求められるときに、サブユニットアイソフォームの存在に対してポジティブな応答が得られるように、対応する抗体に結合するために十分であろう。(実施例27において詳述されるような)免疫組織化学染色法に対して、ポジティブコントロール中のサブユニットアイソフォームの量又は濃度は、電気泳動を用いて他の蛋白質から分離されたゲルに応用され、そして次に前述の通り一次抗体及び二次抗体を用いて染色されたときに、又はデジタル画像取り込み及び定量的画像解析ソフトウエアを用いた顕微鏡検査の下で定量分析に応用されたときに、容易な可視化及び定量化を可能ならしめるために十分であろう。もし、コントロールサンプル中のサブユニットアイソフォームの量又は濃度が既知であるか、又は分析の前に事前に求められるならば、サブユニットアイソフォームに対する検量線を供するように、ポジティブな応答のレベルが量又は濃度と相関付けられ得る。
【0056】
もし、Na、K−ATPアーゼのα3サブユニットアイソフォームがポジティブコントロールサンプル中に存在するならば、α1アイソフォームに対するα3アイソフォームの比は一般的に0.3から100以上の範囲内であろう。この比に対する適切な範囲は、0.3から0.5、0.5から1.0、1.0から20、及び20から100も含む。
【0057】
キットに関係して本明細書では、「ネガティブコントロールサンプル」はNa、K−ATPアーゼのα1サブユニットアイソフォームを含むが、Na、K−ATPアーゼのα3サブユニットアイソフォームは含まない。α1サブユニットアイソフォームの量又は濃度は、そこでそれがネガティブコントロールとして使用される、ウエスタンブロット法などのアッセイにおいて使用される特別な方法に従って求められるようにアイソフォームの存在に対するポジティブな応答を供するために十分であろう。この量又は濃度は既知又は事前に求められ得て、もしそうであれば、アイソフォームに対する検量線を作成するために使用され得る。
【0058】
本発明の方法及びキットの検証(バリデーション))の部分として、本発明者らは、種々の癌及び腫瘍の表現型の治療のために、強心配糖体含有組成物の前臨床評価を実施した。評価はインビボの、エキソビボ、インビトロ及び異種移植動物モデルを用いて実施された。評価された各表現型に対して、Na、K−ATPアーゼのα1サブユニットアイソフォームに対するNa、K−ATPアーゼのα3サブユニットアイソフォームの比を求めるために、組織の細胞サンプル又は細胞の塊が本明細書に述べられた通りに分析された。強心配糖体の治療に応答する表現型、及び多くのヒト腫瘍細胞株における表現型の各々に対する、Na、K−ATPアーゼのα1サブユニットアイソフォームに対するNa、K−ATPアーゼのα3サブユニットアイソフォームの比の間の相関が観察された。治療応答性の癌又は腫瘍表現型(又は増大した治療応答の確率を有するもの)は、少なくとも0.3のNa、K−ATPアーゼのα1サブユニットアイソフォームに対するNa、K−ATPアーゼのα3サブユニットアイソフォームの比を有すると結論づけられた。
【0059】
齧歯動物(ラット又はマウス)の癌細胞がネガティブコントロールサンプルとして使用され得る。図1Aは、齧歯動物の腫瘍細胞株のウエスタンブロット解析のゲルに対して開発されたフィルムを描写している。本発明者らのデータは、現在までに試験された全ての齧歯動物(ラット又はマウス)の腫瘍細胞株がα3サブユニットアイソフォームを欠いていること、そして強心配糖体(例えば、ウアバイン、オレアンドリン、ブファリン等)を用いたインキュベーションによって、それらのインビトロの増殖が著しく阻害されないことを示している。ヒトの腫瘍細胞株は一般に、強心配糖体含有組成物を用いた治療に対して、ネズミ科の腫瘍細胞がそうであるよりももっと敏感である(図1B)。本発明者らは、治療応答におけるこの違いが、上述の通り、二つの異なる種におけるα1に対するα3のアイソフォーム比の違いのせいであると信じる。
【0060】
尚、α3アイソフォームに対する抗体は、Affinity Bioreagents社(Golden、CO)、Novus社(Littleton、CO)又はSigma hemical社(St Louis、MO)を含む多くの異なる供給メーカーから得られ、それらの全ては、ポジティブコントロールサンプル中のα3エピトープに対して等しい反応性(つまり、結合性)を示した。
【0061】
ヒトにおいて、Na、K−ATPアーゼのαサブユニットに対する、α1に対するα3のアイソフォーム比は、組織の源と悪性状態によって変わり得る。正常結腸組織及び悪性結腸組織からの組織サンプルは、全部で14個の個別の対象物に対して各々の対象物から採取された。各組織サンプルに対する、α1に対するα3のアイソフォーム比は本明細書に述べられた通りに求められた。図2及び下表におけるデータは、正常な組織中のα3アイソフォームの相対的欠如、及び約66〜70%の悪性組織中のα3アイソフォームの存在を示す。正常組織及び悪性組織の両方がα1サブユニットアイソフォームを含有する。
【0062】
【表2】

【0063】
Na、K−ATPアーゼのαサブユニットに対する、α1に対するα3のアイソフォーム比が、培養された細胞株における種々の異なるヒトの癌及び腫瘍の表現型、並びに実際の腫瘍生検標本に対して求められた。また、強心配糖体含有組成物を用いた治療に対する各表現型の相対的感度が、インビトロの細胞培養実験由来のデータを用いて求められた。オレアンドリン含有組成物に対するデータが下表及び図3Aにおいて詳述されている。
【0064】
【表3】

【0065】
上表において定義されたように、「インビトロの応答」は、定義された期間に亘って、既定の濃度の薬剤(強心配糖体)を用いて、ある腫瘍細胞株の増殖がそこまで阻害される程度を表す。「無応答」の表示は、試験された多数の薬剤のどの濃度においても50%未満の増殖抑制であることを表す。つまり、如何なる濃度でもIC50値(実験の規定の期間に亘って50%分の細胞増殖の阻害を生み出す濃度)として同定され得なかった。従って、もしこの腫瘍細胞株がヒトなどの哺乳動物において成長するとすれば、腫瘍成長の著しい阻害を生み出す点でその薬剤効果がないであろうことがあり得る。上表における「部分的応答」の表示は、未治療の腫瘍細胞の成長に対して、50%を超えるが75%未満だけの細胞増殖を阻害するための、オレアンドリン又はブファリンのような所定の強心配糖体の能力を表す。従って、これは、もしこの製品がヒトのような哺乳動物において、腫瘍成長の治療のために使用されたとして、強心配糖体に対する腫瘍の部分的つまり完全より少ない治療応答に等しいであろう。最後に、上表における「完全応答」の表示は、未治療の腫瘍細胞集団に対する、75%を超える腫瘍細胞増殖の阻害を表す。従って、哺乳動物において、腫瘍成長の全体的阻害(又は完全な治療応答)が達成されるであろうことがあり得る。
【0066】
前述のアイソフォーム比のデータに基づいて、本方法は以下のことを予測する:1)MDA231、BXPC3及びMCF7細胞株が、治療上適切な量の強心配糖体を用いた治療に対して実質的に無応答性であろう;2)SUM149及びHCT116細胞株が、治療上適切な量の強心配糖体を用いた治療に対して少なくとも部分的な応答を示すであろう;及び3)CACO2、HT29、LS174T、BRO、DOD−1及びPANC1細胞株が、治療上適切な量の強心配糖体を用いた治療に対して完全な治療応答を示すであろう。
【0067】
図3Aはコントロールの成長のパーセントに対して、オレアンドリン(オレアンドリンとして供された)の濃度(nM)のプロットを描写している。これらのデータは評価された細胞株が、ヒト腫瘍細胞株の増殖の相対的阻害によって定められる通りの、強心配糖体治療に対するそれらの応答に従って3つの異なるグループに分類され得ることを示す:強心配糖体の125nMまでの濃度で達成される50%未満の増殖抑制を受けるグループI;強心配糖体の62nMまでの濃度で達成される50%以上の増殖抑制を受けるグループII;及び強心配糖体の62nMまでの濃度で達成される75%以上の増殖抑制を受けるグループIII。これらのグループの例示的細胞株は以下の通りである:グループI−MDA231、BXPC3、MCF−7;グループII−SUM149、BRO;グループIII−Panc−1、CaCo2。応答データはアイソフォーム比データによって予測された通りである。本発明の方法及びキットの頑強さを確立するために、細胞応答データの統計分析が実施された。図3Bにおけるデータは、ヒト腫瘍細胞のインビトロの増殖を阻害するオレアンドリン含有組成物の相対的能力を示している。これらのデータは平均±SDとして示されている。オレアンドリンが媒介した増殖抑制を、そこにおいて相対的サブユニット含有量α3/α1アイソフォーム比が1.0よりも大きい10個の細胞株(種々の固形腫瘍を表している)、及びそこにおいてα3/α1アイソフォーム比が1.0よりも小さい6個の細胞株において調べられた。これらのデータは、これらのグループ間で8倍(800%)の違いがあることを示す。つまり、そこにおいてα3/α1アイソフォーム比が1.0以上であるそれらの細胞株において、そこにおいてα3/α1アイソフォーム比が僅かに発現されただけのものと比べて、オレアンドリンがはるかにより効果的な薬剤であることが見出された。これらのデータは、強心配糖体含有組成物を用いた治療に対する癌又は腫瘍の細胞株の応答性を予測するために、α3/α1サブユニットアイソフォームの比が使用され得ることを証明している。
【0068】
強心配糖体を用いた治療に対する目標とする悪性組織による治療応答の予測可能性に向けたα3/α1アイソフォーム比の相対的重要性の更なる証明が以下のように確立された。ヒト膵臓癌細胞中のα3アイソフォーム発現の人工的なダウンレギュレーション、つまり、Na、K−ATPアーゼのサブユニットのアイソフォーム含有量の操作は、α3アイソフォームに特異的なsiRNA(サレンシングRNA)による細胞のトランスフェクションによって達成された。これらのデータは(ウエスタンブロットによって求められた通りの(図4A))α3アイソフォームの発現の低下を示している。ウエスタンブロットによるα3の減少した発現の定量が図4Bにおいて詳述されている。図4Cは、その中でα3の発現が減少したトランスフェクトされた細胞が、オレアンドリンを用いた治療に対するそれらの感度を失うことを示している。
【0069】
強心配糖体を用いた治療に対する目標の悪性組織による治療応答の予測可能性に向けたα3/α1アイソフォーム比の相対的重要性の更なる証明が、α1サブユニットアイソフォームを有するPanc−1細胞へのトランスフェクトによって確立された。Na、K−ATPアーゼのα1サブユニットアイソフォームが、通常α1発現を欠くPanc−1細胞にトランスフェクトされた。図5Aにおけるコントロールサンプルは、トランスフェクトされていないPanc−1細胞に対するものであり、そして図5Aにおけるα1cDNAサンプルは、α1サブユニットアイソフォームでトランスフェクトされたPanc−1細胞に対するものである。その結果、α1に対するα3の比は、トランスフェクトされたPanc−1細胞において減少した(図5B)。次いでオレアンドリン治療に対するトランスフェクトされたPanc−1細胞の感度が評価された。オレアンドリン治療に対するこれらのトランスフェクトされた細胞の感度は、オレアンドリンのIC50値のシフトによって実証される通り、4.1nMのトランスフェクトされていないPanc−1細胞からα1トランスフェクトされた細胞において50nMを超えるまで低下した(図5C)。従って、オレアンドリンの抗増殖性活性は、α1サブユニットアイソフォームでトランスフェクトされたPanc−1細胞において著しく減少した。
【0070】
Na、K−ATPアーゼサブユニットのα3及びα1アイソフォームの検出及び定量も、実施例27において詳述されているように、免疫組織化学的染色によって成し遂げ得る。細胞は、α3及びα1アイソフォームが差動的に染色されるよう、免疫組織化学的に染色される。各アイソフォームタイプの含有量が定量され、そしてα1に対するα3のアイソフォームの含有量比が求められる。α3及びα1アイソフォームの差動的な免疫組織化学的染色は種々の手段によって成し遂げ得る。幾つかの実施態様において、組織サンプルが二つの異なる染色剤を用いて染色される:一方の染色剤はα3アイソフォームに対して選択的に又は特異的に使用され、そして他方の染色剤はα1アイソフォームに対して選択的に又は特異的に使用される。幾つかの実施態様において、二つの近いけれども異なるサンプルが同じ組織から得られ、そして第一のサンプルがα3アイソフォームを染色するために処理され、そして第二のサンプルがα1アイソフォームを染色するために処理されるように染色される。次いで、α3及びα1アイソフォームの比が定量され、そして次にα1アイソフォームに対するα3アイソフォームの比が求められる。この比に基づいて、強心配糖体を用いた治療に対する組織の治療応答の可能性に関する予測がなされる。
【0071】
免疫組織化学的に染色されたサンプル(細胞又は組織のスライド)中のNa、K−ATPアーゼサブユニットのα3アイソフォーム及びα1アイソフォームの定量が手動の又は自動化された手順を通して成し遂げ得る。これらには、限定するものではないが、適切に染色されたスライドの設定領域の染色強度の個別段階付け(例えば、0〜5の強度の相対的な染色強度の目視観察を用い、ここで0は検出できる染色がないこと、5は強い染色を表す);次いで調べられた領域の設定数の平均染色強度のコンパイリング、及びα3染色の相対的染色とα1に対して染色されたスライドのそれとの比較;並びにサンプル中のα1に対するα3の比の計算;が含まれる。そこにおいて、α1及びα3の相対的染色の定量(つまり、サンプル中に存在するα1に対するα3の比)が、染色されたスライドの設定領域の顕微鏡検査の使用、及び相対的染色強度を求めるためのデジタル解析ソフトウエアの使用を通して成し遂げ得る他の方法がある。同様に、相対的アイソフォーム染色を求めるために、そしてα1に対するα3の染色強度の比を計算するために、コンピュータ支援デジタルビデオ分析も実行され得て、それによりサンプル中のα1アイソフォームに対するα3アイソフォームの含有量比が求められる。
【0072】
例えば、図6A〜6Fは、DI13782からの正常な皮膚細胞の写真を描写している。図6A、6C及び6Eは(免疫組織化学的に染色された)Na+/K+ATPアーゼ免疫反応性のαサブユニットを描写している。図6B、6D及び6Fは、対応する非免疫(コントロール)IgGインキュベーションされた切片の写真を描写している。正常な皮膚の全てのドナーにおいて、強い2+又は3+レベルの免疫反応性が見られた。扁平上皮、毛包上皮、皮脂腺の基底膜、汗腺及び血管中の単核リンパ球が全てポジティブに染色された。Pyloerector筋は弱い免疫反応性であった。
【0073】
図7A〜7Hは、メラノーマ細胞の写真を描写している。図7A、7C、7E及び7Gは、(免疫組織化学的に染色された)Na+/K+ATPアーゼ免疫反応性のαサブユニットを描写している。図7B、7D、7F及び7Hは、対応する非免疫(コントロール)IgGインキュベーションされた切片を描写している。図7A及び7Bは、DI15838細胞を描写している。図7C及び7Dは、DI15840細胞を描写している。図7E及び7Fは、DI15842細胞を描写している。図7G及び7Hは、DI15844細胞を描写している。全てのBCCサンプルは、種々の程度の強度を有するNa+/K+ATPアーゼのαサブユニットに対してポジティブであった。全ての免疫反応性は腫瘍細胞の核及び細胞質に局在化されていた。組織の差動的な免疫組織化学的染色に続いて、α1サブユニットアイソフォームに対するα3サブユニットアイソフォームの比が求められ得て、そして強心配糖体を用いた治療に対する治療応答に関する予測がなされ得る。
【0074】
別の強心配糖体に向けた本発明の方法の関連が評価された。HuaChanSuは、ブファジェノリドとして知られている強心配糖体を含有するヒキガエルの皮膚の抽出物である。HuaChanSuを用いた治療に対する、二つのヒトの膵臓細胞株(SW1990及びPanc−1)の治療応答が評価された。上表のデータに基づけば、SW1990細胞がHuaChanSuに対して治療応答性ではないであろうが、Panc−1人はHuaChanSuに対して治療応答性であろうと予測されるであろう。応答データは期待された結果を供した。
【0075】
以下の実施例は、癌及び腫瘍に関連する疾病又は疾患の治療における強心配糖体の有効性の証拠を含む。実施例21は転移性膵臓ガストリノーマを示している患者の治療に対する事例履歴を含む。本発明の予後アッセイ、方法及びキットは、過剰な細胞増殖に関連した病因を有する疾病又は疾患の当業技術において公知である一つ又はそれ以上の他の予後又は診断アッセイ、方法及びキットを組み合わせて使用され得る。例えば、もし臨床医が、癌又は腫瘍を有する対象物を強心配糖体及び他の化学療法剤又は放射線治療の組み合わせを用いて治療することを意図るならば、対象物が有する癌又は腫瘍の特別な表現型が、上記他の化学療法剤又は放射線治療を用いる治療に対して、少なくとも部分的に治療応答性であり、次に、強心配糖体を用いて治療されたときに、対象物における癌又は腫瘍の少なくとも部分的な治療応答の確率を求めるために本発明が使用され得ることが知られている。もしその結果により、癌又は腫瘍が強心配糖体を用いた治療に対して治療応答性であろうという確率の増加があることを示されるならば、次いで臨床医は、強心配糖体及び他の治療剤又は放射線治療又はその組み合わせを用いた癌又は腫瘍の治療を処方し及び/又は投与し得る。
【0076】
強心配糖体は、過剰な細胞増殖に関連した病因を有する疾病又は疾患の治療において治療作用を有すると知られている、如何なる強心配糖体でもあり得る。強心配糖体は純粋な形態で、又は一つ又はそれ以上の他の化合物との混合物として存在し得る。強心配糖体は抽出物として存在し得る。抽出物は超臨界流体(SFC)二酸化炭素(CO2)抽出によって、又はそのような抽出物の化学的に改良された(例えば、エタノールを含む抽出物、又はSFC−CO2及びエタノールを用いて得られた抽出物)形態によって製造され得る。抽出物は植物性又は動物性材料から得ることができる。動物性材料はヒキガエル(例えば、Bufo bufo)の抽出物であり得る。植物性材料は、ネリウム オレアンダー(Nerium oleander)のようなネリウム(Nerium)種、又はテベティア ネリフオリア(Thevetia nerifolia)若しくは(別名yellow oleanderとして知られている)テベティア プルビアナ(Thevetia puruviana)のようなテベティア(Thevetia)種から得られるような植物群であり得る。抽出プロセスは、それらの全ての開示が本明細書に参照されることによって組み込まれているものとする、Addingtonの名前で2005年2月15日に出願された現在係属中の米国仮出願第60/653,210号又はAddingtonの名前で2006年1月26日に出願された米国出願第11/340,016号,Addingtonの名前で2006年7月28日に出願された米国出願第11/191,650号、(2008年7月22日に発行された、現在の米国特許第7,402,325号)、又は2006年7月26日に出願されたPCT国際特許出願PCT/US第06/29061号において記述されたプロセスに従って、又は本明細書中に記述されたプロセスによって製造されたネリウム オレアンダー(Nerium oleander)の葉の乾燥粉末上で実行され得る。
【0077】
本明細書では、用語「オレアンドリン」は、別に特定されない限り、オレアンドリンの全ての公知な形態を意味するものと取られる。オレアンドリンはラセミ体、光学的に純粋な又は光学的に濃縮された形態で存在し得る。ネリウム オレアンダー(Nerium oleander)植物材料は、例えば、Aldridge Nursery社、Atascosa、Texasのような市販の植物供給者から得ることができる。
【0078】
抽出物は、強心配糖体含有植物群の改良された(例えば、エタノール)又は未改良の超臨界流体抽出によって得ることができる。超臨界流体抽出物は、抽出物が対象物に投与されるときに、強心配糖体の治療効果に寄与する、少なくとも一つの他の薬理活性物質を含み得る。それは強心配糖体の治療効果に追加的に又は相乗的に寄与し得る。
【0079】
抽出物は種々の異なるプロセスによって製造され得る。抽出物は、Huseyin Ziya Ozel博士によって開発されたプロセスに従って製造され得る(米国特許第5,135,745号に、水中で植物の抽出物を製造する手順が述べられている)。伝えられるところでは、水系抽出物は、分子量が2KDから30KDまで変わる幾つかの多糖類、オレアンドリン及びオレアンドリゲニン、odoroside及びneritalosideを含有する。伝えられることろでは、多糖類は酸性homopolygalacturomnans又はarabinogalaturonansを含有する。Selvarajらの米国特許第5,869,060号はネリウム(Nerium)種の熱水抽出物及びその製造方法を開示している。得られた抽出物は粉末を製造するために次いで凍結乾燥され得る。米国特許第6,565,897号(Selvarajらの米国付与前公告第20020114852号及びPCT国際公開公報WO2000/016793)は、実質的に無菌の抽出物を製造するための熱水抽出プロセスを開示している。Erdemogluら(J. Ethnopharmacol. (2003) Nov. 89(1), 123-129)は、抗侵害性及び抗炎症活性に基づくネリウム オレアンダー(Nerium oleander)を含む植物の水及びエタノール抽出物の比較の結果を開示している。ネリウム オレアンダー(Nerium oleander)の有機溶媒抽出物が、Adome ら(Afr. Health Sci. (2003) Aug. 3(2), 77-86; 「エタノール抽出物」ethanolic extract)、el-Shazlyら(J. Egypt Soc. Parasitol. (1996), Aug. 26(2), 461-473;「エタノール抽出物」(ethanolic extract)、Begumら(Phytochemistry (1999) Feb. 50(3), 435-438; 「メタノール抽出物」(methanolic extrac)、Ziaら(J. Ethnolpharmacol. (1995) Nov. 49(1), 33-39; 「メタノール抽出物」(methanolic extract)及びVlasenkoら(Farmatsiia. (1972) Sept.-Oct. 21(5), 46-47; 「アルコール抽出物」alcoholic extract)によって開示されている。Singhらの米国付与前特許出願公開公報第20040247660号は、癌の治療において使用するための、蛋白質で安定化されたオレアンドリンのリボソーム製剤の製造を開示している。Singhらの米国付与前特許出願公開公報第20050026849号はシクロデキストリンを含有するオレアンドリンの水溶性処方を開示している。Singhらの米国付与前特許出願公開公報第20040082521号は熱水抽出物からの、蛋白質で安定化されたオレアンドリンのナノ粒子製剤の製造を開示している。
【0080】
SCF抽出は、植物群からの望ましい化合物の抽出を向上させるために、エタノールのような超臨界流体中のモディファイヤーの存在下で実行され得る。モディファイヤーは一般的に、超臨界流体の揮発性及び抽出される化合物の揮発性の間の揮発性を有し、そしてそれらは超臨界流体と混和し得なければならない。幾つかの実施態様において、モディファイヤーは周囲条件下で液体である。制限するものではなく例示目的で、モディファイヤーはエタノール、メタノール、プロパノール、アセトン、酢酸エチル、塩化メチレンなどから成るグループから選ばれ得る。
【0081】
抽出物は、オレアンドリン又は他の強心配糖体、oleaside、及び他の植物材料のような薬理学的に活性な化合物の混合物である。超臨界流体プロセスからのオレアンドリン抽出物は質量ベースで、0.9%から2.5%の理論的範囲のオレアンドリンを含有する。種々の量のオレアンドリンを含むSCF抽出物が得られている。一つの実施態様において、SCF抽出物は約2質量%のオレアンドリンを含む。
【0082】
本明細書におけるデータによって証明された通り、SCF抽出物は種々の成分の混合物を含む。それらの成分の幾つかはオレアンドリン、oleaside A、オレアンドリゲニン、neritaloside、odorside(Wang X、Plomley JB、Newman RA及びCisneros A. 「癌治療のためのセイヨウキョウチクトウ抽出物のLC/MS/MS分析」(LC/MS/MS analyses of an oleander extract for cancer treatment)、Analytical Chem. 72: 3547-3552, 2000)及び他の未同定成分を含む。SCF抽出物のSCF抽出され得る未同定成分は、SCF抽出物におけるオレアンドリンの有効性に寄与する少なくとも一つの他の薬理活性成分を含むように思われる。つまり、少なくとも一つの他のSCF抽出され得る成分は、観察された有効性を供するためにオレアンドリンと共に追加的に又は相乗的に機能する。
【0083】
抽出物が、幾つかの腫瘍細胞株に対する有効性によって決定されるようなその相対的性能において異なることもあり得る。そうであっても、治療上適切な用量を製造し得るために、もし強心配糖体が抽出物中に十分に高い量又は濃度で存在するならば、その時その抽出物は本発明の部分と考えられる。下表には、強心配糖体レアンドリンの三つの異なる形態に対する幾つかの相対的有効性データが要約されている。
【0084】
【表4】

【0085】
上表において示された通り、超臨界CO2抽出物のIC50値は、Panc−1又はBRO細胞の両方において、そのオレアンドリン単独の50%に過ぎず、これはセイヨウキョウチクトウの超臨界CO2抽出物が、Panc−1又はBRO細胞の増殖抑制に関して、オレアンドリン単独よりも少なくとも2倍強い(より能力がある)ことを示唆する。比較すると、試験された三つの実体の中で、熱水抽出物は最も能力が低い。これらのデータはヒト腫瘍細胞株に対するオレアンドリン、並びに以下のような相対的能力を発生を有する抽出物による潜在的細胞毒性を示す:超臨界CO2抽出物>オレアンドリン>熱水抽出物。これらのデータは、超臨界CO2抽出物の細胞毒性がおそらく、SCF抽出物中に、少なくとも一つの他の薬理学活性成分がオレアンドリンに加えて存在することによること、そして超臨界CO2抽出物の能力が熱水抽出物のそれよりもはるかに大きい(7.4倍)ことを示唆する。これらのデータは、熱水抽出物及びオレアンドリン単独さえも凌ぐSCF抽出物の有効性の実質的な改善を明らかに示している。有効性における改善は、SCF抽出物中のオレアンドリンの濃度上昇のみに基づいて得られたであろう予想された改善を超えていた。
【0086】
本発明はまた、本発明のSCF又は水での抽出物のような有効量の抽出物を用いた細胞の治療による癌又は腫瘍細胞の増殖を阻害する方法も供する。
【0087】
強心配糖体は、如何なる適切な薬学的に許容できる剤形においても処方され得る。非経口、耳、眼、鼻、吸入、頬側、舌下、腸内、局所、経口、及び注射可能な剤形が特に有用である。特別な剤形は、固体又は液体の剤形を含む。例示的な適切な剤形は、錠剤、カプセル、ピル、カプレット、トローチ、小袋及び製薬科学において当業者に公知である他のそのような剤形を含む。
【0088】
本発明の単位用量に組み込まれるオレアンドリンの量は、少なくとも一つ又はそれ以上の剤形であろうし、そして薬局の公知の原理に従って選択され得る。有効量の又は治療上適切な量の治療用化合物が具体的に熟慮される。用語「有効な量」によって、例えば、医薬品に関しては、薬学的に有効な量が熟慮されていることが理解される。薬学的に有効な量は、要求される又は望ましい治療応答に対して十分である活性剤の量、又は言い換えれば、患者に投入されたときに、明らかな生物学的応答を引き出すために十分な量である。明らかな生理学的応答が、活性物質の単独又は複数の単位用量の投与の結果として生じ得る。単位用量は、一つ又はそれ以上の剤形を含み得る。如何なる患者に対する特定の用量レベルも、治療されるべき適応症、適応症の重症度、患者の健康、年齢、性別、体重、食事、薬理学的応答、採用される特定の剤形及びその他のそのような因子を含む種々の因子に依存するであろうことが理解されるであろう。
【0089】
僅か一つでそして10もの多くの剤形が投与され得るものの、経口投与のための望まれる用量は5つまでの剤形である。例示的な薬学的形態は、合計で用量当たり0.6から60mg(1から10の用量レベル)に対して、剤形当たり0.6mgのSCF抽出物を含有する。
【0090】
強心配糖体は、対象物に12から1200ug、又はそれより多い又は少ないオレアンドリンの初期用量を供するために十分な量における剤形で存在し得る。
【0091】
哺乳類の治療における使用に対して、強心配糖体が剤形中に含有され得る。剤形の幾つかの実施態様は腸内被覆されておらず、そして強心配糖体のそれらの投入量を0.5から1時間以内の期間内で放出する。剤形の幾つかの実施態様は腸内被覆されており、そして強心配糖体のそれらの負荷を、空腸、回腸、小腸、及び/又は大腸(結腸)からなど、胃の下流で放出する。腸内被覆された剤形は、体循環内に、経口投与の後1〜10時間以内に強心配糖体を放出するであろう。
【0092】
予備的な動物への投与データに基づけば、セイヨウキョウチクトウ抽出物の投与用量の50から75%が経口投与可能であろうことが予想され、従って0.25から0.4mg、0.1から50mg、0.1から40mg、0.2から40mg、0.2から30mg、0.2から20mg、0.2から10mg、0.2から5mg、0.2から2.5mg、0.2から2mg、0.2から1.5mg、0.2から1mg、0.2から0.8mg、0.2から0.7mg、又は0.25から0.5mgのオレアンドリンが剤形当たりに供される。成人における平均血液容積が5リッターであるとした場合、予想されるオレアンドリン血漿濃度は0.05から2ng/ml、0.005から10ng/mL、0.005から8ng/mL、0.01から7ng/mL、0.02から7ng/mL、0.03から6ng/mL、0.04から5ng/mL、又は0.05から2.5ng/mLの範囲にあるであろう。SCF抽出物中に存在するオレアンドリンの1日当たりの推奨用量は、一般的に一日に二度、約0.25から約50mg、又は一日に二度、つまり約12時間毎に0.9から5mgである。この用量は約0.5から約100mg/日、約1から約80mg/日、約1.5から約60mg/日、約1.8から約60mg/日、約1.8から約40mg/日であり得る。最大許容用量は約100mg/日、約80mg/日、約60mg/日、約40mg/日、約38.4mg/日、又は約30mg日の、オレアンドリン含有セイヨウキョウチクトウ抽出物であり、そして最低有効量は約0.5mg/日、約1mg/日、約1.5mg/日、約1.8mg/日、約2mg/日、又は約5mg/日であり得る。
【0093】
本発明のキット又は組成物は、分析用又は薬学用に適している如何なる賦形剤をも含有し得る。
尚、本明細書における化合物は、本発明の処方において一つ又はそれ以上の機能を有してもよい。例えば、ある化合物が界面活性剤及び水混和性溶媒の両方として、又は界面活性剤及び水不混和性溶媒の両方として作用してもよい。
液体組成物は一つ又はそれ以上の薬学的に又は分析的に許容できる液体キャリアーを含み得る。液体キャリアーは水系、非水系、極性、非極性及び/又は有機キャリアーであり得る。液体キャリアーには、制限するものではないが例として、水混和性溶媒、水不混和性溶媒、水、緩衝液及びそれらの混合物が挙げられる。
【0094】
本明細書では、同じ意味で使われる用語である「水溶性溶媒」又は「水混合性溶媒」は、水と二相混合物を形成しない、又は液相を分離しないで、少なくとも5パーセントの溶媒を含有する水系溶媒混合物を供するために、水に十分に溶解する有機液体を意味する。溶媒はヒト又は動物への投与に適している。例示的な水溶性溶媒には、制限するものではないが例として、PEG(ポリ(エチレングリコール))、PEG400(約400の分子量を有するポリ(エチレングリコール))、エタノール、アセトン、アルカノール、アルコール、エーテル、プロピレングリコール、グリセリン、トリアセチン、ポリ(プロピレングリコール)、PVP(ポリ(ビニルピロリドン))、ジメチルスルホキシド、N,N−ジメチルホルムアミド、ホルムアミド、N,N−ジメチルアセトアミド、ピリジン、プロパノール、N−メチルアセトアミド、ブタノール、Soluphor(2−ピロリドン)、Pharmasolve(N−メチル−2−ピロリドン)が挙げられる。
【0095】
本明細書では、同じ意味で使われる用語である「非水溶性溶媒」又は「水不混和性溶媒」は水と二相混合物を形成する、又は水中の溶媒の濃度が5パーセントを超えたときに相分離を供する有機液体を意味する。溶媒はヒト又は動物への投与に適している。例示的な水不溶性溶媒には、制限するものではないが例として、中鎖/長鎖のトリグリセリド、油、ヒマシ油、トウモロコシ油、ビタミンE、ビタミンE誘導体、オレイン酸、脂肪酸、オリーブ油、Softisan645(ジグリセリルカプリル酸エステル/カプリン酸エステル/ステアリン酸エステル/ヒドロキシステアリン酸エステルアジパート)、Myglyol、Captex(Captex350:グリセリルトリカプリル酸エステル/カプリン酸エステル/ラウリン酸トリグリセリド;Captex355:グリセリルトリカプリル酸エステル/カプリン酸エステルトリグリセリド;Captex355EP/NF:グリセリルトリカプリル酸エステル/カプリン酸エステル中鎖トリグリセリドが挙げられる。
【0096】
適切な溶媒は、「日米EU医薬品規制調和国際会議(ICH)、工業Q3C不純物に対する指針:残留溶媒」(International Conference on Harmonisation of Technical Requirements for Registration of Pharmaceuticals for Human Use (ICH) guidance for industry q3C Impurities: Residual Solvents、1997)中にリストアップされており、如何なる量の残留溶媒が医薬品において安全と考えられるかに関しての推奨がなされている。例示的溶媒は、クラス2又はクラス3溶媒として表示されている。クラス3溶媒には、例えば、酢酸、アセトン、アニソール、1−ブタノール、2−ブタノール、酢酸ブチル、tert−ブチルメチルエーテル、クメン、エタノール、エチルエーテル、酢酸エチル、ギ酸エチル、ギ酸、ヘプタン、酢酸イソブチル、酢酸イソプロピル、酢酸メチル、メチル−1−ブタノール、メチルエチルケトン、メチルイソブチルケトン、2−メチル−1−プロパノール、ペンタン、1−ペンタノール、1−プロパノール、2−プロパノール又は酢酸プロピルが含まれる。
【0097】
本発明において水不混和性溶媒として使用され得る他の材料には以下が含まれる:Captex 100:プロピレングリコールジカプリン酸エステル;Captex 200:プロピレングリコールジカプリル酸エステル/ジカプリン酸エステル;Captex 200P:プロピレングリコールジカプリル酸エステル/ジカプリン酸エステル;プロピレングリコールジカプリロカプリン酸エステル;Captex 300:グリセリルトリカプリル酸エステル/カプリン酸エステル;Captex 300 EP/NF:グリセリルトリカプリル酸エステル/カプリン酸エステル中鎖トリグリセリド;Captex 350:グリセリルトリカプリル酸エステル/カプリン酸エステル/ラウリン酸エステル;Captex 355:グリセリルトリカプリル酸エステル/カプリン酸エステル;Captex 355 EP/NF:グリセリルトリカプリル酸エステル/カプリン酸エステル中鎖トリグリセリド;Captex 500:トリアセチン;Captex 500 P:トリアセチン(医薬品グレード);Captex 800:プロピレングリコールジ(ヘキサン酸2−エチル);Captex 810 D:グリセリルトリカプリル酸エステル/カプリン酸エステル/リノール酸エステル;Captex 1000:グリセリルトリカプリン酸エステル;Captex CA:中鎖トリグリセリド;Captex MCT-170:中鎖トリグリセリド;Capmul GMO:グリセリルモノオレイン酸エステル;Capmul GMO-50 EP/NF:グリセリルモノオレイン酸エステル;Capmul MCM:中鎖モノ−&ジグリセリド;Capmul MCM C8:グリセリルモノカプリル酸エステル;Capmul MCM C10:グリセリルモノカプリン酸エステル;Capmul PG-8:プロピレングリコールモノカプリル酸エステル;Capmul PG-12:プロピレングリコールモノラウリン酸エステル;Caprol 10G10O:デカグリセロールデカオレイン酸エステル;Caprol 3GO:トリグリセロールモノオレイン酸エステル;Caprol ET:混合脂肪酸のポリグリセロールエステル;Caprol MPGO:ヘキサグリセロールジオレイン酸エステル;Caprol PGE 860:デカグリセロールモノ−、ジオレイン酸エステル。
【0098】
本明細書では、「界面活性剤」は、極性の又は荷電された親水性の部位並びに非極性の疎水性(親油性)部位を含む化合物を意味する;つまり界面活性剤は両親媒性である。用語、界面活性剤は、一つの化合物又は化合物の混合物を意味し得る。界面活性剤は可溶化剤、乳化剤又は分散剤であり得る。界面活性剤は親水性又は親油性であり得る。
【0099】
親水性界面活性剤は、医薬組成物中での使用に適している如何なる親水性界面活性剤でもあり得る。そのような界面活性剤はノニオン性の親水性界面活性剤が現在のところ好ましいものの、アニオン性、カチオン性、双性イオン性又はノニオン性であり得る。上で論じた通り、これらのノニオン性の親水性界面活性剤は、一般的に約10より大きなHLB値を有するであろう。親水性界面活性剤の混合物も本発明の範囲内にある。
【0100】
同様に、疏水性界面活性剤は、医薬組成物中での使用に適している如何なる疏水性界面活性剤でもあり得る。一般に、適切な疏水性界面活性剤は約10より小さなHLB値を有するであろう。疏水性界面活性剤の混合物も本発明の範囲内にある。
【0101】
追加の適切な可溶化剤の例には以下が含まれる:エタノール、イソプロパノール、ブタノール、ベンジルアルコール、エチレングリコール、プロピレングリコール、ブタンジオール及びその異性体、グリセロール、ペンタエリトリトール、ソルビトール、マンニトール、トランスクトール、ジメチルイソソルビド、ポリエチレングリコール、ポリプロピレングリコール、ポリビニルアルコール、ヒドロキシプロピルメチルセルロースなどのアルコール及びポリオール及びその他のセルロース誘導体、シクロデキストリン及びシクロデキストリン誘導体などのアルコール及びポリオール;テトラヒドロフルフリルアルコールPEGエーテル(Tetraglycolの商標名でBASF社から市販品として入手できるglycofurol)又はメトキシPEG(Union Carbide社)などの、約200〜6000の平均分子量を有するポリエチレングリコールのエーテル;2−ピロリドン、2−ピペリドン、カプロラクタム、N−アルキルピロリドン、N−ヒドロキシアルキルピロリドン、N−アルキルピペリドン、N−アルキルカプロラクタム、ジメチルアセトアミド及びポリビニルピロリドンなどのアミド;プロピオン酸エチル、クエン酸トリブチル、アセチルクエン酸トリエチル、アセチルクエン酸トリブチル、クエン酸トリエチル、オレイン酸エチル、カプリル酸エチル、酪酸エチル、トリアセチン、プロピレングリコールモノアセタート、プロピレングリコールジアセタート、カプロラクトン及びその異性体、バレロラクトン及びその異性体、ブチロラクトン及びその異性体などのエステル;及びジメチルアセトアミド、ジメチルイソソルビド(Arlasolve DMI(ICI社))、N−メチルピロリドン(Pharmasolve(ISP社))、モノオクタノイン、ジエチレングリコールモノエチルエーテル(Transcutolの商標名でGattefosse社から入手できる)、及び水などの当該技術分野で公知のその他の可溶化剤。可溶化剤の混合物も本発明の範囲内である。
【0102】
示された通りのものを除き、本明細書に述べられた化合物は標準的な市販源から容易に入手可能である。
【0103】
透明な液体組成物は、組成物の全質量に基づいて5質量%未満、3質量%未満、又は1質量%未満の懸濁固体を含有するであろう故に、視覚的に肉眼に透明である。
【0104】
必要とは言えないものの、本発明の組成物又はキットは、キレート化剤、保存剤、酸化防止剤、吸着剤、酸性化剤、アルカリ化剤、消泡剤、緩衝剤、着色剤、電解質、塩、安定剤、浸透圧調整剤、希釈剤、その他の医薬品添加物、又はそれらの混合物を含み得る。
【0105】
本明細書では、用語「酸化防止剤」は酸化を阻害し、従って酸化プロセスによる製剤の劣化を防ぐために使用される試薬を意味することを意図している。そのような化合物には、制限されることなく例として、アスコルビン酸、アスコルビルパルミタート、ビタミンE、ビタミンE誘導体、ブチル化ヒドロキシアニソール、ブチル化ヒドロキシトルエン、次亜リン酸、モノチオグリセロール、没食子酸プロピル、アスコルビン酸ナドリウム、重亜硫酸ナトリウム、ホルムアルデヒド・スルホキシル酸ナトリウム、メタ重亜硫酸ナトリウム、及び当業者に公知の他のそのような物質が挙げられる。
【0106】
本明細書では、用語キレート化剤は、溶液中の金属イオンをキレートする化合物を意味することを意図している。例示的キレート化剤にはEDTA(エチレンジアミン四酢酸テトラナトリウム)、DTPA(ジエチレントリアミン五酢酸ペンタナトリム)、HEDTA(N−(ヒドロキシエチル)−エチレンジアミン三酢酸のトリナトリウム塩)、NTA(ニトリロ三酢酸トリナトリウム)、ジナトリウムエタノールジグリシン(Na2EDG)、ナトリウムジエタノールグリシン(DEGNa)、クエン酸、及び当業者に公知の他の化合物が挙げられる。
【0107】
本明細書では、用語「吸着剤」は、物理的又は化学的(化学吸着)手段によってその表面上に他の分子を保持し得る試薬を意味することを意図している。そのような化合物には、制限されることなく例として、粉末化されたそして活性化された炭、及び当業者に公知の他のそのような物質が挙げられる。
【0108】
本明細書では、用語「アルカリ化剤」は、アルカリ性培地を供するために使用される化合物を意味することを意図している。そのような化合物には、制限されることなく例として、アンモニア溶液、炭酸アンモニム、ジエタノールアミン、モノエタノールアミン、水酸化カリウム、ホウ酸ナトリウム、炭酸ナトリウム、重炭酸ナトリウム、水酸化ナトリウム、トリエタノールアミン及びトロラミン、及び当業者に公知の他のものが挙げられる。
【0109】
本明細書では、用語「酸性化剤」は、酸性培地を供するために使用される化合物を意味することを意図している。そのような化合物には、制限されることなく例として、酢酸、アミノ酸、クエン酸、フマル酸、及びその他α−ヒドロキシ酸、塩酸、アスコルビン酸、及び硝酸、及び当業者に公知の他のものが挙げられる。
【0110】
本明細書では、用語「消泡剤」は、充填組成物の表面上に形成する発泡の量を防ぐ又は削減する化合物又は化合物類を意味することを意図している。そのような化合物には、制限されることなく例として、ジメチコン、SIMETHICONE、オクトキシノール、及び当業者に公知の他のものが挙げられる。
【0111】
本明細書では、用語「緩衝剤」は、酸又はアルカリの希釈時又は添加時のpH変化を緩和するために使用される化合物を意味することを意図している。そのような化合物には、制限されることなく例として、メタリン酸カリウム、リン酸カリウム、一塩基性酢酸ナトリウム及びクエン酸ナトリウム無水物及び脱水塩、及び当業者に公知の他のそのような材料が挙げられる。
【0112】
本明細書では、用語「希釈剤」又は「充填剤」は、錠剤及びカプセルの製造において、望みのバルク、流動性及び圧縮特性を創出するために充填剤として使用される不活性物質を意味することを意図している。そのような化合物には、制限されることなく例として、二塩基性リン酸カルシウム、カオリン、乳糖、ショ糖、マンニトール、微結晶性セルロース、粉末セルロース、沈降炭酸カルシウム、ソルビトール及び澱粉、及び当業者に公知の他の材料が挙げられる。
【0113】
本明細書では、用語「保存剤」は、微生物の成長を防ぐために使用される化合物を意味することを意図している。そのような化合物には、制限されることなく例として、塩化ベンザルコニウム、塩化ベンゼトニウム、安息香酸、ベンジルアルコール、セチルピリジニウムクロリド、クロロブタノール、フェノール、フェニルエチルアルコール、硝酸フェニル水銀、酢酸フェニル水銀、チメロサール、メタクレゾール、ミリスチル−γ−ピコリニウムクロリド、安息香酸カリウム、ソルビン酸カリウム、安息香酸ナトリウム、プロピオン酸ナトリウム、ソルビン酸、チモール、及びメチル、エチル、プロピル又はブチルパラベン、及び当業者に公知の他のものが挙げられる。
【0114】
本明細書では、用語「着色剤」は、医薬品に色を付与するために使用される化合物を意味することを意図している。そのような化合物には、制限されることなく例として、FD&CレッドNo.3、FD&CレッドNo.20、FD&CイエローNo.6、FD&CブルーNo.2、FD&CグリーンNo.5、FD&CオレンジNo.5、FD&CレッドNo.8、カラメル及び酸化鉄(黒、赤、黄)、その他のFD&C染料及びブドウ皮抽出物、ビートの赤色粉末、β−カロテン、アナトー、カルミン、ウコン、パプリカなどの天然着色剤、それらの組み合わせ、及び当業者に公知の他のそのような材料が挙げられる。
【0115】
本明細書では、用語「安定剤」は、もし使用しなければ試薬の治療活性を低減するであろう物理的、化学的、又は生化学的プロセスに抗して活性剤を安定化するために使用される化合物を意味することを意図している。そのような安定剤には、制限されることなく例として、アルブミン、シアル酸、クレアチニン、グリシン及びその他のアミノ酸、ナイアシンアミド、アセチルトリプトファン酸ナトリウム、酸化亜鉛、ショ糖、グルコース、乳糖、ソルビトール、マンニトール、グリセロール、ポリエチレングリコール、カプリル酸ナトリウム及びサッカリンナトリウム及び当業者に公知の他のものが挙げられる。
【0116】
本明細書では、用語「浸透圧調整剤」は、液体製剤の浸透圧を調節するために使用され得る化合物を意味することを意図している。好適な浸透圧調整剤にはグリセリン、乳糖、マンニトール、デキストロース、塩化ナトリウム、硫酸ナトリウム、ソルビトール、トレハロース及び当業者に公知の他のものが挙げられる。
【0117】
実施例3および6には例示的なカプセル剤形が述べられている。実施例12には例示的な錠剤剤形が述べられている。
【0118】
本発明の組成物は、不揮発性油、ピーナツ油、ゴマ油、綿実油、トウモロコシ油、及びオリーブ油などの油;オレイン酸、ステアリン酸及びイソステアリン酸などの脂肪酸;及びオレイン酸エチル、ミリスチン酸イソプロピル、脂肪酸グリセリド及びアセチル化脂肪酸グリセリドなどの脂肪酸エステルも含み得る。本組成物は、エタノール、イソプロパノール、ヘキサデシルアルコール、グリセロール及びプロピレングリコールなどのアルコール;2,2−ジメチル−1,3−ジオキソラン−4−メタノールなどのグリセロールケタール;ポリ(エチレングリコール)450などのエーテル;鉱油及びワセリンなどの石油系炭化水素;水;薬学的に適切な界面活性剤、懸濁剤又は乳化剤;又はそれらの混合物も含み得る。
【0119】
尚、医薬製剤技術において使用される化合物が一般的に種々の機能又は目的の役を果たす。このように、もし、本明細書において名前を挙げられた化合物が、本明細書において一つより多くの用語を定義するために一度だけ述べられ又は使用されるならば、その目的又は機能は、その名前を挙げられた目的(等)又は機能(等)のみに限定されると考えられるべきではない。
【0120】
一つ又はそれ以上の製剤成分は、その遊離塩基で、又は薬学的に又は分析的に許容できる塩形態で存在し得る。本明細書では、「薬学的に又は分析的に許容できる塩」は、イオン的に結合された対を形成するために必要に応じてそれを酸と反応させて改質された化合物を意味する。許容できる塩の例には、例えば、非毒性の無機酸又は有機酸から形成された従来の非毒性塩が挙げられる。適切な非毒性塩には、塩酸、臭化水素酸、硫酸、スルホン酸、スルファミン酸、リン酸、硝酸などの無機酸及び当業者に公知の他のものから誘導されるものが挙げられる。これらの塩はアミノ酸、酢酸、プロピオン酸、コハク酸、グリコール酸、ステアリン酸、乳酸、リンゴ酸、酒石酸、クエン酸、アスコルビン酸、パモ酸、マレイン酸、ヒドロキシマレイン酸、フェニル酢酸、グルタミン酸、安息香酸、サリチル酸、スルファニル酸、2−アセトキシ安息香酸、フマル酸、トルエンスルホン酸、メタンスルホン酸、エタンジスルホン酸、シュウ酸、イセチオン酸などの有機酸及び当業者に公知の他のものから製造される。他の適切な塩のリストがRemington's Pharmaceutical Sciences, 17th. ed., Mack Publishing Company, Easton, PA, 1985, p. 1418に見られ、その関連する開示は、参照されることにより本明細書に組み込まれているものとする。
【0121】
フレーズの「薬学的に許容できる」は、妥当な医学判断の範囲内で、ヒト及び動物の組織と接触して使用するのに適しており、そして過剰な毒性、刺激、アレルギー応答又は如何なるその他の問題又は合併症無しに合理的な便益/リスク比に見合う、そのような化合物、材料、組成物及び/又は剤形を参照するために、本明細書において使用される。
【0122】
上記記述及び下記実施例を見れば、当業者は請求された通りに本発明を、必要以上の実験無しに、実行し得るであろう。前述のことは、本発明の実施態様の調製のためのある手順を詳述している以下の実施例を参照すればよりよく理解されるであろう。これらの実施例に対する全ての参照は説明目的のためである。以下の実施例は網羅的なものではなく、本発明によって意図された多くの実施態様の単に二、三を説明するものであると考えられるべきである。
【0123】
オレアンドリン及びMTTは、Sigma Chemical社(St.Louis、MO)から購入される。BODIPY−オレアンドリン、Mito-Tracker Red CM-H2XRos、カルセインアセトキシメチル(CAM)エステル及び4’−6−ジアミジノ−2−フェニルインドール(DAPI)はMolecular Probes-Invitrogen社(Carlsbad、CA)から得られる。抗β−アクチン抗体もSigma社から購入される。
【0124】
ヒトの膵臓癌細胞:Panc-1、BxPC3、MiaPaca;ヒトの結腸癌細胞株:CaCO-2、DOD-1、HCT-116、HT29、RKO及びLST174;齧歯動物のメラノーマB16細胞;ヒトの乳癌細胞:SUM149、MCF-7及びMDA231;ヒトの口腔癌細胞:SCC9及びCAL-27;ヒトの卵巣癌ES3、TOV1120及びSKOV細胞及びヒトの非小細胞癌A549及びH1299細胞は全てThe American Type Culture Collection(Manassas、VA)から得られ、そして37℃で、5%CO2を含む加湿雰囲気中に維持された。ヒトのメラノーマBRO細胞は、The Stehlin Foundation(Houston、TX)からの親切な贈与であった。異なる上皮源に由来する細胞株は、10%の熱で不活性化されたウシ胎仔血清(FBS)、(Hyclone Laboratories社、Logan、UT)、50IU/mlのペニシリン及び50μg/mlのストレプトマイシン、並びにGIBCO(Invitrogen社)製の2mのL−グルタミンで補われた組織培養培地(Invitrogen社、Grand Island、NY)(表1)中で規定どうりに培養される。
【0125】
〔実施例1〕
粉末化されたセイヨウキョウチクトウの葉の超臨界流体抽出
方法A.二酸化炭素使用
セイヨウキョウチクトウの葉材料を収穫、洗浄及び乾燥し、次いでセイヨウキョウチクトウの葉材料を、米国特許第5,236,132号,第5,598,979号,第6,517,015,及び第6,715,705号に記載されているもののような粉砕脱水装置を通過させることによって、粉末化されたセイヨウキョウチクトウの葉を製造した。使用された出発原料の質量は3.94kgであった。
出発原料を、抽出装置中で、300バール(30MPa、4351psi)の圧力及び50℃(122oF)の温度で純粋なCO2と混ぜ合わせた。全部で197kgのCO2を使用し、原材料に対する溶媒の比を50:1とした。次いで、CO2及び原材料の混合物を分離装置に通過させ、混合物の圧力及び温度を変え、そして抽出物を二酸化炭素から分離した。
抽出物(65g)が、よい芳香を有する茶色の、粘っこい、粘着性の物質として得られた。その色はクロロフィルによってもたらされたようであった。正確な収量を求めるために、チューブ及び分離機をアセトンでゆすぎ出し、そしてアセトンを蒸発させたところ、追加の9gの抽出物を得た。全抽出物量は74gであった。出発原料の質量に基づくと、抽出物の収率は1.88%であった。抽出物中のオレアンドリンの含有量を高圧液体クロマトグラフィー及び質量分析を用いて計算したところ560.1mg、つまり0.76%の収率であった。
【0126】
方法B.二酸化炭素及びエタノールの混合物使用
セイヨウキョウチクトウの葉材料を収穫、洗浄及び乾燥し、次いでセイヨウキョウチクトウの葉材料を、米国特許第5,236,132号,第5,598,979号,第6,517,015,及び第6,715,705号に記載されているもののような粉砕脱水装置を通過させることによって、粉末化されたセイヨウキョウチクトウの葉を製造した。使用された出発原料の質量は3.85kgであった。
出発原料を、抽出装置中で、280バール(28MPa、4061psi)の圧力及び50℃(122oF)の温度で、純粋なCO2及び改質剤として5%エタノールを混ぜ合わせた。全部で160kgのCO2及び8kgのエタノールを使用し、原材料に対する溶媒の比を43.6:1とした。次いで、CO2、エタノール及び原材料の混合物を分離装置に通過させ、混合物の圧力及び温度を変え、そして抽出物を二酸化炭素から分離した。
エタノールを除去した後、抽出物(207g)が、明らかに幾らかのクロロフィルを含有する、暗緑色の粘っこい、粘着性の塊として得られた。出発原料の質量に基づいて、抽出物の収率は5.38%であった。抽出物中のオレアンドリンの含有量を高圧液体クロマトグラフィー及び質量分析を用いて計算したところ1.89mg、つまり2.1%の収率であった。
【0127】
〔実施例2〕
粉末化されたセイヨウキョウチクトウの葉の熱水抽出
セイヨウキョウチクトウの葉からオレアンドリン及び他の活性剤を抽出するために熱水抽出が一般的に使用された。熱水抽出プロセスの例は米国特許第5,135,745号及び第5,869,060号において見出され得る。
5gの粉末化されたセイヨウキョウチクトウの葉を用いて熱水抽出を行った。(セイヨウキョウチクトウ出発原料の質量当たり)10倍の容積の沸騰水を粉末化されたセイヨウキョウチクトウの葉に加え、そして混合物を6時間、絶えず撹拌した。次いで、混合物をろ過して葉の残留物を集め、そして再び同じ条件下で抽出した。濾液を合わせて凍結乾燥させた。抽出物の外観は茶色であった。乾燥された抽出物の質量は約1.44gであった。34.21mgの抽出物を水中に溶解させ、高圧液体クロマトグラフィー及び質量分析を用いてオレアンドリン含有量分析にかけた。オレアンドリンの量は3.68mgであった。抽出物の量に基づいて、オレアンドリンの収率を計算したところ0.26%であった。下表は実施例1の二つの超臨界二酸化炭素抽出物及び熱水抽出物に対するオレアンドリン収率の間の比較を示す。
【0128】
【表5】

【0129】
〔実施例3〕
細胞株
ヒトの膵臓癌細胞:Panc-1、BxPC3、MiaPaca;ヒトの結腸癌細胞株:CaCO-2、DOD-1、HCT-116、HT29、RKO及びLST174;齧歯動物のメラノーマB16細胞;ヒトの乳癌細胞:SUM149、MCF-7及びMDA231;ヒトの口腔癌細胞:SCC9及びCAL-27;ヒトの卵巣癌ES3、TOV1120及びSKOV細胞及びヒトの非小細胞癌A549及びH1299細胞は全てThe American Type Culture Collection (Manassas、VA)から得られ、そして37℃で、5%CO2を含む加湿雰囲気中に維持された。ヒトのメラノーマBRO細胞は、The Stehlin Foundation (Houston、TX)からの親切な贈与であった。異なる上皮源に由来する細胞株は、10%の熱で不活性化されたウシ胎仔血清(FBS)、(Hyclone Laboratories社、Logan、UT)、50IU/mlのペニシリン及び50μg/mlのストレプトマイシン、並びにGIBCO(Invitrogen)製の2mのL−グルタミンで補われた組織培養培地(Invitrogen社、Grand Island、NY)(表1)中で規定どおりに培養された。
【0130】
〔実施例4〕
細胞毒性のインビトロの決定
細胞を、下表に示された通りのその関連する培地中で、1×104細胞/ウエルの密度で成長させた。24時間のインキュベーション期間の後、細胞を種々の濃度(1から500nM)のオレアンドリンを用いて処理した。追加の72時間後、細胞増殖の阻害をMTT分析(23)によって評価した。Molecular Devices社(Sunnyvale、CA)製のV-Max Micro-plate Readerを用いて、570nmの波長、及び650nmの参照波長で吸光度を読んだ。ある濃度のセイヨウキョウチクトウ抽出物、又は強心配糖体化合物を含有する他の植物抽出物が存在する故の、細胞増殖の阻害の相対的程度は、細胞増殖を可能とする設定時間(例えば、24〜72時間)後の、未処理の細胞数に対する処理された細胞数を比較することによって導くことができる。
【0131】
【表6】

【0132】
〔実施例5〕
強心配糖体の細胞摂取の決定
Panc-1(α3:α1アイソフォームの最高比)細胞及びBxPC3細胞(より低いα3:α1比)中のオレアンドリン及びウアバインの摂取を、オレアンドリンの蛍光類似体であるBODYPI−オレアンドリンを用いて処理した後、蛍光顕微鏡法によって求めた。96−ウエルプレート中の細胞を、0、5、20及び50nMのオレアンドリンで2時間又は24時間、処理した。処理はDMEM/F12培地の0.5%のウシ胎仔血清中で実行された。細胞は、MitoTracker Red CM-H2XRos(1μM)、及び選択的核染料(Molecular Probes)であるDAPI(1ng/ml)を用いて同時にインキュベーションされた。核形態、DNA及びミトコンドリア染料摂取をOlympus IX-70倒立顕微鏡を用いた蛍光顕微鏡法によって評価した。画像の取得は、Quantix電荷結合素子カメラ及びIP Labsソフトウエア(Scanalytics社、Fairfax、VA)を用いて達成された。野生型及びα3siRNAをトランスフェクトされたPanc-1の細胞中のオレアンドリン摂取の変化を、ラミニンで被覆されたカバーガラス上で培養された細胞、及びBODIBY−オレアンドリンで1時間処理された細胞において求めた。
【0133】
〔実施例6〕
α3及びα1アイソフォーム発現としてのNa、K−ATPアーゼの決定
細胞を冷PBSで洗浄し、そしてリシス緩衝液(20mMのMOPS、2mMのEGTA、5mMのEDTA、30mMのNaF、40mMのβ−グリセロリホスフェート、20mMのピルビン酸ナトリウム、0.5%のTriton X-100及びプロテアーゼ阻害剤カクテルを有する1mMのオルソバナジン酸ナトリウム)の存在下で、削り落とした。次いで、細胞溶解物を氷の上で3分間、超音波分解させ、そして14,000×g(4℃で10分間)での遠心分離の前に追加の10分間、4℃でインキュベーションさせた。蛋白質レベルをBioRad Dc蛋白質測定(BioRad社、Hercules、CA)を介して定量した。同レベルの蛋白質(50μg)をプレキャストゲル(BioRad社)に適用し、そして次に標準法に従ってポリビニリデンジフルオリド膜上に移した。0.1%のTween20を有するトリス−緩衝食塩水中で調製した5%の脱脂乾燥ミルクブロッキング緩衝剤中における1から2時間のインキュベーション期間に続いて、ブロッキング緩衝液中1:2,000倍に希釈したα3アイソフォーム(Affinity Bioreagents、Golden、CO)及びα1アイソフォーム(Upstate、Lake Placid、NY)に対する一次抗体を用いて膜を調べた。ECL+検出キット及びhyper-film (Amersham Biosciences, Piscataway, NJ)を用いて、化学発光を介して蛋白質のバンドを可視化した。β−アクチンの存在に対するサンプルの等量負荷がウエスタンブロットによって示された。蛋白質のバンドを、Alpha DigiDoc 1000ソフトウエア(Alpha Innotech社、San Leandro、CA)を用いて定量した。
【0134】
〔実施例7〕
限定はされないが、メラノーマ、基底細胞癌腫、及び扁平上皮癌、並びに限定はされないが光線性角化症、乾癬及び湿疹を含む非癌性炎症性の皮膚病の治療の防止を含む、癌などの皮膚に関連する疾病の治療
SCF抽出物が、上に引用されたもののような悪性又は非悪性の増殖性皮膚疾患を患っている対象物に投与される。SCF抽出物は、クリーム又は軟膏として投与され、又は単位用量当たり0.01mgから10mgのSCF抽出物を含有する皮膚パッチ内に含有される。対象物に、1から14日の期間、又は皮膚病が寛解期になるまで、毎日3回までの単位用量が投与される。そのような治療が炎症、及び疾病の進行に繋がる悪性プロセスを著しく軽減又は排除するであろうことが期待される。対象物は皮膚病変の重篤性における軽減、及び皮膚病自身の最終的な消散を経験するはずである。悪性の疾病が成長速度において軽減される、又は疾病の重篤性の増大が阻害されることが期待されるはずである。確立された悪性病変の実際の退行が期待され得る。
【0135】
〔実施例8〕
皮膚癌などの皮膚に関連する疾病の防止
SCF抽出物が、(太陽光からの)紫外線又は薬品からの発癌物質に頻繁に曝される対象物等の皮膚癌の形成への素因に悩まされている対象物に投与される。SCF抽出物は、クリーム又は軟膏として投与され、又は単位用量当たり0.01mgから10mgのSCF抽出物を含有する皮膚パッチ内に含有される。発癌性物質の促進イベントへの暴露が予想される時(日光への暴露)はいつでも毎日3回までの単位用量が対象物に投与される。そのような投与は、例えば、太陽光UV暴露をブロックするための日焼け止め、及び、皮膚組織における腫瘍誘起を防止するためのSCF抽出物としてなされ得る。皮膚製品におけるSCFのそのような使用が、増殖が疾病過程(例えば、光線性角化症、乾癬及び/又は湿疹)の悪化につながる悪性皮膚病又は非悪性皮膚疾患の形成及び/又は促進をブロックするであろうことが期待されるであろう。
【0136】
〔実施例9〕
ヒト又は他の脊椎動物における固形腫瘍の治療
強心配糖体を含有する植物又は動物のSCF抽出物は、直腸、肛門、結腸直腸組織、頭頚部組織、食道組織、肺(非小細胞癌及び小細胞癌の両方)、乳房、胃、膵臓、前立腺、肝臓、腎臓、膀胱、尿管、卵巣組織、カルチノイド腫瘍、骨肉腫、中皮腫、及び中枢神経系の新生物の癌の治療のために使用され得る。
SCF抽出物が、上述のもののような固形の悪性疾病を患っている対象物に投与される。単位用量当たり1から50mgのSCF抽出物を含有する経口剤形としてSCF抽出物が投与される。対象物は、28日/サイクルの治療期間に対して、毎日2回までの単位用量が投与される。3サイクルまでの治療が要求され得る。対象物は腫瘍の成長が増殖速度において低下するか又は退行するかを経験するはずである。腫瘍の完全消散も起こり得る。SCF抽出物を用いた治療は、単独剤として又は細胞毒化学療法若しくは放射線治療と組み合わされて使用され得て、又は不当な干渉を引き起こすことなく、従来の治療の所望の抗腫瘍効果を有する適切な免疫治療と組み合わせられ得る。
【0137】
〔実施例10〕
二つのヒト腫瘍細胞株における、超臨界CO2を用いて作成されたSCF抽出 物に対する、Nerium oleanderの熱水抽出物の細胞毒性の比較
両方の抽出物の細胞毒性のポテンシャルをオレアンドリンのそれと直接比較した。オレアンドリンのそれらの濃度が、抽出物中に存在するオレアンドリンの濃度故に異なるものの、サンプルは同量のオレアンドリンを含有していた。
BRO(ヒトメラノーマ)及びPanc−1(ヒト膵臓癌)細胞(8×103ウエル)を96ウエルプレート中に置き、そして一晩、付着させた。次いで、薬品又は抽出物を細胞に加えた。72時間のインキュベーションの後、相対的細胞増殖(コントロールの未処理細胞に対して)をクリスタルバイオレット染色法によって評価した。
【0138】
〔実施例11〕
オレアンドリンを含有する溶液のHPLC分析
サンプル(オレアンドリン標準、SCF抽出物及び熱水抽出物)を以下の条件を用いてHPLC(Waters社)上で分析した:対称性C18カラム(5.0μm、150×4.6mm内径;Waters社);MeOH:水=54:46(v/v)及び流速が1.0ml/minの移動相。検出波長は217nmに設定された。サンプルは、化合物又は抽出物を固定された量のHPLC溶媒中に溶解させることによって製造され、ほぼ目標のオレアンドリン濃度を達成した。
【0139】
〔実施例12〕
SCF抽出物の抗ウイルス活性の評価
試験は、ヒト末梢血単核細胞(PBMCs)におけるHIV−1のROJO株の増殖を阻害するセイヨウキョウチクトウ抽出物又はポジティブコントロール(AZT)の相対的能力の決定から成る。感染細胞が薬剤又は抽出物に48時間、曝された。試験は、ヒトPBMCを殺し得る抽出物のその濃度に対して、セイヨウキョウチクトウ抽出物のIC50(ウイルス増殖の50%の阻害を生み出す抽出物のその濃度)を求めるために使用された。これは、実際に、抽出物の処理指数の決定である。これは本質的に、抽出物がPBMC細胞そのものを殺すことなく、HIV−1を殺し得るか否かの決定である。
100ug/mlという高い濃度でも、細胞を殺すために要求される濃度が到達されていない一方、約5.0ug/ml以下のウイルス増殖に対するIC50を観察するにちがいない。得られたこれらのデータは、HIV−1ウイルス増殖の阻害、又はPBMC細胞内に宿されたウイルスの感染性の点で、セイヨウキョウチクトウ抽出物が有用であるにちがいないことを示唆した。
【0140】
〔実施例13〕
Panc−1細胞のα3siRNAとのトランスフェクション
Panc−1細胞を6及び48ウエルプレート中に置き、そして一晩、付着させた。α3siRNA分子の過渡的トランスフェクションを、siPORT(商標)Amine Transfection Agent(Ambion Austin社、TX)及び 0.4μMのα3サイレンシングRNA(Santa Cruz Biotech.社)を用いてメーカーの指示書に従って実施した。トランスフェクションの24時間後、細胞を10から50nMのオレアンドリンを用いて48時間処理した。ウェスタンブロット解析のために蛋白質を6ウエルプレートから集め、そして細胞生存率の評価をCalcien AM染色によって実施した。
【0141】
〔実施例14〕
正常及び結腸生検組織におけるα3及びα1発現の決定
急速冷凍された正常な結腸粘膜及び腫瘍組織生検を得て、液体窒素で冷却した乳鉢を用いて粉砕した。サンプルを前記の通り、リシス緩衝液に曝した。次いで、溶解物を氷上で3分間、超音波分解し、4℃で10分間、インキュベーションさせ、そして14,000rpmで遠心分離し(4℃で10分間)、続いて前記の通り、α−サブユニットのα3及びα1アイソフォームのウエスタンブロック分析を行った。
【0142】
〔実施例15〕
統計解析
種々の実験グループの間の統計的違いを求めるために、スチューデントt検定を用いた;P<0.05の値が有意差有りと考えられた。
【0143】
〔実施例16〕
α3抗体の感度の決定
異なるα3抗体の感度を比較するために、ポジティブ及びネガティブのコントロールサンプルの等量の同じ溶解物を3つのプレキャストゲル(BioRad社、Hercules、CA)上に載せ、次いで標準法に従って、ポリビニリデンジフルオリド膜に移した。0.1%のTween20を有するトリス−緩衝食塩水(TBS−T)中で製造した5%の脱脂乾燥ミルクブロッキング緩衝剤における1〜2時間のインキュベーションに続いて、各々ブロッキング緩衝液中1:2,000倍に希釈した、Sigma(St Luoise、MO)、Affinity Bioreagents(Golden社、CO)及びNovus(Littleton、CO)からのα3抗体で膜を探索した。蛋白質のバンドをChemiglow West検出キット及びAlpha Imager(Alpha Innotech社、San Leandro、CA)を用いて、化学発光を介して可視化した。蛋白質のバンドを、Alpha DigiDoc 1000ソフトウエア(Alpha Innotech社、San Leandro、CA)を用いて定量し、そして3つの抗体の間で比較した。β−アクチンに対するサンプルの等量負荷がウエスタンブロットによって示された。これらのデータは、選択された抗体の各々の一つの、α3に対する感度が実質的に等しいことを示す。
【表7】

【0144】
〔実施例17〕
予後アッセイを実施するためのキット
このキットは、本発明の方法に従って、実施例18において詳述されているように、ウエスタンブロット技法を用いて予後アッセイを実施するために、使用され得る。
1.溶解組成物
【表8】

2.一次抗体:(ブロッキング溶液中、1:2000)
α3(Affinity Bioreagents Cat# MA3-915)
α1(Upstate Cat# 05-369)
3.二次抗体:ヤギ抗マウス IgG HRP(Santa Cruz Cat# sc-2005)
4.ゲル/膜製造:
7.5〜10%のゲル(BioRad Precast)
BioRad Laemmliサンプル緩衝液(Cat# 161-0737)
分子量マーカー(Cat# 161-0318)
泳動緩衝液(BioRad 10X トリス/グリシン/SDS)(Cat# 161-0 732)
膜(Biorad PVDF)
トランスファー緩衝液:
3.03gのトリス(最終濃度−25mM)
14.4gのグリシン(最終濃度−0.192mM)
200mlのメタノール(20%)
1LまでのH2O
5.ブロッキング溶液:TBS(20mM トリス HCl、150mM NaCl)中、5%のミルク
6.洗浄緩衝液:TBS−T(20mM トリス HCl、150mM NaCl、0.05% Tween−20)
8.ポジティブコントロール細胞:ヒト膵臓癌、Panc-1細胞の細胞溶解物
9.ネガティブコントロール細胞:マウスメラノーマB16細胞
10.α−サブユニットのアイソフォームのウエスタンブロット法のための詳細なプロトコールを含むパンフレット
【0145】
〔実施例18〕
細胞組織のサンプルの製造
方法A.細胞ペレットから
200万から400万の細胞を含有する細胞ペレットを得る。培地を除くために生理的平衡溶液(PBS)を用いてすすぐ。100ulのリシス緩衝液を添加する。常に冷たく保つ(氷上)。実施例18における超音波分解工程を続ける。
方法B.プレート上の細胞から
100mmの組織培養プレート上で120万から150万の細胞を24時間かけて成長させる。細胞増殖培地を注意深くデカントして廃棄する。1mlのPBSを用いてプレートを2回すすぐ。100ulのリシス緩衝液を添加し、細胞をプレートからこすり落とし、そしてチューブ中に集める。常に冷たく保つ(氷上)。実施例18における超音波分解工程を続ける。
方法C.組織から
冷凍された組織を粉砕する。粉砕された組織をチューブ中に置く。最低5mgの粉砕された組織に100μlの冷たいリシス緩衝液を添加する。常に冷たく保つ(氷上)。実施例18における超音波分解工程を続ける。
【0146】
〔実施例19〕
ウエスタンブロットによるサンプル中のα−サブユニットのアイソフォーム含有量の決定
下記の手順は、そこにおいてサンプル中のNa、K−ATPアーゼのαサブユニットのアイソフォーム含有量を検出して定量するために本発明の方法が採用され得る単なる一つの方法である。工程の順序は必要に応じて修正され得る。
ウェスタンブロット解析
1.氷で冷した浴を用いるなど、冷却しながら細胞溶解物を超音波分解する。
2.溶解物を4℃にて10分間、14,000rpmで回転させる。
3.上澄み液を集めて−常に氷上に保つ。
4.蛋白質分析によって蛋白質レベルを求める(BioRad(登録商標)Protein Assay Kit指示書を参照)。
5.蛋白質分析に基づいて、ゲル上に載せるためのサンプルを製造する(ウエル当たり50μgの蛋白質)。
a.ポジティブ及びネガティブのコントロール溶解物並びにサンプルを製造する。
i.ポジティブコントロール:Panc−1蛋白質溶解物
ii.ネガティブコントロール:Panc−2又はB16蛋白質溶解物
b.ラエムリ(Laemmli)サンプル緩衝液(LSB社)をサンプル及びコントロールに添加する(LSB社指示書を参照)。
c.サンプル及びコントロールを95℃で5分間、加熱する。
d.サンプルを回転して落とす。
6.ゲルを搭載する。
7.染料がゲルの底から流出するまで、ゲルを200ボルトで流す。
8.100ボルトで1〜2時間、移す。
9.ブロッキング緩衝液中で、室温にて30分から1時間、膜をブロックする。
10.4℃で一晩、膜をインキュベーションする。
11.洗浄緩衝液を用いて膜を洗浄する。
3回の迅速洗浄、1〜15分の洗浄、2〜10分の洗浄
12.IIo抗体中で、室温にて45分から1時間、膜をインキュベーションする。
13.洗浄緩衝液を用いて膜を洗浄する。
3回の迅速洗浄、1〜15分の洗浄、2〜10分の洗浄
14.ECL+(Amersham Cat# RPN2132)中で5分間、膜をインキュベーションする。
15.フィルム(Amersham Cat# RPN3114k)に膜を曝し、そしてフィルム展開機上に展開する。
16.曝された膜の写真を、Alpha Digi Docソフトウエア(又は、貴方の現在の画像撮影機)を用いて、Alpha Imagerで撮る。
17.Alpha Digi Docにおける解析ツールのSpot Densoアプリケーションを用いて、α1及びα3画像の対応するバンドを選択する。
18.各バンドに対する積分密度値Ietegrated Density Value(IDV)を得る。
19.α1アイソフォームに対するα3アイソフォームの比を計算する。
【0147】
〔実施例20〕
Na、K−ATPアーゼ特異的αサブユニットに対するmRNAを求めるためのRT−PCR法
RNASTAT-60試薬(Tel-Test社、Friendswood、TX)が、逆転写ポリメラーゼ連鎖反応(RT−PCR)分析における使用前にDNアーゼIで処理された全RNAを抽出するために使用された。1μgのRNAが、マウス乳癌ウイルスRT(Life Technologies社、Rockville、MD)を用いて逆転写された。α3−371bp配列が、プライマーのセット、α3−NKA3VSAS−2−F 5’−NNNNNNNNNN−3’(正順)及び−R5’−NNNNNNNN−3’(逆順)によって増幅された。これらのセット及び追加プライマーのセットが、Oligo 6.7 Molecular Biology Insights(Cascade、CO)を用いて設計されそして検証された。GAPDHmRNAを検出するためにRT−PCR分析において、プライマー対(5’−CAGCTCTGGAGAACTGCTG−3’;5’−GTGTACTCAGTCTCCACAGA−3’)が使用された。
【0148】
〔実施例21〕
転移性膵臓ガストリノーマの治療に対する、強心配糖体含有抽出物と他の抗癌剤の組み合わせの臨床評価
以下は、転移性膵臓ガストリノーマを患っている患者が強心配糖体含有抽出物を用いて治療された事例履歴である。
63歳の男性が、膵臓病の疑いでM. D. Anderson癌センターに2002年8月30日を訪れた。CTスキャンの結果、膵臓の尾上に腫瘤が見つかった。2002年9月17日に、患者は、強心配糖体、主としてオレアンドリン、を含有する実験薬の自己投与を始めた。2002年10月9日に、患者は膵臓の高分化型膵島細胞腫瘍を有すると診断された。患者は、アドリアマイシン、ストレプトゾシン及び5−FUの8サイクルの化学療法、続いてストレプトゾシン及び5−FUの3サイクルの化学療法を推奨された。2002年11月13日に、患者は推奨された治療を始め、一方でオレアンドリンを含む薬の自己投与を継続した。2003年7月23日に、患者は化学療法の推奨されたレジメンを完結した。彼の元の診断において、何の変化も認められなかった。患者は2003年7月23日以降、何の化学療法も受けなかった。患者は、化学療法レジメンの完結に続いて、強心配糖体を含有する抽出物の自己投与を続けた。遅くとも2007年2月16日に、患者は放射線的に安定な疾病を有するとして記載された。患者は、オレアンドリンなどの強心配糖体含有抽出物の自己投入を続け、そして無症候性であり、かつカルノフスキー尺度で100
%であると報告された。
【0149】
〔実施例22〕
腺癌の治療に対する、強心配糖体含有抽出物の臨床評価
35歳の男性が、通常の食事を取った後に、腹部において痛み及び膨満を経験した。彼は民間の診療所を訪れ、そして螺旋腹部コンピュータ支援断層撮影(CAT)スキャンが実施された。結論の中に膵臓頭部の容積増大、柔組織密度の異質性、及び膵臓頭部の前部位での多数のリンパ節腫があった。磁気共鳴映像法(MRI)検査でこれらの発見が確認された。同じ日に、超音波支援細針吸引生検が実施された。超音波検査の結果、膵臓頭部に39×33mmの腫瘍塊が分かった。生検用標本の組織病理学的検査で腺癌としての診断が分かった。化学療法コースが推奨されたが、患者が拒否した。
一月後、患者は自己投与による、非常に少量のオレアンドリンを含有する植物抽出物治療を始めた。一月以内に得られた上部腹部のMR画像は膵臓頭部上に35×25mmのコントラストを保持した病巣を示した。その中で最大のものが5mmであった多くのリンパ節症も、膵臓頭部の前部位及び胃洞の後部位に見つかった。
三月後に得られたMRI画像は、膵臓頭部における30×25mmのサイズの腫瘍を示した。少量のオレアンドリンを含有する抽出物の用量がこの時点で増やされた。三週間後に、骨シンチグラフィーが実施された。それは転移性疾病に対しては目立たなかった。七週間後に得られた上部及び下部腹部のMR画像は膵臓頭部上の腫瘍塊を示し、そして全てのリンパ節腫が寛解の兆しを示した。二か月後に得られた上部及び下部腹部のMRIでは、膵臓腺癌及び/又はリンパ節腫に対しては目立たなかった。引き続いて、四か月後に上部及び下部腹部のMRIが実施された。膵臓腺癌及び転移性の疾病に対して目立たない状態が続いた。
2007年3月現在、患者は寛解状態を継続中である。
【0150】
〔実施例23〕
癌及び腫瘍細胞の培養
以下の手順は、特定の癌又は腫瘍細胞の培養を最適化するために、必要に応じて修正され得る。Panc−1ヒト膵臓癌細胞はAmerican Type Culture Collection(Manassas、VA)から購入された。細胞は、10〜15%のウシ胎仔血清(Invitrogen、Carlsbad、CA)、100U/mlのペニシリン(Invitrogen)及び2.5ug/mlの抗真菌薬(Fungizone;Invitrogen)で補充されたDMEM培地中、5%のCO2において、37℃で培養された。オレアンドリン及びアドリアマイシンによる細胞増殖の相対的阻害を、一連の濃度の各薬品の72時間の連続薬品暴露の後で求めた。未処理のPanc−1細胞増殖に対する細胞増殖を評価するために、以前に述べられた通り(Mosmann、1983)、MTT分析が使用された。細胞増殖の評価の前72の間、細胞を無処理(コントロール)、オレアンドリン又はアドリアマイシンに暴露した。
【0151】
〔実施例24〕
細胞染色
アクリジンオレンジを用いて細胞を染色するために、以下の手順が使用された。
1ug/mlのアクリジンオレンジを用いて、37℃で15分間、細胞を染色した。細胞を、PBSを用いて洗浄し、プレートからトリプシン処理し、FBSを用いてPBS中に集め、そしてフローサイトメトリーを介して分析した。
【0152】
〔実施例25〕
細胞サイクル分析
細胞サイクルを求めるために、以下の手順が使用された。
Panc−1細胞を、オレアンドリン(0、20及び40uM)を用いて72時間処理し、トリプシン処理し、4℃の70%エタノールを用いて固定し、細胞DNAフローサイトメトリー分析試薬セット(Roche社)を用いて沃化プロピジウムで染色し、次いでFACScan(Becton Dickinson社、San Jose、CA)によってDNA含有量を分析した。Cell Questソフトウエア(Becton Dickinson社)によってデータを分析した。各サンプルに対して、少なくとも100,000個の細胞が分析された。
【0153】
〔実施例26〕
非小細胞癌の治療に対する、強心配糖体含有抽出物の臨床評価
81歳の男性が左上方葉の非小細胞肺癌を有すると診断された。患者は放射線治療、続いて化学療法のコースを推奨された。七週間後、患者は放射線治療を始め、そして24日で治療を完了した。次いで患者は6日以内に5つの化学療法のレイメンを始め、そして8カ月後にそれらを完了した。完了前の二十七日前に、彼は左上部葉の非小細胞肺癌の以前の診断の再現のために病院を訪れた。全身PETスキャンが実施され、そして患者の既知の悪性腫瘍と一致する左上部葉を含む大きな面積の異常な代謝亢進作用と結論付けられた。追加的に、右門及び前縦隔を含む代謝亢進作用の微妙な領域が結節関与を同様に反映した。胸のCTスキャンによって5cmの軟質組織密度が左上部葉に確認された。引き続いて化学療法のレジメンが開始された。一か月以内に、患者が耐えられないため、化学療法が中断された。一週間後、比較のために胸のCTスキャンが実施された。約4cmの軟質組織の腫瘤が左上部葉の後部セグメントにあった。左上部葉の腫瘤の全体的バルクにおいて間隔の減少があった。五週間以内に、患者はオレアンドリンを含有する植物抽出物の自己投与を始めた。三ヶ月後、フォローアップの胸部レントゲン撮影が以前のスキャンと比較されたところ、左上部葉の腫瘍瘤密度は変化していなかった。一年後、胸部レントゲン撮影が、三か月前のスキャンで発見されたものと比較され、そしてその上の左上部葉における約4cmのサイズの腫瘍瘤密度に変化がないことが判明した。
患者はオレアンドリンを含有する植物抽出物の自己投与を続けた。四か月以内に、IVコントラストを用いる胸のCTスキャンが実施された。左上部葉の中央腫瘤のサイズにおいて約20%の減少が観察された。現時点で、患者はオレアンドリンを含有する植物抽出物の自己投与を続けており、そして高いカルノフスキー尺度が報告された。臨床データは、患者の最後の化学療法の後の多くの月に中央腫瘤ノサイズ変化が起きたため、植物抽出物が治療上の便益を有することを示唆している。
【0154】
〔実施例27〕
免疫組織化学的染色によるサンプル中のα−サブユニットのアイソフォーム含有量の決定
下記の手順は、そこにおいてサンプル中のNa、K−ATPアーゼのαサブユニットのアイソフォーム含有量を検出して定量するために本発明の方法が採用され得る単なる一つの方法である。工程の順序は必要に応じて修正され得る。この分析において使用された材料は、Vector Laboratories(Burlingame、CA又はPeterborough、England)から得ることができる。
【0155】
免疫組織化学的分析
ヒト組織の新鮮凍結された切片が使用された。切片はキシレンを3回換えて(各々5分)用いて脱パラフィン処理され、濃度を順に下げたエタノール中(99%で2回、90%で2回、各5分間)で再水和され、そして蒸留水中でよくすすがれた。熱媒介された抗原検索方法がVector抗原アンマスキング溶液(Vector-AMS社)の沸騰溶液中、高pH(Vector Laboratories社、Catalog # H-3301)で3×5分間、切片のインキュベーションによって完了された。
【0156】
抗原検索に続いて、切片を50mMのトリス−HCl、300mMのNaCl、0.1%、pH7.6の(TBS)中で2×5分間、洗浄した。メタノール中、0.3%(v/v)の過酸化水素中で20分間、切片をインキュベーションさせることによって、続いてTBS中で10分間、洗浄することによって、内因性ペルオキシド活性をクエンチした。
【0157】
TBS中、4ug/mlで、2.5%(v/v)の正常な馬血清(2.5%NHS)中に希釈した抗Na、K−ATPアーゼのα3サブユニットアイソフォーム抗体(Sigma-Aldrich社 Cat # A273)を用いて1時間、切片をインキュベーションした。ネガティブコントロール切片を非免疫性マウスIgG1抗体(Biostat Diagnostics社、Cat #093101)を用いて4ug/mlで、又は2.5%のNHS(「非一次」コントロール)中でインキュベーションした。
【0158】
TBS中で2×5分の洗浄に続いて、Vector ImmPress(商標)ユニバーサル抗体試薬(抗ウサギIgG及び抗マウスIgG試薬の混合物;Vector Labortories社、Cat #MP-7500)を用いて30分間、切片をインキュベーションした。次いで、切片を2×5分間、洗浄し、そしてジアミノベンジジン(DAB)基材を用いてインキュベーションし、適切な染色レベルに到達するまで監視した。スライドを希釈水中に浸漬することによって発色反応を停止させた。
【0159】
色素形成に続いて、ヘマトキシリンを用いて切片を対比染色し、濃度を順に上げたエタノール中(90−99−100%)で脱水し、二度変えたキシレン中で精製し、そしてDePeX下でカースリップした。
【0160】
結腸粘膜中でサイトケラチン免疫反応を示すアッセイコントロールを、ImmPress(商標)及び発色試薬を確認するために含ませた。二次抗体及び他の検定用試薬の非特異的結合を評価するために、「非一次」コントロールを含ませた。染色された切片を分析し、そしてLeica DFC290カメラを有するOlympus BX51顕微鏡を用いて、適切なデジタル画像を得た。
【0161】
免疫組織化学的に染色された細胞の写真が図6A〜6F及び図7A〜7Hに描かれている。サブユニットのアイソフォームの定量は本明細書に述べられ通りに成し遂げ得る。サンプル中のα1アイソフォームに対するα3アイソフォームの含有量比を求めたのに続いて、強心配糖体を用いた治療に対する治療応答の可能性に関して決定がなされる。
【0162】
上記は、本発明の特別な実施態様の詳細な記述である。本明細書において、本発明の特定の実施態様が説明目的で述べられているが、種々の修正 が、本発明の精神と範囲を逸脱することなくなされるであろうことが理解されるであろう。従って、本発明は添付された請求の範囲による場合を除いて、限定されるものではない。本明細書に開示されそして請求された全ての実施態様は、本開示を参照して、不当な実験設定なしに、なされ得てかつ実行され得る。
【技術分野】
【0001】
本発明は、強心配糖体を用いた癌の化学療法における予後を決定する方法に関する。特に、本発明は過剰な細胞増殖に関連した病因を有する、インビトロの又はインビボの細胞の疾病又は疾患が、強心配糖体を用いた治療に治療応答性であるか否かの確率を求める方法に関する。
【背景技術】
【0002】
過剰な細胞増殖に関連した病因を有する多くの疾病又は疾患は命にかかわる。これらの最も共通的なものが癌及び腫瘍である。しかしながら、癌ではない増殖性疾患も生命を脅かすものであり得て、又は生活の質の低下に繋がり得る。これらには、例えば:1)抗原誘発性の関節炎及びアレルギー性脳脊髄炎などの自己免疫疾患、2)関節リュウマチ、全身発症型若年性慢性関節炎、骨粗鬆症及び乾癬などの慢性炎症性増殖性疾患、3)線維嚢胞性疾患を含む乳房の増殖性疾患、4)良性前立腺肥大症(BPH)を含む前立腺の増殖性疾患、5)増殖性糖尿病性網膜症を含む目の増殖性疾患、及び6)アテローム性動脈硬化症及び冠動脈狭窄を含む血管増殖性疾患が挙げられる。これらの疾病又は疾患に対する治癒的な又は改善的な療法を開発するために多くの努力がなされてきた;しかしながら、種々の異なる癌、腫瘍及び他のタイプの増殖性疾患に対して有効であると証明されてきた多くの化学療法的方法があるものの、包括的又は万能的な治癒的療法は全く開発されていない。
【0003】
化学療法剤は、個々の患者のニーズに合わせる療法を開発する試みにおいて、臨床医によって個々に又は組み合わされて処方される。そうではあっても、これらのオーダーメードの療法の開発に向けた主要な障害物は、特定の癌又は腫瘍の発現型に対する化学療法剤の有効性の非予測性である。臨床医は、行き当たりばったりのやり方を使用することによって、これらの命にかかわる疾病に対処することを強いられる。彼らは、特定の化学療法剤の認められた又は指示された使用の歴史的レビューに頼り、そして次に、特定の単一化学療法剤又は化学療法剤の組み合わせが、臨床医が治癒を試みている癌又は腫瘍に対して治療上有効であろうか否かについて思索又は推定をせざるを得ない。そのような従来法は病院において限られた成功しか収めていない。
【0004】
臨床医は、特定の癌又は腫瘍の表現型が、特定の単一化学療法剤又は化学療法剤の組み合わせに対して治療応答性があるか否かを、幾つかの合理的なレベルの確実性で予測し得る予後アッセイを必要としている。このタイプの予後アッセイは、臨床環境に登場したばかりのものなどの、限られた使用の歴史しか有しない化学療法剤に対して極めて有用である。一つ又はそれ以上のそのような化学療法剤に対してそのような予後アッセイを有することは、臨床医によって極めて便益があるあろう。
【0005】
患者のデータの前臨床試験及び遡及検査によって、例えば、乳房、肺、前立線及び白血病を含む種々の癌の治療において、強心配糖体(例えば、ブファリン、ジゴキシン、ジギトキシン、ウアバイン及びオレアンドリン)の潜在的価値が示唆されている。
【0006】
強心配糖体の作用の薬理学的メカニズムの一つには、イオン交換ポンプであるNa、K−ATPアーゼに対する結合能力、及びこの特定の酵素の活性の阻害能力が挙げられる。細胞膜を横切ってNa+及びK+の活発な輸送を触媒する膜貫通蛋白質であるNa、K−ATPアーゼは、強心配糖体に対するよく確立された薬理学的レセプターである。この酵素はATPを加水分解し、そしてその電気化学的勾配に抗して細胞内へのK+、細胞外へのNa+の輸送を駆動するために自由エネルギーを用いる(非特許文献1)。
【0007】
Na、K−ATPアーゼは二つのヘテロ二量体サブユニット、触媒的α−サブユニット及びグリコシル化β−サブユニットから構成されている。γサブユニットもあるが、それは詳細には研究されていない。α−サブユニットは、ATP、Na+、K+及び強心配糖体に対する結合部位を有する。β−サブユニットは触媒的α−サブユニットを安定化するよう機能し、そして調節的役割も果たし得る。四つの異なるαアイソフォーム(α1、α2、α3、α4)及び三つの異なるβサブユニット(β1、β2、β3)が哺乳類の細胞において同定されている。各々のタイプの相対的発現は、正常な状態及び疾病の状態において著しく変わる。αアイソフォームの発現は、組織のタイプに特異的であり、そして齧歯動物及びヒトの組織の間で変わる(非特許文献2)。腎臓、肺、肝細胞、及び結腸などのヒトの癌におけるNa、K−ATPアーゼアイソフォームの変化した発現も、対応する正常な組織におけるそれらと対照させて報告されている(非特許文献3;非特許文献4;非特許文献5;非特許文献6)。加えるに、異なるαアイソフォームに対する強心配糖体の見かけの親和性は非常に異なる。α1アイソフォームに対する強心配糖体の結合は、このタイプの薬剤による阻害に対して250倍又はそれより高い感度があるα2及びα3アイソフォームと一緒に生じるそれよりも少ない(非特許文献7)。(非特許文献8)には、正常な結腸直腸細胞と比べ、ヒトの結腸直腸癌細胞においてα3サブユニットアイソフォームの発現が増加することが報告されている。
【0008】
オレアンドリン及びオレアンドリゲニンは、少なくとも部分的に、Na、K−ATPアーゼの阻害を介する細胞内Ca2+の増加のせいであるアポトーシスの誘発を通して、ヒトの前立腺癌細胞の増殖を阻害する(非特許文献9)。オレアンドリン及びオレアンドリゲニンは、膜相互作用及びNa、K−ATPアーゼ活性の阻害を通した線維芽細胞増殖因子−2の搬出も阻害する(非特許文献10)。
【0009】
α1β1複合体は「ハウスキーピング」遺伝子と考えられる故に、Na、K−ATPアーゼサブユニットα1は多くの組織中に存在する一方、α3は励起され得る組織、腎皮質、髄質、及び乳頭、並びに神経組織において主として検出される。
【0010】
Nerium oleanderは、亜熱帯アジア、米国南西部及び地中海において広く分布している観賞植物である。その医学的及び毒物学的な性質は長い間、認識されてきた。それは、例えば、痔、潰瘍、ハンセン病、ヘビ咬傷の治療、及び流産の誘発においてさえも使用されてきた。セイヨウキョウチクトウの抽出物の重要な成分であるオレアンドリンは、ヒト腫瘍細胞の増殖の強力な阻害剤である(非特許文献11)。オレアンドリンに仲介される細胞死はカルシウムの流入、ミトコンドリアからのシトクロムCの放出、カスパーゼ8及び3の蛋白分解プロセス、ポリ(ADP−リボース)ポリメラーゼの切断、及びDNAの断片化と関連する。
【0011】
オレアンドリンはNerium oleanderの主要な細胞毒成分であることが示されている(非特許文献12)。オレアンドリンは、外因性であり、そして通常、体の中に存在しない強心配糖体である。オレアンドリンはヒトにおいてアポトーシスを誘発するが、マウスでは腫瘍細胞株ではなく(非特許文献13)、NF−κBの活性化を阻害し(非特許文献14)、そして部分的にカルシウムに媒介されたシトクロムCの放出を通して細胞死を媒介する(非特許文献15)。最近、セイヨウキョウチクトウの熱水抽出物(すなわち、Anvirzel(商標))のフェーズIトライアルが完了した(非特許文献16)。セイヨウキョウチクトウ抽出物は1.2ml/m2/dまでの用量で安全に投与できると結論付けられた。用量制限毒性は全く見出されなかった。
【0012】
体に対して内因性の強心配糖体であるウアバインが、A549ヒト肺腺癌細胞のインビトロの放射線感受性を向上させるが、正常なヒトの肺線維芽細胞の放射線応答の改質においては効果がないことが報告された(非特許文献17)。続いて、ウアバインは、扁平上皮癌及びメラノーマを含む、異なる組織学タイプのヒト腫瘍細胞を放射線増感させることが示された(非特許文献18)。強心配糖体レアンドリンも、イオン化放射の細胞毒作用に対する細胞の感度を向上させる能力を有する((特許文献1)及び(非特許文献19))。(特許文献2)は、オレアンドリンの投与による癌の治療における放射線治療の向上を開示している。
【0013】
非特許文献20は、ウアバイン及びジギタリスのような強心配糖体が、Na+、K+−ATPアーゼ阻害剤及びERアンタゴニストの両方として、抗乳癌薬の開発に向けて有用であろうと示唆している。
【0014】
非特許文献21は、ANVIRZEL及びその主要な強心配糖体成分オレアンドリンが腫瘍増殖因子である線維芽細胞増殖因子−2(FGF−2)の、前立腺癌細胞株PC3及びDU145からの搬出を阻害することを報告している。
【0015】
非特許文献22は、オレアンドリンを用いたヒト悪性メラノーマBRO細胞のインキュベーションによって、ミトコンドリアの損傷、細胞グルタチオン(GSH)プールの損失、及び最終的には腫瘍細胞死を媒介する活性酸素種であるスーパーオキシドアニオンラジカルの時間依存性形成がもたらされることを報告している。
【0016】
ネリウム(Nerium)種の植物からのグリコシドの抽出により、ネリウム オレアンダー(Nerium oleander)からの薬理学的に/治療的に活性な成分が供されてきた。これらの中には、オレアンドリン、ネリネ、及び他の強心配糖体化合物がある。植物抽出物は動物における細胞増殖性疾患の治療において有用である。ネリウム オレアンダー(Nerium oleander)の熱水抽出によって得られる、商標ANVIRZEL(商標)として販売されているオレアンドリン抽出物は、市販品として入手可能であり、そしてネリウム オレアンダー(Nerium oleander)の熱水抽出の濃縮形態又は粉末化された形態を含む。
【0017】
Huachansuは、ヒキガエルの皮膚から得られる抽出物であり、そしてそれは強心配糖体であるブファリンのようなブファジェノリドを含む。HuaChanSuは、中国において癌の治療に対して承認薬である。それは、肝臓、胃、肺、皮膚及び食道癌を含む種々の癌を治療するために使用されてきた。
【0018】
細胞増殖に関連した病因を有する疾病又は疾患の治療における強心配糖体の重要な有用性に鑑み、強心配糖体に対する疾病又は疾患の治療応答を予測する方法の必要性が残っている。そのような方法は、従来技術によって全く開示されても示唆されてもいない。
【先行技術文献】
【特許文献】
【0019】
【特許文献1】米国特許出願 第10/957,875号公報、Newmanら
【特許文献2】米国特許付与前出願公告第20050112059号公報、Newmanら
【非特許文献】
【0020】
【非特許文献1】Hauptman, P. J., Garg, R.,及びKelly, R.A.「次の千年における強心配糖体」(Cardiac glycosides in the next millieum)、 Prog. Cardiovasc. Dis. 41: 247-254, 1999
【非特許文献2】Blanco, G. 及びMercer, R.W.「Na、K−ATPアーゼのイソザイム:構造における不均一性、機能における多様性」(Isozymes of the Na, K-ATPアーゼ: heterogeneity in structure, diversity in function)、 Am. J. Physiol. 275 (Renal Physiol. 44): F633-F650, 1998
【非特許文献3】Rajasekaran, S.A., Ball, W.J., Bander, N.H., Pardee, J.D.及びRajasekaran, AK.「ヒトの正常細胞、腎臓細胞癌腫におけるNa、K−ATPアーゼのβ サブユニットの低下した発現」(Reduced expression of beta subuniからf Na/K-APTアーゼ in human clear cell renal cell carcinoma)、 J. Urol. 162: 574-580, 1999
【非特許文献4】Avila, J., Lecuona, E., Morales, M., Soriano, A., Alonso, T.及びMartin-Vasallo, P.「胃及び結腸の腺癌におけるヒトNa、K−ATPアーゼのβ−1アイソフォームの逆の発現パターン」(Opposite expression pattern of the human Na/K-ATPアーゼ beta-1 isoform in stomach 及び colon adenocarcinomas)、 Ann. N. Y. Acad. Sci. 834: 633-635, 1997
【非特許文献5】Espineda, C., Seligson, D.B., Ball, W.J., Rao, J., Palotie, A., Horvath, S., Huang, Y., Shi. T及びRajasekaran, A.K.「組織マイクロ配列を用いた膀胱癌のNa、K−ATPアーゼのα−及びβ−サブユニット発現プロファイルの分析」(Analysis of the Na, K-ATPアーゼ α- 及びβ-subunit expression profiles of bladder cancer using tissue microarrays)、Cancer 97: 1851868, 2003
【非特許文献6】Jung, M.H., Kim,S.C., Jeon, G.A., Kim, S.H., Kim, Y., Choi, K.S., Park, S.I., Joe, M.K.,及びKimm, K.「正常及び腫瘍のヒト胃組織において差動的に発現された遺伝子の同定」(Identification of differentially expressed genes in normal 及び tumor human gastric tissue)、 Genomics 69: 281-286, 2000
【非特許文献7】Blanco, G.及びMercer, R.W.「Na、K−ATPアーゼのイソザイム:構造における不均一性、機能における多様性」(Isozymes of the Na, K-ATPアーゼ: heterogeneity in structure, diversity in function)、 Am. J. Physiol. 275 (Renal Physiol. 44): F633-F650, 1998
【非特許文献8】Sakaiら、(FEBS Letters 563: 151-154, 2004)
【非特許文献9】McConkey, D.J., Lin, Y., Nutt, L.K., Ozel, H.Z.,及びNewman, R.A.「強心配糖体が、アンドロゲンに依存しない、転移性ヒト前立腺腺癌細胞におけるCa2+の増加及びアポトーシスを刺激する」(Cardiac glycosides stimulate Ca2+ increアーゼs and apoptosis in androgen-independent, metastatic human prostate adenocarcinoma cells)、 Cancer Res. 60: 3807-3812, 2000
【非特許文献10】Smith, J.A., Madden, T., Vijjeswarapu, M.,及びNewman, R.A.「Anvirzel及びその強心配糖体成分であるオレアンドリンによる、前立腺癌細胞株PC3及びDU145からの線維芽細胞増殖因子−2(EGF−1)の搬出の阻害」(Inhibition of export of fibroblast growth factor-2 (EGF-1) from the prostate cancer cell lines PC3 and DU145 by Anvirzel and its cardiac glycoside component, oleandrin)、 Biochem. Pharmacol. 62: 469-472, 2001
【非特許文献11】Afaq F et al, Toxicol. Appl. Pharmacol. 195:361-369, 2004
【非特許文献12】Newman et al, J. Herbal Pharmacotherapy, vol. 13, pp. 1-15, 2001
【非特許文献13】Pathak et al、 Anti-Cancer Drugs, vol. 11, pp. 455-463, 2000
【非特許文献14】Mannaら、Cancer Res., vol. 60, pp. 3838-3847, 2000
【非特許文献15】McConkeyら、Cancer Res., vol. 60, pp. 3807-3812, 2000
【非特許文献16】Mekhail et al、 Am. Soc. Clin. Oncol., vol. 20, p. 82b, 2001
【非特許文献17】Lawrence, Int. J. Radiaからncol. Biol. Phys., vol. 15, pp. 953-958, 1988
【非特許文献18】Verheye-Dua et al、 Strahlenther. Onkol., vol. 176, pp. 186-191, 2000
【非特許文献19】Nasu et al, Cancer Lett. Vol 185, pp.145-151, 2002
【非特許文献20】Chen et al, Breast Cancer Research and Treatment、 (2006), 96, 1-15
【非特許文献21】Smith et al,Biochemical Pharmacology (2000), 62, 1-4
【非特許文献22】Newman et al,J. Experimental Therapeutics and Oncology (2006), 5, 167-181
【発明の概要】
【発明が解決しようとする課題】
【0021】
本発明は、過剰な細胞増殖に関連した病因を有する疾病又は疾患の特別な表現型に対して、強心配糖体の、又は強心配糖体を含有する組成物の有効性を予測する方法を供する。本発明者らは、そのような疾病又は疾患の、強心配糖体を用いる治療に対する感度又は治療応答が、疾病又は増殖性疾患を有する細胞又は組織中の、Na、K−ATPアーゼサブユニットのα1アイソフォーム発現に対するα3アイソフォームの比に依存することを見出した。一般に、細胞又は組織において、Na、K−ATPアーゼのα1アイソフォーム発現に対するα3アイソフォームの比が高いほど、それらの細胞が強心配糖体に対してより敏感(治療応答性)になる。つまり、α1(薬剤感受性でない)アイソフォームに対するα3アイソフォーム(薬剤感受性)の比がより高いほど、細胞又は組織が強心配糖体による増殖の阻害に対してより敏感になるであろう。
【課題を解決するための手段】
【0022】
本発明の一つの態様は、強心配糖体又は強心配糖体を含む組成物を用いる治療に対する、過剰な細胞増殖に関連した病因を有する疾病又は疾患のインビボの治療応答性を予測するために有用なインビトロの予後アッセイを供することであり、
該アッセイが:
過剰な細胞増殖に関連した病因を有する疾病又は疾患を持つ対象物の疾病にかかったインビボの細胞組織から直接的に又は間接的に得られるサンプル中のNa、K−ATPアーゼのα−サブユニットのα1アイソフォームに対するα3アイソフォームの比を求めること、ここでサンプルはNa、K−ATPアーゼのαサブユニットの一つ又はそれ以上のアイソフォームを含む;及び
対象物が強心配糖体の治療上適切な用量を用いて治療されるとして、対象物における治療応答の確率を求めることを含む。
【0023】
幾つかの実施態様において:1)アッセイは、もし、比が少なくとも1以上であれば、細胞組織が、強心配糖体を用いた治療に対して治療的に応答性であろうと予測することを更に含む;2)アッセイは、もし、比が0.5から1.0の範囲内であれば、細胞組織が、強心配糖体を用いた治療に対して治療的に少なくとも部分的に応答性であろうと予測することを更に含む;3)アッセイは、もし、比が0.3未満であれば、細胞組織が、強心配糖体を用いた治療に対して実質的に治療的に非応答性であろうと予測することを更に含む;4)アッセイは、1から100の範囲内のα−サブユニットアイソフォーム比を有する疾病にかかった組織が、1未満のα−サブユニットアイソフォーム比を有するものよりも治療的により応答性であろうと予測することも更に含む;5)アッセイは、検出できるα3アイソフォームのみを有し、そして検出できるα1アイソフォームを有しないそれらの組織が、強心配糖体に最も治療的に応答性であろうと予測することを更に含む;及び/又は6)アッセイは、もし、比が≧2、≧3、≧4、≧5、≧7、≧9、≧10、≧15、≧20、≧25、≧40、≧50、≧75、又は≧100であれば、細胞組織が、強心配糖体を用いた治療に対して治療的に少なくとも部分的に応答性であろうと予測することを更に含む。
【0024】
幾つかの実施態様において、治療応答があるであろう確率が、下表に記載のNa、K−ATPアーゼのα1アイソフォームに対するα3アイソフォームの比と関連する:
【表1】

【0025】
上の表において、治療応答は部分的又は完全な治療応答又は進行までの遅延時間であり得る。
【0026】
幾つかの実施態様において:1)比を求める工程は、インビトロのサンプル又は生検標本中のNa、K−ATPアーゼのα3サブユニットアイソフォーム及びNa、K−ATPアーゼのα1サブユニットアイソフォーム各々の発現レベルを定量すること、並びにその比を計算することを含む;2)比を求める工程は、インビトロのサンプル中のNa、K−ATPアーゼのα1サブユニットアイソフォームの量に対する、Na、K−ATPアーゼの各α3サブユニットアイソフォームの量を求めること、並びにその比を計算することを含む;3)アッセイは、それから比が求められるデータについて統計解析を実行することを更に含む;4)サンプルは、細胞組織、細胞の塊、細胞溶解物、これらから調製された膜標本、又はそれらの固定された組織病理学スライドである;5)サンプルは、インビトロのサンプルである;6)サンプルは、Na、K−ATPアーゼのαサブユニットの少なくとも二つのアイソフォームを含む;7)サンプルは、少なくともNa、K−ATPアーゼのαサブユニットのα1及びα3アイソフォームを含む;8)本法は、細胞、組織又は生検標本を溶解又は破壊すること;又はサンプルを形成するために、疾病にかかったインビボの細胞組織から組織病理学的検査のために組織切片を固定することを更に含む;9)本法は、サンプル中のNa、K−ATPアーゼのα1サブユニットアイソフォームに対する、Na、K−ATPアーゼのα3サブユニットアイソフォームの量及び相対的発現を求めるために、サンプルについてウエスタンブロット法及び/又は免疫組織化学染色法を実施すること、及びその比を計算することを含む;10)本法は、サンプル中のNa、K−ATPアーゼのα1サブユニットアイソフォームの含量に対する、Na、K−ATPアーゼのα3サブユニットアイソフォームの含量を求めるために、ゲルの放射分析又は濃度分析を行うことを更に含む;11)本法は、サンプル中のNa、K−ATPアーゼのα1サブユニットアイソフォームの及び、Na、K−ATPアーゼのα3サブユニットアイソフォームの存在を検出しそして含量を定量するために、ゲルの放射分析又は濃度分析を行うことを含む;12)ポジティブコントロールサンプル及び/又はネガティブコントロールサンプル中の、Na、K−ATPアーゼのα3サブユニットアイソフォームの及び/又はNa、K−ATPアーゼのα1サブユニットアイソフォームの含有量に対する、サンプル中のNa、K−ATPアーゼのα3サブユニットアイソフォームの及びNa、K−ATPアーゼのα1サブユニットアイソフォームの含有量を比較すること;及び/又は13)コントロールとして、α3サブユニット及びα1サブユニットのただ一つの発現が生じることが知られている組織サンプル中の、Na、K−ATPアーゼのα3サブユニットアイソフォームの及びNa、K−ATPアーゼのα1サブユニットアイソフォームの含有量を比較すること。
【0027】
幾つかの実施態様において:1)疾病にかかった細胞組織は、哺乳動物のような対象物から得られる;2)疾病にかかった細胞組織は、商業的価値の有無に拘わらず、ヒト、牛、犬、猫、馬、豚又は他の家畜から得られる;3)過剰な細胞増殖に関連した病因を有する疾病又は疾患は、癌若しくは腫瘍、又はヒト若しくは動物の生活の質に悪影響を及ぼす他の増殖性疾患である;及び/又は4)癌又は腫瘍は、結腸直腸癌、頭頚部癌、副腎皮質癌、肛門癌、胆管癌、膀胱癌、骨癌、骨転移、骨肉腫、脳腫瘍、乳癌、子宮頸癌、非ホジキンリンパ腫、直腸癌、食道癌、目の癌、胆嚢癌、消化管カルチノイド、妊娠性絨毛性疾患、ホジキン病、カポジ肉腫、腎癌、喉頭癌及び下咽頭癌、肝癌、肺癌(非小細胞癌及び小細胞癌の両方)、肺カルチノイド腫瘍、悪性中皮腫、転移性癌、多発性骨髄腫、骨髄異形成症候群、鼻腔癌及び副鼻腔癌、鼻咽頭癌、神経芽細胞腫、中枢神経系の新生物、口腔癌及び中咽頭癌、骨肉腫、卵巣癌、膵臓癌、陰茎癌、下垂体癌、前立腺癌、網膜芽細胞腫、唾液腺癌、肉腫、皮膚癌、胃癌、精巣癌、胸腺癌、甲状腺腫瘍、尿管癌;子宮肉腫、膣癌、外陰癌又はウィルムス腫瘍から成るグループから選ばれる。
【0028】
幾つかの実施態様において:1)本法は、過剰な細胞増殖に関連した病因を有する疾病又は疾患を持つ対象物を同定することを更に含む;2)本法は、対象物から疾病にかかった細胞のサンプルを得ることを更に含む;3)本法は、Na、K−ATPアーゼのα−サブユニットのα1アイソフォーム及びα3アイソフォームに対するアッセイを如何に実行するかを特定する情報を供することを含む;及び/又は4)本法は、予後データを如何に解釈するかを詳細に示す情報を供することを含む。
【0029】
幾つかの実施態様において、増殖性疾患は、制限されるものではないが:1)抗原誘発性の関節炎及びアレルギー性脳脊髄炎などの自己免疫疾患;2)関節リュウマチ、全身発症型若年性慢性関節炎、骨粗鬆症及び乾癬などの慢性炎症性増殖性疾患;3)線維嚢胞性疾患を含む乳房の増殖性疾患;4)良性前立腺肥大症(BPH)を含む前立腺の増殖性疾患;5)増殖性糖尿病性網膜症を含む目の増殖性疾患;及び6)アテローム性動脈硬化症及び冠動脈狭窄を含む血管増殖性疾患から成るグループから選ばれる。幾つかの実施態様において、二つ又はそれ以上の増殖性疾患が同時に治療されている。
【0030】
ヒト腫瘍細胞株を用いた実験室での研究に基づいて、強心配糖体を用いた治療に特に応答すると信じられる癌には、前立腺癌、肺癌、 乳癌、膀胱癌、骨肉腫、脳腫瘍 (多形神経膠芽腫)及び結腸癌が挙げられる。これらの癌はヒト、非ヒトつまり動物に由来するものであり得る。
【0031】
幾つかの実施態様において:1)強心配糖体は、オレアンドリン、ウアバイン、ブファリン、ジギトキシン、ジゴキシン、シノブファタリン(cynobufatalin)、シノブファギン(cynobufagin)及びレジブフォゲニンから成るグループから選ばれる;2)植物若しくは動物源の抽出を通して得られるもの、合成されるもの又は入手可能な強心配糖体の化学的改質(例えば、誘導体化)を通して製造されるものかに拘わらず、強心配糖体は純粋な形態で存在する;3)強心配糖体は、抽出物中に存在する;4)強心配糖体は製剤処方又は組成物中に存在する;5)強心配糖体はセイヨウキョウチクトウ植物群から得られる;6)セイヨウキョウチクトウ植物群は、Nerium oleanderなどのNerium種、又はThevetia nerifolia(別名、yellow oleanderとして知られている)などのThevetia種を含む;及び/又は7)強心配糖体抽出物は、場合によりモディファイヤーの存在下で、超臨界流体(SCF)抽出によって製造される。
【0032】
幾つかの実施態様において:1)SCF抽出物は、強心配糖体とは別に、少なくとも一つの他の薬理学的活性剤を更に含む;2)抽出物が対象物に投与されるときに、他の活性剤は強心配糖体の治療効果に寄与し得る;3)他の活性剤は、強心配糖体の治療効果に寄与するために追加的に又は相乗的に機能する;及び/又は4)抽出物はヒキガエルの皮膚又はそれから由来する分泌物から得られる。
【0033】
本発明の別の態様は、本発明の予後アッセイを実行する際に使用するのに適しているキットを供する。キットは: a)Na、K−ATPアーゼのα3サブユニットアイソフォームに対する結合親和性を有する第一の一次抗体;及びb)Na、K−ATPアーゼのα1サブユニットアイソフォームに対する結合親和性を有する第二の一次抗体;を含む。キットは、ウエスタンブロットゲル電気泳動分析を実施する際の使用に及び/又は免疫組織化学染色法を実施するために適応され得る。
【0034】
キットは場合によりa)溶解組成物;b)Na、K−ATPアーゼのα3サブユニットアイソフォームを含むポジティブコントロールサンプル;c)Na、K−ATPアーゼのα3サブユニットアイソフォーム及びNa、K−ATPアーゼのα1サブユニットアイソフォームを含むポジティブコントロールサンプル;d)Na、K−ATPアーゼのα1サブユニットアイソフォームを含み、そしてNa、K−ATPアーゼのα3サブユニットアイソフォームを含まないネガティブコントロールサンプル;e)第二抗体、ヤギの抗マウスIgG−HRP(これは、例えば、関心ある蛋白質の可視化のために使用され得る);f)ゲル電気泳動分析に適しているゲル形成材料;g)放射線標識マーカー;h)キットの使用及び予後アッセイの性能に対する指示;i)濃度計及び線量計;j)水系液体培地;k)ゲル/膜製造キット;l)ブロッキング溶液;m)洗浄緩衝液;n)ウェスタンブロット解析キットを含む材料;又はo)それらの組み合わせ;を更に含む。
【0035】
キットの幾つかの実施態様において:a)第一の一次抗体は、Na、K−ATPアーゼのα3サブユニットアイソフォームに対して特異的結合親和性を有する;b)第二の一次抗体は、Na、K−ATPアーゼのα1サブユニットアイソフォームに対して特異的結合親和性を有する;c)第二抗体は、ヤギαマウスIgG西洋ワサビペルオキシダーゼであり、又は西洋ワサビペルオキシダーゼのような適切なマーカーを付けられたマウスIgGに抗して産生されたマウス以外の種からの他の第二抗体を含む;及び/又はd)一次抗体は、モノクロナール抗体である。
【0036】
幾つかの実施態様において、免疫組織化学染色法キットは:a)抗原アンマスキング溶液;b)緩衝液;c)内因性ペルオキシド活性のクエンチング物質;d)抗Na、K−ATPアーゼのα3サブユニットアイソフォーム抗体、及び抗Na、K−ATPアーゼのα1サブユニットアイソフォーム抗体;e)非免疫性マウスIgGI抗体;f)抗ウサギIgG及び抗マウスIgGの試薬の混合物を含むユニバーサル抗体試薬;g)ジアミノベンジジンのような主要な化学的染色剤;h)ヘマトキシリンまたはエオシンのような一般的な化学的でない染色剤;i)核を染色するために使用するもの(例えば、臭化エチジウム、ビスベンズイミダゾール又は硫酸アルミニウムカリウム)又はミトコンドリア(例えば、Mito tracker red、10−ノニルアクリジンオレンジ)のような特定細胞小器官染色剤;j)免疫組織化学的染色キットを含む材料;又はk)それらの二つ又はそれ以上の組み合わせ;を含む。組織又は細胞の隣接切片を用いて、α1サブユニットのアイソフォームの染色が、そこにおいてα1サブユニットのアイソフォーム及びα3サブユニットのアイソフォームに対する適切な特定の一次抗体が使用される、α3サブユニットのアイソフォームの染色に対して使用されたものと同様の方法で実施され得る。本明細書において使用されるように、特定細胞小器官染色剤は、細胞(ヒト、非ヒト、つまり動物)における小器官(ミトコンドリア、核、核小体、ゴルジ装置、空胞等)の特別なタイプを特異的に染色するために使用される試薬、又は試薬の組み合わせである。
【0037】
幾つかの実施態様において、免疫組織化学染色法は:a)哺乳動物の組織のサンプルを供すること;b)サンプル中に存在するNa、K−ATPアーゼのα−サブユニットのα3アイソフォーム及びα1アイソフォームを免疫化学的に染色すること;c)サンプル中のNa、K−ATPアーゼのα3アイソフォームの含有量及びNa、K−ATPアーゼのα1アイソフォームの含有量を求めること;及び d)サンプル中に存在するα1アイソフォームに対するα3アイソフォームの比を求めること;の工程を含む。
【0038】
幾つかの実施態様において、免疫組織化学染色法は:a)哺乳類の組織のサンプルを供する;b)組織について抗原検索手順を実施する;c)組織における内因性ペルオキシド活性をクエンチングする;d)クエンチングされた組織を抗Na、K−ATPアーゼのα3サブユニットアイソフォーム及び/又は抗Na、K−ATPアーゼのα1サブユニットアイソフォームの一次抗体に曝露する;e)抗体処理された組織を第二抗ウサギIrG、抗マウスIrGの抗体、又はそれらの組み合わせに曝露する;f)IgG処理された組織を主要染色剤に曝露する;g)免疫組織化学的に染色された組織を形成するために、染色された組織を対比染色剤に曝露する;h)免疫組織化学的に染色された組織を目視又は写真手段によって分析する;及びi)哺乳類の組織中に存在するα3及び/又はα1アイソフォームの量を定量する工程を含む。例えば、もし第二抗体がビオチン化されていれば、アイソフォーム抗体の染色の定量がなされ得る。次いで、Vectastatin ABC染色剤が追加され、そして30分間、インキュベーションされ得る。染色された切片の洗浄に続いて、適切な染色レベルを展開するために、それらは次にジアミノベンジジン基材を用いてインキュベーションされる。次いで、染色された組織の定量は、染色の強度をグレード付けすることによって手動で、又は関心分野のコンピュータ画像取り込み及びデジタルスキャンを用いて電子的に実施され得る。定量化は、市販のデジタル画像ソフトウエアを用いて更に容易にし得る。幾つかの実施態様において、アッセイは更に:j)工程a)から得られる組織を洗浄する;k)工程c)から得られる組織を洗浄する;l)「非一次」コントロールとしてネガティブコントロール切片(腫瘍又は癌を有しないもの)を供する;m)非免疫性マウスIgGI抗体を持ったネガティブコントロール切片をに曝露する;n)工程e)から得られる組織を洗浄する;o)工程f)から得られる組織を洗浄する;及び/又は工程g)から得られる組織を洗浄する工程を含む。洗浄は、水、緩衝水、及び/又はTBS(約50mMのトリス HCl、約300mMのNaCl、約0.1%のツイーン−20、約7.6のpH)を用いて実施され得る。
【0039】
ポジティブコントロールサンプルは、生検又は他の外科的切除手段を通して得ることができる組織、細胞の塊、細胞溶解物、及びこれらから調製された膜標本であり得る。ネガティブコントロールサンプルは、組織、細胞の塊、細胞溶解物、及びNa、K−ATPアーゼのα−サブユニットのα3アイソフォームを含まないことが事前の分析を通して知られているこれらから調製された膜標本であり得る。幾つかの実施態様において、ネガティブコントロールは、齧歯動物(マウス若しくはラット)腫瘍組織の細胞の塊、又はインビトロの成長させたマウス若しくはラットの細胞の塊から成る。
【0040】
α1アイソフォームに対するα3のアイソフォームの比を求めるために、相対的なNa、K−ATPアーゼのα−サブユニットアイソフォームの組成及び比を決定する代替手段である分析方法が本発明に従って採用され得る。これらは、例えば、ELISA(酵素結合免疫吸着法)における適切な抗体、又は蛋白質組織又は細胞溶解物配列の使用から成る。代替法として、異なるNa、K−ATPアーゼのαサブユニットアイソフォームに対するmRNAの測定のためのノーザンブロット分析及び関連技法(例えば、rtPCR、リアルタイムポリメラーゼ連鎖反応)の使用が可能である。サンプル中に存在するα−サブユニットのα3アイソフォーム及びα1アイソフォームの量を定量するために、免疫組織化学染色法も使用され得る。
【0041】
本発明の別の態様は、過剰な細胞増殖に関連した病因を有する疾病又は疾患を、強心配糖体を含む組成物を用いて、対象物において治療する方法を供し、該方法が:過剰な細胞増殖に関連した病因を有する疾病又は疾患を持つ対象物の疾病にかかったインビボの細胞組織から直接的に又は間接的に得られるサンプル中のNa、K−ATPアーゼのα−サブユニットのα1アイソフォームに対するα3アイソフォームの比を求めること、ここでサンプルはNa、K−ATPアーゼのαサブユニットの一つ又はそれ以上のアイソフォームを含む;及びもし、比が0.3以上、0.5以上、1以上又は10以上であれば、強心配糖体を含む組成物の投与を対象物に指示することを含む。
【0042】
本発明の更に別の態様は、過剰な細胞増殖に関連した病因を有する疾病又は疾患を、強心配糖体を含む組成物を用いて、対象物において治療する方法を供し、該方法が:対象物から疾病にかかった組織のサンプルを得ること、ここで疾病は過剰な細胞増殖に関連した病因を有し、そしてサンプルはNa、K−ATPアーゼのα−サブユニットの一つ又はそれ以上のアイソフォームを含む;サンプル中のNa、K−ATPアーゼのα−サブユニットのα1アイソフォームに対するα3アイソフォームの比が求められるよう要求すること;及び、もし、比が0.3以上、0.5以上、1以上又は10以上であれば、強心配糖体を含む組成物の投与を対象物に指示することを含む。
【0043】
本発明の幾つかの実施態様は以下のことを含む:1)対象物は、強心配糖体を含む組成物の治療上適切な用量を処方されそして投与される;2)対象物は、所定の投与処方に従って、強心配糖体を含む組成物を投与される;3)対象物は、強心配糖体を含む抽出物を含む組成物を投与される;4)抽出物は、一つ又はそれ以上の他の治療的に有効な成分を更に含む;5)組成物は、一つ又はそれ以上の他の治療的に有効な成分を更に含む;6)対象物は、一日当たり2mgから22.5mgの強心配糖体を含む植物又は動物源の熱水抽出物;又は7)0.6から4.8mgの範囲の強心配糖体の植物又は動物源の濃縮抽出物(例えば、超臨界CO2抽出物);又は8)10から500ugの範囲の強心配糖体の純粋な単独薬物形態が対象物に投与される。
【0044】
本発明の方法の個々の工程は、別々の施設で又は同じ施設内で実行され得る。
【0045】
本発明は、本明細書に開示された本発明の態様、実施態様及びサブ実施態様の全ての組み合わせを含む。
【0046】
以下の図は、本明細書の部分を形成し、そして請求された発明の例示的実施様を記述する。これらの図及び本明細書の記述を考慮すると、当業者は不当な実験設定でなければ本発明を実行し得るであろう。
【図面の簡単な説明】
【0047】
【図1A】Na、K−ATPアーゼのα−サブユニットのα1アイソフォーム及びα3アイソフォームの相対的定量に対して、ヒト及びマウスの細胞株のウェスタンブロット解析の部分として得られるゲル電気泳動図の関連バンドの写真を描写している。
【図1B】ヒト及びマウスの腫瘍に対する細胞増殖抑制のパーセントに対するオレアンドリンの濃度(nM)のプロットを描写している。
【図2】正常及び悪性のヒト結腸細胞のウェスタンブロット解析の部分として得られるゲル電気泳動図の関連バンドの写真を描写している。
【図3A】Na、K−ATPアーゼのα1アイソフォーム及びα3アイソフォームの相対的出現が異なっている種々の異なる腫瘍細胞株に対する細胞増殖抑制のパーセントに対するオレアンドリンの濃度(nM)のプロットを描写している。
【図3B】腫瘍細胞株の二つの異なるグループ:1よりも大きいα1に対するα3のサブユニットアイソフォーム比を有する第一グループ:及び1よりも小さいα1に対するα3のサブユニットアイソフォーム比を有する第二グループ、における、細胞増殖抑制に対するオレアンドリンの平均IC50の棒グラフを描写している。
【図4A】トランスフェクトされていない及びトランスフェクトされているヒト腫瘍細胞のウエスタンブロット法の部分として得られるゲル電気泳動図の関連するバンドの写真を描写している。
【図4B】図4Aのトランスフェクトされていない及びトランスフェクトされている細胞中の、α3アイソフォームの相対的出現を示す棒グラフである。
【図4C】図4Aの細胞に対して、癌細胞増殖抑制のパーセントに対するオレアンドリンの濃度(nM)のプロットを描写している。
【図5A】トランスフェクトされていない及びトランスフェクトされているPanc−1細胞のウエスタンブロット法の部分として得られるゲル電気泳動図の関連するバンドの写真を描写している。
【図5B】図5Aのトランスフェクトされていない及びトランスフェクトされている細胞中の、α3アイソフォームの相対的出現を示す棒グラフである。
【図5C】図5Aの細胞に対して、癌細胞増殖抑制のパーセントに対するオレアンドリンの濃度(nM)のプロットを描写している。
【図6】DI13782からの免疫組織化学的に染色された正常な皮膚細胞の写真を描写している。
【図7】A〜Hは免疫組織化学的に染色されたメラノーマ皮膚細胞の写真を描写している;A−BはDI15041細胞を描写している;C−DはDI1582細胞を描写している;E−FはDI15833細胞を描写している;G−7HはDI15834細胞を描写している。
【発明を実施するための最良の形態】
【0048】
本発明は、過剰な細胞増殖に関連した病因を有する疾病又は疾患を患っている対象物が、強心配糖体含有組成物を用いた対象物の処置によって、その疾病又は疾患に対して臨床的便益を受けるであろうか否かを予測する方法を供する。本方法は、対象物における疾病又は疾患が、強心配糖体含有組成物を用いた処置に対して治療応答性であろうか否かを定めるために使用される。言い換えれば、本方法は、一つ又はそれ以上の強心配糖体の治療上適切な用量(又は有効量)を用いたその治療に記載の、対象物における治療応答の確率を求めるために使用される。
【0049】
要するに、サンプルは対象物における疾病にかかった組織から得られる。本サンプルは、疾病にかかった組織からのNa、K−ATPアーゼのαサブユニットの一つ又はそれ以上のアイソフォームを含み、そして、Na、K−ATPアーゼのαサブユニットのα3アイソフォーム及びα1アイソフォームの相対量又は濃度を求めるために、本明細書に記載されている通りにアッセイされる。次いで、相対量又は濃度の比が計算される。もし、α1アイソフォームに対するα3アイソフォームの比が0.3以上であれば、本方法は、疾病又は疾患が強心配糖体を用いた治療に対して治療応答性であろう増加した確率を予測する。例えば、もしこの比が0.3〜0.45±0.05であれば、疾病又は疾患が強心配糖体を用いた治療に対して応答するであろう、少なくとも20%又は20%から30%未満の確率がある。もし、この比が0.2未満又は0.3未満であれば、本方法は、疾病又は疾患が強心配糖体を用いた治療に対して治療応答性であろう20%未満の確率を予測する。一般に、この比が高いほど治療応答の確率がより大きい。例えば、もし、この比が0.5〜0.95±0.05であれば、疾病又は疾患が強心配糖体を用いた治療に対して応答するであろう少なくとも30%又は30%から50%の確率がある。もし、この比が1±0.05以上であれば、疾病又は疾患が強心配糖体を用いた治療に対して応答するであろう少なくとも50%の確率がある。もし、この比が10±0.05よりも大きければ、疾病又は疾患が強心配糖体を用いた治療に対して応答するであろう少なくとも75%の確率がある。
【0050】
「治療応答性である」は、疾病又は疾患を患っている対象物が、強心配糖体を用いた治療の結果として、以下の臨床的便益の少なくとも一つを享受するであろうことを意味する:疾病又は疾患の寛解、疾病又は疾患に関連する症状の発生の減少、疾病又は疾患の部分的緩解、疾病又は疾患の完全な緩解、又は増殖抑制期間の増加。言い換えれば、治療応答は完全な又は部分的な治療応答であり得て、そして本方法は、それが完全な又は部分的な応答か否かに拘わらず、治療応答の確率を求めるために使用される。
【0051】
本明細書では、「増殖抑制期間」は、疾病が診断された(又は治療された)後から、(腫瘍が成長を始めるか継続するなど)疾病が悪化し始めるまでの時間の期間、長さ又は継続である。それは、その間に疾病のレベルが疾病の更なる進展なしで維持される時間の期間、そして疾病が再び進展し始める時に終わる時間の期間である。疾病の進行は、治療の前に又は開始時に、細胞増殖性疾患を患っている対象物の「疾病分類」によって求められる。例えば、対象物が有する腫瘍のサイズ、場所及び数が、治療の前に又は開始時に求められる。次いで、対象物は強心配糖体を用いて治療され、そして腫瘍のサイズ及び数が周期的にモニターされる。いくらか後になった時点で、腫瘍のサイズ及び/又は数が増加し得て、そのように疾病の進展及び「増殖抑制期間」の終了が印される。その間に疾病が進展しなかった、又はその間に疾病のレベル又は重篤さが悪化しなかった時間の期間が「増殖抑制期間」である。
【0052】
尚、治療応答は、対象物への治療上適切な用量での完全な又は部分的な応答であり得る。言い換えれば、強心配糖体が投入される対象物に対して致命的ではないであろう用量で、予想される治療応答のレベルが求められる。従って、治療上適切な用量は、そこで強心配糖体を用いた治療に対して疾病又は疾患の治療応答が観察され、そしてそこで過剰な量の望まれない又は有害な副作用無しで、対象物が強心配糖体を投与される治療上の用量である。それが患者においてある副作用を引き起こすかもしれないが、治療上適切な用量は対象物に対して致死的ではない。それは、そこで強心配糖体を投与されている対象物に対する臨床的便益のレベルが、強心配糖体の投与に起因して、対象物によって経験される有害な副作用のレベルを上回る用量である。治療上適切な用量は、多様な確立された薬理学的、薬力学的及び薬物動態的な原理に従って、対象物毎に変わるであろう。しかしながら、治療上適切な用量(例えば、オレアンドリンに対して)は一般的には一日当たりで25、100、250、500、又は1000ミリグラムの強心配糖体を超えないであろうし、又は一日当たりで25〜500又は25〜1000ミリグラムの強心配糖体の範囲にあり得る。従って、本発明の方法は、対象物が治療上適切な用量を投与されたときに、疾病又は疾患の治療応答を予測するために使用される。対象物において目標の治療結果を供するために要求される薬の実際の量が、薬学の基本原理に従って、対象物毎に変わり得ることが当業技術においては知られている。
【0053】
治療上適切な用量は、過剰な細胞増殖に関連した病因を有する疾病又は疾患の治療において一般的に使用される如何なる投与処方に従っても投与され得る。治療上適切な用量は一日に一回、二回、三回又はそれより多く投与され得る。それは一日おきに、二日おきに、三日おきに、週二回、毎週、一週間おきに、二週間おきに、三週間おきに、毎月、一月おきに、月二回、二月おきに、三月おきに、年二回、毎年、又は上記の如何なる組み合わせに従っても投与され得る。例えば、治療上適切な用量は毎日一回、一週間又はそれより長い間、投与され得る。
【0054】
「溶解組成物」は、細胞溶解物を形成するために、又は細胞内容物を完全に溶解するために、細胞膜を溶解させ得る一つ又はそれ以上の試薬を意味する。溶解組成物は一つ又はそれ以上の以下のものを含み得る:水系液体培地、緩衝剤、塩、キレート化剤、界面活性剤、消泡剤、プロテアーゼ阻害剤並びにフォスファターゼ及びATPアーゼ阻害剤。
【0055】
キットに関係して本明細書では、「ポジティブコントロールサンプル」はNa、K−ATPアーゼのα3サブユニットアイソフォームを含む。ポジティブコントロールは、Na、K−ATPアーゼのα1サブユニットアイソフォームを更に含む。各サブユニットアイソフォームの量又は濃度は独立に事前に求められ得るか既知であり得る。サブユニットアイソフォームの量又は濃度は、それに対してそれがポジティブコントロールであるアッセイにおいて使用される特別な方法に従って求められた通りのサブユニットアイソフォームの存在に対してポジティブな応答を供するために十分であろう。例えば、ウエスタンブロット法において、ポジティブコントロール中のサブユニットアイソフォームの量又は濃度は、サブユニットの存在が、例えば、濃度測定又は放射測定によって求められるときに、サブユニットアイソフォームの存在に対してポジティブな応答が得られるように、対応する抗体に結合するために十分であろう。(実施例27において詳述されるような)免疫組織化学染色法に対して、ポジティブコントロール中のサブユニットアイソフォームの量又は濃度は、電気泳動を用いて他の蛋白質から分離されたゲルに応用され、そして次に前述の通り一次抗体及び二次抗体を用いて染色されたときに、又はデジタル画像取り込み及び定量的画像解析ソフトウエアを用いた顕微鏡検査の下で定量分析に応用されたときに、容易な可視化及び定量化を可能ならしめるために十分であろう。もし、コントロールサンプル中のサブユニットアイソフォームの量又は濃度が既知であるか、又は分析の前に事前に求められるならば、サブユニットアイソフォームに対する検量線を供するように、ポジティブな応答のレベルが量又は濃度と相関付けられ得る。
【0056】
もし、Na、K−ATPアーゼのα3サブユニットアイソフォームがポジティブコントロールサンプル中に存在するならば、α1アイソフォームに対するα3アイソフォームの比は一般的に0.3から100以上の範囲内であろう。この比に対する適切な範囲は、0.3から0.5、0.5から1.0、1.0から20、及び20から100も含む。
【0057】
キットに関係して本明細書では、「ネガティブコントロールサンプル」はNa、K−ATPアーゼのα1サブユニットアイソフォームを含むが、Na、K−ATPアーゼのα3サブユニットアイソフォームは含まない。α1サブユニットアイソフォームの量又は濃度は、そこでそれがネガティブコントロールとして使用される、ウエスタンブロット法などのアッセイにおいて使用される特別な方法に従って求められるようにアイソフォームの存在に対するポジティブな応答を供するために十分であろう。この量又は濃度は既知又は事前に求められ得て、もしそうであれば、アイソフォームに対する検量線を作成するために使用され得る。
【0058】
本発明の方法及びキットの検証(バリデーション))の部分として、本発明者らは、種々の癌及び腫瘍の表現型の治療のために、強心配糖体含有組成物の前臨床評価を実施した。評価はインビボの、エキソビボ、インビトロ及び異種移植動物モデルを用いて実施された。評価された各表現型に対して、Na、K−ATPアーゼのα1サブユニットアイソフォームに対するNa、K−ATPアーゼのα3サブユニットアイソフォームの比を求めるために、組織の細胞サンプル又は細胞の塊が本明細書に述べられた通りに分析された。強心配糖体の治療に応答する表現型、及び多くのヒト腫瘍細胞株における表現型の各々に対する、Na、K−ATPアーゼのα1サブユニットアイソフォームに対するNa、K−ATPアーゼのα3サブユニットアイソフォームの比の間の相関が観察された。治療応答性の癌又は腫瘍表現型(又は増大した治療応答の確率を有するもの)は、少なくとも0.3のNa、K−ATPアーゼのα1サブユニットアイソフォームに対するNa、K−ATPアーゼのα3サブユニットアイソフォームの比を有すると結論づけられた。
【0059】
齧歯動物(ラット又はマウス)の癌細胞がネガティブコントロールサンプルとして使用され得る。図1Aは、齧歯動物の腫瘍細胞株のウエスタンブロット解析のゲルに対して開発されたフィルムを描写している。本発明者らのデータは、現在までに試験された全ての齧歯動物(ラット又はマウス)の腫瘍細胞株がα3サブユニットアイソフォームを欠いていること、そして強心配糖体(例えば、ウアバイン、オレアンドリン、ブファリン等)を用いたインキュベーションによって、それらのインビトロの増殖が著しく阻害されないことを示している。ヒトの腫瘍細胞株は一般に、強心配糖体含有組成物を用いた治療に対して、ネズミ科の腫瘍細胞がそうであるよりももっと敏感である(図1B)。本発明者らは、治療応答におけるこの違いが、上述の通り、二つの異なる種におけるα1に対するα3のアイソフォーム比の違いのせいであると信じる。
【0060】
尚、α3アイソフォームに対する抗体は、Affinity Bioreagents社(Golden、CO)、Novus社(Littleton、CO)又はSigma hemical社(St Louis、MO)を含む多くの異なる供給メーカーから得られ、それらの全ては、ポジティブコントロールサンプル中のα3エピトープに対して等しい反応性(つまり、結合性)を示した。
【0061】
ヒトにおいて、Na、K−ATPアーゼのαサブユニットに対する、α1に対するα3のアイソフォーム比は、組織の源と悪性状態によって変わり得る。正常結腸組織及び悪性結腸組織からの組織サンプルは、全部で14個の個別の対象物に対して各々の対象物から採取された。各組織サンプルに対する、α1に対するα3のアイソフォーム比は本明細書に述べられた通りに求められた。図2及び下表におけるデータは、正常な組織中のα3アイソフォームの相対的欠如、及び約66〜70%の悪性組織中のα3アイソフォームの存在を示す。正常組織及び悪性組織の両方がα1サブユニットアイソフォームを含有する。
【0062】
【表2】

【0063】
Na、K−ATPアーゼのαサブユニットに対する、α1に対するα3のアイソフォーム比が、培養された細胞株における種々の異なるヒトの癌及び腫瘍の表現型、並びに実際の腫瘍生検標本に対して求められた。また、強心配糖体含有組成物を用いた治療に対する各表現型の相対的感度が、インビトロの細胞培養実験由来のデータを用いて求められた。オレアンドリン含有組成物に対するデータが下表及び図3Aにおいて詳述されている。
【0064】
【表3】

【0065】
上表において定義されたように、「インビトロの応答」は、定義された期間に亘って、既定の濃度の薬剤(強心配糖体)を用いて、ある腫瘍細胞株の増殖がそこまで阻害される程度を表す。「無応答」の表示は、試験された多数の薬剤のどの濃度においても50%未満の増殖抑制であることを表す。つまり、如何なる濃度でもIC50値(実験の規定の期間に亘って50%分の細胞増殖の阻害を生み出す濃度)として同定され得なかった。従って、もしこの腫瘍細胞株がヒトなどの哺乳動物において成長するとすれば、腫瘍成長の著しい阻害を生み出す点でその薬剤効果がないであろうことがあり得る。上表における「部分的応答」の表示は、未治療の腫瘍細胞の成長に対して、50%を超えるが75%未満だけの細胞増殖を阻害するための、オレアンドリン又はブファリンのような所定の強心配糖体の能力を表す。従って、これは、もしこの製品がヒトのような哺乳動物において、腫瘍成長の治療のために使用されたとして、強心配糖体に対する腫瘍の部分的つまり完全より少ない治療応答に等しいであろう。最後に、上表における「完全応答」の表示は、未治療の腫瘍細胞集団に対する、75%を超える腫瘍細胞増殖の阻害を表す。従って、哺乳動物において、腫瘍成長の全体的阻害(又は完全な治療応答)が達成されるであろうことがあり得る。
【0066】
前述のアイソフォーム比のデータに基づいて、本方法は以下のことを予測する:1)MDA231、BXPC3及びMCF7細胞株が、治療上適切な量の強心配糖体を用いた治療に対して実質的に無応答性であろう;2)SUM149及びHCT116細胞株が、治療上適切な量の強心配糖体を用いた治療に対して少なくとも部分的な応答を示すであろう;及び3)CACO2、HT29、LS174T、BRO、DOD−1及びPANC1細胞株が、治療上適切な量の強心配糖体を用いた治療に対して完全な治療応答を示すであろう。
【0067】
図3Aはコントロールの成長のパーセントに対して、オレアンドリン(オレアンドリンとして供された)の濃度(nM)のプロットを描写している。これらのデータは評価された細胞株が、ヒト腫瘍細胞株の増殖の相対的阻害によって定められる通りの、強心配糖体治療に対するそれらの応答に従って3つの異なるグループに分類され得ることを示す:強心配糖体の125nMまでの濃度で達成される50%未満の増殖抑制を受けるグループI;強心配糖体の62nMまでの濃度で達成される50%以上の増殖抑制を受けるグループII;及び強心配糖体の62nMまでの濃度で達成される75%以上の増殖抑制を受けるグループIII。これらのグループの例示的細胞株は以下の通りである:グループI−MDA231、BXPC3、MCF−7;グループII−SUM149、BRO;グループIII−Panc−1、CaCo2。応答データはアイソフォーム比データによって予測された通りである。本発明の方法及びキットの頑強さを確立するために、細胞応答データの統計分析が実施された。図3Bにおけるデータは、ヒト腫瘍細胞のインビトロの増殖を阻害するオレアンドリン含有組成物の相対的能力を示している。これらのデータは平均±SDとして示されている。オレアンドリンが媒介した増殖抑制を、そこにおいて相対的サブユニット含有量α3/α1アイソフォーム比が1.0よりも大きい10個の細胞株(種々の固形腫瘍を表している)、及びそこにおいてα3/α1アイソフォーム比が1.0よりも小さい6個の細胞株において調べられた。これらのデータは、これらのグループ間で8倍(800%)の違いがあることを示す。つまり、そこにおいてα3/α1アイソフォーム比が1.0以上であるそれらの細胞株において、そこにおいてα3/α1アイソフォーム比が僅かに発現されただけのものと比べて、オレアンドリンがはるかにより効果的な薬剤であることが見出された。これらのデータは、強心配糖体含有組成物を用いた治療に対する癌又は腫瘍の細胞株の応答性を予測するために、α3/α1サブユニットアイソフォームの比が使用され得ることを証明している。
【0068】
強心配糖体を用いた治療に対する目標とする悪性組織による治療応答の予測可能性に向けたα3/α1アイソフォーム比の相対的重要性の更なる証明が以下のように確立された。ヒト膵臓癌細胞中のα3アイソフォーム発現の人工的なダウンレギュレーション、つまり、Na、K−ATPアーゼのサブユニットのアイソフォーム含有量の操作は、α3アイソフォームに特異的なsiRNA(サレンシングRNA)による細胞のトランスフェクションによって達成された。これらのデータは(ウエスタンブロットによって求められた通りの(図4A))α3アイソフォームの発現の低下を示している。ウエスタンブロットによるα3の減少した発現の定量が図4Bにおいて詳述されている。図4Cは、その中でα3の発現が減少したトランスフェクトされた細胞が、オレアンドリンを用いた治療に対するそれらの感度を失うことを示している。
【0069】
強心配糖体を用いた治療に対する目標の悪性組織による治療応答の予測可能性に向けたα3/α1アイソフォーム比の相対的重要性の更なる証明が、α1サブユニットアイソフォームを有するPanc−1細胞へのトランスフェクトによって確立された。Na、K−ATPアーゼのα1サブユニットアイソフォームが、通常α1発現を欠くPanc−1細胞にトランスフェクトされた。図5Aにおけるコントロールサンプルは、トランスフェクトされていないPanc−1細胞に対するものであり、そして図5Aにおけるα1cDNAサンプルは、α1サブユニットアイソフォームでトランスフェクトされたPanc−1細胞に対するものである。その結果、α1に対するα3の比は、トランスフェクトされたPanc−1細胞において減少した(図5B)。次いでオレアンドリン治療に対するトランスフェクトされたPanc−1細胞の感度が評価された。オレアンドリン治療に対するこれらのトランスフェクトされた細胞の感度は、オレアンドリンのIC50値のシフトによって実証される通り、4.1nMのトランスフェクトされていないPanc−1細胞からα1トランスフェクトされた細胞において50nMを超えるまで低下した(図5C)。従って、オレアンドリンの抗増殖性活性は、α1サブユニットアイソフォームでトランスフェクトされたPanc−1細胞において著しく減少した。
【0070】
Na、K−ATPアーゼサブユニットのα3及びα1アイソフォームの検出及び定量も、実施例27において詳述されているように、免疫組織化学的染色によって成し遂げ得る。細胞は、α3及びα1アイソフォームが差動的に染色されるよう、免疫組織化学的に染色される。各アイソフォームタイプの含有量が定量され、そしてα1に対するα3のアイソフォームの含有量比が求められる。α3及びα1アイソフォームの差動的な免疫組織化学的染色は種々の手段によって成し遂げ得る。幾つかの実施態様において、組織サンプルが二つの異なる染色剤を用いて染色される:一方の染色剤はα3アイソフォームに対して選択的に又は特異的に使用され、そして他方の染色剤はα1アイソフォームに対して選択的に又は特異的に使用される。幾つかの実施態様において、二つの近いけれども異なるサンプルが同じ組織から得られ、そして第一のサンプルがα3アイソフォームを染色するために処理され、そして第二のサンプルがα1アイソフォームを染色するために処理されるように染色される。次いで、α3及びα1アイソフォームの比が定量され、そして次にα1アイソフォームに対するα3アイソフォームの比が求められる。この比に基づいて、強心配糖体を用いた治療に対する組織の治療応答の可能性に関する予測がなされる。
【0071】
免疫組織化学的に染色されたサンプル(細胞又は組織のスライド)中のNa、K−ATPアーゼサブユニットのα3アイソフォーム及びα1アイソフォームの定量が手動の又は自動化された手順を通して成し遂げ得る。これらには、限定するものではないが、適切に染色されたスライドの設定領域の染色強度の個別段階付け(例えば、0〜5の強度の相対的な染色強度の目視観察を用い、ここで0は検出できる染色がないこと、5は強い染色を表す);次いで調べられた領域の設定数の平均染色強度のコンパイリング、及びα3染色の相対的染色とα1に対して染色されたスライドのそれとの比較;並びにサンプル中のα1に対するα3の比の計算;が含まれる。そこにおいて、α1及びα3の相対的染色の定量(つまり、サンプル中に存在するα1に対するα3の比)が、染色されたスライドの設定領域の顕微鏡検査の使用、及び相対的染色強度を求めるためのデジタル解析ソフトウエアの使用を通して成し遂げ得る他の方法がある。同様に、相対的アイソフォーム染色を求めるために、そしてα1に対するα3の染色強度の比を計算するために、コンピュータ支援デジタルビデオ分析も実行され得て、それによりサンプル中のα1アイソフォームに対するα3アイソフォームの含有量比が求められる。
【0072】
例えば、図6A〜6Fは、DI13782からの正常な皮膚細胞の写真を描写している。図6A、6C及び6Eは(免疫組織化学的に染色された)Na+/K+ATPアーゼ免疫反応性のαサブユニットを描写している。図6B、6D及び6Fは、対応する非免疫(コントロール)IgGインキュベーションされた切片の写真を描写している。正常な皮膚の全てのドナーにおいて、強い2+又は3+レベルの免疫反応性が見られた。扁平上皮、毛包上皮、皮脂腺の基底膜、汗腺及び血管中の単核リンパ球が全てポジティブに染色された。Pyloerector筋は弱い免疫反応性であった。
【0073】
図7A〜7Hは、メラノーマ細胞の写真を描写している。図7A、7C、7E及び7Gは、(免疫組織化学的に染色された)Na+/K+ATPアーゼ免疫反応性のαサブユニットを描写している。図7B、7D、7F及び7Hは、対応する非免疫(コントロール)IgGインキュベーションされた切片を描写している。図7A及び7Bは、DI15838細胞を描写している。図7C及び7Dは、DI15840細胞を描写している。図7E及び7Fは、DI15842細胞を描写している。図7G及び7Hは、DI15844細胞を描写している。全てのBCCサンプルは、種々の程度の強度を有するNa+/K+ATPアーゼのαサブユニットに対してポジティブであった。全ての免疫反応性は腫瘍細胞の核及び細胞質に局在化されていた。組織の差動的な免疫組織化学的染色に続いて、α1サブユニットアイソフォームに対するα3サブユニットアイソフォームの比が求められ得て、そして強心配糖体を用いた治療に対する治療応答に関する予測がなされ得る。
【0074】
別の強心配糖体に向けた本発明の方法の関連が評価された。HuaChanSuは、ブファジェノリドとして知られている強心配糖体を含有するヒキガエルの皮膚の抽出物である。HuaChanSuを用いた治療に対する、二つのヒトの膵臓細胞株(SW1990及びPanc−1)の治療応答が評価された。上表のデータに基づけば、SW1990細胞がHuaChanSuに対して治療応答性ではないであろうが、Panc−1人はHuaChanSuに対して治療応答性であろうと予測されるであろう。応答データは期待された結果を供した。
【0075】
以下の実施例は、癌及び腫瘍に関連する疾病又は疾患の治療における強心配糖体の有効性の証拠を含む。実施例21は転移性膵臓ガストリノーマを示している患者の治療に対する事例履歴を含む。本発明の予後アッセイ、方法及びキットは、過剰な細胞増殖に関連した病因を有する疾病又は疾患の当業技術において公知である一つ又はそれ以上の他の予後又は診断アッセイ、方法及びキットを組み合わせて使用され得る。例えば、もし臨床医が、癌又は腫瘍を有する対象物を強心配糖体及び他の化学療法剤又は放射線治療の組み合わせを用いて治療することを意図るならば、対象物が有する癌又は腫瘍の特別な表現型が、上記他の化学療法剤又は放射線治療を用いる治療に対して、少なくとも部分的に治療応答性であり、次に、強心配糖体を用いて治療されたときに、対象物における癌又は腫瘍の少なくとも部分的な治療応答の確率を求めるために本発明が使用され得ることが知られている。もしその結果により、癌又は腫瘍が強心配糖体を用いた治療に対して治療応答性であろうという確率の増加があることを示されるならば、次いで臨床医は、強心配糖体及び他の治療剤又は放射線治療又はその組み合わせを用いた癌又は腫瘍の治療を処方し及び/又は投与し得る。
【0076】
強心配糖体は、過剰な細胞増殖に関連した病因を有する疾病又は疾患の治療において治療作用を有すると知られている、如何なる強心配糖体でもあり得る。強心配糖体は純粋な形態で、又は一つ又はそれ以上の他の化合物との混合物として存在し得る。強心配糖体は抽出物として存在し得る。抽出物は超臨界流体(SFC)二酸化炭素(CO2)抽出によって、又はそのような抽出物の化学的に改良された(例えば、エタノールを含む抽出物、又はSFC−CO2及びエタノールを用いて得られた抽出物)形態によって製造され得る。抽出物は植物性又は動物性材料から得ることができる。動物性材料はヒキガエル(例えば、Bufo bufo)の抽出物であり得る。植物性材料は、ネリウム オレアンダー(Nerium oleander)のようなネリウム(Nerium)種、又はテベティア ネリフオリア(Thevetia nerifolia)若しくは(別名yellow oleanderとして知られている)テベティア プルビアナ(Thevetia puruviana)のようなテベティア(Thevetia)種から得られるような植物群であり得る。抽出プロセスは、それらの全ての開示が本明細書に参照されることによって組み込まれているものとする、Addingtonの名前で2005年2月15日に出願された現在係属中の米国仮出願第60/653,210号又はAddingtonの名前で2006年1月26日に出願された米国出願第11/340,016号,Addingtonの名前で2006年7月28日に出願された米国出願第11/191,650号、(2008年7月22日に発行された、現在の米国特許第7,402,325号)、又は2006年7月26日に出願されたPCT国際特許出願PCT/US第06/29061号において記述されたプロセスに従って、又は本明細書中に記述されたプロセスによって製造されたネリウム オレアンダー(Nerium oleander)の葉の乾燥粉末上で実行され得る。
【0077】
本明細書では、用語「オレアンドリン」は、別に特定されない限り、オレアンドリンの全ての公知な形態を意味するものと取られる。オレアンドリンはラセミ体、光学的に純粋な又は光学的に濃縮された形態で存在し得る。ネリウム オレアンダー(Nerium oleander)植物材料は、例えば、Aldridge Nursery社、Atascosa、Texasのような市販の植物供給者から得ることができる。
【0078】
抽出物は、強心配糖体含有植物群の改良された(例えば、エタノール)又は未改良の超臨界流体抽出によって得ることができる。超臨界流体抽出物は、抽出物が対象物に投与されるときに、強心配糖体の治療効果に寄与する、少なくとも一つの他の薬理活性物質を含み得る。それは強心配糖体の治療効果に追加的に又は相乗的に寄与し得る。
【0079】
抽出物は種々の異なるプロセスによって製造され得る。抽出物は、Huseyin Ziya Ozel博士によって開発されたプロセスに従って製造され得る(米国特許第5,135,745号に、水中で植物の抽出物を製造する手順が述べられている)。伝えられるところでは、水系抽出物は、分子量が2KDから30KDまで変わる幾つかの多糖類、オレアンドリン及びオレアンドリゲニン、odoroside及びneritalosideを含有する。伝えられることろでは、多糖類は酸性homopolygalacturomnans又はarabinogalaturonansを含有する。Selvarajらの米国特許第5,869,060号はネリウム(Nerium)種の熱水抽出物及びその製造方法を開示している。得られた抽出物は粉末を製造するために次いで凍結乾燥され得る。米国特許第6,565,897号(Selvarajらの米国付与前公告第20020114852号及びPCT国際公開公報WO2000/016793)は、実質的に無菌の抽出物を製造するための熱水抽出プロセスを開示している。Erdemogluら(J. Ethnopharmacol. (2003) Nov. 89(1), 123-129)は、抗侵害性及び抗炎症活性に基づくネリウム オレアンダー(Nerium oleander)を含む植物の水及びエタノール抽出物の比較の結果を開示している。ネリウム オレアンダー(Nerium oleander)の有機溶媒抽出物が、Adome ら(Afr. Health Sci. (2003) Aug. 3(2), 77-86; 「エタノール抽出物」ethanolic extract)、el-Shazlyら(J. Egypt Soc. Parasitol. (1996), Aug. 26(2), 461-473;「エタノール抽出物」(ethanolic extract)、Begumら(Phytochemistry (1999) Feb. 50(3), 435-438; 「メタノール抽出物」(methanolic extrac)、Ziaら(J. Ethnolpharmacol. (1995) Nov. 49(1), 33-39; 「メタノール抽出物」(methanolic extract)及びVlasenkoら(Farmatsiia. (1972) Sept.-Oct. 21(5), 46-47; 「アルコール抽出物」alcoholic extract)によって開示されている。Singhらの米国付与前特許出願公開公報第20040247660号は、癌の治療において使用するための、蛋白質で安定化されたオレアンドリンのリボソーム製剤の製造を開示している。Singhらの米国付与前特許出願公開公報第20050026849号はシクロデキストリンを含有するオレアンドリンの水溶性処方を開示している。Singhらの米国付与前特許出願公開公報第20040082521号は熱水抽出物からの、蛋白質で安定化されたオレアンドリンのナノ粒子製剤の製造を開示している。
【0080】
SCF抽出は、植物群からの望ましい化合物の抽出を向上させるために、エタノールのような超臨界流体中のモディファイヤーの存在下で実行され得る。モディファイヤーは一般的に、超臨界流体の揮発性及び抽出される化合物の揮発性の間の揮発性を有し、そしてそれらは超臨界流体と混和し得なければならない。幾つかの実施態様において、モディファイヤーは周囲条件下で液体である。制限するものではなく例示目的で、モディファイヤーはエタノール、メタノール、プロパノール、アセトン、酢酸エチル、塩化メチレンなどから成るグループから選ばれ得る。
【0081】
抽出物は、オレアンドリン又は他の強心配糖体、oleaside、及び他の植物材料のような薬理学的に活性な化合物の混合物である。超臨界流体プロセスからのオレアンドリン抽出物は質量ベースで、0.9%から2.5%の理論的範囲のオレアンドリンを含有する。種々の量のオレアンドリンを含むSCF抽出物が得られている。一つの実施態様において、SCF抽出物は約2質量%のオレアンドリンを含む。
【0082】
本明細書におけるデータによって証明された通り、SCF抽出物は種々の成分の混合物を含む。それらの成分の幾つかはオレアンドリン、oleaside A、オレアンドリゲニン、neritaloside、odorside(Wang X、Plomley JB、Newman RA及びCisneros A. 「癌治療のためのセイヨウキョウチクトウ抽出物のLC/MS/MS分析」(LC/MS/MS analyses of an oleander extract for cancer treatment)、Analytical Chem. 72: 3547-3552, 2000)及び他の未同定成分を含む。SCF抽出物のSCF抽出され得る未同定成分は、SCF抽出物におけるオレアンドリンの有効性に寄与する少なくとも一つの他の薬理活性成分を含むように思われる。つまり、少なくとも一つの他のSCF抽出され得る成分は、観察された有効性を供するためにオレアンドリンと共に追加的に又は相乗的に機能する。
【0083】
抽出物が、幾つかの腫瘍細胞株に対する有効性によって決定されるようなその相対的性能において異なることもあり得る。そうであっても、治療上適切な用量を製造し得るために、もし強心配糖体が抽出物中に十分に高い量又は濃度で存在するならば、その時その抽出物は本発明の部分と考えられる。下表には、強心配糖体レアンドリンの三つの異なる形態に対する幾つかの相対的有効性データが要約されている。
【0084】
【表4】

【0085】
上表において示された通り、超臨界CO2抽出物のIC50値は、Panc−1又はBRO細胞の両方において、そのオレアンドリン単独の50%に過ぎず、これはセイヨウキョウチクトウの超臨界CO2抽出物が、Panc−1又はBRO細胞の増殖抑制に関して、オレアンドリン単独よりも少なくとも2倍強い(より能力がある)ことを示唆する。比較すると、試験された三つの実体の中で、熱水抽出物は最も能力が低い。これらのデータはヒト腫瘍細胞株に対するオレアンドリン、並びに以下のような相対的能力を発生を有する抽出物による潜在的細胞毒性を示す:超臨界CO2抽出物>オレアンドリン>熱水抽出物。これらのデータは、超臨界CO2抽出物の細胞毒性がおそらく、SCF抽出物中に、少なくとも一つの他の薬理学活性成分がオレアンドリンに加えて存在することによること、そして超臨界CO2抽出物の能力が熱水抽出物のそれよりもはるかに大きい(7.4倍)ことを示唆する。これらのデータは、熱水抽出物及びオレアンドリン単独さえも凌ぐSCF抽出物の有効性の実質的な改善を明らかに示している。有効性における改善は、SCF抽出物中のオレアンドリンの濃度上昇のみに基づいて得られたであろう予想された改善を超えていた。
【0086】
本発明はまた、本発明のSCF又は水での抽出物のような有効量の抽出物を用いた細胞の治療による癌又は腫瘍細胞の増殖を阻害する方法も供する。
【0087】
強心配糖体は、如何なる適切な薬学的に許容できる剤形においても処方され得る。非経口、耳、眼、鼻、吸入、頬側、舌下、腸内、局所、経口、及び注射可能な剤形が特に有用である。特別な剤形は、固体又は液体の剤形を含む。例示的な適切な剤形は、錠剤、カプセル、ピル、カプレット、トローチ、小袋及び製薬科学において当業者に公知である他のそのような剤形を含む。
【0088】
本発明の単位用量に組み込まれるオレアンドリンの量は、少なくとも一つ又はそれ以上の剤形であろうし、そして薬局の公知の原理に従って選択され得る。有効量の又は治療上適切な量の治療用化合物が具体的に熟慮される。用語「有効な量」によって、例えば、医薬品に関しては、薬学的に有効な量が熟慮されていることが理解される。薬学的に有効な量は、要求される又は望ましい治療応答に対して十分である活性剤の量、又は言い換えれば、患者に投入されたときに、明らかな生物学的応答を引き出すために十分な量である。明らかな生理学的応答が、活性物質の単独又は複数の単位用量の投与の結果として生じ得る。単位用量は、一つ又はそれ以上の剤形を含み得る。如何なる患者に対する特定の用量レベルも、治療されるべき適応症、適応症の重症度、患者の健康、年齢、性別、体重、食事、薬理学的応答、採用される特定の剤形及びその他のそのような因子を含む種々の因子に依存するであろうことが理解されるであろう。
【0089】
僅か一つでそして10もの多くの剤形が投与され得るものの、経口投与のための望まれる用量は5つまでの剤形である。例示的な薬学的形態は、合計で用量当たり0.6から60mg(1から10の用量レベル)に対して、剤形当たり0.6mgのSCF抽出物を含有する。
【0090】
強心配糖体は、対象物に12から1200ug、又はそれより多い又は少ないオレアンドリンの初期用量を供するために十分な量における剤形で存在し得る。
【0091】
哺乳類の治療における使用に対して、強心配糖体が剤形中に含有され得る。剤形の幾つかの実施態様は腸内被覆されておらず、そして強心配糖体のそれらの投入量を0.5から1時間以内の期間内で放出する。剤形の幾つかの実施態様は腸内被覆されており、そして強心配糖体のそれらの負荷を、空腸、回腸、小腸、及び/又は大腸(結腸)からなど、胃の下流で放出する。腸内被覆された剤形は、体循環内に、経口投与の後1〜10時間以内に強心配糖体を放出するであろう。
【0092】
予備的な動物への投与データに基づけば、セイヨウキョウチクトウ抽出物の投与用量の50から75%が経口投与可能であろうことが予想され、従って0.25から0.4mg、0.1から50mg、0.1から40mg、0.2から40mg、0.2から30mg、0.2から20mg、0.2から10mg、0.2から5mg、0.2から2.5mg、0.2から2mg、0.2から1.5mg、0.2から1mg、0.2から0.8mg、0.2から0.7mg、又は0.25から0.5mgのオレアンドリンが剤形当たりに供される。成人における平均血液容積が5リッターであるとした場合、予想されるオレアンドリン血漿濃度は0.05から2ng/ml、0.005から10ng/mL、0.005から8ng/mL、0.01から7ng/mL、0.02から7ng/mL、0.03から6ng/mL、0.04から5ng/mL、又は0.05から2.5ng/mLの範囲にあるであろう。SCF抽出物中に存在するオレアンドリンの1日当たりの推奨用量は、一般的に一日に二度、約0.25から約50mg、又は一日に二度、つまり約12時間毎に0.9から5mgである。この用量は約0.5から約100mg/日、約1から約80mg/日、約1.5から約60mg/日、約1.8から約60mg/日、約1.8から約40mg/日であり得る。最大許容用量は約100mg/日、約80mg/日、約60mg/日、約40mg/日、約38.4mg/日、又は約30mg日の、オレアンドリン含有セイヨウキョウチクトウ抽出物であり、そして最低有効量は約0.5mg/日、約1mg/日、約1.5mg/日、約1.8mg/日、約2mg/日、又は約5mg/日であり得る。
【0093】
本発明のキット又は組成物は、分析用又は薬学用に適している如何なる賦形剤をも含有し得る。
尚、本明細書における化合物は、本発明の処方において一つ又はそれ以上の機能を有してもよい。例えば、ある化合物が界面活性剤及び水混和性溶媒の両方として、又は界面活性剤及び水不混和性溶媒の両方として作用してもよい。
液体組成物は一つ又はそれ以上の薬学的に又は分析的に許容できる液体キャリアーを含み得る。液体キャリアーは水系、非水系、極性、非極性及び/又は有機キャリアーであり得る。液体キャリアーには、制限するものではないが例として、水混和性溶媒、水不混和性溶媒、水、緩衝液及びそれらの混合物が挙げられる。
【0094】
本明細書では、同じ意味で使われる用語である「水溶性溶媒」又は「水混合性溶媒」は、水と二相混合物を形成しない、又は液相を分離しないで、少なくとも5パーセントの溶媒を含有する水系溶媒混合物を供するために、水に十分に溶解する有機液体を意味する。溶媒はヒト又は動物への投与に適している。例示的な水溶性溶媒には、制限するものではないが例として、PEG(ポリ(エチレングリコール))、PEG400(約400の分子量を有するポリ(エチレングリコール))、エタノール、アセトン、アルカノール、アルコール、エーテル、プロピレングリコール、グリセリン、トリアセチン、ポリ(プロピレングリコール)、PVP(ポリ(ビニルピロリドン))、ジメチルスルホキシド、N,N−ジメチルホルムアミド、ホルムアミド、N,N−ジメチルアセトアミド、ピリジン、プロパノール、N−メチルアセトアミド、ブタノール、Soluphor(2−ピロリドン)、Pharmasolve(N−メチル−2−ピロリドン)が挙げられる。
【0095】
本明細書では、同じ意味で使われる用語である「非水溶性溶媒」又は「水不混和性溶媒」は水と二相混合物を形成する、又は水中の溶媒の濃度が5パーセントを超えたときに相分離を供する有機液体を意味する。溶媒はヒト又は動物への投与に適している。例示的な水不溶性溶媒には、制限するものではないが例として、中鎖/長鎖のトリグリセリド、油、ヒマシ油、トウモロコシ油、ビタミンE、ビタミンE誘導体、オレイン酸、脂肪酸、オリーブ油、Softisan645(ジグリセリルカプリル酸エステル/カプリン酸エステル/ステアリン酸エステル/ヒドロキシステアリン酸エステルアジパート)、Myglyol、Captex(Captex350:グリセリルトリカプリル酸エステル/カプリン酸エステル/ラウリン酸トリグリセリド;Captex355:グリセリルトリカプリル酸エステル/カプリン酸エステルトリグリセリド;Captex355EP/NF:グリセリルトリカプリル酸エステル/カプリン酸エステル中鎖トリグリセリドが挙げられる。
【0096】
適切な溶媒は、「日米EU医薬品規制調和国際会議(ICH)、工業Q3C不純物に対する指針:残留溶媒」(International Conference on Harmonisation of Technical Requirements for Registration of Pharmaceuticals for Human Use (ICH) guidance for industry q3C Impurities: Residual Solvents、1997)中にリストアップされており、如何なる量の残留溶媒が医薬品において安全と考えられるかに関しての推奨がなされている。例示的溶媒は、クラス2又はクラス3溶媒として表示されている。クラス3溶媒には、例えば、酢酸、アセトン、アニソール、1−ブタノール、2−ブタノール、酢酸ブチル、tert−ブチルメチルエーテル、クメン、エタノール、エチルエーテル、酢酸エチル、ギ酸エチル、ギ酸、ヘプタン、酢酸イソブチル、酢酸イソプロピル、酢酸メチル、メチル−1−ブタノール、メチルエチルケトン、メチルイソブチルケトン、2−メチル−1−プロパノール、ペンタン、1−ペンタノール、1−プロパノール、2−プロパノール又は酢酸プロピルが含まれる。
【0097】
本発明において水不混和性溶媒として使用され得る他の材料には以下が含まれる:Captex 100:プロピレングリコールジカプリン酸エステル;Captex 200:プロピレングリコールジカプリル酸エステル/ジカプリン酸エステル;Captex 200P:プロピレングリコールジカプリル酸エステル/ジカプリン酸エステル;プロピレングリコールジカプリロカプリン酸エステル;Captex 300:グリセリルトリカプリル酸エステル/カプリン酸エステル;Captex 300 EP/NF:グリセリルトリカプリル酸エステル/カプリン酸エステル中鎖トリグリセリド;Captex 350:グリセリルトリカプリル酸エステル/カプリン酸エステル/ラウリン酸エステル;Captex 355:グリセリルトリカプリル酸エステル/カプリン酸エステル;Captex 355 EP/NF:グリセリルトリカプリル酸エステル/カプリン酸エステル中鎖トリグリセリド;Captex 500:トリアセチン;Captex 500 P:トリアセチン(医薬品グレード);Captex 800:プロピレングリコールジ(ヘキサン酸2−エチル);Captex 810 D:グリセリルトリカプリル酸エステル/カプリン酸エステル/リノール酸エステル;Captex 1000:グリセリルトリカプリン酸エステル;Captex CA:中鎖トリグリセリド;Captex MCT-170:中鎖トリグリセリド;Capmul GMO:グリセリルモノオレイン酸エステル;Capmul GMO-50 EP/NF:グリセリルモノオレイン酸エステル;Capmul MCM:中鎖モノ−&ジグリセリド;Capmul MCM C8:グリセリルモノカプリル酸エステル;Capmul MCM C10:グリセリルモノカプリン酸エステル;Capmul PG-8:プロピレングリコールモノカプリル酸エステル;Capmul PG-12:プロピレングリコールモノラウリン酸エステル;Caprol 10G10O:デカグリセロールデカオレイン酸エステル;Caprol 3GO:トリグリセロールモノオレイン酸エステル;Caprol ET:混合脂肪酸のポリグリセロールエステル;Caprol MPGO:ヘキサグリセロールジオレイン酸エステル;Caprol PGE 860:デカグリセロールモノ−、ジオレイン酸エステル。
【0098】
本明細書では、「界面活性剤」は、極性の又は荷電された親水性の部位並びに非極性の疎水性(親油性)部位を含む化合物を意味する;つまり界面活性剤は両親媒性である。用語、界面活性剤は、一つの化合物又は化合物の混合物を意味し得る。界面活性剤は可溶化剤、乳化剤又は分散剤であり得る。界面活性剤は親水性又は親油性であり得る。
【0099】
親水性界面活性剤は、医薬組成物中での使用に適している如何なる親水性界面活性剤でもあり得る。そのような界面活性剤はノニオン性の親水性界面活性剤が現在のところ好ましいものの、アニオン性、カチオン性、双性イオン性又はノニオン性であり得る。上で論じた通り、これらのノニオン性の親水性界面活性剤は、一般的に約10より大きなHLB値を有するであろう。親水性界面活性剤の混合物も本発明の範囲内にある。
【0100】
同様に、疏水性界面活性剤は、医薬組成物中での使用に適している如何なる疏水性界面活性剤でもあり得る。一般に、適切な疏水性界面活性剤は約10より小さなHLB値を有するであろう。疏水性界面活性剤の混合物も本発明の範囲内にある。
【0101】
追加の適切な可溶化剤の例には以下が含まれる:エタノール、イソプロパノール、ブタノール、ベンジルアルコール、エチレングリコール、プロピレングリコール、ブタンジオール及びその異性体、グリセロール、ペンタエリトリトール、ソルビトール、マンニトール、トランスクトール、ジメチルイソソルビド、ポリエチレングリコール、ポリプロピレングリコール、ポリビニルアルコール、ヒドロキシプロピルメチルセルロースなどのアルコール及びポリオール及びその他のセルロース誘導体、シクロデキストリン及びシクロデキストリン誘導体などのアルコール及びポリオール;テトラヒドロフルフリルアルコールPEGエーテル(Tetraglycolの商標名でBASF社から市販品として入手できるglycofurol)又はメトキシPEG(Union Carbide社)などの、約200〜6000の平均分子量を有するポリエチレングリコールのエーテル;2−ピロリドン、2−ピペリドン、カプロラクタム、N−アルキルピロリドン、N−ヒドロキシアルキルピロリドン、N−アルキルピペリドン、N−アルキルカプロラクタム、ジメチルアセトアミド及びポリビニルピロリドンなどのアミド;プロピオン酸エチル、クエン酸トリブチル、アセチルクエン酸トリエチル、アセチルクエン酸トリブチル、クエン酸トリエチル、オレイン酸エチル、カプリル酸エチル、酪酸エチル、トリアセチン、プロピレングリコールモノアセタート、プロピレングリコールジアセタート、カプロラクトン及びその異性体、バレロラクトン及びその異性体、ブチロラクトン及びその異性体などのエステル;及びジメチルアセトアミド、ジメチルイソソルビド(Arlasolve DMI(ICI社))、N−メチルピロリドン(Pharmasolve(ISP社))、モノオクタノイン、ジエチレングリコールモノエチルエーテル(Transcutolの商標名でGattefosse社から入手できる)、及び水などの当該技術分野で公知のその他の可溶化剤。可溶化剤の混合物も本発明の範囲内である。
【0102】
示された通りのものを除き、本明細書に述べられた化合物は標準的な市販源から容易に入手可能である。
【0103】
透明な液体組成物は、組成物の全質量に基づいて5質量%未満、3質量%未満、又は1質量%未満の懸濁固体を含有するであろう故に、視覚的に肉眼に透明である。
【0104】
必要とは言えないものの、本発明の組成物又はキットは、キレート化剤、保存剤、酸化防止剤、吸着剤、酸性化剤、アルカリ化剤、消泡剤、緩衝剤、着色剤、電解質、塩、安定剤、浸透圧調整剤、希釈剤、その他の医薬品添加物、又はそれらの混合物を含み得る。
【0105】
本明細書では、用語「酸化防止剤」は酸化を阻害し、従って酸化プロセスによる製剤の劣化を防ぐために使用される試薬を意味することを意図している。そのような化合物には、制限されることなく例として、アスコルビン酸、アスコルビルパルミタート、ビタミンE、ビタミンE誘導体、ブチル化ヒドロキシアニソール、ブチル化ヒドロキシトルエン、次亜リン酸、モノチオグリセロール、没食子酸プロピル、アスコルビン酸ナドリウム、重亜硫酸ナトリウム、ホルムアルデヒド・スルホキシル酸ナトリウム、メタ重亜硫酸ナトリウム、及び当業者に公知の他のそのような物質が挙げられる。
【0106】
本明細書では、用語キレート化剤は、溶液中の金属イオンをキレートする化合物を意味することを意図している。例示的キレート化剤にはEDTA(エチレンジアミン四酢酸テトラナトリウム)、DTPA(ジエチレントリアミン五酢酸ペンタナトリム)、HEDTA(N−(ヒドロキシエチル)−エチレンジアミン三酢酸のトリナトリウム塩)、NTA(ニトリロ三酢酸トリナトリウム)、ジナトリウムエタノールジグリシン(Na2EDG)、ナトリウムジエタノールグリシン(DEGNa)、クエン酸、及び当業者に公知の他の化合物が挙げられる。
【0107】
本明細書では、用語「吸着剤」は、物理的又は化学的(化学吸着)手段によってその表面上に他の分子を保持し得る試薬を意味することを意図している。そのような化合物には、制限されることなく例として、粉末化されたそして活性化された炭、及び当業者に公知の他のそのような物質が挙げられる。
【0108】
本明細書では、用語「アルカリ化剤」は、アルカリ性培地を供するために使用される化合物を意味することを意図している。そのような化合物には、制限されることなく例として、アンモニア溶液、炭酸アンモニム、ジエタノールアミン、モノエタノールアミン、水酸化カリウム、ホウ酸ナトリウム、炭酸ナトリウム、重炭酸ナトリウム、水酸化ナトリウム、トリエタノールアミン及びトロラミン、及び当業者に公知の他のものが挙げられる。
【0109】
本明細書では、用語「酸性化剤」は、酸性培地を供するために使用される化合物を意味することを意図している。そのような化合物には、制限されることなく例として、酢酸、アミノ酸、クエン酸、フマル酸、及びその他α−ヒドロキシ酸、塩酸、アスコルビン酸、及び硝酸、及び当業者に公知の他のものが挙げられる。
【0110】
本明細書では、用語「消泡剤」は、充填組成物の表面上に形成する発泡の量を防ぐ又は削減する化合物又は化合物類を意味することを意図している。そのような化合物には、制限されることなく例として、ジメチコン、SIMETHICONE、オクトキシノール、及び当業者に公知の他のものが挙げられる。
【0111】
本明細書では、用語「緩衝剤」は、酸又はアルカリの希釈時又は添加時のpH変化を緩和するために使用される化合物を意味することを意図している。そのような化合物には、制限されることなく例として、メタリン酸カリウム、リン酸カリウム、一塩基性酢酸ナトリウム及びクエン酸ナトリウム無水物及び脱水塩、及び当業者に公知の他のそのような材料が挙げられる。
【0112】
本明細書では、用語「希釈剤」又は「充填剤」は、錠剤及びカプセルの製造において、望みのバルク、流動性及び圧縮特性を創出するために充填剤として使用される不活性物質を意味することを意図している。そのような化合物には、制限されることなく例として、二塩基性リン酸カルシウム、カオリン、乳糖、ショ糖、マンニトール、微結晶性セルロース、粉末セルロース、沈降炭酸カルシウム、ソルビトール及び澱粉、及び当業者に公知の他の材料が挙げられる。
【0113】
本明細書では、用語「保存剤」は、微生物の成長を防ぐために使用される化合物を意味することを意図している。そのような化合物には、制限されることなく例として、塩化ベンザルコニウム、塩化ベンゼトニウム、安息香酸、ベンジルアルコール、セチルピリジニウムクロリド、クロロブタノール、フェノール、フェニルエチルアルコール、硝酸フェニル水銀、酢酸フェニル水銀、チメロサール、メタクレゾール、ミリスチル−γ−ピコリニウムクロリド、安息香酸カリウム、ソルビン酸カリウム、安息香酸ナトリウム、プロピオン酸ナトリウム、ソルビン酸、チモール、及びメチル、エチル、プロピル又はブチルパラベン、及び当業者に公知の他のものが挙げられる。
【0114】
本明細書では、用語「着色剤」は、医薬品に色を付与するために使用される化合物を意味することを意図している。そのような化合物には、制限されることなく例として、FD&CレッドNo.3、FD&CレッドNo.20、FD&CイエローNo.6、FD&CブルーNo.2、FD&CグリーンNo.5、FD&CオレンジNo.5、FD&CレッドNo.8、カラメル及び酸化鉄(黒、赤、黄)、その他のFD&C染料及びブドウ皮抽出物、ビートの赤色粉末、β−カロテン、アナトー、カルミン、ウコン、パプリカなどの天然着色剤、それらの組み合わせ、及び当業者に公知の他のそのような材料が挙げられる。
【0115】
本明細書では、用語「安定剤」は、もし使用しなければ試薬の治療活性を低減するであろう物理的、化学的、又は生化学的プロセスに抗して活性剤を安定化するために使用される化合物を意味することを意図している。そのような安定剤には、制限されることなく例として、アルブミン、シアル酸、クレアチニン、グリシン及びその他のアミノ酸、ナイアシンアミド、アセチルトリプトファン酸ナトリウム、酸化亜鉛、ショ糖、グルコース、乳糖、ソルビトール、マンニトール、グリセロール、ポリエチレングリコール、カプリル酸ナトリウム及びサッカリンナトリウム及び当業者に公知の他のものが挙げられる。
【0116】
本明細書では、用語「浸透圧調整剤」は、液体製剤の浸透圧を調節するために使用され得る化合物を意味することを意図している。好適な浸透圧調整剤にはグリセリン、乳糖、マンニトール、デキストロース、塩化ナトリウム、硫酸ナトリウム、ソルビトール、トレハロース及び当業者に公知の他のものが挙げられる。
【0117】
実施例3および6には例示的なカプセル剤形が述べられている。実施例12には例示的な錠剤剤形が述べられている。
【0118】
本発明の組成物は、不揮発性油、ピーナツ油、ゴマ油、綿実油、トウモロコシ油、及びオリーブ油などの油;オレイン酸、ステアリン酸及びイソステアリン酸などの脂肪酸;及びオレイン酸エチル、ミリスチン酸イソプロピル、脂肪酸グリセリド及びアセチル化脂肪酸グリセリドなどの脂肪酸エステルも含み得る。本組成物は、エタノール、イソプロパノール、ヘキサデシルアルコール、グリセロール及びプロピレングリコールなどのアルコール;2,2−ジメチル−1,3−ジオキソラン−4−メタノールなどのグリセロールケタール;ポリ(エチレングリコール)450などのエーテル;鉱油及びワセリンなどの石油系炭化水素;水;薬学的に適切な界面活性剤、懸濁剤又は乳化剤;又はそれらの混合物も含み得る。
【0119】
尚、医薬製剤技術において使用される化合物が一般的に種々の機能又は目的の役を果たす。このように、もし、本明細書において名前を挙げられた化合物が、本明細書において一つより多くの用語を定義するために一度だけ述べられ又は使用されるならば、その目的又は機能は、その名前を挙げられた目的(等)又は機能(等)のみに限定されると考えられるべきではない。
【0120】
一つ又はそれ以上の製剤成分は、その遊離塩基で、又は薬学的に又は分析的に許容できる塩形態で存在し得る。本明細書では、「薬学的に又は分析的に許容できる塩」は、イオン的に結合された対を形成するために必要に応じてそれを酸と反応させて改質された化合物を意味する。許容できる塩の例には、例えば、非毒性の無機酸又は有機酸から形成された従来の非毒性塩が挙げられる。適切な非毒性塩には、塩酸、臭化水素酸、硫酸、スルホン酸、スルファミン酸、リン酸、硝酸などの無機酸及び当業者に公知の他のものから誘導されるものが挙げられる。これらの塩はアミノ酸、酢酸、プロピオン酸、コハク酸、グリコール酸、ステアリン酸、乳酸、リンゴ酸、酒石酸、クエン酸、アスコルビン酸、パモ酸、マレイン酸、ヒドロキシマレイン酸、フェニル酢酸、グルタミン酸、安息香酸、サリチル酸、スルファニル酸、2−アセトキシ安息香酸、フマル酸、トルエンスルホン酸、メタンスルホン酸、エタンジスルホン酸、シュウ酸、イセチオン酸などの有機酸及び当業者に公知の他のものから製造される。他の適切な塩のリストがRemington's Pharmaceutical Sciences, 17th. ed., Mack Publishing Company, Easton, PA, 1985, p. 1418に見られ、その関連する開示は、参照されることにより本明細書に組み込まれているものとする。
【0121】
フレーズの「薬学的に許容できる」は、妥当な医学判断の範囲内で、ヒト及び動物の組織と接触して使用するのに適しており、そして過剰な毒性、刺激、アレルギー応答又は如何なるその他の問題又は合併症無しに合理的な便益/リスク比に見合う、そのような化合物、材料、組成物及び/又は剤形を参照するために、本明細書において使用される。
【0122】
上記記述及び下記実施例を見れば、当業者は請求された通りに本発明を、必要以上の実験無しに、実行し得るであろう。前述のことは、本発明の実施態様の調製のためのある手順を詳述している以下の実施例を参照すればよりよく理解されるであろう。これらの実施例に対する全ての参照は説明目的のためである。以下の実施例は網羅的なものではなく、本発明によって意図された多くの実施態様の単に二、三を説明するものであると考えられるべきである。
【0123】
オレアンドリン及びMTTは、Sigma Chemical社(St.Louis、MO)から購入される。BODIPY−オレアンドリン、Mito-Tracker Red CM-H2XRos、カルセインアセトキシメチル(CAM)エステル及び4’−6−ジアミジノ−2−フェニルインドール(DAPI)はMolecular Probes-Invitrogen社(Carlsbad、CA)から得られる。抗β−アクチン抗体もSigma社から購入される。
【0124】
ヒトの膵臓癌細胞:Panc-1、BxPC3、MiaPaca;ヒトの結腸癌細胞株:CaCO-2、DOD-1、HCT-116、HT29、RKO及びLST174;齧歯動物のメラノーマB16細胞;ヒトの乳癌細胞:SUM149、MCF-7及びMDA231;ヒトの口腔癌細胞:SCC9及びCAL-27;ヒトの卵巣癌ES3、TOV1120及びSKOV細胞及びヒトの非小細胞癌A549及びH1299細胞は全てThe American Type Culture Collection(Manassas、VA)から得られ、そして37℃で、5%CO2を含む加湿雰囲気中に維持された。ヒトのメラノーマBRO細胞は、The Stehlin Foundation(Houston、TX)からの親切な贈与であった。異なる上皮源に由来する細胞株は、10%の熱で不活性化されたウシ胎仔血清(FBS)、(Hyclone Laboratories社、Logan、UT)、50IU/mlのペニシリン及び50μg/mlのストレプトマイシン、並びにGIBCO(Invitrogen社)製の2mのL−グルタミンで補われた組織培養培地(Invitrogen社、Grand Island、NY)(表1)中で規定どうりに培養される。
【0125】
〔実施例1〕
粉末化されたセイヨウキョウチクトウの葉の超臨界流体抽出
方法A.二酸化炭素使用
セイヨウキョウチクトウの葉材料を収穫、洗浄及び乾燥し、次いでセイヨウキョウチクトウの葉材料を、米国特許第5,236,132号,第5,598,979号,第6,517,015,及び第6,715,705号に記載されているもののような粉砕脱水装置を通過させることによって、粉末化されたセイヨウキョウチクトウの葉を製造した。使用された出発原料の質量は3.94kgであった。
出発原料を、抽出装置中で、300バール(30MPa、4351psi)の圧力及び50℃(122oF)の温度で純粋なCO2と混ぜ合わせた。全部で197kgのCO2を使用し、原材料に対する溶媒の比を50:1とした。次いで、CO2及び原材料の混合物を分離装置に通過させ、混合物の圧力及び温度を変え、そして抽出物を二酸化炭素から分離した。
抽出物(65g)が、よい芳香を有する茶色の、粘っこい、粘着性の物質として得られた。その色はクロロフィルによってもたらされたようであった。正確な収量を求めるために、チューブ及び分離機をアセトンでゆすぎ出し、そしてアセトンを蒸発させたところ、追加の9gの抽出物を得た。全抽出物量は74gであった。出発原料の質量に基づくと、抽出物の収率は1.88%であった。抽出物中のオレアンドリンの含有量を高圧液体クロマトグラフィー及び質量分析を用いて計算したところ560.1mg、つまり0.76%の収率であった。
【0126】
方法B.二酸化炭素及びエタノールの混合物使用
セイヨウキョウチクトウの葉材料を収穫、洗浄及び乾燥し、次いでセイヨウキョウチクトウの葉材料を、米国特許第5,236,132号,第5,598,979号,第6,517,015,及び第6,715,705号に記載されているもののような粉砕脱水装置を通過させることによって、粉末化されたセイヨウキョウチクトウの葉を製造した。使用された出発原料の質量は3.85kgであった。
出発原料を、抽出装置中で、280バール(28MPa、4061psi)の圧力及び50℃(122oF)の温度で、純粋なCO2及び改質剤として5%エタノールを混ぜ合わせた。全部で160kgのCO2及び8kgのエタノールを使用し、原材料に対する溶媒の比を43.6:1とした。次いで、CO2、エタノール及び原材料の混合物を分離装置に通過させ、混合物の圧力及び温度を変え、そして抽出物を二酸化炭素から分離した。
エタノールを除去した後、抽出物(207g)が、明らかに幾らかのクロロフィルを含有する、暗緑色の粘っこい、粘着性の塊として得られた。出発原料の質量に基づいて、抽出物の収率は5.38%であった。抽出物中のオレアンドリンの含有量を高圧液体クロマトグラフィー及び質量分析を用いて計算したところ1.89mg、つまり2.1%の収率であった。
【0127】
〔実施例2〕
粉末化されたセイヨウキョウチクトウの葉の熱水抽出
セイヨウキョウチクトウの葉からオレアンドリン及び他の活性剤を抽出するために熱水抽出が一般的に使用された。熱水抽出プロセスの例は米国特許第5,135,745号及び第5,869,060号において見出され得る。
5gの粉末化されたセイヨウキョウチクトウの葉を用いて熱水抽出を行った。(セイヨウキョウチクトウ出発原料の質量当たり)10倍の容積の沸騰水を粉末化されたセイヨウキョウチクトウの葉に加え、そして混合物を6時間、絶えず撹拌した。次いで、混合物をろ過して葉の残留物を集め、そして再び同じ条件下で抽出した。濾液を合わせて凍結乾燥させた。抽出物の外観は茶色であった。乾燥された抽出物の質量は約1.44gであった。34.21mgの抽出物を水中に溶解させ、高圧液体クロマトグラフィー及び質量分析を用いてオレアンドリン含有量分析にかけた。オレアンドリンの量は3.68mgであった。抽出物の量に基づいて、オレアンドリンの収率を計算したところ0.26%であった。下表は実施例1の二つの超臨界二酸化炭素抽出物及び熱水抽出物に対するオレアンドリン収率の間の比較を示す。
【0128】
【表5】

【0129】
〔実施例3〕
細胞株
ヒトの膵臓癌細胞:Panc-1、BxPC3、MiaPaca;ヒトの結腸癌細胞株:CaCO-2、DOD-1、HCT-116、HT29、RKO及びLST174;齧歯動物のメラノーマB16細胞;ヒトの乳癌細胞:SUM149、MCF-7及びMDA231;ヒトの口腔癌細胞:SCC9及びCAL-27;ヒトの卵巣癌ES3、TOV1120及びSKOV細胞及びヒトの非小細胞癌A549及びH1299細胞は全てThe American Type Culture Collection (Manassas、VA)から得られ、そして37℃で、5%CO2を含む加湿雰囲気中に維持された。ヒトのメラノーマBRO細胞は、The Stehlin Foundation (Houston、TX)からの親切な贈与であった。異なる上皮源に由来する細胞株は、10%の熱で不活性化されたウシ胎仔血清(FBS)、(Hyclone Laboratories社、Logan、UT)、50IU/mlのペニシリン及び50μg/mlのストレプトマイシン、並びにGIBCO(Invitrogen)製の2mのL−グルタミンで補われた組織培養培地(Invitrogen社、Grand Island、NY)(表1)中で規定どおりに培養された。
【0130】
〔実施例4〕
細胞毒性のインビトロの決定
細胞を、下表に示された通りのその関連する培地中で、1×104細胞/ウエルの密度で成長させた。24時間のインキュベーション期間の後、細胞を種々の濃度(1から500nM)のオレアンドリンを用いて処理した。追加の72時間後、細胞増殖の阻害をMTT分析(23)によって評価した。Molecular Devices社(Sunnyvale、CA)製のV-Max Micro-plate Readerを用いて、570nmの波長、及び650nmの参照波長で吸光度を読んだ。ある濃度のセイヨウキョウチクトウ抽出物、又は強心配糖体化合物を含有する他の植物抽出物が存在する故の、細胞増殖の阻害の相対的程度は、細胞増殖を可能とする設定時間(例えば、24〜72時間)後の、未処理の細胞数に対する処理された細胞数を比較することによって導くことができる。
【0131】
【表6】

【0132】
〔実施例5〕
強心配糖体の細胞摂取の決定
Panc-1(α3:α1アイソフォームの最高比)細胞及びBxPC3細胞(より低いα3:α1比)中のオレアンドリン及びウアバインの摂取を、オレアンドリンの蛍光類似体であるBODYPI−オレアンドリンを用いて処理した後、蛍光顕微鏡法によって求めた。96−ウエルプレート中の細胞を、0、5、20及び50nMのオレアンドリンで2時間又は24時間、処理した。処理はDMEM/F12培地の0.5%のウシ胎仔血清中で実行された。細胞は、MitoTracker Red CM-H2XRos(1μM)、及び選択的核染料(Molecular Probes)であるDAPI(1ng/ml)を用いて同時にインキュベーションされた。核形態、DNA及びミトコンドリア染料摂取をOlympus IX-70倒立顕微鏡を用いた蛍光顕微鏡法によって評価した。画像の取得は、Quantix電荷結合素子カメラ及びIP Labsソフトウエア(Scanalytics社、Fairfax、VA)を用いて達成された。野生型及びα3siRNAをトランスフェクトされたPanc-1の細胞中のオレアンドリン摂取の変化を、ラミニンで被覆されたカバーガラス上で培養された細胞、及びBODIBY−オレアンドリンで1時間処理された細胞において求めた。
【0133】
〔実施例6〕
α3及びα1アイソフォーム発現としてのNa、K−ATPアーゼの決定
細胞を冷PBSで洗浄し、そしてリシス緩衝液(20mMのMOPS、2mMのEGTA、5mMのEDTA、30mMのNaF、40mMのβ−グリセロリホスフェート、20mMのピルビン酸ナトリウム、0.5%のTriton X-100及びプロテアーゼ阻害剤カクテルを有する1mMのオルソバナジン酸ナトリウム)の存在下で、削り落とした。次いで、細胞溶解物を氷の上で3分間、超音波分解させ、そして14,000×g(4℃で10分間)での遠心分離の前に追加の10分間、4℃でインキュベーションさせた。蛋白質レベルをBioRad Dc蛋白質測定(BioRad社、Hercules、CA)を介して定量した。同レベルの蛋白質(50μg)をプレキャストゲル(BioRad社)に適用し、そして次に標準法に従ってポリビニリデンジフルオリド膜上に移した。0.1%のTween20を有するトリス−緩衝食塩水中で調製した5%の脱脂乾燥ミルクブロッキング緩衝剤中における1から2時間のインキュベーション期間に続いて、ブロッキング緩衝液中1:2,000倍に希釈したα3アイソフォーム(Affinity Bioreagents、Golden、CO)及びα1アイソフォーム(Upstate、Lake Placid、NY)に対する一次抗体を用いて膜を調べた。ECL+検出キット及びhyper-film (Amersham Biosciences, Piscataway, NJ)を用いて、化学発光を介して蛋白質のバンドを可視化した。β−アクチンの存在に対するサンプルの等量負荷がウエスタンブロットによって示された。蛋白質のバンドを、Alpha DigiDoc 1000ソフトウエア(Alpha Innotech社、San Leandro、CA)を用いて定量した。
【0134】
〔実施例7〕
限定はされないが、メラノーマ、基底細胞癌腫、及び扁平上皮癌、並びに限定はされないが光線性角化症、乾癬及び湿疹を含む非癌性炎症性の皮膚病の治療の防止を含む、癌などの皮膚に関連する疾病の治療
SCF抽出物が、上に引用されたもののような悪性又は非悪性の増殖性皮膚疾患を患っている対象物に投与される。SCF抽出物は、クリーム又は軟膏として投与され、又は単位用量当たり0.01mgから10mgのSCF抽出物を含有する皮膚パッチ内に含有される。対象物に、1から14日の期間、又は皮膚病が寛解期になるまで、毎日3回までの単位用量が投与される。そのような治療が炎症、及び疾病の進行に繋がる悪性プロセスを著しく軽減又は排除するであろうことが期待される。対象物は皮膚病変の重篤性における軽減、及び皮膚病自身の最終的な消散を経験するはずである。悪性の疾病が成長速度において軽減される、又は疾病の重篤性の増大が阻害されることが期待されるはずである。確立された悪性病変の実際の退行が期待され得る。
【0135】
〔実施例8〕
皮膚癌などの皮膚に関連する疾病の防止
SCF抽出物が、(太陽光からの)紫外線又は薬品からの発癌物質に頻繁に曝される対象物等の皮膚癌の形成への素因に悩まされている対象物に投与される。SCF抽出物は、クリーム又は軟膏として投与され、又は単位用量当たり0.01mgから10mgのSCF抽出物を含有する皮膚パッチ内に含有される。発癌性物質の促進イベントへの暴露が予想される時(日光への暴露)はいつでも毎日3回までの単位用量が対象物に投与される。そのような投与は、例えば、太陽光UV暴露をブロックするための日焼け止め、及び、皮膚組織における腫瘍誘起を防止するためのSCF抽出物としてなされ得る。皮膚製品におけるSCFのそのような使用が、増殖が疾病過程(例えば、光線性角化症、乾癬及び/又は湿疹)の悪化につながる悪性皮膚病又は非悪性皮膚疾患の形成及び/又は促進をブロックするであろうことが期待されるであろう。
【0136】
〔実施例9〕
ヒト又は他の脊椎動物における固形腫瘍の治療
強心配糖体を含有する植物又は動物のSCF抽出物は、直腸、肛門、結腸直腸組織、頭頚部組織、食道組織、肺(非小細胞癌及び小細胞癌の両方)、乳房、胃、膵臓、前立腺、肝臓、腎臓、膀胱、尿管、卵巣組織、カルチノイド腫瘍、骨肉腫、中皮腫、及び中枢神経系の新生物の癌の治療のために使用され得る。
SCF抽出物が、上述のもののような固形の悪性疾病を患っている対象物に投与される。単位用量当たり1から50mgのSCF抽出物を含有する経口剤形としてSCF抽出物が投与される。対象物は、28日/サイクルの治療期間に対して、毎日2回までの単位用量が投与される。3サイクルまでの治療が要求され得る。対象物は腫瘍の成長が増殖速度において低下するか又は退行するかを経験するはずである。腫瘍の完全消散も起こり得る。SCF抽出物を用いた治療は、単独剤として又は細胞毒化学療法若しくは放射線治療と組み合わされて使用され得て、又は不当な干渉を引き起こすことなく、従来の治療の所望の抗腫瘍効果を有する適切な免疫治療と組み合わせられ得る。
【0137】
〔実施例10〕
二つのヒト腫瘍細胞株における、超臨界CO2を用いて作成されたSCF抽出 物に対する、Nerium oleanderの熱水抽出物の細胞毒性の比較
両方の抽出物の細胞毒性のポテンシャルをオレアンドリンのそれと直接比較した。オレアンドリンのそれらの濃度が、抽出物中に存在するオレアンドリンの濃度故に異なるものの、サンプルは同量のオレアンドリンを含有していた。
BRO(ヒトメラノーマ)及びPanc−1(ヒト膵臓癌)細胞(8×103ウエル)を96ウエルプレート中に置き、そして一晩、付着させた。次いで、薬品又は抽出物を細胞に加えた。72時間のインキュベーションの後、相対的細胞増殖(コントロールの未処理細胞に対して)をクリスタルバイオレット染色法によって評価した。
【0138】
〔実施例11〕
オレアンドリンを含有する溶液のHPLC分析
サンプル(オレアンドリン標準、SCF抽出物及び熱水抽出物)を以下の条件を用いてHPLC(Waters社)上で分析した:対称性C18カラム(5.0μm、150×4.6mm内径;Waters社);MeOH:水=54:46(v/v)及び流速が1.0ml/minの移動相。検出波長は217nmに設定された。サンプルは、化合物又は抽出物を固定された量のHPLC溶媒中に溶解させることによって製造され、ほぼ目標のオレアンドリン濃度を達成した。
【0139】
〔実施例12〕
SCF抽出物の抗ウイルス活性の評価
試験は、ヒト末梢血単核細胞(PBMCs)におけるHIV−1のROJO株の増殖を阻害するセイヨウキョウチクトウ抽出物又はポジティブコントロール(AZT)の相対的能力の決定から成る。感染細胞が薬剤又は抽出物に48時間、曝された。試験は、ヒトPBMCを殺し得る抽出物のその濃度に対して、セイヨウキョウチクトウ抽出物のIC50(ウイルス増殖の50%の阻害を生み出す抽出物のその濃度)を求めるために使用された。これは、実際に、抽出物の処理指数の決定である。これは本質的に、抽出物がPBMC細胞そのものを殺すことなく、HIV−1を殺し得るか否かの決定である。
100ug/mlという高い濃度でも、細胞を殺すために要求される濃度が到達されていない一方、約5.0ug/ml以下のウイルス増殖に対するIC50を観察するにちがいない。得られたこれらのデータは、HIV−1ウイルス増殖の阻害、又はPBMC細胞内に宿されたウイルスの感染性の点で、セイヨウキョウチクトウ抽出物が有用であるにちがいないことを示唆した。
【0140】
〔実施例13〕
Panc−1細胞のα3siRNAとのトランスフェクション
Panc−1細胞を6及び48ウエルプレート中に置き、そして一晩、付着させた。α3siRNA分子の過渡的トランスフェクションを、siPORT(商標)Amine Transfection Agent(Ambion Austin社、TX)及び 0.4μMのα3サイレンシングRNA(Santa Cruz Biotech.社)を用いてメーカーの指示書に従って実施した。トランスフェクションの24時間後、細胞を10から50nMのオレアンドリンを用いて48時間処理した。ウェスタンブロット解析のために蛋白質を6ウエルプレートから集め、そして細胞生存率の評価をCalcien AM染色によって実施した。
【0141】
〔実施例14〕
正常及び結腸生検組織におけるα3及びα1発現の決定
急速冷凍された正常な結腸粘膜及び腫瘍組織生検を得て、液体窒素で冷却した乳鉢を用いて粉砕した。サンプルを前記の通り、リシス緩衝液に曝した。次いで、溶解物を氷上で3分間、超音波分解し、4℃で10分間、インキュベーションさせ、そして14,000rpmで遠心分離し(4℃で10分間)、続いて前記の通り、α−サブユニットのα3及びα1アイソフォームのウエスタンブロック分析を行った。
【0142】
〔実施例15〕
統計解析
種々の実験グループの間の統計的違いを求めるために、スチューデントt検定を用いた;P<0.05の値が有意差有りと考えられた。
【0143】
〔実施例16〕
α3抗体の感度の決定
異なるα3抗体の感度を比較するために、ポジティブ及びネガティブのコントロールサンプルの等量の同じ溶解物を3つのプレキャストゲル(BioRad社、Hercules、CA)上に載せ、次いで標準法に従って、ポリビニリデンジフルオリド膜に移した。0.1%のTween20を有するトリス−緩衝食塩水(TBS−T)中で製造した5%の脱脂乾燥ミルクブロッキング緩衝剤における1〜2時間のインキュベーションに続いて、各々ブロッキング緩衝液中1:2,000倍に希釈した、Sigma(St Luoise、MO)、Affinity Bioreagents(Golden社、CO)及びNovus(Littleton、CO)からのα3抗体で膜を探索した。蛋白質のバンドをChemiglow West検出キット及びAlpha Imager(Alpha Innotech社、San Leandro、CA)を用いて、化学発光を介して可視化した。蛋白質のバンドを、Alpha DigiDoc 1000ソフトウエア(Alpha Innotech社、San Leandro、CA)を用いて定量し、そして3つの抗体の間で比較した。β−アクチンに対するサンプルの等量負荷がウエスタンブロットによって示された。これらのデータは、選択された抗体の各々の一つの、α3に対する感度が実質的に等しいことを示す。
【表7】

【0144】
〔実施例17〕
予後アッセイを実施するためのキット
このキットは、本発明の方法に従って、実施例18において詳述されているように、ウエスタンブロット技法を用いて予後アッセイを実施するために、使用され得る。
1.溶解組成物
【表8】

2.一次抗体:(ブロッキング溶液中、1:2000)
α3(Affinity Bioreagents Cat# MA3-915)
α1(Upstate Cat# 05-369)
3.二次抗体:ヤギ抗マウス IgG HRP(Santa Cruz Cat# sc-2005)
4.ゲル/膜製造:
7.5〜10%のゲル(BioRad Precast)
BioRad Laemmliサンプル緩衝液(Cat# 161-0737)
分子量マーカー(Cat# 161-0318)
泳動緩衝液(BioRad 10X トリス/グリシン/SDS)(Cat# 161-0 732)
膜(Biorad PVDF)
トランスファー緩衝液:
3.03gのトリス(最終濃度−25mM)
14.4gのグリシン(最終濃度−0.192mM)
200mlのメタノール(20%)
1LまでのH2O
5.ブロッキング溶液:TBS(20mM トリス HCl、150mM NaCl)中、5%のミルク
6.洗浄緩衝液:TBS−T(20mM トリス HCl、150mM NaCl、0.05% Tween−20)
8.ポジティブコントロール細胞:ヒト膵臓癌、Panc-1細胞の細胞溶解物
9.ネガティブコントロール細胞:マウスメラノーマB16細胞
10.α−サブユニットのアイソフォームのウエスタンブロット法のための詳細なプロトコールを含むパンフレット
【0145】
〔実施例18〕
細胞組織のサンプルの製造
方法A.細胞ペレットから
200万から400万の細胞を含有する細胞ペレットを得る。培地を除くために生理的平衡溶液(PBS)を用いてすすぐ。100ulのリシス緩衝液を添加する。常に冷たく保つ(氷上)。実施例18における超音波分解工程を続ける。
方法B.プレート上の細胞から
100mmの組織培養プレート上で120万から150万の細胞を24時間かけて成長させる。細胞増殖培地を注意深くデカントして廃棄する。1mlのPBSを用いてプレートを2回すすぐ。100ulのリシス緩衝液を添加し、細胞をプレートからこすり落とし、そしてチューブ中に集める。常に冷たく保つ(氷上)。実施例18における超音波分解工程を続ける。
方法C.組織から
冷凍された組織を粉砕する。粉砕された組織をチューブ中に置く。最低5mgの粉砕された組織に100μlの冷たいリシス緩衝液を添加する。常に冷たく保つ(氷上)。実施例18における超音波分解工程を続ける。
【0146】
〔実施例19〕
ウエスタンブロットによるサンプル中のα−サブユニットのアイソフォーム含有量の決定
下記の手順は、そこにおいてサンプル中のNa、K−ATPアーゼのαサブユニットのアイソフォーム含有量を検出して定量するために本発明の方法が採用され得る単なる一つの方法である。工程の順序は必要に応じて修正され得る。
ウェスタンブロット解析
1.氷で冷した浴を用いるなど、冷却しながら細胞溶解物を超音波分解する。
2.溶解物を4℃にて10分間、14,000rpmで回転させる。
3.上澄み液を集めて−常に氷上に保つ。
4.蛋白質分析によって蛋白質レベルを求める(BioRad(登録商標)Protein Assay Kit指示書を参照)。
5.蛋白質分析に基づいて、ゲル上に載せるためのサンプルを製造する(ウエル当たり50μgの蛋白質)。
a.ポジティブ及びネガティブのコントロール溶解物並びにサンプルを製造する。
i.ポジティブコントロール:Panc−1蛋白質溶解物
ii.ネガティブコントロール:Panc−2又はB16蛋白質溶解物
b.ラエムリ(Laemmli)サンプル緩衝液(LSB社)をサンプル及びコントロールに添加する(LSB社指示書を参照)。
c.サンプル及びコントロールを95℃で5分間、加熱する。
d.サンプルを回転して落とす。
6.ゲルを搭載する。
7.染料がゲルの底から流出するまで、ゲルを200ボルトで流す。
8.100ボルトで1〜2時間、移す。
9.ブロッキング緩衝液中で、室温にて30分から1時間、膜をブロックする。
10.4℃で一晩、膜をインキュベーションする。
11.洗浄緩衝液を用いて膜を洗浄する。
3回の迅速洗浄、1〜15分の洗浄、2〜10分の洗浄
12.IIo抗体中で、室温にて45分から1時間、膜をインキュベーションする。
13.洗浄緩衝液を用いて膜を洗浄する。
3回の迅速洗浄、1〜15分の洗浄、2〜10分の洗浄
14.ECL+(Amersham Cat# RPN2132)中で5分間、膜をインキュベーションする。
15.フィルム(Amersham Cat# RPN3114k)に膜を曝し、そしてフィルム展開機上に展開する。
16.曝された膜の写真を、Alpha Digi Docソフトウエア(又は、貴方の現在の画像撮影機)を用いて、Alpha Imagerで撮る。
17.Alpha Digi Docにおける解析ツールのSpot Densoアプリケーションを用いて、α1及びα3画像の対応するバンドを選択する。
18.各バンドに対する積分密度値Ietegrated Density Value(IDV)を得る。
19.α1アイソフォームに対するα3アイソフォームの比を計算する。
【0147】
〔実施例20〕
Na、K−ATPアーゼ特異的αサブユニットに対するmRNAを求めるためのRT−PCR法
RNASTAT-60試薬(Tel-Test社、Friendswood、TX)が、逆転写ポリメラーゼ連鎖反応(RT−PCR)分析における使用前にDNアーゼIで処理された全RNAを抽出するために使用された。1μgのRNAが、マウス乳癌ウイルスRT(Life Technologies社、Rockville、MD)を用いて逆転写された。α3−371bp配列が、プライマーのセット、α3−NKA3VSAS−2−F 5’−NNNNNNNNNN−3’(正順)及び−R5’−NNNNNNNN−3’(逆順)によって増幅された。これらのセット及び追加プライマーのセットが、Oligo 6.7 Molecular Biology Insights(Cascade、CO)を用いて設計されそして検証された。GAPDHmRNAを検出するためにRT−PCR分析において、プライマー対(5’−CAGCTCTGGAGAACTGCTG−3’;5’−GTGTACTCAGTCTCCACAGA−3’)が使用された。
【0148】
〔実施例21〕
転移性膵臓ガストリノーマの治療に対する、強心配糖体含有抽出物と他の抗癌剤の組み合わせの臨床評価
以下は、転移性膵臓ガストリノーマを患っている患者が強心配糖体含有抽出物を用いて治療された事例履歴である。
63歳の男性が、膵臓病の疑いでM. D. Anderson癌センターに2002年8月30日を訪れた。CTスキャンの結果、膵臓の尾上に腫瘤が見つかった。2002年9月17日に、患者は、強心配糖体、主としてオレアンドリン、を含有する実験薬の自己投与を始めた。2002年10月9日に、患者は膵臓の高分化型膵島細胞腫瘍を有すると診断された。患者は、アドリアマイシン、ストレプトゾシン及び5−FUの8サイクルの化学療法、続いてストレプトゾシン及び5−FUの3サイクルの化学療法を推奨された。2002年11月13日に、患者は推奨された治療を始め、一方でオレアンドリンを含む薬の自己投与を継続した。2003年7月23日に、患者は化学療法の推奨されたレジメンを完結した。彼の元の診断において、何の変化も認められなかった。患者は2003年7月23日以降、何の化学療法も受けなかった。患者は、化学療法レジメンの完結に続いて、強心配糖体を含有する抽出物の自己投与を続けた。遅くとも2007年2月16日に、患者は放射線的に安定な疾病を有するとして記載された。患者は、オレアンドリンなどの強心配糖体含有抽出物の自己投入を続け、そして無症候性であり、かつカルノフスキー尺度で100
%であると報告された。
【0149】
〔実施例22〕
腺癌の治療に対する、強心配糖体含有抽出物の臨床評価
35歳の男性が、通常の食事を取った後に、腹部において痛み及び膨満を経験した。彼は民間の診療所を訪れ、そして螺旋腹部コンピュータ支援断層撮影(CAT)スキャンが実施された。結論の中に膵臓頭部の容積増大、柔組織密度の異質性、及び膵臓頭部の前部位での多数のリンパ節腫があった。磁気共鳴映像法(MRI)検査でこれらの発見が確認された。同じ日に、超音波支援細針吸引生検が実施された。超音波検査の結果、膵臓頭部に39×33mmの腫瘍塊が分かった。生検用標本の組織病理学的検査で腺癌としての診断が分かった。化学療法コースが推奨されたが、患者が拒否した。
一月後、患者は自己投与による、非常に少量のオレアンドリンを含有する植物抽出物治療を始めた。一月以内に得られた上部腹部のMR画像は膵臓頭部上に35×25mmのコントラストを保持した病巣を示した。その中で最大のものが5mmであった多くのリンパ節症も、膵臓頭部の前部位及び胃洞の後部位に見つかった。
三月後に得られたMRI画像は、膵臓頭部における30×25mmのサイズの腫瘍を示した。少量のオレアンドリンを含有する抽出物の用量がこの時点で増やされた。三週間後に、骨シンチグラフィーが実施された。それは転移性疾病に対しては目立たなかった。七週間後に得られた上部及び下部腹部のMR画像は膵臓頭部上の腫瘍塊を示し、そして全てのリンパ節腫が寛解の兆しを示した。二か月後に得られた上部及び下部腹部のMRIでは、膵臓腺癌及び/又はリンパ節腫に対しては目立たなかった。引き続いて、四か月後に上部及び下部腹部のMRIが実施された。膵臓腺癌及び転移性の疾病に対して目立たない状態が続いた。
2007年3月現在、患者は寛解状態を継続中である。
【0150】
〔実施例23〕
癌及び腫瘍細胞の培養
以下の手順は、特定の癌又は腫瘍細胞の培養を最適化するために、必要に応じて修正され得る。Panc−1ヒト膵臓癌細胞はAmerican Type Culture Collection(Manassas、VA)から購入された。細胞は、10〜15%のウシ胎仔血清(Invitrogen、Carlsbad、CA)、100U/mlのペニシリン(Invitrogen)及び2.5ug/mlの抗真菌薬(Fungizone;Invitrogen)で補充されたDMEM培地中、5%のCO2において、37℃で培養された。オレアンドリン及びアドリアマイシンによる細胞増殖の相対的阻害を、一連の濃度の各薬品の72時間の連続薬品暴露の後で求めた。未処理のPanc−1細胞増殖に対する細胞増殖を評価するために、以前に述べられた通り(Mosmann、1983)、MTT分析が使用された。細胞増殖の評価の前72の間、細胞を無処理(コントロール)、オレアンドリン又はアドリアマイシンに暴露した。
【0151】
〔実施例24〕
細胞染色
アクリジンオレンジを用いて細胞を染色するために、以下の手順が使用された。
1ug/mlのアクリジンオレンジを用いて、37℃で15分間、細胞を染色した。細胞を、PBSを用いて洗浄し、プレートからトリプシン処理し、FBSを用いてPBS中に集め、そしてフローサイトメトリーを介して分析した。
【0152】
〔実施例25〕
細胞サイクル分析
細胞サイクルを求めるために、以下の手順が使用された。
Panc−1細胞を、オレアンドリン(0、20及び40uM)を用いて72時間処理し、トリプシン処理し、4℃の70%エタノールを用いて固定し、細胞DNAフローサイトメトリー分析試薬セット(Roche社)を用いて沃化プロピジウムで染色し、次いでFACScan(Becton Dickinson社、San Jose、CA)によってDNA含有量を分析した。Cell Questソフトウエア(Becton Dickinson社)によってデータを分析した。各サンプルに対して、少なくとも100,000個の細胞が分析された。
【0153】
〔実施例26〕
非小細胞癌の治療に対する、強心配糖体含有抽出物の臨床評価
81歳の男性が左上方葉の非小細胞肺癌を有すると診断された。患者は放射線治療、続いて化学療法のコースを推奨された。七週間後、患者は放射線治療を始め、そして24日で治療を完了した。次いで患者は6日以内に5つの化学療法のレイメンを始め、そして8カ月後にそれらを完了した。完了前の二十七日前に、彼は左上部葉の非小細胞肺癌の以前の診断の再現のために病院を訪れた。全身PETスキャンが実施され、そして患者の既知の悪性腫瘍と一致する左上部葉を含む大きな面積の異常な代謝亢進作用と結論付けられた。追加的に、右門及び前縦隔を含む代謝亢進作用の微妙な領域が結節関与を同様に反映した。胸のCTスキャンによって5cmの軟質組織密度が左上部葉に確認された。引き続いて化学療法のレジメンが開始された。一か月以内に、患者が耐えられないため、化学療法が中断された。一週間後、比較のために胸のCTスキャンが実施された。約4cmの軟質組織の腫瘤が左上部葉の後部セグメントにあった。左上部葉の腫瘤の全体的バルクにおいて間隔の減少があった。五週間以内に、患者はオレアンドリンを含有する植物抽出物の自己投与を始めた。三ヶ月後、フォローアップの胸部レントゲン撮影が以前のスキャンと比較されたところ、左上部葉の腫瘍瘤密度は変化していなかった。一年後、胸部レントゲン撮影が、三か月前のスキャンで発見されたものと比較され、そしてその上の左上部葉における約4cmのサイズの腫瘍瘤密度に変化がないことが判明した。
患者はオレアンドリンを含有する植物抽出物の自己投与を続けた。四か月以内に、IVコントラストを用いる胸のCTスキャンが実施された。左上部葉の中央腫瘤のサイズにおいて約20%の減少が観察された。現時点で、患者はオレアンドリンを含有する植物抽出物の自己投与を続けており、そして高いカルノフスキー尺度が報告された。臨床データは、患者の最後の化学療法の後の多くの月に中央腫瘤ノサイズ変化が起きたため、植物抽出物が治療上の便益を有することを示唆している。
【0154】
〔実施例27〕
免疫組織化学的染色によるサンプル中のα−サブユニットのアイソフォーム含有量の決定
下記の手順は、そこにおいてサンプル中のNa、K−ATPアーゼのαサブユニットのアイソフォーム含有量を検出して定量するために本発明の方法が採用され得る単なる一つの方法である。工程の順序は必要に応じて修正され得る。この分析において使用された材料は、Vector Laboratories(Burlingame、CA又はPeterborough、England)から得ることができる。
【0155】
免疫組織化学的分析
ヒト組織の新鮮凍結された切片が使用された。切片はキシレンを3回換えて(各々5分)用いて脱パラフィン処理され、濃度を順に下げたエタノール中(99%で2回、90%で2回、各5分間)で再水和され、そして蒸留水中でよくすすがれた。熱媒介された抗原検索方法がVector抗原アンマスキング溶液(Vector-AMS社)の沸騰溶液中、高pH(Vector Laboratories社、Catalog # H-3301)で3×5分間、切片のインキュベーションによって完了された。
【0156】
抗原検索に続いて、切片を50mMのトリス−HCl、300mMのNaCl、0.1%、pH7.6の(TBS)中で2×5分間、洗浄した。メタノール中、0.3%(v/v)の過酸化水素中で20分間、切片をインキュベーションさせることによって、続いてTBS中で10分間、洗浄することによって、内因性ペルオキシド活性をクエンチした。
【0157】
TBS中、4ug/mlで、2.5%(v/v)の正常な馬血清(2.5%NHS)中に希釈した抗Na、K−ATPアーゼのα3サブユニットアイソフォーム抗体(Sigma-Aldrich社 Cat # A273)を用いて1時間、切片をインキュベーションした。ネガティブコントロール切片を非免疫性マウスIgG1抗体(Biostat Diagnostics社、Cat #093101)を用いて4ug/mlで、又は2.5%のNHS(「非一次」コントロール)中でインキュベーションした。
【0158】
TBS中で2×5分の洗浄に続いて、Vector ImmPress(商標)ユニバーサル抗体試薬(抗ウサギIgG及び抗マウスIgG試薬の混合物;Vector Labortories社、Cat #MP-7500)を用いて30分間、切片をインキュベーションした。次いで、切片を2×5分間、洗浄し、そしてジアミノベンジジン(DAB)基材を用いてインキュベーションし、適切な染色レベルに到達するまで監視した。スライドを希釈水中に浸漬することによって発色反応を停止させた。
【0159】
色素形成に続いて、ヘマトキシリンを用いて切片を対比染色し、濃度を順に上げたエタノール中(90−99−100%)で脱水し、二度変えたキシレン中で精製し、そしてDePeX下でカースリップした。
【0160】
結腸粘膜中でサイトケラチン免疫反応を示すアッセイコントロールを、ImmPress(商標)及び発色試薬を確認するために含ませた。二次抗体及び他の検定用試薬の非特異的結合を評価するために、「非一次」コントロールを含ませた。染色された切片を分析し、そしてLeica DFC290カメラを有するOlympus BX51顕微鏡を用いて、適切なデジタル画像を得た。
【0161】
免疫組織化学的に染色された細胞の写真が図6A〜6F及び図7A〜7Hに描かれている。サブユニットのアイソフォームの定量は本明細書に述べられ通りに成し遂げ得る。サンプル中のα1アイソフォームに対するα3アイソフォームの含有量比を求めたのに続いて、強心配糖体を用いた治療に対する治療応答の可能性に関して決定がなされる。
【0162】
上記は、本発明の特別な実施態様の詳細な記述である。本明細書において、本発明の特定の実施態様が説明目的で述べられているが、種々の修正 が、本発明の精神と範囲を逸脱することなくなされるであろうことが理解されるであろう。従って、本発明は添付された請求の範囲による場合を除いて、限定されるものではない。本明細書に開示されそして請求された全ての実施態様は、本開示を参照して、不当な実験設定なしに、なされ得てかつ実行され得る。
【特許請求の範囲】
【請求項1】
強心配糖体又は強心配糖体を含む組成物を用いる治療に対する、過剰な細胞増殖に関連した病因を有する疾病又は疾患のインビボの治療応答性を予測するために有用なインビトロの予後アッセイであって、
該アッセイが:
過剰な細胞増殖に関連した病因を有する疾病又は疾患を持つ対象物の疾病にかかったインビボの細胞組織から直接的に又は間接的に得られるサンプル中のNa、K−ATPアーゼのα−サブユニットのα1アイソフォームに対するα3アイソフォームの比を求めること、ここでサンプルはNa、K−ATPアーゼのαサブユニットの一つ又はそれ以上のアイソフォームを含む;及び
対象物が強心配糖体の治療上適切な用量を用いて治療されるとして、対象物における治療応答の確率を求めること;
を含むインビトロの予後アッセイ。
【請求項2】
もし、その比が少なくとも1以上であれば、細胞組織が強心配糖体を用いた治療に対して治療的に応答性であろうと予測することを更に含む請求項1に記載のアッセイ。
【請求項3】
もし、その比が0.5から1.0の範囲内であれば、細胞組織が強心配糖体を用いた治療に対して少なくとも部分的に治療的に応答性であろうと予測することを更に含む請求項1に記載のアッセイ。
【請求項4】
もし、その比が0.3未満であれば、細胞組織が強心配糖体を用いた治療に対して実質的に治療的に非応答性であろうと予測することを更に含む請求項1に記載のアッセイ。
【請求項5】
1から100の範囲内のα−サブユニットアイソフォーム比を有する疾病にかかった組織が、1未満のα−サブユニットアイソフォーム比を有するものよりも治療的により応答性であろうと予測することを更に含む請求項1に記載のアッセイ。
【請求項6】
検出できるα3アイソフォームのみを有し、そして検出できるα1アイソフォームを有しないそれらの組織が、強心配糖体に最も治療的に応答性であろうと予測することを更に含む請求項1に記載のアッセイ。
【請求項7】
もし、その比が2以上であれば、細胞組織が、強心配糖体を用いた治療に対して少なくとも部分的に治療的に応答性であろうと予測することを更に含む請求項1に記載のアッセイ。
【請求項8】
もし、その比が10以上であれば、細胞組織が、強心配糖体を用いた治療に対して治療的に少なくとも部分的に応答性であろうと予測することを更に含む請求項1に記載のアッセイ。
【請求項9】
もし、その比が25以上であれば、細胞組織が、強心配糖体を用いた治療に対して治療的に少なくとも部分的に応答性であろうと予測することを更に含む請求項1に記載のアッセイ。
【請求項10】
もし、その比が75以上であれば、細胞組織が、強心配糖体を用いた治療に対して治療的に少なくとも部分的に応答性であろうと予測することを更に含む請求項1に記載のアッセイ。
【請求項11】
少なくとも部分的な治療応答があるであろう確率が下表に記載のNa、K−ATPアーゼのα1アイソフォームに対するα3アイソフォームの比に関係している、請求項1に記載のアッセイ:
【表1】

【請求項12】
比を求める工程が、インビトロのサンプル又は生検標本中のNa、K−ATPアーゼのα3サブユニットアイソフォーム及びNa、K−ATPアーゼのα1サブユニットアイソフォーム各々の発現レベルを定量すること、並びにその比を計算することを含む、請求項1に記載のアッセイ。
【請求項13】
比を求める工程が、インビトロのサンプル中のNa、K−ATPアーゼのα1サブユニットアイソフォームの量に対する、Na、K−ATPアーゼの各α3サブユニットアイソフォームの量を求めること、並びにその比を計算することを含む、請求項1に記載のアッセイ。
【請求項14】
それから比が求められるデータについて統計解析を実行することを更に含む請求項1に記載のアッセイ。
【請求項15】
治療応答が完全な治療応答である、請求項1〜14の何れか1項に記載のアッセイ。
【請求項16】
サンプルが細胞組織、細胞の塊、細胞溶解物、これらから調製された膜標本、又はそれらの固定された組織病理学スライドである、請求項1〜14の何れか1項に記載のアッセイ。
【請求項17】
サンプルがインビトロのサンプルである、請求項1〜14の何れか1項に記載のアッセイ。
【請求項18】
サンプルが、少なくともNa、K−ATPアーゼのαサブユニットの二つのアイソフォームを含む、請求項1〜14の何れか1項に記載のアッセイ。
【請求項19】
サンプルが、少なくともNa、K−ATPアーゼのαサブユニットのα1及びα3アイソフォームを含む、請求項1〜14の何れか1項に記載のアッセイ。
【請求項20】
細胞、組織又は生検標本を溶解又は破壊すること;又はサンプルを形成するために、疾病にかかったインビボの細胞組織から組織病理学的検査のために組織切片を固定すること;を更に含む、請求項1〜14の何れか1項に記載のアッセイ。
【請求項21】
サンプル中のNa、K−ATPアーゼのα1サブユニットアイソフォームに対する、Na、K−ATPアーゼのα3サブユニットアイソフォームの量及び相対的発現を求めるために、サンプルについてウエスタンブロット法及び/又は免疫組織化学染色法を実施すること;及びその比を計算すること;を含む、請求項1〜14の何れか1項に記載のアッセイ。
【請求項22】
サンプル中のNa、K−ATPアーゼのα1サブユニットアイソフォームの含量に対する、Na、K−ATPアーゼのα3サブユニットアイソフォームの含量を求めるために、ゲルの放射分析又は濃度分析を行うことを含む、請求項1〜14及び21の何れか1項に記載のアッセイ。
【請求項23】
サンプル中のNa、K−ATPアーゼのα1サブユニットアイソフォームの及び、Na、K−ATPアーゼのα3サブユニットアイソフォームの存在を検出しそして含量を定量するために、ゲルの放射分析又は濃度分析を行うことを含む、請求項1〜14及び21の何れか1項に記載のアッセイ。
【請求項24】
ポジティブコントロールサンプル及び/又はネガティブコントロールサンプル中の、Na、K−ATPアーゼのα3サブユニットアイソフォームの及び/又はNa、K−ATPアーゼのα1サブユニットアイソフォームの含有量に対する、サンプル中のNa、K−ATPアーゼのα3サブユニットアイソフォームの及びNa、K−ATPアーゼのα1サブユニットアイソフォームの含有量を比較することを更に含む、請求項1〜14及び21の何れか1項に記載のアッセイ。
【請求項25】
コントロールとして、α3サブユニット及びα1サブユニットのただ一つの発現が生じることが知られている組織サンプル中の、Na、K−ATPアーゼのα3サブユニットアイソフォームの及びNa、K−ATPアーゼのα1サブユニットアイソフォームの含有量を比較することを更に含む、請求項1〜14及び21の何れか1項に記載のアッセイ。
【請求項26】
疾病にかかった細胞組織が、哺乳動物のような対象物から得られる、請求項1〜14の何れか1項に記載のアッセイ。
【請求項27】
疾病にかかった細胞組織が、商業的価値の有無に拘わらず、ヒト、牛、犬、猫、馬、豚又は他の家畜から得られる、請求項26記載のアッセイ。
【請求項28】
過剰な細胞増殖に関連した病因を有する疾病又は疾患が、癌若しくは腫瘍、又はヒト若しくは動物の生活の質に悪影響を及ぼす他の増殖性疾患である、請求項1〜14、21又は26の何れか1項に記載のアッセイ。
【請求項29】
癌又は腫瘍が、結腸直腸癌、頭頚部癌、副腎皮質癌、肛門癌、胆管癌、膀胱癌、骨癌、骨転移、骨肉腫、脳腫瘍、乳癌、子宮頸癌、非ホジキンリンパ腫、直腸癌、食道癌、目の癌、胆嚢癌、消化管カルチノイド腫瘍、妊娠性絨毛性疾患、ホジキン病、カポジ肉腫、腎癌、喉頭癌及び下咽頭癌、肝癌、肺癌(非小細胞癌及び小細胞癌の両方)、肺カルチノイド腫瘍、悪性中皮腫、転移性癌、多発性骨髄腫、骨髄異形成症候群、鼻腔癌及び副鼻腔癌、鼻咽頭癌、神経芽細胞腫、中枢神経系の新生物、口腔癌及び中咽頭癌、骨肉腫、卵巣癌、膵臓癌、陰茎癌、下垂体癌、前立腺癌、網膜芽細胞腫、唾液腺癌、肉腫、皮膚癌、胃癌、精巣癌、胸腺癌、甲状腺腫瘍、尿管癌;子宮肉腫、膣癌、外陰癌又はウィルムス腫瘍から成るグループから選ばれる、請求項28に記載のアッセイ。
【請求項30】
癌が、前立腺癌、肺癌、 乳癌、膀胱癌、イヌ骨肉腫(及び推測によってヒト骨肉腫)、ヒト脳腫瘍 (多形神経膠芽腫)及びヒト結腸癌から成るグループから選ばれる、請求項28項に記載のアッセイ。
【請求項31】
過剰な細胞増殖に関連した病因を有する疾病又は疾患を持つ対象物を同定すること:を更に含む、請求項1〜14、21、26又は28の何れか1項に記載のアッセイ。
【請求項32】
対象物から疾病にかかった細胞のサンプルを得ること:を更に含む、請求項31記載のアッセイ。
【請求項33】
Na、K−ATPアーゼのα−サブユニットのα1アイソフォーム及びα3アイソフォームに対する分析を如何に実行するかを特定する情報を更に含む、請求項1〜14、21、26、28、31又は32の何れか1項に記載のアッセイ。
【請求項34】
予後データを如何に解釈するかを詳細に示す情報を更に含む、請求項1〜14、21、26、28、31、32又は33の何れか1項に記載のアッセイ。
【請求項35】
過剰な細胞増殖に関連した病因を有する疾病又は疾患が、1)抗原誘発性の関節炎及びアレルギー性脳脊髄炎などの自己免疫疾患; 2)関節リュウマチ、全身発症型若年性慢性関節炎、骨粗鬆症及び乾癬などの慢性炎症性増殖性疾患; 3)線維嚢胞性疾患を含む乳房の増殖性疾患; 4)良性前立腺肥大症(BPH)を含む前立腺の増殖性疾患;5)増殖性糖尿病性網膜症を含む目の増殖性疾患;及び6)アテローム性動脈硬化症及び冠動脈狭窄を含む血管増殖性疾患から成るグループから選ばれる、請求項1〜14、21又は26の何れか1項に記載のアッセイ。
【請求項36】
植物若しくは動物源の抽出を通して得られるもの、合成されるもの又は入手可能な強心配糖体の化学的改質を通して製造されるものかに拘わらず、強心配糖体が純粋な形態で存在する、請求項1〜14、21、26、28又は35の何れか1項に記載のアッセイ。
【請求項37】
強心配糖体が抽出物中に存在する、請求項36に記載のアッセイ。
【請求項38】
強心配糖体抽出物が、場合によりモディファイヤーの存在下で、超臨界流体(SCF)抽出によって製造された、請求項37に記載のアッセイ。
【請求項39】
SCF抽出物が、強心配糖体とは別に、少なくとも一つの他の薬理学的活性剤を更に含む、請求項38に記載のアッセイ。
【請求項40】
抽出物が対象物に投与されるときに、他の活性剤が強心配糖体の治療効果に寄与し得る、請求項39に記載のアッセイ。
【請求項41】
他の活性剤が、強心配糖体の治療効果に寄与するために追加的に又は相乗的に機能する、請求項40に記載のアッセイ。
【請求項42】
強心配糖体が製剤処方又は製剤組成物中に存在する、請求項36〜40又は41の何れか1項に記載のアッセイ。
【請求項43】
強心配糖体が、オレアンドリン、ウアバイン、ブファリン、ジギトキシン、ジゴキシン、シノブファタリン、シノブファギン及びレジブフォゲニンから成るグループから選ばれる、請求項36〜40又は41の何れか1項に記載のアッセイ。
【請求項44】
強心配糖体がセイヨウキョウチクトウ植物群から得られる、請求項36〜40又は41の何れか1項に記載のアッセイ。
【請求項45】
セイヨウキョウチクトウ植物群が、ネリウム オレアンダーなどのネリウム種、又はテベティア ネリフオリアなどのテベティア種を含む、請求項44に記載のアッセイ。
【請求項46】
抽出物がヒキガエルの皮膚又はそれから由来する分泌物から得られる、請求項36〜40又は41の何れか1項に記載のアッセイ。
【請求項47】
キットが:
a)Na、K−ATPアーゼのα3サブユニットアイソフォームに対する結合親和性を有する第一の一次抗体;及び
b)Na、K−ATPアーゼのα1サブユニットアイソフォームに対する結合親和性を有する第二の一次抗体;
を含む、予後アッセイを実行する際に使用するのに適しているキット。
【請求項48】
キットが、ウエスタンブロットゲル電気泳動分析を実施する際の使用に適応され、又はキットが、免疫組織化学染色法を実施するために適応される、請求項47に記載のキット。
【請求項49】
請求項47又は48に記載のキットであって:
a)溶解組成物;
b)Na、K−ATPアーゼのα3サブユニットアイソフォームを含むポジティブコントロールサンプル;
c)Na、K−ATPアーゼのα3サブユニットアイソフォーム及びNa、K−ATPアーゼのα1サブユニットアイソフォームを含むポジティブコントロールサンプル;
d)Na、K−ATPアーゼのα1サブユニットアイソフォームを含み、そしてNa、K−ATPアーゼのα3サブユニットアイソフォームを含まないネガティブコントロールサンプル;
e)第二抗体、ヤギの抗マウスIgG−HRP(これは、例えば、関心ある蛋白質の可視化のために使用され得る);
f)ゲル電気泳動分析に適しているゲル形成材料;
g)放射線標識マーカー;
h)キットの使用及び予後アッセイの性能に対する指示;
i)濃度計及び線量計;
j)水系液体培地;
k)ゲル/膜製造キット;
l)ブロッキング溶液;
m)洗浄緩衝液;
n)ウェスタンブロット解析キットを含む材料;又は
o)それらの組み合わせ;
を更に含むキット。
【請求項50】
第一の一次抗体がNa、K−ATPアーゼのα3サブユニットアイソフォームに対して特異的結合親和性を有する、請求項47〜49の何れか1項に記載のキット。
【請求項51】
第二の一次抗体がNa、K−ATPアーゼのα1サブユニットアイソフォームに対して特異的結合親和性を有する、請求項47〜50の何れか1項に記載のキット。
【請求項52】
第二抗体がヤギαマウスIgG西洋ワサビペルオキシダーゼであり、又は西洋ワサビペルオキシダーゼのような適切なマーカーを付けられたマウスIgGに抗して産生されたマウス以外の種からの他の第二抗体を含む、請求項47〜51の何れか1項に記載のキット。
【請求項53】
一次抗体がモノクロナール抗体である、請求項47〜52の何れか1項に記載のキット。
【請求項54】
ポジティブコントロールサンプルが、生検又は他の外科的切除手段を通して得ることができる組織、細胞の塊、細胞溶解物、及びこれらから調製された膜標本から成るグループから選ばれる、請求項49〜53の何れか1項に記載のアッセイ。
【請求項55】
ネガティブコントロールサンプルが、組織、細胞の塊、細胞溶解物、及びNa、K−ATPアーゼのα−サブユニットのα3アイソフォームを含まない、これらから調製された膜標本から成るグループから選ばれる、請求項49〜54の何れか1項に記載のアッセイ。
【請求項56】
ネガティブコントロールが、インビトロで成長させた齧歯動物(マウス若しくはラット)の腫瘍組織又はマウス又はラットの細胞の塊を含む、請求項55に記載のアッセイ。
【請求項57】
相対的なNa、K−ATPアーゼのα−サブユニット組成及びアイソフォーム比を決定する代替手段を含み、ここで代替手段が:ELISA(酵素結合免疫吸着法)における抗体又は蛋白質組織又は細胞溶解物配列の使用;異なるNa、K−ATPアーゼサブユニットアイソフォームに対するmRNAの測定のためのノーザンブロット分析及び関連技法(例えば、rtPCR)の使用;又は免疫組織化学染色法の使用;を含む、請求項1〜56の何れか1項に記載の発明。
【請求項58】
過剰な細胞増殖に関連した病因を有する疾病又は疾患を、強心配糖体を含む組成物を用いて、対象物において治療する方法であって、該方法が:
a)過剰な細胞増殖に関連した病因を有する疾病又は疾患を持つ対象物の疾病にかかったインビボの細胞組織から直接的に又は間接的に得られるサンプル中のNa、K−ATPアーゼのα−サブユニットのα1アイソフォームに対するα3アイソフォームの比を求めること、ここでサンプルはNa、K−ATPアーゼのαサブユニットの一つ又はそれ以上のアイソフォームを含む;及び
b)もし、比が0.3以上であれば、強心配糖体を含む組成物の投与を対象物に指示すること;
を含む方法。
【請求項59】
過剰な細胞増殖に関連した病因を有する疾病又は疾患を、強心配糖体を含む組成物を用いて、対象物において治療する方法であって、該方法が:
a)対象物から疾病にかかった組織のサンプルを得ること、ここで疾病は過剰な細胞増殖に関連した病因を有し、そしてサンプルはNa、K−ATPアーゼのα−サブユニットの一つ又はそれ以上のアイソフォームを含む;
b)サンプル中のNa、K−ATPアーゼのα−サブユニットのα1アイソフォームに対するα3アイソフォームの比が求められるよう要求すること;及び
c)もし、比が0.3以上であれば、強心配糖体を含む組成物の投与を対象物に指示すること;
を含む方法。
【請求項60】
対象物が強心配糖体を含む組成物の治療上適切な用量を処方されそして投与される、請求項58又は59に記載の方法。
【請求項61】
所定の投与処方に従って、対象物が強心配糖体を含む組成物を投与される、請求項60に記載の方法。
【請求項62】
対象物が強心配糖体を含む抽出物を含む組成物を投与される、請求項61に記載の方法。
【請求項63】
抽出物が一つ又はそれ以上の他の治療的に有効な成分を更に含む、請求項62に記載の方法。
【請求項64】
組成物が一つ又はそれ以上の他の治療的に有効な成分を更に含む、請求項58〜63の何れか1項に記載の方法。
【請求項65】
対象物が強心配糖体を含む植物又は動物源の熱水抽出物を投与される、請求項58〜64の何れか1項に記載の方法。
【請求項66】
対象物が一日当たり2mgから22.5mgの強心配糖体を投与される、請求項65に記載の方法。
【請求項67】
対象物が一日当たり0.6mgから4.8mgの強心配糖体を含む植物又は動物源の超臨界流体抽出物を投与される、請求項58〜64の何れか1項に記載の方法。
【請求項68】
対象物が一日当たり10mgから500μgの強心配糖体を含む組成物を投与される、請求項58〜64の何れか1項に記載の方法。
【請求項69】
過剰な細胞増殖に関連した病因を有する疾病又は疾患が、そのような疾病又は疾患を有する対象物において、強心配糖体又物を用いる治療に対して、少なくとも部分的に治療応答性であろう確率を求める方法であって、その方法が:
a)対象物の疾病にかかった細胞組織から直接的に又は間接的に得られるサンプル中のNa、K−ATPアーゼのα−サブユニットのα1アイソフォームに対するα3アイソフォームの比を求めること、ここでサンプルはNa、K−ATPアーゼのαサブユニットの一つ又はそれ以上のアイソフォームを含む;及び
b)対象物が強心配糖体の治療上適切な用量を用いて治療されるとして、対象物における治療応答の確率を求めること;ここで少なくとも部分的な治療応答がある確率が下表に記載のNa、K−ATPアーゼのα1アイソフォームに対するα3アイソフォームの比に関係している、
を含む。
【表2】

【請求項70】
比を求める工程が、インビトロのサンプル又は生検標本中のNa、K−ATPアーゼのα3サブユニットアイソフォーム及びNa、K−ATPアーゼのα1サブユニットアイソフォーム各々の発現レベルを定量すること、並びにその比を計算することを含む、請求項69に記載の方法。
【請求項71】
それから比が求められるデータについて統計解析を実行することを更に含む、請求項70に記載の方法。
【請求項72】
細胞、組織又は生検標本を溶解又は破壊すること;又はサンプルを形成するために、疾病にかかったインビボの細胞組織から組織病理学的検査のために組織切片を固定すること;を更に含む、請求項71に記載の方法。
【請求項73】
サンプル中のNa、K−ATPアーゼのα3サブユニットアイソフォームの、及びNa、K−ATPアーゼのα1サブユニットアイソフォームの量及び相対的発現を求めるために、サンプルについてウエスタンブロット法又は免疫組織化学染色法を実施すること;及びその比を計算すること;を含む、請求項72に記載の方法。
【請求項74】
ポジティブコントロールサンプル及び/又はネガティブコントロールサンプル中の、Na、K−ATPアーゼのα3サブユニットアイソフォームの及び/又はNa、K−ATPアーゼのα1サブユニットアイソフォームの含有量に対する、サンプル中のNa、K−ATPアーゼのα3サブユニットアイソフォームの及びNa、K−ATPアーゼのα1サブユニットアイソフォームの含有量を比較することを更に含む、請求項73に記載の方法。
【請求項75】
過剰な細胞増殖に関連した病因を有する疾病又は疾患を持つ対象物を同定すること:を更に含む、請求項74に記載の方法。
【請求項76】
対象物から疾病にかかった細胞のサンプルを得ること:を更に含む、請求項75に記載の方法。
【請求項77】
Na、K−ATPアーゼのα−サブユニットのα1アイソフォーム及びα3アイソフォームに対する分析を如何に実行するかを特定する情報を供することを更に含む、請求項76に記載の方法。
【請求項78】
予後データを如何に解釈するかを詳細に示す情報を供することを更に含む、請求項77に記載の方法。
【請求項79】
ウエスタンブロット法が:
a)Na、K−ATPアーゼのα3サブユニットアイソフォームに対する結合親和性を有する第一の一次抗体;及び
b)Na、K−ATPアーゼのα1サブユニットアイソフォームに対する結合親和性を有する第二の一次抗体;
を含む、請求項73に記載の方法。
【請求項80】
請求項74に記載の方法であって:
サンプル中のNa、K−ATPアーゼのα3サブユニットアイソフォームの含量、及びNa、K−ATPアーゼのα1サブユニットアイソフォームの含量を求めるために、ゲルの放射分析又は濃度分析を行うこと含む;及び
サンプル中に存在するα1アイソフォームに対するα3アイソフォームの比を求めること;
を含む方法。
【請求項81】
請求項73に記載の方法であって、ここで免疫組織化学染色法が:
a)抗原アンマスキング溶液;
b)緩衝液;
c)内因性ペルオキシド活性のクエンチング物質;
d)抗Na、K−ATPアーゼのα3サブユニットアイソフォーム抗体、及び抗Na、K−ATPアーゼのα1サブユニットアイソフォーム抗体;
e)非免疫性マウスIgGI抗体;
f)抗ウサギIgG及び抗マウスIgGの試薬の混合物を含むユニバーサル抗体試薬;
g)主要な化学的染色剤;
h)一般的な化学的でない染色剤;
i)特定細胞小器官染色剤;又は
j)それらの二つ又はそれ以上の組み合わせ;
を含む方法。
【請求項82】
請求項81に記載の方法であって:
a)哺乳動物の組織のサンプルを供すること;
b)サンプル中に存在するNa、K−ATPアーゼのα−サブユニットのα3アイソフォーム及びα1アイソフォームを免疫化学的に染色すること;
c)サンプル中のNa、K−ATPアーゼのα3アイソフォームの含有量及びNa、K−ATPアーゼのα1アイソフォームの含有量を求めること;及び
d)サンプル中に存在するα1アイソフォームに対するα3アイソフォームの比を求めること;
を含む方法。
【請求項83】
請求項69、73、79又は81の何れか1項に記載の方法であって、ここで過剰な細胞増殖に関連した病因を有する疾病又は疾患が、1)抗原誘発性の関節炎及びアレルギー性脳脊髄炎などの自己免疫疾患;2)関節リュウマチ、全身発症型若年性慢性関節炎、骨粗鬆症及び乾癬などの慢性炎症性増殖性疾患;3)線維嚢胞性疾患を含む乳房の増殖性疾患;4)良性前立腺肥大症(BPH)を含む前立腺の増殖性疾患;5)増殖性糖尿病性網膜症を含む目の増殖性疾患;6)アテローム性動脈硬化症及び冠動脈狭窄を含む血管増殖性疾患;7)癌;及び/又は8)腫瘍;から成るグループから選ばれる方法。
【請求項84】
強心配糖体が、オレアンドリン、ウアバイン、ブファリン、ジギトキシン、ジゴキシン、シノブファタリン、シノブファギン及びレジブフォゲニンから成るグループから選ばれる、請求項83に記載の方法。
【請求項1】
強心配糖体又は強心配糖体を含む組成物を用いる治療に対する、過剰な細胞増殖に関連した病因を有する疾病又は疾患のインビボの治療応答性を予測するために有用なインビトロの予後アッセイであって、
該アッセイが:
過剰な細胞増殖に関連した病因を有する疾病又は疾患を持つ対象物の疾病にかかったインビボの細胞組織から直接的に又は間接的に得られるサンプル中のNa、K−ATPアーゼのα−サブユニットのα1アイソフォームに対するα3アイソフォームの比を求めること、ここでサンプルはNa、K−ATPアーゼのαサブユニットの一つ又はそれ以上のアイソフォームを含む;及び
対象物が強心配糖体の治療上適切な用量を用いて治療されるとして、対象物における治療応答の確率を求めること;
を含むインビトロの予後アッセイ。
【請求項2】
もし、その比が少なくとも1以上であれば、細胞組織が強心配糖体を用いた治療に対して治療的に応答性であろうと予測することを更に含む請求項1に記載のアッセイ。
【請求項3】
もし、その比が0.5から1.0の範囲内であれば、細胞組織が強心配糖体を用いた治療に対して少なくとも部分的に治療的に応答性であろうと予測することを更に含む請求項1に記載のアッセイ。
【請求項4】
もし、その比が0.3未満であれば、細胞組織が強心配糖体を用いた治療に対して実質的に治療的に非応答性であろうと予測することを更に含む請求項1に記載のアッセイ。
【請求項5】
1から100の範囲内のα−サブユニットアイソフォーム比を有する疾病にかかった組織が、1未満のα−サブユニットアイソフォーム比を有するものよりも治療的により応答性であろうと予測することを更に含む請求項1に記載のアッセイ。
【請求項6】
検出できるα3アイソフォームのみを有し、そして検出できるα1アイソフォームを有しないそれらの組織が、強心配糖体に最も治療的に応答性であろうと予測することを更に含む請求項1に記載のアッセイ。
【請求項7】
もし、その比が2以上であれば、細胞組織が、強心配糖体を用いた治療に対して少なくとも部分的に治療的に応答性であろうと予測することを更に含む請求項1に記載のアッセイ。
【請求項8】
もし、その比が10以上であれば、細胞組織が、強心配糖体を用いた治療に対して治療的に少なくとも部分的に応答性であろうと予測することを更に含む請求項1に記載のアッセイ。
【請求項9】
もし、その比が25以上であれば、細胞組織が、強心配糖体を用いた治療に対して治療的に少なくとも部分的に応答性であろうと予測することを更に含む請求項1に記載のアッセイ。
【請求項10】
もし、その比が75以上であれば、細胞組織が、強心配糖体を用いた治療に対して治療的に少なくとも部分的に応答性であろうと予測することを更に含む請求項1に記載のアッセイ。
【請求項11】
少なくとも部分的な治療応答があるであろう確率が下表に記載のNa、K−ATPアーゼのα1アイソフォームに対するα3アイソフォームの比に関係している、請求項1に記載のアッセイ:
【表1】

【請求項12】
比を求める工程が、インビトロのサンプル又は生検標本中のNa、K−ATPアーゼのα3サブユニットアイソフォーム及びNa、K−ATPアーゼのα1サブユニットアイソフォーム各々の発現レベルを定量すること、並びにその比を計算することを含む、請求項1に記載のアッセイ。
【請求項13】
比を求める工程が、インビトロのサンプル中のNa、K−ATPアーゼのα1サブユニットアイソフォームの量に対する、Na、K−ATPアーゼの各α3サブユニットアイソフォームの量を求めること、並びにその比を計算することを含む、請求項1に記載のアッセイ。
【請求項14】
それから比が求められるデータについて統計解析を実行することを更に含む請求項1に記載のアッセイ。
【請求項15】
治療応答が完全な治療応答である、請求項1〜14の何れか1項に記載のアッセイ。
【請求項16】
サンプルが細胞組織、細胞の塊、細胞溶解物、これらから調製された膜標本、又はそれらの固定された組織病理学スライドである、請求項1〜14の何れか1項に記載のアッセイ。
【請求項17】
サンプルがインビトロのサンプルである、請求項1〜14の何れか1項に記載のアッセイ。
【請求項18】
サンプルが、少なくともNa、K−ATPアーゼのαサブユニットの二つのアイソフォームを含む、請求項1〜14の何れか1項に記載のアッセイ。
【請求項19】
サンプルが、少なくともNa、K−ATPアーゼのαサブユニットのα1及びα3アイソフォームを含む、請求項1〜14の何れか1項に記載のアッセイ。
【請求項20】
細胞、組織又は生検標本を溶解又は破壊すること;又はサンプルを形成するために、疾病にかかったインビボの細胞組織から組織病理学的検査のために組織切片を固定すること;を更に含む、請求項1〜14の何れか1項に記載のアッセイ。
【請求項21】
サンプル中のNa、K−ATPアーゼのα1サブユニットアイソフォームに対する、Na、K−ATPアーゼのα3サブユニットアイソフォームの量及び相対的発現を求めるために、サンプルについてウエスタンブロット法及び/又は免疫組織化学染色法を実施すること;及びその比を計算すること;を含む、請求項1〜14の何れか1項に記載のアッセイ。
【請求項22】
サンプル中のNa、K−ATPアーゼのα1サブユニットアイソフォームの含量に対する、Na、K−ATPアーゼのα3サブユニットアイソフォームの含量を求めるために、ゲルの放射分析又は濃度分析を行うことを含む、請求項1〜14及び21の何れか1項に記載のアッセイ。
【請求項23】
サンプル中のNa、K−ATPアーゼのα1サブユニットアイソフォームの及び、Na、K−ATPアーゼのα3サブユニットアイソフォームの存在を検出しそして含量を定量するために、ゲルの放射分析又は濃度分析を行うことを含む、請求項1〜14及び21の何れか1項に記載のアッセイ。
【請求項24】
ポジティブコントロールサンプル及び/又はネガティブコントロールサンプル中の、Na、K−ATPアーゼのα3サブユニットアイソフォームの及び/又はNa、K−ATPアーゼのα1サブユニットアイソフォームの含有量に対する、サンプル中のNa、K−ATPアーゼのα3サブユニットアイソフォームの及びNa、K−ATPアーゼのα1サブユニットアイソフォームの含有量を比較することを更に含む、請求項1〜14及び21の何れか1項に記載のアッセイ。
【請求項25】
コントロールとして、α3サブユニット及びα1サブユニットのただ一つの発現が生じることが知られている組織サンプル中の、Na、K−ATPアーゼのα3サブユニットアイソフォームの及びNa、K−ATPアーゼのα1サブユニットアイソフォームの含有量を比較することを更に含む、請求項1〜14及び21の何れか1項に記載のアッセイ。
【請求項26】
疾病にかかった細胞組織が、哺乳動物のような対象物から得られる、請求項1〜14の何れか1項に記載のアッセイ。
【請求項27】
疾病にかかった細胞組織が、商業的価値の有無に拘わらず、ヒト、牛、犬、猫、馬、豚又は他の家畜から得られる、請求項26記載のアッセイ。
【請求項28】
過剰な細胞増殖に関連した病因を有する疾病又は疾患が、癌若しくは腫瘍、又はヒト若しくは動物の生活の質に悪影響を及ぼす他の増殖性疾患である、請求項1〜14、21又は26の何れか1項に記載のアッセイ。
【請求項29】
癌又は腫瘍が、結腸直腸癌、頭頚部癌、副腎皮質癌、肛門癌、胆管癌、膀胱癌、骨癌、骨転移、骨肉腫、脳腫瘍、乳癌、子宮頸癌、非ホジキンリンパ腫、直腸癌、食道癌、目の癌、胆嚢癌、消化管カルチノイド腫瘍、妊娠性絨毛性疾患、ホジキン病、カポジ肉腫、腎癌、喉頭癌及び下咽頭癌、肝癌、肺癌(非小細胞癌及び小細胞癌の両方)、肺カルチノイド腫瘍、悪性中皮腫、転移性癌、多発性骨髄腫、骨髄異形成症候群、鼻腔癌及び副鼻腔癌、鼻咽頭癌、神経芽細胞腫、中枢神経系の新生物、口腔癌及び中咽頭癌、骨肉腫、卵巣癌、膵臓癌、陰茎癌、下垂体癌、前立腺癌、網膜芽細胞腫、唾液腺癌、肉腫、皮膚癌、胃癌、精巣癌、胸腺癌、甲状腺腫瘍、尿管癌;子宮肉腫、膣癌、外陰癌又はウィルムス腫瘍から成るグループから選ばれる、請求項28に記載のアッセイ。
【請求項30】
癌が、前立腺癌、肺癌、 乳癌、膀胱癌、イヌ骨肉腫(及び推測によってヒト骨肉腫)、ヒト脳腫瘍 (多形神経膠芽腫)及びヒト結腸癌から成るグループから選ばれる、請求項28項に記載のアッセイ。
【請求項31】
過剰な細胞増殖に関連した病因を有する疾病又は疾患を持つ対象物を同定すること:を更に含む、請求項1〜14、21、26又は28の何れか1項に記載のアッセイ。
【請求項32】
対象物から疾病にかかった細胞のサンプルを得ること:を更に含む、請求項31記載のアッセイ。
【請求項33】
Na、K−ATPアーゼのα−サブユニットのα1アイソフォーム及びα3アイソフォームに対する分析を如何に実行するかを特定する情報を更に含む、請求項1〜14、21、26、28、31又は32の何れか1項に記載のアッセイ。
【請求項34】
予後データを如何に解釈するかを詳細に示す情報を更に含む、請求項1〜14、21、26、28、31、32又は33の何れか1項に記載のアッセイ。
【請求項35】
過剰な細胞増殖に関連した病因を有する疾病又は疾患が、1)抗原誘発性の関節炎及びアレルギー性脳脊髄炎などの自己免疫疾患; 2)関節リュウマチ、全身発症型若年性慢性関節炎、骨粗鬆症及び乾癬などの慢性炎症性増殖性疾患; 3)線維嚢胞性疾患を含む乳房の増殖性疾患; 4)良性前立腺肥大症(BPH)を含む前立腺の増殖性疾患;5)増殖性糖尿病性網膜症を含む目の増殖性疾患;及び6)アテローム性動脈硬化症及び冠動脈狭窄を含む血管増殖性疾患から成るグループから選ばれる、請求項1〜14、21又は26の何れか1項に記載のアッセイ。
【請求項36】
植物若しくは動物源の抽出を通して得られるもの、合成されるもの又は入手可能な強心配糖体の化学的改質を通して製造されるものかに拘わらず、強心配糖体が純粋な形態で存在する、請求項1〜14、21、26、28又は35の何れか1項に記載のアッセイ。
【請求項37】
強心配糖体が抽出物中に存在する、請求項36に記載のアッセイ。
【請求項38】
強心配糖体抽出物が、場合によりモディファイヤーの存在下で、超臨界流体(SCF)抽出によって製造された、請求項37に記載のアッセイ。
【請求項39】
SCF抽出物が、強心配糖体とは別に、少なくとも一つの他の薬理学的活性剤を更に含む、請求項38に記載のアッセイ。
【請求項40】
抽出物が対象物に投与されるときに、他の活性剤が強心配糖体の治療効果に寄与し得る、請求項39に記載のアッセイ。
【請求項41】
他の活性剤が、強心配糖体の治療効果に寄与するために追加的に又は相乗的に機能する、請求項40に記載のアッセイ。
【請求項42】
強心配糖体が製剤処方又は製剤組成物中に存在する、請求項36〜40又は41の何れか1項に記載のアッセイ。
【請求項43】
強心配糖体が、オレアンドリン、ウアバイン、ブファリン、ジギトキシン、ジゴキシン、シノブファタリン、シノブファギン及びレジブフォゲニンから成るグループから選ばれる、請求項36〜40又は41の何れか1項に記載のアッセイ。
【請求項44】
強心配糖体がセイヨウキョウチクトウ植物群から得られる、請求項36〜40又は41の何れか1項に記載のアッセイ。
【請求項45】
セイヨウキョウチクトウ植物群が、ネリウム オレアンダーなどのネリウム種、又はテベティア ネリフオリアなどのテベティア種を含む、請求項44に記載のアッセイ。
【請求項46】
抽出物がヒキガエルの皮膚又はそれから由来する分泌物から得られる、請求項36〜40又は41の何れか1項に記載のアッセイ。
【請求項47】
キットが:
a)Na、K−ATPアーゼのα3サブユニットアイソフォームに対する結合親和性を有する第一の一次抗体;及び
b)Na、K−ATPアーゼのα1サブユニットアイソフォームに対する結合親和性を有する第二の一次抗体;
を含む、予後アッセイを実行する際に使用するのに適しているキット。
【請求項48】
キットが、ウエスタンブロットゲル電気泳動分析を実施する際の使用に適応され、又はキットが、免疫組織化学染色法を実施するために適応される、請求項47に記載のキット。
【請求項49】
請求項47又は48に記載のキットであって:
a)溶解組成物;
b)Na、K−ATPアーゼのα3サブユニットアイソフォームを含むポジティブコントロールサンプル;
c)Na、K−ATPアーゼのα3サブユニットアイソフォーム及びNa、K−ATPアーゼのα1サブユニットアイソフォームを含むポジティブコントロールサンプル;
d)Na、K−ATPアーゼのα1サブユニットアイソフォームを含み、そしてNa、K−ATPアーゼのα3サブユニットアイソフォームを含まないネガティブコントロールサンプル;
e)第二抗体、ヤギの抗マウスIgG−HRP(これは、例えば、関心ある蛋白質の可視化のために使用され得る);
f)ゲル電気泳動分析に適しているゲル形成材料;
g)放射線標識マーカー;
h)キットの使用及び予後アッセイの性能に対する指示;
i)濃度計及び線量計;
j)水系液体培地;
k)ゲル/膜製造キット;
l)ブロッキング溶液;
m)洗浄緩衝液;
n)ウェスタンブロット解析キットを含む材料;又は
o)それらの組み合わせ;
を更に含むキット。
【請求項50】
第一の一次抗体がNa、K−ATPアーゼのα3サブユニットアイソフォームに対して特異的結合親和性を有する、請求項47〜49の何れか1項に記載のキット。
【請求項51】
第二の一次抗体がNa、K−ATPアーゼのα1サブユニットアイソフォームに対して特異的結合親和性を有する、請求項47〜50の何れか1項に記載のキット。
【請求項52】
第二抗体がヤギαマウスIgG西洋ワサビペルオキシダーゼであり、又は西洋ワサビペルオキシダーゼのような適切なマーカーを付けられたマウスIgGに抗して産生されたマウス以外の種からの他の第二抗体を含む、請求項47〜51の何れか1項に記載のキット。
【請求項53】
一次抗体がモノクロナール抗体である、請求項47〜52の何れか1項に記載のキット。
【請求項54】
ポジティブコントロールサンプルが、生検又は他の外科的切除手段を通して得ることができる組織、細胞の塊、細胞溶解物、及びこれらから調製された膜標本から成るグループから選ばれる、請求項49〜53の何れか1項に記載のアッセイ。
【請求項55】
ネガティブコントロールサンプルが、組織、細胞の塊、細胞溶解物、及びNa、K−ATPアーゼのα−サブユニットのα3アイソフォームを含まない、これらから調製された膜標本から成るグループから選ばれる、請求項49〜54の何れか1項に記載のアッセイ。
【請求項56】
ネガティブコントロールが、インビトロで成長させた齧歯動物(マウス若しくはラット)の腫瘍組織又はマウス又はラットの細胞の塊を含む、請求項55に記載のアッセイ。
【請求項57】
相対的なNa、K−ATPアーゼのα−サブユニット組成及びアイソフォーム比を決定する代替手段を含み、ここで代替手段が:ELISA(酵素結合免疫吸着法)における抗体又は蛋白質組織又は細胞溶解物配列の使用;異なるNa、K−ATPアーゼサブユニットアイソフォームに対するmRNAの測定のためのノーザンブロット分析及び関連技法(例えば、rtPCR)の使用;又は免疫組織化学染色法の使用;を含む、請求項1〜56の何れか1項に記載の発明。
【請求項58】
過剰な細胞増殖に関連した病因を有する疾病又は疾患を、強心配糖体を含む組成物を用いて、対象物において治療する方法であって、該方法が:
a)過剰な細胞増殖に関連した病因を有する疾病又は疾患を持つ対象物の疾病にかかったインビボの細胞組織から直接的に又は間接的に得られるサンプル中のNa、K−ATPアーゼのα−サブユニットのα1アイソフォームに対するα3アイソフォームの比を求めること、ここでサンプルはNa、K−ATPアーゼのαサブユニットの一つ又はそれ以上のアイソフォームを含む;及び
b)もし、比が0.3以上であれば、強心配糖体を含む組成物の投与を対象物に指示すること;
を含む方法。
【請求項59】
過剰な細胞増殖に関連した病因を有する疾病又は疾患を、強心配糖体を含む組成物を用いて、対象物において治療する方法であって、該方法が:
a)対象物から疾病にかかった組織のサンプルを得ること、ここで疾病は過剰な細胞増殖に関連した病因を有し、そしてサンプルはNa、K−ATPアーゼのα−サブユニットの一つ又はそれ以上のアイソフォームを含む;
b)サンプル中のNa、K−ATPアーゼのα−サブユニットのα1アイソフォームに対するα3アイソフォームの比が求められるよう要求すること;及び
c)もし、比が0.3以上であれば、強心配糖体を含む組成物の投与を対象物に指示すること;
を含む方法。
【請求項60】
対象物が強心配糖体を含む組成物の治療上適切な用量を処方されそして投与される、請求項58又は59に記載の方法。
【請求項61】
所定の投与処方に従って、対象物が強心配糖体を含む組成物を投与される、請求項60に記載の方法。
【請求項62】
対象物が強心配糖体を含む抽出物を含む組成物を投与される、請求項61に記載の方法。
【請求項63】
抽出物が一つ又はそれ以上の他の治療的に有効な成分を更に含む、請求項62に記載の方法。
【請求項64】
組成物が一つ又はそれ以上の他の治療的に有効な成分を更に含む、請求項58〜63の何れか1項に記載の方法。
【請求項65】
対象物が強心配糖体を含む植物又は動物源の熱水抽出物を投与される、請求項58〜64の何れか1項に記載の方法。
【請求項66】
対象物が一日当たり2mgから22.5mgの強心配糖体を投与される、請求項65に記載の方法。
【請求項67】
対象物が一日当たり0.6mgから4.8mgの強心配糖体を含む植物又は動物源の超臨界流体抽出物を投与される、請求項58〜64の何れか1項に記載の方法。
【請求項68】
対象物が一日当たり10mgから500μgの強心配糖体を含む組成物を投与される、請求項58〜64の何れか1項に記載の方法。
【請求項69】
過剰な細胞増殖に関連した病因を有する疾病又は疾患が、そのような疾病又は疾患を有する対象物において、強心配糖体又物を用いる治療に対して、少なくとも部分的に治療応答性であろう確率を求める方法であって、その方法が:
a)対象物の疾病にかかった細胞組織から直接的に又は間接的に得られるサンプル中のNa、K−ATPアーゼのα−サブユニットのα1アイソフォームに対するα3アイソフォームの比を求めること、ここでサンプルはNa、K−ATPアーゼのαサブユニットの一つ又はそれ以上のアイソフォームを含む;及び
b)対象物が強心配糖体の治療上適切な用量を用いて治療されるとして、対象物における治療応答の確率を求めること;ここで少なくとも部分的な治療応答がある確率が下表に記載のNa、K−ATPアーゼのα1アイソフォームに対するα3アイソフォームの比に関係している、
を含む。
【表2】

【請求項70】
比を求める工程が、インビトロのサンプル又は生検標本中のNa、K−ATPアーゼのα3サブユニットアイソフォーム及びNa、K−ATPアーゼのα1サブユニットアイソフォーム各々の発現レベルを定量すること、並びにその比を計算することを含む、請求項69に記載の方法。
【請求項71】
それから比が求められるデータについて統計解析を実行することを更に含む、請求項70に記載の方法。
【請求項72】
細胞、組織又は生検標本を溶解又は破壊すること;又はサンプルを形成するために、疾病にかかったインビボの細胞組織から組織病理学的検査のために組織切片を固定すること;を更に含む、請求項71に記載の方法。
【請求項73】
サンプル中のNa、K−ATPアーゼのα3サブユニットアイソフォームの、及びNa、K−ATPアーゼのα1サブユニットアイソフォームの量及び相対的発現を求めるために、サンプルについてウエスタンブロット法又は免疫組織化学染色法を実施すること;及びその比を計算すること;を含む、請求項72に記載の方法。
【請求項74】
ポジティブコントロールサンプル及び/又はネガティブコントロールサンプル中の、Na、K−ATPアーゼのα3サブユニットアイソフォームの及び/又はNa、K−ATPアーゼのα1サブユニットアイソフォームの含有量に対する、サンプル中のNa、K−ATPアーゼのα3サブユニットアイソフォームの及びNa、K−ATPアーゼのα1サブユニットアイソフォームの含有量を比較することを更に含む、請求項73に記載の方法。
【請求項75】
過剰な細胞増殖に関連した病因を有する疾病又は疾患を持つ対象物を同定すること:を更に含む、請求項74に記載の方法。
【請求項76】
対象物から疾病にかかった細胞のサンプルを得ること:を更に含む、請求項75に記載の方法。
【請求項77】
Na、K−ATPアーゼのα−サブユニットのα1アイソフォーム及びα3アイソフォームに対する分析を如何に実行するかを特定する情報を供することを更に含む、請求項76に記載の方法。
【請求項78】
予後データを如何に解釈するかを詳細に示す情報を供することを更に含む、請求項77に記載の方法。
【請求項79】
ウエスタンブロット法が:
a)Na、K−ATPアーゼのα3サブユニットアイソフォームに対する結合親和性を有する第一の一次抗体;及び
b)Na、K−ATPアーゼのα1サブユニットアイソフォームに対する結合親和性を有する第二の一次抗体;
を含む、請求項73に記載の方法。
【請求項80】
請求項74に記載の方法であって:
サンプル中のNa、K−ATPアーゼのα3サブユニットアイソフォームの含量、及びNa、K−ATPアーゼのα1サブユニットアイソフォームの含量を求めるために、ゲルの放射分析又は濃度分析を行うこと含む;及び
サンプル中に存在するα1アイソフォームに対するα3アイソフォームの比を求めること;
を含む方法。
【請求項81】
請求項73に記載の方法であって、ここで免疫組織化学染色法が:
a)抗原アンマスキング溶液;
b)緩衝液;
c)内因性ペルオキシド活性のクエンチング物質;
d)抗Na、K−ATPアーゼのα3サブユニットアイソフォーム抗体、及び抗Na、K−ATPアーゼのα1サブユニットアイソフォーム抗体;
e)非免疫性マウスIgGI抗体;
f)抗ウサギIgG及び抗マウスIgGの試薬の混合物を含むユニバーサル抗体試薬;
g)主要な化学的染色剤;
h)一般的な化学的でない染色剤;
i)特定細胞小器官染色剤;又は
j)それらの二つ又はそれ以上の組み合わせ;
を含む方法。
【請求項82】
請求項81に記載の方法であって:
a)哺乳動物の組織のサンプルを供すること;
b)サンプル中に存在するNa、K−ATPアーゼのα−サブユニットのα3アイソフォーム及びα1アイソフォームを免疫化学的に染色すること;
c)サンプル中のNa、K−ATPアーゼのα3アイソフォームの含有量及びNa、K−ATPアーゼのα1アイソフォームの含有量を求めること;及び
d)サンプル中に存在するα1アイソフォームに対するα3アイソフォームの比を求めること;
を含む方法。
【請求項83】
請求項69、73、79又は81の何れか1項に記載の方法であって、ここで過剰な細胞増殖に関連した病因を有する疾病又は疾患が、1)抗原誘発性の関節炎及びアレルギー性脳脊髄炎などの自己免疫疾患;2)関節リュウマチ、全身発症型若年性慢性関節炎、骨粗鬆症及び乾癬などの慢性炎症性増殖性疾患;3)線維嚢胞性疾患を含む乳房の増殖性疾患;4)良性前立腺肥大症(BPH)を含む前立腺の増殖性疾患;5)増殖性糖尿病性網膜症を含む目の増殖性疾患;6)アテローム性動脈硬化症及び冠動脈狭窄を含む血管増殖性疾患;7)癌;及び/又は8)腫瘍;から成るグループから選ばれる方法。
【請求項84】
強心配糖体が、オレアンドリン、ウアバイン、ブファリン、ジギトキシン、ジゴキシン、シノブファタリン、シノブファギン及びレジブフォゲニンから成るグループから選ばれる、請求項83に記載の方法。
【図1A】


【図1B】


【図2】


【図3A】


【図3B】


【図4A】


【図4B】


【図4C】


【図5A】


【図5B】


【図5C】


【図6】


【図7】




【図1B】


【図2】


【図3A】


【図3B】


【図4A】


【図4B】


【図4C】


【図5A】


【図5B】


【図5C】


【図6】


【図7】


【公表番号】特表2011−508184(P2011−508184A)
【公表日】平成23年3月10日(2011.3.10)
【国際特許分類】
【出願番号】特願2010−534103(P2010−534103)
【出願日】平成20年11月6日(2008.11.6)
【国際出願番号】PCT/US2008/082641
【国際公開番号】WO2009/064657
【国際公開日】平成21年5月22日(2009.5.22)
【出願人】(508025518)フェニックス・バイオテクノロジー・インコーポレイテッド (4)
【Fターム(参考)】
【公表日】平成23年3月10日(2011.3.10)
【国際特許分類】
【出願日】平成20年11月6日(2008.11.6)
【国際出願番号】PCT/US2008/082641
【国際公開番号】WO2009/064657
【国際公開日】平成21年5月22日(2009.5.22)
【出願人】(508025518)フェニックス・バイオテクノロジー・インコーポレイテッド (4)
【Fターム(参考)】
[ Back to top ]

