形質転換イネ、血圧降下をもたらす米、および、イネ用ベクター
【課題】イネ科植物においてGADタンパク質を種子(胚乳部)に効率良く蓄積させることが可能な発現ベクターを提供し、可食部にGABAを集積させることが可能な技術を提供すること。
【解決手段】 特定なアミノ酸配列をコードするDNA、若しくは、特定なアミノ酸配列の1若しくは数個のアミノ酸の置換、欠失、挿入、付加、又は逆位を含むアミノ酸配列をコードするDNAを導入した形質転換イネ。また、この形質転換イネから得られ、GABAを少なくとも30mg/100g含有した血圧降下作用を有する白米。
【解決手段】 特定なアミノ酸配列をコードするDNA、若しくは、特定なアミノ酸配列の1若しくは数個のアミノ酸の置換、欠失、挿入、付加、又は逆位を含むアミノ酸配列をコードするDNAを導入した形質転換イネ。また、この形質転換イネから得られ、GABAを少なくとも30mg/100g含有した血圧降下作用を有する白米。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、主にイネにおけるグルタミン酸脱炭酸酵素を特定の組織において高濃度に蓄積させるための発現ベクターの作製、これを用いた形質転換イネ植物の作製、および、これらの利用ないし利用法に関するものである。
【背景技術】
【0002】
21世紀に入り、肥満、高脂血症、高血圧などの生活習慣病に苦しむ患者が全世界で急激に増加している。従って、生活習慣病を予防し、その症状を改善するための対策は、緊急の課題である。我が国においては、生活習慣病の予防のために、高齢者は降圧剤を大量に服用している実情がある。その薬剤費は2004年に8千億円と試算され、医療財政の圧迫のみならず、その副作用に対する懸念も指摘されている。
【0003】
近年γ−アミノ酪酸(GABA)は血圧降下、肥満防止、内蔵機能の改善などの優れた効能を持つために健康成分として注目され、発芽玄米などGABAを富化した様々な食品やサプリメントが広く商品化されている。すなわち、医食同源の観点からGABAを富化させた発芽玄米を米飯に混ぜて毎日食べたり、GABAサプリメントを日常的に摂取することで血圧上昇の予防など健康増進への効果が期待される。
【0004】
なお、GABAは、グルタミン酸からの不可逆的な合成を触媒するグルタミン酸脱炭酸酵素(GAD)により合成される。このGADは、大腸菌からヒト、イネにいたるまで生物に普遍的に存在する酵素タンパク質の一種である。
【0005】
【特許文献1】特開2004−290069号公報
【非特許文献1】Kazuhito Akama,Takashi Akihiro,MasatoKitagawa,Fumio Takaiwa(2001)Rice(Oryza sativa) contains a novel isoformof glutamate decarbyoxylase that lacks an authenticcalmodulin-binding domain at the C-terminus. Biochemica et Biophysica Acta1522,147-150.
【非特許文献2】Fumio Takaiwa,Kiyoharu Oono,David Wing and Akira Kato(1991) Sequenceof three members and expression of a new major subfamily of glutelin genes fromrice.Plant Molecular Biology 17(4),875-885.
【非特許文献3】Elizabeth E.Hood,Jenifer M.Murphy and Robert C.Pendleton(1993)Molecularcharacterization of maize extensin expression.Plant Molecular Biology,23(4),685-695.
【非特許文献4】Yukoh Hiei,Shozo Ohta,Toshihiko Komari and TAkahashiKumashiro(1994)Efficient transformation of rice(Oryza sativa L.) mediated byAgorbacterium and sequence analysis of the boundaries of the T-DNA.The PlantJournal,6(2),271-282.
【非特許文献5】Jeff J.Doyle and Jane I.Doyle(1990)Isolation of plant DNAfrom fresh tissue.Focus,12,135-137.
【非特許文献6】L.Q.Qu,Y.Tada and F.Takaiwa (2003) In situ westernhybridization: a new, highly sensitive technique to detect foreign andendogenous protein distribution in rice seeds.Plant Cell Reports,22,282-285.
【発明の開示】
【発明が解決しようとする課題】
【0006】
しかしながら、発芽玄米の場合は、食味が必ずしも優れず恒常的な摂取が困難であるとう問題点があった。また、米の場合、GABAは糠部分に蓄積され、玄米であれば摂取量がある程度確保されるものの、精米したものは数分の一未満まで低減してしまうという問題点があった。サプリメントの場合も摂取の煩わしさと高コストであるという問題点があった。
【0007】
本発明は上記に鑑みてなされたものであって、GABA含有量の多い白米を提供可能にすることを目的とする。より詳しくは、イネ科植物においてGADタンパク質を種子(胚乳部)に効率良く蓄積させることが可能な発現ベクターを提供し、可食部にGABAを集積させることが可能な技術を提供することにある。
【0008】
また、GABAに限らず遊離アミノ酸、ミネラル、または、ビタミンの豊富な玄米を提供可能にすることを目的とする。
【課題を解決するための手段】
【0009】
上記の目的を達成するために、請求項1に記載の形質転換イネは、配列番号2に記載のアミノ酸配列をコードするDNA、若しくは、配列番号2に記載のアミノ酸配列の1若しくは数個のアミノ酸の置換、欠失、挿入、付加、又は逆位を含むアミノ酸配列をコードするDNAを導入したものである。
【0010】
また、請求項2に記載の形質転換イネは、請求項1に記載の形質転換イネにおいて、前記アミノ酸配列をコードするDNAがイネグルテリン遺伝子のプロモーター領域の下流側に連結しているものである。
【0011】
なお、イネグルテリン遺伝子は、A遺伝子族、B遺伝子族が挙げられるが、そのうち、GluB−1が好ましい。GluB−1のプロモーター領域としては、標準的な2.3kbの長さを用いることができる。
【0012】
また、請求項3に記載の白米は、請求項1または請求項2に記載の形質転換イネから得られ、GABAを少なくとも30mg/100g含有した血圧降下作用を有する白米である。
【0013】
また、請求項4に記載のイネ用ベクターは、イネグルテリン遺伝子のプロモーター領域と、配列番号2に記載のアミノ酸配列をコードするDNAまたは配列番号2に記載のアミノ酸配列の1若しくは数個のアミノ酸の置換、欠失、挿入、付加、又は逆位を含むアミノ酸配列をコードするDNAと、を連結した遺伝子を有し、胚乳部のGABA含量を高めるベクターである。
【0014】
また、請求項5に記載のイネ用ベクターは、イネグルテリン遺伝子のプロモーター領域と、配列番号2に記載のアミノ酸配列または配列番号2に記載のアミノ酸配列の1若しくは数個のアミノ酸の置換、欠失、挿入、付加、又は逆位を含むアミノ酸配列をコードするDNAと、を連結した遺伝子を有し、玄米のミネラル、遊離アミノ酸、または、ビタミン含量、を高めるベクターである。
【0015】
また、請求項6に記載の機能性成分強化米開発用ベクターは、配列番号2に記載のアミノ酸配列、または、配列番号2に記載のアミノ酸配列の1若しくは数個のアミノ酸の置換、欠失、挿入、付加、又は逆位を含むアミノ酸配列、をコードするDNAを有するベクターである。
【発明の効果】
【0016】
本発明によれば、発現ベクターにコードされているGADをイネの白米部分に高レベルに発現させ、同時にその生産物であるGABAを高濃度に蓄積させることができる。従って、この形質転換イネから得られた精白米を食することによりGABAが作用し、様々な生活習慣病の予防ないし治療に用いることができる。
【発明を実施するための最良の形態】
【0017】
以下、本発明の実施の形態について図面を参照しながら説明するが、本発明はここに記載した形態のみに限定されるものではなく、本明細書の記載および当分野で公知の技術に基づいて、当業者が容易に修飾や改変可能な技術に関しては本発明の範囲内に含まれるものとする。
【0018】
GADはグルタミン酸の脱炭酸反応によるGABAの生産を触媒する。GADは大腸菌からヒトにいたるまで生物が普遍的に持つ酵素の一種であるが、植物のGADのみがそのC末端領域にカルモジュリン結合部位(CaMBD)を持ち、この部位とCaMとの相互作用が酵素活性の調節に重要な役割を担っている。
【0019】
単子葉植物イネで少なくとも5種類のアイソフォームの存在が推定され、その中でもOsGAD2をコードする遺伝子(アクセッション番号:AB056061)は例外的にCaMBDを持たない(非特許文献1参照)。なお、以降においては、適宜OsGAD2を単にGAD2と表記するものとする。
【0020】
さらに、本願発明者によって明らかになったことであるが、GAD2のC末端側ペプチド部分を欠如させることにより、酵素活性が5倍以上も上昇することが確認されている(特許文献1参照)。本願発明者は、さらにGAD2を研究し、鋭意検討の結果本願発明をなした。
【0021】
<概要>
本願発明者は、イネのGAD2遺伝子(特許文献1)を改変し、種子特異的な遺伝子プロモーターで発現させるためのベクターを作製し、アグロバクテリウムを介して当該遺伝子を植物細胞に組み込み、組換えイネ個体を再生させて、GABAを高度に種子に蓄積させることに成功した。さらに、世代を進めることでその形質を固定した。開発した玄米は、期待された胚乳中へのGABA含量の向上のみならず、予想外にも、玄米全体のミネラル、遊離アミノ酸、および、ビタミン含量が向上したものであった。これを材料として混合飼料を作製して高血圧ラットに投与したところ、血圧降下の作用等を持つことを確認した。より詳細には、以下のとおりある。
【0022】
<発現ベクターの構築>
植物発現ベクターの構築について、以下のとおりとした。まず、GAD2をコードするcDNAを鋳型として特異的なプライマーセットを用いてPCR法により開始コドンから469番目までのアミノ酸に対応する塩基配列を増幅した。なお、GAD2は、500アミノ酸残基からなり、OsGAD1に見られるCaMBD(C末端側31残基)がみられないが、酵素活性を調節すると考えられるCaMBDに相当する31残基を欠失させ、酵素機能そのものを司る領域と考えられる469残基をコードするDNAにてベクターを構築することを試みた。
【0023】
このとき用いたセンスプライマーは配列番号3に示したように5’−CGTGCGTAGCCATGGTTCTG−3’、アンチセンスプライマーは配列番号4に示したように5’−AAAGCATGCCTAGGCGGTCCGGGCGGGGCC−3’である。なお、下線部は前者がNcoI認識配列を、後者がSphI認識配列を示す。PCRで得られたDNA断片は、GAD2のC末端側の31アミノ酸残基分を欠失させたものであり、以降では、このDNA断片を適宜GAD2ΔC31と称することとする。
【0024】
得られたGAD2ΔC31を大腸菌プラスミドに組み込み、その塩基配列を確認した。プラスミドは始めSphIで切断してT4DNAポリメラーゼによる平滑末端化後にNcoIで切断した。このDNA断片は、植物発現ベクターpCAMBIA1302(CAMBIA社製、オーストラリア)をNcoI/PlmI切断することにより、内生の緑色蛍光タンパク質をコードするDNA断片を取り除いてから、同じ位置に組み込んだ。
【0025】
そして、イネグルテリン遺伝子(GluB−1)のプロモーター領域2.3kb(非特許文献2)をXbaI/NcoIで切り出し、上記ベクターを同一の制限酵素で処理することにより内生のカリフラワーモザイクウイルス35Sプロモーターと置換した。本発明の一つの特徴は35Sプロモーターでなく、GluB−1プロモーターを用いたことにある。これは、本願発明者の検討の結果、汎用される35Sプロモーターを用いた形質転換イネでは、不稔という不具合があったためである。すなわち、本発明の一つの特徴は、この遺伝子カセットを有する発現ベクターであるといえる。
【0026】
このようにして作製した植物発現ベクターを、以降では適宜pCAMBIA GluB-1::GADΔC31と称することとする。なお、図1にこのベクター構築までの流れを示した。なお、本実施の形態では、GluB−1プロモーターの下流に、人工的な配列を介さずGAD2ΔC31を直接連結させている。
【0027】
<発現ベクターのアグロバクテリウム株への導入>
作製したベクターをエレクトロポレーション法によりアグロバクテリウム株EHA105へ導入した(非特許文献3参照)。バクテリア懸濁液は100mg/lカナマイシンを含むLB寒天培地(1%バクトトリプトン,0.5%酵母エキス,0.5%NaCl,1.5%寒天)を用い、28℃で2日間培養した。形成されたコロニーは滅菌ループでかき取り、上と同じ濃度のカナマイシンを含むAB培地(非特許文献4参照)に接種し、28℃で2〜3日間培養した。
【0028】
<イネ玄米の2N6培地でのカルス誘導>
イネ品種「キタアケ」の種籾を脱穀し、約50粒の玄米を、2倍希釈したブリーチ(花王製)を用いて30分間滅菌処理した。その後、玄米を滅菌水により5回洗浄し、2N6カルス誘導培地(非特許文献4参照)に置床した。これを、グロースチャンバー内(28℃,明:暗=16時間:8時間)で2〜3週間培養し、胚盤由来のカルスを形成させた。
【0029】
<アグロバクテリウムを介したイネカルス細胞の形質転換>
アグロバクテリウムを用いたイネの形質転換をおこなった。その方法、または、形質転換に際して使用する各種試薬は、通常の方法ないし試薬であるが、たとえば、イネに関して汎用される非特許文献4に開示の方法ないし試薬を用いることができる。
【0030】
目的の発現ベクターを運ぶアグロバクテリウムをN6CO液体培地に懸濁した。これに対して直径2〜3mmに増殖したカルスを適量入れた。カルスを取り出し、滅菌した濾紙の上で余分な水分を除いた後にN6CO寒天培地に静置し、23℃、3日間暗所で培養した。
【0031】
菌が充分に増殖したカルスを取り出し、除菌剤を含むN6CO液体培地でカルスを振とうさせながら洗浄した。この操作は5回繰り返した。カルスは滅菌濾紙上で余分な水分を除き、ハイグロマイシンを含むN6SE培地(選抜培地)に移しグロースチャンバー内(28℃,明:暗=16時間:8時間)で3〜4週間培養した。
【0032】
<耐性カルスの選抜と固体再生>
ハイグロマイシン耐性のカルスをMSRE培地(再分化培地)に移して、シュートが出現するまで培養を行った。発根したシュートは試験管内につくったホルモンフリーのMS培地に移し、植物体の成長を促した。
【0033】
<鉢上げ>
続いて、試験管から植物体を取り出して、根に付着した寒天を取り除き育苗用培土を入れたポットに移し、特定網室内で栽培を行い、次世代の種子(米)を収穫して各種の分析に供した。
【0034】
<形質転換イネ植物体の外来遺伝子組み込みの確認>
種子(T1世代)を籾摺り後、玄米を滅菌して50μg/mlのハイグロマイシンを含むMS寒天培地に播種した(非特許文献4参照)。約10日後に耐性植物体の葉片を材料としてCTAB法により全DNAを抽出した(DNA抽出技術については、たとえば非特許文献5に開示の技術を参照できる)。選択マーカーのハイグロマイシン耐性遺伝子配列を元にして作製したプライマーセットを用いてPCRを行った。なお、用いたセンスプライマーを配列番号5に、アンチセンスプライマーを配列番号6に示した。
【0035】
続いて、変性(95℃,30秒)→アニーリング(60℃,30秒)→伸長(72℃,60秒)を30サイクル繰り返した。反応サンプルは2%アガロースゲル電気泳動法により分画した。
【0036】
この結果、図2に示したように、野生型DNAではPCR増幅が観察されなかったのに対して、組換え植物から抽出したDNAを鋳型として用いたものでは、いずれも予想される800bpに対応する位置に増幅産物が観察された。このことから、調査した全ての植物体は目的の遺伝子が組み込まれていることが確認できた。
【0037】
<RT−PCR法を用いた玄米におけるGAD2ΔC31のRNAレベルでの発現解析>
形質転換植物の登熟過程で目的の遺伝子の発現が起きていることを調べるために、未熟種子(T1世代)を液体窒素下で破砕後にRNA抽出試薬セパゾールRNAI(ナカライテスク社製)を用いて全RNAを抽出した。全RNAと相補プライマーを混合し、0.5mM dNTP存在下で逆転写酵素SuperScriptII(GIBCO BRL社製)を用いてcDNA合成を42℃で1時間行った。なお、用いた相補プライマーを配列番号7に示した。
【0038】
10分の1容量のcDNAサンプルを鋳型として、プライマーセットを用いてPCRを行った。用いたセンスプライマーを配列番号8に示した。アンチセンスプライマーは、配列番号7に示したものと同じものを用いた。なお、反応条件は、95℃(30秒)、55℃(30秒)、72℃(30秒)であり、これを35サイクル繰り返した。適量の反応サンプルを2%アガロースゲル電気泳動法により分画した。その結果、図3に示したように、コントロールとして用いた野生型種子ではGAD2が発現していないか、あるいは非常に低いレベルであるのに対して、組換え植物由来の種子では高レベルのGAD2ΔC31の発現が観察された。
【0039】
<ウエスタン法によるタンパク質レベルでのGAD2ΔC31発現解析とGABA分析>
同一の形質転換植物の複数の種子(T1世代)を採取して、導入遺伝子のタンパク質レベルでの発現とGABA蓄積との関係を調べた。まず、玄米をマイクロチューブに入れて液体窒素で凍結破砕後に抽出バッファー(50mM Tris−HCl,pH7.5,5mM EDTA,1mM DTT,1mM PMSF)を加えて懸濁した。
【0040】
遠心分離(20,000g,20分間,4℃)後に上澄みを新しいチューブに移した。サンプルを2等分し、一方をタンパク質分析用に、もう一方をアミノ酸分析用に用いた。タンパク質のウエスタン分析は以下のように行った。タンパク質サンプル(約10μg)を12%SDS−ポリアクリルアミドゲル電気泳動法により分画し、タンパク質をセミドライブロッティング装置でメンブレンに転写した。
【0041】
TBST(10mM Tris−HCl,500mM NaCl,pH7.5,0.1%Tween−20)に5,000倍希釈したウサギ抗GAD2ポリクローナル抗体液にメンブレンを浸して、30分間振とうした。TBSTで5分間ずつ3回メンブレンを洗浄し、TBSTで5,000倍希釈した抗ウサギIgG−アルカリフォスファターゼに浸し30分間振とうした。メンブレンはTBSTで5分間ずつ3回洗浄し、検出バッファー(100mM Tris−HCl,pH9.5,100mM NaCl,50mM MgCl2)に移して平衡化した。検出バッファーで200倍希釈したCSPD(ロッシュ社製)でメンブレンを浸して5分間反応を行い、紫外線ランプ下で観察した。
【0042】
一方、遊離アミノ酸を抽出するために、サンプルに対して最終濃度8%(v/v)になるようにトリクロロ酢酸(TCA)を加えて撹拌した。遠心分離後、上澄みを新しいチューブに移し、等量のジエチルエーテルを加えて撹拌した。遠心分離を行い、上層のジエチルエーテルを除いた。この操作をさらにもう一度繰り返した。ドラフト内で完全にジエチルエーテルを揮発させ、一部を分析に用いた。
【0043】
アミノ酸サンプルをマイクロチューブに入れ、これに対して、100mMピロリン酸ナトリウム(pH9.0),0.5mM NADP+,0.6mM α−ケトグルタル酸,1.2mM 2−メルカプトエタノール,0.005ユニットGABase(シグマ社製)を加えて37℃で1時間反応させた。
【0044】
反応後にGABA合成に伴う還元型補酵素NADPHを紫外線照射により可視化、あるいは分光光度計(340nm)で定量分析した。この結果を図4に示す。図から明らかなように、玄米中に目的の酵素タンパク質GAD2ΔC31が高度に蓄積しているものでは、GABA含量も同様に高いレベルにあることが確認できた。
【0045】
以上から、GAD2ΔC31遺伝子の種子中での過剰発現の結果、細胞内でGAD酵素活性の上昇が引き起こされ、GABAの高濃度蓄積がもたらされることが確認できた。
【0046】
<玄米中の遊離アミノ酸の分析>
次に、玄米中の各種遊離アミノ酸の含量を定量するために、TCA法で抽出したアミノ酸サンプルを自動アミノ酸分析装置(日本電子社製JLC−300)にかけて定量分析を行った。この結果を図5に示す。図5−1のチャートに示すように、組換え玄米(T1世代)では野生型玄米に比べ、驚くべきことにGABAのみならず多くの種類のアミノ酸でその含量が増加していることが判明した。図5−2は野生型玄米と幾つかの組換え玄米(T1世代)のGABAとタンパク質性のアミノ酸含量を定量しまとめたものである。GABAの蓄積度が高いものほど、全体的にアミノ酸含量が高まる傾向にあることが確認できた。
【0047】
なお、この結果はT1世代であり、ばらつきが多いものの、必須アミノ酸では、2倍か14倍もの含量増が認められた。特に、リシンは、穀物中の含量増が望まれているアミノ酸の一種であり、チャートでは、少なくとも4倍増、多い系統では14倍増となっている。また、遊離アミノ酸の総量が30倍程度も増えており、これは、一つの遺伝子を操作したことからは想定できない、多面的な効果を引き起こしたものと考えられる。
【0048】
<特異抗体を用いた、組換え玄米中でのGAD2ΔC31タンパク質とGABAの免疫組織化学的検出>
種子中での導入遺伝子産物とそれにより作り出されたGABAの局在を調べるために、免疫組織化学的な手法を用いた検出を行った。なお、実施にあたっては、非特許文献6に開示されている手法に主に基づいて行った。
【0049】
まず、一晩水に浸した種子をメスで縦方向に2分割して、3%スキムミルクを含むTBS(10mM Tris−HCl,500mM NaCl,pH7.5)で3時間以上ブロッキングした。一次抗体として、ウサギ抗GAD2ポリクローナル抗体、あるいはウサギ抗GABAモノクローナル抗体を、1%スキムミルクを含むTBSで200倍希釈して用いた。
【0050】
一晩反応させた後に、TBSTで15分間3回洗浄した。二次抗体として、TBSTで2,000倍に希釈した抗ウサギIgG−アルカリフォスファターゼを用い2時間反応させた。検出反応はWestern Blue Stabilized Substrate for Alkaline Phosphatase(プロメガ社製)を用いて行い、実体顕微鏡を用いて染色の様子を観察した。図6は実体顕微鏡で得られた画像である。図に示したように、GAD2とGABAに対するいずれの特異抗体を用いた場合でも、組換え玄米ではこれらの局在を示す青い染色が胚乳組織において認められた。
【0051】
<玄米の各種成分の分析>
遊離アミノ酸以外の玄米中の各種成分分析をおこなうために、T3世代の玄米の化学成分分析を行った。その結果を図7に示した。水分と可溶無機窒素物(主にデンプン)を除き、ビタミン類および各種ミネラルはいずれの分析項目ともに組換え玄米が野生型を上回る値であった。その上昇率は1.3倍〜2.5倍であり、GADの直接の影響があるとは考えられない各種項目が著しく上昇していることが確認できた。
【0052】
特に、ミネラル分では、カリウムが2倍以上増えているため、GABAに加え血圧抑制作用が期待できる。また、ビタミンB1は糖質を分解する酵素を助け、ビタミンB6はタンパク質の代謝を促し、ビタミンEは過酸化脂質がつくられるのを防ぐため、これらが約2倍に増えていることも、好適に人体に影響を及ぼすこと期待できる。
【0053】
すなわち、図7の結果も図5の結果も全く想定外であり、これらの数値は、有意に上昇したとしてもせいぜい数項目について1.5倍程度までであると考えられるため、本発明の発現ベクターは、単にGABAの増加をもたらすのみならず、細胞内の代謝経路の活性化を引き起こすベクターであるといえる。
【0054】
<T2世代とT3世代の組換えイネ系統に関してのGABA含量の分析>
GABAの蓄積について遺伝的に安定した系統を開発するために、組換えイネ系統の当代(T0世代)の自家受粉によって得られた種子(T1世代)の自殖によるT2世代の種子12粒ずつをGABaseを用いた方法で分析した。
【0055】
その結果、図8Aに示すように、多くの系統で野生型や発芽玄米に比べて、高いGABA蓄積が確認された。これらの中からバラツキの少ない系統を選抜し、さらに世代を進めてT3世代におけるGABA分析を行った。図8Bに示したように、T3世代でも、野生型と同程度の玄米重量を持ちながら(小粒化することなく)、GABA含量が発芽玄米の2〜9倍のものが得られた。換言すれば、本発明の組換えイネ系統株は、世代の更新によっても稔性が維持されており、かつ、玄米重量も従来品種と同程度であるので、収量も保証された品種開発を可能とする。
【0056】
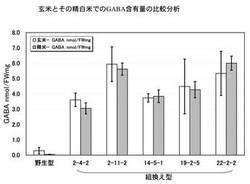
<玄米とその精白米でのGABA蓄積の比較分析>
組換えイネから得られた玄米で胚乳組織にGABAが蓄積していることをさらに検証するために、玄米(T3世代)を小型精米器(ケット科学社製)にかけて精白米にし、玄米とその精白米を粉砕してTCA法により遊離アミノ酸を抽出し、GABaseを用いた間接法によりGABA含量を測定した。その結果を図9に示す。図示したように、野生型では精米処理によりGABA含量が5分の1以下に低下したのに対して、組換えイネでは玄米とその精白米でのGABA含量はほとんど差が認められず、かつ、驚くほど多量に精白米自体(可食部である胚乳組織)にGABAが含有していることが確認できた。
【0057】
すなわち、系統によって異なるが、白米中のGABA含有量は少なくとも30mg/100gであり、多いものでは60mg/100gまで上昇した。野生型の白米が多くても0.5mg/100gであるため、60倍以上上昇することが確認できた。なお、野生型の玄米では2.9mg/100gであるため、これと比較しても10倍以上上昇することが確認できた。なお、この結果は、図6に示した結果と一致する。なお、本結果は、形質的にある程度安定化したT3世代における評価であるので、品種固定された場合であっても、同様の結果を期待できる。
【0058】
<高血圧ラットを用いた臨床試験>
特定網室で試験栽培・収穫された組換えイネ系統の玄米(T3世代)を脱穀後に籾摺り機にかけて玄米にした。玄米はブレンダーを用いて粉砕し、マウス・ラット用精製飼料AIN−93G(オリエンタル酵母社製)をベースにして、これに含まれる40%コーンスターチを同量比の玄米粉と配合変更することで特注飼料を作製した。
【0059】
組換え玄米の効果を調べるための臨床試験は以下のように行った。株式会社日本チャールズリバー社より購入した、9週齢のオスの本態性高血圧自然発症ラット(SHR/NCrlCrlj)を普通食にて1週間馴化後に、8匹ずつ2群に分けて、A群には野生型玄米粉の添加飼料を、B群には組換え玄米粉の添加試料を、C群には野生型玄米粉に発芽玄米と同程度となるように精製GABAを添加した添加試料を、それぞれ自由摂餌させて、食餌実験の開始前と1週間毎に5週目まで体重と血圧を測定した。
【0060】
その結果、5週目では、A群は平均血圧が235mmHgであり、B,C群はともに220mmHg以下となり、有意な血圧降下作用が確認できた。このほか、血液生化学的には、A群に比較してB群では、総コレステロール、中性脂肪、GOT、GPTの低下が確認された。
【0061】
<他の形質転換イネ植物体の作成および評価>
次に、上記「キタアケ」と同様にして、イネ品種「日本晴」に対して、形質転換イネを作出した。
T4世代における精白米の遊離アミノ酸含有量を自動アミノ酸分析装置により分析した結果を図10に示す。GABAに関しては野生型に比し3〜30倍の含有量の上昇が見られた。また、キタアケの結果と同様、GABAの蓄積度が高いものほど、全体的にアミノ酸含量が高まる傾向にあることが確認できた。
【0062】
次に、GABA含有量の多いこのT4世代の(47−52)系統と(78−87)系統に関し、遊離アミノ酸以外の白米中各種成分分析を行った結果を図11に示す。ビタミン類および各種ミネラルはいずれの分析項目ともに組換え米が野生型を上回る値であった。ここでも、GAD高発現の直接の影響があるとは考えられない各種項目が著しく上昇していることが確認できた。
【0063】
キタアケに導入した結果(図7)と同様に、特に、ミネラル分では、カリウムが2倍以上増えているため、GABAに加え血圧抑制作用が期待できる。また、ビタミンB1は糖質を分解する酵素を助け、ビタミンB6はタンパク質の代謝を促し、ビタミンEは過酸化脂質がつくられるのを防ぐため、これらが約2倍に増えていることも、好適に人体に影響を及ぼすこと期待できる。
【0064】
<高血圧ラットへの経口投与試験>
次に、高血圧ラットであるSHR/Izmへ、(47−52)系統の白米をすり潰した餌を一日一回5週間与えて、血圧変化を観察した。SHR/Izmは、一般に5,6週齢から高血圧の傾向が現れ始め、おおよそ11週齢あたりで高血圧状態への移行が完了する。評価に際しては9週齢から6匹ずつ3グループに分け、
・標準餌+すり潰した通常精白米投与(コントロール群)
・標準餌+個体1kgに対してGABA量換算で0.1mgの投与となるようにすり潰した(47−52)系統の白米投与
・標準餌+個体1kgに対してGABA量換算で0.5mgの投与となるようにすり潰した(47−52)系統の白米投与
で評価した。結果を図12に示す。図示したように、コントロール群とGABA量が少ない群とは有意差は見られなかったが、GABA量が多い群では、高血圧状態への移行抑制が確認できた。なお、3群とも、体重差は見られなかった。
【0065】
次に、この(47−52)系統の組換え白米と野生型(日本晴)白米とを、かつ脳卒中易発症高血圧ラット(SHRSP)へ経口投与した場合の血圧の経時変化を観察した。図13に結果を示す。図から明らかなように投与後次第に血圧降下が観測され、8時間で最も血圧が下がり24時間では略通常の高血圧状態に戻ることが確認できた。なお、投与量は、生体1kgに対して0.5mgのGABAとなるような白米量とした。
【0066】
図12、図13に示した結果から、組換え白米には、確かに白米摂取による血圧降下作用があることが分かった。
【0067】
<水浸漬処理によるGABA含有量の変化>
GABAは、グルタミン酸がGADおよび補酵素ピリドキサルリン酸 (PLP) の介在のもと、脱炭酸反応によって生成される。また、玄米は浸漬処理により発芽玄米としてGABA強化米として流通している。そこで、組み換えない日本晴(WildType:WT)と(47−52)系統とを用いて、
・水浸漬するだけの群(w/o)
・グルタミン酸(Glu)添加+水浸漬の群
・補酵素PLP添加+水浸漬の群
・グルタミン酸(Glu)添加+補酵素PLP添加+水浸漬の群
でGABAの含有量変化を観測した。結果を図14に示す。図示したように、Glu+PLPの両方を添加したものは、組み換えないものも組み換えたものも上昇率が大きいが、組換え体は上昇率および絶対量が極めて大きなことを確認した。PLPはビタミンであるので、たとえば、本発明の白米は、炊き込み御飯に用いたり、α化して非常食等への加工に適しているといえる。
【産業上の利用可能性】
【0068】
本発明は、生活習慣病患者の食事療法や中高年者以上の常用食として用いることができる。また、本発明のベクターを用いて、機能性成分強化米を開発することができる。ここで、機能性成分強化米とは、必須アミノ酸、および/または、ビタミン、および/または、ミネラルが、野生型ないし既存品種に比べて増強されている米をいう。
【図面の簡単な説明】
【0069】
【図1】本発明にかかる植物発現ベクターpCAMBIA GluB-1::GAD2ΔC31の構築方法を示す工程図である。
【図2】T1世代の植物体における外来遺伝子の組み込みの確認をPCR法によって行った結果を示す電気泳動図である。
【図3】T1世代の未熟種子におけるGAD2ΔC31遺伝子の転写レベルでの発現をRT−PCRによって確認した電気泳動図である。
【図4】T1世代の玄米から抽出した、GABA含量の分析の蛍光図とGAD2ΔC31タンパク質のウエスタン解析の結果を示す図である。
【図5−1】T1世代の玄米から抽出した遊離アミノ酸の自動アミノ酸分析装置を用いて分析したチャートである。
【図5−2】野生型玄米と組換え玄米のアミノ酸分析の結果を比較して表にまとめたものである。
【図6】抗GAD2抗体と抗GABA抗体を用いて組換え玄米におけるGAD2ΔC31タンパク質とGABAの局在を免疫組織化学的手法によって明らかにした図である。
【図7】野生型玄米と組換え玄米に含まれる各種成分を定量分析した結果をもとめた表である。
【図8】後代(T2世代とT3世代)での玄米のGABA分析を行った結果である。
【図9】玄米とその精白米でのGABA含有量を調べて比較した図である。
【図10】組換え日本晴のT4世代における精白米の遊離アミノ酸含有量を自動アミノ酸分析装置により分析した結果を示した図である。
【図11】遊離アミノ酸以外の白米中の各種成分分析を行った結果である。
【図12】高血圧ラットSHR/IzmへGABA強化米(白米)を経口投与した場合の血圧の長期変化を示した図である。
【図13】ラットSHRSPへGABA強化米(白米)を経口投与した場合の血圧の24時間の変化の様子を示した図である。
【図14】水浸漬とGABAの変化を添加物を変えて測定した図である。なお、なお、自動アミノ酸分析装置を用いた精密な定量評価でないため、絶対値としては図10と相違する。
【技術分野】
【0001】
本発明は、主にイネにおけるグルタミン酸脱炭酸酵素を特定の組織において高濃度に蓄積させるための発現ベクターの作製、これを用いた形質転換イネ植物の作製、および、これらの利用ないし利用法に関するものである。
【背景技術】
【0002】
21世紀に入り、肥満、高脂血症、高血圧などの生活習慣病に苦しむ患者が全世界で急激に増加している。従って、生活習慣病を予防し、その症状を改善するための対策は、緊急の課題である。我が国においては、生活習慣病の予防のために、高齢者は降圧剤を大量に服用している実情がある。その薬剤費は2004年に8千億円と試算され、医療財政の圧迫のみならず、その副作用に対する懸念も指摘されている。
【0003】
近年γ−アミノ酪酸(GABA)は血圧降下、肥満防止、内蔵機能の改善などの優れた効能を持つために健康成分として注目され、発芽玄米などGABAを富化した様々な食品やサプリメントが広く商品化されている。すなわち、医食同源の観点からGABAを富化させた発芽玄米を米飯に混ぜて毎日食べたり、GABAサプリメントを日常的に摂取することで血圧上昇の予防など健康増進への効果が期待される。
【0004】
なお、GABAは、グルタミン酸からの不可逆的な合成を触媒するグルタミン酸脱炭酸酵素(GAD)により合成される。このGADは、大腸菌からヒト、イネにいたるまで生物に普遍的に存在する酵素タンパク質の一種である。
【0005】
【特許文献1】特開2004−290069号公報
【非特許文献1】Kazuhito Akama,Takashi Akihiro,MasatoKitagawa,Fumio Takaiwa(2001)Rice(Oryza sativa) contains a novel isoformof glutamate decarbyoxylase that lacks an authenticcalmodulin-binding domain at the C-terminus. Biochemica et Biophysica Acta1522,147-150.
【非特許文献2】Fumio Takaiwa,Kiyoharu Oono,David Wing and Akira Kato(1991) Sequenceof three members and expression of a new major subfamily of glutelin genes fromrice.Plant Molecular Biology 17(4),875-885.
【非特許文献3】Elizabeth E.Hood,Jenifer M.Murphy and Robert C.Pendleton(1993)Molecularcharacterization of maize extensin expression.Plant Molecular Biology,23(4),685-695.
【非特許文献4】Yukoh Hiei,Shozo Ohta,Toshihiko Komari and TAkahashiKumashiro(1994)Efficient transformation of rice(Oryza sativa L.) mediated byAgorbacterium and sequence analysis of the boundaries of the T-DNA.The PlantJournal,6(2),271-282.
【非特許文献5】Jeff J.Doyle and Jane I.Doyle(1990)Isolation of plant DNAfrom fresh tissue.Focus,12,135-137.
【非特許文献6】L.Q.Qu,Y.Tada and F.Takaiwa (2003) In situ westernhybridization: a new, highly sensitive technique to detect foreign andendogenous protein distribution in rice seeds.Plant Cell Reports,22,282-285.
【発明の開示】
【発明が解決しようとする課題】
【0006】
しかしながら、発芽玄米の場合は、食味が必ずしも優れず恒常的な摂取が困難であるとう問題点があった。また、米の場合、GABAは糠部分に蓄積され、玄米であれば摂取量がある程度確保されるものの、精米したものは数分の一未満まで低減してしまうという問題点があった。サプリメントの場合も摂取の煩わしさと高コストであるという問題点があった。
【0007】
本発明は上記に鑑みてなされたものであって、GABA含有量の多い白米を提供可能にすることを目的とする。より詳しくは、イネ科植物においてGADタンパク質を種子(胚乳部)に効率良く蓄積させることが可能な発現ベクターを提供し、可食部にGABAを集積させることが可能な技術を提供することにある。
【0008】
また、GABAに限らず遊離アミノ酸、ミネラル、または、ビタミンの豊富な玄米を提供可能にすることを目的とする。
【課題を解決するための手段】
【0009】
上記の目的を達成するために、請求項1に記載の形質転換イネは、配列番号2に記載のアミノ酸配列をコードするDNA、若しくは、配列番号2に記載のアミノ酸配列の1若しくは数個のアミノ酸の置換、欠失、挿入、付加、又は逆位を含むアミノ酸配列をコードするDNAを導入したものである。
【0010】
また、請求項2に記載の形質転換イネは、請求項1に記載の形質転換イネにおいて、前記アミノ酸配列をコードするDNAがイネグルテリン遺伝子のプロモーター領域の下流側に連結しているものである。
【0011】
なお、イネグルテリン遺伝子は、A遺伝子族、B遺伝子族が挙げられるが、そのうち、GluB−1が好ましい。GluB−1のプロモーター領域としては、標準的な2.3kbの長さを用いることができる。
【0012】
また、請求項3に記載の白米は、請求項1または請求項2に記載の形質転換イネから得られ、GABAを少なくとも30mg/100g含有した血圧降下作用を有する白米である。
【0013】
また、請求項4に記載のイネ用ベクターは、イネグルテリン遺伝子のプロモーター領域と、配列番号2に記載のアミノ酸配列をコードするDNAまたは配列番号2に記載のアミノ酸配列の1若しくは数個のアミノ酸の置換、欠失、挿入、付加、又は逆位を含むアミノ酸配列をコードするDNAと、を連結した遺伝子を有し、胚乳部のGABA含量を高めるベクターである。
【0014】
また、請求項5に記載のイネ用ベクターは、イネグルテリン遺伝子のプロモーター領域と、配列番号2に記載のアミノ酸配列または配列番号2に記載のアミノ酸配列の1若しくは数個のアミノ酸の置換、欠失、挿入、付加、又は逆位を含むアミノ酸配列をコードするDNAと、を連結した遺伝子を有し、玄米のミネラル、遊離アミノ酸、または、ビタミン含量、を高めるベクターである。
【0015】
また、請求項6に記載の機能性成分強化米開発用ベクターは、配列番号2に記載のアミノ酸配列、または、配列番号2に記載のアミノ酸配列の1若しくは数個のアミノ酸の置換、欠失、挿入、付加、又は逆位を含むアミノ酸配列、をコードするDNAを有するベクターである。
【発明の効果】
【0016】
本発明によれば、発現ベクターにコードされているGADをイネの白米部分に高レベルに発現させ、同時にその生産物であるGABAを高濃度に蓄積させることができる。従って、この形質転換イネから得られた精白米を食することによりGABAが作用し、様々な生活習慣病の予防ないし治療に用いることができる。
【発明を実施するための最良の形態】
【0017】
以下、本発明の実施の形態について図面を参照しながら説明するが、本発明はここに記載した形態のみに限定されるものではなく、本明細書の記載および当分野で公知の技術に基づいて、当業者が容易に修飾や改変可能な技術に関しては本発明の範囲内に含まれるものとする。
【0018】
GADはグルタミン酸の脱炭酸反応によるGABAの生産を触媒する。GADは大腸菌からヒトにいたるまで生物が普遍的に持つ酵素の一種であるが、植物のGADのみがそのC末端領域にカルモジュリン結合部位(CaMBD)を持ち、この部位とCaMとの相互作用が酵素活性の調節に重要な役割を担っている。
【0019】
単子葉植物イネで少なくとも5種類のアイソフォームの存在が推定され、その中でもOsGAD2をコードする遺伝子(アクセッション番号:AB056061)は例外的にCaMBDを持たない(非特許文献1参照)。なお、以降においては、適宜OsGAD2を単にGAD2と表記するものとする。
【0020】
さらに、本願発明者によって明らかになったことであるが、GAD2のC末端側ペプチド部分を欠如させることにより、酵素活性が5倍以上も上昇することが確認されている(特許文献1参照)。本願発明者は、さらにGAD2を研究し、鋭意検討の結果本願発明をなした。
【0021】
<概要>
本願発明者は、イネのGAD2遺伝子(特許文献1)を改変し、種子特異的な遺伝子プロモーターで発現させるためのベクターを作製し、アグロバクテリウムを介して当該遺伝子を植物細胞に組み込み、組換えイネ個体を再生させて、GABAを高度に種子に蓄積させることに成功した。さらに、世代を進めることでその形質を固定した。開発した玄米は、期待された胚乳中へのGABA含量の向上のみならず、予想外にも、玄米全体のミネラル、遊離アミノ酸、および、ビタミン含量が向上したものであった。これを材料として混合飼料を作製して高血圧ラットに投与したところ、血圧降下の作用等を持つことを確認した。より詳細には、以下のとおりある。
【0022】
<発現ベクターの構築>
植物発現ベクターの構築について、以下のとおりとした。まず、GAD2をコードするcDNAを鋳型として特異的なプライマーセットを用いてPCR法により開始コドンから469番目までのアミノ酸に対応する塩基配列を増幅した。なお、GAD2は、500アミノ酸残基からなり、OsGAD1に見られるCaMBD(C末端側31残基)がみられないが、酵素活性を調節すると考えられるCaMBDに相当する31残基を欠失させ、酵素機能そのものを司る領域と考えられる469残基をコードするDNAにてベクターを構築することを試みた。
【0023】
このとき用いたセンスプライマーは配列番号3に示したように5’−CGTGCGTAGCCATGGTTCTG−3’、アンチセンスプライマーは配列番号4に示したように5’−AAAGCATGCCTAGGCGGTCCGGGCGGGGCC−3’である。なお、下線部は前者がNcoI認識配列を、後者がSphI認識配列を示す。PCRで得られたDNA断片は、GAD2のC末端側の31アミノ酸残基分を欠失させたものであり、以降では、このDNA断片を適宜GAD2ΔC31と称することとする。
【0024】
得られたGAD2ΔC31を大腸菌プラスミドに組み込み、その塩基配列を確認した。プラスミドは始めSphIで切断してT4DNAポリメラーゼによる平滑末端化後にNcoIで切断した。このDNA断片は、植物発現ベクターpCAMBIA1302(CAMBIA社製、オーストラリア)をNcoI/PlmI切断することにより、内生の緑色蛍光タンパク質をコードするDNA断片を取り除いてから、同じ位置に組み込んだ。
【0025】
そして、イネグルテリン遺伝子(GluB−1)のプロモーター領域2.3kb(非特許文献2)をXbaI/NcoIで切り出し、上記ベクターを同一の制限酵素で処理することにより内生のカリフラワーモザイクウイルス35Sプロモーターと置換した。本発明の一つの特徴は35Sプロモーターでなく、GluB−1プロモーターを用いたことにある。これは、本願発明者の検討の結果、汎用される35Sプロモーターを用いた形質転換イネでは、不稔という不具合があったためである。すなわち、本発明の一つの特徴は、この遺伝子カセットを有する発現ベクターであるといえる。
【0026】
このようにして作製した植物発現ベクターを、以降では適宜pCAMBIA GluB-1::GADΔC31と称することとする。なお、図1にこのベクター構築までの流れを示した。なお、本実施の形態では、GluB−1プロモーターの下流に、人工的な配列を介さずGAD2ΔC31を直接連結させている。
【0027】
<発現ベクターのアグロバクテリウム株への導入>
作製したベクターをエレクトロポレーション法によりアグロバクテリウム株EHA105へ導入した(非特許文献3参照)。バクテリア懸濁液は100mg/lカナマイシンを含むLB寒天培地(1%バクトトリプトン,0.5%酵母エキス,0.5%NaCl,1.5%寒天)を用い、28℃で2日間培養した。形成されたコロニーは滅菌ループでかき取り、上と同じ濃度のカナマイシンを含むAB培地(非特許文献4参照)に接種し、28℃で2〜3日間培養した。
【0028】
<イネ玄米の2N6培地でのカルス誘導>
イネ品種「キタアケ」の種籾を脱穀し、約50粒の玄米を、2倍希釈したブリーチ(花王製)を用いて30分間滅菌処理した。その後、玄米を滅菌水により5回洗浄し、2N6カルス誘導培地(非特許文献4参照)に置床した。これを、グロースチャンバー内(28℃,明:暗=16時間:8時間)で2〜3週間培養し、胚盤由来のカルスを形成させた。
【0029】
<アグロバクテリウムを介したイネカルス細胞の形質転換>
アグロバクテリウムを用いたイネの形質転換をおこなった。その方法、または、形質転換に際して使用する各種試薬は、通常の方法ないし試薬であるが、たとえば、イネに関して汎用される非特許文献4に開示の方法ないし試薬を用いることができる。
【0030】
目的の発現ベクターを運ぶアグロバクテリウムをN6CO液体培地に懸濁した。これに対して直径2〜3mmに増殖したカルスを適量入れた。カルスを取り出し、滅菌した濾紙の上で余分な水分を除いた後にN6CO寒天培地に静置し、23℃、3日間暗所で培養した。
【0031】
菌が充分に増殖したカルスを取り出し、除菌剤を含むN6CO液体培地でカルスを振とうさせながら洗浄した。この操作は5回繰り返した。カルスは滅菌濾紙上で余分な水分を除き、ハイグロマイシンを含むN6SE培地(選抜培地)に移しグロースチャンバー内(28℃,明:暗=16時間:8時間)で3〜4週間培養した。
【0032】
<耐性カルスの選抜と固体再生>
ハイグロマイシン耐性のカルスをMSRE培地(再分化培地)に移して、シュートが出現するまで培養を行った。発根したシュートは試験管内につくったホルモンフリーのMS培地に移し、植物体の成長を促した。
【0033】
<鉢上げ>
続いて、試験管から植物体を取り出して、根に付着した寒天を取り除き育苗用培土を入れたポットに移し、特定網室内で栽培を行い、次世代の種子(米)を収穫して各種の分析に供した。
【0034】
<形質転換イネ植物体の外来遺伝子組み込みの確認>
種子(T1世代)を籾摺り後、玄米を滅菌して50μg/mlのハイグロマイシンを含むMS寒天培地に播種した(非特許文献4参照)。約10日後に耐性植物体の葉片を材料としてCTAB法により全DNAを抽出した(DNA抽出技術については、たとえば非特許文献5に開示の技術を参照できる)。選択マーカーのハイグロマイシン耐性遺伝子配列を元にして作製したプライマーセットを用いてPCRを行った。なお、用いたセンスプライマーを配列番号5に、アンチセンスプライマーを配列番号6に示した。
【0035】
続いて、変性(95℃,30秒)→アニーリング(60℃,30秒)→伸長(72℃,60秒)を30サイクル繰り返した。反応サンプルは2%アガロースゲル電気泳動法により分画した。
【0036】
この結果、図2に示したように、野生型DNAではPCR増幅が観察されなかったのに対して、組換え植物から抽出したDNAを鋳型として用いたものでは、いずれも予想される800bpに対応する位置に増幅産物が観察された。このことから、調査した全ての植物体は目的の遺伝子が組み込まれていることが確認できた。
【0037】
<RT−PCR法を用いた玄米におけるGAD2ΔC31のRNAレベルでの発現解析>
形質転換植物の登熟過程で目的の遺伝子の発現が起きていることを調べるために、未熟種子(T1世代)を液体窒素下で破砕後にRNA抽出試薬セパゾールRNAI(ナカライテスク社製)を用いて全RNAを抽出した。全RNAと相補プライマーを混合し、0.5mM dNTP存在下で逆転写酵素SuperScriptII(GIBCO BRL社製)を用いてcDNA合成を42℃で1時間行った。なお、用いた相補プライマーを配列番号7に示した。
【0038】
10分の1容量のcDNAサンプルを鋳型として、プライマーセットを用いてPCRを行った。用いたセンスプライマーを配列番号8に示した。アンチセンスプライマーは、配列番号7に示したものと同じものを用いた。なお、反応条件は、95℃(30秒)、55℃(30秒)、72℃(30秒)であり、これを35サイクル繰り返した。適量の反応サンプルを2%アガロースゲル電気泳動法により分画した。その結果、図3に示したように、コントロールとして用いた野生型種子ではGAD2が発現していないか、あるいは非常に低いレベルであるのに対して、組換え植物由来の種子では高レベルのGAD2ΔC31の発現が観察された。
【0039】
<ウエスタン法によるタンパク質レベルでのGAD2ΔC31発現解析とGABA分析>
同一の形質転換植物の複数の種子(T1世代)を採取して、導入遺伝子のタンパク質レベルでの発現とGABA蓄積との関係を調べた。まず、玄米をマイクロチューブに入れて液体窒素で凍結破砕後に抽出バッファー(50mM Tris−HCl,pH7.5,5mM EDTA,1mM DTT,1mM PMSF)を加えて懸濁した。
【0040】
遠心分離(20,000g,20分間,4℃)後に上澄みを新しいチューブに移した。サンプルを2等分し、一方をタンパク質分析用に、もう一方をアミノ酸分析用に用いた。タンパク質のウエスタン分析は以下のように行った。タンパク質サンプル(約10μg)を12%SDS−ポリアクリルアミドゲル電気泳動法により分画し、タンパク質をセミドライブロッティング装置でメンブレンに転写した。
【0041】
TBST(10mM Tris−HCl,500mM NaCl,pH7.5,0.1%Tween−20)に5,000倍希釈したウサギ抗GAD2ポリクローナル抗体液にメンブレンを浸して、30分間振とうした。TBSTで5分間ずつ3回メンブレンを洗浄し、TBSTで5,000倍希釈した抗ウサギIgG−アルカリフォスファターゼに浸し30分間振とうした。メンブレンはTBSTで5分間ずつ3回洗浄し、検出バッファー(100mM Tris−HCl,pH9.5,100mM NaCl,50mM MgCl2)に移して平衡化した。検出バッファーで200倍希釈したCSPD(ロッシュ社製)でメンブレンを浸して5分間反応を行い、紫外線ランプ下で観察した。
【0042】
一方、遊離アミノ酸を抽出するために、サンプルに対して最終濃度8%(v/v)になるようにトリクロロ酢酸(TCA)を加えて撹拌した。遠心分離後、上澄みを新しいチューブに移し、等量のジエチルエーテルを加えて撹拌した。遠心分離を行い、上層のジエチルエーテルを除いた。この操作をさらにもう一度繰り返した。ドラフト内で完全にジエチルエーテルを揮発させ、一部を分析に用いた。
【0043】
アミノ酸サンプルをマイクロチューブに入れ、これに対して、100mMピロリン酸ナトリウム(pH9.0),0.5mM NADP+,0.6mM α−ケトグルタル酸,1.2mM 2−メルカプトエタノール,0.005ユニットGABase(シグマ社製)を加えて37℃で1時間反応させた。
【0044】
反応後にGABA合成に伴う還元型補酵素NADPHを紫外線照射により可視化、あるいは分光光度計(340nm)で定量分析した。この結果を図4に示す。図から明らかなように、玄米中に目的の酵素タンパク質GAD2ΔC31が高度に蓄積しているものでは、GABA含量も同様に高いレベルにあることが確認できた。
【0045】
以上から、GAD2ΔC31遺伝子の種子中での過剰発現の結果、細胞内でGAD酵素活性の上昇が引き起こされ、GABAの高濃度蓄積がもたらされることが確認できた。
【0046】
<玄米中の遊離アミノ酸の分析>
次に、玄米中の各種遊離アミノ酸の含量を定量するために、TCA法で抽出したアミノ酸サンプルを自動アミノ酸分析装置(日本電子社製JLC−300)にかけて定量分析を行った。この結果を図5に示す。図5−1のチャートに示すように、組換え玄米(T1世代)では野生型玄米に比べ、驚くべきことにGABAのみならず多くの種類のアミノ酸でその含量が増加していることが判明した。図5−2は野生型玄米と幾つかの組換え玄米(T1世代)のGABAとタンパク質性のアミノ酸含量を定量しまとめたものである。GABAの蓄積度が高いものほど、全体的にアミノ酸含量が高まる傾向にあることが確認できた。
【0047】
なお、この結果はT1世代であり、ばらつきが多いものの、必須アミノ酸では、2倍か14倍もの含量増が認められた。特に、リシンは、穀物中の含量増が望まれているアミノ酸の一種であり、チャートでは、少なくとも4倍増、多い系統では14倍増となっている。また、遊離アミノ酸の総量が30倍程度も増えており、これは、一つの遺伝子を操作したことからは想定できない、多面的な効果を引き起こしたものと考えられる。
【0048】
<特異抗体を用いた、組換え玄米中でのGAD2ΔC31タンパク質とGABAの免疫組織化学的検出>
種子中での導入遺伝子産物とそれにより作り出されたGABAの局在を調べるために、免疫組織化学的な手法を用いた検出を行った。なお、実施にあたっては、非特許文献6に開示されている手法に主に基づいて行った。
【0049】
まず、一晩水に浸した種子をメスで縦方向に2分割して、3%スキムミルクを含むTBS(10mM Tris−HCl,500mM NaCl,pH7.5)で3時間以上ブロッキングした。一次抗体として、ウサギ抗GAD2ポリクローナル抗体、あるいはウサギ抗GABAモノクローナル抗体を、1%スキムミルクを含むTBSで200倍希釈して用いた。
【0050】
一晩反応させた後に、TBSTで15分間3回洗浄した。二次抗体として、TBSTで2,000倍に希釈した抗ウサギIgG−アルカリフォスファターゼを用い2時間反応させた。検出反応はWestern Blue Stabilized Substrate for Alkaline Phosphatase(プロメガ社製)を用いて行い、実体顕微鏡を用いて染色の様子を観察した。図6は実体顕微鏡で得られた画像である。図に示したように、GAD2とGABAに対するいずれの特異抗体を用いた場合でも、組換え玄米ではこれらの局在を示す青い染色が胚乳組織において認められた。
【0051】
<玄米の各種成分の分析>
遊離アミノ酸以外の玄米中の各種成分分析をおこなうために、T3世代の玄米の化学成分分析を行った。その結果を図7に示した。水分と可溶無機窒素物(主にデンプン)を除き、ビタミン類および各種ミネラルはいずれの分析項目ともに組換え玄米が野生型を上回る値であった。その上昇率は1.3倍〜2.5倍であり、GADの直接の影響があるとは考えられない各種項目が著しく上昇していることが確認できた。
【0052】
特に、ミネラル分では、カリウムが2倍以上増えているため、GABAに加え血圧抑制作用が期待できる。また、ビタミンB1は糖質を分解する酵素を助け、ビタミンB6はタンパク質の代謝を促し、ビタミンEは過酸化脂質がつくられるのを防ぐため、これらが約2倍に増えていることも、好適に人体に影響を及ぼすこと期待できる。
【0053】
すなわち、図7の結果も図5の結果も全く想定外であり、これらの数値は、有意に上昇したとしてもせいぜい数項目について1.5倍程度までであると考えられるため、本発明の発現ベクターは、単にGABAの増加をもたらすのみならず、細胞内の代謝経路の活性化を引き起こすベクターであるといえる。
【0054】
<T2世代とT3世代の組換えイネ系統に関してのGABA含量の分析>
GABAの蓄積について遺伝的に安定した系統を開発するために、組換えイネ系統の当代(T0世代)の自家受粉によって得られた種子(T1世代)の自殖によるT2世代の種子12粒ずつをGABaseを用いた方法で分析した。
【0055】
その結果、図8Aに示すように、多くの系統で野生型や発芽玄米に比べて、高いGABA蓄積が確認された。これらの中からバラツキの少ない系統を選抜し、さらに世代を進めてT3世代におけるGABA分析を行った。図8Bに示したように、T3世代でも、野生型と同程度の玄米重量を持ちながら(小粒化することなく)、GABA含量が発芽玄米の2〜9倍のものが得られた。換言すれば、本発明の組換えイネ系統株は、世代の更新によっても稔性が維持されており、かつ、玄米重量も従来品種と同程度であるので、収量も保証された品種開発を可能とする。
【0056】
<玄米とその精白米でのGABA蓄積の比較分析>
組換えイネから得られた玄米で胚乳組織にGABAが蓄積していることをさらに検証するために、玄米(T3世代)を小型精米器(ケット科学社製)にかけて精白米にし、玄米とその精白米を粉砕してTCA法により遊離アミノ酸を抽出し、GABaseを用いた間接法によりGABA含量を測定した。その結果を図9に示す。図示したように、野生型では精米処理によりGABA含量が5分の1以下に低下したのに対して、組換えイネでは玄米とその精白米でのGABA含量はほとんど差が認められず、かつ、驚くほど多量に精白米自体(可食部である胚乳組織)にGABAが含有していることが確認できた。
【0057】
すなわち、系統によって異なるが、白米中のGABA含有量は少なくとも30mg/100gであり、多いものでは60mg/100gまで上昇した。野生型の白米が多くても0.5mg/100gであるため、60倍以上上昇することが確認できた。なお、野生型の玄米では2.9mg/100gであるため、これと比較しても10倍以上上昇することが確認できた。なお、この結果は、図6に示した結果と一致する。なお、本結果は、形質的にある程度安定化したT3世代における評価であるので、品種固定された場合であっても、同様の結果を期待できる。
【0058】
<高血圧ラットを用いた臨床試験>
特定網室で試験栽培・収穫された組換えイネ系統の玄米(T3世代)を脱穀後に籾摺り機にかけて玄米にした。玄米はブレンダーを用いて粉砕し、マウス・ラット用精製飼料AIN−93G(オリエンタル酵母社製)をベースにして、これに含まれる40%コーンスターチを同量比の玄米粉と配合変更することで特注飼料を作製した。
【0059】
組換え玄米の効果を調べるための臨床試験は以下のように行った。株式会社日本チャールズリバー社より購入した、9週齢のオスの本態性高血圧自然発症ラット(SHR/NCrlCrlj)を普通食にて1週間馴化後に、8匹ずつ2群に分けて、A群には野生型玄米粉の添加飼料を、B群には組換え玄米粉の添加試料を、C群には野生型玄米粉に発芽玄米と同程度となるように精製GABAを添加した添加試料を、それぞれ自由摂餌させて、食餌実験の開始前と1週間毎に5週目まで体重と血圧を測定した。
【0060】
その結果、5週目では、A群は平均血圧が235mmHgであり、B,C群はともに220mmHg以下となり、有意な血圧降下作用が確認できた。このほか、血液生化学的には、A群に比較してB群では、総コレステロール、中性脂肪、GOT、GPTの低下が確認された。
【0061】
<他の形質転換イネ植物体の作成および評価>
次に、上記「キタアケ」と同様にして、イネ品種「日本晴」に対して、形質転換イネを作出した。
T4世代における精白米の遊離アミノ酸含有量を自動アミノ酸分析装置により分析した結果を図10に示す。GABAに関しては野生型に比し3〜30倍の含有量の上昇が見られた。また、キタアケの結果と同様、GABAの蓄積度が高いものほど、全体的にアミノ酸含量が高まる傾向にあることが確認できた。
【0062】
次に、GABA含有量の多いこのT4世代の(47−52)系統と(78−87)系統に関し、遊離アミノ酸以外の白米中各種成分分析を行った結果を図11に示す。ビタミン類および各種ミネラルはいずれの分析項目ともに組換え米が野生型を上回る値であった。ここでも、GAD高発現の直接の影響があるとは考えられない各種項目が著しく上昇していることが確認できた。
【0063】
キタアケに導入した結果(図7)と同様に、特に、ミネラル分では、カリウムが2倍以上増えているため、GABAに加え血圧抑制作用が期待できる。また、ビタミンB1は糖質を分解する酵素を助け、ビタミンB6はタンパク質の代謝を促し、ビタミンEは過酸化脂質がつくられるのを防ぐため、これらが約2倍に増えていることも、好適に人体に影響を及ぼすこと期待できる。
【0064】
<高血圧ラットへの経口投与試験>
次に、高血圧ラットであるSHR/Izmへ、(47−52)系統の白米をすり潰した餌を一日一回5週間与えて、血圧変化を観察した。SHR/Izmは、一般に5,6週齢から高血圧の傾向が現れ始め、おおよそ11週齢あたりで高血圧状態への移行が完了する。評価に際しては9週齢から6匹ずつ3グループに分け、
・標準餌+すり潰した通常精白米投与(コントロール群)
・標準餌+個体1kgに対してGABA量換算で0.1mgの投与となるようにすり潰した(47−52)系統の白米投与
・標準餌+個体1kgに対してGABA量換算で0.5mgの投与となるようにすり潰した(47−52)系統の白米投与
で評価した。結果を図12に示す。図示したように、コントロール群とGABA量が少ない群とは有意差は見られなかったが、GABA量が多い群では、高血圧状態への移行抑制が確認できた。なお、3群とも、体重差は見られなかった。
【0065】
次に、この(47−52)系統の組換え白米と野生型(日本晴)白米とを、かつ脳卒中易発症高血圧ラット(SHRSP)へ経口投与した場合の血圧の経時変化を観察した。図13に結果を示す。図から明らかなように投与後次第に血圧降下が観測され、8時間で最も血圧が下がり24時間では略通常の高血圧状態に戻ることが確認できた。なお、投与量は、生体1kgに対して0.5mgのGABAとなるような白米量とした。
【0066】
図12、図13に示した結果から、組換え白米には、確かに白米摂取による血圧降下作用があることが分かった。
【0067】
<水浸漬処理によるGABA含有量の変化>
GABAは、グルタミン酸がGADおよび補酵素ピリドキサルリン酸 (PLP) の介在のもと、脱炭酸反応によって生成される。また、玄米は浸漬処理により発芽玄米としてGABA強化米として流通している。そこで、組み換えない日本晴(WildType:WT)と(47−52)系統とを用いて、
・水浸漬するだけの群(w/o)
・グルタミン酸(Glu)添加+水浸漬の群
・補酵素PLP添加+水浸漬の群
・グルタミン酸(Glu)添加+補酵素PLP添加+水浸漬の群
でGABAの含有量変化を観測した。結果を図14に示す。図示したように、Glu+PLPの両方を添加したものは、組み換えないものも組み換えたものも上昇率が大きいが、組換え体は上昇率および絶対量が極めて大きなことを確認した。PLPはビタミンであるので、たとえば、本発明の白米は、炊き込み御飯に用いたり、α化して非常食等への加工に適しているといえる。
【産業上の利用可能性】
【0068】
本発明は、生活習慣病患者の食事療法や中高年者以上の常用食として用いることができる。また、本発明のベクターを用いて、機能性成分強化米を開発することができる。ここで、機能性成分強化米とは、必須アミノ酸、および/または、ビタミン、および/または、ミネラルが、野生型ないし既存品種に比べて増強されている米をいう。
【図面の簡単な説明】
【0069】
【図1】本発明にかかる植物発現ベクターpCAMBIA GluB-1::GAD2ΔC31の構築方法を示す工程図である。
【図2】T1世代の植物体における外来遺伝子の組み込みの確認をPCR法によって行った結果を示す電気泳動図である。
【図3】T1世代の未熟種子におけるGAD2ΔC31遺伝子の転写レベルでの発現をRT−PCRによって確認した電気泳動図である。
【図4】T1世代の玄米から抽出した、GABA含量の分析の蛍光図とGAD2ΔC31タンパク質のウエスタン解析の結果を示す図である。
【図5−1】T1世代の玄米から抽出した遊離アミノ酸の自動アミノ酸分析装置を用いて分析したチャートである。
【図5−2】野生型玄米と組換え玄米のアミノ酸分析の結果を比較して表にまとめたものである。
【図6】抗GAD2抗体と抗GABA抗体を用いて組換え玄米におけるGAD2ΔC31タンパク質とGABAの局在を免疫組織化学的手法によって明らかにした図である。
【図7】野生型玄米と組換え玄米に含まれる各種成分を定量分析した結果をもとめた表である。
【図8】後代(T2世代とT3世代)での玄米のGABA分析を行った結果である。
【図9】玄米とその精白米でのGABA含有量を調べて比較した図である。
【図10】組換え日本晴のT4世代における精白米の遊離アミノ酸含有量を自動アミノ酸分析装置により分析した結果を示した図である。
【図11】遊離アミノ酸以外の白米中の各種成分分析を行った結果である。
【図12】高血圧ラットSHR/IzmへGABA強化米(白米)を経口投与した場合の血圧の長期変化を示した図である。
【図13】ラットSHRSPへGABA強化米(白米)を経口投与した場合の血圧の24時間の変化の様子を示した図である。
【図14】水浸漬とGABAの変化を添加物を変えて測定した図である。なお、なお、自動アミノ酸分析装置を用いた精密な定量評価でないため、絶対値としては図10と相違する。
【特許請求の範囲】
【請求項1】
配列番号2に記載のアミノ酸配列をコードするDNA、若しくは、配列番号2に記載のアミノ酸配列の1若しくは数個のアミノ酸の置換、欠失、挿入、付加、又は逆位を含むアミノ酸配列をコードするDNAを導入した形質転換イネ。
【請求項2】
前記アミノ酸配列をコードするDNAがイネグルテリン遺伝子のプロモーター領域の下流側に連結している請求項1に記載の形質転換イネ。
【請求項3】
請求項1または請求項2に記載の形質転換イネから得られ、GABAを少なくとも30mg/100g含有した血圧降下作用を有する白米。
【請求項4】
イネグルテリン遺伝子のプロモーター領域と、
配列番号2に記載のアミノ酸配列をコードするDNAまたは配列番号2に記載のアミノ酸配列の1若しくは数個のアミノ酸の置換、欠失、挿入、付加、又は逆位を含むアミノ酸配列をコードするDNAと、
を連結した遺伝子を有し、胚乳部のGABA含量を高めるイネ用ベクター。
【請求項5】
イネグルテリン遺伝子のプロモーター領域と、
配列番号2に記載のアミノ酸配列または配列番号2に記載のアミノ酸配列の1若しくは数個のアミノ酸の置換、欠失、挿入、付加、又は逆位を含むアミノ酸配列をコードするDNAと、
を連結した遺伝子を有し、玄米のミネラル、遊離アミノ酸、または、ビタミン含量、を高めるイネ用ベクター。
【請求項6】
配列番号2に記載のアミノ酸配列、または、配列番号2に記載のアミノ酸配列の1若しくは数個のアミノ酸の置換、欠失、挿入、付加、又は逆位を含むアミノ酸配列、をコードするDNAを有する機能性成分強化米開発用ベクター。
【請求項1】
配列番号2に記載のアミノ酸配列をコードするDNA、若しくは、配列番号2に記載のアミノ酸配列の1若しくは数個のアミノ酸の置換、欠失、挿入、付加、又は逆位を含むアミノ酸配列をコードするDNAを導入した形質転換イネ。
【請求項2】
前記アミノ酸配列をコードするDNAがイネグルテリン遺伝子のプロモーター領域の下流側に連結している請求項1に記載の形質転換イネ。
【請求項3】
請求項1または請求項2に記載の形質転換イネから得られ、GABAを少なくとも30mg/100g含有した血圧降下作用を有する白米。
【請求項4】
イネグルテリン遺伝子のプロモーター領域と、
配列番号2に記載のアミノ酸配列をコードするDNAまたは配列番号2に記載のアミノ酸配列の1若しくは数個のアミノ酸の置換、欠失、挿入、付加、又は逆位を含むアミノ酸配列をコードするDNAと、
を連結した遺伝子を有し、胚乳部のGABA含量を高めるイネ用ベクター。
【請求項5】
イネグルテリン遺伝子のプロモーター領域と、
配列番号2に記載のアミノ酸配列または配列番号2に記載のアミノ酸配列の1若しくは数個のアミノ酸の置換、欠失、挿入、付加、又は逆位を含むアミノ酸配列をコードするDNAと、
を連結した遺伝子を有し、玄米のミネラル、遊離アミノ酸、または、ビタミン含量、を高めるイネ用ベクター。
【請求項6】
配列番号2に記載のアミノ酸配列、または、配列番号2に記載のアミノ酸配列の1若しくは数個のアミノ酸の置換、欠失、挿入、付加、又は逆位を含むアミノ酸配列、をコードするDNAを有する機能性成分強化米開発用ベクター。
【図10】


【図11】


【図12】


【図13】


【図14】


【図1】


【図2】


【図3】


【図4】


【図5−1】


【図5−2】


【図6】


【図7】


【図8】


【図9】




【図11】


【図12】


【図13】


【図14】


【図1】


【図2】


【図3】


【図4】


【図5−1】


【図5−2】


【図6】


【図7】


【図8】


【図9】


【公開番号】特開2008−129(P2008−129A)
【公開日】平成20年1月10日(2008.1.10)
【国際特許分類】
【出願番号】特願2007−35778(P2007−35778)
【出願日】平成19年2月16日(2007.2.16)
【新規性喪失の例外の表示】特許法第30条第1項適用申請有り 2006年3月 第47回日本植物生理学会年会委員会発行の「第47回日本植物生理学会年会要旨集」に発表
【出願人】(504155293)国立大学法人島根大学 (113)
【Fターム(参考)】
【公開日】平成20年1月10日(2008.1.10)
【国際特許分類】
【出願日】平成19年2月16日(2007.2.16)
【新規性喪失の例外の表示】特許法第30条第1項適用申請有り 2006年3月 第47回日本植物生理学会年会委員会発行の「第47回日本植物生理学会年会要旨集」に発表
【出願人】(504155293)国立大学法人島根大学 (113)
【Fターム(参考)】
[ Back to top ]

