形質転換酵母、それを用いた動物核内受容体リガンドの分析方法および分析キット
【課題】 高検出感度で核内受容体のリガンドの分析が可能な形質転換酵母を提供する。
【解決手段】 本発明の形質転換酵母は、核内受容体遺伝子およびレポーター遺伝子が発現可能に導入されており、かつ核内受容体リガンドと核内受容体との複合体を認識して前記レポーター遺伝子を発現し得る形質転換酵母であって、さらに、細胞壁タンパク質の機能および排出ポンプタンパク質の機能の少なくとも一方が欠損されたことを特徴とする。本発明の形質転換酵母を使用すれば、核内受容体のリガンドを高感度で分析可能である。前記核内受容体遺伝子は、例えば、ヒト核内受容体のコード遺伝子であることが好ましい。
【解決手段】 本発明の形質転換酵母は、核内受容体遺伝子およびレポーター遺伝子が発現可能に導入されており、かつ核内受容体リガンドと核内受容体との複合体を認識して前記レポーター遺伝子を発現し得る形質転換酵母であって、さらに、細胞壁タンパク質の機能および排出ポンプタンパク質の機能の少なくとも一方が欠損されたことを特徴とする。本発明の形質転換酵母を使用すれば、核内受容体のリガンドを高感度で分析可能である。前記核内受容体遺伝子は、例えば、ヒト核内受容体のコード遺伝子であることが好ましい。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、形質転換酵母、それを用いた動物核内受容体リガンドの分析方法および分析キットに関する。
【背景技術】
【0002】
環境中の化学物質の分析方法として、近年、核内受容体遺伝子を組み込んだ宿主細胞を使用して、レポーター遺伝子の発現の程度により、前記化学物質を分析するという手法が開発されている。この方法によれば、例えば、生物的な影響も評価できる。前記宿主細胞は、例えば、動物細胞および酵母が使用されている。
【0003】
前記動物細胞は、例えば、ヒトの細胞株が使用されている。ヒト由来細胞を用いた分析は、例えば、アンドロゲンレセプター(AR)に結合するリガンドであるテストステロン(T)等の分析が報告されている。この方法は、例えば、アンドロゲンレセプター(AR)遺伝子を組み込んだヒト由来細胞株が使用されている(非特許文献1)。
【0004】
一方、酵母を用いた方法は、例えば、雌化現象等で注目された環境ホルモン(内分泌撹乱物質)について、エストロゲン様活性の分析が報告されている。この方法は、例えば、ブルーギル由来のエストロゲン受容体遺伝子(特許文献1)、オオマキトカゲ由来エストロゲン受容体遺伝子、(特許文献2)、ワニ由来エストロゲン受容体遺伝子(特許文献3)、ファットヘッドミノー由来エストロゲン受容体遺伝子(特許文献4)等の各種動物のエストロゲン受容体遺伝子を酵母に組み込み、レポーター遺伝子の発現を測定するという手法が開発されている(特許文献1、特許文献2、特許文献3、特許文献4)。この他に、例えば、ヒト由来エストロゲン受容体遺伝子を組み込んだ形質転換酵母を用いて、アルキルフェノール化合物のエストロゲン様活性を測定する手法が開発されている(非特許文献2)。また、例えば、ダイオキシン等のアリールハイドロカーボン類を測定するために、モルモット由来のアリールハイドロカーボン受容体遺伝子を組み込んだ形質転換酵母を用いた手法が開発されている(特許文献5)。
【0005】
前記酵母を用いた手法では、前記酵母において、核内受容体遺伝子が発現し、発現した核内受容体に、測定対象のリガンド(例えば、化学物質等)が結合して複合体を形成する。そして、この複合体が、酵母内のレポーター遺伝子を発現させる。前記レポーター遺伝子は、例えば、β−ガラクトシダーゼ遺伝子が使用されており、β−ガラクトシダーゼの酵素活性の測定により、前記レポーター遺伝子の発現が測定できる。
【0006】
前記酵母を用いた分析方法は、動物細胞を用いた分析方法に比べて、例えば、短時間での分析が可能であり、操作の簡便性および低コスト等の利点を有する。しかしながら、酵母を用いた分析方法では、動物細胞を用いた分析手法に比べ、分析感度が低いという問題がある。
【先行技術文献】
【特許文献】
【0007】
【特許文献1】特開2001−197890号公報
【特許文献2】特開2003−274号公報
【特許文献3】特開2002−360273号公報
【特許文献4】特開2001−352992号公報
【特許文献5】特開2005−87077号公報
【非特許文献】
【0008】
【非特許文献1】Toxicology 220(2006)90−103
【非特許文献2】The Journal Of Biological Chemistry Vol.272,No.6,Feb.7 pp.3280−3288
【発明の概要】
【発明が解決しようとする課題】
【0009】
そこで、本発明の目的は、核内受容体リガンドを、高感度で分析可能な形質転換酵母、それを用いた核内受容体リガンドの分析方法および分析キットを提供することである。より詳細には、例えば、前記酵母に発現させる核内受容体の種類に関わらず、前記核内受容体リガンドを高感度で分析可能な形質転換酵母、それを用いた核内受容体リガンドの分析方法および分析キットを提供する。
【課題を解決するための手段】
【0010】
前記目的を達成するために、本発明の形質転換酵母は、核内受容体遺伝子およびレポーター遺伝子が発現可能に導入されており、かつ核内受容体リガンドと核内受容体との複合体を認識して前記レポーター遺伝子を発現し得る形質転換酵母であって、さらに、細胞壁タンパク質の機能および排出ポンプタンパク質の機能の少なくとも一方が欠損されたことを特徴とする。
【0011】
本発明の分析方法は、検体に含まれる核内受容体リガンドを分析するための方法であって、
検体を含む培地中で、前記本発明の形質転換酵母を培養する培養工程と、
前記培養工程の後、前記培地中に産生された前記レポーター遺伝子の発現産物を測定する測定工程とを含むことを特徴とする。
【0012】
本発明の分析キットは、検体に含まれる核内受容体リガンドを分析するためのキットであって、
(a)培地と、
(b)前記本発明の形質転換酵母と、
(c)発色試薬と
を備えることを特徴とする。
【発明の効果】
【0013】
本発明の形質転換酵母によれば、メカニズムは不明であるが、細胞壁タンパク質の機能および排出ポンプタンパク質の機能の少なくとも一方を欠損することによって、核内受容体に対するリガンドの分析感度を向上できる。このため、本発明の形質転換酵母によれば、核内受容体に対するリガンドを、高感度で分析可能である。特に、本発明の形質転換酵母は、前記形質転換酵母に導入される前記核内受容体遺伝子の種類に関わらず、リガンドの分析感度を向上できる。例えば、野生型の酵母等、従来公知の酵母によると、導入される核内受容体の種類によって、リガンドが存在しているにも関わらず、リガンドを検出できない場合がある。これに対して、本発明の形質転換酵母は、導入する前記核内受容体の種類に関わらず、例えば、前記野生型の酵母等では行うことができなかったリガンドの検出も可能である。このように本発明の形質転換酵母は、前記核内受容体遺伝子の種類に関わらず使用可能であることから、核内受容体の分析において、汎用性の高いツールと言える。また、本発明の分析キットを用いれば、さらに簡便に、核内受容体に対するリガンドの分析を実施できる。
【図面の簡単な説明】
【0014】
【図1】図1の(A)、(B)および(C)は、本発明の実施例2におけるβ−ガラクトシダーゼ活性の測定結果を示すグラフである。
【図2】図2は、本発明の実施例4におけるβ−ガラクトシダーゼ活性の測定結果を示すグラフである。
【図3】図3は、本発明の実施例6におけるβ−ガラクトシダーゼ活性の測定結果を示すグラフである。
【図4】図4は、本発明の実施例8におけるβ−ガラクトシダーゼ活性の測定結果を示すグラフである。
【図5】図5は、本発明の実施例10におけるβ−ガラクトシダーゼ活性の測定結果を示すグラフである。
【図6】図6は、本発明の実施例12におけるβ−ガラクトシダーゼ活性の測定結果を示すグラフである。
【図7】図7は、本発明の実施例14におけるβ−ガラクトシダーゼ活性の測定結果を示すグラフである。
【図8】図8は、本発明の実施例16におけるβ−ガラクトシダーゼ活性の測定結果を示すグラフである。
【図9】図9は、本発明の実施例18におけるβ−ガラクトシダーゼ活性の測定結果を示すグラフである。
【図10】図10は、本発明の実施例20におけるβ−ガラクトシダーゼ活性の測定結果を示すグラフである。
【図11】図11は、本発明の実施例22におけるβ−ガラクトシダーゼ活性の測定結果を示すグラフである。
【図12】図12は、本発明の実施例24におけるβ−ガラクトシダーゼ活性の測定結果を示すグラフである。
【発明を実施するための形態】
【0015】
本発明の形質転換酵母は、前述のように、核内受容体遺伝子およびレポーター遺伝子が発現可能に導入されており、かつ核内受容体リガンドと核内受容体との複合体を認識して前記レポーター遺伝子を発現し得る形質転換酵母であって、
さらに、細胞壁タンパク質の機能および排出ポンプタンパク質の機能の少なくとも一方が欠損されたことを特徴とする。
【0016】
本発明の形質転換酵母は、前記細胞壁タンパク質のコード遺伝子を欠失することにより、前記細胞壁タンパク質の機能を欠損することが好ましい。
【0017】
本発明の形質転換酵母は、前記細胞壁タンパク質のコード遺伝子が、マンナン結合タンパク質のコード遺伝子であることが好ましい。
【0018】
本発明の形質転換酵母は、前記マンナン結合タンパク質のコード遺伝子が、CWP1遺伝子、CWP2遺伝子、CCW14遺伝子、CIS3遺伝子、KRE11遺伝子、PIR1遺伝子、PIR3遺伝子、TIP1遺伝子、TIR1遺伝子、TIR2遺伝子からなる群から選択された少なくとも一つであることが好ましい。
【0019】
本発明の形質転換酵母は、前記排出ポンプタンパク質のコード遺伝子を欠失することにより、前記排出ポンプタンパク質の機能を欠損することが好ましい。
【0020】
本発明の形質転換酵母は、前記排出ポンプタンパク質のコード遺伝子が、ABCトランスポーター遺伝子であることが好ましい。
【0021】
本発明の形質転換酵母は、前記ABCトランスポーター遺伝子が、PDR5遺伝子、STE6遺伝子、PDR12遺伝子、PDR15遺伝子、SNQ2遺伝子、YOR1遺伝子、YDR061W遺伝子、PDR18遺伝子、YOL075C遺伝子、YBT1遺伝子、AUS1遺伝子、PDR10遺伝子、PDR11遺伝子からなる群から選択された少なくとも一つであることが好ましい。
【0022】
本発明の形質転換酵母は、前記細胞壁タンパク質のコード遺伝子および前記排出ポンプタンパク質のコード遺伝子を欠失することが好ましい。
【0023】
本発明の形質転換酵母は、前記核内受容体が、動物核内受容体であることが好ましく、より好ましくは、ヒト核内受容体である。
【0024】
本発明の形質転換酵母は、前記核内受容体が、ホモ二量体、ヘテロ二量体または単量体の受容体であることが好ましい。前記ヘテロ二量体の受容体は、レチノイドX受容体(RXR)を含む受容体が好ましく、より好ましくは前記RXRとPXRとのヘテロ二量体である。
【0025】
本発明の形質転換酵母は、前記レポーター遺伝子が、β−ガラクトシダーゼ遺伝子が好ましい。
【0026】
本発明の形質転換酵母は、前記核内受容体遺伝子を染色体上に有し、
前記レポーター遺伝子をプラスミドに有し、
前記プラスミドは、前記レポーター遺伝子と作動的に組み込まれた核内受容体応答配列を含むことが好ましい。
【0027】
本発明の形質転換酵母は、出芽酵母(Saccharomyces cerevisiae)であることが好ましい。
【0028】
本発明の形質転換酵母は、検体に含まれる核内受容体リガンドの分析に使用されることが好ましい。
【0029】
本発明の分析方法は、前述のように、検体に含まれる核内受容体リガンドを分析するための方法であって、
検体を含む培地中で、前記本発明の形質転換酵母を培養する培養工程と、
前記培養工程の後、前記培地中に産生された前記レポーター遺伝子の発現産物を測定する測定工程とを含むことを特徴とする。
【0030】
本発明の分析方法は、前記レポーター遺伝子が、β−ガラクトシダーゼ遺伝子であり、
前記培地が、炭素源として、ガラクトースおよびグルコースの少なくとも一方を含むことが好ましい。
【0031】
本発明の分析方法は、前記培地が、ガラクトースおよびグルコースを含み、
ガラクトースおよびグルコースの合計に対するグルコースの重量割合が、0を超え60重量%以下の範囲であることが好ましい。
【0032】
本発明の分析方法は、前記形質転換酵母が、予め、グリセロール存在下で保存されていた酵母であることが好ましい。
【0033】
本発明の分析方法は、前記形質転換酵母が、予め、グルコース単独を炭素源とする培地で培養された酵母であることが好ましい。
【0034】
本発明の分析キットは、前述のように、検体に含まれる核内受容体リガンドを分析するための分析キットであって、
(a)培地と、
(b)前記本発明の形質転換酵母と、
(c)発色試薬と
を備えることを特徴とする。
【0035】
本発明の分析キットは、前記培地が、グルコースおよびガラクトースの少なくとも一方を含む培地であることが好ましい。
【0036】
つぎに、本発明について詳しく説明する。
【0037】
本発明の形質転換酵母は、前述のように、例えば、導入される核内受容体遺伝子の種類に関わらず、前記核内受容体遺伝子から発現された核内受容体に結合する検体中のリガンドを検出できる。このため、本発明において、前記核内受容体および前記核内受容体に対するリガンドは、特に制限されない。
【0038】
前記核内受容体遺伝子は、例えば、分析対象のリガンドに応じて、適宜選択すればよい。前記核内受容体遺伝子から発現する核内受容体の構造は、特に制限されず、単量体および二量体等があげられる。前記二量体は、例えば、同じ分子から構成されるホモ二量体でもよいし、異なる分子から構成されるヘテロ二量体でもよい。
【0039】
前記核内受容体を構成する分子は、特に制限されず、例えば、以下のものがあげられる。
【0040】
(1)TRα:Thyroid Hormone Receptor alpha
(2)TRβ:Thyroid Hormone Receptor beta
(3)RARα:Retinoic Acid Receptor alpha
(4)RARβ:Retinoic Acid Receptor beta
(5)RARγ:Retinoic Acid Receptor gamma
(6)PPARα:Peroxisome proliferator activated receptor alpha(PPAR−alpha)
(7)PPARδ:Peroxisome proliferator activated receptor delta(PPAR−delta、PPAR−beta、Nuclear hormone receptor 1、NUC1)
(8)PPARγ1:Peroxisome proliferator activated receptor gamma 1(PPAR−gamma1)
(9)PPARγ2:Peroxisome proliferator activated receptor gamma 2(PPAR−gamma2)
(10)Rev−erbα:Orphan nuclear receptor NR1D1(V−erbA related protein EAR−1、Rev−erbA−alpha)
(11)Rev−erbβ:Orphan nuclear receptor NR1D2(Rev−erb−beta、EAR−1R、Orphan nuclear hormone receptor BD73)
(12)RORα:Nuclear receptor ROR−alpha(Nuclear receptor RZR−alpha)
(13)RORβ:Nuclear receptor ROR−beta(Nuclear receptor RZR−beta)
(14)RORγ:Nuclear receptor ROR−gamma(Nuclear receptor RZR−gamma)
(15)LXRβ:Oxysterols receptor LXR−beta (Liver X receptor beta、Nuclear orphan receptor LXR−beta、Ubiquitously−expressed nuclear receptor、Nuclear receptor NER)
(16)LXRα:Oxysterols receptor LXR−alpha(Liver X receptor alpha、Nuclear orphan receptor LXR−alpha)
(17)FXR:Bile acid receptor(Farnesoid X−activated receptor、Farnesol receptor HRR−1、Retinoid X receptor−interacting protein 14、RXR−interacting protein 14)
(18)VDR:Vitamin D3 receptor(VDR、1,25−dihydroxyvitamin D3 receptor)
(19)PXR−1:Orphan nuclear receptor PXR−1(Pregnane X receptor−1、Orphan nuclear receptor PAR−1、Steroid and xenobiotic receptor−1、SXR−1)
(20)PXR−2:Orphan nuclear receptor PXR−2(Pregnane X receptor−2、Orphan nuclear receptor PAR−2、Steroid and xenobiotic receptor−2、SXR−2)
(21)CAR:Orphan nuclear receptor NR1I3(Constitutive androstane receptor、CAR、Orphan nuclear receptor MB67)
(22)HNF4α:Hepatocyte nuclear factor 4−alpha(HNF−4−alpha、Transcription factor 14)
(23)HNF4γ:Hepatocyte nuclear factor 4−gamma(HNF−4−gamma)
(24)RXRα:Retinoid X receptor RXR−alpha
(25)RXRβ:Retinoid X receptor RXR−beta
(26)RXRγ:Retinoid X receptor RXR−gamma
(27)TR2:Nuclear Hormone Receptor TR2(Orphan nuclear receptor TR2)
(28)TR4:Orphan nuclear receptor TR4(Orphan nuclear receptor TAK1)
(29)TLX:Orphan nuclear receptor NR2E1(Nuclear receptor TLX、Tailless homolog、Tll、hTll)
(30)PNR:Photoreceptor−specific nuclear receptor(Retina−specific nuclear receptor)
(31)COUP−TF I:COUP transcription factor 1(COUP−TF1、COUP−TFα、V−erbA related protein EAR−3)
(32)COUP−TF II:COUP transcription factor 2(COUP−TF2、COUP−TFβ、Apolipoprotein AI regulatory protein−1、ARP−1)
(33)EAR−2:Orphan nuclear receptor EAR−2(V−erbA related protein EAR−2、COUP−TFγ)
(34)ERα:Estrogen receptor(ER、Estradiol receptor、ER−alpha)
(35)ERβ:Estrogen receptor beta(ER−beta)
(36)ERRα:Steroid hormone receptor ERR1(Estrogen−related receptor, alpha、ERR−alpha、Estrogen receptor−like 1)
(37)ERRβ:Steroid hormone receptor ERR2(Estrogen−related receptor,beta、ERR−beta、Estrogen receptor−like 2、ERR beta−2)
(38)ERRγ:Estrogen−related receptor gamma(Estrogen receptor related protein 3、ERR gamma−2)
(39)GRα:Glucocorticoid receptor alpha
(40)GRβ:Glucocorticoid Receptor beta
(41)MR:Mineralcorticoid receptor(MR)
(42)PRα:Progesterone receptor alpha
(43)PRβ:Progesterone receptor beta
(44)AR:Androgen receptor(Dihydrotestosterone receptor)
(45)NGFI−Bα:Orphan nuclear receptor HMR(Early response protein NAK1、TR3 orphan receptor)
(46)NGFI−Bβ:Orphan nuclear receptor NURR1(Immediate−early response protein NOT、Transcriptionally inducible nuclear receptor)
(47)NGFI−Bγ:Nuclear hormone receptor NOR−1(Neuron−derived orphan receptor 1、Mitogen induced nuclear orphan receptor)
(48)SF−1:Steroidogenic factor 1(STF−1、SF−1、Steroid hormone receptor AD4BP、Fushi tarazu factor homolog 1、FTZ−FIα)
(49)LRH−1:Orphan nuclear receptor NR5A2(Alpha−1−fetoprotein transcription factor、Hepatocytic transcription factor、B1−binding factor、hB1F、CYP7A promoter binding factor、FTZ−FIβ)
(50)GCNF:Germ cell nuclear factor(Orphan nuclear receptor NR6A1、Retinoid receptor−related testis specific receptor、RTR)
(51)DAX1:Orphan nuclear receptor DAX−1
(52)SHP:Small heterodimer partner(Orphan nuclear receptor SHP)
(53)AhR:aryl hydrocarbon receptor(AHR、Dioxin nuclear receptor)
【0041】
前記ホモ二量体の核内受容体は、例えば、TR4、HNF4α、HNF4γ、RXRα、RXRβ、RXRγ、TR2、PNR、COUP−TF I、COUP−TF II、EAR2、ERα、ERβ、GRα、GRβ、MR、PRα、PRβ、AR等があげられる。
【0042】
前記ヘテロ二量体の核内受容体は、例えば、RXRを含む核内受容体またはArntを含む核内受容体があげられる。前記RXRを含む核内受容体は、二量体を構成する他方の分子として、例えば、TRα、TRβ、RARα、RARβ、RARγ、PPARα、PPARδ、PPARγ、LXRβ、LXRα、FXR、VDR、PXR−1、PXR−2、CARがあげられる。中でも、RXRとPXR−1とのヘテロ二量体(RXR/PXR−1)、およびRXRとPXR−2とのヘテロ二量体(RXR/PXR−2)が特に好ましい。また、前記Arntを含む核内受容体は、二量体を構成する他の分子として、例えば、AhRがあげられる。
【0043】
前記単量体の核内受容体は、例えば、Rev−erbα、Rev−erbβ、RORα、RORβ、RORγ、TLX、ERRα、ERRβ、ERRγ、SF−1、LRH、GCNF、DAX1、SHPがあげられる。
【0044】
前記単量体、ホモ二量体およびヘテロ二量体のいずれをも取り得る核内受容体は、例えば、NGF1−Bα、NGF1−Bβ、NGF1−Bγがあげられる。
【0045】
本発明においては、前記核内受容体遺伝子の種類を適宜設定することで、前記核内受容体に対するリガンドを検出できる。なお、本発明において分析対象のリガンドは、例えば、前記核内受容体に結合する公知リガンドでもよいし、前記核内受容体に結合する未知のリガンドでもよい。
【0046】
本発明において、前記核内受容体は、例えば、分析対象のリガンドに応じて、適宜選択すればよい。
【0047】
<形質転換酵母>
本発明の形質転換酵母は、前述のように、核内受容体遺伝子およびレポーター遺伝子が発現可能に導入されており、かつ核内受容体リガンドと核内受容体との複合体を認識して前記レポーター遺伝子を発現し得る形質転換酵母であって、さらに、細胞壁タンパク質の機能および排出ポンプタンパク質の機能の少なくとも一方が欠損されたことを特徴とする。
【0048】
本発明の形質転換酵母は、例えば、出芽酵母、分裂酵母、糸状酵母等があげられ、出芽酵母(Saccharomyces cerevisiae)が好ましい。本発明の形質転換酵母の形態は、特に制限されず、例えば、培養液、凍結乾燥菌体、グリセロール存在下での保存菌体(グリセロールストック)等の形態があげられる。
【0049】
本発明の形質転換酵母は、前記細胞壁タンパク質の機能および前記排出ポンプタンパク質の機能の少なくとも一方を欠損すればよい。本発明の形質転換酵母は、例えば、前記細胞壁タンパク質の機能および前記排出ポンプタンパク質の機能のいずれか一方のみが欠損されてもよいが、前記細胞壁タンパク質の機能および前記排出ポンプタンパク質の機能の両方が欠損されたことが好ましい。
【0050】
前記細胞壁タンパク質は、特に制限されず、例えば、マンナン結合タンパク質等があげられる。前記マンナン結合タンパク質は、例えば、CWP1タンパク質、CWP2タンパク質、CCW14タンパク質、CIS3タンパク質、KRE11タンパク質、PIR1タンパク質、PIR3タンパク質、TIP1タンパク質、TIR1タンパク質、TIR2タンパク質等があげられる。本発明の形質転換酵母において、前記機能が欠損された前記細胞壁タンパク質の種類は、例えば、一種類でもよいし、二種類以上でもよい。後者の場合、機能が欠損した前記細胞壁タンパク質の組合せは、特に制限されず、例えば、CWP1タンパク質とCWP2タンパク質の組合せが例示できる。
【0051】
前記排出ポンプタンパク質は、特に制限されず、例えば、ABC(ATP−Binding Cassette)トランスポータータンパク質、MFS(major facilitator superfamily)トランスポータータンパク質等があげられる。前記ABCトランスポータータンパク質は、例えば、PDR5タンパク質、STE6タンパク質、PDR12タンパク質、PDR15タンパク質、SNQ2タンパク質、YOR1タンパク質、YDR061Wタンパク質、PDR18タンパク質、YOL075Cタンパク質、YBT1タンパク質、AUS1タンパク質、PDR10タンパク質、PDR11タンパク質等があげられる。本発明の形質転換酵母において、前記機能が欠損した前記排出ポンプタンパク質の種類は、例えば、一種類でもよいし、二種類以上でもよい。後者の場合、機能が欠損した前記排出ポンプの組合せは、特に制限されず、例えば、PDR5タンパク質とPDR10タンパク質の組み合わせが例示できる。
【0052】
本発明の形質転換酵母は、前述のように、前記細胞壁タンパク質の機能および前記排出ポンプタンパク質の機能の両方が欠損されたことが好ましい。機能が欠損された前記細胞壁タンパク質および前記排出ポンプタンパク質の組み合わせは、特に制限されない。前記組み合わせは、例えば、前記マンナン結合タンパク質と前記ABCトランスポータータンパク質の組み合わせがあげられる。具体的には、例えば、
CWP1タンパク質とPDR5タンパク質との組み合わせ、
CWP1タンパク質とPDR10タンパク質との組み合わせ、
CWP2タンパク質とPDR5タンパク質との組み合わせ、
CWP1タンパク質、CWP2タンパク質およびPDR5タンパク質の組み合わせ、
CWP1タンパク質、PDR5タンパク質およびPDR10タンパク質の組み合わせ
等があげられる。
【0053】
本発明の形質転換酵母において、前記細胞壁タンパク質の機能および前記排出ポンプタンパク質の機能は、どのようなメカニズムによって欠損してもよい。タンパク質の機能は、例えば、前記形質転換酵母における、前記タンパク質のコード遺伝子の欠失、前記タンパク質のコード遺伝子における点変異または配列挿入等による欠損、前記タンパク質のコード遺伝子からの転写の抑制、転写産物からの翻訳の抑制により、欠損させることができ、中でも、前記コード遺伝子の欠失によることが好ましい。
【0054】
本発明の形質転換酵母は、例えば、前記細胞壁タンパク質のコード遺伝子および/または前記排出ポンプタンパク質のコード遺伝子について、全領域を欠失してもよいし、部分領域を欠失してもよい。後者の場合、例えば、前記コード遺伝子におけるオープンリーディングフレーム(ORF)を欠失してもよいし、前記タンパク質の機能に関与する領域を欠失してもよい。本発明の形質転換酵母は、前記細胞壁タンパク質のコード遺伝子および前記排出ポンプタンパク質のコード遺伝子の少なくとも一方が、ORFを欠失することが好ましく、前記両方のコード遺伝子が、それぞれORFを欠失することがより好ましい。
【0055】
前記細胞壁タンパク質のコード遺伝子は、特に制限されず、例えば、前述のタンパク質のコード遺伝子、すなわち、マンナン結合タンパク質等のタンパク質のコード遺伝子があげられる。前記マンナンタンパク質のコード遺伝子は、例えば、CWP1遺伝子、CWP2遺伝子、CCW14遺伝子、CIS3遺伝子、KRE11遺伝子、PIR1遺伝子、PIR3遺伝子、TIP1遺伝子、TIR1遺伝子、TIR2遺伝子があげられる。本発明の形質転換酵母において、前記細胞壁タンパク質のコード遺伝子は、例えば、一種類が欠失してもよいし、二種類以上が欠失してもよい。後者の場合、例えば、CWP1遺伝子およびCWP2遺伝子を欠失してもよい。
【0056】
前記排出ポンプタンパク質のコード遺伝子は、特に制限されず、例えば、前述のタンパク質のコード遺伝子、すなわち、ABCトランスポータータンパク質、MFS(major facilitator superfamily)トランスポータータンパク質等のタンパク質のコード遺伝子があげられる。前記ABCトランスポータータンパク質のコード遺伝子は、例えば、PDR5遺伝子、STE6遺伝子、PDR12遺伝子、PDR15遺伝子、SNQ2遺伝子、YOR1遺伝子、YDR061W遺伝子、PDR18遺伝子、YOL075C遺伝子、YBT1遺伝子、AUS1遺伝子、PDR10遺伝子、PDR11遺伝子等があげられる。本発明の形質転換酵母において、前記排出ポンプタンパク質のコード遺伝子は、例えば、一種類が欠失してもよいし、二種類以上が欠失してもよい。後者の場合、例えば、PDR5遺伝子およびPDR10遺伝子を欠失してもよい。
【0057】
本発明の形質転換酵母は、例えば、前記細胞壁タンパク質のコード遺伝子および前記排出ポンプタンパク質のコード遺伝子の両方を欠失することが好ましい。前記欠損した前記細胞壁タンパク質のコード遺伝子および前記排出ポンプタンパク質のコード遺伝子の組み合わせは、特に制限されない。前記組み合せは、例えば、前記マンナン結合タンパク質のコード遺伝子と前記ABCトランスポータータンパク質のコード遺伝子の組み合わせがあげられる。具体的には、
CWP1遺伝子とPDR5遺伝子との組み合わせ、
CWP1遺伝子とPDR10遺伝子との組み合わせ、
CWP2遺伝子とPDR5遺伝子の組み合わせ、
CWP1遺伝子、CWP2遺伝子およびPDR5遺伝子の組み合わせ、
CWP1遺伝子、PDR5遺伝子およびPDR10遺伝子の組み合わせ
等があげられ、好ましくはCWP1遺伝子とPDR5遺伝子との組み合わせである。
【0058】
前記細胞壁タンパク質のコード遺伝子および/または前記排出ポンプタンパク質のコード遺伝子の欠失は、特に制限されない。本発明においては、前記細胞壁タンパク質のコード遺伝子および前記排出ポンプ遺伝子の少なくともいずれかを欠失させることで、様々な核内受容体遺伝子を導入した場合も、リガンドの分析に使用可能である。
【0059】
前記核内受容体の種類に応じて、例えば、前記細胞壁タンパク質のコード遺伝子および前記排出ポンプ遺伝子の欠失を以下のように設定すれば、より優れた分析精度が実現できる。
【0060】
前記核内受容体がGRのホモ二量体であり、GRに対するリガンドを分析する場合、例えば、PDR5遺伝子の欠失、PDR10遺伝子の欠失、CWP1遺伝子およびPDR5遺伝子の欠失、CWP1遺伝子およびPDR10遺伝子の欠失、PDR5遺伝子およびPDR10遺伝子の欠失、ならびに、CWP1遺伝子、PDR5遺伝子およびPDR10遺伝子の欠失が好ましく、より好ましくは、PDR5遺伝子の欠失、CWP1遺伝子およびPDR5遺伝子の欠失、PDR5遺伝子およびPDR10遺伝子の欠失、ならびに、CWP1遺伝子、PDR5遺伝子およびPDR10遺伝子の欠失である。
【0061】
前記核内受容体がAhRとArntとのヘテロ二量体であり、AhRに対するリガンドを分析する場合、例えば、CWP1遺伝子の欠失、CWP2遺伝子の欠失、PDR5遺伝子の欠失、PDR10遺伝子の欠失、CWP1遺伝子およびCWP2遺伝子の欠失、CWP1遺伝子およびPDR5遺伝子の欠失、CWP1遺伝子およびPDR10遺伝子の欠失、PDR5遺伝子およびPDR10遺伝子の欠失、ならびに、CWP1遺伝子、PDR5遺伝子およびPDR10遺伝子の欠失が好ましく、より好ましくは、PDR10遺伝子の欠失、CWP1遺伝子およびPDR5遺伝子の欠失、CWP1遺伝子およびPDR10遺伝子の欠失、PDR5遺伝子およびPDR10遺伝子の欠失、ならびに、CWP1遺伝子、PDR5遺伝子およびPDR10遺伝子の欠失であり、特に好ましくは、PDR5遺伝子およびPDR10遺伝子の欠失、ならびに、CWP1遺伝子、PDR5遺伝子およびPDR10遺伝子の欠失である。
【0062】
前記核内受容体がERαのホモ二量体であり、ERαに対するリガンドを分析する場合、例えば、CWP1遺伝子の欠失、CWP2遺伝子の欠失、PDR5遺伝子の欠失、CWP1遺伝子およびCWP2遺伝子の欠失、CWP1遺伝子およびPDR5遺伝子の欠失、CWP2遺伝子およびPDR5遺伝子の欠失、ならびに、CWP1遺伝子、CWP2遺伝子およびPDR5遺伝子の欠失が好ましく、より好ましくは、CWP1遺伝子の欠失、CWP2遺伝子の欠失、CWP1遺伝子およびCWP2遺伝子の欠失、ならびに、CWP1遺伝子およびPDR5遺伝子の欠失である。
【0063】
前記核内受容体がERβのホモ二量体であり、ERβに対するリガンドを分析する場合、例えば、CWP1遺伝子の欠失、CWP2遺伝子の欠失、PDR5遺伝子の欠失、CWP1遺伝子およびCWP2遺伝子の欠失、CWP1遺伝子およびPDR5遺伝子の欠失、CWP2遺伝子およびPDR5遺伝子の欠失、ならびに、CWP1遺伝子、CWP2遺伝子およびPDR5遺伝子の欠失が好ましく、より好ましくは、CWP1遺伝子およびCWP2遺伝子の欠失である。
【0064】
前記核内受容体がTRαのホモ二量体であり、TRαに対するリガンドを分析する場合、例えば、CWP1遺伝子およびCWP2遺伝子の欠失が好ましい。
【0065】
前記核内受容体がTRβのホモ二量体であり、TRβに対するリガンドを分析する場合、例えば、PDR5遺伝子の欠失、CWP1遺伝子およびCWP2遺伝子の欠失、ならびに、CWP1遺伝子、CWP2遺伝子およびPDR5遺伝子の欠失が好ましく、より好ましくは、PDR5遺伝子の欠失である。
【0066】
前記核内受容体がRXRとPXR−1とのヘテロ二量体であり、前記ヘテロ二量体に対するリガンドを分析する場合、例えば、PDR5遺伝子の欠失、CWP1遺伝子およびPDR5遺伝子の欠失、CWP2遺伝子およびPDR5遺伝子の欠失、ならびに、CWP1遺伝子、CWP2遺伝子およびPDR5遺伝子の欠失が好ましく、より好ましくは、PDR5遺伝子の欠失である。
【0067】
前記核内受容体がPRのホモ二量体であり、PRに対するリガンドを分析する場合、例えば、PDR5遺伝子の欠失、CWP2遺伝子の欠失、CWP1遺伝子およびPDR5遺伝子の欠失、CWP1遺伝子およびCWP2遺伝子の欠失、CWP2遺伝子およびPDR5遺伝子の欠失、CWP1遺伝子およびPDR10遺伝子の欠失、PDR5遺伝子およびPDR10遺伝子の欠失、CWP1遺伝子、CWP2遺伝子およびPDR5遺伝子の欠失、ならびに、CWP1遺伝子、PDR5遺伝子およびPDR10遺伝子の欠失が好ましく、より好ましくは、PDR5遺伝子の欠失、ならびに、CWP1遺伝子およびCWP2遺伝子の欠失である。
【0068】
前記核内受容体がARのホモ二量体であり、ARに対するリガンドを分析する場合、例えば、PDR5遺伝子の欠失、CWP1遺伝子およびPDR5遺伝子の欠失、CWP2遺伝子およびPDR5遺伝子の欠失、CWP1遺伝子およびCWP2遺伝子の欠失、PDR5遺伝子およびPDR10遺伝子の欠失、CWP1遺伝子、PDR5遺伝子およびPDR10遺伝子の欠失、ならびに、CWP1遺伝子、CWP2遺伝子およびPDR5遺伝子の欠失が好ましく、より好ましくは、CWP1遺伝子およびPDR5遺伝子の欠失、ならびに、PDR5遺伝子およびPDR10遺伝子の欠失である。
【0069】
前記核内受容体がMRのホモ二量体であり、MRに対するリガンドを分析する場合、例えば、PDR5遺伝子の欠失が好ましい。
【0070】
本発明の形質転換酵母は、例えば、発現する核内受容体が、動物核内受容体であることが好ましく、具体的には、ヒト核内受容体であることが好ましい。このため、本発明の形質転換酵母は、前記核内受容体遺伝子として、動物核内受容体遺伝子が導入されていることが好ましく、より好ましくは、ヒト核内受容体遺伝子が導入されている。
【0071】
本発明の形質転換酵母によれば、任意の核内受容体に対するリガンドを分析できる。このため、本発明の形質転換酵母において、前記核内受容体遺伝子は、特に制限されず、分析対象である前記リガンドの種類に応じて、適宜決定できる。
【0072】
本発明の形質転換酵母において、発現する前記核内受容体は、例えば、前述した核内受容体が例示でき、具体例としては、アンドロゲン受容体(AR)、グルココルチコイド受容体(GR)、アリールハイドロカーボン受容体(AhR)、レチノイン酸X受容体α(RXRα)、エストロゲン受容体α(ERα)、エストロゲン受容体β(ERβ)、甲状腺ホルモン受容体α(TRα)、甲状腺ホルモン受容体β(TRβ)、プロゲステロン受容体(PR)、鉱質コルチコイド受容体(MR)、プレグナンX受容体(PXR(PXR−1またはPXR−2))等があげられる。これらの核内受容体は、動物核内受容体が好ましく、より好ましくはヒト核内受容体である。
【0073】
本発明の形質転換酵母は、さらに、転写共役因子遺伝子が発現可能に導入されてもよい。本発明の形質転換酵母において、例えば、前記転写共役因子遺伝子から発現された転写共役因子(コアクチベーター)は、前記核内受容体に直接結合して、前記レポーター遺伝子の転写を活性化する。前記転写共役因子遺伝子は、例えば、前記核内受容体遺伝子の種類に応じて、適宜決定できる。
【0074】
本発明の形質転換酵母は、例えば、発現する転写共役因子が、動物転写共役因子であることが好ましく、より好ましくは、ヒト転写共役因子である。このため、本発明の形質転換酵母は、例えば、前記転写共役因子遺伝子として、動物転写共役因子遺伝子が導入されていることが好ましく、より好ましくは、ヒト転写共役因子遺伝子が導入されている。
【0075】
発現する前記転写共役因子の由来は、特に制限されず、例えば、発現する前記核内受容体の由来と同じ系統であることが好ましく、より好ましくは同じ動物由来である。具体的には、前記核内受容体がヒト核内受容体の場合、前記転写共役因子は、ヒト転写共役因子が好ましい。このため、本発明の形質転換酵母は、例えば、前記核内受容体遺伝子として、動物核内受容体遺伝子が導入されている場合、前記動物転写共役因子遺伝子が導入されていることが好ましく、ヒト核内受容体遺伝子が導入されている場合、ヒト転写共役因子遺伝子が導入されていることが好ましい。このように、前記核内受容体遺伝子と前記転写共役因子遺伝子とを同じ由来とすることで、分析感度をさらに向上できる。このメカニズムは不明であるが、例えば、由来が同じ前記核内受容体と前記転写共役因子とを含む複合体により、前記レポーター遺伝子の転写の効率が向上すると推測される。本発明は、このメカニズムには制限されない。
【0076】
以下に、前記転写共役因子と、それが結合可能な核内受容体の組み合わせを例示する。本発明は、これらの組み合わせには制限されない。
【表1】

【0077】
本発明の形質転換酵母において、前記レポーター遺伝子は、特に制限されず、公知の遺伝子があげられる。具体例としては、β−ガラクトシダーゼ遺伝子、ルシフェラーゼ遺伝子、蛍光タンパク質遺伝子、β−グルクロニダーゼ遺伝子等があげられる。
【0078】
本発明の形質転換酵母において、前記核内受容体遺伝子の導入部位は、特に制限されない。前記核内受容体遺伝子は、例えば、前記酵母の染色体上に導入されていることが好ましい。
【0079】
本発明の形質転換酵母が、導入された前記転写共役因子遺伝子を有する場合、前記転写共役因子遺伝子の導入部位は、特に制限されない。本発明の形質転換部位は、前記プラスミドを有し、前記プラスミドが、前記転写共役因子遺伝子を有することが好ましい。
【0080】
本発明の形質転換酵母において、前記レポーター遺伝子の導入部位は、特に制限されない。本発明の形質転換酵母は、例えば、さらに、プラスミドを有し、前記プラスミドが、前記レポーター遺伝子を有することが好ましい。
【0081】
本発明の形質転換酵母は、例えば、さらに、核内受容体応答配列が導入されていることが好ましい。前記核内受容体応答配列は、特に制限されず、前記核内受容体の種類に応じて適宜決定できる。
【0082】
前記核内受容体応答配列の由来は、特に制限されず、例えば、発現する前記核内受容体の由来と同じ系統であることが好ましく、より好ましくは同じ動物由来である。具体的には、前記核内受容体がヒト核内受容体の場合、前記核内受容体応答配列は、ヒト核内受容体応答配列が好ましい。このため、本発明の形質転換酵母は、例えば、前記核内受容体遺伝子として、動物核内受容体遺伝子が導入されている場合、前記動物核内受容体応答配列が導入されていることが好ましく、ヒト核内受容体遺伝子が導入されている場合、ヒト核内受容体応答配列が導入されていることが好ましい。
【0083】
本発明の形質転換酵母において、前記核内受容体応答配列の導入部位は、特に制限されない。本発明の形質転換酵母は、例えば、さらに、プラスミドを有し、前記プラスミドが、前記核内受容体応答配列を有することが好ましい。前記核内受容体応答配列は、例えば、前記レポーター遺伝子を有する前記プラスミドに、挿入されていることが好ましい。前記プラスミドにおいて、前記核内受容体応答配列および前記レポーター遺伝子は、作動的に連結して、挿入されていることが好ましい。前記プラスミドにおいて、前記核内受容体応答配列は、前記レポーター遺伝子の上流に挿入されていることが好ましい。前記核内受容体応答配列は、例えば、繰り返し配列として、前記プラスミドに挿入されていることが好ましい。
【0084】
前記レポーター遺伝子と、前記転写共役因子遺伝子は、例えば、それぞれ、別個のプラスミドに挿入されていることが好ましい。以下、レポーター遺伝子および任意で前記核内受容体応答配列を有する前記プラスミドを、第1のプラスミド、前記転写共役因子遺伝子を有する前記プラスミドを、第2のプラスミドという。前記1のプラスミドは、例えば、低コピー型プラスミドが好ましく、前記第2のプラスミドは、例えば、高コピー型プラスミドが好ましい。
【0085】
以下に、本発明の形質転換酵母の例として、前記核内受容体が、前述したAR、GR、RXRα、ERβ、TRα、AhR、ERα、TRβ、PXR−1、PRまたはMRであり、これらに対するリガンドの分析に使用する形質転換酵母について、説明する。
【0086】
まず、前記核内受容体がARであり、AR遺伝子が導入された形質転換酵母について説明する。
【0087】
ARに対するリガンドは、例えば、アンドロゲンまたはアンドロゲン様化学物質等があげられる。前記リガンドが存在すると、前記形質転換酵母において、ARは、前記リガンドおよび前記転写共役因子と複合体を形成する。前記複合体は、前記核内受容体応答配列を認識して結合する。前記複合体の結合により、前記応答配列の下流に存在する前記レポーター遺伝子が発現する。この際、前記レポーター遺伝子の転写は、前記転写共役因子によって、活性化される。前記核内受容体がARの場合、前記応答配列は、例えば、グルココルチコイド応答配列(glucocorticoid response element:GRE)があげられる。
【0088】
前記ARは、特に制限されず、前述のように、動物ARが好ましく、より好ましくはヒトARである。本発明の形質転換酵母において、前記ヒトARを発現させるには、例えば、ヒトAR遺伝子が前記酵母の染色体上に導入されていることが好ましい。
【0089】
前記ヒトAR遺伝子は、例えば、下記(a)または(b)のポリヌクレオチドを含むことが好ましい。
(a)配列番号1に記載の塩基配列からなるポリヌクレオチド。
(b)配列番号1に記載の塩基配列において、少なくとも1つの塩基が置換、付加、挿入もしくは欠失した塩基配列からなるポリヌクレオチドであって、ヒトARとして機能するタンパク質をコードするポリヌクレオチド。
【0090】
前記(b)のポリヌクレオチドは、前記(a)のポリヌクレオチドとの相同性が、例えば、90%以上であって、好ましくは、93%以上であり、より好ましくは、95%以上であり、さらに好ましくは、98%以上である。前記(b)のポリヌクレオチドにおいて、置換、付加、挿入もしくは欠失した塩基の数は、例えば、前記相同性に対応した数である。
【0091】
前記AR遺伝子は、例えば、配列番号1の塩基配列に基づいて、ヒトの核酸を使用して、クローニングすることにより得ることができる。前記核酸は、例えば、DNAでもよいし、トータルRNA等のRNAでもよい。前記AR遺伝子は、例えば、ホスホルアミダイト(phosphoramidite)法を利用して、化学的にDNA合成してもよい。前記クローニングの方法は、特に制限されず、例えば、市販のクローニングキット等を利用して実施できる。
【0092】
前記核内受容体がARの場合、前記ARに対する前記転写共役因子は、特に制限されず、例えば、SRC1、CBP、P300およびTIF2等がある。これらの中で、例えば、SRC1が好ましい。前記転写共役因子は、前述のように動物転写共役因子が好ましく、より好ましくはヒト転写共役因子である。前記転写共役因子遺伝子は、例えば、前述のように、前記第2のプラスミドに挿入し、このプラスミドを形質転換酵母に導入することが好ましい。前記第2のプラスミドは、高コピー型であることが好ましい。
【0093】
前記核内受容体応答配列は、例えば、前述のように、前記第1のプラスミドに挿入し、このプラスミドを形質転換酵母に導入することが好ましい。前記核内受容体応答配列および前記レポーター遺伝子は、前述のように、作動的に連結して、前記第1のプラスミドに挿入することが好ましい。前記核内受容体応答配列、例えば、GREは、繰り返し配列として、前記第1のプラスミドに挿入することが好ましい。前記第1のプラスミドは、低コピー型であることが好ましい。
【0094】
つぎに、前記核内受容体がGRであり、GR遺伝子が導入された形質転換酵母について説明する。
【0095】
GRに対するリガンドは、例えば、グルココルチコイドまたはグルココルチコイド様化学物質等があげられる。前記リガンドが存在すると、前記形質転換酵母において、GRは、前記リガンドおよび前記転写共役因子と複合体を形成する。前記複合体は、前記核内受容体応答配列を認識して結合する。前記複合体の結合により、前記応答配列の下流に存在する前記レポーター遺伝子が発現する。この際、前記レポーター遺伝子の転写は、前記転写共役因子によって、活性化される。前記核内受容体がGRの場合、前記応答配列は、例えば、グルココルチノイド応答配列(GRE)があげられる。
【0096】
前記GRは、特に制限されず、前述のように、動物GRが好ましく、より好ましくはヒトGRである。本発明の形質転換酵母において、前記ヒトGRを発現させるには、例えば、ヒトGR遺伝子を前記酵母の染色体上に導入することが好ましい。
【0097】
前記ヒトGR遺伝子は、例えば、下記(c)または(d)のポリヌクレオチドを含むことが好ましい。
(c)配列番号2に記載の塩基配列からなるポリヌクレオチド。
(d)配列番号2に記載の塩基配列において、少なくとも1つの塩基が置換、付加、挿入もしくは欠失した塩基配列からなるポリヌクレオチドであって、ヒトGRとして機能するタンパク質をコードするポリヌクレオチド。
【0098】
前記(d)のポリヌクレオチドは、前記(c)のポリヌクレオチドとの相同性が、例えば、90%以上であって、好ましくは、93%以上であり、より好ましくは、95%以上であり、さらに好ましくは、98%以上である。前記(d)のポリヌクレオチドにおいて、置換、付加、挿入もしくは欠失した塩基の数は、例えば、前記相同性に対応した数である。
【0099】
前記GR遺伝子は、例えば、配列番号2の塩基配列に基づいて、ヒトの核酸を使用してクローニングすることにより得ることができる。前記核酸は、例えば、DNAでもよいし、トータルRNA等のRNAでもよい。前記GR遺伝子は、例えば、ホスホルアミダイト法を利用して、化学的にDNA合成してもよい。前記クローニングの方法は、特に制限されず、例えば、市販のクローニングキット等を利用して実施できる。
【0100】
前記核内受容体がGRの場合、前記GRに対する前記転写共役因子は、特に制限されず、例えば、SRC1、CBP、P300およびTIF2等がある。これらの中で、例えば、SRC1が好ましい。前記転写共役因子は、前述のように動物転写共役因子が好ましく、より好ましくはヒト転写共役因子である。前記転写共役因子遺伝子は、例えば、前述のように、前記第2のプラスミドに挿入し、このプラスミドを形質転換酵母に導入することが好ましい。前記第2のプラスミドは、高コピー型であることが好ましい。
【0101】
前記核内受容体応答配列は、例えば、前述のように、前記第1のプラスミドに挿入し、このプラスミドを形質転換酵母に導入することが好ましい。前記核内受容体応答配列および前記レポーター遺伝子は、前述のように、作動的に連結して、前記第1のプラスミドに挿入することが好ましい。前記核内受容体応答配列、例えば、GREは、繰り返し配列として、前記第1のプラスミドに挿入することが好ましい。前記第1のプラスミドは、低コピー型であることが好ましい。
【0102】
つぎに、前記核内受容体がRXRαであり、RXRα遺伝子が導入された形質転換酵母について説明する。
【0103】
RXRαに対するリガンドは、例えば、レチノイン酸またはレチノイン酸様化学物質等があげられる。前記リガンドが存在すると、前記形質転換酵母において、RXRαは、前記リガンドおよび前記転写共役因子と複合体を形成する。前記複合体は、前記核内受容体応答配列を認識して結合する。前記複合体の結合により、前記応答配列の下流に存在する前記レポーター遺伝子が発現する。この際、前記レポーター遺伝子の転写は、前記転写共役因子によって、活性化される。前記核内受容体がRXRαの場合、前記応答配列は、例えば、薬物応答配列(DR1エレメント)があげられる。
【0104】
前記RXRαは、特に制限されず、前述のように、動物RXRαが好ましく、より好ましくはヒトRXRαである。本発明の形質転換酵母において、前記ヒトRXRαを発現させるには、例えば、ヒトRXRα遺伝子を前記酵母の染色体上に導入することが好ましい。
【0105】
前記ヒトRXRα遺伝子は、例えば、下記(e)または(f)のポリヌクレオチドを含むことが好ましい。
(e)配列番号3に記載の塩基配列からなるポリヌクレオチド。
(f)配列番号3に記載の塩基配列において、少なくとも1つの塩基が置換、付加、挿入もしくは欠失した塩基配列からなるポリヌクレオチドであって、ヒトRXRαとして機能するタンパク質をコードするポリヌクレオチド。
【0106】
前記(f)のポリヌクレオチドは、前記(e)のポリヌクレオチドとの相同性が、例えば、90%以上であって、好ましくは、93%以上であり、より好ましくは、95%以上であり、さらに好ましくは、98%以上である。前記(f)のポリヌクレオチドにおいて、置換、付加、挿入もしくは欠失した塩基の数は、例えば、前記相同性に対応した数である。
【0107】
前記RXRα遺伝子は、例えば、配列番号3の塩基配列に基づいて、ヒトの核酸を使用してクローニングすることにより得ることができる。前記核酸は、例えば、DNAでもよいし、トータルRNA等のRNAでもよい。前記RXRα遺伝子は、例えば、ホスホルアミダイト法を利用して、化学的にDNA合成してもよい。前記クローニングの方法は、特に制限されず、例えば、市販のクローニングキット等を利用して実施できる。
【0108】
前記核内受容体がRXRαの場合、前記RXRαに対する前記転写共役因子は、特に制限されず、例えば、SRC1、CBP、P300およびARA70等がある。これらの中で、SRC1が好ましい。前記転写共役因子は、前述のように動物転写共役因子が好ましく、より好ましくはヒト転写共役因子である。前記転写共役因子遺伝子は、例えば、前述のように、前記第2のプラスミドに挿入し、このプラスミドを形質転換酵母に導入することが好ましい。前記第2のプラスミドは、高コピー型であることが好ましい。
【0109】
前記核内受容体応答配列は、例えば、前述のように、前記第1のプラスミドに挿入し、このプラスミドを形質転換酵母に導入することが好ましい。前記核内受容体応答配列および前記レポーター遺伝子は、前述のように、作動的に連結して、前記第1のプラスミドに挿入することが好ましい。前記核内受容体応答配列、例えば、DR1エレメントは、繰り返し配列として、前記第1のプラスミドに挿入することが好ましい。前記第1のプラスミドは、低コピー型であることが好ましい。
【0110】
つぎに、前記核内受容体がERβであり、ERβ遺伝子が導入された形質転換酵母について説明する。
【0111】
ERβに対するリガンドは、例えば、エストロゲンまたはエストロゲン様化学物質等があげられる。前記リガンドが存在すると、前記形質転換酵母において、ERβは、前記リガンドおよび前記転写共役因子と複合体を形成する。前記複合体は、前記核内受容体応答配列を認識して結合する。前記複合体の結合により、前記応答配列の下流に存在する前記レポーター遺伝子が発現する。この際、前記レポーター遺伝子の転写は、前記転写共役因子によって、活性化される。前記核内受容体がERβの場合、前記応答配列は、例えば、エストロゲン応答配列(estrogen response element:ERE)があげられる。
【0112】
前記ERβは、特に制限されず、前述のように、動物ERβが好ましく、より好ましくはヒトERβである。本発明の形質転換酵母において、前記ヒトERβを発現させるには、例えば、ヒトERβ遺伝子を前記酵母の染色体上に導入することが好ましい。
【0113】
前記ヒトERβ遺伝子は、例えば、下記(g)または(h)のポリヌクレオチドを含むことが好ましい。
(g)配列番号4に記載の塩基配列からなるポリヌクレオチド。
(h)配列番号4に記載の塩基配列において、少なくとも1つの塩基が置換、付加、挿入もしくは欠失した塩基配列からなるポリヌクレオチドであって、ヒトERβとして機能するタンパク質をコードするポリヌクレオチド。
【0114】
前記(h)のポリヌクレオチドは、前記(g)のポリヌクレオチドとの相同性が、例えば、90%以上であって、好ましくは、93%以上であり、より好ましくは、95%以上であり、さらに好ましくは、98%以上である。前記(h)のポリヌクレオチドにおいて、置換、付加、挿入もしくは欠失した塩基の数は、例えば、前記相同性に対応した数である。
【0115】
前記ERβ遺伝子は、例えば、配列番号4の塩基配列に基づいて、ヒトの核酸を使用してクローニングすることにより得ることができる。前記核酸は、例えば、DNAでもよいし、トータルRNA等のRNAでもよい。前記ERβ遺伝子は、例えば、ホスホルアミダイト法を利用して、化学的にDNA合成してもよい。前記クローニングの方法は、特に制限されず、例えば、市販のクローニングキット等を利用して実施できる。
【0116】
前記核内受容体がERβの場合、前記ERβに対する転写共役因子は、特に制限されず、例えば、SRC1、CBP、P300、ASC2およびERAP140等がある。これらの中で、例えば、SRC1が好ましい。前記転写共役因子は、前述のように動物転写共役因子が好ましく、より好ましくはヒト転写共役因子である。前記転写共役因子遺伝子は、例えば、前述のように、前記第2のプラスミドに挿入し、このプラスミドを形質転換酵母に導入することが好ましい。前記第2のプラスミドは、高コピー型であることが好ましい。
【0117】
前記核内受容体応答配列は、例えば、前述のように、前記第1のプラスミドに挿入し、このプラスミドを形質転換酵母に導入することが好ましい。前記核内受容体応答配列および前記レポーター遺伝子は、前述のように、作動的に連結して、前記第1のプラスミドに挿入することが好ましい。前記核内受容体応答配列、例えば、EREは、繰り返し配列として、前記第1のプラスミドに挿入することが好ましい。前記第1のプラスミドは、低コピー型であることが好ましい。
【0118】
つぎに、前記核内受容体がTRαであり、TRα遺伝子が導入された形質転換酵母について説明する。
【0119】
TRαに対するリガンドは、例えば、甲状腺ホルモンまたは甲状腺ホルモン様化学物質等があげられる。前記リガンドが存在すると、前記形質転換酵母において、TRαは、前記リガンドおよび前記転写共役因子と複合体を形成する。前記複合体は、前記核内受容体応答配列を認識して結合する。前記複合体の結合により、前記応答配列の下流に存在する前記レポーター遺伝子が発現する。この際、前記レポーター遺伝子の転写は、前記転写共役因子によって、活性化される。前記核内受容体がTRαの場合、前記応答配列は、例えば、薬物応答配列(IR0エレメント)があげられる。
【0120】
前記TRαは、特に制限されず、前述のように、ヒトTRαが好ましい。本発明の形質転換酵母において、前記ヒトTRαを発現させるには、ヒトTRα遺伝子を前記酵母の染色体上に導入することが好ましい。
【0121】
前記ヒトTRα遺伝子は、例えば、下記(i)または(j)のポリヌクレオチドを含むことが好ましい。
(i)配列番号5に記載の塩基配列からなるポリヌクレオチド。
(j)配列番号5に記載の塩基配列において、少なくとも1つの塩基が置換、付加、挿入もしくは欠失した塩基配列からなるポリヌクレオチドであって、ヒトTRαとして機能するタンパク質をコードするポリヌクレオチド。
【0122】
前記(j)のポリヌクレオチドは、例えば、ヒトの核酸を使用してクローニングすることにより得ることができる。前記核酸は、例えば、DNAでもよいし、トータルRNA等のRNAでもよい。前記TRα遺伝子は、例えば、ホスホルアミダイト法を利用して、化学的にDNA合成してもよい。前記クローニングの方法は、特に制限されず、例えば、市販のクローニングキット等を利用して実施できる。
【0123】
前記核内受容体がTRαの場合、前記TRαに対する転写共役因子は、特に制限されず、例えば、SRC1、CBP、P300、AIB、ARA70およびASC2等がある。これらの中で、例えば、SRC1が好ましい。前記転写共役因子は、前述のように動物転写共役因子が好ましく、より好ましくはヒト転写共役因子である。前記転写共役因子遺伝子は、例えば、前述のように、前記第2のプラスミドに挿入し、このプラスミドを形質転換酵母に導入することが好ましい。前記第2のプラスミドは、高コピー型であることが好ましい。
【0124】
前記核内受容体応答配列は、例えば、前述のように、前記第1のプラスミドに挿入し、このプラスミドを形質転換酵母に導入することが好ましい。前記核内受容体応答配列および前記レポーター遺伝子は、前述のように、作動的に連結して、前記第1のプラスミドに挿入することが好ましい。前記核内受容体応答配列、例えば、IR0エレメントは、繰り返し配列として、前記第1のプラスミドに挿入することが好ましい。前記第1のプラスミドは、低コピー型であることが好ましい。
【0125】
つぎに、前記核内受容体がAhRであり、AhR遺伝子が導入された形質転換酵母について説明する。
【0126】
AhRに対するリガンドは、例えば、β−NF(ナフトフラボン)、ダイオキシン、ダイオキシン様化学物質、ポリ塩化ジベンゾフラン(PCDF)、ポリ塩化ビフェニル(PCB)、3−メチルコラントレン、ベンゾピレン、ベンゾイミダゾール、ジベンゾアンスラセン、ペンタクロロフェノール、ジコホール、オクタクロロスチレンおよびこれらの誘導体等があげられる。前記リガンドが存在すると、前記形質転換酵母において、AhRは、前記リガンドおよび前記転写共役因子と複合体を形成する。前記複合体は、前記核内受容体応答配列を認識して結合する。前記複合体の結合により、前記応答配列の下流に存在する前記レポーター遺伝子が発現する。この際、前記レポーター遺伝子の転写は、前記転写共役因子によって、活性化される。前記核内受容体がAhRの場合、前記応答配列は、例えば、異物応答配列(Xenobiotic Responsive Element:XRE)があげられる。
【0127】
前記AhRは、特に制限されず、前述のように、ヒトAhRが好ましい。本発明の形質転換酵母において、前記ヒトAhRを発現させるには、ヒトAhR遺伝子を前記酵母の染色体上に導入することが好ましい。前記転写共役因子は、前述のように動物転写共役因子が好ましく、より好ましくはヒト転写共役因子である。
【0128】
前記ヒトAhR遺伝子は、例えば、下記(k)または(l)のポリヌクレオチドを含むことが好ましい。
(k)配列番号6に記載の塩基配列からなるポリヌクレオチド。
(l)配列番号6に記載の塩基配列において、少なくとも1つの塩基が置換、付加、挿入もしくは欠失した塩基配列からなるポリヌクレオチドであって、ヒトAhRとして機能するタンパク質をコードするポリヌクレオチド。
【0129】
前記(l)のポリヌクレオチドは、例えば、配列番号6の塩基配列に基づいて、ヒトの核酸を使用してクローニングすることにより得ることができる。前記核酸は、例えば、DNAでもよいし、トータルRNA等のRNAでもよい。前記AhR遺伝子は、例えば、ホスホルアミダイト法を利用して、化学的にDNA合成してもよい。前記クローニングの方法は、特に制限されず、例えば、市販のクローニングキット等を利用して実施できる。
【0130】
核内受容体がAhRの場合、前記形質転換酵母は、例えば、さらに、AhR核内移行因子(Arnt)遺伝子を有してもよい。前記形質転換酵母において、前記Arnt遺伝子の導入部位は、特に制限されない。前記Arnt遺伝子は、例えば、前記酵母の染色体上に導入されていることが好ましい。
【0131】
前記Arntは、特に制限されず、前述のように、ヒトArntが好ましい。本発明の形質転換酵母において、前記ヒトArntを発現させるには、ヒトArnt遺伝子を前記酵母の染色体上に導入することが好ましい。
【0132】
前記ヒトArnt遺伝子は、例えば、下記(m)または(n)のポリヌクレオチドを含むことが好ましい。
(m)配列番号7に記載の塩基配列からなるポリヌクレオチド。
(n)配列番号7に記載の塩基配列において、少なくとも1つの塩基が置換、付加、挿入もしくは欠失した塩基配列からなるポリヌクレオチドであって、ヒトArntとして機能するタンパク質をコードするポリヌクレオチド。
【0133】
前記(n)のポリヌクレオチドは、例えば、配列番号7の塩基配列に基づいて、ヒトの核酸を使用してクローニングすることにより得ることができる。前記核酸は、例えば、DNAでもよいし、トータルRNA等のRNAでもよい。前記Arnt遺伝子は、例えば、ホスホルアミダイト法を利用して、化学的にDNA合成してもよい。前記クローニングの方法は、特に制限されず、例えば、市販のクローニングキット等を利用して実施できる。
【0134】
前記核内受容体応答配列は、例えば、前述のように、前記第1のプラスミドに挿入し、このプラスミドを形質転換酵母に導入することが好ましい。前記核内受容体応答配列および前記レポーター遺伝子は、前述のように、作動的に連結して、前記第1のプラスミドに挿入することが好ましい。前記核内受容体応答配列、例えば、XREは、繰り返し配列として、前記第1のプラスミドに挿入することが好ましい。前記第1のプラスミドは、低コピー型であることが好ましい。
【0135】
つぎに、前記核内受容体がERαであり、ERα遺伝子が導入された形質転換酵母について説明する。
【0136】
ERαに対するリガンドは、例えば、エストロゲンまたはエストロゲン様化学物質等があげられる。前記リガンドが存在すると、前記形質転換酵母において、ERαは、前記リガンドおよび前記転写共役因子と複合体を形成する。前記複合体は、前記核内受容体応答配列を認識して結合する。前記複合体の結合により、前記応答配列の下流に存在する前記レポーター遺伝子が発現する。この際、前記レポーター遺伝子の転写は、前記転写共役因子によって、活性化される。前記核内受容体がERαの場合、前記応答配列は、例えば、エストロゲン応答配列(ERE)があげられる。
【0137】
前記ERαは、特に制限されず、前述のように、動物ERαが好ましく、より好ましくはヒトERαである。本発明の形質転換酵母において、前記ヒトERαを発現させるには、例えば、ヒトERα遺伝子を前記酵母の染色体上に導入することが好ましい。
【0138】
前記ヒトERα遺伝子は、例えば、下記(q)または(r)のポリヌクレオチドを含むことが好ましい。
(q)配列番号37に記載の塩基配列からなるポリヌクレオチド。
(r)配列番号37に記載の塩基配列において、少なくとも1つの塩基が置換、付加、挿入もしくは欠失した塩基配列からなるポリヌクレオチドであって、ヒトERαとして機能するタンパク質をコードするポリヌクレオチド。
【0139】
前記(r)のポリヌクレオチドは、前記(q)のポリヌクレオチドとの相同性が、例えば、90%以上であって、好ましくは、93%以上であり、より好ましくは、95%以上であり、さらに好ましくは、98%以上である。前記(r)のポリヌクレオチドにおいて、置換、付加、挿入もしくは欠失した塩基の数は、例えば、前記相同性に対応した数である。
【0140】
前記ERα遺伝子は、例えば、配列番号37の塩基配列に基づいて、ヒトの核酸を使用してクローニングすることにより得ることができる。前記核酸は、例えば、DNAでもよいし、トータルRNA等のRNAでもよい。前記ERα遺伝子は、例えば、ホスホルアミダイト法を利用して、化学的にDNA合成してもよい。前記クローニングの方法は、特に制限されず、例えば、市販のクローニングキット等を利用して実施できる。
【0141】
前記核内受容体がERαの場合、前記ERαに対する転写共役因子は、特に制限されず、例えば、SRC1、CBP、P300、ASC2およびERAP140等がある。これらの中で、例えば、SRC1が好ましい。前記転写共役因子は、前述のように動物転写共役因子が好ましく、より好ましくはヒト転写共役因子である。前記転写共役因子遺伝子は、例えば、前述のように、前記第2のプラスミドに挿入し、このプラスミドを形質転換酵母に導入することが好ましい。前記第2のプラスミドは、高コピー型であることが好ましい。
【0142】
つぎに、前記核内受容体がTRβであり、TRβ遺伝子が導入された形質転換酵母について説明する。
【0143】
TRβに対するリガンドは、例えば、甲状腺ホルモンまたは甲状腺ホルモン様化学物質等があげられる。前記リガンドが存在すると、前記形質転換酵母において、TRβは、前記リガンドおよび前記転写共役因子と複合体を形成する。前記複合体は、前記核内受容体応答配列を認識して結合する。前記複合体の結合により、前記応答配列の下流に存在する前記レポーター遺伝子が発現する。この際、前記レポーター遺伝子の転写は、前記転写共役因子によって、活性化される。前記核内受容体がTRβの場合、前記応答配列は、例えば、薬物応答配列(IR0エレメント)があげられる。
【0144】
前記TRβは、特に制限されず、前述のように、ヒトTRβが好ましい。本発明の形質転換酵母において、前記ヒトTRβを発現させるには、ヒトTRβ遺伝子を前記酵母の染色体上に導入することが好ましい。
【0145】
前記ヒトTRβ遺伝子は、例えば、下記(s)または(t)のポリヌクレオチドを含むことが好ましい。
(s)配列番号38に記載の塩基配列からなるポリヌクレオチド。
(t)配列番号38に記載の塩基配列において、少なくとも1つの塩基が置換、付加、挿入もしくは欠失した塩基配列からなるポリヌクレオチドであって、ヒトTRβとして機能するタンパク質をコードするポリヌクレオチド。
【0146】
前記(t)のポリヌクレオチドは、例えば、ヒトの核酸を使用してクローニングすることにより得ることができる。前記核酸は、例えば、DNAでもよいし、トータルRNA等のRNAでもよい。前記TRβ遺伝子は、例えば、ホスホルアミダイト法を利用して、化学的にDNA合成してもよい。前記クローニングの方法は、特に制限されず、例えば、市販のクローニングキット等を利用して実施できる。
【0147】
前記核内受容体がTRβの場合、前記TRβに対する転写共役因子は、特に制限されず、例えば、SRC1、CBP、P300、AIB、ARA70、ASC2およびERAP140等がある。これらの中で、例えば、SRC1が好ましい。前記転写共役因子は、前述のように動物転写共役因子が好ましく、より好ましくはヒト転写共役因子である。前記転写共役因子遺伝子は、例えば、前述のように、前記第2のプラスミドに挿入し、このプラスミドを形質転換酵母に導入することが好ましい。前記第2のプラスミドは、高コピー型であることが好ましい。
【0148】
前記核内受容体応答配列は、例えば、前述のように、前記第1のプラスミドに挿入し、このプラスミドを形質転換酵母に導入することが好ましい。前記核内受容体応答配列および前記レポーター遺伝子は、前述のように、作動的に連結して、前記第1のプラスミドに挿入することが好ましい。前記核内受容体応答配列、例えば、IR0エレメントは、繰り返し配列として、前記第1のプラスミドに挿入することが好ましい。前記第1のプラスミドは、低コピー型であることが好ましい。
【0149】
つぎに、前記核内受容体がPXR−1であり、PXR−1遺伝子が導入された形質転換酵母について説明する。
【0150】
PXR−1に対するリガンドは、例えば、リファンピシンまたはリファンピシン様化学物質等があげられる。前記リガンドが存在すると、前記形質転換酵母において、PXR−1は、前記リガンドおよび前記転写共役因子と複合体を形成する。前記複合体は、前記核内受容体応答配列を認識して結合する。前記複合体の結合により、前記応答配列の下流に存在する前記レポーター遺伝子が発現する。この際、前記レポーター遺伝子の転写は、前記転写共役因子によって、活性化される。前記核内受容体がPXR−1の場合、前記応答配列は、例えば、薬物応答配列(DR−3)があげられる。
【0151】
前記PXR−1は、特に制限されず、前述のように、動物PXR−1が好ましく、より好ましくはヒトPXR−1である。本発明の形質転換酵母において、前記ヒトPXR−1を発現させるには、例えば、ヒトPXR−1遺伝子を前記酵母の染色体上に導入することが好ましい。
【0152】
前記ヒトPXR−1遺伝子は、例えば、下記(u)または(v)のポリヌクレオチドを含むことが好ましい。
(u)配列番号39に記載の塩基配列からなるポリヌクレオチド。
(v)配列番号39に記載の塩基配列において、少なくとも1つの塩基が置換、付加、挿入もしくは欠失した塩基配列からなるポリヌクレオチドであって、ヒトPXR−1として機能するタンパク質をコードするポリヌクレオチド。
【0153】
前記(v)のポリヌクレオチドは、前記(u)のポリヌクレオチドとの相同性が、例えば、90%以上であって、好ましくは、93%以上であり、より好ましくは、95%以上であり、さらに好ましくは、98%以上である。前記(v)のポリヌクレオチドにおいて、置換、付加、挿入もしくは欠失した塩基の数は、例えば、前記相同性に対応した数である。
【0154】
前記PXR−1遺伝子は、例えば、配列番号39の塩基配列に基づいて、ヒトの核酸を使用してクローニングすることにより得ることができる。前記核酸は、例えば、DNAでもよいし、トータルRNA等のRNAでもよい。前記PXR−1遺伝子は、例えば、ホスホルアミダイト法を利用して、化学的にDNA合成してもよい。前記クローニングの方法は、特に制限されず、例えば、市販のクローニングキット等を利用して実施できる。
【0155】
前記核内受容体がPXR−1の場合、前記PXR−1に対する前記転写共役因子は、特に制限されず、例えば、CBPおよびP300等がある。前記転写共役因子は、前述のように動物転写共役因子が好ましく、より好ましくはヒト転写共役因子である。前記転写共役因子遺伝子は、例えば、前述のように、前記第2のプラスミドに挿入し、このプラスミドを形質転換酵母に導入することが好ましい。前記第2のプラスミドは、高コピー型であることが好ましい。
【0156】
前記核内受容体応答配列は、例えば、前述のように、前記第1のプラスミドに挿入し、このプラスミドを形質転換酵母に導入することが好ましい。前記核内受容体応答配列および前記レポーター遺伝子は、前述のように、作動的に連結して、前記第1のプラスミドに挿入することが好ましい。前記核内受容体応答配列、例えば、DR−3は、繰り返し配列として、前記第1のプラスミドに挿入することが好ましい。前記第1のプラスミドは、低コピー型であることが好ましい。
【0157】
つぎに、前記核内受容体がPRであり、PR遺伝子が導入された形質転換酵母について説明する。
【0158】
PRに対するリガンドは、例えば、プロゲステロンまたプロゲステロン様化学物質等があげられる。前記リガンドが存在すると、前記形質転換酵母において、PRは、前記リガンドおよび前記転写共役因子と複合体を形成する。前記複合体は、前記核内受容体応答配列を認識して結合する。前記複合体の結合により、前記応答配列の下流に存在する前記レポーター遺伝子が発現する。この際、前記レポーター遺伝子の転写は、前記転写共役因子によって、活性化される。前記核内受容体がPRの場合、前記応答配列は、例えば、グルココルチコイド応答配列(GRE)があげられる。
【0159】
前記PRは、特に制限されず、前述のように、ヒトPRが好ましい。本発明の形質転換酵母において、前記ヒトPRを発現させるには、ヒトPR遺伝子を前記酵母の染色体上に導入することが好ましい。
【0160】
前記ヒトPR遺伝子は、例えば、下記(w)または(x)のポリヌクレオチドを含むことが好ましい。
(w)配列番号40に記載の塩基配列からなるポリヌクレオチド。
(x)配列番号40に記載の塩基配列において、少なくとも1つの塩基が置換、付加、挿入もしくは欠失した塩基配列からなるポリヌクレオチドであって、ヒトPRとして機能するタンパク質をコードするポリヌクレオチド。
【0161】
前記(x)のポリヌクレオチドは、前記(w)のポリヌクレオチドとの相同性が、例えば、90%以上であって、好ましくは、93%以上であり、より好ましくは、95%以上であり、さらに好ましくは、98%以上である。前記(x)のポリヌクレオチドにおいて、置換、付加、挿入もしくは欠失した塩基の数は、例えば、前記相同性に対応した数である。
【0162】
前記PR遺伝子は、例えば、配列番号40の塩基配列に基づいて、ヒトの核酸を使用して、クローニングすることにより得ることができる。前記核酸は、例えば、DNAでもよいし、トータルRNA等のRNAでもよい。前記PR遺伝子は、例えば、ホスホルアミダイト(phosphoramidite)法を利用して、化学的にDNA合成してもよい。前記クローニングの方法は、特に制限されず、例えば、市販のクローニングキット等を利用して実施できる。
【0163】
前記核内受容体がPRの場合、前記PRに対する前記転写共役因子は、特に制限されず、例えば、CBPおよびP300等がある。前記転写共役因子は、前述のように動物転写共役因子が好ましく、より好ましくはヒト転写共役因子である。前記転写共役因子遺伝子は、例えば、前述のように、前記第2のプラスミドに挿入し、このプラスミドを形質転換酵母に導入することが好ましい。前記第2のプラスミドは、高コピー型であることが好ましい。
【0164】
前記核内受容体応答配列は、例えば、前述のように、前記第1のプラスミドに挿入し、このプラスミドを形質転換酵母に導入することが好ましい。前記核内受容体応答配列および前記レポーター遺伝子は、前述のように、作動的に連結して、前記第1のプラスミドに挿入することが好ましい。前記核内受容体応答配列、例えば、GREは、繰り返し配列として、前記第1のプラスミドに挿入することが好ましい。前記第1のプラスミドは、低コピー型であることが好ましい。
【0165】
つぎに、前記核内受容体がMRであり、MR遺伝子が導入された形質転換酵母について説明する。
【0166】
MRに対するリガンドは、例えば、アルドステロンまたアルドステロン様化学物質等があげられる。前記リガンドが存在すると、前記形質転換酵母において、MRは、前記リガンドおよび前記転写共役因子と複合体を形成する。前記複合体は、前記核内受容体応答配列を認識して結合する。前記複合体の結合により、前記応答配列の下流に存在する前記レポーター遺伝子が発現する。この際、前記レポーター遺伝子の転写は、前記転写共役因子によって、活性化される。前記核内受容体がMRの場合、前記応答配列は、例えば、グルココルチコイド応答配列(GRE)があげられる。
【0167】
前記MRは、特に制限されず、前述のように、ヒトMRが好ましい。本発明の形質転換酵母において、前記ヒトMRを発現させるには、ヒトMR遺伝子を前記酵母の染色体上に導入することが好ましい。
【0168】
前記ヒトMR遺伝子は、例えば、下記(y)または(z)のポリヌクレオチドを含むことが好ましい。
(y)配列番号41に記載の塩基配列からなるポリヌクレオチド。
(z)配列番号41に記載の塩基配列において、少なくとも1つの塩基が置換、付加、挿入もしくは欠失した塩基配列からなるポリヌクレオチドであって、ヒトMRとして機能するタンパク質をコードするポリヌクレオチド。
【0169】
前記(z)のポリヌクレオチドは、前記(y)のポリヌクレオチドとの相同性が、例えば、90%以上であって、好ましくは、93%以上であり、より好ましくは、95%以上であり、さらに好ましくは、98%以上である。前記(z)のポリヌクレオチドにおいて、置換、付加、挿入もしくは欠失した塩基の数は、例えば、前記相同性に対応した数である。
【0170】
前記MR遺伝子は、例えば、配列番号41の塩基配列に基づいて、ヒトの核酸を使用して、クローニングすることにより得ることができる。前記核酸は、例えば、DNAでもよいし、トータルRNA等のRNAでもよい。前記MR遺伝子は、例えば、ホスホルアミダイト(phosphoramidite)法を利用して、化学的にDNA合成してもよい。前記クローニングの方法は、特に制限されず、例えば、市販のクローニングキット等を利用して実施できる。
【0171】
前記核内受容体がMRの場合、前記MRに対する前記転写共役因子は、特に制限されず、例えば、CBPおよびP300等がある。前記転写共役因子は、前述のように動物転写共役因子が好ましく、より好ましくはヒト転写共役因子である。前記転写共役因子遺伝子は、例えば、前述のように、前記第2のプラスミドに挿入し、このプラスミドを形質転換酵母に導入することが好ましい。前記第2のプラスミドは、高コピー型であることが好ましい。
【0172】
前記核内受容体応答配列は、例えば、前述のように、前記第1のプラスミドに挿入し、このプラスミドを形質転換酵母に導入することが好ましい。前記核内受容体応答配列および前記レポーター遺伝子は、前述のように、作動的に連結して、前記第1のプラスミドに挿入することが好ましい。前記核内受容体応答配列、例えば、GREは、繰り返し配列として、前記第1のプラスミドに挿入することが好ましい。前記第1のプラスミドは、低コピー型であることが好ましい。
【0173】
前記転写共役因子遺伝子の一例として、前記ヒトSRC1遺伝子を以下に示す。前記ヒトSRC1遺伝子は、例えば、下記(o)または(p)のポリヌクレオチドを含むことが好ましい。
(o)配列番号8に記載の塩基配列からなるポリヌクレオチド。
(p)配列番号8に記載の塩基配列において、少なくとも1つの塩基が置換、付加、挿入もしくは欠失した塩基配列からなるポリヌクレオチドであって、ヒトSRC1として機能するタンパク質をコードするポリヌクレオチド。
【0174】
前記(p)のポリヌクレオチドは、前記(o)のポリヌクレオチドとの相同性が、例えば、90%以上であって、好ましくは、93%以上であり、より好ましくは、95%以上であり、さらに好ましくは、98%以上である。前記(p)のポリヌクレオチドにおいて、置換、付加、挿入もしくは欠失した塩基の数は、例えば、前記相同性に対応した数である。
【0175】
本発明の形質転換酵母の製造方法は、特に制限されない。本発明の形質転換酵母は、例えば、宿主となる酵母からの前記コード遺伝子の欠失、および、前記酵母への前記各種遺伝子の導入等により、製造できる。
【0176】
前記宿主となる酵母は、特に制限されず、例えば、出芽酵母、分裂酵母、糸状酵母等があり、出芽酵母(Saccharomyces cerevisiae)が好ましい。
【0177】
前記酵母から、前記細胞壁タンパク質のコード遺伝子および前記排出ポンプタンパク質のコード遺伝子の少なくとも一方を欠失させる方法は、特に制限されず、公知の方法が採用できる。前記コード遺伝子は、例えば、cre−loxPシステムを利用して、欠失できる。
【0178】
前記酵母内に、前記核内受容体遺伝子を導入する方法は、特に制限されず、公知の遺伝子導入方法が採用できる。前記遺伝子導入方法は、例えば、酢酸リチウム法、リン酸カルシウム法、リポソームを用いた方法、エレクトロポレーション法、ウイルスベクターを用いる方法、マイクロピペットインジェクション法等があげられる。本発明において、前記核内受容体遺伝子の導入は、例えば、前記核内受容体に対するリガンドの分析に用いることが可能であればよい。このため、前記導入は、例えば、一過性型の導入、宿主である酵母の染色体上への組込み型の導入、または自律複製および分配が可能な人工染色体型もしくはプラスミド型の導入でもよい。中でも、例えば、取扱い、保存の容易性、ならびにリガンドの分析の迅速性、正確性および簡便性から、前述のように、宿主である酵母の染色体上への遺伝子導入が好ましい。
【0179】
前記酵母内に導入する前記核内受容体遺伝子は、例えば、酵母内で恒常的または任意に発現するように、必要な調節配列と作動的に連結されていることが好ましい。前記調節配列とは、例えば、宿主細胞すなわち酵母内において、作動的に連結された前記遺伝子の発現に必要な塩基配列である。真核細胞に適した前記調節配列は、特に制限されず、例えば、プロモーター、ポリアデニル化シグナル、エンハンサー等があげられる。本発明において、「作動的に連結」とは、例えば、各構成要素が機能を果たすことができるように並置していることを意味する。
【0180】
本発明において、前記核内受容体および前記リガンドの複合体を検出するためのレポーター遺伝子は、例えば、β−ガラクトシダーゼ遺伝子が好ましい。前記β−ガラクトシダーゼ遺伝子は、例えば、その上流に、前記複合体が認識して結合する前記応答配列と作動的に結合している。前記応答配列は、例えば、転写調節配列ともいう。前記応答配列は、例えば、前記核内受容体遺伝子の種類により適宜決定される。前記核内受容体が、AR、GR、PRおよびMRの場合、前記応答配列は、例えば、GREであり、RXRαの場合、前記応答配列は、例えば、DR1エレメントであり、ERβおよびERαの場合、前記応答配列は、例えば、EREであり、TRαおよびTRβの場合、前記応答配列は、例えば、IR0エレメントであり、AhRの場合、前記応答配列は、例えば、XREであり、PXR−1の場合は、前記応答配列は、DR−3である。前記応答配列および前記レポーター遺伝子(例えば、β−ガラクトシダーゼ遺伝子)は、前述のように、第1のプラスミドに組み込んで、酵母に導入することが好ましい。前記レポーター遺伝子は、例えば、β−ガラクトシダーゼ遺伝子に限定されず、その他、ルシフェラーゼ遺伝子、蛍光タンパク質遺伝子、β−グルクロニダーゼ遺伝子等が使用できる。
【0181】
前記転写共役因子遺伝子は、例えば、前記レポーター遺伝子を組み込んだプラスミド(第1のプラスミド)とは別のプラスミド(第2のプラスミド)に組み込んで、酵母に導入することが好ましい。
【0182】
つぎに、本発明の形質転換酵母を用いて、検体に含まれる核内受容体リガンドを分析する方法の一例を示す。本例は、前記形質転換酵母として、前記マンナン結合タンパク質のコード遺伝子と前記排出タンパク質のコード遺伝子の両方を欠失し、且つ、前記核内受容体遺伝子、前記転写共役因子遺伝子、前記核内受容体応答配列および前記レポーター遺伝子としてβ−ガラクトシダーゼ遺伝子が導入されたものの使用を例示する。本発明は、これらの例には制限されない。
【0183】
まず、前記形質転換酵母を準備する。前記形質転換酵母は、例えば、グリセロールストックを調製することが好ましい。前記グリセロールストックの調製に使用する培地は、特に制限されず、例えば、窒素源、炭素源、アミノ酸、核酸、ビタミン類等を含む培地があげられる。前記グリセロールストックの調製に使用する培地として、組成の一例を、下記表2に示す。
【0184】
【表2】

【0185】
前記グリセロールストックの調製は、例えば、以下のように前記形質転換酵母を培養することで行える。前記形質転換酵母として、前記培地で継続的に培養された状態の前記形質転換酵母を使用する場合、例えば、前記継続培養後の培養液を50μL分取し、前記表2に示す培地5000μL中に加え、30℃で12〜24時間程度振とう培養する。また、前記形質転換酵母として、凍結乾燥菌体を使用する場合、例えば、前記凍結乾燥菌体を、YPD培地等の栄養培地を加え、30℃で24時間培養し、その培養液を50μL分取し、前記表2に示す培地5000μLに加え、30℃で12〜24時間程度振とう培養する。
【0186】
前記培養によって菌体を十分増殖させた後、得られた培養液から、10倍濃縮グリセロールストック液を作製する。前記グリセロールストック液の組成は、例えば、培養液80%およびグリセロール20%を含む。前記グリセロールストック液は、例えば、−80℃での保存も可能である。
【0187】
つぎに、前記形質転換酵母を、被検物質の存在下で、本培養する。この際、前述のように調製した前記グリセロールストック液を使用することが好ましい。
【0188】
前記本培養に使用する培地は、特に制限されず、例えば、前記表2に示す培地であって、前記炭素源として、ガラクトースおよびグルコースを含むものを使用する。ガラクトースとグルコースの比率は、特に制限されず、ガラクトースおよびグルコースの合計重量に対するグルコースの重量割合が、例えば、0を超え60重量%以下、好ましくは、0を超え40重量%以下、より好ましくは、10〜30重量%の範囲である。このように、前記培地にガラクトースおよびグルコースを添加した場合、本培養において、前記形質転換酵母の増殖をより促進できる。このため、例えば、より短時間の本培養で、前記被験物質を高感度かつ高信頼性で分析可能である。
【0189】
前記本培養は、前述のように、前記培地中に、化学物質等の被験物質を添加して行う。前記培地への前記被検物質の添加方法は、特に制限されず、例えば、直接添加してもよいし、溶媒に混合、溶解または懸濁してから添加してもよい。前記被験物質が固体の場合、例えば、前記被検物質を溶媒と混合してから、前記培地に混合することが好ましい。前記溶媒は、特に制限されず、例えば、前記形質転換酵母に対して毒性が低いまたは毒性を示さないものが好ましく、ジメチルスルホキシド(DMSO)等が例示できる。
【0190】
前記本培養の条件は、特に制限されず、温度は、例えば、28〜30℃であり、前記時間は、例えば、10〜48時間、好ましくは、15〜36時間、より好ましくは18〜24時間である。前記本培養は、例えば、振とう培養でもよいし、静置培養でもよい。
【0191】
そして、前記本培養後の前記形質転換酵母を溶菌させる。前記溶菌の方法は、特に制限されず、例えば、公知の手法により行うことができる。前記溶菌は、例えば、溶菌液として、界面活性剤を含む緩衝液を使用して、行うことができる。前記界面活性剤は、特に制限されず、例えば、サルコシル(N−Lauroylsarcosine sodium salt)があげられる。前記緩衝液は、特に制限されず、例えば、Zバッファーがあげられる。前記溶菌液として、組成の一例を以下に示す。
【0192】
【表3】

【0193】
つぎに、前記溶菌後の溶菌液について、産生されたβ−ガラクトシダーゼの活性を測定する。β−ガラクトシダーゼ活性は、例えば、発色試薬と反応させ、その発色程度を、例えば、吸光度等として測定すればよい。前記発色試薬は、特に制限されず、ONPG(オルソニトロフェニルガラクトピラノシド、o−ニトロフェニル−β−D−ガラクトピラノシド)、CPRG(クロロフェノールレッドガラクトピラノシド)等の公知の発色基質が使用できる。
【0194】
活性測定において、予め、標準物質を用いて、検量線を作成しておくことが好ましい。前記検量線は、例えば、被験物質の測定と同じ条件で作成することが好ましく、被検物質の測定と同時に測定を行い、その結果に基づいて作成することが好ましい。活性測定においては、例えば、用量作用関係の範囲内に納まるように、被験物質を適宜希釈することが好ましい。このような分析方法によれば、例えば、吸光度を測定するだけでよく、簡便かつ迅速に被検物質を分析できる。
【0195】
<分析方法>
本発明の分析方法は、検体に含まれる核内受容体リガンドを分析するための方法であって、検体を含む培地中で、前記本発明の形質転換酵母を培養する培養工程と、
前記培養工程の後、前記培地中に産生された前記レポーター遺伝子の発現産物を測定する測定工程を含むことを特徴とする。
【0196】
本発明の分析方法は、前記本発明の形質転換酵母を使用することが特徴であって、その他の工程および条件等は、何ら制限されない。本発明の分析方法は、例えば、前記本発明の形質転換酵母の説明において述べた方法により実施できる。
【0197】
本発明において、分析は、例えば、前記リガンドの検出、定性、定量のいずれであってもよい。
【0198】
<分析キット>
本発明の分析キットは、本発明の分析方法を簡単に実施するためのキットである。本発明の分析キットは、前述のように、培地、本発明の前記形質転換酵母および発色試薬を含むキットである。前記発色試薬は、例えば、前述のように、ONPG、CPRG等の発色基質があげられる。さらに、本発明の分析キットは、検量線作成のための標準物質等を含んでいてもよい。前記形質転換酵母は、凍結乾燥させて粉末状にしてもよい。本発明の分析キットは、さらに、使用説明書を含んでもよい。
【0199】
<スクリーニング方法およびスクリーニングキット>
本発明の分析方法および分析キットは、例えば、スクリーニング方法およびスクリーニングキットということもできる。本発明によれば、例えば、検体中に含まれる未知物質が、どのような核内受容体に結合するのかを、簡易にスクリーニングできる。本発明のスクリーニング方法は、例えば、各核内受容体についての本発明の形質転換酵母を、複数種類同時に使用するのが好ましい。
【実施例】
【0200】
つぎに、本発明の実施例について、説明する。本発明は、以下の実施例に限定されるものではない。
【0201】
〔実施例1〕
本実施例では、以下の手順により、CWP1遺伝子およびPDR5遺伝子を欠失させた二重欠失酵母を作製し、ヒトGR遺伝子を組み込んだ形質転換酵母を作製した。
【0202】
(1)遺伝子欠失酵母の作製
プラスミドpUG6は、loxP配列で挟まれたG418耐性遺伝子を有し、前記G418耐性遺伝子が、菌類TEFプロモーターおよびターミネーターで制御されたプラスミドである(Nucleic Acids Res. (1996) 24、2519−2524)。前記プラスミドpUG6を鋳型として、下記プライマーSH005、SH006、SH013およびSH014を用いて、loxP−KanMX−loxP領域を、PCRにより増幅した。具体的には、CWP1遺伝子の近傍配列が付加されたloxP−KanMX−loxP(以下、CWP1近傍配列付加loxP−KanMX−loxPという)およびPDR5遺伝子の近傍配列が付加されたloxP−KanMX−loxP(以下、PDR5近傍配列付加loxP−KanMX−loxPという)を増幅した。前記各プライマーは、それぞれ、CWP1遺伝子またはPDR5遺伝子の近傍配列を含む配列とした。下記配列において、大文字の領域は、CWP1遺伝子またはPDR5遺伝子の近傍配列の相補配列であり、小文字の領域は、loxP−KanMX−loxPの相補配列である。
【0203】
(CWP1近傍配列付加loxP−KanMX−loxP用プライマー)
SH005(配列番号9)
5’−CTGAAGTAAAATATCCCGTAACAAACTAATAAATACTACGAcagctgaagcttcgtacgc−3’
SH006(配列番号10)
5’−TATTGAAGGAAATAAAACATGCAGGTTTTGTTCTCGTACcataggccactagtggatctg−3’
(PDR5近傍配列付加loxP−KanMX−loxP用プライマー)
SH013(配列番号11)
5’−TAAGTTTTCGTATCCGCTCGTTCGAAAGACTTTAGACAAAAcagctgaagcttcgtacgc−3’
SH014(配列番号12)
5’−AAAGTCCATCTTGGTAAGTTTCTTTTCTTAACCAAATTCcataggccactagtggatctg−3’
【0204】
【表4】

【0205】
(PCR条件1)
94℃で2分処理して、鋳型を熱変成した後、94℃で30秒、50℃で10秒および68℃で2分を1サイクルとして、35サイクル実施した。
【0206】
そして、PCR後、増幅したCWP1近傍配列付加loxP−KanMX−loxPまたはPDR5近傍配列付加loxP−KanMX−loxPを、酵母(Saccharomyces cerevisiae)W303a株に、酢酸リチウム法にて導入した。この際、形質転換酵母の選択培地は、YPD培地に、200μg/mLとなるようにG418(Geneticin、GIBCO BRL社製)を添加した、G418含有YPD培地を使用した。
【0207】
ここで、前記配列の導入により、前記形質転換酵母が、CWP1遺伝子またはPDR5遺伝子を欠失しているかを確認した。前記各遺伝子の欠失の確認は、前記形質転換酵母のDNAを鋳型として、下記プライマーを用いて、PCRにより行った。下記プライマーを用いたPCRによって、増幅が確認された場合は、CWP1遺伝子またはPDR5遺伝子を欠失していると判断した。
【0208】
(5’CWP1欠失の検証用プライマー)
SH007(配列番号13)
5’−gtgctcgaccttctatcccgt−3’
SH018(配列番号14)
5’−ctgcgcacgtcaagactg−3’
(3’CWP1欠失の検証用プライマー)
SH017(配列番号15)
5’−cctcgacatcatctgccc−3’
SH008(配列番号16)
5’−cttgtattctcctatcagcctgg−3’
(5’PDR5欠失の検証用プライマー)
SH015(配列番号17)
5’−ggactgaaacttaagactgccc−3’
SH018(配列番号14)
5’−ctgcgcacgtcaagactg−3’
(3’PDR5欠失の検証用プライマー)
SH017(配列番号15)
5’−cctcgacatcatctgccc−3’
SH016(配列番号18)
5’−gcaaaagatccgattatacttacc−3’
【0209】
【表5】

【0210】
(PCR条件2)
94℃で2分処理して、鋳型を熱変成した後、94℃で30秒、50℃で10秒および68℃で1分を1サイクルとして、35サイクル実施した。
【0211】
つづいて、Nucleic Acids Res. (1996) 24、2519−2524に準じて、プラスミドpSH47を作製した。前記プラスミドpSH47は、部位特異的組換え酵素Cre遺伝子およびウラシル選択マーカーURA3遺伝子を有し、これらの遺伝子が、Gal1−10プロモーターおよびCYC1ターミネーターで制御されたプラスミドである。前記プラスミドpSH47を、前記形質転換酵母に、酢酸リチウム法によって導入した。この際、形質転換酵母の選択培地は、ウラシル無添加のグルコース培地を使用した。前記ウラシル無添加グルコース培地は、前記表2の培地組成において、炭素源としてグルコースを含み、前記ドロップアウトパウダーとして、下記表6の組成のドロップアウトパウダーを添加した。
【0212】
【表6】

【0213】
得られたウラシル非要求性の形質転換酵母を、ウラシル無添加のグルコース液体培地を用いて、30℃で一晩、前培養を行った。前培養した前記形質転換酵母を遠心分離によって集菌した後、滅菌水で2回洗浄した。培地を、ウラシル無添加のガラクトース液体培地に代え、前記洗浄後の前記形質転換酵母を、30℃で4時間培養した。培養後、適宜希釈した菌液を、YPD寒天培地上に播種した。そして、コロニー形成後、レプリカ法によって、G418感受性となったコロニーを選抜した。前記ウラシル無添加ガラクトース培地は、前記表2の培地組成において、炭素源としてガラクトースを含み、前記ドロップアウトパウダーとして、前記表6の組成のドロップアウトパウダーを添加した。
【0214】
ここで、Cre遺伝子によってG418耐性遺伝子が切り出され、最終的に、CWP1遺伝子またはPDR5遺伝子のORFが、それぞれloxP配列に置換されたことを確認した。この確認は、前記G418感受性のコロニーのDNAを鋳型とし、前記プライマーSH007(配列番号13)、SH008(配列番号16)、SH015(配列番号17)およびSH016(配列番号18)を用いて、PCRにより行った。前記PCRは、前記PCR反応液2を使用し、前記PCR条件2で行った。前記プライマーを用いたPCRによって、増幅が確認された場合は、CWP1遺伝子またはPDR5遺伝子を欠失していると判断した。
【0215】
以上のようにして、CWP1遺伝子およびG418耐性遺伝子を欠失する遺伝子欠失酵母株、PDR5遺伝子およびG418耐性遺伝子を欠失する遺伝子欠失酵母株を得た。そして、最終的に、プラスミドpSH47が脱落して、再びウラシル要求性となった一重欠失株を、遺伝子欠失酵母株として、以下の実験に用いた。
【0216】
さらに、前記CWP1遺伝子およびG418耐性遺伝子を欠失する遺伝子欠失酵母株または前記PDR5遺伝子およびG418耐性遺伝子を欠失する遺伝子欠失酵母株から、前述と同様の操作により、二重欠失株として、前記PDR5遺伝子および前記CWP1遺伝子の両方を欠失する遺伝子欠失酵母を作製した。すなわち、前記PDR5遺伝子の欠失株に対しては、さらに、前述と同様に、CWP1遺伝子欠失の操作を行い、PDR5遺伝子およびCWP1遺伝子を欠失する遺伝子欠失株を得た。また、前記CWP1遺伝子欠失株に対しては、さらに、前述と同様に、PDR5遺伝子欠失の操作を行い、PDR5遺伝子およびCWP1遺伝子を欠失する遺伝子欠失株を得た。そして、最終的に、プラスミドpSH47が脱落して、再びウラシル要求性となった二重欠失株を、遺伝子欠失酵母株として、以下の実験に用いた。
【0217】
(2)レポータープラスミドの作製
Wolf et al. ; Biotechniques 20, 568−573 (1996)に準じて、pRW95−3を作製した。前記プラスミドpRW95−3は、β−ガラクトシダーゼ遺伝子を有するプラスミドである。
【0218】
GRに応答する配列としてGRE配列を使用した。前記GRE配列を含む下記オリゴDNA(配列番号19)およびそれに相補なオリゴDNA(配列番号20)を作製した。これらのオリゴDNAをアニーリングした。アニーリングは、94℃で1分間を1サイクルで実施した。アニーリング後、GRE配列が連続して8個アニーリングしたものを精製して、pRW95−3のBgl IIサイトに挿入した。GRE配列が連続して8個挿入されたプラスミドを、GRレポータープラスミドとした。
【0219】
(GRE配列)
GREcsfBg(配列番号19)
5’−agatctttgagaacaaactgttcttaaat−3’
GREcsrBc(配列番号20)
3’−aaactcttgtttgacaagaatttactag−5’
【0220】
(3)動物核内受容体発現プラスミドの作製
GR遺伝子のcDNAのORFを、ヒト精巣cDNA(クロンテック社製)を鋳型として、下記プライマーを用いたPCRにより増幅した。PCRは、下記PCR反応液3を用いて、下記PCR条件3により行った。
【0221】
(GR用プライマー)
GRfRbBm(配列番号21)
5’−tcgaggatccaacaaaatggactccaaagaatcattaact−3’
GRrXh(配列番号22)
5’−attcttctcgaggcagtcacttttgatgaaac−3’
【0222】
【表7】

【0223】
(PCR条件3)
94℃で40秒、58℃で20秒、68℃で3分のサイクルを1サイクルとして、40サイクル実施した。
【0224】
つぎに、増幅させたGR遺伝子のcDNAを、制限酵素BamHIおよびXhoIで切断した。切断した前記cDNAを、制限酵素BamHIおよびSalI切断した前記プラスミドpUdp6に挿入した。プラスミドpUdp6は、両方向プロモーター領域gal1、gal10およびgal10の下流にCYCターミネーターを持ち、gal1の下流にADHターミネーターを持ち、さらにウラシル選択マーカーURA3遺伝子を持つプラスミドである。前記切断したGR遺伝子のcDNAは、前記プラスミドpUdp6において、前記GAL10プロモーターの下流に挿入した。これによって、前記核内受容体遺伝子を有し、その上流にプロモーターを有するGR発現プラスミドpUdp6GRを得た。
【0225】
(4)動物転写共役因子発現プラスミドの作製
SRC1遺伝子のcDNAのORFを、ヒト精巣cDNA(クロンテック社製)を鋳型として、下記プライマーを用いたPCRにより増幅した。PCRは、下記PCR反応液4を用いて、下記PCR条件4により行った。
【0226】
(SRC1用プライマー)
hSRC1bgF(配列番号23)
5’−tggaactcaagatttgaccatatc−3’
hSRC1xhR(配列番号24)
5’−gagcattcctctagtctgtagtc−3’
【0227】
【表8】

【0228】
(PCR条件4)
94℃で40秒、56℃で20秒、68℃で5分のサイクルを1サイクルとして、40サイクル実施した。
【0229】
つぎに、増幅したSRC1遺伝子のcDNAを精製した。この精製cDNAを鋳型として、さらに、下記プライマーを用いたPCRにより、前記cDNAに制限酵素サイトを付加した。PCRは、前記PCR反応液4を用いて、下記PCR条件5により行った。
【0230】
(PCR条件5)
94℃で40秒、56℃で20秒、68℃で5分のサイクルを1サイクルとして、20サイクル実施した。
【0231】
(付加用プライマー)
SRC−1eFbg2(配列番号25)
5’−caaagaagatctcccaggtgtgaag−3’
SRC−1eRxh2(配列番号26)
5’−agggccctcgagactctagtctgtag−3’
【0232】
増幅した前記cDNAを、制限酵素BglIIおよびXhoIで切断した後、プラスミドpESC−Leuのgal1プロモーター領域の下流に挿入した。得られたプラスミドを、動物転写因子発現プラスミドpESC−Leu−hSRC1とした。
【0233】
(5)形質転換酵母の作製
前記GR発現プラスミドpUdp6GRを、制限酵素EcoRVで処理し、直鎖状とした。前記直鎖状の前記GR発現プラスミドpUdp6GRを、以下に示すように、酢酸リチウム法により、宿主となる酵母へ導入し、さらに、染色体上への組込みを行った。宿主として、前記(1)で作製したPDR5遺伝子を欠失する遺伝子欠失酵母株、PDR5遺伝子およびCWP1遺伝子を欠失する遺伝子欠失酵母株を使用した。
【0234】
まず、前記PDR5遺伝子を欠失する遺伝子欠失酵母株、PDR5遺伝子およびCWP1遺伝子を欠失する遺伝子欠失酵母株を、YPD培地中で、OD660が1〜2になるまで、30℃で培養した。培養した菌体を、ソリューションAで洗浄した後、OD660が150となるように、前記ソリューションAに再懸濁した。前記ソリューションAの組成は、0.1mol/L Lithium acetate、10mmol/L Tris−HCl(pH7.5)、1mmol/L EDTAとした(いずれも最終濃度)。菌体の懸濁液を、1.5mLマイクロチューブに100μLずつ分注して、30℃で1時間インキュベートした。インキュベート後、前記チューブに、前記直鎖状のプラスミドpUdp6GR 5μg、キャリアーDNA(商品名SALMON TESTES DNA for hybridization、SIGMA社製)150μgを合計20μL添加し、さらに、ソリューションB 850μLを添加し、緩やかに混合した。前記ソリューションBは、ソリューションA100mLにポリエチレングリコール4000を混合したものを使用した。
【0235】
つぎに、前記混合液を、30℃で30分インキュベートし、42℃で15分熱処理した後、さらに、10分室温に放置した。そして、5000rpm、1分間の遠心分離により、前記酵母を集菌した。前記酵母を、5〜10mLのYPD培地に懸濁し、30℃で一晩培養した。培養後、前記酵母を集菌し、洗浄した後、0.9%NaCl溶液に懸濁し、懸濁液100μLを、AureobasidinA(0.5g/mL)を含むYPD選択プレートに塗布し、培養した。そして、AureobasidinA耐性株を、gal1プロモーターおよびGR遺伝子のcDNA領域が、染色体上に組込まれた形質転換酵母として選択した。
【0236】
つづいて、前記形質転換酵母に、前記動物転写共役因子発現プラスミドpESC−Leu−hSRC1を導入した。この際、形質転換酵母の選択培地は、以下に示す前培養培地1にトリプトファンを100mg添加した、トリプトファン添加前培養培地を使用した。下記組成において、ドロップアウトパウダーおよび窒素源は、前記表2と同様とした。
【0237】
【表9】

【0238】
つぎに、前記形質転換酵母に、酢酸リチウム法により、前記GRレポータープラスミドを導入した。この際、形質転換酵母の選択培地は、トリプトファン無添加の前記前培養培地を使用した。このようにして、CWP1遺伝子、またはCWP1遺伝子およびPDR5遺伝子を欠失し、レポーター遺伝子を前記GRレポータープラスミドにより保持し、且つSRC1遺伝子を前記プラスミドpESC−Leu−hSRC1として保持し、ゲノムにヒトGR遺伝子を有する、形質転換酵母株を作製した。以下、PDR5遺伝子を欠失する前記形質転換酵母株を、PDR5Δ株、CWP1遺伝子およびPDR遺伝子を欠失する前記形質転換酵母株を、PDR5Δ−CWP1Δ株という。
【0239】
〔実施例2〕
本実施例では、前記実施例1で作製した形質転換酵母を用いて、GRに対するリガンドの分析を行った。比較例は、酵母(Saccharomyces cerevisiae) W 303a株を使用した。
【0240】
(1)形質転換酵母の前培養
前記形質転換酵母を、以下に示す前培養培地2を用いて、30℃で18時間、前培養を行った。その結果、濁度が、Abs595nm=1.0程度となり、前記形質転換酵母の増殖が確認された。下記組成において、ドロップアウトパウダーおよび窒素源は、前記表2と同様とした。
【0241】
【表10】

【0242】
(2)形質転換酵母の本培養
96穴プレートを用い、1ウェルあたり、リガンド溶液1μL、前培養した菌体液(O.D.=1〜1.5)5μLおよび本培養培地100μLを混合し、30℃で18時間、静置培養を行った。前記リガンド溶液は、デキサメサゾン、コルチコステロンまたはヒドロコルチゾンを、所定の濃度となるように、DMSOに溶解して調製した。下記本培養培地のドロップアウドパウダーは、トリプトファンおよびロイシンを未添加とした。下記組成において、ドロップアウトパウダーおよび窒素源は、前記表2と同様とした。
【0243】
【表11】

【0244】
(3)β−ガラクトシダーゼ活性の測定
前記本培養の後、各ウェルから培養液を5μLずつ採取し、新たな96穴プレートの各ウェルに移した。前記各ウェルに、以下の測定試薬 100μLを加えた後、37℃で30分間反応させた。反応後、マイクロプレートリーダーを用いて、前記反応液のβ−ガラクトシダーゼ活性および菌体量を測定した。前記β−ガラクトシダーゼ活性は、生成したo−ニトロフェノールの生成量から算出するため、405nmにおける前記反応液の吸光度を測定した。また、前記菌体量は、595nmにおける前記反応液の吸光度を測定した。各反応液について、405nmの吸光度と595nmの吸光度の比(Abs.405nm/Abs.595nm)を算出した。そして、分析結果は、リガンド無添加の反応液、すなわち、前記リガンド溶液に代えてDMSO 1μLを添加した反応液の比を「1」として、各反応液について誘導率で表わした。
【0245】
【表12】

【0246】
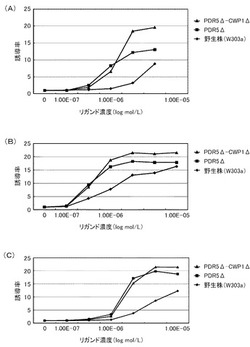
これらの結果を、下記表13、表14および図1に示す。図1において、(A)は、デキサメサゾンに対する結果を示すグラフであり、(B)が、コルチコステロンに対する結果を示すグラフであり、(C)が、ヒドロコルチゾンに対する結果を示すグラフである。前記各グラフにおいて、横軸は、各リガンド濃度(log mol/L)であり、具体的には、0、1.00E−07、5×1E−07、1.00E−06、3.3×1.00E−06、6.6×1.00E−06、1.00E−05におけるプロットであり、縦軸は、前記誘導率である。前記各グラフにおいて、黒三角のプロットが、PDR5Δ−CWP1Δ株の結果であり、黒四角のプロットが、PDR5Δ株の結果であり、黒菱形のプロットが、野生株の結果である。
【0247】
【表13】

【0248】
【表14】

【0249】
前記表13、表14および図1に示すように、野生株は、検出可能なデキサメタゾン濃度が1μmol/L以上であった。これに対して、PDR5Δ株およびPDR5Δ−CWP1Δ株は、デキメサゾン濃度300nmol/Lでβ−ガラクトシダーゼの誘導が確認できた。この結果から、本発明の形質転換酵母によれば、低いリガンド濃度であっても、十分に優れた感度を得られるといえる。また、PDR5Δ株およびPDR5Δ−CWP1Δ株は、所定のデキメサゾン濃度に対して、野生株よりも高い誘導率を示した。具体例として、前記表14に示すように、PDR5Δ株およびPDR5Δ−CWP1Δ株は、それぞれ、所定濃度において、野生株の1.5倍または2.2倍の誘導率を示した。特に、PDR5遺伝子およびCWP1遺伝子の両方を欠失したPDR5Δ−CWP1Δ株は、PDR5Δ株よりも、誘導率をさらに1.5倍向上できた。これらの結果から、本発明の形質転換酵母によれば、所定のリガンド濃度に対して、野生株よりも、さらに優れた応答性を示すといえる。また、前記表13に示すように、EC50は、野生株が、8.3μmol/Lであったのに対して、PDR5Δ株およびPDR5Δ−CWP1Δ株が、500nmol/Lであり、1/16に低減された。
【0250】
前記表13、表14および図1に示すように、PDR5Δ株およびPDR5Δ−CWP1Δ株は、コルチコステロン濃度に対して、野生株よりも高い誘導率を示した。具体例として、前記表14に示すように、PDR5Δ株およびPDR5Δ−CWP1Δ株は、それぞれ、所定のコルチコステロン濃度において、野生株の1.3倍または1.5倍の誘導率を示した。特に、PDR5遺伝子およびCWP1遺伝子の両方を欠失したPDR5Δ−CWP1Δ株は、PDR5Δ株よりも、誘導率をさらに1.2倍向上できた。これらの結果から、本発明の形質転換酵母によれば、所定のリガンド濃度に対して、野生株よりも、さらに優れた応答性を示すといえる。また、前記表13に示すように、EC50は、野生株が、1μmol/Lであったのに対して、PDR5Δ株、PDR5Δ−CWP1Δ株が、500nmol/Lであり、1/2に低減された。
【0251】
前記表13、表14および図1に示すように、野生株は、検出可能なヒドロコルチゾン濃度が1μmol/L以上であった。これに対して、PDR5Δ株およびPDR5Δ−CWP1Δ株は、ヒドロコルチゾン濃度600nmol/Lでβ−ガラクトシダーゼの誘導が確認できた。この結果から、本発明の形質転換酵母によれば、低いリガンド濃度であっても、十分に優れた感度を得られるといえる。また、PDR5Δ株およびPDR5Δ−CWP1Δ株は、所定のヒドロコルチゾン濃度に対して、野生株よりも高い誘導率を示した。具体例として、前記表14に示すように、PDR5Δ株およびPDR5Δ−CWP1Δ株は、それぞれ、所定濃度において、野生株の2.3倍または2.5倍の誘導率を示した。特に、PDR5遺伝子およびCWP1遺伝子の両方を欠失したPDR5Δ−CWP1Δ株は、PDR5Δ株よりも、誘導率をさらに1.1倍向上できた。これらの結果から、本発明の形質転換酵母によれば、所定のリガンド濃度に対して、野生株よりも、さらに優れた応答性を示すといえる。また、前記表13に示すように、EC50は、野生株が、10μmol/Lであったのに対して、PDR5Δ株およびPDR5Δ−CWP1Δ株が、1.5μmol/Lであり、1/7に低減された。
【0252】
このように、PDR5遺伝子および/またはCWP1遺伝子を欠失させることによって、前記形質転換酵母は、GRのリガンドに対して、検出感度および/または検出応答性が改善された。このため、本発明の形質転換酵母は、動物核内受容体に対するリガンドのアッセイに極めて有効といえる。
【0253】
〔実施例3〕
本実施例では、CWP1遺伝子、CWP2遺伝子およびPDR5遺伝子のいずれかを欠失させた二重欠失酵母を作製し、ヒトAhR遺伝子を組み込んだ形質転換酵母を作製した。
【0254】
(1)遺伝子欠失酵母の作製
前記実施例1で作製した、前記CWP1遺伝子を欠失する遺伝子欠失酵母株、前記PDR5遺伝子を欠失する遺伝子欠失酵母株、ならびに、PDR5遺伝子およびCWP1遺伝子を欠失する遺伝子欠失酵母株を使用した。
【0255】
また、以下のようにして、CWP2遺伝子を欠失する遺伝子欠失酵母株、CWP1遺伝子およびCWP2遺伝子を欠失する遺伝子欠失酵母株を作製した。特に示さない限りは、前記実施例1における(1)遺伝子欠失酵母の作製と同様に行った。
【0256】
前記実施例1のプラスミドpUG6を鋳型として、下記プライマーSH009およびSH010を用いて、loxP−KanMX−loxP領域を、PCRにより増幅した。具体的には、CWP2遺伝子の近傍配列が付加されたloxP−KanMX−loxP(以下、CWP2近傍配列付加loxP−KanMX−loxPという)を増幅した。前記各プライマーは、それぞれ、CWP2遺伝子の近傍配列を含む配列とした。下記配列において、大文字の領域は、CWP2の近傍配列の相補配列であり、小文字の領域は、loxP−KanMX−loxPの相補配列である。
【0257】
(CWP2近傍配列付加loxP−KanMX−loxP用プライマー)
SH009(配列番号27)
5’−CAAGAATAAATAACTTCATCACATTCGCTACACACTAACAAcagctgaagcttcgtacgc−3’
SH010(配列番号28)
5’−TACCTAGTAAAACCGAAAATTTTGAAAAAAGCCATATAGcataggccactagtggatctg−3’
【0258】
そして、PCR後、増幅したCWP2近傍配列付加loxP−KanMX−loxPを、酵母(Saccharomyces cerevisiae)W303a株に、酢酸リチウム法にて導入した。この際、形質転換酵母の選択培地は、YPD培地に、200μg/mLとなるようにG418(Geneticin、GIBCO BRL社製)を添加した、G418含有YPD培地を使用した。
【0259】
ここで、前記配列の導入により、前記形質転換酵母が、CWP2遺伝子を欠失しているかを確認した。前記遺伝子の欠失の確認は、前記形質転換酵母のDNAを鋳型として、下記プライマーを用いて、PCRにより行った。下記プライマーを用いたPCRによって、増幅が確認された場合は、CWP2遺伝子を欠失していると判断した。
【0260】
(5’CWP2欠失の検証用プライマー)
SH011(配列番号29)
5’−gctccgaagggcaattccaca−3’
SH018(配列番号14)
5’−ctgcgcacgtcaagactg−3’
(3’CWP2欠失の検証用プライマー)
SH017(配列番号15)
5’−cctcgacatcatctgccc−3’
SH012(配列番号30)
5’−cccaccgtagcacaccaatatc−3’
【0261】
ここで、Cre遺伝子によってG418耐性遺伝子が切り出され、最終的に、CWP2遺伝子のORFが、loxP配列に置換されたことを確認した。この確認は、前記G418感受性のコロニーのDNAを鋳型とし、前記プライマーSH011(配列番号29)、SH012(配列番号30)を用いて、PCRにより行った。前記PCRは、前記PCR反応液2を使用し、前記PCR条件2で行った。前記プライマーを用いたPCRによって、増幅が確認された場合は、CWP2遺伝子を欠失していると判断した。
【0262】
以上のようにして、CWP2遺伝子およびG418耐性遺伝子を欠失する遺伝子欠失酵母株を得た。そして、最終的に、プラスミドpSH47が脱落して、再びウラシル要求性となった一重欠失株を、遺伝子欠失酵母株として、以下の実験に用いた。
【0263】
さらに、前記CWP1遺伝子およびG418耐性遺伝子を欠失する遺伝子欠失酵母株または前記CWP2遺伝子およびG418耐性遺伝子を欠失する遺伝子欠失酵母株から、前述と同様の操作により、二重欠失株として、前記CWP1遺伝子および前記CWP2遺伝子の両方を欠失する遺伝子欠失酵母を作製した。すなわち、前記CWP1遺伝子の欠失株に対しては、さらに、前述と同様に、CWP2遺伝子欠失の操作を行い、CWP1遺伝子およびCWP2遺伝子を欠失する遺伝子欠失株を得た。また、前記CWP2遺伝子欠失株に対しては、さらに、前述と同様に、CWP1遺伝子欠失の操作を行い、CWP1遺伝子およびCWP2遺伝子を欠失する遺伝子欠失株を得た。そして、最終的に、プラスミドpSH47が脱落して、再びウラシル要求性となった二重欠失株を、遺伝子欠失酵母株として、以下の実験に用いた。
【0264】
(2)レポータープラスミドの作製
Wolf et al. ; Biotechniques 20, 568−573 (1996)に準じて、pRW95−3を作製した。前記プラスミドpRW95−3は、β−ガラクトシダーゼ遺伝子を有するプラスミドである。
【0265】
AhRに応答する配列として、XRE配列を使用した。前記XRE配列を含む下記オリゴDNA(配列番号31)およびそれに相補なオリゴDNA(配列番号32)を作製した。これらのオリゴDNAをアニーリングした。アニーリングは、94℃で1分間を1サイクルで実施した。アニーリング後、XRE配列が連続して5個アニーリングしたものを精製して、pRW95−3のBamHI/XmaI部位にサイトに挿入し、レポータープラスミドを作製した。XRE配列が連続して5個挿入されたプラスミドを、AhRレポータープラスミドとした。
(XRE配列)
XREfBm(配列番号31)
5’-atccttgcgtgaca-3’
XREr(配列番号32)
5’-ggattgtcacgcaa-3’
【0266】
(3)動物核内受容体発現プラスミドの作製
AhR遺伝子またはArnt遺伝子のcDNAのORFを、ヒト精巣cDNA(クロンテック社製)を鋳型として、下記プライマーを用いたPCRにより増幅した。PCRは、前記PCR反応液3を用いて、前記PCR条件3により行った。
【0267】
(AhR用プライマー)
AhRfBsiWI(配列番号33)
5’−tcgacgtacgatgaacagcagcagcgccaacatc−3’
AhRrBsiWI(配列番号34)
5’−attccgtacgttacaggaatccactggatgtcaa−3’
(Arnt用プライマー)
ArntfXbaI(配列番号35)
5’−tcgatctagaatggcggcgactactgccaacccc−3’
ArntrSse8387I(配列番号36)
5’−attccctgcaggctattctgaaaaggggggaaacat−3’
【0268】
つぎに、増幅させたAhR遺伝子のcDNAを、制限酵素BsiWIで切断した。切断した前記cDNAを、制限酵素BsiWI切断した前記プラスミドYEpLacGal1、10に挿入した。一方、増幅させたArnt遺伝子のcDNAを、制限酵素XbaIおよびSse8387Iで切断した。そして、AhR遺伝子のcDNAを挿入した前記プラスミドYEpLacGal1、10に、さらに、Arnt遺伝子のcDNAを挿入した。具体的には、切断したArnt遺伝子の前記cDNAを、制限酵素XbaIおよびSse8387Iで切断した前記プラスミドYEpLacGal1、10に挿入した。前記プラスミドYEpLacGal1、10は、両方向プロモーター領域gal1、gal10を持つプラスミドである。前記切断したAhR遺伝子のcDNAは、前記プラスミドYEpLacGal1、10において、Gal1プロモーターの下流に挿入し、前記切断したArnt遺伝子のcDNAは、前記プラスミドYEpLacGal1、10において、Gal10プロモーターの下流に挿入した。これによって、前記核内受容体遺伝子を有し、その上流にプロモーターを有するプラスミドYEpLacAhR/Arntを得た。クローニングには、大腸菌HB101株を使用した。
【0269】
前記プラスミドYEpLacAhR/Arntから、gal1プロモーター領域、gal10プロモーター領域および前記cDNAを含むDNAフラグメントを、制限酵素SacIおよびSalIで切り出し、プラスミドpAUR101のSacIサイトおよびSalIサイトの間に挿入した。得られたプラスミドを、AhR発現プラスミドpAUR101AhR/Arntとした。
【0270】
(4)形質転換酵母の作製
前記遺伝子欠失酵母、前記AhRレポータープラスミド、前記AhR発現プラスミドを使用し、前記動物転写共役因子発現プラスミドを使用しなかった以外は、前記実施例1と同様にして形質転換酵母を作製した。以下、CWP1遺伝子を欠失する前記形質転換酵母株を、CWP1Δ株、CWP2遺伝子を欠失する前記形質転換酵母株を、CWP2Δ株、PDR5遺伝子を欠失する前記形質転換酵母株を、PDR5Δ株、CWP1遺伝子およびCWP2遺伝子を欠失する前記形質転換酵母株を、CWP1Δ−CWP2Δ株、CWP1遺伝子およびPDR5遺伝子を欠失する前記形質転換酵母株を、PDR5Δ−CWP1Δ株という。
【0271】
〔実施例4〕
本実施例では、前記実施例3で作製した形質転換酵母を用いて、AhRに対するリガンドの分析を行った。比較例は、酵母(Saccharomyces cerevisiae) W 303a株を使用した。
【0272】
本実施例では、β−NFを、所定の濃度となるように、DMSOに溶解して調製したリガンド溶液を使用した以外は、前記実施例2と同様にして、誘導率を求めた。
【0273】
これらの結果を、下記表15、表16および図2に示す。図2は、β−NFに対する結果を示すグラフである。前記グラフにおいて、横軸は、各リガンド濃度(μmol/L)であり、具体的には、0、0.0001、0.001、0.01、0.1、1、10、100μmol/Lにおけるプロットであり、縦軸は、前記誘導率である。前記グラフにおいて、黒三角のプロットが、PDR5Δ−CWP1Δ株の結果であり、黒逆三角のプロットが、CWP1Δ−CWP2Δ株の結果であり、黒丸のプロットが、CWP1Δ株の結果であり、黒四角のプロットが、PDR5Δ株の結果であり、白丸のプロットが、CWP2Δ株の結果であり、黒菱形のプロットが、野生株の結果である。
【0274】
【表15】

【0275】
【表16】

【0276】
前記表15、表16および図2に示すように、野生株は、検出可能なβ−NF濃度が100nmol/L以上であった。これに対して、全ての変異株について、β−NF濃度10nmol/Lでβ−ガラクトシダーゼの誘導が確認できた。この結果から、本発明の形質転換酵母によれば、低いリガンド濃度であっても、十分に優れた感度を得ることができる。また、全ての変異株が、検出可能なリガンド濃度において、野生株よりも高い誘導率を示した。具体例として、前記表16に示すように、PDR5Δ株およびPDR5Δ−CWP1Δ株は、それぞれ、野生株の5.3倍または3.5倍の最大誘導率を示した。これらの結果から、本発明の形質転換酵母によれば、所定のリガンド濃度に対して、野生株よりも、さらに優れた応答性を示すといえる。また、前記表15に示すように、EC50は、野生株が、500nmol/Lであったのに対して、CWP1Δが、90nmol/L、CWP2Δが、150nmol/L、PDR5Δ株が、150nmol/L、CWP1Δ−CWP2Δが、15nmol/L、PDR5Δ−CWP1Δ株では60nmol/Lであり、1/3から1/30に低減された。
【0277】
このように、PDR5遺伝子、CWP1遺伝子およびCWP2遺伝子の少なくともいずれかを欠失させることによって、前記形質転換酵母は、AhRのリガンドに対して、検出感度および/または検出応答性が改善された。このため、本発明の形質転換酵母は、動物核内受容体に対するリガンドのアッセイに極めて有効といえる。
【0278】
以下の方法により、形質転換酵母を作製し、リガンド分析を行った。
【0279】
(A)遺伝子欠失酵母の作製
下記の方法により、各1遺伝子欠失酵母、各2遺伝子欠失酵母および各3遺伝子欠失酵母を作製した。
【0280】
(1)1遺伝子欠失酵母の作製
(1−1)CWP1遺伝子
実施例1と同様の方法で、CWP1遺伝子を欠失する遺伝子欠失酵母を作製した。
【0281】
(1−2)PDR5遺伝子
実施例1と同様の方法で、PDR5遺伝子を欠失する遺伝子欠失酵母を作製した。
【0282】
(1−3)CWP2遺伝子
実施例3と同様の方法で、CWP2遺伝子を欠失する遺伝子欠失酵母を作製した。
【0283】
(1−4)PDR10遺伝子
下記のようにして、PDR10遺伝子を欠失する遺伝子欠失酵母を作製した。特に示さない限りは、前記実施例1における(1)遺伝子欠失酵母の作製と同様に行った。
【0284】
前記実施例1のプラスミドpUG6を鋳型として、下記プライマーSH049およびSH050を用いて、loxP−KanMX−loxP領域を、PCRにより増幅した。具体的には、PDR10遺伝子の近傍配列が付加されたloxP−KanMX−loxP(以下、PDR10近傍配列付加loxP−KanMX−loxPという)を増幅した。前記各プライマーは、PDR10遺伝子の近傍配列を含む配列とした。下記配列において、大文字の領域は、PDR10遺伝子の近傍配列の相補配列であり、小文字の領域は、loxP−KanMX−loxPの相補配列である。
【0285】
(PDR10近傍配列付加loxP−KanMX−loxP用プライマー)
SH049(配列番号42)
5’−AAAAATCAAACAATAATTTCTGGTCTTACATAGTTGTTAGGcagctgaagcttcgtacgc−3’
SH050(配列番号43)
5’−ATTTCTTTAATTTTTTGCTTTTCTTTGGAACCCGCACCAcataggccactagtggatctg−3’
【0286】
そして、PCR後、増幅したPDR10近傍配列付加loxP−KanMX−loxPを、以下のように、酵母(Saccharomyces cerevisiae)W303a株に、酢酸リチウム法にて導入した。この際、形質転換酵母の選択培地は、YPD培地に、200μg/mLとなるようにG418(Geneticin、GIBCO BRL社製)を添加した、G418含有YPD培地を使用した。
【0287】
ここで、前記配列の導入により、前記形質転換酵母が、PDR10遺伝子を欠失しているかを確認した。前記遺伝子の欠失の確認は、前記形質転換酵母のDNAを鋳型として、下記プライマーを用いて、PCRにより行った。下記プライマーを用いたPCRによって、増幅が確認された場合は、PDR10遺伝子を欠失していると判断した。
【0288】
(5’PDR10欠失の検証用プライマー)
SH051(配列番号44)
5’−cgcgctataatgccaaaatccg−3’
SH018(配列番号14)
5’−ctgcgcacgtcaagactg−3’
(3’PDR10欠失の検証用プライマー)
SH017(配列番号15)
5’−cctcgacatcatctgccc−3’
SH052(配列番号45)
5’−catcagacgtatattcagcagc−3’
【0289】
つづいて、Nucleic Acids Res. (1996) 24、2519−2524に準じて、プラスミドpSH47を作製した。前記プラスミドpSH47は、部位特異的組換え酵素Cre遺伝子およびウラシル選択マーカーURA3遺伝子を有し、これらの遺伝子が、Gal1−10プロモーターおよびCYC1ターミネーターで制御されたプラスミドである。前記プラスミドpSH47を、前記形質転換酵母に、酢酸リチウム法によって導入した。この際、形質転換酵母の選択培地は、ウラシル無添加のグルコース培地を使用した。前記ウラシル無添加グルコース培地は、前記表2の培地組成において、炭素源としてグルコースを含み、前記ドロップアウトパウダーとして、前記表6の組成のドロップアウトパウダーを添加した。
【0290】
得られたウラシル非要求性の形質転換酵母を、ウラシル無添加のグルコース液体培地を用いて、30℃で一晩、前培養を行った。前培養した前記形質転換酵母を遠心分離によって集菌した後、滅菌水で2回洗浄した。培地を、ウラシル無添加のガラクトース液体培地に代え、前記洗浄後の前記形質転換酵母を、30℃で4時間培養した。培養後、適宜希釈した菌液を、YPD寒天培地上に播種した。そして、コロニー形成後、レプリカ法によって、G418感受性となったコロニーを選抜した。前記ウラシル無添加ガラクトース培地は、前記表2の培地組成において、炭素源としてガラクトースを含み、前記ドロップアウトパウダーとして、前記表6の組成のドロップアウトパウダーを添加した。
【0291】
ここで、Cre遺伝子によってG418耐性遺伝子が切り出され、最終的に、PDR10遺伝子のORFが、loxP配列に置換されたことを確認した。この確認は、前記G418感受性のコロニーのDNAを鋳型とし、前記プライマーSH051(配列番号44)およびSH052(配列番号45)を用いて、PCRにより行った。前記PCRは、前記PCR反応液2を使用し、前記PCR条件2で行った。前記プライマーを用いたPCRによって、増幅が確認された場合は、PDR10遺伝子を欠失していると判断した。
【0292】
以上のようにして、一重欠失株として、PDR10遺伝子およびG418耐性遺伝子を欠失する遺伝子欠失酵母株を得た。そして、最終的に、プラスミドpSH47が脱落して、再びウラシル要求性となった株を、遺伝子欠失酵母株とした。
【0293】
(2)2遺伝子欠失酵母の作製
(2−1)PDR5遺伝子およびCWP1遺伝子
実施例1と同様の方法で、PDR5遺伝子およびCWP1遺伝子を欠失する遺伝子欠失酵母を作製した。
【0294】
(2−2)CWP1遺伝子およびCWP2遺伝子
実施例3と同様の方法で、CWP1遺伝子およびCWP2遺伝子を欠失する遺伝子欠失酵母を作製した。
【0295】
(2−3)PDR5遺伝子およびCWP2遺伝子
下記のようにして、PDR5遺伝子およびCWP2遺伝子を欠失する遺伝子欠失酵母株を作製した。特に示さない限りは、前記実施例1および前記実施例3における(1)遺伝子欠失酵母の作製と同様に行った(以下、同様)。
【0296】
前記CWP2遺伝子およびG418耐性遺伝子を欠失する遺伝子欠失酵母株または前記PDR5遺伝子およびG418耐性遺伝子を欠失する遺伝子欠失酵母株から、前述と同様の操作により、二重欠失株として、前記PDR5遺伝子および前記CWP2遺伝子の両方を欠失する遺伝子欠失酵母を作製した。すなわち、前記PDR5遺伝子の欠失株に対しては、さらに、前述と同様に、CWP2遺伝子欠失の操作を行い、PDR5遺伝子およびCWP2遺伝子を欠失する遺伝子欠失株を得た。また、前記CWP2遺伝子欠失株に対しては、さらに、前述と同様に、PDR5遺伝子欠失の操作を行い、PDR5遺伝子およびCWP2遺伝子を欠失する遺伝子欠失株を得た。そして、最終的に、プラスミドpSH47が脱落して、再びウラシル要求性となった株を、遺伝子欠失酵母株とした。
【0297】
(2−4)CWP1遺伝子およびPDR10遺伝子
前記CWP1遺伝子およびG418耐性遺伝子を欠失する遺伝子欠失酵母株、または前記PDR10遺伝子およびG418耐性遺伝子を欠失する遺伝子欠失酵母株から、前述と同様の操作により、二重欠失株として、前記CWP1遺伝子および前記PDR10遺伝子の両方を欠失する遺伝子欠失酵母を作製した。すなわち、前記CWP1遺伝子の欠失株に対しては、さらに、前述と同様に、PDR10遺伝子欠失の操作を行い、CWP1遺伝子およびPDR10遺伝子を欠失する遺伝子欠失株を得た。また、前記PDR10遺伝子欠失株に対しては、さらに、前述と同様に、CWP1遺伝子欠失の操作を行い、CWP1遺伝子およびPDR10遺伝子を欠失する遺伝子欠失株を得た。そして、最終的に、プラスミドpSH47が脱落して、再びウラシル要求性となった株を、遺伝子欠失酵母株とした。
【0298】
(2−5)PDR5遺伝子およびPDR10遺伝子
前記PDR5遺伝子およびG418耐性遺伝子を欠失する遺伝子欠失酵母株、または前記PDR10遺伝子およびG418耐性遺伝子を欠失する遺伝子欠失酵母株から、前述と同様の操作により、二重欠失株として、前記PDR5遺伝子および前記PDR10遺伝子の両方を欠失する遺伝子欠失酵母を作製した。すなわち、前記PDR5遺伝子の欠失株に対しては、さらに、前述と同様に、PDR10遺伝子欠失の操作を行い、PDR5遺伝子およびPDR10遺伝子を欠失する遺伝子欠失株を得た。また、前記PDR10遺伝子欠失株に対しては、さらに、前述と同様に、PDR5遺伝子欠失の操作を行い、PDR5遺伝子およびPDR10遺伝子を欠失する遺伝子欠失株を得た。そして、最終的に、プラスミドpSH47が脱落して、再びウラシル要求性となった株を、遺伝子欠失酵母株とした。
【0299】
(3)3遺伝子欠失酵母の作製
(3−1)CWP1遺伝子、CWP2遺伝子およびPDR5遺伝子
前記CWP1遺伝子、CWP2遺伝子およびG418耐性遺伝子を欠失する遺伝子欠失酵母株、または前記CWP1遺伝子、PDR5遺伝子およびG418耐性遺伝子を欠失する遺伝子欠失酵母株、または前記CWP2遺伝子、PDR5遺伝子およびG418耐性遺伝子を欠失する遺伝子欠失酵母株から、前述と同様の操作により、三重重欠株として、前記CWP1遺伝子、CWP2遺伝子およびPDR5遺伝子すべてを欠失する遺伝子欠失酵母を作製した。すなわち、前記CWP1遺伝子およびCWP2遺伝子の欠失株に対しては、さらに、前述と同様に、PDR5遺伝子欠失の操作を行い、CWP1遺伝子、CWP2遺伝子およびPDR5遺伝子を欠失する遺伝子欠失株を得た。また、前記CWP1遺伝子およびPDR5遺伝子欠失株に対しては、さらに、前述と同様に、CWP2遺伝子欠失の操作を行い、CWP1遺伝子、CWP2遺伝子およびPDR5遺伝子を欠失する遺伝子欠失株を得た。また、前記CWP2遺伝子およびPDR5遺伝子欠失株に対しては、さらに、前述と同様に、CWP1遺伝子欠失の操作を行い、CWP1遺伝子、CWP2遺伝子およびPDR5遺伝子を欠失する遺伝子欠失株を得た。そして、最終的に、プラスミドpSH47が脱落して、再びウラシル要求性となった株を、遺伝子欠失酵母株とした。
【0300】
(3−2)CWP1遺伝子、PDR5遺伝子およびPDR10遺伝子
前記CWP1遺伝子、PDR5遺伝子およびG418耐性遺伝子を欠失する遺伝子欠失酵母株、前記CWP1遺伝子、PDR10遺伝子およびG418耐性遺伝子を欠失する遺伝子欠失酵母株、または前記PDR5遺伝子、PDR10遺伝子およびG418耐性遺伝子を欠失する遺伝子欠失酵母株から、前述と同様の操作により、三重重欠株として、前記CWP1遺伝子、PDR5遺伝子およびPDR10遺伝子すべてを欠失する遺伝子欠失酵母を作製した。すなわち、前記CWP1遺伝子およびPDR5遺伝子の欠失株に対しては、さらに、前述と同様に、PDR10遺伝子欠失の操作を行い、CWP1遺伝子、PDR5遺伝子およびPDR10遺伝子を欠失する遺伝子欠失株を得た。また、前記CWP1遺伝子およびPDR10遺伝子欠失株に対しては、さらに、前述と同様に、PDR5遺伝子欠失の操作を行い、CWP1遺伝子、PDR5遺伝子およびPDR10遺伝子を欠失する遺伝子欠失株を得た。また、前記PDR5遺伝子およびPDR10遺伝子欠失株に対しては、さらに、前述と同様に、CWP1遺伝子欠失の操作を行い、CWP1遺伝子、PDR5遺伝子およびPDR10遺伝子を欠失する遺伝子欠失株を得た。そして、最終的に、プラスミドpSH47が脱落して、再びウラシル要求性となった株を、遺伝子欠失酵母株とした。
【0301】
(B)レポータープラスミドの作製
Wolf et al. ; Biotechniques 20, 568−573 (1996)に準じて、pRW95−3を作製した。前記プラスミドpRW95−3は、β−ガラクトシダーゼ遺伝子を有するプラスミドである。
【0302】
核内受容体に応答する配列(応答配列)を含むオリゴDNAおよびそれに相補的なオリゴDNAを作製した。アニーリングは、94℃で1分間を1サイクルで実施した。アニーリング後、前記応答配列が連続して複数個アニーリングしたものを精製して、pRW95−3の所定の制限酵素サイトに挿入した。前記応答配列が連続して複数個挿入されたプラスミドを、核内受容体レポータープラスミドとした。各応答配列についてのオリゴDNAおよびそれに相補的なオリゴDNAは、下記のとおりである。なお、応答配列である前記「GRE配列」を含むオリゴヌクレオチドDNAおよびそれに相補的なオリゴDNAは、前記実施例1と同様のものを使用した。また、応答配列である前記「XRE配列」を含むオリゴヌクレオチドDNAおよびそれに相補的なオリゴDNAは、前記実施例3と同様のものを使用した。
【0303】
(ERE配列)
ERE−Bmg2(配列番号46)
5’−gatcccaggtcaacatgacctagaa−3’
ERE−Bgm2(配列番号47)
5’−gatcttctaggtcatgttgacctgg−3’
(IR−0配列)
IR0XbaF (配列番号48)
5’−ctagatctcaggtcatgacctttcatcca−3’
IR0SpeR (配列番号49)
5’−ctagtggatgaaaggtcatgacctgagat−3’
(DR−3配列)
DR−3 Xb(配列番号50)
5’−ctagaaacagttcataaagttcatctg−3’
DR−3 Nh(配列番号51)
5’−ctagcagatgaactttatgaactgttt−3’
【0304】
(C)動物核内受容体発現プラスミドの作製
核内受容体遺伝子のcDNAのORFを、ヒトcDNAを鋳型として、下記プライマーを用いたPCRにより増幅した。PCRは、前記PCR反応液3を用いて、前記PCR条件3により行った。なお、AhR遺伝子については、AhR遺伝子またはArnt遺伝子のcDNAのORFを増幅し、PXR−1遺伝子については、PXR−1遺伝子またはRXRα遺伝子のcDNAのORFを増幅した。また、GR遺伝子用のプライマーは、前記実施例1と同様のものを使用した。AhR遺伝子またはArnt遺伝子用のプライマーは、前記実施例3と同様のものを使用した。
【0305】
(ERα用プライマー)
ERaRbSPf(配列番号52)
5’−ccacactagtctaaaaacatgatgaccatgaccctccacac−3’
ERaSLr (配列番号53)
5’−ggaagtcgactcagaccgtggcagggaaaccctc−3’
(ERβ用プライマー)
ERβfXb(配列番号54)
5’−gcctcttctagaaaggtgttttctcagc−3’
ERβrHd(配列番号55)
5’−acgcttaagcttgtgacctctgtgggcc−3’
(TRα用プライマー)
TRaRbSpF(配列番号56)
5’−gggcactagtaacaaaatggaacagaagccaagca−3’
TRaHdR (配列番号57)
5’−ggccaagcttgctttagacttcctgatcctcaaag−3’
(TRβ用プライマー)
TRb1frbSp(配列番号58)
5’−caggactagtaaactatgactcccaacagtatgac−3’
TRb1rHd (配列番号59)
5’−ttcgtgaagcttcagtctaatcctcgaacacttcc−3’
(PXR−1用プライマー)
PXRfRbSp(配列番号60)
5’−ttccaactagtaaaacatggaggtgagacccaaag−3’
PXRrHd (配列番号61)
5’−ccttcaagcttctcagctacctgtgatgccgaac−3’
(RXRα用プライマー)
RXRaRbKpnF(配列番号62)
5’−aaaggggtacctcaaaaatggacaccaaacatttcctgcc−3’
RXRaEcr (配列番号63)
5’−cttaagaattctaagtcatttggtgcggc−3’
(PR用プライマー)
hPRfBg(配列番号64)
5’−gggcagatctacaaaatgactgagctgaaggcaaa−3’
hPRrXh(配列番号65)
5’−caagacctcgagatcctgaccaaac−3’
(AR用プライマー)
ARfRbBm(配列番号66)
5’−tcgaggatccaacaaaatggaagtgcagttagggctggg−3’
ARrXh (配列番号67)
5’−agggggctcgagctggggtggggaaatagg−3’
(MR用プライマー)
hMRfBg(配列番号68)
5’−ccgagatctaacacaatggagaccaaaggctacca−3’
hMRrHi(配列番号69)
5’−gaattcaaagggacacaacaaggtgttcgaattcc−3’
【0306】
つぎに、増幅させた核内受容体遺伝子のcDNAを、所望の制限酵素で切断した。切断した前記cDNAを、所望の制限酵素で切断した下記プラスミドに挿入した。これによって、前記核内受容体遺伝子を有し、その上流にプロモーターを有する核内受容体発現プラスミドを得た。
【0307】
(プラスミドpUdp5)
プラスミドpUdp5は、両方向プロモーター領域gal1、gal10およびgal10の下流にCYCターミネーターおよびウラシル選択マーカーURA3遺伝子を持つプラスミドである。プラスミドpUdp5の作製方法等については、例えば、特開2009−232697号公報(特願2008−79803)の[0080]〜[0084]の記載を参照できる。
(プラスミドpUdp6)
プラスミドpUdp6は、両方向プロモーター領域gal1、gal10およびgal10の下流にCYCターミネーター、gal1の下流にADHターミネーターを持ち、さらにウラシル選択マーカーURA3遺伝子を持つプラスミドである。プラスミドpUdp6の作製方法等については、例えば、「Shiizaki et al. Toxicology in Vitro 24, 638−644 (2010)の記載を参照できる。
(プラスミドpUdp8)
プラスミドpUdp8は、両方向プロモーター領域gal1、gal10およびgal10の下流にURS mRNA不安定化配列、CYCターミネーターおよびウラシル選択マーカーURA3遺伝子を持つプラスミドである。プラスミドpUdp8の作製方法等については、例えば、特開2009−232697号公報(特願2008−79803)の[0080]〜[0087]の記載を参照できる。
(プラスミドpUra3)
プラスミドpUra3は、両方向プロモーター領域gal1、gal10およびウラシル選択マーカーURA3遺伝子を持つプラスミドである。プラスミドpUdp3の作製方法等については、例えば、特開2009−232697号公報(特願2008−79803)の[0080]の記載を参照できる。
【0308】
(D)動物転写共役因子発現プラスミドの作製
前記実施例1と同様にして、動物転写共役因子発現プラスミドpESC−Leu−hSRC1を作製した。
【0309】
(E)形質転換酵母の作製
前記核内受容体発現プラスミドを、制限酵素EcoRV処理し、直鎖状とした。なお、ERβ発現プラスミドの場合には、制限酵素NcoI処理し、直鎖状とした。前記遺伝子欠失酵母、前記レポータープラスミド、直鎖状の前記核内受容体発現プラスミドを使用し、前記実施例1と同様にして形質転換酵母を作製した。なお、AhRについては、前記動物転写共役因子発現プラスミドを導入しなかった。
【0310】
各遺伝子を欠失する前記形質転換酵母株を、以下のように示す。
(1遺伝子欠失株)
CWP1遺伝子を欠失:CWP1Δ株
CWP2遺伝子を欠失:CWP2Δ株
PDR5遺伝子を欠失:PDR5Δ株
PDR10遺伝子を欠失:PDR10Δ株
(2遺伝子欠失株)
PDR5遺伝子およびCWP1遺伝子を欠失:PDR5Δ−CWP1Δ株
CWP1遺伝子およびCWP2遺伝子を欠失:CWP1Δ−CWP2Δ株
CWP2遺伝子およびPDR5遺伝子を欠失:CWP2Δ−PDR5Δ株
CWP1遺伝子およびPDR10遺伝子を欠失:CWP1Δ−PDR10Δ株
PDR5遺伝子およびPDR10遺伝子を欠失:PDR5Δ−PDR10Δ株
(3遺伝子欠失株)
CWP1遺伝子、CWP2遺伝子およびPDR5遺伝子を欠失:
CWP1Δ−CWP2Δ−PDR5Δ株
CWP1遺伝子、PDR5遺伝子およびPDR10遺伝子を欠失:
CWP1Δ−PDR5Δ−PDR10Δ株
【0311】
(F)リガンド分析
作製した形質転換酵母を用いて、前記核内受容体に対するリガンドの分析を行った。比較例は、酵母(Saccharomyces cerevisiae) W303a株(野生株)を使用した。
【0312】
具体的には、前記リガンドを所定の濃度となるように、DMSOに溶解して調製したリガンド溶液を使用した。さらに分析結果について、前記実施例2および前記実施例4で算出した誘導率に代えて、リガンド無添加の反応液、すなわち、前記リガンド溶液に代えてDMSO 1μLを添加した反応液の値を、リガンド添加の反応液の値をから差し引いた誘導増加量を求めた。これら以外は、前記実施例2および前記実施例4と同様とした。前記誘導増加量を、レポーター活性値ということがあり、前記誘導の増加を、レポーター活性ということがある(以下、同様)。
【0313】
〔実施例5〕
本実施例では、CWP1遺伝子、CWP2遺伝子およびPDR5遺伝子のいずれかを欠失させた欠失酵母を作製し、ヒトERα遺伝子を組み込んだ形質転換酵母を作製した。
【0314】
(1)遺伝子欠失酵母の作製
前記PDR5遺伝子、前記CWP1遺伝子、または前記CWP2遺伝子を欠失する遺伝子欠失酵母株、前記PDR5遺伝子および前記CWP1遺伝子、前記CWP1遺伝子および前記CWP2遺伝子、または前記CWP2遺伝子および前記PDR5遺伝子を欠失する遺伝子欠失酵母株、ならびに、CWP1遺伝子、CWP2遺伝子およびPDR5遺伝子を欠失する遺伝子欠失酵母を使用した。
【0315】
(2)レポータープラスミドの作製
前記ERαに応答する配列であるERE配列が連続して3個アニーリングしたものを精製して、pRW95−3のBglII部位に挿入した。ERE配列が3個挿入されたプラスミドを、ERαレポータープラスミドとした。
【0316】
(3)動物核内受容体発現プラスミドの作製
増幅させたERα遺伝子のcDNAを、制限酵素SpeIおよびSalIで切断した。切断した前記cDNAを、制限酵素SpeIおよびSalI切断したプラスミドpUdp5に挿入した。前記プラスミドpUdp5において、切断した前記cDNAは、前記Gal10プロモーターの下流に挿入した。これによって、前記核内受容体遺伝子を有し、その上流にプロモーターを有するERα発現プラスミドpUdp5ERαを得た。
【0317】
(4)形質転換酵母の作製
前記遺伝子欠失酵母、ERαレポータープラスミド、直鎖状の前記ERα発現プラスミド、前記動物転写因子発現プラスミドを使用し、下記の7種類の形質転換酵母を作製した。
1遺伝子欠失株:CWP1Δ株、CWP2Δ株、PDR5Δ株
2遺伝子欠失株:CWP1Δ−CWP2Δ株、PDR5Δ−CWP1Δ株、CWP2Δ−PDR5Δ株
3遺伝子欠失株:CWP1Δ−CWP2Δ−PDR5Δ株
【0318】
〔実施例6〕
本実施例では、前記実施例5で作製した形質転換酵母を使用し、前記リガンドとして、17β−エストラジオールを使用し、誘導増加量を求めた。
【0319】
これらの結果を、下記表17、表18および図3に示す。図3は、17β−エストラジオールに対する結果を示すグラフである。前記グラフにおいて、横軸は、各リガンド濃度(μmol/L)であり、具体的には、0.000001、0.00001、0.0001、0.001、0.01、0.1、1、10μmol/Lにおけるプロットであり、縦軸は、リガンドにより誘導された誘導増加量(レポーター活性値)である。前記グラフにおいて、黒菱形のプロット(◆)が野生株の結果であり、黒四角のプロット(■)がCWP1Δ株の結果であり、黒三角のプロット(▲)がCWP2Δ株の結果であり、バツのプロット(×)がPDR5Δ株の結果であり、アスタリスクのプロット(*)がPDR5Δ−CWP1Δ株の結果であり、黒丸のプロット(●)がCWP2Δ−PDR5Δ株の結果であり、縦線のプロット(|)がCWP1Δ−CWP2Δ株の結果であり、白三角のプロット(△)がCWP1Δ−CWP2Δ−PDR5Δ株の結果である。
【0320】
【表17】

【0321】
【表18】

【0322】
前記表17、表18および図3に示すように、野生株は、検出可能な17β−エストラジオール濃度が100pmol/L以上であった。これに対して、全ての変異株について、17β−エストラジオール濃度10pmol/Lでβ−ガラクトシダーゼの誘導が確認できた。この結果から、本発明の形質転換酵母によれば、PDR5遺伝子、CWP1遺伝子およびCWP2遺伝子の少なくともいずれかを欠失させることによって、ERαに対するリガンドが低濃度であっても、十分に優れた感度を得ることができる。また、全ての変異株が、検出可能なリガンド濃度において、野生株よりも高いレポーター活性を示した。具体例として、前記表18に示すように、CWP1Δ株、CWP2Δ株、CWP1Δ−CWP2Δ株およびPDR5Δ−CWP1Δ株は、それぞれ、野生株の40.6倍、37.9倍、41.7倍、36.1倍と、特に優れたレポーター活性を示した。その他の株も7〜15倍のレポーター活性を示した。これらの結果から、本発明の形質転換酵母によれば、所定のリガンド濃度に対して、野生株よりも、さらに優れた応答性を示すといえる。また、前記表17に示すように、EC50は、野生株が、396pmol/Lであったのに対して、CWP1Δ株が、33.6pmol/L、CWP2Δ株が、25.6pmol/L、PDR5Δ株が、69.8pmol/L、CWP1Δ−CWP2Δ株が、37.9pmol/L、PDR5Δ−CWP1Δ株が、33.6pmol/Lであり、1/6から1/15に低減された。
【0323】
以上のように、マンナン結合タンパク質のコード遺伝子または排出ポンプタンパク質のコード遺伝子のいずれを欠失させることにより、前記形質転換酵母は、ERαのリガンドに対して、検出感度および/または検出応答性が改善された。このため、本発明の形質転換酵母は、動物核内受容体に対するリガンドのアッセイに極めて有効といえる。
【0324】
〔実施例7〕
本実施例では、CWP1遺伝子、CWP2遺伝子およびPDR5遺伝子のいずれかを欠失させた欠失酵母を作製し、ヒトERβ遺伝子を組み込んだ形質転換酵母を作製した。
【0325】
(1)遺伝子欠失酵母の作製
前記PDR5遺伝子、前記CWP1遺伝子、または前記CWP2遺伝子を欠失する遺伝子欠失酵母株、前記PDR5遺伝子および前記CWP1遺伝子、前記CWP1遺伝子および前記CWP2遺伝子、または前記CWP2遺伝子および前記PDR5遺伝子を欠失する遺伝子欠失酵母株、ならびに、CWP1遺伝子、CWP2遺伝子およびPDR5遺伝子を欠失する遺伝子欠失酵母を使用した。
【0326】
(2)レポータープラスミドの作製
前記実施例5と同様にして、ERE配列が3個挿入されたプラスミドを作製した。このプラスミドを、ERβレポータープラスミドとした。
【0327】
(3)動物核内受容体発現プラスミドの作製
増幅させたERβ遺伝子のcDNAを、制限酵素XbaIおよびHindIIIで切断した。切断した前記cDNAを、制限酵素XbaIおよびHindIII切断した前記プラスミドpUdp5に挿入した。前記プラスミドpUdp5において、切断した前記cDNAは、前記Gal10プロモーターの下流に挿入した。これによって、前記核内受容体遺伝子を有し、その上流にプロモーターを有するERβ発現プラスミドpUdp5ERβを得た。
【0328】
(4)形質転換酵母の作製
前記遺伝子欠失酵母、ERβレポータープラスミド、直鎖状の前記Eβ発現プラスミド、前記動物転写因子発現プラスミドを使用し、下記の7種類の形質転換酵母を作製した。
1遺伝子欠失株:CWP1Δ株、CWP2Δ株、PDR5Δ株
2遺伝子欠失株:CWP1Δ−CWP2Δ株、PDR5Δ−CWP1Δ株、CWP2Δ−PDR5Δ株
3遺伝子欠失株:CWP1Δ−CWP2Δ−PDR5Δ株
【0329】
〔実施例8〕
本実施例では、前記実施例7で作製した形質転換酵母を使用し、前記リガンドとして、17β−エストラジオールを使用し、誘導増加量を求めた。
【0330】
これらの結果を、下記表19、表20および図4に示す。図4は、17β−エストラジオールに対する結果を示すグラフである。前記グラフにおいて、横軸は、各リガンド濃度(μmol/L)であり、具体的には、0.000001、0.00001、0.0001、0.001、0.01、0.1、1、10μmol/Lにおけるプロットであり、縦軸は、リガンドにより誘導された誘導増加量(レポーター活性値)である。前記グラフにおいて、黒菱形のプロット(◆)が野生株の結果であり、黒四角のプロット(■)がCWP1Δ株の結果であり、黒三角のプロット(▲)がCWP2Δ株の結果であり、アスタリスクのプロット(*)がPDR5Δ−CWP1Δ株の結果であり、縦線のプロット(|)がCWP1Δ−CWP2Δ株の結果であり、白三角のプロット(△)がCWP1Δ−CWP2Δ−PDR5Δ株の結果である。
【0331】
【表19】

【0332】
【表20】

【0333】
前記表19、表20および図4に示すように、野生株は、検出可能な17β−エストラジオール濃度が100pmol/L以上であった。これに対して、CWP2Δ以外の全ての変異株について、17β−エストラジオール濃度10pmol/Lでβ−ガラクトシダーゼの誘導が確認できた。この結果から、本発明の形質転換酵母によれば、ERβに対するリガンドが低濃度であっても、十分に優れた感度を得ることができる。また、全ての変異株が、検出可能なリガンド濃度において、野生株よりも高い誘導率を示した。具体例として、前記表20に示すように、CWP1Δ株、PDR5Δ株、CWP1Δ−CWP2Δ株およびPDR5Δ−CWP1Δ株は、それぞれ、野生株の1.6倍、1.8倍、2.7倍、2.3倍のレポーター活性を示した。その他の株も1.3倍のレポーター活性を示した。これらの結果から、本発明の形質転換酵母によれば、所定のリガンド濃度に対して、野生株よりも、さらに優れた応答性を示すといえる。
【0334】
以上のように、マンナン結合タンパク質のコード遺伝子または排出ポンプタンパク質のコード遺伝子のいずれを欠失させることにより、前記形質転換酵母は、ERβのリガンドに対して、検出感度および/または検出応答性が改善された。このため、本発明の形質転換酵母は、動物核内受容体に対するリガンドのアッセイに極めて有効といえる。
【0335】
〔実施例9〕
本実施例では、CWP1遺伝子およびCWP2遺伝子を欠失させた欠失酵母を作製し、ヒトTRα遺伝子を組み込んだ形質転換酵母を作製した。
【0336】
(1)遺伝子欠失酵母の作製
前記CWP1遺伝子および前記CWP2遺伝子を欠失する遺伝子欠失酵母を使用した。
【0337】
(2)レポータープラスミドの作製
前記TRαに応答する配列であるIR−0配列が連続して5個アニーリングしたものを精製して、pRW95−3のSpeI位にサイトに挿入した。IR−0配列が5個挿入されたプラスミドを、TRαレポータープラスミドとした。
【0338】
(3)動物核内受容体発現プラスミドの作製
増幅させたTRα遺伝子のcDNAを、制限酵素SpeIおよびHindIIIで切断した。切断した前記cDNAを、制限酵素XbaIおよびHindIII切断した前記プラスミドpUdp6に挿入した。前記プラスミドpUdp6において、前記切断したcDNAは、前記Gal10プロモーターの下流に挿入した。これによって、前記核内受容体遺伝子を有し、その上流にプロモーターを有するTRα発現プラスミドpUdp6TRαを得た。
【0339】
(4)形質転換酵母の作製
前記遺伝子欠失酵母、TRαレポータープラスミド、直鎖状の前記TRα発現プラスミド、前記動物転写因子発現プラスミドを使用し、下記の1種類の形質転換酵母を作製した。
2遺伝子欠失株:CWP1Δ−CWP2Δ株
【0340】
〔実施例10〕
本実施例では、前記実施例9で作製した形質転換酵母を使用し、前記リガンドとして、トリヨードチロニンを使用し、誘導増加量を求めた。
【0341】
これらの結果を、下記表21、表22および図5に示す。図5は、トリヨードチロニンに対する結果を示すグラフである。前記グラフにおいて、横軸は、各リガンド濃度(μmol/L)であり、具体的には、0.00001、0.0001、0.001、0.01、0.1、1、10、100μmol/Lにおけるプロットであり、縦軸は、リガンドにより誘導された誘導増加量(レポーター活性値)である。前記グラフにおいて、黒菱形のプロット(◆)が野生株の結果であり、縦線のプロット(|)がCWP1Δ−CWP2Δ株の結果である。
【0342】
【表21】

【0343】
【表22】

【0344】
前記表21、表22および図5に示すように、野生株は、検出可能なトリヨードチロニン濃度が10nmol/L以上であった。これに対して、CWP1Δ−CWP2Δ株では、リガンド濃度1nmol/Lでレポーター活性が検出され、10nmol/Lでは野生株よりも高い活性を示した。具体例として、前記表22に示すように、CWP1Δ−CWP2Δ株は野生株の13倍であった。これらの結果から、本発明の形質転換酵母によれば、所定のリガンド濃度に対して、野生株よりも、さらに優れた応答性を示すといえる。また、前記表21に示すように、EC50は、野生株が、65.5nmol/Lであったのに対し、CWP1Δ−CWP2Δ株が、13.6nmol/Lであり、1/5に低減された。
【0345】
以上のように、CWP1およびCWP2遺伝子を欠失させることにより、前記形質転換酵母は、TRαのリガンドに対して、検出感度および/または検出応答性が改善された。このため、本発明の形質転換酵母は、動物核内受容体に対するリガンドのアッセイに極めて有効といえる。
【0346】
〔実施例11〕
本実施例では、CWP1遺伝子、CWP2遺伝子およびPDR5遺伝子のいずれかを欠失させた欠失酵母を作製し、ヒトTRβ遺伝子を組み込んだ形質転換酵母を作製した。
【0347】
(1)遺伝子欠失酵母の作製
前記PDR5遺伝子を欠失する遺伝子欠失酵母株、CWP1遺伝子およびCWP2遺伝子を欠失する遺伝子欠失酵母株、ならびに、PDR5遺伝子、CWP1遺伝子およびCWP2遺伝子を欠失する遺伝子欠失酵母株を使用した。
【0348】
(2)レポータープラスミドの作製
前記実施例9と同様にして、IR−0配列が5個挿入されたプラスミドを作製した。このプラスミドを、TRβレポータープラスミドとした。
【0349】
(3)動物核内受容体発現プラスミドの作製
増幅させたTRβ遺伝子のcDNAを、制限酵素SpeIおよびHindIIIで切断した。切断した前記cDNAを、制限酵素XbaIおよびHindIII切断した前記プラスミドpUdp6に挿入した。前記プラスミドpUdp6において、前記切断したcDNAは、前記Gal10プロモーターの下流に挿入した。これによって、前記核内受容体遺伝子を有し、その上流にプロモーターを有するTRβ発現プラスミドpUdp6TRβを得た。
【0350】
(4)形質転換酵母の作製
前記遺伝子欠失酵母、TRβレポータープラスミド、直鎖状の前記Tβ発現プラスミド、前記動物転写因子発現プラスミドを使用し、下記の3種類の形質転換酵母を作製した。
1遺伝子欠失株:PDR5Δ株
2遺伝子欠失株:CWP1Δ−CWP2Δ株
3遺伝子欠失株:CWP1Δ−CWP2Δ−PDR5Δ株
【0351】
〔実施例12〕
本実施例では、前記実施例11で作製した形質転換酵母を使用し、前記リガンドとして、トリヨードチロニンを使用し、誘導増加量を求めた。
【0352】
これらの結果を、下記表23、表24および図6に示す。図6は、トリヨードチロニンに対する結果を示すグラフである。前記グラフにおいて、横軸は、各リガンド濃度(μmol/L)であり、具体的には、0.001、0.01、0.1、1、10μmol/Lにおけるプロットであり、縦軸は、リガンドにより誘導された誘導増加量(レポーター活性値)である。前記グラフにおいて、黒菱形のプロット(◆)が野生株の結果であり、バツのプロット(×)がPDR5Δ株の結果であり、縦線のプロット(|)がCWP1Δ−CWP2Δ株の結果であり、白三角のプロット(△)がCWP1Δ−CWP2Δ−PDR5Δ株の結果である。
【0353】
【表23】

【0354】
【表24】

【0355】
前記表23、表24および図6に示すように、すべての株で、検出可能なトリヨードチロニン濃度は10nmol/L以上であった。この結果から、本発明の形質転換酵母によれば、PDR5遺伝子、CWP1遺伝子およびCWP2遺伝子の少なくともいずれかを欠失させることによって、TRβに対するリガンドが低濃度であっても、十分に優れた感度を得ることができる。全ての変異株は、リガンド濃度1μmol/Lにおいて、野生株よりも高いレポーター活性を示した。具体例として、前記表24に示すように、PDR5Δ株、CWP1Δ−CWP2Δ株、PDR5Δ−CWP1Δ−CWP2Δ株は、それぞれ、野生株の3.21倍、2.23倍、1.90倍を示した。これらの結果から、本発明の形質転換酵母によれば、所定のリガンド濃度に対して、野生株よりも、さらに優れた応答性を示すといえる。また、前記表23に示すように、EC50は、野生株が、1.31μmol/Lであったのに対して、PDR5Δ株が、10.2nmol/L、CWP1Δ−CWP2Δ株が、92.5nmol/L、PDR5Δ−CWP1Δ−CWP2Δ株が、182nmol/Lであり、1/128から1/7に低減された。
【0356】
以上のように、マンナン結合タンパク質のコード遺伝子または排出ポンプタンパク質のコード遺伝子のいずれを欠失させることにより、前記形質転換酵母は、TRβのリガンドに対して、検出感度および/または検出応答性が改善された。このため、本発明の形質転換酵母は、動物核内受容体に対するリガンドのアッセイに極めて有効といえる。
【0357】
〔実施例13〕
本実施例では、CWP1遺伝子、CWP2遺伝子およびPDR5遺伝子のいずれかを欠失させた欠失酵母を作製し、ヒトPXR−1遺伝子を組み込んだ形質転換酵母を作製した。
【0358】
(1)遺伝子欠失酵母の作製
前記PDR5遺伝子を欠失する遺伝子欠失酵母株、前記PDR5遺伝子および前記CWP1遺伝子、または前記CWP2遺伝子および前記PDR5遺伝子を欠失する遺伝子欠失酵母株、ならびに、CWP1遺伝子、CWP2遺伝子およびPDR5遺伝子を欠失する遺伝子欠失酵母を使用した。
【0359】
(2)レポータープラスミドの作製
前記PXR−1に応答する配列であるDR−3配列が連続して2個アニーリングしたものを精製して、pRW95−3のXbaI部位に挿入した。DR−3配列が2個挿入されたプラスミドを、PXRレポータープラスミドとした。
【0360】
(3)動物核内受容体発現プラスミドの作製
増幅させたRXRα遺伝子のcDNAを、制限酵素KpnIおよびEcoRIで切断した。切断した前記cDNAを、制限酵素KpnIおよびEcoRIで切断したプラスミドpUdp8に挿入した。一方で、増幅させたPXR−1遺伝子のcDNAを、制限酵素SpeIおよびHindIIIで切断した。そして、RXRα遺伝子のcDNAを挿入した前記プラスミドpUdp8に、さらに、PXR−1遺伝子のcDNAを挿入した。具体的には、切断した前記cDNAを、制限酵素SpeIおよびHindIII切断した前記プラスミドpUdp8に挿入した。前記プラスミドpUdp8において、前記切断したRXRα遺伝子のcDNAは、前記Gal1プロモーターの下流に挿入し、前記切断したPXR−1遺伝子のcDNAは、前記Gal10ロモーターの下流に挿入した。これによって、前記核内受容体遺伝子を有し、その上流にプロモーターを有するプラスミドpUdp8PXR/RXRαを得た。
【0361】
本実施例では、動物核内受容体発現プラスミドを、前記プラスミドpUdp8PXR/RXRαにおける、RXRαのC末端のHelix12を欠失させたプラスミドpUdp8PXR/RXRαTとした。前記プラスミドpUdp8PXR/RXRαTは、以下のように作製した。
【0362】
まず、QuickChangeSite−DirectedMutagenesisKit(Stratagene社製)を使用して、前記pUdp8PXR/RXRαに含まれるRXRαcDNAの443番目のコドンにナンセンス変異を導入し、RXRαのC末端に存在するHelix12領域を欠失させた。前記変異に使用したプライマー(配列番号70および71)および反応条件(PCR反応液およびPCR条件)を、下記に示す。
【0363】
RXR443F(配列番号70)
5’−cttcttcaagctcatcgggtagacacccat−3’
RXR443R(配列番号71)
5’−ggtgtcaatgggtgtctacccgatgagctt−3’
【0364】
(PCR反応液:1×反応バッファー)
0.25mmol/L dNTP、3μL Quick solution、pfu ultra polymerase 10unit(以上、Stratagene社製)、0.25μmol/L 各プライマー、10ng プラスミドDNAを、PCR反応液50μL中に含む。
【0365】
(PCR条件:サイクル)
94℃で50秒、60℃で50秒、68℃で7分のサイクルを、18サイクル実施した。
【0366】
前記PCR後、制限酵素DpnIで鋳型プラスミドDNAを消化し、大腸菌に形質転換した。得られたプラスミドDNAを、PXR発現プラスミドpUdp8PXR/RXRαTとした。
【0367】
(4)形質転換酵母の作製
前記遺伝子欠失酵母、PXRレポータープラスミド、直鎖状の前記PXR発現プラスミド、前記動物転写因子発現プラスミドを使用し、下記の4種類の形質転換酵母を作製した。
1遺伝子欠失株:PDR5Δ株
2遺伝子欠失株:PDR5Δ−CWP1Δ株、CWP2Δ−PDR5Δ株
3遺伝子欠失株:CWP1Δ−CWP2Δ−PDR5Δ株
【0368】
〔実施例14〕
本実施例では、前記実施例13で作製した形質転換酵母を使用し、前記リガンドとして、リファンピシンを使用し、誘導増加量を求めた。
【0369】
これらの結果を、下記表25、表26および図7に示す。図7は、リファンピシンに対する結果を示すグラフである。前記グラフにおいて、横軸は、各リガンド濃度(μmol/L)であり、具体的には、0.1、1、10、100μmol/Lにおけるプロットであり、縦軸は、リガンドにより誘導された誘導増加量(レポーター活性値)である。前記グラフにおいて、黒菱形のプロット(◆)が野生株の結果であり、バツのプロット(×)がPDR5Δ株の結果であり、アスタリスクのプロット(*)がCWP1Δ−PDR5Δ株の結果であり、黒丸のプロット(●)がCWP2Δ−PDR5Δ株の結果であり、白三角のプロット(△)がCWP1Δ−CWP2Δ−PDR5Δ株の結果である。
【0370】
【表25】

【0371】
【表26】

【0372】
前記表25、表26および図7に示すように、すべての株で検出可能なリファンピシン濃度が1μmol/L以上であった。この結果から、本発明の形質転換酵母によれば、PXR−1に対するリガンドが低濃度であっても、十分に優れた感度を得ることができる。また、全ての変異株が、リガンド濃度1μmol/Lにおいて、野生株よりも高いレポーター活性を示した。具体例として、前記表26に示すように、PDR5Δ株、PDR5Δ−CWP1Δ株、PDR5Δ−CWP2Δ株、PDR5Δ−CWP1Δ−CWP2Δ株は、それぞれ、野生株の13.35倍、5.21倍、2.23倍、5.02倍を示した。これらの結果から、本発明の形質転換酵母によれば、所定のリガンド濃度に対して、野生株よりも、さらに優れた応答性を示すといえる。また、前記表25に示すように、EC50は、野生株が、31.6μmol/Lであったのに対して、PDR5Δ株が、7.86μmol/L、PDR5Δ−CWP1Δ株が、7.33μmol/L、PDR5Δ−CWP2Δ株が、8.10μmol/L、PDR5Δ−CWP1Δ−CWP2Δ株が、10.0μmol/Lであり、1/4から1/3に低減された。
【0373】
以上のように、マンナン結合タンパク質のコード遺伝子または排出ポンプタンパク質のコード遺伝子のいずれを欠失させることにより、前記形質転換酵母は、PXR−1のリガンドに対して、検出感度および/または検出応答性が改善された。このため、本発明の形質転換酵母は、動物核内受容体に対するリガンドのアッセイに極めて有効といえる。
【0374】
〔実施例15〕
本実施例では、CWP1遺伝子、CWP2遺伝子、PDR5遺伝子およびPDR10遺伝子のいずれかを欠失させた欠失酵母を作製し、ヒトPR遺伝子を組み込んだ形質転換酵母を作製した。
【0375】
(1)遺伝子欠失酵母の作製
前記PDR5遺伝子、または前記CWP2遺伝子を欠失する遺伝子欠失酵母株、前記PDR5遺伝子および前記CWP1遺伝子、前記CWP1遺伝子および前記CWP2遺伝子、前記CWP2遺伝子および前記PDR5遺伝子、前記CWP1遺伝子および前記PDR10遺伝子、または前記PDR5遺伝子および前記PDR10遺伝子を欠失する遺伝子欠失酵母株、ならびに、前記CWP1遺伝子、前記CWP2遺伝子および前記PDR5遺伝子、または、前記CWP1遺伝子、前記PDR5遺伝子および前記PDR10遺伝子を欠失する遺伝子欠失酵母を使用した。
【0376】
(2)レポータープラスミドの作製
前記PRに応答する配列であるGRE配列が8個挿入されたプラスミドを、PRレポータープラスミドとした。
【0377】
(3)動物核内受容体発現プラスミドの作製
増幅させたPR遺伝子のcDNAを、制限酵素BglIIおよびXhoIで切断した。切断した前記cDNAを、制限酵素BamHIおよびSalI切断したプラスミドpUdp6に挿入した。前記プラスミドpUdp6において、前記切断したPR遺伝子のcDNAは、前記Gal10プロモーターの下流に挿入した。これによって、前記核内受容体遺伝子を有し、その上流にプロモーターを有するPR発現プラスミドpUdp6PRを得た。
【0378】
(4)形質転換酵母の作製
前記遺伝子欠失酵母、PRレポータープラスミド、直鎖状の前記PR発現プラスミド、前記動物転写因子発現プラスミドを使用し、下記の9種類の形質転換酵母を作製した。
1遺伝子欠失株:CWP2Δ株、PDR5Δ株
2遺伝子欠失株:CWP1Δ−CWP2Δ株、PDR5Δ−CWP1Δ株、PDR5Δ−CWP2Δ株、CWP1Δ−PDR10Δ株、PDR5Δ−PDR10Δ株
3遺伝子欠失株:CWP1Δ−CWP2Δ−PDR5Δ株、CWP1Δ−PDR5Δ−PDR10Δ株
【0379】
〔実施例16〕
本実施例では、前記実施例15で作製した形質転換酵母を使用し、前記リガンドとして、プロゲステロンを使用し、誘導増加量を求めた。
【0380】
これらの結果を、下記表27、表28および図8に示す。図8は、プロゲステロンに対する結果を示すグラフである。前記グラフにおいて、横軸は、各リガンド濃度(μmol/L)であり、具体的には、0.000001、0.00001、0.0001、0.001、0.01、0.1、1、10μmol/Lにおけるプロットであり、縦軸は、リガンドにより誘導された誘導増加量(レポーター活性値)である。前記グラフにおいて、黒菱形のプロット(◆)が野生株の結果であり、黒三角のプロット(▲)がCWP2Δ株の結果であり、バツのプロット(×)がPDR5Δ株の結果であり、アスタリスクのプロット(*)がCWP1Δ−PDR5Δ株の結果であり、黒丸のプロット(●)がCWP2Δ−PDR5Δ株の結果であり、縦線のプロット(|)がCWP1Δ−CWP2Δ株の結果であり、白三角のプロット(△)がPDR5Δ−PDR10Δ株の結果であり、白菱形のプロット(◇)がCWP1Δ−PDR10Δ株の結果であり、白丸のプロット(○)がCWP1Δ−CWP2Δ−PDR5Δ株の結果であり、白四角のプロット(□)がCWP1Δ−PDR5Δ−PDR10Δ株の結果である。
【0381】
【表27】

【0382】
【表28】

【0383】
前記表27、表28および図8に示すように、すべての株で検出可能なリガンド濃度において、野生株よりも高いレポーター活性を示した。具体例として、前記表28に示すように、プロゲステロン濃度1μmol/Lにおいて、CWP2Δ株、PDR5Δ株、CWP1Δ−PDR5Δ株、CWP2Δ−PDR5Δ株、CWP1Δ−CWP2Δ株、CWP1Δ−CWP2Δ−PDR5Δ株、PDR5Δ−PDR10Δ株、CWP1Δ−PDR10Δ株、CWP1Δ−PDR5Δ−PDR10Δ株は、それぞれ、野生株の3.94倍、48.55倍、29.98倍、22.96倍、77.2倍、19.56倍、22.02倍、22.5倍、18.67倍のレポーター活性を示した。これらの結果から、本発明の形質転換酵母によれば、所定のリガンド濃度に対して、野生株よりも、さらに優れた応答性を示すといえる。また、前記表27に示すように、EC50は、野生株が、3.16μmol/Lであったのに対して、CWP2Δ株が、1.34μmol/L、PDR5Δ株が、853nmol/L、CWP1Δ−PDR5Δ株が、1.36μmol/L、CWP2Δ−PDR5Δ株が、1.13μmol/L、CWP1Δ−CWP2Δ株が、114nmol/L、CWP1Δ−CWP2Δ−PDR5Δ株が、689nmol/L、PDR5Δ−PDR10Δ株が、1.39μmol/L、CWP1Δ−PDR10Δ株が、123nmol/L、CWP1Δ−PDR5Δ−PDR10Δ株が、696nmol/Lであり、1/3から1/28に低減された。
【0384】
以上のように、マンナン結合タンパク質のコード遺伝子または排出ポンプタンパク質のコード遺伝子のいずれを欠失させることにより、前記形質転換酵母は、PRのリガンドに対して、検出感度および/または検出応答性が改善された。このため、本発明の形質転換酵母は、動物核内受容体に対するリガンドのアッセイに極めて有効といえる。
【0385】
〔実施例17〕
本実施例では、CWP1遺伝子、PDR5遺伝子、およびPDR10遺伝子のいずれかを欠失させた欠失酵母を作製し、ヒトGR遺伝子を組み込んだ形質転換酵母を作製した。
【0386】
(1)遺伝子欠失酵母の作製
前記PDR5遺伝子または前記PDR10遺伝子を欠失する遺伝子欠失酵母株、前記PDR5遺伝子および前記CWP1遺伝子、前記CWP1遺伝子および前記PDR10遺伝子、または前記PDR5遺伝子および前記PDR10遺伝子を欠失する遺伝子欠失酵母株、ならびに、CWP1遺伝子、PDR5遺伝子およびPDR10遺伝子を欠失する遺伝子欠失酵母を使用した。
【0387】
(2)レポータープラスミドの作製
前記GRに応答する配列であるGRE配列が8個挿入されたプラスミドを、GRレポータープラスミドとした。
【0388】
(3)動物核内受容体発現プラスミドの作製
増幅させたGR遺伝子のcDNAを、制限酵素BamHIおよびXhoIで切断した。切断した前記cDNAを、制限酵素BamHIおよびSalI切断した前記プラスミドpUdp6に挿入した。前記プラスミドpUdp6において、前記切断したGR遺伝子のcDNAは、前記GAL10プロモーターの下流に挿入した。これによって、前記核内受容体遺伝子を有し、その上流にプロモーターを有するGR発現プラスミドpUdp6GRを得た。
【0389】
(4)形質転換酵母の作製
前記遺伝子欠失酵母、GRレポータープラスミド、直鎖状の前記GR発現プラスミド、前記動物転写因子発現プラスミドを使用し、下記の6種類の形質転換酵母を作製した。
1遺伝子欠失株:PDR5Δ株、PDR10Δ株
2遺伝子欠失株:PDR5Δ−CWP1Δ株、CWP1Δ−PDR10Δ株、PDR5Δ−PDR10Δ株
3遺伝子欠失株:CWP1Δ−PDR5Δ−PDR10Δ株
【0390】
〔実施例18〕
本実施例では、前記実施例17で作製した形質転換酵母を使用し、前記リガンドとして、コルチコステロンを使用し、誘導増加量を求めた。
【0391】
これらの結果を、下記表29、表30および図9に示す。図9は、コルチコステロンに対する結果を示すグラフである。前記グラフにおいて、横軸は、各リガンド濃度(μmol/L)であり、具体的には、0.1、1、10μmol/Lにおけるプロットであり、縦軸は、前記誘導増加量(レポーター活性値)である。前記グラフにおいて、黒三角のプロット(▲)が、PDR5Δ株の結果であり、バツのプロット(×)がPDR10Δ株の結果であり、アスタリスクのプロット(*)が、PDR5Δ−CWP1Δ株の結果であり、黒丸のプロット(●)がPDR10Δ−CWP1Δ株の結果であり、縦線のプロット(|)がPDR5Δ−PDR10Δ株の結果であり、白三角のプロット(△)がCWP1Δ−PDR5Δ−PDR10Δ株の結果であり、黒菱形のプロット(◆)が、野生株の結果である。
【0392】
【表29】

【0393】
【表30】

【0394】
前記表29、表30および図9に示すように、野生株は、検出可能なコルチコステロン濃度が1μmol/L以上であった。これに対して、全ての欠失株について、コルチコステロン濃度10〜30nmol/Lにおいて、β−ガラクトシダーゼの誘導が確認できた。この結果から、本発明の形質転換酵母によれば、PDR5遺伝子、PDR10遺伝子およびCWP1遺伝子の少なくともいずれかを欠失させることによって、低いリガンド濃度であっても、十分に優れた感度を得ることができる。また、全ての遺伝子欠失株が、検出可能なリガンド濃度において、野生株よりも高いレポーター活性を示した。具体例として、前記表30に示すように、リガンド濃度1μmol/Lにおいて、PDR5Δ株、PDR10Δ株、PDR5Δ−CWP1Δ株、PDR10Δ−CWP1Δ株、PDR5Δ−PDR10Δ株、CWP1Δ−PDR5Δ−PDR10Δ株は、それぞれ、野生株の13.68倍、3.58倍、13.62倍、6.21倍、19.78倍、14.72倍のレポーター活性を示した。これらの結果から、本発明の形質転換酵母によれば、所定のリガンド濃度に対して、野生株よりも、さらに優れた応答性を示すといえる。また、前記表29に示すように、EC50は、野生株が、6.5μmol/Lであったのに対して、PDR5Δ株が、648nmol/L、PDR10Δ株が、1μmol/L、PDR5Δ−CWP1Δ株が、789nmol/L、PDR10Δ−CWP1Δ株が、1μmol/L、PDR5Δ−PDR10Δ株が、316nmol/L、CWP1Δ−PDR5Δ−PDR10Δ株が、739nmol/Lであり、1/7から1/20に低減された。
【0395】
以上のように、マンナン結合タンパク質のコード遺伝子または排出ポンプタンパク質のコード遺伝子のいずれを欠失させることにより、前記形質転換酵母は、GRのリガンドに対して、検出感度および/または検出応答性が改善された。このため、本発明の形質転換酵母は、動物核内受容体に対するリガンドのアッセイに極めて有効といえる。
【0396】
〔実施例19〕
本実施例では、CWP1遺伝子、PDR5遺伝子、およびPDR10遺伝子のいずれかを欠失させた欠失酵母を作製し、ヒトAhR遺伝子を組み込んだ形質転換酵母を作製した。
【0397】
(1)遺伝子欠失酵母の作製
前記CWP1遺伝子、前記PDR5遺伝子、または前記PDR10遺伝子を欠失する遺伝子欠失酵母株、前記PDR5遺伝子および前記CWP1遺伝子、前記CWP1遺伝子および前記PDR10遺伝子、または前記PDR5遺伝子および前記PDR10遺伝子を欠失する遺伝子欠失酵母株、ならびに、CWP1遺伝子、PDR5遺伝子、および前記PDR10遺伝子を欠失する遺伝子欠失酵母を使用した。
【0398】
(2)レポータープラスミドの作製
前記AhRに応答する配列であるXRE配列が5個挿入されたプラスミドを、AhRレポータープラスミドとした。
【0399】
(3)動物核内受容体発現プラスミドの作製
増幅させたAhR遺伝子またはArnt遺伝子のcDNAを、前記実施例3と同様にして、前記プラスミドYEpLacGal1、10に挿入した。これによって、前記核内受容体遺伝子を有し、その上流にプロモーターを有するプラスミドYEpLacAhR/Arntを得た。このプラスミドを、AhR発現プラスミドとした。
【0400】
(4)形質転換酵母の作製
前記遺伝子欠失酵母、前記AhRレポータープラスミド、直鎖状の前記AhR発現プラスミドを使用し、下記の7種類の形質転換酵母を作製した。
1遺伝子欠失株:CWP1Δ株、PDR5Δ株、PDR10Δ株
2遺伝子欠失株:CWP1Δ−PDR5Δ株、CWP1Δ−PDR10Δ株、PDR5Δ−PDR10Δ株
3遺伝子欠失株:CWP1Δ−PDR5Δ−PDR10Δ株
【0401】
〔実施例20〕
本実施例では、前記実施例19で作製した形質転換酵母を使用し、前記リガンドとして、β−ナフトフラボンを使用し、誘導増加量を求めた。
【0402】
これらの結果を、下記表31、表32および図10に示す。図10は、β−ナフトフラボンに対する結果を示すグラフである。前記グラフにおいて、横軸は、各リガンド濃度(μmol/L)であり、具体的には、0.0001、0.001、0.01、0.1、1、10μmol/Lにおけるプロットであり、縦軸は、前記誘導増加量(レポーター活性値)である。前記グラフにおいて、黒四角のプロット(■)が、CWP1Δ株の結果であり、黒三角のプロット(▲)が、PDR5Δ株の結果であり、バツのプロット(×)がPDR10Δ株の結果であり、アスタリスクのプロット(*)が、PDR5Δ−CWP1Δ株の結果であり、黒丸のプロット(●)がPDR10Δ−CWP1Δ株の結果であり、縦線のプロット(|)がPDR5Δ−PDR10Δ株の結果であり、白三角のプロット(△)がCWP1Δ−PDR5Δ−PDR10Δ株の結果であり、黒菱形のプロット(◆)が、野生株の結果である。
【0403】
【表31】

【0404】
【表32】

【0405】
前記表31、表32および図10に示すように、野生株は、検出可能なβ−ナフトフラボン濃度が10nmol/L以上であった。これに対して、全ての欠失株について、β−ガラクトシダーゼの誘導が確認できた。中でも、PDR5Δ株は、β−ナフトフラボン濃度が10nmol/Lの場合、野生株と比較して高いβ−ガラクトシダーゼの誘導が確認でき、また、その他の株は、β−ナフトフラボン濃度1nmol/Lでβ−ガラクトシダーゼの誘導が確認できた。この結果から、本発明の形質転換酵母によれば、PDR5遺伝子、PDR10遺伝子、およびCWP1遺伝子の少なくともいずれかを欠失させることによって、AhRに対するリガンドが低濃度であっても、十分に優れた感度を得ることができる。また、全ての遺伝子欠失株が、検出可能なリガンド濃度において、野生株よりも高いレポーター活性を示した。具体例として、前記表32に示すように、リガンド濃度10nmol/LではCWP1Δ株、PDR5Δ株、PDR10Δ株、PDR5Δ−CWP1Δ株、PDR10Δ−CWP1Δ株、PDR5Δ−PDR10Δ株、CWP1Δ−PDR5Δ−PDR10Δ株は、それぞれ、野生株の16.68倍、5.52倍、38.73倍,29.25倍、12.54倍,96.08倍、または95.28倍のレポーター活性を示した。これらの結果から、本発明の形質転換酵母によれば、所定のリガンド濃度に対して、野生株よりも、さらに優れた応答性を示すといえる。また、前記表31に示すように、EC50は、野生株が、771nmol/Lであったのに対して、CWP1Δ株が、96.9nmol/L、PDR10Δ株が、86.2nmol/L、PDR5Δ−CWP1Δ株が、85.6nmol/L、PDR10Δ−CWP1Δ株が、94.9nmol/L、PDR5Δ−PDR10Δ株が、2.72nmol/L、CWP1Δ−PDR5Δ−PDR10Δ株が、10.9nmol/Lであり、1/8から1/283に低減された。
【0406】
以上のように、マンナン結合タンパク質のコード遺伝子または排出ポンプタンパク質のコード遺伝子のいずれを欠失させることにより、前記形質転換酵母は、AhRのリガンドに対して、検出感度および/または検出応答性が改善された。このため、本発明の形質転換酵母は、動物核内受容体に対するリガンドのアッセイに極めて有効といえる。
【0407】
〔実施例21〕
本実施例では、CWP1遺伝子、CWP2遺伝子、PDR5遺伝子およびPDR10遺伝子のいずれかを欠失させた欠失酵母を作製し、ヒトAR遺伝子を組み込んだ形質転換酵母を作製した。
【0408】
(1)遺伝子欠失酵母の作製
前記PDR5遺伝子を欠失する遺伝子欠失酵母株、前記PDR5遺伝子および前記CWP1遺伝子、前記PDR5遺伝子および前記CWP2遺伝子、前記CWP1遺伝子および前記CWP2遺伝子、または前記PDR5遺伝子および前記PDR10遺伝子を欠失する遺伝子欠失酵母株、ならびに、CWP1遺伝子、PDR5遺伝子およびPDR10遺伝子、またはCWP1遺伝子、CWP2遺伝子およびPDR5遺伝子を欠失する遺伝子欠失酵母を使用した。
【0409】
(2)レポータープラスミドの作製
前記ARに応答する配列であるGRE配列が8個挿入されたプラスミドを、ARレポータープラスミドとした。
【0410】
(3)動物核内受容体発現プラスミドの作製
増幅させたAR遺伝子のcDNAを、制限酵素BamHIおよびXhoIで切断した。切断した前記cDNAを、制限酵素BamHIおよびSalI切断した前記プラスミドpUdp6に挿入した。前記プラスミドpUdp6において、前記切断したAR遺伝子のcDNAは、前記GAL10プロモーターの下流に挿入した。これによって、前記核内受容体遺伝子を有し、その上流にプロモーターを有するAR発現プラスミドpUdp6ARを得た。
【0411】
(4)形質転換酵母の作製
前記遺伝子欠失酵母、ARレポータープラスミド、直鎖状の前記AR発現プラスミド、前記動物転写因子発現プラスミドを使用し、下記の7種類の形質転換酵母を作製した。
1遺伝子欠失株:PDR5Δ株
2遺伝子欠失株:PDR5Δ−CWP1Δ株、PDR5Δ−CWP2Δ株、CWP1Δ−CWP2Δ株、PDR5Δ−PDR10Δ株
3遺伝子欠失株:CWP1Δ−PDR5Δ−PDR10Δ株、CWP1Δ−CWP2Δ−PDR5Δ株
【0412】
〔実施例22〕
本実施例では、前記実施例21で作製した形質転換酵母を使用し、前記リガンドとして、テストステロンを使用し、誘導増加量を求めた。
【0413】
これらの結果を、下記表33、表34および図11に示す。図11は、テストステロンに対する結果を示すグラフである。前記グラフにおいて、横軸は、各リガンド濃度(μmol/L)であり、具体的には、0.000001、0.00001、0.0001、0.001、0.01、0.1、1、10、100μmol/Lにおけるプロットであり、縦軸は、リガンドにより誘導された誘導増加量(レポーター活性値)である。前記グラフにおいて、黒菱形のプロット(◆)が野生株の結果であり、黒四角のプロット(■)がPDR5Δ株の結果であり、黒三角のプロット(▲)がCWP1Δ−PDR5Δ株の結果であり、バツのプロット(×)がCWP2Δ−PDR5Δ株の結果であり、アスタリスクのプロットが(*)がCWP1Δ−CWP2株の結果であり、黒丸のプロット(●)がCWP1Δ−CWP2Δ−PDR5Δ株の結果であり、縦線のプロット(|)がPDR5Δ−PDR10Δ株の結果であり、白三角のプロット(△)がCWP1Δ−PDR5Δ−PDR10Δ株の結果である。
【0414】
【表33】

【0415】
【表34】

【0416】
前記表33、表34および図11に示すように、全ての変異株が、検出可能なリガンド濃度において、野生株よりも高いレポーター活性を示した。具体例として、前記表34に示すように、テストステロン濃度100nmol/Lにおいて、PDR5Δ株、CWP1Δ−PDR5Δ株、CWP2Δ−PDR5Δ株、CWP1Δ−CWP2Δ株、CWP1Δ−CWP2Δ−PDR5Δ株、PDR5Δ−PDR10Δ株、CWP1Δ−PDR5Δ−PDR10Δ株は、それぞれ、野生株の7.7倍、18.52倍、3.33倍、5.49倍、7.42倍、10.07倍、4.57倍のレポーター活性を示した。これらの結果から、本発明の形質転換酵母によれば、所定のリガンド濃度に対して、野生株よりも、さらに優れた応答性を示すといえる。また、前記表33に示すように、EC50は、野生株が、53.1nmol/Lであったのに対して、CWP1Δ−CWP2Δが、26.4nmol/L、CWP1Δ−CWP2Δ−PDR5Δ株が、7.99nmol/Lであり、それぞれ1/2および1/7に低減された。
【0417】
以上のように、マンナン結合タンパク質のコード遺伝子または排出ポンプタンパク質のコード遺伝子のいずれを欠失させることにより、前記形質転換酵母は、ARのリガンドに対して、検出感度および/または検出応答性が改善された。このため、本発明の形質転換酵母は、動物核内受容体に対するリガンドのアッセイに極めて有効といえる。
【0418】
〔実施例23〕
本実施例では、PDR5遺伝子を欠失させた欠失酵母を作製し、ヒトMR遺伝子を組み込んだ形質転換酵母を作製した。
【0419】
(1)遺伝子欠失酵母の作製
前記PDR5遺伝子を欠失する遺伝子欠失酵母株を使用した。
【0420】
(2)レポータープラスミドの作製
前記MRに応答する配列であるGRE配列が8個挿入されたプラスミドを、MRレポータープラスミドとした。
【0421】
(3)動物核内受容体発現プラスミドの作製
増幅させたMR遺伝子のcDNAを、制限酵素AflIIで切断後平滑化し、その後BglIIで切断した。切断した前記cDNAを、制限酵素HindIIIで切断後、平滑化し、その後BamHIで切断した前記プラスミドpUdp6に挿入した。前記プラスミドpUdp6において、前記切断したMR遺伝子のcDNAは、前記gal10プロモーターの下流に挿入した。これによって、前記核内受容体遺伝子を有し、その上流にプロモーターを有するMR発現プラスミドpUdp6MRを得た。
【0422】
(4)形質転換酵母の作製
前記遺伝子欠失酵母、前記MRレポータープラスミド、直鎖状の前記MR発現プラスミド、前記動物転写因子発現プラスミドを使用し、PDR5Δ株を作製した。
【0423】
〔実施例24〕
本実施例では、前記実施例23で作製した形質転換酵母を使用し、前記リガンドとして、アルドステロンを使用し、誘導増加量を求めた。
【0424】
これらの結果を、下記表35、表36および図12に示す。図12は、アルドステロンに対する結果を示すグラフである。前記グラフにおいて、横軸は、各リガンド濃度(μmol/L)であり、具体的には、0.001、0.01、0.1、1、10μmol/Lにおけるプロットであり、縦軸は、前記誘導増加量(レポーター活性値)である。前記グラフにおいて、黒四角のプロット(■)が、PDR5Δ株の結果であり、黒菱形のプロット(◆)が、野生株の結果である。
【0425】
【表35】

【0426】
【表36】

【0427】
前記表35、表36および図12に示すように、野生株、PDR5Δ株ともに検出可能なアルドステロン濃度は10 nmol/L以上であった。PDR5Δ株では、リガンド濃度100nmol/Lにおいて、野生株の59.1倍のレポーター活性を示した。またEC50は野生株が790nmol/Lであったのに対し、PDR5Δ株が、61.1nmol/Lであり、1/13に低減された。
【0428】
以上のように、PDR5遺伝子を欠失させることによって、前記形質転換酵母は、MRのリガンドに対して、検出感度および/または検出応答性が改善された。このため、本発明の形質転換酵母は、動物核内受容体に対するリガンドのアッセイに極めて有効といえる。
【0429】
以上の本発明の実施例の結果から、マンナン結合タンパク質のコード遺伝子または排出ポンプタンパク質のコード遺伝子のいずれを欠失させることにより、前記形質転換酵母は、核内受容体遺伝子の種類に関わらず、動物核内受容体のリガンドに対して、検出感度および/または検出応答性が改善された。このため、本発明の形質転換酵母は、動物核内受容体に対するリガンドのアッセイに極めて有効といえる。
【産業上の利用可能性】
【0430】
以上のように、本発明の形質転換酵母を用いれば、高検出感度で、核内受容体に対するリガンドの分析が可能となる。したがって、本発明の分析方法は、例えば、化学物質およびタンパク質等のリガンドの分析の分野において、有用な方法であり、その用途は制限されず広い。
【技術分野】
【0001】
本発明は、形質転換酵母、それを用いた動物核内受容体リガンドの分析方法および分析キットに関する。
【背景技術】
【0002】
環境中の化学物質の分析方法として、近年、核内受容体遺伝子を組み込んだ宿主細胞を使用して、レポーター遺伝子の発現の程度により、前記化学物質を分析するという手法が開発されている。この方法によれば、例えば、生物的な影響も評価できる。前記宿主細胞は、例えば、動物細胞および酵母が使用されている。
【0003】
前記動物細胞は、例えば、ヒトの細胞株が使用されている。ヒト由来細胞を用いた分析は、例えば、アンドロゲンレセプター(AR)に結合するリガンドであるテストステロン(T)等の分析が報告されている。この方法は、例えば、アンドロゲンレセプター(AR)遺伝子を組み込んだヒト由来細胞株が使用されている(非特許文献1)。
【0004】
一方、酵母を用いた方法は、例えば、雌化現象等で注目された環境ホルモン(内分泌撹乱物質)について、エストロゲン様活性の分析が報告されている。この方法は、例えば、ブルーギル由来のエストロゲン受容体遺伝子(特許文献1)、オオマキトカゲ由来エストロゲン受容体遺伝子、(特許文献2)、ワニ由来エストロゲン受容体遺伝子(特許文献3)、ファットヘッドミノー由来エストロゲン受容体遺伝子(特許文献4)等の各種動物のエストロゲン受容体遺伝子を酵母に組み込み、レポーター遺伝子の発現を測定するという手法が開発されている(特許文献1、特許文献2、特許文献3、特許文献4)。この他に、例えば、ヒト由来エストロゲン受容体遺伝子を組み込んだ形質転換酵母を用いて、アルキルフェノール化合物のエストロゲン様活性を測定する手法が開発されている(非特許文献2)。また、例えば、ダイオキシン等のアリールハイドロカーボン類を測定するために、モルモット由来のアリールハイドロカーボン受容体遺伝子を組み込んだ形質転換酵母を用いた手法が開発されている(特許文献5)。
【0005】
前記酵母を用いた手法では、前記酵母において、核内受容体遺伝子が発現し、発現した核内受容体に、測定対象のリガンド(例えば、化学物質等)が結合して複合体を形成する。そして、この複合体が、酵母内のレポーター遺伝子を発現させる。前記レポーター遺伝子は、例えば、β−ガラクトシダーゼ遺伝子が使用されており、β−ガラクトシダーゼの酵素活性の測定により、前記レポーター遺伝子の発現が測定できる。
【0006】
前記酵母を用いた分析方法は、動物細胞を用いた分析方法に比べて、例えば、短時間での分析が可能であり、操作の簡便性および低コスト等の利点を有する。しかしながら、酵母を用いた分析方法では、動物細胞を用いた分析手法に比べ、分析感度が低いという問題がある。
【先行技術文献】
【特許文献】
【0007】
【特許文献1】特開2001−197890号公報
【特許文献2】特開2003−274号公報
【特許文献3】特開2002−360273号公報
【特許文献4】特開2001−352992号公報
【特許文献5】特開2005−87077号公報
【非特許文献】
【0008】
【非特許文献1】Toxicology 220(2006)90−103
【非特許文献2】The Journal Of Biological Chemistry Vol.272,No.6,Feb.7 pp.3280−3288
【発明の概要】
【発明が解決しようとする課題】
【0009】
そこで、本発明の目的は、核内受容体リガンドを、高感度で分析可能な形質転換酵母、それを用いた核内受容体リガンドの分析方法および分析キットを提供することである。より詳細には、例えば、前記酵母に発現させる核内受容体の種類に関わらず、前記核内受容体リガンドを高感度で分析可能な形質転換酵母、それを用いた核内受容体リガンドの分析方法および分析キットを提供する。
【課題を解決するための手段】
【0010】
前記目的を達成するために、本発明の形質転換酵母は、核内受容体遺伝子およびレポーター遺伝子が発現可能に導入されており、かつ核内受容体リガンドと核内受容体との複合体を認識して前記レポーター遺伝子を発現し得る形質転換酵母であって、さらに、細胞壁タンパク質の機能および排出ポンプタンパク質の機能の少なくとも一方が欠損されたことを特徴とする。
【0011】
本発明の分析方法は、検体に含まれる核内受容体リガンドを分析するための方法であって、
検体を含む培地中で、前記本発明の形質転換酵母を培養する培養工程と、
前記培養工程の後、前記培地中に産生された前記レポーター遺伝子の発現産物を測定する測定工程とを含むことを特徴とする。
【0012】
本発明の分析キットは、検体に含まれる核内受容体リガンドを分析するためのキットであって、
(a)培地と、
(b)前記本発明の形質転換酵母と、
(c)発色試薬と
を備えることを特徴とする。
【発明の効果】
【0013】
本発明の形質転換酵母によれば、メカニズムは不明であるが、細胞壁タンパク質の機能および排出ポンプタンパク質の機能の少なくとも一方を欠損することによって、核内受容体に対するリガンドの分析感度を向上できる。このため、本発明の形質転換酵母によれば、核内受容体に対するリガンドを、高感度で分析可能である。特に、本発明の形質転換酵母は、前記形質転換酵母に導入される前記核内受容体遺伝子の種類に関わらず、リガンドの分析感度を向上できる。例えば、野生型の酵母等、従来公知の酵母によると、導入される核内受容体の種類によって、リガンドが存在しているにも関わらず、リガンドを検出できない場合がある。これに対して、本発明の形質転換酵母は、導入する前記核内受容体の種類に関わらず、例えば、前記野生型の酵母等では行うことができなかったリガンドの検出も可能である。このように本発明の形質転換酵母は、前記核内受容体遺伝子の種類に関わらず使用可能であることから、核内受容体の分析において、汎用性の高いツールと言える。また、本発明の分析キットを用いれば、さらに簡便に、核内受容体に対するリガンドの分析を実施できる。
【図面の簡単な説明】
【0014】
【図1】図1の(A)、(B)および(C)は、本発明の実施例2におけるβ−ガラクトシダーゼ活性の測定結果を示すグラフである。
【図2】図2は、本発明の実施例4におけるβ−ガラクトシダーゼ活性の測定結果を示すグラフである。
【図3】図3は、本発明の実施例6におけるβ−ガラクトシダーゼ活性の測定結果を示すグラフである。
【図4】図4は、本発明の実施例8におけるβ−ガラクトシダーゼ活性の測定結果を示すグラフである。
【図5】図5は、本発明の実施例10におけるβ−ガラクトシダーゼ活性の測定結果を示すグラフである。
【図6】図6は、本発明の実施例12におけるβ−ガラクトシダーゼ活性の測定結果を示すグラフである。
【図7】図7は、本発明の実施例14におけるβ−ガラクトシダーゼ活性の測定結果を示すグラフである。
【図8】図8は、本発明の実施例16におけるβ−ガラクトシダーゼ活性の測定結果を示すグラフである。
【図9】図9は、本発明の実施例18におけるβ−ガラクトシダーゼ活性の測定結果を示すグラフである。
【図10】図10は、本発明の実施例20におけるβ−ガラクトシダーゼ活性の測定結果を示すグラフである。
【図11】図11は、本発明の実施例22におけるβ−ガラクトシダーゼ活性の測定結果を示すグラフである。
【図12】図12は、本発明の実施例24におけるβ−ガラクトシダーゼ活性の測定結果を示すグラフである。
【発明を実施するための形態】
【0015】
本発明の形質転換酵母は、前述のように、核内受容体遺伝子およびレポーター遺伝子が発現可能に導入されており、かつ核内受容体リガンドと核内受容体との複合体を認識して前記レポーター遺伝子を発現し得る形質転換酵母であって、
さらに、細胞壁タンパク質の機能および排出ポンプタンパク質の機能の少なくとも一方が欠損されたことを特徴とする。
【0016】
本発明の形質転換酵母は、前記細胞壁タンパク質のコード遺伝子を欠失することにより、前記細胞壁タンパク質の機能を欠損することが好ましい。
【0017】
本発明の形質転換酵母は、前記細胞壁タンパク質のコード遺伝子が、マンナン結合タンパク質のコード遺伝子であることが好ましい。
【0018】
本発明の形質転換酵母は、前記マンナン結合タンパク質のコード遺伝子が、CWP1遺伝子、CWP2遺伝子、CCW14遺伝子、CIS3遺伝子、KRE11遺伝子、PIR1遺伝子、PIR3遺伝子、TIP1遺伝子、TIR1遺伝子、TIR2遺伝子からなる群から選択された少なくとも一つであることが好ましい。
【0019】
本発明の形質転換酵母は、前記排出ポンプタンパク質のコード遺伝子を欠失することにより、前記排出ポンプタンパク質の機能を欠損することが好ましい。
【0020】
本発明の形質転換酵母は、前記排出ポンプタンパク質のコード遺伝子が、ABCトランスポーター遺伝子であることが好ましい。
【0021】
本発明の形質転換酵母は、前記ABCトランスポーター遺伝子が、PDR5遺伝子、STE6遺伝子、PDR12遺伝子、PDR15遺伝子、SNQ2遺伝子、YOR1遺伝子、YDR061W遺伝子、PDR18遺伝子、YOL075C遺伝子、YBT1遺伝子、AUS1遺伝子、PDR10遺伝子、PDR11遺伝子からなる群から選択された少なくとも一つであることが好ましい。
【0022】
本発明の形質転換酵母は、前記細胞壁タンパク質のコード遺伝子および前記排出ポンプタンパク質のコード遺伝子を欠失することが好ましい。
【0023】
本発明の形質転換酵母は、前記核内受容体が、動物核内受容体であることが好ましく、より好ましくは、ヒト核内受容体である。
【0024】
本発明の形質転換酵母は、前記核内受容体が、ホモ二量体、ヘテロ二量体または単量体の受容体であることが好ましい。前記ヘテロ二量体の受容体は、レチノイドX受容体(RXR)を含む受容体が好ましく、より好ましくは前記RXRとPXRとのヘテロ二量体である。
【0025】
本発明の形質転換酵母は、前記レポーター遺伝子が、β−ガラクトシダーゼ遺伝子が好ましい。
【0026】
本発明の形質転換酵母は、前記核内受容体遺伝子を染色体上に有し、
前記レポーター遺伝子をプラスミドに有し、
前記プラスミドは、前記レポーター遺伝子と作動的に組み込まれた核内受容体応答配列を含むことが好ましい。
【0027】
本発明の形質転換酵母は、出芽酵母(Saccharomyces cerevisiae)であることが好ましい。
【0028】
本発明の形質転換酵母は、検体に含まれる核内受容体リガンドの分析に使用されることが好ましい。
【0029】
本発明の分析方法は、前述のように、検体に含まれる核内受容体リガンドを分析するための方法であって、
検体を含む培地中で、前記本発明の形質転換酵母を培養する培養工程と、
前記培養工程の後、前記培地中に産生された前記レポーター遺伝子の発現産物を測定する測定工程とを含むことを特徴とする。
【0030】
本発明の分析方法は、前記レポーター遺伝子が、β−ガラクトシダーゼ遺伝子であり、
前記培地が、炭素源として、ガラクトースおよびグルコースの少なくとも一方を含むことが好ましい。
【0031】
本発明の分析方法は、前記培地が、ガラクトースおよびグルコースを含み、
ガラクトースおよびグルコースの合計に対するグルコースの重量割合が、0を超え60重量%以下の範囲であることが好ましい。
【0032】
本発明の分析方法は、前記形質転換酵母が、予め、グリセロール存在下で保存されていた酵母であることが好ましい。
【0033】
本発明の分析方法は、前記形質転換酵母が、予め、グルコース単独を炭素源とする培地で培養された酵母であることが好ましい。
【0034】
本発明の分析キットは、前述のように、検体に含まれる核内受容体リガンドを分析するための分析キットであって、
(a)培地と、
(b)前記本発明の形質転換酵母と、
(c)発色試薬と
を備えることを特徴とする。
【0035】
本発明の分析キットは、前記培地が、グルコースおよびガラクトースの少なくとも一方を含む培地であることが好ましい。
【0036】
つぎに、本発明について詳しく説明する。
【0037】
本発明の形質転換酵母は、前述のように、例えば、導入される核内受容体遺伝子の種類に関わらず、前記核内受容体遺伝子から発現された核内受容体に結合する検体中のリガンドを検出できる。このため、本発明において、前記核内受容体および前記核内受容体に対するリガンドは、特に制限されない。
【0038】
前記核内受容体遺伝子は、例えば、分析対象のリガンドに応じて、適宜選択すればよい。前記核内受容体遺伝子から発現する核内受容体の構造は、特に制限されず、単量体および二量体等があげられる。前記二量体は、例えば、同じ分子から構成されるホモ二量体でもよいし、異なる分子から構成されるヘテロ二量体でもよい。
【0039】
前記核内受容体を構成する分子は、特に制限されず、例えば、以下のものがあげられる。
【0040】
(1)TRα:Thyroid Hormone Receptor alpha
(2)TRβ:Thyroid Hormone Receptor beta
(3)RARα:Retinoic Acid Receptor alpha
(4)RARβ:Retinoic Acid Receptor beta
(5)RARγ:Retinoic Acid Receptor gamma
(6)PPARα:Peroxisome proliferator activated receptor alpha(PPAR−alpha)
(7)PPARδ:Peroxisome proliferator activated receptor delta(PPAR−delta、PPAR−beta、Nuclear hormone receptor 1、NUC1)
(8)PPARγ1:Peroxisome proliferator activated receptor gamma 1(PPAR−gamma1)
(9)PPARγ2:Peroxisome proliferator activated receptor gamma 2(PPAR−gamma2)
(10)Rev−erbα:Orphan nuclear receptor NR1D1(V−erbA related protein EAR−1、Rev−erbA−alpha)
(11)Rev−erbβ:Orphan nuclear receptor NR1D2(Rev−erb−beta、EAR−1R、Orphan nuclear hormone receptor BD73)
(12)RORα:Nuclear receptor ROR−alpha(Nuclear receptor RZR−alpha)
(13)RORβ:Nuclear receptor ROR−beta(Nuclear receptor RZR−beta)
(14)RORγ:Nuclear receptor ROR−gamma(Nuclear receptor RZR−gamma)
(15)LXRβ:Oxysterols receptor LXR−beta (Liver X receptor beta、Nuclear orphan receptor LXR−beta、Ubiquitously−expressed nuclear receptor、Nuclear receptor NER)
(16)LXRα:Oxysterols receptor LXR−alpha(Liver X receptor alpha、Nuclear orphan receptor LXR−alpha)
(17)FXR:Bile acid receptor(Farnesoid X−activated receptor、Farnesol receptor HRR−1、Retinoid X receptor−interacting protein 14、RXR−interacting protein 14)
(18)VDR:Vitamin D3 receptor(VDR、1,25−dihydroxyvitamin D3 receptor)
(19)PXR−1:Orphan nuclear receptor PXR−1(Pregnane X receptor−1、Orphan nuclear receptor PAR−1、Steroid and xenobiotic receptor−1、SXR−1)
(20)PXR−2:Orphan nuclear receptor PXR−2(Pregnane X receptor−2、Orphan nuclear receptor PAR−2、Steroid and xenobiotic receptor−2、SXR−2)
(21)CAR:Orphan nuclear receptor NR1I3(Constitutive androstane receptor、CAR、Orphan nuclear receptor MB67)
(22)HNF4α:Hepatocyte nuclear factor 4−alpha(HNF−4−alpha、Transcription factor 14)
(23)HNF4γ:Hepatocyte nuclear factor 4−gamma(HNF−4−gamma)
(24)RXRα:Retinoid X receptor RXR−alpha
(25)RXRβ:Retinoid X receptor RXR−beta
(26)RXRγ:Retinoid X receptor RXR−gamma
(27)TR2:Nuclear Hormone Receptor TR2(Orphan nuclear receptor TR2)
(28)TR4:Orphan nuclear receptor TR4(Orphan nuclear receptor TAK1)
(29)TLX:Orphan nuclear receptor NR2E1(Nuclear receptor TLX、Tailless homolog、Tll、hTll)
(30)PNR:Photoreceptor−specific nuclear receptor(Retina−specific nuclear receptor)
(31)COUP−TF I:COUP transcription factor 1(COUP−TF1、COUP−TFα、V−erbA related protein EAR−3)
(32)COUP−TF II:COUP transcription factor 2(COUP−TF2、COUP−TFβ、Apolipoprotein AI regulatory protein−1、ARP−1)
(33)EAR−2:Orphan nuclear receptor EAR−2(V−erbA related protein EAR−2、COUP−TFγ)
(34)ERα:Estrogen receptor(ER、Estradiol receptor、ER−alpha)
(35)ERβ:Estrogen receptor beta(ER−beta)
(36)ERRα:Steroid hormone receptor ERR1(Estrogen−related receptor, alpha、ERR−alpha、Estrogen receptor−like 1)
(37)ERRβ:Steroid hormone receptor ERR2(Estrogen−related receptor,beta、ERR−beta、Estrogen receptor−like 2、ERR beta−2)
(38)ERRγ:Estrogen−related receptor gamma(Estrogen receptor related protein 3、ERR gamma−2)
(39)GRα:Glucocorticoid receptor alpha
(40)GRβ:Glucocorticoid Receptor beta
(41)MR:Mineralcorticoid receptor(MR)
(42)PRα:Progesterone receptor alpha
(43)PRβ:Progesterone receptor beta
(44)AR:Androgen receptor(Dihydrotestosterone receptor)
(45)NGFI−Bα:Orphan nuclear receptor HMR(Early response protein NAK1、TR3 orphan receptor)
(46)NGFI−Bβ:Orphan nuclear receptor NURR1(Immediate−early response protein NOT、Transcriptionally inducible nuclear receptor)
(47)NGFI−Bγ:Nuclear hormone receptor NOR−1(Neuron−derived orphan receptor 1、Mitogen induced nuclear orphan receptor)
(48)SF−1:Steroidogenic factor 1(STF−1、SF−1、Steroid hormone receptor AD4BP、Fushi tarazu factor homolog 1、FTZ−FIα)
(49)LRH−1:Orphan nuclear receptor NR5A2(Alpha−1−fetoprotein transcription factor、Hepatocytic transcription factor、B1−binding factor、hB1F、CYP7A promoter binding factor、FTZ−FIβ)
(50)GCNF:Germ cell nuclear factor(Orphan nuclear receptor NR6A1、Retinoid receptor−related testis specific receptor、RTR)
(51)DAX1:Orphan nuclear receptor DAX−1
(52)SHP:Small heterodimer partner(Orphan nuclear receptor SHP)
(53)AhR:aryl hydrocarbon receptor(AHR、Dioxin nuclear receptor)
【0041】
前記ホモ二量体の核内受容体は、例えば、TR4、HNF4α、HNF4γ、RXRα、RXRβ、RXRγ、TR2、PNR、COUP−TF I、COUP−TF II、EAR2、ERα、ERβ、GRα、GRβ、MR、PRα、PRβ、AR等があげられる。
【0042】
前記ヘテロ二量体の核内受容体は、例えば、RXRを含む核内受容体またはArntを含む核内受容体があげられる。前記RXRを含む核内受容体は、二量体を構成する他方の分子として、例えば、TRα、TRβ、RARα、RARβ、RARγ、PPARα、PPARδ、PPARγ、LXRβ、LXRα、FXR、VDR、PXR−1、PXR−2、CARがあげられる。中でも、RXRとPXR−1とのヘテロ二量体(RXR/PXR−1)、およびRXRとPXR−2とのヘテロ二量体(RXR/PXR−2)が特に好ましい。また、前記Arntを含む核内受容体は、二量体を構成する他の分子として、例えば、AhRがあげられる。
【0043】
前記単量体の核内受容体は、例えば、Rev−erbα、Rev−erbβ、RORα、RORβ、RORγ、TLX、ERRα、ERRβ、ERRγ、SF−1、LRH、GCNF、DAX1、SHPがあげられる。
【0044】
前記単量体、ホモ二量体およびヘテロ二量体のいずれをも取り得る核内受容体は、例えば、NGF1−Bα、NGF1−Bβ、NGF1−Bγがあげられる。
【0045】
本発明においては、前記核内受容体遺伝子の種類を適宜設定することで、前記核内受容体に対するリガンドを検出できる。なお、本発明において分析対象のリガンドは、例えば、前記核内受容体に結合する公知リガンドでもよいし、前記核内受容体に結合する未知のリガンドでもよい。
【0046】
本発明において、前記核内受容体は、例えば、分析対象のリガンドに応じて、適宜選択すればよい。
【0047】
<形質転換酵母>
本発明の形質転換酵母は、前述のように、核内受容体遺伝子およびレポーター遺伝子が発現可能に導入されており、かつ核内受容体リガンドと核内受容体との複合体を認識して前記レポーター遺伝子を発現し得る形質転換酵母であって、さらに、細胞壁タンパク質の機能および排出ポンプタンパク質の機能の少なくとも一方が欠損されたことを特徴とする。
【0048】
本発明の形質転換酵母は、例えば、出芽酵母、分裂酵母、糸状酵母等があげられ、出芽酵母(Saccharomyces cerevisiae)が好ましい。本発明の形質転換酵母の形態は、特に制限されず、例えば、培養液、凍結乾燥菌体、グリセロール存在下での保存菌体(グリセロールストック)等の形態があげられる。
【0049】
本発明の形質転換酵母は、前記細胞壁タンパク質の機能および前記排出ポンプタンパク質の機能の少なくとも一方を欠損すればよい。本発明の形質転換酵母は、例えば、前記細胞壁タンパク質の機能および前記排出ポンプタンパク質の機能のいずれか一方のみが欠損されてもよいが、前記細胞壁タンパク質の機能および前記排出ポンプタンパク質の機能の両方が欠損されたことが好ましい。
【0050】
前記細胞壁タンパク質は、特に制限されず、例えば、マンナン結合タンパク質等があげられる。前記マンナン結合タンパク質は、例えば、CWP1タンパク質、CWP2タンパク質、CCW14タンパク質、CIS3タンパク質、KRE11タンパク質、PIR1タンパク質、PIR3タンパク質、TIP1タンパク質、TIR1タンパク質、TIR2タンパク質等があげられる。本発明の形質転換酵母において、前記機能が欠損された前記細胞壁タンパク質の種類は、例えば、一種類でもよいし、二種類以上でもよい。後者の場合、機能が欠損した前記細胞壁タンパク質の組合せは、特に制限されず、例えば、CWP1タンパク質とCWP2タンパク質の組合せが例示できる。
【0051】
前記排出ポンプタンパク質は、特に制限されず、例えば、ABC(ATP−Binding Cassette)トランスポータータンパク質、MFS(major facilitator superfamily)トランスポータータンパク質等があげられる。前記ABCトランスポータータンパク質は、例えば、PDR5タンパク質、STE6タンパク質、PDR12タンパク質、PDR15タンパク質、SNQ2タンパク質、YOR1タンパク質、YDR061Wタンパク質、PDR18タンパク質、YOL075Cタンパク質、YBT1タンパク質、AUS1タンパク質、PDR10タンパク質、PDR11タンパク質等があげられる。本発明の形質転換酵母において、前記機能が欠損した前記排出ポンプタンパク質の種類は、例えば、一種類でもよいし、二種類以上でもよい。後者の場合、機能が欠損した前記排出ポンプの組合せは、特に制限されず、例えば、PDR5タンパク質とPDR10タンパク質の組み合わせが例示できる。
【0052】
本発明の形質転換酵母は、前述のように、前記細胞壁タンパク質の機能および前記排出ポンプタンパク質の機能の両方が欠損されたことが好ましい。機能が欠損された前記細胞壁タンパク質および前記排出ポンプタンパク質の組み合わせは、特に制限されない。前記組み合わせは、例えば、前記マンナン結合タンパク質と前記ABCトランスポータータンパク質の組み合わせがあげられる。具体的には、例えば、
CWP1タンパク質とPDR5タンパク質との組み合わせ、
CWP1タンパク質とPDR10タンパク質との組み合わせ、
CWP2タンパク質とPDR5タンパク質との組み合わせ、
CWP1タンパク質、CWP2タンパク質およびPDR5タンパク質の組み合わせ、
CWP1タンパク質、PDR5タンパク質およびPDR10タンパク質の組み合わせ
等があげられる。
【0053】
本発明の形質転換酵母において、前記細胞壁タンパク質の機能および前記排出ポンプタンパク質の機能は、どのようなメカニズムによって欠損してもよい。タンパク質の機能は、例えば、前記形質転換酵母における、前記タンパク質のコード遺伝子の欠失、前記タンパク質のコード遺伝子における点変異または配列挿入等による欠損、前記タンパク質のコード遺伝子からの転写の抑制、転写産物からの翻訳の抑制により、欠損させることができ、中でも、前記コード遺伝子の欠失によることが好ましい。
【0054】
本発明の形質転換酵母は、例えば、前記細胞壁タンパク質のコード遺伝子および/または前記排出ポンプタンパク質のコード遺伝子について、全領域を欠失してもよいし、部分領域を欠失してもよい。後者の場合、例えば、前記コード遺伝子におけるオープンリーディングフレーム(ORF)を欠失してもよいし、前記タンパク質の機能に関与する領域を欠失してもよい。本発明の形質転換酵母は、前記細胞壁タンパク質のコード遺伝子および前記排出ポンプタンパク質のコード遺伝子の少なくとも一方が、ORFを欠失することが好ましく、前記両方のコード遺伝子が、それぞれORFを欠失することがより好ましい。
【0055】
前記細胞壁タンパク質のコード遺伝子は、特に制限されず、例えば、前述のタンパク質のコード遺伝子、すなわち、マンナン結合タンパク質等のタンパク質のコード遺伝子があげられる。前記マンナンタンパク質のコード遺伝子は、例えば、CWP1遺伝子、CWP2遺伝子、CCW14遺伝子、CIS3遺伝子、KRE11遺伝子、PIR1遺伝子、PIR3遺伝子、TIP1遺伝子、TIR1遺伝子、TIR2遺伝子があげられる。本発明の形質転換酵母において、前記細胞壁タンパク質のコード遺伝子は、例えば、一種類が欠失してもよいし、二種類以上が欠失してもよい。後者の場合、例えば、CWP1遺伝子およびCWP2遺伝子を欠失してもよい。
【0056】
前記排出ポンプタンパク質のコード遺伝子は、特に制限されず、例えば、前述のタンパク質のコード遺伝子、すなわち、ABCトランスポータータンパク質、MFS(major facilitator superfamily)トランスポータータンパク質等のタンパク質のコード遺伝子があげられる。前記ABCトランスポータータンパク質のコード遺伝子は、例えば、PDR5遺伝子、STE6遺伝子、PDR12遺伝子、PDR15遺伝子、SNQ2遺伝子、YOR1遺伝子、YDR061W遺伝子、PDR18遺伝子、YOL075C遺伝子、YBT1遺伝子、AUS1遺伝子、PDR10遺伝子、PDR11遺伝子等があげられる。本発明の形質転換酵母において、前記排出ポンプタンパク質のコード遺伝子は、例えば、一種類が欠失してもよいし、二種類以上が欠失してもよい。後者の場合、例えば、PDR5遺伝子およびPDR10遺伝子を欠失してもよい。
【0057】
本発明の形質転換酵母は、例えば、前記細胞壁タンパク質のコード遺伝子および前記排出ポンプタンパク質のコード遺伝子の両方を欠失することが好ましい。前記欠損した前記細胞壁タンパク質のコード遺伝子および前記排出ポンプタンパク質のコード遺伝子の組み合わせは、特に制限されない。前記組み合せは、例えば、前記マンナン結合タンパク質のコード遺伝子と前記ABCトランスポータータンパク質のコード遺伝子の組み合わせがあげられる。具体的には、
CWP1遺伝子とPDR5遺伝子との組み合わせ、
CWP1遺伝子とPDR10遺伝子との組み合わせ、
CWP2遺伝子とPDR5遺伝子の組み合わせ、
CWP1遺伝子、CWP2遺伝子およびPDR5遺伝子の組み合わせ、
CWP1遺伝子、PDR5遺伝子およびPDR10遺伝子の組み合わせ
等があげられ、好ましくはCWP1遺伝子とPDR5遺伝子との組み合わせである。
【0058】
前記細胞壁タンパク質のコード遺伝子および/または前記排出ポンプタンパク質のコード遺伝子の欠失は、特に制限されない。本発明においては、前記細胞壁タンパク質のコード遺伝子および前記排出ポンプ遺伝子の少なくともいずれかを欠失させることで、様々な核内受容体遺伝子を導入した場合も、リガンドの分析に使用可能である。
【0059】
前記核内受容体の種類に応じて、例えば、前記細胞壁タンパク質のコード遺伝子および前記排出ポンプ遺伝子の欠失を以下のように設定すれば、より優れた分析精度が実現できる。
【0060】
前記核内受容体がGRのホモ二量体であり、GRに対するリガンドを分析する場合、例えば、PDR5遺伝子の欠失、PDR10遺伝子の欠失、CWP1遺伝子およびPDR5遺伝子の欠失、CWP1遺伝子およびPDR10遺伝子の欠失、PDR5遺伝子およびPDR10遺伝子の欠失、ならびに、CWP1遺伝子、PDR5遺伝子およびPDR10遺伝子の欠失が好ましく、より好ましくは、PDR5遺伝子の欠失、CWP1遺伝子およびPDR5遺伝子の欠失、PDR5遺伝子およびPDR10遺伝子の欠失、ならびに、CWP1遺伝子、PDR5遺伝子およびPDR10遺伝子の欠失である。
【0061】
前記核内受容体がAhRとArntとのヘテロ二量体であり、AhRに対するリガンドを分析する場合、例えば、CWP1遺伝子の欠失、CWP2遺伝子の欠失、PDR5遺伝子の欠失、PDR10遺伝子の欠失、CWP1遺伝子およびCWP2遺伝子の欠失、CWP1遺伝子およびPDR5遺伝子の欠失、CWP1遺伝子およびPDR10遺伝子の欠失、PDR5遺伝子およびPDR10遺伝子の欠失、ならびに、CWP1遺伝子、PDR5遺伝子およびPDR10遺伝子の欠失が好ましく、より好ましくは、PDR10遺伝子の欠失、CWP1遺伝子およびPDR5遺伝子の欠失、CWP1遺伝子およびPDR10遺伝子の欠失、PDR5遺伝子およびPDR10遺伝子の欠失、ならびに、CWP1遺伝子、PDR5遺伝子およびPDR10遺伝子の欠失であり、特に好ましくは、PDR5遺伝子およびPDR10遺伝子の欠失、ならびに、CWP1遺伝子、PDR5遺伝子およびPDR10遺伝子の欠失である。
【0062】
前記核内受容体がERαのホモ二量体であり、ERαに対するリガンドを分析する場合、例えば、CWP1遺伝子の欠失、CWP2遺伝子の欠失、PDR5遺伝子の欠失、CWP1遺伝子およびCWP2遺伝子の欠失、CWP1遺伝子およびPDR5遺伝子の欠失、CWP2遺伝子およびPDR5遺伝子の欠失、ならびに、CWP1遺伝子、CWP2遺伝子およびPDR5遺伝子の欠失が好ましく、より好ましくは、CWP1遺伝子の欠失、CWP2遺伝子の欠失、CWP1遺伝子およびCWP2遺伝子の欠失、ならびに、CWP1遺伝子およびPDR5遺伝子の欠失である。
【0063】
前記核内受容体がERβのホモ二量体であり、ERβに対するリガンドを分析する場合、例えば、CWP1遺伝子の欠失、CWP2遺伝子の欠失、PDR5遺伝子の欠失、CWP1遺伝子およびCWP2遺伝子の欠失、CWP1遺伝子およびPDR5遺伝子の欠失、CWP2遺伝子およびPDR5遺伝子の欠失、ならびに、CWP1遺伝子、CWP2遺伝子およびPDR5遺伝子の欠失が好ましく、より好ましくは、CWP1遺伝子およびCWP2遺伝子の欠失である。
【0064】
前記核内受容体がTRαのホモ二量体であり、TRαに対するリガンドを分析する場合、例えば、CWP1遺伝子およびCWP2遺伝子の欠失が好ましい。
【0065】
前記核内受容体がTRβのホモ二量体であり、TRβに対するリガンドを分析する場合、例えば、PDR5遺伝子の欠失、CWP1遺伝子およびCWP2遺伝子の欠失、ならびに、CWP1遺伝子、CWP2遺伝子およびPDR5遺伝子の欠失が好ましく、より好ましくは、PDR5遺伝子の欠失である。
【0066】
前記核内受容体がRXRとPXR−1とのヘテロ二量体であり、前記ヘテロ二量体に対するリガンドを分析する場合、例えば、PDR5遺伝子の欠失、CWP1遺伝子およびPDR5遺伝子の欠失、CWP2遺伝子およびPDR5遺伝子の欠失、ならびに、CWP1遺伝子、CWP2遺伝子およびPDR5遺伝子の欠失が好ましく、より好ましくは、PDR5遺伝子の欠失である。
【0067】
前記核内受容体がPRのホモ二量体であり、PRに対するリガンドを分析する場合、例えば、PDR5遺伝子の欠失、CWP2遺伝子の欠失、CWP1遺伝子およびPDR5遺伝子の欠失、CWP1遺伝子およびCWP2遺伝子の欠失、CWP2遺伝子およびPDR5遺伝子の欠失、CWP1遺伝子およびPDR10遺伝子の欠失、PDR5遺伝子およびPDR10遺伝子の欠失、CWP1遺伝子、CWP2遺伝子およびPDR5遺伝子の欠失、ならびに、CWP1遺伝子、PDR5遺伝子およびPDR10遺伝子の欠失が好ましく、より好ましくは、PDR5遺伝子の欠失、ならびに、CWP1遺伝子およびCWP2遺伝子の欠失である。
【0068】
前記核内受容体がARのホモ二量体であり、ARに対するリガンドを分析する場合、例えば、PDR5遺伝子の欠失、CWP1遺伝子およびPDR5遺伝子の欠失、CWP2遺伝子およびPDR5遺伝子の欠失、CWP1遺伝子およびCWP2遺伝子の欠失、PDR5遺伝子およびPDR10遺伝子の欠失、CWP1遺伝子、PDR5遺伝子およびPDR10遺伝子の欠失、ならびに、CWP1遺伝子、CWP2遺伝子およびPDR5遺伝子の欠失が好ましく、より好ましくは、CWP1遺伝子およびPDR5遺伝子の欠失、ならびに、PDR5遺伝子およびPDR10遺伝子の欠失である。
【0069】
前記核内受容体がMRのホモ二量体であり、MRに対するリガンドを分析する場合、例えば、PDR5遺伝子の欠失が好ましい。
【0070】
本発明の形質転換酵母は、例えば、発現する核内受容体が、動物核内受容体であることが好ましく、具体的には、ヒト核内受容体であることが好ましい。このため、本発明の形質転換酵母は、前記核内受容体遺伝子として、動物核内受容体遺伝子が導入されていることが好ましく、より好ましくは、ヒト核内受容体遺伝子が導入されている。
【0071】
本発明の形質転換酵母によれば、任意の核内受容体に対するリガンドを分析できる。このため、本発明の形質転換酵母において、前記核内受容体遺伝子は、特に制限されず、分析対象である前記リガンドの種類に応じて、適宜決定できる。
【0072】
本発明の形質転換酵母において、発現する前記核内受容体は、例えば、前述した核内受容体が例示でき、具体例としては、アンドロゲン受容体(AR)、グルココルチコイド受容体(GR)、アリールハイドロカーボン受容体(AhR)、レチノイン酸X受容体α(RXRα)、エストロゲン受容体α(ERα)、エストロゲン受容体β(ERβ)、甲状腺ホルモン受容体α(TRα)、甲状腺ホルモン受容体β(TRβ)、プロゲステロン受容体(PR)、鉱質コルチコイド受容体(MR)、プレグナンX受容体(PXR(PXR−1またはPXR−2))等があげられる。これらの核内受容体は、動物核内受容体が好ましく、より好ましくはヒト核内受容体である。
【0073】
本発明の形質転換酵母は、さらに、転写共役因子遺伝子が発現可能に導入されてもよい。本発明の形質転換酵母において、例えば、前記転写共役因子遺伝子から発現された転写共役因子(コアクチベーター)は、前記核内受容体に直接結合して、前記レポーター遺伝子の転写を活性化する。前記転写共役因子遺伝子は、例えば、前記核内受容体遺伝子の種類に応じて、適宜決定できる。
【0074】
本発明の形質転換酵母は、例えば、発現する転写共役因子が、動物転写共役因子であることが好ましく、より好ましくは、ヒト転写共役因子である。このため、本発明の形質転換酵母は、例えば、前記転写共役因子遺伝子として、動物転写共役因子遺伝子が導入されていることが好ましく、より好ましくは、ヒト転写共役因子遺伝子が導入されている。
【0075】
発現する前記転写共役因子の由来は、特に制限されず、例えば、発現する前記核内受容体の由来と同じ系統であることが好ましく、より好ましくは同じ動物由来である。具体的には、前記核内受容体がヒト核内受容体の場合、前記転写共役因子は、ヒト転写共役因子が好ましい。このため、本発明の形質転換酵母は、例えば、前記核内受容体遺伝子として、動物核内受容体遺伝子が導入されている場合、前記動物転写共役因子遺伝子が導入されていることが好ましく、ヒト核内受容体遺伝子が導入されている場合、ヒト転写共役因子遺伝子が導入されていることが好ましい。このように、前記核内受容体遺伝子と前記転写共役因子遺伝子とを同じ由来とすることで、分析感度をさらに向上できる。このメカニズムは不明であるが、例えば、由来が同じ前記核内受容体と前記転写共役因子とを含む複合体により、前記レポーター遺伝子の転写の効率が向上すると推測される。本発明は、このメカニズムには制限されない。
【0076】
以下に、前記転写共役因子と、それが結合可能な核内受容体の組み合わせを例示する。本発明は、これらの組み合わせには制限されない。
【表1】

【0077】
本発明の形質転換酵母において、前記レポーター遺伝子は、特に制限されず、公知の遺伝子があげられる。具体例としては、β−ガラクトシダーゼ遺伝子、ルシフェラーゼ遺伝子、蛍光タンパク質遺伝子、β−グルクロニダーゼ遺伝子等があげられる。
【0078】
本発明の形質転換酵母において、前記核内受容体遺伝子の導入部位は、特に制限されない。前記核内受容体遺伝子は、例えば、前記酵母の染色体上に導入されていることが好ましい。
【0079】
本発明の形質転換酵母が、導入された前記転写共役因子遺伝子を有する場合、前記転写共役因子遺伝子の導入部位は、特に制限されない。本発明の形質転換部位は、前記プラスミドを有し、前記プラスミドが、前記転写共役因子遺伝子を有することが好ましい。
【0080】
本発明の形質転換酵母において、前記レポーター遺伝子の導入部位は、特に制限されない。本発明の形質転換酵母は、例えば、さらに、プラスミドを有し、前記プラスミドが、前記レポーター遺伝子を有することが好ましい。
【0081】
本発明の形質転換酵母は、例えば、さらに、核内受容体応答配列が導入されていることが好ましい。前記核内受容体応答配列は、特に制限されず、前記核内受容体の種類に応じて適宜決定できる。
【0082】
前記核内受容体応答配列の由来は、特に制限されず、例えば、発現する前記核内受容体の由来と同じ系統であることが好ましく、より好ましくは同じ動物由来である。具体的には、前記核内受容体がヒト核内受容体の場合、前記核内受容体応答配列は、ヒト核内受容体応答配列が好ましい。このため、本発明の形質転換酵母は、例えば、前記核内受容体遺伝子として、動物核内受容体遺伝子が導入されている場合、前記動物核内受容体応答配列が導入されていることが好ましく、ヒト核内受容体遺伝子が導入されている場合、ヒト核内受容体応答配列が導入されていることが好ましい。
【0083】
本発明の形質転換酵母において、前記核内受容体応答配列の導入部位は、特に制限されない。本発明の形質転換酵母は、例えば、さらに、プラスミドを有し、前記プラスミドが、前記核内受容体応答配列を有することが好ましい。前記核内受容体応答配列は、例えば、前記レポーター遺伝子を有する前記プラスミドに、挿入されていることが好ましい。前記プラスミドにおいて、前記核内受容体応答配列および前記レポーター遺伝子は、作動的に連結して、挿入されていることが好ましい。前記プラスミドにおいて、前記核内受容体応答配列は、前記レポーター遺伝子の上流に挿入されていることが好ましい。前記核内受容体応答配列は、例えば、繰り返し配列として、前記プラスミドに挿入されていることが好ましい。
【0084】
前記レポーター遺伝子と、前記転写共役因子遺伝子は、例えば、それぞれ、別個のプラスミドに挿入されていることが好ましい。以下、レポーター遺伝子および任意で前記核内受容体応答配列を有する前記プラスミドを、第1のプラスミド、前記転写共役因子遺伝子を有する前記プラスミドを、第2のプラスミドという。前記1のプラスミドは、例えば、低コピー型プラスミドが好ましく、前記第2のプラスミドは、例えば、高コピー型プラスミドが好ましい。
【0085】
以下に、本発明の形質転換酵母の例として、前記核内受容体が、前述したAR、GR、RXRα、ERβ、TRα、AhR、ERα、TRβ、PXR−1、PRまたはMRであり、これらに対するリガンドの分析に使用する形質転換酵母について、説明する。
【0086】
まず、前記核内受容体がARであり、AR遺伝子が導入された形質転換酵母について説明する。
【0087】
ARに対するリガンドは、例えば、アンドロゲンまたはアンドロゲン様化学物質等があげられる。前記リガンドが存在すると、前記形質転換酵母において、ARは、前記リガンドおよび前記転写共役因子と複合体を形成する。前記複合体は、前記核内受容体応答配列を認識して結合する。前記複合体の結合により、前記応答配列の下流に存在する前記レポーター遺伝子が発現する。この際、前記レポーター遺伝子の転写は、前記転写共役因子によって、活性化される。前記核内受容体がARの場合、前記応答配列は、例えば、グルココルチコイド応答配列(glucocorticoid response element:GRE)があげられる。
【0088】
前記ARは、特に制限されず、前述のように、動物ARが好ましく、より好ましくはヒトARである。本発明の形質転換酵母において、前記ヒトARを発現させるには、例えば、ヒトAR遺伝子が前記酵母の染色体上に導入されていることが好ましい。
【0089】
前記ヒトAR遺伝子は、例えば、下記(a)または(b)のポリヌクレオチドを含むことが好ましい。
(a)配列番号1に記載の塩基配列からなるポリヌクレオチド。
(b)配列番号1に記載の塩基配列において、少なくとも1つの塩基が置換、付加、挿入もしくは欠失した塩基配列からなるポリヌクレオチドであって、ヒトARとして機能するタンパク質をコードするポリヌクレオチド。
【0090】
前記(b)のポリヌクレオチドは、前記(a)のポリヌクレオチドとの相同性が、例えば、90%以上であって、好ましくは、93%以上であり、より好ましくは、95%以上であり、さらに好ましくは、98%以上である。前記(b)のポリヌクレオチドにおいて、置換、付加、挿入もしくは欠失した塩基の数は、例えば、前記相同性に対応した数である。
【0091】
前記AR遺伝子は、例えば、配列番号1の塩基配列に基づいて、ヒトの核酸を使用して、クローニングすることにより得ることができる。前記核酸は、例えば、DNAでもよいし、トータルRNA等のRNAでもよい。前記AR遺伝子は、例えば、ホスホルアミダイト(phosphoramidite)法を利用して、化学的にDNA合成してもよい。前記クローニングの方法は、特に制限されず、例えば、市販のクローニングキット等を利用して実施できる。
【0092】
前記核内受容体がARの場合、前記ARに対する前記転写共役因子は、特に制限されず、例えば、SRC1、CBP、P300およびTIF2等がある。これらの中で、例えば、SRC1が好ましい。前記転写共役因子は、前述のように動物転写共役因子が好ましく、より好ましくはヒト転写共役因子である。前記転写共役因子遺伝子は、例えば、前述のように、前記第2のプラスミドに挿入し、このプラスミドを形質転換酵母に導入することが好ましい。前記第2のプラスミドは、高コピー型であることが好ましい。
【0093】
前記核内受容体応答配列は、例えば、前述のように、前記第1のプラスミドに挿入し、このプラスミドを形質転換酵母に導入することが好ましい。前記核内受容体応答配列および前記レポーター遺伝子は、前述のように、作動的に連結して、前記第1のプラスミドに挿入することが好ましい。前記核内受容体応答配列、例えば、GREは、繰り返し配列として、前記第1のプラスミドに挿入することが好ましい。前記第1のプラスミドは、低コピー型であることが好ましい。
【0094】
つぎに、前記核内受容体がGRであり、GR遺伝子が導入された形質転換酵母について説明する。
【0095】
GRに対するリガンドは、例えば、グルココルチコイドまたはグルココルチコイド様化学物質等があげられる。前記リガンドが存在すると、前記形質転換酵母において、GRは、前記リガンドおよび前記転写共役因子と複合体を形成する。前記複合体は、前記核内受容体応答配列を認識して結合する。前記複合体の結合により、前記応答配列の下流に存在する前記レポーター遺伝子が発現する。この際、前記レポーター遺伝子の転写は、前記転写共役因子によって、活性化される。前記核内受容体がGRの場合、前記応答配列は、例えば、グルココルチノイド応答配列(GRE)があげられる。
【0096】
前記GRは、特に制限されず、前述のように、動物GRが好ましく、より好ましくはヒトGRである。本発明の形質転換酵母において、前記ヒトGRを発現させるには、例えば、ヒトGR遺伝子を前記酵母の染色体上に導入することが好ましい。
【0097】
前記ヒトGR遺伝子は、例えば、下記(c)または(d)のポリヌクレオチドを含むことが好ましい。
(c)配列番号2に記載の塩基配列からなるポリヌクレオチド。
(d)配列番号2に記載の塩基配列において、少なくとも1つの塩基が置換、付加、挿入もしくは欠失した塩基配列からなるポリヌクレオチドであって、ヒトGRとして機能するタンパク質をコードするポリヌクレオチド。
【0098】
前記(d)のポリヌクレオチドは、前記(c)のポリヌクレオチドとの相同性が、例えば、90%以上であって、好ましくは、93%以上であり、より好ましくは、95%以上であり、さらに好ましくは、98%以上である。前記(d)のポリヌクレオチドにおいて、置換、付加、挿入もしくは欠失した塩基の数は、例えば、前記相同性に対応した数である。
【0099】
前記GR遺伝子は、例えば、配列番号2の塩基配列に基づいて、ヒトの核酸を使用してクローニングすることにより得ることができる。前記核酸は、例えば、DNAでもよいし、トータルRNA等のRNAでもよい。前記GR遺伝子は、例えば、ホスホルアミダイト法を利用して、化学的にDNA合成してもよい。前記クローニングの方法は、特に制限されず、例えば、市販のクローニングキット等を利用して実施できる。
【0100】
前記核内受容体がGRの場合、前記GRに対する前記転写共役因子は、特に制限されず、例えば、SRC1、CBP、P300およびTIF2等がある。これらの中で、例えば、SRC1が好ましい。前記転写共役因子は、前述のように動物転写共役因子が好ましく、より好ましくはヒト転写共役因子である。前記転写共役因子遺伝子は、例えば、前述のように、前記第2のプラスミドに挿入し、このプラスミドを形質転換酵母に導入することが好ましい。前記第2のプラスミドは、高コピー型であることが好ましい。
【0101】
前記核内受容体応答配列は、例えば、前述のように、前記第1のプラスミドに挿入し、このプラスミドを形質転換酵母に導入することが好ましい。前記核内受容体応答配列および前記レポーター遺伝子は、前述のように、作動的に連結して、前記第1のプラスミドに挿入することが好ましい。前記核内受容体応答配列、例えば、GREは、繰り返し配列として、前記第1のプラスミドに挿入することが好ましい。前記第1のプラスミドは、低コピー型であることが好ましい。
【0102】
つぎに、前記核内受容体がRXRαであり、RXRα遺伝子が導入された形質転換酵母について説明する。
【0103】
RXRαに対するリガンドは、例えば、レチノイン酸またはレチノイン酸様化学物質等があげられる。前記リガンドが存在すると、前記形質転換酵母において、RXRαは、前記リガンドおよび前記転写共役因子と複合体を形成する。前記複合体は、前記核内受容体応答配列を認識して結合する。前記複合体の結合により、前記応答配列の下流に存在する前記レポーター遺伝子が発現する。この際、前記レポーター遺伝子の転写は、前記転写共役因子によって、活性化される。前記核内受容体がRXRαの場合、前記応答配列は、例えば、薬物応答配列(DR1エレメント)があげられる。
【0104】
前記RXRαは、特に制限されず、前述のように、動物RXRαが好ましく、より好ましくはヒトRXRαである。本発明の形質転換酵母において、前記ヒトRXRαを発現させるには、例えば、ヒトRXRα遺伝子を前記酵母の染色体上に導入することが好ましい。
【0105】
前記ヒトRXRα遺伝子は、例えば、下記(e)または(f)のポリヌクレオチドを含むことが好ましい。
(e)配列番号3に記載の塩基配列からなるポリヌクレオチド。
(f)配列番号3に記載の塩基配列において、少なくとも1つの塩基が置換、付加、挿入もしくは欠失した塩基配列からなるポリヌクレオチドであって、ヒトRXRαとして機能するタンパク質をコードするポリヌクレオチド。
【0106】
前記(f)のポリヌクレオチドは、前記(e)のポリヌクレオチドとの相同性が、例えば、90%以上であって、好ましくは、93%以上であり、より好ましくは、95%以上であり、さらに好ましくは、98%以上である。前記(f)のポリヌクレオチドにおいて、置換、付加、挿入もしくは欠失した塩基の数は、例えば、前記相同性に対応した数である。
【0107】
前記RXRα遺伝子は、例えば、配列番号3の塩基配列に基づいて、ヒトの核酸を使用してクローニングすることにより得ることができる。前記核酸は、例えば、DNAでもよいし、トータルRNA等のRNAでもよい。前記RXRα遺伝子は、例えば、ホスホルアミダイト法を利用して、化学的にDNA合成してもよい。前記クローニングの方法は、特に制限されず、例えば、市販のクローニングキット等を利用して実施できる。
【0108】
前記核内受容体がRXRαの場合、前記RXRαに対する前記転写共役因子は、特に制限されず、例えば、SRC1、CBP、P300およびARA70等がある。これらの中で、SRC1が好ましい。前記転写共役因子は、前述のように動物転写共役因子が好ましく、より好ましくはヒト転写共役因子である。前記転写共役因子遺伝子は、例えば、前述のように、前記第2のプラスミドに挿入し、このプラスミドを形質転換酵母に導入することが好ましい。前記第2のプラスミドは、高コピー型であることが好ましい。
【0109】
前記核内受容体応答配列は、例えば、前述のように、前記第1のプラスミドに挿入し、このプラスミドを形質転換酵母に導入することが好ましい。前記核内受容体応答配列および前記レポーター遺伝子は、前述のように、作動的に連結して、前記第1のプラスミドに挿入することが好ましい。前記核内受容体応答配列、例えば、DR1エレメントは、繰り返し配列として、前記第1のプラスミドに挿入することが好ましい。前記第1のプラスミドは、低コピー型であることが好ましい。
【0110】
つぎに、前記核内受容体がERβであり、ERβ遺伝子が導入された形質転換酵母について説明する。
【0111】
ERβに対するリガンドは、例えば、エストロゲンまたはエストロゲン様化学物質等があげられる。前記リガンドが存在すると、前記形質転換酵母において、ERβは、前記リガンドおよび前記転写共役因子と複合体を形成する。前記複合体は、前記核内受容体応答配列を認識して結合する。前記複合体の結合により、前記応答配列の下流に存在する前記レポーター遺伝子が発現する。この際、前記レポーター遺伝子の転写は、前記転写共役因子によって、活性化される。前記核内受容体がERβの場合、前記応答配列は、例えば、エストロゲン応答配列(estrogen response element:ERE)があげられる。
【0112】
前記ERβは、特に制限されず、前述のように、動物ERβが好ましく、より好ましくはヒトERβである。本発明の形質転換酵母において、前記ヒトERβを発現させるには、例えば、ヒトERβ遺伝子を前記酵母の染色体上に導入することが好ましい。
【0113】
前記ヒトERβ遺伝子は、例えば、下記(g)または(h)のポリヌクレオチドを含むことが好ましい。
(g)配列番号4に記載の塩基配列からなるポリヌクレオチド。
(h)配列番号4に記載の塩基配列において、少なくとも1つの塩基が置換、付加、挿入もしくは欠失した塩基配列からなるポリヌクレオチドであって、ヒトERβとして機能するタンパク質をコードするポリヌクレオチド。
【0114】
前記(h)のポリヌクレオチドは、前記(g)のポリヌクレオチドとの相同性が、例えば、90%以上であって、好ましくは、93%以上であり、より好ましくは、95%以上であり、さらに好ましくは、98%以上である。前記(h)のポリヌクレオチドにおいて、置換、付加、挿入もしくは欠失した塩基の数は、例えば、前記相同性に対応した数である。
【0115】
前記ERβ遺伝子は、例えば、配列番号4の塩基配列に基づいて、ヒトの核酸を使用してクローニングすることにより得ることができる。前記核酸は、例えば、DNAでもよいし、トータルRNA等のRNAでもよい。前記ERβ遺伝子は、例えば、ホスホルアミダイト法を利用して、化学的にDNA合成してもよい。前記クローニングの方法は、特に制限されず、例えば、市販のクローニングキット等を利用して実施できる。
【0116】
前記核内受容体がERβの場合、前記ERβに対する転写共役因子は、特に制限されず、例えば、SRC1、CBP、P300、ASC2およびERAP140等がある。これらの中で、例えば、SRC1が好ましい。前記転写共役因子は、前述のように動物転写共役因子が好ましく、より好ましくはヒト転写共役因子である。前記転写共役因子遺伝子は、例えば、前述のように、前記第2のプラスミドに挿入し、このプラスミドを形質転換酵母に導入することが好ましい。前記第2のプラスミドは、高コピー型であることが好ましい。
【0117】
前記核内受容体応答配列は、例えば、前述のように、前記第1のプラスミドに挿入し、このプラスミドを形質転換酵母に導入することが好ましい。前記核内受容体応答配列および前記レポーター遺伝子は、前述のように、作動的に連結して、前記第1のプラスミドに挿入することが好ましい。前記核内受容体応答配列、例えば、EREは、繰り返し配列として、前記第1のプラスミドに挿入することが好ましい。前記第1のプラスミドは、低コピー型であることが好ましい。
【0118】
つぎに、前記核内受容体がTRαであり、TRα遺伝子が導入された形質転換酵母について説明する。
【0119】
TRαに対するリガンドは、例えば、甲状腺ホルモンまたは甲状腺ホルモン様化学物質等があげられる。前記リガンドが存在すると、前記形質転換酵母において、TRαは、前記リガンドおよび前記転写共役因子と複合体を形成する。前記複合体は、前記核内受容体応答配列を認識して結合する。前記複合体の結合により、前記応答配列の下流に存在する前記レポーター遺伝子が発現する。この際、前記レポーター遺伝子の転写は、前記転写共役因子によって、活性化される。前記核内受容体がTRαの場合、前記応答配列は、例えば、薬物応答配列(IR0エレメント)があげられる。
【0120】
前記TRαは、特に制限されず、前述のように、ヒトTRαが好ましい。本発明の形質転換酵母において、前記ヒトTRαを発現させるには、ヒトTRα遺伝子を前記酵母の染色体上に導入することが好ましい。
【0121】
前記ヒトTRα遺伝子は、例えば、下記(i)または(j)のポリヌクレオチドを含むことが好ましい。
(i)配列番号5に記載の塩基配列からなるポリヌクレオチド。
(j)配列番号5に記載の塩基配列において、少なくとも1つの塩基が置換、付加、挿入もしくは欠失した塩基配列からなるポリヌクレオチドであって、ヒトTRαとして機能するタンパク質をコードするポリヌクレオチド。
【0122】
前記(j)のポリヌクレオチドは、例えば、ヒトの核酸を使用してクローニングすることにより得ることができる。前記核酸は、例えば、DNAでもよいし、トータルRNA等のRNAでもよい。前記TRα遺伝子は、例えば、ホスホルアミダイト法を利用して、化学的にDNA合成してもよい。前記クローニングの方法は、特に制限されず、例えば、市販のクローニングキット等を利用して実施できる。
【0123】
前記核内受容体がTRαの場合、前記TRαに対する転写共役因子は、特に制限されず、例えば、SRC1、CBP、P300、AIB、ARA70およびASC2等がある。これらの中で、例えば、SRC1が好ましい。前記転写共役因子は、前述のように動物転写共役因子が好ましく、より好ましくはヒト転写共役因子である。前記転写共役因子遺伝子は、例えば、前述のように、前記第2のプラスミドに挿入し、このプラスミドを形質転換酵母に導入することが好ましい。前記第2のプラスミドは、高コピー型であることが好ましい。
【0124】
前記核内受容体応答配列は、例えば、前述のように、前記第1のプラスミドに挿入し、このプラスミドを形質転換酵母に導入することが好ましい。前記核内受容体応答配列および前記レポーター遺伝子は、前述のように、作動的に連結して、前記第1のプラスミドに挿入することが好ましい。前記核内受容体応答配列、例えば、IR0エレメントは、繰り返し配列として、前記第1のプラスミドに挿入することが好ましい。前記第1のプラスミドは、低コピー型であることが好ましい。
【0125】
つぎに、前記核内受容体がAhRであり、AhR遺伝子が導入された形質転換酵母について説明する。
【0126】
AhRに対するリガンドは、例えば、β−NF(ナフトフラボン)、ダイオキシン、ダイオキシン様化学物質、ポリ塩化ジベンゾフラン(PCDF)、ポリ塩化ビフェニル(PCB)、3−メチルコラントレン、ベンゾピレン、ベンゾイミダゾール、ジベンゾアンスラセン、ペンタクロロフェノール、ジコホール、オクタクロロスチレンおよびこれらの誘導体等があげられる。前記リガンドが存在すると、前記形質転換酵母において、AhRは、前記リガンドおよび前記転写共役因子と複合体を形成する。前記複合体は、前記核内受容体応答配列を認識して結合する。前記複合体の結合により、前記応答配列の下流に存在する前記レポーター遺伝子が発現する。この際、前記レポーター遺伝子の転写は、前記転写共役因子によって、活性化される。前記核内受容体がAhRの場合、前記応答配列は、例えば、異物応答配列(Xenobiotic Responsive Element:XRE)があげられる。
【0127】
前記AhRは、特に制限されず、前述のように、ヒトAhRが好ましい。本発明の形質転換酵母において、前記ヒトAhRを発現させるには、ヒトAhR遺伝子を前記酵母の染色体上に導入することが好ましい。前記転写共役因子は、前述のように動物転写共役因子が好ましく、より好ましくはヒト転写共役因子である。
【0128】
前記ヒトAhR遺伝子は、例えば、下記(k)または(l)のポリヌクレオチドを含むことが好ましい。
(k)配列番号6に記載の塩基配列からなるポリヌクレオチド。
(l)配列番号6に記載の塩基配列において、少なくとも1つの塩基が置換、付加、挿入もしくは欠失した塩基配列からなるポリヌクレオチドであって、ヒトAhRとして機能するタンパク質をコードするポリヌクレオチド。
【0129】
前記(l)のポリヌクレオチドは、例えば、配列番号6の塩基配列に基づいて、ヒトの核酸を使用してクローニングすることにより得ることができる。前記核酸は、例えば、DNAでもよいし、トータルRNA等のRNAでもよい。前記AhR遺伝子は、例えば、ホスホルアミダイト法を利用して、化学的にDNA合成してもよい。前記クローニングの方法は、特に制限されず、例えば、市販のクローニングキット等を利用して実施できる。
【0130】
核内受容体がAhRの場合、前記形質転換酵母は、例えば、さらに、AhR核内移行因子(Arnt)遺伝子を有してもよい。前記形質転換酵母において、前記Arnt遺伝子の導入部位は、特に制限されない。前記Arnt遺伝子は、例えば、前記酵母の染色体上に導入されていることが好ましい。
【0131】
前記Arntは、特に制限されず、前述のように、ヒトArntが好ましい。本発明の形質転換酵母において、前記ヒトArntを発現させるには、ヒトArnt遺伝子を前記酵母の染色体上に導入することが好ましい。
【0132】
前記ヒトArnt遺伝子は、例えば、下記(m)または(n)のポリヌクレオチドを含むことが好ましい。
(m)配列番号7に記載の塩基配列からなるポリヌクレオチド。
(n)配列番号7に記載の塩基配列において、少なくとも1つの塩基が置換、付加、挿入もしくは欠失した塩基配列からなるポリヌクレオチドであって、ヒトArntとして機能するタンパク質をコードするポリヌクレオチド。
【0133】
前記(n)のポリヌクレオチドは、例えば、配列番号7の塩基配列に基づいて、ヒトの核酸を使用してクローニングすることにより得ることができる。前記核酸は、例えば、DNAでもよいし、トータルRNA等のRNAでもよい。前記Arnt遺伝子は、例えば、ホスホルアミダイト法を利用して、化学的にDNA合成してもよい。前記クローニングの方法は、特に制限されず、例えば、市販のクローニングキット等を利用して実施できる。
【0134】
前記核内受容体応答配列は、例えば、前述のように、前記第1のプラスミドに挿入し、このプラスミドを形質転換酵母に導入することが好ましい。前記核内受容体応答配列および前記レポーター遺伝子は、前述のように、作動的に連結して、前記第1のプラスミドに挿入することが好ましい。前記核内受容体応答配列、例えば、XREは、繰り返し配列として、前記第1のプラスミドに挿入することが好ましい。前記第1のプラスミドは、低コピー型であることが好ましい。
【0135】
つぎに、前記核内受容体がERαであり、ERα遺伝子が導入された形質転換酵母について説明する。
【0136】
ERαに対するリガンドは、例えば、エストロゲンまたはエストロゲン様化学物質等があげられる。前記リガンドが存在すると、前記形質転換酵母において、ERαは、前記リガンドおよび前記転写共役因子と複合体を形成する。前記複合体は、前記核内受容体応答配列を認識して結合する。前記複合体の結合により、前記応答配列の下流に存在する前記レポーター遺伝子が発現する。この際、前記レポーター遺伝子の転写は、前記転写共役因子によって、活性化される。前記核内受容体がERαの場合、前記応答配列は、例えば、エストロゲン応答配列(ERE)があげられる。
【0137】
前記ERαは、特に制限されず、前述のように、動物ERαが好ましく、より好ましくはヒトERαである。本発明の形質転換酵母において、前記ヒトERαを発現させるには、例えば、ヒトERα遺伝子を前記酵母の染色体上に導入することが好ましい。
【0138】
前記ヒトERα遺伝子は、例えば、下記(q)または(r)のポリヌクレオチドを含むことが好ましい。
(q)配列番号37に記載の塩基配列からなるポリヌクレオチド。
(r)配列番号37に記載の塩基配列において、少なくとも1つの塩基が置換、付加、挿入もしくは欠失した塩基配列からなるポリヌクレオチドであって、ヒトERαとして機能するタンパク質をコードするポリヌクレオチド。
【0139】
前記(r)のポリヌクレオチドは、前記(q)のポリヌクレオチドとの相同性が、例えば、90%以上であって、好ましくは、93%以上であり、より好ましくは、95%以上であり、さらに好ましくは、98%以上である。前記(r)のポリヌクレオチドにおいて、置換、付加、挿入もしくは欠失した塩基の数は、例えば、前記相同性に対応した数である。
【0140】
前記ERα遺伝子は、例えば、配列番号37の塩基配列に基づいて、ヒトの核酸を使用してクローニングすることにより得ることができる。前記核酸は、例えば、DNAでもよいし、トータルRNA等のRNAでもよい。前記ERα遺伝子は、例えば、ホスホルアミダイト法を利用して、化学的にDNA合成してもよい。前記クローニングの方法は、特に制限されず、例えば、市販のクローニングキット等を利用して実施できる。
【0141】
前記核内受容体がERαの場合、前記ERαに対する転写共役因子は、特に制限されず、例えば、SRC1、CBP、P300、ASC2およびERAP140等がある。これらの中で、例えば、SRC1が好ましい。前記転写共役因子は、前述のように動物転写共役因子が好ましく、より好ましくはヒト転写共役因子である。前記転写共役因子遺伝子は、例えば、前述のように、前記第2のプラスミドに挿入し、このプラスミドを形質転換酵母に導入することが好ましい。前記第2のプラスミドは、高コピー型であることが好ましい。
【0142】
つぎに、前記核内受容体がTRβであり、TRβ遺伝子が導入された形質転換酵母について説明する。
【0143】
TRβに対するリガンドは、例えば、甲状腺ホルモンまたは甲状腺ホルモン様化学物質等があげられる。前記リガンドが存在すると、前記形質転換酵母において、TRβは、前記リガンドおよび前記転写共役因子と複合体を形成する。前記複合体は、前記核内受容体応答配列を認識して結合する。前記複合体の結合により、前記応答配列の下流に存在する前記レポーター遺伝子が発現する。この際、前記レポーター遺伝子の転写は、前記転写共役因子によって、活性化される。前記核内受容体がTRβの場合、前記応答配列は、例えば、薬物応答配列(IR0エレメント)があげられる。
【0144】
前記TRβは、特に制限されず、前述のように、ヒトTRβが好ましい。本発明の形質転換酵母において、前記ヒトTRβを発現させるには、ヒトTRβ遺伝子を前記酵母の染色体上に導入することが好ましい。
【0145】
前記ヒトTRβ遺伝子は、例えば、下記(s)または(t)のポリヌクレオチドを含むことが好ましい。
(s)配列番号38に記載の塩基配列からなるポリヌクレオチド。
(t)配列番号38に記載の塩基配列において、少なくとも1つの塩基が置換、付加、挿入もしくは欠失した塩基配列からなるポリヌクレオチドであって、ヒトTRβとして機能するタンパク質をコードするポリヌクレオチド。
【0146】
前記(t)のポリヌクレオチドは、例えば、ヒトの核酸を使用してクローニングすることにより得ることができる。前記核酸は、例えば、DNAでもよいし、トータルRNA等のRNAでもよい。前記TRβ遺伝子は、例えば、ホスホルアミダイト法を利用して、化学的にDNA合成してもよい。前記クローニングの方法は、特に制限されず、例えば、市販のクローニングキット等を利用して実施できる。
【0147】
前記核内受容体がTRβの場合、前記TRβに対する転写共役因子は、特に制限されず、例えば、SRC1、CBP、P300、AIB、ARA70、ASC2およびERAP140等がある。これらの中で、例えば、SRC1が好ましい。前記転写共役因子は、前述のように動物転写共役因子が好ましく、より好ましくはヒト転写共役因子である。前記転写共役因子遺伝子は、例えば、前述のように、前記第2のプラスミドに挿入し、このプラスミドを形質転換酵母に導入することが好ましい。前記第2のプラスミドは、高コピー型であることが好ましい。
【0148】
前記核内受容体応答配列は、例えば、前述のように、前記第1のプラスミドに挿入し、このプラスミドを形質転換酵母に導入することが好ましい。前記核内受容体応答配列および前記レポーター遺伝子は、前述のように、作動的に連結して、前記第1のプラスミドに挿入することが好ましい。前記核内受容体応答配列、例えば、IR0エレメントは、繰り返し配列として、前記第1のプラスミドに挿入することが好ましい。前記第1のプラスミドは、低コピー型であることが好ましい。
【0149】
つぎに、前記核内受容体がPXR−1であり、PXR−1遺伝子が導入された形質転換酵母について説明する。
【0150】
PXR−1に対するリガンドは、例えば、リファンピシンまたはリファンピシン様化学物質等があげられる。前記リガンドが存在すると、前記形質転換酵母において、PXR−1は、前記リガンドおよび前記転写共役因子と複合体を形成する。前記複合体は、前記核内受容体応答配列を認識して結合する。前記複合体の結合により、前記応答配列の下流に存在する前記レポーター遺伝子が発現する。この際、前記レポーター遺伝子の転写は、前記転写共役因子によって、活性化される。前記核内受容体がPXR−1の場合、前記応答配列は、例えば、薬物応答配列(DR−3)があげられる。
【0151】
前記PXR−1は、特に制限されず、前述のように、動物PXR−1が好ましく、より好ましくはヒトPXR−1である。本発明の形質転換酵母において、前記ヒトPXR−1を発現させるには、例えば、ヒトPXR−1遺伝子を前記酵母の染色体上に導入することが好ましい。
【0152】
前記ヒトPXR−1遺伝子は、例えば、下記(u)または(v)のポリヌクレオチドを含むことが好ましい。
(u)配列番号39に記載の塩基配列からなるポリヌクレオチド。
(v)配列番号39に記載の塩基配列において、少なくとも1つの塩基が置換、付加、挿入もしくは欠失した塩基配列からなるポリヌクレオチドであって、ヒトPXR−1として機能するタンパク質をコードするポリヌクレオチド。
【0153】
前記(v)のポリヌクレオチドは、前記(u)のポリヌクレオチドとの相同性が、例えば、90%以上であって、好ましくは、93%以上であり、より好ましくは、95%以上であり、さらに好ましくは、98%以上である。前記(v)のポリヌクレオチドにおいて、置換、付加、挿入もしくは欠失した塩基の数は、例えば、前記相同性に対応した数である。
【0154】
前記PXR−1遺伝子は、例えば、配列番号39の塩基配列に基づいて、ヒトの核酸を使用してクローニングすることにより得ることができる。前記核酸は、例えば、DNAでもよいし、トータルRNA等のRNAでもよい。前記PXR−1遺伝子は、例えば、ホスホルアミダイト法を利用して、化学的にDNA合成してもよい。前記クローニングの方法は、特に制限されず、例えば、市販のクローニングキット等を利用して実施できる。
【0155】
前記核内受容体がPXR−1の場合、前記PXR−1に対する前記転写共役因子は、特に制限されず、例えば、CBPおよびP300等がある。前記転写共役因子は、前述のように動物転写共役因子が好ましく、より好ましくはヒト転写共役因子である。前記転写共役因子遺伝子は、例えば、前述のように、前記第2のプラスミドに挿入し、このプラスミドを形質転換酵母に導入することが好ましい。前記第2のプラスミドは、高コピー型であることが好ましい。
【0156】
前記核内受容体応答配列は、例えば、前述のように、前記第1のプラスミドに挿入し、このプラスミドを形質転換酵母に導入することが好ましい。前記核内受容体応答配列および前記レポーター遺伝子は、前述のように、作動的に連結して、前記第1のプラスミドに挿入することが好ましい。前記核内受容体応答配列、例えば、DR−3は、繰り返し配列として、前記第1のプラスミドに挿入することが好ましい。前記第1のプラスミドは、低コピー型であることが好ましい。
【0157】
つぎに、前記核内受容体がPRであり、PR遺伝子が導入された形質転換酵母について説明する。
【0158】
PRに対するリガンドは、例えば、プロゲステロンまたプロゲステロン様化学物質等があげられる。前記リガンドが存在すると、前記形質転換酵母において、PRは、前記リガンドおよび前記転写共役因子と複合体を形成する。前記複合体は、前記核内受容体応答配列を認識して結合する。前記複合体の結合により、前記応答配列の下流に存在する前記レポーター遺伝子が発現する。この際、前記レポーター遺伝子の転写は、前記転写共役因子によって、活性化される。前記核内受容体がPRの場合、前記応答配列は、例えば、グルココルチコイド応答配列(GRE)があげられる。
【0159】
前記PRは、特に制限されず、前述のように、ヒトPRが好ましい。本発明の形質転換酵母において、前記ヒトPRを発現させるには、ヒトPR遺伝子を前記酵母の染色体上に導入することが好ましい。
【0160】
前記ヒトPR遺伝子は、例えば、下記(w)または(x)のポリヌクレオチドを含むことが好ましい。
(w)配列番号40に記載の塩基配列からなるポリヌクレオチド。
(x)配列番号40に記載の塩基配列において、少なくとも1つの塩基が置換、付加、挿入もしくは欠失した塩基配列からなるポリヌクレオチドであって、ヒトPRとして機能するタンパク質をコードするポリヌクレオチド。
【0161】
前記(x)のポリヌクレオチドは、前記(w)のポリヌクレオチドとの相同性が、例えば、90%以上であって、好ましくは、93%以上であり、より好ましくは、95%以上であり、さらに好ましくは、98%以上である。前記(x)のポリヌクレオチドにおいて、置換、付加、挿入もしくは欠失した塩基の数は、例えば、前記相同性に対応した数である。
【0162】
前記PR遺伝子は、例えば、配列番号40の塩基配列に基づいて、ヒトの核酸を使用して、クローニングすることにより得ることができる。前記核酸は、例えば、DNAでもよいし、トータルRNA等のRNAでもよい。前記PR遺伝子は、例えば、ホスホルアミダイト(phosphoramidite)法を利用して、化学的にDNA合成してもよい。前記クローニングの方法は、特に制限されず、例えば、市販のクローニングキット等を利用して実施できる。
【0163】
前記核内受容体がPRの場合、前記PRに対する前記転写共役因子は、特に制限されず、例えば、CBPおよびP300等がある。前記転写共役因子は、前述のように動物転写共役因子が好ましく、より好ましくはヒト転写共役因子である。前記転写共役因子遺伝子は、例えば、前述のように、前記第2のプラスミドに挿入し、このプラスミドを形質転換酵母に導入することが好ましい。前記第2のプラスミドは、高コピー型であることが好ましい。
【0164】
前記核内受容体応答配列は、例えば、前述のように、前記第1のプラスミドに挿入し、このプラスミドを形質転換酵母に導入することが好ましい。前記核内受容体応答配列および前記レポーター遺伝子は、前述のように、作動的に連結して、前記第1のプラスミドに挿入することが好ましい。前記核内受容体応答配列、例えば、GREは、繰り返し配列として、前記第1のプラスミドに挿入することが好ましい。前記第1のプラスミドは、低コピー型であることが好ましい。
【0165】
つぎに、前記核内受容体がMRであり、MR遺伝子が導入された形質転換酵母について説明する。
【0166】
MRに対するリガンドは、例えば、アルドステロンまたアルドステロン様化学物質等があげられる。前記リガンドが存在すると、前記形質転換酵母において、MRは、前記リガンドおよび前記転写共役因子と複合体を形成する。前記複合体は、前記核内受容体応答配列を認識して結合する。前記複合体の結合により、前記応答配列の下流に存在する前記レポーター遺伝子が発現する。この際、前記レポーター遺伝子の転写は、前記転写共役因子によって、活性化される。前記核内受容体がMRの場合、前記応答配列は、例えば、グルココルチコイド応答配列(GRE)があげられる。
【0167】
前記MRは、特に制限されず、前述のように、ヒトMRが好ましい。本発明の形質転換酵母において、前記ヒトMRを発現させるには、ヒトMR遺伝子を前記酵母の染色体上に導入することが好ましい。
【0168】
前記ヒトMR遺伝子は、例えば、下記(y)または(z)のポリヌクレオチドを含むことが好ましい。
(y)配列番号41に記載の塩基配列からなるポリヌクレオチド。
(z)配列番号41に記載の塩基配列において、少なくとも1つの塩基が置換、付加、挿入もしくは欠失した塩基配列からなるポリヌクレオチドであって、ヒトMRとして機能するタンパク質をコードするポリヌクレオチド。
【0169】
前記(z)のポリヌクレオチドは、前記(y)のポリヌクレオチドとの相同性が、例えば、90%以上であって、好ましくは、93%以上であり、より好ましくは、95%以上であり、さらに好ましくは、98%以上である。前記(z)のポリヌクレオチドにおいて、置換、付加、挿入もしくは欠失した塩基の数は、例えば、前記相同性に対応した数である。
【0170】
前記MR遺伝子は、例えば、配列番号41の塩基配列に基づいて、ヒトの核酸を使用して、クローニングすることにより得ることができる。前記核酸は、例えば、DNAでもよいし、トータルRNA等のRNAでもよい。前記MR遺伝子は、例えば、ホスホルアミダイト(phosphoramidite)法を利用して、化学的にDNA合成してもよい。前記クローニングの方法は、特に制限されず、例えば、市販のクローニングキット等を利用して実施できる。
【0171】
前記核内受容体がMRの場合、前記MRに対する前記転写共役因子は、特に制限されず、例えば、CBPおよびP300等がある。前記転写共役因子は、前述のように動物転写共役因子が好ましく、より好ましくはヒト転写共役因子である。前記転写共役因子遺伝子は、例えば、前述のように、前記第2のプラスミドに挿入し、このプラスミドを形質転換酵母に導入することが好ましい。前記第2のプラスミドは、高コピー型であることが好ましい。
【0172】
前記核内受容体応答配列は、例えば、前述のように、前記第1のプラスミドに挿入し、このプラスミドを形質転換酵母に導入することが好ましい。前記核内受容体応答配列および前記レポーター遺伝子は、前述のように、作動的に連結して、前記第1のプラスミドに挿入することが好ましい。前記核内受容体応答配列、例えば、GREは、繰り返し配列として、前記第1のプラスミドに挿入することが好ましい。前記第1のプラスミドは、低コピー型であることが好ましい。
【0173】
前記転写共役因子遺伝子の一例として、前記ヒトSRC1遺伝子を以下に示す。前記ヒトSRC1遺伝子は、例えば、下記(o)または(p)のポリヌクレオチドを含むことが好ましい。
(o)配列番号8に記載の塩基配列からなるポリヌクレオチド。
(p)配列番号8に記載の塩基配列において、少なくとも1つの塩基が置換、付加、挿入もしくは欠失した塩基配列からなるポリヌクレオチドであって、ヒトSRC1として機能するタンパク質をコードするポリヌクレオチド。
【0174】
前記(p)のポリヌクレオチドは、前記(o)のポリヌクレオチドとの相同性が、例えば、90%以上であって、好ましくは、93%以上であり、より好ましくは、95%以上であり、さらに好ましくは、98%以上である。前記(p)のポリヌクレオチドにおいて、置換、付加、挿入もしくは欠失した塩基の数は、例えば、前記相同性に対応した数である。
【0175】
本発明の形質転換酵母の製造方法は、特に制限されない。本発明の形質転換酵母は、例えば、宿主となる酵母からの前記コード遺伝子の欠失、および、前記酵母への前記各種遺伝子の導入等により、製造できる。
【0176】
前記宿主となる酵母は、特に制限されず、例えば、出芽酵母、分裂酵母、糸状酵母等があり、出芽酵母(Saccharomyces cerevisiae)が好ましい。
【0177】
前記酵母から、前記細胞壁タンパク質のコード遺伝子および前記排出ポンプタンパク質のコード遺伝子の少なくとも一方を欠失させる方法は、特に制限されず、公知の方法が採用できる。前記コード遺伝子は、例えば、cre−loxPシステムを利用して、欠失できる。
【0178】
前記酵母内に、前記核内受容体遺伝子を導入する方法は、特に制限されず、公知の遺伝子導入方法が採用できる。前記遺伝子導入方法は、例えば、酢酸リチウム法、リン酸カルシウム法、リポソームを用いた方法、エレクトロポレーション法、ウイルスベクターを用いる方法、マイクロピペットインジェクション法等があげられる。本発明において、前記核内受容体遺伝子の導入は、例えば、前記核内受容体に対するリガンドの分析に用いることが可能であればよい。このため、前記導入は、例えば、一過性型の導入、宿主である酵母の染色体上への組込み型の導入、または自律複製および分配が可能な人工染色体型もしくはプラスミド型の導入でもよい。中でも、例えば、取扱い、保存の容易性、ならびにリガンドの分析の迅速性、正確性および簡便性から、前述のように、宿主である酵母の染色体上への遺伝子導入が好ましい。
【0179】
前記酵母内に導入する前記核内受容体遺伝子は、例えば、酵母内で恒常的または任意に発現するように、必要な調節配列と作動的に連結されていることが好ましい。前記調節配列とは、例えば、宿主細胞すなわち酵母内において、作動的に連結された前記遺伝子の発現に必要な塩基配列である。真核細胞に適した前記調節配列は、特に制限されず、例えば、プロモーター、ポリアデニル化シグナル、エンハンサー等があげられる。本発明において、「作動的に連結」とは、例えば、各構成要素が機能を果たすことができるように並置していることを意味する。
【0180】
本発明において、前記核内受容体および前記リガンドの複合体を検出するためのレポーター遺伝子は、例えば、β−ガラクトシダーゼ遺伝子が好ましい。前記β−ガラクトシダーゼ遺伝子は、例えば、その上流に、前記複合体が認識して結合する前記応答配列と作動的に結合している。前記応答配列は、例えば、転写調節配列ともいう。前記応答配列は、例えば、前記核内受容体遺伝子の種類により適宜決定される。前記核内受容体が、AR、GR、PRおよびMRの場合、前記応答配列は、例えば、GREであり、RXRαの場合、前記応答配列は、例えば、DR1エレメントであり、ERβおよびERαの場合、前記応答配列は、例えば、EREであり、TRαおよびTRβの場合、前記応答配列は、例えば、IR0エレメントであり、AhRの場合、前記応答配列は、例えば、XREであり、PXR−1の場合は、前記応答配列は、DR−3である。前記応答配列および前記レポーター遺伝子(例えば、β−ガラクトシダーゼ遺伝子)は、前述のように、第1のプラスミドに組み込んで、酵母に導入することが好ましい。前記レポーター遺伝子は、例えば、β−ガラクトシダーゼ遺伝子に限定されず、その他、ルシフェラーゼ遺伝子、蛍光タンパク質遺伝子、β−グルクロニダーゼ遺伝子等が使用できる。
【0181】
前記転写共役因子遺伝子は、例えば、前記レポーター遺伝子を組み込んだプラスミド(第1のプラスミド)とは別のプラスミド(第2のプラスミド)に組み込んで、酵母に導入することが好ましい。
【0182】
つぎに、本発明の形質転換酵母を用いて、検体に含まれる核内受容体リガンドを分析する方法の一例を示す。本例は、前記形質転換酵母として、前記マンナン結合タンパク質のコード遺伝子と前記排出タンパク質のコード遺伝子の両方を欠失し、且つ、前記核内受容体遺伝子、前記転写共役因子遺伝子、前記核内受容体応答配列および前記レポーター遺伝子としてβ−ガラクトシダーゼ遺伝子が導入されたものの使用を例示する。本発明は、これらの例には制限されない。
【0183】
まず、前記形質転換酵母を準備する。前記形質転換酵母は、例えば、グリセロールストックを調製することが好ましい。前記グリセロールストックの調製に使用する培地は、特に制限されず、例えば、窒素源、炭素源、アミノ酸、核酸、ビタミン類等を含む培地があげられる。前記グリセロールストックの調製に使用する培地として、組成の一例を、下記表2に示す。
【0184】
【表2】

【0185】
前記グリセロールストックの調製は、例えば、以下のように前記形質転換酵母を培養することで行える。前記形質転換酵母として、前記培地で継続的に培養された状態の前記形質転換酵母を使用する場合、例えば、前記継続培養後の培養液を50μL分取し、前記表2に示す培地5000μL中に加え、30℃で12〜24時間程度振とう培養する。また、前記形質転換酵母として、凍結乾燥菌体を使用する場合、例えば、前記凍結乾燥菌体を、YPD培地等の栄養培地を加え、30℃で24時間培養し、その培養液を50μL分取し、前記表2に示す培地5000μLに加え、30℃で12〜24時間程度振とう培養する。
【0186】
前記培養によって菌体を十分増殖させた後、得られた培養液から、10倍濃縮グリセロールストック液を作製する。前記グリセロールストック液の組成は、例えば、培養液80%およびグリセロール20%を含む。前記グリセロールストック液は、例えば、−80℃での保存も可能である。
【0187】
つぎに、前記形質転換酵母を、被検物質の存在下で、本培養する。この際、前述のように調製した前記グリセロールストック液を使用することが好ましい。
【0188】
前記本培養に使用する培地は、特に制限されず、例えば、前記表2に示す培地であって、前記炭素源として、ガラクトースおよびグルコースを含むものを使用する。ガラクトースとグルコースの比率は、特に制限されず、ガラクトースおよびグルコースの合計重量に対するグルコースの重量割合が、例えば、0を超え60重量%以下、好ましくは、0を超え40重量%以下、より好ましくは、10〜30重量%の範囲である。このように、前記培地にガラクトースおよびグルコースを添加した場合、本培養において、前記形質転換酵母の増殖をより促進できる。このため、例えば、より短時間の本培養で、前記被験物質を高感度かつ高信頼性で分析可能である。
【0189】
前記本培養は、前述のように、前記培地中に、化学物質等の被験物質を添加して行う。前記培地への前記被検物質の添加方法は、特に制限されず、例えば、直接添加してもよいし、溶媒に混合、溶解または懸濁してから添加してもよい。前記被験物質が固体の場合、例えば、前記被検物質を溶媒と混合してから、前記培地に混合することが好ましい。前記溶媒は、特に制限されず、例えば、前記形質転換酵母に対して毒性が低いまたは毒性を示さないものが好ましく、ジメチルスルホキシド(DMSO)等が例示できる。
【0190】
前記本培養の条件は、特に制限されず、温度は、例えば、28〜30℃であり、前記時間は、例えば、10〜48時間、好ましくは、15〜36時間、より好ましくは18〜24時間である。前記本培養は、例えば、振とう培養でもよいし、静置培養でもよい。
【0191】
そして、前記本培養後の前記形質転換酵母を溶菌させる。前記溶菌の方法は、特に制限されず、例えば、公知の手法により行うことができる。前記溶菌は、例えば、溶菌液として、界面活性剤を含む緩衝液を使用して、行うことができる。前記界面活性剤は、特に制限されず、例えば、サルコシル(N−Lauroylsarcosine sodium salt)があげられる。前記緩衝液は、特に制限されず、例えば、Zバッファーがあげられる。前記溶菌液として、組成の一例を以下に示す。
【0192】
【表3】

【0193】
つぎに、前記溶菌後の溶菌液について、産生されたβ−ガラクトシダーゼの活性を測定する。β−ガラクトシダーゼ活性は、例えば、発色試薬と反応させ、その発色程度を、例えば、吸光度等として測定すればよい。前記発色試薬は、特に制限されず、ONPG(オルソニトロフェニルガラクトピラノシド、o−ニトロフェニル−β−D−ガラクトピラノシド)、CPRG(クロロフェノールレッドガラクトピラノシド)等の公知の発色基質が使用できる。
【0194】
活性測定において、予め、標準物質を用いて、検量線を作成しておくことが好ましい。前記検量線は、例えば、被験物質の測定と同じ条件で作成することが好ましく、被検物質の測定と同時に測定を行い、その結果に基づいて作成することが好ましい。活性測定においては、例えば、用量作用関係の範囲内に納まるように、被験物質を適宜希釈することが好ましい。このような分析方法によれば、例えば、吸光度を測定するだけでよく、簡便かつ迅速に被検物質を分析できる。
【0195】
<分析方法>
本発明の分析方法は、検体に含まれる核内受容体リガンドを分析するための方法であって、検体を含む培地中で、前記本発明の形質転換酵母を培養する培養工程と、
前記培養工程の後、前記培地中に産生された前記レポーター遺伝子の発現産物を測定する測定工程を含むことを特徴とする。
【0196】
本発明の分析方法は、前記本発明の形質転換酵母を使用することが特徴であって、その他の工程および条件等は、何ら制限されない。本発明の分析方法は、例えば、前記本発明の形質転換酵母の説明において述べた方法により実施できる。
【0197】
本発明において、分析は、例えば、前記リガンドの検出、定性、定量のいずれであってもよい。
【0198】
<分析キット>
本発明の分析キットは、本発明の分析方法を簡単に実施するためのキットである。本発明の分析キットは、前述のように、培地、本発明の前記形質転換酵母および発色試薬を含むキットである。前記発色試薬は、例えば、前述のように、ONPG、CPRG等の発色基質があげられる。さらに、本発明の分析キットは、検量線作成のための標準物質等を含んでいてもよい。前記形質転換酵母は、凍結乾燥させて粉末状にしてもよい。本発明の分析キットは、さらに、使用説明書を含んでもよい。
【0199】
<スクリーニング方法およびスクリーニングキット>
本発明の分析方法および分析キットは、例えば、スクリーニング方法およびスクリーニングキットということもできる。本発明によれば、例えば、検体中に含まれる未知物質が、どのような核内受容体に結合するのかを、簡易にスクリーニングできる。本発明のスクリーニング方法は、例えば、各核内受容体についての本発明の形質転換酵母を、複数種類同時に使用するのが好ましい。
【実施例】
【0200】
つぎに、本発明の実施例について、説明する。本発明は、以下の実施例に限定されるものではない。
【0201】
〔実施例1〕
本実施例では、以下の手順により、CWP1遺伝子およびPDR5遺伝子を欠失させた二重欠失酵母を作製し、ヒトGR遺伝子を組み込んだ形質転換酵母を作製した。
【0202】
(1)遺伝子欠失酵母の作製
プラスミドpUG6は、loxP配列で挟まれたG418耐性遺伝子を有し、前記G418耐性遺伝子が、菌類TEFプロモーターおよびターミネーターで制御されたプラスミドである(Nucleic Acids Res. (1996) 24、2519−2524)。前記プラスミドpUG6を鋳型として、下記プライマーSH005、SH006、SH013およびSH014を用いて、loxP−KanMX−loxP領域を、PCRにより増幅した。具体的には、CWP1遺伝子の近傍配列が付加されたloxP−KanMX−loxP(以下、CWP1近傍配列付加loxP−KanMX−loxPという)およびPDR5遺伝子の近傍配列が付加されたloxP−KanMX−loxP(以下、PDR5近傍配列付加loxP−KanMX−loxPという)を増幅した。前記各プライマーは、それぞれ、CWP1遺伝子またはPDR5遺伝子の近傍配列を含む配列とした。下記配列において、大文字の領域は、CWP1遺伝子またはPDR5遺伝子の近傍配列の相補配列であり、小文字の領域は、loxP−KanMX−loxPの相補配列である。
【0203】
(CWP1近傍配列付加loxP−KanMX−loxP用プライマー)
SH005(配列番号9)
5’−CTGAAGTAAAATATCCCGTAACAAACTAATAAATACTACGAcagctgaagcttcgtacgc−3’
SH006(配列番号10)
5’−TATTGAAGGAAATAAAACATGCAGGTTTTGTTCTCGTACcataggccactagtggatctg−3’
(PDR5近傍配列付加loxP−KanMX−loxP用プライマー)
SH013(配列番号11)
5’−TAAGTTTTCGTATCCGCTCGTTCGAAAGACTTTAGACAAAAcagctgaagcttcgtacgc−3’
SH014(配列番号12)
5’−AAAGTCCATCTTGGTAAGTTTCTTTTCTTAACCAAATTCcataggccactagtggatctg−3’
【0204】
【表4】

【0205】
(PCR条件1)
94℃で2分処理して、鋳型を熱変成した後、94℃で30秒、50℃で10秒および68℃で2分を1サイクルとして、35サイクル実施した。
【0206】
そして、PCR後、増幅したCWP1近傍配列付加loxP−KanMX−loxPまたはPDR5近傍配列付加loxP−KanMX−loxPを、酵母(Saccharomyces cerevisiae)W303a株に、酢酸リチウム法にて導入した。この際、形質転換酵母の選択培地は、YPD培地に、200μg/mLとなるようにG418(Geneticin、GIBCO BRL社製)を添加した、G418含有YPD培地を使用した。
【0207】
ここで、前記配列の導入により、前記形質転換酵母が、CWP1遺伝子またはPDR5遺伝子を欠失しているかを確認した。前記各遺伝子の欠失の確認は、前記形質転換酵母のDNAを鋳型として、下記プライマーを用いて、PCRにより行った。下記プライマーを用いたPCRによって、増幅が確認された場合は、CWP1遺伝子またはPDR5遺伝子を欠失していると判断した。
【0208】
(5’CWP1欠失の検証用プライマー)
SH007(配列番号13)
5’−gtgctcgaccttctatcccgt−3’
SH018(配列番号14)
5’−ctgcgcacgtcaagactg−3’
(3’CWP1欠失の検証用プライマー)
SH017(配列番号15)
5’−cctcgacatcatctgccc−3’
SH008(配列番号16)
5’−cttgtattctcctatcagcctgg−3’
(5’PDR5欠失の検証用プライマー)
SH015(配列番号17)
5’−ggactgaaacttaagactgccc−3’
SH018(配列番号14)
5’−ctgcgcacgtcaagactg−3’
(3’PDR5欠失の検証用プライマー)
SH017(配列番号15)
5’−cctcgacatcatctgccc−3’
SH016(配列番号18)
5’−gcaaaagatccgattatacttacc−3’
【0209】
【表5】

【0210】
(PCR条件2)
94℃で2分処理して、鋳型を熱変成した後、94℃で30秒、50℃で10秒および68℃で1分を1サイクルとして、35サイクル実施した。
【0211】
つづいて、Nucleic Acids Res. (1996) 24、2519−2524に準じて、プラスミドpSH47を作製した。前記プラスミドpSH47は、部位特異的組換え酵素Cre遺伝子およびウラシル選択マーカーURA3遺伝子を有し、これらの遺伝子が、Gal1−10プロモーターおよびCYC1ターミネーターで制御されたプラスミドである。前記プラスミドpSH47を、前記形質転換酵母に、酢酸リチウム法によって導入した。この際、形質転換酵母の選択培地は、ウラシル無添加のグルコース培地を使用した。前記ウラシル無添加グルコース培地は、前記表2の培地組成において、炭素源としてグルコースを含み、前記ドロップアウトパウダーとして、下記表6の組成のドロップアウトパウダーを添加した。
【0212】
【表6】

【0213】
得られたウラシル非要求性の形質転換酵母を、ウラシル無添加のグルコース液体培地を用いて、30℃で一晩、前培養を行った。前培養した前記形質転換酵母を遠心分離によって集菌した後、滅菌水で2回洗浄した。培地を、ウラシル無添加のガラクトース液体培地に代え、前記洗浄後の前記形質転換酵母を、30℃で4時間培養した。培養後、適宜希釈した菌液を、YPD寒天培地上に播種した。そして、コロニー形成後、レプリカ法によって、G418感受性となったコロニーを選抜した。前記ウラシル無添加ガラクトース培地は、前記表2の培地組成において、炭素源としてガラクトースを含み、前記ドロップアウトパウダーとして、前記表6の組成のドロップアウトパウダーを添加した。
【0214】
ここで、Cre遺伝子によってG418耐性遺伝子が切り出され、最終的に、CWP1遺伝子またはPDR5遺伝子のORFが、それぞれloxP配列に置換されたことを確認した。この確認は、前記G418感受性のコロニーのDNAを鋳型とし、前記プライマーSH007(配列番号13)、SH008(配列番号16)、SH015(配列番号17)およびSH016(配列番号18)を用いて、PCRにより行った。前記PCRは、前記PCR反応液2を使用し、前記PCR条件2で行った。前記プライマーを用いたPCRによって、増幅が確認された場合は、CWP1遺伝子またはPDR5遺伝子を欠失していると判断した。
【0215】
以上のようにして、CWP1遺伝子およびG418耐性遺伝子を欠失する遺伝子欠失酵母株、PDR5遺伝子およびG418耐性遺伝子を欠失する遺伝子欠失酵母株を得た。そして、最終的に、プラスミドpSH47が脱落して、再びウラシル要求性となった一重欠失株を、遺伝子欠失酵母株として、以下の実験に用いた。
【0216】
さらに、前記CWP1遺伝子およびG418耐性遺伝子を欠失する遺伝子欠失酵母株または前記PDR5遺伝子およびG418耐性遺伝子を欠失する遺伝子欠失酵母株から、前述と同様の操作により、二重欠失株として、前記PDR5遺伝子および前記CWP1遺伝子の両方を欠失する遺伝子欠失酵母を作製した。すなわち、前記PDR5遺伝子の欠失株に対しては、さらに、前述と同様に、CWP1遺伝子欠失の操作を行い、PDR5遺伝子およびCWP1遺伝子を欠失する遺伝子欠失株を得た。また、前記CWP1遺伝子欠失株に対しては、さらに、前述と同様に、PDR5遺伝子欠失の操作を行い、PDR5遺伝子およびCWP1遺伝子を欠失する遺伝子欠失株を得た。そして、最終的に、プラスミドpSH47が脱落して、再びウラシル要求性となった二重欠失株を、遺伝子欠失酵母株として、以下の実験に用いた。
【0217】
(2)レポータープラスミドの作製
Wolf et al. ; Biotechniques 20, 568−573 (1996)に準じて、pRW95−3を作製した。前記プラスミドpRW95−3は、β−ガラクトシダーゼ遺伝子を有するプラスミドである。
【0218】
GRに応答する配列としてGRE配列を使用した。前記GRE配列を含む下記オリゴDNA(配列番号19)およびそれに相補なオリゴDNA(配列番号20)を作製した。これらのオリゴDNAをアニーリングした。アニーリングは、94℃で1分間を1サイクルで実施した。アニーリング後、GRE配列が連続して8個アニーリングしたものを精製して、pRW95−3のBgl IIサイトに挿入した。GRE配列が連続して8個挿入されたプラスミドを、GRレポータープラスミドとした。
【0219】
(GRE配列)
GREcsfBg(配列番号19)
5’−agatctttgagaacaaactgttcttaaat−3’
GREcsrBc(配列番号20)
3’−aaactcttgtttgacaagaatttactag−5’
【0220】
(3)動物核内受容体発現プラスミドの作製
GR遺伝子のcDNAのORFを、ヒト精巣cDNA(クロンテック社製)を鋳型として、下記プライマーを用いたPCRにより増幅した。PCRは、下記PCR反応液3を用いて、下記PCR条件3により行った。
【0221】
(GR用プライマー)
GRfRbBm(配列番号21)
5’−tcgaggatccaacaaaatggactccaaagaatcattaact−3’
GRrXh(配列番号22)
5’−attcttctcgaggcagtcacttttgatgaaac−3’
【0222】
【表7】

【0223】
(PCR条件3)
94℃で40秒、58℃で20秒、68℃で3分のサイクルを1サイクルとして、40サイクル実施した。
【0224】
つぎに、増幅させたGR遺伝子のcDNAを、制限酵素BamHIおよびXhoIで切断した。切断した前記cDNAを、制限酵素BamHIおよびSalI切断した前記プラスミドpUdp6に挿入した。プラスミドpUdp6は、両方向プロモーター領域gal1、gal10およびgal10の下流にCYCターミネーターを持ち、gal1の下流にADHターミネーターを持ち、さらにウラシル選択マーカーURA3遺伝子を持つプラスミドである。前記切断したGR遺伝子のcDNAは、前記プラスミドpUdp6において、前記GAL10プロモーターの下流に挿入した。これによって、前記核内受容体遺伝子を有し、その上流にプロモーターを有するGR発現プラスミドpUdp6GRを得た。
【0225】
(4)動物転写共役因子発現プラスミドの作製
SRC1遺伝子のcDNAのORFを、ヒト精巣cDNA(クロンテック社製)を鋳型として、下記プライマーを用いたPCRにより増幅した。PCRは、下記PCR反応液4を用いて、下記PCR条件4により行った。
【0226】
(SRC1用プライマー)
hSRC1bgF(配列番号23)
5’−tggaactcaagatttgaccatatc−3’
hSRC1xhR(配列番号24)
5’−gagcattcctctagtctgtagtc−3’
【0227】
【表8】

【0228】
(PCR条件4)
94℃で40秒、56℃で20秒、68℃で5分のサイクルを1サイクルとして、40サイクル実施した。
【0229】
つぎに、増幅したSRC1遺伝子のcDNAを精製した。この精製cDNAを鋳型として、さらに、下記プライマーを用いたPCRにより、前記cDNAに制限酵素サイトを付加した。PCRは、前記PCR反応液4を用いて、下記PCR条件5により行った。
【0230】
(PCR条件5)
94℃で40秒、56℃で20秒、68℃で5分のサイクルを1サイクルとして、20サイクル実施した。
【0231】
(付加用プライマー)
SRC−1eFbg2(配列番号25)
5’−caaagaagatctcccaggtgtgaag−3’
SRC−1eRxh2(配列番号26)
5’−agggccctcgagactctagtctgtag−3’
【0232】
増幅した前記cDNAを、制限酵素BglIIおよびXhoIで切断した後、プラスミドpESC−Leuのgal1プロモーター領域の下流に挿入した。得られたプラスミドを、動物転写因子発現プラスミドpESC−Leu−hSRC1とした。
【0233】
(5)形質転換酵母の作製
前記GR発現プラスミドpUdp6GRを、制限酵素EcoRVで処理し、直鎖状とした。前記直鎖状の前記GR発現プラスミドpUdp6GRを、以下に示すように、酢酸リチウム法により、宿主となる酵母へ導入し、さらに、染色体上への組込みを行った。宿主として、前記(1)で作製したPDR5遺伝子を欠失する遺伝子欠失酵母株、PDR5遺伝子およびCWP1遺伝子を欠失する遺伝子欠失酵母株を使用した。
【0234】
まず、前記PDR5遺伝子を欠失する遺伝子欠失酵母株、PDR5遺伝子およびCWP1遺伝子を欠失する遺伝子欠失酵母株を、YPD培地中で、OD660が1〜2になるまで、30℃で培養した。培養した菌体を、ソリューションAで洗浄した後、OD660が150となるように、前記ソリューションAに再懸濁した。前記ソリューションAの組成は、0.1mol/L Lithium acetate、10mmol/L Tris−HCl(pH7.5)、1mmol/L EDTAとした(いずれも最終濃度)。菌体の懸濁液を、1.5mLマイクロチューブに100μLずつ分注して、30℃で1時間インキュベートした。インキュベート後、前記チューブに、前記直鎖状のプラスミドpUdp6GR 5μg、キャリアーDNA(商品名SALMON TESTES DNA for hybridization、SIGMA社製)150μgを合計20μL添加し、さらに、ソリューションB 850μLを添加し、緩やかに混合した。前記ソリューションBは、ソリューションA100mLにポリエチレングリコール4000を混合したものを使用した。
【0235】
つぎに、前記混合液を、30℃で30分インキュベートし、42℃で15分熱処理した後、さらに、10分室温に放置した。そして、5000rpm、1分間の遠心分離により、前記酵母を集菌した。前記酵母を、5〜10mLのYPD培地に懸濁し、30℃で一晩培養した。培養後、前記酵母を集菌し、洗浄した後、0.9%NaCl溶液に懸濁し、懸濁液100μLを、AureobasidinA(0.5g/mL)を含むYPD選択プレートに塗布し、培養した。そして、AureobasidinA耐性株を、gal1プロモーターおよびGR遺伝子のcDNA領域が、染色体上に組込まれた形質転換酵母として選択した。
【0236】
つづいて、前記形質転換酵母に、前記動物転写共役因子発現プラスミドpESC−Leu−hSRC1を導入した。この際、形質転換酵母の選択培地は、以下に示す前培養培地1にトリプトファンを100mg添加した、トリプトファン添加前培養培地を使用した。下記組成において、ドロップアウトパウダーおよび窒素源は、前記表2と同様とした。
【0237】
【表9】

【0238】
つぎに、前記形質転換酵母に、酢酸リチウム法により、前記GRレポータープラスミドを導入した。この際、形質転換酵母の選択培地は、トリプトファン無添加の前記前培養培地を使用した。このようにして、CWP1遺伝子、またはCWP1遺伝子およびPDR5遺伝子を欠失し、レポーター遺伝子を前記GRレポータープラスミドにより保持し、且つSRC1遺伝子を前記プラスミドpESC−Leu−hSRC1として保持し、ゲノムにヒトGR遺伝子を有する、形質転換酵母株を作製した。以下、PDR5遺伝子を欠失する前記形質転換酵母株を、PDR5Δ株、CWP1遺伝子およびPDR遺伝子を欠失する前記形質転換酵母株を、PDR5Δ−CWP1Δ株という。
【0239】
〔実施例2〕
本実施例では、前記実施例1で作製した形質転換酵母を用いて、GRに対するリガンドの分析を行った。比較例は、酵母(Saccharomyces cerevisiae) W 303a株を使用した。
【0240】
(1)形質転換酵母の前培養
前記形質転換酵母を、以下に示す前培養培地2を用いて、30℃で18時間、前培養を行った。その結果、濁度が、Abs595nm=1.0程度となり、前記形質転換酵母の増殖が確認された。下記組成において、ドロップアウトパウダーおよび窒素源は、前記表2と同様とした。
【0241】
【表10】

【0242】
(2)形質転換酵母の本培養
96穴プレートを用い、1ウェルあたり、リガンド溶液1μL、前培養した菌体液(O.D.=1〜1.5)5μLおよび本培養培地100μLを混合し、30℃で18時間、静置培養を行った。前記リガンド溶液は、デキサメサゾン、コルチコステロンまたはヒドロコルチゾンを、所定の濃度となるように、DMSOに溶解して調製した。下記本培養培地のドロップアウドパウダーは、トリプトファンおよびロイシンを未添加とした。下記組成において、ドロップアウトパウダーおよび窒素源は、前記表2と同様とした。
【0243】
【表11】

【0244】
(3)β−ガラクトシダーゼ活性の測定
前記本培養の後、各ウェルから培養液を5μLずつ採取し、新たな96穴プレートの各ウェルに移した。前記各ウェルに、以下の測定試薬 100μLを加えた後、37℃で30分間反応させた。反応後、マイクロプレートリーダーを用いて、前記反応液のβ−ガラクトシダーゼ活性および菌体量を測定した。前記β−ガラクトシダーゼ活性は、生成したo−ニトロフェノールの生成量から算出するため、405nmにおける前記反応液の吸光度を測定した。また、前記菌体量は、595nmにおける前記反応液の吸光度を測定した。各反応液について、405nmの吸光度と595nmの吸光度の比(Abs.405nm/Abs.595nm)を算出した。そして、分析結果は、リガンド無添加の反応液、すなわち、前記リガンド溶液に代えてDMSO 1μLを添加した反応液の比を「1」として、各反応液について誘導率で表わした。
【0245】
【表12】

【0246】
これらの結果を、下記表13、表14および図1に示す。図1において、(A)は、デキサメサゾンに対する結果を示すグラフであり、(B)が、コルチコステロンに対する結果を示すグラフであり、(C)が、ヒドロコルチゾンに対する結果を示すグラフである。前記各グラフにおいて、横軸は、各リガンド濃度(log mol/L)であり、具体的には、0、1.00E−07、5×1E−07、1.00E−06、3.3×1.00E−06、6.6×1.00E−06、1.00E−05におけるプロットであり、縦軸は、前記誘導率である。前記各グラフにおいて、黒三角のプロットが、PDR5Δ−CWP1Δ株の結果であり、黒四角のプロットが、PDR5Δ株の結果であり、黒菱形のプロットが、野生株の結果である。
【0247】
【表13】

【0248】
【表14】

【0249】
前記表13、表14および図1に示すように、野生株は、検出可能なデキサメタゾン濃度が1μmol/L以上であった。これに対して、PDR5Δ株およびPDR5Δ−CWP1Δ株は、デキメサゾン濃度300nmol/Lでβ−ガラクトシダーゼの誘導が確認できた。この結果から、本発明の形質転換酵母によれば、低いリガンド濃度であっても、十分に優れた感度を得られるといえる。また、PDR5Δ株およびPDR5Δ−CWP1Δ株は、所定のデキメサゾン濃度に対して、野生株よりも高い誘導率を示した。具体例として、前記表14に示すように、PDR5Δ株およびPDR5Δ−CWP1Δ株は、それぞれ、所定濃度において、野生株の1.5倍または2.2倍の誘導率を示した。特に、PDR5遺伝子およびCWP1遺伝子の両方を欠失したPDR5Δ−CWP1Δ株は、PDR5Δ株よりも、誘導率をさらに1.5倍向上できた。これらの結果から、本発明の形質転換酵母によれば、所定のリガンド濃度に対して、野生株よりも、さらに優れた応答性を示すといえる。また、前記表13に示すように、EC50は、野生株が、8.3μmol/Lであったのに対して、PDR5Δ株およびPDR5Δ−CWP1Δ株が、500nmol/Lであり、1/16に低減された。
【0250】
前記表13、表14および図1に示すように、PDR5Δ株およびPDR5Δ−CWP1Δ株は、コルチコステロン濃度に対して、野生株よりも高い誘導率を示した。具体例として、前記表14に示すように、PDR5Δ株およびPDR5Δ−CWP1Δ株は、それぞれ、所定のコルチコステロン濃度において、野生株の1.3倍または1.5倍の誘導率を示した。特に、PDR5遺伝子およびCWP1遺伝子の両方を欠失したPDR5Δ−CWP1Δ株は、PDR5Δ株よりも、誘導率をさらに1.2倍向上できた。これらの結果から、本発明の形質転換酵母によれば、所定のリガンド濃度に対して、野生株よりも、さらに優れた応答性を示すといえる。また、前記表13に示すように、EC50は、野生株が、1μmol/Lであったのに対して、PDR5Δ株、PDR5Δ−CWP1Δ株が、500nmol/Lであり、1/2に低減された。
【0251】
前記表13、表14および図1に示すように、野生株は、検出可能なヒドロコルチゾン濃度が1μmol/L以上であった。これに対して、PDR5Δ株およびPDR5Δ−CWP1Δ株は、ヒドロコルチゾン濃度600nmol/Lでβ−ガラクトシダーゼの誘導が確認できた。この結果から、本発明の形質転換酵母によれば、低いリガンド濃度であっても、十分に優れた感度を得られるといえる。また、PDR5Δ株およびPDR5Δ−CWP1Δ株は、所定のヒドロコルチゾン濃度に対して、野生株よりも高い誘導率を示した。具体例として、前記表14に示すように、PDR5Δ株およびPDR5Δ−CWP1Δ株は、それぞれ、所定濃度において、野生株の2.3倍または2.5倍の誘導率を示した。特に、PDR5遺伝子およびCWP1遺伝子の両方を欠失したPDR5Δ−CWP1Δ株は、PDR5Δ株よりも、誘導率をさらに1.1倍向上できた。これらの結果から、本発明の形質転換酵母によれば、所定のリガンド濃度に対して、野生株よりも、さらに優れた応答性を示すといえる。また、前記表13に示すように、EC50は、野生株が、10μmol/Lであったのに対して、PDR5Δ株およびPDR5Δ−CWP1Δ株が、1.5μmol/Lであり、1/7に低減された。
【0252】
このように、PDR5遺伝子および/またはCWP1遺伝子を欠失させることによって、前記形質転換酵母は、GRのリガンドに対して、検出感度および/または検出応答性が改善された。このため、本発明の形質転換酵母は、動物核内受容体に対するリガンドのアッセイに極めて有効といえる。
【0253】
〔実施例3〕
本実施例では、CWP1遺伝子、CWP2遺伝子およびPDR5遺伝子のいずれかを欠失させた二重欠失酵母を作製し、ヒトAhR遺伝子を組み込んだ形質転換酵母を作製した。
【0254】
(1)遺伝子欠失酵母の作製
前記実施例1で作製した、前記CWP1遺伝子を欠失する遺伝子欠失酵母株、前記PDR5遺伝子を欠失する遺伝子欠失酵母株、ならびに、PDR5遺伝子およびCWP1遺伝子を欠失する遺伝子欠失酵母株を使用した。
【0255】
また、以下のようにして、CWP2遺伝子を欠失する遺伝子欠失酵母株、CWP1遺伝子およびCWP2遺伝子を欠失する遺伝子欠失酵母株を作製した。特に示さない限りは、前記実施例1における(1)遺伝子欠失酵母の作製と同様に行った。
【0256】
前記実施例1のプラスミドpUG6を鋳型として、下記プライマーSH009およびSH010を用いて、loxP−KanMX−loxP領域を、PCRにより増幅した。具体的には、CWP2遺伝子の近傍配列が付加されたloxP−KanMX−loxP(以下、CWP2近傍配列付加loxP−KanMX−loxPという)を増幅した。前記各プライマーは、それぞれ、CWP2遺伝子の近傍配列を含む配列とした。下記配列において、大文字の領域は、CWP2の近傍配列の相補配列であり、小文字の領域は、loxP−KanMX−loxPの相補配列である。
【0257】
(CWP2近傍配列付加loxP−KanMX−loxP用プライマー)
SH009(配列番号27)
5’−CAAGAATAAATAACTTCATCACATTCGCTACACACTAACAAcagctgaagcttcgtacgc−3’
SH010(配列番号28)
5’−TACCTAGTAAAACCGAAAATTTTGAAAAAAGCCATATAGcataggccactagtggatctg−3’
【0258】
そして、PCR後、増幅したCWP2近傍配列付加loxP−KanMX−loxPを、酵母(Saccharomyces cerevisiae)W303a株に、酢酸リチウム法にて導入した。この際、形質転換酵母の選択培地は、YPD培地に、200μg/mLとなるようにG418(Geneticin、GIBCO BRL社製)を添加した、G418含有YPD培地を使用した。
【0259】
ここで、前記配列の導入により、前記形質転換酵母が、CWP2遺伝子を欠失しているかを確認した。前記遺伝子の欠失の確認は、前記形質転換酵母のDNAを鋳型として、下記プライマーを用いて、PCRにより行った。下記プライマーを用いたPCRによって、増幅が確認された場合は、CWP2遺伝子を欠失していると判断した。
【0260】
(5’CWP2欠失の検証用プライマー)
SH011(配列番号29)
5’−gctccgaagggcaattccaca−3’
SH018(配列番号14)
5’−ctgcgcacgtcaagactg−3’
(3’CWP2欠失の検証用プライマー)
SH017(配列番号15)
5’−cctcgacatcatctgccc−3’
SH012(配列番号30)
5’−cccaccgtagcacaccaatatc−3’
【0261】
ここで、Cre遺伝子によってG418耐性遺伝子が切り出され、最終的に、CWP2遺伝子のORFが、loxP配列に置換されたことを確認した。この確認は、前記G418感受性のコロニーのDNAを鋳型とし、前記プライマーSH011(配列番号29)、SH012(配列番号30)を用いて、PCRにより行った。前記PCRは、前記PCR反応液2を使用し、前記PCR条件2で行った。前記プライマーを用いたPCRによって、増幅が確認された場合は、CWP2遺伝子を欠失していると判断した。
【0262】
以上のようにして、CWP2遺伝子およびG418耐性遺伝子を欠失する遺伝子欠失酵母株を得た。そして、最終的に、プラスミドpSH47が脱落して、再びウラシル要求性となった一重欠失株を、遺伝子欠失酵母株として、以下の実験に用いた。
【0263】
さらに、前記CWP1遺伝子およびG418耐性遺伝子を欠失する遺伝子欠失酵母株または前記CWP2遺伝子およびG418耐性遺伝子を欠失する遺伝子欠失酵母株から、前述と同様の操作により、二重欠失株として、前記CWP1遺伝子および前記CWP2遺伝子の両方を欠失する遺伝子欠失酵母を作製した。すなわち、前記CWP1遺伝子の欠失株に対しては、さらに、前述と同様に、CWP2遺伝子欠失の操作を行い、CWP1遺伝子およびCWP2遺伝子を欠失する遺伝子欠失株を得た。また、前記CWP2遺伝子欠失株に対しては、さらに、前述と同様に、CWP1遺伝子欠失の操作を行い、CWP1遺伝子およびCWP2遺伝子を欠失する遺伝子欠失株を得た。そして、最終的に、プラスミドpSH47が脱落して、再びウラシル要求性となった二重欠失株を、遺伝子欠失酵母株として、以下の実験に用いた。
【0264】
(2)レポータープラスミドの作製
Wolf et al. ; Biotechniques 20, 568−573 (1996)に準じて、pRW95−3を作製した。前記プラスミドpRW95−3は、β−ガラクトシダーゼ遺伝子を有するプラスミドである。
【0265】
AhRに応答する配列として、XRE配列を使用した。前記XRE配列を含む下記オリゴDNA(配列番号31)およびそれに相補なオリゴDNA(配列番号32)を作製した。これらのオリゴDNAをアニーリングした。アニーリングは、94℃で1分間を1サイクルで実施した。アニーリング後、XRE配列が連続して5個アニーリングしたものを精製して、pRW95−3のBamHI/XmaI部位にサイトに挿入し、レポータープラスミドを作製した。XRE配列が連続して5個挿入されたプラスミドを、AhRレポータープラスミドとした。
(XRE配列)
XREfBm(配列番号31)
5’-atccttgcgtgaca-3’
XREr(配列番号32)
5’-ggattgtcacgcaa-3’
【0266】
(3)動物核内受容体発現プラスミドの作製
AhR遺伝子またはArnt遺伝子のcDNAのORFを、ヒト精巣cDNA(クロンテック社製)を鋳型として、下記プライマーを用いたPCRにより増幅した。PCRは、前記PCR反応液3を用いて、前記PCR条件3により行った。
【0267】
(AhR用プライマー)
AhRfBsiWI(配列番号33)
5’−tcgacgtacgatgaacagcagcagcgccaacatc−3’
AhRrBsiWI(配列番号34)
5’−attccgtacgttacaggaatccactggatgtcaa−3’
(Arnt用プライマー)
ArntfXbaI(配列番号35)
5’−tcgatctagaatggcggcgactactgccaacccc−3’
ArntrSse8387I(配列番号36)
5’−attccctgcaggctattctgaaaaggggggaaacat−3’
【0268】
つぎに、増幅させたAhR遺伝子のcDNAを、制限酵素BsiWIで切断した。切断した前記cDNAを、制限酵素BsiWI切断した前記プラスミドYEpLacGal1、10に挿入した。一方、増幅させたArnt遺伝子のcDNAを、制限酵素XbaIおよびSse8387Iで切断した。そして、AhR遺伝子のcDNAを挿入した前記プラスミドYEpLacGal1、10に、さらに、Arnt遺伝子のcDNAを挿入した。具体的には、切断したArnt遺伝子の前記cDNAを、制限酵素XbaIおよびSse8387Iで切断した前記プラスミドYEpLacGal1、10に挿入した。前記プラスミドYEpLacGal1、10は、両方向プロモーター領域gal1、gal10を持つプラスミドである。前記切断したAhR遺伝子のcDNAは、前記プラスミドYEpLacGal1、10において、Gal1プロモーターの下流に挿入し、前記切断したArnt遺伝子のcDNAは、前記プラスミドYEpLacGal1、10において、Gal10プロモーターの下流に挿入した。これによって、前記核内受容体遺伝子を有し、その上流にプロモーターを有するプラスミドYEpLacAhR/Arntを得た。クローニングには、大腸菌HB101株を使用した。
【0269】
前記プラスミドYEpLacAhR/Arntから、gal1プロモーター領域、gal10プロモーター領域および前記cDNAを含むDNAフラグメントを、制限酵素SacIおよびSalIで切り出し、プラスミドpAUR101のSacIサイトおよびSalIサイトの間に挿入した。得られたプラスミドを、AhR発現プラスミドpAUR101AhR/Arntとした。
【0270】
(4)形質転換酵母の作製
前記遺伝子欠失酵母、前記AhRレポータープラスミド、前記AhR発現プラスミドを使用し、前記動物転写共役因子発現プラスミドを使用しなかった以外は、前記実施例1と同様にして形質転換酵母を作製した。以下、CWP1遺伝子を欠失する前記形質転換酵母株を、CWP1Δ株、CWP2遺伝子を欠失する前記形質転換酵母株を、CWP2Δ株、PDR5遺伝子を欠失する前記形質転換酵母株を、PDR5Δ株、CWP1遺伝子およびCWP2遺伝子を欠失する前記形質転換酵母株を、CWP1Δ−CWP2Δ株、CWP1遺伝子およびPDR5遺伝子を欠失する前記形質転換酵母株を、PDR5Δ−CWP1Δ株という。
【0271】
〔実施例4〕
本実施例では、前記実施例3で作製した形質転換酵母を用いて、AhRに対するリガンドの分析を行った。比較例は、酵母(Saccharomyces cerevisiae) W 303a株を使用した。
【0272】
本実施例では、β−NFを、所定の濃度となるように、DMSOに溶解して調製したリガンド溶液を使用した以外は、前記実施例2と同様にして、誘導率を求めた。
【0273】
これらの結果を、下記表15、表16および図2に示す。図2は、β−NFに対する結果を示すグラフである。前記グラフにおいて、横軸は、各リガンド濃度(μmol/L)であり、具体的には、0、0.0001、0.001、0.01、0.1、1、10、100μmol/Lにおけるプロットであり、縦軸は、前記誘導率である。前記グラフにおいて、黒三角のプロットが、PDR5Δ−CWP1Δ株の結果であり、黒逆三角のプロットが、CWP1Δ−CWP2Δ株の結果であり、黒丸のプロットが、CWP1Δ株の結果であり、黒四角のプロットが、PDR5Δ株の結果であり、白丸のプロットが、CWP2Δ株の結果であり、黒菱形のプロットが、野生株の結果である。
【0274】
【表15】

【0275】
【表16】

【0276】
前記表15、表16および図2に示すように、野生株は、検出可能なβ−NF濃度が100nmol/L以上であった。これに対して、全ての変異株について、β−NF濃度10nmol/Lでβ−ガラクトシダーゼの誘導が確認できた。この結果から、本発明の形質転換酵母によれば、低いリガンド濃度であっても、十分に優れた感度を得ることができる。また、全ての変異株が、検出可能なリガンド濃度において、野生株よりも高い誘導率を示した。具体例として、前記表16に示すように、PDR5Δ株およびPDR5Δ−CWP1Δ株は、それぞれ、野生株の5.3倍または3.5倍の最大誘導率を示した。これらの結果から、本発明の形質転換酵母によれば、所定のリガンド濃度に対して、野生株よりも、さらに優れた応答性を示すといえる。また、前記表15に示すように、EC50は、野生株が、500nmol/Lであったのに対して、CWP1Δが、90nmol/L、CWP2Δが、150nmol/L、PDR5Δ株が、150nmol/L、CWP1Δ−CWP2Δが、15nmol/L、PDR5Δ−CWP1Δ株では60nmol/Lであり、1/3から1/30に低減された。
【0277】
このように、PDR5遺伝子、CWP1遺伝子およびCWP2遺伝子の少なくともいずれかを欠失させることによって、前記形質転換酵母は、AhRのリガンドに対して、検出感度および/または検出応答性が改善された。このため、本発明の形質転換酵母は、動物核内受容体に対するリガンドのアッセイに極めて有効といえる。
【0278】
以下の方法により、形質転換酵母を作製し、リガンド分析を行った。
【0279】
(A)遺伝子欠失酵母の作製
下記の方法により、各1遺伝子欠失酵母、各2遺伝子欠失酵母および各3遺伝子欠失酵母を作製した。
【0280】
(1)1遺伝子欠失酵母の作製
(1−1)CWP1遺伝子
実施例1と同様の方法で、CWP1遺伝子を欠失する遺伝子欠失酵母を作製した。
【0281】
(1−2)PDR5遺伝子
実施例1と同様の方法で、PDR5遺伝子を欠失する遺伝子欠失酵母を作製した。
【0282】
(1−3)CWP2遺伝子
実施例3と同様の方法で、CWP2遺伝子を欠失する遺伝子欠失酵母を作製した。
【0283】
(1−4)PDR10遺伝子
下記のようにして、PDR10遺伝子を欠失する遺伝子欠失酵母を作製した。特に示さない限りは、前記実施例1における(1)遺伝子欠失酵母の作製と同様に行った。
【0284】
前記実施例1のプラスミドpUG6を鋳型として、下記プライマーSH049およびSH050を用いて、loxP−KanMX−loxP領域を、PCRにより増幅した。具体的には、PDR10遺伝子の近傍配列が付加されたloxP−KanMX−loxP(以下、PDR10近傍配列付加loxP−KanMX−loxPという)を増幅した。前記各プライマーは、PDR10遺伝子の近傍配列を含む配列とした。下記配列において、大文字の領域は、PDR10遺伝子の近傍配列の相補配列であり、小文字の領域は、loxP−KanMX−loxPの相補配列である。
【0285】
(PDR10近傍配列付加loxP−KanMX−loxP用プライマー)
SH049(配列番号42)
5’−AAAAATCAAACAATAATTTCTGGTCTTACATAGTTGTTAGGcagctgaagcttcgtacgc−3’
SH050(配列番号43)
5’−ATTTCTTTAATTTTTTGCTTTTCTTTGGAACCCGCACCAcataggccactagtggatctg−3’
【0286】
そして、PCR後、増幅したPDR10近傍配列付加loxP−KanMX−loxPを、以下のように、酵母(Saccharomyces cerevisiae)W303a株に、酢酸リチウム法にて導入した。この際、形質転換酵母の選択培地は、YPD培地に、200μg/mLとなるようにG418(Geneticin、GIBCO BRL社製)を添加した、G418含有YPD培地を使用した。
【0287】
ここで、前記配列の導入により、前記形質転換酵母が、PDR10遺伝子を欠失しているかを確認した。前記遺伝子の欠失の確認は、前記形質転換酵母のDNAを鋳型として、下記プライマーを用いて、PCRにより行った。下記プライマーを用いたPCRによって、増幅が確認された場合は、PDR10遺伝子を欠失していると判断した。
【0288】
(5’PDR10欠失の検証用プライマー)
SH051(配列番号44)
5’−cgcgctataatgccaaaatccg−3’
SH018(配列番号14)
5’−ctgcgcacgtcaagactg−3’
(3’PDR10欠失の検証用プライマー)
SH017(配列番号15)
5’−cctcgacatcatctgccc−3’
SH052(配列番号45)
5’−catcagacgtatattcagcagc−3’
【0289】
つづいて、Nucleic Acids Res. (1996) 24、2519−2524に準じて、プラスミドpSH47を作製した。前記プラスミドpSH47は、部位特異的組換え酵素Cre遺伝子およびウラシル選択マーカーURA3遺伝子を有し、これらの遺伝子が、Gal1−10プロモーターおよびCYC1ターミネーターで制御されたプラスミドである。前記プラスミドpSH47を、前記形質転換酵母に、酢酸リチウム法によって導入した。この際、形質転換酵母の選択培地は、ウラシル無添加のグルコース培地を使用した。前記ウラシル無添加グルコース培地は、前記表2の培地組成において、炭素源としてグルコースを含み、前記ドロップアウトパウダーとして、前記表6の組成のドロップアウトパウダーを添加した。
【0290】
得られたウラシル非要求性の形質転換酵母を、ウラシル無添加のグルコース液体培地を用いて、30℃で一晩、前培養を行った。前培養した前記形質転換酵母を遠心分離によって集菌した後、滅菌水で2回洗浄した。培地を、ウラシル無添加のガラクトース液体培地に代え、前記洗浄後の前記形質転換酵母を、30℃で4時間培養した。培養後、適宜希釈した菌液を、YPD寒天培地上に播種した。そして、コロニー形成後、レプリカ法によって、G418感受性となったコロニーを選抜した。前記ウラシル無添加ガラクトース培地は、前記表2の培地組成において、炭素源としてガラクトースを含み、前記ドロップアウトパウダーとして、前記表6の組成のドロップアウトパウダーを添加した。
【0291】
ここで、Cre遺伝子によってG418耐性遺伝子が切り出され、最終的に、PDR10遺伝子のORFが、loxP配列に置換されたことを確認した。この確認は、前記G418感受性のコロニーのDNAを鋳型とし、前記プライマーSH051(配列番号44)およびSH052(配列番号45)を用いて、PCRにより行った。前記PCRは、前記PCR反応液2を使用し、前記PCR条件2で行った。前記プライマーを用いたPCRによって、増幅が確認された場合は、PDR10遺伝子を欠失していると判断した。
【0292】
以上のようにして、一重欠失株として、PDR10遺伝子およびG418耐性遺伝子を欠失する遺伝子欠失酵母株を得た。そして、最終的に、プラスミドpSH47が脱落して、再びウラシル要求性となった株を、遺伝子欠失酵母株とした。
【0293】
(2)2遺伝子欠失酵母の作製
(2−1)PDR5遺伝子およびCWP1遺伝子
実施例1と同様の方法で、PDR5遺伝子およびCWP1遺伝子を欠失する遺伝子欠失酵母を作製した。
【0294】
(2−2)CWP1遺伝子およびCWP2遺伝子
実施例3と同様の方法で、CWP1遺伝子およびCWP2遺伝子を欠失する遺伝子欠失酵母を作製した。
【0295】
(2−3)PDR5遺伝子およびCWP2遺伝子
下記のようにして、PDR5遺伝子およびCWP2遺伝子を欠失する遺伝子欠失酵母株を作製した。特に示さない限りは、前記実施例1および前記実施例3における(1)遺伝子欠失酵母の作製と同様に行った(以下、同様)。
【0296】
前記CWP2遺伝子およびG418耐性遺伝子を欠失する遺伝子欠失酵母株または前記PDR5遺伝子およびG418耐性遺伝子を欠失する遺伝子欠失酵母株から、前述と同様の操作により、二重欠失株として、前記PDR5遺伝子および前記CWP2遺伝子の両方を欠失する遺伝子欠失酵母を作製した。すなわち、前記PDR5遺伝子の欠失株に対しては、さらに、前述と同様に、CWP2遺伝子欠失の操作を行い、PDR5遺伝子およびCWP2遺伝子を欠失する遺伝子欠失株を得た。また、前記CWP2遺伝子欠失株に対しては、さらに、前述と同様に、PDR5遺伝子欠失の操作を行い、PDR5遺伝子およびCWP2遺伝子を欠失する遺伝子欠失株を得た。そして、最終的に、プラスミドpSH47が脱落して、再びウラシル要求性となった株を、遺伝子欠失酵母株とした。
【0297】
(2−4)CWP1遺伝子およびPDR10遺伝子
前記CWP1遺伝子およびG418耐性遺伝子を欠失する遺伝子欠失酵母株、または前記PDR10遺伝子およびG418耐性遺伝子を欠失する遺伝子欠失酵母株から、前述と同様の操作により、二重欠失株として、前記CWP1遺伝子および前記PDR10遺伝子の両方を欠失する遺伝子欠失酵母を作製した。すなわち、前記CWP1遺伝子の欠失株に対しては、さらに、前述と同様に、PDR10遺伝子欠失の操作を行い、CWP1遺伝子およびPDR10遺伝子を欠失する遺伝子欠失株を得た。また、前記PDR10遺伝子欠失株に対しては、さらに、前述と同様に、CWP1遺伝子欠失の操作を行い、CWP1遺伝子およびPDR10遺伝子を欠失する遺伝子欠失株を得た。そして、最終的に、プラスミドpSH47が脱落して、再びウラシル要求性となった株を、遺伝子欠失酵母株とした。
【0298】
(2−5)PDR5遺伝子およびPDR10遺伝子
前記PDR5遺伝子およびG418耐性遺伝子を欠失する遺伝子欠失酵母株、または前記PDR10遺伝子およびG418耐性遺伝子を欠失する遺伝子欠失酵母株から、前述と同様の操作により、二重欠失株として、前記PDR5遺伝子および前記PDR10遺伝子の両方を欠失する遺伝子欠失酵母を作製した。すなわち、前記PDR5遺伝子の欠失株に対しては、さらに、前述と同様に、PDR10遺伝子欠失の操作を行い、PDR5遺伝子およびPDR10遺伝子を欠失する遺伝子欠失株を得た。また、前記PDR10遺伝子欠失株に対しては、さらに、前述と同様に、PDR5遺伝子欠失の操作を行い、PDR5遺伝子およびPDR10遺伝子を欠失する遺伝子欠失株を得た。そして、最終的に、プラスミドpSH47が脱落して、再びウラシル要求性となった株を、遺伝子欠失酵母株とした。
【0299】
(3)3遺伝子欠失酵母の作製
(3−1)CWP1遺伝子、CWP2遺伝子およびPDR5遺伝子
前記CWP1遺伝子、CWP2遺伝子およびG418耐性遺伝子を欠失する遺伝子欠失酵母株、または前記CWP1遺伝子、PDR5遺伝子およびG418耐性遺伝子を欠失する遺伝子欠失酵母株、または前記CWP2遺伝子、PDR5遺伝子およびG418耐性遺伝子を欠失する遺伝子欠失酵母株から、前述と同様の操作により、三重重欠株として、前記CWP1遺伝子、CWP2遺伝子およびPDR5遺伝子すべてを欠失する遺伝子欠失酵母を作製した。すなわち、前記CWP1遺伝子およびCWP2遺伝子の欠失株に対しては、さらに、前述と同様に、PDR5遺伝子欠失の操作を行い、CWP1遺伝子、CWP2遺伝子およびPDR5遺伝子を欠失する遺伝子欠失株を得た。また、前記CWP1遺伝子およびPDR5遺伝子欠失株に対しては、さらに、前述と同様に、CWP2遺伝子欠失の操作を行い、CWP1遺伝子、CWP2遺伝子およびPDR5遺伝子を欠失する遺伝子欠失株を得た。また、前記CWP2遺伝子およびPDR5遺伝子欠失株に対しては、さらに、前述と同様に、CWP1遺伝子欠失の操作を行い、CWP1遺伝子、CWP2遺伝子およびPDR5遺伝子を欠失する遺伝子欠失株を得た。そして、最終的に、プラスミドpSH47が脱落して、再びウラシル要求性となった株を、遺伝子欠失酵母株とした。
【0300】
(3−2)CWP1遺伝子、PDR5遺伝子およびPDR10遺伝子
前記CWP1遺伝子、PDR5遺伝子およびG418耐性遺伝子を欠失する遺伝子欠失酵母株、前記CWP1遺伝子、PDR10遺伝子およびG418耐性遺伝子を欠失する遺伝子欠失酵母株、または前記PDR5遺伝子、PDR10遺伝子およびG418耐性遺伝子を欠失する遺伝子欠失酵母株から、前述と同様の操作により、三重重欠株として、前記CWP1遺伝子、PDR5遺伝子およびPDR10遺伝子すべてを欠失する遺伝子欠失酵母を作製した。すなわち、前記CWP1遺伝子およびPDR5遺伝子の欠失株に対しては、さらに、前述と同様に、PDR10遺伝子欠失の操作を行い、CWP1遺伝子、PDR5遺伝子およびPDR10遺伝子を欠失する遺伝子欠失株を得た。また、前記CWP1遺伝子およびPDR10遺伝子欠失株に対しては、さらに、前述と同様に、PDR5遺伝子欠失の操作を行い、CWP1遺伝子、PDR5遺伝子およびPDR10遺伝子を欠失する遺伝子欠失株を得た。また、前記PDR5遺伝子およびPDR10遺伝子欠失株に対しては、さらに、前述と同様に、CWP1遺伝子欠失の操作を行い、CWP1遺伝子、PDR5遺伝子およびPDR10遺伝子を欠失する遺伝子欠失株を得た。そして、最終的に、プラスミドpSH47が脱落して、再びウラシル要求性となった株を、遺伝子欠失酵母株とした。
【0301】
(B)レポータープラスミドの作製
Wolf et al. ; Biotechniques 20, 568−573 (1996)に準じて、pRW95−3を作製した。前記プラスミドpRW95−3は、β−ガラクトシダーゼ遺伝子を有するプラスミドである。
【0302】
核内受容体に応答する配列(応答配列)を含むオリゴDNAおよびそれに相補的なオリゴDNAを作製した。アニーリングは、94℃で1分間を1サイクルで実施した。アニーリング後、前記応答配列が連続して複数個アニーリングしたものを精製して、pRW95−3の所定の制限酵素サイトに挿入した。前記応答配列が連続して複数個挿入されたプラスミドを、核内受容体レポータープラスミドとした。各応答配列についてのオリゴDNAおよびそれに相補的なオリゴDNAは、下記のとおりである。なお、応答配列である前記「GRE配列」を含むオリゴヌクレオチドDNAおよびそれに相補的なオリゴDNAは、前記実施例1と同様のものを使用した。また、応答配列である前記「XRE配列」を含むオリゴヌクレオチドDNAおよびそれに相補的なオリゴDNAは、前記実施例3と同様のものを使用した。
【0303】
(ERE配列)
ERE−Bmg2(配列番号46)
5’−gatcccaggtcaacatgacctagaa−3’
ERE−Bgm2(配列番号47)
5’−gatcttctaggtcatgttgacctgg−3’
(IR−0配列)
IR0XbaF (配列番号48)
5’−ctagatctcaggtcatgacctttcatcca−3’
IR0SpeR (配列番号49)
5’−ctagtggatgaaaggtcatgacctgagat−3’
(DR−3配列)
DR−3 Xb(配列番号50)
5’−ctagaaacagttcataaagttcatctg−3’
DR−3 Nh(配列番号51)
5’−ctagcagatgaactttatgaactgttt−3’
【0304】
(C)動物核内受容体発現プラスミドの作製
核内受容体遺伝子のcDNAのORFを、ヒトcDNAを鋳型として、下記プライマーを用いたPCRにより増幅した。PCRは、前記PCR反応液3を用いて、前記PCR条件3により行った。なお、AhR遺伝子については、AhR遺伝子またはArnt遺伝子のcDNAのORFを増幅し、PXR−1遺伝子については、PXR−1遺伝子またはRXRα遺伝子のcDNAのORFを増幅した。また、GR遺伝子用のプライマーは、前記実施例1と同様のものを使用した。AhR遺伝子またはArnt遺伝子用のプライマーは、前記実施例3と同様のものを使用した。
【0305】
(ERα用プライマー)
ERaRbSPf(配列番号52)
5’−ccacactagtctaaaaacatgatgaccatgaccctccacac−3’
ERaSLr (配列番号53)
5’−ggaagtcgactcagaccgtggcagggaaaccctc−3’
(ERβ用プライマー)
ERβfXb(配列番号54)
5’−gcctcttctagaaaggtgttttctcagc−3’
ERβrHd(配列番号55)
5’−acgcttaagcttgtgacctctgtgggcc−3’
(TRα用プライマー)
TRaRbSpF(配列番号56)
5’−gggcactagtaacaaaatggaacagaagccaagca−3’
TRaHdR (配列番号57)
5’−ggccaagcttgctttagacttcctgatcctcaaag−3’
(TRβ用プライマー)
TRb1frbSp(配列番号58)
5’−caggactagtaaactatgactcccaacagtatgac−3’
TRb1rHd (配列番号59)
5’−ttcgtgaagcttcagtctaatcctcgaacacttcc−3’
(PXR−1用プライマー)
PXRfRbSp(配列番号60)
5’−ttccaactagtaaaacatggaggtgagacccaaag−3’
PXRrHd (配列番号61)
5’−ccttcaagcttctcagctacctgtgatgccgaac−3’
(RXRα用プライマー)
RXRaRbKpnF(配列番号62)
5’−aaaggggtacctcaaaaatggacaccaaacatttcctgcc−3’
RXRaEcr (配列番号63)
5’−cttaagaattctaagtcatttggtgcggc−3’
(PR用プライマー)
hPRfBg(配列番号64)
5’−gggcagatctacaaaatgactgagctgaaggcaaa−3’
hPRrXh(配列番号65)
5’−caagacctcgagatcctgaccaaac−3’
(AR用プライマー)
ARfRbBm(配列番号66)
5’−tcgaggatccaacaaaatggaagtgcagttagggctggg−3’
ARrXh (配列番号67)
5’−agggggctcgagctggggtggggaaatagg−3’
(MR用プライマー)
hMRfBg(配列番号68)
5’−ccgagatctaacacaatggagaccaaaggctacca−3’
hMRrHi(配列番号69)
5’−gaattcaaagggacacaacaaggtgttcgaattcc−3’
【0306】
つぎに、増幅させた核内受容体遺伝子のcDNAを、所望の制限酵素で切断した。切断した前記cDNAを、所望の制限酵素で切断した下記プラスミドに挿入した。これによって、前記核内受容体遺伝子を有し、その上流にプロモーターを有する核内受容体発現プラスミドを得た。
【0307】
(プラスミドpUdp5)
プラスミドpUdp5は、両方向プロモーター領域gal1、gal10およびgal10の下流にCYCターミネーターおよびウラシル選択マーカーURA3遺伝子を持つプラスミドである。プラスミドpUdp5の作製方法等については、例えば、特開2009−232697号公報(特願2008−79803)の[0080]〜[0084]の記載を参照できる。
(プラスミドpUdp6)
プラスミドpUdp6は、両方向プロモーター領域gal1、gal10およびgal10の下流にCYCターミネーター、gal1の下流にADHターミネーターを持ち、さらにウラシル選択マーカーURA3遺伝子を持つプラスミドである。プラスミドpUdp6の作製方法等については、例えば、「Shiizaki et al. Toxicology in Vitro 24, 638−644 (2010)の記載を参照できる。
(プラスミドpUdp8)
プラスミドpUdp8は、両方向プロモーター領域gal1、gal10およびgal10の下流にURS mRNA不安定化配列、CYCターミネーターおよびウラシル選択マーカーURA3遺伝子を持つプラスミドである。プラスミドpUdp8の作製方法等については、例えば、特開2009−232697号公報(特願2008−79803)の[0080]〜[0087]の記載を参照できる。
(プラスミドpUra3)
プラスミドpUra3は、両方向プロモーター領域gal1、gal10およびウラシル選択マーカーURA3遺伝子を持つプラスミドである。プラスミドpUdp3の作製方法等については、例えば、特開2009−232697号公報(特願2008−79803)の[0080]の記載を参照できる。
【0308】
(D)動物転写共役因子発現プラスミドの作製
前記実施例1と同様にして、動物転写共役因子発現プラスミドpESC−Leu−hSRC1を作製した。
【0309】
(E)形質転換酵母の作製
前記核内受容体発現プラスミドを、制限酵素EcoRV処理し、直鎖状とした。なお、ERβ発現プラスミドの場合には、制限酵素NcoI処理し、直鎖状とした。前記遺伝子欠失酵母、前記レポータープラスミド、直鎖状の前記核内受容体発現プラスミドを使用し、前記実施例1と同様にして形質転換酵母を作製した。なお、AhRについては、前記動物転写共役因子発現プラスミドを導入しなかった。
【0310】
各遺伝子を欠失する前記形質転換酵母株を、以下のように示す。
(1遺伝子欠失株)
CWP1遺伝子を欠失:CWP1Δ株
CWP2遺伝子を欠失:CWP2Δ株
PDR5遺伝子を欠失:PDR5Δ株
PDR10遺伝子を欠失:PDR10Δ株
(2遺伝子欠失株)
PDR5遺伝子およびCWP1遺伝子を欠失:PDR5Δ−CWP1Δ株
CWP1遺伝子およびCWP2遺伝子を欠失:CWP1Δ−CWP2Δ株
CWP2遺伝子およびPDR5遺伝子を欠失:CWP2Δ−PDR5Δ株
CWP1遺伝子およびPDR10遺伝子を欠失:CWP1Δ−PDR10Δ株
PDR5遺伝子およびPDR10遺伝子を欠失:PDR5Δ−PDR10Δ株
(3遺伝子欠失株)
CWP1遺伝子、CWP2遺伝子およびPDR5遺伝子を欠失:
CWP1Δ−CWP2Δ−PDR5Δ株
CWP1遺伝子、PDR5遺伝子およびPDR10遺伝子を欠失:
CWP1Δ−PDR5Δ−PDR10Δ株
【0311】
(F)リガンド分析
作製した形質転換酵母を用いて、前記核内受容体に対するリガンドの分析を行った。比較例は、酵母(Saccharomyces cerevisiae) W303a株(野生株)を使用した。
【0312】
具体的には、前記リガンドを所定の濃度となるように、DMSOに溶解して調製したリガンド溶液を使用した。さらに分析結果について、前記実施例2および前記実施例4で算出した誘導率に代えて、リガンド無添加の反応液、すなわち、前記リガンド溶液に代えてDMSO 1μLを添加した反応液の値を、リガンド添加の反応液の値をから差し引いた誘導増加量を求めた。これら以外は、前記実施例2および前記実施例4と同様とした。前記誘導増加量を、レポーター活性値ということがあり、前記誘導の増加を、レポーター活性ということがある(以下、同様)。
【0313】
〔実施例5〕
本実施例では、CWP1遺伝子、CWP2遺伝子およびPDR5遺伝子のいずれかを欠失させた欠失酵母を作製し、ヒトERα遺伝子を組み込んだ形質転換酵母を作製した。
【0314】
(1)遺伝子欠失酵母の作製
前記PDR5遺伝子、前記CWP1遺伝子、または前記CWP2遺伝子を欠失する遺伝子欠失酵母株、前記PDR5遺伝子および前記CWP1遺伝子、前記CWP1遺伝子および前記CWP2遺伝子、または前記CWP2遺伝子および前記PDR5遺伝子を欠失する遺伝子欠失酵母株、ならびに、CWP1遺伝子、CWP2遺伝子およびPDR5遺伝子を欠失する遺伝子欠失酵母を使用した。
【0315】
(2)レポータープラスミドの作製
前記ERαに応答する配列であるERE配列が連続して3個アニーリングしたものを精製して、pRW95−3のBglII部位に挿入した。ERE配列が3個挿入されたプラスミドを、ERαレポータープラスミドとした。
【0316】
(3)動物核内受容体発現プラスミドの作製
増幅させたERα遺伝子のcDNAを、制限酵素SpeIおよびSalIで切断した。切断した前記cDNAを、制限酵素SpeIおよびSalI切断したプラスミドpUdp5に挿入した。前記プラスミドpUdp5において、切断した前記cDNAは、前記Gal10プロモーターの下流に挿入した。これによって、前記核内受容体遺伝子を有し、その上流にプロモーターを有するERα発現プラスミドpUdp5ERαを得た。
【0317】
(4)形質転換酵母の作製
前記遺伝子欠失酵母、ERαレポータープラスミド、直鎖状の前記ERα発現プラスミド、前記動物転写因子発現プラスミドを使用し、下記の7種類の形質転換酵母を作製した。
1遺伝子欠失株:CWP1Δ株、CWP2Δ株、PDR5Δ株
2遺伝子欠失株:CWP1Δ−CWP2Δ株、PDR5Δ−CWP1Δ株、CWP2Δ−PDR5Δ株
3遺伝子欠失株:CWP1Δ−CWP2Δ−PDR5Δ株
【0318】
〔実施例6〕
本実施例では、前記実施例5で作製した形質転換酵母を使用し、前記リガンドとして、17β−エストラジオールを使用し、誘導増加量を求めた。
【0319】
これらの結果を、下記表17、表18および図3に示す。図3は、17β−エストラジオールに対する結果を示すグラフである。前記グラフにおいて、横軸は、各リガンド濃度(μmol/L)であり、具体的には、0.000001、0.00001、0.0001、0.001、0.01、0.1、1、10μmol/Lにおけるプロットであり、縦軸は、リガンドにより誘導された誘導増加量(レポーター活性値)である。前記グラフにおいて、黒菱形のプロット(◆)が野生株の結果であり、黒四角のプロット(■)がCWP1Δ株の結果であり、黒三角のプロット(▲)がCWP2Δ株の結果であり、バツのプロット(×)がPDR5Δ株の結果であり、アスタリスクのプロット(*)がPDR5Δ−CWP1Δ株の結果であり、黒丸のプロット(●)がCWP2Δ−PDR5Δ株の結果であり、縦線のプロット(|)がCWP1Δ−CWP2Δ株の結果であり、白三角のプロット(△)がCWP1Δ−CWP2Δ−PDR5Δ株の結果である。
【0320】
【表17】

【0321】
【表18】

【0322】
前記表17、表18および図3に示すように、野生株は、検出可能な17β−エストラジオール濃度が100pmol/L以上であった。これに対して、全ての変異株について、17β−エストラジオール濃度10pmol/Lでβ−ガラクトシダーゼの誘導が確認できた。この結果から、本発明の形質転換酵母によれば、PDR5遺伝子、CWP1遺伝子およびCWP2遺伝子の少なくともいずれかを欠失させることによって、ERαに対するリガンドが低濃度であっても、十分に優れた感度を得ることができる。また、全ての変異株が、検出可能なリガンド濃度において、野生株よりも高いレポーター活性を示した。具体例として、前記表18に示すように、CWP1Δ株、CWP2Δ株、CWP1Δ−CWP2Δ株およびPDR5Δ−CWP1Δ株は、それぞれ、野生株の40.6倍、37.9倍、41.7倍、36.1倍と、特に優れたレポーター活性を示した。その他の株も7〜15倍のレポーター活性を示した。これらの結果から、本発明の形質転換酵母によれば、所定のリガンド濃度に対して、野生株よりも、さらに優れた応答性を示すといえる。また、前記表17に示すように、EC50は、野生株が、396pmol/Lであったのに対して、CWP1Δ株が、33.6pmol/L、CWP2Δ株が、25.6pmol/L、PDR5Δ株が、69.8pmol/L、CWP1Δ−CWP2Δ株が、37.9pmol/L、PDR5Δ−CWP1Δ株が、33.6pmol/Lであり、1/6から1/15に低減された。
【0323】
以上のように、マンナン結合タンパク質のコード遺伝子または排出ポンプタンパク質のコード遺伝子のいずれを欠失させることにより、前記形質転換酵母は、ERαのリガンドに対して、検出感度および/または検出応答性が改善された。このため、本発明の形質転換酵母は、動物核内受容体に対するリガンドのアッセイに極めて有効といえる。
【0324】
〔実施例7〕
本実施例では、CWP1遺伝子、CWP2遺伝子およびPDR5遺伝子のいずれかを欠失させた欠失酵母を作製し、ヒトERβ遺伝子を組み込んだ形質転換酵母を作製した。
【0325】
(1)遺伝子欠失酵母の作製
前記PDR5遺伝子、前記CWP1遺伝子、または前記CWP2遺伝子を欠失する遺伝子欠失酵母株、前記PDR5遺伝子および前記CWP1遺伝子、前記CWP1遺伝子および前記CWP2遺伝子、または前記CWP2遺伝子および前記PDR5遺伝子を欠失する遺伝子欠失酵母株、ならびに、CWP1遺伝子、CWP2遺伝子およびPDR5遺伝子を欠失する遺伝子欠失酵母を使用した。
【0326】
(2)レポータープラスミドの作製
前記実施例5と同様にして、ERE配列が3個挿入されたプラスミドを作製した。このプラスミドを、ERβレポータープラスミドとした。
【0327】
(3)動物核内受容体発現プラスミドの作製
増幅させたERβ遺伝子のcDNAを、制限酵素XbaIおよびHindIIIで切断した。切断した前記cDNAを、制限酵素XbaIおよびHindIII切断した前記プラスミドpUdp5に挿入した。前記プラスミドpUdp5において、切断した前記cDNAは、前記Gal10プロモーターの下流に挿入した。これによって、前記核内受容体遺伝子を有し、その上流にプロモーターを有するERβ発現プラスミドpUdp5ERβを得た。
【0328】
(4)形質転換酵母の作製
前記遺伝子欠失酵母、ERβレポータープラスミド、直鎖状の前記Eβ発現プラスミド、前記動物転写因子発現プラスミドを使用し、下記の7種類の形質転換酵母を作製した。
1遺伝子欠失株:CWP1Δ株、CWP2Δ株、PDR5Δ株
2遺伝子欠失株:CWP1Δ−CWP2Δ株、PDR5Δ−CWP1Δ株、CWP2Δ−PDR5Δ株
3遺伝子欠失株:CWP1Δ−CWP2Δ−PDR5Δ株
【0329】
〔実施例8〕
本実施例では、前記実施例7で作製した形質転換酵母を使用し、前記リガンドとして、17β−エストラジオールを使用し、誘導増加量を求めた。
【0330】
これらの結果を、下記表19、表20および図4に示す。図4は、17β−エストラジオールに対する結果を示すグラフである。前記グラフにおいて、横軸は、各リガンド濃度(μmol/L)であり、具体的には、0.000001、0.00001、0.0001、0.001、0.01、0.1、1、10μmol/Lにおけるプロットであり、縦軸は、リガンドにより誘導された誘導増加量(レポーター活性値)である。前記グラフにおいて、黒菱形のプロット(◆)が野生株の結果であり、黒四角のプロット(■)がCWP1Δ株の結果であり、黒三角のプロット(▲)がCWP2Δ株の結果であり、アスタリスクのプロット(*)がPDR5Δ−CWP1Δ株の結果であり、縦線のプロット(|)がCWP1Δ−CWP2Δ株の結果であり、白三角のプロット(△)がCWP1Δ−CWP2Δ−PDR5Δ株の結果である。
【0331】
【表19】

【0332】
【表20】

【0333】
前記表19、表20および図4に示すように、野生株は、検出可能な17β−エストラジオール濃度が100pmol/L以上であった。これに対して、CWP2Δ以外の全ての変異株について、17β−エストラジオール濃度10pmol/Lでβ−ガラクトシダーゼの誘導が確認できた。この結果から、本発明の形質転換酵母によれば、ERβに対するリガンドが低濃度であっても、十分に優れた感度を得ることができる。また、全ての変異株が、検出可能なリガンド濃度において、野生株よりも高い誘導率を示した。具体例として、前記表20に示すように、CWP1Δ株、PDR5Δ株、CWP1Δ−CWP2Δ株およびPDR5Δ−CWP1Δ株は、それぞれ、野生株の1.6倍、1.8倍、2.7倍、2.3倍のレポーター活性を示した。その他の株も1.3倍のレポーター活性を示した。これらの結果から、本発明の形質転換酵母によれば、所定のリガンド濃度に対して、野生株よりも、さらに優れた応答性を示すといえる。
【0334】
以上のように、マンナン結合タンパク質のコード遺伝子または排出ポンプタンパク質のコード遺伝子のいずれを欠失させることにより、前記形質転換酵母は、ERβのリガンドに対して、検出感度および/または検出応答性が改善された。このため、本発明の形質転換酵母は、動物核内受容体に対するリガンドのアッセイに極めて有効といえる。
【0335】
〔実施例9〕
本実施例では、CWP1遺伝子およびCWP2遺伝子を欠失させた欠失酵母を作製し、ヒトTRα遺伝子を組み込んだ形質転換酵母を作製した。
【0336】
(1)遺伝子欠失酵母の作製
前記CWP1遺伝子および前記CWP2遺伝子を欠失する遺伝子欠失酵母を使用した。
【0337】
(2)レポータープラスミドの作製
前記TRαに応答する配列であるIR−0配列が連続して5個アニーリングしたものを精製して、pRW95−3のSpeI位にサイトに挿入した。IR−0配列が5個挿入されたプラスミドを、TRαレポータープラスミドとした。
【0338】
(3)動物核内受容体発現プラスミドの作製
増幅させたTRα遺伝子のcDNAを、制限酵素SpeIおよびHindIIIで切断した。切断した前記cDNAを、制限酵素XbaIおよびHindIII切断した前記プラスミドpUdp6に挿入した。前記プラスミドpUdp6において、前記切断したcDNAは、前記Gal10プロモーターの下流に挿入した。これによって、前記核内受容体遺伝子を有し、その上流にプロモーターを有するTRα発現プラスミドpUdp6TRαを得た。
【0339】
(4)形質転換酵母の作製
前記遺伝子欠失酵母、TRαレポータープラスミド、直鎖状の前記TRα発現プラスミド、前記動物転写因子発現プラスミドを使用し、下記の1種類の形質転換酵母を作製した。
2遺伝子欠失株:CWP1Δ−CWP2Δ株
【0340】
〔実施例10〕
本実施例では、前記実施例9で作製した形質転換酵母を使用し、前記リガンドとして、トリヨードチロニンを使用し、誘導増加量を求めた。
【0341】
これらの結果を、下記表21、表22および図5に示す。図5は、トリヨードチロニンに対する結果を示すグラフである。前記グラフにおいて、横軸は、各リガンド濃度(μmol/L)であり、具体的には、0.00001、0.0001、0.001、0.01、0.1、1、10、100μmol/Lにおけるプロットであり、縦軸は、リガンドにより誘導された誘導増加量(レポーター活性値)である。前記グラフにおいて、黒菱形のプロット(◆)が野生株の結果であり、縦線のプロット(|)がCWP1Δ−CWP2Δ株の結果である。
【0342】
【表21】

【0343】
【表22】

【0344】
前記表21、表22および図5に示すように、野生株は、検出可能なトリヨードチロニン濃度が10nmol/L以上であった。これに対して、CWP1Δ−CWP2Δ株では、リガンド濃度1nmol/Lでレポーター活性が検出され、10nmol/Lでは野生株よりも高い活性を示した。具体例として、前記表22に示すように、CWP1Δ−CWP2Δ株は野生株の13倍であった。これらの結果から、本発明の形質転換酵母によれば、所定のリガンド濃度に対して、野生株よりも、さらに優れた応答性を示すといえる。また、前記表21に示すように、EC50は、野生株が、65.5nmol/Lであったのに対し、CWP1Δ−CWP2Δ株が、13.6nmol/Lであり、1/5に低減された。
【0345】
以上のように、CWP1およびCWP2遺伝子を欠失させることにより、前記形質転換酵母は、TRαのリガンドに対して、検出感度および/または検出応答性が改善された。このため、本発明の形質転換酵母は、動物核内受容体に対するリガンドのアッセイに極めて有効といえる。
【0346】
〔実施例11〕
本実施例では、CWP1遺伝子、CWP2遺伝子およびPDR5遺伝子のいずれかを欠失させた欠失酵母を作製し、ヒトTRβ遺伝子を組み込んだ形質転換酵母を作製した。
【0347】
(1)遺伝子欠失酵母の作製
前記PDR5遺伝子を欠失する遺伝子欠失酵母株、CWP1遺伝子およびCWP2遺伝子を欠失する遺伝子欠失酵母株、ならびに、PDR5遺伝子、CWP1遺伝子およびCWP2遺伝子を欠失する遺伝子欠失酵母株を使用した。
【0348】
(2)レポータープラスミドの作製
前記実施例9と同様にして、IR−0配列が5個挿入されたプラスミドを作製した。このプラスミドを、TRβレポータープラスミドとした。
【0349】
(3)動物核内受容体発現プラスミドの作製
増幅させたTRβ遺伝子のcDNAを、制限酵素SpeIおよびHindIIIで切断した。切断した前記cDNAを、制限酵素XbaIおよびHindIII切断した前記プラスミドpUdp6に挿入した。前記プラスミドpUdp6において、前記切断したcDNAは、前記Gal10プロモーターの下流に挿入した。これによって、前記核内受容体遺伝子を有し、その上流にプロモーターを有するTRβ発現プラスミドpUdp6TRβを得た。
【0350】
(4)形質転換酵母の作製
前記遺伝子欠失酵母、TRβレポータープラスミド、直鎖状の前記Tβ発現プラスミド、前記動物転写因子発現プラスミドを使用し、下記の3種類の形質転換酵母を作製した。
1遺伝子欠失株:PDR5Δ株
2遺伝子欠失株:CWP1Δ−CWP2Δ株
3遺伝子欠失株:CWP1Δ−CWP2Δ−PDR5Δ株
【0351】
〔実施例12〕
本実施例では、前記実施例11で作製した形質転換酵母を使用し、前記リガンドとして、トリヨードチロニンを使用し、誘導増加量を求めた。
【0352】
これらの結果を、下記表23、表24および図6に示す。図6は、トリヨードチロニンに対する結果を示すグラフである。前記グラフにおいて、横軸は、各リガンド濃度(μmol/L)であり、具体的には、0.001、0.01、0.1、1、10μmol/Lにおけるプロットであり、縦軸は、リガンドにより誘導された誘導増加量(レポーター活性値)である。前記グラフにおいて、黒菱形のプロット(◆)が野生株の結果であり、バツのプロット(×)がPDR5Δ株の結果であり、縦線のプロット(|)がCWP1Δ−CWP2Δ株の結果であり、白三角のプロット(△)がCWP1Δ−CWP2Δ−PDR5Δ株の結果である。
【0353】
【表23】

【0354】
【表24】

【0355】
前記表23、表24および図6に示すように、すべての株で、検出可能なトリヨードチロニン濃度は10nmol/L以上であった。この結果から、本発明の形質転換酵母によれば、PDR5遺伝子、CWP1遺伝子およびCWP2遺伝子の少なくともいずれかを欠失させることによって、TRβに対するリガンドが低濃度であっても、十分に優れた感度を得ることができる。全ての変異株は、リガンド濃度1μmol/Lにおいて、野生株よりも高いレポーター活性を示した。具体例として、前記表24に示すように、PDR5Δ株、CWP1Δ−CWP2Δ株、PDR5Δ−CWP1Δ−CWP2Δ株は、それぞれ、野生株の3.21倍、2.23倍、1.90倍を示した。これらの結果から、本発明の形質転換酵母によれば、所定のリガンド濃度に対して、野生株よりも、さらに優れた応答性を示すといえる。また、前記表23に示すように、EC50は、野生株が、1.31μmol/Lであったのに対して、PDR5Δ株が、10.2nmol/L、CWP1Δ−CWP2Δ株が、92.5nmol/L、PDR5Δ−CWP1Δ−CWP2Δ株が、182nmol/Lであり、1/128から1/7に低減された。
【0356】
以上のように、マンナン結合タンパク質のコード遺伝子または排出ポンプタンパク質のコード遺伝子のいずれを欠失させることにより、前記形質転換酵母は、TRβのリガンドに対して、検出感度および/または検出応答性が改善された。このため、本発明の形質転換酵母は、動物核内受容体に対するリガンドのアッセイに極めて有効といえる。
【0357】
〔実施例13〕
本実施例では、CWP1遺伝子、CWP2遺伝子およびPDR5遺伝子のいずれかを欠失させた欠失酵母を作製し、ヒトPXR−1遺伝子を組み込んだ形質転換酵母を作製した。
【0358】
(1)遺伝子欠失酵母の作製
前記PDR5遺伝子を欠失する遺伝子欠失酵母株、前記PDR5遺伝子および前記CWP1遺伝子、または前記CWP2遺伝子および前記PDR5遺伝子を欠失する遺伝子欠失酵母株、ならびに、CWP1遺伝子、CWP2遺伝子およびPDR5遺伝子を欠失する遺伝子欠失酵母を使用した。
【0359】
(2)レポータープラスミドの作製
前記PXR−1に応答する配列であるDR−3配列が連続して2個アニーリングしたものを精製して、pRW95−3のXbaI部位に挿入した。DR−3配列が2個挿入されたプラスミドを、PXRレポータープラスミドとした。
【0360】
(3)動物核内受容体発現プラスミドの作製
増幅させたRXRα遺伝子のcDNAを、制限酵素KpnIおよびEcoRIで切断した。切断した前記cDNAを、制限酵素KpnIおよびEcoRIで切断したプラスミドpUdp8に挿入した。一方で、増幅させたPXR−1遺伝子のcDNAを、制限酵素SpeIおよびHindIIIで切断した。そして、RXRα遺伝子のcDNAを挿入した前記プラスミドpUdp8に、さらに、PXR−1遺伝子のcDNAを挿入した。具体的には、切断した前記cDNAを、制限酵素SpeIおよびHindIII切断した前記プラスミドpUdp8に挿入した。前記プラスミドpUdp8において、前記切断したRXRα遺伝子のcDNAは、前記Gal1プロモーターの下流に挿入し、前記切断したPXR−1遺伝子のcDNAは、前記Gal10ロモーターの下流に挿入した。これによって、前記核内受容体遺伝子を有し、その上流にプロモーターを有するプラスミドpUdp8PXR/RXRαを得た。
【0361】
本実施例では、動物核内受容体発現プラスミドを、前記プラスミドpUdp8PXR/RXRαにおける、RXRαのC末端のHelix12を欠失させたプラスミドpUdp8PXR/RXRαTとした。前記プラスミドpUdp8PXR/RXRαTは、以下のように作製した。
【0362】
まず、QuickChangeSite−DirectedMutagenesisKit(Stratagene社製)を使用して、前記pUdp8PXR/RXRαに含まれるRXRαcDNAの443番目のコドンにナンセンス変異を導入し、RXRαのC末端に存在するHelix12領域を欠失させた。前記変異に使用したプライマー(配列番号70および71)および反応条件(PCR反応液およびPCR条件)を、下記に示す。
【0363】
RXR443F(配列番号70)
5’−cttcttcaagctcatcgggtagacacccat−3’
RXR443R(配列番号71)
5’−ggtgtcaatgggtgtctacccgatgagctt−3’
【0364】
(PCR反応液:1×反応バッファー)
0.25mmol/L dNTP、3μL Quick solution、pfu ultra polymerase 10unit(以上、Stratagene社製)、0.25μmol/L 各プライマー、10ng プラスミドDNAを、PCR反応液50μL中に含む。
【0365】
(PCR条件:サイクル)
94℃で50秒、60℃で50秒、68℃で7分のサイクルを、18サイクル実施した。
【0366】
前記PCR後、制限酵素DpnIで鋳型プラスミドDNAを消化し、大腸菌に形質転換した。得られたプラスミドDNAを、PXR発現プラスミドpUdp8PXR/RXRαTとした。
【0367】
(4)形質転換酵母の作製
前記遺伝子欠失酵母、PXRレポータープラスミド、直鎖状の前記PXR発現プラスミド、前記動物転写因子発現プラスミドを使用し、下記の4種類の形質転換酵母を作製した。
1遺伝子欠失株:PDR5Δ株
2遺伝子欠失株:PDR5Δ−CWP1Δ株、CWP2Δ−PDR5Δ株
3遺伝子欠失株:CWP1Δ−CWP2Δ−PDR5Δ株
【0368】
〔実施例14〕
本実施例では、前記実施例13で作製した形質転換酵母を使用し、前記リガンドとして、リファンピシンを使用し、誘導増加量を求めた。
【0369】
これらの結果を、下記表25、表26および図7に示す。図7は、リファンピシンに対する結果を示すグラフである。前記グラフにおいて、横軸は、各リガンド濃度(μmol/L)であり、具体的には、0.1、1、10、100μmol/Lにおけるプロットであり、縦軸は、リガンドにより誘導された誘導増加量(レポーター活性値)である。前記グラフにおいて、黒菱形のプロット(◆)が野生株の結果であり、バツのプロット(×)がPDR5Δ株の結果であり、アスタリスクのプロット(*)がCWP1Δ−PDR5Δ株の結果であり、黒丸のプロット(●)がCWP2Δ−PDR5Δ株の結果であり、白三角のプロット(△)がCWP1Δ−CWP2Δ−PDR5Δ株の結果である。
【0370】
【表25】

【0371】
【表26】

【0372】
前記表25、表26および図7に示すように、すべての株で検出可能なリファンピシン濃度が1μmol/L以上であった。この結果から、本発明の形質転換酵母によれば、PXR−1に対するリガンドが低濃度であっても、十分に優れた感度を得ることができる。また、全ての変異株が、リガンド濃度1μmol/Lにおいて、野生株よりも高いレポーター活性を示した。具体例として、前記表26に示すように、PDR5Δ株、PDR5Δ−CWP1Δ株、PDR5Δ−CWP2Δ株、PDR5Δ−CWP1Δ−CWP2Δ株は、それぞれ、野生株の13.35倍、5.21倍、2.23倍、5.02倍を示した。これらの結果から、本発明の形質転換酵母によれば、所定のリガンド濃度に対して、野生株よりも、さらに優れた応答性を示すといえる。また、前記表25に示すように、EC50は、野生株が、31.6μmol/Lであったのに対して、PDR5Δ株が、7.86μmol/L、PDR5Δ−CWP1Δ株が、7.33μmol/L、PDR5Δ−CWP2Δ株が、8.10μmol/L、PDR5Δ−CWP1Δ−CWP2Δ株が、10.0μmol/Lであり、1/4から1/3に低減された。
【0373】
以上のように、マンナン結合タンパク質のコード遺伝子または排出ポンプタンパク質のコード遺伝子のいずれを欠失させることにより、前記形質転換酵母は、PXR−1のリガンドに対して、検出感度および/または検出応答性が改善された。このため、本発明の形質転換酵母は、動物核内受容体に対するリガンドのアッセイに極めて有効といえる。
【0374】
〔実施例15〕
本実施例では、CWP1遺伝子、CWP2遺伝子、PDR5遺伝子およびPDR10遺伝子のいずれかを欠失させた欠失酵母を作製し、ヒトPR遺伝子を組み込んだ形質転換酵母を作製した。
【0375】
(1)遺伝子欠失酵母の作製
前記PDR5遺伝子、または前記CWP2遺伝子を欠失する遺伝子欠失酵母株、前記PDR5遺伝子および前記CWP1遺伝子、前記CWP1遺伝子および前記CWP2遺伝子、前記CWP2遺伝子および前記PDR5遺伝子、前記CWP1遺伝子および前記PDR10遺伝子、または前記PDR5遺伝子および前記PDR10遺伝子を欠失する遺伝子欠失酵母株、ならびに、前記CWP1遺伝子、前記CWP2遺伝子および前記PDR5遺伝子、または、前記CWP1遺伝子、前記PDR5遺伝子および前記PDR10遺伝子を欠失する遺伝子欠失酵母を使用した。
【0376】
(2)レポータープラスミドの作製
前記PRに応答する配列であるGRE配列が8個挿入されたプラスミドを、PRレポータープラスミドとした。
【0377】
(3)動物核内受容体発現プラスミドの作製
増幅させたPR遺伝子のcDNAを、制限酵素BglIIおよびXhoIで切断した。切断した前記cDNAを、制限酵素BamHIおよびSalI切断したプラスミドpUdp6に挿入した。前記プラスミドpUdp6において、前記切断したPR遺伝子のcDNAは、前記Gal10プロモーターの下流に挿入した。これによって、前記核内受容体遺伝子を有し、その上流にプロモーターを有するPR発現プラスミドpUdp6PRを得た。
【0378】
(4)形質転換酵母の作製
前記遺伝子欠失酵母、PRレポータープラスミド、直鎖状の前記PR発現プラスミド、前記動物転写因子発現プラスミドを使用し、下記の9種類の形質転換酵母を作製した。
1遺伝子欠失株:CWP2Δ株、PDR5Δ株
2遺伝子欠失株:CWP1Δ−CWP2Δ株、PDR5Δ−CWP1Δ株、PDR5Δ−CWP2Δ株、CWP1Δ−PDR10Δ株、PDR5Δ−PDR10Δ株
3遺伝子欠失株:CWP1Δ−CWP2Δ−PDR5Δ株、CWP1Δ−PDR5Δ−PDR10Δ株
【0379】
〔実施例16〕
本実施例では、前記実施例15で作製した形質転換酵母を使用し、前記リガンドとして、プロゲステロンを使用し、誘導増加量を求めた。
【0380】
これらの結果を、下記表27、表28および図8に示す。図8は、プロゲステロンに対する結果を示すグラフである。前記グラフにおいて、横軸は、各リガンド濃度(μmol/L)であり、具体的には、0.000001、0.00001、0.0001、0.001、0.01、0.1、1、10μmol/Lにおけるプロットであり、縦軸は、リガンドにより誘導された誘導増加量(レポーター活性値)である。前記グラフにおいて、黒菱形のプロット(◆)が野生株の結果であり、黒三角のプロット(▲)がCWP2Δ株の結果であり、バツのプロット(×)がPDR5Δ株の結果であり、アスタリスクのプロット(*)がCWP1Δ−PDR5Δ株の結果であり、黒丸のプロット(●)がCWP2Δ−PDR5Δ株の結果であり、縦線のプロット(|)がCWP1Δ−CWP2Δ株の結果であり、白三角のプロット(△)がPDR5Δ−PDR10Δ株の結果であり、白菱形のプロット(◇)がCWP1Δ−PDR10Δ株の結果であり、白丸のプロット(○)がCWP1Δ−CWP2Δ−PDR5Δ株の結果であり、白四角のプロット(□)がCWP1Δ−PDR5Δ−PDR10Δ株の結果である。
【0381】
【表27】

【0382】
【表28】

【0383】
前記表27、表28および図8に示すように、すべての株で検出可能なリガンド濃度において、野生株よりも高いレポーター活性を示した。具体例として、前記表28に示すように、プロゲステロン濃度1μmol/Lにおいて、CWP2Δ株、PDR5Δ株、CWP1Δ−PDR5Δ株、CWP2Δ−PDR5Δ株、CWP1Δ−CWP2Δ株、CWP1Δ−CWP2Δ−PDR5Δ株、PDR5Δ−PDR10Δ株、CWP1Δ−PDR10Δ株、CWP1Δ−PDR5Δ−PDR10Δ株は、それぞれ、野生株の3.94倍、48.55倍、29.98倍、22.96倍、77.2倍、19.56倍、22.02倍、22.5倍、18.67倍のレポーター活性を示した。これらの結果から、本発明の形質転換酵母によれば、所定のリガンド濃度に対して、野生株よりも、さらに優れた応答性を示すといえる。また、前記表27に示すように、EC50は、野生株が、3.16μmol/Lであったのに対して、CWP2Δ株が、1.34μmol/L、PDR5Δ株が、853nmol/L、CWP1Δ−PDR5Δ株が、1.36μmol/L、CWP2Δ−PDR5Δ株が、1.13μmol/L、CWP1Δ−CWP2Δ株が、114nmol/L、CWP1Δ−CWP2Δ−PDR5Δ株が、689nmol/L、PDR5Δ−PDR10Δ株が、1.39μmol/L、CWP1Δ−PDR10Δ株が、123nmol/L、CWP1Δ−PDR5Δ−PDR10Δ株が、696nmol/Lであり、1/3から1/28に低減された。
【0384】
以上のように、マンナン結合タンパク質のコード遺伝子または排出ポンプタンパク質のコード遺伝子のいずれを欠失させることにより、前記形質転換酵母は、PRのリガンドに対して、検出感度および/または検出応答性が改善された。このため、本発明の形質転換酵母は、動物核内受容体に対するリガンドのアッセイに極めて有効といえる。
【0385】
〔実施例17〕
本実施例では、CWP1遺伝子、PDR5遺伝子、およびPDR10遺伝子のいずれかを欠失させた欠失酵母を作製し、ヒトGR遺伝子を組み込んだ形質転換酵母を作製した。
【0386】
(1)遺伝子欠失酵母の作製
前記PDR5遺伝子または前記PDR10遺伝子を欠失する遺伝子欠失酵母株、前記PDR5遺伝子および前記CWP1遺伝子、前記CWP1遺伝子および前記PDR10遺伝子、または前記PDR5遺伝子および前記PDR10遺伝子を欠失する遺伝子欠失酵母株、ならびに、CWP1遺伝子、PDR5遺伝子およびPDR10遺伝子を欠失する遺伝子欠失酵母を使用した。
【0387】
(2)レポータープラスミドの作製
前記GRに応答する配列であるGRE配列が8個挿入されたプラスミドを、GRレポータープラスミドとした。
【0388】
(3)動物核内受容体発現プラスミドの作製
増幅させたGR遺伝子のcDNAを、制限酵素BamHIおよびXhoIで切断した。切断した前記cDNAを、制限酵素BamHIおよびSalI切断した前記プラスミドpUdp6に挿入した。前記プラスミドpUdp6において、前記切断したGR遺伝子のcDNAは、前記GAL10プロモーターの下流に挿入した。これによって、前記核内受容体遺伝子を有し、その上流にプロモーターを有するGR発現プラスミドpUdp6GRを得た。
【0389】
(4)形質転換酵母の作製
前記遺伝子欠失酵母、GRレポータープラスミド、直鎖状の前記GR発現プラスミド、前記動物転写因子発現プラスミドを使用し、下記の6種類の形質転換酵母を作製した。
1遺伝子欠失株:PDR5Δ株、PDR10Δ株
2遺伝子欠失株:PDR5Δ−CWP1Δ株、CWP1Δ−PDR10Δ株、PDR5Δ−PDR10Δ株
3遺伝子欠失株:CWP1Δ−PDR5Δ−PDR10Δ株
【0390】
〔実施例18〕
本実施例では、前記実施例17で作製した形質転換酵母を使用し、前記リガンドとして、コルチコステロンを使用し、誘導増加量を求めた。
【0391】
これらの結果を、下記表29、表30および図9に示す。図9は、コルチコステロンに対する結果を示すグラフである。前記グラフにおいて、横軸は、各リガンド濃度(μmol/L)であり、具体的には、0.1、1、10μmol/Lにおけるプロットであり、縦軸は、前記誘導増加量(レポーター活性値)である。前記グラフにおいて、黒三角のプロット(▲)が、PDR5Δ株の結果であり、バツのプロット(×)がPDR10Δ株の結果であり、アスタリスクのプロット(*)が、PDR5Δ−CWP1Δ株の結果であり、黒丸のプロット(●)がPDR10Δ−CWP1Δ株の結果であり、縦線のプロット(|)がPDR5Δ−PDR10Δ株の結果であり、白三角のプロット(△)がCWP1Δ−PDR5Δ−PDR10Δ株の結果であり、黒菱形のプロット(◆)が、野生株の結果である。
【0392】
【表29】

【0393】
【表30】

【0394】
前記表29、表30および図9に示すように、野生株は、検出可能なコルチコステロン濃度が1μmol/L以上であった。これに対して、全ての欠失株について、コルチコステロン濃度10〜30nmol/Lにおいて、β−ガラクトシダーゼの誘導が確認できた。この結果から、本発明の形質転換酵母によれば、PDR5遺伝子、PDR10遺伝子およびCWP1遺伝子の少なくともいずれかを欠失させることによって、低いリガンド濃度であっても、十分に優れた感度を得ることができる。また、全ての遺伝子欠失株が、検出可能なリガンド濃度において、野生株よりも高いレポーター活性を示した。具体例として、前記表30に示すように、リガンド濃度1μmol/Lにおいて、PDR5Δ株、PDR10Δ株、PDR5Δ−CWP1Δ株、PDR10Δ−CWP1Δ株、PDR5Δ−PDR10Δ株、CWP1Δ−PDR5Δ−PDR10Δ株は、それぞれ、野生株の13.68倍、3.58倍、13.62倍、6.21倍、19.78倍、14.72倍のレポーター活性を示した。これらの結果から、本発明の形質転換酵母によれば、所定のリガンド濃度に対して、野生株よりも、さらに優れた応答性を示すといえる。また、前記表29に示すように、EC50は、野生株が、6.5μmol/Lであったのに対して、PDR5Δ株が、648nmol/L、PDR10Δ株が、1μmol/L、PDR5Δ−CWP1Δ株が、789nmol/L、PDR10Δ−CWP1Δ株が、1μmol/L、PDR5Δ−PDR10Δ株が、316nmol/L、CWP1Δ−PDR5Δ−PDR10Δ株が、739nmol/Lであり、1/7から1/20に低減された。
【0395】
以上のように、マンナン結合タンパク質のコード遺伝子または排出ポンプタンパク質のコード遺伝子のいずれを欠失させることにより、前記形質転換酵母は、GRのリガンドに対して、検出感度および/または検出応答性が改善された。このため、本発明の形質転換酵母は、動物核内受容体に対するリガンドのアッセイに極めて有効といえる。
【0396】
〔実施例19〕
本実施例では、CWP1遺伝子、PDR5遺伝子、およびPDR10遺伝子のいずれかを欠失させた欠失酵母を作製し、ヒトAhR遺伝子を組み込んだ形質転換酵母を作製した。
【0397】
(1)遺伝子欠失酵母の作製
前記CWP1遺伝子、前記PDR5遺伝子、または前記PDR10遺伝子を欠失する遺伝子欠失酵母株、前記PDR5遺伝子および前記CWP1遺伝子、前記CWP1遺伝子および前記PDR10遺伝子、または前記PDR5遺伝子および前記PDR10遺伝子を欠失する遺伝子欠失酵母株、ならびに、CWP1遺伝子、PDR5遺伝子、および前記PDR10遺伝子を欠失する遺伝子欠失酵母を使用した。
【0398】
(2)レポータープラスミドの作製
前記AhRに応答する配列であるXRE配列が5個挿入されたプラスミドを、AhRレポータープラスミドとした。
【0399】
(3)動物核内受容体発現プラスミドの作製
増幅させたAhR遺伝子またはArnt遺伝子のcDNAを、前記実施例3と同様にして、前記プラスミドYEpLacGal1、10に挿入した。これによって、前記核内受容体遺伝子を有し、その上流にプロモーターを有するプラスミドYEpLacAhR/Arntを得た。このプラスミドを、AhR発現プラスミドとした。
【0400】
(4)形質転換酵母の作製
前記遺伝子欠失酵母、前記AhRレポータープラスミド、直鎖状の前記AhR発現プラスミドを使用し、下記の7種類の形質転換酵母を作製した。
1遺伝子欠失株:CWP1Δ株、PDR5Δ株、PDR10Δ株
2遺伝子欠失株:CWP1Δ−PDR5Δ株、CWP1Δ−PDR10Δ株、PDR5Δ−PDR10Δ株
3遺伝子欠失株:CWP1Δ−PDR5Δ−PDR10Δ株
【0401】
〔実施例20〕
本実施例では、前記実施例19で作製した形質転換酵母を使用し、前記リガンドとして、β−ナフトフラボンを使用し、誘導増加量を求めた。
【0402】
これらの結果を、下記表31、表32および図10に示す。図10は、β−ナフトフラボンに対する結果を示すグラフである。前記グラフにおいて、横軸は、各リガンド濃度(μmol/L)であり、具体的には、0.0001、0.001、0.01、0.1、1、10μmol/Lにおけるプロットであり、縦軸は、前記誘導増加量(レポーター活性値)である。前記グラフにおいて、黒四角のプロット(■)が、CWP1Δ株の結果であり、黒三角のプロット(▲)が、PDR5Δ株の結果であり、バツのプロット(×)がPDR10Δ株の結果であり、アスタリスクのプロット(*)が、PDR5Δ−CWP1Δ株の結果であり、黒丸のプロット(●)がPDR10Δ−CWP1Δ株の結果であり、縦線のプロット(|)がPDR5Δ−PDR10Δ株の結果であり、白三角のプロット(△)がCWP1Δ−PDR5Δ−PDR10Δ株の結果であり、黒菱形のプロット(◆)が、野生株の結果である。
【0403】
【表31】

【0404】
【表32】

【0405】
前記表31、表32および図10に示すように、野生株は、検出可能なβ−ナフトフラボン濃度が10nmol/L以上であった。これに対して、全ての欠失株について、β−ガラクトシダーゼの誘導が確認できた。中でも、PDR5Δ株は、β−ナフトフラボン濃度が10nmol/Lの場合、野生株と比較して高いβ−ガラクトシダーゼの誘導が確認でき、また、その他の株は、β−ナフトフラボン濃度1nmol/Lでβ−ガラクトシダーゼの誘導が確認できた。この結果から、本発明の形質転換酵母によれば、PDR5遺伝子、PDR10遺伝子、およびCWP1遺伝子の少なくともいずれかを欠失させることによって、AhRに対するリガンドが低濃度であっても、十分に優れた感度を得ることができる。また、全ての遺伝子欠失株が、検出可能なリガンド濃度において、野生株よりも高いレポーター活性を示した。具体例として、前記表32に示すように、リガンド濃度10nmol/LではCWP1Δ株、PDR5Δ株、PDR10Δ株、PDR5Δ−CWP1Δ株、PDR10Δ−CWP1Δ株、PDR5Δ−PDR10Δ株、CWP1Δ−PDR5Δ−PDR10Δ株は、それぞれ、野生株の16.68倍、5.52倍、38.73倍,29.25倍、12.54倍,96.08倍、または95.28倍のレポーター活性を示した。これらの結果から、本発明の形質転換酵母によれば、所定のリガンド濃度に対して、野生株よりも、さらに優れた応答性を示すといえる。また、前記表31に示すように、EC50は、野生株が、771nmol/Lであったのに対して、CWP1Δ株が、96.9nmol/L、PDR10Δ株が、86.2nmol/L、PDR5Δ−CWP1Δ株が、85.6nmol/L、PDR10Δ−CWP1Δ株が、94.9nmol/L、PDR5Δ−PDR10Δ株が、2.72nmol/L、CWP1Δ−PDR5Δ−PDR10Δ株が、10.9nmol/Lであり、1/8から1/283に低減された。
【0406】
以上のように、マンナン結合タンパク質のコード遺伝子または排出ポンプタンパク質のコード遺伝子のいずれを欠失させることにより、前記形質転換酵母は、AhRのリガンドに対して、検出感度および/または検出応答性が改善された。このため、本発明の形質転換酵母は、動物核内受容体に対するリガンドのアッセイに極めて有効といえる。
【0407】
〔実施例21〕
本実施例では、CWP1遺伝子、CWP2遺伝子、PDR5遺伝子およびPDR10遺伝子のいずれかを欠失させた欠失酵母を作製し、ヒトAR遺伝子を組み込んだ形質転換酵母を作製した。
【0408】
(1)遺伝子欠失酵母の作製
前記PDR5遺伝子を欠失する遺伝子欠失酵母株、前記PDR5遺伝子および前記CWP1遺伝子、前記PDR5遺伝子および前記CWP2遺伝子、前記CWP1遺伝子および前記CWP2遺伝子、または前記PDR5遺伝子および前記PDR10遺伝子を欠失する遺伝子欠失酵母株、ならびに、CWP1遺伝子、PDR5遺伝子およびPDR10遺伝子、またはCWP1遺伝子、CWP2遺伝子およびPDR5遺伝子を欠失する遺伝子欠失酵母を使用した。
【0409】
(2)レポータープラスミドの作製
前記ARに応答する配列であるGRE配列が8個挿入されたプラスミドを、ARレポータープラスミドとした。
【0410】
(3)動物核内受容体発現プラスミドの作製
増幅させたAR遺伝子のcDNAを、制限酵素BamHIおよびXhoIで切断した。切断した前記cDNAを、制限酵素BamHIおよびSalI切断した前記プラスミドpUdp6に挿入した。前記プラスミドpUdp6において、前記切断したAR遺伝子のcDNAは、前記GAL10プロモーターの下流に挿入した。これによって、前記核内受容体遺伝子を有し、その上流にプロモーターを有するAR発現プラスミドpUdp6ARを得た。
【0411】
(4)形質転換酵母の作製
前記遺伝子欠失酵母、ARレポータープラスミド、直鎖状の前記AR発現プラスミド、前記動物転写因子発現プラスミドを使用し、下記の7種類の形質転換酵母を作製した。
1遺伝子欠失株:PDR5Δ株
2遺伝子欠失株:PDR5Δ−CWP1Δ株、PDR5Δ−CWP2Δ株、CWP1Δ−CWP2Δ株、PDR5Δ−PDR10Δ株
3遺伝子欠失株:CWP1Δ−PDR5Δ−PDR10Δ株、CWP1Δ−CWP2Δ−PDR5Δ株
【0412】
〔実施例22〕
本実施例では、前記実施例21で作製した形質転換酵母を使用し、前記リガンドとして、テストステロンを使用し、誘導増加量を求めた。
【0413】
これらの結果を、下記表33、表34および図11に示す。図11は、テストステロンに対する結果を示すグラフである。前記グラフにおいて、横軸は、各リガンド濃度(μmol/L)であり、具体的には、0.000001、0.00001、0.0001、0.001、0.01、0.1、1、10、100μmol/Lにおけるプロットであり、縦軸は、リガンドにより誘導された誘導増加量(レポーター活性値)である。前記グラフにおいて、黒菱形のプロット(◆)が野生株の結果であり、黒四角のプロット(■)がPDR5Δ株の結果であり、黒三角のプロット(▲)がCWP1Δ−PDR5Δ株の結果であり、バツのプロット(×)がCWP2Δ−PDR5Δ株の結果であり、アスタリスクのプロットが(*)がCWP1Δ−CWP2株の結果であり、黒丸のプロット(●)がCWP1Δ−CWP2Δ−PDR5Δ株の結果であり、縦線のプロット(|)がPDR5Δ−PDR10Δ株の結果であり、白三角のプロット(△)がCWP1Δ−PDR5Δ−PDR10Δ株の結果である。
【0414】
【表33】

【0415】
【表34】

【0416】
前記表33、表34および図11に示すように、全ての変異株が、検出可能なリガンド濃度において、野生株よりも高いレポーター活性を示した。具体例として、前記表34に示すように、テストステロン濃度100nmol/Lにおいて、PDR5Δ株、CWP1Δ−PDR5Δ株、CWP2Δ−PDR5Δ株、CWP1Δ−CWP2Δ株、CWP1Δ−CWP2Δ−PDR5Δ株、PDR5Δ−PDR10Δ株、CWP1Δ−PDR5Δ−PDR10Δ株は、それぞれ、野生株の7.7倍、18.52倍、3.33倍、5.49倍、7.42倍、10.07倍、4.57倍のレポーター活性を示した。これらの結果から、本発明の形質転換酵母によれば、所定のリガンド濃度に対して、野生株よりも、さらに優れた応答性を示すといえる。また、前記表33に示すように、EC50は、野生株が、53.1nmol/Lであったのに対して、CWP1Δ−CWP2Δが、26.4nmol/L、CWP1Δ−CWP2Δ−PDR5Δ株が、7.99nmol/Lであり、それぞれ1/2および1/7に低減された。
【0417】
以上のように、マンナン結合タンパク質のコード遺伝子または排出ポンプタンパク質のコード遺伝子のいずれを欠失させることにより、前記形質転換酵母は、ARのリガンドに対して、検出感度および/または検出応答性が改善された。このため、本発明の形質転換酵母は、動物核内受容体に対するリガンドのアッセイに極めて有効といえる。
【0418】
〔実施例23〕
本実施例では、PDR5遺伝子を欠失させた欠失酵母を作製し、ヒトMR遺伝子を組み込んだ形質転換酵母を作製した。
【0419】
(1)遺伝子欠失酵母の作製
前記PDR5遺伝子を欠失する遺伝子欠失酵母株を使用した。
【0420】
(2)レポータープラスミドの作製
前記MRに応答する配列であるGRE配列が8個挿入されたプラスミドを、MRレポータープラスミドとした。
【0421】
(3)動物核内受容体発現プラスミドの作製
増幅させたMR遺伝子のcDNAを、制限酵素AflIIで切断後平滑化し、その後BglIIで切断した。切断した前記cDNAを、制限酵素HindIIIで切断後、平滑化し、その後BamHIで切断した前記プラスミドpUdp6に挿入した。前記プラスミドpUdp6において、前記切断したMR遺伝子のcDNAは、前記gal10プロモーターの下流に挿入した。これによって、前記核内受容体遺伝子を有し、その上流にプロモーターを有するMR発現プラスミドpUdp6MRを得た。
【0422】
(4)形質転換酵母の作製
前記遺伝子欠失酵母、前記MRレポータープラスミド、直鎖状の前記MR発現プラスミド、前記動物転写因子発現プラスミドを使用し、PDR5Δ株を作製した。
【0423】
〔実施例24〕
本実施例では、前記実施例23で作製した形質転換酵母を使用し、前記リガンドとして、アルドステロンを使用し、誘導増加量を求めた。
【0424】
これらの結果を、下記表35、表36および図12に示す。図12は、アルドステロンに対する結果を示すグラフである。前記グラフにおいて、横軸は、各リガンド濃度(μmol/L)であり、具体的には、0.001、0.01、0.1、1、10μmol/Lにおけるプロットであり、縦軸は、前記誘導増加量(レポーター活性値)である。前記グラフにおいて、黒四角のプロット(■)が、PDR5Δ株の結果であり、黒菱形のプロット(◆)が、野生株の結果である。
【0425】
【表35】

【0426】
【表36】

【0427】
前記表35、表36および図12に示すように、野生株、PDR5Δ株ともに検出可能なアルドステロン濃度は10 nmol/L以上であった。PDR5Δ株では、リガンド濃度100nmol/Lにおいて、野生株の59.1倍のレポーター活性を示した。またEC50は野生株が790nmol/Lであったのに対し、PDR5Δ株が、61.1nmol/Lであり、1/13に低減された。
【0428】
以上のように、PDR5遺伝子を欠失させることによって、前記形質転換酵母は、MRのリガンドに対して、検出感度および/または検出応答性が改善された。このため、本発明の形質転換酵母は、動物核内受容体に対するリガンドのアッセイに極めて有効といえる。
【0429】
以上の本発明の実施例の結果から、マンナン結合タンパク質のコード遺伝子または排出ポンプタンパク質のコード遺伝子のいずれを欠失させることにより、前記形質転換酵母は、核内受容体遺伝子の種類に関わらず、動物核内受容体のリガンドに対して、検出感度および/または検出応答性が改善された。このため、本発明の形質転換酵母は、動物核内受容体に対するリガンドのアッセイに極めて有効といえる。
【産業上の利用可能性】
【0430】
以上のように、本発明の形質転換酵母を用いれば、高検出感度で、核内受容体に対するリガンドの分析が可能となる。したがって、本発明の分析方法は、例えば、化学物質およびタンパク質等のリガンドの分析の分野において、有用な方法であり、その用途は制限されず広い。
【特許請求の範囲】
【請求項1】
核内受容体遺伝子およびレポーター遺伝子が発現可能に導入されており、かつ核内受容体リガンドと核内受容体との複合体を認識して前記レポーター遺伝子を発現し得る形質転換酵母であって、
さらに、細胞壁タンパク質の機能および排出ポンプタンパク質の機能の少なくとも一方が欠損されたことを特徴とする形質転換酵母。
【請求項2】
前記細胞壁タンパク質のコード遺伝子を欠失することにより、前記細胞壁タンパク質の機能を欠損する、請求項1記載の形質転換酵母。
【請求項3】
前記細胞壁タンパク質のコード遺伝子が、マンナン結合タンパク質のコード遺伝子である、請求項1または2記載の形質転換酵母。
【請求項4】
前記マンナン結合タンパク質のコード遺伝子が、CWP1遺伝子、CWP2遺伝子、CCW14遺伝子、CIS3遺伝子、KRE11遺伝子、PIR1遺伝子、PIR3遺伝子、TIP1遺伝子、TIR1遺伝子およびTIR2遺伝子からなる群から選択された少なくとも一つである、請求項3記載の形質転換酵母。
【請求項5】
前記排出ポンプタンパク質のコード遺伝子を欠失することにより、前記排出ポンプタンパク質の機能を欠損する、請求項1から4のいずれか一項に記載の形質転換酵母。
【請求項6】
前記排出ポンプタンパク質のコード遺伝子が、ABCトランスポーター遺伝子である、請求項1から5のいずれか一項に記載の形質転換酵母。
【請求項7】
前記ABCトランスポーター遺伝子が、PDR5遺伝子、STE6遺伝子、PDR12遺伝子、PDR15遺伝子、SNQ2遺伝子、YOR1遺伝子、YDR061W遺伝子、PDR18遺伝子、YOL075C遺伝子、YBT1遺伝子、AUS1遺伝子、PDR10遺伝子、PDR11遺伝子からなる群から選択された少なくとも一つである、請求項6記載の形質転換酵母。
【請求項8】
前記細胞壁タンパク質のコード遺伝子および前記排出ポンプタンパク質のコード遺伝子を欠失する、請求項1から7のいずれか一項に記載の形質転換酵母。
【請求項9】
前記核内受容体が、動物核内受容体である、請求項1から8のいずれか一項に記載の形質転換酵母。
【請求項10】
前記動物核内受容体が、ヒト核内受容体である、請求項9記載の形質転換酵母。
【請求項11】
前記核内受容体が、ホモ二量体、ヘテロ二量体または単量体の受容体である、請求項1から10のいずれか一項に記載の形質転換酵母。
【請求項12】
前記ヘテロ二量体の受容体が、レチノイドX受容体(RXR)を含む受容体である、請求項11記載の形質転換酵母。
【請求項13】
前記ヘテロ二量体の受容体が、前記RXRとPXRとのヘテロ二量体である、請求項12記載の形質転換酵母。
【請求項14】
前記レポーター遺伝子が、β−ガラクトシダーゼ遺伝子である、請求項1から13のいずれか一項に記載の形質転換酵母。
【請求項15】
前記核内受容体遺伝子を染色体上に有し、
前記レポーター遺伝子をプラスミドに有し、
前記プラスミドは、前記レポーター遺伝子と作動的に組み込まれた核内受容体応答配列を含む、請求項1から14のいずれか一項に記載の形質転換酵母。
【請求項16】
前記形質転換酵母が、出芽酵母(Saccharomyces cerevisiae)である、請求項1から15のいずれか一項に記載の形質転換酵母。
【請求項17】
検体に含まれる、核内受容体に対するリガンドの分析に使用される、請求項1から16のいずれか一項に記載の形質転換酵母。
【請求項18】
検体に含まれる核内受容体リガンドを分析するための方法であって、
検体を含む培地中で、請求項1から17のいずれか一項に記載の形質転換酵母を培養する培養工程と、
前記培養工程の後、前記培地中に産生された前記レポーター遺伝子の発現産物を測定する測定工程とを含むことを特徴とする分析方法。
【請求項19】
前記レポーター遺伝子が、β−ガラクトシダーゼ遺伝子であり、
前記培地が、炭素源として、ガラクトースおよびグルコースの少なくとも一方を含む、請求項18記載の分析方法。
【請求項20】
検体に含まれる核内受容体リガンドを分析するための分析キットであって、
(a)培地と、
(b)請求項1から17のいずれか一項に記載の形質転換酵母と、
(c)発色試薬と
を備えることを特徴とする分析キット。
【請求項21】
前記培地が、グルコースおよびガラクトースの少なくとも一方を含む培地である、請求項20記載の分析キット。
【請求項1】
核内受容体遺伝子およびレポーター遺伝子が発現可能に導入されており、かつ核内受容体リガンドと核内受容体との複合体を認識して前記レポーター遺伝子を発現し得る形質転換酵母であって、
さらに、細胞壁タンパク質の機能および排出ポンプタンパク質の機能の少なくとも一方が欠損されたことを特徴とする形質転換酵母。
【請求項2】
前記細胞壁タンパク質のコード遺伝子を欠失することにより、前記細胞壁タンパク質の機能を欠損する、請求項1記載の形質転換酵母。
【請求項3】
前記細胞壁タンパク質のコード遺伝子が、マンナン結合タンパク質のコード遺伝子である、請求項1または2記載の形質転換酵母。
【請求項4】
前記マンナン結合タンパク質のコード遺伝子が、CWP1遺伝子、CWP2遺伝子、CCW14遺伝子、CIS3遺伝子、KRE11遺伝子、PIR1遺伝子、PIR3遺伝子、TIP1遺伝子、TIR1遺伝子およびTIR2遺伝子からなる群から選択された少なくとも一つである、請求項3記載の形質転換酵母。
【請求項5】
前記排出ポンプタンパク質のコード遺伝子を欠失することにより、前記排出ポンプタンパク質の機能を欠損する、請求項1から4のいずれか一項に記載の形質転換酵母。
【請求項6】
前記排出ポンプタンパク質のコード遺伝子が、ABCトランスポーター遺伝子である、請求項1から5のいずれか一項に記載の形質転換酵母。
【請求項7】
前記ABCトランスポーター遺伝子が、PDR5遺伝子、STE6遺伝子、PDR12遺伝子、PDR15遺伝子、SNQ2遺伝子、YOR1遺伝子、YDR061W遺伝子、PDR18遺伝子、YOL075C遺伝子、YBT1遺伝子、AUS1遺伝子、PDR10遺伝子、PDR11遺伝子からなる群から選択された少なくとも一つである、請求項6記載の形質転換酵母。
【請求項8】
前記細胞壁タンパク質のコード遺伝子および前記排出ポンプタンパク質のコード遺伝子を欠失する、請求項1から7のいずれか一項に記載の形質転換酵母。
【請求項9】
前記核内受容体が、動物核内受容体である、請求項1から8のいずれか一項に記載の形質転換酵母。
【請求項10】
前記動物核内受容体が、ヒト核内受容体である、請求項9記載の形質転換酵母。
【請求項11】
前記核内受容体が、ホモ二量体、ヘテロ二量体または単量体の受容体である、請求項1から10のいずれか一項に記載の形質転換酵母。
【請求項12】
前記ヘテロ二量体の受容体が、レチノイドX受容体(RXR)を含む受容体である、請求項11記載の形質転換酵母。
【請求項13】
前記ヘテロ二量体の受容体が、前記RXRとPXRとのヘテロ二量体である、請求項12記載の形質転換酵母。
【請求項14】
前記レポーター遺伝子が、β−ガラクトシダーゼ遺伝子である、請求項1から13のいずれか一項に記載の形質転換酵母。
【請求項15】
前記核内受容体遺伝子を染色体上に有し、
前記レポーター遺伝子をプラスミドに有し、
前記プラスミドは、前記レポーター遺伝子と作動的に組み込まれた核内受容体応答配列を含む、請求項1から14のいずれか一項に記載の形質転換酵母。
【請求項16】
前記形質転換酵母が、出芽酵母(Saccharomyces cerevisiae)である、請求項1から15のいずれか一項に記載の形質転換酵母。
【請求項17】
検体に含まれる、核内受容体に対するリガンドの分析に使用される、請求項1から16のいずれか一項に記載の形質転換酵母。
【請求項18】
検体に含まれる核内受容体リガンドを分析するための方法であって、
検体を含む培地中で、請求項1から17のいずれか一項に記載の形質転換酵母を培養する培養工程と、
前記培養工程の後、前記培地中に産生された前記レポーター遺伝子の発現産物を測定する測定工程とを含むことを特徴とする分析方法。
【請求項19】
前記レポーター遺伝子が、β−ガラクトシダーゼ遺伝子であり、
前記培地が、炭素源として、ガラクトースおよびグルコースの少なくとも一方を含む、請求項18記載の分析方法。
【請求項20】
検体に含まれる核内受容体リガンドを分析するための分析キットであって、
(a)培地と、
(b)請求項1から17のいずれか一項に記載の形質転換酵母と、
(c)発色試薬と
を備えることを特徴とする分析キット。
【請求項21】
前記培地が、グルコースおよびガラクトースの少なくとも一方を含む培地である、請求項20記載の分析キット。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【公開番号】特開2012−70730(P2012−70730A)
【公開日】平成24年4月12日(2012.4.12)
【国際特許分類】
【出願番号】特願2011−189468(P2011−189468)
【出願日】平成23年8月31日(2011.8.31)
【出願人】(000214272)長瀬産業株式会社 (137)
【出願人】(505127721)公立大学法人大阪府立大学 (688)
【Fターム(参考)】
【公開日】平成24年4月12日(2012.4.12)
【国際特許分類】
【出願日】平成23年8月31日(2011.8.31)
【出願人】(000214272)長瀬産業株式会社 (137)
【出願人】(505127721)公立大学法人大阪府立大学 (688)
【Fターム(参考)】
[ Back to top ]

