微小容量の試料溶液を形成する方法
【課題】微小流路型チップを用いて、リンパ細胞のような微小な物質を、微小容量の試料溶液として容易に分離できる方法を提供する。
【解決手段】
水に混和若しくは溶解する試料または親水性の試料(対象試料)を含有する独立の分画を連続して形成する、微小容量の試料溶液を形成する方法。対象試料を含有する水性溶液を経路1に注入し、油類を経路2に注入し、経路1と経路2とは合流して経路3を形成し、経路1と経路2との合流部において、水性溶液と油類とは、交互に、独立の分画を形成し、経路3中に前記対象試料が含有される水性溶液の独立分画が得られる前記方法。
【解決手段】
水に混和若しくは溶解する試料または親水性の試料(対象試料)を含有する独立の分画を連続して形成する、微小容量の試料溶液を形成する方法。対象試料を含有する水性溶液を経路1に注入し、油類を経路2に注入し、経路1と経路2とは合流して経路3を形成し、経路1と経路2との合流部において、水性溶液と油類とは、交互に、独立の分画を形成し、経路3中に前記対象試料が含有される水性溶液の独立分画が得られる前記方法。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、微小容量の試料溶液を形成する方法に関する。特に本発明は、細胞のような生体物質が、制御された数、例えば、1つ含まれる微小容量の試料溶液を形成することができる方法に関する。
【背景技術】
【0002】
最近、DNAチップ、プロティンチップに続くバイオチップとして細胞チップが関心を集めている。本発明者らは直径10μmのマイクロウェルを1チップあたり数十万個、アレイ状に配置したマイクロアレイチップを用いて、そこにリンパ細胞を1個ずつ配置し、抗原刺激することで陽性の細胞を1個単位で選び出し、回収し、遺伝子解析などを行うことで、効率的、かつ特異的な抗体医薬の開発につなげる研究を行っている[民谷ら:バイオインダストリー, 20(7), 60-67(2003)](非特許文献1)。
【0003】
また、半導体産業で利用されている微細加工技術を用いて数センチ角のチップに微小な流路を形成し、ここで、混合、反応、検出などを行い、化学分析や合成を行うことが試みられている。このようなシステムではマイクロ流路型チップが用いられ、システム自体は、μTAS(micro total analysis systems)と呼ばれている。このシステムは、例えば、血液検査などの診断に使用され、あるいは細胞の分離(セルソーター)としても用いることが研究されている[高村:バイオインダストリー, 20(12), 52-58(2003)] (非特許文献2)。
【非特許文献1】民谷ら:バイオインダストリー, 20(7), 60-67(2003)
【非特許文献2】高村:バイオインダストリー, 20(12), 52-58(2003)
【発明の開示】
【発明が解決しようとする課題】
【0004】
マイクロアレイチップを用いて、抗原に特異的なリンパ細胞を選択し、回収する方法は、1つの抗原特異的リンパ細胞に基づいた特異的な抗体医薬の開発には非常に有効である。しかし、対象が直径10μm程度のリンパ細胞であること、マイクロアレイチップとリンパ細胞との相互作用(特に、細胞の粘着)があること、集積度の高いチップであればあるほど、他のリンパ細胞のコンタミの問題があること、などがあり、現状では、マイクロアレイチップのハンドリングは、必ずしも容易ではない。
【0005】
さらに、マイクロアレイチップでは、細胞のアッセイのように、反応を行うことは難しく、また、細胞を出し入れすることも容易ではない。そこで、マイクロアレイチップに代えて、フロー型のチップの開発が望まれていた。
【0006】
そこで、本発明の目的は、微小流路型チップを用いて、リンパ細胞のような微小な物質を、微小容量の試料溶液として容易に分離できる方法を提供することにある。
【課題を解決するための手段】
【0007】
上記課題を解決する本発明は以下の通りである。
[請求項1]
水に混和若しくは溶解する試料または親水性の試料(対象試料)を含有する独立の分画を連続して形成する、微小容量の試料溶液を形成する方法であって、
前記対象試料を含有する水性溶液を管状の経路1に注入し、
油類を管状の経路2に注入し、
経路1と経路2とは合流して管状の経路3を形成し、
経路1と経路2との合流部において、水性溶液と油類とは、交互に、独立の分画を形成し、経路3中に前記対象試料が含有される水性溶液の独立分画が得られる
前記方法。
[請求項2]
前記水性溶液中に含まれる対象試料の濃度及び水性溶液の独立分画の容量を制御することで、形成される独立分画中に含まれる対象試料の数を制御する請求項1に記載の方法。
[請求項3]
前記油類は、粘度が10〜150cpsの範囲である請求項1または2に記載の方法。
[請求項4]
前記油類は、ミネラルオイル、サラダ油、またはココナッツ油である請求項1〜3のいずれか1項に記載の方法。
[請求項5]
水性溶液の流速は、0.2〜1.5μl/minの範囲であり、
油類の流速は、0.2〜1.5μl/minの範囲である請求項1〜4のいずれか1項に記載の方法。
[請求項6]
経路1〜3の断面形状が矩形であり、
経路1の幅及び深さは独立に30〜500μmの範囲であり、
経路2の幅及び深さは立に30〜500μmの範囲であり、
経路3の幅及び深さは独立に30〜500μmの範囲である請求項1〜5のいずれか1項に記載の方法。
[請求項7]
前記合流部において、
経路1と経路2とがなす角度は60°〜120°の範囲であり、
経路1と経路3とがなす角度は120°〜150°の範囲であり、
経路2と経路3とがなす角度は90°〜150°の範囲である請求項1〜6のいずれか1項に記載の方法。
[請求項8]
水性溶液の各独立分画の容量が1.0 nl〜1.0μlの範囲であり、
油類の各独立分画の容量が1.0 nl〜1.0μlの範囲である請求項1〜7のいずれか1項に記載の方法。
[請求項9]
経路1、経路2及び経路3の内壁は、PDMS、ガラス、またはPDMS及びガラスの組合せで形成されている請求項1〜8のいずれか1項に記載の方法。
[請求項10]
前記対象試料が、生体物質、有機物または無機物である請求項1〜8のいずれか1項に記載の方法。
[請求項11]
生体物質が、細胞、タンパク質、核酸、または細胞組織である請求項9に記載の方法。
【発明の効果】
【0008】
本発明によれば、移動成分を用いず、流体の流速を変化させることで、微小容量の試料溶液を簡単形成することができる。本発明の方法に用いるシステムは組み立て及び操作が容易でありコンパートメント形成現象は連続的で安定なプロセスであり、混合懸濁液から特定の単一細胞の分離、及び特定の単一細胞遺伝物質の分析に用いることができる。
【発明を実施するための最良の形態】
【0009】
本発明は、水に混和若しくは溶解する試料または親水性の試料(対象試料)を含有する独立の分画を連続して形成する、微小容量の試料溶液を形成する方法である。各微小容量の試料溶液には、所定量(数)の対象試料が含まれており、水性溶液中に含まれる対象試料の濃度及び水性溶液の独立分画の容量等を制御することで、各微小容量の試料溶液に1つの対象試料が含まれるように制御することも可能である。
【0010】
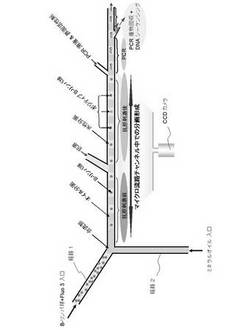
本発明の方法では、図1に示すようなマイクロ流路型チップを用いて実施することができる。このマイクロ流路型チップは、それぞれ管状の経路1、経路2及び経路3を有し、この3つの経路は、合流部で合流している。合流部における各経路のなす角度は、経路1と経路2とがなす角度は、例えば、60°〜120°の範囲であり、経路1と経路3とがなす角度は、例えば、120°〜150°の範囲であり、経路2と経路3とがなす角度は、例えば、90°〜150°の範囲である。合流部における各経路のなす角度を上記範囲にすることで、経路1と経路2との合流部において、水性溶液と油類とは、交互に、独立の分画を形成し、経路3中に前記対象試料が含有される水性溶液の独立分画が得られ易くなる。
【0011】
マイクロ流路型チップは、各経路に相当する溝を1つの主表面に成形した基板とこの溝を多い各経路を形成するようにもう一方の基板を張り合わせて形成することができる。いずれの基板もPDMS(ポリジメチルシロキサン)のような樹脂やガラス等で形成することができ、両方の基板をPDMSのような樹脂またはガラスで形成することも、一方の基板をPDMSのような樹脂で形成し、他方の基板をガラス形成することもできる。従って、経路1、経路2及び経路3の内壁は、PDMSのような樹脂、ガラス、またはPDMSのような樹脂及びガラスの組合せで形成されていることができる。尚、PDMSの経路(流路)内壁は、例えば、酸素プラズマイオンェッチング等で親水性にすることができる。
【0012】
経路1〜3の断面形状は、特に制限されないが、例えば、矩形や円形または半円形等であることができる。各経路の断面積は、1つの経路の中では一定していることが、経路3において安定して分画を形成し、維持するために好ましい。また、経路1〜3の断面積は、同一であることが適当であるが、同一である場合に限られない。
【0013】
経路1〜3の断面形状が矩形である場合、経路1の幅及び深さは独立に、例えば、30〜500μmの範囲であり、経路2の幅及び深さは立に、例えば、30〜500μmの範囲であり、経路3の幅及び深さは独立に、例えば、30〜500μmの範囲であることができる。経路1は、好ましくは、幅及び深さが独立に30〜200μmの範囲であり、経路2は、好ましくは、幅及び深さが独立に30〜200μmの範囲であり、経路3は、好ましくは、幅及び深さが独立に30〜200μmの範囲であることができる。経路1〜3の断面形状が、矩形以外である場合は、上記矩形の断面積とほぼ同様の範囲であることが適当である。円形または半円形の場合、直径は例えば、30〜500μmの範囲であることが適当である。
【0014】
上記マイクロ流路型チップを用い、対象試料を含有する水性溶液を経路1に注入し、油類を経路2に注入する。対象試料を含有する水性溶液及び油類の注入は、マイクロシリンジポンプ等のポンプを用いて、流速を所定の値に制御しながら行うことが適当である。そして、経路1と経路2との合流部において、水性溶液と油類とは、交互に、独立の分画を形成し、経路3中に前記対象試料が含有される水性溶液の独立分画が得られる。
【0015】
水性溶液の各独立分画の容量は、例えば、1.0 nl〜1.0μlの範囲であり、油類の各独立分画の容量は、例えば、1.0 nl〜1.0μlの範囲である。水性溶液の各独立分画の容量及び油類の各独立分画の容量は、2種類の溶液の流速等を変化させることで、適宜制御することができる。
【0016】
本発明において、独立分画を形成する対象である「水に混和若しくは溶解する試料または親水性の試料」(対象試料)は、水に混和するか、若しくは溶解する試料である、または親水性の試料であれば特に制限されない。対象試料は、例えば、例えば、生体物質、有機物または無機物であることができ、さらに、生体物質は、細胞、タンパク質、核酸、細胞組織、または菌体などであることができる。本発明の方法の目的の1つが、物質または物質の集合体として、単一物(例えば、単一粒子)を、1つの独立分画に格納した、独立分画を形成することである。例えば、対象試料が、本発明によれば、細胞の場合、1つの独立分画に1つの細胞を格納した分画を連続的に形成することができる。
【0017】
油類は、粘度が10〜150cpsの範囲であるものが好ましく、15〜100 cpsの範囲であることがより好ましく、この範囲の粘度を有する油類としては、例えば、ミネラルオイル、シリコンオイル、サラダ油、ココナッツ油等を挙げることができる。さらに、前記油類は、比較的粘度が低いとうい観点から、ミネラルオイル、サラダ油、ココナッツ油であることが好ましい。
【0018】
対象試料を含有する水性溶液の流速は、例えば、0.2〜1.5μl/minの範囲とし、油類の流速は、0.2〜1.5μl/minの範囲とすることが適当である。この範囲に対象試料を含有する水性溶液及び油類の流速を制御することが、よりきれいな独立分画(コンパートメント)を形成するという観点から好ましい。
【0019】
対象試料を含有する水性溶液中に含まれる対象試料の濃度及び水性溶液の独立分画の容量を制御することで、形成される独立分画中に含まれる対象試料の数を制御することができる。例えば、図1に、対象試料が蛍光標識されたリンパ球であり、水性溶液の独立分画中にこのリンパ球を1つずつ格納する様子を示す。水性溶液の独立分画中に格納されるリンパ球の数は、リンパ球を含有する水性溶液中に含まれるリンパ球の濃度及び水性溶液の独立分画の容量を制御することで、適宜制御できる。
【0020】
本発明の方法により形成された微小容量の試料溶液は、経路3の延長上で、各微小容量の独立分画について、各分画に含まれる試料についての分析等を行うことができる。例えば、図1には、1つのリンパ球(蛍光標識された)を格納した分画について、抗原を作用させ、リンパ球の抗原に対する反応性を、リンパ球から発せられる蛍光を検出することにより判定し、抗原に対する反応性を有するリンパ球を分取する方法を示す。この方法は、具体的には以下のように行うことができる。経路3の途中の流路において、独立分画になった細胞溶液に対して抗原溶液を導入し、蛍光顕微鏡下で、例えば、細胞内カルシウム濃度に依存する蛍光色素を刺激前後で検出し、蛍光強度が大きく、抗原に対する反応性を示すリンパ球を含む独立分画を分取する。
【0021】
さらに、図1には、抗原特異性を判定したリンパ球について、分画毎に、その遺伝子をPCRにより増幅する方法も示している。この方法は、具体的には以下のように行うことができる。抗原特異的なリンパ球細胞を検出した後、独立分画になった細胞容液が流れる流路中に、界面活性剤およびPCR反応溶液を導入し、細胞破砕およびPCR反応を行う。なおPCRはカートリッジヒーターなどを用いて流路中の温度をコントロールして行うことができる。
【実施例】
【0022】
以下、本発明を実施例によりさらに詳細に説明する。
PDMSチップは、フォトリソグラフィー技術を用いて作製した(Whitesides et al., 2001)。PDMS マイクロ流路型チップ作製の第一段階は、 PDMSデバイスの鋳型の作製である。この鋳型は、直径4インチのシリコン ウエハー から4 cmの断片を切り出し、水中で10 min、次いで沸騰アセトン中で約10 min洗浄し、窒素ブロアーで乾燥した。
【0023】
フォトレジストであるSU-8 50 (Microchem, USA)をシリコン基板上に2 ml載せ、スピンコータにより2000 rpm、10 秒間コーティングした。95oCで20 minソフトベーキングして、フォトレジストから溶媒を除去した。流路1と流路2の間の接触角度として60、90 又は120o を有するY-字型にデザインされたフォトマスク(50μm x 50μm 又は100μm x 100μm(幅及び深さ))を用いてフォトリソグラフィーを行った。フォトリソグラフィーは、マスクアライナーを用いて約380 mJ/cm2、30 秒間紫外線を照射し、その後、現像液を用いて未重合のフォトレジストを除き、SU-8の鋳型とした。
【0024】
次に、PDMSのモノマー及び その架橋剤を体積比10:1 で充分に混合し、かつ真空下で、混合中に発生した空気の泡を除去し、混合物はSU-8鋳型に注入し、80oC で60 min.硬化させた。 PDMS チップはSU-8鋳型から剥がし、2つの注入口及び排出口をニードル形状のもので形成し、チューブを取り付け、PDMS混合物(10:1)でシールして再度120oCで10 min硬化させた。得られたPDMSマイクロ流路型チップ表面を酸素プラズマイオンェッチングで親水性にし、ガラス 基板に接着した。流路1と2との接触角度が60、90 及び120oであり、寸法(幅及び深さ)が50μm x 50 μm 及び100μm x 100 μmのY字型 マイクロ 流路を有するPDMS/ガラスチップ デバイスを、蛍光単一微粒子の分離及び単一B-細胞の分析及び選別に用いた(図1)。
。
【0025】
マイクロ流路型チップデバイスを、蛍光顕微鏡に設置した。画像作製(イメージング)は、CCDカメラによって行った。これはリアルタイムイメージングが容易であり、コンピューターで制御された。水性及び非水性ミネラルオイル溶液は、100 μl のマイクロシリンジを用いてポンプ送液された。
【0026】
水性(ニュートラルレッドを溶解したもの)及び非水性溶液、例えば、ミネラルオイル及び市販のサラダ油及びココナッツ油のコンパートメント形成の視覚化を、50μm x 50μm及び100μm x 100μmマイクロ流路型流路を用いて、0.2-1.5 μl/minの範囲の流速で、CCDカメラ装着蛍光立体写真顕微鏡で行った。ニュートラルレッド 0.1% (w/v) 水溶液は、蒸留水で調製し、未溶解ニュートラルレッドの粒子をフィルターで除去した。ミネラルオイルはそのまま使用した。それらを流路同志の接触角度60o デバイスの2つの異なる注入口にポンプで、種々の流速で送液して、光顕微鏡により、ニュートラルレッド水溶液及びミネラルオイルの視覚化を行った。水性相として0.1% (w/v) FITC 溶液、非水性相としてミネラルオイルを用い、0.2-2.0 μl/minの流速で、60、90または120oの角度のPDMS/ガラスマイクロ流路型デバイスで、同様の試験を行った。
【0027】
60oの角度のPDMS/ガラスマイクロ流路型デバイスを用いた系は図2及び5に示す。図2のAは、マイクロ流路型デバイスの全体の写真であり、Bは、を独立分画にした様子を示す。図5はココナッツ油とエオシン水溶液を用いた系であり、Aは光学顕微鏡を用いて観察した画像であり、Bは蛍光顕微鏡を用いて観察した画像である。
【0028】
90oの角度のPDMS/ガラスマイクロ流路型デバイスを用いた系は図7に示す。Aは、マイクロ流路型デバイスの全体の写真であり、Bは、FITC水溶液及びミネラルオイルを独立分画にした様子を示す。
【0029】
120oの角度のPDMS/ガラスマイクロ流路型デバイスを用いた系は図3、4、6に示す。図3はミネラルオイルとFITC水溶液を用いた系であり、Aは、マイクロ流路型デバイスの全体の写真であり、Bは、FITC水溶液及びミネラルオイルを独立分画にした様子を示す。図4はサラダ油とエオシン水溶液を用いた系であり、Aは光学顕微鏡を用いて観察した画像であり、Bは蛍光顕微鏡を用いて観察した画像である。図6はミネラルオイルを用い蛍光ビーズを分離した系である。Aは光学顕微鏡を用いて観察した画像であり、Bは蛍光顕微鏡を用いて観察した画像である。
【0030】
図2〜7の各マイクロ流路型デバイスを用いた系における実験条件を以下の表1にまとめる。
【0031】
【表1】

【0032】
デバイスの出口から廃液を回収した。 液体溶液の流速は、マイクロシリンジポンプにより制御できた。また、コンパートメントの容量も流速をコントロールすることによって制御可能である。
【0033】
2-相液体を用いるマイクロ流路型デバイスを、単一微粒子を各コンパートメント中に分離するために用いた。これは、単一細胞分析の一例である。用いた微粒子であるポリスチレンビーズ(直径4.5μm)の大きさは、ターゲットとするB-細胞 (6-8 μm 直径)より多少小さく選択した。蛍光標識ポリスチレンビーズ溶液(105 ビーズper ml) を蒸留水中で調製して水性相とし、ミネラルオイルを対向する相として、マイクロ流路型デバイスの注入口に、100μlマイクロシリンジを用いて、それぞれ流速0.2, 0.5 及び1.0 μl/minで供給した。単一微粒子の各水性コンパートメントへの分離が観察された。
【0034】
ニュートラルレッド水溶液及びミネラルオイルを用い、60o の流路同志の接触角度でデザインされたチップを用いて行った実験を図2に示す。ニュートラルレッド水溶液及びミネラルオイルは、独立流路のウエルに入り、マイクロ流路に沿って移送され、Y字型マイクロ流路の交差点で互いに混合され、ミネラルオイル及びニュートラルレッドのコンパートメントの自発的な形成が、観察された。デバイス流路中での、ニュートラルレッド水溶液及び非水性(ミネラルオイル)相のコンパートメントを提供するナノリッター容量の安定でかつ均一な寸法の形成は、マイクロシリンジポンプからの 圧力流のみにより視覚化された(図2)。
【0035】
ナノリッター及びサブナノリッター容量を有するコンパートメント形成は、デバイスの流路同志の接触角度や流路の形状(デザイン)等に影響された。調べた接触角度の異なる3つのデバイスのいずれにおいてもコンパートメント形成が比較的容易であった。また安定な水性溶液及びミネラルオイル溶液のコンパートメントを示し、2相のコンパートメント形成は等分配であった。
【0036】
コンパートメント形成は、マイクロ流路型デバイスに用いられた液体の粘度に大きく依存する。ミネラルオイル(粘度20cps)に代えて、ココナッツ油(粘度31cps)及びサラダ油(カノーラ油)(粘度60cps)を用い、コンパートメント形成における液体の粘度の影響を調べた。その結果、ココナッツ油及びカノーラ油のいずれを使用した場合にも、ミネラルオイルを用いた場合と同様に、コンパートメントが形成された。
【0037】
これらの結果は、非水性液体の粘度は、マイクロ 流路中の液体のコンパートメント形成において、大きな役割を果たすことを示した。コンパートメント形成には、非水性液体としては、油類中では、ミネラルオイル(粘度20cps)が最も適している。流路形状のデザイン、特に流路同志の接触角度、液体の流速、液体の表面張力、流路表面の表面特性及び液体の粘度は、マイクロ流路における非水性及び水性溶液のコンパートメント形成における主な決定要因である。水性及び非水性 (ミネラルオイル) 溶液のナノリッター容量を提供する、安定で、均一な寸法のコンパートメントは、混合細胞 懸濁液からの迅速に単一細胞分離を可能にし、特定のターゲットの単一細胞の検出を可能にする。
【0038】
各コンパートメント中の単一粒子はマイクロ流路中で早く動くことも観察された。使用したCCD カメラのスピードが不十分であるため、粒子が線状に見える。各 コンパートメント中の単一微粒子または単一細胞 の分離は、流路の形状に大きく依存した。なぜなら、50 x 50 μm2の寸法を有する流路は、100 x 100 μm2 の寸法を有するデバイスよりより適当であったからである。これは、生じる表面張力が、50 x 50 μm2流路でより高いためと思われる。各コンパートメント中での単一微粒子の分離は、水性 及び非水性液体単独のコンパートメントの形成とは多少異なる。各水性コンパートメントへの単一微粒子の分離は、低流速ミネラルオイル(0.2 μl/min)が行うことができ, 高流速では、単一粒子状態の観察は難しく、水性及び非水性のコンパートメント形成が崩壊することもあった。重要なパラメーターの特定は困難であるが、コンパートメント形成及び粒子または細胞の分離において、1つ以上のパラメーターが重大な役割を果たしているものと思われる。上記結果からは、重要なパラメーターの選択は、システムによって異なり、粒子または細胞及びときには細胞の型も考慮する必要があることもある。
【0039】
上記システムは組み立て及び操作が容易であり、移動成分を用いず、流体の流速を変化させることで簡単に制御できる。 コンパートメント形成現象は連続的で安定なプロセスであり、混合懸濁液から特定の単一細胞の分離、及び特定の単一細胞遺伝物質の分析に用いることができる。
【産業上の利用可能性】
【0040】
本発明によれば、例えば、抗原特異的なリンパ球細胞のスクリーニングおよびそれらの細胞から高いアフィニティーを有するモノクローナル抗体を作製することが可能である。そのため、抗体医薬を作製する新規システム(新規デバイス)になり得ると考えられる。各コンパートメント中での種々のバイオアッセイを行うことの他に、多様なアッセイを、単一プラットフォーム中で1回の実験操作で、非水性相により相互汚染なしに行うことができる。微量液体試薬を用いた多数のアッセイフォーマットを可能にし、魅力的なμTAS(マイクロ全分析システム)となり得る。
【図面の簡単な説明】
【0041】
【図1】本発明の方法で使用する微小流路型チップの説明図。
【図2】ニュートラルレッド水溶液及びミネラルオイルを用い、60o の流路同志の接触角度でデザインされたチップを用いて行った実験の様子を示す。
【図3】120oの流路同志の接触角度のPDMS/ガラスマイクロ流路型デバイス及びミネラルオイルを用いた系で行った実験の様子を示す。
【図4】120oの流路同志の接触角度のPDMS/ガラスマイクロ流路型デバイス及びサラダ油を用いた系で行った実験の様子を示す。
【図5】60oの流路同志の接触角度のPDMS/ガラスマイクロ流路型デバイス及びココナッツ油を用いた系で行った実験の様子を示す。
【図6】120oの流路同志の接触角度のPDMS/ガラスマイクロ流路型デバイス及びミネラルオイルを用い蛍光ビーズを分離した実験の様子を示す。系を用いた系
【図7】90 oの流路同志の接触角度のPDMS/ガラスマイクロ流路型デバイスを用いた系で行った実験の様子を示す。
【技術分野】
【0001】
本発明は、微小容量の試料溶液を形成する方法に関する。特に本発明は、細胞のような生体物質が、制御された数、例えば、1つ含まれる微小容量の試料溶液を形成することができる方法に関する。
【背景技術】
【0002】
最近、DNAチップ、プロティンチップに続くバイオチップとして細胞チップが関心を集めている。本発明者らは直径10μmのマイクロウェルを1チップあたり数十万個、アレイ状に配置したマイクロアレイチップを用いて、そこにリンパ細胞を1個ずつ配置し、抗原刺激することで陽性の細胞を1個単位で選び出し、回収し、遺伝子解析などを行うことで、効率的、かつ特異的な抗体医薬の開発につなげる研究を行っている[民谷ら:バイオインダストリー, 20(7), 60-67(2003)](非特許文献1)。
【0003】
また、半導体産業で利用されている微細加工技術を用いて数センチ角のチップに微小な流路を形成し、ここで、混合、反応、検出などを行い、化学分析や合成を行うことが試みられている。このようなシステムではマイクロ流路型チップが用いられ、システム自体は、μTAS(micro total analysis systems)と呼ばれている。このシステムは、例えば、血液検査などの診断に使用され、あるいは細胞の分離(セルソーター)としても用いることが研究されている[高村:バイオインダストリー, 20(12), 52-58(2003)] (非特許文献2)。
【非特許文献1】民谷ら:バイオインダストリー, 20(7), 60-67(2003)
【非特許文献2】高村:バイオインダストリー, 20(12), 52-58(2003)
【発明の開示】
【発明が解決しようとする課題】
【0004】
マイクロアレイチップを用いて、抗原に特異的なリンパ細胞を選択し、回収する方法は、1つの抗原特異的リンパ細胞に基づいた特異的な抗体医薬の開発には非常に有効である。しかし、対象が直径10μm程度のリンパ細胞であること、マイクロアレイチップとリンパ細胞との相互作用(特に、細胞の粘着)があること、集積度の高いチップであればあるほど、他のリンパ細胞のコンタミの問題があること、などがあり、現状では、マイクロアレイチップのハンドリングは、必ずしも容易ではない。
【0005】
さらに、マイクロアレイチップでは、細胞のアッセイのように、反応を行うことは難しく、また、細胞を出し入れすることも容易ではない。そこで、マイクロアレイチップに代えて、フロー型のチップの開発が望まれていた。
【0006】
そこで、本発明の目的は、微小流路型チップを用いて、リンパ細胞のような微小な物質を、微小容量の試料溶液として容易に分離できる方法を提供することにある。
【課題を解決するための手段】
【0007】
上記課題を解決する本発明は以下の通りである。
[請求項1]
水に混和若しくは溶解する試料または親水性の試料(対象試料)を含有する独立の分画を連続して形成する、微小容量の試料溶液を形成する方法であって、
前記対象試料を含有する水性溶液を管状の経路1に注入し、
油類を管状の経路2に注入し、
経路1と経路2とは合流して管状の経路3を形成し、
経路1と経路2との合流部において、水性溶液と油類とは、交互に、独立の分画を形成し、経路3中に前記対象試料が含有される水性溶液の独立分画が得られる
前記方法。
[請求項2]
前記水性溶液中に含まれる対象試料の濃度及び水性溶液の独立分画の容量を制御することで、形成される独立分画中に含まれる対象試料の数を制御する請求項1に記載の方法。
[請求項3]
前記油類は、粘度が10〜150cpsの範囲である請求項1または2に記載の方法。
[請求項4]
前記油類は、ミネラルオイル、サラダ油、またはココナッツ油である請求項1〜3のいずれか1項に記載の方法。
[請求項5]
水性溶液の流速は、0.2〜1.5μl/minの範囲であり、
油類の流速は、0.2〜1.5μl/minの範囲である請求項1〜4のいずれか1項に記載の方法。
[請求項6]
経路1〜3の断面形状が矩形であり、
経路1の幅及び深さは独立に30〜500μmの範囲であり、
経路2の幅及び深さは立に30〜500μmの範囲であり、
経路3の幅及び深さは独立に30〜500μmの範囲である請求項1〜5のいずれか1項に記載の方法。
[請求項7]
前記合流部において、
経路1と経路2とがなす角度は60°〜120°の範囲であり、
経路1と経路3とがなす角度は120°〜150°の範囲であり、
経路2と経路3とがなす角度は90°〜150°の範囲である請求項1〜6のいずれか1項に記載の方法。
[請求項8]
水性溶液の各独立分画の容量が1.0 nl〜1.0μlの範囲であり、
油類の各独立分画の容量が1.0 nl〜1.0μlの範囲である請求項1〜7のいずれか1項に記載の方法。
[請求項9]
経路1、経路2及び経路3の内壁は、PDMS、ガラス、またはPDMS及びガラスの組合せで形成されている請求項1〜8のいずれか1項に記載の方法。
[請求項10]
前記対象試料が、生体物質、有機物または無機物である請求項1〜8のいずれか1項に記載の方法。
[請求項11]
生体物質が、細胞、タンパク質、核酸、または細胞組織である請求項9に記載の方法。
【発明の効果】
【0008】
本発明によれば、移動成分を用いず、流体の流速を変化させることで、微小容量の試料溶液を簡単形成することができる。本発明の方法に用いるシステムは組み立て及び操作が容易でありコンパートメント形成現象は連続的で安定なプロセスであり、混合懸濁液から特定の単一細胞の分離、及び特定の単一細胞遺伝物質の分析に用いることができる。
【発明を実施するための最良の形態】
【0009】
本発明は、水に混和若しくは溶解する試料または親水性の試料(対象試料)を含有する独立の分画を連続して形成する、微小容量の試料溶液を形成する方法である。各微小容量の試料溶液には、所定量(数)の対象試料が含まれており、水性溶液中に含まれる対象試料の濃度及び水性溶液の独立分画の容量等を制御することで、各微小容量の試料溶液に1つの対象試料が含まれるように制御することも可能である。
【0010】
本発明の方法では、図1に示すようなマイクロ流路型チップを用いて実施することができる。このマイクロ流路型チップは、それぞれ管状の経路1、経路2及び経路3を有し、この3つの経路は、合流部で合流している。合流部における各経路のなす角度は、経路1と経路2とがなす角度は、例えば、60°〜120°の範囲であり、経路1と経路3とがなす角度は、例えば、120°〜150°の範囲であり、経路2と経路3とがなす角度は、例えば、90°〜150°の範囲である。合流部における各経路のなす角度を上記範囲にすることで、経路1と経路2との合流部において、水性溶液と油類とは、交互に、独立の分画を形成し、経路3中に前記対象試料が含有される水性溶液の独立分画が得られ易くなる。
【0011】
マイクロ流路型チップは、各経路に相当する溝を1つの主表面に成形した基板とこの溝を多い各経路を形成するようにもう一方の基板を張り合わせて形成することができる。いずれの基板もPDMS(ポリジメチルシロキサン)のような樹脂やガラス等で形成することができ、両方の基板をPDMSのような樹脂またはガラスで形成することも、一方の基板をPDMSのような樹脂で形成し、他方の基板をガラス形成することもできる。従って、経路1、経路2及び経路3の内壁は、PDMSのような樹脂、ガラス、またはPDMSのような樹脂及びガラスの組合せで形成されていることができる。尚、PDMSの経路(流路)内壁は、例えば、酸素プラズマイオンェッチング等で親水性にすることができる。
【0012】
経路1〜3の断面形状は、特に制限されないが、例えば、矩形や円形または半円形等であることができる。各経路の断面積は、1つの経路の中では一定していることが、経路3において安定して分画を形成し、維持するために好ましい。また、経路1〜3の断面積は、同一であることが適当であるが、同一である場合に限られない。
【0013】
経路1〜3の断面形状が矩形である場合、経路1の幅及び深さは独立に、例えば、30〜500μmの範囲であり、経路2の幅及び深さは立に、例えば、30〜500μmの範囲であり、経路3の幅及び深さは独立に、例えば、30〜500μmの範囲であることができる。経路1は、好ましくは、幅及び深さが独立に30〜200μmの範囲であり、経路2は、好ましくは、幅及び深さが独立に30〜200μmの範囲であり、経路3は、好ましくは、幅及び深さが独立に30〜200μmの範囲であることができる。経路1〜3の断面形状が、矩形以外である場合は、上記矩形の断面積とほぼ同様の範囲であることが適当である。円形または半円形の場合、直径は例えば、30〜500μmの範囲であることが適当である。
【0014】
上記マイクロ流路型チップを用い、対象試料を含有する水性溶液を経路1に注入し、油類を経路2に注入する。対象試料を含有する水性溶液及び油類の注入は、マイクロシリンジポンプ等のポンプを用いて、流速を所定の値に制御しながら行うことが適当である。そして、経路1と経路2との合流部において、水性溶液と油類とは、交互に、独立の分画を形成し、経路3中に前記対象試料が含有される水性溶液の独立分画が得られる。
【0015】
水性溶液の各独立分画の容量は、例えば、1.0 nl〜1.0μlの範囲であり、油類の各独立分画の容量は、例えば、1.0 nl〜1.0μlの範囲である。水性溶液の各独立分画の容量及び油類の各独立分画の容量は、2種類の溶液の流速等を変化させることで、適宜制御することができる。
【0016】
本発明において、独立分画を形成する対象である「水に混和若しくは溶解する試料または親水性の試料」(対象試料)は、水に混和するか、若しくは溶解する試料である、または親水性の試料であれば特に制限されない。対象試料は、例えば、例えば、生体物質、有機物または無機物であることができ、さらに、生体物質は、細胞、タンパク質、核酸、細胞組織、または菌体などであることができる。本発明の方法の目的の1つが、物質または物質の集合体として、単一物(例えば、単一粒子)を、1つの独立分画に格納した、独立分画を形成することである。例えば、対象試料が、本発明によれば、細胞の場合、1つの独立分画に1つの細胞を格納した分画を連続的に形成することができる。
【0017】
油類は、粘度が10〜150cpsの範囲であるものが好ましく、15〜100 cpsの範囲であることがより好ましく、この範囲の粘度を有する油類としては、例えば、ミネラルオイル、シリコンオイル、サラダ油、ココナッツ油等を挙げることができる。さらに、前記油類は、比較的粘度が低いとうい観点から、ミネラルオイル、サラダ油、ココナッツ油であることが好ましい。
【0018】
対象試料を含有する水性溶液の流速は、例えば、0.2〜1.5μl/minの範囲とし、油類の流速は、0.2〜1.5μl/minの範囲とすることが適当である。この範囲に対象試料を含有する水性溶液及び油類の流速を制御することが、よりきれいな独立分画(コンパートメント)を形成するという観点から好ましい。
【0019】
対象試料を含有する水性溶液中に含まれる対象試料の濃度及び水性溶液の独立分画の容量を制御することで、形成される独立分画中に含まれる対象試料の数を制御することができる。例えば、図1に、対象試料が蛍光標識されたリンパ球であり、水性溶液の独立分画中にこのリンパ球を1つずつ格納する様子を示す。水性溶液の独立分画中に格納されるリンパ球の数は、リンパ球を含有する水性溶液中に含まれるリンパ球の濃度及び水性溶液の独立分画の容量を制御することで、適宜制御できる。
【0020】
本発明の方法により形成された微小容量の試料溶液は、経路3の延長上で、各微小容量の独立分画について、各分画に含まれる試料についての分析等を行うことができる。例えば、図1には、1つのリンパ球(蛍光標識された)を格納した分画について、抗原を作用させ、リンパ球の抗原に対する反応性を、リンパ球から発せられる蛍光を検出することにより判定し、抗原に対する反応性を有するリンパ球を分取する方法を示す。この方法は、具体的には以下のように行うことができる。経路3の途中の流路において、独立分画になった細胞溶液に対して抗原溶液を導入し、蛍光顕微鏡下で、例えば、細胞内カルシウム濃度に依存する蛍光色素を刺激前後で検出し、蛍光強度が大きく、抗原に対する反応性を示すリンパ球を含む独立分画を分取する。
【0021】
さらに、図1には、抗原特異性を判定したリンパ球について、分画毎に、その遺伝子をPCRにより増幅する方法も示している。この方法は、具体的には以下のように行うことができる。抗原特異的なリンパ球細胞を検出した後、独立分画になった細胞容液が流れる流路中に、界面活性剤およびPCR反応溶液を導入し、細胞破砕およびPCR反応を行う。なおPCRはカートリッジヒーターなどを用いて流路中の温度をコントロールして行うことができる。
【実施例】
【0022】
以下、本発明を実施例によりさらに詳細に説明する。
PDMSチップは、フォトリソグラフィー技術を用いて作製した(Whitesides et al., 2001)。PDMS マイクロ流路型チップ作製の第一段階は、 PDMSデバイスの鋳型の作製である。この鋳型は、直径4インチのシリコン ウエハー から4 cmの断片を切り出し、水中で10 min、次いで沸騰アセトン中で約10 min洗浄し、窒素ブロアーで乾燥した。
【0023】
フォトレジストであるSU-8 50 (Microchem, USA)をシリコン基板上に2 ml載せ、スピンコータにより2000 rpm、10 秒間コーティングした。95oCで20 minソフトベーキングして、フォトレジストから溶媒を除去した。流路1と流路2の間の接触角度として60、90 又は120o を有するY-字型にデザインされたフォトマスク(50μm x 50μm 又は100μm x 100μm(幅及び深さ))を用いてフォトリソグラフィーを行った。フォトリソグラフィーは、マスクアライナーを用いて約380 mJ/cm2、30 秒間紫外線を照射し、その後、現像液を用いて未重合のフォトレジストを除き、SU-8の鋳型とした。
【0024】
次に、PDMSのモノマー及び その架橋剤を体積比10:1 で充分に混合し、かつ真空下で、混合中に発生した空気の泡を除去し、混合物はSU-8鋳型に注入し、80oC で60 min.硬化させた。 PDMS チップはSU-8鋳型から剥がし、2つの注入口及び排出口をニードル形状のもので形成し、チューブを取り付け、PDMS混合物(10:1)でシールして再度120oCで10 min硬化させた。得られたPDMSマイクロ流路型チップ表面を酸素プラズマイオンェッチングで親水性にし、ガラス 基板に接着した。流路1と2との接触角度が60、90 及び120oであり、寸法(幅及び深さ)が50μm x 50 μm 及び100μm x 100 μmのY字型 マイクロ 流路を有するPDMS/ガラスチップ デバイスを、蛍光単一微粒子の分離及び単一B-細胞の分析及び選別に用いた(図1)。
。
【0025】
マイクロ流路型チップデバイスを、蛍光顕微鏡に設置した。画像作製(イメージング)は、CCDカメラによって行った。これはリアルタイムイメージングが容易であり、コンピューターで制御された。水性及び非水性ミネラルオイル溶液は、100 μl のマイクロシリンジを用いてポンプ送液された。
【0026】
水性(ニュートラルレッドを溶解したもの)及び非水性溶液、例えば、ミネラルオイル及び市販のサラダ油及びココナッツ油のコンパートメント形成の視覚化を、50μm x 50μm及び100μm x 100μmマイクロ流路型流路を用いて、0.2-1.5 μl/minの範囲の流速で、CCDカメラ装着蛍光立体写真顕微鏡で行った。ニュートラルレッド 0.1% (w/v) 水溶液は、蒸留水で調製し、未溶解ニュートラルレッドの粒子をフィルターで除去した。ミネラルオイルはそのまま使用した。それらを流路同志の接触角度60o デバイスの2つの異なる注入口にポンプで、種々の流速で送液して、光顕微鏡により、ニュートラルレッド水溶液及びミネラルオイルの視覚化を行った。水性相として0.1% (w/v) FITC 溶液、非水性相としてミネラルオイルを用い、0.2-2.0 μl/minの流速で、60、90または120oの角度のPDMS/ガラスマイクロ流路型デバイスで、同様の試験を行った。
【0027】
60oの角度のPDMS/ガラスマイクロ流路型デバイスを用いた系は図2及び5に示す。図2のAは、マイクロ流路型デバイスの全体の写真であり、Bは、を独立分画にした様子を示す。図5はココナッツ油とエオシン水溶液を用いた系であり、Aは光学顕微鏡を用いて観察した画像であり、Bは蛍光顕微鏡を用いて観察した画像である。
【0028】
90oの角度のPDMS/ガラスマイクロ流路型デバイスを用いた系は図7に示す。Aは、マイクロ流路型デバイスの全体の写真であり、Bは、FITC水溶液及びミネラルオイルを独立分画にした様子を示す。
【0029】
120oの角度のPDMS/ガラスマイクロ流路型デバイスを用いた系は図3、4、6に示す。図3はミネラルオイルとFITC水溶液を用いた系であり、Aは、マイクロ流路型デバイスの全体の写真であり、Bは、FITC水溶液及びミネラルオイルを独立分画にした様子を示す。図4はサラダ油とエオシン水溶液を用いた系であり、Aは光学顕微鏡を用いて観察した画像であり、Bは蛍光顕微鏡を用いて観察した画像である。図6はミネラルオイルを用い蛍光ビーズを分離した系である。Aは光学顕微鏡を用いて観察した画像であり、Bは蛍光顕微鏡を用いて観察した画像である。
【0030】
図2〜7の各マイクロ流路型デバイスを用いた系における実験条件を以下の表1にまとめる。
【0031】
【表1】

【0032】
デバイスの出口から廃液を回収した。 液体溶液の流速は、マイクロシリンジポンプにより制御できた。また、コンパートメントの容量も流速をコントロールすることによって制御可能である。
【0033】
2-相液体を用いるマイクロ流路型デバイスを、単一微粒子を各コンパートメント中に分離するために用いた。これは、単一細胞分析の一例である。用いた微粒子であるポリスチレンビーズ(直径4.5μm)の大きさは、ターゲットとするB-細胞 (6-8 μm 直径)より多少小さく選択した。蛍光標識ポリスチレンビーズ溶液(105 ビーズper ml) を蒸留水中で調製して水性相とし、ミネラルオイルを対向する相として、マイクロ流路型デバイスの注入口に、100μlマイクロシリンジを用いて、それぞれ流速0.2, 0.5 及び1.0 μl/minで供給した。単一微粒子の各水性コンパートメントへの分離が観察された。
【0034】
ニュートラルレッド水溶液及びミネラルオイルを用い、60o の流路同志の接触角度でデザインされたチップを用いて行った実験を図2に示す。ニュートラルレッド水溶液及びミネラルオイルは、独立流路のウエルに入り、マイクロ流路に沿って移送され、Y字型マイクロ流路の交差点で互いに混合され、ミネラルオイル及びニュートラルレッドのコンパートメントの自発的な形成が、観察された。デバイス流路中での、ニュートラルレッド水溶液及び非水性(ミネラルオイル)相のコンパートメントを提供するナノリッター容量の安定でかつ均一な寸法の形成は、マイクロシリンジポンプからの 圧力流のみにより視覚化された(図2)。
【0035】
ナノリッター及びサブナノリッター容量を有するコンパートメント形成は、デバイスの流路同志の接触角度や流路の形状(デザイン)等に影響された。調べた接触角度の異なる3つのデバイスのいずれにおいてもコンパートメント形成が比較的容易であった。また安定な水性溶液及びミネラルオイル溶液のコンパートメントを示し、2相のコンパートメント形成は等分配であった。
【0036】
コンパートメント形成は、マイクロ流路型デバイスに用いられた液体の粘度に大きく依存する。ミネラルオイル(粘度20cps)に代えて、ココナッツ油(粘度31cps)及びサラダ油(カノーラ油)(粘度60cps)を用い、コンパートメント形成における液体の粘度の影響を調べた。その結果、ココナッツ油及びカノーラ油のいずれを使用した場合にも、ミネラルオイルを用いた場合と同様に、コンパートメントが形成された。
【0037】
これらの結果は、非水性液体の粘度は、マイクロ 流路中の液体のコンパートメント形成において、大きな役割を果たすことを示した。コンパートメント形成には、非水性液体としては、油類中では、ミネラルオイル(粘度20cps)が最も適している。流路形状のデザイン、特に流路同志の接触角度、液体の流速、液体の表面張力、流路表面の表面特性及び液体の粘度は、マイクロ流路における非水性及び水性溶液のコンパートメント形成における主な決定要因である。水性及び非水性 (ミネラルオイル) 溶液のナノリッター容量を提供する、安定で、均一な寸法のコンパートメントは、混合細胞 懸濁液からの迅速に単一細胞分離を可能にし、特定のターゲットの単一細胞の検出を可能にする。
【0038】
各コンパートメント中の単一粒子はマイクロ流路中で早く動くことも観察された。使用したCCD カメラのスピードが不十分であるため、粒子が線状に見える。各 コンパートメント中の単一微粒子または単一細胞 の分離は、流路の形状に大きく依存した。なぜなら、50 x 50 μm2の寸法を有する流路は、100 x 100 μm2 の寸法を有するデバイスよりより適当であったからである。これは、生じる表面張力が、50 x 50 μm2流路でより高いためと思われる。各コンパートメント中での単一微粒子の分離は、水性 及び非水性液体単独のコンパートメントの形成とは多少異なる。各水性コンパートメントへの単一微粒子の分離は、低流速ミネラルオイル(0.2 μl/min)が行うことができ, 高流速では、単一粒子状態の観察は難しく、水性及び非水性のコンパートメント形成が崩壊することもあった。重要なパラメーターの特定は困難であるが、コンパートメント形成及び粒子または細胞の分離において、1つ以上のパラメーターが重大な役割を果たしているものと思われる。上記結果からは、重要なパラメーターの選択は、システムによって異なり、粒子または細胞及びときには細胞の型も考慮する必要があることもある。
【0039】
上記システムは組み立て及び操作が容易であり、移動成分を用いず、流体の流速を変化させることで簡単に制御できる。 コンパートメント形成現象は連続的で安定なプロセスであり、混合懸濁液から特定の単一細胞の分離、及び特定の単一細胞遺伝物質の分析に用いることができる。
【産業上の利用可能性】
【0040】
本発明によれば、例えば、抗原特異的なリンパ球細胞のスクリーニングおよびそれらの細胞から高いアフィニティーを有するモノクローナル抗体を作製することが可能である。そのため、抗体医薬を作製する新規システム(新規デバイス)になり得ると考えられる。各コンパートメント中での種々のバイオアッセイを行うことの他に、多様なアッセイを、単一プラットフォーム中で1回の実験操作で、非水性相により相互汚染なしに行うことができる。微量液体試薬を用いた多数のアッセイフォーマットを可能にし、魅力的なμTAS(マイクロ全分析システム)となり得る。
【図面の簡単な説明】
【0041】
【図1】本発明の方法で使用する微小流路型チップの説明図。
【図2】ニュートラルレッド水溶液及びミネラルオイルを用い、60o の流路同志の接触角度でデザインされたチップを用いて行った実験の様子を示す。
【図3】120oの流路同志の接触角度のPDMS/ガラスマイクロ流路型デバイス及びミネラルオイルを用いた系で行った実験の様子を示す。
【図4】120oの流路同志の接触角度のPDMS/ガラスマイクロ流路型デバイス及びサラダ油を用いた系で行った実験の様子を示す。
【図5】60oの流路同志の接触角度のPDMS/ガラスマイクロ流路型デバイス及びココナッツ油を用いた系で行った実験の様子を示す。
【図6】120oの流路同志の接触角度のPDMS/ガラスマイクロ流路型デバイス及びミネラルオイルを用い蛍光ビーズを分離した実験の様子を示す。系を用いた系
【図7】90 oの流路同志の接触角度のPDMS/ガラスマイクロ流路型デバイスを用いた系で行った実験の様子を示す。
【特許請求の範囲】
【請求項1】
水に混和若しくは溶解する試料または親水性の試料(以下、対象試料という)を含有する独立の分画を連続して形成する、微小容量の試料溶液を形成する方法であって、
前記対象試料を含有する水性溶液を管状の経路1に注入し、
油類を管状の経路2に注入し、
経路1と状経路2とは合流して管状の経路3を形成し、
経路1と経路2との合流部において、水性溶液と油類とは、交互に、独立の分画を形成し、経路3中に前記対象試料が含有される水性溶液の独立分画が得られる
前記方法。
【請求項2】
前記水性溶液中に含まれる対象試料の濃度及び水性溶液の独立分画の容量を制御することで、形成される独立分画中に含まれる対象試料の数を制御する請求項1に記載の方法。
【請求項3】
前記油類は、粘度が10〜150cpsの範囲である請求項1または2に記載の方法。
【請求項4】
前記油類は、ミネラルオイル、サラダ油、またはココナッツ油である請求項1〜3のいずれか1項に記載の方法。
【請求項5】
水性溶液の流速は、0.2〜1.5μl/minの範囲であり、
油類の流速は、0.2〜1.5μl/minの範囲である請求項1〜4のいずれか1項に記載の方法。
【請求項6】
経路1〜3の断面形状が矩形であり、
経路1の幅及び深さは独立に30〜500μmの範囲であり、
経路2の幅及び深さは立に30〜500μmの範囲であり、
経路3の幅及び深さは独立に30〜500μmの範囲である請求項1〜5のいずれか1項に記載の方法。
【請求項7】
前記合流部において、
経路1と経路2とがなす角度は60°〜120°の範囲であり、
経路1と経路3とがなす角度は120°〜150°の範囲であり、
経路2と経路3とがなす角度は90°〜150°の範囲である請求項1〜6のいずれか1項に記載の方法。
【請求項8】
水性溶液の各独立分画の容量が1.0 nl〜1.0μlの範囲であり、
油類の各独立分画の容量が1.0 nl〜1.0μlの範囲である請求項1〜7のいずれか1項に記載の方法。
【請求項9】
経路1、経路2及び経路3の内壁は、PDMS、ガラス、またはPDMS及びガラスの組合せで形成されている請求項1〜8のいずれか1項に記載の方法。
【請求項10】
前記対象試料が、生体物質、有機物または無機物である請求項1〜8のいずれか1項に記載の方法。
【請求項11】
生体物質が、細胞、タンパク質、核酸、細胞組織または菌体である請求項9に記載の方法。
【請求項1】
水に混和若しくは溶解する試料または親水性の試料(以下、対象試料という)を含有する独立の分画を連続して形成する、微小容量の試料溶液を形成する方法であって、
前記対象試料を含有する水性溶液を管状の経路1に注入し、
油類を管状の経路2に注入し、
経路1と状経路2とは合流して管状の経路3を形成し、
経路1と経路2との合流部において、水性溶液と油類とは、交互に、独立の分画を形成し、経路3中に前記対象試料が含有される水性溶液の独立分画が得られる
前記方法。
【請求項2】
前記水性溶液中に含まれる対象試料の濃度及び水性溶液の独立分画の容量を制御することで、形成される独立分画中に含まれる対象試料の数を制御する請求項1に記載の方法。
【請求項3】
前記油類は、粘度が10〜150cpsの範囲である請求項1または2に記載の方法。
【請求項4】
前記油類は、ミネラルオイル、サラダ油、またはココナッツ油である請求項1〜3のいずれか1項に記載の方法。
【請求項5】
水性溶液の流速は、0.2〜1.5μl/minの範囲であり、
油類の流速は、0.2〜1.5μl/minの範囲である請求項1〜4のいずれか1項に記載の方法。
【請求項6】
経路1〜3の断面形状が矩形であり、
経路1の幅及び深さは独立に30〜500μmの範囲であり、
経路2の幅及び深さは立に30〜500μmの範囲であり、
経路3の幅及び深さは独立に30〜500μmの範囲である請求項1〜5のいずれか1項に記載の方法。
【請求項7】
前記合流部において、
経路1と経路2とがなす角度は60°〜120°の範囲であり、
経路1と経路3とがなす角度は120°〜150°の範囲であり、
経路2と経路3とがなす角度は90°〜150°の範囲である請求項1〜6のいずれか1項に記載の方法。
【請求項8】
水性溶液の各独立分画の容量が1.0 nl〜1.0μlの範囲であり、
油類の各独立分画の容量が1.0 nl〜1.0μlの範囲である請求項1〜7のいずれか1項に記載の方法。
【請求項9】
経路1、経路2及び経路3の内壁は、PDMS、ガラス、またはPDMS及びガラスの組合せで形成されている請求項1〜8のいずれか1項に記載の方法。
【請求項10】
前記対象試料が、生体物質、有機物または無機物である請求項1〜8のいずれか1項に記載の方法。
【請求項11】
生体物質が、細胞、タンパク質、核酸、細胞組織または菌体である請求項9に記載の方法。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【公開番号】特開2006−10332(P2006−10332A)
【公開日】平成18年1月12日(2006.1.12)
【国際特許分類】
【出願番号】特願2004−183794(P2004−183794)
【出願日】平成16年6月22日(2004.6.22)
【出願人】(395015227)
【出願人】(503117829)財団法人富山県新世紀産業機構 (12)
【Fターム(参考)】
【公開日】平成18年1月12日(2006.1.12)
【国際特許分類】
【出願日】平成16年6月22日(2004.6.22)
【出願人】(395015227)

【出願人】(503117829)財団法人富山県新世紀産業機構 (12)
【Fターム(参考)】
[ Back to top ]

