微小流体の核酸解析
【課題】微小流体デバイスを提供すること。
【解決手段】種々の環境から採取された細胞およびウイルス由来の核酸が、微小流体技術を利用して精製および発現され得る。本発明の実施形態に従って、個々の細胞またはウイルスあるいは細胞またはウイルスの小さな集団が、希釈、分類および/またはセグメント化によって微小流体チャンバに単離され得る。単離された細胞またはウイルスは、微小流体チャンバ内で直接溶解され得、生じた核酸は、親和性ビーズに曝露することによって精製される。その後の精製核酸の溶出の後に、すべて同じ微小流体チップ内で、連結および細胞形質転換が続き得る。1つの特定の適用において、細胞の単離、溶解および核酸精製が、高度に並行化した微小流体アーキテクチャーを利用して実施され、gDNAライブラリーおよびcDNAライブラリーを構築し得る。
【解決手段】種々の環境から採取された細胞およびウイルス由来の核酸が、微小流体技術を利用して精製および発現され得る。本発明の実施形態に従って、個々の細胞またはウイルスあるいは細胞またはウイルスの小さな集団が、希釈、分類および/またはセグメント化によって微小流体チャンバに単離され得る。単離された細胞またはウイルスは、微小流体チャンバ内で直接溶解され得、生じた核酸は、親和性ビーズに曝露することによって精製される。その後の精製核酸の溶出の後に、すべて同じ微小流体チップ内で、連結および細胞形質転換が続き得る。1つの特定の適用において、細胞の単離、溶解および核酸精製が、高度に並行化した微小流体アーキテクチャーを利用して実施され、gDNAライブラリーおよびcDNAライブラリーを構築し得る。
【発明の詳細な説明】
【技術分野】
【0001】
(関連出願への相互参照)
即時の通常特許出願は、2002年10月2日に出願された米国仮特許出願番号60/415,407から優先権を主張する。即時の通常特許出願はまた、2003年1月31日に出願された米国仮特許出願番号60/444,022から優先権を主張する。即時の通常特許出願は、2003年8月11日に出願された米国仮特許出願番号60/494,377および米国仮特許出願番号60/494,388からさらに優先権を主張する。従って、これらの以前に出願された仮特許出願の各々が、全ての目的のために本明細書により参考として援用される。
【0002】
(連邦政府によって後援を受けている研究開発の下でなされた発明に対する権利としての宣言)
本明細書中に記載されている研究は、部分的に、Army Research Office(No.DAAD19−00−1−0392)およびDARPA Bioflips programからのNSF助成金によって支援されている。従って、米国政府は本発明の特定の権利を有する。
【背景技術】
【0003】
(発明の背景)
多くの生態系において、微生物の個体集団の99%以上が、実験室の培養に抵抗性であるという証明がある。N.R.Pace「A Molecular View of Microbial Diversity and the Biosphere」、Science 276、734(1997)。これにより、人間の体内での微生物の生態系は、以前に推測していたよりも複雑で、培養不能な微生物のいくらか、または多くは、病原菌であり得るということが示唆される。D.A.Relman「The Search for Unrecognized Pathogens」、Science 284、1308(1999)。
【0004】
感染症に似ている相当な数の疾病、および不明な死または重症疾病が、100,000人につき0.5人の割合で発生している。B.A.Perkinsら、「Unexplained Deaths Due to Possibly Infectious Causes in the United States:Defining the Problem and Designing Surveillance and Laboratory Approaches」、Emerging Inject.Dis.2,47(1996)。多くのそのような病原体は、従来の表現型の方法による同定に抵抗するので、病原体同定の遺伝子型の方法の開発がもたらされる。
【0005】
その結果、ここ20年間で、ヒトの疾患と以前に推測されていない微生物病原体との関係のリストの増加が見られる。表1は、人間の疾患および過去20年間で明らかにされた関連した微生物病原体の例を列挙している。Heliobacter pyloriを除く、これらの病原菌の全てが、最初に遺伝子型アプローチを使用する臨床生検から直接同定された。
【0006】
【表1】

人体は、細菌およびウイルスにとって非常に多様な生態系を提供するが、その中に生きている多くの生物体を培養することは、困難または不可能であると証明されているので、多様性および個体集団分布の正確な測定を行うことは難しい。
【発明の概要】
【発明が解決しようとする課題】
【0007】
従って、種々の環境中に存在している細菌およびウイルスの特徴づけ、および解析のための技術および装置に対する必要性が当該分野において存在する。
【課題を解決するための手段】
【0008】
(発明の要旨)
種々の環境から採取された細胞およびウイルス由来の核酸が微小流体の技術を利用して、精製および発現され得る。本発明の1つの実施形態に従って、細胞またはウイルスの個々あるいは小さな集団が希釈、分類および/またはセグメント化によって、微小流体チャンバ内に隔離され得る。隔離された細胞またはウイルスは微小流体チャンバ内で直接溶解され得、その結果得られた核酸が、親和性ビーズに曝露することによって精製される。その後の精製された核酸の溶出の後に、連結および細胞形質転換が続き得る。1つの特定の適用において、細胞の隔離、溶解および核酸精製が、ゲノムDNAおよび相補鎖DNAのライブラリーを作製するために高度に並行化した微小流体アーキテクチャーを利用して行われ得る。
【0009】
本発明に従う微小流体デバイスの実施形態は、第1微小流体チャンバおよび、第1微小流体チャンバにウイルス、細菌および細胞のうちの少なくとも1つを含むサンプルを送達するように構成されている第1微小流体チャネルを備える。第2微小流体流動チャネルは第1微小流体チャンバに溶解化学物質を送達するように構成されている。
【0010】
核酸を精製するための本発明に従う方法の実施形態は、細菌、ウイルスおよび細胞のうちの少なくとも1つを含むサンプルを提供する工程を包含する。細菌、ウイルスおよび細胞のうちの少なくとも1つのサブセットは、微小流体チャンバ内に物理的に隔離される。細菌、ウイルスおよび細胞のうちの少なくとも1つは、微小流体チャンバ内で溶解される。核酸は、核酸精製媒体を含む第2微小流体チャンバを通して、溶解された細菌、ウイルスおよび細胞のうちの少なくとも1つから流動される。
【0011】
微小流体処理のための本発明に従う方法の実施形態は、複数の微小流体構造に並行してサンプルを提供する工程、および、複数の微小流体構造と共通連絡する1つの制御構造の操作によって、複数の微小流体構造によるサンプルの処理を制御する工程を包含する。
【0012】
サンプルを解析するための本発明に従う方法の実施形態は、微小流体チャネルに沿って、ウイルスおよび細胞のうちの少なくとも1つを含むサンプルを流動させる工程を包含する。微小流体チャンネルの一部分は、限られた数の細菌、ウイルスまたは細胞を含むセグメントへと隔離される。ゲノムDNAまたはcDNAの遺伝子解析、生化学解析、およびクローニングのうちの少なくとも1つが、限られた数の細菌、ウイルスまたは細胞に対して行われる。
【0013】
核酸処理のための本発明に従う方法の実施形態は、複数の生物学的実体を含むサンプルを提供する工程、および個々の生物学的実体または、生物学的実体のサブセットを微小流体チャンバ内に物理的に隔離する工程を包含する。個々の生物学的実体または生物学的実体のサブセットは溶解され、実験的に操作可能な核酸調製物が、個々の生物学的実体または生物学的実体のサブセットから得られる。
【0014】
異種の生物学的エレメントのサンプルから核酸を得るための本発明に従う方法の実施形態は、異種の生物学的エレメントを含むサンプルを提供する工程、およびサンプルの個々の生物学的エレメントまたは生物学的エレメントのサブセットを微小流体チャンバ内に物理的に隔離する工程を包含する。個々の生物学的エレメントまたは生物学的エレメントのサブセットは溶解され、個々の生物学的実体または生物学的実体のサブセット由来の核酸が精製される。精製された核酸の少なくとも一部分は、増幅される。
【0015】
複数の生物学的エレメントを含む特定の環境によって示される系統的多様性、遺伝子多様性および機能的多様性を特徴づけるための本発明に従う方法の実施形態は、異種の生物学的エレメントを含む環境からサンプルを提供する工程を包含する。サンプルの個々の生物学的エレメントまたは生物学的エレメントのサブセットは、微小流体チャンバ内に物理的に隔離される。個々の生物学的エレメントまたは生物学的エレメントのサブセットは溶解されて、その中に存在する核酸を露出する。個々の生物学的実体または生物学的実体のサブセット由来の露出された核酸は、精製される。精製された核酸の少なくとも一部分は増幅されて、精製された核酸の増幅された部分の系統的多様性、遺伝子多様性および機能的多様性のうちの少なくとも1つが、同定される。
【0016】
複雑な環境サンプルの個々の生物学的エレメントに関する遺伝情報を取得するための本発明に従う方法の実施形態は、異種の生物学的エレメントを含む環境サンプルを提供する工程、およびサンプルの個々の生物学的エレメントまたは生物学的エレメントのサブセットを微小流体チャンバ内に物理的に隔離する工程を包含する。個々の生物学的エレメントまたは生物学的エレメントのサブセットは、溶解されて、その中に存在する核酸を露出する。露出された核酸は精製されて、精製された核酸の少なくとも一部分が増幅される。
【0017】
本発明のこれらおよび別の実施形態、ならびに、その利点および特徴は、以下の本文および添付した図面と併せてより詳細に記載されている。
(項目1)
微小流体デバイスであって、以下:
第1微小流体チャンバ;
ウイルス、細菌および細胞のうちの少なくとも1つを含むサンプルを該第1微小流体チャンバに送達するために構成された第1微小流体チャネル;ならびに
溶解化学物質を該第1微小流体チャンバに送達するために構成された第2微小流体流動チャネル
を備える、微小流体デバイス。
(項目2)
項目1に記載の微小流体デバイスであって、上記第1微小流体チャンバが、回転式混合構造を備える、微小流体デバイス。
(項目3)
項目1に記載の微小流体デバイスであって、上記第1微小流体チャンバが、偏向可能な膜を通して上記第2微小流体流動チャネルと選択的に流体連絡している、微小流体デバイス。
(項目4)
項目1に記載の微小流体デバイスであって:
上記第1微小流体チャンバが、複数の第1微小流体チャンバを備え;そして
該第1微小流体チャネルが、該複数の第1微小チャンバと共通に流体連絡している、微小流体デバイス。
(項目5)
項目4に記載の微小流体デバイスであって、上記複数の第1微小流体チャンバが、上記第1微小流体チャネルのセグメントを備える、微小流体デバイス。
(項目6)
項目4に記載の微小流体デバイスであって、並行微小流体溶解構造を規定する、上記複数の第1微小流体チャンバと共通に作動連絡している制御構造をさらに備える、微小流体デバイス。
(項目7)
項目1に記載の微小流体デバイスであって、上記第1微小流体チャンバと選択的に流体連絡している第2微小流体チャンバをさらに備え、該第2微小流体チャンバが核酸精製媒体を含む、微小流体デバイス。
(項目8)
項目7に記載の微小流体デバイスであって、上記核酸精製媒体が、特定の核酸に親和性を示す、コーティングされたビーズを含む、微小流体デバイス。
(項目9)
項目7に記載の微小流体デバイスであって、上記第2微小流体チャンバが、上記第1微小流体チャネルと第3微小流体チャネルとの接合部により規定される、微小流体デバイス。
(項目10)
項目9に記載の微小流体デバイスであって:
上記第1微小流体チャネルが、複数の第1微小流体チャネルを備え;そして
上記第2微小流体チャンバが、該複数の第1微小流体チャネルと上記第2微小流体チャネルとの間の接合部により規定された複数の第2微小流体チャンバを備える、微小流体デバイス。
(項目11)
項目10に記載の微小流体デバイスであって、上記複数の第1微小流体チャンバと上記複数の第2微小流体チャンバとの間の流体連絡を選択的に容認するように共通に作動連絡している制御ラインをさらに備え、該制御ラインは、並行核酸精製構造を規定する、微小流体デバイス。
(項目12)
項目7に記載の微小流体デバイスであって、第1の一体化微小流体構造をさらに備え、該第1の一体化微小流体構造は、上記第2微小流体チャンバと流体連絡し、そこから受け取った精製された核酸を増幅するように構成されている、微小流体デバイス。
(項目13)
項目12に記載の微小流体デバイスであって、上記第1の一体化微小流体構造が、加熱素子と熱連絡するセグメントを有する回転式混合構造を備える、微小流体デバイス。
(項目14)
項目12に記載の微小流体デバイスであって、上記第1の一体化微小流体構造が、分離可能な回転式混合構造のアドレス可能なマトリックスを備える、微小流体デバイス。
(項目15)
項目7に記載の微小流体デバイスであって、一体化微小流体構造をさらに備え、該一体化微小流体構造は、上記第2微小流体チャンバと流体連絡し、そこから受け取った精製された核酸を連結酵素の存在下で宿主ベクターに曝露するように構成されている、微小流体デバイス。
(項目16)
項目15に記載の微小流体デバイスであって、上記第1の一体化微小流体構造が、回転式混合構造を備える、微小流体デバイス。
(項目17)
項目16に記載の微小流体デバイスであって:
上記第1微小流体チャネルが、複数の第1微小流体チャネルを備え;
上記第2微小流体チャンバが、該複数の第1微小流体チャネルと該第2微小流体チャネルとの間の接合部により規定される複数の第2微小流体チャンバを備え;そして
上記第1の一体化微小流体構造が、該複数の第2チャンバのそれぞれと選択的に並行流体連絡する第1の回転式ミキサーセットを備える、微小流体デバイス。
(項目18)
項目17に記載の微小流体デバイスであって、並行核酸連結構造を規定する上記回転式ミキサーセットと共通に作動連絡している制御ラインをさらに備える、微小流体デバイス。
(項目19)
項目15に記載の微小流体デバイスであって、上記第1の一体化微小流体構造と流体連絡している第2の一体化微小流体構造をさらに備え、該第2の一体化微 小流体構造は、宿主ベクター内に連結された精製された核酸を、該精製された核酸の形質転換および発現のための細胞に曝露するように構成されている、微小流体デバイス。
(項目20)
項目19に記載の微小流体デバイスであって、上記第2の一体化微小流体構造が、第2の回転式混合構造を備える、微小流体デバイス。
(項目21)
項目20に記載の微小流体デバイスであって:
上記第1微小流体チャネルが、複数の第1微小流体チャネルを備え;
上記第2微小流体チャンバが、該複数の第1微小流体チャネルと上記第2微小流体チャネルとの間の接合部により規定される複数の第2微小流体チャンバを備え;
上記第1の一体化微小流体構造が、上記複数の第2チャンバのそれぞれと選択的に並行流体連絡している第1の回転式ミキサーセットを備え;そして
上記第2の一体化微小流体構造が、該第1の回転式ミキサーセットのそれぞれと選択的に並行流体連絡している第2の回転式ミキサーセットを備える、微小流体デバイス。
(項目22)
項目21に記載の微小流体デバイスであって、並行核酸形質転換構造を規定する上記第2の回転式ミキサーセットと共通に作動連絡している制御ラインをさらに備える、微小流体デバイス。
(項目23)
核酸を精製する方法であって、以下:
細菌、ウイルスおよび細胞のうちの少なくとも1つを含むサンプルを提供する工程;
微小流体チャンバ内に、細菌、ウイルスおよび細胞のうちの少なくとも1つのサブセットを物理的に隔離する工程;
該微小流体チャンバ内で、該細菌、ウイルスおよび細胞のうちの少なくとも1つを溶解する工程;
該溶解された細菌、ウイルスおよび細胞のうちの少なくとも1つ由来の核酸を、核酸精製媒体を含む第2微小流体チャンバを通して、流動する工程
を包含する方法。
(項目24)
項目23に記載の方法であって、上記隔離工程より前に、上記サンプルを希釈する工程をさらに包含する、方法。
(項目25)
項目23に記載の方法であって、上記隔離工程が、細長い流動チャネル内でセグメントを作り出し、それによって、該チャネル中に細菌、ウイルスおよび細胞を含ませる工程を包含する、方法。
(項目26)
項目23に記載の方法であって、上記隔離工程より前に、環境サンプルを分類することをさらに包含する、方法。
(項目27)
項目23に記載の方法であって、精製された核酸を、核酸親和性ビーズを含む上記核酸精製媒体から溶出する工程をさらに包含する、方法。
(項目28)
項目23に記載の方法であって、mRNAが、上記核酸精製媒体から溶出される、方法。
(項目29)
項目28に記載の方法であって、上記精製されたmRNAを逆転写酵素に曝露して、該精製されたmRNAをcDNAに変換する工程をさらに包含する、方法。
(項目30)
項目29に記載の方法であって、cDNAライブラリーを構築する工程をさらに包含する、方法。
(項目31)
項目28に記載の方法であって、遺伝子発現解析を行う工程をさらに包含する、方法。
(項目32)
項目31に記載の方法であって、上記遺伝子発現解析が、マイクロアレイチップを利用して行われる、方法。
(項目33)
項目23に記載の方法であって、精製された核酸を第2微小流体チャンバ内で宿主ベクターおよび連結酵素に曝露して、該精製された核酸を該宿主ベクター内に連結する工程をさらに包含する、方法。
(項目34)
項目33に記載の方法であって、上記精製された核酸を上記宿主ベクターに曝露するより前に、第3微小流体チャンバ内で、該精製された核酸を増幅させる工程をさらに包含する、方法。
(項目35)
項目34に記載の方法であって、上記精製された核酸が、微小流体回転式混合構造内で、循環により宿主ベクターおよび連結酵素に曝露される、方法。
(項目36)
項目33に記載の方法であって、以下:
第3微小流体チャンバ内で、上記連結および精製された核酸を含む上記宿主ベクターを細胞に曝露する工程;および
該細胞を該宿主ベクターで形質転換する工程
をさらに包含する、方法。
(項目37)
項目36に記載の方法であって、上記宿主ベクターが、微小流体回転式混合構造内で、循環により上記細胞に曝露される、方法。
(項目38)
項目37に記載の方法であって、上記第1、第2および第3の微小流体チャンバを含む微小流体チップが、熱ショックに曝露され、上記細胞を形質転換する、方法。
(項目39)
項目36に記載の方法であって、上記形質転換された細胞を培養して、上記精製された核酸を発現する工程をさらに包含する、方法。
(項目40)
項目36に記載の方法であって、上記隔離、溶解および流動の工程を、複数のウイルス、細菌または細胞に対して並行に行う工程をさらに包含する、方法。
(項目41)
項目40に記載の方法であって、上記連結および形質転換の工程を、上記複数のウイルス、細菌または細胞に対して並行に行う工程をさらに包含する、方法。
(項目42)
項目41に記載の方法であって、上記精製された核酸からgDNAライブラリーおよびcDNAライブラリーのうちの1つを構築する工程をさらに包含する、方法。
(項目43)
項目42に記載の方法であって、環境サンプルから集めた1つの細胞タイプの形態型、リボタイプおよび遺伝子型を同定する工程をさらに包含する、方法。
(項目44)
微小流体処理の方法であって、以下:
複数の微小流体構造に並行してサンプルを提供する工程;
該複数の微小流体構造と共通に連絡した1つの制御構造の操作により、該複数の微小流体構造による該サンプルの処理を制御する工程、
を包含する、方法。
(項目45)
項目44に記載の方法であって、
上記サンプルが、並行微小流体構造の段階で順番に処理される工程;および
各段階による該サンプルの処理が、1つの段階内で該並行微小流体構造の各々と共通に連絡する別々の制御構造により制御される、方法。
(項目46)
項目45に記載の方法であって、上記処理段階が、隔離段階、溶解段階、核酸精製段階、精製された核酸の連結段階および細胞形質転換段階を包含する、方法。
(項目47)
項目46に記載の方法であって、上記溶解段階、上記精製された核酸の連結段階および上記細胞形質転換段階のうちの少なくとも1つが、制御構造の共通のセットにより制御された循環を有する並行回転式混合構造を備える、方法。
(項目48)
サンプルを解析する方法であって、以下:
ウイルスおよび細胞のうちの少なくとも1つを含むサンプルを微小流体チャネルに沿って流動する工程;
該微小流体チャネルの一部分を、限られた数の細菌、ウイルスまたは細胞を含むセグメントの中に隔離する工程;
該限られた数の細菌、ウイルスまたは細胞について、遺伝子解析、生化学解析、およびゲノムDNAまたはcDNAのクローニングのうちの少なくとも1つを行う工程、
を包含する、方法。
(項目49)
項目48に記載の方法であって、隔離する工程が、上記微小流体チャネルの中にバルブのたわみを引き起こして、隣接するセグメントを規定する工程を包含する、方法。
(項目50)
項目49に記載の方法であって、上記バルブをたわませる工程が、上記微小流体チャネルと隣接する制御チャネルとの間に規定された膜をたわませる工程を包含する、方法。
(項目51)
項目48に記載の方法であって、隔離する工程が、50未満の細菌、細胞またはウイルスをセグメント内に隔離する工程を包含する、方法。
(項目52)
項目49に記載の方法であって、行う工程が、以下:
上記セグメントの内容物を溶解して、上記細胞またはウイルス内に存在する物質を露出させる工程;および
該セグメント内の該露出された内容物を精製する工程
を包含する、方法。
(項目53)
項目52に記載の方法であって、上記精製された内容物が、核酸を含み、該方法が、該精製された核酸を発現のための細胞中に組み込む工程をさらに包含する、方法。
(項目54)
項目53に記載の方法であって、上記発現のための細胞中に組み込むより前に、上記精製された核酸を増幅する工程をさらに包含する、方法。
(項目55)
核酸処理の方法であって、以下:
複数の生物学的実体を含むサンプルを提供する工程;
個々の生物学的実体または該生物学的実体のサブセットを微小流体チャンバ内に、物理的に隔離する工程;
該個々の生物学的実体または該生物学的実体のサブセットを溶解する工程;および
実験的に操作可能な核酸調製物を該個々の生物学的実体または該生物学的実体のサブセットから取得する工程
を包含する、方法。
(項目56)
項目55に記載の方法であって、取得する工程が、上記個々の生物学的実体または上記生物学的実体のサブセットの溶解から生じた混合物を精製する工程を包含する、方法。
(項目57)
項目56に記載の方法であって、精製する工程が、親和性ビーズを通して上記混合物を流動し、次いで、該親和性ビーズから上記精製された核酸を溶出する工程によって達成される、方法。
(項目58)
項目55に記載の方法であって、物理的隔離が、微小流体チャネルを通して上記サンプルを流動し、次いで、上記微小流体チャネルを隔離されたセグメントへと変換する工程によって達成される、方法。
(項目59)
項目55に記載の方法であって、上記核酸の一部を増幅する工程をさらに包含する、方法。
(項目60)
項目55に記載の方法であって、上記核酸調製物を精製する工程、および上記精製された核酸の一部を増幅する工程をさらに包含する、方法。
(項目61)
項目60に記載の方法であって、上記精製された核酸の実質的に全てが増幅されてライブラリーが作製される、方法。
(項目62)
項目60に記載の方法であって、上記精製された核酸の個々の遺伝子または遺伝子フラグメントが、特異的プライマーセットによって増幅される、方法。
(項目63)
項目62に記載の方法であって、上記精製された核酸の上記遺伝子または遺伝子フラグメントが、逆転写酵素ポリメラーゼ連鎖反応(RT−PCR)によって増幅されて、発現された遺伝子または遺伝子フラグメントだけを増幅する、方法。
(項目64)
項目60に記載の方法であって、上記精製された核酸の上記増幅された部分の配列を解析する工程をさらに包含する、方法。
(項目65)
項目60に記載の方法であって、上記精製された核酸の上記増幅された部分で生物体を形質転換する工程をさらに包含する、方法。
(項目66)
項目65に記載の方法であって、上記形質転換された生物体を培養して、上記精製された核酸の上記増幅された部分を発現させる工程をさらに包含する、方法。
(項目67)
異種の生物学的エレメントのサンプルから核酸を取得する方法であって、該方法が、以下:
異種の生物学的エレメントを含むサンプルを提供する工程;
該サンプルの個々の生物学的エレメントまたは該生物学的エレメントのサブセットを微小流体チャンバ内に、物理的に隔離する工程;
該個々の生物学的エレメントまたは該生物学的エレメントのサブセットを溶解する工程;
個々の生物学的実体または生物学的実体のサブセットから核酸を精製する工程;および
該精製された核酸のうちの少なくとも一部分を増幅する工程
を包含する、方法。
(項目68)
項目67に記載の方法であって、上記精製された核酸の実質的に全てが増幅されて、上記個々の生物学的エレメントまたは生物学的エレメントのサブセットの再生を可能にする、方法。
(項目69)
項目67に記載の方法であって、上記精製された核酸の全ての一部分だけが増幅されて、上記個々の生物学的エレメントまたは生物学的エレメントのサブセットと関連した遺伝子または遺伝子フラグメントの再生を可能にする、方法。
(項目70)
複数の生物学的エレメントを含む特定の環境によって示された系統的多様性、遺伝子多様性および機能的多様性を特徴づける方法であって、該方法が以下:
異種の生物学的エレメントを含む該環境からサンプルを提供する工程;
該サンプルの個々の生物学的要素エレメントまたは該生物学的エレメントのサブセットを微小流体チャンバ内に、物理的に隔離する工程;
該個々の生物学的エレメントまたは該生物学的エレメントのサブセットを溶解して、その中に存在する核酸を露出する工程;
個々の生物学的実体または該生物学的実体のサブセットから該露出された核酸を精製する工程;
該精製された核酸のうちの少なくとも一部分を増幅する工程;および
該精製された核酸の該増幅された部分の系統的多様性、遺伝子多様性および機能的多様性のうちの少なくとも1つを同定する工程を包含する、方法。
(項目71)
項目70に記載の方法であって、遺伝的多様性が、配列解析によって同定される、方法。
(項目72)
項目70に記載の方法であって、以下:
溶解より前に、上記個々の生物学的エレメントまたは生物学的エレメントのサブセットの形態を観察する工程;および
該観察された形態と上記遺伝的多様性とを関連づける工程
をさらに包含する、方法。
(項目73)
複雑な環境サンプルの個々の生物学的エレメントに関する遺伝情報を取得する方法であって、該方法が、以下:
異種の生物学的エレメントを含む環境サンプルを提供する工程;
該サンプルの個々の生物学的エレメントまたは該生物学的エレメントのサブセットを微小流体チャンバ内に、物理的に隔離する工程;
該個々の生物学的エレメントまたは該生物学的エレメントのサブセットを溶解して、その中に存在する核酸を露出させる工程;
該露出された核酸を精製する工程;および
該精製された核酸のうちの少なくとも一部分を増幅する工程
を包含する、方法。
(項目74)
項目73に記載の方法であって、上記増幅および精製された核酸によって表された遺伝情報を同定する工程をさらに包含する、方法。
(項目75)
項目73に記載の方法であって、以下:
適切なベクターの中に連結された上記精製された核酸の上記増幅された部分で細胞を形質転換する工程;および
該形質転換された細胞を培養して、該増幅された配列をクローニングする工程
をさらに包含する、方法。
【図面の簡単な説明】
【0018】
【図1】図1は微小機械加工型の頂部に形成された第1エラストマー層の図である。
【図2】図2は微小機械加工型の頂部に形成された第2エラストマー層の図である。
【図3】図3は微小機械加工型から取り外され、図1のエラストマー層の頂部より上に配置された図2のエラストマー層の図である。
【図4】図4は図3に対応する図であるが、第1エラストマー層の頂部に配置された第2エラストマー層を示す。
【図5】図5は図4に対応する図であるが、共に結合された第1および第2エラストマー層を示す。
【図6】図6は図5に対応する図であるが、第1微小機械加工型が取り外され、その場所に配置された平面基板を示す。
【図7A】図7Aは図6に対応する図であるが、平面基板の上にシールされたエラストマーアーキテクチャーを示す。図7Bは図7Aに対応する正面断面図であるが、開いている流動チャネルを示す。図7C〜7Gは、別々のエラストマー層から形成された膜を有するエラストマーアーキテクチャーを形成するための方法の工程を示す図である。図7Hは、作動させた状態での図7Bのバルブを示す正面断面図である。
【図7B】図7Aは図6に対応する図であるが、平面基板の上にシールされたエラストマーアーキテクチャーを示す。図7Bは図7Aに対応する正面断面図であるが、開いている流動チャネルを示す。図7C〜7Gは、別々のエラストマー層から形成された膜を有するエラストマーアーキテクチャーを形成するための方法の工程を示す図である。図7Hは、作動させた状態での図7Bのバルブを示す正面断面図である。
【図7C】図7Aは図6に対応する図であるが、平面基板の上にシールされたエラストマーアーキテクチャーを示す。図7Bは図7Aに対応する正面断面図であるが、開いている流動チャネルを示す。図7C〜7Gは、別々のエラストマー層から形成された膜を有するエラストマーアーキテクチャーを形成するための方法の工程を示す図である。図7Hは、作動させた状態での図7Bのバルブを示す正面断面図である。
【図7D】図7Aは図6に対応する図であるが、平面基板の上にシールされたエラストマーアーキテクチャーを示す。図7Bは図7Aに対応する正面断面図であるが、開いている流動チャネルを示す。図7C〜7Gは、別々のエラストマー層から形成された膜を有するエラストマーアーキテクチャーを形成するための方法の工程を示す図である。図7Hは、作動させた状態での図7Bのバルブを示す正面断面図である。
【図7E】図7Aは図6に対応する図であるが、平面基板の上にシールされたエラストマーアーキテクチャーを示す。図7Bは図7Aに対応する正面断面図であるが、開いている流動チャネルを示す。図7C〜7Gは、別々のエラストマー層から形成された膜を有するエラストマーアーキテクチャーを形成するための方法の工程を示す図である。図7Hは、作動させた状態での図7Bのバルブを示す正面断面図である。
【図7F】図7Aは図6に対応する図であるが、平面基板の上にシールされたエラストマーアーキテクチャーを示す。図7Bは図7Aに対応する正面断面図であるが、開いている流動チャネルを示す。図7C〜7Gは、別々のエラストマー層から形成された膜を有するエラストマーアーキテクチャーを形成するための方法の工程を示す図である。図7Hは、作動させた状態での図7Bのバルブを示す正面断面図である。
【図7G】図7Aは図6に対応する図であるが、平面基板の上にシールされたエラストマーアーキテクチャーを示す。図7Bは図7Aに対応する正面断面図であるが、開いている流動チャネルを示す。図7C〜7Gは、別々のエラストマー層から形成された膜を有するエラストマーアーキテクチャーを形成するための方法の工程を示す図である。図7Hは、作動させた状態での図7Bのバルブを示す正面断面図である。
【図7H】図7Aは図6に対応する図であるが、平面基板の上にシールされたエラストマーアーキテクチャーを示す。図7Bは図7Aに対応する正面断面図であるが、開いている流動チャネルを示す。図7C〜7Gは、別々のエラストマー層から形成された膜を有するエラストマーアーキテクチャーを形成するための方法の工程を示す図である。図7Hは、作動させた状態での図7Bのバルブを示す正面断面図である。
【図8】図8Aおよび8Bは、種々の流動チャネルの付与された圧力に対するバルブの開度を図示する。
【図9】図9は、100μm×100μm×10μmRTVマイクロバルブの時間応答を図示する。
【図10】図10は、膜の作動を示す図7Bのバルブの正面断面図である。
【図11】図11は、湾曲した上面を備える流動チャネルを有するバルブの代替的な実施形態の正面断面図である。
【図12A】図12Aは、オン/オフバルブの上面概略図である。
【図12B】図12Bは、図12Aのライン23B−23Bに沿った部分的な立面図である。
【図13A】図13Aは、蠕動ポンピングシステムの上面概略図である。
【図13B】図13Bは、図13Aのライン24B−24Bに沿った部分的な立面図である。
【図14】図14は、図13の蠕動ポンピングシステムの実施形態の回転数に対して、実験的に達成されたポンピング速度を示すグラフである。
【図15A】図15Aは、複数の流動ラインを同時に作動させる1つの制御ラインの上面概略図である。
【図15B】図15Bは、図15Aのライン26B−26Bに沿った部分的な立面図である。
【図16】図16は、種々のチャネルを通して流動を可能にするように適合された多重化システムの概略図である。
【図17A】図17A〜Dは、切り換え可能な流動アレイの1つの実施形態の平面図を示す。
【図17B】図17A〜Dは、切り換え可能な流動アレイの1つの実施形態の平面図を示す。
【図17C】図17A〜Dは、切り換え可能な流動アレイの1つの実施形態の平面図を示す。
【図17D】図17A〜Dは、切り換え可能な流動アレイの1つの実施形態の平面図を示す。
【図18】図18A〜Dは、細胞囲いアレイアーキテクチャーの1つの実施形態の平面図を示す。
【図19】図19A〜Bは、本発明に従う細胞ケージアーキテクチャーの1つの実施形態の操作を図示する平面図および断面図を示す。
【図20】図20A〜20Dは、本発明の実施形態に従う交差チャネル注入を利用するアーキテクチャーの動作の平面図を示す。
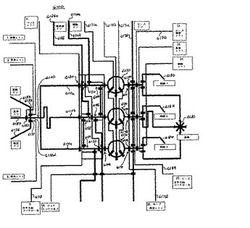
【図21】図21は、本発明に従う回転式混合アーキテクチャーの1つの実施形態の平面図を示す。
【図22A】図22Aは、2分木の微小流体マルチプレキサー動作線図を図示する単純化された平面図を示す。
【図22B】図22Bは、3分木の微小流体マルチプレキサー動作線図を図示する単純化された平面図を示す。
【図22C】図22Cは、図22A〜Bのデバイスの一般的な微小流体アーキテクチャーの単純化された断面図を示す。
【図23】図23は、種々の基本数のマルチプレキサーのための制御されている流動ラインの数に対する制御ラインの数をプロットする。
【図24】図24は、他の制御チャネルを制御する制御チャネルを利用する微小流体構造の実施形態の単純化された平面図を示す。
【図24A】図24Aは、ラインA−A’に沿って取った図24のアーキテクチャーの単純化された断面図を示す。
【図24B】図24Bは、ラインB−B’に沿って取った図24のアーキテクチャーの単純化された断面図を示す。
【図25】図25は、図24〜24Bのデバイスの一般的な微小流体アーキテクチャーの単純化された断面図を示す。
【図26】図26は、他の制御チャネルを制御する制御チャネルを利用する微小流体構造の代替的な実施形態の単純化された平面図を示す。
【図26A】図26Aは、ラインA−A’に沿って取った図26のアーキテクチャーの単純化された断面図を示す。
【図26B】図26Bは、ラインB−B’に沿って取った図26のアーキテクチャーの単純化された断面図を示す。
【図27A】図27Aは、微小流体コンパレータチップの光学マイクログラフを示す。
【図27B】図27Bは、図27Aの微小流体コンパレータチップの単純化された概略図である。
【図27C】図27Cは、図27Aの微小流体構造のチャンバのロードを示す単純化された拡大平面図である。
【図27D】図27Dは、図27Aの微小流体構造のチャンバのロードを示す単純化された拡大平面図である。
【図27E】図27Eは、図27Aの微小流体構造のチャンバのロードを示す単純化された拡大平面図である。
【図27F】図27Fは、図27Aの微小流体構造のチャンバのロードを示す単純化された拡大平面図である。
【図27G】図27Gは、図27Aの微小流体構造のチャンバのロードを示す単純化された拡大平面図である。
【図27H】図27Hは、図27Aの微小流体構造のチャンバのロードを示す単純化された拡大平面図である。
【図28】図28は、本発明の実施形態に従って核酸を操作する工程を図示する単純化されたフローチャートである。
【図29A】図29Aは、細胞溶解およびその中に存在するDNAの精製を可能にする本発明に従う微小流体アーキテクチャーの1つ実施形態の平面図を示す。
【図29B】図29Bは、図22Aの微小流体アーキテクチャーの拡大された領域の写真を示す。
【図29C】図29Cは、図22Aの微小流体アーキテクチャーの拡大された領域の写真を示す。
【図29D】図29Dは、図22Aの微小流体アーキテクチャーの拡大された領域の写真を示す。
【図30A】図30A〜Bは、細胞溶解前後の図29Aの微小流体アーキテクチャーの拡大された領域の写真を示す。
【図30B】図30A〜Bは、細胞溶解前後の図29Aの微小流体アーキテクチャーの拡大された領域の写真を示す。
【図31A】図31A〜Bは、本発明の実施形態に従って精製された核酸サンプルの電気泳動を示す。
【図31B】図31A〜Bは、本発明の実施形態に従って精製された核酸サンプルの電気泳動を示す。
【図32A】図32A〜Bは、図29Aの微小流体アーキテクチャーを利用して精製された核酸物質の異なるサンプルを解析した結果を示す。
【図32B】図32A〜Bは、図29Aの微小流体アーキテクチャーを利用して精製された核酸物質の異なるサンプルを解析した結果を示す。
【図33】図33は、精製された核酸の連結および連結された核酸での細胞の形質転換を可能にする、本発明に従う微小流体アーキテクチャーの1つの実施形態の平面図を示す。
【図33A】図33Aは、精製された核酸の連結を可能にする図33の微小流体アーキテクチャーの領域の拡大図を示す。
【図33B】図33Bは、連結された精製された核酸での細胞形質転換を可能にする図33の微小流体アーキテクチャーの領域の拡大図を示す。
【図34】図34は、PCRを行うための微小流体構造の分解図を示す。
【図35】図35は、図34に示された微小流体構造を利用してPCRによって増幅された核酸の時間に対する蛍光をプロットする。
【図36A】図36Aは、マトリックスPCRアーキテクチャーの平面図を示す。
【図36B】図36Bは、図36AのマトリックスPCRアーキテクチャーの1つの細胞の拡大図を示す。
【図37A】図37Aは、本発明に従う代替的な微小流体アーキテクチャーの平面図を示す。
【図37B】図37Bは、図37Aの隣接した溶解および細胞チャンバの拡大を示す写真である。
【図37C】図37Cは、図37Aの隣接したビーズおよび細胞チャンバの拡大を示す写真である。
【図37D】図37Dは、溶解化学物質の拡散混合の前、間、後のそれぞれの細胞チャンバの拡大された部分の写真を示す。
【図37E】図37Eは、溶解化学物質の拡散混合の前、間、後のそれぞれの細胞チャンバの拡大された部分の写真を示す。
【図37F】図37Fは、溶解化学物質の拡散混合の前、間、後のそれぞれの細胞チャンバの拡大された部分の写真を示す。
【図38】図38は、ネガティブコントロールと共に1つの細胞の感受性を示すために行われた一連の実験の電気泳動結果を示す。
【図39】図39は、2%アガロースゲルで解析されたβ−アクチンとozfの両方のRT PCR生成物をプロットする。
【図40】図40は、本発明に従う微小流体アーキテクチャーの代替的な実施形態の平面図を示す。
【図41A】図41A〜Bは、マウスの骨髄細胞の表面マーカー発現プロフィールのフローサイトメトリーの解析を示す。
【図41B】図41A〜Bは、マウスの骨髄細胞の表面マーカー発現プロフィールのフローサイトメトリーの解析を示す。
【図42】図42は、マウスの多能性の造血幹細胞の提案された調節ネットワークを図示する。
【発明を実施するための形態】
【0019】
(発明の詳細な説明)
(I.微小製造の概要)
以下の議論は、2003年9月24日に出願された米国特許出願10/___,___号(代理人整理番号20174C−009410US)、2002年10月4日に出願された10/265,473号、2002年4月5日に出願された10/118,466号、2001年4月6日に出願された09/826,585号、2000年11月28日に出願された09/724,784号、および2000年6月27日に出願された09/605,520号に概ね記載されているように、エラストマー物質を利用する微小製造した流体デバイスの構成に関係している。これによって、これらの以前に出願された特許出願は、あらゆる目的のためにその全体が本明細書により参考として援用される。
【0020】
(1.製造の方法)
本発明を製造する例示的な方法が、本明細書中に提供されている。本発明は、これらの方法の1つまたは他の方法による製造に限られないことが理解されるべきである。むしろ、本方法を改変することを含む、本発明の微小構造を製造する他の適切な方法もまた、意図されている。
【0021】
図1〜7Bは、(ポンプまたはバルブとして使用され得る)本発明の微小構造を製造する第1の好ましい方法の一連の工程を図示する。図8〜18は、(ポンプまたはバルブとしてもまた使用され得る)本発明の微小構造を製造する第2の好ましい方法の一連の工程を図示する。
【0022】
説明されるように、図1〜7Bの好ましい方法は、組み立てられかつ結合されているあらかじめ硬化されたエラストマー層を使用することを含む。代替的な方法において、エラストマーの各層は「配置されて」硬化され得る。以下の明細書において「チャネル」は流体または気体の流動を含み得るエラストマー構造の溝を言う。
【0023】
図1を参照すると、第1の微小機械加工型10が提供される。微小機械加工型10はフォトリソグラフィ、イオンエッチング、および電子ビームリソグラフィを含むが、これらに限られていない多くの従来のシリコン処理方法によって、製造され得る。
【0024】
見られ得るように、微小機械加工型10は、隆起したラインまたはそこに沿って伸びている突出部11を有する。図に示すように、第1エラストマー層20は、型10の頂部に鋳造されるので、第1の溝21は、エラストマー層20の底面に形成される(突出部11の寸法に相当する溝21)。
【0025】
図2に見られ得るように、第2の微小機械加工型12に沿って伸びている隆起した突出部13を有する第2の微小機械加工型12もまた、提供される。示されるように、第2のエラストマー層22は、型12の上に鋳造されるので、溝23は、突出部13の寸法に相当するその底面に形成される。
【0026】
図3および図4に図示される一連の工程に見られ得るように、第2のエラストマー層22は、次いで型12から取り外されて第1のエラストマー層20の頂部に配置される。見られ得るように、第2のエラストマー層22の底面に沿って伸びている溝23は、流動チャネル32を形成する。
【0027】
図5を参照すると、別々の第1のエラストマー層20および第2のエラストマー層22(図4)は、次いで共に結合されて、一体化した(すなわち:モノリシック)エラストマー構造24を形成する。
【0028】
図6および7Aの一連の工程で見られ得るように、エラストマー構造24は次いで、型10から取りはずされ、平面基板14の上に置かれる。図7Aおよび7Bで見られ得るように、エラストマー構造24がその底面に平面基板14をシールされた場合、溝21は流動チャネル30を形成する。
【0029】
本エラストマー構造は、ほとんど任意の滑らかな平面基板で可逆な密閉シールを形成する。このようにシールを形成することの利点は、エラストマー構造がはがされ得、洗浄され得および再利用され得ることである。好ましい局面では、平面基板14はガラスである。さらにガラスを使用することの利点は、ガラスは透明であるので、エラストマーチャネルおよびリザーバの視覚的な問い合わせを可能にすることである。あるいは、エラストマー構造は、永続性の、高強度な結合を形成して、上記した同じ方法によって平らなエラストマー層の上に結合される。これは、高い背圧が使用される場合、有利であると証明され得る。
【0030】
図7Aおよび7Bで見られ得るように、流動チャネル30および32は、好ましくは互いに一定角度で配置され、基板24の小膜25で、流動チャネル32の底から流動チャネル30の最上部が分離される。
【0031】
好ましい局面において、平面基板14はガラスである。ガラスを使用することの利点は、本エラストマー構造がはがされ得、洗浄され得および再利用され得ることである。さらにガラスを使用することの利点は、視覚が用いられ得ることである。あるいは、平面基板14は、高い背圧が使用される場合、有利であり得ると証明されているエラストマー自身であり得る。
【0032】
たったいま、記載した製造方法は、デバイスのチャネルの壁を形成する物質とは異なるエラストマー物質から構成される膜を有する構造を形成するように変えられ得る。この改変型製造方法は、図7C〜7Gに示される。
【0033】
図7Cを参照すると、第1微小機械加工型10が提供される。微小機械加工型10は、そこに沿って伸びている一段高いラインまたは突出部11を有する。図7Dで、第1エラストマー層20が第1微小機械加工型10の上に鋳造されるので、第1エラストマー層20の頂部は一段高いラインまたは突出部11の上と同一平面になる。これは、一段高いライン11の既知の高さに対して型10の上で回転させたエラストマー物質の量を注意深く制御することによって達成され得る。あるいは、望ましい形状は射出成形によって形成され得る。
【0034】
図7Eで、第2微小機械加工型12に沿って伸びている一段高い突出部13を有する第2微小機械加工型12もまた提供される。第2エラストマー層22は、図のように、第2型12の上で鋳造されるので、溝23は突出部13の寸法に対応してその底面に形成される。
【0035】
図7Fで、第2エラストマー層22は、型12から取りはずされて第3エラストマー層222の上に置かれる。第2エラストマー層22は、以下詳細に記載された技術を使用して、一体化したエラストマーブロック224を形成して第3エラストマー層20に結合される。このプロセスの点で、以前は一段高いライン13によって占められた溝23は流動チャネル23を形成する。
【0036】
図7Gで、エラストマーブロック224は、第1微小機械加工型10および第1エラストマー層20の上に置かれる。エラストマーブロックおよび第1エラストマー層20は次いで、別のエラストマー層222で構成された膜を有する一体化した(すなわち:モノリシック)エラストマー構造24を形成して共に結合される。
【0037】
エラストマー構造24が、図7Aに関連して上記したように、その底面で平面基板にシールされた場合、以前に一段高いライン11によって占められていた溝は流動チャネル30を形成する。
【0038】
図7C〜7Gに関連して上記したように、改変型製造方法は、膜部分が構造の残部のエラストマー物質とは別の物質から構成されることを可能にするという利点を提供する。このことは、膜の厚さおよび弾性特性がデバイスの操作において中心的な役割を果たすので、重要である。さらに、この方法は別のエラストマー層をエラストマー構造の中に組み入れるより前に、容易に調製しやすくすることを可能にする。詳細に以下に述べるように、可能性として望ましい状態の例は、膜の作動を可能にする磁性または電気伝導種の導入、および/またはその弾性を変えるために膜の中に添加物(dopant)を導入することを含む。
【0039】
微小機械加工型の上に複製を鋳造することによって形成された様々な形状をしたエラストマー層を形成することに関連する上記方法が示されているが、本発明はこの技術に限られていない。共に結合される成形されたエラストマー物質の個々の層を形成するために他の技術が使用され得る。例えば、エラストマー物質の成形された層は、レーザー切断または射出成形によって、または化学エッチングおよび/または第2の模範的な方法と併せて以下に述べるような犠牲材料を利用する方法によって形成され得る。
【0040】
代替の方法は、エラストマー物質内にカプセル化されたフォトレジストの発生を利用するパターン化されたエラストマー構造を製造する。しかし、本発明に従う方法はフォトレジストを利用することに限られていない。金属のような他の物質もまた、囲んでいるエラストマー物質に選択的に除去されて犠牲材料としての機能を果たすことができ、この方法は、本発明の範囲内に残る。例えば、金金属は、適切な化学混合物を利用するRTV615エラストマーに選択的にエッチングされ得る。
【0041】
(2.層およびチャネルの寸法)
微小製造は、本発明の実施形態に従って製造されたエラストマー構造の特徴の大きさについて言及している。一般に、微小製造構造のうちの少なくとも1つの寸法の変化はミクロンレベルで、少なくとも1つの寸法が微視的(すなわち、1000μm以下)に制御される。微小製造は一般に、微視的なレベルの特徴の寸法を生産するために設計されるフォトリソグラフィーおよびスピンコーティングのような半導体またはMEMS製造技術を含み、微小製造された構造の寸法のうちの少なくともいくつかは、適度に構造を分解/画像化するためにマイクロスコープを必要とする。
【0042】
好ましい局面において、流動チャネル30、32、60および62は好ましくは、幅と深さが約10:1の比を有する。本発明の実施形態に従う幅と深さの比の他の範囲の非排他的なリストは0.1:1〜100:1であって、さらに好ましくは1:1〜50:1で、さらに好ましくは2:1〜20:1で、最も好ましくは3:1〜15:1である。典型的な局面において、流動チャネル30、32、60および62は、約1〜1000ミクロンの幅を有する。本発明に従う流動チャネルの幅の他の範囲の非排他的なリストは0.01〜1000マイクロンであって、さらに好ましくは0.05〜1000マイクロンで、さらに好ましくは0.2〜500マイクロンで、さらに好ましくは1〜250マイクロンで、最も好ましくは、10〜200マイクロンである。典型的なチャネル幅としては、0.1μm、1μm、2μm、5μm、10μm、20μm、30μm、40μm、50μm、60μm、70μm、80μm、90μm、100μm、110μm、120μm、130μm、140μm、150μm、160μm、170μm、180μm、190μm、200μm、210μm、220μm、230μm、240μm、250μmが挙げられる。
【0043】
流動チャネル30、32、60および62は、約1〜100ミクロンの深さを有する。本発明の実施形態に従う流動チャネルの深さの他の範囲の非排他的なリストは0.01〜1000ミクロンであって、さらに好ましくは0.05〜500ミクロンで、さらに好ましくは0.2〜250ミクロンで、さらに好ましくは1〜100ミクロンで、さらに好ましくは2〜20ミクロンで、最も好ましくは5〜10ミクロンである。典型的なチャネルの深さとしては、0.01μm、0.02μm、0.05μm、0.1μm、0.2μm、0.5μm、1μm、2μm、3μm、4μm、5μm、7.5μm、10μm、12.5μm、15μm、17.5μm、20μm、22.5μm、25μm、30μm、40μm、50μm、75μm、100μm、150μm、200μm、および250μmが挙げられる。
【0044】
流動チャネルは、これらの特定の寸法の範囲および上記した例に限られず、図27と併せて以下に長さについて述べるように、膜を偏向させるのに必要とする力の規模に影響するために幅の点で変化する。例えば、0.01μmのオーダーの幅を有する典型的な狭い流動チャネルは、以下に詳細に述べるように、視覚的および他の適用に有益であり得る。上記したよりもかるい幅広いチャネルを有する部分を含むエラストマー構造もまた、本発明によって企図され、幅広い流動チャネルを利用する適用の例は流体リザーバおよび混合チャネル構造を含む。
【0045】
エラストマー層は、機械的安定性のために厚く鋳造され得る。典型的な実施形態において、図1のエラストマー層22は、50ミクロン〜数cmの厚さで、さらに好ましくは約4mmの厚さである。本発明の他の実施形態に従うエラストマー層の厚さの範囲の非排他的なリストは、0.1ミクロン〜約10cm、1ミクロン〜5cm、10ミクロン〜2cm、100ミクロン〜10mmの間である。
【0046】
したがって、流動チャネル30および32を分けている図7Bの膜25は、約0.01と1000ミクロンの間、さらに好ましくは0.05〜500ミクロン、さらに好ましくは0.2〜250ミクロン、さらに好ましくは1〜100ミクロン、さらに好ましくは2〜50ミクロン、および最も好ましくは5〜40ミクロンの特有の厚さを有する。このように、エラストマー層22の厚さは、エラストマー層20の厚さの約100倍である。典型的な膜の厚さとしては、0.01μm、0.02μm、0.03μm、0.05μm、0.1μm、0.2μm、0.3μm、0.5μm、1μm、2μm、3μm、5μm、7.5μm、10μm、12.5μm、15μm、17.5μm、20μm、22.5μm、25μm、30μm、40μm、50μm、75μm、100μm、150μm、200μm、250μm、300μm、400μm、500μm、750μmおよび1000μmが挙げられる。
【0047】
(3.ソフトリソグラフィック結合)
好ましくはエラストマー層は、パターン化されたエラストマー層を含むポリマーに固有である化学的性質を使用して、化学的に共に結合される。最も好ましくは、結合は2つの成分「添加硬化」結合を含む。
【0048】
好ましい局面において、エラストマーの様々な層は、層が異なる化学的性質を有する異質の結合においては共に結合される。あるいは、同質の結合は全ての層が同じ化学的性質である場合に使用され得る。第3に、それぞれのエラストマー層は、必要に応じて代わりに接着剤によって共に接着され得る。第4の局面において、エラストマー層は、熱によって共に結合される熱硬化性のエラストマーであり得る。
【0049】
同種の結合の1つの局面において、エラストマー層は、同じエラストマー物質から構成され、1つの層の中の同じ化学的実体と他の層の中の同じ化学的実体と反応して、共に層が結合される。1つの実施形態において、同様なエラストマー層のポリマー鎖との間の結合は、光、熱または別の化学物質種との化学反応による架橋剤の活性化の結果として起こり得る。
【0050】
あるいは、異質の局面において、エラストマー層は、異なるエラストマー物質から構成され、1つの層の中の第1の化学的実体と他の層の中の第2の化学的実体が反応する。1つの典型的な異質の局面において、それぞれのエラストマー層を共に結合するのに使用される結合プロセスは、RTV615シリコーンの2層を共に結合することを含み得る。RTV615シリコーンは、2つの部分の添加硬化シリコーンゴムである。部分Aはビニル基および触媒を含み;部分Bは水素化珪素(Si−H)基を含む。RTV615の従来の比は、10A:1Bである。結合のために、1つの層は30A:1B(すなわち、過剰のビニル基)で作られ得、他の層は3A:1B(すなわち、過剰のSi−H基)で作られ得る。各層は別々に硬化される。2つの層が高温で接触および加熱される場合、それらはモノリシックエラストマー構造を形成して不可逆的に結合する。
【0051】
本発明の典型的な局面において、エラストマー構造は、Sylgard182、184または186、あるいはUCB Chemicalから提供されるEbecryl270またはIrr245(これらに限られてはいない)のような脂肪族のウレタンジアクリレートを利用して形成される。
【0052】
本発明に従う1つの実施形態において、2層のエラストマー構造は、純粋なアクリル化Urethane Ebe270から製造された。薄い低部層は、170℃で15秒間、8000rpmでスピンコートされた。頂部層および低部層は、Electrolite
corporationによって製造されたModel ELC500デバイスを利用する窒素の下で10分間紫外線下で最初に硬化された。集められた層は次いで、さらに30分間硬化された。反応は、Ciba−Geigy Chemicalsによって製造されたIrgacure500の0.5%vol/vol混合物によって触媒作用を及ぼされた。その結果として生じたエラストマー物質は、適度な弾性およびガラスに対する接着を示した。
【0053】
本発明に従う他の実施形態において、2層のエラストマー構造は、薄い底部層には25%Ebe270/50%Irr245/25%イソプロピルアルコールの組合わせから製造され、頂部層としては純粋なアクリル化Urethane Ebe270から製造された。Electrolite corporationによって製造されたModel ELC500デバイスを利用する窒素の下で紫外線下で、薄い底部層は5分間最初に硬化され、頂部層は10分間最初に硬化された。集められた層は次いで、さらに30分間硬化された。反応は、Ciba−Geigy Chemicalsによって製造されたIrgacure500の0.5%vol/vol混合物によって触媒作用を及ぼされた。その結果生じたエラストマー物質は、適度な弾性およびガラスに対する接着を示した。
【0054】
あるいは、例えばプラズマ曝露による、エラストマー表面を活性化させることを含む他の結合方法が使用され得、そのためエラストマー層/基材は、接触された場合結合する。例えば、同じ物質から構成されたエラストマー層を共に結合させる1つの可能なアプローチは、本明細書中に参考文献として援用されるDuffyら、「Rapid Prototyping of Microfluidic Systems in Poly(dimethylsiloxane)」、Analytical Chemistry(1998)、70、4974−4984によって示されている。この論文は、ポリジメチルシロキサン(PDMS)層を酸素プラズマに曝露することは、表面の酸化を引き起こし、2つの酸化された層が接触された場合に不可逆の結合が起こることを述べている。
【0055】
エラストマーの連続的な層を共に結合させるさらに別のアプローチは、硬化されていないエラストマーの接着特性を利用することである。具体的には、RTV615のような硬化されていないエラストマーの薄い層が、第1の硬化されたエラストマー層の上に適用される。次に、第2の硬化されたエラストマー層が、硬化されていないエラストマー層の上に置かれる。硬化されていないエラストマーの薄い中央の層は、次いで硬化されてモノリシックエラストマー構造を生成する。あるいは、硬化されていないエラストマーは、第1の硬化されたエラストマー層の底部に適用され得て、第1の硬化されたエラストマー層が、第2の硬化されたエラストマー層の上に置かれる。中央の薄いエラストマー層が再び硬化されて、モノリシックエラストマー構造の形成が生じる。
【0056】
犠牲層のカプセル化がエラストマー構造を製造するのに使用される場合、連続的なエラストマー層の結合が、以前に硬化されたエラストマー層およびその上にパターン化された任意の犠牲材料の上に、硬化されていないエラストマーを流すことによって達成され得る。エラストマー層の間の結合は、相互浸透および硬化されたエラストマー層のポリマー鎖と硬化されていないエラストマー層のポリマー鎖の反応によって起こる。エラストマー層のその後の硬化は、エラストマー層の間の結合を作り、モノリシックエラストマー構造を作製する。
【0057】
図1〜7Bの第1の方法を参照すると、第1のエラストマー層20は、30秒間、2000rpmで微小製造型12でRTV混合物をスピンコーティングすることによって作製され得、約40ミクロンの厚さを生じる。第2のエラストマー層22は、微小製造型11でRTV混合物をスピンコーティングすることによって作製され得る。層20および22の両方は、約80℃で1.5時間別々に焼かれ得または硬化され得る。第2のエラストマー層22は、第1のエラストマー層20の上に約80℃で約1.5時間結合され得る。
【0058】
微小機械加工型10および12は、シリコンウェハーにパターン化されたフォトレジストであり得る。典型的な局面において、Shipley SJR5740フォトレジストが、2000rpmでスピンされ、マスクとして高解像透明度フィルムを用いてパターン化され、次いで高さ約10ミクロンの逆のチャネルを生じさせた。約200℃で約30分間焼かれた場合、フォトレジストは逆流し、逆のチャネルは丸くなる。好ましい局面において、シリコーンゴムの接着を防ぐために各々使用する前に、型は約1分間トリメチルクロロシラン(TMCS)蒸気で処理され得る。
【0059】
(4.適切なエラストマー物質)
Allcockら、Contemporary Polymer Chemistry第2版は、ガラス転移温度と液化温度との間の温度で存在するポリマーとして一般のエラストマーについて記載している。ポリマー鎖は容易にねじれ運動を受けて、力に応じて主鎖を伸ばすことを可能にし、力を欠く場合、先の形状をとるように骨格を再び巻くので、エラストマー物質は弾力性を示す。一般に、エラストマーは力が適用された場合変形するが、次いで力が離れた場合それらの原形に戻る。エラストマー物質によって示された弾力性は、ヤング率によって特徴づけられ得る。約1Pa〜1TPaの間、さらに好ましくは約10Pa〜100GPaの間、さらに好ましくは約20Pa〜1GPaの間、さらに好ましくは約50Pa〜10MPaの間、およびさらに好ましくは約100Pa〜1MPaの間のヤング率を有するエラストマー物質は、本発明に基づいて有益であるが、これらの範囲外のヤング率を有するエラストマー物質もまた、特定用途の必要次第で利用され得る。
【0060】
本発明のシステムは、広範囲のエラストマーから製造され得る。典型的な局面において、エラストマー層は、好ましくはシリコーンゴムから製造され得る。しかしながら、他の適切なエラストマーもまた使用され得る。
【0061】
本発明の典型的な局面において、本システムはGE RTV615(製剤)、ビニル−シラン架橋(タイプ)シリコーンエラストマー(系)のようなエラストマーポリマーから製造される。しかしながら、本システムはこの1つの製剤、タイプまたはこのポリマーの系に限られてなく;むしろ、ほとんど任意のエラストマーポリマーが適切である。本微小バルブ製造の好ましい方法のための重要な条件は、エラストマーの複数の層を共に結合できることである。多層ソフトリソグラフィの場合において、エラストマーの層は、別々に硬化され、次いで共に結合される。この計画は、硬化された層が共に結合するのに十分な反応性を保有していることを必要とする。層は同じタイプであり得てそれら自体で結合できるか、またはそれらが2つの異なるタイプであり得て互いに結合できるかのいずれかであり得る。他の可能性としては、層の間の接着剤の使用および熱硬化性のエラストマーの使用が挙げられる。
【0062】
ポリマーの化学的性質、前駆体、合成方法、反応条件、および可能な添加剤の途方もなく多い多様性を考えると、モノリシックエラストマー微小バルブおよびポンプを作製するために使用され得る膨大な数の可能なエラストマーシステムがある。使用された物質の変化は、ほとんど特定の物質特性、すなわち、耐溶剤性、堅さ、ガス透過性または温度安定性の必要によって制御される。
【0063】
エラストマーポリマーの型は、とてもたくさんある。エラストマーの最も普通の分類の簡単な説明は、本明細書中に示されており、比較的に「標準」ポリマーでさえ、結合について多くの可能性が存在することを示す意図がある。普通のエラストマーポリマーとしては、ポリイソプレン、ポリブタジレン、ポリクロロプレン、ポリイソブチレン、ポリ(スチレン−ブタジエン−スチレン)、ポリウレタン、およびシリコーンが挙げられる。
【0064】
ポリイソプレン、ポリブタジエン、ポリクロロプレン:
ポリイソプレン、ポリブタジエン、およびポリクロロプレンは全て、ジエンモノマーから重合されて、その結果として重合された場合モノマーにつき1つの二重結合を有する。この二重結合は、ポリマーが加硫によってエラストマーに変換されることを可能にする(本質的に、硫黄は熱によって二重結合の間の架橋を形成するように使用される)。このことは、層の不完全な加硫によって同質の多層ソフトリソグラフィーが容易に結合することを可能にする;フォトレジストカプセル化は、同様の機構によって可能である。
【0065】
ポリイソブチレン:
純粋なポリイソブチレンは二重結合を持たないが、重合に少量(約1%)のイソプレンを含むことによってエラストマーとして使用されるように架橋される。イソプレンモノマーは、ポリイソブチレン骨格でペンダント二重結合を与え、次いで上記のように加硫され得る。
【0066】
ポリ(スチレン−ブタジエン−スチレン):
ポリ(スチレン−ブタジエン−スチレン)はリビングアニオン重合によって生産され(すなわち、反応において自然な連鎖停止段階がない)、「生きた(live)」ポリマーの末端が、硬化されたポリマーの中に存在できる。このことは、本フォトレジストカプセル化システムに対する自然な候補にさせる(硬化された層の上に注がれた液体層の中にたくさんの反応を起こしていないモノマーがある場合)。不完全な硬化は、同質の多層ソフトリソグラフィー(A−A結合)を可能にする。化学的性質もまた、余分なブタジエン(「A」)およびカップリング剤を有する1つの層ならびにブタジエンの無い他の層(「B」)を作ることを容易にする(異質の多層ソフトリソグラフィーにおいて)。SBSは「熱硬化性のエラストマー」であり、これは特定の温度より上で溶けて可塑性(弾性に反対するような)になることを意味する;温度を下げていくと再びエラストマーが生じる。このように、層は熱によって共に結合され得る。
【0067】
ポリウレタン:
ポリウレタンは、ジ−イソシアネート(A−A)およびジ−アルコールまたはジ−アミン(B−B)から生成される;ジ−イソシアネートおよびジ−アルコール/アミンの多数の多様性があるので、ポリウレタンの異なるタイプの数は莫大である。ポリマーA対Bの性質は、しかしながら、それらをちょうどRTV615のように異質な多層ソフトリソグラフィにとって有効にさせる:1つの層の中の過剰のA−Aおよび他の層の中の過剰のB−Bを使用することによる。
【0068】
シリコーン:
シリコーンポリマーは、おそらく最大の構造多様性を有し、商業的に利用できる製剤の最大数をほとんど確実に有する。RTV615のビニルと(Si−H)の架橋(異質の多層ソフトリソグラフィおよびフォトレジストカプセル化の両方を可能にする)は、すでに述べられているが、これはシリコーンポリマー化学で使用される数個の架橋方法のうちの単なる1つである。
【0069】
(5.デバイスの操作)
図7Bおよび7Hは共に、第2流動チャネルを加圧することによる第1流動チャネルの閉鎖を示し、図7B(図7Aに相当する流動チャネル32を通して切り取った正面断面図)で、開いた第1流動チャネル30を示し;図7Hで、第2流動チャネル32の加圧によって閉じられた第1流動チャネル30を示す。
【0070】
図7Bを参照すると、第1流動チャネル30および第2流動チャネル32が示される。膜25が流動チャネルを分けて、第1流動チャネル30の頂部および第2流動チャネル32の底を形成する。見られ得るように、流動チャネル30は「開放」である。
【0071】
図7Hに見られ得るように、流動チャネル32の加圧(その中に導入された気体または液体のいずれかによる)は膜25を下方へ偏向させることを引き起こし、それによって流動チャネル30を通過している流動Fをつまんで遮断する。その結果、チャネル32の圧力を変化させることによって、直線的に作動できるバルビングシステムが提供されるので、所望のように膜25を動かすことによって流動チャネル30は開かれ得、または閉じられ得る。(図示の目的だけのために、図7Gのチャネル30は「完全に閉じられた」位置というよりむしろ、「ほとんど閉じられた」位置で示される。)
そのようなバルブはチャネルの屋根を動かすことによってそれら自身(すなわち:膜25を動かすこと)が作動されるので、この技術によって製造されたバルブおよびポンプは正確にゼロデッドボリュームを有し、この技術によって作られた切り換えバルブはおよそバルブのアクティブボリュームと同等のデッドボリュームを有する、例えば、約100×100×10μm=100pLである。膜を動かすことによって消滅されたそのようなデッドボリュームおよびエリアは、既知の従来の微小バルブよりもおよそ2桁小さい。より小さいおよびより大きいバルブならびに切り換えバルブは本発明に考慮されており、デッドボリュームの範囲の包括的なリストは、1aLから1μL、100aLから100nL、1fLから10nL、100fLから1nL、および1pLから100pLを含む。
【0072】
本発明に基づいたポンプおよびバルブによって送達され得る極めて小さいボリュームは、十分な利点を表す。特に、手動で測定され得る流体の最も小さい既知のボリュームは約0.1μlである。自動化されたシステムによって測定され得る最も小さい既知のボリュームは、約10倍大きい(1μl)。本発明に基づいたポンプおよびバルブを利用することによって、10nl以下の液体のボリュームが慣用的に測定および分配され得る。本発明によって可能にされた流体の極めて小さいボリュームの正確な測定は、診断テストおよびアッセイを含む、多数の生物学的な適用に極めて有益である。
【0073】
式1は極めて単純化した、付与される圧力による長方形、直線、弾性、一様な厚さの等方性プレートの偏向の数学モデルを表す:
(1) w=(BPb4)/(Eh3)、ここで:
w=プレートの偏向;
B=形状係数(長さ対幅およびプレートの端の支持体に依存している);
P=付与される圧力;
b=プレート幅
E=ヤング率;および
h=プレート厚さ
このようにこの極めて単純化した式においてでさえ、圧力に応答するエラストマー膜の偏向は:膜の長さ、幅、および厚さ、膜の可撓性(ヤング率)、ならびに付与された作動力によって変化する。これらのパラメータの各々は、本発明に従う特定のエラストマーデバイスの実寸法および物理組成に依存して広く変わるので、膜厚さおよび弾性、チャネル幅、ならびに作動力の広い範囲は、本発明によって考慮されている。
【0074】
提示されたばかりの式は単なる近似であることは理解されるべきである。なぜなら、一般に膜は一様な厚さを有さず、膜の厚さは長さおよび幅と比較して必ずしも小さくなく、偏向は長さ、幅、または膜の厚さと比較して必ずしも小さくないからである。それにもかかわらず、この式は、付与された力に対する偏向の所望の応答を達成するように可変のパラメータを調整する有益な指針として役立つ。
【0075】
図8Aおよび8Bは、100μm幅の第1流動チャネル30および50μm幅の第2流動チャネル32の付与された圧力に対するバルブ開度を示す。このデバイスの膜は約30μmの厚さおよび約750kPaのヤング率を有するGeneral Electric
Silicones RTV615の層によって形成された。図21aおよび21bは、バルブの開いている範囲が、付与された圧力のほとんどの範囲にわたって実質的に直線的であることを示す。
【0076】
0.025インチの外径および0.013インチの内径を有する25mmのステンレススチールの皮下チュービング片とつながった0.025インチの外径を有する10cmの長さのプラスティックチュービング片を通して空気圧がデバイスの膜を作動させるのに付与された。このチュービングは、制御チャネルに対して垂直な方向でエラストマーブロックの中に挿入することによって制御チャネルと接触させて置かれた。空気圧がLee Coによって製造された外部のLHDA微小ソレノイドバルブから皮下チュービングに付与された。
【0077】
デバイスを通しての物質の流動の制御は、付与されたガス圧力を利用することと今までに記載されているが、他の流体が使用され得る。
【0078】
例えば、空気は圧縮性であり、従って、外部のソレノイドバルブによる圧力の付与の時間と、この圧力が膜によって受けられる時間との間のいくらかの限られた遅れを受ける。本発明の代替の実施形態において、圧力が水または液圧オイルのような非圧縮性の流体に外部源から付与され得、その結果として付与された圧力をほとんど瞬間に膜に移す。しかし、バルブの置き換えたボリュームが大きくまたは制御チャネルが狭い場合、制御流体のより高い粘性が作動を遅らせることに寄与し得る。したがって、圧力を移すための最良の媒体は、特定の用途およびデバイス構造に依存し、ガスおよび液体の両方の媒体は本発明によって考慮されている。
【0079】
上記したような外部の付与された圧力は、圧力調節装置を通してポンプ/タンクシステムおよび外部の微小バルブによって付与されているが、他の外部の圧力を付与する方法もまた、本発明において考慮されており、ガスタンク、コンプレッサー、ピストンシステム、および液体カラムを含む。血圧、胃圧、脳脊髄液に存在する圧力、眼内空間に存在する圧力および標準的な屈曲中に筋肉によって与えられる圧力のような生きている生物体内に見出され得るような天然に存在する圧力源の使用もまた考慮されている。微小バルブ、ポンプ、巨視的な蠕動ポンプ、ピンチバルブ、および当該分野において公知のような流体調節装備の他のタイプのような外部の圧力を調節する他の方法もまた考慮されている。
【0080】
見られ得るように、本発明の実施形態に従ったバルブの応答が、最小のヒステリシスを伴って、伝わる範囲の大部分にわたってほとんど完全に直線的であることは、実験的に示されている。従って、本バルブは微小流体測定および流体制御にとって理想的に適している。バルブ応答の直線性は、個々のバルブがフックの法則に従うばねとしてよくモデル化されることを実証する。さらに、流動チャネルの高い圧力(すなわち、背圧)は作動圧力を増大することによって簡単に対抗され得る。実験的に、本発明は70kPaの背圧でバルブ閉鎖を達成しているが、より高い圧力もまた考慮されている。本発明によって包含された圧力範囲の包括的なリストは次の通りである:10Pa〜25MPa;100Pa〜10Mpa、1kPa〜1MPa、1kPa〜300kPa、5kPa〜200kPa、および15kPa〜100kPa。
【0081】
バルブおよびポンプは、開閉に直線的な作動を必要としないが、直線的な応答は、バルブが測定デバイスとしてより容易に使用されることを可能にする。本発明の1つの実施形態において、バルブの開口は、既知の閉鎖程度に部分的に作動されることによって、流量を制御することに使用される。直線的なバルブ作動は、バルブを所望の程度の閉鎖に閉じるために要とされる作動力の量を決定することをより容易にする。直線的な作動の別の利点は、バルブ作動のために必要とされる力が、流動チャネルの圧力から容易に決定され得ることである。作動が直線的である場合、流動チャネルの増加した圧力は、バルブの作動された部分に同じ圧力(単位面積当たりの力)を加えることによって、対抗され得る。
【0082】
バルブの直線性は、構造、組成、およびバルブ構造の作動の方法に依存している。さらに、直線性が、バルブにおいて所望の特性であるかどうかは、適用に依存している。従って、直線的および非直線的の作動可能なバルブの両方は、本発明において考慮されており、バルブが直線的に作動可能である圧力の範囲は、特定の実施形態で変わる。
【0083】
図9は、上記したような空気バルブにチップから結合した10cmの長さの空気チュービングを備える100μm×100μm×10μmのRTV微小バルブの時間応答(すなわち:付与された圧力の変化に応答する時間の関数としてのバルブの閉鎖)を図示する。
【0084】
デジタル制御シグナルの2つの周期、チュービングおよびバルブ開度の末端での実際の空気圧力が、図9に示される。制御ラインに付与された圧力は、100kPaであり、バルブを閉鎖するのに必要とされる約40kPaよりかなり高い。従って、閉鎖する場合、バルブは必要とされるよりも60kPa大きい圧力で押されて閉められる。しかし、開ける場合、バルブはその特有のばねの力(40kPa以下)によってのみ、その静止位置に戻る。従って、τ閉鎖はτ開口より小さいと予想される。制御シグナルと制御圧力応答との間にまた、ずれがあり、圧力を制御するのに使用される小型のバルブの限界によるものである。このようなずれをtと呼び、そして1/e時間定数をτと呼ぶと、これらの値は:t開口=3.63ms、τ開口=1.88ms、t閉鎖=2.15ms、τ閉鎖=0.51msである。3τの各々が、開口および閉鎖を可能にされる場合、水溶液で満たされると、バルブは75Hzで十分に作動する。
【0085】
開口および閉鎖のずれを受けない別の作動方法を使用する場合、このバルブは、約375Hzで作動する。ばね定数は、膜の厚さを変えることによって調整され得ることにもまた注目のこと;これは、速い開口および速い閉鎖のいずれかの最適化を可能にする。ばね定数はまた、膜の弾性(ヤング率)を変えることによって調整され得、膜の中に添加物を取り入れることによって、または異なるエラストマー物質を利用することによって、膜としての役目を果たすことが可能であるのと同様である(図7C〜7Hに関連して上記した)。
【0086】
図9に図示したように、バルブ特性を実験的に測定する場合、バルブ開口は蛍光によって測定された。これらの実験において、流動チャネルは、緩衝液(pH8以上)中のフルオレセインイソチオシアネート(FITC)溶液で満たされ、チャネルの中央から3分の1を占める正方形の範囲の蛍光が、10kHzバンド幅の光電子増倍管を備えるエピ蛍光顕微鏡上で観測された。圧力は、ほとんど同一の気体連結を通して制御ラインと同時に加圧されたホイートストンブリッジ圧力センサー(SenSym SCC15GD2)で観測された。
【0087】
(6.流動チャネル横断面)
本発明の流動チャネルは、異なる横断面のサイズおよび形状で必要に応じて設計され得、それらの所望の適用に依存して、異なる利点を提供する。例えば、下方の流動チャネルの横断面の形状は、湾曲した上面(全長に沿った、または上方の交差チャネルの下に配置された範囲のいずれか)を有し得る。そのような湾曲した上面は、以下のように、バルブの密閉を促進する。
【0088】
図10を参照すると、流動チャネル30および32を通る横断面図(図7Bのそれと同様である)が示される。見られ得るように、流動チャネル30は、横断面の形状において長方形である。本発明の代替の好ましい局面において、図10に示されるように、流動チャネル30の横断面は、代わりに上方の湾曲した面を有する。
【0089】
最初に図10を参照すると、流動チャネル32が加圧される場合、流動チャネル30と32を分けるエラストマーブロック24の膜部分25は、点線25A、25B、25C、25Dおよび25Eによって示された連続した位置に下方へ動く。見られ得るように、不完全な密閉は、おそらく、平面基板14に隣接した流動チャネル30の先端に起こり得る。
【0090】
図11の代替の好ましい実施形態において、流動チャネル30aは、湾曲した上方の壁25Aを有する。流動チャネル32が加圧される場合、膜部分25は、点線25A2、25A3、25A4および25A5によって示された連続した位置に下方へ動き、膜の先端部分は最初、流動チャネルの中に、続いて頂部の膜部分に移動する。膜25Aでそのような湾曲した上面を有することの利点は、流動チャネル32が加圧される場合、より完全なシールが提供されることである。特に、流動チャネル30の上方の壁は、平面基板14に対して連続的に接触する先端を提供し、それによって、図10の壁25と流動チャネル30の底との間に見られる接触の「島」を避ける。
【0091】
膜25Aで湾曲した上方の流動チャネル表面を有することの別の利点は、作動に応答する流動チャネルの形状およびボリュームに、この膜がより容易に適合し得ることである。特に、長方形の流動チャネルが使用される場合、全周(2×(流動チャネル高さ+流動チャネル幅))は、流動チャネルの中に強制的に入れられなければならない。しかし、アーチ形の流動チャネルが使用される場合、より小さい周囲の長さの物質(半円のアーチ形部分のみ)が、チャネルの中に強制的に入れられなければならない。この方法において、膜は作動のための周囲の長さにおいてより小さい変化を必要とし、それによって、流動チャネルをブロックするために付与された作動力に、より応答する。
【0092】
代替の局面(図示されていない)において、流動チャネル30の底は、丸くなっているので、その湾曲した表面は、上記した図20に見られるように湾曲した上方の壁25Aと嵌合する。
【0093】
要約すると、作動に対する膜が受ける実際の構造の変化は、特定のエラストマー構造の構成に依存する。特に、構造の変化は、膜の長さ、幅、および厚さの特徴、構造の残部に対する結合、ならびに流動および制御チャネルの高さ、幅、および形状、ならびに使用されるエラストマーの材料特性に依存する。構造の変化はまた、作動の方法に依存し得る。なぜなら付与された圧力に応答する膜の作動は、磁力または静電気力に応答する作動からいくらか変化するからである。
【0094】
さらに、膜の所望の構造の変化はまた、エラストマー構造の特定の適用に依存して変化する。上記した最も簡単な実施形態において、バルブは開口または閉鎖のいずれかであり得、バルブの閉鎖の度合いを制御することを測定する。しかし、別の実施形態において、より複雑な流動調節を達成するために、膜および/または流動チャネルの形状を変えることが望ましくあり得る。例えば、流動チャネルは、膜部分の下の一段高い突出部を提供され得るので、作動に際して膜は、流動チャネルを通る流動の1部分のみを止め、流動の部分がブロックされるこの部分は、付与された作動力に非感受性である。
【0095】
多くの膜の厚さの特徴および流動チャネル横断面は、本発明によって考慮されており、長方形、台形、円形、長円形、放物線、双曲線および多角形、ならびに上記の形状の部分が挙げられる。すぐ上に議論した突出部を備える実施形態または流動チャネルの凹面を有する実施形態のような、より複雑な横断面の形状もまた、本発明によって考慮されている。
加えて、本発明は、流動チャネルの壁および天井はエラストマーから形成され、チャネルの床は下にある基板から形成される実施形態と併せて最初に上記しているが、本発明はこの特定の方向に限定されていない。チャネルの壁および床はまた、下にある基板に形成され得、流動チャネルの天井だけがエラストマーから構成される。このエラストマー流動チャネルの天井は、付与された作動力に応答してチャネルの中の下方へ突出し、それによって、流動チャネルを通る物質の流動を制御している。一般に、本願における別のところで記載したように、モノリシック構造は、微小流体適用にとって好ましい。しかし、基板で形成されるチャネルを使用することはこの配置が利点を与える場合に有益であり得る。例えば、導光板を含む基板が構成され得るので、導光板は微小流体チャネルの側面に特に光を方向付ける。
【0096】
(7.ネットワークシステム)
図12Aおよび12Bは、1つのオン/オフバルブの図を示し、上記で説明した(例えば、図7A)システムと同一である。図13Aおよび13Bは、図12に見られるが、共にネットワーク化されているような1つのアドレス可能なオン/オフバルブ複数から構成された蠕動ポンピングシステムを示す。図14は、図13の蠕動ポンピングシステムの回転数に対して実験的に達成されたポンピング速度を示すグラフである。図15Aおよび15Bは、1つの制御ラインによって制御可能である複数の流動チャネルの概略図を示す。このシステムはまた、ともに多重化されるが、図12のそれとは異なる配置である、図12の1つのアドレス可能なオン/オフバルブ複数から構成される。図16は、選択されたチャネルを通して流体流動を可能にするのに適用された多重化システムの概略図であり、ともに結合またはネットワーク化された、図12の1つのオン/オフバルブ複数から構成される。
【0097】
図12Aおよび12Bを最初に参照すると、流動チャネル30および32の概要が示される。流動チャネル30は、好ましくは、そこを通る流体(またはガス)流動Fを有する。流動チャネル32(すでに本明細書中に説明されたように、流動チャネル30の上に交差する)は、圧力が付与されるので、流動チャネルを分けている膜25は流動チャネル30の通路の中に押し下げられて、説明されたように、そこを通る流動Fの通路を遮断し得る。従って、「流動チャネル」32はまた、流動チャネル30の1つのバルブを作動させる「制御ライン」と称され得る。図12〜15において、複数のそのようなアドレス可能なバルブは、ポンプを作成するために多様な配置において共に結合またはネットワーク化され、蠕動ポンピングおよび他の流体論理の適用を可能にする。
【0098】
図13Aおよび13Bを参照すると、以下の通りに、蠕動ポンピングのためのシステムが提供される。流動チャネル30は、その上を通る複数のほぼ平行な流動チャネル(すなわち:制御ライン)32A、32Bおよび32Cを有する。制御ライン32Aに圧力が付与されることによって、流動チャネル30を通る流動Fは、制御ライン32Aおよび流動チャネル30の交差点の膜25Aの下で、遮断される。同様に、(しかし示されていない)制御ライン32Bに圧力を付与することによって、流動チャネル30を通る流動Fは、制御ライン32Bおよび流動チャネル30の交差点の膜25Bの下で、遮断される、などである。
【0099】
制御ライン32A、32Bおよび32Cの各々は、別々にアドレス可能である。従って、蠕動は、32Aおよび32Cを一緒に作動させ、次に32Aを作動させ、次に32Aおよび32Bを一緒に作動させ、次に32Bを作動させ、次に32BおよびCを一緒に作動させるなど、のパターンによって作動され得る。これは、一連の「101、100、110、010、011、001」パターンと一致し、ここで、「0」は「バルブ開口」を示し、「1」は「バルブ閉鎖」を示す。この蠕動パターンはまた、120°パターン(3つのバルブの間の作動の位相角について言及している)として公知である。他の蠕動パターンは、同様に可能であり、60°および90°パターンを含む。
【0100】
本発明者らによって行われた実験において、2.35nL/sのポンピング速度が、細い(すなわち内径0.5mm)チュービング(40kPaの作動圧力の下で100×100×10μmバルブを備える)中で水のカラムが移動した距離を測定することによって、測定された。ポンピング速度は、作動回転数とともに約75Hzまで増加し、次いで200Hzを超えるまでほとんど変わらなかった。バルブおよびポンプはまた、相当に耐久性があり、エラストマー膜、制御チャネルまたは結合は、決して衰えることは見られなかった。本発明者らによって行われた実験において、本明細書中に記載された蠕動ポンプのバルブのどれも、400万回を超える作動後に、水または疲労のいかなる徴候も示さない。それらの耐久性に加えて、それらはまた、穏やかである。チャネルを通してポンプされ、および生存度をテストされたE.Coliの溶液は、94%の生存率を示した。
【0101】
図14は、図13の蠕動ポンピングシステムの回転数に対して、実験的に達成されたポンピング率を示すグラフである。
【0102】
図15Aおよび15Bは、複数の図12のアドレス可能なバルブを組み立てる別の方法を図示する。特に、複数の平行流動チャネル30A、30B、および30Cが提供される。流動チャネル(すなわち:制御ライン)32は、流動チャネル30A、30Bおよび30Cの上を横断する。制御ライン32の加圧は、制御ライン32と、流動チャネル30A、30B、および30Cとの交差点に置かれた膜25A、25Bおよび25Cを押し下げることによって、流動F1、F2およびF3を同時に遮断する。
【0103】
図16は、以下の通りに、流体を選択されたチャネルを通して流動させることを、選択的に可能にするために適応された多重化システムの概略図である。それらの上を通る制御ラインからそれぞれの流動チャネルを分けている膜(例えば、図15Aおよび15Bの膜25A、25Bおよび25C)の下方への湾曲は、膜の寸法に強く依存する。従って、図15Aおよび15Bの流動チャネル制御ライン32の幅を変えることによって、複数の流動チャネルの上を通る制御ラインを有することは可能であるが、作動のみ(すなわち:シール)が流動に要求される。図16は、以下の通りの、そのようなシステムの概略図である。
【0104】
複数の平行流動チャネル30A、30B、30C、30C、30D、30Eおよび30Fは、複数の平行制御ライン32A、32B、32C、32D、32Eおよび32Fの下に配置される。制御チャネル32A、32B、32C、32D、32Eおよび32Fは、次のような改変を伴って、上記した任意のバルブシステムを使用する平行流動チャネル30A、30B、30C、30D、30Eおよび30Fを通る流体流動F1、F2、F3、F4、F5およびF6を遮断するように適合される。
【0105】
制御ライン32A、32B、32C、32D、32Eおよび32Fの各々は、広い部分および狭い部分の両方を有する。例えば、制御ライン32Aは、流動チャネル30A、30Cおよび30Eの上に配置された位置において広い。同様に、制御ライン32Bは、流動チャネル30B、30D、および30Fの上に配置された位置において広く、制御ライン32Cは、流動チャネル30A、30B、30Eおよび30Fの上に配置された位置において広い。
【0106】
それぞれの制御ラインが広い位置で、その加圧は、流動チャネルと制御ラインを分けている膜(25)を流動チャネルの中に顕著に押し下げさせ、それによって、そこを通る流動通路をブロックする。逆に、それぞれの制御ラインが狭い位置において、膜(25)もまた狭い。従って、加圧の同じ度合いが、流動チャネル(30)の中に膜(25)を押し下げる結果にはならない。従って、それらの下の流体通路は、ブロックされない。
【0107】
例えば、制御ライン32Aが加圧される場合、流動チャネル30A、30Cおよび30Eの流動F1、F3およびF5をブロックする。同様に、制御ライン32Cが加圧される場合、流動チャネル30A、30B、30Eおよび30Fの流動F1、F2、F5およびF6をブロックする。評価され得るように、1つより多くの制御ラインが、同時に作動され得る。例えば、制御ライン32Aおよび32Cは、F4を除く全ての流体流動をブロックするために同時に加圧され得る(32AはF1、F3およびF5をブロックし;そして32CはF1、F2、F5およびF6をブロックする)。
【0108】
両方一緒におよび様々な順番で、異なる制御ライン(32)を選択的に加圧することによって、流体流動制御の大きな度合いが達成され得る。さらに、6より多い並行流動チャネル(30)および4より多い並行流動チャネル(32)に本システムを拡張することによって、ならびに制御ラインの広い範囲および狭い範囲の配置を変えることによって、非常に複雑な流体流動制御システムが、製造され得る。そのようなシステムの特性は、2(log2n)個の制御ラインだけを備えるn個の流動チャネルの中から任意の1つの流動チャネルを作動させることを可能にする。
【0109】
(8.切り換え可能な流動アレイ)
さらに別の新規な実施形態において、流体通路は、2つの垂直な方向のいずれかの流動に選択的に方向づけされ得る。「切り換え可能な流動アレイ」システムのような例が、図17A〜図17Dに提供されている。図17Aは、エラストマー90の第1の層(または任意の他の適切な基板)の下面図を示し、エラストマー90は、固体柱92のアレイによって規定された流動チャネル格子を形成する溝のパターンを有する滑走面を有し、各固体柱は、その周りを通過する流動チャネルを有する。
【0110】
好ましい局面において、エラストマーのさらなる層は、層90の上面に結合され、その結果、流体流動が方向F1または垂直な方向F2のいずれかで移動するように選択的に方向づけされ得る。図17Bは、エラストマー95の第2層の滑走面の下面図であり、「垂直」制御ライン96および「水平」制御ライン94を交互した形状で形成される溝を示す。「垂直」制御ライン96は、そこに沿った同じ幅を有するのに対して、「水平」制御ライン94は、示されるように、交互した広い部分および狭い部分を有する。
【0111】
エラストマー層95は、エラストマー層90の上に置かれ、その結果、「垂直」制御ライン96は、図17Cに示されるように柱92の上に置かれ、「水平」制御ライン94は、図17Dに示されるように、柱92の間のそれらの広い部分に置かれる。
【0112】
図17Cに見られ得るように、「垂直」制御ライン96が加圧された場合、初めに領域98の層90と95との間に置かれたエラストマー層によって形成された一体化構造の膜は、流動チャネルのアレイを越えて下方へ偏向され、その結果、示されるように、流動方向F2(すなわち:垂直)にのみ通り得るように流入する。
【0113】
図17Dに見られ得るように、「水平」制御ライン94が加圧された場合、初めに領域99の層90と95との間に置かれたエラストマー層によって形成された一体化構造の膜は、流動チャネルのアレイを越えて下方へ(しかし、最も幅の広い領域においてのみ)偏向され、その結果、示されるように、流動方向F1(すなわち:水平)にだけ通ることができるように流入する。
【0114】
図17A〜Dで例示される設計は、切り換え可能な流動アレイが、2つのエラストマー層だけから構築され、異なるエラストマー層が必要とされる制御ラインの間を通る垂直な経由を有さないことを可能にする。すべての垂直な流動制御ライン94が連結される場合、それらは1つの入力から加圧され得る。同じことが、すべての水平な流動制御ライン96にとって当てはまる。
【0115】
(9.細胞囲い)
本発明のなおさらなる適用において、エラストマー構造は、生物体または他の生物学的物質を操作することに利用され得る。図18A〜18Dは、本発明に従う細胞囲い構造の1つの実施形態の平面図を示す。
【0116】
細胞囲いアレイ4400は、直交に方向づけられた流動チャネル4402のアレイで、交互に並んだ流動チャネルの交点に、増大した「囲い」構造4404を有する特徴をもつ。バルブ4406は、各囲い構造4404の入り口および出口に配置される。蠕動ポンプ構造4408は、細胞囲い構造を欠いている各水平流動チャネルおよび垂直流動チャネルに配置される。
【0117】
図18Aの細胞囲いアレイ4400は、以前に分別されている細胞A〜Hがロードされている。図18B〜18Cは、1)隣接した囲い4404aおよび4404bのいずれかの側のバルブ4406を開ける工程、2)水平流動チャネル4402aをポンピングして、細胞CおよびGを移動させる工程、次いで3)垂直流動チャネル4402bをポンピングして細胞Cを除去する工程、によって個々に分別された細胞Cの接近および除去を示す。図18Dは、第2の細胞Gが、水平流動チャネル4402aを通して液体流動の方向を逆にすることによって細胞囲いアレイ4400の前の位置の中に戻されることを示す。上述の細胞囲いアレイ4404は、選択された範囲内(すぐにアクセス可能なアドレス可能な位置)で、物質を分別可能である。
【0118】
図18A〜18Dに関連して上記かつ上述の実施形態は、流動チャネル交点の反対側の連結バルブ対を利用するが、これは本発明によって必須ではない。交点の隣接したバルブの連結、または交点を囲む各バルブの独立の作動を含む他の構造は、所望の流動特徴を供給することを可能にする。しかし、独立バルブ作動アプローチにより、別々の制御構造が各バルブのために利用されると、デバイスレイアウトが複雑になることは、理解されるべきである。
【0119】
(10.細胞ケージ)
上記の細胞囲いアレイ4404は、選択された範囲内(すぐにアクセスするためのアドレス可能な位置)で、物質を蓄え得る。しかし、細胞のような生きている生物体は、生き残るために持続的な食物の摂取および水の排出を必要とし得る。したがって、図19Aおよび19Bは、それぞれに、本発明に従う細胞ケージ構造の1つの実施形態の(ライン45B−45B’に沿った)平面および横断面図を示す。
【0120】
細胞ケージ4500は、基板4505と接触しているエラストマーブロック4503の中の流動チャネル4501の拡張部分4500aとして形成される。細胞ケージ4500は、細胞ケージ4500の末端4500bおよび4500cが領域4500aの内部を完全に囲まないことを除いて、図18A〜18Dに上記した個々の細胞囲いに類似している。むしろ、ケージ4500の末端4500aおよび4500bは、多数の伸縮自在の支柱4502によって形成される。
【0121】
具体的には、制御チャネル4504は、支柱4502の上におかれる。制御チャネル4504の圧力が減少された場合、エラストマー支柱4502は上方へ引き出されて制御チャネル4504の中に入り、それによって細胞ケージ4500の終点4500bを開いて細胞を中に入れることを可能にする。制御チャネル4504における圧力の上昇に際し、支柱4502は下方へ緩み、基板4505に当たって、細胞がケージ4500から出ていくことを防ぐ。
【0122】
エラストマー支柱4502は、十分な大きさおよび数で、ケージ4500の外へ細胞が移動することを防ぐが、その中に蓄えられた細胞を維持するために栄養のケージ内部4500aの中への流動を可能にする隙間4508もまた備える。末端4500cに対向する支柱4502は、同様に、所望されるように上記ケージを開いて細胞を除去することを可能にする第2制御チャネル4506の下に構成される。
【0123】
(11.交差チャネルインジェクター)
図18A〜18Dに示された交差流動チャネル構造は、記載した細胞囲い以外の機能を果たすために使用され得る。例えば、交差流動チャネル構造は、混合する用途に利用され得る。
【0124】
このことは、本発明の別の実施形態に従う微小製造構造によって行われた混合工程の平面図である図20A〜Dに示される。具体的には、微小加工混合構造の部分7400は、第2流動チャネル7404と直交し、かつ交差している第1流動チャネル7402を備える。制御チャネル7406は、流動チャネル7402および7404の上にあり、各々交差点7412を取り囲むバルブ対7408a−bおよび7408c−dを形成する。
【0125】
図20Aに示されるように、バルブ対7408c−dは、バルブ対7408a−bが閉じる間に、最初に開かれて、流体サンプル7410は、流動チャネル7404を通して交差点7412に流入される。次いで、バルブ対7408a−bが作動され、交差点7412で流体サンプル7410を捕捉する。
【0126】
次に、図20Bに示されるように、バルブ対7408c−dが閉じられて7408a−bが開かれ、その結果、流体サンプル7410は、流体の交差流動を担う流動チャネル7402に交差点7412から注入される。図20A〜Bに示されたプロセスは、交差流動チャネル7402の下方へ、任意の数の流体サンプルを正確に分配するように繰り返され得る。
【0127】
図20A−Bに示されたプロセス−チャネル流動インジェクター構造の実施形態は、1つの接合点で交差するチャネルの特徴を有するが、これは本発明に必要ではない。従って、図20Cは、本発明に従うインジェクション構造の別の実施形態の単純化した平面図を示し、ここで、交差する流動チャネル7452の間の接合点7450は、拡張され、さらなる容積容量を提供する。図20Dは、本発明に従うインジェクション構造のさらに別の実施形態の単純化した平面図を示し、ここで、交差する流動チャネル7462の間の延長した接合点7460は、分岐7464を備え、より多くのインジェクション容積容量をさらに提供する。
【0128】
(12.回転式混合構造)
本発明の実施形態に従う微小流体制御チャネルおよび微小流体流動チャネルは、閉鎖回路流動チャネルを通して流体を循環させる回転ポンプデザインに方向づけられ得る。本明細書中に使用される用語「閉鎖回路」は、当該分野において周知であり、楕円および長円のような環状ならびにその変形、ならびに三角形、長方形またはさらに複雑な形状によって作られるような、角を有する流動回路経路である構造をいう意味を有する。
【0129】
図21に図示されるように、流動チャネル2100を有する層は、多数のサンプル入力の2102、混合T−接合点2104、中央循環ループ2106(すなわち、実質的に環状流動チャネル)、および出力チャネル2108を有する。流動チャネルを有する制御チャネルのオーバーレイは、微小バルブを形成し得る。この微小バルブは、制御チャネルと流動チャネルとが薄いエラストマー膜によって分けられるので、流動チャネルの中に湾曲し得るか、流動チャネルから後退し得る。
【0130】
実質的に環状の中央ループ、およびそれと交差する制御チャネルは、回転式ポンプの中央部分を形成する。実質的に環状の流動チャネルを通して溶液を流動させるポンプは、互いに隣接する少なくとも3つの制御チャネル2110a〜cのセットから成り、実質的に環状の分岐流動チャネル2106(すなわち、中央ループ)と交差する。
【0131】
001、011、010、110、100、101のような一連のオン/オフ作動順序が制御チャネルに適用される場合、中央ループの流体は、時計回りまたは反時計回りのいずれかの選択された方向に蠕動的にポンピングされ得る。蠕動ポンピング作動は、制御チャネルと流動チャネルとを分ける膜の、流動チャネルの中へまたは外への連続的な湾曲から起こる。
【0132】
一般に、作動回転数がより高くなると、流体は、中央ループを通ってより速く回転する。しかし、飽和点は、最終的に、より速い流体流動を生じない点に達する。これは、主に、膜が作動できない位置に戻り得る速度の限界に起図する。
【0133】
図21に示されるシステムは、3つの制御チャネルを備える各ポンプを示すが、異なった数の制御チャネルが利用され得る(例えば、複数の交差点を有する単一の曲がりくねった制御チャネルが使用され得る)。
【0134】
中央ループと流体連絡する多様な異なる補助的な流動チャネルは、サンプルおよび反応溶液を中央ループに導入しそして回収するために利用され得る。同様に、中央ループと流体連絡する1つ以上の出口流動チャネル、すなわち排出口流動チャネルが、中央ループから溶液を除去するために利用され得る。例えば、中央ループ内へまたは中央ループから外に溶液が流動することを防ぐために、制御バルブが、注入口および排出口で利用され得る。
【0135】
流動チャネルの寸法および形状は変わり得る。特定のデバイスで、チャネルの直径は約1mmから2cmまでの範囲に及ぶ傾向があるが、特定のデバイスにおいて、この直径はかなり大きくなり得る(例えば、4、6、8または10cm)。環状の流動チャネルの直径の最小の限界は、本来多層ソフトリソグラフィープロセスによって、定められた限界の関数であり得る。チャネル幅(流動または制御のいずれか)は、通常30μmと250μmとの間で変化する。しかし、いくらかのデバイスのチャネル幅は、1μmほどの狭さである。より広い幅のチャネルもまた利用され得るが、一般に流動チャネル内にある型の構造的支柱を必要とする。チャネルの高さは、一般に5μmと50μmとの間で変化する。100μm以下の幅を有する流動チャネルにおいて、チャネルの高さは1μm以下であり得る。流動チャネルは、概して円形で、一旦、膜がチャネルの中に湾曲すると、チャネルの完全な閉塞を可能にする。幾つかのデバイスにおいて、チャネルは、例えば八角形または六角形の形状を有する。特定のデバイスにおいて、流動チャネルは、円形で、かつ100μm幅で、かつ10μm高であり、そして制御チャネルは、100μm幅でかつ10μm高である。特定の研究で利用されている1つのシステムは、2cmの直径、100μmの流動チャネル幅および10μmの深さを有する中央ループを利用している。
【0136】
チャネルは、代表的に上記の寸法および形状を有するが、本明細書中に提供されるデバイスは、これらの特定の寸法および形状に制限されないことは、理解されるべきである。例えば、閉鎖回路流動チャネルに存在する分岐は、分散を制御し、従って、その中に流動された物質の混合に役立ち得る。
【0137】
(13.微小流体大規模一体化)
前節は、実質的に密封および拡張可能であるモノリシック微小バルブを記載し、これらの微小バルブを製造するための方法もまた記載している。前に記載した比較的単純な微小流体バルブの集合のために、各流体流動チャネルは、その特有の個々のバルブ制御チャネルによって制御され得る。しかし、そのような非一体化制御戦略は、個々にアドレス可能な何千または何万ものバルブを含む、より複雑な集合に対して実際的に実施され得ない。従って、技術の多様性が、単独でまたは組合わせて適用され、個々にアドレス可能なバルブを有する大規模一体化微小流体デバイスの製造を可能にし得る。
【0138】
本発明の実施形態に従う大規模一体化微小流体構造を実施するために有用な技術は、係属中の米国非仮特許出願第10/___,___号(代理人整理番号20174C−009410US)に詳細に記載されている。大規模一体化微小流体デバイスの製造を可能にする1つの技術は、マルチプレキサー構造の使用である。
【0139】
マルチプレキサー構造の使用は、流動チャネルの1つのセットの上にある制御ラインの1つのセットと関連して、前に記載されている。図22Aは、微小流体2分木マルチプレキサー動作線図(microfluidic binary tree multiplexor operational diagram)を例示する単純化した平面図を示す。下方のエラストマー層で規定された流動チャネル1900は、目的の流体を含み、一方では、上にあるエラストマー層で規定された制御チャネル1902は、空気または水のような作動流体を含む制御ラインを表す。バルブ1904は、流動チャネル1900を備える制御チャネル1902の幅広い部分1902aの交差点で形成された膜によって規定される。作動圧力は、ただ一つの広い膜が、流動チャネル1900の中に完全に湾曲するように選択される。特に、マルチプレキサー構造は、制御チャネル幅:流動チャネル幅の比が減少するようにバルブを作動するために必要とされる圧力の急な増加に基づく。
【0140】
図22Aに示されるマルチプレキサー構造は、各段階が流動チャネルの2つの全グループから1つを選ぶ場合、2分木のバルブの形態である。図22Aに示されるマルチプレキサー実施形態において、マルチプレキサーの開口/閉鎖バルブの各組合わせは、n流動チャネルが、2log2n制御チャネルのみでアドレスされ得るように単一のチャネルを選ぶ。
【0141】
多重化バルブシステムを使用することによって、2進法の累乗が、明らかになる:1024流動チャネルを特定にアドレスするために、約20の制御チャネルだけが、必要である。これは、多数のエラストマー微小バルブがこれらのデバイス内で複雑な流体操作を行うことを可能にし、一方、デバイスと外部環境との間の境界は、単純で強固である。
【0142】
図22Bは、本発明に従うマルチプレキサー構造の代替の実施形態の単純化した平面図を示す。マルチプレキサー構造1950は、エラストマー層の下にある流動チャネル1954の上にあるエラストマー層で形成された制御チャネル1952を備える。図22Aのマルチプレキサーの同じ物理的原理の下での作動により、マルチプレキサー1950は、バルブの3分木を備え、ここで各段は3ビット(「トリット(trit)」)を備え、流動チャネルの3つの全グループから1つを選ぶ。マルチプレキサー1950の開口/閉鎖バルブの各組合わせは、n流動はチャネルが3log3n制御チャネルのみでアドレスされ得るように、単一のチャネルを選ぶ。
【0143】
図22A〜Bに示される基礎のマルチプレキサーデバイスのいずれかの一般的な微小流動構造は、図22Cの単純化した横断面図で一般的に表され得、ここで制御チャネルネットワークCを規定する第2エラストマー層E2は、流動チャネルネットワークFを規定する第1エラストマー層E1の上にある。
【0144】
図22Bの低3マルチプレキサーは、多数の「流動」チャネルをアドレスするのに使用され得る最も効率の良い設計である。これは、eがlogの底として使用される場合、xlogxnバルブは最小化されるからである。分数は実際のマルチプレキサーの底に使用されないので、最も効率の良いマルチプレキサー構造は、x=3(e(約2.71828)に最も近い整数)のバルブの場合、達成される。
【0145】
この点を明らかにするために、表2は、底2マルチプレキサーと底3マルチプレキサーとの効率を比較する。
【0146】
【表2】

上記は、同じ底の数を有する段階を利用する種々のマルチプレキサー構造に対して焦点を合わせているが、これは本発明に必須ではない。本発明に従うマルチプレキサー構造の代替の実施形態は、異なる低の数の段から成る。例えば、1ビット段および1トリット段から成る2段マルチプレキサーは、アドレスする6流動チャネルの最も効率の良い進路を表す。階の位は任意であり、同じ数の制御されている流動ラインを生じる。異なる2進法および3進法の段から成るマルチプレキサー構造の使用は、数2および3の積である任意の数の「流動」チャネルを効果的にアドレスすることを可能にする。
【0147】
マルチプレキサーは、おそらく任意の底の数を使用する。例えば、必要な場合、5もまた低の数として使用され得る。しかし、制御ラインの利用の効率は低減するので、制御ラインの数はeの値から離れる。これは図23に示されており、異なる低の数を有するマルチプレキサー構造の、制御ラインの数対制御されている流動ラインの数をプロットする。
【0148】
大規模一体化(LSI)微小流体デバイスの製造を可能にする別の技術は、多層の制御ラインの使用である。図24〜24Bは、このアプローチを図示する。図24は、第2制御ラインによって制御された第1制御ラインを有する微小流体デバイスの1つの実施形態の平面図を示す。図24Aは、ラインA−A’に沿った図24の微小流体デバイスの横断面図を示す。図24Bは、ラインB−B’に沿った図24の微小流体デバイスの横断面図を示す。
【0149】
微小流体構造2100は、最低のエラストマー層2104に形成された2個の流動チャネル2102a−bから成る。第1分岐2106bおよび第2分岐2106cと流体連絡する第1入口2106aを含む第1制御チャネルネットワーク2106は、第1エラストマー層2104の上にある第2エラストマー層2108に形成される。第1制御チャネルネットワーク2106の第1分岐2106bは、第1バルブ2112を規定する第1流動チャネル2102aの上にある広くなった部分2110を含む。第1制御チャネルネットワーク2106の第2分岐2106cは、第2バルブ2116を規定する第2流動チャネル2102bの上にある広くなった部分2114を含む。
【0150】
第3制御チャネル2118aを備える第2制御チャネルネットワーク2118は、第2エラストマー層2108の上にある第3エラストマー層2120に形成される。第3制御チャネル2118aは、バルブ2122を形成する第1制御チャネルネットワーク2106の第1分岐2106bの上にある広くなった部分2118bを含む。
【0151】
図24〜24Bに図示される微小流体デバイスは、下記の通りに作動され得る。操作され得る流体は、流動チャネル2102aおよび2102bに存在する。第1制御チャネルネットワーク2106に対する圧力の適用は、バルブ2112およびバルブ2116の膜を、それらのそれぞれの流動チャネルである2102aおよび2102bの中へ下方に湾曲させ、それにより、流動チャネルを通して流動をバルブで調整する。
【0152】
第2制御チャネルネットワーク2118に対する圧力の適用は、バルブ2122の膜を、下にある第1制御チャネルネットワーク2106の第1分岐2106cのみの下方へ湾曲させる。これはその湾曲された状態でバルブ2112を固定し、今度は、第1制御チャネルネットワーク2106内で、圧力を、バルブ2112の状態に影響せずに変えることを可能にする。
【0153】
図24〜24Bに描かれた微小流体デバイスの一般的な構造は、図25の単純化された横断面図にまとめられている。特に、エラストマーデバイス2200は、流動チャネルネットワークFを規定する最も低いエラストマー層E1から成り、第1制御チャネルネットワークC1を規定する第2エラストマー層E2の下にある。同様に、第1制御チャネルネットワークC1は、第3エラストマー層E3内で規定される第2制御チャネルネットワークC2の下にある。
【0154】
図24〜24Bの微小流体デバイスの実施形態は、3つの分離したエラストマー層から製造されるように記載されているが、これは本発明に必須ではない。多重化制御ラインを特徴づける本発明の実施形態に従う大規模一体化微小流体構造は、2つのエラストマー層のみを利用して製造され得る。このアプローチは、図26〜26Bに関連して図示される。
【0155】
図26は、第1流動チャネル2300aおよび第2流動チャネル2300b、ならびに、バルブ2304および2306それぞれを規定する流動チャネル2300aおよび2300bの上にある第1分岐制御チャネルネットワーク2302を備える微小製造(microfablicated)エラストマーデバイスの単純化された平面図を示す。図26Aは、ラインA−A’に沿った図26の微小製造エラストマーデバイスの横断面図を示し、より低いエラストマー層2306で規定された流動チャネル2300a、および上方のエラストマー層2310で規定された第1制御チャネル2302を備える。
【0156】
より低いエラストマー層2308は、バルブ2314を規定する第1制御チャネル2302の底面に広がる第2制御チャネルネットワーク2312をさらに備える。従って、図26Bは、ラインB−B’に沿った図26の微小製造エラストマーデバイスの横断面図を示す。同じ(より低い)エラストマー層2308に存在する、流動チャネルネットワーク2300および第2制御チャネルネットワーク2312は、分離し、互いに交差しない。
【0157】
図27の単純化された横断面図に表されるように、分離した流動チャネルネットワークFおよび制御チャネルネットワークC2は、このように1つの(より低い)エラストマー層E1に存在し得、制御チャネルネットワークC1のみを規定する別のエラストマー層E2を覆う。
【0158】
図26〜26Bに図示された微小流体デバイスは、以下のように作動され得る。操作され得る流体は、流動チャネル2300aおよび2300bに存在する。第1制御チャネルネットワーク2302に対する圧力の適用は、バルブ2304の膜を、それらのそれぞれの流動チャネル2300aおよび2300bの中へ下方に湾曲させ、それにより、流動チャネルを通して流動をバルブで調節する。
【0159】
第2の制御チャネルネットワーク2312への圧力の適用は、バルブ2314の膜を、上に重なっている第1の制御チャネルネットワーク2302の分岐へ上向きに湾曲させる。このことは、バルブ2314を、その湾曲した状態で固定する。換言すると、第1の制御ネットワーク2302内の圧力が、バルブ2314の状態に影響を及ぼすことなく変化されることを可能にする。図24に示される実施形態とは対照的に、図26〜26Bの微小流体デバイスは、増大した圧力に応じて隣接制御チャネルへ上向きに湾曲することによって作動するバルブを特徴とする。
【0160】
図27Aは、大規模集積技術を用いて微小加工された微小流体コンパレータチップ3000の光学顕微鏡写真を示し、このチップは、256個のコンパレータのアレイに類似している。具体的には、2056個の微小バルブを備える第2のデバイスが、より複雑な流体操作を実行し得るように設計された。種々の入力は、有色の食用色素と共にロードされて、流体論理のチャネルおよびサブエレメントを可視化する。図27Bは、図27Aのチップの一部分の簡略化した概略平面図を示す。
【0161】
コンパレータチップ3000は、一対の平行な折れ曲がったフローチャネル3002および3004から形成され、そのフローチャネル3002および3004は、それぞれ、注入口3002aおよび3004a、ならびに排出口3002bおよび3004bを有し、フローチャネル3006の分岐した水平方向の列によって種々の点で交差されている。折れ曲がったフローチャネルの間に位置付けられた水平方向のフローチャネルの部分は、混合位置3010を規定する。
【0162】
接続チャネルの中央に重なっている第1のバリア制御ライン3012は、隣接チャンバを作製するように作動可能であり、そして隣接チャンバの内容物が混合し得るように停止可能である。第2のバリア制御ライン3014は、水平方向のフローチャネルのレスト(rest)から隣接チャンバを隔てるために、隣接チャンバのいずれかの端部を越えて折り返す。
【0163】
水平方向のフローチャネル3006の一方の端部3006aは、圧力源3016と流体連絡し、そして接続水平フローチャネル3006の他方の端部3006bは、マルチプレクサ(multiplexor:MUX)3020を通ってサンプル収集出力3018と流体連絡する。
【0164】
図27C〜Hは、図27A〜Bの構造のうちの1つの混合エレメントの動作の単純化した拡大平面図を示す。図27Cは、ローディング前の混合エレメント示し、この混合エレメントは、混合バリア制御ラインと加圧されていないラップアラウンド(wrap−around)バリア制御ラインとを備える。図27Dは、隣接チャンバ3050および3052を規定するために隔離バルブおよび分離バルブを作動させるための、ラップアラウンドバリア制御ラインおよびバリア混合ラインの加圧を示す。図27Eは、これらの物質をそれぞれのフローチャネルに流すことによる、第1の成分および第2の成分のチャンバへのローディングを示す。図27Fは、鉛直区画化制御ライン3025の加圧および隣接チャンバを規定するための隔離を示す。
【0165】
図27Gは、分離バリアバルブを停止するために混合バリア制御チャネルを減圧し、それによって隣接チャンバ中に存在する様々な成分が自由に混合することを可能にすることを示す。
【0166】
図27Hは、隔離制御ラインのバリアを停止して、隔離バルブを停止させ、その後、制御ラインに圧力を適用し、そしてマルチプレクサを停止させて、組み合わされた混合物が回収されることを可能にすることを示す。
【0167】
図27A〜Hに示されるデバイスの事例において、2つの異なる試薬が、別個にロードされ得、対になって混合され得、そして選択的に回収され得る。このことは、256個のナノリットル以下の反応チャンバで別個のアッセイを実施し、次いで特定の目的の試薬を回収することを可能にする。マイクロチャネルの配置は、1つのカラムあたり64個のチャンバからなるフロー層中の4つの主要なカラムからなり、このカラムは、区画化および混合の後に、約750pLの液体を含有する各々のチャンバを備える。液体は、低い外部圧力(約20kPa)下で、2つの別個の入力を通してこれらのカラムにロードされて、折れ曲がり様式でアレイを満たす。制御層上のバリアバルブは、サンプル流体をお互いから隔離するように、そして個々のチャンバの内容物を回収するために使用されるフロー層上のチャネルネットワークから隔離するように機能する。これらのネットワークは、マルチプレクサおよびいくつかの他の制御バルブの制御下で機能する。
【0168】
図27A〜Hに示される貯蔵アレイおよびコンパレータ微小流体デバイスは、2つの別個の層を使用して多層ソフトリソグラフィー技術によって製造された。バルブを作動するために必要なすべてのチャネルを備える「制御」層は、制御されるべきチャネルのネットワークを備える「フロー」層の上端に位置される。バルブは、制御チャネルがフローチャネルを横切る場合に作製される。2つのチャネル間の連結部で生じる薄い膜は、水圧または空気圧の作動によって湾曲され得る。すべての生物学的アッセイおよび流体操作は、「フロー」層上で実行される。
【0169】
微小流体チャネル用の原型は、高さ9μmのシリコン上にポジティブなフォトレジスト(Shipley SJR 5740)をスピンコーティングし、そしてそれらに高解像度(3386dpi)の透過性マスクを施すことによって作製された。フォトレジスト型上のチャネルは、完全にバルブが閉じることが可能な幾何学を作り出すために、120℃で20分間、円形にされた。
【0170】
デバイスは、フォトレジスト型から2パートの硬化シリコン(Dow Corning Sylgard 184)キャストの2つの層を一緒に接着することによって製造された。「フロー」チャネルを含むデバイスの下部層は、パートA:パートBが20:1のSylgardで、2500rpmにて1分間スピンコーティングされる。得られるシリコン層は、約30μmの厚さである。「コントロール」チャネルを含むデバイスの上部層は、別個の型を用いて、パートA:パートBが5:1のSylgardを使用して、厚い層(厚さ約0.5μm)として成型される。この2つの層は、最初に80℃にて30分間湾
曲される。
【0171】
次いで、コントロールチャネル相互接続空孔が、(型から取り外された)厚い層を突き
抜けて穿孔され、その後、薄層上でチャネルのある面を下にして封着されて、それぞれのチャネルネットワークが整列される。構築された層の間の接着は、デバイスを80℃にてさらに45〜60分間加硫することによって達成される。得られる多層デバイスは、サイズに切り取られ、そしてRCA洗浄した番号1の25mm四方のカバーガラス上に取り付けられるか、またはカバーガラス上にパートA:パートBが5:1のSylgardで5000rpmにてスピンコーティングされ、そして80℃にて30分間加硫され、その後、80℃で一晩インキュベートされる。
【0172】
複数の近接していないフローチャネルの同時アドレス指定は、固定されるフローチャネルの寸法(幅100μmおよび高さ9μm)を維持しながらも、種々の幅の制御チャネル
を製造することによって達成される。フローチャネルを閉じるために必要とされるコントロールチャネルにおける空気圧は、コントロールチャネルの幅に応じて、より高い作動閾値を有する50μm×100μmの交差領域を閉鎖することなく、比較的より低い圧力(約40kPa)で100μm×100μmのバルブを作動するのを容易にする。
【0173】
これらのデバイスへの流体の誘導は、シリコンを突き抜けて穿孔された空孔に挿入されたスチールピンを通して達成される。微小機械化デバイスが、高いヤング率を有する硬質な材料で作製されるのとは異なり、シリコンは、軟質でありかつ入力ピンの周りを密封し、漏出を伴わずに300kPaまでの圧力を容易に可能にする。コンピュータ制御された外部ソレノイドバルブは、マルチプレクサの作動を可能にする。換言すると、複合体が多数の微小バルブをアドレス指定することを可能にする。
【0174】
(II.細菌およびウイルスの特徴付けおよび分析)
ヒトの腸の細菌生態学および以前は到達不可能であった他の環境が、個々の細菌からゲノムDNA(gDNA)ライブラリーを作製するための微小流体チップを利用して、高度に類似の様式で特徴付けられ得、かつ分析され得る。gDNAライブラリーは、高スループットなスクリーニングまたはハイブリダイゼーションアッセイを使用して分析され得る。微小流体構造が個々の細菌から試薬を生成する能力によって、以前は解決不可能であった問題に対処するために機能ゲノム科学の適用が可能になる。
【0175】
図28は、本発明の1つの実施形態に従う、特徴付けおよび分析のための、一般的なプロセス6000の簡略化したフローチャートを示す。工程6002では、細菌および/またはウイルスを含むサンプルが、目的の環境から収集される。工程6004では、目的の細菌またはウイルスが、実質的に、収集したサンプルの他の成分から物理的に単離される。
【0176】
工程6006では、単離された細菌またはウイルスが、その核酸内容物へのアクセスを提供するために溶解される。工程6008では、細胞/ウイルス溶解物によって曝露された核酸が精製される。
【0177】
最良の工程6010および6012では、それぞれ、精製された核酸が特徴付けられ得、そして増幅され得る。図28は、増幅前に生じる核酸の特徴付けの工程を示すが、この工程の順序は、本発明によって規定されない。代替の実施形態によると、精製された核酸は、特徴付けの前に増幅され得る。
【0178】
なお他の最良の工程では、本発明の実施形態に従って精製された核酸が発現され得る。具体的には、工程6014は、精製された核酸のプラスミドまたはベクター中への連結を示す。工程6016は、連結された核酸を有する宿主細胞の形質転換を示す。工程6018は、形質転換された細胞による核酸の発現を示す。
【0179】
上記のように、プロセス6000のうちの1つの工程またはすべての工程は、本発明の実施形態に従って微小流体アーキテクチャーを利用して実施され得る。以下の節は、細菌およびウイルスを単離および特徴付けするための特定の機能を要約しており、微小流体構造の特定の例が、これらの機能を実行するのに適切であることを示す。
【0180】
(1.細菌/ウイルス単離)
図29Aは、本発明に従う微小流体アーキテクチャーの1つの実施形態の平面図を示す。微小流体チップ6100は、第1のフローチャネル6102を備え、この第1のフローチャネル6102は、第1のゲートクロスフロー注入構造物6104、第2のゲートクロスフロー注入構造物6106、そして第3のゲートクロスフロー注入構造物6108に連続的に通じている。ゲートクロスフロー注入器6104、6106、および6108は、第1のフローチャネル6102と、分岐6110a、6110b、および6110cを有する第2のフローチャネルネットワーク6110との交差によって規定される。3つの並行単離が、それぞれクロスフロー注入構造物6104、6106、および6108について、1.6nl、1.0nl、および0.4nlの異なるサンプル容積を用いて利用可能である。図29Bは、クロスフロー注入構造物6104の拡大図を示す。
【0181】
水平方向のフロー制御ライン6112は、クロスフロー注入構造物6104、6106、および6108に対する注入口および排出口でフローチャネル6102および9110と重なり合い、それによって、これらの構造物内および構造物外への液体の流れを制御する。
【0182】
図29に示される流体デバイスの実施形態の作動の前に、サンプルが、目的の環境から入手されている。環境から入手されたサンプルは、1×108〜9実体/mlまたはさらに高い細菌/ウイルス濃度を有し得る。このような濃度は、1ピコリットル(pL)(1ピコリットル=1000ナノリットル)当たり約1個の細菌またはウイルス実体に相当する。必要な場合には、サンプルの濃度は、所望の細菌またはウイルス実体の最大数が、特定の容積を有する微小流体チャンバ内に捕獲されることを確証するために希釈され得る。希釈はまた、所望のサンプル特性(例えば、粘度またはpH)を得るために有益である。
【0183】
最初の単離工程において、サンプルは、第1のフローチャネル6102の注入口6102aを通して流される。上記の希釈工程のために、サンプル由来の限られた数のウイルス/細胞が、各々のゲートクロスフロー注入構造物6104、6106、および6108に存在する。次いで、水平方向のコントロールライン6112が作動されて、希釈されたサンプルをクロスフロー注入構造物6104、6106、および6108内に捕捉する。
【0184】
1つの実施例において、eGFPを発現するE.coliの培養物は、5.3±3.5×108細胞/mLの最終細胞濃度に到達することが確認された。次いで、その培養物は、ヌクレアーゼを含まない水中に1:10で希釈され、チップにロードされた。0.4nL区画、1.0nL区画、および1.6nL区画中の細菌の平均数は、それぞれ27、61、および139であり、予測された結果の21、53、および85と、非常に良く一致した。
【0185】
単離目的のためのサンプルのいくらかの希釈は、チップの外で行われ得るが、特定の程度のサンプル希釈もまた、図29の微小流体構造それ自体を利用して達成され得る。具体的には、クロスフロー注入構造物6104、6106、および6108のすぐ上流に、それぞれ、第2のクロスフロー注入構造物6120、6122、および6124が配置される。第2のクロスフロー注入構造物6120、6122、および6124は、第2のフローチャネルネットワーク6110の分岐6110a〜cを備える第3のフローチャネル6126の交差によって規定される。
【0186】
緩衝液は、3のフローチャネル6126の注入口6126aを通って、クロスフロー注入構造物6120、6122、および6124へ配置され得る。次いで、クロスフロー注入構造物の対6104/6120、6106/6122、および6106/6124を隔てる水平方向のバルブ6130が停止されて、これらの隣接する注入構造物の内容物の混合が可能になり、それによって、サンプルがさらに希釈される。
【0187】
上記の説明は、微小流体チャンバ中の希釈されたサンプルの物理的な封じ込めによる、特定の細菌またはウイルスの単離に着目してきたが、他のアプローチは、分類アプローチを利用して、細菌またはウイルスを最初に単離し得る。このような分類適用に有用な微小流体構造の一例は、Fuら、S.R.Anal.Chem.Vol.74、2451−2457頁(2002)によって記載されており、本明細書において参考として援用される。
【0188】
(2.ウイルス/細菌核酸の溶解および精製)
特定の細胞またはウイルスから核酸を精製し、そして回収するために、細胞またはウイルスはまず、その内容物を曝露するために溶解されなければならない。図29Aに戻ると、第2のフローチャネルネットワーク6110への注入口6110dは、フローチャネルの3つの注入口に流体連絡している。
【0189】
第2のフローチャネルネットワーク6110の注入口6110aは、バルブ6133を通って溶解化学注入口6132に流体連絡している。第2のフローチャネルネットワーク6110の注入口6110aは、バルブ6135を通って洗浄注入口6134に流体連絡している。第2のフローチャネルネットワーク6110の注入口6110aは、バルブ6137を通って溶出注入口6136に流体連絡している。
【0190】
図29の微小流体構造の作動の溶解段階中に、溶解化学が、フローチャネルネットワーク6110へ流される。クロスフロー注入構造物を隔てている水平バルブが開放され、そして全サンプル、緩衝液、および溶解溶液混合物が混合構造物6170へ流される。
【0191】
組み合わされたサンプル/緩衝液/溶解溶液混合物は、ループ出口コントロールライン6172が作動し続けたままで、展開性のないローディングプロセスによって混合器6170に流される。次いで、混合コントロールライン6171a〜cが作動されて、混合を達成するように環状フローチャネルの周りを混合物が流れる。図29Cは、5nLの容積を有する回転混合構造物の拡大図の写真を示す。
【0192】
上記の実施例では、27、61、および139の細胞の平均数が0.4nL区画、1.0nL区画、および1.6nL区画にロードされ、その後のロードされた細菌の回転混合器への移動は、約70%〜92%の範囲であった。
【0193】
図30A〜Bは、それぞれ、溶解前および溶解後のE.coli細菌のサンプルの写真を示す。溶解は、水酸化ナトリウムと尿素とを含有する溶解緩衝液と共に混合することによって達成された。溶解後、細菌細胞は自動運動を停止し、そして蛍光シグナルは消失した。
【0194】
細菌またはウイルスがチップ上で単離され、溶解された後、次の工程は、目的の核酸を精製することである。チップ上で溶解された細菌細胞からゲノムDNAを精製することが可能である。
【0195】
再び図29Aに戻ると、一旦、サンプル、緩衝液、および溶解溶液の組み合わせが完全に混合されると、混合器6171の洗浄注入バルブ6133、排出バルブ6140が開放される。洗浄液は、フローチャネルネットワーク6110およびその内容物(混合器6170を含む)を通って流れ、その内容物は、順番に、それぞれ第3のセットのクロスフロ
ー注入構造物6171、6172、および6174を通って廃棄物6180へ流される。図29Dは、あるビーズを中心としたクロスフロー注入構造物の拡大図を示す。
【0196】
クロスフロー注入構造物6171、6172、および6174は、特定の核酸に対して親和性を示す物質でコーティングされたビーズを備えるビーズ捕捉コントロールライン6186から、第4のフローチャネル6176および再び作動されたバルブを通ってロードされている。このようなビーズの例は、ノルウェー国オスロのDynal Biotechから入手可能なDYNABEADS(登録商標)である。
【0197】
コントロールライン6188によって規定されるビーズ水平コントロールバルブの停止は、混合器からの流体をビーズに曝すことを可能にする。溶解されたサンプルが、混合器から、コーティングされたビーズを備える第3のセットのクロスフロー注入構造物を通って流れるにつれて、サンプル中の核酸がコーティングされたビーズに吸着するが、サンプルの残留物および洗浄液は廃棄される。
【0198】
次に、溶出溶液が、注入口6136からフローチャネルネットワーク6110を通って、そしてビーズを備える第3のクロスフロー注入構造物6171および6172および6174を通って流される。流れている溶出溶液の圧力の結果として、これまでビーズに結合されていた核酸が放出される。この溶出された核酸は、回収ポート6180、6182、および6184のうちの1つに回収され、次いで、増幅および/または分析され得る。
【0199】
各々のビーズについて製造者が指定した最低容量に基づいて、図29Aの第3のクロスフロー注入構造物によって形成された各々のカラムは、100pgのDNAの総容量を有することが算出され、これは、およそ20,000の細菌からゲノムDNAを精製するのに十分である。
【0200】
溶出液体は、単一の注入口6136から第3のクロスフロー注入構造物の各々に流されて、精製された核酸が同時に溶出するので、各々のプロセッサが、同じ流体抵抗を示すことが重要である。具体的には、チャネル長が異なる場合、対応する抵抗は、別個のプロセッサにおける不均等な流体フローを生じるので、溶出速度に影響を及ぼす。従って、各々のプロセッサについて全体的な微小流体チャネル長は、フローチャネル長の補正を与えるための折れ曲がり部分を備える中央のフローチャネルによって、同一であった。
【0201】
図32Aは、約280未満の個体のE.coli細菌細胞を含むチャンバから精製されたゲノムDNAの電気泳動の結果を示す。細菌のゲノムDNAは、溶出緩衝液を使用することによってチップから回収された。溶出緩衝液中のDNAは、ppdDプライマーセットを用いて、50μlの作業容量で従来のPCR法を使用することによって増幅された。
【0202】
精製された標的核酸は、E.coliゲノムDNA由来の461bp ppdD(プレピリンペプチダーゼ依存性前駆体)遺伝子であった。ポリスチレン磁気ビーズの表面上で
捕獲されたゲノムDNAは、溶出緩衝液を使用することによって回収され、そしてPCR反応によって増幅された。サンプルは、TBE(トリス−ホウ酸塩−EDTA)緩衝液中
の1.2%アガロースゲルで電気泳動された。
【0203】
ゲルのレーンは、以下の通りであった:左、右−100bp DNAラダー;レーン1、4および7−1120未満の細胞数に相当する1.6nLのE.coli培養物ブロスからのゲノムDNAの単離;レーン2、5、および8−700未満の細胞数に相当する1.0nLのE.coli培養物ブロスからのゲノムDNAの単離;レーン3、5、および9−280未満の細胞数に相当する0.4nLのE.coli培養物ブロスからのゲノムDNAの単離。レーン10は、ネガティブコントロールである。
【0204】
図32Bは、28未満の個体のE.coli細菌細胞を含有するチャンバから精製されたゲノムDNAの電気泳動分析の結果を示す。細菌のゲノムDNAは、溶出緩衝液を使用することによってチップから回収された。
【0205】
溶出緩衝液中のDNAは、ppdD遺伝子プライマーセットを用いて、50μlの作業容積で従来のPCR装置を使用することによって増幅された。この場合も、精製された標的核酸は、E.coliゲノムDNA由来の461bp ppdD(プレピリンペプチダーゼ依存性プロテインD前駆体)遺伝子である。
【0206】
ゲルのレーンは以下の通りである:左、右−100bp DNAラダー;レーン1、4および7−112未満の細胞数に相当する1.6nLの10倍希釈したE.coli培養物ブロスからのゲノムDNAの単離;レーン2、5、および8−70未満の細胞数に相当する1.0nLの10倍希釈したE.coli培養物ブロスからのゲノムDNAの単離;レーン3、5、および9−28未満の細胞数に相当する0.4nLの10倍希釈したE.coli培養物ブロスからのゲノムDNAの単離。レーン10は、ネガティブコントロールである。
【0207】
図31A〜Bは、本発明の実施形態に従って精製された核酸についての他の電気泳動結果を示す。具体的には、図31A〜Bは、図29Aの微小流体アーキテクチャーから精製されたE.coliゲノムDNAの回収の成功を実証する。溶出されたサンプルは、チップから取り出され、そしてPCRによって増幅された。増幅物は、0.5%TBE(トリス−ホウ酸塩−EDTA)緩衝液中の2.0%アガロースゲルで電気泳動された。標的D
NAは、E.coli ppdD(プレピリンペプチダーゼ依存性プロテインD前駆体)遺伝子のうちの461bpのフラグメントである。
【0208】
図31Aは、希釈していないE.coli培養物を用いるゲノムDNAの単離を示し、ゲルのレーンは以下である:M−PCRマーカー;レーン1−約1,120の細胞数に相当する1.6nLの培養物からのゲノムDNAの単離;レーン2−約700の細胞数に相当する1.0nLのサンプル;そしてレーン3−約280の細胞数を有する0.4nLのサンプル。図31Aのレーン1〜3は、長さが約500塩基対のはっきりと分離されたバンド示し、このことは、ゲノムDNAの精製を明らかにする。
【0209】
レーン4、5および6は、ゲノムDNA単離についてのネガティブコントロールであり、これらのレーンでは、細胞培養サンプルの代わりに精製水が使用され、そして他のすべての条件はレーン1、2、および3と同じであった。これらのコントロール事象のいずれにおいても増幅シグナルは存在しなかった。
【0210】
図31Bは、1:10希釈の細胞培養物からのゲノムDNAの単離を示す。レーン1、2、3、レーン4、5、6、およびレーン7、8、9は、それぞれ、3つの異なるチップからの結果である。ゲルのレーンは以下の通りである:M−PCRマーカー;レーン1、4、および7−平均112の細菌細胞からのゲノムDNAの単離;レーン2、5、および8−平均70の細菌細胞からのゲノムDNAの単離;レーン3、6、および9−平均28の細菌細胞からのゲノムDNAの単離。
【0211】
精製されたDNAの量は、従来の手段によって測定するには少なすぎるので、首尾よい回収の評価のために、プレリピンペプチダーゼ依存性タンパク質(ppdG)遺伝子のPCR増幅が使用された。図31A〜Bの結果は、DNA単離に必要とされる細胞数を減少し、それによって、このプロセスの感度を従来の方法よりも2,000〜20,000倍高めることが可能であることを示す。
【0212】
図29A〜Dに示す核酸精製微小流体アーキテクチャーは、採用された平行化ストラテジーを示す。プロセスの工程は、おおまかに線形のチャネルに沿って行なわれ、直交方向のプロセスの平行化を可能にする。この幾何学は、単一の試薬の充填ラインが、全ての平行プロセスに同時に試薬を分配することを可能にする。
【0213】
図29A〜Dに示す微小流体アーキテクチャーは、多層ソフトリトグラフィーによって製造された。マスクデザインは、CADプログラムFluidArchitect(Fluidigm,South San Francisco,CA)で作製され、高解像度の透過性マスク(3,389dpi)に移された。流体チャネルの寸法は、幅100μmおよび深さ10μmであり、バルブ作動チャネルは、代表的に、幅200μmおよび深さ15μmである。チップは、20×20mm以内の空間、13の流体アクセスバイアス、54のバルブおよび14の作動バイアスを備え、微小流体の流れを可能にし、制御した。
【0214】
流体チャネルのためのマスク型は、シリコンウェハ上に、2,000rpmで1分間のスピンコーティング陽性フォトレジスト(Shipley SJR 5740)、その後の、マスクへの曝露および発色により作製された。この成形チャネルは、135℃で15分間丸められ、全バルブの閉鎖を可能にする幾何学を生成する。
【0215】
作動層のための別の型は、1,600rpmにて1分間、得られる高さが13μmである別個のウェハ上へのスピンフォトレジスト、その後のマスクへの曝露および発色により作製される。デバイスは、フォトレジスト型から2つのパーツの硬化シリコン(GE Silicone RTV615)キャストの2つの層を一緒に結合することにより製造された。
【0216】
流れチャネルを含む、デバイスの底部層は、2,400rpmにて1分間、20:1のパートA:B RTV615でスピンコーティングし、得られたシリコン層は、11μm厚のフィルムである。作動チャネルを含む、デバイスの頂部層は、別個の型を使用して、5:1のパートA:B RTV615で、厚い層(5mm厚)として成型される。
【0217】
2つの層は、最初に、80℃にて30分間硬化される。次いで、作動チャネル内部連絡穴が、20ゲージのルアースタブで、厚い層から穿孔される、その後、それぞれのチャネルネットワークを光学顕微鏡と並べた後、厚い層上で、チャネル側を下にしてシールされる。
【0218】
組み立てられた層の間の結合は、80℃にて90分以上、組み立てられたデバイスを硬化し、その後、流体チャネル内部連絡を穿孔することによって達成される。得られたデバイスは、サイズにカットされ、RCA清潔カバーガラス(No.1、24mm×50mm)上に取り付けられ、その後、80℃にて一晩のインキュベーションにより、接着を促進する。
【0219】
微小流体アーキテクチャーを含むチップは、倒立顕微鏡(Nikon Eclipse
TE2000−S)上に設置される。蛍光励起は、水銀ランプ(100W)により提供された。FITCフィルターセット(Ex465−495、DM 505、BA 515−555)を使用し、PC制御カラーデジタルカメラ(Sony DFW−V500)を使用することにより、画像を記録した。
【0220】
チップ上の各作動ラインを、ステンレス鋼ピン(New England Small
Tube,Litchfield,NH)で接続し、外部ソレノイドバルブへのポリウレタンチュービングを、デジタルデータI/Oカード(CCA,PPC1−DI032HS;National Instruments,Austin,TX)により制御した。調節された外圧を、正常に閉じたポートにかけ、最小限のバルブを切り替えることによって、大気圧まで、制御チャネルに圧力をかけるか、または、通気させる。
【0221】
サンプルおよび緩衝液の導入および回収のための流体バイアスを、ポリプロピレンチップ(Multiplex tips,Sorenson BioScience,Inc.,West Salt Lake City,Utah)により外圧供給源に接続した。液体をチップの内側に駆動するための代表的な圧力は、0.5〜2.0psi(1psi=6.89kPa)である。
【0222】
微小流体チップが光学顕微鏡のステージ上に取り付けられ、制御チャネルが、外部ニューマチック制御システムに接続された後、DNA結合能力を有するマイクロビーズ(Dynabeads(登録商標)DNA DIRECTTMユニバーサル,Dynal ASA,Oslo,Norway)を、図29Aの右上部分にある「ビーズイン」入口から充填する。この操作のために、バルブ10「ループ排出制御」およびバルブ12「ビーズ捕捉制御」が閉じられる。ビーズは、バルブ6および12を制御することによって、バルブ12の直前に位置付けられる。バルブ12についての圧力制御は、他のバルブ制御についての圧力よりも低く、結果として、ビーズがカラム内に蓄積する間に、緩衝液が通過することが可能な、複数の閉じたバルブを生じる。
【0223】
緩衝溶液(溶解緩衝液(XtraAmp(登録商標)溶解緩衝液シリーズ1,Xtrana,Inc.,Ventura,CA)、洗浄緩衝液(XtraAmp(登録商標)洗浄緩衝液シリーズ1)および溶出緩衝液(Tris−EDTA緩衝液、pH7.8)の各々1μLを、それぞれ、「溶解イン」ポート、「洗浄イン」ポートおよび「溶出イン」ポートから充填される。
【0224】
eGFPを発現するE.coli(BL21−2+)を、37℃にて12時間、40pg/mlの濃度のアンピシリンを含有するLuria−Bertani(LB)液体培地中で増殖させた。DNAを精製し、チップから回収した後、本発明者らは、遺伝子、ppgD(プレピリンペプチダーゼ依存性タンパク質D前駆体、461bp)、すなわち、E.coli細菌細胞中に含まれるDNAを、従来のPCR法を用いて増幅することを試みた。
【0225】
サーマルサイクリング条件は以下の通りであった:最初の変性:95℃にて2分;DNA変性:95℃にて30秒;プライマーアニーリング:60℃にて30秒;dNTP重合:72℃にて2分および30秒;変性から重合までの工程を30回繰り返す;最後の伸長:72℃にて10分。
【0226】
ppdD遺伝子についてのプライマーセットは、5’−GGTGGTTATTGGCATCATTGC−3’(フォワード)および5’−GTTATCCCAACCCGGTGTCA−3’(リバース)である。PCRカクテルは、5μLの10×反応緩衝液、10mMの最終濃度を有する1μLのdNTP混合物、各1μLのフォワードプライマーおよびリバースプライマー、0.5μLのTaqポリメラーゼ 5U/μL、ならびに、鋳型、そして、50μLの合計反応容量にするための水である。
【0227】
(3.非細菌核酸の溶解/精製)
上記の関連の議論は、細菌細胞から得た核酸の精製に関する。しかし、本発明に従う実施形態は、この型の核酸の精製に限定されない。他の型の核酸(真核細胞からのメッセンジャーRNA(mRNA)が挙げられるがこれらに限定されない)が、本発明の実施形態に従って単離および精製され得る。
【0228】
遺伝子発現を測定するため、または、cDNAライブラリーを構築するためのいずれかの、mRNAの単離は、現代の分子生物学の基礎である。mRNAの単離には多数の技術が存在するが、ほとんど全ての技術が、出発物質として数百から数千の細胞を必要とする。単一の細胞から、遺伝子発現プロフィールを解明すること、または、cDNAライブラリーを開発することが有用である、多くの状況がなお存在する。
【0229】
いくつかの原発性細胞型は、幹細胞のように非常に稀であり、多くの細胞を得るための培養における増幅が、細胞の発現プロフィールを変化させる。多数の原発性細胞を、動物または患者から単離する試みは、常に、細胞型の混合物を生じる。なぜならば、正確に同定することが不可能であり、従って、純粋な形態で、任意の単一細胞型を単離することが不可能であるからである。さらに、近年、通常は同一の遺伝子型である細胞間の遺伝子発現における後生的改変において、これらの改変が、いかにして発生および他の表現型の分化プロセスにおいて役割を演じ得るかを理解することに新たな興味が存在している。
【0230】
単一の細胞からの少数の遺伝子の発現を測定するための十分に確立された方法が存在するが、これらは、少数の標的の演繹的な選択を必要とする。この制限は、より高度な平行マイクロアレイにおける用途のために、単一細胞からのmRNAの増幅の近年の進歩により、幾分緩和されている。これらの方法は、より多数の標的の平行分析を可能にするが、mRNA増幅プロセスは常に、一定の程度のゆがみを導入し、マイクロアレイ自体は、可能な転写物の有限のセットの選択を必要とする。
【0231】
単一細胞からのcDNAライブラリーの構築は、依然として実施されていないが、どの遺伝子が追跡されるかについての演繹的な推測なしに、発現を追跡するための強力なツールを提供し得る。従ってさらに、通常は10,000である、cDNAライブラリーの構築に必要とされる最小数の細胞は、1,000であり、このようなライブラリーを構築するために微小流体を使用することの利点が認識されている。
【0232】
従って、図37Aは、細菌またはウイルス以外からの核酸の単離および精製に有用な、本発明に従う、微小流体アーキテクチャー6400の実施形態を示す。ライン6402は、100μmの流体チャネルを表し、ライン6404は、100μm幅のバルブ作動チャネルである。流体ポートが指定され;作動ポートは、1〜10と指定される。
【0233】
溶解緩衝液チャンバ6408は、バルブ1、2、3および4により線引きされるチャネル空間を備える。セルチャンバ6410は、バルブ4、5、6および7により線引きされるチャネル空間を備える。ビーズチャンバ6412は、バルブ7、8、9および10により線引きされるチャネル空間を備える。
【0234】
核酸精製チップ6400は、単一の構造へと一体化された異なる機能のユニットを備える。チップの処理構造は、水平であり、試薬は垂直に充填され、多くのクラスの連続したバッチ処理反応を実施するために一般化され得るスキームである。
【0235】
構造6400の第1の機能的ユニットは、可変数の細胞を充填され得るチャンバ6410を備える。このような充填された細胞の正確な数は、充填された溶液中の細胞濃度により制御され得る。この研究において、サンプルは、1個と100個の間の細胞を捕捉するように希釈された。
【0236】
細胞チャンバ6410には、溶解緩衝液チャンバ6408が隣接し、これは、固定量のカオトロピック塩の溶液で充填され得る。チャンバ6408および6410を分離しているバルブ4が開放されて、溶解緩衝液の細胞内への拡散を可能にし得る。細胞が溶解される合計容量(バルブ1、2、3、5、6および7の間)は、約20μLである。
【0237】
図37Bは、図37Aの隣接する溶解緩衝液と細胞チャンバの拡大図を示す写真である。バルブ1〜7を形成する作動チャネルが、食用色素オレンジGの水溶液で充填される。スケールバーは200ミクロンである。
【0238】
チップの次の機能的ユニットは、オリゴdT誘導体化常磁性ビーズ(Dynabeads Oligo(dT)25)のパッケージングされたカラムを作製するように設計され、ここを通って、細胞様怪物がフラッシュされ得る。正確な量のビーズを捕捉するために、開口部が圧力制御装置により正確に制御され得る微小流体バルブが使用された。
【0239】
バルブ8は、調節された流体流れが通過し得るが、大きな(2.8μm)ビーズが捕捉されるように、わずかに開いたままになっている。他の全てのバルブは、オンオフバルブであり、個々の圧力源により制御される。これらの圧力源は、NI DAQカード(National Instrument)およびLabview 6.0(Fluidigm Corp)の下で開発されたグラフィックインターフェースにより作動される。各実行の終わりに、ビーズが、チップから回収され、ベンチトップRT PCRを用いて、mRNAの存在についてアッセイされる。
【0240】
図37Cは、図37Aの隣接するビーズおよび細胞チャンバの拡大図を示す写真である。直径2.1μmのオリゴdTで覆われた常磁性ビーズのカラムが、部分的に閉じた微小流体バルブ8に対して構築される。スケールバーは、ここでも200ミクロンである。
【0241】
微小流体チップ6400特有の操作は、以下のようにまとめられ得る。全てのバルブ作動ラインが、流体チャネルにおける泡の形成を防止するために、流体(オレンジGの濃水溶液)で充填された。流体チャネルと制御ラインとを分離する膜は、非常に薄く(5ミクロン未満)、空気が浸透可能である。各制御ラインは、その圧力源に接続されている。
【0242】
全ての圧力源が設定される動作圧は、バルブの作動圧より上の2psiであり、従って、流体チャネル上に1psiの圧力が可能となった。動作圧は、膜の厚さの少しの変化によって、チップ間で互いに異なるが、代表的には、8psiと15psiとの間であった。全てのバルブを、試薬を充填する前に閉じた。
【0243】
試薬は、ポリエチレンチュービングから送達され、このチュービングは、23ゲージのステンレス鋼ピン(New England Small Tubes,Litchfield,NH)を使用してチップに接続した。チュービングの他方の端は、全ての流体チャネル入口に共通する圧力源(1psi)に接続した。チップは、10μLの細胞溶液、20μLの溶解緩衝液および5μLのビーズ溶液で充填した。元々のDynalビーズは、Dynal溶解緩衝液中に再懸濁し、5×濃度の濃度にした。
【0244】
溶解緩衝液は、まず、バルブ1および2を開けることによって、チップ上に充填された。一旦溶解緩衝液が、溶解緩衝液アウトチャネルから流れると、バルブ1が閉じられた。溶解緩衝液チャンバは、空気を気体浸透可能なチップに押し出すことによって、充填が止められた。
【0245】
サンプルの細胞を、以下のように調製した。新しく回収したNIH 3T3細胞を、各実験に使用した。NIH 3T3細胞を、100mm組織培養プレートにおいてほぼコンフルエンシーまで増殖させた。細胞を1×PBSでリンスし、次いで、トリプシン処理した。トリプシン処理した細胞を、106/mL〜107/mLの間の最終細胞濃度に調節するために、1×PBS中に再懸濁した。
【0246】
細胞を、バルブ5および6を開けることによって充填した。細胞懸濁液が細胞チャンバを通って流れると、バルブ5を閉じた。バルブ5は、適切な数の細胞が細胞チャンバ内に捕捉されるまで、繰り返し開け閉めされ得る。チャンバ内に捕捉される細胞数はまた、細胞懸濁液の濃度を変更することにより影響を受け得る。代表的に、1個〜100個の細胞がチップ上に捕捉され、溶解され得る。
【0247】
バルブ6は、細胞チャンバ内の残りの空気が押し出されるまで開いたままであった。次いで、バルブ6を閉じた。
【0248】
ビーズ懸濁液を、バルブ9および10を開けることによって充填した。一旦ビーズ懸濁液がビーズチャンバを通って流れると、バルブ9を閉じ、チャンバは、残りの空気を気体浸透可能チップに押し出すことによって充填が止められた。次いで、バルブ8および11を開け、バルブ8上の圧力を、直径2.1μmのビーズが、部分的に閉じられたバルブに匹敵し始めるまで、圧力調節装置を使用してゆっくりと上昇させた。スタックがチャネル内のビーズに到達するのに十分長くなると、バルブ10を閉じた。
【0249】
バルブ4を開け、それによって、溶解緩衝液が、細胞チャンバ内に拡散することを可能にした。溶解緩衝液が個々の細胞に到達すると、細胞は直ちに溶解し、次いで、徐々に分解する。図37Dは、最初の充填後の細胞チャンバの拡大部分の写真である。図37Eは、細胞が溶解するにつれて、膜が分解し始めるような、溶解化学の拡散の5分後の細胞チャンバの拡大部分の写真を示す。図37Fは、細胞が完全に分解したような、拡散の10分後の細胞チャンバの拡大部分の写真を示す。図37D〜Fのスケールバーは、100ミクロンである。
【0250】
細胞溶解物を、バルブ3、4、7および11を開けることによって、「細胞チャンバ」からフラッシュした。溶解物を、チャネル内の空気に対する圧力を変更することによって調節され得る制御された速度(代表的には、100μm/s)にて、ビーズのスタックを通して流れさせた。ポリA含有mRNAは、ビーズ上のオリゴdTにハイブリダイズし、細胞沈殿物の大半が、チップから洗い流された間に、ビーズ上に残ったままであった。ビーズのスタックにおける空気/流体接点は、表面張力によるものである。
【0251】
次いで、バルブ3を閉じ、バルブ2を開け、そして、溶解緩衝液を、ビーズを通してフラッシュして、できるだけ多くの細胞沈殿物を含まないように洗浄した。次いで、バルブ2を閉じた。
【0252】
短いチュービングを、チップの出口ポートに接続し、0.1mLのPCRチューブ内に配置した。バルブ2および8を開け、溶解緩衝液を用いて、ビーズをPCRチューブ内にフラッシュした。磁石を用いて、自動流れチャネル内に残るあらゆるビーズを引き出した。ビーズを遠心分離し、次いで、100μLの新しい溶解緩衝液中に再懸濁した。RNaseインヒビター(1μL)を添加した。チューブをボルテックスし、mRNAを直ちに分析するか、または、チューブを−80℃にて凍結保存した。
【0253】
代表的な実験において、いくつかのチップを使用して、1つ以上の細胞由来のmRNAを保有するビーズを得た。逆転写および増幅を、Qiagen OneStep RT PCRキットを使用してビーズ上で直接行ない、その後、生成物のゲル電気泳動を行なった。2つの型のmRNAを同定するためにプライマーを使用した:多い量のアクチン転写物および中程度の量の転写物のジンクフィンガー。
【0254】
図38は、ネガティブコントロールと共に、単一の細胞の感度を示すために行なった一連の実験についての電気泳動結果を示す。RT PCR生成物を、反応物の5%をロードして2%アガロースゲル上で分析した;増幅された遺伝子は、βアクチンである。
【0255】
ゲルレーンは以下の通りである:レーン1:1kbラダー;レーン2:PBS、細胞なし(チップ上);レーン3:1個の細胞(チップ上);レーン4:9個の細胞(チップ上);レーン5:1日齢の細胞の200μLの上清+5μLのビーズ(試験管内);レーン6:200μLの溶解緩衝液+5μLのビーズ(試験管内);レーン7:チップ上に充填されたが、チャンバには捕捉されなかった細胞(チップ上);レーン8:200μLのD1水+5μLのビーズ(試験管内);レーン9:PCR試薬のみ。
【0256】
図38は、レーン3における単一のNIH 3T3細胞からの首尾よいmRNAの単離を示す。ポジティブコントロールである、溶解したNIH 3T3細胞からの上清をレーン5に示し、種々のネガティブコントロールを示す:全てのネガティブコントロールは、βアクチンDNA領域にバンドを示さず、一方で、ポジティブコントロールは、強いバンドを示す。
【0257】
バンドの強度が、カラム内のビーズの数により標準化される場合、モニター上で増加する関係が、より多い量のβアクチンmRNAについての強度と細胞数との間で見出され、減少する関係が、単一の細胞レベルに対して見出される。具体的には、高コピー数転写物と中程度のコピー数の転写物との両方で、可変数の細胞を用いて、チップを試験するために、二連の実験を行なった。
【0258】
βアクチンおよびozfの両方についてのRT PCR生成物を、2%アガロースゲル上で分析し、このバンドを定量し、標準化し、そして、図39にプロットした。0の値は、ゲル中の検出可能なバンドが存在しないことを示す;19個の細胞を用いる実験は、おそらくRNAaseの混入またはチップの不良によって、両方の転写物について失敗した。
【0259】
多い量のアクチンmRNA(黒丸)については、検出は、単一細胞レベルまで減少する。中程度の量のジンクフィンガーozf mRNAについては、シグナルは、2細胞程度から検出され得るが、代表的な感度は、2細胞と10細胞との間のどこかである。従って、この第一の作製チップの感度が確立される。
【0260】
RT PCRが、線形増幅プロセスでないという事実にもかかわらず、これらの結果は、増幅が、細胞数と一致するという意味において、半定量的である。バンドの強度がカラムのサイズによって標準化されない場合、結果は、単調でなく、任意の明白な機能的関係性に従わない。
【0261】
この結果は、mRNAのビーズに対する結合動力学が完全には平衡化されず、将来的なデバイスの感度は、溶解物のカラムとの相互作用時間を増加させることによって改善され得ることを示すものとして意図される。
【0262】
微小流体mRNA調製のための興味深い可能性のある将来的な適用は、単一細胞(もしくは、より正確には、単一の細胞の対)からサブトラクティブなライブラリーを作製するためのツールとしてのものである。このような手順は、差示的に発現される転写物について富化しつつ、共通に発現される転写物を排除することに価値があり、従来のツールを使用して、少数の細胞については実行可能ではない。
【0263】
標準的な調製において、およそ1×106細胞から単離されたmRNAは、10μLのオーダーの容量で処理される。1つの細胞からのmRNAが10pL容量に含まれる場合、同じmRNA濃度が得られる(容器の壁へのmRNAの接着はないものとする)。このような容量は、本発明の研究において使用されるものよりも多く、これらは、現在の微小流体技術で容易に成し遂げられ得るものであり、より小さい程度の置き換え容量のオーダーを有するバルブは、既に示されている。
【0264】
細菌核酸の単離および精製に利用される図29Aの微小流体アーキテクチャーと、非細菌核酸の単離および精製に利用される図37Aの微小流体アーキテクチャーとの1つの差異は、溶解化学物質およびサンプルの混合を増強するような活性混合構造の存在である。ウイルスまたは細菌の場合、このような活性混合は、ウイルスまたは細菌を保護する弾性力のあるウイルスシースまたは細胞壁構造を迅速に破壊するのに有用である。しかし、細菌またはウイルス以外の他の実体(例えば、哺乳動物細胞)は、これらの保護構造を欠き、従って、より低いストリンジェントな条件下での溶解(例えば、微小流体を含まない界面を横切る単なる拡散)を経験し得る。
【0265】
細菌核酸の単離および精製に利用される図29Aの微小流体アーキテクチャーと、非細菌核酸の単離および精製に利用される図37Aの微小流体アーキテクチャーとの別の差異は、共通する制御ラインにより制御されるパラレル流れ構造の使用である。しかし、この技術はまた、図40と組み合わせて例示されるように、非細菌核酸の単離および精製においても用いられ得る。
【0266】
図40は、本発明による微小流体アーキテクチャーの代替の実施形態の平面図を示す。微小流体アーキテクチャー6500は、SMART cDNAライブラリーキットをチップフォーマットで履行することにより8つのcDNAライブラリーを同時に生成することを可能にする。
【0267】
入力の左カラム6502は、溶出緩衝液多岐管に連結され得る。上部の行6504は、コントロールラインおよび試薬入力を含み;10の試薬入力は、順に、幹細胞、溶解緩衝液、オリゴdTビーズ、プライマー、逆転写酵素、PCR試薬、プロテイナーゼK、SwiI、プラスミド、およびコンピテント細菌を含む。上部の行の流れおよびコントロール入口は、展開されて巨視的連結のためのスペースへの接近を可能にする。
【0268】
図40の平行cDNA微小流体アーキテクチャーは、工程の時間感度に依存して、拡散および能動回転混合の両方を用いる。8つの別個のライブラリーが出力6506から回収され得る。
【0269】
チップ設計6500は、細胞溶解、mRNA精製、および市販cDNAライブラリーキットのチップを基礎にした履行を組み合わせる。温度は、顕微鏡にマウントされた熱電気ステージで制御され得、そして試薬は、必要に応じて垂直チャネル中にフラッシュされ、それ故、実験のより早期のステージの間の、ねかし、変性または不適切な温度を避ける。
【0270】
チップ6500は、小数(1〜1,000)の細胞からのcDNAクローンのライブラリーを作製するように設計されている。それは、細胞を単離、溶解、およびそれからmRNAを精製するために既に記載された基礎的微小流体技法を用い、それは、次いで、ClontechからのCreator SMART cDNA Library Constructionキットを用いてコンピテントE.coli細胞中にクローン化される。このキットは、チップフォーマットに容易に変換され得る。なぜなら、それは、1チューブ、1工程反応であるからである。
【0271】
細菌は、細胞ソーターおよびMHTSCチップのために開発された方法を用いてチップから回収される。細菌は指数関数的に増殖するので、従来のゲノム技法を用いてライブラリーを質問するに十分な材料を容易に増殖し得る:DNAマイクロアレイおよび高スループットEST配列決定が2つの例である。このチップは、細胞株を用いること、およびクローン頻度を高スループットEST配列決定によって測定された頻度と比較することにより有効にされ得る。
【0272】
チップ上で小数の細胞から構築されたcDNAライブラリーを評価するために、以下の工程が続き得る。第1に、細胞の1つの大きなアリコート(1×108)が、mRNAを単離し、ゲル上の完全性をチェックするために用いられる。同じ細胞の小アリコート(1〜1000細胞)がチップ中に捕獲され、そしてmRNAが単離され、そしてゲル上でチェックされる。
【0273】
従来のcDNAライブラリー構築が、次いで、最小1ugのmRNAで実施され;同時に、cDNAイラブラリーがチップ上に構築される。初期には、従来法により単離されたmRNAを用いて、cDNAがチップ上に作製得ることを確認する。後に、第1ステージのチップ(mRNAに対する細胞)が、第2の部分(cDNAライブラリーに対するmRNA)と組み合わされる。
【0274】
次に、各ライブラリーからのランダムクローン(12)が、平均挿入サイズについて特徴付けられる。各ライブラリーから100の個々のクローンが、次いで、配列決定分析のために選択され、各cDNAライブラリーのプロフィールを確立する。
【0275】
余分のcDNAは混合され、かつプローブを作製するために用いられ、そしてハイブリダイゼーションがその他の9900コロニーに対して実施される。ネガティブコロニーが、次に配列決定される。この手順は、配列決定される必要があるコロニーの数を多いに減少する。なぜなら、余分のコロニーが取り除かれるからである。
【0276】
生命情報科学分析が次に実施され、従来のcDNAライブラリー構築物とこのチップを基礎にしたcDNAライブラリー構築との間の遺伝子発現プロフィールを比較する。
【0277】
ライブラリーの挿入サイズもまた特徴付けられる。チップの初期バージョンについて全長転写物を得ることは難しくはない。なぜなら、ヒトゲノムの分析のための生命情報科学ツールは、大部分のギャップがコンピューターによりフィルインされ得るという成熟した十分な状態であるからである。しかし、その他の適用に対するチップの後期のバージョンは、全長転写物について最適化され得る。
【0278】
本発明の実施形態による微小流体技法を利用するmRNAの単離および精製は、任意の数の適用における使用を見出し得る。1つのこのような適用は、cDNAライブラリーの構築である。別の適用は、遺伝子発現分析のためのmRNA単離であり、例えば、当業者に周知であるようなマイクロアレイチップを利用する。
【0279】
上記に記載のような微小流体アーキテクチャーは、精製された核酸の連結および形質転換で採用されるが、混合および流れスキームは、その他の有用な機能性を包含するために一般化され得る。例えば、連結または形質転換で利用される混合構造は、次に、化学的キットから特有の材料を調製するために用いられるその他の混合構造と流体連絡され得る。このような化学的キットによって調製される材料の例は、制限されないで、当業者に周知なように、連結のための特有のプラスミド、およびcDNAライブラリーを構築することで利用される特有の酵素を含む。
【0280】
上記のセクションは、微小流体チャンバ内の不均一サンプルの個々の要素またはサブセットの要素の単離を記載している。本発明による実施形態は、特定の微小流体チャンバ内の任意の特定数の関係ある生物学的実体の単離に制限されない。本発明による微小流体アーキテクチャーおよび方法の実施形態は、単一の微小流体チャンバ内の、1、2、3、4、5、6、7、8、9、10、15、20、25、30、35、40、45、50、60、70、80、90、100、200、300、400、500、1000、5,000、10000、50,000、100,000、またはなおより大きな数の生物学的実体を単離するように設計され得る。
【0281】
(4.核酸の増幅)
ポリメラーゼ連鎖反応(PCR)は、分子生物学で最も遍在するツールの1つとなり、そしてそれ故、微小流体デバイス中で履行されるべき最も重要な生化学的反応の1つは核酸を増幅する能力である。Liuら、「A Nanoliter Rorary Device for PCR」、Electrophoresis、第23巻、1531頁(2002)は、本明細書中にすべての目的のために援用され、PCRを実施するために先に微小流体構造を創製している。
【0282】
図34は、PCRを実施するための本発明による微小流体構造6300の1つの実施形態の概略図を示す。上層6302は、ポンプ類およびバルブ類を制御するための制御チャネル6304a〜dを含む。中央層6304は、入口6305a、ロータリー6305b、および出口6305c流体流れチャネルを規定する。底層6306は、一体型ヒーター構造6308およびそれと電気的連絡している電気リード6310を含む。
【0283】
流体層中のループは、ロータリーポンプを形成し、それによって、PCR試薬が、異なる温度の領域上を輸送され得る。温度は、ガラス上に蒸発されたタングステンヒーターによって設定され、これは、ナノ流体チップの底基板になる。PCR反応の総容積は12nLであった。
【0284】
図35は、ロータリーポンプチップ中で実施されたTaqman PCRアッセイの結果を示す。蛍光は、PCR反応混合物が、異なる温度領域を通ってポンプ輸送されたとき、種々の時点にインサイチュ(in situ)で測定された。β−アクチン遺伝子のフラグメントは、ヒト男性ゲノムDNAから増幅された。黒丸は、ヒトテンプレートDNAを含めた実験からのデータを表す。白丸は、テンプレートDNAが差し控えられたネガティブコントロール実験からのデータを表す。
【0285】
本発明の実施形態による精製された核酸サンプルの増幅は、図34に示される特有の微小流体構造に制限されない。代替の、より複雑な微小流体幾何学が可能である。代替の実施形態によれば、反応チャンバのマトリックスを含む微小流体構造は、nのDNAサンプルがmのプライマーペアと反応することを可能にし得、それによって、m×nの反応が同時に実施されることを可能にする。
【0286】
図36Aは、マトリックスPCR構造アーキテクチャーの平面図を示す。図36Bは、図36AのマトリックスPCR構造アーキテクチャーの1つのセルの拡大図を示す。図36A〜Bに示されるマトリックスPCR構造アーキテクチャーの完全な説明は、すべての目的のために本明細書中に参考として援用される、米国仮特許出願第60/494,432号に記載される。
【0287】
図36A〜Bの概略レイアウトに示されるように、このデバイスは、別個の機能を有する3つの層を備える。中央のマトリックス流れチャネル構造は、一体型水力バルブを備える上層と、空気圧ポンプを備える下層との間に挟持される。中央層において、微小流体流れチャネルは、106μm幅および1214μm高さである。マトリックスの各頭頂は、約3nLの容量を有する、リアクターを含む矩形形状のチャネルを含む。
【0288】
リアクターの各行は、それを通じて特有のプライマーが装填され得る、別個の入力ポート(直径が約625μm)に連結される。各カラムは、同様に、異なるDNAテンプレートでリアクターを装填し得る。ポリメラーゼの付加のための単一の入力は、マトリックス中のすべてのリアクターに連結される。
【0289】
上部制御層では、バルブシステムが、交差汚染を防ぎながら、各リアクターに3つの異なる別個の試薬を装填するように設計されている。水平方向または垂直方向にディスプレイされる合計2860のバルブが、穴を通るたった2つの独立の圧力供給によって制御される。さらに、大バルブ(図36の挿入ではB、270μm幅)または小バルブ(C、96μm幅)は選択的に作動され得る。なぜなら、それらは、作動に必要な水圧の異なる閾値を有しているからである。
【0290】
試薬装填は、バルブシステムを連結する狭い制御チャネル(42μm幅)によってはブロックされない。なぜなら、それらの小さなメンブレンが、用いられる作動圧力で偏向しないからである。第2の底部制御層は、試薬の混合を容易にするために20×20のアレイのロータリーポンプを備えるからである。
【0291】
上部制御層中の能動バルブは、試薬の装填および単離を容易にする。バルブAを作動し、プライマーセットは、マトリックスの各行に沿って装填される。バルブBおよびCの能動化は、各リアクター内のプライマーの良好に規定された容量を隔離する。
【0292】
バルブAが次いで開けられ、各カラムを下るDNAテンプレートの装填を許容し、その一方、ポリメラーゼは、単一の入口からすべてのリアクターに同時に導入される。バルブAはもう一度能動化され、ポリメラーゼおよびテンプレートの所望の容量を規定し、そして各リアクターを隔離する。
【0293】
バルブBおよびCの異なるメンブレン領域は、作動圧力を260から110kPaに減少することによりバルブCの選択的開放を許容し、それ故、3つすべての成分を各リアクター内で流体接触にもたらす。底部層中のペリスタポンプは、リアクター内のすべての試薬の迅速回転混合を許容する。
【0294】
図36A〜B中に示されるマトリックスPCR微小流体デバイス設計は、ナノ流体チップをマクロ世界にインターフェースすることに関する問題を取り扱うことにおける進歩を表す。なぜなら、DNAテンプレートおよびプライマーサンプルは、チップ上で、それぞれ、mおよびn倍に区画されるからである。さらに、しばしば、サンプルの最も高価な部分であるポリメラーゼはm×nの係数によって区画される。設計は、単純に倍率をかけて、n=20およびm=20である場合、400の同時の反応を生じる微小流体デバイスの製作を可能にする。
【0295】
(5.核酸の連結)
一旦、核酸が精製されると、それは、細胞内に取り込まれ得、そして次に発現され得る。このような発現プロセスの最初の工程は、この核酸をプラスミドのような宿主ベクター内に連結することである。図33は、精製された核酸のこのような連結および発現のために適切な微小流体アーキテクチャーの1つの実施形態の平面図を示す。図33の微小流体構造6200は、核酸の連結のために用いられる第1のセットの平行混合構造、および連結された、精製核酸での細胞の形質転換のために用いられる第2のセットの平行混合構造を備える。
【0296】
図33Aは、精製核酸の連結を可能にする図33の微小流体アーキテクチャーの領域の拡大図を示す。制御ライン6205は、混合構造6201、6202、6203の各々を二分し、流体的に隔離された半球を生成する。混合構造6201の第1の半球6
201aは、入口流れチャネル6207と流体連絡している。第2の混合構造6202の第1の半球6202aは、連結流れチャネル6209を通って第1の混合構造6201の第1の半球6201aと流体連絡している。第3の混合構造6203の第1の半球6203aは、連結流れチャネル6211を通って第2の混合構造6202の第1の半球6202aと流体連絡している。制御ライン6205の作動は、宿主ベクター/プラスミドが入口6207を通じて流れることを可能にし、そして6209および6211を、3つすべての混合構造の第1の半球中に連結する。
【0297】
混合構造6201の第2の半球6201bは、入口流れチャネル6213と流体連絡している。第2の混合構造6202の第2の半球6202bは、連結流れチャネル6215を通って第1の半球6201と流体連絡している。第3の混合構造6203の第2の半球6203bは、連結流れチャネル6217を通って第2の混合構造6202の第2の半球6202bと流体連絡している。制御ライン6205の作動は、精製核酸が、入口6213および分岐6215および6217を通って、3つすべての混合構造の第2の半球中に流れる連結酵素と混合されることを可能にする。
【0298】
混合構造6201、6202、および6203の第2の半球6201b、6202b、および6203bの各々はまた、装填構造6290を通る入口流れチャネル6221との流体連絡している。詳細には、制御ライン6227が作動される間、流体は流れチャネル6221を通って流れる。制御ライン6227によって規定されるバルブの閉鎖状態の結果として、この流体が下に流れるチャネル6221は反れて、交差−コネクター流れチャネル6229および流れチャネル6219および6223を利用する。流れチャネル6219および6223は開放端部であるので、装填構造6290は、それ故、洗浄またはその他の流体で迅速に充填され得、そうでなければ行き詰まりの装填流れチャネル6221に必要であり得る遅延を避ける。
【0299】
次に、制御ライン6227は作動を解かれ、そして制御ライン6225が作動され、その結果、流れチャネル6221への圧力の付与が、装填構造6290の内容物が、混合構造6201、6202、および6203の第2の半球6201b、6202b、および6203b中にそれぞれ流れることを生じる。まさに示された様式で、入口6221を利用して、混合構造に、後に遺伝子形質転換の間に有用な洗浄流体および/またはSOC培地を装填する。
【0300】
一旦、混合構造6201、6202、および6203の第1および第2の半球が、ベクターおよび連結酵素/精製核酸でそれぞれ装填されると、制御チャネル6231a〜cが系統的な様式で作動され得、これら混合構造内の循環を達成する。この循環は、酵素が宿主ベクター/プラスミド内で精製核酸を連結することを生じる。
【0301】
(6.核酸での細胞の形質転換)
図33の微小流体構造6200はまた、連結された精製核酸で細胞を形質転換するために用いられる平行混合構造6251、6252、および6253の第2のセットを備える。図33Bは、連結された精製核酸での細胞形質転換を可能にする図33の微小流体アーキテクチャーの領域の拡大図を示す。
【0302】
細胞形質転換のために採用されるこの微小流体アーキテクチャーは、核酸連結のために用いられるのと類似している。詳細には、3つの平行混合構造6251、6252、および6253は、制御ライン6255によって二分され、流体が隔離される半球を生成する。混合構造6251の第1の半球6251aは、入口流れチャネル6257と流体連絡している。第2の混合構造6252の第1の半球6252aは、連結流れチャネル6259を通って第1の混合構造6251の第1の半球6251aと流体連絡している。第3の混合構造6253の第1の半球6253aは、連結流れチャネル6261を通って第2の混合構造6252の第1の半球6252aと流体連絡している。制御ライン6255の作動は、宿主細胞が、入口6257およびリンク6259および6261を通って、3つすべての平行混合構造6151〜6153の第1の半球中に流れることを可能にする。
【0303】
混合構造6251の第2の半球6251bは、連結流れチャネル6271を通って混合構造6201と流体連絡している。混合構造6252の第2の半球6252bは、連結流れチャネル6272を通って混合構造6202と流体連絡している。混合構造6253の第2の半球6253bは、連結流れチャネル6273を通って混合構造6203と流体連絡している。制御ライン6275は、連結流れチャネル6171〜6173の各々の上に横たわり、このアーキテクチャーの核酸連結領域をこのアーキテクチャーの細胞形質転換領域から隔離するバルブを規定する。
【0304】
一旦、これら混合構造の第1の半球が、形質転換されるべき細胞で装填されると、制御ライン6255の作動を解き、そして連結核酸を取り込む宿主ベクターが第1の混合構造6201、6202、および6203から第2の混合構造6251、6252、および6253にそれぞれ流れる。制御チャネル6177a〜cは系統的な様式で作動され、これら混合構造内の細胞および宿主ベクターの循環を達成する。
【0305】
第2の混合構造の内容物への熱ショックの付与に際し、細胞は、ベクターおよびその中に存在する精製核酸を取り込む。このような熱ショックは、全体の流体チップを横切って付与され得るか、またはそれに代わって、その目的のために製作された小さな温度制御構造を利用して第2の混合構造に局所的にのみ付与され得る。
【0306】
(7.形質転換細胞の培養)
一旦、第2の混合構造内の細胞が、熱ショックに曝され、そしてそれによって、精製核酸を含む宿主ベクターを取り込むと、それらは、培養のために出口流れチャネル6179a〜cから流れ得る。1つの実施形態によれば、形質転換細胞は、培養のためにチップから除去され得る。あるいは、形質転換された細胞を培養することは、上記で説明された細胞ペンまたはケージ中でチップ上直接行われ得る。
【0307】
培養および形質転換された細胞は、取り込まれたベクター中に存在する精製核酸を発現することが予期され得る。細胞単離への代替のアプローチと組み合わせて上記で記載したように、この培養された形質転換細胞は、さらなる微小流体構造によってソートされ得る。このソーティングは、精製核酸のそれらの発現から生じる形質転換細胞の生理的特徴に依存し得る。
【0308】
(8.細菌/ウイルス核酸のための適用)
進化のバリエーション:細胞−>gDNA−>PCR−>回収DNA
本発明による核酸精製について1つの適用は、制限されたセットの遺伝子における進化のバリエーションを研究することである。進化の関係は、現在、リボゾームRNAか、または利用可能であるとき、全ゲノム比較のいずれかを主に基礎にして推定されている。本発明の実施形態によれば、サンプルの微小流体操作は、培養することができない細菌における選択された遺伝子についての変異の分布の比例的測定を可能とし得る。この微小流体アーキテクチャーは、サンプルから単一の細菌を単離し、その細菌を溶解し、そして次にこの細菌からゲノムDNAを精製し得る。この微小流体アーキテクチャーは、次いで、PCRを用いて選択された遺伝子(または遺伝子のセット)を増幅し得る。この増幅された材料は、チップから回収され得、再増幅され、そして配列決定される。
【0309】
gDNAクローン化ライブラリー:細胞−>gDNA−>消化−>gDNAライブラリー
本発明による別の実施形態によれば、ゲノムDNAのクローン化ライブラリーが、単一または小数の細菌から創製され得る。希釈サンプルからの個々の細菌は、微小流体チャンバ中に分配され得る。次いで、細菌は溶解され、ゲノムDNAが精製され、消化され、そして次にクローニングベクター中に連結される。これらのベクターは、次いで、図33と組み合わせて記載したように、熱ショックを用いること、および混合することにより、E.coli中に形質転換される。
【0310】
1〜2kbpの範囲の平均挿入サイズを可能にするベクターが用いられ得る。gDNAライブラリーが回収され得、そして従来のゲノム方法を用いて分析される。このgDNAライブラリーは、マイクロアレイへのハイブリダイゼーション、または代表的な配列決定によって特徴付けられ得る。クローニング効率が測定され、かつ評価され得る。
【0311】
クローン化BACライブラリー:細胞−>gDNA−>消化−>BACライブラリー
本発明のなおその他の実施形態によれば、微小流体アーキテクチャーを用いて、単一または小数の細菌からのゲノムDNAのクローン化細菌人工染色体(BAC)ライブラリーを作製し得る。これらのBACライブラリーは、約200kbpのオーダーのかなりより大きな平均挿入サイズを有する利点を提供する。
【0312】
個々の細菌は、チップ上のチャンバ中に分配され得る。次いで、単離された細菌は溶解され得、そして得られるゲノムDNAは精製され、消化され、そして次にクローニングベクター中に連結され得る。これらのベクターは、次いで、E.coli中に形質転換され得る。BACを構築するためのベクターおよび試薬は、公知の供給源から供給され得る。得られるBACライブラリーは、チップから回収され得、そして従来のゲノム方法を用いて分析される。回収されたBACライブラリーは、末端配列決定により特徴付けられ得る。クローニング効率が測定され、かつ評価され得る。
【0313】
BACライブラリーを用いることは、遺伝子順序を保存すること、再アセンブリをより容易にする利点を提供する。先行する全ゲノム配列決定努力におけるように、長い挿入ライブラリーおよび短い挿入ライブラリーを有することは、最も完全な可能なゲノムアセンブリを達成することで有用であり得る。
【0314】
(微生物の多様性の特徴付け)
一世紀にわたって、シロアリの胃内容物は、豊富かつ微生物学的に多岐にわたるスピロヘータの顕微鏡観察のための優れた供給源であるとして言及されてきた。スピロヘータは、超微細構造的に別個でありかつ遺伝的に首尾一貫しいている、原核生物の門レベルの集合である。多くのシロアリの胃において有力である(時には、直接数のうちの50%程度の多さを占める)が、スピロヘータはまた、「培養可能ではないこと」についての評判を有する。しかし、Leadbetterらは、カリフォルニア湿材(dampwod)シロアリ(Zootemopsis angusticollis)の後腸内容物由来の9株のコレクションを集めた。
【0315】
得られた最初の単離株ZAS−1およびZAS−2は、H2+CO2酢酸生成することが可能であることが示されている。最初の代表的シロアリ単離物であることに加えて、これらは、Spirochetes門において、初めて、化学合成無機栄養代謝可能であることが示された。さらに、これは、Firmicutes門、Clostridium綱に属さない何らかの微生物によるH2+CO2酢酸生成代謝を最初に示したものであった。
【0316】
かなりのことが、Zootemopsisの後腸の非培養微生物の多様性の機能に関して、学ばれ得る。Leadbetterらは、その後腸の細菌群生の分子目録(Inventory)を得た。サンプル中の種々の種の細菌は、それらの細胞塊、表面領域、および活性速度において差異を有し得る。さらに問題を複雑にすることに、種々の細菌種が、そのゲノム上にコードされる1個から12個を超えるrRNA遺伝子をどこかに有し得る。これにより、(そのDNAから増幅することにより評価した場合に)サンプル中で豊富な遺伝子を、それをコードする生物の活性バイオマス(これは、それ自体を全rRNA含量として表す)と相関付けることが困難である。
【0317】
胃における活性微生物の良好な理解を得るために、細胞体積、活性、16s遺伝子コピー数が、そのrRNA自体から分子目録(Inventory)を誘導することによって「正規化」された。(全胃核酸からの)RNA精製およびRT−PCRが、cDNAテンプレートを構築するために使用され、その後、このcDNAテンプレートから、目録(Inventory)が増幅されてクローン化された。
【0318】
この目録(inventory)は、すべてのBacteriaプライマーを使用する細菌配列の回収に焦点を合わせた。従って、この目録は、原生動物代表物も古細菌代表物も含まない。約200個の完全16s rRNA配列が、クローン化されRFLP選別され、それにより、約50個の独特なリボタイプが同定された。回収されたクローンのうちの20%を超えるものが、極めて分岐した細菌系統である「Leptospirillumおよび関連種」に属する未知の微生物に対応した。この門に属する唯一の研究された微生物は、1)鉄を酸化することにより生存する高度好酸性であるか、2)亜硝酸塩を酸化することにより生存する好気性菌であるか、または3)硫酸塩を硫化物にして呼吸する高熱菌である。
【0319】
しかし、この微生物の系統学を知ることは、その生理についても機能についてもほとんど明らかにしない。このような異化作用のいずれかを有する何らかの微生物についての何らかの動物の胃における生態学的地位は、知られておらず、上記目録の結果から推測されるように、シロアリ後腸における5番目の活性微生物バイオマスは、なお潜在的には、そのような異化作用を有するこれらに関連する微生物に由来する。これらの細菌の推定量に起因して、それらは、細胞選別の効力および影響を探求するための、さらにナノ流体デバイスを介する深さ分析における、優れた候補物になる。
【0320】
ヒト胃における微生物の多様性はまた、以前に考察されたgDNAチップを使用して特徴付けられ得る。以下のモデルは、そのような実験から予測されるデータの品質を評価するために使用され得る。ライブラリーが、1,000個の個別の細菌集団から作製されると仮定すると、この集団は、ほぼ100種から構成され、それらの種の各々が10回出現する。さらに、各細菌ゲノムが1Mbpであること、および平均インサートサイズが1kbpであると仮定する。このgDNAチップが100%の効率でクローン化された場合、得られるライブラリーは、100種の細菌種各々の10倍の有効範囲を有する。より現実的な数字である10%効率を仮定すると、各種は、平均1倍の有効範囲を有する。
【0321】
所定の任意の種について、この有効範囲は、10個の異なるライブラリーにわたって広がり、この1,000個のライブラリーのうちのどの10個がこのライブラリーであるかについての先験的知見は何らない。このことは、これらのライブラリーが完全に配列決定された場合に、同じ種に属するものとしてそれらのライブラリー間での重複を関連付けるために十分な重複が存在するか否かという、自然な疑問をもたらす。
【0322】
上記の数字を使用する簡単な計算は、任意のライブラリー対を関連付けることができない確率は、ほぼe−20であることを示す。従って、各ライブラリーを完全に配列決定した後、所定の任意のライブラリーは、同じに由来する別のライブラリーと関連付けることが可能である。これにより、ライブラリーデータの完全なデコンボリューションおよびサンプルの微生物多様性の再構築が可能になる。
【0323】
従って、上記の仮説的な例において、平均配列決定読取り長が500塩基対であり、すべての細菌ゲノムが未知であった場合、1回の実験当たり200,000個の配列決定レーンが、必要である(すなわち、1,000個の細菌当たり)。実際、既知のゲノムの再配列決定は、それらのゲノムが同定されるとすぐに停止される。これらは、少数の配列決定レーンの後であるべきである。
【0324】
別の実験セットにより、細胞選別要素を、直前に記載されたgDNAチップの前に組み込むことが探求される。抗体マーカーおよびFACSが、未知の細菌についてその集団を濃縮するために使用され、それにより、既知種を廃棄物チャネルに選別し、未知細菌を収集することが可能になる。
【0325】
上記の胃微生物の多くは、別個の異なる形態を有する。これにより、その形態の基礎となる遺伝的多様性の重要なサンプルを同定して収集することが、合理的に簡単になる。収集した個体のゲノムDNAのBACライブラリーが、構築される。この後、各BACライブラリーからのクローンが、本発明者らにより16S rRNA分子目録(inventory)の間に以前に同定された未だ培養されていない鉄酸化細菌関連体の遺伝子をコードするrRNAのみを特異的に増幅するように設計されたプライマーを用いてスクリーニングされる。
【0326】
一旦同定されると、上記rDNAをコードする単一ゲノムDNAフラグメントを含むBACクローンだけではなく、そのリボタイプを有する細胞の全ゲノムまたはほぼ全ゲノムのライブラリーもまた、回収される。
【0327】
(微生物生態)
微生物生態は、特定の環境と、その環境中に存在する生物学的実体との間の関係を探求する、新たに生まれた研究分野である。そのような環境的生物学的実態の特性および遺伝的構成の調査は、その環境中に存在するペニシリンカビの抗生物質特性の発見により例証されるような、ものすごい利益を提供し得る。
【0328】
偶発的に、ペニシリンは、実験室培養されやすいことが示されており、その抗生物質特性は、調査および利用することが可能であった。しかし、その環境由来の細菌細胞および他の生物学的実体のうちの比較的大部分が、現在まで実験室培養に抵抗している。これらの環境的生物学的実体を制御された条件下にて複製することが継続してできないことにより、それらの遺伝的情報および代謝能力に対する接近が現在まで防止され、それにより、微生物生態の調査が制限されている。
【0329】
特定の生態環境または臨床環境中に存在する未だ培養されていない生物学的実体に関する情報を収集する試みにおいて、多くの研究者が、メタゲノミクスにおいて、生物学的実体の非常に複雑な不均質混合物を含むサンプルが、環境から収集される。そのサンプル内に存在する生物学的実体は、全体として破壊され、生じた核酸およびその中に含まれる遺伝情報が、まず、具体的な生物にではなく環境全体に対応する、単一単位−「メタ」ゲノムとして処理される。最近のメタゲノム調査の例としては、Lorenzら「Screening for novel enzymes for biocatalytic processes:accessing the metagenome as a resource of novel functional sequence space」J.Curr Opin Biotechnol.2002 Dec;13(6):572〜7;およびRondonら「Cloning the soil metagenome:a strategy for accessing the genetic and functional diversity of uncultured microorganisms」Appl Environ Microbiol.2000 Jun;66(6):2541〜7(これらは、両方とも、すべての目的のために本明細書中で参考として援用される)が挙げられる。
【0330】
メタゲノミクスが、微生物生態調査についていくらかの期待を示す一方で、メタゲノミクスは、いくらかの深刻な欠点を提供する。メタゲノミクスアプローチの一欠点は、得られる遺伝情報(すなわち、核酸)と、その情報の起源(すなわち、その核酸を含む生物学的実体)との間の関係の分離である。情報と供給源との間のこの関係は、群生の生物複雑度という難局から、大いなる努力のみにて再構築され得る。従って、そのようなメタゲノムアプローチを使用して、上記遺伝子が同じBACゲノムフラグメント上に共に位置する場合に、上記遺伝子を同じ生物学的実体由来であると同定することは、簡単になった。上記種についてのゲノムライブラリーの残りは、非常に不均質な環境サンプルまたは臨床サンプル中に存在するすべての生物学的実体または要素の全体的破壊によって生成される、分別不能な巨大なBAC混合物へと失われる。
【0331】
対照的に、本発明の実施形態に従う微小流体技術は、メタゲノムアプローチに対する有望な代替法を提供する。具体的には、微小流体方法およびアーキテクチャーは、より大きなサンプル内にある個々または少数の生物学的実体の物理的単離を可能にする。個々または部分集合の生物学的実体内に存在する核酸のその後の精製は、物理的に分離された生物学的実体から得られる形態学的情報、リボタイプ情報および遺伝子型情報に容易に連結され得る。これは、クローニングに到るメタゲノムアプローチとは対照的である。このメタゲノムアプローチにおいては、全群生環境DNAが、制限され、そしてBACライブラリーへとクローニングされる。微生物群生の正味の配列決定は、メタゲノム技術および微小流体技術の両方を使用して達成されるが、後者のアプローチにおいてだけ、維持される個々のゲノムの情報の首尾一貫性が存在する。
【0332】
(9.非細菌核酸についての増幅)
上記の説明は、現在まで、細菌またはウイルスから核酸を精製するための適用に焦点を合わせている。しかし、本発明は、この特定の適用に限定されず、代替的実施形態に従って、哺乳動物細胞型または他の非細菌細胞型に由来する核酸が、2003年8月11日に出願した米国特許仮出願番号60/494,388(すべての目的のために本明細書中に参考として援用される)において詳細に考察されるように、微量流体アプローチを使用して精製され得る。
【0333】
(細胞→mRNA→cDNA→マトリックスにおけるTaqman PCR)
一実施形態に従って、微小流体チップを設計して、少数の細胞(1個〜1,000個)を取得し、それらの細胞を溶解し、mRNAを精製し、cDNAを生成し、そしてマトリックスの外形におけるTaqman PCRを使用して、特定の転写物の存在を検出し得る。そのような微小流体構造を使用して、mRNA精製およびcDNA合成のパラメーターを最適化し得る。
【0334】
細胞溶解、ビート捕捉、親和性精製、およびTaqman PCRのための要素を合わせて、選択した遺伝子を精製してその発現を検出し得る。cDNAを生成するために使用される細胞の数を、対称的に変化させ得、従来の巨視的技術において使用した多数からの結果を、1,000個の細胞、100個の細胞、10個の細胞、および1個の細胞を使用したチップベースの結果と比較し得る。そのような比較により、細胞数確率論の効果の理解、および中程度のコピー数および低コピー数のmRNAの信頼できる測定を行なうために必要な細胞の数の決定が、可能になる。
【0335】
そのような微小流体設計の利点は、この設計により、クローニングプロセスにおいてさらなる損失を導入することなく、cDNA生成効率の直接的測定が可能になることである。十分に特徴付けられた細胞株(例えば、NIH_MGC_53またはNIH_MGC_93)(これらについて、広範なESTおよびマイクロアレイデータが存在する)を、これらの実験のために使用し得る。組織の代わりに細胞株を使用すると、不均質サンプルにおける未同定部分集団からの結果において、可能なバイアスを制御する。チップの結果を、手動で得られる従来の結果およびNIH ESTデータベースにおいて列挙される結果(配列決定された10,000個のクローン)と比較することによって、確認を行い得る。
【0336】
(細胞→mRNA→cDNA→RNA→マイクロアレイ)
別の適用において、微小流体チップを設計して、少数の細胞(1個〜1,000個)を取得し、それらを溶解し、mRNAを精製し、T7プロモーターを用いてcDNAを生成し、その後、T7RNAポリメラーゼを使用して、線形増幅された蛍光RNAを生成し得、その後、その蛍光RNAをマイクロアレイにハイブリダイズし得る。このマイクロアレイは、表面ビオチニル化について以前に示された表面誘導体化と類似する方法を使用して、チップ上にインサイチュで製造し得る。
【0337】
そのようなチップアーキテクチャーは、最初の確認よりも厳密なcDNAの品質の試験を提供する。なぜなら、増幅段階は、線形であるからである。確認は、従来の方法により得られるDNAマイクロアレイデータと比較することによって、実施し得る。また、細胞株の使用により、未同定部分集団について制御される。そのような微小流体構造について可能な適用としては、腫瘍型分類、臨床診断、処置結果の予測、および発生生物学が挙げられる。
【0338】
(細胞→mRNA→cDNA→差次的にクローン化されたライブラリー)
なお別の適用において、微小流体チップを設計して、少数(1個〜1,000個)の細胞から、cDNAクローンのライブラリーを構築し得る。そのようなチップは、上記ライブラリーを構築するためにもとのcDNAチップの方法を使用し得る。
【0339】
しかし、この適用において、2つの細胞集団を、並行して処理し、クローニングの前に、上記ライブラリーを互いに対して正規化する。そのようなチップ構造を、従来技術を使用し得る2つの細胞株を使用して確認し得る。得られるライブラリー要素を、配列決定し得る。
【0340】
(造血幹細胞の研究)
多能性造血幹細胞(PHSC)は、骨髄中に存在し、かつ血液系の動態を維持する、稀な細胞集団である。固有の特徴および環境の影響に従って、これらの細胞は、以下の経路のうちの1つへと移動する:始原幹細胞としての自己再生、分化した造血細胞への成熟、またはアポトーシス。生体の骨髄において、これらの3つの経路の間のバランスは、清浄な造血を提供するために維持される。
【0341】
制限希釈競合再生アッセイに基づいて、骨髄中のPHSCの頻度は、100,000個の有核細胞中で約1個である。PHSCの単離は、その機能を研究する際に必要な段階である。
【0342】
PHSCを単離するためのこの分野で最も信頼できる方法は、マーカーとして種々の細胞膜表面タンパク質を使用するFACS選別を使用することである。精製したマウスPHSCは、Summitデータ分析ソフトウェアを用いる3レーザーMoFlo Cytometerを使用する5色FACS選別システムを開発することによって、得られた(他の調査者は、3色タンパク質発現プロフィールに基づく3色選別を使用し、いくつかのグループは、4色選別を行ない得る)。
【0343】
5色システムを用いて、骨髄細胞を、異なる発蛍光団に結合体化した5つの異なる抗体(系統マーカーカクテル、抗Sca 1、抗c kit、抗CD38、および抗CD34)を用いて標識した。ほとんどの始原造血幹細胞は、表面発現プロフィール(LinSca 1+kit+CD38+CD34(+++−細胞と略す))により特徴付けられる。これらの細胞(長期再増殖細胞(LTRC)と呼ばれる)は、致死的に照射されたマウスにおける血液系の長期再増殖を提供することが示された。
【0344】
図41A〜Bは、マウス骨髄細胞の表面マーカー発現のフローサイトメトリー分析を示す。系統陽性細胞を、フローサイトメトリーの前にCSカラムにより除去した。図41Aは、細胞表面上でのSca 1およびc kitの発現が、示されるようにゲーティングされたことを示す。Lin−Sca+kit+細胞は、ボックスAにおいて示されるようにゲーティングされた。
【0345】
図41Bは、Lin−Sca+kit+細胞の細胞表面上でのCD38およびCD34の発現を使用して、左図のボックスAにおいて示される部分集団を、以下の4つの部分集合:Sca+kit+CD38−CD34、Sca+kit+CD38+CD34+、Sca+kit+CD38−CD34+、およびSca+kit+CD38−CD34−へと分離したことを示す。各集団における細胞を、選別し、再増殖アッセイにおける分析のために収集した。図41A〜Bに基づいて、骨髄有核細胞における頻度は、100,000個の有核細胞中2個であることが示された。
【0346】
さらなる分析により、生理学的経路は、+++−細胞が、次に、++++細胞(LinSca 1+kit+CD38+CD34+)へと分化し、その後、++−+細胞(Lin Sca 1+kit+CD38−CD34+)へと分化するようであることが、示された。++++細胞および++−+細胞の両方が、短期再増殖細胞(STRC)の分類に属する。なぜなら、これらは、致死的に照射したマウスを複数の週間だけ再増殖し得るが、動物の通常の寿命の間までは再増殖し得ないからである。しかし、LTRCおよびSTRCの両方は、致死的に照射したレシピエントを効果的にレスキューする必要がある。
【0347】
上記の知見から、PHSC調節の仮説を、以下のようにモデル化する。図42は、マウス多能性造血幹細胞について提唱される調節ネットワークを示す。示されるように、これらの骨髄部分集合の間のシグナル(陽性および/または陰性)は、骨髄注の幹細胞の区画内の細胞のバランスを調節し、それにより、造血を制御する。図42に示される部分的調節ネットワークを支持する予備的証拠が、得られた。
【0348】
ヒトにおいて造血を制御する調節機構を理解することは、その系をインビボで操作することを可能にする。そのような制御は、広範囲の臨床適用(癌治療、血液疾患の処置、遺伝的障害、ならびに幹細胞遺伝子治療を包含する)を有する。
【0349】
造血の調節に対する洞察を得るためのアプローチのうちの1つは、細胞成熟の初期段階において特異的に発現される遺伝子を同定し、その後、造血経路におけるその遺伝子の機能を決定することである。+++−細胞において特異的に発現されるが、++++細胞でも++−+細胞でも発現されない遺伝子は、LTRC表現型を特異的に提供する遺伝子を決定するために同定された。
【0350】
具体的には、ディファレンシャルディスプレイPCR(DD PCR)を使用して、184個の遺伝子転写物を、合計1395個のDD PCRフラグメントから、++++細胞および++−+細胞と比較して、+++−細胞において有意に増加しているかまたは独特に発現されるとして、同定した。これらの184個の遺伝子フラグメントを、逆ノーザンブロットにより確認し、サブクローニングし、そして配列決定した。
【0351】
3つの既知データベース、Genbank、EST(発現配列タグ)、およびPrinceton大学からの幹細胞データベース(Ihor Lemishkaにより開発された)を、スクリーニングした。それらの遺伝子のうちの72個(39%)が、既知の機能を有する遺伝子に対して相同性を示した。15個の遺伝子(8%)が、上記ESTデータベースにおける配列に対して相同性を示した。
【0352】
97個の遺伝子(53%)は、新規であるようである。すなわち、それらは、試験した3つのデータベースにおけるいかなる配列に対しても相同性を有さない。Celeraデータベースを、これらの「未知」遺伝子についてスクリーニングし得る。これらの「未知」遺伝子の全長バージョンを得るために、市販の17日齢マウス胚cDNAライブラリーを、まず、スクリーニングした。しかし、それらの遺伝子のうちのわずか10.1%しか、PCR反応において陽性シグナルを生じなかった。
【0353】
上記胚cDNAライブラリーは、細胞型の混合物から誘導した。結果として、何らかの単一細胞型からの低発現転写物が、バックグラウンド中に隠れる。
【0354】
従って、2つのcDNAライブラリーを、全マウス骨髄を出発点として使用して構築した。1つのライブラリーは、「低密度細胞」由来であり、第2のライブラリーは、「系統陰性」細胞由来であった。市販のcDNAライブラリー調製物のために必要とされるような約1×108個の胞を必要とすることなく、各段階の規模を小さくすることによって、1×104〜5個の細胞を含む妥当なライブラリーが、得られた。
【0355】
上記低密度細胞および系統陰性細胞cDNAライブラリーを、ClontechおよびGibco BRLによってそれぞれ開発された技術を用いて、構築した。放射性のトレーサー(32P dCTP)を、各ライブラリー構築物からアリコートで使用して、1’’および2’’の鎖合成効率を測定した。
【0356】
12個のランダムなクローンを選び、DNAを、調製し、その後、制限酵素消化した。インサートの平均サイズは、低密度細胞ライブラリーについて1.5kb(インサートサイズ範囲は、0.8kb〜3.1kb)であり、系統陰性細胞ライブラリーについては、平均2.2kbであった。しかし、合計109個および108個の細胞を、それぞれ必要とした。
【0357】
上記の3つのcDNAライブラリーの各々について「未知」遺伝子フラグメントを使用する陽性PCR反応を比較して、観察される陽性頻度は、系統陰性細胞cDNAライブラリーにおいて最高であり、系統陰性ライブラリーにおいて30%であり、低密度ライブラリーで18%であり、市販の17日齢胚ライブラリーで17%であった。それにも関わらず、+++細胞は、なお、系統陰性ライブラリーにおいてさえ稀な集団である(100,000個の細胞中50個)。上記遺伝子のうちの70個は、欠失したままである。
【0358】
適切な解決は、+++−細胞からcDNAライブラリーを構築することである。しかし、1×105個の+++−細胞を得ることは、非常に困難な作業である。約200個の+++−細胞を、1匹のマウスから取得し得る。従って、1×105個の+++−細胞を得ることには、500匹のマウスから骨髄細胞を採取することが必要であり、これは、学術研究室にとって論理的に不可能な作業である。さらに、5色選別さえ、純粋な細胞集団を提供しない。
【0359】
従って、本発明に従う微小流体アプローチの実施形態に従って、1個またはほんの2〜3個の細胞からチップ上にcDNAライブラリーを生成することは、両方の問題に取り組む。具体的には、微小流体の使用は、限定数の細胞しか含まず、任意の始原細胞集団中の細胞混合物の減少に起因して、比較的純粋な物質を生じる。
【0360】
上記の説明は、ウイルス、細菌、および多細胞生物から核酸を単離および精製するための微小流体構造の使用に焦点を合わせたが、本発明は、この特定の適用に限定はされない。代替的実施形態に従って、核酸以外の生物学的実体の要素が、本発明を使用して回収および精製され得る。例えば、ウイルス、細菌、または細胞の中に存在するタンパク質は、溶解を通して露出され得、その後、回収され得、そして本発明の実施形態に従って分析および精製され得る。
【0361】
上記の説明は、ウイルス、細胞、または細菌の要素の単離を、単離された要素の精製と組み合わせる、微小流体構造に焦点を合わせたが、これは、本発明には必要とされない。代替的実施形態において、サンプルからの生物学的実体のうちの1つまたは部分集合の単離および溶解の直後に、分析し得、介在する精製工程は必要としない。
【0362】
そのような代替的な実施形態は、ただ1つまたは少数の生物学的実体の微小流体単離が達成されて、生じた溶解混合物の全体的複雑度が減少した場合に、特に価値が有り得る。そのような代替的実施形態はまた、混合物中に存在する特定の標的に対して非常に感度の高い技術を使用して混合物を分析する場合に、価値があることが証明された。
【0363】
本発明は、その特定の実施形態に関して本明細書中に記載されているが、一定の範囲の改変、種々の変化および置換が、上記の開示において意図される。いくつかの場合において、本発明のいくつかの特徴は、示されるような本発明の範囲から逸脱することなく、他の特徴を対応して使用することなく使用されることが、認識される。従って、多くの改変が、本発明の不可欠の範囲および趣旨から逸脱することなく、本発明の教示に特定の状況または物質を適合させるためになされ得る。本発明は、本発明を実施するために企図される最良の様式として開示される特定の実施形態には限定されないこと、しかし、本発明は、特許請求の範囲の範囲内にあるすべての実施形態および等価物を包含することが、意図される。
【技術分野】
【0001】
(関連出願への相互参照)
即時の通常特許出願は、2002年10月2日に出願された米国仮特許出願番号60/415,407から優先権を主張する。即時の通常特許出願はまた、2003年1月31日に出願された米国仮特許出願番号60/444,022から優先権を主張する。即時の通常特許出願は、2003年8月11日に出願された米国仮特許出願番号60/494,377および米国仮特許出願番号60/494,388からさらに優先権を主張する。従って、これらの以前に出願された仮特許出願の各々が、全ての目的のために本明細書により参考として援用される。
【0002】
(連邦政府によって後援を受けている研究開発の下でなされた発明に対する権利としての宣言)
本明細書中に記載されている研究は、部分的に、Army Research Office(No.DAAD19−00−1−0392)およびDARPA Bioflips programからのNSF助成金によって支援されている。従って、米国政府は本発明の特定の権利を有する。
【背景技術】
【0003】
(発明の背景)
多くの生態系において、微生物の個体集団の99%以上が、実験室の培養に抵抗性であるという証明がある。N.R.Pace「A Molecular View of Microbial Diversity and the Biosphere」、Science 276、734(1997)。これにより、人間の体内での微生物の生態系は、以前に推測していたよりも複雑で、培養不能な微生物のいくらか、または多くは、病原菌であり得るということが示唆される。D.A.Relman「The Search for Unrecognized Pathogens」、Science 284、1308(1999)。
【0004】
感染症に似ている相当な数の疾病、および不明な死または重症疾病が、100,000人につき0.5人の割合で発生している。B.A.Perkinsら、「Unexplained Deaths Due to Possibly Infectious Causes in the United States:Defining the Problem and Designing Surveillance and Laboratory Approaches」、Emerging Inject.Dis.2,47(1996)。多くのそのような病原体は、従来の表現型の方法による同定に抵抗するので、病原体同定の遺伝子型の方法の開発がもたらされる。
【0005】
その結果、ここ20年間で、ヒトの疾患と以前に推測されていない微生物病原体との関係のリストの増加が見られる。表1は、人間の疾患および過去20年間で明らかにされた関連した微生物病原体の例を列挙している。Heliobacter pyloriを除く、これらの病原菌の全てが、最初に遺伝子型アプローチを使用する臨床生検から直接同定された。
【0006】
【表1】

人体は、細菌およびウイルスにとって非常に多様な生態系を提供するが、その中に生きている多くの生物体を培養することは、困難または不可能であると証明されているので、多様性および個体集団分布の正確な測定を行うことは難しい。
【発明の概要】
【発明が解決しようとする課題】
【0007】
従って、種々の環境中に存在している細菌およびウイルスの特徴づけ、および解析のための技術および装置に対する必要性が当該分野において存在する。
【課題を解決するための手段】
【0008】
(発明の要旨)
種々の環境から採取された細胞およびウイルス由来の核酸が微小流体の技術を利用して、精製および発現され得る。本発明の1つの実施形態に従って、細胞またはウイルスの個々あるいは小さな集団が希釈、分類および/またはセグメント化によって、微小流体チャンバ内に隔離され得る。隔離された細胞またはウイルスは微小流体チャンバ内で直接溶解され得、その結果得られた核酸が、親和性ビーズに曝露することによって精製される。その後の精製された核酸の溶出の後に、連結および細胞形質転換が続き得る。1つの特定の適用において、細胞の隔離、溶解および核酸精製が、ゲノムDNAおよび相補鎖DNAのライブラリーを作製するために高度に並行化した微小流体アーキテクチャーを利用して行われ得る。
【0009】
本発明に従う微小流体デバイスの実施形態は、第1微小流体チャンバおよび、第1微小流体チャンバにウイルス、細菌および細胞のうちの少なくとも1つを含むサンプルを送達するように構成されている第1微小流体チャネルを備える。第2微小流体流動チャネルは第1微小流体チャンバに溶解化学物質を送達するように構成されている。
【0010】
核酸を精製するための本発明に従う方法の実施形態は、細菌、ウイルスおよび細胞のうちの少なくとも1つを含むサンプルを提供する工程を包含する。細菌、ウイルスおよび細胞のうちの少なくとも1つのサブセットは、微小流体チャンバ内に物理的に隔離される。細菌、ウイルスおよび細胞のうちの少なくとも1つは、微小流体チャンバ内で溶解される。核酸は、核酸精製媒体を含む第2微小流体チャンバを通して、溶解された細菌、ウイルスおよび細胞のうちの少なくとも1つから流動される。
【0011】
微小流体処理のための本発明に従う方法の実施形態は、複数の微小流体構造に並行してサンプルを提供する工程、および、複数の微小流体構造と共通連絡する1つの制御構造の操作によって、複数の微小流体構造によるサンプルの処理を制御する工程を包含する。
【0012】
サンプルを解析するための本発明に従う方法の実施形態は、微小流体チャネルに沿って、ウイルスおよび細胞のうちの少なくとも1つを含むサンプルを流動させる工程を包含する。微小流体チャンネルの一部分は、限られた数の細菌、ウイルスまたは細胞を含むセグメントへと隔離される。ゲノムDNAまたはcDNAの遺伝子解析、生化学解析、およびクローニングのうちの少なくとも1つが、限られた数の細菌、ウイルスまたは細胞に対して行われる。
【0013】
核酸処理のための本発明に従う方法の実施形態は、複数の生物学的実体を含むサンプルを提供する工程、および個々の生物学的実体または、生物学的実体のサブセットを微小流体チャンバ内に物理的に隔離する工程を包含する。個々の生物学的実体または生物学的実体のサブセットは溶解され、実験的に操作可能な核酸調製物が、個々の生物学的実体または生物学的実体のサブセットから得られる。
【0014】
異種の生物学的エレメントのサンプルから核酸を得るための本発明に従う方法の実施形態は、異種の生物学的エレメントを含むサンプルを提供する工程、およびサンプルの個々の生物学的エレメントまたは生物学的エレメントのサブセットを微小流体チャンバ内に物理的に隔離する工程を包含する。個々の生物学的エレメントまたは生物学的エレメントのサブセットは溶解され、個々の生物学的実体または生物学的実体のサブセット由来の核酸が精製される。精製された核酸の少なくとも一部分は、増幅される。
【0015】
複数の生物学的エレメントを含む特定の環境によって示される系統的多様性、遺伝子多様性および機能的多様性を特徴づけるための本発明に従う方法の実施形態は、異種の生物学的エレメントを含む環境からサンプルを提供する工程を包含する。サンプルの個々の生物学的エレメントまたは生物学的エレメントのサブセットは、微小流体チャンバ内に物理的に隔離される。個々の生物学的エレメントまたは生物学的エレメントのサブセットは溶解されて、その中に存在する核酸を露出する。個々の生物学的実体または生物学的実体のサブセット由来の露出された核酸は、精製される。精製された核酸の少なくとも一部分は増幅されて、精製された核酸の増幅された部分の系統的多様性、遺伝子多様性および機能的多様性のうちの少なくとも1つが、同定される。
【0016】
複雑な環境サンプルの個々の生物学的エレメントに関する遺伝情報を取得するための本発明に従う方法の実施形態は、異種の生物学的エレメントを含む環境サンプルを提供する工程、およびサンプルの個々の生物学的エレメントまたは生物学的エレメントのサブセットを微小流体チャンバ内に物理的に隔離する工程を包含する。個々の生物学的エレメントまたは生物学的エレメントのサブセットは、溶解されて、その中に存在する核酸を露出する。露出された核酸は精製されて、精製された核酸の少なくとも一部分が増幅される。
【0017】
本発明のこれらおよび別の実施形態、ならびに、その利点および特徴は、以下の本文および添付した図面と併せてより詳細に記載されている。
(項目1)
微小流体デバイスであって、以下:
第1微小流体チャンバ;
ウイルス、細菌および細胞のうちの少なくとも1つを含むサンプルを該第1微小流体チャンバに送達するために構成された第1微小流体チャネル;ならびに
溶解化学物質を該第1微小流体チャンバに送達するために構成された第2微小流体流動チャネル
を備える、微小流体デバイス。
(項目2)
項目1に記載の微小流体デバイスであって、上記第1微小流体チャンバが、回転式混合構造を備える、微小流体デバイス。
(項目3)
項目1に記載の微小流体デバイスであって、上記第1微小流体チャンバが、偏向可能な膜を通して上記第2微小流体流動チャネルと選択的に流体連絡している、微小流体デバイス。
(項目4)
項目1に記載の微小流体デバイスであって:
上記第1微小流体チャンバが、複数の第1微小流体チャンバを備え;そして
該第1微小流体チャネルが、該複数の第1微小チャンバと共通に流体連絡している、微小流体デバイス。
(項目5)
項目4に記載の微小流体デバイスであって、上記複数の第1微小流体チャンバが、上記第1微小流体チャネルのセグメントを備える、微小流体デバイス。
(項目6)
項目4に記載の微小流体デバイスであって、並行微小流体溶解構造を規定する、上記複数の第1微小流体チャンバと共通に作動連絡している制御構造をさらに備える、微小流体デバイス。
(項目7)
項目1に記載の微小流体デバイスであって、上記第1微小流体チャンバと選択的に流体連絡している第2微小流体チャンバをさらに備え、該第2微小流体チャンバが核酸精製媒体を含む、微小流体デバイス。
(項目8)
項目7に記載の微小流体デバイスであって、上記核酸精製媒体が、特定の核酸に親和性を示す、コーティングされたビーズを含む、微小流体デバイス。
(項目9)
項目7に記載の微小流体デバイスであって、上記第2微小流体チャンバが、上記第1微小流体チャネルと第3微小流体チャネルとの接合部により規定される、微小流体デバイス。
(項目10)
項目9に記載の微小流体デバイスであって:
上記第1微小流体チャネルが、複数の第1微小流体チャネルを備え;そして
上記第2微小流体チャンバが、該複数の第1微小流体チャネルと上記第2微小流体チャネルとの間の接合部により規定された複数の第2微小流体チャンバを備える、微小流体デバイス。
(項目11)
項目10に記載の微小流体デバイスであって、上記複数の第1微小流体チャンバと上記複数の第2微小流体チャンバとの間の流体連絡を選択的に容認するように共通に作動連絡している制御ラインをさらに備え、該制御ラインは、並行核酸精製構造を規定する、微小流体デバイス。
(項目12)
項目7に記載の微小流体デバイスであって、第1の一体化微小流体構造をさらに備え、該第1の一体化微小流体構造は、上記第2微小流体チャンバと流体連絡し、そこから受け取った精製された核酸を増幅するように構成されている、微小流体デバイス。
(項目13)
項目12に記載の微小流体デバイスであって、上記第1の一体化微小流体構造が、加熱素子と熱連絡するセグメントを有する回転式混合構造を備える、微小流体デバイス。
(項目14)
項目12に記載の微小流体デバイスであって、上記第1の一体化微小流体構造が、分離可能な回転式混合構造のアドレス可能なマトリックスを備える、微小流体デバイス。
(項目15)
項目7に記載の微小流体デバイスであって、一体化微小流体構造をさらに備え、該一体化微小流体構造は、上記第2微小流体チャンバと流体連絡し、そこから受け取った精製された核酸を連結酵素の存在下で宿主ベクターに曝露するように構成されている、微小流体デバイス。
(項目16)
項目15に記載の微小流体デバイスであって、上記第1の一体化微小流体構造が、回転式混合構造を備える、微小流体デバイス。
(項目17)
項目16に記載の微小流体デバイスであって:
上記第1微小流体チャネルが、複数の第1微小流体チャネルを備え;
上記第2微小流体チャンバが、該複数の第1微小流体チャネルと該第2微小流体チャネルとの間の接合部により規定される複数の第2微小流体チャンバを備え;そして
上記第1の一体化微小流体構造が、該複数の第2チャンバのそれぞれと選択的に並行流体連絡する第1の回転式ミキサーセットを備える、微小流体デバイス。
(項目18)
項目17に記載の微小流体デバイスであって、並行核酸連結構造を規定する上記回転式ミキサーセットと共通に作動連絡している制御ラインをさらに備える、微小流体デバイス。
(項目19)
項目15に記載の微小流体デバイスであって、上記第1の一体化微小流体構造と流体連絡している第2の一体化微小流体構造をさらに備え、該第2の一体化微 小流体構造は、宿主ベクター内に連結された精製された核酸を、該精製された核酸の形質転換および発現のための細胞に曝露するように構成されている、微小流体デバイス。
(項目20)
項目19に記載の微小流体デバイスであって、上記第2の一体化微小流体構造が、第2の回転式混合構造を備える、微小流体デバイス。
(項目21)
項目20に記載の微小流体デバイスであって:
上記第1微小流体チャネルが、複数の第1微小流体チャネルを備え;
上記第2微小流体チャンバが、該複数の第1微小流体チャネルと上記第2微小流体チャネルとの間の接合部により規定される複数の第2微小流体チャンバを備え;
上記第1の一体化微小流体構造が、上記複数の第2チャンバのそれぞれと選択的に並行流体連絡している第1の回転式ミキサーセットを備え;そして
上記第2の一体化微小流体構造が、該第1の回転式ミキサーセットのそれぞれと選択的に並行流体連絡している第2の回転式ミキサーセットを備える、微小流体デバイス。
(項目22)
項目21に記載の微小流体デバイスであって、並行核酸形質転換構造を規定する上記第2の回転式ミキサーセットと共通に作動連絡している制御ラインをさらに備える、微小流体デバイス。
(項目23)
核酸を精製する方法であって、以下:
細菌、ウイルスおよび細胞のうちの少なくとも1つを含むサンプルを提供する工程;
微小流体チャンバ内に、細菌、ウイルスおよび細胞のうちの少なくとも1つのサブセットを物理的に隔離する工程;
該微小流体チャンバ内で、該細菌、ウイルスおよび細胞のうちの少なくとも1つを溶解する工程;
該溶解された細菌、ウイルスおよび細胞のうちの少なくとも1つ由来の核酸を、核酸精製媒体を含む第2微小流体チャンバを通して、流動する工程
を包含する方法。
(項目24)
項目23に記載の方法であって、上記隔離工程より前に、上記サンプルを希釈する工程をさらに包含する、方法。
(項目25)
項目23に記載の方法であって、上記隔離工程が、細長い流動チャネル内でセグメントを作り出し、それによって、該チャネル中に細菌、ウイルスおよび細胞を含ませる工程を包含する、方法。
(項目26)
項目23に記載の方法であって、上記隔離工程より前に、環境サンプルを分類することをさらに包含する、方法。
(項目27)
項目23に記載の方法であって、精製された核酸を、核酸親和性ビーズを含む上記核酸精製媒体から溶出する工程をさらに包含する、方法。
(項目28)
項目23に記載の方法であって、mRNAが、上記核酸精製媒体から溶出される、方法。
(項目29)
項目28に記載の方法であって、上記精製されたmRNAを逆転写酵素に曝露して、該精製されたmRNAをcDNAに変換する工程をさらに包含する、方法。
(項目30)
項目29に記載の方法であって、cDNAライブラリーを構築する工程をさらに包含する、方法。
(項目31)
項目28に記載の方法であって、遺伝子発現解析を行う工程をさらに包含する、方法。
(項目32)
項目31に記載の方法であって、上記遺伝子発現解析が、マイクロアレイチップを利用して行われる、方法。
(項目33)
項目23に記載の方法であって、精製された核酸を第2微小流体チャンバ内で宿主ベクターおよび連結酵素に曝露して、該精製された核酸を該宿主ベクター内に連結する工程をさらに包含する、方法。
(項目34)
項目33に記載の方法であって、上記精製された核酸を上記宿主ベクターに曝露するより前に、第3微小流体チャンバ内で、該精製された核酸を増幅させる工程をさらに包含する、方法。
(項目35)
項目34に記載の方法であって、上記精製された核酸が、微小流体回転式混合構造内で、循環により宿主ベクターおよび連結酵素に曝露される、方法。
(項目36)
項目33に記載の方法であって、以下:
第3微小流体チャンバ内で、上記連結および精製された核酸を含む上記宿主ベクターを細胞に曝露する工程;および
該細胞を該宿主ベクターで形質転換する工程
をさらに包含する、方法。
(項目37)
項目36に記載の方法であって、上記宿主ベクターが、微小流体回転式混合構造内で、循環により上記細胞に曝露される、方法。
(項目38)
項目37に記載の方法であって、上記第1、第2および第3の微小流体チャンバを含む微小流体チップが、熱ショックに曝露され、上記細胞を形質転換する、方法。
(項目39)
項目36に記載の方法であって、上記形質転換された細胞を培養して、上記精製された核酸を発現する工程をさらに包含する、方法。
(項目40)
項目36に記載の方法であって、上記隔離、溶解および流動の工程を、複数のウイルス、細菌または細胞に対して並行に行う工程をさらに包含する、方法。
(項目41)
項目40に記載の方法であって、上記連結および形質転換の工程を、上記複数のウイルス、細菌または細胞に対して並行に行う工程をさらに包含する、方法。
(項目42)
項目41に記載の方法であって、上記精製された核酸からgDNAライブラリーおよびcDNAライブラリーのうちの1つを構築する工程をさらに包含する、方法。
(項目43)
項目42に記載の方法であって、環境サンプルから集めた1つの細胞タイプの形態型、リボタイプおよび遺伝子型を同定する工程をさらに包含する、方法。
(項目44)
微小流体処理の方法であって、以下:
複数の微小流体構造に並行してサンプルを提供する工程;
該複数の微小流体構造と共通に連絡した1つの制御構造の操作により、該複数の微小流体構造による該サンプルの処理を制御する工程、
を包含する、方法。
(項目45)
項目44に記載の方法であって、
上記サンプルが、並行微小流体構造の段階で順番に処理される工程;および
各段階による該サンプルの処理が、1つの段階内で該並行微小流体構造の各々と共通に連絡する別々の制御構造により制御される、方法。
(項目46)
項目45に記載の方法であって、上記処理段階が、隔離段階、溶解段階、核酸精製段階、精製された核酸の連結段階および細胞形質転換段階を包含する、方法。
(項目47)
項目46に記載の方法であって、上記溶解段階、上記精製された核酸の連結段階および上記細胞形質転換段階のうちの少なくとも1つが、制御構造の共通のセットにより制御された循環を有する並行回転式混合構造を備える、方法。
(項目48)
サンプルを解析する方法であって、以下:
ウイルスおよび細胞のうちの少なくとも1つを含むサンプルを微小流体チャネルに沿って流動する工程;
該微小流体チャネルの一部分を、限られた数の細菌、ウイルスまたは細胞を含むセグメントの中に隔離する工程;
該限られた数の細菌、ウイルスまたは細胞について、遺伝子解析、生化学解析、およびゲノムDNAまたはcDNAのクローニングのうちの少なくとも1つを行う工程、
を包含する、方法。
(項目49)
項目48に記載の方法であって、隔離する工程が、上記微小流体チャネルの中にバルブのたわみを引き起こして、隣接するセグメントを規定する工程を包含する、方法。
(項目50)
項目49に記載の方法であって、上記バルブをたわませる工程が、上記微小流体チャネルと隣接する制御チャネルとの間に規定された膜をたわませる工程を包含する、方法。
(項目51)
項目48に記載の方法であって、隔離する工程が、50未満の細菌、細胞またはウイルスをセグメント内に隔離する工程を包含する、方法。
(項目52)
項目49に記載の方法であって、行う工程が、以下:
上記セグメントの内容物を溶解して、上記細胞またはウイルス内に存在する物質を露出させる工程;および
該セグメント内の該露出された内容物を精製する工程
を包含する、方法。
(項目53)
項目52に記載の方法であって、上記精製された内容物が、核酸を含み、該方法が、該精製された核酸を発現のための細胞中に組み込む工程をさらに包含する、方法。
(項目54)
項目53に記載の方法であって、上記発現のための細胞中に組み込むより前に、上記精製された核酸を増幅する工程をさらに包含する、方法。
(項目55)
核酸処理の方法であって、以下:
複数の生物学的実体を含むサンプルを提供する工程;
個々の生物学的実体または該生物学的実体のサブセットを微小流体チャンバ内に、物理的に隔離する工程;
該個々の生物学的実体または該生物学的実体のサブセットを溶解する工程;および
実験的に操作可能な核酸調製物を該個々の生物学的実体または該生物学的実体のサブセットから取得する工程
を包含する、方法。
(項目56)
項目55に記載の方法であって、取得する工程が、上記個々の生物学的実体または上記生物学的実体のサブセットの溶解から生じた混合物を精製する工程を包含する、方法。
(項目57)
項目56に記載の方法であって、精製する工程が、親和性ビーズを通して上記混合物を流動し、次いで、該親和性ビーズから上記精製された核酸を溶出する工程によって達成される、方法。
(項目58)
項目55に記載の方法であって、物理的隔離が、微小流体チャネルを通して上記サンプルを流動し、次いで、上記微小流体チャネルを隔離されたセグメントへと変換する工程によって達成される、方法。
(項目59)
項目55に記載の方法であって、上記核酸の一部を増幅する工程をさらに包含する、方法。
(項目60)
項目55に記載の方法であって、上記核酸調製物を精製する工程、および上記精製された核酸の一部を増幅する工程をさらに包含する、方法。
(項目61)
項目60に記載の方法であって、上記精製された核酸の実質的に全てが増幅されてライブラリーが作製される、方法。
(項目62)
項目60に記載の方法であって、上記精製された核酸の個々の遺伝子または遺伝子フラグメントが、特異的プライマーセットによって増幅される、方法。
(項目63)
項目62に記載の方法であって、上記精製された核酸の上記遺伝子または遺伝子フラグメントが、逆転写酵素ポリメラーゼ連鎖反応(RT−PCR)によって増幅されて、発現された遺伝子または遺伝子フラグメントだけを増幅する、方法。
(項目64)
項目60に記載の方法であって、上記精製された核酸の上記増幅された部分の配列を解析する工程をさらに包含する、方法。
(項目65)
項目60に記載の方法であって、上記精製された核酸の上記増幅された部分で生物体を形質転換する工程をさらに包含する、方法。
(項目66)
項目65に記載の方法であって、上記形質転換された生物体を培養して、上記精製された核酸の上記増幅された部分を発現させる工程をさらに包含する、方法。
(項目67)
異種の生物学的エレメントのサンプルから核酸を取得する方法であって、該方法が、以下:
異種の生物学的エレメントを含むサンプルを提供する工程;
該サンプルの個々の生物学的エレメントまたは該生物学的エレメントのサブセットを微小流体チャンバ内に、物理的に隔離する工程;
該個々の生物学的エレメントまたは該生物学的エレメントのサブセットを溶解する工程;
個々の生物学的実体または生物学的実体のサブセットから核酸を精製する工程;および
該精製された核酸のうちの少なくとも一部分を増幅する工程
を包含する、方法。
(項目68)
項目67に記載の方法であって、上記精製された核酸の実質的に全てが増幅されて、上記個々の生物学的エレメントまたは生物学的エレメントのサブセットの再生を可能にする、方法。
(項目69)
項目67に記載の方法であって、上記精製された核酸の全ての一部分だけが増幅されて、上記個々の生物学的エレメントまたは生物学的エレメントのサブセットと関連した遺伝子または遺伝子フラグメントの再生を可能にする、方法。
(項目70)
複数の生物学的エレメントを含む特定の環境によって示された系統的多様性、遺伝子多様性および機能的多様性を特徴づける方法であって、該方法が以下:
異種の生物学的エレメントを含む該環境からサンプルを提供する工程;
該サンプルの個々の生物学的要素エレメントまたは該生物学的エレメントのサブセットを微小流体チャンバ内に、物理的に隔離する工程;
該個々の生物学的エレメントまたは該生物学的エレメントのサブセットを溶解して、その中に存在する核酸を露出する工程;
個々の生物学的実体または該生物学的実体のサブセットから該露出された核酸を精製する工程;
該精製された核酸のうちの少なくとも一部分を増幅する工程;および
該精製された核酸の該増幅された部分の系統的多様性、遺伝子多様性および機能的多様性のうちの少なくとも1つを同定する工程を包含する、方法。
(項目71)
項目70に記載の方法であって、遺伝的多様性が、配列解析によって同定される、方法。
(項目72)
項目70に記載の方法であって、以下:
溶解より前に、上記個々の生物学的エレメントまたは生物学的エレメントのサブセットの形態を観察する工程;および
該観察された形態と上記遺伝的多様性とを関連づける工程
をさらに包含する、方法。
(項目73)
複雑な環境サンプルの個々の生物学的エレメントに関する遺伝情報を取得する方法であって、該方法が、以下:
異種の生物学的エレメントを含む環境サンプルを提供する工程;
該サンプルの個々の生物学的エレメントまたは該生物学的エレメントのサブセットを微小流体チャンバ内に、物理的に隔離する工程;
該個々の生物学的エレメントまたは該生物学的エレメントのサブセットを溶解して、その中に存在する核酸を露出させる工程;
該露出された核酸を精製する工程;および
該精製された核酸のうちの少なくとも一部分を増幅する工程
を包含する、方法。
(項目74)
項目73に記載の方法であって、上記増幅および精製された核酸によって表された遺伝情報を同定する工程をさらに包含する、方法。
(項目75)
項目73に記載の方法であって、以下:
適切なベクターの中に連結された上記精製された核酸の上記増幅された部分で細胞を形質転換する工程;および
該形質転換された細胞を培養して、該増幅された配列をクローニングする工程
をさらに包含する、方法。
【図面の簡単な説明】
【0018】
【図1】図1は微小機械加工型の頂部に形成された第1エラストマー層の図である。
【図2】図2は微小機械加工型の頂部に形成された第2エラストマー層の図である。
【図3】図3は微小機械加工型から取り外され、図1のエラストマー層の頂部より上に配置された図2のエラストマー層の図である。
【図4】図4は図3に対応する図であるが、第1エラストマー層の頂部に配置された第2エラストマー層を示す。
【図5】図5は図4に対応する図であるが、共に結合された第1および第2エラストマー層を示す。
【図6】図6は図5に対応する図であるが、第1微小機械加工型が取り外され、その場所に配置された平面基板を示す。
【図7A】図7Aは図6に対応する図であるが、平面基板の上にシールされたエラストマーアーキテクチャーを示す。図7Bは図7Aに対応する正面断面図であるが、開いている流動チャネルを示す。図7C〜7Gは、別々のエラストマー層から形成された膜を有するエラストマーアーキテクチャーを形成するための方法の工程を示す図である。図7Hは、作動させた状態での図7Bのバルブを示す正面断面図である。
【図7B】図7Aは図6に対応する図であるが、平面基板の上にシールされたエラストマーアーキテクチャーを示す。図7Bは図7Aに対応する正面断面図であるが、開いている流動チャネルを示す。図7C〜7Gは、別々のエラストマー層から形成された膜を有するエラストマーアーキテクチャーを形成するための方法の工程を示す図である。図7Hは、作動させた状態での図7Bのバルブを示す正面断面図である。
【図7C】図7Aは図6に対応する図であるが、平面基板の上にシールされたエラストマーアーキテクチャーを示す。図7Bは図7Aに対応する正面断面図であるが、開いている流動チャネルを示す。図7C〜7Gは、別々のエラストマー層から形成された膜を有するエラストマーアーキテクチャーを形成するための方法の工程を示す図である。図7Hは、作動させた状態での図7Bのバルブを示す正面断面図である。
【図7D】図7Aは図6に対応する図であるが、平面基板の上にシールされたエラストマーアーキテクチャーを示す。図7Bは図7Aに対応する正面断面図であるが、開いている流動チャネルを示す。図7C〜7Gは、別々のエラストマー層から形成された膜を有するエラストマーアーキテクチャーを形成するための方法の工程を示す図である。図7Hは、作動させた状態での図7Bのバルブを示す正面断面図である。
【図7E】図7Aは図6に対応する図であるが、平面基板の上にシールされたエラストマーアーキテクチャーを示す。図7Bは図7Aに対応する正面断面図であるが、開いている流動チャネルを示す。図7C〜7Gは、別々のエラストマー層から形成された膜を有するエラストマーアーキテクチャーを形成するための方法の工程を示す図である。図7Hは、作動させた状態での図7Bのバルブを示す正面断面図である。
【図7F】図7Aは図6に対応する図であるが、平面基板の上にシールされたエラストマーアーキテクチャーを示す。図7Bは図7Aに対応する正面断面図であるが、開いている流動チャネルを示す。図7C〜7Gは、別々のエラストマー層から形成された膜を有するエラストマーアーキテクチャーを形成するための方法の工程を示す図である。図7Hは、作動させた状態での図7Bのバルブを示す正面断面図である。
【図7G】図7Aは図6に対応する図であるが、平面基板の上にシールされたエラストマーアーキテクチャーを示す。図7Bは図7Aに対応する正面断面図であるが、開いている流動チャネルを示す。図7C〜7Gは、別々のエラストマー層から形成された膜を有するエラストマーアーキテクチャーを形成するための方法の工程を示す図である。図7Hは、作動させた状態での図7Bのバルブを示す正面断面図である。
【図7H】図7Aは図6に対応する図であるが、平面基板の上にシールされたエラストマーアーキテクチャーを示す。図7Bは図7Aに対応する正面断面図であるが、開いている流動チャネルを示す。図7C〜7Gは、別々のエラストマー層から形成された膜を有するエラストマーアーキテクチャーを形成するための方法の工程を示す図である。図7Hは、作動させた状態での図7Bのバルブを示す正面断面図である。
【図8】図8Aおよび8Bは、種々の流動チャネルの付与された圧力に対するバルブの開度を図示する。
【図9】図9は、100μm×100μm×10μmRTVマイクロバルブの時間応答を図示する。
【図10】図10は、膜の作動を示す図7Bのバルブの正面断面図である。
【図11】図11は、湾曲した上面を備える流動チャネルを有するバルブの代替的な実施形態の正面断面図である。
【図12A】図12Aは、オン/オフバルブの上面概略図である。
【図12B】図12Bは、図12Aのライン23B−23Bに沿った部分的な立面図である。
【図13A】図13Aは、蠕動ポンピングシステムの上面概略図である。
【図13B】図13Bは、図13Aのライン24B−24Bに沿った部分的な立面図である。
【図14】図14は、図13の蠕動ポンピングシステムの実施形態の回転数に対して、実験的に達成されたポンピング速度を示すグラフである。
【図15A】図15Aは、複数の流動ラインを同時に作動させる1つの制御ラインの上面概略図である。
【図15B】図15Bは、図15Aのライン26B−26Bに沿った部分的な立面図である。
【図16】図16は、種々のチャネルを通して流動を可能にするように適合された多重化システムの概略図である。
【図17A】図17A〜Dは、切り換え可能な流動アレイの1つの実施形態の平面図を示す。
【図17B】図17A〜Dは、切り換え可能な流動アレイの1つの実施形態の平面図を示す。
【図17C】図17A〜Dは、切り換え可能な流動アレイの1つの実施形態の平面図を示す。
【図17D】図17A〜Dは、切り換え可能な流動アレイの1つの実施形態の平面図を示す。
【図18】図18A〜Dは、細胞囲いアレイアーキテクチャーの1つの実施形態の平面図を示す。
【図19】図19A〜Bは、本発明に従う細胞ケージアーキテクチャーの1つの実施形態の操作を図示する平面図および断面図を示す。
【図20】図20A〜20Dは、本発明の実施形態に従う交差チャネル注入を利用するアーキテクチャーの動作の平面図を示す。
【図21】図21は、本発明に従う回転式混合アーキテクチャーの1つの実施形態の平面図を示す。
【図22A】図22Aは、2分木の微小流体マルチプレキサー動作線図を図示する単純化された平面図を示す。
【図22B】図22Bは、3分木の微小流体マルチプレキサー動作線図を図示する単純化された平面図を示す。
【図22C】図22Cは、図22A〜Bのデバイスの一般的な微小流体アーキテクチャーの単純化された断面図を示す。
【図23】図23は、種々の基本数のマルチプレキサーのための制御されている流動ラインの数に対する制御ラインの数をプロットする。
【図24】図24は、他の制御チャネルを制御する制御チャネルを利用する微小流体構造の実施形態の単純化された平面図を示す。
【図24A】図24Aは、ラインA−A’に沿って取った図24のアーキテクチャーの単純化された断面図を示す。
【図24B】図24Bは、ラインB−B’に沿って取った図24のアーキテクチャーの単純化された断面図を示す。
【図25】図25は、図24〜24Bのデバイスの一般的な微小流体アーキテクチャーの単純化された断面図を示す。
【図26】図26は、他の制御チャネルを制御する制御チャネルを利用する微小流体構造の代替的な実施形態の単純化された平面図を示す。
【図26A】図26Aは、ラインA−A’に沿って取った図26のアーキテクチャーの単純化された断面図を示す。
【図26B】図26Bは、ラインB−B’に沿って取った図26のアーキテクチャーの単純化された断面図を示す。
【図27A】図27Aは、微小流体コンパレータチップの光学マイクログラフを示す。
【図27B】図27Bは、図27Aの微小流体コンパレータチップの単純化された概略図である。
【図27C】図27Cは、図27Aの微小流体構造のチャンバのロードを示す単純化された拡大平面図である。
【図27D】図27Dは、図27Aの微小流体構造のチャンバのロードを示す単純化された拡大平面図である。
【図27E】図27Eは、図27Aの微小流体構造のチャンバのロードを示す単純化された拡大平面図である。
【図27F】図27Fは、図27Aの微小流体構造のチャンバのロードを示す単純化された拡大平面図である。
【図27G】図27Gは、図27Aの微小流体構造のチャンバのロードを示す単純化された拡大平面図である。
【図27H】図27Hは、図27Aの微小流体構造のチャンバのロードを示す単純化された拡大平面図である。
【図28】図28は、本発明の実施形態に従って核酸を操作する工程を図示する単純化されたフローチャートである。
【図29A】図29Aは、細胞溶解およびその中に存在するDNAの精製を可能にする本発明に従う微小流体アーキテクチャーの1つ実施形態の平面図を示す。
【図29B】図29Bは、図22Aの微小流体アーキテクチャーの拡大された領域の写真を示す。
【図29C】図29Cは、図22Aの微小流体アーキテクチャーの拡大された領域の写真を示す。
【図29D】図29Dは、図22Aの微小流体アーキテクチャーの拡大された領域の写真を示す。
【図30A】図30A〜Bは、細胞溶解前後の図29Aの微小流体アーキテクチャーの拡大された領域の写真を示す。
【図30B】図30A〜Bは、細胞溶解前後の図29Aの微小流体アーキテクチャーの拡大された領域の写真を示す。
【図31A】図31A〜Bは、本発明の実施形態に従って精製された核酸サンプルの電気泳動を示す。
【図31B】図31A〜Bは、本発明の実施形態に従って精製された核酸サンプルの電気泳動を示す。
【図32A】図32A〜Bは、図29Aの微小流体アーキテクチャーを利用して精製された核酸物質の異なるサンプルを解析した結果を示す。
【図32B】図32A〜Bは、図29Aの微小流体アーキテクチャーを利用して精製された核酸物質の異なるサンプルを解析した結果を示す。
【図33】図33は、精製された核酸の連結および連結された核酸での細胞の形質転換を可能にする、本発明に従う微小流体アーキテクチャーの1つの実施形態の平面図を示す。
【図33A】図33Aは、精製された核酸の連結を可能にする図33の微小流体アーキテクチャーの領域の拡大図を示す。
【図33B】図33Bは、連結された精製された核酸での細胞形質転換を可能にする図33の微小流体アーキテクチャーの領域の拡大図を示す。
【図34】図34は、PCRを行うための微小流体構造の分解図を示す。
【図35】図35は、図34に示された微小流体構造を利用してPCRによって増幅された核酸の時間に対する蛍光をプロットする。
【図36A】図36Aは、マトリックスPCRアーキテクチャーの平面図を示す。
【図36B】図36Bは、図36AのマトリックスPCRアーキテクチャーの1つの細胞の拡大図を示す。
【図37A】図37Aは、本発明に従う代替的な微小流体アーキテクチャーの平面図を示す。
【図37B】図37Bは、図37Aの隣接した溶解および細胞チャンバの拡大を示す写真である。
【図37C】図37Cは、図37Aの隣接したビーズおよび細胞チャンバの拡大を示す写真である。
【図37D】図37Dは、溶解化学物質の拡散混合の前、間、後のそれぞれの細胞チャンバの拡大された部分の写真を示す。
【図37E】図37Eは、溶解化学物質の拡散混合の前、間、後のそれぞれの細胞チャンバの拡大された部分の写真を示す。
【図37F】図37Fは、溶解化学物質の拡散混合の前、間、後のそれぞれの細胞チャンバの拡大された部分の写真を示す。
【図38】図38は、ネガティブコントロールと共に1つの細胞の感受性を示すために行われた一連の実験の電気泳動結果を示す。
【図39】図39は、2%アガロースゲルで解析されたβ−アクチンとozfの両方のRT PCR生成物をプロットする。
【図40】図40は、本発明に従う微小流体アーキテクチャーの代替的な実施形態の平面図を示す。
【図41A】図41A〜Bは、マウスの骨髄細胞の表面マーカー発現プロフィールのフローサイトメトリーの解析を示す。
【図41B】図41A〜Bは、マウスの骨髄細胞の表面マーカー発現プロフィールのフローサイトメトリーの解析を示す。
【図42】図42は、マウスの多能性の造血幹細胞の提案された調節ネットワークを図示する。
【発明を実施するための形態】
【0019】
(発明の詳細な説明)
(I.微小製造の概要)
以下の議論は、2003年9月24日に出願された米国特許出願10/___,___号(代理人整理番号20174C−009410US)、2002年10月4日に出願された10/265,473号、2002年4月5日に出願された10/118,466号、2001年4月6日に出願された09/826,585号、2000年11月28日に出願された09/724,784号、および2000年6月27日に出願された09/605,520号に概ね記載されているように、エラストマー物質を利用する微小製造した流体デバイスの構成に関係している。これによって、これらの以前に出願された特許出願は、あらゆる目的のためにその全体が本明細書により参考として援用される。
【0020】
(1.製造の方法)
本発明を製造する例示的な方法が、本明細書中に提供されている。本発明は、これらの方法の1つまたは他の方法による製造に限られないことが理解されるべきである。むしろ、本方法を改変することを含む、本発明の微小構造を製造する他の適切な方法もまた、意図されている。
【0021】
図1〜7Bは、(ポンプまたはバルブとして使用され得る)本発明の微小構造を製造する第1の好ましい方法の一連の工程を図示する。図8〜18は、(ポンプまたはバルブとしてもまた使用され得る)本発明の微小構造を製造する第2の好ましい方法の一連の工程を図示する。
【0022】
説明されるように、図1〜7Bの好ましい方法は、組み立てられかつ結合されているあらかじめ硬化されたエラストマー層を使用することを含む。代替的な方法において、エラストマーの各層は「配置されて」硬化され得る。以下の明細書において「チャネル」は流体または気体の流動を含み得るエラストマー構造の溝を言う。
【0023】
図1を参照すると、第1の微小機械加工型10が提供される。微小機械加工型10はフォトリソグラフィ、イオンエッチング、および電子ビームリソグラフィを含むが、これらに限られていない多くの従来のシリコン処理方法によって、製造され得る。
【0024】
見られ得るように、微小機械加工型10は、隆起したラインまたはそこに沿って伸びている突出部11を有する。図に示すように、第1エラストマー層20は、型10の頂部に鋳造されるので、第1の溝21は、エラストマー層20の底面に形成される(突出部11の寸法に相当する溝21)。
【0025】
図2に見られ得るように、第2の微小機械加工型12に沿って伸びている隆起した突出部13を有する第2の微小機械加工型12もまた、提供される。示されるように、第2のエラストマー層22は、型12の上に鋳造されるので、溝23は、突出部13の寸法に相当するその底面に形成される。
【0026】
図3および図4に図示される一連の工程に見られ得るように、第2のエラストマー層22は、次いで型12から取り外されて第1のエラストマー層20の頂部に配置される。見られ得るように、第2のエラストマー層22の底面に沿って伸びている溝23は、流動チャネル32を形成する。
【0027】
図5を参照すると、別々の第1のエラストマー層20および第2のエラストマー層22(図4)は、次いで共に結合されて、一体化した(すなわち:モノリシック)エラストマー構造24を形成する。
【0028】
図6および7Aの一連の工程で見られ得るように、エラストマー構造24は次いで、型10から取りはずされ、平面基板14の上に置かれる。図7Aおよび7Bで見られ得るように、エラストマー構造24がその底面に平面基板14をシールされた場合、溝21は流動チャネル30を形成する。
【0029】
本エラストマー構造は、ほとんど任意の滑らかな平面基板で可逆な密閉シールを形成する。このようにシールを形成することの利点は、エラストマー構造がはがされ得、洗浄され得および再利用され得ることである。好ましい局面では、平面基板14はガラスである。さらにガラスを使用することの利点は、ガラスは透明であるので、エラストマーチャネルおよびリザーバの視覚的な問い合わせを可能にすることである。あるいは、エラストマー構造は、永続性の、高強度な結合を形成して、上記した同じ方法によって平らなエラストマー層の上に結合される。これは、高い背圧が使用される場合、有利であると証明され得る。
【0030】
図7Aおよび7Bで見られ得るように、流動チャネル30および32は、好ましくは互いに一定角度で配置され、基板24の小膜25で、流動チャネル32の底から流動チャネル30の最上部が分離される。
【0031】
好ましい局面において、平面基板14はガラスである。ガラスを使用することの利点は、本エラストマー構造がはがされ得、洗浄され得および再利用され得ることである。さらにガラスを使用することの利点は、視覚が用いられ得ることである。あるいは、平面基板14は、高い背圧が使用される場合、有利であり得ると証明されているエラストマー自身であり得る。
【0032】
たったいま、記載した製造方法は、デバイスのチャネルの壁を形成する物質とは異なるエラストマー物質から構成される膜を有する構造を形成するように変えられ得る。この改変型製造方法は、図7C〜7Gに示される。
【0033】
図7Cを参照すると、第1微小機械加工型10が提供される。微小機械加工型10は、そこに沿って伸びている一段高いラインまたは突出部11を有する。図7Dで、第1エラストマー層20が第1微小機械加工型10の上に鋳造されるので、第1エラストマー層20の頂部は一段高いラインまたは突出部11の上と同一平面になる。これは、一段高いライン11の既知の高さに対して型10の上で回転させたエラストマー物質の量を注意深く制御することによって達成され得る。あるいは、望ましい形状は射出成形によって形成され得る。
【0034】
図7Eで、第2微小機械加工型12に沿って伸びている一段高い突出部13を有する第2微小機械加工型12もまた提供される。第2エラストマー層22は、図のように、第2型12の上で鋳造されるので、溝23は突出部13の寸法に対応してその底面に形成される。
【0035】
図7Fで、第2エラストマー層22は、型12から取りはずされて第3エラストマー層222の上に置かれる。第2エラストマー層22は、以下詳細に記載された技術を使用して、一体化したエラストマーブロック224を形成して第3エラストマー層20に結合される。このプロセスの点で、以前は一段高いライン13によって占められた溝23は流動チャネル23を形成する。
【0036】
図7Gで、エラストマーブロック224は、第1微小機械加工型10および第1エラストマー層20の上に置かれる。エラストマーブロックおよび第1エラストマー層20は次いで、別のエラストマー層222で構成された膜を有する一体化した(すなわち:モノリシック)エラストマー構造24を形成して共に結合される。
【0037】
エラストマー構造24が、図7Aに関連して上記したように、その底面で平面基板にシールされた場合、以前に一段高いライン11によって占められていた溝は流動チャネル30を形成する。
【0038】
図7C〜7Gに関連して上記したように、改変型製造方法は、膜部分が構造の残部のエラストマー物質とは別の物質から構成されることを可能にするという利点を提供する。このことは、膜の厚さおよび弾性特性がデバイスの操作において中心的な役割を果たすので、重要である。さらに、この方法は別のエラストマー層をエラストマー構造の中に組み入れるより前に、容易に調製しやすくすることを可能にする。詳細に以下に述べるように、可能性として望ましい状態の例は、膜の作動を可能にする磁性または電気伝導種の導入、および/またはその弾性を変えるために膜の中に添加物(dopant)を導入することを含む。
【0039】
微小機械加工型の上に複製を鋳造することによって形成された様々な形状をしたエラストマー層を形成することに関連する上記方法が示されているが、本発明はこの技術に限られていない。共に結合される成形されたエラストマー物質の個々の層を形成するために他の技術が使用され得る。例えば、エラストマー物質の成形された層は、レーザー切断または射出成形によって、または化学エッチングおよび/または第2の模範的な方法と併せて以下に述べるような犠牲材料を利用する方法によって形成され得る。
【0040】
代替の方法は、エラストマー物質内にカプセル化されたフォトレジストの発生を利用するパターン化されたエラストマー構造を製造する。しかし、本発明に従う方法はフォトレジストを利用することに限られていない。金属のような他の物質もまた、囲んでいるエラストマー物質に選択的に除去されて犠牲材料としての機能を果たすことができ、この方法は、本発明の範囲内に残る。例えば、金金属は、適切な化学混合物を利用するRTV615エラストマーに選択的にエッチングされ得る。
【0041】
(2.層およびチャネルの寸法)
微小製造は、本発明の実施形態に従って製造されたエラストマー構造の特徴の大きさについて言及している。一般に、微小製造構造のうちの少なくとも1つの寸法の変化はミクロンレベルで、少なくとも1つの寸法が微視的(すなわち、1000μm以下)に制御される。微小製造は一般に、微視的なレベルの特徴の寸法を生産するために設計されるフォトリソグラフィーおよびスピンコーティングのような半導体またはMEMS製造技術を含み、微小製造された構造の寸法のうちの少なくともいくつかは、適度に構造を分解/画像化するためにマイクロスコープを必要とする。
【0042】
好ましい局面において、流動チャネル30、32、60および62は好ましくは、幅と深さが約10:1の比を有する。本発明の実施形態に従う幅と深さの比の他の範囲の非排他的なリストは0.1:1〜100:1であって、さらに好ましくは1:1〜50:1で、さらに好ましくは2:1〜20:1で、最も好ましくは3:1〜15:1である。典型的な局面において、流動チャネル30、32、60および62は、約1〜1000ミクロンの幅を有する。本発明に従う流動チャネルの幅の他の範囲の非排他的なリストは0.01〜1000マイクロンであって、さらに好ましくは0.05〜1000マイクロンで、さらに好ましくは0.2〜500マイクロンで、さらに好ましくは1〜250マイクロンで、最も好ましくは、10〜200マイクロンである。典型的なチャネル幅としては、0.1μm、1μm、2μm、5μm、10μm、20μm、30μm、40μm、50μm、60μm、70μm、80μm、90μm、100μm、110μm、120μm、130μm、140μm、150μm、160μm、170μm、180μm、190μm、200μm、210μm、220μm、230μm、240μm、250μmが挙げられる。
【0043】
流動チャネル30、32、60および62は、約1〜100ミクロンの深さを有する。本発明の実施形態に従う流動チャネルの深さの他の範囲の非排他的なリストは0.01〜1000ミクロンであって、さらに好ましくは0.05〜500ミクロンで、さらに好ましくは0.2〜250ミクロンで、さらに好ましくは1〜100ミクロンで、さらに好ましくは2〜20ミクロンで、最も好ましくは5〜10ミクロンである。典型的なチャネルの深さとしては、0.01μm、0.02μm、0.05μm、0.1μm、0.2μm、0.5μm、1μm、2μm、3μm、4μm、5μm、7.5μm、10μm、12.5μm、15μm、17.5μm、20μm、22.5μm、25μm、30μm、40μm、50μm、75μm、100μm、150μm、200μm、および250μmが挙げられる。
【0044】
流動チャネルは、これらの特定の寸法の範囲および上記した例に限られず、図27と併せて以下に長さについて述べるように、膜を偏向させるのに必要とする力の規模に影響するために幅の点で変化する。例えば、0.01μmのオーダーの幅を有する典型的な狭い流動チャネルは、以下に詳細に述べるように、視覚的および他の適用に有益であり得る。上記したよりもかるい幅広いチャネルを有する部分を含むエラストマー構造もまた、本発明によって企図され、幅広い流動チャネルを利用する適用の例は流体リザーバおよび混合チャネル構造を含む。
【0045】
エラストマー層は、機械的安定性のために厚く鋳造され得る。典型的な実施形態において、図1のエラストマー層22は、50ミクロン〜数cmの厚さで、さらに好ましくは約4mmの厚さである。本発明の他の実施形態に従うエラストマー層の厚さの範囲の非排他的なリストは、0.1ミクロン〜約10cm、1ミクロン〜5cm、10ミクロン〜2cm、100ミクロン〜10mmの間である。
【0046】
したがって、流動チャネル30および32を分けている図7Bの膜25は、約0.01と1000ミクロンの間、さらに好ましくは0.05〜500ミクロン、さらに好ましくは0.2〜250ミクロン、さらに好ましくは1〜100ミクロン、さらに好ましくは2〜50ミクロン、および最も好ましくは5〜40ミクロンの特有の厚さを有する。このように、エラストマー層22の厚さは、エラストマー層20の厚さの約100倍である。典型的な膜の厚さとしては、0.01μm、0.02μm、0.03μm、0.05μm、0.1μm、0.2μm、0.3μm、0.5μm、1μm、2μm、3μm、5μm、7.5μm、10μm、12.5μm、15μm、17.5μm、20μm、22.5μm、25μm、30μm、40μm、50μm、75μm、100μm、150μm、200μm、250μm、300μm、400μm、500μm、750μmおよび1000μmが挙げられる。
【0047】
(3.ソフトリソグラフィック結合)
好ましくはエラストマー層は、パターン化されたエラストマー層を含むポリマーに固有である化学的性質を使用して、化学的に共に結合される。最も好ましくは、結合は2つの成分「添加硬化」結合を含む。
【0048】
好ましい局面において、エラストマーの様々な層は、層が異なる化学的性質を有する異質の結合においては共に結合される。あるいは、同質の結合は全ての層が同じ化学的性質である場合に使用され得る。第3に、それぞれのエラストマー層は、必要に応じて代わりに接着剤によって共に接着され得る。第4の局面において、エラストマー層は、熱によって共に結合される熱硬化性のエラストマーであり得る。
【0049】
同種の結合の1つの局面において、エラストマー層は、同じエラストマー物質から構成され、1つの層の中の同じ化学的実体と他の層の中の同じ化学的実体と反応して、共に層が結合される。1つの実施形態において、同様なエラストマー層のポリマー鎖との間の結合は、光、熱または別の化学物質種との化学反応による架橋剤の活性化の結果として起こり得る。
【0050】
あるいは、異質の局面において、エラストマー層は、異なるエラストマー物質から構成され、1つの層の中の第1の化学的実体と他の層の中の第2の化学的実体が反応する。1つの典型的な異質の局面において、それぞれのエラストマー層を共に結合するのに使用される結合プロセスは、RTV615シリコーンの2層を共に結合することを含み得る。RTV615シリコーンは、2つの部分の添加硬化シリコーンゴムである。部分Aはビニル基および触媒を含み;部分Bは水素化珪素(Si−H)基を含む。RTV615の従来の比は、10A:1Bである。結合のために、1つの層は30A:1B(すなわち、過剰のビニル基)で作られ得、他の層は3A:1B(すなわち、過剰のSi−H基)で作られ得る。各層は別々に硬化される。2つの層が高温で接触および加熱される場合、それらはモノリシックエラストマー構造を形成して不可逆的に結合する。
【0051】
本発明の典型的な局面において、エラストマー構造は、Sylgard182、184または186、あるいはUCB Chemicalから提供されるEbecryl270またはIrr245(これらに限られてはいない)のような脂肪族のウレタンジアクリレートを利用して形成される。
【0052】
本発明に従う1つの実施形態において、2層のエラストマー構造は、純粋なアクリル化Urethane Ebe270から製造された。薄い低部層は、170℃で15秒間、8000rpmでスピンコートされた。頂部層および低部層は、Electrolite
corporationによって製造されたModel ELC500デバイスを利用する窒素の下で10分間紫外線下で最初に硬化された。集められた層は次いで、さらに30分間硬化された。反応は、Ciba−Geigy Chemicalsによって製造されたIrgacure500の0.5%vol/vol混合物によって触媒作用を及ぼされた。その結果として生じたエラストマー物質は、適度な弾性およびガラスに対する接着を示した。
【0053】
本発明に従う他の実施形態において、2層のエラストマー構造は、薄い底部層には25%Ebe270/50%Irr245/25%イソプロピルアルコールの組合わせから製造され、頂部層としては純粋なアクリル化Urethane Ebe270から製造された。Electrolite corporationによって製造されたModel ELC500デバイスを利用する窒素の下で紫外線下で、薄い底部層は5分間最初に硬化され、頂部層は10分間最初に硬化された。集められた層は次いで、さらに30分間硬化された。反応は、Ciba−Geigy Chemicalsによって製造されたIrgacure500の0.5%vol/vol混合物によって触媒作用を及ぼされた。その結果生じたエラストマー物質は、適度な弾性およびガラスに対する接着を示した。
【0054】
あるいは、例えばプラズマ曝露による、エラストマー表面を活性化させることを含む他の結合方法が使用され得、そのためエラストマー層/基材は、接触された場合結合する。例えば、同じ物質から構成されたエラストマー層を共に結合させる1つの可能なアプローチは、本明細書中に参考文献として援用されるDuffyら、「Rapid Prototyping of Microfluidic Systems in Poly(dimethylsiloxane)」、Analytical Chemistry(1998)、70、4974−4984によって示されている。この論文は、ポリジメチルシロキサン(PDMS)層を酸素プラズマに曝露することは、表面の酸化を引き起こし、2つの酸化された層が接触された場合に不可逆の結合が起こることを述べている。
【0055】
エラストマーの連続的な層を共に結合させるさらに別のアプローチは、硬化されていないエラストマーの接着特性を利用することである。具体的には、RTV615のような硬化されていないエラストマーの薄い層が、第1の硬化されたエラストマー層の上に適用される。次に、第2の硬化されたエラストマー層が、硬化されていないエラストマー層の上に置かれる。硬化されていないエラストマーの薄い中央の層は、次いで硬化されてモノリシックエラストマー構造を生成する。あるいは、硬化されていないエラストマーは、第1の硬化されたエラストマー層の底部に適用され得て、第1の硬化されたエラストマー層が、第2の硬化されたエラストマー層の上に置かれる。中央の薄いエラストマー層が再び硬化されて、モノリシックエラストマー構造の形成が生じる。
【0056】
犠牲層のカプセル化がエラストマー構造を製造するのに使用される場合、連続的なエラストマー層の結合が、以前に硬化されたエラストマー層およびその上にパターン化された任意の犠牲材料の上に、硬化されていないエラストマーを流すことによって達成され得る。エラストマー層の間の結合は、相互浸透および硬化されたエラストマー層のポリマー鎖と硬化されていないエラストマー層のポリマー鎖の反応によって起こる。エラストマー層のその後の硬化は、エラストマー層の間の結合を作り、モノリシックエラストマー構造を作製する。
【0057】
図1〜7Bの第1の方法を参照すると、第1のエラストマー層20は、30秒間、2000rpmで微小製造型12でRTV混合物をスピンコーティングすることによって作製され得、約40ミクロンの厚さを生じる。第2のエラストマー層22は、微小製造型11でRTV混合物をスピンコーティングすることによって作製され得る。層20および22の両方は、約80℃で1.5時間別々に焼かれ得または硬化され得る。第2のエラストマー層22は、第1のエラストマー層20の上に約80℃で約1.5時間結合され得る。
【0058】
微小機械加工型10および12は、シリコンウェハーにパターン化されたフォトレジストであり得る。典型的な局面において、Shipley SJR5740フォトレジストが、2000rpmでスピンされ、マスクとして高解像透明度フィルムを用いてパターン化され、次いで高さ約10ミクロンの逆のチャネルを生じさせた。約200℃で約30分間焼かれた場合、フォトレジストは逆流し、逆のチャネルは丸くなる。好ましい局面において、シリコーンゴムの接着を防ぐために各々使用する前に、型は約1分間トリメチルクロロシラン(TMCS)蒸気で処理され得る。
【0059】
(4.適切なエラストマー物質)
Allcockら、Contemporary Polymer Chemistry第2版は、ガラス転移温度と液化温度との間の温度で存在するポリマーとして一般のエラストマーについて記載している。ポリマー鎖は容易にねじれ運動を受けて、力に応じて主鎖を伸ばすことを可能にし、力を欠く場合、先の形状をとるように骨格を再び巻くので、エラストマー物質は弾力性を示す。一般に、エラストマーは力が適用された場合変形するが、次いで力が離れた場合それらの原形に戻る。エラストマー物質によって示された弾力性は、ヤング率によって特徴づけられ得る。約1Pa〜1TPaの間、さらに好ましくは約10Pa〜100GPaの間、さらに好ましくは約20Pa〜1GPaの間、さらに好ましくは約50Pa〜10MPaの間、およびさらに好ましくは約100Pa〜1MPaの間のヤング率を有するエラストマー物質は、本発明に基づいて有益であるが、これらの範囲外のヤング率を有するエラストマー物質もまた、特定用途の必要次第で利用され得る。
【0060】
本発明のシステムは、広範囲のエラストマーから製造され得る。典型的な局面において、エラストマー層は、好ましくはシリコーンゴムから製造され得る。しかしながら、他の適切なエラストマーもまた使用され得る。
【0061】
本発明の典型的な局面において、本システムはGE RTV615(製剤)、ビニル−シラン架橋(タイプ)シリコーンエラストマー(系)のようなエラストマーポリマーから製造される。しかしながら、本システムはこの1つの製剤、タイプまたはこのポリマーの系に限られてなく;むしろ、ほとんど任意のエラストマーポリマーが適切である。本微小バルブ製造の好ましい方法のための重要な条件は、エラストマーの複数の層を共に結合できることである。多層ソフトリソグラフィの場合において、エラストマーの層は、別々に硬化され、次いで共に結合される。この計画は、硬化された層が共に結合するのに十分な反応性を保有していることを必要とする。層は同じタイプであり得てそれら自体で結合できるか、またはそれらが2つの異なるタイプであり得て互いに結合できるかのいずれかであり得る。他の可能性としては、層の間の接着剤の使用および熱硬化性のエラストマーの使用が挙げられる。
【0062】
ポリマーの化学的性質、前駆体、合成方法、反応条件、および可能な添加剤の途方もなく多い多様性を考えると、モノリシックエラストマー微小バルブおよびポンプを作製するために使用され得る膨大な数の可能なエラストマーシステムがある。使用された物質の変化は、ほとんど特定の物質特性、すなわち、耐溶剤性、堅さ、ガス透過性または温度安定性の必要によって制御される。
【0063】
エラストマーポリマーの型は、とてもたくさんある。エラストマーの最も普通の分類の簡単な説明は、本明細書中に示されており、比較的に「標準」ポリマーでさえ、結合について多くの可能性が存在することを示す意図がある。普通のエラストマーポリマーとしては、ポリイソプレン、ポリブタジレン、ポリクロロプレン、ポリイソブチレン、ポリ(スチレン−ブタジエン−スチレン)、ポリウレタン、およびシリコーンが挙げられる。
【0064】
ポリイソプレン、ポリブタジエン、ポリクロロプレン:
ポリイソプレン、ポリブタジエン、およびポリクロロプレンは全て、ジエンモノマーから重合されて、その結果として重合された場合モノマーにつき1つの二重結合を有する。この二重結合は、ポリマーが加硫によってエラストマーに変換されることを可能にする(本質的に、硫黄は熱によって二重結合の間の架橋を形成するように使用される)。このことは、層の不完全な加硫によって同質の多層ソフトリソグラフィーが容易に結合することを可能にする;フォトレジストカプセル化は、同様の機構によって可能である。
【0065】
ポリイソブチレン:
純粋なポリイソブチレンは二重結合を持たないが、重合に少量(約1%)のイソプレンを含むことによってエラストマーとして使用されるように架橋される。イソプレンモノマーは、ポリイソブチレン骨格でペンダント二重結合を与え、次いで上記のように加硫され得る。
【0066】
ポリ(スチレン−ブタジエン−スチレン):
ポリ(スチレン−ブタジエン−スチレン)はリビングアニオン重合によって生産され(すなわち、反応において自然な連鎖停止段階がない)、「生きた(live)」ポリマーの末端が、硬化されたポリマーの中に存在できる。このことは、本フォトレジストカプセル化システムに対する自然な候補にさせる(硬化された層の上に注がれた液体層の中にたくさんの反応を起こしていないモノマーがある場合)。不完全な硬化は、同質の多層ソフトリソグラフィー(A−A結合)を可能にする。化学的性質もまた、余分なブタジエン(「A」)およびカップリング剤を有する1つの層ならびにブタジエンの無い他の層(「B」)を作ることを容易にする(異質の多層ソフトリソグラフィーにおいて)。SBSは「熱硬化性のエラストマー」であり、これは特定の温度より上で溶けて可塑性(弾性に反対するような)になることを意味する;温度を下げていくと再びエラストマーが生じる。このように、層は熱によって共に結合され得る。
【0067】
ポリウレタン:
ポリウレタンは、ジ−イソシアネート(A−A)およびジ−アルコールまたはジ−アミン(B−B)から生成される;ジ−イソシアネートおよびジ−アルコール/アミンの多数の多様性があるので、ポリウレタンの異なるタイプの数は莫大である。ポリマーA対Bの性質は、しかしながら、それらをちょうどRTV615のように異質な多層ソフトリソグラフィにとって有効にさせる:1つの層の中の過剰のA−Aおよび他の層の中の過剰のB−Bを使用することによる。
【0068】
シリコーン:
シリコーンポリマーは、おそらく最大の構造多様性を有し、商業的に利用できる製剤の最大数をほとんど確実に有する。RTV615のビニルと(Si−H)の架橋(異質の多層ソフトリソグラフィおよびフォトレジストカプセル化の両方を可能にする)は、すでに述べられているが、これはシリコーンポリマー化学で使用される数個の架橋方法のうちの単なる1つである。
【0069】
(5.デバイスの操作)
図7Bおよび7Hは共に、第2流動チャネルを加圧することによる第1流動チャネルの閉鎖を示し、図7B(図7Aに相当する流動チャネル32を通して切り取った正面断面図)で、開いた第1流動チャネル30を示し;図7Hで、第2流動チャネル32の加圧によって閉じられた第1流動チャネル30を示す。
【0070】
図7Bを参照すると、第1流動チャネル30および第2流動チャネル32が示される。膜25が流動チャネルを分けて、第1流動チャネル30の頂部および第2流動チャネル32の底を形成する。見られ得るように、流動チャネル30は「開放」である。
【0071】
図7Hに見られ得るように、流動チャネル32の加圧(その中に導入された気体または液体のいずれかによる)は膜25を下方へ偏向させることを引き起こし、それによって流動チャネル30を通過している流動Fをつまんで遮断する。その結果、チャネル32の圧力を変化させることによって、直線的に作動できるバルビングシステムが提供されるので、所望のように膜25を動かすことによって流動チャネル30は開かれ得、または閉じられ得る。(図示の目的だけのために、図7Gのチャネル30は「完全に閉じられた」位置というよりむしろ、「ほとんど閉じられた」位置で示される。)
そのようなバルブはチャネルの屋根を動かすことによってそれら自身(すなわち:膜25を動かすこと)が作動されるので、この技術によって製造されたバルブおよびポンプは正確にゼロデッドボリュームを有し、この技術によって作られた切り換えバルブはおよそバルブのアクティブボリュームと同等のデッドボリュームを有する、例えば、約100×100×10μm=100pLである。膜を動かすことによって消滅されたそのようなデッドボリュームおよびエリアは、既知の従来の微小バルブよりもおよそ2桁小さい。より小さいおよびより大きいバルブならびに切り換えバルブは本発明に考慮されており、デッドボリュームの範囲の包括的なリストは、1aLから1μL、100aLから100nL、1fLから10nL、100fLから1nL、および1pLから100pLを含む。
【0072】
本発明に基づいたポンプおよびバルブによって送達され得る極めて小さいボリュームは、十分な利点を表す。特に、手動で測定され得る流体の最も小さい既知のボリュームは約0.1μlである。自動化されたシステムによって測定され得る最も小さい既知のボリュームは、約10倍大きい(1μl)。本発明に基づいたポンプおよびバルブを利用することによって、10nl以下の液体のボリュームが慣用的に測定および分配され得る。本発明によって可能にされた流体の極めて小さいボリュームの正確な測定は、診断テストおよびアッセイを含む、多数の生物学的な適用に極めて有益である。
【0073】
式1は極めて単純化した、付与される圧力による長方形、直線、弾性、一様な厚さの等方性プレートの偏向の数学モデルを表す:
(1) w=(BPb4)/(Eh3)、ここで:
w=プレートの偏向;
B=形状係数(長さ対幅およびプレートの端の支持体に依存している);
P=付与される圧力;
b=プレート幅
E=ヤング率;および
h=プレート厚さ
このようにこの極めて単純化した式においてでさえ、圧力に応答するエラストマー膜の偏向は:膜の長さ、幅、および厚さ、膜の可撓性(ヤング率)、ならびに付与された作動力によって変化する。これらのパラメータの各々は、本発明に従う特定のエラストマーデバイスの実寸法および物理組成に依存して広く変わるので、膜厚さおよび弾性、チャネル幅、ならびに作動力の広い範囲は、本発明によって考慮されている。
【0074】
提示されたばかりの式は単なる近似であることは理解されるべきである。なぜなら、一般に膜は一様な厚さを有さず、膜の厚さは長さおよび幅と比較して必ずしも小さくなく、偏向は長さ、幅、または膜の厚さと比較して必ずしも小さくないからである。それにもかかわらず、この式は、付与された力に対する偏向の所望の応答を達成するように可変のパラメータを調整する有益な指針として役立つ。
【0075】
図8Aおよび8Bは、100μm幅の第1流動チャネル30および50μm幅の第2流動チャネル32の付与された圧力に対するバルブ開度を示す。このデバイスの膜は約30μmの厚さおよび約750kPaのヤング率を有するGeneral Electric
Silicones RTV615の層によって形成された。図21aおよび21bは、バルブの開いている範囲が、付与された圧力のほとんどの範囲にわたって実質的に直線的であることを示す。
【0076】
0.025インチの外径および0.013インチの内径を有する25mmのステンレススチールの皮下チュービング片とつながった0.025インチの外径を有する10cmの長さのプラスティックチュービング片を通して空気圧がデバイスの膜を作動させるのに付与された。このチュービングは、制御チャネルに対して垂直な方向でエラストマーブロックの中に挿入することによって制御チャネルと接触させて置かれた。空気圧がLee Coによって製造された外部のLHDA微小ソレノイドバルブから皮下チュービングに付与された。
【0077】
デバイスを通しての物質の流動の制御は、付与されたガス圧力を利用することと今までに記載されているが、他の流体が使用され得る。
【0078】
例えば、空気は圧縮性であり、従って、外部のソレノイドバルブによる圧力の付与の時間と、この圧力が膜によって受けられる時間との間のいくらかの限られた遅れを受ける。本発明の代替の実施形態において、圧力が水または液圧オイルのような非圧縮性の流体に外部源から付与され得、その結果として付与された圧力をほとんど瞬間に膜に移す。しかし、バルブの置き換えたボリュームが大きくまたは制御チャネルが狭い場合、制御流体のより高い粘性が作動を遅らせることに寄与し得る。したがって、圧力を移すための最良の媒体は、特定の用途およびデバイス構造に依存し、ガスおよび液体の両方の媒体は本発明によって考慮されている。
【0079】
上記したような外部の付与された圧力は、圧力調節装置を通してポンプ/タンクシステムおよび外部の微小バルブによって付与されているが、他の外部の圧力を付与する方法もまた、本発明において考慮されており、ガスタンク、コンプレッサー、ピストンシステム、および液体カラムを含む。血圧、胃圧、脳脊髄液に存在する圧力、眼内空間に存在する圧力および標準的な屈曲中に筋肉によって与えられる圧力のような生きている生物体内に見出され得るような天然に存在する圧力源の使用もまた考慮されている。微小バルブ、ポンプ、巨視的な蠕動ポンプ、ピンチバルブ、および当該分野において公知のような流体調節装備の他のタイプのような外部の圧力を調節する他の方法もまた考慮されている。
【0080】
見られ得るように、本発明の実施形態に従ったバルブの応答が、最小のヒステリシスを伴って、伝わる範囲の大部分にわたってほとんど完全に直線的であることは、実験的に示されている。従って、本バルブは微小流体測定および流体制御にとって理想的に適している。バルブ応答の直線性は、個々のバルブがフックの法則に従うばねとしてよくモデル化されることを実証する。さらに、流動チャネルの高い圧力(すなわち、背圧)は作動圧力を増大することによって簡単に対抗され得る。実験的に、本発明は70kPaの背圧でバルブ閉鎖を達成しているが、より高い圧力もまた考慮されている。本発明によって包含された圧力範囲の包括的なリストは次の通りである:10Pa〜25MPa;100Pa〜10Mpa、1kPa〜1MPa、1kPa〜300kPa、5kPa〜200kPa、および15kPa〜100kPa。
【0081】
バルブおよびポンプは、開閉に直線的な作動を必要としないが、直線的な応答は、バルブが測定デバイスとしてより容易に使用されることを可能にする。本発明の1つの実施形態において、バルブの開口は、既知の閉鎖程度に部分的に作動されることによって、流量を制御することに使用される。直線的なバルブ作動は、バルブを所望の程度の閉鎖に閉じるために要とされる作動力の量を決定することをより容易にする。直線的な作動の別の利点は、バルブ作動のために必要とされる力が、流動チャネルの圧力から容易に決定され得ることである。作動が直線的である場合、流動チャネルの増加した圧力は、バルブの作動された部分に同じ圧力(単位面積当たりの力)を加えることによって、対抗され得る。
【0082】
バルブの直線性は、構造、組成、およびバルブ構造の作動の方法に依存している。さらに、直線性が、バルブにおいて所望の特性であるかどうかは、適用に依存している。従って、直線的および非直線的の作動可能なバルブの両方は、本発明において考慮されており、バルブが直線的に作動可能である圧力の範囲は、特定の実施形態で変わる。
【0083】
図9は、上記したような空気バルブにチップから結合した10cmの長さの空気チュービングを備える100μm×100μm×10μmのRTV微小バルブの時間応答(すなわち:付与された圧力の変化に応答する時間の関数としてのバルブの閉鎖)を図示する。
【0084】
デジタル制御シグナルの2つの周期、チュービングおよびバルブ開度の末端での実際の空気圧力が、図9に示される。制御ラインに付与された圧力は、100kPaであり、バルブを閉鎖するのに必要とされる約40kPaよりかなり高い。従って、閉鎖する場合、バルブは必要とされるよりも60kPa大きい圧力で押されて閉められる。しかし、開ける場合、バルブはその特有のばねの力(40kPa以下)によってのみ、その静止位置に戻る。従って、τ閉鎖はτ開口より小さいと予想される。制御シグナルと制御圧力応答との間にまた、ずれがあり、圧力を制御するのに使用される小型のバルブの限界によるものである。このようなずれをtと呼び、そして1/e時間定数をτと呼ぶと、これらの値は:t開口=3.63ms、τ開口=1.88ms、t閉鎖=2.15ms、τ閉鎖=0.51msである。3τの各々が、開口および閉鎖を可能にされる場合、水溶液で満たされると、バルブは75Hzで十分に作動する。
【0085】
開口および閉鎖のずれを受けない別の作動方法を使用する場合、このバルブは、約375Hzで作動する。ばね定数は、膜の厚さを変えることによって調整され得ることにもまた注目のこと;これは、速い開口および速い閉鎖のいずれかの最適化を可能にする。ばね定数はまた、膜の弾性(ヤング率)を変えることによって調整され得、膜の中に添加物を取り入れることによって、または異なるエラストマー物質を利用することによって、膜としての役目を果たすことが可能であるのと同様である(図7C〜7Hに関連して上記した)。
【0086】
図9に図示したように、バルブ特性を実験的に測定する場合、バルブ開口は蛍光によって測定された。これらの実験において、流動チャネルは、緩衝液(pH8以上)中のフルオレセインイソチオシアネート(FITC)溶液で満たされ、チャネルの中央から3分の1を占める正方形の範囲の蛍光が、10kHzバンド幅の光電子増倍管を備えるエピ蛍光顕微鏡上で観測された。圧力は、ほとんど同一の気体連結を通して制御ラインと同時に加圧されたホイートストンブリッジ圧力センサー(SenSym SCC15GD2)で観測された。
【0087】
(6.流動チャネル横断面)
本発明の流動チャネルは、異なる横断面のサイズおよび形状で必要に応じて設計され得、それらの所望の適用に依存して、異なる利点を提供する。例えば、下方の流動チャネルの横断面の形状は、湾曲した上面(全長に沿った、または上方の交差チャネルの下に配置された範囲のいずれか)を有し得る。そのような湾曲した上面は、以下のように、バルブの密閉を促進する。
【0088】
図10を参照すると、流動チャネル30および32を通る横断面図(図7Bのそれと同様である)が示される。見られ得るように、流動チャネル30は、横断面の形状において長方形である。本発明の代替の好ましい局面において、図10に示されるように、流動チャネル30の横断面は、代わりに上方の湾曲した面を有する。
【0089】
最初に図10を参照すると、流動チャネル32が加圧される場合、流動チャネル30と32を分けるエラストマーブロック24の膜部分25は、点線25A、25B、25C、25Dおよび25Eによって示された連続した位置に下方へ動く。見られ得るように、不完全な密閉は、おそらく、平面基板14に隣接した流動チャネル30の先端に起こり得る。
【0090】
図11の代替の好ましい実施形態において、流動チャネル30aは、湾曲した上方の壁25Aを有する。流動チャネル32が加圧される場合、膜部分25は、点線25A2、25A3、25A4および25A5によって示された連続した位置に下方へ動き、膜の先端部分は最初、流動チャネルの中に、続いて頂部の膜部分に移動する。膜25Aでそのような湾曲した上面を有することの利点は、流動チャネル32が加圧される場合、より完全なシールが提供されることである。特に、流動チャネル30の上方の壁は、平面基板14に対して連続的に接触する先端を提供し、それによって、図10の壁25と流動チャネル30の底との間に見られる接触の「島」を避ける。
【0091】
膜25Aで湾曲した上方の流動チャネル表面を有することの別の利点は、作動に応答する流動チャネルの形状およびボリュームに、この膜がより容易に適合し得ることである。特に、長方形の流動チャネルが使用される場合、全周(2×(流動チャネル高さ+流動チャネル幅))は、流動チャネルの中に強制的に入れられなければならない。しかし、アーチ形の流動チャネルが使用される場合、より小さい周囲の長さの物質(半円のアーチ形部分のみ)が、チャネルの中に強制的に入れられなければならない。この方法において、膜は作動のための周囲の長さにおいてより小さい変化を必要とし、それによって、流動チャネルをブロックするために付与された作動力に、より応答する。
【0092】
代替の局面(図示されていない)において、流動チャネル30の底は、丸くなっているので、その湾曲した表面は、上記した図20に見られるように湾曲した上方の壁25Aと嵌合する。
【0093】
要約すると、作動に対する膜が受ける実際の構造の変化は、特定のエラストマー構造の構成に依存する。特に、構造の変化は、膜の長さ、幅、および厚さの特徴、構造の残部に対する結合、ならびに流動および制御チャネルの高さ、幅、および形状、ならびに使用されるエラストマーの材料特性に依存する。構造の変化はまた、作動の方法に依存し得る。なぜなら付与された圧力に応答する膜の作動は、磁力または静電気力に応答する作動からいくらか変化するからである。
【0094】
さらに、膜の所望の構造の変化はまた、エラストマー構造の特定の適用に依存して変化する。上記した最も簡単な実施形態において、バルブは開口または閉鎖のいずれかであり得、バルブの閉鎖の度合いを制御することを測定する。しかし、別の実施形態において、より複雑な流動調節を達成するために、膜および/または流動チャネルの形状を変えることが望ましくあり得る。例えば、流動チャネルは、膜部分の下の一段高い突出部を提供され得るので、作動に際して膜は、流動チャネルを通る流動の1部分のみを止め、流動の部分がブロックされるこの部分は、付与された作動力に非感受性である。
【0095】
多くの膜の厚さの特徴および流動チャネル横断面は、本発明によって考慮されており、長方形、台形、円形、長円形、放物線、双曲線および多角形、ならびに上記の形状の部分が挙げられる。すぐ上に議論した突出部を備える実施形態または流動チャネルの凹面を有する実施形態のような、より複雑な横断面の形状もまた、本発明によって考慮されている。
加えて、本発明は、流動チャネルの壁および天井はエラストマーから形成され、チャネルの床は下にある基板から形成される実施形態と併せて最初に上記しているが、本発明はこの特定の方向に限定されていない。チャネルの壁および床はまた、下にある基板に形成され得、流動チャネルの天井だけがエラストマーから構成される。このエラストマー流動チャネルの天井は、付与された作動力に応答してチャネルの中の下方へ突出し、それによって、流動チャネルを通る物質の流動を制御している。一般に、本願における別のところで記載したように、モノリシック構造は、微小流体適用にとって好ましい。しかし、基板で形成されるチャネルを使用することはこの配置が利点を与える場合に有益であり得る。例えば、導光板を含む基板が構成され得るので、導光板は微小流体チャネルの側面に特に光を方向付ける。
【0096】
(7.ネットワークシステム)
図12Aおよび12Bは、1つのオン/オフバルブの図を示し、上記で説明した(例えば、図7A)システムと同一である。図13Aおよび13Bは、図12に見られるが、共にネットワーク化されているような1つのアドレス可能なオン/オフバルブ複数から構成された蠕動ポンピングシステムを示す。図14は、図13の蠕動ポンピングシステムの回転数に対して実験的に達成されたポンピング速度を示すグラフである。図15Aおよび15Bは、1つの制御ラインによって制御可能である複数の流動チャネルの概略図を示す。このシステムはまた、ともに多重化されるが、図12のそれとは異なる配置である、図12の1つのアドレス可能なオン/オフバルブ複数から構成される。図16は、選択されたチャネルを通して流体流動を可能にするのに適用された多重化システムの概略図であり、ともに結合またはネットワーク化された、図12の1つのオン/オフバルブ複数から構成される。
【0097】
図12Aおよび12Bを最初に参照すると、流動チャネル30および32の概要が示される。流動チャネル30は、好ましくは、そこを通る流体(またはガス)流動Fを有する。流動チャネル32(すでに本明細書中に説明されたように、流動チャネル30の上に交差する)は、圧力が付与されるので、流動チャネルを分けている膜25は流動チャネル30の通路の中に押し下げられて、説明されたように、そこを通る流動Fの通路を遮断し得る。従って、「流動チャネル」32はまた、流動チャネル30の1つのバルブを作動させる「制御ライン」と称され得る。図12〜15において、複数のそのようなアドレス可能なバルブは、ポンプを作成するために多様な配置において共に結合またはネットワーク化され、蠕動ポンピングおよび他の流体論理の適用を可能にする。
【0098】
図13Aおよび13Bを参照すると、以下の通りに、蠕動ポンピングのためのシステムが提供される。流動チャネル30は、その上を通る複数のほぼ平行な流動チャネル(すなわち:制御ライン)32A、32Bおよび32Cを有する。制御ライン32Aに圧力が付与されることによって、流動チャネル30を通る流動Fは、制御ライン32Aおよび流動チャネル30の交差点の膜25Aの下で、遮断される。同様に、(しかし示されていない)制御ライン32Bに圧力を付与することによって、流動チャネル30を通る流動Fは、制御ライン32Bおよび流動チャネル30の交差点の膜25Bの下で、遮断される、などである。
【0099】
制御ライン32A、32Bおよび32Cの各々は、別々にアドレス可能である。従って、蠕動は、32Aおよび32Cを一緒に作動させ、次に32Aを作動させ、次に32Aおよび32Bを一緒に作動させ、次に32Bを作動させ、次に32BおよびCを一緒に作動させるなど、のパターンによって作動され得る。これは、一連の「101、100、110、010、011、001」パターンと一致し、ここで、「0」は「バルブ開口」を示し、「1」は「バルブ閉鎖」を示す。この蠕動パターンはまた、120°パターン(3つのバルブの間の作動の位相角について言及している)として公知である。他の蠕動パターンは、同様に可能であり、60°および90°パターンを含む。
【0100】
本発明者らによって行われた実験において、2.35nL/sのポンピング速度が、細い(すなわち内径0.5mm)チュービング(40kPaの作動圧力の下で100×100×10μmバルブを備える)中で水のカラムが移動した距離を測定することによって、測定された。ポンピング速度は、作動回転数とともに約75Hzまで増加し、次いで200Hzを超えるまでほとんど変わらなかった。バルブおよびポンプはまた、相当に耐久性があり、エラストマー膜、制御チャネルまたは結合は、決して衰えることは見られなかった。本発明者らによって行われた実験において、本明細書中に記載された蠕動ポンプのバルブのどれも、400万回を超える作動後に、水または疲労のいかなる徴候も示さない。それらの耐久性に加えて、それらはまた、穏やかである。チャネルを通してポンプされ、および生存度をテストされたE.Coliの溶液は、94%の生存率を示した。
【0101】
図14は、図13の蠕動ポンピングシステムの回転数に対して、実験的に達成されたポンピング率を示すグラフである。
【0102】
図15Aおよび15Bは、複数の図12のアドレス可能なバルブを組み立てる別の方法を図示する。特に、複数の平行流動チャネル30A、30B、および30Cが提供される。流動チャネル(すなわち:制御ライン)32は、流動チャネル30A、30Bおよび30Cの上を横断する。制御ライン32の加圧は、制御ライン32と、流動チャネル30A、30B、および30Cとの交差点に置かれた膜25A、25Bおよび25Cを押し下げることによって、流動F1、F2およびF3を同時に遮断する。
【0103】
図16は、以下の通りに、流体を選択されたチャネルを通して流動させることを、選択的に可能にするために適応された多重化システムの概略図である。それらの上を通る制御ラインからそれぞれの流動チャネルを分けている膜(例えば、図15Aおよび15Bの膜25A、25Bおよび25C)の下方への湾曲は、膜の寸法に強く依存する。従って、図15Aおよび15Bの流動チャネル制御ライン32の幅を変えることによって、複数の流動チャネルの上を通る制御ラインを有することは可能であるが、作動のみ(すなわち:シール)が流動に要求される。図16は、以下の通りの、そのようなシステムの概略図である。
【0104】
複数の平行流動チャネル30A、30B、30C、30C、30D、30Eおよび30Fは、複数の平行制御ライン32A、32B、32C、32D、32Eおよび32Fの下に配置される。制御チャネル32A、32B、32C、32D、32Eおよび32Fは、次のような改変を伴って、上記した任意のバルブシステムを使用する平行流動チャネル30A、30B、30C、30D、30Eおよび30Fを通る流体流動F1、F2、F3、F4、F5およびF6を遮断するように適合される。
【0105】
制御ライン32A、32B、32C、32D、32Eおよび32Fの各々は、広い部分および狭い部分の両方を有する。例えば、制御ライン32Aは、流動チャネル30A、30Cおよび30Eの上に配置された位置において広い。同様に、制御ライン32Bは、流動チャネル30B、30D、および30Fの上に配置された位置において広く、制御ライン32Cは、流動チャネル30A、30B、30Eおよび30Fの上に配置された位置において広い。
【0106】
それぞれの制御ラインが広い位置で、その加圧は、流動チャネルと制御ラインを分けている膜(25)を流動チャネルの中に顕著に押し下げさせ、それによって、そこを通る流動通路をブロックする。逆に、それぞれの制御ラインが狭い位置において、膜(25)もまた狭い。従って、加圧の同じ度合いが、流動チャネル(30)の中に膜(25)を押し下げる結果にはならない。従って、それらの下の流体通路は、ブロックされない。
【0107】
例えば、制御ライン32Aが加圧される場合、流動チャネル30A、30Cおよび30Eの流動F1、F3およびF5をブロックする。同様に、制御ライン32Cが加圧される場合、流動チャネル30A、30B、30Eおよび30Fの流動F1、F2、F5およびF6をブロックする。評価され得るように、1つより多くの制御ラインが、同時に作動され得る。例えば、制御ライン32Aおよび32Cは、F4を除く全ての流体流動をブロックするために同時に加圧され得る(32AはF1、F3およびF5をブロックし;そして32CはF1、F2、F5およびF6をブロックする)。
【0108】
両方一緒におよび様々な順番で、異なる制御ライン(32)を選択的に加圧することによって、流体流動制御の大きな度合いが達成され得る。さらに、6より多い並行流動チャネル(30)および4より多い並行流動チャネル(32)に本システムを拡張することによって、ならびに制御ラインの広い範囲および狭い範囲の配置を変えることによって、非常に複雑な流体流動制御システムが、製造され得る。そのようなシステムの特性は、2(log2n)個の制御ラインだけを備えるn個の流動チャネルの中から任意の1つの流動チャネルを作動させることを可能にする。
【0109】
(8.切り換え可能な流動アレイ)
さらに別の新規な実施形態において、流体通路は、2つの垂直な方向のいずれかの流動に選択的に方向づけされ得る。「切り換え可能な流動アレイ」システムのような例が、図17A〜図17Dに提供されている。図17Aは、エラストマー90の第1の層(または任意の他の適切な基板)の下面図を示し、エラストマー90は、固体柱92のアレイによって規定された流動チャネル格子を形成する溝のパターンを有する滑走面を有し、各固体柱は、その周りを通過する流動チャネルを有する。
【0110】
好ましい局面において、エラストマーのさらなる層は、層90の上面に結合され、その結果、流体流動が方向F1または垂直な方向F2のいずれかで移動するように選択的に方向づけされ得る。図17Bは、エラストマー95の第2層の滑走面の下面図であり、「垂直」制御ライン96および「水平」制御ライン94を交互した形状で形成される溝を示す。「垂直」制御ライン96は、そこに沿った同じ幅を有するのに対して、「水平」制御ライン94は、示されるように、交互した広い部分および狭い部分を有する。
【0111】
エラストマー層95は、エラストマー層90の上に置かれ、その結果、「垂直」制御ライン96は、図17Cに示されるように柱92の上に置かれ、「水平」制御ライン94は、図17Dに示されるように、柱92の間のそれらの広い部分に置かれる。
【0112】
図17Cに見られ得るように、「垂直」制御ライン96が加圧された場合、初めに領域98の層90と95との間に置かれたエラストマー層によって形成された一体化構造の膜は、流動チャネルのアレイを越えて下方へ偏向され、その結果、示されるように、流動方向F2(すなわち:垂直)にのみ通り得るように流入する。
【0113】
図17Dに見られ得るように、「水平」制御ライン94が加圧された場合、初めに領域99の層90と95との間に置かれたエラストマー層によって形成された一体化構造の膜は、流動チャネルのアレイを越えて下方へ(しかし、最も幅の広い領域においてのみ)偏向され、その結果、示されるように、流動方向F1(すなわち:水平)にだけ通ることができるように流入する。
【0114】
図17A〜Dで例示される設計は、切り換え可能な流動アレイが、2つのエラストマー層だけから構築され、異なるエラストマー層が必要とされる制御ラインの間を通る垂直な経由を有さないことを可能にする。すべての垂直な流動制御ライン94が連結される場合、それらは1つの入力から加圧され得る。同じことが、すべての水平な流動制御ライン96にとって当てはまる。
【0115】
(9.細胞囲い)
本発明のなおさらなる適用において、エラストマー構造は、生物体または他の生物学的物質を操作することに利用され得る。図18A〜18Dは、本発明に従う細胞囲い構造の1つの実施形態の平面図を示す。
【0116】
細胞囲いアレイ4400は、直交に方向づけられた流動チャネル4402のアレイで、交互に並んだ流動チャネルの交点に、増大した「囲い」構造4404を有する特徴をもつ。バルブ4406は、各囲い構造4404の入り口および出口に配置される。蠕動ポンプ構造4408は、細胞囲い構造を欠いている各水平流動チャネルおよび垂直流動チャネルに配置される。
【0117】
図18Aの細胞囲いアレイ4400は、以前に分別されている細胞A〜Hがロードされている。図18B〜18Cは、1)隣接した囲い4404aおよび4404bのいずれかの側のバルブ4406を開ける工程、2)水平流動チャネル4402aをポンピングして、細胞CおよびGを移動させる工程、次いで3)垂直流動チャネル4402bをポンピングして細胞Cを除去する工程、によって個々に分別された細胞Cの接近および除去を示す。図18Dは、第2の細胞Gが、水平流動チャネル4402aを通して液体流動の方向を逆にすることによって細胞囲いアレイ4400の前の位置の中に戻されることを示す。上述の細胞囲いアレイ4404は、選択された範囲内(すぐにアクセス可能なアドレス可能な位置)で、物質を分別可能である。
【0118】
図18A〜18Dに関連して上記かつ上述の実施形態は、流動チャネル交点の反対側の連結バルブ対を利用するが、これは本発明によって必須ではない。交点の隣接したバルブの連結、または交点を囲む各バルブの独立の作動を含む他の構造は、所望の流動特徴を供給することを可能にする。しかし、独立バルブ作動アプローチにより、別々の制御構造が各バルブのために利用されると、デバイスレイアウトが複雑になることは、理解されるべきである。
【0119】
(10.細胞ケージ)
上記の細胞囲いアレイ4404は、選択された範囲内(すぐにアクセスするためのアドレス可能な位置)で、物質を蓄え得る。しかし、細胞のような生きている生物体は、生き残るために持続的な食物の摂取および水の排出を必要とし得る。したがって、図19Aおよび19Bは、それぞれに、本発明に従う細胞ケージ構造の1つの実施形態の(ライン45B−45B’に沿った)平面および横断面図を示す。
【0120】
細胞ケージ4500は、基板4505と接触しているエラストマーブロック4503の中の流動チャネル4501の拡張部分4500aとして形成される。細胞ケージ4500は、細胞ケージ4500の末端4500bおよび4500cが領域4500aの内部を完全に囲まないことを除いて、図18A〜18Dに上記した個々の細胞囲いに類似している。むしろ、ケージ4500の末端4500aおよび4500bは、多数の伸縮自在の支柱4502によって形成される。
【0121】
具体的には、制御チャネル4504は、支柱4502の上におかれる。制御チャネル4504の圧力が減少された場合、エラストマー支柱4502は上方へ引き出されて制御チャネル4504の中に入り、それによって細胞ケージ4500の終点4500bを開いて細胞を中に入れることを可能にする。制御チャネル4504における圧力の上昇に際し、支柱4502は下方へ緩み、基板4505に当たって、細胞がケージ4500から出ていくことを防ぐ。
【0122】
エラストマー支柱4502は、十分な大きさおよび数で、ケージ4500の外へ細胞が移動することを防ぐが、その中に蓄えられた細胞を維持するために栄養のケージ内部4500aの中への流動を可能にする隙間4508もまた備える。末端4500cに対向する支柱4502は、同様に、所望されるように上記ケージを開いて細胞を除去することを可能にする第2制御チャネル4506の下に構成される。
【0123】
(11.交差チャネルインジェクター)
図18A〜18Dに示された交差流動チャネル構造は、記載した細胞囲い以外の機能を果たすために使用され得る。例えば、交差流動チャネル構造は、混合する用途に利用され得る。
【0124】
このことは、本発明の別の実施形態に従う微小製造構造によって行われた混合工程の平面図である図20A〜Dに示される。具体的には、微小加工混合構造の部分7400は、第2流動チャネル7404と直交し、かつ交差している第1流動チャネル7402を備える。制御チャネル7406は、流動チャネル7402および7404の上にあり、各々交差点7412を取り囲むバルブ対7408a−bおよび7408c−dを形成する。
【0125】
図20Aに示されるように、バルブ対7408c−dは、バルブ対7408a−bが閉じる間に、最初に開かれて、流体サンプル7410は、流動チャネル7404を通して交差点7412に流入される。次いで、バルブ対7408a−bが作動され、交差点7412で流体サンプル7410を捕捉する。
【0126】
次に、図20Bに示されるように、バルブ対7408c−dが閉じられて7408a−bが開かれ、その結果、流体サンプル7410は、流体の交差流動を担う流動チャネル7402に交差点7412から注入される。図20A〜Bに示されたプロセスは、交差流動チャネル7402の下方へ、任意の数の流体サンプルを正確に分配するように繰り返され得る。
【0127】
図20A−Bに示されたプロセス−チャネル流動インジェクター構造の実施形態は、1つの接合点で交差するチャネルの特徴を有するが、これは本発明に必要ではない。従って、図20Cは、本発明に従うインジェクション構造の別の実施形態の単純化した平面図を示し、ここで、交差する流動チャネル7452の間の接合点7450は、拡張され、さらなる容積容量を提供する。図20Dは、本発明に従うインジェクション構造のさらに別の実施形態の単純化した平面図を示し、ここで、交差する流動チャネル7462の間の延長した接合点7460は、分岐7464を備え、より多くのインジェクション容積容量をさらに提供する。
【0128】
(12.回転式混合構造)
本発明の実施形態に従う微小流体制御チャネルおよび微小流体流動チャネルは、閉鎖回路流動チャネルを通して流体を循環させる回転ポンプデザインに方向づけられ得る。本明細書中に使用される用語「閉鎖回路」は、当該分野において周知であり、楕円および長円のような環状ならびにその変形、ならびに三角形、長方形またはさらに複雑な形状によって作られるような、角を有する流動回路経路である構造をいう意味を有する。
【0129】
図21に図示されるように、流動チャネル2100を有する層は、多数のサンプル入力の2102、混合T−接合点2104、中央循環ループ2106(すなわち、実質的に環状流動チャネル)、および出力チャネル2108を有する。流動チャネルを有する制御チャネルのオーバーレイは、微小バルブを形成し得る。この微小バルブは、制御チャネルと流動チャネルとが薄いエラストマー膜によって分けられるので、流動チャネルの中に湾曲し得るか、流動チャネルから後退し得る。
【0130】
実質的に環状の中央ループ、およびそれと交差する制御チャネルは、回転式ポンプの中央部分を形成する。実質的に環状の流動チャネルを通して溶液を流動させるポンプは、互いに隣接する少なくとも3つの制御チャネル2110a〜cのセットから成り、実質的に環状の分岐流動チャネル2106(すなわち、中央ループ)と交差する。
【0131】
001、011、010、110、100、101のような一連のオン/オフ作動順序が制御チャネルに適用される場合、中央ループの流体は、時計回りまたは反時計回りのいずれかの選択された方向に蠕動的にポンピングされ得る。蠕動ポンピング作動は、制御チャネルと流動チャネルとを分ける膜の、流動チャネルの中へまたは外への連続的な湾曲から起こる。
【0132】
一般に、作動回転数がより高くなると、流体は、中央ループを通ってより速く回転する。しかし、飽和点は、最終的に、より速い流体流動を生じない点に達する。これは、主に、膜が作動できない位置に戻り得る速度の限界に起図する。
【0133】
図21に示されるシステムは、3つの制御チャネルを備える各ポンプを示すが、異なった数の制御チャネルが利用され得る(例えば、複数の交差点を有する単一の曲がりくねった制御チャネルが使用され得る)。
【0134】
中央ループと流体連絡する多様な異なる補助的な流動チャネルは、サンプルおよび反応溶液を中央ループに導入しそして回収するために利用され得る。同様に、中央ループと流体連絡する1つ以上の出口流動チャネル、すなわち排出口流動チャネルが、中央ループから溶液を除去するために利用され得る。例えば、中央ループ内へまたは中央ループから外に溶液が流動することを防ぐために、制御バルブが、注入口および排出口で利用され得る。
【0135】
流動チャネルの寸法および形状は変わり得る。特定のデバイスで、チャネルの直径は約1mmから2cmまでの範囲に及ぶ傾向があるが、特定のデバイスにおいて、この直径はかなり大きくなり得る(例えば、4、6、8または10cm)。環状の流動チャネルの直径の最小の限界は、本来多層ソフトリソグラフィープロセスによって、定められた限界の関数であり得る。チャネル幅(流動または制御のいずれか)は、通常30μmと250μmとの間で変化する。しかし、いくらかのデバイスのチャネル幅は、1μmほどの狭さである。より広い幅のチャネルもまた利用され得るが、一般に流動チャネル内にある型の構造的支柱を必要とする。チャネルの高さは、一般に5μmと50μmとの間で変化する。100μm以下の幅を有する流動チャネルにおいて、チャネルの高さは1μm以下であり得る。流動チャネルは、概して円形で、一旦、膜がチャネルの中に湾曲すると、チャネルの完全な閉塞を可能にする。幾つかのデバイスにおいて、チャネルは、例えば八角形または六角形の形状を有する。特定のデバイスにおいて、流動チャネルは、円形で、かつ100μm幅で、かつ10μm高であり、そして制御チャネルは、100μm幅でかつ10μm高である。特定の研究で利用されている1つのシステムは、2cmの直径、100μmの流動チャネル幅および10μmの深さを有する中央ループを利用している。
【0136】
チャネルは、代表的に上記の寸法および形状を有するが、本明細書中に提供されるデバイスは、これらの特定の寸法および形状に制限されないことは、理解されるべきである。例えば、閉鎖回路流動チャネルに存在する分岐は、分散を制御し、従って、その中に流動された物質の混合に役立ち得る。
【0137】
(13.微小流体大規模一体化)
前節は、実質的に密封および拡張可能であるモノリシック微小バルブを記載し、これらの微小バルブを製造するための方法もまた記載している。前に記載した比較的単純な微小流体バルブの集合のために、各流体流動チャネルは、その特有の個々のバルブ制御チャネルによって制御され得る。しかし、そのような非一体化制御戦略は、個々にアドレス可能な何千または何万ものバルブを含む、より複雑な集合に対して実際的に実施され得ない。従って、技術の多様性が、単独でまたは組合わせて適用され、個々にアドレス可能なバルブを有する大規模一体化微小流体デバイスの製造を可能にし得る。
【0138】
本発明の実施形態に従う大規模一体化微小流体構造を実施するために有用な技術は、係属中の米国非仮特許出願第10/___,___号(代理人整理番号20174C−009410US)に詳細に記載されている。大規模一体化微小流体デバイスの製造を可能にする1つの技術は、マルチプレキサー構造の使用である。
【0139】
マルチプレキサー構造の使用は、流動チャネルの1つのセットの上にある制御ラインの1つのセットと関連して、前に記載されている。図22Aは、微小流体2分木マルチプレキサー動作線図(microfluidic binary tree multiplexor operational diagram)を例示する単純化した平面図を示す。下方のエラストマー層で規定された流動チャネル1900は、目的の流体を含み、一方では、上にあるエラストマー層で規定された制御チャネル1902は、空気または水のような作動流体を含む制御ラインを表す。バルブ1904は、流動チャネル1900を備える制御チャネル1902の幅広い部分1902aの交差点で形成された膜によって規定される。作動圧力は、ただ一つの広い膜が、流動チャネル1900の中に完全に湾曲するように選択される。特に、マルチプレキサー構造は、制御チャネル幅:流動チャネル幅の比が減少するようにバルブを作動するために必要とされる圧力の急な増加に基づく。
【0140】
図22Aに示されるマルチプレキサー構造は、各段階が流動チャネルの2つの全グループから1つを選ぶ場合、2分木のバルブの形態である。図22Aに示されるマルチプレキサー実施形態において、マルチプレキサーの開口/閉鎖バルブの各組合わせは、n流動チャネルが、2log2n制御チャネルのみでアドレスされ得るように単一のチャネルを選ぶ。
【0141】
多重化バルブシステムを使用することによって、2進法の累乗が、明らかになる:1024流動チャネルを特定にアドレスするために、約20の制御チャネルだけが、必要である。これは、多数のエラストマー微小バルブがこれらのデバイス内で複雑な流体操作を行うことを可能にし、一方、デバイスと外部環境との間の境界は、単純で強固である。
【0142】
図22Bは、本発明に従うマルチプレキサー構造の代替の実施形態の単純化した平面図を示す。マルチプレキサー構造1950は、エラストマー層の下にある流動チャネル1954の上にあるエラストマー層で形成された制御チャネル1952を備える。図22Aのマルチプレキサーの同じ物理的原理の下での作動により、マルチプレキサー1950は、バルブの3分木を備え、ここで各段は3ビット(「トリット(trit)」)を備え、流動チャネルの3つの全グループから1つを選ぶ。マルチプレキサー1950の開口/閉鎖バルブの各組合わせは、n流動はチャネルが3log3n制御チャネルのみでアドレスされ得るように、単一のチャネルを選ぶ。
【0143】
図22A〜Bに示される基礎のマルチプレキサーデバイスのいずれかの一般的な微小流動構造は、図22Cの単純化した横断面図で一般的に表され得、ここで制御チャネルネットワークCを規定する第2エラストマー層E2は、流動チャネルネットワークFを規定する第1エラストマー層E1の上にある。
【0144】
図22Bの低3マルチプレキサーは、多数の「流動」チャネルをアドレスするのに使用され得る最も効率の良い設計である。これは、eがlogの底として使用される場合、xlogxnバルブは最小化されるからである。分数は実際のマルチプレキサーの底に使用されないので、最も効率の良いマルチプレキサー構造は、x=3(e(約2.71828)に最も近い整数)のバルブの場合、達成される。
【0145】
この点を明らかにするために、表2は、底2マルチプレキサーと底3マルチプレキサーとの効率を比較する。
【0146】
【表2】

上記は、同じ底の数を有する段階を利用する種々のマルチプレキサー構造に対して焦点を合わせているが、これは本発明に必須ではない。本発明に従うマルチプレキサー構造の代替の実施形態は、異なる低の数の段から成る。例えば、1ビット段および1トリット段から成る2段マルチプレキサーは、アドレスする6流動チャネルの最も効率の良い進路を表す。階の位は任意であり、同じ数の制御されている流動ラインを生じる。異なる2進法および3進法の段から成るマルチプレキサー構造の使用は、数2および3の積である任意の数の「流動」チャネルを効果的にアドレスすることを可能にする。
【0147】
マルチプレキサーは、おそらく任意の底の数を使用する。例えば、必要な場合、5もまた低の数として使用され得る。しかし、制御ラインの利用の効率は低減するので、制御ラインの数はeの値から離れる。これは図23に示されており、異なる低の数を有するマルチプレキサー構造の、制御ラインの数対制御されている流動ラインの数をプロットする。
【0148】
大規模一体化(LSI)微小流体デバイスの製造を可能にする別の技術は、多層の制御ラインの使用である。図24〜24Bは、このアプローチを図示する。図24は、第2制御ラインによって制御された第1制御ラインを有する微小流体デバイスの1つの実施形態の平面図を示す。図24Aは、ラインA−A’に沿った図24の微小流体デバイスの横断面図を示す。図24Bは、ラインB−B’に沿った図24の微小流体デバイスの横断面図を示す。
【0149】
微小流体構造2100は、最低のエラストマー層2104に形成された2個の流動チャネル2102a−bから成る。第1分岐2106bおよび第2分岐2106cと流体連絡する第1入口2106aを含む第1制御チャネルネットワーク2106は、第1エラストマー層2104の上にある第2エラストマー層2108に形成される。第1制御チャネルネットワーク2106の第1分岐2106bは、第1バルブ2112を規定する第1流動チャネル2102aの上にある広くなった部分2110を含む。第1制御チャネルネットワーク2106の第2分岐2106cは、第2バルブ2116を規定する第2流動チャネル2102bの上にある広くなった部分2114を含む。
【0150】
第3制御チャネル2118aを備える第2制御チャネルネットワーク2118は、第2エラストマー層2108の上にある第3エラストマー層2120に形成される。第3制御チャネル2118aは、バルブ2122を形成する第1制御チャネルネットワーク2106の第1分岐2106bの上にある広くなった部分2118bを含む。
【0151】
図24〜24Bに図示される微小流体デバイスは、下記の通りに作動され得る。操作され得る流体は、流動チャネル2102aおよび2102bに存在する。第1制御チャネルネットワーク2106に対する圧力の適用は、バルブ2112およびバルブ2116の膜を、それらのそれぞれの流動チャネルである2102aおよび2102bの中へ下方に湾曲させ、それにより、流動チャネルを通して流動をバルブで調整する。
【0152】
第2制御チャネルネットワーク2118に対する圧力の適用は、バルブ2122の膜を、下にある第1制御チャネルネットワーク2106の第1分岐2106cのみの下方へ湾曲させる。これはその湾曲された状態でバルブ2112を固定し、今度は、第1制御チャネルネットワーク2106内で、圧力を、バルブ2112の状態に影響せずに変えることを可能にする。
【0153】
図24〜24Bに描かれた微小流体デバイスの一般的な構造は、図25の単純化された横断面図にまとめられている。特に、エラストマーデバイス2200は、流動チャネルネットワークFを規定する最も低いエラストマー層E1から成り、第1制御チャネルネットワークC1を規定する第2エラストマー層E2の下にある。同様に、第1制御チャネルネットワークC1は、第3エラストマー層E3内で規定される第2制御チャネルネットワークC2の下にある。
【0154】
図24〜24Bの微小流体デバイスの実施形態は、3つの分離したエラストマー層から製造されるように記載されているが、これは本発明に必須ではない。多重化制御ラインを特徴づける本発明の実施形態に従う大規模一体化微小流体構造は、2つのエラストマー層のみを利用して製造され得る。このアプローチは、図26〜26Bに関連して図示される。
【0155】
図26は、第1流動チャネル2300aおよび第2流動チャネル2300b、ならびに、バルブ2304および2306それぞれを規定する流動チャネル2300aおよび2300bの上にある第1分岐制御チャネルネットワーク2302を備える微小製造(microfablicated)エラストマーデバイスの単純化された平面図を示す。図26Aは、ラインA−A’に沿った図26の微小製造エラストマーデバイスの横断面図を示し、より低いエラストマー層2306で規定された流動チャネル2300a、および上方のエラストマー層2310で規定された第1制御チャネル2302を備える。
【0156】
より低いエラストマー層2308は、バルブ2314を規定する第1制御チャネル2302の底面に広がる第2制御チャネルネットワーク2312をさらに備える。従って、図26Bは、ラインB−B’に沿った図26の微小製造エラストマーデバイスの横断面図を示す。同じ(より低い)エラストマー層2308に存在する、流動チャネルネットワーク2300および第2制御チャネルネットワーク2312は、分離し、互いに交差しない。
【0157】
図27の単純化された横断面図に表されるように、分離した流動チャネルネットワークFおよび制御チャネルネットワークC2は、このように1つの(より低い)エラストマー層E1に存在し得、制御チャネルネットワークC1のみを規定する別のエラストマー層E2を覆う。
【0158】
図26〜26Bに図示された微小流体デバイスは、以下のように作動され得る。操作され得る流体は、流動チャネル2300aおよび2300bに存在する。第1制御チャネルネットワーク2302に対する圧力の適用は、バルブ2304の膜を、それらのそれぞれの流動チャネル2300aおよび2300bの中へ下方に湾曲させ、それにより、流動チャネルを通して流動をバルブで調節する。
【0159】
第2の制御チャネルネットワーク2312への圧力の適用は、バルブ2314の膜を、上に重なっている第1の制御チャネルネットワーク2302の分岐へ上向きに湾曲させる。このことは、バルブ2314を、その湾曲した状態で固定する。換言すると、第1の制御ネットワーク2302内の圧力が、バルブ2314の状態に影響を及ぼすことなく変化されることを可能にする。図24に示される実施形態とは対照的に、図26〜26Bの微小流体デバイスは、増大した圧力に応じて隣接制御チャネルへ上向きに湾曲することによって作動するバルブを特徴とする。
【0160】
図27Aは、大規模集積技術を用いて微小加工された微小流体コンパレータチップ3000の光学顕微鏡写真を示し、このチップは、256個のコンパレータのアレイに類似している。具体的には、2056個の微小バルブを備える第2のデバイスが、より複雑な流体操作を実行し得るように設計された。種々の入力は、有色の食用色素と共にロードされて、流体論理のチャネルおよびサブエレメントを可視化する。図27Bは、図27Aのチップの一部分の簡略化した概略平面図を示す。
【0161】
コンパレータチップ3000は、一対の平行な折れ曲がったフローチャネル3002および3004から形成され、そのフローチャネル3002および3004は、それぞれ、注入口3002aおよび3004a、ならびに排出口3002bおよび3004bを有し、フローチャネル3006の分岐した水平方向の列によって種々の点で交差されている。折れ曲がったフローチャネルの間に位置付けられた水平方向のフローチャネルの部分は、混合位置3010を規定する。
【0162】
接続チャネルの中央に重なっている第1のバリア制御ライン3012は、隣接チャンバを作製するように作動可能であり、そして隣接チャンバの内容物が混合し得るように停止可能である。第2のバリア制御ライン3014は、水平方向のフローチャネルのレスト(rest)から隣接チャンバを隔てるために、隣接チャンバのいずれかの端部を越えて折り返す。
【0163】
水平方向のフローチャネル3006の一方の端部3006aは、圧力源3016と流体連絡し、そして接続水平フローチャネル3006の他方の端部3006bは、マルチプレクサ(multiplexor:MUX)3020を通ってサンプル収集出力3018と流体連絡する。
【0164】
図27C〜Hは、図27A〜Bの構造のうちの1つの混合エレメントの動作の単純化した拡大平面図を示す。図27Cは、ローディング前の混合エレメント示し、この混合エレメントは、混合バリア制御ラインと加圧されていないラップアラウンド(wrap−around)バリア制御ラインとを備える。図27Dは、隣接チャンバ3050および3052を規定するために隔離バルブおよび分離バルブを作動させるための、ラップアラウンドバリア制御ラインおよびバリア混合ラインの加圧を示す。図27Eは、これらの物質をそれぞれのフローチャネルに流すことによる、第1の成分および第2の成分のチャンバへのローディングを示す。図27Fは、鉛直区画化制御ライン3025の加圧および隣接チャンバを規定するための隔離を示す。
【0165】
図27Gは、分離バリアバルブを停止するために混合バリア制御チャネルを減圧し、それによって隣接チャンバ中に存在する様々な成分が自由に混合することを可能にすることを示す。
【0166】
図27Hは、隔離制御ラインのバリアを停止して、隔離バルブを停止させ、その後、制御ラインに圧力を適用し、そしてマルチプレクサを停止させて、組み合わされた混合物が回収されることを可能にすることを示す。
【0167】
図27A〜Hに示されるデバイスの事例において、2つの異なる試薬が、別個にロードされ得、対になって混合され得、そして選択的に回収され得る。このことは、256個のナノリットル以下の反応チャンバで別個のアッセイを実施し、次いで特定の目的の試薬を回収することを可能にする。マイクロチャネルの配置は、1つのカラムあたり64個のチャンバからなるフロー層中の4つの主要なカラムからなり、このカラムは、区画化および混合の後に、約750pLの液体を含有する各々のチャンバを備える。液体は、低い外部圧力(約20kPa)下で、2つの別個の入力を通してこれらのカラムにロードされて、折れ曲がり様式でアレイを満たす。制御層上のバリアバルブは、サンプル流体をお互いから隔離するように、そして個々のチャンバの内容物を回収するために使用されるフロー層上のチャネルネットワークから隔離するように機能する。これらのネットワークは、マルチプレクサおよびいくつかの他の制御バルブの制御下で機能する。
【0168】
図27A〜Hに示される貯蔵アレイおよびコンパレータ微小流体デバイスは、2つの別個の層を使用して多層ソフトリソグラフィー技術によって製造された。バルブを作動するために必要なすべてのチャネルを備える「制御」層は、制御されるべきチャネルのネットワークを備える「フロー」層の上端に位置される。バルブは、制御チャネルがフローチャネルを横切る場合に作製される。2つのチャネル間の連結部で生じる薄い膜は、水圧または空気圧の作動によって湾曲され得る。すべての生物学的アッセイおよび流体操作は、「フロー」層上で実行される。
【0169】
微小流体チャネル用の原型は、高さ9μmのシリコン上にポジティブなフォトレジスト(Shipley SJR 5740)をスピンコーティングし、そしてそれらに高解像度(3386dpi)の透過性マスクを施すことによって作製された。フォトレジスト型上のチャネルは、完全にバルブが閉じることが可能な幾何学を作り出すために、120℃で20分間、円形にされた。
【0170】
デバイスは、フォトレジスト型から2パートの硬化シリコン(Dow Corning Sylgard 184)キャストの2つの層を一緒に接着することによって製造された。「フロー」チャネルを含むデバイスの下部層は、パートA:パートBが20:1のSylgardで、2500rpmにて1分間スピンコーティングされる。得られるシリコン層は、約30μmの厚さである。「コントロール」チャネルを含むデバイスの上部層は、別個の型を用いて、パートA:パートBが5:1のSylgardを使用して、厚い層(厚さ約0.5μm)として成型される。この2つの層は、最初に80℃にて30分間湾
曲される。
【0171】
次いで、コントロールチャネル相互接続空孔が、(型から取り外された)厚い層を突き
抜けて穿孔され、その後、薄層上でチャネルのある面を下にして封着されて、それぞれのチャネルネットワークが整列される。構築された層の間の接着は、デバイスを80℃にてさらに45〜60分間加硫することによって達成される。得られる多層デバイスは、サイズに切り取られ、そしてRCA洗浄した番号1の25mm四方のカバーガラス上に取り付けられるか、またはカバーガラス上にパートA:パートBが5:1のSylgardで5000rpmにてスピンコーティングされ、そして80℃にて30分間加硫され、その後、80℃で一晩インキュベートされる。
【0172】
複数の近接していないフローチャネルの同時アドレス指定は、固定されるフローチャネルの寸法(幅100μmおよび高さ9μm)を維持しながらも、種々の幅の制御チャネル
を製造することによって達成される。フローチャネルを閉じるために必要とされるコントロールチャネルにおける空気圧は、コントロールチャネルの幅に応じて、より高い作動閾値を有する50μm×100μmの交差領域を閉鎖することなく、比較的より低い圧力(約40kPa)で100μm×100μmのバルブを作動するのを容易にする。
【0173】
これらのデバイスへの流体の誘導は、シリコンを突き抜けて穿孔された空孔に挿入されたスチールピンを通して達成される。微小機械化デバイスが、高いヤング率を有する硬質な材料で作製されるのとは異なり、シリコンは、軟質でありかつ入力ピンの周りを密封し、漏出を伴わずに300kPaまでの圧力を容易に可能にする。コンピュータ制御された外部ソレノイドバルブは、マルチプレクサの作動を可能にする。換言すると、複合体が多数の微小バルブをアドレス指定することを可能にする。
【0174】
(II.細菌およびウイルスの特徴付けおよび分析)
ヒトの腸の細菌生態学および以前は到達不可能であった他の環境が、個々の細菌からゲノムDNA(gDNA)ライブラリーを作製するための微小流体チップを利用して、高度に類似の様式で特徴付けられ得、かつ分析され得る。gDNAライブラリーは、高スループットなスクリーニングまたはハイブリダイゼーションアッセイを使用して分析され得る。微小流体構造が個々の細菌から試薬を生成する能力によって、以前は解決不可能であった問題に対処するために機能ゲノム科学の適用が可能になる。
【0175】
図28は、本発明の1つの実施形態に従う、特徴付けおよび分析のための、一般的なプロセス6000の簡略化したフローチャートを示す。工程6002では、細菌および/またはウイルスを含むサンプルが、目的の環境から収集される。工程6004では、目的の細菌またはウイルスが、実質的に、収集したサンプルの他の成分から物理的に単離される。
【0176】
工程6006では、単離された細菌またはウイルスが、その核酸内容物へのアクセスを提供するために溶解される。工程6008では、細胞/ウイルス溶解物によって曝露された核酸が精製される。
【0177】
最良の工程6010および6012では、それぞれ、精製された核酸が特徴付けられ得、そして増幅され得る。図28は、増幅前に生じる核酸の特徴付けの工程を示すが、この工程の順序は、本発明によって規定されない。代替の実施形態によると、精製された核酸は、特徴付けの前に増幅され得る。
【0178】
なお他の最良の工程では、本発明の実施形態に従って精製された核酸が発現され得る。具体的には、工程6014は、精製された核酸のプラスミドまたはベクター中への連結を示す。工程6016は、連結された核酸を有する宿主細胞の形質転換を示す。工程6018は、形質転換された細胞による核酸の発現を示す。
【0179】
上記のように、プロセス6000のうちの1つの工程またはすべての工程は、本発明の実施形態に従って微小流体アーキテクチャーを利用して実施され得る。以下の節は、細菌およびウイルスを単離および特徴付けするための特定の機能を要約しており、微小流体構造の特定の例が、これらの機能を実行するのに適切であることを示す。
【0180】
(1.細菌/ウイルス単離)
図29Aは、本発明に従う微小流体アーキテクチャーの1つの実施形態の平面図を示す。微小流体チップ6100は、第1のフローチャネル6102を備え、この第1のフローチャネル6102は、第1のゲートクロスフロー注入構造物6104、第2のゲートクロスフロー注入構造物6106、そして第3のゲートクロスフロー注入構造物6108に連続的に通じている。ゲートクロスフロー注入器6104、6106、および6108は、第1のフローチャネル6102と、分岐6110a、6110b、および6110cを有する第2のフローチャネルネットワーク6110との交差によって規定される。3つの並行単離が、それぞれクロスフロー注入構造物6104、6106、および6108について、1.6nl、1.0nl、および0.4nlの異なるサンプル容積を用いて利用可能である。図29Bは、クロスフロー注入構造物6104の拡大図を示す。
【0181】
水平方向のフロー制御ライン6112は、クロスフロー注入構造物6104、6106、および6108に対する注入口および排出口でフローチャネル6102および9110と重なり合い、それによって、これらの構造物内および構造物外への液体の流れを制御する。
【0182】
図29に示される流体デバイスの実施形態の作動の前に、サンプルが、目的の環境から入手されている。環境から入手されたサンプルは、1×108〜9実体/mlまたはさらに高い細菌/ウイルス濃度を有し得る。このような濃度は、1ピコリットル(pL)(1ピコリットル=1000ナノリットル)当たり約1個の細菌またはウイルス実体に相当する。必要な場合には、サンプルの濃度は、所望の細菌またはウイルス実体の最大数が、特定の容積を有する微小流体チャンバ内に捕獲されることを確証するために希釈され得る。希釈はまた、所望のサンプル特性(例えば、粘度またはpH)を得るために有益である。
【0183】
最初の単離工程において、サンプルは、第1のフローチャネル6102の注入口6102aを通して流される。上記の希釈工程のために、サンプル由来の限られた数のウイルス/細胞が、各々のゲートクロスフロー注入構造物6104、6106、および6108に存在する。次いで、水平方向のコントロールライン6112が作動されて、希釈されたサンプルをクロスフロー注入構造物6104、6106、および6108内に捕捉する。
【0184】
1つの実施例において、eGFPを発現するE.coliの培養物は、5.3±3.5×108細胞/mLの最終細胞濃度に到達することが確認された。次いで、その培養物は、ヌクレアーゼを含まない水中に1:10で希釈され、チップにロードされた。0.4nL区画、1.0nL区画、および1.6nL区画中の細菌の平均数は、それぞれ27、61、および139であり、予測された結果の21、53、および85と、非常に良く一致した。
【0185】
単離目的のためのサンプルのいくらかの希釈は、チップの外で行われ得るが、特定の程度のサンプル希釈もまた、図29の微小流体構造それ自体を利用して達成され得る。具体的には、クロスフロー注入構造物6104、6106、および6108のすぐ上流に、それぞれ、第2のクロスフロー注入構造物6120、6122、および6124が配置される。第2のクロスフロー注入構造物6120、6122、および6124は、第2のフローチャネルネットワーク6110の分岐6110a〜cを備える第3のフローチャネル6126の交差によって規定される。
【0186】
緩衝液は、3のフローチャネル6126の注入口6126aを通って、クロスフロー注入構造物6120、6122、および6124へ配置され得る。次いで、クロスフロー注入構造物の対6104/6120、6106/6122、および6106/6124を隔てる水平方向のバルブ6130が停止されて、これらの隣接する注入構造物の内容物の混合が可能になり、それによって、サンプルがさらに希釈される。
【0187】
上記の説明は、微小流体チャンバ中の希釈されたサンプルの物理的な封じ込めによる、特定の細菌またはウイルスの単離に着目してきたが、他のアプローチは、分類アプローチを利用して、細菌またはウイルスを最初に単離し得る。このような分類適用に有用な微小流体構造の一例は、Fuら、S.R.Anal.Chem.Vol.74、2451−2457頁(2002)によって記載されており、本明細書において参考として援用される。
【0188】
(2.ウイルス/細菌核酸の溶解および精製)
特定の細胞またはウイルスから核酸を精製し、そして回収するために、細胞またはウイルスはまず、その内容物を曝露するために溶解されなければならない。図29Aに戻ると、第2のフローチャネルネットワーク6110への注入口6110dは、フローチャネルの3つの注入口に流体連絡している。
【0189】
第2のフローチャネルネットワーク6110の注入口6110aは、バルブ6133を通って溶解化学注入口6132に流体連絡している。第2のフローチャネルネットワーク6110の注入口6110aは、バルブ6135を通って洗浄注入口6134に流体連絡している。第2のフローチャネルネットワーク6110の注入口6110aは、バルブ6137を通って溶出注入口6136に流体連絡している。
【0190】
図29の微小流体構造の作動の溶解段階中に、溶解化学が、フローチャネルネットワーク6110へ流される。クロスフロー注入構造物を隔てている水平バルブが開放され、そして全サンプル、緩衝液、および溶解溶液混合物が混合構造物6170へ流される。
【0191】
組み合わされたサンプル/緩衝液/溶解溶液混合物は、ループ出口コントロールライン6172が作動し続けたままで、展開性のないローディングプロセスによって混合器6170に流される。次いで、混合コントロールライン6171a〜cが作動されて、混合を達成するように環状フローチャネルの周りを混合物が流れる。図29Cは、5nLの容積を有する回転混合構造物の拡大図の写真を示す。
【0192】
上記の実施例では、27、61、および139の細胞の平均数が0.4nL区画、1.0nL区画、および1.6nL区画にロードされ、その後のロードされた細菌の回転混合器への移動は、約70%〜92%の範囲であった。
【0193】
図30A〜Bは、それぞれ、溶解前および溶解後のE.coli細菌のサンプルの写真を示す。溶解は、水酸化ナトリウムと尿素とを含有する溶解緩衝液と共に混合することによって達成された。溶解後、細菌細胞は自動運動を停止し、そして蛍光シグナルは消失した。
【0194】
細菌またはウイルスがチップ上で単離され、溶解された後、次の工程は、目的の核酸を精製することである。チップ上で溶解された細菌細胞からゲノムDNAを精製することが可能である。
【0195】
再び図29Aに戻ると、一旦、サンプル、緩衝液、および溶解溶液の組み合わせが完全に混合されると、混合器6171の洗浄注入バルブ6133、排出バルブ6140が開放される。洗浄液は、フローチャネルネットワーク6110およびその内容物(混合器6170を含む)を通って流れ、その内容物は、順番に、それぞれ第3のセットのクロスフロ
ー注入構造物6171、6172、および6174を通って廃棄物6180へ流される。図29Dは、あるビーズを中心としたクロスフロー注入構造物の拡大図を示す。
【0196】
クロスフロー注入構造物6171、6172、および6174は、特定の核酸に対して親和性を示す物質でコーティングされたビーズを備えるビーズ捕捉コントロールライン6186から、第4のフローチャネル6176および再び作動されたバルブを通ってロードされている。このようなビーズの例は、ノルウェー国オスロのDynal Biotechから入手可能なDYNABEADS(登録商標)である。
【0197】
コントロールライン6188によって規定されるビーズ水平コントロールバルブの停止は、混合器からの流体をビーズに曝すことを可能にする。溶解されたサンプルが、混合器から、コーティングされたビーズを備える第3のセットのクロスフロー注入構造物を通って流れるにつれて、サンプル中の核酸がコーティングされたビーズに吸着するが、サンプルの残留物および洗浄液は廃棄される。
【0198】
次に、溶出溶液が、注入口6136からフローチャネルネットワーク6110を通って、そしてビーズを備える第3のクロスフロー注入構造物6171および6172および6174を通って流される。流れている溶出溶液の圧力の結果として、これまでビーズに結合されていた核酸が放出される。この溶出された核酸は、回収ポート6180、6182、および6184のうちの1つに回収され、次いで、増幅および/または分析され得る。
【0199】
各々のビーズについて製造者が指定した最低容量に基づいて、図29Aの第3のクロスフロー注入構造物によって形成された各々のカラムは、100pgのDNAの総容量を有することが算出され、これは、およそ20,000の細菌からゲノムDNAを精製するのに十分である。
【0200】
溶出液体は、単一の注入口6136から第3のクロスフロー注入構造物の各々に流されて、精製された核酸が同時に溶出するので、各々のプロセッサが、同じ流体抵抗を示すことが重要である。具体的には、チャネル長が異なる場合、対応する抵抗は、別個のプロセッサにおける不均等な流体フローを生じるので、溶出速度に影響を及ぼす。従って、各々のプロセッサについて全体的な微小流体チャネル長は、フローチャネル長の補正を与えるための折れ曲がり部分を備える中央のフローチャネルによって、同一であった。
【0201】
図32Aは、約280未満の個体のE.coli細菌細胞を含むチャンバから精製されたゲノムDNAの電気泳動の結果を示す。細菌のゲノムDNAは、溶出緩衝液を使用することによってチップから回収された。溶出緩衝液中のDNAは、ppdDプライマーセットを用いて、50μlの作業容量で従来のPCR法を使用することによって増幅された。
【0202】
精製された標的核酸は、E.coliゲノムDNA由来の461bp ppdD(プレピリンペプチダーゼ依存性前駆体)遺伝子であった。ポリスチレン磁気ビーズの表面上で
捕獲されたゲノムDNAは、溶出緩衝液を使用することによって回収され、そしてPCR反応によって増幅された。サンプルは、TBE(トリス−ホウ酸塩−EDTA)緩衝液中
の1.2%アガロースゲルで電気泳動された。
【0203】
ゲルのレーンは、以下の通りであった:左、右−100bp DNAラダー;レーン1、4および7−1120未満の細胞数に相当する1.6nLのE.coli培養物ブロスからのゲノムDNAの単離;レーン2、5、および8−700未満の細胞数に相当する1.0nLのE.coli培養物ブロスからのゲノムDNAの単離;レーン3、5、および9−280未満の細胞数に相当する0.4nLのE.coli培養物ブロスからのゲノムDNAの単離。レーン10は、ネガティブコントロールである。
【0204】
図32Bは、28未満の個体のE.coli細菌細胞を含有するチャンバから精製されたゲノムDNAの電気泳動分析の結果を示す。細菌のゲノムDNAは、溶出緩衝液を使用することによってチップから回収された。
【0205】
溶出緩衝液中のDNAは、ppdD遺伝子プライマーセットを用いて、50μlの作業容積で従来のPCR装置を使用することによって増幅された。この場合も、精製された標的核酸は、E.coliゲノムDNA由来の461bp ppdD(プレピリンペプチダーゼ依存性プロテインD前駆体)遺伝子である。
【0206】
ゲルのレーンは以下の通りである:左、右−100bp DNAラダー;レーン1、4および7−112未満の細胞数に相当する1.6nLの10倍希釈したE.coli培養物ブロスからのゲノムDNAの単離;レーン2、5、および8−70未満の細胞数に相当する1.0nLの10倍希釈したE.coli培養物ブロスからのゲノムDNAの単離;レーン3、5、および9−28未満の細胞数に相当する0.4nLの10倍希釈したE.coli培養物ブロスからのゲノムDNAの単離。レーン10は、ネガティブコントロールである。
【0207】
図31A〜Bは、本発明の実施形態に従って精製された核酸についての他の電気泳動結果を示す。具体的には、図31A〜Bは、図29Aの微小流体アーキテクチャーから精製されたE.coliゲノムDNAの回収の成功を実証する。溶出されたサンプルは、チップから取り出され、そしてPCRによって増幅された。増幅物は、0.5%TBE(トリス−ホウ酸塩−EDTA)緩衝液中の2.0%アガロースゲルで電気泳動された。標的D
NAは、E.coli ppdD(プレピリンペプチダーゼ依存性プロテインD前駆体)遺伝子のうちの461bpのフラグメントである。
【0208】
図31Aは、希釈していないE.coli培養物を用いるゲノムDNAの単離を示し、ゲルのレーンは以下である:M−PCRマーカー;レーン1−約1,120の細胞数に相当する1.6nLの培養物からのゲノムDNAの単離;レーン2−約700の細胞数に相当する1.0nLのサンプル;そしてレーン3−約280の細胞数を有する0.4nLのサンプル。図31Aのレーン1〜3は、長さが約500塩基対のはっきりと分離されたバンド示し、このことは、ゲノムDNAの精製を明らかにする。
【0209】
レーン4、5および6は、ゲノムDNA単離についてのネガティブコントロールであり、これらのレーンでは、細胞培養サンプルの代わりに精製水が使用され、そして他のすべての条件はレーン1、2、および3と同じであった。これらのコントロール事象のいずれにおいても増幅シグナルは存在しなかった。
【0210】
図31Bは、1:10希釈の細胞培養物からのゲノムDNAの単離を示す。レーン1、2、3、レーン4、5、6、およびレーン7、8、9は、それぞれ、3つの異なるチップからの結果である。ゲルのレーンは以下の通りである:M−PCRマーカー;レーン1、4、および7−平均112の細菌細胞からのゲノムDNAの単離;レーン2、5、および8−平均70の細菌細胞からのゲノムDNAの単離;レーン3、6、および9−平均28の細菌細胞からのゲノムDNAの単離。
【0211】
精製されたDNAの量は、従来の手段によって測定するには少なすぎるので、首尾よい回収の評価のために、プレリピンペプチダーゼ依存性タンパク質(ppdG)遺伝子のPCR増幅が使用された。図31A〜Bの結果は、DNA単離に必要とされる細胞数を減少し、それによって、このプロセスの感度を従来の方法よりも2,000〜20,000倍高めることが可能であることを示す。
【0212】
図29A〜Dに示す核酸精製微小流体アーキテクチャーは、採用された平行化ストラテジーを示す。プロセスの工程は、おおまかに線形のチャネルに沿って行なわれ、直交方向のプロセスの平行化を可能にする。この幾何学は、単一の試薬の充填ラインが、全ての平行プロセスに同時に試薬を分配することを可能にする。
【0213】
図29A〜Dに示す微小流体アーキテクチャーは、多層ソフトリトグラフィーによって製造された。マスクデザインは、CADプログラムFluidArchitect(Fluidigm,South San Francisco,CA)で作製され、高解像度の透過性マスク(3,389dpi)に移された。流体チャネルの寸法は、幅100μmおよび深さ10μmであり、バルブ作動チャネルは、代表的に、幅200μmおよび深さ15μmである。チップは、20×20mm以内の空間、13の流体アクセスバイアス、54のバルブおよび14の作動バイアスを備え、微小流体の流れを可能にし、制御した。
【0214】
流体チャネルのためのマスク型は、シリコンウェハ上に、2,000rpmで1分間のスピンコーティング陽性フォトレジスト(Shipley SJR 5740)、その後の、マスクへの曝露および発色により作製された。この成形チャネルは、135℃で15分間丸められ、全バルブの閉鎖を可能にする幾何学を生成する。
【0215】
作動層のための別の型は、1,600rpmにて1分間、得られる高さが13μmである別個のウェハ上へのスピンフォトレジスト、その後のマスクへの曝露および発色により作製される。デバイスは、フォトレジスト型から2つのパーツの硬化シリコン(GE Silicone RTV615)キャストの2つの層を一緒に結合することにより製造された。
【0216】
流れチャネルを含む、デバイスの底部層は、2,400rpmにて1分間、20:1のパートA:B RTV615でスピンコーティングし、得られたシリコン層は、11μm厚のフィルムである。作動チャネルを含む、デバイスの頂部層は、別個の型を使用して、5:1のパートA:B RTV615で、厚い層(5mm厚)として成型される。
【0217】
2つの層は、最初に、80℃にて30分間硬化される。次いで、作動チャネル内部連絡穴が、20ゲージのルアースタブで、厚い層から穿孔される、その後、それぞれのチャネルネットワークを光学顕微鏡と並べた後、厚い層上で、チャネル側を下にしてシールされる。
【0218】
組み立てられた層の間の結合は、80℃にて90分以上、組み立てられたデバイスを硬化し、その後、流体チャネル内部連絡を穿孔することによって達成される。得られたデバイスは、サイズにカットされ、RCA清潔カバーガラス(No.1、24mm×50mm)上に取り付けられ、その後、80℃にて一晩のインキュベーションにより、接着を促進する。
【0219】
微小流体アーキテクチャーを含むチップは、倒立顕微鏡(Nikon Eclipse
TE2000−S)上に設置される。蛍光励起は、水銀ランプ(100W)により提供された。FITCフィルターセット(Ex465−495、DM 505、BA 515−555)を使用し、PC制御カラーデジタルカメラ(Sony DFW−V500)を使用することにより、画像を記録した。
【0220】
チップ上の各作動ラインを、ステンレス鋼ピン(New England Small
Tube,Litchfield,NH)で接続し、外部ソレノイドバルブへのポリウレタンチュービングを、デジタルデータI/Oカード(CCA,PPC1−DI032HS;National Instruments,Austin,TX)により制御した。調節された外圧を、正常に閉じたポートにかけ、最小限のバルブを切り替えることによって、大気圧まで、制御チャネルに圧力をかけるか、または、通気させる。
【0221】
サンプルおよび緩衝液の導入および回収のための流体バイアスを、ポリプロピレンチップ(Multiplex tips,Sorenson BioScience,Inc.,West Salt Lake City,Utah)により外圧供給源に接続した。液体をチップの内側に駆動するための代表的な圧力は、0.5〜2.0psi(1psi=6.89kPa)である。
【0222】
微小流体チップが光学顕微鏡のステージ上に取り付けられ、制御チャネルが、外部ニューマチック制御システムに接続された後、DNA結合能力を有するマイクロビーズ(Dynabeads(登録商標)DNA DIRECTTMユニバーサル,Dynal ASA,Oslo,Norway)を、図29Aの右上部分にある「ビーズイン」入口から充填する。この操作のために、バルブ10「ループ排出制御」およびバルブ12「ビーズ捕捉制御」が閉じられる。ビーズは、バルブ6および12を制御することによって、バルブ12の直前に位置付けられる。バルブ12についての圧力制御は、他のバルブ制御についての圧力よりも低く、結果として、ビーズがカラム内に蓄積する間に、緩衝液が通過することが可能な、複数の閉じたバルブを生じる。
【0223】
緩衝溶液(溶解緩衝液(XtraAmp(登録商標)溶解緩衝液シリーズ1,Xtrana,Inc.,Ventura,CA)、洗浄緩衝液(XtraAmp(登録商標)洗浄緩衝液シリーズ1)および溶出緩衝液(Tris−EDTA緩衝液、pH7.8)の各々1μLを、それぞれ、「溶解イン」ポート、「洗浄イン」ポートおよび「溶出イン」ポートから充填される。
【0224】
eGFPを発現するE.coli(BL21−2+)を、37℃にて12時間、40pg/mlの濃度のアンピシリンを含有するLuria−Bertani(LB)液体培地中で増殖させた。DNAを精製し、チップから回収した後、本発明者らは、遺伝子、ppgD(プレピリンペプチダーゼ依存性タンパク質D前駆体、461bp)、すなわち、E.coli細菌細胞中に含まれるDNAを、従来のPCR法を用いて増幅することを試みた。
【0225】
サーマルサイクリング条件は以下の通りであった:最初の変性:95℃にて2分;DNA変性:95℃にて30秒;プライマーアニーリング:60℃にて30秒;dNTP重合:72℃にて2分および30秒;変性から重合までの工程を30回繰り返す;最後の伸長:72℃にて10分。
【0226】
ppdD遺伝子についてのプライマーセットは、5’−GGTGGTTATTGGCATCATTGC−3’(フォワード)および5’−GTTATCCCAACCCGGTGTCA−3’(リバース)である。PCRカクテルは、5μLの10×反応緩衝液、10mMの最終濃度を有する1μLのdNTP混合物、各1μLのフォワードプライマーおよびリバースプライマー、0.5μLのTaqポリメラーゼ 5U/μL、ならびに、鋳型、そして、50μLの合計反応容量にするための水である。
【0227】
(3.非細菌核酸の溶解/精製)
上記の関連の議論は、細菌細胞から得た核酸の精製に関する。しかし、本発明に従う実施形態は、この型の核酸の精製に限定されない。他の型の核酸(真核細胞からのメッセンジャーRNA(mRNA)が挙げられるがこれらに限定されない)が、本発明の実施形態に従って単離および精製され得る。
【0228】
遺伝子発現を測定するため、または、cDNAライブラリーを構築するためのいずれかの、mRNAの単離は、現代の分子生物学の基礎である。mRNAの単離には多数の技術が存在するが、ほとんど全ての技術が、出発物質として数百から数千の細胞を必要とする。単一の細胞から、遺伝子発現プロフィールを解明すること、または、cDNAライブラリーを開発することが有用である、多くの状況がなお存在する。
【0229】
いくつかの原発性細胞型は、幹細胞のように非常に稀であり、多くの細胞を得るための培養における増幅が、細胞の発現プロフィールを変化させる。多数の原発性細胞を、動物または患者から単離する試みは、常に、細胞型の混合物を生じる。なぜならば、正確に同定することが不可能であり、従って、純粋な形態で、任意の単一細胞型を単離することが不可能であるからである。さらに、近年、通常は同一の遺伝子型である細胞間の遺伝子発現における後生的改変において、これらの改変が、いかにして発生および他の表現型の分化プロセスにおいて役割を演じ得るかを理解することに新たな興味が存在している。
【0230】
単一の細胞からの少数の遺伝子の発現を測定するための十分に確立された方法が存在するが、これらは、少数の標的の演繹的な選択を必要とする。この制限は、より高度な平行マイクロアレイにおける用途のために、単一細胞からのmRNAの増幅の近年の進歩により、幾分緩和されている。これらの方法は、より多数の標的の平行分析を可能にするが、mRNA増幅プロセスは常に、一定の程度のゆがみを導入し、マイクロアレイ自体は、可能な転写物の有限のセットの選択を必要とする。
【0231】
単一細胞からのcDNAライブラリーの構築は、依然として実施されていないが、どの遺伝子が追跡されるかについての演繹的な推測なしに、発現を追跡するための強力なツールを提供し得る。従ってさらに、通常は10,000である、cDNAライブラリーの構築に必要とされる最小数の細胞は、1,000であり、このようなライブラリーを構築するために微小流体を使用することの利点が認識されている。
【0232】
従って、図37Aは、細菌またはウイルス以外からの核酸の単離および精製に有用な、本発明に従う、微小流体アーキテクチャー6400の実施形態を示す。ライン6402は、100μmの流体チャネルを表し、ライン6404は、100μm幅のバルブ作動チャネルである。流体ポートが指定され;作動ポートは、1〜10と指定される。
【0233】
溶解緩衝液チャンバ6408は、バルブ1、2、3および4により線引きされるチャネル空間を備える。セルチャンバ6410は、バルブ4、5、6および7により線引きされるチャネル空間を備える。ビーズチャンバ6412は、バルブ7、8、9および10により線引きされるチャネル空間を備える。
【0234】
核酸精製チップ6400は、単一の構造へと一体化された異なる機能のユニットを備える。チップの処理構造は、水平であり、試薬は垂直に充填され、多くのクラスの連続したバッチ処理反応を実施するために一般化され得るスキームである。
【0235】
構造6400の第1の機能的ユニットは、可変数の細胞を充填され得るチャンバ6410を備える。このような充填された細胞の正確な数は、充填された溶液中の細胞濃度により制御され得る。この研究において、サンプルは、1個と100個の間の細胞を捕捉するように希釈された。
【0236】
細胞チャンバ6410には、溶解緩衝液チャンバ6408が隣接し、これは、固定量のカオトロピック塩の溶液で充填され得る。チャンバ6408および6410を分離しているバルブ4が開放されて、溶解緩衝液の細胞内への拡散を可能にし得る。細胞が溶解される合計容量(バルブ1、2、3、5、6および7の間)は、約20μLである。
【0237】
図37Bは、図37Aの隣接する溶解緩衝液と細胞チャンバの拡大図を示す写真である。バルブ1〜7を形成する作動チャネルが、食用色素オレンジGの水溶液で充填される。スケールバーは200ミクロンである。
【0238】
チップの次の機能的ユニットは、オリゴdT誘導体化常磁性ビーズ(Dynabeads Oligo(dT)25)のパッケージングされたカラムを作製するように設計され、ここを通って、細胞様怪物がフラッシュされ得る。正確な量のビーズを捕捉するために、開口部が圧力制御装置により正確に制御され得る微小流体バルブが使用された。
【0239】
バルブ8は、調節された流体流れが通過し得るが、大きな(2.8μm)ビーズが捕捉されるように、わずかに開いたままになっている。他の全てのバルブは、オンオフバルブであり、個々の圧力源により制御される。これらの圧力源は、NI DAQカード(National Instrument)およびLabview 6.0(Fluidigm Corp)の下で開発されたグラフィックインターフェースにより作動される。各実行の終わりに、ビーズが、チップから回収され、ベンチトップRT PCRを用いて、mRNAの存在についてアッセイされる。
【0240】
図37Cは、図37Aの隣接するビーズおよび細胞チャンバの拡大図を示す写真である。直径2.1μmのオリゴdTで覆われた常磁性ビーズのカラムが、部分的に閉じた微小流体バルブ8に対して構築される。スケールバーは、ここでも200ミクロンである。
【0241】
微小流体チップ6400特有の操作は、以下のようにまとめられ得る。全てのバルブ作動ラインが、流体チャネルにおける泡の形成を防止するために、流体(オレンジGの濃水溶液)で充填された。流体チャネルと制御ラインとを分離する膜は、非常に薄く(5ミクロン未満)、空気が浸透可能である。各制御ラインは、その圧力源に接続されている。
【0242】
全ての圧力源が設定される動作圧は、バルブの作動圧より上の2psiであり、従って、流体チャネル上に1psiの圧力が可能となった。動作圧は、膜の厚さの少しの変化によって、チップ間で互いに異なるが、代表的には、8psiと15psiとの間であった。全てのバルブを、試薬を充填する前に閉じた。
【0243】
試薬は、ポリエチレンチュービングから送達され、このチュービングは、23ゲージのステンレス鋼ピン(New England Small Tubes,Litchfield,NH)を使用してチップに接続した。チュービングの他方の端は、全ての流体チャネル入口に共通する圧力源(1psi)に接続した。チップは、10μLの細胞溶液、20μLの溶解緩衝液および5μLのビーズ溶液で充填した。元々のDynalビーズは、Dynal溶解緩衝液中に再懸濁し、5×濃度の濃度にした。
【0244】
溶解緩衝液は、まず、バルブ1および2を開けることによって、チップ上に充填された。一旦溶解緩衝液が、溶解緩衝液アウトチャネルから流れると、バルブ1が閉じられた。溶解緩衝液チャンバは、空気を気体浸透可能なチップに押し出すことによって、充填が止められた。
【0245】
サンプルの細胞を、以下のように調製した。新しく回収したNIH 3T3細胞を、各実験に使用した。NIH 3T3細胞を、100mm組織培養プレートにおいてほぼコンフルエンシーまで増殖させた。細胞を1×PBSでリンスし、次いで、トリプシン処理した。トリプシン処理した細胞を、106/mL〜107/mLの間の最終細胞濃度に調節するために、1×PBS中に再懸濁した。
【0246】
細胞を、バルブ5および6を開けることによって充填した。細胞懸濁液が細胞チャンバを通って流れると、バルブ5を閉じた。バルブ5は、適切な数の細胞が細胞チャンバ内に捕捉されるまで、繰り返し開け閉めされ得る。チャンバ内に捕捉される細胞数はまた、細胞懸濁液の濃度を変更することにより影響を受け得る。代表的に、1個〜100個の細胞がチップ上に捕捉され、溶解され得る。
【0247】
バルブ6は、細胞チャンバ内の残りの空気が押し出されるまで開いたままであった。次いで、バルブ6を閉じた。
【0248】
ビーズ懸濁液を、バルブ9および10を開けることによって充填した。一旦ビーズ懸濁液がビーズチャンバを通って流れると、バルブ9を閉じ、チャンバは、残りの空気を気体浸透可能チップに押し出すことによって充填が止められた。次いで、バルブ8および11を開け、バルブ8上の圧力を、直径2.1μmのビーズが、部分的に閉じられたバルブに匹敵し始めるまで、圧力調節装置を使用してゆっくりと上昇させた。スタックがチャネル内のビーズに到達するのに十分長くなると、バルブ10を閉じた。
【0249】
バルブ4を開け、それによって、溶解緩衝液が、細胞チャンバ内に拡散することを可能にした。溶解緩衝液が個々の細胞に到達すると、細胞は直ちに溶解し、次いで、徐々に分解する。図37Dは、最初の充填後の細胞チャンバの拡大部分の写真である。図37Eは、細胞が溶解するにつれて、膜が分解し始めるような、溶解化学の拡散の5分後の細胞チャンバの拡大部分の写真を示す。図37Fは、細胞が完全に分解したような、拡散の10分後の細胞チャンバの拡大部分の写真を示す。図37D〜Fのスケールバーは、100ミクロンである。
【0250】
細胞溶解物を、バルブ3、4、7および11を開けることによって、「細胞チャンバ」からフラッシュした。溶解物を、チャネル内の空気に対する圧力を変更することによって調節され得る制御された速度(代表的には、100μm/s)にて、ビーズのスタックを通して流れさせた。ポリA含有mRNAは、ビーズ上のオリゴdTにハイブリダイズし、細胞沈殿物の大半が、チップから洗い流された間に、ビーズ上に残ったままであった。ビーズのスタックにおける空気/流体接点は、表面張力によるものである。
【0251】
次いで、バルブ3を閉じ、バルブ2を開け、そして、溶解緩衝液を、ビーズを通してフラッシュして、できるだけ多くの細胞沈殿物を含まないように洗浄した。次いで、バルブ2を閉じた。
【0252】
短いチュービングを、チップの出口ポートに接続し、0.1mLのPCRチューブ内に配置した。バルブ2および8を開け、溶解緩衝液を用いて、ビーズをPCRチューブ内にフラッシュした。磁石を用いて、自動流れチャネル内に残るあらゆるビーズを引き出した。ビーズを遠心分離し、次いで、100μLの新しい溶解緩衝液中に再懸濁した。RNaseインヒビター(1μL)を添加した。チューブをボルテックスし、mRNAを直ちに分析するか、または、チューブを−80℃にて凍結保存した。
【0253】
代表的な実験において、いくつかのチップを使用して、1つ以上の細胞由来のmRNAを保有するビーズを得た。逆転写および増幅を、Qiagen OneStep RT PCRキットを使用してビーズ上で直接行ない、その後、生成物のゲル電気泳動を行なった。2つの型のmRNAを同定するためにプライマーを使用した:多い量のアクチン転写物および中程度の量の転写物のジンクフィンガー。
【0254】
図38は、ネガティブコントロールと共に、単一の細胞の感度を示すために行なった一連の実験についての電気泳動結果を示す。RT PCR生成物を、反応物の5%をロードして2%アガロースゲル上で分析した;増幅された遺伝子は、βアクチンである。
【0255】
ゲルレーンは以下の通りである:レーン1:1kbラダー;レーン2:PBS、細胞なし(チップ上);レーン3:1個の細胞(チップ上);レーン4:9個の細胞(チップ上);レーン5:1日齢の細胞の200μLの上清+5μLのビーズ(試験管内);レーン6:200μLの溶解緩衝液+5μLのビーズ(試験管内);レーン7:チップ上に充填されたが、チャンバには捕捉されなかった細胞(チップ上);レーン8:200μLのD1水+5μLのビーズ(試験管内);レーン9:PCR試薬のみ。
【0256】
図38は、レーン3における単一のNIH 3T3細胞からの首尾よいmRNAの単離を示す。ポジティブコントロールである、溶解したNIH 3T3細胞からの上清をレーン5に示し、種々のネガティブコントロールを示す:全てのネガティブコントロールは、βアクチンDNA領域にバンドを示さず、一方で、ポジティブコントロールは、強いバンドを示す。
【0257】
バンドの強度が、カラム内のビーズの数により標準化される場合、モニター上で増加する関係が、より多い量のβアクチンmRNAについての強度と細胞数との間で見出され、減少する関係が、単一の細胞レベルに対して見出される。具体的には、高コピー数転写物と中程度のコピー数の転写物との両方で、可変数の細胞を用いて、チップを試験するために、二連の実験を行なった。
【0258】
βアクチンおよびozfの両方についてのRT PCR生成物を、2%アガロースゲル上で分析し、このバンドを定量し、標準化し、そして、図39にプロットした。0の値は、ゲル中の検出可能なバンドが存在しないことを示す;19個の細胞を用いる実験は、おそらくRNAaseの混入またはチップの不良によって、両方の転写物について失敗した。
【0259】
多い量のアクチンmRNA(黒丸)については、検出は、単一細胞レベルまで減少する。中程度の量のジンクフィンガーozf mRNAについては、シグナルは、2細胞程度から検出され得るが、代表的な感度は、2細胞と10細胞との間のどこかである。従って、この第一の作製チップの感度が確立される。
【0260】
RT PCRが、線形増幅プロセスでないという事実にもかかわらず、これらの結果は、増幅が、細胞数と一致するという意味において、半定量的である。バンドの強度がカラムのサイズによって標準化されない場合、結果は、単調でなく、任意の明白な機能的関係性に従わない。
【0261】
この結果は、mRNAのビーズに対する結合動力学が完全には平衡化されず、将来的なデバイスの感度は、溶解物のカラムとの相互作用時間を増加させることによって改善され得ることを示すものとして意図される。
【0262】
微小流体mRNA調製のための興味深い可能性のある将来的な適用は、単一細胞(もしくは、より正確には、単一の細胞の対)からサブトラクティブなライブラリーを作製するためのツールとしてのものである。このような手順は、差示的に発現される転写物について富化しつつ、共通に発現される転写物を排除することに価値があり、従来のツールを使用して、少数の細胞については実行可能ではない。
【0263】
標準的な調製において、およそ1×106細胞から単離されたmRNAは、10μLのオーダーの容量で処理される。1つの細胞からのmRNAが10pL容量に含まれる場合、同じmRNA濃度が得られる(容器の壁へのmRNAの接着はないものとする)。このような容量は、本発明の研究において使用されるものよりも多く、これらは、現在の微小流体技術で容易に成し遂げられ得るものであり、より小さい程度の置き換え容量のオーダーを有するバルブは、既に示されている。
【0264】
細菌核酸の単離および精製に利用される図29Aの微小流体アーキテクチャーと、非細菌核酸の単離および精製に利用される図37Aの微小流体アーキテクチャーとの1つの差異は、溶解化学物質およびサンプルの混合を増強するような活性混合構造の存在である。ウイルスまたは細菌の場合、このような活性混合は、ウイルスまたは細菌を保護する弾性力のあるウイルスシースまたは細胞壁構造を迅速に破壊するのに有用である。しかし、細菌またはウイルス以外の他の実体(例えば、哺乳動物細胞)は、これらの保護構造を欠き、従って、より低いストリンジェントな条件下での溶解(例えば、微小流体を含まない界面を横切る単なる拡散)を経験し得る。
【0265】
細菌核酸の単離および精製に利用される図29Aの微小流体アーキテクチャーと、非細菌核酸の単離および精製に利用される図37Aの微小流体アーキテクチャーとの別の差異は、共通する制御ラインにより制御されるパラレル流れ構造の使用である。しかし、この技術はまた、図40と組み合わせて例示されるように、非細菌核酸の単離および精製においても用いられ得る。
【0266】
図40は、本発明による微小流体アーキテクチャーの代替の実施形態の平面図を示す。微小流体アーキテクチャー6500は、SMART cDNAライブラリーキットをチップフォーマットで履行することにより8つのcDNAライブラリーを同時に生成することを可能にする。
【0267】
入力の左カラム6502は、溶出緩衝液多岐管に連結され得る。上部の行6504は、コントロールラインおよび試薬入力を含み;10の試薬入力は、順に、幹細胞、溶解緩衝液、オリゴdTビーズ、プライマー、逆転写酵素、PCR試薬、プロテイナーゼK、SwiI、プラスミド、およびコンピテント細菌を含む。上部の行の流れおよびコントロール入口は、展開されて巨視的連結のためのスペースへの接近を可能にする。
【0268】
図40の平行cDNA微小流体アーキテクチャーは、工程の時間感度に依存して、拡散および能動回転混合の両方を用いる。8つの別個のライブラリーが出力6506から回収され得る。
【0269】
チップ設計6500は、細胞溶解、mRNA精製、および市販cDNAライブラリーキットのチップを基礎にした履行を組み合わせる。温度は、顕微鏡にマウントされた熱電気ステージで制御され得、そして試薬は、必要に応じて垂直チャネル中にフラッシュされ、それ故、実験のより早期のステージの間の、ねかし、変性または不適切な温度を避ける。
【0270】
チップ6500は、小数(1〜1,000)の細胞からのcDNAクローンのライブラリーを作製するように設計されている。それは、細胞を単離、溶解、およびそれからmRNAを精製するために既に記載された基礎的微小流体技法を用い、それは、次いで、ClontechからのCreator SMART cDNA Library Constructionキットを用いてコンピテントE.coli細胞中にクローン化される。このキットは、チップフォーマットに容易に変換され得る。なぜなら、それは、1チューブ、1工程反応であるからである。
【0271】
細菌は、細胞ソーターおよびMHTSCチップのために開発された方法を用いてチップから回収される。細菌は指数関数的に増殖するので、従来のゲノム技法を用いてライブラリーを質問するに十分な材料を容易に増殖し得る:DNAマイクロアレイおよび高スループットEST配列決定が2つの例である。このチップは、細胞株を用いること、およびクローン頻度を高スループットEST配列決定によって測定された頻度と比較することにより有効にされ得る。
【0272】
チップ上で小数の細胞から構築されたcDNAライブラリーを評価するために、以下の工程が続き得る。第1に、細胞の1つの大きなアリコート(1×108)が、mRNAを単離し、ゲル上の完全性をチェックするために用いられる。同じ細胞の小アリコート(1〜1000細胞)がチップ中に捕獲され、そしてmRNAが単離され、そしてゲル上でチェックされる。
【0273】
従来のcDNAライブラリー構築が、次いで、最小1ugのmRNAで実施され;同時に、cDNAイラブラリーがチップ上に構築される。初期には、従来法により単離されたmRNAを用いて、cDNAがチップ上に作製得ることを確認する。後に、第1ステージのチップ(mRNAに対する細胞)が、第2の部分(cDNAライブラリーに対するmRNA)と組み合わされる。
【0274】
次に、各ライブラリーからのランダムクローン(12)が、平均挿入サイズについて特徴付けられる。各ライブラリーから100の個々のクローンが、次いで、配列決定分析のために選択され、各cDNAライブラリーのプロフィールを確立する。
【0275】
余分のcDNAは混合され、かつプローブを作製するために用いられ、そしてハイブリダイゼーションがその他の9900コロニーに対して実施される。ネガティブコロニーが、次に配列決定される。この手順は、配列決定される必要があるコロニーの数を多いに減少する。なぜなら、余分のコロニーが取り除かれるからである。
【0276】
生命情報科学分析が次に実施され、従来のcDNAライブラリー構築物とこのチップを基礎にしたcDNAライブラリー構築との間の遺伝子発現プロフィールを比較する。
【0277】
ライブラリーの挿入サイズもまた特徴付けられる。チップの初期バージョンについて全長転写物を得ることは難しくはない。なぜなら、ヒトゲノムの分析のための生命情報科学ツールは、大部分のギャップがコンピューターによりフィルインされ得るという成熟した十分な状態であるからである。しかし、その他の適用に対するチップの後期のバージョンは、全長転写物について最適化され得る。
【0278】
本発明の実施形態による微小流体技法を利用するmRNAの単離および精製は、任意の数の適用における使用を見出し得る。1つのこのような適用は、cDNAライブラリーの構築である。別の適用は、遺伝子発現分析のためのmRNA単離であり、例えば、当業者に周知であるようなマイクロアレイチップを利用する。
【0279】
上記に記載のような微小流体アーキテクチャーは、精製された核酸の連結および形質転換で採用されるが、混合および流れスキームは、その他の有用な機能性を包含するために一般化され得る。例えば、連結または形質転換で利用される混合構造は、次に、化学的キットから特有の材料を調製するために用いられるその他の混合構造と流体連絡され得る。このような化学的キットによって調製される材料の例は、制限されないで、当業者に周知なように、連結のための特有のプラスミド、およびcDNAライブラリーを構築することで利用される特有の酵素を含む。
【0280】
上記のセクションは、微小流体チャンバ内の不均一サンプルの個々の要素またはサブセットの要素の単離を記載している。本発明による実施形態は、特定の微小流体チャンバ内の任意の特定数の関係ある生物学的実体の単離に制限されない。本発明による微小流体アーキテクチャーおよび方法の実施形態は、単一の微小流体チャンバ内の、1、2、3、4、5、6、7、8、9、10、15、20、25、30、35、40、45、50、60、70、80、90、100、200、300、400、500、1000、5,000、10000、50,000、100,000、またはなおより大きな数の生物学的実体を単離するように設計され得る。
【0281】
(4.核酸の増幅)
ポリメラーゼ連鎖反応(PCR)は、分子生物学で最も遍在するツールの1つとなり、そしてそれ故、微小流体デバイス中で履行されるべき最も重要な生化学的反応の1つは核酸を増幅する能力である。Liuら、「A Nanoliter Rorary Device for PCR」、Electrophoresis、第23巻、1531頁(2002)は、本明細書中にすべての目的のために援用され、PCRを実施するために先に微小流体構造を創製している。
【0282】
図34は、PCRを実施するための本発明による微小流体構造6300の1つの実施形態の概略図を示す。上層6302は、ポンプ類およびバルブ類を制御するための制御チャネル6304a〜dを含む。中央層6304は、入口6305a、ロータリー6305b、および出口6305c流体流れチャネルを規定する。底層6306は、一体型ヒーター構造6308およびそれと電気的連絡している電気リード6310を含む。
【0283】
流体層中のループは、ロータリーポンプを形成し、それによって、PCR試薬が、異なる温度の領域上を輸送され得る。温度は、ガラス上に蒸発されたタングステンヒーターによって設定され、これは、ナノ流体チップの底基板になる。PCR反応の総容積は12nLであった。
【0284】
図35は、ロータリーポンプチップ中で実施されたTaqman PCRアッセイの結果を示す。蛍光は、PCR反応混合物が、異なる温度領域を通ってポンプ輸送されたとき、種々の時点にインサイチュ(in situ)で測定された。β−アクチン遺伝子のフラグメントは、ヒト男性ゲノムDNAから増幅された。黒丸は、ヒトテンプレートDNAを含めた実験からのデータを表す。白丸は、テンプレートDNAが差し控えられたネガティブコントロール実験からのデータを表す。
【0285】
本発明の実施形態による精製された核酸サンプルの増幅は、図34に示される特有の微小流体構造に制限されない。代替の、より複雑な微小流体幾何学が可能である。代替の実施形態によれば、反応チャンバのマトリックスを含む微小流体構造は、nのDNAサンプルがmのプライマーペアと反応することを可能にし得、それによって、m×nの反応が同時に実施されることを可能にする。
【0286】
図36Aは、マトリックスPCR構造アーキテクチャーの平面図を示す。図36Bは、図36AのマトリックスPCR構造アーキテクチャーの1つのセルの拡大図を示す。図36A〜Bに示されるマトリックスPCR構造アーキテクチャーの完全な説明は、すべての目的のために本明細書中に参考として援用される、米国仮特許出願第60/494,432号に記載される。
【0287】
図36A〜Bの概略レイアウトに示されるように、このデバイスは、別個の機能を有する3つの層を備える。中央のマトリックス流れチャネル構造は、一体型水力バルブを備える上層と、空気圧ポンプを備える下層との間に挟持される。中央層において、微小流体流れチャネルは、106μm幅および1214μm高さである。マトリックスの各頭頂は、約3nLの容量を有する、リアクターを含む矩形形状のチャネルを含む。
【0288】
リアクターの各行は、それを通じて特有のプライマーが装填され得る、別個の入力ポート(直径が約625μm)に連結される。各カラムは、同様に、異なるDNAテンプレートでリアクターを装填し得る。ポリメラーゼの付加のための単一の入力は、マトリックス中のすべてのリアクターに連結される。
【0289】
上部制御層では、バルブシステムが、交差汚染を防ぎながら、各リアクターに3つの異なる別個の試薬を装填するように設計されている。水平方向または垂直方向にディスプレイされる合計2860のバルブが、穴を通るたった2つの独立の圧力供給によって制御される。さらに、大バルブ(図36の挿入ではB、270μm幅)または小バルブ(C、96μm幅)は選択的に作動され得る。なぜなら、それらは、作動に必要な水圧の異なる閾値を有しているからである。
【0290】
試薬装填は、バルブシステムを連結する狭い制御チャネル(42μm幅)によってはブロックされない。なぜなら、それらの小さなメンブレンが、用いられる作動圧力で偏向しないからである。第2の底部制御層は、試薬の混合を容易にするために20×20のアレイのロータリーポンプを備えるからである。
【0291】
上部制御層中の能動バルブは、試薬の装填および単離を容易にする。バルブAを作動し、プライマーセットは、マトリックスの各行に沿って装填される。バルブBおよびCの能動化は、各リアクター内のプライマーの良好に規定された容量を隔離する。
【0292】
バルブAが次いで開けられ、各カラムを下るDNAテンプレートの装填を許容し、その一方、ポリメラーゼは、単一の入口からすべてのリアクターに同時に導入される。バルブAはもう一度能動化され、ポリメラーゼおよびテンプレートの所望の容量を規定し、そして各リアクターを隔離する。
【0293】
バルブBおよびCの異なるメンブレン領域は、作動圧力を260から110kPaに減少することによりバルブCの選択的開放を許容し、それ故、3つすべての成分を各リアクター内で流体接触にもたらす。底部層中のペリスタポンプは、リアクター内のすべての試薬の迅速回転混合を許容する。
【0294】
図36A〜B中に示されるマトリックスPCR微小流体デバイス設計は、ナノ流体チップをマクロ世界にインターフェースすることに関する問題を取り扱うことにおける進歩を表す。なぜなら、DNAテンプレートおよびプライマーサンプルは、チップ上で、それぞれ、mおよびn倍に区画されるからである。さらに、しばしば、サンプルの最も高価な部分であるポリメラーゼはm×nの係数によって区画される。設計は、単純に倍率をかけて、n=20およびm=20である場合、400の同時の反応を生じる微小流体デバイスの製作を可能にする。
【0295】
(5.核酸の連結)
一旦、核酸が精製されると、それは、細胞内に取り込まれ得、そして次に発現され得る。このような発現プロセスの最初の工程は、この核酸をプラスミドのような宿主ベクター内に連結することである。図33は、精製された核酸のこのような連結および発現のために適切な微小流体アーキテクチャーの1つの実施形態の平面図を示す。図33の微小流体構造6200は、核酸の連結のために用いられる第1のセットの平行混合構造、および連結された、精製核酸での細胞の形質転換のために用いられる第2のセットの平行混合構造を備える。
【0296】
図33Aは、精製核酸の連結を可能にする図33の微小流体アーキテクチャーの領域の拡大図を示す。制御ライン6205は、混合構造6201、6202、6203の各々を二分し、流体的に隔離された半球を生成する。混合構造6201の第1の半球6
201aは、入口流れチャネル6207と流体連絡している。第2の混合構造6202の第1の半球6202aは、連結流れチャネル6209を通って第1の混合構造6201の第1の半球6201aと流体連絡している。第3の混合構造6203の第1の半球6203aは、連結流れチャネル6211を通って第2の混合構造6202の第1の半球6202aと流体連絡している。制御ライン6205の作動は、宿主ベクター/プラスミドが入口6207を通じて流れることを可能にし、そして6209および6211を、3つすべての混合構造の第1の半球中に連結する。
【0297】
混合構造6201の第2の半球6201bは、入口流れチャネル6213と流体連絡している。第2の混合構造6202の第2の半球6202bは、連結流れチャネル6215を通って第1の半球6201と流体連絡している。第3の混合構造6203の第2の半球6203bは、連結流れチャネル6217を通って第2の混合構造6202の第2の半球6202bと流体連絡している。制御ライン6205の作動は、精製核酸が、入口6213および分岐6215および6217を通って、3つすべての混合構造の第2の半球中に流れる連結酵素と混合されることを可能にする。
【0298】
混合構造6201、6202、および6203の第2の半球6201b、6202b、および6203bの各々はまた、装填構造6290を通る入口流れチャネル6221との流体連絡している。詳細には、制御ライン6227が作動される間、流体は流れチャネル6221を通って流れる。制御ライン6227によって規定されるバルブの閉鎖状態の結果として、この流体が下に流れるチャネル6221は反れて、交差−コネクター流れチャネル6229および流れチャネル6219および6223を利用する。流れチャネル6219および6223は開放端部であるので、装填構造6290は、それ故、洗浄またはその他の流体で迅速に充填され得、そうでなければ行き詰まりの装填流れチャネル6221に必要であり得る遅延を避ける。
【0299】
次に、制御ライン6227は作動を解かれ、そして制御ライン6225が作動され、その結果、流れチャネル6221への圧力の付与が、装填構造6290の内容物が、混合構造6201、6202、および6203の第2の半球6201b、6202b、および6203b中にそれぞれ流れることを生じる。まさに示された様式で、入口6221を利用して、混合構造に、後に遺伝子形質転換の間に有用な洗浄流体および/またはSOC培地を装填する。
【0300】
一旦、混合構造6201、6202、および6203の第1および第2の半球が、ベクターおよび連結酵素/精製核酸でそれぞれ装填されると、制御チャネル6231a〜cが系統的な様式で作動され得、これら混合構造内の循環を達成する。この循環は、酵素が宿主ベクター/プラスミド内で精製核酸を連結することを生じる。
【0301】
(6.核酸での細胞の形質転換)
図33の微小流体構造6200はまた、連結された精製核酸で細胞を形質転換するために用いられる平行混合構造6251、6252、および6253の第2のセットを備える。図33Bは、連結された精製核酸での細胞形質転換を可能にする図33の微小流体アーキテクチャーの領域の拡大図を示す。
【0302】
細胞形質転換のために採用されるこの微小流体アーキテクチャーは、核酸連結のために用いられるのと類似している。詳細には、3つの平行混合構造6251、6252、および6253は、制御ライン6255によって二分され、流体が隔離される半球を生成する。混合構造6251の第1の半球6251aは、入口流れチャネル6257と流体連絡している。第2の混合構造6252の第1の半球6252aは、連結流れチャネル6259を通って第1の混合構造6251の第1の半球6251aと流体連絡している。第3の混合構造6253の第1の半球6253aは、連結流れチャネル6261を通って第2の混合構造6252の第1の半球6252aと流体連絡している。制御ライン6255の作動は、宿主細胞が、入口6257およびリンク6259および6261を通って、3つすべての平行混合構造6151〜6153の第1の半球中に流れることを可能にする。
【0303】
混合構造6251の第2の半球6251bは、連結流れチャネル6271を通って混合構造6201と流体連絡している。混合構造6252の第2の半球6252bは、連結流れチャネル6272を通って混合構造6202と流体連絡している。混合構造6253の第2の半球6253bは、連結流れチャネル6273を通って混合構造6203と流体連絡している。制御ライン6275は、連結流れチャネル6171〜6173の各々の上に横たわり、このアーキテクチャーの核酸連結領域をこのアーキテクチャーの細胞形質転換領域から隔離するバルブを規定する。
【0304】
一旦、これら混合構造の第1の半球が、形質転換されるべき細胞で装填されると、制御ライン6255の作動を解き、そして連結核酸を取り込む宿主ベクターが第1の混合構造6201、6202、および6203から第2の混合構造6251、6252、および6253にそれぞれ流れる。制御チャネル6177a〜cは系統的な様式で作動され、これら混合構造内の細胞および宿主ベクターの循環を達成する。
【0305】
第2の混合構造の内容物への熱ショックの付与に際し、細胞は、ベクターおよびその中に存在する精製核酸を取り込む。このような熱ショックは、全体の流体チップを横切って付与され得るか、またはそれに代わって、その目的のために製作された小さな温度制御構造を利用して第2の混合構造に局所的にのみ付与され得る。
【0306】
(7.形質転換細胞の培養)
一旦、第2の混合構造内の細胞が、熱ショックに曝され、そしてそれによって、精製核酸を含む宿主ベクターを取り込むと、それらは、培養のために出口流れチャネル6179a〜cから流れ得る。1つの実施形態によれば、形質転換細胞は、培養のためにチップから除去され得る。あるいは、形質転換された細胞を培養することは、上記で説明された細胞ペンまたはケージ中でチップ上直接行われ得る。
【0307】
培養および形質転換された細胞は、取り込まれたベクター中に存在する精製核酸を発現することが予期され得る。細胞単離への代替のアプローチと組み合わせて上記で記載したように、この培養された形質転換細胞は、さらなる微小流体構造によってソートされ得る。このソーティングは、精製核酸のそれらの発現から生じる形質転換細胞の生理的特徴に依存し得る。
【0308】
(8.細菌/ウイルス核酸のための適用)
進化のバリエーション:細胞−>gDNA−>PCR−>回収DNA
本発明による核酸精製について1つの適用は、制限されたセットの遺伝子における進化のバリエーションを研究することである。進化の関係は、現在、リボゾームRNAか、または利用可能であるとき、全ゲノム比較のいずれかを主に基礎にして推定されている。本発明の実施形態によれば、サンプルの微小流体操作は、培養することができない細菌における選択された遺伝子についての変異の分布の比例的測定を可能とし得る。この微小流体アーキテクチャーは、サンプルから単一の細菌を単離し、その細菌を溶解し、そして次にこの細菌からゲノムDNAを精製し得る。この微小流体アーキテクチャーは、次いで、PCRを用いて選択された遺伝子(または遺伝子のセット)を増幅し得る。この増幅された材料は、チップから回収され得、再増幅され、そして配列決定される。
【0309】
gDNAクローン化ライブラリー:細胞−>gDNA−>消化−>gDNAライブラリー
本発明による別の実施形態によれば、ゲノムDNAのクローン化ライブラリーが、単一または小数の細菌から創製され得る。希釈サンプルからの個々の細菌は、微小流体チャンバ中に分配され得る。次いで、細菌は溶解され、ゲノムDNAが精製され、消化され、そして次にクローニングベクター中に連結される。これらのベクターは、次いで、図33と組み合わせて記載したように、熱ショックを用いること、および混合することにより、E.coli中に形質転換される。
【0310】
1〜2kbpの範囲の平均挿入サイズを可能にするベクターが用いられ得る。gDNAライブラリーが回収され得、そして従来のゲノム方法を用いて分析される。このgDNAライブラリーは、マイクロアレイへのハイブリダイゼーション、または代表的な配列決定によって特徴付けられ得る。クローニング効率が測定され、かつ評価され得る。
【0311】
クローン化BACライブラリー:細胞−>gDNA−>消化−>BACライブラリー
本発明のなおその他の実施形態によれば、微小流体アーキテクチャーを用いて、単一または小数の細菌からのゲノムDNAのクローン化細菌人工染色体(BAC)ライブラリーを作製し得る。これらのBACライブラリーは、約200kbpのオーダーのかなりより大きな平均挿入サイズを有する利点を提供する。
【0312】
個々の細菌は、チップ上のチャンバ中に分配され得る。次いで、単離された細菌は溶解され得、そして得られるゲノムDNAは精製され、消化され、そして次にクローニングベクター中に連結され得る。これらのベクターは、次いで、E.coli中に形質転換され得る。BACを構築するためのベクターおよび試薬は、公知の供給源から供給され得る。得られるBACライブラリーは、チップから回収され得、そして従来のゲノム方法を用いて分析される。回収されたBACライブラリーは、末端配列決定により特徴付けられ得る。クローニング効率が測定され、かつ評価され得る。
【0313】
BACライブラリーを用いることは、遺伝子順序を保存すること、再アセンブリをより容易にする利点を提供する。先行する全ゲノム配列決定努力におけるように、長い挿入ライブラリーおよび短い挿入ライブラリーを有することは、最も完全な可能なゲノムアセンブリを達成することで有用であり得る。
【0314】
(微生物の多様性の特徴付け)
一世紀にわたって、シロアリの胃内容物は、豊富かつ微生物学的に多岐にわたるスピロヘータの顕微鏡観察のための優れた供給源であるとして言及されてきた。スピロヘータは、超微細構造的に別個でありかつ遺伝的に首尾一貫しいている、原核生物の門レベルの集合である。多くのシロアリの胃において有力である(時には、直接数のうちの50%程度の多さを占める)が、スピロヘータはまた、「培養可能ではないこと」についての評判を有する。しかし、Leadbetterらは、カリフォルニア湿材(dampwod)シロアリ(Zootemopsis angusticollis)の後腸内容物由来の9株のコレクションを集めた。
【0315】
得られた最初の単離株ZAS−1およびZAS−2は、H2+CO2酢酸生成することが可能であることが示されている。最初の代表的シロアリ単離物であることに加えて、これらは、Spirochetes門において、初めて、化学合成無機栄養代謝可能であることが示された。さらに、これは、Firmicutes門、Clostridium綱に属さない何らかの微生物によるH2+CO2酢酸生成代謝を最初に示したものであった。
【0316】
かなりのことが、Zootemopsisの後腸の非培養微生物の多様性の機能に関して、学ばれ得る。Leadbetterらは、その後腸の細菌群生の分子目録(Inventory)を得た。サンプル中の種々の種の細菌は、それらの細胞塊、表面領域、および活性速度において差異を有し得る。さらに問題を複雑にすることに、種々の細菌種が、そのゲノム上にコードされる1個から12個を超えるrRNA遺伝子をどこかに有し得る。これにより、(そのDNAから増幅することにより評価した場合に)サンプル中で豊富な遺伝子を、それをコードする生物の活性バイオマス(これは、それ自体を全rRNA含量として表す)と相関付けることが困難である。
【0317】
胃における活性微生物の良好な理解を得るために、細胞体積、活性、16s遺伝子コピー数が、そのrRNA自体から分子目録(Inventory)を誘導することによって「正規化」された。(全胃核酸からの)RNA精製およびRT−PCRが、cDNAテンプレートを構築するために使用され、その後、このcDNAテンプレートから、目録(Inventory)が増幅されてクローン化された。
【0318】
この目録(inventory)は、すべてのBacteriaプライマーを使用する細菌配列の回収に焦点を合わせた。従って、この目録は、原生動物代表物も古細菌代表物も含まない。約200個の完全16s rRNA配列が、クローン化されRFLP選別され、それにより、約50個の独特なリボタイプが同定された。回収されたクローンのうちの20%を超えるものが、極めて分岐した細菌系統である「Leptospirillumおよび関連種」に属する未知の微生物に対応した。この門に属する唯一の研究された微生物は、1)鉄を酸化することにより生存する高度好酸性であるか、2)亜硝酸塩を酸化することにより生存する好気性菌であるか、または3)硫酸塩を硫化物にして呼吸する高熱菌である。
【0319】
しかし、この微生物の系統学を知ることは、その生理についても機能についてもほとんど明らかにしない。このような異化作用のいずれかを有する何らかの微生物についての何らかの動物の胃における生態学的地位は、知られておらず、上記目録の結果から推測されるように、シロアリ後腸における5番目の活性微生物バイオマスは、なお潜在的には、そのような異化作用を有するこれらに関連する微生物に由来する。これらの細菌の推定量に起因して、それらは、細胞選別の効力および影響を探求するための、さらにナノ流体デバイスを介する深さ分析における、優れた候補物になる。
【0320】
ヒト胃における微生物の多様性はまた、以前に考察されたgDNAチップを使用して特徴付けられ得る。以下のモデルは、そのような実験から予測されるデータの品質を評価するために使用され得る。ライブラリーが、1,000個の個別の細菌集団から作製されると仮定すると、この集団は、ほぼ100種から構成され、それらの種の各々が10回出現する。さらに、各細菌ゲノムが1Mbpであること、および平均インサートサイズが1kbpであると仮定する。このgDNAチップが100%の効率でクローン化された場合、得られるライブラリーは、100種の細菌種各々の10倍の有効範囲を有する。より現実的な数字である10%効率を仮定すると、各種は、平均1倍の有効範囲を有する。
【0321】
所定の任意の種について、この有効範囲は、10個の異なるライブラリーにわたって広がり、この1,000個のライブラリーのうちのどの10個がこのライブラリーであるかについての先験的知見は何らない。このことは、これらのライブラリーが完全に配列決定された場合に、同じ種に属するものとしてそれらのライブラリー間での重複を関連付けるために十分な重複が存在するか否かという、自然な疑問をもたらす。
【0322】
上記の数字を使用する簡単な計算は、任意のライブラリー対を関連付けることができない確率は、ほぼe−20であることを示す。従って、各ライブラリーを完全に配列決定した後、所定の任意のライブラリーは、同じに由来する別のライブラリーと関連付けることが可能である。これにより、ライブラリーデータの完全なデコンボリューションおよびサンプルの微生物多様性の再構築が可能になる。
【0323】
従って、上記の仮説的な例において、平均配列決定読取り長が500塩基対であり、すべての細菌ゲノムが未知であった場合、1回の実験当たり200,000個の配列決定レーンが、必要である(すなわち、1,000個の細菌当たり)。実際、既知のゲノムの再配列決定は、それらのゲノムが同定されるとすぐに停止される。これらは、少数の配列決定レーンの後であるべきである。
【0324】
別の実験セットにより、細胞選別要素を、直前に記載されたgDNAチップの前に組み込むことが探求される。抗体マーカーおよびFACSが、未知の細菌についてその集団を濃縮するために使用され、それにより、既知種を廃棄物チャネルに選別し、未知細菌を収集することが可能になる。
【0325】
上記の胃微生物の多くは、別個の異なる形態を有する。これにより、その形態の基礎となる遺伝的多様性の重要なサンプルを同定して収集することが、合理的に簡単になる。収集した個体のゲノムDNAのBACライブラリーが、構築される。この後、各BACライブラリーからのクローンが、本発明者らにより16S rRNA分子目録(inventory)の間に以前に同定された未だ培養されていない鉄酸化細菌関連体の遺伝子をコードするrRNAのみを特異的に増幅するように設計されたプライマーを用いてスクリーニングされる。
【0326】
一旦同定されると、上記rDNAをコードする単一ゲノムDNAフラグメントを含むBACクローンだけではなく、そのリボタイプを有する細胞の全ゲノムまたはほぼ全ゲノムのライブラリーもまた、回収される。
【0327】
(微生物生態)
微生物生態は、特定の環境と、その環境中に存在する生物学的実体との間の関係を探求する、新たに生まれた研究分野である。そのような環境的生物学的実態の特性および遺伝的構成の調査は、その環境中に存在するペニシリンカビの抗生物質特性の発見により例証されるような、ものすごい利益を提供し得る。
【0328】
偶発的に、ペニシリンは、実験室培養されやすいことが示されており、その抗生物質特性は、調査および利用することが可能であった。しかし、その環境由来の細菌細胞および他の生物学的実体のうちの比較的大部分が、現在まで実験室培養に抵抗している。これらの環境的生物学的実体を制御された条件下にて複製することが継続してできないことにより、それらの遺伝的情報および代謝能力に対する接近が現在まで防止され、それにより、微生物生態の調査が制限されている。
【0329】
特定の生態環境または臨床環境中に存在する未だ培養されていない生物学的実体に関する情報を収集する試みにおいて、多くの研究者が、メタゲノミクスにおいて、生物学的実体の非常に複雑な不均質混合物を含むサンプルが、環境から収集される。そのサンプル内に存在する生物学的実体は、全体として破壊され、生じた核酸およびその中に含まれる遺伝情報が、まず、具体的な生物にではなく環境全体に対応する、単一単位−「メタ」ゲノムとして処理される。最近のメタゲノム調査の例としては、Lorenzら「Screening for novel enzymes for biocatalytic processes:accessing the metagenome as a resource of novel functional sequence space」J.Curr Opin Biotechnol.2002 Dec;13(6):572〜7;およびRondonら「Cloning the soil metagenome:a strategy for accessing the genetic and functional diversity of uncultured microorganisms」Appl Environ Microbiol.2000 Jun;66(6):2541〜7(これらは、両方とも、すべての目的のために本明細書中で参考として援用される)が挙げられる。
【0330】
メタゲノミクスが、微生物生態調査についていくらかの期待を示す一方で、メタゲノミクスは、いくらかの深刻な欠点を提供する。メタゲノミクスアプローチの一欠点は、得られる遺伝情報(すなわち、核酸)と、その情報の起源(すなわち、その核酸を含む生物学的実体)との間の関係の分離である。情報と供給源との間のこの関係は、群生の生物複雑度という難局から、大いなる努力のみにて再構築され得る。従って、そのようなメタゲノムアプローチを使用して、上記遺伝子が同じBACゲノムフラグメント上に共に位置する場合に、上記遺伝子を同じ生物学的実体由来であると同定することは、簡単になった。上記種についてのゲノムライブラリーの残りは、非常に不均質な環境サンプルまたは臨床サンプル中に存在するすべての生物学的実体または要素の全体的破壊によって生成される、分別不能な巨大なBAC混合物へと失われる。
【0331】
対照的に、本発明の実施形態に従う微小流体技術は、メタゲノムアプローチに対する有望な代替法を提供する。具体的には、微小流体方法およびアーキテクチャーは、より大きなサンプル内にある個々または少数の生物学的実体の物理的単離を可能にする。個々または部分集合の生物学的実体内に存在する核酸のその後の精製は、物理的に分離された生物学的実体から得られる形態学的情報、リボタイプ情報および遺伝子型情報に容易に連結され得る。これは、クローニングに到るメタゲノムアプローチとは対照的である。このメタゲノムアプローチにおいては、全群生環境DNAが、制限され、そしてBACライブラリーへとクローニングされる。微生物群生の正味の配列決定は、メタゲノム技術および微小流体技術の両方を使用して達成されるが、後者のアプローチにおいてだけ、維持される個々のゲノムの情報の首尾一貫性が存在する。
【0332】
(9.非細菌核酸についての増幅)
上記の説明は、現在まで、細菌またはウイルスから核酸を精製するための適用に焦点を合わせている。しかし、本発明は、この特定の適用に限定されず、代替的実施形態に従って、哺乳動物細胞型または他の非細菌細胞型に由来する核酸が、2003年8月11日に出願した米国特許仮出願番号60/494,388(すべての目的のために本明細書中に参考として援用される)において詳細に考察されるように、微量流体アプローチを使用して精製され得る。
【0333】
(細胞→mRNA→cDNA→マトリックスにおけるTaqman PCR)
一実施形態に従って、微小流体チップを設計して、少数の細胞(1個〜1,000個)を取得し、それらの細胞を溶解し、mRNAを精製し、cDNAを生成し、そしてマトリックスの外形におけるTaqman PCRを使用して、特定の転写物の存在を検出し得る。そのような微小流体構造を使用して、mRNA精製およびcDNA合成のパラメーターを最適化し得る。
【0334】
細胞溶解、ビート捕捉、親和性精製、およびTaqman PCRのための要素を合わせて、選択した遺伝子を精製してその発現を検出し得る。cDNAを生成するために使用される細胞の数を、対称的に変化させ得、従来の巨視的技術において使用した多数からの結果を、1,000個の細胞、100個の細胞、10個の細胞、および1個の細胞を使用したチップベースの結果と比較し得る。そのような比較により、細胞数確率論の効果の理解、および中程度のコピー数および低コピー数のmRNAの信頼できる測定を行なうために必要な細胞の数の決定が、可能になる。
【0335】
そのような微小流体設計の利点は、この設計により、クローニングプロセスにおいてさらなる損失を導入することなく、cDNA生成効率の直接的測定が可能になることである。十分に特徴付けられた細胞株(例えば、NIH_MGC_53またはNIH_MGC_93)(これらについて、広範なESTおよびマイクロアレイデータが存在する)を、これらの実験のために使用し得る。組織の代わりに細胞株を使用すると、不均質サンプルにおける未同定部分集団からの結果において、可能なバイアスを制御する。チップの結果を、手動で得られる従来の結果およびNIH ESTデータベースにおいて列挙される結果(配列決定された10,000個のクローン)と比較することによって、確認を行い得る。
【0336】
(細胞→mRNA→cDNA→RNA→マイクロアレイ)
別の適用において、微小流体チップを設計して、少数の細胞(1個〜1,000個)を取得し、それらを溶解し、mRNAを精製し、T7プロモーターを用いてcDNAを生成し、その後、T7RNAポリメラーゼを使用して、線形増幅された蛍光RNAを生成し得、その後、その蛍光RNAをマイクロアレイにハイブリダイズし得る。このマイクロアレイは、表面ビオチニル化について以前に示された表面誘導体化と類似する方法を使用して、チップ上にインサイチュで製造し得る。
【0337】
そのようなチップアーキテクチャーは、最初の確認よりも厳密なcDNAの品質の試験を提供する。なぜなら、増幅段階は、線形であるからである。確認は、従来の方法により得られるDNAマイクロアレイデータと比較することによって、実施し得る。また、細胞株の使用により、未同定部分集団について制御される。そのような微小流体構造について可能な適用としては、腫瘍型分類、臨床診断、処置結果の予測、および発生生物学が挙げられる。
【0338】
(細胞→mRNA→cDNA→差次的にクローン化されたライブラリー)
なお別の適用において、微小流体チップを設計して、少数(1個〜1,000個)の細胞から、cDNAクローンのライブラリーを構築し得る。そのようなチップは、上記ライブラリーを構築するためにもとのcDNAチップの方法を使用し得る。
【0339】
しかし、この適用において、2つの細胞集団を、並行して処理し、クローニングの前に、上記ライブラリーを互いに対して正規化する。そのようなチップ構造を、従来技術を使用し得る2つの細胞株を使用して確認し得る。得られるライブラリー要素を、配列決定し得る。
【0340】
(造血幹細胞の研究)
多能性造血幹細胞(PHSC)は、骨髄中に存在し、かつ血液系の動態を維持する、稀な細胞集団である。固有の特徴および環境の影響に従って、これらの細胞は、以下の経路のうちの1つへと移動する:始原幹細胞としての自己再生、分化した造血細胞への成熟、またはアポトーシス。生体の骨髄において、これらの3つの経路の間のバランスは、清浄な造血を提供するために維持される。
【0341】
制限希釈競合再生アッセイに基づいて、骨髄中のPHSCの頻度は、100,000個の有核細胞中で約1個である。PHSCの単離は、その機能を研究する際に必要な段階である。
【0342】
PHSCを単離するためのこの分野で最も信頼できる方法は、マーカーとして種々の細胞膜表面タンパク質を使用するFACS選別を使用することである。精製したマウスPHSCは、Summitデータ分析ソフトウェアを用いる3レーザーMoFlo Cytometerを使用する5色FACS選別システムを開発することによって、得られた(他の調査者は、3色タンパク質発現プロフィールに基づく3色選別を使用し、いくつかのグループは、4色選別を行ない得る)。
【0343】
5色システムを用いて、骨髄細胞を、異なる発蛍光団に結合体化した5つの異なる抗体(系統マーカーカクテル、抗Sca 1、抗c kit、抗CD38、および抗CD34)を用いて標識した。ほとんどの始原造血幹細胞は、表面発現プロフィール(LinSca 1+kit+CD38+CD34(+++−細胞と略す))により特徴付けられる。これらの細胞(長期再増殖細胞(LTRC)と呼ばれる)は、致死的に照射されたマウスにおける血液系の長期再増殖を提供することが示された。
【0344】
図41A〜Bは、マウス骨髄細胞の表面マーカー発現のフローサイトメトリー分析を示す。系統陽性細胞を、フローサイトメトリーの前にCSカラムにより除去した。図41Aは、細胞表面上でのSca 1およびc kitの発現が、示されるようにゲーティングされたことを示す。Lin−Sca+kit+細胞は、ボックスAにおいて示されるようにゲーティングされた。
【0345】
図41Bは、Lin−Sca+kit+細胞の細胞表面上でのCD38およびCD34の発現を使用して、左図のボックスAにおいて示される部分集団を、以下の4つの部分集合:Sca+kit+CD38−CD34、Sca+kit+CD38+CD34+、Sca+kit+CD38−CD34+、およびSca+kit+CD38−CD34−へと分離したことを示す。各集団における細胞を、選別し、再増殖アッセイにおける分析のために収集した。図41A〜Bに基づいて、骨髄有核細胞における頻度は、100,000個の有核細胞中2個であることが示された。
【0346】
さらなる分析により、生理学的経路は、+++−細胞が、次に、++++細胞(LinSca 1+kit+CD38+CD34+)へと分化し、その後、++−+細胞(Lin Sca 1+kit+CD38−CD34+)へと分化するようであることが、示された。++++細胞および++−+細胞の両方が、短期再増殖細胞(STRC)の分類に属する。なぜなら、これらは、致死的に照射したマウスを複数の週間だけ再増殖し得るが、動物の通常の寿命の間までは再増殖し得ないからである。しかし、LTRCおよびSTRCの両方は、致死的に照射したレシピエントを効果的にレスキューする必要がある。
【0347】
上記の知見から、PHSC調節の仮説を、以下のようにモデル化する。図42は、マウス多能性造血幹細胞について提唱される調節ネットワークを示す。示されるように、これらの骨髄部分集合の間のシグナル(陽性および/または陰性)は、骨髄注の幹細胞の区画内の細胞のバランスを調節し、それにより、造血を制御する。図42に示される部分的調節ネットワークを支持する予備的証拠が、得られた。
【0348】
ヒトにおいて造血を制御する調節機構を理解することは、その系をインビボで操作することを可能にする。そのような制御は、広範囲の臨床適用(癌治療、血液疾患の処置、遺伝的障害、ならびに幹細胞遺伝子治療を包含する)を有する。
【0349】
造血の調節に対する洞察を得るためのアプローチのうちの1つは、細胞成熟の初期段階において特異的に発現される遺伝子を同定し、その後、造血経路におけるその遺伝子の機能を決定することである。+++−細胞において特異的に発現されるが、++++細胞でも++−+細胞でも発現されない遺伝子は、LTRC表現型を特異的に提供する遺伝子を決定するために同定された。
【0350】
具体的には、ディファレンシャルディスプレイPCR(DD PCR)を使用して、184個の遺伝子転写物を、合計1395個のDD PCRフラグメントから、++++細胞および++−+細胞と比較して、+++−細胞において有意に増加しているかまたは独特に発現されるとして、同定した。これらの184個の遺伝子フラグメントを、逆ノーザンブロットにより確認し、サブクローニングし、そして配列決定した。
【0351】
3つの既知データベース、Genbank、EST(発現配列タグ)、およびPrinceton大学からの幹細胞データベース(Ihor Lemishkaにより開発された)を、スクリーニングした。それらの遺伝子のうちの72個(39%)が、既知の機能を有する遺伝子に対して相同性を示した。15個の遺伝子(8%)が、上記ESTデータベースにおける配列に対して相同性を示した。
【0352】
97個の遺伝子(53%)は、新規であるようである。すなわち、それらは、試験した3つのデータベースにおけるいかなる配列に対しても相同性を有さない。Celeraデータベースを、これらの「未知」遺伝子についてスクリーニングし得る。これらの「未知」遺伝子の全長バージョンを得るために、市販の17日齢マウス胚cDNAライブラリーを、まず、スクリーニングした。しかし、それらの遺伝子のうちのわずか10.1%しか、PCR反応において陽性シグナルを生じなかった。
【0353】
上記胚cDNAライブラリーは、細胞型の混合物から誘導した。結果として、何らかの単一細胞型からの低発現転写物が、バックグラウンド中に隠れる。
【0354】
従って、2つのcDNAライブラリーを、全マウス骨髄を出発点として使用して構築した。1つのライブラリーは、「低密度細胞」由来であり、第2のライブラリーは、「系統陰性」細胞由来であった。市販のcDNAライブラリー調製物のために必要とされるような約1×108個の胞を必要とすることなく、各段階の規模を小さくすることによって、1×104〜5個の細胞を含む妥当なライブラリーが、得られた。
【0355】
上記低密度細胞および系統陰性細胞cDNAライブラリーを、ClontechおよびGibco BRLによってそれぞれ開発された技術を用いて、構築した。放射性のトレーサー(32P dCTP)を、各ライブラリー構築物からアリコートで使用して、1’’および2’’の鎖合成効率を測定した。
【0356】
12個のランダムなクローンを選び、DNAを、調製し、その後、制限酵素消化した。インサートの平均サイズは、低密度細胞ライブラリーについて1.5kb(インサートサイズ範囲は、0.8kb〜3.1kb)であり、系統陰性細胞ライブラリーについては、平均2.2kbであった。しかし、合計109個および108個の細胞を、それぞれ必要とした。
【0357】
上記の3つのcDNAライブラリーの各々について「未知」遺伝子フラグメントを使用する陽性PCR反応を比較して、観察される陽性頻度は、系統陰性細胞cDNAライブラリーにおいて最高であり、系統陰性ライブラリーにおいて30%であり、低密度ライブラリーで18%であり、市販の17日齢胚ライブラリーで17%であった。それにも関わらず、+++細胞は、なお、系統陰性ライブラリーにおいてさえ稀な集団である(100,000個の細胞中50個)。上記遺伝子のうちの70個は、欠失したままである。
【0358】
適切な解決は、+++−細胞からcDNAライブラリーを構築することである。しかし、1×105個の+++−細胞を得ることは、非常に困難な作業である。約200個の+++−細胞を、1匹のマウスから取得し得る。従って、1×105個の+++−細胞を得ることには、500匹のマウスから骨髄細胞を採取することが必要であり、これは、学術研究室にとって論理的に不可能な作業である。さらに、5色選別さえ、純粋な細胞集団を提供しない。
【0359】
従って、本発明に従う微小流体アプローチの実施形態に従って、1個またはほんの2〜3個の細胞からチップ上にcDNAライブラリーを生成することは、両方の問題に取り組む。具体的には、微小流体の使用は、限定数の細胞しか含まず、任意の始原細胞集団中の細胞混合物の減少に起因して、比較的純粋な物質を生じる。
【0360】
上記の説明は、ウイルス、細菌、および多細胞生物から核酸を単離および精製するための微小流体構造の使用に焦点を合わせたが、本発明は、この特定の適用に限定はされない。代替的実施形態に従って、核酸以外の生物学的実体の要素が、本発明を使用して回収および精製され得る。例えば、ウイルス、細菌、または細胞の中に存在するタンパク質は、溶解を通して露出され得、その後、回収され得、そして本発明の実施形態に従って分析および精製され得る。
【0361】
上記の説明は、ウイルス、細胞、または細菌の要素の単離を、単離された要素の精製と組み合わせる、微小流体構造に焦点を合わせたが、これは、本発明には必要とされない。代替的実施形態において、サンプルからの生物学的実体のうちの1つまたは部分集合の単離および溶解の直後に、分析し得、介在する精製工程は必要としない。
【0362】
そのような代替的な実施形態は、ただ1つまたは少数の生物学的実体の微小流体単離が達成されて、生じた溶解混合物の全体的複雑度が減少した場合に、特に価値が有り得る。そのような代替的実施形態はまた、混合物中に存在する特定の標的に対して非常に感度の高い技術を使用して混合物を分析する場合に、価値があることが証明された。
【0363】
本発明は、その特定の実施形態に関して本明細書中に記載されているが、一定の範囲の改変、種々の変化および置換が、上記の開示において意図される。いくつかの場合において、本発明のいくつかの特徴は、示されるような本発明の範囲から逸脱することなく、他の特徴を対応して使用することなく使用されることが、認識される。従って、多くの改変が、本発明の不可欠の範囲および趣旨から逸脱することなく、本発明の教示に特定の状況または物質を適合させるためになされ得る。本発明は、本発明を実施するために企図される最良の様式として開示される特定の実施形態には限定されないこと、しかし、本発明は、特許請求の範囲の範囲内にあるすべての実施形態および等価物を包含することが、意図される。
【特許請求の範囲】
【請求項1】
明細書に記載の発明。
【請求項1】
明細書に記載の発明。
【図8】


【図9】


【図14】


【図22A】


【図22B】


【図23】


【図27A】


【図27B】


【図27C】


【図27D】


【図27E】


【図27F】


【図27G】


【図27H】


【図28】


【図29A】


【図33A】


【図33B】


【図35】


【図36A】


【図36B】


【図37A】


【図39】


【図40】


【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7A】


【図7B】


【図7C】


【図7D】


【図7E】


【図7F】


【図7G】


【図7H】


【図10】


【図11】


【図12A】


【図12B】


【図13A】


【図13B】


【図15A】


【図15B】


【図16】


【図17A】


【図17B】


【図17C】


【図17D】


【図18】


【図19】


【図20】


【図21】


【図22C】


【図24】


【図24A】


【図24B】


【図25】


【図26】


【図26A】


【図26B】


【図29B】


【図29C】


【図29D】


【図30A】


【図30B】


【図31A】


【図31B】


【図32A】


【図32B】


【図33】


【図34】


【図37B】


【図37C】


【図37D】


【図37E】


【図37F】


【図38】


【図41A】


【図41B】


【図42】




【図9】


【図14】


【図22A】


【図22B】


【図23】


【図27A】


【図27B】


【図27C】


【図27D】


【図27E】


【図27F】


【図27G】


【図27H】


【図28】


【図29A】


【図33A】


【図33B】


【図35】


【図36A】


【図36B】


【図37A】


【図39】


【図40】


【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7A】


【図7B】


【図7C】


【図7D】


【図7E】


【図7F】


【図7G】


【図7H】


【図10】


【図11】


【図12A】


【図12B】


【図13A】


【図13B】


【図15A】


【図15B】


【図16】


【図17A】


【図17B】


【図17C】


【図17D】


【図18】


【図19】


【図20】


【図21】


【図22C】


【図24】


【図24A】


【図24B】


【図25】


【図26】


【図26A】


【図26B】


【図29B】


【図29C】


【図29D】


【図30A】


【図30B】


【図31A】


【図31B】


【図32A】


【図32B】


【図33】


【図34】


【図37B】


【図37C】


【図37D】


【図37E】


【図37F】


【図38】


【図41A】


【図41B】


【図42】


【公開番号】特開2010−104373(P2010−104373A)
【公開日】平成22年5月13日(2010.5.13)
【国際特許分類】
【出願番号】特願2009−293514(P2009−293514)
【出願日】平成21年12月24日(2009.12.24)
【分割の表示】特願2005−501880(P2005−501880)の分割
【原出願日】平成15年10月2日(2003.10.2)
【出願人】(598128421)カリフォルニア インスティテュート オブ テクノロジー (26)
【Fターム(参考)】
【公開日】平成22年5月13日(2010.5.13)
【国際特許分類】
【出願日】平成21年12月24日(2009.12.24)
【分割の表示】特願2005−501880(P2005−501880)の分割
【原出願日】平成15年10月2日(2003.10.2)
【出願人】(598128421)カリフォルニア インスティテュート オブ テクノロジー (26)
【Fターム(参考)】
[ Back to top ]

