微小流体素子のための光学レンズシステムおよび方法
【課題】微小流体素子(205)から選択された1つ以上の蛍光指標を撮像する装置を提供すること。
【解決手段】本装置は少なくとも1つの微小流体素子(205)内の少なくとも1つのチャンバに連結された撮像パスを含む。上記撮像パスは、上記少なくとも1つの微小流体素子(205)内の上記少なくとも1つのチャンバ内の1つ以上のサンプルからの1つ以上の蛍光発光信号の送信を準備する。上記チャンバは、上記撮像パスの法線の実空間寸法によって特徴付けられるチャンバサイズを有する。本装置はまた、上記撮像パスに連結された光学レンズシステム(210、212)を含む。この光学レンズシステムは、上記チャンバに関連付けられた上記1つ以上の蛍光信号を送信するよう構成されている。
【解決手段】本装置は少なくとも1つの微小流体素子(205)内の少なくとも1つのチャンバに連結された撮像パスを含む。上記撮像パスは、上記少なくとも1つの微小流体素子(205)内の上記少なくとも1つのチャンバ内の1つ以上のサンプルからの1つ以上の蛍光発光信号の送信を準備する。上記チャンバは、上記撮像パスの法線の実空間寸法によって特徴付けられるチャンバサイズを有する。本装置はまた、上記撮像パスに連結された光学レンズシステム(210、212)を含む。この光学レンズシステムは、上記チャンバに関連付けられた上記1つ以上の蛍光信号を送信するよう構成されている。
【発明の詳細な説明】
【技術分野】
【0001】
(関連出願に対する相互参照)
本出願は、2004年6月7日に出願された米国仮出願番号60/578,106号(これは、本明細書中において、全ての目的のために、参考として援用される)に対する優先権を主張する。
【背景技術】
【0002】
(発明の背景)
本発明は、大まかには微小流体技術に関する。特に、本発明は、微小流体素子のチャンバ内で1つ以上のエンティティ(例えば、多量の流体内に浮遊している)を撮像する方法とシステムを提供する。より詳細には、本撮像方法と撮像システムは、微小流体素子内の1つ以上のエンティティに関連付けられた蛍光信号からの指標を用いる。微小流体素子に連結された蛍光体、化学発光、および生体発光リーダーを用いた微小流体方法およびシステムの技術は単なる例として適用されており、本発明がより広い範囲の適用可能性を有することは言うまでもない。
【0003】
各種の化学的および生化学的解析および合成を行うための微小流体システムを開発製造するために、一斉に努力が行われてきた。このようなシステムは、調製または解析用途に開発されてきた。このような極小サイズの素子を製造する目的は、面倒で非効率であることが多い従来の常量法の解析および合成の小型化により実現される著しい利益から生じる。実質的な時間短縮、コスト引き下げ、およびより効率的な空間割当が、この微小流体システムを用いる利益として実現される。さらなる利益として、この微小流体素子を用いてシステムを自動化することにより人間のオペレータを削減することが可能となる。自動化されたシステムは、また、オペレータによるエラーおよびその他のオペレータによる限界を少なくする。例えばキャピラリー電気泳動、ガスクロマトグラフィーおよび細胞分離などを含む、各種の用途において、微小流体素子の使用が提案されてきた。
【0004】
核酸増幅処理を実施するために採用される微小流体素子は、各種の用途で役に立つ可能性がある。例えば、このような素子は、サンプル中の特定の対象核酸の有無を判定するために解析ツールとして用いられてもよい。解析ツールとして用いられる微小流体素子としては、以下のものがある。
【0005】
・特定の病原体(例えば、ウイルス、細菌または真菌)の存在についての試験
・身元確認処理(例えば、実父確定および法医学的用途)
・特定の疾病または遺伝性疾患に関連付けられた固有の核酸の発見と特徴付け
・特定の薬物行動に関連付けられた遺伝子発現プロファイル/配列の発見(例えば、薬理遺伝学上の目的、すなわち、固有の遺伝プロファイルに適合的/特に効果的な、あるいは危険ではない薬物を選択するため)
・遺伝子型解析および遺伝子発現解析の実施(例えば、識別的遺伝子発現研究)。
【0006】
また、この素子は、核酸増幅の調製方法で用いることができ、さらなる解析に必要とされる十分なレベルの増幅産物を作り出すことができる。この解析処理の例としては、増幅産物の配列決定、細胞型決定、DNAフィンガープリント法、などがある。増幅産物は、また、各種の遺伝子工学の用途に用いられる。この遺伝子工学の用途には、所望のタンパク質製品に細胞を変換するためにそのときに用いられているベクターに増幅産物を挿入することにより実現される、所望のタンパク製品の製造などがある(が、これに限定されるものではない)。
【0007】
上記利用可能性にもかかわらず、このような微小流体素子からの撮像データ、例えば蛍光データを収集処理するよう構成された撮像システム(リーダーとも呼ぶ)にはさまざまな欠陥がある。従来のリーダーには、微小流体素子上をレーザビームがラスタスキャンする走査モードで動作するものがある。このようなシステムの別のものでは、素子またはレーザと素子の両方が平行移動する。これらのスキャナは、微小流体素子内にある反応チャンバからレーザ源/素子のラスタスキャンに関連して順次蛍光データを収集する。他の従来のスキャナは、例えば1mm2よりせまい範囲を順次撮像する際にスティッチモードで動作し、これらの小さいイメージを縫い合わせてアッセイ中の微小流体素子のイメージをつくる。
【0008】
走査システムとスティッチングシステムの両方ともに、欠陥がある。例えば、いずれのタイプのシステムも、時間に応じて撮像した範囲に比例した比較的低いシステム周波数で動作する。従来のシステムは1〜20cm2/分の周波数で動作する。タンパク質熱量測定および核酸増幅のようないくつかの興味ぶかいアッセイでは、約1〜20cm2/分より大きいシステム周波数は、一般的に、微小流体素子の反応容器内で起こる蛍光プロセスを撮像するために必要とされる。従来の走査システムとスティッチングシステムは、これらの性能目的に合わない。システムの処理能力(スループット)を遅くするのに加えて、これらの走査システムとスティッチングシステムは、例えば、リアルタイムPCRの性能など、ある種のアッセイにおいて用いられる可能性を制限しうる。
【発明の概要】
【発明が解決しようとする課題】
【0009】
したがって、当該技術分野では、微小流体素子のチャンバ内の多量の流体に浮かんでいる1つ以上のエンティティを撮像する改良された方法およびシステムが望まれている。
【課題を解決するための手段】
【0010】
(発明の開示)
本発明によれば、微小流体システム技術が提供される。とりわけ、本発明は、微小流体素子のチャンバ内のある量の流体内に浮かんでいる1つ以上のエンティティを撮像する方法およびシステムを提供する。より詳細には、本撮像方法および撮像システムでは、微小流体素子内の1つ以上のエンティティに関連付けられた蛍光信号からの指標が用いられる。単なる例として、微小流体方法およびシステムの技術は、微小流体素子に連結された蛍光リーダー、化学発光リーダー、および生体発光リーダーを用いて適用されるが、本発明がより広い範囲の適用可能性を有することは言うまでもない。
【0011】
具体的な実施形態においては、本発明は微小流体素子からの選択された1つ以上の蛍光指標を撮像する装置を提供する。この装置は、少なくとも1つの微小流体素子内の少なくとも1つのチャンバに連結された撮像パスを備える。この装置は、上記少なくとも1つの微小流体素子内の上記少なくとも1つのチャンバ内の1つ以上のサンプルからの1つ以上の蛍光発光信号の送信を行う。このチャンバは、上記撮像パスの法線の実空間寸法によって特徴付けられるチャンバサイズを有する。この装置は、また、上記撮像パスに連結された光学レンズシステムを備える。この光学レンズシステムは上記チャンバに関連付けられた上記1つ以上の蛍光信号を送信するよう構成される。
【0012】
別の具体的な実施形態においては、微小流体素子の少なくとも1つのチャンバから選択された1つ以上の蛍光指標を撮像する方法が提供される。この方法は、少なくとも1つの微小流体素子の上記少なくとも1つのチャンバ内の1つ以上のサンプルからの1つ以上の蛍光発光信号を、上記少なくとも1つのチャンバに連結された撮像パスに沿って送信する。上記少なくとも1つのチャンバは、撮像パスの法線の実空間寸法によって、特徴付けられるチャンバサイズを有する。この方法はまた、上記撮像パスに連結された光学レンズシステムを介して上記チャンバに関連付けられた上記1つ以上の蛍光発光信号を送信する。この光学レンズシステムは、上記実空間寸法のサイズを定まったレベルまで縮小させるよう構成されている。
【0013】
さらに別の具体的な実施形態においては、微小流体素子の1つ以上のチャンバから1つ以上の指標を撮像するシステムが提供される。このシステムは光学経路を含み、この光学経路微小流体素子の空間領域の一部分の1つ以上のイメージを上記微小流体素子の上記空間領域の上記一部分から送信できる。一実施形態において、上記微小流体素子の上記空間領域の上記部分は第1の寸法に特徴付けられる。このシステムは、また、上記光学経路の第1の部分に連結される第1レンズシステムを備える。この第1レンズシステムは、第1光学特性によって特徴付けられる。このシステムは、さらに、上記光学経路の第2の部分に連結される第2レンズシステムを備える。この第2レンズシステムは、第2光学特性によって特徴付けられる。このシステムは、さらに、上記光学経路の第3の部分に連結された検出器素子を備える。この検出器素子は、上記空間領域の上記部分の上記1つ以上のイメージをキャプチャする。さらに、この検出器は上記1つ以上のイメージをキャプチャするように構成される。この1つ以上のイメージは上記検出器素子においてほぼ上記第1の寸法またはそれ以下の定まったサイズを有する。
【0014】
代替的な実施形態においては、微小流体素子の1つ以上のチャンバから1つ以上の指標を撮像する方法が提供される。この方法は、微小流体素子の空間領域の一部分の1つ以上のイメージを上記微小流体素子の上記空間領域の上記一部分から光学経路に沿って送信する。上記微小流体素子の上記空間領域の上記部分は、第1の寸法に特徴付けられる。この方法は、また、第1レンズシステムを上記光学経路の第1の部分に連結する。この第1レンズシステムは、第1光学特性によって特徴付けられる。本方法は、さらに、第2レンズシステムを上記光学経路の第2の部分に連結する。この第2レンズシステムは、第2光学特性によって特徴付けられる。さらに、本発明は、検出器素子を用いて上記空間領域の上記部分の上記1つ以上のイメージをキャプチャする。この検出器素子は、上記光学経路の第3の部分に連結されており、上記1つ以上のイメージは上記検出器素子においてほぼ上記第1の寸法またはそれ以下の定まったサイズを有する。
【0015】
別の代替的な実施形態において、微小流体素子を撮像する方法が提供され、この方法は、微小流体素子の少なくとも定まった数のチャンバに関連付けられた空間領域のイメージを、1分未満のタイムフレームでイメージ検出空間領域を用いてキャプチャすることを包含する。具体的な実施形態においては、上記空間領域の上記イメージの上記キャプチャには実質的にスティッチングおよび/またはスキャニングプロセスがない。
【0016】
さらに他の代替的な実施形態においては、微小流体素子から選択された1つ以上の蛍光指標を撮像する装置を提供する。この装置は、少なくとも1つの微小流体素子内の少なくとも1つのチャンバに連結された撮像パスを備える。この撮像パスは、上記少なくとも1つの微小流体素子内の上記少なくとも1つのチャンバ内の1つ以上のサンプルからの1つ以上の蛍光発光信号の送信を行う。この装置は、また、上記撮像パスの第1の空間部分に連結され、上記1つ以上の発光信号の送信用に備えられた光フィルタ素子を備える。この光フィルタ素子は、上記1つ以上の蛍光発光信号から選択されたスペクトルバンド幅を送信するよう構成され、上記1つ以上の蛍光発光信号に関連付けられた1つ以上の色収差を定まったレベルに処理するよう構成される。
【0017】
特定の実施形態においては、エラストマー微小流体素子における処理の解析方法が提供される。この方法は、1分未満の時間の間に少なくとも96個のチャンバのイメージをキャプチャする。一実施形態では、上記少なくとも96個のチャンバのそれぞれは、上記少なくとも96個のチャンバのほかのチャンバのいずれからも流体的に分離されている。この方法は、また、上記イメージを処理する。
【0018】
別の特定の実施形態においては、複数の処理部位を備える微小流体素子の撮像装置を提供する。この複数の処理部位は、M個のサンプルから選択された少なくとも1つのサンプルとN個の試薬から選択された少なくとも1つの試薬とを含む。この装置は、上記微小流体素子に連結され、上記微小流体素子を電磁放射で照射するよう構成された照明システムを備える。この装置は、また、上記微小流体素子に連結され、上記複数の処理部位から発せられた電磁放射を受光するよう構成された撮像システムを備える。この装置は、さらに、撮像システムに連結された検出器を備える。
【0019】
さらに別の特定の実施形態においては、光撮像システムが提供される。この光撮像システムは、コンピュータと、流体的に分離された少なくとも1536個の反応チャンバを有するエラストマー微小流体アレー素子を照射するよう構成された光照明システムとを備える。このエラストマー微小流体アレー素子は、複数の層から形成されるエラストマーブロックを備える。少なくとも1つの層は少なくとも1つのくぼみがその内部に形成されている。上記くぼみは上記くぼみを有する上記層に一体形成された少なくとも1つの偏向膜を有する。この光撮像システムは、また、光検出システムを備える。
【0020】
さらに別の代替的な特定の実施形態において、微小流体素子の複数のチャンバから1つ以上の選択された蛍光指標を撮像する方法が提供される。この方法は、1つ以上の蛍光発光信号を撮像パスに沿って送信し、この1つ以上の蛍光発光信号は、微小流体素子の複数のチャンバの少なくとも1つの1つ以上のサンプルから得られる。この方法は、また、所定のスペクトルバンド幅内の蛍光発光信号を通すように、かつ1つ以上の蛍光発光信号に関連付けられた1つ以上の色収差を定まったレベルに処理するよう構成された光フィルタ素子を用いて、撮像パスに沿って1つ以上の蛍光発光信号のサブセットを選択的に送信する。
【0021】
具体的な実施形態においては、この方法は、さらに、検出器において1つ以上の蛍光発光信号のサブセットの部分を読み取り、微小流体素子の複数のチャンバの少なくとも1つの内の1つ以上のサンプルからの1つ以上の蛍光発光信号をキャプチャし、上記少なくとも1つの微小流体素子の少なくとも96個のチャンバを照射し、ここで48個より多いチャンバ群は、上記48個より多いチャンバ群のほかのチャンバのいずれからも流体的に分離されており、少なくとも1つの微小流体素子を定められた時に所定の温度に維持し、ここで所定の時の上記所定の温度は、マルチステップ熱循環プロファイルの一部分である。別の具体的な実施形態においては、1つ以上の蛍光発光信号に関連付けられた1つ以上の色収差の処理は、1つ以上の色収差を所定のレベルまで縮小させることを含む。上記所定のレベルは、第1の色によって特徴付けられた第1の光線および第2の色によって特徴付けられた第2の光線に関連付けられた焦点における所定のシフトによって特徴付けられる。さらに別の具体的な実施形態においては、上記光フィルタ素子は複数のゼロ出力ダブレットおよび複数の分光フィルタを備える。
【0022】
本発明にかかる実施形態においては、微小流体素子に関する情報を収集するために光撮像システムが使用される。具体的な実施形態においては、上記撮像システムの使用は、63個を越えるチャンバを含む微小流体素子を含む。別の具体的な実施形態において、撮像システムの使用は、エラストマー微小流体素子を有する微小流体素子を含む。代替的な実施形態においては、上記撮像システムの使用は95個を超えるチャンバからなる微小流体素子を含む。別の代替的な実施形態においては、上記撮像システムの使用は383個を超えるチャンバからなる微小流体素子を含む。さらに他の代替的な実施形態においては、上記撮像システムの使用は511個を超えるチャンバからなる微小流体素子を含む。追加的な実施形態では、上記撮像システムの使用は2,304個を超えるチャンバからなる微小流体素子を含む。別の追加的な実施形態においては、上記撮像システムの使用は9,216個を超えるチャンバからなる微小流体素子を含む。さらに別の追加的な実施形態においては、上記撮像システムの使用は100,000個を超えるチャンバからなる微小流体素子を含む。
【0023】
本発明の別の実施形態によれば、微小流体素子に関する情報を収集するために光撮像システムが使用される。上記光システムの使用は、特定の実施形態においてタンパク質結晶化処理を行うよう構成されたエラストマー微小流体素子を含む。別の実施形態では、上記撮像システムの使用は蛍光処理を行うよう構成されたエラストマー微小流体素子を含む。さらに別の実施形態では、上記撮像システムの使用は、長時間の間に選択された温度または温度範囲で反応を行うよう構成されたエラストマー微小流体素子を含む。別の具体的な実施形態においては、PCR反応に関する情報を収集するために光撮像システムが使用される。さらに別の具体的な実施形態においては、上記撮像システムの使用は、微小流体分離した閉鎖反応チャンバを備える微小流体素子を含む。その他の実施形態では、上記撮像システムの使用は、微小流体素子に連結された熱制御部を含む。
【0024】
代替的な実施形態においては、微小流体素子を撮像するために光撮像システムが使用される。この代替的な実施形態では、光撮像システムは、色収差の値を所定のレベルまで低減するよう構成された複数のダブレットを有している。一実施形態において、上記光撮像システムは0.23を超えるNAにより特徴付けられる。別の実施形態では、上記光撮像システムは0.36以上のNAにより特徴付けられる。さらに別の実施形態においては、上記光撮像システムは0.2を超えるNAを有する。具体的な実施形態においては、上記光撮像システムは、第1のダブレットに連結された第1分光フィルタと第2のダブレットに連結された第2分光フィルタを含む。さらに、追加的な実施形態では、上記第1のダブレットは、色収差の値を第1分光フィルタを通過する第1の所定波長で第2の所定のレベルまで低減し、そして第2のダブレットは、色収差の値を第2分光フィルタを通過する第2の所定波長で第2の所定のレベルまで低減する。ある実施形態では、上記第1のダブレットおよび上記第2のダブレットはゼロ出力ダブレットである。ほかの実施形態では、上記第1分光フィルタ、上記第1のダブレット、上記第2分光フィルタ、および上記第2のダブレットはフィルタホイールとして構成される。
【0025】
本発明の別の実施形態では、微小流体素子から1つ以上の蛍光発光信号を含む複数のイメージを得るために蛍光撮像システムが使用される。蛍光撮像システムの使用は、他の反応チャンバから流体的に分離された63個を超える反応チャンバを有する微小流体素子を含む。一実施形態においては、蛍光撮像システムの使用は、エラストマー微小流体素子を有する微小流体素子を含む。別の実施形態では、蛍光撮像システムの使用は、10nl未満の容積により特徴づけられる複数の反応チャンバを含む。さらに別の実施形態において、蛍光撮像システムの使用は、100反応チャンバ/cm2以上のアレー密度により特徴づけられるエラストマー微小流体素子を含む。代替的な実施形態においては、この蛍光撮像システムは、光フィルタ素子を含み、この光フィルタ素子は、上記1つ以上の蛍光発光信号から選択されたスペクトルバンド幅を通すよう構成され、上記1つ以上の蛍光発光信号に関連付けられた1つ以上の色収差を定まったレベルに処理するよう構成される。
【0026】
本発明の実施形態においては、微小流体システムにおいてサンプルを検査する光システムが提供される。この実施形態により提供される光システムにおいては、上記検出器は、撮像される微小流体システムの寸法以上の大きさのアレー(例えば、CCD)からなる。別の実施形態においては、上記検出器は、任意で少なくとも1つのレンズを用いて上記微小流体素子に連結される。さらに別の実施形態において、上記検出器は上記微小流体素子と共形接触(conformal conatact)しない。具体的な実施形態においては、上記検出器は上記微小流体素子と共形接触する。別の具体的な実施形態においては、本明細書で論じる色収差補正システムは、上記光学連結部で用いられる。
【0027】
別の実施形態では、微小流体素子を検査する光システムが提供される。上記光システムは、倍率M≧NA0/NAdetを有し、NA0は、対物/サンプル側NAであり、そしてNAdetは、上記検出器面で起こる反射による損失が閾値を越える前の検出器において許容可能な最大NAである。具体的な実施形態においては、上記検出器はCCDであり、NAdet=0.36である。別の実施形態において、上記検出器はCCDであり、0.23≦NAdet≦0.5である。
【0028】
追加的な実施形態では、微小流体システム内のサンプルを検査する光システムが提供される。上記検出器は、反応チャンバを含む上記微小流体素子の面積の寸法のM倍に等しいアレー(例えば、CCD)を備える。一実施形態において、上記微小流体素子の上記面積は検査対象のサンプルチャンバを含む。この実施形態において、M=NA0/NAdet+/−10%であり、ここで、NA0は反応チャンバ間の許容範囲クロストーク、そのXY間隔およびサイズ、上記Z軸上の程度に関する焦点深度の考慮により決定される許容範囲の最大NAであり、NAdetは、入射光の≦40%が上記検出器面の反射、口径食、などにより失われる。具体的な実施形態においては、上記NAdetは、入射光の≦30%が上記検出器面の反射、口径食、などにより失われる。別の具体的な実施形態においては、上記NAdetは、入射光の≦20%が上記検出器面の反射、口径食、などにより失われる。さらに別の具体的な実施形態においては、NAdetは、入射光の≦10%が上記検出器面の反射、口径食、などにより失われる。代替的な実施形態においては、Mは≧1である。別の代替的な実施形態では、M=1である。
【0029】
本発明を用いることにより、従来の技術に対して数々の利益が実現される。ある実施形態では、微小流体素子からの蛍光を生成し検出する光撮像システムが提供される。加えて、本発明の実施形態は、分光フィルタに連結されたゼロ出力アクロマチックダブレットを用いることにより色収差を縮小する光システムを提供する。
【0030】
単一のプラットフォームで各種の利用を行う能力が、本発明の実施形態により提供される。例えば遺伝子発現および遺伝子型を含むゲノミクス利用が本発明の実施形態を用いて行われる。さらに、デジタル分離検出(Digital Isolation and Detection:DID)での利用が可能となる。例として、がん検出に関する利用ならびに単細胞高分子検出および数量化が提供される。さらに、タンパク質リガンド結合や免疫アッセイプロセスを含むプロテオミクス利用が、本発明の実施形態より提供される。
【0031】
さらに、本発明の実施形態によると、特定の利益および/または利点を実現し、他の技術に関連する限界を克服することができる。計算に基づいて、以下のことが判明している。
【0032】
あるスキャニングシステムでは、10umの所望の解像度を有する。これらのシステムでは、蛍光が望ましく数量化される「スポット」がトータルで3000×3000(=約1067)ある。例えば、これを10秒で完遂しようとすると、各スポットでの滞留時間は、約1マイクロ秒である。したがって、ラインスキャン(3000ポイント)は3msで完了する。得られた信号対雑音に等価の信号対雑音を本発明の実施形態を用いて得るためには、スポットでの光強度が、1秒間で信号を得る本発明にかかる撮像システムで実現できるよりも約106倍明るくなければならない。3cmのスポットを3msで毎秒1000倍ラスタすることは、機械的にかなり困難である。加えて、高い効率での発光信号の収集が望まれる。これには、通常、大きな視野光学か高いNAフライングヘッド(例えば10m/s以上で移動する)が必要となる。この場合、素子の右下角で収集されたデータは素子の左上で収集されたデータよりも10秒古くなり、用途によっては望ましくない。
【0033】
あるスティッチングシステムでは、複数のイメージを獲得し、合成イメージを作るためにこれらを張り合わせる。一システムでは、複数の3mm×3mmのイメージを張り合わせてイメージをつくるために、100個のイメージが用いられる。個々のイメージすべてを得るためのトータルの時間は100msである。この時間の半分が移動により使われ、もう半分がイメージの獲得に使われるとすると、この撮像時間は約50msである。このシステムは、一般に、1秒の間に信号を得るのに得られる本発明の実施形態で用いられる強度の約20倍の光強度および/または高いNA対物を必要とする。加えて、これらのシステムは、一般に、3mm移動して50msで完全に停止することができる速いステージを必要とする。加えて、これらのシステムは、一般に、スティッチングによるアーチファクトを排除するために動作および光強度の両方について注意深い検定を要する。素子の右下角で収集されたデータは素子の左上で収集されたデータよりも10秒古くなり、用途によっては望ましくない。
【0034】
ある本発明の実施形態では、微小流体素子の面積が1度で撮像される撮像システムを提供する。10秒毎イメージが可能な実施形態において、数秒の統合時間が利用できる。同期化の問題は、データが全ての画素から同時に収集されるため、低減または排除される。さらに、本発明の実施形態は、一般的に、同時に微小流体素子全体(約31mm×31mmの面積)を照射し、高いNAおよび広い視野のレンズシステムを用いる。本願明細書を通じて説明されるように、本発明の実施形態は、従来のシステムに比べて複雑さが低くより強力な方法およびシステムを提供する。実施形態によっては、これらの制限の1つ以上が本発明の実施形態にかかる本方法およびシステムによって克服される。本発明のさらなる詳細は本願明細書を通じて説明されており、より詳細には以下に説明される。実施形態によっては、これらの利益の1つ以上が存在する。これらおよびその他の利益は本願明細書を通じて説明され、より詳細には以下に説明される。
本発明の各種の追加の目的、特徴、および利点は、以下の詳細な説明と添付の図面を参照することにより、より完全に理解可能となる。
例えば、本発明は以下の項目を提供する。
(項目1)
微小流体素子からの選択された1つ以上の蛍光指標を撮像する装置であって、
少なくとも1つの微小流体素子内の少なくとも1つのチャンバに連結された撮像パスであって、該撮像パスは、該少なくとも1つの微小流体素子内の該少なくとも1つのチャンバ内の1つ以上のサンプルからの1つ以上の蛍光発光信号の送信を行い、該チャンバは、該撮像パスの法線の実空間寸法によって特徴付けられるチャンバサイズを有する撮像パスと、
該撮像パスに連結され、該チャンバに関連付けられた該1つ以上の蛍光信号を送信するよう構成された光学レンズシステムとを備える、装置。
(項目2)
前記光学レンズシステムは、前記実空間寸法のサイズを定まったレベルまで縮小させるよう構成され、該定まったレベルで縮小されたサイズの前記チャンバに関連付けられた前記1つ以上の蛍光発光信号を送信するよう構成された、項目1に記載の装置。
(項目3)
前記少なくとも1つの微小流体素子は、微小流体寸法により特徴付けられ、前記光学レンズシステムは、前記微小流体寸法とほぼ同じサイズである前記少なくとも1つの微小流体素子のイメージを提供するよう構成され、かつ前記ほぼ同じサイズの前記チャンバに関連付けられた前記1つ以上の蛍光発光信号を送信するよう構成された、項目1に記載の装置。
(項目4)
前記実空間寸法の前記縮小サイズと前記実空間寸法の比率が1未満であることを特徴とする、項目2に記載の装置。
(項目5)
前記比率が0.9未満である、項目4に記載の装置。
(項目6)
前記比率が0.5未満である、項目5に記載の装置。
(項目7)
前記微小流体素子はエラストマー微小流体素子であり、前記少なくとも1つのチャンバは閉鎖反応チャンバである、項目1に記載の装置。
(項目8)
微小流体素子の少なくとも1つのチャンバから選択された1つ以上の蛍光指標を撮像する方法であって、
少なくとも1つの微小流体素子の該少なくとも1つのチャンバ内の1つ以上のサンプル由来の1つ以上の蛍光発光信号を、該少なくとも1つのチャンバに連結された撮像パスに沿って送信する工程であって、ここで該少なくとも1つのチャンバは、該撮像パスの法線の実空間寸法によって特徴付けられるチャンバサイズを有する、工程、
該撮像パスに連結された光学レンズシステムを介して該チャンバに関連付けられた該1つ以上の蛍光発光信号を送信し、ここで該光学レンズシステムは該実空間寸法のサイズを定まったレベルまで縮小させるよう構成されている工程、
を包含する、方法。
(項目9)
前記実空間寸法の前記縮小サイズと前記実空間寸法の比率が1未満であることを特徴とする、項目8に記載の方法。
(項目10)
前記比率が0.9未満である、項目9に記載の方法。
(項目11)
前記比率が0.5未満である、項目10に記載の方法。
(項目12)
前記微小流体素子はエラストマー微小流体素子であり、前記少なくとも1つのチャンバは閉鎖反応チャンバである、項目8に記載の方法。
(項目13)
微小流体素子の1つ以上のチャンバから1つ以上の指標を撮像するシステムであって、
微小流体素子の空間領域の一部分の1つ以上のイメージを該微小流体素子の該空間領域の該部分から送信できる光学経路であって、該微小流体素子の該空間領域の該一部分は第1の寸法に特徴付けられる、光学経路と、
該光学経路の第1の部分に連結され、第1光学特性によって特徴付けられる第1レンズシステムと、
該光学経路の第2の部分に連結され、第2光学特性によって特徴付けられる第2レンズシステムと、
該光学経路の第3の部分に連結された検出器素子であって、該検出器素子は該空間領域の該部分の該1つ以上のイメージをキャプチャし、該検出器は該1つ以上のイメージをキャプチャするように構成され、該1つ以上のイメージは該検出器素子においてほぼ第1の寸法またはそれ以下の定まったサイズを有する検出器素子と
を備えるシステム。
(項目14)
前記定まったサイズは前記第1の寸法の約0.99またはそれ未満である、項目13に記載のシステム。
(項目15)
前記第1レンズシステムおよび前記第2レンズシステムは、タンデムレンズシステムとして特徴付けられる、項目13に記載のシステム。
(項目16)
前記微小流体素子は微小流体寸法により特徴付けられ、前記検出器素子は活性領域における空間寸法により特徴付けられる、項目13に記載のシステム。
(項目17)
前記微小流体寸法は前記空間寸法とほぼ同じサイズである、項目16に記載のシステム。
(項目18)
前記微小流体寸法は前記空間寸法より小さい、項目16に記載のシステム。
(項目19)
前記微小流体素子は、少なくとも48個の閉鎖反応チャンバを備えるエラストマー微小流体素子である、項目13に記載のシステム。
(項目20)
前記少なくとも48個の閉鎖反応チャンバは、ほかの反応チャンバのいずれからも流体的に分離されている、項目19に記載のシステム。
(項目21)
微小流体素子の1つ以上のチャンバから1つ以上の指標を撮像する方法であって、
微小流体素子の空間領域の一部分の1つ以上のイメージを該微小流体素子の該空間領域の該部分から光学経路に沿って送信する工程であって、該微小流体素子の該空間領域の該部分は第1の寸法に特徴付けられる工程、
第1光学特性によって特徴付けられる第1レンズシステムを該光学経路の第1の部分に連結する工程、
第2光学特性によって特徴付けられる第2レンズシステムを該光学経路の第2の部分に連結する工程、
該光学経路の第3の部分に連結された検出器素子を用いて該空間領域の該部分の該1つ以上のイメージをキャプチャする工程であって、該1つ以上のイメージは該検出器素子においてほぼ第1の寸法またはそれ未満の定まったサイズを有する工程、
を包含する、方法
(項目22)
前記定まったサイズは前記第1の寸法の約0.99またはそれ未満である、項目21に記載の方法。
(項目23)
前記第1レンズシステムおよび前記第2レンズシステムは、タンデムレンズシステムとして特徴付けられる、項目21に記載の方法。
(項目24)
前記微小流体素子は微小流体寸法により特徴付けられ、前記検出器素子は活性領域における空間寸法により特徴付けられ、前記微小流体寸法は該空間寸法とほぼ同じサイズである、項目21に記載の方法。
(項目25)
微小流体素子の撮像方法であって、
微小流体素子の96を超える数のチャンバに関連付けられた空間領域のイメージを送信する工程、
イメージ検出器素子に関連付けられて該微小流体素子の該空間領域のサイズとほぼ等しいサイズであるイメージ検出空間領域を用いて、該空間領域の該イメージをキャプチャする工程、
を包含する、方法。
(項目26)
前記イメージ検出空間領域により分割される前記空間領域はほぼ1である、項目25に記載の方法。
(項目27)
前記イメージ検出空間領域により分割される前記空間領域はほぼ0.99以下である、項目25に記載の方法。
(項目28)
前記イメージ検出空間領域により分割される前記空間領域はほぼ0.88以下である、項目27に記載の方法。
(項目29)
前記イメージ検出空間領域はほぼ30.7mm×30.7mm以上である、項目25に記載の方法。
(項目30)
前記イメージ検出空間領域はほぼ27.6mm×27.6mm以上である、項目25に記載の方法。
(項目31)
前記イメージ検出空間領域はほぼ2048×2048画素領域である、項目25に記載の方法。
(項目32)
前記イメージ検出空間領域はほぼ2048×2048画素領域を含み、該画素領域のそれぞれはほぼ15μm×15μm以上の空間寸法を有する、項目25に記載の方法。
(項目33)
少なくとも2つの画素領域は前記チャンバの少なくとも1つに関連付けられている、項目32に記載の方法。
(項目34)
少なくとも9つの画素領域は前記チャンバの少なくとも1つに関連付けられている、項目33に記載の方法。
(項目35)
20個より多くの画素領域は前記チャンバの少なくとも1つに関連付けられている、項目34に記載の方法。
(項目36)
微小流体素子の撮像方法であって、
微小流体素子の少なくとも定まった数のチャンバに関連付けられた空間領域のイメージを、1分未満のタイムフレームでイメージ検出空間領域を用いてキャプチャする工程であって、ここで該空間領域の該イメージの該キャプチャには実質的にスティッチングプロセスおよび/またはスキャニングプロセスがない工程を包含する、方法。
(項目37)
さらに、前記微小流体素子の少なくとも前記定まった数のチャンバに関連付けられた前記空間領域の前記イメージを、10ミリ秒を超えるタイムフレームで前記イメージ検出空間領域を用いてキャプチャする工程を包含する、項目36に記載の方法。
(項目38)
前記空間領域の前記イメージのキャプチャは30秒未満のタイムフレームで行われる、項目36に記載の方法。
(項目39)
前記空間領域の前記イメージのキャプチャは15秒未満のタイムフレームで行われる、項目36に記載の方法。
(項目40)
前記キャプチャは、前記定まった数のチャンバについて1分未満のタイムフレームで同時に行われる、項目36に記載の方法。
(項目41)
前記キャプチャは、前記定まった数のチャンバを定まった温度範囲に維持しつつ行われる、項目36に記載の方法。
(項目42)
前記定まった温度範囲は±2℃である、項目41に記載の方法。
(項目43)
前記定まった温度は、PCRプロセスに関連付けられた周期的温度環境の一部分である、項目41に記載の方法。
(項目44)
前記定まった数のチャンバは少なくとも96個以上である、項目36に記載の方法。
(項目45)
さらに、前記微小流体素子の少なくとも前記定まった数のチャンバに関連付けられた前記空間領域の少なくとも第2イメージを、前記1分未満のタイムフレームで前記イメージ検出空間領域を用いてキャプチャする工程を包含し、ここで前記空間領域の前記第2イメージの前記キャプチャは蛍光発光を表す、項目36に記載の方法。
(項目46)
微小流体素子から選択された1つ以上の蛍光指標を撮像する装置であって、
少なくとも1つの微小流体素子内の少なくとも1つのチャンバに連結された撮像パスであって、該撮像パスは、該少なくとも1つの微小流体素子内の該少なくとも1つのチャンバ内の1つ以上のサンプルからの1つ以上の蛍光発光信号の送信を行う撮像パスと、
該撮像パスの第1の空間部分に連結され、該1つ以上の発光信号の送信用に備えられた光フィルタ素子であって、該1つ以上の蛍光発光信号から選択されたスペクトルバンド幅を送信するよう構成され、該1つ以上の蛍光発光信号に関連付けられた1つ以上の色収差を定まったレベルに処理するよう構成された光フィルタ素子とを備える、装置。
(項目47)
さらに、前記撮像パスの第2の空間部分に連結されて、前記1つ以上の蛍光発光信号の一部分を読む検出器と、
前記撮像パスの第3の空間部分に連結された第1レンズシステムであって、前記少なくとも1つの微小流体素子内の前記少なくとも1つのチャンバからの1つ以上の蛍光発光信号をキャプチャするよう構成された、第1レンズシステムと、
1つ以上のスペクトルバンド幅によって特徴付けられる電磁放射を発する光源と、
該光源に連結された光学素子であって、該光学素子が、前記少なくとも1つの微小流体素子の少なくとも96個のチャンバを照射するよう構成されており、ここで48個より多いチャンバ群は、前記48個より多いチャンバ群のほかのチャンバのいずれからも流体的に分離されている、光学素子、
を備える、項目46に記載の装置。
(項目48)
さらに、
前記撮像パスの第4の空間部分に連結された第2レンズシステムと、
前記少なくとも1つの微小流体素子に熱制御を行うよう構成された熱制御モジュールとを備え、
前記光フィルタ素子は複数の分光フィルタおよび複数のゼロ出力ダブレットを備える、項目47に記載の装置。
(項目49)
前記複数のゼロ出力ダブレットは、第1の所定波長で色収差を低減するよう構成された第1ゼロ出力ダブレットと、第2の所定波長で色収差を低減するよう構成された第2ゼロ出力ダブレットとを備える、項目46に記載の装置。
(項目50)
前記光フィルタ素子は、前記撮像パスの一部分に関連付けられたバックグラウンド信号を所定のレベルまで縮小させる、項目46に記載の装置。
(項目51)
前記1つ以上の色収差の処理は前記1つ以上の色収差の補正を含む、項目46に記載の装置。
(項目52)
前記1つ以上の色収差の補正は前記1つ以上の色収差を所定のレベルまで縮小させることを含み、該所定のレベルは、第1の色によって特徴付けられた第1の光線および第2の色によって特徴付けられた第2の光線に関連付けられた焦点における所定のシフトによって特徴付けられる、項目51に記載の装置。
(項目53)
エラストマー微小流体素子における処理の解析方法であって、
1分未満の時間の間に少なくとも96個のチャンバのイメージをキャプチャする工程であって、ここで該少なくとも96個のチャンバのそれぞれは、該少なくとも96個のチャンバのほかのチャンバのいずれからも流体的に分離されている工程、
該イメージを処理する工程、
を包含する、方法。
(項目54)
さらに、1分未満の時間の間に前記少なくとも96個のチャンバの第2イメージをキャプチャする工程、および前記第2イメージを処理する工程を包含する、項目53に記載の方法。
(項目55)
イメージのキャプチャは、開口数が0.23以上で倍率が2以下である光システムを用いて行われる、項目53に記載の方法。
(項目56)
前記光システムは開口数が0.23以上である、項目55に記載の方法。
(項目57)
前記少なくとも96個のチャンバはそれぞれ、約100ナノリットル以下の容積を有する、項目53に記載の方法。
(項目58)
前記少なくとも96個のチャンバはそれぞれ、約10ナノリットル以下の容積を有する、項目57に記載の方法。
(項目59)
前記少なくとも96個のチャンバはそれぞれ、約100ピコリットル以下の容積を有する、項目58に記載の方法。
(項目60)
前記少なくとも96個のチャンバそれぞれの密度は約100チャンバ/cm2以上である、項目53に記載の方法。
(項目61)
前記少なくとも96個のチャンバそれぞれの密度は約250チャンバ/cm2以上である、項目60に記載の方法。
(項目62)
前記少なくとも96個のチャンバそれぞれの密度は約1,000チャンバ/cm2以上である、項目61に記載の方法。
(項目63)
M個のサンプルから選択された少なくとも1つのサンプルとN個の試薬から選択された少なくとも1つの試薬とを含む複数の処理部位を備える微小流体素子の撮像装置であって、該装置は、
該微小流体素子に連結され、該微小流体素子を電磁放射で照射するよう構成された照明システムと、
該微小流体素子に連結され、該複数の処理部位から発せられた電磁放射を受光するよう構成された撮像システムと、
該撮像システムと連結された検出器、
を備える、装置。
(項目64)
前記微小流体素子はエラストマー微小流体素子である、項目63に記載の装置。
(項目65)
前記処理部位は閉鎖反応チャンバである、項目63に記載の装置。
(項目66)
前記複数の閉鎖反応チャンバは反応密度が、平方cmの面積あたりの流体的に分離された反応が約250以上である、項目65に記載の装置。
(項目67)
前記複数の処理部位から発せられる前記電磁放射は蛍光信号である、項目63に記載の装置。
(項目68)
さらに、前記微小流体素子に連結された熱制御部を備える、項目67に記載の装置。
(項目69)
前記複数の処理部位は約100ナノリットル以下の容積により特徴づけられる、項目68に記載の装置。
(項目70)
前記複数の処理部位は約10ナノリットル以下の容積により特徴づけられる、項目69に記載の装置。
(項目71)
前記複数の処理部位は250部位/cm2以上のアレー密度により特徴づけられる、項目69に記載の装置。
(項目72)
前記複数の処理部位は1,000部位/cm2以上のアレー密度により特徴づけられる、項目69に記載の装置。
(項目73)
前記複数の処理部位はタンパク質結晶化処理に対応するよう構成されている、項目63に記載の装置。
(項目74)
前記電磁放射は光学的放射である、項目63に記載の装置。
(項目75)
光撮像システムであって、
コンピュータと、
流体的に分離された少なくとも1,536個の反応チャンバを有するエラストマー微小流体アレー素子を照射するために適合された光学照射システムであって、該エラストマー微小流体アレー素子は複数の層から形成される弾性ブロックを備え、少なくとも1つの層は少なくとも1つのくぼみがその内部に形成されており、該くぼみは該くぼみを有する該層に一体形成された少なくとも1つの偏向膜を有する、光学照射システムと、
光検出システムとを備える、システム。
(項目76)
前記少なくとも1,536個の反応チャンバは100ナノリットル未満の容積により特徴づけられる、項目75に記載の光撮像システム。
(項目77)
前記少なくとも1,536個の反応チャンバは、250チャンバ/平方センチメータ以上のアレー密度で空間的に配置されている、項目75に記載の光撮像システム。
(項目78)
M個のサンプルおよびN個の試薬は、前記少なくとも1,536個の反応チャンバに分散している、項目75に記載の光撮像システム。
(項目79)
前記光照明システムは、前記少なくとも1,536個の反応チャンバのサブセットからの1つ以上の蛍光信号の発光を誘導する、項目75に記載の光撮像システム。
(項目80)
前記光検出システムは、前記少なくとも1,536個の反応チャンバのサブセットに関連付けられたタンパク質結晶化処理の1つ以上のイメージを提供するよう構成されている、項目75に記載の光撮像システム。
【図面の簡単な説明】
【0035】
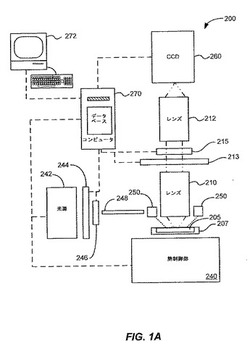
【図1A】図1Aは、発明の実施形態にかかる撮像システムを示す単純化した模式図である。
【図1B】図1Bは、本発明の別の実施形態にかかる例示的撮像システムの概観図である。
【図1C】図1Cは、本発明の実施形態にかかる熱制御素子を示す単純化した模式図である。
【図2A】図2A〜2Cは、本発明の実施形態にかかるレンズアセンブリを示す単純化した模式図である。
【図2B】図2A〜2Cは、本発明の実施形態にかかるレンズアセンブリを示す単純化した模式図である。
【図2C】図2A〜2Cは、本発明の実施形態にかかるレンズアセンブリを示す単純化した模式図である。
【図3】図3は、本発明の実施形態にかかる微小流体素子にある多数の反応チャンバで起こる反応により発生する第1の波長に中心をおく蛍光発光の写真である。
【図4】図4は、本発明の実施形態にかかる微小流体素子にある多数の反応チャンバで起こる反応により発生する第2の波長に中心をおく蛍光発光の写真である。
【図5】図5は、本発明の実施形態を用いて生成された選択された波長のスポット図である。
【図6】図6は、本発明の実施形態を用いて生成された選択された波長のスポット図である。
【図7】図7は、本発明の実施形態を用いて生成された選択された波長のスポット図である。
【図8】図8は、本発明の実施形態を用いて生成される位置に応じた比較的均一な照射図である。
【図9】図9は、本発明にかかるいくつかの実施形態の正方形内に含まれるエネルギー(ensquared energy)の図である。
【図10】図10は、本発明にかかるいくつかの実施形態の正方形内に含まれるエネルギーの図である。
【図11】図11は、本発明にかかるいくつかの実施形態の正方形内に含まれるエネルギーの図である。
【図12】図12は、本発明の実施形態にかかる光システムの像面湾曲および歪みの図である。
【図13】図13は、本発明の実施形態にかかるシステムにより生成された二重波長対焦点の図である。
【図14】図14は、本発明の実施形態を用いて生成された選択された波長のスポット図である。
【図15】図15は、本発明の実施形態を用いて生成された選択された波長のスポット図である。
【図16】図16は、本発明の実施形態を用いて生成された選択された波長のスポット図である。
【図17】図17は、本発明の実施形態を用いて生成された選択された波長のスポット図である。
【図18】図18は、本発明の実施形態を用いて生成された選択された波長のスポット図である。
【図19】図19は、本発明の実施形態を用いて生成された選択された波長のスポット図である。
【図20】図20は、本発明の実施形態を用いて生成された選択された波長のスポット図である。
【図21】図21は、本発明の実施形態を用いて生成された選択された波長のスポット図である。
【図22】図22は、本発明の実施形態を用いて生成された選択された波長のスポット図である。
【図23】図23は、本発明の別の実施形態を用いて生成された選択された波長のスポット図である。
【図24】図24は、本発明の別の実施形態を用いて生成された選択された波長のスポット図である。
【図25】図25は、本発明の別の実施形態を用いて生成された選択された波長のスポット図である。
【図26】図26は、本発明にかかるいくつかの実施形態の正方形内に含まれるエネルギーの図である。
【図27】図27は、本発明にかかるいくつかの実施形態の正方形内に含まれるエネルギーの図である。
【図28】図28は、本発明にかかるいくつかの実施形態の正方形内に含まれるエネルギーの図である。
【発明を実施するための形態】
【0036】
(特定の実施形態の詳細な説明)
本発明によれば、微小流体システム用の技術が提供される。特に、本発明は微小流体素子のチャンバ内である量の流体内に浮かんでいる1つ以上のエンティティを撮像する方法とシステムを提供する。より詳細には、本撮像方法と撮像システムは、微小流体素子内の1つ以上のエンティティに関連付けられた蛍光信号からの指標を用いる。微小流体素子に連結された蛍光体リーダー、化学発光リーダー、および生体発光リーダーを用いた微小流体方法およびシステムの技術は単なる例として適用されており、本発明がより広い範囲の適用可能性を有することは言うまでもない。
【0037】
本出願において、微小流体素子内の特定のタイプの「反応」チャンバに対する参照がなされる。一般に、これらの「反応チャンバ」は処理部位と、処理チャンバと、および/または反応部位、これらの組み合わせなどからなる。これらのチャンバは、閉鎖されていても、部分的に閉鎖されていても、開放されていてもよく、部分的に開放されていても、シールされていても、もしくはこれらの組み合わせであってもよく、これらの状態などのいずれかを伴う一時的または過渡的状況を含んでもよい。ある実施形態では、チャンバはシール状態、シール可能、閉鎖可能、分離状態、分離可能、またはこれらの組み合わせであり、一時的もしくは過渡的状況の組み合わせまたは単一の状況はこれらの状態のいずれかを伴う。したがって、反応チャンバという用語は、本発明を限定するものではなく、これらその他の構造を含むものである。加えて、チャンバという用語は、本発明を限定するものではなく、チャンバに関連付けられた具体的な特徴を記載するのでない限り、通常の意味で用いられるべきものである。もちろん、その他の変形例、修正例、および代替例もありうる。
【0038】
さらに、本願では、微小流体素子からの蛍光指標についても言及する。本発明の範囲に含まれるのは蛍光指標に限らず、化学発光、電場発光、電気化学発光、リン発光、生体発光、その他の発光プロセス、あるいは検出素子を用いて検出可能な他のタイプの指標を伴うその他のいずれのプロセスを含む発光性指標を含む。当業者には明らかなように、これらの蛍光および発光性指標の検出および解析において実施可能な方法およびシステムは、指標間で変換可能である。加えて、本発明の実施形態では光学要素として分光フィルタを用いるものもあるが、これは本発明に必須のものではない。蛍光および発光の用途では、光学励起パスもしくは光学発光パスまたはその両方において分光フィルタは用いないものもある。ここに記載するように、分光フィルタを用いる実施形態もある。当業者であれば、特定の用途に関連する差異を理解する。
【0039】
ある実施形態では、核酸増幅反応などの熱循環的反応を行うために用いられる素子を含む各種の素子および微小流体解析方法が用いられる。この素子は、エラストマー成分を含むという点で、従来の微小流体素子とは異なる。場合によっては、素子のほとんどまたは全てがエラストマー材料からなる。例えば、増幅反応は、線形増幅(単一のプライマーでの増幅)、または指数増幅(すなわち、フォワードおよびリバースプライマー群で行われる増幅)であってもよい。
【0040】
本発明のいくつかの実施形態によって提供される方法およびシステムは、核酸増幅反応を行う際にブラインドチャネル型素子を用いる。これらの素子では、反応部位内に通常堆積する試薬は、所望の種類の増幅反応に必要な試薬である。普通、これは例えば、プライマー、ポリメラーゼ、ヌクレオチド、金属イオン、バッファ、補因子のうちいくつかまたは全てが堆積されることを意味する。このような場合に反応部位に導入されるサンプルは核酸鋳型である。また、しかしながら、鋳型は堆積されてもよく、反応部位に流れてもよい。本明細書を通して詳細に論じるように、マトリックス素子を用いて増幅反応を行う場合、核酸鋳型を含むサンプルは垂直フローチャネルを流れ、増幅試薬は水平フローチャネルを流れ、あるいはその逆であってもよい。
【0041】
PCRは、おそらく最もよく知られている増幅技術である。本発明の実施形態で用いられる素子はPCR増幅を行うものに限られない。その他の種類の行うことのできる増幅反応としては、(1)リガーゼ連鎖反応(LCR)(WuおよびWallace、Genomics4:560(1989)、ならびにLandegren他、Science241:1077(1988))参照)、(2)転写増幅(Kwoh他、Proc.Natl.Acad.Sci.USA86:1173(1989)参照)、(3)自立的な配列複製(Guatelli他、Proc.Natl.Acad.Sci.USA、87:1874(1990)参照)、(4)核酸配列を基礎にした増幅(NASBA)(Sooknanan,R.およびMalek,L.,BioTechnology13:563−65(1995)参照)などがあるが、これに限らない。これらの参照文献は、本明細書において、全体として参照により組み込まれる。
【0042】
さらに、ある素子は、溶液の流れを調整する1つ以上のエラストマーバルブを含む素子で、熱循環反応(例えば、PCR)を行うよう構成されている。したがって、このような構成の素子を用いた増幅反応を行う方法もまた提供される。
【0043】
増幅産物(単位複製配列)は、決まった核酸検出方法で検出し(反応チャンバ内で分離されているかその後であるかを)見分けることができる。二本鎖DNAからなる単位複製配列は、SYBRTM、ピコグリーン(オレゴン州ユージーンのMolecular Probes,Inc.社)などのインターカレーション色素、エチジウムブロマイドなど(Zhu他、1994、Anal.Chem.66:1941−48)、および/またはゲル電気泳動を用いて検出することができる。たいてい、配列固有の検出方法(すなわち、単位複製配列のヌクレオチド配列に基づいて検出される)が用いられる。検出方法の例としては、固定されたオリゴヌクレオチドまたはポリヌクレオチドのアレイへのハイブリダイゼーション、および差次的標識付きの分子指標またはその他の「蛍光共鳴エネルギー移動(FRET)」に基づく検出システムの使用がある。FRETに基づく検出システムは、本発明の実施形態のあるものについては好適な検出方法である。FRETに基づくアッセイでは、供与体/受容体蛍光プローブペアの供与体(レポーター)および/または受容体(クエンチャー)蛍光プローブからの蛍光の変化が検出される。供与体および受容体蛍光プローブペアは、供与体の発光スペクトルが受容体の励起スペクトルにオーバーラップするように選択される。したがって、蛍光プローブのペアが互いに十分に近傍におかれた場合には、供与体から受容体へのエネルギー移動が起こって検出可能となる。各種のアッセイとして、例えば鋳型伸長反応、量的RT−PCR、分子指標、インベーダーアッセイなどがあるが、これに限るものではない。これらについては以下に簡単に述べる。
【0044】
FRETおよび鋳型伸長反応は、供与体/受容体ペアの1員が標識としてついたプライマー、および供与体/受容体ペアのもう一方の1員が標識としてついたヌクレオチドを用いる。標識付きヌクレオチドをプライマーに結合する前、鋳型依存の伸長反応の間、供与体および受容体はエネルギー移動が起こらないよう十分に離されている。しかしながら、標識付きヌクレオチドがプライマーに結合されると、間隔は十分に近くなり、エネルギー移動が起こって検出可能となる。これらの方法は、単一のヌクレオチド多型の検出における単一基ペア伸長反応を行う際にとりわけ有用であり、米国特許第5,945,283号および国際公開第WO97/22719号に記載されている。この反応は、任意で、信号を増やすために温度制御方法と本発明に記載する装置を用いて熱循環してもよい。
【0045】
各種のいわゆる「リアルタイム増幅」方法または「リアルタイム量的PCR」方法は、増幅プロセス中または後で形成される増幅産物の量を測定することにより、サンプル内の目標核酸の量の判定に用いてもよい。蛍光性ヌクレアーゼアッセイは、リアルタイム計量方法の1つの具体例であり、ここに記載の素子とともにうまく用いることができる。このような増幅産物の形成をモニタする方法は、二重標識付き蛍光性オリゴヌクレオチドプローブを用いたPCR産物蓄積の連続的な測定を伴う。この測定は、文献では「TaqMan」方法と呼ばれることが多い。例えば、米国特許第5,723,591号を参照のこと。
【0046】
分子指標を用いると、それが増幅産物の相補性領域にハイブリダイズするときのプローブのコンフォメーションの変化は、検出可能な信号の形成につながる。このプローブ自体は2つのセクションを含む。1つが5’末端であり、もう1つは3’末端である。これらのセクションは、プローブ結合部位でアニールするプローブのセクションの側面に位置し、互いに相補的となっている。一方の末端セクションは、通常、レポーター色素が結合し、もう一方の末端セクションは普通クエンチャー色素が結合する。溶液中では、これら2つの末端セクションが互いに複合してヘアピンループを形成してもよい。この構造においては、レポーター色素およびクエンチャー色素は十分に近傍にあるため、レポーター色素からの蛍光がクエンチャー色素により効果的にクエンチされる。これに対して、ハイブリッドプローブは、クエンチの程度が減少した線形構造となる。したがって、これら2つの色素の発光変化をモニタすることにより、間接的に増幅産物の形成をモニタすることが可能となる。この種のプローブおよびその使用方法は、例えば、Nat.Biotechnol.16:359−63(1998)のPiatek他、Nat.Biotechnology14:303−308(1996)のTyagiおよびKramer、Nat.Biotechnol.16:49−53(1998)のTyagi他などにより、さらに説明されている。
【0047】
スコルピオン検出方法は、例えば、Nucleic Acids Research、28:3752−3761(2000)のThelwell他、およびSolinas他「Duplex Scorpion primers in SNP analysis
and FRET applications」Nucleic Acids Research29:20(2001)に記載されている。スコルピオンプライマーは、PCRストッパーを介して5’末端に付随するプローブ要素蛍光性PCRプライマーである。これらは、均質な溶液中のPCR産物のリアルタイム単位複製配列に固有の検出において用いられる。2つの異なる構成が可能であって、これらは、「ステムループ」構成と「二本鎖」構成である。いずれの場合にも、プローブメカニズムは分子内である。全ての構成において基本的なスコルピオンの要素は(1)PCRプライマー、(2)プローブ要素のPCR読過しを回避するPCRストッパー、(3)固有のプローブ配列、(4)少なくとも1つの蛍光プローブおよびクエンチャーを含む蛍光検出システム、である。スコルピオンプライマーのPCR伸長の後、結果として生じる単位複製配列は、各PCR周期の変性ステージ中に単鎖となるプローブに相補的な配列を含む。冷却の際、クエンチャーがもはや蛍光プローブの近傍にないため、プローブはこの相補配列に自由に結合することができ、蛍光発光が増加する。PCRストッパーは、TaqDNAポリメラーゼによる望ましくないプローブの読過しを回避する。
【0048】
インベーダーアッセイ(ウィスコンシン州マディソンのThird Wave Technologies社)は、とりわけSNP遺伝子型に用いられ、目標核酸(DNAまたはRNA)または多型部位に相補的な信号プローブを示すオリゴヌクレオチドを用いる。第2のオリゴヌクレオチド(Invader Oligoと指定される)は、同じ5’ヌクレオチド配列を含むが、3’ヌクレオチド配列は、ヌクレオチド多型を含む。インベーダーオリゴは、信号プローブの5’末端が多型を含むヌクレオチドで「フラップ」を形成するよう、目標核酸への信号プローブの結合を干渉する。この複合体は、固有のエンドヌクレアーゼに固有の構造により認識され、Cleavase酵素と呼ばれる。Cleavaseは、ヌクレオチドの5’フラップを劈開する。開放されたフラップは、FRET標識を付された第3のプローブと結合し、これにより、Cleavase酵素により認識可能な別の二本鎖構造を形成する。このとき、Cleavase酵素は、クエンチャーから離して蛍光プローブを劈開し、蛍光信号を生成する。SNP遺伝子型については、信号プローブは、基準(野生型)対立遺伝子または変異体(突然変異体)対立遺伝子のいずれかと複合するよう構成される。PCRと異なり、核酸の増幅を伴わない信号の線形増幅がある。当業者の手引きとして、さらに詳細は、例えば、Advances in Nucleic Acid and Protein Analysis 3826:117−125(2000)のNeri、B.P.他、および米国特許第6,706,471号などに記載される。
【0049】
本発明とあわせて各種の多重化増幅システムを用いることができる。あるタイプでは、複数の異なる標識の付いたプローブを用いて、いくつかの異なる目標を同時検出可能である。これらのプローブのそれぞれは、特定の目標とのみ複合するよう構成されている。各プローブが異なる標識を有しているので、各目標との結合は蛍光信号に基づいて検出される。用いる各種の標識を注意深く選択することで、単一の反応において、異なる波長で異なる標識が励起および/または検出される解析を行うことができる。例えば以下を参照のこと。Fluorescence Spectroscopy(Pesce他編) Marcel Dekker, New York,(1971); White他, Fluorescence Analysis: A Practical Approach, Marcel Dekker, New York,(1970); Berlman, Handbook of Fluorescence Spectra of Aromatic Molecules, 2nd ed., Academic Press, New York,(1971); Griffiths, Colour and Constitution of Organic Molecules, Academic Press, New York,(1976); Indicators(Bishop編) Pergamon Press, Oxford, 19723; and Haugland, Handbook of Fluorescent
Probes and Research Chemicals, Molecular Probes, Eugene(1992)。
【0050】
宿主生物または感染性微生物のゲノム修飾にリンクした疾病の多くは、多くの場合単一ヌクレオチドの変化を伴う、少量のヌクレオチドの変更の結果である。このような単一ヌクレオチドの変化は、単一ヌクレオチド多型または単にSNPと呼ばれ、SNPが起こる部位は、通常多形性部位と呼ばれる。このような多形性部位に現れるヌクレオチドを同一性を判定するために、本明細書に記載の素子を用いてもよい。この能力の拡張として、この素子は、遺伝子型決定において利用され得る。遺伝子型決定は、2倍体生物(すなわち、各遺伝子のコピーを2つ持っている生物)が基準対立遺伝子のコピーを2つ含む(基準型同型接合体)か、基準および変異体対立遺伝子を各1つ含む(すなわち、ヘテロ接合体)か、または変異体対立遺伝子のコピーを2つ含む(すなわち、変異体型同型接合体)の判定を伴う。遺伝子型解析を行う場合には、本発明の方法は単一変異部位を調べるために用いることができる。しかしながら、多重化に関するセクションでさらに説明するように、この方法は、多数の異なるDNA遺伝子座の個々の遺伝子型が、同じ遺伝子、異なる遺伝子、またはその組み合わせであるかを判定するのに用いることもできる。
【0051】
遺伝子型解析に用いられる素子は、統計的な見地から、2倍体の2つの対立遺伝子それぞれのコピーが有効なDNA濃度の反応部位に存在するようにした適切なサイズの反応部位を用いるよう構成されている。さもなくば、反応部位に第2の対立遺伝子のコピーがないために、解析の結果、ヘテロ接合体が同型接合体であることになってしまう可能性がある。下の表1は、ここに記載の素子で用いることのできる、各種の例示的DNA濃度における1nlの反応容積中のゲノムのコピーの数を示す。
【0052】
表1:示されたDNA濃度における1ナノリットルの容積中のゲノムのコピーの数
【0053】
【表1】

一般論として、サンプル確率論的比率により、増幅反応が始まる前に存在するコピー数は測定のありうるエラーを判定する。本発明の発明者らは各反応部位にゲノムが1つである濃度においてTaqMan反応をうまく行ったが、ある種の素子を用いた遺伝子型解析は、通常、DNA濃度がおよそ0.10μg/μLであるサンプルで行われる。
【0054】
遺伝子型解析は、各種の異なるアプローチを用いて行うことができる。これらの方法では、普通、「YES」または「NO」がわかれば十分である。すなわち、検出は任意の対立遺伝子の有無を答えることができればよい。したがって、解析は、多形性部位で可能性のある1つの対立遺伝子の存在を検出するために必要なプライマーまたはヌクレオチドを用いてのみ実行され得る。しかしながら、より一般的には、多形性部位で行われる可能性の高い各対立遺伝子の有無を検出するプライマーおよびヌクレオチドが含まれる。
【0055】
単一塩基ペア伸長(SBPE)反応は、遺伝子型解析を行うために特に開発された技術の一つである。多数のSPBEアッセイが開発されてきたが、一般的なアプローチは全く同様である。通常、これらのアッセイは、プライマーの3’末端がそのまま変異部位の5’末端であるかまたはこれに隣接するように、目標核酸に相補的なプライマーとの複合を伴う。伸長は、変異部位を占有するヌクレオチド(複数)およびポリメラーゼに相補的な、1つ以上の標識付き伸長不可能なヌクレオチドが存在するときに行われる。伸長不可能なヌクレオチドは、一旦プライマーに結合されるとポリメラーゼによるさらなる伸長が妨げられるヌクレオチド類似体である。追加された伸長不可能なヌクレオチド(複数)が変異部位のヌクレオチドに相補的である場合、標識付き伸長不可能なヌクレオチドはプライマー3’末端に結合されて標識付き伸長産物を生成する。したがって、伸長プライマーは、ヌクレオチドが目標核酸の変異部位に存在するという指標となる。このような方法および関連する方法は、例えば、米国特許第5,846,710号、第6,004,744号、第5,888,819号、第5,856,092号、第5,710,028号、および国際公開第WO92/16657号で論じられている。
【0056】
遺伝子型解析は、量的PCR方法を用いて行うこともできる。この場合、プライマー、ヌクレオチド、ポリメラーゼとともに、対立形質のそれぞれに相補的な異なる標識付きプローブが試薬に含まれる。しかしながら、反応は単一プローブによってのみ行われ、信号がないことが、特定の対立遺伝子の欠如によるものかまたは単に反応の失敗によるものかについて曖昧さが生じることになる。多形性部位に2つの対立遺伝子が可能な通常の2対立遺伝子の場合には、それぞれ完全に対立遺伝子のうち1つに相補的な2つの異なった標識付きプローブが、増幅プライマー、ヌクレオチド、ポリメラーゼとともに、試薬混合に含まれているのが普通である。目標DNAを含むサンプルが反応部位に導入される。プローブに相補的な対立遺伝子が目標DNAに存在する場合、増幅が起こり、これにより上記の検出で説明した検出可能な信号につながる。いずれの差動信号が得られたのかに基づいて、多形性部位におけるヌクレオチドの同一性が判定される。両方の信号が検出されれば、両方の対立遺伝子が存在することになる。上述の温度制御部で説明したように、反応の間熱循環が行われる。
【0057】
遺伝子発現解析は、1つ以上の遺伝子が特定の細胞で発現するレベルを決定することを包含する。判定は質的であってもよいが、普通は量的である。識別的遺伝子発現解析において、1つの細胞(例えば、試験細胞)における遺伝子(複数)のレベルは、別の細胞(コントロール細胞)の同じ遺伝子の発現レベルに比較される。各種のこのような比較がおこなわれてもよい。例えば、健康な細胞と疾病細胞、薬物の処置を受けた個体からの細胞と処置を受けていない個体からの細胞、特定の毒物にさらされた細胞とそうでない細胞間の比較などを含むが、これに限らない。テスト細胞およびコントロール細胞間で発現レベルが変化する遺伝子では、治療のマーカおよび/または目標としての役割を果たしてもよい。例えば、あるグループの遺伝子が健康な細胞よりも疾病細胞で上方制御される場合には、このような遺伝子は疾病のマーカとしての役割を果たすことができ、診断テストの基礎として用いることができる可能性がある。これらの遺伝子は、また標的とすることができる。疾病処置の戦略は、上方制御された遺伝子の発現を低減する結果となる手続きを含むこともできる。
【0058】
本発明の実施形態で用いられる微小流体素子の構成は、各種の遺伝子発現解析を容易にするのに有用である。この素子は多数の反応部位を含むため、多数の遺伝子および/またはサンプルを同時にテストすることが可能である。例えば、ブラインドフローチャネル素子では、数百または数千もの遺伝子の発現レベルを同時に判定することができる。素子は、また、識別的遺伝子発現解析を容易にする。マトリックス構造では、例えば、健康な細胞から得たサンプル1つのフローチャネルでテストし、疾病細胞からのサンプルをすぐ隣のチャネルで処理することができる。この特徴により、2つのサンプルを同じ素子で同時に同一の条件でテストすることができるため、検出の容易さおよび結果の精度を向上させることができる。
【0059】
各種のマトリクスまたはアレー型素子を、本発明の実施形態に従って利用してもよい。これらの素子のあるものは、以下を含む。(1)エラストマー基板に形成される第1の複数のフローチャネル、(2)第1の複数のフローチャネルと交差して反応部位のアレーを規定する、エラストマー基板に形成される第2の複数のフローチャネル、(3)第1および第2の複数のフローチャネル内に配された、各反応部位内の溶液を他の反応部位の溶液から分離するよう動作可能な複数の分離バルブ、(4)フローチャネルの1つ以上のおよび/または反応部位の1つ以上に重畳する複数のガードチャネルであって、そこからの溶液の蒸発を妨げるための複数のガードチャネル。上記素子は、温度規制を伴う多数の異なる種類の反応(例えば、核酸解析の熱循環)を行うために利用され得る。
【0060】
微小流体素子には、通常、ここでは「ブラインドチャネル」または「ブラインド充填」と呼ぶ、溶液がブラインドチャネルの一端のみから出入りするように終端または分離端を有する(すなわち、ブラインドチャネルの入口と出口が分離されていない)フローチャネルである複数のブラインドチャネルを有することによって特徴付けられる構成を用いるものがある。これらの素子は、各ブラインドチャネルについてブラインドチャネルの領域を分離して反応部位を分離するために単一のバルブしか必要としない。この種の素子の製造中、解析を行う1つ以上の試薬は、反応部位に堆積され、これにより入出力数の顕著な減少につながる。加えて、ブラインドチャネルは、反応部位が単一のまたは限定数のサンプル入力から充填されるようにチャネルの相互接続ネットワークに接続されている。入出力複雑性の低減および各反応部位の分離に単一のバルブのみを用いることにより、反応部位の利用可能な空間が増加する。したがって、これらの素子の特徴は、各素子が多数の反応部位を含むことができ(例えば、数万程度まで)、高い反応部位密度(例えば、1,000〜4,000反応部位/cm2)を実現することができることを意味する。個別に、また集合的に、これらの特徴は、既存の微小流体素子に比べて素子の大きさを直接的に顕著に低減させると言い換えることもできる。
【0061】
本明細書に開示されるその他の微小流体素子は、マトリックス構造を用いる。一般に、この種の微小流体素子は、複数の交差する水平フローチャネルおよび垂直フローチャネルを用いて、交差部分における反応部位のアレーを規定する。したがって、この構成の素子は、アレーまたは反応部位も有する。しかしながら、この構成においてより多数のサンプルに対応するために、より多数のサンプル入力とそれに対応する出力がある。切替可能なフローアレーアーキテクチャーと呼ばれるバルブシステムは、溶液が水平またはフローチャネルのみを選択的に流れるようにし、したがってマトリクス内の各種のフローチャネルの切り替え可能な分離を可能とする。したがって、ブラインドチャネル素子が限られた数のサンプルでの異なる状況下で多数の解析を行うように構成されているのに対して、マトリックス素子は、限定された状況下における多数のサンプルの解析を行うよう構成されている。さらに別の素子は、これら2つのハイブリッドである。
【0062】
他の微小流体素子は、国際公開第WO 2004/089810、米国公開番号第20050019792号として公開された米国特許出願番号第10/819088号、同時係属中の同一出願人による2006年6月2日出願の「Analysis using microfluidic partitioning devices」と題された特許出願第 号(代理人整理番号020174−012400)に記載されているような大量に分割された素子(これらのそれぞれは、本明細書において、全体として参照により組み込まれる)である。大量に分割された素子を用いることにより、サンプルは多数の分離された反応チャンバに分割されて、反応は各チャンバ内で同時に実行されてもよい。
【0063】
本明細書に記載の微小流体素子は、さらに、フローチャネル、制御チャネル、バルブ、および/またはエラストマー材料で製造されたポンプなどの各種のコンポーネントを用いることにより特徴づけられる。場合によっては、基本的に素子全体がエラストマー材料からなる。結果として、このような素子は、その形態および機能において、プラスチックやシリコンベースの材料から作られた大多数の従来の微小流体素子とは顕著に異なる。多数の反応チャンバは、本発明の実施形態に従って変化するよう提供される。
【0064】
素子の構成により、多数の異なる加熱システムとの組み合わせで素子を用いることができるようになる。したがって、素子は、温度制御の必要な多様な解析を行う際に有益である。加えて、これらの加熱用途用に構成された微小流体素子には、さらに、反応部位からのサンプルの蒸発を最小限にする構成上の特徴を組み込むことができる。この種の素子は、一般に、エラストマー素子内に形成された、多数のガードチャネルおよび/またはリザーバー、またはチャンバを備え、これらの内部を水が流れて素子が形成されるエラストマー材料内の水蒸気圧を増加させ、これにより反応部位からのサンプル材料の蒸発を低減する。
【0065】
別の実施形態においては、微小流体素子の温度を制御するために温度循環素子を用いることができる。好ましくは、この微小流体素子は微小流体素子と熱接触をするよう構成される。微小流体素子が、ガラススライドやプラスチックキャリアなどキャリアプレートの底面などの基板材料によって支持されるとき、微小流体素子、好ましくは弾性ブロックを有する素子が、温度循環素子の加熱/冷却ブロックと直接接触するようにキャリアまたはスライドの領域に窓が形成されてもよい。好適な実施形態においては、加熱/冷却ブロックは、好ましくは、反応が起こる場所に隣接した部分に、微小流体素子に吸引力を適用するために、内部に真空源に連通する溝部を有する。また、硬質の熱伝導性プレートは、微小流体素子に接合してその後、効率的な熱伝導性を得るために加熱/冷却ブロックに一致させてもよい。
【0066】
ある素子のアレー構成は、素子がハイスループットを実現可能であることを意味する。集合的には、ハイスループットおよび温度制御能力は、素子が多数の核酸増幅(例えば、ポリメラーゼ連鎖反応(PCR))を行うために有用である。このような反応は素子の利用、特に、その温度制御を要するあらゆる反応における利用について、説明しながら詳細に論じる。しかしながら、素子がこれらの特定の用途に限定されるものではないことは言うまでもない。素子は、各種のその他の種類の解析または反応において用いることができる。この例として、タンパク質リガンド相互作用、および細胞と各種の化合物との間の相互作用の解析などがある。さらなる例が本明細書を通じて提示される。
【0067】
ここに開示される微小流体素子は、通常、少なくともエラストマー材料から構成され、
単一またはマルチレイヤーソフトリソグラフィ(MSL)技術および/または犠牲層封止方法(例えば、Science288:113−116(2000)のUnger他、および国際公開第WO01/01025号を参照のこと。いずれも、本明細書において、全体として参照により組み込まれる)によって構成される。このような方法を用いて、素子のフローチャネル内の溶液の流れが制御される微小流体素子が、エラストマー膜または断片によってフローチャネルから分離された少なくとも1つ以上の制御チャネルで構成される。この膜または断片は、駆動力を制御チャネルに与えることにより制御チャネルと関連付けられるフローチャネルに偏向するまたはフローチャネルから退避する。フローチャネルに対する膜の偏向や退避の程度を制御することにより、フローチャネル内の溶液の流れが遅くなったり完全に遮断されたりすることができる。制御とこの種のフローチャネルを組み合わせて用いることにより、Science288:113−116(2000)のUnger他、ならびに国際公開第WO/02/43615号および第WO 01/01025号においてさらに詳細に説明されるように、各種の異なる種類の溶液の流れを調整するバルブとポンプを提供することができる。
【0068】
ここで提供される素子は、試薬が反応するようにされる反応部位を選択的に分離するポンプおよび/またはバルブが組み込まれる。また、ポンプおよび/またはバルブのない、圧力駆動フロープロセスまたはポリメリゼーションプロセスを適切なチャネルの近くで使用して、これによって反応部位を選択的に分離する素子を用いることもできる。この反応部位は、素子内の多数の異なる位置のいずれに位置してもよい。例えば、マトリクス型素子では、反応部位が一群のフローチャネルの交差部に位置するものもある。ブラインドチャネル素子では、反応部位はブラインドチャネルの端部に位置する。
【0069】
素子が温度制御反応(例えば、熱循環反応)に用いられる場合には、そのときは、下により詳細に説明するように、通常、エラストマー素子が支持体(例えばガラススライド)に固定される。得られた構造物は、その後、例えば各種の反応部位における温度を制御する温度制御プレートにおかれる。熱循環反応の場合、素子は多数の熱循環プレートのいずれにおかれてもよい。
【0070】
素子が比較的光学的に透明なエラストマー材料から作製されるので、反応は、基本的に微小流体素子の任意の位置にある各種の異なる検出システムを用いて簡単にモニタすることができる。しかしながら、ほとんどの場合、検出は、反応部位自体(例えば、フローチャネルの交差部を含む領域内またはフローチャネルの盲端)において起こる。素子が実質的に透明材料から製造されるという事実は、また、検出システムには、既存のシリコンベースの微小流体素子とともには用いることのできない電流素子とともに用いることのできるものもあることを意味する。検出は、素子に組み込まれた検出器、または素子から分離されているが検出対象である素子の領域に整列された検出器を用いて、実現されてもよい。
【0071】
一般に、マトリックス構造を用いた素子は、交差して接合点のアレーを形成する複数の垂直または水平フローチャネルを有する。異なるサンプルと試薬(または試薬のセット)は、各フローチャネルに導入することができ、多数のサンプルはハイスループット構成において比較的多数の反応状況に対してテストされる。したがって、例えば、異なるサンプルがM個の異なる垂直フローチャネルそれぞれに導入され、異なる試薬(または試薬のセット)がN個の水平フローチャネルそれぞれに導入されると、M×N個の異なる反応を同時に行うことができる。通常、マトリックス素子は垂直フローチャネルおよび水平フローチャネルの切替可能な分離を可能とするバルブを備える。さらに、バルブは垂直フローチャネルのみまたは水平フローチャネルのみを選択的に通されるように配置される。この種の素子はサンプルの種類と数および試薬の数と種類の選択について柔軟であるため、これらの素子は、比較的多数の反応条件に対して多くのサンプルをスクリーニングすることが所望される分析を行うのに、良好に適合される。マトリックス素子は、任意でガードチャネルを組み込み、サンプルおよび反応物質の蒸発を防ぐようにする。
【0072】
高密度マトリックス構成には、素子内に制御ラインや流体ラインを作るために微小流体素子の複数の層の間に流体連絡通路(ビア)を用いるものがある。例えば、2層弾性ブロックの各層に流体ラインを有することにより、より高密度の反応セル配置が可能となる。当業者には明らかなように、マルチレイヤー素子は、流体ラインが流体的に連絡せず互いに上下で交差するようにすることができる。例えば、特定の構成では、第1層の試薬流体チャネルはビアを介して第2層の試薬流体チャネルに接続され、第2層もまた内部にサンプルチャネルを有し、サンプルチャネルと試薬チャネルはそれぞれサンプルチャンバおよび試薬チャンバにおいて終結する。サンプルチャンバおよび試薬チャンバはインターフェースチャネルを通じて互いに流体的に連絡しており、このインターフェースチャネルは、反応セルの各チャンバ間の流体的な連絡を制御するためにこれと関連付けられたインターフェースバルブを有する。使用時には、最初はインターフェースは閉鎖されており、その後、試薬が試薬入口から試薬チャネル中に導入され、サンプルがサンプル入口からサンプルチャネル中に導入される。封じ込めバルブがその後閉じられて各反応セルをその他の反応セルから分離する。一旦反応セルが分離されると、インターフェースバルブは開放され、所望の反応が起こり得るようにサンプルチャンバと試薬チャンバが互いに流体的に連絡させる。当業者であれば、多くの変形例、修正例、および代替例がわかるであろう。
【0073】
したがって、微小流体素子の特定の構成は、M個の異なるサンプルをN個の異なる試薬と反応させるよう適合された微小流体素子を提供し、この微小流体素子は、複数の反応セルであって、各反応セルがサンプルチャンバと試薬チャンバとを備え、そのサンプルチャンバおよび試薬チャンバがサンプルチャンバと試薬チャンバとの間の流体的な連通を制御するためにこれらと関連付けられたインターフェースバルブを有するインターフェースチャネルを介して流体的に連通している、複数の反応セル;それぞれサンプルチャンバと流体的に連絡している、複数のサンプル入口;およびそれぞれ試薬チャンバと流体的に連絡している、複数の試薬入口、を備え;ここにおいてサンプル入口および試薬入口のうちの一方はサンプルチャンバおよび試薬チャンバのいずれか一方とそれぞれビアを介して流体的に連通している。ある実施形態では、反応セルを接合された複数の層からなる弾性ブロック内に形成させ、インターフェースバルブは屈折可能な膜であり;サインプルチャネルを介してサンプル入口をサンプルチャンバと流体的に連絡させ、そして試薬チャネルを介して試薬入口を試薬チャンバと流体的に連通させ、サンプルチャネルの一部と試薬チャネルの一部とは互いにほぼ平行方向を向いており、それぞれこれと関連付けられた、流体的な連通を制御する封じ込めバルブを有し;共通の封じ込め制御チャネルを介して互いに操作可能に連通する、サンプルチャネルに関連付けられたバルブと試薬チャネルに関連付けられたバルブとを有し;この共通の封じ込め制御チャネルをサンプルチャネルまたは試薬チャネルのいずれか一方のほぼ法線に沿って配置する。
【0074】
本発明の実施形態で用いられる微小流体素子は、さらに、同時継続中の同一出願人により2004年3月29日にUngerにより出願された米国特許出願番号第60/557,715号に記載されたキャリア素子に一体化されてもよく、本明細書において参照により組み込まれる。Ungerのキャリアは、バルブの閉鎖を例えばハウス空気圧などの流体圧力源から離れるように維持するオンボードの連続流体圧力を提供する。Ungerはさらに、ここに記載の本発明のバルブを荷電して作動させる自動化されたシステムを提供する。別の好適な実施形態においては、アキュムレータを充填させバルブを作動させる自動化されたシステムは、微小流体素子の1つ以上の表面に対して一致するプラテンを有する素子を採用し、ここにおいて上記プラテンは少なくとも2つ以上の制御された真空源または圧力源と流体的に連通するポートを有し、微小流体素子の部分を操作するための機械的部分(例えばチェックバルブ、ただしこれに限らない)を備えてもよい。
【0075】
本発明の実施形態で用いられる別の素子は、弾性ブロックを安定させるための基板として用いられるキャリアを提供する。好ましくは、上記キャリアは以下の特徴のうち1つ以上を備える。キャリア内またはキャリアで形成される少なくとも1つのチャネルを介して弾性ブロックと流体的に連通するウェルまたはリザーバー;キャリア内またはキャリアで形成される少なくとも1つのチャネルを介して弾性ブロックと流体的に連通するアキュムレータ;および弾性ブロックと流体的に連通する流体ポート。ここで、上記流体ポートは好適には、上述の自動化されたシステムなど、自動化された真空源または圧力源にアクセス可能であり、上記自動化された真空源または圧力源はさらに、流体ポートに一致して弾性ブロックに流体圧力または真空を加える自動化されたシステムの間に流体接続の分離を形成するポートを有するプラテンを備える。ある実施形態で用いられる素子において、自動化された源は、また、アキュムレーター内に維持される圧力を充填および排出させるためのキャリアに関連付けられた1つ以上のアキュムレータと、流体的に連通させ得る。特定の実施形態において、キャリアはさらに、微小流体素子に接触するキャリアの範囲に位置する領域を備え、ここにおいて上記領域は、上記キャリアのもう一方の部分とは異なる材料から作られ、この領域の材料は、上記キャリアのもう一方の部分は異なる改良された熱伝導性および熱分配性のために選択される。改良された熱伝導性および熱分配性のための好適な材料としては、シリコン、好ましくは半導体分野で研磨されたウエハとして用いられるまたはチップなどのウエハから切り出された部分(例えば、チップ)として用いられる種類のシリコンのように高度に研磨されたシリコンが挙げられるが、これに限らない。
【0076】
以下でさらに詳細に説明するように、本発明の実施形態は、例えばPCR熱循環器など(ただしこれに限らない)の熱源を用い、これは製造時の状態から変更が加えられていてもよい。一般に、熱源はキャリアの部分と一致させることができる熱的に調整された部分を有し、好ましくは、キャリアの熱伝導および分配部は、これらキャリアの熱伝導および分配部を介して弾性ブロックに熱制御を与えるためである。好適な実施形態においては、熱接触は、熱源の熱的に調整された部分内に形成された1つ以上のチャネルに真空源を適用することによって改良され、ここにおいて、チャネルは、キャリアの熱伝導および分配部の表面に接触してキャリアの熱伝導および分配部に吸引を作動しこれを維持するよう形成される。好適な実施形態においては、キャリアの熱伝導および分配部は、熱伝導および分配部の端部を弾性ブロックのみに添付することによって、そして熱伝導および分配部を囲むギャップを残してキャリアにより引き起こされる寄生的熱効果を低減することによって、キャリアのその他の部分とは物理的に接触しないが、キャリアおよび弾性ブロックのその他の部分に付けられる。言うまでもなく、ここに記載の本発明の様態の多くにおいて、好適な弾性ブロックは、例えば、米国カリフォルニア州サンタクララのAffymetrix(R)によるGeneChip(R)などに製造される素子や、米国カリフォルニア州マウンテンビューのCaliperにより製造される素子などの、ここには記載されないいずれの周知の微小流体素子に置き換えてもよい。Soane、Parce、Fodor、Wilding、Ekstrom、Quake、またはUngerへの米国特許は、例えば、弾性ブロックの利用に関して上述した、吸引配置や流体素子の他の領域への寄生的熱転移の低減などの熱的な利点および改良を活用するために、本発明の弾性ブロックに置き換えることのできる微小流体素子または中規模の流体素子を記載する。
【0077】
本発明の実施形態に従って提供されるシステムおよび方法を利用して、384以上のウェルシステムの処理能力の増加がもたらされる。例えば、ある実施形態では、4倍、6倍、12倍、24倍以上、処理能力の増加がもたらされる。これらの処理能力の増加は、物流上の摩擦を低減しつつもたらされる。さらに、本発明の実施形態の上記システムおよび方法は、複数のサンプルに対する複数のアッセイを可能とする。例えば、具体的な実施形態において、96個のサンプルおよび96個のアッセイが用いられて、総計9,216のデータポイントを提供する。特定の例においては、96個のアッセイは、TaqMan5’ヌクレアーゼアッセイの要素である。
【0078】
さらに、本発明の実施形態は、反応容積の低減を提供する。本発明の実施形態では、10ピコリットルから100ナノリットルの範囲の反応容積が用いられる。ある実施形態では、100ナノリットルを超える反応容積が用いられる。単なる例として、ある実施形態では、本発明の方法およびシステムは、10ピコリットル、50ピコリットル、100ピコリットル、250ピコリットル、500ピコリットル、および1ナノリットルの反応容積で用いられる。別の実施形態では、2ナノリットル、5ナノリットル、10ナノリットル、20ナノリットル、30ナノリットル、40ナノリットル、50ナノリットル、75ナノリットル、および100ナノリットルの反応容積で用いられる。
【0079】
特定の微小流体素子の形状、微小流体素子のサイズ、流体的な連通パスと処理部位の配置によって、本発明の実施形態は、処理部位(または反応チャンバ)密度の範囲を提供する。ある実施形態では、本発明の方法およびシステムは、1cm2あたり約100チャンバから、1cm2あたり約100万チャンバの範囲のチャンバ密度で用いられる。単なる例として、本発明の実施形態によれば、1cm2あたり、250チャンバ、1,000チャンバ、2,500チャンバ、10,000チャンバ、25,000チャンバ、100,000チャンバ、および250,000チャンバのチャンバ密度の微小流体素子が用いられる。ある実施形態では、1cm2あたり1,000,000チャンバを超えるチャンバ密度が用いられるが、これは本発明では必須ではない。
【0080】
このように小さな反応容積で微小流体素子を動作させることにより、試薬使用量およびサンプル使用量を減らすことができる。さらに、本発明の実施形態には、リアルタイム量的PCRと組み合わせる場合にリアルタイム検出を行うよう適合された方法およびシステムを提供するものもある。これらのシステムおよび方法の使用により、いくつかの適用に対して線形ダイナミックレンジの6桁が提供され、そして10ナノリットル容量中でサブナノモル蛍光プローブの検出を可能にするに十分に高い量的解像度が提供される。当業者は、多くの変形例、修正例、および代替例がわかるであろう。
【0081】
ブラインドチャネルタイプの素子で行う方法は、エラストマー材料内に形成されたフローチャネルと、このフローチャネルと流体的に連通した複数のブラインドフローチャネルとを備え、各ブラインドフローチャネルの端部が反応部位を規定する、微小流体素子の提供を伴う。少なくとも1つの試薬が反応部位それぞれに導入され、反応部位の1つ以上で反応が検出される。本方法は、任意で、反応部位内で少なくとも1つの試薬を加熱する工程を含んでもよい。したがって、例えば、1方法は、核酸増幅反応の構成成分の導入およびその後の当該構成成分を熱循環して増幅産物を形成することを含み得る。以下により十分に説明するように、本発明の実施形態にしたがって、特定の微小流体素子において起こる反応により特徴付けられるよう適合された光撮像システムが提供される。
【0082】
図1Aに示すように、本発明の実施形態のいくつかに従って提供される光撮像システムは、熱制御モジュールに連結された蛍光撮像システムを含む。このようなシステムは、N×M形状の微小流体チップからデータを収集するよう適合される。ある実施形態では、NはMに等しい。例えば、本発明の実施形態では、48×48の反応チャンバ、96×96の反応チャンバ、およびその他の形状を有する微小流体素子を用いる。特定の実施形態においては、96×96の反応チャンバ形状を有する微小流体素子において、96個のサンプルおよび96個の試薬が用いられる。当業者には明らかなように、本発明の実施形態に従って提供される方法およびシステムは、ひとつのプラットフォームで複数の利用を行うことを可能にする。
【0083】
図1Aは、本発明の実施形態にかかる光撮像システムを示す単純化した模式図である。図1Aに示すように、本発明の実施形態に従って光源242が提供される。以下にさらに十分に説明するように、本発明のある実施形態では、光源242からの光を用いて、サンプル内に蛍光を引き起こす。他の実施の形態においては、化学発光が指標として用いられる。当業者には明らかなように、実施例によって、システムコンポーネントが追加され、削除され、または用いられる。各種の実施形態において、発光ダイオード(LED)、レーザ、アークランプ、白熱灯そのほかを含む光源が用いられる。これらの光源は、多色性であってもよいし単色性であってもよい。特定の実施形態においては、上記光源は第1のスペクトルバンド幅により特徴付けられる。特定の実施形態において、光源は、約400nmから約700nmのスペクトル域にわたって光学的放射を作り出す白色光源である。単なる例として、ある本発明の実施形態では、カリフォルニア州ナヴァトのSutter
Instruments社により販売されているLambdaLS300Wキセノンアークランプが光源として用いられる。当業者には明らかなように、これよりもスペクトルバンド幅が広いまたは狭いことにより特徴付けられるその他の光源も、代替的な実施形態において使用することができる。
【0084】
励起フィルタホイール244を図1Aに示す。ある実施形態では、例えば、光源が多色性であるものの場合、励起フィルタホイール244は、光源242から発せられる光をスペクトル的にフィルタするのに用いられる。もちろん、複数のフィルタを用いてもよい。例として、ある実施形態では、励起フィルタホイールは多数の分光フィルタを備え、この分光フィルタはそれぞれサンプルからの固有の蛍光を励起するために適当な所定の波長域を通過させるよう適合されている。図1Aに示すとおり、励起フィルタホイール244は、フィルタのコンピュータ制御を行えるようにコンピュータ270に連結されている。具体的な実施形態では、励起フィルタホイールは多数の分光フィルタを備えている:
フィルタ1:中心波長485nm、スペクトルバンド幅20nmのフィルタ
フィルタ2:中心波長530nm、スペクトルバンド幅20nmのフィルタ、および
フィルタ3:中心波長580nm、スペクトルバンド幅20nmのフィルタ。
【0085】
当業者には明らかなように、本発明の実施形態はこれらの特定の分光フィルタに限定されるものではなく、特定のサンプル用の蛍光プロセスに適合される分光フィルタを用いてもよい。さらに、前の議論はフィルタホイールの使用に関するものであるが、フィルタホイールは本発明に必ずしも必要ではない。代替的な実施形態においては、分光フィルタはホイール以外の形状でもたらされる。本発明の実施形態よれば、例えば、フィルタホルダにはめた分光フィルタ、電気光学フィルタ、アクチュエータによって光路内に配置されたフィルタ他が含まれる。さらに別の実施形態では、光源は、蛍光発光の励起に適切な所定の波長で放射を出すよう適合された整調可能な(チューナブル)レーザである。当業者であれば、多くの変形例、修正例、および代替例がわかるであろう。
【0086】
図1Aに示されるように、励起シャッター246が本発明の実施形態に従って提供される。ある実施形態では、励起シャッターはコンピュータ270の制御下で動作し、光源242により生成され励起フィルタホイール244によりスペクトル的にフィルタされた光学信号を遮断/通過させる。用途によって、サンプルがシステムに挿入され取り除かれる間、および検定動作の際には、励起源は遮断される。ある実施形態において、例えばレーザ源を用いる実施形態では、光源を消す代替手段を備えており、励起シャッターは用いられない。
【0087】
励起シャッターが開放位置で動作する際には、光学励起信号はファイババンドル248を通過し、チップキャリア207に備えられた微小流体素子205に作用するよう導かれる。その他の本発明の実施形態は、クオーツ光導体、液体光導体、その他のスクランブル用システムそのほかを用いて照射均一性を高める。図1Aに示すように、励起光学信号は、光学発光体250による反射、屈折、またはその組み合わせを介して、微小流体素子205の表面に作用するように導かれる。図1Aに示すように、微小流体素子の照射は光学発光体250を介して行われる。他の実施形態において、照射は、素子の1つ以上の側面から斜めにリングライトまたは回収光学連結部(微小流体素子および検出器260の間の光路)を介して微小流体素子に連結されてもよい。
【0088】
ある実施形態では、励起源による光での微小流体素子の照射は、サンプルの2次元領域に渡って行われる。この実施形態において、広い視野が提供され、これにより、化学的プロセスおよび反応を時間分解した撮像を含む、蛍光用途の実施が可能となる。例として、タンパク質熱量測定および核酸増幅処理の蛍光撮像は、本発明の実施形態による利点である時間分解したプロセスである。これらのプロセスのあるものでは、多数の反応チャンバに与えられた蛍光サンプルの同時励起および多数の反応チャンバで起こる反応により生成された蛍光信号の同時収集が望ましい。別のプロセス、例えば、蛍光寿命撮像では、初期レベルから時間とともに減衰するにしたがって、蛍光信号の検出(および解析)に続いて簡単な励起パルスがおこる。当業者であれば、多くの変形例、修正例、および代替例がわかるであろう。
【0089】
例えば、核酸の増幅プロセスは、代表的に、標的DNA、熱安定性DNAポリメラーゼ、2つのオリゴヌクレオチドプライマー、デオキシリボヌクレオチド三リン酸(dNTP)、反応バッファ、およびマグネシウムを含む。一旦組み合わされると、この反応物はサーマルサイクラーに入れられる。この器具は、時間の量を変化させながら一連の異なる温度にその反応物を供する。この一連の温度および時間の調整を、1サイクルの増幅と呼ぶ。各サイクルは、理論的には反応中の目標配列(単位複製配列)の量を倍にする。10サイクルは、理論的には単位複製配列を約1000倍にし、20サイクルであれば、数時間で100万倍を超えることになる。ある用途では、数秒から数分の範囲の期間に広い範囲(例えば数cm2程度)から蛍光撮像データを得ることが望ましい。
【0090】
本発明のある実施形態では、本発明の実施形態により提供される方法およびシステムは、所定の期間行われるイメージキャプチャプロセスを容易にする。単なる例として、本発明の実施形態では、微小流体素子の撮像方法が提供される。この方法は、1分未満のタイムフレームの間に、イメージ検出空間領域を用いて微小流体素子の少なくとも定まった数のチャンバに関連付けられた空間領域のイメージのキャプチャする工程を含み、ここで空間領域のイメージのキャプチャには、実質的にスティッチングプロセスおよび/またはスキャニングプロセスがない。
【0091】
本発明の実施形態は、イメージキャプチャ用の各種のタイムフレームを1ミリ秒から1分の範囲で提供する。ある実施形態では、イメージキャプチャ用のタイムフレームは、1分を超える。微小流体素子のチャンバで行われるプロセスに関係した発光特性によって、イメージキャプチャのタイムフレームは変化する。例えば、ある実施形態では、タイムフレームは、10ms、50ms、100ms、250ms、500ms、750ms、または1秒である。別の実施形態では、タイムフレームは2秒、5秒、10秒、15秒、20秒、30秒、40秒、50秒、または1分である。もちろん、タイムフレームは特定の用途に依存する。
【0092】
ある実施形態では、イメージキャプチャプロセスは同期して行われ、定まった数のチャンバのイメージを同時にキャプチャする。例えば、例示的PCRプロセスでは、微小流体素子が92℃の温度で15秒間維持される。結果として、微小流体素子は60℃の温度で60秒間維持される。加熱および冷却サイクルは1分間のサイクル期間で多数のサイクル繰り返される。本発明の実施形態を用いることにより、微小流体素子において存在する所定の数のチャンバのイメージは、位置に応じてチャンバが均一な温度に維持されたまま、同期して獲得される。例えば、微小流体素子が60℃の温度に維持されつつ30秒の露出を用いることで、微小流体素子全体の2次元イメージを得ることができる。当業者であれば、ラスタースキャニングまたはスティッチングシステムより優れた本発明の利点が提供されることは言うまでもないであろう。ここで、微小流体素子の第1の部分(例えば、左上の象限)内のチャンバのイメージは、微小流体素子の第2の部分(例えば、右下の象限)内のチャンバのイメージに先立って得られる。
【0093】
他の実施形態では、1分未満のタイムフレームの間に定まった数のチャンバから複数のイメージが得られる。これらの実施形態の例として、特定の実施形態において、複数の蛍光プローブに関連付けられた複数のイメージを得ることができる。微小流体素子が60℃の温度に維持される60秒の間、20秒の露出を用いて、3つの異なる蛍光プローブ、例えばRoxTM、Vic(登録商標)、およびFamTMについて、3つの連続したイメージを得ることができる。もちろん、用途に応じて露出時間は短くてもよく、1秒以下であってもよい。これらの複数のイメージを用いて、差動蛍光比を計算し解析することができる。もちろん、蛍光発光の強度によって、各種の蛍光プローブ用の露出時間を特定の用途に適するように変更してもよい。このようにして、本発明の実施形態は、微小流体素子を一定温度で維持しつつ、複数のスペクトルバンドにおける微小流体素子の撮像を行う。この一定温度は、先の例で示したように、周期的な温度処理を含むPCRプロセスの1部であってもよい。
【0094】
本発明の実施形態が提供する方法およびシステムは、また、化学発光プロセスを行い解析するよう適合されている。これらのプロセスの中には、反応が第1の時間スケールでおこり、化学発光プロセスのイメージが第2の時間スケールで得られるものがある。特定のプロセスにおいては、第2の時間スケールは第1の時間スケールよりも短い。したがって、本発明の実施形態は、目的の反応チャンバ中のサンプルが同じ時間だけ反応されている場合に、化学発光プロセスの同期イメージをキャプチャするよう適合されている。これらのプロセスの中には、サンプル温度循環を含む温度制御が提供されるが、他の実施形態では、反応チャンバは一定温度に維持される。
【0095】
図1Aに示されるように、温度制御部ともいわれる熱制御部240は、本発明の実施形態に従って提供される。微小流体素子選択された領域内または素子全体の温度の制御するために、多数の異なる変更の工夫のための選択肢が利用可能である。したがって、本明細書中では、温度制御部という語は、広く、微小流体素子全体または微小流体素子の部分の内部(例えば、特定の温度領域内または1つ以上の微小流体素子のチャネルのマトリクスの接合点)の温度を調整することができる素子または要素をさすものである。
【0096】
図1Cは、本発明の実施形態にかかる熱制御素子を示す単純化した模式図である。図1Cに示すように、微小流体素子205はサンプルアレー206を含む。当業者には明らかなように、サンプルアレー206は1次元で図示されているが、本発明の実施形態に従って3次元のサンプルアレーが提供される。例として、本発明の実施形態で用いられる微小流体素子では、反応チャンバのアレーおよび流体的に連通したチャネルが、図の平面に伸張するものがある。反応チャンバを含む微小流体素子の要素は、3次元の深さにより特徴づけられる。微小流体素子205は、キャリア207により支持され、次にキャリア支持体208によって支持される。微小流体素子またはチップ下層209は、ある実施形態では対応しており、キャリア207およびインテグレーテッドヒートスプレッダ(Integrated Heat Spreader:IHS)241に連結されている。熱プラテン243を図1Cに示し、以下でより十分に説明する。ある実施形態では、微小流体素子とIHS/プラテンとの間のハードコンタクトが提供される。さらに、以下でより詳細に説明するように、ある実施形態では、真空技術を用いて微小流体素子をキャリアに対して配置および保持する。
【0097】
一般に、素子は熱循環プレートに配置されて素子を熱循環する。このような各種のプレートは、商業的供給源から容易に調達でき、例えばThermo Hybaid Px2(マサチューセッツ州フランクリン)、MJ Research PTC−200(カリフォルニア州サウスサンフランシスコ)、Eppendorf Part# E5331(ニューヨーク州ウェストベリー)、Techne Part# 205330(ニュージャージー州プリンストン)などが挙げられる。
【0098】
ある実施形態では、微小流体素子は熱制御素子が熱制御源と熱的に連通するように熱制御素子と接触し、反応チャンバの少なくとも1つにおける反応温度が、熱制御源の温度変化の結果として変化される。異なる実施形態において、熱転移素子は、シリコンなどの半導体を含み得、反射性材料を含み得、および/または金属を含み得る。
【0099】
熱制御素子は、熱制御源に向かって熱転移素子を付勢するために熱転移素子に力を加えるよう適合されてもよい。この力は、異なる実施形態においては、機械的な圧力でも、磁力でも、静電気力でも、真空力でもよい。例えば、一実施形態においては、この力は、熱転移素子に向かって、熱制御素子または熱転移素子の表面に形成されたチャネルを介して加えられる真空力を含む。熱制御素子の表面と熱転移素子の表面(または表面の1部分)の間で得られる真空のレベルが検出されてもよい。このような検出は、真空源の位置から離れた、単一のチャネルまたは複数のチャネルに沿って位置する真空レベル検出器により行われる。真空が前もって設定したレベルを超えない場合は、警報が発せられてもよく、また再調整プロトコルを用いてもよい。
【0100】
アレー素子は、1つ以上の機械的または電気機械的な位置決め装置の採用により熱制御素子と接触させられてもよい。この方法の実行は、自動的に制御されモニタされる。例えば、このような自動制御およびモニタリングは、アレー素子を熱制御素子に導入したり、アレー素子を熱制御素子から取り除いたりするロボット制御システムとの操作可能な連通状態において自動制御システムで行われてもよい。反応の進行もまた、モニタすることができる。
【0101】
熱制御素子を備えるユニットが提供され得る。システムはアレー素子および熱制御素子を備えて提供され得る。熱循環ステップの精度を保証するために、ある素子では、素子のさまざまな領域で温度を検出するセンサを組み込むことが有用である。温度検出用の一構造として、熱電対がある。このような熱電対は、基礎となる基板材料上にパターンを描く薄膜ワイヤとして形成することができ、または微細加工エラストマー材料そのものに直接組み込まれたワイヤとして形成されてもよい。
【0102】
温度は、電気抵抗の変化により検出されてもよい。例えば、基礎となる半導体基板上に従来の技術を用いて製造されたサーミスタの抵抗の変化を、任意の温度変化に対して較正することができる。また、サーミスタは、微細加工エラストマー材料に直接挿入してもよい。抵抗によるさらに別の温度検出アプローチは、Wuら、「MEMS Flow Sensors for Nano−fluidic Applications」Sensors and Actuators A 89 152−158 (2001)に記載されており、これは、全体として参照によりここに組み込まれる。この論文では、温度の制御と検出の双方のために、ドープされたポリシリコン構造を使用することを記載している。ポリシリコンおよびその他の半導体材料については、抵抗の温度係数は、ドーパントの同一性および量により正確に制御することが可能であり、これにより任意の用途のセンサの性能を最適化することができる。
【0103】
サーモクロマチック材料は、増幅素子の領域の温度検出に利用可能な別の種類の構造である。具体的には、特定の材料は、異なる温度にさらされる際に顕著にかつ再生可能に色を変化させる。このような材料は、異なる温度にさらされる際に溶液に加えることができる。サーモクロマチック材料は基礎となる基板に形成可能であり、またエラストマー材料内に組み込むこともできる。また、サーモクロマチック材料は粒子の形状でサンプル溶液に加えることができる。
【0104】
温度検出の別のアプローチは、赤外線カメラの利用によるものである。顕微鏡とともに赤外線カメラを使用することにより、増幅構造全体の温度プロファイルを判定することができる。適切な波長(例えば、熱、赤外線、その他)の放射に対するエラストマー材料の透過性により、この解析が容易になる。
【0105】
温度検出のさらに別のアプローチは、焦電センサの使用による。具体的には、結晶材料、とりわけ圧電作用も示す材料には、焦電効果を示すものがある。この効果は材料の結晶格子の偏光、これによる材料上にわたる電圧が高度に温度依存性になる現象を説明する。このような材料は基板またはエラストマーに組み込むことができ、温度の検出に用いることができる。本発明の実施形態に従って、キャパシタンスやインダクタンスなど、その他の電気現象を温度の検出に用いることができる。当業者であれば、多くの変形例、修正例、および代替例がわかるであろう。
【0106】
一実施形態において、撮像システム200は以下のように動作する。まず、微小流体素子205はキャリア207上にしっかりと固定される。微小流体素子205が固定される機構、例えば微小流体素子のベース支持体の端部に基づき、コンピュータ270は、その後キャリア207を動かして微小流体素子と第1のxy位置にそろうようにxy駆動(不図示)する。ある実施形態では、1つ以上の基点のマーキングが、整列の間および位置決めプロセスの間に利用される。特定の実施形態において、システムのユーザはその後、撮像システムに1つ以上の基点マーカの正確な座標を登録する。別の実施形態では、左右対称のXY基準オブジェクトを配置し任意の非対称のコンポーネント取り除くことにより基準の重心を正確に計算することができるので、このプロセスは自動的に行われる。ある実施形態では、位置合わせプロセスの間に端部や角部などの基準特徴が用いられる。当業者であれば、多くの変形例、修正例、および代替例がわかるであろう。
【0107】
コンピュータ270の制御下で、キャリア207が光学要素210および212の焦点面に位置するようキャリア207を調整するか、または光学要素210および212の焦点面がキャリア207に位置するように光学要素210および212を調整することが実施される。好適な実施形態では、視野は、微小流体素子に存在する多数の反応チャンバを含む微小流体素子全体を包含することができる。
【0108】
微小流体素子の反応チャンバ内で起こる化学的プロセスにより発せられる蛍光、化学発光、または光学信号は、第1レンズシステム210により収集される。本発明のある実施形態では、第1レンズシステムは、1つ以上のレンズと1つ以上の開口を含むマルチ要素光学連結部である。図2Aに示すように、第1レンズシステム210は、1つのレンズ要素とダブレットその他を備える。焦点距離、f/#、そのほかを含む第1レンズシステム210の光学特性が、所望の光学性能を備えるために選択される。当業者であれば、多くの変形例、修正例、および代替例がわかるであろう。光軸から所定の距離を越えて伝播する光線を遮蔽するための発光シャッター215を図1Aに示すが、これは本発明に必須ではない。
【0109】
再び図1Aを参照して、光フィルタ素子213が光学アセンブリの一部として備えられる。ある実施形態では、光フィルタ素子は、蛍光または化学発光により標識が付された試薬により生じる蛍光または化学発光を通過させ光学的に処理するように構成された、多数の光学要素を備えるフィルタホイール213である。例として、ある実施形態では、発光フィルタホイールの第1部分は、第1の蛍光色素により生じる蛍光発光を通過させるように構成されている。例えば、第1の蛍光色素の例としては、例えば、Piscataway,NJ.のGE Healthcareの一部であるAmersham Biosciencesより市販されているCyTM3Fluorがある。発光フィルタホイールの第2部分は、第2の蛍光色素により生じる蛍光発光を通過するように適合される。第2の蛍光色素としては、例えば、同じくAmersham Biosciencesより市販されているCyTM5Fluorがある。もちろん、これらの蛍光色素の使用は本発明に必須ではない。代替的な実施形態においては、カリフォルニア州カールズバッドのInvitrogen Corporationより市販されているAlexa Fluorsが用いられる。例として別の実施形態においては、発光フィルタホイールの第1部分は、例えばInvitrogen Corporationより市販されているAlexa Fluor350などの第3の蛍光色素による蛍光発光を通過させるよう構成される。発光フィルタホイールの第2部分は、例えば同じくInvitrogen Corporationより市販されているAlexa Fluor488などの第4の蛍光色素による蛍光発光を通過させるよう構成される。以下に、発光フィルタホイールに関する詳細をさらに示す。
【0110】
ある実施形態では、光フィルタ素子213および発光シャッター215は、第1レンズシステムおよび第2レンズシステムの間に位置する。これらの実施形態には、光フィルタ素子を通過する光線が光軸に対して小さな角度で伝播するものもある。当業者には明らかなように、入射光線角の小さい領域に配される分光フィルタ(例えば、干渉フィルタ)は、その構成がより簡単であり、総スペクトルバンド幅が狭くなる可能性があるが、このような狭いスペクトルバンド幅による特徴および/またはフィルタ位置は本発明に必須である。図1Aに示すように、光フィルタ素子および発光シャッターの双方は、コンピュータ270に連結され、これらの要素のコンピュータ制御を行う。さらに当業者には明らかなように、複数の、おそらくは複数の同一のフィルタを光路中に配置して励起波長の遮断性を向上させることができる。ある実施形態では、これらのフィルタはフィルタで反射された光線がその光路からはずれるように光軸に対して角度を成している。
【0111】
別の実施形態では、二本鎖DNAへの結合に際して飛躍的な蛍光増進を有するおよび/または二本鎖DNAに対する強い化学的親和性を示すインターカレーション色素を、二本鎖増幅DNAの検出に用いてもよい。適切な色素の例としては、SYBRTMおよびピコグリーン(オレゴン州ユージーンのMolecular Probes,Inc.社)、エチジウムブロマイド、ヨウ化プロピジウム、クロモマイシン、アクリジン・オレンジ、ヘキスト33258、Toto−1、Yoyo−1、およびDAPI(4’,6−ジアミジノ−2−フェニルインドール塩酸塩)が挙げられるがこれらに限定されない。インターカレーション色素の使用に関しては、さらに、Zhu他、1994、Anal.Chem.66:1941−1948(1994)により検討されており、これは全体として参照により組み込まれる。
【0112】
第2のレンズシステム212もまた図1Aに示される。光フィルタ素子213および発光シャッター215を通過する蛍光発光放射または化学発光放射は第2レンズシステムにより検出器260上に収束される。ある実施形態では、この検出器はCCDカメラアレーであるが、これは本発明に必須ではない。特定の実施形態において、ほぼ微小流体素子のサイズであるアレー検出器が用いられる。好ましくは、検出器アレー260の画素サイズは、微小流体素子内の反応チャンバの面積よりも小さい面積となるように選択され、これにより、反応チャンバごとに複数の検出器画素が備えられる。特定の実施形態において、検出器260はおおよそ15μm×15μm画素のCCDアレーである。
【0113】
微小流体素子により、ここに記載の多数の異なる検出戦略を用いることができる。適切なシステムの選択は、イベントの種類および/または検出されている因子について、ある程度情報提供される。検出器は、多数の異なる信号種を検出するよう構成されてもよく、異なる信号種には、放射性同位体、蛍光プローブ、発色団、高電子密度粒子、磁性粒子、スピン標識、化学発光を発する分子、電気化学的活性分子、酵素、補因子、核酸プローブにリンクされた酵素、および酵素基質からの信号が挙げられるが、これに限らない。
【0114】
本発明の微小流体素子との使用に適切な検出方法の実例には、光散乱、マルチチャネル蛍光検出、紫外線および可視波長吸収、発光、差動反射、および共焦点レーザ走査などが挙げられるが、これに限らない。特定の用途に用いることのできるこのほかの検出方法に、シンチレーション近接アッセイ技術、放射化学的検出、蛍光偏光異方性、蛍光寿命、蛍光相関分光法(FCS)、時間分解エネルギー移動(TRET)、蛍光共鳴エネルギー移動(FRET)、および生体発光共鳴エネルギー移動(BRET)などの変形例が挙げられる。その他の検出オプションには、電気抵抗、固有抵抗、インピーダンス、および電圧検出などが挙げられる。
【0115】
ある実施形態では、検出は「検出部」または「検出領域」で起こる。これらの用語およびその他の関連用語は、微小流体素子内の検出が起こる部分を指している。ある微小流体素子では、検出部は、普通、微小流体素子内に存在する反応チャンバである。その他の素子用の検出部は、交差部に隣接するフローチャネル内にあってもよく、交差部自体、または交差部を取り囲む領域、および周囲の領域であってもよい。
【0116】
検出部は、1つ以上の顕微鏡、ダイオード、光刺激素子(例えばレーザ)、光電子増倍管、プロセッサ、およびこれらの組み合わせと連絡し得る。これらは、特定のイベントおよび/または因子に関連付けられた信号を検出するために協働する。検出されている信号は、1つ以上の光学検出器により検出部内で検出される光学信号であることが多い。光学検出器は、例えば、1つ以上の光電子増倍管、顕微鏡、および/またはビデオカメラ(例えば、CCDカメラ)に続く、1つ以上のフォトダイオード(例えばアバランシェフォトダイオード)、光ファイバー光導体を備えてもよい。
【0117】
検出器は、微小流体素子内での微細加工が可能であり、または独立した要素であってもよい。検出器が別個の要素として存在し、微小流体素子が複数の検出部を備える場合、検出は任意の瞬間に単回の検出部で起きてもよい。具体的な実例として、微小流体素子は移動可能なステージに取り付けられ、顕微鏡対物の下でスキャンされてもよい。このようにして得られた信号は、その後、信号解釈と処理のためにプロセッサに送られる。光電子増倍管のアレーを用いてもよい。加えて、各部分からの信号を判定しつつ、全ての異なる検出部から同時に信号を収集することのできる光システムを用いてもよい。
【0118】
外部検出器は、提供される素子が、全てまたはおおむね、モニタされている波長において光学的に透明である材料から製造されるため、有用である。この特徴により、ここに記載の素子が多数の光検出システムを用いることを可能にするが、これは従来のシリコンベースの微小流体素子では実現できなかった。
【0119】
特定の本発明の実施形態では、各反応チャンバから収集した光の量を最大限にするために、CCDカメラとして検出器を、そして広い視野および大きな開口数を与える光路を用い、これにより検出感度を高める。この実施形態では、CCDは、アレーのイメージ生成ではなく、各画素または一群の画素が反応チャンバに対応する光センサのアレーとして用いられる。したがって、光学は、光システムの使用可能な被写界深度を高めてより多くの光を各反応チャンバから集めるために、検出器で画質を下げるまたは不鮮明になるよう構成または変更されてもよい。とりわけ、本発明のある実施形態が意図するアッセイは蛍光色素を用いる生物学的アッセイを含み、この色素が励起光に対する露出により光退色して所定のサンプルから取得可能な信号光子の総数を制限することになるため、その制限された信号光子の効果的な収集は、考察されるような器具において重要であり得る。面積効率の考慮は、任意の光システムの対物およびイメージNA(開口数)ならびに総システム倍率に関する。(例えば、高入射角光線のCCD表面における反射損により)イメージ側NAが制限されるため、一般に、任意のシステム倍率と同時に任意に高い対物(サンプル)側NAを得ることはできない。実際、より大きなシステム倍率により、同時にイメージ側NAを大きくすること(および上記の理由による有害な可能性)の必要なしに、高い対物側NAを得ることができる。結果として、記載のシステムにおいて、1:1光システム(すなわち、システム倍率1)を可能とする大きなCCD(例えば、30.7mm×30.7mm)焦点面アレーが用いられてきた。これにより、CCDに対するイメージ側NA0.36と同時に収集NA0.36が可能となり、このことは表面反射損に対して適度な性能を実現する。
【0120】
ある実施形態では、対物側NAが大きくなると対物側焦点深度が低減することになり、そのため、サンプル内の反応チャンバの任意の深さにおいて、(焦点深度による不鮮明さが、レンズ逸脱などの問題による不鮮明さ以上と仮定すると)検出器での不鮮明さが大きくなり、チャンバ間の信号のクロストークを低くした場合に、サンプルの反応チャンバ間の許容可能な最小間隔を制限することになる。1:1光システムと合わせて、この対物側NAの考慮は、最大約0.5NAに維持するのによく、これは、その表面における反射損を回避しようとする場合には、CCD(またはシリコン検出器)に通常望ましいNAとされる。さらに、1:1撮像レンズシステムは、本質的に奇数次逸脱がほとんどなく、この特定の倍率(M=1)の利点を高める。撮像対象の微小流体システムと同じくらいかそれ以上の大きさの検出器による1:1光システムの使用は、このように、詳細なシステム用の構成として本発明のある実施形態により提供される。
【0121】
その他の実施形態では、検出器(例えば、CCD焦点面アレー)のサイズに関連して費用制約条件があることがある。例えば、現在の高量子効率フルフレームCCDアレーでは、27.6mm×27.6mmの寸法を有するものがある。この検出器は、30.7mm×30.7mmの寸法の微小流体素子よりもわずかに小さく、記載のシステム用の構成としてはシステム倍率が0.88となる。システム倍率M=1に近いため、このような倍率での上記の検出器(イメージ側)入射NAに関する制約条件は満たされる。
【0122】
他の実施形態において、所定のXY面(光軸に対して垂直方向)の間隔および反応チャンバのサイズは特定されてもよい(例えば、XY面におけるサンプル−チャンバの所望の密度を得るため)が、チャンバの最小総容積の制約条件は、依然として残る(例えば、化学的容積に必要な最小容積を実現するために、例えば試薬の数または目標分子の数が少ないことにより過度の統計的な変動を回避すること、また、単に要求される最小の数の蛍光、光学発光分子または対象物を得ること)。このような場合、各チャンバの総容積が最小数値以上となるように、Z(任意)軸に平行なチャンバを拡張することが必要となることがある。Zに沿ってよりいっそう拡張すること(高いアスペクト比、またはZ軸に沿って検査対象のサンプルに集中する円柱状のチャンバを作り出すこと)により、一般に、焦点深度による不鮮明さがレンズ逸脱他の問題による不鮮明さ以上とすると、焦点深度の考慮による、任意の対物側NAの検出器におけるチャンバイメージの不鮮明さはより大きくなる。ある状況では、これによって対物側NAの低いユーザにつながる。NAの低いレンズシステムを用いることにより、焦点深度が大きくなり、したがって、一般に隣接または近傍のチャンバ間の光学信号における過度のクロストークを起こすことなく光軸に対して平行に伸びるチャンバからの光の収集を可能とする。このようにして、Z(光軸に平行)におけるチャンバの拡張により総チャンバ容量を大きくしつつ、過度のクロストークなしにXY面(光軸に垂直な面)にあるチャンバの密度を大きくすることができる。この場合、または低い対物側NAが利用可能である他の場合(例えば、反応チャンバのXY間隔が大きいことにより、過度のクロストークが生じることなく検出器におけるチャンバイメージの不鮮明さを高くすることができる場合、または高いNAが必須でない非光制限用途の場合、光退色が問題にならないほど十分なサンプルがある場合、非光退色サンプルを用いる場合、低いシステム感度が許容範囲である状況、など)には、とりわけ、M≧NA0/0.5の場合、より望ましくはM≧NA0/0.36(ここでNA0=対物側NA)の場合、より一般的にはM≧NA0/NAdetであって、NAdetが検出器に対する過度の反射/挿入損なしに検出器面に対して許容範囲である最大NAである(通常のCCDについてNAdet=0.36〜0.5)場合には、より低いシステム倍率(M<1)が適切であってもよい。
【0123】
対物側焦点深度および/または不鮮明さ要求が対物側NA≦0.36もしくはNA≦0.5の必要がなく、またはより一般的にはNA0≦NAdetである必要がない場合、(上述のとおり)面積効率を考慮して、より大きな検出器が望ましい。なぜなら、より大きいM(一般に任意のサンプルサイズについてより大きな検出器を必要とする)は、所定のNA0についてより小さいNAi(イメージ側NA)が可能となるからである。このように、光収束要件(例えば、特定のアッセイ感度を達成するため)は、より大きなNA0(NA0>NAdetにより規定される)を要求し、そして被写界深度および他の構成上の考慮(例えば、費用)により大きなNA0が可能となり、検出器での損失が最小限となるようより大きなMが望ましい。このような実施形態では、検出器素子、例えば、撮像対象の微小流体素子の面積と同じくらいかそれ以上のサイズの1つ以上のCCD素子を用いることが有用であることがある。このような大きな検出器を使用することにより、光システムの倍率が高くなり、したがって(面積効率の考慮を介して)検出器に対する固定入射NAについてサンプルからの高いNA光収集が可能となる(後者は、例えば、高い入射光線入射角でのCCD面における反射損による)。
【0124】
とりわけ好適な検出器は、各反応チャンバから収集した光の量を最大限にするために、CCDカメラおよび広い視野および大きな開口数を与える光路を使用し、これにより検出感度を高める。この点について、CCDは、アレーのイメージ生成として使用されるのではなく、各画素または一群の画素が反応チャンバに対応する光センサのアレーとして用いられる。したがって、光学は、光システムの被写界深度を高めてより多くの光を各反応チャンバから集めるために、検出器で画質を下げるまたは焦点をぼかすよう変更される。ある実施形態では、高いアスペクト比または円柱状のチャンバを採用して、光システムの光軸に沿って検出器により、および好ましくは被写界深度を深めるためにイメージの焦点をぼかすことにより、検査対象のサンプルに集中することが有用である。NAの低いレンズシステム、好ましくは相互に左右対称のレンズシステムが用いられる。検出器素子、例えば、撮像対象の微小流体素子の面積と同じくらいかそれ以上のサイズの1つ以上のCCD素子を用いることもまた有用である。NAの低い光学とともに用いることにより、検出感度の向上が実現できる。
【0125】
検出器システムは、検出可能な信号を生成するレポーターを刺激する光源を備えてもよい。用いられる光源の種類は、ある程度、活性化したレポーターの性質による。適切な光源としては、レーザ、レーザダイオード、白色光源、および高輝度ランプなどがあるが、これに限らない。レーザを用いる場合、レーザは一群の検出部または単一の検出部上の走査に用いられてもよい。レーザダイオードは、微小流体素子自体に微細加工することができる。また、レーザダイオードは、熱循環反応を行うために用いられる微小流体素子に隣接して配された別の素子に形成して、ダイオードからのレーザ光が検出部に導かれるようにすることもできる。
【0126】
検出は、複数の非光学的アプローチも備え得る。例えば、検出器は、例えば、温度センサ、伝導度センサ、電位差センサ(例えば、pH電極)および/または電流測定センサ(例えば、酸化反応および還元反応のモニタのため)などを備え得る。
【0127】
二本鎖DNAへの結合に際して飛躍的な蛍光増進を有し、そして/または二本鎖DNAに対する強い化学的親和性を示すインターカレーション色素を、二本鎖増幅DNAの検出に用いてもよい。適切な色素の例としては、SYBRTMおよびピコグリーン(オレゴン州ユージーンのMolecular Probes,Inc.社)、エチジウムブロマイド、ヨウ化プロピジウム、クロモマイシン、アクリジン・オレンジ、ヘキスト33258、Toto−1、Yoyo−1、およびDAPI(4’,6−ジアミジノ−2−フェニルインドール塩酸塩)が挙げられるがこれらに限定されない。インターカレーション色素の使用に関しては、さらに、Zhu他、Anal.Chem.66:1941−1948(1994)により検討されており、これは全体として参照により組み込まれる。
【0128】
図1Aに示すように、本発明の実施形態のあるものは、微小流体素子からの蛍光、化学発光、生物発光、およびその他の信号を生成検出するよう構成された1:1撮像システムを提供する。1:1撮像システムは、撮像対象のサンプルと同じ大きさのイメージ検出素子を用いるいくつかの実施形態で提供される。数cm2程度の広い視野の1:1撮像を提供することにより、本発明の実施形態は、開口数(NA)の大きい光システムを提供する。光収集効率がほぼNA2に比例することから、本発明のいくつかの実施形態によるNAの増加は、1〜10ナノリットル程度の反応容積および1.0ナノモル濃度程度の活性蛍光プローブ濃度を有する反応チャンバからの適切な蛍光信号の収集を可能とする。その他の実施形態では、ピコモル濃度範囲の活性蛍光プローブ濃度が適切な蛍光信号を提供する。
【0129】
加えて、本発明の実施形態は、例えば、イメージをわずかに縮小して、対象とほぼ同じ大きさからその約半分のサイズまでの範囲のイメージを形成する撮像システムを提供する。例えば、一実施形態において、微小流体素子の空間領域(この空間領域は、96を超える数のチャンバに関連付けられている)のイメージが送信されキャプチャされる。空間領域のイメージのキャプチャにはイメージ検出器素子が用いられ、微小流体素子の空間領域とほぼ等しいかわずかに小さいイメージ検出空間領域を用いる。単なる例として、微小流体素子の空間領域の面積 対 空間領域のイメージの面積の比は、1:1、1:0.99、1:0.95、1:0.9、1:0.88、1:0.85、1:0.8、1:0.7、1:0.6、および1:0.5であり得る。ある実施形態では、この比は1:0.5未満である。これら特定の比率は単なる例示であって、撮像システム用に選択される比は特定の用途に依存することになる。
【0130】
ある実施形態では、光撮像システムは、約3cm×3cmの視野を有する。他の実施形態では、光撮像システムは、約1cm×1cm〜約5cm×5cmの範囲の視野を有する。特定の実施形態においては、2cm×2cm、2.5cm×2.5cm、2.76cm×2.76cm、3.07cm×3.07cm、3.5cm×3.5cm、および4cm×4cmの対物視野が提供される。一般に、光撮像システムの視野は、微小流体素子の空間領域、例えば、関連する多数の反応チャンバを含む面積に対応するよう選択される。
【0131】
さらに、本発明の実施形態は、さまざまな開口数を有する光撮像システムを提供する。例として、各種の実施形態にしたがって0.1〜0.5の範囲のNAが提供される。特定の実施形態においては、0.15、0.18、0.2、0.23、0.25、0.3、0.36、および0.4のNAが提供される。
【0132】
光撮像システムの空間解像は、一般に、イメージ検出器素子中の画素のサイズに応じる。本発明のある実施形態では、検出器に存在する画素の倍率(ある実施形態では1に等しい)およびサイズは、反応チャンバに関連付けられた画素の数を決定する。一般に、反応チャンバそれぞれに関連付けられた複数の検出器画素を有することが好ましい。例えば、反応チャンバの一辺が45μmであれば、一辺の寸法が15μmに等しい9つまでの正方形の画素は1:1撮像システム内の反応チャンバと重なる。したがって、本発明の実施形態によれば、各反応チャンバに関連付けられた多数の画素数は1から100の範囲である。本発明の実施形態によれば、例えば、4画素領域、9画素領域、16画素領域、25画素領域、36画素領域、49画素領域、64画素領域、および81画素領域が反応チャンバに関連付けられている。
【0133】
本発明の実施形態では、1μm2〜900μm2の画素サイズの範囲が用いられる。例えば、一辺が1μm、2μm、3μm、4μm、5μm、10μm、13.5μm、15μm、20μm、25μm、および30μmの正方形の画素が、本発明の各種の実施形態で用いられる。当業者には明らかなように、画素サイズ、検出器、アレー配置、およびアレーあたりの画素数が関係する。代替の実施形態において、1μm2〜900μm2の範囲の画素面積を有する長方形の画素が用いられる。
【0134】
さらに、イメージ検出素子とも呼ばれ、さまざまな画素数を含む検出器アレーが、本発明の各種の実施形態により用いられる。アレー寸法は、512×512画素領域から3,000×3,000画素領域の範囲をとる。ある実施形態では、検出器アレーの利用可能性に応じて、より多数の画素を1つのアレーに提供することができる。特定の実施形態では、1,024×1,024画素領域および2,048×2,048画素領域の寸法のアレーが用いられる。
【0135】
本発明の実施形態は、いくつかのシステムパラメータによって特徴付けられる光撮像システムを提供する。例を挙げると、35mmを超える作業距離、例えば45.92mmが本発明の実施形態により利用可能である。別の実施形態では、平均13.44μm最大17.85μmの平方次乗平均(RMS)スポットが提供される。さらに、本発明の実施形態により、およそ±5%の照射変動が実現される。ある実施形態では、最大フィルタAOIが12.56度、フィルタでの最大ビームが76mm、歪みが<0.10%、最大レンズ径が5.512インチの光撮像システムの全体的な長さが、542.1mmである。
【0136】
図1Bは、本発明の実施形態にかかる撮像システムの単純化した図である。ある実施形態では、図1Bに図示する撮像システムは、タンパク質結晶化処理を行うよう構成された素子を含む微小流体素子を撮像するために用いられる。図1Bに図示する撮像システムおよび関連する微小流体素子に関するさらなる詳細は、同時継続中の同一出願人により2004年7月28日に出願された米国特許出願第10/902,494号、および2004年5月20日に出願された米国特許出願第10/851,777号に記載されており、この開示は、本明細書において参照により組み込まれる。とりわけ、本発明の実施形態に従って提供される微小流体素子、およびその図1Bに示す撮像システムとあわせての利用に関するさらなる詳細が、これらに記載される。これらの図は単なる例であり、本発明の請求の範囲を過度に限定するものではない。当業者であれば、多くの変形例、代替例、および修正例がわかるであろう。
【0137】
一実施形態において、撮像システム(10)は以下のように動作する。まず、微小流体素子(30)はステージ(20)上に固定される。この微小流体素子(30)の固定された特徴(例えば、微小流体素子(30)の基材の端)に基づいて、その後、コンピュータ(110)は、微小流体素子(30)が複数の基準マーキングのうちの第1のマーカと第1のx,y位置で位置を合わせるように、x,yドライブ(25)にステージ(20)を移動させる。ここで、基準マーキングは、チャンバの中央点より既知の距離zだけ離れた微小流体素子に埋め込まれており、固定された特徴からの推測に基づいて、撮像素子(60)により焦点が合うようになる。システムのユーザはその後、撮像システムの基準の正確な座標を登録する。2つ以上の追加の基準マーカは、その後、同様にユーザによりマップされる。その他の実施形態では、このプロセスは、左右対称のXY基準オブジェクトを配して非左右対称のコンポーネントを取り除くことにより基準の重心が正確に計算されるため、自動的に行われる。コンピュータ(110)の制御下にある撮像素子(60)は、その後、基準マーキングに焦点をあわせるために焦点面(100)のz寸法位置を調整する。例えば、一旦基準マーキングに焦点があわされると、撮像システムは、その後、撮像素子(60)の視野内の追加基準マーキングを探して、微小流体素子(30)の第1のx,y座標イメージを得る。好適な実施形態では、視野は計測セル全体を含むことができる。その後、コンピュータは、第1のx,y座標イメージを分析して微小流体素子に歪みや伸びがあるかどうかを判定する。歪みや伸びがあると判定された場合には、微小流体素子のイメージと座標マップが理想的な座標マップに位置を合わせるように第1のx,yイメージを変形する。理想的な座標マップは、後で、イメージ減算ステップとマスキングするステップにおいて用いられる。
【0138】
好適な実施形態において、理想的な座標マップに位置を合わせた微小流体素子x,y座標イメージを用いて、システムは、その後、微小流体素子内の、伸び、歪み、または各種の微小流体層間のコレジストレーションの欠如の有無を、x,y座標イメージ内の基準マーキングの位置を理想的格納イメージのx,y座標イメージ内の基準マーキング位置と比較することによって判定する。実際の基準位置と撮像された基準位置の間に差が存在する場合には、マトリクス変換、好ましくはアフィン変換が行われて、撮像された測定セルの形状を理想的な測定セル形状の仮想形状に変換する。測定された実際の基準位置および格納された理想的基準位置間の差から計算されたマトリクス変換を用いて実イメージを周知かつ固定の理想イメージに変換することにより、イメージ減算やその他のイメージ解析が可能にされる。
【0139】
マトリクス分析を介して座標マップの間の差異を計算することによって、マトリクス変換は、さらにここに記載のイメージプロセッシングで用いられるために実イメージを理想的イメージに改正するために開発されてもよい。撮像された微小流体素子を標準的な形状に合わせるために、測定セルのチャンバ視認可能な面積を最大化するためにイメージ減算およびマスキングが可能となる。さらに、連続する時間にもとづくイメージのゼロ時間においてチャンバに欠陥や破片が存在する場合には、このような欠陥や破片は、その後のイメージからはマスクされて、自動化解析を行う際の誤信号を回避する。欠陥や破片を含むチャンバの領域のマスキングに加えて、その後の解析において誤読み取りをおこさないようにチャンバの壁をその後のイメージから減算してもよい。制御層とチャネル層など、各種の層間の不一致も、制御ラインそのものなど、制御層内の発見された対象の位置に基づいて計算することができる。別の例では、この補正は制御層基準そのものに基づいて決定される。ある実施形態では、この特別な変換は、制御層がプロテインチャンバを残りの制御ラインから区切るので、重要である。
【0140】
図2A〜2Cは、本発明の実施形態にかかるレンズアセンブリを示す単純化した模式図である。図2A〜2Cに示すように、微小流体素子205は、各図に示されている。熱制御部およびその他のシステム要素は図2A〜2Cに図示されていないが、当業者であれば、2つの図面間の関係については言うまでもない。したがって、適切ものについては、各種の図面間の関係をさらに明らかにするために、図1Aから参照番号を引き継いでいる。
【0141】
第1レンズシステム210は、第1の開口211を含むものとして図2Aに示す。この図に示すように、第1の開口は個々のレンズ要素間に位置するが、これは本発明において必須ではない。他の光学構成においては、第1の開口の位置、サイズ、およびその他の特徴は、所定の光学構成の目標を実現するために選択される。第2レンズシステム212も、第2の開口213を含むものとして図2Aに示されている。第1レンズシステム210との関連で検討したように、光学要素は、所定の光学構成目標に従って構成される。
【0142】
図1Aおよび図2A〜2Cを参照して、光フィルタ素子について、更なる詳細を説明する。一般に、レンズシステム210および212は、光フィルタ素子213とともに、撮像パスの部分に備えられる。ある実施形態において、撮像通路は、1つ以上の蛍光発光信号が微小流体素子から検出器へ移動するために提供される発光通路である。以下にさらに十分に説明するように、光フィルタ素子は、1つ以上の蛍光発光信号から選択されたスペクトルバンド幅を通すように、そして1つ以上の蛍光発光信号に関連付けられた1つ以上の色収差を定まったレベルに処理するように構成される。ある実施形態においては、この1つ以上の色収差の処理は、そのような色収差の縮小を含む。
【0143】
特定の実施形態において、第1の分光フィルタ214およびゼロ出力光学要素216が、図2Aに示すように提供されている。図1を参照すると、光フィルタ素子213(ある実施形態では、発光フィルタホイール)が第1の動作位置にあるとき、フィルタ/ゼロ出力要素の組み合わせが微小流体素子と検出器の間の光路中に存在する。図2Aの光学要素は、光スペクトルのほぼ中心にある波長の伝達と焦点あわせに最適化されている。したがって、一実施形態において、カリフォルニア州フォスターシティのApplied Biosystem社より市販されている蛍光プローブVic(登録商標)に関連付けられた分光フィルタ214は、570nmの波長に中心をおいている。加えて、分光フィルタは、30nmのスペクトルバンド幅により特徴付けられる。以下にさらに十分に説明するように、ある実施形態では、色収差を補正するよう構成された、普通は570nmより長いか短い、その他の波長に中心をおくフィルタ/ゼロ出力要素も提供される。
【0144】
図1Aの分光フィルタ244に関連して検討したように、光フィルタ素子はホイール形状に限らない。例えば、フィルタ保持部にはめ込まれる分光フィルタ、逸脱補正要素、およびその組み合わせが、本発明の実施形態に含まれる。さらに、逸脱補正要素と組み合わせて、電気光学フィルタや、アクチュエータそのほかにより光路中に配されるフィルタも、本発明の実施形態に従って含まれる。
【0145】
図2Bに、第2の動作位置にある発光フィルタホイールを有する第1および第2レンズシステムを示す。図2Bの実施形態に図示するように、分光フィルタ224は、518nmの波長(Applied Biosystem社より市販されている蛍光プローブFamTMに関連付けられる)に中心がおかれており、25nmのスペクトルバンド幅により特徴付けられる。一般に、分光フィルタ224は、蛍光プローブ(フルオロフォア)に関連付けられた蛍光信号を送信するよう構成され、代表的に光スペクトルの短波長部分近くの波長と関係した「青色」波長を発する。
【0146】
ゼロ出力ダブレットとして作用する光学要素226は、図2Bに図示される。ある実施形態では、1つの複合光学要素としてフィルタ/ゼロ出力ダブレットが提供され、その他の実施形態では、フィルタおよびゼロ出力ダブレットはそれぞれ分離されている。さらに、ある実施形態では、発光フィルタホイールは、第1の動作位置から第2の動作位置へ移動してフィルタ/ゼロ出力光学要素の位置を修正するよう回転する。図2Bに示すゼロ出力ダブレット226は、光システムにより導入される色収差を「青色」波長で補正するよう構成されている。具体的な実施形態においては、ゼロ出力ダブレットは、例えば、FamTMなどの特定の蛍光プローブからの発光に関連付けられた波長の色収差を補正するよう選択される。
【0147】
ある実施形態では、ゼロ出力ダブレットは、屈折率の値が異なる別の光学材料から製造される。単なる例として、図2Bに示すように、平面状の凹レンズが平面状の凸レンズに連結されている。具体的な実施形態においては、ゼロ出力ダブレットは、光学要素が合わさって固定されたフラウンホーファー型アクロマートレンズである。その他の実施形態では、当業者には明らかなような代替的な構成が用いられる。ある実施形態では、本明細書にわたって説明される埋め込みダブレットが用いられ、青色および赤色のフィルタ帯域における軸色収差を縮小する。
【0148】
図2Cは、発光フィルタホイールが第3の動作位置における第1および第2レンズシステムを示す。図2Cに示す実施形態では、分光フィルタ228は、645nmの波長(Applied Biosciencesから市販されている蛍光プローブRoxTMに関連付けられている)に中心をおいており、75nmのスペクトルバンド幅に特徴付けられている。一般に、分光フィルタ228は、通常は光スペクトルの長波長部分の波長に関連付けられている「赤色」波長を発する蛍光プローブに関連付けられた蛍光信号を伝えるように構成されている。
【0149】
図2Bと同様、図2Cに、ゼロ出力ダブレットとして作用する光学要素230を示す。ある実施形態では、1つの複合光学要素としてフィルタ/ゼロ出力ダブレットが提供され、その他の実施形態では、フィルタおよびゼロ出力ダブレットはそれぞれ分離されている。さらに、ある実施形態では、発光フィルタホイールは、第1または第2の動作位置から第3の動作位置へ移動してフィルタ/ゼロ出力光学要素の位置を修正するよう回転する。図2Cに示すゼロ出力ダブレット230は、光システムにより導入される色収差を「赤色」波長で補正するよう構成されている。具体的な実施形態においては、ゼロ出力ダブレットは、例えば、RoxTMなどの特定の蛍光プローブからの発光と関係した波長における色収差について補正するように選択される。図2Bと2Cとを比較すると、図2Cのゼロ出力ダブレットは平面状の凹レンズに連結された平面状の凸レンズを含む。
【0150】
図2A、2B、および2Cに関して検討してきたように、それぞれのフィルタに関連付けられた補正光学要素216、226、および230は、それぞれのフィルタを通る波長の色収差の補正を助けるように構成されている。この構成は、異なる波長領域を通す各種のフィルタにわたってよりいっそう均一で一貫したスポットサイズ、不鮮明さ、およびレンズシステムのその他の光学特性を可能とする。これらの利益は、上述のように微小流体素子内の反応チャンバが密閉されて利用される場合を説明したような用途においては、有用である。加えて、異なる反応チャンバからの光学信号間クロストークを許容範囲内にするための構成目標は、一般的に、イメージ面で許容される最大スポットまたは不鮮明サイズの制限におかれる。逸脱補正光学は、極端な波長における不鮮明さおよびスポットサイズを縮小し(例えば、青色波長領域を通るフィルタ)、また、異なる波長領域における不鮮明さおよびスポットサイズを縮小する(例えば、赤色波長領域のパスバンドを有するフィルタ)。この利益は、全体的な測定がレシオメトリックである場合に、例えば赤色および青色波長領域両方において検出される個別の信号によっては有用であり、これにより、アッセイ全体の感度が向上する。上記の検討は具体的な実施形態に関するものであるが、当業者であれば、本発明の範囲に含まれる異なる波長パスバンドのフィルタと合わせて同様に光学連結部に配することのできる補正ゼロ出力光学の変形例が多くあることは言うまでもない。
【0151】
図3は、本発明の実施形態にかかる微小流体素子にある多数の反応チャンバでおこる反応による、第1の波長に中心をおく蛍光発光の写真である。図3に示すように、多数の反応チャンバでは第1の波長「波長1」での発光が生じる。図3に示す本発明の実施形態においては、反応チャンバの10×16アレーが撮像される。ある実施形態では、先に述べたように、第1の波長は蛍光プローブに関連付けられている。当業者には明らかなように、第1の波長での発光強度は、反応チャンバで起こる化学的プロセスに応じる。図に示すように、本発明の実施形態にかかる光撮像システムによって10×16反応チャンバの2次元アレーが撮像される。すでに検討したように、本発明のいくつかの実施形態において、反応チャンバは流体的に分離されている。さらに代替の実施形態に従って、反応チャンバは、ナノリットルスケールの体積および/または約数100チャンバ平方センチメートルのチャンバ密度により特徴づけられる。
【0152】
図4は、本発明の実施形態にかかる微小流体素子にある多数の反応チャンバでおこる反応によって生じる、第2の波長に中心をおく蛍光発光の写真である。図4に示すように、多数の反応チャンバでは第2の波長「波長2」での発光が生じる。図3と4とを比較すると、ある反応チャンバはほとんどまたはまったく光を発しないが、他の反応チャンバは第1の波長、第2の波長、または第1の波長と第2の波長を発する。もちろん、蛍光活性の収集および分析は、反応チャンバ内で生じる学的プロセスの性質に対する洞察を与える。
【0153】
図5〜7は、本発明の実施形態を用いて生成された選択された波長のスポット図である。これらの図の説明文を参照すると、図示された波長の範囲は、一般に、緑色波長、青色波長、赤色波長の3つの波長バンドに分類される。図5に示された525nm、550nm、および575nmの波長は、一般には、光スペクトルの緑色領域に関連付けられる。図6に示す486nm、501nm、および516nmの波長は、一般には、光スペクトルの青色領域に関連付けられる。図7に示す616nm、636nm、および656nmの波長は、一般には、光スペクトルの赤色領域に関連付けられる。図5は、図2Aに示すレンズシステム用に計算されたものであり、図6は図2Bに示すレンズシステム用に計算されたものであり、図7は図2C示すレンズシステム用に計算されたものである。
【0154】
図8は、本発明の実施形態を用いて生成される位置に応じた比較的均一な照射図である。図8において、比較照射は、図2Aに示す光システムについて、Yフィールドに応じてミリメートル単位でプロットされている。0.550μmの波長では、21.4mmの距離にわたる比較照射の均一性は90%を超える。
【0155】
図9〜11は、本発明にかかるいくつかの実施形態の正方形内に含まれるエネルギー(ensquared energy)の図である。ある光システムにおいて、光システム性能の測定は、正方形内に含まれるエネルギーパーセンテージであり、これは特定の中央領域の総エネルギーのパーセントである。図9を参照すると、取り囲まれたエネルギーの割合は、図2Aに示されるレンズシステムを使用して、種々の位置に対して、重心から半分の幅(ミクロン単位)に応じてプロットされる。例として、中心から14.8mmの位置では約50%のエネルギーが重心から同じ約7.5μmで取り囲まれ、中心から21.4mmの位置では約90%のエネルギーが重心から約7.5μmで取り囲まれる。図9〜11において、回折が含まれ、一般に、計算は速度の速いフーリエ変換(FFT)アルゴリズムで行われる。図10および11は、それぞれ、図2Bおよび2Cに示すレンズシステムの正方形内に含まれるエネルギーの図である。これらの図では、図9と同じく、回折が含まれる。
【0156】
図12は、本発明の実施形態にかかる光システムの像面湾曲および歪みの図である。像面湾曲は、0.525μm、0.550μm、および0.575μmの波長について、図中では標識が付いたものとして示されている。歪みは、図示された波長について変化し、各種の波長の誤差は図示するように0.05%の規模と無視できるものである。
【0157】
図13は、本発明の実施形態にかかるシステムにより生成された二重波長 対 焦点の模式図である。この図では、有色焦点の移動は、ミクロンでの波長に応じて図示される。図13でプロットされる波長領域は、480nmから650nmの波長領域をカバーする。図に示すように、最大焦点移動領域は214.3702μmであり回折制限領域は4.243μmである。図13を参照すると、色は、指示された領域にわたって214μmの長いスパンで焦点をあわせる。したがって、システム性能の解析は、一般に、±100μmで焦点をぼかすスポットサイズ考慮を含む。一般に、焦点がぼけたスポットのサイズは、フォーカスされたスポットのサイズを超える。本発明の実施形態によれば、軸色収差は上記の埋め込みダブレットを用いて補正される。代替的な実施形態においては、特殊なガラスタイプが用いられてアポクロマート性能を実現する(一般に、他のガラスタイプに比べてコストの上昇を伴う)。
【0158】
図14〜16は、本発明の実施形態を用いて生成された選択された波長のスポット図である。図14の説明文にあるように、光スペクトルの緑色領域の波長(525nm、550nm、および575nm)のスポット図は、最適な焦点位置にあるシステムにより与えられる。図14〜16に示すスポット図をつくるために、図2Aに示すレンズシステムが用いられた。図15および16は、それぞれ+100μmのデフォーカスと−100μmのデフォーカスで計算されたスポット図でありる。図15および図16において、緑色領域の光スペクトルの同じ波長が考慮される。
【0159】
図17〜19は、本発明の実施形態を用いて生成された選択された波長のスポット図である。図17の説明文にあるように、光スペクトルの青色領域の波長(486nm、501nm、および516nm)のスポット図は、最適な焦点位置にあるシステムにより与えられる。図17〜19に示すスポット図をつくるために、図2Bに示すレンズシステムが用いられた。図18および19は、それぞれ、+100μmのデフォーカスと−100μmのデフォーカスで計算されたスポット図である。図18および19では、光スペクトルの青色領域の同じ波長が考慮される。図19に示すように、フィールド4は、同図の100μmのボックスの外部に伸張する501nmの光線を含む。
【0160】
図20〜22は、本発明の実施形態を用いて生成された選択された波長のスポット図である。図20の説明文にあるように、光スペクトルの赤色領域の波長(616nm、636nm、および656nm)のスポット図は、最適な焦点位置にあるシステムにより与えられる。図20〜22に示すスポット図をつくるために、図2Cに示すレンズシステムが用いられた。図21および22は、それぞれ、+100μmのデフォーカスと−100μmのデフォーカスで計算されたスポット図である。図21および22では、光スペクトルの赤色領域の同じ波長が考慮される。
【0161】
本発明にかかる代替的な実施形態においては、図2A〜2Cに図示する光学要素への変更を含む別の1:1光学リレー撮像システムが提供される。一般光学連結部は残るが、フィルタ/ゼロ出力ダブレットの組み合わせを含む特定の要素の特徴は変更される。この代替的な実施形態においては、35mmを超える作動距離、例えば、46.12mmが与えられる。さらに、平均11.28μm最大値14.73μmのRMSスポット径が与えられ、光撮像システムの全体長は542.2mm、最大フィルタAOIが12.59度、フィルタでの最大ビームが76mmである。
【0162】
図23〜25は、本発明の代替の実施形態を用いて作製された、選択された波長のスポット図である。これらの図の説明文を参照すると、図示された波長の範囲は、それぞれ、緑色波長、青色波長、赤色波長の3つの波長バンドに概ね分類される。図23に示される525nm、550nmおよび575nmの波長は、一般には、光スペクトルの緑色領域に関連付けられる。図24に示される486nm、501nmおよび516nmの波長は、一般に光スペクトルの青色領域に関連付けられる。図25に示される621nm、636nmおよび651nmの波長は、一般には、光スペクトルの赤色領域に関連付けられる。図23は、図2Aに示すレンズシステムに基づいて計算されたものであり、図24は図2Bに示すレンズシステムに基づいて計算されたものであり、図25は図2C示すレンズシステムに基づいて計算されたものである。
【0163】
図26〜28は、本発明にかかるいくつかの実施形態の正方形内に含まれるエネルギーの図である。図26を参照すると、取り囲まれたエネルギーの割合は、図2Aに示すレンズシステムを用いた各種の位置に対する重心(ミクロン単位)からの半値幅に応じてプロットされる。例として、中心から14.8mmの位置では約80%のエネルギーが重心から約7.5μmで取り囲まれ、中心から21.4mmの位置では約90%のエネルギーが重心から同じ約7.5μmで取り囲まれる。図26〜28において、回折が含まれ、一般に、計算は速度の速いフーリエ変換(FFT)アルゴリズムで行われる。図27および28は、それぞれ、図2Bおよび2Cに示すレンズシステムの正方形内に含まれるエネルギーの図である。これらの図では、図26と同じく、回折が含まれる。
【0164】
本明細書の例および実施形態は例示の目的のみのために記載されたものであり、これに照らして各種の修正や変更が、当業者に示唆され、この用途の本質および範囲内ならびに添付の請求項の範囲の趣旨の範囲内に含まれるものであることは、言うまでもない。
【技術分野】
【0001】
(関連出願に対する相互参照)
本出願は、2004年6月7日に出願された米国仮出願番号60/578,106号(これは、本明細書中において、全ての目的のために、参考として援用される)に対する優先権を主張する。
【背景技術】
【0002】
(発明の背景)
本発明は、大まかには微小流体技術に関する。特に、本発明は、微小流体素子のチャンバ内で1つ以上のエンティティ(例えば、多量の流体内に浮遊している)を撮像する方法とシステムを提供する。より詳細には、本撮像方法と撮像システムは、微小流体素子内の1つ以上のエンティティに関連付けられた蛍光信号からの指標を用いる。微小流体素子に連結された蛍光体、化学発光、および生体発光リーダーを用いた微小流体方法およびシステムの技術は単なる例として適用されており、本発明がより広い範囲の適用可能性を有することは言うまでもない。
【0003】
各種の化学的および生化学的解析および合成を行うための微小流体システムを開発製造するために、一斉に努力が行われてきた。このようなシステムは、調製または解析用途に開発されてきた。このような極小サイズの素子を製造する目的は、面倒で非効率であることが多い従来の常量法の解析および合成の小型化により実現される著しい利益から生じる。実質的な時間短縮、コスト引き下げ、およびより効率的な空間割当が、この微小流体システムを用いる利益として実現される。さらなる利益として、この微小流体素子を用いてシステムを自動化することにより人間のオペレータを削減することが可能となる。自動化されたシステムは、また、オペレータによるエラーおよびその他のオペレータによる限界を少なくする。例えばキャピラリー電気泳動、ガスクロマトグラフィーおよび細胞分離などを含む、各種の用途において、微小流体素子の使用が提案されてきた。
【0004】
核酸増幅処理を実施するために採用される微小流体素子は、各種の用途で役に立つ可能性がある。例えば、このような素子は、サンプル中の特定の対象核酸の有無を判定するために解析ツールとして用いられてもよい。解析ツールとして用いられる微小流体素子としては、以下のものがある。
【0005】
・特定の病原体(例えば、ウイルス、細菌または真菌)の存在についての試験
・身元確認処理(例えば、実父確定および法医学的用途)
・特定の疾病または遺伝性疾患に関連付けられた固有の核酸の発見と特徴付け
・特定の薬物行動に関連付けられた遺伝子発現プロファイル/配列の発見(例えば、薬理遺伝学上の目的、すなわち、固有の遺伝プロファイルに適合的/特に効果的な、あるいは危険ではない薬物を選択するため)
・遺伝子型解析および遺伝子発現解析の実施(例えば、識別的遺伝子発現研究)。
【0006】
また、この素子は、核酸増幅の調製方法で用いることができ、さらなる解析に必要とされる十分なレベルの増幅産物を作り出すことができる。この解析処理の例としては、増幅産物の配列決定、細胞型決定、DNAフィンガープリント法、などがある。増幅産物は、また、各種の遺伝子工学の用途に用いられる。この遺伝子工学の用途には、所望のタンパク質製品に細胞を変換するためにそのときに用いられているベクターに増幅産物を挿入することにより実現される、所望のタンパク製品の製造などがある(が、これに限定されるものではない)。
【0007】
上記利用可能性にもかかわらず、このような微小流体素子からの撮像データ、例えば蛍光データを収集処理するよう構成された撮像システム(リーダーとも呼ぶ)にはさまざまな欠陥がある。従来のリーダーには、微小流体素子上をレーザビームがラスタスキャンする走査モードで動作するものがある。このようなシステムの別のものでは、素子またはレーザと素子の両方が平行移動する。これらのスキャナは、微小流体素子内にある反応チャンバからレーザ源/素子のラスタスキャンに関連して順次蛍光データを収集する。他の従来のスキャナは、例えば1mm2よりせまい範囲を順次撮像する際にスティッチモードで動作し、これらの小さいイメージを縫い合わせてアッセイ中の微小流体素子のイメージをつくる。
【0008】
走査システムとスティッチングシステムの両方ともに、欠陥がある。例えば、いずれのタイプのシステムも、時間に応じて撮像した範囲に比例した比較的低いシステム周波数で動作する。従来のシステムは1〜20cm2/分の周波数で動作する。タンパク質熱量測定および核酸増幅のようないくつかの興味ぶかいアッセイでは、約1〜20cm2/分より大きいシステム周波数は、一般的に、微小流体素子の反応容器内で起こる蛍光プロセスを撮像するために必要とされる。従来の走査システムとスティッチングシステムは、これらの性能目的に合わない。システムの処理能力(スループット)を遅くするのに加えて、これらの走査システムとスティッチングシステムは、例えば、リアルタイムPCRの性能など、ある種のアッセイにおいて用いられる可能性を制限しうる。
【発明の概要】
【発明が解決しようとする課題】
【0009】
したがって、当該技術分野では、微小流体素子のチャンバ内の多量の流体に浮かんでいる1つ以上のエンティティを撮像する改良された方法およびシステムが望まれている。
【課題を解決するための手段】
【0010】
(発明の開示)
本発明によれば、微小流体システム技術が提供される。とりわけ、本発明は、微小流体素子のチャンバ内のある量の流体内に浮かんでいる1つ以上のエンティティを撮像する方法およびシステムを提供する。より詳細には、本撮像方法および撮像システムでは、微小流体素子内の1つ以上のエンティティに関連付けられた蛍光信号からの指標が用いられる。単なる例として、微小流体方法およびシステムの技術は、微小流体素子に連結された蛍光リーダー、化学発光リーダー、および生体発光リーダーを用いて適用されるが、本発明がより広い範囲の適用可能性を有することは言うまでもない。
【0011】
具体的な実施形態においては、本発明は微小流体素子からの選択された1つ以上の蛍光指標を撮像する装置を提供する。この装置は、少なくとも1つの微小流体素子内の少なくとも1つのチャンバに連結された撮像パスを備える。この装置は、上記少なくとも1つの微小流体素子内の上記少なくとも1つのチャンバ内の1つ以上のサンプルからの1つ以上の蛍光発光信号の送信を行う。このチャンバは、上記撮像パスの法線の実空間寸法によって特徴付けられるチャンバサイズを有する。この装置は、また、上記撮像パスに連結された光学レンズシステムを備える。この光学レンズシステムは上記チャンバに関連付けられた上記1つ以上の蛍光信号を送信するよう構成される。
【0012】
別の具体的な実施形態においては、微小流体素子の少なくとも1つのチャンバから選択された1つ以上の蛍光指標を撮像する方法が提供される。この方法は、少なくとも1つの微小流体素子の上記少なくとも1つのチャンバ内の1つ以上のサンプルからの1つ以上の蛍光発光信号を、上記少なくとも1つのチャンバに連結された撮像パスに沿って送信する。上記少なくとも1つのチャンバは、撮像パスの法線の実空間寸法によって、特徴付けられるチャンバサイズを有する。この方法はまた、上記撮像パスに連結された光学レンズシステムを介して上記チャンバに関連付けられた上記1つ以上の蛍光発光信号を送信する。この光学レンズシステムは、上記実空間寸法のサイズを定まったレベルまで縮小させるよう構成されている。
【0013】
さらに別の具体的な実施形態においては、微小流体素子の1つ以上のチャンバから1つ以上の指標を撮像するシステムが提供される。このシステムは光学経路を含み、この光学経路微小流体素子の空間領域の一部分の1つ以上のイメージを上記微小流体素子の上記空間領域の上記一部分から送信できる。一実施形態において、上記微小流体素子の上記空間領域の上記部分は第1の寸法に特徴付けられる。このシステムは、また、上記光学経路の第1の部分に連結される第1レンズシステムを備える。この第1レンズシステムは、第1光学特性によって特徴付けられる。このシステムは、さらに、上記光学経路の第2の部分に連結される第2レンズシステムを備える。この第2レンズシステムは、第2光学特性によって特徴付けられる。このシステムは、さらに、上記光学経路の第3の部分に連結された検出器素子を備える。この検出器素子は、上記空間領域の上記部分の上記1つ以上のイメージをキャプチャする。さらに、この検出器は上記1つ以上のイメージをキャプチャするように構成される。この1つ以上のイメージは上記検出器素子においてほぼ上記第1の寸法またはそれ以下の定まったサイズを有する。
【0014】
代替的な実施形態においては、微小流体素子の1つ以上のチャンバから1つ以上の指標を撮像する方法が提供される。この方法は、微小流体素子の空間領域の一部分の1つ以上のイメージを上記微小流体素子の上記空間領域の上記一部分から光学経路に沿って送信する。上記微小流体素子の上記空間領域の上記部分は、第1の寸法に特徴付けられる。この方法は、また、第1レンズシステムを上記光学経路の第1の部分に連結する。この第1レンズシステムは、第1光学特性によって特徴付けられる。本方法は、さらに、第2レンズシステムを上記光学経路の第2の部分に連結する。この第2レンズシステムは、第2光学特性によって特徴付けられる。さらに、本発明は、検出器素子を用いて上記空間領域の上記部分の上記1つ以上のイメージをキャプチャする。この検出器素子は、上記光学経路の第3の部分に連結されており、上記1つ以上のイメージは上記検出器素子においてほぼ上記第1の寸法またはそれ以下の定まったサイズを有する。
【0015】
別の代替的な実施形態において、微小流体素子を撮像する方法が提供され、この方法は、微小流体素子の少なくとも定まった数のチャンバに関連付けられた空間領域のイメージを、1分未満のタイムフレームでイメージ検出空間領域を用いてキャプチャすることを包含する。具体的な実施形態においては、上記空間領域の上記イメージの上記キャプチャには実質的にスティッチングおよび/またはスキャニングプロセスがない。
【0016】
さらに他の代替的な実施形態においては、微小流体素子から選択された1つ以上の蛍光指標を撮像する装置を提供する。この装置は、少なくとも1つの微小流体素子内の少なくとも1つのチャンバに連結された撮像パスを備える。この撮像パスは、上記少なくとも1つの微小流体素子内の上記少なくとも1つのチャンバ内の1つ以上のサンプルからの1つ以上の蛍光発光信号の送信を行う。この装置は、また、上記撮像パスの第1の空間部分に連結され、上記1つ以上の発光信号の送信用に備えられた光フィルタ素子を備える。この光フィルタ素子は、上記1つ以上の蛍光発光信号から選択されたスペクトルバンド幅を送信するよう構成され、上記1つ以上の蛍光発光信号に関連付けられた1つ以上の色収差を定まったレベルに処理するよう構成される。
【0017】
特定の実施形態においては、エラストマー微小流体素子における処理の解析方法が提供される。この方法は、1分未満の時間の間に少なくとも96個のチャンバのイメージをキャプチャする。一実施形態では、上記少なくとも96個のチャンバのそれぞれは、上記少なくとも96個のチャンバのほかのチャンバのいずれからも流体的に分離されている。この方法は、また、上記イメージを処理する。
【0018】
別の特定の実施形態においては、複数の処理部位を備える微小流体素子の撮像装置を提供する。この複数の処理部位は、M個のサンプルから選択された少なくとも1つのサンプルとN個の試薬から選択された少なくとも1つの試薬とを含む。この装置は、上記微小流体素子に連結され、上記微小流体素子を電磁放射で照射するよう構成された照明システムを備える。この装置は、また、上記微小流体素子に連結され、上記複数の処理部位から発せられた電磁放射を受光するよう構成された撮像システムを備える。この装置は、さらに、撮像システムに連結された検出器を備える。
【0019】
さらに別の特定の実施形態においては、光撮像システムが提供される。この光撮像システムは、コンピュータと、流体的に分離された少なくとも1536個の反応チャンバを有するエラストマー微小流体アレー素子を照射するよう構成された光照明システムとを備える。このエラストマー微小流体アレー素子は、複数の層から形成されるエラストマーブロックを備える。少なくとも1つの層は少なくとも1つのくぼみがその内部に形成されている。上記くぼみは上記くぼみを有する上記層に一体形成された少なくとも1つの偏向膜を有する。この光撮像システムは、また、光検出システムを備える。
【0020】
さらに別の代替的な特定の実施形態において、微小流体素子の複数のチャンバから1つ以上の選択された蛍光指標を撮像する方法が提供される。この方法は、1つ以上の蛍光発光信号を撮像パスに沿って送信し、この1つ以上の蛍光発光信号は、微小流体素子の複数のチャンバの少なくとも1つの1つ以上のサンプルから得られる。この方法は、また、所定のスペクトルバンド幅内の蛍光発光信号を通すように、かつ1つ以上の蛍光発光信号に関連付けられた1つ以上の色収差を定まったレベルに処理するよう構成された光フィルタ素子を用いて、撮像パスに沿って1つ以上の蛍光発光信号のサブセットを選択的に送信する。
【0021】
具体的な実施形態においては、この方法は、さらに、検出器において1つ以上の蛍光発光信号のサブセットの部分を読み取り、微小流体素子の複数のチャンバの少なくとも1つの内の1つ以上のサンプルからの1つ以上の蛍光発光信号をキャプチャし、上記少なくとも1つの微小流体素子の少なくとも96個のチャンバを照射し、ここで48個より多いチャンバ群は、上記48個より多いチャンバ群のほかのチャンバのいずれからも流体的に分離されており、少なくとも1つの微小流体素子を定められた時に所定の温度に維持し、ここで所定の時の上記所定の温度は、マルチステップ熱循環プロファイルの一部分である。別の具体的な実施形態においては、1つ以上の蛍光発光信号に関連付けられた1つ以上の色収差の処理は、1つ以上の色収差を所定のレベルまで縮小させることを含む。上記所定のレベルは、第1の色によって特徴付けられた第1の光線および第2の色によって特徴付けられた第2の光線に関連付けられた焦点における所定のシフトによって特徴付けられる。さらに別の具体的な実施形態においては、上記光フィルタ素子は複数のゼロ出力ダブレットおよび複数の分光フィルタを備える。
【0022】
本発明にかかる実施形態においては、微小流体素子に関する情報を収集するために光撮像システムが使用される。具体的な実施形態においては、上記撮像システムの使用は、63個を越えるチャンバを含む微小流体素子を含む。別の具体的な実施形態において、撮像システムの使用は、エラストマー微小流体素子を有する微小流体素子を含む。代替的な実施形態においては、上記撮像システムの使用は95個を超えるチャンバからなる微小流体素子を含む。別の代替的な実施形態においては、上記撮像システムの使用は383個を超えるチャンバからなる微小流体素子を含む。さらに他の代替的な実施形態においては、上記撮像システムの使用は511個を超えるチャンバからなる微小流体素子を含む。追加的な実施形態では、上記撮像システムの使用は2,304個を超えるチャンバからなる微小流体素子を含む。別の追加的な実施形態においては、上記撮像システムの使用は9,216個を超えるチャンバからなる微小流体素子を含む。さらに別の追加的な実施形態においては、上記撮像システムの使用は100,000個を超えるチャンバからなる微小流体素子を含む。
【0023】
本発明の別の実施形態によれば、微小流体素子に関する情報を収集するために光撮像システムが使用される。上記光システムの使用は、特定の実施形態においてタンパク質結晶化処理を行うよう構成されたエラストマー微小流体素子を含む。別の実施形態では、上記撮像システムの使用は蛍光処理を行うよう構成されたエラストマー微小流体素子を含む。さらに別の実施形態では、上記撮像システムの使用は、長時間の間に選択された温度または温度範囲で反応を行うよう構成されたエラストマー微小流体素子を含む。別の具体的な実施形態においては、PCR反応に関する情報を収集するために光撮像システムが使用される。さらに別の具体的な実施形態においては、上記撮像システムの使用は、微小流体分離した閉鎖反応チャンバを備える微小流体素子を含む。その他の実施形態では、上記撮像システムの使用は、微小流体素子に連結された熱制御部を含む。
【0024】
代替的な実施形態においては、微小流体素子を撮像するために光撮像システムが使用される。この代替的な実施形態では、光撮像システムは、色収差の値を所定のレベルまで低減するよう構成された複数のダブレットを有している。一実施形態において、上記光撮像システムは0.23を超えるNAにより特徴付けられる。別の実施形態では、上記光撮像システムは0.36以上のNAにより特徴付けられる。さらに別の実施形態においては、上記光撮像システムは0.2を超えるNAを有する。具体的な実施形態においては、上記光撮像システムは、第1のダブレットに連結された第1分光フィルタと第2のダブレットに連結された第2分光フィルタを含む。さらに、追加的な実施形態では、上記第1のダブレットは、色収差の値を第1分光フィルタを通過する第1の所定波長で第2の所定のレベルまで低減し、そして第2のダブレットは、色収差の値を第2分光フィルタを通過する第2の所定波長で第2の所定のレベルまで低減する。ある実施形態では、上記第1のダブレットおよび上記第2のダブレットはゼロ出力ダブレットである。ほかの実施形態では、上記第1分光フィルタ、上記第1のダブレット、上記第2分光フィルタ、および上記第2のダブレットはフィルタホイールとして構成される。
【0025】
本発明の別の実施形態では、微小流体素子から1つ以上の蛍光発光信号を含む複数のイメージを得るために蛍光撮像システムが使用される。蛍光撮像システムの使用は、他の反応チャンバから流体的に分離された63個を超える反応チャンバを有する微小流体素子を含む。一実施形態においては、蛍光撮像システムの使用は、エラストマー微小流体素子を有する微小流体素子を含む。別の実施形態では、蛍光撮像システムの使用は、10nl未満の容積により特徴づけられる複数の反応チャンバを含む。さらに別の実施形態において、蛍光撮像システムの使用は、100反応チャンバ/cm2以上のアレー密度により特徴づけられるエラストマー微小流体素子を含む。代替的な実施形態においては、この蛍光撮像システムは、光フィルタ素子を含み、この光フィルタ素子は、上記1つ以上の蛍光発光信号から選択されたスペクトルバンド幅を通すよう構成され、上記1つ以上の蛍光発光信号に関連付けられた1つ以上の色収差を定まったレベルに処理するよう構成される。
【0026】
本発明の実施形態においては、微小流体システムにおいてサンプルを検査する光システムが提供される。この実施形態により提供される光システムにおいては、上記検出器は、撮像される微小流体システムの寸法以上の大きさのアレー(例えば、CCD)からなる。別の実施形態においては、上記検出器は、任意で少なくとも1つのレンズを用いて上記微小流体素子に連結される。さらに別の実施形態において、上記検出器は上記微小流体素子と共形接触(conformal conatact)しない。具体的な実施形態においては、上記検出器は上記微小流体素子と共形接触する。別の具体的な実施形態においては、本明細書で論じる色収差補正システムは、上記光学連結部で用いられる。
【0027】
別の実施形態では、微小流体素子を検査する光システムが提供される。上記光システムは、倍率M≧NA0/NAdetを有し、NA0は、対物/サンプル側NAであり、そしてNAdetは、上記検出器面で起こる反射による損失が閾値を越える前の検出器において許容可能な最大NAである。具体的な実施形態においては、上記検出器はCCDであり、NAdet=0.36である。別の実施形態において、上記検出器はCCDであり、0.23≦NAdet≦0.5である。
【0028】
追加的な実施形態では、微小流体システム内のサンプルを検査する光システムが提供される。上記検出器は、反応チャンバを含む上記微小流体素子の面積の寸法のM倍に等しいアレー(例えば、CCD)を備える。一実施形態において、上記微小流体素子の上記面積は検査対象のサンプルチャンバを含む。この実施形態において、M=NA0/NAdet+/−10%であり、ここで、NA0は反応チャンバ間の許容範囲クロストーク、そのXY間隔およびサイズ、上記Z軸上の程度に関する焦点深度の考慮により決定される許容範囲の最大NAであり、NAdetは、入射光の≦40%が上記検出器面の反射、口径食、などにより失われる。具体的な実施形態においては、上記NAdetは、入射光の≦30%が上記検出器面の反射、口径食、などにより失われる。別の具体的な実施形態においては、上記NAdetは、入射光の≦20%が上記検出器面の反射、口径食、などにより失われる。さらに別の具体的な実施形態においては、NAdetは、入射光の≦10%が上記検出器面の反射、口径食、などにより失われる。代替的な実施形態においては、Mは≧1である。別の代替的な実施形態では、M=1である。
【0029】
本発明を用いることにより、従来の技術に対して数々の利益が実現される。ある実施形態では、微小流体素子からの蛍光を生成し検出する光撮像システムが提供される。加えて、本発明の実施形態は、分光フィルタに連結されたゼロ出力アクロマチックダブレットを用いることにより色収差を縮小する光システムを提供する。
【0030】
単一のプラットフォームで各種の利用を行う能力が、本発明の実施形態により提供される。例えば遺伝子発現および遺伝子型を含むゲノミクス利用が本発明の実施形態を用いて行われる。さらに、デジタル分離検出(Digital Isolation and Detection:DID)での利用が可能となる。例として、がん検出に関する利用ならびに単細胞高分子検出および数量化が提供される。さらに、タンパク質リガンド結合や免疫アッセイプロセスを含むプロテオミクス利用が、本発明の実施形態より提供される。
【0031】
さらに、本発明の実施形態によると、特定の利益および/または利点を実現し、他の技術に関連する限界を克服することができる。計算に基づいて、以下のことが判明している。
【0032】
あるスキャニングシステムでは、10umの所望の解像度を有する。これらのシステムでは、蛍光が望ましく数量化される「スポット」がトータルで3000×3000(=約1067)ある。例えば、これを10秒で完遂しようとすると、各スポットでの滞留時間は、約1マイクロ秒である。したがって、ラインスキャン(3000ポイント)は3msで完了する。得られた信号対雑音に等価の信号対雑音を本発明の実施形態を用いて得るためには、スポットでの光強度が、1秒間で信号を得る本発明にかかる撮像システムで実現できるよりも約106倍明るくなければならない。3cmのスポットを3msで毎秒1000倍ラスタすることは、機械的にかなり困難である。加えて、高い効率での発光信号の収集が望まれる。これには、通常、大きな視野光学か高いNAフライングヘッド(例えば10m/s以上で移動する)が必要となる。この場合、素子の右下角で収集されたデータは素子の左上で収集されたデータよりも10秒古くなり、用途によっては望ましくない。
【0033】
あるスティッチングシステムでは、複数のイメージを獲得し、合成イメージを作るためにこれらを張り合わせる。一システムでは、複数の3mm×3mmのイメージを張り合わせてイメージをつくるために、100個のイメージが用いられる。個々のイメージすべてを得るためのトータルの時間は100msである。この時間の半分が移動により使われ、もう半分がイメージの獲得に使われるとすると、この撮像時間は約50msである。このシステムは、一般に、1秒の間に信号を得るのに得られる本発明の実施形態で用いられる強度の約20倍の光強度および/または高いNA対物を必要とする。加えて、これらのシステムは、一般に、3mm移動して50msで完全に停止することができる速いステージを必要とする。加えて、これらのシステムは、一般に、スティッチングによるアーチファクトを排除するために動作および光強度の両方について注意深い検定を要する。素子の右下角で収集されたデータは素子の左上で収集されたデータよりも10秒古くなり、用途によっては望ましくない。
【0034】
ある本発明の実施形態では、微小流体素子の面積が1度で撮像される撮像システムを提供する。10秒毎イメージが可能な実施形態において、数秒の統合時間が利用できる。同期化の問題は、データが全ての画素から同時に収集されるため、低減または排除される。さらに、本発明の実施形態は、一般的に、同時に微小流体素子全体(約31mm×31mmの面積)を照射し、高いNAおよび広い視野のレンズシステムを用いる。本願明細書を通じて説明されるように、本発明の実施形態は、従来のシステムに比べて複雑さが低くより強力な方法およびシステムを提供する。実施形態によっては、これらの制限の1つ以上が本発明の実施形態にかかる本方法およびシステムによって克服される。本発明のさらなる詳細は本願明細書を通じて説明されており、より詳細には以下に説明される。実施形態によっては、これらの利益の1つ以上が存在する。これらおよびその他の利益は本願明細書を通じて説明され、より詳細には以下に説明される。
本発明の各種の追加の目的、特徴、および利点は、以下の詳細な説明と添付の図面を参照することにより、より完全に理解可能となる。
例えば、本発明は以下の項目を提供する。
(項目1)
微小流体素子からの選択された1つ以上の蛍光指標を撮像する装置であって、
少なくとも1つの微小流体素子内の少なくとも1つのチャンバに連結された撮像パスであって、該撮像パスは、該少なくとも1つの微小流体素子内の該少なくとも1つのチャンバ内の1つ以上のサンプルからの1つ以上の蛍光発光信号の送信を行い、該チャンバは、該撮像パスの法線の実空間寸法によって特徴付けられるチャンバサイズを有する撮像パスと、
該撮像パスに連結され、該チャンバに関連付けられた該1つ以上の蛍光信号を送信するよう構成された光学レンズシステムとを備える、装置。
(項目2)
前記光学レンズシステムは、前記実空間寸法のサイズを定まったレベルまで縮小させるよう構成され、該定まったレベルで縮小されたサイズの前記チャンバに関連付けられた前記1つ以上の蛍光発光信号を送信するよう構成された、項目1に記載の装置。
(項目3)
前記少なくとも1つの微小流体素子は、微小流体寸法により特徴付けられ、前記光学レンズシステムは、前記微小流体寸法とほぼ同じサイズである前記少なくとも1つの微小流体素子のイメージを提供するよう構成され、かつ前記ほぼ同じサイズの前記チャンバに関連付けられた前記1つ以上の蛍光発光信号を送信するよう構成された、項目1に記載の装置。
(項目4)
前記実空間寸法の前記縮小サイズと前記実空間寸法の比率が1未満であることを特徴とする、項目2に記載の装置。
(項目5)
前記比率が0.9未満である、項目4に記載の装置。
(項目6)
前記比率が0.5未満である、項目5に記載の装置。
(項目7)
前記微小流体素子はエラストマー微小流体素子であり、前記少なくとも1つのチャンバは閉鎖反応チャンバである、項目1に記載の装置。
(項目8)
微小流体素子の少なくとも1つのチャンバから選択された1つ以上の蛍光指標を撮像する方法であって、
少なくとも1つの微小流体素子の該少なくとも1つのチャンバ内の1つ以上のサンプル由来の1つ以上の蛍光発光信号を、該少なくとも1つのチャンバに連結された撮像パスに沿って送信する工程であって、ここで該少なくとも1つのチャンバは、該撮像パスの法線の実空間寸法によって特徴付けられるチャンバサイズを有する、工程、
該撮像パスに連結された光学レンズシステムを介して該チャンバに関連付けられた該1つ以上の蛍光発光信号を送信し、ここで該光学レンズシステムは該実空間寸法のサイズを定まったレベルまで縮小させるよう構成されている工程、
を包含する、方法。
(項目9)
前記実空間寸法の前記縮小サイズと前記実空間寸法の比率が1未満であることを特徴とする、項目8に記載の方法。
(項目10)
前記比率が0.9未満である、項目9に記載の方法。
(項目11)
前記比率が0.5未満である、項目10に記載の方法。
(項目12)
前記微小流体素子はエラストマー微小流体素子であり、前記少なくとも1つのチャンバは閉鎖反応チャンバである、項目8に記載の方法。
(項目13)
微小流体素子の1つ以上のチャンバから1つ以上の指標を撮像するシステムであって、
微小流体素子の空間領域の一部分の1つ以上のイメージを該微小流体素子の該空間領域の該部分から送信できる光学経路であって、該微小流体素子の該空間領域の該一部分は第1の寸法に特徴付けられる、光学経路と、
該光学経路の第1の部分に連結され、第1光学特性によって特徴付けられる第1レンズシステムと、
該光学経路の第2の部分に連結され、第2光学特性によって特徴付けられる第2レンズシステムと、
該光学経路の第3の部分に連結された検出器素子であって、該検出器素子は該空間領域の該部分の該1つ以上のイメージをキャプチャし、該検出器は該1つ以上のイメージをキャプチャするように構成され、該1つ以上のイメージは該検出器素子においてほぼ第1の寸法またはそれ以下の定まったサイズを有する検出器素子と
を備えるシステム。
(項目14)
前記定まったサイズは前記第1の寸法の約0.99またはそれ未満である、項目13に記載のシステム。
(項目15)
前記第1レンズシステムおよび前記第2レンズシステムは、タンデムレンズシステムとして特徴付けられる、項目13に記載のシステム。
(項目16)
前記微小流体素子は微小流体寸法により特徴付けられ、前記検出器素子は活性領域における空間寸法により特徴付けられる、項目13に記載のシステム。
(項目17)
前記微小流体寸法は前記空間寸法とほぼ同じサイズである、項目16に記載のシステム。
(項目18)
前記微小流体寸法は前記空間寸法より小さい、項目16に記載のシステム。
(項目19)
前記微小流体素子は、少なくとも48個の閉鎖反応チャンバを備えるエラストマー微小流体素子である、項目13に記載のシステム。
(項目20)
前記少なくとも48個の閉鎖反応チャンバは、ほかの反応チャンバのいずれからも流体的に分離されている、項目19に記載のシステム。
(項目21)
微小流体素子の1つ以上のチャンバから1つ以上の指標を撮像する方法であって、
微小流体素子の空間領域の一部分の1つ以上のイメージを該微小流体素子の該空間領域の該部分から光学経路に沿って送信する工程であって、該微小流体素子の該空間領域の該部分は第1の寸法に特徴付けられる工程、
第1光学特性によって特徴付けられる第1レンズシステムを該光学経路の第1の部分に連結する工程、
第2光学特性によって特徴付けられる第2レンズシステムを該光学経路の第2の部分に連結する工程、
該光学経路の第3の部分に連結された検出器素子を用いて該空間領域の該部分の該1つ以上のイメージをキャプチャする工程であって、該1つ以上のイメージは該検出器素子においてほぼ第1の寸法またはそれ未満の定まったサイズを有する工程、
を包含する、方法
(項目22)
前記定まったサイズは前記第1の寸法の約0.99またはそれ未満である、項目21に記載の方法。
(項目23)
前記第1レンズシステムおよび前記第2レンズシステムは、タンデムレンズシステムとして特徴付けられる、項目21に記載の方法。
(項目24)
前記微小流体素子は微小流体寸法により特徴付けられ、前記検出器素子は活性領域における空間寸法により特徴付けられ、前記微小流体寸法は該空間寸法とほぼ同じサイズである、項目21に記載の方法。
(項目25)
微小流体素子の撮像方法であって、
微小流体素子の96を超える数のチャンバに関連付けられた空間領域のイメージを送信する工程、
イメージ検出器素子に関連付けられて該微小流体素子の該空間領域のサイズとほぼ等しいサイズであるイメージ検出空間領域を用いて、該空間領域の該イメージをキャプチャする工程、
を包含する、方法。
(項目26)
前記イメージ検出空間領域により分割される前記空間領域はほぼ1である、項目25に記載の方法。
(項目27)
前記イメージ検出空間領域により分割される前記空間領域はほぼ0.99以下である、項目25に記載の方法。
(項目28)
前記イメージ検出空間領域により分割される前記空間領域はほぼ0.88以下である、項目27に記載の方法。
(項目29)
前記イメージ検出空間領域はほぼ30.7mm×30.7mm以上である、項目25に記載の方法。
(項目30)
前記イメージ検出空間領域はほぼ27.6mm×27.6mm以上である、項目25に記載の方法。
(項目31)
前記イメージ検出空間領域はほぼ2048×2048画素領域である、項目25に記載の方法。
(項目32)
前記イメージ検出空間領域はほぼ2048×2048画素領域を含み、該画素領域のそれぞれはほぼ15μm×15μm以上の空間寸法を有する、項目25に記載の方法。
(項目33)
少なくとも2つの画素領域は前記チャンバの少なくとも1つに関連付けられている、項目32に記載の方法。
(項目34)
少なくとも9つの画素領域は前記チャンバの少なくとも1つに関連付けられている、項目33に記載の方法。
(項目35)
20個より多くの画素領域は前記チャンバの少なくとも1つに関連付けられている、項目34に記載の方法。
(項目36)
微小流体素子の撮像方法であって、
微小流体素子の少なくとも定まった数のチャンバに関連付けられた空間領域のイメージを、1分未満のタイムフレームでイメージ検出空間領域を用いてキャプチャする工程であって、ここで該空間領域の該イメージの該キャプチャには実質的にスティッチングプロセスおよび/またはスキャニングプロセスがない工程を包含する、方法。
(項目37)
さらに、前記微小流体素子の少なくとも前記定まった数のチャンバに関連付けられた前記空間領域の前記イメージを、10ミリ秒を超えるタイムフレームで前記イメージ検出空間領域を用いてキャプチャする工程を包含する、項目36に記載の方法。
(項目38)
前記空間領域の前記イメージのキャプチャは30秒未満のタイムフレームで行われる、項目36に記載の方法。
(項目39)
前記空間領域の前記イメージのキャプチャは15秒未満のタイムフレームで行われる、項目36に記載の方法。
(項目40)
前記キャプチャは、前記定まった数のチャンバについて1分未満のタイムフレームで同時に行われる、項目36に記載の方法。
(項目41)
前記キャプチャは、前記定まった数のチャンバを定まった温度範囲に維持しつつ行われる、項目36に記載の方法。
(項目42)
前記定まった温度範囲は±2℃である、項目41に記載の方法。
(項目43)
前記定まった温度は、PCRプロセスに関連付けられた周期的温度環境の一部分である、項目41に記載の方法。
(項目44)
前記定まった数のチャンバは少なくとも96個以上である、項目36に記載の方法。
(項目45)
さらに、前記微小流体素子の少なくとも前記定まった数のチャンバに関連付けられた前記空間領域の少なくとも第2イメージを、前記1分未満のタイムフレームで前記イメージ検出空間領域を用いてキャプチャする工程を包含し、ここで前記空間領域の前記第2イメージの前記キャプチャは蛍光発光を表す、項目36に記載の方法。
(項目46)
微小流体素子から選択された1つ以上の蛍光指標を撮像する装置であって、
少なくとも1つの微小流体素子内の少なくとも1つのチャンバに連結された撮像パスであって、該撮像パスは、該少なくとも1つの微小流体素子内の該少なくとも1つのチャンバ内の1つ以上のサンプルからの1つ以上の蛍光発光信号の送信を行う撮像パスと、
該撮像パスの第1の空間部分に連結され、該1つ以上の発光信号の送信用に備えられた光フィルタ素子であって、該1つ以上の蛍光発光信号から選択されたスペクトルバンド幅を送信するよう構成され、該1つ以上の蛍光発光信号に関連付けられた1つ以上の色収差を定まったレベルに処理するよう構成された光フィルタ素子とを備える、装置。
(項目47)
さらに、前記撮像パスの第2の空間部分に連結されて、前記1つ以上の蛍光発光信号の一部分を読む検出器と、
前記撮像パスの第3の空間部分に連結された第1レンズシステムであって、前記少なくとも1つの微小流体素子内の前記少なくとも1つのチャンバからの1つ以上の蛍光発光信号をキャプチャするよう構成された、第1レンズシステムと、
1つ以上のスペクトルバンド幅によって特徴付けられる電磁放射を発する光源と、
該光源に連結された光学素子であって、該光学素子が、前記少なくとも1つの微小流体素子の少なくとも96個のチャンバを照射するよう構成されており、ここで48個より多いチャンバ群は、前記48個より多いチャンバ群のほかのチャンバのいずれからも流体的に分離されている、光学素子、
を備える、項目46に記載の装置。
(項目48)
さらに、
前記撮像パスの第4の空間部分に連結された第2レンズシステムと、
前記少なくとも1つの微小流体素子に熱制御を行うよう構成された熱制御モジュールとを備え、
前記光フィルタ素子は複数の分光フィルタおよび複数のゼロ出力ダブレットを備える、項目47に記載の装置。
(項目49)
前記複数のゼロ出力ダブレットは、第1の所定波長で色収差を低減するよう構成された第1ゼロ出力ダブレットと、第2の所定波長で色収差を低減するよう構成された第2ゼロ出力ダブレットとを備える、項目46に記載の装置。
(項目50)
前記光フィルタ素子は、前記撮像パスの一部分に関連付けられたバックグラウンド信号を所定のレベルまで縮小させる、項目46に記載の装置。
(項目51)
前記1つ以上の色収差の処理は前記1つ以上の色収差の補正を含む、項目46に記載の装置。
(項目52)
前記1つ以上の色収差の補正は前記1つ以上の色収差を所定のレベルまで縮小させることを含み、該所定のレベルは、第1の色によって特徴付けられた第1の光線および第2の色によって特徴付けられた第2の光線に関連付けられた焦点における所定のシフトによって特徴付けられる、項目51に記載の装置。
(項目53)
エラストマー微小流体素子における処理の解析方法であって、
1分未満の時間の間に少なくとも96個のチャンバのイメージをキャプチャする工程であって、ここで該少なくとも96個のチャンバのそれぞれは、該少なくとも96個のチャンバのほかのチャンバのいずれからも流体的に分離されている工程、
該イメージを処理する工程、
を包含する、方法。
(項目54)
さらに、1分未満の時間の間に前記少なくとも96個のチャンバの第2イメージをキャプチャする工程、および前記第2イメージを処理する工程を包含する、項目53に記載の方法。
(項目55)
イメージのキャプチャは、開口数が0.23以上で倍率が2以下である光システムを用いて行われる、項目53に記載の方法。
(項目56)
前記光システムは開口数が0.23以上である、項目55に記載の方法。
(項目57)
前記少なくとも96個のチャンバはそれぞれ、約100ナノリットル以下の容積を有する、項目53に記載の方法。
(項目58)
前記少なくとも96個のチャンバはそれぞれ、約10ナノリットル以下の容積を有する、項目57に記載の方法。
(項目59)
前記少なくとも96個のチャンバはそれぞれ、約100ピコリットル以下の容積を有する、項目58に記載の方法。
(項目60)
前記少なくとも96個のチャンバそれぞれの密度は約100チャンバ/cm2以上である、項目53に記載の方法。
(項目61)
前記少なくとも96個のチャンバそれぞれの密度は約250チャンバ/cm2以上である、項目60に記載の方法。
(項目62)
前記少なくとも96個のチャンバそれぞれの密度は約1,000チャンバ/cm2以上である、項目61に記載の方法。
(項目63)
M個のサンプルから選択された少なくとも1つのサンプルとN個の試薬から選択された少なくとも1つの試薬とを含む複数の処理部位を備える微小流体素子の撮像装置であって、該装置は、
該微小流体素子に連結され、該微小流体素子を電磁放射で照射するよう構成された照明システムと、
該微小流体素子に連結され、該複数の処理部位から発せられた電磁放射を受光するよう構成された撮像システムと、
該撮像システムと連結された検出器、
を備える、装置。
(項目64)
前記微小流体素子はエラストマー微小流体素子である、項目63に記載の装置。
(項目65)
前記処理部位は閉鎖反応チャンバである、項目63に記載の装置。
(項目66)
前記複数の閉鎖反応チャンバは反応密度が、平方cmの面積あたりの流体的に分離された反応が約250以上である、項目65に記載の装置。
(項目67)
前記複数の処理部位から発せられる前記電磁放射は蛍光信号である、項目63に記載の装置。
(項目68)
さらに、前記微小流体素子に連結された熱制御部を備える、項目67に記載の装置。
(項目69)
前記複数の処理部位は約100ナノリットル以下の容積により特徴づけられる、項目68に記載の装置。
(項目70)
前記複数の処理部位は約10ナノリットル以下の容積により特徴づけられる、項目69に記載の装置。
(項目71)
前記複数の処理部位は250部位/cm2以上のアレー密度により特徴づけられる、項目69に記載の装置。
(項目72)
前記複数の処理部位は1,000部位/cm2以上のアレー密度により特徴づけられる、項目69に記載の装置。
(項目73)
前記複数の処理部位はタンパク質結晶化処理に対応するよう構成されている、項目63に記載の装置。
(項目74)
前記電磁放射は光学的放射である、項目63に記載の装置。
(項目75)
光撮像システムであって、
コンピュータと、
流体的に分離された少なくとも1,536個の反応チャンバを有するエラストマー微小流体アレー素子を照射するために適合された光学照射システムであって、該エラストマー微小流体アレー素子は複数の層から形成される弾性ブロックを備え、少なくとも1つの層は少なくとも1つのくぼみがその内部に形成されており、該くぼみは該くぼみを有する該層に一体形成された少なくとも1つの偏向膜を有する、光学照射システムと、
光検出システムとを備える、システム。
(項目76)
前記少なくとも1,536個の反応チャンバは100ナノリットル未満の容積により特徴づけられる、項目75に記載の光撮像システム。
(項目77)
前記少なくとも1,536個の反応チャンバは、250チャンバ/平方センチメータ以上のアレー密度で空間的に配置されている、項目75に記載の光撮像システム。
(項目78)
M個のサンプルおよびN個の試薬は、前記少なくとも1,536個の反応チャンバに分散している、項目75に記載の光撮像システム。
(項目79)
前記光照明システムは、前記少なくとも1,536個の反応チャンバのサブセットからの1つ以上の蛍光信号の発光を誘導する、項目75に記載の光撮像システム。
(項目80)
前記光検出システムは、前記少なくとも1,536個の反応チャンバのサブセットに関連付けられたタンパク質結晶化処理の1つ以上のイメージを提供するよう構成されている、項目75に記載の光撮像システム。
【図面の簡単な説明】
【0035】
【図1A】図1Aは、発明の実施形態にかかる撮像システムを示す単純化した模式図である。
【図1B】図1Bは、本発明の別の実施形態にかかる例示的撮像システムの概観図である。
【図1C】図1Cは、本発明の実施形態にかかる熱制御素子を示す単純化した模式図である。
【図2A】図2A〜2Cは、本発明の実施形態にかかるレンズアセンブリを示す単純化した模式図である。
【図2B】図2A〜2Cは、本発明の実施形態にかかるレンズアセンブリを示す単純化した模式図である。
【図2C】図2A〜2Cは、本発明の実施形態にかかるレンズアセンブリを示す単純化した模式図である。
【図3】図3は、本発明の実施形態にかかる微小流体素子にある多数の反応チャンバで起こる反応により発生する第1の波長に中心をおく蛍光発光の写真である。
【図4】図4は、本発明の実施形態にかかる微小流体素子にある多数の反応チャンバで起こる反応により発生する第2の波長に中心をおく蛍光発光の写真である。
【図5】図5は、本発明の実施形態を用いて生成された選択された波長のスポット図である。
【図6】図6は、本発明の実施形態を用いて生成された選択された波長のスポット図である。
【図7】図7は、本発明の実施形態を用いて生成された選択された波長のスポット図である。
【図8】図8は、本発明の実施形態を用いて生成される位置に応じた比較的均一な照射図である。
【図9】図9は、本発明にかかるいくつかの実施形態の正方形内に含まれるエネルギー(ensquared energy)の図である。
【図10】図10は、本発明にかかるいくつかの実施形態の正方形内に含まれるエネルギーの図である。
【図11】図11は、本発明にかかるいくつかの実施形態の正方形内に含まれるエネルギーの図である。
【図12】図12は、本発明の実施形態にかかる光システムの像面湾曲および歪みの図である。
【図13】図13は、本発明の実施形態にかかるシステムにより生成された二重波長対焦点の図である。
【図14】図14は、本発明の実施形態を用いて生成された選択された波長のスポット図である。
【図15】図15は、本発明の実施形態を用いて生成された選択された波長のスポット図である。
【図16】図16は、本発明の実施形態を用いて生成された選択された波長のスポット図である。
【図17】図17は、本発明の実施形態を用いて生成された選択された波長のスポット図である。
【図18】図18は、本発明の実施形態を用いて生成された選択された波長のスポット図である。
【図19】図19は、本発明の実施形態を用いて生成された選択された波長のスポット図である。
【図20】図20は、本発明の実施形態を用いて生成された選択された波長のスポット図である。
【図21】図21は、本発明の実施形態を用いて生成された選択された波長のスポット図である。
【図22】図22は、本発明の実施形態を用いて生成された選択された波長のスポット図である。
【図23】図23は、本発明の別の実施形態を用いて生成された選択された波長のスポット図である。
【図24】図24は、本発明の別の実施形態を用いて生成された選択された波長のスポット図である。
【図25】図25は、本発明の別の実施形態を用いて生成された選択された波長のスポット図である。
【図26】図26は、本発明にかかるいくつかの実施形態の正方形内に含まれるエネルギーの図である。
【図27】図27は、本発明にかかるいくつかの実施形態の正方形内に含まれるエネルギーの図である。
【図28】図28は、本発明にかかるいくつかの実施形態の正方形内に含まれるエネルギーの図である。
【発明を実施するための形態】
【0036】
(特定の実施形態の詳細な説明)
本発明によれば、微小流体システム用の技術が提供される。特に、本発明は微小流体素子のチャンバ内である量の流体内に浮かんでいる1つ以上のエンティティを撮像する方法とシステムを提供する。より詳細には、本撮像方法と撮像システムは、微小流体素子内の1つ以上のエンティティに関連付けられた蛍光信号からの指標を用いる。微小流体素子に連結された蛍光体リーダー、化学発光リーダー、および生体発光リーダーを用いた微小流体方法およびシステムの技術は単なる例として適用されており、本発明がより広い範囲の適用可能性を有することは言うまでもない。
【0037】
本出願において、微小流体素子内の特定のタイプの「反応」チャンバに対する参照がなされる。一般に、これらの「反応チャンバ」は処理部位と、処理チャンバと、および/または反応部位、これらの組み合わせなどからなる。これらのチャンバは、閉鎖されていても、部分的に閉鎖されていても、開放されていてもよく、部分的に開放されていても、シールされていても、もしくはこれらの組み合わせであってもよく、これらの状態などのいずれかを伴う一時的または過渡的状況を含んでもよい。ある実施形態では、チャンバはシール状態、シール可能、閉鎖可能、分離状態、分離可能、またはこれらの組み合わせであり、一時的もしくは過渡的状況の組み合わせまたは単一の状況はこれらの状態のいずれかを伴う。したがって、反応チャンバという用語は、本発明を限定するものではなく、これらその他の構造を含むものである。加えて、チャンバという用語は、本発明を限定するものではなく、チャンバに関連付けられた具体的な特徴を記載するのでない限り、通常の意味で用いられるべきものである。もちろん、その他の変形例、修正例、および代替例もありうる。
【0038】
さらに、本願では、微小流体素子からの蛍光指標についても言及する。本発明の範囲に含まれるのは蛍光指標に限らず、化学発光、電場発光、電気化学発光、リン発光、生体発光、その他の発光プロセス、あるいは検出素子を用いて検出可能な他のタイプの指標を伴うその他のいずれのプロセスを含む発光性指標を含む。当業者には明らかなように、これらの蛍光および発光性指標の検出および解析において実施可能な方法およびシステムは、指標間で変換可能である。加えて、本発明の実施形態では光学要素として分光フィルタを用いるものもあるが、これは本発明に必須のものではない。蛍光および発光の用途では、光学励起パスもしくは光学発光パスまたはその両方において分光フィルタは用いないものもある。ここに記載するように、分光フィルタを用いる実施形態もある。当業者であれば、特定の用途に関連する差異を理解する。
【0039】
ある実施形態では、核酸増幅反応などの熱循環的反応を行うために用いられる素子を含む各種の素子および微小流体解析方法が用いられる。この素子は、エラストマー成分を含むという点で、従来の微小流体素子とは異なる。場合によっては、素子のほとんどまたは全てがエラストマー材料からなる。例えば、増幅反応は、線形増幅(単一のプライマーでの増幅)、または指数増幅(すなわち、フォワードおよびリバースプライマー群で行われる増幅)であってもよい。
【0040】
本発明のいくつかの実施形態によって提供される方法およびシステムは、核酸増幅反応を行う際にブラインドチャネル型素子を用いる。これらの素子では、反応部位内に通常堆積する試薬は、所望の種類の増幅反応に必要な試薬である。普通、これは例えば、プライマー、ポリメラーゼ、ヌクレオチド、金属イオン、バッファ、補因子のうちいくつかまたは全てが堆積されることを意味する。このような場合に反応部位に導入されるサンプルは核酸鋳型である。また、しかしながら、鋳型は堆積されてもよく、反応部位に流れてもよい。本明細書を通して詳細に論じるように、マトリックス素子を用いて増幅反応を行う場合、核酸鋳型を含むサンプルは垂直フローチャネルを流れ、増幅試薬は水平フローチャネルを流れ、あるいはその逆であってもよい。
【0041】
PCRは、おそらく最もよく知られている増幅技術である。本発明の実施形態で用いられる素子はPCR増幅を行うものに限られない。その他の種類の行うことのできる増幅反応としては、(1)リガーゼ連鎖反応(LCR)(WuおよびWallace、Genomics4:560(1989)、ならびにLandegren他、Science241:1077(1988))参照)、(2)転写増幅(Kwoh他、Proc.Natl.Acad.Sci.USA86:1173(1989)参照)、(3)自立的な配列複製(Guatelli他、Proc.Natl.Acad.Sci.USA、87:1874(1990)参照)、(4)核酸配列を基礎にした増幅(NASBA)(Sooknanan,R.およびMalek,L.,BioTechnology13:563−65(1995)参照)などがあるが、これに限らない。これらの参照文献は、本明細書において、全体として参照により組み込まれる。
【0042】
さらに、ある素子は、溶液の流れを調整する1つ以上のエラストマーバルブを含む素子で、熱循環反応(例えば、PCR)を行うよう構成されている。したがって、このような構成の素子を用いた増幅反応を行う方法もまた提供される。
【0043】
増幅産物(単位複製配列)は、決まった核酸検出方法で検出し(反応チャンバ内で分離されているかその後であるかを)見分けることができる。二本鎖DNAからなる単位複製配列は、SYBRTM、ピコグリーン(オレゴン州ユージーンのMolecular Probes,Inc.社)などのインターカレーション色素、エチジウムブロマイドなど(Zhu他、1994、Anal.Chem.66:1941−48)、および/またはゲル電気泳動を用いて検出することができる。たいてい、配列固有の検出方法(すなわち、単位複製配列のヌクレオチド配列に基づいて検出される)が用いられる。検出方法の例としては、固定されたオリゴヌクレオチドまたはポリヌクレオチドのアレイへのハイブリダイゼーション、および差次的標識付きの分子指標またはその他の「蛍光共鳴エネルギー移動(FRET)」に基づく検出システムの使用がある。FRETに基づく検出システムは、本発明の実施形態のあるものについては好適な検出方法である。FRETに基づくアッセイでは、供与体/受容体蛍光プローブペアの供与体(レポーター)および/または受容体(クエンチャー)蛍光プローブからの蛍光の変化が検出される。供与体および受容体蛍光プローブペアは、供与体の発光スペクトルが受容体の励起スペクトルにオーバーラップするように選択される。したがって、蛍光プローブのペアが互いに十分に近傍におかれた場合には、供与体から受容体へのエネルギー移動が起こって検出可能となる。各種のアッセイとして、例えば鋳型伸長反応、量的RT−PCR、分子指標、インベーダーアッセイなどがあるが、これに限るものではない。これらについては以下に簡単に述べる。
【0044】
FRETおよび鋳型伸長反応は、供与体/受容体ペアの1員が標識としてついたプライマー、および供与体/受容体ペアのもう一方の1員が標識としてついたヌクレオチドを用いる。標識付きヌクレオチドをプライマーに結合する前、鋳型依存の伸長反応の間、供与体および受容体はエネルギー移動が起こらないよう十分に離されている。しかしながら、標識付きヌクレオチドがプライマーに結合されると、間隔は十分に近くなり、エネルギー移動が起こって検出可能となる。これらの方法は、単一のヌクレオチド多型の検出における単一基ペア伸長反応を行う際にとりわけ有用であり、米国特許第5,945,283号および国際公開第WO97/22719号に記載されている。この反応は、任意で、信号を増やすために温度制御方法と本発明に記載する装置を用いて熱循環してもよい。
【0045】
各種のいわゆる「リアルタイム増幅」方法または「リアルタイム量的PCR」方法は、増幅プロセス中または後で形成される増幅産物の量を測定することにより、サンプル内の目標核酸の量の判定に用いてもよい。蛍光性ヌクレアーゼアッセイは、リアルタイム計量方法の1つの具体例であり、ここに記載の素子とともにうまく用いることができる。このような増幅産物の形成をモニタする方法は、二重標識付き蛍光性オリゴヌクレオチドプローブを用いたPCR産物蓄積の連続的な測定を伴う。この測定は、文献では「TaqMan」方法と呼ばれることが多い。例えば、米国特許第5,723,591号を参照のこと。
【0046】
分子指標を用いると、それが増幅産物の相補性領域にハイブリダイズするときのプローブのコンフォメーションの変化は、検出可能な信号の形成につながる。このプローブ自体は2つのセクションを含む。1つが5’末端であり、もう1つは3’末端である。これらのセクションは、プローブ結合部位でアニールするプローブのセクションの側面に位置し、互いに相補的となっている。一方の末端セクションは、通常、レポーター色素が結合し、もう一方の末端セクションは普通クエンチャー色素が結合する。溶液中では、これら2つの末端セクションが互いに複合してヘアピンループを形成してもよい。この構造においては、レポーター色素およびクエンチャー色素は十分に近傍にあるため、レポーター色素からの蛍光がクエンチャー色素により効果的にクエンチされる。これに対して、ハイブリッドプローブは、クエンチの程度が減少した線形構造となる。したがって、これら2つの色素の発光変化をモニタすることにより、間接的に増幅産物の形成をモニタすることが可能となる。この種のプローブおよびその使用方法は、例えば、Nat.Biotechnol.16:359−63(1998)のPiatek他、Nat.Biotechnology14:303−308(1996)のTyagiおよびKramer、Nat.Biotechnol.16:49−53(1998)のTyagi他などにより、さらに説明されている。
【0047】
スコルピオン検出方法は、例えば、Nucleic Acids Research、28:3752−3761(2000)のThelwell他、およびSolinas他「Duplex Scorpion primers in SNP analysis
and FRET applications」Nucleic Acids Research29:20(2001)に記載されている。スコルピオンプライマーは、PCRストッパーを介して5’末端に付随するプローブ要素蛍光性PCRプライマーである。これらは、均質な溶液中のPCR産物のリアルタイム単位複製配列に固有の検出において用いられる。2つの異なる構成が可能であって、これらは、「ステムループ」構成と「二本鎖」構成である。いずれの場合にも、プローブメカニズムは分子内である。全ての構成において基本的なスコルピオンの要素は(1)PCRプライマー、(2)プローブ要素のPCR読過しを回避するPCRストッパー、(3)固有のプローブ配列、(4)少なくとも1つの蛍光プローブおよびクエンチャーを含む蛍光検出システム、である。スコルピオンプライマーのPCR伸長の後、結果として生じる単位複製配列は、各PCR周期の変性ステージ中に単鎖となるプローブに相補的な配列を含む。冷却の際、クエンチャーがもはや蛍光プローブの近傍にないため、プローブはこの相補配列に自由に結合することができ、蛍光発光が増加する。PCRストッパーは、TaqDNAポリメラーゼによる望ましくないプローブの読過しを回避する。
【0048】
インベーダーアッセイ(ウィスコンシン州マディソンのThird Wave Technologies社)は、とりわけSNP遺伝子型に用いられ、目標核酸(DNAまたはRNA)または多型部位に相補的な信号プローブを示すオリゴヌクレオチドを用いる。第2のオリゴヌクレオチド(Invader Oligoと指定される)は、同じ5’ヌクレオチド配列を含むが、3’ヌクレオチド配列は、ヌクレオチド多型を含む。インベーダーオリゴは、信号プローブの5’末端が多型を含むヌクレオチドで「フラップ」を形成するよう、目標核酸への信号プローブの結合を干渉する。この複合体は、固有のエンドヌクレアーゼに固有の構造により認識され、Cleavase酵素と呼ばれる。Cleavaseは、ヌクレオチドの5’フラップを劈開する。開放されたフラップは、FRET標識を付された第3のプローブと結合し、これにより、Cleavase酵素により認識可能な別の二本鎖構造を形成する。このとき、Cleavase酵素は、クエンチャーから離して蛍光プローブを劈開し、蛍光信号を生成する。SNP遺伝子型については、信号プローブは、基準(野生型)対立遺伝子または変異体(突然変異体)対立遺伝子のいずれかと複合するよう構成される。PCRと異なり、核酸の増幅を伴わない信号の線形増幅がある。当業者の手引きとして、さらに詳細は、例えば、Advances in Nucleic Acid and Protein Analysis 3826:117−125(2000)のNeri、B.P.他、および米国特許第6,706,471号などに記載される。
【0049】
本発明とあわせて各種の多重化増幅システムを用いることができる。あるタイプでは、複数の異なる標識の付いたプローブを用いて、いくつかの異なる目標を同時検出可能である。これらのプローブのそれぞれは、特定の目標とのみ複合するよう構成されている。各プローブが異なる標識を有しているので、各目標との結合は蛍光信号に基づいて検出される。用いる各種の標識を注意深く選択することで、単一の反応において、異なる波長で異なる標識が励起および/または検出される解析を行うことができる。例えば以下を参照のこと。Fluorescence Spectroscopy(Pesce他編) Marcel Dekker, New York,(1971); White他, Fluorescence Analysis: A Practical Approach, Marcel Dekker, New York,(1970); Berlman, Handbook of Fluorescence Spectra of Aromatic Molecules, 2nd ed., Academic Press, New York,(1971); Griffiths, Colour and Constitution of Organic Molecules, Academic Press, New York,(1976); Indicators(Bishop編) Pergamon Press, Oxford, 19723; and Haugland, Handbook of Fluorescent
Probes and Research Chemicals, Molecular Probes, Eugene(1992)。
【0050】
宿主生物または感染性微生物のゲノム修飾にリンクした疾病の多くは、多くの場合単一ヌクレオチドの変化を伴う、少量のヌクレオチドの変更の結果である。このような単一ヌクレオチドの変化は、単一ヌクレオチド多型または単にSNPと呼ばれ、SNPが起こる部位は、通常多形性部位と呼ばれる。このような多形性部位に現れるヌクレオチドを同一性を判定するために、本明細書に記載の素子を用いてもよい。この能力の拡張として、この素子は、遺伝子型決定において利用され得る。遺伝子型決定は、2倍体生物(すなわち、各遺伝子のコピーを2つ持っている生物)が基準対立遺伝子のコピーを2つ含む(基準型同型接合体)か、基準および変異体対立遺伝子を各1つ含む(すなわち、ヘテロ接合体)か、または変異体対立遺伝子のコピーを2つ含む(すなわち、変異体型同型接合体)の判定を伴う。遺伝子型解析を行う場合には、本発明の方法は単一変異部位を調べるために用いることができる。しかしながら、多重化に関するセクションでさらに説明するように、この方法は、多数の異なるDNA遺伝子座の個々の遺伝子型が、同じ遺伝子、異なる遺伝子、またはその組み合わせであるかを判定するのに用いることもできる。
【0051】
遺伝子型解析に用いられる素子は、統計的な見地から、2倍体の2つの対立遺伝子それぞれのコピーが有効なDNA濃度の反応部位に存在するようにした適切なサイズの反応部位を用いるよう構成されている。さもなくば、反応部位に第2の対立遺伝子のコピーがないために、解析の結果、ヘテロ接合体が同型接合体であることになってしまう可能性がある。下の表1は、ここに記載の素子で用いることのできる、各種の例示的DNA濃度における1nlの反応容積中のゲノムのコピーの数を示す。
【0052】
表1:示されたDNA濃度における1ナノリットルの容積中のゲノムのコピーの数
【0053】
【表1】

一般論として、サンプル確率論的比率により、増幅反応が始まる前に存在するコピー数は測定のありうるエラーを判定する。本発明の発明者らは各反応部位にゲノムが1つである濃度においてTaqMan反応をうまく行ったが、ある種の素子を用いた遺伝子型解析は、通常、DNA濃度がおよそ0.10μg/μLであるサンプルで行われる。
【0054】
遺伝子型解析は、各種の異なるアプローチを用いて行うことができる。これらの方法では、普通、「YES」または「NO」がわかれば十分である。すなわち、検出は任意の対立遺伝子の有無を答えることができればよい。したがって、解析は、多形性部位で可能性のある1つの対立遺伝子の存在を検出するために必要なプライマーまたはヌクレオチドを用いてのみ実行され得る。しかしながら、より一般的には、多形性部位で行われる可能性の高い各対立遺伝子の有無を検出するプライマーおよびヌクレオチドが含まれる。
【0055】
単一塩基ペア伸長(SBPE)反応は、遺伝子型解析を行うために特に開発された技術の一つである。多数のSPBEアッセイが開発されてきたが、一般的なアプローチは全く同様である。通常、これらのアッセイは、プライマーの3’末端がそのまま変異部位の5’末端であるかまたはこれに隣接するように、目標核酸に相補的なプライマーとの複合を伴う。伸長は、変異部位を占有するヌクレオチド(複数)およびポリメラーゼに相補的な、1つ以上の標識付き伸長不可能なヌクレオチドが存在するときに行われる。伸長不可能なヌクレオチドは、一旦プライマーに結合されるとポリメラーゼによるさらなる伸長が妨げられるヌクレオチド類似体である。追加された伸長不可能なヌクレオチド(複数)が変異部位のヌクレオチドに相補的である場合、標識付き伸長不可能なヌクレオチドはプライマー3’末端に結合されて標識付き伸長産物を生成する。したがって、伸長プライマーは、ヌクレオチドが目標核酸の変異部位に存在するという指標となる。このような方法および関連する方法は、例えば、米国特許第5,846,710号、第6,004,744号、第5,888,819号、第5,856,092号、第5,710,028号、および国際公開第WO92/16657号で論じられている。
【0056】
遺伝子型解析は、量的PCR方法を用いて行うこともできる。この場合、プライマー、ヌクレオチド、ポリメラーゼとともに、対立形質のそれぞれに相補的な異なる標識付きプローブが試薬に含まれる。しかしながら、反応は単一プローブによってのみ行われ、信号がないことが、特定の対立遺伝子の欠如によるものかまたは単に反応の失敗によるものかについて曖昧さが生じることになる。多形性部位に2つの対立遺伝子が可能な通常の2対立遺伝子の場合には、それぞれ完全に対立遺伝子のうち1つに相補的な2つの異なった標識付きプローブが、増幅プライマー、ヌクレオチド、ポリメラーゼとともに、試薬混合に含まれているのが普通である。目標DNAを含むサンプルが反応部位に導入される。プローブに相補的な対立遺伝子が目標DNAに存在する場合、増幅が起こり、これにより上記の検出で説明した検出可能な信号につながる。いずれの差動信号が得られたのかに基づいて、多形性部位におけるヌクレオチドの同一性が判定される。両方の信号が検出されれば、両方の対立遺伝子が存在することになる。上述の温度制御部で説明したように、反応の間熱循環が行われる。
【0057】
遺伝子発現解析は、1つ以上の遺伝子が特定の細胞で発現するレベルを決定することを包含する。判定は質的であってもよいが、普通は量的である。識別的遺伝子発現解析において、1つの細胞(例えば、試験細胞)における遺伝子(複数)のレベルは、別の細胞(コントロール細胞)の同じ遺伝子の発現レベルに比較される。各種のこのような比較がおこなわれてもよい。例えば、健康な細胞と疾病細胞、薬物の処置を受けた個体からの細胞と処置を受けていない個体からの細胞、特定の毒物にさらされた細胞とそうでない細胞間の比較などを含むが、これに限らない。テスト細胞およびコントロール細胞間で発現レベルが変化する遺伝子では、治療のマーカおよび/または目標としての役割を果たしてもよい。例えば、あるグループの遺伝子が健康な細胞よりも疾病細胞で上方制御される場合には、このような遺伝子は疾病のマーカとしての役割を果たすことができ、診断テストの基礎として用いることができる可能性がある。これらの遺伝子は、また標的とすることができる。疾病処置の戦略は、上方制御された遺伝子の発現を低減する結果となる手続きを含むこともできる。
【0058】
本発明の実施形態で用いられる微小流体素子の構成は、各種の遺伝子発現解析を容易にするのに有用である。この素子は多数の反応部位を含むため、多数の遺伝子および/またはサンプルを同時にテストすることが可能である。例えば、ブラインドフローチャネル素子では、数百または数千もの遺伝子の発現レベルを同時に判定することができる。素子は、また、識別的遺伝子発現解析を容易にする。マトリックス構造では、例えば、健康な細胞から得たサンプル1つのフローチャネルでテストし、疾病細胞からのサンプルをすぐ隣のチャネルで処理することができる。この特徴により、2つのサンプルを同じ素子で同時に同一の条件でテストすることができるため、検出の容易さおよび結果の精度を向上させることができる。
【0059】
各種のマトリクスまたはアレー型素子を、本発明の実施形態に従って利用してもよい。これらの素子のあるものは、以下を含む。(1)エラストマー基板に形成される第1の複数のフローチャネル、(2)第1の複数のフローチャネルと交差して反応部位のアレーを規定する、エラストマー基板に形成される第2の複数のフローチャネル、(3)第1および第2の複数のフローチャネル内に配された、各反応部位内の溶液を他の反応部位の溶液から分離するよう動作可能な複数の分離バルブ、(4)フローチャネルの1つ以上のおよび/または反応部位の1つ以上に重畳する複数のガードチャネルであって、そこからの溶液の蒸発を妨げるための複数のガードチャネル。上記素子は、温度規制を伴う多数の異なる種類の反応(例えば、核酸解析の熱循環)を行うために利用され得る。
【0060】
微小流体素子には、通常、ここでは「ブラインドチャネル」または「ブラインド充填」と呼ぶ、溶液がブラインドチャネルの一端のみから出入りするように終端または分離端を有する(すなわち、ブラインドチャネルの入口と出口が分離されていない)フローチャネルである複数のブラインドチャネルを有することによって特徴付けられる構成を用いるものがある。これらの素子は、各ブラインドチャネルについてブラインドチャネルの領域を分離して反応部位を分離するために単一のバルブしか必要としない。この種の素子の製造中、解析を行う1つ以上の試薬は、反応部位に堆積され、これにより入出力数の顕著な減少につながる。加えて、ブラインドチャネルは、反応部位が単一のまたは限定数のサンプル入力から充填されるようにチャネルの相互接続ネットワークに接続されている。入出力複雑性の低減および各反応部位の分離に単一のバルブのみを用いることにより、反応部位の利用可能な空間が増加する。したがって、これらの素子の特徴は、各素子が多数の反応部位を含むことができ(例えば、数万程度まで)、高い反応部位密度(例えば、1,000〜4,000反応部位/cm2)を実現することができることを意味する。個別に、また集合的に、これらの特徴は、既存の微小流体素子に比べて素子の大きさを直接的に顕著に低減させると言い換えることもできる。
【0061】
本明細書に開示されるその他の微小流体素子は、マトリックス構造を用いる。一般に、この種の微小流体素子は、複数の交差する水平フローチャネルおよび垂直フローチャネルを用いて、交差部分における反応部位のアレーを規定する。したがって、この構成の素子は、アレーまたは反応部位も有する。しかしながら、この構成においてより多数のサンプルに対応するために、より多数のサンプル入力とそれに対応する出力がある。切替可能なフローアレーアーキテクチャーと呼ばれるバルブシステムは、溶液が水平またはフローチャネルのみを選択的に流れるようにし、したがってマトリクス内の各種のフローチャネルの切り替え可能な分離を可能とする。したがって、ブラインドチャネル素子が限られた数のサンプルでの異なる状況下で多数の解析を行うように構成されているのに対して、マトリックス素子は、限定された状況下における多数のサンプルの解析を行うよう構成されている。さらに別の素子は、これら2つのハイブリッドである。
【0062】
他の微小流体素子は、国際公開第WO 2004/089810、米国公開番号第20050019792号として公開された米国特許出願番号第10/819088号、同時係属中の同一出願人による2006年6月2日出願の「Analysis using microfluidic partitioning devices」と題された特許出願第 号(代理人整理番号020174−012400)に記載されているような大量に分割された素子(これらのそれぞれは、本明細書において、全体として参照により組み込まれる)である。大量に分割された素子を用いることにより、サンプルは多数の分離された反応チャンバに分割されて、反応は各チャンバ内で同時に実行されてもよい。
【0063】
本明細書に記載の微小流体素子は、さらに、フローチャネル、制御チャネル、バルブ、および/またはエラストマー材料で製造されたポンプなどの各種のコンポーネントを用いることにより特徴づけられる。場合によっては、基本的に素子全体がエラストマー材料からなる。結果として、このような素子は、その形態および機能において、プラスチックやシリコンベースの材料から作られた大多数の従来の微小流体素子とは顕著に異なる。多数の反応チャンバは、本発明の実施形態に従って変化するよう提供される。
【0064】
素子の構成により、多数の異なる加熱システムとの組み合わせで素子を用いることができるようになる。したがって、素子は、温度制御の必要な多様な解析を行う際に有益である。加えて、これらの加熱用途用に構成された微小流体素子には、さらに、反応部位からのサンプルの蒸発を最小限にする構成上の特徴を組み込むことができる。この種の素子は、一般に、エラストマー素子内に形成された、多数のガードチャネルおよび/またはリザーバー、またはチャンバを備え、これらの内部を水が流れて素子が形成されるエラストマー材料内の水蒸気圧を増加させ、これにより反応部位からのサンプル材料の蒸発を低減する。
【0065】
別の実施形態においては、微小流体素子の温度を制御するために温度循環素子を用いることができる。好ましくは、この微小流体素子は微小流体素子と熱接触をするよう構成される。微小流体素子が、ガラススライドやプラスチックキャリアなどキャリアプレートの底面などの基板材料によって支持されるとき、微小流体素子、好ましくは弾性ブロックを有する素子が、温度循環素子の加熱/冷却ブロックと直接接触するようにキャリアまたはスライドの領域に窓が形成されてもよい。好適な実施形態においては、加熱/冷却ブロックは、好ましくは、反応が起こる場所に隣接した部分に、微小流体素子に吸引力を適用するために、内部に真空源に連通する溝部を有する。また、硬質の熱伝導性プレートは、微小流体素子に接合してその後、効率的な熱伝導性を得るために加熱/冷却ブロックに一致させてもよい。
【0066】
ある素子のアレー構成は、素子がハイスループットを実現可能であることを意味する。集合的には、ハイスループットおよび温度制御能力は、素子が多数の核酸増幅(例えば、ポリメラーゼ連鎖反応(PCR))を行うために有用である。このような反応は素子の利用、特に、その温度制御を要するあらゆる反応における利用について、説明しながら詳細に論じる。しかしながら、素子がこれらの特定の用途に限定されるものではないことは言うまでもない。素子は、各種のその他の種類の解析または反応において用いることができる。この例として、タンパク質リガンド相互作用、および細胞と各種の化合物との間の相互作用の解析などがある。さらなる例が本明細書を通じて提示される。
【0067】
ここに開示される微小流体素子は、通常、少なくともエラストマー材料から構成され、
単一またはマルチレイヤーソフトリソグラフィ(MSL)技術および/または犠牲層封止方法(例えば、Science288:113−116(2000)のUnger他、および国際公開第WO01/01025号を参照のこと。いずれも、本明細書において、全体として参照により組み込まれる)によって構成される。このような方法を用いて、素子のフローチャネル内の溶液の流れが制御される微小流体素子が、エラストマー膜または断片によってフローチャネルから分離された少なくとも1つ以上の制御チャネルで構成される。この膜または断片は、駆動力を制御チャネルに与えることにより制御チャネルと関連付けられるフローチャネルに偏向するまたはフローチャネルから退避する。フローチャネルに対する膜の偏向や退避の程度を制御することにより、フローチャネル内の溶液の流れが遅くなったり完全に遮断されたりすることができる。制御とこの種のフローチャネルを組み合わせて用いることにより、Science288:113−116(2000)のUnger他、ならびに国際公開第WO/02/43615号および第WO 01/01025号においてさらに詳細に説明されるように、各種の異なる種類の溶液の流れを調整するバルブとポンプを提供することができる。
【0068】
ここで提供される素子は、試薬が反応するようにされる反応部位を選択的に分離するポンプおよび/またはバルブが組み込まれる。また、ポンプおよび/またはバルブのない、圧力駆動フロープロセスまたはポリメリゼーションプロセスを適切なチャネルの近くで使用して、これによって反応部位を選択的に分離する素子を用いることもできる。この反応部位は、素子内の多数の異なる位置のいずれに位置してもよい。例えば、マトリクス型素子では、反応部位が一群のフローチャネルの交差部に位置するものもある。ブラインドチャネル素子では、反応部位はブラインドチャネルの端部に位置する。
【0069】
素子が温度制御反応(例えば、熱循環反応)に用いられる場合には、そのときは、下により詳細に説明するように、通常、エラストマー素子が支持体(例えばガラススライド)に固定される。得られた構造物は、その後、例えば各種の反応部位における温度を制御する温度制御プレートにおかれる。熱循環反応の場合、素子は多数の熱循環プレートのいずれにおかれてもよい。
【0070】
素子が比較的光学的に透明なエラストマー材料から作製されるので、反応は、基本的に微小流体素子の任意の位置にある各種の異なる検出システムを用いて簡単にモニタすることができる。しかしながら、ほとんどの場合、検出は、反応部位自体(例えば、フローチャネルの交差部を含む領域内またはフローチャネルの盲端)において起こる。素子が実質的に透明材料から製造されるという事実は、また、検出システムには、既存のシリコンベースの微小流体素子とともには用いることのできない電流素子とともに用いることのできるものもあることを意味する。検出は、素子に組み込まれた検出器、または素子から分離されているが検出対象である素子の領域に整列された検出器を用いて、実現されてもよい。
【0071】
一般に、マトリックス構造を用いた素子は、交差して接合点のアレーを形成する複数の垂直または水平フローチャネルを有する。異なるサンプルと試薬(または試薬のセット)は、各フローチャネルに導入することができ、多数のサンプルはハイスループット構成において比較的多数の反応状況に対してテストされる。したがって、例えば、異なるサンプルがM個の異なる垂直フローチャネルそれぞれに導入され、異なる試薬(または試薬のセット)がN個の水平フローチャネルそれぞれに導入されると、M×N個の異なる反応を同時に行うことができる。通常、マトリックス素子は垂直フローチャネルおよび水平フローチャネルの切替可能な分離を可能とするバルブを備える。さらに、バルブは垂直フローチャネルのみまたは水平フローチャネルのみを選択的に通されるように配置される。この種の素子はサンプルの種類と数および試薬の数と種類の選択について柔軟であるため、これらの素子は、比較的多数の反応条件に対して多くのサンプルをスクリーニングすることが所望される分析を行うのに、良好に適合される。マトリックス素子は、任意でガードチャネルを組み込み、サンプルおよび反応物質の蒸発を防ぐようにする。
【0072】
高密度マトリックス構成には、素子内に制御ラインや流体ラインを作るために微小流体素子の複数の層の間に流体連絡通路(ビア)を用いるものがある。例えば、2層弾性ブロックの各層に流体ラインを有することにより、より高密度の反応セル配置が可能となる。当業者には明らかなように、マルチレイヤー素子は、流体ラインが流体的に連絡せず互いに上下で交差するようにすることができる。例えば、特定の構成では、第1層の試薬流体チャネルはビアを介して第2層の試薬流体チャネルに接続され、第2層もまた内部にサンプルチャネルを有し、サンプルチャネルと試薬チャネルはそれぞれサンプルチャンバおよび試薬チャンバにおいて終結する。サンプルチャンバおよび試薬チャンバはインターフェースチャネルを通じて互いに流体的に連絡しており、このインターフェースチャネルは、反応セルの各チャンバ間の流体的な連絡を制御するためにこれと関連付けられたインターフェースバルブを有する。使用時には、最初はインターフェースは閉鎖されており、その後、試薬が試薬入口から試薬チャネル中に導入され、サンプルがサンプル入口からサンプルチャネル中に導入される。封じ込めバルブがその後閉じられて各反応セルをその他の反応セルから分離する。一旦反応セルが分離されると、インターフェースバルブは開放され、所望の反応が起こり得るようにサンプルチャンバと試薬チャンバが互いに流体的に連絡させる。当業者であれば、多くの変形例、修正例、および代替例がわかるであろう。
【0073】
したがって、微小流体素子の特定の構成は、M個の異なるサンプルをN個の異なる試薬と反応させるよう適合された微小流体素子を提供し、この微小流体素子は、複数の反応セルであって、各反応セルがサンプルチャンバと試薬チャンバとを備え、そのサンプルチャンバおよび試薬チャンバがサンプルチャンバと試薬チャンバとの間の流体的な連通を制御するためにこれらと関連付けられたインターフェースバルブを有するインターフェースチャネルを介して流体的に連通している、複数の反応セル;それぞれサンプルチャンバと流体的に連絡している、複数のサンプル入口;およびそれぞれ試薬チャンバと流体的に連絡している、複数の試薬入口、を備え;ここにおいてサンプル入口および試薬入口のうちの一方はサンプルチャンバおよび試薬チャンバのいずれか一方とそれぞれビアを介して流体的に連通している。ある実施形態では、反応セルを接合された複数の層からなる弾性ブロック内に形成させ、インターフェースバルブは屈折可能な膜であり;サインプルチャネルを介してサンプル入口をサンプルチャンバと流体的に連絡させ、そして試薬チャネルを介して試薬入口を試薬チャンバと流体的に連通させ、サンプルチャネルの一部と試薬チャネルの一部とは互いにほぼ平行方向を向いており、それぞれこれと関連付けられた、流体的な連通を制御する封じ込めバルブを有し;共通の封じ込め制御チャネルを介して互いに操作可能に連通する、サンプルチャネルに関連付けられたバルブと試薬チャネルに関連付けられたバルブとを有し;この共通の封じ込め制御チャネルをサンプルチャネルまたは試薬チャネルのいずれか一方のほぼ法線に沿って配置する。
【0074】
本発明の実施形態で用いられる微小流体素子は、さらに、同時継続中の同一出願人により2004年3月29日にUngerにより出願された米国特許出願番号第60/557,715号に記載されたキャリア素子に一体化されてもよく、本明細書において参照により組み込まれる。Ungerのキャリアは、バルブの閉鎖を例えばハウス空気圧などの流体圧力源から離れるように維持するオンボードの連続流体圧力を提供する。Ungerはさらに、ここに記載の本発明のバルブを荷電して作動させる自動化されたシステムを提供する。別の好適な実施形態においては、アキュムレータを充填させバルブを作動させる自動化されたシステムは、微小流体素子の1つ以上の表面に対して一致するプラテンを有する素子を採用し、ここにおいて上記プラテンは少なくとも2つ以上の制御された真空源または圧力源と流体的に連通するポートを有し、微小流体素子の部分を操作するための機械的部分(例えばチェックバルブ、ただしこれに限らない)を備えてもよい。
【0075】
本発明の実施形態で用いられる別の素子は、弾性ブロックを安定させるための基板として用いられるキャリアを提供する。好ましくは、上記キャリアは以下の特徴のうち1つ以上を備える。キャリア内またはキャリアで形成される少なくとも1つのチャネルを介して弾性ブロックと流体的に連通するウェルまたはリザーバー;キャリア内またはキャリアで形成される少なくとも1つのチャネルを介して弾性ブロックと流体的に連通するアキュムレータ;および弾性ブロックと流体的に連通する流体ポート。ここで、上記流体ポートは好適には、上述の自動化されたシステムなど、自動化された真空源または圧力源にアクセス可能であり、上記自動化された真空源または圧力源はさらに、流体ポートに一致して弾性ブロックに流体圧力または真空を加える自動化されたシステムの間に流体接続の分離を形成するポートを有するプラテンを備える。ある実施形態で用いられる素子において、自動化された源は、また、アキュムレーター内に維持される圧力を充填および排出させるためのキャリアに関連付けられた1つ以上のアキュムレータと、流体的に連通させ得る。特定の実施形態において、キャリアはさらに、微小流体素子に接触するキャリアの範囲に位置する領域を備え、ここにおいて上記領域は、上記キャリアのもう一方の部分とは異なる材料から作られ、この領域の材料は、上記キャリアのもう一方の部分は異なる改良された熱伝導性および熱分配性のために選択される。改良された熱伝導性および熱分配性のための好適な材料としては、シリコン、好ましくは半導体分野で研磨されたウエハとして用いられるまたはチップなどのウエハから切り出された部分(例えば、チップ)として用いられる種類のシリコンのように高度に研磨されたシリコンが挙げられるが、これに限らない。
【0076】
以下でさらに詳細に説明するように、本発明の実施形態は、例えばPCR熱循環器など(ただしこれに限らない)の熱源を用い、これは製造時の状態から変更が加えられていてもよい。一般に、熱源はキャリアの部分と一致させることができる熱的に調整された部分を有し、好ましくは、キャリアの熱伝導および分配部は、これらキャリアの熱伝導および分配部を介して弾性ブロックに熱制御を与えるためである。好適な実施形態においては、熱接触は、熱源の熱的に調整された部分内に形成された1つ以上のチャネルに真空源を適用することによって改良され、ここにおいて、チャネルは、キャリアの熱伝導および分配部の表面に接触してキャリアの熱伝導および分配部に吸引を作動しこれを維持するよう形成される。好適な実施形態においては、キャリアの熱伝導および分配部は、熱伝導および分配部の端部を弾性ブロックのみに添付することによって、そして熱伝導および分配部を囲むギャップを残してキャリアにより引き起こされる寄生的熱効果を低減することによって、キャリアのその他の部分とは物理的に接触しないが、キャリアおよび弾性ブロックのその他の部分に付けられる。言うまでもなく、ここに記載の本発明の様態の多くにおいて、好適な弾性ブロックは、例えば、米国カリフォルニア州サンタクララのAffymetrix(R)によるGeneChip(R)などに製造される素子や、米国カリフォルニア州マウンテンビューのCaliperにより製造される素子などの、ここには記載されないいずれの周知の微小流体素子に置き換えてもよい。Soane、Parce、Fodor、Wilding、Ekstrom、Quake、またはUngerへの米国特許は、例えば、弾性ブロックの利用に関して上述した、吸引配置や流体素子の他の領域への寄生的熱転移の低減などの熱的な利点および改良を活用するために、本発明の弾性ブロックに置き換えることのできる微小流体素子または中規模の流体素子を記載する。
【0077】
本発明の実施形態に従って提供されるシステムおよび方法を利用して、384以上のウェルシステムの処理能力の増加がもたらされる。例えば、ある実施形態では、4倍、6倍、12倍、24倍以上、処理能力の増加がもたらされる。これらの処理能力の増加は、物流上の摩擦を低減しつつもたらされる。さらに、本発明の実施形態の上記システムおよび方法は、複数のサンプルに対する複数のアッセイを可能とする。例えば、具体的な実施形態において、96個のサンプルおよび96個のアッセイが用いられて、総計9,216のデータポイントを提供する。特定の例においては、96個のアッセイは、TaqMan5’ヌクレアーゼアッセイの要素である。
【0078】
さらに、本発明の実施形態は、反応容積の低減を提供する。本発明の実施形態では、10ピコリットルから100ナノリットルの範囲の反応容積が用いられる。ある実施形態では、100ナノリットルを超える反応容積が用いられる。単なる例として、ある実施形態では、本発明の方法およびシステムは、10ピコリットル、50ピコリットル、100ピコリットル、250ピコリットル、500ピコリットル、および1ナノリットルの反応容積で用いられる。別の実施形態では、2ナノリットル、5ナノリットル、10ナノリットル、20ナノリットル、30ナノリットル、40ナノリットル、50ナノリットル、75ナノリットル、および100ナノリットルの反応容積で用いられる。
【0079】
特定の微小流体素子の形状、微小流体素子のサイズ、流体的な連通パスと処理部位の配置によって、本発明の実施形態は、処理部位(または反応チャンバ)密度の範囲を提供する。ある実施形態では、本発明の方法およびシステムは、1cm2あたり約100チャンバから、1cm2あたり約100万チャンバの範囲のチャンバ密度で用いられる。単なる例として、本発明の実施形態によれば、1cm2あたり、250チャンバ、1,000チャンバ、2,500チャンバ、10,000チャンバ、25,000チャンバ、100,000チャンバ、および250,000チャンバのチャンバ密度の微小流体素子が用いられる。ある実施形態では、1cm2あたり1,000,000チャンバを超えるチャンバ密度が用いられるが、これは本発明では必須ではない。
【0080】
このように小さな反応容積で微小流体素子を動作させることにより、試薬使用量およびサンプル使用量を減らすことができる。さらに、本発明の実施形態には、リアルタイム量的PCRと組み合わせる場合にリアルタイム検出を行うよう適合された方法およびシステムを提供するものもある。これらのシステムおよび方法の使用により、いくつかの適用に対して線形ダイナミックレンジの6桁が提供され、そして10ナノリットル容量中でサブナノモル蛍光プローブの検出を可能にするに十分に高い量的解像度が提供される。当業者は、多くの変形例、修正例、および代替例がわかるであろう。
【0081】
ブラインドチャネルタイプの素子で行う方法は、エラストマー材料内に形成されたフローチャネルと、このフローチャネルと流体的に連通した複数のブラインドフローチャネルとを備え、各ブラインドフローチャネルの端部が反応部位を規定する、微小流体素子の提供を伴う。少なくとも1つの試薬が反応部位それぞれに導入され、反応部位の1つ以上で反応が検出される。本方法は、任意で、反応部位内で少なくとも1つの試薬を加熱する工程を含んでもよい。したがって、例えば、1方法は、核酸増幅反応の構成成分の導入およびその後の当該構成成分を熱循環して増幅産物を形成することを含み得る。以下により十分に説明するように、本発明の実施形態にしたがって、特定の微小流体素子において起こる反応により特徴付けられるよう適合された光撮像システムが提供される。
【0082】
図1Aに示すように、本発明の実施形態のいくつかに従って提供される光撮像システムは、熱制御モジュールに連結された蛍光撮像システムを含む。このようなシステムは、N×M形状の微小流体チップからデータを収集するよう適合される。ある実施形態では、NはMに等しい。例えば、本発明の実施形態では、48×48の反応チャンバ、96×96の反応チャンバ、およびその他の形状を有する微小流体素子を用いる。特定の実施形態においては、96×96の反応チャンバ形状を有する微小流体素子において、96個のサンプルおよび96個の試薬が用いられる。当業者には明らかなように、本発明の実施形態に従って提供される方法およびシステムは、ひとつのプラットフォームで複数の利用を行うことを可能にする。
【0083】
図1Aは、本発明の実施形態にかかる光撮像システムを示す単純化した模式図である。図1Aに示すように、本発明の実施形態に従って光源242が提供される。以下にさらに十分に説明するように、本発明のある実施形態では、光源242からの光を用いて、サンプル内に蛍光を引き起こす。他の実施の形態においては、化学発光が指標として用いられる。当業者には明らかなように、実施例によって、システムコンポーネントが追加され、削除され、または用いられる。各種の実施形態において、発光ダイオード(LED)、レーザ、アークランプ、白熱灯そのほかを含む光源が用いられる。これらの光源は、多色性であってもよいし単色性であってもよい。特定の実施形態においては、上記光源は第1のスペクトルバンド幅により特徴付けられる。特定の実施形態において、光源は、約400nmから約700nmのスペクトル域にわたって光学的放射を作り出す白色光源である。単なる例として、ある本発明の実施形態では、カリフォルニア州ナヴァトのSutter
Instruments社により販売されているLambdaLS300Wキセノンアークランプが光源として用いられる。当業者には明らかなように、これよりもスペクトルバンド幅が広いまたは狭いことにより特徴付けられるその他の光源も、代替的な実施形態において使用することができる。
【0084】
励起フィルタホイール244を図1Aに示す。ある実施形態では、例えば、光源が多色性であるものの場合、励起フィルタホイール244は、光源242から発せられる光をスペクトル的にフィルタするのに用いられる。もちろん、複数のフィルタを用いてもよい。例として、ある実施形態では、励起フィルタホイールは多数の分光フィルタを備え、この分光フィルタはそれぞれサンプルからの固有の蛍光を励起するために適当な所定の波長域を通過させるよう適合されている。図1Aに示すとおり、励起フィルタホイール244は、フィルタのコンピュータ制御を行えるようにコンピュータ270に連結されている。具体的な実施形態では、励起フィルタホイールは多数の分光フィルタを備えている:
フィルタ1:中心波長485nm、スペクトルバンド幅20nmのフィルタ
フィルタ2:中心波長530nm、スペクトルバンド幅20nmのフィルタ、および
フィルタ3:中心波長580nm、スペクトルバンド幅20nmのフィルタ。
【0085】
当業者には明らかなように、本発明の実施形態はこれらの特定の分光フィルタに限定されるものではなく、特定のサンプル用の蛍光プロセスに適合される分光フィルタを用いてもよい。さらに、前の議論はフィルタホイールの使用に関するものであるが、フィルタホイールは本発明に必ずしも必要ではない。代替的な実施形態においては、分光フィルタはホイール以外の形状でもたらされる。本発明の実施形態よれば、例えば、フィルタホルダにはめた分光フィルタ、電気光学フィルタ、アクチュエータによって光路内に配置されたフィルタ他が含まれる。さらに別の実施形態では、光源は、蛍光発光の励起に適切な所定の波長で放射を出すよう適合された整調可能な(チューナブル)レーザである。当業者であれば、多くの変形例、修正例、および代替例がわかるであろう。
【0086】
図1Aに示されるように、励起シャッター246が本発明の実施形態に従って提供される。ある実施形態では、励起シャッターはコンピュータ270の制御下で動作し、光源242により生成され励起フィルタホイール244によりスペクトル的にフィルタされた光学信号を遮断/通過させる。用途によって、サンプルがシステムに挿入され取り除かれる間、および検定動作の際には、励起源は遮断される。ある実施形態において、例えばレーザ源を用いる実施形態では、光源を消す代替手段を備えており、励起シャッターは用いられない。
【0087】
励起シャッターが開放位置で動作する際には、光学励起信号はファイババンドル248を通過し、チップキャリア207に備えられた微小流体素子205に作用するよう導かれる。その他の本発明の実施形態は、クオーツ光導体、液体光導体、その他のスクランブル用システムそのほかを用いて照射均一性を高める。図1Aに示すように、励起光学信号は、光学発光体250による反射、屈折、またはその組み合わせを介して、微小流体素子205の表面に作用するように導かれる。図1Aに示すように、微小流体素子の照射は光学発光体250を介して行われる。他の実施形態において、照射は、素子の1つ以上の側面から斜めにリングライトまたは回収光学連結部(微小流体素子および検出器260の間の光路)を介して微小流体素子に連結されてもよい。
【0088】
ある実施形態では、励起源による光での微小流体素子の照射は、サンプルの2次元領域に渡って行われる。この実施形態において、広い視野が提供され、これにより、化学的プロセスおよび反応を時間分解した撮像を含む、蛍光用途の実施が可能となる。例として、タンパク質熱量測定および核酸増幅処理の蛍光撮像は、本発明の実施形態による利点である時間分解したプロセスである。これらのプロセスのあるものでは、多数の反応チャンバに与えられた蛍光サンプルの同時励起および多数の反応チャンバで起こる反応により生成された蛍光信号の同時収集が望ましい。別のプロセス、例えば、蛍光寿命撮像では、初期レベルから時間とともに減衰するにしたがって、蛍光信号の検出(および解析)に続いて簡単な励起パルスがおこる。当業者であれば、多くの変形例、修正例、および代替例がわかるであろう。
【0089】
例えば、核酸の増幅プロセスは、代表的に、標的DNA、熱安定性DNAポリメラーゼ、2つのオリゴヌクレオチドプライマー、デオキシリボヌクレオチド三リン酸(dNTP)、反応バッファ、およびマグネシウムを含む。一旦組み合わされると、この反応物はサーマルサイクラーに入れられる。この器具は、時間の量を変化させながら一連の異なる温度にその反応物を供する。この一連の温度および時間の調整を、1サイクルの増幅と呼ぶ。各サイクルは、理論的には反応中の目標配列(単位複製配列)の量を倍にする。10サイクルは、理論的には単位複製配列を約1000倍にし、20サイクルであれば、数時間で100万倍を超えることになる。ある用途では、数秒から数分の範囲の期間に広い範囲(例えば数cm2程度)から蛍光撮像データを得ることが望ましい。
【0090】
本発明のある実施形態では、本発明の実施形態により提供される方法およびシステムは、所定の期間行われるイメージキャプチャプロセスを容易にする。単なる例として、本発明の実施形態では、微小流体素子の撮像方法が提供される。この方法は、1分未満のタイムフレームの間に、イメージ検出空間領域を用いて微小流体素子の少なくとも定まった数のチャンバに関連付けられた空間領域のイメージのキャプチャする工程を含み、ここで空間領域のイメージのキャプチャには、実質的にスティッチングプロセスおよび/またはスキャニングプロセスがない。
【0091】
本発明の実施形態は、イメージキャプチャ用の各種のタイムフレームを1ミリ秒から1分の範囲で提供する。ある実施形態では、イメージキャプチャ用のタイムフレームは、1分を超える。微小流体素子のチャンバで行われるプロセスに関係した発光特性によって、イメージキャプチャのタイムフレームは変化する。例えば、ある実施形態では、タイムフレームは、10ms、50ms、100ms、250ms、500ms、750ms、または1秒である。別の実施形態では、タイムフレームは2秒、5秒、10秒、15秒、20秒、30秒、40秒、50秒、または1分である。もちろん、タイムフレームは特定の用途に依存する。
【0092】
ある実施形態では、イメージキャプチャプロセスは同期して行われ、定まった数のチャンバのイメージを同時にキャプチャする。例えば、例示的PCRプロセスでは、微小流体素子が92℃の温度で15秒間維持される。結果として、微小流体素子は60℃の温度で60秒間維持される。加熱および冷却サイクルは1分間のサイクル期間で多数のサイクル繰り返される。本発明の実施形態を用いることにより、微小流体素子において存在する所定の数のチャンバのイメージは、位置に応じてチャンバが均一な温度に維持されたまま、同期して獲得される。例えば、微小流体素子が60℃の温度に維持されつつ30秒の露出を用いることで、微小流体素子全体の2次元イメージを得ることができる。当業者であれば、ラスタースキャニングまたはスティッチングシステムより優れた本発明の利点が提供されることは言うまでもないであろう。ここで、微小流体素子の第1の部分(例えば、左上の象限)内のチャンバのイメージは、微小流体素子の第2の部分(例えば、右下の象限)内のチャンバのイメージに先立って得られる。
【0093】
他の実施形態では、1分未満のタイムフレームの間に定まった数のチャンバから複数のイメージが得られる。これらの実施形態の例として、特定の実施形態において、複数の蛍光プローブに関連付けられた複数のイメージを得ることができる。微小流体素子が60℃の温度に維持される60秒の間、20秒の露出を用いて、3つの異なる蛍光プローブ、例えばRoxTM、Vic(登録商標)、およびFamTMについて、3つの連続したイメージを得ることができる。もちろん、用途に応じて露出時間は短くてもよく、1秒以下であってもよい。これらの複数のイメージを用いて、差動蛍光比を計算し解析することができる。もちろん、蛍光発光の強度によって、各種の蛍光プローブ用の露出時間を特定の用途に適するように変更してもよい。このようにして、本発明の実施形態は、微小流体素子を一定温度で維持しつつ、複数のスペクトルバンドにおける微小流体素子の撮像を行う。この一定温度は、先の例で示したように、周期的な温度処理を含むPCRプロセスの1部であってもよい。
【0094】
本発明の実施形態が提供する方法およびシステムは、また、化学発光プロセスを行い解析するよう適合されている。これらのプロセスの中には、反応が第1の時間スケールでおこり、化学発光プロセスのイメージが第2の時間スケールで得られるものがある。特定のプロセスにおいては、第2の時間スケールは第1の時間スケールよりも短い。したがって、本発明の実施形態は、目的の反応チャンバ中のサンプルが同じ時間だけ反応されている場合に、化学発光プロセスの同期イメージをキャプチャするよう適合されている。これらのプロセスの中には、サンプル温度循環を含む温度制御が提供されるが、他の実施形態では、反応チャンバは一定温度に維持される。
【0095】
図1Aに示されるように、温度制御部ともいわれる熱制御部240は、本発明の実施形態に従って提供される。微小流体素子選択された領域内または素子全体の温度の制御するために、多数の異なる変更の工夫のための選択肢が利用可能である。したがって、本明細書中では、温度制御部という語は、広く、微小流体素子全体または微小流体素子の部分の内部(例えば、特定の温度領域内または1つ以上の微小流体素子のチャネルのマトリクスの接合点)の温度を調整することができる素子または要素をさすものである。
【0096】
図1Cは、本発明の実施形態にかかる熱制御素子を示す単純化した模式図である。図1Cに示すように、微小流体素子205はサンプルアレー206を含む。当業者には明らかなように、サンプルアレー206は1次元で図示されているが、本発明の実施形態に従って3次元のサンプルアレーが提供される。例として、本発明の実施形態で用いられる微小流体素子では、反応チャンバのアレーおよび流体的に連通したチャネルが、図の平面に伸張するものがある。反応チャンバを含む微小流体素子の要素は、3次元の深さにより特徴づけられる。微小流体素子205は、キャリア207により支持され、次にキャリア支持体208によって支持される。微小流体素子またはチップ下層209は、ある実施形態では対応しており、キャリア207およびインテグレーテッドヒートスプレッダ(Integrated Heat Spreader:IHS)241に連結されている。熱プラテン243を図1Cに示し、以下でより十分に説明する。ある実施形態では、微小流体素子とIHS/プラテンとの間のハードコンタクトが提供される。さらに、以下でより詳細に説明するように、ある実施形態では、真空技術を用いて微小流体素子をキャリアに対して配置および保持する。
【0097】
一般に、素子は熱循環プレートに配置されて素子を熱循環する。このような各種のプレートは、商業的供給源から容易に調達でき、例えばThermo Hybaid Px2(マサチューセッツ州フランクリン)、MJ Research PTC−200(カリフォルニア州サウスサンフランシスコ)、Eppendorf Part# E5331(ニューヨーク州ウェストベリー)、Techne Part# 205330(ニュージャージー州プリンストン)などが挙げられる。
【0098】
ある実施形態では、微小流体素子は熱制御素子が熱制御源と熱的に連通するように熱制御素子と接触し、反応チャンバの少なくとも1つにおける反応温度が、熱制御源の温度変化の結果として変化される。異なる実施形態において、熱転移素子は、シリコンなどの半導体を含み得、反射性材料を含み得、および/または金属を含み得る。
【0099】
熱制御素子は、熱制御源に向かって熱転移素子を付勢するために熱転移素子に力を加えるよう適合されてもよい。この力は、異なる実施形態においては、機械的な圧力でも、磁力でも、静電気力でも、真空力でもよい。例えば、一実施形態においては、この力は、熱転移素子に向かって、熱制御素子または熱転移素子の表面に形成されたチャネルを介して加えられる真空力を含む。熱制御素子の表面と熱転移素子の表面(または表面の1部分)の間で得られる真空のレベルが検出されてもよい。このような検出は、真空源の位置から離れた、単一のチャネルまたは複数のチャネルに沿って位置する真空レベル検出器により行われる。真空が前もって設定したレベルを超えない場合は、警報が発せられてもよく、また再調整プロトコルを用いてもよい。
【0100】
アレー素子は、1つ以上の機械的または電気機械的な位置決め装置の採用により熱制御素子と接触させられてもよい。この方法の実行は、自動的に制御されモニタされる。例えば、このような自動制御およびモニタリングは、アレー素子を熱制御素子に導入したり、アレー素子を熱制御素子から取り除いたりするロボット制御システムとの操作可能な連通状態において自動制御システムで行われてもよい。反応の進行もまた、モニタすることができる。
【0101】
熱制御素子を備えるユニットが提供され得る。システムはアレー素子および熱制御素子を備えて提供され得る。熱循環ステップの精度を保証するために、ある素子では、素子のさまざまな領域で温度を検出するセンサを組み込むことが有用である。温度検出用の一構造として、熱電対がある。このような熱電対は、基礎となる基板材料上にパターンを描く薄膜ワイヤとして形成することができ、または微細加工エラストマー材料そのものに直接組み込まれたワイヤとして形成されてもよい。
【0102】
温度は、電気抵抗の変化により検出されてもよい。例えば、基礎となる半導体基板上に従来の技術を用いて製造されたサーミスタの抵抗の変化を、任意の温度変化に対して較正することができる。また、サーミスタは、微細加工エラストマー材料に直接挿入してもよい。抵抗によるさらに別の温度検出アプローチは、Wuら、「MEMS Flow Sensors for Nano−fluidic Applications」Sensors and Actuators A 89 152−158 (2001)に記載されており、これは、全体として参照によりここに組み込まれる。この論文では、温度の制御と検出の双方のために、ドープされたポリシリコン構造を使用することを記載している。ポリシリコンおよびその他の半導体材料については、抵抗の温度係数は、ドーパントの同一性および量により正確に制御することが可能であり、これにより任意の用途のセンサの性能を最適化することができる。
【0103】
サーモクロマチック材料は、増幅素子の領域の温度検出に利用可能な別の種類の構造である。具体的には、特定の材料は、異なる温度にさらされる際に顕著にかつ再生可能に色を変化させる。このような材料は、異なる温度にさらされる際に溶液に加えることができる。サーモクロマチック材料は基礎となる基板に形成可能であり、またエラストマー材料内に組み込むこともできる。また、サーモクロマチック材料は粒子の形状でサンプル溶液に加えることができる。
【0104】
温度検出の別のアプローチは、赤外線カメラの利用によるものである。顕微鏡とともに赤外線カメラを使用することにより、増幅構造全体の温度プロファイルを判定することができる。適切な波長(例えば、熱、赤外線、その他)の放射に対するエラストマー材料の透過性により、この解析が容易になる。
【0105】
温度検出のさらに別のアプローチは、焦電センサの使用による。具体的には、結晶材料、とりわけ圧電作用も示す材料には、焦電効果を示すものがある。この効果は材料の結晶格子の偏光、これによる材料上にわたる電圧が高度に温度依存性になる現象を説明する。このような材料は基板またはエラストマーに組み込むことができ、温度の検出に用いることができる。本発明の実施形態に従って、キャパシタンスやインダクタンスなど、その他の電気現象を温度の検出に用いることができる。当業者であれば、多くの変形例、修正例、および代替例がわかるであろう。
【0106】
一実施形態において、撮像システム200は以下のように動作する。まず、微小流体素子205はキャリア207上にしっかりと固定される。微小流体素子205が固定される機構、例えば微小流体素子のベース支持体の端部に基づき、コンピュータ270は、その後キャリア207を動かして微小流体素子と第1のxy位置にそろうようにxy駆動(不図示)する。ある実施形態では、1つ以上の基点のマーキングが、整列の間および位置決めプロセスの間に利用される。特定の実施形態において、システムのユーザはその後、撮像システムに1つ以上の基点マーカの正確な座標を登録する。別の実施形態では、左右対称のXY基準オブジェクトを配置し任意の非対称のコンポーネント取り除くことにより基準の重心を正確に計算することができるので、このプロセスは自動的に行われる。ある実施形態では、位置合わせプロセスの間に端部や角部などの基準特徴が用いられる。当業者であれば、多くの変形例、修正例、および代替例がわかるであろう。
【0107】
コンピュータ270の制御下で、キャリア207が光学要素210および212の焦点面に位置するようキャリア207を調整するか、または光学要素210および212の焦点面がキャリア207に位置するように光学要素210および212を調整することが実施される。好適な実施形態では、視野は、微小流体素子に存在する多数の反応チャンバを含む微小流体素子全体を包含することができる。
【0108】
微小流体素子の反応チャンバ内で起こる化学的プロセスにより発せられる蛍光、化学発光、または光学信号は、第1レンズシステム210により収集される。本発明のある実施形態では、第1レンズシステムは、1つ以上のレンズと1つ以上の開口を含むマルチ要素光学連結部である。図2Aに示すように、第1レンズシステム210は、1つのレンズ要素とダブレットその他を備える。焦点距離、f/#、そのほかを含む第1レンズシステム210の光学特性が、所望の光学性能を備えるために選択される。当業者であれば、多くの変形例、修正例、および代替例がわかるであろう。光軸から所定の距離を越えて伝播する光線を遮蔽するための発光シャッター215を図1Aに示すが、これは本発明に必須ではない。
【0109】
再び図1Aを参照して、光フィルタ素子213が光学アセンブリの一部として備えられる。ある実施形態では、光フィルタ素子は、蛍光または化学発光により標識が付された試薬により生じる蛍光または化学発光を通過させ光学的に処理するように構成された、多数の光学要素を備えるフィルタホイール213である。例として、ある実施形態では、発光フィルタホイールの第1部分は、第1の蛍光色素により生じる蛍光発光を通過させるように構成されている。例えば、第1の蛍光色素の例としては、例えば、Piscataway,NJ.のGE Healthcareの一部であるAmersham Biosciencesより市販されているCyTM3Fluorがある。発光フィルタホイールの第2部分は、第2の蛍光色素により生じる蛍光発光を通過するように適合される。第2の蛍光色素としては、例えば、同じくAmersham Biosciencesより市販されているCyTM5Fluorがある。もちろん、これらの蛍光色素の使用は本発明に必須ではない。代替的な実施形態においては、カリフォルニア州カールズバッドのInvitrogen Corporationより市販されているAlexa Fluorsが用いられる。例として別の実施形態においては、発光フィルタホイールの第1部分は、例えばInvitrogen Corporationより市販されているAlexa Fluor350などの第3の蛍光色素による蛍光発光を通過させるよう構成される。発光フィルタホイールの第2部分は、例えば同じくInvitrogen Corporationより市販されているAlexa Fluor488などの第4の蛍光色素による蛍光発光を通過させるよう構成される。以下に、発光フィルタホイールに関する詳細をさらに示す。
【0110】
ある実施形態では、光フィルタ素子213および発光シャッター215は、第1レンズシステムおよび第2レンズシステムの間に位置する。これらの実施形態には、光フィルタ素子を通過する光線が光軸に対して小さな角度で伝播するものもある。当業者には明らかなように、入射光線角の小さい領域に配される分光フィルタ(例えば、干渉フィルタ)は、その構成がより簡単であり、総スペクトルバンド幅が狭くなる可能性があるが、このような狭いスペクトルバンド幅による特徴および/またはフィルタ位置は本発明に必須である。図1Aに示すように、光フィルタ素子および発光シャッターの双方は、コンピュータ270に連結され、これらの要素のコンピュータ制御を行う。さらに当業者には明らかなように、複数の、おそらくは複数の同一のフィルタを光路中に配置して励起波長の遮断性を向上させることができる。ある実施形態では、これらのフィルタはフィルタで反射された光線がその光路からはずれるように光軸に対して角度を成している。
【0111】
別の実施形態では、二本鎖DNAへの結合に際して飛躍的な蛍光増進を有するおよび/または二本鎖DNAに対する強い化学的親和性を示すインターカレーション色素を、二本鎖増幅DNAの検出に用いてもよい。適切な色素の例としては、SYBRTMおよびピコグリーン(オレゴン州ユージーンのMolecular Probes,Inc.社)、エチジウムブロマイド、ヨウ化プロピジウム、クロモマイシン、アクリジン・オレンジ、ヘキスト33258、Toto−1、Yoyo−1、およびDAPI(4’,6−ジアミジノ−2−フェニルインドール塩酸塩)が挙げられるがこれらに限定されない。インターカレーション色素の使用に関しては、さらに、Zhu他、1994、Anal.Chem.66:1941−1948(1994)により検討されており、これは全体として参照により組み込まれる。
【0112】
第2のレンズシステム212もまた図1Aに示される。光フィルタ素子213および発光シャッター215を通過する蛍光発光放射または化学発光放射は第2レンズシステムにより検出器260上に収束される。ある実施形態では、この検出器はCCDカメラアレーであるが、これは本発明に必須ではない。特定の実施形態において、ほぼ微小流体素子のサイズであるアレー検出器が用いられる。好ましくは、検出器アレー260の画素サイズは、微小流体素子内の反応チャンバの面積よりも小さい面積となるように選択され、これにより、反応チャンバごとに複数の検出器画素が備えられる。特定の実施形態において、検出器260はおおよそ15μm×15μm画素のCCDアレーである。
【0113】
微小流体素子により、ここに記載の多数の異なる検出戦略を用いることができる。適切なシステムの選択は、イベントの種類および/または検出されている因子について、ある程度情報提供される。検出器は、多数の異なる信号種を検出するよう構成されてもよく、異なる信号種には、放射性同位体、蛍光プローブ、発色団、高電子密度粒子、磁性粒子、スピン標識、化学発光を発する分子、電気化学的活性分子、酵素、補因子、核酸プローブにリンクされた酵素、および酵素基質からの信号が挙げられるが、これに限らない。
【0114】
本発明の微小流体素子との使用に適切な検出方法の実例には、光散乱、マルチチャネル蛍光検出、紫外線および可視波長吸収、発光、差動反射、および共焦点レーザ走査などが挙げられるが、これに限らない。特定の用途に用いることのできるこのほかの検出方法に、シンチレーション近接アッセイ技術、放射化学的検出、蛍光偏光異方性、蛍光寿命、蛍光相関分光法(FCS)、時間分解エネルギー移動(TRET)、蛍光共鳴エネルギー移動(FRET)、および生体発光共鳴エネルギー移動(BRET)などの変形例が挙げられる。その他の検出オプションには、電気抵抗、固有抵抗、インピーダンス、および電圧検出などが挙げられる。
【0115】
ある実施形態では、検出は「検出部」または「検出領域」で起こる。これらの用語およびその他の関連用語は、微小流体素子内の検出が起こる部分を指している。ある微小流体素子では、検出部は、普通、微小流体素子内に存在する反応チャンバである。その他の素子用の検出部は、交差部に隣接するフローチャネル内にあってもよく、交差部自体、または交差部を取り囲む領域、および周囲の領域であってもよい。
【0116】
検出部は、1つ以上の顕微鏡、ダイオード、光刺激素子(例えばレーザ)、光電子増倍管、プロセッサ、およびこれらの組み合わせと連絡し得る。これらは、特定のイベントおよび/または因子に関連付けられた信号を検出するために協働する。検出されている信号は、1つ以上の光学検出器により検出部内で検出される光学信号であることが多い。光学検出器は、例えば、1つ以上の光電子増倍管、顕微鏡、および/またはビデオカメラ(例えば、CCDカメラ)に続く、1つ以上のフォトダイオード(例えばアバランシェフォトダイオード)、光ファイバー光導体を備えてもよい。
【0117】
検出器は、微小流体素子内での微細加工が可能であり、または独立した要素であってもよい。検出器が別個の要素として存在し、微小流体素子が複数の検出部を備える場合、検出は任意の瞬間に単回の検出部で起きてもよい。具体的な実例として、微小流体素子は移動可能なステージに取り付けられ、顕微鏡対物の下でスキャンされてもよい。このようにして得られた信号は、その後、信号解釈と処理のためにプロセッサに送られる。光電子増倍管のアレーを用いてもよい。加えて、各部分からの信号を判定しつつ、全ての異なる検出部から同時に信号を収集することのできる光システムを用いてもよい。
【0118】
外部検出器は、提供される素子が、全てまたはおおむね、モニタされている波長において光学的に透明である材料から製造されるため、有用である。この特徴により、ここに記載の素子が多数の光検出システムを用いることを可能にするが、これは従来のシリコンベースの微小流体素子では実現できなかった。
【0119】
特定の本発明の実施形態では、各反応チャンバから収集した光の量を最大限にするために、CCDカメラとして検出器を、そして広い視野および大きな開口数を与える光路を用い、これにより検出感度を高める。この実施形態では、CCDは、アレーのイメージ生成ではなく、各画素または一群の画素が反応チャンバに対応する光センサのアレーとして用いられる。したがって、光学は、光システムの使用可能な被写界深度を高めてより多くの光を各反応チャンバから集めるために、検出器で画質を下げるまたは不鮮明になるよう構成または変更されてもよい。とりわけ、本発明のある実施形態が意図するアッセイは蛍光色素を用いる生物学的アッセイを含み、この色素が励起光に対する露出により光退色して所定のサンプルから取得可能な信号光子の総数を制限することになるため、その制限された信号光子の効果的な収集は、考察されるような器具において重要であり得る。面積効率の考慮は、任意の光システムの対物およびイメージNA(開口数)ならびに総システム倍率に関する。(例えば、高入射角光線のCCD表面における反射損により)イメージ側NAが制限されるため、一般に、任意のシステム倍率と同時に任意に高い対物(サンプル)側NAを得ることはできない。実際、より大きなシステム倍率により、同時にイメージ側NAを大きくすること(および上記の理由による有害な可能性)の必要なしに、高い対物側NAを得ることができる。結果として、記載のシステムにおいて、1:1光システム(すなわち、システム倍率1)を可能とする大きなCCD(例えば、30.7mm×30.7mm)焦点面アレーが用いられてきた。これにより、CCDに対するイメージ側NA0.36と同時に収集NA0.36が可能となり、このことは表面反射損に対して適度な性能を実現する。
【0120】
ある実施形態では、対物側NAが大きくなると対物側焦点深度が低減することになり、そのため、サンプル内の反応チャンバの任意の深さにおいて、(焦点深度による不鮮明さが、レンズ逸脱などの問題による不鮮明さ以上と仮定すると)検出器での不鮮明さが大きくなり、チャンバ間の信号のクロストークを低くした場合に、サンプルの反応チャンバ間の許容可能な最小間隔を制限することになる。1:1光システムと合わせて、この対物側NAの考慮は、最大約0.5NAに維持するのによく、これは、その表面における反射損を回避しようとする場合には、CCD(またはシリコン検出器)に通常望ましいNAとされる。さらに、1:1撮像レンズシステムは、本質的に奇数次逸脱がほとんどなく、この特定の倍率(M=1)の利点を高める。撮像対象の微小流体システムと同じくらいかそれ以上の大きさの検出器による1:1光システムの使用は、このように、詳細なシステム用の構成として本発明のある実施形態により提供される。
【0121】
その他の実施形態では、検出器(例えば、CCD焦点面アレー)のサイズに関連して費用制約条件があることがある。例えば、現在の高量子効率フルフレームCCDアレーでは、27.6mm×27.6mmの寸法を有するものがある。この検出器は、30.7mm×30.7mmの寸法の微小流体素子よりもわずかに小さく、記載のシステム用の構成としてはシステム倍率が0.88となる。システム倍率M=1に近いため、このような倍率での上記の検出器(イメージ側)入射NAに関する制約条件は満たされる。
【0122】
他の実施形態において、所定のXY面(光軸に対して垂直方向)の間隔および反応チャンバのサイズは特定されてもよい(例えば、XY面におけるサンプル−チャンバの所望の密度を得るため)が、チャンバの最小総容積の制約条件は、依然として残る(例えば、化学的容積に必要な最小容積を実現するために、例えば試薬の数または目標分子の数が少ないことにより過度の統計的な変動を回避すること、また、単に要求される最小の数の蛍光、光学発光分子または対象物を得ること)。このような場合、各チャンバの総容積が最小数値以上となるように、Z(任意)軸に平行なチャンバを拡張することが必要となることがある。Zに沿ってよりいっそう拡張すること(高いアスペクト比、またはZ軸に沿って検査対象のサンプルに集中する円柱状のチャンバを作り出すこと)により、一般に、焦点深度による不鮮明さがレンズ逸脱他の問題による不鮮明さ以上とすると、焦点深度の考慮による、任意の対物側NAの検出器におけるチャンバイメージの不鮮明さはより大きくなる。ある状況では、これによって対物側NAの低いユーザにつながる。NAの低いレンズシステムを用いることにより、焦点深度が大きくなり、したがって、一般に隣接または近傍のチャンバ間の光学信号における過度のクロストークを起こすことなく光軸に対して平行に伸びるチャンバからの光の収集を可能とする。このようにして、Z(光軸に平行)におけるチャンバの拡張により総チャンバ容量を大きくしつつ、過度のクロストークなしにXY面(光軸に垂直な面)にあるチャンバの密度を大きくすることができる。この場合、または低い対物側NAが利用可能である他の場合(例えば、反応チャンバのXY間隔が大きいことにより、過度のクロストークが生じることなく検出器におけるチャンバイメージの不鮮明さを高くすることができる場合、または高いNAが必須でない非光制限用途の場合、光退色が問題にならないほど十分なサンプルがある場合、非光退色サンプルを用いる場合、低いシステム感度が許容範囲である状況、など)には、とりわけ、M≧NA0/0.5の場合、より望ましくはM≧NA0/0.36(ここでNA0=対物側NA)の場合、より一般的にはM≧NA0/NAdetであって、NAdetが検出器に対する過度の反射/挿入損なしに検出器面に対して許容範囲である最大NAである(通常のCCDについてNAdet=0.36〜0.5)場合には、より低いシステム倍率(M<1)が適切であってもよい。
【0123】
対物側焦点深度および/または不鮮明さ要求が対物側NA≦0.36もしくはNA≦0.5の必要がなく、またはより一般的にはNA0≦NAdetである必要がない場合、(上述のとおり)面積効率を考慮して、より大きな検出器が望ましい。なぜなら、より大きいM(一般に任意のサンプルサイズについてより大きな検出器を必要とする)は、所定のNA0についてより小さいNAi(イメージ側NA)が可能となるからである。このように、光収束要件(例えば、特定のアッセイ感度を達成するため)は、より大きなNA0(NA0>NAdetにより規定される)を要求し、そして被写界深度および他の構成上の考慮(例えば、費用)により大きなNA0が可能となり、検出器での損失が最小限となるようより大きなMが望ましい。このような実施形態では、検出器素子、例えば、撮像対象の微小流体素子の面積と同じくらいかそれ以上のサイズの1つ以上のCCD素子を用いることが有用であることがある。このような大きな検出器を使用することにより、光システムの倍率が高くなり、したがって(面積効率の考慮を介して)検出器に対する固定入射NAについてサンプルからの高いNA光収集が可能となる(後者は、例えば、高い入射光線入射角でのCCD面における反射損による)。
【0124】
とりわけ好適な検出器は、各反応チャンバから収集した光の量を最大限にするために、CCDカメラおよび広い視野および大きな開口数を与える光路を使用し、これにより検出感度を高める。この点について、CCDは、アレーのイメージ生成として使用されるのではなく、各画素または一群の画素が反応チャンバに対応する光センサのアレーとして用いられる。したがって、光学は、光システムの被写界深度を高めてより多くの光を各反応チャンバから集めるために、検出器で画質を下げるまたは焦点をぼかすよう変更される。ある実施形態では、高いアスペクト比または円柱状のチャンバを採用して、光システムの光軸に沿って検出器により、および好ましくは被写界深度を深めるためにイメージの焦点をぼかすことにより、検査対象のサンプルに集中することが有用である。NAの低いレンズシステム、好ましくは相互に左右対称のレンズシステムが用いられる。検出器素子、例えば、撮像対象の微小流体素子の面積と同じくらいかそれ以上のサイズの1つ以上のCCD素子を用いることもまた有用である。NAの低い光学とともに用いることにより、検出感度の向上が実現できる。
【0125】
検出器システムは、検出可能な信号を生成するレポーターを刺激する光源を備えてもよい。用いられる光源の種類は、ある程度、活性化したレポーターの性質による。適切な光源としては、レーザ、レーザダイオード、白色光源、および高輝度ランプなどがあるが、これに限らない。レーザを用いる場合、レーザは一群の検出部または単一の検出部上の走査に用いられてもよい。レーザダイオードは、微小流体素子自体に微細加工することができる。また、レーザダイオードは、熱循環反応を行うために用いられる微小流体素子に隣接して配された別の素子に形成して、ダイオードからのレーザ光が検出部に導かれるようにすることもできる。
【0126】
検出は、複数の非光学的アプローチも備え得る。例えば、検出器は、例えば、温度センサ、伝導度センサ、電位差センサ(例えば、pH電極)および/または電流測定センサ(例えば、酸化反応および還元反応のモニタのため)などを備え得る。
【0127】
二本鎖DNAへの結合に際して飛躍的な蛍光増進を有し、そして/または二本鎖DNAに対する強い化学的親和性を示すインターカレーション色素を、二本鎖増幅DNAの検出に用いてもよい。適切な色素の例としては、SYBRTMおよびピコグリーン(オレゴン州ユージーンのMolecular Probes,Inc.社)、エチジウムブロマイド、ヨウ化プロピジウム、クロモマイシン、アクリジン・オレンジ、ヘキスト33258、Toto−1、Yoyo−1、およびDAPI(4’,6−ジアミジノ−2−フェニルインドール塩酸塩)が挙げられるがこれらに限定されない。インターカレーション色素の使用に関しては、さらに、Zhu他、Anal.Chem.66:1941−1948(1994)により検討されており、これは全体として参照により組み込まれる。
【0128】
図1Aに示すように、本発明の実施形態のあるものは、微小流体素子からの蛍光、化学発光、生物発光、およびその他の信号を生成検出するよう構成された1:1撮像システムを提供する。1:1撮像システムは、撮像対象のサンプルと同じ大きさのイメージ検出素子を用いるいくつかの実施形態で提供される。数cm2程度の広い視野の1:1撮像を提供することにより、本発明の実施形態は、開口数(NA)の大きい光システムを提供する。光収集効率がほぼNA2に比例することから、本発明のいくつかの実施形態によるNAの増加は、1〜10ナノリットル程度の反応容積および1.0ナノモル濃度程度の活性蛍光プローブ濃度を有する反応チャンバからの適切な蛍光信号の収集を可能とする。その他の実施形態では、ピコモル濃度範囲の活性蛍光プローブ濃度が適切な蛍光信号を提供する。
【0129】
加えて、本発明の実施形態は、例えば、イメージをわずかに縮小して、対象とほぼ同じ大きさからその約半分のサイズまでの範囲のイメージを形成する撮像システムを提供する。例えば、一実施形態において、微小流体素子の空間領域(この空間領域は、96を超える数のチャンバに関連付けられている)のイメージが送信されキャプチャされる。空間領域のイメージのキャプチャにはイメージ検出器素子が用いられ、微小流体素子の空間領域とほぼ等しいかわずかに小さいイメージ検出空間領域を用いる。単なる例として、微小流体素子の空間領域の面積 対 空間領域のイメージの面積の比は、1:1、1:0.99、1:0.95、1:0.9、1:0.88、1:0.85、1:0.8、1:0.7、1:0.6、および1:0.5であり得る。ある実施形態では、この比は1:0.5未満である。これら特定の比率は単なる例示であって、撮像システム用に選択される比は特定の用途に依存することになる。
【0130】
ある実施形態では、光撮像システムは、約3cm×3cmの視野を有する。他の実施形態では、光撮像システムは、約1cm×1cm〜約5cm×5cmの範囲の視野を有する。特定の実施形態においては、2cm×2cm、2.5cm×2.5cm、2.76cm×2.76cm、3.07cm×3.07cm、3.5cm×3.5cm、および4cm×4cmの対物視野が提供される。一般に、光撮像システムの視野は、微小流体素子の空間領域、例えば、関連する多数の反応チャンバを含む面積に対応するよう選択される。
【0131】
さらに、本発明の実施形態は、さまざまな開口数を有する光撮像システムを提供する。例として、各種の実施形態にしたがって0.1〜0.5の範囲のNAが提供される。特定の実施形態においては、0.15、0.18、0.2、0.23、0.25、0.3、0.36、および0.4のNAが提供される。
【0132】
光撮像システムの空間解像は、一般に、イメージ検出器素子中の画素のサイズに応じる。本発明のある実施形態では、検出器に存在する画素の倍率(ある実施形態では1に等しい)およびサイズは、反応チャンバに関連付けられた画素の数を決定する。一般に、反応チャンバそれぞれに関連付けられた複数の検出器画素を有することが好ましい。例えば、反応チャンバの一辺が45μmであれば、一辺の寸法が15μmに等しい9つまでの正方形の画素は1:1撮像システム内の反応チャンバと重なる。したがって、本発明の実施形態によれば、各反応チャンバに関連付けられた多数の画素数は1から100の範囲である。本発明の実施形態によれば、例えば、4画素領域、9画素領域、16画素領域、25画素領域、36画素領域、49画素領域、64画素領域、および81画素領域が反応チャンバに関連付けられている。
【0133】
本発明の実施形態では、1μm2〜900μm2の画素サイズの範囲が用いられる。例えば、一辺が1μm、2μm、3μm、4μm、5μm、10μm、13.5μm、15μm、20μm、25μm、および30μmの正方形の画素が、本発明の各種の実施形態で用いられる。当業者には明らかなように、画素サイズ、検出器、アレー配置、およびアレーあたりの画素数が関係する。代替の実施形態において、1μm2〜900μm2の範囲の画素面積を有する長方形の画素が用いられる。
【0134】
さらに、イメージ検出素子とも呼ばれ、さまざまな画素数を含む検出器アレーが、本発明の各種の実施形態により用いられる。アレー寸法は、512×512画素領域から3,000×3,000画素領域の範囲をとる。ある実施形態では、検出器アレーの利用可能性に応じて、より多数の画素を1つのアレーに提供することができる。特定の実施形態では、1,024×1,024画素領域および2,048×2,048画素領域の寸法のアレーが用いられる。
【0135】
本発明の実施形態は、いくつかのシステムパラメータによって特徴付けられる光撮像システムを提供する。例を挙げると、35mmを超える作業距離、例えば45.92mmが本発明の実施形態により利用可能である。別の実施形態では、平均13.44μm最大17.85μmの平方次乗平均(RMS)スポットが提供される。さらに、本発明の実施形態により、およそ±5%の照射変動が実現される。ある実施形態では、最大フィルタAOIが12.56度、フィルタでの最大ビームが76mm、歪みが<0.10%、最大レンズ径が5.512インチの光撮像システムの全体的な長さが、542.1mmである。
【0136】
図1Bは、本発明の実施形態にかかる撮像システムの単純化した図である。ある実施形態では、図1Bに図示する撮像システムは、タンパク質結晶化処理を行うよう構成された素子を含む微小流体素子を撮像するために用いられる。図1Bに図示する撮像システムおよび関連する微小流体素子に関するさらなる詳細は、同時継続中の同一出願人により2004年7月28日に出願された米国特許出願第10/902,494号、および2004年5月20日に出願された米国特許出願第10/851,777号に記載されており、この開示は、本明細書において参照により組み込まれる。とりわけ、本発明の実施形態に従って提供される微小流体素子、およびその図1Bに示す撮像システムとあわせての利用に関するさらなる詳細が、これらに記載される。これらの図は単なる例であり、本発明の請求の範囲を過度に限定するものではない。当業者であれば、多くの変形例、代替例、および修正例がわかるであろう。
【0137】
一実施形態において、撮像システム(10)は以下のように動作する。まず、微小流体素子(30)はステージ(20)上に固定される。この微小流体素子(30)の固定された特徴(例えば、微小流体素子(30)の基材の端)に基づいて、その後、コンピュータ(110)は、微小流体素子(30)が複数の基準マーキングのうちの第1のマーカと第1のx,y位置で位置を合わせるように、x,yドライブ(25)にステージ(20)を移動させる。ここで、基準マーキングは、チャンバの中央点より既知の距離zだけ離れた微小流体素子に埋め込まれており、固定された特徴からの推測に基づいて、撮像素子(60)により焦点が合うようになる。システムのユーザはその後、撮像システムの基準の正確な座標を登録する。2つ以上の追加の基準マーカは、その後、同様にユーザによりマップされる。その他の実施形態では、このプロセスは、左右対称のXY基準オブジェクトを配して非左右対称のコンポーネントを取り除くことにより基準の重心が正確に計算されるため、自動的に行われる。コンピュータ(110)の制御下にある撮像素子(60)は、その後、基準マーキングに焦点をあわせるために焦点面(100)のz寸法位置を調整する。例えば、一旦基準マーキングに焦点があわされると、撮像システムは、その後、撮像素子(60)の視野内の追加基準マーキングを探して、微小流体素子(30)の第1のx,y座標イメージを得る。好適な実施形態では、視野は計測セル全体を含むことができる。その後、コンピュータは、第1のx,y座標イメージを分析して微小流体素子に歪みや伸びがあるかどうかを判定する。歪みや伸びがあると判定された場合には、微小流体素子のイメージと座標マップが理想的な座標マップに位置を合わせるように第1のx,yイメージを変形する。理想的な座標マップは、後で、イメージ減算ステップとマスキングするステップにおいて用いられる。
【0138】
好適な実施形態において、理想的な座標マップに位置を合わせた微小流体素子x,y座標イメージを用いて、システムは、その後、微小流体素子内の、伸び、歪み、または各種の微小流体層間のコレジストレーションの欠如の有無を、x,y座標イメージ内の基準マーキングの位置を理想的格納イメージのx,y座標イメージ内の基準マーキング位置と比較することによって判定する。実際の基準位置と撮像された基準位置の間に差が存在する場合には、マトリクス変換、好ましくはアフィン変換が行われて、撮像された測定セルの形状を理想的な測定セル形状の仮想形状に変換する。測定された実際の基準位置および格納された理想的基準位置間の差から計算されたマトリクス変換を用いて実イメージを周知かつ固定の理想イメージに変換することにより、イメージ減算やその他のイメージ解析が可能にされる。
【0139】
マトリクス分析を介して座標マップの間の差異を計算することによって、マトリクス変換は、さらにここに記載のイメージプロセッシングで用いられるために実イメージを理想的イメージに改正するために開発されてもよい。撮像された微小流体素子を標準的な形状に合わせるために、測定セルのチャンバ視認可能な面積を最大化するためにイメージ減算およびマスキングが可能となる。さらに、連続する時間にもとづくイメージのゼロ時間においてチャンバに欠陥や破片が存在する場合には、このような欠陥や破片は、その後のイメージからはマスクされて、自動化解析を行う際の誤信号を回避する。欠陥や破片を含むチャンバの領域のマスキングに加えて、その後の解析において誤読み取りをおこさないようにチャンバの壁をその後のイメージから減算してもよい。制御層とチャネル層など、各種の層間の不一致も、制御ラインそのものなど、制御層内の発見された対象の位置に基づいて計算することができる。別の例では、この補正は制御層基準そのものに基づいて決定される。ある実施形態では、この特別な変換は、制御層がプロテインチャンバを残りの制御ラインから区切るので、重要である。
【0140】
図2A〜2Cは、本発明の実施形態にかかるレンズアセンブリを示す単純化した模式図である。図2A〜2Cに示すように、微小流体素子205は、各図に示されている。熱制御部およびその他のシステム要素は図2A〜2Cに図示されていないが、当業者であれば、2つの図面間の関係については言うまでもない。したがって、適切ものについては、各種の図面間の関係をさらに明らかにするために、図1Aから参照番号を引き継いでいる。
【0141】
第1レンズシステム210は、第1の開口211を含むものとして図2Aに示す。この図に示すように、第1の開口は個々のレンズ要素間に位置するが、これは本発明において必須ではない。他の光学構成においては、第1の開口の位置、サイズ、およびその他の特徴は、所定の光学構成の目標を実現するために選択される。第2レンズシステム212も、第2の開口213を含むものとして図2Aに示されている。第1レンズシステム210との関連で検討したように、光学要素は、所定の光学構成目標に従って構成される。
【0142】
図1Aおよび図2A〜2Cを参照して、光フィルタ素子について、更なる詳細を説明する。一般に、レンズシステム210および212は、光フィルタ素子213とともに、撮像パスの部分に備えられる。ある実施形態において、撮像通路は、1つ以上の蛍光発光信号が微小流体素子から検出器へ移動するために提供される発光通路である。以下にさらに十分に説明するように、光フィルタ素子は、1つ以上の蛍光発光信号から選択されたスペクトルバンド幅を通すように、そして1つ以上の蛍光発光信号に関連付けられた1つ以上の色収差を定まったレベルに処理するように構成される。ある実施形態においては、この1つ以上の色収差の処理は、そのような色収差の縮小を含む。
【0143】
特定の実施形態において、第1の分光フィルタ214およびゼロ出力光学要素216が、図2Aに示すように提供されている。図1を参照すると、光フィルタ素子213(ある実施形態では、発光フィルタホイール)が第1の動作位置にあるとき、フィルタ/ゼロ出力要素の組み合わせが微小流体素子と検出器の間の光路中に存在する。図2Aの光学要素は、光スペクトルのほぼ中心にある波長の伝達と焦点あわせに最適化されている。したがって、一実施形態において、カリフォルニア州フォスターシティのApplied Biosystem社より市販されている蛍光プローブVic(登録商標)に関連付けられた分光フィルタ214は、570nmの波長に中心をおいている。加えて、分光フィルタは、30nmのスペクトルバンド幅により特徴付けられる。以下にさらに十分に説明するように、ある実施形態では、色収差を補正するよう構成された、普通は570nmより長いか短い、その他の波長に中心をおくフィルタ/ゼロ出力要素も提供される。
【0144】
図1Aの分光フィルタ244に関連して検討したように、光フィルタ素子はホイール形状に限らない。例えば、フィルタ保持部にはめ込まれる分光フィルタ、逸脱補正要素、およびその組み合わせが、本発明の実施形態に含まれる。さらに、逸脱補正要素と組み合わせて、電気光学フィルタや、アクチュエータそのほかにより光路中に配されるフィルタも、本発明の実施形態に従って含まれる。
【0145】
図2Bに、第2の動作位置にある発光フィルタホイールを有する第1および第2レンズシステムを示す。図2Bの実施形態に図示するように、分光フィルタ224は、518nmの波長(Applied Biosystem社より市販されている蛍光プローブFamTMに関連付けられる)に中心がおかれており、25nmのスペクトルバンド幅により特徴付けられる。一般に、分光フィルタ224は、蛍光プローブ(フルオロフォア)に関連付けられた蛍光信号を送信するよう構成され、代表的に光スペクトルの短波長部分近くの波長と関係した「青色」波長を発する。
【0146】
ゼロ出力ダブレットとして作用する光学要素226は、図2Bに図示される。ある実施形態では、1つの複合光学要素としてフィルタ/ゼロ出力ダブレットが提供され、その他の実施形態では、フィルタおよびゼロ出力ダブレットはそれぞれ分離されている。さらに、ある実施形態では、発光フィルタホイールは、第1の動作位置から第2の動作位置へ移動してフィルタ/ゼロ出力光学要素の位置を修正するよう回転する。図2Bに示すゼロ出力ダブレット226は、光システムにより導入される色収差を「青色」波長で補正するよう構成されている。具体的な実施形態においては、ゼロ出力ダブレットは、例えば、FamTMなどの特定の蛍光プローブからの発光に関連付けられた波長の色収差を補正するよう選択される。
【0147】
ある実施形態では、ゼロ出力ダブレットは、屈折率の値が異なる別の光学材料から製造される。単なる例として、図2Bに示すように、平面状の凹レンズが平面状の凸レンズに連結されている。具体的な実施形態においては、ゼロ出力ダブレットは、光学要素が合わさって固定されたフラウンホーファー型アクロマートレンズである。その他の実施形態では、当業者には明らかなような代替的な構成が用いられる。ある実施形態では、本明細書にわたって説明される埋め込みダブレットが用いられ、青色および赤色のフィルタ帯域における軸色収差を縮小する。
【0148】
図2Cは、発光フィルタホイールが第3の動作位置における第1および第2レンズシステムを示す。図2Cに示す実施形態では、分光フィルタ228は、645nmの波長(Applied Biosciencesから市販されている蛍光プローブRoxTMに関連付けられている)に中心をおいており、75nmのスペクトルバンド幅に特徴付けられている。一般に、分光フィルタ228は、通常は光スペクトルの長波長部分の波長に関連付けられている「赤色」波長を発する蛍光プローブに関連付けられた蛍光信号を伝えるように構成されている。
【0149】
図2Bと同様、図2Cに、ゼロ出力ダブレットとして作用する光学要素230を示す。ある実施形態では、1つの複合光学要素としてフィルタ/ゼロ出力ダブレットが提供され、その他の実施形態では、フィルタおよびゼロ出力ダブレットはそれぞれ分離されている。さらに、ある実施形態では、発光フィルタホイールは、第1または第2の動作位置から第3の動作位置へ移動してフィルタ/ゼロ出力光学要素の位置を修正するよう回転する。図2Cに示すゼロ出力ダブレット230は、光システムにより導入される色収差を「赤色」波長で補正するよう構成されている。具体的な実施形態においては、ゼロ出力ダブレットは、例えば、RoxTMなどの特定の蛍光プローブからの発光と関係した波長における色収差について補正するように選択される。図2Bと2Cとを比較すると、図2Cのゼロ出力ダブレットは平面状の凹レンズに連結された平面状の凸レンズを含む。
【0150】
図2A、2B、および2Cに関して検討してきたように、それぞれのフィルタに関連付けられた補正光学要素216、226、および230は、それぞれのフィルタを通る波長の色収差の補正を助けるように構成されている。この構成は、異なる波長領域を通す各種のフィルタにわたってよりいっそう均一で一貫したスポットサイズ、不鮮明さ、およびレンズシステムのその他の光学特性を可能とする。これらの利益は、上述のように微小流体素子内の反応チャンバが密閉されて利用される場合を説明したような用途においては、有用である。加えて、異なる反応チャンバからの光学信号間クロストークを許容範囲内にするための構成目標は、一般的に、イメージ面で許容される最大スポットまたは不鮮明サイズの制限におかれる。逸脱補正光学は、極端な波長における不鮮明さおよびスポットサイズを縮小し(例えば、青色波長領域を通るフィルタ)、また、異なる波長領域における不鮮明さおよびスポットサイズを縮小する(例えば、赤色波長領域のパスバンドを有するフィルタ)。この利益は、全体的な測定がレシオメトリックである場合に、例えば赤色および青色波長領域両方において検出される個別の信号によっては有用であり、これにより、アッセイ全体の感度が向上する。上記の検討は具体的な実施形態に関するものであるが、当業者であれば、本発明の範囲に含まれる異なる波長パスバンドのフィルタと合わせて同様に光学連結部に配することのできる補正ゼロ出力光学の変形例が多くあることは言うまでもない。
【0151】
図3は、本発明の実施形態にかかる微小流体素子にある多数の反応チャンバでおこる反応による、第1の波長に中心をおく蛍光発光の写真である。図3に示すように、多数の反応チャンバでは第1の波長「波長1」での発光が生じる。図3に示す本発明の実施形態においては、反応チャンバの10×16アレーが撮像される。ある実施形態では、先に述べたように、第1の波長は蛍光プローブに関連付けられている。当業者には明らかなように、第1の波長での発光強度は、反応チャンバで起こる化学的プロセスに応じる。図に示すように、本発明の実施形態にかかる光撮像システムによって10×16反応チャンバの2次元アレーが撮像される。すでに検討したように、本発明のいくつかの実施形態において、反応チャンバは流体的に分離されている。さらに代替の実施形態に従って、反応チャンバは、ナノリットルスケールの体積および/または約数100チャンバ平方センチメートルのチャンバ密度により特徴づけられる。
【0152】
図4は、本発明の実施形態にかかる微小流体素子にある多数の反応チャンバでおこる反応によって生じる、第2の波長に中心をおく蛍光発光の写真である。図4に示すように、多数の反応チャンバでは第2の波長「波長2」での発光が生じる。図3と4とを比較すると、ある反応チャンバはほとんどまたはまったく光を発しないが、他の反応チャンバは第1の波長、第2の波長、または第1の波長と第2の波長を発する。もちろん、蛍光活性の収集および分析は、反応チャンバ内で生じる学的プロセスの性質に対する洞察を与える。
【0153】
図5〜7は、本発明の実施形態を用いて生成された選択された波長のスポット図である。これらの図の説明文を参照すると、図示された波長の範囲は、一般に、緑色波長、青色波長、赤色波長の3つの波長バンドに分類される。図5に示された525nm、550nm、および575nmの波長は、一般には、光スペクトルの緑色領域に関連付けられる。図6に示す486nm、501nm、および516nmの波長は、一般には、光スペクトルの青色領域に関連付けられる。図7に示す616nm、636nm、および656nmの波長は、一般には、光スペクトルの赤色領域に関連付けられる。図5は、図2Aに示すレンズシステム用に計算されたものであり、図6は図2Bに示すレンズシステム用に計算されたものであり、図7は図2C示すレンズシステム用に計算されたものである。
【0154】
図8は、本発明の実施形態を用いて生成される位置に応じた比較的均一な照射図である。図8において、比較照射は、図2Aに示す光システムについて、Yフィールドに応じてミリメートル単位でプロットされている。0.550μmの波長では、21.4mmの距離にわたる比較照射の均一性は90%を超える。
【0155】
図9〜11は、本発明にかかるいくつかの実施形態の正方形内に含まれるエネルギー(ensquared energy)の図である。ある光システムにおいて、光システム性能の測定は、正方形内に含まれるエネルギーパーセンテージであり、これは特定の中央領域の総エネルギーのパーセントである。図9を参照すると、取り囲まれたエネルギーの割合は、図2Aに示されるレンズシステムを使用して、種々の位置に対して、重心から半分の幅(ミクロン単位)に応じてプロットされる。例として、中心から14.8mmの位置では約50%のエネルギーが重心から同じ約7.5μmで取り囲まれ、中心から21.4mmの位置では約90%のエネルギーが重心から約7.5μmで取り囲まれる。図9〜11において、回折が含まれ、一般に、計算は速度の速いフーリエ変換(FFT)アルゴリズムで行われる。図10および11は、それぞれ、図2Bおよび2Cに示すレンズシステムの正方形内に含まれるエネルギーの図である。これらの図では、図9と同じく、回折が含まれる。
【0156】
図12は、本発明の実施形態にかかる光システムの像面湾曲および歪みの図である。像面湾曲は、0.525μm、0.550μm、および0.575μmの波長について、図中では標識が付いたものとして示されている。歪みは、図示された波長について変化し、各種の波長の誤差は図示するように0.05%の規模と無視できるものである。
【0157】
図13は、本発明の実施形態にかかるシステムにより生成された二重波長 対 焦点の模式図である。この図では、有色焦点の移動は、ミクロンでの波長に応じて図示される。図13でプロットされる波長領域は、480nmから650nmの波長領域をカバーする。図に示すように、最大焦点移動領域は214.3702μmであり回折制限領域は4.243μmである。図13を参照すると、色は、指示された領域にわたって214μmの長いスパンで焦点をあわせる。したがって、システム性能の解析は、一般に、±100μmで焦点をぼかすスポットサイズ考慮を含む。一般に、焦点がぼけたスポットのサイズは、フォーカスされたスポットのサイズを超える。本発明の実施形態によれば、軸色収差は上記の埋め込みダブレットを用いて補正される。代替的な実施形態においては、特殊なガラスタイプが用いられてアポクロマート性能を実現する(一般に、他のガラスタイプに比べてコストの上昇を伴う)。
【0158】
図14〜16は、本発明の実施形態を用いて生成された選択された波長のスポット図である。図14の説明文にあるように、光スペクトルの緑色領域の波長(525nm、550nm、および575nm)のスポット図は、最適な焦点位置にあるシステムにより与えられる。図14〜16に示すスポット図をつくるために、図2Aに示すレンズシステムが用いられた。図15および16は、それぞれ+100μmのデフォーカスと−100μmのデフォーカスで計算されたスポット図でありる。図15および図16において、緑色領域の光スペクトルの同じ波長が考慮される。
【0159】
図17〜19は、本発明の実施形態を用いて生成された選択された波長のスポット図である。図17の説明文にあるように、光スペクトルの青色領域の波長(486nm、501nm、および516nm)のスポット図は、最適な焦点位置にあるシステムにより与えられる。図17〜19に示すスポット図をつくるために、図2Bに示すレンズシステムが用いられた。図18および19は、それぞれ、+100μmのデフォーカスと−100μmのデフォーカスで計算されたスポット図である。図18および19では、光スペクトルの青色領域の同じ波長が考慮される。図19に示すように、フィールド4は、同図の100μmのボックスの外部に伸張する501nmの光線を含む。
【0160】
図20〜22は、本発明の実施形態を用いて生成された選択された波長のスポット図である。図20の説明文にあるように、光スペクトルの赤色領域の波長(616nm、636nm、および656nm)のスポット図は、最適な焦点位置にあるシステムにより与えられる。図20〜22に示すスポット図をつくるために、図2Cに示すレンズシステムが用いられた。図21および22は、それぞれ、+100μmのデフォーカスと−100μmのデフォーカスで計算されたスポット図である。図21および22では、光スペクトルの赤色領域の同じ波長が考慮される。
【0161】
本発明にかかる代替的な実施形態においては、図2A〜2Cに図示する光学要素への変更を含む別の1:1光学リレー撮像システムが提供される。一般光学連結部は残るが、フィルタ/ゼロ出力ダブレットの組み合わせを含む特定の要素の特徴は変更される。この代替的な実施形態においては、35mmを超える作動距離、例えば、46.12mmが与えられる。さらに、平均11.28μm最大値14.73μmのRMSスポット径が与えられ、光撮像システムの全体長は542.2mm、最大フィルタAOIが12.59度、フィルタでの最大ビームが76mmである。
【0162】
図23〜25は、本発明の代替の実施形態を用いて作製された、選択された波長のスポット図である。これらの図の説明文を参照すると、図示された波長の範囲は、それぞれ、緑色波長、青色波長、赤色波長の3つの波長バンドに概ね分類される。図23に示される525nm、550nmおよび575nmの波長は、一般には、光スペクトルの緑色領域に関連付けられる。図24に示される486nm、501nmおよび516nmの波長は、一般に光スペクトルの青色領域に関連付けられる。図25に示される621nm、636nmおよび651nmの波長は、一般には、光スペクトルの赤色領域に関連付けられる。図23は、図2Aに示すレンズシステムに基づいて計算されたものであり、図24は図2Bに示すレンズシステムに基づいて計算されたものであり、図25は図2C示すレンズシステムに基づいて計算されたものである。
【0163】
図26〜28は、本発明にかかるいくつかの実施形態の正方形内に含まれるエネルギーの図である。図26を参照すると、取り囲まれたエネルギーの割合は、図2Aに示すレンズシステムを用いた各種の位置に対する重心(ミクロン単位)からの半値幅に応じてプロットされる。例として、中心から14.8mmの位置では約80%のエネルギーが重心から約7.5μmで取り囲まれ、中心から21.4mmの位置では約90%のエネルギーが重心から同じ約7.5μmで取り囲まれる。図26〜28において、回折が含まれ、一般に、計算は速度の速いフーリエ変換(FFT)アルゴリズムで行われる。図27および28は、それぞれ、図2Bおよび2Cに示すレンズシステムの正方形内に含まれるエネルギーの図である。これらの図では、図26と同じく、回折が含まれる。
【0164】
本明細書の例および実施形態は例示の目的のみのために記載されたものであり、これに照らして各種の修正や変更が、当業者に示唆され、この用途の本質および範囲内ならびに添付の請求項の範囲の趣旨の範囲内に含まれるものであることは、言うまでもない。
【特許請求の範囲】
【請求項1】
明細書に記載の発明。
【請求項1】
明細書に記載の発明。
【図1A】


【図1B】


【図1C】


【図2A】


【図2B】


【図2C】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【図15】


【図16】


【図17】


【図18】


【図19】


【図20】


【図21】


【図22】


【図23】


【図24】


【図25】


【図26】


【図27】


【図28】


【図3】


【図4】




【図1B】


【図1C】


【図2A】


【図2B】


【図2C】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【図15】


【図16】


【図17】


【図18】


【図19】


【図20】


【図21】


【図22】


【図23】


【図24】


【図25】


【図26】


【図27】


【図28】


【図3】


【図4】


【公開番号】特開2012−53070(P2012−53070A)
【公開日】平成24年3月15日(2012.3.15)
【国際特許分類】
【外国語出願】
【出願番号】特願2011−269349(P2011−269349)
【出願日】平成23年12月8日(2011.12.8)
【分割の表示】特願2007−527713(P2007−527713)の分割
【原出願日】平成17年6月7日(2005.6.7)
【出願人】(503367169)フルイディグム コーポレイション (14)
【Fターム(参考)】
【公開日】平成24年3月15日(2012.3.15)
【国際特許分類】
【出願番号】特願2011−269349(P2011−269349)
【出願日】平成23年12月8日(2011.12.8)
【分割の表示】特願2007−527713(P2007−527713)の分割
【原出願日】平成17年6月7日(2005.6.7)
【出願人】(503367169)フルイディグム コーポレイション (14)
【Fターム(参考)】
[ Back to top ]

