微小粒子を用いた生きた生物負荷の検出法
本発明は、細胞を微小粒子上に濃縮し、この微小粒子を濃縮し、更に細胞を検出するための方法を提供する。本発明はまた、上記方法に基づいて使用するための一体型の試料調製及び検出装置も含む。
【発明の詳細な説明】
【技術分野】
【0001】
(関連出願の相互参照)
本出願は、2009年12月30日に出願された米国仮特許出願第61/291,301号、及び2010年5月6日に出願された同第61/331,931号の利益を主張するものであり、これらの仮特許出願は、参照によってその全体が本明細書に組み込まれる。
【背景技術】
【0002】
試料(例えば表面、水、空気等)中の細胞又は複数の細胞と関連する生物学的検体の存在を評価するために用いることができる種々の試験が利用可能である。こうした試験としては、ホタルルシフェラーゼ反応を利用したATPの検出に基づく試験、比色計を用いたタンパク質の検出に基づく試験、微生物培養法を用いた微生物の検出に基づく試験、及び免疫化学的方法を用いた微生物の検出に基づく試験がある。スワブ装置を用いたり、あるいは寒天プレートなどの培養装置との直接的な接触によって表面の試料を採取することができる。この試料を、生きた細胞の存在、特に生きた微生物の存在について分析することができる。
【0003】
これらの試験の結果はしばしば、表面の清浄度について判定を行うために用いられる。例えば、こうした試験は、食品加工機器が生産に使用するうえで充分に洗浄されているか否かを判定するために用いることができる。上記の試験は、汚染された表面の検出に有用であるが、試験の実施に多くの工程を要し得るものであり、生きた細胞の存在を死細胞から迅速かつ/又は容易に区別できない場合があり、場合によっては、結果を判定できるまでに長い時間(例えば、数時間又は数日)を要し得る。
【0004】
これらの試験を用いて、生きた微生物の存在を示すことができる。こうした試験では、生きた細胞に付随する生物学的検体(例えば、ATP)を放出させるために、細胞抽出剤がしばしば使用される。細胞外物質(例えば、死んだ又はストレス下の動物細胞、植物細胞、及び/又は微生物から環境中に放出される非細胞性ATPなど)が存在すると、高い「バックグラウンド」濃度のATPを生じ、これが生きた細胞の検出を困難とする場合がある。
【発明の概要】
【発明が解決しようとする課題】
【0005】
生きた細胞を検出するための多くの方法及び装置が存在するにも関わらず、生きた細胞、特に生きた微生物細胞の検出のための単純かつ信頼できる試験が依然求められている。
【課題を解決するための手段】
【0006】
本開示は一般的には、試料中の生きた細胞を検出するための物品及び方法に関する。本物品及び方法により、表面上の細菌などの細胞の存在を迅速に検出する(例えば、蛍光、化学発光、又は色反応などにより)ことが可能になる。いくつかの実施形態では、本発明の物品は「すぐに試料測定が行える状態」(即ち、物品が、試料中の生きた細胞を検出するために必要なすべての要素を含む)である。特定の態様では、本発明の物品及び方法は、真核細胞(例えば、植物細胞又は動物細胞)に関連する生物学的検体(例えば、ATP又は酵素)を原核細胞(例えば、細菌細胞)に関連する同様又は同一の生物学的検体から区別するための手段を提供する。更に、本発明の物品及び方法は、環境中に遊離している生物学的検体(即ち、非細胞性の生物学的検体)を、生きた細胞に関連する同様又は同一の生物学的検体から区別するための手段を提供する。
【0007】
本開示の方法は、操作者が液体試料から細胞を濃縮し、細胞に関連した検体を検出することを可能とするものである。特定の実施形態では、検体の検出は、特に試料中の生きた微生物細胞を含む生きた細胞の指標となり得る。いくつかの実施形態において、本方法は、操作者が試料中の生物学的検体及び/又は細胞の量を測定することを提供する。いくつかの実施形態では、本方法は、組成物から有効量の細胞抽出剤が液体混合物中に放出される所定の時間の後に操作者が生物学的検体の量を測定することにより、試料中の非細胞性物質に由来する生物学的検体の量と、生きた細胞に由来する生物学的検体の量を区別して求めることを提供する。いくつかの実施形態では、本方法は、操作者が第1の所定の時間内に生物学的検体の量の第1の測定を行い、更に組成物から有効量の細胞抽出剤が放出される第2の所定の時間内に生物学的検体の量の第2の測定を行うことによって、試料中の生きた細胞の存在を検出することを提供する。いくつかの実施形態では、本方法は、試料中の生物学的検体が生きた植物又は動物細胞から放出されたものであるか、あるいは生きた微生物細胞(例えば、細菌)から放出されたものであるかを操作者が区別することを提供する。本発明は、食品調理サービス施設、医療環境などの比較的過酷な現場環境において、操作者が使用することが可能である。
【0008】
一態様では、本開示は、試料中の細胞を検出する方法を提供する。本方法は、細胞濃縮剤と、細胞抽出剤を含む放出要素と、液体試料とを提供することを含むことができる。本方法は、液体試料と細胞濃縮剤とを所定の時間接触させることと、液体試料の少なくとも一部から細胞濃縮剤を分離することと、分離された細胞濃縮剤と放出要素とを含む液体混合物を形成することと、ここで、細胞抽出剤は混合物中に放出される、細胞からの生物学的検体を検出すること、を更に含むことができる。任意に、検体は、2つ以上の別個の時点で検出されることができる。いくつかの実施形態において、生物学的検体を検出することは、生きた細胞を検出することを含む。いくつかの実施形態において、生物学的検体を検出することは、検出系を使用することを含むことができる。いくつかの実施形態において、生物学的検体を検出することは、検体の量を定量することを含むことができる。いくつかの実施形態において、生物学的検体を検出することは、細胞からのATPを検出することを含むことができる。いくつかの実施形態において、生物学的検体を検出することは、遺伝学的又は免疫学的方法によって細胞を検出することを含むことができる。いくつかの実施形態において、本方法は、体細胞抽出剤を提供する工程と、この体細胞抽出剤を試料からの細胞と接触させる工程と、を更に含むことができる。
【0009】
別の態様において、本開示は試料中の細胞を検出する方法を提供する。本方法は、試料;細胞濃縮剤;細胞抽出剤を含む放出要素;第1及び第2の貯留部を備えたハウジングと試料を受容するように構成された開口部とを含む検出物品;細胞濃縮剤を分離してハウジングの第1の貯留部から第2の貯留部に移動させるための手段、を提供する工程を含むことができる。本方法は、ハウジングの第1の貯留部内の液体媒質中で試料と細胞濃縮剤とを接触させることを更に含むことができる。本方法は、ハウジング内の第2の貯留部に細胞濃縮剤を移動させることを更に含むことができる。本方法は、分離された細胞濃縮剤と放出要素とを含む液体混合物を形成することを更に含むことができ、細胞抽出剤は混合物中に放出される。本方法は、細胞からの生物学的検体を検出することを更に含むことができる。任意に、生物学的検体は、2つ以上の別個の時点で検出することができる。いくつかの実施形態において、生物学的検体を検出することは、生きた細胞を検出することを含むことができる。いくつかの実施形態において、生物学的検体を検出することは、検出系を使用することを含むことができる。いくつかの実施形態において、生物学的検体を検出することは、検体の量を定量することを含むことができる。いくつかの実施形態において、生物学的検体を検出することは、細胞からのATPを検出することを含むことができる。いくつかの実施形態において、生物学的検体を検出することは、遺伝学的又は免疫学的方法によって細胞を検出することを含むことができる。いくつかの実施形態において、本方法は、体細胞抽出剤を提供する工程と、この体細胞抽出剤を試料からの細胞と接触させる工程と、を更に含むことができる。
【0010】
別の態様において、本開示は試料中の細胞を検出するための方法を提供する。本方法は、試料;試料を受容するように構成された開口部と、細胞濃縮剤が収容された第1の貯留部と、細胞抽出剤を含む放出要素が収容された第2の貯留部と、を備えるハウジングを含む検出物品;細胞濃縮剤を液体試料の少なくとも一部から分離するための手段;及び細胞濃縮剤をハウジングの第1の貯留部から第2の貯留部に移動させるための手段、を提供する工程を含むことができる。本方法は、ハウジングの第1の貯留部内の液体媒質中で試料と細胞濃縮剤とを接触させることを含むことができる。本方法は、細胞濃縮剤を分離して、ハウジングの第2の貯留部に移動させる工程を更に含むことができる。本方法は、分離された細胞濃縮剤と放出要素とを含む液体混合物を形成することを更に含むことができ、細胞抽出剤は、混合物中に放出される。本方法は、細胞からの生物学的検体を検出することを更に含むことができる。任意に、生物学的検体は、2つ以上の別個の時点で検出されることができる。いくつかの実施形態において、生物学的検体を検出することは、生きた細胞を検出することを含むことができる。いくつかの実施形態において、生物学的検体を検出することは、検出系を使用することを含むことができる。いくつかの実施形態において、生物学的検体を検出することは、検体の量を定量することを含むことができる。いくつかの実施形態において、生物学的検体を検出することは、細胞からのATPを検出することを含むことができる。いくつかの実施形態において、生物学的検体を検出することは、遺伝学的又は免疫学的方法によって細胞を検出することを含むことができる。いくつかの実施形態において、本方法は、体細胞抽出剤を提供する工程と、この体細胞抽出剤を試料からの細胞と接触させる工程と、を更に含むことができる。
【0011】
別の態様において、本開示は一体型試料調製及び検出装置を提供する。装置は、それらの間に通路を有する第1の貯留部と第2の貯留部とを含むハウジングを含むことができる。ハウジングの第1の貯留部は、試料を受容するように構成された開口部と、その中に配置された細胞濃縮剤を含むことができる。ハウジングの第2の貯留部は、その中に配置された検出試薬を含むことができる。装置は、第1の貯留部を第2の貯留部から隔離するための手段を更に含むことができる。装置は、細胞濃縮剤を第1の貯留部から第2の貯留部に移動させるための手段を更に含むことができる。いくつかの実施形態において、第1の貯留部と第2の貯留部とを隔離するための手段は、細胞濃縮剤を第1の貯留部から第2の貯留部に移動させるための手段である。いくつかの実施形態において、ハウジングは、隔離された第1の貯留部と第2の貯留部との間の破断可能なシールを更に含むことができる。いくつかの実施形態において、第1の貯留部はテーパ領域を含むことができる。いくつかの実施形態において、装置は、細胞抽出剤を含む放出要素を更に含むことができる。いくつかの実施形態において、ハウジングは、第3の貯留部を更に含むことができる。いくつかの実施形態において、装置は、試料取得装置を更に含むことができる。いくつかの実施形態において、検出試薬は、ATPを検出するための試薬を含むことができる。いくつかの実施形態において、装置は、検出試薬を含む放出要素を更に含むことができる。
【0012】
別の態様において、本開示は一体型試料調製及び検出装置を提供する。装置は、それらの間に通路を有する隔離された第1及び第2の貯留部と、通路に嵌合するように構成されたピストンとを含むハウジングを含むことができる。ハウジングの第1の貯留部は、試料を受容するように構成された開口部と、その中に配置された細胞濃縮剤を含むことができる。ハウジングの第2の貯留部は、その中に配置された検出試薬を含むことができる。いくつかの実施形態において、ハウジングは、隔離された第1の貯留部と第2の貯留部との間の破断可能なシールを更に含むことができる。いくつかの実施形態において、第1の貯留部は、テーパ形状の内壁を含むことができる。いくつかの実施形態において、装置は、細胞抽出剤を含む放出要素を更に含むことができる。いくつかの実施形態において、ハウジングは、第3の隔離された貯留部を更に含むことができる。いくつかの実施形態において、装置は、試料取得装置を更に含むことができる。いくつかの実施形態において、検出試薬は、ATPを検出するための試薬を含むことができる。いくつかの実施形態において、装置は、検出試薬を含む徐放性組成物を更に含むことができる。
【0013】
別の態様において、本開示は一体型試料調製及び検出装置を提供する。装置は、それらの間に通路を有する隔離された第1の貯留部と第2の貯留部を含むハウジングを含むことができる。ハウジングの第1の貯留部は、試料を受容するように構成された開口部と、その中に配置された細胞濃縮剤とを含む。第2の貯留部は、その中に配置された検出試薬を含むことができる。装置は、第1の貯留部から第2の貯留部への物質の通過を制御するように構成された弁を更に含むことができる。いくつかの実施形態において、第1の貯留部は、テーパ形状の内壁を含むことができる。いくつかの実施形態において、装置は、細胞抽出剤を含む放出要素を更に含むことができる。いくつかの実施形態において、ハウジングは、第3の隔離された貯留部を更に含むことができる。いくつかの実施形態において、装置は、試料取得装置を更に含むことができる。いくつかの実施形態において、検出試薬は、ATPを検出するための試薬を含むことができる。いくつかの実施形態において、装置は、検出試薬を含む徐放性組成物を更に含むことができる。
【0014】
別の態様において、本開示は、それらの間に通路を有する隔離された第1の貯留部と第2の貯留部を含むハウジングと、細胞濃縮剤を第1の貯留部から第2の貯留部に移動させるための手段と、を含むキットを提供する。ハウジングの第1の貯留部は、試料を受容するように構成された開口部を含むことができる。第2の貯留部は、その中に配置された検出試薬を含むことができる。キットは、細胞濃縮剤を更に含むことができる。いくつかの実施形態において、細胞濃縮剤は、ハウジングの第1の貯留部内に配置される。いくつかの実施形態において、キットは、微生物細胞抽出剤を含む放出要素を更に含むことができる。いくつかの実施形態において、キットは、体細胞抽出剤を更に含むことができる。いくつかの実施形態において、キットは、試料取得装置を更に含むことができる。
【0015】
別の態様において、本開示は、それらの間に通路を有する隔離された第1の貯留部と第2の貯留部を含むハウジングとを含むキットを提供する。ハウジング内の第1の貯留部は、試料を受容するように構成された開口部を含むことができる。ハウジング内の第2の貯留部は、その中に配置された検出試薬を含むことができる。キットは、細胞濃縮剤と、細胞濃縮剤を第1の貯留部から第2の貯留部に移動させるための手段と、を更に含むことができる。いくつかの実施形態において、細胞濃縮剤は、ハウジングの第1の貯留部の中に配置される。いくつかの実施形態において、キットは、微生物細胞抽出剤を含む放出要素を更に含むことができる。いくつかの実施形態において、キットは、体細胞抽出剤を更に含むことができる。いくつかの実施形態において、キットは、試料取得装置を更に含むことができる。
【0016】
用語解説
本明細書で使用する「生物学的検体」とは、生物内に生ずる、又は生物によって生成される分子、又はその誘導体を指す。例えば、生物学的検体としては、これらに限定されるものではないが、アミノ酸、核酸、ポリペプチド、タンパク質、ヌクレオチド、ポリヌクレオチド、脂質、リン脂質、糖類、多糖類、及びこれらの組み合わせのうちの少なくとも1つを挙げることができる。生物学的検体の具体例としては、これらに限定されるものではないが、代謝産物(例えば、ATPなどの小分子、又はプロテインAなどのポリペプチド)、アレルゲン(例えば、落花生アレルゲン)、ホルモン、毒素(例えば、Bacillus属下痢毒素、アフラトキシンなど)、RNA(例えば、mRNA、全RNA、tRNAなど)、DNA(例えば、プラスミドDNA、植物DNAなど)、タグ付きタンパク質、抗体、抗原、及びこれらの組み合わせを挙げることができる。
【0017】
本明細書で使用する「液体試料」とは、液体を含む試料物質を指す。試料は、その元々の形態では、例えば、水、母乳、分泌液、血液、傷口の滲出液などの液体を含むものでよい。また、液体試料は、液体懸濁媒質(例えば、水、水性緩衝液など)中に固体を懸濁した懸濁液であることができる。例えば、固体、半固体、又はゼラチン状試料を試料取得装置によって採取し、液体に懸濁させて液体試料とすることができる。
【0018】
「清澄化液体試料」とは、液体試料を細胞濃縮剤と接触させ、細胞濃縮剤を液体のバルクから分離した(例えば、沈降、濾過、遠心、又は沈殿により)後に残る液体試料のバルクを指す。
【0019】
「試料取得装置」とは、本明細書では最も広い意味で使用され、液体、半固体、又は固体の試料物質を採取するために使用される器具を指す。試料取得装置の非限定的な例としては、スワブ、ワイプ、スポンジ、スクープ、スパチュラ、ピペット、ピペット先端、及びサイフォンホースが挙げられる。
【0020】
本明細書で使用する「行き止まり弁」とは、検出装置のハウジング内の2つ以上の貯留部間の物質(例えば、液体、固体、又は液体中の固体の懸濁液)の移動を調節するために使用される弁の一種を指す。行き止まり弁は、物質の移動に使用される弁内のキャビティが、一度に1つの貯留部とのみ流体連通し得るような設計となっている。
【0021】
本明細書で使用する用語「ヒドロゲル」は、親水性であり、極性溶媒によって膨潤しているかあるいは膨潤させることが可能なポリマー材料を指す。このポリマー材料は、通常、極性溶媒と接触すると膨潤するが溶解しない。即ち、ヒドロゲルは、極性溶媒に不溶である。膨潤したヒドロゲルは、乾燥させることで極性溶媒の少なくとも一部を除去することができる。
【0022】
本明細書で使用する「細胞抽出剤」とは、細胞膜又は細胞壁の透過性を変化させるか、あるいは細胞(例えば、体細胞若しくは微生物細胞)の細胞膜及び/又は細胞壁の完全性を乱す(即ち、溶解又は孔を形成する)ことにより、生きた細胞に通常見られる生物学的検体を抽出又は放出させるような任意の化合物又は化合物の組み合わせを指す。
【0023】
本明細書で使用する「検出系」とは、生物学的検体を検出するために使用される成分を指し、酵素、酵素基質、結合相手(例えば、抗体又は受容体)、標識、色素、並びに吸光度若しくは反射率、蛍光及び/又は発光(例えば、生物発光若しくは化学発光)を検出するための装置が挙げられる。
【0024】
用語「好ましい」及び「好ましくは」は、特定の状況下で、特定の利点をもたらし得る本発明の実施形態を指す。しかしながら、同一の又は他の状況下で、他の実施形態もまた好ましい可能性がある。更に、1つ以上の好ましい実施形態の引用は、他の実施形態が有用でないことを含意するものではなく、本発明の範囲内から他の実施形態を排除することを意図するものではない。
【0025】
用語「含む」及びその変化形は、これらの用語が説明文及び特許請求の範囲において現れる場合、限定的な意味を有するものではない。
【0026】
本明細書で使用するとき、「1つの(a)」、「1つの(an)」、「その(the)」、「少なくとも1つの」及び「1つ以上の」は、同じ意味で使用される。したがって、例えば、「a」検出試薬を含むハウジングとは、ハウジングが「1つ以上の」検出試薬を含むことができることを意味するものとして解釈することができる。
【0027】
「及び/又は」という用語は、記載した要素の一部若しくはすべて、又は記載した要素のうちの任意の2つ以上の組み合わせを意味する。
【0028】
また本明細書において、端点による数の範囲の列挙には、その範囲内に包含されるすべての数(例えば、1〜5には、1、1.5、2、2.75、3、3.80、4、5、等)が包含される。
【0029】
本発明の上述の「課題を解決するための手段」は、本発明の開示されるそれぞれの実施形態又はすべての実施を記載することを目的としていない。以下の説明により、例示的な実施形態をより具体的に例示する。本出願のいくつかの箇所で、実施例の一覧として説明を提供するが、実施例は種々の組み合わせにて使用することが可能である。いずれの場合にも、記載した一覧は、代表的な群としてのみ役立つものであり、排他的な一覧として解釈されるべきではない。
【図面の簡単な説明】
【0030】
【図1A】2個の受容部を含むハウジングの一実施形態の断面図、及びハウジングと使用するために適合されたプランジャの断面図を示すものであり、これらはいずれも本開示に基づく試料調製及び検出装置の構成要素。
【図1B】プランジャがハウジング内の第1の位置に配置され、ハウジングの第1の貯留部内に細胞濃縮剤を含む、組み立てられた状態の図1Aの装置の断面図を示す。
【図1C】プランジャがハウジング内の第2の位置に配置され、ハウジングの第1の貯留部内に液体試料を含む、図1Bの装置の断面図を示す。
【図1D】プランジャが第1の位置にあり、細胞濃縮剤がハウジングの第2の貯留部内にある、図1Cの装置の断面図を示す。
【図2A】破断可能なシールによって分離された3個の貯留部を含むハウジングの一実施形態の断面図、及びハウジングと使用するために適合されたプランジャの側面図を示すものであり、これらはいずれも本開示に基づく試料調製及び検出装置の構成要素。
【図2B】キャップが取り付けられ、ハウジングの第1の貯留部内に液体試料が配置された、図2Aのハウジングの断面図を示す。
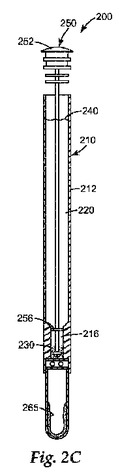
【図2C】キャップのない状態で、かつプランジャがハウジング内の第1の位置に配置された、図2Bのハウジングの断面図を示す。
【図2D】プランジャがハウジング内の第2の位置に配置され、細胞濃縮剤がハウジングの第2の貯留部に移動された、図2Cの装置の断面図を示す。
【図3A】本開示に基づく、ハウジング及び弁を含む試料調製及び検出装置の一実施形態の正面図を示す。
【図3B】図3Aの装置の側面図を示す。
【図3C】液体試料及び細胞濃縮剤がハウジングの第1の貯留部内に配置され、弁が第1の位置にある、図3Aの装置の断面図を示す。
【図3D】弁が第2の位置にあり、細胞濃縮剤がハウジングの第2の貯留部に移動された、図3Cの装置の断面図を示す。
【図4A】2個の貯留部及びドレーン弁を含むハウジングの一実施形態の断面図、並びにプランジャの側面図を示すものであり、これらはいずれも試料調製及び検出装置の構成要素。
【図4B】ドレーン弁が開いた配置にあり、プランジャがハウジング内の第1の位置に配置された、組み立てられた状態の図4Aの装置の断面図を示す。
【図4C】プランジャがハウジング内の第2の位置に配置され、細胞濃縮剤がハウジングの第2の貯留部に移された、組み立てられた状態の図4Bの装置の断面図を示す。
【図4D】プランジャが破断可能なシールに穿孔して細胞濃縮剤を第2の貯留部に移動させた、図4Cの装置の断面図を示す。
【図5A】ハウジングの一実施形態の断面図、及び部分的に断面にて示されたプランジャの側面図を示すものであり、これらはいずれも本開示に基づく試料調製及び検出装置の一実施形態の構成要素。
【図5B】プランジャがハウジングの異なる深さに挿入された、組み立てられた状態の図5Aの装置の断面図を示す。
【図5C】プランジャがハウジングの異なる深さに挿入された、組み立てられた状態の図5Aの装置の断面図を示す。
【図5D】プランジャがハウジングの異なる深さに挿入された、組み立てられた状態の図5Aの装置の断面図を示す。
【図6A】図5Aのプランジャの先端部の、部分的に断面にて示された分解側面図を示す。
【図6B】組み立てられた状態の図6Aの先端部の、部分的に断面にて示された側面図を示す。
【図7A】ハウジングの一実施形態の断面図、及び部分的に断面にて示された中空のプランジャの側面図を示すものであり、これらはいずれも本開示に基づく試料調製及び検出装置の一実施形態の構成要素。
【図7B】プランジャがハウジングの異なる深さに挿入された、組み立てられた状態の図7Aの装置の側面図を示す。
【図7C】プランジャがハウジングの異なる深さに挿入された、組み立てられた状態の図7Aの装置の側面図を示す。
【図7D】プランジャがハウジングの異なる深さに挿入された、組み立てられた状態の図7Aの装置の側面図を示す。
【図8A】図7Aのプランジャの先端部の、部分的に断面にて示された分解側面図を示す。
【図8B】組み立てられた状態の図8Aの先端部の、部分的に断面にて示された側面図を示す。
【図9】本開示に基づく細胞濃縮剤回収要素の一実施形態を示す。
【図10A】ハウジングの一実施形態の断面図、及び部分的に断面にて示されたプランジャの側面図を示すものであり、これらはいずれも本開示に基づく試料調製及び検出装置の一実施形態の構成要素。
【図10B】組み立てられた状態の図10Aの装置の、部分的に断面にて示された側面図を示す。
【図11】その中に細胞抽出剤が分散されている放出要素の一実施形態の上面斜視図を示す。
【図12a】空洞を有する基材を含む放出要素の一実施形態の平面図。
【図12b】図12aの放出要素の断面図。
【図13】マイクロチャネル空洞を含む放出要素の一実施形態の上面斜視図。
【図14】ゲスト化合物を含むコアを有するシェル構造を含む放出要素の一実施形態の断面図。
【図15】ゲスト化合物を含むシェル構造を含む放出要素の一実施形態の断面図。
【図16】第1のゲスト化合物を含むコア、及び第2のゲスト化合物を含むシェル構造を有するシェル構造を含む放出要素の一実施形態の断面図。
【図17】連続した層で配列された複数のシェル構造を含む放出要素の一実施形態の断面図。
【図18】外側のシェル構造内に独立して配列された複数のシェル構造を含む放出要素の一実施形態の断面図。
【発明を実施するための形態】
【0031】
本明細書に引用する特許、特許出願、政府刊行物、政府規制、及び参照文献はすべて、その全容を本明細書に援用する。記載の不一致の場合には、定義を含めた本明細書の記載内容が優先する。
【0032】
本発明は、試料中の微生物を検出するための物品及び方法に一般的に関する。特定の好ましい実施形態では、本発明は試料中の生きた微生物の検出に関する。試料からの細胞を濃縮するための方法及び装置は、いずれも参照によりその全体が本明細書に組み込まれるPCT国際公開特許WO 2010/078399、発明の名称「SAMPLING DEVICES AND METHODS FOR CONCENTRATING MICROORGANISMS」、及びPCT国際公開特許WO 2010/078404、発明の名称「METHODS,KITS AND SYSTEMS FOR PROCESSING SAMPLES」に記載されている。本明細書で開示する本発明の装置及び方法は、試料中に存在する少数の微生物を検出するための高い感度を与える。
【0033】
生物学的検体を使用して、試料中の生きた細胞などの生物学的物質の存在を検出することができる。生物学的検体は、検体が関与し得る様々な反応によって検出することができる(例えば、結合反応、触媒反応など)。
【0034】
様々な形態の化学発光反応を利用して、液体中及び加工処理された材料中の細菌細胞などの細胞を検出することができる。本開示のいくつかの実施形態では、酵素ルシフェラーゼの存在下でのアデノシン三リン酸(ATP)とルシフェリンとの反応に基づく化学発光反応による光の発生が、生物学的検体としてのATPを検出するためのシグナルの発生の化学的基礎を与える。ATPはすべての微生物細胞を含む、すべての生きた細胞中に存在することから、この方法は、試料中の生きた細胞の数を定量的又は準定量的に推定するための迅速なアッセイを提供することができる。基礎となる反応の性質、その発見の経緯、及びその一般的な応用分野に関する初期の論説が、E.N.Harvey(1957)、A History of Luminescence:From the Earliest Times Until 1900、Amer.Phil.Soc.、Philadelphia、Pa.及びW.D.McElroy及びB.L.Strehler(1949)、Arch.Biochem.Biophys.22:420〜433に述べられている。
【0035】
細菌及びその他の微生物種はある程度のATPを含むため、ATP検出は細菌及びその他の微生物種を検出するうえで信頼性の高い手段である。ATPから得られる化学結合エネルギーは、北米産ホタル(Photinus pyralis)の尾部で起こる生物発光反応に利用されている。この反応の生化学的成分はATPを含まずに単離することができ、その後これを他の供給源のATPを検出するために使用することができる。このホタルの生物発光反応の機構はよく特徴付けられている(DeLuca,M.,et al.、1979 Anal.Biochem.95:194〜198)。
【0036】
放出要素:
本開示による放出要素は、封入材料を含む。封入材料は、一般に、液体混合物(例えば、試料を含む水性混合物)の中への有効量の細胞抽出剤の即時溶解を所定の時間の間防止するための物理的バリア及び/又は拡散バリアとしての役割を果たす。
【0037】
いくつかの実施形態において、封入材料は、封入材が活性化刺激に曝露された後に有効量の細胞抽出剤を放出するように活性化されてよい。活性化は、例えば、封入材料の溶解又は部分的な溶解、封入材料の透過化(例えば、部分的に脱水されたポリマーを膨潤させることによる)、封入材料の離解又は部分的な離解(例えば、ワックスなどの固形物を融解させることによる)を包含し得る。
【0038】
いくつかの実施形態において、封入材料は、本明細書に記載のように、シェル構造(例えば、クロモニック物質)を含むことができる。
【0039】
いくつかの実施形態において、封入材料は、マトリックスを含むことができる。好適なマトリックス材料の例は、参照によりその全体が本明細書に組み込まれるPCT国際公開特許WO 2010/129726、発明の名称「ARTICLES WITH MATRIX COMPRISING A CELL EXTRACTANT AND BIODETECTION METHODS THEREOF」に見出すことができる。いくつかの実施形態において、マトリックスは、液体(例えば、試料を含む水性液体)に実質的に不溶性である材料(例えば、ポリマー材料又はセラミックなどの非ポリマー材料)を含む。いくつかの実施形態において、マトリックスは、周囲温度で水溶液に実質的に可溶性及び/又は分散性である賦形剤を含む。いくつかの実施形態において、マトリックスは、周囲温度で水溶液に実質的に不溶性及び非分散性である賦形剤を含む(即ち、賦形剤の溶解又は分散は、温度変化及び/又は化学的トリガの添加によって引き起こされることができる)。
【0040】
いくつかの実施形態において、マトリックスは、予備形成されたマトリックス(即ち、マトリックスに細胞抽出剤が注入される前に形成されるマトリックス)であることができる。これらの実施形態では、細胞抽出剤を含有する液体の中にマトリックスを入れて、細胞抽出剤をマトリックス材料の中に拡散させることによって、細胞抽出剤をマトリックスに装填することができる。いくつかの実施形態において、マトリックス前駆体は、細胞抽出剤を有する溶液中で混合することができ、マトリックス内に分散した細胞抽出剤を有するマトリックスが形成される。別の実施形態において、細胞抽出剤は、例えば、参照によりその全体が本明細書に組み込まれる米国特許出願公開第2005/0152992号に記述されているように、ワックスの中に分散させることができる。
【0041】
封入材料には、ヒドロゲルを含むことができる。物品におけるヒドロゲルの使用及び試料中の細胞の検出方法は、それぞれが参照によりその全体が本明細書に組み込まれる2008年9月30日出願のPCT国際公開特許WO 2010/039627及び米国特許出願第61/101,563号、発明の名称「BIODETECTION ARTICLES and BIODETECTION METHODS」に記載されている。
【0042】
ヒドロゲルは、架橋ヒドロゲル、膨潤ヒドロゲル、及び乾燥又は部分的に乾燥したヒドロゲルを広義に包含する。本開示の好適なヒドロゲルには、例えば、ヒドロゲル、及びそのヒドロゲルから製造されるポリマービーズが挙げられ、これらはPCT国際公開特許公報WO 2007/146722に記述されており、この全体が参照により本明細書に組み込まれる。
【0043】
その他の好適なヒドロゲルには、エチレン性不飽和カルボキシル含有モノマーとカルボン酸、ビニルスルホン酸、セルロースモノマー、ポリビニルアルコールから選択されるコモノマーとを含むポリマー(米国特許出願公開第US2004/0157971号に記載);でんぷん、セルロース、ポリビニルアルコール、ポリエチレンオキシド、ポリプロピレングリコール、及びこれらのコポリマーを含むポリマー(米国特許出願公開第US 2006/0062854号に記載);分子量2000ダルトン未満の、多官能基ポリ(アルキレンオキシド)のフリーラジカル重合性マクロモノマーを含むポリマー(米国特許第7,005,143号に記載);液体媒体にさらされると架橋するシラン官能化ポリエチレンオキシドを含むポリマー(米国特許第6,967,261号に記載);ポリエチレングリコール、ポリプロピレングリコール、及びプロピレングリコールから選択される少なくとも1つのアルコールをともなうポリウレタンプレポリマーを含むポリマー(米国特許第6,861,067号に記載);多糖類、ポリビニルピロリドン、ポリビニルアルコール、ポリビニルエーテル、ポリウレタン、ポリアクリレート、ポリアクリルアミド、コラーゲン及びゼラチンから選択される親水性ポリマーを含むポリマー(米国特許第6,669,981号に記載)が挙げられ、これらの開示はすべてその全体が参照により本明細書に組み込まれる。その他の好適なヒドロゲルには、寒天、アガロース、ポリアクリルアミドヒドロゲル、及びこれらの誘導体が挙げられる。
【0044】
本開示は、成形ヒドロゲルを含む物品及び方法を提供する。成形ヒドロゲルには、例えば、ビーズ、シート、リボン、及び繊維に成形したヒドロゲルが挙げられる。成形ヒドロゲルの更なる例、及び成形ヒドロゲルを製造することができる代表的なプロセスは、米国特許出願公開第2008/0207794 A1号、発明の名称「POLYMERIC FIBERS AND METHODS OF MAKING」、及び米国特許出願公開第第2010/0295219号、発明の名称「METHODS OF MAKING SHAPED POLYMERIC MATERIALS」に開示されており、これらはともに参照によりそれら全体が本明細書に組み込まれる。
【0045】
本開示のヒドロゲルは、細胞抽出剤を含むことができる。細胞抽出剤を含むヒドロゲルは、2つの基本的プロセスによって製造することができる。第一のプロセスでは、細胞抽出剤が、ヒドロゲルポリマーの合成中にヒドロゲル内に組み込まれる。第1のプロセスの例は、PCT国際公開特許WO 2007/146722に見出すことができる。第二のプロセスでは、細胞抽出剤が、ヒドロゲルポリマーの合成後にヒドロゲル内に組み込まれる。例えば、ヒドロゲルを細胞抽出剤の溶液に入れ、細胞抽出剤をヒドロゲルに吸収及び/又は吸着させる。第2のプロセスの更なる例は、ヒドロゲルにイオン性モノマーを組み込む、例えばカチオン性モノマーをヒドロゲルに組み込むことなどである。
【0046】
いくつかの用途においては、細胞抽出剤を含む放出要素が、乾燥状態又は部分的乾燥状態であることが望ましい場合がある。例えば、蒸発プロセス、熱対流炉、電子レンジ、及び真空炉内での乾燥、並びに凍結乾燥などの、当業者に既知の方法によって、特定の放出要素(例えば、水膨潤ヒドロゲル)を乾燥させることができる。乾燥状態又は部分的乾燥状態である放出要素が液体又は水溶液に曝露されると、細胞抽出剤は放出要素から拡散することができる。細胞抽出剤は、液体又は水溶液に曝露されるまでは、放出要素内で本質的に休止状態に留まっていることができる。即ち、細胞抽出剤は、放出要素が液体に曝露されるまで、乾燥状態又は部分的乾燥状態である放出要素内に収納されることができる。この結果、必要でないときに細胞抽出剤が浪費又は損失されるのを防止することができ、かつ加水分解、酸化、又は他のメカニズムによって劣化する可能性がある水分に敏感な多数の細胞抽出剤の安定性を改善することができる。
【0047】
いくつかの実施形態では、封入材料が圧力、剪断力、熱、光、pHの変化、別の化学物質への曝露、イオン強度変化等の活性化刺激に曝露された後、封入材料は活性化されて、有効量の細胞抽出剤を放出することができる。活性化により、例えば、封入材料の溶解若しくは部分的な溶解、封入材料の透過化(例えば脂質二重層の破壊)、及び/又は封入材料の離解若しくは部分的な離解(例えば微結晶ワックスなどの固形物を破砕又は融解することによる)を引き起こすことができる。
【0048】
放出要素は、本開示によると、細胞抽出剤を封入する錠剤を包含する。製薬学的組成物の放出を遅れさせる錠剤は、当該技術分野において既知である(例えば、PCT国際公開特許WO 97/02812及びWO 08/129517を参照のこと)。「錠剤」は広義に用いられ、参照によりその全体が本明細書に組み込まれる米国特許出願公開第2010/0209927号、発明の名称「PROCESSING DEVICE TABLET」で開示されているような微小錠剤を包含する。
【0049】
錠剤は、本開示によると、賦形剤と混合された細胞抽出剤を含む。「賦形剤」は、例えば、結合剤、流動促進剤(例えば、流動補助剤)、潤滑剤、崩壊剤、及び前述の任意の2つ以上を包含して広く用いられる。いくつかの実施形態では、錠剤は、外側のコーティングを含むことができ、この外側のコーティングは、錠剤が液体(例えば、試料を含む水性液体)と接触した際の活性物質(例えば、細胞抽出剤)の放出に影響を与えることができる。いくつかの実施形態において、錠剤は、充填剤(例えば、ラクトース又はソルビトールなどの糖)を錠剤の充填剤として含むことができる。崩壊剤(例えば、デンプン又はセルロースなどの多糖類)は、錠剤の湿潤及び/又は膨潤を促進し、それによって、錠剤が液体と接触した際の活性物質の放出を容易にすることができる。ソルビトール及びマンニトールは、特定の細胞抽出剤(例えば、酵素)の安定性を促進することができる賦形剤である。マンニトールを使用して、細胞抽出剤の放出を遅らせることができる。いくつかの実施形態では、ポリエチレングリコール(PEG)は、錠剤からの活性物質の放出を制御するのに好ましい賦形剤である。いくつかの実施形態では、3300及び8000ダルトンの分子量を有するPEG化合物を使用して、錠剤からの活性物質の放出を遅らせることができる。
【0050】
錠剤の製造方法は当該技術分野において既知であり、例えば、直接圧縮、湿式造粒法、乾式造粒、及び流動層造粒が挙げられる。
【0051】
放出要素は、本開示によると、細胞抽出剤を封入するワックスマトリックスを含む。いくつかの実施形態では、細胞抽出剤の複数の塊を、ワックスマトリックスに分散させることができる。ワックスが崩壊すると(例えば、熱融解又は機械的破砕によって)細胞抽出剤はワックスから放出される。好適なワックスの非限定的な例としては、天然若しくは合成ワックス又はワックス類似物、例えば、石蝋、モンタン蝋、カルナバ蝋、蜜蝋、スケールワックス、オゾケライト、ユタ蝋など、微結晶ワックス、例えば、プラスチック及びタンク底部から得られたワックスなど、ワックス代用品、例えば、フィッシャー・トロプシュワックスなど、ポリアルキレン、例えば、ポリエチレン、ポリプロピレンなど、これらの混合物及びコポリマーが挙げられる。
【0052】
いくつかの実施形態において、細胞抽出剤は、ワックスと不混和性の溶液(例えば、水溶液)の液滴としてワックス中に分散されることができる。いくつかの実施形態において、細胞抽出剤は、固体又は半固体の粒子又は凝集体としてワックス中に分散されることができる。このような液体又は固体の分散をワックス中に生じさせる方法は、当該技術分野において周知である。
【0053】
図11は、マトリックス材料1192を含む放出要素1140の一実施形態の斜視図を示す。図に示される実施形態では、マトリックス材料1192は、ワックスのフィルム又はブロックを含む。マトリックス材料1192中に分散しているのは、細胞抽出剤を含む空洞1194である。放出要素1140中に分散される細胞抽出剤の量及び/又は濃度、並びに放出要素1140の形状及び寸法は、所与の検出物品中で使用するために変更可能であることが認識される。
【0054】
放出要素は、本発明によると、細胞抽出剤を含むマトリックス材料でコーティングされた基材を含む。細胞抽出剤でコーティングされた基材を含む放出要素は、参照によりその全体が本明細書に組み込まれる、PCT国際公開特許WO 2010/129727、発明の名称「COATED SUBSTRATES COMPRISING A CELL EXTRACTANT AND BIODETECTION METHODS THEREOF」に開示されている。マトリックス材料は、本明細書に記載されるような任意の好適なマトリックス材料であることができる。
【0055】
マトリックス材料は、例えば、ディップコーティング、ナイフコーティング、カーテンコーティング、吹付け塗り、キスコーティング、グラビアコーティング、オフセットグラビアコーティング、及び/又はスクリーン印刷及びインクジェット印刷などの印刷方式といった、当該技術分野において既知のコーティングプロセスを用いて、基材上にコーティングされることができる。いくつかの実施形態において、コーティングは、予め定められたパターンで塗布されることができる。コーティングプロセスの選択は、固体基材の形状及び寸法によって影響され、任意の所与の固体基材をコーティングするための好適なプロセスを判別することは、当業者の把握する範囲内である。
【0056】
いくつかの実施形態では、マトリックス材料は、細胞抽出剤を含む予備形成されたマトリックス(例えば、ポリマーマトリックス)として基材上にコーティングされる。いくつかの実施形態では、マトリックス前駆体と細胞抽出剤とを含む混合物が基材上にコーティングされ、マトリックスは、例えば、当該技術分野において既知の及び/又は本明細書に記載される重合プロセスを用いて、基材上に形成される。いくつかの実施形態では、予備形成されたマトリックスが基材上にコーティングされるか又はマトリックスが基材上に形成された後、続いて当該技術分野において既知の及び/又は本明細書に記載されるプロセスを用いて、細胞抽出剤が基材に装填される。
【0057】
いくつかの実施形態において、コーティング混合物は、コーティングプロセスを容易にする及び/又は基材に対するマトリックス材料の付着力を促進するために、添加剤(例えば、結合剤又は増粘剤)を含む。添加剤の非限定例としては、ガム(例えば、グアーガム、キサンタンガム、アルギン酸塩、カラギーナン、ペクチン、寒天、ジェラン、アガロース)、多糖類(例えば、デンプン、メチルセルロース、カルボキシメチルセルロース、ヒドロキシプロピルメチルセルロース)、及びポリペプチド(例えば、ゼラチン)が挙げられる。
【0058】
コーティング添加剤は、試料中の細胞を検出するのに使用される検出系との適合性で選択される必要がある。この適合性は、本明細書に記載されるように、添加剤を検出系(例えば、ルシフェラーゼ及びルシフェリン)及び検出すべき検体(例えば、ATP)と混合し、反応を測定し、かつ添加剤が検体の検出を実質的に阻害したしたかどうかを判定することによって試験されることができる。
【0059】
マトリックス材料がコーティングされる基材は、様々な固体基材を包含する。細胞抽出剤を含むマトリックスがコーティングされる好適な基材材料の非限定例としては、プラスチック(例えば、ポリカーボネート、ポリエチレン及びポリプロピレンなどのポリアルキレン、ポリエステル、ポリアクリレート、並びにこれらの誘導体及び混合物)、金属(例えば、金、グラファイト、白金、パラジウム、ニッケル)、ガラス、セルロース及びセルロース誘導体(例えば、濾紙)、セラミック材料、開放セル発泡体(例えば、ポリウレタンフォーム)、不織布材料(例えば、膜、PTFE膜)、並びにこれらの組み合わせ(例えば、プラスチックコーティング金属箔)が挙げられる。基材は、例えば、繊維、不織布材料(例えば、セルロース、ガラス、ポリエステル、ポリアルキレン、ポリスチレン、及びこれらの誘導体又はこれらの組み合わせを含む繊維性材料から製造される不織布材料)、粒子(例えば、ビーズ)、シート、フィルム、及び膜などを含む様々な形態で構成されることができる。
【0060】
いくつかの実施形態において、基材は、フィルタ、例えばグレード4の20〜25μmの定性濾紙、グレード30のガラス繊維濾紙、グレードGB005の厚い(1.5mm)吸収性の極めて高い吸い取り紙(すべてWhatman,Inc(Florham Park,NJ)より入手)、Zeta Plus Virosorb 1MDSディスク(CUNO,Inc,Meriden,CT)及び0.45μmのMF−Millipore膜(Millipore,Billerica,MA)などであることができる。上記基材のうちの任意の1つに、ポリビニルアルコールを含有する細胞抽出剤溶液を装填することができる。上記基材のうちの任意の1つに、VANTOCIL(Arch Chemicals,Norwalk,CT)を含有する細胞抽出剤溶液を装填することができる。上記基材のうちの任意の1つに、CARBOSHIELD(Lonza,Walkersville,MD)を含有する細胞抽出剤溶液を装填することができる。上記基材のうちの任意の1つに、5%塩化ベンザルコニウム溶液を含有する細胞抽出剤溶液を装填することができる。
【0061】
マトリックス材料、細胞抽出剤、及び基材は、試料中の細胞を検出するのに使用される検出系との適合性で選択される必要がある。この適合性は、1)検出系中の検体の量を検出する(例えば、本明細書に記載されるように、ATPをルシフェリン及びルシフェラーゼと混合し、照度計で発光量を測定する)、2)マトリックス材料、細胞抽出剤、又は基材を用いた検出工程を繰り返す、3)工程1の結果と工程2の結果とを比較して、マトリックス材料、細胞抽出剤、又は基材が反応中の検体の検出及び/又は測定を実質的に阻害したかどうかを判定することによって、試験されることができる。
【0062】
いくつかの実施形態において、放出要素は、コーティングされた基材を含む。コーティング、基材及び/又はコーティングされた基材は、有効量の細胞抽出剤が水性混合物中に即時溶解するのを短時間の間妨げるための、物理的バリア及び/又は拡散バリアとしての役割を果たすように適合される。
【0063】
コーティングされた基材は、コーティングと基材とを含む。コーティングは細胞抽出剤を含む。コーティングは、例えば、ディップコーティング、ナイフコーティング、カーテンコーティング、吹付け塗り、キスコーティング、グラビアコーティング、オフセットグラビアコーティング、及び/又はスクリーン印刷及びインクジェット印刷などの印刷方式といった、当該技術分野において既知のコーティングプロセスを用いて、基材上に塗布されることができる。いくつかの実施形態では、コーティングは、予め定められたパターン(例えば、ストライプ、格子、斑点)で塗布されることができる。コーティングプロセスの選択は、固体基材の形状及び寸法によって影響され、任意の所与の固体基材をコーティングするための好適なプロセスを判別することは、当業者の把握する範囲内である。
【0064】
コーティングが塗布される基材は、様々な基材材料を包含する。本開示のコーティングを塗布することができる好適な基材材料の非限定例としては、プラスチック(例えば、ポリカーボネート、ポリエチレン及びポリプロピレンなどのポリアルキレン、ポリエステル、ポリアクリレート、並びにこれらの誘導体及び混合物)、金属(例えば、金、グラファイト、白金、パラジウム、ニッケル)、ガラス、セルロース及びセルロース誘導体(例えば、濾紙)、セラミック材料、開放セル発泡体(例えば、ポリウレタンフォーム)、不織布材料(例えば、膜、PTFE膜)、並びにこれらの組み合わせ(例えば、プラスチックコーティング金属箔)が挙げられる。基材は、例えば、繊維、不織布材料、シート、及びフィルムなどを含む様々な形態で構成されることができる。
【0065】
いくつかの実施形態では、基材の表面は、比較的滑らかであることができる。いくつかの実施形態では、基材の少なくとも一部は、空洞を含むことができる。図12aは、空洞1294を有する基材1292を含む放出要素1240の一実施形態の平面図を示す。図に示される実施形態では、基材1292はフィルム基材であってよい。図12bは、図12aの放出要素1240の断面図を示す。図で示した実施形態は、空洞1294aを含む基材1292を示しており、空洞開口部1295aの断面積は、空洞1294aの最大断面積にほぼ等しい。基材1292は空洞1294bも含み、空洞開口部1295bの断面積は、空洞1294bの最大断面積よりも小さい。理論に束縛されるものではないが、空洞開口部の面積と空洞容積の比は、細胞抽出剤の放出要素からの放出速度を制御する1つの手段として用いられることができると予想される。図で示した実施形態は、比較的均一な球形又は半球形の空洞を含むが、好適な空洞は、不均一で不規則な形状といった様々な形状を包含すると予想される。
【0066】
基材は、本明細書で使用する場合、マイクロ複製された基材を包含する。マイクロ複製又は「マイクロ複製された」とは、構造化面の特徴部が、製造中に製品毎に、約50マイクロメートルを超えて変化しない個々の特徴部の忠実度を保持するプロセスを介した、微小構造化表面(例えば、マイクロチャンネル)の形成を意味する。マイクロ複製された表面は、好ましくは、製造中に製品毎に、25マイクロメートルを超えて変化しない個々の特徴部の忠実度を構造化面の特徴部が保持するように製造される。本発明によると、微小構造化表面は、約50マイクロメートル〜0.05マイクロメートル、より好ましくは25マイクロメートル〜1マイクロメートルの解像度に維持された個々の特徴部の忠実度を有するトポグラフィー(物体、その場所又はその領域の表面特徴)を有する表面を含む。好適なマイクロ複製された基材は、参照によりその全体が本明細書に組み込まれる、米国特許出願公開第2007/0212266 A1号に記載されている。
【0067】
図13は、マイクロ複製された空洞を含む放出要素1340の一実施形態の上面斜視図を示す。放出要素1340は、それらの間にチャネル1304を形成する離間したピーク1302を含む基材1392を含む。本明細書に記載されるように、基材1392は、細胞抽出剤を含む組成物でコーティングされることができる。任意に、カバー1306(例えば、プラスチック又は金属フィルム)を基材1392に取り付けて(例えば、図示されていない接着剤によって)、覆われたチャネル1305を形成することができる。任意に、2つ以上の基材1392を(図のように)積み重ねて、覆われたチャネル1305の1つ以上の層を形成することができる。基材1392は、細胞抽出剤でコーティングされた後に積み重ねられることができる、又は細胞抽出剤でコーティングされる前に積み重ねられることができる。基材1392がコーティングの前に積み重ねられる実施形態では、覆われたチャネル1305の末端部に細胞抽出剤を適用することによって個々のチャネルをコーティングすることができ、毛管現象によって覆われたチャネルを満たすことができる。
【0068】
覆われたチャネル1305は、その中に放出要素1340が懸濁された液体と接触する比較的小さな開口部(即ち、チャネルの一方又は両方の末端部)を提供し、それによって、覆われたチャネル1305から出た有効量の細胞抽出剤が液体の中に拡散するのを制限する及び/又は遅らせることができる。
【0069】
マイクロチャンネル又は空洞を細胞抽出剤組成物で充填するように、マイクロ複製された表面及び/又は空洞を有する放出要素をコーティングすることができる。細胞抽出剤組成物は、液体、固体、半固体、又はこれらの任意の2つ以上の組み合わせであってよい。
【0070】
いくつかの実施形態において、基材は、フィルタ、例えばグレード4の20〜25μmの定性濾紙、グレード30のガラス繊維濾紙、グレードGB005の厚い(1.5mm)吸収性の極めて高い吸い取り紙(すべてWhatman,Inc(Florham Park,NJ)より入手)、Zeta Plus Virosorb 1MDSディスク(CUNO,Inc,Meriden,CT)、及び0.45μmのMF−Millipore membrane(Millipore,Billerica,MA)などであることができる。上記基材のうちの任意の1つに、ポリビニルアルコールを含有する細胞抽出剤溶液を装填することができる。上記基材のうちの任意の1つに、VANTOCIL(Arch Chemicals,Norwalk,CT)を含有する細胞抽出剤溶液を装填することができる。上記基材のうちの任意の1つに、CARBOSHIELD(Lonza,Walkersville,MD)を含有する細胞抽出剤溶液を装填することができる。上記基材のうちの任意の1つに、5%塩化ベンザルコニウム溶液を含有する細胞抽出剤溶液を装填することができる。
【0071】
いくつかの実施形態において、基材は、本明細書に記載されるような、細胞抽出剤を含むマトリックス材料でコーティングされることができる。いくつかの実施形態において、マトリックス材料(例えば、ポリマー材料又はセラミックなどの非ポリマー材料)は、液体(例えば、試料を含む水性液体)に実質的に不溶性であることができる。これに加えて、あるいは別の方法として、マトリックス材料は、有機溶媒に実質的に不溶性であることができる。いくつかの実施形態では、マトリックス材料は、周囲温度で試料を含む液体混合物(例えば、水溶液)に実質的に可溶性及び/又は分散性である賦形剤を含むことができる。いくつかの実施形態では、マトリックス材料は、周囲温度で水溶液に実質的に不溶性及び非分散性である賦形剤を含むことができる(即ち、賦形剤の溶解又は分散は、温度変化及び/又は化学的トリガの添加によって引き起こされることができる)。
【0072】
いくつかの実施形態では、基材をコーティングするのに使用するマトリックス材料は、細胞抽出剤を含む予備形成されたマトリックス(例えば、ポリマーマトリックス)であることができる。いくつかの実施形態では、マトリックス前駆体と細胞抽出剤とを含む混合物が基材上にコーティングされ、マトリックスは、続いて、例えば、当該技術分野において既知の及び/又は本明細書に記載される重合プロセスを用いて、基材上に形成される。いくつかの実施形態では、予備形成されたマトリックスは、基材上にコーティングされるか又はマトリックスが基材上に形成された後、続いて、当該技術分野において既知の及び/又は本明細書に記載されるプロセスを用いて、細胞抽出剤が基材に装填される。
【0073】
マトリックスは、本開示によると、賦形剤と混合された細胞抽出剤を含むことができる。「賦形剤」は、例えば、結合剤、流動促進剤(例えば、流動補助剤)、潤滑剤、崩壊剤、及び前述の任意の2つ以上を包含して広く用いられる。いくつかの実施形態では、コーティングされた基材は外側のコーティングを含むことができ、この外側のコーティングは、コーティングされた基材が液体(例えば、試料を含む水性液体)と接触した際の活性物質(例えば、細胞抽出剤)の放出に影響を与えることができる。いくつかの実施形態では、マトリックスは、充填剤(例えば、ラクトース又はソルビトールなどの糖)をマトリックスの増量剤として含むことができる。崩壊剤(例えば、デンプン又はセルロースなどの多糖類)は、マトリックスの湿潤及び/又は膨潤を促進し、それによって、マトリックスが液体と接触した際の活性物質の放出を容易にすることができる。ソルビトール及びマンニトールは、特定の細胞抽出剤(例えば、酵素)の安定性を促進することができる賦形剤である。マンニトールを、細胞抽出剤の放出を遅れさせるために使用することができる。いくつかの実施形態において、ポリエチレングリコール(PEG)は、マトリックスからの活性物質の放出を制御するのに好ましい賦形剤である。いくつかの実施形態では、3300及び8000ダルトンの分子量を有するPEG化合物を使用して、マトリックスからの活性物質の放出を遅らせることができる。
【0074】
いくつかの実施形態では、コーティング混合物は、コーティングプロセスを容易にするため、及び/又は基材に対するマトリックス材料の付着力を促進するために、添加剤(例えば、結合剤又は増粘剤)を含む。添加剤の非限定例としては、ガム(例えば、グアーガム、キサンタンガム、アルギン酸塩、カラギーナン、ペクチン、寒天、ジェラン)、多糖類(例えば、デンプン、メチルセルロース、カルボキシメチルセルロース、ヒドロキシプロピルメチルセルロース、アガロース)、及びポリペプチド(例えば、ゼラチン)が挙げられる。
【0075】
マトリックス材料、細胞抽出剤、基材、及びコーティング添加剤は、試料中の細胞を検出するのに使用される検出系との適合性で選択される必要がある。この適合性は、1)検出系中の検体の量を検出する(例えば、PCT国際公開特許WO 2010/129727の実施例6に記載されるように、ATPをルシフェリン及びルシフェラーゼと混合し、照度計で発光量を測定する)、2)マトリックス材料、細胞抽出剤、基材又はコーティング添加剤を用いた検出工程を繰り返す、3)工程1の結果と工程2の結果とを比較して、添加剤が反応中の検体の検出及び/又は測定を実質的に阻害したかどうかを判定することによって、試験されることができる。
【0076】
いくつかの実施形態において、基材をコーティングするのに使用する材料は、本明細書に記載されるような、細胞抽出剤を含むシェル構造を含んでよい。特定のシェル構造と特定の検出系との適合性は、本明細書に記載されるように判定されることができる。
【0077】
いくつかの実施形態において、コーティングされた基材は、バリア層を更に含んでよい。バリア層は、コーティングされた基材からの細胞抽出剤の放出を遅らせるための手段としての機能を果たすことができる。バリア層は、例えば、錠剤又はカプセル薬物からの活性成分の放出を制御する及び/又は遅れさせるための、当該技術分野において既知のもののような浸食性コーティングを包含する。バリア層はまた、物理的又は機械的操作によって崩壊し得る層(例えば、高温で崩壊し得るワックス層)も包含する。
【0078】
いくつかの実施形態では、封入材料が圧力、剪断力、熱、光、pHの変化、別の化学物質への曝露、イオン強度の変化等の活性化刺激に曝露された後、封入材料は、活性化されて、有効量の細胞抽出剤を放出してよい。活性化により、例えば、封入材料の溶解若しくは部分的な溶解、封入材料の透過化、及び/又は封入材料の離解若しくは部分的な離解(例えば、例えば微結晶ワックスなどの固形物を破砕又は融解することによる)を引き起こしてよい。
【0079】
いくつかの実施形態において、放出要素は、細胞抽出剤を保持する及び/又は含む封入材料を含む。好適な封入材料は、参照によりその全体が本明細書に組み込まれる、PCT国際公開特許WO 2010/129728、発明の名称「ARTICLES WITH SHELL STRUCTURES INCLUDING A CELL EXTRACTANT AND BIODETECTION METHODS THEREOF」に記載されている。封入材料は、液体混合物(例えば、試料を含む水性混合物)の中への有効量の細胞抽出剤の即時溶解及び/又は分散を、所定の時間の間防止するための物理的バリア及び/又は拡散バリアとしての役割を果たすことができる。
【0080】
いくつかの実施形態において、封入材料は、本明細書に記載されるようなマトリックス材料を含むことができる。
【0081】
いくつかの実施形態では、封入材料が圧力、剪断力、熱、光、pHの変化、別の化学物質への曝露、イオン強度の変化等の活性化刺激に曝露された後、封入材料は、活性化されて、有効量の細胞抽出剤を放出してよい。活性化により、例えば、封入材料の溶解若しくは部分的な溶解、封入材料の透過化(例えば、脂質二重層の破壊)、及び/又は封入材料の離解若しくは部分的な離解(例えば、例えば微結晶ワックスなどの固形物を破砕又は融解することによる)を引き起こしてよい。
【0082】
いくつかの実施形態において、放出要素は、シェル構造を形成する。図14は、本開示による放出要素1440の実施形態を示す。放出要素1440は、シェル構造1401とコア1404とを有する。コア1404の中に位置決めされているのは、ゲスト化合物1405(例えば、本明細書に記載されるような細胞抽出剤)である。コア1404は、液体、固体、半固体又はこれらの組み合わせを含むことができる。ゲスト化合物1405は、その中に溶解及び/又は分散されてよい。
【0083】
いくつかの実施形態において、放出要素のシェル構造は、細胞抽出剤を含むことができる。図15は、本開示による放出要素1540の実施形態を示す。放出要素1540は、ゲスト化合物1505(例えば、本明細書に記載されるような細胞抽出剤)を含むシェル構造1501を有する。放出要素1540は、液体、固体、半固体、又はこれらの組み合わせを含むことができるコア1504を更に含む。
【0084】
いくつかの実施形態において、放出要素は、2つ以上のゲスト分子を含むことができる。図16は、本開示による複合体放出要素1640の実施形態を示す。複合体放出要素1640は、第1のゲスト分子1606を含むシェル構造1602と、第2のゲスト分子1605を含むコア1604とを有する。いくつかの実施形態において、第1及び第2のゲスト化合物(それぞれ1604及び1605)は、同じ化合物であることができる。いくつかの実施形態において、第1及び第2のゲスト化合物(それぞれ1606及び1605)は、異なる化合物であることができる。いくつかの実施形態において、少なくとも1つのゲスト化合物は、細胞抽出剤であることができる。いくつかの実施形態において、少なくとも1つのゲスト化合物は、本明細書に記載されるような検出試薬であることができる。いくつかの実施形態において、少なくとも1つのゲスト化合物は、細胞抽出剤であることができ、少なくとも1つのゲスト化合物は、検出試薬であることができる。
【0085】
いくつかの実施形態において、放出要素は、2つ以上のシェル構造を含むことができる。図17は、第1のシェル構造1701と、第2のシェル構造1702と、第3のシェル構造1703とを含む放出要素1740の実施形態を示す(放出要素1740のコアは、この図示せず)。この実施形態では、第2のシェル構造1702は、第1のゲスト化合物1705を含み、第3のシェル構造1703は、第2のゲスト化合物1706を含む。この実施形態では、それぞれの連続したシェル構造は、タマネギのような様式で次のシェル構造によって封入される。いくつかの実施形態において、第1及び第2のゲスト化合物(それぞれ1705及び1706)は、同じ化合物であることができる。いくつかの実施形態において、第1及び第2のゲスト化合物(それぞれ1705及び1706)は、異なる化合物であることができる。いくつかの実施形態において、少なくとも1つのゲスト化合物は、細胞抽出剤であることができる。いくつかの実施形態において、少なくとも1つのゲスト化合物は、本明細書に記載されるような検出試薬であることができる。いくつかの実施形態において、少なくとも1つのゲスト化合物は細胞抽出剤であることができ、少なくとも1つのゲスト化合物は、検出試薬であることができる。
【0086】
図18は、2つ以上のシェル構造を含む放出要素1840の代替実施形態を示す。放出要素1840は、第1のシェル構造1801と、第2のシェル構造1802と、第3のシェル構造1803とを有する。第2のシェル構造1802は、第1のゲスト化合物1805を含み、第3のシェル構造は、第2のゲスト化合物1806を含む。この実施形態では、第2のシェル構造1802及び第3のシェル構造1803の両方が、第1のシェル構造1801によって封入されている。いくつかの実施形態において、第1及び第2のゲスト化合物(それぞれ1805及び1806)は、同じ化合物であることができる。いくつかの実施形態において、第1及び第2のゲスト化合物(それぞれ1805及び1806)は、異なる化合物であることができる。いくつかの実施形態において、少なくとも1つのゲスト化合物は、細胞抽出剤であることができる。いくつかの実施形態において、少なくとも1つのゲスト化合物は、本明細書に記載されるような検出試薬であることができる。いくつかの実施形態において、少なくとも1つのゲスト化合物は、細胞抽出剤であり、少なくとも1つのゲスト化合物は、検出試薬であることができる。
【0087】
本開示の好適なシェル構造としては、参照によりその全体が本明細書に組み込まれる、米国特許第7,485,609号に記載されているような、例えば、セルロース、セルロース誘導体(例えば、セルロースエーテル、セルロースエステル、ニトロセルロース、セルローストリアセテート、セルロースアセテートフタレート、メチルセルロース、エチルセルロース、ヒドロキシプロピルセルロース、ヒドロキシプロピルメチルセルロース、カルボキシメチルセルロース、及びヒドロキシプロピルメチルセルロースフタレート);アクリレートのポリマー若しくはコポリマー、又はアクリレート誘導体のコポリマー(例えば、ポリアクリレート、ポリメチルアクリレート、ポリ(ポリアクリレート−メタクリレート)、ポリ(メタクリレート−メチルメタクリレート)、ポリエチルアクリレート−メチルメタクリレート、ポリ(エチルアクリレート−メチルメタクリレート−トリメチルアンモニオエチルメタクリレートクロリド)、及びポリ(エチルアクリレート−メチルメタクリレート−トリメチルアンモニオエチルメタクリレートクロリド));タンパク質(例えば、アルブミン、ゼラチン、ゼイン、カゼイン、コラーゲン、及びフィブリノゲン);ビニルポリマー(例えば、ポリ塩化ビニル、ポリ酢酸ビニル、ポリビニルアルコール、ポリスチレン、及びポリアクリロニトリル);ガム(例えば、グアーガム、アラビアガム、キサンタンガム、ローカストビーンガム);天然又は加工デンプン;デキストリン;デキストラン;キトサン;アルギン酸塩;並びに前述の任意の2つ以上の組み合わせを含むポリマーシェルが挙げられる。
【0088】
これに加えて又は代わりに、本開示の好適なシェル構造は、クロモニック物質を含むシェル構造を包含する。好適なクロモニック物質としては、例えば、参照によりその全体が本明細書に組み込まれる、米国特許第7,824,732号に記載されているようなシェル層を形成するものが挙げられる。
【0089】
クロモニック物質からなるシェル層は、ゲスト化合物(例えば、細胞抽出剤)の封入及び制御放出のために、特に有用であることができる。例えば、細胞抽出剤は、米国特許第7,824,732号に記載のクロモニックナノ粒子の中に封入されることができる。クロモニックスは、細胞抽出剤を特定の環境条件から保護した後、細胞抽出剤を他の環境条件下で制御可能に送達することができる。しかしながら、クロモニック物質と、多価カチオンと、HCO3−、PO43−、CH3CHOHCOO−、C3H5O(COO)33−、BO33−、及びSO42−からなる群から選択される酸性アニオンとを含む複合体を含むシェル(「複合シェル」)は、クロモニックス単独と比較して、特定の環境条件からの保護の増大を提供することが可能である。
【0090】
クロモニック物質の1つ以上のシェル層の中に封入されたクロモニックナノ粒子を含む多層クロモニック構造は、当該技術分野において既知である。細胞抽出剤は、クロモニックナノ粒子の中に、及び/又は、ナノ粒子を封入している1つ以上のクロモニックシェル層の中に封入されることができる。複合シェルは、1つ以上のクロモニックシェル層と組み合わされて使用されることができる(例えば、複合シェルは、最も内側のシェル層、中間のシェル層、最も外側のシェル層、又はこれらの任意の組み合わせであることができる)。複合シェル層は、細胞抽出剤の制御放出に増大した柔軟性を提供することができる(例えば、徐放)。
【0091】
本開示によるシェル層はまた、細胞抽出剤を実質的に包囲するワックス構造(例えば、カプセル)を包含する。いくつかの実施形態において、細胞抽出剤の概ね一体型の塊(例えば液体、固体、粒子などの複数の固体、半固体、又はこれらの組み合わせ)は、外側のワックスシェル内部に配置されることができる。ワックスが崩壊すると(例えば、熱融解又は機械的破砕によって)、細胞抽出剤は、ワックスから放出される。好適なワックスとしては、石蝋、微結晶ワックス、並びにこれらの誘導体及び/又は組み合わせが挙げられる。
【0092】
本開示によるシェル層はまた、脂質二重層(例えば、リポソーム)を包含する。リポソームは、当該技術分野において既知のリポソーム形成技術によって形成されることができる。リポソームは、細胞抽出剤の少なくとも一部がリポソームのコアに閉じ込められるように、細胞抽出剤を含有する溶液から形成されることができる。任意のタイプの脂質二重層を分裂させる可能性のある細胞抽出剤を含むことができる他の種類の放出要素とは大きく異なり、リポソーム放出要素は、リポソームの脂質二重層の一体性を実質的に損なわない細胞抽出剤を含有することができる。このような細胞抽出剤の非限定例としては、リゾチーム及びリソスタフィンなどのポリペプチド、及びリポソームを実質的に損なわない抗生物質が挙げられる。
【0093】
リポソームが液体(例えば、試料を含有する水性液体)と接触すると、細胞抽出剤は、例えば、脂質二重層を通る拡散によってリポソームから放出されてよい。いくつかの実施形態では、リポソームの全内容物(例えば、細胞抽出剤溶液)は、熱又は機械的エネルギー(例えば、熱、凍結融解、又は音波破砕)を用いて脂質二重層の一体性を分裂させる放出因子で、あるいは脂質二重層を透過性にする及び/又は可溶化するための化学物質放出因子を添加することにより、「破裂」して放出されてもよい。いくつかの実施形態では、リポソームの破壊は、参照によりその全体が本明細書に組み込まれる、PCT国際公開特許WO 2009/102859、発明の名称「POLYPEPTIDES FOR MICROBIAL DETECTION」に記載のように、細胞溶解性ペプチドを使用して引き起こされることができる。
【0094】
いくつかの実施形態では、本開示の放出要素は、基材上にコーティングされた細胞抽出剤を含むシェル構造を包含することができる。
【0095】
細胞抽出剤:
いくつかの実施形態において、化学的細胞抽出剤には、タンパク質(例えば、細胞溶解性ペプチド及び酵素)などの生化学物質が含まれる。いくつかの実施形態において、細胞抽出剤は、細胞の浸透性を高め、これにより細胞内部からの生物学的検体の放出を起こす。いくつかの実施形態において、細胞抽出剤は、細胞の溶解(例えば破裂又は部分的破裂)を起こすか又は促進することができる。
【0096】
いくつかの実施形態において、細胞抽出剤には、当該技術分野において既知の化学物質及び化学物質混合物が挙げられ、例えば、界面活性剤及び第四級アミン、ビグアニド、界面活性剤、フェノール類、細胞溶解性ペプチド、並びに酵素が挙げられる。典型的には、細胞抽出剤は、放出要素に(共有的又は非共有的のいずれかで)強く結合せず、放出要素が水性液体と接触すると、放出要素から放出されることができる。
【0097】
界面活性剤は、一般に、親水基及び疎水基の両方を含有する。放出要素は、アニオン性、非イオン性、カチオン性、両性、両性及び双極イオン性界面活性剤並びにこれらの混合物から選択される1種以上の界面活性剤を含有してよい。水中で解離し、カチオン及びアニオンを放出する界面活性剤は、イオン性と称される。存在する場合には、両性、両性及び双極性界面活性剤は、一般に、1つ以上のアニオン性及び/又は非イオン性界面活性剤と組み合わせて使用される。好適な界面活性剤及び第四級アミンの非限定的な例には、TRITON X−100、Nonidet P−40(NP−40)、Tergitol、サルコシル、Tween、SDS、Igepal、サポニン、CHAPSO、塩化ベンザルコニウム、塩化ベンゼトニウム、「セトリミド」(ドデシル−、テトラデシル−、及びヘキサデシル−トリメチルアンモニウムブロミドの混合物)、塩化セチルピリジウム、メタ(アクリルアミドアルキルトリメチルアンモニウム塩(例えば、3−メタクリルアミドプロピルトリメチルアンモニウムクロリド、及び3−アクリルアミドプロピルトリメチルアンモニウムクロリド)、並びに(メタ)アクリロキシアルキルトリメチルアンモニウム塩(例えば、2−アクリロキシエチルトリメチルアンモニウムクロリド、2−メタクリロキシエチルトリメチルアンモニウムクロリド、3−メタクリロキシ−2−ヒドロキシプロピルトリメチルアンモニウムクロリド、3−アクリロキシ−2−ヒドロキシプロピルトリメチルアンモニウムクロリド、及び2−アクリロキシエチルトリメチルアンモニウムメチル硫酸塩)が挙げられる。他の好適なモノマーの第四級アミノ塩には、ジメチルアルキルアンモニウム基として、アルキル基が2〜22個の炭素原子又は2〜20個の炭素原子を有するものが挙げられる。即ち、モノマーは、式:
【0098】
−N(CH3)2(CnH2n+1)+の基を含む(式中、nは、2〜22の値の整数である)。代表的なモノマーには、以下の式のモノマーが挙げられるが、これらに限定されない。
【化1】

式中、nは、2〜22の範囲の整数である。
【0099】
好適なビグアニド(ビス−ビグアニドを含む)の非限定的な例には、ポリヘキサメチレンビグアニド塩酸塩、p−クロロフェニルビグアニド、4−クロロ−ベンズヒドリルビグアニド、アレキシジン、ハロゲン化ヘキシジン(例えばクロルヘキシジン(1,1’−ヘキサメチレン−ビス−5−(4−クロロフェニルビグアニド)を含むがこれに限定されない)、及びこれらの塩が挙げられる。
【0100】
好適なフェノール類の非限定的な例には、フェノール、サリチル酸、2−フェニルフェノール、4−t−アミルフェノール、クロロキシレノール、ヘキサクロロフェン、4−クロロ−3,5−ジメチルフェノール(PCMX)、2−ベンジル−4−クロロフェノール、トリクロサン、ブチル化ヒドロキシトルエン、2−イソプロピル−5−メチルフェノール、4−ノニルフェノール、キシレノール、ビスフェノールA、オルトフェニルフェノール、並びにフェノチアジン類(クロルプロマジン、プロクロルペラジン、及びチオリジジンなど)が挙げられる。
【0101】
好適な細胞溶解性ペプチドの非限定例には、A−23187(カルシウムイオノフォア)、デルマセプチン、リステリオリシン、レナレキシン、アエロリシン、デルマトキシン、マクラチン、ラナテウリン、アンホテリシンB、動物毒液由来の直接溶解因子、マガイニン、ルゴシン、アスカフィン、ジフテリア毒素、マキシミン、サポニン、Aspergillus属溶血素、ジスチンクチン、メリチン、黄色ブドウ球菌毒素(α、β、χ、δ)、アラメシチン、エスクレチン、メトリジオリシン、ストレプトリシンO、アポリポタンパク質、フィリピン、ニゲリシン、ストレプトリシンS、ATPトランスロカーゼ、ガエグリン、ナイスタチン、シネキシン、ボンビニン、GALA、オセラチン、スルファクチン、ブレビニン、グラミシジン、P25、ツブリン、ブフォリン、らせん構造赤血球溶解ペプチド、パルストリン、バリノマイシン、カエリン、溶血素、ホスホリパーゼ、ビブリオリシン、セレオリシン、イオノマイシン、フィロキシン、コリシン、KALA、ポリエン抗生物質、デルマジスチンクチン、LAGA、ポリミキシンBが挙げられる。
【0102】
好適な酵素の非限定的な例には、リゾチーム、リソスタフィン、バクテリオファージ溶解素、アクロモペプチダーゼ、ラビアーゼ、ムタノリジン、ストレプトリジン、テタノリジン、a−ヘモリジン、リチカーゼ、菌類由来の溶解酵素、セルラーゼ、ペクチナーゼ、Driselase(登録商標)、Viscozyme(登録商標)L、ペクトリアーゼが挙げられる。
【0103】
放出要素がヒドロゲルであるいくつかの実施形態では、ヒドロゲルが形成される前駆体組成物は、参照によりその全体が本明細書に組み込まれる、WO 2007/146722に記載されているようなアニオン性又はカチオン性モノマーを含有することができる。アニオン性又はカチオン性モノマーは、ヒドロゲルに組み込まれ、それ自体は細胞抽出剤活性を保持することができる。いくつかの実施形態において、アニオン性又はカチオン性モノマーは、ヒドロゲルの表面に架橋されることができる。ヒドロゲルのビーズ又は繊維をカチオン性モノマーの溶液に短時間浸してからすぐに取り出し、化学線(例えば、紫外線、電子線)を使用して架橋させることができる。これにより、カチオン性モノマーが、ヒドロゲルのビーズ又は繊維の外表面に化学的に結合する。
【0104】
いくつかの実施形態において、細胞抽出剤の様々な組み合わせが、前駆体組成物(これからヒドロゲルが合成される)中、又はソルビン酸塩(ヒドロゲルの合成後にヒドロゲル内に装填される)中に使用できる。前駆体組成物又はその結果として生じるヒドロゲルと相溶する任意の他の既知の細胞抽出剤を用いることができる。これらのものとしては、クロルヘキシジン塩、例えば、グルコン酸クロルヘキシジン(CHG)、パラクロロメタキシレノール(PCMX)、トリクロサン、ヘキサクロロフェン、グリセリン及びプロピレングリコールの脂肪酸モノエステル及びモノエーテル、例えばモノラウリン酸グリセロール、セチルトリメチルアンモニウムブロミド(CTAB)、モノカプリル酸グリセロール、モノカプリン酸グリセロール、モノラウリン酸プロピレングリコール、モノカプリル酸プロピレングリコール、モノカプリン酸プロピレングリコール、(C12〜C22)疎水性物質及び四級アンモニウム基又はプロトン化三級アミノ基を含むフェノール類、界面活性剤及びポリマー、四級シラン及びポリ四級アミンのような四級アミノ含有化合物、例えばポリヘキサメチレンビグアニド、遷移金属イオン、例えば銅含有化合物、亜鉛含有化合物、及び銀含有化合物、例えば金属銀、銀塩、例えば塩化銀、酸化銀、及びスルファジアジン銀、メチルパラベン、エチルパラベン、プロピルパラベン、ブチルパラベン、オクテニデン、2−ブロモ−2−ニトロプロパン−1,3ジオール、又は上記の任意の2つ以上の混合物が挙げられるが、これらに限定されない。
【0105】
好適な細胞抽出剤には、ジアルキルアンモニウム塩(N−(n−ドデシル)−ジエタノールアミンなど);カチオン性エトキシル化アミン(「Genaminox K−10」、Genaminox K−12、「Genamin TCL030」、及び「Genamin C100」など);アミジン(プロパミジン及びジブロモプロパミジンなど);ペプチド抗生物質(ポリミキシンB及びナイシンなど);ポリエン抗生物質(ナイスタチン、アンホテリシンB、及びナタマイシンなど);イミダゾール類(エコナゾール、クロトラミゾール及びミコナゾールなど);酸化剤(安定な形態の塩素及びヨウ素など);並びに米国特許第7,422,868号(その全体が参照により本明細書に組み込まれる)に記述されている細胞抽出剤が更に挙げられる。
【0106】
細胞抽出剤は、本発明の検出系(例えば、ルシフェラーゼ酵素などの検出試薬)を不活性化しないよう選択されるのが好ましい。強い細胞抽出剤(例えば、イオン性洗剤など)を必要とする微生物については、改善された検出系(例えば、これら試薬の存在下で強化された安定性を示すルシフェラーゼなどで、これらは米国特許出願第2003/0104507号に開示されているものが挙げられ、この全体が参照により本明細書に組み込まれる)が特に好ましい。
【0107】
本発明の方法は、放出要素から有効量の細胞抽出剤を放出させることにより、生きた細胞からの生物学的検体の放出を引き起こす。本開示には、当該技術分野において既知のさまざまな細胞抽出剤が含まれ、これらそれぞれは、放出要素から異なる速度で放出されてよく、かつ他とは異なる濃度で生きた細胞に対して影響を及ぼしてよい。以下は、細胞抽出剤の選択、及び放出要素中に含める有効量の決定の際に、考慮すべき要素に関するガイダンスを提供する。
【0108】
いずれの細胞抽出剤の有効性も、濃度及び曝露時間という主に2つの要素によって決定されることは、当該技術分野において既知である。即ち、一般に、細胞抽出剤の濃度が高いほど、生きた細胞にもたらす効果(例えば、細胞膜の浸透化及び/又は細胞からの生物学的検体の放出)は大きくなる。また、任意の所定の濃度の細胞抽出剤において、一般に、細胞抽出剤に生きた細胞をさらす時間が長いほど、細胞抽出剤の効果は大きくなる。他の付帯的な要素(例えば、pH、共溶媒、イオン強度、及び温度)は、特定の細胞抽出剤の有効性に影響を与えることが当該技術分野において既知である。これらの付帯的要素は、例えば、温度制御器、緩衝液、試料調製などによって制御できることが知られている。これらの要素並びに細胞抽出剤はまた、生物学的検体の検出に使用される検出系に対して影響を与えることもできる。いくつかの単純な実験を実施することによって、本開示の物品を生成し、本開示の方法を実行するのに有効な量の細胞抽出剤を決定することは、当業者の把握する領域内である。
【0109】
細胞及び/又は検出系に対する、様々な濃度の細胞抽出剤の効果を判定するための初期実験を実施することができる。最初に、候補放出要素を、生物学的検体の検出系に与える影響に関してスクリーニングすることができる。例えば、本明細書に記載されるように放出要素に細胞抽出剤を注入することができる。続いて、細胞抽出剤を含む放出要素を(細菌性細胞なしに)ATPアッセイに入れることができる。このアッセイを試薬等級ATP溶液(例えば約0.1〜約100ピコモルのATP)で実行することができ、放出要素をともなう試料中のルシフェラーゼ反応によって発光する生物発光量を、放出要素のない試料によって発光する生物発光量と比較することができる。好ましくは、放出要素を有する試料中の生物発光量は、放出要素を有さない試料中の生物発光量の50%超過である。好ましくは、放出要素を有する試料中の生物発光量は、放出要素を有さない試料中の生物発光量の90%超過である。最も好ましくは、放出要素を有する試料中の生物発光量は、放出要素を有さない試料中の生物発光量の95%超過である。
【0110】
加えて、細胞からの生物学的検体の放出に細胞抽出剤が与える影響を、PCT国際公開特許WO 2010/129726の実施例21に記載されているのと同様に、実験的に判定することができる。例えば、細胞(例えば、黄色ブドウ球菌などの微生物細胞)の懸濁液を、比較的幅広い範囲の濃度の細胞抽出剤(例えば、BARDAC 205M)に、検出系の存在下で、一定時間(例えば数分以内)さらすことにより、細胞からの生物学的検体を検出することができる(例えば、ルシフェリン、ルシフェラーゼ、及びpH約7.6〜7.8の緩衝液を含むATP検出系)。この生物学的検体を定期的に測定し、第一測定は通常、細胞抽出剤を混合液に加えた直後に行い、これにより、細胞からの生物学的検体(この例では、ATP)の放出が検出できるかどうかを調べることができる。この結果は、その細胞から放出される生物学的検体を検出するための最適条件(即ち、細胞抽出剤の液体濃度及び曝露時間)を示すことができる。PCT国際公開特許WO 2010/129726の表26に示されるように、この結果は、より高濃度の細胞抽出剤では、細胞抽出剤は、生物学的検体(例えば、ATP)の放出において効果が弱い可能性がある、及び/又は検出系に干渉する可能性がある(即ち、検出試薬によって生成された光又は色を吸収する可能性がある)ことも示すことができる。
【0111】
液体混合物中の有効量の細胞抽出剤を決定した後、本明細書に記述されている方法によって放出要素に組み込む細胞抽出剤の量を考慮すべきである。放出要素が液体混合物(例えば、水性懸濁液中の試料)と接触すると、細胞抽出剤は放出要素から放出されることができ(例えば、拡散により)、液体混合物中の細胞抽出剤の濃度は、平衡に達するまで増加する。理論に束縛されるものではないが、平衡に達するまで、細胞抽出剤の濃度勾配が液体中に存在し、放出要素の近くにある液体部分ではより高濃度の抽出剤が存在すると推定できる。細胞抽出剤の濃度が、細胞を含む液体部分で有効濃度に達すると、細胞は生物学的検体を放出する。放出された生物学的検体は、ここで、検出系によって検出することができるようになる。
【0112】
試料を含む液体中で細胞抽出剤を有効濃度にするのは、いくつかの要素によって制御することができる。例えば、放出要素に搭載された細胞抽出剤の量は、平衡に達した液体中での細胞抽出剤の最終濃度に影響を与える。加えて、液体混合物中の放出要素の量、及びいくつかの実施形態では、放出要素の表面積の量は、放出要素からの細胞抽出剤の放出速度、及び平衡に達した液体中の細胞抽出剤の最終濃度に影響を与えることができる。更に、水性媒体の温度は、放出要素が細胞抽出剤を放出する速度に影響を与えることができる。他の要素、例えば細胞抽出剤及び放出要素のイオン特性及び/又は疎水性特性が、放出要素から放出される細胞抽出剤の量、及び細胞抽出剤が放出要素から放出される速度に影響を与えることができる。これらの要素のすべてを、試料中の細胞の検出のために、望ましいパラメータ(例えば、その物品の製造時の検討事項及びその方法の結果を得るまでの時間など)を達成するよう、当業者が定期的に実験を行うことにより最適化することができる。一般に、細胞抽出剤が放出要素と試料物質を含む液体の容積との間の平衡に達したときに、有効量(放出要素のない細胞抽出剤を使用した実験により決定される)を達成するのに少なくとも充分な細胞抽出剤を、放出要素に組み込むのが望ましい。放出要素が有効量の細胞抽出剤を放出するのに要する時間を短くするために、(放出要素のない細胞抽出剤を使用した実験により決定された量よりも)多くの量の細胞抽出剤を放出要素に加えるのが望ましいことがある。
【0113】
放出要素がマトリックスを含むいくつかの実施形態では、細胞抽出剤は、マトリックスの中に拡散する、マトリックスから外へ拡散する、又はその両方であることができる。拡散速度は、例えば、マトリックス材料及び/又は架橋密度を変えること、マトリックスが作製される極性溶媒を変えること、マトリックスが作製される極性溶媒中の細胞抽出剤の溶解度を変えること、及び/又は細胞抽出剤の分子量を変えることによって、制御可能であるべきである。拡散速度はまた、マトリックスの形状、サイズ、及び表面トポグラフィーを変えることによっても改善することができる。
【0114】
理論に束縛されるものではないが、放出要素からの細胞抽出剤の移動は、放出要素と液体(例えば、試料を含む水性液体)が接触した際に、自然発生的に(例えば、拡散によって)起こることができると考えられている。いくつかの実施形態において、細胞抽出剤の放出要素からの移動は、促進されることができる。
【0115】
いくつかの実施形態では、細胞抽出剤の放出要素からの移動は、化学的促進剤を提供することによって促進される。化学的促進剤は、例えば、酸又は塩基であることができる。混合物のpHを変化させることにより、放出要素と細胞抽出剤との間のイオン相互作用を妨げ、それによって放出要素からの細胞抽出剤の移動を促進してよい。参照によりその全体が本明細書に組み込まれる、PCT国際公開特許WO2005/094792、発明の名称「ANIONIC HYDROGEL MATRICES WITH PH DEPENDENT MODIFIED RELEASE AS DRUG CARRIERS」は、薬物又は殺菌剤がpH依存的に調整されて放出されるヒドロゲル組成物を開示している。いくつかの実施形態では、細胞抽出剤の移動は、(例えば、塩を添加又は除去することによって)液体のイオン強度を変化させることで促進されることができる。
【0116】
いくつかの実施形態では、放出要素からの細胞抽出剤の移動は、機械的処理によって促進される。好適な機械的処理の非限定例には、放出要素を振動させる、撹拌する、又は圧縮することを含む。
【0117】
放出要素は、液体試料材料と静的に接触させるか、動的に接触させる(即ち、例えば振動、攪拌、エアレーション又は圧縮によって混合)か、あるいはこれらの組み合わせで接触させることができる。PCT国際公開特許WO 2010/129726の実施例16は、混合することで、有効量の細胞抽出剤の放出要素からのより迅速な放出を引き起こすことができることを示している。PCT国際公開特許WO 2010/129726の実施例17は、放出要素を圧縮することにより、いくつかの実施形態で、有効量の細胞抽出剤の放出要素からのより迅速な放出をもたらすことができることを示している。放出要素を圧縮することは、例えば、放出要素を表面に押し付けること及び/又放出要素を圧壊することを包含することができる。したがって、いくつかの実施形態において、混合することにより、細胞抽出剤のより迅速な放出を有利にもたらし、これにより試料中の生物学的検体(例えば、生きた細胞から)のより迅速な検出をたらすことができる。いくつかの実施形態において、放出要素の圧縮(例えば、スワブ若しくはスパチュラ、キャリア(後述)、又は他の好適な用具などの試料取得装置を使用して放出要素に対し圧力を加えることによって)により、細胞抽出剤のより迅速な放出を有利にもたらし、これにより試料中の生物学的検体のより迅速な検出をもたらすことができる。加えて、放出要素圧縮の工程は、操作者に便利な時点で細胞抽出剤の放出を加速させるために行うことができる。
【0118】
いくつかの実施形態において、静的な接触は、有効量の細胞抽出剤放出を遅らせることがあるため、生物学的検体の検出の前に、操作者が他の処理(例えば試薬の追加、装置の較正、及び/又は検体の輸送など)を実施するための追加の時間を提供することができる。いくつかの実施形態において、最初の生物学的検体測定が行われるまでは、混合物を静的に保持し、それから、有効量の細胞抽出剤放出に必要な時間を短縮するために動的に試料を混合することが有利な場合がある。
【0119】
本発明の方法において機能的な最も好ましい濃度又は濃度範囲は、異なる微生物及び異なる細胞抽出剤によって異なり、本明細書に記述されている方法、又は当業者に周知の方法を用いて経験的に決定され得ることが、充分に予測される。
【0120】
試料及び試料取得装置:
本開示の物品及び方法は、試料中の生物学的検体の検出法を提供する。いくつかの実施形態では、本物品及び方法は、試料中の生きた細胞からの生物学的検体の検出法を提供する。特定の実施形態では、本物品及び方法は、試料中の生きた微生物細胞の検出法を提供する。特定の好ましい実施形態では、本物品及び方法は、試料中の生きた細菌細胞の検出法を提供する。
【0121】
本明細書で使用する用語「試料」は、その最も広い意味で使用される。試料は、本発明を用いて分析される生物学的検体(例えば、ATP)を含む可能性のある組成物である。生物学的検体は、試料中の細胞(例えば、細菌)内に存在してよい。更に多くの場合、試料は、(任意に培地中の)細胞又は細胞集団、あるいは細胞可溶化物を含むことが知られている又は含むことが疑われる。試料はまた、表面に吸着細胞又は細胞集団を有してよい固体表面(例えば、スワブ、膜、フィルタ、粒子)であってもよい。こうした固体試料では、本発明に基づく細胞濃縮剤と混合することが可能な液体(例えば、水溶液)と固体を接触させることによって水性試料を調製することが考えられる。
【0122】
好適な試料としては、固体物質(例えば、粒子、フィルタ)、半固体物質(例えば、ゲル、固体の懸濁液、又はスラリー)、液体、又はこれらの組み合わせが挙げられる。好適な試料としては、固体、液体、又はこれらの組み合わせを含む表面残留物が更に挙げられる。表面残留物の非限定的な例としては、環境表面(例えば、床、壁、天井、媒介物、機器、水、及び水容器、エアフィルタ)、食品表面(例えば、野菜、果物、及び肉の表面)、食品加工表面(例えば、食品加工装置及びまな板)、並びに臨床表面(例えば、組織試料、皮膚、及び粘膜)からの残留物が挙げられる。試料にはまた、原油若しくは粗精製油、ガソリン、又は塗料などの混合物を含むことができる。
【0123】
生物学的検体の検出のための試料物質(表面残留物を含む)の採取法は、当該技術分野では周知である。ピペット、スパチュラ、スポンジ、スワブなどを含むそれぞれの種の試料取得装置がこれまでに述べられており、本発明の方法において使用することができる。
【0124】
細胞濃縮剤:
本開示の方法では、液体試料中に存在する細胞と結合する細胞濃縮剤を使用する。細胞濃縮剤を液体試料と所定の時間接触させる。細胞は、共有結合又は非共有結合(例えば、疎水性又はイオン性相互作用)によって、あるいは共有結合と非共有結合との組み合わせによって細胞濃縮剤と結合することができる。細胞が細胞濃縮剤と結合した後、例えば、沈降、凝集、遠心、濾過、又はこれらの任意の組み合わせによって細胞濃縮剤を液体試料から除去することができる。
【0125】
「細胞濃縮剤」とは、液体に懸濁可能であることによって液体中に存在する微生物を捕捉かつ保持することができる物質(例えば、粒子、繊維)を含む広い意味で使用される。細胞濃縮剤は、濾過処理によって回収することができるが、微生物を捕捉するうえで必ずしも濾過処理を必要としない。
【0126】
特定の細胞濃縮剤が当該技術分野において知られており、本開示の方法における使用に適している。好適な細胞濃縮剤の非限定的な例としては、ヒドロキシアパタイト(Berryら、Appl.Environ.Microbiol.;63:4069〜4074;1997)、磁気ビーズ(Osterら、J.Magnetism and Magnetic Mat.;225:145〜150;2001)、フェリ磁性鉱物、マグネタイト、キトサン、及び親和性支持物質が挙げられる。試料から微生物を捕捉又は濃縮するための固定化金属支持物質を含む組成物の使用は、参照によりその全体が本明細書に組み込まれる、米国特許出願公開第2010/0062421号、発明の名称「COMPOSITIONS,METHODS,AND DEVICES FOR ISOLATING BIOLOGICAL MATERIALS」に記載されている。
【0127】
濃縮剤の例示的な種類の1つとしては、珪藻土及び表面処理した珪藻土が挙げられる。こうした濃縮剤の具体例は、その開示内容が参照により本明細書に組み込まれる、同一出願人による米国特許出願公開第2010/0209961号、発明の名称「MICROORGANISMS CONCENTRATION PROCESS AND AGENT」に見出すことができる。無機材料は、水系に分散又は懸濁されると、その物質及び水系のpHに特徴的な表面電荷を示す。物質−水の界面の両側の電位は「ゼータ電位」と呼ばれ、電気泳動における移動度から(即ち、水系中に置かれた帯電電極間を物質の粒子が移動する速度から)計算することができる。一実施形態では、濃縮剤は、非処理の珪藻土のゼータ電位よりも少なくともある程度正のゼータ電位を有してよく、こうした濃縮剤は、その表面が一般的に負に帯電する傾向を有する細菌などの微生物を濃縮するうえで非処理の珪藻土と比較して驚くほど顕著に効果的となりうる。
【0128】
濃縮剤の代表的な種類の1つとして珪藻土がある。濃縮剤の別の代表的な種類として、表面処理した珪藻土がある。代表的な表面処理としては、二酸化チタンなどの表面改質剤、微細なナノスケールの金若しくは白金、又はこれらの組み合わせがある。こうした表面処理は、微生物を濃縮するうえで非処理の珪藻土と比較して驚くほど顕著に効果的となり得る。表面処理としてはまた、酸化第二鉄、酸化亜鉛、酸化アルミニウム、及びこれらに類するもの、並びにこれらの組み合わせから選択される金属酸化物が挙げられる。一実施形態では、酸化第二鉄が使用される。金などの貴金属は抗微生物特性を示すことが知られているが、金含有濃縮剤は、微生物を結合するうえで有効であるばかりでなく、検出又はアッセイ用に微生物を生存状態に維持するうえでも有効である。
【0129】
有用な表面改質剤としては、微細なナノスケールの金、微細なナノスケールの白金、少なくとも1つの金属酸化物(例えば、二酸化チタン、酸化第二鉄、又はこれらの組み合わせ)と組み合わせた微細なナノスケール金、二酸化チタン、少なくとも1つの他の(即ち、二酸化チタン以外)金属酸化物と組み合わせた二酸化チタン、及びこれらに類するもの、並びにこれらの組み合わせが挙げられる。一実施形態では、微細なナノスケール金、微細なナノスケール白金、少なくとも酸化第二鉄若しくは二酸化チタンと組み合わせた微細なナノスケール金、二酸化チタン、少なくとも酸化第二鉄と組み合わせた二酸化チタン、又はこれらの組み合わせのような表面改質剤を使用することができる。
【0130】
一実施形態では、以下のような表面改質剤を使用することができる:微細なナノスケール金、微細なナノスケール白金、酸化第二鉄又は二酸化チタンと組み合わせた微細なナノスケール金、二酸化チタン、酸化第二鉄と組み合わせた二酸化チタン、及びこれらの組み合わせ。一実施形態では、微細なナノスケール金、酸化第二鉄又は二酸化チタンと組み合わせた微細なナノスケール金、酸化第二鉄と組み合わせた二酸化チタン、及びこれらの組み合わせを使用することができる。一実施形態では、微細なナノスケール金、酸化第二鉄又は二酸化チタンと組み合わせた微細なナノスケール金、及びこれらの組み合わせを使用することができる。
【0131】
濃縮剤の別の代表的な種類として、γ−FeO(OH)(レピドクロサイトとしても知られる)がある。こうした濃縮剤の具体例は、同一出願人による米国特許出願公開第2010/0248214号、発明の名称「MICROORGANISM CONCENTRATION PROCESS」に見出すことができ、その開示は参照により本明細書に組み込まれる。こうした濃縮剤は、食品及び水によって媒介される疾患及びヒトの細菌感染において重大な問題となりうるグラム陰性菌を捕捉するうえで他の鉄含有濃縮剤と比較して、驚くほど効果的であることが見出されている。濃縮剤は、他の成分(例えば、ベーマイト(α−AlO(OH)、粘土、酸化鉄、及び酸化ケイ素など)を(γ−FeO(OH)以外に)更に含んでよい。このような他の成分が含まれる実施形態では、他の成分は試料と濃縮剤との密接な接触を一般的に大きく妨げない。
【0132】
γ−FeO(OH)は既知の物質であり、公知の方法によって化学的に合成することができる(例えば、米国特許第4,729,846号(Matsuiら)(この記載内容は参照によりその全体が本明細書に組み込まれる)に磁気テープ製造を目的として述べられているように、中性又は弱酸性pHで水酸化第一鉄の酸化によって)。γ−FeO(OH)はまた、市販されている(例えば、Johnson Matthey Company(Ward Hill,MA)グループの一企業であるAlfa Aesar及びSigma−Aldrich Corporation(St.Louis,MO)。
【0133】
γ−FeO(OH)を濃縮剤として使用する一実施形態では、γ−FeO(OH)は、一般的に微粒子の形態である。一実施形態では、γ−FeO(OH)は、約3マイクロメートル(他の実施形態では、約5マイクロメートル、又は約10マイクロメートル)〜約100マイクロメートル(他の実施形態では、約80マイクロメートル、又は約50マイクロメートル、又は約35マイクロメートル、ただし任意の下限値を範囲の任意の上限値と組み合わせることができる)の範囲の粒径(最大の寸法)を有する微粒子の形態である。一実施形態では、粒子は、より小さな粒子の凝集体である。粒子は、粒径約1マイクロメートル未満(一実施形態では粒径約0.5マイクロメートル未満)の微結晶を含むことができる。微結晶は、針状微結晶として、針状微結晶を含むいかだ状構造として、又は針状微結晶といかだ状構造との組み合わせとして存在することができる。
【0134】
一実施形態では、濃縮剤は、BET(ブルナウアー・エメット・テラー)法(窒素ガス分子の物理的吸着による固体の表面積計算)によって測定される表面積が、1グラム当たり約25平方メートル(m2/g)よりも大きく、一実施形態では約50m2/gよりも大きく、更に別の実施形態では約75m2/gよりも大きい。
【0135】
粒子の凝集形態は、微粒子にしばしばともなう取扱い及びその他の危険性をともなわずに、微粒子システムの吸着能を与え得るものである。加えて、そのような凝集体粒子は液体中で容易に沈殿し得るものであり、このため液相から微生物を速やかに分離することが可能となる(同時に、濾過時の背圧が低くて済む)。
【0136】
濃縮剤の別の代表的な種類としては、金属ケイ酸塩がある。こうした濃縮剤の具体例は、その開示内容が参照により本明細書に組み込まれる、同一出願人による米国特許出願公開第2010/0190171号、発明の名称「MICROORGANISM CONCENTRATION PROCESS」に見出すことができる。代表的な金属ケイ酸塩は、X線光電子分光法(XPS)で測定した場合に、金属原子とケイ素原子の比が約0.5以下(ある実施形態では、約0.4以下、別の実施形態では、0.3以下、更に別の実施形態では、約0.2以下)の表面組成を有することができる。ある実施形態では、表面組成はまた、X線光電子分光法(XPS)で測定した場合に、少なくとも平均10原子パーセントの炭素(ある実施形態では、少なくとも平均約12原子パーセントの炭素、更に別の実施形態では、少なくとも平均約14原子パーセントの炭素)を含む。XPSは、試料表面の最も外側のほぼ3〜10ナノメートル(nm)の元素組成を定量することができ、水素及びヘリウムを除いて周期率表中のすべての元素に感度のある手法である。XPSは、大多数の元素に対して0.1〜1原子パーセント濃度範囲の検出限界を持つ定量的な手法である。XPSの代表的な表面組成の評価条件としては、受光立体角±10°で試料表面に対して測定される取り出し角90°がある。
【0137】
金属ケイ酸塩などの無機材料は、水系に分散又は懸濁されると、その材料及び水系のpHに特徴的な表面電荷を示す。物質−水の界面の両側の電位は「ゼータ電位」と呼ばれ、電気泳動における移動度から(即ち、水系中に置かれた帯電電極間を物質の粒子が移動する速度から)計算することができる。代表的な濃縮剤は、例えば、普通のタルクなどの一般的な金属ケイ酸塩のゼータ電位よりも負のゼータ電位を有することができる。それにも関わらず、こうした濃縮剤は、表面が一般的に負に帯電する傾向を有する細菌などの微生物を濃縮するうえでタルクと比較して驚くほど効果的である。一実施形態では、濃縮剤は、pH約7において負のゼータ電位(一実施形態では、pH約7において約−9ミリボルト〜約−25ミリボルトの範囲のスモルコフスキーゼータ電位、別の実施形態では、pH約7において約−10ミリボルト〜約−20ミリボルトの範囲のスモルコフスキーゼータ電位、更に別の実施形態では、pH約7において約−11ミリボルト〜約−15ミリボルトの範囲のスモルコフスキーゼータ電位)を有する。
【0138】
有用な金属ケイ酸塩としては、これらに限定されるものではないが、マグネシウム、カルシウム、亜鉛、アルミニウム、鉄、チタン、及びこれらに類するもの、並びにこれらの組み合わせなどの金属の非晶質ケイ酸塩が挙げられる。一実施形態では、マグネシウム、亜鉛、鉄、チタン、又はこれらの組み合わせを使用することができる。更に別の実施形態では、マグネシウムを使用することができる。一実施形態では、少なくとも部分的に融合した粒子の形態の非晶質金属ケイ酸塩を使用することができる。一実施形態では、非晶質の球状化された金属ケイ酸塩を使用することができる。更に別の実施形態では、球状化された非晶質ケイ酸マグネシウムを使用することができる。金属ケイ酸塩は既知であり、公知の方法によって化学的に合成するか、又は天然に生じる未加工鉱石の採鉱及び処理によって入手することができる。
【0139】
いくつかの非晶質金属ケイ酸塩は、市販されている。例えば、球状化された非晶質ケイ酸マグネシウムは、化粧品の処方における使用を目的として市販されている(例えば、3M Company(St.Paul,MN)より販売されるCosmetic Microspheres CM−111として)。
【0140】
非晶質金属ケイ酸塩に加えて、濃縮剤が上記の表面組成を有するかぎりにおいて、濃縮剤は、金属(例えば、鉄又はチタン)の酸化物、結晶性金属ケイ酸塩、他の結晶性物質、及びこれらに類するものを含む他の物質を更に含んでよい。一実施形態では、濃縮剤は結晶性シリカを基本的に含まない。
【0141】
濃縮剤は、試料の接触及び微生物の捕捉に適した任意の形態で使用することができる。一実施形態では、濃縮剤は粒子の形態で使用される。一実施形態では、濃縮剤は微粒子の形態である。一実施形態では、濃縮剤は約1マイクロメートル(一実施形態では、約2マイクロメートル)〜約100マイクロメートル(一実施形態では、約50マイクロメートル、別の実施形態では、約25マイクロメートル、更に別の実施形態では、約15マイクロメートル、ただし任意の下限値を範囲の任意の上限値と組み合わせることができる)の範囲の粒径を有する微粒子の形態である。
【0142】
濃縮剤を使用した微生物の濃縮又は捕捉は、微生物の特定の株、種又はタイプに特異的なものではなく、したがって試料中の一般的な微生物の集団を濃縮するものである。次いで、株特異的なプローブによる任意の公知の検出方法を用いて、捕捉された微生物の集団から微生物の特定の株を検出することができる。したがって、この濃縮剤は、臨床試料、食品試料、環境試料、又は他の試料中の汚染微生物又は病原体(特に細菌などの食品によって媒介される病原体)の検出に使用することができる。
【0143】
本発明のプロセスを実施するうえで、濃縮剤は、試料との接触及び微生物の捕捉に適した任意の形態で使用することができる(例えば、粒子の形態で使用するか、あるいは微小流体装置のディップスティック、フィルム、フィルタ、チューブ、ウェル、プレート、ビーズ、膜、若しくはチャネル、又はこれらに類するものなどの支持体に塗布して)。好ましくは、濃縮剤は、粒子の形態で使用される。
【0144】
必要に応じて、細胞濃縮剤は、微生物と結合することが可能な結合相手(例えば、抗体、抗体フラグメント、抗原結合ドメイン、レクチン(例えば、コンカナバリンA)、受容体、ファージ受容体、又はこれらに類するもの)を含んでよい。結合は、直接的なものであっても、間接的なものであってもよい。結合は、特定の微生物の種類に対して選択的であってもよく、あるいは非選択的あってもよい。
【0145】
試料から微生物を捕捉するために使用される濃縮剤の量は、使用される濃縮剤の種類、試料のサイズ、貯留部の種類及びサイズ、試料の混合、特定の用途、本明細書では詳細に考察されない他の因子、又はこれらの組み合わせに少なくとも一部よって決まる。捕捉効率(濃縮剤と結合した試料中の微生物の比率)は、微生物を濃縮剤と長時間かけて接触させることによって一般的に高めることができる。捕捉効率は、濃縮剤の濃度を高くすることによって高めることもでき、高濃度の濃縮剤は、微生物が捕捉されるまでに移動する平均拡散距離を小さくすることから、インキュベーション時間が短縮される。したがって、一般論として、より多くの濃縮剤を加えるほど、同じ量の微生物を捕捉するために必要とされるインキュベーション時間は短くなる。
【0146】
一実施形態では、濃縮剤の適切な量は、微生物が濃縮剤に結合するのを待つのに要する時間(「捕捉時間」と呼ぶ)に応じて変化することができる。例えば、1分間の捕捉時間では、試料10mL当たり1000mgの濃縮剤が適切であり、10分間の捕捉時間では、試料10mL当たり100mgの濃縮剤が適切であり、60分間の捕捉時間では、試料10mL当たり10mgの濃縮剤が適当であり得る。一実施形態では、試料10mL当たり約1mg〜約100mgの濃縮剤を使用することができる。一実施形態では、試料10mL当たり約1mg〜約50mgの濃縮剤を使用することができる。一実施形態では、試料10mL当たり約10mg〜約25mgの濃縮剤を使用することができる。例えば、金属ケイ酸塩濃縮剤を使用する一実施形態では、試料10mL当たり約10mgの金属ケイ酸塩濃縮剤を使用することができる。例えば、金属ケイ酸塩濃縮剤を使用する一実施形態では、試料10mL当たり約25mgの金属ケイ酸塩濃縮剤を使用することができる。
【0147】
検出装置:
本開示は、試料中の微生物を検出するために使用することができる装置を提供する。装置は、少なくとも2個の貯留部を含み、その間に通路を有するハウジングと、ハウジングの第1の貯留部内に配置された任意の細胞濃縮剤と、ハウジング内の少なくとも2個の貯留部を隔離するための手段と、ハウジングの第1の貯留部から第2の貯留部へと細胞濃縮剤を移動させるための手段とを含むことができる。いくつかの実施形態では、ハウジングは、2個の貯留部を隔離するための手段(例えば、破断可能なシール)を含むことができる。いくつかの実施形態において、ハウジングは、細胞濃縮剤をハウジングの第1の貯留部から第2の貯留部へと移動させるための手段(例えば、弁)を含むことができる。いくつかの実施形態では、装置は、微生物を検出するための試薬を更に含むことができる。特定の実施形態では、装置は、細胞抽出剤を含む放出要素を更に含むことができる。細胞抽出剤は、微生物からの生物学的検体の検出を促進することができる。
【0148】
ここで図1Aを参照すると、本開示に基づく検出装置100の一実施形態の構成要素の断面図が示される。検出装置の構成要素は、ハウジング110とプランジャ150とを含む。ハウジング110は、下側部分114に隣接した上側部分112を含む。上側部分112と下側部分114とは、型成形などの当該技術分野では周知の方法によって、ポリエチレン又はポリプロピレンなどのポリマー材料から別々に形成することができる。それぞれの部分は、実質的に液密な結合を与えるように一体に圧入されるような寸法とするか、あるいは当該技術分野において知られる手段(例えば、接着剤、超音波溶接など)によって一体に結合することができる。また、ハウジングは、例えば、中空体を押し出し成形し、通路を型成形し、熱を用いたプロセスによってハウジングの底をシールするなど、当該技術分野において知られるプロセスによって単一のユニットとして形成することもできる。他の実施形態では、狭い通路を含む挿入部材を一体型ハウジング内に配置して、第1及び第2の貯留部(それぞれ120及び124)を形成することができる。
【0149】
上側部分112の、下側部分114からみて遠位となる端部には、プランジャ150を受容するような寸法の開口部113が形成される。上側部分112の反対側の端部には、ハウジング110の下側部分114内に開口する通路116が形成される。図に示される実施形態では、第1の貯留部120の断面積よりも小さい断面積を有する通路116が、上側部分112を形成する壁の内向きの延長部として示される。あるいは、通路116は、上側部分112の壁の内側にハウジング110の下側部分114に隣接して嵌まる挿入要素によって形成されてよい(図に示されていない)。挿入要素は、ハウジング110の下側部分114に隣接した通路116を形成することができる。図1Aの上側部分112、下側部分114、及び通路116の相対的比率はあくまで例示的なものであって、試料の体積及び/又は器具の制限条件などの異なるパラメータに対応するうえで必要に応じて適合させることができる。
【0150】
プランジャ150は、一端にハンドル152を、他端に複数のシール(第1の下側シール156及び第2の下側シール157)を有するシャフト151を含む。必要に応じて、プランジャ150は1つ以上の上側シール154及び/又はインデックスマーク153を含むことができる。ハンドル152、第1の下側シール156、及び第2の下側シール157間の相対的な距離については後述する。図1Aに更に示されているのは、任意の検出試薬165及び任意の放出要素162である。
【0151】
「検出試薬」とは、本明細書ではその最も広い意味で使用される。検出試薬とは、生物学的検体を検出するために反応中で使用することのできる試薬である。検出反応の非限定的な例としては、結合相手間の相互作用(例えば、抗原−抗体、受容体−リガンド、プローブ−標的分子、及びハイブリダイゼーション結合相互作用など)、及び/又は酵素反応(例えば、蛍光発生反応、色素生成反応、光発生反応、又は重合反応などの酵素媒介反応)が挙げられる。検出試薬は検出反応に関与する(例えば、結合相手、酵素、酵素基質、又は指示薬として)ものでもよく、かつ/又は検出反応を促進する(例えば、緩衝剤、補因子、又は共役反応の成分として)ものでもよい。検出試薬の例としては、例えば、ルシフェラーゼ、アデニル酸キナーゼ、ペルオキシダーゼ、アルカリフォスファターゼ、アピラーゼなどの酵素、例えば、ルシフェリン、リン酸メチルウンベリフェリル、o−ニトロフェニルリン酸、p−ニトロフェニルリン酸、及び5−ブロモ−4−クロロ−3−インドキシル−リン酸塩などの酵素基質、例えば、リン酸緩衝液、TRIS緩衝液、及びHEPES緩衝液などの緩衝液、並びに、FADH、NADH、補酵素Aなどの補因子が挙げられる。
【0152】
検出試薬は、様々な形態でハウジング110内に含まれることができる。例えば、検出試薬165は、図1Aに示されるような乾燥した又は部分的に乾燥したコーティングからなることができる。検出試薬165に適した別の形態(図に示されていない)は当該技術分野では周知のものであり、例えば、液体試薬(必要に応じて、アンプルのような破断可能な区画内に入った)、粉末、ゲル、錠剤、凍結乾燥試薬、コーティングされたフィルム、ケーキ、及び、完全乾燥試薬などが挙げられる。
【0153】
図1Bは、図1Aのプランジャ150を有するハウジング110を含む検出装置100の断面図を示す。この図は、装置100を使用前に保管することができるような形態を示す。プランジャ150は、ハウジング110内に完全に挿入されている。この位置では、ハンドル152の下縁部がハウジング110の上側部分112の開口部113を封鎖することによって、ハウジング110への物質の出入りが防止されている。必要に応じて用いられる上側シール154も、ハウジング110への物質の出入りを防止するうえで機能することができる。上側シール154はハウジング110の上側部分112の壁の内表面と接触するような寸法に構成され、バリア、好ましくは液密バリアを形成するのに適した材料(例えば、ポリプロピレン、ブチルゴムなど)で形成される。
【0154】
プランジャ150が図1Bに示される位置にある場合、第1の下側シール156が通路116を封鎖することにより、ハウジング110の第1の貯留部120が第2の貯留部124から隔離される。プランジャ150が図1Bに示される位置にある場合、プランジャ150の第2の下側シール157を含む部分が第2の貯留部124内に延びており、この部分はハウジング110の下側部分114の壁と接触していない。第1の下側シール156及び第2の下側シール157は通路116の壁と接触するような寸法となっており、第1の貯留部120と第2の貯留部124との間において通路116内にバリア、好ましくは液密バリアを形成するのに適した材料(例えば、ポリプロピレン、ブチルゴム)で形成される。また、図1Bには、第1の貯留部120内に位置決めされた、任意の濃縮剤130が示される。
【0155】
図1Cは、プランジャ150が第2の位置にある図1Bの装置100の断面図を示す。このプランジャ150は、例えばハウジング110内に試料を装填するために使用できる。プランジャ150は、ハンドル152を把持して、第2の下側シール157が通路116の上端に近くなる位置にまで引き出すことができる。必要に応じて用いられるプランジャシャフト151上のインデックスマーク153を用いて(例えば、インデックスマーク153が開口部113と整列した時点で)、この位置に達するためのプランジャ150の適切な位置を示すことができる。図1Cは、第1の貯留部120内の濃縮剤130と接触している液体試料140を更に含む。使用時には、装置100を、例えば、ボルテックスにかける又は振動させることによって濃縮剤130と液体試料140とを混合することができる。所定の時間の後、濃縮剤130は、図1Cに示すように第1の貯留部120の底に沈殿することができる。いくつかの実施形態では、必要に応じて用いられるテーパ領域118が通路116に隣接して配置される。テーパ領域118は、ハウジング110の上側部分112及び/又は通路116と同じ材料及び/又はプロセスによって形成することができる。使用時には、テーパ領域118は、ハウジング110の内部において通路116の方向に沈降する、液体に懸濁された粒子(例えば、細胞濃縮剤130)を通路116の方向に向かわせることができる。
【0156】
図1Dは、図1Bに示される第1の位置にプランジャ150が戻された、図1Cの装置100の断面図を示す。ハンドル152の下縁部は開口部113に近い位置にあり、液体試料の、濃縮剤130を含む部分142が第2の貯留部124に移され、そこで部分142は検出試薬165(図1Aに示される)が存在する場合に試薬165と相互作用することができる。部分142と検出試薬165との間の相互作用の非限定的な例としては、検出試薬の溶解及び/又は懸濁、検出試薬と部分中に存在する生物学的検体との間の結合相互作用、及び/又は酵素反応が挙げられる。図1Dはまた、液体試料の部分142が第2の貯留部124内の放出要素162と接触している状態を示しており、これにより放出要素162から細胞抽出剤が放出されることができる。
【0157】
図1に示す実施形態では、第2の貯留部124から第1の貯留部120を隔離するための手段は、プランジャ150の第1の下側シール156及び/又は第2の下側シール157と通路116との組み合わせから構成される。図1に示す実施形態では、濃縮剤130を第1の貯留部120から第2の貯留部124に移動させるための手段は、通路116と、プランジャ150の第1の下側シール156及び第2の下側シール157とを含む。
【0158】
図2Aは、本発明に基づく検出装置200の一実施形態の構成要素であるプランジャ250の断面図、及びハウジング210の部分分解断面図である。ハウジング210は、下側部分214に隣接した上側部分212を含む。上側部分212及び下側部分214は、上記に述べたように形成することができる。
【0159】
上側部分212の、下側部分214からみて遠位となる端部には、プランジャ250を受容するような寸法の開口部213が形成される。上側部分212の反対側の端部には、上記に述べたような通路216が形成される。必要に応じて用いられる上記に述べたようなテーパ領域218が、通路216に隣接して形成される。破断可能なシール260a及び260bによって、ハウジングが第1の貯留部220、第2の貯留部224、及び第3の貯留部226に分割される。この実施形態では、第3の貯留部226は、第1の貯留部220と第2の貯留部224との間に配置される。破断可能なシール260a及び260bは耐水性材料(例えば、薄いポリマーフィルム、ポリマーコーティングされた紙、薄い箔など)で形成されることが好ましく、当該技術分野では周知の材料及び/又はプロセス(例えば、接着剤、熱シール、超音波接着)を用いて耐水性の破断可能なバリアを形成するようにハウジング210の壁に固定することができる。
【0160】
第3の貯留部226内に位置決めされているのは、細胞抽出剤を含む放出要素262である。いくつかの実施形態において、放出要素は、ヒドロゲルを含むことができる。細胞抽出剤を含むヒドロゲルの好適な例は、参照によりその全体が本明細書に組み込まれる、PCT国際公開特許WO 2010/039627、発明の名称「BIODETECTION ARTICLES」に述べられている。
【0161】
図2Aの3個の貯留部の相対的比率はあくまで例示的なものであって、試料の体積及び/又は器具の制限条件などの異なるパラメータに対応するうえで必要に応じて適合させることができる。図2Aには更に、必要に応じて用いられる濃縮剤230、本明細書で述べるような必要に応じて用いられる検出試薬265、及び必要に応じて用いられる着脱式キャップ278が示されている。キャップ278は、当該技術分野では周知のプロセス(例えば、型成形)を用いてポリマー材料(例えば、ポリエチレン、ポリプロピレンなど)から形成することができ、ハウジング210の液密カバーを形成するような寸法とすることができる。
【0162】
プランジャ250は、一方の端部にハンドル252を、反対側の端部に下側シール256及び穿孔端259を有するシャフト251を含む。好ましくは、下側シール256は通路216の壁と接触するような寸法となっており、通路216内にバリア、好ましくは液密バリアを形成するのに適した材料(例えば、ポリプロピレン、ブチルゴムなど)で形成される。必要に応じて、プランジャ250は、上記に述べたような1つ以上の上側シール254を含んでよい。ハンドル252、下側シール256、及び穿孔端259間の相対距離については後述する。
【0163】
図2Bは、図2Aの装置200の断面図を示す。この図では、ハウジング210は第1の貯留部220内に液体試料240を更に含む。キャップ278はハウジング210上にしっかりと着座しているため、ハウジング210をボルテックス、振動、振盪、又は反転するなど、当該技術分野では周知のプロセスによって液体試料240を細胞濃縮剤230と混合することができる。混合の後、細胞濃縮剤230を通路216内の破断可能なシール260a上に沈殿させることができる。
【0164】
図2Cは、プランジャ250が部分的に挿入された図2Bのハウジング210を含む装置200の断面図を示す。この位置では、プランジャ250の下側シール256が通路216の壁と接触することにより、通路216内において少なくとも部分242を液体試料240の残りの部分から隔離している。通路216内には、細胞濃縮剤230が更に隔離されている。
【0165】
図2Dは、プランジャ250が完全に挿入された図2Cの装置200の断面図を示す。プランジャ250の下側シール256が通路216の壁に接触し、穿孔端259が破断可能なシール260a及び260bに穿孔していることにより、液体試料の部分242、細胞濃縮剤230、及び放出要素262が第2の貯留部224内に移され、そこで任意の検出試薬265(図2Aに示される)が存在する場合に部分242が検出試薬265と相互作用することができる。部分242と検出試薬265との間の相互作用の非限定的な例としては、検出試薬の溶解及び/又は懸濁、検出試薬と部分中に存在する生物学的検体との間の結合相互作用、及び/又は酵素反応が挙げられる。
【0166】
図2に示される実施形態では、第2の貯留部224から第1の貯留部220を隔離するための手段には、破断可能なシール260a及び260bが含まれる。第2の貯留部224から第1の貯留部220を隔離するための手段には、プランジャ250の下側シール256と通路216との組み合わせが更に含まれることができる。図2に示される実施形態では、第1の貯留部220から第2の貯留部224に細胞濃縮剤230を移動させるための手段には、プランジャ250の穿孔端259及び下側シール256と、通路216とが含まれる。
【0167】
図3Aは、本開示に基づく検出装置300の一実施形態の正面図を示す。装置300は、ハウジング310及び必要に応じて用いられるキャップ378を含む。ハウジング310は、上記に述べたように上側部分312、通路316、及び下側部分314を有するように構成することができる。必要に応じて用いられるキャップ378は、上記に述べたように構成することができる。装置300は、図3Aの第1の位置に示される弁アクチュエータ372を有する行き止まり弁370を更に含む。図3Bは、図3Aの装置300及び弁アクチュエータ372の側面図である。
【0168】
図3Cは、図3Aに示される装置300の断面図を示す。装置300は、キャップ378及びハウジング310を含む。ハウジング310は、上側部分312及び下側部分314を含む。上側部分312は、内部に行き止まり弁370が配置された通路316を含む。行き止まり弁370は、弁がこの第1の位置にある場合に第1の貯留部320と流体連通する弁キャビティ374を含む。弁キャビティ374は、第1の貯留部320内の液体試料340と接触する、任意の細胞濃縮剤330を含む。第2の貯留部324は、ともに本明細書に記載されているような、任意の放出要素362及び/又は任意の検出試薬365を収容する。また、図3Cには、本明細書で述べるような、必要に応じて用いられるテーパ領域318が示されている。
【0169】
図3Dは、弁370が第2の位置にある図3Cの装置300の断面図を示す。弁370が第2の位置にある場合、液体試料の、細胞濃縮剤330を含む部分342は隔離されて第2の貯留部324に移され、そこで部分342は、本明細書で述べるような放出要素362が存在する場合にはヒドロゲル362と接触し、検出試薬365が存在する場合には検出試薬365と相互作用することができる。
【0170】
弁キャビティ374の寸法が既知の所定の量を与え、そのため弁370を1回以上使用して所定量の液体試料340を第1の貯留部320から第2の貯留部324に移動させることが可能であることが認識される。更に、液体試料の部分342が第1の貯留部320から第2の貯留部324に移された後、第1の貯留部320内の液体試料340の残部を捨てることができ、異なる物質(例えば、希釈剤、緩衝剤、液体及び/又は粉末試薬)を第1の貯留部320内に入れることができ、その後弁370を使用して所定量を第2の貯留部324に移すことが可能であることが認識される(図示せず)。
【0171】
図3に示される実施形態では、ハウジングの第1の貯留部320と第2の貯留部324とを隔離するための手段は、弁370を含む。図3に示される実施形態では、第1の貯留部320から第2の貯留部324に細胞濃縮剤330を移動するための手段には、通路316及び弁370を含む。
【0172】
図4Aは、いずれも本開示に基づく検出装置400の構成要素である、プランジャ450の側面図及びハウジング410の断面図を示す。プランジャは、シャフト451、必要に応じて用いられるOリング455、及び穿孔端459を含む。Oリングは、ハウジング410との液密なシールを与えるように柔軟性のある材料(例えば、ブチルゴム)で形成することができる。ハウジング410は、上記に述べたように上側部分412及び下側部分414を有するように構成することができる。必要に応じて用いられるキャップ478は、上記に述べたように構成することができる。破断可能なシール460は、ハウジング410を、3つの貯留部、即ち第1の貯留部420、第2の貯留部424、及び第1の貯留部420と第2の貯留部424との間に配置される第3の貯留部426に分割する。この図では、破断可能なシール460は、第1の貯留部420の第2の貯留部424に近い方の端部に位置決めされている。破断可能なシール460間の空間によって第3の貯留部426が画定されている。第3の貯留部426内に位置決めされているのは、細胞抽出剤を含む放出要素462である。代替構成(図示せず)は、第2の貯留部424の近くに破断可能なシール460を1個だけ有し、図3Cに示されるように放出要素462が第2の貯留部424内に位置決めされてよい。
【0173】
第1の貯留部420内の破断可能なシール460の近くに位置決めされているのは、閉位置で示されている弁ゲート482を有するドレーン弁480である。同様に第1の貯留部420内内に位置決めされているのは、液体試料440及び任意の細胞濃縮剤430である。任意の検出試薬465が第2の貯留部424内に示されている。
【0174】
図4Bは、図4Aのハウジング410及びプランジャ450を含む組み立てられた状態の検出装置400の断面図を示す。細胞濃縮剤430は、第1の貯留部420の底に沈殿している。ドレーン弁480の弁ゲート482は開位置にあり、矢印によって示される方向に力が作用する(例えば、指又は手からの圧力によって)と、清澄化した液体試料445がドレーン弁480から排出される。また、図4Bに示されているのは、第2の貯留部424の壁にコーティングされた検出試薬465である。
【0175】
図4Cは、図4Bの検出装置400の断面図を示す。この図では、プランジャ450のOリング455及び穿孔端459が、ドレーン弁480の、最も近くの破断可能なシール460に近い方の側でハウジング410内に挿入されている。この位置では、プランジャ450によって、液体試料の細胞濃縮剤430を含む部分442がプランジャ450と最も近くの破断可能なシール460との間に閉じ込められる。
【0176】
図4Dは、図4Cの検出装置400の断面図を示す。この図では、プランジャ450の穿孔端459が破断可能なシール460の両方を穿孔しており、液体試料の部分442が第2の貯留部424へと移動しており、第2の貯留部424において部分442が検出試薬(図4Cに示される)を溶解し、細胞抽出剤を含む放出要素462と接触している。
【0177】
図5Aは、いずれも検出装置500の構成要素であるプランジャ550及びハウジング510の断面図を示す。プランジャ550は、必要に応じて用いられるハンドル552及び先端部590を備えるシャフト551を含む。任意の実施形態において、ハンドル552は、任意のOリング555を更に含んでよい。
【0178】
ハウジング510は、上記に述べたように上側部分512及び下側部分514を有するように構成することができる。破断可能なシール560a及び560bは、ハウジング510を、3つの貯留部、即ち第1の貯留部520、第2の貯留部524、及び第1の貯留部520と第2の貯留部524との間に配置される第3の貯留部526に分割している。この図では、破断可能なシール560a及び560bは、第1の貯留部520の第2の貯留部524に近い方の端部に位置決めされている。破断可能なシール560aと560bとの間の空間によって、第3の貯留部526が画定される。第3の貯留部526内に位置決めされているのは、本明細書で述べるような細胞抽出剤を含む放出要素562である。図に示される実施形態では、第2の貯留部524は、任意の検出試薬565を含む。代替構成(図示せず)は、第2の貯留部の近くに破断可能なシールを1個だけ有し、図3Cに示されるように放出要素が第2の貯留部内に位置決めされてよい。
【0179】
ハンドル552は、例えば、プラスチック、木材、金属、及びこれらの組み合わせなどのそれぞれの種の材料から、当該技術分野では周知のプロセスを用いて作製することができる。必要に応じて用いられるOリング555は、ハンドル552の切り欠き554内に配置されている。ハンドル552は、プランジャ550がハウジング510に完全に挿入される際に、ハンドル552の少なくとも一部がハウジング510に挿入されうるような形状及び寸法とすることができる。一実施形態では、ハンドル552は、ハウジング510の開口部と係合して、ハンドル552がハウジング510に完全に挿入されることを防止するリム554を更に含む。
【0180】
プランジャ550のシャフト551は、例えば、プラスチック、木材、金属、及びこれらの組み合わせなどのそれぞれの種の材料で形成することができる。シャフト551の一端は、例えば、凹部(図5に示される)に圧入することにより、超音波溶接により、又は接着剤を使用することによりハンドル552に対して結合される。シャフト551の他端は、例えば、圧入により、超音波溶接により、又は接着剤を使用することにより先端部590に対して結合される。
【0181】
プランジャ550の先端部590の細部が図6A及び6Bに示されている。
【0182】
図6Aは、部分的に断面にて示された図5Aの先端部590の部分分解側面図を示す。先端部690は、本体691、一方向弁697、及びフィルタ696を含む。
【0183】
本体691は、第1の端部691a、第2の端部691b、及び第1の端部691aから第2の端部691bへと本体691を通じて延びる導管692を含む。第1の端部691aにおいて、導管692は、プランジャのシャフト651によってシールされる。第2の端部691bにおいて、導管692は陥凹した開口部694内に開口する。2本のドレーン通路695が、本体691の第1の端部691aから導管692へと延びる。したがって、それぞれのドレーン通路は、導管692及び陥凹開口部694に流体接続される。更に、陥凹開口部694、導管692、及びプランジャの先端部690を通過する流体経路のためのドレーン通路695に接続される。このように、この実施形態では、プランジャは流体経路を含む。
【0184】
一実施形態(図示せず)では、先端部690は、1本のみのドレーン通路695を含んでよい。複数のドレーン通路695は、背圧を低くでき、先端部690を通じた流体の輸送速度が大きくなり、有利である。
【0185】
本体691は、例えば、型成形することなどによりプラスチック(例えば、ポリプロピレン、ポリエチレン、ポリテトラフルオロエチレンなど)から作製することができる。本体691は、ハウジング(例えば、図5Aのハウジング510)内に嵌合するような形状及び寸法に構成される。任意の実施形態において、本体691又はOリング686は、本体691がハウジングに挿入される際に、ハウジングの壁と実質的に液密なシールを形成できる。Oリング686を含む任意の実施形態では、Oリング686は液密なシールを形成することと、Oリング686がハウジングの壁に対して動かされる際に、ハウジングの壁から粒子状物質(例えば、細胞濃縮剤)を拭い取ることとの両方の機能を有してよい。シャフト651は、当該技術分野では周知の手段によって(例えば、接着剤、圧入などにより)導管692と連結することができる。必要に応じて用いられるOリング686は、本体691の切り欠き689内に配置される。
【0186】
先端部690は、フィルタ696を更に含む。フィルタ696は、本体691に対して結合されている。図に示される実施形態では、フィルタ696は、陥凹開口部694に圧入及び/又は接着剤により結合することが可能な多孔質材料で形成される。いくつかの実施形態では、多孔質材料は、半剛性の多孔質材料(例えば、Porex Corporation(Fairburn,GA)により部品番号X6854として販売されるPOREX濾過媒質)であってよい。フィルタ696は、比較的角張った、あるいは尖った端部を有するように構成することにより、端部が破断可能なシールを容易に貫通することができる。代替的な実施形態(図示せず)では、フィルタは、本体に対して結合された膜フィルタからなるものでよい。膜フィルタは、本体と結合すると、導管及びドレーン通路を含む流体経路の一部を形成する。
【0187】
いくつかの実施形態では、フィルタ696の多孔度は、フィルタ696が比較的大きな粒子(例えば、>1μm、>5μm、又は>10μm)の通過のみを防止するように選択することができる。比較的大きな粒子には、例えば、本明細書で述べるような細胞濃縮剤が含まれる。これらの実施形態では、細菌、酵母、及び/又は真菌類(カビ)の糸状体などの微生物は、フィルタ696を通過することができる。
【0188】
いくつかの実施形態では、フィルタ696の多孔度は、フィルタ696が比較的小さな粒子(例えば、<1μm、<0.45μm、又は<0.2μm)の通過のみを防止するように選択することができる。これらの実施形態では、細菌、酵母、及び/又は真菌類(カビ)の糸状体などの微生物はフィルタ696によって保持され得る。
【0189】
先端部690は、陥凹開口部694内においてフィルタ696と導管692との間に配置される一方向弁697を更に含む。必要に応じて用いられる、一方向弁697を定位置に保持する機能を有する保持ワッシャ698も更に示されている。一方向弁697は、プラスチック(例えば、ポリプロピレン、ポリエチレン、ポリエステルなど)又はゴムで形成することができ、例えば、ダックビル弁として構成することができる。使用時には、一方向弁697は、フィルタ696を通過した液体の流れがフィルタ696を通じて逆方向に戻ることを実質的に防止する。
【0190】
図6Bは、組み立てられた状態の図6Aの先端部690の、部分的に断面にて示された側面図を示す。一方向弁697、必要に応じて用いられる保持ワッシャ698、及びフィルタ696が陥凹した開口部内に配置され、導管692及びドレーン通路695と流体接続している。シャフト651は、先端部690の本体691に対して結合されている。
【0191】
図5Aを再び参照すると、ハウジング510及びプランジャ550を含む検出装置500は、微生物、特に生きた微生物を検出するための方法において使用される。
【0192】
使用時には、液体試料は、ハウジング510の第1の貯留部520内に移され、そこで細胞濃縮剤530と接触させられる。液体試料540がハウジング510に加えられた後、プランジャ550の先端部がハウジング510に挿入され、図5Bに示されるようにハウジング510の第2の貯留部524の方向に付勢される(例えば、手動により、又は機械的に)。プランジャ550の先端部591が液体試料540と接触すると、図5Bに示されるように液体は先端部590を通過してハウジング510内に戻る。このプロセスでは、細胞濃縮剤530、及びいくつかの実施形態では遊離微生物が、液体試料の第3の貯留部526に近い部分542内に保持される。
【0193】
プランジャ550の先端部590が図示されていない破断可能なシール560aを貫通すると、液体試料の細胞濃縮剤530を含む部分542が放出要素562と接触する。プランジャ550が更に動く(図5Dに示されるように)と、破断可能なシール560bを貫通し、これにより液体試料の部分542及び放出要素562が第2の貯留部524に移動し、そこで検出試薬565と接触する。
【0194】
図7Aは、本開示に基づく検出装置700の別の実施形態の側断面図を示す。検出装置700は、プランジャ750及びハウジング610を含む。
【0195】
ハウジング710は、上記に述べたようにして上側部分712及び下側部分714を有するように構成することができる。破断可能なシール760a及び760bは、ハウジング710を、3つの貯留部、即ち第1の貯留部720、第2の貯留部724、及び第1の貯留部720と第2の貯留部724との間に配置される第3の貯留部726に分割する。この図では、破断可能なシール760a及び760bは、第1の貯留部720の第2の貯留部724に近い方の端部に位置決めされている。破断可能なシール760aと760bとの間の空間によって第3の貯留部726が画定されている。第3の貯留部726内に位置決めされているのは、細胞抽出剤を含む放出要素762である。図に示される実施形態では、第2の貯留部724は、任意の検出試薬765を含む。代替構成(図示せず)は、第2の貯留部724の近くに破断可能なシール760を1個だけ有し、図3Cに示されるように放出要素762が第2の貯留部724内に位置決めされてよい。
【0196】
プランジャ750は、ハンドル752及び先端部790に連結されたシャフト751を含む。この実施形態では、シャフト751は、中空であり、ハンドルは、シャフト751の内部と外部との間で圧力を等しくするための通気口748を含む。プランジャは、必要に応じて用いられるドレーン管753を更に含む。ドレーン管753は先端部790から液体濾液を受けて、この濾液をシャフト751の内部に分配する。ドレーン管753はまた、オーバーフロー弁として機能することによって逆方向に先端部790を通じて逆流する濾液の量を低減させる。
【0197】
プランジャ750の先端部790の細部が図8に示されている。
【0198】
図8Aは、部分的に断面にて示された図7Aの先端部790の部分分解側面図を示す。先端部890は、本体891、必要に応じて用いられる一方向弁897、及びフィルタ896を含む。また、図8Aには、プランジャ850の、中空シャフト851及びドレーン管853を含む部分も示されている。
【0199】
本体891は、第1の端部891a、第2の端部891b、及び第1の端部891aから第2の端部891bへと本体891を通じて延びる導管892を含む。第1の端部891aにおいて、導管892は、プランジャのドレーン管853と連結されている(例えば、圧入、及び接着剤、又はネジによる連結により)。第2の端部891bにおいて、導管892は、陥凹した開口部894内に開口している。したがって、陥凹開口部894は、導管892及びドレーン管853と流体連結される。
【0200】
本体891は、例えば、型成形することなどによりプラスチック(例えば、ポリプロピレン、ポリエチレン、ポリテトラフルオロエチレンなど)から作製することができる。本体891は、ハウジング(例えば、図7Aのハウジング710)内に嵌合するような形状及び寸法に構成される。任意の実施形態において、本体891又はOリング886は、本体891がハウジングに挿入される際に、ハウジングの壁と実質的に液密なシールを形成することができる。Oリング886を含む任意の実施形態では、Oリング886は、液密なシールを形成することと、Oリング886がハウジングの壁に対して動かされる際に、ハウジングの壁から粒子状物質(例えば、細胞濃縮剤)を拭い取ることとの両方の機能を有してよい。シャフト851は、当該技術分野では周知の手段によって(例えば、接着剤、圧入などにより)導管892と連結することができる。必要に応じて用いられるOリング886は、本体891の切り欠き889内に配置される。
【0201】
先端部890は、フィルタ896を更に含む。フィルタ896は、陥凹開口部894において本体891に対して結合されている。図に示される実施形態では、フィルタ896は、陥凹開口部894に圧入及び/又は接着剤により結合することが可能な多孔質材料で形成されている。いくつかの実施形態では、多孔質材料は、半剛性の多孔質材料(例えば、Porex Corporation(Fairburn,GA)により部品番号X6854として販売されるPOREX濾過媒質)であってよい。フィルタ896は、比較的角張った、あるいは尖った端部を有するように構成することにより、端部が破断可能なシールを容易に貫通することができる。代替的な実施形態(図示せず)では、フィルタは、本体に対して結合された膜フィルタからなるものでよい。膜フィルタは、本体と結合すると、導管及びドレーン通路を含む流体経路の一部を形成する。
【0202】
いくつかの実施形態では、フィルタ896の多孔度は、フィルタ896が比較的大きな粒子(例えば>、1μm、>5μm、又は>10μm)の通過のみを防止するように選択することができる。比較的大きな粒子には、例えば、本明細書で述べるような細胞濃縮剤が含まれる。これらの実施形態では、細菌、酵母、及び/又は真菌類(カビ)の糸状体などの微生物はフィルタ896を通過することができる。
【0203】
いくつかの実施形態では、フィルタ896の多孔度は、フィルタ896が比較的小さな粒子(例えば、<1μm、<0.45μm、又は<0.2μm)の通過のみを防止するように選択することができる。これらの実施形態では、細菌、酵母、及び/又は真菌類(カビ)の糸状体などの微生物はフィルタ896によって保持され得る。
【0204】
先端部890は、陥凹開口部894内においてフィルタ896と導管892との間に配置される、必要に応じて用いられる一方向弁897を更に含んでよい。必要に応じて用いられる一方向弁897を定位置に保持する機能を有する保持ワッシャ898もまた、示されている。一方向弁897は、プラスチック(例えば、ポリプロピレン、ポリエチレン、ポリエステルなど)又はゴムで形成することができ、例えば、ダックビル弁として構成することができる。使用時には、一方向弁897は、フィルタ896を通過した液体の流れがフィルタ896を通じて逆方向に戻ることを実質的に防止する。
【0205】
図8Bは、組み立てられた状態の図7Aの先端部790の、部分的に断面にて示された側面図を示す。一方向弁897、必要に応じて用いられる保持ワッシャ898、及びフィルタ896が陥凹した開口部内に配置され、導管892及びドレーン管853と流体接続している。シャフト851は、先端部890の本体891に対して結合されている。
【0206】
図7Aを再び参照すると、ハウジング710及びプランジャ750を含む検出装置700は、微生物、特に生きた微生物を検出するための方法において使用される。
【0207】
使用時には、液体試料は、ハウジング710の第1の貯留部720内に移され、そこで細胞濃縮剤730と接触させられる。液体試料740がハウジング710に加えられた後、プランジャ750の先端部790がハウジング710に挿入され、図7Bに示されるようにハウジング710の第2の貯留部724の方向に付勢される(例えば、手動により、又は機械的に)。プランジャ750の先端部791が液体試料740と接触すると、図7Bに示されるように液体は、先端部790を通過して、ドレーン管753を通過して、プランジャ750の中空シャフト内に通る。このプロセスでは、細胞濃縮剤730、及びいくつかの実施形態では、遊離微生物が、液体試料の第3の貯留部726に近い部分742内に保持される。
【0208】
プランジャ750の先端部790が図示されていない破断可能なシール760aを貫通すると、液体試料の細胞濃縮剤730を含む部分742が放出要素762と接触する。プランジャ750が更に動く(図7Dに示されるように)と、破断可能なシール760bを貫通し、これにより液体試料の部分742及び放出要素762が第2の貯留部724に移動し、そこで検出試薬765と接触する。
【0209】
本開示の装置は、ハウジング内に破断可能なシールを含む。破断可能なシールが穿孔されることによって、装置の1つの区画から別の区画へと細胞濃縮剤が輸送される。いくつかの実施形態では、このプロセスで移動させられる細胞濃縮剤の量を、破断可能なシールの比較的面積に細胞濃縮剤を集めることによって大きくすることができる。図9は、細胞濃縮剤の回収率を高めるための回収要素967の一実施形態を示す。回収要素967は、本開示に基づく検出装置のハウジング内に嵌合するような寸法に構成されている。回収要素967は、細胞濃縮剤(図示せず)を含む試料の方向に向けられる、面取りされた縁部968を含む。通常、面取りされた縁部968は、重力によって沈降する粒子を回収するように上側を向いている。また、面取りされた縁部968を、例えば、遠心力又は流体力の方向に向けることによって、重力以外の力が作用する粒子を回収することもできる。回収要素967は、必要に応じて用いられる破断可能なシール969を更に含む。
【0210】
回収要素967は、例えば、ポリマー(例えば、ポリエステル、ポリプロピレン、ポリテトラフルオロエチレン、ポリプロピレン、ポリスチレン、ナイロン、並びにこれらの組み合わせ及び誘導体)、ガラス、及び金属などのそれぞれの種の材料で形成することができる。回収要素967は、その表面に対する粒子の接着を阻止するための潤滑性コーティングを更に含んでよい。面取りされた縁部968は、その斜面に沿った粒子の運動を促進するために角度(例えば、45°の角度、>45°よりも大きな角度)が付けられていてもよい。破断可能なシール969は本明細書に述べられるように作製し、本明細書に述べられるような手段によって回収要素967に結合することができる。
【0211】
図10Aは、回収要素1067を含む検出装置1000の一実施形態を示す。装置1000は、ハウジング1010及びプランジャ1050を含む。ハウジング1010は、上側部分1012及び下側部分1014を含む。上側部分1012の内部かつ下側部分1014の近くに、破断可能なシール1069が結合された回収要素1067が配置されている。破断可能なシール1069は、回収要素1067の下側部分1014に面した側面に結合されている。したがって、破断可能なシール1069は、ハウジング1010を、第1の貯留部1020及び第2の貯留部1024の2個の隔離された貯留部に分割する。
【0212】
プランジャ1050は、ハンドル1052、シャフト1051、及び先端部1090を含む。ハンドル1052は、上記に述べたように形成することができ、プランジャ1050がハンドル1010内に過度に深く挿入されることを防止するための、ハウジング1010と係合する、必要に応じて用いられるリム1054を含むことができる。ハンドル1052は、ネジ嵌め又は他の連結手段(例えば、圧入、接着剤)によってシャフト1051に対して連結することができる。先端部1090は、本明細書で述べる他の先端部の実施形態について述べられるプロセス及び材料を用いて作製することができる。先端部1090は、1つ以上のガイド1083を含んでよい。それぞれのガイドは、ハウジング1010の内部にゆるく嵌まるような寸法に構成され、先端部1090がハウジング1010を通じて長手方向に動く際に、先端部1090の横方向の運動を低減させる機能を有する。
【0213】
先端部1090は、先端部1090上の固定位置に保持されたスクレーパー1086を更に含む。図の実施形態では、スクレーパー1086は、保持部材1087によって固定位置に保持される。保持部材1087は、先端部1090の一部として成形又は機械加工するか、あるいは先端部1090に結合されたブラケット又は複数のブラケットからなるものでよい。また、スクレーパー1086を先端部1090に直接結合する(例えば、接着剤により結合する)こともできる。
【0214】
スクレーパー1086は、ディスク形状をしており、ハウジング1010の内部に比較的緊密な嵌合を形成するような寸法である。いくつかの実施形態では、スクレーパーは、Oリングを含むことができる。スクレーパー1086は、水性の液体に浸漬される際に、その形状をほぼ維持する必要がある。スクレーパーは、ハウジングの内部に比較的緊密な嵌合を形成するような寸法でなければならないが、スクレーパーは、プランジャがハウジング1010内の液体試料を通じて押されるにしたがって液体がその縁部を回り込んで流れることができるように比較的可撓性のものでなければならない。スクレーパー1086を作製するのに適した材料としては、例えば、ポリウレタンゴムが挙げられる。
【0215】
使用時には、図10Bに示すように、液体試料1040と細胞濃縮剤1030は、装置のハウジング1010内で接触させられる。プランジャ1050がハウジング1010内に挿入され、プランジャ1050の先端部1090がハウジング1010の底の方向に押される。先端部1090が液体試料1040を通過するにしたがって、スクレーパー1086によって細胞濃縮剤1030がハウジング1010の底の方向に押されるのと同時に、液体試料1040がスクレーパー1086の縁部を回り込んで流れる。有利な点として、この装置によって使用者は、細胞濃縮剤1030が重力によってハウジング1010の底へと沈降させられる場合に、可能であるよりも大幅に短い時間で細胞濃縮剤1030を回収かつ濃縮することができる。更に、可撓性のスクレーパーによって、スクレーパーがなければハウジングの壁に接着し得る細胞濃縮剤1030の部分の回収が容易となる。したがって、本発明の装置1000は、細胞濃縮剤の回収率を高め、これにより微生物を濃縮するために細胞濃縮剤を使用する方法の感度を高める。
【0216】
細胞濃縮剤が強磁性材料(例えば、粒子)を含む試料調製及び検出装置では、磁石又は電磁石を装置の近傍に配置することによって粒子(及び粒子に結合した微生物)を、粒子を回収し、かつ/又は粒子を別の貯留部に移すための所望の位置に引き寄せることができる点は認識されるはずである。いくつかの実施形態では、細胞濃縮剤が液体試料中の微生物のほぼすべてを結合するだけの充分な時間の後に、磁石を装置の近傍(例えば、装置の底の近傍)に配置することができる。
【0217】
生きた細胞からの生物学的検体の検出方法:
本開示の方法は、有効量の細胞抽出剤への曝露後に、例えば、生きた微生物などの、生きた細胞から放出される生物学的検体を検出するための方法を含む。
【0218】
本開示の方法は、試料と細胞抽出剤を含む放出要素とを含む液体混合物を形成することを含む。本開示の方法は、生物学的検体を検出する工程を更に含む。生物学的検体を検出する工程は、試料中の生物学的検体の量を定量することを更に含むことができる。
【0219】
一態様では、本開示は、試料中の細胞を検出する方法を提供する。本方法は、細胞濃縮剤、細胞抽出剤を含む放出要素、及び液体試料を提供することを含む。好適な細胞濃縮剤が、参照によりその全体が本明細書に組み込まれる、米国特許出願公開第2010/0190171号、発明の名称「MICROORGANISM CONCENTRATION PROCESS」に記載されている。
【0220】
本方法は、液体試料を細胞濃縮剤と所定の時間にわたって接触させる工程を更に含む。細胞濃縮剤は、粒子、繊維、粒子を含むマトリクス(例えば、繊維状マトリクス)、又は上記の2つ以上のものの任意の組み合わせを含むことができる。細胞濃縮剤は、接触時間の間に液体試料に懸濁することができる。懸濁液は試験管、試験管、フラスコ、ビーカー又は本明細書で述べる検出装置のいずれかのような容器に入れることができる。特定の好ましい実施形態では、液体試料は、例えば、懸濁液を攪拌、ボルテックス、又は振動することによって、所定の時間にわたって細胞濃縮剤と混合される。細胞濃縮剤が液体試料と接触させられている間に、液体試料からの細胞が細胞濃縮剤と結合する。
【0221】
本方法は、液体試料の少なくとも一部から細胞濃縮剤を分離する工程を更に含む。このプロセスにおいて、細胞濃縮剤を最初の液体試料よりも小さな体積に濃縮することができる。細胞濃縮剤は、様々な手段によって液体試料の少なくとも一部から単離することができる。例えば、細胞濃縮剤が液体試料よりも大きな比重を有する場合、細胞濃縮剤は懸濁液の底に沈降し得る。液体試料の少なくとも一部を除去する(例えば、ピペッティング又はデカンテーションにより)ことができる。これに代えるか、又はこれに加えて、液体試料の少なくとも一部を遠心分離又は濾過によって除去することもできる。
【0222】
フィルタはその孔径によって(例えば、その泡立ち点の孔径によって)定義することができる。フィルタの泡立ち点の孔径は、一般的にフィルタの孔の最大径の平均である。いくつかの実施形態では、フィルタは、細胞濃縮剤の平均径よりも小さい平均孔径を有することができる。これらの比較的大きな孔径を有するフィルタを利用することができるために、本明細書で開示される方法は、水試料などの試料から微生物を分離するための他の方法と比較した場合に大きな利点を有する。
【0223】
一実施形態では、フィルタは、少なくとも約1マイクロメートル(μm)以上の平均孔径を有することができる。一実施形態では、フィルタは、少なくとも約1.5μm以上の平均孔径を有することができる。一実施形態では、フィルタは、少なくとも約5μm以上の平均孔径を有することができる。一実施形態では、フィルタは、少なくとも約10μm以上の平均孔径を有することができる。より大きな孔径のフィルタを利用すると、孔径が大きくなるにつれて背圧が低くなるために、試料はより容易かつ迅速に濾過される。
【0224】
試料の濾過は、公知の方法によって行うことができる。一実施形態では、選択される濾過方法は、その方法の特定の用途の少なくとも一部によって決定され得る。例えば、試料は、重力によって陽圧を作用させることにより、負の真空を用いて濾過することができる。試料を濾過するために使用される特定の方法は、本方法を実行するために利用される装置の種類の少なくとも一部によって決定され得る。例えば、負の真空を利用するためには、装置を真空源に取り付ける、あるいは逆向きに取り付けることができるポートを有するように構成することが可能であり、陽圧を作用させるためには、使用者が手で力を加えることによって陽圧を作用させることができるように装置を構成することが可能である。一実施形態では、試料は、陽圧を作用させることによって濾過することができる。陽圧を利用した(又は重力を利用した)濾過によれば、真空ポンプなどの更なる機器を一切使用することなく、現場で本方法を容易に行うことができるという利点が与えられる。
【0225】
いくつかの実施形態では、遠心分離工程において、細胞濃縮剤は液体から分離する(例えば、沈降によって)が、細胞濃縮剤に結合しない微生物(例えば、細菌、酵母カビ、胞子)は、液体中に浮遊したままとなるような比較的低速の遠心分離を使用することができる。
【0226】
必要に応じて、細胞濃縮剤を洗浄液(例えば、水又は緩衝溶液)に再懸濁し、洗浄液の少なくとも一部から細胞濃縮剤を単離することができる。洗浄工程が増殖及び/又は検出プロセスを妨害し得る夾雑物を液体試料から除去する機能を有し得る点は、認識されるであろう。
【0227】
本方法は、分離された細胞濃縮剤と放出要素とを含む液体混合物を形成することを更に含み、この工程において放出要素から細胞抽出剤が放出される。いくつかの実施形態では、細胞濃縮剤が液体試料の少なくとも一部から分離される際に、細胞濃縮剤が液体の残部に残る。必要に応じて更なる液体(例えば、水又は緩衝溶液)を細胞濃縮剤に加えることができる。細胞濃縮剤が液体試料から濾過される実施形態では、細胞濃縮剤を所定の体積の液体(例えば、水又は緩衝溶液)に再懸濁することができる。細胞濃縮剤を含む液体懸濁液を放出要素と接触させることにより、細胞抽出剤を液体混合物中に放出させる。細胞濃縮剤を回収するためにフィルタを使用する方法では、細胞濃縮剤を含む液体懸濁液がフィルタを含むこともできる。混合物中に細胞が存在する場合に、細胞から生物学的検体を放出させるうえで有効量の細胞抽出剤を放出要素から放出させることができる。有効量の細胞抽出剤の放出は、所定の時間にわたって起こりうる(例えば、最大で数秒間、最大で数分間、最大で数時間、又はそれよりも長時間)。
【0228】
本方法は、検体を検出する工程を更に含む。生物学的検体の検出では、検出系を使用することができる。ヌクレオチド(例えば、ATP、NADH、NAD)、ポリヌクレオチド(例えば、DNA又はRNA)又は酵素(例えば、NADHデヒドロゲナーゼ、又はアデニル酸キナーゼ)などの特定の生物学的検体の検出系は当該技術分野では周知のものであり、本開示に従って使用することができる。本開示の方法には、生物学的検体を検出するための公知の検出系が含まれる。この検出系の精度及び感度は、細胞抽出剤によって大きく低減されないことが好ましい。検出系は、均一アッセイを含むことがより好ましい。
【0229】
いくつかの実施形態において、生物学的分析物を検出することは、容器(例えば、試験管、多穴プレート、及び本明細書に記載の検出装置)中の検体を直接検出することを含むことができ、この工程では、試料と細胞抽出剤を含む放出要素とを含む液体混合物が形成される。いくつかの実施形態において、生物学的検体を検出することは、液体混合物の少なくとも一部を、試料と細胞抽出剤を含む放出要素とを含む液体混合物がその中で形成される容器以外の容器に移すことを含むことができる。いくつかの実施形態では、生物学的検体を検出する工程には、例えばpH調整、希釈、濾過、遠心分離、抽出などの1つ以上の試料調製プロセスが含まれてよい。
【0230】
いくつかの実施形態では、検出系は検出試薬を含む。検出試薬としては、例えば、色素、酵素、酵素基質、結合相手(例えば、抗体、モノクローナル抗体、レクチン、受容体など)、標識された結合相手、及び/又は、補因子が挙げられる。いくつかの実施形態において、検出試薬は、PCT国際公開特許WO 2010/039627号、発明の名称「BIODETECTION ARTICLES」に記載されるように、酵素又は酵素基質を含むヒドロゲルといったヒドロゲルを含む。いくつかの実施形態では、検出系は、器具を含む。検出器具の非限定的な例としては、分光光度計、ルミノメーター、プレートリーダー、サーモサイクラー、インキュベーターが挙げられる。
【0231】
検出系は、検出器具を含むことができる。検出器具は、当該技術分野では周知のものであり、比色測定法(即ち、光の吸光度及び/又は散乱により)、蛍光測定法、又は光量測定法によって生物学的検体を検出するために使用することができる。発光による生体分子検出の例は、F.Gorus及び、E.Schram(Applications of bio−and chemiluminescence in the clinical laboratory、1979、Clin.Chem.25:512〜519)に述べられている。
【0232】
生物学的検体の検出系の一例としては、ATP検出系がある。ATP検出系は、酵素(例えば、ルシフェラーゼ)及び酵素基質(例えば、ルシフェリン)を含むことができる。ATP検出系は、ルミノメーターを更に含むことができる。いくつかの実施形態では、ルミノメーターには、例えば、FB−12シングルチューブ型ルミノメーター(Berthold Detection Systems USA,Oak Ridge,TN)のようなベンチトップ型のルミノメーターを含むことができる。いくつかの実施形態において、照度計は、例えば、3M Company(St.Paul,MN)から入手可能な、NG照度計、UNG2又はUNG3などの小型照度計を含むことができる。
【0233】
いくつかの実施形態では、生物学的検体は、単一の時点において検出される。いくつかの実施形態では、生物学的検体は、2つ以上の時点において検出される。2つ以上の時点で生物学的検体が検出される場合、第1の時点(例えば、試料の少なくとも一部の生きた細胞から生物学的検体を放出させるうえで有効量の細胞抽出剤が放出要素から放出される前)において検出された生物学的検体の量を、第2の時点(例えば、試料の少なくとも一部の生きた細胞から生物学的検体を放出させるうえで有効量の細胞抽出剤が放出要素から放出された後)において検出された生物学的検体の量と比較することができる。いくつかの実施形態では、1つ以上の時点における生物学的検体の測定は、処理装置を備えた器具によって行われる。特定の好ましい実施形態では、第1の時点における生物学的検体の量と、第2の時点における生物学的検体の量との比較は処理装置によって行われる。
【0234】
例えば、操作者は、試料と、細胞抽出剤を含む放出要素とを含む液体混合物を形成した後の試料において、生物学的分析物の量を測定する。この第1の測定における生物学的検体の量(T1)は、「遊離した」(即ち、非細胞性)生物学的検体、及び/又は、試料中の非生存細胞からの生物学的検体の存在を示すことができる。いくつかの実施形態において、第1の測定は、試料と細胞抽出剤を含む放出要素とを含む液体混合物が形成された直後(例えば、約1秒後)に行うことができる。いくつかの実施形態において、第一測定は、試料と細胞抽出剤を含む放出要素とを含む液体混合物を形成してから少なくとも約5秒後、少なくとも約10秒後、少なくとも約20秒後、少なくとも約30秒後、少なくとも約40秒後、少なくとも約60秒後、少なくとも約80秒後、少なくとも約100秒後、少なくとも約120秒後、少なくとも約150秒後、少なくとも約180秒後、少なくとも約240秒後、少なくとも約5分後、少なくとも約10分後、少なくとも約20分後に行うことができる。これらの時間は例示的なものであり、生物学的検体の検出が開始されるまでの時間のみを挙げたものである。生物学的検体の検出を開始することには、試料を希釈すること、及び/又は細胞抽出剤の活性を阻害する試薬を添加することが含まれる。特定の検出系(例えば、核酸の増幅又はELISA)は、通常、完了までに数分〜数時間を要する点は認識されるであろう。
【0235】
操作者は、生物学的検体の第1の測定を行った後、細胞抽出剤を含む放出要素に試料を所定の時間にわたって接触させる。試料を一定時間放出要素と接触させた後、生物学的分析物の第2の測定が行われる。いくつかの実施形態では、第2の測定は、生物学的検体の第1の測定後の約0.5秒以内、約1秒以内、約5秒以内、約10秒以内、約20秒以内、約30秒以内、約40秒以内、約60秒以内、約90秒以内、約120秒以内、約180秒以内、約300秒、少なくとも約10分、少なくとも約20分、少なくとも約60分以内、又はそれ以降に行うことができる。これらの時間は例示的なものであり、生物学的検体を検出するための第1の測定が開始されてから生物学的検体を検出するための第2の測定が開始されるまでの時間間隔のみを挙げたものである。生物学的検体の検出を開始することには、試料を希釈すること、及び/又は細胞抽出剤の活性を阻害する試薬を添加することが含まれる。
【0236】
好ましくは、生物学的検体の第1の測定は、試料と細胞抽出剤を含む放出要素とを含む液体混合物が形成された約1秒後〜約240秒後に行われ、第1の測定の後に行われる第2の測定は、液体混合物が形成された約1.5秒後〜約540秒後に行われる。より好ましくは、生物学的検体の第1の測定は、液体混合物が形成されてから約1秒後〜約180秒後に行われ、第1の測定の後に行われる第2の測定は、液体混合物が形成されてから約1.5秒後〜約120秒後に行われる。最も好ましくは、生物学的検体の第1の測定は、液体混合物が形成されてから約1秒後〜約5秒後に行われ、第1の測定の後に行われる第2の測定は、液体混合物が形成されてから約1.5秒後〜約10秒後に行われる。
【0237】
操作者は、第1の測定において検出された生物学的検体の量を、第2の測定において検出された生物学的検体の量と比較する。第2の測定において検出された生物学的検体の量が増加している場合、試料中に1つ以上の生きた細胞が存在することを示す。
【0238】
特定の方法では、生きた体細胞(例えば、非微生物細胞)の存在を検出することが望ましい場合がある。これらの実施形態では、放出要素は、体細胞から生物学的検体を選択的に放出させる細胞抽出剤を含む。体細胞の抽出剤の非限定的な例としては、これらに限定されるものではないが、例えば、エトキシル化オクチルフェノールであるTriton X−100(TX−100)及びその他のエトキシル化アルキルフェノールを含む非イオン性エトキシル化アルキルフェノールなどの非イオン性洗剤;例えば、カルボキシプロピルベタイン(CB−18)、NP−40、TWEEN、タージトール、イゲパール、市販のM−NRS(Celsis,Chicago,IL))、M−PER(Pierce,Rockford,IL)、CelLytic M(Sigma Aldrich)などのベタイン洗剤が挙げられる。細胞抽出剤は、検体及びその検出試薬を不活性化しないように選択されることが好ましい。
【0239】
特定の方法では、生きた微生物細胞の存在を検出することが望ましい場合がある。これらの実施形態において、放出要素は、微生物細胞から生物学的分析物を選択的に放出させる細胞抽出剤を含むことができる。微生物細胞抽出剤の非限定的な例には、塩化ベンザルコニウム、塩化ベンゼトニウム、「セトリミド」(ドデシル−、テトラデシル−、及びヘキサデシル−臭化トリメチルアンモニウムの混合物)、塩化セチルピリジウムなどの四級アンモニウム化合物;トリエチルアミン(TEA)及びトリエタノールアミン(TeolA)などのアミン;クロルヘキシジン、アレキシジン及びポリヘキサメチレンビグアニドなどのビス−ビグアニド;N−(n−ドデシル)−ジエタノールアミンなどのジアルキルアンモニウム塩;ポリミキシンB(例えば、ポリミキシンB1及びポリミキシンB2)、ポリミキシン−β−ノナペプチド(PMBN)などの抗生物質;オクチル−β−D−1−チオグルコピラノシド(本明細書にその全容を援用する米国特許第6,174,704号を参照)などのアルキルグルコシド又はアルキルチオグルコシド;エトキシル化オクチルフェノールであるTriton X−100(TX−100)及びその他のエトキシル化アルキルフェノール類を含むがこれらに限定されない非イオン性エトキシル化アルキルフェノールなどの非イオン性洗剤;カルボキシプロピルベタイン(CB−18)などのベタイン洗剤;並びに、ポリリシン、ナイシン、マガイニン、メリチン、ホスホリパーゼA2、ホスホリパーゼA2活性化ペプチド(PLAP)などのカチオン性、抗細菌性、孔形成性、膜活性、及び/又は細胞壁活性であるポリマー;バクテリオファージ;並びにこれらに類するものが挙げられる。例えば、参照によりその全体が本明細書に組み込まれる、イオン性界面活性化合物を開示するMorbeら、Microbiol.Res.(1997)vol.152,pp.385〜394、及び米国特許第4,303,752号を参照されたい。細胞抽出剤は、生物学的検体、及び/又は生物学的検体を検出するために使用される検出試薬を不活性化しないように選択されることが好ましい。
【0240】
試料中の生きた微生物細胞の存在を検出するための特定の代替的方法では、試料を所定の時間にわたって体細胞抽出剤で前処理することができる(例えば、試料と、微生物細胞抽出剤を含む放出要素とを含む液体混合物を形成する前に、体細胞を抽出するうえで充分な時間にわたって試料を体細胞抽出剤と接触させる)。この代替的な実施形態では、第1の測定において検出される生物学的検体の量には、体細胞から放出されたすべての生物学的検体が含まれ、第2の測定で検出される更なる生物学的検体(検出される場合)の量には、試料中の生きた微生物細胞からの生物学的検体が含まれることになる。
【0241】
試料中の微生物の存在を検出するための方法では、本明細書で開示される検出装置を使用することができる。特定の実施形態では、本方法は、i)試料、ii)第1及び第2の貯留部を備えたハウジングと試料を受容するように構成された開口部とを備える検出物品、iii)細胞濃縮剤、及び、iv)細胞濃縮剤を隔離して、ハウジングの第1の(例えば、上側)貯留部から第2の(例えば、下側)貯留部へと移動させるための手段、及び、v)細胞抽出剤を含む放出要素を提供することを含む。これらの実施形態では、検出装置は、図1〜4に示される検出装置100、200、300、又は400のいずれか1つのものを含むことができる。任意に、検出装置は、細胞濃縮剤及び/又は放出要素を含むことができる。
【0242】
本方法は、ハウジングの第1の貯留部内に試料を移動させることを更に含み、この工程では液体媒質中で試料物質を細胞濃縮剤と接触させる。試料は、ハウジングの第1の貯留部に移動させられる液体、固体、半固体、又はこれらの組み合わせを含むことができる。試料が液体媒質を含んでいない場合には、液体媒質(例えば、水又は緩衝溶液)を第1の貯留部に加えることができる。細胞濃縮剤を液体試料に加える。細胞濃縮剤を、所定の時間にわたって液体試料と接触させる。必要に応じて、ハウジングを例えば振盪、攪拌、ボルテックス、及び/又は振動することによって、接触時間の間に混合物を混合することができる。試料及び/又は細胞濃縮剤の損失を防止するために、ハウジングは接触時間の間、閉鎖される(例えば、必要に応じて用いられるキャップによって)ことが好ましい。
【0243】
方法は、液体媒質の少なくとも一部から細胞濃縮剤を隔離することを更に含み、細胞濃縮剤を隔離する工程は、細胞濃縮剤をハウジングの第2の貯留部に移動させることを含む。本明細書で述べるように、細胞濃縮剤を隔離するためのそれぞれの種の手段がある。細胞濃縮剤を隔離及び移動するための手段の非限定的な例には、プランジャを用いて通路を通じて細胞濃縮剤を分割及び移動すること(図1及び2を参照)、一方向弁のキャビティ内に細胞濃縮剤を回収及び移動すること(図3を参照)、並びに、ドレーン弁及びプランジャを用いて細胞濃縮剤を濃縮及び移動すること(図4を参照)が含まれる。
【0244】
本方法は、分離された細胞濃縮剤と放出要素とを含む液体混合物を形成することを更に含み、細胞抽出剤は、混合物中に放出される。細胞濃縮剤を含む液体混合物は、細胞抽出剤を含む放出要素と接触させられる。放出要素(例えば、ヒドロゲルビーズ)は、ハウジングの第1の貯留部及び/又は第2の貯留部内の液体混合物と接触させられることができる。いくつかの実施形態では、ハウジングの第2の貯留部は放出要素を含み(図1及び図3参照)、混合物が第2の貯留部の中に移動したときに、液体混合物は放出要素と接触させられる。いくつかの実施形態において、放出要素は第3の貯留部内に配置され(図2及び図4を参照)、液体試料が第1の貯留部から第2の貯留部に移される際に、第3の貯留部を液体試料が通過する(これにより液体試料が放出要素と接触する)。
【0245】
図2及び図4では、破断可能なシールに穿孔して細胞濃縮剤を第2の貯留部に移動させるためのプランジャの使用が示されているが、プランジャの代わりに代替的な器具(例えば、スワブ、ピペット、フィルタなど)を使用することも可能であることが認識される。このような代替的な器具が使用される方法では、破断可能なシールが代替的器具によって穿孔される際に液体試料の全体が第2の貯留部に移されないように、液体試料の少なくとも一部を除去する(例えば、デカンテーション、ピペッティング、濾過により又はドレーン弁が設けられている場合にはドレーン弁を開放することにより)ことが好ましい。
【0246】
本方法は、生物学的検体を検出する工程を更に含む。生物学的検体は、放出要素から有効量の細胞抽出剤が細胞濃縮剤を含む液体混合物中に放出される前に、検出装置の第2の貯留部内で、本明細書で記載されるように、検出することができる。生物学的検体は、放出要素から有効量の細胞抽出剤が細胞濃縮剤を含む液体混合物中に放出された後で、検出装置の第2の貯留部内で、本明細書で記載されるように、検出することができる。生物学的検体は、放出要素から有効量の細胞抽出剤が細胞濃縮剤を含む液体混合物中に放出される前及び後で、検出装置の第2の貯留部内で、本明細書で記載されるように、検出することができる。
【0247】
本明細書で開示される方法のいずれも、生物学的な増殖工程を更に含むことができることは予想されることである。増殖工程は、微生物の増殖を支持する栄養培地を与えることによって促進される。栄養培地は、細胞濃縮剤による微生物の濃縮の前、その間、又はその後に試料と混合することができる。いくつかの実施形態では、生物学的増殖工程は、細胞濃縮剤によって微生物が濃縮された後であるが、生物学的検体が検出される前に行われる。いくつかの実施形態では、栄養培地は、試料中に存在し得る他の微生物よりも特定の種類の微生物の増殖にとって有利な栄養素及び/又は選択物質(例えば、塩、抗生物質)を含有してよい。
【0248】
粒子状細胞濃縮剤を濃縮する方法:
本開示は、粒子状の細胞濃縮剤を濃縮するための装置を提供する。本方法は、液体試料の一部を液体試料中への粒子状物質の懸濁液から分離する装置を提供する工程を含む。好適な装置としては、例えば、図2A、図3A、図4A、図5A、図7A、及び図10Aに図示及び説明される装置が挙げられる。それぞれの装置は、粒子状の細胞濃縮剤を含む液体試料を収容するためのハウジングと粒子状細胞濃縮剤を液体試料の少なくとも一部から分離するための手段とを含む。
【0249】
図2Aでは、粒子状細胞濃縮剤を分離するための手段は、テーパ領域218、及び下側シール256を含むプランジャを含む。図3Aでは、粒子状細胞濃縮剤を分離するための手段は、行き止まり弁370及び弁アクチュエータ372を含む。図4Aでは、粒子状細胞濃縮剤を分離するための手段は、ドレーン弁480及び弁ゲート482を含む。図5A及び7Aでは、粒子状細胞濃縮剤を分離するための手段は、フィルタ596が内部に配置された流体経路を含むプランジャを含む。図10Aでは、粒子状細胞濃縮剤を分離するための手段は、スクレーパーの縁部とハウジングとの間で液体を通過させるように構成されたスクレーパーを備えるプランジャを含む。
【0250】
本方法は、液体試料中への粒子状細胞濃縮剤の懸濁液を形成する工程を更に含む。懸濁液は、ハウジング内において形成するか、あるいはハウジングの外部で形成することができる。懸濁液がハウジングの外部で形成される場合、本方法は、ハウジング内に懸濁液を移動する工程を更に含む。本方法は、微生物を捕捉するだけの充分な時間にわたって、粒子状細胞濃縮剤を液体試料と接触させる工程を更に含む。接触は、ハウジング内で起こってよい。接触は、ハウジングの外部で起こってよい。接触は、ハウジングの外部及び内部の両方で起こってよい。本方法は、図2A、3A、4A、5A、7A及び10Aの装置について上記に述べたように、液体試料中への粒子状物質の懸濁液から液体試料の一部を分離する工程を更に含む。
【0251】
試料の調製及び検出キット:
本開示の構成要素及び/又は装置は、使用説明書及び必要に応じて付属物品又は試薬とともにパッケージングすることによって、試料の調製及び検出キットとすることができる。したがって、一態様において、本開示は、i)少なくとも2個の貯留部を含み、その間に通路を有するハウジングと、ii)ハウジングの第1の貯留部を第2の貯留部から隔離するための手段と、iii)細胞濃縮剤と、iv)細胞濃縮剤を第1の貯留部から第2の貯留部に移動させるための手段とを備えるキットを提供する。第1の貯留部は、試料を受容するように構成された開口部を含む。第2の貯留部は、その内部に配置された検出試薬を含む。いくつかの実施形態において、ハウジングは、本明細書で記載されるように、第1の貯留部を第2の貯留部から隔離するための手段を更に含むことができる。いくつかの実施形態において、ハウジングは、細胞濃縮剤を第1の貯留部から第2の貯留部に移動させるための手段を更に含むことができる。いくつかの実施形態において、細胞濃縮剤は、ハウジングの第1の貯留部の中に配置される。
【0252】
いくつかの実施形態では、本開示のキットには、試料調製及び検出装置とともに使用することができる付属物品及び試薬を含む。付属物品の非限定的な例としては、試料取得装置、フィルタ、グローブ、培養装置(例えば、ペトリ皿、培養試験管、3M Company(St.Paul,MN)より入手されるPETRIFILMプレートなど)、核酸の単離又は増幅試薬、ラテラルフロー装置、ELISAプレート及び試薬などの免疫アッセイ装置、又は上記の物品の2つ以上のものの任意の組み合わせが挙げられる。付属試薬の非限定的な例としては、水、緩衝剤、指示薬(例えば、pH指示薬)、色素、体細胞抽出剤、細胞抽出剤を含む放出要素、本明細書で記載されるような結合パートナー、酵素、酵素基質、オリゴヌクレオチド、対照試料、又は上記の試薬の2つ以上のものの任意の組み合わせが挙げられる。
【実施例】
【0253】
ここで、本発明について、実施できる説明を行うために、本発明者が予見するいくつかの特定の実施形態を説明している。本発明の想像上の修正形態がそれでもなお、現在は予見されない修正形態を含めて、それらの等価物をなし得る。したがって、本発明の範囲は、本明細書に記載した細部及び構造によってではなく、以下の「特許請求の範囲」及びその等価物によってのみ限定されるべきである。
【0254】
材料:
細菌培養は、特に断らないかぎり、すべてThe American Type Culture Collection(ATCC,Manassas,VA)より入手した。
【0255】
水はすべて、特に指定のない限り、Millipore Corporation(Bedford,MA)より販売されるMilli−Q(商標)勾配脱イオンシステムを使用して18メガオームの滅菌脱イオン水として入手した。
【0256】
CM−111:球状化された非晶質ケイ酸マグネシウム:マイクロスフェアを3M Company(St.Paul,MN)より販売される3M(商標)Cosmetic Microspheres CM111として入手した。粒子は、2.3g/ccの粒子密度を有する中実の球として成形したものであり、約3.3m2/gの表面積を有していた。粒子の99%は、約11マイクロメートル未満であった。粒子の50%は、約5マイクロメートル未満であった。粒子の10%は、約2マイクロメートル未満であった。CM−111マイクロスフェアは、参照によりその全体が本明細書に組み込まれる、2009年12月22日出願の米国特許出願第61/289,213号、発明の名称「MICROORGANISM CONCENTRATION PROCESS AND CONCENTRATION AGENT FOR USE THEREIN」に述べられるようにして調製した。
【0257】
500mMのKCl、100mMのCaCl2、10mMのMgCl2、及び100mMのK2HPO4を含むpH 7.2の100倍の吸着緩衝液を調製し、使用前にフィルタ滅菌した。
【0258】
表面を滅菌したそれぞれの構成要素を、70%イソプロピルアルコールと接触させた(イソプロピルアルコールで拭くか又はイソプロピルアルコールに浸漬した)。余分なアルコールを流れ落とし、それぞれの構成要素を使用前に少なくとも30分間風乾した。
【0259】
化学物質はすべて、特に断らないかぎり、Sigma−Aldrich Chemical Company(Milwaukee,WI)より入手した。
【0260】
(実施例1)
ヒドロゲルの重合後のヒドロゲルビーズへの細胞抽出剤の取り込み
国際特許出願公開第2007/146722の実施例1に述べられるようにしてヒドロゲルビーズを調製した。国際特許出願公開2007/146722の実施例19に述べられるようにして乾燥させた後、実施例23に述べられるようにして活性溶液中に浸漬することによって活性ビーズを調製した。1gのビーズを60℃で2時間乾燥させて、ビーズから水を除去した。乾燥したビーズを2gのBARDAC 205M(Lonza Group Ltd.(Valais,Switzerland))の50%(w/v)水溶液中に少なくとも3時間〜一晩、室温で浸漬した。浸漬後、ビーズをブフナー漏斗に注いでビーズの水分を切り、次いで10〜20mLの蒸留水ですすいだ。ペーパータオルを押し付けることによって余分な水をビーズ表面から除去した。使用する前に、ビーズを室温で少なくとも2週間、ジャーに保存した。
【0261】
(実施例2)
微小粒子の使用による細胞濃縮、並びに細胞抽出剤を充填したヒドロゲル及びATP生物発光を利用した検出
3M(商標)CLEAN−TRACE表面ATPシステムを3M Company(St.Paul,MN)より入手した。大腸菌ATCC 51183の純粋培養物をトリプシン処理した大豆ブロス中に植菌して、37℃で一晩増殖させた。細菌培養物をButterfield緩衝液(pH 7.2±0.2;リン酸二水素カリウム緩衝液;VWR,West Chester,PA)中で約106又は105CFU/mLに希釈する。
【0262】
「捕捉」反応(表1)では、100マイクロリットルの希釈細菌懸濁液を、10mLの脱イオン水(Milli−Q Biocel System,Millipore,MA)試料の入った個々の試験管に直接加えて、それぞれ10mL中に約105CFU又は104CFUを得た。10mgのオートクレーブしたCM−111 3M(商標)Cosmetic Microspheres(か焼した非晶質の球状化ケイ酸マグネシウム粉末、3M Company;St.Paul,MN)を細胞の入った試験管に加え、室温で約15分間混合した。粒子を沈降させ、上清を除去した。粒子を100μLのButterfield緩衝液に懸濁し、1.5mLの微量遠心管に移した。400マイクロリットルのCLEAN−TRACE表面ATPシステムからのルシフェラーゼ/ルシフェリン液体試薬溶液を遠心管に加えた。
【0263】
コントロール反応(対照、表1)として、100μLの約106又は105CFU/mLの細胞懸濁液を1.5mLの微小遠心管に加え、400μLのCLEAN−TRACE表面ATPシステムからのルシフェラーゼ/ルシフェリン液体試薬溶液を遠心管に加えた。試薬を加えた直後に、細胞抽出剤を含むヒドロゲルビーズ(約11mg)を個々の遠心管に加え、相対発光量(RLU)の測定値をベンチトップ型ルミノメーター(Turner Biosystems,Sunnyvale,CA)より販売される20/20nシングルチューブ型ルミノメーター)で10秒間隔で記録した。発光量の測定値は、ルミノメーターとともに提供される20/20n SISソフトウェアを使用してルミノメーターから得た。光信号を1秒間にわたって積分し、RLUで表される結果を表1に示した。
【0264】
データは、同様の数の非希釈細胞とのコントロール反応と比較した場合、本明細書に記載のプロトコルを使用すると、微小粒子は、細胞を捕捉することができ、ヒドロゲルビーズから放出された細胞抽出剤は、より大きな(10mL)容積に希釈された微生物細胞からATPの約半分を抽出することができたことを示している。この結果は、細胞から放出されたATPがATP検出試薬と反応し、測定可能な生物発光を生じたことを更に示している。
【0265】
【表1】

【0266】
(実施例3)
ATP生物発光検出系を利用した一体型試料調製及び検出装置による微生物細胞の検出
この実施例では、図2に示されるような一体型の試料調製及び検出装置200を使用する。装置は、第1の貯留部220に約10mgのオートクレーブしたCM−111 3M Cosmetic Microspheresを備える。第2の貯留部224は、約0.6ミリリットルのCLEAN−TRACE表面ATPシステムからのルシフェラーゼ/ルシフェリン液体試薬溶液からなる液体検出試薬265を備える。第3の貯留部226は、PCT国際公開特許WO 2010/039627の調製例5に従って作製された2つのBARDAC 205Mビーズを備える。10ミリリットルの滅菌脱イオン水を、使用直前に一体型装置200の第1の貯留部220に加える。
【0267】
大腸菌の一晩培養物を実施例2で述べたようにして調製する。この細菌培養物を、Butterfield緩衝液中で約106又は105CFU/mLに希釈する。100マイクロリットルの希釈懸濁液を一体型装置200の上側貯留部220に直接ピペットで加えることによって、それぞれ10ミリリットル中に約105CFU又は104CFUの懸濁液を得る。キャップ278を使用してハウジング210を閉鎖し、細菌懸濁液を室温でマイクロスフェア(細胞濃縮剤230)と混合して通路216内に沈降させる。キャップ278を外して、プランジャ250を挿入することにより沈降したマイクロスフェアを含む液体試料の部分及びヒドロゲルビーズをATP検出試薬の入った第2の貯留部224内に移す。一体型装置を直ちにルミノメーター(例えば、NGルミノメーターUNG2)の読み取りチャンバに挿入し、UNGルミノメーターの非計画試験モードを用いてRLU測定値を10秒間隔で記録する。RLU測定値をRLUの数がプラトーに達するまで収集する。データをNGルミノミーターとともに提供されるソフトウェアを使用してダウンロードする。このデータは、微生物細胞がマイクロスフェアによって濃縮され、ヒドロゲルによって細胞抽出剤が放出され、この細胞抽出剤が細胞からのATPの放出を引き起こし、かつ細胞から放出されたATPがATP検出系によって検出されることを示すものである。
【0268】
(実施例4)
ATP生物発光検出系を利用した一体型試料調製及び検出装置による微生物細胞の検出
この実施例では、図3に示されるような一体型試料調製及び検出装置300を使用する。弁アクチュエータ372は、使用に先だって、弁キャビティ374が第1の貯留部320と流体連通するように配置されている。装置は、第1の貯留部320に約10mgのオートクレーブしたCM−111 3M Cosmetic Microspheresを備える。第2の貯留部324は、約0.6ミリリットルのCLEAN−TRACE表面ATPシステムからのルシフェラーゼ/ルシフェリン液体試薬溶液からなる液体検出試薬365を備える。BARDAC 205Mビーズは、PCT国際公開特許WO 2010/039627の調製例5に従って作製される。10ミリリットルの滅菌脱イオン水を、使用直前に一体型装置300の第1の貯留部320に加える。
【0269】
大腸菌の一晩培養物を実施例2で述べたようにして調製する。この細菌培養物を、Butterfield緩衝液中で約106又は105CFU/mLに希釈する。100マイクロリットルの希釈懸濁液を一体型装置300の上側貯留部320に直接ピペットで加えることによって、それぞれ10ミリリットル中に約105CFU又は104CFUの懸濁液を得る。キャップ378を使用してハウジング310を閉鎖し、細菌懸濁液を室温でマイクロスフェア(細胞濃縮剤330)と混合して弁キャビティ374内に沈降させる。キャップ378を外して、2個のBARDAC 205Mビーズ(放出要素362)をハウジング310の中に落とす。ビーズが弁キャビティ374内に沈降した直後に、弁アクチュエータ372を回して弁キャビティ内の液体試料の部分(細胞濃縮剤330及び放出要素362を含む)をATP検出試薬の入った第2の貯留部324内に移す。一体型装置を直ちにルミノメーター(例えば、NGルミノメーターUNG2)の読み取りチャンバに挿入し、UNGルミノメーターの非計画試験モードを用いてRLU測定値を10秒間隔で記録する。RLU測定値をRLUの数がプラトーに達するまで収集する。データをNGルミノミーターとともに提供されるソフトウェアを使用してダウンロードする。このデータは、微生物細胞がマイクロスフェアによって濃縮され、放出要素によって細胞抽出剤が放出され、この細胞抽出剤が細胞からのATPの放出を引き起こし、かつ細胞から放出されたATPがATP検出系によって検出されることを示すものである。
【0270】
(実施例5)
検出装置の調製:
I型の装置:これらの検出装置では、以下に述べる相違点を有する以外は図10Aのハウジングと同様のハウジングを構成した。以下の参照符合は、図10Aの対応する部材を示す。ハウジング1100の上側部分1012及び下側部分1014は、3M Clean−Trace(商標)表面ATP試験(3M Company(Bridgend,UK)から入手)から類似構成要素を使用して得た。破断可能なシール1068が結合された回収要素1067を、下側部分1014の上側部分に、破断可能なシール1068がハウジング1100の下側部分1014に面するようにして圧入した。上側部分1012は、ヒートガン(Master Appliances Corp,Racine,WI)を使用してbuyheatshrink.comより入手した、3:1ポリオレフィン2重壁の接着剤でライニングされた熱収縮フィルム(部品番号_HSC3A−050−cc、直径1.5cm)の2cmの切片を用いて下側部分1014と連結した。
【0271】
これらの検出装置では、図2Aのプランジャと同様のプランジャを構成した。以下の参照符合は、図2Aの対応する部材を示す。3M Clean−Trace(商標)表面ATP試験からのポリオレフィン製プラスチックハンドル(252)の一部、真鍮製金属シャフト(251)及びアセタール製穿孔部材259を用いてプランジャ(250)を組み立てた。ハンドル252及び穿孔部材259は、ネジによる連結によって真鍮シャフトの両端に取り付けた。真鍮製金属シャフトは、長さ11.5cm及び直径3.9mmであった。旋盤を使用してシャフトの両端に6mmの6〜23のネジ山を切った。穿孔部材259は、10インチ(25.4cm)のサウスベンド旋盤を使用して1/2インチ(12.7mm)のアセタールコポリマーロッド(部品番号8497K211、McMASTER−CARR(Santa Fe Springs,CA)より入手)から作製した。下側シール256としてOリング(McMASTER−CARRより入手したBuna N AS568A−010)を使用し、プランジャ250の穿孔端259の約11.5mm上に取り付けた。プランジャは、1回の使用毎に表面を滅菌した。
【0272】
II型の装置:これらの検出装置は、図6Aに示されるものと同様の先端部を有する図5Aで図示及び説明したものと同様のプランジャを使用して組み立てた。ハウジングは、I型の装置について述べたのと同様に構成した。プランジャの先端部は、10インチ(25.4cm)のサウスベンド旋盤を使用して1/2インチ(12.7mm)のアセタールコポリマー製ロッド(部品番号8497K211、McMASTER−CARR(Santa Fe Springs,CA)より入手)から作製した。ダックビル型一方向弁及びプラスチック製保持ワッシャを、プランジャの先端部の本体の陥凹した開口部内にプレス嵌めした。フィルタは、POREXフィルタ(Porex Corporation(Fairburn,GA)より入手される部品番号X6854)を図6Aに示される形状に機械加工し、一端を先端部の陥凹した開口部に圧入し、弁及び保持ワッシャを定位置に保持するような寸法に形成することによって作製した。プランジャは、1回の使用毎に表面を滅菌した。
【0273】
III型の装置:以下に述べる相違点を有する以外は図10Aに示されるものと同様の検出装置を構成した。以下の参照符合は、図10Aの対応する部材を示す。ハウジング1100の上側部分1012及び下側部分1014は、3M Clean−Trace(商標)表面ATP試験(3M Company(Bridgend,UK)から入手)から類似構成要素を使用して得た。破断可能なシール1068が結合された回収要素1067を、下側部分1014の上側部分に、破断可能なシール1068がハウジング1100の下側部分1014に面するようにして圧入した。上側部分1012は、ヒートガン(Master Appliances Corp,Racine,WI)を使用してbuyheatshrink.comより入手した、3:1ポリオレフィン2重壁の接着剤でライニングされた熱収縮フィルム(部品番号_HSC3A−050−cc、直径1.5cm)の2cmの切片を用いて下側部分1014と連結した。
【0274】
3M Clean−Trace(商標)表面ATP試験からのポリオレフィン製プラスチックハンドル(1052)の一部、真鍮製金属シャフト(1051)及び先端部1090を用いてプランジャ(1050)を組み立てた。ハンドル1052及び先端部1090は、ネジによる連結によって真鍮シャフトの両端に取り付けた。真鍮製金属シャフトは、長さ11.5cm及び直径3.9mmであった。旋盤を使用してシャフトの両端に6mmの6〜23のネジ山を切った。先端部1090は、10インチ(25.4cm)のサウスベンド旋盤を使用して1/2インチ(12.7mm)のアセタールコポリマー製ロッド(部品番号8497K211、McMASTER−CARR(Santa Fe Springs,CA))より入手)から作製した。Oリング1086を先端部1090に取り付けた。先端部は、図10に示されるような保持部材1087を含むように機械加工した。厚さ1mmのポリウレタンゴムの小片を打抜き、これを保持部材1087内に滑り込ませることによってスクレーパーを構成した。スクレーパー1086の外径は、ハウジング1010の内側に緊密に嵌合するような寸法に構成した。プランジャは、1回の使用毎に表面を滅菌した。
【0275】
(実施例6)
I型装置を使用した、スパイク水からの粒子状濃縮剤による大腸菌の捕捉
トリプシン処理大豆寒天プレート(Becton Dickinson,Sparks,MD)から単離した大腸菌(ATCC 51813)の単離されたコロニーを使用して5mLのトリプシン処理大豆ブロス(Becton Dickinson,Sparks,MD)に植菌し、37℃のインキュベーター内で一晩インキュベートした。約109個のコロニー形成単位/mL(CFU/mL)を含む一晩培養物をフィルタ滅菌した18メガオームの水で1:10,000に希釈した(約105CFU/mLにまで、以後、「初期希釈懸濁液」と呼ぶ)。500マイクロリットルの希釈培養液を50mLのフィルタ滅菌した18メガオームの水に移し、約1000個/mLの最終濃度とした。
【0276】
100倍の吸着緩衝液(pH 7.2)の一定分量(0.5mL)を、上記の50mLの希釈した大腸菌懸濁液に加えた(以後、「スパイク水試料」と呼ぶ)。内容物を約1分間、手動で混合した。
【0277】
10mgの蒸気滅菌したCM−111を秤量し、実施例5で述べたようにして調製したI型装置に加えた。体積10mLのスパイク水試料をそれぞれの装置に加え、表面滅菌したパラフィルムで装置をキャップした。内容物を室温(25℃)で約約30秒間、手で振盪することによって混合した。
【0278】
混合後、それぞれの装置を、Thermolyne Vari Mix(商標)ロッキングプラットフォーム(Barnstead International,Iowa、14サイクル/分)上で異なる時間(それぞれ1、5、10及び20分間)インキュベートした。インキュベート後、それぞれの管をベンチトップに10分間置いて粒子状の濃縮剤CM−111を沈降させた。沈降後、パラフィルムのラッピングを外し、予め滅菌したプランジャ装置を使用して箔シールに穿孔し、沈降したCM−111剤を装置の下側部分内に堆積させた。ピペットを用いて上清を除去し、カミソリ刃を用いて装置の下側部分(細胞濃縮剤が入った)を装置の上側部分から分離した。沈降したCM−111濃縮剤(約100マイクロリットルの水中)を装置から取り出し、滅菌水で1:100に希釈し、希釈した濃縮剤の1ミリリットルの一定分量を、製造者の指示に従って3M(商標)Petrifilm(商標)Aerobic Countプレート(3M Company,St.Paul,MN)上にプレートした。
【0279】
コントロールとして、初期希釈懸濁液を滅菌水で1:1000の希釈度で更に希釈し、製造者の指示に従って3M(商標)Petrifilm(商標)Aerobic Countプレート(3M Company,St.Paul,MN)上にプレートした。滅菌性のコントロールとして、粒子状物質も3M(商標)Petrifilm(商標)Aerobic Countプレート上にプレートした。それぞれのプレートを37℃のインキュベーター(VWR Orbital Shaker Incubator,VWR,West Chester,PA)内で一晩インキュベートした。
【0280】
すべてのプレートを、製造者の指示に従って3M(商標)Petrifilm(商標)プレートリーダー(3M Company,St.Paul,MN)により分析し、コロニーのカウントを得た。結果を表2に示す。結果は、下式によって計算した。
捕捉効率=(濃縮剤上のコロニー数)/(スパイクコントロール中の全コロニー数)×100
【0281】
【表2】

【0282】
(実施例7)
III型装置を使用したCM−111による大腸菌の濃縮
単離した大腸菌(ATCC 51813)のコロニーをストリークプレートから5mLのトリプシン処理した大豆ブロス(TSB、Becton Dickinson(Sparks,MD))に植菌し、37℃で18〜20時間インキュベートした。約109個のコロニー形成単位/mLのこの一晩培養物をフィルタ滅菌した脱イオン水(MilliQ,Millipore,MA)中で希釈し、10mLのフィルタ滅菌した脱イオン水中でスパイクして1×103個/mL及び1×104個/mL(全体で約1×104/mL cfu及び約1×105/mL cfu)の最終濃度を得た。スパイクした水を、10mgの予め滅菌した(121℃、15分)CM−111(Cosmetic Microspheres−111、3M Company,St Paul)の粉末及び100マイクロリットルの100倍吸着緩衝液(pH 7.2)の入ったIII型装置のハウジングに加えた。ハウジングを表面滅菌したパラフィルムで密封し、ロッキングプラットフォーム上に置いた。次いで、キャップした装置を、Thermolyne Vari Mix(商標)ロッキングプラットフォーム(Barnstead International,Iowa、14サイクル/分)上で5分間の接触時間にわたって室温(25℃)でインキュベートした。次いで装置を振盪させずに(重力によって粒子を沈降させるため)5分間静置し(ロッキング及び沈降の全経過時間=10分間)、パラフィルムを取り外して、II型装置のプランジャをハウジングに挿入し、ハウジングの底の方向に押し込むことによってバルク試料からCM−111粒子を分離した。プランジャが破断可能なシールを破ると、約0.1mLの液体試料に懸濁されたCM−111粒子は、ハウジングの第2の貯留部に移された。CM−111粒子を第2の貯留部から回収して、1.5mLの滅菌した微小遠心管に移した。体積100mLのBacTiter−Glo(商標)試薬(Promega,Madison,WI)をペレットに加え、VWR Fixed Speed Vortexミキサー上で5秒間(3200rpmで5秒)ボルテックスして混合し、卓上型ルミノメーター(FB12シングルチューブ型ルミノメーター、Berthold Detection Systems USA(Oak Ridge,TN))上で読み取った。大腸菌細胞の1×105個/mL及び1×106個/mLの懸濁液から100マイクロリットルの体積を試験することにより、ポジティブコントロール(「100%シグナル」)を調製した。結果は、下式によって計算し、下記表3にまとめた。
ATPシグナル捕捉効率(%)=(CM−111ペレットのRLU/100%シグナルからのRLU)×100
RLU=相対ルシフェラーゼ単位
【0283】
【表3】

N=2、標準偏差<10%。データは、大腸菌コントロールについては水のみ(16,464RLU)のバックグラウンドに対して標準化し、細菌と接触させたCM−111ペレットについては未反応のCM−111(41,424RLU)のバックグラウンドに対して標準化した。
【0284】
上記実施例から、粒子状の捕捉剤を使用して水性試料から細菌を濃縮できることが分かる。
【0285】
(実施例8)
II型装置を使用したCM−111による大腸菌の濃縮。
単離した大腸菌(ATCC 33090)のコロニーをストリークプレートから5mLのトリプシン処理した大豆ブロス(TSB、Becton Dickinson,Sparks,MD)に植菌し、37℃で18〜20時間インキュベートした。約108個のコロニー形成単位/mLのこの一晩培養物をフィルタ滅菌した脱イオン水(MilliQ,Millipore,MA)中で希釈し、10mLのフィルタ滅菌した脱イオン水中でスパイクして103個/mL(全体で約104cfu)の最終濃度を得た。スパイクした水を、10mgの予め滅菌した(121℃、15分)CM−111(Cosmetic Microspheres−111、3M Company,St Paul)の粉末及び100マイクロリットルの100倍吸着緩衝液が既に入っている装置に加えた。装置を表面滅菌したパラフィルムで密封し、ロッキングプラットフォーム上に置いた。キャップした装置を、Thermolyne Vari Mix(商標)ロッキングプラットフォーム(Barnstead International,Iowa、14サイクル/分)上で1分及び9分間(全経過時間=2分及び10分間)室温(25℃)でインキュベートした。
【0286】
インキュベートの後、パラフィルムを取り外し、プランジャを破断可能なシールと接触するまでハウジング内に挿入した。プランジャを更に挿入して破断可能なシールを破ることにより、大腸菌が結合したCM−111が約100マイクロリットルの液体試料とともにハウジングの第2の貯留部に移された。微小粒子なしの大腸菌が入ったコントロールの管を同様に処理した。
【0287】
第2の貯留部を切り開いてCM−111ペレットを回収し、粒子を1.5mLの滅菌した微小遠心管に移した。体積100mLのBacTiter−Glo(商標)試薬(Promega,Madison,WI)をペレットに加え、VWR Fixed Speed Vortexミキサー上で5秒間(3200rpmで5秒)ボルテックスして混合し、卓上型ルミノメーター(FB12シングルチューブ型ルミノメーター、Berthold Detection Systems USA(Oak Ridge,TN))上で読み取った。100%シグナルについては、105個/mLの希釈液から体積100マイクロリットルを使用した。結果は、下式によって計算し、下記表4にまとめた。
ATPシグナル捕捉効率(%)=(CM−111ペレットのRLU/約104個の全大腸菌からのRLU)×100
RLU=相対ルシフェラーゼ単位
【0288】
【表4】

N=2、標準偏差<10%。データは、大腸菌コントロールについては水のみ(27,938RLU)のバックグラウンドに対して標準化し、細菌と接触させたCM−111ペレットについては未反応のCM−111(30,611RLU)のバックグラウンドに対して標準化した。
【0289】
(実施例9)
II型装置を使用したAB−CM−111による大腸菌の濃縮
実施例8において述べた手順を用い、AB−CM(吸着緩衝液で処理したCM−111)の10mgの一定分量についても、10mLの水からの大腸菌の濃縮について試験を行った。接触時間を9分、1分として、POREXプランジャを使用してAB−CMを沈降させた。データを表5にまとめた。
【0290】
【表5】

N=2、標準偏差<10%。データは、大腸菌コントロールについては水のみ(20,281RLU)のバックグラウンドに対して標準化し、細菌と接触させたCM−111ペレットについては未反応のAB−CM(44,488RLU)のバックグラウンドに対して標準化した。
【0291】
上記実施例から、粒子状の捕捉剤を使用して水性試料から細菌を濃縮できることが分かる。
【0292】
(実施例10)
比較例−非濃縮試料における大腸菌の検出。
現時点の技術水準における水試験法として、標準的なATP生物発光アッセイ(例えば、3M Company(St.Paul,MN)より入手可能な3M CLEANTRACE Water−Free ATP、カタログ番号AQF100)を用いて100マイクロリットルの水をATPについて試験する方法がある。
【0293】
トリプシン処理した大豆ブロス中での大腸菌の一晩培養物(ATCC 33090)を、滅菌水で希釈して2つの懸濁液を得た。懸濁液Aは、約103CFU/mLを含み、懸濁液Bは、約105CFU/mLを含んでいた。
【0294】
それぞれの懸濁液の100マイクロリットルの一定分量を体積100マイクロリットルのBacTiter−Glo(商標)試薬(Promega,Madison,WI)と混合し、生じた生物発光を実施例8で述べたようにしてルミノメーターで測定した。結果を表6に示す。
【0295】
【表6】

N=2、標準偏差<10%
【0296】
本明細書に引用するすべての特許、特許出願及び公開公報、並びに電子的に入手可能な資料の開示内容の全体を援用する。本出願の開示内容と参照により本明細書に組み込まれるいずれかの文書の開示内容との間になんらかの矛盾が存在する場合には、本出願の開示内容が優先するものとする。上記の詳細な説明及び実施例はあくまで理解を助けるために示したものである。これらによって不要な限定をするものと理解されるべきではない。本発明は、図示及び説明された厳密な詳細に限定されるものではなく、当業者には明らかな変形例は特許請求の範囲によって定義される本発明に含まれるものとする。
【0297】
特に指示がない限り、明細書及び添付の特許請求の範囲に使用される成分の量、分子量を表すすべての数は、すべての例において、「約」という用語により修正されることを理解されたい。したがって、特に断らないかぎり、本明細書及び添付の特許請求の範囲に記載される数値パラメータは、本発明が実現しようとする所望の性質に応じて変わりうる近似値である。少なくとも、また、均等論を特許請求の範囲に限定しようとするものではなく、それぞれの数値パラメータは少なくとも報告される有効数字の数を考慮し、更に通常の数値の端数処理を適用して解釈されるべきである。
【0298】
本発明の広義の範囲で示す数値的範囲及びパラメータは近似値ではあるが、具体例に記載される数値は可能な限り正確に報告されている。しかしながら、数値はすべて、それぞれの試験測定値における標準偏差から必然的に生じる一定の範囲を本質的に含むものである。
【0299】
すべての見出しは読者の便宜のためのものであって、特に断らないかぎり、見出しの後に続く文面の意味を限定するために使用されるものではない。
【技術分野】
【0001】
(関連出願の相互参照)
本出願は、2009年12月30日に出願された米国仮特許出願第61/291,301号、及び2010年5月6日に出願された同第61/331,931号の利益を主張するものであり、これらの仮特許出願は、参照によってその全体が本明細書に組み込まれる。
【背景技術】
【0002】
試料(例えば表面、水、空気等)中の細胞又は複数の細胞と関連する生物学的検体の存在を評価するために用いることができる種々の試験が利用可能である。こうした試験としては、ホタルルシフェラーゼ反応を利用したATPの検出に基づく試験、比色計を用いたタンパク質の検出に基づく試験、微生物培養法を用いた微生物の検出に基づく試験、及び免疫化学的方法を用いた微生物の検出に基づく試験がある。スワブ装置を用いたり、あるいは寒天プレートなどの培養装置との直接的な接触によって表面の試料を採取することができる。この試料を、生きた細胞の存在、特に生きた微生物の存在について分析することができる。
【0003】
これらの試験の結果はしばしば、表面の清浄度について判定を行うために用いられる。例えば、こうした試験は、食品加工機器が生産に使用するうえで充分に洗浄されているか否かを判定するために用いることができる。上記の試験は、汚染された表面の検出に有用であるが、試験の実施に多くの工程を要し得るものであり、生きた細胞の存在を死細胞から迅速かつ/又は容易に区別できない場合があり、場合によっては、結果を判定できるまでに長い時間(例えば、数時間又は数日)を要し得る。
【0004】
これらの試験を用いて、生きた微生物の存在を示すことができる。こうした試験では、生きた細胞に付随する生物学的検体(例えば、ATP)を放出させるために、細胞抽出剤がしばしば使用される。細胞外物質(例えば、死んだ又はストレス下の動物細胞、植物細胞、及び/又は微生物から環境中に放出される非細胞性ATPなど)が存在すると、高い「バックグラウンド」濃度のATPを生じ、これが生きた細胞の検出を困難とする場合がある。
【発明の概要】
【発明が解決しようとする課題】
【0005】
生きた細胞を検出するための多くの方法及び装置が存在するにも関わらず、生きた細胞、特に生きた微生物細胞の検出のための単純かつ信頼できる試験が依然求められている。
【課題を解決するための手段】
【0006】
本開示は一般的には、試料中の生きた細胞を検出するための物品及び方法に関する。本物品及び方法により、表面上の細菌などの細胞の存在を迅速に検出する(例えば、蛍光、化学発光、又は色反応などにより)ことが可能になる。いくつかの実施形態では、本発明の物品は「すぐに試料測定が行える状態」(即ち、物品が、試料中の生きた細胞を検出するために必要なすべての要素を含む)である。特定の態様では、本発明の物品及び方法は、真核細胞(例えば、植物細胞又は動物細胞)に関連する生物学的検体(例えば、ATP又は酵素)を原核細胞(例えば、細菌細胞)に関連する同様又は同一の生物学的検体から区別するための手段を提供する。更に、本発明の物品及び方法は、環境中に遊離している生物学的検体(即ち、非細胞性の生物学的検体)を、生きた細胞に関連する同様又は同一の生物学的検体から区別するための手段を提供する。
【0007】
本開示の方法は、操作者が液体試料から細胞を濃縮し、細胞に関連した検体を検出することを可能とするものである。特定の実施形態では、検体の検出は、特に試料中の生きた微生物細胞を含む生きた細胞の指標となり得る。いくつかの実施形態において、本方法は、操作者が試料中の生物学的検体及び/又は細胞の量を測定することを提供する。いくつかの実施形態では、本方法は、組成物から有効量の細胞抽出剤が液体混合物中に放出される所定の時間の後に操作者が生物学的検体の量を測定することにより、試料中の非細胞性物質に由来する生物学的検体の量と、生きた細胞に由来する生物学的検体の量を区別して求めることを提供する。いくつかの実施形態では、本方法は、操作者が第1の所定の時間内に生物学的検体の量の第1の測定を行い、更に組成物から有効量の細胞抽出剤が放出される第2の所定の時間内に生物学的検体の量の第2の測定を行うことによって、試料中の生きた細胞の存在を検出することを提供する。いくつかの実施形態では、本方法は、試料中の生物学的検体が生きた植物又は動物細胞から放出されたものであるか、あるいは生きた微生物細胞(例えば、細菌)から放出されたものであるかを操作者が区別することを提供する。本発明は、食品調理サービス施設、医療環境などの比較的過酷な現場環境において、操作者が使用することが可能である。
【0008】
一態様では、本開示は、試料中の細胞を検出する方法を提供する。本方法は、細胞濃縮剤と、細胞抽出剤を含む放出要素と、液体試料とを提供することを含むことができる。本方法は、液体試料と細胞濃縮剤とを所定の時間接触させることと、液体試料の少なくとも一部から細胞濃縮剤を分離することと、分離された細胞濃縮剤と放出要素とを含む液体混合物を形成することと、ここで、細胞抽出剤は混合物中に放出される、細胞からの生物学的検体を検出すること、を更に含むことができる。任意に、検体は、2つ以上の別個の時点で検出されることができる。いくつかの実施形態において、生物学的検体を検出することは、生きた細胞を検出することを含む。いくつかの実施形態において、生物学的検体を検出することは、検出系を使用することを含むことができる。いくつかの実施形態において、生物学的検体を検出することは、検体の量を定量することを含むことができる。いくつかの実施形態において、生物学的検体を検出することは、細胞からのATPを検出することを含むことができる。いくつかの実施形態において、生物学的検体を検出することは、遺伝学的又は免疫学的方法によって細胞を検出することを含むことができる。いくつかの実施形態において、本方法は、体細胞抽出剤を提供する工程と、この体細胞抽出剤を試料からの細胞と接触させる工程と、を更に含むことができる。
【0009】
別の態様において、本開示は試料中の細胞を検出する方法を提供する。本方法は、試料;細胞濃縮剤;細胞抽出剤を含む放出要素;第1及び第2の貯留部を備えたハウジングと試料を受容するように構成された開口部とを含む検出物品;細胞濃縮剤を分離してハウジングの第1の貯留部から第2の貯留部に移動させるための手段、を提供する工程を含むことができる。本方法は、ハウジングの第1の貯留部内の液体媒質中で試料と細胞濃縮剤とを接触させることを更に含むことができる。本方法は、ハウジング内の第2の貯留部に細胞濃縮剤を移動させることを更に含むことができる。本方法は、分離された細胞濃縮剤と放出要素とを含む液体混合物を形成することを更に含むことができ、細胞抽出剤は混合物中に放出される。本方法は、細胞からの生物学的検体を検出することを更に含むことができる。任意に、生物学的検体は、2つ以上の別個の時点で検出することができる。いくつかの実施形態において、生物学的検体を検出することは、生きた細胞を検出することを含むことができる。いくつかの実施形態において、生物学的検体を検出することは、検出系を使用することを含むことができる。いくつかの実施形態において、生物学的検体を検出することは、検体の量を定量することを含むことができる。いくつかの実施形態において、生物学的検体を検出することは、細胞からのATPを検出することを含むことができる。いくつかの実施形態において、生物学的検体を検出することは、遺伝学的又は免疫学的方法によって細胞を検出することを含むことができる。いくつかの実施形態において、本方法は、体細胞抽出剤を提供する工程と、この体細胞抽出剤を試料からの細胞と接触させる工程と、を更に含むことができる。
【0010】
別の態様において、本開示は試料中の細胞を検出するための方法を提供する。本方法は、試料;試料を受容するように構成された開口部と、細胞濃縮剤が収容された第1の貯留部と、細胞抽出剤を含む放出要素が収容された第2の貯留部と、を備えるハウジングを含む検出物品;細胞濃縮剤を液体試料の少なくとも一部から分離するための手段;及び細胞濃縮剤をハウジングの第1の貯留部から第2の貯留部に移動させるための手段、を提供する工程を含むことができる。本方法は、ハウジングの第1の貯留部内の液体媒質中で試料と細胞濃縮剤とを接触させることを含むことができる。本方法は、細胞濃縮剤を分離して、ハウジングの第2の貯留部に移動させる工程を更に含むことができる。本方法は、分離された細胞濃縮剤と放出要素とを含む液体混合物を形成することを更に含むことができ、細胞抽出剤は、混合物中に放出される。本方法は、細胞からの生物学的検体を検出することを更に含むことができる。任意に、生物学的検体は、2つ以上の別個の時点で検出されることができる。いくつかの実施形態において、生物学的検体を検出することは、生きた細胞を検出することを含むことができる。いくつかの実施形態において、生物学的検体を検出することは、検出系を使用することを含むことができる。いくつかの実施形態において、生物学的検体を検出することは、検体の量を定量することを含むことができる。いくつかの実施形態において、生物学的検体を検出することは、細胞からのATPを検出することを含むことができる。いくつかの実施形態において、生物学的検体を検出することは、遺伝学的又は免疫学的方法によって細胞を検出することを含むことができる。いくつかの実施形態において、本方法は、体細胞抽出剤を提供する工程と、この体細胞抽出剤を試料からの細胞と接触させる工程と、を更に含むことができる。
【0011】
別の態様において、本開示は一体型試料調製及び検出装置を提供する。装置は、それらの間に通路を有する第1の貯留部と第2の貯留部とを含むハウジングを含むことができる。ハウジングの第1の貯留部は、試料を受容するように構成された開口部と、その中に配置された細胞濃縮剤を含むことができる。ハウジングの第2の貯留部は、その中に配置された検出試薬を含むことができる。装置は、第1の貯留部を第2の貯留部から隔離するための手段を更に含むことができる。装置は、細胞濃縮剤を第1の貯留部から第2の貯留部に移動させるための手段を更に含むことができる。いくつかの実施形態において、第1の貯留部と第2の貯留部とを隔離するための手段は、細胞濃縮剤を第1の貯留部から第2の貯留部に移動させるための手段である。いくつかの実施形態において、ハウジングは、隔離された第1の貯留部と第2の貯留部との間の破断可能なシールを更に含むことができる。いくつかの実施形態において、第1の貯留部はテーパ領域を含むことができる。いくつかの実施形態において、装置は、細胞抽出剤を含む放出要素を更に含むことができる。いくつかの実施形態において、ハウジングは、第3の貯留部を更に含むことができる。いくつかの実施形態において、装置は、試料取得装置を更に含むことができる。いくつかの実施形態において、検出試薬は、ATPを検出するための試薬を含むことができる。いくつかの実施形態において、装置は、検出試薬を含む放出要素を更に含むことができる。
【0012】
別の態様において、本開示は一体型試料調製及び検出装置を提供する。装置は、それらの間に通路を有する隔離された第1及び第2の貯留部と、通路に嵌合するように構成されたピストンとを含むハウジングを含むことができる。ハウジングの第1の貯留部は、試料を受容するように構成された開口部と、その中に配置された細胞濃縮剤を含むことができる。ハウジングの第2の貯留部は、その中に配置された検出試薬を含むことができる。いくつかの実施形態において、ハウジングは、隔離された第1の貯留部と第2の貯留部との間の破断可能なシールを更に含むことができる。いくつかの実施形態において、第1の貯留部は、テーパ形状の内壁を含むことができる。いくつかの実施形態において、装置は、細胞抽出剤を含む放出要素を更に含むことができる。いくつかの実施形態において、ハウジングは、第3の隔離された貯留部を更に含むことができる。いくつかの実施形態において、装置は、試料取得装置を更に含むことができる。いくつかの実施形態において、検出試薬は、ATPを検出するための試薬を含むことができる。いくつかの実施形態において、装置は、検出試薬を含む徐放性組成物を更に含むことができる。
【0013】
別の態様において、本開示は一体型試料調製及び検出装置を提供する。装置は、それらの間に通路を有する隔離された第1の貯留部と第2の貯留部を含むハウジングを含むことができる。ハウジングの第1の貯留部は、試料を受容するように構成された開口部と、その中に配置された細胞濃縮剤とを含む。第2の貯留部は、その中に配置された検出試薬を含むことができる。装置は、第1の貯留部から第2の貯留部への物質の通過を制御するように構成された弁を更に含むことができる。いくつかの実施形態において、第1の貯留部は、テーパ形状の内壁を含むことができる。いくつかの実施形態において、装置は、細胞抽出剤を含む放出要素を更に含むことができる。いくつかの実施形態において、ハウジングは、第3の隔離された貯留部を更に含むことができる。いくつかの実施形態において、装置は、試料取得装置を更に含むことができる。いくつかの実施形態において、検出試薬は、ATPを検出するための試薬を含むことができる。いくつかの実施形態において、装置は、検出試薬を含む徐放性組成物を更に含むことができる。
【0014】
別の態様において、本開示は、それらの間に通路を有する隔離された第1の貯留部と第2の貯留部を含むハウジングと、細胞濃縮剤を第1の貯留部から第2の貯留部に移動させるための手段と、を含むキットを提供する。ハウジングの第1の貯留部は、試料を受容するように構成された開口部を含むことができる。第2の貯留部は、その中に配置された検出試薬を含むことができる。キットは、細胞濃縮剤を更に含むことができる。いくつかの実施形態において、細胞濃縮剤は、ハウジングの第1の貯留部内に配置される。いくつかの実施形態において、キットは、微生物細胞抽出剤を含む放出要素を更に含むことができる。いくつかの実施形態において、キットは、体細胞抽出剤を更に含むことができる。いくつかの実施形態において、キットは、試料取得装置を更に含むことができる。
【0015】
別の態様において、本開示は、それらの間に通路を有する隔離された第1の貯留部と第2の貯留部を含むハウジングとを含むキットを提供する。ハウジング内の第1の貯留部は、試料を受容するように構成された開口部を含むことができる。ハウジング内の第2の貯留部は、その中に配置された検出試薬を含むことができる。キットは、細胞濃縮剤と、細胞濃縮剤を第1の貯留部から第2の貯留部に移動させるための手段と、を更に含むことができる。いくつかの実施形態において、細胞濃縮剤は、ハウジングの第1の貯留部の中に配置される。いくつかの実施形態において、キットは、微生物細胞抽出剤を含む放出要素を更に含むことができる。いくつかの実施形態において、キットは、体細胞抽出剤を更に含むことができる。いくつかの実施形態において、キットは、試料取得装置を更に含むことができる。
【0016】
用語解説
本明細書で使用する「生物学的検体」とは、生物内に生ずる、又は生物によって生成される分子、又はその誘導体を指す。例えば、生物学的検体としては、これらに限定されるものではないが、アミノ酸、核酸、ポリペプチド、タンパク質、ヌクレオチド、ポリヌクレオチド、脂質、リン脂質、糖類、多糖類、及びこれらの組み合わせのうちの少なくとも1つを挙げることができる。生物学的検体の具体例としては、これらに限定されるものではないが、代謝産物(例えば、ATPなどの小分子、又はプロテインAなどのポリペプチド)、アレルゲン(例えば、落花生アレルゲン)、ホルモン、毒素(例えば、Bacillus属下痢毒素、アフラトキシンなど)、RNA(例えば、mRNA、全RNA、tRNAなど)、DNA(例えば、プラスミドDNA、植物DNAなど)、タグ付きタンパク質、抗体、抗原、及びこれらの組み合わせを挙げることができる。
【0017】
本明細書で使用する「液体試料」とは、液体を含む試料物質を指す。試料は、その元々の形態では、例えば、水、母乳、分泌液、血液、傷口の滲出液などの液体を含むものでよい。また、液体試料は、液体懸濁媒質(例えば、水、水性緩衝液など)中に固体を懸濁した懸濁液であることができる。例えば、固体、半固体、又はゼラチン状試料を試料取得装置によって採取し、液体に懸濁させて液体試料とすることができる。
【0018】
「清澄化液体試料」とは、液体試料を細胞濃縮剤と接触させ、細胞濃縮剤を液体のバルクから分離した(例えば、沈降、濾過、遠心、又は沈殿により)後に残る液体試料のバルクを指す。
【0019】
「試料取得装置」とは、本明細書では最も広い意味で使用され、液体、半固体、又は固体の試料物質を採取するために使用される器具を指す。試料取得装置の非限定的な例としては、スワブ、ワイプ、スポンジ、スクープ、スパチュラ、ピペット、ピペット先端、及びサイフォンホースが挙げられる。
【0020】
本明細書で使用する「行き止まり弁」とは、検出装置のハウジング内の2つ以上の貯留部間の物質(例えば、液体、固体、又は液体中の固体の懸濁液)の移動を調節するために使用される弁の一種を指す。行き止まり弁は、物質の移動に使用される弁内のキャビティが、一度に1つの貯留部とのみ流体連通し得るような設計となっている。
【0021】
本明細書で使用する用語「ヒドロゲル」は、親水性であり、極性溶媒によって膨潤しているかあるいは膨潤させることが可能なポリマー材料を指す。このポリマー材料は、通常、極性溶媒と接触すると膨潤するが溶解しない。即ち、ヒドロゲルは、極性溶媒に不溶である。膨潤したヒドロゲルは、乾燥させることで極性溶媒の少なくとも一部を除去することができる。
【0022】
本明細書で使用する「細胞抽出剤」とは、細胞膜又は細胞壁の透過性を変化させるか、あるいは細胞(例えば、体細胞若しくは微生物細胞)の細胞膜及び/又は細胞壁の完全性を乱す(即ち、溶解又は孔を形成する)ことにより、生きた細胞に通常見られる生物学的検体を抽出又は放出させるような任意の化合物又は化合物の組み合わせを指す。
【0023】
本明細書で使用する「検出系」とは、生物学的検体を検出するために使用される成分を指し、酵素、酵素基質、結合相手(例えば、抗体又は受容体)、標識、色素、並びに吸光度若しくは反射率、蛍光及び/又は発光(例えば、生物発光若しくは化学発光)を検出するための装置が挙げられる。
【0024】
用語「好ましい」及び「好ましくは」は、特定の状況下で、特定の利点をもたらし得る本発明の実施形態を指す。しかしながら、同一の又は他の状況下で、他の実施形態もまた好ましい可能性がある。更に、1つ以上の好ましい実施形態の引用は、他の実施形態が有用でないことを含意するものではなく、本発明の範囲内から他の実施形態を排除することを意図するものではない。
【0025】
用語「含む」及びその変化形は、これらの用語が説明文及び特許請求の範囲において現れる場合、限定的な意味を有するものではない。
【0026】
本明細書で使用するとき、「1つの(a)」、「1つの(an)」、「その(the)」、「少なくとも1つの」及び「1つ以上の」は、同じ意味で使用される。したがって、例えば、「a」検出試薬を含むハウジングとは、ハウジングが「1つ以上の」検出試薬を含むことができることを意味するものとして解釈することができる。
【0027】
「及び/又は」という用語は、記載した要素の一部若しくはすべて、又は記載した要素のうちの任意の2つ以上の組み合わせを意味する。
【0028】
また本明細書において、端点による数の範囲の列挙には、その範囲内に包含されるすべての数(例えば、1〜5には、1、1.5、2、2.75、3、3.80、4、5、等)が包含される。
【0029】
本発明の上述の「課題を解決するための手段」は、本発明の開示されるそれぞれの実施形態又はすべての実施を記載することを目的としていない。以下の説明により、例示的な実施形態をより具体的に例示する。本出願のいくつかの箇所で、実施例の一覧として説明を提供するが、実施例は種々の組み合わせにて使用することが可能である。いずれの場合にも、記載した一覧は、代表的な群としてのみ役立つものであり、排他的な一覧として解釈されるべきではない。
【図面の簡単な説明】
【0030】
【図1A】2個の受容部を含むハウジングの一実施形態の断面図、及びハウジングと使用するために適合されたプランジャの断面図を示すものであり、これらはいずれも本開示に基づく試料調製及び検出装置の構成要素。
【図1B】プランジャがハウジング内の第1の位置に配置され、ハウジングの第1の貯留部内に細胞濃縮剤を含む、組み立てられた状態の図1Aの装置の断面図を示す。
【図1C】プランジャがハウジング内の第2の位置に配置され、ハウジングの第1の貯留部内に液体試料を含む、図1Bの装置の断面図を示す。
【図1D】プランジャが第1の位置にあり、細胞濃縮剤がハウジングの第2の貯留部内にある、図1Cの装置の断面図を示す。
【図2A】破断可能なシールによって分離された3個の貯留部を含むハウジングの一実施形態の断面図、及びハウジングと使用するために適合されたプランジャの側面図を示すものであり、これらはいずれも本開示に基づく試料調製及び検出装置の構成要素。
【図2B】キャップが取り付けられ、ハウジングの第1の貯留部内に液体試料が配置された、図2Aのハウジングの断面図を示す。
【図2C】キャップのない状態で、かつプランジャがハウジング内の第1の位置に配置された、図2Bのハウジングの断面図を示す。
【図2D】プランジャがハウジング内の第2の位置に配置され、細胞濃縮剤がハウジングの第2の貯留部に移動された、図2Cの装置の断面図を示す。
【図3A】本開示に基づく、ハウジング及び弁を含む試料調製及び検出装置の一実施形態の正面図を示す。
【図3B】図3Aの装置の側面図を示す。
【図3C】液体試料及び細胞濃縮剤がハウジングの第1の貯留部内に配置され、弁が第1の位置にある、図3Aの装置の断面図を示す。
【図3D】弁が第2の位置にあり、細胞濃縮剤がハウジングの第2の貯留部に移動された、図3Cの装置の断面図を示す。
【図4A】2個の貯留部及びドレーン弁を含むハウジングの一実施形態の断面図、並びにプランジャの側面図を示すものであり、これらはいずれも試料調製及び検出装置の構成要素。
【図4B】ドレーン弁が開いた配置にあり、プランジャがハウジング内の第1の位置に配置された、組み立てられた状態の図4Aの装置の断面図を示す。
【図4C】プランジャがハウジング内の第2の位置に配置され、細胞濃縮剤がハウジングの第2の貯留部に移された、組み立てられた状態の図4Bの装置の断面図を示す。
【図4D】プランジャが破断可能なシールに穿孔して細胞濃縮剤を第2の貯留部に移動させた、図4Cの装置の断面図を示す。
【図5A】ハウジングの一実施形態の断面図、及び部分的に断面にて示されたプランジャの側面図を示すものであり、これらはいずれも本開示に基づく試料調製及び検出装置の一実施形態の構成要素。
【図5B】プランジャがハウジングの異なる深さに挿入された、組み立てられた状態の図5Aの装置の断面図を示す。
【図5C】プランジャがハウジングの異なる深さに挿入された、組み立てられた状態の図5Aの装置の断面図を示す。
【図5D】プランジャがハウジングの異なる深さに挿入された、組み立てられた状態の図5Aの装置の断面図を示す。
【図6A】図5Aのプランジャの先端部の、部分的に断面にて示された分解側面図を示す。
【図6B】組み立てられた状態の図6Aの先端部の、部分的に断面にて示された側面図を示す。
【図7A】ハウジングの一実施形態の断面図、及び部分的に断面にて示された中空のプランジャの側面図を示すものであり、これらはいずれも本開示に基づく試料調製及び検出装置の一実施形態の構成要素。
【図7B】プランジャがハウジングの異なる深さに挿入された、組み立てられた状態の図7Aの装置の側面図を示す。
【図7C】プランジャがハウジングの異なる深さに挿入された、組み立てられた状態の図7Aの装置の側面図を示す。
【図7D】プランジャがハウジングの異なる深さに挿入された、組み立てられた状態の図7Aの装置の側面図を示す。
【図8A】図7Aのプランジャの先端部の、部分的に断面にて示された分解側面図を示す。
【図8B】組み立てられた状態の図8Aの先端部の、部分的に断面にて示された側面図を示す。
【図9】本開示に基づく細胞濃縮剤回収要素の一実施形態を示す。
【図10A】ハウジングの一実施形態の断面図、及び部分的に断面にて示されたプランジャの側面図を示すものであり、これらはいずれも本開示に基づく試料調製及び検出装置の一実施形態の構成要素。
【図10B】組み立てられた状態の図10Aの装置の、部分的に断面にて示された側面図を示す。
【図11】その中に細胞抽出剤が分散されている放出要素の一実施形態の上面斜視図を示す。
【図12a】空洞を有する基材を含む放出要素の一実施形態の平面図。
【図12b】図12aの放出要素の断面図。
【図13】マイクロチャネル空洞を含む放出要素の一実施形態の上面斜視図。
【図14】ゲスト化合物を含むコアを有するシェル構造を含む放出要素の一実施形態の断面図。
【図15】ゲスト化合物を含むシェル構造を含む放出要素の一実施形態の断面図。
【図16】第1のゲスト化合物を含むコア、及び第2のゲスト化合物を含むシェル構造を有するシェル構造を含む放出要素の一実施形態の断面図。
【図17】連続した層で配列された複数のシェル構造を含む放出要素の一実施形態の断面図。
【図18】外側のシェル構造内に独立して配列された複数のシェル構造を含む放出要素の一実施形態の断面図。
【発明を実施するための形態】
【0031】
本明細書に引用する特許、特許出願、政府刊行物、政府規制、及び参照文献はすべて、その全容を本明細書に援用する。記載の不一致の場合には、定義を含めた本明細書の記載内容が優先する。
【0032】
本発明は、試料中の微生物を検出するための物品及び方法に一般的に関する。特定の好ましい実施形態では、本発明は試料中の生きた微生物の検出に関する。試料からの細胞を濃縮するための方法及び装置は、いずれも参照によりその全体が本明細書に組み込まれるPCT国際公開特許WO 2010/078399、発明の名称「SAMPLING DEVICES AND METHODS FOR CONCENTRATING MICROORGANISMS」、及びPCT国際公開特許WO 2010/078404、発明の名称「METHODS,KITS AND SYSTEMS FOR PROCESSING SAMPLES」に記載されている。本明細書で開示する本発明の装置及び方法は、試料中に存在する少数の微生物を検出するための高い感度を与える。
【0033】
生物学的検体を使用して、試料中の生きた細胞などの生物学的物質の存在を検出することができる。生物学的検体は、検体が関与し得る様々な反応によって検出することができる(例えば、結合反応、触媒反応など)。
【0034】
様々な形態の化学発光反応を利用して、液体中及び加工処理された材料中の細菌細胞などの細胞を検出することができる。本開示のいくつかの実施形態では、酵素ルシフェラーゼの存在下でのアデノシン三リン酸(ATP)とルシフェリンとの反応に基づく化学発光反応による光の発生が、生物学的検体としてのATPを検出するためのシグナルの発生の化学的基礎を与える。ATPはすべての微生物細胞を含む、すべての生きた細胞中に存在することから、この方法は、試料中の生きた細胞の数を定量的又は準定量的に推定するための迅速なアッセイを提供することができる。基礎となる反応の性質、その発見の経緯、及びその一般的な応用分野に関する初期の論説が、E.N.Harvey(1957)、A History of Luminescence:From the Earliest Times Until 1900、Amer.Phil.Soc.、Philadelphia、Pa.及びW.D.McElroy及びB.L.Strehler(1949)、Arch.Biochem.Biophys.22:420〜433に述べられている。
【0035】
細菌及びその他の微生物種はある程度のATPを含むため、ATP検出は細菌及びその他の微生物種を検出するうえで信頼性の高い手段である。ATPから得られる化学結合エネルギーは、北米産ホタル(Photinus pyralis)の尾部で起こる生物発光反応に利用されている。この反応の生化学的成分はATPを含まずに単離することができ、その後これを他の供給源のATPを検出するために使用することができる。このホタルの生物発光反応の機構はよく特徴付けられている(DeLuca,M.,et al.、1979 Anal.Biochem.95:194〜198)。
【0036】
放出要素:
本開示による放出要素は、封入材料を含む。封入材料は、一般に、液体混合物(例えば、試料を含む水性混合物)の中への有効量の細胞抽出剤の即時溶解を所定の時間の間防止するための物理的バリア及び/又は拡散バリアとしての役割を果たす。
【0037】
いくつかの実施形態において、封入材料は、封入材が活性化刺激に曝露された後に有効量の細胞抽出剤を放出するように活性化されてよい。活性化は、例えば、封入材料の溶解又は部分的な溶解、封入材料の透過化(例えば、部分的に脱水されたポリマーを膨潤させることによる)、封入材料の離解又は部分的な離解(例えば、ワックスなどの固形物を融解させることによる)を包含し得る。
【0038】
いくつかの実施形態において、封入材料は、本明細書に記載のように、シェル構造(例えば、クロモニック物質)を含むことができる。
【0039】
いくつかの実施形態において、封入材料は、マトリックスを含むことができる。好適なマトリックス材料の例は、参照によりその全体が本明細書に組み込まれるPCT国際公開特許WO 2010/129726、発明の名称「ARTICLES WITH MATRIX COMPRISING A CELL EXTRACTANT AND BIODETECTION METHODS THEREOF」に見出すことができる。いくつかの実施形態において、マトリックスは、液体(例えば、試料を含む水性液体)に実質的に不溶性である材料(例えば、ポリマー材料又はセラミックなどの非ポリマー材料)を含む。いくつかの実施形態において、マトリックスは、周囲温度で水溶液に実質的に可溶性及び/又は分散性である賦形剤を含む。いくつかの実施形態において、マトリックスは、周囲温度で水溶液に実質的に不溶性及び非分散性である賦形剤を含む(即ち、賦形剤の溶解又は分散は、温度変化及び/又は化学的トリガの添加によって引き起こされることができる)。
【0040】
いくつかの実施形態において、マトリックスは、予備形成されたマトリックス(即ち、マトリックスに細胞抽出剤が注入される前に形成されるマトリックス)であることができる。これらの実施形態では、細胞抽出剤を含有する液体の中にマトリックスを入れて、細胞抽出剤をマトリックス材料の中に拡散させることによって、細胞抽出剤をマトリックスに装填することができる。いくつかの実施形態において、マトリックス前駆体は、細胞抽出剤を有する溶液中で混合することができ、マトリックス内に分散した細胞抽出剤を有するマトリックスが形成される。別の実施形態において、細胞抽出剤は、例えば、参照によりその全体が本明細書に組み込まれる米国特許出願公開第2005/0152992号に記述されているように、ワックスの中に分散させることができる。
【0041】
封入材料には、ヒドロゲルを含むことができる。物品におけるヒドロゲルの使用及び試料中の細胞の検出方法は、それぞれが参照によりその全体が本明細書に組み込まれる2008年9月30日出願のPCT国際公開特許WO 2010/039627及び米国特許出願第61/101,563号、発明の名称「BIODETECTION ARTICLES and BIODETECTION METHODS」に記載されている。
【0042】
ヒドロゲルは、架橋ヒドロゲル、膨潤ヒドロゲル、及び乾燥又は部分的に乾燥したヒドロゲルを広義に包含する。本開示の好適なヒドロゲルには、例えば、ヒドロゲル、及びそのヒドロゲルから製造されるポリマービーズが挙げられ、これらはPCT国際公開特許公報WO 2007/146722に記述されており、この全体が参照により本明細書に組み込まれる。
【0043】
その他の好適なヒドロゲルには、エチレン性不飽和カルボキシル含有モノマーとカルボン酸、ビニルスルホン酸、セルロースモノマー、ポリビニルアルコールから選択されるコモノマーとを含むポリマー(米国特許出願公開第US2004/0157971号に記載);でんぷん、セルロース、ポリビニルアルコール、ポリエチレンオキシド、ポリプロピレングリコール、及びこれらのコポリマーを含むポリマー(米国特許出願公開第US 2006/0062854号に記載);分子量2000ダルトン未満の、多官能基ポリ(アルキレンオキシド)のフリーラジカル重合性マクロモノマーを含むポリマー(米国特許第7,005,143号に記載);液体媒体にさらされると架橋するシラン官能化ポリエチレンオキシドを含むポリマー(米国特許第6,967,261号に記載);ポリエチレングリコール、ポリプロピレングリコール、及びプロピレングリコールから選択される少なくとも1つのアルコールをともなうポリウレタンプレポリマーを含むポリマー(米国特許第6,861,067号に記載);多糖類、ポリビニルピロリドン、ポリビニルアルコール、ポリビニルエーテル、ポリウレタン、ポリアクリレート、ポリアクリルアミド、コラーゲン及びゼラチンから選択される親水性ポリマーを含むポリマー(米国特許第6,669,981号に記載)が挙げられ、これらの開示はすべてその全体が参照により本明細書に組み込まれる。その他の好適なヒドロゲルには、寒天、アガロース、ポリアクリルアミドヒドロゲル、及びこれらの誘導体が挙げられる。
【0044】
本開示は、成形ヒドロゲルを含む物品及び方法を提供する。成形ヒドロゲルには、例えば、ビーズ、シート、リボン、及び繊維に成形したヒドロゲルが挙げられる。成形ヒドロゲルの更なる例、及び成形ヒドロゲルを製造することができる代表的なプロセスは、米国特許出願公開第2008/0207794 A1号、発明の名称「POLYMERIC FIBERS AND METHODS OF MAKING」、及び米国特許出願公開第第2010/0295219号、発明の名称「METHODS OF MAKING SHAPED POLYMERIC MATERIALS」に開示されており、これらはともに参照によりそれら全体が本明細書に組み込まれる。
【0045】
本開示のヒドロゲルは、細胞抽出剤を含むことができる。細胞抽出剤を含むヒドロゲルは、2つの基本的プロセスによって製造することができる。第一のプロセスでは、細胞抽出剤が、ヒドロゲルポリマーの合成中にヒドロゲル内に組み込まれる。第1のプロセスの例は、PCT国際公開特許WO 2007/146722に見出すことができる。第二のプロセスでは、細胞抽出剤が、ヒドロゲルポリマーの合成後にヒドロゲル内に組み込まれる。例えば、ヒドロゲルを細胞抽出剤の溶液に入れ、細胞抽出剤をヒドロゲルに吸収及び/又は吸着させる。第2のプロセスの更なる例は、ヒドロゲルにイオン性モノマーを組み込む、例えばカチオン性モノマーをヒドロゲルに組み込むことなどである。
【0046】
いくつかの用途においては、細胞抽出剤を含む放出要素が、乾燥状態又は部分的乾燥状態であることが望ましい場合がある。例えば、蒸発プロセス、熱対流炉、電子レンジ、及び真空炉内での乾燥、並びに凍結乾燥などの、当業者に既知の方法によって、特定の放出要素(例えば、水膨潤ヒドロゲル)を乾燥させることができる。乾燥状態又は部分的乾燥状態である放出要素が液体又は水溶液に曝露されると、細胞抽出剤は放出要素から拡散することができる。細胞抽出剤は、液体又は水溶液に曝露されるまでは、放出要素内で本質的に休止状態に留まっていることができる。即ち、細胞抽出剤は、放出要素が液体に曝露されるまで、乾燥状態又は部分的乾燥状態である放出要素内に収納されることができる。この結果、必要でないときに細胞抽出剤が浪費又は損失されるのを防止することができ、かつ加水分解、酸化、又は他のメカニズムによって劣化する可能性がある水分に敏感な多数の細胞抽出剤の安定性を改善することができる。
【0047】
いくつかの実施形態では、封入材料が圧力、剪断力、熱、光、pHの変化、別の化学物質への曝露、イオン強度変化等の活性化刺激に曝露された後、封入材料は活性化されて、有効量の細胞抽出剤を放出することができる。活性化により、例えば、封入材料の溶解若しくは部分的な溶解、封入材料の透過化(例えば脂質二重層の破壊)、及び/又は封入材料の離解若しくは部分的な離解(例えば微結晶ワックスなどの固形物を破砕又は融解することによる)を引き起こすことができる。
【0048】
放出要素は、本開示によると、細胞抽出剤を封入する錠剤を包含する。製薬学的組成物の放出を遅れさせる錠剤は、当該技術分野において既知である(例えば、PCT国際公開特許WO 97/02812及びWO 08/129517を参照のこと)。「錠剤」は広義に用いられ、参照によりその全体が本明細書に組み込まれる米国特許出願公開第2010/0209927号、発明の名称「PROCESSING DEVICE TABLET」で開示されているような微小錠剤を包含する。
【0049】
錠剤は、本開示によると、賦形剤と混合された細胞抽出剤を含む。「賦形剤」は、例えば、結合剤、流動促進剤(例えば、流動補助剤)、潤滑剤、崩壊剤、及び前述の任意の2つ以上を包含して広く用いられる。いくつかの実施形態では、錠剤は、外側のコーティングを含むことができ、この外側のコーティングは、錠剤が液体(例えば、試料を含む水性液体)と接触した際の活性物質(例えば、細胞抽出剤)の放出に影響を与えることができる。いくつかの実施形態において、錠剤は、充填剤(例えば、ラクトース又はソルビトールなどの糖)を錠剤の充填剤として含むことができる。崩壊剤(例えば、デンプン又はセルロースなどの多糖類)は、錠剤の湿潤及び/又は膨潤を促進し、それによって、錠剤が液体と接触した際の活性物質の放出を容易にすることができる。ソルビトール及びマンニトールは、特定の細胞抽出剤(例えば、酵素)の安定性を促進することができる賦形剤である。マンニトールを使用して、細胞抽出剤の放出を遅らせることができる。いくつかの実施形態では、ポリエチレングリコール(PEG)は、錠剤からの活性物質の放出を制御するのに好ましい賦形剤である。いくつかの実施形態では、3300及び8000ダルトンの分子量を有するPEG化合物を使用して、錠剤からの活性物質の放出を遅らせることができる。
【0050】
錠剤の製造方法は当該技術分野において既知であり、例えば、直接圧縮、湿式造粒法、乾式造粒、及び流動層造粒が挙げられる。
【0051】
放出要素は、本開示によると、細胞抽出剤を封入するワックスマトリックスを含む。いくつかの実施形態では、細胞抽出剤の複数の塊を、ワックスマトリックスに分散させることができる。ワックスが崩壊すると(例えば、熱融解又は機械的破砕によって)細胞抽出剤はワックスから放出される。好適なワックスの非限定的な例としては、天然若しくは合成ワックス又はワックス類似物、例えば、石蝋、モンタン蝋、カルナバ蝋、蜜蝋、スケールワックス、オゾケライト、ユタ蝋など、微結晶ワックス、例えば、プラスチック及びタンク底部から得られたワックスなど、ワックス代用品、例えば、フィッシャー・トロプシュワックスなど、ポリアルキレン、例えば、ポリエチレン、ポリプロピレンなど、これらの混合物及びコポリマーが挙げられる。
【0052】
いくつかの実施形態において、細胞抽出剤は、ワックスと不混和性の溶液(例えば、水溶液)の液滴としてワックス中に分散されることができる。いくつかの実施形態において、細胞抽出剤は、固体又は半固体の粒子又は凝集体としてワックス中に分散されることができる。このような液体又は固体の分散をワックス中に生じさせる方法は、当該技術分野において周知である。
【0053】
図11は、マトリックス材料1192を含む放出要素1140の一実施形態の斜視図を示す。図に示される実施形態では、マトリックス材料1192は、ワックスのフィルム又はブロックを含む。マトリックス材料1192中に分散しているのは、細胞抽出剤を含む空洞1194である。放出要素1140中に分散される細胞抽出剤の量及び/又は濃度、並びに放出要素1140の形状及び寸法は、所与の検出物品中で使用するために変更可能であることが認識される。
【0054】
放出要素は、本発明によると、細胞抽出剤を含むマトリックス材料でコーティングされた基材を含む。細胞抽出剤でコーティングされた基材を含む放出要素は、参照によりその全体が本明細書に組み込まれる、PCT国際公開特許WO 2010/129727、発明の名称「COATED SUBSTRATES COMPRISING A CELL EXTRACTANT AND BIODETECTION METHODS THEREOF」に開示されている。マトリックス材料は、本明細書に記載されるような任意の好適なマトリックス材料であることができる。
【0055】
マトリックス材料は、例えば、ディップコーティング、ナイフコーティング、カーテンコーティング、吹付け塗り、キスコーティング、グラビアコーティング、オフセットグラビアコーティング、及び/又はスクリーン印刷及びインクジェット印刷などの印刷方式といった、当該技術分野において既知のコーティングプロセスを用いて、基材上にコーティングされることができる。いくつかの実施形態において、コーティングは、予め定められたパターンで塗布されることができる。コーティングプロセスの選択は、固体基材の形状及び寸法によって影響され、任意の所与の固体基材をコーティングするための好適なプロセスを判別することは、当業者の把握する範囲内である。
【0056】
いくつかの実施形態では、マトリックス材料は、細胞抽出剤を含む予備形成されたマトリックス(例えば、ポリマーマトリックス)として基材上にコーティングされる。いくつかの実施形態では、マトリックス前駆体と細胞抽出剤とを含む混合物が基材上にコーティングされ、マトリックスは、例えば、当該技術分野において既知の及び/又は本明細書に記載される重合プロセスを用いて、基材上に形成される。いくつかの実施形態では、予備形成されたマトリックスが基材上にコーティングされるか又はマトリックスが基材上に形成された後、続いて当該技術分野において既知の及び/又は本明細書に記載されるプロセスを用いて、細胞抽出剤が基材に装填される。
【0057】
いくつかの実施形態において、コーティング混合物は、コーティングプロセスを容易にする及び/又は基材に対するマトリックス材料の付着力を促進するために、添加剤(例えば、結合剤又は増粘剤)を含む。添加剤の非限定例としては、ガム(例えば、グアーガム、キサンタンガム、アルギン酸塩、カラギーナン、ペクチン、寒天、ジェラン、アガロース)、多糖類(例えば、デンプン、メチルセルロース、カルボキシメチルセルロース、ヒドロキシプロピルメチルセルロース)、及びポリペプチド(例えば、ゼラチン)が挙げられる。
【0058】
コーティング添加剤は、試料中の細胞を検出するのに使用される検出系との適合性で選択される必要がある。この適合性は、本明細書に記載されるように、添加剤を検出系(例えば、ルシフェラーゼ及びルシフェリン)及び検出すべき検体(例えば、ATP)と混合し、反応を測定し、かつ添加剤が検体の検出を実質的に阻害したしたかどうかを判定することによって試験されることができる。
【0059】
マトリックス材料がコーティングされる基材は、様々な固体基材を包含する。細胞抽出剤を含むマトリックスがコーティングされる好適な基材材料の非限定例としては、プラスチック(例えば、ポリカーボネート、ポリエチレン及びポリプロピレンなどのポリアルキレン、ポリエステル、ポリアクリレート、並びにこれらの誘導体及び混合物)、金属(例えば、金、グラファイト、白金、パラジウム、ニッケル)、ガラス、セルロース及びセルロース誘導体(例えば、濾紙)、セラミック材料、開放セル発泡体(例えば、ポリウレタンフォーム)、不織布材料(例えば、膜、PTFE膜)、並びにこれらの組み合わせ(例えば、プラスチックコーティング金属箔)が挙げられる。基材は、例えば、繊維、不織布材料(例えば、セルロース、ガラス、ポリエステル、ポリアルキレン、ポリスチレン、及びこれらの誘導体又はこれらの組み合わせを含む繊維性材料から製造される不織布材料)、粒子(例えば、ビーズ)、シート、フィルム、及び膜などを含む様々な形態で構成されることができる。
【0060】
いくつかの実施形態において、基材は、フィルタ、例えばグレード4の20〜25μmの定性濾紙、グレード30のガラス繊維濾紙、グレードGB005の厚い(1.5mm)吸収性の極めて高い吸い取り紙(すべてWhatman,Inc(Florham Park,NJ)より入手)、Zeta Plus Virosorb 1MDSディスク(CUNO,Inc,Meriden,CT)及び0.45μmのMF−Millipore膜(Millipore,Billerica,MA)などであることができる。上記基材のうちの任意の1つに、ポリビニルアルコールを含有する細胞抽出剤溶液を装填することができる。上記基材のうちの任意の1つに、VANTOCIL(Arch Chemicals,Norwalk,CT)を含有する細胞抽出剤溶液を装填することができる。上記基材のうちの任意の1つに、CARBOSHIELD(Lonza,Walkersville,MD)を含有する細胞抽出剤溶液を装填することができる。上記基材のうちの任意の1つに、5%塩化ベンザルコニウム溶液を含有する細胞抽出剤溶液を装填することができる。
【0061】
マトリックス材料、細胞抽出剤、及び基材は、試料中の細胞を検出するのに使用される検出系との適合性で選択される必要がある。この適合性は、1)検出系中の検体の量を検出する(例えば、本明細書に記載されるように、ATPをルシフェリン及びルシフェラーゼと混合し、照度計で発光量を測定する)、2)マトリックス材料、細胞抽出剤、又は基材を用いた検出工程を繰り返す、3)工程1の結果と工程2の結果とを比較して、マトリックス材料、細胞抽出剤、又は基材が反応中の検体の検出及び/又は測定を実質的に阻害したかどうかを判定することによって、試験されることができる。
【0062】
いくつかの実施形態において、放出要素は、コーティングされた基材を含む。コーティング、基材及び/又はコーティングされた基材は、有効量の細胞抽出剤が水性混合物中に即時溶解するのを短時間の間妨げるための、物理的バリア及び/又は拡散バリアとしての役割を果たすように適合される。
【0063】
コーティングされた基材は、コーティングと基材とを含む。コーティングは細胞抽出剤を含む。コーティングは、例えば、ディップコーティング、ナイフコーティング、カーテンコーティング、吹付け塗り、キスコーティング、グラビアコーティング、オフセットグラビアコーティング、及び/又はスクリーン印刷及びインクジェット印刷などの印刷方式といった、当該技術分野において既知のコーティングプロセスを用いて、基材上に塗布されることができる。いくつかの実施形態では、コーティングは、予め定められたパターン(例えば、ストライプ、格子、斑点)で塗布されることができる。コーティングプロセスの選択は、固体基材の形状及び寸法によって影響され、任意の所与の固体基材をコーティングするための好適なプロセスを判別することは、当業者の把握する範囲内である。
【0064】
コーティングが塗布される基材は、様々な基材材料を包含する。本開示のコーティングを塗布することができる好適な基材材料の非限定例としては、プラスチック(例えば、ポリカーボネート、ポリエチレン及びポリプロピレンなどのポリアルキレン、ポリエステル、ポリアクリレート、並びにこれらの誘導体及び混合物)、金属(例えば、金、グラファイト、白金、パラジウム、ニッケル)、ガラス、セルロース及びセルロース誘導体(例えば、濾紙)、セラミック材料、開放セル発泡体(例えば、ポリウレタンフォーム)、不織布材料(例えば、膜、PTFE膜)、並びにこれらの組み合わせ(例えば、プラスチックコーティング金属箔)が挙げられる。基材は、例えば、繊維、不織布材料、シート、及びフィルムなどを含む様々な形態で構成されることができる。
【0065】
いくつかの実施形態では、基材の表面は、比較的滑らかであることができる。いくつかの実施形態では、基材の少なくとも一部は、空洞を含むことができる。図12aは、空洞1294を有する基材1292を含む放出要素1240の一実施形態の平面図を示す。図に示される実施形態では、基材1292はフィルム基材であってよい。図12bは、図12aの放出要素1240の断面図を示す。図で示した実施形態は、空洞1294aを含む基材1292を示しており、空洞開口部1295aの断面積は、空洞1294aの最大断面積にほぼ等しい。基材1292は空洞1294bも含み、空洞開口部1295bの断面積は、空洞1294bの最大断面積よりも小さい。理論に束縛されるものではないが、空洞開口部の面積と空洞容積の比は、細胞抽出剤の放出要素からの放出速度を制御する1つの手段として用いられることができると予想される。図で示した実施形態は、比較的均一な球形又は半球形の空洞を含むが、好適な空洞は、不均一で不規則な形状といった様々な形状を包含すると予想される。
【0066】
基材は、本明細書で使用する場合、マイクロ複製された基材を包含する。マイクロ複製又は「マイクロ複製された」とは、構造化面の特徴部が、製造中に製品毎に、約50マイクロメートルを超えて変化しない個々の特徴部の忠実度を保持するプロセスを介した、微小構造化表面(例えば、マイクロチャンネル)の形成を意味する。マイクロ複製された表面は、好ましくは、製造中に製品毎に、25マイクロメートルを超えて変化しない個々の特徴部の忠実度を構造化面の特徴部が保持するように製造される。本発明によると、微小構造化表面は、約50マイクロメートル〜0.05マイクロメートル、より好ましくは25マイクロメートル〜1マイクロメートルの解像度に維持された個々の特徴部の忠実度を有するトポグラフィー(物体、その場所又はその領域の表面特徴)を有する表面を含む。好適なマイクロ複製された基材は、参照によりその全体が本明細書に組み込まれる、米国特許出願公開第2007/0212266 A1号に記載されている。
【0067】
図13は、マイクロ複製された空洞を含む放出要素1340の一実施形態の上面斜視図を示す。放出要素1340は、それらの間にチャネル1304を形成する離間したピーク1302を含む基材1392を含む。本明細書に記載されるように、基材1392は、細胞抽出剤を含む組成物でコーティングされることができる。任意に、カバー1306(例えば、プラスチック又は金属フィルム)を基材1392に取り付けて(例えば、図示されていない接着剤によって)、覆われたチャネル1305を形成することができる。任意に、2つ以上の基材1392を(図のように)積み重ねて、覆われたチャネル1305の1つ以上の層を形成することができる。基材1392は、細胞抽出剤でコーティングされた後に積み重ねられることができる、又は細胞抽出剤でコーティングされる前に積み重ねられることができる。基材1392がコーティングの前に積み重ねられる実施形態では、覆われたチャネル1305の末端部に細胞抽出剤を適用することによって個々のチャネルをコーティングすることができ、毛管現象によって覆われたチャネルを満たすことができる。
【0068】
覆われたチャネル1305は、その中に放出要素1340が懸濁された液体と接触する比較的小さな開口部(即ち、チャネルの一方又は両方の末端部)を提供し、それによって、覆われたチャネル1305から出た有効量の細胞抽出剤が液体の中に拡散するのを制限する及び/又は遅らせることができる。
【0069】
マイクロチャンネル又は空洞を細胞抽出剤組成物で充填するように、マイクロ複製された表面及び/又は空洞を有する放出要素をコーティングすることができる。細胞抽出剤組成物は、液体、固体、半固体、又はこれらの任意の2つ以上の組み合わせであってよい。
【0070】
いくつかの実施形態において、基材は、フィルタ、例えばグレード4の20〜25μmの定性濾紙、グレード30のガラス繊維濾紙、グレードGB005の厚い(1.5mm)吸収性の極めて高い吸い取り紙(すべてWhatman,Inc(Florham Park,NJ)より入手)、Zeta Plus Virosorb 1MDSディスク(CUNO,Inc,Meriden,CT)、及び0.45μmのMF−Millipore membrane(Millipore,Billerica,MA)などであることができる。上記基材のうちの任意の1つに、ポリビニルアルコールを含有する細胞抽出剤溶液を装填することができる。上記基材のうちの任意の1つに、VANTOCIL(Arch Chemicals,Norwalk,CT)を含有する細胞抽出剤溶液を装填することができる。上記基材のうちの任意の1つに、CARBOSHIELD(Lonza,Walkersville,MD)を含有する細胞抽出剤溶液を装填することができる。上記基材のうちの任意の1つに、5%塩化ベンザルコニウム溶液を含有する細胞抽出剤溶液を装填することができる。
【0071】
いくつかの実施形態において、基材は、本明細書に記載されるような、細胞抽出剤を含むマトリックス材料でコーティングされることができる。いくつかの実施形態において、マトリックス材料(例えば、ポリマー材料又はセラミックなどの非ポリマー材料)は、液体(例えば、試料を含む水性液体)に実質的に不溶性であることができる。これに加えて、あるいは別の方法として、マトリックス材料は、有機溶媒に実質的に不溶性であることができる。いくつかの実施形態では、マトリックス材料は、周囲温度で試料を含む液体混合物(例えば、水溶液)に実質的に可溶性及び/又は分散性である賦形剤を含むことができる。いくつかの実施形態では、マトリックス材料は、周囲温度で水溶液に実質的に不溶性及び非分散性である賦形剤を含むことができる(即ち、賦形剤の溶解又は分散は、温度変化及び/又は化学的トリガの添加によって引き起こされることができる)。
【0072】
いくつかの実施形態では、基材をコーティングするのに使用するマトリックス材料は、細胞抽出剤を含む予備形成されたマトリックス(例えば、ポリマーマトリックス)であることができる。いくつかの実施形態では、マトリックス前駆体と細胞抽出剤とを含む混合物が基材上にコーティングされ、マトリックスは、続いて、例えば、当該技術分野において既知の及び/又は本明細書に記載される重合プロセスを用いて、基材上に形成される。いくつかの実施形態では、予備形成されたマトリックスは、基材上にコーティングされるか又はマトリックスが基材上に形成された後、続いて、当該技術分野において既知の及び/又は本明細書に記載されるプロセスを用いて、細胞抽出剤が基材に装填される。
【0073】
マトリックスは、本開示によると、賦形剤と混合された細胞抽出剤を含むことができる。「賦形剤」は、例えば、結合剤、流動促進剤(例えば、流動補助剤)、潤滑剤、崩壊剤、及び前述の任意の2つ以上を包含して広く用いられる。いくつかの実施形態では、コーティングされた基材は外側のコーティングを含むことができ、この外側のコーティングは、コーティングされた基材が液体(例えば、試料を含む水性液体)と接触した際の活性物質(例えば、細胞抽出剤)の放出に影響を与えることができる。いくつかの実施形態では、マトリックスは、充填剤(例えば、ラクトース又はソルビトールなどの糖)をマトリックスの増量剤として含むことができる。崩壊剤(例えば、デンプン又はセルロースなどの多糖類)は、マトリックスの湿潤及び/又は膨潤を促進し、それによって、マトリックスが液体と接触した際の活性物質の放出を容易にすることができる。ソルビトール及びマンニトールは、特定の細胞抽出剤(例えば、酵素)の安定性を促進することができる賦形剤である。マンニトールを、細胞抽出剤の放出を遅れさせるために使用することができる。いくつかの実施形態において、ポリエチレングリコール(PEG)は、マトリックスからの活性物質の放出を制御するのに好ましい賦形剤である。いくつかの実施形態では、3300及び8000ダルトンの分子量を有するPEG化合物を使用して、マトリックスからの活性物質の放出を遅らせることができる。
【0074】
いくつかの実施形態では、コーティング混合物は、コーティングプロセスを容易にするため、及び/又は基材に対するマトリックス材料の付着力を促進するために、添加剤(例えば、結合剤又は増粘剤)を含む。添加剤の非限定例としては、ガム(例えば、グアーガム、キサンタンガム、アルギン酸塩、カラギーナン、ペクチン、寒天、ジェラン)、多糖類(例えば、デンプン、メチルセルロース、カルボキシメチルセルロース、ヒドロキシプロピルメチルセルロース、アガロース)、及びポリペプチド(例えば、ゼラチン)が挙げられる。
【0075】
マトリックス材料、細胞抽出剤、基材、及びコーティング添加剤は、試料中の細胞を検出するのに使用される検出系との適合性で選択される必要がある。この適合性は、1)検出系中の検体の量を検出する(例えば、PCT国際公開特許WO 2010/129727の実施例6に記載されるように、ATPをルシフェリン及びルシフェラーゼと混合し、照度計で発光量を測定する)、2)マトリックス材料、細胞抽出剤、基材又はコーティング添加剤を用いた検出工程を繰り返す、3)工程1の結果と工程2の結果とを比較して、添加剤が反応中の検体の検出及び/又は測定を実質的に阻害したかどうかを判定することによって、試験されることができる。
【0076】
いくつかの実施形態において、基材をコーティングするのに使用する材料は、本明細書に記載されるような、細胞抽出剤を含むシェル構造を含んでよい。特定のシェル構造と特定の検出系との適合性は、本明細書に記載されるように判定されることができる。
【0077】
いくつかの実施形態において、コーティングされた基材は、バリア層を更に含んでよい。バリア層は、コーティングされた基材からの細胞抽出剤の放出を遅らせるための手段としての機能を果たすことができる。バリア層は、例えば、錠剤又はカプセル薬物からの活性成分の放出を制御する及び/又は遅れさせるための、当該技術分野において既知のもののような浸食性コーティングを包含する。バリア層はまた、物理的又は機械的操作によって崩壊し得る層(例えば、高温で崩壊し得るワックス層)も包含する。
【0078】
いくつかの実施形態では、封入材料が圧力、剪断力、熱、光、pHの変化、別の化学物質への曝露、イオン強度の変化等の活性化刺激に曝露された後、封入材料は、活性化されて、有効量の細胞抽出剤を放出してよい。活性化により、例えば、封入材料の溶解若しくは部分的な溶解、封入材料の透過化、及び/又は封入材料の離解若しくは部分的な離解(例えば、例えば微結晶ワックスなどの固形物を破砕又は融解することによる)を引き起こしてよい。
【0079】
いくつかの実施形態において、放出要素は、細胞抽出剤を保持する及び/又は含む封入材料を含む。好適な封入材料は、参照によりその全体が本明細書に組み込まれる、PCT国際公開特許WO 2010/129728、発明の名称「ARTICLES WITH SHELL STRUCTURES INCLUDING A CELL EXTRACTANT AND BIODETECTION METHODS THEREOF」に記載されている。封入材料は、液体混合物(例えば、試料を含む水性混合物)の中への有効量の細胞抽出剤の即時溶解及び/又は分散を、所定の時間の間防止するための物理的バリア及び/又は拡散バリアとしての役割を果たすことができる。
【0080】
いくつかの実施形態において、封入材料は、本明細書に記載されるようなマトリックス材料を含むことができる。
【0081】
いくつかの実施形態では、封入材料が圧力、剪断力、熱、光、pHの変化、別の化学物質への曝露、イオン強度の変化等の活性化刺激に曝露された後、封入材料は、活性化されて、有効量の細胞抽出剤を放出してよい。活性化により、例えば、封入材料の溶解若しくは部分的な溶解、封入材料の透過化(例えば、脂質二重層の破壊)、及び/又は封入材料の離解若しくは部分的な離解(例えば、例えば微結晶ワックスなどの固形物を破砕又は融解することによる)を引き起こしてよい。
【0082】
いくつかの実施形態において、放出要素は、シェル構造を形成する。図14は、本開示による放出要素1440の実施形態を示す。放出要素1440は、シェル構造1401とコア1404とを有する。コア1404の中に位置決めされているのは、ゲスト化合物1405(例えば、本明細書に記載されるような細胞抽出剤)である。コア1404は、液体、固体、半固体又はこれらの組み合わせを含むことができる。ゲスト化合物1405は、その中に溶解及び/又は分散されてよい。
【0083】
いくつかの実施形態において、放出要素のシェル構造は、細胞抽出剤を含むことができる。図15は、本開示による放出要素1540の実施形態を示す。放出要素1540は、ゲスト化合物1505(例えば、本明細書に記載されるような細胞抽出剤)を含むシェル構造1501を有する。放出要素1540は、液体、固体、半固体、又はこれらの組み合わせを含むことができるコア1504を更に含む。
【0084】
いくつかの実施形態において、放出要素は、2つ以上のゲスト分子を含むことができる。図16は、本開示による複合体放出要素1640の実施形態を示す。複合体放出要素1640は、第1のゲスト分子1606を含むシェル構造1602と、第2のゲスト分子1605を含むコア1604とを有する。いくつかの実施形態において、第1及び第2のゲスト化合物(それぞれ1604及び1605)は、同じ化合物であることができる。いくつかの実施形態において、第1及び第2のゲスト化合物(それぞれ1606及び1605)は、異なる化合物であることができる。いくつかの実施形態において、少なくとも1つのゲスト化合物は、細胞抽出剤であることができる。いくつかの実施形態において、少なくとも1つのゲスト化合物は、本明細書に記載されるような検出試薬であることができる。いくつかの実施形態において、少なくとも1つのゲスト化合物は、細胞抽出剤であることができ、少なくとも1つのゲスト化合物は、検出試薬であることができる。
【0085】
いくつかの実施形態において、放出要素は、2つ以上のシェル構造を含むことができる。図17は、第1のシェル構造1701と、第2のシェル構造1702と、第3のシェル構造1703とを含む放出要素1740の実施形態を示す(放出要素1740のコアは、この図示せず)。この実施形態では、第2のシェル構造1702は、第1のゲスト化合物1705を含み、第3のシェル構造1703は、第2のゲスト化合物1706を含む。この実施形態では、それぞれの連続したシェル構造は、タマネギのような様式で次のシェル構造によって封入される。いくつかの実施形態において、第1及び第2のゲスト化合物(それぞれ1705及び1706)は、同じ化合物であることができる。いくつかの実施形態において、第1及び第2のゲスト化合物(それぞれ1705及び1706)は、異なる化合物であることができる。いくつかの実施形態において、少なくとも1つのゲスト化合物は、細胞抽出剤であることができる。いくつかの実施形態において、少なくとも1つのゲスト化合物は、本明細書に記載されるような検出試薬であることができる。いくつかの実施形態において、少なくとも1つのゲスト化合物は細胞抽出剤であることができ、少なくとも1つのゲスト化合物は、検出試薬であることができる。
【0086】
図18は、2つ以上のシェル構造を含む放出要素1840の代替実施形態を示す。放出要素1840は、第1のシェル構造1801と、第2のシェル構造1802と、第3のシェル構造1803とを有する。第2のシェル構造1802は、第1のゲスト化合物1805を含み、第3のシェル構造は、第2のゲスト化合物1806を含む。この実施形態では、第2のシェル構造1802及び第3のシェル構造1803の両方が、第1のシェル構造1801によって封入されている。いくつかの実施形態において、第1及び第2のゲスト化合物(それぞれ1805及び1806)は、同じ化合物であることができる。いくつかの実施形態において、第1及び第2のゲスト化合物(それぞれ1805及び1806)は、異なる化合物であることができる。いくつかの実施形態において、少なくとも1つのゲスト化合物は、細胞抽出剤であることができる。いくつかの実施形態において、少なくとも1つのゲスト化合物は、本明細書に記載されるような検出試薬であることができる。いくつかの実施形態において、少なくとも1つのゲスト化合物は、細胞抽出剤であり、少なくとも1つのゲスト化合物は、検出試薬であることができる。
【0087】
本開示の好適なシェル構造としては、参照によりその全体が本明細書に組み込まれる、米国特許第7,485,609号に記載されているような、例えば、セルロース、セルロース誘導体(例えば、セルロースエーテル、セルロースエステル、ニトロセルロース、セルローストリアセテート、セルロースアセテートフタレート、メチルセルロース、エチルセルロース、ヒドロキシプロピルセルロース、ヒドロキシプロピルメチルセルロース、カルボキシメチルセルロース、及びヒドロキシプロピルメチルセルロースフタレート);アクリレートのポリマー若しくはコポリマー、又はアクリレート誘導体のコポリマー(例えば、ポリアクリレート、ポリメチルアクリレート、ポリ(ポリアクリレート−メタクリレート)、ポリ(メタクリレート−メチルメタクリレート)、ポリエチルアクリレート−メチルメタクリレート、ポリ(エチルアクリレート−メチルメタクリレート−トリメチルアンモニオエチルメタクリレートクロリド)、及びポリ(エチルアクリレート−メチルメタクリレート−トリメチルアンモニオエチルメタクリレートクロリド));タンパク質(例えば、アルブミン、ゼラチン、ゼイン、カゼイン、コラーゲン、及びフィブリノゲン);ビニルポリマー(例えば、ポリ塩化ビニル、ポリ酢酸ビニル、ポリビニルアルコール、ポリスチレン、及びポリアクリロニトリル);ガム(例えば、グアーガム、アラビアガム、キサンタンガム、ローカストビーンガム);天然又は加工デンプン;デキストリン;デキストラン;キトサン;アルギン酸塩;並びに前述の任意の2つ以上の組み合わせを含むポリマーシェルが挙げられる。
【0088】
これに加えて又は代わりに、本開示の好適なシェル構造は、クロモニック物質を含むシェル構造を包含する。好適なクロモニック物質としては、例えば、参照によりその全体が本明細書に組み込まれる、米国特許第7,824,732号に記載されているようなシェル層を形成するものが挙げられる。
【0089】
クロモニック物質からなるシェル層は、ゲスト化合物(例えば、細胞抽出剤)の封入及び制御放出のために、特に有用であることができる。例えば、細胞抽出剤は、米国特許第7,824,732号に記載のクロモニックナノ粒子の中に封入されることができる。クロモニックスは、細胞抽出剤を特定の環境条件から保護した後、細胞抽出剤を他の環境条件下で制御可能に送達することができる。しかしながら、クロモニック物質と、多価カチオンと、HCO3−、PO43−、CH3CHOHCOO−、C3H5O(COO)33−、BO33−、及びSO42−からなる群から選択される酸性アニオンとを含む複合体を含むシェル(「複合シェル」)は、クロモニックス単独と比較して、特定の環境条件からの保護の増大を提供することが可能である。
【0090】
クロモニック物質の1つ以上のシェル層の中に封入されたクロモニックナノ粒子を含む多層クロモニック構造は、当該技術分野において既知である。細胞抽出剤は、クロモニックナノ粒子の中に、及び/又は、ナノ粒子を封入している1つ以上のクロモニックシェル層の中に封入されることができる。複合シェルは、1つ以上のクロモニックシェル層と組み合わされて使用されることができる(例えば、複合シェルは、最も内側のシェル層、中間のシェル層、最も外側のシェル層、又はこれらの任意の組み合わせであることができる)。複合シェル層は、細胞抽出剤の制御放出に増大した柔軟性を提供することができる(例えば、徐放)。
【0091】
本開示によるシェル層はまた、細胞抽出剤を実質的に包囲するワックス構造(例えば、カプセル)を包含する。いくつかの実施形態において、細胞抽出剤の概ね一体型の塊(例えば液体、固体、粒子などの複数の固体、半固体、又はこれらの組み合わせ)は、外側のワックスシェル内部に配置されることができる。ワックスが崩壊すると(例えば、熱融解又は機械的破砕によって)、細胞抽出剤は、ワックスから放出される。好適なワックスとしては、石蝋、微結晶ワックス、並びにこれらの誘導体及び/又は組み合わせが挙げられる。
【0092】
本開示によるシェル層はまた、脂質二重層(例えば、リポソーム)を包含する。リポソームは、当該技術分野において既知のリポソーム形成技術によって形成されることができる。リポソームは、細胞抽出剤の少なくとも一部がリポソームのコアに閉じ込められるように、細胞抽出剤を含有する溶液から形成されることができる。任意のタイプの脂質二重層を分裂させる可能性のある細胞抽出剤を含むことができる他の種類の放出要素とは大きく異なり、リポソーム放出要素は、リポソームの脂質二重層の一体性を実質的に損なわない細胞抽出剤を含有することができる。このような細胞抽出剤の非限定例としては、リゾチーム及びリソスタフィンなどのポリペプチド、及びリポソームを実質的に損なわない抗生物質が挙げられる。
【0093】
リポソームが液体(例えば、試料を含有する水性液体)と接触すると、細胞抽出剤は、例えば、脂質二重層を通る拡散によってリポソームから放出されてよい。いくつかの実施形態では、リポソームの全内容物(例えば、細胞抽出剤溶液)は、熱又は機械的エネルギー(例えば、熱、凍結融解、又は音波破砕)を用いて脂質二重層の一体性を分裂させる放出因子で、あるいは脂質二重層を透過性にする及び/又は可溶化するための化学物質放出因子を添加することにより、「破裂」して放出されてもよい。いくつかの実施形態では、リポソームの破壊は、参照によりその全体が本明細書に組み込まれる、PCT国際公開特許WO 2009/102859、発明の名称「POLYPEPTIDES FOR MICROBIAL DETECTION」に記載のように、細胞溶解性ペプチドを使用して引き起こされることができる。
【0094】
いくつかの実施形態では、本開示の放出要素は、基材上にコーティングされた細胞抽出剤を含むシェル構造を包含することができる。
【0095】
細胞抽出剤:
いくつかの実施形態において、化学的細胞抽出剤には、タンパク質(例えば、細胞溶解性ペプチド及び酵素)などの生化学物質が含まれる。いくつかの実施形態において、細胞抽出剤は、細胞の浸透性を高め、これにより細胞内部からの生物学的検体の放出を起こす。いくつかの実施形態において、細胞抽出剤は、細胞の溶解(例えば破裂又は部分的破裂)を起こすか又は促進することができる。
【0096】
いくつかの実施形態において、細胞抽出剤には、当該技術分野において既知の化学物質及び化学物質混合物が挙げられ、例えば、界面活性剤及び第四級アミン、ビグアニド、界面活性剤、フェノール類、細胞溶解性ペプチド、並びに酵素が挙げられる。典型的には、細胞抽出剤は、放出要素に(共有的又は非共有的のいずれかで)強く結合せず、放出要素が水性液体と接触すると、放出要素から放出されることができる。
【0097】
界面活性剤は、一般に、親水基及び疎水基の両方を含有する。放出要素は、アニオン性、非イオン性、カチオン性、両性、両性及び双極イオン性界面活性剤並びにこれらの混合物から選択される1種以上の界面活性剤を含有してよい。水中で解離し、カチオン及びアニオンを放出する界面活性剤は、イオン性と称される。存在する場合には、両性、両性及び双極性界面活性剤は、一般に、1つ以上のアニオン性及び/又は非イオン性界面活性剤と組み合わせて使用される。好適な界面活性剤及び第四級アミンの非限定的な例には、TRITON X−100、Nonidet P−40(NP−40)、Tergitol、サルコシル、Tween、SDS、Igepal、サポニン、CHAPSO、塩化ベンザルコニウム、塩化ベンゼトニウム、「セトリミド」(ドデシル−、テトラデシル−、及びヘキサデシル−トリメチルアンモニウムブロミドの混合物)、塩化セチルピリジウム、メタ(アクリルアミドアルキルトリメチルアンモニウム塩(例えば、3−メタクリルアミドプロピルトリメチルアンモニウムクロリド、及び3−アクリルアミドプロピルトリメチルアンモニウムクロリド)、並びに(メタ)アクリロキシアルキルトリメチルアンモニウム塩(例えば、2−アクリロキシエチルトリメチルアンモニウムクロリド、2−メタクリロキシエチルトリメチルアンモニウムクロリド、3−メタクリロキシ−2−ヒドロキシプロピルトリメチルアンモニウムクロリド、3−アクリロキシ−2−ヒドロキシプロピルトリメチルアンモニウムクロリド、及び2−アクリロキシエチルトリメチルアンモニウムメチル硫酸塩)が挙げられる。他の好適なモノマーの第四級アミノ塩には、ジメチルアルキルアンモニウム基として、アルキル基が2〜22個の炭素原子又は2〜20個の炭素原子を有するものが挙げられる。即ち、モノマーは、式:
【0098】
−N(CH3)2(CnH2n+1)+の基を含む(式中、nは、2〜22の値の整数である)。代表的なモノマーには、以下の式のモノマーが挙げられるが、これらに限定されない。
【化1】

式中、nは、2〜22の範囲の整数である。
【0099】
好適なビグアニド(ビス−ビグアニドを含む)の非限定的な例には、ポリヘキサメチレンビグアニド塩酸塩、p−クロロフェニルビグアニド、4−クロロ−ベンズヒドリルビグアニド、アレキシジン、ハロゲン化ヘキシジン(例えばクロルヘキシジン(1,1’−ヘキサメチレン−ビス−5−(4−クロロフェニルビグアニド)を含むがこれに限定されない)、及びこれらの塩が挙げられる。
【0100】
好適なフェノール類の非限定的な例には、フェノール、サリチル酸、2−フェニルフェノール、4−t−アミルフェノール、クロロキシレノール、ヘキサクロロフェン、4−クロロ−3,5−ジメチルフェノール(PCMX)、2−ベンジル−4−クロロフェノール、トリクロサン、ブチル化ヒドロキシトルエン、2−イソプロピル−5−メチルフェノール、4−ノニルフェノール、キシレノール、ビスフェノールA、オルトフェニルフェノール、並びにフェノチアジン類(クロルプロマジン、プロクロルペラジン、及びチオリジジンなど)が挙げられる。
【0101】
好適な細胞溶解性ペプチドの非限定例には、A−23187(カルシウムイオノフォア)、デルマセプチン、リステリオリシン、レナレキシン、アエロリシン、デルマトキシン、マクラチン、ラナテウリン、アンホテリシンB、動物毒液由来の直接溶解因子、マガイニン、ルゴシン、アスカフィン、ジフテリア毒素、マキシミン、サポニン、Aspergillus属溶血素、ジスチンクチン、メリチン、黄色ブドウ球菌毒素(α、β、χ、δ)、アラメシチン、エスクレチン、メトリジオリシン、ストレプトリシンO、アポリポタンパク質、フィリピン、ニゲリシン、ストレプトリシンS、ATPトランスロカーゼ、ガエグリン、ナイスタチン、シネキシン、ボンビニン、GALA、オセラチン、スルファクチン、ブレビニン、グラミシジン、P25、ツブリン、ブフォリン、らせん構造赤血球溶解ペプチド、パルストリン、バリノマイシン、カエリン、溶血素、ホスホリパーゼ、ビブリオリシン、セレオリシン、イオノマイシン、フィロキシン、コリシン、KALA、ポリエン抗生物質、デルマジスチンクチン、LAGA、ポリミキシンBが挙げられる。
【0102】
好適な酵素の非限定的な例には、リゾチーム、リソスタフィン、バクテリオファージ溶解素、アクロモペプチダーゼ、ラビアーゼ、ムタノリジン、ストレプトリジン、テタノリジン、a−ヘモリジン、リチカーゼ、菌類由来の溶解酵素、セルラーゼ、ペクチナーゼ、Driselase(登録商標)、Viscozyme(登録商標)L、ペクトリアーゼが挙げられる。
【0103】
放出要素がヒドロゲルであるいくつかの実施形態では、ヒドロゲルが形成される前駆体組成物は、参照によりその全体が本明細書に組み込まれる、WO 2007/146722に記載されているようなアニオン性又はカチオン性モノマーを含有することができる。アニオン性又はカチオン性モノマーは、ヒドロゲルに組み込まれ、それ自体は細胞抽出剤活性を保持することができる。いくつかの実施形態において、アニオン性又はカチオン性モノマーは、ヒドロゲルの表面に架橋されることができる。ヒドロゲルのビーズ又は繊維をカチオン性モノマーの溶液に短時間浸してからすぐに取り出し、化学線(例えば、紫外線、電子線)を使用して架橋させることができる。これにより、カチオン性モノマーが、ヒドロゲルのビーズ又は繊維の外表面に化学的に結合する。
【0104】
いくつかの実施形態において、細胞抽出剤の様々な組み合わせが、前駆体組成物(これからヒドロゲルが合成される)中、又はソルビン酸塩(ヒドロゲルの合成後にヒドロゲル内に装填される)中に使用できる。前駆体組成物又はその結果として生じるヒドロゲルと相溶する任意の他の既知の細胞抽出剤を用いることができる。これらのものとしては、クロルヘキシジン塩、例えば、グルコン酸クロルヘキシジン(CHG)、パラクロロメタキシレノール(PCMX)、トリクロサン、ヘキサクロロフェン、グリセリン及びプロピレングリコールの脂肪酸モノエステル及びモノエーテル、例えばモノラウリン酸グリセロール、セチルトリメチルアンモニウムブロミド(CTAB)、モノカプリル酸グリセロール、モノカプリン酸グリセロール、モノラウリン酸プロピレングリコール、モノカプリル酸プロピレングリコール、モノカプリン酸プロピレングリコール、(C12〜C22)疎水性物質及び四級アンモニウム基又はプロトン化三級アミノ基を含むフェノール類、界面活性剤及びポリマー、四級シラン及びポリ四級アミンのような四級アミノ含有化合物、例えばポリヘキサメチレンビグアニド、遷移金属イオン、例えば銅含有化合物、亜鉛含有化合物、及び銀含有化合物、例えば金属銀、銀塩、例えば塩化銀、酸化銀、及びスルファジアジン銀、メチルパラベン、エチルパラベン、プロピルパラベン、ブチルパラベン、オクテニデン、2−ブロモ−2−ニトロプロパン−1,3ジオール、又は上記の任意の2つ以上の混合物が挙げられるが、これらに限定されない。
【0105】
好適な細胞抽出剤には、ジアルキルアンモニウム塩(N−(n−ドデシル)−ジエタノールアミンなど);カチオン性エトキシル化アミン(「Genaminox K−10」、Genaminox K−12、「Genamin TCL030」、及び「Genamin C100」など);アミジン(プロパミジン及びジブロモプロパミジンなど);ペプチド抗生物質(ポリミキシンB及びナイシンなど);ポリエン抗生物質(ナイスタチン、アンホテリシンB、及びナタマイシンなど);イミダゾール類(エコナゾール、クロトラミゾール及びミコナゾールなど);酸化剤(安定な形態の塩素及びヨウ素など);並びに米国特許第7,422,868号(その全体が参照により本明細書に組み込まれる)に記述されている細胞抽出剤が更に挙げられる。
【0106】
細胞抽出剤は、本発明の検出系(例えば、ルシフェラーゼ酵素などの検出試薬)を不活性化しないよう選択されるのが好ましい。強い細胞抽出剤(例えば、イオン性洗剤など)を必要とする微生物については、改善された検出系(例えば、これら試薬の存在下で強化された安定性を示すルシフェラーゼなどで、これらは米国特許出願第2003/0104507号に開示されているものが挙げられ、この全体が参照により本明細書に組み込まれる)が特に好ましい。
【0107】
本発明の方法は、放出要素から有効量の細胞抽出剤を放出させることにより、生きた細胞からの生物学的検体の放出を引き起こす。本開示には、当該技術分野において既知のさまざまな細胞抽出剤が含まれ、これらそれぞれは、放出要素から異なる速度で放出されてよく、かつ他とは異なる濃度で生きた細胞に対して影響を及ぼしてよい。以下は、細胞抽出剤の選択、及び放出要素中に含める有効量の決定の際に、考慮すべき要素に関するガイダンスを提供する。
【0108】
いずれの細胞抽出剤の有効性も、濃度及び曝露時間という主に2つの要素によって決定されることは、当該技術分野において既知である。即ち、一般に、細胞抽出剤の濃度が高いほど、生きた細胞にもたらす効果(例えば、細胞膜の浸透化及び/又は細胞からの生物学的検体の放出)は大きくなる。また、任意の所定の濃度の細胞抽出剤において、一般に、細胞抽出剤に生きた細胞をさらす時間が長いほど、細胞抽出剤の効果は大きくなる。他の付帯的な要素(例えば、pH、共溶媒、イオン強度、及び温度)は、特定の細胞抽出剤の有効性に影響を与えることが当該技術分野において既知である。これらの付帯的要素は、例えば、温度制御器、緩衝液、試料調製などによって制御できることが知られている。これらの要素並びに細胞抽出剤はまた、生物学的検体の検出に使用される検出系に対して影響を与えることもできる。いくつかの単純な実験を実施することによって、本開示の物品を生成し、本開示の方法を実行するのに有効な量の細胞抽出剤を決定することは、当業者の把握する領域内である。
【0109】
細胞及び/又は検出系に対する、様々な濃度の細胞抽出剤の効果を判定するための初期実験を実施することができる。最初に、候補放出要素を、生物学的検体の検出系に与える影響に関してスクリーニングすることができる。例えば、本明細書に記載されるように放出要素に細胞抽出剤を注入することができる。続いて、細胞抽出剤を含む放出要素を(細菌性細胞なしに)ATPアッセイに入れることができる。このアッセイを試薬等級ATP溶液(例えば約0.1〜約100ピコモルのATP)で実行することができ、放出要素をともなう試料中のルシフェラーゼ反応によって発光する生物発光量を、放出要素のない試料によって発光する生物発光量と比較することができる。好ましくは、放出要素を有する試料中の生物発光量は、放出要素を有さない試料中の生物発光量の50%超過である。好ましくは、放出要素を有する試料中の生物発光量は、放出要素を有さない試料中の生物発光量の90%超過である。最も好ましくは、放出要素を有する試料中の生物発光量は、放出要素を有さない試料中の生物発光量の95%超過である。
【0110】
加えて、細胞からの生物学的検体の放出に細胞抽出剤が与える影響を、PCT国際公開特許WO 2010/129726の実施例21に記載されているのと同様に、実験的に判定することができる。例えば、細胞(例えば、黄色ブドウ球菌などの微生物細胞)の懸濁液を、比較的幅広い範囲の濃度の細胞抽出剤(例えば、BARDAC 205M)に、検出系の存在下で、一定時間(例えば数分以内)さらすことにより、細胞からの生物学的検体を検出することができる(例えば、ルシフェリン、ルシフェラーゼ、及びpH約7.6〜7.8の緩衝液を含むATP検出系)。この生物学的検体を定期的に測定し、第一測定は通常、細胞抽出剤を混合液に加えた直後に行い、これにより、細胞からの生物学的検体(この例では、ATP)の放出が検出できるかどうかを調べることができる。この結果は、その細胞から放出される生物学的検体を検出するための最適条件(即ち、細胞抽出剤の液体濃度及び曝露時間)を示すことができる。PCT国際公開特許WO 2010/129726の表26に示されるように、この結果は、より高濃度の細胞抽出剤では、細胞抽出剤は、生物学的検体(例えば、ATP)の放出において効果が弱い可能性がある、及び/又は検出系に干渉する可能性がある(即ち、検出試薬によって生成された光又は色を吸収する可能性がある)ことも示すことができる。
【0111】
液体混合物中の有効量の細胞抽出剤を決定した後、本明細書に記述されている方法によって放出要素に組み込む細胞抽出剤の量を考慮すべきである。放出要素が液体混合物(例えば、水性懸濁液中の試料)と接触すると、細胞抽出剤は放出要素から放出されることができ(例えば、拡散により)、液体混合物中の細胞抽出剤の濃度は、平衡に達するまで増加する。理論に束縛されるものではないが、平衡に達するまで、細胞抽出剤の濃度勾配が液体中に存在し、放出要素の近くにある液体部分ではより高濃度の抽出剤が存在すると推定できる。細胞抽出剤の濃度が、細胞を含む液体部分で有効濃度に達すると、細胞は生物学的検体を放出する。放出された生物学的検体は、ここで、検出系によって検出することができるようになる。
【0112】
試料を含む液体中で細胞抽出剤を有効濃度にするのは、いくつかの要素によって制御することができる。例えば、放出要素に搭載された細胞抽出剤の量は、平衡に達した液体中での細胞抽出剤の最終濃度に影響を与える。加えて、液体混合物中の放出要素の量、及びいくつかの実施形態では、放出要素の表面積の量は、放出要素からの細胞抽出剤の放出速度、及び平衡に達した液体中の細胞抽出剤の最終濃度に影響を与えることができる。更に、水性媒体の温度は、放出要素が細胞抽出剤を放出する速度に影響を与えることができる。他の要素、例えば細胞抽出剤及び放出要素のイオン特性及び/又は疎水性特性が、放出要素から放出される細胞抽出剤の量、及び細胞抽出剤が放出要素から放出される速度に影響を与えることができる。これらの要素のすべてを、試料中の細胞の検出のために、望ましいパラメータ(例えば、その物品の製造時の検討事項及びその方法の結果を得るまでの時間など)を達成するよう、当業者が定期的に実験を行うことにより最適化することができる。一般に、細胞抽出剤が放出要素と試料物質を含む液体の容積との間の平衡に達したときに、有効量(放出要素のない細胞抽出剤を使用した実験により決定される)を達成するのに少なくとも充分な細胞抽出剤を、放出要素に組み込むのが望ましい。放出要素が有効量の細胞抽出剤を放出するのに要する時間を短くするために、(放出要素のない細胞抽出剤を使用した実験により決定された量よりも)多くの量の細胞抽出剤を放出要素に加えるのが望ましいことがある。
【0113】
放出要素がマトリックスを含むいくつかの実施形態では、細胞抽出剤は、マトリックスの中に拡散する、マトリックスから外へ拡散する、又はその両方であることができる。拡散速度は、例えば、マトリックス材料及び/又は架橋密度を変えること、マトリックスが作製される極性溶媒を変えること、マトリックスが作製される極性溶媒中の細胞抽出剤の溶解度を変えること、及び/又は細胞抽出剤の分子量を変えることによって、制御可能であるべきである。拡散速度はまた、マトリックスの形状、サイズ、及び表面トポグラフィーを変えることによっても改善することができる。
【0114】
理論に束縛されるものではないが、放出要素からの細胞抽出剤の移動は、放出要素と液体(例えば、試料を含む水性液体)が接触した際に、自然発生的に(例えば、拡散によって)起こることができると考えられている。いくつかの実施形態において、細胞抽出剤の放出要素からの移動は、促進されることができる。
【0115】
いくつかの実施形態では、細胞抽出剤の放出要素からの移動は、化学的促進剤を提供することによって促進される。化学的促進剤は、例えば、酸又は塩基であることができる。混合物のpHを変化させることにより、放出要素と細胞抽出剤との間のイオン相互作用を妨げ、それによって放出要素からの細胞抽出剤の移動を促進してよい。参照によりその全体が本明細書に組み込まれる、PCT国際公開特許WO2005/094792、発明の名称「ANIONIC HYDROGEL MATRICES WITH PH DEPENDENT MODIFIED RELEASE AS DRUG CARRIERS」は、薬物又は殺菌剤がpH依存的に調整されて放出されるヒドロゲル組成物を開示している。いくつかの実施形態では、細胞抽出剤の移動は、(例えば、塩を添加又は除去することによって)液体のイオン強度を変化させることで促進されることができる。
【0116】
いくつかの実施形態では、放出要素からの細胞抽出剤の移動は、機械的処理によって促進される。好適な機械的処理の非限定例には、放出要素を振動させる、撹拌する、又は圧縮することを含む。
【0117】
放出要素は、液体試料材料と静的に接触させるか、動的に接触させる(即ち、例えば振動、攪拌、エアレーション又は圧縮によって混合)か、あるいはこれらの組み合わせで接触させることができる。PCT国際公開特許WO 2010/129726の実施例16は、混合することで、有効量の細胞抽出剤の放出要素からのより迅速な放出を引き起こすことができることを示している。PCT国際公開特許WO 2010/129726の実施例17は、放出要素を圧縮することにより、いくつかの実施形態で、有効量の細胞抽出剤の放出要素からのより迅速な放出をもたらすことができることを示している。放出要素を圧縮することは、例えば、放出要素を表面に押し付けること及び/又放出要素を圧壊することを包含することができる。したがって、いくつかの実施形態において、混合することにより、細胞抽出剤のより迅速な放出を有利にもたらし、これにより試料中の生物学的検体(例えば、生きた細胞から)のより迅速な検出をたらすことができる。いくつかの実施形態において、放出要素の圧縮(例えば、スワブ若しくはスパチュラ、キャリア(後述)、又は他の好適な用具などの試料取得装置を使用して放出要素に対し圧力を加えることによって)により、細胞抽出剤のより迅速な放出を有利にもたらし、これにより試料中の生物学的検体のより迅速な検出をもたらすことができる。加えて、放出要素圧縮の工程は、操作者に便利な時点で細胞抽出剤の放出を加速させるために行うことができる。
【0118】
いくつかの実施形態において、静的な接触は、有効量の細胞抽出剤放出を遅らせることがあるため、生物学的検体の検出の前に、操作者が他の処理(例えば試薬の追加、装置の較正、及び/又は検体の輸送など)を実施するための追加の時間を提供することができる。いくつかの実施形態において、最初の生物学的検体測定が行われるまでは、混合物を静的に保持し、それから、有効量の細胞抽出剤放出に必要な時間を短縮するために動的に試料を混合することが有利な場合がある。
【0119】
本発明の方法において機能的な最も好ましい濃度又は濃度範囲は、異なる微生物及び異なる細胞抽出剤によって異なり、本明細書に記述されている方法、又は当業者に周知の方法を用いて経験的に決定され得ることが、充分に予測される。
【0120】
試料及び試料取得装置:
本開示の物品及び方法は、試料中の生物学的検体の検出法を提供する。いくつかの実施形態では、本物品及び方法は、試料中の生きた細胞からの生物学的検体の検出法を提供する。特定の実施形態では、本物品及び方法は、試料中の生きた微生物細胞の検出法を提供する。特定の好ましい実施形態では、本物品及び方法は、試料中の生きた細菌細胞の検出法を提供する。
【0121】
本明細書で使用する用語「試料」は、その最も広い意味で使用される。試料は、本発明を用いて分析される生物学的検体(例えば、ATP)を含む可能性のある組成物である。生物学的検体は、試料中の細胞(例えば、細菌)内に存在してよい。更に多くの場合、試料は、(任意に培地中の)細胞又は細胞集団、あるいは細胞可溶化物を含むことが知られている又は含むことが疑われる。試料はまた、表面に吸着細胞又は細胞集団を有してよい固体表面(例えば、スワブ、膜、フィルタ、粒子)であってもよい。こうした固体試料では、本発明に基づく細胞濃縮剤と混合することが可能な液体(例えば、水溶液)と固体を接触させることによって水性試料を調製することが考えられる。
【0122】
好適な試料としては、固体物質(例えば、粒子、フィルタ)、半固体物質(例えば、ゲル、固体の懸濁液、又はスラリー)、液体、又はこれらの組み合わせが挙げられる。好適な試料としては、固体、液体、又はこれらの組み合わせを含む表面残留物が更に挙げられる。表面残留物の非限定的な例としては、環境表面(例えば、床、壁、天井、媒介物、機器、水、及び水容器、エアフィルタ)、食品表面(例えば、野菜、果物、及び肉の表面)、食品加工表面(例えば、食品加工装置及びまな板)、並びに臨床表面(例えば、組織試料、皮膚、及び粘膜)からの残留物が挙げられる。試料にはまた、原油若しくは粗精製油、ガソリン、又は塗料などの混合物を含むことができる。
【0123】
生物学的検体の検出のための試料物質(表面残留物を含む)の採取法は、当該技術分野では周知である。ピペット、スパチュラ、スポンジ、スワブなどを含むそれぞれの種の試料取得装置がこれまでに述べられており、本発明の方法において使用することができる。
【0124】
細胞濃縮剤:
本開示の方法では、液体試料中に存在する細胞と結合する細胞濃縮剤を使用する。細胞濃縮剤を液体試料と所定の時間接触させる。細胞は、共有結合又は非共有結合(例えば、疎水性又はイオン性相互作用)によって、あるいは共有結合と非共有結合との組み合わせによって細胞濃縮剤と結合することができる。細胞が細胞濃縮剤と結合した後、例えば、沈降、凝集、遠心、濾過、又はこれらの任意の組み合わせによって細胞濃縮剤を液体試料から除去することができる。
【0125】
「細胞濃縮剤」とは、液体に懸濁可能であることによって液体中に存在する微生物を捕捉かつ保持することができる物質(例えば、粒子、繊維)を含む広い意味で使用される。細胞濃縮剤は、濾過処理によって回収することができるが、微生物を捕捉するうえで必ずしも濾過処理を必要としない。
【0126】
特定の細胞濃縮剤が当該技術分野において知られており、本開示の方法における使用に適している。好適な細胞濃縮剤の非限定的な例としては、ヒドロキシアパタイト(Berryら、Appl.Environ.Microbiol.;63:4069〜4074;1997)、磁気ビーズ(Osterら、J.Magnetism and Magnetic Mat.;225:145〜150;2001)、フェリ磁性鉱物、マグネタイト、キトサン、及び親和性支持物質が挙げられる。試料から微生物を捕捉又は濃縮するための固定化金属支持物質を含む組成物の使用は、参照によりその全体が本明細書に組み込まれる、米国特許出願公開第2010/0062421号、発明の名称「COMPOSITIONS,METHODS,AND DEVICES FOR ISOLATING BIOLOGICAL MATERIALS」に記載されている。
【0127】
濃縮剤の例示的な種類の1つとしては、珪藻土及び表面処理した珪藻土が挙げられる。こうした濃縮剤の具体例は、その開示内容が参照により本明細書に組み込まれる、同一出願人による米国特許出願公開第2010/0209961号、発明の名称「MICROORGANISMS CONCENTRATION PROCESS AND AGENT」に見出すことができる。無機材料は、水系に分散又は懸濁されると、その物質及び水系のpHに特徴的な表面電荷を示す。物質−水の界面の両側の電位は「ゼータ電位」と呼ばれ、電気泳動における移動度から(即ち、水系中に置かれた帯電電極間を物質の粒子が移動する速度から)計算することができる。一実施形態では、濃縮剤は、非処理の珪藻土のゼータ電位よりも少なくともある程度正のゼータ電位を有してよく、こうした濃縮剤は、その表面が一般的に負に帯電する傾向を有する細菌などの微生物を濃縮するうえで非処理の珪藻土と比較して驚くほど顕著に効果的となりうる。
【0128】
濃縮剤の代表的な種類の1つとして珪藻土がある。濃縮剤の別の代表的な種類として、表面処理した珪藻土がある。代表的な表面処理としては、二酸化チタンなどの表面改質剤、微細なナノスケールの金若しくは白金、又はこれらの組み合わせがある。こうした表面処理は、微生物を濃縮するうえで非処理の珪藻土と比較して驚くほど顕著に効果的となり得る。表面処理としてはまた、酸化第二鉄、酸化亜鉛、酸化アルミニウム、及びこれらに類するもの、並びにこれらの組み合わせから選択される金属酸化物が挙げられる。一実施形態では、酸化第二鉄が使用される。金などの貴金属は抗微生物特性を示すことが知られているが、金含有濃縮剤は、微生物を結合するうえで有効であるばかりでなく、検出又はアッセイ用に微生物を生存状態に維持するうえでも有効である。
【0129】
有用な表面改質剤としては、微細なナノスケールの金、微細なナノスケールの白金、少なくとも1つの金属酸化物(例えば、二酸化チタン、酸化第二鉄、又はこれらの組み合わせ)と組み合わせた微細なナノスケール金、二酸化チタン、少なくとも1つの他の(即ち、二酸化チタン以外)金属酸化物と組み合わせた二酸化チタン、及びこれらに類するもの、並びにこれらの組み合わせが挙げられる。一実施形態では、微細なナノスケール金、微細なナノスケール白金、少なくとも酸化第二鉄若しくは二酸化チタンと組み合わせた微細なナノスケール金、二酸化チタン、少なくとも酸化第二鉄と組み合わせた二酸化チタン、又はこれらの組み合わせのような表面改質剤を使用することができる。
【0130】
一実施形態では、以下のような表面改質剤を使用することができる:微細なナノスケール金、微細なナノスケール白金、酸化第二鉄又は二酸化チタンと組み合わせた微細なナノスケール金、二酸化チタン、酸化第二鉄と組み合わせた二酸化チタン、及びこれらの組み合わせ。一実施形態では、微細なナノスケール金、酸化第二鉄又は二酸化チタンと組み合わせた微細なナノスケール金、酸化第二鉄と組み合わせた二酸化チタン、及びこれらの組み合わせを使用することができる。一実施形態では、微細なナノスケール金、酸化第二鉄又は二酸化チタンと組み合わせた微細なナノスケール金、及びこれらの組み合わせを使用することができる。
【0131】
濃縮剤の別の代表的な種類として、γ−FeO(OH)(レピドクロサイトとしても知られる)がある。こうした濃縮剤の具体例は、同一出願人による米国特許出願公開第2010/0248214号、発明の名称「MICROORGANISM CONCENTRATION PROCESS」に見出すことができ、その開示は参照により本明細書に組み込まれる。こうした濃縮剤は、食品及び水によって媒介される疾患及びヒトの細菌感染において重大な問題となりうるグラム陰性菌を捕捉するうえで他の鉄含有濃縮剤と比較して、驚くほど効果的であることが見出されている。濃縮剤は、他の成分(例えば、ベーマイト(α−AlO(OH)、粘土、酸化鉄、及び酸化ケイ素など)を(γ−FeO(OH)以外に)更に含んでよい。このような他の成分が含まれる実施形態では、他の成分は試料と濃縮剤との密接な接触を一般的に大きく妨げない。
【0132】
γ−FeO(OH)は既知の物質であり、公知の方法によって化学的に合成することができる(例えば、米国特許第4,729,846号(Matsuiら)(この記載内容は参照によりその全体が本明細書に組み込まれる)に磁気テープ製造を目的として述べられているように、中性又は弱酸性pHで水酸化第一鉄の酸化によって)。γ−FeO(OH)はまた、市販されている(例えば、Johnson Matthey Company(Ward Hill,MA)グループの一企業であるAlfa Aesar及びSigma−Aldrich Corporation(St.Louis,MO)。
【0133】
γ−FeO(OH)を濃縮剤として使用する一実施形態では、γ−FeO(OH)は、一般的に微粒子の形態である。一実施形態では、γ−FeO(OH)は、約3マイクロメートル(他の実施形態では、約5マイクロメートル、又は約10マイクロメートル)〜約100マイクロメートル(他の実施形態では、約80マイクロメートル、又は約50マイクロメートル、又は約35マイクロメートル、ただし任意の下限値を範囲の任意の上限値と組み合わせることができる)の範囲の粒径(最大の寸法)を有する微粒子の形態である。一実施形態では、粒子は、より小さな粒子の凝集体である。粒子は、粒径約1マイクロメートル未満(一実施形態では粒径約0.5マイクロメートル未満)の微結晶を含むことができる。微結晶は、針状微結晶として、針状微結晶を含むいかだ状構造として、又は針状微結晶といかだ状構造との組み合わせとして存在することができる。
【0134】
一実施形態では、濃縮剤は、BET(ブルナウアー・エメット・テラー)法(窒素ガス分子の物理的吸着による固体の表面積計算)によって測定される表面積が、1グラム当たり約25平方メートル(m2/g)よりも大きく、一実施形態では約50m2/gよりも大きく、更に別の実施形態では約75m2/gよりも大きい。
【0135】
粒子の凝集形態は、微粒子にしばしばともなう取扱い及びその他の危険性をともなわずに、微粒子システムの吸着能を与え得るものである。加えて、そのような凝集体粒子は液体中で容易に沈殿し得るものであり、このため液相から微生物を速やかに分離することが可能となる(同時に、濾過時の背圧が低くて済む)。
【0136】
濃縮剤の別の代表的な種類としては、金属ケイ酸塩がある。こうした濃縮剤の具体例は、その開示内容が参照により本明細書に組み込まれる、同一出願人による米国特許出願公開第2010/0190171号、発明の名称「MICROORGANISM CONCENTRATION PROCESS」に見出すことができる。代表的な金属ケイ酸塩は、X線光電子分光法(XPS)で測定した場合に、金属原子とケイ素原子の比が約0.5以下(ある実施形態では、約0.4以下、別の実施形態では、0.3以下、更に別の実施形態では、約0.2以下)の表面組成を有することができる。ある実施形態では、表面組成はまた、X線光電子分光法(XPS)で測定した場合に、少なくとも平均10原子パーセントの炭素(ある実施形態では、少なくとも平均約12原子パーセントの炭素、更に別の実施形態では、少なくとも平均約14原子パーセントの炭素)を含む。XPSは、試料表面の最も外側のほぼ3〜10ナノメートル(nm)の元素組成を定量することができ、水素及びヘリウムを除いて周期率表中のすべての元素に感度のある手法である。XPSは、大多数の元素に対して0.1〜1原子パーセント濃度範囲の検出限界を持つ定量的な手法である。XPSの代表的な表面組成の評価条件としては、受光立体角±10°で試料表面に対して測定される取り出し角90°がある。
【0137】
金属ケイ酸塩などの無機材料は、水系に分散又は懸濁されると、その材料及び水系のpHに特徴的な表面電荷を示す。物質−水の界面の両側の電位は「ゼータ電位」と呼ばれ、電気泳動における移動度から(即ち、水系中に置かれた帯電電極間を物質の粒子が移動する速度から)計算することができる。代表的な濃縮剤は、例えば、普通のタルクなどの一般的な金属ケイ酸塩のゼータ電位よりも負のゼータ電位を有することができる。それにも関わらず、こうした濃縮剤は、表面が一般的に負に帯電する傾向を有する細菌などの微生物を濃縮するうえでタルクと比較して驚くほど効果的である。一実施形態では、濃縮剤は、pH約7において負のゼータ電位(一実施形態では、pH約7において約−9ミリボルト〜約−25ミリボルトの範囲のスモルコフスキーゼータ電位、別の実施形態では、pH約7において約−10ミリボルト〜約−20ミリボルトの範囲のスモルコフスキーゼータ電位、更に別の実施形態では、pH約7において約−11ミリボルト〜約−15ミリボルトの範囲のスモルコフスキーゼータ電位)を有する。
【0138】
有用な金属ケイ酸塩としては、これらに限定されるものではないが、マグネシウム、カルシウム、亜鉛、アルミニウム、鉄、チタン、及びこれらに類するもの、並びにこれらの組み合わせなどの金属の非晶質ケイ酸塩が挙げられる。一実施形態では、マグネシウム、亜鉛、鉄、チタン、又はこれらの組み合わせを使用することができる。更に別の実施形態では、マグネシウムを使用することができる。一実施形態では、少なくとも部分的に融合した粒子の形態の非晶質金属ケイ酸塩を使用することができる。一実施形態では、非晶質の球状化された金属ケイ酸塩を使用することができる。更に別の実施形態では、球状化された非晶質ケイ酸マグネシウムを使用することができる。金属ケイ酸塩は既知であり、公知の方法によって化学的に合成するか、又は天然に生じる未加工鉱石の採鉱及び処理によって入手することができる。
【0139】
いくつかの非晶質金属ケイ酸塩は、市販されている。例えば、球状化された非晶質ケイ酸マグネシウムは、化粧品の処方における使用を目的として市販されている(例えば、3M Company(St.Paul,MN)より販売されるCosmetic Microspheres CM−111として)。
【0140】
非晶質金属ケイ酸塩に加えて、濃縮剤が上記の表面組成を有するかぎりにおいて、濃縮剤は、金属(例えば、鉄又はチタン)の酸化物、結晶性金属ケイ酸塩、他の結晶性物質、及びこれらに類するものを含む他の物質を更に含んでよい。一実施形態では、濃縮剤は結晶性シリカを基本的に含まない。
【0141】
濃縮剤は、試料の接触及び微生物の捕捉に適した任意の形態で使用することができる。一実施形態では、濃縮剤は粒子の形態で使用される。一実施形態では、濃縮剤は微粒子の形態である。一実施形態では、濃縮剤は約1マイクロメートル(一実施形態では、約2マイクロメートル)〜約100マイクロメートル(一実施形態では、約50マイクロメートル、別の実施形態では、約25マイクロメートル、更に別の実施形態では、約15マイクロメートル、ただし任意の下限値を範囲の任意の上限値と組み合わせることができる)の範囲の粒径を有する微粒子の形態である。
【0142】
濃縮剤を使用した微生物の濃縮又は捕捉は、微生物の特定の株、種又はタイプに特異的なものではなく、したがって試料中の一般的な微生物の集団を濃縮するものである。次いで、株特異的なプローブによる任意の公知の検出方法を用いて、捕捉された微生物の集団から微生物の特定の株を検出することができる。したがって、この濃縮剤は、臨床試料、食品試料、環境試料、又は他の試料中の汚染微生物又は病原体(特に細菌などの食品によって媒介される病原体)の検出に使用することができる。
【0143】
本発明のプロセスを実施するうえで、濃縮剤は、試料との接触及び微生物の捕捉に適した任意の形態で使用することができる(例えば、粒子の形態で使用するか、あるいは微小流体装置のディップスティック、フィルム、フィルタ、チューブ、ウェル、プレート、ビーズ、膜、若しくはチャネル、又はこれらに類するものなどの支持体に塗布して)。好ましくは、濃縮剤は、粒子の形態で使用される。
【0144】
必要に応じて、細胞濃縮剤は、微生物と結合することが可能な結合相手(例えば、抗体、抗体フラグメント、抗原結合ドメイン、レクチン(例えば、コンカナバリンA)、受容体、ファージ受容体、又はこれらに類するもの)を含んでよい。結合は、直接的なものであっても、間接的なものであってもよい。結合は、特定の微生物の種類に対して選択的であってもよく、あるいは非選択的あってもよい。
【0145】
試料から微生物を捕捉するために使用される濃縮剤の量は、使用される濃縮剤の種類、試料のサイズ、貯留部の種類及びサイズ、試料の混合、特定の用途、本明細書では詳細に考察されない他の因子、又はこれらの組み合わせに少なくとも一部よって決まる。捕捉効率(濃縮剤と結合した試料中の微生物の比率)は、微生物を濃縮剤と長時間かけて接触させることによって一般的に高めることができる。捕捉効率は、濃縮剤の濃度を高くすることによって高めることもでき、高濃度の濃縮剤は、微生物が捕捉されるまでに移動する平均拡散距離を小さくすることから、インキュベーション時間が短縮される。したがって、一般論として、より多くの濃縮剤を加えるほど、同じ量の微生物を捕捉するために必要とされるインキュベーション時間は短くなる。
【0146】
一実施形態では、濃縮剤の適切な量は、微生物が濃縮剤に結合するのを待つのに要する時間(「捕捉時間」と呼ぶ)に応じて変化することができる。例えば、1分間の捕捉時間では、試料10mL当たり1000mgの濃縮剤が適切であり、10分間の捕捉時間では、試料10mL当たり100mgの濃縮剤が適切であり、60分間の捕捉時間では、試料10mL当たり10mgの濃縮剤が適当であり得る。一実施形態では、試料10mL当たり約1mg〜約100mgの濃縮剤を使用することができる。一実施形態では、試料10mL当たり約1mg〜約50mgの濃縮剤を使用することができる。一実施形態では、試料10mL当たり約10mg〜約25mgの濃縮剤を使用することができる。例えば、金属ケイ酸塩濃縮剤を使用する一実施形態では、試料10mL当たり約10mgの金属ケイ酸塩濃縮剤を使用することができる。例えば、金属ケイ酸塩濃縮剤を使用する一実施形態では、試料10mL当たり約25mgの金属ケイ酸塩濃縮剤を使用することができる。
【0147】
検出装置:
本開示は、試料中の微生物を検出するために使用することができる装置を提供する。装置は、少なくとも2個の貯留部を含み、その間に通路を有するハウジングと、ハウジングの第1の貯留部内に配置された任意の細胞濃縮剤と、ハウジング内の少なくとも2個の貯留部を隔離するための手段と、ハウジングの第1の貯留部から第2の貯留部へと細胞濃縮剤を移動させるための手段とを含むことができる。いくつかの実施形態では、ハウジングは、2個の貯留部を隔離するための手段(例えば、破断可能なシール)を含むことができる。いくつかの実施形態において、ハウジングは、細胞濃縮剤をハウジングの第1の貯留部から第2の貯留部へと移動させるための手段(例えば、弁)を含むことができる。いくつかの実施形態では、装置は、微生物を検出するための試薬を更に含むことができる。特定の実施形態では、装置は、細胞抽出剤を含む放出要素を更に含むことができる。細胞抽出剤は、微生物からの生物学的検体の検出を促進することができる。
【0148】
ここで図1Aを参照すると、本開示に基づく検出装置100の一実施形態の構成要素の断面図が示される。検出装置の構成要素は、ハウジング110とプランジャ150とを含む。ハウジング110は、下側部分114に隣接した上側部分112を含む。上側部分112と下側部分114とは、型成形などの当該技術分野では周知の方法によって、ポリエチレン又はポリプロピレンなどのポリマー材料から別々に形成することができる。それぞれの部分は、実質的に液密な結合を与えるように一体に圧入されるような寸法とするか、あるいは当該技術分野において知られる手段(例えば、接着剤、超音波溶接など)によって一体に結合することができる。また、ハウジングは、例えば、中空体を押し出し成形し、通路を型成形し、熱を用いたプロセスによってハウジングの底をシールするなど、当該技術分野において知られるプロセスによって単一のユニットとして形成することもできる。他の実施形態では、狭い通路を含む挿入部材を一体型ハウジング内に配置して、第1及び第2の貯留部(それぞれ120及び124)を形成することができる。
【0149】
上側部分112の、下側部分114からみて遠位となる端部には、プランジャ150を受容するような寸法の開口部113が形成される。上側部分112の反対側の端部には、ハウジング110の下側部分114内に開口する通路116が形成される。図に示される実施形態では、第1の貯留部120の断面積よりも小さい断面積を有する通路116が、上側部分112を形成する壁の内向きの延長部として示される。あるいは、通路116は、上側部分112の壁の内側にハウジング110の下側部分114に隣接して嵌まる挿入要素によって形成されてよい(図に示されていない)。挿入要素は、ハウジング110の下側部分114に隣接した通路116を形成することができる。図1Aの上側部分112、下側部分114、及び通路116の相対的比率はあくまで例示的なものであって、試料の体積及び/又は器具の制限条件などの異なるパラメータに対応するうえで必要に応じて適合させることができる。
【0150】
プランジャ150は、一端にハンドル152を、他端に複数のシール(第1の下側シール156及び第2の下側シール157)を有するシャフト151を含む。必要に応じて、プランジャ150は1つ以上の上側シール154及び/又はインデックスマーク153を含むことができる。ハンドル152、第1の下側シール156、及び第2の下側シール157間の相対的な距離については後述する。図1Aに更に示されているのは、任意の検出試薬165及び任意の放出要素162である。
【0151】
「検出試薬」とは、本明細書ではその最も広い意味で使用される。検出試薬とは、生物学的検体を検出するために反応中で使用することのできる試薬である。検出反応の非限定的な例としては、結合相手間の相互作用(例えば、抗原−抗体、受容体−リガンド、プローブ−標的分子、及びハイブリダイゼーション結合相互作用など)、及び/又は酵素反応(例えば、蛍光発生反応、色素生成反応、光発生反応、又は重合反応などの酵素媒介反応)が挙げられる。検出試薬は検出反応に関与する(例えば、結合相手、酵素、酵素基質、又は指示薬として)ものでもよく、かつ/又は検出反応を促進する(例えば、緩衝剤、補因子、又は共役反応の成分として)ものでもよい。検出試薬の例としては、例えば、ルシフェラーゼ、アデニル酸キナーゼ、ペルオキシダーゼ、アルカリフォスファターゼ、アピラーゼなどの酵素、例えば、ルシフェリン、リン酸メチルウンベリフェリル、o−ニトロフェニルリン酸、p−ニトロフェニルリン酸、及び5−ブロモ−4−クロロ−3−インドキシル−リン酸塩などの酵素基質、例えば、リン酸緩衝液、TRIS緩衝液、及びHEPES緩衝液などの緩衝液、並びに、FADH、NADH、補酵素Aなどの補因子が挙げられる。
【0152】
検出試薬は、様々な形態でハウジング110内に含まれることができる。例えば、検出試薬165は、図1Aに示されるような乾燥した又は部分的に乾燥したコーティングからなることができる。検出試薬165に適した別の形態(図に示されていない)は当該技術分野では周知のものであり、例えば、液体試薬(必要に応じて、アンプルのような破断可能な区画内に入った)、粉末、ゲル、錠剤、凍結乾燥試薬、コーティングされたフィルム、ケーキ、及び、完全乾燥試薬などが挙げられる。
【0153】
図1Bは、図1Aのプランジャ150を有するハウジング110を含む検出装置100の断面図を示す。この図は、装置100を使用前に保管することができるような形態を示す。プランジャ150は、ハウジング110内に完全に挿入されている。この位置では、ハンドル152の下縁部がハウジング110の上側部分112の開口部113を封鎖することによって、ハウジング110への物質の出入りが防止されている。必要に応じて用いられる上側シール154も、ハウジング110への物質の出入りを防止するうえで機能することができる。上側シール154はハウジング110の上側部分112の壁の内表面と接触するような寸法に構成され、バリア、好ましくは液密バリアを形成するのに適した材料(例えば、ポリプロピレン、ブチルゴムなど)で形成される。
【0154】
プランジャ150が図1Bに示される位置にある場合、第1の下側シール156が通路116を封鎖することにより、ハウジング110の第1の貯留部120が第2の貯留部124から隔離される。プランジャ150が図1Bに示される位置にある場合、プランジャ150の第2の下側シール157を含む部分が第2の貯留部124内に延びており、この部分はハウジング110の下側部分114の壁と接触していない。第1の下側シール156及び第2の下側シール157は通路116の壁と接触するような寸法となっており、第1の貯留部120と第2の貯留部124との間において通路116内にバリア、好ましくは液密バリアを形成するのに適した材料(例えば、ポリプロピレン、ブチルゴム)で形成される。また、図1Bには、第1の貯留部120内に位置決めされた、任意の濃縮剤130が示される。
【0155】
図1Cは、プランジャ150が第2の位置にある図1Bの装置100の断面図を示す。このプランジャ150は、例えばハウジング110内に試料を装填するために使用できる。プランジャ150は、ハンドル152を把持して、第2の下側シール157が通路116の上端に近くなる位置にまで引き出すことができる。必要に応じて用いられるプランジャシャフト151上のインデックスマーク153を用いて(例えば、インデックスマーク153が開口部113と整列した時点で)、この位置に達するためのプランジャ150の適切な位置を示すことができる。図1Cは、第1の貯留部120内の濃縮剤130と接触している液体試料140を更に含む。使用時には、装置100を、例えば、ボルテックスにかける又は振動させることによって濃縮剤130と液体試料140とを混合することができる。所定の時間の後、濃縮剤130は、図1Cに示すように第1の貯留部120の底に沈殿することができる。いくつかの実施形態では、必要に応じて用いられるテーパ領域118が通路116に隣接して配置される。テーパ領域118は、ハウジング110の上側部分112及び/又は通路116と同じ材料及び/又はプロセスによって形成することができる。使用時には、テーパ領域118は、ハウジング110の内部において通路116の方向に沈降する、液体に懸濁された粒子(例えば、細胞濃縮剤130)を通路116の方向に向かわせることができる。
【0156】
図1Dは、図1Bに示される第1の位置にプランジャ150が戻された、図1Cの装置100の断面図を示す。ハンドル152の下縁部は開口部113に近い位置にあり、液体試料の、濃縮剤130を含む部分142が第2の貯留部124に移され、そこで部分142は検出試薬165(図1Aに示される)が存在する場合に試薬165と相互作用することができる。部分142と検出試薬165との間の相互作用の非限定的な例としては、検出試薬の溶解及び/又は懸濁、検出試薬と部分中に存在する生物学的検体との間の結合相互作用、及び/又は酵素反応が挙げられる。図1Dはまた、液体試料の部分142が第2の貯留部124内の放出要素162と接触している状態を示しており、これにより放出要素162から細胞抽出剤が放出されることができる。
【0157】
図1に示す実施形態では、第2の貯留部124から第1の貯留部120を隔離するための手段は、プランジャ150の第1の下側シール156及び/又は第2の下側シール157と通路116との組み合わせから構成される。図1に示す実施形態では、濃縮剤130を第1の貯留部120から第2の貯留部124に移動させるための手段は、通路116と、プランジャ150の第1の下側シール156及び第2の下側シール157とを含む。
【0158】
図2Aは、本発明に基づく検出装置200の一実施形態の構成要素であるプランジャ250の断面図、及びハウジング210の部分分解断面図である。ハウジング210は、下側部分214に隣接した上側部分212を含む。上側部分212及び下側部分214は、上記に述べたように形成することができる。
【0159】
上側部分212の、下側部分214からみて遠位となる端部には、プランジャ250を受容するような寸法の開口部213が形成される。上側部分212の反対側の端部には、上記に述べたような通路216が形成される。必要に応じて用いられる上記に述べたようなテーパ領域218が、通路216に隣接して形成される。破断可能なシール260a及び260bによって、ハウジングが第1の貯留部220、第2の貯留部224、及び第3の貯留部226に分割される。この実施形態では、第3の貯留部226は、第1の貯留部220と第2の貯留部224との間に配置される。破断可能なシール260a及び260bは耐水性材料(例えば、薄いポリマーフィルム、ポリマーコーティングされた紙、薄い箔など)で形成されることが好ましく、当該技術分野では周知の材料及び/又はプロセス(例えば、接着剤、熱シール、超音波接着)を用いて耐水性の破断可能なバリアを形成するようにハウジング210の壁に固定することができる。
【0160】
第3の貯留部226内に位置決めされているのは、細胞抽出剤を含む放出要素262である。いくつかの実施形態において、放出要素は、ヒドロゲルを含むことができる。細胞抽出剤を含むヒドロゲルの好適な例は、参照によりその全体が本明細書に組み込まれる、PCT国際公開特許WO 2010/039627、発明の名称「BIODETECTION ARTICLES」に述べられている。
【0161】
図2Aの3個の貯留部の相対的比率はあくまで例示的なものであって、試料の体積及び/又は器具の制限条件などの異なるパラメータに対応するうえで必要に応じて適合させることができる。図2Aには更に、必要に応じて用いられる濃縮剤230、本明細書で述べるような必要に応じて用いられる検出試薬265、及び必要に応じて用いられる着脱式キャップ278が示されている。キャップ278は、当該技術分野では周知のプロセス(例えば、型成形)を用いてポリマー材料(例えば、ポリエチレン、ポリプロピレンなど)から形成することができ、ハウジング210の液密カバーを形成するような寸法とすることができる。
【0162】
プランジャ250は、一方の端部にハンドル252を、反対側の端部に下側シール256及び穿孔端259を有するシャフト251を含む。好ましくは、下側シール256は通路216の壁と接触するような寸法となっており、通路216内にバリア、好ましくは液密バリアを形成するのに適した材料(例えば、ポリプロピレン、ブチルゴムなど)で形成される。必要に応じて、プランジャ250は、上記に述べたような1つ以上の上側シール254を含んでよい。ハンドル252、下側シール256、及び穿孔端259間の相対距離については後述する。
【0163】
図2Bは、図2Aの装置200の断面図を示す。この図では、ハウジング210は第1の貯留部220内に液体試料240を更に含む。キャップ278はハウジング210上にしっかりと着座しているため、ハウジング210をボルテックス、振動、振盪、又は反転するなど、当該技術分野では周知のプロセスによって液体試料240を細胞濃縮剤230と混合することができる。混合の後、細胞濃縮剤230を通路216内の破断可能なシール260a上に沈殿させることができる。
【0164】
図2Cは、プランジャ250が部分的に挿入された図2Bのハウジング210を含む装置200の断面図を示す。この位置では、プランジャ250の下側シール256が通路216の壁と接触することにより、通路216内において少なくとも部分242を液体試料240の残りの部分から隔離している。通路216内には、細胞濃縮剤230が更に隔離されている。
【0165】
図2Dは、プランジャ250が完全に挿入された図2Cの装置200の断面図を示す。プランジャ250の下側シール256が通路216の壁に接触し、穿孔端259が破断可能なシール260a及び260bに穿孔していることにより、液体試料の部分242、細胞濃縮剤230、及び放出要素262が第2の貯留部224内に移され、そこで任意の検出試薬265(図2Aに示される)が存在する場合に部分242が検出試薬265と相互作用することができる。部分242と検出試薬265との間の相互作用の非限定的な例としては、検出試薬の溶解及び/又は懸濁、検出試薬と部分中に存在する生物学的検体との間の結合相互作用、及び/又は酵素反応が挙げられる。
【0166】
図2に示される実施形態では、第2の貯留部224から第1の貯留部220を隔離するための手段には、破断可能なシール260a及び260bが含まれる。第2の貯留部224から第1の貯留部220を隔離するための手段には、プランジャ250の下側シール256と通路216との組み合わせが更に含まれることができる。図2に示される実施形態では、第1の貯留部220から第2の貯留部224に細胞濃縮剤230を移動させるための手段には、プランジャ250の穿孔端259及び下側シール256と、通路216とが含まれる。
【0167】
図3Aは、本開示に基づく検出装置300の一実施形態の正面図を示す。装置300は、ハウジング310及び必要に応じて用いられるキャップ378を含む。ハウジング310は、上記に述べたように上側部分312、通路316、及び下側部分314を有するように構成することができる。必要に応じて用いられるキャップ378は、上記に述べたように構成することができる。装置300は、図3Aの第1の位置に示される弁アクチュエータ372を有する行き止まり弁370を更に含む。図3Bは、図3Aの装置300及び弁アクチュエータ372の側面図である。
【0168】
図3Cは、図3Aに示される装置300の断面図を示す。装置300は、キャップ378及びハウジング310を含む。ハウジング310は、上側部分312及び下側部分314を含む。上側部分312は、内部に行き止まり弁370が配置された通路316を含む。行き止まり弁370は、弁がこの第1の位置にある場合に第1の貯留部320と流体連通する弁キャビティ374を含む。弁キャビティ374は、第1の貯留部320内の液体試料340と接触する、任意の細胞濃縮剤330を含む。第2の貯留部324は、ともに本明細書に記載されているような、任意の放出要素362及び/又は任意の検出試薬365を収容する。また、図3Cには、本明細書で述べるような、必要に応じて用いられるテーパ領域318が示されている。
【0169】
図3Dは、弁370が第2の位置にある図3Cの装置300の断面図を示す。弁370が第2の位置にある場合、液体試料の、細胞濃縮剤330を含む部分342は隔離されて第2の貯留部324に移され、そこで部分342は、本明細書で述べるような放出要素362が存在する場合にはヒドロゲル362と接触し、検出試薬365が存在する場合には検出試薬365と相互作用することができる。
【0170】
弁キャビティ374の寸法が既知の所定の量を与え、そのため弁370を1回以上使用して所定量の液体試料340を第1の貯留部320から第2の貯留部324に移動させることが可能であることが認識される。更に、液体試料の部分342が第1の貯留部320から第2の貯留部324に移された後、第1の貯留部320内の液体試料340の残部を捨てることができ、異なる物質(例えば、希釈剤、緩衝剤、液体及び/又は粉末試薬)を第1の貯留部320内に入れることができ、その後弁370を使用して所定量を第2の貯留部324に移すことが可能であることが認識される(図示せず)。
【0171】
図3に示される実施形態では、ハウジングの第1の貯留部320と第2の貯留部324とを隔離するための手段は、弁370を含む。図3に示される実施形態では、第1の貯留部320から第2の貯留部324に細胞濃縮剤330を移動するための手段には、通路316及び弁370を含む。
【0172】
図4Aは、いずれも本開示に基づく検出装置400の構成要素である、プランジャ450の側面図及びハウジング410の断面図を示す。プランジャは、シャフト451、必要に応じて用いられるOリング455、及び穿孔端459を含む。Oリングは、ハウジング410との液密なシールを与えるように柔軟性のある材料(例えば、ブチルゴム)で形成することができる。ハウジング410は、上記に述べたように上側部分412及び下側部分414を有するように構成することができる。必要に応じて用いられるキャップ478は、上記に述べたように構成することができる。破断可能なシール460は、ハウジング410を、3つの貯留部、即ち第1の貯留部420、第2の貯留部424、及び第1の貯留部420と第2の貯留部424との間に配置される第3の貯留部426に分割する。この図では、破断可能なシール460は、第1の貯留部420の第2の貯留部424に近い方の端部に位置決めされている。破断可能なシール460間の空間によって第3の貯留部426が画定されている。第3の貯留部426内に位置決めされているのは、細胞抽出剤を含む放出要素462である。代替構成(図示せず)は、第2の貯留部424の近くに破断可能なシール460を1個だけ有し、図3Cに示されるように放出要素462が第2の貯留部424内に位置決めされてよい。
【0173】
第1の貯留部420内の破断可能なシール460の近くに位置決めされているのは、閉位置で示されている弁ゲート482を有するドレーン弁480である。同様に第1の貯留部420内内に位置決めされているのは、液体試料440及び任意の細胞濃縮剤430である。任意の検出試薬465が第2の貯留部424内に示されている。
【0174】
図4Bは、図4Aのハウジング410及びプランジャ450を含む組み立てられた状態の検出装置400の断面図を示す。細胞濃縮剤430は、第1の貯留部420の底に沈殿している。ドレーン弁480の弁ゲート482は開位置にあり、矢印によって示される方向に力が作用する(例えば、指又は手からの圧力によって)と、清澄化した液体試料445がドレーン弁480から排出される。また、図4Bに示されているのは、第2の貯留部424の壁にコーティングされた検出試薬465である。
【0175】
図4Cは、図4Bの検出装置400の断面図を示す。この図では、プランジャ450のOリング455及び穿孔端459が、ドレーン弁480の、最も近くの破断可能なシール460に近い方の側でハウジング410内に挿入されている。この位置では、プランジャ450によって、液体試料の細胞濃縮剤430を含む部分442がプランジャ450と最も近くの破断可能なシール460との間に閉じ込められる。
【0176】
図4Dは、図4Cの検出装置400の断面図を示す。この図では、プランジャ450の穿孔端459が破断可能なシール460の両方を穿孔しており、液体試料の部分442が第2の貯留部424へと移動しており、第2の貯留部424において部分442が検出試薬(図4Cに示される)を溶解し、細胞抽出剤を含む放出要素462と接触している。
【0177】
図5Aは、いずれも検出装置500の構成要素であるプランジャ550及びハウジング510の断面図を示す。プランジャ550は、必要に応じて用いられるハンドル552及び先端部590を備えるシャフト551を含む。任意の実施形態において、ハンドル552は、任意のOリング555を更に含んでよい。
【0178】
ハウジング510は、上記に述べたように上側部分512及び下側部分514を有するように構成することができる。破断可能なシール560a及び560bは、ハウジング510を、3つの貯留部、即ち第1の貯留部520、第2の貯留部524、及び第1の貯留部520と第2の貯留部524との間に配置される第3の貯留部526に分割している。この図では、破断可能なシール560a及び560bは、第1の貯留部520の第2の貯留部524に近い方の端部に位置決めされている。破断可能なシール560aと560bとの間の空間によって、第3の貯留部526が画定される。第3の貯留部526内に位置決めされているのは、本明細書で述べるような細胞抽出剤を含む放出要素562である。図に示される実施形態では、第2の貯留部524は、任意の検出試薬565を含む。代替構成(図示せず)は、第2の貯留部の近くに破断可能なシールを1個だけ有し、図3Cに示されるように放出要素が第2の貯留部内に位置決めされてよい。
【0179】
ハンドル552は、例えば、プラスチック、木材、金属、及びこれらの組み合わせなどのそれぞれの種の材料から、当該技術分野では周知のプロセスを用いて作製することができる。必要に応じて用いられるOリング555は、ハンドル552の切り欠き554内に配置されている。ハンドル552は、プランジャ550がハウジング510に完全に挿入される際に、ハンドル552の少なくとも一部がハウジング510に挿入されうるような形状及び寸法とすることができる。一実施形態では、ハンドル552は、ハウジング510の開口部と係合して、ハンドル552がハウジング510に完全に挿入されることを防止するリム554を更に含む。
【0180】
プランジャ550のシャフト551は、例えば、プラスチック、木材、金属、及びこれらの組み合わせなどのそれぞれの種の材料で形成することができる。シャフト551の一端は、例えば、凹部(図5に示される)に圧入することにより、超音波溶接により、又は接着剤を使用することによりハンドル552に対して結合される。シャフト551の他端は、例えば、圧入により、超音波溶接により、又は接着剤を使用することにより先端部590に対して結合される。
【0181】
プランジャ550の先端部590の細部が図6A及び6Bに示されている。
【0182】
図6Aは、部分的に断面にて示された図5Aの先端部590の部分分解側面図を示す。先端部690は、本体691、一方向弁697、及びフィルタ696を含む。
【0183】
本体691は、第1の端部691a、第2の端部691b、及び第1の端部691aから第2の端部691bへと本体691を通じて延びる導管692を含む。第1の端部691aにおいて、導管692は、プランジャのシャフト651によってシールされる。第2の端部691bにおいて、導管692は陥凹した開口部694内に開口する。2本のドレーン通路695が、本体691の第1の端部691aから導管692へと延びる。したがって、それぞれのドレーン通路は、導管692及び陥凹開口部694に流体接続される。更に、陥凹開口部694、導管692、及びプランジャの先端部690を通過する流体経路のためのドレーン通路695に接続される。このように、この実施形態では、プランジャは流体経路を含む。
【0184】
一実施形態(図示せず)では、先端部690は、1本のみのドレーン通路695を含んでよい。複数のドレーン通路695は、背圧を低くでき、先端部690を通じた流体の輸送速度が大きくなり、有利である。
【0185】
本体691は、例えば、型成形することなどによりプラスチック(例えば、ポリプロピレン、ポリエチレン、ポリテトラフルオロエチレンなど)から作製することができる。本体691は、ハウジング(例えば、図5Aのハウジング510)内に嵌合するような形状及び寸法に構成される。任意の実施形態において、本体691又はOリング686は、本体691がハウジングに挿入される際に、ハウジングの壁と実質的に液密なシールを形成できる。Oリング686を含む任意の実施形態では、Oリング686は液密なシールを形成することと、Oリング686がハウジングの壁に対して動かされる際に、ハウジングの壁から粒子状物質(例えば、細胞濃縮剤)を拭い取ることとの両方の機能を有してよい。シャフト651は、当該技術分野では周知の手段によって(例えば、接着剤、圧入などにより)導管692と連結することができる。必要に応じて用いられるOリング686は、本体691の切り欠き689内に配置される。
【0186】
先端部690は、フィルタ696を更に含む。フィルタ696は、本体691に対して結合されている。図に示される実施形態では、フィルタ696は、陥凹開口部694に圧入及び/又は接着剤により結合することが可能な多孔質材料で形成される。いくつかの実施形態では、多孔質材料は、半剛性の多孔質材料(例えば、Porex Corporation(Fairburn,GA)により部品番号X6854として販売されるPOREX濾過媒質)であってよい。フィルタ696は、比較的角張った、あるいは尖った端部を有するように構成することにより、端部が破断可能なシールを容易に貫通することができる。代替的な実施形態(図示せず)では、フィルタは、本体に対して結合された膜フィルタからなるものでよい。膜フィルタは、本体と結合すると、導管及びドレーン通路を含む流体経路の一部を形成する。
【0187】
いくつかの実施形態では、フィルタ696の多孔度は、フィルタ696が比較的大きな粒子(例えば、>1μm、>5μm、又は>10μm)の通過のみを防止するように選択することができる。比較的大きな粒子には、例えば、本明細書で述べるような細胞濃縮剤が含まれる。これらの実施形態では、細菌、酵母、及び/又は真菌類(カビ)の糸状体などの微生物は、フィルタ696を通過することができる。
【0188】
いくつかの実施形態では、フィルタ696の多孔度は、フィルタ696が比較的小さな粒子(例えば、<1μm、<0.45μm、又は<0.2μm)の通過のみを防止するように選択することができる。これらの実施形態では、細菌、酵母、及び/又は真菌類(カビ)の糸状体などの微生物はフィルタ696によって保持され得る。
【0189】
先端部690は、陥凹開口部694内においてフィルタ696と導管692との間に配置される一方向弁697を更に含む。必要に応じて用いられる、一方向弁697を定位置に保持する機能を有する保持ワッシャ698も更に示されている。一方向弁697は、プラスチック(例えば、ポリプロピレン、ポリエチレン、ポリエステルなど)又はゴムで形成することができ、例えば、ダックビル弁として構成することができる。使用時には、一方向弁697は、フィルタ696を通過した液体の流れがフィルタ696を通じて逆方向に戻ることを実質的に防止する。
【0190】
図6Bは、組み立てられた状態の図6Aの先端部690の、部分的に断面にて示された側面図を示す。一方向弁697、必要に応じて用いられる保持ワッシャ698、及びフィルタ696が陥凹した開口部内に配置され、導管692及びドレーン通路695と流体接続している。シャフト651は、先端部690の本体691に対して結合されている。
【0191】
図5Aを再び参照すると、ハウジング510及びプランジャ550を含む検出装置500は、微生物、特に生きた微生物を検出するための方法において使用される。
【0192】
使用時には、液体試料は、ハウジング510の第1の貯留部520内に移され、そこで細胞濃縮剤530と接触させられる。液体試料540がハウジング510に加えられた後、プランジャ550の先端部がハウジング510に挿入され、図5Bに示されるようにハウジング510の第2の貯留部524の方向に付勢される(例えば、手動により、又は機械的に)。プランジャ550の先端部591が液体試料540と接触すると、図5Bに示されるように液体は先端部590を通過してハウジング510内に戻る。このプロセスでは、細胞濃縮剤530、及びいくつかの実施形態では遊離微生物が、液体試料の第3の貯留部526に近い部分542内に保持される。
【0193】
プランジャ550の先端部590が図示されていない破断可能なシール560aを貫通すると、液体試料の細胞濃縮剤530を含む部分542が放出要素562と接触する。プランジャ550が更に動く(図5Dに示されるように)と、破断可能なシール560bを貫通し、これにより液体試料の部分542及び放出要素562が第2の貯留部524に移動し、そこで検出試薬565と接触する。
【0194】
図7Aは、本開示に基づく検出装置700の別の実施形態の側断面図を示す。検出装置700は、プランジャ750及びハウジング610を含む。
【0195】
ハウジング710は、上記に述べたようにして上側部分712及び下側部分714を有するように構成することができる。破断可能なシール760a及び760bは、ハウジング710を、3つの貯留部、即ち第1の貯留部720、第2の貯留部724、及び第1の貯留部720と第2の貯留部724との間に配置される第3の貯留部726に分割する。この図では、破断可能なシール760a及び760bは、第1の貯留部720の第2の貯留部724に近い方の端部に位置決めされている。破断可能なシール760aと760bとの間の空間によって第3の貯留部726が画定されている。第3の貯留部726内に位置決めされているのは、細胞抽出剤を含む放出要素762である。図に示される実施形態では、第2の貯留部724は、任意の検出試薬765を含む。代替構成(図示せず)は、第2の貯留部724の近くに破断可能なシール760を1個だけ有し、図3Cに示されるように放出要素762が第2の貯留部724内に位置決めされてよい。
【0196】
プランジャ750は、ハンドル752及び先端部790に連結されたシャフト751を含む。この実施形態では、シャフト751は、中空であり、ハンドルは、シャフト751の内部と外部との間で圧力を等しくするための通気口748を含む。プランジャは、必要に応じて用いられるドレーン管753を更に含む。ドレーン管753は先端部790から液体濾液を受けて、この濾液をシャフト751の内部に分配する。ドレーン管753はまた、オーバーフロー弁として機能することによって逆方向に先端部790を通じて逆流する濾液の量を低減させる。
【0197】
プランジャ750の先端部790の細部が図8に示されている。
【0198】
図8Aは、部分的に断面にて示された図7Aの先端部790の部分分解側面図を示す。先端部890は、本体891、必要に応じて用いられる一方向弁897、及びフィルタ896を含む。また、図8Aには、プランジャ850の、中空シャフト851及びドレーン管853を含む部分も示されている。
【0199】
本体891は、第1の端部891a、第2の端部891b、及び第1の端部891aから第2の端部891bへと本体891を通じて延びる導管892を含む。第1の端部891aにおいて、導管892は、プランジャのドレーン管853と連結されている(例えば、圧入、及び接着剤、又はネジによる連結により)。第2の端部891bにおいて、導管892は、陥凹した開口部894内に開口している。したがって、陥凹開口部894は、導管892及びドレーン管853と流体連結される。
【0200】
本体891は、例えば、型成形することなどによりプラスチック(例えば、ポリプロピレン、ポリエチレン、ポリテトラフルオロエチレンなど)から作製することができる。本体891は、ハウジング(例えば、図7Aのハウジング710)内に嵌合するような形状及び寸法に構成される。任意の実施形態において、本体891又はOリング886は、本体891がハウジングに挿入される際に、ハウジングの壁と実質的に液密なシールを形成することができる。Oリング886を含む任意の実施形態では、Oリング886は、液密なシールを形成することと、Oリング886がハウジングの壁に対して動かされる際に、ハウジングの壁から粒子状物質(例えば、細胞濃縮剤)を拭い取ることとの両方の機能を有してよい。シャフト851は、当該技術分野では周知の手段によって(例えば、接着剤、圧入などにより)導管892と連結することができる。必要に応じて用いられるOリング886は、本体891の切り欠き889内に配置される。
【0201】
先端部890は、フィルタ896を更に含む。フィルタ896は、陥凹開口部894において本体891に対して結合されている。図に示される実施形態では、フィルタ896は、陥凹開口部894に圧入及び/又は接着剤により結合することが可能な多孔質材料で形成されている。いくつかの実施形態では、多孔質材料は、半剛性の多孔質材料(例えば、Porex Corporation(Fairburn,GA)により部品番号X6854として販売されるPOREX濾過媒質)であってよい。フィルタ896は、比較的角張った、あるいは尖った端部を有するように構成することにより、端部が破断可能なシールを容易に貫通することができる。代替的な実施形態(図示せず)では、フィルタは、本体に対して結合された膜フィルタからなるものでよい。膜フィルタは、本体と結合すると、導管及びドレーン通路を含む流体経路の一部を形成する。
【0202】
いくつかの実施形態では、フィルタ896の多孔度は、フィルタ896が比較的大きな粒子(例えば>、1μm、>5μm、又は>10μm)の通過のみを防止するように選択することができる。比較的大きな粒子には、例えば、本明細書で述べるような細胞濃縮剤が含まれる。これらの実施形態では、細菌、酵母、及び/又は真菌類(カビ)の糸状体などの微生物はフィルタ896を通過することができる。
【0203】
いくつかの実施形態では、フィルタ896の多孔度は、フィルタ896が比較的小さな粒子(例えば、<1μm、<0.45μm、又は<0.2μm)の通過のみを防止するように選択することができる。これらの実施形態では、細菌、酵母、及び/又は真菌類(カビ)の糸状体などの微生物はフィルタ896によって保持され得る。
【0204】
先端部890は、陥凹開口部894内においてフィルタ896と導管892との間に配置される、必要に応じて用いられる一方向弁897を更に含んでよい。必要に応じて用いられる一方向弁897を定位置に保持する機能を有する保持ワッシャ898もまた、示されている。一方向弁897は、プラスチック(例えば、ポリプロピレン、ポリエチレン、ポリエステルなど)又はゴムで形成することができ、例えば、ダックビル弁として構成することができる。使用時には、一方向弁897は、フィルタ896を通過した液体の流れがフィルタ896を通じて逆方向に戻ることを実質的に防止する。
【0205】
図8Bは、組み立てられた状態の図7Aの先端部790の、部分的に断面にて示された側面図を示す。一方向弁897、必要に応じて用いられる保持ワッシャ898、及びフィルタ896が陥凹した開口部内に配置され、導管892及びドレーン管853と流体接続している。シャフト851は、先端部890の本体891に対して結合されている。
【0206】
図7Aを再び参照すると、ハウジング710及びプランジャ750を含む検出装置700は、微生物、特に生きた微生物を検出するための方法において使用される。
【0207】
使用時には、液体試料は、ハウジング710の第1の貯留部720内に移され、そこで細胞濃縮剤730と接触させられる。液体試料740がハウジング710に加えられた後、プランジャ750の先端部790がハウジング710に挿入され、図7Bに示されるようにハウジング710の第2の貯留部724の方向に付勢される(例えば、手動により、又は機械的に)。プランジャ750の先端部791が液体試料740と接触すると、図7Bに示されるように液体は、先端部790を通過して、ドレーン管753を通過して、プランジャ750の中空シャフト内に通る。このプロセスでは、細胞濃縮剤730、及びいくつかの実施形態では、遊離微生物が、液体試料の第3の貯留部726に近い部分742内に保持される。
【0208】
プランジャ750の先端部790が図示されていない破断可能なシール760aを貫通すると、液体試料の細胞濃縮剤730を含む部分742が放出要素762と接触する。プランジャ750が更に動く(図7Dに示されるように)と、破断可能なシール760bを貫通し、これにより液体試料の部分742及び放出要素762が第2の貯留部724に移動し、そこで検出試薬765と接触する。
【0209】
本開示の装置は、ハウジング内に破断可能なシールを含む。破断可能なシールが穿孔されることによって、装置の1つの区画から別の区画へと細胞濃縮剤が輸送される。いくつかの実施形態では、このプロセスで移動させられる細胞濃縮剤の量を、破断可能なシールの比較的面積に細胞濃縮剤を集めることによって大きくすることができる。図9は、細胞濃縮剤の回収率を高めるための回収要素967の一実施形態を示す。回収要素967は、本開示に基づく検出装置のハウジング内に嵌合するような寸法に構成されている。回収要素967は、細胞濃縮剤(図示せず)を含む試料の方向に向けられる、面取りされた縁部968を含む。通常、面取りされた縁部968は、重力によって沈降する粒子を回収するように上側を向いている。また、面取りされた縁部968を、例えば、遠心力又は流体力の方向に向けることによって、重力以外の力が作用する粒子を回収することもできる。回収要素967は、必要に応じて用いられる破断可能なシール969を更に含む。
【0210】
回収要素967は、例えば、ポリマー(例えば、ポリエステル、ポリプロピレン、ポリテトラフルオロエチレン、ポリプロピレン、ポリスチレン、ナイロン、並びにこれらの組み合わせ及び誘導体)、ガラス、及び金属などのそれぞれの種の材料で形成することができる。回収要素967は、その表面に対する粒子の接着を阻止するための潤滑性コーティングを更に含んでよい。面取りされた縁部968は、その斜面に沿った粒子の運動を促進するために角度(例えば、45°の角度、>45°よりも大きな角度)が付けられていてもよい。破断可能なシール969は本明細書に述べられるように作製し、本明細書に述べられるような手段によって回収要素967に結合することができる。
【0211】
図10Aは、回収要素1067を含む検出装置1000の一実施形態を示す。装置1000は、ハウジング1010及びプランジャ1050を含む。ハウジング1010は、上側部分1012及び下側部分1014を含む。上側部分1012の内部かつ下側部分1014の近くに、破断可能なシール1069が結合された回収要素1067が配置されている。破断可能なシール1069は、回収要素1067の下側部分1014に面した側面に結合されている。したがって、破断可能なシール1069は、ハウジング1010を、第1の貯留部1020及び第2の貯留部1024の2個の隔離された貯留部に分割する。
【0212】
プランジャ1050は、ハンドル1052、シャフト1051、及び先端部1090を含む。ハンドル1052は、上記に述べたように形成することができ、プランジャ1050がハンドル1010内に過度に深く挿入されることを防止するための、ハウジング1010と係合する、必要に応じて用いられるリム1054を含むことができる。ハンドル1052は、ネジ嵌め又は他の連結手段(例えば、圧入、接着剤)によってシャフト1051に対して連結することができる。先端部1090は、本明細書で述べる他の先端部の実施形態について述べられるプロセス及び材料を用いて作製することができる。先端部1090は、1つ以上のガイド1083を含んでよい。それぞれのガイドは、ハウジング1010の内部にゆるく嵌まるような寸法に構成され、先端部1090がハウジング1010を通じて長手方向に動く際に、先端部1090の横方向の運動を低減させる機能を有する。
【0213】
先端部1090は、先端部1090上の固定位置に保持されたスクレーパー1086を更に含む。図の実施形態では、スクレーパー1086は、保持部材1087によって固定位置に保持される。保持部材1087は、先端部1090の一部として成形又は機械加工するか、あるいは先端部1090に結合されたブラケット又は複数のブラケットからなるものでよい。また、スクレーパー1086を先端部1090に直接結合する(例えば、接着剤により結合する)こともできる。
【0214】
スクレーパー1086は、ディスク形状をしており、ハウジング1010の内部に比較的緊密な嵌合を形成するような寸法である。いくつかの実施形態では、スクレーパーは、Oリングを含むことができる。スクレーパー1086は、水性の液体に浸漬される際に、その形状をほぼ維持する必要がある。スクレーパーは、ハウジングの内部に比較的緊密な嵌合を形成するような寸法でなければならないが、スクレーパーは、プランジャがハウジング1010内の液体試料を通じて押されるにしたがって液体がその縁部を回り込んで流れることができるように比較的可撓性のものでなければならない。スクレーパー1086を作製するのに適した材料としては、例えば、ポリウレタンゴムが挙げられる。
【0215】
使用時には、図10Bに示すように、液体試料1040と細胞濃縮剤1030は、装置のハウジング1010内で接触させられる。プランジャ1050がハウジング1010内に挿入され、プランジャ1050の先端部1090がハウジング1010の底の方向に押される。先端部1090が液体試料1040を通過するにしたがって、スクレーパー1086によって細胞濃縮剤1030がハウジング1010の底の方向に押されるのと同時に、液体試料1040がスクレーパー1086の縁部を回り込んで流れる。有利な点として、この装置によって使用者は、細胞濃縮剤1030が重力によってハウジング1010の底へと沈降させられる場合に、可能であるよりも大幅に短い時間で細胞濃縮剤1030を回収かつ濃縮することができる。更に、可撓性のスクレーパーによって、スクレーパーがなければハウジングの壁に接着し得る細胞濃縮剤1030の部分の回収が容易となる。したがって、本発明の装置1000は、細胞濃縮剤の回収率を高め、これにより微生物を濃縮するために細胞濃縮剤を使用する方法の感度を高める。
【0216】
細胞濃縮剤が強磁性材料(例えば、粒子)を含む試料調製及び検出装置では、磁石又は電磁石を装置の近傍に配置することによって粒子(及び粒子に結合した微生物)を、粒子を回収し、かつ/又は粒子を別の貯留部に移すための所望の位置に引き寄せることができる点は認識されるはずである。いくつかの実施形態では、細胞濃縮剤が液体試料中の微生物のほぼすべてを結合するだけの充分な時間の後に、磁石を装置の近傍(例えば、装置の底の近傍)に配置することができる。
【0217】
生きた細胞からの生物学的検体の検出方法:
本開示の方法は、有効量の細胞抽出剤への曝露後に、例えば、生きた微生物などの、生きた細胞から放出される生物学的検体を検出するための方法を含む。
【0218】
本開示の方法は、試料と細胞抽出剤を含む放出要素とを含む液体混合物を形成することを含む。本開示の方法は、生物学的検体を検出する工程を更に含む。生物学的検体を検出する工程は、試料中の生物学的検体の量を定量することを更に含むことができる。
【0219】
一態様では、本開示は、試料中の細胞を検出する方法を提供する。本方法は、細胞濃縮剤、細胞抽出剤を含む放出要素、及び液体試料を提供することを含む。好適な細胞濃縮剤が、参照によりその全体が本明細書に組み込まれる、米国特許出願公開第2010/0190171号、発明の名称「MICROORGANISM CONCENTRATION PROCESS」に記載されている。
【0220】
本方法は、液体試料を細胞濃縮剤と所定の時間にわたって接触させる工程を更に含む。細胞濃縮剤は、粒子、繊維、粒子を含むマトリクス(例えば、繊維状マトリクス)、又は上記の2つ以上のものの任意の組み合わせを含むことができる。細胞濃縮剤は、接触時間の間に液体試料に懸濁することができる。懸濁液は試験管、試験管、フラスコ、ビーカー又は本明細書で述べる検出装置のいずれかのような容器に入れることができる。特定の好ましい実施形態では、液体試料は、例えば、懸濁液を攪拌、ボルテックス、又は振動することによって、所定の時間にわたって細胞濃縮剤と混合される。細胞濃縮剤が液体試料と接触させられている間に、液体試料からの細胞が細胞濃縮剤と結合する。
【0221】
本方法は、液体試料の少なくとも一部から細胞濃縮剤を分離する工程を更に含む。このプロセスにおいて、細胞濃縮剤を最初の液体試料よりも小さな体積に濃縮することができる。細胞濃縮剤は、様々な手段によって液体試料の少なくとも一部から単離することができる。例えば、細胞濃縮剤が液体試料よりも大きな比重を有する場合、細胞濃縮剤は懸濁液の底に沈降し得る。液体試料の少なくとも一部を除去する(例えば、ピペッティング又はデカンテーションにより)ことができる。これに代えるか、又はこれに加えて、液体試料の少なくとも一部を遠心分離又は濾過によって除去することもできる。
【0222】
フィルタはその孔径によって(例えば、その泡立ち点の孔径によって)定義することができる。フィルタの泡立ち点の孔径は、一般的にフィルタの孔の最大径の平均である。いくつかの実施形態では、フィルタは、細胞濃縮剤の平均径よりも小さい平均孔径を有することができる。これらの比較的大きな孔径を有するフィルタを利用することができるために、本明細書で開示される方法は、水試料などの試料から微生物を分離するための他の方法と比較した場合に大きな利点を有する。
【0223】
一実施形態では、フィルタは、少なくとも約1マイクロメートル(μm)以上の平均孔径を有することができる。一実施形態では、フィルタは、少なくとも約1.5μm以上の平均孔径を有することができる。一実施形態では、フィルタは、少なくとも約5μm以上の平均孔径を有することができる。一実施形態では、フィルタは、少なくとも約10μm以上の平均孔径を有することができる。より大きな孔径のフィルタを利用すると、孔径が大きくなるにつれて背圧が低くなるために、試料はより容易かつ迅速に濾過される。
【0224】
試料の濾過は、公知の方法によって行うことができる。一実施形態では、選択される濾過方法は、その方法の特定の用途の少なくとも一部によって決定され得る。例えば、試料は、重力によって陽圧を作用させることにより、負の真空を用いて濾過することができる。試料を濾過するために使用される特定の方法は、本方法を実行するために利用される装置の種類の少なくとも一部によって決定され得る。例えば、負の真空を利用するためには、装置を真空源に取り付ける、あるいは逆向きに取り付けることができるポートを有するように構成することが可能であり、陽圧を作用させるためには、使用者が手で力を加えることによって陽圧を作用させることができるように装置を構成することが可能である。一実施形態では、試料は、陽圧を作用させることによって濾過することができる。陽圧を利用した(又は重力を利用した)濾過によれば、真空ポンプなどの更なる機器を一切使用することなく、現場で本方法を容易に行うことができるという利点が与えられる。
【0225】
いくつかの実施形態では、遠心分離工程において、細胞濃縮剤は液体から分離する(例えば、沈降によって)が、細胞濃縮剤に結合しない微生物(例えば、細菌、酵母カビ、胞子)は、液体中に浮遊したままとなるような比較的低速の遠心分離を使用することができる。
【0226】
必要に応じて、細胞濃縮剤を洗浄液(例えば、水又は緩衝溶液)に再懸濁し、洗浄液の少なくとも一部から細胞濃縮剤を単離することができる。洗浄工程が増殖及び/又は検出プロセスを妨害し得る夾雑物を液体試料から除去する機能を有し得る点は、認識されるであろう。
【0227】
本方法は、分離された細胞濃縮剤と放出要素とを含む液体混合物を形成することを更に含み、この工程において放出要素から細胞抽出剤が放出される。いくつかの実施形態では、細胞濃縮剤が液体試料の少なくとも一部から分離される際に、細胞濃縮剤が液体の残部に残る。必要に応じて更なる液体(例えば、水又は緩衝溶液)を細胞濃縮剤に加えることができる。細胞濃縮剤が液体試料から濾過される実施形態では、細胞濃縮剤を所定の体積の液体(例えば、水又は緩衝溶液)に再懸濁することができる。細胞濃縮剤を含む液体懸濁液を放出要素と接触させることにより、細胞抽出剤を液体混合物中に放出させる。細胞濃縮剤を回収するためにフィルタを使用する方法では、細胞濃縮剤を含む液体懸濁液がフィルタを含むこともできる。混合物中に細胞が存在する場合に、細胞から生物学的検体を放出させるうえで有効量の細胞抽出剤を放出要素から放出させることができる。有効量の細胞抽出剤の放出は、所定の時間にわたって起こりうる(例えば、最大で数秒間、最大で数分間、最大で数時間、又はそれよりも長時間)。
【0228】
本方法は、検体を検出する工程を更に含む。生物学的検体の検出では、検出系を使用することができる。ヌクレオチド(例えば、ATP、NADH、NAD)、ポリヌクレオチド(例えば、DNA又はRNA)又は酵素(例えば、NADHデヒドロゲナーゼ、又はアデニル酸キナーゼ)などの特定の生物学的検体の検出系は当該技術分野では周知のものであり、本開示に従って使用することができる。本開示の方法には、生物学的検体を検出するための公知の検出系が含まれる。この検出系の精度及び感度は、細胞抽出剤によって大きく低減されないことが好ましい。検出系は、均一アッセイを含むことがより好ましい。
【0229】
いくつかの実施形態において、生物学的分析物を検出することは、容器(例えば、試験管、多穴プレート、及び本明細書に記載の検出装置)中の検体を直接検出することを含むことができ、この工程では、試料と細胞抽出剤を含む放出要素とを含む液体混合物が形成される。いくつかの実施形態において、生物学的検体を検出することは、液体混合物の少なくとも一部を、試料と細胞抽出剤を含む放出要素とを含む液体混合物がその中で形成される容器以外の容器に移すことを含むことができる。いくつかの実施形態では、生物学的検体を検出する工程には、例えばpH調整、希釈、濾過、遠心分離、抽出などの1つ以上の試料調製プロセスが含まれてよい。
【0230】
いくつかの実施形態では、検出系は検出試薬を含む。検出試薬としては、例えば、色素、酵素、酵素基質、結合相手(例えば、抗体、モノクローナル抗体、レクチン、受容体など)、標識された結合相手、及び/又は、補因子が挙げられる。いくつかの実施形態において、検出試薬は、PCT国際公開特許WO 2010/039627号、発明の名称「BIODETECTION ARTICLES」に記載されるように、酵素又は酵素基質を含むヒドロゲルといったヒドロゲルを含む。いくつかの実施形態では、検出系は、器具を含む。検出器具の非限定的な例としては、分光光度計、ルミノメーター、プレートリーダー、サーモサイクラー、インキュベーターが挙げられる。
【0231】
検出系は、検出器具を含むことができる。検出器具は、当該技術分野では周知のものであり、比色測定法(即ち、光の吸光度及び/又は散乱により)、蛍光測定法、又は光量測定法によって生物学的検体を検出するために使用することができる。発光による生体分子検出の例は、F.Gorus及び、E.Schram(Applications of bio−and chemiluminescence in the clinical laboratory、1979、Clin.Chem.25:512〜519)に述べられている。
【0232】
生物学的検体の検出系の一例としては、ATP検出系がある。ATP検出系は、酵素(例えば、ルシフェラーゼ)及び酵素基質(例えば、ルシフェリン)を含むことができる。ATP検出系は、ルミノメーターを更に含むことができる。いくつかの実施形態では、ルミノメーターには、例えば、FB−12シングルチューブ型ルミノメーター(Berthold Detection Systems USA,Oak Ridge,TN)のようなベンチトップ型のルミノメーターを含むことができる。いくつかの実施形態において、照度計は、例えば、3M Company(St.Paul,MN)から入手可能な、NG照度計、UNG2又はUNG3などの小型照度計を含むことができる。
【0233】
いくつかの実施形態では、生物学的検体は、単一の時点において検出される。いくつかの実施形態では、生物学的検体は、2つ以上の時点において検出される。2つ以上の時点で生物学的検体が検出される場合、第1の時点(例えば、試料の少なくとも一部の生きた細胞から生物学的検体を放出させるうえで有効量の細胞抽出剤が放出要素から放出される前)において検出された生物学的検体の量を、第2の時点(例えば、試料の少なくとも一部の生きた細胞から生物学的検体を放出させるうえで有効量の細胞抽出剤が放出要素から放出された後)において検出された生物学的検体の量と比較することができる。いくつかの実施形態では、1つ以上の時点における生物学的検体の測定は、処理装置を備えた器具によって行われる。特定の好ましい実施形態では、第1の時点における生物学的検体の量と、第2の時点における生物学的検体の量との比較は処理装置によって行われる。
【0234】
例えば、操作者は、試料と、細胞抽出剤を含む放出要素とを含む液体混合物を形成した後の試料において、生物学的分析物の量を測定する。この第1の測定における生物学的検体の量(T1)は、「遊離した」(即ち、非細胞性)生物学的検体、及び/又は、試料中の非生存細胞からの生物学的検体の存在を示すことができる。いくつかの実施形態において、第1の測定は、試料と細胞抽出剤を含む放出要素とを含む液体混合物が形成された直後(例えば、約1秒後)に行うことができる。いくつかの実施形態において、第一測定は、試料と細胞抽出剤を含む放出要素とを含む液体混合物を形成してから少なくとも約5秒後、少なくとも約10秒後、少なくとも約20秒後、少なくとも約30秒後、少なくとも約40秒後、少なくとも約60秒後、少なくとも約80秒後、少なくとも約100秒後、少なくとも約120秒後、少なくとも約150秒後、少なくとも約180秒後、少なくとも約240秒後、少なくとも約5分後、少なくとも約10分後、少なくとも約20分後に行うことができる。これらの時間は例示的なものであり、生物学的検体の検出が開始されるまでの時間のみを挙げたものである。生物学的検体の検出を開始することには、試料を希釈すること、及び/又は細胞抽出剤の活性を阻害する試薬を添加することが含まれる。特定の検出系(例えば、核酸の増幅又はELISA)は、通常、完了までに数分〜数時間を要する点は認識されるであろう。
【0235】
操作者は、生物学的検体の第1の測定を行った後、細胞抽出剤を含む放出要素に試料を所定の時間にわたって接触させる。試料を一定時間放出要素と接触させた後、生物学的分析物の第2の測定が行われる。いくつかの実施形態では、第2の測定は、生物学的検体の第1の測定後の約0.5秒以内、約1秒以内、約5秒以内、約10秒以内、約20秒以内、約30秒以内、約40秒以内、約60秒以内、約90秒以内、約120秒以内、約180秒以内、約300秒、少なくとも約10分、少なくとも約20分、少なくとも約60分以内、又はそれ以降に行うことができる。これらの時間は例示的なものであり、生物学的検体を検出するための第1の測定が開始されてから生物学的検体を検出するための第2の測定が開始されるまでの時間間隔のみを挙げたものである。生物学的検体の検出を開始することには、試料を希釈すること、及び/又は細胞抽出剤の活性を阻害する試薬を添加することが含まれる。
【0236】
好ましくは、生物学的検体の第1の測定は、試料と細胞抽出剤を含む放出要素とを含む液体混合物が形成された約1秒後〜約240秒後に行われ、第1の測定の後に行われる第2の測定は、液体混合物が形成された約1.5秒後〜約540秒後に行われる。より好ましくは、生物学的検体の第1の測定は、液体混合物が形成されてから約1秒後〜約180秒後に行われ、第1の測定の後に行われる第2の測定は、液体混合物が形成されてから約1.5秒後〜約120秒後に行われる。最も好ましくは、生物学的検体の第1の測定は、液体混合物が形成されてから約1秒後〜約5秒後に行われ、第1の測定の後に行われる第2の測定は、液体混合物が形成されてから約1.5秒後〜約10秒後に行われる。
【0237】
操作者は、第1の測定において検出された生物学的検体の量を、第2の測定において検出された生物学的検体の量と比較する。第2の測定において検出された生物学的検体の量が増加している場合、試料中に1つ以上の生きた細胞が存在することを示す。
【0238】
特定の方法では、生きた体細胞(例えば、非微生物細胞)の存在を検出することが望ましい場合がある。これらの実施形態では、放出要素は、体細胞から生物学的検体を選択的に放出させる細胞抽出剤を含む。体細胞の抽出剤の非限定的な例としては、これらに限定されるものではないが、例えば、エトキシル化オクチルフェノールであるTriton X−100(TX−100)及びその他のエトキシル化アルキルフェノールを含む非イオン性エトキシル化アルキルフェノールなどの非イオン性洗剤;例えば、カルボキシプロピルベタイン(CB−18)、NP−40、TWEEN、タージトール、イゲパール、市販のM−NRS(Celsis,Chicago,IL))、M−PER(Pierce,Rockford,IL)、CelLytic M(Sigma Aldrich)などのベタイン洗剤が挙げられる。細胞抽出剤は、検体及びその検出試薬を不活性化しないように選択されることが好ましい。
【0239】
特定の方法では、生きた微生物細胞の存在を検出することが望ましい場合がある。これらの実施形態において、放出要素は、微生物細胞から生物学的分析物を選択的に放出させる細胞抽出剤を含むことができる。微生物細胞抽出剤の非限定的な例には、塩化ベンザルコニウム、塩化ベンゼトニウム、「セトリミド」(ドデシル−、テトラデシル−、及びヘキサデシル−臭化トリメチルアンモニウムの混合物)、塩化セチルピリジウムなどの四級アンモニウム化合物;トリエチルアミン(TEA)及びトリエタノールアミン(TeolA)などのアミン;クロルヘキシジン、アレキシジン及びポリヘキサメチレンビグアニドなどのビス−ビグアニド;N−(n−ドデシル)−ジエタノールアミンなどのジアルキルアンモニウム塩;ポリミキシンB(例えば、ポリミキシンB1及びポリミキシンB2)、ポリミキシン−β−ノナペプチド(PMBN)などの抗生物質;オクチル−β−D−1−チオグルコピラノシド(本明細書にその全容を援用する米国特許第6,174,704号を参照)などのアルキルグルコシド又はアルキルチオグルコシド;エトキシル化オクチルフェノールであるTriton X−100(TX−100)及びその他のエトキシル化アルキルフェノール類を含むがこれらに限定されない非イオン性エトキシル化アルキルフェノールなどの非イオン性洗剤;カルボキシプロピルベタイン(CB−18)などのベタイン洗剤;並びに、ポリリシン、ナイシン、マガイニン、メリチン、ホスホリパーゼA2、ホスホリパーゼA2活性化ペプチド(PLAP)などのカチオン性、抗細菌性、孔形成性、膜活性、及び/又は細胞壁活性であるポリマー;バクテリオファージ;並びにこれらに類するものが挙げられる。例えば、参照によりその全体が本明細書に組み込まれる、イオン性界面活性化合物を開示するMorbeら、Microbiol.Res.(1997)vol.152,pp.385〜394、及び米国特許第4,303,752号を参照されたい。細胞抽出剤は、生物学的検体、及び/又は生物学的検体を検出するために使用される検出試薬を不活性化しないように選択されることが好ましい。
【0240】
試料中の生きた微生物細胞の存在を検出するための特定の代替的方法では、試料を所定の時間にわたって体細胞抽出剤で前処理することができる(例えば、試料と、微生物細胞抽出剤を含む放出要素とを含む液体混合物を形成する前に、体細胞を抽出するうえで充分な時間にわたって試料を体細胞抽出剤と接触させる)。この代替的な実施形態では、第1の測定において検出される生物学的検体の量には、体細胞から放出されたすべての生物学的検体が含まれ、第2の測定で検出される更なる生物学的検体(検出される場合)の量には、試料中の生きた微生物細胞からの生物学的検体が含まれることになる。
【0241】
試料中の微生物の存在を検出するための方法では、本明細書で開示される検出装置を使用することができる。特定の実施形態では、本方法は、i)試料、ii)第1及び第2の貯留部を備えたハウジングと試料を受容するように構成された開口部とを備える検出物品、iii)細胞濃縮剤、及び、iv)細胞濃縮剤を隔離して、ハウジングの第1の(例えば、上側)貯留部から第2の(例えば、下側)貯留部へと移動させるための手段、及び、v)細胞抽出剤を含む放出要素を提供することを含む。これらの実施形態では、検出装置は、図1〜4に示される検出装置100、200、300、又は400のいずれか1つのものを含むことができる。任意に、検出装置は、細胞濃縮剤及び/又は放出要素を含むことができる。
【0242】
本方法は、ハウジングの第1の貯留部内に試料を移動させることを更に含み、この工程では液体媒質中で試料物質を細胞濃縮剤と接触させる。試料は、ハウジングの第1の貯留部に移動させられる液体、固体、半固体、又はこれらの組み合わせを含むことができる。試料が液体媒質を含んでいない場合には、液体媒質(例えば、水又は緩衝溶液)を第1の貯留部に加えることができる。細胞濃縮剤を液体試料に加える。細胞濃縮剤を、所定の時間にわたって液体試料と接触させる。必要に応じて、ハウジングを例えば振盪、攪拌、ボルテックス、及び/又は振動することによって、接触時間の間に混合物を混合することができる。試料及び/又は細胞濃縮剤の損失を防止するために、ハウジングは接触時間の間、閉鎖される(例えば、必要に応じて用いられるキャップによって)ことが好ましい。
【0243】
方法は、液体媒質の少なくとも一部から細胞濃縮剤を隔離することを更に含み、細胞濃縮剤を隔離する工程は、細胞濃縮剤をハウジングの第2の貯留部に移動させることを含む。本明細書で述べるように、細胞濃縮剤を隔離するためのそれぞれの種の手段がある。細胞濃縮剤を隔離及び移動するための手段の非限定的な例には、プランジャを用いて通路を通じて細胞濃縮剤を分割及び移動すること(図1及び2を参照)、一方向弁のキャビティ内に細胞濃縮剤を回収及び移動すること(図3を参照)、並びに、ドレーン弁及びプランジャを用いて細胞濃縮剤を濃縮及び移動すること(図4を参照)が含まれる。
【0244】
本方法は、分離された細胞濃縮剤と放出要素とを含む液体混合物を形成することを更に含み、細胞抽出剤は、混合物中に放出される。細胞濃縮剤を含む液体混合物は、細胞抽出剤を含む放出要素と接触させられる。放出要素(例えば、ヒドロゲルビーズ)は、ハウジングの第1の貯留部及び/又は第2の貯留部内の液体混合物と接触させられることができる。いくつかの実施形態では、ハウジングの第2の貯留部は放出要素を含み(図1及び図3参照)、混合物が第2の貯留部の中に移動したときに、液体混合物は放出要素と接触させられる。いくつかの実施形態において、放出要素は第3の貯留部内に配置され(図2及び図4を参照)、液体試料が第1の貯留部から第2の貯留部に移される際に、第3の貯留部を液体試料が通過する(これにより液体試料が放出要素と接触する)。
【0245】
図2及び図4では、破断可能なシールに穿孔して細胞濃縮剤を第2の貯留部に移動させるためのプランジャの使用が示されているが、プランジャの代わりに代替的な器具(例えば、スワブ、ピペット、フィルタなど)を使用することも可能であることが認識される。このような代替的な器具が使用される方法では、破断可能なシールが代替的器具によって穿孔される際に液体試料の全体が第2の貯留部に移されないように、液体試料の少なくとも一部を除去する(例えば、デカンテーション、ピペッティング、濾過により又はドレーン弁が設けられている場合にはドレーン弁を開放することにより)ことが好ましい。
【0246】
本方法は、生物学的検体を検出する工程を更に含む。生物学的検体は、放出要素から有効量の細胞抽出剤が細胞濃縮剤を含む液体混合物中に放出される前に、検出装置の第2の貯留部内で、本明細書で記載されるように、検出することができる。生物学的検体は、放出要素から有効量の細胞抽出剤が細胞濃縮剤を含む液体混合物中に放出された後で、検出装置の第2の貯留部内で、本明細書で記載されるように、検出することができる。生物学的検体は、放出要素から有効量の細胞抽出剤が細胞濃縮剤を含む液体混合物中に放出される前及び後で、検出装置の第2の貯留部内で、本明細書で記載されるように、検出することができる。
【0247】
本明細書で開示される方法のいずれも、生物学的な増殖工程を更に含むことができることは予想されることである。増殖工程は、微生物の増殖を支持する栄養培地を与えることによって促進される。栄養培地は、細胞濃縮剤による微生物の濃縮の前、その間、又はその後に試料と混合することができる。いくつかの実施形態では、生物学的増殖工程は、細胞濃縮剤によって微生物が濃縮された後であるが、生物学的検体が検出される前に行われる。いくつかの実施形態では、栄養培地は、試料中に存在し得る他の微生物よりも特定の種類の微生物の増殖にとって有利な栄養素及び/又は選択物質(例えば、塩、抗生物質)を含有してよい。
【0248】
粒子状細胞濃縮剤を濃縮する方法:
本開示は、粒子状の細胞濃縮剤を濃縮するための装置を提供する。本方法は、液体試料の一部を液体試料中への粒子状物質の懸濁液から分離する装置を提供する工程を含む。好適な装置としては、例えば、図2A、図3A、図4A、図5A、図7A、及び図10Aに図示及び説明される装置が挙げられる。それぞれの装置は、粒子状の細胞濃縮剤を含む液体試料を収容するためのハウジングと粒子状細胞濃縮剤を液体試料の少なくとも一部から分離するための手段とを含む。
【0249】
図2Aでは、粒子状細胞濃縮剤を分離するための手段は、テーパ領域218、及び下側シール256を含むプランジャを含む。図3Aでは、粒子状細胞濃縮剤を分離するための手段は、行き止まり弁370及び弁アクチュエータ372を含む。図4Aでは、粒子状細胞濃縮剤を分離するための手段は、ドレーン弁480及び弁ゲート482を含む。図5A及び7Aでは、粒子状細胞濃縮剤を分離するための手段は、フィルタ596が内部に配置された流体経路を含むプランジャを含む。図10Aでは、粒子状細胞濃縮剤を分離するための手段は、スクレーパーの縁部とハウジングとの間で液体を通過させるように構成されたスクレーパーを備えるプランジャを含む。
【0250】
本方法は、液体試料中への粒子状細胞濃縮剤の懸濁液を形成する工程を更に含む。懸濁液は、ハウジング内において形成するか、あるいはハウジングの外部で形成することができる。懸濁液がハウジングの外部で形成される場合、本方法は、ハウジング内に懸濁液を移動する工程を更に含む。本方法は、微生物を捕捉するだけの充分な時間にわたって、粒子状細胞濃縮剤を液体試料と接触させる工程を更に含む。接触は、ハウジング内で起こってよい。接触は、ハウジングの外部で起こってよい。接触は、ハウジングの外部及び内部の両方で起こってよい。本方法は、図2A、3A、4A、5A、7A及び10Aの装置について上記に述べたように、液体試料中への粒子状物質の懸濁液から液体試料の一部を分離する工程を更に含む。
【0251】
試料の調製及び検出キット:
本開示の構成要素及び/又は装置は、使用説明書及び必要に応じて付属物品又は試薬とともにパッケージングすることによって、試料の調製及び検出キットとすることができる。したがって、一態様において、本開示は、i)少なくとも2個の貯留部を含み、その間に通路を有するハウジングと、ii)ハウジングの第1の貯留部を第2の貯留部から隔離するための手段と、iii)細胞濃縮剤と、iv)細胞濃縮剤を第1の貯留部から第2の貯留部に移動させるための手段とを備えるキットを提供する。第1の貯留部は、試料を受容するように構成された開口部を含む。第2の貯留部は、その内部に配置された検出試薬を含む。いくつかの実施形態において、ハウジングは、本明細書で記載されるように、第1の貯留部を第2の貯留部から隔離するための手段を更に含むことができる。いくつかの実施形態において、ハウジングは、細胞濃縮剤を第1の貯留部から第2の貯留部に移動させるための手段を更に含むことができる。いくつかの実施形態において、細胞濃縮剤は、ハウジングの第1の貯留部の中に配置される。
【0252】
いくつかの実施形態では、本開示のキットには、試料調製及び検出装置とともに使用することができる付属物品及び試薬を含む。付属物品の非限定的な例としては、試料取得装置、フィルタ、グローブ、培養装置(例えば、ペトリ皿、培養試験管、3M Company(St.Paul,MN)より入手されるPETRIFILMプレートなど)、核酸の単離又は増幅試薬、ラテラルフロー装置、ELISAプレート及び試薬などの免疫アッセイ装置、又は上記の物品の2つ以上のものの任意の組み合わせが挙げられる。付属試薬の非限定的な例としては、水、緩衝剤、指示薬(例えば、pH指示薬)、色素、体細胞抽出剤、細胞抽出剤を含む放出要素、本明細書で記載されるような結合パートナー、酵素、酵素基質、オリゴヌクレオチド、対照試料、又は上記の試薬の2つ以上のものの任意の組み合わせが挙げられる。
【実施例】
【0253】
ここで、本発明について、実施できる説明を行うために、本発明者が予見するいくつかの特定の実施形態を説明している。本発明の想像上の修正形態がそれでもなお、現在は予見されない修正形態を含めて、それらの等価物をなし得る。したがって、本発明の範囲は、本明細書に記載した細部及び構造によってではなく、以下の「特許請求の範囲」及びその等価物によってのみ限定されるべきである。
【0254】
材料:
細菌培養は、特に断らないかぎり、すべてThe American Type Culture Collection(ATCC,Manassas,VA)より入手した。
【0255】
水はすべて、特に指定のない限り、Millipore Corporation(Bedford,MA)より販売されるMilli−Q(商標)勾配脱イオンシステムを使用して18メガオームの滅菌脱イオン水として入手した。
【0256】
CM−111:球状化された非晶質ケイ酸マグネシウム:マイクロスフェアを3M Company(St.Paul,MN)より販売される3M(商標)Cosmetic Microspheres CM111として入手した。粒子は、2.3g/ccの粒子密度を有する中実の球として成形したものであり、約3.3m2/gの表面積を有していた。粒子の99%は、約11マイクロメートル未満であった。粒子の50%は、約5マイクロメートル未満であった。粒子の10%は、約2マイクロメートル未満であった。CM−111マイクロスフェアは、参照によりその全体が本明細書に組み込まれる、2009年12月22日出願の米国特許出願第61/289,213号、発明の名称「MICROORGANISM CONCENTRATION PROCESS AND CONCENTRATION AGENT FOR USE THEREIN」に述べられるようにして調製した。
【0257】
500mMのKCl、100mMのCaCl2、10mMのMgCl2、及び100mMのK2HPO4を含むpH 7.2の100倍の吸着緩衝液を調製し、使用前にフィルタ滅菌した。
【0258】
表面を滅菌したそれぞれの構成要素を、70%イソプロピルアルコールと接触させた(イソプロピルアルコールで拭くか又はイソプロピルアルコールに浸漬した)。余分なアルコールを流れ落とし、それぞれの構成要素を使用前に少なくとも30分間風乾した。
【0259】
化学物質はすべて、特に断らないかぎり、Sigma−Aldrich Chemical Company(Milwaukee,WI)より入手した。
【0260】
(実施例1)
ヒドロゲルの重合後のヒドロゲルビーズへの細胞抽出剤の取り込み
国際特許出願公開第2007/146722の実施例1に述べられるようにしてヒドロゲルビーズを調製した。国際特許出願公開2007/146722の実施例19に述べられるようにして乾燥させた後、実施例23に述べられるようにして活性溶液中に浸漬することによって活性ビーズを調製した。1gのビーズを60℃で2時間乾燥させて、ビーズから水を除去した。乾燥したビーズを2gのBARDAC 205M(Lonza Group Ltd.(Valais,Switzerland))の50%(w/v)水溶液中に少なくとも3時間〜一晩、室温で浸漬した。浸漬後、ビーズをブフナー漏斗に注いでビーズの水分を切り、次いで10〜20mLの蒸留水ですすいだ。ペーパータオルを押し付けることによって余分な水をビーズ表面から除去した。使用する前に、ビーズを室温で少なくとも2週間、ジャーに保存した。
【0261】
(実施例2)
微小粒子の使用による細胞濃縮、並びに細胞抽出剤を充填したヒドロゲル及びATP生物発光を利用した検出
3M(商標)CLEAN−TRACE表面ATPシステムを3M Company(St.Paul,MN)より入手した。大腸菌ATCC 51183の純粋培養物をトリプシン処理した大豆ブロス中に植菌して、37℃で一晩増殖させた。細菌培養物をButterfield緩衝液(pH 7.2±0.2;リン酸二水素カリウム緩衝液;VWR,West Chester,PA)中で約106又は105CFU/mLに希釈する。
【0262】
「捕捉」反応(表1)では、100マイクロリットルの希釈細菌懸濁液を、10mLの脱イオン水(Milli−Q Biocel System,Millipore,MA)試料の入った個々の試験管に直接加えて、それぞれ10mL中に約105CFU又は104CFUを得た。10mgのオートクレーブしたCM−111 3M(商標)Cosmetic Microspheres(か焼した非晶質の球状化ケイ酸マグネシウム粉末、3M Company;St.Paul,MN)を細胞の入った試験管に加え、室温で約15分間混合した。粒子を沈降させ、上清を除去した。粒子を100μLのButterfield緩衝液に懸濁し、1.5mLの微量遠心管に移した。400マイクロリットルのCLEAN−TRACE表面ATPシステムからのルシフェラーゼ/ルシフェリン液体試薬溶液を遠心管に加えた。
【0263】
コントロール反応(対照、表1)として、100μLの約106又は105CFU/mLの細胞懸濁液を1.5mLの微小遠心管に加え、400μLのCLEAN−TRACE表面ATPシステムからのルシフェラーゼ/ルシフェリン液体試薬溶液を遠心管に加えた。試薬を加えた直後に、細胞抽出剤を含むヒドロゲルビーズ(約11mg)を個々の遠心管に加え、相対発光量(RLU)の測定値をベンチトップ型ルミノメーター(Turner Biosystems,Sunnyvale,CA)より販売される20/20nシングルチューブ型ルミノメーター)で10秒間隔で記録した。発光量の測定値は、ルミノメーターとともに提供される20/20n SISソフトウェアを使用してルミノメーターから得た。光信号を1秒間にわたって積分し、RLUで表される結果を表1に示した。
【0264】
データは、同様の数の非希釈細胞とのコントロール反応と比較した場合、本明細書に記載のプロトコルを使用すると、微小粒子は、細胞を捕捉することができ、ヒドロゲルビーズから放出された細胞抽出剤は、より大きな(10mL)容積に希釈された微生物細胞からATPの約半分を抽出することができたことを示している。この結果は、細胞から放出されたATPがATP検出試薬と反応し、測定可能な生物発光を生じたことを更に示している。
【0265】
【表1】

【0266】
(実施例3)
ATP生物発光検出系を利用した一体型試料調製及び検出装置による微生物細胞の検出
この実施例では、図2に示されるような一体型の試料調製及び検出装置200を使用する。装置は、第1の貯留部220に約10mgのオートクレーブしたCM−111 3M Cosmetic Microspheresを備える。第2の貯留部224は、約0.6ミリリットルのCLEAN−TRACE表面ATPシステムからのルシフェラーゼ/ルシフェリン液体試薬溶液からなる液体検出試薬265を備える。第3の貯留部226は、PCT国際公開特許WO 2010/039627の調製例5に従って作製された2つのBARDAC 205Mビーズを備える。10ミリリットルの滅菌脱イオン水を、使用直前に一体型装置200の第1の貯留部220に加える。
【0267】
大腸菌の一晩培養物を実施例2で述べたようにして調製する。この細菌培養物を、Butterfield緩衝液中で約106又は105CFU/mLに希釈する。100マイクロリットルの希釈懸濁液を一体型装置200の上側貯留部220に直接ピペットで加えることによって、それぞれ10ミリリットル中に約105CFU又は104CFUの懸濁液を得る。キャップ278を使用してハウジング210を閉鎖し、細菌懸濁液を室温でマイクロスフェア(細胞濃縮剤230)と混合して通路216内に沈降させる。キャップ278を外して、プランジャ250を挿入することにより沈降したマイクロスフェアを含む液体試料の部分及びヒドロゲルビーズをATP検出試薬の入った第2の貯留部224内に移す。一体型装置を直ちにルミノメーター(例えば、NGルミノメーターUNG2)の読み取りチャンバに挿入し、UNGルミノメーターの非計画試験モードを用いてRLU測定値を10秒間隔で記録する。RLU測定値をRLUの数がプラトーに達するまで収集する。データをNGルミノミーターとともに提供されるソフトウェアを使用してダウンロードする。このデータは、微生物細胞がマイクロスフェアによって濃縮され、ヒドロゲルによって細胞抽出剤が放出され、この細胞抽出剤が細胞からのATPの放出を引き起こし、かつ細胞から放出されたATPがATP検出系によって検出されることを示すものである。
【0268】
(実施例4)
ATP生物発光検出系を利用した一体型試料調製及び検出装置による微生物細胞の検出
この実施例では、図3に示されるような一体型試料調製及び検出装置300を使用する。弁アクチュエータ372は、使用に先だって、弁キャビティ374が第1の貯留部320と流体連通するように配置されている。装置は、第1の貯留部320に約10mgのオートクレーブしたCM−111 3M Cosmetic Microspheresを備える。第2の貯留部324は、約0.6ミリリットルのCLEAN−TRACE表面ATPシステムからのルシフェラーゼ/ルシフェリン液体試薬溶液からなる液体検出試薬365を備える。BARDAC 205Mビーズは、PCT国際公開特許WO 2010/039627の調製例5に従って作製される。10ミリリットルの滅菌脱イオン水を、使用直前に一体型装置300の第1の貯留部320に加える。
【0269】
大腸菌の一晩培養物を実施例2で述べたようにして調製する。この細菌培養物を、Butterfield緩衝液中で約106又は105CFU/mLに希釈する。100マイクロリットルの希釈懸濁液を一体型装置300の上側貯留部320に直接ピペットで加えることによって、それぞれ10ミリリットル中に約105CFU又は104CFUの懸濁液を得る。キャップ378を使用してハウジング310を閉鎖し、細菌懸濁液を室温でマイクロスフェア(細胞濃縮剤330)と混合して弁キャビティ374内に沈降させる。キャップ378を外して、2個のBARDAC 205Mビーズ(放出要素362)をハウジング310の中に落とす。ビーズが弁キャビティ374内に沈降した直後に、弁アクチュエータ372を回して弁キャビティ内の液体試料の部分(細胞濃縮剤330及び放出要素362を含む)をATP検出試薬の入った第2の貯留部324内に移す。一体型装置を直ちにルミノメーター(例えば、NGルミノメーターUNG2)の読み取りチャンバに挿入し、UNGルミノメーターの非計画試験モードを用いてRLU測定値を10秒間隔で記録する。RLU測定値をRLUの数がプラトーに達するまで収集する。データをNGルミノミーターとともに提供されるソフトウェアを使用してダウンロードする。このデータは、微生物細胞がマイクロスフェアによって濃縮され、放出要素によって細胞抽出剤が放出され、この細胞抽出剤が細胞からのATPの放出を引き起こし、かつ細胞から放出されたATPがATP検出系によって検出されることを示すものである。
【0270】
(実施例5)
検出装置の調製:
I型の装置:これらの検出装置では、以下に述べる相違点を有する以外は図10Aのハウジングと同様のハウジングを構成した。以下の参照符合は、図10Aの対応する部材を示す。ハウジング1100の上側部分1012及び下側部分1014は、3M Clean−Trace(商標)表面ATP試験(3M Company(Bridgend,UK)から入手)から類似構成要素を使用して得た。破断可能なシール1068が結合された回収要素1067を、下側部分1014の上側部分に、破断可能なシール1068がハウジング1100の下側部分1014に面するようにして圧入した。上側部分1012は、ヒートガン(Master Appliances Corp,Racine,WI)を使用してbuyheatshrink.comより入手した、3:1ポリオレフィン2重壁の接着剤でライニングされた熱収縮フィルム(部品番号_HSC3A−050−cc、直径1.5cm)の2cmの切片を用いて下側部分1014と連結した。
【0271】
これらの検出装置では、図2Aのプランジャと同様のプランジャを構成した。以下の参照符合は、図2Aの対応する部材を示す。3M Clean−Trace(商標)表面ATP試験からのポリオレフィン製プラスチックハンドル(252)の一部、真鍮製金属シャフト(251)及びアセタール製穿孔部材259を用いてプランジャ(250)を組み立てた。ハンドル252及び穿孔部材259は、ネジによる連結によって真鍮シャフトの両端に取り付けた。真鍮製金属シャフトは、長さ11.5cm及び直径3.9mmであった。旋盤を使用してシャフトの両端に6mmの6〜23のネジ山を切った。穿孔部材259は、10インチ(25.4cm)のサウスベンド旋盤を使用して1/2インチ(12.7mm)のアセタールコポリマーロッド(部品番号8497K211、McMASTER−CARR(Santa Fe Springs,CA)より入手)から作製した。下側シール256としてOリング(McMASTER−CARRより入手したBuna N AS568A−010)を使用し、プランジャ250の穿孔端259の約11.5mm上に取り付けた。プランジャは、1回の使用毎に表面を滅菌した。
【0272】
II型の装置:これらの検出装置は、図6Aに示されるものと同様の先端部を有する図5Aで図示及び説明したものと同様のプランジャを使用して組み立てた。ハウジングは、I型の装置について述べたのと同様に構成した。プランジャの先端部は、10インチ(25.4cm)のサウスベンド旋盤を使用して1/2インチ(12.7mm)のアセタールコポリマー製ロッド(部品番号8497K211、McMASTER−CARR(Santa Fe Springs,CA)より入手)から作製した。ダックビル型一方向弁及びプラスチック製保持ワッシャを、プランジャの先端部の本体の陥凹した開口部内にプレス嵌めした。フィルタは、POREXフィルタ(Porex Corporation(Fairburn,GA)より入手される部品番号X6854)を図6Aに示される形状に機械加工し、一端を先端部の陥凹した開口部に圧入し、弁及び保持ワッシャを定位置に保持するような寸法に形成することによって作製した。プランジャは、1回の使用毎に表面を滅菌した。
【0273】
III型の装置:以下に述べる相違点を有する以外は図10Aに示されるものと同様の検出装置を構成した。以下の参照符合は、図10Aの対応する部材を示す。ハウジング1100の上側部分1012及び下側部分1014は、3M Clean−Trace(商標)表面ATP試験(3M Company(Bridgend,UK)から入手)から類似構成要素を使用して得た。破断可能なシール1068が結合された回収要素1067を、下側部分1014の上側部分に、破断可能なシール1068がハウジング1100の下側部分1014に面するようにして圧入した。上側部分1012は、ヒートガン(Master Appliances Corp,Racine,WI)を使用してbuyheatshrink.comより入手した、3:1ポリオレフィン2重壁の接着剤でライニングされた熱収縮フィルム(部品番号_HSC3A−050−cc、直径1.5cm)の2cmの切片を用いて下側部分1014と連結した。
【0274】
3M Clean−Trace(商標)表面ATP試験からのポリオレフィン製プラスチックハンドル(1052)の一部、真鍮製金属シャフト(1051)及び先端部1090を用いてプランジャ(1050)を組み立てた。ハンドル1052及び先端部1090は、ネジによる連結によって真鍮シャフトの両端に取り付けた。真鍮製金属シャフトは、長さ11.5cm及び直径3.9mmであった。旋盤を使用してシャフトの両端に6mmの6〜23のネジ山を切った。先端部1090は、10インチ(25.4cm)のサウスベンド旋盤を使用して1/2インチ(12.7mm)のアセタールコポリマー製ロッド(部品番号8497K211、McMASTER−CARR(Santa Fe Springs,CA))より入手)から作製した。Oリング1086を先端部1090に取り付けた。先端部は、図10に示されるような保持部材1087を含むように機械加工した。厚さ1mmのポリウレタンゴムの小片を打抜き、これを保持部材1087内に滑り込ませることによってスクレーパーを構成した。スクレーパー1086の外径は、ハウジング1010の内側に緊密に嵌合するような寸法に構成した。プランジャは、1回の使用毎に表面を滅菌した。
【0275】
(実施例6)
I型装置を使用した、スパイク水からの粒子状濃縮剤による大腸菌の捕捉
トリプシン処理大豆寒天プレート(Becton Dickinson,Sparks,MD)から単離した大腸菌(ATCC 51813)の単離されたコロニーを使用して5mLのトリプシン処理大豆ブロス(Becton Dickinson,Sparks,MD)に植菌し、37℃のインキュベーター内で一晩インキュベートした。約109個のコロニー形成単位/mL(CFU/mL)を含む一晩培養物をフィルタ滅菌した18メガオームの水で1:10,000に希釈した(約105CFU/mLにまで、以後、「初期希釈懸濁液」と呼ぶ)。500マイクロリットルの希釈培養液を50mLのフィルタ滅菌した18メガオームの水に移し、約1000個/mLの最終濃度とした。
【0276】
100倍の吸着緩衝液(pH 7.2)の一定分量(0.5mL)を、上記の50mLの希釈した大腸菌懸濁液に加えた(以後、「スパイク水試料」と呼ぶ)。内容物を約1分間、手動で混合した。
【0277】
10mgの蒸気滅菌したCM−111を秤量し、実施例5で述べたようにして調製したI型装置に加えた。体積10mLのスパイク水試料をそれぞれの装置に加え、表面滅菌したパラフィルムで装置をキャップした。内容物を室温(25℃)で約約30秒間、手で振盪することによって混合した。
【0278】
混合後、それぞれの装置を、Thermolyne Vari Mix(商標)ロッキングプラットフォーム(Barnstead International,Iowa、14サイクル/分)上で異なる時間(それぞれ1、5、10及び20分間)インキュベートした。インキュベート後、それぞれの管をベンチトップに10分間置いて粒子状の濃縮剤CM−111を沈降させた。沈降後、パラフィルムのラッピングを外し、予め滅菌したプランジャ装置を使用して箔シールに穿孔し、沈降したCM−111剤を装置の下側部分内に堆積させた。ピペットを用いて上清を除去し、カミソリ刃を用いて装置の下側部分(細胞濃縮剤が入った)を装置の上側部分から分離した。沈降したCM−111濃縮剤(約100マイクロリットルの水中)を装置から取り出し、滅菌水で1:100に希釈し、希釈した濃縮剤の1ミリリットルの一定分量を、製造者の指示に従って3M(商標)Petrifilm(商標)Aerobic Countプレート(3M Company,St.Paul,MN)上にプレートした。
【0279】
コントロールとして、初期希釈懸濁液を滅菌水で1:1000の希釈度で更に希釈し、製造者の指示に従って3M(商標)Petrifilm(商標)Aerobic Countプレート(3M Company,St.Paul,MN)上にプレートした。滅菌性のコントロールとして、粒子状物質も3M(商標)Petrifilm(商標)Aerobic Countプレート上にプレートした。それぞれのプレートを37℃のインキュベーター(VWR Orbital Shaker Incubator,VWR,West Chester,PA)内で一晩インキュベートした。
【0280】
すべてのプレートを、製造者の指示に従って3M(商標)Petrifilm(商標)プレートリーダー(3M Company,St.Paul,MN)により分析し、コロニーのカウントを得た。結果を表2に示す。結果は、下式によって計算した。
捕捉効率=(濃縮剤上のコロニー数)/(スパイクコントロール中の全コロニー数)×100
【0281】
【表2】

【0282】
(実施例7)
III型装置を使用したCM−111による大腸菌の濃縮
単離した大腸菌(ATCC 51813)のコロニーをストリークプレートから5mLのトリプシン処理した大豆ブロス(TSB、Becton Dickinson(Sparks,MD))に植菌し、37℃で18〜20時間インキュベートした。約109個のコロニー形成単位/mLのこの一晩培養物をフィルタ滅菌した脱イオン水(MilliQ,Millipore,MA)中で希釈し、10mLのフィルタ滅菌した脱イオン水中でスパイクして1×103個/mL及び1×104個/mL(全体で約1×104/mL cfu及び約1×105/mL cfu)の最終濃度を得た。スパイクした水を、10mgの予め滅菌した(121℃、15分)CM−111(Cosmetic Microspheres−111、3M Company,St Paul)の粉末及び100マイクロリットルの100倍吸着緩衝液(pH 7.2)の入ったIII型装置のハウジングに加えた。ハウジングを表面滅菌したパラフィルムで密封し、ロッキングプラットフォーム上に置いた。次いで、キャップした装置を、Thermolyne Vari Mix(商標)ロッキングプラットフォーム(Barnstead International,Iowa、14サイクル/分)上で5分間の接触時間にわたって室温(25℃)でインキュベートした。次いで装置を振盪させずに(重力によって粒子を沈降させるため)5分間静置し(ロッキング及び沈降の全経過時間=10分間)、パラフィルムを取り外して、II型装置のプランジャをハウジングに挿入し、ハウジングの底の方向に押し込むことによってバルク試料からCM−111粒子を分離した。プランジャが破断可能なシールを破ると、約0.1mLの液体試料に懸濁されたCM−111粒子は、ハウジングの第2の貯留部に移された。CM−111粒子を第2の貯留部から回収して、1.5mLの滅菌した微小遠心管に移した。体積100mLのBacTiter−Glo(商標)試薬(Promega,Madison,WI)をペレットに加え、VWR Fixed Speed Vortexミキサー上で5秒間(3200rpmで5秒)ボルテックスして混合し、卓上型ルミノメーター(FB12シングルチューブ型ルミノメーター、Berthold Detection Systems USA(Oak Ridge,TN))上で読み取った。大腸菌細胞の1×105個/mL及び1×106個/mLの懸濁液から100マイクロリットルの体積を試験することにより、ポジティブコントロール(「100%シグナル」)を調製した。結果は、下式によって計算し、下記表3にまとめた。
ATPシグナル捕捉効率(%)=(CM−111ペレットのRLU/100%シグナルからのRLU)×100
RLU=相対ルシフェラーゼ単位
【0283】
【表3】

N=2、標準偏差<10%。データは、大腸菌コントロールについては水のみ(16,464RLU)のバックグラウンドに対して標準化し、細菌と接触させたCM−111ペレットについては未反応のCM−111(41,424RLU)のバックグラウンドに対して標準化した。
【0284】
上記実施例から、粒子状の捕捉剤を使用して水性試料から細菌を濃縮できることが分かる。
【0285】
(実施例8)
II型装置を使用したCM−111による大腸菌の濃縮。
単離した大腸菌(ATCC 33090)のコロニーをストリークプレートから5mLのトリプシン処理した大豆ブロス(TSB、Becton Dickinson,Sparks,MD)に植菌し、37℃で18〜20時間インキュベートした。約108個のコロニー形成単位/mLのこの一晩培養物をフィルタ滅菌した脱イオン水(MilliQ,Millipore,MA)中で希釈し、10mLのフィルタ滅菌した脱イオン水中でスパイクして103個/mL(全体で約104cfu)の最終濃度を得た。スパイクした水を、10mgの予め滅菌した(121℃、15分)CM−111(Cosmetic Microspheres−111、3M Company,St Paul)の粉末及び100マイクロリットルの100倍吸着緩衝液が既に入っている装置に加えた。装置を表面滅菌したパラフィルムで密封し、ロッキングプラットフォーム上に置いた。キャップした装置を、Thermolyne Vari Mix(商標)ロッキングプラットフォーム(Barnstead International,Iowa、14サイクル/分)上で1分及び9分間(全経過時間=2分及び10分間)室温(25℃)でインキュベートした。
【0286】
インキュベートの後、パラフィルムを取り外し、プランジャを破断可能なシールと接触するまでハウジング内に挿入した。プランジャを更に挿入して破断可能なシールを破ることにより、大腸菌が結合したCM−111が約100マイクロリットルの液体試料とともにハウジングの第2の貯留部に移された。微小粒子なしの大腸菌が入ったコントロールの管を同様に処理した。
【0287】
第2の貯留部を切り開いてCM−111ペレットを回収し、粒子を1.5mLの滅菌した微小遠心管に移した。体積100mLのBacTiter−Glo(商標)試薬(Promega,Madison,WI)をペレットに加え、VWR Fixed Speed Vortexミキサー上で5秒間(3200rpmで5秒)ボルテックスして混合し、卓上型ルミノメーター(FB12シングルチューブ型ルミノメーター、Berthold Detection Systems USA(Oak Ridge,TN))上で読み取った。100%シグナルについては、105個/mLの希釈液から体積100マイクロリットルを使用した。結果は、下式によって計算し、下記表4にまとめた。
ATPシグナル捕捉効率(%)=(CM−111ペレットのRLU/約104個の全大腸菌からのRLU)×100
RLU=相対ルシフェラーゼ単位
【0288】
【表4】

N=2、標準偏差<10%。データは、大腸菌コントロールについては水のみ(27,938RLU)のバックグラウンドに対して標準化し、細菌と接触させたCM−111ペレットについては未反応のCM−111(30,611RLU)のバックグラウンドに対して標準化した。
【0289】
(実施例9)
II型装置を使用したAB−CM−111による大腸菌の濃縮
実施例8において述べた手順を用い、AB−CM(吸着緩衝液で処理したCM−111)の10mgの一定分量についても、10mLの水からの大腸菌の濃縮について試験を行った。接触時間を9分、1分として、POREXプランジャを使用してAB−CMを沈降させた。データを表5にまとめた。
【0290】
【表5】

N=2、標準偏差<10%。データは、大腸菌コントロールについては水のみ(20,281RLU)のバックグラウンドに対して標準化し、細菌と接触させたCM−111ペレットについては未反応のAB−CM(44,488RLU)のバックグラウンドに対して標準化した。
【0291】
上記実施例から、粒子状の捕捉剤を使用して水性試料から細菌を濃縮できることが分かる。
【0292】
(実施例10)
比較例−非濃縮試料における大腸菌の検出。
現時点の技術水準における水試験法として、標準的なATP生物発光アッセイ(例えば、3M Company(St.Paul,MN)より入手可能な3M CLEANTRACE Water−Free ATP、カタログ番号AQF100)を用いて100マイクロリットルの水をATPについて試験する方法がある。
【0293】
トリプシン処理した大豆ブロス中での大腸菌の一晩培養物(ATCC 33090)を、滅菌水で希釈して2つの懸濁液を得た。懸濁液Aは、約103CFU/mLを含み、懸濁液Bは、約105CFU/mLを含んでいた。
【0294】
それぞれの懸濁液の100マイクロリットルの一定分量を体積100マイクロリットルのBacTiter−Glo(商標)試薬(Promega,Madison,WI)と混合し、生じた生物発光を実施例8で述べたようにしてルミノメーターで測定した。結果を表6に示す。
【0295】
【表6】

N=2、標準偏差<10%
【0296】
本明細書に引用するすべての特許、特許出願及び公開公報、並びに電子的に入手可能な資料の開示内容の全体を援用する。本出願の開示内容と参照により本明細書に組み込まれるいずれかの文書の開示内容との間になんらかの矛盾が存在する場合には、本出願の開示内容が優先するものとする。上記の詳細な説明及び実施例はあくまで理解を助けるために示したものである。これらによって不要な限定をするものと理解されるべきではない。本発明は、図示及び説明された厳密な詳細に限定されるものではなく、当業者には明らかな変形例は特許請求の範囲によって定義される本発明に含まれるものとする。
【0297】
特に指示がない限り、明細書及び添付の特許請求の範囲に使用される成分の量、分子量を表すすべての数は、すべての例において、「約」という用語により修正されることを理解されたい。したがって、特に断らないかぎり、本明細書及び添付の特許請求の範囲に記載される数値パラメータは、本発明が実現しようとする所望の性質に応じて変わりうる近似値である。少なくとも、また、均等論を特許請求の範囲に限定しようとするものではなく、それぞれの数値パラメータは少なくとも報告される有効数字の数を考慮し、更に通常の数値の端数処理を適用して解釈されるべきである。
【0298】
本発明の広義の範囲で示す数値的範囲及びパラメータは近似値ではあるが、具体例に記載される数値は可能な限り正確に報告されている。しかしながら、数値はすべて、それぞれの試験測定値における標準偏差から必然的に生じる一定の範囲を本質的に含むものである。
【0299】
すべての見出しは読者の便宜のためのものであって、特に断らないかぎり、見出しの後に続く文面の意味を限定するために使用されるものではない。
【特許請求の範囲】
【請求項1】
試料中の細胞を検出する方法であって、該方法が、
細胞濃縮剤、細胞抽出剤を含む放出要素及び液体試料を提供することと、
前記液体試料と前記細胞濃縮剤とを所定の時間接触させることと、
前記液体試料の少なくとも一部から前記細胞濃縮剤を分離することと、
前記分離された細胞濃縮剤と前記放出要素とを含む液体混合物を形成する、ここで、前記細胞抽出剤は前記混合物中に放出される、ことと、
前記細胞からの生物学的検体を検出すること、を含む方法。
【請求項2】
試料中の細胞を検出する方法であって、該方法が、
試料;細胞濃縮剤;細胞抽出剤を含む放出要素;第1及び第2の貯留部を備えたハウジングと前記試料を受容するように構成された開口部とを含む検出物品;及び前記細胞濃縮剤を分離して前記ハウジング内の第1の貯留部から第2の貯留部に移動させるための手段を提供することと、
前記ハウジングの前記第1の貯留部内の液体媒質の中で、前記試料と前記細胞濃縮剤とを接触させることと、
前記細胞濃縮剤を分離して前記ハウジング内の前記第2の貯留部に移動させることと、
前記分離された細胞濃縮剤と前記放出要素とを含む液体混合物を形成する、ここで、前記細胞抽出剤は前記混合物中に放出される、ことと、
前記細胞からの生物学的検体を検出することと、を含む方法。
【請求項3】
試料中の細胞を検出する方法であって、該方法が、
試料;前記試料を受容するように構成された開口部と、細胞濃縮剤が収容された第1の貯留部と、細胞抽出剤を含む放出要素が収容された第2の貯留部とを有する検出物品;前記細胞濃縮剤を液体試料の少なくとも一部から分離するための手段;及び前記細胞濃縮剤を前記ハウジング内の前記第1の貯留部から前記第2の貯留部に移動させるための手段を提供することと、
前記ハウジングの前記第1の貯留部内の液体媒質中で前記試料と前記細胞濃縮剤とを接触させることと、
前記細胞濃縮剤を分離して前記ハウジングの前記第2の貯留部に移動させることと、
前記分離された細胞濃縮剤と前記放出要素とを含む液体混合物を形成する、ここで、前記細胞抽出剤は前記混合物中に放出される、ことと、
前記細胞からの生物学的検体を検出することと、を含む方法。
【請求項4】
前記放出要素が、マトリックス、コーティングされた基材、又はシェル構造を含む、請求項1〜3のいずれか一項に記載の方法。
【請求項5】
前記生物学的検体を検出することが、生きた細胞の存在を検出することを含む、請求項1〜4のいずれか一項に記載の方法。
【請求項6】
前記生物学的検体を検出することが、検出系を使用することを含む、請求項1〜5のいずれか一項に記載の方法。
【請求項7】
前記生物学的検体を検出することが、微生物細胞に関連する生物学的検体を検出することを含む、請求項1〜6のいずれか一項に記載の方法。
【請求項8】
体細胞抽出剤を提供する工程と、該体細胞抽出剤を前記試料からの細胞と接触させる工程とを更に含む、請求項1〜7のいずれか一項に記載の方法。
【請求項9】
前記生物学的検体を検出することが、前記生物学的検体の量を定量することを含む、請求項1〜8のいずれか一項に記載の方法。
【請求項10】
前記生物学的検体の量が、2回以上定量される、請求項9に記載の方法。
【請求項11】
1回目の時点において検出される前記生物学的検体の量が、2回目の時点において検出される前記生物学的検体の量と比較される、請求項10に記載の方法。
【請求項12】
前記生物学的検体を検出することが、細胞からのATPを検出することを含む、請求項1〜11のいずれか一項に記載の方法。
【請求項13】
前記細胞からのATPを検出することが、微生物細胞からのATPを検出することを含む、請求項12に記載の方法。
【請求項14】
前記ATPを検出することが、細菌細胞からのATPを検出することを含む、請求項13に記載の方法。
【請求項15】
前記細胞からのATPを検出することが、ルシフェリン及びルシフェラーゼが関与する反応においてATPを検出することを含む、請求項12〜14のいずれか一項に記載の方法。
【請求項16】
ATPを加水分解することが可能な酵素を準備する工程と、該酵素を前記試料の少なくとも一部と接触させる工程とを更に含む、請求項15に記載の方法。
【請求項17】
前記生物学的検体を検出することが、前記生物学的検体を免疫学的に検出することを含む、請求項1〜11のいずれか一項に記載の方法。
【請求項18】
前記生物学的検体を検出することが、前記生物学的検体を遺伝学的に検出することを含む、請求項1〜11のいずれか一項に記載の方法。
【請求項19】
前記生物学的検体を検出することが、前記試料中の生きた細胞から放出される酵素を検出することを含む、請求項1〜11のいずれか一項に記載の方法。
【請求項20】
前記酵素が、アデニル酸キナーゼ酵素を含む、請求項19に記載の方法。
【請求項21】
前記生物学的検体を検出することが、比色測定法により、蛍光測定法により、電気化学的方法により、又は光量測定法により検出することを含む、請求項1〜20のいずれか一項に記載の方法。
【請求項22】
一体型試料調製及び検出装置であって、
それらの間に通路を有する第1の貯留部と第2の貯留部とを含むハウジングと、
ここで、前記第1の貯留部は、試料を受容するように構成された開口部と、前記第1の貯留部内に配置された細胞濃縮剤とを含み、
ここで、前記第2の貯留部は、その内部に配置された検出試薬を含み、
前記第1の貯留部を前記第2の貯留部から隔離するための手段と、
前記細胞濃縮剤を前記第1の貯留部から前記第2の貯留部に移動させるための手段と、を含む、一体型試料調製及び検出装置。
【請求項23】
前記細胞濃縮剤が、粒子状の又は分散された細胞濃縮剤を含む、請求項22に記載の装置。
【請求項24】
前記ハウジングの前記第1の貯留部と前記第2の貯留部とを隔離するための手段が、プランジャ、弁、又は破断可能なシールを包含する、請求項22又は23に記載の装置。
【請求項25】
前記細胞濃縮剤を前記ハウジングの前記第1の貯留部から前記第2の貯留部に移動させるための手段が、プランジャ、スワブ、又は弁を包含する、請求項22〜24のいずれか一項に記載の装置。
【請求項26】
前記第1の貯留部が、テーパ形状の内壁を含む、請求項22〜25のいずれか一項に記載の装置。
【請求項27】
細胞抽出剤を含む放出要素を更に含む、請求項22〜26のいずれか一項に記載の装置。
【請求項28】
前記放出要素が、ビーズ、繊維、リボン、又はシートを含む、請求項27に記載の装置。
【請求項29】
前記放出要素が、コーティングされた基材を含む、請求項27に記載の装置。
【請求項30】
前記ハウジングが、前記第1の貯留部と前記第2の貯留部との間に配置された第3の貯留部を更に含む、請求項22〜29のいずれか一項に記載の装置。
【請求項31】
前記放出要素が、前記第3の貯留部内に配置される、請求項30に記載の装置。
【請求項32】
貯留部内に配置される体細胞抽出剤を更に含む、請求項22〜31のいずれか一項に記載の装置。
【請求項33】
プランジャを更に備える、請求項22に記載の装置。
【請求項34】
前記プランジャが、流体経路を含む、請求項33に記載の装置。
【請求項35】
前記流体経路が、その中に配置されたフィルタを含む、請求項34に記載の装置。
【請求項36】
前記フィルタが、微多孔性フィルタを含む、請求項35に記載の装置。
【請求項37】
前記プランジャが、スクレーパーを更に含む、請求項33に記載の装置。
【請求項38】
前記スクレーパーが、前記スクレーパーの縁部と前記ハウジングとの間に液体を通過させるように構成される、請求項37に記載の装置。
【請求項39】
キットであって、
それらの間に通路を有する少なくとも2個の貯留部を含むハウジングと、
ここで、第1の貯留部は、試料を受容するように構成された開口部を含み、
ここで、第2の貯留部は、その内部に配置された検出試薬を含み、
前記第1の貯留部を前記第2の貯留部から隔離するための手段と、
細胞濃縮剤と、
前記細胞濃縮剤を前記第1の貯留部から前記第2の貯留部に移動させるための手段と、を含むキット。
【請求項40】
前記ハウジングが、前記細胞濃縮剤を前記第1の貯留部から前記第2の貯留部に移動させるための手段を含む、請求項39に記載のキット。
【請求項41】
前記細胞濃縮剤が、前記ハウジングの前記第1の貯留部の中に配置される、請求項39又は40に記載のキット。
【請求項42】
前記細胞濃縮剤が、粒子状の又は分散された細胞濃縮剤を含む、請求項39〜41のいずれか一項に記載のキット。
【請求項43】
微生物細胞抽出剤を含む放出要素を更に含む、請求項39〜42のいずれか一項に記載のキット。
【請求項44】
体細胞抽出剤を更に含む、請求項43に記載のキット。
【請求項45】
試料取得装置を更に備える、請求項39〜44のいずれか一項に記載のキット。
【請求項46】
プランジャを更に備える、請求項39〜45のいずれか一項に記載のキット。
【請求項47】
前記プランジャが、流体経路を含む、請求項46に記載のキット。
【請求項48】
前記流体経路が、その中に配置されたフィルタを含む、請求項47に記載のキット。
【請求項49】
前記フィルタが、微多孔性フィルタを含む、請求項48に記載のキット。
【請求項50】
前記プランジャが、スクレーパーを更に含む、請求項46に記載のキット。
【請求項51】
前記スクレーパーが、前記スクレーパーの縁部と前記ハウジングとの間に液体を通過させるように構成される、請求項50に記載のキット。
【請求項1】
試料中の細胞を検出する方法であって、該方法が、
細胞濃縮剤、細胞抽出剤を含む放出要素及び液体試料を提供することと、
前記液体試料と前記細胞濃縮剤とを所定の時間接触させることと、
前記液体試料の少なくとも一部から前記細胞濃縮剤を分離することと、
前記分離された細胞濃縮剤と前記放出要素とを含む液体混合物を形成する、ここで、前記細胞抽出剤は前記混合物中に放出される、ことと、
前記細胞からの生物学的検体を検出すること、を含む方法。
【請求項2】
試料中の細胞を検出する方法であって、該方法が、
試料;細胞濃縮剤;細胞抽出剤を含む放出要素;第1及び第2の貯留部を備えたハウジングと前記試料を受容するように構成された開口部とを含む検出物品;及び前記細胞濃縮剤を分離して前記ハウジング内の第1の貯留部から第2の貯留部に移動させるための手段を提供することと、
前記ハウジングの前記第1の貯留部内の液体媒質の中で、前記試料と前記細胞濃縮剤とを接触させることと、
前記細胞濃縮剤を分離して前記ハウジング内の前記第2の貯留部に移動させることと、
前記分離された細胞濃縮剤と前記放出要素とを含む液体混合物を形成する、ここで、前記細胞抽出剤は前記混合物中に放出される、ことと、
前記細胞からの生物学的検体を検出することと、を含む方法。
【請求項3】
試料中の細胞を検出する方法であって、該方法が、
試料;前記試料を受容するように構成された開口部と、細胞濃縮剤が収容された第1の貯留部と、細胞抽出剤を含む放出要素が収容された第2の貯留部とを有する検出物品;前記細胞濃縮剤を液体試料の少なくとも一部から分離するための手段;及び前記細胞濃縮剤を前記ハウジング内の前記第1の貯留部から前記第2の貯留部に移動させるための手段を提供することと、
前記ハウジングの前記第1の貯留部内の液体媒質中で前記試料と前記細胞濃縮剤とを接触させることと、
前記細胞濃縮剤を分離して前記ハウジングの前記第2の貯留部に移動させることと、
前記分離された細胞濃縮剤と前記放出要素とを含む液体混合物を形成する、ここで、前記細胞抽出剤は前記混合物中に放出される、ことと、
前記細胞からの生物学的検体を検出することと、を含む方法。
【請求項4】
前記放出要素が、マトリックス、コーティングされた基材、又はシェル構造を含む、請求項1〜3のいずれか一項に記載の方法。
【請求項5】
前記生物学的検体を検出することが、生きた細胞の存在を検出することを含む、請求項1〜4のいずれか一項に記載の方法。
【請求項6】
前記生物学的検体を検出することが、検出系を使用することを含む、請求項1〜5のいずれか一項に記載の方法。
【請求項7】
前記生物学的検体を検出することが、微生物細胞に関連する生物学的検体を検出することを含む、請求項1〜6のいずれか一項に記載の方法。
【請求項8】
体細胞抽出剤を提供する工程と、該体細胞抽出剤を前記試料からの細胞と接触させる工程とを更に含む、請求項1〜7のいずれか一項に記載の方法。
【請求項9】
前記生物学的検体を検出することが、前記生物学的検体の量を定量することを含む、請求項1〜8のいずれか一項に記載の方法。
【請求項10】
前記生物学的検体の量が、2回以上定量される、請求項9に記載の方法。
【請求項11】
1回目の時点において検出される前記生物学的検体の量が、2回目の時点において検出される前記生物学的検体の量と比較される、請求項10に記載の方法。
【請求項12】
前記生物学的検体を検出することが、細胞からのATPを検出することを含む、請求項1〜11のいずれか一項に記載の方法。
【請求項13】
前記細胞からのATPを検出することが、微生物細胞からのATPを検出することを含む、請求項12に記載の方法。
【請求項14】
前記ATPを検出することが、細菌細胞からのATPを検出することを含む、請求項13に記載の方法。
【請求項15】
前記細胞からのATPを検出することが、ルシフェリン及びルシフェラーゼが関与する反応においてATPを検出することを含む、請求項12〜14のいずれか一項に記載の方法。
【請求項16】
ATPを加水分解することが可能な酵素を準備する工程と、該酵素を前記試料の少なくとも一部と接触させる工程とを更に含む、請求項15に記載の方法。
【請求項17】
前記生物学的検体を検出することが、前記生物学的検体を免疫学的に検出することを含む、請求項1〜11のいずれか一項に記載の方法。
【請求項18】
前記生物学的検体を検出することが、前記生物学的検体を遺伝学的に検出することを含む、請求項1〜11のいずれか一項に記載の方法。
【請求項19】
前記生物学的検体を検出することが、前記試料中の生きた細胞から放出される酵素を検出することを含む、請求項1〜11のいずれか一項に記載の方法。
【請求項20】
前記酵素が、アデニル酸キナーゼ酵素を含む、請求項19に記載の方法。
【請求項21】
前記生物学的検体を検出することが、比色測定法により、蛍光測定法により、電気化学的方法により、又は光量測定法により検出することを含む、請求項1〜20のいずれか一項に記載の方法。
【請求項22】
一体型試料調製及び検出装置であって、
それらの間に通路を有する第1の貯留部と第2の貯留部とを含むハウジングと、
ここで、前記第1の貯留部は、試料を受容するように構成された開口部と、前記第1の貯留部内に配置された細胞濃縮剤とを含み、
ここで、前記第2の貯留部は、その内部に配置された検出試薬を含み、
前記第1の貯留部を前記第2の貯留部から隔離するための手段と、
前記細胞濃縮剤を前記第1の貯留部から前記第2の貯留部に移動させるための手段と、を含む、一体型試料調製及び検出装置。
【請求項23】
前記細胞濃縮剤が、粒子状の又は分散された細胞濃縮剤を含む、請求項22に記載の装置。
【請求項24】
前記ハウジングの前記第1の貯留部と前記第2の貯留部とを隔離するための手段が、プランジャ、弁、又は破断可能なシールを包含する、請求項22又は23に記載の装置。
【請求項25】
前記細胞濃縮剤を前記ハウジングの前記第1の貯留部から前記第2の貯留部に移動させるための手段が、プランジャ、スワブ、又は弁を包含する、請求項22〜24のいずれか一項に記載の装置。
【請求項26】
前記第1の貯留部が、テーパ形状の内壁を含む、請求項22〜25のいずれか一項に記載の装置。
【請求項27】
細胞抽出剤を含む放出要素を更に含む、請求項22〜26のいずれか一項に記載の装置。
【請求項28】
前記放出要素が、ビーズ、繊維、リボン、又はシートを含む、請求項27に記載の装置。
【請求項29】
前記放出要素が、コーティングされた基材を含む、請求項27に記載の装置。
【請求項30】
前記ハウジングが、前記第1の貯留部と前記第2の貯留部との間に配置された第3の貯留部を更に含む、請求項22〜29のいずれか一項に記載の装置。
【請求項31】
前記放出要素が、前記第3の貯留部内に配置される、請求項30に記載の装置。
【請求項32】
貯留部内に配置される体細胞抽出剤を更に含む、請求項22〜31のいずれか一項に記載の装置。
【請求項33】
プランジャを更に備える、請求項22に記載の装置。
【請求項34】
前記プランジャが、流体経路を含む、請求項33に記載の装置。
【請求項35】
前記流体経路が、その中に配置されたフィルタを含む、請求項34に記載の装置。
【請求項36】
前記フィルタが、微多孔性フィルタを含む、請求項35に記載の装置。
【請求項37】
前記プランジャが、スクレーパーを更に含む、請求項33に記載の装置。
【請求項38】
前記スクレーパーが、前記スクレーパーの縁部と前記ハウジングとの間に液体を通過させるように構成される、請求項37に記載の装置。
【請求項39】
キットであって、
それらの間に通路を有する少なくとも2個の貯留部を含むハウジングと、
ここで、第1の貯留部は、試料を受容するように構成された開口部を含み、
ここで、第2の貯留部は、その内部に配置された検出試薬を含み、
前記第1の貯留部を前記第2の貯留部から隔離するための手段と、
細胞濃縮剤と、
前記細胞濃縮剤を前記第1の貯留部から前記第2の貯留部に移動させるための手段と、を含むキット。
【請求項40】
前記ハウジングが、前記細胞濃縮剤を前記第1の貯留部から前記第2の貯留部に移動させるための手段を含む、請求項39に記載のキット。
【請求項41】
前記細胞濃縮剤が、前記ハウジングの前記第1の貯留部の中に配置される、請求項39又は40に記載のキット。
【請求項42】
前記細胞濃縮剤が、粒子状の又は分散された細胞濃縮剤を含む、請求項39〜41のいずれか一項に記載のキット。
【請求項43】
微生物細胞抽出剤を含む放出要素を更に含む、請求項39〜42のいずれか一項に記載のキット。
【請求項44】
体細胞抽出剤を更に含む、請求項43に記載のキット。
【請求項45】
試料取得装置を更に備える、請求項39〜44のいずれか一項に記載のキット。
【請求項46】
プランジャを更に備える、請求項39〜45のいずれか一項に記載のキット。
【請求項47】
前記プランジャが、流体経路を含む、請求項46に記載のキット。
【請求項48】
前記流体経路が、その中に配置されたフィルタを含む、請求項47に記載のキット。
【請求項49】
前記フィルタが、微多孔性フィルタを含む、請求項48に記載のキット。
【請求項50】
前記プランジャが、スクレーパーを更に含む、請求項46に記載のキット。
【請求項51】
前記スクレーパーが、前記スクレーパーの縁部と前記ハウジングとの間に液体を通過させるように構成される、請求項50に記載のキット。
【図1A】


【図1B】


【図1C】


【図1D】


【図2A】


【図2B】


【図2C】


【図2D】


【図3A】


【図3B】


【図3C】


【図3D】


【図4A】


【図4B】


【図4C】


【図4D】


【図5A】


【図5B】


【図5C】


【図5D】


【図6A】


【図6B】


【図7A】


【図7B】


【図7C】


【図7D】


【図8A】


【図8B】


【図9】


【図10A】


【図10B】


【図11】


【図12a】


【図12b】


【図13】


【図14】


【図15】


【図16】


【図17】


【図18】




【図1B】


【図1C】


【図1D】


【図2A】


【図2B】


【図2C】


【図2D】


【図3A】


【図3B】


【図3C】


【図3D】


【図4A】


【図4B】


【図4C】


【図4D】


【図5A】


【図5B】


【図5C】


【図5D】


【図6A】


【図6B】


【図7A】


【図7B】


【図7C】


【図7D】


【図8A】


【図8B】


【図9】


【図10A】


【図10B】


【図11】


【図12a】


【図12b】


【図13】


【図14】


【図15】


【図16】


【図17】


【図18】


【公表番号】特表2013−516179(P2013−516179A)
【公表日】平成25年5月13日(2013.5.13)
【国際特許分類】
【出願番号】特願2012−547301(P2012−547301)
【出願日】平成22年12月30日(2010.12.30)
【国際出願番号】PCT/US2010/062517
【国際公開番号】WO2011/082309
【国際公開日】平成23年7月7日(2011.7.7)
【出願人】(505005049)スリーエム イノベイティブ プロパティズ カンパニー (2,080)
【Fターム(参考)】
【公表日】平成25年5月13日(2013.5.13)
【国際特許分類】
【出願日】平成22年12月30日(2010.12.30)
【国際出願番号】PCT/US2010/062517
【国際公開番号】WO2011/082309
【国際公開日】平成23年7月7日(2011.7.7)
【出願人】(505005049)スリーエム イノベイティブ プロパティズ カンパニー (2,080)
【Fターム(参考)】
[ Back to top ]

