微生物によるγ−アミノ酪酸(GABA)の生産方法
【課題】2−ピロリドン、ポリアミド4、N−メチル−2−ピロリドン、及びポリビニルピロリドンの原料となるGABAを、石油を使用することなく、高効率に生産する方法を提供する。
【解決手段】グルタミン酸及び/またはグルタミン酸塩と水との混合液中で、グルタミン酸及び/またはグルタミン酸塩と微生物または微生物を破砕して調製された酵素溶液とを作用させてGABAを生産する工程を含み、グルタミン酸及び/またはグルタミン酸塩の反応液中の初期濃度が50重量%以上であるGABA生産方法。
【解決手段】グルタミン酸及び/またはグルタミン酸塩と水との混合液中で、グルタミン酸及び/またはグルタミン酸塩と微生物または微生物を破砕して調製された酵素溶液とを作用させてGABAを生産する工程を含み、グルタミン酸及び/またはグルタミン酸塩の反応液中の初期濃度が50重量%以上であるGABA生産方法。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、バイオマスからγ−アミノ酪酸(GABA)を生産する方法に関する。更に、本発明は当該GABAから2−ピロリドン、2−ピロリドンポリアミド4、N−メチル−2−ピロリドン及びポリビニルピロリドンを合成する方法に関する。
【背景技術】
【0002】
ポリアミド(ナイロン)は軽さ、強度、耐熱性、弾性及び染色性など点で優れているため、繊維、医療用品、工業材料など多くの用途に使用されている。ポリアミドには所謂ナイロン6やナイロン66などの多くの種類が存在するが、これらは主に焼却や埋立てなど、多くのエネルギーを要する方法や手間のかかる方法により処分されている。一方、ポリアミドの一種であるポリアミド4(ナイロン4)は、生分解可能なプラスチックである(非特許文献1)。このため、ポリアミド4は従来のナイロン6などとは異なり、微生物による低エネルギーかつ簡便な分解処理が可能である。このため、ポリアミド4は有用な生分解性のナイロンとして注目されている。
【0003】
このようなポリアミド4は2−ピロリドンから合成されるが、現在、2−ピロリドンは石油から生産されている(非特許文献2)。また、ポリビニルピロリドンも2−ピロリドンから合成される。N−メチル−2−ピロリドンは石油由来のγーブチロラクトンから合成されるが、2−ピロリドンからの合成も可能である。しかしながら、現在の2−ピロリドン合成法では化石資源に依存しており、また多くのエネルギーを必要とする。このため、原料として石油ではなくバイオマスを原料とし、低エネルギー、安価かつ簡便な2−ピロリドン、ポリアミド4、N−メチル−2−ピロリドン、及びポリビニルピロリドンの合成方法を構築することは重要である。
【0004】
一方、2−ピロリドンの原料となるGABAは神経伝達物質として脳内に存在するほか、発芽玄米、漬物などの発酵製品中に多く含まれ、精神安定作用、血圧降下作用などの生理作用がある。そのために、機能性食品として近年注目されている。GABAの生産方法としては微生物や植物に内在する酵素を利用した方法がある。微生物としては食品として利用されるため、発酵食品生産に用いる乳酸菌、カビが主として利用されている(特許文献1、特許文献2、特許文献3)。
【0005】
特許文献4には、グルタミン酸及び/またはグルタミン酸塩と微生物または微生物を破砕して調製された酵素溶液とを作用させてGABAを生産する工程を含む、GABA生産方法が開示されている。そして、グルタミン酸及び/またはグルタミン酸塩と水という、栄養成分及び緩衝液成分を含まない単純な系で微生物を使用したとしても、該微生物の活性を維持させ続けることが可能であり、高収率でグルタミン酸及び/またはグルタミン酸塩からGABAを生産できることが記載されている。
【0006】
しかしながら、グルタミン酸及び/またはグルタミン酸塩からのGABAの生産の更なる効率向上が必要である。
【先行技術文献】
【特許文献】
【0007】
【特許文献1】特開2007−143487号公報
【特許文献2】特開2007−135416号公報
【特許文献3】特開2007−028998号公報
【特許文献4】特開2009−159840号公報
【非特許文献】
【0008】
【非特許文献1】N. Kawasaki et al., Polymer, 46, 9987-9993 (2005).
【非特許文献2】新食品添加物安全性検討委員会報告書p.9(資料2−1:ポリビニルピロリドンの指定に向けた検討のための報告書)、平成18年
【発明の概要】
【発明が解決しようとする課題】
【0009】
本発明は、2−ピロリドン、ポリアミド4、N−メチル−2−ピロリドン、及びポリビニルピロリドンの原料となるGABAを、石油を使用することなく、高効率に生産する方法を提供することを目的とする。また、本発明は、このようにして入手されたGABAから、2−ピロリドン、ポリアミド4、N−メチル−2−ピロリドン及びポリビニルピロリドンを合成する方法を提供することを目的とする。
【課題を解決するための手段】
【0010】
本発明者らは、グルタミン酸及び/またはグルタミン酸塩を高濃度にしてGABAの生産を行うことによって、高濃度の生産物(GABA)溶液を得ることができるという知見を得た。本発明は、これら知見に基づき、更に検討を重ねて完成されたものであり、次のGABAの生産方法等を提供するものである。
【0011】
項1.グルタミン酸及び/またはグルタミン酸塩と水との混合液中で、グルタミン酸及び/またはグルタミン酸塩と微生物または微生物を破砕して調製された酵素溶液とを作用させてGABAを生産する工程を含み、グルタミン酸及び/またはグルタミン酸塩の反応液中の初期濃度が50重量%以上であるGABA生産方法。
【0012】
項2.グルタミン酸及び/またはグルタミン酸塩と水との混合液中で、グルタミン酸及び/またはグルタミン酸塩と微生物または微生物を破砕して調製された固定化酵素とを作用させてGABAを生産する工程を含み、
反応容器から生産されたGABAの回収、且つ反応容器へ水の添加を連続的に行い、グルタミン酸及び/またはグルタミン酸塩の反応液中の初期濃度が50重量%以上であることを特
徴とするGABA生産方法。
【0013】
項3.前記反応容器がフィルター付きの反応容器であり、前記反応液は該フィルターを通して回収され、該フィルター上で撹拌装置を回転させることにより反応液を撹拌することを特徴とする、項2に記載の方法。
【0014】
項4.反応容器から反応液を回収する速度Fが以下の式で求められる値であることを特徴とする、項2又は3に記載の方法。
【0015】
【数1】

CA [mol L-1]:反応液中のGlu濃度
F [L/h]:反応液の回収速度
r [mol L-1 h-1]:体積当たりの反応量
V [L]:反応液体積
pH:反応液のpH
pKa:グルタミン酸の酸解離定数
【0016】
項5.栄養成分を含まない混合液中で、グルタミン酸及び/またはグルタミン酸塩と微生物または微生物を破砕して調製された酵素溶液とを作用させる、項1に記載の方法。
【0017】
項6.栄養成分を含まない混合液中で、グルタミン酸及び/またはグルタミン酸塩と微生物または微生物を破砕して調製された固定化酵素とを作用させる、項2〜4のいずれかに記載の方法。
【0018】
項7.微生物が大腸菌である、項1〜6のいずれかに記載の方法。
【0019】
項8.項1〜7のいずれかで生産されたGABAを加熱処理して2−ピロリドンを合成する工程を含む、2−ピロリドン合成方法。
【0020】
項9.項8に記載の方法で合成された2−ピロリドンを開環重合してポリアミド4を合成する工程を含む、ポリアミド4合成方法。
【0021】
項10.項8に記載の方法で合成された2−ピロリドンをN−メチル化してN−メチル−2−ピロリドンを合成する工程を含む、N−メチル−2−ピロリドン合成方法。
【0022】
項11.項8に記載の方法で合成された2−ピロリドンをN−ビニル化し、重合してポリビニルピロリドンを合成する工程を含む、ポリビニルピロリドン合成方法。
【発明の効果】
【0023】
本発明によれば、石油を使用することなく微生物を利用して、グルタミン酸及び/またはグルタミン酸塩から高濃度のGABAを生産することができる。そのため、反応後の溶液からGABAを精製する際の水分除去に必要なエネルギーは少なくてすみ、高効率にGABAを生産することができる。
【0024】
また、本発明によれば、微生物を利用することにより高効率に得られたGABAから2−ピロリドン、ポリアミド4、N−メチル−2−ピロリドン及びポリビニルピロリドンを合成することができる。
【図面の簡単な説明】
【0025】
【図1】グルタミン酸及び/またはグルタミン酸塩と微生物との作用条件の例を示す図である。
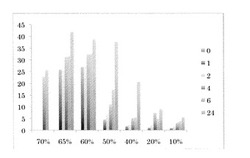
【図2】反応液のグルタミン酸濃度(重量%)とGABAの生産量(重量%)の関係を示すグラフである。凡例は培養時間を表している。
【図3】連続生産における反応時間と反応液中のGABA濃度(重量%)及びGlu濃度(重量%)、並びに回収GABA量(g)の関係を示すグラフである。
【発明を実施するための形態】
【0026】
以下、本発明のGABAの生産方法等について詳細に説明する。
【0027】
GABA生産方法(1)
本発明のGABA生産方法は、グルタミン酸及び/またはグルタミン酸塩と水との混合液中で、グルタミン酸及び/またはグルタミン酸塩と微生物または微生物を破砕して調製された酵素溶液とを作用させてGABAを生産する工程を含み、グルタミン酸及び/またはグルタミン酸塩の反応液中の初期濃度が50重量%以上であることを特徴とする。
【0028】
・グルタミン酸及び/またはグルタミン酸塩
本発明においては、GABAの原料としてグルタミン酸及び/またはグルタミン酸塩が使用
される。ここでグルタミン酸塩は特に限定されないが、グルタミン酸ナトリウム、グルタミン酸塩酸塩、グルタミン酸カリウム、グルタミン酸カルシウム、グルタミン酸マグネシウムなどが例示される。本発明においてGABAの原料としては、好ましくはグルタミン酸、グルタミン酸ナトリウム、グルタミン酸塩酸塩、さらに好ましくはグルタミン酸が使用される。
【0029】
本発明において、上記のようなグルタミン酸及び/またはグルタミン酸塩は、バイオマスから発酵法を用いて生産することもできる。バイオマスとしては限定されないが、サトウキビ、キャッサバ、サトウ大根、及びトウモロコシが例示される。
【0030】
グルタミン酸を生産する微生物は日本で発見され、発酵法によるバイオマスからのグルタミン酸及び/またはグルタミン酸塩生産法は日本で開発された生産システムであり、その生産量は世界で年間約100万トンである。例えば、発酵生産されたグルタミン酸塩の用途としては、ナトリウム塩は主として食品調味料として利用され、その他には医薬品合成の中間体や界面活性剤として利用されている(文献:発酵ハンドブック共立出版 20
01)。このように、バイオマスからのグルタミン酸及び/またはグルタミン酸塩の生産は、公知の方法に従い行うことができる。
【0031】
・微生物
本発明において使用される微生物は、グルタミン酸及び/またはグルタミン酸塩からGABAを生産できるものであれば限定されず、大腸菌、酵母、カビ、乳酸菌などが例示される。これらは、グルタミン酸デカルボキシラーゼをコードする遺伝子を含む核酸が導入された組み換え体であってもよいが、環境中に放出された際の動物や生態系への影響などを考えると、微生物は非組み換え体である方が容易に使用できる。例えば、大腸菌を例に挙げると、大腸菌NBRC3806株、及び大腸菌NBRC12713が例示される。また、乳酸菌を例に挙げると、ラクトバシラス・ブレビス(Lactobacillus brevis) NBRC1
2005、及びラクトコッカス・ラクティス(Lactococcus lactis) NBRC10093
3が例示される。
【0032】
・微生物を破砕して調製された酵素溶液
本発明において使用される微生物を破砕して調製された酵素溶液は、微生物を破砕して適宜調製されたものであり、かつグルタミン酸及び/またはグルタミン酸塩からGABAを生産できるものであれば限定されない。このような酵素溶液は、従来公知の微生物から酵素溶液を調製する方法により、当業者が適宜製造することができる。ここで使用される微生物としては、前記の微生物が挙げられ、同様に、組み換え体であっても非組み換え体であってもよい。また、必要に応じて酵素を固定化して用いてもよい。
【0033】
酵素を固定化する方法としては、公知の方法を使用できるが、例えば、担体結合法、架橋法、及び包括法が挙げられる。担体結合法は、水不溶性の固定化担体に酵素を化学的又は物理的に結合させる方法である。架橋法は、酵素を2個又はそれ以上の官能基を持った試薬で架橋する方法である。包括法は酵素を高分子ゲルの微細な格子の中に包み込むか、又は半透膜性の高分子の皮膜によって被覆する方法である。
【0034】
・グルタミン酸及び/またはグルタミン酸塩と微生物または微生物を破砕して調製された酵素溶液との作用条件
ここで、「作用」とは、グルタミン酸及び/またはグルタミン酸塩からGABAを生産するために、グルタミン酸及び/またはグルタミン酸塩と微生物または微生物を破砕して調製された酵素溶液とを混合し、一定時間共存させておくことを意味する。
【0035】
本発明においてグルタミン酸及び/またはグルタミン酸塩の反応液中の初期濃度は、50
重量%以上、好ましくは55重量%以上、より好ましくは60〜65重量%である。ここで、反
応液とは、グルタミン酸及び/またはグルタミン酸塩と、微生物または微生物を破砕して調製された酵素溶液を作用させる溶液のことである。このように高濃度のグルタミン酸及び/またはグルタミン酸塩を含む反応液を使用したとしてもGABAの生産が阻害されずに、高濃度のGABAを生産することができる。
【0036】
これらグルタミン酸及び/またはグルタミン酸塩は、すべて溶液中に溶けている必要はない。グルタミン酸及び/またはグルタミン酸塩すべてが溶液中に溶けていない状態であってもGABAを生産することができる。
【0037】
グルタミン酸及び/またはグルタミン酸塩と微生物または微生物を破砕して調製された酵素溶液との上記以外の作用条件は、微生物または微生物を破砕して調製された酵素溶液を作用させることにより、グルタミン酸及び/またはグルタミン酸塩からGABAを生産でき、本発明の効果が得られるものであれば限定されない。
【0038】
例えば、グルタミン酸及び/またはグルタミン酸塩と微生物とを作用させる場合、これらの作用は使用される微生物が増殖可能な栄養成分を含有しない条件下で行ってもよく、また該栄養成分を含有する条件下で行ってもよい。好ましくは、これらの作用は栄養成分を含有しない条件下で行われる。栄養成分を含有しない条件では、反応液中には栄養成分以外の物質が含まれていてもよい。ここで、本発明における栄養成分とは微生物が増殖するために必要な成分であり、このような成分としては、炭素源(グルコース、フルクトー
ス、グリセロール、スターチ等)、及び無機若しくは有機窒素源(硫酸アンモニウム、塩化アンモニウム、カゼインの加水分解物、酵母抽出物、ポリペプトン、バクトトリプトン、ビーフ抽出物等)が挙げられる。
【0039】
これらの作用が栄養成分を含有しない条件下で行われる場合、例えば、グルタミン酸及び/またはグルタミン酸塩と微生物とは、以下のようにして作用させることができる。
【0040】
例えば、使用される微生物を、該微生物が増殖可能な栄養培地で培養し、集菌、洗浄することにより培地成分を除去し、得られた微生物を、グルタミン酸及び/またはグルタミン酸塩と水の混合液に添加することにより、グルタミン酸及び/またはグルタミン酸塩と微生物とを作用させることができる(例えば図1の〔1−1〕参照)。このように微生物をグルタミン酸及び/またはグルタミン酸塩と水の混合液に添加した場合であっても、微生物の活性は長時間低下することなく、効率よくGABAを生産することができる。
【0041】
また、例えば、同様に培地成分を除去して得られた微生物を、グルタミン酸及び/またはグルタミン酸塩と緩衝液の混合液に添加することにより、グルタミン酸及び/またはグルタミン酸塩と微生物とを作用させることができる(例えば図1の〔1−2〕参照)。
【0042】
好ましくは、培地成分を除去して得られた微生物を、グルタミン酸及び/またはグルタミン酸塩と水の混合溶液に添加することにより、グルタミン酸及び/またはグルタミン酸塩と微生物とを作用させることにより行われる。
【0043】
ここで、増殖可能な培地での培養回数は限定されず、いわゆる本培養の前に、前培養を単回又は複数回行ってもよい。好ましくは、本培養の前に、前培養を単回又は複数回行われる。増殖可能な培地は、使用する微生物の種類に応じて、適宜選択できる。
【0044】
グルタミン酸及び/またはグルタミン酸塩と微生物との作用が栄養成分を含有する条件下で行われる場合、例えば、グルタミン酸及び/またはグルタミン酸塩と微生物とは、以下のようにして作用させることができる。
【0045】
例えば、使用される微生物を、該微生物が増殖可能な栄養培地で培養し、得られた培養液にグルタミン酸及び/またはグルタミン酸塩を添加することにより作用させることができる(例えば図1の〔2−1〕、〔2−1’〕参照)。また、例えば、使用される微生物を、該微生物が増殖可能な栄養培地で培養し、得られた培養液を、別に用意しておいたグルタミン酸及び/またはグルタミン酸塩と新しい栄養培地との混合液に添加することにより作用させることができる(例えば図1の〔2−2〕、〔2−2’〕参照)。また、例えば、使用される微生物を、該微生物が増殖可能な栄養培地で培養し、集菌、洗浄することにより得た微生物を、別に用意しておいたグルタミン酸及び/またはグルタミン酸塩と新しい栄養培地との混合液に添加することにより作用させることができる(例えば図1の〔2−3〕参照)。
【0046】
ここで、別に用意する混合液に含まれる新たな培地は、微生物が生育できるものであれば、使用される微生物を培養した培地と同一でもよく、異なってもよい。また、グルタミン酸及び/またはグルタミン酸塩と微生物との作用が栄養成分を含有する条件下で行われる場合も、増殖可能な培地での培養回数は限定されず、いわゆる本培養の前に、前培養を単回又は複数回行ってもよい。好ましくは、本培養の前に、前培養を単回又は複数回行われる。増殖可能な培地は、使用する微生物の種類に応じて、適宜選択できる。
【0047】
また、グルタミン酸及び/またはグルタミン酸塩と微生物とを作用させる場合、ほかの作用条件としては、反応液中のpH、作用温度、作用時間、微生物の濃度などが挙げられるが、これらはグルタミン酸及び/またはグルタミン酸塩からGABAが生産されるかぎり限定されず、使用する微生物の種類や濃度、グルタミン酸及び/またはグルタミン酸塩の濃度、反応液中の緩衝液成分の有無及び栄養成分の有無などに応じて適宜調整すればよい。
【0048】
例えば、反応液のpHはグルタミン酸及び/またはグルタミン酸塩からGABAが生産されるかぎり限定されないが大腸菌の場合は酸性域、好ましくはpH3.5〜5.5、さらに好ましくはpH4.5〜5.5である。例えば、前述のように、グルタミン酸と水の混合溶液中で、グルタミン酸と微生物とを作用させる場合には、得られる反応液は栄養成分及び緩衝液成分を含んでおらず、従って、pH値を調整しなくともこれらを好適なpH値とすることができる。グルタミン酸塩と微生物とを作用させる場合には、適宜pHを調整すればよい。
【0049】
作用温度は、グルタミン酸及び/またはグルタミン酸塩からGABAを生産でき、かつ使用する微生物が生育可能であるかぎり限定されず、使用する微生物に応じて適宜調整できる。大腸菌の場合、好ましくは20〜55℃、さらに好ましくは25〜37℃である。
【0050】
作用時間も、グルタミン酸及び/またはグルタミン酸塩からGABAが生産されるかぎり限定されず、反応液のpH、反応温度、使用する微生物の種類や濃度、グルタミン酸及び/またはグルタミン酸塩の濃度、反応液中の緩衝液成分の有無及び栄養成分の有無などその溶媒の組成に応じて適宜調整すればよい。例えば、反応液中のGABA濃度があるレベルに到達した際に、これらの作用を終了させてもよい。また例えば、反応液中のGABA濃度があるレベルに到達した際に、生産されたGABAを分離し、当該反応液中で、残存するグルタミン酸及び/またはグルタミン酸塩と微生物との作用をさらに続けてもよい。この場合、必要に応じて反応液中にグルタミン酸及び/またはグルタミン酸塩を新たに添加してもよい。
【0051】
微生物の濃度も、グルタミン酸及び/またはグルタミン酸塩からGABAが生産されるかぎり限定されず、使用する微生物の種類、グルタミン酸及び/またはグルタミン酸塩の濃度、pH、反応温度、溶媒の組成などに応じて適宜調整すればよい。例えば微生物の濃度は0.1〜30g/100mL、好ましくは0.5〜10g/100mL、さらに好ましく
は0.5〜5g/100mLである。
【0052】
また、グルタミン酸及び/またはグルタミン酸塩と微生物を破砕して調製された酵素溶液とを作用させる場合、緩衝成分及び補酵素の少なくとも一方を含有する条件下で行ってもよく、緩衝成分及び補酵素を含有しない条件で行ってもよい。好ましくは、これらの作用は、前記栄養成分、緩衝成分及び補酵素を含有しない条件で行われる。当該条件では、反応液中には栄養成分、緩衝成分及び補酵素以外の物質が含まれていてもよい。さらに好ましくは、これらの作用は、微生物を破砕して調製された酵素溶液を、グルタミン酸と水の混合液に添加することにより行われる。
【0053】
グルタミン酸及び/またはグルタミン酸塩と微生物を破砕して調製された酵素溶液とを作用させる場合、ほかの作用条件としては、反応液のpH、作用温度、作用時間、微生物を破砕して調製された酵素溶液の種類及び濃度などが挙げられるが、これらはグルタミン酸及び/またはグルタミン酸塩からGABAが生産されるかぎり限定されず、使用する微生物の種類、反応液中の栄養成分、緩衝液成分及び栄養成分の有無などに応じて適宜調整すればよい。
【0054】
例えば、反応液のpHはグルタミン酸及び/またはグルタミン酸塩からGABAが生産されるかぎり限定されないが、酵素として大腸菌由来の酵素を使用した場合は酸性域、好ましくはpH3.5〜5.5、さらに好ましくはpH4.5〜5.5である。例えば、前述のように、グルタミン酸と水の混合液中で、グルタミン酸と微生物を破砕して調製された酵素溶液とを作用させる場合には、得られる反応液は栄養成分及び緩衝液成分を含んでおらず、従って、pH値を調整しなくともこれらを好適なpH値とすることができる。グルタミン酸塩と微生物を破砕して調製された酵素溶液とを作用させる場合には、適宜pHを調整すればよい。
【0055】
作用温度は、グルタミン酸及び/またはグルタミン酸塩からGABAを生産できるかぎり限定されず、使用する酵素に応じて適宜調整できる。酵素が大腸菌由来の酵素の場合、好ましくは20〜55℃、さらに好ましくは25〜37℃である。
【0056】
作用時間も、グルタミン酸及び/またはグルタミン酸塩からGABAが生産されるかぎり限定されず、反応液のpH、反応温度、使用する微生物の種類や濃度、グルタミン酸及び/またはグルタミン酸塩の濃度、反応液中の緩衝液成分の有無及び栄養成分の有無などその溶媒の組成に応じて適宜調整すればよい。例えば、反応液中のGABA濃度があるレベルに到達した際に、これらの作用を終了させてもよい。また例えば、反応液中のGABA濃度があるレベルに到達した際に、生産されたGABAを分離し、当該反応液中で、残存するグルタミン酸及び/またはグルタミン酸塩と微生物を破砕して調製された酵素溶液との作用をさらに続けてもよい。この場合、必要に応じて反応液中にグルタミン酸及び/またはグルタミン酸塩を新たに添加してもよい。
【0057】
微生物を破砕して調製された酵素溶液の濃度も、グルタミン酸及び/またはグルタミン酸塩からGABAが生産されるかぎり限定されず、使用する微生物の種類、グルタミン酸及び/またはグルタミン酸塩の濃度、pH、反応温度、溶媒の組成などに応じて適宜調整すればよい。例えば酵素溶液のタンパク濃度は0.1〜30mg/mL、好ましくは0.5〜10mg/mL、さらに好ましくは1〜5mg/mLである。
【0058】
GABA生産方法(2)
本発明のGABA生産方法は、グルタミン酸及び/またはグルタミン酸塩と水との混合液中で、グルタミン酸及び/またはグルタミン酸塩と微生物または微生物を破砕して調製された固定化酵素とを作用させてGABAを生産する工程を含み、反応容器から生産されたGABAの
回収、且つ反応容器へ水の添加を連続的に行い、グルタミン酸及び/またはグルタミン酸塩の反応液中の初期濃度が50重量%以上であることを特徴とする。
【0059】
グルタミン酸及び/またはグルタミン酸塩、並びに微生物については前述したものと同様である。
【0060】
・微生物を破砕して調製された固定化酵素
本発明において使用される微生物を破砕して調製された固定化酵素は、微生物を破砕して適宜調製されたものであり、かつグルタミン酸及び/またはグルタミン酸塩からGABAを生産できるものであれば限定されない。このような固定化酵素に用いる酵素は、従来公知の微生物から酵素溶液を調製する方法により、当業者が適宜製造することができる。ここで使用される微生物としては、前述した微生物が挙げられ、同様に、組み換え体であっても非組み換え体であってもよい。
【0061】
酵素を固定化する方法は、前述したものと同様である。
【0062】
・連続操作
本発明では、反応容器から生産されたGABAの回収、且つ反応容器へ水の添加を連続的に行うことを特徴とする。
【0063】
このように連続操作でもバッチ操作で行うのと同様に、高濃度のグルタミン酸及び/またはグルタミン酸塩を使用してGABAの生産を行うことができる。
【0064】
反応容器への水の添加に加えて、必要に応じてグルタミン酸及び/またはグルタミン酸塩を新たに添加してもよい。
【0065】
上記反応容器としては、公知のものを使用することができるが、好ましくは、フィルター付きの反応容器であって、当該フィルター上に撹拌装置を有するものである。このような反応容器を使用することにより、フィルター上で撹拌装置を回転させながら、反応液をフィルターを通して回収することができので、溶解していないグルタミン酸及び/またはグルタミン酸塩によりフィルターが詰まることが無く、連続的にGABAの排出を行うことが可能になる。
【0066】
上記撹拌装置としては、反応液を撹拌できるものであれば特に限定されないが、例えば、マグネットスターラー、撹拌翼、プロペラなどを挙げられる。
【0067】
反応液の最適回収速度Fは、例えば反応系のpHを至適状態に保つ下記の式により計算で
求めることができる。反応液量を変化させないために、回収速度と同じ速度でH2Oを反応
液に加える。基質の反応系への供給は、溶解せずに系内に固体状で存在する基質から連続的に供給される。
【0068】
【数2】

CA [mol L-1]:反応液中のGlu濃度
F [L/h]:反応液の回収速度
r [mol L-1 h-1]:(反応液の)体積当たりの反応量
V [L]:反応液体積
pH:反応液のpH
pKa:グルタミン酸の酸解離定数
【0069】
・グルタミン酸及び/またはグルタミン酸塩と微生物または微生物を破砕して調製された固定化酵素との作用条件
ここで、「作用」とは、グルタミン酸及び/またはグルタミン酸塩からGABAを生産するために、グルタミン酸及び/またはグルタミン酸塩と微生物または微生物を破砕して調製された固定化酵素とを混合し、共存させておくことを意味する。
【0070】
本発明においてグルタミン酸及び/またはグルタミン酸塩の反応液中の初期濃度は、50重量%以上、好ましくは55重量%以上、より好ましくは60〜65重量%である。ここで、反
応液とは、グルタミン酸及び/またはグルタミン酸塩と、微生物または微生物を破砕して調製された固定化酵素を作用させる溶液のことである。このように高濃度のグルタミン酸及び/またはグルタミン酸塩を含む反応液を使用したとしてもGABAの生産が阻害されずに、GABAを生産することができる。
【0071】
これらグルタミン酸及び/またはグルタミン酸塩は、すべて溶液中に溶けている必要はない。グルタミン酸及び/またはグルタミン酸塩すべてが溶けていない状態であってもGABAを生産することができる。
【0072】
グルタミン酸及び/またはグルタミン酸塩と微生物または微生物を破砕して調製された固定化酵素との上記以外の作用条件は、微生物または微生物を破砕して調製された酵素溶液を作用させることにより、グルタミン酸及び/またはグルタミン酸塩からGABAを生産でき、本発明の効果が得られるものであれば限定されない。
【0073】
例えば、グルタミン酸及び/またはグルタミン酸塩と微生物とを作用させる場合、これらの作用は使用される微生物が増殖可能な栄養成分を含有しない条件下で行ってもよく、また該栄養成分を含有する条件下で行ってもよい。好ましくは、これらの作用は栄養成分を含有しない条件下で行われる。栄養成分を含有しない条件では、反応液中には栄養成分以外の物質が含まれていてもよい。
【0074】
また、グルタミン酸及び/またはグルタミン酸塩と微生物とを作用させる場合、ほかの作用条件としては、反応液中のpH、作用温度、作用時間、微生物の濃度などが挙げられるが、これらはグルタミン酸及び/またはグルタミン酸塩からGABAが生産されるかぎり限定されず、使用する微生物の種類や濃度、グルタミン酸及び/またはグルタミン酸塩の濃度、反応液中の緩衝液成分の有無及び栄養成分の有無などに応じて適宜調整すればよい。これらの条件の値としては前記の値を適用できる。
【0075】
また、グルタミン酸及び/またはグルタミン酸塩と微生物を破砕して調製された固定化酵素とを作用させる場合、緩衝成分及び補酵素の少なくとも一方を含有する条件下で行ってもよく、緩衝成分及び補酵素を含有しない条件で行ってもよい。好ましくは、これらの作用は、前記栄養成分、緩衝成分及び補酵素を含有しない条件で行われる。当該条件では、反応液中には栄養成分、緩衝成分及び補酵素以外の物質が含まれていてもよい。さらに好ましくは、これらの作用は、微生物を破砕して調製された固定化酵素を、グルタミン酸と水の混合液に添加することにより行われる。
【0076】
グルタミン酸及び/またはグルタミン酸塩と微生物を破砕して調製された固定化酵素とを作用させる場合、ほかの作用条件としては、反応液のpH、作用温度、作用時間、微生物を破砕して調製された酵素溶液の種類及び濃度などが挙げられるが、これらはグルタミン酸及び/またはグルタミン酸塩からGABAが生産されるかぎり限定されず、使用する微生物の種類、反応液中の栄養成分、緩衝液成分及び栄養成分の有無などに応じて適宜調整す
ればよい。これらの条件の値としては前記の値を適用できる。
【0077】
2−ピロリドン合成方法
本発明の2−ピロリドン合成方法は、上記のGABA生産方法(1)又は(2)で生産されたGABAを加熱処理して2−ピロリドンを合成する工程を含むことを特徴とする。
【0078】
前述のようにして生産されたGABAを用いる際、反応液から分離・精製されたGABAを加熱してもよく、得られた反応後の溶液そのものを加熱してもよい。得られた反応液そのものを加熱する場合には、GABAを分離・精製する手間が省け、また分離時に生じ得るGABAの損失を回避することができる。また、前述のようにして生産されたGABAを含む溶液を、更に電気透析等を使用する濃縮工程に供し、当該濃縮された溶液を加熱してもよい。
【0079】
分離・精製したGABAはそのまま加熱してもよく、またGABAを種々の溶媒に添加し、その後、当該溶媒とともに加熱してもよい。溶媒としては水、酢酸、酢酸塩水溶液、塩酸、水酸化ナトリウム水溶液、各種緩衝液、培地を含む水溶液、ジメチルスルホキシド(DMSO)、2−ピロリドンなどの有機溶媒が例示され、好ましくは水、酢酸水溶液、投入するGABAのモル量の10%以下の酸もしくはアルカリ量を含む水溶液、DMSOや2−ピロリドンなどのように200℃まで安定な有機溶媒であり、さらに好ましくは水、酢酸水溶液、2−ピロリドンである。例えば、溶媒として水を用いた場合には、迅速に2−ピロリドンを合成することができる。また、例えば溶媒として酢酸水溶液を用いた場合には、反応系の着色を抑制することができる。この場合、酢酸は2−ピロリドンの生成速度を抑制するので少ない方が望ましく、酢酸の量は反応系内のGABAのモル数の20%以下が望ましい。また、2−ピロリドンそのものを溶媒として用いた場合、反応温度を下げることができ、かつ、精製が容易である。
【0080】
また、前述のようにして微生物を使用して生産されたGABAを使用する場合、好ましくは、反応液は栄養成分を含有していないものであり、さらに好ましくは養成分及び緩衝液成分のいずれも含有していないものである。これらの反応溶媒は、得られた反応液そのものを加熱する場合に特に好ましい。また、前述のようにして微生物を破砕して調製された酵素溶液(固定化酵素)を使用して生産されたGABAを使用する場合、好ましくは、反応液は栄養成分を含有していないものであり、さらに好ましくは栄養成分、緩衝液成分及び補酵素のいずれも含有していないものである。これらの反応溶媒は、得られた反応後の溶液そのものを加熱する場合に特に好ましい。
【0081】
このような反応溶媒であれば、GABAを加熱する前に該反応液からGABAを分離・精製するという手順を省いた場合であっても、より迅速に2−ピロリドンを合成することができる。その場合、系内に残存していたグルタミン酸は環化し、2−ピロリドンより高沸点分であるピログルタミン酸となり、2−ピロリドンの減圧蒸留により容易に分離される。
【0082】
また、反応液が緩衝液成分または培地成分の少なくともいずれか一方を含有する場合には、得られた反応液をそのまま加熱してもよいが、pHが酸もしくはアルカリ側に偏る場合あるいはGABAの塩を形成する場合、反応速度が低下するので、反応液からGABAを分離・精製し、得られたGABAを加熱することが好ましい。得られたGABAは、必要に応じて溶媒に添加され、その後に加熱されてもよい。
【0083】
加熱条件は、GABAから2−ピロリドンが合成されるかぎり限定されず、GABAの濃度、溶媒の有無及び種類などにより適宜調整できる。例えば加熱温度は水もしくは無溶媒の場合、200℃以上、好ましくは210〜240℃、さらに好ましくは220℃である。
【0084】
該加熱は有機溶媒存在下で加熱してもよく、有機溶媒としてはDMSO、DMF、ピロ
リドンなどの高沸点の有機溶媒が例示される。有機溶媒を用いると、加熱温度を低くすることができる。例えば加熱温度は150℃以上、好ましくは170〜200℃、さらに好ましくは180℃で副反応が起こることなく2−ピロリドンが合成される。ただし、溶媒の沸点に注意すべきである。
【0085】
ポリアミド4合成方法
本発明のポリアミド4合成方法は、上記の方法で合成された2−ピロリドンを開環重合してポリアミド4を合成する工程を含むことを特徴とする。
【0086】
例えば、2−ピロリドンを、減圧蒸留などによる精製、及び乾燥後、開環重合してポリアミド4を合成することができる。開環重合は公知の方法に従い適宜行うことができ、例えば2−ピロリドンを金属ナトリウムなどの塩基で活性化させ、酸塩化物を開始剤として用い、25〜90℃で10分以上の反応時間で行うことができる。
【0087】
N−メチル−2−ピロリドン合成方法
本発明のN−メチル−2−ピロリドン合成方法は、上記の方法で合成された2−ピロリドンをN−メチル化してN−メチル−2−ピロリドンを合成する工程を含むことを特徴とする。
【0088】
N−メチル化は公知の方法に従い適宜行うことができ、例えば、塩基触媒下、ヨウ化メチルを作用させて合成できる。
【0089】
ポリビニルピロリドン合成方法
本発明のポリビニルピロリドン合成方法は、上記の方法で合成された2−ピロリドンをN−ビニル化し、重合してポリビニルピロリドンを合成する工程を含むことを特徴とする。
【0090】
N−ビニル−2−ピロリドンの合成は公知の方法に従い適宜行うことができ、例えばアルカリ触媒存在下、アセチレンを反応させて得ることができ、N−ビニル−2−ピロリドンを重合させるとポリビニルピロリドンが得られる。
【実施例】
【0091】
以下、本発明を更に詳しく説明するため試験例及び実施例を挙げる。しかし、本発明はこれら試験例等になんら限定されるものではない。
【0092】
試験例1.微生物によるGABA生産に対する基質濃度の影響
方法
下記の表1の組成の反応液(約5 mL)を50 mL容遠心管に入れ、37℃で振とう撹拌しながら反応させた。微生物は大腸菌NBRC3806株を用いた。時間毎にサンプリングし、GABA量はHPLCを用いた次の方法で定量した。試料はイソチオシアン酸フェニルでフェニルチオカルバモイル化した後に、アミノ酸分析用カラムWakosil-PTC(Wako)を用い分析した。尚、グ
ルタミン酸は完全に溶解していなかった。
【0093】
【表1】

【0094】
結果
結果を表2及び図2に示す。
【0095】
【表2】

【0096】
75%、80%は水分が無く、サンプリング不能であった。70%は反応が進んで一部サンプリ
ングが可能であった。
【0097】
初期グルタミン酸濃度を10重量%から50重量%に上げることにより、6.7倍高濃度のGABA
溶液を得ることができた。更に、10重量%から65重量%に上げることにより、8倍高濃度のGABA溶液を得ることができた。基質が高濃度であることはGABA生産を阻害することではなかった。より高濃度では反応が進まなかったが、これは水分量の影響と考えられる。
【0098】
実施例1.微生物による連続的高濃度GABA生産
方法
基質グルタミン酸25 g、大腸菌NBRC3806株10 g、H2O 15 mLをフィルター付き容器に入
れ、37℃で撹拌しながら反応させた。反応液は液量を変化させないように等量のH2Oを加
えながら、フィルターを通して連続的に回収した。基質グルタミン酸は適宜添加した。反応液中のGABA及びGlu量はHPLCを用いて上記と同様の方法により定量した。反応開始1時間後から反応液の回収を開始した。
【0099】
結果
結果を図3に示す。反応液回収の平均流速は5.57 mL/hであった。
【0100】
フィルターを通して反応液を回収することにより、連続的に一定濃度のGABA溶液を回収することができた。また、試験例1のバッチ培養と同様に連続培養でも高濃度のグルタミン酸を使用してGABAの生産を行うことができる。回収した反応液中のGABAの濃度は約25重量%であった。
【技術分野】
【0001】
本発明は、バイオマスからγ−アミノ酪酸(GABA)を生産する方法に関する。更に、本発明は当該GABAから2−ピロリドン、2−ピロリドンポリアミド4、N−メチル−2−ピロリドン及びポリビニルピロリドンを合成する方法に関する。
【背景技術】
【0002】
ポリアミド(ナイロン)は軽さ、強度、耐熱性、弾性及び染色性など点で優れているため、繊維、医療用品、工業材料など多くの用途に使用されている。ポリアミドには所謂ナイロン6やナイロン66などの多くの種類が存在するが、これらは主に焼却や埋立てなど、多くのエネルギーを要する方法や手間のかかる方法により処分されている。一方、ポリアミドの一種であるポリアミド4(ナイロン4)は、生分解可能なプラスチックである(非特許文献1)。このため、ポリアミド4は従来のナイロン6などとは異なり、微生物による低エネルギーかつ簡便な分解処理が可能である。このため、ポリアミド4は有用な生分解性のナイロンとして注目されている。
【0003】
このようなポリアミド4は2−ピロリドンから合成されるが、現在、2−ピロリドンは石油から生産されている(非特許文献2)。また、ポリビニルピロリドンも2−ピロリドンから合成される。N−メチル−2−ピロリドンは石油由来のγーブチロラクトンから合成されるが、2−ピロリドンからの合成も可能である。しかしながら、現在の2−ピロリドン合成法では化石資源に依存しており、また多くのエネルギーを必要とする。このため、原料として石油ではなくバイオマスを原料とし、低エネルギー、安価かつ簡便な2−ピロリドン、ポリアミド4、N−メチル−2−ピロリドン、及びポリビニルピロリドンの合成方法を構築することは重要である。
【0004】
一方、2−ピロリドンの原料となるGABAは神経伝達物質として脳内に存在するほか、発芽玄米、漬物などの発酵製品中に多く含まれ、精神安定作用、血圧降下作用などの生理作用がある。そのために、機能性食品として近年注目されている。GABAの生産方法としては微生物や植物に内在する酵素を利用した方法がある。微生物としては食品として利用されるため、発酵食品生産に用いる乳酸菌、カビが主として利用されている(特許文献1、特許文献2、特許文献3)。
【0005】
特許文献4には、グルタミン酸及び/またはグルタミン酸塩と微生物または微生物を破砕して調製された酵素溶液とを作用させてGABAを生産する工程を含む、GABA生産方法が開示されている。そして、グルタミン酸及び/またはグルタミン酸塩と水という、栄養成分及び緩衝液成分を含まない単純な系で微生物を使用したとしても、該微生物の活性を維持させ続けることが可能であり、高収率でグルタミン酸及び/またはグルタミン酸塩からGABAを生産できることが記載されている。
【0006】
しかしながら、グルタミン酸及び/またはグルタミン酸塩からのGABAの生産の更なる効率向上が必要である。
【先行技術文献】
【特許文献】
【0007】
【特許文献1】特開2007−143487号公報
【特許文献2】特開2007−135416号公報
【特許文献3】特開2007−028998号公報
【特許文献4】特開2009−159840号公報
【非特許文献】
【0008】
【非特許文献1】N. Kawasaki et al., Polymer, 46, 9987-9993 (2005).
【非特許文献2】新食品添加物安全性検討委員会報告書p.9(資料2−1:ポリビニルピロリドンの指定に向けた検討のための報告書)、平成18年
【発明の概要】
【発明が解決しようとする課題】
【0009】
本発明は、2−ピロリドン、ポリアミド4、N−メチル−2−ピロリドン、及びポリビニルピロリドンの原料となるGABAを、石油を使用することなく、高効率に生産する方法を提供することを目的とする。また、本発明は、このようにして入手されたGABAから、2−ピロリドン、ポリアミド4、N−メチル−2−ピロリドン及びポリビニルピロリドンを合成する方法を提供することを目的とする。
【課題を解決するための手段】
【0010】
本発明者らは、グルタミン酸及び/またはグルタミン酸塩を高濃度にしてGABAの生産を行うことによって、高濃度の生産物(GABA)溶液を得ることができるという知見を得た。本発明は、これら知見に基づき、更に検討を重ねて完成されたものであり、次のGABAの生産方法等を提供するものである。
【0011】
項1.グルタミン酸及び/またはグルタミン酸塩と水との混合液中で、グルタミン酸及び/またはグルタミン酸塩と微生物または微生物を破砕して調製された酵素溶液とを作用させてGABAを生産する工程を含み、グルタミン酸及び/またはグルタミン酸塩の反応液中の初期濃度が50重量%以上であるGABA生産方法。
【0012】
項2.グルタミン酸及び/またはグルタミン酸塩と水との混合液中で、グルタミン酸及び/またはグルタミン酸塩と微生物または微生物を破砕して調製された固定化酵素とを作用させてGABAを生産する工程を含み、
反応容器から生産されたGABAの回収、且つ反応容器へ水の添加を連続的に行い、グルタミン酸及び/またはグルタミン酸塩の反応液中の初期濃度が50重量%以上であることを特
徴とするGABA生産方法。
【0013】
項3.前記反応容器がフィルター付きの反応容器であり、前記反応液は該フィルターを通して回収され、該フィルター上で撹拌装置を回転させることにより反応液を撹拌することを特徴とする、項2に記載の方法。
【0014】
項4.反応容器から反応液を回収する速度Fが以下の式で求められる値であることを特徴とする、項2又は3に記載の方法。
【0015】
【数1】

CA [mol L-1]:反応液中のGlu濃度
F [L/h]:反応液の回収速度
r [mol L-1 h-1]:体積当たりの反応量
V [L]:反応液体積
pH:反応液のpH
pKa:グルタミン酸の酸解離定数
【0016】
項5.栄養成分を含まない混合液中で、グルタミン酸及び/またはグルタミン酸塩と微生物または微生物を破砕して調製された酵素溶液とを作用させる、項1に記載の方法。
【0017】
項6.栄養成分を含まない混合液中で、グルタミン酸及び/またはグルタミン酸塩と微生物または微生物を破砕して調製された固定化酵素とを作用させる、項2〜4のいずれかに記載の方法。
【0018】
項7.微生物が大腸菌である、項1〜6のいずれかに記載の方法。
【0019】
項8.項1〜7のいずれかで生産されたGABAを加熱処理して2−ピロリドンを合成する工程を含む、2−ピロリドン合成方法。
【0020】
項9.項8に記載の方法で合成された2−ピロリドンを開環重合してポリアミド4を合成する工程を含む、ポリアミド4合成方法。
【0021】
項10.項8に記載の方法で合成された2−ピロリドンをN−メチル化してN−メチル−2−ピロリドンを合成する工程を含む、N−メチル−2−ピロリドン合成方法。
【0022】
項11.項8に記載の方法で合成された2−ピロリドンをN−ビニル化し、重合してポリビニルピロリドンを合成する工程を含む、ポリビニルピロリドン合成方法。
【発明の効果】
【0023】
本発明によれば、石油を使用することなく微生物を利用して、グルタミン酸及び/またはグルタミン酸塩から高濃度のGABAを生産することができる。そのため、反応後の溶液からGABAを精製する際の水分除去に必要なエネルギーは少なくてすみ、高効率にGABAを生産することができる。
【0024】
また、本発明によれば、微生物を利用することにより高効率に得られたGABAから2−ピロリドン、ポリアミド4、N−メチル−2−ピロリドン及びポリビニルピロリドンを合成することができる。
【図面の簡単な説明】
【0025】
【図1】グルタミン酸及び/またはグルタミン酸塩と微生物との作用条件の例を示す図である。
【図2】反応液のグルタミン酸濃度(重量%)とGABAの生産量(重量%)の関係を示すグラフである。凡例は培養時間を表している。
【図3】連続生産における反応時間と反応液中のGABA濃度(重量%)及びGlu濃度(重量%)、並びに回収GABA量(g)の関係を示すグラフである。
【発明を実施するための形態】
【0026】
以下、本発明のGABAの生産方法等について詳細に説明する。
【0027】
GABA生産方法(1)
本発明のGABA生産方法は、グルタミン酸及び/またはグルタミン酸塩と水との混合液中で、グルタミン酸及び/またはグルタミン酸塩と微生物または微生物を破砕して調製された酵素溶液とを作用させてGABAを生産する工程を含み、グルタミン酸及び/またはグルタミン酸塩の反応液中の初期濃度が50重量%以上であることを特徴とする。
【0028】
・グルタミン酸及び/またはグルタミン酸塩
本発明においては、GABAの原料としてグルタミン酸及び/またはグルタミン酸塩が使用
される。ここでグルタミン酸塩は特に限定されないが、グルタミン酸ナトリウム、グルタミン酸塩酸塩、グルタミン酸カリウム、グルタミン酸カルシウム、グルタミン酸マグネシウムなどが例示される。本発明においてGABAの原料としては、好ましくはグルタミン酸、グルタミン酸ナトリウム、グルタミン酸塩酸塩、さらに好ましくはグルタミン酸が使用される。
【0029】
本発明において、上記のようなグルタミン酸及び/またはグルタミン酸塩は、バイオマスから発酵法を用いて生産することもできる。バイオマスとしては限定されないが、サトウキビ、キャッサバ、サトウ大根、及びトウモロコシが例示される。
【0030】
グルタミン酸を生産する微生物は日本で発見され、発酵法によるバイオマスからのグルタミン酸及び/またはグルタミン酸塩生産法は日本で開発された生産システムであり、その生産量は世界で年間約100万トンである。例えば、発酵生産されたグルタミン酸塩の用途としては、ナトリウム塩は主として食品調味料として利用され、その他には医薬品合成の中間体や界面活性剤として利用されている(文献:発酵ハンドブック共立出版 20
01)。このように、バイオマスからのグルタミン酸及び/またはグルタミン酸塩の生産は、公知の方法に従い行うことができる。
【0031】
・微生物
本発明において使用される微生物は、グルタミン酸及び/またはグルタミン酸塩からGABAを生産できるものであれば限定されず、大腸菌、酵母、カビ、乳酸菌などが例示される。これらは、グルタミン酸デカルボキシラーゼをコードする遺伝子を含む核酸が導入された組み換え体であってもよいが、環境中に放出された際の動物や生態系への影響などを考えると、微生物は非組み換え体である方が容易に使用できる。例えば、大腸菌を例に挙げると、大腸菌NBRC3806株、及び大腸菌NBRC12713が例示される。また、乳酸菌を例に挙げると、ラクトバシラス・ブレビス(Lactobacillus brevis) NBRC1
2005、及びラクトコッカス・ラクティス(Lactococcus lactis) NBRC10093
3が例示される。
【0032】
・微生物を破砕して調製された酵素溶液
本発明において使用される微生物を破砕して調製された酵素溶液は、微生物を破砕して適宜調製されたものであり、かつグルタミン酸及び/またはグルタミン酸塩からGABAを生産できるものであれば限定されない。このような酵素溶液は、従来公知の微生物から酵素溶液を調製する方法により、当業者が適宜製造することができる。ここで使用される微生物としては、前記の微生物が挙げられ、同様に、組み換え体であっても非組み換え体であってもよい。また、必要に応じて酵素を固定化して用いてもよい。
【0033】
酵素を固定化する方法としては、公知の方法を使用できるが、例えば、担体結合法、架橋法、及び包括法が挙げられる。担体結合法は、水不溶性の固定化担体に酵素を化学的又は物理的に結合させる方法である。架橋法は、酵素を2個又はそれ以上の官能基を持った試薬で架橋する方法である。包括法は酵素を高分子ゲルの微細な格子の中に包み込むか、又は半透膜性の高分子の皮膜によって被覆する方法である。
【0034】
・グルタミン酸及び/またはグルタミン酸塩と微生物または微生物を破砕して調製された酵素溶液との作用条件
ここで、「作用」とは、グルタミン酸及び/またはグルタミン酸塩からGABAを生産するために、グルタミン酸及び/またはグルタミン酸塩と微生物または微生物を破砕して調製された酵素溶液とを混合し、一定時間共存させておくことを意味する。
【0035】
本発明においてグルタミン酸及び/またはグルタミン酸塩の反応液中の初期濃度は、50
重量%以上、好ましくは55重量%以上、より好ましくは60〜65重量%である。ここで、反
応液とは、グルタミン酸及び/またはグルタミン酸塩と、微生物または微生物を破砕して調製された酵素溶液を作用させる溶液のことである。このように高濃度のグルタミン酸及び/またはグルタミン酸塩を含む反応液を使用したとしてもGABAの生産が阻害されずに、高濃度のGABAを生産することができる。
【0036】
これらグルタミン酸及び/またはグルタミン酸塩は、すべて溶液中に溶けている必要はない。グルタミン酸及び/またはグルタミン酸塩すべてが溶液中に溶けていない状態であってもGABAを生産することができる。
【0037】
グルタミン酸及び/またはグルタミン酸塩と微生物または微生物を破砕して調製された酵素溶液との上記以外の作用条件は、微生物または微生物を破砕して調製された酵素溶液を作用させることにより、グルタミン酸及び/またはグルタミン酸塩からGABAを生産でき、本発明の効果が得られるものであれば限定されない。
【0038】
例えば、グルタミン酸及び/またはグルタミン酸塩と微生物とを作用させる場合、これらの作用は使用される微生物が増殖可能な栄養成分を含有しない条件下で行ってもよく、また該栄養成分を含有する条件下で行ってもよい。好ましくは、これらの作用は栄養成分を含有しない条件下で行われる。栄養成分を含有しない条件では、反応液中には栄養成分以外の物質が含まれていてもよい。ここで、本発明における栄養成分とは微生物が増殖するために必要な成分であり、このような成分としては、炭素源(グルコース、フルクトー
ス、グリセロール、スターチ等)、及び無機若しくは有機窒素源(硫酸アンモニウム、塩化アンモニウム、カゼインの加水分解物、酵母抽出物、ポリペプトン、バクトトリプトン、ビーフ抽出物等)が挙げられる。
【0039】
これらの作用が栄養成分を含有しない条件下で行われる場合、例えば、グルタミン酸及び/またはグルタミン酸塩と微生物とは、以下のようにして作用させることができる。
【0040】
例えば、使用される微生物を、該微生物が増殖可能な栄養培地で培養し、集菌、洗浄することにより培地成分を除去し、得られた微生物を、グルタミン酸及び/またはグルタミン酸塩と水の混合液に添加することにより、グルタミン酸及び/またはグルタミン酸塩と微生物とを作用させることができる(例えば図1の〔1−1〕参照)。このように微生物をグルタミン酸及び/またはグルタミン酸塩と水の混合液に添加した場合であっても、微生物の活性は長時間低下することなく、効率よくGABAを生産することができる。
【0041】
また、例えば、同様に培地成分を除去して得られた微生物を、グルタミン酸及び/またはグルタミン酸塩と緩衝液の混合液に添加することにより、グルタミン酸及び/またはグルタミン酸塩と微生物とを作用させることができる(例えば図1の〔1−2〕参照)。
【0042】
好ましくは、培地成分を除去して得られた微生物を、グルタミン酸及び/またはグルタミン酸塩と水の混合溶液に添加することにより、グルタミン酸及び/またはグルタミン酸塩と微生物とを作用させることにより行われる。
【0043】
ここで、増殖可能な培地での培養回数は限定されず、いわゆる本培養の前に、前培養を単回又は複数回行ってもよい。好ましくは、本培養の前に、前培養を単回又は複数回行われる。増殖可能な培地は、使用する微生物の種類に応じて、適宜選択できる。
【0044】
グルタミン酸及び/またはグルタミン酸塩と微生物との作用が栄養成分を含有する条件下で行われる場合、例えば、グルタミン酸及び/またはグルタミン酸塩と微生物とは、以下のようにして作用させることができる。
【0045】
例えば、使用される微生物を、該微生物が増殖可能な栄養培地で培養し、得られた培養液にグルタミン酸及び/またはグルタミン酸塩を添加することにより作用させることができる(例えば図1の〔2−1〕、〔2−1’〕参照)。また、例えば、使用される微生物を、該微生物が増殖可能な栄養培地で培養し、得られた培養液を、別に用意しておいたグルタミン酸及び/またはグルタミン酸塩と新しい栄養培地との混合液に添加することにより作用させることができる(例えば図1の〔2−2〕、〔2−2’〕参照)。また、例えば、使用される微生物を、該微生物が増殖可能な栄養培地で培養し、集菌、洗浄することにより得た微生物を、別に用意しておいたグルタミン酸及び/またはグルタミン酸塩と新しい栄養培地との混合液に添加することにより作用させることができる(例えば図1の〔2−3〕参照)。
【0046】
ここで、別に用意する混合液に含まれる新たな培地は、微生物が生育できるものであれば、使用される微生物を培養した培地と同一でもよく、異なってもよい。また、グルタミン酸及び/またはグルタミン酸塩と微生物との作用が栄養成分を含有する条件下で行われる場合も、増殖可能な培地での培養回数は限定されず、いわゆる本培養の前に、前培養を単回又は複数回行ってもよい。好ましくは、本培養の前に、前培養を単回又は複数回行われる。増殖可能な培地は、使用する微生物の種類に応じて、適宜選択できる。
【0047】
また、グルタミン酸及び/またはグルタミン酸塩と微生物とを作用させる場合、ほかの作用条件としては、反応液中のpH、作用温度、作用時間、微生物の濃度などが挙げられるが、これらはグルタミン酸及び/またはグルタミン酸塩からGABAが生産されるかぎり限定されず、使用する微生物の種類や濃度、グルタミン酸及び/またはグルタミン酸塩の濃度、反応液中の緩衝液成分の有無及び栄養成分の有無などに応じて適宜調整すればよい。
【0048】
例えば、反応液のpHはグルタミン酸及び/またはグルタミン酸塩からGABAが生産されるかぎり限定されないが大腸菌の場合は酸性域、好ましくはpH3.5〜5.5、さらに好ましくはpH4.5〜5.5である。例えば、前述のように、グルタミン酸と水の混合溶液中で、グルタミン酸と微生物とを作用させる場合には、得られる反応液は栄養成分及び緩衝液成分を含んでおらず、従って、pH値を調整しなくともこれらを好適なpH値とすることができる。グルタミン酸塩と微生物とを作用させる場合には、適宜pHを調整すればよい。
【0049】
作用温度は、グルタミン酸及び/またはグルタミン酸塩からGABAを生産でき、かつ使用する微生物が生育可能であるかぎり限定されず、使用する微生物に応じて適宜調整できる。大腸菌の場合、好ましくは20〜55℃、さらに好ましくは25〜37℃である。
【0050】
作用時間も、グルタミン酸及び/またはグルタミン酸塩からGABAが生産されるかぎり限定されず、反応液のpH、反応温度、使用する微生物の種類や濃度、グルタミン酸及び/またはグルタミン酸塩の濃度、反応液中の緩衝液成分の有無及び栄養成分の有無などその溶媒の組成に応じて適宜調整すればよい。例えば、反応液中のGABA濃度があるレベルに到達した際に、これらの作用を終了させてもよい。また例えば、反応液中のGABA濃度があるレベルに到達した際に、生産されたGABAを分離し、当該反応液中で、残存するグルタミン酸及び/またはグルタミン酸塩と微生物との作用をさらに続けてもよい。この場合、必要に応じて反応液中にグルタミン酸及び/またはグルタミン酸塩を新たに添加してもよい。
【0051】
微生物の濃度も、グルタミン酸及び/またはグルタミン酸塩からGABAが生産されるかぎり限定されず、使用する微生物の種類、グルタミン酸及び/またはグルタミン酸塩の濃度、pH、反応温度、溶媒の組成などに応じて適宜調整すればよい。例えば微生物の濃度は0.1〜30g/100mL、好ましくは0.5〜10g/100mL、さらに好ましく
は0.5〜5g/100mLである。
【0052】
また、グルタミン酸及び/またはグルタミン酸塩と微生物を破砕して調製された酵素溶液とを作用させる場合、緩衝成分及び補酵素の少なくとも一方を含有する条件下で行ってもよく、緩衝成分及び補酵素を含有しない条件で行ってもよい。好ましくは、これらの作用は、前記栄養成分、緩衝成分及び補酵素を含有しない条件で行われる。当該条件では、反応液中には栄養成分、緩衝成分及び補酵素以外の物質が含まれていてもよい。さらに好ましくは、これらの作用は、微生物を破砕して調製された酵素溶液を、グルタミン酸と水の混合液に添加することにより行われる。
【0053】
グルタミン酸及び/またはグルタミン酸塩と微生物を破砕して調製された酵素溶液とを作用させる場合、ほかの作用条件としては、反応液のpH、作用温度、作用時間、微生物を破砕して調製された酵素溶液の種類及び濃度などが挙げられるが、これらはグルタミン酸及び/またはグルタミン酸塩からGABAが生産されるかぎり限定されず、使用する微生物の種類、反応液中の栄養成分、緩衝液成分及び栄養成分の有無などに応じて適宜調整すればよい。
【0054】
例えば、反応液のpHはグルタミン酸及び/またはグルタミン酸塩からGABAが生産されるかぎり限定されないが、酵素として大腸菌由来の酵素を使用した場合は酸性域、好ましくはpH3.5〜5.5、さらに好ましくはpH4.5〜5.5である。例えば、前述のように、グルタミン酸と水の混合液中で、グルタミン酸と微生物を破砕して調製された酵素溶液とを作用させる場合には、得られる反応液は栄養成分及び緩衝液成分を含んでおらず、従って、pH値を調整しなくともこれらを好適なpH値とすることができる。グルタミン酸塩と微生物を破砕して調製された酵素溶液とを作用させる場合には、適宜pHを調整すればよい。
【0055】
作用温度は、グルタミン酸及び/またはグルタミン酸塩からGABAを生産できるかぎり限定されず、使用する酵素に応じて適宜調整できる。酵素が大腸菌由来の酵素の場合、好ましくは20〜55℃、さらに好ましくは25〜37℃である。
【0056】
作用時間も、グルタミン酸及び/またはグルタミン酸塩からGABAが生産されるかぎり限定されず、反応液のpH、反応温度、使用する微生物の種類や濃度、グルタミン酸及び/またはグルタミン酸塩の濃度、反応液中の緩衝液成分の有無及び栄養成分の有無などその溶媒の組成に応じて適宜調整すればよい。例えば、反応液中のGABA濃度があるレベルに到達した際に、これらの作用を終了させてもよい。また例えば、反応液中のGABA濃度があるレベルに到達した際に、生産されたGABAを分離し、当該反応液中で、残存するグルタミン酸及び/またはグルタミン酸塩と微生物を破砕して調製された酵素溶液との作用をさらに続けてもよい。この場合、必要に応じて反応液中にグルタミン酸及び/またはグルタミン酸塩を新たに添加してもよい。
【0057】
微生物を破砕して調製された酵素溶液の濃度も、グルタミン酸及び/またはグルタミン酸塩からGABAが生産されるかぎり限定されず、使用する微生物の種類、グルタミン酸及び/またはグルタミン酸塩の濃度、pH、反応温度、溶媒の組成などに応じて適宜調整すればよい。例えば酵素溶液のタンパク濃度は0.1〜30mg/mL、好ましくは0.5〜10mg/mL、さらに好ましくは1〜5mg/mLである。
【0058】
GABA生産方法(2)
本発明のGABA生産方法は、グルタミン酸及び/またはグルタミン酸塩と水との混合液中で、グルタミン酸及び/またはグルタミン酸塩と微生物または微生物を破砕して調製された固定化酵素とを作用させてGABAを生産する工程を含み、反応容器から生産されたGABAの
回収、且つ反応容器へ水の添加を連続的に行い、グルタミン酸及び/またはグルタミン酸塩の反応液中の初期濃度が50重量%以上であることを特徴とする。
【0059】
グルタミン酸及び/またはグルタミン酸塩、並びに微生物については前述したものと同様である。
【0060】
・微生物を破砕して調製された固定化酵素
本発明において使用される微生物を破砕して調製された固定化酵素は、微生物を破砕して適宜調製されたものであり、かつグルタミン酸及び/またはグルタミン酸塩からGABAを生産できるものであれば限定されない。このような固定化酵素に用いる酵素は、従来公知の微生物から酵素溶液を調製する方法により、当業者が適宜製造することができる。ここで使用される微生物としては、前述した微生物が挙げられ、同様に、組み換え体であっても非組み換え体であってもよい。
【0061】
酵素を固定化する方法は、前述したものと同様である。
【0062】
・連続操作
本発明では、反応容器から生産されたGABAの回収、且つ反応容器へ水の添加を連続的に行うことを特徴とする。
【0063】
このように連続操作でもバッチ操作で行うのと同様に、高濃度のグルタミン酸及び/またはグルタミン酸塩を使用してGABAの生産を行うことができる。
【0064】
反応容器への水の添加に加えて、必要に応じてグルタミン酸及び/またはグルタミン酸塩を新たに添加してもよい。
【0065】
上記反応容器としては、公知のものを使用することができるが、好ましくは、フィルター付きの反応容器であって、当該フィルター上に撹拌装置を有するものである。このような反応容器を使用することにより、フィルター上で撹拌装置を回転させながら、反応液をフィルターを通して回収することができので、溶解していないグルタミン酸及び/またはグルタミン酸塩によりフィルターが詰まることが無く、連続的にGABAの排出を行うことが可能になる。
【0066】
上記撹拌装置としては、反応液を撹拌できるものであれば特に限定されないが、例えば、マグネットスターラー、撹拌翼、プロペラなどを挙げられる。
【0067】
反応液の最適回収速度Fは、例えば反応系のpHを至適状態に保つ下記の式により計算で
求めることができる。反応液量を変化させないために、回収速度と同じ速度でH2Oを反応
液に加える。基質の反応系への供給は、溶解せずに系内に固体状で存在する基質から連続的に供給される。
【0068】
【数2】

CA [mol L-1]:反応液中のGlu濃度
F [L/h]:反応液の回収速度
r [mol L-1 h-1]:(反応液の)体積当たりの反応量
V [L]:反応液体積
pH:反応液のpH
pKa:グルタミン酸の酸解離定数
【0069】
・グルタミン酸及び/またはグルタミン酸塩と微生物または微生物を破砕して調製された固定化酵素との作用条件
ここで、「作用」とは、グルタミン酸及び/またはグルタミン酸塩からGABAを生産するために、グルタミン酸及び/またはグルタミン酸塩と微生物または微生物を破砕して調製された固定化酵素とを混合し、共存させておくことを意味する。
【0070】
本発明においてグルタミン酸及び/またはグルタミン酸塩の反応液中の初期濃度は、50重量%以上、好ましくは55重量%以上、より好ましくは60〜65重量%である。ここで、反
応液とは、グルタミン酸及び/またはグルタミン酸塩と、微生物または微生物を破砕して調製された固定化酵素を作用させる溶液のことである。このように高濃度のグルタミン酸及び/またはグルタミン酸塩を含む反応液を使用したとしてもGABAの生産が阻害されずに、GABAを生産することができる。
【0071】
これらグルタミン酸及び/またはグルタミン酸塩は、すべて溶液中に溶けている必要はない。グルタミン酸及び/またはグルタミン酸塩すべてが溶けていない状態であってもGABAを生産することができる。
【0072】
グルタミン酸及び/またはグルタミン酸塩と微生物または微生物を破砕して調製された固定化酵素との上記以外の作用条件は、微生物または微生物を破砕して調製された酵素溶液を作用させることにより、グルタミン酸及び/またはグルタミン酸塩からGABAを生産でき、本発明の効果が得られるものであれば限定されない。
【0073】
例えば、グルタミン酸及び/またはグルタミン酸塩と微生物とを作用させる場合、これらの作用は使用される微生物が増殖可能な栄養成分を含有しない条件下で行ってもよく、また該栄養成分を含有する条件下で行ってもよい。好ましくは、これらの作用は栄養成分を含有しない条件下で行われる。栄養成分を含有しない条件では、反応液中には栄養成分以外の物質が含まれていてもよい。
【0074】
また、グルタミン酸及び/またはグルタミン酸塩と微生物とを作用させる場合、ほかの作用条件としては、反応液中のpH、作用温度、作用時間、微生物の濃度などが挙げられるが、これらはグルタミン酸及び/またはグルタミン酸塩からGABAが生産されるかぎり限定されず、使用する微生物の種類や濃度、グルタミン酸及び/またはグルタミン酸塩の濃度、反応液中の緩衝液成分の有無及び栄養成分の有無などに応じて適宜調整すればよい。これらの条件の値としては前記の値を適用できる。
【0075】
また、グルタミン酸及び/またはグルタミン酸塩と微生物を破砕して調製された固定化酵素とを作用させる場合、緩衝成分及び補酵素の少なくとも一方を含有する条件下で行ってもよく、緩衝成分及び補酵素を含有しない条件で行ってもよい。好ましくは、これらの作用は、前記栄養成分、緩衝成分及び補酵素を含有しない条件で行われる。当該条件では、反応液中には栄養成分、緩衝成分及び補酵素以外の物質が含まれていてもよい。さらに好ましくは、これらの作用は、微生物を破砕して調製された固定化酵素を、グルタミン酸と水の混合液に添加することにより行われる。
【0076】
グルタミン酸及び/またはグルタミン酸塩と微生物を破砕して調製された固定化酵素とを作用させる場合、ほかの作用条件としては、反応液のpH、作用温度、作用時間、微生物を破砕して調製された酵素溶液の種類及び濃度などが挙げられるが、これらはグルタミン酸及び/またはグルタミン酸塩からGABAが生産されるかぎり限定されず、使用する微生物の種類、反応液中の栄養成分、緩衝液成分及び栄養成分の有無などに応じて適宜調整す
ればよい。これらの条件の値としては前記の値を適用できる。
【0077】
2−ピロリドン合成方法
本発明の2−ピロリドン合成方法は、上記のGABA生産方法(1)又は(2)で生産されたGABAを加熱処理して2−ピロリドンを合成する工程を含むことを特徴とする。
【0078】
前述のようにして生産されたGABAを用いる際、反応液から分離・精製されたGABAを加熱してもよく、得られた反応後の溶液そのものを加熱してもよい。得られた反応液そのものを加熱する場合には、GABAを分離・精製する手間が省け、また分離時に生じ得るGABAの損失を回避することができる。また、前述のようにして生産されたGABAを含む溶液を、更に電気透析等を使用する濃縮工程に供し、当該濃縮された溶液を加熱してもよい。
【0079】
分離・精製したGABAはそのまま加熱してもよく、またGABAを種々の溶媒に添加し、その後、当該溶媒とともに加熱してもよい。溶媒としては水、酢酸、酢酸塩水溶液、塩酸、水酸化ナトリウム水溶液、各種緩衝液、培地を含む水溶液、ジメチルスルホキシド(DMSO)、2−ピロリドンなどの有機溶媒が例示され、好ましくは水、酢酸水溶液、投入するGABAのモル量の10%以下の酸もしくはアルカリ量を含む水溶液、DMSOや2−ピロリドンなどのように200℃まで安定な有機溶媒であり、さらに好ましくは水、酢酸水溶液、2−ピロリドンである。例えば、溶媒として水を用いた場合には、迅速に2−ピロリドンを合成することができる。また、例えば溶媒として酢酸水溶液を用いた場合には、反応系の着色を抑制することができる。この場合、酢酸は2−ピロリドンの生成速度を抑制するので少ない方が望ましく、酢酸の量は反応系内のGABAのモル数の20%以下が望ましい。また、2−ピロリドンそのものを溶媒として用いた場合、反応温度を下げることができ、かつ、精製が容易である。
【0080】
また、前述のようにして微生物を使用して生産されたGABAを使用する場合、好ましくは、反応液は栄養成分を含有していないものであり、さらに好ましくは養成分及び緩衝液成分のいずれも含有していないものである。これらの反応溶媒は、得られた反応液そのものを加熱する場合に特に好ましい。また、前述のようにして微生物を破砕して調製された酵素溶液(固定化酵素)を使用して生産されたGABAを使用する場合、好ましくは、反応液は栄養成分を含有していないものであり、さらに好ましくは栄養成分、緩衝液成分及び補酵素のいずれも含有していないものである。これらの反応溶媒は、得られた反応後の溶液そのものを加熱する場合に特に好ましい。
【0081】
このような反応溶媒であれば、GABAを加熱する前に該反応液からGABAを分離・精製するという手順を省いた場合であっても、より迅速に2−ピロリドンを合成することができる。その場合、系内に残存していたグルタミン酸は環化し、2−ピロリドンより高沸点分であるピログルタミン酸となり、2−ピロリドンの減圧蒸留により容易に分離される。
【0082】
また、反応液が緩衝液成分または培地成分の少なくともいずれか一方を含有する場合には、得られた反応液をそのまま加熱してもよいが、pHが酸もしくはアルカリ側に偏る場合あるいはGABAの塩を形成する場合、反応速度が低下するので、反応液からGABAを分離・精製し、得られたGABAを加熱することが好ましい。得られたGABAは、必要に応じて溶媒に添加され、その後に加熱されてもよい。
【0083】
加熱条件は、GABAから2−ピロリドンが合成されるかぎり限定されず、GABAの濃度、溶媒の有無及び種類などにより適宜調整できる。例えば加熱温度は水もしくは無溶媒の場合、200℃以上、好ましくは210〜240℃、さらに好ましくは220℃である。
【0084】
該加熱は有機溶媒存在下で加熱してもよく、有機溶媒としてはDMSO、DMF、ピロ
リドンなどの高沸点の有機溶媒が例示される。有機溶媒を用いると、加熱温度を低くすることができる。例えば加熱温度は150℃以上、好ましくは170〜200℃、さらに好ましくは180℃で副反応が起こることなく2−ピロリドンが合成される。ただし、溶媒の沸点に注意すべきである。
【0085】
ポリアミド4合成方法
本発明のポリアミド4合成方法は、上記の方法で合成された2−ピロリドンを開環重合してポリアミド4を合成する工程を含むことを特徴とする。
【0086】
例えば、2−ピロリドンを、減圧蒸留などによる精製、及び乾燥後、開環重合してポリアミド4を合成することができる。開環重合は公知の方法に従い適宜行うことができ、例えば2−ピロリドンを金属ナトリウムなどの塩基で活性化させ、酸塩化物を開始剤として用い、25〜90℃で10分以上の反応時間で行うことができる。
【0087】
N−メチル−2−ピロリドン合成方法
本発明のN−メチル−2−ピロリドン合成方法は、上記の方法で合成された2−ピロリドンをN−メチル化してN−メチル−2−ピロリドンを合成する工程を含むことを特徴とする。
【0088】
N−メチル化は公知の方法に従い適宜行うことができ、例えば、塩基触媒下、ヨウ化メチルを作用させて合成できる。
【0089】
ポリビニルピロリドン合成方法
本発明のポリビニルピロリドン合成方法は、上記の方法で合成された2−ピロリドンをN−ビニル化し、重合してポリビニルピロリドンを合成する工程を含むことを特徴とする。
【0090】
N−ビニル−2−ピロリドンの合成は公知の方法に従い適宜行うことができ、例えばアルカリ触媒存在下、アセチレンを反応させて得ることができ、N−ビニル−2−ピロリドンを重合させるとポリビニルピロリドンが得られる。
【実施例】
【0091】
以下、本発明を更に詳しく説明するため試験例及び実施例を挙げる。しかし、本発明はこれら試験例等になんら限定されるものではない。
【0092】
試験例1.微生物によるGABA生産に対する基質濃度の影響
方法
下記の表1の組成の反応液(約5 mL)を50 mL容遠心管に入れ、37℃で振とう撹拌しながら反応させた。微生物は大腸菌NBRC3806株を用いた。時間毎にサンプリングし、GABA量はHPLCを用いた次の方法で定量した。試料はイソチオシアン酸フェニルでフェニルチオカルバモイル化した後に、アミノ酸分析用カラムWakosil-PTC(Wako)を用い分析した。尚、グ
ルタミン酸は完全に溶解していなかった。
【0093】
【表1】

【0094】
結果
結果を表2及び図2に示す。
【0095】
【表2】

【0096】
75%、80%は水分が無く、サンプリング不能であった。70%は反応が進んで一部サンプリ
ングが可能であった。
【0097】
初期グルタミン酸濃度を10重量%から50重量%に上げることにより、6.7倍高濃度のGABA
溶液を得ることができた。更に、10重量%から65重量%に上げることにより、8倍高濃度のGABA溶液を得ることができた。基質が高濃度であることはGABA生産を阻害することではなかった。より高濃度では反応が進まなかったが、これは水分量の影響と考えられる。
【0098】
実施例1.微生物による連続的高濃度GABA生産
方法
基質グルタミン酸25 g、大腸菌NBRC3806株10 g、H2O 15 mLをフィルター付き容器に入
れ、37℃で撹拌しながら反応させた。反応液は液量を変化させないように等量のH2Oを加
えながら、フィルターを通して連続的に回収した。基質グルタミン酸は適宜添加した。反応液中のGABA及びGlu量はHPLCを用いて上記と同様の方法により定量した。反応開始1時間後から反応液の回収を開始した。
【0099】
結果
結果を図3に示す。反応液回収の平均流速は5.57 mL/hであった。
【0100】
フィルターを通して反応液を回収することにより、連続的に一定濃度のGABA溶液を回収することができた。また、試験例1のバッチ培養と同様に連続培養でも高濃度のグルタミン酸を使用してGABAの生産を行うことができる。回収した反応液中のGABAの濃度は約25重量%であった。
【特許請求の範囲】
【請求項1】
グルタミン酸及び/またはグルタミン酸塩と水との混合液中で、グルタミン酸及び/またはグルタミン酸塩と微生物または微生物を破砕して調製された酵素溶液とを作用させてγ−アミノ酪酸(GABA)を生産する工程を含み、グルタミン酸及び/またはグルタミン酸塩の反応液中の初期濃度が50重量%以上であるGABA生産方法。
【請求項2】
グルタミン酸及び/またはグルタミン酸塩と水との混合液中で、グルタミン酸及び/またはグルタミン酸塩と微生物または微生物を破砕して調製された固定化酵素とを作用させてGABAを生産する工程を含み、
反応容器から生産されたGABAの回収、且つ反応容器へ水の添加を連続的に行い、グルタミン酸及び/またはグルタミン酸塩の反応液中の初期濃度が50重量%以上であることを特
徴とするGABA生産方法。
【請求項3】
前記反応容器がフィルター付きの反応容器であり、前記反応液は該フィルターを通して回収され、該フィルター上で撹拌装置を回転させることにより反応液を撹拌することを特徴とする、請求項2に記載の方法。
【請求項4】
反応容器から反応液を回収する速度Fが以下の式で求められる値であることを特徴とする、請求項2又は3に記載の方法。
【数1】

CA [mol L-1]:反応液中のGlu濃度
F [L/h]:反応液流量
r [mol L-1 h-1]:体積当たりの反応量
V [L]:反応液体積
pH:反応液のpH
pKa:グルタミン酸の酸解離定数
【請求項5】
栄養成分を含まない混合液中で、グルタミン酸及び/またはグルタミン酸塩と微生物または微生物を破砕して調製された酵素溶液とを作用させる、請求項1に記載の方法。
【請求項6】
栄養成分を含まない混合液中で、グルタミン酸及び/またはグルタミン酸塩と微生物または微生物を破砕して調製された固定化酵素とを作用させる、請求項2〜4のいずれかに記載の方法。
【請求項7】
微生物が大腸菌である、請求項1〜6のいずれかに記載の方法。
【請求項8】
請求項1〜7のいずれかで生産されたGABAを加熱処理して2−ピロリドンを合成する工程を含む、2−ピロリドン合成方法。
【請求項9】
請求項8に記載の方法で合成された2−ピロリドンを開環重合してポリアミド4を合成する工程を含む、ポリアミド4合成方法。
【請求項10】
請求項8に記載の方法で合成された2−ピロリドンをN−メチル化してN−メチル−2−ピロリドンを合成する工程を含む、N−メチル−2−ピロリドン合成方法。
【請求項11】
請求項8に記載の方法で合成された2−ピロリドンをN−ビニル化し、重合してポリビニ
ルピロリドンを合成する工程を含む、ポリビニルピロリドン合成方法。
【請求項1】
グルタミン酸及び/またはグルタミン酸塩と水との混合液中で、グルタミン酸及び/またはグルタミン酸塩と微生物または微生物を破砕して調製された酵素溶液とを作用させてγ−アミノ酪酸(GABA)を生産する工程を含み、グルタミン酸及び/またはグルタミン酸塩の反応液中の初期濃度が50重量%以上であるGABA生産方法。
【請求項2】
グルタミン酸及び/またはグルタミン酸塩と水との混合液中で、グルタミン酸及び/またはグルタミン酸塩と微生物または微生物を破砕して調製された固定化酵素とを作用させてGABAを生産する工程を含み、
反応容器から生産されたGABAの回収、且つ反応容器へ水の添加を連続的に行い、グルタミン酸及び/またはグルタミン酸塩の反応液中の初期濃度が50重量%以上であることを特
徴とするGABA生産方法。
【請求項3】
前記反応容器がフィルター付きの反応容器であり、前記反応液は該フィルターを通して回収され、該フィルター上で撹拌装置を回転させることにより反応液を撹拌することを特徴とする、請求項2に記載の方法。
【請求項4】
反応容器から反応液を回収する速度Fが以下の式で求められる値であることを特徴とする、請求項2又は3に記載の方法。
【数1】

CA [mol L-1]:反応液中のGlu濃度
F [L/h]:反応液流量
r [mol L-1 h-1]:体積当たりの反応量
V [L]:反応液体積
pH:反応液のpH
pKa:グルタミン酸の酸解離定数
【請求項5】
栄養成分を含まない混合液中で、グルタミン酸及び/またはグルタミン酸塩と微生物または微生物を破砕して調製された酵素溶液とを作用させる、請求項1に記載の方法。
【請求項6】
栄養成分を含まない混合液中で、グルタミン酸及び/またはグルタミン酸塩と微生物または微生物を破砕して調製された固定化酵素とを作用させる、請求項2〜4のいずれかに記載の方法。
【請求項7】
微生物が大腸菌である、請求項1〜6のいずれかに記載の方法。
【請求項8】
請求項1〜7のいずれかで生産されたGABAを加熱処理して2−ピロリドンを合成する工程を含む、2−ピロリドン合成方法。
【請求項9】
請求項8に記載の方法で合成された2−ピロリドンを開環重合してポリアミド4を合成する工程を含む、ポリアミド4合成方法。
【請求項10】
請求項8に記載の方法で合成された2−ピロリドンをN−メチル化してN−メチル−2−ピロリドンを合成する工程を含む、N−メチル−2−ピロリドン合成方法。
【請求項11】
請求項8に記載の方法で合成された2−ピロリドンをN−ビニル化し、重合してポリビニ
ルピロリドンを合成する工程を含む、ポリビニルピロリドン合成方法。
【図1】


【図2】


【図3】




【図2】


【図3】


【公開番号】特開2011−211993(P2011−211993A)
【公開日】平成23年10月27日(2011.10.27)
【国際特許分類】
【出願番号】特願2010−85618(P2010−85618)
【出願日】平成22年4月2日(2010.4.2)
【出願人】(301021533)独立行政法人産業技術総合研究所 (6,529)
【Fターム(参考)】
【公開日】平成23年10月27日(2011.10.27)
【国際特許分類】
【出願日】平成22年4月2日(2010.4.2)
【出願人】(301021533)独立行政法人産業技術総合研究所 (6,529)
【Fターム(参考)】
[ Back to top ]

