微生物を利用した肥満及び肥満によって引き起こされた代謝性疾患の予防と治療
本発明は、肥満及び肥満によって引き起こされた代謝性疾患の予防と治療に関するもので、特に、腸内細菌叢の変化を通して肥満を予防及び治療することに関するものである。本発明では、自由脂肪酸吸収能が改善された微生物製剤の摂取を通して小腸内細菌の特性改善及び移植で胃腸管内での脂肪酸吸収を減少できることが確認される。本発明では、このような実験結果に基づいて、肥満と肥満によって引き起こされた代謝性疾患の予防及び治療方法、予防及び治療用薬学的組成物と機能性食品、そして、このような目的で使用可能な改良乳酸菌株が提供される。本発明は、現在抗肥満治療剤として最も広く使用されているオルリスタットと同じ水準の体重減少効果を有する。本発明は、小腸内細菌の特性改善及び移植を通して胃腸管内での脂肪酸吸収を防止することによって肥満を治療できることを示す。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、肥満及び肥満によって引き起こされた代謝性疾患の予防と治療に関するものであり、特に、微生物を利用した予防と治療に関するものである。
【背景技術】
【0002】
肥満は、全世界的に問題となっている慢性疾患であり、効果的な治療方法がなく、継続して増加しつつある深刻な疾患である。また、肥満は、他の様々な深刻な慢性疾患をもたらす。肥満によって引き起こされる代謝性疾患としては、高血圧、糖尿病、高脂血症、動脈硬化症、虚血性心臓疾患、脂肪肝、胆石症、関節炎、肺機能障害、生殖器異常などがある。
【0003】
現在、肥満治療剤として使用されている処方薬は、シブトラミン(アボット社のメリディア)とオルリスタット(ロシュ社のゼニカル)である。シブトラミンは、ノルアドレナリンとセロトニンの再吸収を防止することによって食欲を調節し、食物の摂取量を減少させる。しかし、シブトラミンは、中枢神経系に作用する物質という特性のため、心臓搏動と血圧などに影響を与えるという副作用を有している。シブトラミンと異なり、オルリスタットは局所的に作用する。オルリスタットは、胃と小臓の脂肪分解酵素であるリパーゼ(lipase)の阻害剤であって、脂肪の加水分解を妨害する役割をするので、食物で摂取された脂肪の30%程度が体内に吸収されずに排出されるようになり、結果的に体重調節効果を有する。しかし、消化されていない脂肪が胃腸管に沿って移動しながら下痢、脂肪便などの副作用をもたらすが、これは、不便なだけでなく、正常な社会生活を困難にするほどの副作用である。したがって、このような既存の肥満治療剤の問題のため、新しい概念の肥満治療剤が要求されている。
【先行技術文献】
【非特許文献】
【0004】
【非特許文献1】B.S.Drew,A.F.Dixn,J.B.Dixon,Vasc.Health Risk Manag.3,817(2007)
【非特許文献2】P.G.Kopelman,Nature 404,635(2000)
【非特許文献3】Must et al.,J.Am.Med.Assoc.282,1523(1999)
【非特許文献4】R.Padwal,SK Li,DC Lau,Cochrane DatabaseSyst.Rev.3,CD004094(2003)
【非特許文献5】R.S.Padwal,S.R.Majumdar,Lancet 369,71(2007)
【非特許文献6】J.Rolls,D.J.Shide,M.L.Thorwart,J.S.Ulbrecht,Obes.Res.6,1(1998)
【非特許文献7】G.A.Bray et al.,Obes.Res.7,189(1999)
【非特許文献8】R.Guercolini,Int.J.Obes.Relat.Metab.Disord.21,S12(1997)
【非特許文献9】J.B.Hauptman,F.S.Jeunet,D.Hartmann,Am.J.Clin.Nutr.55,309S(1992)
【非特許文献10】J.O.Hill,et al.,Am.J.Clin.Nutr.69,1108(1999)
【非特許文献11】R.E.Ley,P.J.Turnbaugh,S.Klein,J.I.Gordon,Nature 444,1022(2006)
【非特許文献12】P.J.Turnbaugh,R.E.Ley,M.A.Mahowald,V.Magrini,E.R.Mardis,J.I.Gordon,Nature 444,1027(2006)
【非特許文献13】P.J.Turnbaugh,F.Backhed,L.Fulton,J.I.Gordon.Cell Host Microbe 3,213(2008)
【非特許文献14】W.H.Lin,C.F.Hwang,et al.,Food Microb.23,74(2006)
【非特許文献15】Appl Environ Microbiol.59,15(1993)
【非特許文献16】R.Leenen et al.,Am.J.Physiol.263,E913(1992)
【非特許文献17】Y.Keno et al.,Int.J.Obes.15,205(1991)
【非特許文献18】Molavi,N.Rasouli,P.A.Kern,Curr.Opin.Cardiol.21,479(2006)
【非特許文献19】R.T.Spiotta,G.B.Luma,Am.Fam.Physician78,1052(2008)
【非特許文献20】S.Rand,J.ChronicDis.40,911(1987)
【非特許文献21】National Heart Lung and Blood Institute,Obes.Res.6,51S(1998)
【非特許文献22】J.O.Hill,Endocr.Rev.27,750(2006)
【非特許文献23】C.Thompson―Chagoyon,J.Maldonado,A.Gil,Dig.Dis.Sci.52,2069(2007)
【非特許文献24】B.Stecher,W.D.Hardt,Trends.Microbiol.16,107(2008)
【非特許文献25】Isolauri,M.Kalliomaki,K.Laitinen,S.Salminen,Curr Pharm Des.14,1368(2008)
【非特許文献26】W.Jia,H.Li,L.Zao,J.K.Nicholson,Nature Rev.Drug Disc.7,123(2008)
【発明の概要】
【発明が解決しようとする課題】
【0005】
本発明者らは、肥満ネズミと低体重ネズミの臓内細菌叢を無菌ネズミに移植した実験を通して胃腸管(GI track)内の細菌叢の組成を変化させると、食物からのカロリー摂取効率に差が生じ、これによって体重の変化をもたらすという結論を得た。この結果によると、胃腸管でのカロリー摂取効率が少し変わる場合にも、体重が有意に増加又は減少するようになる。したがって、本発明者らは、最も主要なカロリー摂取源である脂肪が体内で自由脂肪酸の形態で摂取されるという事実を勘案した上で、胃腸管内で自由脂肪酸を減少させる微生物を棲息させると、この微生物が、体内に吸収される直前の自由脂肪酸を除去するので、食物からの脂肪摂取を効果的に減少できるようになり、その結果、カロリー摂取率を低下させることによって肥満治療剤になり得ると判断し、これを実験を通して立証することによって、本発明を完成するに至った。
【0006】
本発明の目的は、新しい肥満及び肥満によって引き起こされた代謝性疾患の予防・治療剤及び予防・治療方法を提供することにあり、特に、体内で脂肪分解物である自由脂肪酸を除去することによって食物を通した脂肪摂取を減少させる方法及びこのための薬学的組成物を提供することにある。また、本発明の目的は、既存の肥満治療剤であるシブトラミンやオルリスタットの問題である副作用を解消した肥満治療剤を提供することにある。
【課題を解決するための手段】
【0007】
本発明では、一般の乳酸菌であるラクトバチルス・アシドフィラス(Lactobacillus acidophilus)を段階的に突然変異させ、一般の乳酸菌に比べて自由脂肪酸吸収能が改善された改良乳酸菌(fatty acid robbing microbe、FARM)を得た後、これをネズミに一定期間摂取させ、ネズミの体脂肪蓄積と体重増加に及ぼす効果を確認する実験を実施し、その結果、現在の抗肥満治療剤として最も広く使用されているオルリスタットと同じ水準の体重減少効果を確認する。すなわち、本発明では、自由脂肪酸吸収能が改善された微生物製剤の摂取を通して小腸内細菌の特性改善及び移植で胃腸管内での脂肪酸吸収を減少できることを確認し、これは、本発明の微生物製剤及び方法で肥満を治療できることを意味する。
【0008】
本発明では、このような実験結果に基づいて、哺乳類の胃腸管内で棲息可能で、かつ、自由脂肪酸吸収能がある微生物を有効成分として含有する、肥満及び肥満によって引き起こされた代謝性疾患の予防と治療のための薬学的組成物を提供する。本発明で提供する薬学的組成物が有効成分として含む微生物は、哺乳類の胃腸管内で棲息可能で、かつ、自由脂肪酸吸収能がある微生物であって、望ましくは、ヒトの腸内細菌叢を構成する微生物又はヒトの腸管から由来した微生物である。より望ましくは、前記微生物は乳酸菌である。本発明の実施例では、自由脂肪酸の吸収能力が増加した改良乳酸菌株としてラクトバチルス・アシドフィラスFARM1(KCTC 11513BP)、ラクトバチルス・アシドフィラスFARM2(KCTC 11514BP)及びラクトバチルス・アシドフィラスFARM3(KCTC 11515BP)を得た。
【0009】
また、本発明では、哺乳類の胃腸管内で棲息可能で、かつ、自由脂肪酸吸収能がある乳酸菌を含む、肥満及び肥満によって引き起こされた代謝性疾患の予防と改善のための機能性食品を提供する。本明細書における「機能性食品」は、食品の本来の目的以外に特定の機能性が付加された食品であって、健康食品、健康機能性食品などを全て含む意味である。本発明の機能性食品が目的とする機能性は、肥満予防及び改善である。
【0010】
また、本発明では、自由脂肪酸吸収能が改善された改良乳酸菌であるラクトバチルス・アシドフィラスFARM1(KCTC 11513BP)、ラクトバチルス・アシドフィラスFARM2(KCTC 11514BP)及びラクトバチルス・アシドフィラスFARM3(KCTC 11515BP)を提供する。
【0011】
また、本発明では、哺乳類の胃腸管内で棲息可能で、かつ、自由脂肪酸吸収能がある微生物を投与し、体内での自由脂肪酸吸収を減少させることを含む、肥満と肥満によって引き起こされた代謝性疾患の予防及び治療方法を提供する。
【0012】
本発明によって自由脂肪酸吸収能がある微生物を投与又は摂取すると、体内での自由脂肪酸吸収を減少できるので、効果的な肥満及び肥満によって引き起こされた代謝性疾患の予防と治療方法になり得る。
【発明の効果】
【0013】
食物からのカロリー過多摂取は、肥満をもたらす最も重要な決定要素であり、これは、低開発国で肥満を最も速く増加させる要因でもある。ほとんど場合、体内カロリー消費より1%でもカロリー摂取が超えると、体脂肪が蓄積されるようになり、結局、これが肥満につながる。本発明の薬学的組成物は、自由脂肪酸摂取能が改善された乳酸菌を宿主の小腸管内に移植させることによって宿主のカロリー摂取を制限し、抗肥満効果をもたらすが、これは、抗肥満治療剤として最も広く使用されているオルリスタットとも類似した水準である。さらに、自由脂肪酸吸収能がある微生物を有効成分として含有する本発明の薬学的組成物は、既存の肥満治療剤に比べて次のような非常に優れた長所を有している。第一に、中枢神経系に作用しないので、シブトラミンなどの中枢神経系に作用する薬物に比べて遥かに優れた長期安全性を有している。第二に、脂肪分解に関与しないので、小腸管内で下痢や脂肪便などの副作用を引き起こさない。第三に、乳酸菌などの人体に有益な微生物を有効成分としているので、医薬品の素材として非常に優れた安全性を確保している。
【0014】
また、腸内細菌叢は、肥満の他にも感染疾患、癌、アレルギー疾患などの多様な複合疾患と関連している。したがって、生菌移植を通した治療は、腸内細菌叢と関連した多様な疾患に適用できる可能性を有している。本発明は、自由脂肪酸摂取能が改善された腸内細菌を小腸管内に移植させることによって宿主の腸内細菌叢を効果的に変化させ、宿主の疾患を治療できることを証明することによって、今後の腸内細菌叢と関連した多様な疾患に対する生菌移植を通した治療の可能性を示唆している。
【図面の簡単な説明】
【0015】
【図1】乳酸菌の脂肪酸吸収能を測定した結果を示したグラフである。
【図2】乳酸菌がコロニー形成(colonization)された宿主でのカロリー摂取変化を測定した結果を示したグラフである。
【図3】実験群の体重変化を測定した結果を示したグラフである。
【図4】実験群の内臓脂肪を磁気共鳴映像装置(MRI)で測定し、映像分析プログラム(Image J、USA)で分析した結果を示したグラフである。
【図5】22週間の高脂肪食餌群とFARM乳酸菌摂取群の内臓脂肪蓄積イメージを示した図である。
【図6】実験群の血中脂質濃度変化を示したグラフである(TGは トリグリセリド(triglycerides)、TCは総コレステロール(total cholesterol)、HDLは高比重リポタンパクコレステロール(high―density lipoprotein cholesterol)、LDLは低比重リポタンパクコレステロール(low―density lipoprotein cholesterol)を示す。)。
【図7】実験群の血中インスリンとレプチンの濃度変化を示したグラフである。
【図8】実験群の血糖変化を示したグラフである。
【図9】FARM3乳酸菌のインビトロ(in vitro)脂肪酸吸収能を3179乳酸菌と比較して示したグラフである。
【図10】FARM乳酸菌がコロニー形成された宿主でのカロリー摂取の減少を示す結果を示したグラフである。
【発明を実施するための形態】
【0016】
(自由脂肪酸の吸収能力が増加した改良菌株)
人体に存在する乳酸菌の一種であるラクトバチルス・アシドフィラスKCTC 3179をNTG(N―methyl―N―nitro―N―nitrosoguanidine:N−メチル−N−ニトロ−N−ニトロソグアニジン)で処理して突然変異を誘導した後、自由脂肪酸の吸収能力が増加した改良乳酸菌の菌株を見出した。この改良乳酸菌は、一般の乳酸菌に比べて周辺環境から自由脂肪酸を吸収する能力が2.1倍以上である菌株であって、ラクトバチルス・アシドフィラスFARM1(fatty acid robbing microbe 1)と命名し、これを2009年5月19日付けで韓国生命工学研究院の生物資源センターに受託番号KCTC 11513BPで寄託した。本発明では、これを「FARM1」と略称する。そして、FARM1を利用して4NQO(4―nitroquinoline 1―oxide:4−ニトロキノリン 1−オキシド)で2次突然変異を誘導し、自由脂肪酸の吸収能が遥かに増加した改良菌株FARM2を得た後、これを2009年5月19日付けで韓国生命工学研究院の生物資源センターに受託番号KCTC 11514BPで寄託した。本発明では、これを「FARM2」と略称する。放射能標識実験によると、FARM2は、一般の菌株に比べて自由脂肪酸を3.1倍以上速く吸収する特性を有していた。
【0017】
食用乳酸菌の最も重要な特徴は、摂取された後、宿主の小腸管内で集落を形成して成長する特性、すなわち、コロニー形成能(colonization)である。乳酸菌としての特性を調査するために、改良菌株FARM1及びFARM2を用いて小腸管内での集落形成及び成長能力を調査した。FARM1及びFARM2は、ヨーグルトに発酵する過程で正常な成長と酸性化能力を維持し、宿主にヨーグルトの形態で摂取された後にもネズミの小腸管内で成功的にコロニー形成された。このような結果は、脂肪酸吸収能が向上したFARM1及びFARM2が乳酸菌の特性を維持していることを示す。
【0018】
(自由脂肪酸の吸収能力が増加した乳酸菌が小腸管の自由脂肪酸を除去することによって実際に宿主のカロリー摂取を減少させるかどうかを確認)
私たちが乳酸菌を摂取したとき、乳酸菌は小腸に一時的に菌叢を形成するようになるが、小腸は、体内で脂肪分解物である脂肪酸が主に吸収される部分である。ほとんどの脂肪酸が摂取される小腸でFARMが自由脂肪酸を消耗するようになると、これによって人体に吸収可能な自由脂肪酸が減少するので、一種の生物捕捉剤(bio―sequestrant)として作用するようになり、その結果、宿主のカロリー摂取量を減少させる。FARMが小腸管の自由脂肪酸を除去することによって実際に宿主のカロリー摂取を減少させるかどうかを実験するために、FARM菌株で発酵させたヨーグルトをネズミに8週間摂取させた。FARM乳酸菌がネズミの小腸管内にコロニー形成されることを確認した後、放射能標識されたトリオレインを給餌し、血清内の放射能量を測定した。この結果は、放射能標識されたトリオレインの消化物である放射能標識された自由脂肪酸の吸収がどれほど減少したかを示すようになる。FARMをコロニー形成したネズミの場合、胃腸管に定着された改良菌株が周辺から自由脂肪酸を摂取する能力が遥かに向上したことを示し、これに比例して宿主の自由脂肪酸摂取が減少することを示した。FARM1及びFARM2をコロニー形成したネズミの場合、一般の乳酸菌をコロニー形成したネズミに比べて、宿主の自由脂肪酸摂取がそれぞれ35%と47%減少することが分かる。これは、FARM1及びFARM2がネズミの小腸管内で吸収可能な自由脂肪酸を減少させることによって、結局、宿主に摂取される食物のカロリー量を減少させる結果を意味する。
【0019】
(自由脂肪酸の吸収能力が増加した小腸管内乳酸菌によるカロリー摂取減少が肥満に及ぼす効果)
小腸管内のFARMによるカロリー摂取の減少が肥満に及ぼす効果を見るために、肥満ネズミに22週間FARMで発酵させたヨーグルトを摂取させた。一般の乳酸菌又はFARM乳酸菌を発酵させ、1ml当たり109CFUを含有しているヨーグルト3mlを毎日摂取させると、4週後にネズミの小腸管内に乳酸菌がコロニー形成されるようになる。予想した通り、正常な乳酸菌を摂取させたネズミに比べて、FARM1及びFARM2乳酸菌を摂取させたネズミの体重がそれぞれ15%と19%に減少する効果を示した。哺乳動物のカロリー過多摂取によると、ほとんどが内臓脂肪として蓄積されるので、体重の増加は内臓脂肪の増加量に比例する。したがって、乳酸菌給餌実験の終了日にオープンタイプの0.3テスラMRIを利用してネズミの内臓脂肪を測定した。非処理対照群、一般の乳酸菌を摂取させたネズミ実験群、FARM1を摂取させたネズミ実験群、FARM2を摂取させたネズミ実験群の内臓脂肪量は、それぞれ27%、24%、14%及び13%であった。この結果は、FARMが宿主の小腸管内にコロニー形成されると、FARMが小腸管内の自由脂肪酸吸収を減少させ、結局、宿主の体重増加と体脂肪蓄積を防止する効果を有することを意味する。すなわち、宿主の自由脂肪酸摂取/吸収量を減少させると、カロリー摂取の減少によって内臓脂肪と体重が減少する。
【0020】
(代謝性症侯群と関連している血清内生化学分析)
肥満は、インスリン抵抗性、グルコース耐性、高脂血症、心血管疾患などの代謝性症侯群と密接に関連している。したがって、乳酸菌給餌実験の終了日には、代謝性症侯群と関連している血清内生化学分析をした。乳酸菌を全く摂取させていない対照群と一般の乳酸菌を摂取させたネズミにおけるTG、TC及びLDL―コレステロール量は、FARM1とFARM2を摂取させたネズミに比べて高かった。一方、予想した通り、HDLコレステロール数値は、対照群では低かったが、FARMグループでは高かった。抗肥満効果を示したFARM乳酸菌は、予想通りに糖尿でも優れた効果を示した。FARM1とFARM2を摂取させると、乳酸菌を全く摂取させていない対照群に比べて血清インスリン数値がそれぞれ23%と30%減少した。血清レプチン数値も、乳酸菌を全く摂取させなかった対照群に比べて、FARM1とFARM2を摂取させたネズミではそれぞれ20%と45%減少した。血清グルコース数値も、乳酸菌を全く摂取させていない対照群と一般の乳酸菌を摂取させたネズミの場合は122.1mg/dlと123.4mg/dlである一方、FARM1とFARM2を摂取させたネズミではそれぞれ107.6mg/dlと108.4mg/dl程度に減少したことが分かる。体重の増加とともに人体のレプチンとインスリンに対する感受性が減少し、これと同時に血清脂質プロファイルが悪化するが、その結果、レプチン、インスリン、グルコース、LDLコレステロール、総コレステロールの血中濃度が増加するようになる。この結果は、FARM乳酸菌が体重増加を防止することによって血中脂質プロファイルを改善し、インスリンとレプチンの耐性を阻害するのに効果的であることを示す。また、FARM乳酸菌が肥満治療剤として優れた性質を有していることを示す。
【0021】
(自由脂肪酸の吸収能力が増加した乳酸菌の抗肥満治療剤としての可能性)
FARMをコロニー形成したネズミは、自由脂肪酸の摂取を減少させ、その結果、体重増加と内臓脂肪蓄積を防止する優れた特性を有しているので、自由脂肪酸摂取能が改善されたFARM乳酸菌の抗肥満治療剤としての可能性を実験した。FARM2乳酸菌を利用してEMS(ethylmethane sulfonate:エチレンメタン スルフォネート)で3次突然変異を誘導することによって、自由脂肪酸摂取能がさらに向上した乳酸菌株を見出した。見出した3次突然変異株FARM3は、一般の乳酸菌より自由脂肪酸摂取能が5.0倍以上改善された菌株であって、ラクトバチルス・アシドフィラスFARM3と命名し、これを2009年5月19日付けで韓国生命工学研究院の生物資源センターに受託番号KCTC 11515BPで寄託した。本発明では、これを「FARM3」と略称する。FARM3で発酵させたヨーグルトを毎日3mlずつネズミに4週間摂取させると、一般の乳酸菌を摂取させた対照群に比べて体重が18%以上減少する結果を示した。このようなFARM3の体重減少程度は、現在医薬品として使用されているオルリスタットと類似した水準である。そして、オルリスタットと異なり、FARM3の場合は、摂取時に体重の効果的な減少以外に脂肪便などの副作用を示さなかった。これは、FARM3が安全かつ効果的な肥満治療剤として開発可能な医薬品素材であることを意味する。本発明では、乳酸菌FARM3を用いて実験したが、本発明の技術思想がFARM3や乳酸菌に限定されることはない。肥満治療に関する本発明の技術思想は、哺乳類、特に、ヒトの胃腸管内で棲息可能で、かつ、自由脂肪酸吸収能がある微生物であればいずれにも適用可能であり、これは、本発明の属する技術分野で通常の知識を有する者にとって自明である。
【実施例】
【0022】
以下、具体的な実施例を通して本発明をより詳細に説明する。しかし、これら実施例は、単に本発明をより具体的に説明するためのものであって、本発明の範囲がこれら実施例によって限定されることはない。
【0023】
(試薬)
試薬は、下記に示したもの以外は、シグマ社(Sigma)製のものを購入して使用した。
【0024】
[1―14C]―パルミチン酸:PerkinElmer Life Sciences社製
【0025】
液体シンチレーションカクテル(LSC):PerkinElmer Life Sciences社製
【0026】
[カルボキシル―14C]―トリオレイン:Research Products International社製
【0027】
MRA(Man―Rogosa―Sharpe):Difco社製
【0028】
オルリスタット(ゼニカル):Roche社製
【0029】
殺菌可能な(sterilizable)384―ウェルプレート及び384―ピンレプリケーター:Nunc社製
【0030】
メンブレン半乾燥システム(Membrane semi―dry system):Bio―Rad社製
【0031】
X―線フィルム:Kodak社製
【0032】
Gel―Proアナライザーソフトウェア(analyzer software):Media cybernetics社製
【0033】
嫌気培養:BBLガスパック嫌気システム(Gas―Pack anaerobic systems)の嫌気性ジャーで行われる。
【0034】
SD(Sprague―Dawley)雄ネズミ:Dae Han Biolink Co.,Ltd.
【0035】
MRIイメージ:ブルカーバイオスペック47/40 4.7―テスラ機器(Bruker Biospec 47/40 4.7―Tesla instrument)(Bruker社製)から得てImage J(NIH)で分析される。
【0036】
血清(Serum):それぞれラット/マウスELISAキット(LINCO research社製)、レプチンELISAキット(RD System社製)、血糖測定器(Accu―Chek社製)及びコレステロールELISAキット(Asan Pharm.Co製)で分析される。
【0037】
(突然変異を通して脂肪酸吸収能が改善された乳酸菌の開発)
L.アシドフィラスKCTC3179乳酸菌をMRS培地に接種し、BBLガスパック(Gas―Pack)によりpH7.2、37℃で嫌気培養した。自由脂肪酸吸収能が改善されたFARM菌株を得るための突然変異実験は、次のように行われた。L.アシドフィラスKCTC3179乳酸菌を24時間精製培養した後、液状培養液にNTG(N―methyl―N―nitro―N―nitrosoguanidine:N−メチル−N−ニトロ−N−ニトロソグアニジン)を2mg/mlの濃度で添加した。25℃で30分間培養した後、MRSブロスで3回洗浄し、MRSブロスに再び懸濁した。連続希釈(serial dilution)後、処理された各細胞をMRS寒天プレートに置き、嫌気状態で37℃、48時間培養した後、50μlのMRSブロスが入っている384―ウェルプレートに接種し、37℃で12時間嫌気培養した。培養が終了した後、MRSブロス培養液のみが入っている384―ウェルプレートと、0.1nCi/mlの14C―パルミチン酸が含まれたMRSブロス培養液が入っている384―ウェルプレートを384―ピンレプリケーターを用いて複製した。複製されたプレートは、パラフィルムで覆った後、37℃でやわらく揺らしながら30分間培養した後、14Cと放射能標識された培養液を2μlずつナイロンメンブレンにそれぞれ移した後、半乾燥システム(semi―dry system)で乾燥させた。乾燥した膜は、MRSブロスで3回洗浄し、付着している14C―パルミチン酸を除去した後、−80℃で3日間X線フィルムに露出させた。X線フィルムから得た放射能程度は、Gel―Proアナライザーソフトウェアで分析して信号の強いコロニーを選別し、これから最終的に脂肪酸吸収能が改善された乳酸菌株を探してFARM1(fatty acid robbing microbe 1)と命名した。次に、FARM1に前記のような方法で4NQO(4―nitroquinoline 1―oxide:4−ニトロキノリン 1−オキシド)を処理してFARM2を得た後、前記と同じ方法でFARM2にEMS(ethylmethane sulphonate:エチルメタン スルフォネート)を処理してFARM3を得た。
【0038】
(インビトロ(In vitro)脂肪酸吸収能評価)
見出された乳酸菌株の脂肪酸吸収能を評価するために、各乳酸菌株を放射能標識された14Cパルミチン酸と共に培養した後、放射能程度を測定した。このために、各乳酸菌株をMRSブロス2mlに接種した後、培養して代数生長期に到逹すると遠心分離し、1nCi/mlの濃度で14C―パルミチン酸が入っているMRS培地に接種した後、37℃で1時間培養した。14Cと標識された各細胞をMRSブロスで3回洗浄した後、MRSブロス1mlに懸濁し、そのうち0.2mlを2mlの液体シンチレーションカクテルが入っているシンチレーションバイアルに移した。混合物を1分間ボルテックスした後、液体シンチレーションスペクトロメーターを用いて14C活性(activity)を測定した。
【0039】
(乳酸能評価)
各乳酸菌株をMRS培地により37℃で嫌気培養して代数生長期に到逹すると、1mlの細胞培養液を無菌状態の脱脂牛乳(10%)とグルコース(2%)を含有した100mlに接種した後、37℃で培養しながら24時間の間隔でpH変化を測定した。細胞生長曲線を測定するためには、48時間発酵した後で作られたヨーグルト5mlを15mlのコニカルチューブに移した後、ボルテックスをした。均質化された混合物1mlをPBSで希釈し、希釈液50μlをMRSプレートに塗抹し、48時間嫌気培養した後、コロニーの数を数えた。
【0040】
(動物実験)
全ての動物実験は、動物管理及び利用委員会(Institutional Animal Care and Use Committee)の規定にしたがって行われた。体重が200〜220g程度であるSD雄ネズミを二匹ずつ檻に入れ、最初の1週間は一般の飼料と水を自由に級餌した。実験期間の間は12時間の間隔で昼と夜の照明を変え、温度は22±1℃、湿度は40〜50%に一定に維持した。一週間後、ネズミたちを一つのグループ当たり14匹になるように無作為に分離し、対照群(高脂肪飼料摂取群)、3179グループ(高脂肪飼料とL.acidophilus KCTC3179乳酸菌発酵ヨーグルト摂取群)、FARMグループ(高脂肪飼料とL.acidophilus FARM乳酸菌発酵ヨーグルト摂取群)に分けた。この実験に使用された高脂肪飼料は、一般のネズミ飼料(複合炭水化物60%、タンパク質22%、脂肪3.5%、繊維素5%、粗灰分8%、カルシウム0.6%、リン1.2%)に豚脂を20%添加した特殊飼料であって、組成は、複合炭水化物48%、タンパク質17.6%、脂肪22.8%、繊維素4%、粗灰分6.4%、カルシウム0.48%、リン0.96%で構成されている。食餌実験のためのヨーグルトは、脱脂粉乳10%、砂糖2%、109/ml以上の菌体濃度を有するL.acidophilus培養液1%である。実験期間の間、ネズミたちは、それぞれに割り当てられた食餌を自由に摂取し、発酵ヨーグルト3mlが口腔に直接給餌された。体重は、12時間禁食した後、午前9時から1時の間に測定された。
【0041】
<1.胃腸管集落形成能>
ネズミに各実験群によるL.acidophilus発酵ヨーグルトを8週間級餌した後、各実験群から4匹のネズミを無作為に選び、エーテルで麻酔させた後、犠牲させた。ネズミから胃と小腸などの胃腸管組織を直ちに収去し、50mlのコニカルチューブに移した後、無菌食塩水で希釈した。次に、胃腸管組織の内容物を排出するために、ホモジナイザーを用いて均質化した後、乳酸菌選別寒天プレート(lactobacillus selective agar plates)に塗抹し、48時間の間嫌気培養した。乳酸菌選別培地で形成された乳酸菌コロニーの数を数え、胃腸管内の組織部位別の1グラム当たりのlog10CFU(湿重量)で計算した。
【0042】
<2.FARM乳酸菌の肥満誘導抑制効果>
長い鎖構造を有しているトリグリセリドの一種であるトリオレインを用いてFARM乳酸菌の肥満誘導抑制効果に対する実験が行われた。[14C]と放射能標識されたトリオレインをベンゼン溶液に作り、−70℃で保管して使用した。[14C]と放射能標識されたトリオレイン1μCiを放射能標識されていないトリオレインと混ぜた後、室温で窒素ガスを用いて溶媒を揮発させた。トリオレイン混合物を、乳酸菌を22週間摂取させたネズミに体重100g当たり0.5mmolで級餌した後、10時間の間2時間の間隔で心臓穿刺でネズミの血液サンプルを収去した。各血清から0.1mlを1.8mlのLSCに添加した後、液体シンチレーションスペクトロメーターで14C活性を測定した。FARM乳酸菌の肥満誘導抑制は、各乳酸菌発酵ヨーグルトを摂取させたネズミでの脂肪酸摂取能の差による血清内放射能程度の差を測定することによって判断した。
【0043】
<3.内臓脂肪の磁気共鳴映像測定>
内臓脂肪部位の体脂肪を磁気共鳴映像(MRI)機器で分析するために、ブルカーバイオスペック47/40 4.7―テスラ機器を使用した。実験に使用されたネズミは、ゾレチル(zoletil)(25mg/kg)とロンパン(rompun)(10mg/kg)で麻酔した。映像を得るためにネズミたちを磁石板に位置させ、ボディコイルを送信機と受信機として使用して記録した。内臓脂肪と皮下脂肪部位を測定するために、第4〜第5の腰椎間で上から8cm、下から8cmの部位をT1強調映像として得た。内臓脂肪と皮下脂肪部位はイメージJプログラムで分析された。
【0044】
<4.血清生化学分析>
実験ネズミたちの血液は、実験開始日と終了日である22週後に収去され、生化学分析に使用された。血液採取前に全ての実験動物は節食し、エーテルで麻酔した状態で心臓穿刺で全ての血液を得た。血液を2,000xgで4℃で10分間遠心分離して得た血清は、分析するまで70℃で保管した。血清生化学分析のために、ラット/マウスELISAキット(インスリン)、レプチンELISAキット(レプチン)、血糖測定器、ELISAキット(血清総コレステロール、HDL―コレステロール、LDL―コレステロール、トリグリセリド)などが使用された。
【0045】
<5.FARM3乳酸菌の抗肥満効果>
3ヶ月になったSD雄ネズミは、8週間高脂肪を食餌し、平均体重が425gになるように肥満を誘導した。これらネズミたちを一つのグループ当たり14匹になるように無作為に分離し、3179グループ(高脂肪飼料とL.acidophilus KCTC3179乳酸菌発酵ヨーグルト摂取群)、FARM3グループ(高脂肪飼料とL.acidophilus FARM3乳酸菌発酵ヨーグルト摂取群)、オルリスタットグループ(高脂肪飼料にゼニカル(Xenical)(登録商標)を200mg/kgの食物として添加して摂取させた群)に分けた。その後、4週間、ネズミたちはそれぞれに割り当てられた食餌を自由に摂取し、体重は、12時間禁食した後、午前9時から1時の間に測定された。
【0046】
<6.統計処理>
全てのデータは平均値±標準偏差に表示され、ANOVA(analysis of variance:分散分析)テストによってp<0.05である場合に統計的に有意であると判断された。
【0047】
(結果)
<1.乳酸菌の脂肪酸吸収能及び乳酸菌がコロニー形成された宿主のカロリー摂取変化>
図1は、乳酸菌の脂肪酸吸収能を測定した結果を示している。ラクトバチルス・アシドフィラスKCTC 3179(「3179」と表示される。)乳酸菌をNTG(N―methyl―N―nitro―N―nitrosoguanidine:N−メチル−N−ニトロ−N−ニトロソグアニジン)で突然変異させて見出されたFARM1乳酸菌は、脂肪酸吸収能が増加していた。FARM1乳酸菌を4NQO(4―nitroquinoline 1―oxide:4−ニトロキノリン 1−オキシド)で2次突然変異させて得たFARM2は、FARM1より改善された脂肪酸吸収能を有していた。外部から脂肪酸を吸収する能力の差を測定するために、1nCi/mlの濃度で14C放射能標識されたパルミチン酸と乳酸菌を1時間培養した後、乳酸菌の放射能程度を液体シンチレーションスペクトロメーターで測定し、これは標準偏差(n=4)に表示された。
【0048】
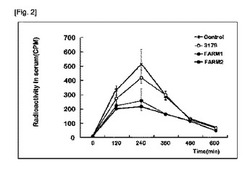
図2は、乳酸菌がコロニー形成された宿主でのカロリー摂取変化を測定した結果を示している。FARM乳酸菌がコロニー形成された宿主でカロリー摂取の減少が確認された。SDネズミに8週間FARM乳酸菌又は一般の乳酸菌L.acidophilus KCTC 3179を給餌し、胃腸管に乳酸菌をコロニー形成した後、14C―標識されたトリオレインを摂取させ、血液を採取して血清内放射能程度を測定することによって宿主のカロリー摂取変化を測定した。
【0049】
図1及び図2の結果から、FARM乳酸菌の脂肪酸吸収能とFARM乳酸菌がコロニー形成された宿主の胃腸管での脂肪吸収が反比例することが分かる。
【0050】
<2.乳酸能>
各乳酸菌株は、無菌状態のグルコース(2%)を含有した脱脂牛乳(10%)100mlに接種し、37℃でヨーグルトに発酵させた。ヨーグルトに発酵される過程で乳酸菌の乳酸能を測定するために、pH変化を24時間後、48時間後、72時間後に測定した。10個の試料の測定値は平均値±標準偏差に表示された。結果は、次の表1に示す通りである。
【0051】
表1
10個の試料の測定値は平均値±標準偏差

【0052】
<3.胃腸管内の集落形成(colonization)能力>
ネズミに各実験群によるL.acidophilus(KCTC3179又はFARM)発酵ヨーグルトを8週間給餌した後、胃と小腸などの胃腸管組織を収去し、胃腸管内の組織部位別の1グラム当たりのlog10CFU(湿重量)を得た。対照群は乳酸菌無処理群で、5個の試料の測定値は平均値±標準偏差に表示された。結果は、次の表2に示す通りである。
【0053】
表2
5個の試料の測定値は平均値±標準偏差

【0054】
<4.食餌で肥満を誘導する間におけるL.acidophilus KCTC3179、FARM1、FARM2の胃腸管内の集落形成(colonization)能力>
ネズミに各実験群によるL.acidophilus(KCTC3179又はFARM)発酵ヨーグルトを4週間給餌した後、胃と小腸などの胃腸管組織を収去し、胃腸管内の組織部位別の1グラム当たりのlog10CFU(湿重量)を得た。対照群は乳酸菌無処理群で、5個の試料の測定値は平均値±標準偏差に表示された。結果は、次の表3に示す通りである。
【0055】
表3
5個の試料の測定値は平均値±標準偏差

【0056】
<5.高脂肪食餌で誘導された肥満に対するFARMのカロリー摂取減少の効果>
結果は、図3〜図5に示す通りである。図3は、実験群の体重変化を測定した結果を示している。体重が200〜220g程度の3ヶ月になったSD雄ネズミを一つのグループ当たり14匹になるように無作為に分離し、対照群(高脂肪飼料摂取群)、3179グループ(高脂肪飼料とL.acidophilus KCTC 3179乳酸菌発酵ヨーグルト摂取群)、FARMグループ(高脂肪飼料とL.acidophilus FARM乳酸菌発酵ヨーグルト摂取群)に分けた。その後、22週間、ネズミたちはそれぞれに割り当てられた食餌を自由に摂取し、体重変化は平均値±標準偏差に表示された。
【0057】
図4は、実験群の内臓脂肪を磁気共鳴映像装置(MRI)で測定して分析し、映像分析プログラム(Image J、USA)で分析した結果を示している。内臓脂肪量の変化は平均値±標準偏差に表示された。
【0058】
図5は、22週間の高脂肪食餌群とFARM乳酸菌摂取群の内臓脂肪蓄積イメージを示している。
【0059】
<6.一般の乳酸菌KCTC 3179とFARM乳酸菌給餌後の血清数値の比較結果>
結果は、図6〜図8に示す通りである。体重が200〜220g程度の3ヶ月になったSD雄ネズミを一つのグループ当たり14匹になるように無作為に分離し、対照群(高脂肪飼料摂取群)、3179グループ(高脂肪飼料とL.acidophilus KCTC3179乳酸菌発酵ヨーグルト摂取群)、FARMグループ(高脂肪飼料とL.acidophilus FARM乳酸菌発酵ヨーグルト摂取群)に分けた。実験開始日及び終了日に採取された血液から得た血清数値を分析した結果は、標準偏差に表示された。図6は、血中脂質濃度の変化を示したもので、TGはトリグリセリド、TCは総コレステロール、HDLは高比重リポタンパクコレステロール、LDLは低比重リポタンパクコレステロールを示す。図7は、血中インスリンとレプチン濃度の変化を示したもので、図8は血糖変化を示している。
【0060】
<7.食餌で誘導された肥満に対するFARM3の抗肥満効果>
結果は、図9及び図10に示す通りである。図9は、FARM3乳酸菌のインビトロ脂肪酸吸収能を3179乳酸菌と比較したものである。FARM2乳酸菌をEMS(ethylmethane sulphonate:エチルメタン スルフォネート)で3次突然変異させて得たFARM3は、FARM2より改善された脂肪酸吸収能を有する。外部から脂肪酸を吸収する能力の差を測定するために、1nCi/mlの濃度で14Cと放射能標識されたパルミチン酸と乳酸菌を1時間培養した後、乳酸菌の放射能程度を液体シンチレーションスペクトロメーターで測定し、これは標準偏差(n=4)に表示された。
【0061】
図10は、FARM乳酸菌がコロニー形成された宿主でのカロリー摂取の減少を示す結果を示している。SDネズミに8週間FARM乳酸菌又は一般の乳酸菌L.acidophilus KCTC3179を給餌し、胃腸管に乳酸菌をコロニー形成した後、14C―標識されたトリオレインを摂取させ、血液を採取して血清内放射能程度を測定することによって宿主のカロリー摂取変化を測定した。まず、3ヶ月になったSD雄ネズミは、8週間高脂肪を食餌し、平均体重が425gになるように肥満を誘導した。
【0062】
これらネズミたちを一つのグループ当たり14匹になるように無作為に分離し、3179グループ(○、高脂肪飼料とL.acidophilus KCTC3179乳酸菌発酵ヨーグルト摂取群)、FARM3グループ(●、高脂肪飼料とL.acidophilus FARM3乳酸菌発酵ヨーグルト摂取群)、オルリスタットグループ(△、高脂肪飼料にゼニカル(Xenical)(登録商標)を200mg/kgの食物として添加して摂取させた群)に分けた。その後、4週間、ネズミたちはそれぞれに割り当てられた食餌を自由に摂取し、体重変化は平均値±標準偏差に表示された。
【0063】
(翻訳文)
特許手続き上の微生物の寄託の国際的承認に関するブダペスト条約
国際様式
原寄託に対する受託証
下記の国際寄託機関によって規則第7.1条の規定によって発行された。
受信:JINIS
大韓民国 全羅北道 完州郡 鳳東邑 デゥン山里 948―9(〒565―902)

【0064】
(翻訳文)
特許手続き上の微生物の寄託の国際的承認に関するブダペスト条約
国際様式
原寄託に対する受託証
下記の国際寄託機関によって規則第7.1条の規定によって発行された。
受信:JINIS
大韓民国 全羅北道 完州郡 鳳東邑 デゥン山里 948―9(〒565―902)

【0065】
(翻訳文)
特許手続き上の微生物の寄託の国際的承認に関するブダペスト条約
国際様式
原寄託に対する受託証
下記の国際寄託機関によって規則第7.1条の規定によって発行された。
受信:JINIS
大韓民国 全羅北道 完州郡 鳳東邑 デゥン山里 948―9(〒565―902)

【技術分野】
【0001】
本発明は、肥満及び肥満によって引き起こされた代謝性疾患の予防と治療に関するものであり、特に、微生物を利用した予防と治療に関するものである。
【背景技術】
【0002】
肥満は、全世界的に問題となっている慢性疾患であり、効果的な治療方法がなく、継続して増加しつつある深刻な疾患である。また、肥満は、他の様々な深刻な慢性疾患をもたらす。肥満によって引き起こされる代謝性疾患としては、高血圧、糖尿病、高脂血症、動脈硬化症、虚血性心臓疾患、脂肪肝、胆石症、関節炎、肺機能障害、生殖器異常などがある。
【0003】
現在、肥満治療剤として使用されている処方薬は、シブトラミン(アボット社のメリディア)とオルリスタット(ロシュ社のゼニカル)である。シブトラミンは、ノルアドレナリンとセロトニンの再吸収を防止することによって食欲を調節し、食物の摂取量を減少させる。しかし、シブトラミンは、中枢神経系に作用する物質という特性のため、心臓搏動と血圧などに影響を与えるという副作用を有している。シブトラミンと異なり、オルリスタットは局所的に作用する。オルリスタットは、胃と小臓の脂肪分解酵素であるリパーゼ(lipase)の阻害剤であって、脂肪の加水分解を妨害する役割をするので、食物で摂取された脂肪の30%程度が体内に吸収されずに排出されるようになり、結果的に体重調節効果を有する。しかし、消化されていない脂肪が胃腸管に沿って移動しながら下痢、脂肪便などの副作用をもたらすが、これは、不便なだけでなく、正常な社会生活を困難にするほどの副作用である。したがって、このような既存の肥満治療剤の問題のため、新しい概念の肥満治療剤が要求されている。
【先行技術文献】
【非特許文献】
【0004】
【非特許文献1】B.S.Drew,A.F.Dixn,J.B.Dixon,Vasc.Health Risk Manag.3,817(2007)
【非特許文献2】P.G.Kopelman,Nature 404,635(2000)
【非特許文献3】Must et al.,J.Am.Med.Assoc.282,1523(1999)
【非特許文献4】R.Padwal,SK Li,DC Lau,Cochrane DatabaseSyst.Rev.3,CD004094(2003)
【非特許文献5】R.S.Padwal,S.R.Majumdar,Lancet 369,71(2007)
【非特許文献6】J.Rolls,D.J.Shide,M.L.Thorwart,J.S.Ulbrecht,Obes.Res.6,1(1998)
【非特許文献7】G.A.Bray et al.,Obes.Res.7,189(1999)
【非特許文献8】R.Guercolini,Int.J.Obes.Relat.Metab.Disord.21,S12(1997)
【非特許文献9】J.B.Hauptman,F.S.Jeunet,D.Hartmann,Am.J.Clin.Nutr.55,309S(1992)
【非特許文献10】J.O.Hill,et al.,Am.J.Clin.Nutr.69,1108(1999)
【非特許文献11】R.E.Ley,P.J.Turnbaugh,S.Klein,J.I.Gordon,Nature 444,1022(2006)
【非特許文献12】P.J.Turnbaugh,R.E.Ley,M.A.Mahowald,V.Magrini,E.R.Mardis,J.I.Gordon,Nature 444,1027(2006)
【非特許文献13】P.J.Turnbaugh,F.Backhed,L.Fulton,J.I.Gordon.Cell Host Microbe 3,213(2008)
【非特許文献14】W.H.Lin,C.F.Hwang,et al.,Food Microb.23,74(2006)
【非特許文献15】Appl Environ Microbiol.59,15(1993)
【非特許文献16】R.Leenen et al.,Am.J.Physiol.263,E913(1992)
【非特許文献17】Y.Keno et al.,Int.J.Obes.15,205(1991)
【非特許文献18】Molavi,N.Rasouli,P.A.Kern,Curr.Opin.Cardiol.21,479(2006)
【非特許文献19】R.T.Spiotta,G.B.Luma,Am.Fam.Physician78,1052(2008)
【非特許文献20】S.Rand,J.ChronicDis.40,911(1987)
【非特許文献21】National Heart Lung and Blood Institute,Obes.Res.6,51S(1998)
【非特許文献22】J.O.Hill,Endocr.Rev.27,750(2006)
【非特許文献23】C.Thompson―Chagoyon,J.Maldonado,A.Gil,Dig.Dis.Sci.52,2069(2007)
【非特許文献24】B.Stecher,W.D.Hardt,Trends.Microbiol.16,107(2008)
【非特許文献25】Isolauri,M.Kalliomaki,K.Laitinen,S.Salminen,Curr Pharm Des.14,1368(2008)
【非特許文献26】W.Jia,H.Li,L.Zao,J.K.Nicholson,Nature Rev.Drug Disc.7,123(2008)
【発明の概要】
【発明が解決しようとする課題】
【0005】
本発明者らは、肥満ネズミと低体重ネズミの臓内細菌叢を無菌ネズミに移植した実験を通して胃腸管(GI track)内の細菌叢の組成を変化させると、食物からのカロリー摂取効率に差が生じ、これによって体重の変化をもたらすという結論を得た。この結果によると、胃腸管でのカロリー摂取効率が少し変わる場合にも、体重が有意に増加又は減少するようになる。したがって、本発明者らは、最も主要なカロリー摂取源である脂肪が体内で自由脂肪酸の形態で摂取されるという事実を勘案した上で、胃腸管内で自由脂肪酸を減少させる微生物を棲息させると、この微生物が、体内に吸収される直前の自由脂肪酸を除去するので、食物からの脂肪摂取を効果的に減少できるようになり、その結果、カロリー摂取率を低下させることによって肥満治療剤になり得ると判断し、これを実験を通して立証することによって、本発明を完成するに至った。
【0006】
本発明の目的は、新しい肥満及び肥満によって引き起こされた代謝性疾患の予防・治療剤及び予防・治療方法を提供することにあり、特に、体内で脂肪分解物である自由脂肪酸を除去することによって食物を通した脂肪摂取を減少させる方法及びこのための薬学的組成物を提供することにある。また、本発明の目的は、既存の肥満治療剤であるシブトラミンやオルリスタットの問題である副作用を解消した肥満治療剤を提供することにある。
【課題を解決するための手段】
【0007】
本発明では、一般の乳酸菌であるラクトバチルス・アシドフィラス(Lactobacillus acidophilus)を段階的に突然変異させ、一般の乳酸菌に比べて自由脂肪酸吸収能が改善された改良乳酸菌(fatty acid robbing microbe、FARM)を得た後、これをネズミに一定期間摂取させ、ネズミの体脂肪蓄積と体重増加に及ぼす効果を確認する実験を実施し、その結果、現在の抗肥満治療剤として最も広く使用されているオルリスタットと同じ水準の体重減少効果を確認する。すなわち、本発明では、自由脂肪酸吸収能が改善された微生物製剤の摂取を通して小腸内細菌の特性改善及び移植で胃腸管内での脂肪酸吸収を減少できることを確認し、これは、本発明の微生物製剤及び方法で肥満を治療できることを意味する。
【0008】
本発明では、このような実験結果に基づいて、哺乳類の胃腸管内で棲息可能で、かつ、自由脂肪酸吸収能がある微生物を有効成分として含有する、肥満及び肥満によって引き起こされた代謝性疾患の予防と治療のための薬学的組成物を提供する。本発明で提供する薬学的組成物が有効成分として含む微生物は、哺乳類の胃腸管内で棲息可能で、かつ、自由脂肪酸吸収能がある微生物であって、望ましくは、ヒトの腸内細菌叢を構成する微生物又はヒトの腸管から由来した微生物である。より望ましくは、前記微生物は乳酸菌である。本発明の実施例では、自由脂肪酸の吸収能力が増加した改良乳酸菌株としてラクトバチルス・アシドフィラスFARM1(KCTC 11513BP)、ラクトバチルス・アシドフィラスFARM2(KCTC 11514BP)及びラクトバチルス・アシドフィラスFARM3(KCTC 11515BP)を得た。
【0009】
また、本発明では、哺乳類の胃腸管内で棲息可能で、かつ、自由脂肪酸吸収能がある乳酸菌を含む、肥満及び肥満によって引き起こされた代謝性疾患の予防と改善のための機能性食品を提供する。本明細書における「機能性食品」は、食品の本来の目的以外に特定の機能性が付加された食品であって、健康食品、健康機能性食品などを全て含む意味である。本発明の機能性食品が目的とする機能性は、肥満予防及び改善である。
【0010】
また、本発明では、自由脂肪酸吸収能が改善された改良乳酸菌であるラクトバチルス・アシドフィラスFARM1(KCTC 11513BP)、ラクトバチルス・アシドフィラスFARM2(KCTC 11514BP)及びラクトバチルス・アシドフィラスFARM3(KCTC 11515BP)を提供する。
【0011】
また、本発明では、哺乳類の胃腸管内で棲息可能で、かつ、自由脂肪酸吸収能がある微生物を投与し、体内での自由脂肪酸吸収を減少させることを含む、肥満と肥満によって引き起こされた代謝性疾患の予防及び治療方法を提供する。
【0012】
本発明によって自由脂肪酸吸収能がある微生物を投与又は摂取すると、体内での自由脂肪酸吸収を減少できるので、効果的な肥満及び肥満によって引き起こされた代謝性疾患の予防と治療方法になり得る。
【発明の効果】
【0013】
食物からのカロリー過多摂取は、肥満をもたらす最も重要な決定要素であり、これは、低開発国で肥満を最も速く増加させる要因でもある。ほとんど場合、体内カロリー消費より1%でもカロリー摂取が超えると、体脂肪が蓄積されるようになり、結局、これが肥満につながる。本発明の薬学的組成物は、自由脂肪酸摂取能が改善された乳酸菌を宿主の小腸管内に移植させることによって宿主のカロリー摂取を制限し、抗肥満効果をもたらすが、これは、抗肥満治療剤として最も広く使用されているオルリスタットとも類似した水準である。さらに、自由脂肪酸吸収能がある微生物を有効成分として含有する本発明の薬学的組成物は、既存の肥満治療剤に比べて次のような非常に優れた長所を有している。第一に、中枢神経系に作用しないので、シブトラミンなどの中枢神経系に作用する薬物に比べて遥かに優れた長期安全性を有している。第二に、脂肪分解に関与しないので、小腸管内で下痢や脂肪便などの副作用を引き起こさない。第三に、乳酸菌などの人体に有益な微生物を有効成分としているので、医薬品の素材として非常に優れた安全性を確保している。
【0014】
また、腸内細菌叢は、肥満の他にも感染疾患、癌、アレルギー疾患などの多様な複合疾患と関連している。したがって、生菌移植を通した治療は、腸内細菌叢と関連した多様な疾患に適用できる可能性を有している。本発明は、自由脂肪酸摂取能が改善された腸内細菌を小腸管内に移植させることによって宿主の腸内細菌叢を効果的に変化させ、宿主の疾患を治療できることを証明することによって、今後の腸内細菌叢と関連した多様な疾患に対する生菌移植を通した治療の可能性を示唆している。
【図面の簡単な説明】
【0015】
【図1】乳酸菌の脂肪酸吸収能を測定した結果を示したグラフである。
【図2】乳酸菌がコロニー形成(colonization)された宿主でのカロリー摂取変化を測定した結果を示したグラフである。
【図3】実験群の体重変化を測定した結果を示したグラフである。
【図4】実験群の内臓脂肪を磁気共鳴映像装置(MRI)で測定し、映像分析プログラム(Image J、USA)で分析した結果を示したグラフである。
【図5】22週間の高脂肪食餌群とFARM乳酸菌摂取群の内臓脂肪蓄積イメージを示した図である。
【図6】実験群の血中脂質濃度変化を示したグラフである(TGは トリグリセリド(triglycerides)、TCは総コレステロール(total cholesterol)、HDLは高比重リポタンパクコレステロール(high―density lipoprotein cholesterol)、LDLは低比重リポタンパクコレステロール(low―density lipoprotein cholesterol)を示す。)。
【図7】実験群の血中インスリンとレプチンの濃度変化を示したグラフである。
【図8】実験群の血糖変化を示したグラフである。
【図9】FARM3乳酸菌のインビトロ(in vitro)脂肪酸吸収能を3179乳酸菌と比較して示したグラフである。
【図10】FARM乳酸菌がコロニー形成された宿主でのカロリー摂取の減少を示す結果を示したグラフである。
【発明を実施するための形態】
【0016】
(自由脂肪酸の吸収能力が増加した改良菌株)
人体に存在する乳酸菌の一種であるラクトバチルス・アシドフィラスKCTC 3179をNTG(N―methyl―N―nitro―N―nitrosoguanidine:N−メチル−N−ニトロ−N−ニトロソグアニジン)で処理して突然変異を誘導した後、自由脂肪酸の吸収能力が増加した改良乳酸菌の菌株を見出した。この改良乳酸菌は、一般の乳酸菌に比べて周辺環境から自由脂肪酸を吸収する能力が2.1倍以上である菌株であって、ラクトバチルス・アシドフィラスFARM1(fatty acid robbing microbe 1)と命名し、これを2009年5月19日付けで韓国生命工学研究院の生物資源センターに受託番号KCTC 11513BPで寄託した。本発明では、これを「FARM1」と略称する。そして、FARM1を利用して4NQO(4―nitroquinoline 1―oxide:4−ニトロキノリン 1−オキシド)で2次突然変異を誘導し、自由脂肪酸の吸収能が遥かに増加した改良菌株FARM2を得た後、これを2009年5月19日付けで韓国生命工学研究院の生物資源センターに受託番号KCTC 11514BPで寄託した。本発明では、これを「FARM2」と略称する。放射能標識実験によると、FARM2は、一般の菌株に比べて自由脂肪酸を3.1倍以上速く吸収する特性を有していた。
【0017】
食用乳酸菌の最も重要な特徴は、摂取された後、宿主の小腸管内で集落を形成して成長する特性、すなわち、コロニー形成能(colonization)である。乳酸菌としての特性を調査するために、改良菌株FARM1及びFARM2を用いて小腸管内での集落形成及び成長能力を調査した。FARM1及びFARM2は、ヨーグルトに発酵する過程で正常な成長と酸性化能力を維持し、宿主にヨーグルトの形態で摂取された後にもネズミの小腸管内で成功的にコロニー形成された。このような結果は、脂肪酸吸収能が向上したFARM1及びFARM2が乳酸菌の特性を維持していることを示す。
【0018】
(自由脂肪酸の吸収能力が増加した乳酸菌が小腸管の自由脂肪酸を除去することによって実際に宿主のカロリー摂取を減少させるかどうかを確認)
私たちが乳酸菌を摂取したとき、乳酸菌は小腸に一時的に菌叢を形成するようになるが、小腸は、体内で脂肪分解物である脂肪酸が主に吸収される部分である。ほとんどの脂肪酸が摂取される小腸でFARMが自由脂肪酸を消耗するようになると、これによって人体に吸収可能な自由脂肪酸が減少するので、一種の生物捕捉剤(bio―sequestrant)として作用するようになり、その結果、宿主のカロリー摂取量を減少させる。FARMが小腸管の自由脂肪酸を除去することによって実際に宿主のカロリー摂取を減少させるかどうかを実験するために、FARM菌株で発酵させたヨーグルトをネズミに8週間摂取させた。FARM乳酸菌がネズミの小腸管内にコロニー形成されることを確認した後、放射能標識されたトリオレインを給餌し、血清内の放射能量を測定した。この結果は、放射能標識されたトリオレインの消化物である放射能標識された自由脂肪酸の吸収がどれほど減少したかを示すようになる。FARMをコロニー形成したネズミの場合、胃腸管に定着された改良菌株が周辺から自由脂肪酸を摂取する能力が遥かに向上したことを示し、これに比例して宿主の自由脂肪酸摂取が減少することを示した。FARM1及びFARM2をコロニー形成したネズミの場合、一般の乳酸菌をコロニー形成したネズミに比べて、宿主の自由脂肪酸摂取がそれぞれ35%と47%減少することが分かる。これは、FARM1及びFARM2がネズミの小腸管内で吸収可能な自由脂肪酸を減少させることによって、結局、宿主に摂取される食物のカロリー量を減少させる結果を意味する。
【0019】
(自由脂肪酸の吸収能力が増加した小腸管内乳酸菌によるカロリー摂取減少が肥満に及ぼす効果)
小腸管内のFARMによるカロリー摂取の減少が肥満に及ぼす効果を見るために、肥満ネズミに22週間FARMで発酵させたヨーグルトを摂取させた。一般の乳酸菌又はFARM乳酸菌を発酵させ、1ml当たり109CFUを含有しているヨーグルト3mlを毎日摂取させると、4週後にネズミの小腸管内に乳酸菌がコロニー形成されるようになる。予想した通り、正常な乳酸菌を摂取させたネズミに比べて、FARM1及びFARM2乳酸菌を摂取させたネズミの体重がそれぞれ15%と19%に減少する効果を示した。哺乳動物のカロリー過多摂取によると、ほとんどが内臓脂肪として蓄積されるので、体重の増加は内臓脂肪の増加量に比例する。したがって、乳酸菌給餌実験の終了日にオープンタイプの0.3テスラMRIを利用してネズミの内臓脂肪を測定した。非処理対照群、一般の乳酸菌を摂取させたネズミ実験群、FARM1を摂取させたネズミ実験群、FARM2を摂取させたネズミ実験群の内臓脂肪量は、それぞれ27%、24%、14%及び13%であった。この結果は、FARMが宿主の小腸管内にコロニー形成されると、FARMが小腸管内の自由脂肪酸吸収を減少させ、結局、宿主の体重増加と体脂肪蓄積を防止する効果を有することを意味する。すなわち、宿主の自由脂肪酸摂取/吸収量を減少させると、カロリー摂取の減少によって内臓脂肪と体重が減少する。
【0020】
(代謝性症侯群と関連している血清内生化学分析)
肥満は、インスリン抵抗性、グルコース耐性、高脂血症、心血管疾患などの代謝性症侯群と密接に関連している。したがって、乳酸菌給餌実験の終了日には、代謝性症侯群と関連している血清内生化学分析をした。乳酸菌を全く摂取させていない対照群と一般の乳酸菌を摂取させたネズミにおけるTG、TC及びLDL―コレステロール量は、FARM1とFARM2を摂取させたネズミに比べて高かった。一方、予想した通り、HDLコレステロール数値は、対照群では低かったが、FARMグループでは高かった。抗肥満効果を示したFARM乳酸菌は、予想通りに糖尿でも優れた効果を示した。FARM1とFARM2を摂取させると、乳酸菌を全く摂取させていない対照群に比べて血清インスリン数値がそれぞれ23%と30%減少した。血清レプチン数値も、乳酸菌を全く摂取させなかった対照群に比べて、FARM1とFARM2を摂取させたネズミではそれぞれ20%と45%減少した。血清グルコース数値も、乳酸菌を全く摂取させていない対照群と一般の乳酸菌を摂取させたネズミの場合は122.1mg/dlと123.4mg/dlである一方、FARM1とFARM2を摂取させたネズミではそれぞれ107.6mg/dlと108.4mg/dl程度に減少したことが分かる。体重の増加とともに人体のレプチンとインスリンに対する感受性が減少し、これと同時に血清脂質プロファイルが悪化するが、その結果、レプチン、インスリン、グルコース、LDLコレステロール、総コレステロールの血中濃度が増加するようになる。この結果は、FARM乳酸菌が体重増加を防止することによって血中脂質プロファイルを改善し、インスリンとレプチンの耐性を阻害するのに効果的であることを示す。また、FARM乳酸菌が肥満治療剤として優れた性質を有していることを示す。
【0021】
(自由脂肪酸の吸収能力が増加した乳酸菌の抗肥満治療剤としての可能性)
FARMをコロニー形成したネズミは、自由脂肪酸の摂取を減少させ、その結果、体重増加と内臓脂肪蓄積を防止する優れた特性を有しているので、自由脂肪酸摂取能が改善されたFARM乳酸菌の抗肥満治療剤としての可能性を実験した。FARM2乳酸菌を利用してEMS(ethylmethane sulfonate:エチレンメタン スルフォネート)で3次突然変異を誘導することによって、自由脂肪酸摂取能がさらに向上した乳酸菌株を見出した。見出した3次突然変異株FARM3は、一般の乳酸菌より自由脂肪酸摂取能が5.0倍以上改善された菌株であって、ラクトバチルス・アシドフィラスFARM3と命名し、これを2009年5月19日付けで韓国生命工学研究院の生物資源センターに受託番号KCTC 11515BPで寄託した。本発明では、これを「FARM3」と略称する。FARM3で発酵させたヨーグルトを毎日3mlずつネズミに4週間摂取させると、一般の乳酸菌を摂取させた対照群に比べて体重が18%以上減少する結果を示した。このようなFARM3の体重減少程度は、現在医薬品として使用されているオルリスタットと類似した水準である。そして、オルリスタットと異なり、FARM3の場合は、摂取時に体重の効果的な減少以外に脂肪便などの副作用を示さなかった。これは、FARM3が安全かつ効果的な肥満治療剤として開発可能な医薬品素材であることを意味する。本発明では、乳酸菌FARM3を用いて実験したが、本発明の技術思想がFARM3や乳酸菌に限定されることはない。肥満治療に関する本発明の技術思想は、哺乳類、特に、ヒトの胃腸管内で棲息可能で、かつ、自由脂肪酸吸収能がある微生物であればいずれにも適用可能であり、これは、本発明の属する技術分野で通常の知識を有する者にとって自明である。
【実施例】
【0022】
以下、具体的な実施例を通して本発明をより詳細に説明する。しかし、これら実施例は、単に本発明をより具体的に説明するためのものであって、本発明の範囲がこれら実施例によって限定されることはない。
【0023】
(試薬)
試薬は、下記に示したもの以外は、シグマ社(Sigma)製のものを購入して使用した。
【0024】
[1―14C]―パルミチン酸:PerkinElmer Life Sciences社製
【0025】
液体シンチレーションカクテル(LSC):PerkinElmer Life Sciences社製
【0026】
[カルボキシル―14C]―トリオレイン:Research Products International社製
【0027】
MRA(Man―Rogosa―Sharpe):Difco社製
【0028】
オルリスタット(ゼニカル):Roche社製
【0029】
殺菌可能な(sterilizable)384―ウェルプレート及び384―ピンレプリケーター:Nunc社製
【0030】
メンブレン半乾燥システム(Membrane semi―dry system):Bio―Rad社製
【0031】
X―線フィルム:Kodak社製
【0032】
Gel―Proアナライザーソフトウェア(analyzer software):Media cybernetics社製
【0033】
嫌気培養:BBLガスパック嫌気システム(Gas―Pack anaerobic systems)の嫌気性ジャーで行われる。
【0034】
SD(Sprague―Dawley)雄ネズミ:Dae Han Biolink Co.,Ltd.
【0035】
MRIイメージ:ブルカーバイオスペック47/40 4.7―テスラ機器(Bruker Biospec 47/40 4.7―Tesla instrument)(Bruker社製)から得てImage J(NIH)で分析される。
【0036】
血清(Serum):それぞれラット/マウスELISAキット(LINCO research社製)、レプチンELISAキット(RD System社製)、血糖測定器(Accu―Chek社製)及びコレステロールELISAキット(Asan Pharm.Co製)で分析される。
【0037】
(突然変異を通して脂肪酸吸収能が改善された乳酸菌の開発)
L.アシドフィラスKCTC3179乳酸菌をMRS培地に接種し、BBLガスパック(Gas―Pack)によりpH7.2、37℃で嫌気培養した。自由脂肪酸吸収能が改善されたFARM菌株を得るための突然変異実験は、次のように行われた。L.アシドフィラスKCTC3179乳酸菌を24時間精製培養した後、液状培養液にNTG(N―methyl―N―nitro―N―nitrosoguanidine:N−メチル−N−ニトロ−N−ニトロソグアニジン)を2mg/mlの濃度で添加した。25℃で30分間培養した後、MRSブロスで3回洗浄し、MRSブロスに再び懸濁した。連続希釈(serial dilution)後、処理された各細胞をMRS寒天プレートに置き、嫌気状態で37℃、48時間培養した後、50μlのMRSブロスが入っている384―ウェルプレートに接種し、37℃で12時間嫌気培養した。培養が終了した後、MRSブロス培養液のみが入っている384―ウェルプレートと、0.1nCi/mlの14C―パルミチン酸が含まれたMRSブロス培養液が入っている384―ウェルプレートを384―ピンレプリケーターを用いて複製した。複製されたプレートは、パラフィルムで覆った後、37℃でやわらく揺らしながら30分間培養した後、14Cと放射能標識された培養液を2μlずつナイロンメンブレンにそれぞれ移した後、半乾燥システム(semi―dry system)で乾燥させた。乾燥した膜は、MRSブロスで3回洗浄し、付着している14C―パルミチン酸を除去した後、−80℃で3日間X線フィルムに露出させた。X線フィルムから得た放射能程度は、Gel―Proアナライザーソフトウェアで分析して信号の強いコロニーを選別し、これから最終的に脂肪酸吸収能が改善された乳酸菌株を探してFARM1(fatty acid robbing microbe 1)と命名した。次に、FARM1に前記のような方法で4NQO(4―nitroquinoline 1―oxide:4−ニトロキノリン 1−オキシド)を処理してFARM2を得た後、前記と同じ方法でFARM2にEMS(ethylmethane sulphonate:エチルメタン スルフォネート)を処理してFARM3を得た。
【0038】
(インビトロ(In vitro)脂肪酸吸収能評価)
見出された乳酸菌株の脂肪酸吸収能を評価するために、各乳酸菌株を放射能標識された14Cパルミチン酸と共に培養した後、放射能程度を測定した。このために、各乳酸菌株をMRSブロス2mlに接種した後、培養して代数生長期に到逹すると遠心分離し、1nCi/mlの濃度で14C―パルミチン酸が入っているMRS培地に接種した後、37℃で1時間培養した。14Cと標識された各細胞をMRSブロスで3回洗浄した後、MRSブロス1mlに懸濁し、そのうち0.2mlを2mlの液体シンチレーションカクテルが入っているシンチレーションバイアルに移した。混合物を1分間ボルテックスした後、液体シンチレーションスペクトロメーターを用いて14C活性(activity)を測定した。
【0039】
(乳酸能評価)
各乳酸菌株をMRS培地により37℃で嫌気培養して代数生長期に到逹すると、1mlの細胞培養液を無菌状態の脱脂牛乳(10%)とグルコース(2%)を含有した100mlに接種した後、37℃で培養しながら24時間の間隔でpH変化を測定した。細胞生長曲線を測定するためには、48時間発酵した後で作られたヨーグルト5mlを15mlのコニカルチューブに移した後、ボルテックスをした。均質化された混合物1mlをPBSで希釈し、希釈液50μlをMRSプレートに塗抹し、48時間嫌気培養した後、コロニーの数を数えた。
【0040】
(動物実験)
全ての動物実験は、動物管理及び利用委員会(Institutional Animal Care and Use Committee)の規定にしたがって行われた。体重が200〜220g程度であるSD雄ネズミを二匹ずつ檻に入れ、最初の1週間は一般の飼料と水を自由に級餌した。実験期間の間は12時間の間隔で昼と夜の照明を変え、温度は22±1℃、湿度は40〜50%に一定に維持した。一週間後、ネズミたちを一つのグループ当たり14匹になるように無作為に分離し、対照群(高脂肪飼料摂取群)、3179グループ(高脂肪飼料とL.acidophilus KCTC3179乳酸菌発酵ヨーグルト摂取群)、FARMグループ(高脂肪飼料とL.acidophilus FARM乳酸菌発酵ヨーグルト摂取群)に分けた。この実験に使用された高脂肪飼料は、一般のネズミ飼料(複合炭水化物60%、タンパク質22%、脂肪3.5%、繊維素5%、粗灰分8%、カルシウム0.6%、リン1.2%)に豚脂を20%添加した特殊飼料であって、組成は、複合炭水化物48%、タンパク質17.6%、脂肪22.8%、繊維素4%、粗灰分6.4%、カルシウム0.48%、リン0.96%で構成されている。食餌実験のためのヨーグルトは、脱脂粉乳10%、砂糖2%、109/ml以上の菌体濃度を有するL.acidophilus培養液1%である。実験期間の間、ネズミたちは、それぞれに割り当てられた食餌を自由に摂取し、発酵ヨーグルト3mlが口腔に直接給餌された。体重は、12時間禁食した後、午前9時から1時の間に測定された。
【0041】
<1.胃腸管集落形成能>
ネズミに各実験群によるL.acidophilus発酵ヨーグルトを8週間級餌した後、各実験群から4匹のネズミを無作為に選び、エーテルで麻酔させた後、犠牲させた。ネズミから胃と小腸などの胃腸管組織を直ちに収去し、50mlのコニカルチューブに移した後、無菌食塩水で希釈した。次に、胃腸管組織の内容物を排出するために、ホモジナイザーを用いて均質化した後、乳酸菌選別寒天プレート(lactobacillus selective agar plates)に塗抹し、48時間の間嫌気培養した。乳酸菌選別培地で形成された乳酸菌コロニーの数を数え、胃腸管内の組織部位別の1グラム当たりのlog10CFU(湿重量)で計算した。
【0042】
<2.FARM乳酸菌の肥満誘導抑制効果>
長い鎖構造を有しているトリグリセリドの一種であるトリオレインを用いてFARM乳酸菌の肥満誘導抑制効果に対する実験が行われた。[14C]と放射能標識されたトリオレインをベンゼン溶液に作り、−70℃で保管して使用した。[14C]と放射能標識されたトリオレイン1μCiを放射能標識されていないトリオレインと混ぜた後、室温で窒素ガスを用いて溶媒を揮発させた。トリオレイン混合物を、乳酸菌を22週間摂取させたネズミに体重100g当たり0.5mmolで級餌した後、10時間の間2時間の間隔で心臓穿刺でネズミの血液サンプルを収去した。各血清から0.1mlを1.8mlのLSCに添加した後、液体シンチレーションスペクトロメーターで14C活性を測定した。FARM乳酸菌の肥満誘導抑制は、各乳酸菌発酵ヨーグルトを摂取させたネズミでの脂肪酸摂取能の差による血清内放射能程度の差を測定することによって判断した。
【0043】
<3.内臓脂肪の磁気共鳴映像測定>
内臓脂肪部位の体脂肪を磁気共鳴映像(MRI)機器で分析するために、ブルカーバイオスペック47/40 4.7―テスラ機器を使用した。実験に使用されたネズミは、ゾレチル(zoletil)(25mg/kg)とロンパン(rompun)(10mg/kg)で麻酔した。映像を得るためにネズミたちを磁石板に位置させ、ボディコイルを送信機と受信機として使用して記録した。内臓脂肪と皮下脂肪部位を測定するために、第4〜第5の腰椎間で上から8cm、下から8cmの部位をT1強調映像として得た。内臓脂肪と皮下脂肪部位はイメージJプログラムで分析された。
【0044】
<4.血清生化学分析>
実験ネズミたちの血液は、実験開始日と終了日である22週後に収去され、生化学分析に使用された。血液採取前に全ての実験動物は節食し、エーテルで麻酔した状態で心臓穿刺で全ての血液を得た。血液を2,000xgで4℃で10分間遠心分離して得た血清は、分析するまで70℃で保管した。血清生化学分析のために、ラット/マウスELISAキット(インスリン)、レプチンELISAキット(レプチン)、血糖測定器、ELISAキット(血清総コレステロール、HDL―コレステロール、LDL―コレステロール、トリグリセリド)などが使用された。
【0045】
<5.FARM3乳酸菌の抗肥満効果>
3ヶ月になったSD雄ネズミは、8週間高脂肪を食餌し、平均体重が425gになるように肥満を誘導した。これらネズミたちを一つのグループ当たり14匹になるように無作為に分離し、3179グループ(高脂肪飼料とL.acidophilus KCTC3179乳酸菌発酵ヨーグルト摂取群)、FARM3グループ(高脂肪飼料とL.acidophilus FARM3乳酸菌発酵ヨーグルト摂取群)、オルリスタットグループ(高脂肪飼料にゼニカル(Xenical)(登録商標)を200mg/kgの食物として添加して摂取させた群)に分けた。その後、4週間、ネズミたちはそれぞれに割り当てられた食餌を自由に摂取し、体重は、12時間禁食した後、午前9時から1時の間に測定された。
【0046】
<6.統計処理>
全てのデータは平均値±標準偏差に表示され、ANOVA(analysis of variance:分散分析)テストによってp<0.05である場合に統計的に有意であると判断された。
【0047】
(結果)
<1.乳酸菌の脂肪酸吸収能及び乳酸菌がコロニー形成された宿主のカロリー摂取変化>
図1は、乳酸菌の脂肪酸吸収能を測定した結果を示している。ラクトバチルス・アシドフィラスKCTC 3179(「3179」と表示される。)乳酸菌をNTG(N―methyl―N―nitro―N―nitrosoguanidine:N−メチル−N−ニトロ−N−ニトロソグアニジン)で突然変異させて見出されたFARM1乳酸菌は、脂肪酸吸収能が増加していた。FARM1乳酸菌を4NQO(4―nitroquinoline 1―oxide:4−ニトロキノリン 1−オキシド)で2次突然変異させて得たFARM2は、FARM1より改善された脂肪酸吸収能を有していた。外部から脂肪酸を吸収する能力の差を測定するために、1nCi/mlの濃度で14C放射能標識されたパルミチン酸と乳酸菌を1時間培養した後、乳酸菌の放射能程度を液体シンチレーションスペクトロメーターで測定し、これは標準偏差(n=4)に表示された。
【0048】
図2は、乳酸菌がコロニー形成された宿主でのカロリー摂取変化を測定した結果を示している。FARM乳酸菌がコロニー形成された宿主でカロリー摂取の減少が確認された。SDネズミに8週間FARM乳酸菌又は一般の乳酸菌L.acidophilus KCTC 3179を給餌し、胃腸管に乳酸菌をコロニー形成した後、14C―標識されたトリオレインを摂取させ、血液を採取して血清内放射能程度を測定することによって宿主のカロリー摂取変化を測定した。
【0049】
図1及び図2の結果から、FARM乳酸菌の脂肪酸吸収能とFARM乳酸菌がコロニー形成された宿主の胃腸管での脂肪吸収が反比例することが分かる。
【0050】
<2.乳酸能>
各乳酸菌株は、無菌状態のグルコース(2%)を含有した脱脂牛乳(10%)100mlに接種し、37℃でヨーグルトに発酵させた。ヨーグルトに発酵される過程で乳酸菌の乳酸能を測定するために、pH変化を24時間後、48時間後、72時間後に測定した。10個の試料の測定値は平均値±標準偏差に表示された。結果は、次の表1に示す通りである。
【0051】
表1
10個の試料の測定値は平均値±標準偏差

【0052】
<3.胃腸管内の集落形成(colonization)能力>
ネズミに各実験群によるL.acidophilus(KCTC3179又はFARM)発酵ヨーグルトを8週間給餌した後、胃と小腸などの胃腸管組織を収去し、胃腸管内の組織部位別の1グラム当たりのlog10CFU(湿重量)を得た。対照群は乳酸菌無処理群で、5個の試料の測定値は平均値±標準偏差に表示された。結果は、次の表2に示す通りである。
【0053】
表2
5個の試料の測定値は平均値±標準偏差

【0054】
<4.食餌で肥満を誘導する間におけるL.acidophilus KCTC3179、FARM1、FARM2の胃腸管内の集落形成(colonization)能力>
ネズミに各実験群によるL.acidophilus(KCTC3179又はFARM)発酵ヨーグルトを4週間給餌した後、胃と小腸などの胃腸管組織を収去し、胃腸管内の組織部位別の1グラム当たりのlog10CFU(湿重量)を得た。対照群は乳酸菌無処理群で、5個の試料の測定値は平均値±標準偏差に表示された。結果は、次の表3に示す通りである。
【0055】
表3
5個の試料の測定値は平均値±標準偏差

【0056】
<5.高脂肪食餌で誘導された肥満に対するFARMのカロリー摂取減少の効果>
結果は、図3〜図5に示す通りである。図3は、実験群の体重変化を測定した結果を示している。体重が200〜220g程度の3ヶ月になったSD雄ネズミを一つのグループ当たり14匹になるように無作為に分離し、対照群(高脂肪飼料摂取群)、3179グループ(高脂肪飼料とL.acidophilus KCTC 3179乳酸菌発酵ヨーグルト摂取群)、FARMグループ(高脂肪飼料とL.acidophilus FARM乳酸菌発酵ヨーグルト摂取群)に分けた。その後、22週間、ネズミたちはそれぞれに割り当てられた食餌を自由に摂取し、体重変化は平均値±標準偏差に表示された。
【0057】
図4は、実験群の内臓脂肪を磁気共鳴映像装置(MRI)で測定して分析し、映像分析プログラム(Image J、USA)で分析した結果を示している。内臓脂肪量の変化は平均値±標準偏差に表示された。
【0058】
図5は、22週間の高脂肪食餌群とFARM乳酸菌摂取群の内臓脂肪蓄積イメージを示している。
【0059】
<6.一般の乳酸菌KCTC 3179とFARM乳酸菌給餌後の血清数値の比較結果>
結果は、図6〜図8に示す通りである。体重が200〜220g程度の3ヶ月になったSD雄ネズミを一つのグループ当たり14匹になるように無作為に分離し、対照群(高脂肪飼料摂取群)、3179グループ(高脂肪飼料とL.acidophilus KCTC3179乳酸菌発酵ヨーグルト摂取群)、FARMグループ(高脂肪飼料とL.acidophilus FARM乳酸菌発酵ヨーグルト摂取群)に分けた。実験開始日及び終了日に採取された血液から得た血清数値を分析した結果は、標準偏差に表示された。図6は、血中脂質濃度の変化を示したもので、TGはトリグリセリド、TCは総コレステロール、HDLは高比重リポタンパクコレステロール、LDLは低比重リポタンパクコレステロールを示す。図7は、血中インスリンとレプチン濃度の変化を示したもので、図8は血糖変化を示している。
【0060】
<7.食餌で誘導された肥満に対するFARM3の抗肥満効果>
結果は、図9及び図10に示す通りである。図9は、FARM3乳酸菌のインビトロ脂肪酸吸収能を3179乳酸菌と比較したものである。FARM2乳酸菌をEMS(ethylmethane sulphonate:エチルメタン スルフォネート)で3次突然変異させて得たFARM3は、FARM2より改善された脂肪酸吸収能を有する。外部から脂肪酸を吸収する能力の差を測定するために、1nCi/mlの濃度で14Cと放射能標識されたパルミチン酸と乳酸菌を1時間培養した後、乳酸菌の放射能程度を液体シンチレーションスペクトロメーターで測定し、これは標準偏差(n=4)に表示された。
【0061】
図10は、FARM乳酸菌がコロニー形成された宿主でのカロリー摂取の減少を示す結果を示している。SDネズミに8週間FARM乳酸菌又は一般の乳酸菌L.acidophilus KCTC3179を給餌し、胃腸管に乳酸菌をコロニー形成した後、14C―標識されたトリオレインを摂取させ、血液を採取して血清内放射能程度を測定することによって宿主のカロリー摂取変化を測定した。まず、3ヶ月になったSD雄ネズミは、8週間高脂肪を食餌し、平均体重が425gになるように肥満を誘導した。
【0062】
これらネズミたちを一つのグループ当たり14匹になるように無作為に分離し、3179グループ(○、高脂肪飼料とL.acidophilus KCTC3179乳酸菌発酵ヨーグルト摂取群)、FARM3グループ(●、高脂肪飼料とL.acidophilus FARM3乳酸菌発酵ヨーグルト摂取群)、オルリスタットグループ(△、高脂肪飼料にゼニカル(Xenical)(登録商標)を200mg/kgの食物として添加して摂取させた群)に分けた。その後、4週間、ネズミたちはそれぞれに割り当てられた食餌を自由に摂取し、体重変化は平均値±標準偏差に表示された。
【0063】
(翻訳文)
特許手続き上の微生物の寄託の国際的承認に関するブダペスト条約
国際様式
原寄託に対する受託証
下記の国際寄託機関によって規則第7.1条の規定によって発行された。
受信:JINIS
大韓民国 全羅北道 完州郡 鳳東邑 デゥン山里 948―9(〒565―902)

【0064】
(翻訳文)
特許手続き上の微生物の寄託の国際的承認に関するブダペスト条約
国際様式
原寄託に対する受託証
下記の国際寄託機関によって規則第7.1条の規定によって発行された。
受信:JINIS
大韓民国 全羅北道 完州郡 鳳東邑 デゥン山里 948―9(〒565―902)

【0065】
(翻訳文)
特許手続き上の微生物の寄託の国際的承認に関するブダペスト条約
国際様式
原寄託に対する受託証
下記の国際寄託機関によって規則第7.1条の規定によって発行された。
受信:JINIS
大韓民国 全羅北道 完州郡 鳳東邑 デゥン山里 948―9(〒565―902)

【特許請求の範囲】
【請求項1】
哺乳類の胃腸管内で棲息可能で、かつ、自由脂肪酸吸収能がある微生物を有効成分として含有する、肥満及び肥満によって引き起こされた代謝性疾患の予防と治療のための薬学的組成物。
【請求項2】
前記微生物は、ヒトの腸内細菌叢を構成する微生物又はヒトの腸管から由来した微生物である、請求項1に記載の薬学的組成物。
【請求項3】
前記微生物は乳酸菌である、請求項1又は2に記載の薬学的組成物。
【請求項4】
前記微生物は、ラクトバチルス・アシドフィラスFARM1(KCTC 11513BP)、ラクトバチルス・アシドフィラスFARM2(KCTC 11514BP)及びラクトバチルス・アシドフィラスFARM3(KCTC 11515BP)から選択された何れか一つである、請求項3に記載の薬学的組成物。
【請求項5】
哺乳類の胃腸管内で棲息可能で、かつ、自由脂肪酸吸収能がある乳酸菌を含む、肥満の予防及び改善のための機能性食品。
【請求項6】
前記乳酸菌は、ラクトバチルス・アシドフィラスFARM1(KCTC 11513BP)、ラクトバチルス・アシドフィラスFARM2(KCTC 11514BP)及びラクトバチルス・アシドフィラスFARM3(KCTC 11515BP)から選択された何れか一つである、請求項5に記載の機能性食品。
【請求項7】
前記食品はヨーグルトである、請求項5又は6に記載の機能性食品。
【請求項8】
自由脂肪酸吸収能があるラクトバチルス・アシドフィラスFARM1(KCTC 11513BP)。
【請求項9】
自由脂肪酸吸収能があるラクトバチルス・アシドフィラスFARM2(KCTC 11514BP)。
【請求項10】
自由脂肪酸吸収能があるラクトバチルス・アシドフィラスFARM3(KCTC 11515BP)。
【請求項11】
哺乳類の胃腸管内で棲息可能で、かつ、自由脂肪酸吸収能がある微生物を投与し、体内での自由脂肪酸吸収を減少させることを含む、肥満と肥満によって引き起こされた代謝性疾患の予防及び治療方法。
【請求項12】
前記微生物は、ヒトの腸内細菌叢を構成する微生物又はヒトの腸管から由来した微生物である、請求項11に記載の予防及び治療方法。
【請求項13】
前記微生物は乳酸菌である、請求項11又は12に記載の予防及び治療方法。
【請求項14】
前記微生物は、ラクトバチルス・アシドフィラスFARM1(KCTC 11513BP)、ラクトバチルス・アシドフィラスFARM2(KCTC 11514BP)及びラクトバチルス・アシドフィラスFARM3(KCTC 11515BP)から選択された何れか一つである、請求項13に記載の予防及び治療方法。
【請求項1】
哺乳類の胃腸管内で棲息可能で、かつ、自由脂肪酸吸収能がある微生物を有効成分として含有する、肥満及び肥満によって引き起こされた代謝性疾患の予防と治療のための薬学的組成物。
【請求項2】
前記微生物は、ヒトの腸内細菌叢を構成する微生物又はヒトの腸管から由来した微生物である、請求項1に記載の薬学的組成物。
【請求項3】
前記微生物は乳酸菌である、請求項1又は2に記載の薬学的組成物。
【請求項4】
前記微生物は、ラクトバチルス・アシドフィラスFARM1(KCTC 11513BP)、ラクトバチルス・アシドフィラスFARM2(KCTC 11514BP)及びラクトバチルス・アシドフィラスFARM3(KCTC 11515BP)から選択された何れか一つである、請求項3に記載の薬学的組成物。
【請求項5】
哺乳類の胃腸管内で棲息可能で、かつ、自由脂肪酸吸収能がある乳酸菌を含む、肥満の予防及び改善のための機能性食品。
【請求項6】
前記乳酸菌は、ラクトバチルス・アシドフィラスFARM1(KCTC 11513BP)、ラクトバチルス・アシドフィラスFARM2(KCTC 11514BP)及びラクトバチルス・アシドフィラスFARM3(KCTC 11515BP)から選択された何れか一つである、請求項5に記載の機能性食品。
【請求項7】
前記食品はヨーグルトである、請求項5又は6に記載の機能性食品。
【請求項8】
自由脂肪酸吸収能があるラクトバチルス・アシドフィラスFARM1(KCTC 11513BP)。
【請求項9】
自由脂肪酸吸収能があるラクトバチルス・アシドフィラスFARM2(KCTC 11514BP)。
【請求項10】
自由脂肪酸吸収能があるラクトバチルス・アシドフィラスFARM3(KCTC 11515BP)。
【請求項11】
哺乳類の胃腸管内で棲息可能で、かつ、自由脂肪酸吸収能がある微生物を投与し、体内での自由脂肪酸吸収を減少させることを含む、肥満と肥満によって引き起こされた代謝性疾患の予防及び治療方法。
【請求項12】
前記微生物は、ヒトの腸内細菌叢を構成する微生物又はヒトの腸管から由来した微生物である、請求項11に記載の予防及び治療方法。
【請求項13】
前記微生物は乳酸菌である、請求項11又は12に記載の予防及び治療方法。
【請求項14】
前記微生物は、ラクトバチルス・アシドフィラスFARM1(KCTC 11513BP)、ラクトバチルス・アシドフィラスFARM2(KCTC 11514BP)及びラクトバチルス・アシドフィラスFARM3(KCTC 11515BP)から選択された何れか一つである、請求項13に記載の予防及び治療方法。
【図1】


【図2】


【図3】


【図4】


【図6】


【図7】


【図8】


【図9】


【図10】


【図5】




【図2】


【図3】


【図4】


【図6】


【図7】


【図8】


【図9】


【図10】


【図5】


【公表番号】特表2012−520292(P2012−520292A)
【公表日】平成24年9月6日(2012.9.6)
【国際特許分類】
【出願番号】特願2011−553927(P2011−553927)
【出願日】平成21年6月5日(2009.6.5)
【国際出願番号】PCT/KR2009/003036
【国際公開番号】WO2010/104242
【国際公開日】平成22年9月16日(2010.9.16)
【出願人】(511221068)ジニス バイオファーマサティカルズ カンパニー (1)
【氏名又は名称原語表記】JINIS BIOPHARMACEUTICALS CO.
【Fターム(参考)】
【公表日】平成24年9月6日(2012.9.6)
【国際特許分類】
【出願日】平成21年6月5日(2009.6.5)
【国際出願番号】PCT/KR2009/003036
【国際公開番号】WO2010/104242
【国際公開日】平成22年9月16日(2010.9.16)
【出願人】(511221068)ジニス バイオファーマサティカルズ カンパニー (1)
【氏名又は名称原語表記】JINIS BIOPHARMACEUTICALS CO.
【Fターム(参考)】
[ Back to top ]

