微生物を検出する方法及びそのためのキット
試験サンプル内の微生物を検出する方法が提供される。本方法は、a)培養サンプルを形成するために、増殖培地を用いて試験サンプルを培養する工程であって、増殖培地が酵素基質を含み、酵素基質が酵素加水分解性基及び蛍光基を含み、試験サンプル内に存在する微生物が、加水分解性基を蛍光基から加水分解し、蛍光検出可能な生成物を形成する酵素を含み、蛍光検出可能な生成物が酸性種及び塩基種の両方を有する、工程と、b)蛍光検出可能な生成物が光を放出するために十分な時間、Exλisoの波長を有する光を用いて蛍光検出可能な生成物を励起する工程であって、Exλisoが蛍光検出可能な生成物の吸光度等吸収点である、工程と、c)Emλ1の波長で放出される光を検出する工程と、を含む。
【発明の詳細な説明】
【技術分野】
【0001】
(関連出願の相互参照)
本出願は、2009年12月22日に出願された米国特許仮出願第61/288,883号の利益を主張し、その開示内容の全体を参照として本明細書に援用する。
【0002】
(発明の分野)
本発明は、蛍光性化合物を利用して、微生物を検出する方法に関する。
【背景技術】
【0003】
7−ヒドロキシクマリン系染料(ウンベリフェロンとも呼ばれる)及びそれらの誘導体は、酵素活性のための指標として広く使用されている。ウンベリフェロンの一例は、4−メチルウンベリフェロン(4−MUと呼ばれる)であり、大腸菌の検出等に使用される。4−MU(及び他のウンベリフェロン)の最も高い蛍光は、塩基形態から観測されるため、そのような検出はpH 8〜10で行われなければならない。
【発明の概要】
【課題を解決するための手段】
【0004】
より低いpH値で検出応答があることが望まれる様々な状況が存在する。例えば、酸性ホスファターゼの動態検査は、酸性培地内での酵素活性のリアルタイム検出を必要とする。酸性pHで蛍光を観察する能力はまた、プロトコル内の必要な工程を排除し、それによって分析をより迅速かつ容易にする。低pHの蛍光分析を実行するという要望のため、pHに関係なく実行され得る分析方法に対する必要性が残る。
【0005】
本明細書に開示されるのは、試験サンプル内の微生物を検出する方法であって、a)培養サンプルを形成するために、増殖培地を用いて試験サンプルを培養する工程であって、増殖培地が酵素基質を含み、酵素基質が酵素加水分解性基及び蛍光基を含み、試験サンプル内に存在する微生物が、加水分解性基を蛍光基から加水分解し、蛍光検出可能な生成物を形成する酵素を含み、蛍光検出可能な生成物が酸性種及び塩基種の両方を有する、工程と、b)蛍光検出可能な生成物が光を放出するために十分な時間、Exλisoの波長を有する光を用いて蛍光検出可能な生成物を励起する工程であって、Exλisoが蛍光検出可能な生成物の吸光度等吸収点である、工程と、c)Emλ1の波長で放出される光を検出する工程と、を含む、方法である。
【0006】
試験サンプル内の微生物を検出する方法であって、a)試験サンプルを酵素基質で培養する工程であって、酵素基質が酵素加水分解性基及び蛍光基を含み、試験サンプル内に存在する微生物が、加水分解性基を蛍光基から加水分解し、蛍光検出可能な生成物を形成する酵素を含み、蛍光検出可能な生成物が、酸性種及び塩基種の両方を有する、工程と、b)蛍光検出可能な生成物が光を放出するために十分な時間、Exλisoの波長を有する光を用いて蛍光検出可能な生成物を励起する工程であって、Exλisoが蛍光検出可能な生成物の等吸収点である、工程と、c)Exλisoの波長を有する光を用いた励起の結果として、Emλ1の波長で放出される光を検出する工程と、d)蛍光検出可能な生成物が光を放出するために十分な時間、Exλ2の波長を有する光を用いて蛍光検出可能な生成物を励起する工程であって、Exλ2が蛍光検出可能な生成物の塩基種の吸収極大、又は蛍光検出可能な生成物の酸性種の吸収極大である、工程と、e)Exλ2の波長を有する光を用いた励起の結果として、Emλの波長で放出される光を検出する工程と、f)Exλiso励起光の結果として放出される光及びExλ2励起光の結果として放出される光に基づいて比率を計算する工程であって、比率が試験サンプル内に存在する微生物の量の指標である、工程と、を含む、方法もまた開示される。
【0007】
試験サンプル内の微生物の存在を試験するためのキットであって、酵素加水分解性基及び蛍光基を含む酵素基質であって、試験サンプル内に存在する微生物が、加水分解性基を蛍光基から加水分解し、蛍光検出可能な生成物を形成する酵素を含み、蛍光検出可能な生成物が、酸性種及び塩基種の両方を有する、酵素基質と、Exλisoの波長を有する光を提供することができる光源であって、Exλisoが蛍光検出可能な生成物の等吸収点であり、Exλisoの波長を有する光を用いた蛍光検出可能な生成物の励起が、蛍光検出可能な生成物に光を放出させる、光源と、を備える、キットもまた開示される。
【0008】
本開示の様々な実施形態についての以下の詳細説明を添付の図面と共に検討することで、本開示はより完全に理解され得る。
図面は、必ずしも一定の比率の縮尺ではない。図中で用いられる類似の数字は、類似の構成要素を示す。しかし、所与の図中の構成要素を意味する数字の使用は、同一数字で表示した別の図中の構成要素を制約するものではないことは理解されよう。
【図面の簡単な説明】
【0009】
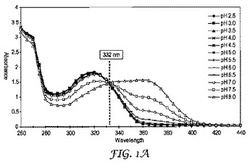
【図1A】異なるpH値に対する4−メチルウンベリフェロン(4−MU)の吸収スペクトル(図1A)。
【図1B】2つの異なる励起波長に対するpHの関数としての放出(励起455nm)(図1B)。
【図1C】異なるpH値に対する400nm〜500nmの放出スペクトル(図1C)。
【図2】本明細書に開示される例示方法を描写するフローチャート。
【図3】本明細書に開示される例示方法を描写するフローチャート。
【図4】本明細書に開示される例示方法を描写するフローチャート。
【図5A】pHの関数としての放出スペクトル(375nm)(図5A)。
【図5B】3つの異なる励起波長でのpHの関数としての放出スペクトル(455nm)(図5B)。
【図5C】異なる波長での励起に対するピーク放出比率のプロット(図5C)。
【図6】pHの関数としての7−ヒドロキシクマリン−3−カルボン酸エチルエステル(EHC)に対する放出スペクトル(450nm)。
【図7A】異なるpH値に対する3−(2−チエニル)ウンベリフェロン(TU)の吸収スペクトル(図7A)、380nm(図7B)、並びにpHの関数としての、405nmでの励起にあたっての放出(500nmで)及び380nmでの励起にあたっての放出(490nmで)(図7C)。
【図7B】異なるpH値に対する3−(2−チエニル)ウンベリフェロン(TU)の吸収スペクトル(図7A)、380nm(図7B)、並びにpHの関数としての、405nmでの励起にあたっての放出(500nmで)及び380nmでの励起にあたっての放出(490nmで)(図7C)。
【図7C】異なるpH値に対する3−(2−チエニル)ウンベリフェロン(TU)の吸収スペクトル(図7A)、380nm(図7B)、並びにpHの関数としての、405nmでの励起にあたっての放出(500nmで)及び380nmでの励起にあたっての放出(490nmで)(図7C)。
【図8A】β−D−ガラクトシダーゼの存在下及び非存在下における4−MU及び4−MUGに対するpHの関数としての335nmでの励起にあたっての放出(455nm)(図8A)。
【図8B】β−D−ガラクトシダーゼの存在下及び非存在下における4−MU及び4−MUGのpHの関数としての360nmでの励起にあたっての放出(455nm)(図8B)。
【図9】β−D−ガラクトシダーゼの存在下及び非存在下におけるMHCgalに対するpHの関数としての445nmでの放出(励起370nm又は400nm)。
【図10】β−D−ガラクトシダーゼの存在及び非存在下における3−(2−チエニル)ウンベリフェロン−β−D−ガラクトピラノシド(TUgal)に対するpHの関数としての380nmでの励起にあたっての490nmでの放出、及びβ−D−ガラクトシダーゼの存在下及び非存在下におけるTUgalに対するpHの関数としての410nmでの励起にあたっての500nmでの放出。
【発明を実施するための形態】
【0010】
次の記述において、本明細書の一部を構成する添付の図面を参照し、幾つかの特定の実施形態を例として示す。本開示の範囲及び趣旨から逸脱することなく、その他の実施形態が検討され、作成され得ることを理解されたい。したがって、以下の「発明を実施するための形態」は、限定する意味で理解すべきではない。
【0011】
本明細書で使用するすべての科学用語及び専門用語は、特に指示がない限り、当該技術分野において一般的に使用される意味を有する。本明細書にて提供される定義は、本明細書でしばしば使用される幾つかの用語の理解を促進しようとするものであり、本開示の範囲を限定するものではない。
【0012】
他に指示がない限り、本明細書及び特許請求の範囲で使用される特徴の大きさ、量、物理特性を表わす数字はすべて、どの場合においても用語「約」によって修飾されるものとして理解されるべきである。それ故に、そうでないことが示されない限り、前述の明細書及び添付の特許請求の範囲で示される数値パラメータは、当業者が本明細書で開示される教示内容を用いて、目標対象とする所望の特性に応じて、変化し得る近似値である。
【0013】
数値の範囲を端点によって列挙したものは、その範囲に包含されるすべての数値(例えば、1〜5は、1、1.5、2、2.75、3、3.80、4、及び5を含む)及びその範囲内の任意の範囲を含む。
【0014】
本明細書及び添付の特許請求の範囲において使用されるとき、単数形「a」、「an」、及び「the」は、その内容が特に明確に指示しない限り、複数の指示対象を有する実施形態を包含する。本明細書及び添付の特許請求の範囲において使用されるとき、用語「又は」は、その内容について別段の明確な指示がない限り、一般的に「及び/又は」を含む意味で用いられる。
【0015】
サンプル内の微生物を検出するための方法及びキットが本明細書において開示される。実施形態において、方法は、一般的に、酵素基質を用いて試験サンプルを培養する工程、培養サンプルに第1の波長を照射する工程、及びサンプルから放出される光を検出する工程、を含んでもよい。酵素基質は、微生物の酵素によって開裂され得る化合物であり、その結果、蛍光検出可能な生成物を形成する。蛍光検出可能な生成物は、次いで、蛍光検出可能な生成物の等吸収点の波長で照射される。蛍光検出可能な生成物を励起すると、蛍光検出可能な生成物は、光を放出し、次いでその光が検出され、試験サンプル内の微生物の存在を確認することができる。
【0016】
実施形態において、本明細書に開示される方法及びキットを使用して検出され得る微生物は、例えば、細菌及び菌類を含み得る。代表的な菌は、例えば、酵母(例えば、サッカロマイセス・セレヴィシエ、クリプトコッカス・ネオフォルマンス、カンジダ・アルビカンス、カンジダ・トロピカリス、カンジダ・ステラトイデア、カンジダ・グラブラタ、カンジダ・クルセイ、カンジダ・パラシローシス、カンジダ・ギリエルモンジィ、カンジダダ・ヴィスワナティ、カンジダ・ルシタニアエ、及びロドトルラ・ムチラギノーザを含む)、並びにカビ(アクレモニウム、アスペルギルス、クラドスポリウム、フザリウム、ムコール、ペニシリウム、クモノスカビ、スタキボトリス、及びトリコデルマを含む)の両方を含む。代表的な細菌は、以下の微生物を含む:エロモナス・ヒドロフィリア、エロモナス・カヴィエ、エロモナス・ソブリア、バチルス・セレウス、バチルス・ステアロサーモフィルス、バチルス・ズブチルス、バチルス・スファエリクス、バクテロイデス・フラジリス、バクテロイデス・インターメディア、シトロバクター・フロインデイ、ウェルシュ菌、エンテロバクター・エロゲネス、エンテロバクター・クロアカエ、腸球菌(エンテロコッカス・ヘシュウム)、エンテロコッカス・フィカリス、大腸菌、エシェリキア・コライ、インフルエンザ菌、パラインフルエンザ菌、肺炎桿菌(クレブシェラ・ニューモニエ)、ラクトコッカス・ラクティス(乳酸菌)、リステリア・モノサイトゲネス、リステリア・イノキュア、マイコバクテリウム・フォーチュイタム、淋菌、オルガネラ・モルガニイ、ペプトストレプトコッカス・アネロビウス、ペプトコッカス・マグナス、プロテウス・ミラビリス、緑膿菌、シュードモナス・フルオレッセンス、シュードモナス・プジタ、ネズミチフス菌、セラチア・リクファシエンス、霊菌、黄色ブドウ球菌、表皮ブドウ球菌、スタフィロコッカス・ホミニス、スタフィロコッカス・シュミランス、ストレプトコッカス・アガラクティエB、ストレプトコッカス・アンギノーサス、ストレプトコッカス・コンステラータス、大便連鎖球菌D、ストレプトコッカス・ミュータンス、化膿連鎖球菌、ストレプトコッカス・ウベリス、及びキサントモナス・マルトフィリア。
【0017】
本明細書に開示される方法及びキットを使用して試験され得るサンプル(「試験サンプル」と称され得る)の種類は、一般的に制限されない。サンプルの代表的な種類は、臨床サンプル、環境サンプル、食物サンプル、化粧品、飲料サンプル、水サンプル、土壌サンプルを含む。あるいは、サンプルは、例えば、試験される水サンプルを形成するために、物品を洗浄することによって、物品から調製されてもよい。食物サンプル及び土壌サンプル等のサンプルは、開示される方法及びキットが微生物を検出するために利用される前に、消化され得るか、あるいは他の処理を受けてもよい。ろ過処理、抽出処理等もまた、実行され得る。試験サンプルが、増殖培地ではなく酵素基質を用いて培養される実施形態において、サンプルの前処理は、増殖培地を用いてサンプルを培養する工程、次いで、結果として生じた溶液を(試験サンプルとして)酵素基質に添加する工程を含むことができる。
【0018】
試験サンプルは、酵素基質を用いて培養されてもよい。酵素基質は、例えば、増殖培地内に提供されてもよく、又は増殖培地を提供されてもよい。増殖培地は、一般的に、微生物の成長を支持するように設計される液体又はゲルである。代表的な増殖培地は、栄養培養液及び寒天プレートを含む。増殖培地は、例えば液体、濃縮又は脱水された液体、あるいはゲルとして供給されてもよい。水和を通しての使用のための増殖培地を供給する製品の例は、3M(商標)のPetrifilm(商標)プレート(3M Co.,St.Paul,MN)である。
【0019】
酵素基質(又は酵素基質及び増殖培地)を用いて試験サンプルを培養する工程は、単にそれら2つを混合する工程か、それら2つを混合し、その混合物を放置する工程か、それら2つを混合し、その混合物を撹拌する工程か、あるいはそれら2つを混合し、その混合物を撹拌し、その混合物を加熱する工程、によって達成されてもよい。培養する工程は、任意の時間量をかけて行われてもよい。実施形態において、試験サンプル及び酵素基質は、少なくとも1つの細胞分裂プロセスが起こるまで、昇温で培養することを許される。
【0020】
実施形態において、試験サンプル及び酵素基質(又は酵素基質及び増殖培地)は、混合され、次いで、広く利用されている任意の機械的撹拌方法を使用して撹拌されてもよい。試験サンプル及び酵素基質は、混合され、次いで、広く利用されている任意の加熱方法を使用して加熱されてもよい。実施形態において、試験サンプル及び増殖培地は、混合され、広く利用されている方法を使用して撹拌されてもよい。例えば、微生物は、3M(商標)のPetrifilm(商標)プレートを使用して検出されてもよい。脱水された増殖培地及び酵素基質を含有するPetrifilm(商標)プレートは、関連する微生物を含有する試験サンプルを用いて再水和される。試験サンプルの添加後、再水和されたPetrifilm(商標)プレートは、微生物の検出を可能にするために適した状態で培養されてもよい(例えば、好気性菌数に対して、3M(商標)のPetrifilm(商標)プレートは、37℃で24〜48時間、培養器に設置されてもよく、又は酵母/菌に対しては、3M(商標)のPetrifilm(商標)プレートは、25〜28℃で3〜5日間培養器に設置されてもよい)。
【0021】
本明細書に使用される酵素基質は、開裂される際、蛍光検出可能な生成物を生成するために、酵素によって選択的に加水分解可能な物質である。酵素基質は、一般的に、酵素加水分解性基(生体分子であってもよいが、そうでなくてもよい)と、蛍光基、の2つの部分を含む。酵素基質は、以下の式Iによって図式的に表され得る。
加水分解性基−−−−−−−−−−−−−蛍光基(式I)
式Iにおいて、「−−−−−−−−−−−」で表される部分は、酵素加水分解性連鎖として称され得る。酵素加水分解性連鎖は、酵素、特に対象とする微生物によって生産される酵素によって容易に開裂され得る連鎖又は固着を指す。
【0022】
蛍光基は、酵素基質から開裂されると、蛍光検出可能になり得る。酵素基質は、蛍光基が開裂される前に蛍光検出可能である場合もある、(言い換えると、蛍光基は酵素基質内か、酵素基質から開裂されるかのどちらかで蛍光検出可能な場合がある)ことにもまた、留意されたい。実施形態において、酵素基質には、対象とする微生物によって生産される酵素によって開裂される部分に結合される蛍光染料が含まれてもよい。
【0023】
酵素基質に含まれる加水分解性基としては、例えば、グリコーン、グリコシルホスフェート、エステル、アミノ酸又はペプチド、リン酸塩、あるいは硫酸塩を挙げることができる。
【0024】
代表的なグリコーン又はグルコシルホスフェートとしては、α−及びβ−D−ガラクトピラノシル、α−及びβ−D−グルコピラノシル、N−アセチル−α−及びβ−D−ガラクトサミニル;N−アセチル−α−及びβ−グルコサミニル;β−D−グルクロニル、α−L−アラビノピラノシル、α−L−アラビノフラノシル、β−D−フコピラノシル、α−及びβ−L−フコピラノシル、α−D−マンノピラノシル、β−D−キシロピラノシル、α−D−マルトシル、β−D−ラクトピラノシル、β−D−セルビオシル、α−D−N−アセチルイラミニル、並びにミオイノシトール−1−イルリン酸が挙げられる。実施形態において、加水分解性基としては、α−及びβ−D−ガラクトピラノシル、α−及びβ−D−グルコピラノシル、又はβ−D−グルクロニルを挙げることができる。実施形態において、加水分解性基には、β−D−ガラクトシル又はβ−D−グリコシルが含まれる。
【0025】
代表的なエステルとしては、酪酸、吉草酸、ヘキサン酸、カプリル酸、オクタノエート、ノナン酸塩、及びパルミチン酸が挙げられる。代表的なエステルとしては、市販の4−メチルウンベリフェリルパルミテート、4−メチルウンベリフェリルラウリン酸、4−メチルウンベリフェリルカプリル酸等のウンベリフェロンの長鎖エステルを挙げることができる(そのような加水分解性基は、エステラーゼ又はパルミターゼを検出するために使用され得る)。更に、Sicart et al.,Biotechnology Journal,2007 2(2),221〜231において参照されるものを含む、リパーゼ、エステラーゼ、アシラーゼ、及びエポキシドヒドロラーゼによって加水分解可能な酵素基質もまた利用されてもよい。
【0026】
代表的なアミノ酸には、カルボキシ末端結合アミノ酸又はその酸付加塩を含むことができる。そのようなアミノ酸としては、N−アセチル−L−リジン、L−アラニン、L−アルギニン、L−アスパラギン酸、N−α−ベンジルオキシカルボニル−L−アルギニン、L−シトルリン、γ−L−グルタミン酸、L−グリシン、L−ヒスチジン、L−ヒドロキシプロリン、L−イソロイシン、L−ロイシン、L−リジン、L−メチオニン、L−オルニチン、L−フェニルアラニン、L−プロリン、L−ピログルタミン酸、L−セリン、L−トリプトファン、L−チロシン、及びL−バリンを挙げることができる。代表的なペプチドとしては、1〜4つのアミノ酸を有するカルボキシ末端結合ペプチド又はその付加塩を挙げることができる。そのようなペプチドとしては、L−アルギニル−L−アルギニン、N−ベンジルオキシカルボニル−グリシル−L−プロリン、L−グルタリル−グリシル−アルギニン、グリシル−グリシン、グリシル−L−フェニルアラニン、グリシル−L−プロリン、及びL−セリル−L−チロシンを挙げることができる。実施形態において、加水分解性基は、1〜4つのアミノ酸を有する末端結合ペプチドであり、遊離アミノ基が、任意に保護基又はその酸付加塩を有する。
【0027】
pH依存の吸収及び等吸収点(又はその蛍光部分)を処理するいずれの蛍光染料も、本明細書に利用される酵素基質において利用され得る。代表的な蛍光染料としては、キサンテン誘導体(フルオレセイン、ローダミン及びそれらの誘導体等)、シアニン誘導体(シアニン、インドカルボシアニン、オキサカルボシアニン、チアカルボシアニン、及びメロシアニン、並びにそれらの誘導体)、ナフタレン誘導体、クマリン誘導体、オキサジアゾール誘導体、ピレン誘導体、オキサジン誘導体、アクリジン誘導体、アリルメチン誘導体、及びテトラピロール誘導体が挙げられる。
【0028】
実施形態において、クマリン誘導体が、酵素基質中で利用されてもよい。代表的なクマリン誘導体には、7−ヒドロキシクマリン(ウンベリフェロン)誘導体が挙げられる。特定の7−ヒドロキシクマリン誘導体としては、4−メチル−7−ヒドロキシクマリン(4−メチルウンベリフェロン又は4−MU)、3−シアノ−7−ヒドロキシクマリン(3−シアノウンベリフェロン又はCyU)、及びエチル−7−ヒドロキシクマリン−3−カルボキシレート(EHC)等の7−ヒドロキシクマリン−3−カルボン酸エステル、メチル−7−ヒドロキシクマリン−3−カルボキシレート(MHC)、3−シアノ−4−メチルウンベリフェロン、3−(4−イミダゾリル)ウンベリフェロン、及び6,8−ジフルオロ−4−メチルウンベリフェロンが挙げられる。5員複素環を含有するもの等の7−ヒドロキシクマリン誘導体もまた、本明細書の蛍光性化合物において利用され得る。そのような7−ヒドロキシクマリン誘導体は、米国特許第6,566,508号(Bentsen et al.)において例示され、その開示は参照によって本明細書に組み込まれる。そのような誘導体の特定の例は、3−(2−チエニル)ウンベリフェロン(TU)である。
【0029】
代表的な酵素基質としては、4−メチルウンベリフェロン−β−D−ガラクトピノシド(MUG)、3−シアノウンベリフェロン−β−D−ガラクトピラノシド、7−ヒドロキシクマリン−3−カルボン酸エチルエステル−β−D−ガラクトピラノシド、7−ヒドロキシクマリン−3−カルボン酸メチルエステル−β−D−ガラクトピラノシド、3−(2−チエニル)ウンベリフェロン−β−D−ガラクトピラノシド、4−メチルウンベリフェリルリン酸、3−シアノウンベリフェリルリン酸、エチルウンベリフェロン−3−カルボキシルリン酸、メチルウンベリフェロン−3−カルボキシルリン酸、3−(2−チエニル)ウンベリフェリルリン酸、5−ブロモ−4−クロロ−3−インドリル−β−D−ガラクトピラノシド(X−gal)、5−ブロモ−4−クロロ−3−インドリルホスフェート(BCIP)、ELF 97アセタート(Invitrogen,Carlsbad,CA)、ELF 97 β Dグルクロニド(Invitrogen,Carlsbad,CA)、及びELF 97 β Dガラクトピラノシド(Invitrogen,Carlsbad,CA)が挙げられるが、これらに限定されない。
【0030】
蛍光検出可能な生成物は、酸性種及び塩基種の両方を有する。一般的に、蛍光検出可能な生成物の酸性種は、溶液中で別の化合物に水素イオン(H+)を供与することができる化合物であり、蛍光検出可能な生成物の塩基種は、溶液中で別の化合物から水素イオン(H+)を受容することができる化合物である。実施形態において、蛍光検出可能な生成物は、中性の酸性種、及びアニオン性の塩基種を有する。実施形態において、蛍光検出可能な生成物は、カチオン性の酸性種、及び中性の塩基種を有する。
【0031】
蛍光検出可能な生成物の酸性種及び塩基種は、異なるように光を吸収してもよく(吸収されるエネルギー量、波長、又はその両方において)、異なるように光を放出してもよく(放出の強度、波長、又はその両方において)、あるいはどちらも異なるように光を吸収及び放出してもよい。図1Aは、pH 2.5〜8.0での4−メチルウンベリフェロン(4−MU)の吸光度スペクトルを示す。そこで見られるように、吸光度は、監視される波長範囲(260ナノメートル〜440ナノメートル)にわたって、大幅に変化する。約332ナノメートル(nm)の波長では、吸光度は、pH範囲全体にわたって有意に変化しない。4−MUに対する332nmのこの波長は、本明細書において励起等吸収点として称される。励起等吸収点は、蛍光検出可能な生成物の酸性種及び塩基種の吸光度が実質的に同一である、波長である。蛍光検出可能な生成物の励起等吸収点はまた、本明細書においてExλisoとして称される。
【0032】
蛍光検出可能な生成物を含有する溶液の励起等吸収点(Exλiso)における励起は、pH独立蛍光応答を提供することができる。実施形態において、培養サンプルは、Exλisoの波長を有する光を用いて照射され得る。実施形態において、Exλisoの波長を有する光は、±10nmのExλisoのピーク波長を有する光を指すことができる。実施形態において、Exλisoの波長を有する光は、±5nmのExλisoのピーク波長を有する光を指すことができる。実施形態において、Exλisoの波長を有する光は、±2nmのExλisoのピーク波長を有する光を指すことができる。
【0033】
培養サンプルは、蛍光検出可能な生成物が光を放出するために十分な時間、Exλisoの波長を有する光を用いて照射されてもよい。実施形態において、培養サンプルは、1秒の数分の1〜数十秒間、Exλisoの波長を有する光を用いて照射されてもよい。実施形態において、培養サンプルは、約1秒〜数十秒間、Exλisoの波長を有する光を用いて照射されてもよい。3M(商標)のAttest(商標)生物学的モニタリングシステム(Biological Monitoring System)(3M Co.,St.Paul,MN)を用いて利用され得る実施形態において、サンプルは、約1秒間照射されてもよく、その時間は、安定的に励起されたサンプルを得、放出の強度を積分するために十分であり得る。3M(商標)のPetrifilm(商標)プレートシステム(3M Co.,St.Paul,MN)を用いて利用され得る実施形態において、サンプルは数十秒間照射されてもよく、その時間は、放出強度を積分し、暗騒音を超えて検出可能な信号を得るために十分であり得る。
【0034】
培養サンプルが、Exλisoの波長を有する光を用いて十分な時間照射された後に、蛍光検出可能な生成物は光を放出する。蛍光検出可能な生成物が吸収する光の波長を用いた照射は、励起と称され得る。Exλiso以外の波長での励起は、酸性種及び塩基種に異なる吸収をさせ、したがって、放出される光もまた異なる。この作用は、ほとんどの蛍光検出可能な生成物からpH感受性蛍光応答を生み出す。この現象の例は、図1Bにおいて見られる。指定される線140は、2.5〜8.0の様々なpHにおける360nmでの励起を用いた、4−メチルウンベリフェロン(4−MU)の蛍光(455nm)を示す。そこに見られるように、蛍光はこのpH範囲にわたって劇的に変化する。pH 6で始まり、蛍光は実質的に増加し始める。この理由のため、4−MUの蛍光測定は、最大蛍光が得られるように、塩基性のpH(通常pH 8〜10)で、約360nmの励起波長を用いて行われるべきであることが一般的に受け入れられている。
【0035】
図1Bにおいて指定される線130は、2.5〜8.0の様々なpHで330nmでの励起を用いた4−MUの蛍光(455nm)を示す。そこに見られるように、蛍光は、このpH範囲に対してほぼ一定である。4−MUの励起等吸収点(Exλiso)が約332nmであることを示す図1Aの結果と、蛍光(455nmでの)が、2.5〜8.0のpH範囲に対してほぼ一定であることを示す図1Bの結果の組み合わせは、励起等吸収点(Exλiso)でのサンプルの励起が、pH非依存性の蛍光応答を提供することができることを示す。
【0036】
図1Cは、330nmでの励起後の2.5〜8.0のpHにおける4−MU溶液の放出曲線(400nm〜500nm)を示す。図1Cにおいて示されるように、蛍光応答は、放出の波長もまたpHによって変化しないため、pHから独立している。この現象は、中性種の光分離(4−MUの場合、酸性種)、続いて、後に特徴的な波長で放出する光合成アニオン(4−MUの場合、塩基種)をもたらす溶媒へのプロトン移動のためであり得る。
【0037】
幾つかの代表的な蛍光検出可能な生成物及びそれらの励起等吸収点は、以下である:4−メチルウンベリフェロン(4−MU)は約330nmの励起等吸収点(Exλiso)を有し、3−シアノ−7−ヒドロキシクマリン(CyU)は約375nmの励起等吸収点(Exλiso)を有し、7−ヒドロキシクマリン−3−カルボン酸エチルエステル(EHC)は約370nmの励起等吸収点(Exλiso)を有し、7−ヒドロキシクマリン−3−カルボン酸メチルエステル(MHC)は約370nmの励起等吸収点(Exλiso)を有し、3−(2−チエニル)ウンベリフェロン(TU)は約380nmの励起等吸収点(Exλiso)を有する。
【0038】
4−MUを例として使用し、広く利用されている360nmから約330nm(Exλiso)に励起周波数を切り替えることは、pH 8からpH 5に進める際に、蛍光強度における20〜30倍の減少を排除することができる。この強度の減少は、更なる工程(例えば、pH調整)を必要とすることなく、開示される方法において排除され得る。
【0039】
pH非依存性の蛍光応答は、様々な分析方法において利点を提供することができる。例えば、分析される試験サンプルのpHを、8〜10のpHに調整する工程(これまでに利用された多数の方法において必要な工程)が排除され得る。これは、分析を、より容易、効率的、かつ費用効率をよくすることができる。例えば、例えば大腸菌、乳酸菌、及び酢酸菌含む様々な種類の細菌は、増殖するにしたがって酸を生成し、pH非依存性の応答は、結果がそのような酸によって影響されないことを確実にするであろう。例えば、様々な酸性度を有するサンプルは、試験の前にそれらを「中和する」必要なく試験されてもよい。例えば、励起と放出波長との間の比較的大きな差異は、安価な光学フィルター(例えば、より効果な挟周波数帯フィルターとは対照的な吸収フィルター)の使用を可能にする。例えば、より高い信号対雑音比が、より大きなストークスシフト及び関連する末尾の交差のために提供されてもよい。
【0040】
培養サンプルの励起は、適切な波長(例えば、Exλiso)を有する光を提供することができる任意の光源を使用して達成され得る。代表的な光源は、可視半導体レーザ、可視発光ダイオード(LED)、白熱フィラメント、又は任意の他の適した光源を含むことができる。光源はまた、広く利用されているような様々なフィルター及び他の光学機器と併用されてもよい。
【0041】
実施形態において、光源は、比較的わずかな量の光が放出検出波長に存在するように選択されてもよい。これは、励起源に起因して検出される光の量を最小化することができるため、有利であり得る。あるいは、光学機器は、励起光源から光の一部分を除去するために使用されてもよい。実施形態において、励起光源、光学機器、検出の波長、検出器、又はそれらの組み合わせは、実質的に励起光源から光が全く検出されず、蛍光検出可能な生成物からの放出に起因されないように、選択される。
【0042】
蛍光検出可能な生成物が光を放出するために十分な時間、Exλisoの波長を用いて蛍光検出可能な生成物が励起されると、放出される光が検出される。実施形態において、放出される光は、少なくとも蛍光検出可能な生成物を励起する約数分以内で検出され得る。実施形態において、放出される光は、少なくとも蛍光検出可能な生成物を励起する約1分以内に検出され得る。シリコンベースのセンサー(1000nmまでのNIR範囲に対する一般的な選択肢)が利用される実施形態において、単一段階の熱電気冷却(TEC)が周辺温度よりも30°下までセンサーを冷却するために使用される場合、積分時間は、約1分であってもよい。
【0043】
励起された蛍光検出可能な生成物による放出される光の検出は、一般的に既知であるとして達成されてもよい。例えば、光電子増倍管、アバランシェフォトダイオード、電荷結合素子(CCD)、光ダイオード、又は他の能動装置等の検出器が、利用される場合がある。検出器はまた、広く利用されているような様々なフィルター及び他の光学機器と併用されてもよい。
【0044】
検出されるであろう放出される光の波長は、少なくとも部分的に、特定の蛍光検出可能な生成物に依存する場合がある。図1Cに見られるように、蛍光検出可能な生成物(例えば、4−MU等)は、様々な量で、広い範囲の波長にわたって、光を放出する。実施形態において、放出は、最大放出に近い波長で検出される場合がある。あるいは、他の波長(最大放出の波長に加えてか、又はそれに替わって)が、放出される光を検出するために監視されてもよい。Emλ1は、あらゆる所望の波長であってもよく、様々な波長における放出の強度、利用され得る特定の検出器(費用等)、サンプル内の他の化合物(例えば、酵素基質)からの干渉、あるいはその組み合わせに部分的に基づいて選択されてもよい。実施形態において、Emλ1は、蛍光検出可能な生成物がその最大強度の放出を有する波長であってもよい。そのようなEmλ1は、背景信号からの干渉を最小化するため、検出限度を減少させるため、又はそれらの組み合わせのために有用である場合がある。放出を監視するために選択される波長が何であれ、本明細書には放出波長、又はEmλ1として称される。
【0045】
実施形態において、酵素基質は、波長(ナノメートル)に関しては実質的にかけ離れているExλiso、及び最大放出(Emλ1として利用される)を有するものを選択されてもよい。実施形態において、酵素基質は、少なくとも約20nm離れているExλiso及び最大放出(Emλ1として)を有するものが選択されてもよい。実施形態において、酵素基質は、少なくとも約30nm離れているExλiso及び最大放出(Emλ1として)を有するものが選択されてもよい。実施形態において、酵素基質は、少なくとも約40nm離れているExλiso及び最大放出(Emλ1として)を有するものが選択されてもよい。
【0046】
放出が監視される特定の波長(Emλ1)はまた、酵素基質の放出に部分的に基づいて選択されてもよい。例えば、酵素基質が等吸収点で吸収するが、蛍光検出可能な生成物とは異なる放出スペクトルを有する実施形態において、酵素基質が放出しない(又は実質的に放出しない)ようにEmλ1が選択されるExλisoでの励起は、Emλ1での検出と同様に、有利である場合がある。そのようなシナリオは、蛍光検出可能な生成物のpH非依存性の検出を可能にするが、酵素基質の検出は可能にしない。異なる蛍光検出可能な生成物(及び/又は異なる酵素基質)は、Emλ1としての使用により有利な異なる波長を表示する。実施形態において、4−メチルウンベリフェロンβ−D−ガラクトピラノシド(4−MUG)、7−ヒドロキシクマリン−3−カルボン酸メチルエステル−β−D−ガラクトピラノシド(MHCgal)、又は7−ヒドロキシクマリン−3−カルボン酸エチルエステル−β−D−ガラクトピラノシド(EHCgal)は、Exλisoで励起されてもよく、蛍光検出可能な生成物は、広く利用されている波長455nmで、酵素基質の実質的な検出なく検出され得る(Emλ1)。
【0047】
放出された光が(Emλ1で)検出されると、様々な追加の工程が、任意に実行されてもよい。1つの任意の工程は、放出された光が、試験サンプル内の微生物の量を測定するために定量化され得ることである。これは、試験サンプルから放出された光の積分強度と、既知の微生物数を有する1つ以上の標準サンプルから放出された光の積分強度とを比較することによって達成されてもよい。相対比較はまた、例えば、2つの異なる時間(例えば、滅菌手順の前と後)における蛍光強度を比較することによって実行されてもよい。
【0048】
任意に実行され得る別の追加の工程は、検出された光の画像を形成する工程である。実施形態において、多数の個々に指定可能な感光検出器又は要素を有するCCD(又は他の検出器)は、ピクセル毎のセンサー又はセンサーアレイからの蛍光データの収集を可能にする。このアレイは、例えば、本明細書に開示されるように、酵素基質を含む培養二次元表面(例えば3M(商標)のPetrifilm(商標)プレート)上の増殖している微生物コロニーの部位の画像を得るために、照明光源と適正な集光光学機器との組み合わせにおいて使用されてもよい。結果として生じる電子画像は、画像解析ソフトウェアが画像のコントラストを強調し、自動的に蛍光スポットの数を計数するために使用され得る処理装置アセンブリに伝送されてもよい(あるいは使用者が手動でスポットの数を計数してもよい)。
【0049】
図2は、本明細書に開示される方法の例示的な実施形態を描写する。開示される方法の実施形態は、酵素基質を用いて試験サンプルを培養する工程201、Exλisoの波長を有する光を用いて培養された試験サンプル内の蛍光検出可能な生成物を励起する工程203、及びEmλ1で放出された光を検出する工程205を含んでもよい。
【0050】
任意選択の工程である工程207が、工程201の前にそのような方法に追加されてもよい。工程207は、試験サンプルを形成するためにサンプルを処理する工程を含み、上述のように、そのような処理は、ろ過、消化、抽出等を含んでもよい。
【0051】
別の任意選択の工程である工程209が、工程205の後にそのような方法に追加されてもよい。工程209は、試験サンプル内の微生物を定量化する工程を含み、上述のように、そのような定量化は、例えば、既知濃度の微生物のサンプルの使用を含んでもよく、あるいは相対比較(つまり、より高いか、より低いかの結果を得る工程)であってもよい。
【0052】
別の任意選択の工程である工程211が、工程205の後にそのような方法に追加されてもよい。工程211は、放出された光の画像を形成する工程を含み、上述のように、画像形成は、設定可能な検出器及び集光光学機器の使用を含んでもよい。工程211が実行される実施形態において、本方法は、工程211の後に実行され得る工程213を更に含んでもよい。工程213は、画像から微生物コロニーを計数する工程を含み、上述のように、そのようなコロニーの計数は、処理装置によって画像形成電子機器と通信して自動的に行われてもよく、あるいはユーザーによって手動で行われてもよい。
【0053】
上述の工程のいずれの組み合わせも、本明細書に開示される方法において実行され得ることにもまた留意されたい。更に、記述された工程のいずれの組み合わせも、異なる試験サンプル(又は同一の試験サンプル)使用して繰り返されてもよい。
【0054】
本明細書に開示される方法はまた、Exλiso以外の波長で培養サンプルを照射する工程を含んでもよい。1つのそのような例は、蛍光検出可能な生成物が光を放出するために十分な時間、Exλ2の波長で培養サンプルを照射する工程を含む。本明細書にExλ2として称される波長は、蛍光検出可能な生成物の塩基種の吸収極大、蛍光検出可能な生成物の酸性種の吸収極大、又は幾つかの他の波長であってもよい。例えば、蛍光検出可能な生成物4−MUは、約360nmに塩基種の吸収極大、及び約320nmに酸性種の吸収極大を有し、蛍光検出可能な生成物CyUは、約405nmに塩基種の吸収極大、及び約355nmに酸性種の吸収極大を有する。
【0055】
蛍光標識された生成物が光を放出するために十分な時間のExλiso及びExλ2での励起は、同一波長の放出を引き起こす場合がある(異なる波長での放出もまた生じ得ることにも留意されたい)。実施形態において、Exλiso及びExλ2での励起は、同時に行われず、別個の時間で行われる。独立した放出される光(Exλiso及びExλ2での励起によって引き起こされる)の検出もまた、別個の時間で生じ得る。別個の放出(Exλiso及びExλ2での励起によって引き起こされる)が検出されると、それらは様々な異なる手段において利用され得る。実施形態において、2つの放出は、結果を再確認する手段として、同様に利用されてもよい。
【0056】
実施形態において、2つの放出は、絶対蛍光強度に依存しない応答を提供するために利用され得る無次元数を判定するために利用されてもよい。これは、Exλisoによって引き起こされる放出と、Exλ2によって引き起こされる放出との比率である比率を判定することによって達成され得る。分子及び分母の選択は無関係であるが、しかしながら、選択が一定に留まる場合、比率はサンプル間の結果を比較するために使用されてもよい。
【0057】
実施形態において、別の相対法が、励起強度(Exλiso)における変動が、放出信号(Emλ1)を積分する間に励起強度を監視することによって補正され得るところで利用されてもよい。そのような実施形態は、3M(商標)のAttest(商標)生物学的モニタリングシステムを伴って利用され得る。3M(商標)のAttest(商標)生物学的モニタリングシステムを伴って利用されるそのような方法の実施形態において、データの2つの群は、3M(商標)のRapid Attest(商標)Autoreader(商標)(3M Co.,St.Paul,MN)内のマイクロプロセッサにおいて数学的に処理されてもよい。
【0058】
実施形態において、2つの異なる励起波長(Exλiso及びExλ2)で培養サンプルを励起することは、試験サンプル内の微生物の量を判定するだけでなく、経時的に培養サンプルのpHを監視するためにも利用される場合がある。Exλ2は、本質的に、酸性種又は塩基種の量を(少なくともその種の1つが吸収する波長が、Exλ2として利用されると推定して)時間の関数として監視するため、そのような事例である。pHを監視することが、微生物の増殖、代謝活性、又はその組み合わせを監視する別の方法である場合がある。
【0059】
図3は、本明細書に開示される方法の例示的な実施形態を描写する。開示される方法の実施形態は、酵素基質を用いて試験サンプルを培養する工程301、Exλisoの波長を有する光を用いて培養試験サンプル内の蛍光検出可能な生成物を励起する工程303、Exλisoの結果として放出される光(Emλ1)を検出する工程305、Exλ2の波長を有する光を用いて培養試験サンプル内の蛍光検出可能な生成物を励起する工程307、及びExλ2の結果として放出される光(Emλ1)を検出する工程309を含んでもよい。実施形態において、工程307及び工程309は、工程303及び305に先立って実行されてもよい。
【0060】
任意選択の工程である工程311が、工程309の後にそのような方法に追加されてもよい。工程311は、Exλisoによって引き起こされる放出と、Exλ2によって引き起こされる放出との比率を判定することを含む。そのような比率は、蛍光強度に基づかない無次元数を提供する目的で使用することができる。図2と関連して上述されたもの等の任意選択の工程はまた、図2において例示されたもの等の方法において含まれてもよい。上述の工程のいずれの組み合わせも、本明細書に開示される方法において実行され得ることもまた留意されたい。更に、記述された工程のいずれの組み合わせも、異なる試験サンプル(又は同一の試験サンプル)使用して繰り返され得る。
【0061】
実施形態において、Exλisoでの放出とExλ2での放出との比率は、サンプル内の生物量の他の事も示すことができる。Exλisoで励起される際に酵素基質が強く放出する実施形態において(例えば、TUgal)、Exλisoでの放出とExλ2での放出との比率は、(アニオン極大付近での励起とは異なって)比率が酵素活性によって概ね不変であるため、生物数を示すことができる。どちらかの励起周波数(Exλiso及びExλ2)で酵素基質からの最小干渉がある実施形態において、Exλisoからの放出とExλ2からの放出との比率は、pHレベルを示すことができる。酸を生成する幾つかの生物については、pHの変化が、それらの存在を示す。
【0062】
本明細書に開示される方法はまた、放出の異なる波長を検出する任意選択の工程を含んでもよい。上述のように、サンプルがExλisoの波長を有する光を用いて照射されると、蛍光検出可能な生成物は、光を放出する。図1Cに見られるように、例えば、蛍光検出可能な生成物は、広い範囲の波長にわたって光を放出することができる。本明細書に開示される方法は、Emλ1の波長の放出された光を検出する工程を含み、そのような方法は、第2の異なる波長で放出された光を検出する更なる工程を任意に含む。放出された光の追加の波長は、本明細書にEmλ2として称される。
【0063】
Emλ2は、あらゆる所望の波長であってもよく、様々な波長での放出の強度、利用され得る特定の検出器(費用等)、サンプル内の他の化合物からの干渉(例えば、酵素気質)、Emλ1の波長、又はそれらの組み合わせに部分的に基づいて選択されてもよい。実施形態において、Emλ2は、蛍光検出可能な生成物がその最大強度放出を有する波長であってもよい(そのような波長がEmλ1として利用されなかった場合)。そのようなEmλ2は、背景信号から見込まれる干渉を最小化するため、検出限度を下げるため、又はその組み合わせのために有用であり得る。実施形態において、Emλ2は、蛍光検出可能な生成物の放出がpHから独立している、つまり等吸収放出点(Emλiso)である波長であってもよい。そのようなEmλ2は、pH依存応答を起こすはずの、酸性種及び塩基種からの有意な放出を有する弱光酸を補正するために有用であり得る。
【0064】
実施形態において、Emλ2は、蛍光検出可能な生成物によって放出される光の量が、少なくとも酵素基質によって放出される光の量を超えるように選択される。実施形態において、Emλ2は、蛍光検出可能な生成物によって放出される光の量が、酵素基質によって放出される光の量を実質的に超えるように選択される。そのようなEmλ2は、微生物内の酵素によって開裂されていない酵素基質からの背景干渉を最小化させるために有用であり得る。
【0065】
実施形態において、Emλ1及びEmλ2における検出は、同時に行われず、別個の時間で行われる。蛍光検出可能な生成物の励起(例えば、Exλisoによる)もまた、別個の時間で生じ得る。Emλ1及びEmλ2における放出は、様々な異なる手段において利用され得る。実施形態において、2つの放出は、結果を再確認する手段として、同様に利用されてもよい。
【0066】
実施形態において、2つの放出は、絶対蛍光強度に依存しない応答を提供するために利用され得る無次元数を判定するために利用されてもよい。これは、Emλ1での放出とEmλ2での放出との比率である比率を判定することによって達成されてもよい。分子及び分母の選択は無関係であるが、しかしながら、選択が一定に留まる場合、比率はサンプル間の結果を比較するために使用されてもよい。
【0067】
図4は、本明細書に開示される方法の例示的な実施形態を描写する。開示される方法の実施形態は、酵素基質を用いて試験サンプルを培養する工程401、Exλisoの波長を有する光を用いて培養試験サンプル内の蛍光検出可能な生成物を励起する工程403、Exλisoの結果としてEmλ1で放出される光を検出する工程405、Exλisoの波長を有する光を用いて培養試験サンプル内の蛍光検出可能な生成物を励起する工程407、及びExλisoの結果としてEmλ2で放出される光を検出する工程409を含むことができる。
【0068】
任意選択の工程である工程411が、工程409の後にそのような方法に追加されてもよい。工程411は、Emλ1とEmλ2との比率を判定する工程を含む。図2と関連して上述されたもの等の任意選択の工程はまた、図4において例示されたもの等の方法に含まれてもよい。上述の工程のいずれの組み合わせも、本明細書に開示される方法において実行され得ることにもまた留意されたい。更に、記述された工程のいずれの組み合わせも、異なる試験サンプル(又は同一の試験サンプル)使用して繰り返されてもよい。
【0069】
キットもまた本明細書に開示される。本明細書に開示されるようなキットは、酵素基質及び光源を含むことができる。上述のような酵素基質が、開示されるキットに含まれてもよい。一般的に、酵素基質は、酵素加水分解性基及び蛍光基を含み、試験サンプル内に存在する微生物が、蛍光検出可能な生成物を形成するために蛍光基から加水分解性基を加水分解する酵素を含み、蛍光検出可能な生成物が、酸性種及び塩基種の両方を有する。実施形態において、酵素基質は、上述のように、より具体的に定義され得る。実施形態において、酵素基質は、開示されるキットに含まれ得る増殖培地の構成成分として含まれてもよい。
【0070】
本明細書に開示されるようなキットはまた、光源を含む。光源は、少なくともExλisoの波長を有する光を提供することができる。代表的な光源は、可視半導体レーザ、可視発光ダイオード(LED)、白熱フィラメント、有機発光ダイオード(OLED)、又は任意の他の適した光源を含むことができる。実施形態において、安価なLEDが、開示されるキット内で光源として利用されてもよい。光源はまた、広く利用されているような様々なフィルター及び光学機器と併用されてもよく、又はその組み合わせで使用されてもよい。
【0071】
キットに含まれる光源はまた、Exλ2の波長を有する光を提供することができ、Exλ2は、蛍光検出可能な生成物の塩基種の吸収極大、蛍光検出可能な生成物の酸性種の吸収極大、又は他の波長であってもよい。あるいは、Exλ2の波長を有する光を提供することができる第2の光源が、開示されるキットに含まれてもよい。後者の実施形態において、キットは、Exλisoの波長を有する光を提供することができる光源、及びExλ2の波長を有する光を提供することができる第2の光源、の少なくとも2つの光源を含むことができ、Exλ2は、蛍光検出可能な生成物の塩基種の吸収極大、蛍光検出可能な生成物の酸性種の吸収極大、又は他の波長であってもよい。
【0072】
本明細書に開示されるキットはまた、少なくとも酵素基質及び試験されるサンプルを混合するように構成される容器を含むことができる。実施形態において、任意選択の容器は、酵素基質を予め装填されていてもよく、又は実施形態において、任意選択の容器は、酵素基質を含有する増殖培地を予め装填されていてもよい。酵素基質を含有する増殖培地を予め装填され得る容器の例は、3M(商標)のPetrifilm(商標)プレート(3M Co.,St.Paul,MN)である。酵素基質を含有する増殖培地を予め装填され得る容器の別の例は、3M(商標)のAttest(商標)生物学的モニタリングシステム(3M Co.,St.Paul,MN)である。あるいは、容器は、増殖培地と混合されているかどうかにかかわらず、別個に包装された酵素基質を伴って任意に提供されてもよい。
【0073】
開示されるキットはまた、検出器を任意に含んでもよい。例えば、光電子増倍管、アバランシェフォトダイオード、電荷結合素子(CCD)、光ダイオード、又は他の能動装置等の検出器が、利用される場合がある。検出器はまた、広く利用されているような様々なフィルター及び光学機器と併用されてもよく、又はその組み合わせで使用されてもよい。開示されるキットに任意に含まれ得る検出器は、放出された光の1つ又は複数の波長を検出することができ得る。あるいは、複数の検出器が任意に含まれてもよい。
【0074】
開示されるキットはまた、例えば、画像化構成要素(例えば、検出された放出された光を画像化するため)、処理装置(1つ又は複数)、あるいはサンプル収集又は調製補助を含む他の構成要素を任意に含んでもよい。実施形態において、1つ以上の処理装置が、画像を整えるため若しくは自動的にコロニーを計数するために画像化構成要素から画像を処理するためか、試験サンプル内の微生物の存否を示す出力を提供するためか、光源(1つ又は複数)、検出器(1つ又は複数)、任意選択の構成要素、若しくはそれらの組み合わせを制御するためか、又はそれらの組み合わせのために、利用されるか、あるいはそのように構成されてもよい。
【0075】
開示されるキットは、3M(商標)Petrifilm(商標)製品ライン、3M(商標)Attest(商標)生物学的モニタリングシステム、SPECTRA MAX M5(Molecular Devices,Sunnyvale,CA)、及び3M(商標)Clean−Trace(商標)システム(3M Co.,St.Paul,MN)等の、現在利用されているシステムとともに機能するように構成されてもよく、又は現在利用されているシステムを伴って含まれてもよい。
【0076】
開示されるキットの実施形態において、蛍光検出可能な生成物は、クマリン誘導体であってもよい。実施形態において、蛍光検出可能な生成物が、4−メチルウンベリフェロンであり、Exλiso(光源が生成することができる波長)が、約330nmであってもよい。実施形態において、蛍光検出可能な生成物が、3−シアノ−7−ヒドロキシクマリンであり、Exλiso(光源が生成することができる波長)が、約375nmであってもよい。実施形態において、蛍光検出可能な生成物が、7−ヒドロキシクマリン−3−カルボン酸エステルであり、Exλiso(光源が生成することができる波長)が約370nmであってもよい。実施形態において、蛍光検出可能な生成物が、3−(2−チエニル)ウンベリフェロンであり、Exλiso(光源が生成することができる波長)が、約380nmであってもよい。
【実施例】
【0077】
材料及び方法
特に言及されない限り、全ての化学物質は、アルドリッチ(Aldrich)から入手され、更に精製することなく使用された。
【0078】
特に記載のない限り、実施例に記載される部、百分率、比率などはすべて、重量による。使用される溶媒及び他の試薬は、異なって示されるか、又は指定されない限り、Sigma−Aldrich Chemical Company;Milwaukee,WIから入手された。
【0079】
材料
7−ヒドロキシクマリン−3−カルボン酸エチルエステル(EHC)は、Chilvers et.al.J.Appl.Microbiology 2001,91,1118〜1130にしたがって調製された。
3−(2−チエニル)ウンベリフェロン(TU)は、米国特許第6,372,895号(Bentsen et al.)にあるように調製された。
3−(2−チエニル)ウンベリフェロンガラクトシド(TUgal)は、米国特許第6,372,895号(Bentsen et al.)にあるように調製された。
β−D−ガラクトシダーゼは、EMD Biosciences,Inc.(San Diego,CA)から入手された。
【0080】
(実施例1)
4−メチルウンベリフェロン(4−MU)は、1mg/mLの濃度でジメチルスルホキシド(DMSO)に溶解された。96ウェルプレートは、各ウェルが、8.0〜2.5までの範囲のpH値で100μLの100mmolarリン酸緩衝液を含有する状態で、調製された。10μLの4−MU溶液が、ウェルのそれぞれに添加された。1セットの10倍希釈ウェルがまた、高濃度での蛍光色素分子の自己消滅によるアーティファクトを排除するために調製された。10倍希釈ウェルは、DMSOを用いて1mg/mL溶液を0.1mg/mLに希釈し、次いで、ウェルのそれぞれにおいて100μLの100mmolarリン酸緩衝液にこの溶液の10μLを添加することによって調製された。
【0081】
250〜500nmの吸収スペクトルは、SPECTRAMAX M5(Molecular Devices,Sunnyvale,CAから入手可能)の蛍光プレートリーダーを使用して記録された。吸収スペクトルに対する結果は、図1Aに示される。これらの結果は、中性の4−MU種(低pHにて形成された)の吸収が、アニオン(高pHで形成された)に対する吸収極大付近の波長では低いことを実証した。中性4−MUの吸収極大は、約320nmで生じ、等吸収点(吸光度が組成物によって変化しない)が、約330nmにある。
【0082】
様々な波長における放出もまた、SPECTRAMAX M5蛍光プレートリーダーを用いて測定された。図1Cは、331nmの励起波長及び様々なpH値に対する放出波長の関数として、10倍希釈サンプルに対する結果として生じた放出を示す。これらの結果は、等吸収点(約330nm)付近の励起が、調査された範囲(2.5〜8)にわたるpH値で概ね不変である蛍光応答を提供することを実証する。最大放出は、450nmの波長で生じた。
【0083】
比較のために、放出は、アニオンに対する最大吸収波長付近である、360nmの励起波長に対するpHの関数としても測定された。図1Bは、360nm及び(おおよそ等吸収点にある)331nmの励起波長に対するpHの関数として、約450nmでの放出を示す。
【0084】
(実施例2)
96ウェルプレートが、実施例1にあるように、しかし4−MUの替わりに3−シアノ−7−ヒドロキシクマリン(CyU)を用いて調製された。吸収及び放出スペクトルは、実施例1にあるように測定された。
【0085】
様々なpH値でのCyUの吸収スペクトルが得られた(示されない)。放出スペクトルは、中性種の最大吸光度(355nm)、等吸収点(375nm)(図5Aに示される)、又はアニオンの吸光度極大(405nm)に対応して、3つの異なる励起波長でのCyUに対する様々なpH値で判定された。励起波長が375nmのとき、最大放出の波長は、約455nmであった。図5Bは、355nm、375nm(おおよそ等吸収点)、及び405nmの励起波長に対するpH値の関数として、455nmの波長での放出を示す。蛍光は、励起が等吸収点にあったとき、pH値からおおよそ独立していた。
【0086】
異なる励起波長で記録されたピーク放出強度の比率が判定された。図5Cに示されるように、これは、pHに敏感に依存する無次元数を生み出す。これは、絶対蛍光強度を測定することに依存しない敏感なpH応答を提供する。
【0087】
(実施例3)
7−ヒドロキシクマリン−3−カルボン酸エチルエステル(EHC)が、ジメチルスルホキシド(DMSO)に1mg/mLの濃度で溶解された。96ウェルプレートは、各ウェルが、8.0〜2.5までの範囲のpH値で100μLの100mmolarリン酸緩衝液を含有する状態で、調製された。10μLのEHC溶液が、ウェルのそれぞれに添加された。10倍希釈ウェルが、初期濃度で調製されたウェルの10μLを取り、それを適正な濃度で90μLの緩衝液に添加することによって、調製された。吸収及び放出スペクトルは、実施例1にあるように測定された。
【0088】
様々なpH値でEHCの吸収スペクトルが得られた(示されない)。等吸収点は、約370nmで生じることがわかった。10倍希釈EHCサンプルに対するpHの関数としての蛍光は、370nmの励起波長、及び比較として400nmの励起波長(アニオンの最大吸光度)を用いて、図6に示される。蛍光は、等吸収点で励起された際、おおよそ一定であった。
【0089】
(実施例4)
96ウェルプレートは、実施例1にあるように、しかし4−MUの替わりに3−(2−チエニル)ウンベリフェロン(TU)を用いて調製された。TUは、米国特許第6,372,895号(Bensten et al.)及び同第6,566,508号(Bensten et al.)において記述され、本明細書に参照によって組み込まれる。吸収及び放出スペクトルは、実施例1〜3にあるように測定された。
【0090】
様々なpH値での10倍TUサンプルの吸収スペクトルは、図7Aにおいて示される。等吸収点は、約380nmで生じることがわかった。吸収ピークは、CyU及びEHCと比較すると、概して5〜10nm赤方偏移された。
【0091】
放出スペクトルが、405nm(アニオンの最大、比較のため)、380nm(図7Bに示される等吸収点)、及び365nm(中性種の最大、比較のため)の3つの異なる励起波長でのTUに対する様々なpH値に対して得られた。アニオン放出バンドは、実施例1及び2の455nmと比較すると、40nm〜約495nm赤方偏移した。アニオン性種に対するストークシフトは、おおよそ90nmと判定された。
【0092】
低pHにあるサンプルが、405nm(アニオンの最大吸光度)で励起された際、495nmでの放出は減少し、ピーク極大は約30nm〜465nm青方偏移した。青方偏移は、励起波長が等吸収点(380nm、図7B)又は中性種極大(365nm)に設定された場合に、より明白であった。これらの結果は、低pH値では、光合成アニオンからのものに加えて、中性TUの励起状態から顕著な放出があることを示す。
【0093】
TUが吸収の等吸収点で励起された際、放出スペクトルにpH値の変化に伴う変化があったが、放出がpHに依存しなかったところの放出の等吸収点(約490nm、図7Bを参照のこと)が存在した。TUサンプルに対するpHの関数として蛍光は、380nm及び405nmの励起波長、並びに490nm及び500nmの放出波長に対して、図7Cに示される。蛍光は、吸収の等吸収点(380nm)で励起された際、及び放出の等吸収点(490nm)で測定された際、pHからおおよそ独立していた。
【0094】
(実施例5)
リン酸4−メチルウンベリフェロン二ナトリウム塩(4−MUP)が1mg/mLの濃度で水に溶解された。96ウェルプレートは、各ウェルが、8.0〜2.5までの範囲のpH値で100μLの100mmolarリン酸緩衝液を含有する状態で、調製された。10μLのMUP溶液が、ウェルのそれぞれに添加された。1セットの10倍希釈ウェルがまた、高濃度での蛍光色素分子の自己消滅によるアーティファクトを排除するために調製された。10倍希釈ウェルは、DMSOを用いて1mg/mL溶液を0.1mg/mLに希釈し、次いでウェルのそれぞれおいて100μLの100mmolarリン酸緩衝液にこの溶液の10μLを添加することによって調製された。吸収及び放出スペクトルは、実施例1にあるように測定された。
【0095】
4−MUは、染料の等吸収点(約330nm)で目立った吸収を有したが、アニオン極大(約360nm)においては最小の吸収を有したことがわかった。MUPの吸収スペクトルは、pH依存をほとんど示さず、等吸収点での吸収は、遊離染料の約4分の1〜3分の1のみであった。
【0096】
最大放出は、考慮されるpH値の範囲に対して、約390nmで生じた。放出は、4−MUの固有放出波長(455nm)では非常に小さかった。これは、4−MUの存在が測定される際、未反応4−MUPの存在が、背景信号を有意に増加させないであろうことを意味する。
【0097】
(実施例6)
4−メチルウンベリフェロン−β−D−ガラクトシド(4−MUG)は、0.1mg/mLの濃度で、ジメチルスルホキシド(DMSO)に溶解された。96ウェルプレートは、各プレートが、2.5(縦列1)〜8.0(縦列12)までの範囲のpH値で100μLの100mmolarのリン酸緩衝液を含有するように調製された。10μLの4−MUG溶液が、最初の4行の各ウェルに添加された。これらの行の2つは、メルカプトエタノール(1.4% v/v)、MgCl2(2% w/w)及びβ−D−ガラクトシダーゼ(80μg/mL)を含有する10μLの試薬溶液で更に処理された。DMSO中の4−MUの0.1mg/mL溶液10μLが、比較のために更に2つの行に添加された。吸収及び放出スペクトルは、実施例1にあるように測定された。
【0098】
ガラクトシダーゼあり及びなしの4−MUGの吸収スペクトルが、得られた。添加β−D−ガラクトシダーゼの非存在下における4−MUGのスペクトルは、pH依存をほとんど示さず、酸性溶液中の4−MUのもの、つまり中性4−MUのものと類似していた。そのため、4−MUGは、4−MU染料の等吸収点(約330nm)で強く吸収するが、アニオン極大(約360nm)においては最小的に吸収する。
【0099】
β−D−ガラクトシダーゼの非存在下及び存在下における4−MUGに対する放出スペクトル(335nmの励起)もまた、2.5〜8のpH値に対して得られた。最大放出は、低く、酵素の非存在下において、4−MUの固有放出波長(455nm)で非常に少ない強度を伴って約390nmで生じた。β−D−ガラクトシダーゼ酵素の存在下において、放出ピークは、遊離4−MUアニオンからの放出に対応して、455nmで観測された。
【0100】
4−MUに対する455nmでの放出(355nmの等吸収波長における励起を用いて)は、β−D−ガラクトシダーゼの非存在下及び存在下における4−MUGと同様に、pHの関数として図8Aに示される。4−MUG+β−D−ガラクトシダーゼに対する放出は、既報の酵素の活性と一致して(Sungur and Akbulut,J.Chem.Tech Biotechnol.1994,59,303〜306)、ゆっくりとpH7より下に低下する。それでもなお、有用な強度が、少なくともpH5程度で観測された。比較のために、アニオン極大(約360nm)での励起からの結果として生じる放出が、図8Bに示される。この事例において、放出は、酸性pH値で非常に低く、pH7を超えると急速に増加した。
【0101】
この実施例は、染料の等吸収点で励起することによって、励起又は放出周波数を調製することなしに、広い範囲のpH値にわたってβ−D−ガラクトシダーゼを効果的に検出するために、MUGを使用する能力を実証した。
【0102】
(実施例7)
メチル7−ヒドロキシクマリン−3−カルボン酸ガラクトシド(MHCgal)が、α−アセトブロモ−D−ガラクトースを用いてEHCを反応させることによって調製され、次いで、Chilvers(J.Appl.Microbiology 2001,91,1118〜1130)に記載のように、ナトリウムメトキシドを用いて保護ガラクトシドを加水分解した。MHCgalは、1.0mg/mLの濃度でジメチルスルホキシド(DMSO)に溶解され、次いで10μLが、ウェルが8.0〜2.5の範囲のpHレベルで100μLの100mmolarリン酸緩衝液を含有するように調製された96ウェルプレートの各ウェルに加えられた。行の半分は、メルカプトエタノール(1.4% v/v)、MgCl2(2% w/w)、及びβ−D−ガラクトシダーゼ(80μg/mL)を含有する10μLの試薬溶液で更に処理された。このプレートの各ウェルから10μLが、次いでウェル内で適正なpHの100μLのリン酸緩衝液を含有する別のプレートの対応するウェルに添加され、10倍希釈プレートを作製した。吸収及び放出スペクトルは、実施例1にあるように測定された。
【0103】
β−D−ガラクトシダーゼあり及びなしのMHCgalの吸収スペクトルが、得られた。添加β−D−ガラクトシダーゼの非存在下におけるMHCgalのスペクトルは、試験されたpH範囲にわたってpH依存を全く示さず、約340nmで最大吸光度をはっきりと示した。添加β−D−ガラクトシダーゼありでは、吸収は、pH 5〜6に対する350nmからアルカリ性の値に対する400nmに偏移した。これらは、中性EHC種及びアニオン性EHC種に対する吸収極大と一致する。
【0104】
β−D−ガラクトシダーゼの非存在下及び存在下におけるMHCgalに対する放出スペクトル(370nmの励起波長を用いて)は、pH値2.5〜8に対して得られた。放出は、酵素なしでは低く、単純クマリンの固有放出波長(〜450nm)では非常に少ない放出を伴った。β−D−ガラクトシダーゼ酵素の存在下においては、強い放出ピークが、遊離MHCアニオンからの放出に対応して445nmで観測された。
【0105】
β−D−ガラクトシダーゼの非存在下及び存在下におけるMHCgalに対する445nmでの放出(370nmの等吸収点での励起、及び比較のための、400nmでのアニオン極大での励起に対して)は、図9にpHの関数として示される。β−D−ガラクトシダーゼの存在下において、370nmで励起された際のMHCgalの放出は、かなりの量であり、pH約5及びそれ以上から一定している。対照的に、アニオン極大での励起は、低pH値では非常に低いが、pH6から急に増加される放出をもたらした。
【0106】
この実施例は、染料の等吸収点で励起することによって、励起又は放出の周波数を調整することなく、広い範囲のpH値にわたってβ−D−ガラクトシダーゼを効果的に検出するために、MHCgalを使用する能力を実証した。
【0107】
比較実施例8
3−(2−チエニル)ウンベリフェロンガラクトシド(TUgal)は、0.1mg/mLの濃度でジメチルスルホキシド(DMSO)に溶解された。96ウェルプレートは、各プレートが、8.0〜2.5の範囲のpHレベルで100μLの100mmolarのリン酸緩衝液を含有する状態で調製された。10μLのTUgal溶液が、ウェルのそれぞれに添加され、次いで、行の半分が、メルカプトエタノール(1.4% v/v)、MgCl2(2% w/w)、及びβ−ガラクトシダーゼ(80μg/mL)を含有する10μLの試薬溶液を用いて更に処理された。吸収及び放出スペクトルは、実施例1にあるように測定された。
【0108】
β−D−ガラクトシダーゼの存在下及び非存在下におけるTUgalに対する490nm(380nm励起)及び500nm(410nm励起)での放出は、図10にpHの関数として示される。TUに対する等吸収周波数(380励起、490放出、実施例4を参照のこと)で測定される際、TUgalは、TUに相当する放出、生成物の蛍光色素分子自体を有した。したがって、酵素の存在下又は非存在下における放出間にほとんど差異はなかった。アニオン極大(励起410nm、放出500nm)付近での蛍光の測定値は、酵素基質の放出をアニオンのものより低く減少させ、TUgalのβ−D−ガラクトシダーゼ基質としての使用を可能にした。
【0109】
この実施例に見られるように、等吸収励起周波数での照射は、酵素基質に遊離蛍光色素分子と同一の周波数で放出させる状況においては、あまり効果的ではない場合がある。
【0110】
このように、微生物を検出する方法の実施形態及びそのためのキットが開示される。本開示が、開示されたもの以外の実施形態で実施されうることは当業者には理解されよう。開示された実施形態は、図示の目的のために示され、制限のために示されてはおらず、本開示は以下の特許請求の範囲によってのみ制限される。
【技術分野】
【0001】
(関連出願の相互参照)
本出願は、2009年12月22日に出願された米国特許仮出願第61/288,883号の利益を主張し、その開示内容の全体を参照として本明細書に援用する。
【0002】
(発明の分野)
本発明は、蛍光性化合物を利用して、微生物を検出する方法に関する。
【背景技術】
【0003】
7−ヒドロキシクマリン系染料(ウンベリフェロンとも呼ばれる)及びそれらの誘導体は、酵素活性のための指標として広く使用されている。ウンベリフェロンの一例は、4−メチルウンベリフェロン(4−MUと呼ばれる)であり、大腸菌の検出等に使用される。4−MU(及び他のウンベリフェロン)の最も高い蛍光は、塩基形態から観測されるため、そのような検出はpH 8〜10で行われなければならない。
【発明の概要】
【課題を解決するための手段】
【0004】
より低いpH値で検出応答があることが望まれる様々な状況が存在する。例えば、酸性ホスファターゼの動態検査は、酸性培地内での酵素活性のリアルタイム検出を必要とする。酸性pHで蛍光を観察する能力はまた、プロトコル内の必要な工程を排除し、それによって分析をより迅速かつ容易にする。低pHの蛍光分析を実行するという要望のため、pHに関係なく実行され得る分析方法に対する必要性が残る。
【0005】
本明細書に開示されるのは、試験サンプル内の微生物を検出する方法であって、a)培養サンプルを形成するために、増殖培地を用いて試験サンプルを培養する工程であって、増殖培地が酵素基質を含み、酵素基質が酵素加水分解性基及び蛍光基を含み、試験サンプル内に存在する微生物が、加水分解性基を蛍光基から加水分解し、蛍光検出可能な生成物を形成する酵素を含み、蛍光検出可能な生成物が酸性種及び塩基種の両方を有する、工程と、b)蛍光検出可能な生成物が光を放出するために十分な時間、Exλisoの波長を有する光を用いて蛍光検出可能な生成物を励起する工程であって、Exλisoが蛍光検出可能な生成物の吸光度等吸収点である、工程と、c)Emλ1の波長で放出される光を検出する工程と、を含む、方法である。
【0006】
試験サンプル内の微生物を検出する方法であって、a)試験サンプルを酵素基質で培養する工程であって、酵素基質が酵素加水分解性基及び蛍光基を含み、試験サンプル内に存在する微生物が、加水分解性基を蛍光基から加水分解し、蛍光検出可能な生成物を形成する酵素を含み、蛍光検出可能な生成物が、酸性種及び塩基種の両方を有する、工程と、b)蛍光検出可能な生成物が光を放出するために十分な時間、Exλisoの波長を有する光を用いて蛍光検出可能な生成物を励起する工程であって、Exλisoが蛍光検出可能な生成物の等吸収点である、工程と、c)Exλisoの波長を有する光を用いた励起の結果として、Emλ1の波長で放出される光を検出する工程と、d)蛍光検出可能な生成物が光を放出するために十分な時間、Exλ2の波長を有する光を用いて蛍光検出可能な生成物を励起する工程であって、Exλ2が蛍光検出可能な生成物の塩基種の吸収極大、又は蛍光検出可能な生成物の酸性種の吸収極大である、工程と、e)Exλ2の波長を有する光を用いた励起の結果として、Emλの波長で放出される光を検出する工程と、f)Exλiso励起光の結果として放出される光及びExλ2励起光の結果として放出される光に基づいて比率を計算する工程であって、比率が試験サンプル内に存在する微生物の量の指標である、工程と、を含む、方法もまた開示される。
【0007】
試験サンプル内の微生物の存在を試験するためのキットであって、酵素加水分解性基及び蛍光基を含む酵素基質であって、試験サンプル内に存在する微生物が、加水分解性基を蛍光基から加水分解し、蛍光検出可能な生成物を形成する酵素を含み、蛍光検出可能な生成物が、酸性種及び塩基種の両方を有する、酵素基質と、Exλisoの波長を有する光を提供することができる光源であって、Exλisoが蛍光検出可能な生成物の等吸収点であり、Exλisoの波長を有する光を用いた蛍光検出可能な生成物の励起が、蛍光検出可能な生成物に光を放出させる、光源と、を備える、キットもまた開示される。
【0008】
本開示の様々な実施形態についての以下の詳細説明を添付の図面と共に検討することで、本開示はより完全に理解され得る。
図面は、必ずしも一定の比率の縮尺ではない。図中で用いられる類似の数字は、類似の構成要素を示す。しかし、所与の図中の構成要素を意味する数字の使用は、同一数字で表示した別の図中の構成要素を制約するものではないことは理解されよう。
【図面の簡単な説明】
【0009】
【図1A】異なるpH値に対する4−メチルウンベリフェロン(4−MU)の吸収スペクトル(図1A)。
【図1B】2つの異なる励起波長に対するpHの関数としての放出(励起455nm)(図1B)。
【図1C】異なるpH値に対する400nm〜500nmの放出スペクトル(図1C)。
【図2】本明細書に開示される例示方法を描写するフローチャート。
【図3】本明細書に開示される例示方法を描写するフローチャート。
【図4】本明細書に開示される例示方法を描写するフローチャート。
【図5A】pHの関数としての放出スペクトル(375nm)(図5A)。
【図5B】3つの異なる励起波長でのpHの関数としての放出スペクトル(455nm)(図5B)。
【図5C】異なる波長での励起に対するピーク放出比率のプロット(図5C)。
【図6】pHの関数としての7−ヒドロキシクマリン−3−カルボン酸エチルエステル(EHC)に対する放出スペクトル(450nm)。
【図7A】異なるpH値に対する3−(2−チエニル)ウンベリフェロン(TU)の吸収スペクトル(図7A)、380nm(図7B)、並びにpHの関数としての、405nmでの励起にあたっての放出(500nmで)及び380nmでの励起にあたっての放出(490nmで)(図7C)。
【図7B】異なるpH値に対する3−(2−チエニル)ウンベリフェロン(TU)の吸収スペクトル(図7A)、380nm(図7B)、並びにpHの関数としての、405nmでの励起にあたっての放出(500nmで)及び380nmでの励起にあたっての放出(490nmで)(図7C)。
【図7C】異なるpH値に対する3−(2−チエニル)ウンベリフェロン(TU)の吸収スペクトル(図7A)、380nm(図7B)、並びにpHの関数としての、405nmでの励起にあたっての放出(500nmで)及び380nmでの励起にあたっての放出(490nmで)(図7C)。
【図8A】β−D−ガラクトシダーゼの存在下及び非存在下における4−MU及び4−MUGに対するpHの関数としての335nmでの励起にあたっての放出(455nm)(図8A)。
【図8B】β−D−ガラクトシダーゼの存在下及び非存在下における4−MU及び4−MUGのpHの関数としての360nmでの励起にあたっての放出(455nm)(図8B)。
【図9】β−D−ガラクトシダーゼの存在下及び非存在下におけるMHCgalに対するpHの関数としての445nmでの放出(励起370nm又は400nm)。
【図10】β−D−ガラクトシダーゼの存在及び非存在下における3−(2−チエニル)ウンベリフェロン−β−D−ガラクトピラノシド(TUgal)に対するpHの関数としての380nmでの励起にあたっての490nmでの放出、及びβ−D−ガラクトシダーゼの存在下及び非存在下におけるTUgalに対するpHの関数としての410nmでの励起にあたっての500nmでの放出。
【発明を実施するための形態】
【0010】
次の記述において、本明細書の一部を構成する添付の図面を参照し、幾つかの特定の実施形態を例として示す。本開示の範囲及び趣旨から逸脱することなく、その他の実施形態が検討され、作成され得ることを理解されたい。したがって、以下の「発明を実施するための形態」は、限定する意味で理解すべきではない。
【0011】
本明細書で使用するすべての科学用語及び専門用語は、特に指示がない限り、当該技術分野において一般的に使用される意味を有する。本明細書にて提供される定義は、本明細書でしばしば使用される幾つかの用語の理解を促進しようとするものであり、本開示の範囲を限定するものではない。
【0012】
他に指示がない限り、本明細書及び特許請求の範囲で使用される特徴の大きさ、量、物理特性を表わす数字はすべて、どの場合においても用語「約」によって修飾されるものとして理解されるべきである。それ故に、そうでないことが示されない限り、前述の明細書及び添付の特許請求の範囲で示される数値パラメータは、当業者が本明細書で開示される教示内容を用いて、目標対象とする所望の特性に応じて、変化し得る近似値である。
【0013】
数値の範囲を端点によって列挙したものは、その範囲に包含されるすべての数値(例えば、1〜5は、1、1.5、2、2.75、3、3.80、4、及び5を含む)及びその範囲内の任意の範囲を含む。
【0014】
本明細書及び添付の特許請求の範囲において使用されるとき、単数形「a」、「an」、及び「the」は、その内容が特に明確に指示しない限り、複数の指示対象を有する実施形態を包含する。本明細書及び添付の特許請求の範囲において使用されるとき、用語「又は」は、その内容について別段の明確な指示がない限り、一般的に「及び/又は」を含む意味で用いられる。
【0015】
サンプル内の微生物を検出するための方法及びキットが本明細書において開示される。実施形態において、方法は、一般的に、酵素基質を用いて試験サンプルを培養する工程、培養サンプルに第1の波長を照射する工程、及びサンプルから放出される光を検出する工程、を含んでもよい。酵素基質は、微生物の酵素によって開裂され得る化合物であり、その結果、蛍光検出可能な生成物を形成する。蛍光検出可能な生成物は、次いで、蛍光検出可能な生成物の等吸収点の波長で照射される。蛍光検出可能な生成物を励起すると、蛍光検出可能な生成物は、光を放出し、次いでその光が検出され、試験サンプル内の微生物の存在を確認することができる。
【0016】
実施形態において、本明細書に開示される方法及びキットを使用して検出され得る微生物は、例えば、細菌及び菌類を含み得る。代表的な菌は、例えば、酵母(例えば、サッカロマイセス・セレヴィシエ、クリプトコッカス・ネオフォルマンス、カンジダ・アルビカンス、カンジダ・トロピカリス、カンジダ・ステラトイデア、カンジダ・グラブラタ、カンジダ・クルセイ、カンジダ・パラシローシス、カンジダ・ギリエルモンジィ、カンジダダ・ヴィスワナティ、カンジダ・ルシタニアエ、及びロドトルラ・ムチラギノーザを含む)、並びにカビ(アクレモニウム、アスペルギルス、クラドスポリウム、フザリウム、ムコール、ペニシリウム、クモノスカビ、スタキボトリス、及びトリコデルマを含む)の両方を含む。代表的な細菌は、以下の微生物を含む:エロモナス・ヒドロフィリア、エロモナス・カヴィエ、エロモナス・ソブリア、バチルス・セレウス、バチルス・ステアロサーモフィルス、バチルス・ズブチルス、バチルス・スファエリクス、バクテロイデス・フラジリス、バクテロイデス・インターメディア、シトロバクター・フロインデイ、ウェルシュ菌、エンテロバクター・エロゲネス、エンテロバクター・クロアカエ、腸球菌(エンテロコッカス・ヘシュウム)、エンテロコッカス・フィカリス、大腸菌、エシェリキア・コライ、インフルエンザ菌、パラインフルエンザ菌、肺炎桿菌(クレブシェラ・ニューモニエ)、ラクトコッカス・ラクティス(乳酸菌)、リステリア・モノサイトゲネス、リステリア・イノキュア、マイコバクテリウム・フォーチュイタム、淋菌、オルガネラ・モルガニイ、ペプトストレプトコッカス・アネロビウス、ペプトコッカス・マグナス、プロテウス・ミラビリス、緑膿菌、シュードモナス・フルオレッセンス、シュードモナス・プジタ、ネズミチフス菌、セラチア・リクファシエンス、霊菌、黄色ブドウ球菌、表皮ブドウ球菌、スタフィロコッカス・ホミニス、スタフィロコッカス・シュミランス、ストレプトコッカス・アガラクティエB、ストレプトコッカス・アンギノーサス、ストレプトコッカス・コンステラータス、大便連鎖球菌D、ストレプトコッカス・ミュータンス、化膿連鎖球菌、ストレプトコッカス・ウベリス、及びキサントモナス・マルトフィリア。
【0017】
本明細書に開示される方法及びキットを使用して試験され得るサンプル(「試験サンプル」と称され得る)の種類は、一般的に制限されない。サンプルの代表的な種類は、臨床サンプル、環境サンプル、食物サンプル、化粧品、飲料サンプル、水サンプル、土壌サンプルを含む。あるいは、サンプルは、例えば、試験される水サンプルを形成するために、物品を洗浄することによって、物品から調製されてもよい。食物サンプル及び土壌サンプル等のサンプルは、開示される方法及びキットが微生物を検出するために利用される前に、消化され得るか、あるいは他の処理を受けてもよい。ろ過処理、抽出処理等もまた、実行され得る。試験サンプルが、増殖培地ではなく酵素基質を用いて培養される実施形態において、サンプルの前処理は、増殖培地を用いてサンプルを培養する工程、次いで、結果として生じた溶液を(試験サンプルとして)酵素基質に添加する工程を含むことができる。
【0018】
試験サンプルは、酵素基質を用いて培養されてもよい。酵素基質は、例えば、増殖培地内に提供されてもよく、又は増殖培地を提供されてもよい。増殖培地は、一般的に、微生物の成長を支持するように設計される液体又はゲルである。代表的な増殖培地は、栄養培養液及び寒天プレートを含む。増殖培地は、例えば液体、濃縮又は脱水された液体、あるいはゲルとして供給されてもよい。水和を通しての使用のための増殖培地を供給する製品の例は、3M(商標)のPetrifilm(商標)プレート(3M Co.,St.Paul,MN)である。
【0019】
酵素基質(又は酵素基質及び増殖培地)を用いて試験サンプルを培養する工程は、単にそれら2つを混合する工程か、それら2つを混合し、その混合物を放置する工程か、それら2つを混合し、その混合物を撹拌する工程か、あるいはそれら2つを混合し、その混合物を撹拌し、その混合物を加熱する工程、によって達成されてもよい。培養する工程は、任意の時間量をかけて行われてもよい。実施形態において、試験サンプル及び酵素基質は、少なくとも1つの細胞分裂プロセスが起こるまで、昇温で培養することを許される。
【0020】
実施形態において、試験サンプル及び酵素基質(又は酵素基質及び増殖培地)は、混合され、次いで、広く利用されている任意の機械的撹拌方法を使用して撹拌されてもよい。試験サンプル及び酵素基質は、混合され、次いで、広く利用されている任意の加熱方法を使用して加熱されてもよい。実施形態において、試験サンプル及び増殖培地は、混合され、広く利用されている方法を使用して撹拌されてもよい。例えば、微生物は、3M(商標)のPetrifilm(商標)プレートを使用して検出されてもよい。脱水された増殖培地及び酵素基質を含有するPetrifilm(商標)プレートは、関連する微生物を含有する試験サンプルを用いて再水和される。試験サンプルの添加後、再水和されたPetrifilm(商標)プレートは、微生物の検出を可能にするために適した状態で培養されてもよい(例えば、好気性菌数に対して、3M(商標)のPetrifilm(商標)プレートは、37℃で24〜48時間、培養器に設置されてもよく、又は酵母/菌に対しては、3M(商標)のPetrifilm(商標)プレートは、25〜28℃で3〜5日間培養器に設置されてもよい)。
【0021】
本明細書に使用される酵素基質は、開裂される際、蛍光検出可能な生成物を生成するために、酵素によって選択的に加水分解可能な物質である。酵素基質は、一般的に、酵素加水分解性基(生体分子であってもよいが、そうでなくてもよい)と、蛍光基、の2つの部分を含む。酵素基質は、以下の式Iによって図式的に表され得る。
加水分解性基−−−−−−−−−−−−−蛍光基(式I)
式Iにおいて、「−−−−−−−−−−−」で表される部分は、酵素加水分解性連鎖として称され得る。酵素加水分解性連鎖は、酵素、特に対象とする微生物によって生産される酵素によって容易に開裂され得る連鎖又は固着を指す。
【0022】
蛍光基は、酵素基質から開裂されると、蛍光検出可能になり得る。酵素基質は、蛍光基が開裂される前に蛍光検出可能である場合もある、(言い換えると、蛍光基は酵素基質内か、酵素基質から開裂されるかのどちらかで蛍光検出可能な場合がある)ことにもまた、留意されたい。実施形態において、酵素基質には、対象とする微生物によって生産される酵素によって開裂される部分に結合される蛍光染料が含まれてもよい。
【0023】
酵素基質に含まれる加水分解性基としては、例えば、グリコーン、グリコシルホスフェート、エステル、アミノ酸又はペプチド、リン酸塩、あるいは硫酸塩を挙げることができる。
【0024】
代表的なグリコーン又はグルコシルホスフェートとしては、α−及びβ−D−ガラクトピラノシル、α−及びβ−D−グルコピラノシル、N−アセチル−α−及びβ−D−ガラクトサミニル;N−アセチル−α−及びβ−グルコサミニル;β−D−グルクロニル、α−L−アラビノピラノシル、α−L−アラビノフラノシル、β−D−フコピラノシル、α−及びβ−L−フコピラノシル、α−D−マンノピラノシル、β−D−キシロピラノシル、α−D−マルトシル、β−D−ラクトピラノシル、β−D−セルビオシル、α−D−N−アセチルイラミニル、並びにミオイノシトール−1−イルリン酸が挙げられる。実施形態において、加水分解性基としては、α−及びβ−D−ガラクトピラノシル、α−及びβ−D−グルコピラノシル、又はβ−D−グルクロニルを挙げることができる。実施形態において、加水分解性基には、β−D−ガラクトシル又はβ−D−グリコシルが含まれる。
【0025】
代表的なエステルとしては、酪酸、吉草酸、ヘキサン酸、カプリル酸、オクタノエート、ノナン酸塩、及びパルミチン酸が挙げられる。代表的なエステルとしては、市販の4−メチルウンベリフェリルパルミテート、4−メチルウンベリフェリルラウリン酸、4−メチルウンベリフェリルカプリル酸等のウンベリフェロンの長鎖エステルを挙げることができる(そのような加水分解性基は、エステラーゼ又はパルミターゼを検出するために使用され得る)。更に、Sicart et al.,Biotechnology Journal,2007 2(2),221〜231において参照されるものを含む、リパーゼ、エステラーゼ、アシラーゼ、及びエポキシドヒドロラーゼによって加水分解可能な酵素基質もまた利用されてもよい。
【0026】
代表的なアミノ酸には、カルボキシ末端結合アミノ酸又はその酸付加塩を含むことができる。そのようなアミノ酸としては、N−アセチル−L−リジン、L−アラニン、L−アルギニン、L−アスパラギン酸、N−α−ベンジルオキシカルボニル−L−アルギニン、L−シトルリン、γ−L−グルタミン酸、L−グリシン、L−ヒスチジン、L−ヒドロキシプロリン、L−イソロイシン、L−ロイシン、L−リジン、L−メチオニン、L−オルニチン、L−フェニルアラニン、L−プロリン、L−ピログルタミン酸、L−セリン、L−トリプトファン、L−チロシン、及びL−バリンを挙げることができる。代表的なペプチドとしては、1〜4つのアミノ酸を有するカルボキシ末端結合ペプチド又はその付加塩を挙げることができる。そのようなペプチドとしては、L−アルギニル−L−アルギニン、N−ベンジルオキシカルボニル−グリシル−L−プロリン、L−グルタリル−グリシル−アルギニン、グリシル−グリシン、グリシル−L−フェニルアラニン、グリシル−L−プロリン、及びL−セリル−L−チロシンを挙げることができる。実施形態において、加水分解性基は、1〜4つのアミノ酸を有する末端結合ペプチドであり、遊離アミノ基が、任意に保護基又はその酸付加塩を有する。
【0027】
pH依存の吸収及び等吸収点(又はその蛍光部分)を処理するいずれの蛍光染料も、本明細書に利用される酵素基質において利用され得る。代表的な蛍光染料としては、キサンテン誘導体(フルオレセイン、ローダミン及びそれらの誘導体等)、シアニン誘導体(シアニン、インドカルボシアニン、オキサカルボシアニン、チアカルボシアニン、及びメロシアニン、並びにそれらの誘導体)、ナフタレン誘導体、クマリン誘導体、オキサジアゾール誘導体、ピレン誘導体、オキサジン誘導体、アクリジン誘導体、アリルメチン誘導体、及びテトラピロール誘導体が挙げられる。
【0028】
実施形態において、クマリン誘導体が、酵素基質中で利用されてもよい。代表的なクマリン誘導体には、7−ヒドロキシクマリン(ウンベリフェロン)誘導体が挙げられる。特定の7−ヒドロキシクマリン誘導体としては、4−メチル−7−ヒドロキシクマリン(4−メチルウンベリフェロン又は4−MU)、3−シアノ−7−ヒドロキシクマリン(3−シアノウンベリフェロン又はCyU)、及びエチル−7−ヒドロキシクマリン−3−カルボキシレート(EHC)等の7−ヒドロキシクマリン−3−カルボン酸エステル、メチル−7−ヒドロキシクマリン−3−カルボキシレート(MHC)、3−シアノ−4−メチルウンベリフェロン、3−(4−イミダゾリル)ウンベリフェロン、及び6,8−ジフルオロ−4−メチルウンベリフェロンが挙げられる。5員複素環を含有するもの等の7−ヒドロキシクマリン誘導体もまた、本明細書の蛍光性化合物において利用され得る。そのような7−ヒドロキシクマリン誘導体は、米国特許第6,566,508号(Bentsen et al.)において例示され、その開示は参照によって本明細書に組み込まれる。そのような誘導体の特定の例は、3−(2−チエニル)ウンベリフェロン(TU)である。
【0029】
代表的な酵素基質としては、4−メチルウンベリフェロン−β−D−ガラクトピノシド(MUG)、3−シアノウンベリフェロン−β−D−ガラクトピラノシド、7−ヒドロキシクマリン−3−カルボン酸エチルエステル−β−D−ガラクトピラノシド、7−ヒドロキシクマリン−3−カルボン酸メチルエステル−β−D−ガラクトピラノシド、3−(2−チエニル)ウンベリフェロン−β−D−ガラクトピラノシド、4−メチルウンベリフェリルリン酸、3−シアノウンベリフェリルリン酸、エチルウンベリフェロン−3−カルボキシルリン酸、メチルウンベリフェロン−3−カルボキシルリン酸、3−(2−チエニル)ウンベリフェリルリン酸、5−ブロモ−4−クロロ−3−インドリル−β−D−ガラクトピラノシド(X−gal)、5−ブロモ−4−クロロ−3−インドリルホスフェート(BCIP)、ELF 97アセタート(Invitrogen,Carlsbad,CA)、ELF 97 β Dグルクロニド(Invitrogen,Carlsbad,CA)、及びELF 97 β Dガラクトピラノシド(Invitrogen,Carlsbad,CA)が挙げられるが、これらに限定されない。
【0030】
蛍光検出可能な生成物は、酸性種及び塩基種の両方を有する。一般的に、蛍光検出可能な生成物の酸性種は、溶液中で別の化合物に水素イオン(H+)を供与することができる化合物であり、蛍光検出可能な生成物の塩基種は、溶液中で別の化合物から水素イオン(H+)を受容することができる化合物である。実施形態において、蛍光検出可能な生成物は、中性の酸性種、及びアニオン性の塩基種を有する。実施形態において、蛍光検出可能な生成物は、カチオン性の酸性種、及び中性の塩基種を有する。
【0031】
蛍光検出可能な生成物の酸性種及び塩基種は、異なるように光を吸収してもよく(吸収されるエネルギー量、波長、又はその両方において)、異なるように光を放出してもよく(放出の強度、波長、又はその両方において)、あるいはどちらも異なるように光を吸収及び放出してもよい。図1Aは、pH 2.5〜8.0での4−メチルウンベリフェロン(4−MU)の吸光度スペクトルを示す。そこで見られるように、吸光度は、監視される波長範囲(260ナノメートル〜440ナノメートル)にわたって、大幅に変化する。約332ナノメートル(nm)の波長では、吸光度は、pH範囲全体にわたって有意に変化しない。4−MUに対する332nmのこの波長は、本明細書において励起等吸収点として称される。励起等吸収点は、蛍光検出可能な生成物の酸性種及び塩基種の吸光度が実質的に同一である、波長である。蛍光検出可能な生成物の励起等吸収点はまた、本明細書においてExλisoとして称される。
【0032】
蛍光検出可能な生成物を含有する溶液の励起等吸収点(Exλiso)における励起は、pH独立蛍光応答を提供することができる。実施形態において、培養サンプルは、Exλisoの波長を有する光を用いて照射され得る。実施形態において、Exλisoの波長を有する光は、±10nmのExλisoのピーク波長を有する光を指すことができる。実施形態において、Exλisoの波長を有する光は、±5nmのExλisoのピーク波長を有する光を指すことができる。実施形態において、Exλisoの波長を有する光は、±2nmのExλisoのピーク波長を有する光を指すことができる。
【0033】
培養サンプルは、蛍光検出可能な生成物が光を放出するために十分な時間、Exλisoの波長を有する光を用いて照射されてもよい。実施形態において、培養サンプルは、1秒の数分の1〜数十秒間、Exλisoの波長を有する光を用いて照射されてもよい。実施形態において、培養サンプルは、約1秒〜数十秒間、Exλisoの波長を有する光を用いて照射されてもよい。3M(商標)のAttest(商標)生物学的モニタリングシステム(Biological Monitoring System)(3M Co.,St.Paul,MN)を用いて利用され得る実施形態において、サンプルは、約1秒間照射されてもよく、その時間は、安定的に励起されたサンプルを得、放出の強度を積分するために十分であり得る。3M(商標)のPetrifilm(商標)プレートシステム(3M Co.,St.Paul,MN)を用いて利用され得る実施形態において、サンプルは数十秒間照射されてもよく、その時間は、放出強度を積分し、暗騒音を超えて検出可能な信号を得るために十分であり得る。
【0034】
培養サンプルが、Exλisoの波長を有する光を用いて十分な時間照射された後に、蛍光検出可能な生成物は光を放出する。蛍光検出可能な生成物が吸収する光の波長を用いた照射は、励起と称され得る。Exλiso以外の波長での励起は、酸性種及び塩基種に異なる吸収をさせ、したがって、放出される光もまた異なる。この作用は、ほとんどの蛍光検出可能な生成物からpH感受性蛍光応答を生み出す。この現象の例は、図1Bにおいて見られる。指定される線140は、2.5〜8.0の様々なpHにおける360nmでの励起を用いた、4−メチルウンベリフェロン(4−MU)の蛍光(455nm)を示す。そこに見られるように、蛍光はこのpH範囲にわたって劇的に変化する。pH 6で始まり、蛍光は実質的に増加し始める。この理由のため、4−MUの蛍光測定は、最大蛍光が得られるように、塩基性のpH(通常pH 8〜10)で、約360nmの励起波長を用いて行われるべきであることが一般的に受け入れられている。
【0035】
図1Bにおいて指定される線130は、2.5〜8.0の様々なpHで330nmでの励起を用いた4−MUの蛍光(455nm)を示す。そこに見られるように、蛍光は、このpH範囲に対してほぼ一定である。4−MUの励起等吸収点(Exλiso)が約332nmであることを示す図1Aの結果と、蛍光(455nmでの)が、2.5〜8.0のpH範囲に対してほぼ一定であることを示す図1Bの結果の組み合わせは、励起等吸収点(Exλiso)でのサンプルの励起が、pH非依存性の蛍光応答を提供することができることを示す。
【0036】
図1Cは、330nmでの励起後の2.5〜8.0のpHにおける4−MU溶液の放出曲線(400nm〜500nm)を示す。図1Cにおいて示されるように、蛍光応答は、放出の波長もまたpHによって変化しないため、pHから独立している。この現象は、中性種の光分離(4−MUの場合、酸性種)、続いて、後に特徴的な波長で放出する光合成アニオン(4−MUの場合、塩基種)をもたらす溶媒へのプロトン移動のためであり得る。
【0037】
幾つかの代表的な蛍光検出可能な生成物及びそれらの励起等吸収点は、以下である:4−メチルウンベリフェロン(4−MU)は約330nmの励起等吸収点(Exλiso)を有し、3−シアノ−7−ヒドロキシクマリン(CyU)は約375nmの励起等吸収点(Exλiso)を有し、7−ヒドロキシクマリン−3−カルボン酸エチルエステル(EHC)は約370nmの励起等吸収点(Exλiso)を有し、7−ヒドロキシクマリン−3−カルボン酸メチルエステル(MHC)は約370nmの励起等吸収点(Exλiso)を有し、3−(2−チエニル)ウンベリフェロン(TU)は約380nmの励起等吸収点(Exλiso)を有する。
【0038】
4−MUを例として使用し、広く利用されている360nmから約330nm(Exλiso)に励起周波数を切り替えることは、pH 8からpH 5に進める際に、蛍光強度における20〜30倍の減少を排除することができる。この強度の減少は、更なる工程(例えば、pH調整)を必要とすることなく、開示される方法において排除され得る。
【0039】
pH非依存性の蛍光応答は、様々な分析方法において利点を提供することができる。例えば、分析される試験サンプルのpHを、8〜10のpHに調整する工程(これまでに利用された多数の方法において必要な工程)が排除され得る。これは、分析を、より容易、効率的、かつ費用効率をよくすることができる。例えば、例えば大腸菌、乳酸菌、及び酢酸菌含む様々な種類の細菌は、増殖するにしたがって酸を生成し、pH非依存性の応答は、結果がそのような酸によって影響されないことを確実にするであろう。例えば、様々な酸性度を有するサンプルは、試験の前にそれらを「中和する」必要なく試験されてもよい。例えば、励起と放出波長との間の比較的大きな差異は、安価な光学フィルター(例えば、より効果な挟周波数帯フィルターとは対照的な吸収フィルター)の使用を可能にする。例えば、より高い信号対雑音比が、より大きなストークスシフト及び関連する末尾の交差のために提供されてもよい。
【0040】
培養サンプルの励起は、適切な波長(例えば、Exλiso)を有する光を提供することができる任意の光源を使用して達成され得る。代表的な光源は、可視半導体レーザ、可視発光ダイオード(LED)、白熱フィラメント、又は任意の他の適した光源を含むことができる。光源はまた、広く利用されているような様々なフィルター及び他の光学機器と併用されてもよい。
【0041】
実施形態において、光源は、比較的わずかな量の光が放出検出波長に存在するように選択されてもよい。これは、励起源に起因して検出される光の量を最小化することができるため、有利であり得る。あるいは、光学機器は、励起光源から光の一部分を除去するために使用されてもよい。実施形態において、励起光源、光学機器、検出の波長、検出器、又はそれらの組み合わせは、実質的に励起光源から光が全く検出されず、蛍光検出可能な生成物からの放出に起因されないように、選択される。
【0042】
蛍光検出可能な生成物が光を放出するために十分な時間、Exλisoの波長を用いて蛍光検出可能な生成物が励起されると、放出される光が検出される。実施形態において、放出される光は、少なくとも蛍光検出可能な生成物を励起する約数分以内で検出され得る。実施形態において、放出される光は、少なくとも蛍光検出可能な生成物を励起する約1分以内に検出され得る。シリコンベースのセンサー(1000nmまでのNIR範囲に対する一般的な選択肢)が利用される実施形態において、単一段階の熱電気冷却(TEC)が周辺温度よりも30°下までセンサーを冷却するために使用される場合、積分時間は、約1分であってもよい。
【0043】
励起された蛍光検出可能な生成物による放出される光の検出は、一般的に既知であるとして達成されてもよい。例えば、光電子増倍管、アバランシェフォトダイオード、電荷結合素子(CCD)、光ダイオード、又は他の能動装置等の検出器が、利用される場合がある。検出器はまた、広く利用されているような様々なフィルター及び他の光学機器と併用されてもよい。
【0044】
検出されるであろう放出される光の波長は、少なくとも部分的に、特定の蛍光検出可能な生成物に依存する場合がある。図1Cに見られるように、蛍光検出可能な生成物(例えば、4−MU等)は、様々な量で、広い範囲の波長にわたって、光を放出する。実施形態において、放出は、最大放出に近い波長で検出される場合がある。あるいは、他の波長(最大放出の波長に加えてか、又はそれに替わって)が、放出される光を検出するために監視されてもよい。Emλ1は、あらゆる所望の波長であってもよく、様々な波長における放出の強度、利用され得る特定の検出器(費用等)、サンプル内の他の化合物(例えば、酵素基質)からの干渉、あるいはその組み合わせに部分的に基づいて選択されてもよい。実施形態において、Emλ1は、蛍光検出可能な生成物がその最大強度の放出を有する波長であってもよい。そのようなEmλ1は、背景信号からの干渉を最小化するため、検出限度を減少させるため、又はそれらの組み合わせのために有用である場合がある。放出を監視するために選択される波長が何であれ、本明細書には放出波長、又はEmλ1として称される。
【0045】
実施形態において、酵素基質は、波長(ナノメートル)に関しては実質的にかけ離れているExλiso、及び最大放出(Emλ1として利用される)を有するものを選択されてもよい。実施形態において、酵素基質は、少なくとも約20nm離れているExλiso及び最大放出(Emλ1として)を有するものが選択されてもよい。実施形態において、酵素基質は、少なくとも約30nm離れているExλiso及び最大放出(Emλ1として)を有するものが選択されてもよい。実施形態において、酵素基質は、少なくとも約40nm離れているExλiso及び最大放出(Emλ1として)を有するものが選択されてもよい。
【0046】
放出が監視される特定の波長(Emλ1)はまた、酵素基質の放出に部分的に基づいて選択されてもよい。例えば、酵素基質が等吸収点で吸収するが、蛍光検出可能な生成物とは異なる放出スペクトルを有する実施形態において、酵素基質が放出しない(又は実質的に放出しない)ようにEmλ1が選択されるExλisoでの励起は、Emλ1での検出と同様に、有利である場合がある。そのようなシナリオは、蛍光検出可能な生成物のpH非依存性の検出を可能にするが、酵素基質の検出は可能にしない。異なる蛍光検出可能な生成物(及び/又は異なる酵素基質)は、Emλ1としての使用により有利な異なる波長を表示する。実施形態において、4−メチルウンベリフェロンβ−D−ガラクトピラノシド(4−MUG)、7−ヒドロキシクマリン−3−カルボン酸メチルエステル−β−D−ガラクトピラノシド(MHCgal)、又は7−ヒドロキシクマリン−3−カルボン酸エチルエステル−β−D−ガラクトピラノシド(EHCgal)は、Exλisoで励起されてもよく、蛍光検出可能な生成物は、広く利用されている波長455nmで、酵素基質の実質的な検出なく検出され得る(Emλ1)。
【0047】
放出された光が(Emλ1で)検出されると、様々な追加の工程が、任意に実行されてもよい。1つの任意の工程は、放出された光が、試験サンプル内の微生物の量を測定するために定量化され得ることである。これは、試験サンプルから放出された光の積分強度と、既知の微生物数を有する1つ以上の標準サンプルから放出された光の積分強度とを比較することによって達成されてもよい。相対比較はまた、例えば、2つの異なる時間(例えば、滅菌手順の前と後)における蛍光強度を比較することによって実行されてもよい。
【0048】
任意に実行され得る別の追加の工程は、検出された光の画像を形成する工程である。実施形態において、多数の個々に指定可能な感光検出器又は要素を有するCCD(又は他の検出器)は、ピクセル毎のセンサー又はセンサーアレイからの蛍光データの収集を可能にする。このアレイは、例えば、本明細書に開示されるように、酵素基質を含む培養二次元表面(例えば3M(商標)のPetrifilm(商標)プレート)上の増殖している微生物コロニーの部位の画像を得るために、照明光源と適正な集光光学機器との組み合わせにおいて使用されてもよい。結果として生じる電子画像は、画像解析ソフトウェアが画像のコントラストを強調し、自動的に蛍光スポットの数を計数するために使用され得る処理装置アセンブリに伝送されてもよい(あるいは使用者が手動でスポットの数を計数してもよい)。
【0049】
図2は、本明細書に開示される方法の例示的な実施形態を描写する。開示される方法の実施形態は、酵素基質を用いて試験サンプルを培養する工程201、Exλisoの波長を有する光を用いて培養された試験サンプル内の蛍光検出可能な生成物を励起する工程203、及びEmλ1で放出された光を検出する工程205を含んでもよい。
【0050】
任意選択の工程である工程207が、工程201の前にそのような方法に追加されてもよい。工程207は、試験サンプルを形成するためにサンプルを処理する工程を含み、上述のように、そのような処理は、ろ過、消化、抽出等を含んでもよい。
【0051】
別の任意選択の工程である工程209が、工程205の後にそのような方法に追加されてもよい。工程209は、試験サンプル内の微生物を定量化する工程を含み、上述のように、そのような定量化は、例えば、既知濃度の微生物のサンプルの使用を含んでもよく、あるいは相対比較(つまり、より高いか、より低いかの結果を得る工程)であってもよい。
【0052】
別の任意選択の工程である工程211が、工程205の後にそのような方法に追加されてもよい。工程211は、放出された光の画像を形成する工程を含み、上述のように、画像形成は、設定可能な検出器及び集光光学機器の使用を含んでもよい。工程211が実行される実施形態において、本方法は、工程211の後に実行され得る工程213を更に含んでもよい。工程213は、画像から微生物コロニーを計数する工程を含み、上述のように、そのようなコロニーの計数は、処理装置によって画像形成電子機器と通信して自動的に行われてもよく、あるいはユーザーによって手動で行われてもよい。
【0053】
上述の工程のいずれの組み合わせも、本明細書に開示される方法において実行され得ることにもまた留意されたい。更に、記述された工程のいずれの組み合わせも、異なる試験サンプル(又は同一の試験サンプル)使用して繰り返されてもよい。
【0054】
本明細書に開示される方法はまた、Exλiso以外の波長で培養サンプルを照射する工程を含んでもよい。1つのそのような例は、蛍光検出可能な生成物が光を放出するために十分な時間、Exλ2の波長で培養サンプルを照射する工程を含む。本明細書にExλ2として称される波長は、蛍光検出可能な生成物の塩基種の吸収極大、蛍光検出可能な生成物の酸性種の吸収極大、又は幾つかの他の波長であってもよい。例えば、蛍光検出可能な生成物4−MUは、約360nmに塩基種の吸収極大、及び約320nmに酸性種の吸収極大を有し、蛍光検出可能な生成物CyUは、約405nmに塩基種の吸収極大、及び約355nmに酸性種の吸収極大を有する。
【0055】
蛍光標識された生成物が光を放出するために十分な時間のExλiso及びExλ2での励起は、同一波長の放出を引き起こす場合がある(異なる波長での放出もまた生じ得ることにも留意されたい)。実施形態において、Exλiso及びExλ2での励起は、同時に行われず、別個の時間で行われる。独立した放出される光(Exλiso及びExλ2での励起によって引き起こされる)の検出もまた、別個の時間で生じ得る。別個の放出(Exλiso及びExλ2での励起によって引き起こされる)が検出されると、それらは様々な異なる手段において利用され得る。実施形態において、2つの放出は、結果を再確認する手段として、同様に利用されてもよい。
【0056】
実施形態において、2つの放出は、絶対蛍光強度に依存しない応答を提供するために利用され得る無次元数を判定するために利用されてもよい。これは、Exλisoによって引き起こされる放出と、Exλ2によって引き起こされる放出との比率である比率を判定することによって達成され得る。分子及び分母の選択は無関係であるが、しかしながら、選択が一定に留まる場合、比率はサンプル間の結果を比較するために使用されてもよい。
【0057】
実施形態において、別の相対法が、励起強度(Exλiso)における変動が、放出信号(Emλ1)を積分する間に励起強度を監視することによって補正され得るところで利用されてもよい。そのような実施形態は、3M(商標)のAttest(商標)生物学的モニタリングシステムを伴って利用され得る。3M(商標)のAttest(商標)生物学的モニタリングシステムを伴って利用されるそのような方法の実施形態において、データの2つの群は、3M(商標)のRapid Attest(商標)Autoreader(商標)(3M Co.,St.Paul,MN)内のマイクロプロセッサにおいて数学的に処理されてもよい。
【0058】
実施形態において、2つの異なる励起波長(Exλiso及びExλ2)で培養サンプルを励起することは、試験サンプル内の微生物の量を判定するだけでなく、経時的に培養サンプルのpHを監視するためにも利用される場合がある。Exλ2は、本質的に、酸性種又は塩基種の量を(少なくともその種の1つが吸収する波長が、Exλ2として利用されると推定して)時間の関数として監視するため、そのような事例である。pHを監視することが、微生物の増殖、代謝活性、又はその組み合わせを監視する別の方法である場合がある。
【0059】
図3は、本明細書に開示される方法の例示的な実施形態を描写する。開示される方法の実施形態は、酵素基質を用いて試験サンプルを培養する工程301、Exλisoの波長を有する光を用いて培養試験サンプル内の蛍光検出可能な生成物を励起する工程303、Exλisoの結果として放出される光(Emλ1)を検出する工程305、Exλ2の波長を有する光を用いて培養試験サンプル内の蛍光検出可能な生成物を励起する工程307、及びExλ2の結果として放出される光(Emλ1)を検出する工程309を含んでもよい。実施形態において、工程307及び工程309は、工程303及び305に先立って実行されてもよい。
【0060】
任意選択の工程である工程311が、工程309の後にそのような方法に追加されてもよい。工程311は、Exλisoによって引き起こされる放出と、Exλ2によって引き起こされる放出との比率を判定することを含む。そのような比率は、蛍光強度に基づかない無次元数を提供する目的で使用することができる。図2と関連して上述されたもの等の任意選択の工程はまた、図2において例示されたもの等の方法において含まれてもよい。上述の工程のいずれの組み合わせも、本明細書に開示される方法において実行され得ることもまた留意されたい。更に、記述された工程のいずれの組み合わせも、異なる試験サンプル(又は同一の試験サンプル)使用して繰り返され得る。
【0061】
実施形態において、Exλisoでの放出とExλ2での放出との比率は、サンプル内の生物量の他の事も示すことができる。Exλisoで励起される際に酵素基質が強く放出する実施形態において(例えば、TUgal)、Exλisoでの放出とExλ2での放出との比率は、(アニオン極大付近での励起とは異なって)比率が酵素活性によって概ね不変であるため、生物数を示すことができる。どちらかの励起周波数(Exλiso及びExλ2)で酵素基質からの最小干渉がある実施形態において、Exλisoからの放出とExλ2からの放出との比率は、pHレベルを示すことができる。酸を生成する幾つかの生物については、pHの変化が、それらの存在を示す。
【0062】
本明細書に開示される方法はまた、放出の異なる波長を検出する任意選択の工程を含んでもよい。上述のように、サンプルがExλisoの波長を有する光を用いて照射されると、蛍光検出可能な生成物は、光を放出する。図1Cに見られるように、例えば、蛍光検出可能な生成物は、広い範囲の波長にわたって光を放出することができる。本明細書に開示される方法は、Emλ1の波長の放出された光を検出する工程を含み、そのような方法は、第2の異なる波長で放出された光を検出する更なる工程を任意に含む。放出された光の追加の波長は、本明細書にEmλ2として称される。
【0063】
Emλ2は、あらゆる所望の波長であってもよく、様々な波長での放出の強度、利用され得る特定の検出器(費用等)、サンプル内の他の化合物からの干渉(例えば、酵素気質)、Emλ1の波長、又はそれらの組み合わせに部分的に基づいて選択されてもよい。実施形態において、Emλ2は、蛍光検出可能な生成物がその最大強度放出を有する波長であってもよい(そのような波長がEmλ1として利用されなかった場合)。そのようなEmλ2は、背景信号から見込まれる干渉を最小化するため、検出限度を下げるため、又はその組み合わせのために有用であり得る。実施形態において、Emλ2は、蛍光検出可能な生成物の放出がpHから独立している、つまり等吸収放出点(Emλiso)である波長であってもよい。そのようなEmλ2は、pH依存応答を起こすはずの、酸性種及び塩基種からの有意な放出を有する弱光酸を補正するために有用であり得る。
【0064】
実施形態において、Emλ2は、蛍光検出可能な生成物によって放出される光の量が、少なくとも酵素基質によって放出される光の量を超えるように選択される。実施形態において、Emλ2は、蛍光検出可能な生成物によって放出される光の量が、酵素基質によって放出される光の量を実質的に超えるように選択される。そのようなEmλ2は、微生物内の酵素によって開裂されていない酵素基質からの背景干渉を最小化させるために有用であり得る。
【0065】
実施形態において、Emλ1及びEmλ2における検出は、同時に行われず、別個の時間で行われる。蛍光検出可能な生成物の励起(例えば、Exλisoによる)もまた、別個の時間で生じ得る。Emλ1及びEmλ2における放出は、様々な異なる手段において利用され得る。実施形態において、2つの放出は、結果を再確認する手段として、同様に利用されてもよい。
【0066】
実施形態において、2つの放出は、絶対蛍光強度に依存しない応答を提供するために利用され得る無次元数を判定するために利用されてもよい。これは、Emλ1での放出とEmλ2での放出との比率である比率を判定することによって達成されてもよい。分子及び分母の選択は無関係であるが、しかしながら、選択が一定に留まる場合、比率はサンプル間の結果を比較するために使用されてもよい。
【0067】
図4は、本明細書に開示される方法の例示的な実施形態を描写する。開示される方法の実施形態は、酵素基質を用いて試験サンプルを培養する工程401、Exλisoの波長を有する光を用いて培養試験サンプル内の蛍光検出可能な生成物を励起する工程403、Exλisoの結果としてEmλ1で放出される光を検出する工程405、Exλisoの波長を有する光を用いて培養試験サンプル内の蛍光検出可能な生成物を励起する工程407、及びExλisoの結果としてEmλ2で放出される光を検出する工程409を含むことができる。
【0068】
任意選択の工程である工程411が、工程409の後にそのような方法に追加されてもよい。工程411は、Emλ1とEmλ2との比率を判定する工程を含む。図2と関連して上述されたもの等の任意選択の工程はまた、図4において例示されたもの等の方法に含まれてもよい。上述の工程のいずれの組み合わせも、本明細書に開示される方法において実行され得ることにもまた留意されたい。更に、記述された工程のいずれの組み合わせも、異なる試験サンプル(又は同一の試験サンプル)使用して繰り返されてもよい。
【0069】
キットもまた本明細書に開示される。本明細書に開示されるようなキットは、酵素基質及び光源を含むことができる。上述のような酵素基質が、開示されるキットに含まれてもよい。一般的に、酵素基質は、酵素加水分解性基及び蛍光基を含み、試験サンプル内に存在する微生物が、蛍光検出可能な生成物を形成するために蛍光基から加水分解性基を加水分解する酵素を含み、蛍光検出可能な生成物が、酸性種及び塩基種の両方を有する。実施形態において、酵素基質は、上述のように、より具体的に定義され得る。実施形態において、酵素基質は、開示されるキットに含まれ得る増殖培地の構成成分として含まれてもよい。
【0070】
本明細書に開示されるようなキットはまた、光源を含む。光源は、少なくともExλisoの波長を有する光を提供することができる。代表的な光源は、可視半導体レーザ、可視発光ダイオード(LED)、白熱フィラメント、有機発光ダイオード(OLED)、又は任意の他の適した光源を含むことができる。実施形態において、安価なLEDが、開示されるキット内で光源として利用されてもよい。光源はまた、広く利用されているような様々なフィルター及び光学機器と併用されてもよく、又はその組み合わせで使用されてもよい。
【0071】
キットに含まれる光源はまた、Exλ2の波長を有する光を提供することができ、Exλ2は、蛍光検出可能な生成物の塩基種の吸収極大、蛍光検出可能な生成物の酸性種の吸収極大、又は他の波長であってもよい。あるいは、Exλ2の波長を有する光を提供することができる第2の光源が、開示されるキットに含まれてもよい。後者の実施形態において、キットは、Exλisoの波長を有する光を提供することができる光源、及びExλ2の波長を有する光を提供することができる第2の光源、の少なくとも2つの光源を含むことができ、Exλ2は、蛍光検出可能な生成物の塩基種の吸収極大、蛍光検出可能な生成物の酸性種の吸収極大、又は他の波長であってもよい。
【0072】
本明細書に開示されるキットはまた、少なくとも酵素基質及び試験されるサンプルを混合するように構成される容器を含むことができる。実施形態において、任意選択の容器は、酵素基質を予め装填されていてもよく、又は実施形態において、任意選択の容器は、酵素基質を含有する増殖培地を予め装填されていてもよい。酵素基質を含有する増殖培地を予め装填され得る容器の例は、3M(商標)のPetrifilm(商標)プレート(3M Co.,St.Paul,MN)である。酵素基質を含有する増殖培地を予め装填され得る容器の別の例は、3M(商標)のAttest(商標)生物学的モニタリングシステム(3M Co.,St.Paul,MN)である。あるいは、容器は、増殖培地と混合されているかどうかにかかわらず、別個に包装された酵素基質を伴って任意に提供されてもよい。
【0073】
開示されるキットはまた、検出器を任意に含んでもよい。例えば、光電子増倍管、アバランシェフォトダイオード、電荷結合素子(CCD)、光ダイオード、又は他の能動装置等の検出器が、利用される場合がある。検出器はまた、広く利用されているような様々なフィルター及び光学機器と併用されてもよく、又はその組み合わせで使用されてもよい。開示されるキットに任意に含まれ得る検出器は、放出された光の1つ又は複数の波長を検出することができ得る。あるいは、複数の検出器が任意に含まれてもよい。
【0074】
開示されるキットはまた、例えば、画像化構成要素(例えば、検出された放出された光を画像化するため)、処理装置(1つ又は複数)、あるいはサンプル収集又は調製補助を含む他の構成要素を任意に含んでもよい。実施形態において、1つ以上の処理装置が、画像を整えるため若しくは自動的にコロニーを計数するために画像化構成要素から画像を処理するためか、試験サンプル内の微生物の存否を示す出力を提供するためか、光源(1つ又は複数)、検出器(1つ又は複数)、任意選択の構成要素、若しくはそれらの組み合わせを制御するためか、又はそれらの組み合わせのために、利用されるか、あるいはそのように構成されてもよい。
【0075】
開示されるキットは、3M(商標)Petrifilm(商標)製品ライン、3M(商標)Attest(商標)生物学的モニタリングシステム、SPECTRA MAX M5(Molecular Devices,Sunnyvale,CA)、及び3M(商標)Clean−Trace(商標)システム(3M Co.,St.Paul,MN)等の、現在利用されているシステムとともに機能するように構成されてもよく、又は現在利用されているシステムを伴って含まれてもよい。
【0076】
開示されるキットの実施形態において、蛍光検出可能な生成物は、クマリン誘導体であってもよい。実施形態において、蛍光検出可能な生成物が、4−メチルウンベリフェロンであり、Exλiso(光源が生成することができる波長)が、約330nmであってもよい。実施形態において、蛍光検出可能な生成物が、3−シアノ−7−ヒドロキシクマリンであり、Exλiso(光源が生成することができる波長)が、約375nmであってもよい。実施形態において、蛍光検出可能な生成物が、7−ヒドロキシクマリン−3−カルボン酸エステルであり、Exλiso(光源が生成することができる波長)が約370nmであってもよい。実施形態において、蛍光検出可能な生成物が、3−(2−チエニル)ウンベリフェロンであり、Exλiso(光源が生成することができる波長)が、約380nmであってもよい。
【実施例】
【0077】
材料及び方法
特に言及されない限り、全ての化学物質は、アルドリッチ(Aldrich)から入手され、更に精製することなく使用された。
【0078】
特に記載のない限り、実施例に記載される部、百分率、比率などはすべて、重量による。使用される溶媒及び他の試薬は、異なって示されるか、又は指定されない限り、Sigma−Aldrich Chemical Company;Milwaukee,WIから入手された。
【0079】
材料
7−ヒドロキシクマリン−3−カルボン酸エチルエステル(EHC)は、Chilvers et.al.J.Appl.Microbiology 2001,91,1118〜1130にしたがって調製された。
3−(2−チエニル)ウンベリフェロン(TU)は、米国特許第6,372,895号(Bentsen et al.)にあるように調製された。
3−(2−チエニル)ウンベリフェロンガラクトシド(TUgal)は、米国特許第6,372,895号(Bentsen et al.)にあるように調製された。
β−D−ガラクトシダーゼは、EMD Biosciences,Inc.(San Diego,CA)から入手された。
【0080】
(実施例1)
4−メチルウンベリフェロン(4−MU)は、1mg/mLの濃度でジメチルスルホキシド(DMSO)に溶解された。96ウェルプレートは、各ウェルが、8.0〜2.5までの範囲のpH値で100μLの100mmolarリン酸緩衝液を含有する状態で、調製された。10μLの4−MU溶液が、ウェルのそれぞれに添加された。1セットの10倍希釈ウェルがまた、高濃度での蛍光色素分子の自己消滅によるアーティファクトを排除するために調製された。10倍希釈ウェルは、DMSOを用いて1mg/mL溶液を0.1mg/mLに希釈し、次いで、ウェルのそれぞれにおいて100μLの100mmolarリン酸緩衝液にこの溶液の10μLを添加することによって調製された。
【0081】
250〜500nmの吸収スペクトルは、SPECTRAMAX M5(Molecular Devices,Sunnyvale,CAから入手可能)の蛍光プレートリーダーを使用して記録された。吸収スペクトルに対する結果は、図1Aに示される。これらの結果は、中性の4−MU種(低pHにて形成された)の吸収が、アニオン(高pHで形成された)に対する吸収極大付近の波長では低いことを実証した。中性4−MUの吸収極大は、約320nmで生じ、等吸収点(吸光度が組成物によって変化しない)が、約330nmにある。
【0082】
様々な波長における放出もまた、SPECTRAMAX M5蛍光プレートリーダーを用いて測定された。図1Cは、331nmの励起波長及び様々なpH値に対する放出波長の関数として、10倍希釈サンプルに対する結果として生じた放出を示す。これらの結果は、等吸収点(約330nm)付近の励起が、調査された範囲(2.5〜8)にわたるpH値で概ね不変である蛍光応答を提供することを実証する。最大放出は、450nmの波長で生じた。
【0083】
比較のために、放出は、アニオンに対する最大吸収波長付近である、360nmの励起波長に対するpHの関数としても測定された。図1Bは、360nm及び(おおよそ等吸収点にある)331nmの励起波長に対するpHの関数として、約450nmでの放出を示す。
【0084】
(実施例2)
96ウェルプレートが、実施例1にあるように、しかし4−MUの替わりに3−シアノ−7−ヒドロキシクマリン(CyU)を用いて調製された。吸収及び放出スペクトルは、実施例1にあるように測定された。
【0085】
様々なpH値でのCyUの吸収スペクトルが得られた(示されない)。放出スペクトルは、中性種の最大吸光度(355nm)、等吸収点(375nm)(図5Aに示される)、又はアニオンの吸光度極大(405nm)に対応して、3つの異なる励起波長でのCyUに対する様々なpH値で判定された。励起波長が375nmのとき、最大放出の波長は、約455nmであった。図5Bは、355nm、375nm(おおよそ等吸収点)、及び405nmの励起波長に対するpH値の関数として、455nmの波長での放出を示す。蛍光は、励起が等吸収点にあったとき、pH値からおおよそ独立していた。
【0086】
異なる励起波長で記録されたピーク放出強度の比率が判定された。図5Cに示されるように、これは、pHに敏感に依存する無次元数を生み出す。これは、絶対蛍光強度を測定することに依存しない敏感なpH応答を提供する。
【0087】
(実施例3)
7−ヒドロキシクマリン−3−カルボン酸エチルエステル(EHC)が、ジメチルスルホキシド(DMSO)に1mg/mLの濃度で溶解された。96ウェルプレートは、各ウェルが、8.0〜2.5までの範囲のpH値で100μLの100mmolarリン酸緩衝液を含有する状態で、調製された。10μLのEHC溶液が、ウェルのそれぞれに添加された。10倍希釈ウェルが、初期濃度で調製されたウェルの10μLを取り、それを適正な濃度で90μLの緩衝液に添加することによって、調製された。吸収及び放出スペクトルは、実施例1にあるように測定された。
【0088】
様々なpH値でEHCの吸収スペクトルが得られた(示されない)。等吸収点は、約370nmで生じることがわかった。10倍希釈EHCサンプルに対するpHの関数としての蛍光は、370nmの励起波長、及び比較として400nmの励起波長(アニオンの最大吸光度)を用いて、図6に示される。蛍光は、等吸収点で励起された際、おおよそ一定であった。
【0089】
(実施例4)
96ウェルプレートは、実施例1にあるように、しかし4−MUの替わりに3−(2−チエニル)ウンベリフェロン(TU)を用いて調製された。TUは、米国特許第6,372,895号(Bensten et al.)及び同第6,566,508号(Bensten et al.)において記述され、本明細書に参照によって組み込まれる。吸収及び放出スペクトルは、実施例1〜3にあるように測定された。
【0090】
様々なpH値での10倍TUサンプルの吸収スペクトルは、図7Aにおいて示される。等吸収点は、約380nmで生じることがわかった。吸収ピークは、CyU及びEHCと比較すると、概して5〜10nm赤方偏移された。
【0091】
放出スペクトルが、405nm(アニオンの最大、比較のため)、380nm(図7Bに示される等吸収点)、及び365nm(中性種の最大、比較のため)の3つの異なる励起波長でのTUに対する様々なpH値に対して得られた。アニオン放出バンドは、実施例1及び2の455nmと比較すると、40nm〜約495nm赤方偏移した。アニオン性種に対するストークシフトは、おおよそ90nmと判定された。
【0092】
低pHにあるサンプルが、405nm(アニオンの最大吸光度)で励起された際、495nmでの放出は減少し、ピーク極大は約30nm〜465nm青方偏移した。青方偏移は、励起波長が等吸収点(380nm、図7B)又は中性種極大(365nm)に設定された場合に、より明白であった。これらの結果は、低pH値では、光合成アニオンからのものに加えて、中性TUの励起状態から顕著な放出があることを示す。
【0093】
TUが吸収の等吸収点で励起された際、放出スペクトルにpH値の変化に伴う変化があったが、放出がpHに依存しなかったところの放出の等吸収点(約490nm、図7Bを参照のこと)が存在した。TUサンプルに対するpHの関数として蛍光は、380nm及び405nmの励起波長、並びに490nm及び500nmの放出波長に対して、図7Cに示される。蛍光は、吸収の等吸収点(380nm)で励起された際、及び放出の等吸収点(490nm)で測定された際、pHからおおよそ独立していた。
【0094】
(実施例5)
リン酸4−メチルウンベリフェロン二ナトリウム塩(4−MUP)が1mg/mLの濃度で水に溶解された。96ウェルプレートは、各ウェルが、8.0〜2.5までの範囲のpH値で100μLの100mmolarリン酸緩衝液を含有する状態で、調製された。10μLのMUP溶液が、ウェルのそれぞれに添加された。1セットの10倍希釈ウェルがまた、高濃度での蛍光色素分子の自己消滅によるアーティファクトを排除するために調製された。10倍希釈ウェルは、DMSOを用いて1mg/mL溶液を0.1mg/mLに希釈し、次いでウェルのそれぞれおいて100μLの100mmolarリン酸緩衝液にこの溶液の10μLを添加することによって調製された。吸収及び放出スペクトルは、実施例1にあるように測定された。
【0095】
4−MUは、染料の等吸収点(約330nm)で目立った吸収を有したが、アニオン極大(約360nm)においては最小の吸収を有したことがわかった。MUPの吸収スペクトルは、pH依存をほとんど示さず、等吸収点での吸収は、遊離染料の約4分の1〜3分の1のみであった。
【0096】
最大放出は、考慮されるpH値の範囲に対して、約390nmで生じた。放出は、4−MUの固有放出波長(455nm)では非常に小さかった。これは、4−MUの存在が測定される際、未反応4−MUPの存在が、背景信号を有意に増加させないであろうことを意味する。
【0097】
(実施例6)
4−メチルウンベリフェロン−β−D−ガラクトシド(4−MUG)は、0.1mg/mLの濃度で、ジメチルスルホキシド(DMSO)に溶解された。96ウェルプレートは、各プレートが、2.5(縦列1)〜8.0(縦列12)までの範囲のpH値で100μLの100mmolarのリン酸緩衝液を含有するように調製された。10μLの4−MUG溶液が、最初の4行の各ウェルに添加された。これらの行の2つは、メルカプトエタノール(1.4% v/v)、MgCl2(2% w/w)及びβ−D−ガラクトシダーゼ(80μg/mL)を含有する10μLの試薬溶液で更に処理された。DMSO中の4−MUの0.1mg/mL溶液10μLが、比較のために更に2つの行に添加された。吸収及び放出スペクトルは、実施例1にあるように測定された。
【0098】
ガラクトシダーゼあり及びなしの4−MUGの吸収スペクトルが、得られた。添加β−D−ガラクトシダーゼの非存在下における4−MUGのスペクトルは、pH依存をほとんど示さず、酸性溶液中の4−MUのもの、つまり中性4−MUのものと類似していた。そのため、4−MUGは、4−MU染料の等吸収点(約330nm)で強く吸収するが、アニオン極大(約360nm)においては最小的に吸収する。
【0099】
β−D−ガラクトシダーゼの非存在下及び存在下における4−MUGに対する放出スペクトル(335nmの励起)もまた、2.5〜8のpH値に対して得られた。最大放出は、低く、酵素の非存在下において、4−MUの固有放出波長(455nm)で非常に少ない強度を伴って約390nmで生じた。β−D−ガラクトシダーゼ酵素の存在下において、放出ピークは、遊離4−MUアニオンからの放出に対応して、455nmで観測された。
【0100】
4−MUに対する455nmでの放出(355nmの等吸収波長における励起を用いて)は、β−D−ガラクトシダーゼの非存在下及び存在下における4−MUGと同様に、pHの関数として図8Aに示される。4−MUG+β−D−ガラクトシダーゼに対する放出は、既報の酵素の活性と一致して(Sungur and Akbulut,J.Chem.Tech Biotechnol.1994,59,303〜306)、ゆっくりとpH7より下に低下する。それでもなお、有用な強度が、少なくともpH5程度で観測された。比較のために、アニオン極大(約360nm)での励起からの結果として生じる放出が、図8Bに示される。この事例において、放出は、酸性pH値で非常に低く、pH7を超えると急速に増加した。
【0101】
この実施例は、染料の等吸収点で励起することによって、励起又は放出周波数を調製することなしに、広い範囲のpH値にわたってβ−D−ガラクトシダーゼを効果的に検出するために、MUGを使用する能力を実証した。
【0102】
(実施例7)
メチル7−ヒドロキシクマリン−3−カルボン酸ガラクトシド(MHCgal)が、α−アセトブロモ−D−ガラクトースを用いてEHCを反応させることによって調製され、次いで、Chilvers(J.Appl.Microbiology 2001,91,1118〜1130)に記載のように、ナトリウムメトキシドを用いて保護ガラクトシドを加水分解した。MHCgalは、1.0mg/mLの濃度でジメチルスルホキシド(DMSO)に溶解され、次いで10μLが、ウェルが8.0〜2.5の範囲のpHレベルで100μLの100mmolarリン酸緩衝液を含有するように調製された96ウェルプレートの各ウェルに加えられた。行の半分は、メルカプトエタノール(1.4% v/v)、MgCl2(2% w/w)、及びβ−D−ガラクトシダーゼ(80μg/mL)を含有する10μLの試薬溶液で更に処理された。このプレートの各ウェルから10μLが、次いでウェル内で適正なpHの100μLのリン酸緩衝液を含有する別のプレートの対応するウェルに添加され、10倍希釈プレートを作製した。吸収及び放出スペクトルは、実施例1にあるように測定された。
【0103】
β−D−ガラクトシダーゼあり及びなしのMHCgalの吸収スペクトルが、得られた。添加β−D−ガラクトシダーゼの非存在下におけるMHCgalのスペクトルは、試験されたpH範囲にわたってpH依存を全く示さず、約340nmで最大吸光度をはっきりと示した。添加β−D−ガラクトシダーゼありでは、吸収は、pH 5〜6に対する350nmからアルカリ性の値に対する400nmに偏移した。これらは、中性EHC種及びアニオン性EHC種に対する吸収極大と一致する。
【0104】
β−D−ガラクトシダーゼの非存在下及び存在下におけるMHCgalに対する放出スペクトル(370nmの励起波長を用いて)は、pH値2.5〜8に対して得られた。放出は、酵素なしでは低く、単純クマリンの固有放出波長(〜450nm)では非常に少ない放出を伴った。β−D−ガラクトシダーゼ酵素の存在下においては、強い放出ピークが、遊離MHCアニオンからの放出に対応して445nmで観測された。
【0105】
β−D−ガラクトシダーゼの非存在下及び存在下におけるMHCgalに対する445nmでの放出(370nmの等吸収点での励起、及び比較のための、400nmでのアニオン極大での励起に対して)は、図9にpHの関数として示される。β−D−ガラクトシダーゼの存在下において、370nmで励起された際のMHCgalの放出は、かなりの量であり、pH約5及びそれ以上から一定している。対照的に、アニオン極大での励起は、低pH値では非常に低いが、pH6から急に増加される放出をもたらした。
【0106】
この実施例は、染料の等吸収点で励起することによって、励起又は放出の周波数を調整することなく、広い範囲のpH値にわたってβ−D−ガラクトシダーゼを効果的に検出するために、MHCgalを使用する能力を実証した。
【0107】
比較実施例8
3−(2−チエニル)ウンベリフェロンガラクトシド(TUgal)は、0.1mg/mLの濃度でジメチルスルホキシド(DMSO)に溶解された。96ウェルプレートは、各プレートが、8.0〜2.5の範囲のpHレベルで100μLの100mmolarのリン酸緩衝液を含有する状態で調製された。10μLのTUgal溶液が、ウェルのそれぞれに添加され、次いで、行の半分が、メルカプトエタノール(1.4% v/v)、MgCl2(2% w/w)、及びβ−ガラクトシダーゼ(80μg/mL)を含有する10μLの試薬溶液を用いて更に処理された。吸収及び放出スペクトルは、実施例1にあるように測定された。
【0108】
β−D−ガラクトシダーゼの存在下及び非存在下におけるTUgalに対する490nm(380nm励起)及び500nm(410nm励起)での放出は、図10にpHの関数として示される。TUに対する等吸収周波数(380励起、490放出、実施例4を参照のこと)で測定される際、TUgalは、TUに相当する放出、生成物の蛍光色素分子自体を有した。したがって、酵素の存在下又は非存在下における放出間にほとんど差異はなかった。アニオン極大(励起410nm、放出500nm)付近での蛍光の測定値は、酵素基質の放出をアニオンのものより低く減少させ、TUgalのβ−D−ガラクトシダーゼ基質としての使用を可能にした。
【0109】
この実施例に見られるように、等吸収励起周波数での照射は、酵素基質に遊離蛍光色素分子と同一の周波数で放出させる状況においては、あまり効果的ではない場合がある。
【0110】
このように、微生物を検出する方法の実施形態及びそのためのキットが開示される。本開示が、開示されたもの以外の実施形態で実施されうることは当業者には理解されよう。開示された実施形態は、図示の目的のために示され、制限のために示されてはおらず、本開示は以下の特許請求の範囲によってのみ制限される。
【特許請求の範囲】
【請求項1】
試験サンプル内の微生物を検出する方法であって、
a)培養サンプルを形成するために酵素基質を用いて試験サンプルを培養する工程であって、前記酵素基質が酵素加水分解性基及び蛍光基を含み、前記試験サンプル内に存在する微生物が、前記加水分解性基を前記蛍光基から加水分解し、蛍光検出可能な生成物を形成する酵素を含み、前記蛍光検出可能な生成物が酸性種及び塩基種の両方を有する、工程と、
b)前記蛍光検出可能な生成物が光を放出するために十分な時間、Exλisoの波長を有する光を用いて前記蛍光検出可能な生成物を励起する工程であって、Exλisoが前記蛍光検出可能な生成物の吸光度等吸収点である、工程と、
c)Emλ1の波長で放出される光を検出する工程と、を含む、方法。
【請求項2】
前記培養サンプルのpHが、前記励起及び検出工程の前に調整されない、請求項1に記載の方法。
【請求項3】
前記試験サンプル内に存在する微生物の量を判定するために前記放出された光を定量化する工程を更に含む、請求項1又は2に記載の方法。
【請求項4】
前記蛍光検出可能な生成物が光を放出するために十分な時間、Exλ2の波長を有する光を用いて前記蛍光検出可能な生成物を励起する工程であって、Exλ2が、前記蛍光検出可能な生成物の前記塩基種の吸収極大、又は前記蛍光検出可能な生成物の前記酸性種の吸収極大である、工程を更に含む、請求項1〜3のいずれか一項に記載の方法。
【請求項5】
Exλisoでの励起によって生じる放出と、Exλ2での励起によって生じる放出との比率を判定する工程を更に含む、請求項4に記載の方法。
【請求項6】
前記蛍光検出可能な生成物が、クマリン誘導体である、請求項1〜5のいずれか一項に記載の方法。
【請求項7】
前記蛍光検出可能な生成物が、4−メチルウンベリフェロンであり、Exλisoが約330nmである、請求項1〜5のいずれか一項に記載の方法。
【請求項8】
前記蛍光検出可能な生成物が、3−シアノ−7−ヒドロキシクマリンであり、Exλisoが約375nmであるか、前記蛍光検出可能な生成物が7−ヒドロキシクマリン−3−カルボン酸エチルエステルであり、Exλisoが約370nmであるか、又は前記蛍光検出可能な生成物が7−ヒドロキシクマリン−3−カルボン酸メチルエステルであり、Exλisoが約370nmである、請求項1〜5のいずれか一項に記載の方法。
【請求項9】
前記蛍光検出可能な生成物が、3−(2−チエニル)ウンベリフェロンであり、Exλisoが約380nmである、請求項1〜5のいずれか一項に記載の方法。
【請求項10】
前記酵素基質を用いて前記試験サンプルを培養する前記工程が、液状の前記サンプルを、前記酵素基質を含有する脱水された増殖培地に添加する工程を含む、請求項1〜9のいずれか一項に記載の方法。
【請求項11】
前記検出された光の画像を形成する工程を更に含む、請求項1〜10のいずれか一項に記載の方法。
【請求項12】
前記画像からコロニーを計数する工程を更に含む、請求項11に記載の方法。
【請求項13】
Emλ1が、前記蛍光検出可能な生成物の最大蛍光における波長である、請求項1〜12のいずれか一項に記載の方法。
【請求項14】
波長Emλ2付近で放出される光を定量化する工程を更に含み、Emλ1及びEmλ2が異なる波長である、請求項1〜13のいずれか一項に記載の方法。
【請求項15】
波長Emλ1で放出される光と、波長Emλ2で放出される光との比率を判定する工程を更に含む、請求項14に記載の方法。
【請求項16】
前記波長Emλ2が、前記等吸収放出点の波長である、請求項14に記載の方法。
【請求項17】
前記波長Emλ2付近で前記蛍光検出可能な生成物によって放出される光の量が、前記波長Emλ2付近で前記酵素基質によって放出されるいずれの光の量をも実質的に超える、請求項14に記載の方法。
【請求項18】
試験サンプル内の微生物を検出する方法であって、
a)培養サンプルを形成するために酵素基質を用いて前記試験サンプルを培養する工程であって、前記酵素基質が酵素加水分解性基及び蛍光基を含み、前記試験サンプル内に存在する微生物が、前記加水分解性基を前記蛍光基から加水分解し、蛍光検出可能な生成物を形成する酵素を含み、前記蛍光検出可能な生成物が、酸性種及び塩基種の両方を有する、工程と、
b)前記蛍光検出可能な生成物が光を放出するために十分な時間、Exλisoの波長を有する光を用いて前記蛍光検出可能な生成物を励起する工程であって、Exλisoが前記蛍光検出可能な生成物の等吸収点である、工程と、
c)Exλisoの波長を有する光を用いた前記励起の結果として、Emλ1の波長で放出される光を検出する工程と、
d)前記蛍光検出可能な生成物が光を放出するために十分な時間、Exλ2の波長を有する光を用いて前記蛍光検出可能な生成物を励起する工程であって、Exλ2が、前記蛍光検出可能な生成物の前記塩基種の吸収極大、又は前記蛍光検出可能な生成物の前記酸性種の吸収極大である、工程と、
e)Exλ2の波長を有する光を用いた前記励起の結果として、Emλ1の波長で放出される光を検出する工程と、
f)前記Exλisoの励起光の結果としてEmλ1の波長で放出される光、及び前記Exλ2励起光の結果として放出される光に基づいて、比率を計算する工程であって、前記比率が前記試験サンプル内に存在する微生物の量を示す、工程と、を含む、方法。
【請求項19】
Exλ2が、前記蛍光検出可能な生成物の前記酸性種の吸収極大である、請求項18に記載の方法。
【請求項20】
前記比率が、前記培養サンプルのpHを経時的に監視するために利用し得る、請求項18又は19に記載の方法。
【請求項21】
試験サンプル内の微生物の存在を試験するためのキットであって、
酵素加水分解性基及び蛍光基を含む酵素基質であって、前記試験サンプル内に存在する微生物が、前記加水分解性基を前記蛍光基から加水分解し、蛍光検出可能な生成物を形成する酵素を含み、前記蛍光検出可能な生成物が、酸性種及び塩基種の両方を有する、酵素基質と、
Exλisoの波長を有する光を提供することができる光源であって、Exλisoが、前記蛍光検出可能な生成物の等吸収点であり、Exλisoの波長を有する光を用いた前記蛍光検出可能な生成物の励起が、前記蛍光検出可能な生成物にEmλ1の波長で光を放出させる、光源と、を備える、キット。
【請求項22】
少なくとも前記酵素基質と、試験される前記サンプルとを混合するように構成される容器を更に備える、請求項21に記載のキット。
【請求項23】
前記酵素基質が、増殖培地の構成成分として提供される、請求項21又は22に記載のキット。
【請求項24】
前記蛍光検出可能な生成物から、Emλ1の波長で放出される光を検出することができる検出器を更に備える、請求項21〜23のいずれか一項に記載のキット。
【請求項25】
前記検出器から信号を受信し、前記サンプル内の微生物の存否を示す出力を提供することができる、処理装置を更に備える、請求項21〜24のいずれか一項に記載のキット。
【請求項26】
前記光源が、Exλ2の波長を有する光を提供することもでき、Exλ2が、前記蛍光検出可能な生成物の前記塩基種の吸収極大、又は前記蛍光検出可能な生成物の前記酸性種の吸収極大である、請求項21〜25のいずれか一項に記載のキット。
【請求項27】
Exλ2の波長を有する光を提供することができる第2の光源を更に備え、Exλ2が前記蛍光検出可能な生成物の前記塩基種の吸収極大、又は前記蛍光検出可能な生成物の前記酸性種の吸収極大である、請求項21〜25のいずれか一項に記載のキット。
【請求項28】
前記蛍光検出可能な生成物がクマリン誘導体である、請求項21〜27のいずれか一項に記載のキット。
【請求項29】
前記蛍光検出可能な生成物が、4−メチルウンベリフェロンであり、Exλisoが約330nmである、請求項21〜28のいずれか一項に記載のキット。
【請求項30】
蛍光検出可能な生成物が、3−シアノ−7−ヒドロキシクマリンであり、Exλisoが約375nmであるか、又は前記蛍光検出可能な生成物が、7−ヒドロキシクマリン−3−カルボン酸エステルであり、Exλisoが約370nmである、請求項21〜28のいずれか一項に記載のキット。
【請求項31】
前記蛍光検出可能な生成物が、3−(2−チエニル)ウンベリフェロンであり、Exλisoが約380nmである、請求項21〜28のいずれか一項に記載のキット。
【請求項1】
試験サンプル内の微生物を検出する方法であって、
a)培養サンプルを形成するために酵素基質を用いて試験サンプルを培養する工程であって、前記酵素基質が酵素加水分解性基及び蛍光基を含み、前記試験サンプル内に存在する微生物が、前記加水分解性基を前記蛍光基から加水分解し、蛍光検出可能な生成物を形成する酵素を含み、前記蛍光検出可能な生成物が酸性種及び塩基種の両方を有する、工程と、
b)前記蛍光検出可能な生成物が光を放出するために十分な時間、Exλisoの波長を有する光を用いて前記蛍光検出可能な生成物を励起する工程であって、Exλisoが前記蛍光検出可能な生成物の吸光度等吸収点である、工程と、
c)Emλ1の波長で放出される光を検出する工程と、を含む、方法。
【請求項2】
前記培養サンプルのpHが、前記励起及び検出工程の前に調整されない、請求項1に記載の方法。
【請求項3】
前記試験サンプル内に存在する微生物の量を判定するために前記放出された光を定量化する工程を更に含む、請求項1又は2に記載の方法。
【請求項4】
前記蛍光検出可能な生成物が光を放出するために十分な時間、Exλ2の波長を有する光を用いて前記蛍光検出可能な生成物を励起する工程であって、Exλ2が、前記蛍光検出可能な生成物の前記塩基種の吸収極大、又は前記蛍光検出可能な生成物の前記酸性種の吸収極大である、工程を更に含む、請求項1〜3のいずれか一項に記載の方法。
【請求項5】
Exλisoでの励起によって生じる放出と、Exλ2での励起によって生じる放出との比率を判定する工程を更に含む、請求項4に記載の方法。
【請求項6】
前記蛍光検出可能な生成物が、クマリン誘導体である、請求項1〜5のいずれか一項に記載の方法。
【請求項7】
前記蛍光検出可能な生成物が、4−メチルウンベリフェロンであり、Exλisoが約330nmである、請求項1〜5のいずれか一項に記載の方法。
【請求項8】
前記蛍光検出可能な生成物が、3−シアノ−7−ヒドロキシクマリンであり、Exλisoが約375nmであるか、前記蛍光検出可能な生成物が7−ヒドロキシクマリン−3−カルボン酸エチルエステルであり、Exλisoが約370nmであるか、又は前記蛍光検出可能な生成物が7−ヒドロキシクマリン−3−カルボン酸メチルエステルであり、Exλisoが約370nmである、請求項1〜5のいずれか一項に記載の方法。
【請求項9】
前記蛍光検出可能な生成物が、3−(2−チエニル)ウンベリフェロンであり、Exλisoが約380nmである、請求項1〜5のいずれか一項に記載の方法。
【請求項10】
前記酵素基質を用いて前記試験サンプルを培養する前記工程が、液状の前記サンプルを、前記酵素基質を含有する脱水された増殖培地に添加する工程を含む、請求項1〜9のいずれか一項に記載の方法。
【請求項11】
前記検出された光の画像を形成する工程を更に含む、請求項1〜10のいずれか一項に記載の方法。
【請求項12】
前記画像からコロニーを計数する工程を更に含む、請求項11に記載の方法。
【請求項13】
Emλ1が、前記蛍光検出可能な生成物の最大蛍光における波長である、請求項1〜12のいずれか一項に記載の方法。
【請求項14】
波長Emλ2付近で放出される光を定量化する工程を更に含み、Emλ1及びEmλ2が異なる波長である、請求項1〜13のいずれか一項に記載の方法。
【請求項15】
波長Emλ1で放出される光と、波長Emλ2で放出される光との比率を判定する工程を更に含む、請求項14に記載の方法。
【請求項16】
前記波長Emλ2が、前記等吸収放出点の波長である、請求項14に記載の方法。
【請求項17】
前記波長Emλ2付近で前記蛍光検出可能な生成物によって放出される光の量が、前記波長Emλ2付近で前記酵素基質によって放出されるいずれの光の量をも実質的に超える、請求項14に記載の方法。
【請求項18】
試験サンプル内の微生物を検出する方法であって、
a)培養サンプルを形成するために酵素基質を用いて前記試験サンプルを培養する工程であって、前記酵素基質が酵素加水分解性基及び蛍光基を含み、前記試験サンプル内に存在する微生物が、前記加水分解性基を前記蛍光基から加水分解し、蛍光検出可能な生成物を形成する酵素を含み、前記蛍光検出可能な生成物が、酸性種及び塩基種の両方を有する、工程と、
b)前記蛍光検出可能な生成物が光を放出するために十分な時間、Exλisoの波長を有する光を用いて前記蛍光検出可能な生成物を励起する工程であって、Exλisoが前記蛍光検出可能な生成物の等吸収点である、工程と、
c)Exλisoの波長を有する光を用いた前記励起の結果として、Emλ1の波長で放出される光を検出する工程と、
d)前記蛍光検出可能な生成物が光を放出するために十分な時間、Exλ2の波長を有する光を用いて前記蛍光検出可能な生成物を励起する工程であって、Exλ2が、前記蛍光検出可能な生成物の前記塩基種の吸収極大、又は前記蛍光検出可能な生成物の前記酸性種の吸収極大である、工程と、
e)Exλ2の波長を有する光を用いた前記励起の結果として、Emλ1の波長で放出される光を検出する工程と、
f)前記Exλisoの励起光の結果としてEmλ1の波長で放出される光、及び前記Exλ2励起光の結果として放出される光に基づいて、比率を計算する工程であって、前記比率が前記試験サンプル内に存在する微生物の量を示す、工程と、を含む、方法。
【請求項19】
Exλ2が、前記蛍光検出可能な生成物の前記酸性種の吸収極大である、請求項18に記載の方法。
【請求項20】
前記比率が、前記培養サンプルのpHを経時的に監視するために利用し得る、請求項18又は19に記載の方法。
【請求項21】
試験サンプル内の微生物の存在を試験するためのキットであって、
酵素加水分解性基及び蛍光基を含む酵素基質であって、前記試験サンプル内に存在する微生物が、前記加水分解性基を前記蛍光基から加水分解し、蛍光検出可能な生成物を形成する酵素を含み、前記蛍光検出可能な生成物が、酸性種及び塩基種の両方を有する、酵素基質と、
Exλisoの波長を有する光を提供することができる光源であって、Exλisoが、前記蛍光検出可能な生成物の等吸収点であり、Exλisoの波長を有する光を用いた前記蛍光検出可能な生成物の励起が、前記蛍光検出可能な生成物にEmλ1の波長で光を放出させる、光源と、を備える、キット。
【請求項22】
少なくとも前記酵素基質と、試験される前記サンプルとを混合するように構成される容器を更に備える、請求項21に記載のキット。
【請求項23】
前記酵素基質が、増殖培地の構成成分として提供される、請求項21又は22に記載のキット。
【請求項24】
前記蛍光検出可能な生成物から、Emλ1の波長で放出される光を検出することができる検出器を更に備える、請求項21〜23のいずれか一項に記載のキット。
【請求項25】
前記検出器から信号を受信し、前記サンプル内の微生物の存否を示す出力を提供することができる、処理装置を更に備える、請求項21〜24のいずれか一項に記載のキット。
【請求項26】
前記光源が、Exλ2の波長を有する光を提供することもでき、Exλ2が、前記蛍光検出可能な生成物の前記塩基種の吸収極大、又は前記蛍光検出可能な生成物の前記酸性種の吸収極大である、請求項21〜25のいずれか一項に記載のキット。
【請求項27】
Exλ2の波長を有する光を提供することができる第2の光源を更に備え、Exλ2が前記蛍光検出可能な生成物の前記塩基種の吸収極大、又は前記蛍光検出可能な生成物の前記酸性種の吸収極大である、請求項21〜25のいずれか一項に記載のキット。
【請求項28】
前記蛍光検出可能な生成物がクマリン誘導体である、請求項21〜27のいずれか一項に記載のキット。
【請求項29】
前記蛍光検出可能な生成物が、4−メチルウンベリフェロンであり、Exλisoが約330nmである、請求項21〜28のいずれか一項に記載のキット。
【請求項30】
蛍光検出可能な生成物が、3−シアノ−7−ヒドロキシクマリンであり、Exλisoが約375nmであるか、又は前記蛍光検出可能な生成物が、7−ヒドロキシクマリン−3−カルボン酸エステルであり、Exλisoが約370nmである、請求項21〜28のいずれか一項に記載のキット。
【請求項31】
前記蛍光検出可能な生成物が、3−(2−チエニル)ウンベリフェロンであり、Exλisoが約380nmである、請求項21〜28のいずれか一項に記載のキット。
【図1A】


【図1B】


【図1C】


【図2】


【図3】


【図4】


【図5A】


【図5B】


【図5C】


【図6】


【図7A】


【図7B】


【図7C】


【図8A】


【図8B】


【図9】


【図10】




【図1B】


【図1C】


【図2】


【図3】


【図4】


【図5A】


【図5B】


【図5C】


【図6】


【図7A】


【図7B】


【図7C】


【図8A】


【図8B】


【図9】


【図10】


【公表番号】特表2013−514809(P2013−514809A)
【公表日】平成25年5月2日(2013.5.2)
【国際特許分類】
【出願番号】特願2012−546070(P2012−546070)
【出願日】平成22年12月17日(2010.12.17)
【国際出願番号】PCT/US2010/060936
【国際公開番号】WO2011/087711
【国際公開日】平成23年7月21日(2011.7.21)
【出願人】(505005049)スリーエム イノベイティブ プロパティズ カンパニー (2,080)
【Fターム(参考)】
【公表日】平成25年5月2日(2013.5.2)
【国際特許分類】
【出願日】平成22年12月17日(2010.12.17)
【国際出願番号】PCT/US2010/060936
【国際公開番号】WO2011/087711
【国際公開日】平成23年7月21日(2011.7.21)
【出願人】(505005049)スリーエム イノベイティブ プロパティズ カンパニー (2,080)
【Fターム(参考)】
[ Back to top ]

