微生物媒介上皮疾患の予防及び治療のための薬剤を製造するための材料の使用
【課題】微生物媒介上皮疾患(例えば、消化管誘導敗血症)及び/又は前記疾患に関連した症状の予防又は治療に有効な組成物、及び治療された生物体の生理機能の重大な変化によってさらなる合併症の可能性を生成しないで前記利益を達成する方法を提供する。
【解決手段】有効量のポリエチレングリコール(PEG)を、それを必要とする動物に投与することによって微生物媒介疾患の発生のリスクがある上皮表面を含む異常状態の動物における死亡確率の低減する薬剤を製造するためのポリエチレングリコール(PEG)の使用であって、前記PEGは少なくとも15,000ダルトンの平均分子量を有する前記使用を提供する。
【解決手段】有効量のポリエチレングリコール(PEG)を、それを必要とする動物に投与することによって微生物媒介疾患の発生のリスクがある上皮表面を含む異常状態の動物における死亡確率の低減する薬剤を製造するためのポリエチレングリコール(PEG)の使用であって、前記PEGは少なくとも15,000ダルトンの平均分子量を有する前記使用を提供する。
【発明の詳細な説明】
【技術分野】
【0001】
発明の分野
本発明は消化管誘導敗血症のような微生物媒介上皮疾患の予防又は治療のための材料及びに方法に関する。
【背景技術】
【0002】
背景
微生物媒介上皮疾患(又は異常状態)はヒト及び動物の健康に対する明らかな脅威を示し、世界中で医療システムに負担をかけている。前記疾患の1つの例である消化管誘導敗血症は、熱傷、新生児全腸炎、激しい好中球減少症、炎症性腸疾患、移植後の器官拒絶のような種々の疾病、障害又は苦痛のいずれかを患っているヒト患者のような生物体の死亡の主な原因である。腸管保有宿主は、例えば重症の、入院した患者において細菌媒介敗血症の潜在的に致死性の病巣であると長い間認識されていた。シュードモナス(例えば、緑膿菌)のような微生物病原体の腸管上皮性関門の調節機能を乱す能力は、消化管誘導敗血症を引き起こすことができる日和見生物体の特徴であり得る。これら感染症の多くの場合、緑膿菌は原因となる病原体であると認定されている。重要なのは、腸管が緑膿菌のような日和見性病原体のコロニー形成の主要な部位であると示されていることである。
【0003】
消化管誘導敗血症のような微生物媒介上皮疾患の予防又は治療に対する従来の治療アプローチは、完全には成功していない。抗生物質をベースとするアプローチは、残っている腸管微生物フローラ(intestinal flora)が影響を受けない様式で腸管病原体に対する抗生物質を作ることの困難さによって妥協されている。さらに、緑膿菌によって類型化される腸管病原体の多くは、しばしば抗生物質曝露に耐性を持つようになり、予防又は治療に対する高価な、進行中の、完全には成功しないアプローチとなる。免疫療法的なアプローチも問題に悩まされている。特に、緑膿菌のような多くの腸管病原体は免疫回避(immunoevasive)であり、前記アプローチが最小限の効果しか持たないようにする。
【0004】
消化管誘導敗血症のような疾患の予防又は治療の他のアプローチは腸管洗浄である。ここ数年、ポリエチレングリコール(PEG)溶液を用いる腸管洗浄が試みられており、いくつかの事例のレポートは、PEGが種々の臨床及び実験の状況を越えて消化管誘導敗血症の治療においていくつかの裏づけを示し得ることを示唆している。これらの溶液のPEGは3,500ダルトンの平均分子量を有し、前記溶液は市販されている(例えば、Golytely)。PEGのこれらの相対的に小さい分子量(LMW)溶液が消化管誘導敗血症の治療又は予防において治療上の利益を与えるメカニズムは知られていない。典型的には、これらの溶液は、消化管誘導敗血症の発生のリスクがある又は消化管誘導敗血症を患っている生物体の腸管を洗浄又は洗い流すために使用される。これらのLMW PEG溶液を腸管に投与した結果、使用した化合物の濃縮方法及び分子量に依存する、治療した腸管微生物フローラ組成物(floral composition)における変化が生じる。例えば、約20%よりも大きい濃度のPEGを有する溶液は、ストレスを受けた宿主の腸管において潜在的な保護微生物の除去を生じる微生物学的な作用を生じ得る。また、低分子量PEGの溶液は、それらを保つにもかかわらず、ある種の生物体のビルレンスに対する耐性を弱めるというその効力を失わせ得る。したがって、微生物のビルレンスの発現(微生物の有害な性質)を抑制するが微生物又は周辺微生物を死滅させず、故に腸管微生物フローラ(intestinal microflora)の自然生態系を保つ利益を与える溶液は、当業界で必要とされている。例えば、自然の微生物フローラ組成物の保持は、別の方法で腸管にコロニーをつくることができる日和見病原体の競合を与える。
【0005】
微生物フローラ組成物における変化に付随するものは生物体の生理機能の変化である。
これらの生理機能の変化はかなり多くの特徴的な酵素活性を評価すること、例えば乳酸脱水素酵素レベルによってモニターしてもよい。したがって、腸管のLMW PEG治療が治療した生物体の生理機能における予測できない明らかな変化を生じ、治療した生物体の健康(health and well-being)の潜在的に有害な、長期的な結果を生じる。さらに、前記治療は、入院した患者のような重病の生物体における過度の腸管放出の形態における肉体的にきつい反応を誘発する。
【発明の概要】
【発明が解決しようとする課題】
【0006】
したがって、当業界において、微生物媒介上皮疾患(例えば、消化管誘導敗血症)及び/又は前記疾患に関連した症状の予防又は治療に有効な組成物、及び治療された生物体の生理機能の重大な変化によってさらなる合併症の可能性を生成しないで前記利益を達成する方法を提供する必要性が残っている。
【課題を解決するための手段】
【0007】
発明の要約
本発明は、微生物媒介疾患の発生のリスクがある上皮表面によって特徴付けられる異常状態に対して有効な保護を与える高分子量(HMW)ポリエチレングリコール組成物を提供することによって、当業界における上記要求を満たす。具体的な異常状態としては、消化管誘導敗血症、及び緑膿菌(これに限定されるものではない)などの腸管病原体による腸管微生物フローラ(intestinal flora)に関連した他の腸管障害/疾病が挙げられる。
HMW PEGは緑膿菌などの病原体が腸管上皮表面に接触することを抑制又は防止する。さらに、高分子量PEGは集団感知シグナルネットワーク(quorum sensing signaling networks)を含み得る種々のシグナルに応答するこれらの病原体(例えば、緑膿菌)におけるビルレンスの発現を抑制する。腸管病原体と腸管上皮との間の感染界面で阻害するHMW PEGの能力は、例えば異化ストレス後の消化管誘導敗血症を予防又は治療する別のアプローチを提供する。重要なことは、HMW PEGによる治療がヒト患者及び農業上重要な家畜(例えば、ウシ、ブタ、ヒツジ、ヤギ、ウマ、ニワトリ、七面鳥、アヒル、ガチョウなど)、ペット及び動物園の動物のような種々の他の生物体に対して行うのにコストパフォーマンスがよく、比較的簡単である。
【0008】
本発明の1つの態様は、微生物媒介疾患の発生のリスクがある上皮表面を含む疾病状態などの異常状態の動物における死亡確率の低減方法を提供し、前記異常状態は消化管誘導敗血症、熱傷、新生児壊死性全腸炎、激しい好中球減少症、中毒性大腸炎、炎症性腸疾患、腸疾患、移植片拒絶、嚢炎及びピッグベリー(pig belly)からなる群より選ばれ、前記方法は、有効量のポリエチレングリコール(PEG)を、それを必要とする動物に投与することを含み、前記PEGは少なくとも5,000ダルトンの平均分子量を有する。適した動物としては、これに限定されるものではないが、イヌ、ネコ、ヒツジ、ヤギ、雌ウシ、ブタ及びヒト等が挙げられる。上記方法において、PEGは、好ましくは少なくとも15,000ダルトンの平均分子量を有し、5,000〜20,000ダルトン、又は15,000〜20,000ダルトンが好ましい。また、好ましくは、PEGは6,000、7,000、8,000、9,000、10,000、11,000、12,000、13,000、14,000及び25,000ダルトンの平均分子量を有する。さらに、前記PEGは5〜20%のPEGを含む水溶液であってもよく、好ましくは10〜20%のPEGを含む水溶液である(例えば、10%のPEG)。前記方法の1つの実施態様において、前記状態は腸管における緑膿菌の存在に関連し、前記緑膿菌の細胞膜完全性は検出可能な程度に変化しない。前記方法の別の実施態様において、緑膿菌の増殖様式は検出可能な程度に変化しない。
【0009】
本発明の別の態様は、哺乳動物の上皮、例えば腸をポリエチレングリコール(PEG)と接触させることを含む消化管誘導敗血症を抑制する方法であり、前記PEGは少なくとも5,000ダルトン、好ましくは少なくとも15,000ダルトンの平均分子量を有する。この方法の1つの実施態様において、哺乳動物の腸は少なくとも30分間PEGと接触する。
【0010】
本発明の更なる態様としては、上皮の病原体、例えば腸管病原体におけるPA-Iレクチン/付着因子発現の抑制方法であって、有効量のポリエチレングリコールを、それを必要とする動物に投与することを含む方法;PA-Iレクチン/付着因子の上皮誘導(例えば、腸上皮誘導)活性化の抑制方法であって、有効量のポリエチレングリコールを、それを必要とする動物に投与することを含む方法;上皮の病原体(例えば、腸管病原体)のC4-HSL-誘導形態的変化の抑制方法であって、有効量のポリエチレングリコールを、それを必要とする動物に投与することを含む方法;上皮の病原体(例えば、腸管病原体)におけるビルレンス発現の低減方法であって、有効量のポリエチレングリコールを、それを必要とする動物に投与することを含む方法;上皮表面と微生物のビルレンス因子との相互作用を低減又は防止する方法であって、有効量のポリエチレングリコールを、それを必要とする動物に投与することを含む方法;病原性集団感知活性化の形成を抑制することによって上皮(例えば、腸管)病原性の改善方法であって、有効量のポリエチレングリコールを、それを必要とする動物に投与することを含む方法;及び脊椎動物の上皮(例えば、腸管上皮)と細菌、例えばシュードモナス(例えば、緑膿菌)との間の相互作用を抑制する方法であって、上皮をポリエチレングリコールと接触させることを含む方法などが挙げられる。本発明のこれらの態様のすべてにおいて、PEGは少なくとも5,000ダルトン、好ましくは少なくとも15,000ダルトンの平均分子量を有する。
【0011】
本発明のまた更なる態様は、哺乳類の上皮層、例えば腸管上皮層の経上皮電気抵抗における緑膿菌誘導減少の抑制方法であって、前記(腸管)上皮層をポリエチレングリコールと接触させることを含み、前記PEGは少なくとも5,000ダルトン、好ましくは少なくとも15,000ダルトンの平均分子量を有する方法である。好ましくは、前記PEGは15,000〜20,000ダルトンの平均分子量を有する。好ましい実施態様において、微生物(例えば、緑膿菌)の膜完全性は検出可能な程度に変化しない。
【0012】
本発明のさらに別の態様は、哺乳動物の上皮、例えば哺乳動物の腸管への細菌細胞接着の抑制方法であって、前記腸管をポリエチレングリコールと接触させることを含み、前記PEGは少なくとも5,000ダルトン、好ましくは少なくとも15,000ダルトンの平均分子量を有する方法である。なお、この方法は、前記PEGが15,000〜20,000ダルトンの平均分子量を有することが好ましい。前記PEGは5〜20%のPEGを含む水溶液であってもよく、好ましくは5〜10%のPEGを含む水溶液である。この方法による付着の抑制が可能であると考えられる具体的な細菌細胞はシュードモナス、例えば緑膿菌である。
【0013】
本発明の別の態様は、細菌細胞におけるPA-Iレクチン/付着因子発現の低減方法であって、前記細菌細胞をポリエチレングリコールと接触させることを含み、前記PEGは少なくとも5,000ダルトン、好ましくは少なくとも15,000ダルトン、好ましくは15,000〜20,000ダルトンの平均分子量を有する方法である。この場合も同様に、前記PEGは5〜20%のPEGを含む水溶液であってもよく、好ましくは5〜10%のPEGを含む水溶液である。
【0014】
別の態様において、本発明は、微生物媒介上皮疾患を示す動物における死亡確率の低減方法であって、前記疾患は消化管誘導敗血症、熱傷、新生児壊死性全腸炎(NEC)、激しい好中球減少症、中毒性大腸炎、炎症性腸疾患、腸疾患(例えば、重病における)、移植片拒絶、嚢炎及びピッグベリーからなる群より選ばれ、哺乳動物の腸管上皮細胞と腸管細菌細胞からなる群より選ばれる細胞に付着する有効量の化合物(例えば、PEG)を投与することを含み、前記化合物は組織分布的に非対称様式で前記細胞に付着して、哺乳動物の腸管上皮細胞と細菌細胞の相互作用を抑制することを含む方法である。好ましい化合物は界面活性剤である。この方法の1つの実施態様において、前記化合物は、好ましくは少なくとも15,000ダルトンの平均分子量を有するPEGである。この方法の別の実施態様において、前記抑制は原子間力顕微鏡よって決定される。この方法のさらに別の態様において、細菌細胞は腸管病原体であり、その増殖特性の検出可能な程度の変更はない。関連した態様において、この方法は、さらに有効量のデキストランを動物の腸に導入すること及び/又は有効量のL-グルタミン、デキストランコートL-グルタミン、デキストランコートイヌリン、デキストランコート酪酸、1つ以上のフラクトオリゴ糖、N-アセチル-D-ガラクトサミン、デキストランコートマンノース及びガラクトース、ラクツロース及び平衡緩衝剤及び安定化剤(当業界で公知)を動物の腸に導入することを含む。1つの組成物として一緒に投与する場合、この多成分単一溶液投与は治療し、例えば多くの異化、外科的及び外傷性タイプのストレス後に生じる腸管微生物フローラ及び腸管関門機能における破壊を予測して腸管を整えさせる。
【0015】
本発明の別の態様は、消化管誘導敗血症のような上皮の異常状態から生じる疾病又は状態、又は前記異常状態を特徴とする疾病又は状態に関連した症状を改善する方法であって、ポリエチレングリコールを腸に投与することを含み、前記PEGは少なくとも5,000ダルトン、好ましくは少なくとも15,000ダルトン、好ましくは15,000〜20,000ダルトンの平均分子量を有する方法である。前記PEGは5〜20%のPEGを含む水溶液であってもよく、好ましくは5〜10%のPEGを含む水溶液である。本発明は、本明細書に開示した疾病又は状態に関連した症状を改善することを包含する。
【0016】
本発明のさらに別の態様は、乳出力に影響を及ぼす微生物媒介疾患の発生のリスクがある乳腺の上皮表面の形態で異常状態を示す動物における泌乳容量の損失の予防方法であって、少なくとも5,000ダルトン、好ましくは少なくとも15,000ダルトンのポリエチレングリコールを有効量乳腺の上皮表面に、例えば局所的に投与することを含む方法である。具体的な動物としては、ヒツジ、ヤギ、雌ウシ、ブタ、ウマ及びヒトのような哺乳動物などが挙げられる。関連した態様において、本発明は、乳出力に影響を及ぼす乳腺の上皮表面の微生物媒介疾患によって特徴付けられる動物における泌乳容量の損失の治療方法であって、少なくとも5,000ダルトン、好ましくは少なくとも15,000ダルトンのポリエチレングリコールを有効量乳腺に、例えば局所的に投与することを含む方法を提供する。別の関連した態様において、本発明は、授乳年齢の動物における微生物媒介上皮疾患の発生の予防方法であって、少なくとも5,000ダルトン、好ましくは少なくとも15,000ダルトンのポリエチレングリコールを有効量動物に投与することを含む方法を提供する。適した動物としては、ヒト、家畜、飼い馴らされたペット及び動物園の動物のような哺乳動物などが挙げられる。1つの実施態様において、PEGは当業界で知られる乳児用調合乳と混合される。
本発明の関連した態様は、乳児用調合乳及びポリエチレングリコール(PEG)を含む組成物であり、PEGは少なくとも5,000ダルトンの平均分子量を有する。この場合も同様に、当業界で公知の任意の乳児用調合乳が使用でき、牛乳、ヤギ乳などの哺乳動物のミルクをベースとする調合乳、及び豆乳をベースとする調合乳が挙げられる。調合乳は、また任意のビタミン及び/又は元素によって栄養価を高めてもよく、鉄で強化するなどが挙げられる。PEGは、好ましくは少なくとも15,000ダルトンの平均分子量を有し、好ましくは乳児又は新生児用調合乳に水を加えて戻したもの(reconstitution or hydration)によって5〜20%の範囲で含まれる。本発明は、さらに動物、好ましくは授乳年齢の動物に栄養を与える方法であって、乳児用調合乳及びPEGを含む有効量の組成物を動物に投与することを含む方法を提供する。
【0017】
本発明のさらに別の態様は、少なくとも5,000ダルトン、好ましくは15,000ダルトンの平均分子量を有するポリエチレングリコール及び適したアジュバント、キャリア又は希釈剤を含む医薬組成物である。関連した態様において、前記組成物は、さらにデキストランコートL-グルタミン、デキストランコートイヌリン、デキストランコート酪酸、1つ以上のフラクトオリゴ糖、N-アセチル-D-ガラクトサミン、デキストランコートマンノース及びガラクトース、ラクツロースからなる群より選ばれる化合物及び平衡緩衝剤及び安定化剤(当業者に公知)を含む。
本発明の更なる態様は、消化管誘導敗血症のような微生物媒介疾患の発生のリスクがある上皮表面によって特徴付けられる異常状態の治療上の処置又は予防用キットであって、1つの上述の医薬組成物及び異常状態の治療上の処置又は予防における前記組成物の使用方法を記載したプロトコールを含むキットである。キットに含まれる適したプロトコールには、本明細書に開示される治療又は予防方法のいずれか1つが記載されている。
【0018】
本発明のさらに別の態様は、微生物媒介疾患(疾病などを含む)のリスクがある上皮表面によって特徴付けられる異常状態の予防方法に関する。例えば、本発明は有効量のポリエチレングリコール(PEG)を含む組成物を動物に投与することを含む疾病又は異常状態の予防方法を包含し、前記PEGは少なくとも5,000ダルトンの平均分子量を有する。
本発明の予防方法が可能である、適した疾病又は異常状態は、水泳者耳、急性中耳炎、慢性中耳炎、人工呼吸器関連の肺炎、消化管誘導敗血症、壊死性腸炎、抗生物質誘導下痢、偽膜性大腸炎、炎症性腸疾患、過敏性腸疾患、好中球減少性全腸炎、膵炎、慢性疲労症候群、生命異常(dysbiosis)症候群、顕微鏡的大腸炎、慢性尿路感染症、性感染症及び感染症からなる群より選ばれる。前記予防方法の対象として適した動物は、イヌ、ネコ、ヒツジ、ヤギ、雌ウシ、ブタ、ニワトリ、ウマ及びヒトからなる群より選ばれる。前記PEGは、好ましくは少なくとも15,000ダルトンの平均分子量を有し、また好ましくは、15,000〜20,000ダルトンの平均分子量を有する。さらに、前記PEGは10〜20%のPEGを含む水溶液であってもよく、好ましくは10%のPEGを含む水溶液である。投与される組成物は、さらに溶液、局所用ゲル及び噴霧に適した溶液からなる群より選ばれる媒体を含んでもよい。さらに、前記組成物はデキストランコートL-グルタミン、デキストランコートイヌリン、デキストランコート酪酸、フラクトオリゴ糖、N-アセチル-D-ガラクトサミン、デキストランコートマンノース、ガラクトース及びラクツロースからなる群より選ばれる化合物を含んでもよい。1つの実施態様において、前記組成物はPEG、デキストランコートL-グルタミン、デキストランコートイヌリン、デキストランコート酪酸、フラクトオリゴ糖、N-アセチル-D-ガラクトサミン、デキストランコートマンノース、ガラクトース及びラクツロースを含む。
【0019】
本発明のさらに別の態様は、有効量のポリエチレングリコール(PEG)を含む組成物を動物に適用する工程を含む皮膚感染症の予防方法であって、前記PEGは少なくとも5,000ダルトンの平均分子量を有する方法である。前記組成物は、さらに軟膏、クリーム、ゲル及びローションからなる群より選ばれる媒体を含んでもよい。本発明は、前記感染症を生じる媒介物が炭疽菌、痘瘡ウイルス、病原性大腸菌(EPEC)、腸管出血性大腸菌(EHEC)、腸管凝集性大腸菌(EAEC)、クロストリジウム・ディフィシル、ロタウイルス、緑膿菌、セラチア菌(Serratia marcescens)、クレブシエラ・オキトカ(Klebsiella oxytocia)、エンテロバクター・クロアカ(Enterobacteria cloacae)、鵞口瘡カンジダ及びカンジダ・グラブラータ(Candida globrata)からなる群より選ばれることも意図する。
【0020】
本発明の別の態様は、有効量のポリエチレングリコール(PEG)を動物に投与する工程を含む呼吸器感染症の予防方法であって、前記PEGは少なくとも5,000ダルトンの平均分子量を有する方法である。本発明の予防方法が可能である呼吸器感染症は当業界で公知の任意の経路によって病原菌と接触することから生じてもよく、人工呼吸器に関連した肺炎(例えば、人工呼吸器関連肺炎)、空気病原菌(air-borne infectious agents)、くしゃみによるなどの噴霧流体に分散された病原菌などが挙げられる。いくつかの実施態様において、前記方法は炭疽菌及び痘瘡ウイルスからなる群より選ばれる媒介物による呼吸器感染症を防止する。
【0021】
本発明のさらに別の態様は、慢性尿路感染症を予防するために尿路の少なくとも一部を洗浄する方法であって、PEGを含む有効量の組成物を尿道に投与する工程を含み、前記PEGは少なくとも5,000ダルトンの平均分子量を有する方法である。1つの実施態様において、前記組成物は少なくとも膀胱を含む前記尿路の一部に投与される。
【0022】
本発明の別の態様は、ポリエチレングリコール(PEG)をコンドームに適用する工程を含む性感染症の予防方法であって、前記PEGは少なくとも5,000ダルトンの平均分子量を有する方法である。本発明の関連した態様は、少なくとも5,000ダルトンの平均分子量を有するPEGでコートした少なくとも一部を有するコンドームである。さらに別の関連した態様は、コンドーム及び少なくとも5,000ダルトンの平均分子量を有するポリエチレングリコール(PEG)を含むキットである。
【0023】
本発明は、またポリエチレングリコール(PEG)を含む有効量の組成物を、それを必要とする動物に投与することを含む消化管疾患の予防方法であって、前記PEGは少なくとも5,000ダルトンの平均分子量を有する方法を包含する。本発明の予防方法に従う具体的な消化管疾患は、新生児壊死性全腸炎、抗生物質誘導下痢、偽膜性大腸炎、炎症性腸疾患、過敏性腸疾患、好中球減少性全腸炎、膵炎、生命異常症候群及び顕微鏡的大腸炎からなる群より選ばれ得る。
【0024】
本発明の別の態様は、ポリエチレングリコール(PEG)の、それを必要とする動物への投与をモニターする方法であって、標識PEGを含む有効量の組成物を、それを必要とする動物へ投与すること、ここで前記PEGは少なくとも5,000ダルトンの平均分子量を有する、及び標識PEGを検出することを含む方法であり、標識PEG(例えば、微生物に関連する)の量及び/又は位置は投与の効果を評価するのに有用な情報を与える。前記モニター方法の1つの実施態様において、標識はフルオロフォア(例えば、フルオレセイン、ローダミン、Cy3、Cy5)である。前記方法の別の実施態様において、標識PEGを検出することは内視鏡検査を含む。前記モニター方法は、標識PEGが便サンプル中で検出されること(すなわち、微生物のような成分に関連した標識PEG、その源は便サンプルである)も意図する。さらに、前記モニター方法は、微生物に特異的な第2の標識を投与し、前記第2の標識を検出することを含んでもよい。本明細書で使用される「特異的」とは、標識が少なくとも1つの微生物と検出可能な程度に結びついていることを意味する。
【0025】
本発明の別の態様は、ポリエチレングリコール(PEG)の、それを必要とする動物への投与をモニターする方法であって、ポリエチレングリコールを受け取る動物からサンプルを得ること、ここで前記PEGは少なくとも5,000ダルトンの平均分子量を有する、前記サンプルを上皮細胞と接触させること、及び前記サンプル中の微生物の上皮細胞への付着性を測定することを含む方法であり、前記PEGの量及び/又は位置は投与の効果を評価するのに有用な情報を与える。前記測定は顕微鏡検査によって達成してもよい。
【0026】
本発明の別のモニター方法は、ポリエチレングリコール(PEG)の、それを必要とする動物への投与をモニターする方法であって、ポリエチレングリコールを受け取る動物からサンプルを得ること、ここで前記PEGは少なくとも5,000ダルトンの平均分子量を有する、上皮細胞層を前記サンプルと接触させること、及び前記上皮層の経上皮電気抵抗を測定することを含む方法であり、有効な投与はコントロール値と比較して経上皮電気抵抗の低下を低減することによって示される。コントロール値は内的(すなわち、PEG投与前のTEERの測定)であってもよく、又は外的(すなわち、比較のために信頼性をもって使用される他の研究において得られた値)であってもよい。
【0027】
本発明のさらに別のモニター方法は、ポリエチレングリコール(PEG)の、それを必要とする動物への投与をモニターする方法であって、ポリエチレングリコールを受け取る動物からサンプルを得ること、ここで前記PEGは少なくとも5,000ダルトンの平均分子量を有する、前記サンプルから微生物を分離すること、及び前記微生物の細胞表面の疎水性を測定することを含む方法であり、前記サンプル中の微生物の疎水性は投与の効果を評価するのに有用な情報を与える。本明細書で使用される「分離」とは、当業界で理解されているであろう疎水性測定を可能にするのに十分に、前記サンプル(例えば、固形物)の他の成分から分離したことを意味する。
【0028】
本発明の関連した態様は、ポリエチレングリコールの投与をモニターするためのキットであって、標識PEG及びその投与をモニターする際の標識PEGの使用方法を記載するプロトコールを含むキットである。適したプロトコールとしては、PEGの投与、デリバリ又は適用に関連する本明細書に開示された方法又は当業界に公知の方法のいずれをも含む。本発明のこの態様のいくつかの実施態様において、前記キットはさらに遊離した標識を含む。
【0029】
本発明のさらに別のモニター方法は、ポリエチレングリコール(PEG)の、それを必要とする動物への投与をモニターする方法であって、ポリエチレングリコールを受け取る動物からサンプルを得ること、ここで前記PEGは少なくとも5,000ダルトンの平均分子量を有する、及びサンプル中のPA-Iレクチン/付着因子活性を検出することを含む方法であり、PA-Iレクチン/付着因子活性は投与の効果を評価するのに有用な情報を与える。この方法の1つの実施態様において、PA-Iレクチン/付着因子は、レクチン/付着因子が特異的に結合する炭水化物又は特異的な抗PA-Iレクチン/付着因子抗体の任意の既知の形態のようなPA-Iレクチン/付着因子結合パートナーと結合することによって検出される。本発明の関連した態様は、PA-Iレクチン/付着因子結合パートナー及びサンプル中のPA-Iレクチン/付着因子を検出するための前記結合パートナーの使用方法を記載したプロトコールを含むポリエチレングリコール(PEG)の投与をモニターするためのキットである。適したプロトコールはPEGの使用に関連する当業界で既知の方法又は本明細書に開示された方法のいずれをも含む。
本発明の他の特徴及び利点は、図面及び実施例を含む以下の詳細な説明を参照してより良く理解されるであろう。
【図面の簡単な説明】
【0030】
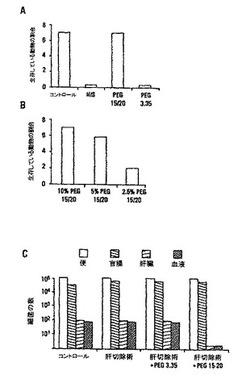
【図1】偽の開腹又は30%の外科的肝切除術後緑膿菌PA27853を盲腸に直接注入した後48時間でのマウスの死亡率を示す。マウスは30%の無血左葉肝切除術を受け、その後直ちに1×107cfu/mlのPA27853の直接盲腸注入を受けた。各グループは7匹のマウスを含んでいた。コントロールマウスは偽の肝切除術を受け、その後同じ量のPA27853を盲腸に注入した。PEGグループのマウスについて、盲腸注入前に、1×107cfu/mlのPA27853をPEG 3.35(LMW PEG 3,350)又はPEG 15-20(HMW PEG 15,000〜20,000ダルトン)のいずれかに懸濁した。PEG 15-20の用量応答曲線をパネルbに示す。a.PEG 15-20の統計的に有意な保護効果をフィッシャーの正確確率検定によって決定した(P<0.001)。b.5%(P<0.05)であるPEG 15-20の最小保護濃度を決定した。c.30%の外科的肝切除術及びPA27853の1×107cfu/mlの直接盲腸注入の24時間後の盲腸内容物(糞便)、洗浄した盲腸の粘膜、肝臓及び血液の定量的な細菌培養。一元配置分散分析(one-way ANOVA)は肝切除術後のマウスの盲腸内容物、粘膜、肝臓及び血液の細菌数の統計的に有意な増加を示した(P<0.001)。肝臓及び血液の細菌数の有意な減少(P<0.05)はPEG 3350について観測されたが、PEG 15-20は、PA27853がマウスの肝臓及び血液へ広がることを完全に防止した。
【図2】経上皮電気抵抗(TEER)による評価としてPA27853誘導上皮関門機能障害に対するPEG 15-20の保護作用を示す。a.データは、1×107cfu/mlのPA27853の先端曝露の8時間観測の3つの培養(n=7)のベースラインからTEERの最大減少を平均±SEM%で表す。TEERの統計的に有意な減少をPA27853に曝露したCaco-2細胞で示した(一元配置分散分析(one-way ANOVA)(P<0.001))。PEG 15-20について、PA27853によって誘導されたTEERの減少に対する統計的に有意な保護作用を示した(P<0.001)。b.PEG 3.35の存在下のCaco-2細胞のイメージ及びPA27853に曝露したアピカル。共培養の4時間後に得たイメージは、PA27853の細胞膜への付着を示す細胞骨格上の30〜40μmを浮いている細胞によって単層の完全性のロスを示した。c. PEG 15-20の存在下でCaco-2細胞をPA27853に先端曝露した4時間後、試験した面のいずれかにおいて浮遊細胞の証拠を示さなかった。
【図3】PA27853におけるPA-I発現に対するPEGの抑制作用を示す。a.ウエスタンブロット分析。1mMの集団感知シグナリング分子C4-HSLへのPA27853の曝露は、10%のPEG 3.35の存在下で部分的に抑制された、及び10%のPEG 15-20によってさらに多く抑制されたPA-Iたんぱく質発現の統計的に有意な増加を生じた(P<0.001一元配置分散分析(one-way ANOVA))。a’.C4-HSL誘導PA-I発現に対するPEG 15-20の最小抑制濃度は5%であった(P<0.01)。b.PEGの存在下及び非存在下でC4-HSLに曝露した個々の細菌細胞の電子顕微鏡観察は、C4-HSLが緑膿菌の形状及び線毛発現における形態学的な変化を生じることを示した。C4-HSL誘導形態学的作用はPEG 15-20の存在下では完全に排除されたが、PEG 3.35の存在下では排除されなかった。ハロタイプの作用はPEG 15-20に曝露されたPA27853の周囲で見られた。c.ノーザンハイブリダイゼーション0.1mMのC4-HSLへのPA27853の曝露は10%のPEG 15-20によって大きく抑制されたPA-ImRNA発現の統計的に有意な増加を生じた(P<0.001、一元配置分散分析(one-way ANOVA))。d.Caco-2細胞への4時間の曝露によって誘導されたPA-ImRNAの増加はPEG 15-20の存在下では抑制されたが、PEG 3.35の存在下では抑制されなかった(P<0.001一元配置分散分析(one-way ANOVA))。
【図4】PA27853の細菌の膜完全性乾地性増殖パターンに対するPEG溶液の作用を示す。a.細菌の膜完全性に対する2つのPEG溶液の作用をSYTO9及びヨウ化プロピジウムからなる染色方法によって評価した。いずれのPEG溶液も細菌の膜透過性に対して作用をもたなかった。b. PEGを含まないTSB培地(コントロール)に対して2つのPEG溶液で同一のPA27853の増殖パターンが現れた。
【図5】PEGに曝露したCaco-2細胞及び細菌細胞の原子間力顕微鏡(AFM)像を示す。a−c.単独培地(a)、PEG 3.35を有する培地(b)及びPEG 15-20を有する培地の存在下でのCaco-2のAFM像。PEG 3.35はCaco-2細胞に対して滑らかなカーペットを形成するように見えたが(b)、PEG 15-20はより組織分散的に確定されたカバーリングを形成した(c)。d−f.PEG 3.35及びPEG 15-20におけるPA27853のAFMイメージ。PEG 3.35は個々の細菌細胞の周りに滑らかなエンベロープを形成したが(e)、PEG 15-20は個々の細胞と固く結びついただけでなく(f)、ポリマー/細菌直径をも増大し(g、h)、それによって個々の細菌を互いに分離した。
【図6】PA27853の分散/集中様式に対するPEG溶液の作用を示す。DIC及びGFP蛍光フィルターを用いるAxiovert 100 TV蛍光倒立顕微鏡により、63倍の拡大率の対物レンズで、DTC3皿の細菌細胞の分散様式を直接観測した。温度をBioptechsサーモスタット温度コントロールシステムにより調整した。タングステンランプ(100V)をDIC及びGFP励起用に用いた。Intelligent Imaging Innovationsの3Dイメージングソフトウエア(Slidebook)を使用して、GFPフィルターを用いるZ面における細菌細胞分散様式の像を描いた。Caco-2細胞のない培地における一様に分散されたプランクトン様緑膿菌細胞はDICイメージ(6a1)及びZ面再構築(6a2)で見られた。Caco-2細胞の存在下で、細菌細胞は集中した外観を発生させ(6b1)Caco-2細胞へ付着するように見えた(6b2)。10%のPEG 3350は細菌の運動性を減少させ、ウエルの底に付着する(6c2)キノコ形状の細菌微小コロニーの形成を直ちに誘導した(6c1)。Caco-2細胞の存在下で、細菌微小コロニーは上皮細胞の面上8μmのオーダーで存在した(6d1,2)。10%のPEG 15-20は緑膿菌細胞の運動性を大きく減少させた。それにもかかわらず、PEG 15-20を含む培地において最初の0.5〜1時間のインキュベーションで、細菌細胞はウエルの底付近にクモ型の微小コロニーを形成した(6e1,2)。数時間以内に、クモの足形状の微小コロニーが培地の全空間/容積を占めた(示さない)。Caco-2細胞の存在下で、緑膿菌細胞はクモ様の構成を失い、上皮の面上に高く上昇するように見えた(30〜40μm)(6f1,2)。
【発明を実施するための形態】
【0031】
発明の詳細な説明
本発明は、ヒトを含む多くの哺乳動物を苦しめる種々の微生物媒介上皮疾患、すなわち異常状態及び疾病の治療及び/又は予防に対する簡単で、かつ、経済的なアプローチを集合的に示す生成物及び方法を提供する。HMWポリエチレングリコールのような高分子量極性ポリマーを、それを必要とする危険な状態の動物に投与することによって、多くの健康又は生命を脅かす異常状態、すなわち消化管誘導敗血症を含む上皮疾患及び疾病は、すべて最小限のコストで、かつ、開業医の最小限の指導で治療され得る。理論によって束縛されることを望まないが、本発明によって与えられる利点は、微生物媒介上皮疾患が前記微生物の生存の助けとなる環境を促進することによって首尾よく予防、改善又は治療され得る原理と一致している。本発明の以下のより詳細な説明の理解は、この開示で使用される用語についての以下の意味を最初に定めることによって容易になる。
【0032】
「異常状態」は、哺乳動物の疾病、哺乳動物の疾患及び微生物媒介疾患の発生のリスクがある上皮表面を特徴とする哺乳動物の健康のあらゆる異常状態を含むように広義に定義される。微生物媒介疾患の発生のリスクがある上皮表面を特徴とする異常状態は、上皮表面が微生物媒介疾患を発生している状態を含む。具体的な状態としては、医療行為を必要とする、又は医療行為から生じるヒトの疾病及びヒトの疾患、例えば熱傷、新生児全腸炎、激しい好中球減少症、炎症性腸疾患、腸疾患(例えば、重病の)及び移植片(例えば、器官)拒絶が挙げられる。
「熱傷」とは、哺乳動物の組織が、例えば、直火、スチーム、熱流体及び熱表面の形態の熱に曝されることによって生じる損傷を意味する。
「激しい」好中球減少症は、循環好中球の数の著しい減少というその通常の(ordinary and accustomed)意味を与える。
「移植片拒絶」とは、宿主生物体によってその材料の根本的な拒絶反応と関連していると認識される移植された材料(例えば、器官)のあらゆる経過を意味する。
「投与」は、当業界で認識されている適したあらゆる手段による投与のその通常の意味を与える。投与の具体的な例としては、経口投与、肛門投与、直接穿刺又は注入、局所適用及び目、耳、鼻、口、肛門又は尿道口へのスプレー(例えば、噴霧スプレー)、ゲル又は流体適用などが挙げられる。
「有効量」は、その量を受け取る生物体に対して薬効を与える物質の量であり、その量を投与する目的、その量を受け取る生物体の大きさ及び状態及び有効量の決定に関連する当業界で認識されている他の変数に依存して変わり得る。有効量を決定する方法は当業者のスキルの範囲内である所定の最適化手順を含む。
「動物」は、非植物、非原生生物のその通常の意味を与える。好ましい動物はヒトなどの哺乳動物である。
本明細書の開示に関連して、「必要」とは、その状態によって特徴付けられる生物体への有効量の投与によって利益をうける生物体、器官、組織又は細胞の状態である。例えば、消化管誘導敗血症の発生又はその症状を示すリスクがあるヒトは、有効量の本発明の生成物(例えば、医薬組成物)を必要とする生物体である。
【0033】
「平均分子量」は、その手段の評価の正確さに関わらず、組成物の成分(例えば、分子)の分子量の相加平均の、その通常の意味を与える。例えば、3.5キロダルトンの平均分子量を有するポリエチレングリコール(すなわち、PEG)は種々の分子量のPEG分子を含んでいてもよいが、その分子量の相加平均が当業界で理解されているようなある程度の正確さで(相加平均の評価を示す)3.5キロダルトンであると評価されることを条件とする。同様に、PEG 15-20は、上述の注意に従う相加平均によって、その分子量が15〜20キロダルトンの相加平均を与えるPEGを意味する。これらのPEG分子としては、単純PEGポリマーが挙げられるが、これに限定されない。例えば、複数の相対的に小さいPEG分子(例えば、7,000〜10,000ダルトン)を、必要によりフェノールのようなリンカー分子と結合してより高い平均分子量(例えば、15,000〜20,000ダルトン)を有する単一分子としてもよい。
「細胞膜完全性」とは、当業界において理解されるとおり、生きている細胞の機能要素としての細胞膜の機能的に重要な変異の相対的な欠如を意味する。
「検出可能な程度の変化」は、当業界において理解されるとおり、その環境下で適した検出手段を用いて感知できる変化の、その通常の意味を与える。
「増殖様式」とは、細胞の発生又は倍加時間、細胞の新生群の形態学の出現及び細胞又は細胞群の常食様式の理解に寄与するものとして当業界で認識されている他の変数のような細胞増殖を特徴付けると当業界で認識されている、細胞又は細胞群(例えば、細胞集団)の特性の評価を集合的に意味する。
【0034】
「抑制」は、抑制、低減又は防止の、その通常の意味を与える。例えば、形態学的な変化を抑制するとは、形態学的な変化をより困難にし、又は完全に防止することを意味する。
「PA-I(すなわち、PA-Iレクチン/付着因子)発現」とは、PA-Iレクチン/付着因子の活性な特徴の生成又は発生を意味する。典型的には、PA-Iレクチン/付着因子の発現は、PA-Iレクチン/付着因子の少なくとも1つの活性な特徴を有するPA-Iレクチン/付着因子ポリペプチドを得るPA-Iレクチン/付着因子コード化mRNAの翻訳を含む。必要により、PA-Iレクチン/付着因子は、さらに前述のmRNAを得るPA-Iレクチン/付着因子コード化DNAの転写を含む。
「上皮誘導活性化」とは、上皮細胞の直接的又は間接的な影響によって所定の標的(例えば、PA-Iレクチン/付着因子)の活性の増加を意味する。本発明の内容において、例えば、PA-Iレクチン/付着因子の上皮誘導活性化とは、上皮細胞の腸管病原体との直接的な接触によって明らかになる上皮の間接的な影響に起因するポリペプチドの活性の増加を意味する。
「形態学的な変化」は、形態の変化の、その通常の意味を与える。
「腸管病原体」とは、ヒトのような動物において、消化管誘導敗血症を、全部又は一部で生じさせることができる病原体を意味する。当業界で公知の腸管病原体はこの定義に包含され、例えばシュードモナス(例えば、緑膿菌)などのグラム陰性桿菌が挙げられる。
「改善」とは、程度又は重症度を低減することを意味し、その通常の意味と一致する。
【0035】
「病原クオラム」とは、当業界で知られているとおり、集団感知シグナルを生じさせ又は維持するのに十分な数の病原体(例えば、緑膿菌)の集合又は結合を意味する。
「相互作用」は、2又はそれよりも多い生物学的生成物、例えば分子、細胞などの間の相互作用のような相互作用の、その通常の意味を与える。
「経上皮電気抵抗」(すなわち、TEER)は、このフレーズが当業界で獲得する意味を与え、上皮組織の電気抵抗の測定を意味し、上皮組織における上皮細胞間の密着結合の状態を評価するのに非排他的に有用である。
「付着」は、一時的な時間よりも長い物理的な結合の、その通常の意味を与える。
「形態学的に非対称」とは、対称でない3次元物体(例えば、細胞)の表面のイメージ、マップ又は他の表示を意味する。
走査型力顕微鏡観察としても知られる「原子間力顕微鏡観察」は、当業界において理解されるとおり、ラスター走査におけるサンプルの表面を移動するカンチレバープローブを有し、プローブのゆがみを検出するための高感度手段を用いることによって、物体の高分解立体マップを得るための技術である。
「医薬組成物」とは、ヒト患者のような生きている動物への治療投与に適した化合物の処方物を意味する。本発明の好ましい医薬組成物は、電解質、デキストランコートL-グルタミン、デキストランコートイヌリン、ラクツロース、D-ガラクトース、N-アセチルD-ガラクトサミン及び5〜20%のPEG(15,000〜20,000)を含み、粘度、電解質特性及び浸透圧を調整した溶液を含む。
「アジュバント」、「キャリア」又は「希釈剤」は、それぞれ当業界で獲得したその用語の意味を与える。アジュバントは共投与イムノゲンの免疫原生を延長するのに役立つ1つ以上の物質である。キャリアは、例えば運ばれる物質のトランスロケーションによって取扱いを容易にする1つ以上の物質である。希釈剤は希釈剤に曝される所定の物質の濃度を減少させる(すなわち、希釈する)1つ以上の物質である。
「HMW PEG」とは、3.5キロダルトンよりも大きい平均分子量を有すると定義する相対的に高い分子量のPEGを意味する。好ましくは、HMW PEGは5キロダルトンよりも大きい平均分子量を有し、特定の実施態様において、HMW PEGは少なくとも8キロダルトン、少なくとも15キロダルトン、及び15〜20キロダルトンの平均分子量を有する。
【0036】
以下の実施例は本発明の実施態様を示す。実施例1は高分子量PEGによって肝切除されたマウスに与えられる消化管誘導敗血症に対する保護を記載する。実施例2は、HMW PEGが腸管上皮細胞への病原体の付着をどのように防止するかを開示する。実施例3は、HMW PEGが一般に病原体のビルレンスの発現を、特にPA-Iレクチン/付着因子発現をどのように抑制するかを明らかにする。実施例4は、PEGが病原体の増殖(又は、細胞膜完全性)に影響を及ぼさないことを示す。実施例5は原子間力顕微鏡観察を用いてHMW PEGコート病原体の特有の形態学的配置を示す。実施例6はHMW PEGによる影響を受けた細胞間相互作用を記載する。実施例7は本発明の組成物を用いる予防方法を記載する。実施例8は本発明の治療方法のようなHMW PEGの投与をモニターする方法及び対応するキットを開示する。
【実施例】
【0037】
実施例1
HMW PEGは30%肝切除術後の消化管誘導敗血症から保護する
雄のBalb/cマウスを麻酔し、従来のプロトコルを用いて肝切除術を施した。柔らかい左葉に沿って肝臓の30%の無血切除術を行った。コントロールマウスは肝切除術なしで肝臓の操作を受けた。実験及びコントロールグループは、それぞれ7匹のマウスを含んでいた。すべてのマウスにおいて、生理食塩水、PEG 3.350又はPEG 15-20(PEG)のいずれかに希釈した107cfu/mlの緑膿菌PA27853 の200μlの容量を直接穿刺法によって盲腸の基部に注入した。相対的に低い分子量のPEGは市販されており、15,000〜20,000ダルトンの平均分子量を有するPEG 15-20はフェノール環に共有結合したPEG 7-8とPEG 8-10の組合せである。PEG 7-8は7,000〜8,000ダルトンの平均分子量を有し、PEG 8-10は8,000〜10,000ダルトンの平均分子量を有する。当業者は、HMW PEGが種々のPEGサブユニットのいずれかを有する化合物を含み、各サブユニットが互いに又は1つ以上のリンカー分子(PEG分子の結合に適した官能基を有する相対的に小さい分子である)と好ましくは共有結合した種々の平均分子量のいずれかを有することを理解するであろう。適したリンカーは実質的にHMW PEGの生物活性を保存する(本明細書に開示される効果的な予防又は治療効果を実現するのに十分な生物活性の保存)。
48時間の実験で一定のPEG源を提供するために、針を小腸(回腸)に導き、1mlの生理食塩水、PEG 3.35又はPEG 15-20を最も近い腸管に注入して退化した。穿刺を絹縫合により結紮し、盲腸をアルコールで拭いた。マウスをかごに戻し、次の48時間H20のみ与えた。
【0038】
PEG 15-20の用量応答曲線を図1のパネルbに示す。a.統計的に有意なPEG 15-20の保護効果をフィッシャーの正確確率検定(P< 0.001)によって決定した。b.PEG 15-20の最小保護濃度を5%(P<0. 05)であると決定した。c. 30%の外科的肝切除術及び1×107cfu/mlのPA27853の直接盲腸注入の24時間後の盲腸の内容物(糞)、洗浄した盲腸の粘膜、肝臓並びに血液の定量的細菌培養。一元配置分散分析(one-way ANOVA)は、肝切除術語のマウスの盲腸の内容物、粘膜、肝臓及び血液における細菌の数が 統計的に有意な増加を示した(P<0.001)。肝臓及び血液細菌の数の有意な減少(P<0.05)はPEG 3350について観測されたが、PEG 15-20は、PA27853がマウスの肝臓及び血液へ広がることを完全に防止した。
緑膿菌株ATCC 27853(PA27853)は血液培養からの非ムコイド臨床単離物である。あらかじめ30%の無血外科的肝切除術を行ったマウスに菌株PA27853を直接盲腸注入することにより、臨床的敗血症を生じ、48時間で生き残っているものはいなかった。緑膿菌を同様に注入した、肝切除術なしで偽の腹開を行ったマウス(コントロール)は、敗血症のどんな臨床的サインもなく完全に生き残った(図1a)。このモデルにおいて死亡を予防し、又は死亡率を低下させるPEG溶液の能力を決定するために、10%(w/v)の2つのポリエチレングリコール溶液(PEG-3.35対PEG-15-20)の1つに1×107Cfu/mlの濃度で200μlのPA27853を懸濁した。最後の25年間臨床使用が可能であったPEGの分子量を示すために、PEG-3.35を選択した(Golytelyt(登録商標))。相対的に、使用された本発明のPEG溶液は15〜20kDaの間の分子量を有した。懸濁した菌株を直接穿刺によって盲腸に導入した。PEG 3.35は肝切除術後のマウスにおいて死亡率に対して効果を持たなかったが、PEG 15-20は完全に保護した。実際、PEG 15-20はフィッシャーの正確確率検定(P< 0.001)によって決定される統計的に有意な保護効果を有した。投与量応答実験は、5%溶液が完全に保護する(P<0.05、図1b参照)PEG 15- 20の最小濃度であることを示した。当業者は、5%未満のHMW PEG溶液がいくらかの保護を与えると期待され、したがって本発明の範囲内であると認識するであろう。実験及びコントロールマウスの細菌の数に関して、一元配置分散分析(ANOVA)は、肝切除術後のマウスにおける盲腸の内容物、粘膜、肝臓及び血液の細菌の数の統計的に有意な増加を示した(P<0.001)。肝臓及び血液における細菌の数の有意な減少がPEG 3350について観測されたが、PEG 15-20は、PA27853がマウスの肝臓及び血液に広がることを完全に防止した。PEG 15-20は、腸のPA27853が肝臓及び血液循環へ広がることを完全に抑制した(図1c)。データは、PEG溶液の作用が非微生物学的であるメカニズムに関連することを示す。哺乳動物の細胞に対して非毒性であるPEG濃度で与える場合(すなわち、約10%以下)、細菌の増殖様式に対して効果が無いことが示され得る。
【0039】
サンプルは、HMW PEGが部分的な肝切除術の形態で外科的な介入を受けたマウスにおいて消化管誘導敗血症に起因する死亡率を下げることを示す。このマウスモデルは、HMW PEG治療が侵襲手術(例えば、部分的な肝切除術)のような生理学上のストレスを受けた動物種、例えばヒトのような哺乳動物の敗血症の死亡率を下げる(すなわち、任意の与えられた生物体における死亡確率を下げる)のに有用であることを示す。HMW PEG治療は、生物学上のストレスを受けた後に行われる場合(例えば、術後の対処の際)、敗血症に関連する死又は重い病気を予防する方法において効果的であることが期待される。さらに、HMW PEG治療は、生物学上のストレスの導入が予測可能である状況下で、重い病気又は死のリスクを下げるために前記ストレス前(例えば、手術前の対処)に使用してもよい。HMW PEG治療は、また、消化管誘導敗血症に関連した疾病又は異常状態に関連した症状を改善するのに有用である。
【0040】
実施例2
HMW PEGは腸管上皮への病原体の接着性を防止する
密着結合は哺乳動物の腸管の関門機能において重要な役割を果たす上皮細胞骨格の動的要素である。緑膿菌はCaco-2細胞及びT-84細胞の経上皮電気抵抗(TEER)によって測定された密着結合透過性(tight junctional permeability)における著しい変更を生じる。Caco-2細胞は、培養において安定なTEERを維持する、十分に特徴付けられたヒト結腸上皮細胞であり、この細胞株は腸管病原体のインビボ特性の認められたインビトロモデルを与える。培養されたCaco-2単層のTEERにおける緑膿菌PA27853-誘導減少に対するPEGの保護効果を決定するために、1×107cfu/mlのPA27853を10%のPEG 3.35又は10%のPEG 15-20の存在下で2つのCaco-2細胞単層に先端接種(apically inoculated)した。TEERを8時間連続的に測定し、記録されたTEERは最大限減少した。
PEG 15-20のみがTEERの緑膿菌-誘導減少に対して有意に保護した(図2a)。図2に示したデータは1×107cfu/mlのPA27853への先端曝露の8時間観測された3つの培養(n=7)のベースラインからTEERの最大減少を平均±SEM%で示す。PA27853を受けたCaco-2細胞で示されるTEERの統計的に有意な減少は一元配置分散分析(one-way ANOVA)(P<0. 001)によって示された。PA27853 によって誘導されるTEERの減少に対する統計的に有意な効果はPEG 15-20について示された(P<0.001)。図2bにPEG 3.35の存在下でPA27853への先端曝露を受けるCaco-2細胞を示す。PEG 3.35の存在下で共培養の4時間後、単層やぐら(monolayer scaffolds)上に30〜40μmを浮いている細胞を有する、焦点接着性細菌(focally adherent bacteria)を示すCaco-2細胞単層の分裂を観測した(図2b)。対照的に、PEG 15-20の存在下でPA27853へ4時間先端曝露したCaco-2細胞のイメージを示す図2cは、試験したいずれの面においても細胞が浮かんでいる証拠を示さない。Caco-2細胞完全性に対するPEG 15-20の保護効果は、1×106cfu/mlのPA27853に4時間曝露した後細胞の上澄みにおける15倍以上の細菌の回復によって映し出された、少ない細菌接着と関連があった。
【0041】
TEERの維持によって判断される、緑膿菌の関門破壊効果に対するPEG-培養されたヒト腸管上皮細胞の耐性は、進入する病原体からの攻撃に直面して密着接合関門機能(tight junctional barrier function)を安定化する実用的なアプローチを提供する。さらに、PEG 15-20の治療上価値の証拠は、上皮の輸送機能(Na+/H+交換、グルコース輸送)がこの化合物によって影響されないことである。
したがって、HMW PEGは相対的に腸管上皮関門に対して不活性であり、かつ安定化効果を有する。本発明は、哺乳動物、好ましくはヒトのような動物にHMW PEGを投与することによって緑膿菌のような腸管病原体に関連する腸管関門の異常を治療する方法を包含する。腸管障壁の異常は、任意の診断方法又は当業者に知られる他の手段によって明らかにされてもよい。しかしながら、HMW PEG治療の前に腸管関門の異常を同定する必要はない。HMW PEG治療に関連した低コスト及び高い安全性は、このアプローチを、好ましくは潜在的に危険な状態にある生物体に予防適用及び腸管関門の異常の特徴的な少なくとも1つの症状を示している動物に適用される治療方法の双方に適したものとする。HMW PEG治療方法は腸管関門の異常に関連した症状を改善し、好ましくは、前記方法は治療された生物体から消化管誘導敗血症の影響を低減又は排除するであろう。
【0042】
実施例3
HMW PEGは病原体におけるビルレンスの発現を抑制する
緑膿菌PA27853のPA-Iレクチン/付着因子の発現は、肝切除術後のマウスの盲腸において増加し、マウスの腸における緑膿菌の致死効果において重要な役割を果たした。PA-Iは、上皮へのPA27853の付着を促進することによって及び細胞毒素、外毒素A及びエラスターゼに鞍替えする有意な障壁を生成することによって、マウスの腸における重要なビルレンスの決定因子として機能する。緑膿菌のPA-I発現は、転写調節因子RhIR及びその同系活性因子C4-HSLによって調節される。PA27853のPA-I発現はC4-HSLへの曝露によって増加しただけでなく、Caco-2細胞、Caco-2細胞膜調製物及びCaco-2細胞培養からの上澄みとの接触によっても増加した。
ノーザンハイブリダイゼーションを使用して転写レベルでPA-I の発現を分析した。緑膿菌の全RNAを修正3洗浄剤法(modified three-detergent method)によって分離した。
PA-Iプライマー:F(ACCCTGGACATTATTGGGTG)(配列番号1)、R(CGATGTCATTACCATCG- TCG)(配列番号2)及び16Sプライマー:F(GGACGGGTGAGTAATGCCTA)(配列番号3)、R(CGTAAGGGCCATGATGACTT)(配列番号4)を用いて、プローブをPCRによって生成し、pCR2.1ベクター(インビトロジェン社)にクローニングした。挿入部分はPA-I又は16Sのいずれかの配列と一致する配列であった。PA-I及び16Sに特異的なcDNAプローブをα32P-dCTPで放射標識した。特異的な放射能をStorm 860 phosphorimager(Molecular Dynamics, CA)によって測定し、PA-Iと16Sの強度比をベースに、コントロールと比較した相対的な変化率を計算した。ウサギのアフィニティー精製した(affinity-purified)ポリクローナル抗PA-I抗体を用いたウエスタンブロッティングをPA-Iたんぱく質分析のために使用した。1mlの緑膿菌細胞をPBSで洗浄し、溶解緩衝液(4% SDS、50mM Tris-HCI、 pH 6.8)中で100℃で加熱し、トリシンSDS- PAGE後たんぱく質の電子移動によって免疫ブロット分析を行った。ECL試薬(Amersham, NJ)により、PA-Iレクチンを検出した。
【0043】
1mMの集団感知シグナル分子C4-HSLへの緑膿菌PA27853の曝露は、10%のPEG 3.35の存在下で部分的に抑制され、10%のPEG 15-20によってはるかに大きな広がりを抑制されたPA-Iたんぱく質発現において統計的に有意な増加を生じた(P<0.001、一元配置分散分析(one-way ANOVA))(図3)。C4-HSL誘導PA-I発現に対するPEG 15-20の完全抑制最小濃度は5%であった(P<0.01、一元配置分散分析(one-way ANOVA))。PEGの存在下及び非存在下でC4-HSLに曝露された個々の細菌細胞の電子顕微鏡による観察は、C4-HSLが緑膿菌の形状及び線毛発現における形態学的な変化を生じることを示した(図3b)。C4-HSL誘導形態学的作用はPEG 15-20の存在下で完全に排除されたが、PEG 3.35の存在下では完全には排除されなかった。ハロタイプの作用はPEG 15-20に曝露されたPA27853の周りで見られた(図3b)。0.1mMのC4-HSLへのPA27853の曝露は、ノーザンブロットを用いて評価されるPA-I mRNA発現における統計的に有意な増加を生じた(P<0.001、一元配置分散分析(one-way ANOVA))。PA-1発現は10%のPEG 15-20によって大きく抑制された。図3dは、Caco-2細胞への4時間の曝露によって誘導されるPA-I mRNAにおける増加がPEG 15-20によって抑制されたが、PEG 3.35によっては抑制されなかったことを示す(P<0.001、一元配置分散分析(one-way ANOVA))。
【0044】
ここで示したデータは、100μm〜1mMのC4-HSLによって誘導されるPA27853におけるPA-I発現(たんぱく質及びmRNA)の有意な減少(3〜4倍減少)が、細菌が10%のPEG 15-20によってあらかじめ処置された場合に観測されたことを示す。この作用はPEG 3.35の場合には観測されなかった(図3a)。C4-HSL-誘導PA-I発現の減少は10%のPEG 3.35の場合にも観測されたが、減少の程度は10%のPEG 15-20の場合よりも明らかに少なかった。PA-Iたんぱく質のC4-HSL誘導発現を抑制するPEG 15-20の最小濃度は5%であった(図3b)。C4-HSLに曝露された個々の細菌細胞の電子顕微鏡検査は、C4-HSLがPA27853の形状及び線毛発現の形態学的な変化を生じることを示した(図3b)。C4-HSL誘導形態学的作用はPEG 15-20の存在下で完全に排除されたが、PEG 3.35の存在下では完全には排除されなかった(図3b)。Caco-2細胞への4時間の曝露によって誘導されたPA-I発現(mRNA)は、PEG 15-20の存在下で抑制されたが、PEG 3.35の存在下では抑制されなかった(図3b)。PEG 15-20によるCaco-2細胞誘導PA-I発現の保護作用は、一晩の曝露実験で持続した。
【0045】
HMW PEGは、また公知の興奮剤に応答して緑膿菌のビルレンスの発現に影響を与える。PA27853におけるC4-HSL誘導PA-I発現の減少はPEG 15-20の主な保護作用であり得るが、集団感知シグナルがこの病原体のビルレンス発現の十分に確立したメカニズムであることを示す。PA-IのCaco-2細胞誘導発現によるPEG 15-20誘導干渉は、PEG 15-20の保護作用の重要な態様であると予想される。PEG 15-20は、30%の肝切除術後のマウスからのフィルター処理した盲腸内容物(糞便)に応答した緑膿菌(PA27853)のPA-I発現の減少によって宿主動物に対する保護作用を有することが分かった。 そのビルレンス発現を増加させる宿主因子から緑膿菌をシールドするPEG 15-20の能力は、生物体が消化管誘導敗血症から保護されるさらに別のメカニズムであると予想される。
したがって、本発明は、シュードモナスの1つのような腸管病原体によるビルレンス因子又は決定因子の発現によって特徴付けられる状態を予防又は治療する動物にHMW PEGを投与する対応する方法及びキットの形態の材料を含む。ビルレンスの決定因子は直接又は間接的にビルレンスに寄与してもよい。間接的な寄与の例としては、腸管上皮への腸管病原体の付着及び/又は細胞毒素、外毒素A及びエラスターゼに対する関門の欠陥の生成に対する緑膿菌のPA/Iレクチン/付着因子の作用などが挙げられる。
【0046】
実施例4
PEGは病原体の細胞増殖又は細胞膜完全性に影響しない
SYTO 9及びヨウ化プロピジウムからなる染色方法によって、2つのPEG溶液(PEG 3.35及びPEG 15-20)の細菌膜完全性に対する作用を評価した。PEG溶液は細胞膜透過性に対していかなる作用ももたなかった(図4a)。生/死細菌生存度キットL-3152(Molecular Probes)を用いて、膜完全性を決定した。細菌を定量化し、異なるインキュベーション時間で得られるサンプルを10倍に希釈したプレーティングによって、数をcfu/mlで表した。
2つのPEG溶液のいずれかを含むTSB培地で一晩増殖させた緑膿菌の増殖曲線は、細菌の数に対するPEG溶液による抑制作用はいずれにおいても示さなかった(図4b)。実際、各PEG含有培地における増殖様式はPEGを含まないTSB培地における増殖様式と区別がつかなかった。増殖の対数期及び定常期の種々の時間点で、エネルギー代謝に関するハウスキーピング酵素、乳酸脱水素酵素(LDH)の活性を測定した。CytoTox 96(Promega)の基質混合物を用いた結合ジアフォラーゼ酵素測定法(coupled diaphorase enzymatic assay)において、LDH活性を測定した。BCAたんぱく質測定法(Pierce)を用いて、たんぱく質濃度を決定した。PEGの存在下で増殖した緑膿菌の細胞を含まない上澄みにおけるLDH活性の変化は観測されなかった。この実験の結果は、HMW PEGが細菌増殖様式に対して極わずかな作用のみを有することを示している。
本発明の方法及び対応する製品(例えば、キット)は、腸管微生物フローラ組成物に有意に影響することなしに、消化管誘導敗血症に関連した疾患又は異常状態を予防又は治療するという利点を与える。同様に、本発明の方法及び製品を使用して、腸管微生物組成物の有意な変化なしに前記疾患又は異常状態に関連した症状を改善してもよい。当業者は、前記方法が前記妨害から生じる二次健康合併症をもたらすと予期されない限りは、腸管微生物フローラ組成物を有意には妨害しない方法(及びキット)が望ましいと認識するであ
【0047】
実施例5
PEGコート病原体の原子間力顕微鏡観察
10%のHMW PEGの有り無しで、一晩増殖させたPA27853の培養の1%分量を4時間37℃でトリプシン大豆ブロス(TSB)に継代培養した。各継代培養の1滴を回収し、緑膿菌PA27853細胞を多量のPBSで洗浄し、10分間空気を送りながら雲母上で乾燥し、直ちにイメージ化した。空気中で、Multimode Nanoscope IIIA Scanning Probe Microscope(MMAFM, Digital Instruments)を用いて、タッピングモードのAFMによって乾燥した細菌のイメージ化を行った。Subconfluent Caco-2細胞を10%のHMW PEGで4時間処理し、多量のPBSで洗浄した。細胞のAFMイメージ化をオーリングを用いることなくPBSで行った。電子顕微鏡観察について、1mMのC4-HSL及び10%のHMW PEGの有り無しで、PA27853をTSBに接種して一晩インキュベートした。1%の緑膿菌の1滴を酢酸ウラニルで染色し、電子顕微鏡下での試験前に0.5MのNaClで洗浄した。
Caco-2の原子間力顕微鏡観察は刷子縁微絨毛による古典的な不均一表面を示したが、PEG 3.35に曝露したCaco-2細胞は上皮細胞の表面上に滑らかな平面外観を示した(図5a、c)。PEG 15-20は組織分布的に定義された面に沿った非相称を満たすことによってCaco-2細胞を覆うように現れ、より複雑に組織分布的に定義された被覆を生じる。いくらか同じ様式で、PEG 3.35に曝露したPA27853細胞は、拡散フラット様式でポリマーが細菌細胞を滑らかにコートする様式を示し(図6d)、PEG 15-20はより組織分布的に非相称様式で周囲に細菌を囲み、固定する。PEG 15-20の細菌の直径の原子間力測定の断面積分析はPEG溶液内で細菌/PEGエンベロープの有意な増加を示す(図5e、f)。換言すれば、PEG 3.35は個々の細菌細胞を囲む滑らかなエンベロープを形成し、PEG 15-20は個々の細胞を固く固定し(図5f)、ポリマー/細菌直径を増加させ(図5g、5h)、それによって個々の細菌細胞を互いに遠ざける。
【0048】
理論によって束縛されることを望まないが、HMW PEGは緑膿菌を腸管上皮から単に物理的に遠ざけることによってその有益な効果を発揮できる。あるいは、HMW PEGは病原体細胞の細胞間相互作用から生じる病原体集団感知活性化シグナルの形成を防止することによって利益を提供できる。同様に、理論によって束縛されることを望まないが、HMW PEGによる生物学的表面のコーティングがコーティングPEG鎖の高次構造上の自由度の減少を生じ、たんぱく質への接近を防止する。HMW PEGとCaco-2細胞の間の極性間相互作用はPEG鎖の弾力性に作用でき、特定のHMW PEG側鎖をたんぱく質を拒絶する分子構成物に束縛する。ここで示したデータは、おそらくHMW PEGのCaco-2細胞によるある種の動的な相互作用の結果として「高次構造上のエントロピー」の減少のために、HMW PEGコートCaco-2細胞が未コートCaco-2細胞よりも緑膿菌に対して強く拒絶する結論を支持する。
この実験の結果は、HMW PEG治療が治療細胞に対する作用を有し、特に前記細胞の表面トポロジーに影響を与える。さらに、前記細胞に対するHMW PEG曝露の作用はPEG 3.35が前記細胞に対して有する作用と異なっている。理論によって束縛されることを望まないが、ここに開示された結果は、PEG 3.35のような低分子量PEGと比較してHMW PEGによって示される細胞に対する顕著な異なる作用について物理的な関連を与える。
【0049】
実施例6
HMW PEGは細胞間相互作用に影響を及ぼす
緑膿菌の空間的な配向に対するPEG溶液の作用を直接観測するために、緑色蛍光たんぱく質をコードするegfp遺伝子を有する緑膿菌PA27853/EGFPの生きた菌株を用いて実験を行った。Caco-2細胞の存在下及び非存在下で実験を行った。PEGの細菌に対する作用及び培養上皮とのその相互作用に対する作用をイメージ化するために、微分干渉コントラスト(DIC)顕微鏡観察及びGFPイメージ化を用いた。
鋳型としてpBl-EGFPプラスミド(Clontech)を用いて、緑色蛍光たんぱく質をコードするEGFP遺伝子を増幅した。プライマーTCTAGAACTAGTGGATCCCCGCGGATG(配列番号5)及びGCAGACTAGGTCGACAAGCTTGATATC(配列番号6)を用いて、Xbal及びPstl制限部位を導入した。TA-クローニングキット(Invitrogen)を用いて、PCR産物を直接pCR 2.1ベクターにクローニングし、次いでpCR2.1/EGFP構築物を大腸菌DH5aに形質転換した。Xbal及びPstlによる消化によって、EGFP遺伝子をこの構築物から切除し、切除した遺伝子を含むフラグメントを(同じ制限酵素によって消化された)大腸菌-緑膿菌シャトルベクターpUCP24にクローニングした。(シャトルベクター内にEGFP遺伝子を含む)得られた構築物(すなわち、pUCP24/EGFP)を25μF及び2500VでPA27583エレクトロコンピテント細胞に電気穿孔した。PA27853/EGFP-含有細胞を100μg/mlのゲンタマイシン(Gm)を含むLB-寒天プレートで選択した。
PA27853/EGFPを有する細胞を一晩100μg/mlのGmを含むLBで増殖させ、1%の培養を使用して50μg/mlのGmを含む新鮮なLBに接種した。3時間増殖した後、イソプロピル-β-D-チオガラクトピラノシド(IPTG)を添加して0.5mMの最終濃度とし、培養をさらに2時間インキュベートした。HEPESで緩衝し、10%のウシ胎仔血清(HDMEM HF)及び10%のHMW PEGを含ませた1mlのHDMEM培地(Gibco BRL)と100μlの細菌培養を混合した。1mlの細菌懸濁液を0.15mm-厚のdTC3皿(Bioptech)に注いだ。0.15mm-厚のdTC3皿(Bioptech)のHDMEM HF中で増殖させた4日目のCaco-2細胞(p10-p30)を、HMW PEGの有り無しで、HDMEM HFで1回洗浄した。上述のとおり調製した1mlの細菌懸濁液を、Caco-2細胞を含むdTC3皿に加えた。DIC及びGFP蛍光フィルターを用いるAxiovert 100 TV蛍光倒立顕微鏡で、63×の対物倍率で、dTC3皿中の細菌細胞の分散様式を直接観測した。Bioptechsサーモスタット温度調節システムで、温度を調整した。DIC及びGFP励起でタングステンランプ(100V)を使用した。Intelligent Imaging Innovationsの3Dイメージングソフトウエア(Slidebook)を用いて、GFPフィルターを用いたZ面の細菌細胞分散様式をイメージ化した。Caco-2細胞を含まない培地中の一様に分散したプランクトン様緑膿菌細胞はDICイメージ(図1a1)及びZ面再構築物(図6a2)で認められた。Caco-2細胞の存在下で、細菌細胞は集中外観で発生し(図6b1)、Caco-2細胞に付着するように見えた(図6b2)。10%のPEG 3350の溶液は細菌運動を低下させ、ウエルの底に付着した(図6c2)キノコ形状細菌微小コロニーの即時形成を誘導した(図6c1)。Caco-2細胞の存在下で、細菌微小コロニーは上皮細胞の面上約8μmであった(図6d1、2)。10%のPEG 15-20の溶液は緑膿菌細胞の運動を大きく低下させた。それにもかかわらず、PEG 15-20含有培地での最初の0.5〜1時間のインキュベーションでは、細菌細胞はウエルの底付近にクモ足形状微小コロニーを形成した(図6e1、2)。数時間以内に、クモ足形状微小コロニーは培地の全空間/容積を占めた。Caco-2細胞の存在下で、緑膿菌細胞はクモ足様配置を失い、上皮の面上に高く(30〜40μm)上昇したように見えた(図6f1、2)。
【0050】
三次元で細菌-上皮細胞相互作用の空間的配向を決定するために、Z面再構築を行った。イメージは、2つのPEG溶液が緑膿菌の集中様式に対して異なる作用を有し、Caco-2細胞の存在又は非存在に依存して細菌の空間的配向に異なる影響を及ぼすことを示した。培地のみによる実験において、緑膿菌は一様な分散様式を示すように見えた(図6a)。しかしながら、Caco-2細胞の存在下で試験した細菌細胞は、集中外観を発生し、ウエルの底で上皮細胞の平面に隣接するように見えた(図6b)。PEG 3.35単独の存在下で試験した細菌細胞は大きな凝集を形成し、培養ウエルの底に残り(図6c)、PEG 3.35を含む培地でCaco-2細胞によって試験された細菌細胞は上皮細胞の面上(約8μm)で懸濁して維持され、その集中外観を保持した(図6d)。PEG 15-20単独の存在下で試験した細菌細胞は一様な微小集中様式を示し(図6e)、PEG 15-20を含む培地でCaco-2の存在下で試験した細菌細胞は集中形態で上皮の面上より高く(約32μm)懸濁された(図6f)。時間実験で、細菌運動がPEG 3.35によって減少することを観測し、PEG 15-20によってさらにより大きく減少することを観測した。
実施例5に開示した実験と同様の様式で、この実施例は、細胞間相互作用に対するHMW PEGの観測された作用について物理的な関係を与え、本明細書に開示されるようなその有用な予防及び治療活性と一致している。HMW PEGの使用は腸管における有害な細胞間相互作用(例えば、腸管上皮細胞とシュードモナスのような腸管病原体との)を低減又は排除し、消化管誘導敗血症に関連した疾病及び/又は異常状態のリスクを低減することが期待される。
【0051】
実施例7
疾病/異常状態の予防方法
また、本発明は、ヒト及び他の動物、特に他の哺乳動物における種々の疾患及び/又は異常状態の予防方法を提供する。これらの方法において、有効量のHMW PEGを、それを必要とするヒト患者又は動物対象に投与する。当業者に知られた所定の最適化手順を用いて決定される投与計画を用いて、PEGを投与してもよい。好ましくは、PEGは5,000〜20,000ダルトン、より好ましくは10,000〜20,000ダルトンの平均分子量を有する。少なくとも5%のHMW PEGを投与すると考えられる。HMW PEGは任意の適した形態で、例えば溶液、ゲル又はクリーム、噴霧に適した溶液(例えば、吸入使用)として、HMW PEGを含む医薬組成物において、及び動物への注入に適した殺菌等張液において投与してもよい。投与は任意の従来の経路を用いて行ってもよい。HMW PEGは経口又は局所投与することが特に考えられる。いくつかの実施態様において、投与されるHMW PEG組成物は、さらにデキストランコートL- グルタミン、デキストランコートイヌリン、デキストランコート酪酸、フラクトオリゴ糖、N-アセチル-D-ガラクトサミン、デキストランコートマンノース、ガラクトース及びラクツロースからなる群より選ばれる化合物を含む。他の実施態様において、投与されたHMW PEG組成物は、さらにデキストランコートL- グルタミン、デキストランコートイヌリン、デキストランコート酪酸、1つ以上のフラクトオリゴ糖、N-アセチル-D-ガラクトサミン、デキストランコートマンノース、ガラクトース及びラクツロースを含む。
本発明は種々の疾病及び異常状態、例えば水泳者耳、急性又は慢性中耳炎、人工呼吸器関連の肺炎、消化管誘導敗血症、壊死性腸炎、抗生物質誘導下痢、偽膜性大腸炎、炎症性腸疾患、過敏性腸疾患、好中球減少性全腸炎、膵炎、慢性疲労症候群、生命異常症候群、顕微鏡的大腸炎、慢性尿路感染症、性感染症及び感染症(例えば、炭疽菌、痘瘡ウイルス、病原性大腸菌(EPEC)、腸管出血性大腸菌(EHEC)、腸管凝集性大腸菌(EAEC)、クロストリジウム・ディフィシル、ロタウイルス、緑膿菌、セラチア菌、クレブシエラ・オキトカ、エンテロバクター・クロアカ、鵞口瘡カンジダ及びカンジダ・グラブラータなど)の予防方法を提供する。慢性尿路感染症の予防方法、又は前記感染の治療方法の好ましい実施態様において、HMW PEGは膀胱潅漑の形態で投与される。性感染症予防について、本発明の組成物はコンドームを潤滑するために好ましく使用される。バイオテロ兵器による感染症の予防方法の好ましい実施態様において、本発明の組成物は局所適用に適したゲル又はクリームの形態で提供される。前記局所適用は、生存、健康又は快適の点でヒト又は動物に対する脅威を引き起こす任意のバイオテロ兵器に関連した又は種々の化学又は物理化学兵器に関連した種々の疾病/異常状態を予防するのに有用であることが期待される。前記化学又は物理化学兵器には、皮膚を燃焼又は別の方法で傷つけることができる兵器が含まれ、本発明の組成物に不活性であり、ほとんど溶解しない。
【0052】
本発明の方法の1つの実施態様において、雄のBalb/cマウスに麻酔し、PEG 15-20の5%溶液を直接鍼穴によって盲腸の基部に注入する。48時間の実験の間持続する一定のPEG源を提供するために、針を小腸(回腸)に向け、1mlのEPG 15-20を腸の近隣に逆に注入した。穿刺部位を縛り、絹縫合し、盲腸をアルコールで拭いた。マウスを籠に戻し、水のみを与えた。48時間後、マウスにフロッピー左葉に沿った肝臓の30%無血切除術に関する従来の肝切除術手順を施す。コントロールマウスは肝切除術しないで肝臓の処置を受ける。HMW PEGの投与に関する予防的治療は、マウスの外科手術に関連した消化管誘導敗血症の発生を低減又は排除すると期待される。
これらの方法は、マウス、モルモット、イヌ及びネコのようなペットからウシ、ウマ、ヤギ、ヒツジ、ブタ、ニワトリ、シチメンチョウ、アヒル、ガチョウ及び他の家畜のような農業上重要な動物までの予防的ケアを越えて適用される。さらに、これらの予防方法は、水泳者耳、急性又は慢性中耳炎、人工呼吸器関連の肺炎、消化管誘導敗血症、壊死性腸炎、抗生物質誘導下痢、偽膜性大腸炎、炎症性腸疾患、過敏性腸疾患、好中球減少性全腸炎、膵炎、慢性疲労症候群、生命異常症候群、顕微鏡的大腸炎、慢性尿路感染症、性感染症及び、これに限定されないが、炭疽菌及び天然痘などの感染症菌(例えば、バイオテロ組成物)のような疾病及び/又は異常状態の発生のリスクがある多くの患者又は候補者の健康及び平均寿命を改善するために、ヒトに適用できると期待される。上述のとおり、前記予防方法は、公知の又は従来の投与経路によって、ヒト又はその他の動物に少なくとも5%のHMW PEG(5〜20 kDa)を含む組成物の投与を含む。好ましくは、前記予防方法は、前述の疾病及び/又は異常状態の1つ以上を発生するリスクがある個体において実施されるが、本発明の組成物及び方法は、ヒト又はその他の動物の個体群全体又は一部において前記疾病又は異常状態を広く治療又は予防する予防又は治療役割において有用であると考えられる。
【0053】
実施例8
HMW PEGの投与をモニターする方法
本発明は、また例えば治療方法におけるHMW PEGの投与をモニターする方法を包含する。前記モニター方法において、標識HMW PEGが単独で又は非標識HMW PEGと組み合わせて投与され、前記標識は、単純な終点決定などの連続又は断続的な計画で治療の間検出される。用語「標識」HMW PEGとは、標識(すなわち、検出可能な化合物)がHMW PEGに直接又は間接的に結合し、又はHMW PEGがHMW PEGを有する標識に結合できるレポーター化合物に結合していることを意味する(もちろん、HMW PEGに結合しない又はそれと結合するように設計されていない標識も後述するように本発明に包含される)。HMW PEGは当業界において知られる任意の検出可能な標識を用いて標識化され、PEGはそれを検出するのに十分な濃度で標識化される。当業者は、その濃度が標識及び検出方法に応じて変化することを認識するであろう。当業者は通常の最適化手順を用いて標識化の程度を最適化できるであろう。標識は、非共有結合又は使用、特に保存の際に安定である共有結合によってHMW PEGに化学的に結合される。HMW PEGに共有結合した標識が好ましい。標識結合の密度はHMW PEGの生物活性を実質的に保持するように調整される(本明細書に開示される有益な予防又は治療効果を実現するのに十分な生物活性の保持)。これは、典型的には当業者に知られるようにHMW PEG:標識比を調整することによって達成される。HMW PEGの相対的な平均分子サイズを考えると、広範囲の標識がその生物活性を実質的に保持してHMW PEGに結合するのに適していると期待される。
本発明によって考慮される標識は当業界で公知の標識であり、例えば放射標識、発色団、フルオロフォア及びレポーター(例えば、検出可能な化合物の生成を触媒する酵素及びレポーターの近くに検出可能な化合物が局在化する抗体のような結合パートナーなど)などが挙げられる。具体的な酵素レポーターとしては、例えば発光システムの酵素成分及び比色反応の触媒などが挙げられる。さらに詳しくは、具体的なレポーター分子としては、ビオチン、アビジン、ストレプトアビジン及び酵素(例えば、西洋わさびペルオキシダーゼ、ルシフェラーゼ、アルカリホスファターゼ、例えば分泌性アルカリホスファターゼ(SEAP)、β-ガラクトシダーゼ、β-グルクロニダーゼ、クロラムフェニコール、アセチルトランスフェラーゼ)などが挙げられる。前記レポーターの使用は当業者によく知られており、例えば米国特許第3,817,837号、第3,850,752号、第3,996,345及び第4,277,437に記載されている。具体的な酵素基質は、レポーター酵素によって検出可能な化合物に変換され得るものであり、例えば5-ブロモ-4-クロロ-3-インドリルβ-D-ガラクトピラノシド又はXgal及びBluo-galなどが挙げられる。検出可能な化合物に変換できる化合物として、酵素基質は、また当業界で理解されているようにある特定の実施態様において標識であってもよい。標識及びその使用方法を教示する米国特許としては、米国特許第3,817,837号、第3,850,752号、第3,939,350号及び第3,996,345号が挙げられる。具体的な放射標識としては、3H、14C、32p、33p、35S及び1251が挙げられる。具体的なフルオロフォアとしては、フルオレセイン(FITC)、ローダミン、Cy3、Cy5、エクオリン及び緑色蛍光たんぱく質が挙げられる。好ましい標識はフルオレセインのようなフルオロフォアである。
【0054】
本発明のモニター方法は、また1よりも多くの標識を含んでもよい。1つの実施態様において、1つの標識が治療後又は治療中のHMW PEGの位置を同定するために役立ち、第2標識は少なくとも1つの微生物に関連して検出可能な標識である限り1つ以上の微生物に特異的である。例えば、モニター方法は、HMW PEGの生物活性を実質的に保持するような態様でHMW PEGに結合したフルオレセインを含み、原核生物特異的βガラクトシダーゼ活性の検出用のXgal又はbluo-galを含まなくてもよい(すなわち、結合しなくてもよい)。
フルオレセインはHMW PEGを局在化させ、着色(青色)生成物はシュードモナスのようなラクトース代謝原核微生物の存在を示す。本発明は、また1つの標識がこの情報を提供するモニター方法(すなわち、HMW PEGの局在化及び微生物の存在の表示)も含む。
当業界で公知の検出方法は本発明のモニター方法で使用することができる。標識のタイプ、モニターされる生体材料(例えば、皮膚、外耳道又は腸の表皮細胞、便、粘液又は組織サンプル)、所望の識別レベル、定量化が期待されるかどうかなどの複数の因子は、選択される検出技術に影響を及ぼす。適した検出技術としては、肉眼による単純目視検査、必要に応じて適した光源及び/又は記録用カメラを備える内視鏡のような器具による目視検査、ガイガー計数管の通常の使用、X線フィルム、シンチレーションカウンターなど、及び当業界で公知の他の検出技術が挙げられる。
当業者は、本発明のモニター方法が治療方法を最適化するのに有用であると認識するであろう。例えば、モニター方法はHMW PEGの量及び/又は濃度を最適化するために(例えば、HMW PEGの溶液又は混合物に関して所望の粘度を与えるために)使用でき、水泳者耳の予防又は治療のために外耳道の上皮細胞のような上皮細胞に与えられる。追加の例として、腸の最適化又は腸管治療は標識HMW PEGに曝露される腸管の内視鏡検査又は便サンプルのモニターによって促進される。
本発明のモニター方法は、腸管上皮細胞に付着できる微生物のための便評価法を含み、、前記評価法は微生物と投函上皮細胞を接触させること、及び微生物の上皮細胞への付着を当業界で公知の技術を用いて検出することを含む。好ましい実施態様において、腸管上皮細胞は、マイクロタイターウエルの底及び/又は側面のような適した表面に固定化される。他の好ましい実施態様において、直接標識、又は検出可能な生成物を生成することができるレポーターのような間接的標識は、検出工程の前、又は検出工程の際に加えられる。モニター方法は、さらに遊離標識の追加を含んでもよい。例えば、遊離Bluo-galはラクトース代謝原核微生物を含むと思われるサンプルに添加され、存在する場合には、微生物酵素β-ガラクトシダーゼはBluo-galを切断して検出可能な青色生成物を生じる。
【0055】
1つの実施態様において、市販の腸管上皮細胞(例えば、Caco-2細胞、ATCC HTB 37、及び/又はIEC-6細胞、ATCC CRL 1952)を、通常の方法を用いてマイクロタイター皿のウエルに固定する。便サンプルを回収し、リン酸緩衝食塩水のような流体と混合する。混合物の液相(懸濁された微生物を含む)が得られ(例えば、適したろ過(すなわち、懸濁液中の細菌からの固体全体の分離)、デカンテーションなどによって)、PBSで1:100に希釈される。Bluo-galを生きた微生物の懸濁液に加える。微生物の懸濁液を1時間24℃でマイクロタイターのウエルに加え、その後適した流体(例えば、PBS)でそのウエルを洗浄して結合していない微生物を除去する。固定化した上皮細胞に結合していない及び/又は結合した微生物を、例えば偏光顕微鏡観察を用いて計数することによって検出した。別の実施態様において、微生物特異的モノクローナル又はポリクローナル抗体(必要により放射標識、フルオロフォア又は発色団のような標識を結合した)である適した免疫学的な試薬を用いて、免疫測定法を使用して付着を検出する。
前記固定化は上皮細胞へ付着する微生物の正確な検出を容易にするが、当業者は、腸管上皮細胞又は微生物のいずれも固定化する必要がないことを認識するであろう。例えば、1つの実施態様において、固定化された便微生物を、固定化されていない腸管上皮細胞と接触させる。さらに、当業者は、当業界で知られる任意の適した流体が微生物懸濁液を得るために使用してもよいことを認識するであろう。好ましい流体は公知の等張緩衝液である。また、上述のとおり、細胞付着の検出のために、任意の公知の標識を使用してもよい。
関連する態様において、本発明は、上皮細胞及び前記上皮細胞への微生物細胞の付着を評価するためのプロトコールを含む、微生物細胞付着を評価するためのキットを提供する。前記プロトコールには、微生物を検出する公知の方法が説明されている。好ましいキットは、腸管上皮細胞を含む。本発明の他のキットは、さらにフルオロフォア又はレポーターのような標識を含む。
【0056】
本発明に含まれる他のモニター方法は微生物疎水性の評価法である。この方法において、微生物細胞の相対的又は絶対的疎水性は任意の従来技術を用いて決定される。具体的な技術は、任意の微生物を疎水性相互作用クロマトグラフィーに追加することを含み、従来技術(Ukukuら, J. Food Prot. 65: 1093-1099 (2002))で知られており、その全内容は参照により本明細書に組み込まれるものとする。他の具体的な技術は任意の微生物の非極性:極性流体分離(例えば、1-オクタノール:水又はキシレン:水)である。Majtanら, Folia Microbiol (Praha) 47: 445-449 (2002)を参照のこと(その全内容は参照により本明細書に組み込まれるものとする)。
PEG投与をモニターする疎水性評価法の1つの実施態様において、0.15MのNaClを含む50mMのリン酸ナトリウム緩衝液(pH7.4)に便サンプルを懸濁する。懸濁液中の微生物を遠心分離法により回収し、同じ緩衝液に再懸濁し、遠心分離-再懸濁サイクルを繰り返す。可能であれば、微生物を同じ緩衝液に再懸濁して660nmで0.4の吸光度とし、標識PEGを用いないで、分光光度法でモニターできるであろう。微生物懸濁液をキシレン(2.5:1(v/v)、Merck)で処理し、懸濁液を2分間激しく混合し、懸濁液を20分間室温で滅菌する。次いで、例えば660nmの吸光度の分光光度法による決定によって、水相中の微生物の存在を決定する。リン酸ナトリウム緩衝液を含むブランクを用いてバックグラウンドを除く。
これらの方法で用いる便サンプルから微生物細胞を得る際に、HMW PEGが微生物懸濁液を得るために使用される流体及び微生物懸濁液を希釈するために使用される任意の流体に相対的に不溶性であることが好ましい。
【0057】
本発明は、腸管上皮細胞及び微生物疎水性の決定法を説明するプロトコールを含む微生物疎水性の評価法を含むモニター方法を実施するキットをさらに提供する。好ましいキットは腸管上皮細胞を含む。関連するキットは、さらにフルオロフォア又はレポーターのような標識を含む。
さらに、本発明は腸管微生物フローラのサンプルを得ること及びPA-Iレクチン/付着因子活性を検出することを含むモニター方法を提供する。当業界で知られるPA-Iレクチン/付着因子活性を検出する任意の技術が使用できる。例えば、PA-Iレクチン/付着因子は、PA-Iレクチン/付着因子を特異的に認識する抗体(ポリクローナル、モノクローナル、Fabフラグメントのような抗体フラグメント、単鎖、キメラ、当業界で知られるヒト化又は任意の他の形態の抗体)を用いて検出できる。免疫測定法は当業界で知られる任意の免疫測定法フォーマット、例えばELISA、ウエスタン、免疫沈降などの形態をとる。あるいは、PA-Iレクチン/付着因子の炭水化物結合能を決定でき、又は例えばサンプルを曝露する前に、及び/又はその際に上皮層の経上皮電気抵抗、すなわちTEERをモニターすることによって、PA-Iレクチン/付着因子の腸管上皮関門破壊活性(breaching activity)を決定してもよい。関連するキットにおいて、本発明はPA-Iレクチン/付着因子結合パートナー及びPA-Iレクチン/付着因子活性(例えば、結合活性)を検出するためのプロトコールを提供する。本発明の他のキットはPA-Iレクチン/付着因子を結合することが知られている任意の炭水化物及びPA-Iレクチン/付着因子活性(例えば、結合活性)を検出するためのプロトコールを含む。
本発明の多くの修正及び変更は上記教示に照らして可能であり、本発明の範囲内である。本明細書で引用されるすべての刊行物の全開示は参照によって本明細書に組み込まれるものとする。
【0058】
次に、本発明の好ましい態様を示す。
1. 微生物媒介疾患の発生のリスクがある上皮表面を含む異常状態の動物における死亡確率の低減方法であって、有効量のポリエチレングリコール(PEG)を、それを必要とする動物に投与することを含み、前記PEGは少なくとも5,000ダルトンの平均分子量を有する前記方法。
2. 異常状態が消化管誘導敗血症、熱傷、新生児壊死性全腸炎、激しい好中球減少症、中毒性大腸炎、炎症性腸疾患、腸疾患、移植片拒絶、嚢炎及びピッグベリーからなる群より選ばれる、上記1記載の方法。
3. 前記動物がイヌ、ネコ、ヒツジ、ヤギ、雌ウシ、ブタ、ニワトリ、ウマ及びヒトからなる群より選ばれる、上記1記載の方法。
4. 前記動物がヒトである、上記3記載の方法。
5. 前記PEGが少なくとも15,000ダルトンの平均分子量を有する、上記1記載の方法。
6. 前記PEGが5,000〜20,000ダルトンの平均分子量を有する、上記5記載の方法。
7. 前記PEGが10〜20%のPEGを含む水溶液である、上記1記載の方法。
8. 前記水溶液が10%のPEGを含む、上記7記載の方法。
9. 腸管病原体におけるPA-Iレクチン/付着因子発現の抑制方法であって、有効量のポリエチレングリコール(PEG)を、それを必要とする動物に投与することを含み、前記PEGは少なくとも5,000ダルトンの平均分子量を有する前記方法。
10. 前記PEGが少なくとも15,000ダルトンの平均分子量を有する、上記9記載の方法。
11. PA-Iレクチン/付着因子の腸誘導活性化の抑制方法であって、有効量のポリエチレングリコール(PEG)を、それを必要とする動物に投与することを含み、前記PEGは少なくとも5,000ダルトンの平均分子量を有する前記方法。
12. 前記PEGが少なくとも15,000ダルトンの平均分子量を有する、上記11記載の方法。
13. 腸管病原体のC4-HSL-誘導形態的変化の抑制方法であって、有効量のポリエチレングリコール(PEG)を、それを必要とする動物に投与することを含み、前記PEGは少なくとも5,000ダルトンの平均分子量を有する前記方法。
14. 前記PEGが少なくとも15,000ダルトンの平均分子量を有する、上記13記載の方法。
15. 腸管病原体におけるビルレンス発現の低減方法であって、有効量のポリエチレングリコール(PEG)を、それを必要とする動物に投与することを含み、前記PEGは少なくとも5,000ダルトンの平均分子量を有する前記方法。
16. 前記PEGが少なくとも15,000ダルトンの平均分子量を有する、上記16記載の方法。
17. 病原集団感知活性化の形成を防止することによる腸管発病の改善方法であって、有効量のポリエチレングリコール(PEG)を、それを必要とする動物に投与することを含み、前記PEGは少なくとも5,000ダルトンの平均分子量を有する前記方法。
18. 前記PEGが少なくとも15,000ダルトンの平均分子量を有する、上記17記載の方法。
19. 哺乳類の腸管への細菌細胞接着の抑制方法であって、腸管をポリエチレングリコール(PEG)と接触させることを含み、前記PEGは少なくとも5,000ダルトンの平均分子量を有する前記方法。
20. 前記細菌細胞がシュードモナスである、上記19記載の方法。
21. シュードモナスが緑膿菌である、上記20記載の方法。
22. 前記PEGが少なくとも15,000ダルトンの平均分子量を有する、上記19記載の方法。
23. 細菌細胞におけるPA-Iレクチン/付着因子発現の低減方法であって、細菌細胞をポリエチレングリコール(PEG)と接触させることを含み、前記PEGは少なくとも5,000ダルトンの平均分子量を有する前記方法。
24. 前記PEGが少なくとも15,000ダルトンの平均分子量を有する、上記23記載の方法。
25. 微生物媒介上皮疾患を示す動物における死亡確率の低減方法であって、有効量のポリエチレングリコール(PEG)を投与して哺乳類の腸管上皮細胞と細菌細胞の相互作用を抑制することを含み、前記PEGは少なくとも5,000ダルトンの平均分子量を有する前記方法。
26. 微生物媒介上皮疾患が消化管誘導敗血症、熱傷、新生児壊死性全腸炎、激しい好中球減少症、中毒性大腸炎、炎症性腸疾患、腸疾患、移植片拒絶及び嚢炎からなる群より選ばれる、上記25記載の方法。
27. 前記PEGが組織分布的に非対称様式で腸管上皮細胞又は細菌細胞に付着する、上記25記載の方法。
28. 前記PEGが少なくとも15,000ダルトンの平均分子量を有する、上記25記載の方法。
29. 細菌細胞が腸管病原体であり、腸管病原体の増殖特性の検出可能な程度の変更がない、上記25記載の方法。
30. さらに、デキストラン、デキストランコートL-グルタミン及びデキストランコートイヌリンからなる群から選ばれた有効量の化合物を前記動物の腸管に導入することを含む、上記25記載の方法。
31. さらに、有効量のL-グルタミンを前記動物の腸管に導入することを含む、上記25記載の方法。
32. 少なくとも15,000ダルトンの平均分子量を有するポリエチレングリコール及び適したアジュバント、キャリア又は希釈剤を含む医薬組成物。
33. さらに、デキストラン、L-グルタミン、デキストランコートL-グルタミン、デキストランコートイヌリン、デキストランコート酪酸、フラクトオリゴ糖、N-アセチル-D-ガラクトサミン、デキストランコートマンノース、ガラクトース及びラクツロースからなる群から選ばれる化合物を含む、上記32記載の医薬組成物。
34. 上記32記載の医薬組成物及び異常状態の治療上の処置又は予防における前記組成物の使用方法を記載したプロトコールを含む消化管誘導敗血症の治療上の処置又は予防用キット。
35. 疾病又は異常状態の予防方法であって、有効量のポリエチレングリコール(PEG)を含む組成物を動物に投与することを含み、前記PEGは少なくとも5,000ダルトンの平均分子量を有する前記方法。
36. 前記疾患又は異常状態が水泳者耳、急性中耳炎、慢性中耳炎、人工呼吸器関連の肺炎、消化管誘導敗血症、壊死性全腸炎、抗生物質誘導下痢、偽膜性大腸炎、炎症性腸疾患、過敏性腸疾患、好中球減少性全腸炎、膵炎、慢性疲労症候群、生命異常症候群、顕微鏡的大腸炎、慢性尿路感染症、性感染症及び感染症からなる群より選ばれる、上記35記載の方法。
37. 前記動物がイヌ、ネコ、ヒツジ、ヤギ、雌ウシ、ブタ、ニワトリ、ウマ及びヒトからなる群より選ばれる、上記36記載の方法。
38. 前記動物がヒトである、上記37記載の方法。
39. 前記PEGが少なくとも15,000ダルトンの平均分子量を有する、上記35記載の方法。
40. 前記PEGが15,000〜20,000ダルトンの平均分子量を有する、上記35記載の方法。
41. 前記PEGが10〜20%のPEGを含む水溶液である、上記35記載の方法。
42. 前記水溶液が10%のPEGを含む、上記41記載の方法。
43. 前記組成物がさらに溶液、局所用ゲル及び噴霧に適した溶液からなる群より選ばれる媒体を含む、上記35記載の方法。
44. 前記組成物がさらにデキストランコートL-グルタミン、デキストランコートイヌリン、デキストランコート酪酸、フラクトオリゴ糖、N-アセチル-D-ガラクトサミン、デキストランコートマンノース、ガラクトース及びラクツロースからなる群より選ばれる化合物を含む、上記35記載の方法。
45. 前記組成物がさらにデキストランコートL-グルタミン、デキストランコートイヌリン、デキストランコート酪酸、フラクトオリゴ糖、N-アセチル-D-ガラクトサミン、デキストランコートマンノース、ガラクトース及びラクツロースを含む、上記35記載の方法。
46. 有効量のポリエチレングリコール(PEG)を含む組成物を動物に適用する工程を含む皮膚感染症の予防方法であって、前記PEGは少なくとも5,000ダルトンの平均分子量を有する前記方法。
47. 前記組成物がさらに軟膏、クリーム、ゲル及びローションからなる群より選ばれる媒体を含む、上記46記載の方法。
48. 前記感染症を生じる媒介物が炭疽菌、痘瘡ウイルス、病原性大腸菌(EPEC)、腸管出血性大腸菌(EHEC)、腸管凝集性大腸菌(EAEC)、クロストリジウム・ディフィシル、ロタウイルス、緑膿菌、セラチア菌、クレブシエラ・オキトカ、エンテロバクター・クロアカ、鵞口瘡カンジダ及びカンジダ・グラブラータからなる群より選ばれる、上記46記載の方法。
49. 有効量のポリエチレングリコール(PEG)を動物に投与する工程を含む呼吸器感染の予防方法であって、前記PEGは少なくとも5,000ダルトンの平均分子量を有する、前記方法。
50. 呼吸器感染症が人工呼吸器関連肺炎及び感染症からなる群より選ばれる、上記49記載の方法。
51. 前記感染症を生じる媒介物が炭疽菌及び痘瘡ウイルスからなる群より選ばれる、上記50記載の方法。
52. 慢性尿路感染症を予防するために尿路の少なくとも一部を洗浄する方法であって、ポリエチレングリコール(PEG)を含む有効量の組成物を尿道に投与する工程を含み、前記PEGは少なくとも5,000ダルトンの平均分子量を有する、前記方法。
53. 前記尿路の一部が少なくとも膀胱を含む、上記52記載の方法。
54. ポリエチレングリコール(PEG)をコンドームに適用する工程を含む性感染症の予防方法であって、前記PEGは少なくとも5,000ダルトンの平均分子量を有する、前記方法。
55. ポリエチレングリコール(PEG)でコートした少なくとも一部を有するコンドームであって、前記PEGは少なくとも5,000ダルトンの平均分子量を有する、前記コンドーム。
56. ポリエチレングリコール(PEG)を含む有効量の組成物を、それを必要とする動物に投与することを含む消化管疾患の予防方法であって、前記PEGは少なくとも5,000ダルトンの平均分子量を有する、前記方法。
57. 前記消化管疾患が新生児壊死性全腸炎、抗生物質誘導下痢、偽膜性大腸炎、炎症性腸疾患、過敏性腸症候群、好中球減少性全腸炎、膵炎、生命異常症候群及び顕微鏡的大腸炎からなる群より選ばれる、上記56記載の方法。
58. ポリエチレングリコール(PEG)の、それを必要とする動物への投与をモニターする方法であって、以下を含む前記方法:
(a)標識PEGを含む有効量の組成物を投与すること、前記PEGは少なくとも5,000ダルトンの平均分子量を有する、及び
(b)標識PEGを検出すること。
59. 前記標識がフルオロフォアである、上記58記載の方法。
60. 前記標識PEGの検出が内視鏡検査を含む、上記58記載の方法。
61. 前記標識PEGが便サンプル中で検出される、上記58記載の方法。
62. さらに微生物に特異的な第2の標識を投与し、前記第2の標識を検出することを含む、上記58記載の方法。
63. ポリエチレングリコール(PEG)の、それを必要とする動物への投与をモニターする方法であって、以下を含む前記方法:
(a)ポリエチレングリコールを受け取る動物からサンプルを得ること、前記PEGは少なくとも5,000ダルトンの平均分子量を有する、
(b)前記サンプルを上皮細胞と接触させること、及び
(c)前記サンプル中の微生物の上皮細胞への付着性を測定すること。
64. ポリエチレングリコール(PEG)の、それを必要とする動物への投与をモニターする方法であって、以下を含む前記方法:
(a)ポリエチレングリコールを受け取る動物からサンプルを得ること、前記PEGは少なくとも5,000ダルトンの平均分子量を有する、
(b)前記サンプルから微生物を分離すること、及び
(c)前記微生物の細胞表面の疎水性を測定すること。
65. ポリエチレングリコール(PEG)の、それを必要とする動物への投与をモニターする方法であって、以下を含む前記方法:
ポリエチレングリコールを受け取る動物からサンプルを得ること、前記PEGは少なくとも5,000ダルトンの平均分子量を有する、及び
サンプル中のPA-Iレクチン/付着因子活性を検出すること。
66. PA-Iレクチン/付着因子がPA-Iレクチン/付着因子結合パートナーと結合することによって検出される、上記65記載の方法。
67. PA-Iレクチン/付着因子結合パートナー及びサンプル中のPA-Iレクチン/付着因子を検出するための前記結合パートナーの使用方法を記載したプロトコールを含む上記66記載のポリエチレングリコール(PEG)の投与をモニターするためのキット。
68. 標識PEG及びその投与のモニターにおける標識PEGの使用方法を記載したプロトコールを含むポリエチレングリコールの投与をモニターするためのキット。
69. 乳出力に影響を及ぼす微生物媒介疾患の発生のリスクがある乳腺の上皮表面を示す動物における泌乳容量の損失の予防方法であって、有効量のポリエチレングリコール(PEG)を乳腺の上皮表面に投与することを含み、前記PEGは少なくとも5,000ダルトンの平均分子量を有する、前記方法。
70. 前記PEGが少なくとも15,000ダルトンの平均分子量を有する、上記69記載の方法。
71. 授乳年齢の動物における微生物媒介上皮疾患の発生の予防方法であって、有効量のポリエチレングリコール(PEG)を前記動物に投与することを含み、前記PEGは少なくとも5,000ダルトンの平均分子量を有する、前記方法。
72. 前記PEGが少なくとも15,000ダルトンの平均分子量を有する、上記71記載の方法。
73. 前記PEGが乳児用調合乳との混合物である、上記71記載の方法。
74. 乳児用調合乳及びポリエチレングリコール(PEG)を含む組成物であって、前記PEGは少なくとも5,000ダルトンの平均分子量を有する、前記組成物。
75. 前記PEGが少なくとも15,000ダルトンの平均分子量を有する、上記73記載の方法。
【技術分野】
【0001】
発明の分野
本発明は消化管誘導敗血症のような微生物媒介上皮疾患の予防又は治療のための材料及びに方法に関する。
【背景技術】
【0002】
背景
微生物媒介上皮疾患(又は異常状態)はヒト及び動物の健康に対する明らかな脅威を示し、世界中で医療システムに負担をかけている。前記疾患の1つの例である消化管誘導敗血症は、熱傷、新生児全腸炎、激しい好中球減少症、炎症性腸疾患、移植後の器官拒絶のような種々の疾病、障害又は苦痛のいずれかを患っているヒト患者のような生物体の死亡の主な原因である。腸管保有宿主は、例えば重症の、入院した患者において細菌媒介敗血症の潜在的に致死性の病巣であると長い間認識されていた。シュードモナス(例えば、緑膿菌)のような微生物病原体の腸管上皮性関門の調節機能を乱す能力は、消化管誘導敗血症を引き起こすことができる日和見生物体の特徴であり得る。これら感染症の多くの場合、緑膿菌は原因となる病原体であると認定されている。重要なのは、腸管が緑膿菌のような日和見性病原体のコロニー形成の主要な部位であると示されていることである。
【0003】
消化管誘導敗血症のような微生物媒介上皮疾患の予防又は治療に対する従来の治療アプローチは、完全には成功していない。抗生物質をベースとするアプローチは、残っている腸管微生物フローラ(intestinal flora)が影響を受けない様式で腸管病原体に対する抗生物質を作ることの困難さによって妥協されている。さらに、緑膿菌によって類型化される腸管病原体の多くは、しばしば抗生物質曝露に耐性を持つようになり、予防又は治療に対する高価な、進行中の、完全には成功しないアプローチとなる。免疫療法的なアプローチも問題に悩まされている。特に、緑膿菌のような多くの腸管病原体は免疫回避(immunoevasive)であり、前記アプローチが最小限の効果しか持たないようにする。
【0004】
消化管誘導敗血症のような疾患の予防又は治療の他のアプローチは腸管洗浄である。ここ数年、ポリエチレングリコール(PEG)溶液を用いる腸管洗浄が試みられており、いくつかの事例のレポートは、PEGが種々の臨床及び実験の状況を越えて消化管誘導敗血症の治療においていくつかの裏づけを示し得ることを示唆している。これらの溶液のPEGは3,500ダルトンの平均分子量を有し、前記溶液は市販されている(例えば、Golytely)。PEGのこれらの相対的に小さい分子量(LMW)溶液が消化管誘導敗血症の治療又は予防において治療上の利益を与えるメカニズムは知られていない。典型的には、これらの溶液は、消化管誘導敗血症の発生のリスクがある又は消化管誘導敗血症を患っている生物体の腸管を洗浄又は洗い流すために使用される。これらのLMW PEG溶液を腸管に投与した結果、使用した化合物の濃縮方法及び分子量に依存する、治療した腸管微生物フローラ組成物(floral composition)における変化が生じる。例えば、約20%よりも大きい濃度のPEGを有する溶液は、ストレスを受けた宿主の腸管において潜在的な保護微生物の除去を生じる微生物学的な作用を生じ得る。また、低分子量PEGの溶液は、それらを保つにもかかわらず、ある種の生物体のビルレンスに対する耐性を弱めるというその効力を失わせ得る。したがって、微生物のビルレンスの発現(微生物の有害な性質)を抑制するが微生物又は周辺微生物を死滅させず、故に腸管微生物フローラ(intestinal microflora)の自然生態系を保つ利益を与える溶液は、当業界で必要とされている。例えば、自然の微生物フローラ組成物の保持は、別の方法で腸管にコロニーをつくることができる日和見病原体の競合を与える。
【0005】
微生物フローラ組成物における変化に付随するものは生物体の生理機能の変化である。
これらの生理機能の変化はかなり多くの特徴的な酵素活性を評価すること、例えば乳酸脱水素酵素レベルによってモニターしてもよい。したがって、腸管のLMW PEG治療が治療した生物体の生理機能における予測できない明らかな変化を生じ、治療した生物体の健康(health and well-being)の潜在的に有害な、長期的な結果を生じる。さらに、前記治療は、入院した患者のような重病の生物体における過度の腸管放出の形態における肉体的にきつい反応を誘発する。
【発明の概要】
【発明が解決しようとする課題】
【0006】
したがって、当業界において、微生物媒介上皮疾患(例えば、消化管誘導敗血症)及び/又は前記疾患に関連した症状の予防又は治療に有効な組成物、及び治療された生物体の生理機能の重大な変化によってさらなる合併症の可能性を生成しないで前記利益を達成する方法を提供する必要性が残っている。
【課題を解決するための手段】
【0007】
発明の要約
本発明は、微生物媒介疾患の発生のリスクがある上皮表面によって特徴付けられる異常状態に対して有効な保護を与える高分子量(HMW)ポリエチレングリコール組成物を提供することによって、当業界における上記要求を満たす。具体的な異常状態としては、消化管誘導敗血症、及び緑膿菌(これに限定されるものではない)などの腸管病原体による腸管微生物フローラ(intestinal flora)に関連した他の腸管障害/疾病が挙げられる。
HMW PEGは緑膿菌などの病原体が腸管上皮表面に接触することを抑制又は防止する。さらに、高分子量PEGは集団感知シグナルネットワーク(quorum sensing signaling networks)を含み得る種々のシグナルに応答するこれらの病原体(例えば、緑膿菌)におけるビルレンスの発現を抑制する。腸管病原体と腸管上皮との間の感染界面で阻害するHMW PEGの能力は、例えば異化ストレス後の消化管誘導敗血症を予防又は治療する別のアプローチを提供する。重要なことは、HMW PEGによる治療がヒト患者及び農業上重要な家畜(例えば、ウシ、ブタ、ヒツジ、ヤギ、ウマ、ニワトリ、七面鳥、アヒル、ガチョウなど)、ペット及び動物園の動物のような種々の他の生物体に対して行うのにコストパフォーマンスがよく、比較的簡単である。
【0008】
本発明の1つの態様は、微生物媒介疾患の発生のリスクがある上皮表面を含む疾病状態などの異常状態の動物における死亡確率の低減方法を提供し、前記異常状態は消化管誘導敗血症、熱傷、新生児壊死性全腸炎、激しい好中球減少症、中毒性大腸炎、炎症性腸疾患、腸疾患、移植片拒絶、嚢炎及びピッグベリー(pig belly)からなる群より選ばれ、前記方法は、有効量のポリエチレングリコール(PEG)を、それを必要とする動物に投与することを含み、前記PEGは少なくとも5,000ダルトンの平均分子量を有する。適した動物としては、これに限定されるものではないが、イヌ、ネコ、ヒツジ、ヤギ、雌ウシ、ブタ及びヒト等が挙げられる。上記方法において、PEGは、好ましくは少なくとも15,000ダルトンの平均分子量を有し、5,000〜20,000ダルトン、又は15,000〜20,000ダルトンが好ましい。また、好ましくは、PEGは6,000、7,000、8,000、9,000、10,000、11,000、12,000、13,000、14,000及び25,000ダルトンの平均分子量を有する。さらに、前記PEGは5〜20%のPEGを含む水溶液であってもよく、好ましくは10〜20%のPEGを含む水溶液である(例えば、10%のPEG)。前記方法の1つの実施態様において、前記状態は腸管における緑膿菌の存在に関連し、前記緑膿菌の細胞膜完全性は検出可能な程度に変化しない。前記方法の別の実施態様において、緑膿菌の増殖様式は検出可能な程度に変化しない。
【0009】
本発明の別の態様は、哺乳動物の上皮、例えば腸をポリエチレングリコール(PEG)と接触させることを含む消化管誘導敗血症を抑制する方法であり、前記PEGは少なくとも5,000ダルトン、好ましくは少なくとも15,000ダルトンの平均分子量を有する。この方法の1つの実施態様において、哺乳動物の腸は少なくとも30分間PEGと接触する。
【0010】
本発明の更なる態様としては、上皮の病原体、例えば腸管病原体におけるPA-Iレクチン/付着因子発現の抑制方法であって、有効量のポリエチレングリコールを、それを必要とする動物に投与することを含む方法;PA-Iレクチン/付着因子の上皮誘導(例えば、腸上皮誘導)活性化の抑制方法であって、有効量のポリエチレングリコールを、それを必要とする動物に投与することを含む方法;上皮の病原体(例えば、腸管病原体)のC4-HSL-誘導形態的変化の抑制方法であって、有効量のポリエチレングリコールを、それを必要とする動物に投与することを含む方法;上皮の病原体(例えば、腸管病原体)におけるビルレンス発現の低減方法であって、有効量のポリエチレングリコールを、それを必要とする動物に投与することを含む方法;上皮表面と微生物のビルレンス因子との相互作用を低減又は防止する方法であって、有効量のポリエチレングリコールを、それを必要とする動物に投与することを含む方法;病原性集団感知活性化の形成を抑制することによって上皮(例えば、腸管)病原性の改善方法であって、有効量のポリエチレングリコールを、それを必要とする動物に投与することを含む方法;及び脊椎動物の上皮(例えば、腸管上皮)と細菌、例えばシュードモナス(例えば、緑膿菌)との間の相互作用を抑制する方法であって、上皮をポリエチレングリコールと接触させることを含む方法などが挙げられる。本発明のこれらの態様のすべてにおいて、PEGは少なくとも5,000ダルトン、好ましくは少なくとも15,000ダルトンの平均分子量を有する。
【0011】
本発明のまた更なる態様は、哺乳類の上皮層、例えば腸管上皮層の経上皮電気抵抗における緑膿菌誘導減少の抑制方法であって、前記(腸管)上皮層をポリエチレングリコールと接触させることを含み、前記PEGは少なくとも5,000ダルトン、好ましくは少なくとも15,000ダルトンの平均分子量を有する方法である。好ましくは、前記PEGは15,000〜20,000ダルトンの平均分子量を有する。好ましい実施態様において、微生物(例えば、緑膿菌)の膜完全性は検出可能な程度に変化しない。
【0012】
本発明のさらに別の態様は、哺乳動物の上皮、例えば哺乳動物の腸管への細菌細胞接着の抑制方法であって、前記腸管をポリエチレングリコールと接触させることを含み、前記PEGは少なくとも5,000ダルトン、好ましくは少なくとも15,000ダルトンの平均分子量を有する方法である。なお、この方法は、前記PEGが15,000〜20,000ダルトンの平均分子量を有することが好ましい。前記PEGは5〜20%のPEGを含む水溶液であってもよく、好ましくは5〜10%のPEGを含む水溶液である。この方法による付着の抑制が可能であると考えられる具体的な細菌細胞はシュードモナス、例えば緑膿菌である。
【0013】
本発明の別の態様は、細菌細胞におけるPA-Iレクチン/付着因子発現の低減方法であって、前記細菌細胞をポリエチレングリコールと接触させることを含み、前記PEGは少なくとも5,000ダルトン、好ましくは少なくとも15,000ダルトン、好ましくは15,000〜20,000ダルトンの平均分子量を有する方法である。この場合も同様に、前記PEGは5〜20%のPEGを含む水溶液であってもよく、好ましくは5〜10%のPEGを含む水溶液である。
【0014】
別の態様において、本発明は、微生物媒介上皮疾患を示す動物における死亡確率の低減方法であって、前記疾患は消化管誘導敗血症、熱傷、新生児壊死性全腸炎(NEC)、激しい好中球減少症、中毒性大腸炎、炎症性腸疾患、腸疾患(例えば、重病における)、移植片拒絶、嚢炎及びピッグベリーからなる群より選ばれ、哺乳動物の腸管上皮細胞と腸管細菌細胞からなる群より選ばれる細胞に付着する有効量の化合物(例えば、PEG)を投与することを含み、前記化合物は組織分布的に非対称様式で前記細胞に付着して、哺乳動物の腸管上皮細胞と細菌細胞の相互作用を抑制することを含む方法である。好ましい化合物は界面活性剤である。この方法の1つの実施態様において、前記化合物は、好ましくは少なくとも15,000ダルトンの平均分子量を有するPEGである。この方法の別の実施態様において、前記抑制は原子間力顕微鏡よって決定される。この方法のさらに別の態様において、細菌細胞は腸管病原体であり、その増殖特性の検出可能な程度の変更はない。関連した態様において、この方法は、さらに有効量のデキストランを動物の腸に導入すること及び/又は有効量のL-グルタミン、デキストランコートL-グルタミン、デキストランコートイヌリン、デキストランコート酪酸、1つ以上のフラクトオリゴ糖、N-アセチル-D-ガラクトサミン、デキストランコートマンノース及びガラクトース、ラクツロース及び平衡緩衝剤及び安定化剤(当業界で公知)を動物の腸に導入することを含む。1つの組成物として一緒に投与する場合、この多成分単一溶液投与は治療し、例えば多くの異化、外科的及び外傷性タイプのストレス後に生じる腸管微生物フローラ及び腸管関門機能における破壊を予測して腸管を整えさせる。
【0015】
本発明の別の態様は、消化管誘導敗血症のような上皮の異常状態から生じる疾病又は状態、又は前記異常状態を特徴とする疾病又は状態に関連した症状を改善する方法であって、ポリエチレングリコールを腸に投与することを含み、前記PEGは少なくとも5,000ダルトン、好ましくは少なくとも15,000ダルトン、好ましくは15,000〜20,000ダルトンの平均分子量を有する方法である。前記PEGは5〜20%のPEGを含む水溶液であってもよく、好ましくは5〜10%のPEGを含む水溶液である。本発明は、本明細書に開示した疾病又は状態に関連した症状を改善することを包含する。
【0016】
本発明のさらに別の態様は、乳出力に影響を及ぼす微生物媒介疾患の発生のリスクがある乳腺の上皮表面の形態で異常状態を示す動物における泌乳容量の損失の予防方法であって、少なくとも5,000ダルトン、好ましくは少なくとも15,000ダルトンのポリエチレングリコールを有効量乳腺の上皮表面に、例えば局所的に投与することを含む方法である。具体的な動物としては、ヒツジ、ヤギ、雌ウシ、ブタ、ウマ及びヒトのような哺乳動物などが挙げられる。関連した態様において、本発明は、乳出力に影響を及ぼす乳腺の上皮表面の微生物媒介疾患によって特徴付けられる動物における泌乳容量の損失の治療方法であって、少なくとも5,000ダルトン、好ましくは少なくとも15,000ダルトンのポリエチレングリコールを有効量乳腺に、例えば局所的に投与することを含む方法を提供する。別の関連した態様において、本発明は、授乳年齢の動物における微生物媒介上皮疾患の発生の予防方法であって、少なくとも5,000ダルトン、好ましくは少なくとも15,000ダルトンのポリエチレングリコールを有効量動物に投与することを含む方法を提供する。適した動物としては、ヒト、家畜、飼い馴らされたペット及び動物園の動物のような哺乳動物などが挙げられる。1つの実施態様において、PEGは当業界で知られる乳児用調合乳と混合される。
本発明の関連した態様は、乳児用調合乳及びポリエチレングリコール(PEG)を含む組成物であり、PEGは少なくとも5,000ダルトンの平均分子量を有する。この場合も同様に、当業界で公知の任意の乳児用調合乳が使用でき、牛乳、ヤギ乳などの哺乳動物のミルクをベースとする調合乳、及び豆乳をベースとする調合乳が挙げられる。調合乳は、また任意のビタミン及び/又は元素によって栄養価を高めてもよく、鉄で強化するなどが挙げられる。PEGは、好ましくは少なくとも15,000ダルトンの平均分子量を有し、好ましくは乳児又は新生児用調合乳に水を加えて戻したもの(reconstitution or hydration)によって5〜20%の範囲で含まれる。本発明は、さらに動物、好ましくは授乳年齢の動物に栄養を与える方法であって、乳児用調合乳及びPEGを含む有効量の組成物を動物に投与することを含む方法を提供する。
【0017】
本発明のさらに別の態様は、少なくとも5,000ダルトン、好ましくは15,000ダルトンの平均分子量を有するポリエチレングリコール及び適したアジュバント、キャリア又は希釈剤を含む医薬組成物である。関連した態様において、前記組成物は、さらにデキストランコートL-グルタミン、デキストランコートイヌリン、デキストランコート酪酸、1つ以上のフラクトオリゴ糖、N-アセチル-D-ガラクトサミン、デキストランコートマンノース及びガラクトース、ラクツロースからなる群より選ばれる化合物及び平衡緩衝剤及び安定化剤(当業者に公知)を含む。
本発明の更なる態様は、消化管誘導敗血症のような微生物媒介疾患の発生のリスクがある上皮表面によって特徴付けられる異常状態の治療上の処置又は予防用キットであって、1つの上述の医薬組成物及び異常状態の治療上の処置又は予防における前記組成物の使用方法を記載したプロトコールを含むキットである。キットに含まれる適したプロトコールには、本明細書に開示される治療又は予防方法のいずれか1つが記載されている。
【0018】
本発明のさらに別の態様は、微生物媒介疾患(疾病などを含む)のリスクがある上皮表面によって特徴付けられる異常状態の予防方法に関する。例えば、本発明は有効量のポリエチレングリコール(PEG)を含む組成物を動物に投与することを含む疾病又は異常状態の予防方法を包含し、前記PEGは少なくとも5,000ダルトンの平均分子量を有する。
本発明の予防方法が可能である、適した疾病又は異常状態は、水泳者耳、急性中耳炎、慢性中耳炎、人工呼吸器関連の肺炎、消化管誘導敗血症、壊死性腸炎、抗生物質誘導下痢、偽膜性大腸炎、炎症性腸疾患、過敏性腸疾患、好中球減少性全腸炎、膵炎、慢性疲労症候群、生命異常(dysbiosis)症候群、顕微鏡的大腸炎、慢性尿路感染症、性感染症及び感染症からなる群より選ばれる。前記予防方法の対象として適した動物は、イヌ、ネコ、ヒツジ、ヤギ、雌ウシ、ブタ、ニワトリ、ウマ及びヒトからなる群より選ばれる。前記PEGは、好ましくは少なくとも15,000ダルトンの平均分子量を有し、また好ましくは、15,000〜20,000ダルトンの平均分子量を有する。さらに、前記PEGは10〜20%のPEGを含む水溶液であってもよく、好ましくは10%のPEGを含む水溶液である。投与される組成物は、さらに溶液、局所用ゲル及び噴霧に適した溶液からなる群より選ばれる媒体を含んでもよい。さらに、前記組成物はデキストランコートL-グルタミン、デキストランコートイヌリン、デキストランコート酪酸、フラクトオリゴ糖、N-アセチル-D-ガラクトサミン、デキストランコートマンノース、ガラクトース及びラクツロースからなる群より選ばれる化合物を含んでもよい。1つの実施態様において、前記組成物はPEG、デキストランコートL-グルタミン、デキストランコートイヌリン、デキストランコート酪酸、フラクトオリゴ糖、N-アセチル-D-ガラクトサミン、デキストランコートマンノース、ガラクトース及びラクツロースを含む。
【0019】
本発明のさらに別の態様は、有効量のポリエチレングリコール(PEG)を含む組成物を動物に適用する工程を含む皮膚感染症の予防方法であって、前記PEGは少なくとも5,000ダルトンの平均分子量を有する方法である。前記組成物は、さらに軟膏、クリーム、ゲル及びローションからなる群より選ばれる媒体を含んでもよい。本発明は、前記感染症を生じる媒介物が炭疽菌、痘瘡ウイルス、病原性大腸菌(EPEC)、腸管出血性大腸菌(EHEC)、腸管凝集性大腸菌(EAEC)、クロストリジウム・ディフィシル、ロタウイルス、緑膿菌、セラチア菌(Serratia marcescens)、クレブシエラ・オキトカ(Klebsiella oxytocia)、エンテロバクター・クロアカ(Enterobacteria cloacae)、鵞口瘡カンジダ及びカンジダ・グラブラータ(Candida globrata)からなる群より選ばれることも意図する。
【0020】
本発明の別の態様は、有効量のポリエチレングリコール(PEG)を動物に投与する工程を含む呼吸器感染症の予防方法であって、前記PEGは少なくとも5,000ダルトンの平均分子量を有する方法である。本発明の予防方法が可能である呼吸器感染症は当業界で公知の任意の経路によって病原菌と接触することから生じてもよく、人工呼吸器に関連した肺炎(例えば、人工呼吸器関連肺炎)、空気病原菌(air-borne infectious agents)、くしゃみによるなどの噴霧流体に分散された病原菌などが挙げられる。いくつかの実施態様において、前記方法は炭疽菌及び痘瘡ウイルスからなる群より選ばれる媒介物による呼吸器感染症を防止する。
【0021】
本発明のさらに別の態様は、慢性尿路感染症を予防するために尿路の少なくとも一部を洗浄する方法であって、PEGを含む有効量の組成物を尿道に投与する工程を含み、前記PEGは少なくとも5,000ダルトンの平均分子量を有する方法である。1つの実施態様において、前記組成物は少なくとも膀胱を含む前記尿路の一部に投与される。
【0022】
本発明の別の態様は、ポリエチレングリコール(PEG)をコンドームに適用する工程を含む性感染症の予防方法であって、前記PEGは少なくとも5,000ダルトンの平均分子量を有する方法である。本発明の関連した態様は、少なくとも5,000ダルトンの平均分子量を有するPEGでコートした少なくとも一部を有するコンドームである。さらに別の関連した態様は、コンドーム及び少なくとも5,000ダルトンの平均分子量を有するポリエチレングリコール(PEG)を含むキットである。
【0023】
本発明は、またポリエチレングリコール(PEG)を含む有効量の組成物を、それを必要とする動物に投与することを含む消化管疾患の予防方法であって、前記PEGは少なくとも5,000ダルトンの平均分子量を有する方法を包含する。本発明の予防方法に従う具体的な消化管疾患は、新生児壊死性全腸炎、抗生物質誘導下痢、偽膜性大腸炎、炎症性腸疾患、過敏性腸疾患、好中球減少性全腸炎、膵炎、生命異常症候群及び顕微鏡的大腸炎からなる群より選ばれ得る。
【0024】
本発明の別の態様は、ポリエチレングリコール(PEG)の、それを必要とする動物への投与をモニターする方法であって、標識PEGを含む有効量の組成物を、それを必要とする動物へ投与すること、ここで前記PEGは少なくとも5,000ダルトンの平均分子量を有する、及び標識PEGを検出することを含む方法であり、標識PEG(例えば、微生物に関連する)の量及び/又は位置は投与の効果を評価するのに有用な情報を与える。前記モニター方法の1つの実施態様において、標識はフルオロフォア(例えば、フルオレセイン、ローダミン、Cy3、Cy5)である。前記方法の別の実施態様において、標識PEGを検出することは内視鏡検査を含む。前記モニター方法は、標識PEGが便サンプル中で検出されること(すなわち、微生物のような成分に関連した標識PEG、その源は便サンプルである)も意図する。さらに、前記モニター方法は、微生物に特異的な第2の標識を投与し、前記第2の標識を検出することを含んでもよい。本明細書で使用される「特異的」とは、標識が少なくとも1つの微生物と検出可能な程度に結びついていることを意味する。
【0025】
本発明の別の態様は、ポリエチレングリコール(PEG)の、それを必要とする動物への投与をモニターする方法であって、ポリエチレングリコールを受け取る動物からサンプルを得ること、ここで前記PEGは少なくとも5,000ダルトンの平均分子量を有する、前記サンプルを上皮細胞と接触させること、及び前記サンプル中の微生物の上皮細胞への付着性を測定することを含む方法であり、前記PEGの量及び/又は位置は投与の効果を評価するのに有用な情報を与える。前記測定は顕微鏡検査によって達成してもよい。
【0026】
本発明の別のモニター方法は、ポリエチレングリコール(PEG)の、それを必要とする動物への投与をモニターする方法であって、ポリエチレングリコールを受け取る動物からサンプルを得ること、ここで前記PEGは少なくとも5,000ダルトンの平均分子量を有する、上皮細胞層を前記サンプルと接触させること、及び前記上皮層の経上皮電気抵抗を測定することを含む方法であり、有効な投与はコントロール値と比較して経上皮電気抵抗の低下を低減することによって示される。コントロール値は内的(すなわち、PEG投与前のTEERの測定)であってもよく、又は外的(すなわち、比較のために信頼性をもって使用される他の研究において得られた値)であってもよい。
【0027】
本発明のさらに別のモニター方法は、ポリエチレングリコール(PEG)の、それを必要とする動物への投与をモニターする方法であって、ポリエチレングリコールを受け取る動物からサンプルを得ること、ここで前記PEGは少なくとも5,000ダルトンの平均分子量を有する、前記サンプルから微生物を分離すること、及び前記微生物の細胞表面の疎水性を測定することを含む方法であり、前記サンプル中の微生物の疎水性は投与の効果を評価するのに有用な情報を与える。本明細書で使用される「分離」とは、当業界で理解されているであろう疎水性測定を可能にするのに十分に、前記サンプル(例えば、固形物)の他の成分から分離したことを意味する。
【0028】
本発明の関連した態様は、ポリエチレングリコールの投与をモニターするためのキットであって、標識PEG及びその投与をモニターする際の標識PEGの使用方法を記載するプロトコールを含むキットである。適したプロトコールとしては、PEGの投与、デリバリ又は適用に関連する本明細書に開示された方法又は当業界に公知の方法のいずれをも含む。本発明のこの態様のいくつかの実施態様において、前記キットはさらに遊離した標識を含む。
【0029】
本発明のさらに別のモニター方法は、ポリエチレングリコール(PEG)の、それを必要とする動物への投与をモニターする方法であって、ポリエチレングリコールを受け取る動物からサンプルを得ること、ここで前記PEGは少なくとも5,000ダルトンの平均分子量を有する、及びサンプル中のPA-Iレクチン/付着因子活性を検出することを含む方法であり、PA-Iレクチン/付着因子活性は投与の効果を評価するのに有用な情報を与える。この方法の1つの実施態様において、PA-Iレクチン/付着因子は、レクチン/付着因子が特異的に結合する炭水化物又は特異的な抗PA-Iレクチン/付着因子抗体の任意の既知の形態のようなPA-Iレクチン/付着因子結合パートナーと結合することによって検出される。本発明の関連した態様は、PA-Iレクチン/付着因子結合パートナー及びサンプル中のPA-Iレクチン/付着因子を検出するための前記結合パートナーの使用方法を記載したプロトコールを含むポリエチレングリコール(PEG)の投与をモニターするためのキットである。適したプロトコールはPEGの使用に関連する当業界で既知の方法又は本明細書に開示された方法のいずれをも含む。
本発明の他の特徴及び利点は、図面及び実施例を含む以下の詳細な説明を参照してより良く理解されるであろう。
【図面の簡単な説明】
【0030】
【図1】偽の開腹又は30%の外科的肝切除術後緑膿菌PA27853を盲腸に直接注入した後48時間でのマウスの死亡率を示す。マウスは30%の無血左葉肝切除術を受け、その後直ちに1×107cfu/mlのPA27853の直接盲腸注入を受けた。各グループは7匹のマウスを含んでいた。コントロールマウスは偽の肝切除術を受け、その後同じ量のPA27853を盲腸に注入した。PEGグループのマウスについて、盲腸注入前に、1×107cfu/mlのPA27853をPEG 3.35(LMW PEG 3,350)又はPEG 15-20(HMW PEG 15,000〜20,000ダルトン)のいずれかに懸濁した。PEG 15-20の用量応答曲線をパネルbに示す。a.PEG 15-20の統計的に有意な保護効果をフィッシャーの正確確率検定によって決定した(P<0.001)。b.5%(P<0.05)であるPEG 15-20の最小保護濃度を決定した。c.30%の外科的肝切除術及びPA27853の1×107cfu/mlの直接盲腸注入の24時間後の盲腸内容物(糞便)、洗浄した盲腸の粘膜、肝臓及び血液の定量的な細菌培養。一元配置分散分析(one-way ANOVA)は肝切除術後のマウスの盲腸内容物、粘膜、肝臓及び血液の細菌数の統計的に有意な増加を示した(P<0.001)。肝臓及び血液の細菌数の有意な減少(P<0.05)はPEG 3350について観測されたが、PEG 15-20は、PA27853がマウスの肝臓及び血液へ広がることを完全に防止した。
【図2】経上皮電気抵抗(TEER)による評価としてPA27853誘導上皮関門機能障害に対するPEG 15-20の保護作用を示す。a.データは、1×107cfu/mlのPA27853の先端曝露の8時間観測の3つの培養(n=7)のベースラインからTEERの最大減少を平均±SEM%で表す。TEERの統計的に有意な減少をPA27853に曝露したCaco-2細胞で示した(一元配置分散分析(one-way ANOVA)(P<0.001))。PEG 15-20について、PA27853によって誘導されたTEERの減少に対する統計的に有意な保護作用を示した(P<0.001)。b.PEG 3.35の存在下のCaco-2細胞のイメージ及びPA27853に曝露したアピカル。共培養の4時間後に得たイメージは、PA27853の細胞膜への付着を示す細胞骨格上の30〜40μmを浮いている細胞によって単層の完全性のロスを示した。c. PEG 15-20の存在下でCaco-2細胞をPA27853に先端曝露した4時間後、試験した面のいずれかにおいて浮遊細胞の証拠を示さなかった。
【図3】PA27853におけるPA-I発現に対するPEGの抑制作用を示す。a.ウエスタンブロット分析。1mMの集団感知シグナリング分子C4-HSLへのPA27853の曝露は、10%のPEG 3.35の存在下で部分的に抑制された、及び10%のPEG 15-20によってさらに多く抑制されたPA-Iたんぱく質発現の統計的に有意な増加を生じた(P<0.001一元配置分散分析(one-way ANOVA))。a’.C4-HSL誘導PA-I発現に対するPEG 15-20の最小抑制濃度は5%であった(P<0.01)。b.PEGの存在下及び非存在下でC4-HSLに曝露した個々の細菌細胞の電子顕微鏡観察は、C4-HSLが緑膿菌の形状及び線毛発現における形態学的な変化を生じることを示した。C4-HSL誘導形態学的作用はPEG 15-20の存在下では完全に排除されたが、PEG 3.35の存在下では排除されなかった。ハロタイプの作用はPEG 15-20に曝露されたPA27853の周囲で見られた。c.ノーザンハイブリダイゼーション0.1mMのC4-HSLへのPA27853の曝露は10%のPEG 15-20によって大きく抑制されたPA-ImRNA発現の統計的に有意な増加を生じた(P<0.001、一元配置分散分析(one-way ANOVA))。d.Caco-2細胞への4時間の曝露によって誘導されたPA-ImRNAの増加はPEG 15-20の存在下では抑制されたが、PEG 3.35の存在下では抑制されなかった(P<0.001一元配置分散分析(one-way ANOVA))。
【図4】PA27853の細菌の膜完全性乾地性増殖パターンに対するPEG溶液の作用を示す。a.細菌の膜完全性に対する2つのPEG溶液の作用をSYTO9及びヨウ化プロピジウムからなる染色方法によって評価した。いずれのPEG溶液も細菌の膜透過性に対して作用をもたなかった。b. PEGを含まないTSB培地(コントロール)に対して2つのPEG溶液で同一のPA27853の増殖パターンが現れた。
【図5】PEGに曝露したCaco-2細胞及び細菌細胞の原子間力顕微鏡(AFM)像を示す。a−c.単独培地(a)、PEG 3.35を有する培地(b)及びPEG 15-20を有する培地の存在下でのCaco-2のAFM像。PEG 3.35はCaco-2細胞に対して滑らかなカーペットを形成するように見えたが(b)、PEG 15-20はより組織分散的に確定されたカバーリングを形成した(c)。d−f.PEG 3.35及びPEG 15-20におけるPA27853のAFMイメージ。PEG 3.35は個々の細菌細胞の周りに滑らかなエンベロープを形成したが(e)、PEG 15-20は個々の細胞と固く結びついただけでなく(f)、ポリマー/細菌直径をも増大し(g、h)、それによって個々の細菌を互いに分離した。
【図6】PA27853の分散/集中様式に対するPEG溶液の作用を示す。DIC及びGFP蛍光フィルターを用いるAxiovert 100 TV蛍光倒立顕微鏡により、63倍の拡大率の対物レンズで、DTC3皿の細菌細胞の分散様式を直接観測した。温度をBioptechsサーモスタット温度コントロールシステムにより調整した。タングステンランプ(100V)をDIC及びGFP励起用に用いた。Intelligent Imaging Innovationsの3Dイメージングソフトウエア(Slidebook)を使用して、GFPフィルターを用いるZ面における細菌細胞分散様式の像を描いた。Caco-2細胞のない培地における一様に分散されたプランクトン様緑膿菌細胞はDICイメージ(6a1)及びZ面再構築(6a2)で見られた。Caco-2細胞の存在下で、細菌細胞は集中した外観を発生させ(6b1)Caco-2細胞へ付着するように見えた(6b2)。10%のPEG 3350は細菌の運動性を減少させ、ウエルの底に付着する(6c2)キノコ形状の細菌微小コロニーの形成を直ちに誘導した(6c1)。Caco-2細胞の存在下で、細菌微小コロニーは上皮細胞の面上8μmのオーダーで存在した(6d1,2)。10%のPEG 15-20は緑膿菌細胞の運動性を大きく減少させた。それにもかかわらず、PEG 15-20を含む培地において最初の0.5〜1時間のインキュベーションで、細菌細胞はウエルの底付近にクモ型の微小コロニーを形成した(6e1,2)。数時間以内に、クモの足形状の微小コロニーが培地の全空間/容積を占めた(示さない)。Caco-2細胞の存在下で、緑膿菌細胞はクモ様の構成を失い、上皮の面上に高く上昇するように見えた(30〜40μm)(6f1,2)。
【発明を実施するための形態】
【0031】
発明の詳細な説明
本発明は、ヒトを含む多くの哺乳動物を苦しめる種々の微生物媒介上皮疾患、すなわち異常状態及び疾病の治療及び/又は予防に対する簡単で、かつ、経済的なアプローチを集合的に示す生成物及び方法を提供する。HMWポリエチレングリコールのような高分子量極性ポリマーを、それを必要とする危険な状態の動物に投与することによって、多くの健康又は生命を脅かす異常状態、すなわち消化管誘導敗血症を含む上皮疾患及び疾病は、すべて最小限のコストで、かつ、開業医の最小限の指導で治療され得る。理論によって束縛されることを望まないが、本発明によって与えられる利点は、微生物媒介上皮疾患が前記微生物の生存の助けとなる環境を促進することによって首尾よく予防、改善又は治療され得る原理と一致している。本発明の以下のより詳細な説明の理解は、この開示で使用される用語についての以下の意味を最初に定めることによって容易になる。
【0032】
「異常状態」は、哺乳動物の疾病、哺乳動物の疾患及び微生物媒介疾患の発生のリスクがある上皮表面を特徴とする哺乳動物の健康のあらゆる異常状態を含むように広義に定義される。微生物媒介疾患の発生のリスクがある上皮表面を特徴とする異常状態は、上皮表面が微生物媒介疾患を発生している状態を含む。具体的な状態としては、医療行為を必要とする、又は医療行為から生じるヒトの疾病及びヒトの疾患、例えば熱傷、新生児全腸炎、激しい好中球減少症、炎症性腸疾患、腸疾患(例えば、重病の)及び移植片(例えば、器官)拒絶が挙げられる。
「熱傷」とは、哺乳動物の組織が、例えば、直火、スチーム、熱流体及び熱表面の形態の熱に曝されることによって生じる損傷を意味する。
「激しい」好中球減少症は、循環好中球の数の著しい減少というその通常の(ordinary and accustomed)意味を与える。
「移植片拒絶」とは、宿主生物体によってその材料の根本的な拒絶反応と関連していると認識される移植された材料(例えば、器官)のあらゆる経過を意味する。
「投与」は、当業界で認識されている適したあらゆる手段による投与のその通常の意味を与える。投与の具体的な例としては、経口投与、肛門投与、直接穿刺又は注入、局所適用及び目、耳、鼻、口、肛門又は尿道口へのスプレー(例えば、噴霧スプレー)、ゲル又は流体適用などが挙げられる。
「有効量」は、その量を受け取る生物体に対して薬効を与える物質の量であり、その量を投与する目的、その量を受け取る生物体の大きさ及び状態及び有効量の決定に関連する当業界で認識されている他の変数に依存して変わり得る。有効量を決定する方法は当業者のスキルの範囲内である所定の最適化手順を含む。
「動物」は、非植物、非原生生物のその通常の意味を与える。好ましい動物はヒトなどの哺乳動物である。
本明細書の開示に関連して、「必要」とは、その状態によって特徴付けられる生物体への有効量の投与によって利益をうける生物体、器官、組織又は細胞の状態である。例えば、消化管誘導敗血症の発生又はその症状を示すリスクがあるヒトは、有効量の本発明の生成物(例えば、医薬組成物)を必要とする生物体である。
【0033】
「平均分子量」は、その手段の評価の正確さに関わらず、組成物の成分(例えば、分子)の分子量の相加平均の、その通常の意味を与える。例えば、3.5キロダルトンの平均分子量を有するポリエチレングリコール(すなわち、PEG)は種々の分子量のPEG分子を含んでいてもよいが、その分子量の相加平均が当業界で理解されているようなある程度の正確さで(相加平均の評価を示す)3.5キロダルトンであると評価されることを条件とする。同様に、PEG 15-20は、上述の注意に従う相加平均によって、その分子量が15〜20キロダルトンの相加平均を与えるPEGを意味する。これらのPEG分子としては、単純PEGポリマーが挙げられるが、これに限定されない。例えば、複数の相対的に小さいPEG分子(例えば、7,000〜10,000ダルトン)を、必要によりフェノールのようなリンカー分子と結合してより高い平均分子量(例えば、15,000〜20,000ダルトン)を有する単一分子としてもよい。
「細胞膜完全性」とは、当業界において理解されるとおり、生きている細胞の機能要素としての細胞膜の機能的に重要な変異の相対的な欠如を意味する。
「検出可能な程度の変化」は、当業界において理解されるとおり、その環境下で適した検出手段を用いて感知できる変化の、その通常の意味を与える。
「増殖様式」とは、細胞の発生又は倍加時間、細胞の新生群の形態学の出現及び細胞又は細胞群の常食様式の理解に寄与するものとして当業界で認識されている他の変数のような細胞増殖を特徴付けると当業界で認識されている、細胞又は細胞群(例えば、細胞集団)の特性の評価を集合的に意味する。
【0034】
「抑制」は、抑制、低減又は防止の、その通常の意味を与える。例えば、形態学的な変化を抑制するとは、形態学的な変化をより困難にし、又は完全に防止することを意味する。
「PA-I(すなわち、PA-Iレクチン/付着因子)発現」とは、PA-Iレクチン/付着因子の活性な特徴の生成又は発生を意味する。典型的には、PA-Iレクチン/付着因子の発現は、PA-Iレクチン/付着因子の少なくとも1つの活性な特徴を有するPA-Iレクチン/付着因子ポリペプチドを得るPA-Iレクチン/付着因子コード化mRNAの翻訳を含む。必要により、PA-Iレクチン/付着因子は、さらに前述のmRNAを得るPA-Iレクチン/付着因子コード化DNAの転写を含む。
「上皮誘導活性化」とは、上皮細胞の直接的又は間接的な影響によって所定の標的(例えば、PA-Iレクチン/付着因子)の活性の増加を意味する。本発明の内容において、例えば、PA-Iレクチン/付着因子の上皮誘導活性化とは、上皮細胞の腸管病原体との直接的な接触によって明らかになる上皮の間接的な影響に起因するポリペプチドの活性の増加を意味する。
「形態学的な変化」は、形態の変化の、その通常の意味を与える。
「腸管病原体」とは、ヒトのような動物において、消化管誘導敗血症を、全部又は一部で生じさせることができる病原体を意味する。当業界で公知の腸管病原体はこの定義に包含され、例えばシュードモナス(例えば、緑膿菌)などのグラム陰性桿菌が挙げられる。
「改善」とは、程度又は重症度を低減することを意味し、その通常の意味と一致する。
【0035】
「病原クオラム」とは、当業界で知られているとおり、集団感知シグナルを生じさせ又は維持するのに十分な数の病原体(例えば、緑膿菌)の集合又は結合を意味する。
「相互作用」は、2又はそれよりも多い生物学的生成物、例えば分子、細胞などの間の相互作用のような相互作用の、その通常の意味を与える。
「経上皮電気抵抗」(すなわち、TEER)は、このフレーズが当業界で獲得する意味を与え、上皮組織の電気抵抗の測定を意味し、上皮組織における上皮細胞間の密着結合の状態を評価するのに非排他的に有用である。
「付着」は、一時的な時間よりも長い物理的な結合の、その通常の意味を与える。
「形態学的に非対称」とは、対称でない3次元物体(例えば、細胞)の表面のイメージ、マップ又は他の表示を意味する。
走査型力顕微鏡観察としても知られる「原子間力顕微鏡観察」は、当業界において理解されるとおり、ラスター走査におけるサンプルの表面を移動するカンチレバープローブを有し、プローブのゆがみを検出するための高感度手段を用いることによって、物体の高分解立体マップを得るための技術である。
「医薬組成物」とは、ヒト患者のような生きている動物への治療投与に適した化合物の処方物を意味する。本発明の好ましい医薬組成物は、電解質、デキストランコートL-グルタミン、デキストランコートイヌリン、ラクツロース、D-ガラクトース、N-アセチルD-ガラクトサミン及び5〜20%のPEG(15,000〜20,000)を含み、粘度、電解質特性及び浸透圧を調整した溶液を含む。
「アジュバント」、「キャリア」又は「希釈剤」は、それぞれ当業界で獲得したその用語の意味を与える。アジュバントは共投与イムノゲンの免疫原生を延長するのに役立つ1つ以上の物質である。キャリアは、例えば運ばれる物質のトランスロケーションによって取扱いを容易にする1つ以上の物質である。希釈剤は希釈剤に曝される所定の物質の濃度を減少させる(すなわち、希釈する)1つ以上の物質である。
「HMW PEG」とは、3.5キロダルトンよりも大きい平均分子量を有すると定義する相対的に高い分子量のPEGを意味する。好ましくは、HMW PEGは5キロダルトンよりも大きい平均分子量を有し、特定の実施態様において、HMW PEGは少なくとも8キロダルトン、少なくとも15キロダルトン、及び15〜20キロダルトンの平均分子量を有する。
【0036】
以下の実施例は本発明の実施態様を示す。実施例1は高分子量PEGによって肝切除されたマウスに与えられる消化管誘導敗血症に対する保護を記載する。実施例2は、HMW PEGが腸管上皮細胞への病原体の付着をどのように防止するかを開示する。実施例3は、HMW PEGが一般に病原体のビルレンスの発現を、特にPA-Iレクチン/付着因子発現をどのように抑制するかを明らかにする。実施例4は、PEGが病原体の増殖(又は、細胞膜完全性)に影響を及ぼさないことを示す。実施例5は原子間力顕微鏡観察を用いてHMW PEGコート病原体の特有の形態学的配置を示す。実施例6はHMW PEGによる影響を受けた細胞間相互作用を記載する。実施例7は本発明の組成物を用いる予防方法を記載する。実施例8は本発明の治療方法のようなHMW PEGの投与をモニターする方法及び対応するキットを開示する。
【実施例】
【0037】
実施例1
HMW PEGは30%肝切除術後の消化管誘導敗血症から保護する
雄のBalb/cマウスを麻酔し、従来のプロトコルを用いて肝切除術を施した。柔らかい左葉に沿って肝臓の30%の無血切除術を行った。コントロールマウスは肝切除術なしで肝臓の操作を受けた。実験及びコントロールグループは、それぞれ7匹のマウスを含んでいた。すべてのマウスにおいて、生理食塩水、PEG 3.350又はPEG 15-20(PEG)のいずれかに希釈した107cfu/mlの緑膿菌PA27853 の200μlの容量を直接穿刺法によって盲腸の基部に注入した。相対的に低い分子量のPEGは市販されており、15,000〜20,000ダルトンの平均分子量を有するPEG 15-20はフェノール環に共有結合したPEG 7-8とPEG 8-10の組合せである。PEG 7-8は7,000〜8,000ダルトンの平均分子量を有し、PEG 8-10は8,000〜10,000ダルトンの平均分子量を有する。当業者は、HMW PEGが種々のPEGサブユニットのいずれかを有する化合物を含み、各サブユニットが互いに又は1つ以上のリンカー分子(PEG分子の結合に適した官能基を有する相対的に小さい分子である)と好ましくは共有結合した種々の平均分子量のいずれかを有することを理解するであろう。適したリンカーは実質的にHMW PEGの生物活性を保存する(本明細書に開示される効果的な予防又は治療効果を実現するのに十分な生物活性の保存)。
48時間の実験で一定のPEG源を提供するために、針を小腸(回腸)に導き、1mlの生理食塩水、PEG 3.35又はPEG 15-20を最も近い腸管に注入して退化した。穿刺を絹縫合により結紮し、盲腸をアルコールで拭いた。マウスをかごに戻し、次の48時間H20のみ与えた。
【0038】
PEG 15-20の用量応答曲線を図1のパネルbに示す。a.統計的に有意なPEG 15-20の保護効果をフィッシャーの正確確率検定(P< 0.001)によって決定した。b.PEG 15-20の最小保護濃度を5%(P<0. 05)であると決定した。c. 30%の外科的肝切除術及び1×107cfu/mlのPA27853の直接盲腸注入の24時間後の盲腸の内容物(糞)、洗浄した盲腸の粘膜、肝臓並びに血液の定量的細菌培養。一元配置分散分析(one-way ANOVA)は、肝切除術語のマウスの盲腸の内容物、粘膜、肝臓及び血液における細菌の数が 統計的に有意な増加を示した(P<0.001)。肝臓及び血液細菌の数の有意な減少(P<0.05)はPEG 3350について観測されたが、PEG 15-20は、PA27853がマウスの肝臓及び血液へ広がることを完全に防止した。
緑膿菌株ATCC 27853(PA27853)は血液培養からの非ムコイド臨床単離物である。あらかじめ30%の無血外科的肝切除術を行ったマウスに菌株PA27853を直接盲腸注入することにより、臨床的敗血症を生じ、48時間で生き残っているものはいなかった。緑膿菌を同様に注入した、肝切除術なしで偽の腹開を行ったマウス(コントロール)は、敗血症のどんな臨床的サインもなく完全に生き残った(図1a)。このモデルにおいて死亡を予防し、又は死亡率を低下させるPEG溶液の能力を決定するために、10%(w/v)の2つのポリエチレングリコール溶液(PEG-3.35対PEG-15-20)の1つに1×107Cfu/mlの濃度で200μlのPA27853を懸濁した。最後の25年間臨床使用が可能であったPEGの分子量を示すために、PEG-3.35を選択した(Golytelyt(登録商標))。相対的に、使用された本発明のPEG溶液は15〜20kDaの間の分子量を有した。懸濁した菌株を直接穿刺によって盲腸に導入した。PEG 3.35は肝切除術後のマウスにおいて死亡率に対して効果を持たなかったが、PEG 15-20は完全に保護した。実際、PEG 15-20はフィッシャーの正確確率検定(P< 0.001)によって決定される統計的に有意な保護効果を有した。投与量応答実験は、5%溶液が完全に保護する(P<0.05、図1b参照)PEG 15- 20の最小濃度であることを示した。当業者は、5%未満のHMW PEG溶液がいくらかの保護を与えると期待され、したがって本発明の範囲内であると認識するであろう。実験及びコントロールマウスの細菌の数に関して、一元配置分散分析(ANOVA)は、肝切除術後のマウスにおける盲腸の内容物、粘膜、肝臓及び血液の細菌の数の統計的に有意な増加を示した(P<0.001)。肝臓及び血液における細菌の数の有意な減少がPEG 3350について観測されたが、PEG 15-20は、PA27853がマウスの肝臓及び血液に広がることを完全に防止した。PEG 15-20は、腸のPA27853が肝臓及び血液循環へ広がることを完全に抑制した(図1c)。データは、PEG溶液の作用が非微生物学的であるメカニズムに関連することを示す。哺乳動物の細胞に対して非毒性であるPEG濃度で与える場合(すなわち、約10%以下)、細菌の増殖様式に対して効果が無いことが示され得る。
【0039】
サンプルは、HMW PEGが部分的な肝切除術の形態で外科的な介入を受けたマウスにおいて消化管誘導敗血症に起因する死亡率を下げることを示す。このマウスモデルは、HMW PEG治療が侵襲手術(例えば、部分的な肝切除術)のような生理学上のストレスを受けた動物種、例えばヒトのような哺乳動物の敗血症の死亡率を下げる(すなわち、任意の与えられた生物体における死亡確率を下げる)のに有用であることを示す。HMW PEG治療は、生物学上のストレスを受けた後に行われる場合(例えば、術後の対処の際)、敗血症に関連する死又は重い病気を予防する方法において効果的であることが期待される。さらに、HMW PEG治療は、生物学上のストレスの導入が予測可能である状況下で、重い病気又は死のリスクを下げるために前記ストレス前(例えば、手術前の対処)に使用してもよい。HMW PEG治療は、また、消化管誘導敗血症に関連した疾病又は異常状態に関連した症状を改善するのに有用である。
【0040】
実施例2
HMW PEGは腸管上皮への病原体の接着性を防止する
密着結合は哺乳動物の腸管の関門機能において重要な役割を果たす上皮細胞骨格の動的要素である。緑膿菌はCaco-2細胞及びT-84細胞の経上皮電気抵抗(TEER)によって測定された密着結合透過性(tight junctional permeability)における著しい変更を生じる。Caco-2細胞は、培養において安定なTEERを維持する、十分に特徴付けられたヒト結腸上皮細胞であり、この細胞株は腸管病原体のインビボ特性の認められたインビトロモデルを与える。培養されたCaco-2単層のTEERにおける緑膿菌PA27853-誘導減少に対するPEGの保護効果を決定するために、1×107cfu/mlのPA27853を10%のPEG 3.35又は10%のPEG 15-20の存在下で2つのCaco-2細胞単層に先端接種(apically inoculated)した。TEERを8時間連続的に測定し、記録されたTEERは最大限減少した。
PEG 15-20のみがTEERの緑膿菌-誘導減少に対して有意に保護した(図2a)。図2に示したデータは1×107cfu/mlのPA27853への先端曝露の8時間観測された3つの培養(n=7)のベースラインからTEERの最大減少を平均±SEM%で示す。PA27853を受けたCaco-2細胞で示されるTEERの統計的に有意な減少は一元配置分散分析(one-way ANOVA)(P<0. 001)によって示された。PA27853 によって誘導されるTEERの減少に対する統計的に有意な効果はPEG 15-20について示された(P<0.001)。図2bにPEG 3.35の存在下でPA27853への先端曝露を受けるCaco-2細胞を示す。PEG 3.35の存在下で共培養の4時間後、単層やぐら(monolayer scaffolds)上に30〜40μmを浮いている細胞を有する、焦点接着性細菌(focally adherent bacteria)を示すCaco-2細胞単層の分裂を観測した(図2b)。対照的に、PEG 15-20の存在下でPA27853へ4時間先端曝露したCaco-2細胞のイメージを示す図2cは、試験したいずれの面においても細胞が浮かんでいる証拠を示さない。Caco-2細胞完全性に対するPEG 15-20の保護効果は、1×106cfu/mlのPA27853に4時間曝露した後細胞の上澄みにおける15倍以上の細菌の回復によって映し出された、少ない細菌接着と関連があった。
【0041】
TEERの維持によって判断される、緑膿菌の関門破壊効果に対するPEG-培養されたヒト腸管上皮細胞の耐性は、進入する病原体からの攻撃に直面して密着接合関門機能(tight junctional barrier function)を安定化する実用的なアプローチを提供する。さらに、PEG 15-20の治療上価値の証拠は、上皮の輸送機能(Na+/H+交換、グルコース輸送)がこの化合物によって影響されないことである。
したがって、HMW PEGは相対的に腸管上皮関門に対して不活性であり、かつ安定化効果を有する。本発明は、哺乳動物、好ましくはヒトのような動物にHMW PEGを投与することによって緑膿菌のような腸管病原体に関連する腸管関門の異常を治療する方法を包含する。腸管障壁の異常は、任意の診断方法又は当業者に知られる他の手段によって明らかにされてもよい。しかしながら、HMW PEG治療の前に腸管関門の異常を同定する必要はない。HMW PEG治療に関連した低コスト及び高い安全性は、このアプローチを、好ましくは潜在的に危険な状態にある生物体に予防適用及び腸管関門の異常の特徴的な少なくとも1つの症状を示している動物に適用される治療方法の双方に適したものとする。HMW PEG治療方法は腸管関門の異常に関連した症状を改善し、好ましくは、前記方法は治療された生物体から消化管誘導敗血症の影響を低減又は排除するであろう。
【0042】
実施例3
HMW PEGは病原体におけるビルレンスの発現を抑制する
緑膿菌PA27853のPA-Iレクチン/付着因子の発現は、肝切除術後のマウスの盲腸において増加し、マウスの腸における緑膿菌の致死効果において重要な役割を果たした。PA-Iは、上皮へのPA27853の付着を促進することによって及び細胞毒素、外毒素A及びエラスターゼに鞍替えする有意な障壁を生成することによって、マウスの腸における重要なビルレンスの決定因子として機能する。緑膿菌のPA-I発現は、転写調節因子RhIR及びその同系活性因子C4-HSLによって調節される。PA27853のPA-I発現はC4-HSLへの曝露によって増加しただけでなく、Caco-2細胞、Caco-2細胞膜調製物及びCaco-2細胞培養からの上澄みとの接触によっても増加した。
ノーザンハイブリダイゼーションを使用して転写レベルでPA-I の発現を分析した。緑膿菌の全RNAを修正3洗浄剤法(modified three-detergent method)によって分離した。
PA-Iプライマー:F(ACCCTGGACATTATTGGGTG)(配列番号1)、R(CGATGTCATTACCATCG- TCG)(配列番号2)及び16Sプライマー:F(GGACGGGTGAGTAATGCCTA)(配列番号3)、R(CGTAAGGGCCATGATGACTT)(配列番号4)を用いて、プローブをPCRによって生成し、pCR2.1ベクター(インビトロジェン社)にクローニングした。挿入部分はPA-I又は16Sのいずれかの配列と一致する配列であった。PA-I及び16Sに特異的なcDNAプローブをα32P-dCTPで放射標識した。特異的な放射能をStorm 860 phosphorimager(Molecular Dynamics, CA)によって測定し、PA-Iと16Sの強度比をベースに、コントロールと比較した相対的な変化率を計算した。ウサギのアフィニティー精製した(affinity-purified)ポリクローナル抗PA-I抗体を用いたウエスタンブロッティングをPA-Iたんぱく質分析のために使用した。1mlの緑膿菌細胞をPBSで洗浄し、溶解緩衝液(4% SDS、50mM Tris-HCI、 pH 6.8)中で100℃で加熱し、トリシンSDS- PAGE後たんぱく質の電子移動によって免疫ブロット分析を行った。ECL試薬(Amersham, NJ)により、PA-Iレクチンを検出した。
【0043】
1mMの集団感知シグナル分子C4-HSLへの緑膿菌PA27853の曝露は、10%のPEG 3.35の存在下で部分的に抑制され、10%のPEG 15-20によってはるかに大きな広がりを抑制されたPA-Iたんぱく質発現において統計的に有意な増加を生じた(P<0.001、一元配置分散分析(one-way ANOVA))(図3)。C4-HSL誘導PA-I発現に対するPEG 15-20の完全抑制最小濃度は5%であった(P<0.01、一元配置分散分析(one-way ANOVA))。PEGの存在下及び非存在下でC4-HSLに曝露された個々の細菌細胞の電子顕微鏡による観察は、C4-HSLが緑膿菌の形状及び線毛発現における形態学的な変化を生じることを示した(図3b)。C4-HSL誘導形態学的作用はPEG 15-20の存在下で完全に排除されたが、PEG 3.35の存在下では完全には排除されなかった。ハロタイプの作用はPEG 15-20に曝露されたPA27853の周りで見られた(図3b)。0.1mMのC4-HSLへのPA27853の曝露は、ノーザンブロットを用いて評価されるPA-I mRNA発現における統計的に有意な増加を生じた(P<0.001、一元配置分散分析(one-way ANOVA))。PA-1発現は10%のPEG 15-20によって大きく抑制された。図3dは、Caco-2細胞への4時間の曝露によって誘導されるPA-I mRNAにおける増加がPEG 15-20によって抑制されたが、PEG 3.35によっては抑制されなかったことを示す(P<0.001、一元配置分散分析(one-way ANOVA))。
【0044】
ここで示したデータは、100μm〜1mMのC4-HSLによって誘導されるPA27853におけるPA-I発現(たんぱく質及びmRNA)の有意な減少(3〜4倍減少)が、細菌が10%のPEG 15-20によってあらかじめ処置された場合に観測されたことを示す。この作用はPEG 3.35の場合には観測されなかった(図3a)。C4-HSL-誘導PA-I発現の減少は10%のPEG 3.35の場合にも観測されたが、減少の程度は10%のPEG 15-20の場合よりも明らかに少なかった。PA-Iたんぱく質のC4-HSL誘導発現を抑制するPEG 15-20の最小濃度は5%であった(図3b)。C4-HSLに曝露された個々の細菌細胞の電子顕微鏡検査は、C4-HSLがPA27853の形状及び線毛発現の形態学的な変化を生じることを示した(図3b)。C4-HSL誘導形態学的作用はPEG 15-20の存在下で完全に排除されたが、PEG 3.35の存在下では完全には排除されなかった(図3b)。Caco-2細胞への4時間の曝露によって誘導されたPA-I発現(mRNA)は、PEG 15-20の存在下で抑制されたが、PEG 3.35の存在下では抑制されなかった(図3b)。PEG 15-20によるCaco-2細胞誘導PA-I発現の保護作用は、一晩の曝露実験で持続した。
【0045】
HMW PEGは、また公知の興奮剤に応答して緑膿菌のビルレンスの発現に影響を与える。PA27853におけるC4-HSL誘導PA-I発現の減少はPEG 15-20の主な保護作用であり得るが、集団感知シグナルがこの病原体のビルレンス発現の十分に確立したメカニズムであることを示す。PA-IのCaco-2細胞誘導発現によるPEG 15-20誘導干渉は、PEG 15-20の保護作用の重要な態様であると予想される。PEG 15-20は、30%の肝切除術後のマウスからのフィルター処理した盲腸内容物(糞便)に応答した緑膿菌(PA27853)のPA-I発現の減少によって宿主動物に対する保護作用を有することが分かった。 そのビルレンス発現を増加させる宿主因子から緑膿菌をシールドするPEG 15-20の能力は、生物体が消化管誘導敗血症から保護されるさらに別のメカニズムであると予想される。
したがって、本発明は、シュードモナスの1つのような腸管病原体によるビルレンス因子又は決定因子の発現によって特徴付けられる状態を予防又は治療する動物にHMW PEGを投与する対応する方法及びキットの形態の材料を含む。ビルレンスの決定因子は直接又は間接的にビルレンスに寄与してもよい。間接的な寄与の例としては、腸管上皮への腸管病原体の付着及び/又は細胞毒素、外毒素A及びエラスターゼに対する関門の欠陥の生成に対する緑膿菌のPA/Iレクチン/付着因子の作用などが挙げられる。
【0046】
実施例4
PEGは病原体の細胞増殖又は細胞膜完全性に影響しない
SYTO 9及びヨウ化プロピジウムからなる染色方法によって、2つのPEG溶液(PEG 3.35及びPEG 15-20)の細菌膜完全性に対する作用を評価した。PEG溶液は細胞膜透過性に対していかなる作用ももたなかった(図4a)。生/死細菌生存度キットL-3152(Molecular Probes)を用いて、膜完全性を決定した。細菌を定量化し、異なるインキュベーション時間で得られるサンプルを10倍に希釈したプレーティングによって、数をcfu/mlで表した。
2つのPEG溶液のいずれかを含むTSB培地で一晩増殖させた緑膿菌の増殖曲線は、細菌の数に対するPEG溶液による抑制作用はいずれにおいても示さなかった(図4b)。実際、各PEG含有培地における増殖様式はPEGを含まないTSB培地における増殖様式と区別がつかなかった。増殖の対数期及び定常期の種々の時間点で、エネルギー代謝に関するハウスキーピング酵素、乳酸脱水素酵素(LDH)の活性を測定した。CytoTox 96(Promega)の基質混合物を用いた結合ジアフォラーゼ酵素測定法(coupled diaphorase enzymatic assay)において、LDH活性を測定した。BCAたんぱく質測定法(Pierce)を用いて、たんぱく質濃度を決定した。PEGの存在下で増殖した緑膿菌の細胞を含まない上澄みにおけるLDH活性の変化は観測されなかった。この実験の結果は、HMW PEGが細菌増殖様式に対して極わずかな作用のみを有することを示している。
本発明の方法及び対応する製品(例えば、キット)は、腸管微生物フローラ組成物に有意に影響することなしに、消化管誘導敗血症に関連した疾患又は異常状態を予防又は治療するという利点を与える。同様に、本発明の方法及び製品を使用して、腸管微生物組成物の有意な変化なしに前記疾患又は異常状態に関連した症状を改善してもよい。当業者は、前記方法が前記妨害から生じる二次健康合併症をもたらすと予期されない限りは、腸管微生物フローラ組成物を有意には妨害しない方法(及びキット)が望ましいと認識するであ
【0047】
実施例5
PEGコート病原体の原子間力顕微鏡観察
10%のHMW PEGの有り無しで、一晩増殖させたPA27853の培養の1%分量を4時間37℃でトリプシン大豆ブロス(TSB)に継代培養した。各継代培養の1滴を回収し、緑膿菌PA27853細胞を多量のPBSで洗浄し、10分間空気を送りながら雲母上で乾燥し、直ちにイメージ化した。空気中で、Multimode Nanoscope IIIA Scanning Probe Microscope(MMAFM, Digital Instruments)を用いて、タッピングモードのAFMによって乾燥した細菌のイメージ化を行った。Subconfluent Caco-2細胞を10%のHMW PEGで4時間処理し、多量のPBSで洗浄した。細胞のAFMイメージ化をオーリングを用いることなくPBSで行った。電子顕微鏡観察について、1mMのC4-HSL及び10%のHMW PEGの有り無しで、PA27853をTSBに接種して一晩インキュベートした。1%の緑膿菌の1滴を酢酸ウラニルで染色し、電子顕微鏡下での試験前に0.5MのNaClで洗浄した。
Caco-2の原子間力顕微鏡観察は刷子縁微絨毛による古典的な不均一表面を示したが、PEG 3.35に曝露したCaco-2細胞は上皮細胞の表面上に滑らかな平面外観を示した(図5a、c)。PEG 15-20は組織分布的に定義された面に沿った非相称を満たすことによってCaco-2細胞を覆うように現れ、より複雑に組織分布的に定義された被覆を生じる。いくらか同じ様式で、PEG 3.35に曝露したPA27853細胞は、拡散フラット様式でポリマーが細菌細胞を滑らかにコートする様式を示し(図6d)、PEG 15-20はより組織分布的に非相称様式で周囲に細菌を囲み、固定する。PEG 15-20の細菌の直径の原子間力測定の断面積分析はPEG溶液内で細菌/PEGエンベロープの有意な増加を示す(図5e、f)。換言すれば、PEG 3.35は個々の細菌細胞を囲む滑らかなエンベロープを形成し、PEG 15-20は個々の細胞を固く固定し(図5f)、ポリマー/細菌直径を増加させ(図5g、5h)、それによって個々の細菌細胞を互いに遠ざける。
【0048】
理論によって束縛されることを望まないが、HMW PEGは緑膿菌を腸管上皮から単に物理的に遠ざけることによってその有益な効果を発揮できる。あるいは、HMW PEGは病原体細胞の細胞間相互作用から生じる病原体集団感知活性化シグナルの形成を防止することによって利益を提供できる。同様に、理論によって束縛されることを望まないが、HMW PEGによる生物学的表面のコーティングがコーティングPEG鎖の高次構造上の自由度の減少を生じ、たんぱく質への接近を防止する。HMW PEGとCaco-2細胞の間の極性間相互作用はPEG鎖の弾力性に作用でき、特定のHMW PEG側鎖をたんぱく質を拒絶する分子構成物に束縛する。ここで示したデータは、おそらくHMW PEGのCaco-2細胞によるある種の動的な相互作用の結果として「高次構造上のエントロピー」の減少のために、HMW PEGコートCaco-2細胞が未コートCaco-2細胞よりも緑膿菌に対して強く拒絶する結論を支持する。
この実験の結果は、HMW PEG治療が治療細胞に対する作用を有し、特に前記細胞の表面トポロジーに影響を与える。さらに、前記細胞に対するHMW PEG曝露の作用はPEG 3.35が前記細胞に対して有する作用と異なっている。理論によって束縛されることを望まないが、ここに開示された結果は、PEG 3.35のような低分子量PEGと比較してHMW PEGによって示される細胞に対する顕著な異なる作用について物理的な関連を与える。
【0049】
実施例6
HMW PEGは細胞間相互作用に影響を及ぼす
緑膿菌の空間的な配向に対するPEG溶液の作用を直接観測するために、緑色蛍光たんぱく質をコードするegfp遺伝子を有する緑膿菌PA27853/EGFPの生きた菌株を用いて実験を行った。Caco-2細胞の存在下及び非存在下で実験を行った。PEGの細菌に対する作用及び培養上皮とのその相互作用に対する作用をイメージ化するために、微分干渉コントラスト(DIC)顕微鏡観察及びGFPイメージ化を用いた。
鋳型としてpBl-EGFPプラスミド(Clontech)を用いて、緑色蛍光たんぱく質をコードするEGFP遺伝子を増幅した。プライマーTCTAGAACTAGTGGATCCCCGCGGATG(配列番号5)及びGCAGACTAGGTCGACAAGCTTGATATC(配列番号6)を用いて、Xbal及びPstl制限部位を導入した。TA-クローニングキット(Invitrogen)を用いて、PCR産物を直接pCR 2.1ベクターにクローニングし、次いでpCR2.1/EGFP構築物を大腸菌DH5aに形質転換した。Xbal及びPstlによる消化によって、EGFP遺伝子をこの構築物から切除し、切除した遺伝子を含むフラグメントを(同じ制限酵素によって消化された)大腸菌-緑膿菌シャトルベクターpUCP24にクローニングした。(シャトルベクター内にEGFP遺伝子を含む)得られた構築物(すなわち、pUCP24/EGFP)を25μF及び2500VでPA27583エレクトロコンピテント細胞に電気穿孔した。PA27853/EGFP-含有細胞を100μg/mlのゲンタマイシン(Gm)を含むLB-寒天プレートで選択した。
PA27853/EGFPを有する細胞を一晩100μg/mlのGmを含むLBで増殖させ、1%の培養を使用して50μg/mlのGmを含む新鮮なLBに接種した。3時間増殖した後、イソプロピル-β-D-チオガラクトピラノシド(IPTG)を添加して0.5mMの最終濃度とし、培養をさらに2時間インキュベートした。HEPESで緩衝し、10%のウシ胎仔血清(HDMEM HF)及び10%のHMW PEGを含ませた1mlのHDMEM培地(Gibco BRL)と100μlの細菌培養を混合した。1mlの細菌懸濁液を0.15mm-厚のdTC3皿(Bioptech)に注いだ。0.15mm-厚のdTC3皿(Bioptech)のHDMEM HF中で増殖させた4日目のCaco-2細胞(p10-p30)を、HMW PEGの有り無しで、HDMEM HFで1回洗浄した。上述のとおり調製した1mlの細菌懸濁液を、Caco-2細胞を含むdTC3皿に加えた。DIC及びGFP蛍光フィルターを用いるAxiovert 100 TV蛍光倒立顕微鏡で、63×の対物倍率で、dTC3皿中の細菌細胞の分散様式を直接観測した。Bioptechsサーモスタット温度調節システムで、温度を調整した。DIC及びGFP励起でタングステンランプ(100V)を使用した。Intelligent Imaging Innovationsの3Dイメージングソフトウエア(Slidebook)を用いて、GFPフィルターを用いたZ面の細菌細胞分散様式をイメージ化した。Caco-2細胞を含まない培地中の一様に分散したプランクトン様緑膿菌細胞はDICイメージ(図1a1)及びZ面再構築物(図6a2)で認められた。Caco-2細胞の存在下で、細菌細胞は集中外観で発生し(図6b1)、Caco-2細胞に付着するように見えた(図6b2)。10%のPEG 3350の溶液は細菌運動を低下させ、ウエルの底に付着した(図6c2)キノコ形状細菌微小コロニーの即時形成を誘導した(図6c1)。Caco-2細胞の存在下で、細菌微小コロニーは上皮細胞の面上約8μmであった(図6d1、2)。10%のPEG 15-20の溶液は緑膿菌細胞の運動を大きく低下させた。それにもかかわらず、PEG 15-20含有培地での最初の0.5〜1時間のインキュベーションでは、細菌細胞はウエルの底付近にクモ足形状微小コロニーを形成した(図6e1、2)。数時間以内に、クモ足形状微小コロニーは培地の全空間/容積を占めた。Caco-2細胞の存在下で、緑膿菌細胞はクモ足様配置を失い、上皮の面上に高く(30〜40μm)上昇したように見えた(図6f1、2)。
【0050】
三次元で細菌-上皮細胞相互作用の空間的配向を決定するために、Z面再構築を行った。イメージは、2つのPEG溶液が緑膿菌の集中様式に対して異なる作用を有し、Caco-2細胞の存在又は非存在に依存して細菌の空間的配向に異なる影響を及ぼすことを示した。培地のみによる実験において、緑膿菌は一様な分散様式を示すように見えた(図6a)。しかしながら、Caco-2細胞の存在下で試験した細菌細胞は、集中外観を発生し、ウエルの底で上皮細胞の平面に隣接するように見えた(図6b)。PEG 3.35単独の存在下で試験した細菌細胞は大きな凝集を形成し、培養ウエルの底に残り(図6c)、PEG 3.35を含む培地でCaco-2細胞によって試験された細菌細胞は上皮細胞の面上(約8μm)で懸濁して維持され、その集中外観を保持した(図6d)。PEG 15-20単独の存在下で試験した細菌細胞は一様な微小集中様式を示し(図6e)、PEG 15-20を含む培地でCaco-2の存在下で試験した細菌細胞は集中形態で上皮の面上より高く(約32μm)懸濁された(図6f)。時間実験で、細菌運動がPEG 3.35によって減少することを観測し、PEG 15-20によってさらにより大きく減少することを観測した。
実施例5に開示した実験と同様の様式で、この実施例は、細胞間相互作用に対するHMW PEGの観測された作用について物理的な関係を与え、本明細書に開示されるようなその有用な予防及び治療活性と一致している。HMW PEGの使用は腸管における有害な細胞間相互作用(例えば、腸管上皮細胞とシュードモナスのような腸管病原体との)を低減又は排除し、消化管誘導敗血症に関連した疾病及び/又は異常状態のリスクを低減することが期待される。
【0051】
実施例7
疾病/異常状態の予防方法
また、本発明は、ヒト及び他の動物、特に他の哺乳動物における種々の疾患及び/又は異常状態の予防方法を提供する。これらの方法において、有効量のHMW PEGを、それを必要とするヒト患者又は動物対象に投与する。当業者に知られた所定の最適化手順を用いて決定される投与計画を用いて、PEGを投与してもよい。好ましくは、PEGは5,000〜20,000ダルトン、より好ましくは10,000〜20,000ダルトンの平均分子量を有する。少なくとも5%のHMW PEGを投与すると考えられる。HMW PEGは任意の適した形態で、例えば溶液、ゲル又はクリーム、噴霧に適した溶液(例えば、吸入使用)として、HMW PEGを含む医薬組成物において、及び動物への注入に適した殺菌等張液において投与してもよい。投与は任意の従来の経路を用いて行ってもよい。HMW PEGは経口又は局所投与することが特に考えられる。いくつかの実施態様において、投与されるHMW PEG組成物は、さらにデキストランコートL- グルタミン、デキストランコートイヌリン、デキストランコート酪酸、フラクトオリゴ糖、N-アセチル-D-ガラクトサミン、デキストランコートマンノース、ガラクトース及びラクツロースからなる群より選ばれる化合物を含む。他の実施態様において、投与されたHMW PEG組成物は、さらにデキストランコートL- グルタミン、デキストランコートイヌリン、デキストランコート酪酸、1つ以上のフラクトオリゴ糖、N-アセチル-D-ガラクトサミン、デキストランコートマンノース、ガラクトース及びラクツロースを含む。
本発明は種々の疾病及び異常状態、例えば水泳者耳、急性又は慢性中耳炎、人工呼吸器関連の肺炎、消化管誘導敗血症、壊死性腸炎、抗生物質誘導下痢、偽膜性大腸炎、炎症性腸疾患、過敏性腸疾患、好中球減少性全腸炎、膵炎、慢性疲労症候群、生命異常症候群、顕微鏡的大腸炎、慢性尿路感染症、性感染症及び感染症(例えば、炭疽菌、痘瘡ウイルス、病原性大腸菌(EPEC)、腸管出血性大腸菌(EHEC)、腸管凝集性大腸菌(EAEC)、クロストリジウム・ディフィシル、ロタウイルス、緑膿菌、セラチア菌、クレブシエラ・オキトカ、エンテロバクター・クロアカ、鵞口瘡カンジダ及びカンジダ・グラブラータなど)の予防方法を提供する。慢性尿路感染症の予防方法、又は前記感染の治療方法の好ましい実施態様において、HMW PEGは膀胱潅漑の形態で投与される。性感染症予防について、本発明の組成物はコンドームを潤滑するために好ましく使用される。バイオテロ兵器による感染症の予防方法の好ましい実施態様において、本発明の組成物は局所適用に適したゲル又はクリームの形態で提供される。前記局所適用は、生存、健康又は快適の点でヒト又は動物に対する脅威を引き起こす任意のバイオテロ兵器に関連した又は種々の化学又は物理化学兵器に関連した種々の疾病/異常状態を予防するのに有用であることが期待される。前記化学又は物理化学兵器には、皮膚を燃焼又は別の方法で傷つけることができる兵器が含まれ、本発明の組成物に不活性であり、ほとんど溶解しない。
【0052】
本発明の方法の1つの実施態様において、雄のBalb/cマウスに麻酔し、PEG 15-20の5%溶液を直接鍼穴によって盲腸の基部に注入する。48時間の実験の間持続する一定のPEG源を提供するために、針を小腸(回腸)に向け、1mlのEPG 15-20を腸の近隣に逆に注入した。穿刺部位を縛り、絹縫合し、盲腸をアルコールで拭いた。マウスを籠に戻し、水のみを与えた。48時間後、マウスにフロッピー左葉に沿った肝臓の30%無血切除術に関する従来の肝切除術手順を施す。コントロールマウスは肝切除術しないで肝臓の処置を受ける。HMW PEGの投与に関する予防的治療は、マウスの外科手術に関連した消化管誘導敗血症の発生を低減又は排除すると期待される。
これらの方法は、マウス、モルモット、イヌ及びネコのようなペットからウシ、ウマ、ヤギ、ヒツジ、ブタ、ニワトリ、シチメンチョウ、アヒル、ガチョウ及び他の家畜のような農業上重要な動物までの予防的ケアを越えて適用される。さらに、これらの予防方法は、水泳者耳、急性又は慢性中耳炎、人工呼吸器関連の肺炎、消化管誘導敗血症、壊死性腸炎、抗生物質誘導下痢、偽膜性大腸炎、炎症性腸疾患、過敏性腸疾患、好中球減少性全腸炎、膵炎、慢性疲労症候群、生命異常症候群、顕微鏡的大腸炎、慢性尿路感染症、性感染症及び、これに限定されないが、炭疽菌及び天然痘などの感染症菌(例えば、バイオテロ組成物)のような疾病及び/又は異常状態の発生のリスクがある多くの患者又は候補者の健康及び平均寿命を改善するために、ヒトに適用できると期待される。上述のとおり、前記予防方法は、公知の又は従来の投与経路によって、ヒト又はその他の動物に少なくとも5%のHMW PEG(5〜20 kDa)を含む組成物の投与を含む。好ましくは、前記予防方法は、前述の疾病及び/又は異常状態の1つ以上を発生するリスクがある個体において実施されるが、本発明の組成物及び方法は、ヒト又はその他の動物の個体群全体又は一部において前記疾病又は異常状態を広く治療又は予防する予防又は治療役割において有用であると考えられる。
【0053】
実施例8
HMW PEGの投与をモニターする方法
本発明は、また例えば治療方法におけるHMW PEGの投与をモニターする方法を包含する。前記モニター方法において、標識HMW PEGが単独で又は非標識HMW PEGと組み合わせて投与され、前記標識は、単純な終点決定などの連続又は断続的な計画で治療の間検出される。用語「標識」HMW PEGとは、標識(すなわち、検出可能な化合物)がHMW PEGに直接又は間接的に結合し、又はHMW PEGがHMW PEGを有する標識に結合できるレポーター化合物に結合していることを意味する(もちろん、HMW PEGに結合しない又はそれと結合するように設計されていない標識も後述するように本発明に包含される)。HMW PEGは当業界において知られる任意の検出可能な標識を用いて標識化され、PEGはそれを検出するのに十分な濃度で標識化される。当業者は、その濃度が標識及び検出方法に応じて変化することを認識するであろう。当業者は通常の最適化手順を用いて標識化の程度を最適化できるであろう。標識は、非共有結合又は使用、特に保存の際に安定である共有結合によってHMW PEGに化学的に結合される。HMW PEGに共有結合した標識が好ましい。標識結合の密度はHMW PEGの生物活性を実質的に保持するように調整される(本明細書に開示される有益な予防又は治療効果を実現するのに十分な生物活性の保持)。これは、典型的には当業者に知られるようにHMW PEG:標識比を調整することによって達成される。HMW PEGの相対的な平均分子サイズを考えると、広範囲の標識がその生物活性を実質的に保持してHMW PEGに結合するのに適していると期待される。
本発明によって考慮される標識は当業界で公知の標識であり、例えば放射標識、発色団、フルオロフォア及びレポーター(例えば、検出可能な化合物の生成を触媒する酵素及びレポーターの近くに検出可能な化合物が局在化する抗体のような結合パートナーなど)などが挙げられる。具体的な酵素レポーターとしては、例えば発光システムの酵素成分及び比色反応の触媒などが挙げられる。さらに詳しくは、具体的なレポーター分子としては、ビオチン、アビジン、ストレプトアビジン及び酵素(例えば、西洋わさびペルオキシダーゼ、ルシフェラーゼ、アルカリホスファターゼ、例えば分泌性アルカリホスファターゼ(SEAP)、β-ガラクトシダーゼ、β-グルクロニダーゼ、クロラムフェニコール、アセチルトランスフェラーゼ)などが挙げられる。前記レポーターの使用は当業者によく知られており、例えば米国特許第3,817,837号、第3,850,752号、第3,996,345及び第4,277,437に記載されている。具体的な酵素基質は、レポーター酵素によって検出可能な化合物に変換され得るものであり、例えば5-ブロモ-4-クロロ-3-インドリルβ-D-ガラクトピラノシド又はXgal及びBluo-galなどが挙げられる。検出可能な化合物に変換できる化合物として、酵素基質は、また当業界で理解されているようにある特定の実施態様において標識であってもよい。標識及びその使用方法を教示する米国特許としては、米国特許第3,817,837号、第3,850,752号、第3,939,350号及び第3,996,345号が挙げられる。具体的な放射標識としては、3H、14C、32p、33p、35S及び1251が挙げられる。具体的なフルオロフォアとしては、フルオレセイン(FITC)、ローダミン、Cy3、Cy5、エクオリン及び緑色蛍光たんぱく質が挙げられる。好ましい標識はフルオレセインのようなフルオロフォアである。
【0054】
本発明のモニター方法は、また1よりも多くの標識を含んでもよい。1つの実施態様において、1つの標識が治療後又は治療中のHMW PEGの位置を同定するために役立ち、第2標識は少なくとも1つの微生物に関連して検出可能な標識である限り1つ以上の微生物に特異的である。例えば、モニター方法は、HMW PEGの生物活性を実質的に保持するような態様でHMW PEGに結合したフルオレセインを含み、原核生物特異的βガラクトシダーゼ活性の検出用のXgal又はbluo-galを含まなくてもよい(すなわち、結合しなくてもよい)。
フルオレセインはHMW PEGを局在化させ、着色(青色)生成物はシュードモナスのようなラクトース代謝原核微生物の存在を示す。本発明は、また1つの標識がこの情報を提供するモニター方法(すなわち、HMW PEGの局在化及び微生物の存在の表示)も含む。
当業界で公知の検出方法は本発明のモニター方法で使用することができる。標識のタイプ、モニターされる生体材料(例えば、皮膚、外耳道又は腸の表皮細胞、便、粘液又は組織サンプル)、所望の識別レベル、定量化が期待されるかどうかなどの複数の因子は、選択される検出技術に影響を及ぼす。適した検出技術としては、肉眼による単純目視検査、必要に応じて適した光源及び/又は記録用カメラを備える内視鏡のような器具による目視検査、ガイガー計数管の通常の使用、X線フィルム、シンチレーションカウンターなど、及び当業界で公知の他の検出技術が挙げられる。
当業者は、本発明のモニター方法が治療方法を最適化するのに有用であると認識するであろう。例えば、モニター方法はHMW PEGの量及び/又は濃度を最適化するために(例えば、HMW PEGの溶液又は混合物に関して所望の粘度を与えるために)使用でき、水泳者耳の予防又は治療のために外耳道の上皮細胞のような上皮細胞に与えられる。追加の例として、腸の最適化又は腸管治療は標識HMW PEGに曝露される腸管の内視鏡検査又は便サンプルのモニターによって促進される。
本発明のモニター方法は、腸管上皮細胞に付着できる微生物のための便評価法を含み、、前記評価法は微生物と投函上皮細胞を接触させること、及び微生物の上皮細胞への付着を当業界で公知の技術を用いて検出することを含む。好ましい実施態様において、腸管上皮細胞は、マイクロタイターウエルの底及び/又は側面のような適した表面に固定化される。他の好ましい実施態様において、直接標識、又は検出可能な生成物を生成することができるレポーターのような間接的標識は、検出工程の前、又は検出工程の際に加えられる。モニター方法は、さらに遊離標識の追加を含んでもよい。例えば、遊離Bluo-galはラクトース代謝原核微生物を含むと思われるサンプルに添加され、存在する場合には、微生物酵素β-ガラクトシダーゼはBluo-galを切断して検出可能な青色生成物を生じる。
【0055】
1つの実施態様において、市販の腸管上皮細胞(例えば、Caco-2細胞、ATCC HTB 37、及び/又はIEC-6細胞、ATCC CRL 1952)を、通常の方法を用いてマイクロタイター皿のウエルに固定する。便サンプルを回収し、リン酸緩衝食塩水のような流体と混合する。混合物の液相(懸濁された微生物を含む)が得られ(例えば、適したろ過(すなわち、懸濁液中の細菌からの固体全体の分離)、デカンテーションなどによって)、PBSで1:100に希釈される。Bluo-galを生きた微生物の懸濁液に加える。微生物の懸濁液を1時間24℃でマイクロタイターのウエルに加え、その後適した流体(例えば、PBS)でそのウエルを洗浄して結合していない微生物を除去する。固定化した上皮細胞に結合していない及び/又は結合した微生物を、例えば偏光顕微鏡観察を用いて計数することによって検出した。別の実施態様において、微生物特異的モノクローナル又はポリクローナル抗体(必要により放射標識、フルオロフォア又は発色団のような標識を結合した)である適した免疫学的な試薬を用いて、免疫測定法を使用して付着を検出する。
前記固定化は上皮細胞へ付着する微生物の正確な検出を容易にするが、当業者は、腸管上皮細胞又は微生物のいずれも固定化する必要がないことを認識するであろう。例えば、1つの実施態様において、固定化された便微生物を、固定化されていない腸管上皮細胞と接触させる。さらに、当業者は、当業界で知られる任意の適した流体が微生物懸濁液を得るために使用してもよいことを認識するであろう。好ましい流体は公知の等張緩衝液である。また、上述のとおり、細胞付着の検出のために、任意の公知の標識を使用してもよい。
関連する態様において、本発明は、上皮細胞及び前記上皮細胞への微生物細胞の付着を評価するためのプロトコールを含む、微生物細胞付着を評価するためのキットを提供する。前記プロトコールには、微生物を検出する公知の方法が説明されている。好ましいキットは、腸管上皮細胞を含む。本発明の他のキットは、さらにフルオロフォア又はレポーターのような標識を含む。
【0056】
本発明に含まれる他のモニター方法は微生物疎水性の評価法である。この方法において、微生物細胞の相対的又は絶対的疎水性は任意の従来技術を用いて決定される。具体的な技術は、任意の微生物を疎水性相互作用クロマトグラフィーに追加することを含み、従来技術(Ukukuら, J. Food Prot. 65: 1093-1099 (2002))で知られており、その全内容は参照により本明細書に組み込まれるものとする。他の具体的な技術は任意の微生物の非極性:極性流体分離(例えば、1-オクタノール:水又はキシレン:水)である。Majtanら, Folia Microbiol (Praha) 47: 445-449 (2002)を参照のこと(その全内容は参照により本明細書に組み込まれるものとする)。
PEG投与をモニターする疎水性評価法の1つの実施態様において、0.15MのNaClを含む50mMのリン酸ナトリウム緩衝液(pH7.4)に便サンプルを懸濁する。懸濁液中の微生物を遠心分離法により回収し、同じ緩衝液に再懸濁し、遠心分離-再懸濁サイクルを繰り返す。可能であれば、微生物を同じ緩衝液に再懸濁して660nmで0.4の吸光度とし、標識PEGを用いないで、分光光度法でモニターできるであろう。微生物懸濁液をキシレン(2.5:1(v/v)、Merck)で処理し、懸濁液を2分間激しく混合し、懸濁液を20分間室温で滅菌する。次いで、例えば660nmの吸光度の分光光度法による決定によって、水相中の微生物の存在を決定する。リン酸ナトリウム緩衝液を含むブランクを用いてバックグラウンドを除く。
これらの方法で用いる便サンプルから微生物細胞を得る際に、HMW PEGが微生物懸濁液を得るために使用される流体及び微生物懸濁液を希釈するために使用される任意の流体に相対的に不溶性であることが好ましい。
【0057】
本発明は、腸管上皮細胞及び微生物疎水性の決定法を説明するプロトコールを含む微生物疎水性の評価法を含むモニター方法を実施するキットをさらに提供する。好ましいキットは腸管上皮細胞を含む。関連するキットは、さらにフルオロフォア又はレポーターのような標識を含む。
さらに、本発明は腸管微生物フローラのサンプルを得ること及びPA-Iレクチン/付着因子活性を検出することを含むモニター方法を提供する。当業界で知られるPA-Iレクチン/付着因子活性を検出する任意の技術が使用できる。例えば、PA-Iレクチン/付着因子は、PA-Iレクチン/付着因子を特異的に認識する抗体(ポリクローナル、モノクローナル、Fabフラグメントのような抗体フラグメント、単鎖、キメラ、当業界で知られるヒト化又は任意の他の形態の抗体)を用いて検出できる。免疫測定法は当業界で知られる任意の免疫測定法フォーマット、例えばELISA、ウエスタン、免疫沈降などの形態をとる。あるいは、PA-Iレクチン/付着因子の炭水化物結合能を決定でき、又は例えばサンプルを曝露する前に、及び/又はその際に上皮層の経上皮電気抵抗、すなわちTEERをモニターすることによって、PA-Iレクチン/付着因子の腸管上皮関門破壊活性(breaching activity)を決定してもよい。関連するキットにおいて、本発明はPA-Iレクチン/付着因子結合パートナー及びPA-Iレクチン/付着因子活性(例えば、結合活性)を検出するためのプロトコールを提供する。本発明の他のキットはPA-Iレクチン/付着因子を結合することが知られている任意の炭水化物及びPA-Iレクチン/付着因子活性(例えば、結合活性)を検出するためのプロトコールを含む。
本発明の多くの修正及び変更は上記教示に照らして可能であり、本発明の範囲内である。本明細書で引用されるすべての刊行物の全開示は参照によって本明細書に組み込まれるものとする。
【0058】
次に、本発明の好ましい態様を示す。
1. 微生物媒介疾患の発生のリスクがある上皮表面を含む異常状態の動物における死亡確率の低減方法であって、有効量のポリエチレングリコール(PEG)を、それを必要とする動物に投与することを含み、前記PEGは少なくとも5,000ダルトンの平均分子量を有する前記方法。
2. 異常状態が消化管誘導敗血症、熱傷、新生児壊死性全腸炎、激しい好中球減少症、中毒性大腸炎、炎症性腸疾患、腸疾患、移植片拒絶、嚢炎及びピッグベリーからなる群より選ばれる、上記1記載の方法。
3. 前記動物がイヌ、ネコ、ヒツジ、ヤギ、雌ウシ、ブタ、ニワトリ、ウマ及びヒトからなる群より選ばれる、上記1記載の方法。
4. 前記動物がヒトである、上記3記載の方法。
5. 前記PEGが少なくとも15,000ダルトンの平均分子量を有する、上記1記載の方法。
6. 前記PEGが5,000〜20,000ダルトンの平均分子量を有する、上記5記載の方法。
7. 前記PEGが10〜20%のPEGを含む水溶液である、上記1記載の方法。
8. 前記水溶液が10%のPEGを含む、上記7記載の方法。
9. 腸管病原体におけるPA-Iレクチン/付着因子発現の抑制方法であって、有効量のポリエチレングリコール(PEG)を、それを必要とする動物に投与することを含み、前記PEGは少なくとも5,000ダルトンの平均分子量を有する前記方法。
10. 前記PEGが少なくとも15,000ダルトンの平均分子量を有する、上記9記載の方法。
11. PA-Iレクチン/付着因子の腸誘導活性化の抑制方法であって、有効量のポリエチレングリコール(PEG)を、それを必要とする動物に投与することを含み、前記PEGは少なくとも5,000ダルトンの平均分子量を有する前記方法。
12. 前記PEGが少なくとも15,000ダルトンの平均分子量を有する、上記11記載の方法。
13. 腸管病原体のC4-HSL-誘導形態的変化の抑制方法であって、有効量のポリエチレングリコール(PEG)を、それを必要とする動物に投与することを含み、前記PEGは少なくとも5,000ダルトンの平均分子量を有する前記方法。
14. 前記PEGが少なくとも15,000ダルトンの平均分子量を有する、上記13記載の方法。
15. 腸管病原体におけるビルレンス発現の低減方法であって、有効量のポリエチレングリコール(PEG)を、それを必要とする動物に投与することを含み、前記PEGは少なくとも5,000ダルトンの平均分子量を有する前記方法。
16. 前記PEGが少なくとも15,000ダルトンの平均分子量を有する、上記16記載の方法。
17. 病原集団感知活性化の形成を防止することによる腸管発病の改善方法であって、有効量のポリエチレングリコール(PEG)を、それを必要とする動物に投与することを含み、前記PEGは少なくとも5,000ダルトンの平均分子量を有する前記方法。
18. 前記PEGが少なくとも15,000ダルトンの平均分子量を有する、上記17記載の方法。
19. 哺乳類の腸管への細菌細胞接着の抑制方法であって、腸管をポリエチレングリコール(PEG)と接触させることを含み、前記PEGは少なくとも5,000ダルトンの平均分子量を有する前記方法。
20. 前記細菌細胞がシュードモナスである、上記19記載の方法。
21. シュードモナスが緑膿菌である、上記20記載の方法。
22. 前記PEGが少なくとも15,000ダルトンの平均分子量を有する、上記19記載の方法。
23. 細菌細胞におけるPA-Iレクチン/付着因子発現の低減方法であって、細菌細胞をポリエチレングリコール(PEG)と接触させることを含み、前記PEGは少なくとも5,000ダルトンの平均分子量を有する前記方法。
24. 前記PEGが少なくとも15,000ダルトンの平均分子量を有する、上記23記載の方法。
25. 微生物媒介上皮疾患を示す動物における死亡確率の低減方法であって、有効量のポリエチレングリコール(PEG)を投与して哺乳類の腸管上皮細胞と細菌細胞の相互作用を抑制することを含み、前記PEGは少なくとも5,000ダルトンの平均分子量を有する前記方法。
26. 微生物媒介上皮疾患が消化管誘導敗血症、熱傷、新生児壊死性全腸炎、激しい好中球減少症、中毒性大腸炎、炎症性腸疾患、腸疾患、移植片拒絶及び嚢炎からなる群より選ばれる、上記25記載の方法。
27. 前記PEGが組織分布的に非対称様式で腸管上皮細胞又は細菌細胞に付着する、上記25記載の方法。
28. 前記PEGが少なくとも15,000ダルトンの平均分子量を有する、上記25記載の方法。
29. 細菌細胞が腸管病原体であり、腸管病原体の増殖特性の検出可能な程度の変更がない、上記25記載の方法。
30. さらに、デキストラン、デキストランコートL-グルタミン及びデキストランコートイヌリンからなる群から選ばれた有効量の化合物を前記動物の腸管に導入することを含む、上記25記載の方法。
31. さらに、有効量のL-グルタミンを前記動物の腸管に導入することを含む、上記25記載の方法。
32. 少なくとも15,000ダルトンの平均分子量を有するポリエチレングリコール及び適したアジュバント、キャリア又は希釈剤を含む医薬組成物。
33. さらに、デキストラン、L-グルタミン、デキストランコートL-グルタミン、デキストランコートイヌリン、デキストランコート酪酸、フラクトオリゴ糖、N-アセチル-D-ガラクトサミン、デキストランコートマンノース、ガラクトース及びラクツロースからなる群から選ばれる化合物を含む、上記32記載の医薬組成物。
34. 上記32記載の医薬組成物及び異常状態の治療上の処置又は予防における前記組成物の使用方法を記載したプロトコールを含む消化管誘導敗血症の治療上の処置又は予防用キット。
35. 疾病又は異常状態の予防方法であって、有効量のポリエチレングリコール(PEG)を含む組成物を動物に投与することを含み、前記PEGは少なくとも5,000ダルトンの平均分子量を有する前記方法。
36. 前記疾患又は異常状態が水泳者耳、急性中耳炎、慢性中耳炎、人工呼吸器関連の肺炎、消化管誘導敗血症、壊死性全腸炎、抗生物質誘導下痢、偽膜性大腸炎、炎症性腸疾患、過敏性腸疾患、好中球減少性全腸炎、膵炎、慢性疲労症候群、生命異常症候群、顕微鏡的大腸炎、慢性尿路感染症、性感染症及び感染症からなる群より選ばれる、上記35記載の方法。
37. 前記動物がイヌ、ネコ、ヒツジ、ヤギ、雌ウシ、ブタ、ニワトリ、ウマ及びヒトからなる群より選ばれる、上記36記載の方法。
38. 前記動物がヒトである、上記37記載の方法。
39. 前記PEGが少なくとも15,000ダルトンの平均分子量を有する、上記35記載の方法。
40. 前記PEGが15,000〜20,000ダルトンの平均分子量を有する、上記35記載の方法。
41. 前記PEGが10〜20%のPEGを含む水溶液である、上記35記載の方法。
42. 前記水溶液が10%のPEGを含む、上記41記載の方法。
43. 前記組成物がさらに溶液、局所用ゲル及び噴霧に適した溶液からなる群より選ばれる媒体を含む、上記35記載の方法。
44. 前記組成物がさらにデキストランコートL-グルタミン、デキストランコートイヌリン、デキストランコート酪酸、フラクトオリゴ糖、N-アセチル-D-ガラクトサミン、デキストランコートマンノース、ガラクトース及びラクツロースからなる群より選ばれる化合物を含む、上記35記載の方法。
45. 前記組成物がさらにデキストランコートL-グルタミン、デキストランコートイヌリン、デキストランコート酪酸、フラクトオリゴ糖、N-アセチル-D-ガラクトサミン、デキストランコートマンノース、ガラクトース及びラクツロースを含む、上記35記載の方法。
46. 有効量のポリエチレングリコール(PEG)を含む組成物を動物に適用する工程を含む皮膚感染症の予防方法であって、前記PEGは少なくとも5,000ダルトンの平均分子量を有する前記方法。
47. 前記組成物がさらに軟膏、クリーム、ゲル及びローションからなる群より選ばれる媒体を含む、上記46記載の方法。
48. 前記感染症を生じる媒介物が炭疽菌、痘瘡ウイルス、病原性大腸菌(EPEC)、腸管出血性大腸菌(EHEC)、腸管凝集性大腸菌(EAEC)、クロストリジウム・ディフィシル、ロタウイルス、緑膿菌、セラチア菌、クレブシエラ・オキトカ、エンテロバクター・クロアカ、鵞口瘡カンジダ及びカンジダ・グラブラータからなる群より選ばれる、上記46記載の方法。
49. 有効量のポリエチレングリコール(PEG)を動物に投与する工程を含む呼吸器感染の予防方法であって、前記PEGは少なくとも5,000ダルトンの平均分子量を有する、前記方法。
50. 呼吸器感染症が人工呼吸器関連肺炎及び感染症からなる群より選ばれる、上記49記載の方法。
51. 前記感染症を生じる媒介物が炭疽菌及び痘瘡ウイルスからなる群より選ばれる、上記50記載の方法。
52. 慢性尿路感染症を予防するために尿路の少なくとも一部を洗浄する方法であって、ポリエチレングリコール(PEG)を含む有効量の組成物を尿道に投与する工程を含み、前記PEGは少なくとも5,000ダルトンの平均分子量を有する、前記方法。
53. 前記尿路の一部が少なくとも膀胱を含む、上記52記載の方法。
54. ポリエチレングリコール(PEG)をコンドームに適用する工程を含む性感染症の予防方法であって、前記PEGは少なくとも5,000ダルトンの平均分子量を有する、前記方法。
55. ポリエチレングリコール(PEG)でコートした少なくとも一部を有するコンドームであって、前記PEGは少なくとも5,000ダルトンの平均分子量を有する、前記コンドーム。
56. ポリエチレングリコール(PEG)を含む有効量の組成物を、それを必要とする動物に投与することを含む消化管疾患の予防方法であって、前記PEGは少なくとも5,000ダルトンの平均分子量を有する、前記方法。
57. 前記消化管疾患が新生児壊死性全腸炎、抗生物質誘導下痢、偽膜性大腸炎、炎症性腸疾患、過敏性腸症候群、好中球減少性全腸炎、膵炎、生命異常症候群及び顕微鏡的大腸炎からなる群より選ばれる、上記56記載の方法。
58. ポリエチレングリコール(PEG)の、それを必要とする動物への投与をモニターする方法であって、以下を含む前記方法:
(a)標識PEGを含む有効量の組成物を投与すること、前記PEGは少なくとも5,000ダルトンの平均分子量を有する、及び
(b)標識PEGを検出すること。
59. 前記標識がフルオロフォアである、上記58記載の方法。
60. 前記標識PEGの検出が内視鏡検査を含む、上記58記載の方法。
61. 前記標識PEGが便サンプル中で検出される、上記58記載の方法。
62. さらに微生物に特異的な第2の標識を投与し、前記第2の標識を検出することを含む、上記58記載の方法。
63. ポリエチレングリコール(PEG)の、それを必要とする動物への投与をモニターする方法であって、以下を含む前記方法:
(a)ポリエチレングリコールを受け取る動物からサンプルを得ること、前記PEGは少なくとも5,000ダルトンの平均分子量を有する、
(b)前記サンプルを上皮細胞と接触させること、及び
(c)前記サンプル中の微生物の上皮細胞への付着性を測定すること。
64. ポリエチレングリコール(PEG)の、それを必要とする動物への投与をモニターする方法であって、以下を含む前記方法:
(a)ポリエチレングリコールを受け取る動物からサンプルを得ること、前記PEGは少なくとも5,000ダルトンの平均分子量を有する、
(b)前記サンプルから微生物を分離すること、及び
(c)前記微生物の細胞表面の疎水性を測定すること。
65. ポリエチレングリコール(PEG)の、それを必要とする動物への投与をモニターする方法であって、以下を含む前記方法:
ポリエチレングリコールを受け取る動物からサンプルを得ること、前記PEGは少なくとも5,000ダルトンの平均分子量を有する、及び
サンプル中のPA-Iレクチン/付着因子活性を検出すること。
66. PA-Iレクチン/付着因子がPA-Iレクチン/付着因子結合パートナーと結合することによって検出される、上記65記載の方法。
67. PA-Iレクチン/付着因子結合パートナー及びサンプル中のPA-Iレクチン/付着因子を検出するための前記結合パートナーの使用方法を記載したプロトコールを含む上記66記載のポリエチレングリコール(PEG)の投与をモニターするためのキット。
68. 標識PEG及びその投与のモニターにおける標識PEGの使用方法を記載したプロトコールを含むポリエチレングリコールの投与をモニターするためのキット。
69. 乳出力に影響を及ぼす微生物媒介疾患の発生のリスクがある乳腺の上皮表面を示す動物における泌乳容量の損失の予防方法であって、有効量のポリエチレングリコール(PEG)を乳腺の上皮表面に投与することを含み、前記PEGは少なくとも5,000ダルトンの平均分子量を有する、前記方法。
70. 前記PEGが少なくとも15,000ダルトンの平均分子量を有する、上記69記載の方法。
71. 授乳年齢の動物における微生物媒介上皮疾患の発生の予防方法であって、有効量のポリエチレングリコール(PEG)を前記動物に投与することを含み、前記PEGは少なくとも5,000ダルトンの平均分子量を有する、前記方法。
72. 前記PEGが少なくとも15,000ダルトンの平均分子量を有する、上記71記載の方法。
73. 前記PEGが乳児用調合乳との混合物である、上記71記載の方法。
74. 乳児用調合乳及びポリエチレングリコール(PEG)を含む組成物であって、前記PEGは少なくとも5,000ダルトンの平均分子量を有する、前記組成物。
75. 前記PEGが少なくとも15,000ダルトンの平均分子量を有する、上記73記載の方法。
【特許請求の範囲】
【請求項1】
有効量のポリエチレングリコール(PEG)を、それを必要とする動物に投与することによって微生物媒介疾患の発生のリスクがある上皮表面を含む異常状態の動物における死亡確率の低減する薬剤を製造するためのポリエチレングリコール(PEG)の使用であって、前記PEGは少なくとも15,000ダルトンの平均分子量を有する前記使用。
【請求項1】
有効量のポリエチレングリコール(PEG)を、それを必要とする動物に投与することによって微生物媒介疾患の発生のリスクがある上皮表面を含む異常状態の動物における死亡確率の低減する薬剤を製造するためのポリエチレングリコール(PEG)の使用であって、前記PEGは少なくとも15,000ダルトンの平均分子量を有する前記使用。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】




【図2】


【図3】


【図4】


【図5】


【図6】


【公開番号】特開2011−12075(P2011−12075A)
【公開日】平成23年1月20日(2011.1.20)
【国際特許分類】
【出願番号】特願2010−226022(P2010−226022)
【出願日】平成22年10月5日(2010.10.5)
【分割の表示】特願2004−555237(P2004−555237)の分割
【原出願日】平成14年11月26日(2002.11.26)
【出願人】(501242712)ザ ユニヴァーシティー オヴ シカゴ (19)
【Fターム(参考)】
【公開日】平成23年1月20日(2011.1.20)
【国際特許分類】
【出願日】平成22年10月5日(2010.10.5)
【分割の表示】特願2004−555237(P2004−555237)の分割
【原出願日】平成14年11月26日(2002.11.26)
【出願人】(501242712)ザ ユニヴァーシティー オヴ シカゴ (19)
【Fターム(参考)】
[ Back to top ]

