微生物検出装置、検出方法、及びそれに用いられる試料容器
【課題】多量のサンプル中に含まれる少数の微生物を迅速・高精度・高感度・簡便に検出・定量する。
【解決手段】上層の第一層116を親水性メンブレンフィルターとして、その下に、湿潤剤を用いずにかつ陰圧を生じさせることで水溶液のろ過が可能な疎水性メンブレンフィルター117を第二層として有する二層構造メンブレンフィルター101を底部に備えた試料容器102を用い、吸引部105により生じる陰圧によって、多量のサンプル水溶液をろ過し、サンプル水溶液中の微生物を親水性メンブレンフィルターで捕捉する。また陰圧から常圧にした後、微生物溶解液を加えて、一定時間微生物溶解液を疎水性メンブレンフィルター上で保持する。その後、発光試薬114の入った反応容器113に分注して、発光を検出することで微生物を検出する。
【解決手段】上層の第一層116を親水性メンブレンフィルターとして、その下に、湿潤剤を用いずにかつ陰圧を生じさせることで水溶液のろ過が可能な疎水性メンブレンフィルター117を第二層として有する二層構造メンブレンフィルター101を底部に備えた試料容器102を用い、吸引部105により生じる陰圧によって、多量のサンプル水溶液をろ過し、サンプル水溶液中の微生物を親水性メンブレンフィルターで捕捉する。また陰圧から常圧にした後、微生物溶解液を加えて、一定時間微生物溶解液を疎水性メンブレンフィルター上で保持する。その後、発光試薬114の入った反応容器113に分注して、発光を検出することで微生物を検出する。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、微生物検出装置、検出方法、及びそれに用いられる試料容器に関する。
【背景技術】
【0002】
微生物の検出や微生物数の定量は、製薬工場や食品工場、再生医療施設などにおいて、製品への微生物汚染を未然に防ぐ安全衛生管理として実施されている。特に微生物数の定量は、日本薬局方の規定により、製薬工場において製品や原料に対して実施されると共に、製薬工場内の空気や壁表面、作業者手袋表面などで実施されている。また微生物数の定量は、食品工場においてもHACCP(Hazard Analysis and Critical Control Point)の導入により、食品工場自体や作業行程の検査として、食品と共に壁表面や床面、まな板表面や包丁表面などの調理器具においても実施されている。
【0003】
微生物数の定量方法は培養法が一般的である。培養法は、サンプルが液体の場合、直接サンプルを寒天平板培地に塗り、またサンプルが液体以外の場合、微生物を洗い出した液体を培地に塗り、培地上で微生物を培養し、1個の微生物が1個のコロニーを形成することを利用して、形成したコロニー数を数える微生物数の定量方法である。
【0004】
また、メンブレンフィルターを使用して微生物数を定量するメンブレンフィルター(Membrane Filter, MF)法も一般的である。MF法は、サンプルをメンブレンフィルターでろ過して微生物を捕捉し、微生物を捕捉したメンブレンフィルターを平板寒天培地上に置いて培養し、コロニー数を数えて定量する方法である。また培養しない場合は、微生物を捕捉したメンブレンフィルター上に、微生物内からアデノシン三リン酸(Adenosine Triphosphate, ATP)を抽出するATP抽出試薬と、ルシフェラーゼとルシフェリンを含む発光試薬を霧状に噴霧することで、ATPがルシフェラーゼとルシフェリンと反応して生じる発光輝点をCCD(Charge Coupled Device)カメラで撮り微生物数を定量する方法がある(特許文献1)。
【先行技術文献】
【特許文献】
【0005】
【特許文献1】特願平9−317792号公報
【発明の概要】
【発明が解決しようとする課題】
【0006】
従来の培養法は、微生物を含むサンプルを寒天平板培地上に塗るため、サンプル量は約1mLが上限となる課題がある。従って、サンプル量が多く微生物数が少ない場合は定量が困難である。また、定量結果を得るまで24〜72時間の培養を必要とする課題がある。その結果、製薬や食品、生細胞等の搬出の段階で定量結果を待たなければならず、安全性や効率性、経済性おいて大きな損失が生じるため、微生物数の定量に要する時間短縮が求められている。
【0007】
また従来のMF法は、微生物を捕捉したメンブレンフィルターと培地間に空気が入るなどして完全に密着しないと、培地の栄養分が微生物まで行き渡りにくく、微生物の増殖速度が一定にならないことでコロニーの大きさがばらつき、定量精度が低下する課題がある。またMF法は、メンブレンフィルターに捕捉した微生物へATP抽出試薬を噴霧するが、噴霧した抽出試薬がメンブレンフィルターに染み込んだサンプルや緩衝液によって希釈されたり、抽出液量に対し微生物の細胞壁が強固であったりすると、抽出効率が減少し、定量感度が低下する。
【0008】
本発明は、多量のサンプル中に含まれる少数の微生物を迅速・高精度・高感度・簡便に検出・定量するものである。
【課題を解決するための手段】
【0009】
我々は、多量のサンプル中に含まれる少数の微生物を迅速・高精度・高感度・簡便に検出して定量する装置と方法を提供するため、微生物を含むサンプルをメンブレンフィルターでろ過し、十分量の微生物溶解液で微生物を溶解し、微生物由来の生体物質を指標に、発光反応もしくは蛍光反応で検出する装置と方法の開発を試みた。その過程においてまず、以下の課題を見出した。
【0010】
微生物を含むサンプルを多孔性親水性メンブレンフィルターでろ過すると、微生物の直径がメンブレンフィルターの孔径よりも明らかに大きい場合、微生物はメンブレンフィルター表面に捕捉されるが、微生物の直径がメンブレンフィルターの孔径に近い場合、微生物はメンブレンフィルターの中に入り込むことで捕捉されることがわかった。微生物がメンブレンフィルター内に捕捉された状態で、メンブレンフィルター上に微生物溶解試薬(例:ATP抽出試薬)を加えると、微生物はメンブレンフィルター内で溶解され、抽出した生体物質(例:ATP)の多くはメンブレンフィルター内に留まることがわかった。このような状態で、抽出したATPをATP抽出試薬と共にメンブレンフィルター上から生物発光試薬(例:ルシフェラーゼ・ルシフェリン)の入った容器に移して発光測定を試みると、メンブレンフィルター内に留まったATPは損失となって発光量が減少するため、定量性は低下することがわかった。
【0011】
そこで、親水性メンブレンフィルター上に抽出試薬を加えて一定時間静置もしくは攪拌することで、ATPをメンブレンフィルター内から遊離させる方法も試みた。しかし、その場合には、ATPがメンブレンフィルター内から遊離する前にATPが抽出試薬共々、メンブレンフィルター下に染み落ちてしまい、遊離が困難となることがわかった。
【0012】
また、ATP抽出試薬がメンブレンフィルターから染み落ちないように、親水性メンブレンフィルターの代わりに、水溶液に対し非浸透の疎水性メンブレンフィルターを用いる方法を試みた。まず、疎水性メンブレンフィルターで微生物を含むサンプル水溶液をろ過する場合、湿潤剤(例:メチルアルコールやエチルアルコールなどのアルコール類やジエチルエーテルなどのエーテル類)を疎水性メンブレンフィルターに染み込ませなければならない。しかし、湿潤剤は微生物を溶解したり損傷させたりし、また湿潤剤がろ過中にメンブレンフィルターから溶出すると、ろ過性能が悪くなる。従って、疎水性メンブレンフィルターに湿潤剤を染み込ませてろ過する手法は、微生物の検出・定量及び微生物の生死判別には困難なことがわかった。
【0013】
本発明は、このような我々が見出した課題と従来の課題を解決するものである。我々は、疎水性メンブレンフィルターであっても、孔径の大きさによって、メンブレンフィルター下に陰圧を生じさせることで、湿潤剤を用いずにサンプル水溶液をろ過でき、また疎水性メンブレンフィルター下が常圧の場合、抽出試薬がメンブレンフィルター下に染み落ちないことを見出した。疎水性メンブレンフィルターによる水溶液のろ過は、孔径がある一定の大きさ以上で可能であり、ある微生物の大きさがその孔径より小さいと、その微生物の捕捉は困難となる。そこで、疎水性メンブレンフィルター上に微生物を捕捉するための微小孔径かつ多孔性の親水性メンブレンフィルターを設けることで、多量の水溶液のろ過が可能で、また微生物の捕捉が可能で、加えて微生物溶解液の保持が可能な、二層構造メンブレンフィルターを開発した。
【0014】
本発明の微生物検出装置は、上層の第一層を親水性メンブレンフィルターとして、その下に、湿潤剤を用いずにかつ陰圧を生じさせることで水溶液のろ過が可能な疎水性メンブレンフィルターを第二層として有する二層構造メンブレンフィルターを底部に備えた試料容器を用い、試料容器の二層構造メンブレンフィルターの下に吸引部を設けた構成を有する。二層構造のメンブレンフィルターの第一層の親水性メンブレンフィルターは微生物を捕捉する役割をし、第二層の疎水性メンブレンフィルターは試薬を保持する役割をする。
【0015】
そして本発明によれば、吸引部により生じる陰圧によって、第一層親水性メンブレンフィルターと第二層疎水性メンブレンフィルターを通じた多量のサンプル水溶液のろ過が可能であり、サンプル水溶液中の微生物を溶解させたり損傷させたりすることなく第一層親水性メンブレンフィルターで捕捉できる。また陰圧から常圧にした後、微生物溶解液を加えて、一定時間微生物溶解液をメンブレンフィルター下から染み落とすこと無く、第二層疎水性メンブレンフィルター上で保持することが可能となる。そして本発明によれば、第一層親水性メンブレンフィルターに捕捉した微生物の溶解が可能であり、かつ、第一層親水性メンブレンフィルター内の微生物由来生体物質を、第一層親水性メンブレンフィルター上に遊離することが可能である。
【0016】
第一層親水性メンブレンフィルターの孔径は0.05μm〜0.65μmが好ましく、第二層疎水性メンブレンフィルターの孔径は0.8μm〜80μmが好ましい。第一層親水性メンブレンフィルターの孔径を0.05μm〜0.65μmとすることで、第一層親水性メンブレンフィルターに微生物を確実に捕捉することができ、第二層疎水性メンブレンフィルターの孔径を0.8μm〜80μmとすることで、湿潤剤を用いずかつ陰圧を生じさせることでサンプル水溶液のろ過を可能にし、かつ陰圧から常圧にすることで、微生物溶解液を疎水性メンブレンフィルター上に保持することが可能になる。
【0017】
本発明の微生物検出方法は、サンプル水溶液中に微生物外の生体物質を分解する第一試薬を加えることで微生物外の生体物質を分解し、サンプル水溶液を二層構造メンブレンフィルターで吸引ろ過することにより、微生物を第一層親水性メンブレンフィルターに捕捉すると共にサンプル水溶液中に含まれる第一試薬や異物を除去する。その後、微生物内生体物質を抽出する第二試薬を加えて、第二層疎水性メンブレンフィルター上で保持することで、微生物から生体物質を抽出し、かつ、第一層親水性メンブレンフィルター内から生体物質を遊離し、遊離した生体物質と反応する第三試薬を作用させることで微生物を定量測定する。ここで、第二試薬としては、疎水性メンブレンフィルターを湿潤することのない試薬を用いる。
【発明の効果】
【0018】
本発明は、多量のサンプル水溶液のろ過が容易であり、微生物の溶解が確実にでき、微生物から抽出した生体物質をメンブレンフィルターから容易に溶離できる微生物検出装置と微生物検出方法を提供する。また、培養することなく、微生物の生死判別と生細胞の定量を、熟練を要することなく高感度で高精度、迅速、簡便に定量できる微生物検出装置及び微生物検出方法を提供する。
【図面の簡単な説明】
【0019】
【図1】本発明による微生物検出装置の一例の一部断面摸式図。
【図2】微生物検出の処理手順を示すフロー図。
【図3】本発明による微生物検出装置の一例の一部断面摸式図。
【図4】本発明による微生物検出装置の一例の一部断面摸式図。
【図5】本発明による微生物検出装置の一例の一部断面摸式図。
【図6】本発明による微生物検出装置の一例の一部断面摸式図。
【図7】容器底部への二層構造メンブレンフィルターの取り付け方の例を示す図。
【図8】容器底部への二層構造メンブレンフィルターの取り付け方の例を示す図。
【図9】本発明による二層構造メンブレンフィルターを用いた検出方法の途中工程を示す模式図。
【図10】単層親水性メンブレンフィルターを用いた検出方法の途中工程を示す模式図。
【図11】吸引ろ過の説明図。
【図12】二層構造メンブレンフィルター用いた際の横軸を大腸菌数とATP数の関係を示す図。
【図13】各種条件で検出されたATP数を示す図。
【図14A】二層構造メンブレンフィルターの微生物溶解液保持能力測定実験の説明図。
【図14B】単層親水性メンブレンフィルターの微生物溶解液保持能力測定実験の説明図。
【図15】二層構造メンブレンフィルター内のATP分子の溶離実験の説明図。
【図16】単層親水性メンブレンフィルター内のATP分子の溶離実験の説明図。
【図17】単層親水性メンブレンフィルター上に残っている微生物溶解液と、染み落ちた微生物溶解液の発光量の経時変化を示す図。
【図18】二層構造メンブレンフィルター上の微生物溶解液の発光量の経時変化を示す図。
【発明を実施するための形態】
【0020】
以下に、本発明の実施の形態を、図面を用いて説明する。だだし、以下の説明は本発明を何ら限定するものではない。
[実施例1]
(微生物の検出装置と方法)
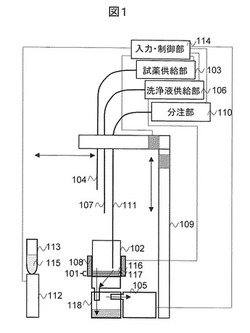
図1は、本発明による微生物検出装置の一例の一部断面摸式図である。微生物検出装置は、二層構造メンブレンフィルター101を底部に備える容器102と、試薬供給部103、試薬供給用配管104、吸引部105、洗浄液供給部106、洗浄液供給用配管107、加熱部108、アーム109、分注部110、分注用配管111、検出部112、反応容器113、入力・制御部114を有する。入力・制御部114は装置各部の動作を統括制御する。容器102は装置に対して着脱自在である。また、反応容器113には発光試薬115が入っている。
【0021】
二層構造メンブレンフィルター101は、上層の第一層が親水性メンブレンフィルター116であり、下層の第二層が疎水性メンブレンフィルター117である。第一層親水性メンブレンフィルター116は、微生物を確実に捕捉するため孔径が0.05μm 〜0.65μmとする。また厚みが7μm〜200μmとし、もちろんこの厚みより薄くても厚くても構わないが、しかしこれより薄いとメンブレンフィルターの機械的な強度が弱くなり、ろ過中にメンブレンフィルターが破断することが予想され、これより厚いとメンブレンフィルター中に多くの溶液が残り、この後に追加する各種試薬が希釈されることが予想される。従って厚みは7μm〜200μmが好ましい。第二層疎水性メンブレンフィルター117は、水溶液を確実にろ過するため、孔径を0.8μm〜180μmとする。また厚みが7μm〜800μmとし、もちろんこの厚みより薄くても厚くても構わないが、しかしこれより薄いとメンブレンフィルターの機械的な強度が弱くなり、ろ過中にメンブレンフィルターが破断することが予想され、これより厚いと吸引ろ過に時間がかかることが予想される。従って厚みは7μm〜800μmが好ましい。
【0022】
図2は、図1に示した微生物検出装置による微生物検出の処理手順を示すフロー図である。なお、図3〜6は、本発明の微生物検出装置の別の形態であり、ともに説明する。
【0023】
装置に、二層構造メンブレンフィルター101を底部に備える容器102を設置し、最初に入力・制御部114に、サンプルの粘性の高低や芽胞状態枯草菌の測定可否の初期値を入力し、微生物検出を開始する(S201)。容器102に測定対象微生物を含むサンプル水溶液を入れる(S202)。入力・制御部114は、ステップ203の判定でサンプル水溶液の粘性が高いと判定された場合、速やかなろ過を促すため加熱部108を駆動してサンプル水溶液を加熱する(S204)。ステップ201で入力されたサンプルの粘性が低い場合には、加熱工程を省略してステップ205に進む。
【0024】
次に、試薬供給部103から試薬供給用配管104を通じて、微生物外生体物質分解試薬を、容器201内のサンプル水溶液に供給する(S205)。微生物外生体物質分解試薬としては、例えばATP分解酵素、又はDNA(DeoxyriboNucleic Acid)分解酵素やRNA(RiboNucleic Acid)分解酵素が用いられる。
【0025】
なお、図3に示すように、微生物検出装置が試薬供給部の代わりに各種の試薬301を収容した試薬槽302を備えている場合、分注部110が分注用配管111を通じて試薬槽302内の微生物外生体物質分解試薬をサンプル水溶液へ分注するように構成してもよい。図1に示した試薬供給部103を有する装置は、1日に多数のサンプルを測定する用途に適し、図3に示した試薬槽を備える装置は、少数のサンプルを測定する用途に適している。
【0026】
次に、吸引部105によって陰圧を生じさせることで、二層構造メンブレンフィルター101を通して容器102内のサンプル水溶液をろ過する。この時、水溶液中の微生物は第一層親水性メンブレンフィルターに捕捉され、生体物質分解試薬や残存生体物質は廃液部118に流入して除かれる。その後、二層構造メンブレンフィルター101を洗浄する目的で、洗浄液供給部106から洗浄液を供給する(S206)。また、サンプル水溶液の粘性が高い場合、粘性を下げる目的で、洗浄液供給部106から洗浄液供給用配管107を通じて洗浄液を加えてもよい。同様に粘性を下げる目的で、加熱部108によって洗浄液を加熱してサンプル水溶液に加えてもよい。
【0027】
次にステップ207の判定で、測定対象微生物が芽胞もしくは胞子を形成していると判断された場合、ろ過後、試薬供給部103から栄養型細胞変換試薬を加える(S208)。栄養型細胞変換試薬として用いられるのは、例えばアラニンやグルコース、リン酸の組み合わせであるが、液体培地を用いてもよい。なお図3のように、微生物検出装置が各種試薬槽302を備えている場合、分注部110によって試薬槽302内の栄養型細胞変換試薬をサンプル水溶液へ分注する。また、栄養型細胞変換を促すため加熱部108によって栄養型細胞変換試薬を加熱してもよい(S209)。また、栄養型細胞変換試薬を除く目的で、ろ過してもよい(S210)。ステップ207の判定がNoの場合、ステップ208からステップ210の処理を省略してステップ211に進む。
【0028】
次に、試薬供給部103から微生物溶解液を加えて、微生物溶解液を二層構造メンブレンフィルター101上に保持する(S211)。微生物溶解液としては、例えば塩化ベンザルコニウムやトリクロロ酢酸、トリス緩衝液が用いられる。図3のように、微生物検出装置が各種試薬槽302を備えている場合には、分注部110によって試薬槽302内の微生物溶解液をサンプル水溶液へ分注する。
【0029】
次に、容器102の二層構造メンブレンフィルター101上の微生物溶解液を分注部110の分注用配管111を通じて吸引し、アーム109を駆動して分注用配管111を検出部112の反応容器113上に移動し、微生物溶解液を反応容器113に移す(S212)。反応容器113内には発光試薬115が納められており、発光試薬115は微生物溶解液中に含まれる生体物質(例えばATP、ルミノール、アルカリホスファターゼ)と反応して発光を生じる。発光試薬115は、例えばルシフェラーゼ・ルシフェリンである。なおペルオキシダーゼやアルカリホスファターゼの基質を用いてもよい。その場合には、動物細胞の検出も可能になる。
【0030】
なお、図4や図5に示す例のように、微生物検出装置が容器102の側面や下部に検出部112を備えている場合、試薬供給部103によって発光試薬を容器102の二層構造メンブレンフィルター101上に直接供給して、発光を生じさせてもよい。図5に示す微生物検出装置の例の場合、二層構造メンブレンフィルター101が底部全面ではなく一部領域に装着され、底部に透明領域が設けられている容器を用いる。検出部112は、その容器底部の透明領域に対向して配置され、容器内の溶液中の発光反応によって生じる発光を検出する。また、図6の装置例のように、微生物検出装置が励起光照射部601を備えている場合、発光試薬を用いなることなく、励起光照射部601から励起光を生体物質(例えばDNAやRNA、NAD、Nicotinamide Adenine Dinucleotide)に照射することで蛍光を生じさせてもよい。
【0031】
生じた発光や蛍光は検出部112によって検出され(S213)、検出された発光量や蛍光量から微生物数が算出され(S214)、微生物検出が終了する。
【0032】
なお、図2に示す処理工程において、ステップ207からステップ210の処理を省略して、ステップ206からステップ211に進み、ステップ213において発光測定すると、サンプル中に含まれる栄養型細胞数を検出することができる。また、ステップ206の後、ステップ208からステップ214の処理を経ることで非栄養型細胞数を検出することができる。このように、ステップ208からステップ210を省略した処理を実行して栄養型細胞数を検出した後、ステップ208に戻ってステップ214まで処理を反復することにより、サンプルに含まれる栄養型細胞数と非栄養型細胞数を区別して検出することができる。
【0033】
[実施例2]
(微生物検出実験1:大腸菌)
本発明による二層構造メンブレンフィルターを備える容器と、従来の親水性メンブレンフィルターを備える容器による大腸菌の検出感度を比較した。
【0034】
二種類のメンブレンフィルターつき容器を用意した。1つは、底部に二層構造メンブレンフィルター101を備える容器102であり、他の一つは底部に親水性メンブレンフィルターのみを備える容器である。
【0035】
図7により、容器底部への二層構造メンブレンフィルターの取り付け方の例を説明する。二層構造メンブレンフィルター101は、上層の第一層が親水性メンブレンフィルター116、下層の第二層が疎水性メンブレンフィルター117で構成される。親水性メンブレンフィルター116には、孔径0.45μm、厚さ150μm、空隙率79%のMF−ミリポアメンブレンフィルター(日本ミリポア)を使用し、直径を0.5cmに加工した。なお、親水性メンブレンフィルターは、DuraporeメンブレンフィルターやIsopreメンブレンフィルター(日本ミリポア)でもよい。疎水性メンブレンフィルター117には孔径10μmのマイテックスメンブレンフィルター(日本ミリポア)を使用し、直径を0.5cmに加工した。なお、疎水性メンブレンフィルターは、ポリプロピレンプレフィルター、孔径30μm(日本ミリポア)でもよい。また材質がナイロン、ポリテトラフルオロエチレン、疎水性であるポリビニリデンフロライド、ポリエチレン、ポリシロキサン、ポリカーボネート、ポリスルホン、ポリアミド、ガラスファイバーで、孔径が0.8μm〜80μmのメンブレンフィルター、もしくはメッシュ構造でピッチサイズが1μm〜59μmであってもよい。
【0036】
図7(a)に示すように、加工した親水性メンブレンフィルター116と疎水性メンブレンフィルター117を重ね、容器102の底部801に設けた装着部に装着し、環状の蓋802でフィルターの周縁部押さえ、図7(b)に示すように、ネジ803で締める事で組み立てを完了した。なお、フィルターの固定はネジ式の蓋によって行ってもよい。例えば、図8(a)に示すように、加工した親水性メンブレンフィルター116と疎水性メンブレンフィルター117を重ね、容器102のネジ様溝を持つ底部901とネジ様溝を持つ環状の蓋902の間に挟み込み、図8(b)に示すように、底部901と蓋902で締めることで組み立てもよい。なお、第一層親水性メンブレンフィルターと第二層疎水性メンブレンフィルターの間には隙間があってもよい。
【0037】
親水性メンブレンフィルターのみを備える容器は、容器の構造は同じであるが、図10(a)に略示するように、二層構造メンブレンフィルターの代わりに単層親水性メンブレンフィルター1001を装着した容器1002である。単層親水性メンブレンフィルター1001には、孔径0.45μm、厚さ150μm、空隙率79%のMF−ミリポアメンブレンフィルター(日本ミリポア)を使用し、直径を0.5cmに加工した。
【0038】
図9は本発明による二層構造メンブレンフィルターを備える容器を用いた検出方法の途中工程を示す模式図、図10は単層親水性メンブレンフィルターを備える容器を用いた検出方法の途中工程を示す模式図である。
【0039】
測定対象微生物として大腸菌を用いた。大腸菌数が20〜2000個/10mLとなるように、大腸菌701をリン酸バッファーpH7.4(インビトロジェン)に懸濁し、大腸菌懸濁液702を作製した。
【0040】
図9(a)及び図10(a)に示すように、まず二層構造メンブレンフィルター101上と単層親水性メンブレンフィルター1001上にそれぞれ大腸菌懸濁液702を10mL加えた。次に、微生物外生体物質除去試薬であるルシフェールHSセット付属のATP消去液を10μL加えた。続いて、図11(a)に示すように、吸引部105の吸引口1101を二層メンブレンフィルター下に接続し、図11(b)に示すように陰圧を生じさせ、大腸菌懸濁液とATP消去液をろ過した。なお単層親水性メンブレンフィルターにおいても同様に大腸菌懸濁液とATP消去液をろ過した。図9(b)及び図10(b)は、ろ過後の状態を示している。ろ過後、微生物溶解液703であるルシフェールHSセット付属のATP抽出液を200μL加えて、図9(c)及び図10(c)に示すように、大腸菌701からATP分子704を抽出した。
【0041】
静置している間、図10(d)に示すように、単層親水性メンブレンフィルター1001下部から微生物溶解液1003が染み落ちてきた。一方、二層構造メンブレンフィルター101では、図9(d)に示すように、変化が観察されなかった。
【0042】
二層構造メンブレンフィルター101と単層親水性メンブレンフィルター1001上に残った微生物溶解液703を、分注部110を用いて検出部112上に設置された反応容器113内にあるルシフェールHSセット付属の発光試薬115に10μL分注した。発光量をATP数に算出した。なお二層構造メンブレンフィルター101について、図12に示すように、縦軸をATP数、横軸を大腸菌数とした図を作成した。
【0043】
二層構造メンブレンフィルターを備える容器を用いた場合、ATP数と大腸菌数は定量的な直線関係 (y=1.4315x−7.9823) を示し、大腸菌1個あたりATP分子数は平均1.4amolを示したが、単層親水性メンブレンフィルターを備える容器を用いた場合、大腸菌100個未満ではATP分子を検出することができず、大腸菌100個でATP分子数は1amolを示し、二層構造メンブレンフィルター101は単層親水性メンブレンフィルター1001に比べて約100倍の値を示した。
【0044】
この結果は、単層親水性メンブレンフィルターを備える容器では微生物溶解液を単層親水性メンブレンフィルター上に保持できないため、微生物溶解液1003が単層親水性メンブレンフィルター下に染み落ちると共に、大腸菌由来ATP分子1004も落ちてしまい、その結果、単層親水性メンブレンフィルター1001上の微生物溶解液に大腸菌由来ATP分子1004が溶離しなかったためと考えられる(図10(d))。
【0045】
その一方で、二層構造メンブレンフィルターを備える容器では、二層構造メンブレンフィルター101上に微生物溶解液703が保持できるため、微生物溶解液703が大腸菌由来ATP分子704と共に二層構造メンブレンフィルター101下に染み落ちることがない。また、第一層親水性メンブレンフィルター116内で大腸菌から抽出されたATP分子704は時間と共に二層構造メンブレンフィルター101上の微生物溶解液に溶離される(図9(d))。
【0046】
本発明の微生物検出装置は、大腸菌1個を高感度、高精度、迅速、簡便に計測できた。なお、大腸菌群やブドウ球菌などの細菌、サッカロミケス・ケレウィシエなどの酵母、アスペルギルス・ニガーなどの真菌に対しても同様の効果が得られる。
【0047】
[実施例3]
(微生物検出実験2:芽胞状態枯草菌)
本発明による二層構造メンブレンフィルターを備える容器と、従来の親水性メンブレンフィルターを備える容器による芽胞状態枯草菌の検出感度を比較した。
【0048】
二種類のメンブレンフィルターつき容器を用意した。1つは、二層構造メンブレンフィルター101を備える容器102、他の一つは親水性メンブレンフィルターのみを備える容器である。容器の構造及び容器への二層構造メンブレンフィルター及び単層親水性メンブレンフィルターの取り付け構造は、図7及び図8にて説明したとおりである。
【0049】
二層構造メンブレンフィルター101は、上層の第一層が親水性メンブレンフィルター116、下層の第二層が疎水性メンブレンフィルター117で構成される。親水性メンブレンフィルター116には、孔径0.45μm、厚さ150μm、空隙率79%のMF−ミリポアメンブレンフィルター(日本ミリポア)を使用し、直径を0.5cmに加工した。なお、親水性メンブレンフィルターは、DuraporeメンブレンフィルターやIsopreメンブレンフィルター(日本ミリポア)でもよい。疎水性メンブレンフィルター117には孔径10μmのマイテックスメンブレンフィルター(日本ミリポア)を使用し、直径を0.5cmに加工した。なお、疎水性メンブレンフィルターは、ポリプロピレンプレフィルター、孔径30μm(日本ミリポア)でもよい。また材質がナイロン、ポリテトラフルオロエチレン、疎水性であるポリビニリデンフロライド、ポリエチレン、ポリシロキサン、ポリカーボネート、ポリスルホン、ポリアミド、ガラスファイバーで、孔径が0.8μm〜80μmのメンブレンフィルター、もしくはメッシュ構造でピッチサイズが1μm〜59μmであってもよい。
【0050】
親水性メンブレンフィルターのみを備える容器に装着した単層親水性メンブレンフィルターには、孔径0.45μm、厚さ150μm、空隙率79%のMF−ミリポアメンブレンフィルター(日本ミリポア)を使用し、直径を0.5cmに加工した。
【0051】
測定対象微生物として芽胞状態の枯草菌を用いた。枯草菌を10%w/vゼラチン溶液+リン酸バッファー(pH7.4)(インビトロジェン)に懸濁して、枯草菌数2000個/10mLとする粘性の高い枯草菌懸濁溶液を調製した。栄養型細胞変換試薬として、100mMアラニン+100mMグルコース+リン酸バッファー(pH7.4)を用いた。微生物外生体物質除去試薬には、ルシフェールHSセット付属のATP消去液を用いた。微生物溶解液には、ルシフェールHSセット付属のATP抽出液を用いた。
【0052】
測定には図3に示した微生物検出装置を用いた。本実施例では、入力・制御部114の入力用にタッチパネルディスプレイを用いた。なお、入力・制御部114はラップトップコンピューターや、デスクトップコンピューター、もしくは入力用ボタンとディスプレイ、入出力用(USB Universal Serial Bus)メモリの組み合わせなどを用いてもよい。
【0053】
まず、枯草菌懸濁液は、ゼラチンを含むことから粘性が高い。また枯草菌懸濁液は、芽胞を形成した菌を含むため、入力・制御部114を用いて、枯草菌懸濁液の粘性が高いこと、芽胞を形成した菌を含むことを入力した。続いて微生物検出の開始を指示した。装置は、図2に示した処理手順に従って検出処理を実行する。
【0054】
二層構造メンブレンフィルター上と単層親水性メンブレンフィルター上に、枯草菌懸濁液をそれぞれ10mL加えた(S202)。入力・制御部114は、入力情報からステップ203の判定で枯草菌懸濁液は粘性が高いと判定し、加熱部108を用いて枯草菌懸濁液を40℃で加熱して粘性を下げた(S204)。
【0055】
枯草菌懸濁液にATP消去液を10μL加えて(S205)、枯草菌懸濁液とATP消去液を、吸引部105が生じる陰圧により二層構造メンブレンフィルター101と単層親水性メンブレンフィルターでそれぞれろ過した(S206)。
【0056】
ろ過後、入力・制御部114は、入力された情報からステップ207の判定で芽胞形成菌が含まれていると判定し、芽胞状態から栄養型細胞に変換するため、栄養型細胞変換試薬1mLを二層構造メンブレンフィルター101上と単層親水性メンブレンフィルター上にそれぞれ加えた(S208)。加熱部108により栄養型細胞変換試薬を40℃もしくは45℃で約1時間加熱し、芽胞状態から栄養型細胞への変換を促した(S209)。1時間後、単層親水性メンブレンフィルターでは、栄養型細胞変換試薬が単層親水性メンブレンフィルター下に染み落ちていたが、二層構造メンブレンフィルター101では栄養型細胞変換試薬が保持されていたため、これを再びろ過した(S210)。
【0057】
続いてATP抽出試薬を200μL加えて10分間静置した(S211)。静置している間、単層親水性メンブレンフィルター下からATP抽出液が染み落ちたが、二層構造メンブレンフィルター101においては変化が観察されなかった。二層構造メンブレンフィルター101と単層親水性メンブレンフィルター上に残ったATP抽出液10μLを、分注部110によって、検出部112上に設置された反応容器113内にある発光試薬115へ分注した(S212)。検出部112は、生じた発光を検出し(S213)、入力・制御部114は発光量からATP数を算出した(S214)。
【0058】
ATP数の検出結果を図13に示す。単層親水性メンブレンフィルターでは枯草菌100個当たりATP数は約10amolであったが、二層構造メンブレンフィルター101では約200amolと見積もられ、約20倍の値を示した。この結果は、単層親水性メンブレンフィルターではATP抽出液を単層親水性メンブレンフィルター上に保持できないため、ATP抽出液が単層親水性メンブレンフィルター下に染み落ちると共に枯草菌由来ATP分子も落ちてしまい、その結果、単層親水性メンブレンフィルター上に枯草菌由来ATP分子が溶離しなかったと考えられる。一方、二層構造メンブレンフィルター101では、ATP抽出液を二層構造メンブレンフィルター101上に保持できるため、ATP抽出液が枯草菌由来ATPと共に二層構造メンブレンフィルター101下に染み落ちない。また、第一層親水性メンブレンフィルター116内の枯草菌由来ATP分子は、時間と共に二層構造メンブレンフィルター110上に溶離されたと考えられる。
【0059】
なお、加熱部108で栄養型細胞変換試薬を加熱しない場合(図13、25℃、室温)は、枯草菌100個当たりのATP数は約10amolであった。
以上のように、本発明の微生物検出装置は、枯草菌を高感度、高精度、迅速、簡便に計測できた。
【0060】
本発明は種々の実験の積み重ねによって完成されたものである。以下に、本発明の基礎となった実験について説明する。
[実験例1]
(水溶液の保持と陰圧で水溶液のろ過が可能な疎水性メンブレンフィルターの調査)
水溶液を保持でき、かつ陰圧でろ過が可能な、疎水性メンブレンフィルターの有無を調べた。
【0061】
調べた疎水性メンブレンフィルターの孔径とピッチサイズ、材質を表1に示す。実験に用いた水溶液は、超純水とリン酸緩衝液、微生物溶解液である。リン酸緩衝液は、50mMリン酸/NaOH緩衝液pH7.4である。微生物溶解液は0.2%塩化ベンザルコニウム+25mMトリシン緩衝液pH12である。
【表1】

【0062】
各疎水性メンブレンフィルター上に各水溶液を滴下して、水溶液の保持能を調べた(表1)。その結果、すべての材質において水溶液を保持し、染み落ちることがなかった。
【0063】
また各水溶液に対して各疎水性メンブレンフィルターの陰圧によるろ過の可否について調べた(表1)。その結果、疎水性メンブレンフィルターは、孔径が0.8μm〜80μmで、常圧では水溶液に対し非浸透で、陰圧にすると水溶液のろ過が可能であった。孔径が0.6μm以下になると陰圧によるろ過は困難となり、孔径0.45μmではろ過はできなかった。加えて、メッシュ構造の疎水性メンブレンフィルターは、ピッチサイズ1μm〜59μmで水溶液を保持し、また陰圧でろ過可能であった。
【0064】
また孔径が0.8μm〜80μm又はピッチサイズ1μm〜59μmの疎水性メンブレンフィルターの上に孔径が0.05μm〜0.65μmの親水性メンブレンフィルターをのせた二層構造メンブレンフィルターを作製し、二層構造メンブレンフィルター上に水溶液を加えてろ過を試みたところ、二層構造メンブレンフィルターでも水溶液のろ過は可能であった。
【0065】
[実験例2]
(二層構造メンブレンフィルターの微生物溶解液保持能力の測定実験)
二層構造メンブレンフィルターと単層親水性メンブレンフィルターの微生物溶解液保持能力を比較するため、二種類のメンブレンフィルターを底部に備えた容器を用意した。
【0066】
1つは、二層構造メンブレンフィルター101を備える容器102である(図14A(a))。二層構造メンブレンフィルター101は上層の第一層が親水性メンブレンフィルター116、下層の第二層が疎水性メンブレンフィルター117で構成される。第一層親水性メンブレンフィルター116には、孔径0.45μm、厚さ150μm、空隙率79%のMF−ミリポアメンブレンフィルター(日本ミリポア)を使用し、直径を0.5cmに加工した。第二層疎水性メンブレンフィルター117には孔径10μmのマイテックスメンブレンフィルター(日本ミリポア)を使用した。
【0067】
もう1つは、親水性メンブレンフィルターのみで構成される単層親水性メンブレンフィルター1001を備える容器1002である(図14B(a))。単層親水性メンブレンフィルター1001には、孔径0.45μm、厚さ150μm、空隙率79%のMF−ミリポアメンブレンフィルター(日本ミリポア)を使用し、直径を0.5cmに加工した。
【0068】
二層構造メンブレンフィルター101上と単層親水性メンブレンフィルター1001上にそれぞれ微生物溶解液703として、0.2%塩化ベンザルコニウム+25mMトリシン緩衝液pH12を200μL加えて10分間静置した。5分間、10分間の静置後、二層構造メンブレンフィルター101で変化は観察されなかったが(図14A(b)(c))、単層親水性メンブレンフィルター1001では、静置時間と共に単層親水性メンブレンフィルター1001下から微生物溶解液1003が染み落ちた(図14B(b)(c))。
【0069】
単層親水性メンブレンフィルター1001から染み落ちる微生物溶解液1003の量を測定するため、染み落ちる微生物溶解液1003を採取して重量の測定を試みた。微生物溶解液703を加えてから4分後、10mgの微生物溶解液1003が染み落ちた。6分後、8分後に測定したところ、15mg、20mgの微生物溶解液1003が染み落ちた。合計45mg分、微生物溶解液1003が染み落ちることがわかった。
【0070】
一方、二層構造メンブレンフィルター101下からは微生物溶解液が染み落ちなかった。代わりに二層構造メンブレンフィルター101上に微生物溶解液703を加えた直後(図14A(a))と10分静置後(図14A(c))で、二層構造メンブレンフィルター101を備える容器102、微生物溶解液703の合計重量をそれぞれ測定し、その差を算出した。差は1mgとなり、ほぼ重量に変化が無いことがわかった。この結果は、微生物溶解液は二層構造メンブレンフィルターを備える容器102の中に保持されることを示している。
この結果から、二層構造メンブレンフィルターは、微生物溶解液をその上に保持できることがわかった。
【0071】
[実験例3]
(メンブレンフィルター内のATP溶離実験)
二層構造メンブレンフィルターと単層親水性メンブレンフィルター内のATP分子の溶離量を比較するため、二種類のメンブレンフィルターを備える容器を用意した。1つは、底部に二層構造メンブレンフィルター101を備える容器102である(図15(a))。二層構造メンブレンフィルター101は上層の第一層が親水性メンブレンフィルター116、下層の第二層が疎水性メンブレンフィルター117で構成される。第一層親水性メンブレンフィルター116には、孔径0.45μm、厚さ150μm、空隙率79%のMF−ミリポアメンブレンフィルター(日本ミリポア)を使用し、直径を0.5cmに加工した。第二層疎水性メンブレンフィルター117には孔径10μmのマイテックスメンブレンフィルター(日本ミリポア)を使用し、直径を0.5cmに加工した。
【0072】
もう1つは、親水性メンブレンフィルターのみで構成される単層親水性メンブレンフィルター1001を底部に備える容器1002である(図16(a))。単層親水性メンブレンフィルター1001には、孔径0.45μm、厚さ150μm、空隙率79%のMF−ミリポアメンブレンフィルター(日本ミリポア)を使用し、直径を0.5cmに加工した。
【0073】
ATP溶液としてルシフェールATP標準試薬(キッコーマン)を用いて20000amol/10μLの濃度のATP溶液を作製した。発光試薬115として、ATP・ルシフェラーゼ・ルシフェリン反応を生じるルシフェールHSセット(キッコーマン)付属の発光試薬を用いた。
【0074】
まず、二層構造メンブレンフィルター101上と単層親水性メンブレンフィルター1001上にそれぞれATP溶液を10μL加えて、第一層親水性メンブレンフィルター116と単層親水性メンブレンフィルター1001内にATP分子1501を染み込ませた(図15(a)、図16(a))。続いて、微生物溶解液703として、0.2%塩化ベンザルコニウム+25mMトリシン緩衝液pH12を200μL加えた後、静置した(図15(b)、図16(b))。
【0075】
静置している間、単層親水性メンブレンフィルター1001下から微生物溶解液1003が時間と共に染み落ちてきた(図16(c)(d))。一方、二層構造メンブレンフィルター101では変化は観察されなかった(図15(c)(d))。
【0076】
単層親水性メンブレンフィルター1001下から染み落ちる微生物溶解液1003中のATP分子1601の数と、単層親水性メンブレンフィルター1001上に遊離した微生物溶解液703中のATP分子1501の数(図16(c)(d))を定量的に評価するため、単層親水性メンブレンフィルター1001上に残っている微生物溶解液703と単層親水性メンブレンフィルター1001下から染み落ちた微生物溶解液1003をそれぞれ10μL採取し、反応容器113中の発光試薬115に加えて、生じた発光反応を検出部112で検出した。
【0077】
単層親水性メンブレンフィルター1001上に微生物溶解液703を加えてから4分後、6分後、8分後に、染み落ちた微生物溶解液1003の発光量は、約20000CPS(Countper Second)、25000CPS、30000CPSを示した(図17)。染み落ちる前、単層親水性メンブレンフィルター1001内にはATP分子が20000amol存在し、200μLの微生物溶解液703を単層親水性メンブレンフィルター1001上に加えたことから、ATP分子1501が理想的に微生物溶解液703中に拡散した場合、ATP濃度は約1000amol/10μLになる。なお1000amol/10μLのATP濃度の発光量を測定すると、発光量は約10000CPSを示す。従って、単層親水性メンブレンフィルター1001から染み落ちた微生物溶解液1003中のATP分子1601の数は、理想的にATP分子1501が微生物溶解液703中に拡散した場合と比較して、2〜3倍多いことがわかった。
【0078】
一方、単層親水性メンブレンフィルター1001上に残った微生物溶解液703に含まれるATP分子1501の数を発光測定したところ、10分経過しても約5000CPSが最高であった。染み落ちた微生物溶解液1003を測定した時に比べて、1/4〜1/6の発光量であった(図17)。この結果から、単層親水性メンブレンフィルター1001内のATP分子1501(図16(a))は1/4〜1/6程度しか親水性メンブレンフィルター1001上に遊離しないことがわかった(図16(d))。
【0079】
一方、二層構造メンブレンフィルター101下から微生物溶解液703は染み落ちなかった。代わりに、微生物溶解液703を二層構造メンブレンフィルター101上に加えた直後と2〜20分静置した後で、二層構造メンブレンフィルター101上の微生物溶解液703を10μLずつ採取して発光測定した。各静置時間において、発光量は約9800CPSを示した(図18)。この結果は、微生物溶解液703を二層構造メンブレンフィルター101を備える容器102の中に保持することで、第一層親水性メンブレンフィルター116内に染み込んだATP分子1501(図15(a))を二層構造メンブレンフィルター101上に溶離できていることを示している(図15(d))。
【0080】
この結果から、二層構造メンブレンフィルター101上に微生物溶解液703を保持することで、第一層親水性メンブレンフィルター116内からATP分子1501を効率よく溶離できることがわかった。また、第一層親水性メンブレンフィルターの直径がより小さく、また厚さが薄いほど効率よく溶離できる。
【0081】
[実験例4]
(湿潤剤を用いた場合の微生物計測実験)
二層構造メンブレンフィルターと、湿潤剤を染みこませることで水溶液がろ過できる疎水性メンブレンフィルターを用いた時の微生物検出感度を比較するため、四種類のメンブレンフィルターを備える容器を用意した。
【0082】
(1)二層構造メンブレンフィルターを備える容器:
二層構造メンブレンフィルターは上層の第一層が親水性メンブレンフィルター、下層の第二層が疎水性メンブレンフィルターで構成される。第一層親水性メンブレンフィルターには、孔径0.45μm、厚さ150μm、空隙率79%のMF−ミリポアメンブレンフィルター(日本ミリポア)を使用し、直径を0.5cmに加工した。第二層疎水性メンブレンフィルターには孔径10μmのマイテックスメンブレンフィルター(日本ミリポア)を使用し、直径を0.5cmに加工した。
【0083】
(2)単層親水性メンブレンフィルターを備える容器:
単層親水性メンブレンフィルターには、孔径0.45μm、厚さ150μm、空隙率79%のMF−ミリポアメンブレンフィルター(日本ミリポア)を使用し、直径を0.5cmに加工した。
【0084】
(3)第一層に親水性メンブレンフィルターと、第二層に湿潤剤を染みこませることで水溶液がろ過できる疎水性メンブレンフィルターで構成される要湿潤剤二層構造メンブレンフィルターを備える容器:
二枚重ねのメンブレンフィルターの第一層親水性メンブレンフィルターには、孔径0.45μm、厚さ150μm、空隙率79%のMF−ミリポアメンブレンフィルター(日本ミリポア)を使用し、直径を0.5cmに加工した。第二層の疎水性メンブレンフィルターとして、孔径0.45μmの疎水性デュラポアメンブレンフィルター(日本ミリポア)を使用し、直径を0.5cmに加工した。
【0085】
(4)湿潤剤を染みこませることで水溶液がろ過できる疎水性メンブレンフィルターで構成される要湿潤剤単層疎水性メンブレンフィルターを備える容器:
単層の疎水性メンブレンフィルターとして孔径0.45μmの疎水性デュラポアメンブレンフィルター(日本ミリポア)を使用し、直径を0.5cmに加工した。
【0086】
測定対象微生物として大腸菌を用いた。大腸菌をリン酸バッファー(pH7.4)(インビトロジェン)に懸濁して、大腸菌数が100個/10mLとなるように調製した。微生物外生体物質除去試薬として、ルシフェールHSセット(キッコーマン)付属のATP消去液を用いた。微生物溶解液には、ルシフェールHSセット(キッコーマン)付属のATP抽出液を用いた。
【0087】
二層構造メンブレンフィルター上と、単層親水性メンブレンフィルター上、要湿潤剤二層構造メンブレンフィルター上、要湿潤剤単層疎水性メンブレンフィルター上にそれぞれ大腸菌懸濁液を10mL加えた。また第一試薬として、ATP消去液を10μL加えた。
【0088】
二層構造メンブレンフィルターと、単層親水性メンブレンフィルターは大腸菌懸濁液をろ過できた。しかし要湿潤剤二層構造メンブレンフィルターと要湿潤剤単層疎水性メンブレンフィルターは大腸菌懸濁液をろ過できなかったため、各疎水性メンブレンフィルターに湿潤剤であるメチルアルコールを染み込ませてろ過を可能にした。
【0089】
ろ過後、第二試薬として、ATP抽出液を200μL加えた。二層構造メンブレンフィルター上と、単層親水性メンブレンフィルター上、要湿潤剤二層構造メンブレンフィルター上、要湿潤剤単層疎水性メンブレンフィルター上に残ったATP抽出液10μLの発光測定をした。
【0090】
二層構造メンブレンフィルターでは、大腸菌100個からATPは140amolが検出された。一方、単層親水性メンブレンフィルターでは10amol、要湿潤剤二層構造メンブレンフィルターと要湿潤剤単層疎水性メンブレンフィルターでは、12amolが検出された。各メンブレンフィルターで検出されたATP数は、二層構造メンブレンフィルターに比べて約1/10以下に減少した。
【0091】
この結果は、疎水性メンブレンフィルターに染み込ませた湿潤剤が、大腸菌を損傷ないし溶解したことにより、大腸菌由来ATPがろ過の間に流れ出てしまったためと考えられる。
【0092】
湿潤剤を使って疎水性メンブレンフィルターでろ過する微生物検出方法は、微生物の検出感度と精度共を減少させる。一方、湿潤剤を使わない二層構造メンブレンフィルターは、微生物の検出感度と精度を向上した。
【符号の説明】
【0093】
101 二層構造メンブレンフィルター
102 容器
103 試薬供給部
105 吸引部
106 洗浄液供給部
108 加熱部
109 アーム
110 分注部
112 検出部
113 反応容器
114 入力・制御部
115 発光試薬
116 親水性メンブレンフィルター
117 疎水性メンブレンフィルター
118 廃液部
301 試薬
302 試薬槽
601 励起光照射部
701 大腸菌
702 大腸菌懸濁液
703 微生物溶解液
704 大腸菌由来ATP分子
801 容器の底部
802 環状の蓋
803 ネジ
901 容器のネジ様溝を持つ底部
902 ネジ様溝を持つ環状の蓋
1001 単層親水性メンブレンフィルター
1002 容器
1003 染み落ちた微生物溶解液
1004 染み落ちた大腸菌由来ATP分子
1101 吸引口
1501 ATP分子
1601 染み落ちたATP分子
【技術分野】
【0001】
本発明は、微生物検出装置、検出方法、及びそれに用いられる試料容器に関する。
【背景技術】
【0002】
微生物の検出や微生物数の定量は、製薬工場や食品工場、再生医療施設などにおいて、製品への微生物汚染を未然に防ぐ安全衛生管理として実施されている。特に微生物数の定量は、日本薬局方の規定により、製薬工場において製品や原料に対して実施されると共に、製薬工場内の空気や壁表面、作業者手袋表面などで実施されている。また微生物数の定量は、食品工場においてもHACCP(Hazard Analysis and Critical Control Point)の導入により、食品工場自体や作業行程の検査として、食品と共に壁表面や床面、まな板表面や包丁表面などの調理器具においても実施されている。
【0003】
微生物数の定量方法は培養法が一般的である。培養法は、サンプルが液体の場合、直接サンプルを寒天平板培地に塗り、またサンプルが液体以外の場合、微生物を洗い出した液体を培地に塗り、培地上で微生物を培養し、1個の微生物が1個のコロニーを形成することを利用して、形成したコロニー数を数える微生物数の定量方法である。
【0004】
また、メンブレンフィルターを使用して微生物数を定量するメンブレンフィルター(Membrane Filter, MF)法も一般的である。MF法は、サンプルをメンブレンフィルターでろ過して微生物を捕捉し、微生物を捕捉したメンブレンフィルターを平板寒天培地上に置いて培養し、コロニー数を数えて定量する方法である。また培養しない場合は、微生物を捕捉したメンブレンフィルター上に、微生物内からアデノシン三リン酸(Adenosine Triphosphate, ATP)を抽出するATP抽出試薬と、ルシフェラーゼとルシフェリンを含む発光試薬を霧状に噴霧することで、ATPがルシフェラーゼとルシフェリンと反応して生じる発光輝点をCCD(Charge Coupled Device)カメラで撮り微生物数を定量する方法がある(特許文献1)。
【先行技術文献】
【特許文献】
【0005】
【特許文献1】特願平9−317792号公報
【発明の概要】
【発明が解決しようとする課題】
【0006】
従来の培養法は、微生物を含むサンプルを寒天平板培地上に塗るため、サンプル量は約1mLが上限となる課題がある。従って、サンプル量が多く微生物数が少ない場合は定量が困難である。また、定量結果を得るまで24〜72時間の培養を必要とする課題がある。その結果、製薬や食品、生細胞等の搬出の段階で定量結果を待たなければならず、安全性や効率性、経済性おいて大きな損失が生じるため、微生物数の定量に要する時間短縮が求められている。
【0007】
また従来のMF法は、微生物を捕捉したメンブレンフィルターと培地間に空気が入るなどして完全に密着しないと、培地の栄養分が微生物まで行き渡りにくく、微生物の増殖速度が一定にならないことでコロニーの大きさがばらつき、定量精度が低下する課題がある。またMF法は、メンブレンフィルターに捕捉した微生物へATP抽出試薬を噴霧するが、噴霧した抽出試薬がメンブレンフィルターに染み込んだサンプルや緩衝液によって希釈されたり、抽出液量に対し微生物の細胞壁が強固であったりすると、抽出効率が減少し、定量感度が低下する。
【0008】
本発明は、多量のサンプル中に含まれる少数の微生物を迅速・高精度・高感度・簡便に検出・定量するものである。
【課題を解決するための手段】
【0009】
我々は、多量のサンプル中に含まれる少数の微生物を迅速・高精度・高感度・簡便に検出して定量する装置と方法を提供するため、微生物を含むサンプルをメンブレンフィルターでろ過し、十分量の微生物溶解液で微生物を溶解し、微生物由来の生体物質を指標に、発光反応もしくは蛍光反応で検出する装置と方法の開発を試みた。その過程においてまず、以下の課題を見出した。
【0010】
微生物を含むサンプルを多孔性親水性メンブレンフィルターでろ過すると、微生物の直径がメンブレンフィルターの孔径よりも明らかに大きい場合、微生物はメンブレンフィルター表面に捕捉されるが、微生物の直径がメンブレンフィルターの孔径に近い場合、微生物はメンブレンフィルターの中に入り込むことで捕捉されることがわかった。微生物がメンブレンフィルター内に捕捉された状態で、メンブレンフィルター上に微生物溶解試薬(例:ATP抽出試薬)を加えると、微生物はメンブレンフィルター内で溶解され、抽出した生体物質(例:ATP)の多くはメンブレンフィルター内に留まることがわかった。このような状態で、抽出したATPをATP抽出試薬と共にメンブレンフィルター上から生物発光試薬(例:ルシフェラーゼ・ルシフェリン)の入った容器に移して発光測定を試みると、メンブレンフィルター内に留まったATPは損失となって発光量が減少するため、定量性は低下することがわかった。
【0011】
そこで、親水性メンブレンフィルター上に抽出試薬を加えて一定時間静置もしくは攪拌することで、ATPをメンブレンフィルター内から遊離させる方法も試みた。しかし、その場合には、ATPがメンブレンフィルター内から遊離する前にATPが抽出試薬共々、メンブレンフィルター下に染み落ちてしまい、遊離が困難となることがわかった。
【0012】
また、ATP抽出試薬がメンブレンフィルターから染み落ちないように、親水性メンブレンフィルターの代わりに、水溶液に対し非浸透の疎水性メンブレンフィルターを用いる方法を試みた。まず、疎水性メンブレンフィルターで微生物を含むサンプル水溶液をろ過する場合、湿潤剤(例:メチルアルコールやエチルアルコールなどのアルコール類やジエチルエーテルなどのエーテル類)を疎水性メンブレンフィルターに染み込ませなければならない。しかし、湿潤剤は微生物を溶解したり損傷させたりし、また湿潤剤がろ過中にメンブレンフィルターから溶出すると、ろ過性能が悪くなる。従って、疎水性メンブレンフィルターに湿潤剤を染み込ませてろ過する手法は、微生物の検出・定量及び微生物の生死判別には困難なことがわかった。
【0013】
本発明は、このような我々が見出した課題と従来の課題を解決するものである。我々は、疎水性メンブレンフィルターであっても、孔径の大きさによって、メンブレンフィルター下に陰圧を生じさせることで、湿潤剤を用いずにサンプル水溶液をろ過でき、また疎水性メンブレンフィルター下が常圧の場合、抽出試薬がメンブレンフィルター下に染み落ちないことを見出した。疎水性メンブレンフィルターによる水溶液のろ過は、孔径がある一定の大きさ以上で可能であり、ある微生物の大きさがその孔径より小さいと、その微生物の捕捉は困難となる。そこで、疎水性メンブレンフィルター上に微生物を捕捉するための微小孔径かつ多孔性の親水性メンブレンフィルターを設けることで、多量の水溶液のろ過が可能で、また微生物の捕捉が可能で、加えて微生物溶解液の保持が可能な、二層構造メンブレンフィルターを開発した。
【0014】
本発明の微生物検出装置は、上層の第一層を親水性メンブレンフィルターとして、その下に、湿潤剤を用いずにかつ陰圧を生じさせることで水溶液のろ過が可能な疎水性メンブレンフィルターを第二層として有する二層構造メンブレンフィルターを底部に備えた試料容器を用い、試料容器の二層構造メンブレンフィルターの下に吸引部を設けた構成を有する。二層構造のメンブレンフィルターの第一層の親水性メンブレンフィルターは微生物を捕捉する役割をし、第二層の疎水性メンブレンフィルターは試薬を保持する役割をする。
【0015】
そして本発明によれば、吸引部により生じる陰圧によって、第一層親水性メンブレンフィルターと第二層疎水性メンブレンフィルターを通じた多量のサンプル水溶液のろ過が可能であり、サンプル水溶液中の微生物を溶解させたり損傷させたりすることなく第一層親水性メンブレンフィルターで捕捉できる。また陰圧から常圧にした後、微生物溶解液を加えて、一定時間微生物溶解液をメンブレンフィルター下から染み落とすこと無く、第二層疎水性メンブレンフィルター上で保持することが可能となる。そして本発明によれば、第一層親水性メンブレンフィルターに捕捉した微生物の溶解が可能であり、かつ、第一層親水性メンブレンフィルター内の微生物由来生体物質を、第一層親水性メンブレンフィルター上に遊離することが可能である。
【0016】
第一層親水性メンブレンフィルターの孔径は0.05μm〜0.65μmが好ましく、第二層疎水性メンブレンフィルターの孔径は0.8μm〜80μmが好ましい。第一層親水性メンブレンフィルターの孔径を0.05μm〜0.65μmとすることで、第一層親水性メンブレンフィルターに微生物を確実に捕捉することができ、第二層疎水性メンブレンフィルターの孔径を0.8μm〜80μmとすることで、湿潤剤を用いずかつ陰圧を生じさせることでサンプル水溶液のろ過を可能にし、かつ陰圧から常圧にすることで、微生物溶解液を疎水性メンブレンフィルター上に保持することが可能になる。
【0017】
本発明の微生物検出方法は、サンプル水溶液中に微生物外の生体物質を分解する第一試薬を加えることで微生物外の生体物質を分解し、サンプル水溶液を二層構造メンブレンフィルターで吸引ろ過することにより、微生物を第一層親水性メンブレンフィルターに捕捉すると共にサンプル水溶液中に含まれる第一試薬や異物を除去する。その後、微生物内生体物質を抽出する第二試薬を加えて、第二層疎水性メンブレンフィルター上で保持することで、微生物から生体物質を抽出し、かつ、第一層親水性メンブレンフィルター内から生体物質を遊離し、遊離した生体物質と反応する第三試薬を作用させることで微生物を定量測定する。ここで、第二試薬としては、疎水性メンブレンフィルターを湿潤することのない試薬を用いる。
【発明の効果】
【0018】
本発明は、多量のサンプル水溶液のろ過が容易であり、微生物の溶解が確実にでき、微生物から抽出した生体物質をメンブレンフィルターから容易に溶離できる微生物検出装置と微生物検出方法を提供する。また、培養することなく、微生物の生死判別と生細胞の定量を、熟練を要することなく高感度で高精度、迅速、簡便に定量できる微生物検出装置及び微生物検出方法を提供する。
【図面の簡単な説明】
【0019】
【図1】本発明による微生物検出装置の一例の一部断面摸式図。
【図2】微生物検出の処理手順を示すフロー図。
【図3】本発明による微生物検出装置の一例の一部断面摸式図。
【図4】本発明による微生物検出装置の一例の一部断面摸式図。
【図5】本発明による微生物検出装置の一例の一部断面摸式図。
【図6】本発明による微生物検出装置の一例の一部断面摸式図。
【図7】容器底部への二層構造メンブレンフィルターの取り付け方の例を示す図。
【図8】容器底部への二層構造メンブレンフィルターの取り付け方の例を示す図。
【図9】本発明による二層構造メンブレンフィルターを用いた検出方法の途中工程を示す模式図。
【図10】単層親水性メンブレンフィルターを用いた検出方法の途中工程を示す模式図。
【図11】吸引ろ過の説明図。
【図12】二層構造メンブレンフィルター用いた際の横軸を大腸菌数とATP数の関係を示す図。
【図13】各種条件で検出されたATP数を示す図。
【図14A】二層構造メンブレンフィルターの微生物溶解液保持能力測定実験の説明図。
【図14B】単層親水性メンブレンフィルターの微生物溶解液保持能力測定実験の説明図。
【図15】二層構造メンブレンフィルター内のATP分子の溶離実験の説明図。
【図16】単層親水性メンブレンフィルター内のATP分子の溶離実験の説明図。
【図17】単層親水性メンブレンフィルター上に残っている微生物溶解液と、染み落ちた微生物溶解液の発光量の経時変化を示す図。
【図18】二層構造メンブレンフィルター上の微生物溶解液の発光量の経時変化を示す図。
【発明を実施するための形態】
【0020】
以下に、本発明の実施の形態を、図面を用いて説明する。だだし、以下の説明は本発明を何ら限定するものではない。
[実施例1]
(微生物の検出装置と方法)
図1は、本発明による微生物検出装置の一例の一部断面摸式図である。微生物検出装置は、二層構造メンブレンフィルター101を底部に備える容器102と、試薬供給部103、試薬供給用配管104、吸引部105、洗浄液供給部106、洗浄液供給用配管107、加熱部108、アーム109、分注部110、分注用配管111、検出部112、反応容器113、入力・制御部114を有する。入力・制御部114は装置各部の動作を統括制御する。容器102は装置に対して着脱自在である。また、反応容器113には発光試薬115が入っている。
【0021】
二層構造メンブレンフィルター101は、上層の第一層が親水性メンブレンフィルター116であり、下層の第二層が疎水性メンブレンフィルター117である。第一層親水性メンブレンフィルター116は、微生物を確実に捕捉するため孔径が0.05μm 〜0.65μmとする。また厚みが7μm〜200μmとし、もちろんこの厚みより薄くても厚くても構わないが、しかしこれより薄いとメンブレンフィルターの機械的な強度が弱くなり、ろ過中にメンブレンフィルターが破断することが予想され、これより厚いとメンブレンフィルター中に多くの溶液が残り、この後に追加する各種試薬が希釈されることが予想される。従って厚みは7μm〜200μmが好ましい。第二層疎水性メンブレンフィルター117は、水溶液を確実にろ過するため、孔径を0.8μm〜180μmとする。また厚みが7μm〜800μmとし、もちろんこの厚みより薄くても厚くても構わないが、しかしこれより薄いとメンブレンフィルターの機械的な強度が弱くなり、ろ過中にメンブレンフィルターが破断することが予想され、これより厚いと吸引ろ過に時間がかかることが予想される。従って厚みは7μm〜800μmが好ましい。
【0022】
図2は、図1に示した微生物検出装置による微生物検出の処理手順を示すフロー図である。なお、図3〜6は、本発明の微生物検出装置の別の形態であり、ともに説明する。
【0023】
装置に、二層構造メンブレンフィルター101を底部に備える容器102を設置し、最初に入力・制御部114に、サンプルの粘性の高低や芽胞状態枯草菌の測定可否の初期値を入力し、微生物検出を開始する(S201)。容器102に測定対象微生物を含むサンプル水溶液を入れる(S202)。入力・制御部114は、ステップ203の判定でサンプル水溶液の粘性が高いと判定された場合、速やかなろ過を促すため加熱部108を駆動してサンプル水溶液を加熱する(S204)。ステップ201で入力されたサンプルの粘性が低い場合には、加熱工程を省略してステップ205に進む。
【0024】
次に、試薬供給部103から試薬供給用配管104を通じて、微生物外生体物質分解試薬を、容器201内のサンプル水溶液に供給する(S205)。微生物外生体物質分解試薬としては、例えばATP分解酵素、又はDNA(DeoxyriboNucleic Acid)分解酵素やRNA(RiboNucleic Acid)分解酵素が用いられる。
【0025】
なお、図3に示すように、微生物検出装置が試薬供給部の代わりに各種の試薬301を収容した試薬槽302を備えている場合、分注部110が分注用配管111を通じて試薬槽302内の微生物外生体物質分解試薬をサンプル水溶液へ分注するように構成してもよい。図1に示した試薬供給部103を有する装置は、1日に多数のサンプルを測定する用途に適し、図3に示した試薬槽を備える装置は、少数のサンプルを測定する用途に適している。
【0026】
次に、吸引部105によって陰圧を生じさせることで、二層構造メンブレンフィルター101を通して容器102内のサンプル水溶液をろ過する。この時、水溶液中の微生物は第一層親水性メンブレンフィルターに捕捉され、生体物質分解試薬や残存生体物質は廃液部118に流入して除かれる。その後、二層構造メンブレンフィルター101を洗浄する目的で、洗浄液供給部106から洗浄液を供給する(S206)。また、サンプル水溶液の粘性が高い場合、粘性を下げる目的で、洗浄液供給部106から洗浄液供給用配管107を通じて洗浄液を加えてもよい。同様に粘性を下げる目的で、加熱部108によって洗浄液を加熱してサンプル水溶液に加えてもよい。
【0027】
次にステップ207の判定で、測定対象微生物が芽胞もしくは胞子を形成していると判断された場合、ろ過後、試薬供給部103から栄養型細胞変換試薬を加える(S208)。栄養型細胞変換試薬として用いられるのは、例えばアラニンやグルコース、リン酸の組み合わせであるが、液体培地を用いてもよい。なお図3のように、微生物検出装置が各種試薬槽302を備えている場合、分注部110によって試薬槽302内の栄養型細胞変換試薬をサンプル水溶液へ分注する。また、栄養型細胞変換を促すため加熱部108によって栄養型細胞変換試薬を加熱してもよい(S209)。また、栄養型細胞変換試薬を除く目的で、ろ過してもよい(S210)。ステップ207の判定がNoの場合、ステップ208からステップ210の処理を省略してステップ211に進む。
【0028】
次に、試薬供給部103から微生物溶解液を加えて、微生物溶解液を二層構造メンブレンフィルター101上に保持する(S211)。微生物溶解液としては、例えば塩化ベンザルコニウムやトリクロロ酢酸、トリス緩衝液が用いられる。図3のように、微生物検出装置が各種試薬槽302を備えている場合には、分注部110によって試薬槽302内の微生物溶解液をサンプル水溶液へ分注する。
【0029】
次に、容器102の二層構造メンブレンフィルター101上の微生物溶解液を分注部110の分注用配管111を通じて吸引し、アーム109を駆動して分注用配管111を検出部112の反応容器113上に移動し、微生物溶解液を反応容器113に移す(S212)。反応容器113内には発光試薬115が納められており、発光試薬115は微生物溶解液中に含まれる生体物質(例えばATP、ルミノール、アルカリホスファターゼ)と反応して発光を生じる。発光試薬115は、例えばルシフェラーゼ・ルシフェリンである。なおペルオキシダーゼやアルカリホスファターゼの基質を用いてもよい。その場合には、動物細胞の検出も可能になる。
【0030】
なお、図4や図5に示す例のように、微生物検出装置が容器102の側面や下部に検出部112を備えている場合、試薬供給部103によって発光試薬を容器102の二層構造メンブレンフィルター101上に直接供給して、発光を生じさせてもよい。図5に示す微生物検出装置の例の場合、二層構造メンブレンフィルター101が底部全面ではなく一部領域に装着され、底部に透明領域が設けられている容器を用いる。検出部112は、その容器底部の透明領域に対向して配置され、容器内の溶液中の発光反応によって生じる発光を検出する。また、図6の装置例のように、微生物検出装置が励起光照射部601を備えている場合、発光試薬を用いなることなく、励起光照射部601から励起光を生体物質(例えばDNAやRNA、NAD、Nicotinamide Adenine Dinucleotide)に照射することで蛍光を生じさせてもよい。
【0031】
生じた発光や蛍光は検出部112によって検出され(S213)、検出された発光量や蛍光量から微生物数が算出され(S214)、微生物検出が終了する。
【0032】
なお、図2に示す処理工程において、ステップ207からステップ210の処理を省略して、ステップ206からステップ211に進み、ステップ213において発光測定すると、サンプル中に含まれる栄養型細胞数を検出することができる。また、ステップ206の後、ステップ208からステップ214の処理を経ることで非栄養型細胞数を検出することができる。このように、ステップ208からステップ210を省略した処理を実行して栄養型細胞数を検出した後、ステップ208に戻ってステップ214まで処理を反復することにより、サンプルに含まれる栄養型細胞数と非栄養型細胞数を区別して検出することができる。
【0033】
[実施例2]
(微生物検出実験1:大腸菌)
本発明による二層構造メンブレンフィルターを備える容器と、従来の親水性メンブレンフィルターを備える容器による大腸菌の検出感度を比較した。
【0034】
二種類のメンブレンフィルターつき容器を用意した。1つは、底部に二層構造メンブレンフィルター101を備える容器102であり、他の一つは底部に親水性メンブレンフィルターのみを備える容器である。
【0035】
図7により、容器底部への二層構造メンブレンフィルターの取り付け方の例を説明する。二層構造メンブレンフィルター101は、上層の第一層が親水性メンブレンフィルター116、下層の第二層が疎水性メンブレンフィルター117で構成される。親水性メンブレンフィルター116には、孔径0.45μm、厚さ150μm、空隙率79%のMF−ミリポアメンブレンフィルター(日本ミリポア)を使用し、直径を0.5cmに加工した。なお、親水性メンブレンフィルターは、DuraporeメンブレンフィルターやIsopreメンブレンフィルター(日本ミリポア)でもよい。疎水性メンブレンフィルター117には孔径10μmのマイテックスメンブレンフィルター(日本ミリポア)を使用し、直径を0.5cmに加工した。なお、疎水性メンブレンフィルターは、ポリプロピレンプレフィルター、孔径30μm(日本ミリポア)でもよい。また材質がナイロン、ポリテトラフルオロエチレン、疎水性であるポリビニリデンフロライド、ポリエチレン、ポリシロキサン、ポリカーボネート、ポリスルホン、ポリアミド、ガラスファイバーで、孔径が0.8μm〜80μmのメンブレンフィルター、もしくはメッシュ構造でピッチサイズが1μm〜59μmであってもよい。
【0036】
図7(a)に示すように、加工した親水性メンブレンフィルター116と疎水性メンブレンフィルター117を重ね、容器102の底部801に設けた装着部に装着し、環状の蓋802でフィルターの周縁部押さえ、図7(b)に示すように、ネジ803で締める事で組み立てを完了した。なお、フィルターの固定はネジ式の蓋によって行ってもよい。例えば、図8(a)に示すように、加工した親水性メンブレンフィルター116と疎水性メンブレンフィルター117を重ね、容器102のネジ様溝を持つ底部901とネジ様溝を持つ環状の蓋902の間に挟み込み、図8(b)に示すように、底部901と蓋902で締めることで組み立てもよい。なお、第一層親水性メンブレンフィルターと第二層疎水性メンブレンフィルターの間には隙間があってもよい。
【0037】
親水性メンブレンフィルターのみを備える容器は、容器の構造は同じであるが、図10(a)に略示するように、二層構造メンブレンフィルターの代わりに単層親水性メンブレンフィルター1001を装着した容器1002である。単層親水性メンブレンフィルター1001には、孔径0.45μm、厚さ150μm、空隙率79%のMF−ミリポアメンブレンフィルター(日本ミリポア)を使用し、直径を0.5cmに加工した。
【0038】
図9は本発明による二層構造メンブレンフィルターを備える容器を用いた検出方法の途中工程を示す模式図、図10は単層親水性メンブレンフィルターを備える容器を用いた検出方法の途中工程を示す模式図である。
【0039】
測定対象微生物として大腸菌を用いた。大腸菌数が20〜2000個/10mLとなるように、大腸菌701をリン酸バッファーpH7.4(インビトロジェン)に懸濁し、大腸菌懸濁液702を作製した。
【0040】
図9(a)及び図10(a)に示すように、まず二層構造メンブレンフィルター101上と単層親水性メンブレンフィルター1001上にそれぞれ大腸菌懸濁液702を10mL加えた。次に、微生物外生体物質除去試薬であるルシフェールHSセット付属のATP消去液を10μL加えた。続いて、図11(a)に示すように、吸引部105の吸引口1101を二層メンブレンフィルター下に接続し、図11(b)に示すように陰圧を生じさせ、大腸菌懸濁液とATP消去液をろ過した。なお単層親水性メンブレンフィルターにおいても同様に大腸菌懸濁液とATP消去液をろ過した。図9(b)及び図10(b)は、ろ過後の状態を示している。ろ過後、微生物溶解液703であるルシフェールHSセット付属のATP抽出液を200μL加えて、図9(c)及び図10(c)に示すように、大腸菌701からATP分子704を抽出した。
【0041】
静置している間、図10(d)に示すように、単層親水性メンブレンフィルター1001下部から微生物溶解液1003が染み落ちてきた。一方、二層構造メンブレンフィルター101では、図9(d)に示すように、変化が観察されなかった。
【0042】
二層構造メンブレンフィルター101と単層親水性メンブレンフィルター1001上に残った微生物溶解液703を、分注部110を用いて検出部112上に設置された反応容器113内にあるルシフェールHSセット付属の発光試薬115に10μL分注した。発光量をATP数に算出した。なお二層構造メンブレンフィルター101について、図12に示すように、縦軸をATP数、横軸を大腸菌数とした図を作成した。
【0043】
二層構造メンブレンフィルターを備える容器を用いた場合、ATP数と大腸菌数は定量的な直線関係 (y=1.4315x−7.9823) を示し、大腸菌1個あたりATP分子数は平均1.4amolを示したが、単層親水性メンブレンフィルターを備える容器を用いた場合、大腸菌100個未満ではATP分子を検出することができず、大腸菌100個でATP分子数は1amolを示し、二層構造メンブレンフィルター101は単層親水性メンブレンフィルター1001に比べて約100倍の値を示した。
【0044】
この結果は、単層親水性メンブレンフィルターを備える容器では微生物溶解液を単層親水性メンブレンフィルター上に保持できないため、微生物溶解液1003が単層親水性メンブレンフィルター下に染み落ちると共に、大腸菌由来ATP分子1004も落ちてしまい、その結果、単層親水性メンブレンフィルター1001上の微生物溶解液に大腸菌由来ATP分子1004が溶離しなかったためと考えられる(図10(d))。
【0045】
その一方で、二層構造メンブレンフィルターを備える容器では、二層構造メンブレンフィルター101上に微生物溶解液703が保持できるため、微生物溶解液703が大腸菌由来ATP分子704と共に二層構造メンブレンフィルター101下に染み落ちることがない。また、第一層親水性メンブレンフィルター116内で大腸菌から抽出されたATP分子704は時間と共に二層構造メンブレンフィルター101上の微生物溶解液に溶離される(図9(d))。
【0046】
本発明の微生物検出装置は、大腸菌1個を高感度、高精度、迅速、簡便に計測できた。なお、大腸菌群やブドウ球菌などの細菌、サッカロミケス・ケレウィシエなどの酵母、アスペルギルス・ニガーなどの真菌に対しても同様の効果が得られる。
【0047】
[実施例3]
(微生物検出実験2:芽胞状態枯草菌)
本発明による二層構造メンブレンフィルターを備える容器と、従来の親水性メンブレンフィルターを備える容器による芽胞状態枯草菌の検出感度を比較した。
【0048】
二種類のメンブレンフィルターつき容器を用意した。1つは、二層構造メンブレンフィルター101を備える容器102、他の一つは親水性メンブレンフィルターのみを備える容器である。容器の構造及び容器への二層構造メンブレンフィルター及び単層親水性メンブレンフィルターの取り付け構造は、図7及び図8にて説明したとおりである。
【0049】
二層構造メンブレンフィルター101は、上層の第一層が親水性メンブレンフィルター116、下層の第二層が疎水性メンブレンフィルター117で構成される。親水性メンブレンフィルター116には、孔径0.45μm、厚さ150μm、空隙率79%のMF−ミリポアメンブレンフィルター(日本ミリポア)を使用し、直径を0.5cmに加工した。なお、親水性メンブレンフィルターは、DuraporeメンブレンフィルターやIsopreメンブレンフィルター(日本ミリポア)でもよい。疎水性メンブレンフィルター117には孔径10μmのマイテックスメンブレンフィルター(日本ミリポア)を使用し、直径を0.5cmに加工した。なお、疎水性メンブレンフィルターは、ポリプロピレンプレフィルター、孔径30μm(日本ミリポア)でもよい。また材質がナイロン、ポリテトラフルオロエチレン、疎水性であるポリビニリデンフロライド、ポリエチレン、ポリシロキサン、ポリカーボネート、ポリスルホン、ポリアミド、ガラスファイバーで、孔径が0.8μm〜80μmのメンブレンフィルター、もしくはメッシュ構造でピッチサイズが1μm〜59μmであってもよい。
【0050】
親水性メンブレンフィルターのみを備える容器に装着した単層親水性メンブレンフィルターには、孔径0.45μm、厚さ150μm、空隙率79%のMF−ミリポアメンブレンフィルター(日本ミリポア)を使用し、直径を0.5cmに加工した。
【0051】
測定対象微生物として芽胞状態の枯草菌を用いた。枯草菌を10%w/vゼラチン溶液+リン酸バッファー(pH7.4)(インビトロジェン)に懸濁して、枯草菌数2000個/10mLとする粘性の高い枯草菌懸濁溶液を調製した。栄養型細胞変換試薬として、100mMアラニン+100mMグルコース+リン酸バッファー(pH7.4)を用いた。微生物外生体物質除去試薬には、ルシフェールHSセット付属のATP消去液を用いた。微生物溶解液には、ルシフェールHSセット付属のATP抽出液を用いた。
【0052】
測定には図3に示した微生物検出装置を用いた。本実施例では、入力・制御部114の入力用にタッチパネルディスプレイを用いた。なお、入力・制御部114はラップトップコンピューターや、デスクトップコンピューター、もしくは入力用ボタンとディスプレイ、入出力用(USB Universal Serial Bus)メモリの組み合わせなどを用いてもよい。
【0053】
まず、枯草菌懸濁液は、ゼラチンを含むことから粘性が高い。また枯草菌懸濁液は、芽胞を形成した菌を含むため、入力・制御部114を用いて、枯草菌懸濁液の粘性が高いこと、芽胞を形成した菌を含むことを入力した。続いて微生物検出の開始を指示した。装置は、図2に示した処理手順に従って検出処理を実行する。
【0054】
二層構造メンブレンフィルター上と単層親水性メンブレンフィルター上に、枯草菌懸濁液をそれぞれ10mL加えた(S202)。入力・制御部114は、入力情報からステップ203の判定で枯草菌懸濁液は粘性が高いと判定し、加熱部108を用いて枯草菌懸濁液を40℃で加熱して粘性を下げた(S204)。
【0055】
枯草菌懸濁液にATP消去液を10μL加えて(S205)、枯草菌懸濁液とATP消去液を、吸引部105が生じる陰圧により二層構造メンブレンフィルター101と単層親水性メンブレンフィルターでそれぞれろ過した(S206)。
【0056】
ろ過後、入力・制御部114は、入力された情報からステップ207の判定で芽胞形成菌が含まれていると判定し、芽胞状態から栄養型細胞に変換するため、栄養型細胞変換試薬1mLを二層構造メンブレンフィルター101上と単層親水性メンブレンフィルター上にそれぞれ加えた(S208)。加熱部108により栄養型細胞変換試薬を40℃もしくは45℃で約1時間加熱し、芽胞状態から栄養型細胞への変換を促した(S209)。1時間後、単層親水性メンブレンフィルターでは、栄養型細胞変換試薬が単層親水性メンブレンフィルター下に染み落ちていたが、二層構造メンブレンフィルター101では栄養型細胞変換試薬が保持されていたため、これを再びろ過した(S210)。
【0057】
続いてATP抽出試薬を200μL加えて10分間静置した(S211)。静置している間、単層親水性メンブレンフィルター下からATP抽出液が染み落ちたが、二層構造メンブレンフィルター101においては変化が観察されなかった。二層構造メンブレンフィルター101と単層親水性メンブレンフィルター上に残ったATP抽出液10μLを、分注部110によって、検出部112上に設置された反応容器113内にある発光試薬115へ分注した(S212)。検出部112は、生じた発光を検出し(S213)、入力・制御部114は発光量からATP数を算出した(S214)。
【0058】
ATP数の検出結果を図13に示す。単層親水性メンブレンフィルターでは枯草菌100個当たりATP数は約10amolであったが、二層構造メンブレンフィルター101では約200amolと見積もられ、約20倍の値を示した。この結果は、単層親水性メンブレンフィルターではATP抽出液を単層親水性メンブレンフィルター上に保持できないため、ATP抽出液が単層親水性メンブレンフィルター下に染み落ちると共に枯草菌由来ATP分子も落ちてしまい、その結果、単層親水性メンブレンフィルター上に枯草菌由来ATP分子が溶離しなかったと考えられる。一方、二層構造メンブレンフィルター101では、ATP抽出液を二層構造メンブレンフィルター101上に保持できるため、ATP抽出液が枯草菌由来ATPと共に二層構造メンブレンフィルター101下に染み落ちない。また、第一層親水性メンブレンフィルター116内の枯草菌由来ATP分子は、時間と共に二層構造メンブレンフィルター110上に溶離されたと考えられる。
【0059】
なお、加熱部108で栄養型細胞変換試薬を加熱しない場合(図13、25℃、室温)は、枯草菌100個当たりのATP数は約10amolであった。
以上のように、本発明の微生物検出装置は、枯草菌を高感度、高精度、迅速、簡便に計測できた。
【0060】
本発明は種々の実験の積み重ねによって完成されたものである。以下に、本発明の基礎となった実験について説明する。
[実験例1]
(水溶液の保持と陰圧で水溶液のろ過が可能な疎水性メンブレンフィルターの調査)
水溶液を保持でき、かつ陰圧でろ過が可能な、疎水性メンブレンフィルターの有無を調べた。
【0061】
調べた疎水性メンブレンフィルターの孔径とピッチサイズ、材質を表1に示す。実験に用いた水溶液は、超純水とリン酸緩衝液、微生物溶解液である。リン酸緩衝液は、50mMリン酸/NaOH緩衝液pH7.4である。微生物溶解液は0.2%塩化ベンザルコニウム+25mMトリシン緩衝液pH12である。
【表1】

【0062】
各疎水性メンブレンフィルター上に各水溶液を滴下して、水溶液の保持能を調べた(表1)。その結果、すべての材質において水溶液を保持し、染み落ちることがなかった。
【0063】
また各水溶液に対して各疎水性メンブレンフィルターの陰圧によるろ過の可否について調べた(表1)。その結果、疎水性メンブレンフィルターは、孔径が0.8μm〜80μmで、常圧では水溶液に対し非浸透で、陰圧にすると水溶液のろ過が可能であった。孔径が0.6μm以下になると陰圧によるろ過は困難となり、孔径0.45μmではろ過はできなかった。加えて、メッシュ構造の疎水性メンブレンフィルターは、ピッチサイズ1μm〜59μmで水溶液を保持し、また陰圧でろ過可能であった。
【0064】
また孔径が0.8μm〜80μm又はピッチサイズ1μm〜59μmの疎水性メンブレンフィルターの上に孔径が0.05μm〜0.65μmの親水性メンブレンフィルターをのせた二層構造メンブレンフィルターを作製し、二層構造メンブレンフィルター上に水溶液を加えてろ過を試みたところ、二層構造メンブレンフィルターでも水溶液のろ過は可能であった。
【0065】
[実験例2]
(二層構造メンブレンフィルターの微生物溶解液保持能力の測定実験)
二層構造メンブレンフィルターと単層親水性メンブレンフィルターの微生物溶解液保持能力を比較するため、二種類のメンブレンフィルターを底部に備えた容器を用意した。
【0066】
1つは、二層構造メンブレンフィルター101を備える容器102である(図14A(a))。二層構造メンブレンフィルター101は上層の第一層が親水性メンブレンフィルター116、下層の第二層が疎水性メンブレンフィルター117で構成される。第一層親水性メンブレンフィルター116には、孔径0.45μm、厚さ150μm、空隙率79%のMF−ミリポアメンブレンフィルター(日本ミリポア)を使用し、直径を0.5cmに加工した。第二層疎水性メンブレンフィルター117には孔径10μmのマイテックスメンブレンフィルター(日本ミリポア)を使用した。
【0067】
もう1つは、親水性メンブレンフィルターのみで構成される単層親水性メンブレンフィルター1001を備える容器1002である(図14B(a))。単層親水性メンブレンフィルター1001には、孔径0.45μm、厚さ150μm、空隙率79%のMF−ミリポアメンブレンフィルター(日本ミリポア)を使用し、直径を0.5cmに加工した。
【0068】
二層構造メンブレンフィルター101上と単層親水性メンブレンフィルター1001上にそれぞれ微生物溶解液703として、0.2%塩化ベンザルコニウム+25mMトリシン緩衝液pH12を200μL加えて10分間静置した。5分間、10分間の静置後、二層構造メンブレンフィルター101で変化は観察されなかったが(図14A(b)(c))、単層親水性メンブレンフィルター1001では、静置時間と共に単層親水性メンブレンフィルター1001下から微生物溶解液1003が染み落ちた(図14B(b)(c))。
【0069】
単層親水性メンブレンフィルター1001から染み落ちる微生物溶解液1003の量を測定するため、染み落ちる微生物溶解液1003を採取して重量の測定を試みた。微生物溶解液703を加えてから4分後、10mgの微生物溶解液1003が染み落ちた。6分後、8分後に測定したところ、15mg、20mgの微生物溶解液1003が染み落ちた。合計45mg分、微生物溶解液1003が染み落ちることがわかった。
【0070】
一方、二層構造メンブレンフィルター101下からは微生物溶解液が染み落ちなかった。代わりに二層構造メンブレンフィルター101上に微生物溶解液703を加えた直後(図14A(a))と10分静置後(図14A(c))で、二層構造メンブレンフィルター101を備える容器102、微生物溶解液703の合計重量をそれぞれ測定し、その差を算出した。差は1mgとなり、ほぼ重量に変化が無いことがわかった。この結果は、微生物溶解液は二層構造メンブレンフィルターを備える容器102の中に保持されることを示している。
この結果から、二層構造メンブレンフィルターは、微生物溶解液をその上に保持できることがわかった。
【0071】
[実験例3]
(メンブレンフィルター内のATP溶離実験)
二層構造メンブレンフィルターと単層親水性メンブレンフィルター内のATP分子の溶離量を比較するため、二種類のメンブレンフィルターを備える容器を用意した。1つは、底部に二層構造メンブレンフィルター101を備える容器102である(図15(a))。二層構造メンブレンフィルター101は上層の第一層が親水性メンブレンフィルター116、下層の第二層が疎水性メンブレンフィルター117で構成される。第一層親水性メンブレンフィルター116には、孔径0.45μm、厚さ150μm、空隙率79%のMF−ミリポアメンブレンフィルター(日本ミリポア)を使用し、直径を0.5cmに加工した。第二層疎水性メンブレンフィルター117には孔径10μmのマイテックスメンブレンフィルター(日本ミリポア)を使用し、直径を0.5cmに加工した。
【0072】
もう1つは、親水性メンブレンフィルターのみで構成される単層親水性メンブレンフィルター1001を底部に備える容器1002である(図16(a))。単層親水性メンブレンフィルター1001には、孔径0.45μm、厚さ150μm、空隙率79%のMF−ミリポアメンブレンフィルター(日本ミリポア)を使用し、直径を0.5cmに加工した。
【0073】
ATP溶液としてルシフェールATP標準試薬(キッコーマン)を用いて20000amol/10μLの濃度のATP溶液を作製した。発光試薬115として、ATP・ルシフェラーゼ・ルシフェリン反応を生じるルシフェールHSセット(キッコーマン)付属の発光試薬を用いた。
【0074】
まず、二層構造メンブレンフィルター101上と単層親水性メンブレンフィルター1001上にそれぞれATP溶液を10μL加えて、第一層親水性メンブレンフィルター116と単層親水性メンブレンフィルター1001内にATP分子1501を染み込ませた(図15(a)、図16(a))。続いて、微生物溶解液703として、0.2%塩化ベンザルコニウム+25mMトリシン緩衝液pH12を200μL加えた後、静置した(図15(b)、図16(b))。
【0075】
静置している間、単層親水性メンブレンフィルター1001下から微生物溶解液1003が時間と共に染み落ちてきた(図16(c)(d))。一方、二層構造メンブレンフィルター101では変化は観察されなかった(図15(c)(d))。
【0076】
単層親水性メンブレンフィルター1001下から染み落ちる微生物溶解液1003中のATP分子1601の数と、単層親水性メンブレンフィルター1001上に遊離した微生物溶解液703中のATP分子1501の数(図16(c)(d))を定量的に評価するため、単層親水性メンブレンフィルター1001上に残っている微生物溶解液703と単層親水性メンブレンフィルター1001下から染み落ちた微生物溶解液1003をそれぞれ10μL採取し、反応容器113中の発光試薬115に加えて、生じた発光反応を検出部112で検出した。
【0077】
単層親水性メンブレンフィルター1001上に微生物溶解液703を加えてから4分後、6分後、8分後に、染み落ちた微生物溶解液1003の発光量は、約20000CPS(Countper Second)、25000CPS、30000CPSを示した(図17)。染み落ちる前、単層親水性メンブレンフィルター1001内にはATP分子が20000amol存在し、200μLの微生物溶解液703を単層親水性メンブレンフィルター1001上に加えたことから、ATP分子1501が理想的に微生物溶解液703中に拡散した場合、ATP濃度は約1000amol/10μLになる。なお1000amol/10μLのATP濃度の発光量を測定すると、発光量は約10000CPSを示す。従って、単層親水性メンブレンフィルター1001から染み落ちた微生物溶解液1003中のATP分子1601の数は、理想的にATP分子1501が微生物溶解液703中に拡散した場合と比較して、2〜3倍多いことがわかった。
【0078】
一方、単層親水性メンブレンフィルター1001上に残った微生物溶解液703に含まれるATP分子1501の数を発光測定したところ、10分経過しても約5000CPSが最高であった。染み落ちた微生物溶解液1003を測定した時に比べて、1/4〜1/6の発光量であった(図17)。この結果から、単層親水性メンブレンフィルター1001内のATP分子1501(図16(a))は1/4〜1/6程度しか親水性メンブレンフィルター1001上に遊離しないことがわかった(図16(d))。
【0079】
一方、二層構造メンブレンフィルター101下から微生物溶解液703は染み落ちなかった。代わりに、微生物溶解液703を二層構造メンブレンフィルター101上に加えた直後と2〜20分静置した後で、二層構造メンブレンフィルター101上の微生物溶解液703を10μLずつ採取して発光測定した。各静置時間において、発光量は約9800CPSを示した(図18)。この結果は、微生物溶解液703を二層構造メンブレンフィルター101を備える容器102の中に保持することで、第一層親水性メンブレンフィルター116内に染み込んだATP分子1501(図15(a))を二層構造メンブレンフィルター101上に溶離できていることを示している(図15(d))。
【0080】
この結果から、二層構造メンブレンフィルター101上に微生物溶解液703を保持することで、第一層親水性メンブレンフィルター116内からATP分子1501を効率よく溶離できることがわかった。また、第一層親水性メンブレンフィルターの直径がより小さく、また厚さが薄いほど効率よく溶離できる。
【0081】
[実験例4]
(湿潤剤を用いた場合の微生物計測実験)
二層構造メンブレンフィルターと、湿潤剤を染みこませることで水溶液がろ過できる疎水性メンブレンフィルターを用いた時の微生物検出感度を比較するため、四種類のメンブレンフィルターを備える容器を用意した。
【0082】
(1)二層構造メンブレンフィルターを備える容器:
二層構造メンブレンフィルターは上層の第一層が親水性メンブレンフィルター、下層の第二層が疎水性メンブレンフィルターで構成される。第一層親水性メンブレンフィルターには、孔径0.45μm、厚さ150μm、空隙率79%のMF−ミリポアメンブレンフィルター(日本ミリポア)を使用し、直径を0.5cmに加工した。第二層疎水性メンブレンフィルターには孔径10μmのマイテックスメンブレンフィルター(日本ミリポア)を使用し、直径を0.5cmに加工した。
【0083】
(2)単層親水性メンブレンフィルターを備える容器:
単層親水性メンブレンフィルターには、孔径0.45μm、厚さ150μm、空隙率79%のMF−ミリポアメンブレンフィルター(日本ミリポア)を使用し、直径を0.5cmに加工した。
【0084】
(3)第一層に親水性メンブレンフィルターと、第二層に湿潤剤を染みこませることで水溶液がろ過できる疎水性メンブレンフィルターで構成される要湿潤剤二層構造メンブレンフィルターを備える容器:
二枚重ねのメンブレンフィルターの第一層親水性メンブレンフィルターには、孔径0.45μm、厚さ150μm、空隙率79%のMF−ミリポアメンブレンフィルター(日本ミリポア)を使用し、直径を0.5cmに加工した。第二層の疎水性メンブレンフィルターとして、孔径0.45μmの疎水性デュラポアメンブレンフィルター(日本ミリポア)を使用し、直径を0.5cmに加工した。
【0085】
(4)湿潤剤を染みこませることで水溶液がろ過できる疎水性メンブレンフィルターで構成される要湿潤剤単層疎水性メンブレンフィルターを備える容器:
単層の疎水性メンブレンフィルターとして孔径0.45μmの疎水性デュラポアメンブレンフィルター(日本ミリポア)を使用し、直径を0.5cmに加工した。
【0086】
測定対象微生物として大腸菌を用いた。大腸菌をリン酸バッファー(pH7.4)(インビトロジェン)に懸濁して、大腸菌数が100個/10mLとなるように調製した。微生物外生体物質除去試薬として、ルシフェールHSセット(キッコーマン)付属のATP消去液を用いた。微生物溶解液には、ルシフェールHSセット(キッコーマン)付属のATP抽出液を用いた。
【0087】
二層構造メンブレンフィルター上と、単層親水性メンブレンフィルター上、要湿潤剤二層構造メンブレンフィルター上、要湿潤剤単層疎水性メンブレンフィルター上にそれぞれ大腸菌懸濁液を10mL加えた。また第一試薬として、ATP消去液を10μL加えた。
【0088】
二層構造メンブレンフィルターと、単層親水性メンブレンフィルターは大腸菌懸濁液をろ過できた。しかし要湿潤剤二層構造メンブレンフィルターと要湿潤剤単層疎水性メンブレンフィルターは大腸菌懸濁液をろ過できなかったため、各疎水性メンブレンフィルターに湿潤剤であるメチルアルコールを染み込ませてろ過を可能にした。
【0089】
ろ過後、第二試薬として、ATP抽出液を200μL加えた。二層構造メンブレンフィルター上と、単層親水性メンブレンフィルター上、要湿潤剤二層構造メンブレンフィルター上、要湿潤剤単層疎水性メンブレンフィルター上に残ったATP抽出液10μLの発光測定をした。
【0090】
二層構造メンブレンフィルターでは、大腸菌100個からATPは140amolが検出された。一方、単層親水性メンブレンフィルターでは10amol、要湿潤剤二層構造メンブレンフィルターと要湿潤剤単層疎水性メンブレンフィルターでは、12amolが検出された。各メンブレンフィルターで検出されたATP数は、二層構造メンブレンフィルターに比べて約1/10以下に減少した。
【0091】
この結果は、疎水性メンブレンフィルターに染み込ませた湿潤剤が、大腸菌を損傷ないし溶解したことにより、大腸菌由来ATPがろ過の間に流れ出てしまったためと考えられる。
【0092】
湿潤剤を使って疎水性メンブレンフィルターでろ過する微生物検出方法は、微生物の検出感度と精度共を減少させる。一方、湿潤剤を使わない二層構造メンブレンフィルターは、微生物の検出感度と精度を向上した。
【符号の説明】
【0093】
101 二層構造メンブレンフィルター
102 容器
103 試薬供給部
105 吸引部
106 洗浄液供給部
108 加熱部
109 アーム
110 分注部
112 検出部
113 反応容器
114 入力・制御部
115 発光試薬
116 親水性メンブレンフィルター
117 疎水性メンブレンフィルター
118 廃液部
301 試薬
302 試薬槽
601 励起光照射部
701 大腸菌
702 大腸菌懸濁液
703 微生物溶解液
704 大腸菌由来ATP分子
801 容器の底部
802 環状の蓋
803 ネジ
901 容器のネジ様溝を持つ底部
902 ネジ様溝を持つ環状の蓋
1001 単層親水性メンブレンフィルター
1002 容器
1003 染み落ちた微生物溶解液
1004 染み落ちた大腸菌由来ATP分子
1101 吸引口
1501 ATP分子
1601 染み落ちたATP分子
【特許請求の範囲】
【請求項1】
上層の親水性メンブレンフィルターと下層の疎水性メンブレンフィルターを重ねた二層構造のメンブレンフィルターと、
前記二層構造のメンブレンフィルターの周縁部を固定して底部に保持する容器と、
を備えることを特徴とする微生物検出処理用試料容器。
【請求項2】
請求項1記載の微生物検出処理用試料容器において、前記親水性メンブレンフィルターは微生物を捕捉し、前記疎水性メンブレンフィルターは試薬を保持する機能を有することを特徴とする微生物検出処理用試料容器。
【請求項3】
請求項1又は2記載の微生物検出処理用試料容器において、前記親水性メンブレンフィルターの孔径は前記疎水性メンブレンフィルターの孔径より小さいことを特徴とする微生物検出処理用試料容器。
【請求項4】
請求項1〜3のいずれか1項記載の微生物検出処理用試料容器において、前記疎水性メンブレンフィルターは、多孔性で孔径が0.8μm〜80μmのメンブレンフィルター、もしくはメッシュ構造でピッチサイズが1μm〜59μmであることを特徴とする微生物検出処理用試料容器。
【請求項5】
請求項1〜4のいずれか1項記載の微生物検出処理用試料容器において、前記疎水性メンブレンフィルターは、厚みが7μm〜800μmのメンブレンフィルターであることを特徴とする微生物検出処理用試料容器。
【請求項6】
請求項1〜5のいずれか1項記載の微生物検出処理用試料容器において、前記親水性メンブレンフィルターは孔径が0.05μm〜0.65μmのメンブレンフィルターであることを特徴とする微生物検出処理用試料容器。
【請求項7】
請求項1〜6のいずれか1項記載の微生物検出処理用試料容器において、前記親水性メンブレンフィルターは、厚みが7μm〜200μmのメンブレンフィルターであることを特徴とする微生物検出処理用試料容器。
【請求項8】
上層の親水性メンブレンフィルターと下層の疎水性メンブレンフィルターを重ねた二層構造のメンブレンフィルターを底部に備える試料容器と、
前記二層構造メンブレンフィルター下に陰圧を生じさせる吸引部と、
微生物外生体物質除去試薬と微生物溶解液を個別に前記試料容器に添加する試薬供給部と、
試料の発光を検出する検出部と、
装置各部の制御を行う制御部とを有し、
前記制御部は、前記試薬供給部を作動させて前記試料容器中の試料に微生物外生体物質除去試薬を添加したのち前記吸引部を作動させて前記試料容器中の溶液を前記二重構造メンブレンフィルターでろ過し、その後、前記試薬供給部を作動させて前記試料容器に前記微生物溶解液を添加する制御を行うことを特徴とする微生物検出装置。
【請求項9】
請求項8記載の微生物検出装置において、前記前記親水性メンブレンフィルターの孔径は前記疎水性メンブレンフィルターの孔径より小さいことを特徴とする微生物検出装置。
【請求項10】
請求項8記載の微生物検出装置において、前記親水性メンブレンフィルターは孔径が0.05μm〜0.65μmであり、前記疎水性メンブレンフィルターは孔径が0.8μm〜80μmであることを特徴とする微生物検出装置。
【請求項11】
請求項8〜10のいずれか1項記載の微生物検出装置において、前記試薬供給部は前記試料容器に発光試薬を添加し、前記検出部は、前記発光試薬が添加された試料容器中の溶液から発生する発光を検出することを特徴とする微生物検出装置。
【請求項12】
請求項8〜10のいずれか1項記載の微生物検出装置において、分注部を備え、前記検出部は、前記分注部によって反応容器に分注された前記微生物溶解液が添加された試料溶液と発光試薬との反応によって生じる発光を検出することを特徴とする微生物検出装置。
【請求項13】
請求項8〜10のいずれか1項記載の微生物検出装置において、励起光照射部を備え、前記検出部は、前記励起光照射部からの励起光照射によって試料から発生される蛍光を検出することを特徴とする微生物検出装置。
【請求項14】
上層の親水性メンブレンフィルターと下層の疎水性メンブレンフィルターを重ねた二層構造のメンブレンフィルターを底部に備える試料容器に微生物を含む試料を添加する工程と、
微生物外生体物質除去試薬を添加する工程と、
前記二層メンブレンフィルター下に陰圧を生じさせ、前記試料容器内の溶液をろ過する工程と、
前記微生物を溶解する試薬を添加し前記微生物から生体物質を抽出する工程と、
を有することを特徴とする微生物検出方法。
【請求項15】
請求項14記載の微生物検出方法において、更に、
前記生体物質と発光試薬とを反応させる工程と、
前記反応で生じた発光を検出する工程と、
を有することを特徴とする微生物検出方法。
【請求項16】
請求項14記載の微生物検出方法において、更に、
前記生体物質に励起光を照射する工程と、
前記励起光照射によって生じた蛍光を検出する工程と、
を有することを特徴とする微生物検出方法。
【請求項17】
請求項14〜16のいずれか1項記載の微生物検出方法において、前記微生物を溶解する試薬は前記疎水性メンブレンフィルターを湿潤しない試薬であることを特徴とする微生物検出方法。
【請求項18】
請求項14〜17のいずれか1項記載の微生物検出方法において、前記親水性メンブレンフィルターの孔径は前記疎水性メンブレンフィルターの孔径より小さいことを特徴とする微生物検出方法。
【請求項19】
請求項14〜17のいずれか1項記載の微生物検出方法において、前記親水性メンブレンフィルターは孔径が0.05μm〜0.65μmであり、前記疎水性メンブレンフィルターは孔径が0.8μm〜80μmであることを特徴とする微生物検出方法。
【請求項20】
請求項14〜19のいずれか1項記載の微生物検出方法において、試料の粘性が高いとき、前記微生物外生体物質除去試薬を添加に先だって試料の加熱及び/又は洗浄液を供給する工程を有することを特徴とする微生物検出方法。
【請求項21】
請求項14〜20のいずれか1項記載の微生物検出方法において、測定対象微生物が非栄養型細胞を形成しているとき、前記ろ過の後、栄養型細胞変換試薬を添加する工程を有することを特徴とする微生物検出方法。
【請求項1】
上層の親水性メンブレンフィルターと下層の疎水性メンブレンフィルターを重ねた二層構造のメンブレンフィルターと、
前記二層構造のメンブレンフィルターの周縁部を固定して底部に保持する容器と、
を備えることを特徴とする微生物検出処理用試料容器。
【請求項2】
請求項1記載の微生物検出処理用試料容器において、前記親水性メンブレンフィルターは微生物を捕捉し、前記疎水性メンブレンフィルターは試薬を保持する機能を有することを特徴とする微生物検出処理用試料容器。
【請求項3】
請求項1又は2記載の微生物検出処理用試料容器において、前記親水性メンブレンフィルターの孔径は前記疎水性メンブレンフィルターの孔径より小さいことを特徴とする微生物検出処理用試料容器。
【請求項4】
請求項1〜3のいずれか1項記載の微生物検出処理用試料容器において、前記疎水性メンブレンフィルターは、多孔性で孔径が0.8μm〜80μmのメンブレンフィルター、もしくはメッシュ構造でピッチサイズが1μm〜59μmであることを特徴とする微生物検出処理用試料容器。
【請求項5】
請求項1〜4のいずれか1項記載の微生物検出処理用試料容器において、前記疎水性メンブレンフィルターは、厚みが7μm〜800μmのメンブレンフィルターであることを特徴とする微生物検出処理用試料容器。
【請求項6】
請求項1〜5のいずれか1項記載の微生物検出処理用試料容器において、前記親水性メンブレンフィルターは孔径が0.05μm〜0.65μmのメンブレンフィルターであることを特徴とする微生物検出処理用試料容器。
【請求項7】
請求項1〜6のいずれか1項記載の微生物検出処理用試料容器において、前記親水性メンブレンフィルターは、厚みが7μm〜200μmのメンブレンフィルターであることを特徴とする微生物検出処理用試料容器。
【請求項8】
上層の親水性メンブレンフィルターと下層の疎水性メンブレンフィルターを重ねた二層構造のメンブレンフィルターを底部に備える試料容器と、
前記二層構造メンブレンフィルター下に陰圧を生じさせる吸引部と、
微生物外生体物質除去試薬と微生物溶解液を個別に前記試料容器に添加する試薬供給部と、
試料の発光を検出する検出部と、
装置各部の制御を行う制御部とを有し、
前記制御部は、前記試薬供給部を作動させて前記試料容器中の試料に微生物外生体物質除去試薬を添加したのち前記吸引部を作動させて前記試料容器中の溶液を前記二重構造メンブレンフィルターでろ過し、その後、前記試薬供給部を作動させて前記試料容器に前記微生物溶解液を添加する制御を行うことを特徴とする微生物検出装置。
【請求項9】
請求項8記載の微生物検出装置において、前記前記親水性メンブレンフィルターの孔径は前記疎水性メンブレンフィルターの孔径より小さいことを特徴とする微生物検出装置。
【請求項10】
請求項8記載の微生物検出装置において、前記親水性メンブレンフィルターは孔径が0.05μm〜0.65μmであり、前記疎水性メンブレンフィルターは孔径が0.8μm〜80μmであることを特徴とする微生物検出装置。
【請求項11】
請求項8〜10のいずれか1項記載の微生物検出装置において、前記試薬供給部は前記試料容器に発光試薬を添加し、前記検出部は、前記発光試薬が添加された試料容器中の溶液から発生する発光を検出することを特徴とする微生物検出装置。
【請求項12】
請求項8〜10のいずれか1項記載の微生物検出装置において、分注部を備え、前記検出部は、前記分注部によって反応容器に分注された前記微生物溶解液が添加された試料溶液と発光試薬との反応によって生じる発光を検出することを特徴とする微生物検出装置。
【請求項13】
請求項8〜10のいずれか1項記載の微生物検出装置において、励起光照射部を備え、前記検出部は、前記励起光照射部からの励起光照射によって試料から発生される蛍光を検出することを特徴とする微生物検出装置。
【請求項14】
上層の親水性メンブレンフィルターと下層の疎水性メンブレンフィルターを重ねた二層構造のメンブレンフィルターを底部に備える試料容器に微生物を含む試料を添加する工程と、
微生物外生体物質除去試薬を添加する工程と、
前記二層メンブレンフィルター下に陰圧を生じさせ、前記試料容器内の溶液をろ過する工程と、
前記微生物を溶解する試薬を添加し前記微生物から生体物質を抽出する工程と、
を有することを特徴とする微生物検出方法。
【請求項15】
請求項14記載の微生物検出方法において、更に、
前記生体物質と発光試薬とを反応させる工程と、
前記反応で生じた発光を検出する工程と、
を有することを特徴とする微生物検出方法。
【請求項16】
請求項14記載の微生物検出方法において、更に、
前記生体物質に励起光を照射する工程と、
前記励起光照射によって生じた蛍光を検出する工程と、
を有することを特徴とする微生物検出方法。
【請求項17】
請求項14〜16のいずれか1項記載の微生物検出方法において、前記微生物を溶解する試薬は前記疎水性メンブレンフィルターを湿潤しない試薬であることを特徴とする微生物検出方法。
【請求項18】
請求項14〜17のいずれか1項記載の微生物検出方法において、前記親水性メンブレンフィルターの孔径は前記疎水性メンブレンフィルターの孔径より小さいことを特徴とする微生物検出方法。
【請求項19】
請求項14〜17のいずれか1項記載の微生物検出方法において、前記親水性メンブレンフィルターは孔径が0.05μm〜0.65μmであり、前記疎水性メンブレンフィルターは孔径が0.8μm〜80μmであることを特徴とする微生物検出方法。
【請求項20】
請求項14〜19のいずれか1項記載の微生物検出方法において、試料の粘性が高いとき、前記微生物外生体物質除去試薬を添加に先だって試料の加熱及び/又は洗浄液を供給する工程を有することを特徴とする微生物検出方法。
【請求項21】
請求項14〜20のいずれか1項記載の微生物検出方法において、測定対象微生物が非栄養型細胞を形成しているとき、前記ろ過の後、栄養型細胞変換試薬を添加する工程を有することを特徴とする微生物検出方法。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14A】


【図14B】


【図15】


【図16】


【図17】


【図18】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14A】


【図14B】


【図15】


【図16】


【図17】


【図18】


【公開番号】特開2010−193835(P2010−193835A)
【公開日】平成22年9月9日(2010.9.9)
【国際特許分類】
【出願番号】特願2009−44648(P2009−44648)
【出願日】平成21年2月26日(2009.2.26)
【出願人】(000005452)株式会社日立プラントテクノロジー (1,767)
【Fターム(参考)】
【公開日】平成22年9月9日(2010.9.9)
【国際特許分類】
【出願日】平成21年2月26日(2009.2.26)
【出願人】(000005452)株式会社日立プラントテクノロジー (1,767)
【Fターム(参考)】
[ Back to top ]

