微生物検査方法及び検査システム
【課題】 微生物の代謝活性を質量分析により定量することで、微生物の薬剤感受性試験において迅速な方法を提供する。
【解決手段】 微生物の細胞内のエネルギー代謝に関連する物質を質量分析により測定し、薬剤添加と無添加の場合とを比較して、薬剤感受性試験を行う。また、合成基質の代謝に関連する物質を質量分析により測定し、そのスペクトル情報から菌種同定を行う。さらに、合成基質の代謝に関連する物質について、薬剤添加と無添加の場合との質量分析結果を比較して、薬剤感受性試験を行う。
【解決手段】 微生物の細胞内のエネルギー代謝に関連する物質を質量分析により測定し、薬剤添加と無添加の場合とを比較して、薬剤感受性試験を行う。また、合成基質の代謝に関連する物質を質量分析により測定し、そのスペクトル情報から菌種同定を行う。さらに、合成基質の代謝に関連する物質について、薬剤添加と無添加の場合との質量分析結果を比較して、薬剤感受性試験を行う。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、質量分析法を用い、試料中の微生物の代謝反応を測定することによる、微生物の薬剤感受性検査方法及びシステムに関する。
【背景技術】
【0002】
臨床検査において感染症関連疾患の治療方針、抗菌剤などの薬剤(以下、薬剤と記載)の決定の為に、疾患起因菌の同定試験、薬剤感受性試験が実施されている。通常、微生物の同定試験、薬剤感受性試験を実施する前に、血液、尿、便、喀痰、髄液等の臨床検体より検査対象となる微生物を単一コロニーとして採取しなくてはならず、単一コロニーを採取するには18〜24時間かけ分離培養が実施されている。
【0003】
臨床検体より単一コロニーとして採取された微生物は、微生物同定の為の同定試験及び薬剤感受性試験が実施される。同定試験は通常、微生物の生化学的性状を微生物の代謝反応に関与する種々の酵素活性や糖代謝反応などを組み合わせた試験が実施される。即ち、微生物を含有する反応液に代謝反応により発色や蛍光を発するような人工的な基質が添加されており、光学的に測定し、対象となる微生物を同定する。しかし光学的測定法は感度が低く同定までに6〜7時間、時には18~24時間を要する。
【0004】
この問題の解決の為、光学的測定方法より反応の検出感度の高い質量分析法を用いて微生物の代謝反応を測定し、30分で反応を検出し1時間以内の微生物を同定する方法が開発された(非特許文献1)。
【0005】
更にMALDI-TOF MASS法による質量分析を用い、微生物のリボソーム蛋白質のフィンガプリントによる微生物同定試験が開発され、同定時間が30分以内に短縮された。(非特許文献2)しかしながら、質量分析を用いる方法では薬剤感受性試験は開発されていない。
【0006】
薬剤感受性試験は、拡散法と希釈法に大別される。拡散法は薬剤を含むろ紙ディスクを分離菌を塗布した寒天平板培地上に置き、16〜18時間培養した後に培地内に拡散した薬剤による微生物の増殖阻止円の半径を測定し、薬剤の微生物に対する増殖阻止能力を判定する(非特許文献3)。希釈法は液体培地を用いる場合(液体希釈法)、段階的に希釈した薬剤を含む液体培地に一定量の分離菌を接種し、16〜20時間培養後の培養液の混濁を肉眼または濁度を測定し、薬剤の菌に対する増殖阻止能力を判定する(非特許文献4)。細菌検査自動化装置には、液体希釈法を微量化した方法が採用されるがこの場合、結果が得られるまでに5〜8時間を要す。
【0007】
薬剤感受性試験の迅速化としては、微生物細胞のエネルギー代謝に関与する補酵素であるニコチンアミドアデニンジヌクレオチド(NAD)またはニコチンアミドアデニンジヌクレオチド(NADPH)の還元作用が、細胞外の電子メディエータをも還元することを利用し、反応液中にメナジオンの様な電子メディエータを添加し、電子メディエータを介した反応で生じた活性酸素を、ルミノール反応等の化学発光法や水溶性ホルマザン色素で比色測定する方法が開発されている(非特許文献5)。この方法を採用した細菌検査自動化装置も開発されており3〜7時間くらいで結果が得られる。
【先行技術文献】
【非特許文献】
【0008】
【非特許文献1】Anal.Chem.2002,74,4290-4293
【非特許文献2】Identification of Microorganisms by Mass Spectrometry p.125-152 Edited by Charles L. Wilkins and Jackson O. Lay, Jr.
【非特許文献3】Performance Standards for Antimicrobial Disk Susceptibility Test; Approved Standard-Tenth Edition(M02-A10)
【非特許文献4】Methods for Dilution Antimicrobial Susceptibility Test for Bacteria That Grow Aerobically; Approved Standard-Eight Edition(M07-A8)
【非特許文献5】Microbiol. Immunol., 2001,45(5),333-340
【発明の概要】
【発明が解決しようとする課題】
【0009】
薬剤感受性試験は、細胞内のエネルギー代謝反応に関与する反応を利用し、迅速化が試みられているが、検出系が光学的方法であるため、迅速化がなされておらず、時間を要していることが課題である。また、微生物同定試験と薬剤感受性試験は別々に行われており、時間と手間を要している。
【課題を解決するための手段】
【0010】
微生物の細胞内のエネルギー代謝に関連する物質を質量分析により測定し、薬剤添加と無添加の場合とを比較して、薬剤感受性試験を行う。また、合成基質の代謝に関連する物質を質量分析により測定し、そのスペクトル情報から菌種同定を行う。
【0011】
さらに、合成基質の代謝に関連する物質について、薬剤添加と無添加の場合との質量分析結果を比較して、薬剤感受性試験を行う。
【発明の効果】
【0012】
迅速な薬剤感受性試験を行うことができる。また、質量分析装置を用いて薬剤感受性試験と微生物同定試験とを共に行い、薬剤感受性試験に伴い有用な情報を取得できる。さらに、薬剤感受性試験について、微生物細胞の直接の生死の指標となるエネルギー代謝と、微生物の栄養(合成基質)利用に関する代謝反応への薬剤の影響を評価することができる。
【図面の簡単な説明】
【0013】
【図1】測定フロー図。
【図2】測定フローとデータ処理の説明図。
【図3】エネルギー代謝反応による薬剤感受性試験結果を示す図。
【図4】エネルギー代謝反応による薬剤感受性試験の結果表示画面図。
【図5】栄養代謝反応による薬剤感受性試験の結果表示画面図。
【図6】システム全体図。
【図7】インターフェース図。
【図8】代謝反応系の説明。
【発明を実施するための形態】
【0014】
図6に、システム全体図を示す。システムとして、菌液を調製する菌試料を準備するための装置601、微生物を培養するための培養装置602、質量分析用の試料を調製するための装置603、微生物の代謝情報を取得するための質量分析装置604、そして、質量分析装置604から取得されたスペクトル情報を分析する計算装置605を用いる。計算装置605は、ユーザの入力を支援するための入力部606、スペクトル情報を基に情報を処理するためのデータ処理部607、データを格納する記憶装置608、データを出力する出力部609等を有している。出力の仕方としてはPC等のディスプレイ上に表示するようにしてもよいし、媒体上に出力するのでもよい。
【0015】
図1に、測定フローを示す。まずステップ101では、臨床検体より、単一微生物よりなるコロニーを取得するための分離培養を行う。続いてステップ102では、コロニーを釣菌し、一定濃度の微生物を含有する菌液を調製し、菌試料の準備をする。具体的には、102−1に示すように、栄養代謝測定用の菌試料として、調製した菌液、培養のための培地、微生物の代謝の基質となるような合成基質、薬剤感受性試験のための当該薬剤を添加した試料と、参照として当該薬剤を含まない試料とを準備する。一方、ステップ102−2では、エネルギー代謝測定の菌試料として、調製した菌液、培養のための培地、酸化型キノン化合物、反応の検出のための反応指示物質、薬剤感受性試験のための当該薬剤を添加した試料と、参照として当該薬剤を含まない試料とを準備する。ここで、栄養代謝とは、微生物の細胞外から細胞内に取り込まれた合成基質等を分解することをいう。また、エネルギー代謝とは、微生物が生存維持するのに必要な代謝をいう。
【0016】
ステップ103では、ステップ102で準備した試料の培養を行う。そして、ステップ104では、培養された当該試料を用いて質量分析用に試料の調製を行い、ステップ105では、質量分析を行って各試料のm/zに基づくスペクトルを取得する。
【0017】
続いてステップ106では、ステップ105で取得したスペクトルのデータ解析を行う。ステップ106−1では、栄養代謝測定結果として、薬剤無添加の条件で得られた質量分析スペクトルと薬剤添加した場合の質量分析スペクトルとを比較し、栄養代謝への薬剤の影響を評価するための薬剤感受性情報を取得する。さらに、薬剤を添加していない場合の質量分析結果スペクトルを、微生物の種類毎に当該合成基質の代謝で特定されるスペクトルを保存したデータベースと照らし合わせて、微生物同定に関する情報を取得する。
【0018】
一方、ステップ106−2では、エネルギー代謝測定結果として、薬剤無添加の条件で得られた質量分析スペクトルと薬剤添加した場合の質量分析スペクトルとを比較し、薬剤によりエネルギー代謝への薬剤の影響を評価するための薬剤感受性情報を取得する。
【0019】
ここで、ステップ102の菌試料準備の工程では、薬剤添加有りの試料について、薬剤の濃度を異ならせた複数の試料を準備して、濃度に応じた薬剤感受性情報を取得するようにすれば、当該菌に対する薬剤の影響を濃度に応じて評価することができる。また、ステップ103にて微生物代謝の培養時間を変化させ、時系列的なデータを取得するようにすれば、当該薬剤による時間的な影響を測ることができる。
【0020】
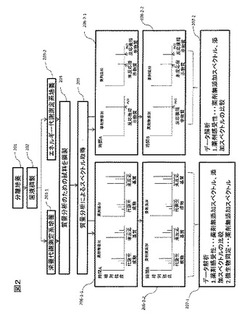
続いて、図2を用い、質量スペクトルによるデータ解析について説明する。ステップ201で分離培養、ステップ202で菌液調製、ステップ203−1またはステップ203−2で培養を行うことにより微生物細胞内で代謝反応を行わせ、ステップ204で質量分析用試料を調製し、ステップ205で質量分析を行う。
【0021】
206−1−1及び206−1−2に示すのは、栄養代謝測定系より取得したスペクトルデータであり、薬剤無添加の場合、添加した合成基質が微生物由来の酵素により代謝され、代謝生成物と残存する未反応基質のピークが観察される。これに対し薬剤を添加した場合、薬剤が微生物に殺菌的もしくは抑制的に作用すれば、図に示すスペクトルのように、薬剤無添加の場合のスペクトルと比較して未反応基質のピークが大きくなり代謝生成物のピークが減少する。一方、薬剤が微生物に作用しない場合には、薬剤添加した場合でも、薬剤無添加の場合と変わらないようなスペクトルが取得される。さらに、薬剤無添加のスペクトルを用い、微生物の種類と当該合成基質の代謝スペクトルの情報を備えたデータベースに照らし合わせることにより、微生物の同定も合わせて行うことができる。更に時間経過に伴うスペクトルを取得すれば、薬剤の有効性の早期検出が可能となる。
【0022】
また、エネルギー代謝の系では、ステップ203−2において微生物をメナジオンを代表とする微生物細胞内でのエネルギー代謝を触媒するような酸化型キノンと共存させ、反応溶液中で起こる酸化還元反応を、ルミノールなどの反応指示物質に伝達させ、エネルギー代謝反応を反応指示物質の分子量変化として質量分析で測定する。尚、反応指示物質としてはルミノール以外にルシゲニンなども挙げられるが、反応溶液中の活性酸素が溶存酸素に変化する反応に共役して分子量変化が起こる物質であれば、反応指示物質とすることが可能である。また、酸化型キノンが還元型キノンに変化する反応において、その変化が分子量変化として測定できるような物質であれば、この段階において質量分析を実施しすることにより結果を得ることも可能である。
【0023】
この系においても薬剤添加、および無添加の場合の結果を比較する。図の206−2−1及び206−2−2に示すように薬剤によるエネルギー代謝反応の抑制または阻害が起こった場合、両者のスペクトルの違いにより薬剤に有効性の判定が可能となる。一方、薬剤により微生物のエネルギー代謝反応の抑制又は阻害が起こらなければ、両者のスペクトルに大きな相違は見られない。本系においても時間経過に伴うスペクトルを取得すれば、薬剤の有効性の早期検出が可能となる。
【0024】
栄養利用に関する代謝を測定する系において基質となる物質(合成基質)としては、ヒドロキシプロリン、L-イソロイシン、L-プロリン、L-チロシン、グリシン、グリシルグリシン、グリシル-L-アルギニン、グリシル-L-プロリン、L-アルギニル-L-アルギニン、L-リジル-L-アラニン、L-アラニン、L-セリン-L-チロシン、L-ヒスチジン、α-D-グルコース、β-D-グルコース、β-D-ガラクトース、β-D-フコース、β-D-セロビオース、N-アセチルガラクトサミン、N-アセチルグルコサミンを、他の官能基に結合させた物質があげられる。結合させる分子団としては、光学的手法で用いられる発色物質や蛍光物質でも良いが、質量分析として外部から添加されたことを示す同位体原子を含むような分子団でも良い。結合させる分子団との結合方法は、例えば、ペプチド結合、エステル結合、グリコシド結合を用いることができる。
【0025】
エネルギー代謝の系において反応液中に添加される酸化型キノンは、メナジオン、ベンゾキノン、ナフトキノン、ジフェノキノン、アントラキノンなどが挙げられる。また、これらの構造を基本骨格としてもつ化合物を用いることも可能である。
【0026】
図8に詳細を説明する。多くの微生物は炭水化物を分解しエネルギーを獲得する。エネルギーを獲得する細胞内の代謝には、細胞膜内の酵素の補酵素であるNAD(P)H→NAD(P)の反応が関与している(801)。この反応は酸化反応であるが、メナジオンを代表とする酸化型キノンはこの反応を触媒し、その結果、還元型キノンとなる(802)。還元型キノンは反応溶液中の溶存酸素を酸化し反応液中に活性酸素が生じる(804)と同時に還元型キノンは酸化型キノンに戻る(803)。反応溶液中の活性酸素はルミノール等の反応指示薬と反応し通常の溶存酸素に戻り(805)、この場合、ルミノールは化学発光し3−アミノフタル酸となる(806)。
【0027】
栄養利用に関する代謝を測定する系、エネルギー代謝の系いずれの系においても薬剤感受性試験のためには、対照として薬剤を添加していない系を測定する必要がある。また、薬剤の濃度は0.06〜512μg/mLとなる希釈列が一般的に使用され、複数の濃度について測定することにより、微生物の薬剤への影響を濃度に応じて調べることができる。尚、培養時間についても異ならせた複数種類の試料を測定することにより、微生物に対する薬剤の時間的な影響についても測定することが可能となる。そして、評価対象の薬剤としては、スクリーニング用に準備した複数の薬剤について測定するようにすれば、それぞれの薬剤の評価を比較しながら行うことができる。
【0028】
続いて、図7にインターフェースの例を示す。画面701に、栄養代謝系より推定される微生物同定試験結果の画面例を示す。検討された微生物が該当する可能性のある微生物名が701−1に示す様に表示され、各微生物に対する信頼度(%)が701−2の様に表示される。この信頼度は、栄養代謝系の測定において取得されたスペクトルを、微生物の種類とその微生物についての当該合成基質の代謝スペクトルの情報を備えたDBと照合し、照合のマッチ度に基づいて算出される値とすればよい。
【0029】
702はエネルギー代謝試験による薬剤感受性試験結果の画面例である。701において信頼度98%で微生物Aと同定された微生物において、3種類の薬剤につき検討し、薬剤Aは薬剤無添加(濃度0)と薬剤濃度を7濃度とした場合で、濃度4以上でエネルギー代謝反応が完全に阻害され、MIC値が濃度4と判定されたことを示す。MIC(minimum inhibitory concentration最小発育阻止濃度)とは、in vitroにおいて菌の発育を阻止する最小の薬剤濃度のことである。同様に薬剤Bに対しては薬剤濃度4濃度を検討し、濃度3以上でエネルギー代謝反応が完全に阻害され、MIC値が濃度3と判定されたことを示す。そして、薬剤Cに対しては薬剤濃度1濃度の検討したところでエネルギー代謝が完全に阻害されたので、MIC濃度は濃度1と判定されたことを示す。
【0030】
また、画面701において、微生物同定試験結果の画面と共に、栄養代謝の薬剤感受性試験の結果が示されている。701-3に使用した合成基質が表示され、701−4に示すように薬剤無添加の場合と薬剤A、B、Cを添加した場合の質量分析定量結果が701−5に表示されている。ここで、薬剤Cはどの基質を入れた場合も0を示しており、エネルギー代謝の結果702と同じく、代謝抑制効果がないことが分かる。また、基質Cについては、どの薬剤を入れた場合でも薬剤無添加の場合と変わりが無く、この微生物では代謝できない合成基質であったことが分かる。その他の薬剤と基質の組み合わせでは、薬剤無添加の場合と比較して変化が見られ、薬剤添加による代謝抑制効果を評価することができる。このように、薬剤無添加の場合と薬剤を添加した場合との質量分析定量結果を比較することによる薬剤の代謝抑制評価が、薬剤の有効性の判断の指標と成り得る。
【0031】
701-5に表示される数値は薬剤無添加の場合の質量分析ピーク強度値を100とし、各薬剤を添加した場合の質量分析ピーク強度値を相対的に評価した値が表示される。
【0032】
このように、反応指示物質の質量分析結果を用いたエネルギー代謝試験により、薬剤感受性試験を簡便かつ迅速に行うことができる。また、質量分析結果を用いた栄養代謝試験により、菌種同定試験ができる他、薬剤有無のデータの比較をすることにより、薬剤感受性試験をも行うことができる。さらに、質量分析結果を用いた栄養代謝試験とエネルギー代謝試験を合わせて行うことにより、微生物の同定と薬剤感受性試験結果を同時に得ることができ、また、微生物検査を迅速に行うことができる。
【0033】
続いて、エネルギー代謝の系による薬剤感受性試験の具体例を示す。
試験菌Escherichia coli(以下E.coliと略す)を分離培養後、滅菌ループにて釣菌し、3×108CFU/mLとなる様に1mMトリス緩衝液pH7.4に懸濁した。そして、酸化型キノン化合物としてメナジオン5.0μg/mL及び評価対象の薬剤としてアミカシン2μg/mLとなる様に添加したミュラー・ヒントン培地を液体培地として調製した。対照としてアミカシン無添加の培地も調製した。
【0034】
ここで、先に調製した液体培地に対し、調製した菌液を1/100容量となるように添加した。装置培養槽で60分及び120分培養後、反応液中より一部を採取し、反応指示物質としてルミノール0.15g/Lを含む水溶液を添加した。ルミノールを添加した反応液の一部を、10分後より採取し、装置上で脱塩処理ESI(エレクトロスプレーイオン化)-三連四重極型質量分析計により質量分析を行った。対照としてアミカシン無添加の場合も同様に培養及び質量分析用試料調製を行い、質量分析を行った。
【0035】
ここで、試験結果を図3,4に示す。図4(A)には、培養1時間のスペクトルを、(B)には培養2時間のスペクトルを示す。質量分析のスペクトルより、薬剤無添加の場合の3−アミノフタル酸量と、薬剤を添加した場合の3−アミノフタル酸量を算出し、両者の比より薬剤を添加した場合の残存生菌率を算出する。
【0036】
培養1時間後のアミカシン添加をした培養液のE.coliの生菌率は、アミカシン無添加の培養液のE.coliの生菌率に比較し65%であった。また、培養2時間後のアミカシン添加をした培養液のE.coliの生菌率は、アミカシン無添加の培養液のE.coliの生菌率に比較し10%であった。このように、生菌率が減ったことによりE.coliはアミカシンに対し薬剤感受性があるという結果が得られた。このように、反応指示物質のスペクトル情報を用いることで、簡便かつ迅速に薬剤感受性試験を行うことができる。また、培養1時間と培養2時間の比較をすることにより、薬剤の微生物に作用する作用機序の違いによる薬剤効果発現の時間依存性が分かる。
【0037】
続いて、栄養利用に関する代謝測定系による薬剤感受性試験及び微生物同定試験の具体例を示す。
前述のエネルギー代謝の系による薬剤感受性試験で調製した菌液を検体として使用した。合成基質として、L-alanine-p-nitroanilide、L-isoleucine-7-amino-4-methylcoumarin、L-arginyl-β-naphthylamide、L-glutamic acid -γ-(4-methoxy-β-naphthylamine)を各0.5μmol/L、評価対象の薬剤として、アミカシン2μg/mLとなる様に含む日水トリプトソーヤブイヨン(日水製薬)を調製した。対照としてアミカシン無添加の培地も調製した。調製した液体培地に対し、菌液を1/10容量となるように添加した。
【0038】
そして装置培養槽で30分後に、反応液中より一部を採取し、装置上で脱塩処理ESI(エレクトロスプレーイオン化)-三連四重極型質量分析計により質量分析を行った。対照としてアミカシン無添加の場合も同様に培養及び質量分析用試料調製を行い、質量分析を行った。
【0039】
ここで、試験結果を図5に示す。培養30分後のスペクトルにおいてアミカシン無添加の培養液を試料とした場合(図5(A))、微生物の酵素アミノペプチダーゼにより分解されたp-nitroaniline(5012-1)、β-naphthylamine(5022-1)、4-methoxy-β-naphthylamine(5032-1)のピークが出現したが、L-isoleucine-7-amido-4-methylcoumarine(5041-1)の酵素分解により生じる7-amino-4-methylcoumarin(5042-1)のピークは、他のピークと比較してピーク高も低く、アミカシンを添加した場合(5041-2、5042-2)との差がほとんどないことより当該微生物には本基質を分解する酵素がなく、基質の自然分解のみの痕跡のピークが観察されたと考えられた。これらのピークをデータベースと比較照合することにより、E.coliと同定できた。
【0040】
培養30分後のスペクトルにおいてアミカシン添加の培養液を試料とした場合(図5(B))、前記の3種類のピークがアミカシン無添加の培養液を試料とした場合のピークより低下し(5012-2、5022-2、5032-2)、また低下したピークに対応する合成基質の未反応基質のピークが、アミカシン無添加の場合と比較するとピーク強度が高いことが示されている。(5011−1と5011−2、5021−1と5021−2、5031−1と5031−2)アミカシンが添加された場合、酵素による該当する合成基質の分解が抑制され、残存する未反応合成基質のピークが高いと考えられ、これらの結果よりE.coliがアミカシンに感受性があるという結果が得られた。
【0041】
また、当該微生物を、前述の栄養代謝試験の場合と同様に操作すると、同様の結果が得られ、未知微生物に対し同定と薬剤感受性を同時に実施することができた。質量分析までの培養時間により、早期に微生物同定情報と薬剤の有効性情報を得ることが可能となった。
【符号の説明】
【0042】
101:分離培養フロー
102:菌試料準備フロー
103:培養フロー
104:質量分析用試料調製フロー
105:質量分析によるスペクトル取得フロー
106:データ解析フロー
201:分離培養フロー
202:菌液調製フロー
203-1:栄養代謝系培養工程
203-2:エネルギー代謝系培養工程
204:質量分析試料調製フロー
205:質量分析フロー
206-1-1:時間Aにおける栄養代謝系質量スペクトル結果の例
206-1-2:時間Bにおける栄養代謝系質量スペクトル結果の例
206-2-1:時間Aにおけるエネルギー代謝系質量スペクトル結果の例
206-2-2:時間Bにおけるエネルギー代謝系質量スペクトル結果の例
207-1:栄養代謝系のデータ解析結果取得
207-2:エネルギー代謝系のデータ解析結果取得
301:X軸 培養時間
302:Y軸 生菌率
303:1時間培養後アミカシン添加試料生菌率
304:2時間培養後アミカシン添加試料生菌率
401:培養1時間後エネルギー代謝系結果の表示例
402:培養2時間後エネルギー代謝系結果の表示例
5011-1:アミカシン無添加 L-alanine-p-nitroanilide未反応基質ピーク
5021-1:アミカシン無添加L-arginyl-β-naphthylamide未反応基質ピーク
5031-1:アミカシン無添加L-glutamic acid -γ-(4-methoxy-β-naphthylamide) 未反応基質ピーク
5041-1:アミカシン無添加L-isoleucine-7-amido-4-methylcoumarin未反応基質ピーク
5012-1:アミカシン無添加 L-alanine-p-nitroanilide代謝反応生成物ピーク
5022-1:アミカシン無添加L-arginyl-β-naphthylamide代謝反応生成物ピーク
5032-1:アミカシン無添加L-glutamic acid -γ-(4-methoxy-β-naphthylamide) 代謝反応生成物ピーク
5042-1:アミカシン無添加L-isoleucine-7-amido-4-methylcoumarin代謝反応生成物ピーク
5011-2:アミカシン添加 L-alanine-p-nitroanilide未反応基質ピーク
5021-2:アミカシン添加L-arginyl-β-naphthylamide未反応基質ピーク
5031-2:アミカシン添加L-glutamic acid -γ-(4-methoxy-β-naphthylamine) 未反応基質ピーク
5041-2:アミカシン添加L-isoleucine-7-amido-4-methylcoumarin未反応基質ピーク
5012-2:アミカシン添加 L-alanine-p-nitroanilide代謝反応生成物ピーク
5022-2:アミカシン添加L-arginyl-β-naphthylamide代謝反応生成物ピーク
5032-2:アミカシン添加L-glutamic acid -γ-(4-methoxy-β-naphthylamine) 代謝反応生成物ピーク
5042-2:アミカシン添加L-isoleucine-7-amido-4-methylcoumarin代謝反応生成物ピーク
601:システム 菌試料準備
602:システム 培養
603:システム 質量分析用試料調製
604:システム 質量分析
605:システム 情報処理
606:システム 入力装置
607:システム データ処理
608:システム データ記憶
609:システム データ出力
701:栄養代謝試験結果画面例
701-1:微生物名
701-2:同定確率
701-3:栄養代謝試験合成基質名
701-4:薬剤名
701-5:質量分析定量結果
702:エネルギー代謝試験結果画面例
702-1:薬剤名
702-2:MIC結果例
801:反応原理 NAD(P)H酸化過程
802:反応原理 酸化型キノン還元過程
803:反応原理 還元型キノン酸化過程
804:反応原理 溶存酸素から活性酸素への変化過程
805:反応原理 活性酸素から溶存酸素への変化過程
806:反応原理 ルミノールから3−アミノフタル酸への変化過程
【技術分野】
【0001】
本発明は、質量分析法を用い、試料中の微生物の代謝反応を測定することによる、微生物の薬剤感受性検査方法及びシステムに関する。
【背景技術】
【0002】
臨床検査において感染症関連疾患の治療方針、抗菌剤などの薬剤(以下、薬剤と記載)の決定の為に、疾患起因菌の同定試験、薬剤感受性試験が実施されている。通常、微生物の同定試験、薬剤感受性試験を実施する前に、血液、尿、便、喀痰、髄液等の臨床検体より検査対象となる微生物を単一コロニーとして採取しなくてはならず、単一コロニーを採取するには18〜24時間かけ分離培養が実施されている。
【0003】
臨床検体より単一コロニーとして採取された微生物は、微生物同定の為の同定試験及び薬剤感受性試験が実施される。同定試験は通常、微生物の生化学的性状を微生物の代謝反応に関与する種々の酵素活性や糖代謝反応などを組み合わせた試験が実施される。即ち、微生物を含有する反応液に代謝反応により発色や蛍光を発するような人工的な基質が添加されており、光学的に測定し、対象となる微生物を同定する。しかし光学的測定法は感度が低く同定までに6〜7時間、時には18~24時間を要する。
【0004】
この問題の解決の為、光学的測定方法より反応の検出感度の高い質量分析法を用いて微生物の代謝反応を測定し、30分で反応を検出し1時間以内の微生物を同定する方法が開発された(非特許文献1)。
【0005】
更にMALDI-TOF MASS法による質量分析を用い、微生物のリボソーム蛋白質のフィンガプリントによる微生物同定試験が開発され、同定時間が30分以内に短縮された。(非特許文献2)しかしながら、質量分析を用いる方法では薬剤感受性試験は開発されていない。
【0006】
薬剤感受性試験は、拡散法と希釈法に大別される。拡散法は薬剤を含むろ紙ディスクを分離菌を塗布した寒天平板培地上に置き、16〜18時間培養した後に培地内に拡散した薬剤による微生物の増殖阻止円の半径を測定し、薬剤の微生物に対する増殖阻止能力を判定する(非特許文献3)。希釈法は液体培地を用いる場合(液体希釈法)、段階的に希釈した薬剤を含む液体培地に一定量の分離菌を接種し、16〜20時間培養後の培養液の混濁を肉眼または濁度を測定し、薬剤の菌に対する増殖阻止能力を判定する(非特許文献4)。細菌検査自動化装置には、液体希釈法を微量化した方法が採用されるがこの場合、結果が得られるまでに5〜8時間を要す。
【0007】
薬剤感受性試験の迅速化としては、微生物細胞のエネルギー代謝に関与する補酵素であるニコチンアミドアデニンジヌクレオチド(NAD)またはニコチンアミドアデニンジヌクレオチド(NADPH)の還元作用が、細胞外の電子メディエータをも還元することを利用し、反応液中にメナジオンの様な電子メディエータを添加し、電子メディエータを介した反応で生じた活性酸素を、ルミノール反応等の化学発光法や水溶性ホルマザン色素で比色測定する方法が開発されている(非特許文献5)。この方法を採用した細菌検査自動化装置も開発されており3〜7時間くらいで結果が得られる。
【先行技術文献】
【非特許文献】
【0008】
【非特許文献1】Anal.Chem.2002,74,4290-4293
【非特許文献2】Identification of Microorganisms by Mass Spectrometry p.125-152 Edited by Charles L. Wilkins and Jackson O. Lay, Jr.
【非特許文献3】Performance Standards for Antimicrobial Disk Susceptibility Test; Approved Standard-Tenth Edition(M02-A10)
【非特許文献4】Methods for Dilution Antimicrobial Susceptibility Test for Bacteria That Grow Aerobically; Approved Standard-Eight Edition(M07-A8)
【非特許文献5】Microbiol. Immunol., 2001,45(5),333-340
【発明の概要】
【発明が解決しようとする課題】
【0009】
薬剤感受性試験は、細胞内のエネルギー代謝反応に関与する反応を利用し、迅速化が試みられているが、検出系が光学的方法であるため、迅速化がなされておらず、時間を要していることが課題である。また、微生物同定試験と薬剤感受性試験は別々に行われており、時間と手間を要している。
【課題を解決するための手段】
【0010】
微生物の細胞内のエネルギー代謝に関連する物質を質量分析により測定し、薬剤添加と無添加の場合とを比較して、薬剤感受性試験を行う。また、合成基質の代謝に関連する物質を質量分析により測定し、そのスペクトル情報から菌種同定を行う。
【0011】
さらに、合成基質の代謝に関連する物質について、薬剤添加と無添加の場合との質量分析結果を比較して、薬剤感受性試験を行う。
【発明の効果】
【0012】
迅速な薬剤感受性試験を行うことができる。また、質量分析装置を用いて薬剤感受性試験と微生物同定試験とを共に行い、薬剤感受性試験に伴い有用な情報を取得できる。さらに、薬剤感受性試験について、微生物細胞の直接の生死の指標となるエネルギー代謝と、微生物の栄養(合成基質)利用に関する代謝反応への薬剤の影響を評価することができる。
【図面の簡単な説明】
【0013】
【図1】測定フロー図。
【図2】測定フローとデータ処理の説明図。
【図3】エネルギー代謝反応による薬剤感受性試験結果を示す図。
【図4】エネルギー代謝反応による薬剤感受性試験の結果表示画面図。
【図5】栄養代謝反応による薬剤感受性試験の結果表示画面図。
【図6】システム全体図。
【図7】インターフェース図。
【図8】代謝反応系の説明。
【発明を実施するための形態】
【0014】
図6に、システム全体図を示す。システムとして、菌液を調製する菌試料を準備するための装置601、微生物を培養するための培養装置602、質量分析用の試料を調製するための装置603、微生物の代謝情報を取得するための質量分析装置604、そして、質量分析装置604から取得されたスペクトル情報を分析する計算装置605を用いる。計算装置605は、ユーザの入力を支援するための入力部606、スペクトル情報を基に情報を処理するためのデータ処理部607、データを格納する記憶装置608、データを出力する出力部609等を有している。出力の仕方としてはPC等のディスプレイ上に表示するようにしてもよいし、媒体上に出力するのでもよい。
【0015】
図1に、測定フローを示す。まずステップ101では、臨床検体より、単一微生物よりなるコロニーを取得するための分離培養を行う。続いてステップ102では、コロニーを釣菌し、一定濃度の微生物を含有する菌液を調製し、菌試料の準備をする。具体的には、102−1に示すように、栄養代謝測定用の菌試料として、調製した菌液、培養のための培地、微生物の代謝の基質となるような合成基質、薬剤感受性試験のための当該薬剤を添加した試料と、参照として当該薬剤を含まない試料とを準備する。一方、ステップ102−2では、エネルギー代謝測定の菌試料として、調製した菌液、培養のための培地、酸化型キノン化合物、反応の検出のための反応指示物質、薬剤感受性試験のための当該薬剤を添加した試料と、参照として当該薬剤を含まない試料とを準備する。ここで、栄養代謝とは、微生物の細胞外から細胞内に取り込まれた合成基質等を分解することをいう。また、エネルギー代謝とは、微生物が生存維持するのに必要な代謝をいう。
【0016】
ステップ103では、ステップ102で準備した試料の培養を行う。そして、ステップ104では、培養された当該試料を用いて質量分析用に試料の調製を行い、ステップ105では、質量分析を行って各試料のm/zに基づくスペクトルを取得する。
【0017】
続いてステップ106では、ステップ105で取得したスペクトルのデータ解析を行う。ステップ106−1では、栄養代謝測定結果として、薬剤無添加の条件で得られた質量分析スペクトルと薬剤添加した場合の質量分析スペクトルとを比較し、栄養代謝への薬剤の影響を評価するための薬剤感受性情報を取得する。さらに、薬剤を添加していない場合の質量分析結果スペクトルを、微生物の種類毎に当該合成基質の代謝で特定されるスペクトルを保存したデータベースと照らし合わせて、微生物同定に関する情報を取得する。
【0018】
一方、ステップ106−2では、エネルギー代謝測定結果として、薬剤無添加の条件で得られた質量分析スペクトルと薬剤添加した場合の質量分析スペクトルとを比較し、薬剤によりエネルギー代謝への薬剤の影響を評価するための薬剤感受性情報を取得する。
【0019】
ここで、ステップ102の菌試料準備の工程では、薬剤添加有りの試料について、薬剤の濃度を異ならせた複数の試料を準備して、濃度に応じた薬剤感受性情報を取得するようにすれば、当該菌に対する薬剤の影響を濃度に応じて評価することができる。また、ステップ103にて微生物代謝の培養時間を変化させ、時系列的なデータを取得するようにすれば、当該薬剤による時間的な影響を測ることができる。
【0020】
続いて、図2を用い、質量スペクトルによるデータ解析について説明する。ステップ201で分離培養、ステップ202で菌液調製、ステップ203−1またはステップ203−2で培養を行うことにより微生物細胞内で代謝反応を行わせ、ステップ204で質量分析用試料を調製し、ステップ205で質量分析を行う。
【0021】
206−1−1及び206−1−2に示すのは、栄養代謝測定系より取得したスペクトルデータであり、薬剤無添加の場合、添加した合成基質が微生物由来の酵素により代謝され、代謝生成物と残存する未反応基質のピークが観察される。これに対し薬剤を添加した場合、薬剤が微生物に殺菌的もしくは抑制的に作用すれば、図に示すスペクトルのように、薬剤無添加の場合のスペクトルと比較して未反応基質のピークが大きくなり代謝生成物のピークが減少する。一方、薬剤が微生物に作用しない場合には、薬剤添加した場合でも、薬剤無添加の場合と変わらないようなスペクトルが取得される。さらに、薬剤無添加のスペクトルを用い、微生物の種類と当該合成基質の代謝スペクトルの情報を備えたデータベースに照らし合わせることにより、微生物の同定も合わせて行うことができる。更に時間経過に伴うスペクトルを取得すれば、薬剤の有効性の早期検出が可能となる。
【0022】
また、エネルギー代謝の系では、ステップ203−2において微生物をメナジオンを代表とする微生物細胞内でのエネルギー代謝を触媒するような酸化型キノンと共存させ、反応溶液中で起こる酸化還元反応を、ルミノールなどの反応指示物質に伝達させ、エネルギー代謝反応を反応指示物質の分子量変化として質量分析で測定する。尚、反応指示物質としてはルミノール以外にルシゲニンなども挙げられるが、反応溶液中の活性酸素が溶存酸素に変化する反応に共役して分子量変化が起こる物質であれば、反応指示物質とすることが可能である。また、酸化型キノンが還元型キノンに変化する反応において、その変化が分子量変化として測定できるような物質であれば、この段階において質量分析を実施しすることにより結果を得ることも可能である。
【0023】
この系においても薬剤添加、および無添加の場合の結果を比較する。図の206−2−1及び206−2−2に示すように薬剤によるエネルギー代謝反応の抑制または阻害が起こった場合、両者のスペクトルの違いにより薬剤に有効性の判定が可能となる。一方、薬剤により微生物のエネルギー代謝反応の抑制又は阻害が起こらなければ、両者のスペクトルに大きな相違は見られない。本系においても時間経過に伴うスペクトルを取得すれば、薬剤の有効性の早期検出が可能となる。
【0024】
栄養利用に関する代謝を測定する系において基質となる物質(合成基質)としては、ヒドロキシプロリン、L-イソロイシン、L-プロリン、L-チロシン、グリシン、グリシルグリシン、グリシル-L-アルギニン、グリシル-L-プロリン、L-アルギニル-L-アルギニン、L-リジル-L-アラニン、L-アラニン、L-セリン-L-チロシン、L-ヒスチジン、α-D-グルコース、β-D-グルコース、β-D-ガラクトース、β-D-フコース、β-D-セロビオース、N-アセチルガラクトサミン、N-アセチルグルコサミンを、他の官能基に結合させた物質があげられる。結合させる分子団としては、光学的手法で用いられる発色物質や蛍光物質でも良いが、質量分析として外部から添加されたことを示す同位体原子を含むような分子団でも良い。結合させる分子団との結合方法は、例えば、ペプチド結合、エステル結合、グリコシド結合を用いることができる。
【0025】
エネルギー代謝の系において反応液中に添加される酸化型キノンは、メナジオン、ベンゾキノン、ナフトキノン、ジフェノキノン、アントラキノンなどが挙げられる。また、これらの構造を基本骨格としてもつ化合物を用いることも可能である。
【0026】
図8に詳細を説明する。多くの微生物は炭水化物を分解しエネルギーを獲得する。エネルギーを獲得する細胞内の代謝には、細胞膜内の酵素の補酵素であるNAD(P)H→NAD(P)の反応が関与している(801)。この反応は酸化反応であるが、メナジオンを代表とする酸化型キノンはこの反応を触媒し、その結果、還元型キノンとなる(802)。還元型キノンは反応溶液中の溶存酸素を酸化し反応液中に活性酸素が生じる(804)と同時に還元型キノンは酸化型キノンに戻る(803)。反応溶液中の活性酸素はルミノール等の反応指示薬と反応し通常の溶存酸素に戻り(805)、この場合、ルミノールは化学発光し3−アミノフタル酸となる(806)。
【0027】
栄養利用に関する代謝を測定する系、エネルギー代謝の系いずれの系においても薬剤感受性試験のためには、対照として薬剤を添加していない系を測定する必要がある。また、薬剤の濃度は0.06〜512μg/mLとなる希釈列が一般的に使用され、複数の濃度について測定することにより、微生物の薬剤への影響を濃度に応じて調べることができる。尚、培養時間についても異ならせた複数種類の試料を測定することにより、微生物に対する薬剤の時間的な影響についても測定することが可能となる。そして、評価対象の薬剤としては、スクリーニング用に準備した複数の薬剤について測定するようにすれば、それぞれの薬剤の評価を比較しながら行うことができる。
【0028】
続いて、図7にインターフェースの例を示す。画面701に、栄養代謝系より推定される微生物同定試験結果の画面例を示す。検討された微生物が該当する可能性のある微生物名が701−1に示す様に表示され、各微生物に対する信頼度(%)が701−2の様に表示される。この信頼度は、栄養代謝系の測定において取得されたスペクトルを、微生物の種類とその微生物についての当該合成基質の代謝スペクトルの情報を備えたDBと照合し、照合のマッチ度に基づいて算出される値とすればよい。
【0029】
702はエネルギー代謝試験による薬剤感受性試験結果の画面例である。701において信頼度98%で微生物Aと同定された微生物において、3種類の薬剤につき検討し、薬剤Aは薬剤無添加(濃度0)と薬剤濃度を7濃度とした場合で、濃度4以上でエネルギー代謝反応が完全に阻害され、MIC値が濃度4と判定されたことを示す。MIC(minimum inhibitory concentration最小発育阻止濃度)とは、in vitroにおいて菌の発育を阻止する最小の薬剤濃度のことである。同様に薬剤Bに対しては薬剤濃度4濃度を検討し、濃度3以上でエネルギー代謝反応が完全に阻害され、MIC値が濃度3と判定されたことを示す。そして、薬剤Cに対しては薬剤濃度1濃度の検討したところでエネルギー代謝が完全に阻害されたので、MIC濃度は濃度1と判定されたことを示す。
【0030】
また、画面701において、微生物同定試験結果の画面と共に、栄養代謝の薬剤感受性試験の結果が示されている。701-3に使用した合成基質が表示され、701−4に示すように薬剤無添加の場合と薬剤A、B、Cを添加した場合の質量分析定量結果が701−5に表示されている。ここで、薬剤Cはどの基質を入れた場合も0を示しており、エネルギー代謝の結果702と同じく、代謝抑制効果がないことが分かる。また、基質Cについては、どの薬剤を入れた場合でも薬剤無添加の場合と変わりが無く、この微生物では代謝できない合成基質であったことが分かる。その他の薬剤と基質の組み合わせでは、薬剤無添加の場合と比較して変化が見られ、薬剤添加による代謝抑制効果を評価することができる。このように、薬剤無添加の場合と薬剤を添加した場合との質量分析定量結果を比較することによる薬剤の代謝抑制評価が、薬剤の有効性の判断の指標と成り得る。
【0031】
701-5に表示される数値は薬剤無添加の場合の質量分析ピーク強度値を100とし、各薬剤を添加した場合の質量分析ピーク強度値を相対的に評価した値が表示される。
【0032】
このように、反応指示物質の質量分析結果を用いたエネルギー代謝試験により、薬剤感受性試験を簡便かつ迅速に行うことができる。また、質量分析結果を用いた栄養代謝試験により、菌種同定試験ができる他、薬剤有無のデータの比較をすることにより、薬剤感受性試験をも行うことができる。さらに、質量分析結果を用いた栄養代謝試験とエネルギー代謝試験を合わせて行うことにより、微生物の同定と薬剤感受性試験結果を同時に得ることができ、また、微生物検査を迅速に行うことができる。
【0033】
続いて、エネルギー代謝の系による薬剤感受性試験の具体例を示す。
試験菌Escherichia coli(以下E.coliと略す)を分離培養後、滅菌ループにて釣菌し、3×108CFU/mLとなる様に1mMトリス緩衝液pH7.4に懸濁した。そして、酸化型キノン化合物としてメナジオン5.0μg/mL及び評価対象の薬剤としてアミカシン2μg/mLとなる様に添加したミュラー・ヒントン培地を液体培地として調製した。対照としてアミカシン無添加の培地も調製した。
【0034】
ここで、先に調製した液体培地に対し、調製した菌液を1/100容量となるように添加した。装置培養槽で60分及び120分培養後、反応液中より一部を採取し、反応指示物質としてルミノール0.15g/Lを含む水溶液を添加した。ルミノールを添加した反応液の一部を、10分後より採取し、装置上で脱塩処理ESI(エレクトロスプレーイオン化)-三連四重極型質量分析計により質量分析を行った。対照としてアミカシン無添加の場合も同様に培養及び質量分析用試料調製を行い、質量分析を行った。
【0035】
ここで、試験結果を図3,4に示す。図4(A)には、培養1時間のスペクトルを、(B)には培養2時間のスペクトルを示す。質量分析のスペクトルより、薬剤無添加の場合の3−アミノフタル酸量と、薬剤を添加した場合の3−アミノフタル酸量を算出し、両者の比より薬剤を添加した場合の残存生菌率を算出する。
【0036】
培養1時間後のアミカシン添加をした培養液のE.coliの生菌率は、アミカシン無添加の培養液のE.coliの生菌率に比較し65%であった。また、培養2時間後のアミカシン添加をした培養液のE.coliの生菌率は、アミカシン無添加の培養液のE.coliの生菌率に比較し10%であった。このように、生菌率が減ったことによりE.coliはアミカシンに対し薬剤感受性があるという結果が得られた。このように、反応指示物質のスペクトル情報を用いることで、簡便かつ迅速に薬剤感受性試験を行うことができる。また、培養1時間と培養2時間の比較をすることにより、薬剤の微生物に作用する作用機序の違いによる薬剤効果発現の時間依存性が分かる。
【0037】
続いて、栄養利用に関する代謝測定系による薬剤感受性試験及び微生物同定試験の具体例を示す。
前述のエネルギー代謝の系による薬剤感受性試験で調製した菌液を検体として使用した。合成基質として、L-alanine-p-nitroanilide、L-isoleucine-7-amino-4-methylcoumarin、L-arginyl-β-naphthylamide、L-glutamic acid -γ-(4-methoxy-β-naphthylamine)を各0.5μmol/L、評価対象の薬剤として、アミカシン2μg/mLとなる様に含む日水トリプトソーヤブイヨン(日水製薬)を調製した。対照としてアミカシン無添加の培地も調製した。調製した液体培地に対し、菌液を1/10容量となるように添加した。
【0038】
そして装置培養槽で30分後に、反応液中より一部を採取し、装置上で脱塩処理ESI(エレクトロスプレーイオン化)-三連四重極型質量分析計により質量分析を行った。対照としてアミカシン無添加の場合も同様に培養及び質量分析用試料調製を行い、質量分析を行った。
【0039】
ここで、試験結果を図5に示す。培養30分後のスペクトルにおいてアミカシン無添加の培養液を試料とした場合(図5(A))、微生物の酵素アミノペプチダーゼにより分解されたp-nitroaniline(5012-1)、β-naphthylamine(5022-1)、4-methoxy-β-naphthylamine(5032-1)のピークが出現したが、L-isoleucine-7-amido-4-methylcoumarine(5041-1)の酵素分解により生じる7-amino-4-methylcoumarin(5042-1)のピークは、他のピークと比較してピーク高も低く、アミカシンを添加した場合(5041-2、5042-2)との差がほとんどないことより当該微生物には本基質を分解する酵素がなく、基質の自然分解のみの痕跡のピークが観察されたと考えられた。これらのピークをデータベースと比較照合することにより、E.coliと同定できた。
【0040】
培養30分後のスペクトルにおいてアミカシン添加の培養液を試料とした場合(図5(B))、前記の3種類のピークがアミカシン無添加の培養液を試料とした場合のピークより低下し(5012-2、5022-2、5032-2)、また低下したピークに対応する合成基質の未反応基質のピークが、アミカシン無添加の場合と比較するとピーク強度が高いことが示されている。(5011−1と5011−2、5021−1と5021−2、5031−1と5031−2)アミカシンが添加された場合、酵素による該当する合成基質の分解が抑制され、残存する未反応合成基質のピークが高いと考えられ、これらの結果よりE.coliがアミカシンに感受性があるという結果が得られた。
【0041】
また、当該微生物を、前述の栄養代謝試験の場合と同様に操作すると、同様の結果が得られ、未知微生物に対し同定と薬剤感受性を同時に実施することができた。質量分析までの培養時間により、早期に微生物同定情報と薬剤の有効性情報を得ることが可能となった。
【符号の説明】
【0042】
101:分離培養フロー
102:菌試料準備フロー
103:培養フロー
104:質量分析用試料調製フロー
105:質量分析によるスペクトル取得フロー
106:データ解析フロー
201:分離培養フロー
202:菌液調製フロー
203-1:栄養代謝系培養工程
203-2:エネルギー代謝系培養工程
204:質量分析試料調製フロー
205:質量分析フロー
206-1-1:時間Aにおける栄養代謝系質量スペクトル結果の例
206-1-2:時間Bにおける栄養代謝系質量スペクトル結果の例
206-2-1:時間Aにおけるエネルギー代謝系質量スペクトル結果の例
206-2-2:時間Bにおけるエネルギー代謝系質量スペクトル結果の例
207-1:栄養代謝系のデータ解析結果取得
207-2:エネルギー代謝系のデータ解析結果取得
301:X軸 培養時間
302:Y軸 生菌率
303:1時間培養後アミカシン添加試料生菌率
304:2時間培養後アミカシン添加試料生菌率
401:培養1時間後エネルギー代謝系結果の表示例
402:培養2時間後エネルギー代謝系結果の表示例
5011-1:アミカシン無添加 L-alanine-p-nitroanilide未反応基質ピーク
5021-1:アミカシン無添加L-arginyl-β-naphthylamide未反応基質ピーク
5031-1:アミカシン無添加L-glutamic acid -γ-(4-methoxy-β-naphthylamide) 未反応基質ピーク
5041-1:アミカシン無添加L-isoleucine-7-amido-4-methylcoumarin未反応基質ピーク
5012-1:アミカシン無添加 L-alanine-p-nitroanilide代謝反応生成物ピーク
5022-1:アミカシン無添加L-arginyl-β-naphthylamide代謝反応生成物ピーク
5032-1:アミカシン無添加L-glutamic acid -γ-(4-methoxy-β-naphthylamide) 代謝反応生成物ピーク
5042-1:アミカシン無添加L-isoleucine-7-amido-4-methylcoumarin代謝反応生成物ピーク
5011-2:アミカシン添加 L-alanine-p-nitroanilide未反応基質ピーク
5021-2:アミカシン添加L-arginyl-β-naphthylamide未反応基質ピーク
5031-2:アミカシン添加L-glutamic acid -γ-(4-methoxy-β-naphthylamine) 未反応基質ピーク
5041-2:アミカシン添加L-isoleucine-7-amido-4-methylcoumarin未反応基質ピーク
5012-2:アミカシン添加 L-alanine-p-nitroanilide代謝反応生成物ピーク
5022-2:アミカシン添加L-arginyl-β-naphthylamide代謝反応生成物ピーク
5032-2:アミカシン添加L-glutamic acid -γ-(4-methoxy-β-naphthylamine) 代謝反応生成物ピーク
5042-2:アミカシン添加L-isoleucine-7-amido-4-methylcoumarin代謝反応生成物ピーク
601:システム 菌試料準備
602:システム 培養
603:システム 質量分析用試料調製
604:システム 質量分析
605:システム 情報処理
606:システム 入力装置
607:システム データ処理
608:システム データ記憶
609:システム データ出力
701:栄養代謝試験結果画面例
701-1:微生物名
701-2:同定確率
701-3:栄養代謝試験合成基質名
701-4:薬剤名
701-5:質量分析定量結果
702:エネルギー代謝試験結果画面例
702-1:薬剤名
702-2:MIC結果例
801:反応原理 NAD(P)H酸化過程
802:反応原理 酸化型キノン還元過程
803:反応原理 還元型キノン酸化過程
804:反応原理 溶存酸素から活性酸素への変化過程
805:反応原理 活性酸素から溶存酸素への変化過程
806:反応原理 ルミノールから3−アミノフタル酸への変化過程
【特許請求の範囲】
【請求項1】
測定対象の微生物を分離培養する工程と、
分離培養された前記微生物について、微生物のエネルギー代謝に伴い作用を受けて変化する反応物質を加えた第1の試料を準備して、評価対象の薬剤を添加した試料をそれぞれ第1のA試料、無添加の試料を第1のB試料として準備する工程と、
前記試料を培養する工程と、
培養された前記試料を質量分析する工程と、
前記質量分析により取得されたスペクトルのデータ解析をする工程と、
データ解析結果を出力する工程と、を有し、
前記データ解析する工程において、前記第1のA試料と前記第1のB試料における前記反応物質の代謝に関連するスペクトルデータを比較することにより、前記微生物の前記薬剤に対する感受性情報を取得することを特徴とする微生物検査方法。
【請求項2】
前記試料を準備する工程は、前記培養分離された微生物について、合成基質を加えた第2の試料を準備する工程を含み、
前記データ解析する工程において、前記第2の試料における前記合成基質の代謝に関連するスペクトルデータを微生物の当該合成基質の代謝スペクトルデータ情報に照らし合わせて、前記微生物同定情報を取得することを特徴とする請求項1記載の微生物検査方法。
【請求項3】
前記試料を準備する工程は、前記培養分離された微生物について、合成基質を加えた第2の試料を準備して、評価対象の薬剤を添加した試料を第2のA試料、無添加の試料を第2のB試料として準備する工程を含み、
前記データ解析する工程において、前記第2のA試料と前記第2のB試料における前記合成基質の代謝に関連するスペクトルデータを比較することにより、前記微生物の前記薬剤に対する感受性情報を取得することを特徴とする請求項1又は2に記載の微生物検査方法。
【請求項4】
前記第1のA試料として、前記評価対象の薬剤の濃度を異ならせた複数の試料を準備し、前記データ解析する工程において、異なる濃度に応じた前記薬剤に対する感受性情報を取得することを特徴とする請求項1記載の微生物検査方法。
【請求項5】
前記第1のA試料について、前記試料を培養する工程の培養時間を異ならせた複数の試料を準備し、前記データ解析する工程において、培養時間に応じた前記薬剤に対する感受性情報を取得することを特徴とする請求項1記載の微生物検査方法。
【請求項6】
前記反応物質に関連するスペクトルデータとして、前記反応物質のスペクトルデータと前記反応物質が前記微生物の代謝に伴い作用を受けた反応後物質のスペクトルデータとについて、前記第1のA試料と前記第1のB試料との比較をすることを特徴とする請求項1記載の微生物検査方法。
【請求項7】
前記反応物質として、酸化型キノンとその指示物質としてルミノールを加えることを特徴とする請求項1記載の微生物検査方法。
【請求項8】
前記合成基質の代謝に関連するスペクトルデータとして、前記合成基質のスペクトルデータと前記合成基質の前記微生物による代謝物質のスペクトルデータとについて、前記第2のA試料と前記第2のB試料との比較をすることを特徴とする請求項3に記載の微生物検査方法。
【請求項9】
前記データ解析する工程において、前記第2の試料における前記合成基質の代謝に関連するスペクトルデータを、微生物の当該合成基質の代謝スペクトルデータ情報に照らし合わせ、互いのスペクトルデータの一致度を基に信頼度を算出することを特徴とする請求項2記載の微生物検査方法。
【請求項10】
分離培養された微生物に対し、エネルギー代謝に伴い作用を受けて変化する反応物質を加えた第1の試料について、評価対象の薬剤を添加した試料をそれぞれ第1のA試料、無添加の試料を第1のB試料とし、前記試料を培養する培養装置と、
培養された前記試料を質量分析する質量分析部と、
前記質量分析部により取得されたスペクトルのデータ解析をするデータ処理部と、
前記データ処理部による解析結果を出力する出力部とを備え、
前記データ処理部は、前記第1のA試料と前記第1のB試料における前記反応物質の代謝に関連するスペクトルデータを比較することにより、前記微生物の前記薬剤に対する感受性情報を取得し、前記出力部は、前記薬剤に対する感受性情報を出力することを特徴とする微生物検査システム。
【請求項11】
前記培養装置は、前記培養分離された微生物について、合成基質を加えた第2の試料を合わせて培養し、前記データ処理部は、前記第2の試料における前記合成基質の代謝に関連するスペクトルデータを微生物の当該合成基質の代謝スペクトルデータ情報に照らし合わせて、前記微生物同定情報を取得し、前記出力部は前記微生物同定情報を出力することを特徴とする請求項10記載の微生物検査システム。
【請求項12】
前記培養装置は、前記培養分離された微生物に対し合成基質を加えた第2の試料について、評価対象の薬剤を添加した試料を第2のA試料、無添加の試料を第2のB試料として培養し、前記データ処理部は、前記第2のA試料と前記第2のB試料における前記合成基質の代謝に関連するスペクトルデータを比較することにより、前記微生物の前記薬剤に対する感受性情報を取得し、前記出力部は前記薬剤に対する感受性情報を出力することを特徴とする請求項10又は11に記載の微生物検査システム。
【請求項13】
前記データ処理部は、前記第1のA試料として、前記評価対象の薬剤の濃度を異ならせた複数の試料を基に異なる濃度に応じた前記薬剤に対する感受性情報を取得し、前記出力部は、前記薬剤における各濃度毎の感受性情報を表示することを特徴とする請求項10に記載の微生物検査システム。
【請求項14】
前記各濃度毎の感受性情報に基づいて、前記出力部は、前記微生物のMIC値を表示することを特徴とする請求項13記載の微生物検査システム。
【請求項15】
前記データ処理部は、複数種類の薬剤を添加した試料を基に前記複数種類の薬剤に対する感受性情報を取得し、前記出力部は、前記複数種類の薬剤毎の感受性情報を表示することを特徴とする請求項10又は12に記載の微生物検査システム。
【請求項16】
前記データ処理部は、前記第1,2のA試料として、前記試料の培養時間を異ならせた複数の試料を基に培養時間に応じた前記薬剤に対する感受性情報を取得し、前記出力部は、前記薬剤における培養時間毎の感受性情報を表示することを特徴とする請求項10記載の微生物検査システム。
【請求項17】
複数種類の微生物の当該合成基質の代謝スペクトルデータ情報に関するデータベースを備え、前記データ処理部は、前記第1のB試料における前記合成基質の代謝に関連するスペクトルデータを、前記データベース中にある前記複数種類の微生物のデータに照らし合わせて一致度を計算し、前記出力部は、前記一致度に基づく信頼度情報を、前記複数の微生物毎に表示することを特徴とする請求項11記載の微生物検査システム。
【請求項1】
測定対象の微生物を分離培養する工程と、
分離培養された前記微生物について、微生物のエネルギー代謝に伴い作用を受けて変化する反応物質を加えた第1の試料を準備して、評価対象の薬剤を添加した試料をそれぞれ第1のA試料、無添加の試料を第1のB試料として準備する工程と、
前記試料を培養する工程と、
培養された前記試料を質量分析する工程と、
前記質量分析により取得されたスペクトルのデータ解析をする工程と、
データ解析結果を出力する工程と、を有し、
前記データ解析する工程において、前記第1のA試料と前記第1のB試料における前記反応物質の代謝に関連するスペクトルデータを比較することにより、前記微生物の前記薬剤に対する感受性情報を取得することを特徴とする微生物検査方法。
【請求項2】
前記試料を準備する工程は、前記培養分離された微生物について、合成基質を加えた第2の試料を準備する工程を含み、
前記データ解析する工程において、前記第2の試料における前記合成基質の代謝に関連するスペクトルデータを微生物の当該合成基質の代謝スペクトルデータ情報に照らし合わせて、前記微生物同定情報を取得することを特徴とする請求項1記載の微生物検査方法。
【請求項3】
前記試料を準備する工程は、前記培養分離された微生物について、合成基質を加えた第2の試料を準備して、評価対象の薬剤を添加した試料を第2のA試料、無添加の試料を第2のB試料として準備する工程を含み、
前記データ解析する工程において、前記第2のA試料と前記第2のB試料における前記合成基質の代謝に関連するスペクトルデータを比較することにより、前記微生物の前記薬剤に対する感受性情報を取得することを特徴とする請求項1又は2に記載の微生物検査方法。
【請求項4】
前記第1のA試料として、前記評価対象の薬剤の濃度を異ならせた複数の試料を準備し、前記データ解析する工程において、異なる濃度に応じた前記薬剤に対する感受性情報を取得することを特徴とする請求項1記載の微生物検査方法。
【請求項5】
前記第1のA試料について、前記試料を培養する工程の培養時間を異ならせた複数の試料を準備し、前記データ解析する工程において、培養時間に応じた前記薬剤に対する感受性情報を取得することを特徴とする請求項1記載の微生物検査方法。
【請求項6】
前記反応物質に関連するスペクトルデータとして、前記反応物質のスペクトルデータと前記反応物質が前記微生物の代謝に伴い作用を受けた反応後物質のスペクトルデータとについて、前記第1のA試料と前記第1のB試料との比較をすることを特徴とする請求項1記載の微生物検査方法。
【請求項7】
前記反応物質として、酸化型キノンとその指示物質としてルミノールを加えることを特徴とする請求項1記載の微生物検査方法。
【請求項8】
前記合成基質の代謝に関連するスペクトルデータとして、前記合成基質のスペクトルデータと前記合成基質の前記微生物による代謝物質のスペクトルデータとについて、前記第2のA試料と前記第2のB試料との比較をすることを特徴とする請求項3に記載の微生物検査方法。
【請求項9】
前記データ解析する工程において、前記第2の試料における前記合成基質の代謝に関連するスペクトルデータを、微生物の当該合成基質の代謝スペクトルデータ情報に照らし合わせ、互いのスペクトルデータの一致度を基に信頼度を算出することを特徴とする請求項2記載の微生物検査方法。
【請求項10】
分離培養された微生物に対し、エネルギー代謝に伴い作用を受けて変化する反応物質を加えた第1の試料について、評価対象の薬剤を添加した試料をそれぞれ第1のA試料、無添加の試料を第1のB試料とし、前記試料を培養する培養装置と、
培養された前記試料を質量分析する質量分析部と、
前記質量分析部により取得されたスペクトルのデータ解析をするデータ処理部と、
前記データ処理部による解析結果を出力する出力部とを備え、
前記データ処理部は、前記第1のA試料と前記第1のB試料における前記反応物質の代謝に関連するスペクトルデータを比較することにより、前記微生物の前記薬剤に対する感受性情報を取得し、前記出力部は、前記薬剤に対する感受性情報を出力することを特徴とする微生物検査システム。
【請求項11】
前記培養装置は、前記培養分離された微生物について、合成基質を加えた第2の試料を合わせて培養し、前記データ処理部は、前記第2の試料における前記合成基質の代謝に関連するスペクトルデータを微生物の当該合成基質の代謝スペクトルデータ情報に照らし合わせて、前記微生物同定情報を取得し、前記出力部は前記微生物同定情報を出力することを特徴とする請求項10記載の微生物検査システム。
【請求項12】
前記培養装置は、前記培養分離された微生物に対し合成基質を加えた第2の試料について、評価対象の薬剤を添加した試料を第2のA試料、無添加の試料を第2のB試料として培養し、前記データ処理部は、前記第2のA試料と前記第2のB試料における前記合成基質の代謝に関連するスペクトルデータを比較することにより、前記微生物の前記薬剤に対する感受性情報を取得し、前記出力部は前記薬剤に対する感受性情報を出力することを特徴とする請求項10又は11に記載の微生物検査システム。
【請求項13】
前記データ処理部は、前記第1のA試料として、前記評価対象の薬剤の濃度を異ならせた複数の試料を基に異なる濃度に応じた前記薬剤に対する感受性情報を取得し、前記出力部は、前記薬剤における各濃度毎の感受性情報を表示することを特徴とする請求項10に記載の微生物検査システム。
【請求項14】
前記各濃度毎の感受性情報に基づいて、前記出力部は、前記微生物のMIC値を表示することを特徴とする請求項13記載の微生物検査システム。
【請求項15】
前記データ処理部は、複数種類の薬剤を添加した試料を基に前記複数種類の薬剤に対する感受性情報を取得し、前記出力部は、前記複数種類の薬剤毎の感受性情報を表示することを特徴とする請求項10又は12に記載の微生物検査システム。
【請求項16】
前記データ処理部は、前記第1,2のA試料として、前記試料の培養時間を異ならせた複数の試料を基に培養時間に応じた前記薬剤に対する感受性情報を取得し、前記出力部は、前記薬剤における培養時間毎の感受性情報を表示することを特徴とする請求項10記載の微生物検査システム。
【請求項17】
複数種類の微生物の当該合成基質の代謝スペクトルデータ情報に関するデータベースを備え、前記データ処理部は、前記第1のB試料における前記合成基質の代謝に関連するスペクトルデータを、前記データベース中にある前記複数種類の微生物のデータに照らし合わせて一致度を計算し、前記出力部は、前記一致度に基づく信頼度情報を、前記複数の微生物毎に表示することを特徴とする請求項11記載の微生物検査システム。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【公開番号】特開2012−10623(P2012−10623A)
【公開日】平成24年1月19日(2012.1.19)
【国際特許分類】
【出願番号】特願2010−148489(P2010−148489)
【出願日】平成22年6月30日(2010.6.30)
【出願人】(501387839)株式会社日立ハイテクノロジーズ (4,325)
【Fターム(参考)】
【公開日】平成24年1月19日(2012.1.19)
【国際特許分類】
【出願日】平成22年6月30日(2010.6.30)
【出願人】(501387839)株式会社日立ハイテクノロジーズ (4,325)
【Fターム(参考)】
[ Back to top ]

