微生物燃料電池
【課題】微生物燃料電池を使用した新しいエネルギー回収技術を提供し、単に電気エネルギーを獲得するだけでなく、処理過程で廃水中に含まれる再利用可能な資源をも同時に回収すること。
【解決手段】アノード3が内部に、カソード5が外表面に設けられた有機物等を含む廃水を内部に収容、反応させる生物反応槽2と、前記有機物を分解して電子を放出する細胞外電子伝達能を有する微生物とを備える微生物燃料電池1において、前記アノード上に前記微生物を含むバイオフィルムが形成されるとともに、処理後の目標最終リン濃度をx[mol/L]、前記廃水中における初期のリン濃度をx+a[mol/L]、マグネシウム濃度y+a[mol/L]、アンモニア濃度z+a[mol/L]としたときに、1.0×10−8≦x×y×z≦1.0×10−3[mol/L]3を満たすこと。
【解決手段】アノード3が内部に、カソード5が外表面に設けられた有機物等を含む廃水を内部に収容、反応させる生物反応槽2と、前記有機物を分解して電子を放出する細胞外電子伝達能を有する微生物とを備える微生物燃料電池1において、前記アノード上に前記微生物を含むバイオフィルムが形成されるとともに、処理後の目標最終リン濃度をx[mol/L]、前記廃水中における初期のリン濃度をx+a[mol/L]、マグネシウム濃度y+a[mol/L]、アンモニア濃度z+a[mol/L]としたときに、1.0×10−8≦x×y×z≦1.0×10−3[mol/L]3を満たすこと。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、微生物燃料電池に関する。また微生物燃料電池により実廃水から電気エネルギーを取り出すと同時にリン含有析出物を回収する方法に係わる。
【背景技術】
【0002】
家畜排せつ物は、野積みや素堀りといった不適切な管理によって、悪臭の発生要因となったり、河川や地下水へ流出して水質汚染を招くなど、環境問題の発生源としての側面を有する一方で、たい肥化などの適切な処理を施すことによって、土壌改良資材や肥料としての有効活用が期待される。平成16年11月に本格施行された「家畜排せつ物の管理の適正化及び利用の促進に関する法律」により所謂廃棄物として自由に処理することができなくなり、畜産業者としては、家畜排せつ物を適正に管理し活用することが義務付けられるようになった。家畜排せつ物処理としては殆どが焼却又は発酵させてたい肥化する方法が適用されるが、水分を多量に含むような場合の処理は活性汚泥法が好適である。活性汚泥とは、人為的・工学的に培養・育成された微生物群を主成分とする有機汚泥の総称であり、廃水・汚水の浄化手段として広く利用されている。
【0003】
廃水が潜在的に持つエネルギーは、その廃水を活性汚泥法によって処理するために必要なエネルギーの約9.3倍以上(Shizas, I. (2004) Journal of Energy Engineering, 130(2)45-53)という推定があるほど高く、これを回収・利用することは循環型社会の形成を目指す上で重要である。
【0004】
廃水処理におけるエネルギー回収技術としては、メタン発酵や水素発酵といった嫌気性処理に関する研究が進められている。例えば、メタン発酵の技術として、「有機廃棄物よりメタンガスを主成分とするバイオガスを発生させるメタン発酵槽と、前記メタン発酵槽で発生したバイオガスから有害な気体を分離して除去する精製装置と、有害な気体及び酸素の濃度を連続的に確認する連続モニタリング装置と、前記バイオガスの圧力を検出する圧力検出装置と、前記メタン発酵槽から発生したバイオガスを貯蔵するガス貯蔵装置と、前記ガス貯蔵装置から供給されるバイオガスと空気とを燃焼させて、ガスエンジンを駆動して発電機を駆動させる複数のガスエンジン発電機と、前記ガスエンジン発電機への余剰バイオガスを燃焼させる余剰ガス燃焼装置と、前記圧力検出装置の検出値、及び連続モニタリング装置の計測値を入力してガスエンジン発電機と余剰ガス燃焼装置の始動及び停止を制御する制御装置とを具備するバイオガス発電装置」がある(特許文献1)。しかし、メタン発酵は回収したバイオガスを電力として利用するために発電機を必要とする上、バイオガスに含まれる硫化水素の除去のためにガスの前処理が必要である。またガス爆発や、硫化水素による中毒など、安全面でも課題を抱えている。
【0005】
他の技術としては、微生物の代謝機能を利用して、有機物質から電気エネルギーを取り出すというもので、水素などの純物質から電気エネルギーを獲得する燃料電池と区別するために「微生物燃料電池(MFC)」と呼ばれるものがある。例えば、「有機性基質に浸漬して嫌気性微生物を担持させる負電極、及び少なくとも一部分がイオン透過性隔膜で形成された外殻と入出孔とを有する密閉型中空カセット内に電解液と共に封入し又は当該カセットの隔膜の内側に結合して前記有機性基質中に差し込む正電極を備え、前記入出孔経由でカセット内に酸素を供給しつつ前記負電極及び正電極を電気的に接続する回路経由で電気を取り出してなる微生物燃料電池」(特許文献2)がある。また、「アノード表面領域を有するアノードと、カソード表面領域を有するカソードと、前記アノードと前記カソードとの間に配置されたカチオン交換膜と、前記アノードの上に配置されるとともに複数のelectricigenic微生物の物質移動を向上させ微生物燃料電池の出力密度を増大させる複数のコロニーを、互いに間隔を開けて形成する複数のelectricigenic微生物と、を含む微生物燃料電池」(特許文献3)などがある。これらは、電気エネルギーを取り出すという点で優れた技術であるものの、廃水成分からの有用な資源を回収するという点では課題を有していた。
【0006】
また、これまでの微生物燃料電池における廃水処理に関する研究は人工基質を用いておこなったものが多く、実廃水で運転した場合の知見は乏しい。実廃水は人工基質に比べて多様な物質を含み、また廃水そのものに多くの微生物を含む。そのため、実廃水を用いた廃水処理生物反応槽では人工基質による運転に比べて内部の微生物群集の構造や相互関係が複雑になり、また人工基質では顕在化しなかった現象が起こる可能性がある。そのため、MFCの実用化に向けて、実廃水を用いた運転の知見が必要となる。実廃水の中でも、畜産廃水に関する知見はとりわけ少なく、Minらが養豚廃水での運転を試みたのがほぼ唯一の報告である(非特許文献1)。
【先行技術文献】
【特許文献】
【0007】
【特許文献1】特開2010−209706号公報
【特許文献2】特開2009−93861号公報
【特許文献3】特開2008−288198号公報
【非特許文献】
【0008】
【非特許文献1】Min, B., Kim, J., Oh, S., Regan, J. M. and Logan, B. E. (2005) Electricity generation from swine wastewater using microbial fuel cells, Water Research, 39(20), 4961-4968.
【発明の概要】
【発明が解決しようとする課題】
【0009】
前記の通り、従来の廃水処理が有する問題点に鑑み、微生物燃料電池を使用した新しいエネルギー回収技術を提供し、単に電気エネルギーを獲得するだけでなく、処理過程で廃水中に含まれる再利用可能な資源をも同時に回収することを目的とする。
【課題を解決するための手段】
【0010】
前記課題を解決するために、廃水中に含まれる成分の比率を適当にコントロールすることによって、電気エネルギーだけでなく、リンの析出物としても資源回収することができることを見いだした。
【0011】
すなわち、本発明の微生物燃料電池は、一対の電極と、有機物等を含む廃水と、前記有機物を分解して電子を放出する細胞外電子伝達能を有する微生物とを備える微生物燃料電池において、前記電極の負極上に前記微生物を含むバイオフィルムが形成されるとともに、目標最終リン濃度をx[mol/L]、前記廃水中における初期のリン濃度をx+a[mol/L]、マグネシウム濃度をy+a[mol/L]、アンモニア濃度をz+a[mol/L]としたときに、1.0×10−8≦x×y×z≦1.0×10−3[mol/L]3を満たすことを特徴とする。ここで、aは、廃水から除去されるリンの濃度を意味する。
【0012】
これを満たさない場合は、廃水中にマグネシウム塩、アンモニウム塩などを添加することによって不足分を補えばよい。これは、リンの回収に際し、マグネシウム及びアンモニアの存在下で反応してリン酸マグネシウムアンモニウム(MAP)の結晶を生成することができるからである。このアンモニアは、微生物が廃水中の窒素源を分解することでも供給されるので、それを考慮に入れて調整することが好ましい。
【0013】
微生物燃料電池でバイオフィルムを形成する微生物は、前記電極に電子を伝達するメディエータの添加が不要である細菌を一種以上含むことを特徴とする。一般的に微生物燃料電池は、微生物の産生する電子を電極が受け取って、外部回路に電気エネルギーとして供給する。その際に直接電極との間で電子授受を行う微生物と、微生物からメディエータと呼ばれる物質(例えば、ニュートラルレッド、メチレンブルー、チオニンなどが挙げられる。)が電子を収奪し、これが電極に電子を渡す所謂仲介役を必要とする微生物がある。本発明では、このメディエータの添加が不要である微生物が特に好適である。
【0014】
前記のような微生物燃料電池を用いて、正極側にリン含有析出物、好適には主としてリン酸マグネシウムアンモニウムを含む析出物を製造する。廃水処理の過程では、微生物の塊(フロック)として、或いは凝集剤やアルカリ剤などを添加して強制的に沈殿物として除去することも行われるが、本発明では、正極近傍におけるpHがアルカリ性に傾くことを利用して廃水中のリンを析出させることができると考えている。
【発明の効果】
【0015】
本発明の微生物燃料電池は、従来の技術に比較すると廃水中の成分をモニターして、リン、マグネシウム、アンモニアの存在濃度を適当な範囲に調整するだけで、電気エネルギーのみならず、有効な資源であるリンを回収することもできる。電気エネルギーは無論のこと、回収したリンもそのまま肥料として利用することができるので、付加価値の高い技術を提供することができる。
【図面の簡単な説明】
【0016】
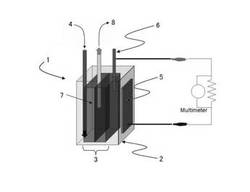
【図1】図1は、本実施形態に係る微生物燃料電池の全体構成の一例を示す概要図である。
【図2】図2は、本実施形態に係わる実廃水を用いた微生物燃料電池の発電の変化を示す図である。なお、廃水を添加した日付を矢印で示した。
【図3】図3は、本実施形態に係わる微生物燃料電池の分極曲線および電力密度曲線を示す図である。
【図4】図4は、アノードとカソード上のバイオフィルム、生物反応槽内部液、および流入させていた廃水を試料としたPCR−DGGEの結果(真正細菌のユニバーサルプライマー(341f-907r)で増幅された16S リボソーマルRNA遺伝子断片のPCR−DGGEプロファイル)を示す図である。なお、図中の略号は以下の通り(SW1:養豚廃水1、SW2:養豚廃水2、SW−MFC−A:養豚廃水MFCのアノード、SW−MFC−C:養豚廃水MFCのカソード、SW−MFC−IL:養豚廃水MFCの内部液、DW1:酪農廃水1、DW2:酪農廃水2、DW−MFC−A:酪農廃水MFCのアノード、DW−MFC−C:酪農廃水MFCのカソード、DW−MFC−IL酪農廃水MFCの内部液、AS:植種に用いた活性汚泥)である。
【図5】図5は、本実施形態に係る微生物燃料電池の全体構成の他の例を示す概要図である。
【図6】図6はカソード上の析出物をICP−MSで分析した結晶構造解析の結果を示す図であって、上図は測定データ、下図は標準データを示す。
【図7】図7はカソード上の析出物を撮影した写真である。
【図8】図8は、本実施形態に係る微生物燃料電池の全体構成の他の例を示す概要図である。
【図9】図9の上図は微生物燃料電池(A)、下図は微生物燃料電池(B)の発電の変化を示す図である。
【図10】図10は、カソード電位を制御しはじめてから約48時間後のカソード上の析出物を撮影した写真である。
【図11】図11は、微生物燃料電池(D、E、F)の内部の液中のリン濃度の変化を示す図である。
【図12】図12は、微生物燃料電池(D、E、F)の内部の液中のマグネシウム濃度の変化を示す図である。
【図13】図13は、実施例5の微生物燃料電池(D、E、F)運転終了後のカソード上の析出物を撮影した写真である。
【発明を実施するための形態】
【0017】
以下に、本発明の微生物燃料電池について詳細に説明する。
微生物燃料電池は、その名称からも推察されるように、電気エネルギーをいかにして効率よく回収することができるかが従来の主たる研究課題であった。電流生成を決定する要素は多様であるが、電極の面積や素材等は他の電池技術分野においても共通要素であるのに対し、微生物から電極への電子伝達は微生物燃料電池に特有で、この点に注目した提案が多いのが現状である。一方、微生物燃料電池を廃水処理の立場からみれば、回収できるのは電気だけでなく、廃水中に多量に含まれるリン成分を例えば肥料として利用できるように回収することが、本発明の目的である。
【0018】
本発明では、従来の微生物燃料電池と同様の構成を有しつつ、廃水中のマグネシウムとアンモニアの存在に注目した。廃水中における初期リン濃度をx+a[mol/L]、目標最終リン濃度をx[mol/L]、廃水中の初期マグネシウム濃度をy+a[mol/L]、アンモニア濃度をz+a[mol/L]としたときに、最終的な処理水中のリン、マグネシウム、アンモニアのモル濃度の積x×y×zが、1.0×10−8〜1.0×10−3、好ましくは、1.0×10−8〜1.0×10−6の範囲で存在することが必要である。前記濃度範囲よりも高い濃度でマグネシウムやアンモニアを共存させることで、MAPの回収率が低下することはないものの、廃水中に回収されずに残存したまま存在するマグネシウムやアンモニアの濃度が多くなって実用的ではないからである。
【0019】
さて、微生物燃料電池の構成としては一対の電極が処理系内に備えられているが、双方或いは一方の電極を複数に分割して存在させることも無論可能である。要するに、正・負の電極が対となって存在していることが条件であって、電極の数を限定するものではない。この電極の比表面積・素材などは適宜選択可能であり、例えば、炭素棒、カーボンフェルト、カーボンペーパーなどの他、白金、金或いは白金などでコーティングした炭素素材などが用いられる。
【0020】
また、有機物等を含む廃水とは、具体的には家庭からの生活排水や工場からの産業廃水、前記の畜産業からの廃水などがある。これらのうち、生活排水にはマグネシウム濃度が低い傾向があり、畜産排水にはマグネシウム濃度が高い傾向がある。MAP回収効果は、適用する廃水のリンとマグネシウム、アンモニアの各濃度に大きく左右されるので、この濃度を前記の通り調整することが必要となる。
【0021】
前記有機物を分解して電子を放出する細胞外電子伝達能を有する微生物としては、一般的には、Acidobacteria門、Proteobacteria門、Firmicutes門、Cyanobacteria門、Bacteroidetes門のいずれかに属していることが知られ、より具体的には、Gammaproteobanteria綱Shewanella属、およびDeltaproteobacteria綱Geobacter属に属する鉄還元細菌がよく知られている。微生物燃料電池の負極上に形成されるバイオフィルム中には各種の細菌が存在し得るが、負極上では電子生産微生物にとって好ましい選択圧がかかるため、主要細菌は、細胞外電子伝達能を有する微生物の割合が多くなる。しかも本発明では、前記微生物は、前記電極に電子を伝達するメディエータの添加を不要とする細菌が好ましい。廃水中には元々含まれている可能性が低い物質であるメディエータを敢えて添加すれば、それだけ手間とコストが必要となり、メディエータの回収という工程も増える結果となるからである。ただし、自らや系内に存在する他の微生物が生産したメディエーターを利用して電極に電子を伝達する微生物に関しては、メディエーターの添加や回収の工程が不要であるため、この種の微生物もまた好ましい。
【0022】
負極上へのバイオフィルムの形成方法は、例えば2枚のカーボンフェルトを重ねてその間に炭素棒を挿入して電極となし、該フェルトの表面に実際の廃水処理場で採取した活性汚泥や水田土壌、湖沼底泥などの微生物を多く含む環境試料を塗布すれば良い。これによりフェルト表面には汚泥中の各種の微生物が植種されることになるが、負極上での選択圧によって主として細胞外電子伝達能を有する微生物の比率が高くなる。もちろん、前記の環境試料から各種微生物を分離または集積培養して、予め細胞外電子伝達能を有する微生物だけを選別した後、負極上に塗布する方法でも良い。また、実廃水にはそのような微生物が含まれることがあり、それらを与える場合は特別な植種を必要としない場合もある。何れにしても成育環境に適合するものが淘汰されてバイオフィルムを形成することになる。
【0023】
正極側ではリンを含む析出物が生じるが、本発明ではリン、マグネシウム、アンモニアの各濃度が調整されているので、リン酸マグネシウムアンモニウムが優先的に生成する。このとき、溶液中のアンモニア濃度に関しては、廃水中の有機物が他の微生物によって分解されて生じたアンモニアが利用されることも可能であるため、必ずしも廃水中に初めからアンモニア態として存在している必要はない。但し、アンモニウム塩の添加を全く否定するものではない。リン酸マグネシウムアンモニウム(MgNH4PO4)は6水和物で析出するが、化学式で示されているようにリン:マグネシウム:アンモニウムのモル比は1:1:1であり、よって、析出物中の各成分のモル比は等モルとなる。
【0024】
前記構成による微生物燃料電池を用いて、正極側にはリン特にリン酸マグネシウムアンモニウム(MAP)を主として含む析出物が生成される。このときの正極近傍では、各電極を電気的に接続する外部回路を流れてくる電子と水素イオンが結合して消費され、廃水全体よりも相対的にpHが上昇することになる。その結果、廃水中に存在するリン酸イオン、アンモニウムイオン、マグネシウムイオンの各イオンが結合して析出すると考えられる。生成した全体の析出物に占めるMAPの割合は乾燥重量比で30%を超えるものとなる。MAPは肥料として直接使用できるので、得られるリン含有析出物は、簡単に資源として再利用できると思われる。但し、廃水に重金属等の有害物質が含まれているような場合には、予め除去する工程を設けるか、肥料として使用することができない場合には、他の用途への転用を考える必要がある。
【0025】
以下本発明をより具体的に明らかにするために、本発明に係る幾つかの実施例を示す。なお、下記実施例では前記文中「負極」を「アノード」と、「正極」を「カソード」と表記した。
【実施例1】
【0026】
図1に示すような、一槽型エアカソード微生物燃料電池(1)を作成した。生物反応槽(2)の容量は350mlで、アノード(3)は8cm×10cm、厚さ20mmのカーボンフェルト(7)(SG-222:大阪ガスケミカル(株)製)2枚を重ねたものに炭素棒(6)(市販の単4マンガン電池を分解して取り出したもの)を挿入して用いた。エアカソード(5)はカーボンペーパー(Toray Carbon Paper TGP-H-120、 Teflon treated: 5% wt. wet proofing 東レ(株)製)をChengらの手法(Cheng,S.,Liu,H. and Logan,B.E. (2006) Increased performance of single-chamber microbial fuel cells using an improved cathode structure, Electrochemistry Communications,8(3)、489-494.)に従って、廃液に接触する側は白金触媒でコーティング(0.5mg 白金/cm2)し、外気に接触する側はPTFEを塗布して空気拡散層となるようにした。エアカソードの投影面積は50cm2(7.1cm×7.1cm)であった。
【0027】
これらの微生物燃料電池の運転は72日間に渡って20℃の恒温室内でおこなった。それぞれ養豚廃水と酪農廃水を基質として与え、1−10日おきに、養豚廃水を基質とした生物反応槽からは30ml、酪農廃水を基質とした生物反応槽からは60mlの内部混合液を引き抜き、同量の新しい廃水を流入させた(水理学的滞留時間:養豚廃水 11.7−117日、酪農廃水 5.8−58日)。廃水の引き抜き(8)は2枚のアノードの間から、流入(4)は図1においてアノードの左側から行った。また、カソードとアノードの間の領域に対しては廃水の引き抜きおよび流入は行っておらず、槽内の攪拌は行わなかった。生物反応槽上部には空間があり、完全な嫌気状態ではなかった。外部抵抗は10Ωとした。
【0028】
養豚廃水は宮城県にある養豚農家から採取した。酪農廃水は東北大学大学院農学研究科附属複合生態フィールド教育研究センター内の乳牛畜舎から採取した。両廃水は、0.7mmのメッシュでろ過した後、ポリ瓶に入れ4℃の冷蔵庫で保管した。生物反応槽への基質としてポリ瓶から取り出す前には、瓶内をよく撹拌して均一にした。養豚廃水は58日、酪農廃水は28日目に保管した最初のポリ瓶(養豚廃水1、酪農廃水1)を使いきり、2本目(養豚廃水2、酪農廃水2)を同様に採取して用い、その使用中に運転を終えた。なお、生物反応槽のアノード(3)に対する植種微生物源には、試験で用いたのと同じ酪農廃水を処理している膜分離型活性汚泥生物反応槽の活性汚泥を用いた。
【0029】
〜化学分析〜
養豚廃水、酪農廃水、および生物反応槽内部液を採取し、水質分析に供した。内部液は基質入れ替え時に引き抜いた液、および基質投入後サンプルとして、基質入れ替えの約2時間後に、基質引き抜き口から採取したものを用いた。水質分析用のサンプルは、全て0.45μmのフィルター(DISMIC 25CS045AN、ADVANTEC MFS、INC)でろ過したあと、分析に供した。Standard Methods (method 5220D)(参考:APHA(1995)Standard Methods for the Examination of Water and Wastewater(19th ed.),American Public Health Association,Washington D.C.)に従って、HACH COD system(HACH Company)を用いてこれらのサンプルのCODCrを測定した。電気伝導度は、上記のろ過サンプルを電気伝導度計(B-173、堀場製作所)で測定した。また、一部のサンプルはろ過せずに後述するPCR−DGGEに用いた。
【0030】
〜電力とクーロン効率〜
電池の電圧はデータ自動収集能力を持つデジタルマルチメータ (midi LOGGER GL200A、 グラフテック株式会社) で行った。電流と電力密度は数式1に従って求めた。ここで、I:電流(A)、E:電圧(V)、P:電力(W)、R:抵抗(Ω)、A:はアノード投影面積(m2)である。クーロン効率は、Minらの方法と同様に、電流生産量と溶解性CODCrの減少量から求めた。
【0031】
【数1】

【0032】
電荷QとCODCrの関係は数式2に従って求めた。ここで、Q:電荷(c)、F:ファラデー定数 96485(C/mol) 、ΔCODCr:生物反応槽内の減少CODCr濃度(g/L)、V:生物反応槽容積(L)である。最大電力密度は42日目に測定し、1−2000Ωの間で外部抵抗を変化させ、その時の電圧から計算によって求めた。これらの結果を表1に示す。人工基質を用いた生物反応槽では有機物濃度を数百から1000mg/L程度の範囲で運転を行うケースが多いが、本試験における養豚廃水の溶解性CODはこの値の数十倍であった。
【0033】
【数2】

【0034】
【表1】

【0035】
また各廃水を用いた微生物燃料電池の発電の変化を図2に示す。最初の27日間、養豚廃水を用いた系では電圧が変動しながら徐々に上昇した。28日目以降、最大電圧が約250mVに達し、以降は最大電圧の上昇が見られなくなり、ほぼ安定した。一方、酪農廃水を用いたMFC生物反応槽でも最初の30日間で最大電圧の上昇が確認されたものの、その上昇速度は養豚廃水の系に比べて小さく、最大電圧は35mV程度であった。運転42日目の各生物反応槽の分極曲線および電力密度曲線を図3に示す。養豚廃水を用いた系での最大電力密度は831mW/m2(R=10Ω)で、酪農廃水を用いた系では59mW/m2(R=200Ω)であった。養豚廃水の方が高い発電能力を示しているが、溶解性CODが高いこと(表1参照)が原因の一つと考えられる。
【0036】
廃水中の電気伝導度もまた、微生物燃料電池の発電力に影響を与える因子である。電気伝導度が低いと内部抵抗が大きくなり、発電力が低くなることが知られている。内部抵抗とは、外部回路に取り付けた抵抗成分以外の抵抗のことであり、電池の場合は電池そのものがもつ抵抗のことを意味する。本試験における内部抵抗を分極曲線の傾きから求めたところ、養豚廃水の系で9Ω、酪農廃水の系では292Ωであった。また、生物反応槽内部液の電気伝導度は、養豚廃水では約20mS/cm、酪農廃水で約1mS/cmであった(表2)。100mMリン酸緩衝液、およびそれに100mM NaClを添加した場合の電気伝導度はそれぞれ、1.1mS/cm、1.9mS/cmである。廃水の電気伝導度が内部抵抗に寄与する度合いは生物反応槽の形状によって異なるため、一概に比較はできないものの、養豚廃水の電気伝導度が高かったことが、養豚廃水生物反応槽において内部抵抗が小さかったことの一因であると考えられる。
【0037】
【表2】

【0038】
運転59日目に基質を投入した後から次の基質投入をする直前の運転64日目までにおける、溶解性COD除去率を表3に示す。養豚廃水を用いた微生物燃料電池では溶解性CODの除去率は89%と、高い有機物除去率を示した。一方、酪農廃水では69%と、やや低い値であった。59日目と64日目の生物反応槽内部液の溶解性COD濃度および電圧データから、クーロン効率を求めた(表4)。クーロン効率は養豚廃水の系で30%、酪農廃水の系で38%であった。先行研究におけるクーロン効率は、人工基質を用いた場合は高いもので81〜98%程度、実廃水を用いた場合は3.6〜20%程度であり、本研究で得られたクーロン効率は、人工基質に比べると低いものの、実廃水と比較すれば高かった。一般的にクーロン効率が低くなる原因として、系内での電子生産微生物以外の微生物による有機物消費の可能性が指摘されている。
【0039】
【表3】

【0040】
【表4】

【0041】
〜PCR−DGGE〜
運転開始59日目に両生物反応槽のアノードの一部(0.5cm×0.5cm×0.5cm程度)を切り取り、DNA抽出に供した。同じ日にカソードバイオフィルムを薬匙で掻き取って集め、これもDNA抽出に供した。また、生物反応槽内部液(59日目)、養豚廃水、酪農廃水、微生物源として用いた活性汚泥は0.5−1.5mLを12000rpmで10分遠心分離し、ペレットをDNA抽出に供した。DNAの抽出には、PowerSoil DNA Isolation Kit(MO BIO Laboratories,Inc.,Carlsbad,CA)を用い、滅菌したTE buffer(10mM Tris-HCl、1mM EDTA)100μlに溶出した。抽出DNAを鋳型としてPCRをおこなった。
【0042】
プライマーには真正細菌16S rRNA遺伝子のV6−V8領域を含む968fGC-1401rのプライマーセット(参考:Heuer,H.,Krsek,M.,Baker, P.,Smalla, K. and Wellington,E.M.(1997)Analysis of actinomycete communities by specific amplification of genes encoding 16S rRNA and gel-electrophoretic separation in denaturing gradients,Applied and Environmental Microbiology,63(8),3233-3241.)を用いて、iCycler(Bio-Rad laboratories Inc.,USA)で増幅した。PCR反応液の組成は1×Ex TaqTM Buffer、dNTP Mixture(各0.2mM)、BSA(ウシ血清アルブミン)0.1μg/μl、各プライマー0.25μM、TaKaRa Ex TaqTM 1.25U(タカラバイオ株式会社製)、鋳型DNA0.5μlとし、滅菌超純水で全量を25μlとした。PCR反応条件は95℃2分の熱変性後、94℃30秒(変性)、57℃30秒(アニーリング)、72℃40秒(伸長)を35サイクル行い、最後の伸長反応は72℃で5分行った。PCRは同一DNA溶液から3回行い、その後の試験に用いた。
【0043】
PCR産物は1.2%アガロースを用いた電気泳動(100V、30min)で増幅を確認した後、変性剤濃度勾配ゲル電気泳動(DGGE)に供した。DGGEには、Dcode Multiple system (Bio-Rad)を用い、同社のプロトコルに準拠した。DGGE条件は、ゲル濃度6%・変性濃度勾配30−60%・60℃・100V・8時間とした。ただし変性剤濃度100%とは、7M尿素・40%ホルムアミドに相当する。
【0044】
電気泳動後、GelStar(登録商標)Nucleic Acid Stain(Lonza Rockland、Inc.)で約15分間染色し、Printgraph(アトー株式会社)で泳動像を確認後、CCD video camera module(アトー株式会社)で撮影した。ゲル中で明確なバンドについては、滅菌カッターナイフで切り出し、80μlの滅菌TE bufferに浸して4℃で一晩保存し、DNA溶液を得た。このDNA溶出液1μlをテンプレートとしてプライマー968f/1401rを用いてPCRを行った。PCR産物は増幅を確認した後ExoSAP-IT(登録商標)(USB Corporation)で精製した。シーケンシング反応は精製DNA溶液0.5−1.0μlをテンプレートとし、プライマー968f/1401rとBigDye(登録商標)Terminator Cycle Sequencing Kit v1.1(Applied Biosystems Inc.)を用いて行った。反応液はエタノール沈殿を行い、精製した後Hi-DiTM Formamide(Applied Biosystems Inc.)12μlに溶解しABI PRISM(登録商標)3130xl Genetic Analyzer(Applied Biosystems Inc.)を用いて塩基配列を決定した。DGGEバンドから決定した塩基配列の近縁種の検索はDNA Databank of Japan(DDBJ)のBLAST WWW system(http://www.ddbj.nig.ac.jp/search/blast-j.html))を用いて行った。
【0045】
それぞれの生物反応槽のアノードとカソード上のバイオフィルム、生物反応槽内部液、および流入させていた廃水を試料としたPCR−DGGEの結果を図4に示す。さらに、それぞれの試料の主要なDGGEバンドを切り出し塩基配列の解読後に相同性検索を行った結果を表5に示す。なお、表中の略号(Sample Name欄)は以下の意味を示す((SW1:養豚廃水1、SW2:養豚廃水2、SW−MFC−A:養豚廃水MFCのアノード、SW−MFC−C:養豚廃水MFCのカソード、SW−MFC−IL:養豚廃水MFCの内部液、DW1:酪農廃水1、DW2:酪農廃水2、DW−MFC−A:酪農廃水MFCのアノード、DW−MFC−C:酪農廃水MFCのカソード、DW−MFC−IL酪農廃水MFCの内部液、AS:植種に用いた活性汚泥))。
【0046】
【表5】

【0047】
2種類の微生物燃料電池に植種した活性汚泥では、MFCのアノードのカーボン布から検出された報告例のある、Gammaproteobacteria綱に属する細菌の塩基配列に近縁なバンドがみられた。また、基質として与えた養豚廃水で検出されたバンドの塩基配列に最近縁な種はFirmicutes門に属していた。養豚廃水中からはFirmicutes門に近縁な細菌が優占することがしばしば報告されている。酪農廃水で検出されたバンドは、Firmicutes門とGammaproteobacteria綱に属する細菌に近縁であった。
【0048】
しかし、生物反応槽内では、アノードおよびカソード、そして内部液のいずれでも、植種汚泥や流入基質中の主要バンドとは異なるバンドが主要になった。養豚廃水生物反応槽のアノードでは、Acidobacteria門に属する種に近縁なバンドが主要となった。酪農廃水生物反応槽のアノードでは養豚廃水生物反応槽に比べて複雑なバンドパターンになったが、Deltaproteobacteria綱に属する種に近縁なバンドが明確に検出された。アノード上は電子生産微生物にとって好ましい選択圧がかかるため、アノードバイオフィルムで主要となった細菌は電子生産能を有しているものが多いと考えられる。既知の報告では、微生物燃料電池のアノードで電子生産に寄与する細菌としては、Gammaproteobanteria綱 Shewanella属、およびDeltaproteobacteria綱 Geobacter属に属する鉄還元細菌がよく知られている。報告されている電気生産細菌の大部分はProteobacteria門に属しているが、Firmicutes門、Cyanobacteria門、Acidobacteria門、Bacteroidetes門に属する細菌の検出も報告されている。本試験で養豚廃水生物反応槽のアノードから検出された細菌はAcidobacteria門に近縁であった。本試験に用いた活性汚泥や養豚廃水からは検出されなかったが、Acidobacteria門の細菌は養豚廃水中や活性汚泥中にわずかに存在することが報告されている。一方、酪農廃水微生物燃料電池のアノードからも、電子生産に寄与することが報告されている種であるDesulfuromonas acetexigensを最近縁に持つバンドが検出された。
【0049】
カソードや内部液中での主要バンドも、植種、流入基質で主要となったものとは異なり、さらにアノードのものとも異なった。これらのバンドに近縁な細菌種は、Proteobacteria門、Tenericutes門、Verrucomicrobia門、Firmicutes門、Gemmatimonadetes門など広く分布した。酪農廃水生物反応槽のカソードからは、Nitrospirae門に属する細菌に近縁なバンドが検出されたが、これはカソードにおいて亜硝酸酸化が起こっていた可能性を示唆している。
【0050】
〜リンの回収〜
養豚廃水を用いた系で、カソードへ析出した塩をICP−AESにて分析したところ、乾燥重量あたりリンが16%(5.17mmol/g)、マグネシウムが10%(4.11 mmol/g)、カルシウムが6.7%(1.67mmol/g)含まれていた。また、このときの流入養豚廃水中の各成分の濃度は、リンが740mg/L(23.9mM)、 マグネシウムが300mg/L(24.7mM)、カルシウムが740mg/L(18.5mM)であった(表6)。
【0051】
【表6】

【0052】
MFCの人工基質においては100mM 程度のリン酸が与えられることが多く、本研究における養豚廃水中のリン濃度がその1/4程度しかないにも関わらず、高濃度のリンを含む物質が析出したことは、リンの濃度ではなく、マグネシウムイオンの濃度が析出に影響していると考えられる。また、発電に伴って、カソードで酸素還元反応が起こってプロトンが消費され、pHが上昇すると考えられている。従って、本試験でもこのpHの局所的上昇によって、塩が析出したと考えられる。
【0053】
HAPの理論的なリン:カルシウムのモル比は0.6:1であるのに対し、本試験において観察された析出物中のモル比は3.1:1であり、仮にカルシウムの全量がHAPとして析出していたとしても、リンの析出の20%しか説明できない。さらに、カルシウムイオンは、炭酸イオンの存在下ではHAPとして析出すると同時に炭酸カルシウムとしても析出するため、HAPの生成を阻害することが知られており、実際のHAP生成量はこれ以下であったと考えられる。また、MAPの理論的なリン:マグネシウムのモル比は1:1であるのに対し、本試験において観察されたリン:マグネシウムのモル比は、1.26:1であった。仮にカルシウムの析出物の全量がHAPであったとすると、析出物中の残りの成分のリン:マグネシウムのモル比は1.01:1となり、MAPとHAPでこのリンの析出量をほぼ説明することができ、その場合析出物の主成分はMAPとなる。
【実施例2】
【0054】
図5に示すような、一槽型エアカソード微生物燃料電池(11)を作成した。生物反応槽(12)の容量は40mlで、アノード(13)は1.5cm×1.5cm×3.5cmのカーボンフェルト(SG-222:大阪ガスケミカル(株)製)にカーボンロッド(16)を挿入して用いた。エアカソード(15)は実施例1と同様にして、廃液に接触する側は白金触媒でコーティング(0.5mg 白金/cm2)し、外気に接触する側はPTFEを塗布して空気拡散層となるようにした。エアカソードからはチタンワイヤー(17)で外部回路と接続し、生物反応槽の液密を保つためにOリング(19)とネジ(18)を使用した。エアカソードの投影面積は10cm2(直径3.7cmの円)であった。
【0055】
この微生物燃料電池の運転は約60日間に渡っておこなった。共に養豚廃水を基質として与え、3−8日おきに、内部混合液を全量引き抜き、再び内部がいっぱいになるまで新しい廃水を流入させた。廃水の引き抜きと流入は上部の孔(14)からシリンジを用いておこなった。槽内の攪拌は行わなかった。生物反応槽上部には空間があり、完全な嫌気状態ではなかった。外部抵抗は100Ωで開始し、42日目に10Ωに変更した。
【0056】
養豚廃水は宮城県にある養豚農家から採取し、メッシュでろ過した後、冷蔵庫で保管した。生物反応槽への基質としてポリ瓶から取り出す前には、瓶内をよく撹拌して均一にした。生物反応槽のアノード(13)に対する植種微生物源には、下水処理場からの活性汚泥を用いた。
【0057】
〜化学分析〜
運転終了後、カソードを取り出して風乾した後、カソード上の析出物の分析をおこなった。カソードの一部を硝酸を用いたマイクロウェーブ分解に供し、析出物の全分解をおこなった。分解溶液はICP−MS(7500C、Agilent)にて、元素分析をおこなった。さらに、風乾したカソードからプラスチックチップで析出物をこそげ落とし、めのう乳鉢で均一な粉体にした後、X線回折装置で結晶構造解析をおこなった。
【0058】
【表7】

【0059】
〜リンの回収〜
カソード上の析出物をICP−MSで分析したところ、カソード1枚(10cm2)あたりリンが11mg、マグネシウムが5.3mg、カルシウムが13mg析出していた。このときの流入養豚廃水中の各成分の濃度は、リンが830mg/L、 マグネシウムが310mg/L、カルシウムが900mg/Lであった(表7)。結晶構造解析の結果、析出物の主成分はMAPであることがわかった(図6)。カソード上の析出物の写真を図7に示す。
【実施例3】
【0060】
図8に示すような、一槽型エアカソード微生物燃料電池(21)を2台(A、B)作成した。生物反応槽(22)の容量は75mlで、アノード(23)は直径7.7cmの円、厚さ1cmのカーボンフェルト(SG-222:大阪ガスケミカル(株)製)にカーボンロッド(26)を押し付けて接触させて用いた。エアカソード(25)は実施例1と同様にして、廃液に接触する側は白金触媒でコーティング(0.5mg 白金/cm2)し、外気に接触する側はPTFEを塗布して空気拡散層となるようにした。エアカソードの投影面積は47cm2(直径7.7cmの円)であった。カソードとアノードの間の空間には直径7.7cm、厚さ1cmの布製のセパレーター(27)およびOリング(29)をセットし、アノードとカソードに接触しながら挟まれる状態とした。生物反応槽の側面と上面にそれぞれ廃水流入孔(24)と流出孔(28)をつけ、ポンプと50mlプラスチックチューブ(廃水ボトル)を接続し、生物反応槽と廃水ボトル間で廃水が(図中太い矢印で示す方向に)循環するようにした。
【0061】
この微生物燃料電池の運転は49日間に渡っておこなった。共に養豚廃水を基質として与え、3−17日おきに、新しい養豚廃水50mlを入れた廃水ボトルを交換することで、基質の投入をおこなった。生物反応槽と廃水ボトル間の廃水の循環速度は20ml/分であった。生物反応槽内はほぼ完全に密閉状態であった。外部抵抗は100Ωで運転を開始し、開始後3日目(微生物燃料電池(A))及び5日目(微生物燃料電池(B))に10Ωに変更した。
【0062】
養豚廃水は宮城県にある養豚農家から採取し、メッシュでろ過した後、冷蔵庫で保管した。生物反応槽への基質としてポリ瓶から取り出す前には、瓶内をよく撹拌して均一にした。生物反応槽のアノード(23)に対する植種微生物源には、微生物燃料電池(A)には水田土壌と実施例2の生物反応槽のアノードの一部、微生物燃料電池(B)には水田土壌のみを用いた。
【0063】
〜化学分析〜
流入養豚廃水、流出処理水(交換後の廃水ボトル内の液体)、およびカソード析出物の元素分析をおこなった。養豚廃水、処理水、カソードの一部、布製セパレーターの一部、およびアノードの一部を硝酸を用いたマイクロウェーブ分解に供し、全分解をおこなった。ICP−MS(7500C、Agilent)を用いて、分解溶液の元素分析をおこなった。
【0064】
〜電力〜
電池の電圧はデータ自動収集能力を持つデジタルマルチメータ (midi LOGGER GL200A、 グラフテック株式会社) で測定・記録をおこなった。
【0065】
微生物燃料電池(A、B)の発電の変化を図9に示す。外部抵抗については、微生物燃料電池(A)では運転開始3日後、微生物燃料電池(B)では運転開始5日後に100Ωから10Ωに変更した。運転初期の10日間程度は、両方の生物反応槽で電圧が変動しながら徐々に上昇した。10日後以降、最大電圧は約200〜250mVに達し、以降は最大電圧の上昇が見られなくなり、ほぼ安定した。
【0066】
微生物燃料電池(A、B)の物質収支を表8、9に示す。49日間の運転で、微生物燃料電池(A)には0.28g、微生物燃料電池(B)には0.24gのリンが流入した。これらのリンは処理水中では大幅に減少し、両生物反応槽共に約80%ものリンが除去されることが確認された。生物反応槽内部に蓄積したリンを測定したところ、流入廃水中から除去されたリンのほぼ全量が内部に存在することが確認され、物質収支の結果は非常に良好であった。生物反応槽内部の蓄積の内訳に関しては、約2/3のリンがカソード及びカソード近傍に析出していることが確認された。残りの約1/3はアノードから検出された。廃水中のリンは、懸濁物質の中に存在するものと、溶存した状態で存在するものがあるが、前者が懸濁物質ごとアノードのカーボンフェルトに補足されたために、アノードからもリンが検出されたと考えられる。
【0067】
【表8】

【0068】
【表9】

【実施例4】
【0069】
〜ポテンショスタットを用いた、人工廃水からのMAP生成試験〜
実施例3と同じ生物反応槽を用いて、人工廃水からのMAP生成試験を行った。ただし、カーボンロッドとカソードの接触を避けるためのセパレーターのサイズを小さくした。人工廃水は、NaH2PO4 10mM 、MgCl2 10mM、NH4Cl 20mMを含んでいた。また、有機物源として、終濃度で33mg/Lのグルコース、及び同じく終濃度で33mg/Lの乳酸ナトリウムを添加した。さらにビタミン(ビオチン2mg/L、葉酸2mg/L、ピリドキシン塩酸塩10mg/L、リボフラビン5mg/L、チアミン5mg/L、ニコチン酸5mg/L、パントテン酸5mg/L、シアノコバラミン1mg/L、3−アミノ安息香酸5mg/L、チオクト酸 5mg/L)およびミネラル(ニトリロ3酢酸(NTA)15mg/L、MnSO4・H2O 5mg/L、NaCl 10mg/L、FeSO4・7H2O 1mg/L、CaCl2・2H2O 1mg/L、CoCl2・6H2O 1mg/L、ZnCl2 1.3mg/L、CuSO4・5H2O 0.1mg/L、AlK(SO4)2・12H2O 0.1mg/L、H3BO3 0.1mg/L、Na2MoO4 0.25mg/L、NiCl2・6H2O 0.24mg/L、Na2WO4・2H2O 0.25mg/L)を含む液を加え、pHを7に調整したHEPESバッファーを終濃度100mMになるように添加した。微生物を含まない生物反応槽に上記溶液を投入し、ポンプを動かしてしばらく溶液を循環させたが、結晶の析出は確認できなかった。
【0070】
次に、廃水ボトルにAg/AgCl参照電極を挿入し、ポテンショスタットという装置を用いて、カソード電位を、参照電極−138mVに設定した。このAg/AgCl電極−138mVという電位は、実施例3におけるカソード電位の実測値にあたる。その結果、カソードに結晶の析出が確認され、他の部分には結晶は析出しなかった。カソード電位を制御しはじめてから約48時間後のカソードの写真を図10に示す。カソード電位を、実施例3のカソードと同じに制御したことから、本実施例と実施例3では、ほぼ同じ酸素還元反応が起こっていたと考えられる。すなわち、実施例1〜3でも本実施例と同様の反応で、カソードのみに塩が析出していると考えられる。実施例3ではアノードからもリンが検出されたが、それは電極反応が起こった結果リンが回収されたわけではなく、廃水中に元から存在するリンを含む懸濁物質がアノードにトラップされたためにすぎないと考えられる。すなわち、リンを効果的に析出させ回収するためには、特に廃水中のリンのほとんどが溶存状態で存在する場合には、微生物燃料電池が適切に運転され発電がおこなわれることが重要である。
【実施例5】
【0071】
実施例3と同様の生物反応槽を用いて、人工廃水からのMAP生成試験を行った。ただし、カーボンロッドとカソードの接触を避けるためのセパレーターのサイズを小さくした。また、廃水ボトルのサイズは300mlとした。人工廃水は、NaH2PO4 10mMを含んでいた。さらにビタミン(ビオチン2mg/L、葉酸2mg/L、ピリドキシン塩酸塩10mg/L、リボフラビン5mg/L、チアミン5mg/L、ニコチン酸5mg/L、パントテン酸5mg/L、シアノコバラミン1mg/L、3−アミノ安息香酸5mg/L、チオクト酸5mg/L)およびミネラル(ニトリロ3酢酸(NTA)15mg/L、MnSO4・H2O 5mg/L、NaCl 10mg/L、FeSO4・7H2O 1mg/L、CaCl2・2H2O 1mg/L、CoCl2・6H2O 1mg/L、ZnCl2 1.3mg/L、CuSO4・5H2O 0.1mg/L、AlK(SO4)2・12H2O 0.1mg/L、H3BO3 0.1mg/L、Na2MoO4 0.25mg/L、NiCl2・6H2O 0.24mg/L、Na2WO4・2H2O 0.25mg/L)を含む液を加え、pHを7に調整したHEPESバッファーを終濃度100mMになるように添加した。
【0072】
これにMgCl2を終濃度5mM、NH4Clを終濃度5mMとなるように添加した系(微生物燃料電池D)、MgCl2を終濃度10mM、NH4Clを終濃度10mMとなるように添加した系(微生物燃料電池E)、MgCl2を終濃度15mM、NH4Clを終濃度15mMとなるように添加した系(微生物燃料電池F)、および、NaH2PO4をさらに追加して33mMとし、MgCl2もNH4Clも添加しなかった系(微生物燃料電池C)の4系列を4〜5日間運転した。全ての系には有機物源として、250mg/dayの酢酸ナトリウムを、シリンジポンプを用いて連続添加した。外部抵抗は10Ωとし、運転期間中の電圧は、約200mVであった。
【0073】
微生物燃料電池(C)においては、内部の液中のリン濃度は、有機物源の流入による希釈効果以上の減少はみられなかった。微生物燃料電池(D、E、F)の内部の液中のリンとマグネシウムの濃度変化を図11、図12に示す。それぞれ15mMのマグネシウムとアンモニウムを投入した系では、リンの濃度は11mMから5.8mMまで減少した。この時マグネシウムの濃度も同様に、14mMから5.5mMまで減少した。10mMのマグネシウムとアンモニウムを投入した系では、リンの濃度は7.4mM、マグネシウムの濃度は4.6mMまで減少した。また、5mMのマグネシウムとアンモニウムを投入した系ではリンの濃度が8.9mM、マグネシウムの濃度が2.7mMまで減少した。
【0074】
5日間の運転終了後、微生物燃料電池(D、E、F)のカソードの表面のみに、析出物ができていることが観察された(図13参照)。投入したマグネシウムとアンモニウムの量が多くなるほど、析出物の発生量も多くなった。これらの析出物を回収し、粉末XRD解析を行った結果、これらの析出物がMAPであることがわかった。
【0075】
各微生物燃料電池において、減少したリンのモル量から析出したMAPのモル量を求め、この値をアンモニウムの投入濃度から引くことにより、アンモニウムの終濃度を求めた。さらにこの値と、リンとマグネシウムの終濃度の測定結果を用いて、運転終了後の[リンの終濃度(M)]×[マグネシウムの終濃度(M)]×[アンモニウムの終濃度(M)]の値を求めたところ、6.3×10−8〜3.2×10−7[mol/L]3であった。
【産業上の利用可能性】
【0076】
本発明の微生物燃料電池は従来の構成とは大差がないので構造が簡単で、発電の過程で二酸化炭素は発生するものの化石燃料に頼らないために炭素循環の流れを乱すことがない。また廃水処理に適用して電気エネルギーのみならず、廃水中に含まれるリンも同時に回収することができる。従って、電力を必要とする様々な用途に有用であるだけでなく、回収したリンを肥料等の農業分野へ利用することもできる。
【符号の説明】
【0077】
1,11,21 微生物燃料電池
2,12,22 生物反応槽
3,13,23 アノード
5,15,25 カソード
7 カーボンフェルト
【技術分野】
【0001】
本発明は、微生物燃料電池に関する。また微生物燃料電池により実廃水から電気エネルギーを取り出すと同時にリン含有析出物を回収する方法に係わる。
【背景技術】
【0002】
家畜排せつ物は、野積みや素堀りといった不適切な管理によって、悪臭の発生要因となったり、河川や地下水へ流出して水質汚染を招くなど、環境問題の発生源としての側面を有する一方で、たい肥化などの適切な処理を施すことによって、土壌改良資材や肥料としての有効活用が期待される。平成16年11月に本格施行された「家畜排せつ物の管理の適正化及び利用の促進に関する法律」により所謂廃棄物として自由に処理することができなくなり、畜産業者としては、家畜排せつ物を適正に管理し活用することが義務付けられるようになった。家畜排せつ物処理としては殆どが焼却又は発酵させてたい肥化する方法が適用されるが、水分を多量に含むような場合の処理は活性汚泥法が好適である。活性汚泥とは、人為的・工学的に培養・育成された微生物群を主成分とする有機汚泥の総称であり、廃水・汚水の浄化手段として広く利用されている。
【0003】
廃水が潜在的に持つエネルギーは、その廃水を活性汚泥法によって処理するために必要なエネルギーの約9.3倍以上(Shizas, I. (2004) Journal of Energy Engineering, 130(2)45-53)という推定があるほど高く、これを回収・利用することは循環型社会の形成を目指す上で重要である。
【0004】
廃水処理におけるエネルギー回収技術としては、メタン発酵や水素発酵といった嫌気性処理に関する研究が進められている。例えば、メタン発酵の技術として、「有機廃棄物よりメタンガスを主成分とするバイオガスを発生させるメタン発酵槽と、前記メタン発酵槽で発生したバイオガスから有害な気体を分離して除去する精製装置と、有害な気体及び酸素の濃度を連続的に確認する連続モニタリング装置と、前記バイオガスの圧力を検出する圧力検出装置と、前記メタン発酵槽から発生したバイオガスを貯蔵するガス貯蔵装置と、前記ガス貯蔵装置から供給されるバイオガスと空気とを燃焼させて、ガスエンジンを駆動して発電機を駆動させる複数のガスエンジン発電機と、前記ガスエンジン発電機への余剰バイオガスを燃焼させる余剰ガス燃焼装置と、前記圧力検出装置の検出値、及び連続モニタリング装置の計測値を入力してガスエンジン発電機と余剰ガス燃焼装置の始動及び停止を制御する制御装置とを具備するバイオガス発電装置」がある(特許文献1)。しかし、メタン発酵は回収したバイオガスを電力として利用するために発電機を必要とする上、バイオガスに含まれる硫化水素の除去のためにガスの前処理が必要である。またガス爆発や、硫化水素による中毒など、安全面でも課題を抱えている。
【0005】
他の技術としては、微生物の代謝機能を利用して、有機物質から電気エネルギーを取り出すというもので、水素などの純物質から電気エネルギーを獲得する燃料電池と区別するために「微生物燃料電池(MFC)」と呼ばれるものがある。例えば、「有機性基質に浸漬して嫌気性微生物を担持させる負電極、及び少なくとも一部分がイオン透過性隔膜で形成された外殻と入出孔とを有する密閉型中空カセット内に電解液と共に封入し又は当該カセットの隔膜の内側に結合して前記有機性基質中に差し込む正電極を備え、前記入出孔経由でカセット内に酸素を供給しつつ前記負電極及び正電極を電気的に接続する回路経由で電気を取り出してなる微生物燃料電池」(特許文献2)がある。また、「アノード表面領域を有するアノードと、カソード表面領域を有するカソードと、前記アノードと前記カソードとの間に配置されたカチオン交換膜と、前記アノードの上に配置されるとともに複数のelectricigenic微生物の物質移動を向上させ微生物燃料電池の出力密度を増大させる複数のコロニーを、互いに間隔を開けて形成する複数のelectricigenic微生物と、を含む微生物燃料電池」(特許文献3)などがある。これらは、電気エネルギーを取り出すという点で優れた技術であるものの、廃水成分からの有用な資源を回収するという点では課題を有していた。
【0006】
また、これまでの微生物燃料電池における廃水処理に関する研究は人工基質を用いておこなったものが多く、実廃水で運転した場合の知見は乏しい。実廃水は人工基質に比べて多様な物質を含み、また廃水そのものに多くの微生物を含む。そのため、実廃水を用いた廃水処理生物反応槽では人工基質による運転に比べて内部の微生物群集の構造や相互関係が複雑になり、また人工基質では顕在化しなかった現象が起こる可能性がある。そのため、MFCの実用化に向けて、実廃水を用いた運転の知見が必要となる。実廃水の中でも、畜産廃水に関する知見はとりわけ少なく、Minらが養豚廃水での運転を試みたのがほぼ唯一の報告である(非特許文献1)。
【先行技術文献】
【特許文献】
【0007】
【特許文献1】特開2010−209706号公報
【特許文献2】特開2009−93861号公報
【特許文献3】特開2008−288198号公報
【非特許文献】
【0008】
【非特許文献1】Min, B., Kim, J., Oh, S., Regan, J. M. and Logan, B. E. (2005) Electricity generation from swine wastewater using microbial fuel cells, Water Research, 39(20), 4961-4968.
【発明の概要】
【発明が解決しようとする課題】
【0009】
前記の通り、従来の廃水処理が有する問題点に鑑み、微生物燃料電池を使用した新しいエネルギー回収技術を提供し、単に電気エネルギーを獲得するだけでなく、処理過程で廃水中に含まれる再利用可能な資源をも同時に回収することを目的とする。
【課題を解決するための手段】
【0010】
前記課題を解決するために、廃水中に含まれる成分の比率を適当にコントロールすることによって、電気エネルギーだけでなく、リンの析出物としても資源回収することができることを見いだした。
【0011】
すなわち、本発明の微生物燃料電池は、一対の電極と、有機物等を含む廃水と、前記有機物を分解して電子を放出する細胞外電子伝達能を有する微生物とを備える微生物燃料電池において、前記電極の負極上に前記微生物を含むバイオフィルムが形成されるとともに、目標最終リン濃度をx[mol/L]、前記廃水中における初期のリン濃度をx+a[mol/L]、マグネシウム濃度をy+a[mol/L]、アンモニア濃度をz+a[mol/L]としたときに、1.0×10−8≦x×y×z≦1.0×10−3[mol/L]3を満たすことを特徴とする。ここで、aは、廃水から除去されるリンの濃度を意味する。
【0012】
これを満たさない場合は、廃水中にマグネシウム塩、アンモニウム塩などを添加することによって不足分を補えばよい。これは、リンの回収に際し、マグネシウム及びアンモニアの存在下で反応してリン酸マグネシウムアンモニウム(MAP)の結晶を生成することができるからである。このアンモニアは、微生物が廃水中の窒素源を分解することでも供給されるので、それを考慮に入れて調整することが好ましい。
【0013】
微生物燃料電池でバイオフィルムを形成する微生物は、前記電極に電子を伝達するメディエータの添加が不要である細菌を一種以上含むことを特徴とする。一般的に微生物燃料電池は、微生物の産生する電子を電極が受け取って、外部回路に電気エネルギーとして供給する。その際に直接電極との間で電子授受を行う微生物と、微生物からメディエータと呼ばれる物質(例えば、ニュートラルレッド、メチレンブルー、チオニンなどが挙げられる。)が電子を収奪し、これが電極に電子を渡す所謂仲介役を必要とする微生物がある。本発明では、このメディエータの添加が不要である微生物が特に好適である。
【0014】
前記のような微生物燃料電池を用いて、正極側にリン含有析出物、好適には主としてリン酸マグネシウムアンモニウムを含む析出物を製造する。廃水処理の過程では、微生物の塊(フロック)として、或いは凝集剤やアルカリ剤などを添加して強制的に沈殿物として除去することも行われるが、本発明では、正極近傍におけるpHがアルカリ性に傾くことを利用して廃水中のリンを析出させることができると考えている。
【発明の効果】
【0015】
本発明の微生物燃料電池は、従来の技術に比較すると廃水中の成分をモニターして、リン、マグネシウム、アンモニアの存在濃度を適当な範囲に調整するだけで、電気エネルギーのみならず、有効な資源であるリンを回収することもできる。電気エネルギーは無論のこと、回収したリンもそのまま肥料として利用することができるので、付加価値の高い技術を提供することができる。
【図面の簡単な説明】
【0016】
【図1】図1は、本実施形態に係る微生物燃料電池の全体構成の一例を示す概要図である。
【図2】図2は、本実施形態に係わる実廃水を用いた微生物燃料電池の発電の変化を示す図である。なお、廃水を添加した日付を矢印で示した。
【図3】図3は、本実施形態に係わる微生物燃料電池の分極曲線および電力密度曲線を示す図である。
【図4】図4は、アノードとカソード上のバイオフィルム、生物反応槽内部液、および流入させていた廃水を試料としたPCR−DGGEの結果(真正細菌のユニバーサルプライマー(341f-907r)で増幅された16S リボソーマルRNA遺伝子断片のPCR−DGGEプロファイル)を示す図である。なお、図中の略号は以下の通り(SW1:養豚廃水1、SW2:養豚廃水2、SW−MFC−A:養豚廃水MFCのアノード、SW−MFC−C:養豚廃水MFCのカソード、SW−MFC−IL:養豚廃水MFCの内部液、DW1:酪農廃水1、DW2:酪農廃水2、DW−MFC−A:酪農廃水MFCのアノード、DW−MFC−C:酪農廃水MFCのカソード、DW−MFC−IL酪農廃水MFCの内部液、AS:植種に用いた活性汚泥)である。
【図5】図5は、本実施形態に係る微生物燃料電池の全体構成の他の例を示す概要図である。
【図6】図6はカソード上の析出物をICP−MSで分析した結晶構造解析の結果を示す図であって、上図は測定データ、下図は標準データを示す。
【図7】図7はカソード上の析出物を撮影した写真である。
【図8】図8は、本実施形態に係る微生物燃料電池の全体構成の他の例を示す概要図である。
【図9】図9の上図は微生物燃料電池(A)、下図は微生物燃料電池(B)の発電の変化を示す図である。
【図10】図10は、カソード電位を制御しはじめてから約48時間後のカソード上の析出物を撮影した写真である。
【図11】図11は、微生物燃料電池(D、E、F)の内部の液中のリン濃度の変化を示す図である。
【図12】図12は、微生物燃料電池(D、E、F)の内部の液中のマグネシウム濃度の変化を示す図である。
【図13】図13は、実施例5の微生物燃料電池(D、E、F)運転終了後のカソード上の析出物を撮影した写真である。
【発明を実施するための形態】
【0017】
以下に、本発明の微生物燃料電池について詳細に説明する。
微生物燃料電池は、その名称からも推察されるように、電気エネルギーをいかにして効率よく回収することができるかが従来の主たる研究課題であった。電流生成を決定する要素は多様であるが、電極の面積や素材等は他の電池技術分野においても共通要素であるのに対し、微生物から電極への電子伝達は微生物燃料電池に特有で、この点に注目した提案が多いのが現状である。一方、微生物燃料電池を廃水処理の立場からみれば、回収できるのは電気だけでなく、廃水中に多量に含まれるリン成分を例えば肥料として利用できるように回収することが、本発明の目的である。
【0018】
本発明では、従来の微生物燃料電池と同様の構成を有しつつ、廃水中のマグネシウムとアンモニアの存在に注目した。廃水中における初期リン濃度をx+a[mol/L]、目標最終リン濃度をx[mol/L]、廃水中の初期マグネシウム濃度をy+a[mol/L]、アンモニア濃度をz+a[mol/L]としたときに、最終的な処理水中のリン、マグネシウム、アンモニアのモル濃度の積x×y×zが、1.0×10−8〜1.0×10−3、好ましくは、1.0×10−8〜1.0×10−6の範囲で存在することが必要である。前記濃度範囲よりも高い濃度でマグネシウムやアンモニアを共存させることで、MAPの回収率が低下することはないものの、廃水中に回収されずに残存したまま存在するマグネシウムやアンモニアの濃度が多くなって実用的ではないからである。
【0019】
さて、微生物燃料電池の構成としては一対の電極が処理系内に備えられているが、双方或いは一方の電極を複数に分割して存在させることも無論可能である。要するに、正・負の電極が対となって存在していることが条件であって、電極の数を限定するものではない。この電極の比表面積・素材などは適宜選択可能であり、例えば、炭素棒、カーボンフェルト、カーボンペーパーなどの他、白金、金或いは白金などでコーティングした炭素素材などが用いられる。
【0020】
また、有機物等を含む廃水とは、具体的には家庭からの生活排水や工場からの産業廃水、前記の畜産業からの廃水などがある。これらのうち、生活排水にはマグネシウム濃度が低い傾向があり、畜産排水にはマグネシウム濃度が高い傾向がある。MAP回収効果は、適用する廃水のリンとマグネシウム、アンモニアの各濃度に大きく左右されるので、この濃度を前記の通り調整することが必要となる。
【0021】
前記有機物を分解して電子を放出する細胞外電子伝達能を有する微生物としては、一般的には、Acidobacteria門、Proteobacteria門、Firmicutes門、Cyanobacteria門、Bacteroidetes門のいずれかに属していることが知られ、より具体的には、Gammaproteobanteria綱Shewanella属、およびDeltaproteobacteria綱Geobacter属に属する鉄還元細菌がよく知られている。微生物燃料電池の負極上に形成されるバイオフィルム中には各種の細菌が存在し得るが、負極上では電子生産微生物にとって好ましい選択圧がかかるため、主要細菌は、細胞外電子伝達能を有する微生物の割合が多くなる。しかも本発明では、前記微生物は、前記電極に電子を伝達するメディエータの添加を不要とする細菌が好ましい。廃水中には元々含まれている可能性が低い物質であるメディエータを敢えて添加すれば、それだけ手間とコストが必要となり、メディエータの回収という工程も増える結果となるからである。ただし、自らや系内に存在する他の微生物が生産したメディエーターを利用して電極に電子を伝達する微生物に関しては、メディエーターの添加や回収の工程が不要であるため、この種の微生物もまた好ましい。
【0022】
負極上へのバイオフィルムの形成方法は、例えば2枚のカーボンフェルトを重ねてその間に炭素棒を挿入して電極となし、該フェルトの表面に実際の廃水処理場で採取した活性汚泥や水田土壌、湖沼底泥などの微生物を多く含む環境試料を塗布すれば良い。これによりフェルト表面には汚泥中の各種の微生物が植種されることになるが、負極上での選択圧によって主として細胞外電子伝達能を有する微生物の比率が高くなる。もちろん、前記の環境試料から各種微生物を分離または集積培養して、予め細胞外電子伝達能を有する微生物だけを選別した後、負極上に塗布する方法でも良い。また、実廃水にはそのような微生物が含まれることがあり、それらを与える場合は特別な植種を必要としない場合もある。何れにしても成育環境に適合するものが淘汰されてバイオフィルムを形成することになる。
【0023】
正極側ではリンを含む析出物が生じるが、本発明ではリン、マグネシウム、アンモニアの各濃度が調整されているので、リン酸マグネシウムアンモニウムが優先的に生成する。このとき、溶液中のアンモニア濃度に関しては、廃水中の有機物が他の微生物によって分解されて生じたアンモニアが利用されることも可能であるため、必ずしも廃水中に初めからアンモニア態として存在している必要はない。但し、アンモニウム塩の添加を全く否定するものではない。リン酸マグネシウムアンモニウム(MgNH4PO4)は6水和物で析出するが、化学式で示されているようにリン:マグネシウム:アンモニウムのモル比は1:1:1であり、よって、析出物中の各成分のモル比は等モルとなる。
【0024】
前記構成による微生物燃料電池を用いて、正極側にはリン特にリン酸マグネシウムアンモニウム(MAP)を主として含む析出物が生成される。このときの正極近傍では、各電極を電気的に接続する外部回路を流れてくる電子と水素イオンが結合して消費され、廃水全体よりも相対的にpHが上昇することになる。その結果、廃水中に存在するリン酸イオン、アンモニウムイオン、マグネシウムイオンの各イオンが結合して析出すると考えられる。生成した全体の析出物に占めるMAPの割合は乾燥重量比で30%を超えるものとなる。MAPは肥料として直接使用できるので、得られるリン含有析出物は、簡単に資源として再利用できると思われる。但し、廃水に重金属等の有害物質が含まれているような場合には、予め除去する工程を設けるか、肥料として使用することができない場合には、他の用途への転用を考える必要がある。
【0025】
以下本発明をより具体的に明らかにするために、本発明に係る幾つかの実施例を示す。なお、下記実施例では前記文中「負極」を「アノード」と、「正極」を「カソード」と表記した。
【実施例1】
【0026】
図1に示すような、一槽型エアカソード微生物燃料電池(1)を作成した。生物反応槽(2)の容量は350mlで、アノード(3)は8cm×10cm、厚さ20mmのカーボンフェルト(7)(SG-222:大阪ガスケミカル(株)製)2枚を重ねたものに炭素棒(6)(市販の単4マンガン電池を分解して取り出したもの)を挿入して用いた。エアカソード(5)はカーボンペーパー(Toray Carbon Paper TGP-H-120、 Teflon treated: 5% wt. wet proofing 東レ(株)製)をChengらの手法(Cheng,S.,Liu,H. and Logan,B.E. (2006) Increased performance of single-chamber microbial fuel cells using an improved cathode structure, Electrochemistry Communications,8(3)、489-494.)に従って、廃液に接触する側は白金触媒でコーティング(0.5mg 白金/cm2)し、外気に接触する側はPTFEを塗布して空気拡散層となるようにした。エアカソードの投影面積は50cm2(7.1cm×7.1cm)であった。
【0027】
これらの微生物燃料電池の運転は72日間に渡って20℃の恒温室内でおこなった。それぞれ養豚廃水と酪農廃水を基質として与え、1−10日おきに、養豚廃水を基質とした生物反応槽からは30ml、酪農廃水を基質とした生物反応槽からは60mlの内部混合液を引き抜き、同量の新しい廃水を流入させた(水理学的滞留時間:養豚廃水 11.7−117日、酪農廃水 5.8−58日)。廃水の引き抜き(8)は2枚のアノードの間から、流入(4)は図1においてアノードの左側から行った。また、カソードとアノードの間の領域に対しては廃水の引き抜きおよび流入は行っておらず、槽内の攪拌は行わなかった。生物反応槽上部には空間があり、完全な嫌気状態ではなかった。外部抵抗は10Ωとした。
【0028】
養豚廃水は宮城県にある養豚農家から採取した。酪農廃水は東北大学大学院農学研究科附属複合生態フィールド教育研究センター内の乳牛畜舎から採取した。両廃水は、0.7mmのメッシュでろ過した後、ポリ瓶に入れ4℃の冷蔵庫で保管した。生物反応槽への基質としてポリ瓶から取り出す前には、瓶内をよく撹拌して均一にした。養豚廃水は58日、酪農廃水は28日目に保管した最初のポリ瓶(養豚廃水1、酪農廃水1)を使いきり、2本目(養豚廃水2、酪農廃水2)を同様に採取して用い、その使用中に運転を終えた。なお、生物反応槽のアノード(3)に対する植種微生物源には、試験で用いたのと同じ酪農廃水を処理している膜分離型活性汚泥生物反応槽の活性汚泥を用いた。
【0029】
〜化学分析〜
養豚廃水、酪農廃水、および生物反応槽内部液を採取し、水質分析に供した。内部液は基質入れ替え時に引き抜いた液、および基質投入後サンプルとして、基質入れ替えの約2時間後に、基質引き抜き口から採取したものを用いた。水質分析用のサンプルは、全て0.45μmのフィルター(DISMIC 25CS045AN、ADVANTEC MFS、INC)でろ過したあと、分析に供した。Standard Methods (method 5220D)(参考:APHA(1995)Standard Methods for the Examination of Water and Wastewater(19th ed.),American Public Health Association,Washington D.C.)に従って、HACH COD system(HACH Company)を用いてこれらのサンプルのCODCrを測定した。電気伝導度は、上記のろ過サンプルを電気伝導度計(B-173、堀場製作所)で測定した。また、一部のサンプルはろ過せずに後述するPCR−DGGEに用いた。
【0030】
〜電力とクーロン効率〜
電池の電圧はデータ自動収集能力を持つデジタルマルチメータ (midi LOGGER GL200A、 グラフテック株式会社) で行った。電流と電力密度は数式1に従って求めた。ここで、I:電流(A)、E:電圧(V)、P:電力(W)、R:抵抗(Ω)、A:はアノード投影面積(m2)である。クーロン効率は、Minらの方法と同様に、電流生産量と溶解性CODCrの減少量から求めた。
【0031】
【数1】

【0032】
電荷QとCODCrの関係は数式2に従って求めた。ここで、Q:電荷(c)、F:ファラデー定数 96485(C/mol) 、ΔCODCr:生物反応槽内の減少CODCr濃度(g/L)、V:生物反応槽容積(L)である。最大電力密度は42日目に測定し、1−2000Ωの間で外部抵抗を変化させ、その時の電圧から計算によって求めた。これらの結果を表1に示す。人工基質を用いた生物反応槽では有機物濃度を数百から1000mg/L程度の範囲で運転を行うケースが多いが、本試験における養豚廃水の溶解性CODはこの値の数十倍であった。
【0033】
【数2】

【0034】
【表1】

【0035】
また各廃水を用いた微生物燃料電池の発電の変化を図2に示す。最初の27日間、養豚廃水を用いた系では電圧が変動しながら徐々に上昇した。28日目以降、最大電圧が約250mVに達し、以降は最大電圧の上昇が見られなくなり、ほぼ安定した。一方、酪農廃水を用いたMFC生物反応槽でも最初の30日間で最大電圧の上昇が確認されたものの、その上昇速度は養豚廃水の系に比べて小さく、最大電圧は35mV程度であった。運転42日目の各生物反応槽の分極曲線および電力密度曲線を図3に示す。養豚廃水を用いた系での最大電力密度は831mW/m2(R=10Ω)で、酪農廃水を用いた系では59mW/m2(R=200Ω)であった。養豚廃水の方が高い発電能力を示しているが、溶解性CODが高いこと(表1参照)が原因の一つと考えられる。
【0036】
廃水中の電気伝導度もまた、微生物燃料電池の発電力に影響を与える因子である。電気伝導度が低いと内部抵抗が大きくなり、発電力が低くなることが知られている。内部抵抗とは、外部回路に取り付けた抵抗成分以外の抵抗のことであり、電池の場合は電池そのものがもつ抵抗のことを意味する。本試験における内部抵抗を分極曲線の傾きから求めたところ、養豚廃水の系で9Ω、酪農廃水の系では292Ωであった。また、生物反応槽内部液の電気伝導度は、養豚廃水では約20mS/cm、酪農廃水で約1mS/cmであった(表2)。100mMリン酸緩衝液、およびそれに100mM NaClを添加した場合の電気伝導度はそれぞれ、1.1mS/cm、1.9mS/cmである。廃水の電気伝導度が内部抵抗に寄与する度合いは生物反応槽の形状によって異なるため、一概に比較はできないものの、養豚廃水の電気伝導度が高かったことが、養豚廃水生物反応槽において内部抵抗が小さかったことの一因であると考えられる。
【0037】
【表2】

【0038】
運転59日目に基質を投入した後から次の基質投入をする直前の運転64日目までにおける、溶解性COD除去率を表3に示す。養豚廃水を用いた微生物燃料電池では溶解性CODの除去率は89%と、高い有機物除去率を示した。一方、酪農廃水では69%と、やや低い値であった。59日目と64日目の生物反応槽内部液の溶解性COD濃度および電圧データから、クーロン効率を求めた(表4)。クーロン効率は養豚廃水の系で30%、酪農廃水の系で38%であった。先行研究におけるクーロン効率は、人工基質を用いた場合は高いもので81〜98%程度、実廃水を用いた場合は3.6〜20%程度であり、本研究で得られたクーロン効率は、人工基質に比べると低いものの、実廃水と比較すれば高かった。一般的にクーロン効率が低くなる原因として、系内での電子生産微生物以外の微生物による有機物消費の可能性が指摘されている。
【0039】
【表3】

【0040】
【表4】

【0041】
〜PCR−DGGE〜
運転開始59日目に両生物反応槽のアノードの一部(0.5cm×0.5cm×0.5cm程度)を切り取り、DNA抽出に供した。同じ日にカソードバイオフィルムを薬匙で掻き取って集め、これもDNA抽出に供した。また、生物反応槽内部液(59日目)、養豚廃水、酪農廃水、微生物源として用いた活性汚泥は0.5−1.5mLを12000rpmで10分遠心分離し、ペレットをDNA抽出に供した。DNAの抽出には、PowerSoil DNA Isolation Kit(MO BIO Laboratories,Inc.,Carlsbad,CA)を用い、滅菌したTE buffer(10mM Tris-HCl、1mM EDTA)100μlに溶出した。抽出DNAを鋳型としてPCRをおこなった。
【0042】
プライマーには真正細菌16S rRNA遺伝子のV6−V8領域を含む968fGC-1401rのプライマーセット(参考:Heuer,H.,Krsek,M.,Baker, P.,Smalla, K. and Wellington,E.M.(1997)Analysis of actinomycete communities by specific amplification of genes encoding 16S rRNA and gel-electrophoretic separation in denaturing gradients,Applied and Environmental Microbiology,63(8),3233-3241.)を用いて、iCycler(Bio-Rad laboratories Inc.,USA)で増幅した。PCR反応液の組成は1×Ex TaqTM Buffer、dNTP Mixture(各0.2mM)、BSA(ウシ血清アルブミン)0.1μg/μl、各プライマー0.25μM、TaKaRa Ex TaqTM 1.25U(タカラバイオ株式会社製)、鋳型DNA0.5μlとし、滅菌超純水で全量を25μlとした。PCR反応条件は95℃2分の熱変性後、94℃30秒(変性)、57℃30秒(アニーリング)、72℃40秒(伸長)を35サイクル行い、最後の伸長反応は72℃で5分行った。PCRは同一DNA溶液から3回行い、その後の試験に用いた。
【0043】
PCR産物は1.2%アガロースを用いた電気泳動(100V、30min)で増幅を確認した後、変性剤濃度勾配ゲル電気泳動(DGGE)に供した。DGGEには、Dcode Multiple system (Bio-Rad)を用い、同社のプロトコルに準拠した。DGGE条件は、ゲル濃度6%・変性濃度勾配30−60%・60℃・100V・8時間とした。ただし変性剤濃度100%とは、7M尿素・40%ホルムアミドに相当する。
【0044】
電気泳動後、GelStar(登録商標)Nucleic Acid Stain(Lonza Rockland、Inc.)で約15分間染色し、Printgraph(アトー株式会社)で泳動像を確認後、CCD video camera module(アトー株式会社)で撮影した。ゲル中で明確なバンドについては、滅菌カッターナイフで切り出し、80μlの滅菌TE bufferに浸して4℃で一晩保存し、DNA溶液を得た。このDNA溶出液1μlをテンプレートとしてプライマー968f/1401rを用いてPCRを行った。PCR産物は増幅を確認した後ExoSAP-IT(登録商標)(USB Corporation)で精製した。シーケンシング反応は精製DNA溶液0.5−1.0μlをテンプレートとし、プライマー968f/1401rとBigDye(登録商標)Terminator Cycle Sequencing Kit v1.1(Applied Biosystems Inc.)を用いて行った。反応液はエタノール沈殿を行い、精製した後Hi-DiTM Formamide(Applied Biosystems Inc.)12μlに溶解しABI PRISM(登録商標)3130xl Genetic Analyzer(Applied Biosystems Inc.)を用いて塩基配列を決定した。DGGEバンドから決定した塩基配列の近縁種の検索はDNA Databank of Japan(DDBJ)のBLAST WWW system(http://www.ddbj.nig.ac.jp/search/blast-j.html))を用いて行った。
【0045】
それぞれの生物反応槽のアノードとカソード上のバイオフィルム、生物反応槽内部液、および流入させていた廃水を試料としたPCR−DGGEの結果を図4に示す。さらに、それぞれの試料の主要なDGGEバンドを切り出し塩基配列の解読後に相同性検索を行った結果を表5に示す。なお、表中の略号(Sample Name欄)は以下の意味を示す((SW1:養豚廃水1、SW2:養豚廃水2、SW−MFC−A:養豚廃水MFCのアノード、SW−MFC−C:養豚廃水MFCのカソード、SW−MFC−IL:養豚廃水MFCの内部液、DW1:酪農廃水1、DW2:酪農廃水2、DW−MFC−A:酪農廃水MFCのアノード、DW−MFC−C:酪農廃水MFCのカソード、DW−MFC−IL酪農廃水MFCの内部液、AS:植種に用いた活性汚泥))。
【0046】
【表5】

【0047】
2種類の微生物燃料電池に植種した活性汚泥では、MFCのアノードのカーボン布から検出された報告例のある、Gammaproteobacteria綱に属する細菌の塩基配列に近縁なバンドがみられた。また、基質として与えた養豚廃水で検出されたバンドの塩基配列に最近縁な種はFirmicutes門に属していた。養豚廃水中からはFirmicutes門に近縁な細菌が優占することがしばしば報告されている。酪農廃水で検出されたバンドは、Firmicutes門とGammaproteobacteria綱に属する細菌に近縁であった。
【0048】
しかし、生物反応槽内では、アノードおよびカソード、そして内部液のいずれでも、植種汚泥や流入基質中の主要バンドとは異なるバンドが主要になった。養豚廃水生物反応槽のアノードでは、Acidobacteria門に属する種に近縁なバンドが主要となった。酪農廃水生物反応槽のアノードでは養豚廃水生物反応槽に比べて複雑なバンドパターンになったが、Deltaproteobacteria綱に属する種に近縁なバンドが明確に検出された。アノード上は電子生産微生物にとって好ましい選択圧がかかるため、アノードバイオフィルムで主要となった細菌は電子生産能を有しているものが多いと考えられる。既知の報告では、微生物燃料電池のアノードで電子生産に寄与する細菌としては、Gammaproteobanteria綱 Shewanella属、およびDeltaproteobacteria綱 Geobacter属に属する鉄還元細菌がよく知られている。報告されている電気生産細菌の大部分はProteobacteria門に属しているが、Firmicutes門、Cyanobacteria門、Acidobacteria門、Bacteroidetes門に属する細菌の検出も報告されている。本試験で養豚廃水生物反応槽のアノードから検出された細菌はAcidobacteria門に近縁であった。本試験に用いた活性汚泥や養豚廃水からは検出されなかったが、Acidobacteria門の細菌は養豚廃水中や活性汚泥中にわずかに存在することが報告されている。一方、酪農廃水微生物燃料電池のアノードからも、電子生産に寄与することが報告されている種であるDesulfuromonas acetexigensを最近縁に持つバンドが検出された。
【0049】
カソードや内部液中での主要バンドも、植種、流入基質で主要となったものとは異なり、さらにアノードのものとも異なった。これらのバンドに近縁な細菌種は、Proteobacteria門、Tenericutes門、Verrucomicrobia門、Firmicutes門、Gemmatimonadetes門など広く分布した。酪農廃水生物反応槽のカソードからは、Nitrospirae門に属する細菌に近縁なバンドが検出されたが、これはカソードにおいて亜硝酸酸化が起こっていた可能性を示唆している。
【0050】
〜リンの回収〜
養豚廃水を用いた系で、カソードへ析出した塩をICP−AESにて分析したところ、乾燥重量あたりリンが16%(5.17mmol/g)、マグネシウムが10%(4.11 mmol/g)、カルシウムが6.7%(1.67mmol/g)含まれていた。また、このときの流入養豚廃水中の各成分の濃度は、リンが740mg/L(23.9mM)、 マグネシウムが300mg/L(24.7mM)、カルシウムが740mg/L(18.5mM)であった(表6)。
【0051】
【表6】

【0052】
MFCの人工基質においては100mM 程度のリン酸が与えられることが多く、本研究における養豚廃水中のリン濃度がその1/4程度しかないにも関わらず、高濃度のリンを含む物質が析出したことは、リンの濃度ではなく、マグネシウムイオンの濃度が析出に影響していると考えられる。また、発電に伴って、カソードで酸素還元反応が起こってプロトンが消費され、pHが上昇すると考えられている。従って、本試験でもこのpHの局所的上昇によって、塩が析出したと考えられる。
【0053】
HAPの理論的なリン:カルシウムのモル比は0.6:1であるのに対し、本試験において観察された析出物中のモル比は3.1:1であり、仮にカルシウムの全量がHAPとして析出していたとしても、リンの析出の20%しか説明できない。さらに、カルシウムイオンは、炭酸イオンの存在下ではHAPとして析出すると同時に炭酸カルシウムとしても析出するため、HAPの生成を阻害することが知られており、実際のHAP生成量はこれ以下であったと考えられる。また、MAPの理論的なリン:マグネシウムのモル比は1:1であるのに対し、本試験において観察されたリン:マグネシウムのモル比は、1.26:1であった。仮にカルシウムの析出物の全量がHAPであったとすると、析出物中の残りの成分のリン:マグネシウムのモル比は1.01:1となり、MAPとHAPでこのリンの析出量をほぼ説明することができ、その場合析出物の主成分はMAPとなる。
【実施例2】
【0054】
図5に示すような、一槽型エアカソード微生物燃料電池(11)を作成した。生物反応槽(12)の容量は40mlで、アノード(13)は1.5cm×1.5cm×3.5cmのカーボンフェルト(SG-222:大阪ガスケミカル(株)製)にカーボンロッド(16)を挿入して用いた。エアカソード(15)は実施例1と同様にして、廃液に接触する側は白金触媒でコーティング(0.5mg 白金/cm2)し、外気に接触する側はPTFEを塗布して空気拡散層となるようにした。エアカソードからはチタンワイヤー(17)で外部回路と接続し、生物反応槽の液密を保つためにOリング(19)とネジ(18)を使用した。エアカソードの投影面積は10cm2(直径3.7cmの円)であった。
【0055】
この微生物燃料電池の運転は約60日間に渡っておこなった。共に養豚廃水を基質として与え、3−8日おきに、内部混合液を全量引き抜き、再び内部がいっぱいになるまで新しい廃水を流入させた。廃水の引き抜きと流入は上部の孔(14)からシリンジを用いておこなった。槽内の攪拌は行わなかった。生物反応槽上部には空間があり、完全な嫌気状態ではなかった。外部抵抗は100Ωで開始し、42日目に10Ωに変更した。
【0056】
養豚廃水は宮城県にある養豚農家から採取し、メッシュでろ過した後、冷蔵庫で保管した。生物反応槽への基質としてポリ瓶から取り出す前には、瓶内をよく撹拌して均一にした。生物反応槽のアノード(13)に対する植種微生物源には、下水処理場からの活性汚泥を用いた。
【0057】
〜化学分析〜
運転終了後、カソードを取り出して風乾した後、カソード上の析出物の分析をおこなった。カソードの一部を硝酸を用いたマイクロウェーブ分解に供し、析出物の全分解をおこなった。分解溶液はICP−MS(7500C、Agilent)にて、元素分析をおこなった。さらに、風乾したカソードからプラスチックチップで析出物をこそげ落とし、めのう乳鉢で均一な粉体にした後、X線回折装置で結晶構造解析をおこなった。
【0058】
【表7】

【0059】
〜リンの回収〜
カソード上の析出物をICP−MSで分析したところ、カソード1枚(10cm2)あたりリンが11mg、マグネシウムが5.3mg、カルシウムが13mg析出していた。このときの流入養豚廃水中の各成分の濃度は、リンが830mg/L、 マグネシウムが310mg/L、カルシウムが900mg/Lであった(表7)。結晶構造解析の結果、析出物の主成分はMAPであることがわかった(図6)。カソード上の析出物の写真を図7に示す。
【実施例3】
【0060】
図8に示すような、一槽型エアカソード微生物燃料電池(21)を2台(A、B)作成した。生物反応槽(22)の容量は75mlで、アノード(23)は直径7.7cmの円、厚さ1cmのカーボンフェルト(SG-222:大阪ガスケミカル(株)製)にカーボンロッド(26)を押し付けて接触させて用いた。エアカソード(25)は実施例1と同様にして、廃液に接触する側は白金触媒でコーティング(0.5mg 白金/cm2)し、外気に接触する側はPTFEを塗布して空気拡散層となるようにした。エアカソードの投影面積は47cm2(直径7.7cmの円)であった。カソードとアノードの間の空間には直径7.7cm、厚さ1cmの布製のセパレーター(27)およびOリング(29)をセットし、アノードとカソードに接触しながら挟まれる状態とした。生物反応槽の側面と上面にそれぞれ廃水流入孔(24)と流出孔(28)をつけ、ポンプと50mlプラスチックチューブ(廃水ボトル)を接続し、生物反応槽と廃水ボトル間で廃水が(図中太い矢印で示す方向に)循環するようにした。
【0061】
この微生物燃料電池の運転は49日間に渡っておこなった。共に養豚廃水を基質として与え、3−17日おきに、新しい養豚廃水50mlを入れた廃水ボトルを交換することで、基質の投入をおこなった。生物反応槽と廃水ボトル間の廃水の循環速度は20ml/分であった。生物反応槽内はほぼ完全に密閉状態であった。外部抵抗は100Ωで運転を開始し、開始後3日目(微生物燃料電池(A))及び5日目(微生物燃料電池(B))に10Ωに変更した。
【0062】
養豚廃水は宮城県にある養豚農家から採取し、メッシュでろ過した後、冷蔵庫で保管した。生物反応槽への基質としてポリ瓶から取り出す前には、瓶内をよく撹拌して均一にした。生物反応槽のアノード(23)に対する植種微生物源には、微生物燃料電池(A)には水田土壌と実施例2の生物反応槽のアノードの一部、微生物燃料電池(B)には水田土壌のみを用いた。
【0063】
〜化学分析〜
流入養豚廃水、流出処理水(交換後の廃水ボトル内の液体)、およびカソード析出物の元素分析をおこなった。養豚廃水、処理水、カソードの一部、布製セパレーターの一部、およびアノードの一部を硝酸を用いたマイクロウェーブ分解に供し、全分解をおこなった。ICP−MS(7500C、Agilent)を用いて、分解溶液の元素分析をおこなった。
【0064】
〜電力〜
電池の電圧はデータ自動収集能力を持つデジタルマルチメータ (midi LOGGER GL200A、 グラフテック株式会社) で測定・記録をおこなった。
【0065】
微生物燃料電池(A、B)の発電の変化を図9に示す。外部抵抗については、微生物燃料電池(A)では運転開始3日後、微生物燃料電池(B)では運転開始5日後に100Ωから10Ωに変更した。運転初期の10日間程度は、両方の生物反応槽で電圧が変動しながら徐々に上昇した。10日後以降、最大電圧は約200〜250mVに達し、以降は最大電圧の上昇が見られなくなり、ほぼ安定した。
【0066】
微生物燃料電池(A、B)の物質収支を表8、9に示す。49日間の運転で、微生物燃料電池(A)には0.28g、微生物燃料電池(B)には0.24gのリンが流入した。これらのリンは処理水中では大幅に減少し、両生物反応槽共に約80%ものリンが除去されることが確認された。生物反応槽内部に蓄積したリンを測定したところ、流入廃水中から除去されたリンのほぼ全量が内部に存在することが確認され、物質収支の結果は非常に良好であった。生物反応槽内部の蓄積の内訳に関しては、約2/3のリンがカソード及びカソード近傍に析出していることが確認された。残りの約1/3はアノードから検出された。廃水中のリンは、懸濁物質の中に存在するものと、溶存した状態で存在するものがあるが、前者が懸濁物質ごとアノードのカーボンフェルトに補足されたために、アノードからもリンが検出されたと考えられる。
【0067】
【表8】

【0068】
【表9】

【実施例4】
【0069】
〜ポテンショスタットを用いた、人工廃水からのMAP生成試験〜
実施例3と同じ生物反応槽を用いて、人工廃水からのMAP生成試験を行った。ただし、カーボンロッドとカソードの接触を避けるためのセパレーターのサイズを小さくした。人工廃水は、NaH2PO4 10mM 、MgCl2 10mM、NH4Cl 20mMを含んでいた。また、有機物源として、終濃度で33mg/Lのグルコース、及び同じく終濃度で33mg/Lの乳酸ナトリウムを添加した。さらにビタミン(ビオチン2mg/L、葉酸2mg/L、ピリドキシン塩酸塩10mg/L、リボフラビン5mg/L、チアミン5mg/L、ニコチン酸5mg/L、パントテン酸5mg/L、シアノコバラミン1mg/L、3−アミノ安息香酸5mg/L、チオクト酸 5mg/L)およびミネラル(ニトリロ3酢酸(NTA)15mg/L、MnSO4・H2O 5mg/L、NaCl 10mg/L、FeSO4・7H2O 1mg/L、CaCl2・2H2O 1mg/L、CoCl2・6H2O 1mg/L、ZnCl2 1.3mg/L、CuSO4・5H2O 0.1mg/L、AlK(SO4)2・12H2O 0.1mg/L、H3BO3 0.1mg/L、Na2MoO4 0.25mg/L、NiCl2・6H2O 0.24mg/L、Na2WO4・2H2O 0.25mg/L)を含む液を加え、pHを7に調整したHEPESバッファーを終濃度100mMになるように添加した。微生物を含まない生物反応槽に上記溶液を投入し、ポンプを動かしてしばらく溶液を循環させたが、結晶の析出は確認できなかった。
【0070】
次に、廃水ボトルにAg/AgCl参照電極を挿入し、ポテンショスタットという装置を用いて、カソード電位を、参照電極−138mVに設定した。このAg/AgCl電極−138mVという電位は、実施例3におけるカソード電位の実測値にあたる。その結果、カソードに結晶の析出が確認され、他の部分には結晶は析出しなかった。カソード電位を制御しはじめてから約48時間後のカソードの写真を図10に示す。カソード電位を、実施例3のカソードと同じに制御したことから、本実施例と実施例3では、ほぼ同じ酸素還元反応が起こっていたと考えられる。すなわち、実施例1〜3でも本実施例と同様の反応で、カソードのみに塩が析出していると考えられる。実施例3ではアノードからもリンが検出されたが、それは電極反応が起こった結果リンが回収されたわけではなく、廃水中に元から存在するリンを含む懸濁物質がアノードにトラップされたためにすぎないと考えられる。すなわち、リンを効果的に析出させ回収するためには、特に廃水中のリンのほとんどが溶存状態で存在する場合には、微生物燃料電池が適切に運転され発電がおこなわれることが重要である。
【実施例5】
【0071】
実施例3と同様の生物反応槽を用いて、人工廃水からのMAP生成試験を行った。ただし、カーボンロッドとカソードの接触を避けるためのセパレーターのサイズを小さくした。また、廃水ボトルのサイズは300mlとした。人工廃水は、NaH2PO4 10mMを含んでいた。さらにビタミン(ビオチン2mg/L、葉酸2mg/L、ピリドキシン塩酸塩10mg/L、リボフラビン5mg/L、チアミン5mg/L、ニコチン酸5mg/L、パントテン酸5mg/L、シアノコバラミン1mg/L、3−アミノ安息香酸5mg/L、チオクト酸5mg/L)およびミネラル(ニトリロ3酢酸(NTA)15mg/L、MnSO4・H2O 5mg/L、NaCl 10mg/L、FeSO4・7H2O 1mg/L、CaCl2・2H2O 1mg/L、CoCl2・6H2O 1mg/L、ZnCl2 1.3mg/L、CuSO4・5H2O 0.1mg/L、AlK(SO4)2・12H2O 0.1mg/L、H3BO3 0.1mg/L、Na2MoO4 0.25mg/L、NiCl2・6H2O 0.24mg/L、Na2WO4・2H2O 0.25mg/L)を含む液を加え、pHを7に調整したHEPESバッファーを終濃度100mMになるように添加した。
【0072】
これにMgCl2を終濃度5mM、NH4Clを終濃度5mMとなるように添加した系(微生物燃料電池D)、MgCl2を終濃度10mM、NH4Clを終濃度10mMとなるように添加した系(微生物燃料電池E)、MgCl2を終濃度15mM、NH4Clを終濃度15mMとなるように添加した系(微生物燃料電池F)、および、NaH2PO4をさらに追加して33mMとし、MgCl2もNH4Clも添加しなかった系(微生物燃料電池C)の4系列を4〜5日間運転した。全ての系には有機物源として、250mg/dayの酢酸ナトリウムを、シリンジポンプを用いて連続添加した。外部抵抗は10Ωとし、運転期間中の電圧は、約200mVであった。
【0073】
微生物燃料電池(C)においては、内部の液中のリン濃度は、有機物源の流入による希釈効果以上の減少はみられなかった。微生物燃料電池(D、E、F)の内部の液中のリンとマグネシウムの濃度変化を図11、図12に示す。それぞれ15mMのマグネシウムとアンモニウムを投入した系では、リンの濃度は11mMから5.8mMまで減少した。この時マグネシウムの濃度も同様に、14mMから5.5mMまで減少した。10mMのマグネシウムとアンモニウムを投入した系では、リンの濃度は7.4mM、マグネシウムの濃度は4.6mMまで減少した。また、5mMのマグネシウムとアンモニウムを投入した系ではリンの濃度が8.9mM、マグネシウムの濃度が2.7mMまで減少した。
【0074】
5日間の運転終了後、微生物燃料電池(D、E、F)のカソードの表面のみに、析出物ができていることが観察された(図13参照)。投入したマグネシウムとアンモニウムの量が多くなるほど、析出物の発生量も多くなった。これらの析出物を回収し、粉末XRD解析を行った結果、これらの析出物がMAPであることがわかった。
【0075】
各微生物燃料電池において、減少したリンのモル量から析出したMAPのモル量を求め、この値をアンモニウムの投入濃度から引くことにより、アンモニウムの終濃度を求めた。さらにこの値と、リンとマグネシウムの終濃度の測定結果を用いて、運転終了後の[リンの終濃度(M)]×[マグネシウムの終濃度(M)]×[アンモニウムの終濃度(M)]の値を求めたところ、6.3×10−8〜3.2×10−7[mol/L]3であった。
【産業上の利用可能性】
【0076】
本発明の微生物燃料電池は従来の構成とは大差がないので構造が簡単で、発電の過程で二酸化炭素は発生するものの化石燃料に頼らないために炭素循環の流れを乱すことがない。また廃水処理に適用して電気エネルギーのみならず、廃水中に含まれるリンも同時に回収することができる。従って、電力を必要とする様々な用途に有用であるだけでなく、回収したリンを肥料等の農業分野へ利用することもできる。
【符号の説明】
【0077】
1,11,21 微生物燃料電池
2,12,22 生物反応槽
3,13,23 アノード
5,15,25 カソード
7 カーボンフェルト
【特許請求の範囲】
【請求項1】
一対の電極と、有機物等を含む廃水と、前記有機物を分解して電子を放出する細胞外電子伝達能を有する微生物とを備える微生物燃料電池において、
前記電極の負極上に前記微生物を含むバイオフィルムが形成されるとともに、
除去後の目標最終リン濃度をx[mol/L]、前記廃水中における初期のリン濃度をx+a[mol/L]、マグネシウム濃度y+a[mol/L]、アンモニア濃度z+a[mol/L]としたときに、1.0×10−8≦x×y×z≦1.0×10−3[mol/L]3を満たすことを特徴とする微生物燃料電池。
【請求項2】
前記微生物は、前記電極に電子を伝達するメディエータの添加を不要とする細菌を一種以上含むことを特徴とする請求項1に記載の微生物燃料電池。
【請求項3】
前記請求項1または2に記載のいずれかの微生物燃料電池を用いて、正極側にリン含有析出物を製造する方法。
【請求項4】
前記リン含有析出物が、リン酸マグネシウムアンモニウム30%以上含むことを特徴とする請求項3に記載の方法。
【請求項1】
一対の電極と、有機物等を含む廃水と、前記有機物を分解して電子を放出する細胞外電子伝達能を有する微生物とを備える微生物燃料電池において、
前記電極の負極上に前記微生物を含むバイオフィルムが形成されるとともに、
除去後の目標最終リン濃度をx[mol/L]、前記廃水中における初期のリン濃度をx+a[mol/L]、マグネシウム濃度y+a[mol/L]、アンモニア濃度z+a[mol/L]としたときに、1.0×10−8≦x×y×z≦1.0×10−3[mol/L]3を満たすことを特徴とする微生物燃料電池。
【請求項2】
前記微生物は、前記電極に電子を伝達するメディエータの添加を不要とする細菌を一種以上含むことを特徴とする請求項1に記載の微生物燃料電池。
【請求項3】
前記請求項1または2に記載のいずれかの微生物燃料電池を用いて、正極側にリン含有析出物を製造する方法。
【請求項4】
前記リン含有析出物が、リン酸マグネシウムアンモニウム30%以上含むことを特徴とする請求項3に記載の方法。
【図2】


【図1】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】




【図1】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【公開番号】特開2013−84597(P2013−84597A)
【公開日】平成25年5月9日(2013.5.9)
【国際特許分類】
【出願番号】特願2012−219612(P2012−219612)
【出願日】平成24年10月1日(2012.10.1)
【出願人】(304019399)国立大学法人岐阜大学 (289)
【Fターム(参考)】
【公開日】平成25年5月9日(2013.5.9)
【国際特許分類】
【出願日】平成24年10月1日(2012.10.1)
【出願人】(304019399)国立大学法人岐阜大学 (289)
【Fターム(参考)】
[ Back to top ]

