微生物等の検査方法及び検査装置
【課題】蛍光サイトメトリー法(蛍光イメージングサイトメトリー法及び蛍光フローサイトメトリー法)による微生物等の検査方法及び検査装置において、生微生物以外の蛍光を発するものによる擬陽性を容易に低減することが可能な微生物等の検査方法及び検査装置を提供する。
【解決手段】蛍光サイトメトリー法による微生物等の検査方法及び検査装置において、微生物等を蛍光色素で染色した後に、退色剤(抗酸化剤)を添加して、微生物等から遊離した蛍光色素を退色させる。微生物検査カセットを用いた蛍光フローサイトメトリー法による微生物等の検査方法及び検査装置においては、微生物等の染色を行う容器の下流に、微生物から遊離した蛍光色素を退色させる容器を備える。
【解決手段】蛍光サイトメトリー法による微生物等の検査方法及び検査装置において、微生物等を蛍光色素で染色した後に、退色剤(抗酸化剤)を添加して、微生物等から遊離した蛍光色素を退色させる。微生物検査カセットを用いた蛍光フローサイトメトリー法による微生物等の検査方法及び検査装置においては、微生物等の染色を行う容器の下流に、微生物から遊離した蛍光色素を退色させる容器を備える。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は微生物等の検査方法及び検査装置にかかり、特に、蛍光サイトメトリー法を用いた微生物等の検査方法及び検査装置に関する。
【背景技術】
【0002】
従来、生微生物数計測を行う微生物数測定装置には、蛍光サイトメトリー法を用いたものがある。蛍光サイトメトリー法には、蛍光イメージングサイトメトリー法と蛍光フローサイトメトリー法がある。
【0003】
蛍光イメージングサイトメトリー法は、フィルタ上に固定した検体を蛍光色素によって染色し、蛍光画像を取得して検体を一個ずつ直接計測する粒子計測方法である。蛍光イメージングサイトメトリー法としては、例えば、特許文献1に記載されたものがある。特許文献1では、微生物と微生物以外の物質(夾雑物)とを第一の試薬で蛍光染色した後、第二の試薬で夾雑物をマスク染色する方法が記載されている。
【0004】
また、蛍光フローサイトメトリー法は、蛍光色素によって染色した検体を含む流体が、小さな径の流路を通過するとき、検体を一個ずつ直接計測する粒子計測方法である。蛍光フローサイトメトリー法としては、例えば、特許文献2に記載されたものがある。特許文献2では、蛍光スペクトルが異なる二種類以上の生菌用蛍光色素により微生物を染色し、微生物から発せられる発光スペクトルが異なる蛍光を検出することにより微生物を計測している。
【先行技術文献】
【特許文献】
【0005】
【特許文献1】特開2006−340684号公報
【特許文献2】特開2011− 92104号公報
【発明の概要】
【発明が解決しようとする課題】
【0006】
蛍光サイトメトリー法において、生微生物数計測を正確に行うためには、生微生物以外の蛍光を発するものによる擬陽性を低減することが重要である。
【0007】
この擬陽性としては、脂肪、蛋白質などの夾雑物による擬陽性(夾雑物が非特異吸着により蛍光染色されて蛍光検出される場合)や、蛍光色素粒子による擬陽性(微生物の染色に使われなかった蛍光色素粒子が蛍光検出される場合。この場合、蛍光色素粒子が夾雑物であるとも言える。)がある。
【0008】
特許文献1では、第一の試薬で蛍光染色された夾雑物を第二の試薬でマスク染色し、夾雑物による擬陽性を低減している。しかし、夾雑物から遊離している第一の試薬の蛍光色素(粒子状の蛍光色素)による擬陽性が生じ、そのため、蛍光色素液の吸引除去が必須である。蛍光色素液の吸引除去は煩雑な作業となり、また、蛍光フローサイトメトリー法の場合には、蛍光色素液の吸引除去によりこの擬陽性を低減することは困難である。
【0009】
特許文献2では、複数の生菌用蛍光色素による多重染色によって、蛍光フローサイトメトリー法においても蛍光色素粒子の擬陽性を低減可能としている。しかし、特許文献2では、脂肪、蛋白質などの夾雑物に非特異吸着した蛍光色素による擬陽性について考慮されていない。
【0010】
本発明の目的は、生微生物以外の蛍光を発するものによる擬陽性を容易に低減することが可能な微生物等の検査方法及び検査装置を提供することにある。
【課題を解決するための手段】
【0011】
本発明は、蛍光サイトメトリー法(蛍光イメージングサイトメトリー法及び蛍光フローサイトメトリー法)による微生物等の検査方法及び検査装置において、微生物等を蛍光色素で染色した後に、退色剤を添加して、微生物等から遊離した蛍光色素を退色させることを特徴とする。
【0012】
退色剤としては、好ましくは、抗酸化剤(酸化防止剤)が用いられる。
【0013】
また、本発明は、微生物検査カセットを用いた蛍光フローサイトメトリー法による微生物等の検査方法及び検査装置においては、微生物等の染色を行う容器の下流に、微生物から遊離した蛍光色素を退色させる容器を備えることを特徴とする。
【発明の効果】
【0014】
蛍光サイトメトリー法において、夾雑物などの生微生物以外の蛍光を発するものによる擬陽性を容易に低減することが可能となり、生微生物数計測を正確に行うことが可能となる。
【図面の簡単な説明】
【0015】
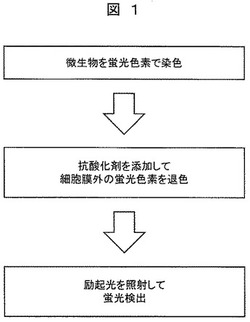
【図1】本発明の一実施例である微生物等の検査方法を示すフロー図である。
【図2】蛍光色素が抗酸化剤により退色する現象を示す図である。
【図3A】本発明を適用しない場合の微生物と微生物以外の夾雑物とが混在する検体の蛍光写真を示す図である。
【図3B】本発明の一実施例を適用した場合の微生物と微生物以外の夾雑物とが混在する検体の蛍光写真を示す図である。
【図4】本発明の一実施例である微生物等の検査装置の概略構成を示す図である。
【図5A】本発明の微生物等の検査装置に用いられる微生物検査カセットにおける微生物検出用流路を含む断面例を示す図である。
【図5B】本発明の微生物等の検査装置に用いられる微生物検査カセットにおける微生物検出用流路を含む分解構造例を示す図である。
【図6】本発明の微生物等の検査装置を用いた分析工程の一例を説明する図である。
【図7】本発明の微生物等の検査装置に用いられる微生物検査カセットの概略構成の一例を示す図である。
【図8】本発明の微生物等の検査装置に用いられる微生物検査カセットの概略構成の他の例を示す図である。
【図9】脂肪や蛋白質を豊富に含む食材について、擬陽性数の計数結果を示す図である。
【発明を実施するための形態】
【0016】
以下、図面を参照して、本発明の実施の形態を説明する。なお、後述する実施の形態は一例であって、各実施の形態同士の組み合わせ、公知又は周知の技術との組み合わせや置換による他の態様も可能である。
【0017】
なお、本発明は、微生物の検査の他に細胞の検査にも同様に適用可能であり、従って、本明細書及び特許請求の範囲において、「微生物等」とは「微生物及び/又は細胞」を意味する。そして、説明を簡単に説明するために、「微生物等」を単に「微生物」と表記する場合がある。また、本明細書及び特許請求の範囲において、「夾雑物」は微生物を検査する際の邪魔となる脂肪、蛋白質などの余計なものを意味する。
【0018】
(A)擬陽性の低減方法
図1に本発明の一実施例である微生物等の検査方法の手順(擬陽性の低減方法の手順)を示す。まず、食品を滅菌水に懸濁して作製した検体に蛍光色素を添加し、検体中の微生物を蛍光染色する。次に、微生物の染色後に検体へ退色剤である抗酸化剤(酸化防止剤)を添加して、微生物の細胞膜外の蛍光色素を退色する。最後に、検体に励起光を照射して、蛍光色素で染色された微生物の蛍光検出を行う。蛍光検出には、微生物の蛍光発光を画像取得して光点を計数する蛍光イメージングサイトメトリー法や、検体を細い流れにして微生物を載せて光点を計測する蛍光フローサイトメトリー法がある。
【0019】
図2に蛍光色素が抗酸化剤により退色する現象(色がだんだん薄くなる現象。色があせる現象。)を示す。図2は蛍光色素として全微生物用シアニン系青色蛍光色素を用い、抗酸化剤のL−アスコルビン酸を検体に対して0.05wt%添加したときの蛍光強度の時間変化を示している。抗酸化剤添加前の蛍光強度が100%とすると、図2より、抗酸化剤添加2分後では蛍光強度が57%に低下し、抗酸化剤添加10分後では蛍光強度が10%に低下し、抗酸化剤添加16分後では2%以下とほぼ蛍光強度が0となっているのが分かる。これにより、蛍光色素が抗酸化剤により退色しているのが分かる。
【0020】
なお、ここでの検体は蛍光色素の量に十分なDNAを添加した滅菌水を検体としている。また、蛍光色素の濃度は2μM(M:mol/L)とした。蛍光色素の量に対して抗酸化剤の量が少ないと、退色しきれずに擬陽性が多くなる。生菌を殺菌するくらい抗酸化剤の量が多いと、生菌が死菌になって擬陰性が多くなる。また、添加後の時間は、蛍光色素の量に対する抗酸化剤の量で変わる可能性がある。
【0021】
図3A及び図3Bに、微生物と微生物以外の夾雑物(脂肪や蛋白質など)とが混在する検体において、蛍光色素で染色して蛍光検出した場合(図3A)と、蛍光色素で染色した後に抗酸化剤を添加して蛍光検出した場合(図3B)を示す。検体はハムをストマッキングしたものに大腸菌を添加したものである。検体に蛍光色素として全微生物用シアニン系青色蛍光色素を終濃度2μMで添加したときの透過光画像が(1a)で、蛍光画像が(2a)である。検体に蛍光色素として全微生物用シアニン系青色蛍光色素を終濃度2μMで添加した後、抗酸化剤のL−アスコルビン酸を検体に対して0.1wt%添加したときの透過光画像が(1b)で、蛍光画像が(2b)である。蛍光色素で染色しただけの透過光画像(1a)にはハム由来の夾雑物311aと微生物である大腸菌321aが確認でき、蛍光画像(2a)の同じ場所にもハム由来の夾雑物312aと微生物である大腸菌322aが確認できる。一方、蛍光色素で染色した後、抗酸化剤を添加した透過光画像(1b)にはハム由来の夾雑物311bと微生物である大腸菌321bが確認できるが、蛍光画像(2b)では同じ場所に微生物である大腸菌322bは確認できるが、ハム由来の夾雑物312bは確認できない。これは、微生物を染色した蛍光色素は、微生物の細胞膜内に取り込まれているため、抗酸化剤の影響を受けずに蛍光発光し、夾雑物に非特異吸着した蛍光色素は、抗酸化剤の影響を受けて退色したことを示している。
【0022】
即ち、微生物や細胞は細胞膜(細胞壁)内に蛍光色素が入り込んで発光するのに対し、脂肪や蛋白質などでは表面に蛍光色素が吸着(非特異吸着)して発光するものと考えられる。退色液(抗酸化剤)は、細胞膜(細胞壁)を透過することが出来ないので、微生物や細胞を染色した蛍光色素は退色せず、脂肪や蛋白質に吸着している蛍光色素が退色することを本発明は利用している。言い換えれば、細胞膜(細胞壁)内に取り込まれていない蛍光色素を選択的に退色させるようにしたものである。光を照射することにより蛍光色素は退色するが、この場合、脂肪や蛋白質に吸着している蛍光色素は退色するが、細胞膜(細胞壁)内の蛍光色素も退色してしまい、従来、選択的に退色させるということは困難であった。本発明では、光照射というような一般的な退色とは異なる手法、即ち、退色剤(退色液)を添加することによって選択的に退色するようにしたものである。
【0023】
以上のように、微生物の染色後に検体へ退色剤(抗酸化剤)を添加して、微生物の細胞膜外の蛍光色素(脂肪や蛋白質に吸着している蛍光色素など)を退色することにより、擬陽性を低減出来ることが分かる。従って、本発明では、蛍光色素液の吸引除去が不要であり煩雑な作業を伴わない。
【0024】
なお、抗酸化剤としてL−アスコルビン酸を用いたが、抗酸化作用を有するものであれば、同様な効果が得られる。例えば、他の抗酸化剤としては、グルタチオン、N-アセチルシステイン、α-トコフェロール、ブチルヒドロキシアニソール、カテキン、クエルセチン、尿酸、ビリルビン、グルコース、フラボノイド セルロブラスミン、アルブミン、フェリチン、メタロチオネイン、スーパーオキシドディスムターゼ、グルタチオンペルオキシダーゼ、グルタチオントランスフェラーゼ、カタラーゼ、チオレドキシンがあり、L−アスコルビン酸と同様の効果があると考えられる。
【0025】
また、抗酸化剤の濃度が高いと微生物の細胞膜内の蛍光色素も退色することになるため、微生物を染色する蛍光色素の添加濃度と抗酸化剤の濃度を調整する必要がある。なお、抗酸化剤としてL−アスコルビン酸を用いた場合、L−アスコルビン酸の検体に対する終濃度の下限値は、0.01wt%で擬陽性が低減し、0.005wt%で擬陽性が低減しないことから0.01wt%が好ましい。また、上限値はアスコルビン酸の菌へのダメージから求め、2wt%で菌の生存率が10%以下になることから、上限値を1wt%が好ましい。尚、通常用いられる蛍光色素の濃度が2μM(M:mol/L)程度であり、上記範囲の抗酸化剤の濃度の場合、微生物の細胞膜内の蛍光色素を退色することはない。
【0026】
(B)微生物検査装置の全体構成例
図4に、本発明の一実施例に係る微生物検査装置1の構成図を示す。微生物検査装置1は、検体や試薬を内部に保持し、微生物計測に必要な工程を行うための機構を内部に備えた微生物検査カセット10と、微生物計測に必要な工程を行うために、微生物検査カセット10と連結したチップ連結管1441〜1444を介して、微生物検査カセット10内の検体や搬送を制御するための圧力供給装置14と、微生物検査カセット10を保持し、微生物検査カセット10の位置を調整するX−Y可動ステージ(ホルダー)125と、微生物検査カセット10内の微生物に励起光を照射し、微生物からの散乱光及び蛍光を電気信号に変換する検出装置11で構成されている。微生物検査装置1に連結したシステム装置18は、圧力供給装置14に対する制御信号の出力と、検出装置11から入力される電気信号に対する信号処理を実行する。なお、電気信号の処理により得られた計測結果は、システム装置18に接続された出力装置19に表示される。
【0027】
圧力供給装置14は、レギュレータ1411付のエアポンプ141を有する。エアポンプ141と微生物検査カセット10の各通気口1591〜1594(図7)は、チップ連結管1441〜1444によって接続されている。チップ連結管1441〜1444には、バルブ1421〜1424がそれぞれ設けられている。バルブ1421〜1424を開閉することにより、微生物検査カセット10の容器に所定の圧力の気体を供給し、又は、微生物検査カセット10の容器を大気開放する。この圧力の制御により、微生物検査カセット10内における検体や試薬の搬送を実現する。この圧力制御による微生物検査カセット10内における検体や試薬の搬送は、特開2008−157829号公報に詳述されている。
【0028】
微生物検査カセット10は、検体1511を保持するための検体容器151と、検体中の微生物の染色するための染色液(試薬液)1521を保持し、検体と染色液を混合して反応させる染色容器152と、検体と染色液を混合した混合液を退色させるための退色液1522を保持し、混合液に退色液を混合して反応させる退色容器155と、励起光源1111,1112より励起光113を照射し、微生物を観測するための微生物検出用流路173を内部に備えた微生物検出部17と、混合液と退色液を混合した検出液が微生物検出用流路173を通過して廃棄されるための検出液廃棄容器156と、検体容器151、染色容器152、退色容器155、微生物検出用流路173を連結し、検体1511や混合液や検出液が流動するための溶液用流路1571〜1574(図7)と、検体1511や混合液や検出液を気圧により流動させるため圧力供給装置14と各容器を接続する通気用流路1581〜1584(図7)とで構成されている。
【0029】
検出装置11は、励起光源1111、1112と、散乱光検出部と、蛍光検出部1201〜1203とで構成される。このうち、散乱光検出部は、微生物検出用流路173を通過する微生物からの散乱光124を検出するための散乱光検出器123と、励起光源112からの励起光113が散乱光検出器123に直接入射することを防ぐための遮光板122とから構成される。一方、蛍光検出部は、微生物検出用流路173を通過する微生物からの蛍光121を集光し、平行光にする対物レンズ114と、励起光113を微生物検出部17の方向に反射する一方で蛍光121は透過するダイクロイックミラー112と、平行光を集光させるための集光レンズ1181,1182と、迷光をカットするための空間フィルタとして用いるピンホール119と、蛍光121の一部波長を反射し、残りの波長を透過するダイクロックミラー1151,1152と、蛍光121の一部波長を通過するバンドパスフィルタ1171〜1173と、バンドパスフィルタ1171〜1173を通過した光を検出する光検出器1201〜1203とで構成される。なお、照射部及び検出部は、互いの焦点が重なるように配置され、測定時には微生物検出用流路173を焦点の位置に調整できるように構成されている。
【0030】
検出装置11は、励起光源1112から出力された励起光113を微生物検出用流路173に照射し、微生物検出用流路173から生じる散乱光の光量と微生物検出部17から生じる蛍光の光量をそれぞれ検出することにより、X−Yステージ125の可動位置と各光量との関係をプロファイルとして取得する。また、検出装置11は、取得されたプロファイルに基づいてX−Y可動ステージ125を可動制御し、微生物検査カセット10(具体的には、微生物検出用流路173)を検出に適した位置に合わせる。即ち、散乱光検出部で検出される散乱光の光量が最大となる微生物検出用流路の位置を励起光の光軸と一致させ、蛍光検出部で検出される蛍光量が最大となる微生物検出用流路の位置に励起光の焦点を一致させる。この位置合わせについては特開2010−256278号公報に詳述されている。位置合わせについては、他の方法、例えば、特開2009−281753号公報に記載の方法を用いても良い。この場合、微生物検査カセットに位置合わせ用試薬等の保持容器や溶液用流路、通気用流路等を設ける。
【0031】
なお、本実施例では励起光源は2つであるが、蛍光色素の種類に応じて励起光源の数量を変更する場合がある。また、本実施例では蛍光検出部は3つであるが、蛍光色素の種類に応じて蛍光検出部の数量を変更する場合がある。
【0032】
(C)微生物検査カセットの微生物検出部の構造例
図5A及び図5Bを用い、微生物検査カセット10のうち微生物検出部17の構造を説明する。図5Aは、微生物検査カセット10の本体15と微生物検出部17の接合部の断面図を示す。図5Bは、微生物検出部17の分解斜視図を示す。
【0033】
なお、本体15と微生物検出部17はそれぞれ別工程で作製され、それぞれを接合する。まず、微生物検出部17の製造方法を説明する。微生物検出部17はカバー部材171と流路部材172からなり、両者は共に薄い平板からなる。流路部材172には溝1731が形成されており、この溝1731の両端には貫通孔1741、1751が形成されている。溝1731が形成された面が張り合わせ面となるように、カバー部材171と流路部材172を張り合わせる。この貼り合わせにより微生物検出部17が形成される。流路部材172の溝1731とカバー部材171によって微生物検出用流路173が構成される。流路部材172の貫通孔1741、1751によって、微生物検出用流路入口174と微生物検出用流路出口175が構成される。
【0034】
一方、本体15に形成された退色容器−微生物検出用流路間流路1573は、その下端にて流路方向を変更し、本体15の表面に開口を形成している。同様に、微生物検出用流路−検出液廃棄容器間流路1574は、その上端にて流路方向を変更し、本体15の表面に開口を形成している。退色容器−微生物検出用流路間流路1573の開口は、微生物検出用流路入口174に接続され、微生物検出用流路−検出液廃棄容器間流路1574の開口は、微生物検出用流路出口175に接続されている。
【0035】
本体15には検出用窓枠部161が形成されている。検出用窓枠部161は、貫通孔、又は、貫通溝である。検出用窓枠部161は、退色容器−微生物検出用流路間流路1573の開口と微生物検出用流路−検出液廃棄容器間流路1574の開口の間に形成されている。製造された微生物検出部17は、前述したように、本体15に装着される。図5Aに示すように、本体15の検出用窓枠部161の上に微生物検出用流路173が配置されるように、微生物検出部17を装着する。
【0036】
本実施例の場合、微生物検出用流路173の背後に、本体15の貫通孔又は貫通溝である検出用窓枠部161が設けられる。従って、励起光113は、微生物検出部17のみを照射し、本体15を照射しない。このため、背景光の増加の原因となる本体15からの反射光や自家蛍光は発生しない。微生物検出用流路173を通過した励起光113が、本体15に照射されないためには、検出用窓枠部161を構成する貫通孔の断面は、励起光113の放射方向に沿って増加することが好ましい。
【0037】
カバー部材171の厚さは、例えば0.01μm〜1mmとする。流路部材172の厚さは、例えば0.01μm〜1mmとする。微生物検出用流路173の断面形状は、例えば正方形、長方形、台形に形成する。微生物検出用流路173の断面寸法は、大きいほど圧力損失は小さくなるが、微生物を一個ずつ流すためには小さいほうが良い。微生物検出用流路173の断面の一辺は、例えば1μm〜1mmが好ましく、長さは例えば0.01mm〜10mmが好ましい。微生物検出用流路173に照射する励起光113の光軸は、微生物検出用流路173の方向ベクトルに対して垂直になる。
【0038】
微生物検出部17を構成する材料について説明する。微生物検査カセット10はディスポーザブルである。すなわち、使用後、微生物検出部17は本体15と共に廃棄する。そのため、微生物検出部17に用いる材料は、安価でなければならない。微生物検出部17に用いる材料は、蛍光計測に好適なように、光学特性に優れている必要がある。すなわち、自家蛍光が低く、光透過性、面精度、屈折率などに優れていることが望ましい。微生物からの蛍光の検出を阻害しないためには、微生物検出部17自身が発生する自家蛍光量が、微生物からの蛍光量に比べて十分小さいことが好ましい。
【0039】
微生物検出部17の表面に、曲面、凹凸等が存在すると、表面における光の屈折、又は、乱反射により微生物計測用流路173に照射される励起光113の光量が変動する。そのため、検出される蛍光量も変動し、計測精度が低下する。そのため、微生物検出部17の表面は、所望の平面度を有する必要がある。微生物検出部17は、凹凸が0.1mm以下の平面度を有することが好ましい。
【0040】
このような条件を考慮すると、微生物検出部17に用いる材料には、ガラス、石英、ポリメタクリル酸メチルエステル(PMMA)、ポリジメチルシロキサン(PDMS)、シクロオレフィンポリマー(COP)、ポリエチレンテレフタラート、ポリカーボネイト等が考えられる。微生物検出部17は、これらの物質から選択された1種類以上の物質から形成される。
【0041】
カバー部材171は単なる平板であるが、流路部材172は平板に溝及び貫通孔を形成したものである。従って、流路部材172は、微細加工が容易で、且つ、加工費が安価な材料によって形成される。ガラス、及び、石英は、光学特性が優れているが、微細加工が容易でない。すなわち、微細加工を行うと、加工費が高くなる。
【0042】
そこで、この形態例の場合、カバー部材171をガラス又は石英によって構成し、流路部材172をポリメタクリル酸メチルエステル、ポリジメチルシロキサン、シクロオレフィンポリマー、ポリエチレンテレフタラート、ポリカーボネイトによって構成する。なお好ましくは、流路部材172をポリジメチルシロキサンによって構成する。この場合、カバー部材171と流路部材172の接合には、ポリジメチルシロキサンの自己接着性を利用する。
【0043】
微生物検出部17の自家蛍光量は、材料ばかりでなく、微生物検出部の厚さ寸法にも依存する。自家蛍光量を少なくするには、微生物検出部の厚さ寸法を小さくすれば良い。微生物検出部17の厚さが小さいほど、微生物検出部17から発生する自家蛍光量は少なくなる。しかしながら、カバー部材171及び流路部材172の厚さ寸法を小さくすると、製造が困難になり、平面度が悪化する。必要な平面度を保ち、微生物の蛍光の検出を阻害しないように自家蛍光量を抑制するには、これらの部品の厚さ寸法は、所定の範囲に制限するする必要がある。
【0044】
ガラス、石英、ポリジメチルシロキサンの自家蛍光量はほぼ同等である。そこで、カバー部材171をガラス又は石英によって製造する場合、その厚さは、例えば0.05mm以上1mm以下が好ましい。流路部材172を、ポリジメチルシロキサンによって製造する場合、その厚さは例えば0.1mm以上1mm以下が好ましい。
【0045】
また、カバー部材171及び流路部材172を、シクロオレフィンポリマー、ポリメタクリル酸メチルエステル、ポリエチレンテレフタラート、又は、ポリカーボネイトによって製造しても良い。この場合、ガラス、又は、石英によってカバー部材171を製造し、ポリジメチルシロキサンによって流路部材172を製造する場合より、単位体積当たりの自家蛍光量が約3倍以上増加する。そのため、カバー部材171及び流路部材172の厚さは例えば0.01mm以上0.3mm以下が好ましい。
【0046】
(C)計測方法(検査方法)例
以下、上述の微生物検査装置1を用いて、食品由来の検体中の生微生物数を計測する場合の実施例を説明する。図6に、微生物検査カセット10を用いた生微生物数計測の工程をフローチャートで示す。また、図7に、微生物検査カセット10の平面図を示す。
【0047】
最初に微生物検査カセット10の構成について説明する。微生物検査カセット10は、検体1511を保持するための検体容器151と、検体中の微生物の染色するための染色液(試薬液)1521を保持するための染色容器152と、退色液1522を保持するための退色容器155と、検体中に含まれる食品残渣を取り除くためのフィルタである食品残渣除去部160と、外部光源より励起光を照射し、微生物の蛍光を観測するための微生物検出用流路173と、微生物検出用流路173を通過した検出液を廃棄するための検出液廃棄容器156と、検体容器151、食品残渣除去部160、染色容器152、退色容器155、微生物検出用流路173を連結し、検体1511や混合液を流動させるための溶液用流路1571〜1574と、各容器内の検体1511や混合液を気圧により流動させるための通気口1591〜1594と、通気口1591〜1594と各容器を接続する通気用流路1581〜1584とを備える。
【0048】
溶液用流路1571〜1574、通気口1591〜1594及び通気用流路1581〜1584は連結する容器の名称から、検体容器−染色容器間流路1571、染色容器−退色容器間流路1572、退色容器−微生物検出用流路間流路1573、微生物検出用流路−検出液廃棄容器間流路1574、検体容器通気口1591、染色容器通気口1592、退色容器通気口1593、検出液廃棄容器通気口1594、検体容器通気流路1581、染色容器通気流路1582、退色容器通気流路1583、検出液廃棄容器通気流路1584とする。
【0049】
検体容器1511と、食品残渣除去部160と、染色容器152と、退色容器155と、微生物検出用流路173と、検出液廃棄容器156は、溶液用流路1571〜1574により直列に連結されている。
【0050】
微生物染色液1521は、微生物検査カセット10内に前もって封入されている。退色液1522は、微生物検査カセット10内に前もって封入されている。検体1511は、検査前に通気口1591から検体容器151に注入する(S901)。
【0051】
検体容器151の体積は、検体1511の体積より大きい。染色容器152の体積は、検体1511と微生物染色液1521の合計体積より大きい。退色容器155の体積は、検体1511と微生物染色液1521と退色液1522の合計体積より大きい。また、検体容器−染色容器間流路1571の最高点は、検体容器151中の検体1511の水位より高くなるように形成される。これと同様に、染色容器−退色容器間流路1572の最高点は、検体1511と微生物染色色素1521の混合液の水位より高くなるように形成される。さらに、退色容器−微生物検出用流路間流路1573の最高点は、検体1511、微生物染色色素1521、退色液1522からなる検出液の水位より高くなるように形成される。
【0052】
ここで使用した検体1511は、検査する食品に対し質量比9倍の滅菌水を加え、ストマッキング処理を行ったものである。
【0053】
微生物染色液は、死微生物(死菌)を染色するための死微生物(死菌)染色液が1種以上と全微生物(全菌)を染色するための全微生物(全菌)染色液が1種以上の混合液であり、死微生物染色液には、例えば、死微生物用シアニン系蛍光色素(終濃度:0.01μM〜10μM)、PI(プロピディウムイオダイド)(終濃度:0.1mg/ml〜20mg/ml)、EB(エチジウムイオダイド)(終濃度:0.1mg/ml〜20mg/ml)を使用し、全微生物染色液には、例えば、全微生物用シアニン系蛍光色素(終濃度:0.01μM〜10μM)、LDS751(終濃度:0.1mg/ml〜20mg/ml)、DAPI(4'、6−ヂアミジン−2'−フェニルインドール)(終濃度:0.1mg/ml〜20mg/ml)、HOECHST33258(終濃度:0.1mg/ml〜20mg/ml)、HOECHST34580(終濃度:0.1mg/ml〜20mg/ml)などを使用する。ここでは、死微生物染色液として死微生物用シアニン系橙蛍光色素を使用し、全微生物染色液として全微生物用シアニン系青蛍光色素とLDS751を使用する。色素溶媒にはDMSO(ジメチルスルオキシド)、エタノール類、水などを使用する。なお、終濃度の単位のMはmol/Lの意味である。また、終濃度は検体(生微生物の入っている液体)に対する濃度である。
【0054】
退色液の主成分は抗酸化剤から成り、溶媒としてDMSO(ジメチルスルオキシド)、エタノール類、水などを用いる。
【0055】
微生物検査カセット10を用いた生微生物数測定は、図6に示すように、微生物検査カセット10を微生物検査装置(分析装置)1にセットした状態で開始される(S902)。この測定工程は、微生物検査カセット10の位置合わせを行う位置合わせ工程(S907)と、検体から食品残渣を取り除いて検体中の微生物を染色した後に遊離した色素を退色する前処理工程(S903〜S906)と、生微生物数を実際に測定する計測工程(S908)とで構成される。
【0056】
位置合わせ工程(S907)と前処理工程(S903〜S906)は独立した工程であるため並列して行い、両工程が終了した段階で計測工程(S908)を行う。続いて、各工程における各液体の移動について説明する。
【0057】
前処理工程では、まず、検体1511が染色容器152に移動される(S903)。通気口1591を介して検体容器151に対して圧力供給装置14の圧力を加える。これにより、検体容器151内の気圧を上げる。同時に、染色容器通気口1592を介して染色容器152の内圧を大気圧に開放する。気圧差により、検体1511は、染色容器152に入り、微生物染色液1521と混合される。混合には、バブリングを使用する(S904)。検体1511中の死微生物は、死微生物染色液(ここでは死微生物用シアニン系橙色蛍光色素を使用する。)と全微生物染色液(ここでは全微生物用シアニン系青色蛍光色素とLDS751を使用する。)により染色され、一方、検体1511中の生微生物は全微生物染色液のみにより染色される。
【0058】
二液の混合液の水位は、染色容器152と退色容器155を連結する染色容器−退色容器間流路1572の最高点を越えず、さらに染色容器152中に入っている空気は、染色容器通気口1592を介して外部に放出される。染色容器152の気圧は大気圧と等しいため、二液の混合液は退色容器155に押し出されず、混合液を反応に必要な時間中、染色容器152に保持することができる。必要な時間は、例えば3〜60分である。
【0059】
このとき、混合液の退色容器155への流入を防ぐ目的で、各通気口1593〜1594に対して圧力供給装置14からの圧力を加え、検体容器151の気圧より低い範囲まで退色容器155と検出液廃液容器156の気圧を上げても良い。
【0060】
なお、染色中は、微生物検査カセット10の温度を一定に保つことにより、温度変化による染色の影響を小さくすることが望ましい。
【0061】
また、検体1511が食品残渣除去部160を経て、染色容器152へ流動する際に、検体1511中の食品残渣は、食品残渣除去部160により検体1511から取り除かれる。なお、夾雑物は食品残渣除去部で取り除かれない微生物(細胞)以外のものとなる。
【0062】
次に、検体1511、微生物染色液1521から成る混合液を、退色容器155に移動させる(S905)。通気口1592を介して染色容器152に対して圧力供給装置14の圧力を加える。これにより、染色容器152内の気圧を上げる。同時に、通気口1593を介して退色容器155の内圧を大気圧に開放する。気圧差により、混合液は、退色容器155に入り、退色液1522と混合される。混合には、バブリングを使用する(S906)。これにより、混合液中の夾雑物(脂肪や蛋白質など)に非特異吸着した全微生物染色液が退色することにより、擬陽性の低減が図られる。
【0063】
退色容器での保持時間は、9分〜20分としている。保持時間は、生菌と非特異吸着の蛍光強度の差を光検出器で認識するために要する時間で十分であり、非特異吸着した蛍光色素を完全に退色させる程の時間を掛けなくても良い。
【0064】
なお、この前処理工程と並行して、微生物検査カセット10の位置合わせが実行される。
【0065】
以上の動作が終了すると、検体1511と微生物染色液1521から成る検出液が微生物検出用流路173に移動され、検体中の生微生物が蛍光フローサイトメトリー法により計測される。(S908)。図4の場合、紙面垂直方向より、励起光113が照射される。このため、微生物を染色した色素からの蛍光と、微生物による散乱光が生じる。検出装置11は、生微生物については全微生物染色液の2色の蛍光を検出し、死微生物については全微生物染色液の2色と死微生物染色液の1色の蛍光を検出する。このため、生微生物と死微生物とを判別して計数することが可能になる。また、散乱光の光量は微生物の大きさにより変わるため、微生物の大きさの判別も可能になる。
【0066】
なお、染色液としては、全微生物染色液として1種としても良い。この場合、微生物検査装置は、1励起または2励起光源及び2蛍光検出となる。また、染色液は生菌だけを染める染色液もある。この場合、1励起光源、1蛍光検出となる。
【0067】
図8は微生物染色液と退色液を容器内に図7とは別の方法により保持する微生物検査カセットの図を示す。内部の各容器及び流路の構成は、前述の図7と同等である。染色容器152にはホルダー1521Hに保持されたガラス管1521Gを配置し、ガラス管1521G内に微生物染色液をガラス管内の毛細管現象で保持している。組み立て順は、ガラス管1521Gをホルダー1521Hに保持し、ガラス管1521Gに微生物染色試薬を充填し、ホルダー1521Hをカセットの染色容器152に挿入して完成となる。ガラス管1521Gの上端位置は染色容器152内の検体液の水位以下に配置することにより、検体液が染色容器152内に流入したときにガラス管は検体液の水面下に位置することになり、ガラス管内の毛細管現象が失われ、ガラス管内の微生物染色試薬が検体に染み出る。検体液中に染み出た微生物染色試薬はバブリングにより混合され、検体液中の微生物等を染色する。このように、ガラス管を検体液の水位以下に配置することにより、ガラス管内の微生物染色試薬を容易に検体内へ染み出すことが出来る。
【0068】
また、退色容器155にはホルダー1522Hに保持されたガラス管1522Gを配置し、ガラス管1522G内に退色液をガラス管内の毛細管現象で保持している。組み立て順は、ガラス管1522Gをホルダー1522Hに保持し、ガラス管1522Gに退色液を充填し、ホルダー1522Hをカセットの退色容器155に挿入して完成となる。ガラス管152Gの上端位置は退色容器155内の検体液(混合液)の水位以下に配置することにより、検体液と微生物染色試薬の混合液が退色容器155内に流入したときにガラス管は混合液の水面下に位置することになり、ガラス管内の毛細管現象が失われ、ガラス管内の退色液が検体液(混合液)に染み出る。混合液中に染み出た退色液はバブリングにより混合され、混合液中の夾雑物に非特異吸着した蛍光色素を退色する。このように、ガラス管を混合液の水位以下に配置することにより、ガラス管内の退色液を容易に混合液内へ染み出すことが出来る。
【0069】
なお、ガラス管は内径0.6mm、長さ8mmとしたが、内径0.1〜3mm、長さ1〜30mmとしても、同様の効果が得られる。
【0070】
なお、本実施例では検査カセットに微生物染色試薬と退色液を検査カセット組み立て時に内包した例であるが、検査カセットに微生物染色試薬と退色液を内包する場所が設けていれば、検査カセット組み立て時には微生物染色試薬と退色液を内包せず、検査直前に微生物染色試薬と退色液を手作業または自動機にて充填しても本実施例と同様の効果が得られる。
【0071】
また、本実施例では微生物染色試薬や退色液をガラス管に保持した例であるが、ガラス管の代わりに親水性海綿体構造でも同様の効果が得られる。特に、ガラス焼結体やメラミンスポンジが適している。
【0072】
図9に脂肪や蛋白質を豊富に含む食材について、擬陽性の計数した結果を示す。なお、食材に含まれる生微生物は培養法により計測すると100個/g以下である。
【0073】
同図に示した食材では、退色なしより退色ありの方が擬陽性数は百分の一〜一万分の一程度に低減されていることが分かる。
【0074】
なお、測定条件は、検査する食品に対し質量比9倍の滅菌水を加えたストマッキング処理を行い、必要に応じて遠心分離を行った後に、カセットへ検体を注入し、死微生物染色液(ここでは死微生物用シアニン系橙色蛍光色素を使用する。)と全微生物染色液(ここでは全微生物用シアニン系青色蛍光色素とLDS751を使用する。)を用いた。混合容器内での保持時間(反応時間=染色時間)は40分で、退色容器での保持時間(退色時間)は9分〜20分ある。
【0075】
また、抗酸化剤として、L−アスコルビン酸の代わりにN−アセチルシステインを終濃度0.02wt%としても同様の結果が得られる。
【0076】
また、上述の実施例では、蛍光サイトメトリー法として蛍光フローサイトメトリー法を用いているが、蛍光イメージングサイトメトリー法にも本発明は適用可能である。蛍光イメージングサイトメトリー法では、図3A、図3Bで示した方法に基づいて行われる。図3A、図3Bでは、ハムのストマッキング処理を行った検体で蛍光画像のイメージから擬陽性数を算出した結果、退色なしでは十万個/g、退色ありでは千個/gとなり、退色なしより退色ありの方が擬陽性数は百分の一程度に低減されていることが分かる。
【符号の説明】
【0077】
1…微生物検査装置、10…微生物検査カセット、11…検出装置、14…圧力供給装置、17…微生物検出部、18…システム装置、19…出力装置、1111…短波長励起光源、1112…長波長励起光源、1113…励起光合成用ダイクロイックミラー、112…ダイクロイックミラー、113…励起光、114…対物レンズ、119…ピンホール、120…光検出器、121…蛍光、124…散乱光、125…X−Y可動ステージ、141…エアポンプ、1411…レギュレータ、151…検体容器、1511…検体、152…染色容器、1521…微生物染色液、1521H…ホルダー、1521G…ガラス管、155…退色容器、1522…退色液、1522H…ホルダー、1522G…ガラス管、156…検出液廃棄容器、1571〜1574…溶液用流路、1581〜1584…通気用流路、161…検出用窓部、173…微生物検出用流路、1151…短波長蛍光分離用ダイクロイックミラー、1152…中波長蛍光分離用ダイクロイックミラー、1171…短波長バンドパスフィルタ、1172…中波長バンドパスフィルタ、1173…長波長バンドパスフィルタ、1181、1182…集光レンズ、1201…短波長用光検出器、1202…中波長用光検出器、1203…長波長用光検出器。
【技術分野】
【0001】
本発明は微生物等の検査方法及び検査装置にかかり、特に、蛍光サイトメトリー法を用いた微生物等の検査方法及び検査装置に関する。
【背景技術】
【0002】
従来、生微生物数計測を行う微生物数測定装置には、蛍光サイトメトリー法を用いたものがある。蛍光サイトメトリー法には、蛍光イメージングサイトメトリー法と蛍光フローサイトメトリー法がある。
【0003】
蛍光イメージングサイトメトリー法は、フィルタ上に固定した検体を蛍光色素によって染色し、蛍光画像を取得して検体を一個ずつ直接計測する粒子計測方法である。蛍光イメージングサイトメトリー法としては、例えば、特許文献1に記載されたものがある。特許文献1では、微生物と微生物以外の物質(夾雑物)とを第一の試薬で蛍光染色した後、第二の試薬で夾雑物をマスク染色する方法が記載されている。
【0004】
また、蛍光フローサイトメトリー法は、蛍光色素によって染色した検体を含む流体が、小さな径の流路を通過するとき、検体を一個ずつ直接計測する粒子計測方法である。蛍光フローサイトメトリー法としては、例えば、特許文献2に記載されたものがある。特許文献2では、蛍光スペクトルが異なる二種類以上の生菌用蛍光色素により微生物を染色し、微生物から発せられる発光スペクトルが異なる蛍光を検出することにより微生物を計測している。
【先行技術文献】
【特許文献】
【0005】
【特許文献1】特開2006−340684号公報
【特許文献2】特開2011− 92104号公報
【発明の概要】
【発明が解決しようとする課題】
【0006】
蛍光サイトメトリー法において、生微生物数計測を正確に行うためには、生微生物以外の蛍光を発するものによる擬陽性を低減することが重要である。
【0007】
この擬陽性としては、脂肪、蛋白質などの夾雑物による擬陽性(夾雑物が非特異吸着により蛍光染色されて蛍光検出される場合)や、蛍光色素粒子による擬陽性(微生物の染色に使われなかった蛍光色素粒子が蛍光検出される場合。この場合、蛍光色素粒子が夾雑物であるとも言える。)がある。
【0008】
特許文献1では、第一の試薬で蛍光染色された夾雑物を第二の試薬でマスク染色し、夾雑物による擬陽性を低減している。しかし、夾雑物から遊離している第一の試薬の蛍光色素(粒子状の蛍光色素)による擬陽性が生じ、そのため、蛍光色素液の吸引除去が必須である。蛍光色素液の吸引除去は煩雑な作業となり、また、蛍光フローサイトメトリー法の場合には、蛍光色素液の吸引除去によりこの擬陽性を低減することは困難である。
【0009】
特許文献2では、複数の生菌用蛍光色素による多重染色によって、蛍光フローサイトメトリー法においても蛍光色素粒子の擬陽性を低減可能としている。しかし、特許文献2では、脂肪、蛋白質などの夾雑物に非特異吸着した蛍光色素による擬陽性について考慮されていない。
【0010】
本発明の目的は、生微生物以外の蛍光を発するものによる擬陽性を容易に低減することが可能な微生物等の検査方法及び検査装置を提供することにある。
【課題を解決するための手段】
【0011】
本発明は、蛍光サイトメトリー法(蛍光イメージングサイトメトリー法及び蛍光フローサイトメトリー法)による微生物等の検査方法及び検査装置において、微生物等を蛍光色素で染色した後に、退色剤を添加して、微生物等から遊離した蛍光色素を退色させることを特徴とする。
【0012】
退色剤としては、好ましくは、抗酸化剤(酸化防止剤)が用いられる。
【0013】
また、本発明は、微生物検査カセットを用いた蛍光フローサイトメトリー法による微生物等の検査方法及び検査装置においては、微生物等の染色を行う容器の下流に、微生物から遊離した蛍光色素を退色させる容器を備えることを特徴とする。
【発明の効果】
【0014】
蛍光サイトメトリー法において、夾雑物などの生微生物以外の蛍光を発するものによる擬陽性を容易に低減することが可能となり、生微生物数計測を正確に行うことが可能となる。
【図面の簡単な説明】
【0015】
【図1】本発明の一実施例である微生物等の検査方法を示すフロー図である。
【図2】蛍光色素が抗酸化剤により退色する現象を示す図である。
【図3A】本発明を適用しない場合の微生物と微生物以外の夾雑物とが混在する検体の蛍光写真を示す図である。
【図3B】本発明の一実施例を適用した場合の微生物と微生物以外の夾雑物とが混在する検体の蛍光写真を示す図である。
【図4】本発明の一実施例である微生物等の検査装置の概略構成を示す図である。
【図5A】本発明の微生物等の検査装置に用いられる微生物検査カセットにおける微生物検出用流路を含む断面例を示す図である。
【図5B】本発明の微生物等の検査装置に用いられる微生物検査カセットにおける微生物検出用流路を含む分解構造例を示す図である。
【図6】本発明の微生物等の検査装置を用いた分析工程の一例を説明する図である。
【図7】本発明の微生物等の検査装置に用いられる微生物検査カセットの概略構成の一例を示す図である。
【図8】本発明の微生物等の検査装置に用いられる微生物検査カセットの概略構成の他の例を示す図である。
【図9】脂肪や蛋白質を豊富に含む食材について、擬陽性数の計数結果を示す図である。
【発明を実施するための形態】
【0016】
以下、図面を参照して、本発明の実施の形態を説明する。なお、後述する実施の形態は一例であって、各実施の形態同士の組み合わせ、公知又は周知の技術との組み合わせや置換による他の態様も可能である。
【0017】
なお、本発明は、微生物の検査の他に細胞の検査にも同様に適用可能であり、従って、本明細書及び特許請求の範囲において、「微生物等」とは「微生物及び/又は細胞」を意味する。そして、説明を簡単に説明するために、「微生物等」を単に「微生物」と表記する場合がある。また、本明細書及び特許請求の範囲において、「夾雑物」は微生物を検査する際の邪魔となる脂肪、蛋白質などの余計なものを意味する。
【0018】
(A)擬陽性の低減方法
図1に本発明の一実施例である微生物等の検査方法の手順(擬陽性の低減方法の手順)を示す。まず、食品を滅菌水に懸濁して作製した検体に蛍光色素を添加し、検体中の微生物を蛍光染色する。次に、微生物の染色後に検体へ退色剤である抗酸化剤(酸化防止剤)を添加して、微生物の細胞膜外の蛍光色素を退色する。最後に、検体に励起光を照射して、蛍光色素で染色された微生物の蛍光検出を行う。蛍光検出には、微生物の蛍光発光を画像取得して光点を計数する蛍光イメージングサイトメトリー法や、検体を細い流れにして微生物を載せて光点を計測する蛍光フローサイトメトリー法がある。
【0019】
図2に蛍光色素が抗酸化剤により退色する現象(色がだんだん薄くなる現象。色があせる現象。)を示す。図2は蛍光色素として全微生物用シアニン系青色蛍光色素を用い、抗酸化剤のL−アスコルビン酸を検体に対して0.05wt%添加したときの蛍光強度の時間変化を示している。抗酸化剤添加前の蛍光強度が100%とすると、図2より、抗酸化剤添加2分後では蛍光強度が57%に低下し、抗酸化剤添加10分後では蛍光強度が10%に低下し、抗酸化剤添加16分後では2%以下とほぼ蛍光強度が0となっているのが分かる。これにより、蛍光色素が抗酸化剤により退色しているのが分かる。
【0020】
なお、ここでの検体は蛍光色素の量に十分なDNAを添加した滅菌水を検体としている。また、蛍光色素の濃度は2μM(M:mol/L)とした。蛍光色素の量に対して抗酸化剤の量が少ないと、退色しきれずに擬陽性が多くなる。生菌を殺菌するくらい抗酸化剤の量が多いと、生菌が死菌になって擬陰性が多くなる。また、添加後の時間は、蛍光色素の量に対する抗酸化剤の量で変わる可能性がある。
【0021】
図3A及び図3Bに、微生物と微生物以外の夾雑物(脂肪や蛋白質など)とが混在する検体において、蛍光色素で染色して蛍光検出した場合(図3A)と、蛍光色素で染色した後に抗酸化剤を添加して蛍光検出した場合(図3B)を示す。検体はハムをストマッキングしたものに大腸菌を添加したものである。検体に蛍光色素として全微生物用シアニン系青色蛍光色素を終濃度2μMで添加したときの透過光画像が(1a)で、蛍光画像が(2a)である。検体に蛍光色素として全微生物用シアニン系青色蛍光色素を終濃度2μMで添加した後、抗酸化剤のL−アスコルビン酸を検体に対して0.1wt%添加したときの透過光画像が(1b)で、蛍光画像が(2b)である。蛍光色素で染色しただけの透過光画像(1a)にはハム由来の夾雑物311aと微生物である大腸菌321aが確認でき、蛍光画像(2a)の同じ場所にもハム由来の夾雑物312aと微生物である大腸菌322aが確認できる。一方、蛍光色素で染色した後、抗酸化剤を添加した透過光画像(1b)にはハム由来の夾雑物311bと微生物である大腸菌321bが確認できるが、蛍光画像(2b)では同じ場所に微生物である大腸菌322bは確認できるが、ハム由来の夾雑物312bは確認できない。これは、微生物を染色した蛍光色素は、微生物の細胞膜内に取り込まれているため、抗酸化剤の影響を受けずに蛍光発光し、夾雑物に非特異吸着した蛍光色素は、抗酸化剤の影響を受けて退色したことを示している。
【0022】
即ち、微生物や細胞は細胞膜(細胞壁)内に蛍光色素が入り込んで発光するのに対し、脂肪や蛋白質などでは表面に蛍光色素が吸着(非特異吸着)して発光するものと考えられる。退色液(抗酸化剤)は、細胞膜(細胞壁)を透過することが出来ないので、微生物や細胞を染色した蛍光色素は退色せず、脂肪や蛋白質に吸着している蛍光色素が退色することを本発明は利用している。言い換えれば、細胞膜(細胞壁)内に取り込まれていない蛍光色素を選択的に退色させるようにしたものである。光を照射することにより蛍光色素は退色するが、この場合、脂肪や蛋白質に吸着している蛍光色素は退色するが、細胞膜(細胞壁)内の蛍光色素も退色してしまい、従来、選択的に退色させるということは困難であった。本発明では、光照射というような一般的な退色とは異なる手法、即ち、退色剤(退色液)を添加することによって選択的に退色するようにしたものである。
【0023】
以上のように、微生物の染色後に検体へ退色剤(抗酸化剤)を添加して、微生物の細胞膜外の蛍光色素(脂肪や蛋白質に吸着している蛍光色素など)を退色することにより、擬陽性を低減出来ることが分かる。従って、本発明では、蛍光色素液の吸引除去が不要であり煩雑な作業を伴わない。
【0024】
なお、抗酸化剤としてL−アスコルビン酸を用いたが、抗酸化作用を有するものであれば、同様な効果が得られる。例えば、他の抗酸化剤としては、グルタチオン、N-アセチルシステイン、α-トコフェロール、ブチルヒドロキシアニソール、カテキン、クエルセチン、尿酸、ビリルビン、グルコース、フラボノイド セルロブラスミン、アルブミン、フェリチン、メタロチオネイン、スーパーオキシドディスムターゼ、グルタチオンペルオキシダーゼ、グルタチオントランスフェラーゼ、カタラーゼ、チオレドキシンがあり、L−アスコルビン酸と同様の効果があると考えられる。
【0025】
また、抗酸化剤の濃度が高いと微生物の細胞膜内の蛍光色素も退色することになるため、微生物を染色する蛍光色素の添加濃度と抗酸化剤の濃度を調整する必要がある。なお、抗酸化剤としてL−アスコルビン酸を用いた場合、L−アスコルビン酸の検体に対する終濃度の下限値は、0.01wt%で擬陽性が低減し、0.005wt%で擬陽性が低減しないことから0.01wt%が好ましい。また、上限値はアスコルビン酸の菌へのダメージから求め、2wt%で菌の生存率が10%以下になることから、上限値を1wt%が好ましい。尚、通常用いられる蛍光色素の濃度が2μM(M:mol/L)程度であり、上記範囲の抗酸化剤の濃度の場合、微生物の細胞膜内の蛍光色素を退色することはない。
【0026】
(B)微生物検査装置の全体構成例
図4に、本発明の一実施例に係る微生物検査装置1の構成図を示す。微生物検査装置1は、検体や試薬を内部に保持し、微生物計測に必要な工程を行うための機構を内部に備えた微生物検査カセット10と、微生物計測に必要な工程を行うために、微生物検査カセット10と連結したチップ連結管1441〜1444を介して、微生物検査カセット10内の検体や搬送を制御するための圧力供給装置14と、微生物検査カセット10を保持し、微生物検査カセット10の位置を調整するX−Y可動ステージ(ホルダー)125と、微生物検査カセット10内の微生物に励起光を照射し、微生物からの散乱光及び蛍光を電気信号に変換する検出装置11で構成されている。微生物検査装置1に連結したシステム装置18は、圧力供給装置14に対する制御信号の出力と、検出装置11から入力される電気信号に対する信号処理を実行する。なお、電気信号の処理により得られた計測結果は、システム装置18に接続された出力装置19に表示される。
【0027】
圧力供給装置14は、レギュレータ1411付のエアポンプ141を有する。エアポンプ141と微生物検査カセット10の各通気口1591〜1594(図7)は、チップ連結管1441〜1444によって接続されている。チップ連結管1441〜1444には、バルブ1421〜1424がそれぞれ設けられている。バルブ1421〜1424を開閉することにより、微生物検査カセット10の容器に所定の圧力の気体を供給し、又は、微生物検査カセット10の容器を大気開放する。この圧力の制御により、微生物検査カセット10内における検体や試薬の搬送を実現する。この圧力制御による微生物検査カセット10内における検体や試薬の搬送は、特開2008−157829号公報に詳述されている。
【0028】
微生物検査カセット10は、検体1511を保持するための検体容器151と、検体中の微生物の染色するための染色液(試薬液)1521を保持し、検体と染色液を混合して反応させる染色容器152と、検体と染色液を混合した混合液を退色させるための退色液1522を保持し、混合液に退色液を混合して反応させる退色容器155と、励起光源1111,1112より励起光113を照射し、微生物を観測するための微生物検出用流路173を内部に備えた微生物検出部17と、混合液と退色液を混合した検出液が微生物検出用流路173を通過して廃棄されるための検出液廃棄容器156と、検体容器151、染色容器152、退色容器155、微生物検出用流路173を連結し、検体1511や混合液や検出液が流動するための溶液用流路1571〜1574(図7)と、検体1511や混合液や検出液を気圧により流動させるため圧力供給装置14と各容器を接続する通気用流路1581〜1584(図7)とで構成されている。
【0029】
検出装置11は、励起光源1111、1112と、散乱光検出部と、蛍光検出部1201〜1203とで構成される。このうち、散乱光検出部は、微生物検出用流路173を通過する微生物からの散乱光124を検出するための散乱光検出器123と、励起光源112からの励起光113が散乱光検出器123に直接入射することを防ぐための遮光板122とから構成される。一方、蛍光検出部は、微生物検出用流路173を通過する微生物からの蛍光121を集光し、平行光にする対物レンズ114と、励起光113を微生物検出部17の方向に反射する一方で蛍光121は透過するダイクロイックミラー112と、平行光を集光させるための集光レンズ1181,1182と、迷光をカットするための空間フィルタとして用いるピンホール119と、蛍光121の一部波長を反射し、残りの波長を透過するダイクロックミラー1151,1152と、蛍光121の一部波長を通過するバンドパスフィルタ1171〜1173と、バンドパスフィルタ1171〜1173を通過した光を検出する光検出器1201〜1203とで構成される。なお、照射部及び検出部は、互いの焦点が重なるように配置され、測定時には微生物検出用流路173を焦点の位置に調整できるように構成されている。
【0030】
検出装置11は、励起光源1112から出力された励起光113を微生物検出用流路173に照射し、微生物検出用流路173から生じる散乱光の光量と微生物検出部17から生じる蛍光の光量をそれぞれ検出することにより、X−Yステージ125の可動位置と各光量との関係をプロファイルとして取得する。また、検出装置11は、取得されたプロファイルに基づいてX−Y可動ステージ125を可動制御し、微生物検査カセット10(具体的には、微生物検出用流路173)を検出に適した位置に合わせる。即ち、散乱光検出部で検出される散乱光の光量が最大となる微生物検出用流路の位置を励起光の光軸と一致させ、蛍光検出部で検出される蛍光量が最大となる微生物検出用流路の位置に励起光の焦点を一致させる。この位置合わせについては特開2010−256278号公報に詳述されている。位置合わせについては、他の方法、例えば、特開2009−281753号公報に記載の方法を用いても良い。この場合、微生物検査カセットに位置合わせ用試薬等の保持容器や溶液用流路、通気用流路等を設ける。
【0031】
なお、本実施例では励起光源は2つであるが、蛍光色素の種類に応じて励起光源の数量を変更する場合がある。また、本実施例では蛍光検出部は3つであるが、蛍光色素の種類に応じて蛍光検出部の数量を変更する場合がある。
【0032】
(C)微生物検査カセットの微生物検出部の構造例
図5A及び図5Bを用い、微生物検査カセット10のうち微生物検出部17の構造を説明する。図5Aは、微生物検査カセット10の本体15と微生物検出部17の接合部の断面図を示す。図5Bは、微生物検出部17の分解斜視図を示す。
【0033】
なお、本体15と微生物検出部17はそれぞれ別工程で作製され、それぞれを接合する。まず、微生物検出部17の製造方法を説明する。微生物検出部17はカバー部材171と流路部材172からなり、両者は共に薄い平板からなる。流路部材172には溝1731が形成されており、この溝1731の両端には貫通孔1741、1751が形成されている。溝1731が形成された面が張り合わせ面となるように、カバー部材171と流路部材172を張り合わせる。この貼り合わせにより微生物検出部17が形成される。流路部材172の溝1731とカバー部材171によって微生物検出用流路173が構成される。流路部材172の貫通孔1741、1751によって、微生物検出用流路入口174と微生物検出用流路出口175が構成される。
【0034】
一方、本体15に形成された退色容器−微生物検出用流路間流路1573は、その下端にて流路方向を変更し、本体15の表面に開口を形成している。同様に、微生物検出用流路−検出液廃棄容器間流路1574は、その上端にて流路方向を変更し、本体15の表面に開口を形成している。退色容器−微生物検出用流路間流路1573の開口は、微生物検出用流路入口174に接続され、微生物検出用流路−検出液廃棄容器間流路1574の開口は、微生物検出用流路出口175に接続されている。
【0035】
本体15には検出用窓枠部161が形成されている。検出用窓枠部161は、貫通孔、又は、貫通溝である。検出用窓枠部161は、退色容器−微生物検出用流路間流路1573の開口と微生物検出用流路−検出液廃棄容器間流路1574の開口の間に形成されている。製造された微生物検出部17は、前述したように、本体15に装着される。図5Aに示すように、本体15の検出用窓枠部161の上に微生物検出用流路173が配置されるように、微生物検出部17を装着する。
【0036】
本実施例の場合、微生物検出用流路173の背後に、本体15の貫通孔又は貫通溝である検出用窓枠部161が設けられる。従って、励起光113は、微生物検出部17のみを照射し、本体15を照射しない。このため、背景光の増加の原因となる本体15からの反射光や自家蛍光は発生しない。微生物検出用流路173を通過した励起光113が、本体15に照射されないためには、検出用窓枠部161を構成する貫通孔の断面は、励起光113の放射方向に沿って増加することが好ましい。
【0037】
カバー部材171の厚さは、例えば0.01μm〜1mmとする。流路部材172の厚さは、例えば0.01μm〜1mmとする。微生物検出用流路173の断面形状は、例えば正方形、長方形、台形に形成する。微生物検出用流路173の断面寸法は、大きいほど圧力損失は小さくなるが、微生物を一個ずつ流すためには小さいほうが良い。微生物検出用流路173の断面の一辺は、例えば1μm〜1mmが好ましく、長さは例えば0.01mm〜10mmが好ましい。微生物検出用流路173に照射する励起光113の光軸は、微生物検出用流路173の方向ベクトルに対して垂直になる。
【0038】
微生物検出部17を構成する材料について説明する。微生物検査カセット10はディスポーザブルである。すなわち、使用後、微生物検出部17は本体15と共に廃棄する。そのため、微生物検出部17に用いる材料は、安価でなければならない。微生物検出部17に用いる材料は、蛍光計測に好適なように、光学特性に優れている必要がある。すなわち、自家蛍光が低く、光透過性、面精度、屈折率などに優れていることが望ましい。微生物からの蛍光の検出を阻害しないためには、微生物検出部17自身が発生する自家蛍光量が、微生物からの蛍光量に比べて十分小さいことが好ましい。
【0039】
微生物検出部17の表面に、曲面、凹凸等が存在すると、表面における光の屈折、又は、乱反射により微生物計測用流路173に照射される励起光113の光量が変動する。そのため、検出される蛍光量も変動し、計測精度が低下する。そのため、微生物検出部17の表面は、所望の平面度を有する必要がある。微生物検出部17は、凹凸が0.1mm以下の平面度を有することが好ましい。
【0040】
このような条件を考慮すると、微生物検出部17に用いる材料には、ガラス、石英、ポリメタクリル酸メチルエステル(PMMA)、ポリジメチルシロキサン(PDMS)、シクロオレフィンポリマー(COP)、ポリエチレンテレフタラート、ポリカーボネイト等が考えられる。微生物検出部17は、これらの物質から選択された1種類以上の物質から形成される。
【0041】
カバー部材171は単なる平板であるが、流路部材172は平板に溝及び貫通孔を形成したものである。従って、流路部材172は、微細加工が容易で、且つ、加工費が安価な材料によって形成される。ガラス、及び、石英は、光学特性が優れているが、微細加工が容易でない。すなわち、微細加工を行うと、加工費が高くなる。
【0042】
そこで、この形態例の場合、カバー部材171をガラス又は石英によって構成し、流路部材172をポリメタクリル酸メチルエステル、ポリジメチルシロキサン、シクロオレフィンポリマー、ポリエチレンテレフタラート、ポリカーボネイトによって構成する。なお好ましくは、流路部材172をポリジメチルシロキサンによって構成する。この場合、カバー部材171と流路部材172の接合には、ポリジメチルシロキサンの自己接着性を利用する。
【0043】
微生物検出部17の自家蛍光量は、材料ばかりでなく、微生物検出部の厚さ寸法にも依存する。自家蛍光量を少なくするには、微生物検出部の厚さ寸法を小さくすれば良い。微生物検出部17の厚さが小さいほど、微生物検出部17から発生する自家蛍光量は少なくなる。しかしながら、カバー部材171及び流路部材172の厚さ寸法を小さくすると、製造が困難になり、平面度が悪化する。必要な平面度を保ち、微生物の蛍光の検出を阻害しないように自家蛍光量を抑制するには、これらの部品の厚さ寸法は、所定の範囲に制限するする必要がある。
【0044】
ガラス、石英、ポリジメチルシロキサンの自家蛍光量はほぼ同等である。そこで、カバー部材171をガラス又は石英によって製造する場合、その厚さは、例えば0.05mm以上1mm以下が好ましい。流路部材172を、ポリジメチルシロキサンによって製造する場合、その厚さは例えば0.1mm以上1mm以下が好ましい。
【0045】
また、カバー部材171及び流路部材172を、シクロオレフィンポリマー、ポリメタクリル酸メチルエステル、ポリエチレンテレフタラート、又は、ポリカーボネイトによって製造しても良い。この場合、ガラス、又は、石英によってカバー部材171を製造し、ポリジメチルシロキサンによって流路部材172を製造する場合より、単位体積当たりの自家蛍光量が約3倍以上増加する。そのため、カバー部材171及び流路部材172の厚さは例えば0.01mm以上0.3mm以下が好ましい。
【0046】
(C)計測方法(検査方法)例
以下、上述の微生物検査装置1を用いて、食品由来の検体中の生微生物数を計測する場合の実施例を説明する。図6に、微生物検査カセット10を用いた生微生物数計測の工程をフローチャートで示す。また、図7に、微生物検査カセット10の平面図を示す。
【0047】
最初に微生物検査カセット10の構成について説明する。微生物検査カセット10は、検体1511を保持するための検体容器151と、検体中の微生物の染色するための染色液(試薬液)1521を保持するための染色容器152と、退色液1522を保持するための退色容器155と、検体中に含まれる食品残渣を取り除くためのフィルタである食品残渣除去部160と、外部光源より励起光を照射し、微生物の蛍光を観測するための微生物検出用流路173と、微生物検出用流路173を通過した検出液を廃棄するための検出液廃棄容器156と、検体容器151、食品残渣除去部160、染色容器152、退色容器155、微生物検出用流路173を連結し、検体1511や混合液を流動させるための溶液用流路1571〜1574と、各容器内の検体1511や混合液を気圧により流動させるための通気口1591〜1594と、通気口1591〜1594と各容器を接続する通気用流路1581〜1584とを備える。
【0048】
溶液用流路1571〜1574、通気口1591〜1594及び通気用流路1581〜1584は連結する容器の名称から、検体容器−染色容器間流路1571、染色容器−退色容器間流路1572、退色容器−微生物検出用流路間流路1573、微生物検出用流路−検出液廃棄容器間流路1574、検体容器通気口1591、染色容器通気口1592、退色容器通気口1593、検出液廃棄容器通気口1594、検体容器通気流路1581、染色容器通気流路1582、退色容器通気流路1583、検出液廃棄容器通気流路1584とする。
【0049】
検体容器1511と、食品残渣除去部160と、染色容器152と、退色容器155と、微生物検出用流路173と、検出液廃棄容器156は、溶液用流路1571〜1574により直列に連結されている。
【0050】
微生物染色液1521は、微生物検査カセット10内に前もって封入されている。退色液1522は、微生物検査カセット10内に前もって封入されている。検体1511は、検査前に通気口1591から検体容器151に注入する(S901)。
【0051】
検体容器151の体積は、検体1511の体積より大きい。染色容器152の体積は、検体1511と微生物染色液1521の合計体積より大きい。退色容器155の体積は、検体1511と微生物染色液1521と退色液1522の合計体積より大きい。また、検体容器−染色容器間流路1571の最高点は、検体容器151中の検体1511の水位より高くなるように形成される。これと同様に、染色容器−退色容器間流路1572の最高点は、検体1511と微生物染色色素1521の混合液の水位より高くなるように形成される。さらに、退色容器−微生物検出用流路間流路1573の最高点は、検体1511、微生物染色色素1521、退色液1522からなる検出液の水位より高くなるように形成される。
【0052】
ここで使用した検体1511は、検査する食品に対し質量比9倍の滅菌水を加え、ストマッキング処理を行ったものである。
【0053】
微生物染色液は、死微生物(死菌)を染色するための死微生物(死菌)染色液が1種以上と全微生物(全菌)を染色するための全微生物(全菌)染色液が1種以上の混合液であり、死微生物染色液には、例えば、死微生物用シアニン系蛍光色素(終濃度:0.01μM〜10μM)、PI(プロピディウムイオダイド)(終濃度:0.1mg/ml〜20mg/ml)、EB(エチジウムイオダイド)(終濃度:0.1mg/ml〜20mg/ml)を使用し、全微生物染色液には、例えば、全微生物用シアニン系蛍光色素(終濃度:0.01μM〜10μM)、LDS751(終濃度:0.1mg/ml〜20mg/ml)、DAPI(4'、6−ヂアミジン−2'−フェニルインドール)(終濃度:0.1mg/ml〜20mg/ml)、HOECHST33258(終濃度:0.1mg/ml〜20mg/ml)、HOECHST34580(終濃度:0.1mg/ml〜20mg/ml)などを使用する。ここでは、死微生物染色液として死微生物用シアニン系橙蛍光色素を使用し、全微生物染色液として全微生物用シアニン系青蛍光色素とLDS751を使用する。色素溶媒にはDMSO(ジメチルスルオキシド)、エタノール類、水などを使用する。なお、終濃度の単位のMはmol/Lの意味である。また、終濃度は検体(生微生物の入っている液体)に対する濃度である。
【0054】
退色液の主成分は抗酸化剤から成り、溶媒としてDMSO(ジメチルスルオキシド)、エタノール類、水などを用いる。
【0055】
微生物検査カセット10を用いた生微生物数測定は、図6に示すように、微生物検査カセット10を微生物検査装置(分析装置)1にセットした状態で開始される(S902)。この測定工程は、微生物検査カセット10の位置合わせを行う位置合わせ工程(S907)と、検体から食品残渣を取り除いて検体中の微生物を染色した後に遊離した色素を退色する前処理工程(S903〜S906)と、生微生物数を実際に測定する計測工程(S908)とで構成される。
【0056】
位置合わせ工程(S907)と前処理工程(S903〜S906)は独立した工程であるため並列して行い、両工程が終了した段階で計測工程(S908)を行う。続いて、各工程における各液体の移動について説明する。
【0057】
前処理工程では、まず、検体1511が染色容器152に移動される(S903)。通気口1591を介して検体容器151に対して圧力供給装置14の圧力を加える。これにより、検体容器151内の気圧を上げる。同時に、染色容器通気口1592を介して染色容器152の内圧を大気圧に開放する。気圧差により、検体1511は、染色容器152に入り、微生物染色液1521と混合される。混合には、バブリングを使用する(S904)。検体1511中の死微生物は、死微生物染色液(ここでは死微生物用シアニン系橙色蛍光色素を使用する。)と全微生物染色液(ここでは全微生物用シアニン系青色蛍光色素とLDS751を使用する。)により染色され、一方、検体1511中の生微生物は全微生物染色液のみにより染色される。
【0058】
二液の混合液の水位は、染色容器152と退色容器155を連結する染色容器−退色容器間流路1572の最高点を越えず、さらに染色容器152中に入っている空気は、染色容器通気口1592を介して外部に放出される。染色容器152の気圧は大気圧と等しいため、二液の混合液は退色容器155に押し出されず、混合液を反応に必要な時間中、染色容器152に保持することができる。必要な時間は、例えば3〜60分である。
【0059】
このとき、混合液の退色容器155への流入を防ぐ目的で、各通気口1593〜1594に対して圧力供給装置14からの圧力を加え、検体容器151の気圧より低い範囲まで退色容器155と検出液廃液容器156の気圧を上げても良い。
【0060】
なお、染色中は、微生物検査カセット10の温度を一定に保つことにより、温度変化による染色の影響を小さくすることが望ましい。
【0061】
また、検体1511が食品残渣除去部160を経て、染色容器152へ流動する際に、検体1511中の食品残渣は、食品残渣除去部160により検体1511から取り除かれる。なお、夾雑物は食品残渣除去部で取り除かれない微生物(細胞)以外のものとなる。
【0062】
次に、検体1511、微生物染色液1521から成る混合液を、退色容器155に移動させる(S905)。通気口1592を介して染色容器152に対して圧力供給装置14の圧力を加える。これにより、染色容器152内の気圧を上げる。同時に、通気口1593を介して退色容器155の内圧を大気圧に開放する。気圧差により、混合液は、退色容器155に入り、退色液1522と混合される。混合には、バブリングを使用する(S906)。これにより、混合液中の夾雑物(脂肪や蛋白質など)に非特異吸着した全微生物染色液が退色することにより、擬陽性の低減が図られる。
【0063】
退色容器での保持時間は、9分〜20分としている。保持時間は、生菌と非特異吸着の蛍光強度の差を光検出器で認識するために要する時間で十分であり、非特異吸着した蛍光色素を完全に退色させる程の時間を掛けなくても良い。
【0064】
なお、この前処理工程と並行して、微生物検査カセット10の位置合わせが実行される。
【0065】
以上の動作が終了すると、検体1511と微生物染色液1521から成る検出液が微生物検出用流路173に移動され、検体中の生微生物が蛍光フローサイトメトリー法により計測される。(S908)。図4の場合、紙面垂直方向より、励起光113が照射される。このため、微生物を染色した色素からの蛍光と、微生物による散乱光が生じる。検出装置11は、生微生物については全微生物染色液の2色の蛍光を検出し、死微生物については全微生物染色液の2色と死微生物染色液の1色の蛍光を検出する。このため、生微生物と死微生物とを判別して計数することが可能になる。また、散乱光の光量は微生物の大きさにより変わるため、微生物の大きさの判別も可能になる。
【0066】
なお、染色液としては、全微生物染色液として1種としても良い。この場合、微生物検査装置は、1励起または2励起光源及び2蛍光検出となる。また、染色液は生菌だけを染める染色液もある。この場合、1励起光源、1蛍光検出となる。
【0067】
図8は微生物染色液と退色液を容器内に図7とは別の方法により保持する微生物検査カセットの図を示す。内部の各容器及び流路の構成は、前述の図7と同等である。染色容器152にはホルダー1521Hに保持されたガラス管1521Gを配置し、ガラス管1521G内に微生物染色液をガラス管内の毛細管現象で保持している。組み立て順は、ガラス管1521Gをホルダー1521Hに保持し、ガラス管1521Gに微生物染色試薬を充填し、ホルダー1521Hをカセットの染色容器152に挿入して完成となる。ガラス管1521Gの上端位置は染色容器152内の検体液の水位以下に配置することにより、検体液が染色容器152内に流入したときにガラス管は検体液の水面下に位置することになり、ガラス管内の毛細管現象が失われ、ガラス管内の微生物染色試薬が検体に染み出る。検体液中に染み出た微生物染色試薬はバブリングにより混合され、検体液中の微生物等を染色する。このように、ガラス管を検体液の水位以下に配置することにより、ガラス管内の微生物染色試薬を容易に検体内へ染み出すことが出来る。
【0068】
また、退色容器155にはホルダー1522Hに保持されたガラス管1522Gを配置し、ガラス管1522G内に退色液をガラス管内の毛細管現象で保持している。組み立て順は、ガラス管1522Gをホルダー1522Hに保持し、ガラス管1522Gに退色液を充填し、ホルダー1522Hをカセットの退色容器155に挿入して完成となる。ガラス管152Gの上端位置は退色容器155内の検体液(混合液)の水位以下に配置することにより、検体液と微生物染色試薬の混合液が退色容器155内に流入したときにガラス管は混合液の水面下に位置することになり、ガラス管内の毛細管現象が失われ、ガラス管内の退色液が検体液(混合液)に染み出る。混合液中に染み出た退色液はバブリングにより混合され、混合液中の夾雑物に非特異吸着した蛍光色素を退色する。このように、ガラス管を混合液の水位以下に配置することにより、ガラス管内の退色液を容易に混合液内へ染み出すことが出来る。
【0069】
なお、ガラス管は内径0.6mm、長さ8mmとしたが、内径0.1〜3mm、長さ1〜30mmとしても、同様の効果が得られる。
【0070】
なお、本実施例では検査カセットに微生物染色試薬と退色液を検査カセット組み立て時に内包した例であるが、検査カセットに微生物染色試薬と退色液を内包する場所が設けていれば、検査カセット組み立て時には微生物染色試薬と退色液を内包せず、検査直前に微生物染色試薬と退色液を手作業または自動機にて充填しても本実施例と同様の効果が得られる。
【0071】
また、本実施例では微生物染色試薬や退色液をガラス管に保持した例であるが、ガラス管の代わりに親水性海綿体構造でも同様の効果が得られる。特に、ガラス焼結体やメラミンスポンジが適している。
【0072】
図9に脂肪や蛋白質を豊富に含む食材について、擬陽性の計数した結果を示す。なお、食材に含まれる生微生物は培養法により計測すると100個/g以下である。
【0073】
同図に示した食材では、退色なしより退色ありの方が擬陽性数は百分の一〜一万分の一程度に低減されていることが分かる。
【0074】
なお、測定条件は、検査する食品に対し質量比9倍の滅菌水を加えたストマッキング処理を行い、必要に応じて遠心分離を行った後に、カセットへ検体を注入し、死微生物染色液(ここでは死微生物用シアニン系橙色蛍光色素を使用する。)と全微生物染色液(ここでは全微生物用シアニン系青色蛍光色素とLDS751を使用する。)を用いた。混合容器内での保持時間(反応時間=染色時間)は40分で、退色容器での保持時間(退色時間)は9分〜20分ある。
【0075】
また、抗酸化剤として、L−アスコルビン酸の代わりにN−アセチルシステインを終濃度0.02wt%としても同様の結果が得られる。
【0076】
また、上述の実施例では、蛍光サイトメトリー法として蛍光フローサイトメトリー法を用いているが、蛍光イメージングサイトメトリー法にも本発明は適用可能である。蛍光イメージングサイトメトリー法では、図3A、図3Bで示した方法に基づいて行われる。図3A、図3Bでは、ハムのストマッキング処理を行った検体で蛍光画像のイメージから擬陽性数を算出した結果、退色なしでは十万個/g、退色ありでは千個/gとなり、退色なしより退色ありの方が擬陽性数は百分の一程度に低減されていることが分かる。
【符号の説明】
【0077】
1…微生物検査装置、10…微生物検査カセット、11…検出装置、14…圧力供給装置、17…微生物検出部、18…システム装置、19…出力装置、1111…短波長励起光源、1112…長波長励起光源、1113…励起光合成用ダイクロイックミラー、112…ダイクロイックミラー、113…励起光、114…対物レンズ、119…ピンホール、120…光検出器、121…蛍光、124…散乱光、125…X−Y可動ステージ、141…エアポンプ、1411…レギュレータ、151…検体容器、1511…検体、152…染色容器、1521…微生物染色液、1521H…ホルダー、1521G…ガラス管、155…退色容器、1522…退色液、1522H…ホルダー、1522G…ガラス管、156…検出液廃棄容器、1571〜1574…溶液用流路、1581〜1584…通気用流路、161…検出用窓部、173…微生物検出用流路、1151…短波長蛍光分離用ダイクロイックミラー、1152…中波長蛍光分離用ダイクロイックミラー、1171…短波長バンドパスフィルタ、1172…中波長バンドパスフィルタ、1173…長波長バンドパスフィルタ、1181、1182…集光レンズ、1201…短波長用光検出器、1202…中波長用光検出器、1203…長波長用光検出器。
【特許請求の範囲】
【請求項1】
検体液中の微生物を蛍光色素で染色し、励起光を照射して蛍光を検出することにより微生物等を計数する微生物等の検査方法において、微生物を蛍光色素で染色した後に、退色剤を添加し、励起光を照射して微生物等を計数することを特徴とする微生物等の検査方法。
【請求項2】
前記退色剤は抗酸化剤であることを特徴とする請求項1記載の微生物等の検査方法。
【請求項3】
前記抗酸化剤はL−アスコルビン酸であることを特徴とする請求項2記載の微生物等の検査方法。
【請求項4】
前記抗酸化剤の前記検体液に対する終濃度が、0.01wt%〜1wt%であることを特徴とする請求項3記載の微生物等の検査方法。
【請求項5】
微生物を含む検体液が保持される検体容器、前記検体液と前記微生物を蛍光染色する染色液とが混合されて保持される染色容器、前記染色容器の混合液と退色液とが混合され保持される退色容器、微生物検出用流路、前記検体容器と前記染色容器、前記染色容器と前記退色容器、及び前記退色容器と前記微生物検出用流路をそれぞれ接続する流路を備えた微生物検査カセットと、
前記微生物検査カセットが装着され、前記微生物検査カセットを移動させるステージと、
前記微生物検査カセットと接続され、前記検体液を前記検体容器から前記染色容器に搬送し、前記染色容器から混合液を前記退色容器に搬送し、前記退色容器から混合液を検出液として前記微生物検出用流路に搬送する圧力を供給する圧力供給装置と、
前記微生物検出用流路に励起光を照射する光源、前記微生物検出用流路を流れる検出液からの蛍光を検出して電気信号に変換する光検出器を有する検出装置と、を有することを特徴とする微生物等の検査装置。
【請求項6】
前記微生物検査カセットは、前記退色容器内に退色液を保持していることを特徴とする請求項5記載の微生物等の検査装置。
【請求項7】
前記微生物検査カセットは、前記退色液が前記退色容器内の混合液の水位よりも下に位置するように保持されていることを特徴とする請求項5記載の微生物等の検査装置。
【請求項8】
前記微生物検査カセットは、前記退色液が前記退色容器内のガラス管内に保持されていることを特徴とする請求項5記載の微生物等の検査装置。
【請求項9】
染色液と混合した検体液に励起光を照射して検体液に含まれる微生物を電気信号として検出する微生物等の検査装置に用いられる微生物検査チップであって、
検体液が保持される検体容器と、
染色液を保持している染色容器と、
退色液を保持している退色容器と、
前記励起光が照射される微生物検出用流路と、
前記検体容器と前記染色容器、前記染色容器と前記退色容器及び前記退色容器と前記微生物検出用流路をそれぞれ接続する流路とを備えたことを特徴とする微生物検査チップ。
【請求項1】
検体液中の微生物を蛍光色素で染色し、励起光を照射して蛍光を検出することにより微生物等を計数する微生物等の検査方法において、微生物を蛍光色素で染色した後に、退色剤を添加し、励起光を照射して微生物等を計数することを特徴とする微生物等の検査方法。
【請求項2】
前記退色剤は抗酸化剤であることを特徴とする請求項1記載の微生物等の検査方法。
【請求項3】
前記抗酸化剤はL−アスコルビン酸であることを特徴とする請求項2記載の微生物等の検査方法。
【請求項4】
前記抗酸化剤の前記検体液に対する終濃度が、0.01wt%〜1wt%であることを特徴とする請求項3記載の微生物等の検査方法。
【請求項5】
微生物を含む検体液が保持される検体容器、前記検体液と前記微生物を蛍光染色する染色液とが混合されて保持される染色容器、前記染色容器の混合液と退色液とが混合され保持される退色容器、微生物検出用流路、前記検体容器と前記染色容器、前記染色容器と前記退色容器、及び前記退色容器と前記微生物検出用流路をそれぞれ接続する流路を備えた微生物検査カセットと、
前記微生物検査カセットが装着され、前記微生物検査カセットを移動させるステージと、
前記微生物検査カセットと接続され、前記検体液を前記検体容器から前記染色容器に搬送し、前記染色容器から混合液を前記退色容器に搬送し、前記退色容器から混合液を検出液として前記微生物検出用流路に搬送する圧力を供給する圧力供給装置と、
前記微生物検出用流路に励起光を照射する光源、前記微生物検出用流路を流れる検出液からの蛍光を検出して電気信号に変換する光検出器を有する検出装置と、を有することを特徴とする微生物等の検査装置。
【請求項6】
前記微生物検査カセットは、前記退色容器内に退色液を保持していることを特徴とする請求項5記載の微生物等の検査装置。
【請求項7】
前記微生物検査カセットは、前記退色液が前記退色容器内の混合液の水位よりも下に位置するように保持されていることを特徴とする請求項5記載の微生物等の検査装置。
【請求項8】
前記微生物検査カセットは、前記退色液が前記退色容器内のガラス管内に保持されていることを特徴とする請求項5記載の微生物等の検査装置。
【請求項9】
染色液と混合した検体液に励起光を照射して検体液に含まれる微生物を電気信号として検出する微生物等の検査装置に用いられる微生物検査チップであって、
検体液が保持される検体容器と、
染色液を保持している染色容器と、
退色液を保持している退色容器と、
前記励起光が照射される微生物検出用流路と、
前記検体容器と前記染色容器、前記染色容器と前記退色容器及び前記退色容器と前記微生物検出用流路をそれぞれ接続する流路とを備えたことを特徴とする微生物検査チップ。
【図1】


【図2】


【図3A】


【図3B】


【図4】


【図5A】


【図5B】


【図6】


【図7】


【図8】


【図9】




【図2】


【図3A】


【図3B】


【図4】


【図5A】


【図5B】


【図6】


【図7】


【図8】


【図9】


【公開番号】特開2013−46576(P2013−46576A)
【公開日】平成25年3月7日(2013.3.7)
【国際特許分類】
【出願番号】特願2011−185582(P2011−185582)
【出願日】平成23年8月29日(2011.8.29)
【出願人】(000233044)株式会社日立エンジニアリング・アンド・サービス (276)
【Fターム(参考)】
【公開日】平成25年3月7日(2013.3.7)
【国際特許分類】
【出願日】平成23年8月29日(2011.8.29)
【出願人】(000233044)株式会社日立エンジニアリング・アンド・サービス (276)
【Fターム(参考)】
[ Back to top ]

