微生物細胞内のエネルギー物質の生産制御方法
【課題】微生物細胞内におけるATP、NADH及びNADPHの単位時間当たりの生産量を高める。
【解決手段】培養対象微生物を含む培養環境の電位を培養対象微生物の至適電位に制御するとともに、至適電位の制御を少なくとも培養開始時から至適電位における培養対象微生物の対数増殖期開始時までの期間において行い、培養対象微生物の細胞内におけるアデノシン三リン酸(ATP)とニコチンアミドアデニンジヌクレオチド(NADH)とニコチンアミドアデニンジヌクレオチドリン酸(NADPH)の単位時間当たりの生産量を向上させるようにした。
【解決手段】培養対象微生物を含む培養環境の電位を培養対象微生物の至適電位に制御するとともに、至適電位の制御を少なくとも培養開始時から至適電位における培養対象微生物の対数増殖期開始時までの期間において行い、培養対象微生物の細胞内におけるアデノシン三リン酸(ATP)とニコチンアミドアデニンジヌクレオチド(NADH)とニコチンアミドアデニンジヌクレオチドリン酸(NADPH)の単位時間当たりの生産量を向上させるようにした。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、微生物細胞内のエネルギー物質の生産制御方法に関する。さらに詳述すると、本発明は、微生物体の反応素過程において必ず使用されるエネルギー物質であるアデノシン三リン酸(ATP)と生物細胞内の酸化還元酵素に関わり且つ細胞内で最も多い補酵素であるニコチンアミドアデニンジヌクレオチド(NADH)及びニコチンアミドアデニンジヌクレオチドリン酸(NADPH)について、これらの単位時間当たりの生産量を向上させる方法に関する。
【背景技術】
【0002】
現在様々な分野で利用されている微生物は自然界に存在する全微生物の僅か1%に満たないと言われている。そこで、残り99%の膨大な微生物資源を有効利用すべく、新たな概念に基づいて微生物の培養技術が各種開発されつつある。
【0003】
例えば、特許文献1には、培養対象微生物によって還元された物質を電気的に酸化し再生させ、これを継続して培養対象微生物に供給することにより培養対象微生物を選択的に培養する方法が開示されている。具体的には、六価クロムを溶解させてクロム還元菌以外の雑多な微生物にとって増殖し難い環境とした培養液中で、六価クロムに対して還元活性を有するShewanella、Pseudomonas、Sulfate reducing bacteria、Arthrobacter、Bacillus、Aerococcus、Micrococcus、Aeromonas、Thermoanaerobacter、Cellulomonas、Geobacter、Streptomyces、Escherichia、Enterobacter等のクロム還元菌を選択的に集積培養し、その際に、培養液中に流した電気により、クロム還元菌によって還元されて生成された三価クロムを酸化して六価クロムに再生しながら培養を行うようにしている。
【先行技術文献】
【特許文献】
【0004】
【特許文献1】特開2006−55134号公報
【発明の概要】
【発明が解決しようとする課題】
【0005】
しかしながら、特許文献1に記載の培養方法は、培養対象微生物の生育に必要な物質が還元されて減少するような状況下になければ適用しても効果が得られない。また、培養開始からある一定期間は培養対象微生物の生育に必要な物質が十分に存在している状態であることから、培養開始からある程度の培養期間が経過してその物質の量が大きく減少し始めるまでは微生物の十分な増殖効果は得られない。
【0006】
ところで、微生物の生育や代謝といった機能は、アデノシン三リン酸(以下、単にATPと呼ぶこともある)により支えられていることが知られている。即ち、ATPは微生物体の反応素過程において必ず使用されるエネルギー物質である。また、ニコチンアミドアデニンジヌクレオチド(以下、単にNADHと呼ぶこともある)及びニコチンアミドアデニンジヌクレオチドリン酸(以下、単にNADPHと呼ぶこともある)は微生物細胞内の酸化還元酵素に関わる細胞内で最も多い補酵素であり、1分子のNADHまたはNADPHから3分子のATPが酸化的リン酸反応により合成されることも知られている。
【0007】
このように、ATP、NADH及びNADPHは、微生物の生育や代謝を担う極めて重要なエネルギー物質である。したがって、これらのエネルギー物質の微生物細胞内の単位時間当たりの生産量を高めることができれば、微生物全般に対し、その生育の活性化や機能の向上が図れるものと考えられる。
【0008】
そこで、本発明は、微生物細胞内におけるATP、NADH及びNADPHの単位時間当たりの生産量を高めることのできる方法を提供することを目的とする。
【課題を解決するための手段】
【0009】
かかる課題を解決するため、本願発明者等は硫酸還元菌を培養対象微生物として各種検討を積み重ねた。その結果、硫酸還元菌を培養する際の培養環境の電位を硫酸還元菌の至適電位に制御するとともに、至適電位の制御を少なくとも培養開始時から至適電位における硫酸還元菌の対数増殖期開始時までの期間において行うことによって、硫酸還元菌の細胞内におけるATP、NADH及びNADPHの単位時間当たりの生産量を向上できることを知見するに至った。そしてこの結果から、微生物全般について、微生物細胞内におけるATP、NADH及びNADPHの単位時間当たりの生産量を向上できる可能性が導かれ、本願発明を完成するに至った。
【0010】
即ち、請求項1に記載の微生物細胞内におけるエネルギー物質の生産制御方法は、培養対象微生物を含む培養環境の電位を培養対象微生物の至適電位に制御するとともに、至適電位の制御を少なくとも培養開始時から至適電位における培養対象微生物の対数増殖期開始時までの期間において行い、培養対象微生物の細胞内におけるアデノシン三リン酸(ATP)とニコチンアミドアデニンジヌクレオチド(NADH)とニコチンアミドアデニンジヌクレオチドリン酸(NADPH)の単位時間当たりの生産量を向上させるようにしている。
【0011】
ここで、請求項2に記載の微生物細胞内におけるエネルギー物質の生産制御方法のように、至適電位の制御を培養開始時から至適電位における培養対象微生物の対数増殖期中点までの期間において行うことが好ましい。この場合には、培養対象微生物の細胞内におけるアデノシン三リン酸(ATP)とニコチンアミドアデニンジヌクレオチド(NADH)とニコチンアミドアデニンジヌクレオチドリン酸(NADPH)の単位時間当たりの生産量をより確実に向上させることができる。
【0012】
尚、本明細書において、至適電位における培養対象微生物の対数増殖期中点までの期間とは、至適電位において培養対象微生物を培養したときの最終到達菌体密度と初期菌体密度(培養環境に植菌された菌体の密度)の差を2で割ることにより算出される菌体密度に到達するまでに必要な培養期間を意味している。
【0013】
次に、請求項3に記載の微生物細胞内におけるエネルギー物質の生産制御方法は、硫酸還元菌を含む培養環境の電位を銀・塩化銀電極電位基準で−0.6V以下に制御するとともに、電位の制御を少なくとも培養開始時からこの電位における硫酸還元菌の対数増殖期開始時までの期間において行い、硫酸還元菌の細胞内におけるアデノシン三リン酸(ATP)とニコチンアミドアデニンジヌクレオチド(NADH)とニコチンアミドアデニンジヌクレオチドリン酸(NADPH)の単位時間当たりの生産量を向上させるようにしている。
【0014】
ここで、請求項4に記載の微生物細胞内におけるエネルギー物質の生産制御方法のように、電位の制御を培養開始時からこの電位における硫酸還元菌の対数増殖期中点までの期間において行うことが好ましい。この場合には、硫酸還元菌の細胞内におけるアデノシン三リン酸(ATP)とニコチンアミドアデニンジヌクレオチド(NADH)とニコチンアミドアデニンジヌクレオチドリン酸(NADPH)の単位時間当たりの生産量をより確実に向上させることができる。
【0015】
次に、請求項5に記載の微生物細胞内におけるエネルギー物質の生産制御方法は、硫酸還元菌を含む培養環境の電位を銀・塩化銀電極電位基準で−0.7Vに制御するとともに、電位の制御を少なくとも培養開始時から24時間行い、硫酸還元菌の細胞内におけるアデノシン三リン酸(ATP)とニコチンアミドアデニンジヌクレオチド(NADH)とニコチンアミドアデニンジヌクレオチドリン酸(NADPH)の単位時間当たりの生産量を向上させるようにしている。
【0016】
ここで、請求項6に記載の微生物細胞内におけるエネルギー物質の生産制御方法のように、電位の制御を培養開始時から35時間行うことが好ましい。この場合には、硫酸還元菌の細胞内におけるアデノシン三リン酸(ATP)とニコチンアミドアデニンジヌクレオチド(NADH)とニコチンアミドアデニンジヌクレオチドリン酸(NADPH)の単位時間当たりの生産量をより確実に向上させることができる。
【発明の効果】
【0017】
請求項1及び請求項2に記載の発明によれば、微生物の生育や代謝を担う極めて重要なエネルギー物質であるATP、NADH及びNADPHの単位時間当たりの生産量を向上させることができる。したがって、微生物全般に対して、増殖速度の向上と微生物の機能の向上を図ることができる。
【0018】
請求項3〜請求項6に記載の発明によれば、硫酸還元菌の生育や代謝を担う極めて重要なエネルギー物質であるATP、NADH及びNADPHの単位時間当たりの生産量を向上させることができる。したがって、硫酸還元菌の増殖速度の向上と硫酸還元能の向上を図ることができる。
【図面の簡単な説明】
【0019】
【図1】本発明の方法の実施に使用する装置の構成の一例を示す断面図である。
【図2】本発明の方法の実施に使用する装置の構成の他の例を示す断面図である。
【図3】本発明の方法の実施に使用する装置の構成のさらに他の例を示す断面図である。
【図4】図3に示す装置のより具体的な構成を示す断面図である。
【図5】硫酸還元菌の増殖とATP濃度の経時変化を示す図である。
【図6】硫酸還元菌の細胞1個体当たりのATP生産量の経時変化を示す図である。
【図7】対数増殖期初期と対数増殖期中点における通電の有無によるAEC値の差異を示す図である。
【図8】対数増殖期初期と対数増殖期中点における通電の有無によるNAD+及びNADHの濃度の差異を示す図である。
【図9】対数増殖期初期と対数増殖期中点における通電の有無によるNADP+及びNADPHの濃度の差異を示す図である。
【図10】実施例において定量対象とした遺伝子の硫酸還元菌体内での機能を示す模式図である。
【図11】対数増殖期初期と対数増殖期中点における通電の有無による遺伝子転写量の解析結果を示す図である。
【図12】通電の有無による乳酸分解速度の違いを示す図である。
【図13】通電の有無による硫酸還元速度の違いを示す図である。
【発明を実施するための形態】
【0020】
以下、本発明を実施するための形態について、図面に基づいて詳細に説明する。
【0021】
本発明の微生物細胞内のエネルギー物質の生産制御方法の実施形態の一例として微生物培養装置1を用いた場合について図1に基づいて説明する。本発明の微生物細胞内のエネルギー物質の生産制御方法は、培養対象微生物2を含む培養環境4に電極を浸漬し、この電極に電位を印加して培養環境4の電位を培養対象微生物2の至適電位に制御し、至適電位の制御を少なくとも培養開始時から至適電位における培養対象微生物2の対数増殖期開始時までの期間において行うようにしている。これにより、培養対象微生物2の細胞内におけるアデノシン三リン酸(ATP)とニコチンアミドアデニンジヌクレオチド(NADH)とニコチンアミドアデニンジヌクレオチドリン酸(NADPH)の単位時間当たりの生産量を向上させることができる。
【0022】
図1において、培養容器5はイオン交換膜6によって培養槽7と対極槽8とに仕切られている。培養槽7には培養液4aが収容され、対極槽8には電解液4bが収容されている。培養槽7の培養液4aには作用極9及び参照電極11が浸漬され、対極槽8の電解液4bには対極10が浸漬される。作用極9、対極10及び参照電極11は3電極式の電位制御装置(ポテンシオスタット)12に結線され、培養液4aに浸漬されている作用極9の電位を厳密に制御可能としている。
【0023】
ここで、培養槽7の培養液4aには、酸化還元物質3がさらに添加される。酸化還元物質3としては、培養液4aに浸漬されている作用極9において可逆的に酸化還元反応を生じ得る物質であって、尚かつ培養対象微生物2に対して毒性を呈しない物質であればよい。具体的には、例えば土壌成分として一般的な鉄イオンが挙げられる。鉄イオンは以下に示す化学反応式1により酸化体と還元体に可逆的に変化する物質である。
Fe(III) + e− = Fe(II) ・・・・・(化学反応式1)
【0024】
尚、鉄イオンを培養液4a中で安定に存在させるためには、鉄イオンをキレート剤に配位させることが好ましい。キレート剤としては、例えばジエチレントリアミンペンタ酢酸(DTPA)、エチレンジアミンテトラ酢酸(EDTA)、テトラエチレントリアミン(TET)、エチレンジアミン(EDA)、ジエチレントリアミン(DETA)、クエン酸、シュウ酸、クラウンエーテル、ニトリロテトラ酢酸、エデト酸二ナトリウム、エデト酸ナトリウム、エデト酸三ナトリウム、ペニシラミン、ペンテテートカルシウム三ナトリウム、ペンテト酸、スクシメルおよびエデト酸トリエンチンを挙げることができるが、鉄イオンを配位させうるキレート剤であれば、上記のキレート剤には限定されない。
【0025】
また、酸化還元物質3として、フェロシアン化カリウム、アントラキノンジスルホン酸ナトリウムなどのキノン化合物、メチルビオロゲン等を用いることができる。これらの物質も酸化還元反応により酸化体と還元体に可逆的に変化する。特に、キノン化合物は土壌成分の一つとして知られている物質であることから、土壌そのものを培養液4aに添加することで、土壌に含まれている酸化還元物質3により培養液4aの電位を制御できる場合がある。但し、酸化還元物質3は上記した物質に限定されるものではない。
【0026】
尚、酸化還元物質3の添加量は、培養液4aの電位を制御しうる量であれば特に限定されないが、培養液4aの酸化還元物質3の濃度を0.1〜100mmol/Lとすることが好適である。0.1mmol/L未満とすると培養液4aの電位の制御を十分に行うことができない可能性があり、100mmol/Lを超えると培養液4aに完全に溶解しなかったり、微生物の生育阻害を生じる可能性がある。
【0027】
ここで、電子受容体物質13を培養液4aに添加してもよい。電子受容体物質13としては、培養対象微生物2の呼吸源となる物質であれば特に限定されない。例示すると、PCE脱塩素微生物に対してテトラクロロエチレン(PCE)、DCE脱塩素微生物に対してジクロロエチレン(DCE)、VC脱塩素微生物に対して塩化ビニル、硝酸還元菌に対して硝酸イオン、硫酸還元菌に対して硫酸イオン、メタン生成菌に対して二酸化炭素、クロロベンゼン脱塩素微生物に対してクロロベンゼン、クロロフェノール脱塩素微生物に対してクロロフェノール、クロム還元菌に対してクロムイオン、キノン還元菌に対してキノン、水銀還元菌に対して水銀イオン、カドミウム還元菌に対してカドミウムイオン、鉄還元菌に対して鉄イオンが挙げられる。
【0028】
培養液4aの電位(酸化還元電位)は、数式1に示すネルンストの式により表される。
E=E0+RT/nF×ln(Cox/Cred)・・・・・(数式1)
【0029】
数式1において、Eは溶液(培養液4a)の酸化還元電位、E0は酸化還元物質3の標準酸化還元電位、Rは気体定数、Tは絶対温度、nは反応電子数、Fはファラデー定数、Coxは酸化体の濃度、Credは還元体の濃度である。つまり、培養液4aに含まれる酸化還元物質3の酸化体の濃度と還元体の濃度の比を一定に制御することにより、培養液4a自体の酸化還元電位を制御することができる。尚、酸化還元物質3が培養液4aの酸化還元電位を決定する要素であり、培養液4aの組成は酸化還元電位にほとんど影響を与えることがない。
【0030】
3極式の電位制御装置12では、作用極9と参照電極11の電位差を測定し、測定した電位差が設定電位Vに達するように作用極9と対極10との間に電流を流し、基準となる参照電極には一切電流が流れないようにしている。このようにして作用極9の電位を設定電位Vに制御し続けることによって、酸化還元物質3の酸化体の濃度と還元体の濃度の比を一定に制御し続けることができる。したがって、例えば培養液7に投入された微生物が酸化還元物質3を酸化あるいは還元することによりCox/Cred(酸化体と還元体の濃度比)が変化した場合でも、所定のCox/Credに制御して、培養液4aの酸化還元電位を一定値に維持することができる。尚、培養液4aの酸化還元電位は、作用極9の設定電位Vに相当する。
【0031】
ここで、作用極9の設定電位Vは、参照電極11に対する作用極9の電位に相当することから、参照電極11の種類によってその値が変化する。本明細書における設定電位Vは、標準水素電極に対して+0.22Vを示す銀・塩化銀電極電位に対する値としているが、参照電極11の種類は銀・塩化銀電極に限られるものではない。
【0032】
培養容器5を二層に区画しているイオン交換膜6は、酸化還元物質3を対極槽8側に透過させることなく、イオンのみを透過させて、培養槽7と対極槽8との間でイオン交換膜6を介してイオン電流を伝達させるものである。例えば、イオン交換膜6を一価の陽イオンのみを透過する膜とし、酸化還元物質3を鉄イオン(二価及び三価)とすれば、酸化還元物質3を培養槽7の培養液4aに留めたままで、培養液4a及び電解液4bのイオン(水素イオン、ナトリウムイオン、カリウムイオン)などの一価の陽イオンがイオン交換膜6を通過して、培養槽7と対極槽8との間でイオン電流を伝達させることができる。その結果、培養液4aの酸化還元電位が所定の値に長期間維持されることになる。ここで、対極槽8に収容する電解液4bについては、イオン交換膜6を透過しうるイオンを組成に有していれば特に限定されるものではない。尚、電解液4bとして培養液4aを用いてもよい。
【0033】
培養対象微生物2の至適電位は、以下に説明する微生物の増殖評価試験から導き出すことができる。即ち、電位以外の培養条件を全て揃え、電位をある範囲内、例えば−1.0V〜+1.0Vの範囲内で各種条件振りして培養実験を行う。また、通電しない(電位制御を行わない)場合についても同様に培養実験を行う。そして、対数増殖期の開始時を判断可能な期間で培養を行い、対数増殖期の開始時が通電しない場合と比較して早まった場合、その電位を培養対象微生物2の至適電位と判断することができる。
【0034】
例えば硫酸還元菌の場合、至適電位は銀・塩化銀電極電位基準で−0.6V以下であり、より好適には−0.6V〜−0.9Vであり、さらに好適には−0.7Vである。−0.9Vよりも小さくすると、対極10からの水素発生量が増加しすぎて酸化還元電位の制御が正確に行えなくなる虞がある。
【0035】
至適電位の制御は、少なくとも培養開始時から至適電位における培養対象微生物2の対数増殖期開始時までの期間において行うことが好ましい。この期間に至適電位の制御を行うことによって、培養対象微生物2の細胞内におけるATP、NADH及びNADPHの単位時間当たりの生産量を向上させる効果が得られる。ここで、至適電位の制御は、培養開始時から至適電位における培養対象微生物2の対数増殖期中点までの期間において行うことがより好ましい。この場合には、培養対象微生物2の細胞内におけるATP、NADH及びNADPHの単位時間当たりの生産量を向上させる効果がより確実に得られる。尚、培養開始時から至適電位における培養対象微生物2の対数増殖期中点までの期間を超えて至適電位の制御を行っても、ATP、NADH及びNADPHの単位時間当たりの生産量の向上効果は殆ど得られなくなる。
【0036】
培養対象微生物2を硫酸還元菌とする場合には、上記至適範囲の電位に制御し、この至適範囲に電位を制御した際の硫酸還元菌の増殖曲線を調べておく。そして、得られた増殖曲線から、対数増殖期開始時と対数増殖期中点を求めることにより、ATP、NADH及びNADPHの単位時間当たりの生産量を向上させる効果が得られる電位制御期間を導き出すことができる。
【0037】
例えば硫酸還元菌を培養対象微生物2とした場合において、至適電位を−0.7Vとすると、対数増殖期開始時は培養開始時から24時間となり、対数増殖期中点は培養開始時から35時間となる。したがって、電位の制御は少なくとも培養開始時から24時間行うことが好ましいことになり、培養開始時から35時間行うことがより好ましいことになる。本願発明者等の実験によれば、実際にこの期間においてATP、NADH及びNADPHの単位時間当たりの生産量の向上効果が得られることが確認されている。、また、培養開始時から35時間を超えて至適電位の制御を行っても、ATP、NADH及びNADPHの単位時間当たりの生産量の向上効果は殆ど得られなくなることも本願発明者等の実験により確認されている。
【0038】
尚、本発明によれば、エネルギー物質であるATP、NADH及びNADPHの単位時間当たりの生産量の向上効果に加えて、呼吸や複製・分裂に関与する遺伝子の転写活性化効果及び呼吸酵素群での電子移動反応の活性化効果が得られることが確認された。即ち、本発明によれば、培養対象微生物2のエネルギー物質であるATP、NADH及びNADPHの単位時間当たりの生産量を向上させることによって、細胞内における利用可能なエネルギー量が多くなり、その結果として、呼吸や複製・分裂に関与する遺伝子の転写活性化効果及び呼吸酵素群での電子移動反応の活性化効果が得られるものと考えられる。また、エネルギー生産と呼吸は酸化的リン酸化経路において密接に関連していることから、電位制御によって呼吸酵素群が活性化したり、さらには電位制御によって呼吸に関与する遺伝子が活性化した結果として呼吸酵素群が活性化したりすることにより、エネルギー物質の単位時間当たりの生産量が向上することも考えられる。つまり、本発明によれば、これらの効果も相俟ってエネルギー物質の生産効率が極めて優れたものになると考えられる。
【0039】
以上、本発明によれば、微生物の細胞内の種々の反応の根幹をなすエネルギー物質であるATP、NADH及びNADPHの単位時間当たりの生産量の向上させる効果が得られることから、細胞内の利用可能エネルギーを高めることができる。したがって、これらのエネルギー物質を利用した微生物反応によりバイオプロセスを実施する場合に、微生物の機能を早期に向上させてバイオプロセスを早期に安定に立ち上げることが可能になる。また、環境中において休眠している微生物の細胞内の利用可能エネルギーを高めて、その増殖に関与する細胞内反応を活性化させることにより、難培養微生物を増殖することが可能になるものと考えられる。
【0040】
また、本発明と特開2006−55134号公報に記載された発明とを組み合わせることで、優れた効果が発揮される場合がある。特開2006−55134号公報に記載された発明は、培養対象微生物によって還元された物質を電気的に酸化し再生させ、これを継続して培養対象微生物に供給することにより培養対象微生物を選択的に培養する方法である。しかしながら、上記の通り、この方法によると、培養開始からある一定期間は培養対象微生物の生育に必要な物質が十分に存在している状態であることから、培養開始からある程度の培養期間が経過してその物質の量が大きく減少し始めるまでは微生物の十分な増殖効果は得られない。そこで、本発明の方法により、至適電位の制御を、少なくとも培養開始時から至適電位における培養対象微生物の対数増殖期開始時までの期間において行い
、より好ましくは培養開始時から至適電位における培養対象微生物の対数増殖期中点までの期間において行い、培養対象微生物の細胞内のATP、NADH及びNADPHの単位時間当たりの生産量を向上させて、その増殖及び呼吸能を早期に誘導させ、その後に培養対象微生物によって還元された物質を電気的に酸化し再生させ、これを継続して培養対象微生物に供給することにより、微生物の培養及び維持を長期にわたり行うことができる。即ち、本発明による培養対象微生物の細胞内のATP、NADH及びNADPHの単位時間当たりの生産量の向上効果によって付随的に培養対象微生物に必要な物質が還元されて減少してしまうが、本発明の方法を実施した後に、培養対象微生物によって還元された物質を電気的に酸化し再生させ、これを継続することで、長期にわたって培養対象微生物の増殖及び維持することができる。
【0041】
尚、上述の形態は本発明の好適な形態の一例ではあるがこれに限定されるものではなく本発明の要旨を逸脱しない範囲において種々変形実施可能である。
【0042】
例えば、上述の実施形態では、培養対象微生物2を培養液4aに添加するようにしていたが、培養対象微生物2を担体上に担持して本発明を実施するようにしてもよい。具体的には、作用極9を微生物を担持し得る導電性担体、例えば炭素電極、好適には多孔性炭素電極とし、導電性担体に培養対象微生物2を予め担持させ、導電性担体の電位を培養対象微生物2の至適電位に制御するようにして培養環境4の電位を制御するようにしてもよい。あるいは、培養液4aに添加した培養対象微生物2を、電位を制御して培養する過程で徐々に導電性担体に担持させるようにしてもよい。いずれの場合においても、本発明と同様の効果が得られる。
【0043】
また、図2に示すように、上述の実施形態で用いた微生物培養装置1とは別の微生物培養装置1aを用いるようにしてもよい。即ち、培養容器5をイオン交換膜6により培養槽7と対極槽8に仕切ることなくイオン交換膜6を少なくとも一部に備える密閉構造の容器とし、作用極9は培養容器5内に配置されると共に対極10は培養容器5の外側に配置され、培養容器5に培養液4aが収容されると共に作用極9が培養液4aに浸され、培養容器5のイオン交換膜6は培養容器5に培養液4が収容されたときに少なくともその一部が培養液4aと接触しうる位置に備えられ、イオン交換膜6の培養液4aとの接触面とは反対側の面の少なくとも一部に対極10が接触して配置されているものとしている。尚、図2では、培養容器5の培養液4aの液面よりも下部に開口部5aが設けられ、開口部5aがイオン交換膜6で塞がれ、培養容器5の外側のイオン交換膜6の表面の少なくとも一部に対極10が接触して配置されているものとしている。また、培養容器5内の培養液4aの液面よりも上部の空間に滞留するガス状物質を回収するガス回収手段15と、培養容器5内の培養液4を採取する培養液採取手段16とを備えるものとしている。
【0044】
図2に示す微生物培養装置1aを用いることで、対極10から発生するガスによる培養対象微生物2の生育状態への悪影響を排除しながら、培養容器5内で発生したガス状物質(培養対象微生物2が生産したガス状物質や微生物が生産した揮発性物質が揮発して生じたガス成分)を培養容器5の外の漏洩することなく、ガス回収手段15から回収しながら、本発明の微生物細胞内のエネルギー物質の生産制御方法を実施することができる。したがって、培養対象微生物2の細胞内においてエネルギー物質(ATP、NADH及びNADPH)の単位時間当たりの生産量が向上したことにより奏される微生物反応の促進効果によって、培養対象微生物2によるガス状物質等の生産が促進された場合にも、生産されたガス状物質等を無駄なく回収することができる。尚、対極10は多孔質体とすることが好適である。この場合には、イオン交換膜6と対極10との接触面で発生したガスを接触面とは反対側の面に通過させやすくなる。また、対極10を多孔質体とし、イオン交換膜6を塗布形成するための薬剤、例えばナフィオン分散液を用いてイオン交換膜6を貼り付けることで、ナフィオン分散液の多孔質体の孔への侵入によりイオン交換膜6と対極10との接触面積を増大させて電気化学反応をより進行させやすくすることができ、好適である。
【0045】
さらに、図3に示すように、上述の実施形態で用いた微生物培養装置1とはさらに別の微生物培養装置1bを用いるようにしてもよい。即ち、イオン交換膜6によって仕切られ且つ開放された二つの槽(培養槽7と対極槽8)と、培養槽7を、対極槽8から発生するガスが培養槽7へ侵入するのを防ぐ密閉構造(図3では、培養槽7の上方開放部をガス不透過膜またはガス不透過部材24により塞いでいる)とするようにしてもよい。この場合にも図2に示す微生物培養装置1aと同様に、対極10から発生するガスによる培養対象微生物2の生育状態への悪影響を排除しながら、培養容器5内で発生したガス状物質(培養対象微生物2が生産したガス状物質や微生物が生産した揮発性物質が揮発して生じたガス成分)を培養容器5の外の漏洩することなく回収しながら、本発明の微生物細胞内のエネルギー物質の生産制御方法を実施することができる。
【0046】
より具体的には、図4に示すように、密閉構造の容器20を培養槽7とし、容器20に収容可能な密閉構造の小容器21を対極槽8とし、小容器21は少なくとも一部にイオン交換膜6を備えると共にガス(対極槽から発生するガス)を容器20の外に排出するガス排出管22を備えるものとする。そして、培養槽7内の培養液4aの液面よりも上部の空間に滞留するガス状物質を回収するガス回収手段15と、培養槽7の培養液4aを採取する培養液採取手段16とを備えるものとしている。尚、培養槽7としての密閉構造の容器20は、対極槽8としての密閉構造の小容器21を収容可能な大きさの容器であり、形状は特に限定されない。容器の材質としては、例えば、ガラス、プラスチック、絶縁処理を施した金属、コンクリート等が挙げられるがこれらに限定されるものではない。また、ガス不透過性の膜材をヒートシール等により袋状に形成した容器を培養槽7として用いるようにしてもよい。また、対極槽8としての密閉構造の小容器21は、培養槽7としての容器20に収容可能な大きさの容器であり、少なくとも一部にイオン交換膜6を備えるものとしている。尚、図4では、小容器21全体をイオン交換膜6で形成した袋状の容器としているが、小容器21はこの形態に限定されるものではない。例えば、袋状の容器の片面だけをイオン交換膜6で構成してもよいし、一つの面のさらに一部分をイオン交換膜6のみで構成してもよい。部分的にイオン交換膜6を用いる場合には、その他の部分は容器20と同様の上記材質で構成してもよいし、イオン交換膜6以外の膜材、例えばガス不透過性の膜材により構成し、小容器21からのガス(対極槽8から発生するガス)が容器20の内部に漏洩しないようにしてもよい。尚、容器20に小容器21を収容することで、容器20に収容されている培養液4aに小容器21が浸され、小容器21の少なくとも一部に備えられているイオン交換膜6と培養液4aとが接触する。したがって、培養液4aに浸されている作用極9と、電解液4aに浸されている対極10との間に電位差を与えた際に、作用極9と対極10との間でイオン電流が発生し、培養液4aの酸化還元電位を制御することが可能となる。
【0047】
尚、図2〜図4に示す微生物培養装置では、培養槽7内の培養液4aの液面よりも上部の空間(ヘッドスペース)に滞留するガス状物質を培養槽7の外(電気培養装置の外)へ導くガス排出管15aを備え、このガス排出管15aをバルブ15bにより開閉可能としたガス回収手段15により、培養槽7内のガス状物質を回収するようにしている。しかしながら、ガスの回収方法は、この方法に限定されるものではない。例えば、培養槽7の上部に開口部を設けて合成ゴム等(例えばシリコーンゴム)の弾性材料でこの開口部を塞ぎ、開口部を塞ぐ弾性材料に注射器の注射針を刺してヘッドスペースからガス状物質を回収するようにしてもよい。合成ゴム等の弾性材料は、注射針を引き抜くと孔が塞がるので、ガス状物質の回収を行わないときには、注射針を引き抜いておいても、培養槽7の密閉状態が維持される。
【0048】
さらに、本実施形態では、培養槽7内の培養液4aの液面よりも下部に、培養槽7内の培養液4aを培養槽7の外に導く培養液排出管16aを備え、この培養液排出管16aをバルブ16bにより開閉可能とした培養液採取手段16により、培養槽7内から培養液4aを採取するようにしている。しかしながら、培養液4aの採取方法は、この方法に限定されるものではなく、上記と同様、培養槽7に開口部を設けて合成ゴム等の弾性材料で塞ぎ、注射器の注射針を刺して培養液4aを採取するようにしてもよい。または両端が開口された管をの一端の注射器に接続し、他端を培養液4aに浸けて、管を介して培養液4aを採取するようにしてもよい。
【0049】
また、ガス回収手段15や培養液採取手段16とは別に、培養液4aに物質を添加・供給する手段を設けるようにしてもよい。具体的には、培養槽7の外部から培養液4aに物質を添加・供給することのできる開閉可能な物質導入管を備えるようにしてもよい。この場合には、微生物2に必要な栄養源や、微生物2が目的の物質を生産するのに必要な物質、微生物2の増殖や代謝に伴い変動する培養液4aの状態を一定の状態に維持するための中和剤、培養液4aそのもの等を必要に応じて添加することができる。また、培養環境を嫌気性や好気性に維持するためにガスを供給することもできる。しかしながら、培養液に物質を添加・供給する手段は必ずしも備える必要はなく、ガス回収手段15や培養液採取手段16を培養液4aに物質を添加・供給する手段として併用するようにしてもよい。また、上記のように注射器の注射針を弾性材料に差し込んで培養液4aに物質を添加・供給するようにしてもよい。
【0050】
尚、図1に示す微生物培養装置1は、培養環境を嫌気性や好気性に制御する際に、微生物培養装置1の培養容器5を密閉性のあるボックスに収容する必要があることから、培養環境の管理(pH調整や物質供給等)が非常に煩雑である。また、微生物2の培養を行った後に再度別の微生物2を培養する場合には、ボックスも滅菌処理する必要があった。これに対し、図2に示す微生物培養装置1aによれば、培養容器5内に供給したガス等が培養容器5の外に漏洩することが無い。また、図3及び図4に示す微生物培養装置1bによれば、培養槽7内に供給したガス等が培養槽7の外に漏洩することが無い。したがって、培養環境を嫌気性や好気性に制御しやすく、図1に示す微生物培養装置1のように培養容器5をボックスに収容することなく、培養環境をそのまま管理することができる。したがって、培養容器5をボックスに収容していた従来法と比較して培養環境の管理が容易になると共に、再度培養を行う際にボックスを滅菌する手間を省くことも可能となる。
【実施例】
【0051】
本発明の実施例を以下に説明するが、本発明は以下の実施例に限定されるものではない。
【0052】
(実施例1)
硫酸還元菌であるDeslfovibrio desulfuricans NBRC13699を培養対象微生物として各種実験を行った。
【0053】
<実験装置>
図1に示す培養装置を使用した。具体的には、培養容器5は外径75mm、高さ90mmのガラス製深底シャーレの内側を、一価の陽イオン透過性の交換膜(旭化成、K−192)6で仕切った二槽式とし、一方を培養槽7、他方を対極槽8とした。培養槽7には炭素板(40mm×70mm、4mm厚)の作用極9と、銀・塩化銀参照電極11(HS−205C、東亜DKK社)を設置した。対極槽8には炭素板(40mm×70mm、4mm厚)の対極10を設置した。これら3本の電極9,10,11は電位制御装置(扶桑製作所、POTENTIO/GALVANOSTAT model 110)12に結線して、培養槽7内の作用極9の電位を厳密に設定可能とした。また、培養に際しては、培養容器5をアクリル製の嫌気ボックス内に封入し、さらに嫌気ボックス全体を30℃に設定した恒温槽内に設置した。嫌気ボックス14には、常時窒素ガスを注入し(0.2L/min)、嫌気雰囲気を維持した。尚、以降の実施例に示す電位は、全て銀・塩化銀電極電位基準の電位である。
【0054】
対極槽8に収容する電解液4bは以下のようにして得た。即ち、NH4Cl;1.0g、K2HPO4;0.5g、MgSO4・7H2O;2.0g、CaSO4・2H2O;1.0gを蒸留水1Lに溶解して調整した液体をオートクレーブ滅菌処理して得た。
【0055】
また、培養槽7に収容する培養液4aは、電解液4bに乳酸ナトリウム;2.8g、クエン酸三ナトリウム二水和物;0.625g、酵母エキスを1.0g、酸化還元物質3としてAQDS(アントラキノン−2,6−ジスルホン酸二ナトリウム)を0.42g添加し、フィルター(0.22μm、Millex−GS、MILLIPORE、Ireland)によりろ過除菌して得た。尚、硫酸還元菌は乳酸を炭素源として生育可能な微生物であるが、硫酸還元菌の生育に必要な微量元素を補填するために酵母エキスを添加した。また、培養液4aには、硫酸還元菌を添加(植菌)し、初期菌体密度を1.0×107cells/mLとした。菌体密度は光学顕微鏡で硫酸還元菌を計数した結果から求めた。
【0056】
<実験結果>
(1)硫酸還元菌の増殖及びエネルギー物質の経時変化
電位を−0.7Vに制御し続けたまま培養した場合と通電を行わずに培養した場合とで、硫酸還元菌の増殖の経時変化と微生物細胞内の主要なエネルギー物質であるATPの濃度の経時変化にどのような違いが現れるのかを確認する実験を行った。
【0057】
一定の培養期間毎に培養液4aを採取し、菌体密度とATP濃度の定量を行った。菌体密度は光学顕微鏡で硫酸還元菌を計数した結果から求めた。ATP濃度の定量は、ルシフェール250プラス及びルミテスターC−100N(キッコーマン)を用い、キット付属のプロトコールに従って実施した。
【0058】
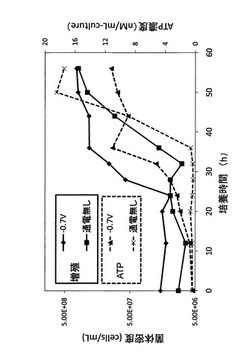
実験結果を図5に示す。図5において、◆は電位を−0.7Vに制御した場合における菌体密度を示し、■は通電しなかった場合における菌体密度を示し、▲は電位を−0.7Vに制御した場合におけるATP濃度を示し、×は通電しなかった場合におけるATP濃度を示している。
【0059】
図5に示される実験結果から、電位を−0.7Vに制御しながら培養を行うことで、対数増殖期の開始時を10時間程度早められることが明らかとなった。また、ATP濃度についても、電位を−0.7Vに制御しながら培養を行うことで、早期に高められることが明らかとなった。一方で、培養開始から35時間経過した後は、ATP濃度に変化が見られなくなった。
【0060】
次に、図5の実験結果について、ATP濃度を細胞1個体当たりに換算した実験結果、つまり、硫酸還元菌の細胞1個体当たりのATP生産量の経時変化を図6に示す。図6に示される結果から、少なくとも培養開始から24時間電位の制御を行うことで、硫酸還元菌の細胞1個体当たりのATP生産量を十分に向上できることが明らかとなった。硫酸還元菌において、尚、電位を−0.7Vに制御しながら硫酸還元菌を培養したときの培養開始から24時間経過時は、電位を−0.7Vに制御しながら培養したときの硫酸還元菌の対数増殖期開始時(対数増殖期の立ち上がり)に該当する。したがって、この結果から硫酸還元菌に限らず微生物全般について、培養対象微生物の培養の際に、培養環境の電位を培養対象微生物の至適電位に制御し、且つ至適電位の制御を少なくとも培養開始時から至適電位における培養対象微生物の対数増殖期開始時まで行うことで、微生物細胞内におけるATPの単位時間当たりの生産量を向上できることが導かれた。
【0061】
ここで、細胞の状態を知るためには、細胞が実際に利用できるエネルギー量の指標であるアデニル酸エネルギー充填率(adenylate energy charge、以下、AEC値と呼ぶ)による評価が有効である。そこで、以下の式によりAEC値を求めた。
(AEC値)=([ATP]+0.5[ADP])/([AMP]+[ADP]+[ATP])
【0062】
また、ADP(アデノシン二リン酸)はピルベートキナーゼによる以下の反応Aを利用してATPに変換してから定量し、AMP(アデノシン一リン酸)は以下の反応A及びmyoキナーゼによる以下の反応Bの組み合わせによりATPに変換してから定量した。
(反応A); ADP+phosphoenolpyruvate→ATP+pyruvate
(反応B); AMP+ATP→2ADP
【0063】
尚、AEC値は、対数増殖期初期及び対数増殖期中点において求めた。対数増殖期中点は、以下の式により算出される対数増殖期中点の菌体密度から求めた。また、対数増殖期初期は、増殖開始(対数増殖期開始時(立ち上がり時))から対数増殖期中点までの期間とした。
(対数増殖期中点の菌体密度)=((最終到達菌体密度)−(初期菌体密度))/2
【0064】
本実験では、対数増殖期中点は培養開始から35時間(電位を−0.7Vに制御時)、培養開始から45時間(通電なし)であり(菌体密度2.0×108cells/mL)、対数増殖期中点のAEC値はこのときの培養液のATP、ADP及びAMPの定量分析結果から求めた。また、対数増殖期初期は24〜35時間(電位を−0.7Vに制御時)、35〜45時間(通電なし)であり、AEC値はこの期間において菌体密度が8.0×107cells/mLとなるとき(培養から30時間(電位を−0.7Vに制御時)、培養から42時間(通電なし))の培養液のATP、ADP及びAMPの定量分析結果から求めた。
【0065】
実験結果を図7に示す。棒グラフの上の数値は通電なしの場合を100とした場合のAEC値の相対値である。図7に示される結果から、電位を−0.7Vに制御しながら培養を行うことで、対数増殖期初期におけるAEC値を通電しないときのおよそ3倍に増加できることが明らかとなった。これに対し、対数増殖期中点では、通電の有無によってはAEC値が殆ど変化しなかった。
【0066】
これらの結果から、電位を−0.7Vに制御しながら培養を行うことで、対数増殖期初期において、通電しない場合よりも酸化的リン酸化を促進させることができることがわかった。つまり、電位を−0.7Vに制御することにより、対数増殖期初期における菌体1個体当たりの単位時間当たりのATP生産量を増加させやすくできることがわかった。一方で、対数増殖期中点においては、電位制御が酸化的リン酸化に影響を与えないこともわかった。
【0067】
次に、対数増殖期初期と対数増殖期中点において、微生物細胞内の主要なエネルギー物質であるNADH及びNADPHの濃度の通電の有無による違いについて検討した。
【0068】
尚、AEC値を求めた場合と同様、対数増殖期中点は培養開始から35時間(電位を−0.7Vに制御時)、培養開始から45時間(通電なし)とした(菌体密度2.0×108cells/mL)。また、対数増殖期初期は24〜35時間(電位を−0.7Vに制御時)、35〜45時間(通電なし)とし、この期間において菌体密度が8.0×107cells/mLとなるときの培養液をNADH及びNADPHの定量分析に供した。
【0069】
NADH及びNADPHの定量は、それぞれNAD/NADH Quantification kit及びNADP/NADPH Quantification kit(Biovision Inc, US)を用いて実施した。詳細には、一定期間培養した後に回収した硫酸還元菌の細胞を超音波破砕機により破砕し、破砕液を遠心分離操作により分離して上清液を測定に供した。
【0070】
実験結果を図8及び図9に示す。尚、図8がNADH(さらにNAD+)の定量分析結果を示す図であり、図9がNADPH(さらにはNADP+)の定量分析結果を示す図である。これらの結果から、電位を−0.7Vに制御することで、対数増殖期初期におけるNADH及びNADPHを通電しないときよりも増加できることが明らかとなった。これに対し、対数増殖期中点では、通電の有無によってはNADH及びNADPHが殆ど変化しなかった。尚、NAD+及びNADP+については、いずれの場合も殆ど変化が見られなかった。
【0071】
NADH及びNADPHは、細胞内の酸化還元酵素に関わる細胞内で最も多い補酵素であり、ATPの合成原料となる分子である(1分子のNAD(P)Hから3分子のATPが酸化的リン酸化反応で合成される)。ここで、細胞内ATPの生産に関する上記実験では、少なくとも培養開始から24時間まで電位を−0.7Vに制御することで、硫酸還元菌の細胞内ATPの単位時間当たりの生産量の向上効果が得られることが確認されたことから、ATPの合成原料であるNADH及びNADPHについても、少なくとも培養開始から24時間まで電位を−0.7Vに制御することで、細胞内生産量を向上できるものと考えられる。また、上記の実験結果から、培養開始時から対数培養期初期における菌体密度が8.0×107cells/mLに到達するまでの期間(培養開始時から30時間)まで電位を−0.7Vに制御し続けることで、ATP、NADH及びNADPHの単位時間当たりの生産量を確実に向上させることができ、培養開始時から対数培養期中点まで−0.7Vに制御し続けることで、ATP、NADH及びNADPHの単位時間当たりの生産量をさらに確実に向上させることができることがわかった。そして、このことから、微生物全般に関し、培養環境の電位を培養対象微生物の至適電位に制御するとともに、至適電位の制御を少なくとも培養開始時から至適電位における培養対象微生物の対数増殖期開始時までの期間において行うことで、ATP、NADH及びNADPHの単位時間当たりの生産量を向上させる効果が得られ、至適電位の制御を培養開始時から至適電位における培養対象微生物の対数増殖期中点までの期間において行うことで、ATP、NADH及びNADPHの単位時間当たりの生産量を向上させる効果が確実に得られることが導かれた。
【0072】
(2)遺伝子転写分析
上記(1)の実験における対数増殖期初期の遺伝子転写活性と対数増殖期中点の遺伝子転写活性について通電の有無による違いを検討した。
【0073】
上記(1)の実験において、電位を−0.7Vに制御しながら培養を行った場合と通電を行わずに培養を行った場合について、対数増殖期初期(菌体密度:8×107cells/mL)の菌体と対数増殖期中点(菌体密度:2×108cells/mL)の菌体を回収した。回収した菌体はRNA精製を行うまでRNA later(Ambion, USA)に浸し、−20℃で保存した。
【0074】
上記保存された菌体から全RNAを抽出・精製した。具体的には、Ribopure-Bacteria kit (Ambion, USA)を用いて精製を行った後、Turbo DNase-free (Ambion, USA) で処理することで混在するゲノムDNAを除去し、精製RNAを得た。精製度は分光光度計(A260/A280)及び電気泳動にて検証した。
【0075】
次に、精製RNAの100ngについて、Transcriptor(Roche, Switzerland)を用いてランダムヘキサマーをプライマーとして逆転写反応を行い、cDNAを調製した。このcDNAを鋳型として、Light cycler ST300(Roche, Switzerland)を用いたリアルタイムPCRにより、16S rRNA遺伝子およびporA, hydA, cytc3, dsrA, gyrA遺伝子の定量を行った。この定量値が各遺伝子の転写量を反映する値である。解析対象とした遺伝子および使用したプライマーの塩基配列を表1に示す。また、使用したプライマーの塩基配列を配列表に示す。尚、プライマーは各種機能遺伝子の配列を基にprimer3 plus programによりデザインした。リアルタイムPCR反応はLight Cycler Fast start DNA Master SYBR GreenIを用い、表2に示す反応条件にて行った。増幅断片の融解曲線分析において目的遺伝子断片の単一ピークのみが得られた試料のみ解析を進めた。
【0076】
【表1】

【0077】
【表2】

【0078】
ここで、本実施例において定量対象とした遺伝子の硫酸還元菌内における機能について図10に基づいて説明する。porAは乳酸分解に関与する遺伝子である(図10の(a))。hydA及びcytc3は電子伝達に関与する遺伝子である(図10の(b))。dsrAは硫酸還元に関与する遺伝子である(図10の(c))。そして、gyrAは複製及び分裂に関与する遺伝子である(図10の(d))。
【0079】
各種遺伝子の発現量は測定値を16S rRNA遺伝子量を基準に標準化し、各細胞あたりの発現量として相対評価した。転写量の相対比較はSecond derivative maximum法により算出したCt値 (Crossing time) を用いた比較Ct法により行った。
【0080】
実験結果を図11に示す。尚、図11では、通電なしの場合の遺伝子転写量を1(図11中の点線)とし、電位を−0.7Vに制御した場合の遺伝子転写量をその相対値として示した。つまり、遺伝子転写量が1より大きければ、電位を−0.7Vに制御することにより遺伝子転写が活性化していることになる。図11に示される結果から、対数増殖期初期において、porA以外の遺伝子の転写が活性化していることが確認された。上記の通り、対数増殖期初期においては、細胞内の主要なエネルギー物質であるATP、NADP及びNADPHの単位時間当たりの生産量が向上することが確認されたことから、細胞内における利用可能エネルギー量が向上したことで、主に呼吸に関与する遺伝子であるhydA、cytc3及びdsrA、複製・分裂に関与する遺伝子であるgyrAの転写が活性化されたものと考えられる。つまり、この結果から、微生物全般に関して、ATP、NADP及びNADPHの単位時間当たりの生産量を増加させることによって、呼吸に関与する遺伝子や複製・分裂に関与する遺伝子を活性化させ、生育の活性化(増殖の促進)を図りつつ、その機能を向上させる効果が得られるものと考えられる。また、エネルギー生産と呼吸は酸化的リン酸化経路において密接に関連していることから、電位制御によって呼吸に関与する遺伝子が活性化した結果として呼吸酵素群が活性化することにより、エネルギー物質の単位時間当たりの生産量が向上することも考えられることから、この効果も相俟ってエネルギー物質の生産効率が極めて優れたものになると考えられる。
【0081】
(3)乳酸分解速度と硫酸還元速度の分析
硫酸還元菌の主要な反応である乳酸分解と硫酸還元について、培養開始時の乳酸濃度及び硫酸濃度の定量分析結果と、対数増殖期初期における乳酸濃度及び硫酸濃度を定量分析結果とに基づき、培養開始時から対数増殖期初期にかけての乳酸分解速度及び硫酸還元速度を求め、通電の有無(通電した場合は電位を−0.7Vに制御)による乳酸分解速度及び硫酸還元速度の違いについて検討した。
【0082】
硫酸イオン濃度及び乳酸イオン濃度はイオンクロマトアナライザ(ICS-1500、DIONEX製)により測定した。
【0083】
結果を図12及び図13に示す。図12が通電の有無による乳酸分解速度の違いを示す図であり、図13が通電の有無による硫酸還元速度の違いを示す図である。尚、図12及び図13ともに、棒グラフの上に、通電なしの場合の速度を100とした場合に対する通電ありの場合の速度を掲載した。これらの結果から、乳酸分解速度及び硫酸還元速度ともに通電ありの場合に向上した。上記の通り、対数増殖期初期においては、細胞内の主要なエネルギー物質であるATP、NADP及びNADPHの単位時間当たりの生産量が向上することが確認されたことから、細胞内における利用可能エネルギー量が向上したことで、乳酸分解反応と硫酸還元反応が促進されたものと考えられる。つまり、この結果から、微生物全般に関して、ATP、NADP及びNADPHの単位時間当たりの生産量を増加させることによって、微生物の呼吸にかかる機能を向上させて、微生物による有用物質等の生産速度の促進や、環境汚染物質の分解速度の促進を図ることが可能になるものと考えられる。また、エネルギー生産と呼吸は酸化的リン酸化経路において密接に関連していることから、電位制御によって呼吸酵素群が活性化することにより、エネルギー物質の単位時間当たりの生産量が向上することも考えられることから、この効果も相俟ってエネルギー物質の生産効率が極めて優れたものになると考えられる。
【技術分野】
【0001】
本発明は、微生物細胞内のエネルギー物質の生産制御方法に関する。さらに詳述すると、本発明は、微生物体の反応素過程において必ず使用されるエネルギー物質であるアデノシン三リン酸(ATP)と生物細胞内の酸化還元酵素に関わり且つ細胞内で最も多い補酵素であるニコチンアミドアデニンジヌクレオチド(NADH)及びニコチンアミドアデニンジヌクレオチドリン酸(NADPH)について、これらの単位時間当たりの生産量を向上させる方法に関する。
【背景技術】
【0002】
現在様々な分野で利用されている微生物は自然界に存在する全微生物の僅か1%に満たないと言われている。そこで、残り99%の膨大な微生物資源を有効利用すべく、新たな概念に基づいて微生物の培養技術が各種開発されつつある。
【0003】
例えば、特許文献1には、培養対象微生物によって還元された物質を電気的に酸化し再生させ、これを継続して培養対象微生物に供給することにより培養対象微生物を選択的に培養する方法が開示されている。具体的には、六価クロムを溶解させてクロム還元菌以外の雑多な微生物にとって増殖し難い環境とした培養液中で、六価クロムに対して還元活性を有するShewanella、Pseudomonas、Sulfate reducing bacteria、Arthrobacter、Bacillus、Aerococcus、Micrococcus、Aeromonas、Thermoanaerobacter、Cellulomonas、Geobacter、Streptomyces、Escherichia、Enterobacter等のクロム還元菌を選択的に集積培養し、その際に、培養液中に流した電気により、クロム還元菌によって還元されて生成された三価クロムを酸化して六価クロムに再生しながら培養を行うようにしている。
【先行技術文献】
【特許文献】
【0004】
【特許文献1】特開2006−55134号公報
【発明の概要】
【発明が解決しようとする課題】
【0005】
しかしながら、特許文献1に記載の培養方法は、培養対象微生物の生育に必要な物質が還元されて減少するような状況下になければ適用しても効果が得られない。また、培養開始からある一定期間は培養対象微生物の生育に必要な物質が十分に存在している状態であることから、培養開始からある程度の培養期間が経過してその物質の量が大きく減少し始めるまでは微生物の十分な増殖効果は得られない。
【0006】
ところで、微生物の生育や代謝といった機能は、アデノシン三リン酸(以下、単にATPと呼ぶこともある)により支えられていることが知られている。即ち、ATPは微生物体の反応素過程において必ず使用されるエネルギー物質である。また、ニコチンアミドアデニンジヌクレオチド(以下、単にNADHと呼ぶこともある)及びニコチンアミドアデニンジヌクレオチドリン酸(以下、単にNADPHと呼ぶこともある)は微生物細胞内の酸化還元酵素に関わる細胞内で最も多い補酵素であり、1分子のNADHまたはNADPHから3分子のATPが酸化的リン酸反応により合成されることも知られている。
【0007】
このように、ATP、NADH及びNADPHは、微生物の生育や代謝を担う極めて重要なエネルギー物質である。したがって、これらのエネルギー物質の微生物細胞内の単位時間当たりの生産量を高めることができれば、微生物全般に対し、その生育の活性化や機能の向上が図れるものと考えられる。
【0008】
そこで、本発明は、微生物細胞内におけるATP、NADH及びNADPHの単位時間当たりの生産量を高めることのできる方法を提供することを目的とする。
【課題を解決するための手段】
【0009】
かかる課題を解決するため、本願発明者等は硫酸還元菌を培養対象微生物として各種検討を積み重ねた。その結果、硫酸還元菌を培養する際の培養環境の電位を硫酸還元菌の至適電位に制御するとともに、至適電位の制御を少なくとも培養開始時から至適電位における硫酸還元菌の対数増殖期開始時までの期間において行うことによって、硫酸還元菌の細胞内におけるATP、NADH及びNADPHの単位時間当たりの生産量を向上できることを知見するに至った。そしてこの結果から、微生物全般について、微生物細胞内におけるATP、NADH及びNADPHの単位時間当たりの生産量を向上できる可能性が導かれ、本願発明を完成するに至った。
【0010】
即ち、請求項1に記載の微生物細胞内におけるエネルギー物質の生産制御方法は、培養対象微生物を含む培養環境の電位を培養対象微生物の至適電位に制御するとともに、至適電位の制御を少なくとも培養開始時から至適電位における培養対象微生物の対数増殖期開始時までの期間において行い、培養対象微生物の細胞内におけるアデノシン三リン酸(ATP)とニコチンアミドアデニンジヌクレオチド(NADH)とニコチンアミドアデニンジヌクレオチドリン酸(NADPH)の単位時間当たりの生産量を向上させるようにしている。
【0011】
ここで、請求項2に記載の微生物細胞内におけるエネルギー物質の生産制御方法のように、至適電位の制御を培養開始時から至適電位における培養対象微生物の対数増殖期中点までの期間において行うことが好ましい。この場合には、培養対象微生物の細胞内におけるアデノシン三リン酸(ATP)とニコチンアミドアデニンジヌクレオチド(NADH)とニコチンアミドアデニンジヌクレオチドリン酸(NADPH)の単位時間当たりの生産量をより確実に向上させることができる。
【0012】
尚、本明細書において、至適電位における培養対象微生物の対数増殖期中点までの期間とは、至適電位において培養対象微生物を培養したときの最終到達菌体密度と初期菌体密度(培養環境に植菌された菌体の密度)の差を2で割ることにより算出される菌体密度に到達するまでに必要な培養期間を意味している。
【0013】
次に、請求項3に記載の微生物細胞内におけるエネルギー物質の生産制御方法は、硫酸還元菌を含む培養環境の電位を銀・塩化銀電極電位基準で−0.6V以下に制御するとともに、電位の制御を少なくとも培養開始時からこの電位における硫酸還元菌の対数増殖期開始時までの期間において行い、硫酸還元菌の細胞内におけるアデノシン三リン酸(ATP)とニコチンアミドアデニンジヌクレオチド(NADH)とニコチンアミドアデニンジヌクレオチドリン酸(NADPH)の単位時間当たりの生産量を向上させるようにしている。
【0014】
ここで、請求項4に記載の微生物細胞内におけるエネルギー物質の生産制御方法のように、電位の制御を培養開始時からこの電位における硫酸還元菌の対数増殖期中点までの期間において行うことが好ましい。この場合には、硫酸還元菌の細胞内におけるアデノシン三リン酸(ATP)とニコチンアミドアデニンジヌクレオチド(NADH)とニコチンアミドアデニンジヌクレオチドリン酸(NADPH)の単位時間当たりの生産量をより確実に向上させることができる。
【0015】
次に、請求項5に記載の微生物細胞内におけるエネルギー物質の生産制御方法は、硫酸還元菌を含む培養環境の電位を銀・塩化銀電極電位基準で−0.7Vに制御するとともに、電位の制御を少なくとも培養開始時から24時間行い、硫酸還元菌の細胞内におけるアデノシン三リン酸(ATP)とニコチンアミドアデニンジヌクレオチド(NADH)とニコチンアミドアデニンジヌクレオチドリン酸(NADPH)の単位時間当たりの生産量を向上させるようにしている。
【0016】
ここで、請求項6に記載の微生物細胞内におけるエネルギー物質の生産制御方法のように、電位の制御を培養開始時から35時間行うことが好ましい。この場合には、硫酸還元菌の細胞内におけるアデノシン三リン酸(ATP)とニコチンアミドアデニンジヌクレオチド(NADH)とニコチンアミドアデニンジヌクレオチドリン酸(NADPH)の単位時間当たりの生産量をより確実に向上させることができる。
【発明の効果】
【0017】
請求項1及び請求項2に記載の発明によれば、微生物の生育や代謝を担う極めて重要なエネルギー物質であるATP、NADH及びNADPHの単位時間当たりの生産量を向上させることができる。したがって、微生物全般に対して、増殖速度の向上と微生物の機能の向上を図ることができる。
【0018】
請求項3〜請求項6に記載の発明によれば、硫酸還元菌の生育や代謝を担う極めて重要なエネルギー物質であるATP、NADH及びNADPHの単位時間当たりの生産量を向上させることができる。したがって、硫酸還元菌の増殖速度の向上と硫酸還元能の向上を図ることができる。
【図面の簡単な説明】
【0019】
【図1】本発明の方法の実施に使用する装置の構成の一例を示す断面図である。
【図2】本発明の方法の実施に使用する装置の構成の他の例を示す断面図である。
【図3】本発明の方法の実施に使用する装置の構成のさらに他の例を示す断面図である。
【図4】図3に示す装置のより具体的な構成を示す断面図である。
【図5】硫酸還元菌の増殖とATP濃度の経時変化を示す図である。
【図6】硫酸還元菌の細胞1個体当たりのATP生産量の経時変化を示す図である。
【図7】対数増殖期初期と対数増殖期中点における通電の有無によるAEC値の差異を示す図である。
【図8】対数増殖期初期と対数増殖期中点における通電の有無によるNAD+及びNADHの濃度の差異を示す図である。
【図9】対数増殖期初期と対数増殖期中点における通電の有無によるNADP+及びNADPHの濃度の差異を示す図である。
【図10】実施例において定量対象とした遺伝子の硫酸還元菌体内での機能を示す模式図である。
【図11】対数増殖期初期と対数増殖期中点における通電の有無による遺伝子転写量の解析結果を示す図である。
【図12】通電の有無による乳酸分解速度の違いを示す図である。
【図13】通電の有無による硫酸還元速度の違いを示す図である。
【発明を実施するための形態】
【0020】
以下、本発明を実施するための形態について、図面に基づいて詳細に説明する。
【0021】
本発明の微生物細胞内のエネルギー物質の生産制御方法の実施形態の一例として微生物培養装置1を用いた場合について図1に基づいて説明する。本発明の微生物細胞内のエネルギー物質の生産制御方法は、培養対象微生物2を含む培養環境4に電極を浸漬し、この電極に電位を印加して培養環境4の電位を培養対象微生物2の至適電位に制御し、至適電位の制御を少なくとも培養開始時から至適電位における培養対象微生物2の対数増殖期開始時までの期間において行うようにしている。これにより、培養対象微生物2の細胞内におけるアデノシン三リン酸(ATP)とニコチンアミドアデニンジヌクレオチド(NADH)とニコチンアミドアデニンジヌクレオチドリン酸(NADPH)の単位時間当たりの生産量を向上させることができる。
【0022】
図1において、培養容器5はイオン交換膜6によって培養槽7と対極槽8とに仕切られている。培養槽7には培養液4aが収容され、対極槽8には電解液4bが収容されている。培養槽7の培養液4aには作用極9及び参照電極11が浸漬され、対極槽8の電解液4bには対極10が浸漬される。作用極9、対極10及び参照電極11は3電極式の電位制御装置(ポテンシオスタット)12に結線され、培養液4aに浸漬されている作用極9の電位を厳密に制御可能としている。
【0023】
ここで、培養槽7の培養液4aには、酸化還元物質3がさらに添加される。酸化還元物質3としては、培養液4aに浸漬されている作用極9において可逆的に酸化還元反応を生じ得る物質であって、尚かつ培養対象微生物2に対して毒性を呈しない物質であればよい。具体的には、例えば土壌成分として一般的な鉄イオンが挙げられる。鉄イオンは以下に示す化学反応式1により酸化体と還元体に可逆的に変化する物質である。
Fe(III) + e− = Fe(II) ・・・・・(化学反応式1)
【0024】
尚、鉄イオンを培養液4a中で安定に存在させるためには、鉄イオンをキレート剤に配位させることが好ましい。キレート剤としては、例えばジエチレントリアミンペンタ酢酸(DTPA)、エチレンジアミンテトラ酢酸(EDTA)、テトラエチレントリアミン(TET)、エチレンジアミン(EDA)、ジエチレントリアミン(DETA)、クエン酸、シュウ酸、クラウンエーテル、ニトリロテトラ酢酸、エデト酸二ナトリウム、エデト酸ナトリウム、エデト酸三ナトリウム、ペニシラミン、ペンテテートカルシウム三ナトリウム、ペンテト酸、スクシメルおよびエデト酸トリエンチンを挙げることができるが、鉄イオンを配位させうるキレート剤であれば、上記のキレート剤には限定されない。
【0025】
また、酸化還元物質3として、フェロシアン化カリウム、アントラキノンジスルホン酸ナトリウムなどのキノン化合物、メチルビオロゲン等を用いることができる。これらの物質も酸化還元反応により酸化体と還元体に可逆的に変化する。特に、キノン化合物は土壌成分の一つとして知られている物質であることから、土壌そのものを培養液4aに添加することで、土壌に含まれている酸化還元物質3により培養液4aの電位を制御できる場合がある。但し、酸化還元物質3は上記した物質に限定されるものではない。
【0026】
尚、酸化還元物質3の添加量は、培養液4aの電位を制御しうる量であれば特に限定されないが、培養液4aの酸化還元物質3の濃度を0.1〜100mmol/Lとすることが好適である。0.1mmol/L未満とすると培養液4aの電位の制御を十分に行うことができない可能性があり、100mmol/Lを超えると培養液4aに完全に溶解しなかったり、微生物の生育阻害を生じる可能性がある。
【0027】
ここで、電子受容体物質13を培養液4aに添加してもよい。電子受容体物質13としては、培養対象微生物2の呼吸源となる物質であれば特に限定されない。例示すると、PCE脱塩素微生物に対してテトラクロロエチレン(PCE)、DCE脱塩素微生物に対してジクロロエチレン(DCE)、VC脱塩素微生物に対して塩化ビニル、硝酸還元菌に対して硝酸イオン、硫酸還元菌に対して硫酸イオン、メタン生成菌に対して二酸化炭素、クロロベンゼン脱塩素微生物に対してクロロベンゼン、クロロフェノール脱塩素微生物に対してクロロフェノール、クロム還元菌に対してクロムイオン、キノン還元菌に対してキノン、水銀還元菌に対して水銀イオン、カドミウム還元菌に対してカドミウムイオン、鉄還元菌に対して鉄イオンが挙げられる。
【0028】
培養液4aの電位(酸化還元電位)は、数式1に示すネルンストの式により表される。
E=E0+RT/nF×ln(Cox/Cred)・・・・・(数式1)
【0029】
数式1において、Eは溶液(培養液4a)の酸化還元電位、E0は酸化還元物質3の標準酸化還元電位、Rは気体定数、Tは絶対温度、nは反応電子数、Fはファラデー定数、Coxは酸化体の濃度、Credは還元体の濃度である。つまり、培養液4aに含まれる酸化還元物質3の酸化体の濃度と還元体の濃度の比を一定に制御することにより、培養液4a自体の酸化還元電位を制御することができる。尚、酸化還元物質3が培養液4aの酸化還元電位を決定する要素であり、培養液4aの組成は酸化還元電位にほとんど影響を与えることがない。
【0030】
3極式の電位制御装置12では、作用極9と参照電極11の電位差を測定し、測定した電位差が設定電位Vに達するように作用極9と対極10との間に電流を流し、基準となる参照電極には一切電流が流れないようにしている。このようにして作用極9の電位を設定電位Vに制御し続けることによって、酸化還元物質3の酸化体の濃度と還元体の濃度の比を一定に制御し続けることができる。したがって、例えば培養液7に投入された微生物が酸化還元物質3を酸化あるいは還元することによりCox/Cred(酸化体と還元体の濃度比)が変化した場合でも、所定のCox/Credに制御して、培養液4aの酸化還元電位を一定値に維持することができる。尚、培養液4aの酸化還元電位は、作用極9の設定電位Vに相当する。
【0031】
ここで、作用極9の設定電位Vは、参照電極11に対する作用極9の電位に相当することから、参照電極11の種類によってその値が変化する。本明細書における設定電位Vは、標準水素電極に対して+0.22Vを示す銀・塩化銀電極電位に対する値としているが、参照電極11の種類は銀・塩化銀電極に限られるものではない。
【0032】
培養容器5を二層に区画しているイオン交換膜6は、酸化還元物質3を対極槽8側に透過させることなく、イオンのみを透過させて、培養槽7と対極槽8との間でイオン交換膜6を介してイオン電流を伝達させるものである。例えば、イオン交換膜6を一価の陽イオンのみを透過する膜とし、酸化還元物質3を鉄イオン(二価及び三価)とすれば、酸化還元物質3を培養槽7の培養液4aに留めたままで、培養液4a及び電解液4bのイオン(水素イオン、ナトリウムイオン、カリウムイオン)などの一価の陽イオンがイオン交換膜6を通過して、培養槽7と対極槽8との間でイオン電流を伝達させることができる。その結果、培養液4aの酸化還元電位が所定の値に長期間維持されることになる。ここで、対極槽8に収容する電解液4bについては、イオン交換膜6を透過しうるイオンを組成に有していれば特に限定されるものではない。尚、電解液4bとして培養液4aを用いてもよい。
【0033】
培養対象微生物2の至適電位は、以下に説明する微生物の増殖評価試験から導き出すことができる。即ち、電位以外の培養条件を全て揃え、電位をある範囲内、例えば−1.0V〜+1.0Vの範囲内で各種条件振りして培養実験を行う。また、通電しない(電位制御を行わない)場合についても同様に培養実験を行う。そして、対数増殖期の開始時を判断可能な期間で培養を行い、対数増殖期の開始時が通電しない場合と比較して早まった場合、その電位を培養対象微生物2の至適電位と判断することができる。
【0034】
例えば硫酸還元菌の場合、至適電位は銀・塩化銀電極電位基準で−0.6V以下であり、より好適には−0.6V〜−0.9Vであり、さらに好適には−0.7Vである。−0.9Vよりも小さくすると、対極10からの水素発生量が増加しすぎて酸化還元電位の制御が正確に行えなくなる虞がある。
【0035】
至適電位の制御は、少なくとも培養開始時から至適電位における培養対象微生物2の対数増殖期開始時までの期間において行うことが好ましい。この期間に至適電位の制御を行うことによって、培養対象微生物2の細胞内におけるATP、NADH及びNADPHの単位時間当たりの生産量を向上させる効果が得られる。ここで、至適電位の制御は、培養開始時から至適電位における培養対象微生物2の対数増殖期中点までの期間において行うことがより好ましい。この場合には、培養対象微生物2の細胞内におけるATP、NADH及びNADPHの単位時間当たりの生産量を向上させる効果がより確実に得られる。尚、培養開始時から至適電位における培養対象微生物2の対数増殖期中点までの期間を超えて至適電位の制御を行っても、ATP、NADH及びNADPHの単位時間当たりの生産量の向上効果は殆ど得られなくなる。
【0036】
培養対象微生物2を硫酸還元菌とする場合には、上記至適範囲の電位に制御し、この至適範囲に電位を制御した際の硫酸還元菌の増殖曲線を調べておく。そして、得られた増殖曲線から、対数増殖期開始時と対数増殖期中点を求めることにより、ATP、NADH及びNADPHの単位時間当たりの生産量を向上させる効果が得られる電位制御期間を導き出すことができる。
【0037】
例えば硫酸還元菌を培養対象微生物2とした場合において、至適電位を−0.7Vとすると、対数増殖期開始時は培養開始時から24時間となり、対数増殖期中点は培養開始時から35時間となる。したがって、電位の制御は少なくとも培養開始時から24時間行うことが好ましいことになり、培養開始時から35時間行うことがより好ましいことになる。本願発明者等の実験によれば、実際にこの期間においてATP、NADH及びNADPHの単位時間当たりの生産量の向上効果が得られることが確認されている。、また、培養開始時から35時間を超えて至適電位の制御を行っても、ATP、NADH及びNADPHの単位時間当たりの生産量の向上効果は殆ど得られなくなることも本願発明者等の実験により確認されている。
【0038】
尚、本発明によれば、エネルギー物質であるATP、NADH及びNADPHの単位時間当たりの生産量の向上効果に加えて、呼吸や複製・分裂に関与する遺伝子の転写活性化効果及び呼吸酵素群での電子移動反応の活性化効果が得られることが確認された。即ち、本発明によれば、培養対象微生物2のエネルギー物質であるATP、NADH及びNADPHの単位時間当たりの生産量を向上させることによって、細胞内における利用可能なエネルギー量が多くなり、その結果として、呼吸や複製・分裂に関与する遺伝子の転写活性化効果及び呼吸酵素群での電子移動反応の活性化効果が得られるものと考えられる。また、エネルギー生産と呼吸は酸化的リン酸化経路において密接に関連していることから、電位制御によって呼吸酵素群が活性化したり、さらには電位制御によって呼吸に関与する遺伝子が活性化した結果として呼吸酵素群が活性化したりすることにより、エネルギー物質の単位時間当たりの生産量が向上することも考えられる。つまり、本発明によれば、これらの効果も相俟ってエネルギー物質の生産効率が極めて優れたものになると考えられる。
【0039】
以上、本発明によれば、微生物の細胞内の種々の反応の根幹をなすエネルギー物質であるATP、NADH及びNADPHの単位時間当たりの生産量の向上させる効果が得られることから、細胞内の利用可能エネルギーを高めることができる。したがって、これらのエネルギー物質を利用した微生物反応によりバイオプロセスを実施する場合に、微生物の機能を早期に向上させてバイオプロセスを早期に安定に立ち上げることが可能になる。また、環境中において休眠している微生物の細胞内の利用可能エネルギーを高めて、その増殖に関与する細胞内反応を活性化させることにより、難培養微生物を増殖することが可能になるものと考えられる。
【0040】
また、本発明と特開2006−55134号公報に記載された発明とを組み合わせることで、優れた効果が発揮される場合がある。特開2006−55134号公報に記載された発明は、培養対象微生物によって還元された物質を電気的に酸化し再生させ、これを継続して培養対象微生物に供給することにより培養対象微生物を選択的に培養する方法である。しかしながら、上記の通り、この方法によると、培養開始からある一定期間は培養対象微生物の生育に必要な物質が十分に存在している状態であることから、培養開始からある程度の培養期間が経過してその物質の量が大きく減少し始めるまでは微生物の十分な増殖効果は得られない。そこで、本発明の方法により、至適電位の制御を、少なくとも培養開始時から至適電位における培養対象微生物の対数増殖期開始時までの期間において行い
、より好ましくは培養開始時から至適電位における培養対象微生物の対数増殖期中点までの期間において行い、培養対象微生物の細胞内のATP、NADH及びNADPHの単位時間当たりの生産量を向上させて、その増殖及び呼吸能を早期に誘導させ、その後に培養対象微生物によって還元された物質を電気的に酸化し再生させ、これを継続して培養対象微生物に供給することにより、微生物の培養及び維持を長期にわたり行うことができる。即ち、本発明による培養対象微生物の細胞内のATP、NADH及びNADPHの単位時間当たりの生産量の向上効果によって付随的に培養対象微生物に必要な物質が還元されて減少してしまうが、本発明の方法を実施した後に、培養対象微生物によって還元された物質を電気的に酸化し再生させ、これを継続することで、長期にわたって培養対象微生物の増殖及び維持することができる。
【0041】
尚、上述の形態は本発明の好適な形態の一例ではあるがこれに限定されるものではなく本発明の要旨を逸脱しない範囲において種々変形実施可能である。
【0042】
例えば、上述の実施形態では、培養対象微生物2を培養液4aに添加するようにしていたが、培養対象微生物2を担体上に担持して本発明を実施するようにしてもよい。具体的には、作用極9を微生物を担持し得る導電性担体、例えば炭素電極、好適には多孔性炭素電極とし、導電性担体に培養対象微生物2を予め担持させ、導電性担体の電位を培養対象微生物2の至適電位に制御するようにして培養環境4の電位を制御するようにしてもよい。あるいは、培養液4aに添加した培養対象微生物2を、電位を制御して培養する過程で徐々に導電性担体に担持させるようにしてもよい。いずれの場合においても、本発明と同様の効果が得られる。
【0043】
また、図2に示すように、上述の実施形態で用いた微生物培養装置1とは別の微生物培養装置1aを用いるようにしてもよい。即ち、培養容器5をイオン交換膜6により培養槽7と対極槽8に仕切ることなくイオン交換膜6を少なくとも一部に備える密閉構造の容器とし、作用極9は培養容器5内に配置されると共に対極10は培養容器5の外側に配置され、培養容器5に培養液4aが収容されると共に作用極9が培養液4aに浸され、培養容器5のイオン交換膜6は培養容器5に培養液4が収容されたときに少なくともその一部が培養液4aと接触しうる位置に備えられ、イオン交換膜6の培養液4aとの接触面とは反対側の面の少なくとも一部に対極10が接触して配置されているものとしている。尚、図2では、培養容器5の培養液4aの液面よりも下部に開口部5aが設けられ、開口部5aがイオン交換膜6で塞がれ、培養容器5の外側のイオン交換膜6の表面の少なくとも一部に対極10が接触して配置されているものとしている。また、培養容器5内の培養液4aの液面よりも上部の空間に滞留するガス状物質を回収するガス回収手段15と、培養容器5内の培養液4を採取する培養液採取手段16とを備えるものとしている。
【0044】
図2に示す微生物培養装置1aを用いることで、対極10から発生するガスによる培養対象微生物2の生育状態への悪影響を排除しながら、培養容器5内で発生したガス状物質(培養対象微生物2が生産したガス状物質や微生物が生産した揮発性物質が揮発して生じたガス成分)を培養容器5の外の漏洩することなく、ガス回収手段15から回収しながら、本発明の微生物細胞内のエネルギー物質の生産制御方法を実施することができる。したがって、培養対象微生物2の細胞内においてエネルギー物質(ATP、NADH及びNADPH)の単位時間当たりの生産量が向上したことにより奏される微生物反応の促進効果によって、培養対象微生物2によるガス状物質等の生産が促進された場合にも、生産されたガス状物質等を無駄なく回収することができる。尚、対極10は多孔質体とすることが好適である。この場合には、イオン交換膜6と対極10との接触面で発生したガスを接触面とは反対側の面に通過させやすくなる。また、対極10を多孔質体とし、イオン交換膜6を塗布形成するための薬剤、例えばナフィオン分散液を用いてイオン交換膜6を貼り付けることで、ナフィオン分散液の多孔質体の孔への侵入によりイオン交換膜6と対極10との接触面積を増大させて電気化学反応をより進行させやすくすることができ、好適である。
【0045】
さらに、図3に示すように、上述の実施形態で用いた微生物培養装置1とはさらに別の微生物培養装置1bを用いるようにしてもよい。即ち、イオン交換膜6によって仕切られ且つ開放された二つの槽(培養槽7と対極槽8)と、培養槽7を、対極槽8から発生するガスが培養槽7へ侵入するのを防ぐ密閉構造(図3では、培養槽7の上方開放部をガス不透過膜またはガス不透過部材24により塞いでいる)とするようにしてもよい。この場合にも図2に示す微生物培養装置1aと同様に、対極10から発生するガスによる培養対象微生物2の生育状態への悪影響を排除しながら、培養容器5内で発生したガス状物質(培養対象微生物2が生産したガス状物質や微生物が生産した揮発性物質が揮発して生じたガス成分)を培養容器5の外の漏洩することなく回収しながら、本発明の微生物細胞内のエネルギー物質の生産制御方法を実施することができる。
【0046】
より具体的には、図4に示すように、密閉構造の容器20を培養槽7とし、容器20に収容可能な密閉構造の小容器21を対極槽8とし、小容器21は少なくとも一部にイオン交換膜6を備えると共にガス(対極槽から発生するガス)を容器20の外に排出するガス排出管22を備えるものとする。そして、培養槽7内の培養液4aの液面よりも上部の空間に滞留するガス状物質を回収するガス回収手段15と、培養槽7の培養液4aを採取する培養液採取手段16とを備えるものとしている。尚、培養槽7としての密閉構造の容器20は、対極槽8としての密閉構造の小容器21を収容可能な大きさの容器であり、形状は特に限定されない。容器の材質としては、例えば、ガラス、プラスチック、絶縁処理を施した金属、コンクリート等が挙げられるがこれらに限定されるものではない。また、ガス不透過性の膜材をヒートシール等により袋状に形成した容器を培養槽7として用いるようにしてもよい。また、対極槽8としての密閉構造の小容器21は、培養槽7としての容器20に収容可能な大きさの容器であり、少なくとも一部にイオン交換膜6を備えるものとしている。尚、図4では、小容器21全体をイオン交換膜6で形成した袋状の容器としているが、小容器21はこの形態に限定されるものではない。例えば、袋状の容器の片面だけをイオン交換膜6で構成してもよいし、一つの面のさらに一部分をイオン交換膜6のみで構成してもよい。部分的にイオン交換膜6を用いる場合には、その他の部分は容器20と同様の上記材質で構成してもよいし、イオン交換膜6以外の膜材、例えばガス不透過性の膜材により構成し、小容器21からのガス(対極槽8から発生するガス)が容器20の内部に漏洩しないようにしてもよい。尚、容器20に小容器21を収容することで、容器20に収容されている培養液4aに小容器21が浸され、小容器21の少なくとも一部に備えられているイオン交換膜6と培養液4aとが接触する。したがって、培養液4aに浸されている作用極9と、電解液4aに浸されている対極10との間に電位差を与えた際に、作用極9と対極10との間でイオン電流が発生し、培養液4aの酸化還元電位を制御することが可能となる。
【0047】
尚、図2〜図4に示す微生物培養装置では、培養槽7内の培養液4aの液面よりも上部の空間(ヘッドスペース)に滞留するガス状物質を培養槽7の外(電気培養装置の外)へ導くガス排出管15aを備え、このガス排出管15aをバルブ15bにより開閉可能としたガス回収手段15により、培養槽7内のガス状物質を回収するようにしている。しかしながら、ガスの回収方法は、この方法に限定されるものではない。例えば、培養槽7の上部に開口部を設けて合成ゴム等(例えばシリコーンゴム)の弾性材料でこの開口部を塞ぎ、開口部を塞ぐ弾性材料に注射器の注射針を刺してヘッドスペースからガス状物質を回収するようにしてもよい。合成ゴム等の弾性材料は、注射針を引き抜くと孔が塞がるので、ガス状物質の回収を行わないときには、注射針を引き抜いておいても、培養槽7の密閉状態が維持される。
【0048】
さらに、本実施形態では、培養槽7内の培養液4aの液面よりも下部に、培養槽7内の培養液4aを培養槽7の外に導く培養液排出管16aを備え、この培養液排出管16aをバルブ16bにより開閉可能とした培養液採取手段16により、培養槽7内から培養液4aを採取するようにしている。しかしながら、培養液4aの採取方法は、この方法に限定されるものではなく、上記と同様、培養槽7に開口部を設けて合成ゴム等の弾性材料で塞ぎ、注射器の注射針を刺して培養液4aを採取するようにしてもよい。または両端が開口された管をの一端の注射器に接続し、他端を培養液4aに浸けて、管を介して培養液4aを採取するようにしてもよい。
【0049】
また、ガス回収手段15や培養液採取手段16とは別に、培養液4aに物質を添加・供給する手段を設けるようにしてもよい。具体的には、培養槽7の外部から培養液4aに物質を添加・供給することのできる開閉可能な物質導入管を備えるようにしてもよい。この場合には、微生物2に必要な栄養源や、微生物2が目的の物質を生産するのに必要な物質、微生物2の増殖や代謝に伴い変動する培養液4aの状態を一定の状態に維持するための中和剤、培養液4aそのもの等を必要に応じて添加することができる。また、培養環境を嫌気性や好気性に維持するためにガスを供給することもできる。しかしながら、培養液に物質を添加・供給する手段は必ずしも備える必要はなく、ガス回収手段15や培養液採取手段16を培養液4aに物質を添加・供給する手段として併用するようにしてもよい。また、上記のように注射器の注射針を弾性材料に差し込んで培養液4aに物質を添加・供給するようにしてもよい。
【0050】
尚、図1に示す微生物培養装置1は、培養環境を嫌気性や好気性に制御する際に、微生物培養装置1の培養容器5を密閉性のあるボックスに収容する必要があることから、培養環境の管理(pH調整や物質供給等)が非常に煩雑である。また、微生物2の培養を行った後に再度別の微生物2を培養する場合には、ボックスも滅菌処理する必要があった。これに対し、図2に示す微生物培養装置1aによれば、培養容器5内に供給したガス等が培養容器5の外に漏洩することが無い。また、図3及び図4に示す微生物培養装置1bによれば、培養槽7内に供給したガス等が培養槽7の外に漏洩することが無い。したがって、培養環境を嫌気性や好気性に制御しやすく、図1に示す微生物培養装置1のように培養容器5をボックスに収容することなく、培養環境をそのまま管理することができる。したがって、培養容器5をボックスに収容していた従来法と比較して培養環境の管理が容易になると共に、再度培養を行う際にボックスを滅菌する手間を省くことも可能となる。
【実施例】
【0051】
本発明の実施例を以下に説明するが、本発明は以下の実施例に限定されるものではない。
【0052】
(実施例1)
硫酸還元菌であるDeslfovibrio desulfuricans NBRC13699を培養対象微生物として各種実験を行った。
【0053】
<実験装置>
図1に示す培養装置を使用した。具体的には、培養容器5は外径75mm、高さ90mmのガラス製深底シャーレの内側を、一価の陽イオン透過性の交換膜(旭化成、K−192)6で仕切った二槽式とし、一方を培養槽7、他方を対極槽8とした。培養槽7には炭素板(40mm×70mm、4mm厚)の作用極9と、銀・塩化銀参照電極11(HS−205C、東亜DKK社)を設置した。対極槽8には炭素板(40mm×70mm、4mm厚)の対極10を設置した。これら3本の電極9,10,11は電位制御装置(扶桑製作所、POTENTIO/GALVANOSTAT model 110)12に結線して、培養槽7内の作用極9の電位を厳密に設定可能とした。また、培養に際しては、培養容器5をアクリル製の嫌気ボックス内に封入し、さらに嫌気ボックス全体を30℃に設定した恒温槽内に設置した。嫌気ボックス14には、常時窒素ガスを注入し(0.2L/min)、嫌気雰囲気を維持した。尚、以降の実施例に示す電位は、全て銀・塩化銀電極電位基準の電位である。
【0054】
対極槽8に収容する電解液4bは以下のようにして得た。即ち、NH4Cl;1.0g、K2HPO4;0.5g、MgSO4・7H2O;2.0g、CaSO4・2H2O;1.0gを蒸留水1Lに溶解して調整した液体をオートクレーブ滅菌処理して得た。
【0055】
また、培養槽7に収容する培養液4aは、電解液4bに乳酸ナトリウム;2.8g、クエン酸三ナトリウム二水和物;0.625g、酵母エキスを1.0g、酸化還元物質3としてAQDS(アントラキノン−2,6−ジスルホン酸二ナトリウム)を0.42g添加し、フィルター(0.22μm、Millex−GS、MILLIPORE、Ireland)によりろ過除菌して得た。尚、硫酸還元菌は乳酸を炭素源として生育可能な微生物であるが、硫酸還元菌の生育に必要な微量元素を補填するために酵母エキスを添加した。また、培養液4aには、硫酸還元菌を添加(植菌)し、初期菌体密度を1.0×107cells/mLとした。菌体密度は光学顕微鏡で硫酸還元菌を計数した結果から求めた。
【0056】
<実験結果>
(1)硫酸還元菌の増殖及びエネルギー物質の経時変化
電位を−0.7Vに制御し続けたまま培養した場合と通電を行わずに培養した場合とで、硫酸還元菌の増殖の経時変化と微生物細胞内の主要なエネルギー物質であるATPの濃度の経時変化にどのような違いが現れるのかを確認する実験を行った。
【0057】
一定の培養期間毎に培養液4aを採取し、菌体密度とATP濃度の定量を行った。菌体密度は光学顕微鏡で硫酸還元菌を計数した結果から求めた。ATP濃度の定量は、ルシフェール250プラス及びルミテスターC−100N(キッコーマン)を用い、キット付属のプロトコールに従って実施した。
【0058】
実験結果を図5に示す。図5において、◆は電位を−0.7Vに制御した場合における菌体密度を示し、■は通電しなかった場合における菌体密度を示し、▲は電位を−0.7Vに制御した場合におけるATP濃度を示し、×は通電しなかった場合におけるATP濃度を示している。
【0059】
図5に示される実験結果から、電位を−0.7Vに制御しながら培養を行うことで、対数増殖期の開始時を10時間程度早められることが明らかとなった。また、ATP濃度についても、電位を−0.7Vに制御しながら培養を行うことで、早期に高められることが明らかとなった。一方で、培養開始から35時間経過した後は、ATP濃度に変化が見られなくなった。
【0060】
次に、図5の実験結果について、ATP濃度を細胞1個体当たりに換算した実験結果、つまり、硫酸還元菌の細胞1個体当たりのATP生産量の経時変化を図6に示す。図6に示される結果から、少なくとも培養開始から24時間電位の制御を行うことで、硫酸還元菌の細胞1個体当たりのATP生産量を十分に向上できることが明らかとなった。硫酸還元菌において、尚、電位を−0.7Vに制御しながら硫酸還元菌を培養したときの培養開始から24時間経過時は、電位を−0.7Vに制御しながら培養したときの硫酸還元菌の対数増殖期開始時(対数増殖期の立ち上がり)に該当する。したがって、この結果から硫酸還元菌に限らず微生物全般について、培養対象微生物の培養の際に、培養環境の電位を培養対象微生物の至適電位に制御し、且つ至適電位の制御を少なくとも培養開始時から至適電位における培養対象微生物の対数増殖期開始時まで行うことで、微生物細胞内におけるATPの単位時間当たりの生産量を向上できることが導かれた。
【0061】
ここで、細胞の状態を知るためには、細胞が実際に利用できるエネルギー量の指標であるアデニル酸エネルギー充填率(adenylate energy charge、以下、AEC値と呼ぶ)による評価が有効である。そこで、以下の式によりAEC値を求めた。
(AEC値)=([ATP]+0.5[ADP])/([AMP]+[ADP]+[ATP])
【0062】
また、ADP(アデノシン二リン酸)はピルベートキナーゼによる以下の反応Aを利用してATPに変換してから定量し、AMP(アデノシン一リン酸)は以下の反応A及びmyoキナーゼによる以下の反応Bの組み合わせによりATPに変換してから定量した。
(反応A); ADP+phosphoenolpyruvate→ATP+pyruvate
(反応B); AMP+ATP→2ADP
【0063】
尚、AEC値は、対数増殖期初期及び対数増殖期中点において求めた。対数増殖期中点は、以下の式により算出される対数増殖期中点の菌体密度から求めた。また、対数増殖期初期は、増殖開始(対数増殖期開始時(立ち上がり時))から対数増殖期中点までの期間とした。
(対数増殖期中点の菌体密度)=((最終到達菌体密度)−(初期菌体密度))/2
【0064】
本実験では、対数増殖期中点は培養開始から35時間(電位を−0.7Vに制御時)、培養開始から45時間(通電なし)であり(菌体密度2.0×108cells/mL)、対数増殖期中点のAEC値はこのときの培養液のATP、ADP及びAMPの定量分析結果から求めた。また、対数増殖期初期は24〜35時間(電位を−0.7Vに制御時)、35〜45時間(通電なし)であり、AEC値はこの期間において菌体密度が8.0×107cells/mLとなるとき(培養から30時間(電位を−0.7Vに制御時)、培養から42時間(通電なし))の培養液のATP、ADP及びAMPの定量分析結果から求めた。
【0065】
実験結果を図7に示す。棒グラフの上の数値は通電なしの場合を100とした場合のAEC値の相対値である。図7に示される結果から、電位を−0.7Vに制御しながら培養を行うことで、対数増殖期初期におけるAEC値を通電しないときのおよそ3倍に増加できることが明らかとなった。これに対し、対数増殖期中点では、通電の有無によってはAEC値が殆ど変化しなかった。
【0066】
これらの結果から、電位を−0.7Vに制御しながら培養を行うことで、対数増殖期初期において、通電しない場合よりも酸化的リン酸化を促進させることができることがわかった。つまり、電位を−0.7Vに制御することにより、対数増殖期初期における菌体1個体当たりの単位時間当たりのATP生産量を増加させやすくできることがわかった。一方で、対数増殖期中点においては、電位制御が酸化的リン酸化に影響を与えないこともわかった。
【0067】
次に、対数増殖期初期と対数増殖期中点において、微生物細胞内の主要なエネルギー物質であるNADH及びNADPHの濃度の通電の有無による違いについて検討した。
【0068】
尚、AEC値を求めた場合と同様、対数増殖期中点は培養開始から35時間(電位を−0.7Vに制御時)、培養開始から45時間(通電なし)とした(菌体密度2.0×108cells/mL)。また、対数増殖期初期は24〜35時間(電位を−0.7Vに制御時)、35〜45時間(通電なし)とし、この期間において菌体密度が8.0×107cells/mLとなるときの培養液をNADH及びNADPHの定量分析に供した。
【0069】
NADH及びNADPHの定量は、それぞれNAD/NADH Quantification kit及びNADP/NADPH Quantification kit(Biovision Inc, US)を用いて実施した。詳細には、一定期間培養した後に回収した硫酸還元菌の細胞を超音波破砕機により破砕し、破砕液を遠心分離操作により分離して上清液を測定に供した。
【0070】
実験結果を図8及び図9に示す。尚、図8がNADH(さらにNAD+)の定量分析結果を示す図であり、図9がNADPH(さらにはNADP+)の定量分析結果を示す図である。これらの結果から、電位を−0.7Vに制御することで、対数増殖期初期におけるNADH及びNADPHを通電しないときよりも増加できることが明らかとなった。これに対し、対数増殖期中点では、通電の有無によってはNADH及びNADPHが殆ど変化しなかった。尚、NAD+及びNADP+については、いずれの場合も殆ど変化が見られなかった。
【0071】
NADH及びNADPHは、細胞内の酸化還元酵素に関わる細胞内で最も多い補酵素であり、ATPの合成原料となる分子である(1分子のNAD(P)Hから3分子のATPが酸化的リン酸化反応で合成される)。ここで、細胞内ATPの生産に関する上記実験では、少なくとも培養開始から24時間まで電位を−0.7Vに制御することで、硫酸還元菌の細胞内ATPの単位時間当たりの生産量の向上効果が得られることが確認されたことから、ATPの合成原料であるNADH及びNADPHについても、少なくとも培養開始から24時間まで電位を−0.7Vに制御することで、細胞内生産量を向上できるものと考えられる。また、上記の実験結果から、培養開始時から対数培養期初期における菌体密度が8.0×107cells/mLに到達するまでの期間(培養開始時から30時間)まで電位を−0.7Vに制御し続けることで、ATP、NADH及びNADPHの単位時間当たりの生産量を確実に向上させることができ、培養開始時から対数培養期中点まで−0.7Vに制御し続けることで、ATP、NADH及びNADPHの単位時間当たりの生産量をさらに確実に向上させることができることがわかった。そして、このことから、微生物全般に関し、培養環境の電位を培養対象微生物の至適電位に制御するとともに、至適電位の制御を少なくとも培養開始時から至適電位における培養対象微生物の対数増殖期開始時までの期間において行うことで、ATP、NADH及びNADPHの単位時間当たりの生産量を向上させる効果が得られ、至適電位の制御を培養開始時から至適電位における培養対象微生物の対数増殖期中点までの期間において行うことで、ATP、NADH及びNADPHの単位時間当たりの生産量を向上させる効果が確実に得られることが導かれた。
【0072】
(2)遺伝子転写分析
上記(1)の実験における対数増殖期初期の遺伝子転写活性と対数増殖期中点の遺伝子転写活性について通電の有無による違いを検討した。
【0073】
上記(1)の実験において、電位を−0.7Vに制御しながら培養を行った場合と通電を行わずに培養を行った場合について、対数増殖期初期(菌体密度:8×107cells/mL)の菌体と対数増殖期中点(菌体密度:2×108cells/mL)の菌体を回収した。回収した菌体はRNA精製を行うまでRNA later(Ambion, USA)に浸し、−20℃で保存した。
【0074】
上記保存された菌体から全RNAを抽出・精製した。具体的には、Ribopure-Bacteria kit (Ambion, USA)を用いて精製を行った後、Turbo DNase-free (Ambion, USA) で処理することで混在するゲノムDNAを除去し、精製RNAを得た。精製度は分光光度計(A260/A280)及び電気泳動にて検証した。
【0075】
次に、精製RNAの100ngについて、Transcriptor(Roche, Switzerland)を用いてランダムヘキサマーをプライマーとして逆転写反応を行い、cDNAを調製した。このcDNAを鋳型として、Light cycler ST300(Roche, Switzerland)を用いたリアルタイムPCRにより、16S rRNA遺伝子およびporA, hydA, cytc3, dsrA, gyrA遺伝子の定量を行った。この定量値が各遺伝子の転写量を反映する値である。解析対象とした遺伝子および使用したプライマーの塩基配列を表1に示す。また、使用したプライマーの塩基配列を配列表に示す。尚、プライマーは各種機能遺伝子の配列を基にprimer3 plus programによりデザインした。リアルタイムPCR反応はLight Cycler Fast start DNA Master SYBR GreenIを用い、表2に示す反応条件にて行った。増幅断片の融解曲線分析において目的遺伝子断片の単一ピークのみが得られた試料のみ解析を進めた。
【0076】
【表1】

【0077】
【表2】

【0078】
ここで、本実施例において定量対象とした遺伝子の硫酸還元菌内における機能について図10に基づいて説明する。porAは乳酸分解に関与する遺伝子である(図10の(a))。hydA及びcytc3は電子伝達に関与する遺伝子である(図10の(b))。dsrAは硫酸還元に関与する遺伝子である(図10の(c))。そして、gyrAは複製及び分裂に関与する遺伝子である(図10の(d))。
【0079】
各種遺伝子の発現量は測定値を16S rRNA遺伝子量を基準に標準化し、各細胞あたりの発現量として相対評価した。転写量の相対比較はSecond derivative maximum法により算出したCt値 (Crossing time) を用いた比較Ct法により行った。
【0080】
実験結果を図11に示す。尚、図11では、通電なしの場合の遺伝子転写量を1(図11中の点線)とし、電位を−0.7Vに制御した場合の遺伝子転写量をその相対値として示した。つまり、遺伝子転写量が1より大きければ、電位を−0.7Vに制御することにより遺伝子転写が活性化していることになる。図11に示される結果から、対数増殖期初期において、porA以外の遺伝子の転写が活性化していることが確認された。上記の通り、対数増殖期初期においては、細胞内の主要なエネルギー物質であるATP、NADP及びNADPHの単位時間当たりの生産量が向上することが確認されたことから、細胞内における利用可能エネルギー量が向上したことで、主に呼吸に関与する遺伝子であるhydA、cytc3及びdsrA、複製・分裂に関与する遺伝子であるgyrAの転写が活性化されたものと考えられる。つまり、この結果から、微生物全般に関して、ATP、NADP及びNADPHの単位時間当たりの生産量を増加させることによって、呼吸に関与する遺伝子や複製・分裂に関与する遺伝子を活性化させ、生育の活性化(増殖の促進)を図りつつ、その機能を向上させる効果が得られるものと考えられる。また、エネルギー生産と呼吸は酸化的リン酸化経路において密接に関連していることから、電位制御によって呼吸に関与する遺伝子が活性化した結果として呼吸酵素群が活性化することにより、エネルギー物質の単位時間当たりの生産量が向上することも考えられることから、この効果も相俟ってエネルギー物質の生産効率が極めて優れたものになると考えられる。
【0081】
(3)乳酸分解速度と硫酸還元速度の分析
硫酸還元菌の主要な反応である乳酸分解と硫酸還元について、培養開始時の乳酸濃度及び硫酸濃度の定量分析結果と、対数増殖期初期における乳酸濃度及び硫酸濃度を定量分析結果とに基づき、培養開始時から対数増殖期初期にかけての乳酸分解速度及び硫酸還元速度を求め、通電の有無(通電した場合は電位を−0.7Vに制御)による乳酸分解速度及び硫酸還元速度の違いについて検討した。
【0082】
硫酸イオン濃度及び乳酸イオン濃度はイオンクロマトアナライザ(ICS-1500、DIONEX製)により測定した。
【0083】
結果を図12及び図13に示す。図12が通電の有無による乳酸分解速度の違いを示す図であり、図13が通電の有無による硫酸還元速度の違いを示す図である。尚、図12及び図13ともに、棒グラフの上に、通電なしの場合の速度を100とした場合に対する通電ありの場合の速度を掲載した。これらの結果から、乳酸分解速度及び硫酸還元速度ともに通電ありの場合に向上した。上記の通り、対数増殖期初期においては、細胞内の主要なエネルギー物質であるATP、NADP及びNADPHの単位時間当たりの生産量が向上することが確認されたことから、細胞内における利用可能エネルギー量が向上したことで、乳酸分解反応と硫酸還元反応が促進されたものと考えられる。つまり、この結果から、微生物全般に関して、ATP、NADP及びNADPHの単位時間当たりの生産量を増加させることによって、微生物の呼吸にかかる機能を向上させて、微生物による有用物質等の生産速度の促進や、環境汚染物質の分解速度の促進を図ることが可能になるものと考えられる。また、エネルギー生産と呼吸は酸化的リン酸化経路において密接に関連していることから、電位制御によって呼吸酵素群が活性化することにより、エネルギー物質の単位時間当たりの生産量が向上することも考えられることから、この効果も相俟ってエネルギー物質の生産効率が極めて優れたものになると考えられる。
【特許請求の範囲】
【請求項1】
培養対象微生物を含む培養環境の電位を前記培養対象微生物の至適電位に制御するとともに、前記至適電位の制御を少なくとも培養開始時から前記至適電位における前記培養対象微生物の対数増殖期開始時までの期間において行い、前記培養対象微生物の細胞内におけるアデノシン三リン酸(ATP)とニコチンアミドアデニンジヌクレオチド(NADH)とニコチンアミドアデニンジヌクレオチドリン酸(NADPH)の単位時間当たりの生産量を向上させることを特徴とする微生物細胞内におけるエネルギー物質の生産制御方法。
【請求項2】
前記至適電位の制御を培養開始時から前記至適電位における前記培養対象微生物の対数増殖期中点までの期間において行う請求項1に記載の微生物細胞内におけるエネルギー物質の生産制御方法。
【請求項3】
硫酸還元菌を含む培養環境の電位を銀・塩化銀電極電位基準で−0.6V以下に制御するとともに、前記電位の制御を少なくとも培養開始時から前記電位における前記硫酸還元菌の対数増殖期開始時までの期間において行い、前記硫酸還元菌の細胞内におけるアデノシン三リン酸(ATP)とニコチンアミドアデニンジヌクレオチド(NADH)とニコチンアミドアデニンジヌクレオチドリン酸(NADPH)の単位時間当たりの生産量を向上させることを特徴とする微生物細胞内におけるエネルギー物質の生産制御方法。
【請求項4】
前記電位の制御を培養開始時から前記電位における前記硫酸還元菌の対数増殖期中点までの期間において行う請求項3に記載の微生物細胞内におけるエネルギー物質の生産制御方法。
【請求項5】
硫酸還元菌を含む培養環境の電位を銀・塩化銀電極電位基準で−0.7Vに制御するとともに、前記電位の制御を少なくとも培養開始時から24時間行い、前記硫酸還元菌の細胞内におけるアデノシン三リン酸(ATP)とニコチンアミドアデニンジヌクレオチド(NADH)とニコチンアミドアデニンジヌクレオチドリン酸(NADPH)の単位時間当たりの生産量を向上させることを特徴とする微生物細胞内におけるエネルギー物質の生産制御方法。
【請求項6】
前記電位の制御を培養開始時から35時間行う請求項5に記載の微生物細胞内におけるエネルギー物質の生産制御方法。
【請求項1】
培養対象微生物を含む培養環境の電位を前記培養対象微生物の至適電位に制御するとともに、前記至適電位の制御を少なくとも培養開始時から前記至適電位における前記培養対象微生物の対数増殖期開始時までの期間において行い、前記培養対象微生物の細胞内におけるアデノシン三リン酸(ATP)とニコチンアミドアデニンジヌクレオチド(NADH)とニコチンアミドアデニンジヌクレオチドリン酸(NADPH)の単位時間当たりの生産量を向上させることを特徴とする微生物細胞内におけるエネルギー物質の生産制御方法。
【請求項2】
前記至適電位の制御を培養開始時から前記至適電位における前記培養対象微生物の対数増殖期中点までの期間において行う請求項1に記載の微生物細胞内におけるエネルギー物質の生産制御方法。
【請求項3】
硫酸還元菌を含む培養環境の電位を銀・塩化銀電極電位基準で−0.6V以下に制御するとともに、前記電位の制御を少なくとも培養開始時から前記電位における前記硫酸還元菌の対数増殖期開始時までの期間において行い、前記硫酸還元菌の細胞内におけるアデノシン三リン酸(ATP)とニコチンアミドアデニンジヌクレオチド(NADH)とニコチンアミドアデニンジヌクレオチドリン酸(NADPH)の単位時間当たりの生産量を向上させることを特徴とする微生物細胞内におけるエネルギー物質の生産制御方法。
【請求項4】
前記電位の制御を培養開始時から前記電位における前記硫酸還元菌の対数増殖期中点までの期間において行う請求項3に記載の微生物細胞内におけるエネルギー物質の生産制御方法。
【請求項5】
硫酸還元菌を含む培養環境の電位を銀・塩化銀電極電位基準で−0.7Vに制御するとともに、前記電位の制御を少なくとも培養開始時から24時間行い、前記硫酸還元菌の細胞内におけるアデノシン三リン酸(ATP)とニコチンアミドアデニンジヌクレオチド(NADH)とニコチンアミドアデニンジヌクレオチドリン酸(NADPH)の単位時間当たりの生産量を向上させることを特徴とする微生物細胞内におけるエネルギー物質の生産制御方法。
【請求項6】
前記電位の制御を培養開始時から35時間行う請求項5に記載の微生物細胞内におけるエネルギー物質の生産制御方法。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図12】


【図13】


【図10】


【図11】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図12】


【図13】


【図10】


【図11】


【公開番号】特開2010−263848(P2010−263848A)
【公開日】平成22年11月25日(2010.11.25)
【国際特許分類】
【出願番号】特願2009−119080(P2009−119080)
【出願日】平成21年5月15日(2009.5.15)
【新規性喪失の例外の表示】特許法第30条第1項適用申請有り 平成21年3月5日 社団法人日本農芸化学会発行の「大会講演要旨集■2009年度(平成21年度)大会[福岡]■」に発表
【出願人】(000173809)財団法人電力中央研究所 (1,040)
【Fターム(参考)】
【公開日】平成22年11月25日(2010.11.25)
【国際特許分類】
【出願日】平成21年5月15日(2009.5.15)
【新規性喪失の例外の表示】特許法第30条第1項適用申請有り 平成21年3月5日 社団法人日本農芸化学会発行の「大会講演要旨集■2009年度(平成21年度)大会[福岡]■」に発表
【出願人】(000173809)財団法人電力中央研究所 (1,040)
【Fターム(参考)】
[ Back to top ]

