微粒子操作装置
【課題】
安価かつ簡便な構成で、その維持、管理に時間、費用更には熟練を必要としない微粒子の操作装置であって、特別の熟練を要することなく、精度の高い微粒子の処理を可能とする装置を提供すること。
【解決の手段】
微粒子懸濁液を収容する収容部、一対の電極が配置された電極基板及び電極に接続された交流電源とから構成され、前記収容部の一部は絶縁体の材料で構成されるとともに前記懸濁液を前記各電極に接触可能とする貫通孔を有することを特徴とする、微粒子操作装置により、前記課題を解決する。
安価かつ簡便な構成で、その維持、管理に時間、費用更には熟練を必要としない微粒子の操作装置であって、特別の熟練を要することなく、精度の高い微粒子の処理を可能とする装置を提供すること。
【解決の手段】
微粒子懸濁液を収容する収容部、一対の電極が配置された電極基板及び電極に接続された交流電源とから構成され、前記収容部の一部は絶縁体の材料で構成されるとともに前記懸濁液を前記各電極に接触可能とする貫通孔を有することを特徴とする、微粒子操作装置により、前記課題を解決する。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、微粒子を特定の位置に誘導し、捕捉する微粒子操作装置に関する。
【背景技術】
【0002】
無機材料系微粒子、有機材料系微粒子、生物試料系微粒子などを、それぞれの微粒子の物理的形状や物性を損なうことのないように、非接触、非破壊で捕捉し、保持し、選択し、移動させ、分別回収等する方法や装置として、光による微粒子の操作方法や光による微粒子の操作装置などが用いられてきた(例えば、特許文献1参照。なお本明細書では微粒子を非接触、非破壊で捕捉し、保持し、選択し、移動させ、分別回収等することを単に「操作する」等と表現することがある。)。この操作方法は、一般に光ピンセット法又は光トラップ法と呼ばれ、光源に主としてレーザーを用いることから、レーザートラッピング法などとも呼ばれている。詳しくは、光源からのレーザー光を集光光学系により円錐状に集光し、媒体中の微粒子近傍に照射することにより、微粒子に発生する光の放射圧を利用して微粒子を捕捉し、保持し、移動等させるものである。
【0003】
しかしながら、光トラップ法は、レーザー光源やその集光等のための光学系を必要とし、しかもその精密な制御が必要となることから、装置が高価、精密かつ大掛かりになって取扱いも複雑になるため、操作者に一定の熟練を強いるという課題がある。また光軸調整を含む光学系及び光源の維持管理にも時間、費用及び熟練が要求され、それに伴い管理費用が高騰するという課題もある。さらに光トラップ法では、基本的に微粒子を1個ずつ顕微鏡等で視覚的に確認しながら捕捉等しなければならないため、一度に大量の微粒子を操作できないという課題がある。
【0004】
光トラップ法等の微粒子操作方法及び操作装置は、例えば細胞等の異なる生物試料系微粒子を捕捉しておき、これらを融合させて1つの交雑細胞とする細胞融合のための基礎的な技術としてとらえることもできる(例えば、特許文献4参照)。しかしながら、上記したように、装置が高価、精密かつ大がかりになって取扱いが煩雑になり、操作者は一定の熟練が強いられる、光軸調整を含む光学系及び光源の維持管理にも時間、費用及び熟練が要求され、それに伴い管理費用も高騰する、微粒子を1個ずつ顕微鏡等で視覚的に確認しながら捕捉等しなければならないため、一度に大量の微粒子を操作できないため、細胞の操作効率を向上するためには更なる改良が必要である。
【0005】
細胞等の生物試料系微粒子の操作に関わる他の公知技術として、例えば特許文献2が開示するような、細胞融合用チャンバーの融合領域に対向するように配置された導電部材よりなる一対の電極と、前記一対の電極間に配置され、且つ前記一対の電極方向に貫通した貫通孔を有する絶縁体とよりなる細胞融合用チャンバーが報告されている。
【0006】
特許文献2について具体的に説明する。図1は特許文献2の細胞融合用チャンバーの断面図を示した概念図である。図1において、例えば樹脂材からなる細胞融合用チャンバーの融合領域(1)の両側には、導電部材からなる電極(2)が配置され、これら電極は導電線(3)を介して外部に設けられた電源(4)と接続されている。外部に設けられた電源は電界の強さが約400V/cmから700V/cm、周波数1MHz程度の高周波交流電圧を出力する交流電源(5)と、約7kV/cm、パルス幅50μsec程度のパルス電圧を出力する直流パルス電源(6)と、電極と交流電源又は直流パルス電源の電気的接続を切り換える為のスイッチ(7)とから構成されている。ここで、交流電源から出力する交流電圧には、通常、一般的な正弦波の波形を用いる。細胞融合用チャンバーは、電気的に絶縁な材料、例えばシリコーン樹脂からなる絶縁体(8)により2つの空間に区分けされている。ここで、絶縁体には最小口径が1μmから数十μmの貫通孔(9)が設けられている。また、細胞A(10)及び細胞B(11)はそれぞれ細胞融合用チャンバーの融合領域内の懸濁液内におかれている。
【0007】
上記特許文献2に記載された装置の動作を図2から図4を用いて具体的に説明する。最初に、電源(4)の切り換えスイッチ(7)を電界の強さが約400V/cmから700V/cm、周波数1MHzの高周波電圧を出力する交流電源(5)に接続する。この状態において電気力線(12)は、図2に示すように貫通孔(9)に集中する。細胞A(10)および細胞B(11)は、ここに集中する電気力線(12)のため誘電泳動力を受け、図3に示すように貫通孔(9)の中心付近に捕捉される。ここで細胞A(10)と細胞B(11)は出会い接触する。次に、電源(4)の切り換えスイッチ(7)を直流パルス電源(6)に切り換える。図3に示した状態におかれた細胞A(10)及び細胞B(11)は、パルス電圧により細胞A(10)および細胞B(11)の接触点で細胞膜の可逆的破壊が起こり、図4に示すように融合が生ずる。
【0008】
特許文献2の装置では、貫通孔において細胞Aと細胞B融合させることを目的としているため、2細胞を一対として取り扱う。従って、特許文献2に記載された装置によって一度に複数の融合細胞(51)を得ようとする場合、複数の貫通孔を絶縁体上に2細胞を一対として複数対捕捉する必要がある。しかしながら、交流電源を接続して細胞を貫通孔に捕捉する際に、ある貫通孔には複数の細胞が捕捉される一方で、細胞が全く捕捉されない貫通孔が発生するというように、不均一な細胞操作(不均一な貫通孔への捕捉)が発生するという課題がある。そこで、貫通孔をアレイ状に配置する(貫通孔をいずれの隣接する貫通孔とも等間隔となるように配置する、又は、貫通孔を縦横が等しい格子状に配置する)ことにより、微小粒子に作用する電気力線を均一化して細胞操作(貫通孔への捕捉)を均一化する試みもなされている。
【0009】
特許文献3では、アレイ状に配置した貫通孔に1つずつ細胞を捕捉する方法が開示されている(特許文献3参照)。この方法は、貫通孔(マイクロウエル)の内径と深さがそれぞれ細胞(被検体リンパ球)の粒径の1から2倍の大きさの貫通孔に、複数の細胞を含む懸濁液を貫通孔を覆うように加え、貫通孔内に細胞が沈むのを待つ過程と、貫通孔に沈んだ細胞以外の細胞を洗い流す洗浄の過程を繰り返し行うことで、1つの貫通孔に1つの細胞を捕捉するものである。しかしながら、特許文献3に記載された方法では、重力により細胞が沈むのを待つ時間が5分程度と長いこと、貫通孔内に細胞が沈むのを待つ過程と貫通孔に入らなかった細胞を洗い流す洗浄過程を繰り返すために操作が面倒かつ煩雑で迅速な処理を行い難いこと、そして貫通孔に入らなかった細胞を洗い流す過程で貫通孔に入った細胞も失われる可能性があるという課題があった。特に、任意の特異性について細胞を処理(選択)した後の場合には、貫通孔に入らなかった細胞を洗い流すのは大きなロスとなってしまう。
【0010】
【特許文献1】特開2001−290083号公報
【特許文献2】特公平7−4218号公報
【特許文献3】特許第3723882号公報
【特許文献4】特開平7−31455号広報
【発明の開示】
【発明が解決しようとする課題】
【0011】
本発明は、かかる従来の実状に鑑みて提案されたものであり、その目的は、安価な装置であって、簡便な構成であり、その維持、管理に時間、費用更には熟練を必要としない、微粒子の操作装置を提供することにある。また本発明の目的は、その使用に当たっては特別の熟練を要することなく、精度の高い微粒子の処理を可能とする装置を提供することにある。更に本発明の目的は、大量の微粒子を一度に処理し得る処理装置を提供することにある。
【課題を解決するための手段】
【0012】
上記目的を達成するためになされた本発明は、微粒子懸濁液を収容する収容部、一対の電極が配置された電極基板及び電極に接続された交流電源とから構成され、前記収容部の一部は絶縁体の材料で構成されるとともに前記懸濁液を前記各電極に接触可能とする貫通孔を有することを特徴とする、微粒子操作装置である。以下、図面を参照しつつ、本発明を詳細に説明する。
【0013】
本発明で取り扱うことができる微粒子は、電気的に静電容量性を有する微粒子であれば特に制限はなく、例えばシリカ、ジルコニア又は酸化ニッケル等の無機材料系微粒子、ポリスチレン等の有機材料系微粒子、抗体産生細胞やミエローマ細胞等の生物試料系微粒子を例示することができる。粒子の大きさも、後述する誘電泳動によって懸濁液中を移動できる範囲の大きさであれば制限はない。また装置に供する微粒子懸濁液は、上記のような微粒子が後述する誘電泳動で移動できる懸濁液であれば良い。例えば微粒子が無機材料系微粒子である場合には粒子径数μmから数百μm程度のジルコニア粒子を懸濁した水溶液を、微粒子が有機材料系微粒子である場合には粒子径粒子径数μmから数百μm程度のポリスチレン粒子を懸濁した水溶液を、微粒子が生物試料系微粒子である場合には抗体産生細胞(5μm程度の大きさ)やマウスのミエローマ細胞(10μm程度の大きさ)を懸濁したマンニトール水溶液(マンニトール濃度:300mM程度)を例示することができる。
【0014】
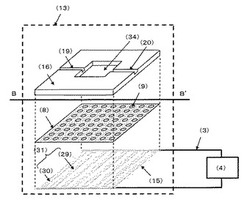
上記した微粒子を懸濁した懸濁液は、収容部に収容される。収容部は、その一部が絶縁体の材料で構成されるとともに、前記懸濁液を本発明の装置を構成する電極基板上に配置された電極に接触可能とする貫通孔を有する。かかる条件を満たす限り、収容部は、寸法や形状に特に制限はなく、また懸濁液を密閉した状態で収容するものに限られず、例えば上蓋のない液溜であっても良いし、例えば別途構成される細胞抽出装置に接続される流路の一部であっても良い。上蓋のない例として、例えば図5の構成において、上蓋14を省いた図8のような構成のものを例示できる(図9はこの図8の構成のB−B’断面を示す図である)。上蓋は、収容部に入れた微粒子を含む懸濁液の水分が蒸発することを防止したり、図5のような態様の装置においては、微粒子を含む懸濁液を安定して装置に供給するという役割を有する。
【0015】
また収容部は、収容部の一部に形成された貫通孔を、電極基板上に配置された電極で塞ぐように(図6参照)、電極基板と接続する。ここで、貫通孔を有する部分を絶縁体の材料で構成するのは、電極に交流電圧を付加した際に、任意の貫通孔に対して電気力線を集中させ、微粒子を当該貫通孔に移動させて捕捉するためである。本発明で採用することができる絶縁体の材料として、例えばガラス、セラミック、樹脂等が例示できるが、貫通孔を形成する際の加工容易性を考慮すると、樹脂等が好ましい絶縁体として例示できる。
【0016】
また、収容部の一部を形成する絶縁体の材質は、微粒子をそこに形成された貫通孔に引き寄せて捕捉することから、微粒子と親和性のある絶縁体であることが好ましい。微粒子と親和性のある絶縁体の材質とは、微粒子が親水性である場合には親水性の絶縁体が、微粒子が疎水性である場合には疎水性の絶縁体が好ましい。親和性の目安としては、一般的には、絶縁体の表面に前記微粒子に近い親和性を有する液体を滴下したときに形成される液滴と絶縁体の表面との接触角で示される(接触角が小さいほど液体と絶縁体の表面との親和性が高く、接触角が大きいほど液体と絶縁体の表面との親和性が低い)。親水性の比較的高い絶縁体としては、ガラスや酸化チタン等があり、疎水性の比較的高い絶縁体としては、ポリスチレン、ポリイミド、テフロン(登録商標)等の樹脂があり、扱う微粒子の親水性、疎水性に応じてこれらの材料を絶縁体として用いることを例示できる。
【0017】
なお、本質的に微粒子との親和性が低い絶縁体を用いざるを得ない場合であっても、絶縁体の表面を改質することによって微粒子との親和性を高めることができる。樹脂等の疎水性の絶縁体を親水化する方法としては、既知の方法である、プラズマ処理、化学修飾、タンパク質の物理吸着などによる修飾、或いはこれらの方法を任意に組み合わせた方法などを用いればよい。ここで、絶縁体表面のプラズマ処理とは、電子・イオン・ラジカルなどの活性種が存在する電気的に中性な電離気体(プラズマ)を絶縁体の表面に照射することにより、絶縁体の表面における有機汚染物の除去や化学結合状態を変化させ、絶縁体の表面を改質する処理である。プラズマ処理には、非重合性ガス(Ar、O2など)を用いるプラズマ表面処理と有機モノマーを用いて絶縁体の表面を高分子薄膜でコーティング処理するプラズマ重合がある。プラズマ表面処理は、Arなどの非反応性ガスによる表面架橋層の形成、O2などの反応性ガスによる官能基の導入などがあり、酸素プラズマ処理により−COOHや−COを導入し、絶縁体の表面の親水性を向上させることで親水性の微粒子との親和性を高めることが可能である。またここで絶縁体表面の化学修飾による親水化とは、水酸基やカルボキシル基、アミノ基、スルホン基などの親水基を有する誘導体やシランカップリング剤などを絶縁体の表面へ結合させることで親水化する方法である。シランカップリング剤は有機物とケイ素から構成される化合物であり、分子中に親水性を示す反応基(水酸基、カルボキシル基、アミノ基、スルホン基など)と疎水性を示す反応基(ビニル基、メチル基、エチル基、プロピル基など)の2種以上の異なった反応基を有している。このため、シランカップリング剤の希薄溶液に疎水性の絶縁体を浸漬すれば、シランカップリング剤の疎水性を示す反応基が疎水性の材料の表面に化学的に結合し、親水性を示す反応基が表面を覆うため、容易に疎水性の材料の表面を均一に親水化することが可能である。またここで、タンパク質の物理吸着などによる修飾であれば、例えばBSA(ウシ血清アルブミン)などのタンパク質含有溶液に絶縁体を数分から数時間を浸漬することで、タンパク質を物理吸着させ、絶縁体の表面を親水化することができる。
【0018】
ガラス等の親水性の絶縁体を疎水化する方法としては、シランカップリング剤を親水性の絶縁体表面に結合させる化学修飾による方法がある。シランカップリング剤は有機物とケイ素から構成される化合物であり、分子中に親水性を示す反応基(水酸基、カルボキシル基、アミノ基、スルホン基など)と疎水性を示す反応基(ビニル基、メチル基、エチル基、プロピル基など)の2種以上の異なった反応基を有している。そのため、シランカップリング剤の希薄溶液に親水性の絶縁体を浸漬すれば、シランカップリング剤の親水性を示す反応基が親水性の絶縁体の表面に化学的に結合し、疎水性を示す反応基が表面を覆うため、絶縁体の表面を均一に疎水化することが可能である。
【0019】
なお、親水性又は疎水性の評価方法としては、以下の一般的な手法を用いることができる。すなわち、絶縁体表面に純水を滴下し、そのときに絶縁体の表面に形成される液滴と絶縁体の表面との接触角を測定することによって絶縁体の表面の親水性及び疎水性を評価するのである。親水性及び疎水性の厳密な定義は存在しないため、本発明においては、親水性を前記接触角が50°以下、好ましくは40°以下であると定義し、疎水性を前記接触角が50°より大きく、好ましくは60°より大きいと定義する。さらに、接触角の測定は、基板上に滴下した液滴の左右端点と頂点を結ぶ直線の、固体表面に対する角度から接触角を算出するθ/2法を用いる。
【0020】
絶縁体に貫通孔を形成するためには、絶縁体の種類に応じた種々の方法を採用することができる。例えば樹脂に貫通孔を形成するためにはレーザーを照射する方法や、貫通孔を形成するためのピンを有する金型を用いて収容部を成形する方法などの既知の方法を用いることができる。また光硬化性樹脂などを用いる場合は、貫通孔に相当するパターンを描画した露光用フォトマスクを用いて一般的なフォトリソグラフィー(露光)とエッチング(現像)により貫通孔を形成することができる。
【0021】
図5に例示した本発明の微粒子操作装置では、装置の本体13は、上蓋14、スペーサー16及び貫通孔を形成した平板状の絶縁体8とからなる収容部と、電極を配置した電極基板15とから構成されている。収容部における貫通孔を有する部分は、例えば収容部を密閉可能な箱状の形態とするならば、微粒子の比重が微粒子を含有する懸濁液の比重以下であり、微粒子が上方向に浮上する場合は、その上面とすることができる。しかし、微粒子の操作に重力をも利用することができること、操作終了後に移動され、捕捉等された微粒子を分別回収するにあたり、上部から回収操作を行う方が簡便であること等を考慮すれば、当該部分は収容分の下部とし、同時に上部を塞ぐ部分(図5における14)を取り外し可能としておくことが特に好ましい。なお、微粒子の比重が小さい場合であっても、懸濁液の比重をそれ以下とすることは比較的容易である。
【0022】
収容部は、その全部を絶縁体の材料で構成することもできるが、例えば図5で示したように、収容部を絶縁体の材料で構成した部分(貫通孔を有する部分8)とその他の部分(16及び14)に分けて構成することも可能である。例えば加工の容易な材料で枠やスペーサー16を形成し、懸濁液が漏れないように貫通孔を設けた樹脂製の平板8を底面として当該枠やスペーサーに結合することで収容部とすることが例示できる。
【0023】
図5に示したような、収容部を上蓋14、スペーサー16及び絶縁体8で構成した場合について更に説明する。スペーサー16は、実際に微粒子の懸濁液を保持するスペースを確保するためのものであり、例えばガラス、セラミック、樹脂等の絶縁体を材料として構成しても良いし、スペーサーが電極aとbの両方(後述)と電気的に導通しなければ、金属等の導電体を材料として構成しても良い。図5の例では、スペーサーに導入流路及び該流路に連通する導入口19と、懸濁液を排出する排出流路及び該流路に連通する排出口20を設け、微粒子操作装置に対する懸濁液の供給と排出が迅速に実施可能にしてある。スペーサーの寸法、形状に特別の制限はないが、電極基板15に配置された一対の電極に合致する寸法、形状であることが好ましい。スペーサーの内側の空間と厚みは、操作対象とする懸濁液の量との関係で決定すれば良く、特に制限はないが、通常は微粒子懸濁液を数μLから数mL程度入れる容量があればよく、例えば、スペーサーのサイズが縦40mm×横40mm程度の場合、スペーサーの内側の空間は、縦20mm×横20mm程度であればよく、スペーサーの厚みは0.5から2.0mm程度であればよい。
【0024】
絶縁体8には、一対の電極の真上に位置する貫通孔9が、アレイ状に構成されている。ここでアレイ状とは、厳密には貫通孔の縦と横の間隔が等間隔に配置されていることを意味するが、本発明では貫通孔が縦方向のみ、あるいは横方向のみに、直線上かつ等間隔に配置された場合もアレイ状と表現する。このように貫通孔をアレイ状に配置することで、電極間に印加した交流電圧によって生じる電界がすべての貫通孔にほぼ均等に生じることになり、本発明の装置において均一な操作を実現するという効果を発揮するのである。
【0025】
貫通孔を塞ぐように収容部に接続される電極基板には、交流電圧を印可するための一対の電極が配置される。電極基板は、その上部に一対の電極を形成するため、絶縁体を用いる以外は特に制限はない。例えばガラス、セラミック、樹脂等を材料となる絶縁体の一例として例示できる。
【0026】
電極の材質は導電部材であって化学的に安定な部材であればとくに制限はなく、白金、金、銅などの金属やステンレスなどの合金及び、ITO(Indium Tin Oxide:酸化インジウムスズ)等の透明導電性材料等を使用することもできる。特に本発明の装置に懸濁液を供して操作を実施した際の、収容部内での微粒子の挙動をモニターする目的で電極基板を透明なガラス等とする場合、ITOは、その透明性や成膜性等の面で特に好ましい材料である。電極基板に配置された電極29及び30とからなる一対の電極31は、交流電源4に接続される(以後、本明細書ではこれら一対の電極の一方を便宜のために電極a、他方を電極b等と称することがある)。電極aとb(図5は、4本の電極aと、同じく4本の電極bを配置した例を記載している)は、収容部が有する全ての貫通孔に対応するものである。むろん、貫通孔の数に対応する、独立した複数の電極aとbであっても良い(a+b=貫通孔の数となる)が、通常、同時に多数の微粒子の操作を可能とするために多数の貫通孔を形成した収容部を使用することが好ましいため、その一つ一つに対応するように独立した複数の電極aとbを配置すると装置の構成が複雑となり、また各電極の維持も煩雑になる。そこで本発明では、図5に示したように、一対の電極を対向する2つの辺のそれぞれから他方の辺に向けて延びる平行な2枚の電極から構成するか、又は、対向する2つの辺のそれぞれから他方の辺に向けて延びる平行かつ等間隔な3枚以上の電極から構成することが好ましい。図5は、この態様に従い、一対の電極の一方を構成する電極aとして4枚、一対の他方を構成する電極bとして4枚の電極を櫛状に配置した例である。
【0027】
図6は、図5に示した微粒子操作装置のA−A’断面図を示した概略図である。上蓋14、スペーサー16、絶縁体8から構成される収容部と、一対の櫛状電極31(電極a29と電極b30)を配置した電極基板15を張り合わせる手段としては、それぞれを接着剤で貼り合わせる方法、加圧した状態で過熱して融着させる方法、スペーサーとしてPDMS(poly−dimethylsiloxane)やシリコンシートのような表面粘着性のある樹脂を用いてこれらを作製し、圧着して貼り合わせる方法等が例示できる。
【0028】
図7は、図5に示した微粒子操作装置の電極基板15と一対の電極31及び貫通孔9の配置の関係を、収容部の上部から観察した様子を示す図である。図7に示すように本発明の微粒子操作装置は、垂直方向に貫通した貫通孔9の真下に櫛状電極31の電極a29又は電極b30のいずれかが配置されており、貫通孔の列または行毎に、電極a29と電極b30が交互に配置されている点に特徴がある。このような構成において、貫通孔の真下に形成される電極の幅は、隣の電極と重ならなければ特に制限はないが、貫通孔内に均等に電気力線が集中するよう、貫通孔の直径以上とすることが好ましい。また、貫通孔の上から見える電極の位置にも特に制限はないが、貫通孔内に均等に電気力線が集中するよう、図7に示すように、貫通孔の中心軸32と電極を形成する導電部材の中心軸35が重複するように配置することが好ましい。
【0029】
図10は、従来の微粒子操作装置を、そして図11は図10の装置のC−C’断面を示すものであり、本発明の微粒子操作装置の優位性を説明するために記載したものである。図10の装置では、一対の電極の一方が上蓋としても機能する上部の電極基板47の下面に配置され、一対の電極の他方が下部の電極基板48の上面に配置されている。そして、これら一対の電極により、スペーサー16、上蓋(上部の電極基板48)、貫通孔を有する平板の絶縁体8で構成される収容部を挟みこむような構成となっている。図10に示した装置では、一対の電極が収容部を挟んでいるため、上蓋として機能する上部の電極基板47を容易に取り外すことができず、貫通孔に微粒子を移動させ、捕捉した後、貫通孔から捕捉された任意の微粒子をマイクロピペット等の微粒子採取手段を用いて採取する際に困難を伴う。これに対して本発明の装置は、収容部の一部に貫通孔を形成し、これを一対の電極を同一面上に配置した電極基板で塞ぐような構成としているため、上蓋そのものを省くことすら可能である。懸濁液の蒸発を防ぐ等の目的で、図5に例示したような構成とした場合でも、本発明の装置は、一対の電極全て(図5における電極a29及び電極b30)を櫛状等にして一枚の電極基板上に配置するため、上蓋を取り外すことも可能であるし、なによりも、電極に交流電圧を印加して微粒子に誘電泳動力を作用させ、貫通孔に捕捉しつつ、捕捉された微粒子のうちの任意のものをマイクロピペット等で採取することが容易にできるのである。
【0030】
本発明の装置では、上記に加え、一枚の電極基板に一対の電極全てを設置していることから、対となる電極同士の間隔を微粒子の粒子径と等の数μmから数十μmと微小にすることが可能である。この結果、一対の電極間に印加する交流電圧が低くとも、この微小な電極間距離によって電極間に大きな電界を発生させて微粒子に大きな誘電泳動力を作用させることが可能になる。例えば図10に示した従来の微粒子操作装置では、一対の電極を上部の電極基板47の下面と下部の電極基板48の上面に配置し、これらでスペーサー16を挟み込んで収容部としていため、電極間の距離はスペーサーの厚みで制限されるが、一般にスペーサーの厚みが1mm未満になると、収容部に微粒子の懸濁液を導入することが困難となるため、両電極基板の離間距離を1mm未満とすることはできない。ここで電界は、電極間に印加する電圧を電極間距離で割った値であるので、電極間の離間距離を数μmから数十μmにすることができる本発明の装置(例えば図5の装置)では、同距離を1mm未満とすることができない図10に示した従来の装置と比較して、同一電圧を印加するならば数十倍の強度の電界を得ることができ、同一強度の電界を得るならば数十分の一の電圧で済むことになる。この結果、小型で安価な交流電源を使用しても、従来の装置以上に効果的な微粒子操作を可能とする装置を提供することが可能となる。
【0031】
微粒子操作装置の電極基板15に配置された一対の電極である電極a29と電極b30には、導電線3を介して交流電源4が接続される。交流電源4は、貫通孔に微粒子を移動させ、捕捉し、又は貫通孔から微粒子を脱離させる電界を発生させるのに十分な交流電圧を電極aとbの間に印加できれば特に制限はない。具体的に例えば、ピーク電圧が1Vから20V程度で、周波数100kHzから3MHz程度の正弦波、矩形波、三角波、台形波等の波形の交流電圧を印加できる電源が例示できるが、中でも、微粒子を移動させ、1つの貫通孔に1個の微粒子のみを捕捉し得るようにできる波形の交流電圧を電極a29と電極b30の電極間に印加することが特に好ましい。かかる波形の交流電圧としては、矩形波を使用することが好ましい。図12から図15に示すように、交流電圧の波形が正弦波(図12)、三角波(図13)、台形波(図14)である場合に比べて、矩形波(図15)である場合は、瞬時に設定したピーク電圧36に到達するため、微粒子を貫通孔に向けて速やかに移動させることが可能となり、2個以上の微粒子が重なるように貫通孔に入る確率を低くできる(1つの貫通孔に1個の微粒子のみを捕捉し得る確率が高くなる)のである。微粒子は電気的にコンデンサーと見なすことができるが、矩形波のピーク電圧が変化しない間は、貫通孔に捕捉された微粒子には電流が流れ難くなって電気力線が生じ難くなり、この結果微粒子を捕捉した貫通孔には誘電泳動力が発生し難くなる。従って、一度貫通孔に微粒子が捕捉されると、別の微粒子がその貫通孔に捕捉される確率は低くなり、代わりに電気力線が生じ誘電泳動力が発生している貫通孔(微粒子を捕捉していない、空の貫通孔)に、順次、微粒子が捕捉されるためである。なお、本発明の微粒子操作装置では、直流成分を有しない交流電圧を発生する電源を採用することが好ましい。直流成分を有する交流電圧を印加すると、直流成分により発生した静電気力により微粒子が特定の方向に偏った力を受けて移動し、誘電泳動力によって貫通孔に捕捉し難くなるからである。また直流成分を有する交流電圧を印加すると、微粒子を含有する懸濁液に含まれるイオンが電極表面で電気反応を生じて発熱し、それによって微粒子が熱運動を起こすため誘電泳動力によって動きを制御できなくなり、貫通孔に移動させて捕捉することが困難になるからである。
【0032】
本発明の微粒子操作装置では、上記したように、印加する交流電圧の波形を好ましくは矩形とすることにより、1つの貫通孔に1個の微粒子のみを捕捉し得るようにすることが好ましいが、かかる目的を達成するために、更に、貫通孔の配置や、貫通孔の寸法、形状を、1つの貫通孔に1個の微粒子のみを捕捉し得るのに適した配置、寸法、形状とすることが好ましい。例えば、本発明において、貫通孔を好ましくアレイ状に配置する場合、隣接する貫通孔同士の間隔が狭すぎても広すぎても、上記目的を達成するのは困難になる。隣接する貫通孔同士の間隔が狭い場合は、1つの貫通孔に複数の微粒子が捕捉されてしまう確率が高くなり、反対に隣接する貫通孔同士の間隔が広い場合は、貫通孔と貫通孔の間に微粒子が残されてしまい、微粒子を捕捉できない貫通孔が生じる確率が高くなるからである。これらを回避するためには、隣接する貫通孔同士の間隔を、捕捉しようとする微粒子の粒径の0.5倍以上6倍以下の範囲であることが好ましく、更には1倍以上2倍未満とすることが特に好ましい。また更に、1つの貫通孔に1個の微粒子のみを捕捉し得るようにするため、貫通孔の収容部側開口に内接する最大円の直径を、捕捉しようとする微粒子の粒径未満とすること、又は、微粒子の粒径の1倍以上2倍未満の範囲でありかつ貫通孔の深さを微粒子の粒径の2倍未満とすること、が好ましい。これは、貫通孔開口の内径が微粒子の粒径より大きいと、微粒子は貫通孔を塞ぐことができずに電気力線が集中してしまい、他の微粒子が誘電泳動力により引き寄せられて1つの貫通孔に2個以上の微粒子が捕捉される確率が高くなるからである。従って、1つの貫通孔に1個の微粒子のみを捕捉するためには、貫通孔の収容部側開口に内接する最大円の直径が、貫通孔に捕捉しようとする微粒子の粒径未満とすることが最も好ましいのである。この他に、貫通孔に捕捉する微粒子の粒径の1倍以上2倍未満倍の範囲でありかつ貫通孔の深さが微粒子の粒径の2倍未満としても、1個の微粒子が貫通孔に捕捉されると他の微粒子は引き寄せられても貫通孔に入れないため、捕捉される確率を低くすることができる。また、貫通孔の収容部側の開口形状(平面的な形状)を、1以上の角を有する形状とすることも、1つの貫通孔に1個の微粒子のみを捕捉するために好ましく、貫通孔の開口形状を四辺形とすることが特に好ましい。ここで、角とは貫通孔の形状を構成する2辺が鋭角あるいは鈍角で交わる部分であり、角の先端が若干丸みを帯びた形状も含む。図16に、貫通孔の開口形状が少なくとも1以上の角を有する代表的な形状を例示する。またここで四辺形とは、前記貫通孔の形状が前記角(その先端が若干丸みを帯びた形状を含む)4つ有するものである。なお4本の辺は直線であってもよいし、4本全ての辺あるいは4本のうち任意の辺が貫通孔の中心あるいは外側に向かって若干湾曲していてもよい。図17に、四辺形の貫通孔の代表的な形状を例示する。このように、貫通孔の開口形状が一部に角を有するものであれば、前記角の部分において電気力線の集中が生じて誘電泳動力が強くなり、より強く微粒子を移動させる(引き寄せる)結果、微粒子が貫通孔に捕捉される確率が向上するのである。角は貫通孔に少なくとも1箇所存在すればよいが、複数存在していた方がより好ましい。ただし、角は鈍角よりも鋭角の方が電気力線の集中が生じやすく誘電泳動力を強くできるため、五角形以上の多角形よりも四角形以下の多角形がより好ましい。また、仮に四角形であっても、その具体的な形状には特に制限はなく、例えば図17に示したような台形や菱形、平行四辺形など、種々の形状を選択し得る。中でも、四辺形の貫通孔の形状が4つの角を結ぶ4辺の長さがほぼ等しく、貫通孔の中心において90度の角度で点対称となる形状は、四辺形の貫通孔の4つの辺に生じる誘電泳動力が等しく、4つの角に生じる誘電泳動力も等しくなり、誘電泳動力の分布が点対称となって貫通孔に対する微粒子の位置によらず、偏りの少ない誘電泳動力を作用させることが可能となり、特に好ましい。かかる形状としては、図17の(a)から(d)のような正方形又は正方形に近い形状を例示することができる。
次に、本発明の微粒子操作装置を用いた微粒子操作方法について、図18から図22を用いて説明する。図18に示したように、微粒子操作装置を形成する電極基板15の上面(収容部を形成するスペーサー16に形成された空間34側の面)には、電極a29と電極b30からなる一対の電極が櫛状に配置され、電極aと電極bの間に交流電源4により交流電圧を印加すると、電極の真上に位置し、垂直方向に貫通した貫通孔9に電気力線12が集中し、微粒子18に誘電泳動力が作用する(特許文献2参照)。ここで、誘電泳動力には、図19に示すように微粒子18を貫通孔9に移動させ、捕捉するように作用する誘電泳動力(以下、正の誘電泳動力37とする)と、図21に示すように微粒子18を貫通孔9から脱離するように移動させる誘電泳動力(以下、負の誘電泳動力38とする)がある。なお、正の誘電泳動力37が作用した場合、図20に示すように微粒子18は貫通孔9に捕捉され、負の誘電泳動力38が作用した場合、図22に示すように微粒子18は、収容部の貫通孔と貫通孔の間の部分(図5に示した装置においては、絶縁体8上)に捕捉される。
【0033】
正の誘電泳動力と負の誘電泳動力は、対象とする微粒子の誘電率とその微粒子を含有する微粒子懸濁液17の誘電率及び使用する交流電圧の周波数によって制御することができる。例えば、微粒子が粒径10μm程度のマウスミエローマ細胞であり、懸濁液が300mMのマンニトール水溶液である場合は、交流電圧の周波数が50kHz以上であれば正の誘電泳動力がマウスミエローマ細胞に作用し、10kHz未満であれば負の誘電泳動力がマウスミエローマ細胞に作用する。また例えば、微粒子が粒径6μm程度のポリスチレン微粒子であり、懸濁液が純水である場合は、交流電圧の周波数が1MHz以上で負の誘電泳動力がポリスチレン微粒子に作用し、10Hz未満で正の誘電泳動力がポリスチレン微粒子に作用する。
【0034】
ある周波数で正の誘電泳動力と負の誘電泳動力が切り換わる理由を説明する。本発明の貫通孔における誘電泳動力は、微粒子半径、交流電圧、電極間距離、微粒子の誘電率、懸濁液の誘電率により、一般に以下の式1で示される。
【0035】
【化1】

ここで、微粒子の誘電率と懸濁液の誘電率は、一般に交流電圧の周波数に依存して変化する。従って、交流電圧の周波数を変化させたときの微粒子の誘電率と懸濁液の誘電率の大小により、誘電泳動力の符号が決まる(変化する)。すなわち、交流電圧の周波数を変化させたとき、微粒子の誘電率が懸濁液の誘電率よりも大きくなれば、微粒子には正の誘電泳動力が作用し、微粒子の誘電率が懸濁液の誘電率よりも小さくなれば微粒子には負の誘電泳動力が作用する。このように、理論的には計算によって微粒子の誘電率と懸濁液の誘電率が等しくなる周波数(正の誘電泳動力と負の誘電泳動力が変化する境界の周波数、以下、境界周波数という)を求めることができる。しかし、微粒子の誘電率や懸濁液の誘電率を周波数ごとに測定することは煩雑であるため、微粒子の移動する方向の変化を観察することで、境界周波数を実験的に決定することが簡便である。このようにして決定される境界周波数は、当然、微粒子の種類や懸濁液の種類によって異なるものとなる。本発明の微粒子操作装置では、操作しようとする微粒子が貫通孔に捕捉されるように移動させるか、又は、微粒子が貫通孔から脱離するように移動させるように誘電泳動力が作用する方向を変化させるべく、適宜、電極に付加する交流の周波数を変えることが好ましい。この意味において、本発明の微粒子操作装置に採用する交流電源は、その周波数を任意に変更し得るものが好ましい。なお本発明の微粒子操作装置において、電極aと電極bの間に、貫通孔から微粒子を脱離させる方向の負の誘電泳動力が作用するような周波数の交流電圧を印加すると、貫通孔ではなく、貫通孔と貫通孔の間、即ち収容部内壁を構成する部分に微粒子を捕捉することが可能となる。
【0036】
本発明の微粒子操作装置を用いれば、前記したように、交流の周波数を適宜選択することによって雑多の微粒子を含む懸濁液の中から所定の誘電率を有する微粒子のみを選別し、貫通孔に捕捉することが可能となる。しかも、本発明の微粒子操作装置は、好ましくは収容部の下部に電極基板を設置しているため、交流電圧を付加して微粒子を貫通孔に捕捉した状態で、当該貫通孔からマイクロピペット等を用いて捕捉された微粒子を採取することが可能となる。図23は、本発明の微粒子操作装置と、貫通孔9に捕捉された微粒子18を採取する微粒子採取手段21として、マイクロピペットを採用した場合の概念図である。目的の微粒子を選んで採取する場合は、図23に示すように顕微鏡22を設置し、顕微鏡での観察下でマイクロピペット21を操作して微粒子を採取する。顕微鏡のステージ40として、1μm前後で精密に位置決めできるものを採用すれば、顕微鏡で観察しながら採取しようとする微粒子を確実にマイクロピペット21で採取することができる。また微粒子を採取する際には、電極aと電極bの間に、微粒子を貫通孔に捕捉する正の誘電泳動力が作用する周波数の交流電圧を電源4から印加しておけば、目的の微粒子だけをマイクロピペットで採取し、他の微粒子は貫通孔に捕捉したままにしておくことが可能である。
【0037】
図24は、本発明の微粒子操作装置の応用例を示すものである。例えば癌などの異常細胞41の存在が疑われる懸濁液を微粒子操作装置に供し、細胞を貫通孔に捕捉する。一方で当該検出の目的となる異常細胞41の表面に特異的に結合するマーカー分子42を蛍光色素43等で修飾しておき、収容部に当該マーカー分子を導入し、マーカー分子と異常細胞を特異的に結合反応させる。細胞を貫通孔に捕捉したまま、収容部中の懸濁液を未反応のマーカー分子とともに排出した後、貫通孔に捕捉された細胞にマーカー分子が導入されたか否かをそのままの状態で、又は、微粒子採取手段で採取した後、顕微鏡等で検出したり、蛍光色素等を検出するための公知の試薬と光学装置等を用いて検出する。これにより、癌などの異常細胞を採取し、又は、検出することが本発明の微粒子操作装置により可能となる。
【0038】
上記では微粒子採取手段としてマイクロピペットを説明したが、微粒子採取手段は微粒子を採取することができれば特に制限はなく、マイクロピペット以外にも、電気浸透流を利用して精密に微粒子を採取可能な微粒子採取手段を用いることができる。
【発明の効果】
【0039】
本発明の微粒子操作装置は、以下の効果を奏するものである。
(1)本発明の微粒子操作装置は、一枚の電極基板に一対の電極全てを設置することから装置構成を簡便にでき、また、簡便であるために安価に提供できる。また構成が簡便であるために、その維持、管理に費用や熟練を要することがない。
(2)本発明の微粒子操作装置は、1つの貫通孔に概ね1つの微粒子を速やかに捕捉することができる。特に、収容部の一部をアレイ状に形成した複数の貫通孔を有する絶縁体で構成した態様では、複数の微粒子を1つずつ速やかにアレイ状に配置した貫通孔に捕捉することができる。
(3)本発明の微粒子操作装置は、1つの貫通孔に概ね1つの微粒子を捕捉できる確率を向上することができる。特に、収容部の一部をアレイ状に形成した複数の貫通孔を有する絶縁体で構成した態様では、複数の微粒子を1つずつアレイ状に配置した貫通孔に捕捉する確率を向上することができる。
(4)本発明の微粒子操作装置は、貫通孔に捕捉した微粒子を速やかに貫通孔から脱離する(取り出す)ことができる。
(5)本発明の微粒子操作装置は、貫通孔に微粒子を捕捉したまま、貫通孔から任意の微粒子を容易に脱離させ、採取する事ができる。
(6)本発明の微粒子操作装置は、電極の距離を短くできるため、比較的小型で安価な交流電源でも十分に微粒子操作を可能とする電界を得る事ができる。
【発明を実施するための最良の形態】
【0040】
以下、本発明を実施例に基づいて更に詳細に説明するが、本発明は実施例に限定されるものではない。
【実施例1】
【0041】
実施例1においては、装置本体13が、収容部(スペーサー16と貫通孔9を形成した絶縁体8とから構成される)及び電極基板15とから構成される、図8に示した微粒子操作装置を使用した。
【0042】
電極基板15には、縦70mm×横40mm×厚さ1mmのガラス基板を用いた。スペーサー16は、縦40mm×横40mm×厚さ1.5mmのシリコンシートの中央(34)を縦20mm×横20mmにくりぬいた形状にして用いた。また、図8に示すように、微粒子が含有した懸濁液を導入、排出するための導入口19と排出口20を設けた。複数の貫通孔9を有する絶縁体8と櫛状電極31は、図25及び図26に示すフォトリソグラフィーとエッチングによる方法により電極基板15上に一体的に形成した。
【0043】
図25に示すように、ガラス24の片面に、スパッタにより膜厚1nmのCrを成膜し(44)、さらにその上にスパッタにより膜厚150nmのAuを成膜した(45)。なおCrは、Auとガラスの密着性を高めるために成膜している。次に、成膜したAuの上にスピンコーターを用いて1μmの膜厚になるようレジスト(25)を塗布し、1分自然乾燥後、ホットプレートを用いてプリベーク(105℃、15分)を行った。レジストにはポジ型のものを用いた。
【0044】
次に、縦30mm×横30mmのエリアに、幅10μmの電極aと幅10μmの電極bを50μm間隔で形成した櫛状電極パターンを描いた露光用フォトマスク26を用いて、UV露光機にてレジストを露光27し、現像液33で現像した。露光時間と現像時間は、現像により剥離する膜厚がレジストの膜厚と等しい1μmになるように調整し、貫通孔の底面にAuが露出するようにした。現像後、3%ヨウ素ヨウ化アンモニウム液49により露出したAu膜を剥離し、次に30%硝酸二アンモニアセリウム液50によりAu膜剥離後に露出したCr膜を剥離した。最後に、レジストをリムーバーにより剥離し、櫛状電極31を形成した。
【0045】
このようにして作製した電極基板上の櫛状電極31の上に、図26に示すようにレジスト25を5μmの膜厚になるようスピンコーターを用いて塗布し、1分自然乾燥後、ホットプレートを用いてプリベーク(65℃、1分 → 95℃、3分)を行った。レジストにはエポキシ系のネガタイプレジストを用いた。次に、縦30mm×横30mmのエリアに、貫通孔と貫通孔の縦と横の間隔が30μmで、縦1000個×横1000個のアレイ状に並べた直径8.5μmの円形の貫通孔パターンを描いた露光用フォトマスク46を用いて、UV露光機にてレジストを露光27し、現像液33で現像した。露光時間と現像時間は、貫通孔の深さがレジストの膜厚と等しい5μmになるように調整し、貫通孔の底面の櫛状電極が露出するようにした。現像後、ホットプレートを用いてポストベーク(150℃、15分)を行い、レジストを固め、貫通孔を形成した絶縁体と一体型となった櫛状電極を形成した下部基板を製作した。
【0046】
このようにして作製した電極基板15、スペーサー16を図9のように積層し圧着した。図9は、図8に示した細胞融合容器のB−B’断面図である。シリコンシートの表面は粘着性があり、圧着することで各部品は密着し、微粒子を含有した懸濁液を漏れなく本体13の中に入れることができた。スペーサーをくりぬいた面積が縦20mm×横20mmであることから、この空間34に存在する貫通孔の数は約40万個である。また、電極間に電圧を印加する電源(信号発生器)をリード線で接続した。
【0047】
微粒子には、マウスミエローマ細胞(粒径約10μm)を用い、300mMの濃度のマンニトール水溶液に懸濁させ、0.7×106個/mLの密度になるように細胞懸濁液を調整した。
【0048】
収容部の一部を構成する貫通孔を形成した絶縁体8の親水性を評価するために、その表面に純水を滴下し、そのときに絶縁体の表面に形成される液滴と絶縁体の表面との接触角を測定したところ、接触角は約74°で、疎水性であった。そこで、貫通孔を形成した絶縁体8を親水化するために、電極基板15(貫通孔を形成した絶縁体8は、電極基板15上に一体に形成されている)をBSA(1mg/mL)含有の300mM濃度のマンニトール水溶液に約1時間浸し、絶縁体表面にBSAを物理吸着させた。BSAを物理吸着させた後、同様に、絶縁体表面に純水を滴下し、そのときに絶縁体の表面に形成される液滴と絶縁体の表面との接触角を測定したところ、接触角は約37°であり、親水性化されたことを確認した。この場合、絶縁体表面と操作対象であるマウスミエローマ細胞(親水性を有する)との親和性は比較的高い。
【0049】
上記細胞懸濁液600μL(細胞数:約40万個)をスペーサー16の導入口よりシリンジを用いて注入し、交流電圧として信号発生器により電圧2Vpp、周波数3MHzの矩形波交流電圧を電極間に印加したところ、2から3秒程度の極めて短い時間でアレイ状に形成した貫通孔1つに、1つの細胞を捕捉することができ、細胞をアレイ状に配置させることができた。なお、「捕捉することができた」とは、貫通孔に微粒子が入った場合及び、貫通孔の縁に微粒子が留まった場合の両方を意味し、以下の実施例と比較例でも同じ定義とした。このときの、1つの貫通孔に概ね1つの細胞が入る微粒子捕捉率は約90%であった。なお微粒子捕捉率とは、顕微鏡の視野に縦15個×横15個の225個の貫通孔が見えるようにし、微粒子を導入して捕捉したときの、1個の微粒子が入った貫通孔数を225個の貫通孔数で割った値で定義し、以下の実施例と比較例でも同じである。
【0050】
図23に示すように、本体13に微粒子採取手段21を設置した。微粒子採取手段には、電気浸透流を利用して精密に微粒子を採取可能なピペットを用いることで、顕微鏡22で観察しながら、貫通孔に捕捉した特定の細胞を採取する事ができた。また、電源4により櫛状電極間に交流電圧(2Vpp、3MHz)を印加しつづけ、細胞を貫通孔に捕捉する方向に誘電泳動力を作用し続けさせることで、採取した以外の細胞は貫通孔に捕捉したままで脱離は確認されなかった。
【0051】
引き続き、交流電圧として信号発生器により電圧2Vpp、周波数1kHzの正弦波交流電圧を電極間に印加したところ、2から3秒程度の極めて短い時間でアレイ状の貫通孔に捕捉していた細胞を貫通孔から容易に取り出すことができた。本体を傾けて細胞懸濁液を取り出したところ、取り出した細胞数は、導入した細胞数の約80%であった。
【0052】
(比較例)
比較のため、図10に示した微粒子操作装置を用いて操作を行った。図10の微粒子操作装置では、本体13は、収容部(スペーサー16と貫通孔を形成した絶縁体8から構成される)を、上部の電極基板47と下部の電極基板48で挟み込んだ構成である。上部の電極基板と下部の極基板には、縦70mm×横40mm×厚さ1mmのガラス基板に、ITOを成膜(膜厚150nm)したものを用いた。スペーサー16は、縦40mm×横40mm×厚さ1.5mmのシリコンシートの中央(34)を縦20mm×横20mmにくりぬいた形状にして用いた。また図10に示すように、微粒子が含有した懸濁液を導入、排出するための導入口19と排出口20を設けた。複数の貫通孔9を有する絶縁体8と電極は、図25及び図26に示すフォトリソグラフィーとエッチングによる方法により、電極基板上に一体成形した。
【0053】
まずガラス24の片面にITO(23)を成膜し、その成膜面にスピンコーターを用いて5μmの膜厚になるようにレジスト(25)を塗布し、1分自然乾燥後、ホットプレートを用いてプリベーク(65℃、1分 → 95℃、3分)を行った。レジストにはエポキシ系のネガタイプレジストを用いた。
【0054】
次に、縦30mm×横30mmのエリアに、貫通孔と貫通孔の縦と横の間隔が30μmで、縦1000個×横1000個のアレイ状に並べた直径8.5μmの円形の貫通孔パターンを描いた露光用フォトマスク46を用いて、UV露光機にてレジストを露光27し、現像液33で現像した。露光時間と現像時間は、貫通孔の深さがレジストの膜厚と等しい5μmになるように調整し、貫通孔の底面にITOが露出するようにした。現像後、ホットプレートを用いてポストベーク(150℃、15分)を行い、レジストを固め、貫通孔を形成した絶縁体8を一体に形成した下部の電極基板48を製作した。
【0055】
このようにして作製した下部の電極基板48とスペーサー16を図11のように積層し圧着した。また圧着物と上部の電極基板47は金具により取り外し可能に圧着した。図11は、図10に示した細胞融合容器のC−C’断面図である。シリコンシートの表面は粘着性があり、圧着することで各部品は密着し、微粒子を含有した懸濁液を漏れなく本体13の中に入れることができた。スペーサーをくりぬいた面積が縦20mm×横20mmであることから、この空間34に存在する貫通孔の数は約40万個である。また、電極間に電圧を印加する電源(信号発生器)をリード線で接続した。
【0056】
微粒子には、マウスミエローマ細胞(粒径約10μm)を用い、300mMの濃度のマンニトール水溶液に懸濁させ、0.7×106個/mLの密度になるように細胞懸濁液を調整した。
【0057】
収容部の一部を構成する貫通孔を形成した絶縁体8の親水性を評価するために、その表面に純水を滴下し、そのときに絶縁体の表面に形成される液滴と絶縁体の表面との接触角を測定したところ、接触角は約74°で疎水性であった。そこで、貫通孔を形成した絶縁体8を親水化するために、下部の電極基板48(貫通孔を形成した絶縁体8は、下部の電極基板48上に一体に形成されている)をBSA(1mg/mL)含有の300mM濃度のマンニトール水溶液に約1時間浸し、絶縁体表面にBSAを物理吸着させた。BSAを物理吸着させた後、同様に、絶縁体表面に純水を滴下し、そのときに絶縁体の表面に形成される液滴と絶縁体の表面との接触角を測定したところ、接触角は約37°であり、親水化されたことを確認した。この場合、絶縁体表面と操作対象であるマウスミエローマ細胞(親水性を有する)との親和性は比較的高い。
【0058】
上記細胞懸濁液600μL(細胞数:約40万個)をスペーサー16の導入口よりシリンジを用いて注入し、交流電圧として信号発生器により電圧2Vpp、周波数3MHzの矩形波交流電圧を電極間に印加したが、貫通孔に細胞を捕捉する事はできなかった。これは、上部の電極基板と下部の電極基板間の距離が1.5mmと長く、2Vppの電圧では細胞を貫通孔に捕捉するための誘電泳動力を発生するための電界を十分に与えることができなかったためである。
【0059】
次に、交流電圧として信号発生器により電圧10Vpp、周波数3MHzの矩形波交流電圧を印加したところ、2から3秒程度でアレイ状に形成した貫通孔1つに、1つの細胞を捕捉することができた。しかしながら本比較例に用いた本体13には上部基板が存在するため、貫通孔に捕捉した任意の細胞を採取する際には、電圧の印可を止め、かつ、金具をはずして上部の電極基板を取り除く必要があり、いったん捕捉した細胞が貫通孔から脱離する例が発生した。
【実施例2】
【0060】
実施例1と同様の微粒子操作装置を用い、微粒子操作領域に実施例1と同様のマウスミエローマ細胞を導入し、電圧および矩形波交流電圧印加時間は上記のままで周波数だけを小さくした。その結果、図31のように50kHzでは細胞の捕捉率は約81%を示し、30kHzで約50%の細胞を捕捉できた。しかし10kHzでは細胞はほとんど捕捉できなかった。この結果から、細胞を貫通孔に捕捉するための交流電源の交流周波数は30kHz以上、好ましくは50kHz以上が望ましいことが分かる。
【0061】
また、同様の手法を用いて細胞脱離率の測定を行った。細胞脱離率とは、懸濁液を導入して第1の交流電源を用いて捕捉されたマウスミエローマ細胞のうち貫通孔から取り出された細胞数を、捕捉された細胞数で割った値で定義した。交流電源により電圧2Vpp、周波数10kHzの矩形波交流電圧を10秒間電極間に印加したところ、アレイ状に形成した複数の貫通孔に捕捉されていた細胞を取り出すことができた。このときの、細胞の脱離率は約100%であった。電圧および矩形波交流電圧印加時間は上記のままで周波数だけを大きくしたところ、図32のように10kHzでは脱離率は約100%を示し、20kHzでは約50%が脱離した。しかし100kHzではほとんど脱離しなかった。この結果から、細胞を貫通孔から脱離させるための交流電源の交流周波数は20kHz未満、好ましくは10kHz未満であることが望ましいことが分かる。
【実施例3】
【0062】
実施例1と同じ微粒子操作装置を用い、微粒子には市販のポリスチレン微粒子(粒径約6μm、ポリスチレン微粒子濃度2.5%)を用い、純水に懸濁させて0.8×106個/mLの密度になるようにポリスチレン微粒子懸濁液を調整した。ただし、実施例1と異なり、貫通孔を形成した絶縁体8の親水化処理は行わなかった。即ち、絶縁体8は疎水性であるため、疎水性を示すポリスチレン微粒子と絶縁体との親和性は比較的高い。
【0063】
上記ポリスチレン微粒子懸濁液500μL(微粒子数:約40万個)をスペーサーの導入口よりシリンジを用いて注入し、交流電圧として信号発生器により電圧2Vpp、周波数9Hzの矩形波交流電圧を電極間に印加したところ、2から3秒程度の極めて短い時間でアレイ状に形成した貫通孔1つに、概ね1つのポリスチレン微粒子を捕捉することができ、微粒子捕捉率は約60%であった。
【0064】
次に、交流電圧として信号発生器により電圧2Vpp、周波数100kHzの正弦波交流電圧を電極間に印加したところ、2から3秒程度の極めて短い時間でアレイ状の貫通孔に捕捉されていたポリスチレン微粒子を、貫通孔から脱離させることができた。引き続き、本体13を傾けてポリスチレン微粒子懸濁液を取り出したところ、取り出したポリスチレン微粒子数は、導入したポリスチレン微粒子数の約78%であった。
【0065】
なお、本実施例3で用いた微粒子操作措置を用いて、交流電圧の周波数とポリスチレン微粒子の貫通孔への捕捉と取り出しをさらに検討した結果、交流電圧(電圧2Vpp)の周波数が約100Hz未満で貫通孔にポリスチレン微粒子が捕捉されはじめ、10Hz未満になると、約50から60%のポリスチレン微粒子が貫通孔に捕捉された。また、交流電圧の周波数が約1kHz以上で貫通孔からポリスチレン微粒子が脱離しはじめ、1MHz以上になると、貫通孔に捕捉されたポリスチレン微粒子のうちほぼ90%以上のポリスチレン微粒子を貫通孔から脱離させることができた。
【図面の簡単な説明】
【0066】
【図1】特許文献2に記載された発明を説明するための図である。
【図2】特許文献2に記載された発明を説明するための図である。
【図3】特許文献2に記載された発明を説明するための図である。
【図4】特許文献2に記載された発明を説明するための図である。
【図5】本発明の微粒子操作装置を説明するための図である。
【図6】図5に示した微粒子操作装置の本体13のAA’断面図である。
【図7】図5に示した装置を構成する電極基板上の一対の電極と貫通孔の配置を上側から見た図である。
【図8】本発明の微粒子操作装置を説明するための図である。
【図9】図8に示した微粒子操作装置の本体13のBB’断面図である。
【図10】比較例として用いた微粒子操作装置を説明するための図である。
【図11】図10に示した微粒子操作装置の本体13のCC’断面図である。
【図12】本発明に用いる交流電圧の波形のうち正弦波を示す図である。
【図13】本発明に用いる交流電圧の波形のうち三角波を示す図である。
【図14】本発明に用いる交流電圧の波形のうち台形波を示す図である。
【図15】本発明に用いる交流電圧の波形のうち矩形波を示す図である。
【図16】本発明における貫通孔形状の例を示す図である。
【図17】本発明における貫通孔形状の例を示す図である。
【図18】本発明の微粒子操作装置による操作を説明するための図である。
【図19】本発明の微粒子操作装置による操作を説明するための図である。
【図20】本発明の微粒子操作装置による操作を説明するための図である。
【図21】本発明の微粒子操作装置による操作を説明するための図である。
【図22】本発明の微粒子操作装置による操作を説明するための図である。
【図23】本発明の微粒子操作装置と、貫通孔に捕捉した特定の微粒子を採取する微粒子採取手段として、マイクロピペットを設置した装置の図である。
【図24】本発明の微粒子操作装置を異常細胞の検出装置として応用した例を示す図である。
【図25】一般的なフォトリソグラフィーとエッチングを用いて、櫛状電極を作製する工程の概略図である。
【図26】一般的なフォトリソグラフィーとエッチングを用いて、貫通孔を作製する工程の概略図である。
【符号の説明】
【0067】
1:融合領域
2:電極
3:導電線
4:電源
5:交流電源
6:直流パルス電源
7:スイッチ
8:絶縁体
9:貫通孔
10:細胞A
11:細胞B
12:電気力線
13:本体
14:上蓋
15:電極基板
16:スペーサー
17:微粒子懸濁液
18:微粒子
19:導入口
20:排出口
21:微粒子操作手段
22:顕微鏡
23:ITO
24:ガラス
25:レジスト
26:櫛状電極パターンを描いた露光用フォトマスク
27:露光
28:貫通孔を形成した絶縁体と一体的に形成した下部の電極
29:電極a
30:電極b
31:櫛状電極
32:貫通孔の中心軸
33:現像液
34:スペーサー16に形成された空間
35:導電部材の中心軸
36:ピーク電圧
37:正の誘電泳動力
38:負の誘電泳動力
39:微粒子操作装置
40:ステージ
41:異常細胞
42:マーカー分子
43:蛍光色素
44:Cr
45:Au
46:貫通孔パターンを描いた露光用フォトマスク
47:上部の電極基板
48:下部の電極基板
49:3%ヨウ素ヨウ化アンモニウム液
50:30%硝酸二アンモニアセリウム液
51:融合細胞
【技術分野】
【0001】
本発明は、微粒子を特定の位置に誘導し、捕捉する微粒子操作装置に関する。
【背景技術】
【0002】
無機材料系微粒子、有機材料系微粒子、生物試料系微粒子などを、それぞれの微粒子の物理的形状や物性を損なうことのないように、非接触、非破壊で捕捉し、保持し、選択し、移動させ、分別回収等する方法や装置として、光による微粒子の操作方法や光による微粒子の操作装置などが用いられてきた(例えば、特許文献1参照。なお本明細書では微粒子を非接触、非破壊で捕捉し、保持し、選択し、移動させ、分別回収等することを単に「操作する」等と表現することがある。)。この操作方法は、一般に光ピンセット法又は光トラップ法と呼ばれ、光源に主としてレーザーを用いることから、レーザートラッピング法などとも呼ばれている。詳しくは、光源からのレーザー光を集光光学系により円錐状に集光し、媒体中の微粒子近傍に照射することにより、微粒子に発生する光の放射圧を利用して微粒子を捕捉し、保持し、移動等させるものである。
【0003】
しかしながら、光トラップ法は、レーザー光源やその集光等のための光学系を必要とし、しかもその精密な制御が必要となることから、装置が高価、精密かつ大掛かりになって取扱いも複雑になるため、操作者に一定の熟練を強いるという課題がある。また光軸調整を含む光学系及び光源の維持管理にも時間、費用及び熟練が要求され、それに伴い管理費用が高騰するという課題もある。さらに光トラップ法では、基本的に微粒子を1個ずつ顕微鏡等で視覚的に確認しながら捕捉等しなければならないため、一度に大量の微粒子を操作できないという課題がある。
【0004】
光トラップ法等の微粒子操作方法及び操作装置は、例えば細胞等の異なる生物試料系微粒子を捕捉しておき、これらを融合させて1つの交雑細胞とする細胞融合のための基礎的な技術としてとらえることもできる(例えば、特許文献4参照)。しかしながら、上記したように、装置が高価、精密かつ大がかりになって取扱いが煩雑になり、操作者は一定の熟練が強いられる、光軸調整を含む光学系及び光源の維持管理にも時間、費用及び熟練が要求され、それに伴い管理費用も高騰する、微粒子を1個ずつ顕微鏡等で視覚的に確認しながら捕捉等しなければならないため、一度に大量の微粒子を操作できないため、細胞の操作効率を向上するためには更なる改良が必要である。
【0005】
細胞等の生物試料系微粒子の操作に関わる他の公知技術として、例えば特許文献2が開示するような、細胞融合用チャンバーの融合領域に対向するように配置された導電部材よりなる一対の電極と、前記一対の電極間に配置され、且つ前記一対の電極方向に貫通した貫通孔を有する絶縁体とよりなる細胞融合用チャンバーが報告されている。
【0006】
特許文献2について具体的に説明する。図1は特許文献2の細胞融合用チャンバーの断面図を示した概念図である。図1において、例えば樹脂材からなる細胞融合用チャンバーの融合領域(1)の両側には、導電部材からなる電極(2)が配置され、これら電極は導電線(3)を介して外部に設けられた電源(4)と接続されている。外部に設けられた電源は電界の強さが約400V/cmから700V/cm、周波数1MHz程度の高周波交流電圧を出力する交流電源(5)と、約7kV/cm、パルス幅50μsec程度のパルス電圧を出力する直流パルス電源(6)と、電極と交流電源又は直流パルス電源の電気的接続を切り換える為のスイッチ(7)とから構成されている。ここで、交流電源から出力する交流電圧には、通常、一般的な正弦波の波形を用いる。細胞融合用チャンバーは、電気的に絶縁な材料、例えばシリコーン樹脂からなる絶縁体(8)により2つの空間に区分けされている。ここで、絶縁体には最小口径が1μmから数十μmの貫通孔(9)が設けられている。また、細胞A(10)及び細胞B(11)はそれぞれ細胞融合用チャンバーの融合領域内の懸濁液内におかれている。
【0007】
上記特許文献2に記載された装置の動作を図2から図4を用いて具体的に説明する。最初に、電源(4)の切り換えスイッチ(7)を電界の強さが約400V/cmから700V/cm、周波数1MHzの高周波電圧を出力する交流電源(5)に接続する。この状態において電気力線(12)は、図2に示すように貫通孔(9)に集中する。細胞A(10)および細胞B(11)は、ここに集中する電気力線(12)のため誘電泳動力を受け、図3に示すように貫通孔(9)の中心付近に捕捉される。ここで細胞A(10)と細胞B(11)は出会い接触する。次に、電源(4)の切り換えスイッチ(7)を直流パルス電源(6)に切り換える。図3に示した状態におかれた細胞A(10)及び細胞B(11)は、パルス電圧により細胞A(10)および細胞B(11)の接触点で細胞膜の可逆的破壊が起こり、図4に示すように融合が生ずる。
【0008】
特許文献2の装置では、貫通孔において細胞Aと細胞B融合させることを目的としているため、2細胞を一対として取り扱う。従って、特許文献2に記載された装置によって一度に複数の融合細胞(51)を得ようとする場合、複数の貫通孔を絶縁体上に2細胞を一対として複数対捕捉する必要がある。しかしながら、交流電源を接続して細胞を貫通孔に捕捉する際に、ある貫通孔には複数の細胞が捕捉される一方で、細胞が全く捕捉されない貫通孔が発生するというように、不均一な細胞操作(不均一な貫通孔への捕捉)が発生するという課題がある。そこで、貫通孔をアレイ状に配置する(貫通孔をいずれの隣接する貫通孔とも等間隔となるように配置する、又は、貫通孔を縦横が等しい格子状に配置する)ことにより、微小粒子に作用する電気力線を均一化して細胞操作(貫通孔への捕捉)を均一化する試みもなされている。
【0009】
特許文献3では、アレイ状に配置した貫通孔に1つずつ細胞を捕捉する方法が開示されている(特許文献3参照)。この方法は、貫通孔(マイクロウエル)の内径と深さがそれぞれ細胞(被検体リンパ球)の粒径の1から2倍の大きさの貫通孔に、複数の細胞を含む懸濁液を貫通孔を覆うように加え、貫通孔内に細胞が沈むのを待つ過程と、貫通孔に沈んだ細胞以外の細胞を洗い流す洗浄の過程を繰り返し行うことで、1つの貫通孔に1つの細胞を捕捉するものである。しかしながら、特許文献3に記載された方法では、重力により細胞が沈むのを待つ時間が5分程度と長いこと、貫通孔内に細胞が沈むのを待つ過程と貫通孔に入らなかった細胞を洗い流す洗浄過程を繰り返すために操作が面倒かつ煩雑で迅速な処理を行い難いこと、そして貫通孔に入らなかった細胞を洗い流す過程で貫通孔に入った細胞も失われる可能性があるという課題があった。特に、任意の特異性について細胞を処理(選択)した後の場合には、貫通孔に入らなかった細胞を洗い流すのは大きなロスとなってしまう。
【0010】
【特許文献1】特開2001−290083号公報
【特許文献2】特公平7−4218号公報
【特許文献3】特許第3723882号公報
【特許文献4】特開平7−31455号広報
【発明の開示】
【発明が解決しようとする課題】
【0011】
本発明は、かかる従来の実状に鑑みて提案されたものであり、その目的は、安価な装置であって、簡便な構成であり、その維持、管理に時間、費用更には熟練を必要としない、微粒子の操作装置を提供することにある。また本発明の目的は、その使用に当たっては特別の熟練を要することなく、精度の高い微粒子の処理を可能とする装置を提供することにある。更に本発明の目的は、大量の微粒子を一度に処理し得る処理装置を提供することにある。
【課題を解決するための手段】
【0012】
上記目的を達成するためになされた本発明は、微粒子懸濁液を収容する収容部、一対の電極が配置された電極基板及び電極に接続された交流電源とから構成され、前記収容部の一部は絶縁体の材料で構成されるとともに前記懸濁液を前記各電極に接触可能とする貫通孔を有することを特徴とする、微粒子操作装置である。以下、図面を参照しつつ、本発明を詳細に説明する。
【0013】
本発明で取り扱うことができる微粒子は、電気的に静電容量性を有する微粒子であれば特に制限はなく、例えばシリカ、ジルコニア又は酸化ニッケル等の無機材料系微粒子、ポリスチレン等の有機材料系微粒子、抗体産生細胞やミエローマ細胞等の生物試料系微粒子を例示することができる。粒子の大きさも、後述する誘電泳動によって懸濁液中を移動できる範囲の大きさであれば制限はない。また装置に供する微粒子懸濁液は、上記のような微粒子が後述する誘電泳動で移動できる懸濁液であれば良い。例えば微粒子が無機材料系微粒子である場合には粒子径数μmから数百μm程度のジルコニア粒子を懸濁した水溶液を、微粒子が有機材料系微粒子である場合には粒子径粒子径数μmから数百μm程度のポリスチレン粒子を懸濁した水溶液を、微粒子が生物試料系微粒子である場合には抗体産生細胞(5μm程度の大きさ)やマウスのミエローマ細胞(10μm程度の大きさ)を懸濁したマンニトール水溶液(マンニトール濃度:300mM程度)を例示することができる。
【0014】
上記した微粒子を懸濁した懸濁液は、収容部に収容される。収容部は、その一部が絶縁体の材料で構成されるとともに、前記懸濁液を本発明の装置を構成する電極基板上に配置された電極に接触可能とする貫通孔を有する。かかる条件を満たす限り、収容部は、寸法や形状に特に制限はなく、また懸濁液を密閉した状態で収容するものに限られず、例えば上蓋のない液溜であっても良いし、例えば別途構成される細胞抽出装置に接続される流路の一部であっても良い。上蓋のない例として、例えば図5の構成において、上蓋14を省いた図8のような構成のものを例示できる(図9はこの図8の構成のB−B’断面を示す図である)。上蓋は、収容部に入れた微粒子を含む懸濁液の水分が蒸発することを防止したり、図5のような態様の装置においては、微粒子を含む懸濁液を安定して装置に供給するという役割を有する。
【0015】
また収容部は、収容部の一部に形成された貫通孔を、電極基板上に配置された電極で塞ぐように(図6参照)、電極基板と接続する。ここで、貫通孔を有する部分を絶縁体の材料で構成するのは、電極に交流電圧を付加した際に、任意の貫通孔に対して電気力線を集中させ、微粒子を当該貫通孔に移動させて捕捉するためである。本発明で採用することができる絶縁体の材料として、例えばガラス、セラミック、樹脂等が例示できるが、貫通孔を形成する際の加工容易性を考慮すると、樹脂等が好ましい絶縁体として例示できる。
【0016】
また、収容部の一部を形成する絶縁体の材質は、微粒子をそこに形成された貫通孔に引き寄せて捕捉することから、微粒子と親和性のある絶縁体であることが好ましい。微粒子と親和性のある絶縁体の材質とは、微粒子が親水性である場合には親水性の絶縁体が、微粒子が疎水性である場合には疎水性の絶縁体が好ましい。親和性の目安としては、一般的には、絶縁体の表面に前記微粒子に近い親和性を有する液体を滴下したときに形成される液滴と絶縁体の表面との接触角で示される(接触角が小さいほど液体と絶縁体の表面との親和性が高く、接触角が大きいほど液体と絶縁体の表面との親和性が低い)。親水性の比較的高い絶縁体としては、ガラスや酸化チタン等があり、疎水性の比較的高い絶縁体としては、ポリスチレン、ポリイミド、テフロン(登録商標)等の樹脂があり、扱う微粒子の親水性、疎水性に応じてこれらの材料を絶縁体として用いることを例示できる。
【0017】
なお、本質的に微粒子との親和性が低い絶縁体を用いざるを得ない場合であっても、絶縁体の表面を改質することによって微粒子との親和性を高めることができる。樹脂等の疎水性の絶縁体を親水化する方法としては、既知の方法である、プラズマ処理、化学修飾、タンパク質の物理吸着などによる修飾、或いはこれらの方法を任意に組み合わせた方法などを用いればよい。ここで、絶縁体表面のプラズマ処理とは、電子・イオン・ラジカルなどの活性種が存在する電気的に中性な電離気体(プラズマ)を絶縁体の表面に照射することにより、絶縁体の表面における有機汚染物の除去や化学結合状態を変化させ、絶縁体の表面を改質する処理である。プラズマ処理には、非重合性ガス(Ar、O2など)を用いるプラズマ表面処理と有機モノマーを用いて絶縁体の表面を高分子薄膜でコーティング処理するプラズマ重合がある。プラズマ表面処理は、Arなどの非反応性ガスによる表面架橋層の形成、O2などの反応性ガスによる官能基の導入などがあり、酸素プラズマ処理により−COOHや−COを導入し、絶縁体の表面の親水性を向上させることで親水性の微粒子との親和性を高めることが可能である。またここで絶縁体表面の化学修飾による親水化とは、水酸基やカルボキシル基、アミノ基、スルホン基などの親水基を有する誘導体やシランカップリング剤などを絶縁体の表面へ結合させることで親水化する方法である。シランカップリング剤は有機物とケイ素から構成される化合物であり、分子中に親水性を示す反応基(水酸基、カルボキシル基、アミノ基、スルホン基など)と疎水性を示す反応基(ビニル基、メチル基、エチル基、プロピル基など)の2種以上の異なった反応基を有している。このため、シランカップリング剤の希薄溶液に疎水性の絶縁体を浸漬すれば、シランカップリング剤の疎水性を示す反応基が疎水性の材料の表面に化学的に結合し、親水性を示す反応基が表面を覆うため、容易に疎水性の材料の表面を均一に親水化することが可能である。またここで、タンパク質の物理吸着などによる修飾であれば、例えばBSA(ウシ血清アルブミン)などのタンパク質含有溶液に絶縁体を数分から数時間を浸漬することで、タンパク質を物理吸着させ、絶縁体の表面を親水化することができる。
【0018】
ガラス等の親水性の絶縁体を疎水化する方法としては、シランカップリング剤を親水性の絶縁体表面に結合させる化学修飾による方法がある。シランカップリング剤は有機物とケイ素から構成される化合物であり、分子中に親水性を示す反応基(水酸基、カルボキシル基、アミノ基、スルホン基など)と疎水性を示す反応基(ビニル基、メチル基、エチル基、プロピル基など)の2種以上の異なった反応基を有している。そのため、シランカップリング剤の希薄溶液に親水性の絶縁体を浸漬すれば、シランカップリング剤の親水性を示す反応基が親水性の絶縁体の表面に化学的に結合し、疎水性を示す反応基が表面を覆うため、絶縁体の表面を均一に疎水化することが可能である。
【0019】
なお、親水性又は疎水性の評価方法としては、以下の一般的な手法を用いることができる。すなわち、絶縁体表面に純水を滴下し、そのときに絶縁体の表面に形成される液滴と絶縁体の表面との接触角を測定することによって絶縁体の表面の親水性及び疎水性を評価するのである。親水性及び疎水性の厳密な定義は存在しないため、本発明においては、親水性を前記接触角が50°以下、好ましくは40°以下であると定義し、疎水性を前記接触角が50°より大きく、好ましくは60°より大きいと定義する。さらに、接触角の測定は、基板上に滴下した液滴の左右端点と頂点を結ぶ直線の、固体表面に対する角度から接触角を算出するθ/2法を用いる。
【0020】
絶縁体に貫通孔を形成するためには、絶縁体の種類に応じた種々の方法を採用することができる。例えば樹脂に貫通孔を形成するためにはレーザーを照射する方法や、貫通孔を形成するためのピンを有する金型を用いて収容部を成形する方法などの既知の方法を用いることができる。また光硬化性樹脂などを用いる場合は、貫通孔に相当するパターンを描画した露光用フォトマスクを用いて一般的なフォトリソグラフィー(露光)とエッチング(現像)により貫通孔を形成することができる。
【0021】
図5に例示した本発明の微粒子操作装置では、装置の本体13は、上蓋14、スペーサー16及び貫通孔を形成した平板状の絶縁体8とからなる収容部と、電極を配置した電極基板15とから構成されている。収容部における貫通孔を有する部分は、例えば収容部を密閉可能な箱状の形態とするならば、微粒子の比重が微粒子を含有する懸濁液の比重以下であり、微粒子が上方向に浮上する場合は、その上面とすることができる。しかし、微粒子の操作に重力をも利用することができること、操作終了後に移動され、捕捉等された微粒子を分別回収するにあたり、上部から回収操作を行う方が簡便であること等を考慮すれば、当該部分は収容分の下部とし、同時に上部を塞ぐ部分(図5における14)を取り外し可能としておくことが特に好ましい。なお、微粒子の比重が小さい場合であっても、懸濁液の比重をそれ以下とすることは比較的容易である。
【0022】
収容部は、その全部を絶縁体の材料で構成することもできるが、例えば図5で示したように、収容部を絶縁体の材料で構成した部分(貫通孔を有する部分8)とその他の部分(16及び14)に分けて構成することも可能である。例えば加工の容易な材料で枠やスペーサー16を形成し、懸濁液が漏れないように貫通孔を設けた樹脂製の平板8を底面として当該枠やスペーサーに結合することで収容部とすることが例示できる。
【0023】
図5に示したような、収容部を上蓋14、スペーサー16及び絶縁体8で構成した場合について更に説明する。スペーサー16は、実際に微粒子の懸濁液を保持するスペースを確保するためのものであり、例えばガラス、セラミック、樹脂等の絶縁体を材料として構成しても良いし、スペーサーが電極aとbの両方(後述)と電気的に導通しなければ、金属等の導電体を材料として構成しても良い。図5の例では、スペーサーに導入流路及び該流路に連通する導入口19と、懸濁液を排出する排出流路及び該流路に連通する排出口20を設け、微粒子操作装置に対する懸濁液の供給と排出が迅速に実施可能にしてある。スペーサーの寸法、形状に特別の制限はないが、電極基板15に配置された一対の電極に合致する寸法、形状であることが好ましい。スペーサーの内側の空間と厚みは、操作対象とする懸濁液の量との関係で決定すれば良く、特に制限はないが、通常は微粒子懸濁液を数μLから数mL程度入れる容量があればよく、例えば、スペーサーのサイズが縦40mm×横40mm程度の場合、スペーサーの内側の空間は、縦20mm×横20mm程度であればよく、スペーサーの厚みは0.5から2.0mm程度であればよい。
【0024】
絶縁体8には、一対の電極の真上に位置する貫通孔9が、アレイ状に構成されている。ここでアレイ状とは、厳密には貫通孔の縦と横の間隔が等間隔に配置されていることを意味するが、本発明では貫通孔が縦方向のみ、あるいは横方向のみに、直線上かつ等間隔に配置された場合もアレイ状と表現する。このように貫通孔をアレイ状に配置することで、電極間に印加した交流電圧によって生じる電界がすべての貫通孔にほぼ均等に生じることになり、本発明の装置において均一な操作を実現するという効果を発揮するのである。
【0025】
貫通孔を塞ぐように収容部に接続される電極基板には、交流電圧を印可するための一対の電極が配置される。電極基板は、その上部に一対の電極を形成するため、絶縁体を用いる以外は特に制限はない。例えばガラス、セラミック、樹脂等を材料となる絶縁体の一例として例示できる。
【0026】
電極の材質は導電部材であって化学的に安定な部材であればとくに制限はなく、白金、金、銅などの金属やステンレスなどの合金及び、ITO(Indium Tin Oxide:酸化インジウムスズ)等の透明導電性材料等を使用することもできる。特に本発明の装置に懸濁液を供して操作を実施した際の、収容部内での微粒子の挙動をモニターする目的で電極基板を透明なガラス等とする場合、ITOは、その透明性や成膜性等の面で特に好ましい材料である。電極基板に配置された電極29及び30とからなる一対の電極31は、交流電源4に接続される(以後、本明細書ではこれら一対の電極の一方を便宜のために電極a、他方を電極b等と称することがある)。電極aとb(図5は、4本の電極aと、同じく4本の電極bを配置した例を記載している)は、収容部が有する全ての貫通孔に対応するものである。むろん、貫通孔の数に対応する、独立した複数の電極aとbであっても良い(a+b=貫通孔の数となる)が、通常、同時に多数の微粒子の操作を可能とするために多数の貫通孔を形成した収容部を使用することが好ましいため、その一つ一つに対応するように独立した複数の電極aとbを配置すると装置の構成が複雑となり、また各電極の維持も煩雑になる。そこで本発明では、図5に示したように、一対の電極を対向する2つの辺のそれぞれから他方の辺に向けて延びる平行な2枚の電極から構成するか、又は、対向する2つの辺のそれぞれから他方の辺に向けて延びる平行かつ等間隔な3枚以上の電極から構成することが好ましい。図5は、この態様に従い、一対の電極の一方を構成する電極aとして4枚、一対の他方を構成する電極bとして4枚の電極を櫛状に配置した例である。
【0027】
図6は、図5に示した微粒子操作装置のA−A’断面図を示した概略図である。上蓋14、スペーサー16、絶縁体8から構成される収容部と、一対の櫛状電極31(電極a29と電極b30)を配置した電極基板15を張り合わせる手段としては、それぞれを接着剤で貼り合わせる方法、加圧した状態で過熱して融着させる方法、スペーサーとしてPDMS(poly−dimethylsiloxane)やシリコンシートのような表面粘着性のある樹脂を用いてこれらを作製し、圧着して貼り合わせる方法等が例示できる。
【0028】
図7は、図5に示した微粒子操作装置の電極基板15と一対の電極31及び貫通孔9の配置の関係を、収容部の上部から観察した様子を示す図である。図7に示すように本発明の微粒子操作装置は、垂直方向に貫通した貫通孔9の真下に櫛状電極31の電極a29又は電極b30のいずれかが配置されており、貫通孔の列または行毎に、電極a29と電極b30が交互に配置されている点に特徴がある。このような構成において、貫通孔の真下に形成される電極の幅は、隣の電極と重ならなければ特に制限はないが、貫通孔内に均等に電気力線が集中するよう、貫通孔の直径以上とすることが好ましい。また、貫通孔の上から見える電極の位置にも特に制限はないが、貫通孔内に均等に電気力線が集中するよう、図7に示すように、貫通孔の中心軸32と電極を形成する導電部材の中心軸35が重複するように配置することが好ましい。
【0029】
図10は、従来の微粒子操作装置を、そして図11は図10の装置のC−C’断面を示すものであり、本発明の微粒子操作装置の優位性を説明するために記載したものである。図10の装置では、一対の電極の一方が上蓋としても機能する上部の電極基板47の下面に配置され、一対の電極の他方が下部の電極基板48の上面に配置されている。そして、これら一対の電極により、スペーサー16、上蓋(上部の電極基板48)、貫通孔を有する平板の絶縁体8で構成される収容部を挟みこむような構成となっている。図10に示した装置では、一対の電極が収容部を挟んでいるため、上蓋として機能する上部の電極基板47を容易に取り外すことができず、貫通孔に微粒子を移動させ、捕捉した後、貫通孔から捕捉された任意の微粒子をマイクロピペット等の微粒子採取手段を用いて採取する際に困難を伴う。これに対して本発明の装置は、収容部の一部に貫通孔を形成し、これを一対の電極を同一面上に配置した電極基板で塞ぐような構成としているため、上蓋そのものを省くことすら可能である。懸濁液の蒸発を防ぐ等の目的で、図5に例示したような構成とした場合でも、本発明の装置は、一対の電極全て(図5における電極a29及び電極b30)を櫛状等にして一枚の電極基板上に配置するため、上蓋を取り外すことも可能であるし、なによりも、電極に交流電圧を印加して微粒子に誘電泳動力を作用させ、貫通孔に捕捉しつつ、捕捉された微粒子のうちの任意のものをマイクロピペット等で採取することが容易にできるのである。
【0030】
本発明の装置では、上記に加え、一枚の電極基板に一対の電極全てを設置していることから、対となる電極同士の間隔を微粒子の粒子径と等の数μmから数十μmと微小にすることが可能である。この結果、一対の電極間に印加する交流電圧が低くとも、この微小な電極間距離によって電極間に大きな電界を発生させて微粒子に大きな誘電泳動力を作用させることが可能になる。例えば図10に示した従来の微粒子操作装置では、一対の電極を上部の電極基板47の下面と下部の電極基板48の上面に配置し、これらでスペーサー16を挟み込んで収容部としていため、電極間の距離はスペーサーの厚みで制限されるが、一般にスペーサーの厚みが1mm未満になると、収容部に微粒子の懸濁液を導入することが困難となるため、両電極基板の離間距離を1mm未満とすることはできない。ここで電界は、電極間に印加する電圧を電極間距離で割った値であるので、電極間の離間距離を数μmから数十μmにすることができる本発明の装置(例えば図5の装置)では、同距離を1mm未満とすることができない図10に示した従来の装置と比較して、同一電圧を印加するならば数十倍の強度の電界を得ることができ、同一強度の電界を得るならば数十分の一の電圧で済むことになる。この結果、小型で安価な交流電源を使用しても、従来の装置以上に効果的な微粒子操作を可能とする装置を提供することが可能となる。
【0031】
微粒子操作装置の電極基板15に配置された一対の電極である電極a29と電極b30には、導電線3を介して交流電源4が接続される。交流電源4は、貫通孔に微粒子を移動させ、捕捉し、又は貫通孔から微粒子を脱離させる電界を発生させるのに十分な交流電圧を電極aとbの間に印加できれば特に制限はない。具体的に例えば、ピーク電圧が1Vから20V程度で、周波数100kHzから3MHz程度の正弦波、矩形波、三角波、台形波等の波形の交流電圧を印加できる電源が例示できるが、中でも、微粒子を移動させ、1つの貫通孔に1個の微粒子のみを捕捉し得るようにできる波形の交流電圧を電極a29と電極b30の電極間に印加することが特に好ましい。かかる波形の交流電圧としては、矩形波を使用することが好ましい。図12から図15に示すように、交流電圧の波形が正弦波(図12)、三角波(図13)、台形波(図14)である場合に比べて、矩形波(図15)である場合は、瞬時に設定したピーク電圧36に到達するため、微粒子を貫通孔に向けて速やかに移動させることが可能となり、2個以上の微粒子が重なるように貫通孔に入る確率を低くできる(1つの貫通孔に1個の微粒子のみを捕捉し得る確率が高くなる)のである。微粒子は電気的にコンデンサーと見なすことができるが、矩形波のピーク電圧が変化しない間は、貫通孔に捕捉された微粒子には電流が流れ難くなって電気力線が生じ難くなり、この結果微粒子を捕捉した貫通孔には誘電泳動力が発生し難くなる。従って、一度貫通孔に微粒子が捕捉されると、別の微粒子がその貫通孔に捕捉される確率は低くなり、代わりに電気力線が生じ誘電泳動力が発生している貫通孔(微粒子を捕捉していない、空の貫通孔)に、順次、微粒子が捕捉されるためである。なお、本発明の微粒子操作装置では、直流成分を有しない交流電圧を発生する電源を採用することが好ましい。直流成分を有する交流電圧を印加すると、直流成分により発生した静電気力により微粒子が特定の方向に偏った力を受けて移動し、誘電泳動力によって貫通孔に捕捉し難くなるからである。また直流成分を有する交流電圧を印加すると、微粒子を含有する懸濁液に含まれるイオンが電極表面で電気反応を生じて発熱し、それによって微粒子が熱運動を起こすため誘電泳動力によって動きを制御できなくなり、貫通孔に移動させて捕捉することが困難になるからである。
【0032】
本発明の微粒子操作装置では、上記したように、印加する交流電圧の波形を好ましくは矩形とすることにより、1つの貫通孔に1個の微粒子のみを捕捉し得るようにすることが好ましいが、かかる目的を達成するために、更に、貫通孔の配置や、貫通孔の寸法、形状を、1つの貫通孔に1個の微粒子のみを捕捉し得るのに適した配置、寸法、形状とすることが好ましい。例えば、本発明において、貫通孔を好ましくアレイ状に配置する場合、隣接する貫通孔同士の間隔が狭すぎても広すぎても、上記目的を達成するのは困難になる。隣接する貫通孔同士の間隔が狭い場合は、1つの貫通孔に複数の微粒子が捕捉されてしまう確率が高くなり、反対に隣接する貫通孔同士の間隔が広い場合は、貫通孔と貫通孔の間に微粒子が残されてしまい、微粒子を捕捉できない貫通孔が生じる確率が高くなるからである。これらを回避するためには、隣接する貫通孔同士の間隔を、捕捉しようとする微粒子の粒径の0.5倍以上6倍以下の範囲であることが好ましく、更には1倍以上2倍未満とすることが特に好ましい。また更に、1つの貫通孔に1個の微粒子のみを捕捉し得るようにするため、貫通孔の収容部側開口に内接する最大円の直径を、捕捉しようとする微粒子の粒径未満とすること、又は、微粒子の粒径の1倍以上2倍未満の範囲でありかつ貫通孔の深さを微粒子の粒径の2倍未満とすること、が好ましい。これは、貫通孔開口の内径が微粒子の粒径より大きいと、微粒子は貫通孔を塞ぐことができずに電気力線が集中してしまい、他の微粒子が誘電泳動力により引き寄せられて1つの貫通孔に2個以上の微粒子が捕捉される確率が高くなるからである。従って、1つの貫通孔に1個の微粒子のみを捕捉するためには、貫通孔の収容部側開口に内接する最大円の直径が、貫通孔に捕捉しようとする微粒子の粒径未満とすることが最も好ましいのである。この他に、貫通孔に捕捉する微粒子の粒径の1倍以上2倍未満倍の範囲でありかつ貫通孔の深さが微粒子の粒径の2倍未満としても、1個の微粒子が貫通孔に捕捉されると他の微粒子は引き寄せられても貫通孔に入れないため、捕捉される確率を低くすることができる。また、貫通孔の収容部側の開口形状(平面的な形状)を、1以上の角を有する形状とすることも、1つの貫通孔に1個の微粒子のみを捕捉するために好ましく、貫通孔の開口形状を四辺形とすることが特に好ましい。ここで、角とは貫通孔の形状を構成する2辺が鋭角あるいは鈍角で交わる部分であり、角の先端が若干丸みを帯びた形状も含む。図16に、貫通孔の開口形状が少なくとも1以上の角を有する代表的な形状を例示する。またここで四辺形とは、前記貫通孔の形状が前記角(その先端が若干丸みを帯びた形状を含む)4つ有するものである。なお4本の辺は直線であってもよいし、4本全ての辺あるいは4本のうち任意の辺が貫通孔の中心あるいは外側に向かって若干湾曲していてもよい。図17に、四辺形の貫通孔の代表的な形状を例示する。このように、貫通孔の開口形状が一部に角を有するものであれば、前記角の部分において電気力線の集中が生じて誘電泳動力が強くなり、より強く微粒子を移動させる(引き寄せる)結果、微粒子が貫通孔に捕捉される確率が向上するのである。角は貫通孔に少なくとも1箇所存在すればよいが、複数存在していた方がより好ましい。ただし、角は鈍角よりも鋭角の方が電気力線の集中が生じやすく誘電泳動力を強くできるため、五角形以上の多角形よりも四角形以下の多角形がより好ましい。また、仮に四角形であっても、その具体的な形状には特に制限はなく、例えば図17に示したような台形や菱形、平行四辺形など、種々の形状を選択し得る。中でも、四辺形の貫通孔の形状が4つの角を結ぶ4辺の長さがほぼ等しく、貫通孔の中心において90度の角度で点対称となる形状は、四辺形の貫通孔の4つの辺に生じる誘電泳動力が等しく、4つの角に生じる誘電泳動力も等しくなり、誘電泳動力の分布が点対称となって貫通孔に対する微粒子の位置によらず、偏りの少ない誘電泳動力を作用させることが可能となり、特に好ましい。かかる形状としては、図17の(a)から(d)のような正方形又は正方形に近い形状を例示することができる。
次に、本発明の微粒子操作装置を用いた微粒子操作方法について、図18から図22を用いて説明する。図18に示したように、微粒子操作装置を形成する電極基板15の上面(収容部を形成するスペーサー16に形成された空間34側の面)には、電極a29と電極b30からなる一対の電極が櫛状に配置され、電極aと電極bの間に交流電源4により交流電圧を印加すると、電極の真上に位置し、垂直方向に貫通した貫通孔9に電気力線12が集中し、微粒子18に誘電泳動力が作用する(特許文献2参照)。ここで、誘電泳動力には、図19に示すように微粒子18を貫通孔9に移動させ、捕捉するように作用する誘電泳動力(以下、正の誘電泳動力37とする)と、図21に示すように微粒子18を貫通孔9から脱離するように移動させる誘電泳動力(以下、負の誘電泳動力38とする)がある。なお、正の誘電泳動力37が作用した場合、図20に示すように微粒子18は貫通孔9に捕捉され、負の誘電泳動力38が作用した場合、図22に示すように微粒子18は、収容部の貫通孔と貫通孔の間の部分(図5に示した装置においては、絶縁体8上)に捕捉される。
【0033】
正の誘電泳動力と負の誘電泳動力は、対象とする微粒子の誘電率とその微粒子を含有する微粒子懸濁液17の誘電率及び使用する交流電圧の周波数によって制御することができる。例えば、微粒子が粒径10μm程度のマウスミエローマ細胞であり、懸濁液が300mMのマンニトール水溶液である場合は、交流電圧の周波数が50kHz以上であれば正の誘電泳動力がマウスミエローマ細胞に作用し、10kHz未満であれば負の誘電泳動力がマウスミエローマ細胞に作用する。また例えば、微粒子が粒径6μm程度のポリスチレン微粒子であり、懸濁液が純水である場合は、交流電圧の周波数が1MHz以上で負の誘電泳動力がポリスチレン微粒子に作用し、10Hz未満で正の誘電泳動力がポリスチレン微粒子に作用する。
【0034】
ある周波数で正の誘電泳動力と負の誘電泳動力が切り換わる理由を説明する。本発明の貫通孔における誘電泳動力は、微粒子半径、交流電圧、電極間距離、微粒子の誘電率、懸濁液の誘電率により、一般に以下の式1で示される。
【0035】
【化1】

ここで、微粒子の誘電率と懸濁液の誘電率は、一般に交流電圧の周波数に依存して変化する。従って、交流電圧の周波数を変化させたときの微粒子の誘電率と懸濁液の誘電率の大小により、誘電泳動力の符号が決まる(変化する)。すなわち、交流電圧の周波数を変化させたとき、微粒子の誘電率が懸濁液の誘電率よりも大きくなれば、微粒子には正の誘電泳動力が作用し、微粒子の誘電率が懸濁液の誘電率よりも小さくなれば微粒子には負の誘電泳動力が作用する。このように、理論的には計算によって微粒子の誘電率と懸濁液の誘電率が等しくなる周波数(正の誘電泳動力と負の誘電泳動力が変化する境界の周波数、以下、境界周波数という)を求めることができる。しかし、微粒子の誘電率や懸濁液の誘電率を周波数ごとに測定することは煩雑であるため、微粒子の移動する方向の変化を観察することで、境界周波数を実験的に決定することが簡便である。このようにして決定される境界周波数は、当然、微粒子の種類や懸濁液の種類によって異なるものとなる。本発明の微粒子操作装置では、操作しようとする微粒子が貫通孔に捕捉されるように移動させるか、又は、微粒子が貫通孔から脱離するように移動させるように誘電泳動力が作用する方向を変化させるべく、適宜、電極に付加する交流の周波数を変えることが好ましい。この意味において、本発明の微粒子操作装置に採用する交流電源は、その周波数を任意に変更し得るものが好ましい。なお本発明の微粒子操作装置において、電極aと電極bの間に、貫通孔から微粒子を脱離させる方向の負の誘電泳動力が作用するような周波数の交流電圧を印加すると、貫通孔ではなく、貫通孔と貫通孔の間、即ち収容部内壁を構成する部分に微粒子を捕捉することが可能となる。
【0036】
本発明の微粒子操作装置を用いれば、前記したように、交流の周波数を適宜選択することによって雑多の微粒子を含む懸濁液の中から所定の誘電率を有する微粒子のみを選別し、貫通孔に捕捉することが可能となる。しかも、本発明の微粒子操作装置は、好ましくは収容部の下部に電極基板を設置しているため、交流電圧を付加して微粒子を貫通孔に捕捉した状態で、当該貫通孔からマイクロピペット等を用いて捕捉された微粒子を採取することが可能となる。図23は、本発明の微粒子操作装置と、貫通孔9に捕捉された微粒子18を採取する微粒子採取手段21として、マイクロピペットを採用した場合の概念図である。目的の微粒子を選んで採取する場合は、図23に示すように顕微鏡22を設置し、顕微鏡での観察下でマイクロピペット21を操作して微粒子を採取する。顕微鏡のステージ40として、1μm前後で精密に位置決めできるものを採用すれば、顕微鏡で観察しながら採取しようとする微粒子を確実にマイクロピペット21で採取することができる。また微粒子を採取する際には、電極aと電極bの間に、微粒子を貫通孔に捕捉する正の誘電泳動力が作用する周波数の交流電圧を電源4から印加しておけば、目的の微粒子だけをマイクロピペットで採取し、他の微粒子は貫通孔に捕捉したままにしておくことが可能である。
【0037】
図24は、本発明の微粒子操作装置の応用例を示すものである。例えば癌などの異常細胞41の存在が疑われる懸濁液を微粒子操作装置に供し、細胞を貫通孔に捕捉する。一方で当該検出の目的となる異常細胞41の表面に特異的に結合するマーカー分子42を蛍光色素43等で修飾しておき、収容部に当該マーカー分子を導入し、マーカー分子と異常細胞を特異的に結合反応させる。細胞を貫通孔に捕捉したまま、収容部中の懸濁液を未反応のマーカー分子とともに排出した後、貫通孔に捕捉された細胞にマーカー分子が導入されたか否かをそのままの状態で、又は、微粒子採取手段で採取した後、顕微鏡等で検出したり、蛍光色素等を検出するための公知の試薬と光学装置等を用いて検出する。これにより、癌などの異常細胞を採取し、又は、検出することが本発明の微粒子操作装置により可能となる。
【0038】
上記では微粒子採取手段としてマイクロピペットを説明したが、微粒子採取手段は微粒子を採取することができれば特に制限はなく、マイクロピペット以外にも、電気浸透流を利用して精密に微粒子を採取可能な微粒子採取手段を用いることができる。
【発明の効果】
【0039】
本発明の微粒子操作装置は、以下の効果を奏するものである。
(1)本発明の微粒子操作装置は、一枚の電極基板に一対の電極全てを設置することから装置構成を簡便にでき、また、簡便であるために安価に提供できる。また構成が簡便であるために、その維持、管理に費用や熟練を要することがない。
(2)本発明の微粒子操作装置は、1つの貫通孔に概ね1つの微粒子を速やかに捕捉することができる。特に、収容部の一部をアレイ状に形成した複数の貫通孔を有する絶縁体で構成した態様では、複数の微粒子を1つずつ速やかにアレイ状に配置した貫通孔に捕捉することができる。
(3)本発明の微粒子操作装置は、1つの貫通孔に概ね1つの微粒子を捕捉できる確率を向上することができる。特に、収容部の一部をアレイ状に形成した複数の貫通孔を有する絶縁体で構成した態様では、複数の微粒子を1つずつアレイ状に配置した貫通孔に捕捉する確率を向上することができる。
(4)本発明の微粒子操作装置は、貫通孔に捕捉した微粒子を速やかに貫通孔から脱離する(取り出す)ことができる。
(5)本発明の微粒子操作装置は、貫通孔に微粒子を捕捉したまま、貫通孔から任意の微粒子を容易に脱離させ、採取する事ができる。
(6)本発明の微粒子操作装置は、電極の距離を短くできるため、比較的小型で安価な交流電源でも十分に微粒子操作を可能とする電界を得る事ができる。
【発明を実施するための最良の形態】
【0040】
以下、本発明を実施例に基づいて更に詳細に説明するが、本発明は実施例に限定されるものではない。
【実施例1】
【0041】
実施例1においては、装置本体13が、収容部(スペーサー16と貫通孔9を形成した絶縁体8とから構成される)及び電極基板15とから構成される、図8に示した微粒子操作装置を使用した。
【0042】
電極基板15には、縦70mm×横40mm×厚さ1mmのガラス基板を用いた。スペーサー16は、縦40mm×横40mm×厚さ1.5mmのシリコンシートの中央(34)を縦20mm×横20mmにくりぬいた形状にして用いた。また、図8に示すように、微粒子が含有した懸濁液を導入、排出するための導入口19と排出口20を設けた。複数の貫通孔9を有する絶縁体8と櫛状電極31は、図25及び図26に示すフォトリソグラフィーとエッチングによる方法により電極基板15上に一体的に形成した。
【0043】
図25に示すように、ガラス24の片面に、スパッタにより膜厚1nmのCrを成膜し(44)、さらにその上にスパッタにより膜厚150nmのAuを成膜した(45)。なおCrは、Auとガラスの密着性を高めるために成膜している。次に、成膜したAuの上にスピンコーターを用いて1μmの膜厚になるようレジスト(25)を塗布し、1分自然乾燥後、ホットプレートを用いてプリベーク(105℃、15分)を行った。レジストにはポジ型のものを用いた。
【0044】
次に、縦30mm×横30mmのエリアに、幅10μmの電極aと幅10μmの電極bを50μm間隔で形成した櫛状電極パターンを描いた露光用フォトマスク26を用いて、UV露光機にてレジストを露光27し、現像液33で現像した。露光時間と現像時間は、現像により剥離する膜厚がレジストの膜厚と等しい1μmになるように調整し、貫通孔の底面にAuが露出するようにした。現像後、3%ヨウ素ヨウ化アンモニウム液49により露出したAu膜を剥離し、次に30%硝酸二アンモニアセリウム液50によりAu膜剥離後に露出したCr膜を剥離した。最後に、レジストをリムーバーにより剥離し、櫛状電極31を形成した。
【0045】
このようにして作製した電極基板上の櫛状電極31の上に、図26に示すようにレジスト25を5μmの膜厚になるようスピンコーターを用いて塗布し、1分自然乾燥後、ホットプレートを用いてプリベーク(65℃、1分 → 95℃、3分)を行った。レジストにはエポキシ系のネガタイプレジストを用いた。次に、縦30mm×横30mmのエリアに、貫通孔と貫通孔の縦と横の間隔が30μmで、縦1000個×横1000個のアレイ状に並べた直径8.5μmの円形の貫通孔パターンを描いた露光用フォトマスク46を用いて、UV露光機にてレジストを露光27し、現像液33で現像した。露光時間と現像時間は、貫通孔の深さがレジストの膜厚と等しい5μmになるように調整し、貫通孔の底面の櫛状電極が露出するようにした。現像後、ホットプレートを用いてポストベーク(150℃、15分)を行い、レジストを固め、貫通孔を形成した絶縁体と一体型となった櫛状電極を形成した下部基板を製作した。
【0046】
このようにして作製した電極基板15、スペーサー16を図9のように積層し圧着した。図9は、図8に示した細胞融合容器のB−B’断面図である。シリコンシートの表面は粘着性があり、圧着することで各部品は密着し、微粒子を含有した懸濁液を漏れなく本体13の中に入れることができた。スペーサーをくりぬいた面積が縦20mm×横20mmであることから、この空間34に存在する貫通孔の数は約40万個である。また、電極間に電圧を印加する電源(信号発生器)をリード線で接続した。
【0047】
微粒子には、マウスミエローマ細胞(粒径約10μm)を用い、300mMの濃度のマンニトール水溶液に懸濁させ、0.7×106個/mLの密度になるように細胞懸濁液を調整した。
【0048】
収容部の一部を構成する貫通孔を形成した絶縁体8の親水性を評価するために、その表面に純水を滴下し、そのときに絶縁体の表面に形成される液滴と絶縁体の表面との接触角を測定したところ、接触角は約74°で、疎水性であった。そこで、貫通孔を形成した絶縁体8を親水化するために、電極基板15(貫通孔を形成した絶縁体8は、電極基板15上に一体に形成されている)をBSA(1mg/mL)含有の300mM濃度のマンニトール水溶液に約1時間浸し、絶縁体表面にBSAを物理吸着させた。BSAを物理吸着させた後、同様に、絶縁体表面に純水を滴下し、そのときに絶縁体の表面に形成される液滴と絶縁体の表面との接触角を測定したところ、接触角は約37°であり、親水性化されたことを確認した。この場合、絶縁体表面と操作対象であるマウスミエローマ細胞(親水性を有する)との親和性は比較的高い。
【0049】
上記細胞懸濁液600μL(細胞数:約40万個)をスペーサー16の導入口よりシリンジを用いて注入し、交流電圧として信号発生器により電圧2Vpp、周波数3MHzの矩形波交流電圧を電極間に印加したところ、2から3秒程度の極めて短い時間でアレイ状に形成した貫通孔1つに、1つの細胞を捕捉することができ、細胞をアレイ状に配置させることができた。なお、「捕捉することができた」とは、貫通孔に微粒子が入った場合及び、貫通孔の縁に微粒子が留まった場合の両方を意味し、以下の実施例と比較例でも同じ定義とした。このときの、1つの貫通孔に概ね1つの細胞が入る微粒子捕捉率は約90%であった。なお微粒子捕捉率とは、顕微鏡の視野に縦15個×横15個の225個の貫通孔が見えるようにし、微粒子を導入して捕捉したときの、1個の微粒子が入った貫通孔数を225個の貫通孔数で割った値で定義し、以下の実施例と比較例でも同じである。
【0050】
図23に示すように、本体13に微粒子採取手段21を設置した。微粒子採取手段には、電気浸透流を利用して精密に微粒子を採取可能なピペットを用いることで、顕微鏡22で観察しながら、貫通孔に捕捉した特定の細胞を採取する事ができた。また、電源4により櫛状電極間に交流電圧(2Vpp、3MHz)を印加しつづけ、細胞を貫通孔に捕捉する方向に誘電泳動力を作用し続けさせることで、採取した以外の細胞は貫通孔に捕捉したままで脱離は確認されなかった。
【0051】
引き続き、交流電圧として信号発生器により電圧2Vpp、周波数1kHzの正弦波交流電圧を電極間に印加したところ、2から3秒程度の極めて短い時間でアレイ状の貫通孔に捕捉していた細胞を貫通孔から容易に取り出すことができた。本体を傾けて細胞懸濁液を取り出したところ、取り出した細胞数は、導入した細胞数の約80%であった。
【0052】
(比較例)
比較のため、図10に示した微粒子操作装置を用いて操作を行った。図10の微粒子操作装置では、本体13は、収容部(スペーサー16と貫通孔を形成した絶縁体8から構成される)を、上部の電極基板47と下部の電極基板48で挟み込んだ構成である。上部の電極基板と下部の極基板には、縦70mm×横40mm×厚さ1mmのガラス基板に、ITOを成膜(膜厚150nm)したものを用いた。スペーサー16は、縦40mm×横40mm×厚さ1.5mmのシリコンシートの中央(34)を縦20mm×横20mmにくりぬいた形状にして用いた。また図10に示すように、微粒子が含有した懸濁液を導入、排出するための導入口19と排出口20を設けた。複数の貫通孔9を有する絶縁体8と電極は、図25及び図26に示すフォトリソグラフィーとエッチングによる方法により、電極基板上に一体成形した。
【0053】
まずガラス24の片面にITO(23)を成膜し、その成膜面にスピンコーターを用いて5μmの膜厚になるようにレジスト(25)を塗布し、1分自然乾燥後、ホットプレートを用いてプリベーク(65℃、1分 → 95℃、3分)を行った。レジストにはエポキシ系のネガタイプレジストを用いた。
【0054】
次に、縦30mm×横30mmのエリアに、貫通孔と貫通孔の縦と横の間隔が30μmで、縦1000個×横1000個のアレイ状に並べた直径8.5μmの円形の貫通孔パターンを描いた露光用フォトマスク46を用いて、UV露光機にてレジストを露光27し、現像液33で現像した。露光時間と現像時間は、貫通孔の深さがレジストの膜厚と等しい5μmになるように調整し、貫通孔の底面にITOが露出するようにした。現像後、ホットプレートを用いてポストベーク(150℃、15分)を行い、レジストを固め、貫通孔を形成した絶縁体8を一体に形成した下部の電極基板48を製作した。
【0055】
このようにして作製した下部の電極基板48とスペーサー16を図11のように積層し圧着した。また圧着物と上部の電極基板47は金具により取り外し可能に圧着した。図11は、図10に示した細胞融合容器のC−C’断面図である。シリコンシートの表面は粘着性があり、圧着することで各部品は密着し、微粒子を含有した懸濁液を漏れなく本体13の中に入れることができた。スペーサーをくりぬいた面積が縦20mm×横20mmであることから、この空間34に存在する貫通孔の数は約40万個である。また、電極間に電圧を印加する電源(信号発生器)をリード線で接続した。
【0056】
微粒子には、マウスミエローマ細胞(粒径約10μm)を用い、300mMの濃度のマンニトール水溶液に懸濁させ、0.7×106個/mLの密度になるように細胞懸濁液を調整した。
【0057】
収容部の一部を構成する貫通孔を形成した絶縁体8の親水性を評価するために、その表面に純水を滴下し、そのときに絶縁体の表面に形成される液滴と絶縁体の表面との接触角を測定したところ、接触角は約74°で疎水性であった。そこで、貫通孔を形成した絶縁体8を親水化するために、下部の電極基板48(貫通孔を形成した絶縁体8は、下部の電極基板48上に一体に形成されている)をBSA(1mg/mL)含有の300mM濃度のマンニトール水溶液に約1時間浸し、絶縁体表面にBSAを物理吸着させた。BSAを物理吸着させた後、同様に、絶縁体表面に純水を滴下し、そのときに絶縁体の表面に形成される液滴と絶縁体の表面との接触角を測定したところ、接触角は約37°であり、親水化されたことを確認した。この場合、絶縁体表面と操作対象であるマウスミエローマ細胞(親水性を有する)との親和性は比較的高い。
【0058】
上記細胞懸濁液600μL(細胞数:約40万個)をスペーサー16の導入口よりシリンジを用いて注入し、交流電圧として信号発生器により電圧2Vpp、周波数3MHzの矩形波交流電圧を電極間に印加したが、貫通孔に細胞を捕捉する事はできなかった。これは、上部の電極基板と下部の電極基板間の距離が1.5mmと長く、2Vppの電圧では細胞を貫通孔に捕捉するための誘電泳動力を発生するための電界を十分に与えることができなかったためである。
【0059】
次に、交流電圧として信号発生器により電圧10Vpp、周波数3MHzの矩形波交流電圧を印加したところ、2から3秒程度でアレイ状に形成した貫通孔1つに、1つの細胞を捕捉することができた。しかしながら本比較例に用いた本体13には上部基板が存在するため、貫通孔に捕捉した任意の細胞を採取する際には、電圧の印可を止め、かつ、金具をはずして上部の電極基板を取り除く必要があり、いったん捕捉した細胞が貫通孔から脱離する例が発生した。
【実施例2】
【0060】
実施例1と同様の微粒子操作装置を用い、微粒子操作領域に実施例1と同様のマウスミエローマ細胞を導入し、電圧および矩形波交流電圧印加時間は上記のままで周波数だけを小さくした。その結果、図31のように50kHzでは細胞の捕捉率は約81%を示し、30kHzで約50%の細胞を捕捉できた。しかし10kHzでは細胞はほとんど捕捉できなかった。この結果から、細胞を貫通孔に捕捉するための交流電源の交流周波数は30kHz以上、好ましくは50kHz以上が望ましいことが分かる。
【0061】
また、同様の手法を用いて細胞脱離率の測定を行った。細胞脱離率とは、懸濁液を導入して第1の交流電源を用いて捕捉されたマウスミエローマ細胞のうち貫通孔から取り出された細胞数を、捕捉された細胞数で割った値で定義した。交流電源により電圧2Vpp、周波数10kHzの矩形波交流電圧を10秒間電極間に印加したところ、アレイ状に形成した複数の貫通孔に捕捉されていた細胞を取り出すことができた。このときの、細胞の脱離率は約100%であった。電圧および矩形波交流電圧印加時間は上記のままで周波数だけを大きくしたところ、図32のように10kHzでは脱離率は約100%を示し、20kHzでは約50%が脱離した。しかし100kHzではほとんど脱離しなかった。この結果から、細胞を貫通孔から脱離させるための交流電源の交流周波数は20kHz未満、好ましくは10kHz未満であることが望ましいことが分かる。
【実施例3】
【0062】
実施例1と同じ微粒子操作装置を用い、微粒子には市販のポリスチレン微粒子(粒径約6μm、ポリスチレン微粒子濃度2.5%)を用い、純水に懸濁させて0.8×106個/mLの密度になるようにポリスチレン微粒子懸濁液を調整した。ただし、実施例1と異なり、貫通孔を形成した絶縁体8の親水化処理は行わなかった。即ち、絶縁体8は疎水性であるため、疎水性を示すポリスチレン微粒子と絶縁体との親和性は比較的高い。
【0063】
上記ポリスチレン微粒子懸濁液500μL(微粒子数:約40万個)をスペーサーの導入口よりシリンジを用いて注入し、交流電圧として信号発生器により電圧2Vpp、周波数9Hzの矩形波交流電圧を電極間に印加したところ、2から3秒程度の極めて短い時間でアレイ状に形成した貫通孔1つに、概ね1つのポリスチレン微粒子を捕捉することができ、微粒子捕捉率は約60%であった。
【0064】
次に、交流電圧として信号発生器により電圧2Vpp、周波数100kHzの正弦波交流電圧を電極間に印加したところ、2から3秒程度の極めて短い時間でアレイ状の貫通孔に捕捉されていたポリスチレン微粒子を、貫通孔から脱離させることができた。引き続き、本体13を傾けてポリスチレン微粒子懸濁液を取り出したところ、取り出したポリスチレン微粒子数は、導入したポリスチレン微粒子数の約78%であった。
【0065】
なお、本実施例3で用いた微粒子操作措置を用いて、交流電圧の周波数とポリスチレン微粒子の貫通孔への捕捉と取り出しをさらに検討した結果、交流電圧(電圧2Vpp)の周波数が約100Hz未満で貫通孔にポリスチレン微粒子が捕捉されはじめ、10Hz未満になると、約50から60%のポリスチレン微粒子が貫通孔に捕捉された。また、交流電圧の周波数が約1kHz以上で貫通孔からポリスチレン微粒子が脱離しはじめ、1MHz以上になると、貫通孔に捕捉されたポリスチレン微粒子のうちほぼ90%以上のポリスチレン微粒子を貫通孔から脱離させることができた。
【図面の簡単な説明】
【0066】
【図1】特許文献2に記載された発明を説明するための図である。
【図2】特許文献2に記載された発明を説明するための図である。
【図3】特許文献2に記載された発明を説明するための図である。
【図4】特許文献2に記載された発明を説明するための図である。
【図5】本発明の微粒子操作装置を説明するための図である。
【図6】図5に示した微粒子操作装置の本体13のAA’断面図である。
【図7】図5に示した装置を構成する電極基板上の一対の電極と貫通孔の配置を上側から見た図である。
【図8】本発明の微粒子操作装置を説明するための図である。
【図9】図8に示した微粒子操作装置の本体13のBB’断面図である。
【図10】比較例として用いた微粒子操作装置を説明するための図である。
【図11】図10に示した微粒子操作装置の本体13のCC’断面図である。
【図12】本発明に用いる交流電圧の波形のうち正弦波を示す図である。
【図13】本発明に用いる交流電圧の波形のうち三角波を示す図である。
【図14】本発明に用いる交流電圧の波形のうち台形波を示す図である。
【図15】本発明に用いる交流電圧の波形のうち矩形波を示す図である。
【図16】本発明における貫通孔形状の例を示す図である。
【図17】本発明における貫通孔形状の例を示す図である。
【図18】本発明の微粒子操作装置による操作を説明するための図である。
【図19】本発明の微粒子操作装置による操作を説明するための図である。
【図20】本発明の微粒子操作装置による操作を説明するための図である。
【図21】本発明の微粒子操作装置による操作を説明するための図である。
【図22】本発明の微粒子操作装置による操作を説明するための図である。
【図23】本発明の微粒子操作装置と、貫通孔に捕捉した特定の微粒子を採取する微粒子採取手段として、マイクロピペットを設置した装置の図である。
【図24】本発明の微粒子操作装置を異常細胞の検出装置として応用した例を示す図である。
【図25】一般的なフォトリソグラフィーとエッチングを用いて、櫛状電極を作製する工程の概略図である。
【図26】一般的なフォトリソグラフィーとエッチングを用いて、貫通孔を作製する工程の概略図である。
【符号の説明】
【0067】
1:融合領域
2:電極
3:導電線
4:電源
5:交流電源
6:直流パルス電源
7:スイッチ
8:絶縁体
9:貫通孔
10:細胞A
11:細胞B
12:電気力線
13:本体
14:上蓋
15:電極基板
16:スペーサー
17:微粒子懸濁液
18:微粒子
19:導入口
20:排出口
21:微粒子操作手段
22:顕微鏡
23:ITO
24:ガラス
25:レジスト
26:櫛状電極パターンを描いた露光用フォトマスク
27:露光
28:貫通孔を形成した絶縁体と一体的に形成した下部の電極
29:電極a
30:電極b
31:櫛状電極
32:貫通孔の中心軸
33:現像液
34:スペーサー16に形成された空間
35:導電部材の中心軸
36:ピーク電圧
37:正の誘電泳動力
38:負の誘電泳動力
39:微粒子操作装置
40:ステージ
41:異常細胞
42:マーカー分子
43:蛍光色素
44:Cr
45:Au
46:貫通孔パターンを描いた露光用フォトマスク
47:上部の電極基板
48:下部の電極基板
49:3%ヨウ素ヨウ化アンモニウム液
50:30%硝酸二アンモニアセリウム液
51:融合細胞
【特許請求の範囲】
【請求項1】
微粒子懸濁液を収容する収容部、一対の電極が配置された電極基板及び電極に接続された交流電源とから構成され、前記収容部の一部は絶縁体の材料で構成されるとともに前記懸濁液を前記各電極に接触可能とする貫通孔を有することを特徴とする、微粒子操作装置。
【請求項2】
前記一対の電極は、対向する2つの辺のそれぞれから他方の辺に向けて延びる平行な2枚の電極から構成されるか、又は、対向する2つの辺のそれぞれから他方の辺に向けて延びる平行かつ等間隔な3枚以上の電極から構成される、請求項1に記載の微粒子操作装置。
【請求項3】
前記電極基板は前記収容部の下部に配置され、前記収容部の下部は絶縁体の材料で構成されるとともに前記懸濁液を前記各電極に接触可能とする垂直方向の貫通孔を有することを特徴とする、請求項1に記載の微粒子操作装置。
【請求項4】
前記収容部は、前記懸濁液を保持する枠体と、当該枠体の下部に配置される、垂直方向の貫通孔を有する絶縁体とによって構成されることを特徴とする、請求項1から3項のいずれかに記載の微粒子操作装置。
【請求項5】
前記収容部の孔は、1つの微粒子を捕捉できる形状・寸法であることを特徴とする、請求項1から4項のいずれかに記載の微粒子操作装置。
【請求項6】
前記孔の開口に内接する最大円の直径が、微粒子の粒径未満であることを特徴とする請求項5に記載の微粒子操作装置。
【請求項7】
前記孔の開口に内接する最大円の直径が、微粒子の粒径の1倍以上2倍未満の範囲であり、かつその深さが微粒子の粒径の2倍未満であることを特徴とする請求項5に記載の微粒子操作装置。
【請求項8】
前記貫通孔は、アレイ状に配置されていることを特徴とする請求項1から7項のいずれかに記載の微粒子操作装置。
【請求項9】
前記収容部の一部を構成する絶縁体の材料は微粒子と親和性を有する材料であることを特徴とする、請求項1から8項のいずれかに記載の微粒子操作装置。
【請求項1】
微粒子懸濁液を収容する収容部、一対の電極が配置された電極基板及び電極に接続された交流電源とから構成され、前記収容部の一部は絶縁体の材料で構成されるとともに前記懸濁液を前記各電極に接触可能とする貫通孔を有することを特徴とする、微粒子操作装置。
【請求項2】
前記一対の電極は、対向する2つの辺のそれぞれから他方の辺に向けて延びる平行な2枚の電極から構成されるか、又は、対向する2つの辺のそれぞれから他方の辺に向けて延びる平行かつ等間隔な3枚以上の電極から構成される、請求項1に記載の微粒子操作装置。
【請求項3】
前記電極基板は前記収容部の下部に配置され、前記収容部の下部は絶縁体の材料で構成されるとともに前記懸濁液を前記各電極に接触可能とする垂直方向の貫通孔を有することを特徴とする、請求項1に記載の微粒子操作装置。
【請求項4】
前記収容部は、前記懸濁液を保持する枠体と、当該枠体の下部に配置される、垂直方向の貫通孔を有する絶縁体とによって構成されることを特徴とする、請求項1から3項のいずれかに記載の微粒子操作装置。
【請求項5】
前記収容部の孔は、1つの微粒子を捕捉できる形状・寸法であることを特徴とする、請求項1から4項のいずれかに記載の微粒子操作装置。
【請求項6】
前記孔の開口に内接する最大円の直径が、微粒子の粒径未満であることを特徴とする請求項5に記載の微粒子操作装置。
【請求項7】
前記孔の開口に内接する最大円の直径が、微粒子の粒径の1倍以上2倍未満の範囲であり、かつその深さが微粒子の粒径の2倍未満であることを特徴とする請求項5に記載の微粒子操作装置。
【請求項8】
前記貫通孔は、アレイ状に配置されていることを特徴とする請求項1から7項のいずれかに記載の微粒子操作装置。
【請求項9】
前記収容部の一部を構成する絶縁体の材料は微粒子と親和性を有する材料であることを特徴とする、請求項1から8項のいずれかに記載の微粒子操作装置。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【図15】


【図16】


【図17】


【図18】


【図19】


【図20】


【図21】


【図22】


【図23】


【図24】


【図25】


【図26】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【図15】


【図16】


【図17】


【図18】


【図19】


【図20】


【図21】


【図22】


【図23】


【図24】


【図25】


【図26】


【公開番号】特開2011−104487(P2011−104487A)
【公開日】平成23年6月2日(2011.6.2)
【国際特許分類】
【出願番号】特願2009−260378(P2009−260378)
【出願日】平成21年11月13日(2009.11.13)
【出願人】(000003300)東ソー株式会社 (1,901)
【Fターム(参考)】
【公開日】平成23年6月2日(2011.6.2)
【国際特許分類】
【出願日】平成21年11月13日(2009.11.13)
【出願人】(000003300)東ソー株式会社 (1,901)
【Fターム(参考)】
[ Back to top ]

