微粒子測定前処理キット
【課題】高溶液導電率を有する試料液において塩濃度が高いために必要十分な感度および精度で測定することが可能な微粒子測定ができないという課題があった。
【解決手段】誘電泳動を用いて試料液中の微粒子数を測定する微粒子測定装置に用いるセルであって、前記セルは少なくとも開放端と底面と連続する側面とを備えるリザーバと、前記リザーバ中のイオン交換担体とを有し、高溶液導電率を有する試料液を脱塩することにより誘電泳動ができる装置を提供する。
【解決手段】誘電泳動を用いて試料液中の微粒子数を測定する微粒子測定装置に用いるセルであって、前記セルは少なくとも開放端と底面と連続する側面とを備えるリザーバと、前記リザーバ中のイオン交換担体とを有し、高溶液導電率を有する試料液を脱塩することにより誘電泳動ができる装置を提供する。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、誘電泳動を用いて試料液中の微粒子数を測定するための微粒子測定前処理キットに関する。更に詳しくは、溶液導電率の影響を前処理によって回避し、高感度、高精度に測定する微粒子測定前処理キットに関する。
【背景技術】
【0002】
昨今、食中毒や感染症などの原因となり、人体に何らかの害を及ぼす可能性がある微生物を、迅速、簡便、高感度に定量測定するニーズは特に高い。食品の製造工程や微生物検査施設を備えない診療所などにおいて、その場で微生物検査を実施することで、食中毒や感染症などの防止、予防が可能になるためである。
【0003】
また、いわゆるバイオセンサにおいて、抗体など、測定対象に特異的に結合する物質を標識したポリスチレンなどの人工微粒子を用いて、検体中の生化学的物質を定量測定する際に、検体中の微粒子数あるいはその結合状態を定量測定する必要がある。このように、昨今、液体中に含まれる微粒子を迅速、簡便、定量的に測定する要求は高い。
【0004】
従来、微生物の検査法として最も一般的に用いられるのは培養法である。培養法は、培地上に微生物検体を塗抹し、微生物が生育条件下で培養を行い、形成される培地上のコロニー数を計数することで微生物数を定量する方法である。
【0005】
しかし、コロニー形成までに通常1〜2日、微生物種によっては数週間を要するため、迅速な検査を実施できない問題があった。また、濃縮や希釈、培地への塗抹などが必要なため、専門家による操作が必要であり、簡便な検査が実施できない、あるいは操作上のバラツキによる精度低下の問題があった。
【0006】
これら従来の問題を解決するため、迅速、簡便、高感度な微生物数測定法として、誘電泳動とインピーダンス計測を組み合わせたDEPIM(Dielectrophoretic Impedance Measurement Method)法が開示されている(例えば、特許文献1を参照)。
【0007】
DEPIM法は、微生物を誘電泳動力によってマイクロ電極に捕集し、同時にマイクロ電極のインピーダンス変化を測定することによって試料液中の微生物数を定量測定する方法である。以下、その測定原理について概説する。
【0008】
微生物は一般に、イオンリッチで誘電率および導電率の高い細胞質および細胞壁が、比較的誘電率および導電率の低い細胞膜に囲まれた構造を有し、誘電体粒子とみなすことができる。DEPIM法では、電界中で分極した誘電体粒子に一定方向に働く力である誘電泳動力を利用し、誘電体粒子である微生物をマイクロ電極のギャップ間に捕集する。
【0009】
誘電体粒子に働く誘電泳動力FDEPは、以下の(数1)で与えられることが公知である(例えば、非特許文献1を参照)。以下、誘電体粒子が、微生物である場合を例として説明する。
【0010】
【数1】

【0011】
ここで、a:球形近似したときの微生物の半径、ε0:真空の誘電率、εm:試料液の比誘電率、E:電界強度であり、▽は演算子で勾配(gradient)を表す。この場合、▽E2は、電界E2の勾配なので、その位置でどれだけE2が傾斜を持っているか、つまり電界Eが空間的にどれだけ急に変化をするかを意味する。また、Kはクラウジウス・モソッティ数と呼ばれ、(数2)で表され、Re[K]>0は正の誘電泳動を表し、微生物は電界勾配と同方向、つまり、電界集中部に向かって泳動される。Re[K]<0は負の誘電泳動を表し、電解集中部から遠ざかる方向、すなわち弱電界部に向かって泳動される。
【0012】
【数2】

【0013】
ここで、εb*およびεm*はそれぞれ、微生物および溶液の複素誘電率を表し、一般に複素誘電率εr*は(数3)で表される。
【0014】
【数3】

【0015】
ここで、εr:微生物あるいは試料液の比誘電率、σ:微生物あるいは試料液の導電率、ω:印加電界の角周波数を表す。
【0016】
(数1)(数2)(数3)から、誘電泳動力は、微生物の半径、クラウジウス・モソッティ数の実部(以下、Re[K]と表す)および電界強度に依存することが分かる。また、Re[K]は、試料液および微生物の複素誘電率、電界周波数に依存して変化することが分かる。
【0017】
そのため、DEPIM法では、これらのパラメータを適切に選択し、微生物に働く誘電泳動力を十分大きくし、微生物を電極ギャップに確実に捕集する必要がある。また、DEPIM法では、上記誘電泳動による電極への微生物捕集と同時に、電気的計測を行い、試料液中の微生物数を定量測定することを特徴としている。
【0018】
微生物は、前述した構造を有するため、電気的には固有のインピーダンスを持った微粒子と考えることができる。そのため、誘電泳動によりマイクロ電極のギャップ間に捕集される微生物数が増加すると、その捕集数に応じて電極間のインピーダンスが変化する。
【0019】
従って、電極間インピーダンス時間変化の傾きは、単位時間当たりに電極ギャップ間に捕集される微生物数に応じた値となり、傾きの大きさは試料液中の微生物濃度に対応する。よって、電極間インピーダンス時間変化の傾きを測定することで、試料液中の微生物濃度、言い換えれば微生物数を測定することが可能となる。
【0020】
更に、DEPIM法では、誘電泳動を開始直後のインピーダンス時間変化の傾きから微生物数を定量することで、短時間での微生物測定を実現している。以上、DEPIM法の測定原理について概説したが、詳しくは非特許文献2を参照されたい。
【0021】
ところで、本願で測定に用いる試料液は、血液や唾液など、何らかの方法によって採取した微生物を、水を主成分とする低導電率の液体で懸濁したものを想定しているが、微生物を採取する際、微生物だけでなく周辺に含まれるイオンも同時に採取されると考えられる。この場合、試料液の誘電率は水と同程度となるが、導電率は水よりも大きな値になり、結局、微生物に働く誘電泳動力は試料液のイオン濃度、言い換えれば、導電率に依存することになる。一般に、試料液導電率が高くなるほど誘電泳動力は小さくなる。そのため、従来のDEPIM法で上記のような試料液の測定を想定した場合、試料液導電率の高い試料では、微生物に働く誘電泳動力が低下しマイクロ電極に捕集される微生物数が少なくなる結果、測定感度が低下するという問題があった。更に、試料液導電率によって微生物に働く誘電泳動力が異なるため、異なる導電率の試料液を測定したときの測定結果バラツキが大きいという問題があった。
【0022】
誘電泳動を利用した微生物等の測定に際し、上記問題を解決するための手段として、測定前にイオン交換等により試料液導電率を低減する技術が公知である。この技術は、分析前に試料液をイオン交換カラムで処理を行い、試料液導電率を低減した後、誘電泳動により試料液中の微生物を分析する方法である(例えば、特許文献2を参照)。
【0023】
また、担体粒子上での生物学的特異的凝集反応により、生物学的特異的反応性物質の存在を検出又は測定する方法が知られている。これは、塩の共存下に交流電圧を該反応系に印加することにより、従来よりも迅速且つ簡便に、しかも高感度で生物学的特異的反応性物質の存在を検出又は測定する方法である(例えば、特許文献3参照)。
【特許文献1】特開2000−125846号公報
【特許文献2】特表平11−501210号公報
【特許文献3】特許第3300493号明細書
【非特許文献1】Hywel Morgan、他:「AC Electrokinetics:colloids and nanoparticles」、RESERCH STUDIES PRESS LTD.2003年出版、pp.15〜63
【非特許文献2】J.Suehiro, R.Yatsunami, R.Hamada, M,Hara,J.Phys. D: Appl. Phys. 32(1999)2814−2820
【発明の開示】
【発明が解決しようとする課題】
【0024】
しかしながら、特許文献1には、平板電極間に周波数1MHzでピーク電圧100Vの正弦波交流電圧を印加する例が記載され、この時印加する交流の周波数は誘電泳動が生じる周波数範囲であれば任意に選ぶことが可能とされているが、導電率を低減する処理により溶液導電率の影響を回避することに関する示唆はない。
【0025】
また、特許文献2に記載の技術によれば、誘電泳動による分析を行う前にイオン交換カラムを用いるため、測定に必要な器具が増えること、カラムを用いて試料を処理するために専門的な技術が必要となり、測定に要する時間も長くなるという問題があった。さらに、溶液誘電率を5μS/cm以下に低下させるためには、イオン交換カラム処理が十分に行き渡るように試料の流速を非常に遅くする必要がある。そのため短時間の処理では、イオン交換処理が不十分なため試料毎にばらついてしまう可能性がある。これは従来のDEPIM法が微生物測定の結果にバラツキを生じるという問題を解決できない。
【0026】
また、カラムにイオン交換担体を密に充填することによって測定対象物が担体に吸着してしまい、測定結果がばらついてしまうという問題も存在する。
【0027】
また、特許文献3には、交流電圧の周波数範囲が記載されているが、パールチェーンと誘電泳動は異なる現象であり、10mM(約1000μS/cm)の塩濃度では誘電泳動が発生しない。すなわち、10mMのNaCl溶液の導電率は約1000μS/cmであり、この程度の高い溶液導電率条件下では、「正の誘電泳動」で電極に菌をトラップすることは困難である。
【0028】
また、特許文献4の微生物活性測定装置は、微生物種類と試料液の導電率を入力し、活性を測定する最適な電圧(振幅と周波数)をテーブルから選択するものであり、活性状態によって誘電泳動力に差が生じる周波数を選択するものである。
【0029】
本発明は、上記事情に鑑みてなされたものであって、高溶液導電率を有する試料液においても、簡便かつ迅速で必要十分な導電率低減の前処理を行うことによって、必要十分な感度および精度で測定することが可能な微粒子測定前処理キットを提供することを目的としている。
【課題を解決するための手段】
【0030】
本発明は、誘電泳動を用いて試料液中の微粒子数を測定する微粒子測定装置に用いるセルであって、前記セルは開放端と底面と連続する側面とを備えるリザーバと、前記リザーバ中のイオン交換担体とを有することを特徴とする微粒子測定前処理キットを提供することができる。上記構成によれば、イオン交換担体を含有する測定セル中に微粒子試料を混合して前処理を行うことによって、従来必要であった煩雑なカラム操作を用いることなく、単純な操作で微粒子試料の試料液の導電率の低減が可能となる前処理キットを提供することができる。
【0031】
また、本発明の微粒子測定前処理キットは、上記のリザーバに微粒子懸濁液を備える。上記構成によれば、測定ごとに微粒子懸濁液を分注する操作を省くことができ、前処理時間を短縮することができる。
【0032】
また、本発明の微粒子測定前処理キットは、上記リザーバにリザーバの開放端を密閉しかつ取り外し可能な蓋を備える。上記構成によれば、試料を微粒子懸濁液に溶解し、イオン交換の前処理を行う際に蓋を閉めることによって、例えば手動でリザーバを上下震盪するなどの操作を行うことができ、簡便で迅速な前処理操作をすることができる。
【0033】
また、本発明の微粒子測定前処理キットは、上記蓋のリザーバ側に微粒子試料の採取部を備える。上記構成によれば、試料採取器具を別に準備する操作を省略することができ、測定試料の採取から前処理を行うまでの工程を簡易に、短時間で行うことができる。
【0034】
また、本発明の微粒子測定前処理キットは、上記の微粒子測定前処理キットにおいて、セル内に測定電極を備える。上記構成によれば、前処理操作後に微粒子懸濁液を測定用セルに移すことなく、速やかに微粒子測定をすることができる。
【0035】
また、本発明の微粒子測定前処理キットは、セル内において電極を含む空間とイオン交換担体を含む空間がイオン分子透過性の遮蔽物によって仕切られている。上記構成によれば、測定中にイオン交換担体が上記電極に衝突することによって生じるノイズを抑制し、より正確な微粒子測定をすることができる。
【0036】
また、本発明の微粒子測定前処理キットは、セル内において電極を含む空間とイオン交換担体を含む空間を仕切るイオン分子透過性の遮蔽物の目開きの大きさが1μmから5000μmの範囲で選択される。上記構成によれば、イオン交換担体の粒径に応じた最適な目開きを選択することで、セル内の液循環を妨げることを防止し、より正確な微粒子測定をすることができる。
【0037】
また、本発明の微粒子測定前処理キットは、セル内のメッシュで区切られたイオン交換担体を含まない空間に試料液の流出口を備える。上記構成によれば、同一の測定セルで導電率低減の前処理と測定を連続的に行え、かつ、前処理された試料液が流出する流れによって電極上に微粒子懸濁液を供給できるため、高感度な測定を行える。
【0038】
また、本発明の微粒子測定前処理キットにおいて、イオン交換担体が、陽イオン交換体、陰イオン交換体の重量比1:0.1から1:10の範囲で規定される混合物である。上記構成によれば、微粒子試料に含まれる陽イオンおよび陰イオンを過不足なく前処理することができる。
【0039】
また、本発明の微粒子測定前処理キットにおいて、担持されるイオン交換担体は試料液中に1ml中に0.3g以上の比率で添加する。上記構成によれば、前処理において試料液中の総イオン数に対して必要十分量のイオン交換担体を添加することとなり、最小限のイオン交換担体使用量で前処理を行うことができる。
【0040】
また、本発明の微粒子測定セルにおいて、担持されるイオン交換担体の基材がスチレン化合物で架橋された均一な網目状構造を有する樹脂である。上記構成によれば、イオン交換担体が前処理操作に耐えうる十分な強度を有し、担体の崩壊で小片を生じることなく後の測定への悪影響を防ぎ、正確な微粒子数の計測が行える。
【0041】
また、本発明の微粒子測定セルにおいて、担持されるイオン交換担体の粒径は400μm以上である。上記構成によれば、試料液中にイオン交換担体が均等に分散して、イオン交換担体同士の凝集による測定対象微粒子が物理的にイオン交換担体の隙間に閉じ込まれることを防止し、正確な微粒子数の計測が行える。
【0042】
また、本発明の微粒子測定セルにおいて、イオン交換担体を、適当な液体で一定時間以上の膨潤処理を施している。上記構成によれば、イオン交換担体の粒子表面を円滑化することで測定対象物が粒子表面に非特異的に吸着することを防止し、正確な微粒子数の計測が行える。
【0043】
また、本発明の微粒子測定セルにおいて、上記微粒子が微生物である。上記構成によれば、生体由来の体液、分泌物、排泄物、あるいは、環境中の海洋、河川、湖沼、あるいは、人工物中の貯水槽、用水路、プールなどから得られる試料を採取し、採取部位の微生物汚染を評価することができる。
【発明の効果】
【0044】
本発明の微粒子測定前処理キットによれば、、高溶液導電率を有する試料液においても、簡便かつ迅速で必要十分な導電率低減の前処理を行うことによって、必要十分な感度および精度で測定することが可能となる。
【発明を実施するための最良の形態】
【0045】
以下本発明を実施するための最良の形態について図面を参照しながら説明する。
【0046】
(第1の実施の形態)
本願における微粒子の定義について説明する。本願で言う微粒子とは、誘電泳動可能な大きさのあらゆる粒子を意味し、ポリスチレン等の高分子による粒子や、カーボンナノチューブ、金コロイドなどの金属粒子およびそれらに何らかのコーティングを施した粒子、細菌、真菌、放線菌、リケッチア、マイコプラズマ、ウイルス、として分類されているいわゆる微生物、原生動物や原虫のうちの小型のもの、生物体の幼生、動植物細胞、精子、血球、核酸、蛋白質等も含む広い意味での生体または生体由来の微粒子である。本願では特に、微生物の測定を想定している。
【0047】
本願で使用される微粒子懸濁液とは、測定対象の微粒子を懸濁するための溶液であり、望ましくは、測定時の溶液環境を安定化させるための緩衝溶液である。この緩衝溶液は、非電解質であること、細胞と同等の浸透圧を有する等の性質を有することが好ましく、例えば10mMマニトールpH7.0溶液等が挙げられる。
【0048】
本願で使用されるイオン交換担体はスチレンにジビニルベンゼンを架橋した高分子化合物であり試料溶媒に不溶な3次元構造の粒状ポリマーを基材とした。ジビニルベンゼンの重量比率を架橋度とよび、架橋度によって樹脂内の分子網目(ミクロポアー)の大きさが変化し、膨潤による体積変化などイオン交換担体の性質を左右している。物理的に数μmの細孔(マクロポアー)を基材に開けた多孔性のものをポーラス型、これよりもさらに架橋度を大きくした基材に、小さな細孔を多く開けた高多孔性のものをハイポーラス型とよび、このような構造をとることによって溶媒との接触面積が大きくなりイオン交換効率を高めている。無多孔性のものはゲル型とよぶ。
【0049】
基材に導入する交換基の種類によって、硫酸基を有するスチレン系強酸性陽イオン交換樹脂、カルボン酸基を有するメタクリル酸系弱酸性陽イオン交換樹脂およびアクリル酸系弱酸性陽イオン交換樹脂、4級アンモニウム基を有するI型およびII型強塩基性陰イオン交換樹脂、3級アミノ基を有する弱塩基性陰イオン交換樹脂、両性イオン交換樹脂に分類される。これらのイオン交換樹脂を用途に応じて単独、あるいは混合して使用することができる。
【0050】
また、本願の前処理法でポーラス型、ハイポーラス型のイオン交換樹脂を用いると、攪拌操作によって樹脂同士または壁面との衝突によって、樹脂が崩壊して無数の小片が生じる。この小片はDEPIM測定において測定対象の微粒子に混入して測定することになり、バックグランド上昇の要因となる。そのためゲル型イオン交換樹脂を用いることが望ましい。イオン交換樹脂の製品例として三菱化学社製のダイアイオンシリーズが挙げられる。
【0051】
本願の微粒子測定前処理セルに担持されるイオン交換樹脂には陽イオン交換樹脂、陰イオン交換樹脂を混合して用いることができる。それぞれの混合比は用途に応じて任意に設定することができ、陽イオン交換樹脂:陰イオン交換樹脂の混合比を1:10から10:1の範囲で設定した(前述)。陽イオン交換樹脂にSK1BH(三菱化学社製)、交換容量2[meq/ml]、粒径0.4−0.6mm、陰イオン交換樹脂はSA10AOH(三菱化学社製)、交換容量1.3[meq/ml]、粒径0.4mmから0.6mmを用いた。陽イオン交換樹脂と陰イオン交換樹脂の混合比は、試料液に含まれる陽イオンと陰イオンの当量比に等しくなるような比率であるのが好ましい。このことにより、どちらか一方のイオンが残存することなく、溶液導電率を過不足なく低下させることができる。より好ましい混合比はSK1BH:SA10AOH=1:1.5の割合である。
【0052】
上記のイオン交換樹脂は使用前に微粒子懸濁液を用いて、膨潤処理を施すのが望ましい。未使用のイオン交換樹脂は一部乾燥状態にあり、粒子表面にしわ、ひび割れ、窪み等、測定対象物を物理的に捕捉する立体障害を形成していると考えられる。十分な水分を粒子に吸収させることによって、粒子を膨潤させ表面を円滑にする作用が期待され、立体障害が減少し、測定対象物の非特異的吸着を防止する効果がある。
【0053】
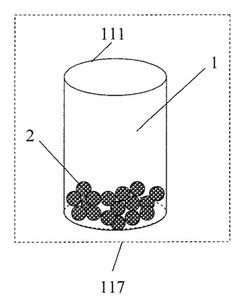
図1は、本実施の形態にかかる微粒子測定前処理セルの構成を説明する図である。図1において、1はリザーバ、2はイオン交換担体である。リザーバ1は一方の端開放した開放端111をもち、他端に底面を有する形状を有し、底面及び開放端の輪郭は多面体、楕円形などの曲線で規定され、微粒子懸濁液の保持が可能な形状を有し、材質は樹脂、金属、ガラス、木材、それらを防水する塗料など水分を密封保持することのできる素材を用いる。リザーバ1の内部にイオン交換担体2を備えている。セル117はリザーバ1とイオン交換担体2とを有する。なお図2以降はセル117の説明を省略する。
【0054】
本実施の形態の微粒子測定前処理セルにて前処理を行う工程を説明する。
【0055】
まず、(1)測定対象の微粒子を含む懸濁液を試料液として、リザーバ1の開放端111から試料液を投入し、試料液とイオン交換担体2を攪拌することでイオン交換前処理を行う。試料液とイオン交換担体を混合し攪拌する方式は、両者が十分に接触しうる方式を用いることが好ましい。例えば、試料液とイオン交換担体を同一容器に混合し、容器内に攪拌子を入れ、これに外力を及ぼし運動させることによって攪拌してもよい。攪拌子の材料は金属、プラスチック、ゴム、生体由来物質等が利用することができる。外力は磁力、気圧変化、水圧変化、位置エネルギー変化、運動エネルギー変化などの物理的エネルギーを利用することができる。また、攪拌子を入れない方式も利用することができる。また、これら攪拌の時間を適切な範囲に規定することで、必要十分なイオン交換前処理、すなわち導電率の低減を行うことができる。また、事前に微粒子懸濁液の導電率を測定しておき、測定された導電率に応じて処理時間を規定すれば、より正確かつ、必要十分な処理時間で前処理を行うことができる。
【0056】
次に、(2)イオン交換前処理を施した試料液を図示しない測定用セルに分注する。分注の方法は、イオン交換担体が測定用セルに混入しない方式を用いることが好ましい。例えば、メッシュを用いて試料液のみをろ過する方式が考えられる。メッシュに用いる材料はナイロン、ポリエステル、ポリプロピレン、テフロン(登録商標)、カーボン、金属、プラスチック、ゴム、生体由来物質などを利用することができる。加えてメッシュの目開きは1μmから5000μmの範囲から選択することができる。加えて、糸径は10μmから1000μmの範囲から選択することができる。さらには、目開き180μm、糸径96μmのポリエステルを材料に用いたメッシュが好ましい。また、メッシュを用いないで、イオン交換処理済みの試料液を静置した上清を、一般に用いられるピペッティング操作によって分注する方式も利用することができる。
【0057】
以上、本実施の形態によれば、イオン交換担体を含有する測定セル中に微粒子試料を混合して前処理を行うことによって、従来のカラム操作で必要であった導電率低減のための煩雑な操作を用いることなく、単純で迅速な操作で、かつ、前処理時に試料中の微粒子を非特異的に減少させることなく、試料液の導電率低減が可能となる測定セルを提供することができる。
【0058】
(第2の実施の形態)
図2は、本願の微粒子測定前処理キットにおける第2の実施の形態を表す図である。図2において、3は試料懸濁液であり、測定対象の微粒子が懸濁されていない状態で予めリザーバ1内にイオン交換担体2と共に充填されている。前処理を行う場合、測定対象の微粒子が懸濁されている試料液もしくは、測定対象の微粒子を試料採取面から採取した採取具を、開放端111から投入し、前処理を行う。前処理の方法については、前述のとおりであるため、説明を省略する。
【0059】
以上、本実施の形態によれば、測定ごとに微粒子懸濁液を分注する操作を省くことができ、前処理時間を短縮することができる。
【0060】
また、図3のように、図2の開放端に蓋4を備えることもできる。蓋4の輪郭は多面体、楕円形などの曲線で規定されるいずれかの形状を有し、リザーバ1の開放端を隙間無く塞ぎ、攪拌時にリザーバ1内の試料液がこぼれないような構成になっている。蓋4を備えることで、リザーバ1に振動を与えて、採取具から測定対象の微粒子を微粒子懸濁液に分散し、同時にあるいはその後、イオン交換担体2と試料液を効率よく攪拌することが可能となる。
【0061】
上記構成によれば、試料を微粒子懸濁液に溶解する際に蓋を閉めることによって、例えば手動でリザーバを上下震盪するなどの操作を行うことができ、簡便で迅速な前処理操作をすることができる。
【0062】
また、図4のように、蓋4のリザーバ1側の面に、試料採取部5を設けることもできる。検体採取部5はリザーバ1の内部に収容可能な寸法を有し、末端部分は検体採取部面を擦過して微粒子を捕捉できる構造を有し、綿、合成繊維、樹脂などの素材を用いるのが望ましい。
【0063】
前処理の手順は、以下の通りである。
(1)蓋4を手に持って規定の採取面を擦過し、測定対象となる微粒子を採取する。
(2)試料採取部5がリザーバ1内部に入る方向に蓋4をリザーバ1にセットし、リザーバ1を蓋4で密閉する。
(3)リザーバ1全体に一定時間振動を与えるなどして、微粒子懸濁液3とイオン交換担体2を攪拌し、イオン交換前処理を行う。
【0064】
本実施の形態では、簡単のため手で上下に往復運動して攪拌した。上記構成によれば、試料採取器具を別に準備する操作を省略することができ、測定試料の採取から前処理を行うまでの工程を簡易に、短時間で行うことができる。
【0065】
(第3の実施の形態)
図5は、本願の微粒子測定前処理キットにおける、第3の実施の形態を表す図である。図5において、6は誘電泳動電極である。誘電泳動電極6は、櫛歯部112を備え、リザーバ1の壁面に固定されるか、リザーバ1の壁面の一部として成形されるか、図示しない電気的接点を含むコネクタなどによって固定される。また、誘電泳動電極6は、図示しない誘電泳動を誘起するための交流電源および、図示しないインピーダンス測定回路に接続するための接点を備える。
【0066】
測定対象の微粒子は、櫛歯部112に誘電泳動されて捕捉されるため、誘電泳動電極6は、リザーバ1内に微粒子懸濁液を入れたときに、櫛歯部112が微粒子懸濁液に全て浸漬する位置に配置される。また、攪拌によるイオン交換処理の効率化の他、リザーバ1内で微粒子懸濁液の流れを作ることで、微粒子懸濁液中の微粒子を櫛歯部112付近に絶えず供給することができ、DEPIM測定の測定信号量を増大できるため、リザーバ1内には図示しない攪拌子を含むことが好ましい。
【0067】
前処理および測定の手順を下記に説明する。
(1)リザーバ1内に測定対象の微粒子を含む微粒子懸濁液を導入する。
(2)攪拌子などで攪拌することでイオン交換により試料導電率を低減する。
【0068】
このとき、誘電泳動電極6には図示しない交流電源およびインピーダンス測定回路が接続され、誘電泳動を起こさない程度の電圧の印加によってインピーダンスを測定し、微粒子懸濁液の導電率低下をモニタリングしても良い。
(3)攪拌子などで攪拌を続けた状態のまま、測定対象の微粒子に誘電泳動を誘起するために十分な電圧を印加し、同時にインピーダンスを計測する(DEPIM測定)。
【0069】
このとき、DEPIM測定の開始は、前述の導電率モニタリングの結果から判断するなどすれば、適切な時間だけイオン交換処理を行うことになるため、効率的な処理が行える。一定時間の電圧印加及びインピーダンス計測が終了すると、図示しないインピーダンス測定回路はインピーダンス変化の傾きを算出して、微粒子濃度あるいは微粒子数などを結果表示して一連の前処理、測定の工程を終了する。
【0070】
上記構成によれば、前処理操作後に微粒子懸濁液を測定用セルに移すことなく、速やかに微粒子測定をすることができる。
【0071】
また、図6のように、リザーバ1内に遮蔽物7を設け、誘電泳動電極6を含む空間と、イオン交換担体2を含む空間に仕切ることもできる。遮蔽物7は微粒子懸濁液中のイオンは透過し、イオン交換担体2は透過しない程度の目開きを持ったメッシュやメンブレンフィルタなどが望ましい。メッシュに用いる材料はナイロン、ポリエステル、ポリプロピレン、テフロン(登録商標)、カーボン、金属、プラスチック、ゴム、生体由来物質などを利用することができる。加えてメッシュの目開きは、イオン交換担体2の粒子径に応じて選択すれば良いが、1μmから5000μmの範囲が最も望ましい。この範囲に設定することで、イオン交換担体2は透過せず、かつ、微粒子懸濁液の拡散あるいは攪拌子などによる攪拌によって、誘電泳動電極6側の空間に微粒子懸濁液中の微粒子を容易に導入することが可能となる。
【0072】
加えて、糸径は10μmから1000μmの範囲から選択することができる。さらには、目開き180μm、糸径96μmのポリエステルを材料に用いたメッシュが好ましい。
【0073】
上記構成によれば、微粒子懸濁液の導電率低減と、DEPIM測定を行うリザーバ1内において、攪拌によって、櫛歯部112へのイオン交換担体2の衝突を防ぐことができ、測定ノイズの無い高精度の微粒子測定を行うことができる。
【0074】
(第4の実施の形態)
図8は、本願の微粒子測定前処理キットにおける、第4の実施の形態を表す図である。図8において、リザーバ1内部にイオン交換担体2が存在する第一の空間114と、イオン交換担体2が存在しない第二の空間115とを遮蔽物7で区分し、イオン交換担体2が存在しない空間側に流出口116を設ける。イオン交換担体2は、開放端111と遮蔽物7との間の第一の空間114内に配置される。誘電泳動電極6は、遮蔽物7と流出口114との間の第二の空間115内に配置される。
【0075】
測定対象の微粒子懸濁液は、開放端111から導入され、第一の空間114を通る。この時、微粒子懸濁液中のイオンはイオン交換担体2に吸着され、導電率が低下する。導電率が低下した微粒子懸濁液は、遮蔽物7を通り、第二の空間115に入る。遮蔽物7の目開きは、前述のようにイオン交換担体2より小さいため、イオン交換担体2は第二の空間115に侵入せず、測定対象の微粒子を含む、導電率が低下した微粒子懸濁液のみが第二の空間115に流入することになる。第二の空間115に流入した微粒子懸濁液は、誘電泳動電極6の櫛歯部112付近を通過する。この時、誘電泳動電極6は接点113を通じて図示しない交流電源およびインピーダンス測定回路に接続されており、DEPIM測定を行う。誘電泳動電極6を通過した微粒子懸濁液は、流出口116から流れ出す。この時、微粒子懸濁液は流出口116から流出するのに伴い、当然ながらある流速をもって誘電泳動電極6を通過することになる。この流速が発生することによって測定対象の微粒子が絶えず櫛歯部112付近を通過することになり、DEPIM測定に必要十分な微粒子を櫛歯部112に捕捉することができるため、高感度なDEPIM測定を行うことができる。流出口116から流れ出した微粒子懸濁液は、図示しない廃液セルなどに貯留するなどとする。
【0076】
上記構成によれば、同一の測定セルで導電率低減の前処理と測定を連続的に行え、かつ、前処理された試料液が流出する流れによって電極上に微粒子懸濁液を供給できるため、高感度な測定を行える。
【0077】
では次に本発明の実施の形態で説明したキットを用い測定した事例を説明する。
【0078】
(実施例1)
本願の微粒子測定前処理セルの実施例1について図面を参照しながら説明する。図1から8は微粒子測定前処理キットの構成図である、図9は本発明の測定セルを用いた微粒子測定のフロー図である、図10Aは微生物数計測を本願の方式と蛍光法で比較したグラフ、図10Bは微生物数計測を本願の方式と培養法で比較したグラフである。
【0079】
具体的な本願の微粒子測定前処理キットを用いた微粒子測定のプロトコルを図9とともに説明する。
【0080】
はじめに、リザーバ1に7mlの試料懸濁液3を分注し、適量のイオン交換体2を分散させて60分以上の膨潤処理を行う。測定に必要な数量を前もって準備しておけばよい。
【0081】
次に、試料採取8した採取具をリザーバ1に投入し蓋4を閉め、測定セルを攪拌する。攪拌操作はより簡便に行うために、手動によって15秒間測定セルを激しく上下左右に往復運動させる方式を用いた。
【0082】
攪拌操作後に試料溶液を静置して蓋4を開けて上清5mlを測定用セルに移し変える。より簡便に行うためにデカント方式を用いた。他にもイオン交換担体が測定用セルに混入しない方式ならば何ら問題ない。最後に測定用セルに誘電泳動電極6を測定装置13にセットして微粒子測定を行う。
【0083】
図10Aは本願の前処理方式を用いたDEPIM測定による微生物数測定方式と、細菌の細胞膜を蛍光色素で染色して測定する原理を用いた市販の微生物数測定方式を用いて、ヒトの口腔内細菌数を測定した結果である。横軸に蛍光染色測定方式で得られた測定値を示し、縦軸に本方式で得られた測定値を示している。相関係数は0.69、測定感度は約10の5乗cells/mlであった。
【0084】
図10Bは本願の前処理方式を用いたDEPIM測定による微生物数測定方式と、コロニーカウント原理を用いた市販の微生物数測定方式を用いて、ヒトの口腔内細菌数を測定した結果である。横軸に蛍光染色測定方式で得られた測定値を示し、縦軸に本方式で得られた測定値を示した。相関係数は0.86、測定感度は約10の5乗cells/mlであった。
【0085】
(実施例2)
セルに担持するイオン交換担体混合物の重量を、それぞれ0.5g,1.0g,1.5g,2.0gとして、初期溶液導電率が50μS/cmのときの、処理時間に対する導電率変化のグラフを図11(A)に示した。また同様に初期溶液導電率が100μS/cmのときの、処理時間に対する導電率変化のグラフを図11(B)に示した。
【0086】
図11(A)において50μS/cmから5μS/cmまで導電率を低減するのに要した時間は、それぞれ0.5g、1.0g、1.5g、2.0gのとき45秒、25秒、15秒、13秒であった。
【0087】
図11(B)において100μS/cmから5μS/cmまで導電率を低減するのに要した時間は、それぞれ0.5g、1.0g、1.5g、2.0gのとき60秒以上、45秒、22秒、21秒であった。
【0088】
DEPIM測定においては溶液導電率を5μS/cm以下に低減させると、十分な感度の測定が可能となる。本実施例では前処理に必要十分なイオン交換担体濃度は0.3g/ml以上であることが示された。
【0089】
(実施例3)
図12は粒径0.4mmのゲル型イオン交換樹脂をあらかじめ膨潤させたものを用いて、本願の前処理方法を行ったときの微生物残存率のグラフである。
【0090】
横軸に処理前の微生物濃度、縦軸に処理後の微生物残存率を示している。膨潤処理なしの場合残存率は30%から50%であった。一方、膨潤処理ありの場合は90%から120%であった。なお前処理操作によって生じる微量の小片がバックグランドとなり、残存率が全体的に高くなっている。このようにゲル型イオン交換樹脂に膨潤処理を行うことによって、樹脂表面が平滑になり微生物が非特異的に樹脂表面に付着することを防止できた。
【0091】
また、本願で使用するゲル型イオン交換樹脂は粒径0.2mmから0.8mmの中から選択して使用することができる。粒径0.2mmのイオン交換樹脂を使用した場合、試料溶液中で樹脂同士が凝集塊を形成した。これは粒径が小さくなると体積あたりの表面積が大きくなり、樹脂表面同士の静電相互作用などの引力の影響を受けるためと考えられる。イオン交換樹脂の凝集塊形成と微生物残存率低下の相関性が実験により確認されている。
【0092】
一方、粒径0.4mm以上のイオン交換樹脂を使用した場合、試料溶液中で樹脂同士の凝集塊は発生せず、良好に分散する。
【産業上の利用可能性】
【0093】
本発明は、イオン交換担体を含有する測定セル中に微粒子試料を混合して前処理を行うことによって、従来必要であった導電率低減のための煩雑な操作を用いることなく、単純な操作で微粒子試料の試料液の導電率低減が可能となる測定セルを提供することができる効果を有し、溶液中の微粒子数または微粒子濃度を、誘電泳動を用いて測定するための微粒子検査チップおよび微粒子数検査方法として有用である。
【図面の簡単な説明】
【0094】
【図1】微粒子測定前処理キットの概略図
【図2】微粒子測定前処理キットに試料懸濁液を備えた図
【図3】微粒子測定前処理キットに開放端を閉じる蓋を備えた図
【図4】微粒子測定前処理キットに開放端を閉じる蓋に試料採取部を備えた図
【図5】微粒子測定前処理キットに誘電泳動電極を備えた図
【図6】微粒子測定前処理キットにイオン透過性の遮蔽物を備えた図
【図7】微粒子測定前処理キットに備えたイオン透過性の遮蔽物の目開きを示す図
【図8】微粒子測定前処理キットにイオン透過性遮蔽物と試料流出口を備えた図
【図9】本願の前処理方式のフロー図
【図10】DEPIM測定と一般的な微生物数測定法との相関図
【図11】前処理による溶液導電率の時間変化を表す図
【図12】前処理後の微生物残存率を表す図
【符号の説明】
【0095】
1 リザーバ
2 イオン交換担体
3 試料懸濁液
4 蓋
5 試料採取部
6 電極
7 遮蔽物
8 試料採取行程
9 イオン交換体を試料懸濁液で膨潤させる行程
10 測定セルに試料採取器具をセットする行程
11 測定セルを攪拌する行程
12 前処理後の上清を抜き取り測定用セルに移動する行程
13 測定機で微粒子数を計測する行程
111 開放端
112 櫛歯部
114 第一の空間
115 第二の空間
116 流出口
117 セル
【技術分野】
【0001】
本発明は、誘電泳動を用いて試料液中の微粒子数を測定するための微粒子測定前処理キットに関する。更に詳しくは、溶液導電率の影響を前処理によって回避し、高感度、高精度に測定する微粒子測定前処理キットに関する。
【背景技術】
【0002】
昨今、食中毒や感染症などの原因となり、人体に何らかの害を及ぼす可能性がある微生物を、迅速、簡便、高感度に定量測定するニーズは特に高い。食品の製造工程や微生物検査施設を備えない診療所などにおいて、その場で微生物検査を実施することで、食中毒や感染症などの防止、予防が可能になるためである。
【0003】
また、いわゆるバイオセンサにおいて、抗体など、測定対象に特異的に結合する物質を標識したポリスチレンなどの人工微粒子を用いて、検体中の生化学的物質を定量測定する際に、検体中の微粒子数あるいはその結合状態を定量測定する必要がある。このように、昨今、液体中に含まれる微粒子を迅速、簡便、定量的に測定する要求は高い。
【0004】
従来、微生物の検査法として最も一般的に用いられるのは培養法である。培養法は、培地上に微生物検体を塗抹し、微生物が生育条件下で培養を行い、形成される培地上のコロニー数を計数することで微生物数を定量する方法である。
【0005】
しかし、コロニー形成までに通常1〜2日、微生物種によっては数週間を要するため、迅速な検査を実施できない問題があった。また、濃縮や希釈、培地への塗抹などが必要なため、専門家による操作が必要であり、簡便な検査が実施できない、あるいは操作上のバラツキによる精度低下の問題があった。
【0006】
これら従来の問題を解決するため、迅速、簡便、高感度な微生物数測定法として、誘電泳動とインピーダンス計測を組み合わせたDEPIM(Dielectrophoretic Impedance Measurement Method)法が開示されている(例えば、特許文献1を参照)。
【0007】
DEPIM法は、微生物を誘電泳動力によってマイクロ電極に捕集し、同時にマイクロ電極のインピーダンス変化を測定することによって試料液中の微生物数を定量測定する方法である。以下、その測定原理について概説する。
【0008】
微生物は一般に、イオンリッチで誘電率および導電率の高い細胞質および細胞壁が、比較的誘電率および導電率の低い細胞膜に囲まれた構造を有し、誘電体粒子とみなすことができる。DEPIM法では、電界中で分極した誘電体粒子に一定方向に働く力である誘電泳動力を利用し、誘電体粒子である微生物をマイクロ電極のギャップ間に捕集する。
【0009】
誘電体粒子に働く誘電泳動力FDEPは、以下の(数1)で与えられることが公知である(例えば、非特許文献1を参照)。以下、誘電体粒子が、微生物である場合を例として説明する。
【0010】
【数1】

【0011】
ここで、a:球形近似したときの微生物の半径、ε0:真空の誘電率、εm:試料液の比誘電率、E:電界強度であり、▽は演算子で勾配(gradient)を表す。この場合、▽E2は、電界E2の勾配なので、その位置でどれだけE2が傾斜を持っているか、つまり電界Eが空間的にどれだけ急に変化をするかを意味する。また、Kはクラウジウス・モソッティ数と呼ばれ、(数2)で表され、Re[K]>0は正の誘電泳動を表し、微生物は電界勾配と同方向、つまり、電界集中部に向かって泳動される。Re[K]<0は負の誘電泳動を表し、電解集中部から遠ざかる方向、すなわち弱電界部に向かって泳動される。
【0012】
【数2】

【0013】
ここで、εb*およびεm*はそれぞれ、微生物および溶液の複素誘電率を表し、一般に複素誘電率εr*は(数3)で表される。
【0014】
【数3】

【0015】
ここで、εr:微生物あるいは試料液の比誘電率、σ:微生物あるいは試料液の導電率、ω:印加電界の角周波数を表す。
【0016】
(数1)(数2)(数3)から、誘電泳動力は、微生物の半径、クラウジウス・モソッティ数の実部(以下、Re[K]と表す)および電界強度に依存することが分かる。また、Re[K]は、試料液および微生物の複素誘電率、電界周波数に依存して変化することが分かる。
【0017】
そのため、DEPIM法では、これらのパラメータを適切に選択し、微生物に働く誘電泳動力を十分大きくし、微生物を電極ギャップに確実に捕集する必要がある。また、DEPIM法では、上記誘電泳動による電極への微生物捕集と同時に、電気的計測を行い、試料液中の微生物数を定量測定することを特徴としている。
【0018】
微生物は、前述した構造を有するため、電気的には固有のインピーダンスを持った微粒子と考えることができる。そのため、誘電泳動によりマイクロ電極のギャップ間に捕集される微生物数が増加すると、その捕集数に応じて電極間のインピーダンスが変化する。
【0019】
従って、電極間インピーダンス時間変化の傾きは、単位時間当たりに電極ギャップ間に捕集される微生物数に応じた値となり、傾きの大きさは試料液中の微生物濃度に対応する。よって、電極間インピーダンス時間変化の傾きを測定することで、試料液中の微生物濃度、言い換えれば微生物数を測定することが可能となる。
【0020】
更に、DEPIM法では、誘電泳動を開始直後のインピーダンス時間変化の傾きから微生物数を定量することで、短時間での微生物測定を実現している。以上、DEPIM法の測定原理について概説したが、詳しくは非特許文献2を参照されたい。
【0021】
ところで、本願で測定に用いる試料液は、血液や唾液など、何らかの方法によって採取した微生物を、水を主成分とする低導電率の液体で懸濁したものを想定しているが、微生物を採取する際、微生物だけでなく周辺に含まれるイオンも同時に採取されると考えられる。この場合、試料液の誘電率は水と同程度となるが、導電率は水よりも大きな値になり、結局、微生物に働く誘電泳動力は試料液のイオン濃度、言い換えれば、導電率に依存することになる。一般に、試料液導電率が高くなるほど誘電泳動力は小さくなる。そのため、従来のDEPIM法で上記のような試料液の測定を想定した場合、試料液導電率の高い試料では、微生物に働く誘電泳動力が低下しマイクロ電極に捕集される微生物数が少なくなる結果、測定感度が低下するという問題があった。更に、試料液導電率によって微生物に働く誘電泳動力が異なるため、異なる導電率の試料液を測定したときの測定結果バラツキが大きいという問題があった。
【0022】
誘電泳動を利用した微生物等の測定に際し、上記問題を解決するための手段として、測定前にイオン交換等により試料液導電率を低減する技術が公知である。この技術は、分析前に試料液をイオン交換カラムで処理を行い、試料液導電率を低減した後、誘電泳動により試料液中の微生物を分析する方法である(例えば、特許文献2を参照)。
【0023】
また、担体粒子上での生物学的特異的凝集反応により、生物学的特異的反応性物質の存在を検出又は測定する方法が知られている。これは、塩の共存下に交流電圧を該反応系に印加することにより、従来よりも迅速且つ簡便に、しかも高感度で生物学的特異的反応性物質の存在を検出又は測定する方法である(例えば、特許文献3参照)。
【特許文献1】特開2000−125846号公報
【特許文献2】特表平11−501210号公報
【特許文献3】特許第3300493号明細書
【非特許文献1】Hywel Morgan、他:「AC Electrokinetics:colloids and nanoparticles」、RESERCH STUDIES PRESS LTD.2003年出版、pp.15〜63
【非特許文献2】J.Suehiro, R.Yatsunami, R.Hamada, M,Hara,J.Phys. D: Appl. Phys. 32(1999)2814−2820
【発明の開示】
【発明が解決しようとする課題】
【0024】
しかしながら、特許文献1には、平板電極間に周波数1MHzでピーク電圧100Vの正弦波交流電圧を印加する例が記載され、この時印加する交流の周波数は誘電泳動が生じる周波数範囲であれば任意に選ぶことが可能とされているが、導電率を低減する処理により溶液導電率の影響を回避することに関する示唆はない。
【0025】
また、特許文献2に記載の技術によれば、誘電泳動による分析を行う前にイオン交換カラムを用いるため、測定に必要な器具が増えること、カラムを用いて試料を処理するために専門的な技術が必要となり、測定に要する時間も長くなるという問題があった。さらに、溶液誘電率を5μS/cm以下に低下させるためには、イオン交換カラム処理が十分に行き渡るように試料の流速を非常に遅くする必要がある。そのため短時間の処理では、イオン交換処理が不十分なため試料毎にばらついてしまう可能性がある。これは従来のDEPIM法が微生物測定の結果にバラツキを生じるという問題を解決できない。
【0026】
また、カラムにイオン交換担体を密に充填することによって測定対象物が担体に吸着してしまい、測定結果がばらついてしまうという問題も存在する。
【0027】
また、特許文献3には、交流電圧の周波数範囲が記載されているが、パールチェーンと誘電泳動は異なる現象であり、10mM(約1000μS/cm)の塩濃度では誘電泳動が発生しない。すなわち、10mMのNaCl溶液の導電率は約1000μS/cmであり、この程度の高い溶液導電率条件下では、「正の誘電泳動」で電極に菌をトラップすることは困難である。
【0028】
また、特許文献4の微生物活性測定装置は、微生物種類と試料液の導電率を入力し、活性を測定する最適な電圧(振幅と周波数)をテーブルから選択するものであり、活性状態によって誘電泳動力に差が生じる周波数を選択するものである。
【0029】
本発明は、上記事情に鑑みてなされたものであって、高溶液導電率を有する試料液においても、簡便かつ迅速で必要十分な導電率低減の前処理を行うことによって、必要十分な感度および精度で測定することが可能な微粒子測定前処理キットを提供することを目的としている。
【課題を解決するための手段】
【0030】
本発明は、誘電泳動を用いて試料液中の微粒子数を測定する微粒子測定装置に用いるセルであって、前記セルは開放端と底面と連続する側面とを備えるリザーバと、前記リザーバ中のイオン交換担体とを有することを特徴とする微粒子測定前処理キットを提供することができる。上記構成によれば、イオン交換担体を含有する測定セル中に微粒子試料を混合して前処理を行うことによって、従来必要であった煩雑なカラム操作を用いることなく、単純な操作で微粒子試料の試料液の導電率の低減が可能となる前処理キットを提供することができる。
【0031】
また、本発明の微粒子測定前処理キットは、上記のリザーバに微粒子懸濁液を備える。上記構成によれば、測定ごとに微粒子懸濁液を分注する操作を省くことができ、前処理時間を短縮することができる。
【0032】
また、本発明の微粒子測定前処理キットは、上記リザーバにリザーバの開放端を密閉しかつ取り外し可能な蓋を備える。上記構成によれば、試料を微粒子懸濁液に溶解し、イオン交換の前処理を行う際に蓋を閉めることによって、例えば手動でリザーバを上下震盪するなどの操作を行うことができ、簡便で迅速な前処理操作をすることができる。
【0033】
また、本発明の微粒子測定前処理キットは、上記蓋のリザーバ側に微粒子試料の採取部を備える。上記構成によれば、試料採取器具を別に準備する操作を省略することができ、測定試料の採取から前処理を行うまでの工程を簡易に、短時間で行うことができる。
【0034】
また、本発明の微粒子測定前処理キットは、上記の微粒子測定前処理キットにおいて、セル内に測定電極を備える。上記構成によれば、前処理操作後に微粒子懸濁液を測定用セルに移すことなく、速やかに微粒子測定をすることができる。
【0035】
また、本発明の微粒子測定前処理キットは、セル内において電極を含む空間とイオン交換担体を含む空間がイオン分子透過性の遮蔽物によって仕切られている。上記構成によれば、測定中にイオン交換担体が上記電極に衝突することによって生じるノイズを抑制し、より正確な微粒子測定をすることができる。
【0036】
また、本発明の微粒子測定前処理キットは、セル内において電極を含む空間とイオン交換担体を含む空間を仕切るイオン分子透過性の遮蔽物の目開きの大きさが1μmから5000μmの範囲で選択される。上記構成によれば、イオン交換担体の粒径に応じた最適な目開きを選択することで、セル内の液循環を妨げることを防止し、より正確な微粒子測定をすることができる。
【0037】
また、本発明の微粒子測定前処理キットは、セル内のメッシュで区切られたイオン交換担体を含まない空間に試料液の流出口を備える。上記構成によれば、同一の測定セルで導電率低減の前処理と測定を連続的に行え、かつ、前処理された試料液が流出する流れによって電極上に微粒子懸濁液を供給できるため、高感度な測定を行える。
【0038】
また、本発明の微粒子測定前処理キットにおいて、イオン交換担体が、陽イオン交換体、陰イオン交換体の重量比1:0.1から1:10の範囲で規定される混合物である。上記構成によれば、微粒子試料に含まれる陽イオンおよび陰イオンを過不足なく前処理することができる。
【0039】
また、本発明の微粒子測定前処理キットにおいて、担持されるイオン交換担体は試料液中に1ml中に0.3g以上の比率で添加する。上記構成によれば、前処理において試料液中の総イオン数に対して必要十分量のイオン交換担体を添加することとなり、最小限のイオン交換担体使用量で前処理を行うことができる。
【0040】
また、本発明の微粒子測定セルにおいて、担持されるイオン交換担体の基材がスチレン化合物で架橋された均一な網目状構造を有する樹脂である。上記構成によれば、イオン交換担体が前処理操作に耐えうる十分な強度を有し、担体の崩壊で小片を生じることなく後の測定への悪影響を防ぎ、正確な微粒子数の計測が行える。
【0041】
また、本発明の微粒子測定セルにおいて、担持されるイオン交換担体の粒径は400μm以上である。上記構成によれば、試料液中にイオン交換担体が均等に分散して、イオン交換担体同士の凝集による測定対象微粒子が物理的にイオン交換担体の隙間に閉じ込まれることを防止し、正確な微粒子数の計測が行える。
【0042】
また、本発明の微粒子測定セルにおいて、イオン交換担体を、適当な液体で一定時間以上の膨潤処理を施している。上記構成によれば、イオン交換担体の粒子表面を円滑化することで測定対象物が粒子表面に非特異的に吸着することを防止し、正確な微粒子数の計測が行える。
【0043】
また、本発明の微粒子測定セルにおいて、上記微粒子が微生物である。上記構成によれば、生体由来の体液、分泌物、排泄物、あるいは、環境中の海洋、河川、湖沼、あるいは、人工物中の貯水槽、用水路、プールなどから得られる試料を採取し、採取部位の微生物汚染を評価することができる。
【発明の効果】
【0044】
本発明の微粒子測定前処理キットによれば、、高溶液導電率を有する試料液においても、簡便かつ迅速で必要十分な導電率低減の前処理を行うことによって、必要十分な感度および精度で測定することが可能となる。
【発明を実施するための最良の形態】
【0045】
以下本発明を実施するための最良の形態について図面を参照しながら説明する。
【0046】
(第1の実施の形態)
本願における微粒子の定義について説明する。本願で言う微粒子とは、誘電泳動可能な大きさのあらゆる粒子を意味し、ポリスチレン等の高分子による粒子や、カーボンナノチューブ、金コロイドなどの金属粒子およびそれらに何らかのコーティングを施した粒子、細菌、真菌、放線菌、リケッチア、マイコプラズマ、ウイルス、として分類されているいわゆる微生物、原生動物や原虫のうちの小型のもの、生物体の幼生、動植物細胞、精子、血球、核酸、蛋白質等も含む広い意味での生体または生体由来の微粒子である。本願では特に、微生物の測定を想定している。
【0047】
本願で使用される微粒子懸濁液とは、測定対象の微粒子を懸濁するための溶液であり、望ましくは、測定時の溶液環境を安定化させるための緩衝溶液である。この緩衝溶液は、非電解質であること、細胞と同等の浸透圧を有する等の性質を有することが好ましく、例えば10mMマニトールpH7.0溶液等が挙げられる。
【0048】
本願で使用されるイオン交換担体はスチレンにジビニルベンゼンを架橋した高分子化合物であり試料溶媒に不溶な3次元構造の粒状ポリマーを基材とした。ジビニルベンゼンの重量比率を架橋度とよび、架橋度によって樹脂内の分子網目(ミクロポアー)の大きさが変化し、膨潤による体積変化などイオン交換担体の性質を左右している。物理的に数μmの細孔(マクロポアー)を基材に開けた多孔性のものをポーラス型、これよりもさらに架橋度を大きくした基材に、小さな細孔を多く開けた高多孔性のものをハイポーラス型とよび、このような構造をとることによって溶媒との接触面積が大きくなりイオン交換効率を高めている。無多孔性のものはゲル型とよぶ。
【0049】
基材に導入する交換基の種類によって、硫酸基を有するスチレン系強酸性陽イオン交換樹脂、カルボン酸基を有するメタクリル酸系弱酸性陽イオン交換樹脂およびアクリル酸系弱酸性陽イオン交換樹脂、4級アンモニウム基を有するI型およびII型強塩基性陰イオン交換樹脂、3級アミノ基を有する弱塩基性陰イオン交換樹脂、両性イオン交換樹脂に分類される。これらのイオン交換樹脂を用途に応じて単独、あるいは混合して使用することができる。
【0050】
また、本願の前処理法でポーラス型、ハイポーラス型のイオン交換樹脂を用いると、攪拌操作によって樹脂同士または壁面との衝突によって、樹脂が崩壊して無数の小片が生じる。この小片はDEPIM測定において測定対象の微粒子に混入して測定することになり、バックグランド上昇の要因となる。そのためゲル型イオン交換樹脂を用いることが望ましい。イオン交換樹脂の製品例として三菱化学社製のダイアイオンシリーズが挙げられる。
【0051】
本願の微粒子測定前処理セルに担持されるイオン交換樹脂には陽イオン交換樹脂、陰イオン交換樹脂を混合して用いることができる。それぞれの混合比は用途に応じて任意に設定することができ、陽イオン交換樹脂:陰イオン交換樹脂の混合比を1:10から10:1の範囲で設定した(前述)。陽イオン交換樹脂にSK1BH(三菱化学社製)、交換容量2[meq/ml]、粒径0.4−0.6mm、陰イオン交換樹脂はSA10AOH(三菱化学社製)、交換容量1.3[meq/ml]、粒径0.4mmから0.6mmを用いた。陽イオン交換樹脂と陰イオン交換樹脂の混合比は、試料液に含まれる陽イオンと陰イオンの当量比に等しくなるような比率であるのが好ましい。このことにより、どちらか一方のイオンが残存することなく、溶液導電率を過不足なく低下させることができる。より好ましい混合比はSK1BH:SA10AOH=1:1.5の割合である。
【0052】
上記のイオン交換樹脂は使用前に微粒子懸濁液を用いて、膨潤処理を施すのが望ましい。未使用のイオン交換樹脂は一部乾燥状態にあり、粒子表面にしわ、ひび割れ、窪み等、測定対象物を物理的に捕捉する立体障害を形成していると考えられる。十分な水分を粒子に吸収させることによって、粒子を膨潤させ表面を円滑にする作用が期待され、立体障害が減少し、測定対象物の非特異的吸着を防止する効果がある。
【0053】
図1は、本実施の形態にかかる微粒子測定前処理セルの構成を説明する図である。図1において、1はリザーバ、2はイオン交換担体である。リザーバ1は一方の端開放した開放端111をもち、他端に底面を有する形状を有し、底面及び開放端の輪郭は多面体、楕円形などの曲線で規定され、微粒子懸濁液の保持が可能な形状を有し、材質は樹脂、金属、ガラス、木材、それらを防水する塗料など水分を密封保持することのできる素材を用いる。リザーバ1の内部にイオン交換担体2を備えている。セル117はリザーバ1とイオン交換担体2とを有する。なお図2以降はセル117の説明を省略する。
【0054】
本実施の形態の微粒子測定前処理セルにて前処理を行う工程を説明する。
【0055】
まず、(1)測定対象の微粒子を含む懸濁液を試料液として、リザーバ1の開放端111から試料液を投入し、試料液とイオン交換担体2を攪拌することでイオン交換前処理を行う。試料液とイオン交換担体を混合し攪拌する方式は、両者が十分に接触しうる方式を用いることが好ましい。例えば、試料液とイオン交換担体を同一容器に混合し、容器内に攪拌子を入れ、これに外力を及ぼし運動させることによって攪拌してもよい。攪拌子の材料は金属、プラスチック、ゴム、生体由来物質等が利用することができる。外力は磁力、気圧変化、水圧変化、位置エネルギー変化、運動エネルギー変化などの物理的エネルギーを利用することができる。また、攪拌子を入れない方式も利用することができる。また、これら攪拌の時間を適切な範囲に規定することで、必要十分なイオン交換前処理、すなわち導電率の低減を行うことができる。また、事前に微粒子懸濁液の導電率を測定しておき、測定された導電率に応じて処理時間を規定すれば、より正確かつ、必要十分な処理時間で前処理を行うことができる。
【0056】
次に、(2)イオン交換前処理を施した試料液を図示しない測定用セルに分注する。分注の方法は、イオン交換担体が測定用セルに混入しない方式を用いることが好ましい。例えば、メッシュを用いて試料液のみをろ過する方式が考えられる。メッシュに用いる材料はナイロン、ポリエステル、ポリプロピレン、テフロン(登録商標)、カーボン、金属、プラスチック、ゴム、生体由来物質などを利用することができる。加えてメッシュの目開きは1μmから5000μmの範囲から選択することができる。加えて、糸径は10μmから1000μmの範囲から選択することができる。さらには、目開き180μm、糸径96μmのポリエステルを材料に用いたメッシュが好ましい。また、メッシュを用いないで、イオン交換処理済みの試料液を静置した上清を、一般に用いられるピペッティング操作によって分注する方式も利用することができる。
【0057】
以上、本実施の形態によれば、イオン交換担体を含有する測定セル中に微粒子試料を混合して前処理を行うことによって、従来のカラム操作で必要であった導電率低減のための煩雑な操作を用いることなく、単純で迅速な操作で、かつ、前処理時に試料中の微粒子を非特異的に減少させることなく、試料液の導電率低減が可能となる測定セルを提供することができる。
【0058】
(第2の実施の形態)
図2は、本願の微粒子測定前処理キットにおける第2の実施の形態を表す図である。図2において、3は試料懸濁液であり、測定対象の微粒子が懸濁されていない状態で予めリザーバ1内にイオン交換担体2と共に充填されている。前処理を行う場合、測定対象の微粒子が懸濁されている試料液もしくは、測定対象の微粒子を試料採取面から採取した採取具を、開放端111から投入し、前処理を行う。前処理の方法については、前述のとおりであるため、説明を省略する。
【0059】
以上、本実施の形態によれば、測定ごとに微粒子懸濁液を分注する操作を省くことができ、前処理時間を短縮することができる。
【0060】
また、図3のように、図2の開放端に蓋4を備えることもできる。蓋4の輪郭は多面体、楕円形などの曲線で規定されるいずれかの形状を有し、リザーバ1の開放端を隙間無く塞ぎ、攪拌時にリザーバ1内の試料液がこぼれないような構成になっている。蓋4を備えることで、リザーバ1に振動を与えて、採取具から測定対象の微粒子を微粒子懸濁液に分散し、同時にあるいはその後、イオン交換担体2と試料液を効率よく攪拌することが可能となる。
【0061】
上記構成によれば、試料を微粒子懸濁液に溶解する際に蓋を閉めることによって、例えば手動でリザーバを上下震盪するなどの操作を行うことができ、簡便で迅速な前処理操作をすることができる。
【0062】
また、図4のように、蓋4のリザーバ1側の面に、試料採取部5を設けることもできる。検体採取部5はリザーバ1の内部に収容可能な寸法を有し、末端部分は検体採取部面を擦過して微粒子を捕捉できる構造を有し、綿、合成繊維、樹脂などの素材を用いるのが望ましい。
【0063】
前処理の手順は、以下の通りである。
(1)蓋4を手に持って規定の採取面を擦過し、測定対象となる微粒子を採取する。
(2)試料採取部5がリザーバ1内部に入る方向に蓋4をリザーバ1にセットし、リザーバ1を蓋4で密閉する。
(3)リザーバ1全体に一定時間振動を与えるなどして、微粒子懸濁液3とイオン交換担体2を攪拌し、イオン交換前処理を行う。
【0064】
本実施の形態では、簡単のため手で上下に往復運動して攪拌した。上記構成によれば、試料採取器具を別に準備する操作を省略することができ、測定試料の採取から前処理を行うまでの工程を簡易に、短時間で行うことができる。
【0065】
(第3の実施の形態)
図5は、本願の微粒子測定前処理キットにおける、第3の実施の形態を表す図である。図5において、6は誘電泳動電極である。誘電泳動電極6は、櫛歯部112を備え、リザーバ1の壁面に固定されるか、リザーバ1の壁面の一部として成形されるか、図示しない電気的接点を含むコネクタなどによって固定される。また、誘電泳動電極6は、図示しない誘電泳動を誘起するための交流電源および、図示しないインピーダンス測定回路に接続するための接点を備える。
【0066】
測定対象の微粒子は、櫛歯部112に誘電泳動されて捕捉されるため、誘電泳動電極6は、リザーバ1内に微粒子懸濁液を入れたときに、櫛歯部112が微粒子懸濁液に全て浸漬する位置に配置される。また、攪拌によるイオン交換処理の効率化の他、リザーバ1内で微粒子懸濁液の流れを作ることで、微粒子懸濁液中の微粒子を櫛歯部112付近に絶えず供給することができ、DEPIM測定の測定信号量を増大できるため、リザーバ1内には図示しない攪拌子を含むことが好ましい。
【0067】
前処理および測定の手順を下記に説明する。
(1)リザーバ1内に測定対象の微粒子を含む微粒子懸濁液を導入する。
(2)攪拌子などで攪拌することでイオン交換により試料導電率を低減する。
【0068】
このとき、誘電泳動電極6には図示しない交流電源およびインピーダンス測定回路が接続され、誘電泳動を起こさない程度の電圧の印加によってインピーダンスを測定し、微粒子懸濁液の導電率低下をモニタリングしても良い。
(3)攪拌子などで攪拌を続けた状態のまま、測定対象の微粒子に誘電泳動を誘起するために十分な電圧を印加し、同時にインピーダンスを計測する(DEPIM測定)。
【0069】
このとき、DEPIM測定の開始は、前述の導電率モニタリングの結果から判断するなどすれば、適切な時間だけイオン交換処理を行うことになるため、効率的な処理が行える。一定時間の電圧印加及びインピーダンス計測が終了すると、図示しないインピーダンス測定回路はインピーダンス変化の傾きを算出して、微粒子濃度あるいは微粒子数などを結果表示して一連の前処理、測定の工程を終了する。
【0070】
上記構成によれば、前処理操作後に微粒子懸濁液を測定用セルに移すことなく、速やかに微粒子測定をすることができる。
【0071】
また、図6のように、リザーバ1内に遮蔽物7を設け、誘電泳動電極6を含む空間と、イオン交換担体2を含む空間に仕切ることもできる。遮蔽物7は微粒子懸濁液中のイオンは透過し、イオン交換担体2は透過しない程度の目開きを持ったメッシュやメンブレンフィルタなどが望ましい。メッシュに用いる材料はナイロン、ポリエステル、ポリプロピレン、テフロン(登録商標)、カーボン、金属、プラスチック、ゴム、生体由来物質などを利用することができる。加えてメッシュの目開きは、イオン交換担体2の粒子径に応じて選択すれば良いが、1μmから5000μmの範囲が最も望ましい。この範囲に設定することで、イオン交換担体2は透過せず、かつ、微粒子懸濁液の拡散あるいは攪拌子などによる攪拌によって、誘電泳動電極6側の空間に微粒子懸濁液中の微粒子を容易に導入することが可能となる。
【0072】
加えて、糸径は10μmから1000μmの範囲から選択することができる。さらには、目開き180μm、糸径96μmのポリエステルを材料に用いたメッシュが好ましい。
【0073】
上記構成によれば、微粒子懸濁液の導電率低減と、DEPIM測定を行うリザーバ1内において、攪拌によって、櫛歯部112へのイオン交換担体2の衝突を防ぐことができ、測定ノイズの無い高精度の微粒子測定を行うことができる。
【0074】
(第4の実施の形態)
図8は、本願の微粒子測定前処理キットにおける、第4の実施の形態を表す図である。図8において、リザーバ1内部にイオン交換担体2が存在する第一の空間114と、イオン交換担体2が存在しない第二の空間115とを遮蔽物7で区分し、イオン交換担体2が存在しない空間側に流出口116を設ける。イオン交換担体2は、開放端111と遮蔽物7との間の第一の空間114内に配置される。誘電泳動電極6は、遮蔽物7と流出口114との間の第二の空間115内に配置される。
【0075】
測定対象の微粒子懸濁液は、開放端111から導入され、第一の空間114を通る。この時、微粒子懸濁液中のイオンはイオン交換担体2に吸着され、導電率が低下する。導電率が低下した微粒子懸濁液は、遮蔽物7を通り、第二の空間115に入る。遮蔽物7の目開きは、前述のようにイオン交換担体2より小さいため、イオン交換担体2は第二の空間115に侵入せず、測定対象の微粒子を含む、導電率が低下した微粒子懸濁液のみが第二の空間115に流入することになる。第二の空間115に流入した微粒子懸濁液は、誘電泳動電極6の櫛歯部112付近を通過する。この時、誘電泳動電極6は接点113を通じて図示しない交流電源およびインピーダンス測定回路に接続されており、DEPIM測定を行う。誘電泳動電極6を通過した微粒子懸濁液は、流出口116から流れ出す。この時、微粒子懸濁液は流出口116から流出するのに伴い、当然ながらある流速をもって誘電泳動電極6を通過することになる。この流速が発生することによって測定対象の微粒子が絶えず櫛歯部112付近を通過することになり、DEPIM測定に必要十分な微粒子を櫛歯部112に捕捉することができるため、高感度なDEPIM測定を行うことができる。流出口116から流れ出した微粒子懸濁液は、図示しない廃液セルなどに貯留するなどとする。
【0076】
上記構成によれば、同一の測定セルで導電率低減の前処理と測定を連続的に行え、かつ、前処理された試料液が流出する流れによって電極上に微粒子懸濁液を供給できるため、高感度な測定を行える。
【0077】
では次に本発明の実施の形態で説明したキットを用い測定した事例を説明する。
【0078】
(実施例1)
本願の微粒子測定前処理セルの実施例1について図面を参照しながら説明する。図1から8は微粒子測定前処理キットの構成図である、図9は本発明の測定セルを用いた微粒子測定のフロー図である、図10Aは微生物数計測を本願の方式と蛍光法で比較したグラフ、図10Bは微生物数計測を本願の方式と培養法で比較したグラフである。
【0079】
具体的な本願の微粒子測定前処理キットを用いた微粒子測定のプロトコルを図9とともに説明する。
【0080】
はじめに、リザーバ1に7mlの試料懸濁液3を分注し、適量のイオン交換体2を分散させて60分以上の膨潤処理を行う。測定に必要な数量を前もって準備しておけばよい。
【0081】
次に、試料採取8した採取具をリザーバ1に投入し蓋4を閉め、測定セルを攪拌する。攪拌操作はより簡便に行うために、手動によって15秒間測定セルを激しく上下左右に往復運動させる方式を用いた。
【0082】
攪拌操作後に試料溶液を静置して蓋4を開けて上清5mlを測定用セルに移し変える。より簡便に行うためにデカント方式を用いた。他にもイオン交換担体が測定用セルに混入しない方式ならば何ら問題ない。最後に測定用セルに誘電泳動電極6を測定装置13にセットして微粒子測定を行う。
【0083】
図10Aは本願の前処理方式を用いたDEPIM測定による微生物数測定方式と、細菌の細胞膜を蛍光色素で染色して測定する原理を用いた市販の微生物数測定方式を用いて、ヒトの口腔内細菌数を測定した結果である。横軸に蛍光染色測定方式で得られた測定値を示し、縦軸に本方式で得られた測定値を示している。相関係数は0.69、測定感度は約10の5乗cells/mlであった。
【0084】
図10Bは本願の前処理方式を用いたDEPIM測定による微生物数測定方式と、コロニーカウント原理を用いた市販の微生物数測定方式を用いて、ヒトの口腔内細菌数を測定した結果である。横軸に蛍光染色測定方式で得られた測定値を示し、縦軸に本方式で得られた測定値を示した。相関係数は0.86、測定感度は約10の5乗cells/mlであった。
【0085】
(実施例2)
セルに担持するイオン交換担体混合物の重量を、それぞれ0.5g,1.0g,1.5g,2.0gとして、初期溶液導電率が50μS/cmのときの、処理時間に対する導電率変化のグラフを図11(A)に示した。また同様に初期溶液導電率が100μS/cmのときの、処理時間に対する導電率変化のグラフを図11(B)に示した。
【0086】
図11(A)において50μS/cmから5μS/cmまで導電率を低減するのに要した時間は、それぞれ0.5g、1.0g、1.5g、2.0gのとき45秒、25秒、15秒、13秒であった。
【0087】
図11(B)において100μS/cmから5μS/cmまで導電率を低減するのに要した時間は、それぞれ0.5g、1.0g、1.5g、2.0gのとき60秒以上、45秒、22秒、21秒であった。
【0088】
DEPIM測定においては溶液導電率を5μS/cm以下に低減させると、十分な感度の測定が可能となる。本実施例では前処理に必要十分なイオン交換担体濃度は0.3g/ml以上であることが示された。
【0089】
(実施例3)
図12は粒径0.4mmのゲル型イオン交換樹脂をあらかじめ膨潤させたものを用いて、本願の前処理方法を行ったときの微生物残存率のグラフである。
【0090】
横軸に処理前の微生物濃度、縦軸に処理後の微生物残存率を示している。膨潤処理なしの場合残存率は30%から50%であった。一方、膨潤処理ありの場合は90%から120%であった。なお前処理操作によって生じる微量の小片がバックグランドとなり、残存率が全体的に高くなっている。このようにゲル型イオン交換樹脂に膨潤処理を行うことによって、樹脂表面が平滑になり微生物が非特異的に樹脂表面に付着することを防止できた。
【0091】
また、本願で使用するゲル型イオン交換樹脂は粒径0.2mmから0.8mmの中から選択して使用することができる。粒径0.2mmのイオン交換樹脂を使用した場合、試料溶液中で樹脂同士が凝集塊を形成した。これは粒径が小さくなると体積あたりの表面積が大きくなり、樹脂表面同士の静電相互作用などの引力の影響を受けるためと考えられる。イオン交換樹脂の凝集塊形成と微生物残存率低下の相関性が実験により確認されている。
【0092】
一方、粒径0.4mm以上のイオン交換樹脂を使用した場合、試料溶液中で樹脂同士の凝集塊は発生せず、良好に分散する。
【産業上の利用可能性】
【0093】
本発明は、イオン交換担体を含有する測定セル中に微粒子試料を混合して前処理を行うことによって、従来必要であった導電率低減のための煩雑な操作を用いることなく、単純な操作で微粒子試料の試料液の導電率低減が可能となる測定セルを提供することができる効果を有し、溶液中の微粒子数または微粒子濃度を、誘電泳動を用いて測定するための微粒子検査チップおよび微粒子数検査方法として有用である。
【図面の簡単な説明】
【0094】
【図1】微粒子測定前処理キットの概略図
【図2】微粒子測定前処理キットに試料懸濁液を備えた図
【図3】微粒子測定前処理キットに開放端を閉じる蓋を備えた図
【図4】微粒子測定前処理キットに開放端を閉じる蓋に試料採取部を備えた図
【図5】微粒子測定前処理キットに誘電泳動電極を備えた図
【図6】微粒子測定前処理キットにイオン透過性の遮蔽物を備えた図
【図7】微粒子測定前処理キットに備えたイオン透過性の遮蔽物の目開きを示す図
【図8】微粒子測定前処理キットにイオン透過性遮蔽物と試料流出口を備えた図
【図9】本願の前処理方式のフロー図
【図10】DEPIM測定と一般的な微生物数測定法との相関図
【図11】前処理による溶液導電率の時間変化を表す図
【図12】前処理後の微生物残存率を表す図
【符号の説明】
【0095】
1 リザーバ
2 イオン交換担体
3 試料懸濁液
4 蓋
5 試料採取部
6 電極
7 遮蔽物
8 試料採取行程
9 イオン交換体を試料懸濁液で膨潤させる行程
10 測定セルに試料採取器具をセットする行程
11 測定セルを攪拌する行程
12 前処理後の上清を抜き取り測定用セルに移動する行程
13 測定機で微粒子数を計測する行程
111 開放端
112 櫛歯部
114 第一の空間
115 第二の空間
116 流出口
117 セル
【特許請求の範囲】
【請求項1】
誘電泳動を用いて試料液中の微粒子数を測定する微粒子測定装置に用いるセルであって、前記セルは少なくとも開放端と底面と連続する側面とを備えるリザーバと、前記リザーバ中のイオン交換担体とを有することを特徴とする微粒子測定前処理キット。
【請求項2】
請求項1に記載のリザーバに、微粒子懸濁液を備えることを特徴とする微粒子測定前処理キット。
【請求項3】
請求項1に記載のリザーバに、リザーバの開放端を密閉しかつ取り外し可能な蓋を備えることを特徴とする微粒子測定前処理キット。
【請求項4】
請求項3に記載の蓋の、リザーバ側に微粒子試料の採取部を備えることを特徴とする微粒子測定前処理キット。
【請求項5】
請求項1の微粒子測定前処理キットにおいて、セル内に測定電極を含むことを特徴とする微粒子測定前処理キット。
【請求項6】
請求項1から請求項5に記載の微粒子測定前処理キットにおいて、計測セル内に測定電極を含み、セル内において電極を含む空間とイオン交換担体を含む空間が、少なくともイオン分子が透過し、かつ、イオン交換担体は通過しない遮蔽物によって仕切られることを特徴とする微粒子測定前処理キット。
【請求項7】
請求項7に記載の微粒子測定前処理キットにおいて、セル内において電極を含む空間とイオン交換担体を含む空間を仕切る遮蔽物の目開きの大きさが1μmから5000μmの範囲で選択されることを特徴とする微粒子測定前処理キット。
【請求項8】
請求項6に記載の微粒子測定前処理キットにおいて、セル内のイオン交換担体を含まない空間に試料液の流出口を備えることを特徴とする微粒子測定前処理キット。
【請求項9】
請求項1に記載のイオン交換担体が、陽イオン交換体、陰イオン交換体の重量比1:0.1から1:10の範囲で規定される混合物であることを特徴とする微粒子測定前処理キット。
【請求項10】
請求項2に記載の、微粒子懸濁液1mlに対し0.3g以上の比率でイオン交換担体を添加することを特徴とする微粒子測定前処理キット。
【請求項11】
請求項1に記載のイオン交換担体の基材がスチレン化合物で架橋された均一な網目状構造を有する樹脂であることを特徴とする微粒子測定前処理キット。
【請求項12】
請求項1に記載のイオン交換担体が粒径400μm以上のイオン交換担体であることを特徴とする微粒子測定前処理キット。
【請求項13】
請求項1に記載のイオン交換担体は、適当な液体で一定時間の膨潤処理を施されていることを特徴とする微粒子測定前処理キット。
【請求項14】
上記微粒子が、微生物であることを特徴とする、請求項1記載の微粒子測定前処理キット。
【請求項1】
誘電泳動を用いて試料液中の微粒子数を測定する微粒子測定装置に用いるセルであって、前記セルは少なくとも開放端と底面と連続する側面とを備えるリザーバと、前記リザーバ中のイオン交換担体とを有することを特徴とする微粒子測定前処理キット。
【請求項2】
請求項1に記載のリザーバに、微粒子懸濁液を備えることを特徴とする微粒子測定前処理キット。
【請求項3】
請求項1に記載のリザーバに、リザーバの開放端を密閉しかつ取り外し可能な蓋を備えることを特徴とする微粒子測定前処理キット。
【請求項4】
請求項3に記載の蓋の、リザーバ側に微粒子試料の採取部を備えることを特徴とする微粒子測定前処理キット。
【請求項5】
請求項1の微粒子測定前処理キットにおいて、セル内に測定電極を含むことを特徴とする微粒子測定前処理キット。
【請求項6】
請求項1から請求項5に記載の微粒子測定前処理キットにおいて、計測セル内に測定電極を含み、セル内において電極を含む空間とイオン交換担体を含む空間が、少なくともイオン分子が透過し、かつ、イオン交換担体は通過しない遮蔽物によって仕切られることを特徴とする微粒子測定前処理キット。
【請求項7】
請求項7に記載の微粒子測定前処理キットにおいて、セル内において電極を含む空間とイオン交換担体を含む空間を仕切る遮蔽物の目開きの大きさが1μmから5000μmの範囲で選択されることを特徴とする微粒子測定前処理キット。
【請求項8】
請求項6に記載の微粒子測定前処理キットにおいて、セル内のイオン交換担体を含まない空間に試料液の流出口を備えることを特徴とする微粒子測定前処理キット。
【請求項9】
請求項1に記載のイオン交換担体が、陽イオン交換体、陰イオン交換体の重量比1:0.1から1:10の範囲で規定される混合物であることを特徴とする微粒子測定前処理キット。
【請求項10】
請求項2に記載の、微粒子懸濁液1mlに対し0.3g以上の比率でイオン交換担体を添加することを特徴とする微粒子測定前処理キット。
【請求項11】
請求項1に記載のイオン交換担体の基材がスチレン化合物で架橋された均一な網目状構造を有する樹脂であることを特徴とする微粒子測定前処理キット。
【請求項12】
請求項1に記載のイオン交換担体が粒径400μm以上のイオン交換担体であることを特徴とする微粒子測定前処理キット。
【請求項13】
請求項1に記載のイオン交換担体は、適当な液体で一定時間の膨潤処理を施されていることを特徴とする微粒子測定前処理キット。
【請求項14】
上記微粒子が、微生物であることを特徴とする、請求項1記載の微粒子測定前処理キット。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【公開番号】特開2009−156604(P2009−156604A)
【公開日】平成21年7月16日(2009.7.16)
【国際特許分類】
【出願番号】特願2007−332081(P2007−332081)
【出願日】平成19年12月25日(2007.12.25)
【出願人】(000005821)パナソニック株式会社 (73,050)
【Fターム(参考)】
【公開日】平成21年7月16日(2009.7.16)
【国際特許分類】
【出願日】平成19年12月25日(2007.12.25)
【出願人】(000005821)パナソニック株式会社 (73,050)
【Fターム(参考)】
[ Back to top ]

