微細藻類細胞内成分の抽出方法
【課題】微細藻類が単細胞であっても、遠心分離などを行うことなく省エネルギーで、かつ簡便な操作により短時間で効率よく微細藻類を回収でき、更に前記微細藻類が細胞内に産生する成分を効率よく簡便に抽出できる微細藻類細胞内成分の抽出方法の提供。
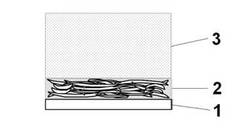
【解決手段】フィルター1上に紙パルプ層2を形成する紙パルプ層形成工程と、少なくとも微細藻類を含む微細藻類懸濁液のゼータ電位を−15mV〜+15mVに調整するゼータ電位調整工程と、前記紙パルプ層に前記ゼータ電位を調整した微細藻類懸濁液3を吐出して前記微細藻類を回収する回収工程と、前記回収工程により得られた微細藻類含有紙パルプシートから、前記微細藻類の細胞内に産生される成分を抽出する抽出工程と、を含む微細藻類細胞内成分の抽出方法。
【解決手段】フィルター1上に紙パルプ層2を形成する紙パルプ層形成工程と、少なくとも微細藻類を含む微細藻類懸濁液のゼータ電位を−15mV〜+15mVに調整するゼータ電位調整工程と、前記紙パルプ層に前記ゼータ電位を調整した微細藻類懸濁液3を吐出して前記微細藻類を回収する回収工程と、前記回収工程により得られた微細藻類含有紙パルプシートから、前記微細藻類の細胞内に産生される成分を抽出する抽出工程と、を含む微細藻類細胞内成分の抽出方法。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、微細藻類細胞内成分の抽出方法に関する。
【背景技術】
【0002】
近年、石油の枯渇や二酸化炭素の増加による地球温暖化などが問題となっており、石油資源の代替原料としてバイオマスから産生されるバイオディーゼルが注目されている。バイオマス原料としては、菜種油、パーム油、オリーブ油、ひまわり油、大豆油等の植物油が利用されているが、これらの原料を用いたバイオディーゼルの生産量を増加させると、食料や飼料の供給に影響を及ぼすことが懸念される。そのため、これらの植物に代わる石油資源の代替原料として、微細藻類が注目されている。
【0003】
微細藻類は、単細胞を単位生命体とし、葉緑素(クロロフィル)を有し、光合成によって大気中の二酸化炭素を固定化し酸素を産生する。海洋だけでなく、湖、池、川等の淡水系にも繁殖し、その種類は10万種類におよぶ。微細藻類は、物質生産量が陸上植物と比較して多く、その種類によっては、陸上植物より光合成能力が高いものや、脂肪酸を蓄積するものなどがあるため、バイオディーゼルの生産を容易に行うことができる。また、微細藻類は、バイオディーゼルの原料として用いた場合であっても、食料や飼料と競合する問題がなく、植物と比較して単位面積当たりの生産性が高く、植物栽培に適さない土地でも利用でき、二酸化炭素固定への寄与率が高いなど、多くの利点を有する。
【0004】
更に、微細藻類が産生する成分としては、脂肪酸の他にも種々の生理活性物質を産生することが知られており、香粧品や医薬品、健康食品、魚類用飼料、家禽用飼料などへの応用が期待されている。例えば、ヘマトコッカス ラキュストリスは、アスタキサンチンを産生する。このアスタキサンチンは、ビタミンEの約1,000倍、β−カロテンの約40倍の抗酸化作用を有することが知られている。そのため、動脈硬化、糖尿病、炎症、皮膚の老化等の防止作用や、免疫賦活化、抗ストレス、美白などの種々の効果が期待されている。また、ナンノクロロプシス オキュラータは、脂肪酸を産生するが、この中でもエイコサペンタエン酸は、ガンの予防作用、中性脂肪やコレステロールの低減作用などが知られている。
【0005】
このような種々の機能を有する微細藻類を回収する方法としては、フィルター濾過する方法や、遠心分離による方法が知られている(例えば、非特許文献1参照)。
しかし、フィルター濾過では単細胞の微細藻類を回収することができず、糸状性や群体性等の限られた種類の微細藻類しか回収できないため、回収率が悪い点で問題であった。また、遠心分離を行うためにはエネルギーが必要となるため、省エネルギーの観点から好ましくない。
紙パルプに藻を添加して抄紙を行った藻マルチングシートも提案されているが、該マルチングシートにおけるクロレラの回収率は70%程度であり、その回収率は十分満足できるものではなかった(特許文献1参照)。
【0006】
したがって、微細藻類が単細胞であっても、遠心分離などを行うことなく省エネルギーで、かつ簡便な操作により短時間で効率よく微細藻類を回収でき、更に前記微細藻類が細胞内に産生する成分を効率よく簡便に抽出できる微細藻類細胞内成分の抽出方法が求められているのが現状である。
【先行技術文献】
【特許文献】
【0007】
【特許文献1】特開2000−346757号公報
【非特許文献】
【0008】
【非特許文献1】Molina Grima E., Biotechnol Adv, 2003, Jan;20(7−8), 491−515.
【発明の概要】
【発明が解決しようとする課題】
【0009】
本発明は、従来における前記諸問題を解決し、以下の目的を達成することを課題とする。即ち、本発明は、微細藻類が単細胞であっても、遠心分離などを行うことなく省エネルギーで、かつ簡便な操作により短時間で効率よく微細藻類を回収でき、更に前記微細藻類が細胞内に産生する成分を効率よく簡便に抽出できる微細藻類細胞内成分の抽出方法を提供することを目的とする。
【課題を解決するための手段】
【0010】
前記課題を解決するため、本発明者らは鋭意検討した結果、以下のような知見を得た。即ち、フィルター上に紙パルプ層を形成した後、前記紙パルプ層に、ゼータ電位を−15mV〜+15mVに調整した微細藻類懸濁液を吐出することにより、微細藻類が単細胞であっても、遠心分離などを行うことなく省エネルギーで、かつ簡便な操作により短時間で効率よく微細藻類を回収でき、更に、前記微細藻類を含有する紙パルプシートをそのまま抽出に用いることができるため、前記微細藻類が細胞内に産生する成分を効率よく簡便に抽出できることを知見し、本発明の完成に至った。
【0011】
本発明は、本発明者らによる前記知見に基づくものであり、前記課題を解決するための手段としては、以下の通りである。即ち、
<1> フィルター上に紙パルプ層を形成する紙パルプ層形成工程と、
少なくとも微細藻類を含む微細藻類懸濁液のゼータ電位を−15mV〜+15mVに調整するゼータ電位調整工程と、
前記紙パルプ層に前記ゼータ電位を調整した微細藻類懸濁液を吐出して前記微細藻類を回収する回収工程と、
前記回収工程により得られた微細藻類含有紙パルプシートから、前記微細藻類の細胞内に産生される成分を抽出する抽出工程と、
を含むことを特徴とする微細藻類細胞内成分の抽出方法である。
<2> 抽出工程が、微細藻類含有紙パルプシートと、抽出溶剤とを接触させて微細藻類の細胞内に産生される成分を抽出する工程である前記<1>に記載の微細藻類細胞内成分の抽出方法である。
<3> 紙パルプ層形成工程が、紙パルプ層における固形パルプ分の絶乾質量が10g/m2〜150g/m2の紙パルプ層を形成する工程である前記<1>から<2>のいずれかに記載の微細藻類細胞内成分の抽出方法である。
<4> 紙パルプ層形成工程が、紙パルプ層における固形パルプ分の含有量が0.5質量%〜20質量%の紙パルプ層を形成する工程である前記<1>から<3>のいずれかに記載の微細藻類細胞内成分の抽出方法である。
<5> ゼータ電位調整工程が、微細藻類懸濁液に多価カチオン及びアニオン性基を有する高分子化合物を添加することにより、前記微細藻類懸濁液のゼータ電位を調整する工程である前記<1>から<4>のいずれかに記載の微細藻類細胞内成分の抽出方法である。
<6> フィルターが、抄紙ワイヤーである前記<1>から<5>のいずれかに記載の微細藻類細胞内成分の抽出方法である。
<7> 微細藻類が、ヘマトコッカス ラキュストリス及びナンノクロロプシス オキュラータの少なくともいずれかである前記<1>から<6>のいずれかに記載の微細藻類細胞内成分の抽出方法である。
である。
<8> 前記<7>に記載の微細藻類細胞内成分の抽出方法により得られることを特徴とするアスタキサンチンである。
<9> 前記<7>に記載の微細藻類細胞内成分の抽出方法により得られることを特徴とするエイコサペンタエン酸である。
【発明の効果】
【0012】
本発明によれば、従来における前記諸問題を解決し、前記目的を達成することができ、微細藻類が単細胞であっても、遠心分離などを行うことなく省エネルギーで、かつ簡便な操作により短時間で効率よく微細藻類を回収でき、更に前記微細藻類が細胞内に産生する成分を効率よく簡便に抽出できる微細藻類細胞内成分の抽出方法を提供することができる。
【図面の簡単な説明】
【0013】
【図1】図1は、本発明の微細藻類細胞内成分の抽出方法の一例を示す概略図である。
【発明を実施するための形態】
【0014】
(微細藻類細胞内成分の抽出方法)
本発明の微細藻類細胞内成分の抽出方法は、紙パルプ層形成工程と、ゼータ電位調整工程と、回収工程と、抽出工程と、を少なくとも含み、必要に応じて更にその他の工程を含む。
【0015】
<紙パルプ層形成工程>
前記紙パルプ層形成工程は、フィルター上に紙パルプ層を形成する工程である。
【0016】
<<フィルター>>
前記フィルターとしては、特に制限はなく、目的に応じて適宜選択することができるが、抄紙ワイヤーが好ましい。前記抄紙ワイヤーとは、例えば、紙パルプ技術協会誌(2005年2月号168頁)に記載された、紙を漉く際に最初に紙層形成を担う用具である。
【0017】
前記フィルターの材質としては、特に制限はなく、目的に応じて適宜選択することができ、例えば、ポリエステル、ポリアミド、ポリプロピレン、ポリフッ化ビニリデン等のプラスチック、ステンレス、ブロンズなどが挙げられる。これらは、1種単独で使用してもよく、2種以上を併用してもよい。これらの中でも、前記材質は、荷重に対する伸びが少なく、剛性、形状安定性、耐疲労性、耐蝕性などが高い点で、プラスチックワイヤーが好ましい。
【0018】
前記フィルターの構造は、平織りであってもよく、重織であってもよいが、平織〜4.5重織が好ましく、濾水性の高さの観点から、平織〜2.5重織がより好ましい。
前記フィルターの篩目開きとしても、特に制限はなく、前記フィルターの構造などに応じて適宜選択することができるが、濾水性の高さの観点から、0.355mm(42メッシュ)〜0.038mm(400メッシュ)が好ましい。
【0019】
<<紙パルプ層>>
前記紙パルプ層は、後述するパルプ懸濁液により好適に形成することができる。
【0020】
−パルプ懸濁液−
前記パルプ懸濁液は、少なくともパルプを含み、必要に応じて、更にその他の成分を含む。
【0021】
−−パルプ−−
前記パルプの原料としては、特に制限はなく、目的に応じて適宜選択することができ、例えば、針葉樹や広葉樹等の木材、サトウキビバガス、草、藁、竹等の非木材などが挙げられる。これらは、1種単独で使用してもよく、2種以上を併用してもよい。
前記パルプを入手する方法としては、特に制限はなく、目的に応じて適宜選択することができ、例えば、前記パルプ原料から製造する方法、市販品を用いる方法などが挙げられる。
【0022】
前記パルプは、その製造方法から、メカニカルパルプ、サーモメカニカルパルプ、化学パルプの3種類に分けることができ、本発明における前記パルプは、これらのうちのいずれであってもよい。また、前記製造方法により得られたパルプに漂白処理を施したものであってもよい。
前記メカニカルパルプとは、物理的な力で前記パルプ原料を叩解することにより得られるパルプである。
前記サーモメカニカルパルプとは、前記パルプ原料を高温及び高圧条件下におき、リグニンを軟化させた状態で叩解することにより得られるパルプである。
前記化学パルプとは、前記パルプ原料に、亜硫酸ナトリウム、水酸化ナトリウム等の化学薬品で化学的な処理を施し、リグニン等の不要成分を除去後、叩解することにより得られるパルプである。
また、前記パルプは、前記パルプ原料から製造したバージンパルプであってもよく、古紙等から再生した再生パルプであってもよい。
【0023】
前記パルプのカナディアンフリーネスとしては、特に制限はなく、目的に応じて適宜選択することができるが、200mL〜500mLが好ましく、250mL〜450mLがより好ましい。前記カナディアンフリーネスが200mL未満であると、パルプ層自体の脱水不良となることがあり、500mLを超えると、前記微細藻類の回収率が低下することがある。
【0024】
前記パルプ懸濁液における固形パルプ分の含有量としては、前記紙パルプ層において所望のパルプ含有量に調整することができれば、特に制限はなく、目的に応じて適宜選択することができる。
【0025】
−−その他の成分−−
前記パルプ懸濁液における前記その他の成分としては、特に制限はなく、目的に応じて適宜選択することができ、例えば、水、乾燥紙力増強剤、湿潤紙力増強剤、撥水剤、濾水性向上剤、填量などが挙げられる。
前記紙パルプ層における前記その他の成分の含有量としては、特に制限はなく、目的に応じて適宜選択することができる。
【0026】
−紙パルプ層の形成方法−
前記紙パルプ層を形成する方法としては、特に制限はなく、公知の方法の中から適宜選択することができ、例えば、抄紙機に前記フィルターを設置し、前記フィルター上に前記パルプ懸濁液を添加して濾過することにより、前記フィルター上に前記パルプ層を堆積させて形成する方法などが挙げられる。
前記抄紙機としては、特に制限はなく、公知の装置の中から適宜選択することができ、例えば、丸型シートマシーン(例えば、熊谷理機工業株式会社製)、ダイナミックシートフォーマー、長網抄紙機、ツインワイヤ抄紙機、円網抄紙機、円網短網コンビネーション抄紙機などが挙げられる。
【0027】
前記紙パルプ層における固形パルプ分の絶乾質量としては、特に制限はなく、目的に応じて適宜選択することができるが、10g/m2〜150g/m2が好ましく、15g/m2〜50g/m2がより好ましい。前記絶乾質量が、10g/m2未満であると、単細胞の微細藻類を回収することができないことがあり、150g/m2を超えると、微細藻回収効果効率に特段な変化はなくパルプの過剰使用となることがある。
【0028】
前記パルプ懸濁液におけるパルプの絶乾質量を測定する方法としては、特に制限はなく、目的に応じて適宜選択することができ、例えば、前記紙パルプ層を乾燥させて秤量する方法などが挙げられる。
前記乾燥させる方法としては、特に制限はなく、目的に応じて適宜選択することができ、例えば、凍結乾燥法、噴霧乾燥法、加熱乾燥法、対流乾燥法などが挙げられる。
【0029】
前記紙パルプ層における固形パルプの含有量としては、特に制限はなく、目的に応じて適宜選択することができるが、0.5質量%〜20質量%が好ましく、1質量%〜5質量%がより好ましい。前記固形パルプの含有量が、0.5質量%未満であると、前記単細胞の微細藻類を回収することができないことがあり、20質量%を超えると、パルプ繊維分散性が低下し、微細藻類の回収率が低下することがある。
【0030】
前記紙パルプ層の水分含有量としては、特に制限はなく、目的に応じて適宜選択することができるが、85質量%〜99質量%が好ましく、85質量%〜95質量%がより好ましい。前記水分含有量が、85質量%未満であると、パルプ繊維分散性が低下し、微細藻類の回収率が低下することがあり、95質量%を超えると、微細藻類の回収率が低下することがある。
前記水分含有量は、例えば、紙パルプ層全体を秤量した後、紙パルプ層を乾燥させて絶乾質量を秤量して、その差分を水分とすることで測定することができる。
【0031】
前記紙パルプ層の水分含有量を調整する方法としては、特に制限はなく、目的に応じて適宜選択することができ、例えば、紙パルプ層の形成時に前記フィルター上に前記パルプ懸濁液を添加して濾過した後、吸引時間及び吸引圧を調整する方法などが挙げられる。
前記吸引時間としては、特に制限はなく、紙パルプ層の水分含有量などに応じて適宜選択することができるが、1分間〜10分間が好ましく、2分間〜5分間がより好ましい。
前記吸引圧としては、特に制限はなく、紙パルプ層の水分含有量などに応じて適宜選択することができるが、30kPa〜500kPaが好ましく、50kPa〜200kPaがより好ましい。
【0032】
<ゼータ電位調整工程>
前記ゼータ電位調整工程は、少なくとも微細藻類を含む微細藻類懸濁液のゼータ電位を調整する工程である。
【0033】
<<微細藻類懸濁液>>
前記微細藻類懸濁液は、少なくとも微細藻類を含み、好ましくは、多価カチオン及びアニオン性基を有する高分子化合物を含み、必要に応じて、更にその他の成分を含む。
【0034】
−微細藻類−
本発明において微細藻類とは、陸上動物と同様に酸素発生を伴う光合成機能を有する単細胞、若しくは、単細胞に近い多細胞の藻類であり、器官として未分化の細胞を有する顕微鏡下の識別を要する小さな個体(1ミクロン〜数十ミクロン)の藻の総称である。前記微細藻類は、クロロフィル、フィコピリン、カロテノイド等の光合成色素を含有していることを特徴としている。
前記微細藻類の分類群としては、例えば、主に淡水に生息する車軸藻、緑藻、珪藻、黄緑藻、真正眼点藻、紅藻、藍藻や、主に海水に存在する緑藻、褐藻、珪藻、ハプト藻などが存在し、いずれも光合成機能を有するため、植物プランクトンとも称される。これらは、1種単独で使用してもよく、2種以上を併用してもよい。
前記微細藻類細胞内成分の抽出方法は、前記単細胞の藻類であっても効率よく回収できる点で有利である。
【0035】
以下に、前記微細藻類の具体的な例を挙げる。
藍藻綱(Cyanophyceae)としては、例えば、クロオコックス目(Cyroococcaceae)の、シネコキスチス属(Synechocystis)、シネココックス属(Synechococcus)、ダクチロコッコプシス属(Dactylococcopsis)、テトラペジア属(Tetrapedia)、クロオコックス属(Chroococcus)、ミクロキスチス属(Microcystis)、アファノカプサ属(Aphanocapsa)、グロエオカプサ属(Gloeocapsa)、アファノテーケ属(Aphanothece)、ラブドゲルマ属(Rhabdoderma)、グロエオケーテ属(Gloeothece)、プソイドホロペジア属(Pseudoholopedia)、メリスモペジウム属(Merismopedium)、ユウカプシス属(Eucapsis)、ゴンフェスフェリア属(Gomphosphaeria)、コエロスフェリウム属(Coelosphaerium)、アイノゴノメ属(Merismopedia);カマエシフォン目(Chamaesiphonales)の、カマエシフォン属(Chamaesiphon);プレウロカプサ目(Pleurocapsales)のミクソサルシナ属(Myxosarcina)、ヒドロコックス属(Hydrococcus)、クセノコックス属(Xenococcus)、プレウロカプサ属(Pleurocapsa);ネンジュモ目(Nostocales)の、ノストック属(Nostoc)、ホモエオスリックス属(Homoeothrix)、ジコスリックス属(Dichothrix)、カロスリックス属(Calothrix)、グロエオトリキア属(Gloeotrichia)、ヒゲモ属(Rivularia)、イサクチス属(Isactis)、プレクトネマ属(Plectonema)、トリポスリックス属(Tolypothrix)、スキトネマ属(Scytonema)、スキトネマトプシス属(Scytonematopsis)、ヒドロコリーネ属(Hydrocoryne)、ミクロケト属(Microchaete)、ネンジュモ属(Nostoc)、アファニゾメノン属(Aphanizomenon)、アナベナ属(Anabaena)、アウロシラ属(Aulosira)、ノジュラリア属(Nodularia)、アナベノプシス属(Anabaenopsis)、キリンドロスペルマム属(Cylindrospermum);ユレモ目(Oscillatoriales)の、ボルジア属(Borzja)、スピルリナ属(Spirulina)、ユレモ属(Oscillatoria)、フォルミジウム属(Phormidium)、リングピア属(Lyngbya)、シンプロカ属(Symploca)、ムラサキクダモ属(Porphyrosiphon)、ダシグロエア属(Dasygloea)、シゾスリックス属(Schizothrix)、ミクロコレウス属(Microcoleus);スチゴネマ目(Stigonematales)の、フィツシェレラ属(Fischerella)、スチゴネマ属(Stigonema)、タルポフィラ属(Thalpophila)、ハパロシフォン属(Hapalosiphon)、ウエステレロプシス属(Westiellopsis)、ノストコプシス属(Nostochopsis)、イデユアイミドリ属(Mastigocladus)などが挙げられる。
【0036】
灰青藻綱(Glaucophyceae)としては、例えば、グラウコスフェラ目(Glaucosphaerales)のスクヤペルタ属(Skujapelta)などが挙げられる。
【0037】
紅藻綱(Rhodophyceae)としては、例えば、チノリモ目(Porphyridiales)の、ポルフィリディウム属(Porphyridium)、チノリモ属(Porphyridium)、イデユコゴメ属(Cyanidiaceae)、ロドソルス属(Rhodosorus)、ロデラ属(Rhodella)、ディクソニエラ属(Dixoniella)などが挙げられる。
【0038】
黄色鞭毛藻綱(Chrysophyceae)としては、例えば、リゾクリシス目(Rhizochrysidales)のラギニオン属(Lagynion);ヒカリモ目(Chromulinales)の、クリソスフェラ属(Chrysosphaera)、ヒカリモ属(Chromulina)、ヘテロクロムリナ属(Heterochromulina)、クリソコックス属(Chrysococcus)、コドモナス属(Codomonas)、クリソカプサ属(Chrysocapsa)、ミズオ属(Hydrurus);オクロモナス目(Ochromonadales)の、オクロモナス属(Ochromonas)0、ディディモクリシス属(Didymochrysis)、シンクリプタ属(Synchrypta)、ウログレナ属(Uroglena)、ウログレノプシス属(Uroglenopsis)、シノブリオン属(Dinobryon)、ヒアロブリオン属(Hyabryon)、マロモナス属(Mallomonas)、シヌラ属(Synura)、クリソスフェラ属(Chysosphaerella)、パラフィソモナス属(Paraphysomonas);ディクチオカ目(Dictyochales)のディクチオカ属(Dictyocha)などが挙げられる。
【0039】
黄緑色藻綱(Xanthophyceae)としては、例えば、リゾクロリス目(Rhizochloridales)のスチピトコックス属(Stipitococcus);ミショコックス目(Mischococcales)の、ボツリジオプシス属(Botrydiopsis)、クロロクロステル属(Chlorocloster)、エリプソイドン属(E1lipsoidon)、モノドス属(Monodus)、クロロボツリス属(Chiorobotrys)、ミショコックス属(Mischococcus)、カラシオプシス属(Characiopsis)、オフィオキチウム属(Ophiocytium)などが挙げられる。
【0040】
渦鞭毛藻綱(Dinophyceae)としては、例えば、ギムノジニウム目(Gymnodiniales)の、アンフィジニウム属(Amphidinium)、ギムノジニウム属(Gymnodinium)、ギロジニウム属(Gyrodinium);ペリジニウム目(Peridiniales)の、へミジニウム属(Hemidinium)、グレンジニウム属(Glenodinium)、ジプロプサリス属(Diplopsalis)、ペリジニウム属(Peridinium)、ケラチウム属(Ceratium)、ヘテロカプサ属(Heterocapsa)、プロトペリジニウム属(Protoperidinium);ジノコックス目(Dinococcales)の、チストジニウム属(Cystodinium)、テトラジニウム属(Tetradinium);プロロケントルム目(Prorocentrles)のプロロケントルム属(Prorocentrum);ディノフィシス目(Dinophysiales)の、ディノフィシス属(Dinophysis)、オウニトケルクス属(Ornithocercus)などが挙げられる。
【0041】
褐色鞭毛藻綱(Cryptophyceae)としては、例えば、クリプトモナス目(Cryptomonadales)の、クリプトモナス属(Cryptomonas)、キロモナス属(Chilomonas)、へミセルミス属(Hemiselmis)、ロドモナス属(Rhodomonas)などが挙げられる。
【0042】
ラフィド藻綱(Raphidophyceae)としては、例えば、ラフィドモナス目(Raphidomonadales)の、バクオラリア属(Vacuolaria)、ゴニオストマム属(Gonyostomum)、メロトリキア属(Merotrichia)、シャットネラ属(Chattonella)などが挙げられる。
【0043】
ミドリムシ藻綱(Euglenophyceae)としては、例えば、ミドリムシ目(Euglenales)の、ミドリムシ属(Euglena)、レポシンクリス属(Lepocinclis)、ファクス属(Phacus)アスタシア属(Astasia)、キクリジオプシス属(Cyclidiopsis)、トラケロモナス属(Trachelomonas)、ジスチグマ属(Distigma)、ペラネマ属(Peranema)、アニソネマ属(Anisonema);コラキウム目(Colaciales)のコラキウム属(Colacium);ユートレプティア目(Eutreptiales)のユートレプティア属(Eutreptia)などが挙げられる。
【0044】
緑藻綱(Chlorophyceae)としては、例えば、オオヒゲマワリ目(Volvocales)の、へマトコックス属(Haematococcus)、カルテリア属(Carteria)、クロロゴニウム属(Chlorogonium)、ロボモナス属(Lobomonas)、クラミドモナス属(Chlamydomonas)、デュナリエラ属(Dunaliella)、ゴニウム属(Gonium)、プレオドリナ属(Pleodorina)、オオヒゲマワリ属(Volvox)、パンドリナ属(Pandorina)、ユウドリナ属(Eudorina);ヨツメモ目(Tetrasporales)の、アステロコックス属(Asterococcus)、パルモジクチオン属(Palmodictyon)、グロエオキスチス属(Gloeocystis)、アスケナシエラ属(Askenasyella)、スファエロキスチス属(Sphaerocystis)、ヨツメモ属(Tetraspora);ヒビミドロ目(Ulotrichales)のスチココックス属(Stichococcus);クロロコックム目(Chlorococcales)の、デスマトラクツム属(Desmatractum)、ブラクテアコックス属(Bracteacoccus)、クロロコックム属(Chlorococcum)、ゴレンキニア属(Golenkinia)、キルヒネリエラ属(Kirchneriella)、アンキストロデスムス属(Ankistrodesmus)、クロレラ属(Chlorella)、セネデスムス属(Scenedesmus);ホシミドロ目(Zygnematales)の、ネトリウム属(Netrium)、ペニウム属(Penium)、ミカヅキモ属(Closterium)、コウガイチリモ属(Pleurotaenium)、ツヅミモ属(Cosmarium)などが挙げられる。
【0045】
プラシノ藻綱(Prasinophyceae)としては、例えば、マミエラ目(Mamiellales)の、プラシノコックス属(Prasinococcus)、ミクロモナス属(Micromonas);プセウドスコウルフィエルディア目(Pseudoscourfieldiales)のネフロセルミス属(Nephroselmis);ピラミモナス目(Pyramimonadales)の、プテロスペルマ属(Pterosperma)、ハロスファエラ属(Halosphaera)、ピラミモナス属(Pyramimonas);クロロデンドロン目(Chlorodendrales)のテトラセルミス属(Tetraselmis)などが挙げられる。
【0046】
珪藻綱(Bacillariophyceae)としては、例えば、円心目(Centrales)の、キクロテラ属(Cyclotella)、デトニューラ属(Detonula)、ミニディスクス属(Minidiscus)、タラシオシーラ属(Thalassiosira)、キートケロス属(Chaetoceros);羽状目(Pennales)のディメレグラムマ属(Dimeregramma)、ナビキュラ属(Navicula)、ニッチア属(Notzschia)などが挙げられる。
【0047】
真正眼点藻綱(Eustigmatophyceae)としては、例えば、ユースティグマトス目(Eustigmatales)のナンノクロロプシス属(Nannochloropsis)などが挙げられる。
【0048】
ハプト藻綱(Haptophyceae)としては、例えば、イソクリシス目(Isochrysidales)の、プリュウロクリシス属(Pleurochrisis)、エミリアニア属(Emiliniania)、プレウロクリシス属(Pleurochrysis)、ゲフィロカプサ属(Gephyrocapsa)、イソクリシス属(Isochrysis)、クリソティラ属(Chrysotyla)、ヒメノモナス属(Hymenomonas)、オクロスファエラ属(Ochrosphaera);プリムネシウム目(Prymnesidales)の、プリムネシウム属(Prymnesium)、クリソクロムリナ属(Chysochromulina)、フェオキィスティス属(Phaeocystis);円石藻目(Coccosphaerales)の、カリプトロスファエラ属(Calyptrosphaera)、ブラルードスファエラ属(Braarudsphaera)、アノプロソレニア属(Anoplosolenia)、カルキオソレニア属(Calciosolenia)、カルキディスクス属(Calcidicus)、コッコリトゥス属(Coccolithus)、オオリトトゥス属(Oolithotus)、ウンビリコスファエラ属(Umbilicosphaera)、へリコスファエラ属(Helicosphaera)、ポンスファエラ属(Pontosphaera)、アカントイカ属(Acanthoica)、アルギロスファエラ属(Algirosphaera)、ディスコスファエラ属(Discosphaera)、ラブドスファエラ属(Rhabdosphaera)、カネオスファエラ属(Caneosphaera)、コロノスファエラ属(Coronosphaera)、シラコスファエラ属(Syracosphaera)、ドイツランディア属(Deutschlandia)、ウンベロスフェラ属(Umbellosphaera)、ミカエルサルシア属(Michaelsarsia)、オフィアスター属(Ophiaster);パブロバ目(Pavlovales)のパブロバ属(Pavlova)などが挙げられる。
【0049】
ユーグレナ藻綱(Euglenophyceae)としては、例えば、ユーグレナ目(Euglenales)のユーグレナ属(Euglena)などが挙げられる。
【0050】
前記微細藻類を入手する方法としては、特に制限はなく、目的に応じて適宜選択することができ、例えば、自然界より採取する方法、市販品を用いる方法、保存機関や寄託機関から入手する方法などが挙げられる。
【0051】
前記微細藻類を培養する方法としては、特に制限はなく、目的に応じて適宜選択することができ、例えば、振盪培養、静置培養などが挙げられる。これらの中でも、前記微細藻類は好気性であることから振盪培養が好ましい。
【0052】
前記微細藻類の培養に用いる培地としては、藻類を培養できるものであれば、特に制限はなく、目的に応じて適宜選択することができ、例えば、無機物から構成される培地などが挙げられる。具体的な例としては、後述する実施例に記載の培地などを用いることができる。また、前記培地は、有機物を含んでいてもよい。
前記培地のpHとしては、特に制限はなく、微細藻類の種類などに応じて適宜選択することができる。
【0053】
前記培養の温度、時間、炭酸ガス濃度、及び照度としても、特に制限はなく、微細藻類の種類などに応じて適宜選択することができる。
【0054】
前記微細藻類懸濁液における前記微細藻類の絶乾質量を測定する方法としては、特に制限はなく、目的に応じて適宜選択することができ、例えば、前記微細藻類懸濁液を乾燥させて秤量する方法などが挙げられる。
前記乾燥させる方法としては、特に制限はなく、目的に応じて適宜選択することができ、例えば、凍結乾燥法、噴霧乾燥法、加熱乾燥法、対流乾燥法などが挙げられる。これらの中でも、前記乾燥方法は、加熱乾燥法が好ましく、オーブンを用いることがより好ましい。
前記オーブンで乾燥させる場合、その温度及び時間としては、特に制限はなく、目的に応じて適宜選択することができるが、80℃〜120℃で2時間〜12時間乾燥させることが好ましい。
なお、前記絶乾質量を測定する際に、前記微細藻類懸濁液は、予め濾過することが、培養液に溶解した各種塩分などを除去できる点で好ましい。
【0055】
−多価カチオン−
前記微細藻類懸濁液は、更に多価カチオンを含むことが、前記微細藻類を好適に凝集させることができ、前記微細藻類の回収率が向上する点で好ましい。
前記多価カチオンとしては、特に制限はなく、目的に応じて適宜選択することができ、例えば、Al3+、Fe3+、Fe2+等の金属イオンなどが挙げられる。
前記微細藻類懸濁液において、前記金属イオンを発生させる方法としては、特に制限はなく、目的に応じて適宜選択することができ、例えば、前記微細藻類懸濁液に、硫酸アルミニウム水溶液、ポリ塩化アルミニウム水溶液、塩化第二鉄水溶液、ポリ硫酸第二鉄水溶液、硫酸第一鉄水溶液等の金属を含む水溶液を添加する方法などが挙げられる。これらの中でも、前記水溶液は、硝酸アルミニウム水溶液が好ましい。また、例えば、ジメチルジアリルアンモニウムクロライド(DMDAA)、アルキルアミン・エピクロルヒドリン縮合物等の分子内に多数のカチオンを有する高分子電解質を添加する方法なども挙げられる。これらは、1種単独で使用してもよく、2種以上を併用してもよい。
【0056】
前記微細藻類懸濁液における、前記金属を含む水溶液又は前記高分子電解質の含有量としては、特に制限はなく、目的に応じて適宜選択することができるが、前記微細藻類懸濁液中の前記微細藻類の絶乾質量100部に対して、0.1質量部〜3.5質量部が好ましく、1質量部〜2質量部がより好ましい。前記金属を含む水溶液又は前記高分子電解質の含有量が、0.1質量部未満又は3.5質量部超えると、前記微細藻類の回収率が低下することがある。
【0057】
−アニオン性基を有する高分子化合物−
前記微細藻類懸濁液は、更にアニオン性基を有する高分子化合物を含むことが、前記微細藻類を好適に凝集させることができ、前記微細藻類の回収率が向上する点で好ましい。
前記アニオン性基を有する高分子化合物としては、特に制限はなく、目的に応じて適宜選択することができ、例えば、ポリアクリル酸ナトリウム(PMNA)、ポリアクリルアミド(PAM)、カルボキシメチルセルロース及びそのナトリウム塩、カルボキシ変性ポリビニルアルコールなどが挙げられる。これらは、1種単独で使用してもよく、2種以上を併用してもよい。これらの中でも、前記アニオン性基を有する高分子化合物は、ポリアクリル酸ナトリウム(PMNA)、ポリアクリルアミド(PAM)が好ましい。
【0058】
前記微細藻類懸濁液における、前記アニオン性基を有する高分子化合物の含有量としては、特に制限はなく、目的に応じて適宜選択することができるが、前記微細藻類懸濁液中の前記微細藻類の絶乾質量100部に対して、0.05質量部〜0.5質量部が好ましく、0.05質量部〜0.1質量部がより好ましい。前記アニオン性基を有する高分子化合物の含有量が、0.05質量部未満又は0.5質量部を超えると、前記微細藻類の回収率が低下することがある。
【0059】
−その他の成分−
前記微細藻類懸濁液における前記その他の成分としては、特に制限はなく、目的に応じて適宜選択することができ、例えば、水、前記多価カチオン及び前記アニオン性基を有する高分子化合物を除くゼータ電位調整剤などが挙げられる。
前記ゼータ電位調整剤としては、特に制限はなく、目的に応じて適宜選択することができ、例えば、カルボキシメチルセルロース及びそのナトリウム塩、カルボキシ変性ポリビニルアルコールなどが挙げられる。これらは、1種単独で使用してもよく、2種以上を併用してもよい。
前記微細藻類懸濁液における前記その他の成分の含有量としては、特に制限はなく、目的に応じて適宜選択することができる。
【0060】
<<ゼータ電位の調整>>
前記微細藻類懸濁液のゼータ電位は、−15mV〜+15mVに調整されるが、−10mV〜+10mVに調整されることが好ましく、−5mV〜+5mVに調整されることがより好ましい。前記ゼータ電位が、−15mV未満又は+15mVを超えると、前記微細藻類の回収率が低下することがある。
【0061】
前記ゼータ電位を調整する方法としては、特に制限はなく、目的に応じて適宜選択することができるが、前記多価カチオンやアニオン性基を有する高分子化合物を前記微細藻類懸濁液に添加し、これらの添加量などによって調整する方法が好ましい。
【0062】
前記ゼータ電位を測定する方法としては、特に制限はなく、目的に応じて適宜選択することができ、例えば、公知のゼータ電位測定装置を用いて測定する方法などが挙げられる。前記ゼータ電位測定装置の具体的な例としては、ゼータ電位測定装置 ZEECOM ZC2000(株式会社マイクロテック・ニチオン社製)などが挙げられる。
【0063】
<回収工程>
前記回収工程は、前記紙パルプ層に前記ゼータ電位を所望の値に調整した微細藻類懸濁液を吐出して前記微細藻類を回収する工程である。なお、本発明において、回収とは、前記紙パルプ層に前記微細藻類が捕捉されることをいう。以下、微細藻類を回収した紙パルプ層を、「微細藻類含有紙パルプシート」と称することがある。
【0064】
前記吐出方法としては、前記フィルター上に形成した前記紙パルプ層に前記微細藻類懸濁液を吐出することができれば、特に制限はなく、目的に応じて適宜選択することができ、例えば、紙パルプ層上に前記微細藻類懸濁液を添加して濾過した後、吸引する方法などが挙げられる。
前記吸引時間としては、特に制限はなく、紙パルプ層の水分含有量などに応じて適宜選択することができるが、1分間〜10分間が好ましく、2分間〜5分間がより好ましい。
前記吸引圧としては、特に制限はなく、紙パルプ層の水分含有量などに応じて適宜選択することができるが、30kPa〜500kPaが好ましく、50kPa〜200kPaがより好ましい。
これにより、前記微細藻類懸濁液が濾過され、前記微細藻類懸濁液中の液体成分と、細胞とを好適に分離することができ、前記紙パルプ層に前記微細藻類を回収することができる。
【0065】
前記回収工程において、前記微細藻類懸濁液を添加する量としては、特に制限はなく、目的に応じて適宜選択することができるが、前記紙パルプ層における固形パルプの含有量100質量部に対して、前記微細藻類の絶乾質量で、400質量部以下が好ましく、300質量部以下がより好ましい。前記添加量が、400質量部を超えると、前記紙パルプ層に詰まりが生じ、前記微細藻類を効率よく回収できないことがある。
【0066】
前記微細藻類の回収率は、以下のように算出することができる。
前記回収工程により得られた、微細藻類含有紙パルプシートを乾燥させた後に秤量する(以下、「微細藻類含有紙パルプシート乾燥質量」と称することがある。)。一方、前記微細藻類懸濁液を添加していない紙パルプ層も同様の方法で乾燥後に秤量する(以下、「紙パルプシート乾燥質量」と称することがある。)。これらの値を用いて、次式により算出することができる。
回収率(%)=[(微細藻類含有紙パルプシート乾燥質量(g))−(紙パルプシート乾燥質量(g))]/[(微細藻類懸濁液添加量(L)×(微細藻類懸濁液中の細胞濃度(g/L))]×100
ここで、「微細藻類懸濁液中の細胞濃度」は、予め秤量したガラス繊維濾紙で、培養懸濁液を濾別後、乾燥させて、乾燥重量を測定し、濾別した培養液全量で除することにより算出することができる。
【0067】
<抽出工程>
前記抽出工程は、前記回収工程により得られた微細藻類含有紙パルプシートから、前記微細藻類の細胞内に産生される成分を抽出する工程である。
前記抽出には、前記微細藻類含有紙パルプシートをそのまま用いることが、操作が簡便であり、抽出効率がよい点で好ましいが、前記微細藻類含有紙パルプシートから前記微細藻類を分離してから用いてもよい。
【0068】
前記抽出方法としては、特に制限はなく、目的に応じて適宜選択することができ、例えば、前記微細藻類含有紙パルプシートに抽出溶剤を作用させて抽出する方法などが挙げられる。
前記抽出溶剤としては、特に制限はなく、前記微細藻類の種類などに応じて適宜選択することができる。
【0069】
以下に、前記微細藻類が、アスタキサンチンを産生するヘマトコッカス ラキュストリス(Haematococcus lacustris)、及び脂肪酸を産生するナンノクロロプシス オキュラータ(Nannochloropsis oculata)である場合を例に、前記抽出工程について詳細に説明するが、本発明の前記微細藻類の種類及びその細胞内成分としては、これらに限られるものではない。
【0070】
−アスタキサンチンの抽出−
例えば、前記微細藻類が、ヘマトコッカス ラキュストリスである場合、その細胞内にはアスタキサンチンが産生されることが知られている。
【0071】
前記微細藻類からアスタキサンチンを抽出する方法としては、特に制限はなく、公知の方法の中から適宜選択することができ、例えば、前記微細藻類含有紙パルプシートを抽出溶剤と接触させる方法などが挙げられる。
【0072】
抽出溶剤としては、特に制限はなく、目的に応じて適宜選択することができ、例えば、アセトン、エタノール、イソアミルアルコール、n−ヘキサンなどが挙げられる。これらは、1種単独で使用してもよく、2種以上を併用してもよい。これらの中でも、溶解度の点から抽出効率のよいアセトンあるいはアセトンを含む混合溶剤が好ましく、アセトン−クロロホルム混合溶剤がより好ましい。
【0073】
前記抽出に用いる前記抽出溶剤の量としては、用いる微細藻類の種類や量などに応じて適宜選択することができるが、微細藻類の絶乾質量100部に対して、200質量部〜2,000質量部が好ましい。
前記抽出温度及び時間としては、特に制限はなく、前記微細藻類の性状、用いる抽出溶剤の種類や量などに応じて適宜選択することができる。
【0074】
前記アスタキサンチンを含む抽出溶剤から、前記微細藻類など固形物を除去した後、抽出溶剤を除去すると、アスタキサンチンを含むカロテノイド類(色素)を得ることができる。この色素を常法にて精製処理することにより、アスタキサンチンを得ることができる。
抽出溶剤の除去方法としては、特に制限はなく、目的に応じて適宜選択することができ、例えば、温和な条件下でアスタキサンチンを含む抽出溶剤を加温処理し、抽出溶剤を蒸発する処理法などが挙げられる。
前記精製処理方法としても、特に制限はなく、目的に応じて適宜選択することができる。
【0075】
前記微細藻類から抽出されたアスタキサンチンは、食品添加剤、食材用色素、飼料用添加剤などとして有用である。具体的には、香粧品や医薬品、健康食品、魚類用飼料、家禽用飼料等として好適に使用可能である。また、アスタキサンチンを精製処理していないカロテノイド類を、上記用途に使用してもよい。更には、アスタキサンチンを細胞内に蓄積した微細藻類の破砕物を上記用途に使用してもよい。
【0076】
−脂肪酸の抽出−
例えば、前記微細藻類が、ナンノクロロプシス オキュラータである場合、その細胞内には脂肪酸が産生されることが知られている。
【0077】
前記微細藻類から脂肪酸を抽出する方法としては、特に制限はなく、公知の方法の中から適宜選択することができ、例えば、前記微細藻類含有紙パルプシートを抽出溶剤と接触させる方法などが挙げられる。
【0078】
抽出溶剤としては、特に制限はなく、目的に応じて適宜選択することができ、例えば、エーテル、ヘキサン、メタノール、エタノール、クロロホルム、ジクロロメタン、石油エーテル等の有機溶媒;前記有機溶媒と塩酸との混合溶媒などが挙げられる。これらは、1種単独で使用してもよく、2種以上を併用してもよい。これらの中でも、メタノールが好ましく、5質量%塩酸を含むメタノールがより好ましい。
【0079】
前記抽出に用いる前記抽出溶剤の量としては、用いる微細藻類の種類や量などに応じて適宜選択することができるが、微細藻類の絶乾質量100部に対して、200質量部〜2,000質量部が好ましい。
前記抽出温度及び時間としては、特に制限はなく、前記微細藻類の性状、用いる抽出溶剤の種類や量などに応じて適宜選択することができる。
【0080】
前記脂肪酸を含む抽出溶剤から、前記微細藻類など固形物を除去した後、抽出溶剤を除去すると、脂肪酸を得ることができる。
抽出溶剤の除去方法としては、特に制限はなく、目的に応じて適宜選択することができ、例えば、凍結乾燥法、噴霧乾燥法、加熱乾燥法、対流乾燥法などが挙げられる。
また、前記脂肪酸をクロマトグラフィー等の公知の方法で分離することにより、エイコサペンタエン酸を精製することもできる。
【0081】
前記微細藻類から抽出された脂肪酸は、メタノールとのエステル交換反応等の公知の方法でメチルエステル化することで、ディーゼルとして利用可能であり、また前記脂肪酸から分離精製したエイコサペンタエン酸は、香粧品や医薬品、健康食品、魚類用飼料、家禽用飼料等として好適に使用可能である。また、脂肪酸を細胞内に蓄積した微細藻類の破砕物を上記用途に使用してもよい。
【0082】
<その他の工程>
前記その他の工程としては、特に制限はなく、目的に応じて適宜選択することができ、例えば、フィルター除去工程、プレス工程、乾燥工程、厚みプロファイル調整工程、水分プロファイル調整工程などが挙げられる。
【0083】
<<フィルター除去工程>>
前記フィルター除去工程は、前記回収工程により得られた前記微細藻含有紙パルプシートから前記フィルターを取除く工程である。
前記フィルターを取り除く方法としては、特に制限はなく、目的に応じて適宜選択することができる。
【0084】
<<プレス工程>>
前記プレス工程は、前記微細藻類含有紙パルプシートをプレスして、該微細藻類含有紙パルプシートから搾水させる工程である。
前記プレスする方法としては、特に制限はなく、目的に応じて適宜選択することができ、例えば、毛布などの上に紙パルプシートを乗せて、ローラーの間を圧搾しながら通す方法などが挙げられる。
【0085】
<<乾燥工程>>
前記微細藻類含有紙パルプシートを乾燥させる方法としては、特に制限はなく、目的に応じて適宜選択することができ、例えば、凍結乾燥法、噴霧乾燥法、加熱乾燥法、対流乾燥法などが挙げられる。これらの中でも、前記乾燥方法は、加熱乾燥法が好ましく、オーブンを用いることがより好ましい。
前記オーブンで乾燥させる場合、その温度及び時間としては、特に制限はなく、目的に応じて適宜選択することができるが、80℃〜120℃で2時間〜12時間乾燥させることが好ましい。
【0086】
<<厚みプロファイル調整工程>>
前記厚みプロファイル調整工程は、前記微細藻含有紙パルプシートの厚みをプロファイルする工程である。
前記厚みを測定する方法としては、特に制限はなく、目的に応じて適宜選択することができ、例えば、β線厚さ計、X線厚さ計等で測定する方法などが挙げられる。
【0087】
<<水分プロファイル調整工程>>
前記水分プロファイル調整工程は、前記微細藻含有紙パルプシート、好ましくは、前記乾燥工程により乾燥された微細藻含有紙パルプシートの水分をプロファイルする工程である。
前記水分量を測定する方法としては、特に制限はなく、目的に応じて適宜選択することができ、例えば、近赤外線式水分計、マイクロ波式水分計等で測定する方法などが挙げられる。
前記微細藻含有紙パルプシートの水分をプロファイルすることで、例えば、前記乾燥工程における乾燥強度を微細藻含有紙パルプシートの幅方向で変え、微細藻含有紙パルプシートの幅方向の水分含有量を均一にすることができ、これにより前記微細藻含有紙パルプシートを抽出工程に用いるまで好適に搬送、保存でき、前記微細藻類細胞内成分の抽出効率が向上する点で好ましい。
【0088】
<用途>
前記微細藻類細胞内成分の抽出方法は、微細藻類が単細胞であっても、遠心分離などを行うことなく省エネルギーで、かつ簡便な操作により短時間で効率よく回収でき、更に前記微細藻類を回収した紙パルプシートをそのまま抽出に用いることで、効率よく簡便に前記微細藻類の細胞内に含まれる成分を抽出することができる点で有利である。
なお、前記微細藻類細胞内成分の抽出方法の回収工程で回収された前記微細藻類懸濁液中の細胞、及び該細胞から抽出された細胞内成分も、本発明の範囲に含まれる。
【実施例】
【0089】
以下に本発明の実施例を挙げて本発明を具体的に説明するが、本発明はこれらの実施例に何ら限定されるものではない。
【0090】
(実施例1〜8、比較例1〜4)
<パルプ懸濁液の調製>
広葉樹晒クラフトパルプ(LBKP)と、針葉樹晒クラフトパルプ(NBKP)との質量比(LBKP/NBKP)が80/20からなる木材パルプ(LBKP: Aracruz社製、NBKP:Harmac Pasific社製)を、ナイアガラビーター(熊谷理機工業株式会社製)で叩解し、カナディアンフリーネスが300mLのパルプ懸濁液を得た。
前記パルプ懸濁液をガラス繊維濾紙で濾別した後、ドライオーブンにて110℃で4時間乾燥させて秤量することにより固形パルプ分の含有量を求めたところ、15g/Lであった。
【0091】
<紙パルプ層の形成>
丸型シートマシーン(熊谷理機工業株式会社製)に、2.5重織プラスチックワイヤー(LL−40E、日本フイルコン株式会社製)を貼付したワイヤーを設置して、パルプ懸濁液を添加し、固形パルプ分の絶乾質量が、表1に示す坪量となるように、吸引時間及び吸引圧を調整することで、紙層水分を調整した。なお、坪量を5g/m2にする場合は、50kPaにて2分間、10g/m2にする場合は、50kPaにて3分間、50g/m2にする場合は100kPaにて3分間吸引した。
【0092】
<ヘマトコッカス ラキュストリスの培養>
ヘマトコッカス ラキュストリス(Haematococcus lacustris:NIES−2164)を細胞濃度が0.05gになるようにSorokin−Krauss培地 1Lに接種し、2L容のガラス製扁平フラスコに入れ、25℃、二酸化炭素濃度5%とした空気を通気して振盪培養した。通気量は、100mL/分間とした。培養は、植物育成用蛍光燈(株式会社チヨダサイエンス製)を光源として照度を5,000ルクスに設定し、連続光照射下で行った。細胞濃度が、1.0g/L以上に達したところで培養を止めた(14日間)。
前記Sorokin−Krauss培地は、蒸留水1,000mLに対して、硝酸カリウム 1.25g/L、硫酸マグネシウム七水和物 1.0g/L、リン酸二水素カリウム 1.25g/L、塩化カルシウム 84mg/L、及び硫酸鉄七水和物 50mg/Lを添加した。次いで、ほう酸 2.86g/L、塩化マンガン四水和物 1.81g/L、硫酸亜鉛七水和物 22mg/L、硫酸銅五水和物 79mg/L、塩化コバルト(II)六水和物 40mg/L、及びモリブデン酸ナトリウム二水和物 21mg/Lを含有する微量元素混合溶液1mLを添加した後、pHを6.8に調整した。
本培養後、光源を植物育成用蛍光燈から、ハロゲン光源(林時計工業株式会社製)に代えて、照度を30,000ルクスに設定し、3日間、連続照射下で、細胞のシスト化を行った。
【0093】
<微細藻類のゼータ電位の調整>
前記培養後のヘマトコッカス ラキュストリスの培養液を、ガラス繊維濾紙(WhatmanグレードGF/D)用いて濾過した後、ドライオーブンにて110℃で4時間乾燥させて秤量することにより、ヘマトコッカス ラキュストリス培養液中のヘマトコッカス ラキュストリスの絶乾質量を測定した。この測定値より、前記培養液中のヘマトコッカス ラキュストリスの細胞濃度を算出したところ、1g/Lであった。
ヘマトコッカス ラキュストリスの乾燥質量100部に対して、表1に示す割合で、硫酸アルミニウム水溶液又はジメチルジアリルアンモニウムクロライド(DMDAA)を添加し、スターラー250rpmで1分間攪拌した。次いで、ポリアクリルアミド(PAM)又はポリアクリル酸ナトリウム(PMNA)を、ヘマトコッカス ラキュストリスの乾燥質量100部に対して、表1に示す割合で添加し、スターラー250rpmで1分間攪拌し、微細藻類懸濁液を調製した。
【0094】
<ゼータ電位の測定>
微細藻類懸濁液のゼータ電位(Zp)を、ゼータ電位測定装置(ZEECOM ZC2000、株式会社マイクロテック・ニチオン社製)により、定法に従い測定した。結果を表1に示す。
【0095】
<回収方法>
前記微細藻類懸濁液を、丸型シートマシーンのポンプで送液し、該丸型シートマシーンの吐出箱より吐出させ、前記紙パルプ層に添加し、微細藻類懸濁液を濾過することにより、ヘマトコッカス ラキュストリスを回収したヘマトコッカス ラキュストリス含有紙パルプシートを得た。微細藻類懸濁液の添加量としては、紙パルプ層の固形パルプ分100質量部に対して、表1に示す割合で添加した。
【0096】
(実施例9〜12、比較例5〜6)
実施例1〜8及び比較例1〜4において、ヘマトコッカス ラキュストリスに代えて、下記方法で培養したナンノクロロプシス オキュラータを用いたこと以外は、実施例1〜8及び比較例1〜4と同様の方法で、パルプ懸濁液の調製、紙パルプ層の形成、微細藻類のゼータ電位の調整、ゼータ電位の測定、及び紙パルプ層への微細藻類の回収を行った。
【0097】
<ナンノクロロプシス オキュラータの培養>
ナンノクロロプシス オキュラータ(Nannochloropsis oculata:NIES−2146)を細胞濃度が0.05gになるようにGuillard F培地 1Lに接種し、2L容のガラス製扁平フラスコに入れ、25℃、二酸化炭素濃度5%とした空気を通気して振盪培養した。通気量は、100mL/分間とした。培養は、植物育成用蛍光燈(株式会社チヨダサイエンス製)を光源として照度を2,000ルクスに設定し、連続光照射下で行った。細胞濃度が、1.0g/L以上に達したところで培養を止めた(8日間)。
前記Guillard F培地は、海水1,000mLに対して、硝酸ナトリウム 0.15g/L、リン酸二水素ナトリウム 0.01g/L、珪酸ナトリウム九水和物 0.06g/L、 Fe−EDTA 0.0098g/L、塩化マンガン四水和物 36μg/L、硫酸銅五水和物 19.6μg/L、硫酸亜鉛七水和物 44μg/L、塩化コバルト(II)六水和物 2μg/L、モリブデン酸ナトリウム二水和物 12.6μg/L、ビタミンB12 1.0μg/L、ビオチン 1.0μg/L、及びチアミン塩酸塩 0.2mg/Lを添加した後、pHを8に調整した。
前記培養液中のナンノクロロプシス オキュラータの細胞濃度を、ヘマトコッカス ラキュストリスと同様の方法で測定した結果、1g/Lであった。
【0098】
<微細藻類回収率の評価>
実施例1〜12及び比較例1〜6において、微細藻類懸濁液を濾過した後、得られた微細藻類含有紙パルプシートを、ドライオーブンにて110℃で4時間乾燥させ、乾燥後の質量を測定した。また、微細藻類懸濁液を添加していない紙パルプ層を同様の操作で乾燥させ、乾燥後の質量を測定した。これらの値を用いて、次式により回収率を算出し、下記評価基準に基づき評価した。結果を表2に示す。なお、表1及び2において、「HL」は、ヘマトコッカス ラキュストリス、「NO」は、ナンノクロロプシス オキュラータを示す。
回収率(%)=[(微細藻類含有紙パルプシート乾燥質量(g))−(紙パルプシート乾燥質量(g))]/[(微細藻類懸濁液添加量(L)×(微細藻類懸濁液中の細胞濃度(g/L))]×100
[評価基準]
◎ :回収率が95%以上
○ :回収率が80%超え95%未満
△ :回収率が65%超え80%以下
× :回収率が65%以下
【0099】
(試験例1:ヘマトコッカス ラキュストリス産生アスタキサンチンの分析)
ヘマトコッカス ラキュストリスが細胞内に産生するアスタキサンチンは、従来、遠心分離後、フィルター濾過を行う2段階の分離工程を経た後、有機溶媒で抽出することにより得られていた(特開2004−129504号公報参照)。
そこで、前記実施例1〜8及び比較例1〜4の方法で得られた細胞から抽出したアスタキサンチンの量と、前記従来の方法である遠心分離及び濾過後に抽出して得たアスタキサンチンの量とをそれぞれ測定して比較した。
【0100】
<遠心分離により回収した微細藻類からのアスタキサンチンの抽出(従来法)>
実施例1〜8及び比較例1〜4と同様の方法で、ヘマトコッカス ラキュストリスを培養した。この培養液を10,000rpmで15分間遠心分離して上清を取除いて藻体を回収し、ヘマトコッカス ラキュストリス藻乾燥質量10部当り、100質量部のアセトンを使用して抽出することにより、アスタキサンチン含有脂質を回収した。
【0101】
<実施例1〜8及び比較例1〜4の方法で回収した微細藻類からのアスタキサンチンの抽出>
実施例1〜8及び比較例1〜4の、ヘマトコッカス ラキュストリス含有紙パルプシートは、そのまま10mm角に裁断した後、ヘマトコッカス ラキュストリス藻乾燥質量10部当り、100質量部のアセトンを使用して抽出し、アスタキサンチン含有脂質を回収した。
【0102】
<アスタキサンチン濃度の測定>
回収したアスタキサンチン含有脂質を含むアセトン溶液上清の吸光度(波長480nm及び750nm)を測定してカロテノイド濃度を求めた(“A Practical Handbook of Sea Water Analysis” p.185−206, Fisheries Research Board of Cnanada (1968))。ヘマトコッカス ラキュストリスのシスト細胞中に蓄積されるカロテノイドの殆どは、アスタキサンチンであることが知られていることから(J. Ferment. Bioeng. 71(5):335−339 (1991))、得られたカロテノイド濃度をアスタキサンチン濃度として表した。
実施例1〜8及び比較例1〜4の成分抽出率は、実施例1〜8及び比較例1〜4で得られたアスタキサンチン濃度値を、前記従来の方法(遠心分離)で得られた濃度値で除した百分率で示した。結果を表2に示す。
【0103】
(試験例2:ナンノクロロプシス オキュラータ産生エイコサペンタエン酸の分析)
ナンノクロロプシス オキュラータが細胞内に産生する脂肪酸は、従来、遠心分離後、フィルター濾過を行う2段階の分離工程を経た後、有機溶媒で抽出することにより得られていた。
そこで、前記実施例9〜12及び比較例5〜6の方法で得られた細胞から抽出した脂肪酸から分離したエイコサペンタエン酸の量、及び前記従来の方法である遠心分離及び濾過後に抽出して得た脂肪酸から分離したエイコサペンタエン酸の量をそれぞれ測定して比較した。
【0104】
<遠心分離により回収した微細藻類からの脂肪酸の抽出(従来法)>
実施例9〜12及び比較例5〜6と同様の方法で、ナンノクロロプシス オキュラータを培養した。この培養液を15,000rpmで30分間遠心分離して上清を取除いて藻体を回収し、ナンノクロロプシス オキュラータ藻乾燥質量1部当たり、10質量部の5質量%塩酸を含むメタノール溶媒を添加し、95℃で3時間還流して、脂肪酸をエステル交換した後、ヘキサン溶媒で脂肪酸メチルエステルを抽出した。
【0105】
<実施例9〜12及び比較例5〜6の方法で回収した微細藻類からの脂肪酸の抽出>
実施例9〜12及び比較例5〜6の、ナンノクロロプシス オキュラータ含有紙パルプシートは、そのまま10mm角に裁断した後、ナンノクロロプシス オキュラータ藻乾燥 1部当たり、10質量部の5質量%塩酸を含むメタノール溶媒を添加し、95℃で3時間還流して、脂肪酸をエステル交換した後、ヘキサン溶媒で脂肪酸メチルエステルを抽出した。
【0106】
<エイコサペンタエン酸濃度の測定>
抽出した脂肪酸メチルエステルに含まれるエイコサペンタエン酸の濃度は、下記ガスクロマトグラフィー分析条件により定量した。
[ガスクロマトグラフィー測定条件]
装置 :Shimadzu GC−14A(株式会社島津製作所製)
検出器 :FID
カラム :DB−WAX(アジレント・テクノロジー社製)
キャリアーガス:ヘリウム
流速 :1mL/分間
カラム温度 :170℃〜210℃(1.5℃/分間)
内部標準物質 :トリコサン酸メチルエステル(SIGMA社製)
実施例9〜12及び比較例5〜6の成分抽出率は、実施例9〜12及び比較例5〜6で得られたエイコサペンタエン酸濃度値を、前記従来の方法(遠心分離)で得られた濃度値で除した百分率で示した。結果を表2に示す。
【0107】
【表1】

【0108】
【表2】

【0109】
表2より、前記実施例の方法で回収された微細藻類から従来法(遠心分離)と同等又はそれ以上の量のアスタキサンチン及びエイコサペンタエン酸を得ることができた。従来の遠心分離の方法では、操作の過程で微細藻類のロスが出ることがあったが、前記実施例の方法では、微細藻類含有紙パルプシートをそのまま抽出に用いるため、紙パルプ層に回収した微細藻類の全てから効率よく細胞内成分を抽出できることがわかった。更に、前記実施例の方法では、従来の方法より少ない工程で簡便であり、かつ省エネルギーで分離できることがわかった。
【産業上の利用可能性】
【0110】
前記微細藻類細胞内成分の抽出方法は、微細藻類が単細胞であっても、遠心分離などを行うことなく省エネルギーで、かつ簡便な操作により短時間で効率よく回収でき、更に前記微細藻類を回収した紙パルプシートをそのまま抽出に用いることで、効率よく簡便に前記微細藻類の細胞内に含まれる成分を抽出することができるため、石油資源の代替原料としてのバイオディーゼルの製造や、香粧品や医薬品、健康食品、魚類用飼料、家禽用飼料などに好適に利用可能である。
【符号の説明】
【0111】
1 フィルター
2 紙パルプ層
3 微細藻類懸濁液
【技術分野】
【0001】
本発明は、微細藻類細胞内成分の抽出方法に関する。
【背景技術】
【0002】
近年、石油の枯渇や二酸化炭素の増加による地球温暖化などが問題となっており、石油資源の代替原料としてバイオマスから産生されるバイオディーゼルが注目されている。バイオマス原料としては、菜種油、パーム油、オリーブ油、ひまわり油、大豆油等の植物油が利用されているが、これらの原料を用いたバイオディーゼルの生産量を増加させると、食料や飼料の供給に影響を及ぼすことが懸念される。そのため、これらの植物に代わる石油資源の代替原料として、微細藻類が注目されている。
【0003】
微細藻類は、単細胞を単位生命体とし、葉緑素(クロロフィル)を有し、光合成によって大気中の二酸化炭素を固定化し酸素を産生する。海洋だけでなく、湖、池、川等の淡水系にも繁殖し、その種類は10万種類におよぶ。微細藻類は、物質生産量が陸上植物と比較して多く、その種類によっては、陸上植物より光合成能力が高いものや、脂肪酸を蓄積するものなどがあるため、バイオディーゼルの生産を容易に行うことができる。また、微細藻類は、バイオディーゼルの原料として用いた場合であっても、食料や飼料と競合する問題がなく、植物と比較して単位面積当たりの生産性が高く、植物栽培に適さない土地でも利用でき、二酸化炭素固定への寄与率が高いなど、多くの利点を有する。
【0004】
更に、微細藻類が産生する成分としては、脂肪酸の他にも種々の生理活性物質を産生することが知られており、香粧品や医薬品、健康食品、魚類用飼料、家禽用飼料などへの応用が期待されている。例えば、ヘマトコッカス ラキュストリスは、アスタキサンチンを産生する。このアスタキサンチンは、ビタミンEの約1,000倍、β−カロテンの約40倍の抗酸化作用を有することが知られている。そのため、動脈硬化、糖尿病、炎症、皮膚の老化等の防止作用や、免疫賦活化、抗ストレス、美白などの種々の効果が期待されている。また、ナンノクロロプシス オキュラータは、脂肪酸を産生するが、この中でもエイコサペンタエン酸は、ガンの予防作用、中性脂肪やコレステロールの低減作用などが知られている。
【0005】
このような種々の機能を有する微細藻類を回収する方法としては、フィルター濾過する方法や、遠心分離による方法が知られている(例えば、非特許文献1参照)。
しかし、フィルター濾過では単細胞の微細藻類を回収することができず、糸状性や群体性等の限られた種類の微細藻類しか回収できないため、回収率が悪い点で問題であった。また、遠心分離を行うためにはエネルギーが必要となるため、省エネルギーの観点から好ましくない。
紙パルプに藻を添加して抄紙を行った藻マルチングシートも提案されているが、該マルチングシートにおけるクロレラの回収率は70%程度であり、その回収率は十分満足できるものではなかった(特許文献1参照)。
【0006】
したがって、微細藻類が単細胞であっても、遠心分離などを行うことなく省エネルギーで、かつ簡便な操作により短時間で効率よく微細藻類を回収でき、更に前記微細藻類が細胞内に産生する成分を効率よく簡便に抽出できる微細藻類細胞内成分の抽出方法が求められているのが現状である。
【先行技術文献】
【特許文献】
【0007】
【特許文献1】特開2000−346757号公報
【非特許文献】
【0008】
【非特許文献1】Molina Grima E., Biotechnol Adv, 2003, Jan;20(7−8), 491−515.
【発明の概要】
【発明が解決しようとする課題】
【0009】
本発明は、従来における前記諸問題を解決し、以下の目的を達成することを課題とする。即ち、本発明は、微細藻類が単細胞であっても、遠心分離などを行うことなく省エネルギーで、かつ簡便な操作により短時間で効率よく微細藻類を回収でき、更に前記微細藻類が細胞内に産生する成分を効率よく簡便に抽出できる微細藻類細胞内成分の抽出方法を提供することを目的とする。
【課題を解決するための手段】
【0010】
前記課題を解決するため、本発明者らは鋭意検討した結果、以下のような知見を得た。即ち、フィルター上に紙パルプ層を形成した後、前記紙パルプ層に、ゼータ電位を−15mV〜+15mVに調整した微細藻類懸濁液を吐出することにより、微細藻類が単細胞であっても、遠心分離などを行うことなく省エネルギーで、かつ簡便な操作により短時間で効率よく微細藻類を回収でき、更に、前記微細藻類を含有する紙パルプシートをそのまま抽出に用いることができるため、前記微細藻類が細胞内に産生する成分を効率よく簡便に抽出できることを知見し、本発明の完成に至った。
【0011】
本発明は、本発明者らによる前記知見に基づくものであり、前記課題を解決するための手段としては、以下の通りである。即ち、
<1> フィルター上に紙パルプ層を形成する紙パルプ層形成工程と、
少なくとも微細藻類を含む微細藻類懸濁液のゼータ電位を−15mV〜+15mVに調整するゼータ電位調整工程と、
前記紙パルプ層に前記ゼータ電位を調整した微細藻類懸濁液を吐出して前記微細藻類を回収する回収工程と、
前記回収工程により得られた微細藻類含有紙パルプシートから、前記微細藻類の細胞内に産生される成分を抽出する抽出工程と、
を含むことを特徴とする微細藻類細胞内成分の抽出方法である。
<2> 抽出工程が、微細藻類含有紙パルプシートと、抽出溶剤とを接触させて微細藻類の細胞内に産生される成分を抽出する工程である前記<1>に記載の微細藻類細胞内成分の抽出方法である。
<3> 紙パルプ層形成工程が、紙パルプ層における固形パルプ分の絶乾質量が10g/m2〜150g/m2の紙パルプ層を形成する工程である前記<1>から<2>のいずれかに記載の微細藻類細胞内成分の抽出方法である。
<4> 紙パルプ層形成工程が、紙パルプ層における固形パルプ分の含有量が0.5質量%〜20質量%の紙パルプ層を形成する工程である前記<1>から<3>のいずれかに記載の微細藻類細胞内成分の抽出方法である。
<5> ゼータ電位調整工程が、微細藻類懸濁液に多価カチオン及びアニオン性基を有する高分子化合物を添加することにより、前記微細藻類懸濁液のゼータ電位を調整する工程である前記<1>から<4>のいずれかに記載の微細藻類細胞内成分の抽出方法である。
<6> フィルターが、抄紙ワイヤーである前記<1>から<5>のいずれかに記載の微細藻類細胞内成分の抽出方法である。
<7> 微細藻類が、ヘマトコッカス ラキュストリス及びナンノクロロプシス オキュラータの少なくともいずれかである前記<1>から<6>のいずれかに記載の微細藻類細胞内成分の抽出方法である。
である。
<8> 前記<7>に記載の微細藻類細胞内成分の抽出方法により得られることを特徴とするアスタキサンチンである。
<9> 前記<7>に記載の微細藻類細胞内成分の抽出方法により得られることを特徴とするエイコサペンタエン酸である。
【発明の効果】
【0012】
本発明によれば、従来における前記諸問題を解決し、前記目的を達成することができ、微細藻類が単細胞であっても、遠心分離などを行うことなく省エネルギーで、かつ簡便な操作により短時間で効率よく微細藻類を回収でき、更に前記微細藻類が細胞内に産生する成分を効率よく簡便に抽出できる微細藻類細胞内成分の抽出方法を提供することができる。
【図面の簡単な説明】
【0013】
【図1】図1は、本発明の微細藻類細胞内成分の抽出方法の一例を示す概略図である。
【発明を実施するための形態】
【0014】
(微細藻類細胞内成分の抽出方法)
本発明の微細藻類細胞内成分の抽出方法は、紙パルプ層形成工程と、ゼータ電位調整工程と、回収工程と、抽出工程と、を少なくとも含み、必要に応じて更にその他の工程を含む。
【0015】
<紙パルプ層形成工程>
前記紙パルプ層形成工程は、フィルター上に紙パルプ層を形成する工程である。
【0016】
<<フィルター>>
前記フィルターとしては、特に制限はなく、目的に応じて適宜選択することができるが、抄紙ワイヤーが好ましい。前記抄紙ワイヤーとは、例えば、紙パルプ技術協会誌(2005年2月号168頁)に記載された、紙を漉く際に最初に紙層形成を担う用具である。
【0017】
前記フィルターの材質としては、特に制限はなく、目的に応じて適宜選択することができ、例えば、ポリエステル、ポリアミド、ポリプロピレン、ポリフッ化ビニリデン等のプラスチック、ステンレス、ブロンズなどが挙げられる。これらは、1種単独で使用してもよく、2種以上を併用してもよい。これらの中でも、前記材質は、荷重に対する伸びが少なく、剛性、形状安定性、耐疲労性、耐蝕性などが高い点で、プラスチックワイヤーが好ましい。
【0018】
前記フィルターの構造は、平織りであってもよく、重織であってもよいが、平織〜4.5重織が好ましく、濾水性の高さの観点から、平織〜2.5重織がより好ましい。
前記フィルターの篩目開きとしても、特に制限はなく、前記フィルターの構造などに応じて適宜選択することができるが、濾水性の高さの観点から、0.355mm(42メッシュ)〜0.038mm(400メッシュ)が好ましい。
【0019】
<<紙パルプ層>>
前記紙パルプ層は、後述するパルプ懸濁液により好適に形成することができる。
【0020】
−パルプ懸濁液−
前記パルプ懸濁液は、少なくともパルプを含み、必要に応じて、更にその他の成分を含む。
【0021】
−−パルプ−−
前記パルプの原料としては、特に制限はなく、目的に応じて適宜選択することができ、例えば、針葉樹や広葉樹等の木材、サトウキビバガス、草、藁、竹等の非木材などが挙げられる。これらは、1種単独で使用してもよく、2種以上を併用してもよい。
前記パルプを入手する方法としては、特に制限はなく、目的に応じて適宜選択することができ、例えば、前記パルプ原料から製造する方法、市販品を用いる方法などが挙げられる。
【0022】
前記パルプは、その製造方法から、メカニカルパルプ、サーモメカニカルパルプ、化学パルプの3種類に分けることができ、本発明における前記パルプは、これらのうちのいずれであってもよい。また、前記製造方法により得られたパルプに漂白処理を施したものであってもよい。
前記メカニカルパルプとは、物理的な力で前記パルプ原料を叩解することにより得られるパルプである。
前記サーモメカニカルパルプとは、前記パルプ原料を高温及び高圧条件下におき、リグニンを軟化させた状態で叩解することにより得られるパルプである。
前記化学パルプとは、前記パルプ原料に、亜硫酸ナトリウム、水酸化ナトリウム等の化学薬品で化学的な処理を施し、リグニン等の不要成分を除去後、叩解することにより得られるパルプである。
また、前記パルプは、前記パルプ原料から製造したバージンパルプであってもよく、古紙等から再生した再生パルプであってもよい。
【0023】
前記パルプのカナディアンフリーネスとしては、特に制限はなく、目的に応じて適宜選択することができるが、200mL〜500mLが好ましく、250mL〜450mLがより好ましい。前記カナディアンフリーネスが200mL未満であると、パルプ層自体の脱水不良となることがあり、500mLを超えると、前記微細藻類の回収率が低下することがある。
【0024】
前記パルプ懸濁液における固形パルプ分の含有量としては、前記紙パルプ層において所望のパルプ含有量に調整することができれば、特に制限はなく、目的に応じて適宜選択することができる。
【0025】
−−その他の成分−−
前記パルプ懸濁液における前記その他の成分としては、特に制限はなく、目的に応じて適宜選択することができ、例えば、水、乾燥紙力増強剤、湿潤紙力増強剤、撥水剤、濾水性向上剤、填量などが挙げられる。
前記紙パルプ層における前記その他の成分の含有量としては、特に制限はなく、目的に応じて適宜選択することができる。
【0026】
−紙パルプ層の形成方法−
前記紙パルプ層を形成する方法としては、特に制限はなく、公知の方法の中から適宜選択することができ、例えば、抄紙機に前記フィルターを設置し、前記フィルター上に前記パルプ懸濁液を添加して濾過することにより、前記フィルター上に前記パルプ層を堆積させて形成する方法などが挙げられる。
前記抄紙機としては、特に制限はなく、公知の装置の中から適宜選択することができ、例えば、丸型シートマシーン(例えば、熊谷理機工業株式会社製)、ダイナミックシートフォーマー、長網抄紙機、ツインワイヤ抄紙機、円網抄紙機、円網短網コンビネーション抄紙機などが挙げられる。
【0027】
前記紙パルプ層における固形パルプ分の絶乾質量としては、特に制限はなく、目的に応じて適宜選択することができるが、10g/m2〜150g/m2が好ましく、15g/m2〜50g/m2がより好ましい。前記絶乾質量が、10g/m2未満であると、単細胞の微細藻類を回収することができないことがあり、150g/m2を超えると、微細藻回収効果効率に特段な変化はなくパルプの過剰使用となることがある。
【0028】
前記パルプ懸濁液におけるパルプの絶乾質量を測定する方法としては、特に制限はなく、目的に応じて適宜選択することができ、例えば、前記紙パルプ層を乾燥させて秤量する方法などが挙げられる。
前記乾燥させる方法としては、特に制限はなく、目的に応じて適宜選択することができ、例えば、凍結乾燥法、噴霧乾燥法、加熱乾燥法、対流乾燥法などが挙げられる。
【0029】
前記紙パルプ層における固形パルプの含有量としては、特に制限はなく、目的に応じて適宜選択することができるが、0.5質量%〜20質量%が好ましく、1質量%〜5質量%がより好ましい。前記固形パルプの含有量が、0.5質量%未満であると、前記単細胞の微細藻類を回収することができないことがあり、20質量%を超えると、パルプ繊維分散性が低下し、微細藻類の回収率が低下することがある。
【0030】
前記紙パルプ層の水分含有量としては、特に制限はなく、目的に応じて適宜選択することができるが、85質量%〜99質量%が好ましく、85質量%〜95質量%がより好ましい。前記水分含有量が、85質量%未満であると、パルプ繊維分散性が低下し、微細藻類の回収率が低下することがあり、95質量%を超えると、微細藻類の回収率が低下することがある。
前記水分含有量は、例えば、紙パルプ層全体を秤量した後、紙パルプ層を乾燥させて絶乾質量を秤量して、その差分を水分とすることで測定することができる。
【0031】
前記紙パルプ層の水分含有量を調整する方法としては、特に制限はなく、目的に応じて適宜選択することができ、例えば、紙パルプ層の形成時に前記フィルター上に前記パルプ懸濁液を添加して濾過した後、吸引時間及び吸引圧を調整する方法などが挙げられる。
前記吸引時間としては、特に制限はなく、紙パルプ層の水分含有量などに応じて適宜選択することができるが、1分間〜10分間が好ましく、2分間〜5分間がより好ましい。
前記吸引圧としては、特に制限はなく、紙パルプ層の水分含有量などに応じて適宜選択することができるが、30kPa〜500kPaが好ましく、50kPa〜200kPaがより好ましい。
【0032】
<ゼータ電位調整工程>
前記ゼータ電位調整工程は、少なくとも微細藻類を含む微細藻類懸濁液のゼータ電位を調整する工程である。
【0033】
<<微細藻類懸濁液>>
前記微細藻類懸濁液は、少なくとも微細藻類を含み、好ましくは、多価カチオン及びアニオン性基を有する高分子化合物を含み、必要に応じて、更にその他の成分を含む。
【0034】
−微細藻類−
本発明において微細藻類とは、陸上動物と同様に酸素発生を伴う光合成機能を有する単細胞、若しくは、単細胞に近い多細胞の藻類であり、器官として未分化の細胞を有する顕微鏡下の識別を要する小さな個体(1ミクロン〜数十ミクロン)の藻の総称である。前記微細藻類は、クロロフィル、フィコピリン、カロテノイド等の光合成色素を含有していることを特徴としている。
前記微細藻類の分類群としては、例えば、主に淡水に生息する車軸藻、緑藻、珪藻、黄緑藻、真正眼点藻、紅藻、藍藻や、主に海水に存在する緑藻、褐藻、珪藻、ハプト藻などが存在し、いずれも光合成機能を有するため、植物プランクトンとも称される。これらは、1種単独で使用してもよく、2種以上を併用してもよい。
前記微細藻類細胞内成分の抽出方法は、前記単細胞の藻類であっても効率よく回収できる点で有利である。
【0035】
以下に、前記微細藻類の具体的な例を挙げる。
藍藻綱(Cyanophyceae)としては、例えば、クロオコックス目(Cyroococcaceae)の、シネコキスチス属(Synechocystis)、シネココックス属(Synechococcus)、ダクチロコッコプシス属(Dactylococcopsis)、テトラペジア属(Tetrapedia)、クロオコックス属(Chroococcus)、ミクロキスチス属(Microcystis)、アファノカプサ属(Aphanocapsa)、グロエオカプサ属(Gloeocapsa)、アファノテーケ属(Aphanothece)、ラブドゲルマ属(Rhabdoderma)、グロエオケーテ属(Gloeothece)、プソイドホロペジア属(Pseudoholopedia)、メリスモペジウム属(Merismopedium)、ユウカプシス属(Eucapsis)、ゴンフェスフェリア属(Gomphosphaeria)、コエロスフェリウム属(Coelosphaerium)、アイノゴノメ属(Merismopedia);カマエシフォン目(Chamaesiphonales)の、カマエシフォン属(Chamaesiphon);プレウロカプサ目(Pleurocapsales)のミクソサルシナ属(Myxosarcina)、ヒドロコックス属(Hydrococcus)、クセノコックス属(Xenococcus)、プレウロカプサ属(Pleurocapsa);ネンジュモ目(Nostocales)の、ノストック属(Nostoc)、ホモエオスリックス属(Homoeothrix)、ジコスリックス属(Dichothrix)、カロスリックス属(Calothrix)、グロエオトリキア属(Gloeotrichia)、ヒゲモ属(Rivularia)、イサクチス属(Isactis)、プレクトネマ属(Plectonema)、トリポスリックス属(Tolypothrix)、スキトネマ属(Scytonema)、スキトネマトプシス属(Scytonematopsis)、ヒドロコリーネ属(Hydrocoryne)、ミクロケト属(Microchaete)、ネンジュモ属(Nostoc)、アファニゾメノン属(Aphanizomenon)、アナベナ属(Anabaena)、アウロシラ属(Aulosira)、ノジュラリア属(Nodularia)、アナベノプシス属(Anabaenopsis)、キリンドロスペルマム属(Cylindrospermum);ユレモ目(Oscillatoriales)の、ボルジア属(Borzja)、スピルリナ属(Spirulina)、ユレモ属(Oscillatoria)、フォルミジウム属(Phormidium)、リングピア属(Lyngbya)、シンプロカ属(Symploca)、ムラサキクダモ属(Porphyrosiphon)、ダシグロエア属(Dasygloea)、シゾスリックス属(Schizothrix)、ミクロコレウス属(Microcoleus);スチゴネマ目(Stigonematales)の、フィツシェレラ属(Fischerella)、スチゴネマ属(Stigonema)、タルポフィラ属(Thalpophila)、ハパロシフォン属(Hapalosiphon)、ウエステレロプシス属(Westiellopsis)、ノストコプシス属(Nostochopsis)、イデユアイミドリ属(Mastigocladus)などが挙げられる。
【0036】
灰青藻綱(Glaucophyceae)としては、例えば、グラウコスフェラ目(Glaucosphaerales)のスクヤペルタ属(Skujapelta)などが挙げられる。
【0037】
紅藻綱(Rhodophyceae)としては、例えば、チノリモ目(Porphyridiales)の、ポルフィリディウム属(Porphyridium)、チノリモ属(Porphyridium)、イデユコゴメ属(Cyanidiaceae)、ロドソルス属(Rhodosorus)、ロデラ属(Rhodella)、ディクソニエラ属(Dixoniella)などが挙げられる。
【0038】
黄色鞭毛藻綱(Chrysophyceae)としては、例えば、リゾクリシス目(Rhizochrysidales)のラギニオン属(Lagynion);ヒカリモ目(Chromulinales)の、クリソスフェラ属(Chrysosphaera)、ヒカリモ属(Chromulina)、ヘテロクロムリナ属(Heterochromulina)、クリソコックス属(Chrysococcus)、コドモナス属(Codomonas)、クリソカプサ属(Chrysocapsa)、ミズオ属(Hydrurus);オクロモナス目(Ochromonadales)の、オクロモナス属(Ochromonas)0、ディディモクリシス属(Didymochrysis)、シンクリプタ属(Synchrypta)、ウログレナ属(Uroglena)、ウログレノプシス属(Uroglenopsis)、シノブリオン属(Dinobryon)、ヒアロブリオン属(Hyabryon)、マロモナス属(Mallomonas)、シヌラ属(Synura)、クリソスフェラ属(Chysosphaerella)、パラフィソモナス属(Paraphysomonas);ディクチオカ目(Dictyochales)のディクチオカ属(Dictyocha)などが挙げられる。
【0039】
黄緑色藻綱(Xanthophyceae)としては、例えば、リゾクロリス目(Rhizochloridales)のスチピトコックス属(Stipitococcus);ミショコックス目(Mischococcales)の、ボツリジオプシス属(Botrydiopsis)、クロロクロステル属(Chlorocloster)、エリプソイドン属(E1lipsoidon)、モノドス属(Monodus)、クロロボツリス属(Chiorobotrys)、ミショコックス属(Mischococcus)、カラシオプシス属(Characiopsis)、オフィオキチウム属(Ophiocytium)などが挙げられる。
【0040】
渦鞭毛藻綱(Dinophyceae)としては、例えば、ギムノジニウム目(Gymnodiniales)の、アンフィジニウム属(Amphidinium)、ギムノジニウム属(Gymnodinium)、ギロジニウム属(Gyrodinium);ペリジニウム目(Peridiniales)の、へミジニウム属(Hemidinium)、グレンジニウム属(Glenodinium)、ジプロプサリス属(Diplopsalis)、ペリジニウム属(Peridinium)、ケラチウム属(Ceratium)、ヘテロカプサ属(Heterocapsa)、プロトペリジニウム属(Protoperidinium);ジノコックス目(Dinococcales)の、チストジニウム属(Cystodinium)、テトラジニウム属(Tetradinium);プロロケントルム目(Prorocentrles)のプロロケントルム属(Prorocentrum);ディノフィシス目(Dinophysiales)の、ディノフィシス属(Dinophysis)、オウニトケルクス属(Ornithocercus)などが挙げられる。
【0041】
褐色鞭毛藻綱(Cryptophyceae)としては、例えば、クリプトモナス目(Cryptomonadales)の、クリプトモナス属(Cryptomonas)、キロモナス属(Chilomonas)、へミセルミス属(Hemiselmis)、ロドモナス属(Rhodomonas)などが挙げられる。
【0042】
ラフィド藻綱(Raphidophyceae)としては、例えば、ラフィドモナス目(Raphidomonadales)の、バクオラリア属(Vacuolaria)、ゴニオストマム属(Gonyostomum)、メロトリキア属(Merotrichia)、シャットネラ属(Chattonella)などが挙げられる。
【0043】
ミドリムシ藻綱(Euglenophyceae)としては、例えば、ミドリムシ目(Euglenales)の、ミドリムシ属(Euglena)、レポシンクリス属(Lepocinclis)、ファクス属(Phacus)アスタシア属(Astasia)、キクリジオプシス属(Cyclidiopsis)、トラケロモナス属(Trachelomonas)、ジスチグマ属(Distigma)、ペラネマ属(Peranema)、アニソネマ属(Anisonema);コラキウム目(Colaciales)のコラキウム属(Colacium);ユートレプティア目(Eutreptiales)のユートレプティア属(Eutreptia)などが挙げられる。
【0044】
緑藻綱(Chlorophyceae)としては、例えば、オオヒゲマワリ目(Volvocales)の、へマトコックス属(Haematococcus)、カルテリア属(Carteria)、クロロゴニウム属(Chlorogonium)、ロボモナス属(Lobomonas)、クラミドモナス属(Chlamydomonas)、デュナリエラ属(Dunaliella)、ゴニウム属(Gonium)、プレオドリナ属(Pleodorina)、オオヒゲマワリ属(Volvox)、パンドリナ属(Pandorina)、ユウドリナ属(Eudorina);ヨツメモ目(Tetrasporales)の、アステロコックス属(Asterococcus)、パルモジクチオン属(Palmodictyon)、グロエオキスチス属(Gloeocystis)、アスケナシエラ属(Askenasyella)、スファエロキスチス属(Sphaerocystis)、ヨツメモ属(Tetraspora);ヒビミドロ目(Ulotrichales)のスチココックス属(Stichococcus);クロロコックム目(Chlorococcales)の、デスマトラクツム属(Desmatractum)、ブラクテアコックス属(Bracteacoccus)、クロロコックム属(Chlorococcum)、ゴレンキニア属(Golenkinia)、キルヒネリエラ属(Kirchneriella)、アンキストロデスムス属(Ankistrodesmus)、クロレラ属(Chlorella)、セネデスムス属(Scenedesmus);ホシミドロ目(Zygnematales)の、ネトリウム属(Netrium)、ペニウム属(Penium)、ミカヅキモ属(Closterium)、コウガイチリモ属(Pleurotaenium)、ツヅミモ属(Cosmarium)などが挙げられる。
【0045】
プラシノ藻綱(Prasinophyceae)としては、例えば、マミエラ目(Mamiellales)の、プラシノコックス属(Prasinococcus)、ミクロモナス属(Micromonas);プセウドスコウルフィエルディア目(Pseudoscourfieldiales)のネフロセルミス属(Nephroselmis);ピラミモナス目(Pyramimonadales)の、プテロスペルマ属(Pterosperma)、ハロスファエラ属(Halosphaera)、ピラミモナス属(Pyramimonas);クロロデンドロン目(Chlorodendrales)のテトラセルミス属(Tetraselmis)などが挙げられる。
【0046】
珪藻綱(Bacillariophyceae)としては、例えば、円心目(Centrales)の、キクロテラ属(Cyclotella)、デトニューラ属(Detonula)、ミニディスクス属(Minidiscus)、タラシオシーラ属(Thalassiosira)、キートケロス属(Chaetoceros);羽状目(Pennales)のディメレグラムマ属(Dimeregramma)、ナビキュラ属(Navicula)、ニッチア属(Notzschia)などが挙げられる。
【0047】
真正眼点藻綱(Eustigmatophyceae)としては、例えば、ユースティグマトス目(Eustigmatales)のナンノクロロプシス属(Nannochloropsis)などが挙げられる。
【0048】
ハプト藻綱(Haptophyceae)としては、例えば、イソクリシス目(Isochrysidales)の、プリュウロクリシス属(Pleurochrisis)、エミリアニア属(Emiliniania)、プレウロクリシス属(Pleurochrysis)、ゲフィロカプサ属(Gephyrocapsa)、イソクリシス属(Isochrysis)、クリソティラ属(Chrysotyla)、ヒメノモナス属(Hymenomonas)、オクロスファエラ属(Ochrosphaera);プリムネシウム目(Prymnesidales)の、プリムネシウム属(Prymnesium)、クリソクロムリナ属(Chysochromulina)、フェオキィスティス属(Phaeocystis);円石藻目(Coccosphaerales)の、カリプトロスファエラ属(Calyptrosphaera)、ブラルードスファエラ属(Braarudsphaera)、アノプロソレニア属(Anoplosolenia)、カルキオソレニア属(Calciosolenia)、カルキディスクス属(Calcidicus)、コッコリトゥス属(Coccolithus)、オオリトトゥス属(Oolithotus)、ウンビリコスファエラ属(Umbilicosphaera)、へリコスファエラ属(Helicosphaera)、ポンスファエラ属(Pontosphaera)、アカントイカ属(Acanthoica)、アルギロスファエラ属(Algirosphaera)、ディスコスファエラ属(Discosphaera)、ラブドスファエラ属(Rhabdosphaera)、カネオスファエラ属(Caneosphaera)、コロノスファエラ属(Coronosphaera)、シラコスファエラ属(Syracosphaera)、ドイツランディア属(Deutschlandia)、ウンベロスフェラ属(Umbellosphaera)、ミカエルサルシア属(Michaelsarsia)、オフィアスター属(Ophiaster);パブロバ目(Pavlovales)のパブロバ属(Pavlova)などが挙げられる。
【0049】
ユーグレナ藻綱(Euglenophyceae)としては、例えば、ユーグレナ目(Euglenales)のユーグレナ属(Euglena)などが挙げられる。
【0050】
前記微細藻類を入手する方法としては、特に制限はなく、目的に応じて適宜選択することができ、例えば、自然界より採取する方法、市販品を用いる方法、保存機関や寄託機関から入手する方法などが挙げられる。
【0051】
前記微細藻類を培養する方法としては、特に制限はなく、目的に応じて適宜選択することができ、例えば、振盪培養、静置培養などが挙げられる。これらの中でも、前記微細藻類は好気性であることから振盪培養が好ましい。
【0052】
前記微細藻類の培養に用いる培地としては、藻類を培養できるものであれば、特に制限はなく、目的に応じて適宜選択することができ、例えば、無機物から構成される培地などが挙げられる。具体的な例としては、後述する実施例に記載の培地などを用いることができる。また、前記培地は、有機物を含んでいてもよい。
前記培地のpHとしては、特に制限はなく、微細藻類の種類などに応じて適宜選択することができる。
【0053】
前記培養の温度、時間、炭酸ガス濃度、及び照度としても、特に制限はなく、微細藻類の種類などに応じて適宜選択することができる。
【0054】
前記微細藻類懸濁液における前記微細藻類の絶乾質量を測定する方法としては、特に制限はなく、目的に応じて適宜選択することができ、例えば、前記微細藻類懸濁液を乾燥させて秤量する方法などが挙げられる。
前記乾燥させる方法としては、特に制限はなく、目的に応じて適宜選択することができ、例えば、凍結乾燥法、噴霧乾燥法、加熱乾燥法、対流乾燥法などが挙げられる。これらの中でも、前記乾燥方法は、加熱乾燥法が好ましく、オーブンを用いることがより好ましい。
前記オーブンで乾燥させる場合、その温度及び時間としては、特に制限はなく、目的に応じて適宜選択することができるが、80℃〜120℃で2時間〜12時間乾燥させることが好ましい。
なお、前記絶乾質量を測定する際に、前記微細藻類懸濁液は、予め濾過することが、培養液に溶解した各種塩分などを除去できる点で好ましい。
【0055】
−多価カチオン−
前記微細藻類懸濁液は、更に多価カチオンを含むことが、前記微細藻類を好適に凝集させることができ、前記微細藻類の回収率が向上する点で好ましい。
前記多価カチオンとしては、特に制限はなく、目的に応じて適宜選択することができ、例えば、Al3+、Fe3+、Fe2+等の金属イオンなどが挙げられる。
前記微細藻類懸濁液において、前記金属イオンを発生させる方法としては、特に制限はなく、目的に応じて適宜選択することができ、例えば、前記微細藻類懸濁液に、硫酸アルミニウム水溶液、ポリ塩化アルミニウム水溶液、塩化第二鉄水溶液、ポリ硫酸第二鉄水溶液、硫酸第一鉄水溶液等の金属を含む水溶液を添加する方法などが挙げられる。これらの中でも、前記水溶液は、硝酸アルミニウム水溶液が好ましい。また、例えば、ジメチルジアリルアンモニウムクロライド(DMDAA)、アルキルアミン・エピクロルヒドリン縮合物等の分子内に多数のカチオンを有する高分子電解質を添加する方法なども挙げられる。これらは、1種単独で使用してもよく、2種以上を併用してもよい。
【0056】
前記微細藻類懸濁液における、前記金属を含む水溶液又は前記高分子電解質の含有量としては、特に制限はなく、目的に応じて適宜選択することができるが、前記微細藻類懸濁液中の前記微細藻類の絶乾質量100部に対して、0.1質量部〜3.5質量部が好ましく、1質量部〜2質量部がより好ましい。前記金属を含む水溶液又は前記高分子電解質の含有量が、0.1質量部未満又は3.5質量部超えると、前記微細藻類の回収率が低下することがある。
【0057】
−アニオン性基を有する高分子化合物−
前記微細藻類懸濁液は、更にアニオン性基を有する高分子化合物を含むことが、前記微細藻類を好適に凝集させることができ、前記微細藻類の回収率が向上する点で好ましい。
前記アニオン性基を有する高分子化合物としては、特に制限はなく、目的に応じて適宜選択することができ、例えば、ポリアクリル酸ナトリウム(PMNA)、ポリアクリルアミド(PAM)、カルボキシメチルセルロース及びそのナトリウム塩、カルボキシ変性ポリビニルアルコールなどが挙げられる。これらは、1種単独で使用してもよく、2種以上を併用してもよい。これらの中でも、前記アニオン性基を有する高分子化合物は、ポリアクリル酸ナトリウム(PMNA)、ポリアクリルアミド(PAM)が好ましい。
【0058】
前記微細藻類懸濁液における、前記アニオン性基を有する高分子化合物の含有量としては、特に制限はなく、目的に応じて適宜選択することができるが、前記微細藻類懸濁液中の前記微細藻類の絶乾質量100部に対して、0.05質量部〜0.5質量部が好ましく、0.05質量部〜0.1質量部がより好ましい。前記アニオン性基を有する高分子化合物の含有量が、0.05質量部未満又は0.5質量部を超えると、前記微細藻類の回収率が低下することがある。
【0059】
−その他の成分−
前記微細藻類懸濁液における前記その他の成分としては、特に制限はなく、目的に応じて適宜選択することができ、例えば、水、前記多価カチオン及び前記アニオン性基を有する高分子化合物を除くゼータ電位調整剤などが挙げられる。
前記ゼータ電位調整剤としては、特に制限はなく、目的に応じて適宜選択することができ、例えば、カルボキシメチルセルロース及びそのナトリウム塩、カルボキシ変性ポリビニルアルコールなどが挙げられる。これらは、1種単独で使用してもよく、2種以上を併用してもよい。
前記微細藻類懸濁液における前記その他の成分の含有量としては、特に制限はなく、目的に応じて適宜選択することができる。
【0060】
<<ゼータ電位の調整>>
前記微細藻類懸濁液のゼータ電位は、−15mV〜+15mVに調整されるが、−10mV〜+10mVに調整されることが好ましく、−5mV〜+5mVに調整されることがより好ましい。前記ゼータ電位が、−15mV未満又は+15mVを超えると、前記微細藻類の回収率が低下することがある。
【0061】
前記ゼータ電位を調整する方法としては、特に制限はなく、目的に応じて適宜選択することができるが、前記多価カチオンやアニオン性基を有する高分子化合物を前記微細藻類懸濁液に添加し、これらの添加量などによって調整する方法が好ましい。
【0062】
前記ゼータ電位を測定する方法としては、特に制限はなく、目的に応じて適宜選択することができ、例えば、公知のゼータ電位測定装置を用いて測定する方法などが挙げられる。前記ゼータ電位測定装置の具体的な例としては、ゼータ電位測定装置 ZEECOM ZC2000(株式会社マイクロテック・ニチオン社製)などが挙げられる。
【0063】
<回収工程>
前記回収工程は、前記紙パルプ層に前記ゼータ電位を所望の値に調整した微細藻類懸濁液を吐出して前記微細藻類を回収する工程である。なお、本発明において、回収とは、前記紙パルプ層に前記微細藻類が捕捉されることをいう。以下、微細藻類を回収した紙パルプ層を、「微細藻類含有紙パルプシート」と称することがある。
【0064】
前記吐出方法としては、前記フィルター上に形成した前記紙パルプ層に前記微細藻類懸濁液を吐出することができれば、特に制限はなく、目的に応じて適宜選択することができ、例えば、紙パルプ層上に前記微細藻類懸濁液を添加して濾過した後、吸引する方法などが挙げられる。
前記吸引時間としては、特に制限はなく、紙パルプ層の水分含有量などに応じて適宜選択することができるが、1分間〜10分間が好ましく、2分間〜5分間がより好ましい。
前記吸引圧としては、特に制限はなく、紙パルプ層の水分含有量などに応じて適宜選択することができるが、30kPa〜500kPaが好ましく、50kPa〜200kPaがより好ましい。
これにより、前記微細藻類懸濁液が濾過され、前記微細藻類懸濁液中の液体成分と、細胞とを好適に分離することができ、前記紙パルプ層に前記微細藻類を回収することができる。
【0065】
前記回収工程において、前記微細藻類懸濁液を添加する量としては、特に制限はなく、目的に応じて適宜選択することができるが、前記紙パルプ層における固形パルプの含有量100質量部に対して、前記微細藻類の絶乾質量で、400質量部以下が好ましく、300質量部以下がより好ましい。前記添加量が、400質量部を超えると、前記紙パルプ層に詰まりが生じ、前記微細藻類を効率よく回収できないことがある。
【0066】
前記微細藻類の回収率は、以下のように算出することができる。
前記回収工程により得られた、微細藻類含有紙パルプシートを乾燥させた後に秤量する(以下、「微細藻類含有紙パルプシート乾燥質量」と称することがある。)。一方、前記微細藻類懸濁液を添加していない紙パルプ層も同様の方法で乾燥後に秤量する(以下、「紙パルプシート乾燥質量」と称することがある。)。これらの値を用いて、次式により算出することができる。
回収率(%)=[(微細藻類含有紙パルプシート乾燥質量(g))−(紙パルプシート乾燥質量(g))]/[(微細藻類懸濁液添加量(L)×(微細藻類懸濁液中の細胞濃度(g/L))]×100
ここで、「微細藻類懸濁液中の細胞濃度」は、予め秤量したガラス繊維濾紙で、培養懸濁液を濾別後、乾燥させて、乾燥重量を測定し、濾別した培養液全量で除することにより算出することができる。
【0067】
<抽出工程>
前記抽出工程は、前記回収工程により得られた微細藻類含有紙パルプシートから、前記微細藻類の細胞内に産生される成分を抽出する工程である。
前記抽出には、前記微細藻類含有紙パルプシートをそのまま用いることが、操作が簡便であり、抽出効率がよい点で好ましいが、前記微細藻類含有紙パルプシートから前記微細藻類を分離してから用いてもよい。
【0068】
前記抽出方法としては、特に制限はなく、目的に応じて適宜選択することができ、例えば、前記微細藻類含有紙パルプシートに抽出溶剤を作用させて抽出する方法などが挙げられる。
前記抽出溶剤としては、特に制限はなく、前記微細藻類の種類などに応じて適宜選択することができる。
【0069】
以下に、前記微細藻類が、アスタキサンチンを産生するヘマトコッカス ラキュストリス(Haematococcus lacustris)、及び脂肪酸を産生するナンノクロロプシス オキュラータ(Nannochloropsis oculata)である場合を例に、前記抽出工程について詳細に説明するが、本発明の前記微細藻類の種類及びその細胞内成分としては、これらに限られるものではない。
【0070】
−アスタキサンチンの抽出−
例えば、前記微細藻類が、ヘマトコッカス ラキュストリスである場合、その細胞内にはアスタキサンチンが産生されることが知られている。
【0071】
前記微細藻類からアスタキサンチンを抽出する方法としては、特に制限はなく、公知の方法の中から適宜選択することができ、例えば、前記微細藻類含有紙パルプシートを抽出溶剤と接触させる方法などが挙げられる。
【0072】
抽出溶剤としては、特に制限はなく、目的に応じて適宜選択することができ、例えば、アセトン、エタノール、イソアミルアルコール、n−ヘキサンなどが挙げられる。これらは、1種単独で使用してもよく、2種以上を併用してもよい。これらの中でも、溶解度の点から抽出効率のよいアセトンあるいはアセトンを含む混合溶剤が好ましく、アセトン−クロロホルム混合溶剤がより好ましい。
【0073】
前記抽出に用いる前記抽出溶剤の量としては、用いる微細藻類の種類や量などに応じて適宜選択することができるが、微細藻類の絶乾質量100部に対して、200質量部〜2,000質量部が好ましい。
前記抽出温度及び時間としては、特に制限はなく、前記微細藻類の性状、用いる抽出溶剤の種類や量などに応じて適宜選択することができる。
【0074】
前記アスタキサンチンを含む抽出溶剤から、前記微細藻類など固形物を除去した後、抽出溶剤を除去すると、アスタキサンチンを含むカロテノイド類(色素)を得ることができる。この色素を常法にて精製処理することにより、アスタキサンチンを得ることができる。
抽出溶剤の除去方法としては、特に制限はなく、目的に応じて適宜選択することができ、例えば、温和な条件下でアスタキサンチンを含む抽出溶剤を加温処理し、抽出溶剤を蒸発する処理法などが挙げられる。
前記精製処理方法としても、特に制限はなく、目的に応じて適宜選択することができる。
【0075】
前記微細藻類から抽出されたアスタキサンチンは、食品添加剤、食材用色素、飼料用添加剤などとして有用である。具体的には、香粧品や医薬品、健康食品、魚類用飼料、家禽用飼料等として好適に使用可能である。また、アスタキサンチンを精製処理していないカロテノイド類を、上記用途に使用してもよい。更には、アスタキサンチンを細胞内に蓄積した微細藻類の破砕物を上記用途に使用してもよい。
【0076】
−脂肪酸の抽出−
例えば、前記微細藻類が、ナンノクロロプシス オキュラータである場合、その細胞内には脂肪酸が産生されることが知られている。
【0077】
前記微細藻類から脂肪酸を抽出する方法としては、特に制限はなく、公知の方法の中から適宜選択することができ、例えば、前記微細藻類含有紙パルプシートを抽出溶剤と接触させる方法などが挙げられる。
【0078】
抽出溶剤としては、特に制限はなく、目的に応じて適宜選択することができ、例えば、エーテル、ヘキサン、メタノール、エタノール、クロロホルム、ジクロロメタン、石油エーテル等の有機溶媒;前記有機溶媒と塩酸との混合溶媒などが挙げられる。これらは、1種単独で使用してもよく、2種以上を併用してもよい。これらの中でも、メタノールが好ましく、5質量%塩酸を含むメタノールがより好ましい。
【0079】
前記抽出に用いる前記抽出溶剤の量としては、用いる微細藻類の種類や量などに応じて適宜選択することができるが、微細藻類の絶乾質量100部に対して、200質量部〜2,000質量部が好ましい。
前記抽出温度及び時間としては、特に制限はなく、前記微細藻類の性状、用いる抽出溶剤の種類や量などに応じて適宜選択することができる。
【0080】
前記脂肪酸を含む抽出溶剤から、前記微細藻類など固形物を除去した後、抽出溶剤を除去すると、脂肪酸を得ることができる。
抽出溶剤の除去方法としては、特に制限はなく、目的に応じて適宜選択することができ、例えば、凍結乾燥法、噴霧乾燥法、加熱乾燥法、対流乾燥法などが挙げられる。
また、前記脂肪酸をクロマトグラフィー等の公知の方法で分離することにより、エイコサペンタエン酸を精製することもできる。
【0081】
前記微細藻類から抽出された脂肪酸は、メタノールとのエステル交換反応等の公知の方法でメチルエステル化することで、ディーゼルとして利用可能であり、また前記脂肪酸から分離精製したエイコサペンタエン酸は、香粧品や医薬品、健康食品、魚類用飼料、家禽用飼料等として好適に使用可能である。また、脂肪酸を細胞内に蓄積した微細藻類の破砕物を上記用途に使用してもよい。
【0082】
<その他の工程>
前記その他の工程としては、特に制限はなく、目的に応じて適宜選択することができ、例えば、フィルター除去工程、プレス工程、乾燥工程、厚みプロファイル調整工程、水分プロファイル調整工程などが挙げられる。
【0083】
<<フィルター除去工程>>
前記フィルター除去工程は、前記回収工程により得られた前記微細藻含有紙パルプシートから前記フィルターを取除く工程である。
前記フィルターを取り除く方法としては、特に制限はなく、目的に応じて適宜選択することができる。
【0084】
<<プレス工程>>
前記プレス工程は、前記微細藻類含有紙パルプシートをプレスして、該微細藻類含有紙パルプシートから搾水させる工程である。
前記プレスする方法としては、特に制限はなく、目的に応じて適宜選択することができ、例えば、毛布などの上に紙パルプシートを乗せて、ローラーの間を圧搾しながら通す方法などが挙げられる。
【0085】
<<乾燥工程>>
前記微細藻類含有紙パルプシートを乾燥させる方法としては、特に制限はなく、目的に応じて適宜選択することができ、例えば、凍結乾燥法、噴霧乾燥法、加熱乾燥法、対流乾燥法などが挙げられる。これらの中でも、前記乾燥方法は、加熱乾燥法が好ましく、オーブンを用いることがより好ましい。
前記オーブンで乾燥させる場合、その温度及び時間としては、特に制限はなく、目的に応じて適宜選択することができるが、80℃〜120℃で2時間〜12時間乾燥させることが好ましい。
【0086】
<<厚みプロファイル調整工程>>
前記厚みプロファイル調整工程は、前記微細藻含有紙パルプシートの厚みをプロファイルする工程である。
前記厚みを測定する方法としては、特に制限はなく、目的に応じて適宜選択することができ、例えば、β線厚さ計、X線厚さ計等で測定する方法などが挙げられる。
【0087】
<<水分プロファイル調整工程>>
前記水分プロファイル調整工程は、前記微細藻含有紙パルプシート、好ましくは、前記乾燥工程により乾燥された微細藻含有紙パルプシートの水分をプロファイルする工程である。
前記水分量を測定する方法としては、特に制限はなく、目的に応じて適宜選択することができ、例えば、近赤外線式水分計、マイクロ波式水分計等で測定する方法などが挙げられる。
前記微細藻含有紙パルプシートの水分をプロファイルすることで、例えば、前記乾燥工程における乾燥強度を微細藻含有紙パルプシートの幅方向で変え、微細藻含有紙パルプシートの幅方向の水分含有量を均一にすることができ、これにより前記微細藻含有紙パルプシートを抽出工程に用いるまで好適に搬送、保存でき、前記微細藻類細胞内成分の抽出効率が向上する点で好ましい。
【0088】
<用途>
前記微細藻類細胞内成分の抽出方法は、微細藻類が単細胞であっても、遠心分離などを行うことなく省エネルギーで、かつ簡便な操作により短時間で効率よく回収でき、更に前記微細藻類を回収した紙パルプシートをそのまま抽出に用いることで、効率よく簡便に前記微細藻類の細胞内に含まれる成分を抽出することができる点で有利である。
なお、前記微細藻類細胞内成分の抽出方法の回収工程で回収された前記微細藻類懸濁液中の細胞、及び該細胞から抽出された細胞内成分も、本発明の範囲に含まれる。
【実施例】
【0089】
以下に本発明の実施例を挙げて本発明を具体的に説明するが、本発明はこれらの実施例に何ら限定されるものではない。
【0090】
(実施例1〜8、比較例1〜4)
<パルプ懸濁液の調製>
広葉樹晒クラフトパルプ(LBKP)と、針葉樹晒クラフトパルプ(NBKP)との質量比(LBKP/NBKP)が80/20からなる木材パルプ(LBKP: Aracruz社製、NBKP:Harmac Pasific社製)を、ナイアガラビーター(熊谷理機工業株式会社製)で叩解し、カナディアンフリーネスが300mLのパルプ懸濁液を得た。
前記パルプ懸濁液をガラス繊維濾紙で濾別した後、ドライオーブンにて110℃で4時間乾燥させて秤量することにより固形パルプ分の含有量を求めたところ、15g/Lであった。
【0091】
<紙パルプ層の形成>
丸型シートマシーン(熊谷理機工業株式会社製)に、2.5重織プラスチックワイヤー(LL−40E、日本フイルコン株式会社製)を貼付したワイヤーを設置して、パルプ懸濁液を添加し、固形パルプ分の絶乾質量が、表1に示す坪量となるように、吸引時間及び吸引圧を調整することで、紙層水分を調整した。なお、坪量を5g/m2にする場合は、50kPaにて2分間、10g/m2にする場合は、50kPaにて3分間、50g/m2にする場合は100kPaにて3分間吸引した。
【0092】
<ヘマトコッカス ラキュストリスの培養>
ヘマトコッカス ラキュストリス(Haematococcus lacustris:NIES−2164)を細胞濃度が0.05gになるようにSorokin−Krauss培地 1Lに接種し、2L容のガラス製扁平フラスコに入れ、25℃、二酸化炭素濃度5%とした空気を通気して振盪培養した。通気量は、100mL/分間とした。培養は、植物育成用蛍光燈(株式会社チヨダサイエンス製)を光源として照度を5,000ルクスに設定し、連続光照射下で行った。細胞濃度が、1.0g/L以上に達したところで培養を止めた(14日間)。
前記Sorokin−Krauss培地は、蒸留水1,000mLに対して、硝酸カリウム 1.25g/L、硫酸マグネシウム七水和物 1.0g/L、リン酸二水素カリウム 1.25g/L、塩化カルシウム 84mg/L、及び硫酸鉄七水和物 50mg/Lを添加した。次いで、ほう酸 2.86g/L、塩化マンガン四水和物 1.81g/L、硫酸亜鉛七水和物 22mg/L、硫酸銅五水和物 79mg/L、塩化コバルト(II)六水和物 40mg/L、及びモリブデン酸ナトリウム二水和物 21mg/Lを含有する微量元素混合溶液1mLを添加した後、pHを6.8に調整した。
本培養後、光源を植物育成用蛍光燈から、ハロゲン光源(林時計工業株式会社製)に代えて、照度を30,000ルクスに設定し、3日間、連続照射下で、細胞のシスト化を行った。
【0093】
<微細藻類のゼータ電位の調整>
前記培養後のヘマトコッカス ラキュストリスの培養液を、ガラス繊維濾紙(WhatmanグレードGF/D)用いて濾過した後、ドライオーブンにて110℃で4時間乾燥させて秤量することにより、ヘマトコッカス ラキュストリス培養液中のヘマトコッカス ラキュストリスの絶乾質量を測定した。この測定値より、前記培養液中のヘマトコッカス ラキュストリスの細胞濃度を算出したところ、1g/Lであった。
ヘマトコッカス ラキュストリスの乾燥質量100部に対して、表1に示す割合で、硫酸アルミニウム水溶液又はジメチルジアリルアンモニウムクロライド(DMDAA)を添加し、スターラー250rpmで1分間攪拌した。次いで、ポリアクリルアミド(PAM)又はポリアクリル酸ナトリウム(PMNA)を、ヘマトコッカス ラキュストリスの乾燥質量100部に対して、表1に示す割合で添加し、スターラー250rpmで1分間攪拌し、微細藻類懸濁液を調製した。
【0094】
<ゼータ電位の測定>
微細藻類懸濁液のゼータ電位(Zp)を、ゼータ電位測定装置(ZEECOM ZC2000、株式会社マイクロテック・ニチオン社製)により、定法に従い測定した。結果を表1に示す。
【0095】
<回収方法>
前記微細藻類懸濁液を、丸型シートマシーンのポンプで送液し、該丸型シートマシーンの吐出箱より吐出させ、前記紙パルプ層に添加し、微細藻類懸濁液を濾過することにより、ヘマトコッカス ラキュストリスを回収したヘマトコッカス ラキュストリス含有紙パルプシートを得た。微細藻類懸濁液の添加量としては、紙パルプ層の固形パルプ分100質量部に対して、表1に示す割合で添加した。
【0096】
(実施例9〜12、比較例5〜6)
実施例1〜8及び比較例1〜4において、ヘマトコッカス ラキュストリスに代えて、下記方法で培養したナンノクロロプシス オキュラータを用いたこと以外は、実施例1〜8及び比較例1〜4と同様の方法で、パルプ懸濁液の調製、紙パルプ層の形成、微細藻類のゼータ電位の調整、ゼータ電位の測定、及び紙パルプ層への微細藻類の回収を行った。
【0097】
<ナンノクロロプシス オキュラータの培養>
ナンノクロロプシス オキュラータ(Nannochloropsis oculata:NIES−2146)を細胞濃度が0.05gになるようにGuillard F培地 1Lに接種し、2L容のガラス製扁平フラスコに入れ、25℃、二酸化炭素濃度5%とした空気を通気して振盪培養した。通気量は、100mL/分間とした。培養は、植物育成用蛍光燈(株式会社チヨダサイエンス製)を光源として照度を2,000ルクスに設定し、連続光照射下で行った。細胞濃度が、1.0g/L以上に達したところで培養を止めた(8日間)。
前記Guillard F培地は、海水1,000mLに対して、硝酸ナトリウム 0.15g/L、リン酸二水素ナトリウム 0.01g/L、珪酸ナトリウム九水和物 0.06g/L、 Fe−EDTA 0.0098g/L、塩化マンガン四水和物 36μg/L、硫酸銅五水和物 19.6μg/L、硫酸亜鉛七水和物 44μg/L、塩化コバルト(II)六水和物 2μg/L、モリブデン酸ナトリウム二水和物 12.6μg/L、ビタミンB12 1.0μg/L、ビオチン 1.0μg/L、及びチアミン塩酸塩 0.2mg/Lを添加した後、pHを8に調整した。
前記培養液中のナンノクロロプシス オキュラータの細胞濃度を、ヘマトコッカス ラキュストリスと同様の方法で測定した結果、1g/Lであった。
【0098】
<微細藻類回収率の評価>
実施例1〜12及び比較例1〜6において、微細藻類懸濁液を濾過した後、得られた微細藻類含有紙パルプシートを、ドライオーブンにて110℃で4時間乾燥させ、乾燥後の質量を測定した。また、微細藻類懸濁液を添加していない紙パルプ層を同様の操作で乾燥させ、乾燥後の質量を測定した。これらの値を用いて、次式により回収率を算出し、下記評価基準に基づき評価した。結果を表2に示す。なお、表1及び2において、「HL」は、ヘマトコッカス ラキュストリス、「NO」は、ナンノクロロプシス オキュラータを示す。
回収率(%)=[(微細藻類含有紙パルプシート乾燥質量(g))−(紙パルプシート乾燥質量(g))]/[(微細藻類懸濁液添加量(L)×(微細藻類懸濁液中の細胞濃度(g/L))]×100
[評価基準]
◎ :回収率が95%以上
○ :回収率が80%超え95%未満
△ :回収率が65%超え80%以下
× :回収率が65%以下
【0099】
(試験例1:ヘマトコッカス ラキュストリス産生アスタキサンチンの分析)
ヘマトコッカス ラキュストリスが細胞内に産生するアスタキサンチンは、従来、遠心分離後、フィルター濾過を行う2段階の分離工程を経た後、有機溶媒で抽出することにより得られていた(特開2004−129504号公報参照)。
そこで、前記実施例1〜8及び比較例1〜4の方法で得られた細胞から抽出したアスタキサンチンの量と、前記従来の方法である遠心分離及び濾過後に抽出して得たアスタキサンチンの量とをそれぞれ測定して比較した。
【0100】
<遠心分離により回収した微細藻類からのアスタキサンチンの抽出(従来法)>
実施例1〜8及び比較例1〜4と同様の方法で、ヘマトコッカス ラキュストリスを培養した。この培養液を10,000rpmで15分間遠心分離して上清を取除いて藻体を回収し、ヘマトコッカス ラキュストリス藻乾燥質量10部当り、100質量部のアセトンを使用して抽出することにより、アスタキサンチン含有脂質を回収した。
【0101】
<実施例1〜8及び比較例1〜4の方法で回収した微細藻類からのアスタキサンチンの抽出>
実施例1〜8及び比較例1〜4の、ヘマトコッカス ラキュストリス含有紙パルプシートは、そのまま10mm角に裁断した後、ヘマトコッカス ラキュストリス藻乾燥質量10部当り、100質量部のアセトンを使用して抽出し、アスタキサンチン含有脂質を回収した。
【0102】
<アスタキサンチン濃度の測定>
回収したアスタキサンチン含有脂質を含むアセトン溶液上清の吸光度(波長480nm及び750nm)を測定してカロテノイド濃度を求めた(“A Practical Handbook of Sea Water Analysis” p.185−206, Fisheries Research Board of Cnanada (1968))。ヘマトコッカス ラキュストリスのシスト細胞中に蓄積されるカロテノイドの殆どは、アスタキサンチンであることが知られていることから(J. Ferment. Bioeng. 71(5):335−339 (1991))、得られたカロテノイド濃度をアスタキサンチン濃度として表した。
実施例1〜8及び比較例1〜4の成分抽出率は、実施例1〜8及び比較例1〜4で得られたアスタキサンチン濃度値を、前記従来の方法(遠心分離)で得られた濃度値で除した百分率で示した。結果を表2に示す。
【0103】
(試験例2:ナンノクロロプシス オキュラータ産生エイコサペンタエン酸の分析)
ナンノクロロプシス オキュラータが細胞内に産生する脂肪酸は、従来、遠心分離後、フィルター濾過を行う2段階の分離工程を経た後、有機溶媒で抽出することにより得られていた。
そこで、前記実施例9〜12及び比較例5〜6の方法で得られた細胞から抽出した脂肪酸から分離したエイコサペンタエン酸の量、及び前記従来の方法である遠心分離及び濾過後に抽出して得た脂肪酸から分離したエイコサペンタエン酸の量をそれぞれ測定して比較した。
【0104】
<遠心分離により回収した微細藻類からの脂肪酸の抽出(従来法)>
実施例9〜12及び比較例5〜6と同様の方法で、ナンノクロロプシス オキュラータを培養した。この培養液を15,000rpmで30分間遠心分離して上清を取除いて藻体を回収し、ナンノクロロプシス オキュラータ藻乾燥質量1部当たり、10質量部の5質量%塩酸を含むメタノール溶媒を添加し、95℃で3時間還流して、脂肪酸をエステル交換した後、ヘキサン溶媒で脂肪酸メチルエステルを抽出した。
【0105】
<実施例9〜12及び比較例5〜6の方法で回収した微細藻類からの脂肪酸の抽出>
実施例9〜12及び比較例5〜6の、ナンノクロロプシス オキュラータ含有紙パルプシートは、そのまま10mm角に裁断した後、ナンノクロロプシス オキュラータ藻乾燥 1部当たり、10質量部の5質量%塩酸を含むメタノール溶媒を添加し、95℃で3時間還流して、脂肪酸をエステル交換した後、ヘキサン溶媒で脂肪酸メチルエステルを抽出した。
【0106】
<エイコサペンタエン酸濃度の測定>
抽出した脂肪酸メチルエステルに含まれるエイコサペンタエン酸の濃度は、下記ガスクロマトグラフィー分析条件により定量した。
[ガスクロマトグラフィー測定条件]
装置 :Shimadzu GC−14A(株式会社島津製作所製)
検出器 :FID
カラム :DB−WAX(アジレント・テクノロジー社製)
キャリアーガス:ヘリウム
流速 :1mL/分間
カラム温度 :170℃〜210℃(1.5℃/分間)
内部標準物質 :トリコサン酸メチルエステル(SIGMA社製)
実施例9〜12及び比較例5〜6の成分抽出率は、実施例9〜12及び比較例5〜6で得られたエイコサペンタエン酸濃度値を、前記従来の方法(遠心分離)で得られた濃度値で除した百分率で示した。結果を表2に示す。
【0107】
【表1】

【0108】
【表2】

【0109】
表2より、前記実施例の方法で回収された微細藻類から従来法(遠心分離)と同等又はそれ以上の量のアスタキサンチン及びエイコサペンタエン酸を得ることができた。従来の遠心分離の方法では、操作の過程で微細藻類のロスが出ることがあったが、前記実施例の方法では、微細藻類含有紙パルプシートをそのまま抽出に用いるため、紙パルプ層に回収した微細藻類の全てから効率よく細胞内成分を抽出できることがわかった。更に、前記実施例の方法では、従来の方法より少ない工程で簡便であり、かつ省エネルギーで分離できることがわかった。
【産業上の利用可能性】
【0110】
前記微細藻類細胞内成分の抽出方法は、微細藻類が単細胞であっても、遠心分離などを行うことなく省エネルギーで、かつ簡便な操作により短時間で効率よく回収でき、更に前記微細藻類を回収した紙パルプシートをそのまま抽出に用いることで、効率よく簡便に前記微細藻類の細胞内に含まれる成分を抽出することができるため、石油資源の代替原料としてのバイオディーゼルの製造や、香粧品や医薬品、健康食品、魚類用飼料、家禽用飼料などに好適に利用可能である。
【符号の説明】
【0111】
1 フィルター
2 紙パルプ層
3 微細藻類懸濁液
【特許請求の範囲】
【請求項1】
フィルター上に紙パルプ層を形成する紙パルプ層形成工程と、
少なくとも微細藻類を含む微細藻類懸濁液のゼータ電位を−15mV〜+15mVに調整するゼータ電位調整工程と、
前記紙パルプ層に前記ゼータ電位を調整した微細藻類懸濁液を吐出して前記微細藻類を回収する回収工程と、
前記回収工程により得られた微細藻類含有紙パルプシートから、前記微細藻類の細胞内に産生される成分を抽出する抽出工程と、
を含むことを特徴とする微細藻類細胞内成分の抽出方法。
【請求項2】
抽出工程が、微細藻類含有紙パルプシートと、抽出溶剤とを接触させて微細藻類の細胞内に産生される成分を抽出する工程である請求項1に記載の微細藻類細胞内成分の抽出方法。
【請求項3】
紙パルプ層形成工程が、紙パルプ層における固形パルプ分の絶乾質量が10g/m2〜150g/m2の紙パルプ層を形成する工程である請求項1から2のいずれかに記載の微細藻類細胞内成分の抽出方法。
【請求項4】
紙パルプ層形成工程が、紙パルプ層における固形パルプ分の含有量が0.5質量%〜20質量%の紙パルプ層を形成する工程である請求項1から3のいずれかに記載の微細藻類細胞内成分の抽出方法。
【請求項5】
ゼータ電位調整工程が、微細藻類懸濁液に多価カチオン及びアニオン性基を有する高分子化合物を添加することにより、前記微細藻類懸濁液のゼータ電位を調整する工程である請求項1から4のいずれかに記載の微細藻類細胞内成分の抽出方法。
【請求項6】
フィルターが、抄紙ワイヤーである請求項1から5のいずれかに記載の微細藻類細胞内成分の抽出方法。
【請求項1】
フィルター上に紙パルプ層を形成する紙パルプ層形成工程と、
少なくとも微細藻類を含む微細藻類懸濁液のゼータ電位を−15mV〜+15mVに調整するゼータ電位調整工程と、
前記紙パルプ層に前記ゼータ電位を調整した微細藻類懸濁液を吐出して前記微細藻類を回収する回収工程と、
前記回収工程により得られた微細藻類含有紙パルプシートから、前記微細藻類の細胞内に産生される成分を抽出する抽出工程と、
を含むことを特徴とする微細藻類細胞内成分の抽出方法。
【請求項2】
抽出工程が、微細藻類含有紙パルプシートと、抽出溶剤とを接触させて微細藻類の細胞内に産生される成分を抽出する工程である請求項1に記載の微細藻類細胞内成分の抽出方法。
【請求項3】
紙パルプ層形成工程が、紙パルプ層における固形パルプ分の絶乾質量が10g/m2〜150g/m2の紙パルプ層を形成する工程である請求項1から2のいずれかに記載の微細藻類細胞内成分の抽出方法。
【請求項4】
紙パルプ層形成工程が、紙パルプ層における固形パルプ分の含有量が0.5質量%〜20質量%の紙パルプ層を形成する工程である請求項1から3のいずれかに記載の微細藻類細胞内成分の抽出方法。
【請求項5】
ゼータ電位調整工程が、微細藻類懸濁液に多価カチオン及びアニオン性基を有する高分子化合物を添加することにより、前記微細藻類懸濁液のゼータ電位を調整する工程である請求項1から4のいずれかに記載の微細藻類細胞内成分の抽出方法。
【請求項6】
フィルターが、抄紙ワイヤーである請求項1から5のいずれかに記載の微細藻類細胞内成分の抽出方法。
【図1】




【公開番号】特開2011−206016(P2011−206016A)
【公開日】平成23年10月20日(2011.10.20)
【国際特許分類】
【出願番号】特願2010−79420(P2010−79420)
【出願日】平成22年3月30日(2010.3.30)
【出願人】(306037311)富士フイルム株式会社 (25,513)
【Fターム(参考)】
【公開日】平成23年10月20日(2011.10.20)
【国際特許分類】
【出願日】平成22年3月30日(2010.3.30)
【出願人】(306037311)富士フイルム株式会社 (25,513)
【Fターム(参考)】
[ Back to top ]

