微量質量分析法
【課題】分析される分子の量や反応試薬の量を減らし、簡便に高感度質量分析測定用の試料を調製でき、イオン化効率や測定の再現性を向上させることによって、信頼性の高い化学構造についての情報を得ることができる質量分析法を提供すること。
【解決手段】分子を誘導体化して質量分析する方法であって、少なくとも、以下の工程
(1)分析される分子及び誘導体化剤を、この質量分析法に用いる試料支持部材上に載せる工程、
(2)分析される分子及び誘導体化剤を試料支持部材上で密閉することなく直接反応及び乾燥させる工程、
(3)試料支持部材を質量分析計に供して、該試料支持部材上の、反応して生成した分析される分子の誘導体を質量分析計に供する工程、
(4)分析される分子の誘導体をイオン化する工程
を有することを特徴とする質量分析法。
【解決手段】分子を誘導体化して質量分析する方法であって、少なくとも、以下の工程
(1)分析される分子及び誘導体化剤を、この質量分析法に用いる試料支持部材上に載せる工程、
(2)分析される分子及び誘導体化剤を試料支持部材上で密閉することなく直接反応及び乾燥させる工程、
(3)試料支持部材を質量分析計に供して、該試料支持部材上の、反応して生成した分析される分子の誘導体を質量分析計に供する工程、
(4)分析される分子の誘導体をイオン化する工程
を有することを特徴とする質量分析法。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、分子の質量分析法に関する。
【背景技術】
【0002】
「質量分析法」とは、分子を含む試料をイオン化し、イオン化した分子を質量/電荷(m/z)に従って分離し検出することによって化学構造の情報を得る方法である。
【0003】
糖鎖、タンパク質(ペプチドを含む)、糖タンパク質(糖ペプチドを含む)、核酸、糖脂質等の分子は、マトリクス支援レーザー脱離イオン化質量分析法(MALDI−MS)やエレクトロスプレーイオン化質量分析法(ESI−MS)によって構造情報を得て同定される。これらの分子は、分子イオン([M+Na]+、[M+H]+、[M−H]−等)生成が効率よく起こるかどうかが検出感度に大きく影響する。特に、糖鎖は分子量及び組成が同一の異性体が複数存在するので、分子イオンをプリカーサイオンとして選択し断片化し、更に生じたイオンをプリカーサイオンとして選択し断片化することを繰り返すMSn解析が必須である。
【0004】
一般に、MS/MS測定により得られるイオンのシグナル強度は前段階のイオンの1/10に減少する。従って、多段階MS測定を行うことによって、構造情報は極めて多くなるが、検出感度は低下していくので、はじめの分子イオン生成量が十分に多いことが必要である。
【0005】
しかしながら、前述のような生体試料由来の分子はそのままではイオン化されにくく、また分子の破壊が起りやすいので、十分な量の分子イオンを得ることが難しい。例えば、糖鎖をそのままマトリクス支援レーザー脱離イオン化−飛行時間型質量分析法(MALDI−TOF MS)で解析しようとすると10pmol以上を要する。この問題に対して、4−アミノ安息香酸エチルエステル、2−アミノピリジン、あるいは1−ピレンブタン酸ヒドラジド(1-pyrenebutanoic acid hydrazide;PBH)等を用いて糖鎖を誘導体化する方法が提案されている(例えば、非特許文献1参照)。
【0006】
しかしながら、これらの誘導体化は、質量分析に先立って行われるが、反応操作や過剰の試薬除去の操作が多工程含まれ、時間と労力がかかることに加えて、超微量な生体試料由来の分子に適用しにくいのが現状であった。
【先行技術文献】
【非特許文献】
【0007】
【非特許文献1】Sugahara, D. et al.,Anal.Sci.,19,第167〜169頁(2003)
【発明の概要】
【発明が解決しようとする課題】
【0008】
本発明は上記背景技術に鑑みてなされたものであり、その課題は、分析される分子の量や反応試薬の量を減らし、簡便に高感度質量分析測定用の試料を調製でき、イオン化効率や測定の再現性を向上させることによって、信頼性の高い化学構造についての情報を得ることができる質量分析法を提供することにあり、また特に、糖タンパク質等の微量な生体試料由来の分子、又は生体試料中の分子に適用して、その機能解明や病態の解明に有用な情報を得ることができる質量分析法を提供することにある。
【課題を解決するための手段】
【0009】
本発明者は、上記の課題を解決すべく鋭意検討を重ねた結果、直接質量分析に用いる試料支持部材上で反応を行うことによって、試料が減量することなく、簡便に効率良く分子の安定な誘導体を作成し、イオン化が困難であった分子のイオン化効率の向上及び生成したイオンの安定化を実現して、質量分析の感度を向上させることができることを見いだして本発明を完成するに至った。
【0010】
すなわち、本発明は、分子の質量分析法であって、少なくとも、工程(1)、(2)、(3)及び(4)
(1)分析される分子及び誘導体化剤を、質量分析法に用いる試料支持部材上に載せる工程、
(2)分析される分子及び誘導体化剤を試料支持部材上で反応させる工程、
(3)試料支持部材上の、反応して生成した、分析される分子の誘導体を質量分析計に供する工程、
(4)分析される分子の誘導体をイオン化する工程
を有することを特徴とする質量分析法を提供するものである。
【0011】
また、本発明は、上記質量分析法に用いることを特徴とする誘導体化剤を提供するものである。
【発明の効果】
【0012】
本発明によれば、試料支持部材上で分子に反応試薬を反応させることによって、用いる分子の量及び反応試薬量を減らすことができ(高収量化を可能にし)、緩和な条件で、処理工程で測定分子を減量させることなく、十分な量の分子イオンを生成させることができ、高感度の質量分析法用の試料を簡便に調製できる。その結果、通常の処理工程では、分析可能な量以下になってしまうような微量サンプルしか得られない場合でも質量分析が可能となる。また、その結果、イオン化効率を向上させ、切断イオン化位置を制御したり、生成イオンの安定化を達成し、それにより測定の再現性を向上させることができ、信頼性の高い化学構造情報を得ることができる。また、本発明は微量な生体試料由来の分子や生体試料中の分子に適用できるので、例えば、糖鎖、タンパク質(ペプチドを含む)、糖タンパク質(糖ペプチドを含む)、核酸、糖脂質等の分子の機能解明や病態の解明に有用な情報を得る方法を提供できる。
【図面の簡単な説明】
【0013】
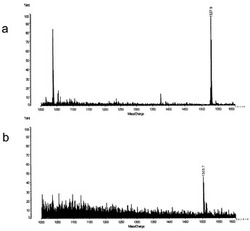
【図1】実施例1において、化合物1にPBHをプレート上で反応させて得たもののMALDI−QIT−TOF質量分析(MS)スペクトルである。 (a)[M+Na]+イオンのピークを示す。(b)[M−H]−イオンのピークを示す。
【図2】(a)実施例2において、化合物2にPBHをプレート上で反応させて得たものの[M−H]−イオンのスペクトルである。 (b)比較例2において、PBHを反応させていない化合物2の[M−H]−イオンのスペクトルである。
【図3】m/z742をプリカーサイオンとして選択して測定したMS/MSスペクトルである(実施例2)。 (a)化合物3にPBHをプレート上で反応させて得たもののMS/MSスペクトル。 (b)化合物2にPBHをプレート上で反応させて得たもののMS/MSスペクトル。
【図4】m/z626をプリカーサイオンとして選択して測定したMS3スペクトルである(実施例2)。 (a)化合物3にPBHをプレート上で反応させて得たもののMS3スペクトル。 (b)化合物2にPBHをプレート上で反応させて得たもののMS3スペクトル。
【図5】実施例3において、PBHをプレート上で反応させて得たもののMALDI−QIT−TOF質量分析(MS)スペクトル([M−H]−イオンのスペクトル)である。 (a)5fmolの化合物3を使用。 (b)5fmolの化合物2を使用。
【図6】実施例4において、アルキル化化合物(II)とPBHを、プレート上で反応させて得たもののMALDI−QIT−TOF質量分析(MS)スペクトルである。 (a)MSスペクトル。 (b)m/z2681をプレカーサーイオンとしたMS/MSスペクトル。
【図7】実施例5で測定したMSスペクトルである。 A:PSA約10ng由来糖鎖をプレートに載せ誘導体化剤を加えずネガティブイオンを測定したMSスペクトル。 B:同量の糖鎖をプレートに載せPBHを添加し反応させた後測定したMSスペクトル。 C:同量の糖鎖をプレートに載せPDAMを添加し反応させた後測定したMSスペクトル。 D:同量の糖鎖をプレートに載せPDAMを添加し反応させ、引き続きPBHを添加し反応させた後測定したMSスペクトル。
【図8】実施例5で測定したMSスペクトルである。 A:PSA約10ng由来糖鎖をプレートに載せ、誘導体化剤を加えずネガティブイオンを測定したMSスペクトルである。 B:同量の糖鎖をプレートに載せ、PDAMを添加し反応させた後測定したMSスペクトルである。
【発明を実施するための形態】
【0014】
以下、本発明について説明するが、本発明は以下の実施の具体的形態に限定されるものではなく、任意に変形して実施することができる。
【0015】
本発明では、分析される分子と誘導体化剤等の反応試薬を、質量分析計に供する試料支持部材上で直接反応させ、反応によって生成した分子の質量分析法による解析を行う。
【0016】
1.分析される分子
(1)分析される分子の種類
「分析される分子」は特に限定はないが、糖、糖鎖、タンパク質、核酸、複合糖質(糖タンパク質、糖脂質等)等であることが、本発明の効果を発揮できるので好ましい。「分析される分子」としては、天然物から調製されるもの、天然物を化学的又は酵素学的に一部改変して調製されるものの他、化学的又は酵素学的に調製されるものも好ましい。また、生体に含まれる分子の部分構造を有するものや生体に含まれる分子を模倣して作製されたものも好ましい。また、質量分析法に用いる試料支持部材上に載せる試料、すなわち、「分析される分子」を含む物体としては、「分析される分子」そのものだけでもよいし、「分析される分子」を含むもの、例えば、生体の組織、細胞、体液や分泌物(例えば、血液、血清、尿、精液、唾液、涙液、汗、糞便等)等でもよい。すなわち、直接生体試料を用いてもよい。また、試料を試料支持部材上に載せ、酵素処理等を行なって、分析される分子を調製してもよい。なお、本発明における用語「タンパク質」はペプチドを含み、「糖タンパク質」は糖ペプチドを含む。
【0017】
上記した分子は、分析に供される試料が少量である場合が多く、また特に、糖、糖鎖、糖タンパク質や糖脂質等の複合糖質等又はそれらから化学的若しくは酵素学的に遊離させて得たもの(以下、それらを全て「糖鎖」と略記する)は、分子量や組成が同一の異性体が複数存在するので、本発明の質量分析法は、それら分子の化学構造解析に対して特に上記効果を奏するので好ましい。
【0018】
(2)分析される分子の有している官能基
本発明においては、分析される分子を誘導体化剤と試料支持部材上で反応させて、質量分析に好適な化合物にして質量分析計に供する。分析される分子の有している官能基としては、誘導体化剤と反応しやすく、反応してできたものが質量分析において悪影響を及ぼさないものであれば特に限定はないが、アルデヒド基、カルボキシル基、アミノ基、メルカプト基又は水酸基が好ましい。すなわち、本発明における分析される分子は、アルデヒド基、カルボキシル基、アミノ基、メルカプト基及び水酸基よりなる群から選ばれた1種以上の官能基を有するものであることが好ましい。
【0019】
以下に、本発明における「分析される分子」について、上記好ましい官能基毎に詳しく説明する。
(イ)アルデヒド基を有する「分析される分子」
非還元末端やC2、C4又はC6位のみに置換基をもつヘキソース等のように隣り合うジオールを持つ糖鎖は、過ヨウ素酸酸化によってアルデヒド基を生じるので、「分析される分子」として好ましい。特に、シアル酸を含む糖鎖は、シアル酸のC7−9位のみを選択的に過ヨウ素酸で酸化してアルデヒド基を生じさせることができる。シアル酸のC7−9位の選択的酸化は、例えば、5mMのNaIO4水溶液中で0℃、10〜20分間にわたり反応させることによってなされる。かかる、シアル酸由来のアルデヒド基を有している「分析される分子」は、後述するように、アミノ基、ヒドラジド基等を有する誘導体化剤と反応して、質量分析に供される誘導体化された分子を、容易に試料支持部材上で反応させて好適に得ることができるので、本発明の質量分析法で分析される分子として好ましい。
【0020】
非還元末端にガラクトースを含む糖鎖も好ましい。その非還元末端のガラクトースを特異的にガラクトースオキシダーゼによってC6位を酸化し、アルデヒド基を生じさせることができるからである。酵素反応は、例えば、中性の緩衝液中で、室温、2時間で行うことができる。アミノ基、ヒドラジド基等を有する誘導体化剤を用いて、上記の酵素的酸化により生じたアルデヒド基と、アミノ基やヒドラジド基を、試料支持部材上で縮合反応を行い、次いで要すれば還元することによって、質量分析に供される誘導体化された分子を容易に試料支持部材上で反応させて好適に得ることができる。
【0021】
上記必要に応じて行う還元は特に限定はないが、NaCNBH3、NaBH4、NaBH(OCOCH3)3等の還元剤を加えて、加温又は室温で反応を行うことが好ましい。また、「分析される分子」と誘導体化剤との反応溶液中に始めから還元剤を共存させておくことも可能である。還元することによって、誘導体化された分子が安定するという効果がある。
【0022】
例えば、アルデヒド基を有する「分析される分子」に、例えば、ヒドラジド基を有する誘導体化剤を反応させる化学反応は下記式(1)で表される。
R1CONHNH2 + R2CHO → R1CONHN=CHR2 (1)
[式中、R1、R2は、互いに独立に任意の有機基を示す。]
【0023】
還元は、例えば上記の場合、化学反応は下記式(2)で表される。
R1CONHN=CHR2 → R1CONHNH−CH2R2 (2)
[式中、R1、R2は、互いに独立に任意の有機基を示す。]
【0024】
シアル酸やガラクトース等に標識を行う上記の方法を、糖タンパク質分子上のシアル酸やガラクトース等に適用することも可能である。その場合、糖タンパク質分子を標識できるので、該分子のイオン化効率が高くなり、質量分析が特に高感度になるので好ましい。また、本発明は、糖鎖を遊離することなく、分子上の糖鎖を標識するので、糖鎖を含むタンパク質のタンデム質量分析スペクトル解析ができ、タンパク質のペプチド鎖上の糖鎖構造の有無及び糖鎖結合位置が特定できる。
【0025】
糖タンパク質の機能を解明する上で、糖鎖がペプチド鎖上のどこの位置に、どのような構造を有して付加しているのかを明らかにすることは極めて重要である。多くの場合、複数の異なる構造の糖鎖がペプチド鎖の複数の結合位置に結合しているので、糖鎖の位置と構造の対応を明確にする必要がある。本発明は、標識された糖鎖部分の糖鎖構造情報を得ることを可能とする。従って、本発明における「分析される分子」として、糖タンパク質は特に好ましい。
【0026】
(ロ)カルボキシル基、アミノ基、メルカプト基等を有する「分析される分子」
例えば、タンパク質や糖タンパク質は、その中に含まれるカルボキシル基、アミノ基、メルカプト基等を用いて誘導体化剤と反応させることができる。「分析される分子」の中に含まれるカルボキシル基を用いて反応させる場合には、それらと、アミノ基、ヒドラジド基、ジアゾメチル基等を有する誘導体化剤とを試料支持部材上で反応させることによって、質量分析に供される化合物を好適に得ることができる。また、「分析される分子」中のカルボキシル基は、誘導体化剤であるヨウ化メチルやトリメチルシリルジアゾメタンと反応してメチルエステルとなり、質量分析に供される誘導体化された分子を、容易に試料支持部材上での反応により得ることができる。必要に応じて、脱水縮合剤を加えて反応させることもできる。シアル酸を有する分子の場合には、シアル酸のカルボキシル基を用いてもよい。
【0027】
また、「分析される分子」の中に含まれるアミノ基を用いて反応させる場合には、スクシニミジルエステル基、塩化スルホニル基等を有する誘導体化剤を反応させることによって、質量分析に供される誘導体化された分子を、試料支持部材上での反応で容易に好適に得ることができる。
【0028】
また例えば、タンパク質や糖タンパク質に含まれるシステイン残基等のメルカプト基を用いて反応させる場合には、ヨード基(−I)等を有する誘導体化剤を反応させることによって、質量分析に供される誘導体化された分子を試料支持部材上で好適に得ることができる。
【0029】
2.誘導体化剤
上記の官能基を有する「分析される分子」は、誘導体化剤を反応させることによって、質量分析に供される分子を得る。誘導体化剤は特に限定はないが、誘導体化された分子すなわち質量分析に供される分子のイオン化効率を高めるものであることが好ましい。レーザー脱離イオン化法においてイオン化効率を高めるものであっても、エレクトロスプレーイオン化法においてイオン化効率を高めるものであってもよい。質量分析法におけるマトリクス分子としての効果を有する化合物、又はそれらに後記する反応性官能基やスペーサ部分を更に有する化合物も好ましい。
【0030】
かかる誘導体化剤の化学構造は上記効果を奏するものであれば特に限定はないが、その分子内にナフタレン、アントラセン、ピレン等の縮合多環を有する縮合多環誘導体化合物等が上記効果を好適に奏するので特に好ましい。ここで「縮合多環誘導体化合物」とは、窒素、硫黄又は酸素分子を含む複素環を一部に含んでいてもよい縮合多環部分と、「分析される分子」と結合することが可能である反応性官能基と、要すれば、該縮合多環部分と該反応性官能基とを連結するスぺーサ部分とを有する化合物をいう。特に、芳香族環を有する化合物であることが更に好ましい。
【0031】
誘導体化剤は、分析される分子に反応することによって、誘導体化された分子すなわち質量分析に供される分子の、イオン化切断位置を制御できるようにするものであることが好ましい。
【0032】
誘導体化剤は、「分析される分子」の項で記載した官能基を有するものが好適に用いられる。すなわち、アミノ基、ヒドラジド基、ジアゾメチル基、スクシニミジルエステル基、塩化スルホニル基、ヨード基(−I)等を有する誘導体化剤が好ましい。特に好ましい誘導体化剤としては、具体的には、ナフタレン環、アントラセン環、ピレン環等の縮合多環に、上記基が直接若しくは他の基(スペーサ部分)を介して結合した縮合多環誘導体化合物;ヨウ化メチル;ジアゾメタン;トリメチルシリルジアゾメタン等が挙げられる。
【0033】
このうち、誘導体化された分子すなわち質量分析に供される分子のイオン化効率を高めたり、イオン化切断位置を制御できるようにしたりする点等で、ピレン誘導体化合物が特に好ましい。ここで「ピレン誘導体化合物」とは、ピレン環と、「分析される分子」に結合することが可能である反応性官能基と、要すれば該ピレン環と該反応性官能基とを連結するスペーサ部分とを有する化合物をいう。
【0034】
具体的には、1−ピレンブタン酸ヒドラジド(1-pyrenebutanoic acid, hydrazide)(以下、「PBH」と略記する)、1−ピレン酢酸ヒドラジド(1-pyreneacetic acid, hydrazide)、1−ピレンプロピオン酸ヒドラジド(1-pyrenepropionic acid, hydrazide)、1−ピレン酢酸スクシニミジルエステル(1-pyreneacetic acid, succinimidyl ester)、1−ピレンプロピオン酸スクシニミジルエステル(1-pyrenepropionic acid, succinimidyl ester)、1−ピレンブタン酸スクシニミジルエステル(1-pyrenebutanoic acid, succinimidyl ester)、N−(1−ピレンブタノイル)システイン酸スクシニミジルエステル(N-(1-pyrenebutanoyl)cysteic acid, succinimidyl ester)、N−(1−ピレン)ヨードアセトアミド(N-(1-pyrene) iodoacetamide)、N−(1−ピレン)ヨードマレイミド(N-(1-pyrene) maleimide)、N−(1−ピレンメチル)ヨードアセトアミド(N-(1-pyrenemethyl) iodoacetamide)、1−ピレンメチルヨードアセテート(1-pyrenemethyl iodoacetate)、アミノピレン(aminopyrene)、1−ピレンメチルアミン(1-pyrenemethyl amine)、1−ピレンプロピルアミン(3-(1-pyrenyl)propylamine)、1−ピレンブチルアミン(4-(1-pyrenyl)butylamine)、1−ピレンスルホン酸クロリド(1-pyrenesulfonyl chloride)、1−ピレニルジアゾメタン(1-pyrenyldiazomethane)(以下、「PDAM」と略記する)、1−ピレンカルバルデヒド ヒドラゾン(1-pyrenecarbaldehyde hydrazone)、1−ピレニルチオシアネート(1-pyrenylthiocyanate)、1−ピレニルイソチオシアネート(1-pyrenylisothiocyanate)等が好ましいものとして挙げられる。このうち最も好ましくはPBH又はPDAMである。
【0035】
誘導体化剤としては、上記具体的化合物において、ピレン環を、ナフタレン環又はアントラセン環に代えたものも好ましいものとして挙げられる。また、ヨウ化メチル、ジアゾメタン又はトリメチルシリルジアゾメタンも好ましい。
【0036】
3.分析される分子と誘導体化剤の組み合わせ
好ましい「分析される分子」と誘導体化剤との組み合わせとしては、「分析される分子」がアルデヒド基を含有する糖鎖を有する分子であり、誘導体化剤がアミノ基又はヒドラジド基等を有するものである場合が挙げられる。また、好ましい組み合わせとしては、「分析される分子」が、カルボキシル基、アミノ基又はメルカプト基を有するタンパク質若しくは糖タンパク質であり、誘導体化剤が、アミノ基、ヒドラジド基又はジアゾメチル基等を有するものである場合が挙げられ、更に、「分析される分子」が、カルボキシル基を有するタンパク質若しくは糖タンパク質であり、誘導体化剤がヨウ化メチル又はトリメチルシリルジアゾメタンである場合が挙げられる。これらの組み合わせは、「分析される分子」及び誘導体化剤を、容易に試料支持部材上で反応させることができる点、イオン化を阻害しない点、反応が選択的である点、一般に微量での分析の必要性が高いので上記効果を奏しやすい点等で好ましい。
【0037】
4.工程
本発明は、少なくとも、工程(1)、(2)、(3)及び(4)
(1)分析される分子及び誘導体化剤を、質量分析法に用いる試料支持部材上に載せる工程、
(2)分析される分子及び誘導体化剤を試料支持部材上で反応させる工程、
(3)試料支持部材上の、反応して生成した分析される分子の誘導体を質量分析計に供する工程、
(4)分析される分子の誘導体をイオン化する工程
を有することを特徴とする分子の質量分析法である。以下に、それぞれの工程について記載する。
【0038】
(1)分析される分子及び誘導体化剤を質量分析法に用いる試料支持部材上に載せる工程
「分析される分子」は、溶媒に溶解又は分散した状態で載せることが好ましい。特に好ましくは、均一に載せることができる点で溶解した方がよい。試料支持部材上に載せる「分析される分子」の量は特に限定はないが、1amol〜100pmolが本発明の前記効果を奏するために好ましく、1fmol〜1pmolが特に好ましい。また、試料支持部材上に載せる「分析される分子」溶液の液量は特に限定はないが、溶液全体又は分散液全体として10pL〜50μLが好ましく、10nL〜500nLが特に好ましい。溶媒としては特に限定はないが、水、エタノール、ジメチルスルホキシド(以下、「DMSO」と略記する)等やそれらの混液等が挙げられる。「分析される分子」を溶解又は分散している溶媒が、誘導体化剤を溶解する溶媒と異なる場合は、乾かしてから誘導体化剤を載せることが好ましい。また、「分析される分子」を含むもの、例えば、生体の組織、細胞、体液や分泌液(血液、尿、唾液、涙液等)等のような生体試料等を、「質量分析法に用いる試料支持部材」上に直接載せることもできるが、その場合には、組織は超薄切片にしたり、細胞は分散状態で載せたり、体液や分泌液は塗布したりして、必要に応じて乾燥したり、メタノールやエタノール等で固定したりすることが好ましい。
【0039】
誘導体化剤は、溶媒に溶解又は分散した状態で載せる。好ましくは、最小量を均一に載せることができる点で溶媒に溶解した方がよい。試料支持部材上に載せる誘導体化剤の量は特に限定はないが、1fmol〜10nmolが好ましく、10pmol〜1nmolが特に好ましい。液量は特に限定はないが、溶液全体又は分散液全体として1nL〜5μLが好ましく、10nL〜500nLが特に好ましい。溶媒としては特に限定はないが、誘導体化剤及び分析される分子の溶解性及び揮発性の点で、DMSO、イソプロパノール、n−ブタノール等が好ましい。特に好ましくは、DMSOである。
【0040】
誘導体化剤を先に試料支持部材上に載せてもよく、誘導体化剤をメタノールやエタノール等揮発性の高い溶媒で溶解し、試料支持部材上に載せた後溶媒を揮発させてから、DMSO等に溶解した分析される分子を載せることが好ましい。また、分析される分子及び誘導体化剤をDMSO等の溶媒に溶解する場合は、どちらを先に試料支持部材上に載せてもよく、載せる度に乾燥及び/又は反応させてもよいし、乾燥又は/反応を実質的にさせずに次のものを載せて、その後に乾燥及び/又は反応をさせてもよい。更に、分析される分子及び誘導体化剤をDMSO等に溶解する場合は、両者を混合したものを試料支持部材に載せてもよい。誘導体化剤は1種を用いてもよいし、2種以上を用いてもよい。また、誘導体化剤を2種以上用いる場合、例えば、試料支持部材上に分析される分子を載せて乾燥後、誘導体化剤Aを載せて、乾燥及び/又は反応をさせた後に、誘導体化剤Bを載せて、乾燥及び/又は反応させることも好ましい。
【0041】
例えば、上記化学反応式(1)で表される化学反応は、従来は、通常、メタノール、DMSO等の有機溶媒中(溶液として10μL〜100μL)で、触媒としての酢酸等の存在下又は非存在下において、例えば糖鎖と大過剰の反応試薬とを加温(例えば80℃)して行ったが、本発明では、試料支持部材上で反応を行うことにより、DMSO中(50nL〜500nL)で、例えば糖鎖(1fmol〜500fmol)と誘導体化剤(1pmol〜100pmol)を反応させて高収率を得るという極めて微量の反応系を容易に実現させることができた。なお、括弧内は、糖鎖と誘導体化剤とを、化学反応式(1)を用いて反応させるときのそれぞれの最も好ましい使用量を示す。
【0042】
その他、必要であれば、「分析される分子」と誘導体化剤のみを先に反応後、還元剤等を、更に試料支持部材上に溶媒に溶解又は分散した状態で載せる。また、還元剤を誘導体化剤と混合して試料支持部材に載せても、操作が一工程で済むので好ましい。試料支持部材上に載せる還元剤等の量は特に限定はないが、1pmol〜1nmolが好ましく、10pmol〜500pmolがイオン化を阻害しない点で特に好ましい。液量は特に限定はないが、溶液全体又は分散液全体として10pL〜50μLが好ましく、10nL〜500nLが特に好ましい。
【0043】
(2)分析される分子及び誘導体化剤を試料支持部材上で反応させる工程
反応は、試料支持部材を−30℃〜100℃に維持することにより行うことが好ましい。反応温度は特に好ましくは、20℃〜80℃であり、より好ましくは40℃〜60℃である。反応時間は反応の種類毎に及び/又は溶媒の種類毎に、最適な範囲を選べばよいが、溶媒が乾く時間が好ましい。通常1分〜24時間、好ましくは2分〜20分である。
【0044】
反応終了後、溶媒が残っている場合は、溶媒を除去する。真空デシケーター等を用いる場合は、室温で通常10分〜24時間程度維持することが好ましい。
【0045】
レーザー脱離イオン化法を用いる場合、マトリクス分子を共存させてもよい。反応終了後、試料支持部材上の溶媒を除去後、マトリクス分子、又はマトリクス分子の溶液を載せてMALDI−MS測定を行う。マトリクス分子としては特に限定はなく、公知のものが使用可能であり、2,5−ジヒドロキシ安息香酸(以下、「DHBA」と略記する)、1,5−ジアミノナフタレン、nor−Harman(9H−ピリド[3,4−b]インドール)等が挙げられる。
【0046】
この他、前記誘導体化剤もマトリクス分子として好ましい。更には、前記誘導体化剤を試料支持部材上で反応させる工程で、前記誘導体化剤が「分析される分子」以外の分子と反応して得られた副産物も好ましい。かかる副産物としては、PBHを誘導体化剤として用いた場合のPBHの副産物;PDAMを誘導体化剤として用いた場合、1−ピレニルメチルアルコール等のPDAMの副産物等が挙げられる。
【0047】
マトリクス分子としてはピレン誘導体等も好ましい。ピレン誘導体のうち、特に好ましくは、PBH、PDAM、1−ピレニルメチルアルコール等である。誘導体化剤としてPBH、PDAM等を用いた場合、未反応のPBH、PDAM等のみでもよいが、反応後新たにPBH、PDAM等の誘導体化剤を追加してもよい。マトリクス分子は単独でもよいし、2種以上の化合物を用いてもよい。「2種以上」については、例えば、(未反応物、反応後の追加物及び/又は副産物としての)ピレン誘導体と、DHBA、nor−Harman等の公知のマトリクス分子の組み合わせも好ましい。
【0048】
試料支持部材上に載せるマトリクス分子の量は特に限定はないが、マトリクス分子として、0.1μg〜20μgが好ましく、0.2μg〜1μgが特に好ましい。溶媒としては特に限定はないが、分析される分子とマトリクスがよく混和する点で、エタノール−水、アセトニトリル−水の混液等が好ましい。特に好ましくは、アセトニトリル−水の混液である。
【0049】
「試料支持部材」とは、分子が反応できる場を提供する表面をもち、実質的に全量を質量分析に供し得るものであれば特に限定されないが、好ましくは、ステンレス等で成形されたターゲットプレート等のサンプルプレート、オートサンプラー用サンプル管等の分析試料を分析装置に供給専用のサンプル管、ミクロウエルプレート、ニトロセルロース膜、ポリフッ化ビニリデン(PVDF)膜等である。特に好ましくは、質量分析に供するサンプルプレートである。サンプルプレートは表面が金でコーティングされていたり、化学的あるいは物理的処理がしてあってもよい。
【0050】
本発明において、「試料支持部材上に載せる」という表現は、例えば上記サンプル管の内壁上に載せることも意味する。すなわち、「試料支持部材」には板状、皿状のみならず、容器状のものも含まれ、「上に載せる」は、容器状のものの中に載せる、すなわち容器状のものの中に入れることをも含むものである。
【0051】
本発明を実施しない場合、反応後、過剰の誘導体化剤等を除くために、有機溶媒−水混液による抽出やC18等のカラムによる分離操作が必要であり、微量の生体試料由来の糖鎖等にこれらの操作を行うと、工程毎に減量して最終的に検出が困難になる場合があった。しかしながら、本発明によると、試料支持部材上で直接反応を行うことで試料の損失もなく、反応溶液が最小量であるため過剰量の反応試薬を用いる必要もない。従って、そのままではイオン化しにくい糖鎖等の質量分析において、簡便で効率よく分子イオンを多く生成させることができ、結果として十分な感度を得ることができる。
【0052】
試験管やフラスコ内で起こる反応は、該試料支持部材上でも起こることは想像できる。しかしながら、従来は、撹拌できないことやふたをしないと乾固すること等のため反応が不十分であるとされていたため、試料支持部材上で反応させようとは通常考えられていなかった。また、未反応の誘導体化剤がイオン化を阻害する場合もあるとして、反応収率を上げたり、精製をしたりする必要があると考えられていたため、本発明を想到できなかったと考えられる。
【0053】
本発明は、(a)微量物質の分析(例えば、微量の生体試料由来の糖鎖あるいは微量の生体試料中の糖鎖等の分析)に、(b)誘導体化剤を反応させること、(c)その反応を試料支持部材上で進行させること、を組み合わせるものであるが、それらを組み合わせることで、反応に用いる試料を実質的に全て分析される分子として用いることができることや、未反応誘導体化剤やその副産物がイオン化を阻害しないために、(a)(b)(c)が組み合わされて初めて相乗効果が認められたものである。
【0054】
更には、未反応の誘導体化剤や、誘導体化剤が「分析される分子」以外の分子と反応してなる副産物が、イオン化を阻害しないのみならず、むしろ促進する(マトリクスとして働く)場合もあるために、本発明が前記効果を奏したものと考えられる。本発明において、工程(2)は必須の工程ではあるが、本発明は、誘導体化剤と「分析される分子」が反応して生成した反応物だけがイオン化を促進している場合のみには限定されない。
【0055】
(3)試料支持部材上の、反応して生成した分析される分子の誘導体を質量分析計に供する工程
本発明の質量分析法に用いられる質量分析計は公知のものが使用できる。レーザー脱離イオン化法によって測定する場合、反応終了後、溶媒を除去した試料支持部材をそのまま質量分析計に供することができる。MALDI法によって測定する場合、反応終了後、溶媒を除去した試料支持部材にマトリクスを載せた後、そのまま質量分析計に供することができる。ESI法によって測定する場合は、試料支持部材上の分析される分子を、酢酸アンモニウム水溶液−アセトニトリル混液等に溶解して、フローインジェクションあるいはカラムを介して液体クロマトグラフ質量分析計に注入する。この場合、試料支持部材はオートサンプラーに供するサンプル管が好ましい。
【0056】
(4)分析される分子の誘導体をイオン化する工程
イオン化する方法については特に限定はなく、ナノエレクトロスプレーイオン化(nanoESI)法を含むエレクトロスプレーイオン化(ESI)法、大気圧イオン化(APCI)法、電子衝撃でイオン化したアルゴンやキセノンを中性原子にあてて生じた中性イオンビームを試料にあてるFAB法、スプレーした試料溶液に紫外線をあてイオン化させるフォトスプレー法、加熱してジェット噴霧しそのときの帯電を利用するサーモスプレー法、加熱しないで噴霧するコールドスプレー法、レーザー脱離イオン化(LDI)法、マトリクス支援レーザー脱離イオン化(MALDI)法等が挙げられる。
【0057】
このうち、本発明においては、ナノエレクトロスプレーイオン化(nanoESI)法を含むエレクトロスプレーイオン化(ESI)法が、試料支持部材から直接分析される分子を吸引し質量分析計に注入する点で好ましい。また、レーザー脱離イオン化(LDI)法が、分析される分子と誘導体化剤が試料支持部材上で反応して生成した誘導体が、場合により未反応の誘導体化剤や誘導体化剤の副産物とともに、イオン化効率を向上させたり、切断イオン化位置を制御したり、生成イオンの安定化に寄与したりできる点で好ましい。糖鎖、タンパク質、糖タンパク質、核酸、糖脂質等の生体試料由来の高分子のイオン化は困難であるが、それらの分析される分子と誘導体化剤が試料支持部材上で反応して誘導体を生成することによって、場合により未反応の誘導体化剤や誘導体化剤の副産物とともに、マトリクスによるイオン化効率を更に倍増させる点、試料支持部材上に載せた分析される分子を実質的に全て質量分析計に供することができる点、高分子を好適に1価にイオン化できる点でMALDI法が特に好ましい。
【0058】
レーザー脱離イオン化(LDI)法、マトリクス支援レーザー脱離イオン化(MALDI)法で用いられるレーザーとしては、窒素レーザー(337nm)、YAGレーザー3倍波(355nm)、NdYAGレーザー(256nm)、炭酸ガスレーザー(2940nm)等が挙げられるが、窒素レーザーが好ましい。また、誘導体化剤として、ピレン誘導体化合物等の縮合多環誘導体化合物を用いた場合には、窒素レーザーが特に好ましい。本発明で、分析される分子と誘導体化剤が試料支持部材上で反応して誘導体になることや、未反応の誘導体化剤や誘導体化剤の副産物が共存することによって、レーザー強度を通常の20%〜80%まで減ずることができる。レーザー強度の低下は分解能を向上させる効果がある。
【0059】
次いで、二重収束法、四重極集束法(四重極(Q)フィルター法)、タンデム型四重極(QQ)法、イオントラップ法、飛行時間(TOF)法等を用いて、イオン化した分子を質量/電荷比(m/z)に従って分離し検出する。好ましくは、QIT−TOFである。
【0060】
糖鎖、タンパク質、糖タンパク質、核酸、糖脂質等の分子は、分子量や組成が同じ異性体を多く含むので、誘導体化を行いイオンの生成効率を向上させ、分子のフラグメント化をn回繰り返す(MSn)法が好ましい。本発明は誘導体化剤を試料支持部材上で反応させ標識化し、MSnにより、選択した標識を含むイオンを解析することで、分子中の結合位置等を決定できる。本発明では、MS2(MS/MS)、MS3又はMS4を行なうことが好ましい。以下、「MS2」を「MS/MS」と表す。
【実施例】
【0061】
以下に、実施例を挙げて本発明を更に具体的に説明するが、本発明は、その要旨を超えない限りこれらの実施例に限定されるものではない。特に、ヒドラジド基を有する誘導体化剤であるPBHを用いた実施例で本発明を具体的に説明するが、本発明はその誘導体化剤に限定されるものではなく、他の誘導体化剤であっても、それと実質的に同様の方法を使用して試料支持部材上で反応させて質量分析計に供することが可能である。
【0062】
実施例1
式(3)に示すLacto−N−fucohexaose−I(化合物1)0.5pmolの水溶液0.5μLを、ステンレスターゲットプレートにスポットし乾かした。PBH125pmol及びNaBH3CN300pmolのDMSO溶液0.25μLを、その上に重層し、60℃で10分加熱した。次いで、デシケーター中にプレートを入れ、10分間、真空ポンプで引きDMSOを揮発させた。
【0063】
【化1】

【0064】
マトリクスとして、DHBAの「アセトニトリル/水=50/50(容量比)」溶液(濃度10mg/mL)0.5μLを載せ、室温で乾固し、MALDI−QIT−TOFMS装置AXIMA−QIT(Shimadzu/Kratos社製)で測定した。
【0065】
図1(a)に示したように、[M+Na]+イオンである、m/z1527、及び、図1(b)に示したように、[M−H]−イオンである、m/z1503のシグナルが得られた。比較例1に示した従来法に比べて、反応に用いる試料量は2000分の1以下、操作も30分以内で終了した。
【0066】
比較例1
化合物1水溶液(化合物1を1nmolを含む)を、ねじふた付きガラス反応管に加え乾固させた。500nmolのPBHをメタノール20μLに溶解して反応管に加え、更に、メタノールで希釈した酢酸(酢酸とメタノールの比は体積比で1:8)2μLを加えてふたを完全に閉めた。よく撹拌後、80℃で20分間加熱し、1MのNaOH水溶液を加えて中和した。1.7MのNaBH4溶液30μLを加えて40℃で30分間反応させ、更に1.7MのNaBH4溶液10μLを加えて40℃で30分間反応させた。
【0067】
次いで、過剰の試薬を除去するために以下の操作を行った。純水400μL及びクロロホルム400μLを加えてよく振った後静置した。下層のクロロホルムを捨て、新しいクロロホルム400μLを加えてもう一度抽出した。上層を取り乾固させた。Sep−pak C18カートリッジをメタノール続いて純水で洗浄し、乾固した反応物を純水に溶解してカートリッジに通した。純水でカートリッジを洗浄し、次に、アセトニトリル−純水(体積比6:4)で溶出することによって、PBHで標識、還元された糖を得た。溶媒を留去して遮光して−30℃に保存した。
【0068】
ここまで測定試料調製に要した時間は9時間であり、実施例1が30分であったことに比べて極めて長時間を要した。また、要した化合物1の量は実施例1の約2000倍であった。更に、得られた還元標識糖は、測定まで遮光して−30℃において保存しなければならなかった。
【0069】
実施例2
式(4)に示す不飽和コンドロー2糖△Di−4S(化合物2)、及び、式(5)に示す△Di−6S(化合物3)水溶液(溶質/溶液=100fmol/10nL)10nLを、それぞれ、ステンレスターゲットプレートに微量分注機でスポットし乾かした。PBH(60pmol)DMSO溶液0.1μLをその上に重層し、50℃で7分加熱した。デシケーター中にプレートを入れ、30分真空ポンプで引き、DMSOを揮発させた。マトリクスとして、nor−Harman(9H−ピリド[3,4−b]インドール)の50容量%アセトニトリル溶液(濃度1mg/mL)0.5μLを載せ、室温で乾固し、実施例1と同様の装置で測定した。
【0070】
【化2】

【0071】
【化3】

【0072】
化合物2に誘導体化剤を反応させて得た「△Di−4Sピレン誘導体」から、[M−H]−イオンであるm/z742のシグナルが得られ、PBHが結合したことがわかった(図2a)。
【0073】
m/z742をプリカーサイオンとして選択してMS/MS測定を行った。その結果、化合物3に誘導体化剤を反応させて得た「△Di−6Sピレン誘導体」から、m/z566、m/z584、m/z626のフラグメントイオンシグナルがこの順に減少して得られた(図3a)。
【0074】
一方、化合物2に誘導体化剤を反応させて得た「△Di−4Sピレン誘導体」からは、同じフラグメントイオンが逆の順に減少して検出された(図3b)。
【0075】
更に、m/z626をプリカーサイオンとして、MS3測定を行い、2種の異性体間で異なるフラグメントイオンのパターンが得られた(図4a及びb)。このように、微量でもMS/MSやMS3測定が可能であった。このことは異性体構造を識別するのに必要なフラグメントイオンが得られたことを示している。
【0076】
また、生体試料等から単離された化合物2や化合物3は、通常、本実施例のように試料の量が極めて少なくならざるを得ず、試料支持部材上以外で誘導体化剤と反応させる方法では、到底、MS/MSやMSn(nは3以上の整数)測定はできない。
【0077】
マトリクスとして、nor−Harmanに代えて、DHBA(濃度1mg/mL)0.5μL、又は、1,5−ジアミノナフタレン(濃度1mg/mL)0.5μLを用いても上記と同様の結果が得られた。
【0078】
比較例2
不飽和コンドロー2糖△Di−4S(化合物2)水溶液(溶質/溶液=100fmol/10nL)をステンレスターゲットプレートに微量分注機でスポットした。誘導体化剤を用いずに、nor−Harman(濃度1mg/mL)0.5μLを載せ室温で乾固し、実施例1と同様の装置で測定した。
【0079】
[M−H]−イオンである、m/z458を検出した(図2b)が、同量をターゲットプレートに載せ、誘導体化剤としてPBHを用いてピレン誘導体にした実施例2(図2a)に比較してシグナルは極めて低く、MS/MS測定は困難であった。このため化合物2について、硫酸基がどの位置に結合しているか等の構造同定はできなかった。
【0080】
実施例3
式(4)に示す不飽和コンドロー2糖△Di−4S(化合物2)、及び、式(5)に示す△Di−6S(化合物3)水溶液(溶質/溶液=5fmol/10nL)10nLを用いて、実施例2と同様な操作を行い、実施例1と同様の装置を用いて測定した。図5に示すように、[M−H]−イオンであるm/z742のシグナルが何れからも検出された。
【0081】
実施例4
下記の式(6)に示す合成糖ペプチド(化合物I)100nmol及び500mMのIodoacetamide水溶液10μmolを、20mMの重炭酸アンモニウム水溶液50μL中で、遮光下室温にて1時間反応を行い、システイン残基のアルキル化を行った。
【0082】
【化4】

【0083】
反応混合物を、Sep−Pak C18 lightに適用し、0.1容量%のトリフルオロ酢酸(以下「TFA」と略記する)水溶液で洗浄、「60容量%アセトニトリル−0.1容量%TFA」水溶液で溶出した。このアルキル化糖ペプチド20nmol、β1,4ガラクトース転移酵素4mU、UDP−ガラクトース200nmolを加えた、20μLの「20mMのCaCl2、20mMMnCl2を含む、50mMのHEPES緩衝液(pH7)」中、37℃にて、21時間反応を行った。
【0084】
反応後、上記糖ペプチドは、Sep−Pak C18 lightにより精製した。この糖ペプチドのpositive−ion mode MS測定を行ったところ、ガラクトース1残基分の162Da増加が確認された。
【0085】
アルキル化糖ペプチド20nmol、α2,6シアル酸転移酵素、又は、α2,3シアル酸転移酵素2U、及びCMP−N−アセチルノイラミン酸200nmolを、20μLの「20mMのCaCl2、20mMのMnCl2を含む、100mMのHEPES緩衝液(pH7)」中で、37℃にて21時間反応を行い、この糖ペプチドを、Sep−Pak C18 lightにより精製した。
【0086】
MS測定により、それぞれシアル酸1残基分の291Da増加し、それぞれ、下記式(7)で示されるアルキル化化合物(II)、又は、下記式(8)で示されるアルキル化化合物(III)が生成したことが確認された。
【0087】
【化5】

【0088】
【化6】

【0089】
アルキル化化合物(II)又は(III)を各2nmolに、1mMのNaIO4を10μL加え、遮光下氷上にて、20分間反応を行った。次いで、100倍希釈エチレングリコール0.5μLを加え、遮光下室温にて、20分間放置した。反応混合物を Sep−Pak C18 lightに適用し、0.1容量%TFA水溶液で洗浄、「60容量%アセトニトリル−0.1容量%TFA」水溶液で溶出した。
【0090】
MS測定により、過ヨウ素酸酸化反応で、62Da減少し、シアル酸残基C7−C8間で炭素間結合が切断され、アルデヒド基が1ヶ所生じたことが確認された。
【0091】
このようにして得られた糖ペプチドを、実施例2と同様にして、ステンレスターゲットプレート上でPBHと反応させ、乾燥させた。用いた量もそれぞれ実施例2と同じである。マトリクスとして、1,5−ジアミノナフタレンの「アセトニトリル/水=50/50(容量比)」溶液(濃度5mg/mL)0.5μLを載せ、室温で乾固し、MALDI−QIT−TOFMS装置AXIMA−QIT(Shimadzu/Kratos社製)で測定した。
【0092】
アルキル化化合物(II)を用いたものから、図6aに示したように、[M−H]−イオンであるm/z3383が検出され、PBHが結合したことが確認された。なお、アルキル化化合物(III)を用いたものからも、同様にPBHが結合したことが確認された。
【0093】
また、アミノ酸が6残基遊離したm/z2681をプレカーサーイオンとしてMS/MS解析を行なった。その結果、図6bに示したように、ガラクトースの環開裂3,5A及びN−アセチルグルコサミンの環開裂0,2A断片にPBHが導入されたイオン、m/z585及びm/z794が検出された。
【0094】
一方、アルキル化化合物(III)にPBHを導入した場合は、m/z585は検出されず、m/z794のみが検出された。
【0095】
単離されたアルキル化化合物(I)ないし(III)のように、生体試料等から調製や単離された糖ペプチドは、何れも通常、試料の量が極めて少なくならざるを得ず、従来の工程では、到底MS/MS解析できない。
【0096】
分析される分子と誘導体化剤を反応させる工程を、直接分析装置に供する試料支持部材上で行うことによって、高感度質量分析測定試料調製の簡便化及び高収量化を可能にできた。これにより、用いる試料量を微量にしたまま検出感度を向上させ、イオン化の促進及び生成イオンの安定化を達成することによって、より微量な試料レベルにおいても十分な量の分子イオンを生成させ、質量分析が可能であった。
【0097】
実施例5
プロテオミクスでは、電気泳動によって分離したタンパク質を酵素でゲル内消化して得たペプチド断片の質量分析によってタンパク質を同定するが、糖鎖の同定まで行うにはマイクログラム(μg)の量が必要である。本発明を適用することによって、微量な糖タンパク質を電気泳動した後に、ゲルより回収した糖鎖を同定できたので、以下にその例を示す。
【0098】
[電気泳動及びゲル内消化]
ヒト精液より精製した前立腺特異抗原(以下、「PSA」と略記する)(ケミコン社)50ngを20μLのサンプルバッファー(0.125M Tris−HCl、pH6.8、10質量%メルカプトエタノール(Mercaptoethanol)、4質量%SDS、10質量%ショ糖(Sucrose)、0.004質量%ブロモフェノールブルー(Bromophenol blue))に溶解し、100℃で3分加熱した後、氷中に静置し冷却した。9質量%アクリルアミドゲル上で電気泳動分離後、純水でゲルを軽く洗浄し、CBB染色を行なった。
【0099】
染色されたタンパク質部分のゲルを切り出し、1.5mLチューブに移し、純水、更に50%アセトニトリル水溶液、最後にアセトニトリルで洗浄した。ゲルを乾燥後、還元溶液(10mM DTT、25mM重炭酸アンモニウム、pH8.0、水溶液)を加えて、56℃で1時間、遮光振盪して反応させた。溶液を除き、アルキル化溶液(55mMヨードアセトアミド(Iodoacetamide)水溶液)を加えて、室温で45分間、遮光振盪して反応させた。重炭酸アンモニウム水溶液(25mM、pH8.0)、アセトニトリルで洗浄後、ゲルを乾燥した。
【0100】
上記乾燥したゲルに、Lysyl Endopeptidase溶液(250ng:Wako Mass Spectrometry Grade、25mM重炭酸アンモニウムpH8.0水溶液)を加えて、氷中で45分間、静置膨潤後、37℃で18時間軽く攪拌しながら反応させた。抽出液(75%アセトニトリル、0.1%トリフルオロ酢酸水溶液)を加えて、20分間振盪後、溶液を回収した。
【0101】
遠心濃縮機によって乾固後、PNGase Fを1unit(1unit/μL、1μg AEBSF:Roche、50mM重炭酸アンモニウムpH8.0水溶液)加えて、37℃で18時間、振盪しながら反応させた。反応混合物に1%トリフルオロ酢酸水溶液を1μL加え、C18チップにサンプルを吸引と排出を繰り返してペプチドを吸着させ、溶液中の糖鎖と分離した。カーボングラファイト30mg(GLサイエンス)をマイクロスピンカラムに詰めて洗浄後、C18チップに結合しなかった糖鎖画分をカラムに加えて、5%アセトニトリル0.1%トリフルオロ酢酸水溶液を加え、遠心分離(300×g、1分〜2分)により洗浄した。50%アセトニトリル0.1%トリフルオロ酢酸水溶液を加え、遠心分離(300×g、1分〜2分)により糖鎖を溶出した。回収された糖鎖溶出液を、遠心濃縮機によって乾固し、2μLの純水に溶解して質量分析試料とした。
【0102】
[標識]
ターゲットプレートに、上記で得られた試料0.5μL(約10ngの糖タンパク質由来の糖鎖を含有)をのせて風乾後、PBH(500pmol)のDMSO溶液0.25μLをその上に重層し、50℃で乾燥するまで約15分加熱した。また、別の部分のターゲットプレート上に、試料0.5μLをのせて風乾後、1−ピレニルジアゾメタン(PDAM)(500pmol)のDMSO溶液0.25μLをその上に重層し、40℃で乾燥するまで約25分加熱した。また、別の部分のターゲットプレート上に、試料0.5μLをのせて風乾後、PDAM(500pmol)のDMSO溶液0.25μLをその上に重層し、40℃で乾燥するまで約25分加熱し、更に、PBH(500pmol)のDMSO溶液0.25μLをその上に重層し、50℃で乾燥するまで約15分加熱した。また、対照として、別の部分のターゲットプレート上に、上記で得られた試料0.5μLを載せて風乾した。ターゲットプレートは、デシケーター中で一晩吸引乾燥した。実施例1と同様に質量分析計で測定した。
【0103】
図7に上記試料のMSスペクトルを示す。図7Aは、PSA約10ng由来糖鎖をプレートに載せ、誘導体化剤を加えず、ネガティブイオンを測定したMSスペクトルを示し、図7Bは、同量の糖鎖をプレートに載せ、PBHを添加し反応させた後測定したMSスペクトルを示し、図7Cは、同量の糖鎖をプレートに載せ、PDAMを添加し反応させた後測定したMSスペクトルを示し、図7Dは、同量の糖鎖をプレートに載せPDAMを添加し反応させ、引き続きPBHを添加し反応させた後測定したMSスペクトルを示す。
【0104】
図7では、縦軸のフルスケールを全て同じ20mVにして示した。白矢印は非標識糖鎖イオンを、白星印はPBHで標識された糖鎖イオンを、灰色星印はPDAMで標識された糖鎖イオンを、白星印及び灰色星印を付けた糖鎖イオンはPDAM及びPBHの両誘導体化剤で標識されたことを示す。
【0105】
図7Aに示したように、誘導体化剤を添加しなかった試料はシグナルが検出されなかった(図7、A)。
PBHを加えてプレート上で反応させると、PBH標識された糖鎖bイオンm/z2362が検出された(図7、B)。
別の誘導体化剤PDAMを同一試料に加えて反応させると、下記の3種の糖鎖a、b、cが標識されたイオン、m/z2144、m/z2290、m/z2581が検出された(図7、C)。
更に、試料にPDAMを反応させた後、続けてPBHを反応させると、それぞれ単独に標識された糖鎖イオンの他に、両方の誘導体化剤で標識された下記糖鎖cイオン、m/z2867が検出された(図7、D)。試料にPBHを反応させた後、続けてPDAMを反応させて、誘導体化の順番を逆にしても同様のマススペクトルが得られた。また、これらの測定の際にレーザー強度を通常の80%でも測定できた。
【0106】
【化7】

【0107】
【化8】

【0108】
【化9】

【0109】
泳動後のゲルからのタンパク質回収は最大でも50%くらいであるとされているので、実際にはPSAは5ng相当であったと思われ、従って糖鎖量は最大でも約160fmolしかプレート上に載っていないことになる。なお、この糖鎖量では、図7Aに示したように、誘導体化剤を添加しない場合(非標識の場合)では微量過ぎて測定できない。
【0110】
PBH、PDAM等の誘導体化剤と糖鎖を共に試料支持部材に載せると、誘導体化剤が反応して標識された糖鎖のみでなく、非標識の糖鎖のイオン化も向上する効果があった。この理由として、共雑するペプチド断片のイオン化を抑制すること、及び、これらの誘導体化剤が共存することによってマトリクスに類似した効果を発することが考えられた。特に、PDAMのマトリクス効果は、これ自身とともに、副反応で生成した1−ピレニルメチルアルコールの相乗効果であると考えられた。すなわち、本発明は、上記工程「(2)分析される分子及び誘導体化剤を試料支持部材上で反応させる工程」は必須の工程ではあるが、本発明は、両者の反応物だけが本発明の効果を奏している場合のみには限定されない。
【0111】
図8Aは、PSA約10ng由来糖鎖をプレートに載せ、誘導体化剤を加えずネガティブイオンを測定したMSスペクトル(縦軸300mV)であり、図8Bは、同量の糖鎖をプレートに載せ、PDAMを添加し反応させた後測定したMSスペクトル(縦軸120mV)である。黒矢印はペプチドイオンを、白矢印は糖鎖イオンを示す。
【0112】
PDAMは糖鎖イオン化生成能が強い。図8に示すように、誘導体化剤が添加されなかった場合(図8、A)では、例えば黒矢印で示した低分子側のペプチドのイオンが多く生成し、糖鎖のイオンはほとんど検出されなかった。しかし、PDAMを添加して反応させた後は、例えば黒矢印で示したペプチドイオンは1/10に抑制され、代わりにほとんど検出できなかった糖鎖イオン(白矢印)が優位に生成した(図8、B)。また、標識された糖鎖cイオン(灰色星印)は、MS3解析を行うことができた。
【0113】
実施例6
以下の分子と誘導体化剤とを、試料支持部材上で反応させた後、質量分析を行なうことができる。
(1)分子がアルデヒド基を有する分子(例えば、糖である分子、又は、糖若しくは糖タンパク質を酸化することによってアルデヒド基を有する分子)と、誘導体化剤として以下の第1群の化合物。
(2)分子がアミノ基又はカルボキシル基を有する分子(例えば、糖、タンパク質又は糖タンパク質である分子)と、誘導体化剤として以下の第2群の化合物。
(3)分子がSH基を有する分子(例えば、糖、タンパク質又は糖タンパク質である分子)と、誘導体化剤として、以下の第3群の化合物。
(4)分子がOH基を有する分子(例えば、糖、タンパク質又は糖タンパク質である分子)と、誘導体化剤として、以下の第4群の化合物。
【0114】
第1群:1−ピレンブタン酸ヒドラジド、1−ピレン酢酸ヒドラジド、1−ピレンプロピオン酸ヒドラジド、1−ピレンカルバルデヒド ヒドラゾン(1-pyrenecarbaldehyde hydrazone)、アミノピレン、1−ピレンメチルアミン、1−ピレンプロピルアミン、1−ピレンブチルアミン、及び類似芳香族化合物。
第2群:ヨウ化メチル、トリメチルシリルジアゾメタン、1−ピレン酢酸スクシニミジルエステル、1−ピレンプロピオン酸スクシニミジルエステル、1−ピレンブタン酸スクシニミジルエステル、N−(1−ピレンブタノイル)システイン酸スクシニミジルエステル、1−ピレンスルホン酸クロリド、1−ピレニルジアゾメタン、1−ピレニルチオシアネート、1−ピレニルイソチオシアネート、及び類似芳香族化合物。
第3群:N−(1−ピレン)ヨードアセトアミド、N−(1−ピレン)ヨードマレイミド、N−(1−ピレンメチル)ヨードアセトアミド、1−ピレンメチルヨードアセテート、及び類似芳香族化合物
第4群:ヨウ化メチル、トリメチルシリルジアゾメタン、1−ピレニルジアゾメタン、及び類似芳香族化合物
【産業上の利用可能性】
【0115】
本発明の質量分析法は、分析される試料や反応試薬の量を減らせ、イオン化効率や測定の再現性を向上させることによって、信頼性の高い化学構造についての情報を得ることができるので、特に、糖タンパク質等の微量な生体試料由来あるいは生体試料中の分子に適用して、その機能解明や病態の解明等に広く利用されるものである。
【技術分野】
【0001】
本発明は、分子の質量分析法に関する。
【背景技術】
【0002】
「質量分析法」とは、分子を含む試料をイオン化し、イオン化した分子を質量/電荷(m/z)に従って分離し検出することによって化学構造の情報を得る方法である。
【0003】
糖鎖、タンパク質(ペプチドを含む)、糖タンパク質(糖ペプチドを含む)、核酸、糖脂質等の分子は、マトリクス支援レーザー脱離イオン化質量分析法(MALDI−MS)やエレクトロスプレーイオン化質量分析法(ESI−MS)によって構造情報を得て同定される。これらの分子は、分子イオン([M+Na]+、[M+H]+、[M−H]−等)生成が効率よく起こるかどうかが検出感度に大きく影響する。特に、糖鎖は分子量及び組成が同一の異性体が複数存在するので、分子イオンをプリカーサイオンとして選択し断片化し、更に生じたイオンをプリカーサイオンとして選択し断片化することを繰り返すMSn解析が必須である。
【0004】
一般に、MS/MS測定により得られるイオンのシグナル強度は前段階のイオンの1/10に減少する。従って、多段階MS測定を行うことによって、構造情報は極めて多くなるが、検出感度は低下していくので、はじめの分子イオン生成量が十分に多いことが必要である。
【0005】
しかしながら、前述のような生体試料由来の分子はそのままではイオン化されにくく、また分子の破壊が起りやすいので、十分な量の分子イオンを得ることが難しい。例えば、糖鎖をそのままマトリクス支援レーザー脱離イオン化−飛行時間型質量分析法(MALDI−TOF MS)で解析しようとすると10pmol以上を要する。この問題に対して、4−アミノ安息香酸エチルエステル、2−アミノピリジン、あるいは1−ピレンブタン酸ヒドラジド(1-pyrenebutanoic acid hydrazide;PBH)等を用いて糖鎖を誘導体化する方法が提案されている(例えば、非特許文献1参照)。
【0006】
しかしながら、これらの誘導体化は、質量分析に先立って行われるが、反応操作や過剰の試薬除去の操作が多工程含まれ、時間と労力がかかることに加えて、超微量な生体試料由来の分子に適用しにくいのが現状であった。
【先行技術文献】
【非特許文献】
【0007】
【非特許文献1】Sugahara, D. et al.,Anal.Sci.,19,第167〜169頁(2003)
【発明の概要】
【発明が解決しようとする課題】
【0008】
本発明は上記背景技術に鑑みてなされたものであり、その課題は、分析される分子の量や反応試薬の量を減らし、簡便に高感度質量分析測定用の試料を調製でき、イオン化効率や測定の再現性を向上させることによって、信頼性の高い化学構造についての情報を得ることができる質量分析法を提供することにあり、また特に、糖タンパク質等の微量な生体試料由来の分子、又は生体試料中の分子に適用して、その機能解明や病態の解明に有用な情報を得ることができる質量分析法を提供することにある。
【課題を解決するための手段】
【0009】
本発明者は、上記の課題を解決すべく鋭意検討を重ねた結果、直接質量分析に用いる試料支持部材上で反応を行うことによって、試料が減量することなく、簡便に効率良く分子の安定な誘導体を作成し、イオン化が困難であった分子のイオン化効率の向上及び生成したイオンの安定化を実現して、質量分析の感度を向上させることができることを見いだして本発明を完成するに至った。
【0010】
すなわち、本発明は、分子の質量分析法であって、少なくとも、工程(1)、(2)、(3)及び(4)
(1)分析される分子及び誘導体化剤を、質量分析法に用いる試料支持部材上に載せる工程、
(2)分析される分子及び誘導体化剤を試料支持部材上で反応させる工程、
(3)試料支持部材上の、反応して生成した、分析される分子の誘導体を質量分析計に供する工程、
(4)分析される分子の誘導体をイオン化する工程
を有することを特徴とする質量分析法を提供するものである。
【0011】
また、本発明は、上記質量分析法に用いることを特徴とする誘導体化剤を提供するものである。
【発明の効果】
【0012】
本発明によれば、試料支持部材上で分子に反応試薬を反応させることによって、用いる分子の量及び反応試薬量を減らすことができ(高収量化を可能にし)、緩和な条件で、処理工程で測定分子を減量させることなく、十分な量の分子イオンを生成させることができ、高感度の質量分析法用の試料を簡便に調製できる。その結果、通常の処理工程では、分析可能な量以下になってしまうような微量サンプルしか得られない場合でも質量分析が可能となる。また、その結果、イオン化効率を向上させ、切断イオン化位置を制御したり、生成イオンの安定化を達成し、それにより測定の再現性を向上させることができ、信頼性の高い化学構造情報を得ることができる。また、本発明は微量な生体試料由来の分子や生体試料中の分子に適用できるので、例えば、糖鎖、タンパク質(ペプチドを含む)、糖タンパク質(糖ペプチドを含む)、核酸、糖脂質等の分子の機能解明や病態の解明に有用な情報を得る方法を提供できる。
【図面の簡単な説明】
【0013】
【図1】実施例1において、化合物1にPBHをプレート上で反応させて得たもののMALDI−QIT−TOF質量分析(MS)スペクトルである。 (a)[M+Na]+イオンのピークを示す。(b)[M−H]−イオンのピークを示す。
【図2】(a)実施例2において、化合物2にPBHをプレート上で反応させて得たものの[M−H]−イオンのスペクトルである。 (b)比較例2において、PBHを反応させていない化合物2の[M−H]−イオンのスペクトルである。
【図3】m/z742をプリカーサイオンとして選択して測定したMS/MSスペクトルである(実施例2)。 (a)化合物3にPBHをプレート上で反応させて得たもののMS/MSスペクトル。 (b)化合物2にPBHをプレート上で反応させて得たもののMS/MSスペクトル。
【図4】m/z626をプリカーサイオンとして選択して測定したMS3スペクトルである(実施例2)。 (a)化合物3にPBHをプレート上で反応させて得たもののMS3スペクトル。 (b)化合物2にPBHをプレート上で反応させて得たもののMS3スペクトル。
【図5】実施例3において、PBHをプレート上で反応させて得たもののMALDI−QIT−TOF質量分析(MS)スペクトル([M−H]−イオンのスペクトル)である。 (a)5fmolの化合物3を使用。 (b)5fmolの化合物2を使用。
【図6】実施例4において、アルキル化化合物(II)とPBHを、プレート上で反応させて得たもののMALDI−QIT−TOF質量分析(MS)スペクトルである。 (a)MSスペクトル。 (b)m/z2681をプレカーサーイオンとしたMS/MSスペクトル。
【図7】実施例5で測定したMSスペクトルである。 A:PSA約10ng由来糖鎖をプレートに載せ誘導体化剤を加えずネガティブイオンを測定したMSスペクトル。 B:同量の糖鎖をプレートに載せPBHを添加し反応させた後測定したMSスペクトル。 C:同量の糖鎖をプレートに載せPDAMを添加し反応させた後測定したMSスペクトル。 D:同量の糖鎖をプレートに載せPDAMを添加し反応させ、引き続きPBHを添加し反応させた後測定したMSスペクトル。
【図8】実施例5で測定したMSスペクトルである。 A:PSA約10ng由来糖鎖をプレートに載せ、誘導体化剤を加えずネガティブイオンを測定したMSスペクトルである。 B:同量の糖鎖をプレートに載せ、PDAMを添加し反応させた後測定したMSスペクトルである。
【発明を実施するための形態】
【0014】
以下、本発明について説明するが、本発明は以下の実施の具体的形態に限定されるものではなく、任意に変形して実施することができる。
【0015】
本発明では、分析される分子と誘導体化剤等の反応試薬を、質量分析計に供する試料支持部材上で直接反応させ、反応によって生成した分子の質量分析法による解析を行う。
【0016】
1.分析される分子
(1)分析される分子の種類
「分析される分子」は特に限定はないが、糖、糖鎖、タンパク質、核酸、複合糖質(糖タンパク質、糖脂質等)等であることが、本発明の効果を発揮できるので好ましい。「分析される分子」としては、天然物から調製されるもの、天然物を化学的又は酵素学的に一部改変して調製されるものの他、化学的又は酵素学的に調製されるものも好ましい。また、生体に含まれる分子の部分構造を有するものや生体に含まれる分子を模倣して作製されたものも好ましい。また、質量分析法に用いる試料支持部材上に載せる試料、すなわち、「分析される分子」を含む物体としては、「分析される分子」そのものだけでもよいし、「分析される分子」を含むもの、例えば、生体の組織、細胞、体液や分泌物(例えば、血液、血清、尿、精液、唾液、涙液、汗、糞便等)等でもよい。すなわち、直接生体試料を用いてもよい。また、試料を試料支持部材上に載せ、酵素処理等を行なって、分析される分子を調製してもよい。なお、本発明における用語「タンパク質」はペプチドを含み、「糖タンパク質」は糖ペプチドを含む。
【0017】
上記した分子は、分析に供される試料が少量である場合が多く、また特に、糖、糖鎖、糖タンパク質や糖脂質等の複合糖質等又はそれらから化学的若しくは酵素学的に遊離させて得たもの(以下、それらを全て「糖鎖」と略記する)は、分子量や組成が同一の異性体が複数存在するので、本発明の質量分析法は、それら分子の化学構造解析に対して特に上記効果を奏するので好ましい。
【0018】
(2)分析される分子の有している官能基
本発明においては、分析される分子を誘導体化剤と試料支持部材上で反応させて、質量分析に好適な化合物にして質量分析計に供する。分析される分子の有している官能基としては、誘導体化剤と反応しやすく、反応してできたものが質量分析において悪影響を及ぼさないものであれば特に限定はないが、アルデヒド基、カルボキシル基、アミノ基、メルカプト基又は水酸基が好ましい。すなわち、本発明における分析される分子は、アルデヒド基、カルボキシル基、アミノ基、メルカプト基及び水酸基よりなる群から選ばれた1種以上の官能基を有するものであることが好ましい。
【0019】
以下に、本発明における「分析される分子」について、上記好ましい官能基毎に詳しく説明する。
(イ)アルデヒド基を有する「分析される分子」
非還元末端やC2、C4又はC6位のみに置換基をもつヘキソース等のように隣り合うジオールを持つ糖鎖は、過ヨウ素酸酸化によってアルデヒド基を生じるので、「分析される分子」として好ましい。特に、シアル酸を含む糖鎖は、シアル酸のC7−9位のみを選択的に過ヨウ素酸で酸化してアルデヒド基を生じさせることができる。シアル酸のC7−9位の選択的酸化は、例えば、5mMのNaIO4水溶液中で0℃、10〜20分間にわたり反応させることによってなされる。かかる、シアル酸由来のアルデヒド基を有している「分析される分子」は、後述するように、アミノ基、ヒドラジド基等を有する誘導体化剤と反応して、質量分析に供される誘導体化された分子を、容易に試料支持部材上で反応させて好適に得ることができるので、本発明の質量分析法で分析される分子として好ましい。
【0020】
非還元末端にガラクトースを含む糖鎖も好ましい。その非還元末端のガラクトースを特異的にガラクトースオキシダーゼによってC6位を酸化し、アルデヒド基を生じさせることができるからである。酵素反応は、例えば、中性の緩衝液中で、室温、2時間で行うことができる。アミノ基、ヒドラジド基等を有する誘導体化剤を用いて、上記の酵素的酸化により生じたアルデヒド基と、アミノ基やヒドラジド基を、試料支持部材上で縮合反応を行い、次いで要すれば還元することによって、質量分析に供される誘導体化された分子を容易に試料支持部材上で反応させて好適に得ることができる。
【0021】
上記必要に応じて行う還元は特に限定はないが、NaCNBH3、NaBH4、NaBH(OCOCH3)3等の還元剤を加えて、加温又は室温で反応を行うことが好ましい。また、「分析される分子」と誘導体化剤との反応溶液中に始めから還元剤を共存させておくことも可能である。還元することによって、誘導体化された分子が安定するという効果がある。
【0022】
例えば、アルデヒド基を有する「分析される分子」に、例えば、ヒドラジド基を有する誘導体化剤を反応させる化学反応は下記式(1)で表される。
R1CONHNH2 + R2CHO → R1CONHN=CHR2 (1)
[式中、R1、R2は、互いに独立に任意の有機基を示す。]
【0023】
還元は、例えば上記の場合、化学反応は下記式(2)で表される。
R1CONHN=CHR2 → R1CONHNH−CH2R2 (2)
[式中、R1、R2は、互いに独立に任意の有機基を示す。]
【0024】
シアル酸やガラクトース等に標識を行う上記の方法を、糖タンパク質分子上のシアル酸やガラクトース等に適用することも可能である。その場合、糖タンパク質分子を標識できるので、該分子のイオン化効率が高くなり、質量分析が特に高感度になるので好ましい。また、本発明は、糖鎖を遊離することなく、分子上の糖鎖を標識するので、糖鎖を含むタンパク質のタンデム質量分析スペクトル解析ができ、タンパク質のペプチド鎖上の糖鎖構造の有無及び糖鎖結合位置が特定できる。
【0025】
糖タンパク質の機能を解明する上で、糖鎖がペプチド鎖上のどこの位置に、どのような構造を有して付加しているのかを明らかにすることは極めて重要である。多くの場合、複数の異なる構造の糖鎖がペプチド鎖の複数の結合位置に結合しているので、糖鎖の位置と構造の対応を明確にする必要がある。本発明は、標識された糖鎖部分の糖鎖構造情報を得ることを可能とする。従って、本発明における「分析される分子」として、糖タンパク質は特に好ましい。
【0026】
(ロ)カルボキシル基、アミノ基、メルカプト基等を有する「分析される分子」
例えば、タンパク質や糖タンパク質は、その中に含まれるカルボキシル基、アミノ基、メルカプト基等を用いて誘導体化剤と反応させることができる。「分析される分子」の中に含まれるカルボキシル基を用いて反応させる場合には、それらと、アミノ基、ヒドラジド基、ジアゾメチル基等を有する誘導体化剤とを試料支持部材上で反応させることによって、質量分析に供される化合物を好適に得ることができる。また、「分析される分子」中のカルボキシル基は、誘導体化剤であるヨウ化メチルやトリメチルシリルジアゾメタンと反応してメチルエステルとなり、質量分析に供される誘導体化された分子を、容易に試料支持部材上での反応により得ることができる。必要に応じて、脱水縮合剤を加えて反応させることもできる。シアル酸を有する分子の場合には、シアル酸のカルボキシル基を用いてもよい。
【0027】
また、「分析される分子」の中に含まれるアミノ基を用いて反応させる場合には、スクシニミジルエステル基、塩化スルホニル基等を有する誘導体化剤を反応させることによって、質量分析に供される誘導体化された分子を、試料支持部材上での反応で容易に好適に得ることができる。
【0028】
また例えば、タンパク質や糖タンパク質に含まれるシステイン残基等のメルカプト基を用いて反応させる場合には、ヨード基(−I)等を有する誘導体化剤を反応させることによって、質量分析に供される誘導体化された分子を試料支持部材上で好適に得ることができる。
【0029】
2.誘導体化剤
上記の官能基を有する「分析される分子」は、誘導体化剤を反応させることによって、質量分析に供される分子を得る。誘導体化剤は特に限定はないが、誘導体化された分子すなわち質量分析に供される分子のイオン化効率を高めるものであることが好ましい。レーザー脱離イオン化法においてイオン化効率を高めるものであっても、エレクトロスプレーイオン化法においてイオン化効率を高めるものであってもよい。質量分析法におけるマトリクス分子としての効果を有する化合物、又はそれらに後記する反応性官能基やスペーサ部分を更に有する化合物も好ましい。
【0030】
かかる誘導体化剤の化学構造は上記効果を奏するものであれば特に限定はないが、その分子内にナフタレン、アントラセン、ピレン等の縮合多環を有する縮合多環誘導体化合物等が上記効果を好適に奏するので特に好ましい。ここで「縮合多環誘導体化合物」とは、窒素、硫黄又は酸素分子を含む複素環を一部に含んでいてもよい縮合多環部分と、「分析される分子」と結合することが可能である反応性官能基と、要すれば、該縮合多環部分と該反応性官能基とを連結するスぺーサ部分とを有する化合物をいう。特に、芳香族環を有する化合物であることが更に好ましい。
【0031】
誘導体化剤は、分析される分子に反応することによって、誘導体化された分子すなわち質量分析に供される分子の、イオン化切断位置を制御できるようにするものであることが好ましい。
【0032】
誘導体化剤は、「分析される分子」の項で記載した官能基を有するものが好適に用いられる。すなわち、アミノ基、ヒドラジド基、ジアゾメチル基、スクシニミジルエステル基、塩化スルホニル基、ヨード基(−I)等を有する誘導体化剤が好ましい。特に好ましい誘導体化剤としては、具体的には、ナフタレン環、アントラセン環、ピレン環等の縮合多環に、上記基が直接若しくは他の基(スペーサ部分)を介して結合した縮合多環誘導体化合物;ヨウ化メチル;ジアゾメタン;トリメチルシリルジアゾメタン等が挙げられる。
【0033】
このうち、誘導体化された分子すなわち質量分析に供される分子のイオン化効率を高めたり、イオン化切断位置を制御できるようにしたりする点等で、ピレン誘導体化合物が特に好ましい。ここで「ピレン誘導体化合物」とは、ピレン環と、「分析される分子」に結合することが可能である反応性官能基と、要すれば該ピレン環と該反応性官能基とを連結するスペーサ部分とを有する化合物をいう。
【0034】
具体的には、1−ピレンブタン酸ヒドラジド(1-pyrenebutanoic acid, hydrazide)(以下、「PBH」と略記する)、1−ピレン酢酸ヒドラジド(1-pyreneacetic acid, hydrazide)、1−ピレンプロピオン酸ヒドラジド(1-pyrenepropionic acid, hydrazide)、1−ピレン酢酸スクシニミジルエステル(1-pyreneacetic acid, succinimidyl ester)、1−ピレンプロピオン酸スクシニミジルエステル(1-pyrenepropionic acid, succinimidyl ester)、1−ピレンブタン酸スクシニミジルエステル(1-pyrenebutanoic acid, succinimidyl ester)、N−(1−ピレンブタノイル)システイン酸スクシニミジルエステル(N-(1-pyrenebutanoyl)cysteic acid, succinimidyl ester)、N−(1−ピレン)ヨードアセトアミド(N-(1-pyrene) iodoacetamide)、N−(1−ピレン)ヨードマレイミド(N-(1-pyrene) maleimide)、N−(1−ピレンメチル)ヨードアセトアミド(N-(1-pyrenemethyl) iodoacetamide)、1−ピレンメチルヨードアセテート(1-pyrenemethyl iodoacetate)、アミノピレン(aminopyrene)、1−ピレンメチルアミン(1-pyrenemethyl amine)、1−ピレンプロピルアミン(3-(1-pyrenyl)propylamine)、1−ピレンブチルアミン(4-(1-pyrenyl)butylamine)、1−ピレンスルホン酸クロリド(1-pyrenesulfonyl chloride)、1−ピレニルジアゾメタン(1-pyrenyldiazomethane)(以下、「PDAM」と略記する)、1−ピレンカルバルデヒド ヒドラゾン(1-pyrenecarbaldehyde hydrazone)、1−ピレニルチオシアネート(1-pyrenylthiocyanate)、1−ピレニルイソチオシアネート(1-pyrenylisothiocyanate)等が好ましいものとして挙げられる。このうち最も好ましくはPBH又はPDAMである。
【0035】
誘導体化剤としては、上記具体的化合物において、ピレン環を、ナフタレン環又はアントラセン環に代えたものも好ましいものとして挙げられる。また、ヨウ化メチル、ジアゾメタン又はトリメチルシリルジアゾメタンも好ましい。
【0036】
3.分析される分子と誘導体化剤の組み合わせ
好ましい「分析される分子」と誘導体化剤との組み合わせとしては、「分析される分子」がアルデヒド基を含有する糖鎖を有する分子であり、誘導体化剤がアミノ基又はヒドラジド基等を有するものである場合が挙げられる。また、好ましい組み合わせとしては、「分析される分子」が、カルボキシル基、アミノ基又はメルカプト基を有するタンパク質若しくは糖タンパク質であり、誘導体化剤が、アミノ基、ヒドラジド基又はジアゾメチル基等を有するものである場合が挙げられ、更に、「分析される分子」が、カルボキシル基を有するタンパク質若しくは糖タンパク質であり、誘導体化剤がヨウ化メチル又はトリメチルシリルジアゾメタンである場合が挙げられる。これらの組み合わせは、「分析される分子」及び誘導体化剤を、容易に試料支持部材上で反応させることができる点、イオン化を阻害しない点、反応が選択的である点、一般に微量での分析の必要性が高いので上記効果を奏しやすい点等で好ましい。
【0037】
4.工程
本発明は、少なくとも、工程(1)、(2)、(3)及び(4)
(1)分析される分子及び誘導体化剤を、質量分析法に用いる試料支持部材上に載せる工程、
(2)分析される分子及び誘導体化剤を試料支持部材上で反応させる工程、
(3)試料支持部材上の、反応して生成した分析される分子の誘導体を質量分析計に供する工程、
(4)分析される分子の誘導体をイオン化する工程
を有することを特徴とする分子の質量分析法である。以下に、それぞれの工程について記載する。
【0038】
(1)分析される分子及び誘導体化剤を質量分析法に用いる試料支持部材上に載せる工程
「分析される分子」は、溶媒に溶解又は分散した状態で載せることが好ましい。特に好ましくは、均一に載せることができる点で溶解した方がよい。試料支持部材上に載せる「分析される分子」の量は特に限定はないが、1amol〜100pmolが本発明の前記効果を奏するために好ましく、1fmol〜1pmolが特に好ましい。また、試料支持部材上に載せる「分析される分子」溶液の液量は特に限定はないが、溶液全体又は分散液全体として10pL〜50μLが好ましく、10nL〜500nLが特に好ましい。溶媒としては特に限定はないが、水、エタノール、ジメチルスルホキシド(以下、「DMSO」と略記する)等やそれらの混液等が挙げられる。「分析される分子」を溶解又は分散している溶媒が、誘導体化剤を溶解する溶媒と異なる場合は、乾かしてから誘導体化剤を載せることが好ましい。また、「分析される分子」を含むもの、例えば、生体の組織、細胞、体液や分泌液(血液、尿、唾液、涙液等)等のような生体試料等を、「質量分析法に用いる試料支持部材」上に直接載せることもできるが、その場合には、組織は超薄切片にしたり、細胞は分散状態で載せたり、体液や分泌液は塗布したりして、必要に応じて乾燥したり、メタノールやエタノール等で固定したりすることが好ましい。
【0039】
誘導体化剤は、溶媒に溶解又は分散した状態で載せる。好ましくは、最小量を均一に載せることができる点で溶媒に溶解した方がよい。試料支持部材上に載せる誘導体化剤の量は特に限定はないが、1fmol〜10nmolが好ましく、10pmol〜1nmolが特に好ましい。液量は特に限定はないが、溶液全体又は分散液全体として1nL〜5μLが好ましく、10nL〜500nLが特に好ましい。溶媒としては特に限定はないが、誘導体化剤及び分析される分子の溶解性及び揮発性の点で、DMSO、イソプロパノール、n−ブタノール等が好ましい。特に好ましくは、DMSOである。
【0040】
誘導体化剤を先に試料支持部材上に載せてもよく、誘導体化剤をメタノールやエタノール等揮発性の高い溶媒で溶解し、試料支持部材上に載せた後溶媒を揮発させてから、DMSO等に溶解した分析される分子を載せることが好ましい。また、分析される分子及び誘導体化剤をDMSO等の溶媒に溶解する場合は、どちらを先に試料支持部材上に載せてもよく、載せる度に乾燥及び/又は反応させてもよいし、乾燥又は/反応を実質的にさせずに次のものを載せて、その後に乾燥及び/又は反応をさせてもよい。更に、分析される分子及び誘導体化剤をDMSO等に溶解する場合は、両者を混合したものを試料支持部材に載せてもよい。誘導体化剤は1種を用いてもよいし、2種以上を用いてもよい。また、誘導体化剤を2種以上用いる場合、例えば、試料支持部材上に分析される分子を載せて乾燥後、誘導体化剤Aを載せて、乾燥及び/又は反応をさせた後に、誘導体化剤Bを載せて、乾燥及び/又は反応させることも好ましい。
【0041】
例えば、上記化学反応式(1)で表される化学反応は、従来は、通常、メタノール、DMSO等の有機溶媒中(溶液として10μL〜100μL)で、触媒としての酢酸等の存在下又は非存在下において、例えば糖鎖と大過剰の反応試薬とを加温(例えば80℃)して行ったが、本発明では、試料支持部材上で反応を行うことにより、DMSO中(50nL〜500nL)で、例えば糖鎖(1fmol〜500fmol)と誘導体化剤(1pmol〜100pmol)を反応させて高収率を得るという極めて微量の反応系を容易に実現させることができた。なお、括弧内は、糖鎖と誘導体化剤とを、化学反応式(1)を用いて反応させるときのそれぞれの最も好ましい使用量を示す。
【0042】
その他、必要であれば、「分析される分子」と誘導体化剤のみを先に反応後、還元剤等を、更に試料支持部材上に溶媒に溶解又は分散した状態で載せる。また、還元剤を誘導体化剤と混合して試料支持部材に載せても、操作が一工程で済むので好ましい。試料支持部材上に載せる還元剤等の量は特に限定はないが、1pmol〜1nmolが好ましく、10pmol〜500pmolがイオン化を阻害しない点で特に好ましい。液量は特に限定はないが、溶液全体又は分散液全体として10pL〜50μLが好ましく、10nL〜500nLが特に好ましい。
【0043】
(2)分析される分子及び誘導体化剤を試料支持部材上で反応させる工程
反応は、試料支持部材を−30℃〜100℃に維持することにより行うことが好ましい。反応温度は特に好ましくは、20℃〜80℃であり、より好ましくは40℃〜60℃である。反応時間は反応の種類毎に及び/又は溶媒の種類毎に、最適な範囲を選べばよいが、溶媒が乾く時間が好ましい。通常1分〜24時間、好ましくは2分〜20分である。
【0044】
反応終了後、溶媒が残っている場合は、溶媒を除去する。真空デシケーター等を用いる場合は、室温で通常10分〜24時間程度維持することが好ましい。
【0045】
レーザー脱離イオン化法を用いる場合、マトリクス分子を共存させてもよい。反応終了後、試料支持部材上の溶媒を除去後、マトリクス分子、又はマトリクス分子の溶液を載せてMALDI−MS測定を行う。マトリクス分子としては特に限定はなく、公知のものが使用可能であり、2,5−ジヒドロキシ安息香酸(以下、「DHBA」と略記する)、1,5−ジアミノナフタレン、nor−Harman(9H−ピリド[3,4−b]インドール)等が挙げられる。
【0046】
この他、前記誘導体化剤もマトリクス分子として好ましい。更には、前記誘導体化剤を試料支持部材上で反応させる工程で、前記誘導体化剤が「分析される分子」以外の分子と反応して得られた副産物も好ましい。かかる副産物としては、PBHを誘導体化剤として用いた場合のPBHの副産物;PDAMを誘導体化剤として用いた場合、1−ピレニルメチルアルコール等のPDAMの副産物等が挙げられる。
【0047】
マトリクス分子としてはピレン誘導体等も好ましい。ピレン誘導体のうち、特に好ましくは、PBH、PDAM、1−ピレニルメチルアルコール等である。誘導体化剤としてPBH、PDAM等を用いた場合、未反応のPBH、PDAM等のみでもよいが、反応後新たにPBH、PDAM等の誘導体化剤を追加してもよい。マトリクス分子は単独でもよいし、2種以上の化合物を用いてもよい。「2種以上」については、例えば、(未反応物、反応後の追加物及び/又は副産物としての)ピレン誘導体と、DHBA、nor−Harman等の公知のマトリクス分子の組み合わせも好ましい。
【0048】
試料支持部材上に載せるマトリクス分子の量は特に限定はないが、マトリクス分子として、0.1μg〜20μgが好ましく、0.2μg〜1μgが特に好ましい。溶媒としては特に限定はないが、分析される分子とマトリクスがよく混和する点で、エタノール−水、アセトニトリル−水の混液等が好ましい。特に好ましくは、アセトニトリル−水の混液である。
【0049】
「試料支持部材」とは、分子が反応できる場を提供する表面をもち、実質的に全量を質量分析に供し得るものであれば特に限定されないが、好ましくは、ステンレス等で成形されたターゲットプレート等のサンプルプレート、オートサンプラー用サンプル管等の分析試料を分析装置に供給専用のサンプル管、ミクロウエルプレート、ニトロセルロース膜、ポリフッ化ビニリデン(PVDF)膜等である。特に好ましくは、質量分析に供するサンプルプレートである。サンプルプレートは表面が金でコーティングされていたり、化学的あるいは物理的処理がしてあってもよい。
【0050】
本発明において、「試料支持部材上に載せる」という表現は、例えば上記サンプル管の内壁上に載せることも意味する。すなわち、「試料支持部材」には板状、皿状のみならず、容器状のものも含まれ、「上に載せる」は、容器状のものの中に載せる、すなわち容器状のものの中に入れることをも含むものである。
【0051】
本発明を実施しない場合、反応後、過剰の誘導体化剤等を除くために、有機溶媒−水混液による抽出やC18等のカラムによる分離操作が必要であり、微量の生体試料由来の糖鎖等にこれらの操作を行うと、工程毎に減量して最終的に検出が困難になる場合があった。しかしながら、本発明によると、試料支持部材上で直接反応を行うことで試料の損失もなく、反応溶液が最小量であるため過剰量の反応試薬を用いる必要もない。従って、そのままではイオン化しにくい糖鎖等の質量分析において、簡便で効率よく分子イオンを多く生成させることができ、結果として十分な感度を得ることができる。
【0052】
試験管やフラスコ内で起こる反応は、該試料支持部材上でも起こることは想像できる。しかしながら、従来は、撹拌できないことやふたをしないと乾固すること等のため反応が不十分であるとされていたため、試料支持部材上で反応させようとは通常考えられていなかった。また、未反応の誘導体化剤がイオン化を阻害する場合もあるとして、反応収率を上げたり、精製をしたりする必要があると考えられていたため、本発明を想到できなかったと考えられる。
【0053】
本発明は、(a)微量物質の分析(例えば、微量の生体試料由来の糖鎖あるいは微量の生体試料中の糖鎖等の分析)に、(b)誘導体化剤を反応させること、(c)その反応を試料支持部材上で進行させること、を組み合わせるものであるが、それらを組み合わせることで、反応に用いる試料を実質的に全て分析される分子として用いることができることや、未反応誘導体化剤やその副産物がイオン化を阻害しないために、(a)(b)(c)が組み合わされて初めて相乗効果が認められたものである。
【0054】
更には、未反応の誘導体化剤や、誘導体化剤が「分析される分子」以外の分子と反応してなる副産物が、イオン化を阻害しないのみならず、むしろ促進する(マトリクスとして働く)場合もあるために、本発明が前記効果を奏したものと考えられる。本発明において、工程(2)は必須の工程ではあるが、本発明は、誘導体化剤と「分析される分子」が反応して生成した反応物だけがイオン化を促進している場合のみには限定されない。
【0055】
(3)試料支持部材上の、反応して生成した分析される分子の誘導体を質量分析計に供する工程
本発明の質量分析法に用いられる質量分析計は公知のものが使用できる。レーザー脱離イオン化法によって測定する場合、反応終了後、溶媒を除去した試料支持部材をそのまま質量分析計に供することができる。MALDI法によって測定する場合、反応終了後、溶媒を除去した試料支持部材にマトリクスを載せた後、そのまま質量分析計に供することができる。ESI法によって測定する場合は、試料支持部材上の分析される分子を、酢酸アンモニウム水溶液−アセトニトリル混液等に溶解して、フローインジェクションあるいはカラムを介して液体クロマトグラフ質量分析計に注入する。この場合、試料支持部材はオートサンプラーに供するサンプル管が好ましい。
【0056】
(4)分析される分子の誘導体をイオン化する工程
イオン化する方法については特に限定はなく、ナノエレクトロスプレーイオン化(nanoESI)法を含むエレクトロスプレーイオン化(ESI)法、大気圧イオン化(APCI)法、電子衝撃でイオン化したアルゴンやキセノンを中性原子にあてて生じた中性イオンビームを試料にあてるFAB法、スプレーした試料溶液に紫外線をあてイオン化させるフォトスプレー法、加熱してジェット噴霧しそのときの帯電を利用するサーモスプレー法、加熱しないで噴霧するコールドスプレー法、レーザー脱離イオン化(LDI)法、マトリクス支援レーザー脱離イオン化(MALDI)法等が挙げられる。
【0057】
このうち、本発明においては、ナノエレクトロスプレーイオン化(nanoESI)法を含むエレクトロスプレーイオン化(ESI)法が、試料支持部材から直接分析される分子を吸引し質量分析計に注入する点で好ましい。また、レーザー脱離イオン化(LDI)法が、分析される分子と誘導体化剤が試料支持部材上で反応して生成した誘導体が、場合により未反応の誘導体化剤や誘導体化剤の副産物とともに、イオン化効率を向上させたり、切断イオン化位置を制御したり、生成イオンの安定化に寄与したりできる点で好ましい。糖鎖、タンパク質、糖タンパク質、核酸、糖脂質等の生体試料由来の高分子のイオン化は困難であるが、それらの分析される分子と誘導体化剤が試料支持部材上で反応して誘導体を生成することによって、場合により未反応の誘導体化剤や誘導体化剤の副産物とともに、マトリクスによるイオン化効率を更に倍増させる点、試料支持部材上に載せた分析される分子を実質的に全て質量分析計に供することができる点、高分子を好適に1価にイオン化できる点でMALDI法が特に好ましい。
【0058】
レーザー脱離イオン化(LDI)法、マトリクス支援レーザー脱離イオン化(MALDI)法で用いられるレーザーとしては、窒素レーザー(337nm)、YAGレーザー3倍波(355nm)、NdYAGレーザー(256nm)、炭酸ガスレーザー(2940nm)等が挙げられるが、窒素レーザーが好ましい。また、誘導体化剤として、ピレン誘導体化合物等の縮合多環誘導体化合物を用いた場合には、窒素レーザーが特に好ましい。本発明で、分析される分子と誘導体化剤が試料支持部材上で反応して誘導体になることや、未反応の誘導体化剤や誘導体化剤の副産物が共存することによって、レーザー強度を通常の20%〜80%まで減ずることができる。レーザー強度の低下は分解能を向上させる効果がある。
【0059】
次いで、二重収束法、四重極集束法(四重極(Q)フィルター法)、タンデム型四重極(QQ)法、イオントラップ法、飛行時間(TOF)法等を用いて、イオン化した分子を質量/電荷比(m/z)に従って分離し検出する。好ましくは、QIT−TOFである。
【0060】
糖鎖、タンパク質、糖タンパク質、核酸、糖脂質等の分子は、分子量や組成が同じ異性体を多く含むので、誘導体化を行いイオンの生成効率を向上させ、分子のフラグメント化をn回繰り返す(MSn)法が好ましい。本発明は誘導体化剤を試料支持部材上で反応させ標識化し、MSnにより、選択した標識を含むイオンを解析することで、分子中の結合位置等を決定できる。本発明では、MS2(MS/MS)、MS3又はMS4を行なうことが好ましい。以下、「MS2」を「MS/MS」と表す。
【実施例】
【0061】
以下に、実施例を挙げて本発明を更に具体的に説明するが、本発明は、その要旨を超えない限りこれらの実施例に限定されるものではない。特に、ヒドラジド基を有する誘導体化剤であるPBHを用いた実施例で本発明を具体的に説明するが、本発明はその誘導体化剤に限定されるものではなく、他の誘導体化剤であっても、それと実質的に同様の方法を使用して試料支持部材上で反応させて質量分析計に供することが可能である。
【0062】
実施例1
式(3)に示すLacto−N−fucohexaose−I(化合物1)0.5pmolの水溶液0.5μLを、ステンレスターゲットプレートにスポットし乾かした。PBH125pmol及びNaBH3CN300pmolのDMSO溶液0.25μLを、その上に重層し、60℃で10分加熱した。次いで、デシケーター中にプレートを入れ、10分間、真空ポンプで引きDMSOを揮発させた。
【0063】
【化1】

【0064】
マトリクスとして、DHBAの「アセトニトリル/水=50/50(容量比)」溶液(濃度10mg/mL)0.5μLを載せ、室温で乾固し、MALDI−QIT−TOFMS装置AXIMA−QIT(Shimadzu/Kratos社製)で測定した。
【0065】
図1(a)に示したように、[M+Na]+イオンである、m/z1527、及び、図1(b)に示したように、[M−H]−イオンである、m/z1503のシグナルが得られた。比較例1に示した従来法に比べて、反応に用いる試料量は2000分の1以下、操作も30分以内で終了した。
【0066】
比較例1
化合物1水溶液(化合物1を1nmolを含む)を、ねじふた付きガラス反応管に加え乾固させた。500nmolのPBHをメタノール20μLに溶解して反応管に加え、更に、メタノールで希釈した酢酸(酢酸とメタノールの比は体積比で1:8)2μLを加えてふたを完全に閉めた。よく撹拌後、80℃で20分間加熱し、1MのNaOH水溶液を加えて中和した。1.7MのNaBH4溶液30μLを加えて40℃で30分間反応させ、更に1.7MのNaBH4溶液10μLを加えて40℃で30分間反応させた。
【0067】
次いで、過剰の試薬を除去するために以下の操作を行った。純水400μL及びクロロホルム400μLを加えてよく振った後静置した。下層のクロロホルムを捨て、新しいクロロホルム400μLを加えてもう一度抽出した。上層を取り乾固させた。Sep−pak C18カートリッジをメタノール続いて純水で洗浄し、乾固した反応物を純水に溶解してカートリッジに通した。純水でカートリッジを洗浄し、次に、アセトニトリル−純水(体積比6:4)で溶出することによって、PBHで標識、還元された糖を得た。溶媒を留去して遮光して−30℃に保存した。
【0068】
ここまで測定試料調製に要した時間は9時間であり、実施例1が30分であったことに比べて極めて長時間を要した。また、要した化合物1の量は実施例1の約2000倍であった。更に、得られた還元標識糖は、測定まで遮光して−30℃において保存しなければならなかった。
【0069】
実施例2
式(4)に示す不飽和コンドロー2糖△Di−4S(化合物2)、及び、式(5)に示す△Di−6S(化合物3)水溶液(溶質/溶液=100fmol/10nL)10nLを、それぞれ、ステンレスターゲットプレートに微量分注機でスポットし乾かした。PBH(60pmol)DMSO溶液0.1μLをその上に重層し、50℃で7分加熱した。デシケーター中にプレートを入れ、30分真空ポンプで引き、DMSOを揮発させた。マトリクスとして、nor−Harman(9H−ピリド[3,4−b]インドール)の50容量%アセトニトリル溶液(濃度1mg/mL)0.5μLを載せ、室温で乾固し、実施例1と同様の装置で測定した。
【0070】
【化2】

【0071】
【化3】

【0072】
化合物2に誘導体化剤を反応させて得た「△Di−4Sピレン誘導体」から、[M−H]−イオンであるm/z742のシグナルが得られ、PBHが結合したことがわかった(図2a)。
【0073】
m/z742をプリカーサイオンとして選択してMS/MS測定を行った。その結果、化合物3に誘導体化剤を反応させて得た「△Di−6Sピレン誘導体」から、m/z566、m/z584、m/z626のフラグメントイオンシグナルがこの順に減少して得られた(図3a)。
【0074】
一方、化合物2に誘導体化剤を反応させて得た「△Di−4Sピレン誘導体」からは、同じフラグメントイオンが逆の順に減少して検出された(図3b)。
【0075】
更に、m/z626をプリカーサイオンとして、MS3測定を行い、2種の異性体間で異なるフラグメントイオンのパターンが得られた(図4a及びb)。このように、微量でもMS/MSやMS3測定が可能であった。このことは異性体構造を識別するのに必要なフラグメントイオンが得られたことを示している。
【0076】
また、生体試料等から単離された化合物2や化合物3は、通常、本実施例のように試料の量が極めて少なくならざるを得ず、試料支持部材上以外で誘導体化剤と反応させる方法では、到底、MS/MSやMSn(nは3以上の整数)測定はできない。
【0077】
マトリクスとして、nor−Harmanに代えて、DHBA(濃度1mg/mL)0.5μL、又は、1,5−ジアミノナフタレン(濃度1mg/mL)0.5μLを用いても上記と同様の結果が得られた。
【0078】
比較例2
不飽和コンドロー2糖△Di−4S(化合物2)水溶液(溶質/溶液=100fmol/10nL)をステンレスターゲットプレートに微量分注機でスポットした。誘導体化剤を用いずに、nor−Harman(濃度1mg/mL)0.5μLを載せ室温で乾固し、実施例1と同様の装置で測定した。
【0079】
[M−H]−イオンである、m/z458を検出した(図2b)が、同量をターゲットプレートに載せ、誘導体化剤としてPBHを用いてピレン誘導体にした実施例2(図2a)に比較してシグナルは極めて低く、MS/MS測定は困難であった。このため化合物2について、硫酸基がどの位置に結合しているか等の構造同定はできなかった。
【0080】
実施例3
式(4)に示す不飽和コンドロー2糖△Di−4S(化合物2)、及び、式(5)に示す△Di−6S(化合物3)水溶液(溶質/溶液=5fmol/10nL)10nLを用いて、実施例2と同様な操作を行い、実施例1と同様の装置を用いて測定した。図5に示すように、[M−H]−イオンであるm/z742のシグナルが何れからも検出された。
【0081】
実施例4
下記の式(6)に示す合成糖ペプチド(化合物I)100nmol及び500mMのIodoacetamide水溶液10μmolを、20mMの重炭酸アンモニウム水溶液50μL中で、遮光下室温にて1時間反応を行い、システイン残基のアルキル化を行った。
【0082】
【化4】

【0083】
反応混合物を、Sep−Pak C18 lightに適用し、0.1容量%のトリフルオロ酢酸(以下「TFA」と略記する)水溶液で洗浄、「60容量%アセトニトリル−0.1容量%TFA」水溶液で溶出した。このアルキル化糖ペプチド20nmol、β1,4ガラクトース転移酵素4mU、UDP−ガラクトース200nmolを加えた、20μLの「20mMのCaCl2、20mMMnCl2を含む、50mMのHEPES緩衝液(pH7)」中、37℃にて、21時間反応を行った。
【0084】
反応後、上記糖ペプチドは、Sep−Pak C18 lightにより精製した。この糖ペプチドのpositive−ion mode MS測定を行ったところ、ガラクトース1残基分の162Da増加が確認された。
【0085】
アルキル化糖ペプチド20nmol、α2,6シアル酸転移酵素、又は、α2,3シアル酸転移酵素2U、及びCMP−N−アセチルノイラミン酸200nmolを、20μLの「20mMのCaCl2、20mMのMnCl2を含む、100mMのHEPES緩衝液(pH7)」中で、37℃にて21時間反応を行い、この糖ペプチドを、Sep−Pak C18 lightにより精製した。
【0086】
MS測定により、それぞれシアル酸1残基分の291Da増加し、それぞれ、下記式(7)で示されるアルキル化化合物(II)、又は、下記式(8)で示されるアルキル化化合物(III)が生成したことが確認された。
【0087】
【化5】

【0088】
【化6】

【0089】
アルキル化化合物(II)又は(III)を各2nmolに、1mMのNaIO4を10μL加え、遮光下氷上にて、20分間反応を行った。次いで、100倍希釈エチレングリコール0.5μLを加え、遮光下室温にて、20分間放置した。反応混合物を Sep−Pak C18 lightに適用し、0.1容量%TFA水溶液で洗浄、「60容量%アセトニトリル−0.1容量%TFA」水溶液で溶出した。
【0090】
MS測定により、過ヨウ素酸酸化反応で、62Da減少し、シアル酸残基C7−C8間で炭素間結合が切断され、アルデヒド基が1ヶ所生じたことが確認された。
【0091】
このようにして得られた糖ペプチドを、実施例2と同様にして、ステンレスターゲットプレート上でPBHと反応させ、乾燥させた。用いた量もそれぞれ実施例2と同じである。マトリクスとして、1,5−ジアミノナフタレンの「アセトニトリル/水=50/50(容量比)」溶液(濃度5mg/mL)0.5μLを載せ、室温で乾固し、MALDI−QIT−TOFMS装置AXIMA−QIT(Shimadzu/Kratos社製)で測定した。
【0092】
アルキル化化合物(II)を用いたものから、図6aに示したように、[M−H]−イオンであるm/z3383が検出され、PBHが結合したことが確認された。なお、アルキル化化合物(III)を用いたものからも、同様にPBHが結合したことが確認された。
【0093】
また、アミノ酸が6残基遊離したm/z2681をプレカーサーイオンとしてMS/MS解析を行なった。その結果、図6bに示したように、ガラクトースの環開裂3,5A及びN−アセチルグルコサミンの環開裂0,2A断片にPBHが導入されたイオン、m/z585及びm/z794が検出された。
【0094】
一方、アルキル化化合物(III)にPBHを導入した場合は、m/z585は検出されず、m/z794のみが検出された。
【0095】
単離されたアルキル化化合物(I)ないし(III)のように、生体試料等から調製や単離された糖ペプチドは、何れも通常、試料の量が極めて少なくならざるを得ず、従来の工程では、到底MS/MS解析できない。
【0096】
分析される分子と誘導体化剤を反応させる工程を、直接分析装置に供する試料支持部材上で行うことによって、高感度質量分析測定試料調製の簡便化及び高収量化を可能にできた。これにより、用いる試料量を微量にしたまま検出感度を向上させ、イオン化の促進及び生成イオンの安定化を達成することによって、より微量な試料レベルにおいても十分な量の分子イオンを生成させ、質量分析が可能であった。
【0097】
実施例5
プロテオミクスでは、電気泳動によって分離したタンパク質を酵素でゲル内消化して得たペプチド断片の質量分析によってタンパク質を同定するが、糖鎖の同定まで行うにはマイクログラム(μg)の量が必要である。本発明を適用することによって、微量な糖タンパク質を電気泳動した後に、ゲルより回収した糖鎖を同定できたので、以下にその例を示す。
【0098】
[電気泳動及びゲル内消化]
ヒト精液より精製した前立腺特異抗原(以下、「PSA」と略記する)(ケミコン社)50ngを20μLのサンプルバッファー(0.125M Tris−HCl、pH6.8、10質量%メルカプトエタノール(Mercaptoethanol)、4質量%SDS、10質量%ショ糖(Sucrose)、0.004質量%ブロモフェノールブルー(Bromophenol blue))に溶解し、100℃で3分加熱した後、氷中に静置し冷却した。9質量%アクリルアミドゲル上で電気泳動分離後、純水でゲルを軽く洗浄し、CBB染色を行なった。
【0099】
染色されたタンパク質部分のゲルを切り出し、1.5mLチューブに移し、純水、更に50%アセトニトリル水溶液、最後にアセトニトリルで洗浄した。ゲルを乾燥後、還元溶液(10mM DTT、25mM重炭酸アンモニウム、pH8.0、水溶液)を加えて、56℃で1時間、遮光振盪して反応させた。溶液を除き、アルキル化溶液(55mMヨードアセトアミド(Iodoacetamide)水溶液)を加えて、室温で45分間、遮光振盪して反応させた。重炭酸アンモニウム水溶液(25mM、pH8.0)、アセトニトリルで洗浄後、ゲルを乾燥した。
【0100】
上記乾燥したゲルに、Lysyl Endopeptidase溶液(250ng:Wako Mass Spectrometry Grade、25mM重炭酸アンモニウムpH8.0水溶液)を加えて、氷中で45分間、静置膨潤後、37℃で18時間軽く攪拌しながら反応させた。抽出液(75%アセトニトリル、0.1%トリフルオロ酢酸水溶液)を加えて、20分間振盪後、溶液を回収した。
【0101】
遠心濃縮機によって乾固後、PNGase Fを1unit(1unit/μL、1μg AEBSF:Roche、50mM重炭酸アンモニウムpH8.0水溶液)加えて、37℃で18時間、振盪しながら反応させた。反応混合物に1%トリフルオロ酢酸水溶液を1μL加え、C18チップにサンプルを吸引と排出を繰り返してペプチドを吸着させ、溶液中の糖鎖と分離した。カーボングラファイト30mg(GLサイエンス)をマイクロスピンカラムに詰めて洗浄後、C18チップに結合しなかった糖鎖画分をカラムに加えて、5%アセトニトリル0.1%トリフルオロ酢酸水溶液を加え、遠心分離(300×g、1分〜2分)により洗浄した。50%アセトニトリル0.1%トリフルオロ酢酸水溶液を加え、遠心分離(300×g、1分〜2分)により糖鎖を溶出した。回収された糖鎖溶出液を、遠心濃縮機によって乾固し、2μLの純水に溶解して質量分析試料とした。
【0102】
[標識]
ターゲットプレートに、上記で得られた試料0.5μL(約10ngの糖タンパク質由来の糖鎖を含有)をのせて風乾後、PBH(500pmol)のDMSO溶液0.25μLをその上に重層し、50℃で乾燥するまで約15分加熱した。また、別の部分のターゲットプレート上に、試料0.5μLをのせて風乾後、1−ピレニルジアゾメタン(PDAM)(500pmol)のDMSO溶液0.25μLをその上に重層し、40℃で乾燥するまで約25分加熱した。また、別の部分のターゲットプレート上に、試料0.5μLをのせて風乾後、PDAM(500pmol)のDMSO溶液0.25μLをその上に重層し、40℃で乾燥するまで約25分加熱し、更に、PBH(500pmol)のDMSO溶液0.25μLをその上に重層し、50℃で乾燥するまで約15分加熱した。また、対照として、別の部分のターゲットプレート上に、上記で得られた試料0.5μLを載せて風乾した。ターゲットプレートは、デシケーター中で一晩吸引乾燥した。実施例1と同様に質量分析計で測定した。
【0103】
図7に上記試料のMSスペクトルを示す。図7Aは、PSA約10ng由来糖鎖をプレートに載せ、誘導体化剤を加えず、ネガティブイオンを測定したMSスペクトルを示し、図7Bは、同量の糖鎖をプレートに載せ、PBHを添加し反応させた後測定したMSスペクトルを示し、図7Cは、同量の糖鎖をプレートに載せ、PDAMを添加し反応させた後測定したMSスペクトルを示し、図7Dは、同量の糖鎖をプレートに載せPDAMを添加し反応させ、引き続きPBHを添加し反応させた後測定したMSスペクトルを示す。
【0104】
図7では、縦軸のフルスケールを全て同じ20mVにして示した。白矢印は非標識糖鎖イオンを、白星印はPBHで標識された糖鎖イオンを、灰色星印はPDAMで標識された糖鎖イオンを、白星印及び灰色星印を付けた糖鎖イオンはPDAM及びPBHの両誘導体化剤で標識されたことを示す。
【0105】
図7Aに示したように、誘導体化剤を添加しなかった試料はシグナルが検出されなかった(図7、A)。
PBHを加えてプレート上で反応させると、PBH標識された糖鎖bイオンm/z2362が検出された(図7、B)。
別の誘導体化剤PDAMを同一試料に加えて反応させると、下記の3種の糖鎖a、b、cが標識されたイオン、m/z2144、m/z2290、m/z2581が検出された(図7、C)。
更に、試料にPDAMを反応させた後、続けてPBHを反応させると、それぞれ単独に標識された糖鎖イオンの他に、両方の誘導体化剤で標識された下記糖鎖cイオン、m/z2867が検出された(図7、D)。試料にPBHを反応させた後、続けてPDAMを反応させて、誘導体化の順番を逆にしても同様のマススペクトルが得られた。また、これらの測定の際にレーザー強度を通常の80%でも測定できた。
【0106】
【化7】

【0107】
【化8】

【0108】
【化9】

【0109】
泳動後のゲルからのタンパク質回収は最大でも50%くらいであるとされているので、実際にはPSAは5ng相当であったと思われ、従って糖鎖量は最大でも約160fmolしかプレート上に載っていないことになる。なお、この糖鎖量では、図7Aに示したように、誘導体化剤を添加しない場合(非標識の場合)では微量過ぎて測定できない。
【0110】
PBH、PDAM等の誘導体化剤と糖鎖を共に試料支持部材に載せると、誘導体化剤が反応して標識された糖鎖のみでなく、非標識の糖鎖のイオン化も向上する効果があった。この理由として、共雑するペプチド断片のイオン化を抑制すること、及び、これらの誘導体化剤が共存することによってマトリクスに類似した効果を発することが考えられた。特に、PDAMのマトリクス効果は、これ自身とともに、副反応で生成した1−ピレニルメチルアルコールの相乗効果であると考えられた。すなわち、本発明は、上記工程「(2)分析される分子及び誘導体化剤を試料支持部材上で反応させる工程」は必須の工程ではあるが、本発明は、両者の反応物だけが本発明の効果を奏している場合のみには限定されない。
【0111】
図8Aは、PSA約10ng由来糖鎖をプレートに載せ、誘導体化剤を加えずネガティブイオンを測定したMSスペクトル(縦軸300mV)であり、図8Bは、同量の糖鎖をプレートに載せ、PDAMを添加し反応させた後測定したMSスペクトル(縦軸120mV)である。黒矢印はペプチドイオンを、白矢印は糖鎖イオンを示す。
【0112】
PDAMは糖鎖イオン化生成能が強い。図8に示すように、誘導体化剤が添加されなかった場合(図8、A)では、例えば黒矢印で示した低分子側のペプチドのイオンが多く生成し、糖鎖のイオンはほとんど検出されなかった。しかし、PDAMを添加して反応させた後は、例えば黒矢印で示したペプチドイオンは1/10に抑制され、代わりにほとんど検出できなかった糖鎖イオン(白矢印)が優位に生成した(図8、B)。また、標識された糖鎖cイオン(灰色星印)は、MS3解析を行うことができた。
【0113】
実施例6
以下の分子と誘導体化剤とを、試料支持部材上で反応させた後、質量分析を行なうことができる。
(1)分子がアルデヒド基を有する分子(例えば、糖である分子、又は、糖若しくは糖タンパク質を酸化することによってアルデヒド基を有する分子)と、誘導体化剤として以下の第1群の化合物。
(2)分子がアミノ基又はカルボキシル基を有する分子(例えば、糖、タンパク質又は糖タンパク質である分子)と、誘導体化剤として以下の第2群の化合物。
(3)分子がSH基を有する分子(例えば、糖、タンパク質又は糖タンパク質である分子)と、誘導体化剤として、以下の第3群の化合物。
(4)分子がOH基を有する分子(例えば、糖、タンパク質又は糖タンパク質である分子)と、誘導体化剤として、以下の第4群の化合物。
【0114】
第1群:1−ピレンブタン酸ヒドラジド、1−ピレン酢酸ヒドラジド、1−ピレンプロピオン酸ヒドラジド、1−ピレンカルバルデヒド ヒドラゾン(1-pyrenecarbaldehyde hydrazone)、アミノピレン、1−ピレンメチルアミン、1−ピレンプロピルアミン、1−ピレンブチルアミン、及び類似芳香族化合物。
第2群:ヨウ化メチル、トリメチルシリルジアゾメタン、1−ピレン酢酸スクシニミジルエステル、1−ピレンプロピオン酸スクシニミジルエステル、1−ピレンブタン酸スクシニミジルエステル、N−(1−ピレンブタノイル)システイン酸スクシニミジルエステル、1−ピレンスルホン酸クロリド、1−ピレニルジアゾメタン、1−ピレニルチオシアネート、1−ピレニルイソチオシアネート、及び類似芳香族化合物。
第3群:N−(1−ピレン)ヨードアセトアミド、N−(1−ピレン)ヨードマレイミド、N−(1−ピレンメチル)ヨードアセトアミド、1−ピレンメチルヨードアセテート、及び類似芳香族化合物
第4群:ヨウ化メチル、トリメチルシリルジアゾメタン、1−ピレニルジアゾメタン、及び類似芳香族化合物
【産業上の利用可能性】
【0115】
本発明の質量分析法は、分析される試料や反応試薬の量を減らせ、イオン化効率や測定の再現性を向上させることによって、信頼性の高い化学構造についての情報を得ることができるので、特に、糖タンパク質等の微量な生体試料由来あるいは生体試料中の分子に適用して、その機能解明や病態の解明等に広く利用されるものである。
【特許請求の範囲】
【請求項1】
分子を誘導体化して質量分析する方法であって、少なくとも、工程(1)、(2)、(3)及び(4)
(1)分析される分子及び誘導体化剤を、この質量分析法に用いる試料支持部材上に載せる工程、
(2)分析される分子及び誘導体化剤を試料支持部材上で密閉することなく直接反応及び乾燥させる工程、
(3)試料支持部材を質量分析計に供して、該試料支持部材上の、反応して生成した分析される分子の誘導体を質量分析計に供する工程、
(4)分析される分子の誘導体をイオン化する工程
を有することを特徴とする質量分析法。
【請求項2】
分析される分子の誘導体をレーザー脱離イオン化法によってイオン化する請求項1に記載の質量分析法。
【請求項3】
反応後の試料支持部材上の分析される分子の誘導体に、マトリクス分子を共存させ、質量分析計に供する請求項2に記載の質量分析法。
【請求項4】
分析される分子の誘導体をエレクトロスプレーイオン化法によってイオン化する請求項1に記載の質量分析法。
【請求項5】
分析される分子が、糖、糖鎖、タンパク質、核酸、糖タンパク質、糖ペプチド又は糖脂質である請求項1ないし請求項4の何れかの請求項に記載の質量分析法。
【請求項6】
分析される分子が、アルデヒド基、カルボキシル基、アミノ基、メルカプト基及び水酸基よりなる群から選ばれた1種以上の官能基を有するものである請求項1ないし請求項5の何れかの請求項に記載の質量分析法。
【請求項7】
分析される分子が、シアル酸又はガラクトースを含む糖若しくは糖タンパク質を酸化してアルデヒド基を導入した分子である請求項1ないし請求項6の何れかの請求項に記載の質量分析法。
【請求項8】
誘導体化剤が、分析される分子に反応することによって、イオン化効率を高めるものである請求項1ないし請求項7の何れかの請求項に記載の質量分析法。
【請求項9】
誘導体化剤が、分析される分子に反応することによって、切断イオン化位置を制御するものである請求項1ないし請求項8の何れかの請求項に記載の質量分析法。
【請求項10】
誘導体化剤が、アミノ基、ヒドラジド基、カルボキシル基、ジアゾメチル基、スクシニミジルエステル基及び塩化スルホニル基よりなる群から選ばれた1種以上の官能基を有するものである請求項1ないし請求項9の何れかの請求項に記載の質量分析法。
【請求項11】
誘導体化剤が、ヨウ化メチル又はトリメチルシリルジアゾメタンである請求項1ないし請求項10の何れかの請求項に記載の質量分析法。
【請求項12】
誘導体化剤が、その分子内に縮合多環を有する縮合多環誘導体化合物である請求項1ないし請求項11の何れかの請求項に記載の質量分析法。
【請求項13】
分析される分子がアルデヒド基を含有する糖鎖を有する分子であり、誘導体化剤がアミノ基又はヒドラジド基等を有するものである請求項1ないし請求項10の何れかの請求項又は請求項12に記載の質量分析法。
【請求項14】
分析される分子が、カルボキシル基、アミノ基又はメルカプト基を有するタンパク質若しくは糖タンパク質であり、誘導体化剤が、アミノ基、ヒドラジド基若しくはジアゾメチル基等を有するもの、又はヨウ化メチル又はトリメチルシリルジアゾメタンである請求項1ないし請求項6の何れかの請求項又は請求項8ないし請求項12の何れかの請求項に記載の質量分析法。
【請求項15】
分析される分子が、1ピコモル(pmol)以下である請求項1ないし請求項14の何れかの請求項に記載の質量分析法。
【請求項16】
誘導体化剤が、ピレン誘導体化合物である請求項1ないし請求項15の何れかの請求項に記載の質量分析法。
【請求項17】
誘導体化剤が、1−ピレンブタン酸ヒドラジド(PBH)又は1−ピレニルジアゾメタン(PDAM)である請求項1ないし請求項16の何れかの請求項に記載の質量分析法。
【請求項1】
分子を誘導体化して質量分析する方法であって、少なくとも、工程(1)、(2)、(3)及び(4)
(1)分析される分子及び誘導体化剤を、この質量分析法に用いる試料支持部材上に載せる工程、
(2)分析される分子及び誘導体化剤を試料支持部材上で密閉することなく直接反応及び乾燥させる工程、
(3)試料支持部材を質量分析計に供して、該試料支持部材上の、反応して生成した分析される分子の誘導体を質量分析計に供する工程、
(4)分析される分子の誘導体をイオン化する工程
を有することを特徴とする質量分析法。
【請求項2】
分析される分子の誘導体をレーザー脱離イオン化法によってイオン化する請求項1に記載の質量分析法。
【請求項3】
反応後の試料支持部材上の分析される分子の誘導体に、マトリクス分子を共存させ、質量分析計に供する請求項2に記載の質量分析法。
【請求項4】
分析される分子の誘導体をエレクトロスプレーイオン化法によってイオン化する請求項1に記載の質量分析法。
【請求項5】
分析される分子が、糖、糖鎖、タンパク質、核酸、糖タンパク質、糖ペプチド又は糖脂質である請求項1ないし請求項4の何れかの請求項に記載の質量分析法。
【請求項6】
分析される分子が、アルデヒド基、カルボキシル基、アミノ基、メルカプト基及び水酸基よりなる群から選ばれた1種以上の官能基を有するものである請求項1ないし請求項5の何れかの請求項に記載の質量分析法。
【請求項7】
分析される分子が、シアル酸又はガラクトースを含む糖若しくは糖タンパク質を酸化してアルデヒド基を導入した分子である請求項1ないし請求項6の何れかの請求項に記載の質量分析法。
【請求項8】
誘導体化剤が、分析される分子に反応することによって、イオン化効率を高めるものである請求項1ないし請求項7の何れかの請求項に記載の質量分析法。
【請求項9】
誘導体化剤が、分析される分子に反応することによって、切断イオン化位置を制御するものである請求項1ないし請求項8の何れかの請求項に記載の質量分析法。
【請求項10】
誘導体化剤が、アミノ基、ヒドラジド基、カルボキシル基、ジアゾメチル基、スクシニミジルエステル基及び塩化スルホニル基よりなる群から選ばれた1種以上の官能基を有するものである請求項1ないし請求項9の何れかの請求項に記載の質量分析法。
【請求項11】
誘導体化剤が、ヨウ化メチル又はトリメチルシリルジアゾメタンである請求項1ないし請求項10の何れかの請求項に記載の質量分析法。
【請求項12】
誘導体化剤が、その分子内に縮合多環を有する縮合多環誘導体化合物である請求項1ないし請求項11の何れかの請求項に記載の質量分析法。
【請求項13】
分析される分子がアルデヒド基を含有する糖鎖を有する分子であり、誘導体化剤がアミノ基又はヒドラジド基等を有するものである請求項1ないし請求項10の何れかの請求項又は請求項12に記載の質量分析法。
【請求項14】
分析される分子が、カルボキシル基、アミノ基又はメルカプト基を有するタンパク質若しくは糖タンパク質であり、誘導体化剤が、アミノ基、ヒドラジド基若しくはジアゾメチル基等を有するもの、又はヨウ化メチル又はトリメチルシリルジアゾメタンである請求項1ないし請求項6の何れかの請求項又は請求項8ないし請求項12の何れかの請求項に記載の質量分析法。
【請求項15】
分析される分子が、1ピコモル(pmol)以下である請求項1ないし請求項14の何れかの請求項に記載の質量分析法。
【請求項16】
誘導体化剤が、ピレン誘導体化合物である請求項1ないし請求項15の何れかの請求項に記載の質量分析法。
【請求項17】
誘導体化剤が、1−ピレンブタン酸ヒドラジド(PBH)又は1−ピレニルジアゾメタン(PDAM)である請求項1ないし請求項16の何れかの請求項に記載の質量分析法。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図8】


【図7】




【図2】


【図3】


【図4】


【図5】


【図6】


【図8】


【図7】


【公開番号】特開2012−32416(P2012−32416A)
【公開日】平成24年2月16日(2012.2.16)
【国際特許分類】
【出願番号】特願2011−251465(P2011−251465)
【出願日】平成23年11月17日(2011.11.17)
【分割の表示】特願2006−354829(P2006−354829)の分割
【原出願日】平成18年12月28日(2006.12.28)
【国等の委託研究の成果に係る記載事項】(出願人による申告)平成17〜18年度、独立行政法人科学技術振興機構、大学発ベンチャー創出推進に係る委託研究契約、産業再生法第30条の適用を受ける特許出願
【出願人】(000173924)公益財団法人野口研究所 (108)
【Fターム(参考)】
【公開日】平成24年2月16日(2012.2.16)
【国際特許分類】
【出願日】平成23年11月17日(2011.11.17)
【分割の表示】特願2006−354829(P2006−354829)の分割
【原出願日】平成18年12月28日(2006.12.28)
【国等の委託研究の成果に係る記載事項】(出願人による申告)平成17〜18年度、独立行政法人科学技術振興機構、大学発ベンチャー創出推進に係る委託研究契約、産業再生法第30条の適用を受ける特許出願
【出願人】(000173924)公益財団法人野口研究所 (108)
【Fターム(参考)】
[ Back to top ]

