心不全の処置のために心筋におけるクレアチンキナーゼ代謝および収縮機能を改善する方法
【課題】心筋の主なエネルギー貯蔵である心臓クレアチンキナーゼ代謝を改善することを対象とした、哺乳動物およびヒト心不全の新規の処置法。また、心筋クレアチンキナーゼタンパク質発現および/またはクレアチンキナーゼ活性、およびクレアチンキナーゼ反応中の流量を増加させるため、ならびにそれによって心不全において心臓収縮機能を改善し、かつリモデリングを改善するための遺伝子導入ベクターを用いた新規の処置法の提供。
【解決手段】心不全治療のための潜在的な薬学的組成物として、クレアチンキナーゼ発現および/またはクレアチンキナーゼ活性を増加させる化合物をスクリーニングし、かつ同定するための方法。
【解決手段】心不全治療のための潜在的な薬学的組成物として、クレアチンキナーゼ発現および/またはクレアチンキナーゼ活性を増加させる化合物をスクリーニングし、かつ同定するための方法。
【発明の詳細な説明】
【技術分野】
【0001】
政府の権利の声明
米国政府は本発明において権利を有し得る。本発明は、NIH助成金第HL61912号およびHL63030号によって(部分的に)資金提供された。
【0002】
関連出願の相互参照
本出願は、2006年5月9日に出願された米国特許仮出願第60/798,886号および2007年5月8日に出願された米国特許非仮出願第 号(代理人整理番号第83284.0001号)の恩典を主張し、これらの両方はあたかも本明細書において完全に示されるかのように参照により本明細書に組み入れられる。
【0003】
発明の分野
一つの局面において、本発明は一般に、心不全を処置および予防する新規の方法に関する。一つの局面において、本発明は、心臓におけるクレアチンキナーゼ代謝を増加させ、それによって心不全において心臓収縮機能を改善し、かつ有害な心臓リモデリングを制限するために、クレアチンキナーゼのアイソフォームをコードする遺伝子の発現を増加させる段階に関する。別の局面において、本発明は、心不全の患者または心不全の危険性がある患者においてクレアチンキナーゼ代謝および/もしくは心臓収縮機能を改善するため、ならびに/または有害な心臓リモデリングを有利に変化させるために、クレアチンキナーゼをコードするDNA配列を含むベクター構築物を用いる新規の方法に関する。別の局面において、本発明は、心筋細胞におけるクレアチンキナーゼ発現または活性において検出可能な増加をもたらす薬理学的物質を同定する新規の方法に関する。
【背景技術】
【0004】
背景技術
心不全(HF)は、心臓が正常な充満圧で体の必要を満たすのに十分な血液を送り出せない状態として典型的に定義される。
【0005】
米国においては520万人がHFを有し、332億ドルの全体的な推定年間コストで毎年100万件以上のHFによる入院がある(American Heart Association, Heart and Stroke Statistical Update 2007, Dallas, Texas(非特許文献1))。
【0006】
ATPは、心筋におけるエネルギーの主要な生化学的形態であり、継続する正常な心臓収縮機能に燃料を供給するために必要とされる。不十分なATP供給がHFを起こし得る可能性が仮定されている(Ingwall 1993(非特許文献2))が、これが事実である直接の証拠はまだ無く、心不全においてATPの利用可能性を増加させるために同定された代謝的手段は無い(Katz 1998(非特許文献3))。
【0007】
心臓におけるATPの生成および/または利用可能性に貢献する多数の代謝経路には多くの反応が存在する。クレアチンキナーゼ反応は心臓のATP利用可能性に影響を及ぼす一つの反応である。クレアチンキナーゼは細胞において発現するタンパク質である。クレアチンキナーゼ(CK)は心臓の主要なエネルギー貯蔵であり、迅速かつ可逆的にクレアチンリン酸(PCr)およびADPをATPおよびクレアチン(Cr)に変換するため、心臓周期の間および増加した要求の期間の間に循環的にATPを提供する(Ingwall et al. 1985(非特許文献4)、Saks 1980(非特許文献5)、Wallimann 1994(非特許文献6))。CKの3種類の主要なアイソフォーム;筋肉アイソフォーム(CK-M)、脳アイソフォーム(CK-B)、およびミトコンドリアアイソフォーム(CK-mito)が存在する。心臓CK代謝における異常はほぼすべてのタイプの実験的および臨床的HFに存在し、CK基質における減少、胎児性CKアイソフォームへの転換、および総CK活性の減少を含む(Nascimben et al. 1996(非特許文献7))。これらの知見、ならびにヒトHFの驚くべき個人的および金銭的犠牲にもかかわらず、心臓CK代謝を増加させることに向けられた治療法は存在しない。
【0008】
しかしながら、変化した心臓CKエネルギー代謝がHFの収縮不全を引き起こすかまたは単にその多くの結果の一つであるかは、全く明らかでない。CKが心不全治療にとって適切な治療標的であるという事前の証拠は無く、かつ、実際に、減少したCKエネルギー代謝はHFに貢献したりまたは引き起こしたりしないことを当業者に予想させると考えられるいくつかの系列の証拠が存在する。第一に、心臓において主要なCK遺伝子を欠損したトランスジェニックマウス(CK-MおよびCK-mito両方についてのCKノックアウトマウス)が作製され、該マウスは明白なHFを発症しない(Saupe et al. 1998(非特許文献8))。遺伝子の欠如がHFを引き起こさないため、このことは、減少したCK代謝は収縮不全またはHFの原因ではないことを示唆する。さらに、ヒト心不全におけるCK反応の基質および産物の枯渇の程度は、10%〜30%のオーダーと比較的少なめであり(Starling et al. 1998(非特許文献9))、ATPの送達および心臓機能を限定すると予想されるであろうレベルではない。最後に、HFにおいて枯渇しているCK反応のための基質であるクレアチンの慢性的補充は、心不全の動物モデルにおいて収縮機能を改善しない(Horn et al. 1999(非特許文献10))。したがって、CK代謝を増加させる段階が成功する可能性が高いHFに対する処置となることは、当業者によって公知でないし、または予想されていない。
【先行技術文献】
【非特許文献】
【0009】
【非特許文献1】American Heart Association, Heart and Stroke Statistical Update 2007, Dallas, Texas
【非特許文献2】Ingwall 1993
【非特許文献3】Katz 1998
【非特許文献4】Ingwall et al. 1985
【非特許文献5】Saks 1980
【非特許文献6】Wallimann 1994
【非特許文献7】Nascimben et al. 1996
【非特許文献8】Saupe et al. 1998
【非特許文献9】Starling et al. 1998
【非特許文献10】Horn et al. 1999
【発明の概要】
【0010】
発明の概要
本発明の新規の方法は、クレアチンキナーゼ反応に影響を与え、それにより心臓細胞のためのエネルギーの供給を増加させることによって、心不全を処置および予防するための有効な方法の欠如と取り組む。本発明は、心筋の主なエネルギー貯蔵である心臓クレアチンキナーゼ代謝を改善することに向けられた、哺乳動物およびヒト心不全の新規の処置を提供する。本方法は、心筋クレアチンキナーゼタンパク質発現および/またはクレアチンキナーゼ活性、およびクレアチンキナーゼ反応中の流量を増加させるため、ならびにそれによって心不全において心臓収縮機能を改善し、かつリモデリングを改善するための遺伝子導入ベクターの使用に関する。本方法はまた、心不全治療のための潜在的な薬学的組成物として、クレアチンキナーゼ発現および/またはクレアチンキナーゼ活性を増加させる化合物をスクリーニングする段階および同定する段階を含む。
【0011】
本発明のいくつかの局面は、哺乳動物およびヒト心不全を処置または予防するためにベクター構築物を使用する新規の方法に関する。他の局面は、哺乳動物においてクレアチンキナーゼ代謝の検出可能な増加、または心臓収縮機能もしくは有害な心臓リモデリングにおける改善をもたらす段階に関する。したがって、本明細書において定義されるとき、「哺乳動物」または「哺乳動物の」へのいずれかの言及は、「ヒト」を含むがそれに限定されない。本発明の他の局面において、ベクターは、プラスミド、ファージ、トランスポゾン、コスミド、染色体、ウイルス、ビリオン、または、適当な制御要素と関連した際に複製が可能であり、かつ遺伝子配列を細胞に導入するように機能し得る任意の他の遺伝要素を含み得るが、それらに限定されない。様々なベクターの任意が、心不全の危険性があるかもしくは心不全の哺乳動物を処置する段階に関連した本発明の新規の方法、または、クレアチンキナーゼ代謝を増加させる段階、および/もしくは心臓収縮機能を増加させる段階、および/もしくは有害な心臓リモデリングを改善する段階に関連した本発明の新規の方法の工程を行うために使用され得る。
【0012】
本発明の別の局面は、ベクター構築物を哺乳動物の心臓に投与する段階に関する。投与に関係する方法の任意は、筋肉内、静脈内、動脈内、皮下、および腹腔内注射、または、カテーテルベースもしくは外科的技術を用いた心筋(心室壁または心房壁など)中もしくは心膜腔中への導入を含むがそれらに限定されない技術の一つまたは複数によって行われ得る。別の局面において、構築物は、増強された心臓形質導入を可能にする技術を用いることによって投与され得る。別の局面において、ベクター構築物は心臓を灌流する血管中に注入され得る。さらに別の局面においては、カテーテルを血管中に挿入して心筋層の一部を灌流する冠動脈中に進め、カテーテルを通してベクターを心臓に投与する。
【0013】
別の局面において、ベクター構築物が投与される本発明の方法の任意において大動脈遮断および体全体の冷却が有意にベクター形質導入を改善し得る。
【0014】
本発明の一つの局面は、哺乳動物においてクレアチンキナーゼ代謝を改善するためにクレアチンキナーゼをコードするヌクレオチド配列を有するベクター構築物を用いる新規の方法に関する。一つの局面において、哺乳動物クレアチンキナーゼのヌクレオチド配列を有するベクター構築物が提供されて哺乳動物の心臓に投与され、クレアチンキナーゼ代謝において検出可能な変化をもたらす。
【0015】
さらなる局面において、検出可能な変化は、心臓クレアチンリン酸のATPに対する割合における変化を含み、および/またはそれによって測定され得る。別の局面において、変化は、クレアチンリン酸および/またはATPの心臓濃度における変化を含み、かつそれによって測定され得る。さらに別の局面において、変化は、心臓クレアチンキナーゼ反応中の流量における変化を含み、かつそれによって測定され得る。
【0016】
さらなる局面において、ヌクレオチド配列はクレアチンキナーゼの脳アイソフォームをコードし得る。別の局面において、ヌクレオチド配列はクレアチンキナーゼの筋肉アイソフォームをコードし得る。さらに別の局面において、ヌクレオチド配列はクレアチンキナーゼのミトコンドリアアイソフォームをコードし得る。さらなる局面において、ヌクレオチド配列は、脳アイソフォーム、筋肉アイソフォーム、および/またはミトコンドリアアイソフォームを含む、クレアチンキナーゼのヒトアイソフォームをコードし得る。
【0017】
本発明の別の局面は、哺乳動物において心臓収縮機能を改善するために哺乳動物クレアチンキナーゼをコードするヌクレオチド配列を有するベクター構築物を用いる新規の方法に関する。哺乳動物クレアチンキナーゼのヌクレオチド配列を有するベクター構築物が提供されて哺乳動物の心臓に投与され、心臓収縮機能において検出可能な増加をもたらす。
【0018】
さらなる局面において、検出可能な増加は、左心室もしくは右心室駆出率における変化および/または心係数における増加を含み、かつそれらによって測定され得るが、それらに限定されない。
【0019】
別の局面において、ヌクレオチド配列はクレアチンキナーゼの脳アイソフォームをコードし得る。別の局面において、ヌクレオチド配列はクレアチンキナーゼの筋肉アイソフォームをコードし得る。別の局面において、ヌクレオチド配列はクレアチンキナーゼのミトコンドリアアイソフォームをコードし得る。またさらなる局面において、ヌクレオチド配列は、脳アイソフォーム、筋肉アイソフォーム、および/またはミトコンドリアアイソフォームを含む、クレアチンキナーゼのヒトアイソフォームをコードし得る。
【0020】
別の局面において、収縮機能における増加は、x線;x線血管造影法;超音波もしくは心エコー検査法;核医学心室造影法もしくはシンチグラフィー;陽電子放出断層撮影法;磁気共鳴画像法;コンピュータ断層撮影法;ならびに/または侵襲性および非侵襲性の血行力学を含むがそれらに限定されない、多数の方法の任意によって測定され得る。
【0021】
本発明の別の局面は、哺乳動物において有害な心臓リモデリングを改善するために哺乳動物クレアチンキナーゼをコードするヌクレオチド配列を有するベクター構築物を用いる新規の方法に関する。哺乳動物クレアチンキナーゼのヌクレオチド配列を有するベクター構築物が提供されて哺乳動物の心臓に投与され、心室の大きさまたは形状における改善をもたらす。
【0022】
別の局面において、改善は、哺乳動物の拡張末期容量、収縮末期容量、心室壁の厚さ、および/または心室重量を含み得、および/またはそれらによって測定され得るが、それらに限定されない。
【0023】
さらなる局面において、有害な心臓リモデリングにおける改善は、例えば、x線、x線血管造影法、超音波もしくは心エコー検査法、核医学心室造影法もしくはシンチグラフィー、陽電子放出断層撮影法、磁気共鳴画像法、コンピュータ断層撮影法などの画像検査によって、および/またはリモデリングと相関するバイオマーカーの使用によって測定され得る。
【0024】
さらなる局面において、ヌクレオチド配列はクレアチンキナーゼの脳アイソフォームをコードし得る。別の局面において、ヌクレオチド配列はクレアチンキナーゼの筋肉アイソフォームをコードし得る。別の局面において、ヌクレオチド配列はクレアチンキナーゼのミトコンドリアアイソフォームをコードし得る。またさらなる局面において、ヌクレオチド配列は、脳アイソフォーム、筋肉アイソフォーム、および/またはミトコンドリアアイソフォームを含む、クレアチンキナーゼのヒトアイソフォームをコードし得る。
【0025】
本発明の一つの局面は、HFにおいて心臓クレアチンキナーゼ代謝を増加させ、および/またはその低下を予防する薬理学的物質または化合物を同定するための新規の方法に関する。
【0026】
本発明の別の局面は、筋肉細胞においてクレアチンキナーゼ発現を増加させる薬理学的物質を同定するための新規の方法に関する。同定の方法の一つの局面は、培養下の単離された筋肉細胞を提供する段階、薬理学的物質を一つまたは複数の筋肉細胞と接触させる段階、およびクレアチンキナーゼ発現における増加を検出する段階を含む。一つの態様において、潜在的な薬理学的物質が多数の試験化合物の任意より選択され得る。
【0027】
本発明の別の局面において、単離された筋肉細胞には、クレアチンキナーゼプロモーターの制御下のレポーター構築物が形質導入され得る。
【0028】
さらに別の局面において、クレアチンキナーゼ発現における増加の検出は、クレアチンキナーゼ発現を反映するように設計されたハイスループットシステムによる。
【0029】
本発明の別の態様において、細胞の一つまたは複数は、心不全の特性を模倣する有害な物質またはシステム(過酸化水素への曝露などの活性酸素種生成システムを含むがそれに限定されない)に曝露され得る。その後、有害な物質またはシステムによってもたらされた減少したCK発現を増加させる薬理学的物質を同定するために、細胞のいくつかを低分子試験化合物の任意と接触させることができ、それらの細胞のCK発現を不活性(対照)薬理学的物質と接触させた細胞と比較することができる。
【0030】
本発明の別の態様において、CK発現を増加させる薬理学的物質を(低分子試験化合物から)同定するために、細胞の一つまたは複数を、上述されたような有害な物質またはシステムへの曝露の前に試験化合物のライブラリーにおいて同定された低分子試験化合物の任意と接触させることができ、それらの細胞のCK発現を不活性(対照)物質と接触させた細胞と比較することができる。本態様において使用されるような増加とは、試験化合物との接触が無い状態において有害な物質またはシステムへの曝露に起因すると予想されるであろう減少したCK発現を予防または改善することを指すように意図される。
【0031】
別の態様において、筋肉細胞は心不全の哺乳動物から取得される心臓細胞であり得る。
【0032】
本発明のさらに別の局面は、CK活性を増加させる分子または試験化合物を同定するための薬理学的物質スクリーニングである。一つの局面において、本方法は、単離されかつ精製されたクレアチンキナーゼを提供する段階、試験化合物を精製されたクレアチンキナーゼと接触させる段階、およびクレアチンキナーゼ活性において増加があるか否かを検出する段階を含む。
【0033】
別の態様において、クレアチンキナーゼ活性における増加の検出は、クレアチンキナーゼ活性を反映するように設計されたハイスループットシステムによる。
【0034】
本発明の別の態様において、単離されたCKアイソフォームの一つまたは複数のアリコートは、心不全の特性を模倣する有害な物質またはシステム(過酸化水素への曝露などの活性酸素種生成システムを含むがそれに限定されない)に曝露され得、一方単離されたCKアイソフォームの他のアリコートは曝露されない(対照)。その後、有害な物質またはシステムによってもたらされた減少したCK活性を増加させる薬理学的物質を同定するために、曝露されたCK酵素および曝露されていないCK酵素を試験化合物のライブラリーにおいて同定された低分子試験化合物の任意と接触させ、CK活性を比較することができる。
【0035】
本発明のさらに別の態様において、有害な物質またはシステムへの曝露に起因すると予想されるであろう減少したCK活性を予防または改善する薬理学的物質を同定するために、単離されたCKアイソフォームの一つまたは複数のアリコートを上述されたような有害な物質またはシステムへの曝露の前に上述されたライブラリーにおいて同定された低分子試験化合物の任意と接触させ、CK活性を比較することができる。
【0036】
本発明の別の局面は、クレアチンキナーゼ代謝を改善するために、クレアチンキナーゼをコードするヌクレオチド配列を有するベクター構築物を用いて、心不全の危険性があるかまたは心不全の哺乳動物を処置するための新規の方法に関する。哺乳動物クレアチンキナーゼのヌクレオチド配列を有するベクター構築物が提供されて対象の心臓に投与され、クレアチンキナーゼ代謝において検出可能な変化をもたらす。
【0037】
さらなる局面において、検出可能な変化は、心臓クレアチンリン酸のATPに対する割合における変化を含み、かつそれによって測定され得る。別の局面において、変化は、クレアチンリン酸および/またはATPの心臓濃度における変化を含み、かつそれによって測定され得る。別の局面において、変化は、心臓クレアチンキナーゼ反応中の流量における変化を含み、かつそれによって測定され得る。
【0038】
別の局面において、ヌクレオチド配列はクレアチンキナーゼの脳アイソフォームをコードし得る。別の局面において、ヌクレオチド配列はクレアチンキナーゼの筋肉アイソフォームをコードし得る。別の局面において、ヌクレオチド配列はクレアチンキナーゼのミトコンドリアアイソフォームをコードし得る。さらなる局面において、ヌクレオチド配列は、脳アイソフォーム、筋肉アイソフォーム、および/またはミトコンドリアアイソフォームを含む、クレアチンキナーゼのヒトアイソフォームをコードし得る。
【0039】
本発明の別の局面は、収縮機能を増加させるために、クレアチンキナーゼをコードするヌクレオチド配列を有するベクター構築物を用いて、心不全の危険性があるかまたは心不全の対象を処置するための新規の方法に関する。哺乳動物クレアチンキナーゼのヌクレオチド配列を有するベクター構築物が提供されて対象の心臓に投与され、心臓収縮機能において検出可能な増加をもたらす。
【0040】
さらなる局面において、検出可能な増加は、左心室もしくは右心室駆出率における変化および/または心係数における増加を含み、かつそれらによって測定され得るが、それらに限定されない。
【0041】
さらなる局面において、心臓収縮機能における増加は、x線、x線血管造影法、超音波もしくは心エコー検査法、核医学心室造影法もしくはシンチグラフィー、陽電子放出断層撮影法、磁気共鳴画像法、コンピュータ断層撮影法、ならびに/または侵襲性および非侵襲性の血行力学を含むがそれらに限定されない、多数の方法によって測定され得る。
【0042】
さらなる局面において、ヌクレオチド配列はクレアチンキナーゼの脳アイソフォームをコードし得る。別の局面において、ヌクレオチド配列はクレアチンキナーゼの筋肉アイソフォームをコードし得る。別の局面において、ヌクレオチド配列はクレアチンキナーゼのミトコンドリアアイソフォームをコードし得る。またさらなる局面において、ヌクレオチド配列は、脳アイソフォーム、筋肉アイソフォーム、および/またはミトコンドリアアイソフォームを含む、クレアチンキナーゼのヒトアイソフォームをコードし得る。
【0043】
本発明の別の局面は、有害な心臓リモデリングを改善するために、クレアチンキナーゼをコードするヌクレオチド配列を有するベクター構築物を用いて、心不全の危険性があるかまたは心不全の対象を処置するための新規の方法に関する。哺乳動物クレアチンキナーゼのヌクレオチド配列を有するベクター構築物が対象の心臓に投与されて、心室の大きさまたは形状における改善をもたらす。
【0044】
別の局面において、改善は、哺乳動物の拡張末期容量、収縮末期容量、心室壁の厚さ、および/または心室重量を含むがそれらに限定されない多数の測定法を含み得、および/またはそれらによって測定され得る。
【0045】
さらなる局面において、有害な心臓リモデリングにおける改善は、x線、x線血管造影法、超音波もしくは心エコー検査法、核医学心室造影法もしくはシンチグラフィー、陽電子放出断層撮影法、磁気共鳴画像法、コンピュータ断層撮影法を含むがそれらに限定されない多数の方法によって、および/またはリモデリングと相関するバイオマーカーの使用によって測定され得る。
【0046】
さらなる局面において、ヌクレオチド配列はクレアチンキナーゼの脳アイソフォームをコードし得る。別の局面において、ヌクレオチド配列はクレアチンキナーゼの筋肉アイソフォームをコードし得る。別の局面において、ヌクレオチド配列はクレアチンキナーゼのミトコンドリアアイソフォームをコードし得る。またさらなる局面において、ヌクレオチド配列は、脳アイソフォーム、筋肉アイソフォーム、および/またはミトコンドリアアイソフォームを含む、クレアチンキナーゼのヒトアイソフォームをコードし得る。
[本発明101]
以下の段階を含む、哺乳動物において検出可能な心臓クレアチンキナーゼ代謝を増加させるための方法:
哺乳動物クレアチンキナーゼをコードするヌクレオチド配列を有するベクター構築物を提供する段階;
ベクター構築物を哺乳動物の心臓に投与して、心臓クレアチンキナーゼ代謝において検出可能な増加をもたらす段階。
[本発明102]
検出可能な増加が以下の一つまたは複数である、本発明101記載の方法:
心臓クレアチンリン酸のATPに対する割合における変化;
クレアチンリン酸もしくはATPの心臓濃度における変化;または
心臓クレアチンキナーゼ反応中の流量における変化。
[本発明103]
以下の段階を含む、哺乳動物において心臓収縮機能を増加させるための方法:
哺乳動物クレアチンキナーゼをコードするヌクレオチド配列を有するベクター構築物を提供する段階;
ベクター構築物を哺乳動物の心臓に投与して、心臓収縮機能において検出可能な増加をもたらす段階。
[本発明104]
検出可能な増加が以下の一つまたは複数である、本発明103記載の方法:
左心室もしくは右心室駆出率における増加;または
心係数における増加。
[本発明105]
心臓収縮機能における増加が以下の一つまたは複数によって測定される、本発明103記載の方法:
x線;x線血管造影法;超音波もしくは心エコー検査法;核医学心室造影法もしくはシンチグラフィー;陽電子放出断層撮影法;磁気共鳴画像法;コンピュータ断層撮影法;または侵襲性もしくは非侵襲性の血行力学。
[本発明106]
以下の段階を含む、哺乳動物において有害な心臓リモデリングを改善するための方法:
哺乳動物クレアチンキナーゼをコードするヌクレオチド配列を有するベクター構築物を提供する段階;
ベクター構築物を哺乳動物の心臓に投与して、心室の大きさまたは形状における改善をもたらす段階。
[本発明107]
改善が以下の一つまたは複数である、本発明106記載の方法:
拡張末期容量;収縮末期容量;心室壁の厚さ;または心室重量。
[本発明108]
心室の大きさまたは形状における改善が、x線;x線血管造影法;超音波もしくは心エコー検査法;核医学心室造影法もしくはシンチグラフィー;陽電子放出断層撮影法;磁気共鳴画像法;コンピュータ断層撮影法の一つまたは複数によって;または、リモデリングと相関するバイオマーカーの使用によって測定される、本発明106記載の方法。
[本発明109]
ヌクレオチド配列が哺乳動物クレアチンキナーゼの脳アイソフォームをコードする、本発明101記載の方法。
[本発明110]
ヌクレオチド配列が哺乳動物クレアチンキナーゼの脳アイソフォームをコードする、本発明103記載の方法。
[本発明111]
ヌクレオチド配列が哺乳動物クレアチンキナーゼの脳アイソフォームをコードする、本発明106記載の方法。
[本発明112]
ヌクレオチド配列が哺乳動物クレアチンキナーゼの筋肉アイソフォームをコードする、本発明101記載の方法。
[本発明113]
ヌクレオチド配列が哺乳動物クレアチンキナーゼの筋肉アイソフォームをコードする、本発明103記載の方法。
[本発明114]
ヌクレオチド配列が哺乳動物クレアチンキナーゼの筋肉アイソフォームをコードする、本発明106記載の方法。
[本発明115]
ヌクレオチド配列が哺乳動物クレアチンキナーゼのミトコンドリアアイソフォームをコードする、本発明101記載の方法。
[本発明116]
ヌクレオチド配列が哺乳動物クレアチンキナーゼのミトコンドリアアイソフォームをコードする、本発明103記載の方法。
[本発明117]
ヌクレオチド配列が哺乳動物クレアチンキナーゼのミトコンドリアアイソフォームをコードする、本発明106記載の方法。
[本発明118]
哺乳動物がヒトである、本発明101記載の方法。
[本発明119]
哺乳動物がヒトである、本発明103記載の方法。
[本発明120]
哺乳動物がヒトである、本発明106記載の方法。
[本発明121]
以下の段階を含む、筋肉細胞においてクレアチンキナーゼ発現を増加させる薬理学的物質を同定するための方法:
培養下の単離された筋肉細胞を提供する段階;
薬理学的物質を一つまたは複数の筋肉細胞と接触させる段階;および
クレアチンキナーゼ発現における増加を検出する段階。
[本発明122]
筋肉細胞が心不全の哺乳動物から取得される心臓細胞である、本発明121記載の方法。
[本発明123]
筋肉細胞にクレアチンキナーゼプロモーターの制御下のレポーター構築物が形質導入され、かつ検出が、クレアチンキナーゼ発現を反映するように設計されたハイスループットシステムによる、本発明121記載の方法。
[本発明124]
単離された筋肉細胞が、薬理学的物質との接触の前または後に、心不全の特性を模倣する有害な物質または条件に曝露される、本発明121記載の方法。
[本発明125]
以下の段階を含む、クレアチンキナーゼ活性を増加させる薬理学的物質を同定するための方法:
単離されかつ精製されたクレアチンキナーゼを提供する段階;
薬理学的物質を精製されたクレアチンキナーゼと接触させる段階;および
クレアチンキナーゼ活性における増加を検出する段階。
[本発明126]
検出が、クレアチンキナーゼ活性を反映するように設計されたハイスループットシステムによる、本発明125記載の方法。
[本発明127]
単離されたクレアチンキナーゼが、薬理学的物質との接触の前または後に、心不全の特性を模倣する有害な物質または条件に曝露される、本発明125記載の方法。
[本発明128]
以下の段階を含む、心不全の危険性があるかまたは心不全の哺乳動物を処置するための方法:
哺乳動物クレアチンキナーゼをコードするヌクレオチド配列を有するベクター構築物を提供する段階;
ベクター構築物を哺乳動物の心臓に投与して、心臓クレアチンキナーゼ代謝において検出可能な増加をもたらす段階。
[本発明129]
検出可能な増加が以下の一つまたは複数である、本発明128記載の方法:
心臓クレアチンリン酸のATPに対する割合における変化;
クレアチンリン酸もしくはATPの心臓濃度における変化;または
心臓クレアチンキナーゼ反応中の流量における変化。
[本発明130]
ヌクレオチド配列が哺乳動物クレアチンキナーゼの脳アイソフォームをコードする、本発明128記載の方法。
[本発明131]
ヌクレオチド配列が哺乳動物クレアチンキナーゼの筋肉アイソフォームをコードする、本発明128記載の方法。
[本発明132]
ヌクレオチド配列が哺乳動物クレアチンキナーゼのミトコンドリアアイソフォームをコードする、本発明128記載の方法。
[本発明133]
以下の段階を含む、心不全の危険性があるかまたは心不全の哺乳動物を処置するための方法:
哺乳動物クレアチンキナーゼをコードするヌクレオチド配列を有するベクター構築物を提供する段階;
ベクター構築物を哺乳動物の心臓に投与して、心臓収縮機能において検出可能な増加をもたらす段階。
[本発明134]
検出可能な増加が以下の一つまたは複数である、本発明133記載の方法:
左心室もしくは右心室駆出率における増加;または
心係数における増加。
[本発明135]
心臓収縮機能における増加が以下の一つまたは複数によって測定される、本発明133記載の方法:
x線;x線血管造影法;超音波もしくは心エコー検査法;核医学心室造影法もしくはシンチグラフィー;陽電子放出断層撮影法;磁気共鳴画像法;コンピュータ断層撮影法;または侵襲性もしくは非侵襲性の血行力学。
[本発明136]
ヌクレオチド配列が哺乳動物クレアチンキナーゼの脳アイソフォームをコードする、本発明133記載の方法。
[本発明137]
ヌクレオチド配列が哺乳動物クレアチンキナーゼの筋肉アイソフォームをコードする、本発明133記載の方法。
[本発明138]
ヌクレオチド配列が哺乳動物クレアチンキナーゼのミトコンドリアアイソフォームをコードする、本発明133記載の方法。
[本発明139]
以下の段階を含む、心不全の危険性があるかまたは心不全の哺乳動物を処置するための方法:
哺乳動物クレアチンキナーゼをコードするヌクレオチド配列を有するベクター構築物を提供する段階;
ベクター構築物を哺乳動物の心臓に投与して、心室の大きさまたは形状における改善をもたらす段階。
[本発明140]
改善が以下の一つまたは複数である、本発明139記載の方法:
拡張末期容量;収縮末期容量;心室壁の厚さ;または心室重量。
[本発明141]
心室の大きさまたは形状における改善が、x線;x線血管造影法;超音波もしくは心エコー検査法;核医学心室造影法もしくはシンチグラフィー;陽電子放出断層撮影法;磁気共鳴画像法;コンピュータ断層撮影法の一つまたは複数によって;または、リモデリングと相関するバイオマーカーの使用によって測定される、本発明139記載の方法。
[本発明142]
ヌクレオチド配列が哺乳動物クレアチンキナーゼの脳アイソフォームをコードする、本発明139記載の方法。
[本発明143]
ヌクレオチド配列が哺乳動物クレアチンキナーゼの筋肉アイソフォームをコードする、本発明139記載の方法。
[本発明144]
ヌクレオチド配列が哺乳動物クレアチンキナーゼのミトコンドリアアイソフォームをコードする、本発明139記載の方法。
【図面の簡単な説明】
【0047】
特許または出願ファイルは、カラーで作成された少なくとも一つの図面を含む。カラーの図面を有する本特許または特許出願公報の複製は、依頼および必要料金の支払いで特許庁より提供される。
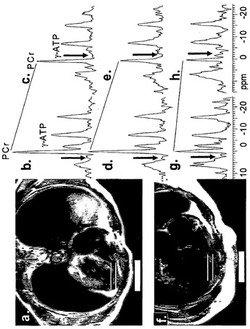
【図1】正常対象(a.)および拡張型心筋症および心不全の患者(f.)の磁気共鳴画像、ならびに健常対象(b〜e.)および心不全の患者(g〜h.)についての磁化移動研究由来の空間的に局在した31P NMRスペクトルを示す。クレアチンキナーゼ反応中の流量は、関心対象の代謝産物の特定の磁気共鳴を飽和させる化学的に選択的な磁化パルスの使用を含む磁化移動技術を用いて測定され得る。本図は、ATPのγ-リン酸共鳴が化学的に選択的な磁化パルスで飽和され得ることを示す(c、e、h、図中、矢印はPCrに対して約−2.5ppmの化学的に選択的な磁化パルスの振動数位置を示す)。対照照射の間に収集されたスペクトル(b、d、g、図中、矢印はPCrに対して約+2.5 ppmの化学的に選択的な磁化パルスの振動数位置を示す)と比較した際の、γ-ATP飽和の間のクレアチンリン酸共鳴における減少(c、e、h)は、クレアチンキナーゼ反応中の流量に直接関連している。CK代謝は、対照照射の間のより低いPCrレベル(より低いPCrピーク)によって証明されるようにHFの患者において減少しており(g)、一方、対照照射(g)とγ-ATP照射(h)との間のPCrピークの高さにおける変化の、PCrピークの間のより緩やかな傾きを伴う少なさによって証明されるようにCK中の流量はより少ない。
【図2】16人の健常対象(「正常」バー)ならびに17人の拡張型心筋症および心不全の患者(「CHF」バー)における、ATPに対する心臓クレアチンリン酸の割合(a)、クレアチンリン酸濃度(b)、ATP濃度(c)、ならびに擬似一次反応速度定数(d)およびCK中の流量(e)を示す。したがって、CK反応の産物および基質ならびにCK流量(すなわち、CK反応中のホスホリルの移動)はヒト心臓において測定可能であり、ヒト心不全および拡張型心筋症において変化している。
【図3】Ad-CK-B形質導入7日後に増加した心臓CK-B発現を示すウェスタンブロットを示す。
【図4A】TAC(0週)、心臓全体の形質導入(AdV Trnfx)(2週)、ならびにMRI/MRSおよび圧‐容積ループ(PVL)研究(3週)を示すスケジュール表を示す。
【図4B】正常動物、ならびに、TAC手術3週間後およびアデノ-CMV-β-ガラクトシダーゼ(β-Gal、n=5)またはアデノ-CMV-CK-B(CK-B、n=9)のいずれかを用いた心臓全体の形質導入(AdV Trnfx)の1週間後の動物における、インビボMRIによる解剖学的および機能的所見を示す。CKの無い構築物を受け入れた動物におけるMRIの所見は明らかに異常であり、一方CK-Bを含む構築物を受け入れた動物における所見は、TACを受けなかった正常動物のものとほぼ同一である。上のパネルは、正常動物由来の代表的な1H MR軸位像(左)および対応する心臓31P NMRスペクトル(右)を示す。中央のパネルは、TAC+βGal動物由来の代表的な1H MR軸位像(左)および対応する心臓31P NMRスペクトル(右)を示す。下のパネルは、TAC+CK-B動物由来の代表的な1H MR軸位像(左)および対応する心臓31P NMRスペクトル(右)を示す。
【図5】正常な対照動物における平均心臓PCr/ATP値(「対照」バー)、TAC+βGal動物における有意に減少した値(「TAC-Bgal」バー)、および、TACを受けなかった正常な対照動物における値とほぼ同一のTAC+CK-B動物における平均値(「TAC-CK」バー)を示す。
【図6】図6Aは、CK-Bの形質導入が、収縮末期容量(ESV)、一回拍出量(SV)、および駆出率(EF)を含む収縮機能のMRI指標を有意に改善することを示し;図6Bは、LV EFが遺伝子治療後の心臓PCr/ATPと相関したことを示し(EF=0.254(PCr/ATP)+0.0655、r2=0.40、P<0.005);および図6Cは、LV重量が遺伝子治療後の心臓PCr/ATPと相関したことを示す(LV重量=−73.7(PCr/ATP)+257.4、r2=0.50、P<.01)。したがって、CK-Bをコードするベクターの投与は機能不全の心臓の収縮またはポンプ機能を有意に改善し、かつ機能的改善の程度および有害なリモデリングの減衰は、この場合心臓PCr/ATP比によって測定されるCK代謝の改善の程度と相関するか、または依存する。
【図7】AAV2/9 CK-Mのプラスミドマップを示す。
【図8】図8Aは、AAV2/9 CK-M実験の実験スキームを示し;図8Bは、1H磁気共鳴画像上でAAV-CK-M投与の影響をAAVβGal(CK-Mが無い)のものと比較し;図8Cは、収縮機能のMRI測定上で同じものを比較し;および図8Dは、LV重量およびLV/体重によって測定されるようなリモデリング上で同じものを比較する。したがって、機能不全の発生の前のCK-Mをコードするベクターの投与は、収縮またはポンプ機能における低下および有害なリモデリングを有意に減衰させる。実際に、TAC手術にもかかわらず、駆出率(EF)が指標となるようにポンプ機能はCK治療後にほぼ正常(65%〜70%)である。
【図9】AAV2/9 CK-M形質導入の有利な長期の収縮効果がTAC後9週までの間持続することを示す。
【図10】図10Aは、筋細胞の単離およびマーカー遺伝子(βガラクトシダーゼ)についての染色を示し;および図10Bは、様々なベクターおよび様々な投与経路の投与後のマウスにおける平均形質導入効率を示す。動脈投与はヒトにおいて容易に達成され得るが、静脈内(IV)投与(図10Bの「AAV2/9 IV投与」)が最も単純、安全で、かつ侵襲性が低く、本マウスモデルにおいては有意な筋細胞のトランスフェクションと関連している。
【発明を実施するための形態】
【0048】
発明の詳細な説明
本開示を通して、本出願者らは、テキスト、特許文献、および他の情報源に言及する。当業者は、本発明の局面を作成および使用するために引用された情報源の任意の全内容を使用することができる。各々のおよびあらゆる引用された情報源は、具体的に全体として参照により本明細書に組み入れられる。これらの源の一部は、許容されるかまたは必要とされるとき本書類に含まれてもよい。しかしながら、本開示において具体的に定義されるかまたは説明される任意の用語または語句の意味は、源の任意の内容によって変更されるべきではない。
【0049】
ヒトにおける最近の観察は、HFにおいて減少したCK代謝の役割に新たな見識を提供する。これらは、CK反応の高エネルギー代謝産物のプール(すなわち基質および産物)における減少のみよりもむしろ、心臓CK活性における異常を明らかにする。31P核磁気共鳴分光法(31P NMR分光法)技術は、ヒト心不全の多くの形態において、減少したクレアチンリン酸(PCr)のATPに対する割合、または心臓PCr/ATP比を示してきており、この比は全体的な心臓血管系死亡率の強力な予兆である(Hardy et al. 1991, Neubauer et al. 1997)。最近実施された31P NMR分光法磁化移動法は、ヒト心臓におけるCK反応中の流量の測定を目下可能にし、HFにおけるATPの任意の損失の前でさえCK流量の割合において有意な50%〜70%の減少を示す。これらの観察は、HFの2種類の異なるタイプである拡張型心筋症(図1および2参照)(Weiss et al. 2005)および肥大性心筋症(Smith et al. 2006)においてなされた。これらのデータは、CK流量における異常が顕著であり、かつヒトHFの最も一般的な形態において起きることを示す。しかしながら、正常または不全の哺乳動物の心臓においてCK活性を増加させるための方法はこれまでは示されなかった。実際に、The New England Journal of Medicine中の心不全においてエネルギー代謝を改善するための戦略の最近の総説は、この選択肢について考察、または増強治療のための標的としてCK酵素を同定していない(Neubauer 2007)。
【0050】
遺伝子治療および低分子は、細胞において特定の酵素または反応の活性を増強するための理論的なアプローチを提供する。しかしながら、先行のアプローチは、HFを処置するための手段として心臓組織において減少したCK活性、CK流量、またはCK代謝産物の減少を予防するかまたは増強するために、これらのいずれかに依存したりまたは活用したりしていない。
【0051】
HFにおいてはCKアイソフォームの発現および活性が異なる。HFにおいてはCK-MおよびCK-mitoが減少し、CK-Bが増加している(Neubauer et al 1995, Nascimben et al 1996)。また、異なるアイソフォームはCK反応の基質に対して異なる親和性を有する可能性がある証拠が存在する。したがって、心不全においてCK発現または活性を改善するために仮に当業者が遺伝子治療または低分子アプローチを試みるとすると、どのCKアイソフォームが選択の標的であるべきか、およびCK-B発現を増加させることまたは減少させることのいずれが例えば恩恵となると考えられるかは不明である。
【0052】
本発明は、心臓クレアチンキナーゼ代謝、収縮機能、および/または心不全と関連するリモデリングの測定値を増加させるか、または減少を予防する新規の方法に関する。クレアチンキナーゼ発現の文脈における「変化した」という用語の使用は、心不全を予防する文脈においてレベルを維持する段階、または心不全の危険性がある哺乳動物を処置する段階を含むがそれらに限定されないことを意図し、心不全の哺乳動物において予想されるであろう、より低いレベルと比較したときの変質または変化を示す。
【0053】
添付の特許請求の範囲を含む本開示を通して、「増加する」または「増加させる」という用語の使用は、本明細書において開示される新規の方法によって標的とされる多数の条件(例えば、クレアチンキナーゼ代謝、発現、活性、および/または心臓収縮機能)の任意における実際の増加、または減少の予防もしくは改善のいずれかを指す。したがって、本発明のすべての局面は、心不全を処置および予防する段階(心不全の危険性がある哺乳動物を処置する段階としても言及される)ために適用可能である。一つの局面において、本発明は、心不全において心臓細胞機能を改善するために心臓細胞におけるCK代謝を増加させる新規の方法に関する。本発明の方法は、心筋においてCK遺伝子発現、CK活性、CK代謝産物、および/またはCK中の高エネルギーホスホリル基の移動を増加させる段階または減少を予防する段階を含み得、これらは遺伝子治療または薬理学的物質によって達成され得る。一つの局面において、本発明は、心臓の収縮またはポンプ機能を改善するため、およびHFが発生して進行するにつれて起きる有害な心臓の拡大(「有害な解剖学的リモデリング」)を制限するために、心臓においてCK代謝を増強するための方法に関する。さらに別の局面において、本発明は、処置モデルおよび予防的モデルの両方において心臓CK発現およびCK活性への物質の効果を評価するために、潜在的な化合物または物質をスクリーニングする段階に関する。したがって、そのような物質を同定するための方法は、CK発現および/または活性を増加させる物質、ならびに、心不全または心不全の特性を模倣する有害な物質またはシステムへの曝露と典型的に関連するCK発現および/または活性における減少を予防または改善する物質を含む。
【0054】
I.定義
本明細書において使用されるような「心不全」という用語は、心臓が正常な充満圧で体の必要を満たすのに十分な血液を送り出せない状態を指す。これは、後天性および遺伝性心疾患を含む。心不全および/または心筋症のいくつかの一般的な原因は、冠動脈疾患および心筋梗塞、浸潤性疾患、高血圧症、糖尿病、毒素(例えば、アルコールまたはアドリアマイシン)、ウイルス、心臓弁異常、ならびに未知(特発性)の原因を含むが、それらに限定されない。遺伝性または先天性心疾患、および原発性または二次性肺高血圧症などの肺疾患は、心不全の他の原因である。心不全はまた、頻拍ペーシングおよび大動脈結紮または狭窄を含むがそれらに限定されないいくつかの手段によって、実験モデルにおいて誘導され得る。
【0055】
本明細書において使用されるような「心臓収縮機能」という語句は、収縮し、かつそれによって体中に血液を送り出す心臓の機能を指す。心臓収縮機能は、休息時および運動の間の生理学的恒常性に重要であり、かつ実際に体におけるすべての器官の生理学的機能を支持する。心臓収縮機能を検出する方法は、臨床症状、身体の所見、検査室検査、ならびに/または侵襲性および非侵襲性の血行力学測定法を含むが、それらに限定されない。検出の他の方法は、x線、x線血管造影法、超音波もしくは心エコー検査法、核医学心室造影法もしくはシンチグラフィー、陽電子放出断層撮影法(PET)、磁気共鳴画像法(MRI)、および/またはコンピュータ断層撮影法(CT)を含むがそれらに限定されない画像検査を含むが、それらに限定されない。研究の場においては心臓収縮機能を定量化するために使用される多くの測定法および測定基準が存在する。臨床診療において、収縮機能の最も一般的な測定値は、駆出率(収縮の間の右心室または左心室の容量における部分的な(fractional)変化)、一回拍出量(各心拍で排出される血液の容量)、および心係数(ボディーマス指数について標準化された、単位時間あたりに排出される血液の容量)を含む。
【0056】
本明細書において使用されるような「心臓収縮不全」という語句は、心臓の収縮または収縮に続く弛緩における減少または欠陥を意味する。心臓収縮不全を検出する方法は、「心臓収縮機能」を評価するために説明されたのと同じ方法を含むがそれらに限定されず、それらの方法は実施例として本明細書に組み入れられる。
【0057】
本明細書において使用されるような「有害な心臓リモデリング」という語句は、心室の大きさまたは形状における変化の過程を意味する。心室の大きさまたは形状における変化は、心不全を含む心臓の疾患において起き得る心室腔の拡張もしくは拡大および/または心筋壁の菲薄化、ならびに/または拡張期弛緩における異常と時に関連する増加した心室重量(例えば、肥大)を含み得るが、それらに限定されない。有害な心臓リモデリングの臨床的測定値は、収縮機能について上述された画像化技術を用いて一般的に取得されるが、それらに限定されず、典型的には拡張末期容量(心拍サイクルの間の弛緩期の末期での右心室または左心室容量)、収縮末期容量(各心臓サイクルの間の収縮期収縮の末期での右心室または左心室容量)、重量(心臓または心臓チャンバーの重さ)、心臓壁の厚さ、およびτ(tau)(収縮後の弛緩の時間)を含む測定値由来である。
【0058】
本明細書において使用されるような「クレアチンキナーゼ代謝」という語句は、クレアチンキナーゼアイソフォーム(非限定的に、脳アイソフォーム(CK-B)、筋肉アイソフォーム(CK-M)、またはミトコンドリアアイソフォーム(CK-mito)を含む)の任意の発現、ならびに/またはクレアチンキナーゼ酵素の活性、ならびに/またはクレアチンキナーゼ反応中の流量、ならびに/またはクレアチンキナーゼ反応中のクレアチンリン酸とATPとの間のホスホリルの移動、ならびに/またはクレアチンリン酸、クレアチン、アデノシン三リン酸(ATP)、およびアデノシン二リン酸(ADP)を含むクレアチンキナーゼ反応の産物および/もしくは反応物のプールの大きさを意味する。
【0059】
本明細書において使用されるような「遺伝子送達」および「遺伝子導入」という語句は、筋肉細胞中などの標的細胞中へ外来性のDNAを確実に挿入するための方法またはシステムを指す。そのような方法は、遺伝子の一過的または長期の発現をもたらし得る。遺伝子導入は、後天性および遺伝性疾患の処置のために独特のアプローチを提供する。哺乳動物細胞中への遺伝子導入について多数のシステムが開発されている。例えば、米国特許第5,399,346号を参照されたい。
【0060】
本明細書において使用されるような「DNA」という用語は、弛緩しているかまたはスーパーコイル状いずれかの二本鎖または一本鎖形態における、デオキシリボヌクレオチド(アデニン、グアニン、チミン、またはシトシン)の多量体形態を指す。本用語は、分子の一次および二次構造のみを指し、任意の特定の三次形態に限定しない。したがって本用語は、とりわけ、直鎖状DNA分子(例えば、制限酵素断片)、ウイルス、プラスミド、および染色体において見出される一本鎖および二本鎖DNAを含む。本用語は、4種類の塩基、アデニン、グアニン、チミン、またはシトシンの任意を含む分子、および当技術分野において公知である塩基類似体を含む分子をとらえる。
【0061】
本明細書において使用されるような「遺伝子」または「コード配列」または特定のタンパク質を「コードする」配列という用語は、適切な調節配列の制御下に置かれた際にインビトロまたはインビボで転写され(DNAの場合)、翻訳される(mRNAの場合)核酸分子を指す。遺伝子の境界は、5'(アミノ)末端の開始コドンおよび3'(カルボキシ)末端の翻訳終止コドンによって決定される。遺伝子は、原核生物または真核生物mRNA由来のcDNA、原核生物または真核生物DNA由来のゲノムDNA配列、および合成DNA配列さえも含み得るが、それらに限定されない。
【0062】
本明細書において使用されるような「ベクター」という用語は、プラスミド、ファージ、トランスポゾン、コスミド、染色体、ウイルス、ビリオン、または、適当な制御要素と関連した際に複製が可能であり、かつ遺伝子配列を細胞に導入するように機能し得る任意の他の遺伝要素などの、任意の遺伝要素を指す。したがって本用語は、クローニングおよび発現媒体、ならびにウイルスベクターを含む。
【0063】
本明細書において使用されるような「発現ベクター」または「発現構築物」という用語は、遺伝子配列を細胞に導入してタンパク質発現に影響を及ぼすベクターの能力を増強し得、かつ機能的に連結されたプロモーターおよび/またはエンハンサーを含み得る追加的な要素とベクターを組み合わせる実体を指す。
【0064】
本明細書において使用されるような「プロモーター」または「プロモーター領域」という用語は、転写が始まる点(すなわち、転写開始部位)の前(上流)のDNAの領域であり、かつ一般化された真核生物RNAポリメラーゼII転写単位の上流プロモーター領域、プロモーター領域、またはプロモーターとして当技術分野において時には称される領域を指す。
【0065】
本明細書において使用されるような「機能的に連結される」または「作動的に連結される」という用語は、そのように説明された成分が通常の機能を果たすために設定される要素の配置を指す。したがって、コード配列に機能的に連結される制御要素は、コード配列の発現をもたらすことができる。制御要素は、コード配列の発現を導くように機能する限り、コード配列と連続している必要は無い。したがって、例えば、プロモーター配列とコード配列との間に介入する翻訳されないが転写される配列が存在し得、プロモーター配列はなおコード配列に「機能的に連結される」と考えられ得る。
【0066】
本明細書において使用されるような「エンハンサー」という用語は、特定のコード領域(例えば、遺伝子)に対して、時間、位置、および/または発現レベルの特異性を提供し得、かつ、該エンハンサーに結合する一つまたは複数の転写因子を含む細胞においてコード配列の転写のレベルを増加させ得る不連続の転写調節配列を指す。
【0067】
本明細書において使用されるような「AAVベクター」という用語は、AAV-1、AAV-2、AAV-3、AAV-4、AAV-5、AAVX7、および/またはAAV2/9を含むがそれらに限定されないアデノ随伴ウイルス血清型由来のベクターを指す。AAVベクターは、全体または一部が欠失した一つまたは複数のAAV野生型遺伝子、好ましくはrepおよび/またはcap遺伝子を有し得るが、機能的な隣接ITR配列を保持している。機能的なITR配列は、AAVビリオンのレスキュー、複製、およびパッケージングに必要である。したがって、AAVベクターは、ウイルスの複製およびパッケージングのためにシスで必要とされる少なくともそれらの配列(例えば、機能的なITR)を含むように本明細書において定義される。ITRは、配列が機能的なレスキュー、複製、およびパッケージングを提供する限り、野生型ヌクレオチド配列である必要は無く、例えばヌクレオチドの挿入、欠失、または置換によって改変されてもよい。
【0068】
本明細書において使用されるような「組換えウイルス」という用語は、例えば、異種の核酸構築物の粒子への添加または挿入によって遺伝的に改変されているウイルスを指す。
【0069】
本明細書において使用されるような「トランスフェクション」という用語は、哺乳動物細胞による外来性DNAの取り込みを指す。外因性DNAが細胞膜内に導入されている際、細胞は「トランスフェクトされて」いる。多数のトランスフェクション技術が当技術分野において公知である。例えば、Graham et al.. (1973) Virology, 52:456、Sambrook et al.. (1989) Molecular Cloning, a laboratory manual, Cold Spring Harbor Laboratories, New York、Davis et al. (1986) Basic Methods in Molecular Biology, Elsevier、およびChu et al. (1981) Gene 13: 197を参照されたい。そのような技術は、プラスミドベクターおよび他の核酸分子などの一つまたは複数の外因性DNA部分を適当な細胞中に導入するために使用され得る。本用語は、遺伝物質の安定的および一過的両方の取り込みを指す。
【0070】
本明細書において使用されるような「形質導入」という用語は、組換えAAVビリオンを介するような複製欠損ウイルスベクターを介した、インビボまたはインビトロいずれかでのレシピエント細胞へのDNA分子の送達を指す。
【0071】
本明細書において使用されるような「筋肉細胞」または「組織」という用語は、骨格筋、平滑筋、および心筋由来の細胞および組織を含むがそれらに限定されない筋肉由来の細胞または細胞の群を指す。本用語は、インビトロおよびインビボ両方の筋肉細胞をとらえる。本用語はまた、筋細胞、筋管、筋芽細胞、心筋細胞、および心筋芽細胞などの分化した筋肉細胞および分化していない筋肉細胞の両方を包含する。
【0072】
本明細書において使用されるような「制御要素」という用語は、レシピエント細胞においてコード配列の複製、転写、および翻訳を集合的に提供する、プロモーター領域、ポリアデニル化シグナル、転写終結配列、上流調節ドメイン、複製開始点、内部リボソーム進入部位(「IRES」)、エンハンサーなどを集合的に指す。選択されたコード配列が適切な宿主細胞において複製、転写、および翻訳されることができるとの条件で、これらの制御要素のすべてがいつも存在する必要は無い。
【0073】
「レポーター構築物」という用語とは、光学的、蛍光測定的、分光光度的、濃度測定的、核磁気共鳴、放射性、陽電子放出断層撮影、または他の技術によって検出され得るタンパク質をコードする遺伝子またはコード配列である。レポーター構築物の一つの例は、ルシフェリンおよびマグネシウム‐ATPに曝露された際に光学的技術で検出され得る光子を生成するホタルルシフェラーゼをコードする遺伝子またはコード配列である。
【0074】
本明細書において使用されるような「相同性」という用語は、二つのポリヌクレオチドまたは二つのペプチド部分の間の同一性のパーセントを指す。一つの部分由来の配列と別の配列の間の対応は、当技術分野において公知である技術によって決定され得る。例えば、配列情報をアラインメントし、かつ容易に入手可能なコンピュータプログラムを用いることによる、二つのポリペプチド分子の間の配列情報の直接比較によって、相同性が決定され得る。または、相同な領域間で安定な二本鎖を形成する条件下でのポリヌクレオチドのハイブリダイゼーション、その後の一本鎖特異的ヌクレアーゼを用いた消化、および消化された断片の大きさ決定によって、相同性が決定され得る。二つのDNAまたは二つのペプチド配列は、ヌクレオチドまたはアミノ酸の少なくとも約80%、好ましくは少なくとも約90%、および最も好ましくは少なくとも約95%が分子の規定された長さにわたって対応する際に、互いに「実質的に相同」である。
【0075】
本明細書において使用されるような「哺乳動物」という用語は、非限定的に、ヒト、ならびに、チンパンジーおよび他の類人猿およびサル種などの非ヒト霊長類;ウシ、ヒツジ、ブタ、ヤギ、およびウマなどの家畜;イヌおよびネコなどの家庭内哺乳動物;マウス、ラット、およびモルモットなどのげっ歯類を含む実験動物などを含む、哺乳綱の任意のメンバーを指す。本用語は、特定の年齢または性別を示さない。したがって、成体および新生児対象、ならびに胎児が、雄であろうと雌であろうとカバーされるように意図される。
【0076】
本明細書において使用されるような「薬理学的物質」または「薬理学的組成物」という用語は、薬学的または薬用効果を有するように投与される生物学的活性物質を指す。本用語は、発現ベクター、ベクター構築物、特定のペプチドまたは酵素(例えば、クレアチンキナーゼ)をコードするDNA、ポリペプチド、2000未満の分子量を有する低分子、タンパク質、抗体、ホルモン、有機および無機分子または組成物を含むが、それらに限定されない。
【0077】
本明細書において使用されるような「バイオマーカー」という用語は、生物学的状態の指標として役割を果たす血液または組織の測定値を指す。
【0078】
II.遺伝子治療
A.アデノウイルスベクター
細胞トランスフェクションのためのベクターとしてのアデノウイルスの使用は、当技術分野において周知である。アデノウイルスベクター媒介細胞トランスフェクションは、心臓を含む種々の細胞について報告されている(Stratford-Perricaudet, et al., 1992, Champion et al., 2004)。
【0079】
本発明のアデノウイルスベクターは、ウイルス初期遺伝子領域1(E1)および/またはE3の欠失によって複製欠損である。任意のアデノウイルスベクターが本発明の実施において使用され得ると考えられる。したがって、アデノウイルスベクターは、42種類の異なる公知の血清型またはサブグループA〜Fの任意の一つであり得る。アデノウイルスは、ベクターとしての使用のためにコードDNA配列を含むように工学される。そのような組換えアデノウイルスは、Gluzman et al., 1982によって記載されている。ベクター構築物を作製するために、遺伝子産物をコードするcDNAなどの個々のDNA配列がアデノウイルス中に挿入される。
【0080】
そのため、好ましい態様において、CK-M(遺伝子バンクエントリーNM 001824.2)、CK-B(遺伝子バンクエントリーNM 001823.3)、またはCK-mito(遺伝子バンクエントリーNM 001825.1)を含むヒトクレアチンキナーゼのコード配列が、アデノウイルス中のE1/E3コード配列が除去された位置に導入されるかまたは組込まれる。アデノウイルスの増殖は、当技術分野において周知である。本発明の組換えアデノウイルスを増殖させるために使用される特定の細胞株は、本発明にとって重要ではない。組換えアデノウイルスベクターは、例えば、条件付きの複製欠損アデノウイルス感染が許容的であるヒト293細胞または他の細胞株、例えば、条件付きの複製欠損ベクターにおける欠損を相補するように「トランスで」アデノウイルスE1遺伝子産物を発現する細胞上で増殖させることができる。さらに、そのウイルスストックを取得するために、細胞をプラスチックディッシュ上または浮遊培養中のいずれかで増殖させることができる。
【0081】
B.アデノ随伴ベクター
アデノ随伴ウイルス(AAV)は複製欠損パルボウイルスであり、その一本鎖DNAゲノムは、145ヌクレオチドの逆位末端反復配列(ITR)を含み、長さが約4.7 kbである。AAVベクターの使用は当技術分野において周知である。AAVがヒト細胞に感染すると、ウイルスゲノムは19番染色体中に組込まれ、細胞の潜伏性感染をもたらす。感染性ウイルスの生成は、細胞にヘルパーウイルス(例えば、アデノウイルスまたはヘルペスウイルス)が感染するまで起きない。アデノウイルスの場合は、遺伝子E1A、E1B、E2A、E4、およびVAがヘルパー機能を提供する。ヘルパーウイルスの感染時に、AAVプロウイルスはレスキューされて増幅され、AAVおよびアデノウイルスの両方が生成される。
【0082】
AAVは、外来性DNAを細胞中に送達するためのベクターとして魅力的にする独特の特徴を有する。培養における細胞のAAV感染は非細胞変性性であり、ヒトおよび他の動物の自然感染は、無症状かつ無症候性である。さらに、AAVは大抵の(全部ではないが)哺乳動物細胞に感染し、インビボで多くの様々な組織を標的とする可能性を許容する。Kotin et al., EMBO J., 11(13): 5071 5078 (1992)は、AAVのDNAゲノムが感染時に19番染色体上への標的化された組込みを受けることを報告した。ウイルスDNAの複製は組込みに必要とされず、したがってヘルパーウイルスは組込みに必要とされない。AAVプロウイルスゲノムは、プラスミドにおけるクローン化されたDNAが組換えゲノムの構築を実行可能にするときに感染性である。さらに、AAVの複製、ゲノムのキャプシド形成、および組込みを指示するシグナルはAAVゲノムのITR内に含まれているため、したがってゲノムの内部の約4.3 kb(複製およびキャプシド構造タンパク質、rep-capをコードする)は、プロモーター、関心対象のDNA、およびポリアデニル化シグナルを含む遺伝子カセットなどの外来性DNAで置換されてもよい。AAVの別の重要な特徴は、極度に安定でかつ強いウイルスであることである。AAVは、アデノウイルスを不活性化するために数時間使用される条件(56℃〜65℃)を容易に耐え、AAVベースのワクチンの低温保存をあまり重要でなくする。最後に、AAV感染細胞は重感染に抵抗性でない。
【0083】
アデノ随伴ウイルス(AAV)由来の組換えベクターは、心臓を含むいくつかの組織への遺伝子送達のために使用されてきた(Champion et al., 2004)。AAVは広い宿主範囲を有し、適当なヘルパーウイルスでの細胞の成功裡の感染がまたある限り、任意の種由来の細胞において複製することができる。したがって、例えば、ヒトAAVはイヌアデノウイルスが重感染したイヌ細胞において複製すると考えられる。AAVはいずれのヒトまたは動物疾患とも関連しておらず、組込み時に宿主細胞の生物学的特性を変化させないようである。AAVの総説については、例えば、Berns and Bohenzky (1987) Advances in Virus Research (Academic Press, Inc.) 32:243-307を参照されたい。AAVゲノムは、約4681塩基を含む直鎖状一本鎖DNA分子から構成される(Berns and Bohenzky、前記)。この場合、AAVウイルスはCK-M、CK-B、またはCK-mitoをコードすると考えられる。AAVゲノムの詳細な説明については、例えば、Muzyczka, N. (1992) Current Topics in Microbiol. and Immunol. 158:97-129を参照されたい。
【0084】
C.レンチウイルスベクターおよび他のベクター
レンチウイルスは、ウシレンチウイルス群、ウマレンチウイルス群、ネコレンチウイルス群、ヒツジヤギレンチウイルス群、および霊長類レンチウイルス群のメンバーを含む。遺伝子治療のためのレンチウイルスベクターの開発は、Klimatcheva et al., 1999, Frontiers in Bioscience 4: 481-496において概説されている。導入遺伝子を含むレンチウイルスは、組換えレンチウイルスが対象において重大な毒性または免疫原性をもたらすことなく対象の細胞に形質導入するために使用され得、かつ、形質導入の後、導入遺伝子が発現するという点で長所を有する。この場合、レンチウイルスはCK-M、CK-B、またはCK-mitoをコードすると考えられる。哺乳動物において心臓トランスフェクションが可能であると考えられ、好ましい態様において、CK-M、CK-B、またはCK-mitoのためのトランスフェクションベクターとして含まれると考えられる他のベクターが将来利用可能になってもよい。
【0085】
D.コード配列
コード配列は任意の遺伝子産物をコードし得る。コード配列は、該ポリペプチドの転写、翻訳、および発現のための少なくとも一つのオープンリーディングフレームを含むとの条件で、イントロンおよびエクソンを含み得る。したがって、コード配列は、遺伝子、分断遺伝子、またはcDNA分子を含み得る。コード配列が分断遺伝子を含む(一つまたは複数のイントロンを含む)事象において、該分断遺伝子を含むDNA分子を形質導入された細胞は、該遺伝子産物の発現が望ましい場合、該DNA分子由来のRNA転写物においてイントロンを除去し、かつエクソンを継ぎ合わせるための手段を有する必要がある。本発明の代替的な態様のいくつかにおいて、CK-M、CK-B、またはCK-mitoは、ベクター構築物のコード配列によってコードされ得る。
【0086】
E.エンハンサー‐プロモーター
ウイルスベクター構築物のコード配列は、好ましくは、アデノウイルス/アデノ随伴ウイルス/レンチウイルスのエンハンサー‐プロモーター以外のエンハンサー‐プロモーターに機能的に連結される。プロモーターは、転写が始まる点(すなわち、転写開始部位)の前(上流)の典型的には約100ヌクレオチドペア以内のDNA分子の領域である。該領域は典型的に、様々な遺伝子において類似した相対的位置に配置されているいくつかのタイプのDNA配列要素を含む。本明細書において使用されるとき、「プロモーター」という用語は、一般化された真核生物RNAポリメラーゼII転写単位の上流プロモーター領域、プロモーター領域、またはプロモーターとして当技術分野において称されるものを含む。
【0087】
別のタイプの不連続の転写調節配列要素はエンハンサーである。エンハンサーは、特定のコード領域(例えば、遺伝子)に対して、時間、位置、および/または発現レベルの特異性を提供する。エンハンサーの主要な機能は、該エンハンサーに結合する一つまたは複数の転写因子を含む細胞においてコード配列の転写のレベルを増加させることである。プロモーターと異なり、エンハンサーは、プロモーターが存在する限り転写開始部位から可変な距離に位置しても機能し得る。エンハンサー‐プロモーターをコード配列に機能的に連結するための手段は、当技術分野において周知である。
【0088】
本発明のベクター構築物において使用されるようなエンハンサー‐プロモーターは、心筋細胞において発現を駆動する任意のエンハンサー‐プロモーターを含み得るが、それらに限定されない。本明細書の下文に示される実施例において、ヒトサイトメガロウイルス(CMV)前初期遺伝子プロモーターが、心臓の心筋層において遺伝子の高レベルの発現をもたらすために使用されてきた。しかしながら、当技術分野において周知である他のウイルスまたは哺乳動物細胞プロモーターの使用もまた、発現のレベルが心筋細胞において特異的に生理学的効果を達成するのに十分であるとの条件で、遺伝子産物の発現を達成するのに適当である。例示的かつ好ましいエンハンサー‐プロモーターは、CMVプロモーター、ラウス肉腫ウイルス(RSV)プロモーター、および筋肉特異的クレアチンキナーゼ(MCK)エンハンサー(Zambetti et al., 1992;Yi et al., 1991およびSternberg et al., 1988)である。好ましい心筋特異的エンハンサー‐プロモーターは、心臓アイソフォームトロポニンC(cTNC)プロモーター(例えば、Parmacek et al., 1992およびParmacek et al., 1990を参照されたい)またはミオシン重鎖プロモーター(MHC)またはトロポニンIである。またさらに、特異的な生理学的シグナルに応答して調節されるエンハンサー‐プロモーターの選択は、誘導性の遺伝子産物発現を可能にし得る。
【0089】
F.ウイルス送達
一般に、ビリオンはインビボまたはインビトロいずれかの形質導入技術を用いて筋肉細胞中に導入される。形質導入された細胞の対象中への送達および導入のための適当な方法が説明されている。例えば、細胞は、組換えビリオンを心臓または心臓前駆細胞と併用することによってインビトロで形質導入され得る。その後、形質導入された細胞は下記でより完全に説明されるように薬学的組成物に製剤化され得、かつ該組成物は、筋肉内、静脈内、動脈内、皮下、および腹腔内注射、または、カテーテルベースもしくは外科的技術を用いた心筋中もしくは心膜腔中への注射などの種々の技術によって、対象中へ導入され得る。
【0090】
インビボ送達のために、ビリオンは上述されたように薬学的組成物に製剤化され、かつ一般に非経口的に投与されると考えられ、増強された心臓形質導入を可能にする技術を含んでもよい。心臓へのウイルストランスフェクションのための新規の方法は以前に記載されており、アデノウイルスおよびアデノ随伴ウイルス両方を用いて堅牢なウイルストランスフェクションを達成することができる(Champion et al. 2004)。
【0091】
薬学的組成物は、関心対象のタンパク質の治療的有効量、すなわち、心不全を処置するのに十分なCK-M、CK-B、またはCK-mitoの量を生成するのに十分な遺伝物質を含むと考えられる。薬学的組成物はまた、薬学的に許容される賦形剤を含むと考えられる。そのような賦形剤は、それ自体が組成物を受け入れる個体にとって有害な抗体の産生を誘導せず、かつ不適当な毒性無く投与され得る任意の物質を含む。薬学的に許容される賦形剤は、水、生理食塩水、グリセロール、およびエタノールなどの液体を含むが、それらに限定されない。薬学的に許容される塩は、塩酸塩、臭化水素酸塩、リン酸塩、硫酸塩などのような無機酸塩;および、酢酸塩、プロピオン酸塩、マロン酸塩、安息香酸塩などの有機酸の塩を含むが、それらに限定されない。さらに、湿潤剤または乳化剤などの補助物質、pH緩衝物質などがそのような賦形剤中に存在してもよい。薬学的に許容される賦形剤の詳細な考察は、REMINGTON'S PHARMACEUTICAL SCIENCES(Mack Pub. Co., N.J. 1991)において入手可能である。
【0092】
適切な用量は、他の因子の中で、処置される哺乳動物(例えば、ヒトまたは非ヒト霊長類または他の哺乳動物)、処置される対象の年齢および全身状態、処置される状態の重症度、問題となっている特定の治療的タンパク質、ならびに投与の様式に依存すると考えられる。適切な有効量は、当業者によって容易に決定され得る。
【0093】
したがって、治療的有効量は、臨床試験を通して決定され得る比較的広い範囲に収まると考えられる。例えば、骨格筋または心筋への直接的な注射によるインビボ投与について、治療的有効量は約106〜1015のオーダーのアデノウイルスまたはAAVビリオン、より好ましくは108〜1014のアデノウイルスまたはAAVビリオンであると考えられる。他の有効用量は、用量反応曲線を確立する日常的な試験を通して当業者によって容易に確立され得る。用量処置は、単一用量スケジュールまたは複数用量スケジュールであってもよい。さらに、対象は適切なだけの用量を投与されてもよい。当業者は適切な数の用量を容易に決定し得る。
【0094】
ウイルス調製物の投与は、複数の方法によって達成され得る。そのような方法は、心臓を灌流する血管中にウイルスベクター構築物を注入する段階、または心室壁もしくは心房壁などの心筋中に直接ウイルスベクター構築物を注射する段階を含むが、それらに限定されない。好ましいインビボの態様において、カテーテルを血管中に挿入し、心筋層の一部を灌流する冠動脈中に進める。いくつかの技術がウイルス形質導入を増強するために使用され得る。例として、ウイルスの肝取り込みを予防し、かつ有意なウイルストランスフェクションを提供する大動脈遮断および体全体の冷却の設定において、堅牢なウイルス形質導入が起こり得ることが最近示されている(Champion et al., 2004)。生理学的条件とは心筋細胞の生存に必要な条件であり、温度、pH、容量オスモル濃度などの条件を含む。好ましい態様において、体温は、約17℃〜約50℃、より好ましくは約30℃〜約40℃、およびさらにより好ましくは約37℃である。pHは、好ましくは約6.0の値〜約8.0の値、より好ましくは約6.8の値〜約7.8の値、および最も好ましくは約7.4である。容量オスモル濃度は、好ましくは1リットルあたり約200ミリオスモル(mosm/L)〜約400 mosm/L、およびより好ましくは約290 mosm/L〜約310 mosm/Lである。心筋細胞の生存を維持するために必要とされる他の生理学的条件は、当技術分野において周知である。
【0095】
III.生理学的物質のスクリーニング
本発明の一つの態様は、薬理学的物質を用いてHFにおいて心臓CK代謝を増加させるかまたはその減少を予防することである。本発明の一つの局面は、心臓細胞においてCK発現および/またはCK活性を増加させ得る物質を同定するために
潜在的な化合物のライブラリーを評価し得るハイスループットスクリーニング(HTS)である。本HTSのための化合物収集物は、ChemBridge(San Diego, CA)由来の40,000個の合成化合物、MicroSource Discovery(Gaylordsville, CT)由来の1680個の合成および天然産物、NCI-DTP由来の42000個の合成化合物、およびTimTec(Neward, DE)由来の2056個の化合物を含むが、それらに限定されない。
【0096】
そのような物質は、特定のCKアイソフォームをコードする遺伝子の発現を増加させることによって、産生されるCKタンパク質の量を増加させることによって、および/またはCK酵素の活性を増加させることによって、HFにおいて心臓CK代謝を増加させ得るか、および/またはその減少を予防し得る。mRNAは、遺伝子発現にとって重要であり、細胞の多くの機能の中心であり、複雑な二次および三次構造的折り畳みを含み、かつ細胞の修復機構を欠損する。RNAと相互作用する低分子の能力はよく認識されており、これらの相互作用は、遺伝子発現を予防または増強し、遺伝子発現の対立遺伝子特異的調節を達成し(対立遺伝子の配列の差異が変化したRNAコンフォメーションをもたらす際)、遺伝子発現のアイソフォーム特異的調節を達成し、かつアロステリック効果を示す能力を有する(Novac et al. Nucleic Acids 2004)。
【0097】
一つの態様において、本発明は、一つまたは複数のCKアイソフォーム(CK-M、CK-B、またはCK-mito)をコードする特異的遺伝子の発現を増加させる薬理学的物質を同定するための方法に関する。本方法は、胎児性または新生児ラット心臓由来のラット新生児心筋細胞またはH9c2細胞などの、クレアチンキナーゼの少なくとも一つのアイソフォームを通常発現する細胞を単離する段階を含むと考えられる。筋細胞はまた、正常の成体哺乳動物心臓および実験的または臨床的HFの心臓からも単離され得る。より大きな動物(例えば、ブタおよびイヌ)における心不全モデルは、より多くの数の心筋細胞を提供するため、しばしば好ましい。心不全は、頻拍ペーシング(O'Rourke et al. 1999, Wei et al. 2007)および大動脈結紮(Ye et al. 2001)を含むがそれらに限定されない多数の方法によって誘導され得る。筋細胞は、心臓を切除する段階、左前下行枝などの単一の冠動脈によって灌流される領域を単離する段階、ならびに、細胞を分離するためのコラゲナーゼおよびプロテアーゼまたは他の物質を含む冷たい名目上カルシウムを含まない溶液で領域を灌流する段階によって、心不全の実験モデルから単離することができる。カルシウムを灌流溶液に再導入し、かつ、心室壁の中間の領域を解剖して遊離させ、細胞を分散させ、網目を通して漉して、使用のために保存する(O'Rourke et al. 1999, Wei et al. 2007)。心筋細胞はまた、研究のためにヒト心臓から単離することができる(del Monte et al. 1995)。したがって、正常または不全の心臓の確立された株由来の細胞を研究のために取得することができる。使用される特定の細胞株、特定の培養条件、単離技術、および正確な濃度は本発明にとって重要ではなく、本発明の概念、趣旨、および範囲から逸脱することなく変形物が適用され得ることを、当業者は認識することができる。
【0098】
1 mlあたり50,000細胞の濃度の細胞に、例えばCK-Mプロモーターの制御下でホタルルシフェラーゼをコードするレポーター構築物(1細胞あたり20 pg)をバッチで形質導入する(Phippard and Manning 2003)。形質導入された細胞を、96ウェル、384ウェル、または1536ウェルプレート(Packard, Biotrend Chemicals)上に1ウェルあたり5,000細胞の密度で蒔く。その後、上述されたような低分子試験化合物のライブラリーを、ロボット液体操作装置(例えば、BioMEK FX)を用いることによって添加し、二重ルシフェラーゼレポーターアッセイシステム(Promegaによるものなど)を用いることによってCK遺伝子転写への推定の物質の効果を決定し得る。プレートの特定の数、プレートの供給業者、ロボット操作装置、およびルシフェラーゼレポーターシステムは単に例として提供され、限定されることを意図していない。本発明の概念、趣旨、および範囲から逸脱することなく変形物が適用され得ることを、当業者は認識することができる。
【0099】
別の態様において、筋肉細胞は心不全の哺乳動物から取得される心臓細胞である。
【0100】
本発明の別の態様において、細胞の一つまたは複数は(形質導入されていようといまいと)、心不全の特性を模倣する有害な物質またはシステム(過酸化水素への曝露などの活性酸素種生成システムを含むがそれに限定されない)に曝露され得る。その後、有害な物質またはシステムによってもたらされた減少したCK発現を増加させる薬理学的物質を同定するために、細胞のいくつかを試験化合物のライブラリーにおいて同定された低分子試験化合物の任意と接触させることができ、それらの細胞のCK発現を不活性(対照)物質と接触させた細胞と比較することができる。本発明の概念、趣旨、および範囲から逸脱することなく変形物が適用され得ることを、当業者は認識することができる。
【0101】
本発明の別の態様において、CK発現を増加させる薬理学的物質を(低分子試験化合物から)同定するために、細胞の一つまたは複数を(形質導入されていようといまいと)、上述されたような有害な物質またはシステムへの曝露の前に試験化合物のライブラリーにおいて同定された低分子試験化合物の任意と接触させることができ、それらの細胞のCK発現を不活性(対照)物質と接触させた細胞と比較することができる。本態様において使用されるような増加とは、薬理学的物質との接触が無い状態において有害な物質またはシステムへの曝露に起因すると予想されるであろう減少したCK発現を予防または改善することを指すように意図される。本発明の概念、趣旨、および範囲から逸脱することなく、なされる比較を含んで変形物が適用され得ることを、当業者は認識することができる。
【0102】
本発明のさらに別の態様は、CK活性を増加させる分子または試験化合物を同定するための薬理学的物質スクリーニングである。これは、mRNA発現についての上記のスクリーニングと類似しているが、CK活性に関する。CK活性を増加させ得る機構は、リン酸化、メチル化(O結合型メチル化など)、酸化、およびスルフヒドリル不活性化の効果を減少させるものを含むが、それらに限定されない。
【0103】
CK活性を増加させるかまたは保存する物質についてのハイスループットスクリーニング(HTS)を作製するアプローチは、CKアイソフォームの一つの精製された源を作製する段階、CKアイソフォームをCK活性についてアッセイできるハイスループットシステム中に配置する段階、試験化合物の低分子ライブラリーにおける物質などの一連の物質の各々をHTSシステム中のCKアイソフォームと別々に接触させる段階、およびその後、適切な対照および標準化合物、ならびに/または化合物無しと関連する際にCK活性を反映する出力上への各低分子の効果を読み取る段階の一般的な段階を含む。
【0104】
CK活性を増強する化合物を同定する本アプローチの一つの態様は、腫瘍学における化学療法応用のためのCK-Bの阻害剤を同定するために使用されるいくつかの共通の段階を利用すると考えられる(Towler et al. Analytical Biochemistry 2000; 279:96-99)。哺乳動物CK-B発現ベクターのEcoRI断片などのCK-B発現ベクター(またはCK-MもしくはCK-mitoのためのベクター)を、市販の大腸菌(E. coli)中への組込みのためにPET21a+のecoRI部位にクローン化することができる。インサートはPfu DNAポリメラーゼで増幅することができ、結果として生じた断片は大腸菌発現ベクターpST085をもたらすように適切にクローン化することができる。可溶性CKの発現は、ベクターを有する大腸菌細胞を増殖させた後にIPTGなどの物質を用いた1〜2時間の誘導期間をおくことによって最適化することができる。必要な際には、細胞を溶解し、その後、遠心分離、カラム溶出、分画、再遠心分離、および追加的なスクリーニングの一連の段階を行うことができ、結果として生じたCK酵素タンパク質をアリコートに分けて凍結乾燥することができる。精製されたクレアチンキナーゼ酵素を取得するための正確な方法は本発明にとって重要ではない。本明細書において使用されるとき、精製されたとは、精製度の正確な測定を強要するようには意図されない。むしろ、他の酵素の存在がスクリーニング法の結果を変化させ得るため、細胞に存在する他の酵素、特にATPまたはクレアチンを利用する酵素から分離されたクレアチンキナーゼ酵素を指すように意図される。本発明の概念、趣旨、および範囲から逸脱することなく、当業者は容易に本アプローチを改変することができ、または精製されたクレアチンキナーゼ酵素を生成する別のアプローチを開発することができる。
【0105】
その後、この精製されて濃縮されたCKアイソフォームおよびロボットシステム(例えば、Tomtec Quadra)を用いて、96ウェル、384ウェル、または1536ウェルプレートの各々において、(1)70 mlの125 mM Trizma, pH 7.5/0.4 mM ADP/8 mM クレアチンリン酸(Cr-P)、(2)20 mlの空隙、(3)70 mlの125 mM Trizma, pH 7.5/5〜10 nM CK-B、(4)20 mlの空隙、および(5)20 mlの50% DMSO中の化合物(最終濃度12.5 mM)を混合する段階を含む、Towlerらにより以前に報告されたものと類似した方法でHTSを行うことができる。CK活性と関連する発色剤であるジアセチルを添加した後、プレートリーダーを用いてある特定の時間後に530 nmで光学濃度を測定することによって読み取ることができる。適切な陽性および陰性対照を組込むことができる。クレアチンキナーゼ活性については多くの従来のアッセイが存在し、それらのいくつかもクレアチンキナーゼの活性化剤を同定する目的のためにHTSに適合させることができる。本アプローチは単に本段階を行うための一つの態様であり、本HTSの特定の段階が本発明を限定することは意図されていない。CK活性の本測定値を増加させる物質は、下記の実施例において説明されるようなインビトロおよびインビボの生理学的モデルおよび心不全モデルの両方におけるさらなる試験のための理想的な候補であると考えられる。
【0106】
本発明の別の態様において、単離されたCKアイソフォームの一つまたは複数のアリコートは、心不全の特性を模倣する有害な物質またはシステム(過酸化水素への曝露などの活性酸素種生成システムを含むがそれに限定されない)に曝露され得、一方単離されたCKアイソフォームの他のアリコートは曝露されない(対照)。その後、有害な物質またはシステムによってもたらされた減少したCK活性を増加させる薬理学的物質を同定するために、曝露されたCK酵素および曝露されていないCK酵素を試験化合物のライブラリーにおいて同定された低分子試験化合物の任意と接触させ、比較することができる。本発明の概念、趣旨、および範囲から逸脱することなく、なされる比較を含んで変形物が適用され得ることを、当業者は認識することができる。
【0107】
本発明のさらに別の態様において、有害な物質またはシステムへの曝露に起因すると予想されるであろう減少したCK活性を予防または改善する薬理学的物質を同定するために、単離されたCKアイソフォームの一つまたは複数のアリコートを、上述されたような有害な物質またはシステムへの曝露の前に上述されたライブラリーにおいて同定された低分子試験化合物の任意と接触させ、CK活性を比較することができる。本発明の概念、趣旨、および範囲から逸脱することなく、なされる比較を含んで変形物が適用され得ることを、当業者は認識することができる。
【実施例】
【0108】
実施例
以下の実施例は、本発明の様々な局面を例証する。これらの実施例は、限定すると解釈されるべきではなく、むしろ例証の目的のために含まれる。本発明は、添付の特許請求の範囲によってのみ限定されると解釈されるべきである。
【0109】
実施例1
CK-Bの遺伝子を含むアデノウイルスベクター構築物を用いて心臓収縮機能を改善する段階。
【0110】
本実施例は、心不全のマウスモデルにおいてCK-B発現を増加させ、エネルギー代謝を改善し、収縮機能を増加させ、かつ有害な心臓リモデリングを制限するためのウイルスベクター構築物の使用を説明する。
【0111】
CMVプロモーターを有するアデノ-CK-Bベクターを以前に記載されたように(Auricchio et al. 2001)作製する。マウスCK-B遺伝子のコード配列を以下のプライマー:フォワード、

;リバース、

を用いることによってマウス脳cDNA(CLONTECH)から増幅する。PCR産物をPCR2.1ベクター(Invitrogen, Carlsbad, CA)中にクローン化して配列決定する。その後、マウスCK-B配列をpAd-CMV-連結シャトルプラスミド(Vector Core, Institute for Human Gene Therapy, Univ. of Pennsylvania;CMVはサイトメガロウイルスプロモーターを示す)中にクローン化する。pAd-CMV導入遺伝子プラスミドを、相同組換えによりアデノウイルスを作製するためのE1領域のマップ単位1〜9およびE3領域(サブ360)中に欠失を含むClaI消化のH5.010CMVEGFPウイルスバックボーンと共に293細胞(American Type Culture Collection)のコトランスフェクションに使用する。組換えプラークを最初に緑色/白色選択によって単離し、Hirt手順により抽出したDNAの制限酵素解析によって確認する。陽性プラークを精製し、CsCl勾配精製のために293細胞において増殖させる。
【0112】
心不全を誘導するため、以前に記載されたように(Knowles et al. 2001)雄のC57BL/6マウス(8〜12週、Jackson Laboratories, Bar Harbor, ME)を研究し、横大動脈を収縮させること(TAC)によって圧負荷を生成させる。先行の研究は、TACの本方法が3週間後に拡張症、機能不全、および心不全をもたらすことを示す(Takimoto et al. 2005a, Takimoto et al. 2005b)。さらに、ヒトHFにおいて観察されるものと類似する(Smith et al. 2006)CK代謝における異常はまた、この時期に31P NMR分光法によって検出される(Maslov et al. 2006)。
【0113】
イソフルランで麻酔する段階、19〜21℃の中核体温に冷却する段階、中間下行大動脈をクランプする段階、および、改変された心停止液をLV中に注入し、続いて以前に記載されたような20μLのベクターを3.3×1011粒子/kgの用量で注入する段階を含む形質導入をマウスに行う(Champion et al. 2003)。クランプは9分間維持し、その後開放して、中核温度が30〜40分にわたって37℃に上昇するまで必要に応じてペーシングまたはアドレナリン作動性の支持を施す(Champion et al. 2003)。アデノウイルス形質導入後の心筋遺伝子過剰発現は3〜5日でピークに達し、かつさらに7〜10日間ピークレベルで維持されるため(Champion et al. 2003)、TACの2週間後にアデノ-CK-Bのベクター構築物をマウスに形質導入し、形質導入の1週間後に調査する(図4A)。
【0114】
CK代謝および機能についてのインビボ結果を測定するために、4.7T/40 cm のOxford磁石および積極的に遮蔽された勾配が装備されたBruker CSI NMR/MRI分光計でインビボMRI/MRS実験を行う。TACの3週間後に、以前に記載されたような(Chacko et al. 2000, Weiss et al. 2002)インビボ心臓複合MRI/MRSプロトコールを用いて研究を行う。重量、心室容量、および駆出率を評価するためには、間隙が無いLV全体の高い時間的かつ空間的解像度の多片映画MR画像の完全なセットが必要とされる(Chacko et al. 2000, Weiss et al. 2002)。高エネルギーリン酸データを取得するために、画像化後に動物を再配置することなく、一次元31P化学シフト画像(1D-CSI)配列を使用する。31P NMR局在スペクトルにおけるPCrおよび[β-P]ATPのピークを、ピーク面積を積分することによって定量化する(Chacko et al. 2000)。インビボ心臓機能はまた、以前に記載されたように(Weiss et al. 2002)連続的なLV圧-容積データのために心尖部を介して左心室中に挿入された4電極圧-容積カテーテル(モデルSPR-839, Millar Instruments, TX, USA)を用いて、麻酔したマウスにおける圧-容積の関係によって評価する。
【0115】
結果を平均±標準偏差(SD)として示す。2群の間(例えば、TAC+βgal対TAC-CK-B)のLVの解剖学的構造、機能、および代謝のMRIおよびMRS由来の測定値の比較はスチューデントt検定で行い、一方、多数の群の間の血行力学的および機能的圧-容積ループ(PVL)測定値(表1)は分散の解析で比較する(ANOVA)。
【0116】
(表1)CK形質導入後の圧容積ループ解析により評価されたLV機能

略語:HR、心拍数;SBP、収縮期血圧;HW、心重量;ESV、収縮末期容量;EDV、拡張末期容量;SV、一回拍出量;PWRmx/EDV、容量で補正された力指数、最大dP/dt、時間にわたる圧力の最大一次導関数;EF、駆出率;CI、心係数;τ、緩和定数;*P<0.05対基線;#P<0.05対AdCMVβgal+TAC。
【0117】
本インビボ遺伝子送達アプローチがCKを増強し得る程度を示すために、正常なマウス心臓にCK-Bをコードするアデノウイルス(Ad-CK-B)を形質導入し、これは正常動物中にCK-B発現において数倍の増加(図3)、総CK活性において40%の増加(97±14対68±11 mmol/l/s、P=0.01)、およびMBにおいて140%の増加をもたらす。TACの2週間後に注射した動物において、Ad-CK-B形質導入は平均総CK活性を20%増加させ(76±8対63±6 mmol/l/s、P=0.02)、かつ7日後にMBを180%増加させる(P=0.004)。
【0118】
TACのインビボ代謝効果を測定するために、形質導入されていない動物をTACの3週間後の収縮機能パラメータが減少した際に調査する。図4Aは、TAC手術の3週間後かつ対照マーカー遺伝子アデノ-CMV-β-ガラクトシダーゼ(β-Gal、n=5)またはアデノ-CMV-CK-B(CK-B、n=9)のいずれかでの心臓全体の形質導入(AdV Trnfx)の1週間後にインビボMRIによる所見を示すスケジュール表を示す。図4Bの上のパネルは、正常動物由来の代表的な1H MR軸位像(左)および対応する心臓31P NMRスペクトル(右)を示す。図4Bの中央のパネルは、TAC+βGal動物由来の代表的な1H MR軸位像(左)および対応する心臓31P NMRスペクトル(右)を示す。図4Bの下のパネルは、TAC+CK-B動物由来の代表的な1H MR軸位像(左)および対応する心臓31P NMRスペクトル(右)を示す。これらのMRI研究の間の平均心拍数は、β-GalおよびCK-B心臓においてそれぞれ602±29および588±36 min-1であった(p=NS)。CKの無い構築物を受け入れた動物におけるMRI/MRS所見は明らかに異常であり、一方CK-Bを含む構築物を受け入れた動物における所見は正常動物のものとほぼ同一である。図5は、正常動物における平均心臓PCr/ATP値(「対照」バー)を、TAC+βGal動物における平均心臓PCr/ATPの減少(「TAC-Bgal」バー)、およびTAC+CK-B動物における平均心臓PCr/ATPのTACを受けなかった対照動物のものとほぼ同一の値への改善(「TAC-CK」バー)と比較して示す。したがって、インビボ平均心筋PCr/ATPは、ヒト心不全と一致して(Conway et al. 1991, Smith et al. 2006)、30〜40%減少している(図5)。したがって、HFの本マウスモデルは、ヒト心不全において報告されたものと類似する変化した心臓CK代謝のPCr/ATP変化を反映する。
【0119】
TACを受ける動物は、左心室肥大、心室拡張、および収縮機能の減少を発生する(表1および図6)。表1はカテーテルベースの圧容積ループ研究由来の知見を示す。表1において、TAC後にCK-B処置された動物(「AdCMVCK-B」、「TAC」カラム)の結果をTAC後に対照処置された動物(「AdCMVβGAL」、「TAC」カラム)と比較することは特に妥当である。特に、駆出率、一回拍出量、および力指数を含む収縮機能の指標は、CK-B処置されたTAC動物において有意により良好である。さらに、心重量および拡張末期容量を含む有害な解剖学的リモデリングの指標もまた、CK-B処置されたTAC動物において有意により良好である。図6Aは、CK-B形質導入が、収縮末期容量(ESV)、一回拍出量(SV)、および駆出率(EF)を含む収縮機能のMRI指標を有意に改善することを示す。
【0120】
最大dP/dTおよび力指数を含むLV収縮機能の他の測定値もまた、CK-Bを形質導入されたTAC動物において有意により良好である(表1)。一般的に使用される臨床測定である心係数は、対照動物(表1、「AdCMVβgal」、「TAC」カラム)よりもCK-B処置された動物(表1、「AdCMVCK-B」、「TAC」カラム)において有意により良好であった。さらに、MRIによるLV重量は、TAC+βgal動物よりもTAC+CK-B処置された動物においてより低く(それぞれ122±22 mg対171±33 mg、p<0.01)、拡張期弛緩の指標(例えば、τ)はCK-B処置された動物において有意により良好である(表1)。機械的機能がTAC+CK-Bにおいてより良好である(図6;表1)だけでなく、駆出率もLV重量のように(LV重量=−73.7(PCr/ATP)+257.4、r2=0.50、P<.01)(図6Cを参照されたい)、心臓PCr/ATPと相関し(図6B)、EF=0.254(PCr/ATP)+0.0655、r2=0.40、P<0.005である。したがって、CK-Bを用いた遺伝子治療はインビボ代謝および収縮機能を有意にかつ劇的に改善し、ならびに心不全における有害な心臓リモデリングを制限し、機能的およびリモデリング改善の程度はエネルギー状態と相関する。
【0121】
実施例2
CK-Mの遺伝子を含むAAVベクター構築物を投与することにより心臓収縮機能における低下を予防する段階。
【0122】
本実施例は、マウス心不全において数ヶ月の経過にわたって、CK-M発現を増加させ、エネルギー代謝を改善し、収縮機能を増加させ、かつ有害な心臓リモデリングを制限するためのアデノ随伴ウイルスベクター構築物の使用を説明する。
【0123】
ベクターを以下のように作製する。マウスCK-MをPCRによりマウス骨格筋cDNAライブラリーからクローン化する。pAAV2-CMV-EGFP3中のEGFPをCK-Mで置換することによってpAAV2-CMV-CK-Mを構築する。本ベクターのマップを図7に示す。AAV2/9トランスプラスミドを用いた3重トランスフェクション法によりAAV2/9ベクターを293細胞中で生成させ、3ラウンドの塩化セシウム勾配遠心分離によって精製する。
【0124】
実施例1で説明されたように、TAC心不全を誘導し、本ベクターを投与する。しかしながら、投与の時期はTACより1週間先立つ(図8A)。AAV2/9-CK-Mを形質導入された動物においては、インビボ心臓PCr/ATPが増加し(それぞれ1.5±0.2対2.5±0.7、TAC+βgal対TAC+CK-M、P<0.05)、収縮機能は有意により良好であり、平均駆出率はより高く、かつ収縮末期容量はより低い(図8C)。具体的には、AAV2/9-βGalまたはAAV2/9-CK-Mのいずれかを4週間前に形質導入された動物においてTACの3週間後に取得された代表的な拡張末期および収縮末期LV短軸MR画像(図8A)は、CKを形質導入された動物においてより良好な駆出を有するより小さいLVを示す(図8B)。対照AAV2/9-βGal(「AAV-βGal」バー、n=3)を形質導入されたマウスよりもAAV2/9-CK-M(「AAV-CK-M」バー、n=7)を形質導入されたマウスにおいて、収縮機能は有意により良好であり(図8C)、平均SVおよびEFはより高い。さらに、LV肥大の量は有意に減衰している(図8D)。これらの結果は、実施例1とTAC後の同じ時について示されている。AAVベクター構築物は長期のCK遺伝子発現を可能にし、収縮の恩恵はTAC後9週まで観察されて(図9)、正常動物のものにほぼ等しい平均駆出率を有する。したがって、心臓CK形質導入およびこの場合改善された心臓PCr/ATPによって指数化されるCK代謝における改善の後、収縮機能における低下および有害な心臓リモデリングの程度は有意に減衰している。
【0125】
実施例3
ヒト心不全におけるCK流量の増加
本発明の方法は、ヒト心不全において収縮機能を改善し、かつ有害な心臓リモデリングを制限するために使用され得、AAV2/9- CK-Bを含むベクターの静脈内投与を含む。
【0126】
心不全の患者は、減少した心室駆出率、減少した拡張期充満、心室拡張を示す画像研究によって、および/または胸部x線所見によって、心不全の症状または身体的所見などの欠陥が生じた収縮機能を示唆する一つまたは複数の臨床所見により同定され得る。31P NMR分光法による異常な心臓クレアチンキナーゼ代謝産物またはクレアチンキナーゼ流量の所見もまた存在し得(図1および2)、心不全の診断を行うのには必要とされないが、介入を誘導し、かつ前処置レベルまたはCK流量を記録するために使用され得る。患者は最初に、ベクター構築物を調製するために使用されるAAVに対する抗体の存在について試験され得る。抗体が存在する場合、患者は好ましくは約103〜106の組換えAAV粒子の試験用量を与えられる。
【0127】
CK遺伝子の一つに対するコード配列、この場合ヒトCK-Bをコードするものを含む組換えAAVは、ヒト対象への投与について食品医薬品局(Food and Drug Administration)に許容されると考えられ、かつヒト使用のために十分な有効性および精製度を有すると証明されると考えられる任意の方法によって、調製されかつ精製される。
【0128】
AAVベクター構築物は、好ましくは、ボーラスまたはある期間にわたる注入いずれかとして適当な薬理学的組成物において脈管内投与により、患者に投与される。本実施例において、ベクターは静脈内に投与され得る。ベクターは、一般的に心臓カテーテル法において行われるように頚静脈または大腿静脈中に配置されたカテーテルを用いて、末梢静脈または中心静脈を介して与えられ得る。
【0129】
AAV2/9血清型の静脈内投与は、心不全において収縮の恩恵をもたらすアデノウイルスの大動脈内投与で取得されるものに匹敵する有意な心筋細胞形質導入率を達成する(上記の実施例1を参照されたい)ことを、最近のデータは示す。β-ガラクトシダーゼを形質導入したマウスの心臓より筋細胞を単離し、形質導入された個々の細胞を同定するために染色し、図10(A)において青色の核で同定する。本アプローチを用いて、トランスフェクションされた筋細胞の分画を定量化して(図10B)、アデノウイルス(「AdV」バー、実施例1において使用されたものと同一)およびアデノ随伴ウイルス血清型2(図10B、「AAV2」バー)の大動脈投与後は約50%、およびアデノ随伴ウイルス血清型2/9(図10B、「AAV2/9」バー、実施例2において使用されたベクターおよび投与経路と同一)ではほぼ70%であることが見出される。AAV2/9の静脈内投与は、約40%の筋細胞の形質導入をもたらす(図10B、「AAV2/9」バー)。したがって、より新しいAAV血清型(例えば、AAV2/9)の静脈内投与によって達成可能な筋細胞形質導入率は、投与のためにより侵襲性の動脈内経路を用いる、より旧式のアデノおよびAAV血清型によって以前に達成されたものに匹敵する。本態様において、AAVベクターは有効な発現を誘導する量、好ましくは106〜1015の間のウイルス粒子またはpfu、および最も好ましくは108〜5×1012の間のウイルス粒子またはpfuで投与される。
【0130】
炎症反応などの急性および遅延有害反応をモニターするために、患者は試験の間入院した状態であり得る。心臓収縮機能への本発明の効果は、駆出率、拡張末期容量および収縮末期容量、心室圧および圧力変化率、ならびに心係数などの指標を評価するために、心エコー検査法、磁気共鳴画像法、コンピュータ断層撮影法、核医学心室造影法もしくはシンチグラフィー、または従来のx線血管造影法でモニターされ得る。6分の歩行において測定されるものなどの運動能力、または運動の間のピーク酸素消費もまた評価され得、心不全患者において改善していることが期待される。CK発現またはCK代謝への本発明の本態様の効果をモニターすることは必須ではない;しかしながら、行われ得、かつ診断または予後の臨床管理恩恵を提供する可能性がある。心臓CK発現への効果は、経静脈的心内膜心筋生検の間に取得されるものなどの生検で取得される組織を解析することによってモニターされ得る。CK代謝、CK流量、CK活性、およびCK中のホスホリルの移動への本発明の効果は、上記で説明されかつ示されたように(図1および2)31P NMR分光法によってモニターされ得る。
【0131】
参照文献




【技術分野】
【0001】
政府の権利の声明
米国政府は本発明において権利を有し得る。本発明は、NIH助成金第HL61912号およびHL63030号によって(部分的に)資金提供された。
【0002】
関連出願の相互参照
本出願は、2006年5月9日に出願された米国特許仮出願第60/798,886号および2007年5月8日に出願された米国特許非仮出願第 号(代理人整理番号第83284.0001号)の恩典を主張し、これらの両方はあたかも本明細書において完全に示されるかのように参照により本明細書に組み入れられる。
【0003】
発明の分野
一つの局面において、本発明は一般に、心不全を処置および予防する新規の方法に関する。一つの局面において、本発明は、心臓におけるクレアチンキナーゼ代謝を増加させ、それによって心不全において心臓収縮機能を改善し、かつ有害な心臓リモデリングを制限するために、クレアチンキナーゼのアイソフォームをコードする遺伝子の発現を増加させる段階に関する。別の局面において、本発明は、心不全の患者または心不全の危険性がある患者においてクレアチンキナーゼ代謝および/もしくは心臓収縮機能を改善するため、ならびに/または有害な心臓リモデリングを有利に変化させるために、クレアチンキナーゼをコードするDNA配列を含むベクター構築物を用いる新規の方法に関する。別の局面において、本発明は、心筋細胞におけるクレアチンキナーゼ発現または活性において検出可能な増加をもたらす薬理学的物質を同定する新規の方法に関する。
【背景技術】
【0004】
背景技術
心不全(HF)は、心臓が正常な充満圧で体の必要を満たすのに十分な血液を送り出せない状態として典型的に定義される。
【0005】
米国においては520万人がHFを有し、332億ドルの全体的な推定年間コストで毎年100万件以上のHFによる入院がある(American Heart Association, Heart and Stroke Statistical Update 2007, Dallas, Texas(非特許文献1))。
【0006】
ATPは、心筋におけるエネルギーの主要な生化学的形態であり、継続する正常な心臓収縮機能に燃料を供給するために必要とされる。不十分なATP供給がHFを起こし得る可能性が仮定されている(Ingwall 1993(非特許文献2))が、これが事実である直接の証拠はまだ無く、心不全においてATPの利用可能性を増加させるために同定された代謝的手段は無い(Katz 1998(非特許文献3))。
【0007】
心臓におけるATPの生成および/または利用可能性に貢献する多数の代謝経路には多くの反応が存在する。クレアチンキナーゼ反応は心臓のATP利用可能性に影響を及ぼす一つの反応である。クレアチンキナーゼは細胞において発現するタンパク質である。クレアチンキナーゼ(CK)は心臓の主要なエネルギー貯蔵であり、迅速かつ可逆的にクレアチンリン酸(PCr)およびADPをATPおよびクレアチン(Cr)に変換するため、心臓周期の間および増加した要求の期間の間に循環的にATPを提供する(Ingwall et al. 1985(非特許文献4)、Saks 1980(非特許文献5)、Wallimann 1994(非特許文献6))。CKの3種類の主要なアイソフォーム;筋肉アイソフォーム(CK-M)、脳アイソフォーム(CK-B)、およびミトコンドリアアイソフォーム(CK-mito)が存在する。心臓CK代謝における異常はほぼすべてのタイプの実験的および臨床的HFに存在し、CK基質における減少、胎児性CKアイソフォームへの転換、および総CK活性の減少を含む(Nascimben et al. 1996(非特許文献7))。これらの知見、ならびにヒトHFの驚くべき個人的および金銭的犠牲にもかかわらず、心臓CK代謝を増加させることに向けられた治療法は存在しない。
【0008】
しかしながら、変化した心臓CKエネルギー代謝がHFの収縮不全を引き起こすかまたは単にその多くの結果の一つであるかは、全く明らかでない。CKが心不全治療にとって適切な治療標的であるという事前の証拠は無く、かつ、実際に、減少したCKエネルギー代謝はHFに貢献したりまたは引き起こしたりしないことを当業者に予想させると考えられるいくつかの系列の証拠が存在する。第一に、心臓において主要なCK遺伝子を欠損したトランスジェニックマウス(CK-MおよびCK-mito両方についてのCKノックアウトマウス)が作製され、該マウスは明白なHFを発症しない(Saupe et al. 1998(非特許文献8))。遺伝子の欠如がHFを引き起こさないため、このことは、減少したCK代謝は収縮不全またはHFの原因ではないことを示唆する。さらに、ヒト心不全におけるCK反応の基質および産物の枯渇の程度は、10%〜30%のオーダーと比較的少なめであり(Starling et al. 1998(非特許文献9))、ATPの送達および心臓機能を限定すると予想されるであろうレベルではない。最後に、HFにおいて枯渇しているCK反応のための基質であるクレアチンの慢性的補充は、心不全の動物モデルにおいて収縮機能を改善しない(Horn et al. 1999(非特許文献10))。したがって、CK代謝を増加させる段階が成功する可能性が高いHFに対する処置となることは、当業者によって公知でないし、または予想されていない。
【先行技術文献】
【非特許文献】
【0009】
【非特許文献1】American Heart Association, Heart and Stroke Statistical Update 2007, Dallas, Texas
【非特許文献2】Ingwall 1993
【非特許文献3】Katz 1998
【非特許文献4】Ingwall et al. 1985
【非特許文献5】Saks 1980
【非特許文献6】Wallimann 1994
【非特許文献7】Nascimben et al. 1996
【非特許文献8】Saupe et al. 1998
【非特許文献9】Starling et al. 1998
【非特許文献10】Horn et al. 1999
【発明の概要】
【0010】
発明の概要
本発明の新規の方法は、クレアチンキナーゼ反応に影響を与え、それにより心臓細胞のためのエネルギーの供給を増加させることによって、心不全を処置および予防するための有効な方法の欠如と取り組む。本発明は、心筋の主なエネルギー貯蔵である心臓クレアチンキナーゼ代謝を改善することに向けられた、哺乳動物およびヒト心不全の新規の処置を提供する。本方法は、心筋クレアチンキナーゼタンパク質発現および/またはクレアチンキナーゼ活性、およびクレアチンキナーゼ反応中の流量を増加させるため、ならびにそれによって心不全において心臓収縮機能を改善し、かつリモデリングを改善するための遺伝子導入ベクターの使用に関する。本方法はまた、心不全治療のための潜在的な薬学的組成物として、クレアチンキナーゼ発現および/またはクレアチンキナーゼ活性を増加させる化合物をスクリーニングする段階および同定する段階を含む。
【0011】
本発明のいくつかの局面は、哺乳動物およびヒト心不全を処置または予防するためにベクター構築物を使用する新規の方法に関する。他の局面は、哺乳動物においてクレアチンキナーゼ代謝の検出可能な増加、または心臓収縮機能もしくは有害な心臓リモデリングにおける改善をもたらす段階に関する。したがって、本明細書において定義されるとき、「哺乳動物」または「哺乳動物の」へのいずれかの言及は、「ヒト」を含むがそれに限定されない。本発明の他の局面において、ベクターは、プラスミド、ファージ、トランスポゾン、コスミド、染色体、ウイルス、ビリオン、または、適当な制御要素と関連した際に複製が可能であり、かつ遺伝子配列を細胞に導入するように機能し得る任意の他の遺伝要素を含み得るが、それらに限定されない。様々なベクターの任意が、心不全の危険性があるかもしくは心不全の哺乳動物を処置する段階に関連した本発明の新規の方法、または、クレアチンキナーゼ代謝を増加させる段階、および/もしくは心臓収縮機能を増加させる段階、および/もしくは有害な心臓リモデリングを改善する段階に関連した本発明の新規の方法の工程を行うために使用され得る。
【0012】
本発明の別の局面は、ベクター構築物を哺乳動物の心臓に投与する段階に関する。投与に関係する方法の任意は、筋肉内、静脈内、動脈内、皮下、および腹腔内注射、または、カテーテルベースもしくは外科的技術を用いた心筋(心室壁または心房壁など)中もしくは心膜腔中への導入を含むがそれらに限定されない技術の一つまたは複数によって行われ得る。別の局面において、構築物は、増強された心臓形質導入を可能にする技術を用いることによって投与され得る。別の局面において、ベクター構築物は心臓を灌流する血管中に注入され得る。さらに別の局面においては、カテーテルを血管中に挿入して心筋層の一部を灌流する冠動脈中に進め、カテーテルを通してベクターを心臓に投与する。
【0013】
別の局面において、ベクター構築物が投与される本発明の方法の任意において大動脈遮断および体全体の冷却が有意にベクター形質導入を改善し得る。
【0014】
本発明の一つの局面は、哺乳動物においてクレアチンキナーゼ代謝を改善するためにクレアチンキナーゼをコードするヌクレオチド配列を有するベクター構築物を用いる新規の方法に関する。一つの局面において、哺乳動物クレアチンキナーゼのヌクレオチド配列を有するベクター構築物が提供されて哺乳動物の心臓に投与され、クレアチンキナーゼ代謝において検出可能な変化をもたらす。
【0015】
さらなる局面において、検出可能な変化は、心臓クレアチンリン酸のATPに対する割合における変化を含み、および/またはそれによって測定され得る。別の局面において、変化は、クレアチンリン酸および/またはATPの心臓濃度における変化を含み、かつそれによって測定され得る。さらに別の局面において、変化は、心臓クレアチンキナーゼ反応中の流量における変化を含み、かつそれによって測定され得る。
【0016】
さらなる局面において、ヌクレオチド配列はクレアチンキナーゼの脳アイソフォームをコードし得る。別の局面において、ヌクレオチド配列はクレアチンキナーゼの筋肉アイソフォームをコードし得る。さらに別の局面において、ヌクレオチド配列はクレアチンキナーゼのミトコンドリアアイソフォームをコードし得る。さらなる局面において、ヌクレオチド配列は、脳アイソフォーム、筋肉アイソフォーム、および/またはミトコンドリアアイソフォームを含む、クレアチンキナーゼのヒトアイソフォームをコードし得る。
【0017】
本発明の別の局面は、哺乳動物において心臓収縮機能を改善するために哺乳動物クレアチンキナーゼをコードするヌクレオチド配列を有するベクター構築物を用いる新規の方法に関する。哺乳動物クレアチンキナーゼのヌクレオチド配列を有するベクター構築物が提供されて哺乳動物の心臓に投与され、心臓収縮機能において検出可能な増加をもたらす。
【0018】
さらなる局面において、検出可能な増加は、左心室もしくは右心室駆出率における変化および/または心係数における増加を含み、かつそれらによって測定され得るが、それらに限定されない。
【0019】
別の局面において、ヌクレオチド配列はクレアチンキナーゼの脳アイソフォームをコードし得る。別の局面において、ヌクレオチド配列はクレアチンキナーゼの筋肉アイソフォームをコードし得る。別の局面において、ヌクレオチド配列はクレアチンキナーゼのミトコンドリアアイソフォームをコードし得る。またさらなる局面において、ヌクレオチド配列は、脳アイソフォーム、筋肉アイソフォーム、および/またはミトコンドリアアイソフォームを含む、クレアチンキナーゼのヒトアイソフォームをコードし得る。
【0020】
別の局面において、収縮機能における増加は、x線;x線血管造影法;超音波もしくは心エコー検査法;核医学心室造影法もしくはシンチグラフィー;陽電子放出断層撮影法;磁気共鳴画像法;コンピュータ断層撮影法;ならびに/または侵襲性および非侵襲性の血行力学を含むがそれらに限定されない、多数の方法の任意によって測定され得る。
【0021】
本発明の別の局面は、哺乳動物において有害な心臓リモデリングを改善するために哺乳動物クレアチンキナーゼをコードするヌクレオチド配列を有するベクター構築物を用いる新規の方法に関する。哺乳動物クレアチンキナーゼのヌクレオチド配列を有するベクター構築物が提供されて哺乳動物の心臓に投与され、心室の大きさまたは形状における改善をもたらす。
【0022】
別の局面において、改善は、哺乳動物の拡張末期容量、収縮末期容量、心室壁の厚さ、および/または心室重量を含み得、および/またはそれらによって測定され得るが、それらに限定されない。
【0023】
さらなる局面において、有害な心臓リモデリングにおける改善は、例えば、x線、x線血管造影法、超音波もしくは心エコー検査法、核医学心室造影法もしくはシンチグラフィー、陽電子放出断層撮影法、磁気共鳴画像法、コンピュータ断層撮影法などの画像検査によって、および/またはリモデリングと相関するバイオマーカーの使用によって測定され得る。
【0024】
さらなる局面において、ヌクレオチド配列はクレアチンキナーゼの脳アイソフォームをコードし得る。別の局面において、ヌクレオチド配列はクレアチンキナーゼの筋肉アイソフォームをコードし得る。別の局面において、ヌクレオチド配列はクレアチンキナーゼのミトコンドリアアイソフォームをコードし得る。またさらなる局面において、ヌクレオチド配列は、脳アイソフォーム、筋肉アイソフォーム、および/またはミトコンドリアアイソフォームを含む、クレアチンキナーゼのヒトアイソフォームをコードし得る。
【0025】
本発明の一つの局面は、HFにおいて心臓クレアチンキナーゼ代謝を増加させ、および/またはその低下を予防する薬理学的物質または化合物を同定するための新規の方法に関する。
【0026】
本発明の別の局面は、筋肉細胞においてクレアチンキナーゼ発現を増加させる薬理学的物質を同定するための新規の方法に関する。同定の方法の一つの局面は、培養下の単離された筋肉細胞を提供する段階、薬理学的物質を一つまたは複数の筋肉細胞と接触させる段階、およびクレアチンキナーゼ発現における増加を検出する段階を含む。一つの態様において、潜在的な薬理学的物質が多数の試験化合物の任意より選択され得る。
【0027】
本発明の別の局面において、単離された筋肉細胞には、クレアチンキナーゼプロモーターの制御下のレポーター構築物が形質導入され得る。
【0028】
さらに別の局面において、クレアチンキナーゼ発現における増加の検出は、クレアチンキナーゼ発現を反映するように設計されたハイスループットシステムによる。
【0029】
本発明の別の態様において、細胞の一つまたは複数は、心不全の特性を模倣する有害な物質またはシステム(過酸化水素への曝露などの活性酸素種生成システムを含むがそれに限定されない)に曝露され得る。その後、有害な物質またはシステムによってもたらされた減少したCK発現を増加させる薬理学的物質を同定するために、細胞のいくつかを低分子試験化合物の任意と接触させることができ、それらの細胞のCK発現を不活性(対照)薬理学的物質と接触させた細胞と比較することができる。
【0030】
本発明の別の態様において、CK発現を増加させる薬理学的物質を(低分子試験化合物から)同定するために、細胞の一つまたは複数を、上述されたような有害な物質またはシステムへの曝露の前に試験化合物のライブラリーにおいて同定された低分子試験化合物の任意と接触させることができ、それらの細胞のCK発現を不活性(対照)物質と接触させた細胞と比較することができる。本態様において使用されるような増加とは、試験化合物との接触が無い状態において有害な物質またはシステムへの曝露に起因すると予想されるであろう減少したCK発現を予防または改善することを指すように意図される。
【0031】
別の態様において、筋肉細胞は心不全の哺乳動物から取得される心臓細胞であり得る。
【0032】
本発明のさらに別の局面は、CK活性を増加させる分子または試験化合物を同定するための薬理学的物質スクリーニングである。一つの局面において、本方法は、単離されかつ精製されたクレアチンキナーゼを提供する段階、試験化合物を精製されたクレアチンキナーゼと接触させる段階、およびクレアチンキナーゼ活性において増加があるか否かを検出する段階を含む。
【0033】
別の態様において、クレアチンキナーゼ活性における増加の検出は、クレアチンキナーゼ活性を反映するように設計されたハイスループットシステムによる。
【0034】
本発明の別の態様において、単離されたCKアイソフォームの一つまたは複数のアリコートは、心不全の特性を模倣する有害な物質またはシステム(過酸化水素への曝露などの活性酸素種生成システムを含むがそれに限定されない)に曝露され得、一方単離されたCKアイソフォームの他のアリコートは曝露されない(対照)。その後、有害な物質またはシステムによってもたらされた減少したCK活性を増加させる薬理学的物質を同定するために、曝露されたCK酵素および曝露されていないCK酵素を試験化合物のライブラリーにおいて同定された低分子試験化合物の任意と接触させ、CK活性を比較することができる。
【0035】
本発明のさらに別の態様において、有害な物質またはシステムへの曝露に起因すると予想されるであろう減少したCK活性を予防または改善する薬理学的物質を同定するために、単離されたCKアイソフォームの一つまたは複数のアリコートを上述されたような有害な物質またはシステムへの曝露の前に上述されたライブラリーにおいて同定された低分子試験化合物の任意と接触させ、CK活性を比較することができる。
【0036】
本発明の別の局面は、クレアチンキナーゼ代謝を改善するために、クレアチンキナーゼをコードするヌクレオチド配列を有するベクター構築物を用いて、心不全の危険性があるかまたは心不全の哺乳動物を処置するための新規の方法に関する。哺乳動物クレアチンキナーゼのヌクレオチド配列を有するベクター構築物が提供されて対象の心臓に投与され、クレアチンキナーゼ代謝において検出可能な変化をもたらす。
【0037】
さらなる局面において、検出可能な変化は、心臓クレアチンリン酸のATPに対する割合における変化を含み、かつそれによって測定され得る。別の局面において、変化は、クレアチンリン酸および/またはATPの心臓濃度における変化を含み、かつそれによって測定され得る。別の局面において、変化は、心臓クレアチンキナーゼ反応中の流量における変化を含み、かつそれによって測定され得る。
【0038】
別の局面において、ヌクレオチド配列はクレアチンキナーゼの脳アイソフォームをコードし得る。別の局面において、ヌクレオチド配列はクレアチンキナーゼの筋肉アイソフォームをコードし得る。別の局面において、ヌクレオチド配列はクレアチンキナーゼのミトコンドリアアイソフォームをコードし得る。さらなる局面において、ヌクレオチド配列は、脳アイソフォーム、筋肉アイソフォーム、および/またはミトコンドリアアイソフォームを含む、クレアチンキナーゼのヒトアイソフォームをコードし得る。
【0039】
本発明の別の局面は、収縮機能を増加させるために、クレアチンキナーゼをコードするヌクレオチド配列を有するベクター構築物を用いて、心不全の危険性があるかまたは心不全の対象を処置するための新規の方法に関する。哺乳動物クレアチンキナーゼのヌクレオチド配列を有するベクター構築物が提供されて対象の心臓に投与され、心臓収縮機能において検出可能な増加をもたらす。
【0040】
さらなる局面において、検出可能な増加は、左心室もしくは右心室駆出率における変化および/または心係数における増加を含み、かつそれらによって測定され得るが、それらに限定されない。
【0041】
さらなる局面において、心臓収縮機能における増加は、x線、x線血管造影法、超音波もしくは心エコー検査法、核医学心室造影法もしくはシンチグラフィー、陽電子放出断層撮影法、磁気共鳴画像法、コンピュータ断層撮影法、ならびに/または侵襲性および非侵襲性の血行力学を含むがそれらに限定されない、多数の方法によって測定され得る。
【0042】
さらなる局面において、ヌクレオチド配列はクレアチンキナーゼの脳アイソフォームをコードし得る。別の局面において、ヌクレオチド配列はクレアチンキナーゼの筋肉アイソフォームをコードし得る。別の局面において、ヌクレオチド配列はクレアチンキナーゼのミトコンドリアアイソフォームをコードし得る。またさらなる局面において、ヌクレオチド配列は、脳アイソフォーム、筋肉アイソフォーム、および/またはミトコンドリアアイソフォームを含む、クレアチンキナーゼのヒトアイソフォームをコードし得る。
【0043】
本発明の別の局面は、有害な心臓リモデリングを改善するために、クレアチンキナーゼをコードするヌクレオチド配列を有するベクター構築物を用いて、心不全の危険性があるかまたは心不全の対象を処置するための新規の方法に関する。哺乳動物クレアチンキナーゼのヌクレオチド配列を有するベクター構築物が対象の心臓に投与されて、心室の大きさまたは形状における改善をもたらす。
【0044】
別の局面において、改善は、哺乳動物の拡張末期容量、収縮末期容量、心室壁の厚さ、および/または心室重量を含むがそれらに限定されない多数の測定法を含み得、および/またはそれらによって測定され得る。
【0045】
さらなる局面において、有害な心臓リモデリングにおける改善は、x線、x線血管造影法、超音波もしくは心エコー検査法、核医学心室造影法もしくはシンチグラフィー、陽電子放出断層撮影法、磁気共鳴画像法、コンピュータ断層撮影法を含むがそれらに限定されない多数の方法によって、および/またはリモデリングと相関するバイオマーカーの使用によって測定され得る。
【0046】
さらなる局面において、ヌクレオチド配列はクレアチンキナーゼの脳アイソフォームをコードし得る。別の局面において、ヌクレオチド配列はクレアチンキナーゼの筋肉アイソフォームをコードし得る。別の局面において、ヌクレオチド配列はクレアチンキナーゼのミトコンドリアアイソフォームをコードし得る。またさらなる局面において、ヌクレオチド配列は、脳アイソフォーム、筋肉アイソフォーム、および/またはミトコンドリアアイソフォームを含む、クレアチンキナーゼのヒトアイソフォームをコードし得る。
[本発明101]
以下の段階を含む、哺乳動物において検出可能な心臓クレアチンキナーゼ代謝を増加させるための方法:
哺乳動物クレアチンキナーゼをコードするヌクレオチド配列を有するベクター構築物を提供する段階;
ベクター構築物を哺乳動物の心臓に投与して、心臓クレアチンキナーゼ代謝において検出可能な増加をもたらす段階。
[本発明102]
検出可能な増加が以下の一つまたは複数である、本発明101記載の方法:
心臓クレアチンリン酸のATPに対する割合における変化;
クレアチンリン酸もしくはATPの心臓濃度における変化;または
心臓クレアチンキナーゼ反応中の流量における変化。
[本発明103]
以下の段階を含む、哺乳動物において心臓収縮機能を増加させるための方法:
哺乳動物クレアチンキナーゼをコードするヌクレオチド配列を有するベクター構築物を提供する段階;
ベクター構築物を哺乳動物の心臓に投与して、心臓収縮機能において検出可能な増加をもたらす段階。
[本発明104]
検出可能な増加が以下の一つまたは複数である、本発明103記載の方法:
左心室もしくは右心室駆出率における増加;または
心係数における増加。
[本発明105]
心臓収縮機能における増加が以下の一つまたは複数によって測定される、本発明103記載の方法:
x線;x線血管造影法;超音波もしくは心エコー検査法;核医学心室造影法もしくはシンチグラフィー;陽電子放出断層撮影法;磁気共鳴画像法;コンピュータ断層撮影法;または侵襲性もしくは非侵襲性の血行力学。
[本発明106]
以下の段階を含む、哺乳動物において有害な心臓リモデリングを改善するための方法:
哺乳動物クレアチンキナーゼをコードするヌクレオチド配列を有するベクター構築物を提供する段階;
ベクター構築物を哺乳動物の心臓に投与して、心室の大きさまたは形状における改善をもたらす段階。
[本発明107]
改善が以下の一つまたは複数である、本発明106記載の方法:
拡張末期容量;収縮末期容量;心室壁の厚さ;または心室重量。
[本発明108]
心室の大きさまたは形状における改善が、x線;x線血管造影法;超音波もしくは心エコー検査法;核医学心室造影法もしくはシンチグラフィー;陽電子放出断層撮影法;磁気共鳴画像法;コンピュータ断層撮影法の一つまたは複数によって;または、リモデリングと相関するバイオマーカーの使用によって測定される、本発明106記載の方法。
[本発明109]
ヌクレオチド配列が哺乳動物クレアチンキナーゼの脳アイソフォームをコードする、本発明101記載の方法。
[本発明110]
ヌクレオチド配列が哺乳動物クレアチンキナーゼの脳アイソフォームをコードする、本発明103記載の方法。
[本発明111]
ヌクレオチド配列が哺乳動物クレアチンキナーゼの脳アイソフォームをコードする、本発明106記載の方法。
[本発明112]
ヌクレオチド配列が哺乳動物クレアチンキナーゼの筋肉アイソフォームをコードする、本発明101記載の方法。
[本発明113]
ヌクレオチド配列が哺乳動物クレアチンキナーゼの筋肉アイソフォームをコードする、本発明103記載の方法。
[本発明114]
ヌクレオチド配列が哺乳動物クレアチンキナーゼの筋肉アイソフォームをコードする、本発明106記載の方法。
[本発明115]
ヌクレオチド配列が哺乳動物クレアチンキナーゼのミトコンドリアアイソフォームをコードする、本発明101記載の方法。
[本発明116]
ヌクレオチド配列が哺乳動物クレアチンキナーゼのミトコンドリアアイソフォームをコードする、本発明103記載の方法。
[本発明117]
ヌクレオチド配列が哺乳動物クレアチンキナーゼのミトコンドリアアイソフォームをコードする、本発明106記載の方法。
[本発明118]
哺乳動物がヒトである、本発明101記載の方法。
[本発明119]
哺乳動物がヒトである、本発明103記載の方法。
[本発明120]
哺乳動物がヒトである、本発明106記載の方法。
[本発明121]
以下の段階を含む、筋肉細胞においてクレアチンキナーゼ発現を増加させる薬理学的物質を同定するための方法:
培養下の単離された筋肉細胞を提供する段階;
薬理学的物質を一つまたは複数の筋肉細胞と接触させる段階;および
クレアチンキナーゼ発現における増加を検出する段階。
[本発明122]
筋肉細胞が心不全の哺乳動物から取得される心臓細胞である、本発明121記載の方法。
[本発明123]
筋肉細胞にクレアチンキナーゼプロモーターの制御下のレポーター構築物が形質導入され、かつ検出が、クレアチンキナーゼ発現を反映するように設計されたハイスループットシステムによる、本発明121記載の方法。
[本発明124]
単離された筋肉細胞が、薬理学的物質との接触の前または後に、心不全の特性を模倣する有害な物質または条件に曝露される、本発明121記載の方法。
[本発明125]
以下の段階を含む、クレアチンキナーゼ活性を増加させる薬理学的物質を同定するための方法:
単離されかつ精製されたクレアチンキナーゼを提供する段階;
薬理学的物質を精製されたクレアチンキナーゼと接触させる段階;および
クレアチンキナーゼ活性における増加を検出する段階。
[本発明126]
検出が、クレアチンキナーゼ活性を反映するように設計されたハイスループットシステムによる、本発明125記載の方法。
[本発明127]
単離されたクレアチンキナーゼが、薬理学的物質との接触の前または後に、心不全の特性を模倣する有害な物質または条件に曝露される、本発明125記載の方法。
[本発明128]
以下の段階を含む、心不全の危険性があるかまたは心不全の哺乳動物を処置するための方法:
哺乳動物クレアチンキナーゼをコードするヌクレオチド配列を有するベクター構築物を提供する段階;
ベクター構築物を哺乳動物の心臓に投与して、心臓クレアチンキナーゼ代謝において検出可能な増加をもたらす段階。
[本発明129]
検出可能な増加が以下の一つまたは複数である、本発明128記載の方法:
心臓クレアチンリン酸のATPに対する割合における変化;
クレアチンリン酸もしくはATPの心臓濃度における変化;または
心臓クレアチンキナーゼ反応中の流量における変化。
[本発明130]
ヌクレオチド配列が哺乳動物クレアチンキナーゼの脳アイソフォームをコードする、本発明128記載の方法。
[本発明131]
ヌクレオチド配列が哺乳動物クレアチンキナーゼの筋肉アイソフォームをコードする、本発明128記載の方法。
[本発明132]
ヌクレオチド配列が哺乳動物クレアチンキナーゼのミトコンドリアアイソフォームをコードする、本発明128記載の方法。
[本発明133]
以下の段階を含む、心不全の危険性があるかまたは心不全の哺乳動物を処置するための方法:
哺乳動物クレアチンキナーゼをコードするヌクレオチド配列を有するベクター構築物を提供する段階;
ベクター構築物を哺乳動物の心臓に投与して、心臓収縮機能において検出可能な増加をもたらす段階。
[本発明134]
検出可能な増加が以下の一つまたは複数である、本発明133記載の方法:
左心室もしくは右心室駆出率における増加;または
心係数における増加。
[本発明135]
心臓収縮機能における増加が以下の一つまたは複数によって測定される、本発明133記載の方法:
x線;x線血管造影法;超音波もしくは心エコー検査法;核医学心室造影法もしくはシンチグラフィー;陽電子放出断層撮影法;磁気共鳴画像法;コンピュータ断層撮影法;または侵襲性もしくは非侵襲性の血行力学。
[本発明136]
ヌクレオチド配列が哺乳動物クレアチンキナーゼの脳アイソフォームをコードする、本発明133記載の方法。
[本発明137]
ヌクレオチド配列が哺乳動物クレアチンキナーゼの筋肉アイソフォームをコードする、本発明133記載の方法。
[本発明138]
ヌクレオチド配列が哺乳動物クレアチンキナーゼのミトコンドリアアイソフォームをコードする、本発明133記載の方法。
[本発明139]
以下の段階を含む、心不全の危険性があるかまたは心不全の哺乳動物を処置するための方法:
哺乳動物クレアチンキナーゼをコードするヌクレオチド配列を有するベクター構築物を提供する段階;
ベクター構築物を哺乳動物の心臓に投与して、心室の大きさまたは形状における改善をもたらす段階。
[本発明140]
改善が以下の一つまたは複数である、本発明139記載の方法:
拡張末期容量;収縮末期容量;心室壁の厚さ;または心室重量。
[本発明141]
心室の大きさまたは形状における改善が、x線;x線血管造影法;超音波もしくは心エコー検査法;核医学心室造影法もしくはシンチグラフィー;陽電子放出断層撮影法;磁気共鳴画像法;コンピュータ断層撮影法の一つまたは複数によって;または、リモデリングと相関するバイオマーカーの使用によって測定される、本発明139記載の方法。
[本発明142]
ヌクレオチド配列が哺乳動物クレアチンキナーゼの脳アイソフォームをコードする、本発明139記載の方法。
[本発明143]
ヌクレオチド配列が哺乳動物クレアチンキナーゼの筋肉アイソフォームをコードする、本発明139記載の方法。
[本発明144]
ヌクレオチド配列が哺乳動物クレアチンキナーゼのミトコンドリアアイソフォームをコードする、本発明139記載の方法。
【図面の簡単な説明】
【0047】
特許または出願ファイルは、カラーで作成された少なくとも一つの図面を含む。カラーの図面を有する本特許または特許出願公報の複製は、依頼および必要料金の支払いで特許庁より提供される。
【図1】正常対象(a.)および拡張型心筋症および心不全の患者(f.)の磁気共鳴画像、ならびに健常対象(b〜e.)および心不全の患者(g〜h.)についての磁化移動研究由来の空間的に局在した31P NMRスペクトルを示す。クレアチンキナーゼ反応中の流量は、関心対象の代謝産物の特定の磁気共鳴を飽和させる化学的に選択的な磁化パルスの使用を含む磁化移動技術を用いて測定され得る。本図は、ATPのγ-リン酸共鳴が化学的に選択的な磁化パルスで飽和され得ることを示す(c、e、h、図中、矢印はPCrに対して約−2.5ppmの化学的に選択的な磁化パルスの振動数位置を示す)。対照照射の間に収集されたスペクトル(b、d、g、図中、矢印はPCrに対して約+2.5 ppmの化学的に選択的な磁化パルスの振動数位置を示す)と比較した際の、γ-ATP飽和の間のクレアチンリン酸共鳴における減少(c、e、h)は、クレアチンキナーゼ反応中の流量に直接関連している。CK代謝は、対照照射の間のより低いPCrレベル(より低いPCrピーク)によって証明されるようにHFの患者において減少しており(g)、一方、対照照射(g)とγ-ATP照射(h)との間のPCrピークの高さにおける変化の、PCrピークの間のより緩やかな傾きを伴う少なさによって証明されるようにCK中の流量はより少ない。
【図2】16人の健常対象(「正常」バー)ならびに17人の拡張型心筋症および心不全の患者(「CHF」バー)における、ATPに対する心臓クレアチンリン酸の割合(a)、クレアチンリン酸濃度(b)、ATP濃度(c)、ならびに擬似一次反応速度定数(d)およびCK中の流量(e)を示す。したがって、CK反応の産物および基質ならびにCK流量(すなわち、CK反応中のホスホリルの移動)はヒト心臓において測定可能であり、ヒト心不全および拡張型心筋症において変化している。
【図3】Ad-CK-B形質導入7日後に増加した心臓CK-B発現を示すウェスタンブロットを示す。
【図4A】TAC(0週)、心臓全体の形質導入(AdV Trnfx)(2週)、ならびにMRI/MRSおよび圧‐容積ループ(PVL)研究(3週)を示すスケジュール表を示す。
【図4B】正常動物、ならびに、TAC手術3週間後およびアデノ-CMV-β-ガラクトシダーゼ(β-Gal、n=5)またはアデノ-CMV-CK-B(CK-B、n=9)のいずれかを用いた心臓全体の形質導入(AdV Trnfx)の1週間後の動物における、インビボMRIによる解剖学的および機能的所見を示す。CKの無い構築物を受け入れた動物におけるMRIの所見は明らかに異常であり、一方CK-Bを含む構築物を受け入れた動物における所見は、TACを受けなかった正常動物のものとほぼ同一である。上のパネルは、正常動物由来の代表的な1H MR軸位像(左)および対応する心臓31P NMRスペクトル(右)を示す。中央のパネルは、TAC+βGal動物由来の代表的な1H MR軸位像(左)および対応する心臓31P NMRスペクトル(右)を示す。下のパネルは、TAC+CK-B動物由来の代表的な1H MR軸位像(左)および対応する心臓31P NMRスペクトル(右)を示す。
【図5】正常な対照動物における平均心臓PCr/ATP値(「対照」バー)、TAC+βGal動物における有意に減少した値(「TAC-Bgal」バー)、および、TACを受けなかった正常な対照動物における値とほぼ同一のTAC+CK-B動物における平均値(「TAC-CK」バー)を示す。
【図6】図6Aは、CK-Bの形質導入が、収縮末期容量(ESV)、一回拍出量(SV)、および駆出率(EF)を含む収縮機能のMRI指標を有意に改善することを示し;図6Bは、LV EFが遺伝子治療後の心臓PCr/ATPと相関したことを示し(EF=0.254(PCr/ATP)+0.0655、r2=0.40、P<0.005);および図6Cは、LV重量が遺伝子治療後の心臓PCr/ATPと相関したことを示す(LV重量=−73.7(PCr/ATP)+257.4、r2=0.50、P<.01)。したがって、CK-Bをコードするベクターの投与は機能不全の心臓の収縮またはポンプ機能を有意に改善し、かつ機能的改善の程度および有害なリモデリングの減衰は、この場合心臓PCr/ATP比によって測定されるCK代謝の改善の程度と相関するか、または依存する。
【図7】AAV2/9 CK-Mのプラスミドマップを示す。
【図8】図8Aは、AAV2/9 CK-M実験の実験スキームを示し;図8Bは、1H磁気共鳴画像上でAAV-CK-M投与の影響をAAVβGal(CK-Mが無い)のものと比較し;図8Cは、収縮機能のMRI測定上で同じものを比較し;および図8Dは、LV重量およびLV/体重によって測定されるようなリモデリング上で同じものを比較する。したがって、機能不全の発生の前のCK-Mをコードするベクターの投与は、収縮またはポンプ機能における低下および有害なリモデリングを有意に減衰させる。実際に、TAC手術にもかかわらず、駆出率(EF)が指標となるようにポンプ機能はCK治療後にほぼ正常(65%〜70%)である。
【図9】AAV2/9 CK-M形質導入の有利な長期の収縮効果がTAC後9週までの間持続することを示す。
【図10】図10Aは、筋細胞の単離およびマーカー遺伝子(βガラクトシダーゼ)についての染色を示し;および図10Bは、様々なベクターおよび様々な投与経路の投与後のマウスにおける平均形質導入効率を示す。動脈投与はヒトにおいて容易に達成され得るが、静脈内(IV)投与(図10Bの「AAV2/9 IV投与」)が最も単純、安全で、かつ侵襲性が低く、本マウスモデルにおいては有意な筋細胞のトランスフェクションと関連している。
【発明を実施するための形態】
【0048】
発明の詳細な説明
本開示を通して、本出願者らは、テキスト、特許文献、および他の情報源に言及する。当業者は、本発明の局面を作成および使用するために引用された情報源の任意の全内容を使用することができる。各々のおよびあらゆる引用された情報源は、具体的に全体として参照により本明細書に組み入れられる。これらの源の一部は、許容されるかまたは必要とされるとき本書類に含まれてもよい。しかしながら、本開示において具体的に定義されるかまたは説明される任意の用語または語句の意味は、源の任意の内容によって変更されるべきではない。
【0049】
ヒトにおける最近の観察は、HFにおいて減少したCK代謝の役割に新たな見識を提供する。これらは、CK反応の高エネルギー代謝産物のプール(すなわち基質および産物)における減少のみよりもむしろ、心臓CK活性における異常を明らかにする。31P核磁気共鳴分光法(31P NMR分光法)技術は、ヒト心不全の多くの形態において、減少したクレアチンリン酸(PCr)のATPに対する割合、または心臓PCr/ATP比を示してきており、この比は全体的な心臓血管系死亡率の強力な予兆である(Hardy et al. 1991, Neubauer et al. 1997)。最近実施された31P NMR分光法磁化移動法は、ヒト心臓におけるCK反応中の流量の測定を目下可能にし、HFにおけるATPの任意の損失の前でさえCK流量の割合において有意な50%〜70%の減少を示す。これらの観察は、HFの2種類の異なるタイプである拡張型心筋症(図1および2参照)(Weiss et al. 2005)および肥大性心筋症(Smith et al. 2006)においてなされた。これらのデータは、CK流量における異常が顕著であり、かつヒトHFの最も一般的な形態において起きることを示す。しかしながら、正常または不全の哺乳動物の心臓においてCK活性を増加させるための方法はこれまでは示されなかった。実際に、The New England Journal of Medicine中の心不全においてエネルギー代謝を改善するための戦略の最近の総説は、この選択肢について考察、または増強治療のための標的としてCK酵素を同定していない(Neubauer 2007)。
【0050】
遺伝子治療および低分子は、細胞において特定の酵素または反応の活性を増強するための理論的なアプローチを提供する。しかしながら、先行のアプローチは、HFを処置するための手段として心臓組織において減少したCK活性、CK流量、またはCK代謝産物の減少を予防するかまたは増強するために、これらのいずれかに依存したりまたは活用したりしていない。
【0051】
HFにおいてはCKアイソフォームの発現および活性が異なる。HFにおいてはCK-MおよびCK-mitoが減少し、CK-Bが増加している(Neubauer et al 1995, Nascimben et al 1996)。また、異なるアイソフォームはCK反応の基質に対して異なる親和性を有する可能性がある証拠が存在する。したがって、心不全においてCK発現または活性を改善するために仮に当業者が遺伝子治療または低分子アプローチを試みるとすると、どのCKアイソフォームが選択の標的であるべきか、およびCK-B発現を増加させることまたは減少させることのいずれが例えば恩恵となると考えられるかは不明である。
【0052】
本発明は、心臓クレアチンキナーゼ代謝、収縮機能、および/または心不全と関連するリモデリングの測定値を増加させるか、または減少を予防する新規の方法に関する。クレアチンキナーゼ発現の文脈における「変化した」という用語の使用は、心不全を予防する文脈においてレベルを維持する段階、または心不全の危険性がある哺乳動物を処置する段階を含むがそれらに限定されないことを意図し、心不全の哺乳動物において予想されるであろう、より低いレベルと比較したときの変質または変化を示す。
【0053】
添付の特許請求の範囲を含む本開示を通して、「増加する」または「増加させる」という用語の使用は、本明細書において開示される新規の方法によって標的とされる多数の条件(例えば、クレアチンキナーゼ代謝、発現、活性、および/または心臓収縮機能)の任意における実際の増加、または減少の予防もしくは改善のいずれかを指す。したがって、本発明のすべての局面は、心不全を処置および予防する段階(心不全の危険性がある哺乳動物を処置する段階としても言及される)ために適用可能である。一つの局面において、本発明は、心不全において心臓細胞機能を改善するために心臓細胞におけるCK代謝を増加させる新規の方法に関する。本発明の方法は、心筋においてCK遺伝子発現、CK活性、CK代謝産物、および/またはCK中の高エネルギーホスホリル基の移動を増加させる段階または減少を予防する段階を含み得、これらは遺伝子治療または薬理学的物質によって達成され得る。一つの局面において、本発明は、心臓の収縮またはポンプ機能を改善するため、およびHFが発生して進行するにつれて起きる有害な心臓の拡大(「有害な解剖学的リモデリング」)を制限するために、心臓においてCK代謝を増強するための方法に関する。さらに別の局面において、本発明は、処置モデルおよび予防的モデルの両方において心臓CK発現およびCK活性への物質の効果を評価するために、潜在的な化合物または物質をスクリーニングする段階に関する。したがって、そのような物質を同定するための方法は、CK発現および/または活性を増加させる物質、ならびに、心不全または心不全の特性を模倣する有害な物質またはシステムへの曝露と典型的に関連するCK発現および/または活性における減少を予防または改善する物質を含む。
【0054】
I.定義
本明細書において使用されるような「心不全」という用語は、心臓が正常な充満圧で体の必要を満たすのに十分な血液を送り出せない状態を指す。これは、後天性および遺伝性心疾患を含む。心不全および/または心筋症のいくつかの一般的な原因は、冠動脈疾患および心筋梗塞、浸潤性疾患、高血圧症、糖尿病、毒素(例えば、アルコールまたはアドリアマイシン)、ウイルス、心臓弁異常、ならびに未知(特発性)の原因を含むが、それらに限定されない。遺伝性または先天性心疾患、および原発性または二次性肺高血圧症などの肺疾患は、心不全の他の原因である。心不全はまた、頻拍ペーシングおよび大動脈結紮または狭窄を含むがそれらに限定されないいくつかの手段によって、実験モデルにおいて誘導され得る。
【0055】
本明細書において使用されるような「心臓収縮機能」という語句は、収縮し、かつそれによって体中に血液を送り出す心臓の機能を指す。心臓収縮機能は、休息時および運動の間の生理学的恒常性に重要であり、かつ実際に体におけるすべての器官の生理学的機能を支持する。心臓収縮機能を検出する方法は、臨床症状、身体の所見、検査室検査、ならびに/または侵襲性および非侵襲性の血行力学測定法を含むが、それらに限定されない。検出の他の方法は、x線、x線血管造影法、超音波もしくは心エコー検査法、核医学心室造影法もしくはシンチグラフィー、陽電子放出断層撮影法(PET)、磁気共鳴画像法(MRI)、および/またはコンピュータ断層撮影法(CT)を含むがそれらに限定されない画像検査を含むが、それらに限定されない。研究の場においては心臓収縮機能を定量化するために使用される多くの測定法および測定基準が存在する。臨床診療において、収縮機能の最も一般的な測定値は、駆出率(収縮の間の右心室または左心室の容量における部分的な(fractional)変化)、一回拍出量(各心拍で排出される血液の容量)、および心係数(ボディーマス指数について標準化された、単位時間あたりに排出される血液の容量)を含む。
【0056】
本明細書において使用されるような「心臓収縮不全」という語句は、心臓の収縮または収縮に続く弛緩における減少または欠陥を意味する。心臓収縮不全を検出する方法は、「心臓収縮機能」を評価するために説明されたのと同じ方法を含むがそれらに限定されず、それらの方法は実施例として本明細書に組み入れられる。
【0057】
本明細書において使用されるような「有害な心臓リモデリング」という語句は、心室の大きさまたは形状における変化の過程を意味する。心室の大きさまたは形状における変化は、心不全を含む心臓の疾患において起き得る心室腔の拡張もしくは拡大および/または心筋壁の菲薄化、ならびに/または拡張期弛緩における異常と時に関連する増加した心室重量(例えば、肥大)を含み得るが、それらに限定されない。有害な心臓リモデリングの臨床的測定値は、収縮機能について上述された画像化技術を用いて一般的に取得されるが、それらに限定されず、典型的には拡張末期容量(心拍サイクルの間の弛緩期の末期での右心室または左心室容量)、収縮末期容量(各心臓サイクルの間の収縮期収縮の末期での右心室または左心室容量)、重量(心臓または心臓チャンバーの重さ)、心臓壁の厚さ、およびτ(tau)(収縮後の弛緩の時間)を含む測定値由来である。
【0058】
本明細書において使用されるような「クレアチンキナーゼ代謝」という語句は、クレアチンキナーゼアイソフォーム(非限定的に、脳アイソフォーム(CK-B)、筋肉アイソフォーム(CK-M)、またはミトコンドリアアイソフォーム(CK-mito)を含む)の任意の発現、ならびに/またはクレアチンキナーゼ酵素の活性、ならびに/またはクレアチンキナーゼ反応中の流量、ならびに/またはクレアチンキナーゼ反応中のクレアチンリン酸とATPとの間のホスホリルの移動、ならびに/またはクレアチンリン酸、クレアチン、アデノシン三リン酸(ATP)、およびアデノシン二リン酸(ADP)を含むクレアチンキナーゼ反応の産物および/もしくは反応物のプールの大きさを意味する。
【0059】
本明細書において使用されるような「遺伝子送達」および「遺伝子導入」という語句は、筋肉細胞中などの標的細胞中へ外来性のDNAを確実に挿入するための方法またはシステムを指す。そのような方法は、遺伝子の一過的または長期の発現をもたらし得る。遺伝子導入は、後天性および遺伝性疾患の処置のために独特のアプローチを提供する。哺乳動物細胞中への遺伝子導入について多数のシステムが開発されている。例えば、米国特許第5,399,346号を参照されたい。
【0060】
本明細書において使用されるような「DNA」という用語は、弛緩しているかまたはスーパーコイル状いずれかの二本鎖または一本鎖形態における、デオキシリボヌクレオチド(アデニン、グアニン、チミン、またはシトシン)の多量体形態を指す。本用語は、分子の一次および二次構造のみを指し、任意の特定の三次形態に限定しない。したがって本用語は、とりわけ、直鎖状DNA分子(例えば、制限酵素断片)、ウイルス、プラスミド、および染色体において見出される一本鎖および二本鎖DNAを含む。本用語は、4種類の塩基、アデニン、グアニン、チミン、またはシトシンの任意を含む分子、および当技術分野において公知である塩基類似体を含む分子をとらえる。
【0061】
本明細書において使用されるような「遺伝子」または「コード配列」または特定のタンパク質を「コードする」配列という用語は、適切な調節配列の制御下に置かれた際にインビトロまたはインビボで転写され(DNAの場合)、翻訳される(mRNAの場合)核酸分子を指す。遺伝子の境界は、5'(アミノ)末端の開始コドンおよび3'(カルボキシ)末端の翻訳終止コドンによって決定される。遺伝子は、原核生物または真核生物mRNA由来のcDNA、原核生物または真核生物DNA由来のゲノムDNA配列、および合成DNA配列さえも含み得るが、それらに限定されない。
【0062】
本明細書において使用されるような「ベクター」という用語は、プラスミド、ファージ、トランスポゾン、コスミド、染色体、ウイルス、ビリオン、または、適当な制御要素と関連した際に複製が可能であり、かつ遺伝子配列を細胞に導入するように機能し得る任意の他の遺伝要素などの、任意の遺伝要素を指す。したがって本用語は、クローニングおよび発現媒体、ならびにウイルスベクターを含む。
【0063】
本明細書において使用されるような「発現ベクター」または「発現構築物」という用語は、遺伝子配列を細胞に導入してタンパク質発現に影響を及ぼすベクターの能力を増強し得、かつ機能的に連結されたプロモーターおよび/またはエンハンサーを含み得る追加的な要素とベクターを組み合わせる実体を指す。
【0064】
本明細書において使用されるような「プロモーター」または「プロモーター領域」という用語は、転写が始まる点(すなわち、転写開始部位)の前(上流)のDNAの領域であり、かつ一般化された真核生物RNAポリメラーゼII転写単位の上流プロモーター領域、プロモーター領域、またはプロモーターとして当技術分野において時には称される領域を指す。
【0065】
本明細書において使用されるような「機能的に連結される」または「作動的に連結される」という用語は、そのように説明された成分が通常の機能を果たすために設定される要素の配置を指す。したがって、コード配列に機能的に連結される制御要素は、コード配列の発現をもたらすことができる。制御要素は、コード配列の発現を導くように機能する限り、コード配列と連続している必要は無い。したがって、例えば、プロモーター配列とコード配列との間に介入する翻訳されないが転写される配列が存在し得、プロモーター配列はなおコード配列に「機能的に連結される」と考えられ得る。
【0066】
本明細書において使用されるような「エンハンサー」という用語は、特定のコード領域(例えば、遺伝子)に対して、時間、位置、および/または発現レベルの特異性を提供し得、かつ、該エンハンサーに結合する一つまたは複数の転写因子を含む細胞においてコード配列の転写のレベルを増加させ得る不連続の転写調節配列を指す。
【0067】
本明細書において使用されるような「AAVベクター」という用語は、AAV-1、AAV-2、AAV-3、AAV-4、AAV-5、AAVX7、および/またはAAV2/9を含むがそれらに限定されないアデノ随伴ウイルス血清型由来のベクターを指す。AAVベクターは、全体または一部が欠失した一つまたは複数のAAV野生型遺伝子、好ましくはrepおよび/またはcap遺伝子を有し得るが、機能的な隣接ITR配列を保持している。機能的なITR配列は、AAVビリオンのレスキュー、複製、およびパッケージングに必要である。したがって、AAVベクターは、ウイルスの複製およびパッケージングのためにシスで必要とされる少なくともそれらの配列(例えば、機能的なITR)を含むように本明細書において定義される。ITRは、配列が機能的なレスキュー、複製、およびパッケージングを提供する限り、野生型ヌクレオチド配列である必要は無く、例えばヌクレオチドの挿入、欠失、または置換によって改変されてもよい。
【0068】
本明細書において使用されるような「組換えウイルス」という用語は、例えば、異種の核酸構築物の粒子への添加または挿入によって遺伝的に改変されているウイルスを指す。
【0069】
本明細書において使用されるような「トランスフェクション」という用語は、哺乳動物細胞による外来性DNAの取り込みを指す。外因性DNAが細胞膜内に導入されている際、細胞は「トランスフェクトされて」いる。多数のトランスフェクション技術が当技術分野において公知である。例えば、Graham et al.. (1973) Virology, 52:456、Sambrook et al.. (1989) Molecular Cloning, a laboratory manual, Cold Spring Harbor Laboratories, New York、Davis et al. (1986) Basic Methods in Molecular Biology, Elsevier、およびChu et al. (1981) Gene 13: 197を参照されたい。そのような技術は、プラスミドベクターおよび他の核酸分子などの一つまたは複数の外因性DNA部分を適当な細胞中に導入するために使用され得る。本用語は、遺伝物質の安定的および一過的両方の取り込みを指す。
【0070】
本明細書において使用されるような「形質導入」という用語は、組換えAAVビリオンを介するような複製欠損ウイルスベクターを介した、インビボまたはインビトロいずれかでのレシピエント細胞へのDNA分子の送達を指す。
【0071】
本明細書において使用されるような「筋肉細胞」または「組織」という用語は、骨格筋、平滑筋、および心筋由来の細胞および組織を含むがそれらに限定されない筋肉由来の細胞または細胞の群を指す。本用語は、インビトロおよびインビボ両方の筋肉細胞をとらえる。本用語はまた、筋細胞、筋管、筋芽細胞、心筋細胞、および心筋芽細胞などの分化した筋肉細胞および分化していない筋肉細胞の両方を包含する。
【0072】
本明細書において使用されるような「制御要素」という用語は、レシピエント細胞においてコード配列の複製、転写、および翻訳を集合的に提供する、プロモーター領域、ポリアデニル化シグナル、転写終結配列、上流調節ドメイン、複製開始点、内部リボソーム進入部位(「IRES」)、エンハンサーなどを集合的に指す。選択されたコード配列が適切な宿主細胞において複製、転写、および翻訳されることができるとの条件で、これらの制御要素のすべてがいつも存在する必要は無い。
【0073】
「レポーター構築物」という用語とは、光学的、蛍光測定的、分光光度的、濃度測定的、核磁気共鳴、放射性、陽電子放出断層撮影、または他の技術によって検出され得るタンパク質をコードする遺伝子またはコード配列である。レポーター構築物の一つの例は、ルシフェリンおよびマグネシウム‐ATPに曝露された際に光学的技術で検出され得る光子を生成するホタルルシフェラーゼをコードする遺伝子またはコード配列である。
【0074】
本明細書において使用されるような「相同性」という用語は、二つのポリヌクレオチドまたは二つのペプチド部分の間の同一性のパーセントを指す。一つの部分由来の配列と別の配列の間の対応は、当技術分野において公知である技術によって決定され得る。例えば、配列情報をアラインメントし、かつ容易に入手可能なコンピュータプログラムを用いることによる、二つのポリペプチド分子の間の配列情報の直接比較によって、相同性が決定され得る。または、相同な領域間で安定な二本鎖を形成する条件下でのポリヌクレオチドのハイブリダイゼーション、その後の一本鎖特異的ヌクレアーゼを用いた消化、および消化された断片の大きさ決定によって、相同性が決定され得る。二つのDNAまたは二つのペプチド配列は、ヌクレオチドまたはアミノ酸の少なくとも約80%、好ましくは少なくとも約90%、および最も好ましくは少なくとも約95%が分子の規定された長さにわたって対応する際に、互いに「実質的に相同」である。
【0075】
本明細書において使用されるような「哺乳動物」という用語は、非限定的に、ヒト、ならびに、チンパンジーおよび他の類人猿およびサル種などの非ヒト霊長類;ウシ、ヒツジ、ブタ、ヤギ、およびウマなどの家畜;イヌおよびネコなどの家庭内哺乳動物;マウス、ラット、およびモルモットなどのげっ歯類を含む実験動物などを含む、哺乳綱の任意のメンバーを指す。本用語は、特定の年齢または性別を示さない。したがって、成体および新生児対象、ならびに胎児が、雄であろうと雌であろうとカバーされるように意図される。
【0076】
本明細書において使用されるような「薬理学的物質」または「薬理学的組成物」という用語は、薬学的または薬用効果を有するように投与される生物学的活性物質を指す。本用語は、発現ベクター、ベクター構築物、特定のペプチドまたは酵素(例えば、クレアチンキナーゼ)をコードするDNA、ポリペプチド、2000未満の分子量を有する低分子、タンパク質、抗体、ホルモン、有機および無機分子または組成物を含むが、それらに限定されない。
【0077】
本明細書において使用されるような「バイオマーカー」という用語は、生物学的状態の指標として役割を果たす血液または組織の測定値を指す。
【0078】
II.遺伝子治療
A.アデノウイルスベクター
細胞トランスフェクションのためのベクターとしてのアデノウイルスの使用は、当技術分野において周知である。アデノウイルスベクター媒介細胞トランスフェクションは、心臓を含む種々の細胞について報告されている(Stratford-Perricaudet, et al., 1992, Champion et al., 2004)。
【0079】
本発明のアデノウイルスベクターは、ウイルス初期遺伝子領域1(E1)および/またはE3の欠失によって複製欠損である。任意のアデノウイルスベクターが本発明の実施において使用され得ると考えられる。したがって、アデノウイルスベクターは、42種類の異なる公知の血清型またはサブグループA〜Fの任意の一つであり得る。アデノウイルスは、ベクターとしての使用のためにコードDNA配列を含むように工学される。そのような組換えアデノウイルスは、Gluzman et al., 1982によって記載されている。ベクター構築物を作製するために、遺伝子産物をコードするcDNAなどの個々のDNA配列がアデノウイルス中に挿入される。
【0080】
そのため、好ましい態様において、CK-M(遺伝子バンクエントリーNM 001824.2)、CK-B(遺伝子バンクエントリーNM 001823.3)、またはCK-mito(遺伝子バンクエントリーNM 001825.1)を含むヒトクレアチンキナーゼのコード配列が、アデノウイルス中のE1/E3コード配列が除去された位置に導入されるかまたは組込まれる。アデノウイルスの増殖は、当技術分野において周知である。本発明の組換えアデノウイルスを増殖させるために使用される特定の細胞株は、本発明にとって重要ではない。組換えアデノウイルスベクターは、例えば、条件付きの複製欠損アデノウイルス感染が許容的であるヒト293細胞または他の細胞株、例えば、条件付きの複製欠損ベクターにおける欠損を相補するように「トランスで」アデノウイルスE1遺伝子産物を発現する細胞上で増殖させることができる。さらに、そのウイルスストックを取得するために、細胞をプラスチックディッシュ上または浮遊培養中のいずれかで増殖させることができる。
【0081】
B.アデノ随伴ベクター
アデノ随伴ウイルス(AAV)は複製欠損パルボウイルスであり、その一本鎖DNAゲノムは、145ヌクレオチドの逆位末端反復配列(ITR)を含み、長さが約4.7 kbである。AAVベクターの使用は当技術分野において周知である。AAVがヒト細胞に感染すると、ウイルスゲノムは19番染色体中に組込まれ、細胞の潜伏性感染をもたらす。感染性ウイルスの生成は、細胞にヘルパーウイルス(例えば、アデノウイルスまたはヘルペスウイルス)が感染するまで起きない。アデノウイルスの場合は、遺伝子E1A、E1B、E2A、E4、およびVAがヘルパー機能を提供する。ヘルパーウイルスの感染時に、AAVプロウイルスはレスキューされて増幅され、AAVおよびアデノウイルスの両方が生成される。
【0082】
AAVは、外来性DNAを細胞中に送達するためのベクターとして魅力的にする独特の特徴を有する。培養における細胞のAAV感染は非細胞変性性であり、ヒトおよび他の動物の自然感染は、無症状かつ無症候性である。さらに、AAVは大抵の(全部ではないが)哺乳動物細胞に感染し、インビボで多くの様々な組織を標的とする可能性を許容する。Kotin et al., EMBO J., 11(13): 5071 5078 (1992)は、AAVのDNAゲノムが感染時に19番染色体上への標的化された組込みを受けることを報告した。ウイルスDNAの複製は組込みに必要とされず、したがってヘルパーウイルスは組込みに必要とされない。AAVプロウイルスゲノムは、プラスミドにおけるクローン化されたDNAが組換えゲノムの構築を実行可能にするときに感染性である。さらに、AAVの複製、ゲノムのキャプシド形成、および組込みを指示するシグナルはAAVゲノムのITR内に含まれているため、したがってゲノムの内部の約4.3 kb(複製およびキャプシド構造タンパク質、rep-capをコードする)は、プロモーター、関心対象のDNA、およびポリアデニル化シグナルを含む遺伝子カセットなどの外来性DNAで置換されてもよい。AAVの別の重要な特徴は、極度に安定でかつ強いウイルスであることである。AAVは、アデノウイルスを不活性化するために数時間使用される条件(56℃〜65℃)を容易に耐え、AAVベースのワクチンの低温保存をあまり重要でなくする。最後に、AAV感染細胞は重感染に抵抗性でない。
【0083】
アデノ随伴ウイルス(AAV)由来の組換えベクターは、心臓を含むいくつかの組織への遺伝子送達のために使用されてきた(Champion et al., 2004)。AAVは広い宿主範囲を有し、適当なヘルパーウイルスでの細胞の成功裡の感染がまたある限り、任意の種由来の細胞において複製することができる。したがって、例えば、ヒトAAVはイヌアデノウイルスが重感染したイヌ細胞において複製すると考えられる。AAVはいずれのヒトまたは動物疾患とも関連しておらず、組込み時に宿主細胞の生物学的特性を変化させないようである。AAVの総説については、例えば、Berns and Bohenzky (1987) Advances in Virus Research (Academic Press, Inc.) 32:243-307を参照されたい。AAVゲノムは、約4681塩基を含む直鎖状一本鎖DNA分子から構成される(Berns and Bohenzky、前記)。この場合、AAVウイルスはCK-M、CK-B、またはCK-mitoをコードすると考えられる。AAVゲノムの詳細な説明については、例えば、Muzyczka, N. (1992) Current Topics in Microbiol. and Immunol. 158:97-129を参照されたい。
【0084】
C.レンチウイルスベクターおよび他のベクター
レンチウイルスは、ウシレンチウイルス群、ウマレンチウイルス群、ネコレンチウイルス群、ヒツジヤギレンチウイルス群、および霊長類レンチウイルス群のメンバーを含む。遺伝子治療のためのレンチウイルスベクターの開発は、Klimatcheva et al., 1999, Frontiers in Bioscience 4: 481-496において概説されている。導入遺伝子を含むレンチウイルスは、組換えレンチウイルスが対象において重大な毒性または免疫原性をもたらすことなく対象の細胞に形質導入するために使用され得、かつ、形質導入の後、導入遺伝子が発現するという点で長所を有する。この場合、レンチウイルスはCK-M、CK-B、またはCK-mitoをコードすると考えられる。哺乳動物において心臓トランスフェクションが可能であると考えられ、好ましい態様において、CK-M、CK-B、またはCK-mitoのためのトランスフェクションベクターとして含まれると考えられる他のベクターが将来利用可能になってもよい。
【0085】
D.コード配列
コード配列は任意の遺伝子産物をコードし得る。コード配列は、該ポリペプチドの転写、翻訳、および発現のための少なくとも一つのオープンリーディングフレームを含むとの条件で、イントロンおよびエクソンを含み得る。したがって、コード配列は、遺伝子、分断遺伝子、またはcDNA分子を含み得る。コード配列が分断遺伝子を含む(一つまたは複数のイントロンを含む)事象において、該分断遺伝子を含むDNA分子を形質導入された細胞は、該遺伝子産物の発現が望ましい場合、該DNA分子由来のRNA転写物においてイントロンを除去し、かつエクソンを継ぎ合わせるための手段を有する必要がある。本発明の代替的な態様のいくつかにおいて、CK-M、CK-B、またはCK-mitoは、ベクター構築物のコード配列によってコードされ得る。
【0086】
E.エンハンサー‐プロモーター
ウイルスベクター構築物のコード配列は、好ましくは、アデノウイルス/アデノ随伴ウイルス/レンチウイルスのエンハンサー‐プロモーター以外のエンハンサー‐プロモーターに機能的に連結される。プロモーターは、転写が始まる点(すなわち、転写開始部位)の前(上流)の典型的には約100ヌクレオチドペア以内のDNA分子の領域である。該領域は典型的に、様々な遺伝子において類似した相対的位置に配置されているいくつかのタイプのDNA配列要素を含む。本明細書において使用されるとき、「プロモーター」という用語は、一般化された真核生物RNAポリメラーゼII転写単位の上流プロモーター領域、プロモーター領域、またはプロモーターとして当技術分野において称されるものを含む。
【0087】
別のタイプの不連続の転写調節配列要素はエンハンサーである。エンハンサーは、特定のコード領域(例えば、遺伝子)に対して、時間、位置、および/または発現レベルの特異性を提供する。エンハンサーの主要な機能は、該エンハンサーに結合する一つまたは複数の転写因子を含む細胞においてコード配列の転写のレベルを増加させることである。プロモーターと異なり、エンハンサーは、プロモーターが存在する限り転写開始部位から可変な距離に位置しても機能し得る。エンハンサー‐プロモーターをコード配列に機能的に連結するための手段は、当技術分野において周知である。
【0088】
本発明のベクター構築物において使用されるようなエンハンサー‐プロモーターは、心筋細胞において発現を駆動する任意のエンハンサー‐プロモーターを含み得るが、それらに限定されない。本明細書の下文に示される実施例において、ヒトサイトメガロウイルス(CMV)前初期遺伝子プロモーターが、心臓の心筋層において遺伝子の高レベルの発現をもたらすために使用されてきた。しかしながら、当技術分野において周知である他のウイルスまたは哺乳動物細胞プロモーターの使用もまた、発現のレベルが心筋細胞において特異的に生理学的効果を達成するのに十分であるとの条件で、遺伝子産物の発現を達成するのに適当である。例示的かつ好ましいエンハンサー‐プロモーターは、CMVプロモーター、ラウス肉腫ウイルス(RSV)プロモーター、および筋肉特異的クレアチンキナーゼ(MCK)エンハンサー(Zambetti et al., 1992;Yi et al., 1991およびSternberg et al., 1988)である。好ましい心筋特異的エンハンサー‐プロモーターは、心臓アイソフォームトロポニンC(cTNC)プロモーター(例えば、Parmacek et al., 1992およびParmacek et al., 1990を参照されたい)またはミオシン重鎖プロモーター(MHC)またはトロポニンIである。またさらに、特異的な生理学的シグナルに応答して調節されるエンハンサー‐プロモーターの選択は、誘導性の遺伝子産物発現を可能にし得る。
【0089】
F.ウイルス送達
一般に、ビリオンはインビボまたはインビトロいずれかの形質導入技術を用いて筋肉細胞中に導入される。形質導入された細胞の対象中への送達および導入のための適当な方法が説明されている。例えば、細胞は、組換えビリオンを心臓または心臓前駆細胞と併用することによってインビトロで形質導入され得る。その後、形質導入された細胞は下記でより完全に説明されるように薬学的組成物に製剤化され得、かつ該組成物は、筋肉内、静脈内、動脈内、皮下、および腹腔内注射、または、カテーテルベースもしくは外科的技術を用いた心筋中もしくは心膜腔中への注射などの種々の技術によって、対象中へ導入され得る。
【0090】
インビボ送達のために、ビリオンは上述されたように薬学的組成物に製剤化され、かつ一般に非経口的に投与されると考えられ、増強された心臓形質導入を可能にする技術を含んでもよい。心臓へのウイルストランスフェクションのための新規の方法は以前に記載されており、アデノウイルスおよびアデノ随伴ウイルス両方を用いて堅牢なウイルストランスフェクションを達成することができる(Champion et al. 2004)。
【0091】
薬学的組成物は、関心対象のタンパク質の治療的有効量、すなわち、心不全を処置するのに十分なCK-M、CK-B、またはCK-mitoの量を生成するのに十分な遺伝物質を含むと考えられる。薬学的組成物はまた、薬学的に許容される賦形剤を含むと考えられる。そのような賦形剤は、それ自体が組成物を受け入れる個体にとって有害な抗体の産生を誘導せず、かつ不適当な毒性無く投与され得る任意の物質を含む。薬学的に許容される賦形剤は、水、生理食塩水、グリセロール、およびエタノールなどの液体を含むが、それらに限定されない。薬学的に許容される塩は、塩酸塩、臭化水素酸塩、リン酸塩、硫酸塩などのような無機酸塩;および、酢酸塩、プロピオン酸塩、マロン酸塩、安息香酸塩などの有機酸の塩を含むが、それらに限定されない。さらに、湿潤剤または乳化剤などの補助物質、pH緩衝物質などがそのような賦形剤中に存在してもよい。薬学的に許容される賦形剤の詳細な考察は、REMINGTON'S PHARMACEUTICAL SCIENCES(Mack Pub. Co., N.J. 1991)において入手可能である。
【0092】
適切な用量は、他の因子の中で、処置される哺乳動物(例えば、ヒトまたは非ヒト霊長類または他の哺乳動物)、処置される対象の年齢および全身状態、処置される状態の重症度、問題となっている特定の治療的タンパク質、ならびに投与の様式に依存すると考えられる。適切な有効量は、当業者によって容易に決定され得る。
【0093】
したがって、治療的有効量は、臨床試験を通して決定され得る比較的広い範囲に収まると考えられる。例えば、骨格筋または心筋への直接的な注射によるインビボ投与について、治療的有効量は約106〜1015のオーダーのアデノウイルスまたはAAVビリオン、より好ましくは108〜1014のアデノウイルスまたはAAVビリオンであると考えられる。他の有効用量は、用量反応曲線を確立する日常的な試験を通して当業者によって容易に確立され得る。用量処置は、単一用量スケジュールまたは複数用量スケジュールであってもよい。さらに、対象は適切なだけの用量を投与されてもよい。当業者は適切な数の用量を容易に決定し得る。
【0094】
ウイルス調製物の投与は、複数の方法によって達成され得る。そのような方法は、心臓を灌流する血管中にウイルスベクター構築物を注入する段階、または心室壁もしくは心房壁などの心筋中に直接ウイルスベクター構築物を注射する段階を含むが、それらに限定されない。好ましいインビボの態様において、カテーテルを血管中に挿入し、心筋層の一部を灌流する冠動脈中に進める。いくつかの技術がウイルス形質導入を増強するために使用され得る。例として、ウイルスの肝取り込みを予防し、かつ有意なウイルストランスフェクションを提供する大動脈遮断および体全体の冷却の設定において、堅牢なウイルス形質導入が起こり得ることが最近示されている(Champion et al., 2004)。生理学的条件とは心筋細胞の生存に必要な条件であり、温度、pH、容量オスモル濃度などの条件を含む。好ましい態様において、体温は、約17℃〜約50℃、より好ましくは約30℃〜約40℃、およびさらにより好ましくは約37℃である。pHは、好ましくは約6.0の値〜約8.0の値、より好ましくは約6.8の値〜約7.8の値、および最も好ましくは約7.4である。容量オスモル濃度は、好ましくは1リットルあたり約200ミリオスモル(mosm/L)〜約400 mosm/L、およびより好ましくは約290 mosm/L〜約310 mosm/Lである。心筋細胞の生存を維持するために必要とされる他の生理学的条件は、当技術分野において周知である。
【0095】
III.生理学的物質のスクリーニング
本発明の一つの態様は、薬理学的物質を用いてHFにおいて心臓CK代謝を増加させるかまたはその減少を予防することである。本発明の一つの局面は、心臓細胞においてCK発現および/またはCK活性を増加させ得る物質を同定するために
潜在的な化合物のライブラリーを評価し得るハイスループットスクリーニング(HTS)である。本HTSのための化合物収集物は、ChemBridge(San Diego, CA)由来の40,000個の合成化合物、MicroSource Discovery(Gaylordsville, CT)由来の1680個の合成および天然産物、NCI-DTP由来の42000個の合成化合物、およびTimTec(Neward, DE)由来の2056個の化合物を含むが、それらに限定されない。
【0096】
そのような物質は、特定のCKアイソフォームをコードする遺伝子の発現を増加させることによって、産生されるCKタンパク質の量を増加させることによって、および/またはCK酵素の活性を増加させることによって、HFにおいて心臓CK代謝を増加させ得るか、および/またはその減少を予防し得る。mRNAは、遺伝子発現にとって重要であり、細胞の多くの機能の中心であり、複雑な二次および三次構造的折り畳みを含み、かつ細胞の修復機構を欠損する。RNAと相互作用する低分子の能力はよく認識されており、これらの相互作用は、遺伝子発現を予防または増強し、遺伝子発現の対立遺伝子特異的調節を達成し(対立遺伝子の配列の差異が変化したRNAコンフォメーションをもたらす際)、遺伝子発現のアイソフォーム特異的調節を達成し、かつアロステリック効果を示す能力を有する(Novac et al. Nucleic Acids 2004)。
【0097】
一つの態様において、本発明は、一つまたは複数のCKアイソフォーム(CK-M、CK-B、またはCK-mito)をコードする特異的遺伝子の発現を増加させる薬理学的物質を同定するための方法に関する。本方法は、胎児性または新生児ラット心臓由来のラット新生児心筋細胞またはH9c2細胞などの、クレアチンキナーゼの少なくとも一つのアイソフォームを通常発現する細胞を単離する段階を含むと考えられる。筋細胞はまた、正常の成体哺乳動物心臓および実験的または臨床的HFの心臓からも単離され得る。より大きな動物(例えば、ブタおよびイヌ)における心不全モデルは、より多くの数の心筋細胞を提供するため、しばしば好ましい。心不全は、頻拍ペーシング(O'Rourke et al. 1999, Wei et al. 2007)および大動脈結紮(Ye et al. 2001)を含むがそれらに限定されない多数の方法によって誘導され得る。筋細胞は、心臓を切除する段階、左前下行枝などの単一の冠動脈によって灌流される領域を単離する段階、ならびに、細胞を分離するためのコラゲナーゼおよびプロテアーゼまたは他の物質を含む冷たい名目上カルシウムを含まない溶液で領域を灌流する段階によって、心不全の実験モデルから単離することができる。カルシウムを灌流溶液に再導入し、かつ、心室壁の中間の領域を解剖して遊離させ、細胞を分散させ、網目を通して漉して、使用のために保存する(O'Rourke et al. 1999, Wei et al. 2007)。心筋細胞はまた、研究のためにヒト心臓から単離することができる(del Monte et al. 1995)。したがって、正常または不全の心臓の確立された株由来の細胞を研究のために取得することができる。使用される特定の細胞株、特定の培養条件、単離技術、および正確な濃度は本発明にとって重要ではなく、本発明の概念、趣旨、および範囲から逸脱することなく変形物が適用され得ることを、当業者は認識することができる。
【0098】
1 mlあたり50,000細胞の濃度の細胞に、例えばCK-Mプロモーターの制御下でホタルルシフェラーゼをコードするレポーター構築物(1細胞あたり20 pg)をバッチで形質導入する(Phippard and Manning 2003)。形質導入された細胞を、96ウェル、384ウェル、または1536ウェルプレート(Packard, Biotrend Chemicals)上に1ウェルあたり5,000細胞の密度で蒔く。その後、上述されたような低分子試験化合物のライブラリーを、ロボット液体操作装置(例えば、BioMEK FX)を用いることによって添加し、二重ルシフェラーゼレポーターアッセイシステム(Promegaによるものなど)を用いることによってCK遺伝子転写への推定の物質の効果を決定し得る。プレートの特定の数、プレートの供給業者、ロボット操作装置、およびルシフェラーゼレポーターシステムは単に例として提供され、限定されることを意図していない。本発明の概念、趣旨、および範囲から逸脱することなく変形物が適用され得ることを、当業者は認識することができる。
【0099】
別の態様において、筋肉細胞は心不全の哺乳動物から取得される心臓細胞である。
【0100】
本発明の別の態様において、細胞の一つまたは複数は(形質導入されていようといまいと)、心不全の特性を模倣する有害な物質またはシステム(過酸化水素への曝露などの活性酸素種生成システムを含むがそれに限定されない)に曝露され得る。その後、有害な物質またはシステムによってもたらされた減少したCK発現を増加させる薬理学的物質を同定するために、細胞のいくつかを試験化合物のライブラリーにおいて同定された低分子試験化合物の任意と接触させることができ、それらの細胞のCK発現を不活性(対照)物質と接触させた細胞と比較することができる。本発明の概念、趣旨、および範囲から逸脱することなく変形物が適用され得ることを、当業者は認識することができる。
【0101】
本発明の別の態様において、CK発現を増加させる薬理学的物質を(低分子試験化合物から)同定するために、細胞の一つまたは複数を(形質導入されていようといまいと)、上述されたような有害な物質またはシステムへの曝露の前に試験化合物のライブラリーにおいて同定された低分子試験化合物の任意と接触させることができ、それらの細胞のCK発現を不活性(対照)物質と接触させた細胞と比較することができる。本態様において使用されるような増加とは、薬理学的物質との接触が無い状態において有害な物質またはシステムへの曝露に起因すると予想されるであろう減少したCK発現を予防または改善することを指すように意図される。本発明の概念、趣旨、および範囲から逸脱することなく、なされる比較を含んで変形物が適用され得ることを、当業者は認識することができる。
【0102】
本発明のさらに別の態様は、CK活性を増加させる分子または試験化合物を同定するための薬理学的物質スクリーニングである。これは、mRNA発現についての上記のスクリーニングと類似しているが、CK活性に関する。CK活性を増加させ得る機構は、リン酸化、メチル化(O結合型メチル化など)、酸化、およびスルフヒドリル不活性化の効果を減少させるものを含むが、それらに限定されない。
【0103】
CK活性を増加させるかまたは保存する物質についてのハイスループットスクリーニング(HTS)を作製するアプローチは、CKアイソフォームの一つの精製された源を作製する段階、CKアイソフォームをCK活性についてアッセイできるハイスループットシステム中に配置する段階、試験化合物の低分子ライブラリーにおける物質などの一連の物質の各々をHTSシステム中のCKアイソフォームと別々に接触させる段階、およびその後、適切な対照および標準化合物、ならびに/または化合物無しと関連する際にCK活性を反映する出力上への各低分子の効果を読み取る段階の一般的な段階を含む。
【0104】
CK活性を増強する化合物を同定する本アプローチの一つの態様は、腫瘍学における化学療法応用のためのCK-Bの阻害剤を同定するために使用されるいくつかの共通の段階を利用すると考えられる(Towler et al. Analytical Biochemistry 2000; 279:96-99)。哺乳動物CK-B発現ベクターのEcoRI断片などのCK-B発現ベクター(またはCK-MもしくはCK-mitoのためのベクター)を、市販の大腸菌(E. coli)中への組込みのためにPET21a+のecoRI部位にクローン化することができる。インサートはPfu DNAポリメラーゼで増幅することができ、結果として生じた断片は大腸菌発現ベクターpST085をもたらすように適切にクローン化することができる。可溶性CKの発現は、ベクターを有する大腸菌細胞を増殖させた後にIPTGなどの物質を用いた1〜2時間の誘導期間をおくことによって最適化することができる。必要な際には、細胞を溶解し、その後、遠心分離、カラム溶出、分画、再遠心分離、および追加的なスクリーニングの一連の段階を行うことができ、結果として生じたCK酵素タンパク質をアリコートに分けて凍結乾燥することができる。精製されたクレアチンキナーゼ酵素を取得するための正確な方法は本発明にとって重要ではない。本明細書において使用されるとき、精製されたとは、精製度の正確な測定を強要するようには意図されない。むしろ、他の酵素の存在がスクリーニング法の結果を変化させ得るため、細胞に存在する他の酵素、特にATPまたはクレアチンを利用する酵素から分離されたクレアチンキナーゼ酵素を指すように意図される。本発明の概念、趣旨、および範囲から逸脱することなく、当業者は容易に本アプローチを改変することができ、または精製されたクレアチンキナーゼ酵素を生成する別のアプローチを開発することができる。
【0105】
その後、この精製されて濃縮されたCKアイソフォームおよびロボットシステム(例えば、Tomtec Quadra)を用いて、96ウェル、384ウェル、または1536ウェルプレートの各々において、(1)70 mlの125 mM Trizma, pH 7.5/0.4 mM ADP/8 mM クレアチンリン酸(Cr-P)、(2)20 mlの空隙、(3)70 mlの125 mM Trizma, pH 7.5/5〜10 nM CK-B、(4)20 mlの空隙、および(5)20 mlの50% DMSO中の化合物(最終濃度12.5 mM)を混合する段階を含む、Towlerらにより以前に報告されたものと類似した方法でHTSを行うことができる。CK活性と関連する発色剤であるジアセチルを添加した後、プレートリーダーを用いてある特定の時間後に530 nmで光学濃度を測定することによって読み取ることができる。適切な陽性および陰性対照を組込むことができる。クレアチンキナーゼ活性については多くの従来のアッセイが存在し、それらのいくつかもクレアチンキナーゼの活性化剤を同定する目的のためにHTSに適合させることができる。本アプローチは単に本段階を行うための一つの態様であり、本HTSの特定の段階が本発明を限定することは意図されていない。CK活性の本測定値を増加させる物質は、下記の実施例において説明されるようなインビトロおよびインビボの生理学的モデルおよび心不全モデルの両方におけるさらなる試験のための理想的な候補であると考えられる。
【0106】
本発明の別の態様において、単離されたCKアイソフォームの一つまたは複数のアリコートは、心不全の特性を模倣する有害な物質またはシステム(過酸化水素への曝露などの活性酸素種生成システムを含むがそれに限定されない)に曝露され得、一方単離されたCKアイソフォームの他のアリコートは曝露されない(対照)。その後、有害な物質またはシステムによってもたらされた減少したCK活性を増加させる薬理学的物質を同定するために、曝露されたCK酵素および曝露されていないCK酵素を試験化合物のライブラリーにおいて同定された低分子試験化合物の任意と接触させ、比較することができる。本発明の概念、趣旨、および範囲から逸脱することなく、なされる比較を含んで変形物が適用され得ることを、当業者は認識することができる。
【0107】
本発明のさらに別の態様において、有害な物質またはシステムへの曝露に起因すると予想されるであろう減少したCK活性を予防または改善する薬理学的物質を同定するために、単離されたCKアイソフォームの一つまたは複数のアリコートを、上述されたような有害な物質またはシステムへの曝露の前に上述されたライブラリーにおいて同定された低分子試験化合物の任意と接触させ、CK活性を比較することができる。本発明の概念、趣旨、および範囲から逸脱することなく、なされる比較を含んで変形物が適用され得ることを、当業者は認識することができる。
【実施例】
【0108】
実施例
以下の実施例は、本発明の様々な局面を例証する。これらの実施例は、限定すると解釈されるべきではなく、むしろ例証の目的のために含まれる。本発明は、添付の特許請求の範囲によってのみ限定されると解釈されるべきである。
【0109】
実施例1
CK-Bの遺伝子を含むアデノウイルスベクター構築物を用いて心臓収縮機能を改善する段階。
【0110】
本実施例は、心不全のマウスモデルにおいてCK-B発現を増加させ、エネルギー代謝を改善し、収縮機能を増加させ、かつ有害な心臓リモデリングを制限するためのウイルスベクター構築物の使用を説明する。
【0111】
CMVプロモーターを有するアデノ-CK-Bベクターを以前に記載されたように(Auricchio et al. 2001)作製する。マウスCK-B遺伝子のコード配列を以下のプライマー:フォワード、

;リバース、

を用いることによってマウス脳cDNA(CLONTECH)から増幅する。PCR産物をPCR2.1ベクター(Invitrogen, Carlsbad, CA)中にクローン化して配列決定する。その後、マウスCK-B配列をpAd-CMV-連結シャトルプラスミド(Vector Core, Institute for Human Gene Therapy, Univ. of Pennsylvania;CMVはサイトメガロウイルスプロモーターを示す)中にクローン化する。pAd-CMV導入遺伝子プラスミドを、相同組換えによりアデノウイルスを作製するためのE1領域のマップ単位1〜9およびE3領域(サブ360)中に欠失を含むClaI消化のH5.010CMVEGFPウイルスバックボーンと共に293細胞(American Type Culture Collection)のコトランスフェクションに使用する。組換えプラークを最初に緑色/白色選択によって単離し、Hirt手順により抽出したDNAの制限酵素解析によって確認する。陽性プラークを精製し、CsCl勾配精製のために293細胞において増殖させる。
【0112】
心不全を誘導するため、以前に記載されたように(Knowles et al. 2001)雄のC57BL/6マウス(8〜12週、Jackson Laboratories, Bar Harbor, ME)を研究し、横大動脈を収縮させること(TAC)によって圧負荷を生成させる。先行の研究は、TACの本方法が3週間後に拡張症、機能不全、および心不全をもたらすことを示す(Takimoto et al. 2005a, Takimoto et al. 2005b)。さらに、ヒトHFにおいて観察されるものと類似する(Smith et al. 2006)CK代謝における異常はまた、この時期に31P NMR分光法によって検出される(Maslov et al. 2006)。
【0113】
イソフルランで麻酔する段階、19〜21℃の中核体温に冷却する段階、中間下行大動脈をクランプする段階、および、改変された心停止液をLV中に注入し、続いて以前に記載されたような20μLのベクターを3.3×1011粒子/kgの用量で注入する段階を含む形質導入をマウスに行う(Champion et al. 2003)。クランプは9分間維持し、その後開放して、中核温度が30〜40分にわたって37℃に上昇するまで必要に応じてペーシングまたはアドレナリン作動性の支持を施す(Champion et al. 2003)。アデノウイルス形質導入後の心筋遺伝子過剰発現は3〜5日でピークに達し、かつさらに7〜10日間ピークレベルで維持されるため(Champion et al. 2003)、TACの2週間後にアデノ-CK-Bのベクター構築物をマウスに形質導入し、形質導入の1週間後に調査する(図4A)。
【0114】
CK代謝および機能についてのインビボ結果を測定するために、4.7T/40 cm のOxford磁石および積極的に遮蔽された勾配が装備されたBruker CSI NMR/MRI分光計でインビボMRI/MRS実験を行う。TACの3週間後に、以前に記載されたような(Chacko et al. 2000, Weiss et al. 2002)インビボ心臓複合MRI/MRSプロトコールを用いて研究を行う。重量、心室容量、および駆出率を評価するためには、間隙が無いLV全体の高い時間的かつ空間的解像度の多片映画MR画像の完全なセットが必要とされる(Chacko et al. 2000, Weiss et al. 2002)。高エネルギーリン酸データを取得するために、画像化後に動物を再配置することなく、一次元31P化学シフト画像(1D-CSI)配列を使用する。31P NMR局在スペクトルにおけるPCrおよび[β-P]ATPのピークを、ピーク面積を積分することによって定量化する(Chacko et al. 2000)。インビボ心臓機能はまた、以前に記載されたように(Weiss et al. 2002)連続的なLV圧-容積データのために心尖部を介して左心室中に挿入された4電極圧-容積カテーテル(モデルSPR-839, Millar Instruments, TX, USA)を用いて、麻酔したマウスにおける圧-容積の関係によって評価する。
【0115】
結果を平均±標準偏差(SD)として示す。2群の間(例えば、TAC+βgal対TAC-CK-B)のLVの解剖学的構造、機能、および代謝のMRIおよびMRS由来の測定値の比較はスチューデントt検定で行い、一方、多数の群の間の血行力学的および機能的圧-容積ループ(PVL)測定値(表1)は分散の解析で比較する(ANOVA)。
【0116】
(表1)CK形質導入後の圧容積ループ解析により評価されたLV機能

略語:HR、心拍数;SBP、収縮期血圧;HW、心重量;ESV、収縮末期容量;EDV、拡張末期容量;SV、一回拍出量;PWRmx/EDV、容量で補正された力指数、最大dP/dt、時間にわたる圧力の最大一次導関数;EF、駆出率;CI、心係数;τ、緩和定数;*P<0.05対基線;#P<0.05対AdCMVβgal+TAC。
【0117】
本インビボ遺伝子送達アプローチがCKを増強し得る程度を示すために、正常なマウス心臓にCK-Bをコードするアデノウイルス(Ad-CK-B)を形質導入し、これは正常動物中にCK-B発現において数倍の増加(図3)、総CK活性において40%の増加(97±14対68±11 mmol/l/s、P=0.01)、およびMBにおいて140%の増加をもたらす。TACの2週間後に注射した動物において、Ad-CK-B形質導入は平均総CK活性を20%増加させ(76±8対63±6 mmol/l/s、P=0.02)、かつ7日後にMBを180%増加させる(P=0.004)。
【0118】
TACのインビボ代謝効果を測定するために、形質導入されていない動物をTACの3週間後の収縮機能パラメータが減少した際に調査する。図4Aは、TAC手術の3週間後かつ対照マーカー遺伝子アデノ-CMV-β-ガラクトシダーゼ(β-Gal、n=5)またはアデノ-CMV-CK-B(CK-B、n=9)のいずれかでの心臓全体の形質導入(AdV Trnfx)の1週間後にインビボMRIによる所見を示すスケジュール表を示す。図4Bの上のパネルは、正常動物由来の代表的な1H MR軸位像(左)および対応する心臓31P NMRスペクトル(右)を示す。図4Bの中央のパネルは、TAC+βGal動物由来の代表的な1H MR軸位像(左)および対応する心臓31P NMRスペクトル(右)を示す。図4Bの下のパネルは、TAC+CK-B動物由来の代表的な1H MR軸位像(左)および対応する心臓31P NMRスペクトル(右)を示す。これらのMRI研究の間の平均心拍数は、β-GalおよびCK-B心臓においてそれぞれ602±29および588±36 min-1であった(p=NS)。CKの無い構築物を受け入れた動物におけるMRI/MRS所見は明らかに異常であり、一方CK-Bを含む構築物を受け入れた動物における所見は正常動物のものとほぼ同一である。図5は、正常動物における平均心臓PCr/ATP値(「対照」バー)を、TAC+βGal動物における平均心臓PCr/ATPの減少(「TAC-Bgal」バー)、およびTAC+CK-B動物における平均心臓PCr/ATPのTACを受けなかった対照動物のものとほぼ同一の値への改善(「TAC-CK」バー)と比較して示す。したがって、インビボ平均心筋PCr/ATPは、ヒト心不全と一致して(Conway et al. 1991, Smith et al. 2006)、30〜40%減少している(図5)。したがって、HFの本マウスモデルは、ヒト心不全において報告されたものと類似する変化した心臓CK代謝のPCr/ATP変化を反映する。
【0119】
TACを受ける動物は、左心室肥大、心室拡張、および収縮機能の減少を発生する(表1および図6)。表1はカテーテルベースの圧容積ループ研究由来の知見を示す。表1において、TAC後にCK-B処置された動物(「AdCMVCK-B」、「TAC」カラム)の結果をTAC後に対照処置された動物(「AdCMVβGAL」、「TAC」カラム)と比較することは特に妥当である。特に、駆出率、一回拍出量、および力指数を含む収縮機能の指標は、CK-B処置されたTAC動物において有意により良好である。さらに、心重量および拡張末期容量を含む有害な解剖学的リモデリングの指標もまた、CK-B処置されたTAC動物において有意により良好である。図6Aは、CK-B形質導入が、収縮末期容量(ESV)、一回拍出量(SV)、および駆出率(EF)を含む収縮機能のMRI指標を有意に改善することを示す。
【0120】
最大dP/dTおよび力指数を含むLV収縮機能の他の測定値もまた、CK-Bを形質導入されたTAC動物において有意により良好である(表1)。一般的に使用される臨床測定である心係数は、対照動物(表1、「AdCMVβgal」、「TAC」カラム)よりもCK-B処置された動物(表1、「AdCMVCK-B」、「TAC」カラム)において有意により良好であった。さらに、MRIによるLV重量は、TAC+βgal動物よりもTAC+CK-B処置された動物においてより低く(それぞれ122±22 mg対171±33 mg、p<0.01)、拡張期弛緩の指標(例えば、τ)はCK-B処置された動物において有意により良好である(表1)。機械的機能がTAC+CK-Bにおいてより良好である(図6;表1)だけでなく、駆出率もLV重量のように(LV重量=−73.7(PCr/ATP)+257.4、r2=0.50、P<.01)(図6Cを参照されたい)、心臓PCr/ATPと相関し(図6B)、EF=0.254(PCr/ATP)+0.0655、r2=0.40、P<0.005である。したがって、CK-Bを用いた遺伝子治療はインビボ代謝および収縮機能を有意にかつ劇的に改善し、ならびに心不全における有害な心臓リモデリングを制限し、機能的およびリモデリング改善の程度はエネルギー状態と相関する。
【0121】
実施例2
CK-Mの遺伝子を含むAAVベクター構築物を投与することにより心臓収縮機能における低下を予防する段階。
【0122】
本実施例は、マウス心不全において数ヶ月の経過にわたって、CK-M発現を増加させ、エネルギー代謝を改善し、収縮機能を増加させ、かつ有害な心臓リモデリングを制限するためのアデノ随伴ウイルスベクター構築物の使用を説明する。
【0123】
ベクターを以下のように作製する。マウスCK-MをPCRによりマウス骨格筋cDNAライブラリーからクローン化する。pAAV2-CMV-EGFP3中のEGFPをCK-Mで置換することによってpAAV2-CMV-CK-Mを構築する。本ベクターのマップを図7に示す。AAV2/9トランスプラスミドを用いた3重トランスフェクション法によりAAV2/9ベクターを293細胞中で生成させ、3ラウンドの塩化セシウム勾配遠心分離によって精製する。
【0124】
実施例1で説明されたように、TAC心不全を誘導し、本ベクターを投与する。しかしながら、投与の時期はTACより1週間先立つ(図8A)。AAV2/9-CK-Mを形質導入された動物においては、インビボ心臓PCr/ATPが増加し(それぞれ1.5±0.2対2.5±0.7、TAC+βgal対TAC+CK-M、P<0.05)、収縮機能は有意により良好であり、平均駆出率はより高く、かつ収縮末期容量はより低い(図8C)。具体的には、AAV2/9-βGalまたはAAV2/9-CK-Mのいずれかを4週間前に形質導入された動物においてTACの3週間後に取得された代表的な拡張末期および収縮末期LV短軸MR画像(図8A)は、CKを形質導入された動物においてより良好な駆出を有するより小さいLVを示す(図8B)。対照AAV2/9-βGal(「AAV-βGal」バー、n=3)を形質導入されたマウスよりもAAV2/9-CK-M(「AAV-CK-M」バー、n=7)を形質導入されたマウスにおいて、収縮機能は有意により良好であり(図8C)、平均SVおよびEFはより高い。さらに、LV肥大の量は有意に減衰している(図8D)。これらの結果は、実施例1とTAC後の同じ時について示されている。AAVベクター構築物は長期のCK遺伝子発現を可能にし、収縮の恩恵はTAC後9週まで観察されて(図9)、正常動物のものにほぼ等しい平均駆出率を有する。したがって、心臓CK形質導入およびこの場合改善された心臓PCr/ATPによって指数化されるCK代謝における改善の後、収縮機能における低下および有害な心臓リモデリングの程度は有意に減衰している。
【0125】
実施例3
ヒト心不全におけるCK流量の増加
本発明の方法は、ヒト心不全において収縮機能を改善し、かつ有害な心臓リモデリングを制限するために使用され得、AAV2/9- CK-Bを含むベクターの静脈内投与を含む。
【0126】
心不全の患者は、減少した心室駆出率、減少した拡張期充満、心室拡張を示す画像研究によって、および/または胸部x線所見によって、心不全の症状または身体的所見などの欠陥が生じた収縮機能を示唆する一つまたは複数の臨床所見により同定され得る。31P NMR分光法による異常な心臓クレアチンキナーゼ代謝産物またはクレアチンキナーゼ流量の所見もまた存在し得(図1および2)、心不全の診断を行うのには必要とされないが、介入を誘導し、かつ前処置レベルまたはCK流量を記録するために使用され得る。患者は最初に、ベクター構築物を調製するために使用されるAAVに対する抗体の存在について試験され得る。抗体が存在する場合、患者は好ましくは約103〜106の組換えAAV粒子の試験用量を与えられる。
【0127】
CK遺伝子の一つに対するコード配列、この場合ヒトCK-Bをコードするものを含む組換えAAVは、ヒト対象への投与について食品医薬品局(Food and Drug Administration)に許容されると考えられ、かつヒト使用のために十分な有効性および精製度を有すると証明されると考えられる任意の方法によって、調製されかつ精製される。
【0128】
AAVベクター構築物は、好ましくは、ボーラスまたはある期間にわたる注入いずれかとして適当な薬理学的組成物において脈管内投与により、患者に投与される。本実施例において、ベクターは静脈内に投与され得る。ベクターは、一般的に心臓カテーテル法において行われるように頚静脈または大腿静脈中に配置されたカテーテルを用いて、末梢静脈または中心静脈を介して与えられ得る。
【0129】
AAV2/9血清型の静脈内投与は、心不全において収縮の恩恵をもたらすアデノウイルスの大動脈内投与で取得されるものに匹敵する有意な心筋細胞形質導入率を達成する(上記の実施例1を参照されたい)ことを、最近のデータは示す。β-ガラクトシダーゼを形質導入したマウスの心臓より筋細胞を単離し、形質導入された個々の細胞を同定するために染色し、図10(A)において青色の核で同定する。本アプローチを用いて、トランスフェクションされた筋細胞の分画を定量化して(図10B)、アデノウイルス(「AdV」バー、実施例1において使用されたものと同一)およびアデノ随伴ウイルス血清型2(図10B、「AAV2」バー)の大動脈投与後は約50%、およびアデノ随伴ウイルス血清型2/9(図10B、「AAV2/9」バー、実施例2において使用されたベクターおよび投与経路と同一)ではほぼ70%であることが見出される。AAV2/9の静脈内投与は、約40%の筋細胞の形質導入をもたらす(図10B、「AAV2/9」バー)。したがって、より新しいAAV血清型(例えば、AAV2/9)の静脈内投与によって達成可能な筋細胞形質導入率は、投与のためにより侵襲性の動脈内経路を用いる、より旧式のアデノおよびAAV血清型によって以前に達成されたものに匹敵する。本態様において、AAVベクターは有効な発現を誘導する量、好ましくは106〜1015の間のウイルス粒子またはpfu、および最も好ましくは108〜5×1012の間のウイルス粒子またはpfuで投与される。
【0130】
炎症反応などの急性および遅延有害反応をモニターするために、患者は試験の間入院した状態であり得る。心臓収縮機能への本発明の効果は、駆出率、拡張末期容量および収縮末期容量、心室圧および圧力変化率、ならびに心係数などの指標を評価するために、心エコー検査法、磁気共鳴画像法、コンピュータ断層撮影法、核医学心室造影法もしくはシンチグラフィー、または従来のx線血管造影法でモニターされ得る。6分の歩行において測定されるものなどの運動能力、または運動の間のピーク酸素消費もまた評価され得、心不全患者において改善していることが期待される。CK発現またはCK代謝への本発明の本態様の効果をモニターすることは必須ではない;しかしながら、行われ得、かつ診断または予後の臨床管理恩恵を提供する可能性がある。心臓CK発現への効果は、経静脈的心内膜心筋生検の間に取得されるものなどの生検で取得される組織を解析することによってモニターされ得る。CK代謝、CK流量、CK活性、およびCK中のホスホリルの移動への本発明の効果は、上記で説明されかつ示されたように(図1および2)31P NMR分光法によってモニターされ得る。
【0131】
参照文献




【特許請求の範囲】
【請求項1】
以下の段階を含む、哺乳動物において検出可能な心臓クレアチンキナーゼ代謝を増加させるための方法:
哺乳動物クレアチンキナーゼをコードするヌクレオチド配列を有するベクター構築物を提供する段階;
ベクター構築物を哺乳動物の心臓に投与して、心臓クレアチンキナーゼ代謝において検出可能な増加をもたらす段階。
【請求項2】
検出可能な増加が以下の一つまたは複数である、請求項1記載の方法:
心臓クレアチンリン酸のATPに対する割合における変化;
クレアチンリン酸もしくはATPの心臓濃度における変化;または
心臓クレアチンキナーゼ反応中の流量における変化。
【請求項3】
以下の段階を含む、哺乳動物において心臓収縮機能を増加させるための方法:
哺乳動物クレアチンキナーゼをコードするヌクレオチド配列を有するベクター構築物を提供する段階;
ベクター構築物を哺乳動物の心臓に投与して、心臓収縮機能において検出可能な増加をもたらす段階。
【請求項4】
検出可能な増加が以下の一つまたは複数である、請求項3記載の方法:
左心室もしくは右心室駆出率における増加;または
心係数における増加。
【請求項5】
心臓収縮機能における増加が以下の一つまたは複数によって測定される、請求項3記載の方法:
x線;x線血管造影法;超音波もしくは心エコー検査法;核医学心室造影法もしくはシンチグラフィー;陽電子放出断層撮影法;磁気共鳴画像法;コンピュータ断層撮影法;または侵襲性もしくは非侵襲性の血行力学。
【請求項6】
以下の段階を含む、哺乳動物において有害な心臓リモデリングを改善するための方法:
哺乳動物クレアチンキナーゼをコードするヌクレオチド配列を有するベクター構築物を提供する段階;
ベクター構築物を哺乳動物の心臓に投与して、心室の大きさまたは形状における改善をもたらす段階。
【請求項7】
改善が以下の一つまたは複数である、請求項6記載の方法:
拡張末期容量;収縮末期容量;心室壁の厚さ;または心室重量。
【請求項8】
心室の大きさまたは形状における改善が、x線;x線血管造影法;超音波もしくは心エコー検査法;核医学心室造影法もしくはシンチグラフィー;陽電子放出断層撮影法;磁気共鳴画像法;コンピュータ断層撮影法の一つまたは複数によって;または、リモデリングと相関するバイオマーカーの使用によって測定される、請求項6記載の方法。
【請求項9】
ヌクレオチド配列が哺乳動物クレアチンキナーゼの脳アイソフォームをコードする、請求項1記載の方法。
【請求項10】
ヌクレオチド配列が哺乳動物クレアチンキナーゼの脳アイソフォームをコードする、請求項3記載の方法。
【請求項11】
ヌクレオチド配列が哺乳動物クレアチンキナーゼの脳アイソフォームをコードする、請求項6記載の方法。
【請求項12】
ヌクレオチド配列が哺乳動物クレアチンキナーゼの筋肉アイソフォームをコードする、請求項1記載の方法。
【請求項13】
ヌクレオチド配列が哺乳動物クレアチンキナーゼの筋肉アイソフォームをコードする、請求項3記載の方法。
【請求項14】
ヌクレオチド配列が哺乳動物クレアチンキナーゼの筋肉アイソフォームをコードする、請求項6記載の方法。
【請求項15】
ヌクレオチド配列が哺乳動物クレアチンキナーゼのミトコンドリアアイソフォームをコードする、請求項1記載の方法。
【請求項16】
ヌクレオチド配列が哺乳動物クレアチンキナーゼのミトコンドリアアイソフォームをコードする、請求項3記載の方法。
【請求項17】
ヌクレオチド配列が哺乳動物クレアチンキナーゼのミトコンドリアアイソフォームをコードする、請求項6記載の方法。
【請求項18】
哺乳動物がヒトである、請求項1記載の方法。
【請求項19】
哺乳動物がヒトである、請求項3記載の方法。
【請求項20】
哺乳動物がヒトである、請求項6記載の方法。
【請求項21】
以下の段階を含む、筋肉細胞においてクレアチンキナーゼ発現を増加させる薬理学的物質を同定するための方法:
培養下の単離された筋肉細胞を提供する段階;
薬理学的物質を一つまたは複数の筋肉細胞と接触させる段階;および
クレアチンキナーゼ発現における増加を検出する段階。
【請求項22】
筋肉細胞が心不全の哺乳動物から取得される心臓細胞である、請求項21記載の方法。
【請求項23】
筋肉細胞にクレアチンキナーゼプロモーターの制御下のレポーター構築物が形質導入され、かつ検出が、クレアチンキナーゼ発現を反映するように設計されたハイスループットシステムによる、請求項21記載の方法。
【請求項24】
単離された筋肉細胞が、薬理学的物質との接触の前または後に、心不全の特性を模倣する有害な物質または条件に曝露される、請求項21記載の方法。
【請求項25】
以下の段階を含む、クレアチンキナーゼ活性を増加させる薬理学的物質を同定するための方法:
単離されかつ精製されたクレアチンキナーゼを提供する段階;
薬理学的物質を精製されたクレアチンキナーゼと接触させる段階;および
クレアチンキナーゼ活性における増加を検出する段階。
【請求項26】
検出が、クレアチンキナーゼ活性を反映するように設計されたハイスループットシステムによる、請求項25記載の方法。
【請求項27】
単離されたクレアチンキナーゼが、薬理学的物質との接触の前または後に、心不全の特性を模倣する有害な物質または条件に曝露される、請求項25記載の方法。
【請求項28】
以下の段階を含む、心不全の危険性があるかまたは心不全の哺乳動物を処置するための方法:
哺乳動物クレアチンキナーゼをコードするヌクレオチド配列を有するベクター構築物を提供する段階;
ベクター構築物を哺乳動物の心臓に投与して、心臓クレアチンキナーゼ代謝において検出可能な増加をもたらす段階。
【請求項29】
検出可能な増加が以下の一つまたは複数である、請求項28記載の方法:
心臓クレアチンリン酸のATPに対する割合における変化;
クレアチンリン酸もしくはATPの心臓濃度における変化;または
心臓クレアチンキナーゼ反応中の流量における変化。
【請求項30】
ヌクレオチド配列が哺乳動物クレアチンキナーゼの脳アイソフォームをコードする、請求項28記載の方法。
【請求項31】
ヌクレオチド配列が哺乳動物クレアチンキナーゼの筋肉アイソフォームをコードする、請求項28記載の方法。
【請求項32】
ヌクレオチド配列が哺乳動物クレアチンキナーゼのミトコンドリアアイソフォームをコードする、請求項28記載の方法。
【請求項33】
以下の段階を含む、心不全の危険性があるかまたは心不全の哺乳動物を処置するための方法:
哺乳動物クレアチンキナーゼをコードするヌクレオチド配列を有するベクター構築物を提供する段階;
ベクター構築物を哺乳動物の心臓に投与して、心臓収縮機能において検出可能な増加をもたらす段階。
【請求項34】
検出可能な増加が以下の一つまたは複数である、請求項33記載の方法:
左心室もしくは右心室駆出率における増加;または
心係数における増加。
【請求項35】
心臓収縮機能における増加が以下の一つまたは複数によって測定される、請求項33記載の方法:
x線;x線血管造影法;超音波もしくは心エコー検査法;核医学心室造影法もしくはシンチグラフィー;陽電子放出断層撮影法;磁気共鳴画像法;コンピュータ断層撮影法;または侵襲性もしくは非侵襲性の血行力学。
【請求項36】
ヌクレオチド配列が哺乳動物クレアチンキナーゼの脳アイソフォームをコードする、請求項33記載の方法。
【請求項37】
ヌクレオチド配列が哺乳動物クレアチンキナーゼの筋肉アイソフォームをコードする、請求項33記載の方法。
【請求項38】
ヌクレオチド配列が哺乳動物クレアチンキナーゼのミトコンドリアアイソフォームをコードする、請求項33記載の方法。
【請求項39】
以下の段階を含む、心不全の危険性があるかまたは心不全の哺乳動物を処置するための方法:
哺乳動物クレアチンキナーゼをコードするヌクレオチド配列を有するベクター構築物を提供する段階;
ベクター構築物を哺乳動物の心臓に投与して、心室の大きさまたは形状における改善をもたらす段階。
【請求項40】
改善が以下の一つまたは複数である、請求項39記載の方法:
拡張末期容量;収縮末期容量;心室壁の厚さ;または心室重量。
【請求項41】
心室の大きさまたは形状における改善が、x線;x線血管造影法;超音波もしくは心エコー検査法;核医学心室造影法もしくはシンチグラフィー;陽電子放出断層撮影法;磁気共鳴画像法;コンピュータ断層撮影法の一つまたは複数によって;または、リモデリングと相関するバイオマーカーの使用によって測定される、請求項39記載の方法。
【請求項42】
ヌクレオチド配列が哺乳動物クレアチンキナーゼの脳アイソフォームをコードする、請求項39記載の方法。
【請求項43】
ヌクレオチド配列が哺乳動物クレアチンキナーゼの筋肉アイソフォームをコードする、請求項39記載の方法。
【請求項44】
ヌクレオチド配列が哺乳動物クレアチンキナーゼのミトコンドリアアイソフォームをコードする、請求項39記載の方法。
【請求項1】
以下の段階を含む、哺乳動物において検出可能な心臓クレアチンキナーゼ代謝を増加させるための方法:
哺乳動物クレアチンキナーゼをコードするヌクレオチド配列を有するベクター構築物を提供する段階;
ベクター構築物を哺乳動物の心臓に投与して、心臓クレアチンキナーゼ代謝において検出可能な増加をもたらす段階。
【請求項2】
検出可能な増加が以下の一つまたは複数である、請求項1記載の方法:
心臓クレアチンリン酸のATPに対する割合における変化;
クレアチンリン酸もしくはATPの心臓濃度における変化;または
心臓クレアチンキナーゼ反応中の流量における変化。
【請求項3】
以下の段階を含む、哺乳動物において心臓収縮機能を増加させるための方法:
哺乳動物クレアチンキナーゼをコードするヌクレオチド配列を有するベクター構築物を提供する段階;
ベクター構築物を哺乳動物の心臓に投与して、心臓収縮機能において検出可能な増加をもたらす段階。
【請求項4】
検出可能な増加が以下の一つまたは複数である、請求項3記載の方法:
左心室もしくは右心室駆出率における増加;または
心係数における増加。
【請求項5】
心臓収縮機能における増加が以下の一つまたは複数によって測定される、請求項3記載の方法:
x線;x線血管造影法;超音波もしくは心エコー検査法;核医学心室造影法もしくはシンチグラフィー;陽電子放出断層撮影法;磁気共鳴画像法;コンピュータ断層撮影法;または侵襲性もしくは非侵襲性の血行力学。
【請求項6】
以下の段階を含む、哺乳動物において有害な心臓リモデリングを改善するための方法:
哺乳動物クレアチンキナーゼをコードするヌクレオチド配列を有するベクター構築物を提供する段階;
ベクター構築物を哺乳動物の心臓に投与して、心室の大きさまたは形状における改善をもたらす段階。
【請求項7】
改善が以下の一つまたは複数である、請求項6記載の方法:
拡張末期容量;収縮末期容量;心室壁の厚さ;または心室重量。
【請求項8】
心室の大きさまたは形状における改善が、x線;x線血管造影法;超音波もしくは心エコー検査法;核医学心室造影法もしくはシンチグラフィー;陽電子放出断層撮影法;磁気共鳴画像法;コンピュータ断層撮影法の一つまたは複数によって;または、リモデリングと相関するバイオマーカーの使用によって測定される、請求項6記載の方法。
【請求項9】
ヌクレオチド配列が哺乳動物クレアチンキナーゼの脳アイソフォームをコードする、請求項1記載の方法。
【請求項10】
ヌクレオチド配列が哺乳動物クレアチンキナーゼの脳アイソフォームをコードする、請求項3記載の方法。
【請求項11】
ヌクレオチド配列が哺乳動物クレアチンキナーゼの脳アイソフォームをコードする、請求項6記載の方法。
【請求項12】
ヌクレオチド配列が哺乳動物クレアチンキナーゼの筋肉アイソフォームをコードする、請求項1記載の方法。
【請求項13】
ヌクレオチド配列が哺乳動物クレアチンキナーゼの筋肉アイソフォームをコードする、請求項3記載の方法。
【請求項14】
ヌクレオチド配列が哺乳動物クレアチンキナーゼの筋肉アイソフォームをコードする、請求項6記載の方法。
【請求項15】
ヌクレオチド配列が哺乳動物クレアチンキナーゼのミトコンドリアアイソフォームをコードする、請求項1記載の方法。
【請求項16】
ヌクレオチド配列が哺乳動物クレアチンキナーゼのミトコンドリアアイソフォームをコードする、請求項3記載の方法。
【請求項17】
ヌクレオチド配列が哺乳動物クレアチンキナーゼのミトコンドリアアイソフォームをコードする、請求項6記載の方法。
【請求項18】
哺乳動物がヒトである、請求項1記載の方法。
【請求項19】
哺乳動物がヒトである、請求項3記載の方法。
【請求項20】
哺乳動物がヒトである、請求項6記載の方法。
【請求項21】
以下の段階を含む、筋肉細胞においてクレアチンキナーゼ発現を増加させる薬理学的物質を同定するための方法:
培養下の単離された筋肉細胞を提供する段階;
薬理学的物質を一つまたは複数の筋肉細胞と接触させる段階;および
クレアチンキナーゼ発現における増加を検出する段階。
【請求項22】
筋肉細胞が心不全の哺乳動物から取得される心臓細胞である、請求項21記載の方法。
【請求項23】
筋肉細胞にクレアチンキナーゼプロモーターの制御下のレポーター構築物が形質導入され、かつ検出が、クレアチンキナーゼ発現を反映するように設計されたハイスループットシステムによる、請求項21記載の方法。
【請求項24】
単離された筋肉細胞が、薬理学的物質との接触の前または後に、心不全の特性を模倣する有害な物質または条件に曝露される、請求項21記載の方法。
【請求項25】
以下の段階を含む、クレアチンキナーゼ活性を増加させる薬理学的物質を同定するための方法:
単離されかつ精製されたクレアチンキナーゼを提供する段階;
薬理学的物質を精製されたクレアチンキナーゼと接触させる段階;および
クレアチンキナーゼ活性における増加を検出する段階。
【請求項26】
検出が、クレアチンキナーゼ活性を反映するように設計されたハイスループットシステムによる、請求項25記載の方法。
【請求項27】
単離されたクレアチンキナーゼが、薬理学的物質との接触の前または後に、心不全の特性を模倣する有害な物質または条件に曝露される、請求項25記載の方法。
【請求項28】
以下の段階を含む、心不全の危険性があるかまたは心不全の哺乳動物を処置するための方法:
哺乳動物クレアチンキナーゼをコードするヌクレオチド配列を有するベクター構築物を提供する段階;
ベクター構築物を哺乳動物の心臓に投与して、心臓クレアチンキナーゼ代謝において検出可能な増加をもたらす段階。
【請求項29】
検出可能な増加が以下の一つまたは複数である、請求項28記載の方法:
心臓クレアチンリン酸のATPに対する割合における変化;
クレアチンリン酸もしくはATPの心臓濃度における変化;または
心臓クレアチンキナーゼ反応中の流量における変化。
【請求項30】
ヌクレオチド配列が哺乳動物クレアチンキナーゼの脳アイソフォームをコードする、請求項28記載の方法。
【請求項31】
ヌクレオチド配列が哺乳動物クレアチンキナーゼの筋肉アイソフォームをコードする、請求項28記載の方法。
【請求項32】
ヌクレオチド配列が哺乳動物クレアチンキナーゼのミトコンドリアアイソフォームをコードする、請求項28記載の方法。
【請求項33】
以下の段階を含む、心不全の危険性があるかまたは心不全の哺乳動物を処置するための方法:
哺乳動物クレアチンキナーゼをコードするヌクレオチド配列を有するベクター構築物を提供する段階;
ベクター構築物を哺乳動物の心臓に投与して、心臓収縮機能において検出可能な増加をもたらす段階。
【請求項34】
検出可能な増加が以下の一つまたは複数である、請求項33記載の方法:
左心室もしくは右心室駆出率における増加;または
心係数における増加。
【請求項35】
心臓収縮機能における増加が以下の一つまたは複数によって測定される、請求項33記載の方法:
x線;x線血管造影法;超音波もしくは心エコー検査法;核医学心室造影法もしくはシンチグラフィー;陽電子放出断層撮影法;磁気共鳴画像法;コンピュータ断層撮影法;または侵襲性もしくは非侵襲性の血行力学。
【請求項36】
ヌクレオチド配列が哺乳動物クレアチンキナーゼの脳アイソフォームをコードする、請求項33記載の方法。
【請求項37】
ヌクレオチド配列が哺乳動物クレアチンキナーゼの筋肉アイソフォームをコードする、請求項33記載の方法。
【請求項38】
ヌクレオチド配列が哺乳動物クレアチンキナーゼのミトコンドリアアイソフォームをコードする、請求項33記載の方法。
【請求項39】
以下の段階を含む、心不全の危険性があるかまたは心不全の哺乳動物を処置するための方法:
哺乳動物クレアチンキナーゼをコードするヌクレオチド配列を有するベクター構築物を提供する段階;
ベクター構築物を哺乳動物の心臓に投与して、心室の大きさまたは形状における改善をもたらす段階。
【請求項40】
改善が以下の一つまたは複数である、請求項39記載の方法:
拡張末期容量;収縮末期容量;心室壁の厚さ;または心室重量。
【請求項41】
心室の大きさまたは形状における改善が、x線;x線血管造影法;超音波もしくは心エコー検査法;核医学心室造影法もしくはシンチグラフィー;陽電子放出断層撮影法;磁気共鳴画像法;コンピュータ断層撮影法の一つまたは複数によって;または、リモデリングと相関するバイオマーカーの使用によって測定される、請求項39記載の方法。
【請求項42】
ヌクレオチド配列が哺乳動物クレアチンキナーゼの脳アイソフォームをコードする、請求項39記載の方法。
【請求項43】
ヌクレオチド配列が哺乳動物クレアチンキナーゼの筋肉アイソフォームをコードする、請求項39記載の方法。
【請求項44】
ヌクレオチド配列が哺乳動物クレアチンキナーゼのミトコンドリアアイソフォームをコードする、請求項39記載の方法。
【図1】


【図2】


【図3】


【図4A】


【図4B】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】




【図2】


【図3】


【図4A】


【図4B】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【公開番号】特開2013−100283(P2013−100283A)
【公開日】平成25年5月23日(2013.5.23)
【国際特許分類】
【出願番号】特願2012−246077(P2012−246077)
【出願日】平成24年11月8日(2012.11.8)
【分割の表示】特願2009−509828(P2009−509828)の分割
【原出願日】平成19年5月9日(2007.5.9)
【出願人】(509044545)ナノコア セラピューティクス インコーポレイテッド (2)
【Fターム(参考)】
【公開日】平成25年5月23日(2013.5.23)
【国際特許分類】
【出願日】平成24年11月8日(2012.11.8)
【分割の表示】特願2009−509828(P2009−509828)の分割
【原出願日】平成19年5月9日(2007.5.9)
【出願人】(509044545)ナノコア セラピューティクス インコーポレイテッド (2)
【Fターム(参考)】
[ Back to top ]

