心疾患マーカーとしての尿中トリアオシルセラミド(GB3)
本発明は、非ファブリー病の心疾患患者の尿中グロボトリアオシルセラミド(Gb3)レベルを判定する方法について記載する。Gb3レベルの判定により、心臓疾患のリスクを判定するスクリーニング方法を提供し、薬学的シャペロン又は他の薬剤を使用してGb3レベルを低減させることによって、心疾患の管理又は心疾患のリスクの軽減に対する代替的な治療の選択肢を提供することができるかもしれない。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、一般に、心疾患マーカーの分野に関し、特に非ファブリー病の心臓病患者における尿中で上昇したグロボトリアオシルセラミド(Gb3)のレベルの検出に関する。
【背景技術】
【0002】
本発明の範囲を限定することなく、本発明の背景を、心疾患マーカー、及び体液中のGb3及び他の糖脂質マーカーの検出方法に関連して記載する。
【0003】
Grior et al. に発行された米国特許第7,445,886号明細書(2008)は、心臓血管系リスクの臨床的に有用な生化学的マーカーであるマクロファージ遊走阻止因子(MIF)の試験を開示している。リスク評価は、ヒトの血中におけるMIF濃度をそのヒトの心臓血管系リスクのマーカーとして検出するステップを含む。‘886特許の方法は、さらにMIF濃度と比例した心臓血管系リスク測定基準をヒトに与える(assign)するステップ、及び/又はMIF濃度にしたがった心臓血管系治療法を処方するステップを含んでもよい。前記方法は、初期スクリーニングとして有用であり、ストレステスト、CRPアッセイ、LDLアッセイ等の追加のテストと併用して、若しくはそれに代用して使用することができる。検出ステップは、経時的及び/又は治療中のヒトの心臓血管系リスクの変化をモニターするに、一定期間内/治療中に繰り返すことができる。
【0004】
米国特許出願番号第20040132688号(Griffin, et al, 2003)は、血栓症のリスク因子及び抗凝固プロテインCのモジュレーターとして血漿グルコシルセラミド欠乏症に関している。Griffinによれば、体外から添加されたグルコシルセラミド(GlcCer)及び同種のGlc含有グロボトリアオシルセラミド(Gb3Cer)等の他の中性糖脂質は、用量依存的にAPC:プロテインSの存在下で正常な血漿の凝固時間を延長し(不在下では延長しなかった)、GlcCer又はGb3Cerが、プロテインC経路抗凝固活性を亢進することができることを示した。精製されたタンパク質を用いた研究では、APC:プロテインSによる因子Vaの不活性化は、GlcCer単独又はGlcCer、グロボトリアオシルセラミド、ラクトシルセラミド及びガラクトシルセラミドによって、ホルファチジルセリン及びホスファチジルコリンを含む多成分小胞において増強された。したがって、Griffinの発明は、プロテインC経路の抗血栓作用に寄与する抗凝固補因子としてGlcCer及びGb3Cer等の中性糖脂質を提供する。Griffinの発明は、血漿GlcCerの欠損は、血栓症のリスク因子であると記載している。個人における血栓症のリスクを判定する方法、その治療方法、及び中性糖脂質から抗血栓因子をスクリーニングする方法が提供されている。
【先行技術文献】
【特許文献】
【0005】
【特許文献1】米国特許第7,445,886号明細書
【特許文献2】米国特許出願番号第20040132688号
【発明の概要】
【0006】
本発明は、一般集団における心疾患のリスク因子である、尿中グロボトリアオシルセラミド(Gb3)の上昇を判定する方法を記載している。尿中のGb3レベルは、心疾患のマーカーとしての機能を果たす。本発明の方法は、心リスクのスクリーニング方法を提供し、Gb3濃度が低いことが、心疾患の治療及びリスク管理に有益であることを示唆している。
【0007】
本発明の1つの実施態様は、以下のステップを含む、尿サンプルにおけるグロボトリアオシルセラミド(Gb3)レベルを計算して、ヒト対象における心疾患、心臓病、又は心疾患のリスク因子の存在をスクリーニングする方法を提供している。
(i)前記ヒト対象から前記尿サンプルを入手し、ろ過紙に配置するステップ;(ii) 前記ろ過紙に配置した前記尿サンプルを乾燥するステップ;(iii) 前記乾燥した尿サンプルをメタノールで抽出するステップ;(iv) 前記抽出した尿サンプルの一部を、メタノール中に既知のGb3濃度を含む放射標識された標準溶液と共にLC−MSシステムに注入するステップ;(v)前記尿サンプル及び前記標準溶液中のGb3をメタノール/水勾配で溶出するステップ;(vi) 前記LC−MSシステムの質量スペクトルから、前記尿サンプル及び前記標準溶液中のGb3の1又は2以上のピークを入手するステップ;(vii) 前記生体サンプル及び前記標準溶液中のGb3の前記1又は2以上のピークの保持時間に対するピーク面積をプロットして、検量線を作成するステップ;(viii)前記検量線から前記尿サンプル中のGb3レベルを計算するステップ;及び(ix) 前記尿サンプル中のGb3のレベルが、正常な閾値を超える場合に、心疾患、心臓病、又は心疾患のリスク因子の存在を判定するステップであって、前記正常な閾値が200ng/mlであるステップ。
【0008】
本発明の方法は、さらに、尿サンプル中のGb3レベルと正常な閾値との比較に基づいて、ヒト対象に心臓血管系リスク測定基準を与える、又は治療計画を処方するステップであって、前記心臓血管系リスクが、前記ヒト対象の尿サンプル中のGb3のレベルに比例するステップを含む。1つの態様において、心疾患又は心臓病は、肥大性心筋症、リズム及び伝導系障害、冠動脈疾患、不整脈、伝導ブロック、及び弁膜症からなる群より選択される。別の態様において、ヒト対象は、健康なヒト対象、非ファブリー病患者、非ファブリー病心臓病患者、又はファブリー病に対する遺伝的素因を有さない対象である。
【0009】
別の実施態様では、本発明は、グロボトリアオシルセラミド(Gb3)のレベルを低減させることによって、ヒト対象における心疾患、心臓病を治療、又は心臓病のリスク因子を軽減する、活性薬理学的又は化学的シャペロン及び1又は2以上の任意の薬学的に許容される賦形剤医薬組成物を記載する。前記活性薬理学的又は化学的シャペロンは、1−デオキシガラクトノジリマイシン(DGJ)、1−デオキシガラクトノジリマイシン塩及び誘導体、イミノ糖及び誘導体、デオキシアザ糖及び誘導体、カリステギンアルカロイド及び誘導体、イソファゴミン、ファゴミン異性体、コンズリトールCエポキシド、ノルトロパンアルカロイド、4−フェニルブチレート、ミガラスタット塩酸塩、基質還元治療に使用される分子(1:http://www.medicalnewstoday.com/articles/71159.php)、上昇したGb3レベルと関連する根本的な後成的修飾を修正するために使用される分子(すなわち、アセチル化修飾、アミノ酸置換によるリン酸化部位の修飾のHDAC阻害剤)、及びα―ガラクトシダーゼAをコードする遺伝子又はGb3の合成遺伝子若しくはGb3シンターゼ等のその前駆体、又はその組み合わせと相互作用する1又は2以上の修飾遺伝子の発現又は機能に影響する分子を含む。
【0010】
本発明の1つの態様において、心疾患又は心臓病は、肥大性心筋症、リズム及び伝導系障害、冠動脈疾患、不整脈、伝導ブロック、及び弁膜症からなる群より選択される。別の1つの態様において、ヒト対象は、健康なヒト対象、非ファブリー病患者、非ファブリー病心臓病患者、又はファブリー病に対する遺伝的素因を有さない対象である。
【0011】
本発明はさらに、以下のステップを含む、ヒト対象における心疾患、心臓病を治療、又は心臓病のリスク因子を軽減する方法を提供する。心疾患、心臓病に対する治療、又は心疾患のリスク因子の軽減を必要とするヒト対象を同定するステップ;活性薬理学的又は化学的シャペロン及び1又は2以上の任意の薬学的に許容される賦形剤を含む薬学的組成物を心疾患、心臓病を治療又は心疾患のリスク因子を軽減するために十分な濃度で投与するステップであって、前記薬理学的又は化学的シャペロンが、1−デオキシガラクトノジリマイシン(DGJ)、1−デオキシガラクトノジリマイシン塩及び誘導体、イミノ糖及び誘導体、デオキシアザ糖及び誘導体、カリステギンアルカロイド及び誘導体、イソファゴミン、ファゴミン異性体、コンズリトールCエポキシド、ノルトロパンアルカロイド、4−フェニルブチレート、ミガラスタット塩酸塩、基質還元治療に使用される分子(1:http://www.medicalnewstoday.com/articles/71159.php)、上昇したGb3レベルと関連する根本的な後成的修飾を修正するために使用される分子(すなわち、アセチル化修飾、アミノ酸置換によるリン酸化部位の修飾のHDAC阻害剤)、α―ガラクトシダーゼAをコードする遺伝子又はGb3若しくはGb3シンターゼ(A4GALT)等の前駆体の合成遺伝子、若しくはその組み合わせと相互作用する1又は2以上の修飾遺伝子の発現及び/又は機能に影響する分子を含むステップ。本発明の方法は、さらに、ヒト対象の尿サンプル中のグロボトリアオシルセラミド(Gb3)のレベルを測定して、心疾患、心臓病の治療又は心臓病のリスク因子の軽減の進展をモニターするステップを含む。
【0012】
本発明の1つの態様において、尿サンプル中のGb3レベルが200ng/ml以下であることが、心疾患又は心臓病の治療の成功、又は心臓病のリスク因子の軽減の成功を示す。別の態様において、心疾患又は心臓病は、肥大性心筋症、リズム及び伝導系障害、冠動脈疾患、不整脈、伝導ブロック、及び弁膜症からなる群より選択される。さらに別の態様において、ヒト対象は、健康なヒト対象、非ファブリー病患者、非ファブリー病心臓病患者、又はファブリー病に対する遺伝的素因を有さない対象である。
【0013】
1つの実施態様において、本発明は、以下のステップを含む、ヒト対象における心疾患又は心臓病を治療、又は心臓病のリスク因子を軽減する方法を提供する。心疾患、心臓病に対する治療、又は心疾患のリスク因子の軽減を必要とするヒト対象を同定するステップ;及びミガラスタット塩酸塩と1又は2以上の任意の薬学的に許容される賦形剤との組成物を心疾患、心臓病を治療又は心疾患のリスク因子を軽減するために十分な濃度で投与するステップ。本発明の方法は、さらに、ヒト対象からの尿サンプル中のグロボトリアオシルセラミド(Gb3)のレベルを測定して、心疾患、心臓病の治療又は心疾患のリスク因子の軽減の進展をモニターするステップを含む。本発明の1つの態様において、尿サンプル中のGb3レベルが200ng/ml以下であることが、心疾患又は心臓病の治療の成功、又は心臓病のリスク因子の軽減の成功を示す。別の態様においては、心疾患又は心臓病は、肥大性心筋症、リズム及び伝導系障害、冠動脈疾患、不整脈、伝導ブロック、及び弁膜症からなる群より選択される。
【0014】
本発明は、以下のステップを含む、ヒト対象からの生体サンプル中の1又は2以上の糖脂質又はスフィンゴ糖脂質の存在を検出する方法をさらに提供する。
(i)前記ヒト対象から前記生体サンプルを入手し、基質に配置するステップであって、前記基質が、ろ過紙、ろ過器、膜、ビーズ、粒子、有機樹脂、マイクロタイタープレート、及びスライドからなる群より選択されるステップ;(ii) 前記基質に配置された前記生体サンプルを乾燥するステップ;(iii) 前記乾燥した生体サンプルを適切な有機溶媒で抽出するステップ;(iv) 前記抽出した生体サンプルの一部を、前記有機溶媒中に既知の濃度の糖脂質又はスフィンゴ糖脂質を有する標準溶液と共にLC−MSシステムに注入するステップ;(v)前記生体サンプル及び前記標準溶液中の前記糖脂質又はスフィンゴ糖脂質を、適切な溶媒勾配で溶出するステップ;(vi) 前記LC−MSシステムの質量スペクトルから、前記生体サンプル及び前記標準溶液中の糖脂質又はスフィンゴ糖脂質の1又は2以上のピークを得るステップ;(vii) 前記生体サンプル及び前記標準溶液中の糖脂質又はスフィンゴ糖脂質の前記1又は2以上のピークの保持時間に対するピーク面積をプロットして、検量線を作成するステップ;及び(viii) 前記検量線から1又は2以上の糖脂質又はスフィンゴ糖脂質の濃度を計算して、前記生体サンプル中の1又は2以上の糖脂質又はスフィンゴ糖脂質の存在を検出するステップ。
【0015】
本発明の1つの態様において、1又は2以上の糖脂質又はスフィンゴ糖脂質は、グロボトリアオシルセラミド(Gb3)、グロボトリアオシルスフィンゴシン(Lyso−Gb3)、ラクトシルセラミド、ガラクトシルセラミド、グルコシルセラミド、中性糖脂質又はその組み合わせを含む。別の態様において、生体サンプルは、血漿、排泄物、喀痰、膵液、胆汁、リンパ液、血液、尿、脳脊髄液、精液、唾液、乳頭吸引物、及び膿汁からなる群より選択される。特別な態様において、スフィンゴ糖脂質はGb3であり、生体サンプルは尿である。
【0016】
さらに別の実施態様において、本発明に記載のヒト対象の尿サンプル中のグロボトリアオシルセラミド(Gb3)の存在を検出する方法は、以下のステップを含む。前記ヒト対象から前記尿サンプルを入手して、ろ過紙に配置するステップ;前記ろ過紙に配置された前記尿サンプルを乾燥するステップ;前記乾燥した尿サンプルをメタノールで抽出するステップ;前記抽出した尿サンプルの一部を、メタノール中に既知のGb3濃度を含む放射標識された標準溶液と共にLC−MSシステムに注入するステップ;前記尿サンプル及び前記標準溶液中のGb3をメタノール/水勾配で溶出するステップ;前記LC−MSシステムの質量スペクトルから、前記尿サンプル及び前記標準溶液中のGb3の1又は2以上のピークを得るステップ;前記生体サンプル及び前記標準溶液中のGb3の前記1又は2以上のピークの保持時間に対するピーク面積をプロットして、検量線を作成するステップ;及び前記検量線からGb3濃度を計算して、前記尿サンプル中のGb3レベルの存在を検出するステップ。
【0017】
本発明の方法は、尿サンプル中のGb3濃度と正常な閾値とを比較して、心疾患、心臓病、心疾患のリスク因子の存在をスクリーニングするステップをさらに含む。前記正常な閾値は、200ng/mlである。1つの態様において、ヒト対象の尿サンプル中でGb3濃度が200ng/mlを超えることが、心疾患、心臓病、心疾患のリスク因子を示す。別の態様において、心疾患又は心臓病は、肥大性心筋症、リズム及び伝導系障害、冠動脈疾患、不整脈、伝導ブロック、及び弁膜症からなる群より選択される。さらに別の態様において、ヒト対象は、健康なヒト対象、非ファブリー病患者、非ファブリー病心臓病患者、又はファブリー病に対する遺伝的素因を有さない対象である。
【図面の簡単な説明】
【0018】
本発明の特徴及び利点をさらに完全に理解するために、添付の図面と共に発明の詳細な説明を参照する。
【0019】
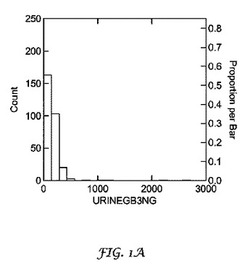
【図1】図1Aは、本発明の研究に参加した心臓病患者から入手可能な全て尿試料におけるGb3の濃度分布を示すグラフである(N=294)。心臓病患者のデータは、ソフトウェアSystatで分析し、カードあたりのGb3をngで示した(尿mL)。図1Bは、図1Aに示す患者のGb3の濃度分布を示すグラフである。濃度分布を明確に示すために、異常値(Gb3>700ng/カード)は除外した。
【図2】図2は、同じ患者群のGb3濃度分布を示す図である。濃度分布を明確に示すために、Gb3<400ng/カードの患者に限定している。
【図3】図3は、正常コントロール群(N=157)のGb3濃度分布を示すグラフである。
【図4】図4は、健康なコントロール(N=157)及び心臓病患者(N=294)のGb3濃度分布を組み合わせた図である。
【発明を実施するための形態】
【0020】
本発明の種々の実施形態の実施及び使用を以下に詳しく論じるが、本発明は、多種多様な特定の状況において具現化され得る多くの適用可能な発明概念を提供することが認識されるべきである。本明細書において論じられる特定の実施形態は、本発明を実施及び使用するための特定の方法を単に説明するだけのものであり、本発明の範囲を定めるものではない。
【0021】
本発明の理解を容易にするために、いくつかの用語を以下に定義する。本明細書において定義されている用語は、本発明に関係のある分野の当業者によって共通に理解されているような意味を有する。「a」、「an」及び「the」などの用語は、単数の物のみに言及することを意図するものではなく、特定の例が説明のために使用され得る一般的なクラスを含む。本明細書における専門用語は、本発明の特定の実施形態を記載するために使用されるが、それらの用法は、特許請求の範囲において概略を述べているもの以外は、本発明の範囲を定めるものではない。
【0022】
本発明は、一般集団(非ファブリー病)における後天的な様々な心臓の障害のリスク因子である、尿中のグロボトリアオシルセラミド(Gb3)レベルの上昇の検出を記載している。尿中Gb3レベルを測定することによって、心疾患のリスクの高い患者をスクリーニングすることを示唆している。本発明者らは、Gb3レベルを低減することが、非ファブリー病の一般集団の心疾患のリスクを低減する方法であることを示唆している。Gb3レベルは、α−ガラクトシダーゼAレベルの低い患者で基質抑制療法又は酵素補充療法として機能する、細胞又は分子中の野生型α−ガラクトシダーゼAのレベルを増加することが知られている薬理シャペロンによって低減することができる。現在は、尿中Gb3レベルの上昇は、ファブリー病と称される遺伝病とだけ関連づけられており、一般的な心臓病集団においては記載されたことがない。
【0023】
Gb3は、ファブリー病で蓄積されるスフィンゴ糖脂質であり、主な原因代謝物であると考えられている。ファブリー病はX染色体に連鎖しており、リソソーム酵素α−ガラクトシダーゼAレベルの不足によって起こり、その結果全ての器官(特に心臓及び腎臓)、及び多くの細胞さらに尿にGb3が蓄積する。この疾患は、特に脳卒中、心疾患(肥大性心筋症、リズム及び伝導系障害、冠動脈疾患、弁の異常等)、及び慢性タンパク尿腎不全のリスクの著しい上昇を伴う。上昇したGb3レベルの原因となっている後天的修飾を修正できる分子(つまり、アセチル化修飾、アミノ酸置換によるリン酸化部位の修飾のHDAC阻害剤)、及び/又はα−ガラクトシダーゼAをコードする遺伝子、Gb3の合成遺伝子、又はGb3シンターゼ(A4GALT)等の前駆体と相互作用することが知られている修飾遺伝子の発現及び/又は機能に影響しうる分子。
【0024】
ファブリー病は稀ではあるが、上記の心合併症、進行性腎疾患及び脳卒中は、一般集団において通常観察されるものと性質的には同じである。グロボトリアオシルスフィンゴシン又はLyso−Gb3も、ファブリー関連原因代謝物となる可能性があり、ファブリー病患者及び心疾患の患者の尿で増加している可能性がある。(2:PNAS, 105(8), 2812-2817)
【0025】
本発明者らは、したがって様々な心臓障害を有する患者の大きな集団に対してファブリー病のスクリーニングを行った。かかる心臓病患者は、尿中Gb3(ファブリー病では上昇することが知られている)、血中α−ガラクトシダーゼ活性及びGLA遺伝子(ファブリー病の遺伝子)のシークエンシングでスクリーニングされる。
【0026】
本発明者らは、心臓疾患の患者は、GLA遺伝子に変異がなくても(ファブリー病患者でなくても)、尿中Gb3のレベルが想定よりも高いことを見い出し、Gb3及びその代謝物が一般的に心臓疾患と関連していることを示唆した。Gb3の異常は、通常よりも低いα−ガラクトシダーゼ活性と、場合によってはGLA遺伝子の非病因性の配列変動(non-disease causing sequence variation)と関連している。器官、組織及び尿中のGb3の上昇と関連している可能性のあるα−ガラクトシダーゼA酵素活性の非遺伝的変異は、以下と関連することができる。(i)翻訳後修飾等の後天的修飾−つまり、原因となっているDNA配列における変化以外のメカニズムによって起こる遺伝子発現における変化−(特にメチル化、ただしアセチル化、ユビキチル化、リン酸化、SUMO化も含む)又は標的プロモータの後天的修飾を介した転写遺伝子発現を調節可能な低分子干渉RNA(siRNA);及び/又は(ii)上位相互作用、リソソーム酵素をコードする遺伝子と相互作用する1又は2以上の別の遺伝子(修飾遺伝子)における遺伝的変異。また、α−ガラクトシダーゼA酵素活性に関連していない未知のメカニズムも役割を果たしているかもしれない。
【0027】
後天的な心臓障害(冠動脈疾患、不整脈、伝導ブロック、及び弁疾患を含む)に罹患した任意抽出の成人患者220人のうち20%以上で、尿中Gb3レベルが上昇していた。正常範囲の上限は、Gb3が200ng/mlであると考えられる。3人の患者の値は、1000以上であった(正常値の上限の5倍以上)。これまでに試験した患者のGb3レベルの上昇は、GLA遺伝子の病因性突然変異とは関連していなかった。心臓病患者と、健康なコントロール集団との尿中Gb3レベル分布を比較すると、心臓病患者の集団と健康なコントロールとは明らかに著しく異なる。
【0028】
尿中グロボトリアオシルセラミドのアッセイ方法
本発明者らは、ろ紙カード上で乾燥した尿中の異なる脂肪酸成分を有するグロボトリアオシルセラミド(Gb3)のアイソフォームの定量に、超高速液体クロマトグラフィ(UPLC)タンデム質量分析(MS/MS)を用いた。5×5cmの表面積のろ紙で乾燥させた1mlの尿を、C17−Gb3を内部標準として用いてメタノールで抽出した。Gb3アイソフォームをクロマトグラフで分離するために、10マイクロリットルをAcquity UPLCに注入した。メタノール/水高速勾配を用いて、C8 BEH、1×50mm、1.7μm UPLCカラム、60℃で、カラム再平衡を含む合計ランタイム3分で行った。多重反応モニタリング転移は、C17−Gb3アイソフォームには、m/z 1060→898であり、m/1046→884、1074→912、1102→940、1128→966、1130→968、1156→994、1158→996、1174→1012が8つの主要なGb3アイソフォームを包含する。Gb3は、エレクトロスプレー陽イオン化法を使用したQuattro Premier MS/MSで分析した。アイソフォームのMRMクロマトグラフィのピーク面積は、尿1mlあたりのGb3ナノグラムを計算するための標準曲線と使用した。
【0029】
研究における心臓病患者の尿試料は、ソフトウェアSystatで分析し、結果は図1Aで示す。カードあたりのGb3をngで示した(1mLの尿)。700ng/mg未満のレベルの患者の結果は、図1B及び表1に示す。
【0030】
【表1】

【0031】
レベルが400ng/mL未満の患者の結果は、図2に示すように表示し、統計分析を表2に示す。
【0032】
【表2】

【0033】
一般集団(N=157)におけるGb3レベルを図3に示す。図4は、心臓病患者集団(N=294)と健康なコントロール群(N=157)から得られた結果を組み合わせて表示している。
【0034】
本明細書中に論じられている任意の実施形態は、任意の方法、キット、試薬又は本発明の組成物に関して実行することができ、その逆もまた同様であることが企図される。その上、本発明の組成物は、本発明の方法を達成するために使用することができる。
【0035】
本明細書に記載されている特定の実施形態は、実例として示されており、本発明の限定として示されているのではないことが理解される。本発明の主な特徴は、本発明の範囲から逸脱することなく、種々の実施形態で用いることができる。当業者であれば、単なる通常の研究手順を使用するだけで、本明細書に記載されている特定の手順に対して非常に多くの相当物を認識するか、又は確認することができる。そのような相当物は、本発明の範囲内であると考えられ、特許請求の範囲によって保護される。
【0036】
本明細書中に記載される全ての出版物、及び特許出願は、本発明の関連する当業者の技術水準を示すものである。全ての出版物及び特許出願は、各出版物及び特許出願が個別に参照により援用されると具体的に記載されていた場合と同様に、参照により援用される。
【0037】
語「a」又は「an」の使用は、特許請求の範囲及び/又は本明細書において、「含む(comprising)」という用語と併せて使用される場合、「1つの(one)」を意味し得るが、「1又は2以上の」、「少なくとも1つの」及び「1又は1を超える」の意味と一致することもある。特許請求の範囲において、「又は」という用語の使用は、本開示が、代替物のみ及び「及び/又は」を指す定義を裏付けるが、代替物のみを指すこと又は代替物が相互に排他的であることを明確に指示されない限り、「及び/又は」を意味するために使用される。本出願全体にわたって、「約」という用語は、デバイスについての誤差の固有変動、値を決定するために用いられる方法の固有変動又は研究課題の中に存在する変動を含む値を示すために使用される。
【0038】
本明細書及び特許請求の範囲において使用される場合、語「含む(comprising)」(並びに「含む(comprise)」及び「含む(comprises)」などのcomprisingの任意の形)、「有する(having)」(並びに「有する(have)」及び「有する(has)」などのhavingの任意の形)、「含む(including)」(並びに「含む(includes)」及び「含む(include)」などのincludingの任意の形)又は「含有する(containing)」(並びに「含有する(contains)」及び「含有する(contain)」などのcontainingの任意の形)は、包括的であるか又は無制限であり、追加の、列挙されていない要素又は方法ステップを除外しない。
【0039】
本明細書に使用されている「又はその組合せ」という用語は、この用語に先立つ掲載品目の全ての順列及び組合せを指す。例えば、「A、B、C又はその組合せ」は、A、B、C、AB、AC、BC又はABCのうちの少なくとも1つを含むことが意図されており、特定の状況において順序が重要である場合には、BA、CA、CB、CBA、BCA、ACB、BAC又はCABのうちからも少なくとも1つを含むことが意図されている。この例を続けると、BB、AAA、MB、BBC、AAABCCCC、CBBAAA、CABABBなどの1又は2以上の品目又は用語の反復を含有する組合せが、明示的に含まれる。当業者であれば、他に状況から明らかでない限り、任意の組合せの中の品目又は用語の数に、典型的に制限は全くないことを理解する。
【0040】
本明細書に開示及び特許請求されている組成物及び/又は方法は全て、本開示に照らし合わせると、不適当な実験をせずに作製及び実行することができる。本発明の組成物及び方法は、好ましい実施形態という言葉で記載されているが、本発明の概念、精神及び範囲から逸脱することなく、改変が、本明細書に記載されている組成物及び/又は方法に並びにステップに又は方法の一連のステップに適用され得ることは、当業者には明らかである。当業者には明らかな、そのような類似の全ての代用例及び変更例が、添付の特許請求の範囲によって定義されている本発明の精神、範囲及び概念の範囲内であるものと見なされる。
【0041】
参考文献
United States Patent No. 7,445,886: Macrophage migration inhibitory factor as a marker for cardiovascular risk.
United States Patent Application No. 20040132688: Plasma glucosylceramide deficiency as risk factor for thrombosis and modulator of anticoagulant protein C.
1 http://www.medicalnewstoday.com/articles/71159.php
2 Johannes M. Aerts, Johanna E. Groener, Sijmen Kuiper, Wilma E. Donker-Koopman Anneke Strijland, Roelof Ottenhoff, Cindy van Roomen, Mina Mirzaian, Frits A. Wijburg, Gabor E. Linthorst, Anouk C. Vedder, Saskia M. Rombach, Josanne Cox-Brinkman, Pentti Somerharju‡, Rolf G. Boot, Carla E. Hollak, Roscoe O. Brady, and Ben J. Poorthuis, (2008), “Elevated globotriaosylsphingosine is a hallmark of Fabry disease”, PNAS, 105(8), 2812-2817.
【技術分野】
【0001】
本発明は、一般に、心疾患マーカーの分野に関し、特に非ファブリー病の心臓病患者における尿中で上昇したグロボトリアオシルセラミド(Gb3)のレベルの検出に関する。
【背景技術】
【0002】
本発明の範囲を限定することなく、本発明の背景を、心疾患マーカー、及び体液中のGb3及び他の糖脂質マーカーの検出方法に関連して記載する。
【0003】
Grior et al. に発行された米国特許第7,445,886号明細書(2008)は、心臓血管系リスクの臨床的に有用な生化学的マーカーであるマクロファージ遊走阻止因子(MIF)の試験を開示している。リスク評価は、ヒトの血中におけるMIF濃度をそのヒトの心臓血管系リスクのマーカーとして検出するステップを含む。‘886特許の方法は、さらにMIF濃度と比例した心臓血管系リスク測定基準をヒトに与える(assign)するステップ、及び/又はMIF濃度にしたがった心臓血管系治療法を処方するステップを含んでもよい。前記方法は、初期スクリーニングとして有用であり、ストレステスト、CRPアッセイ、LDLアッセイ等の追加のテストと併用して、若しくはそれに代用して使用することができる。検出ステップは、経時的及び/又は治療中のヒトの心臓血管系リスクの変化をモニターするに、一定期間内/治療中に繰り返すことができる。
【0004】
米国特許出願番号第20040132688号(Griffin, et al, 2003)は、血栓症のリスク因子及び抗凝固プロテインCのモジュレーターとして血漿グルコシルセラミド欠乏症に関している。Griffinによれば、体外から添加されたグルコシルセラミド(GlcCer)及び同種のGlc含有グロボトリアオシルセラミド(Gb3Cer)等の他の中性糖脂質は、用量依存的にAPC:プロテインSの存在下で正常な血漿の凝固時間を延長し(不在下では延長しなかった)、GlcCer又はGb3Cerが、プロテインC経路抗凝固活性を亢進することができることを示した。精製されたタンパク質を用いた研究では、APC:プロテインSによる因子Vaの不活性化は、GlcCer単独又はGlcCer、グロボトリアオシルセラミド、ラクトシルセラミド及びガラクトシルセラミドによって、ホルファチジルセリン及びホスファチジルコリンを含む多成分小胞において増強された。したがって、Griffinの発明は、プロテインC経路の抗血栓作用に寄与する抗凝固補因子としてGlcCer及びGb3Cer等の中性糖脂質を提供する。Griffinの発明は、血漿GlcCerの欠損は、血栓症のリスク因子であると記載している。個人における血栓症のリスクを判定する方法、その治療方法、及び中性糖脂質から抗血栓因子をスクリーニングする方法が提供されている。
【先行技術文献】
【特許文献】
【0005】
【特許文献1】米国特許第7,445,886号明細書
【特許文献2】米国特許出願番号第20040132688号
【発明の概要】
【0006】
本発明は、一般集団における心疾患のリスク因子である、尿中グロボトリアオシルセラミド(Gb3)の上昇を判定する方法を記載している。尿中のGb3レベルは、心疾患のマーカーとしての機能を果たす。本発明の方法は、心リスクのスクリーニング方法を提供し、Gb3濃度が低いことが、心疾患の治療及びリスク管理に有益であることを示唆している。
【0007】
本発明の1つの実施態様は、以下のステップを含む、尿サンプルにおけるグロボトリアオシルセラミド(Gb3)レベルを計算して、ヒト対象における心疾患、心臓病、又は心疾患のリスク因子の存在をスクリーニングする方法を提供している。
(i)前記ヒト対象から前記尿サンプルを入手し、ろ過紙に配置するステップ;(ii) 前記ろ過紙に配置した前記尿サンプルを乾燥するステップ;(iii) 前記乾燥した尿サンプルをメタノールで抽出するステップ;(iv) 前記抽出した尿サンプルの一部を、メタノール中に既知のGb3濃度を含む放射標識された標準溶液と共にLC−MSシステムに注入するステップ;(v)前記尿サンプル及び前記標準溶液中のGb3をメタノール/水勾配で溶出するステップ;(vi) 前記LC−MSシステムの質量スペクトルから、前記尿サンプル及び前記標準溶液中のGb3の1又は2以上のピークを入手するステップ;(vii) 前記生体サンプル及び前記標準溶液中のGb3の前記1又は2以上のピークの保持時間に対するピーク面積をプロットして、検量線を作成するステップ;(viii)前記検量線から前記尿サンプル中のGb3レベルを計算するステップ;及び(ix) 前記尿サンプル中のGb3のレベルが、正常な閾値を超える場合に、心疾患、心臓病、又は心疾患のリスク因子の存在を判定するステップであって、前記正常な閾値が200ng/mlであるステップ。
【0008】
本発明の方法は、さらに、尿サンプル中のGb3レベルと正常な閾値との比較に基づいて、ヒト対象に心臓血管系リスク測定基準を与える、又は治療計画を処方するステップであって、前記心臓血管系リスクが、前記ヒト対象の尿サンプル中のGb3のレベルに比例するステップを含む。1つの態様において、心疾患又は心臓病は、肥大性心筋症、リズム及び伝導系障害、冠動脈疾患、不整脈、伝導ブロック、及び弁膜症からなる群より選択される。別の態様において、ヒト対象は、健康なヒト対象、非ファブリー病患者、非ファブリー病心臓病患者、又はファブリー病に対する遺伝的素因を有さない対象である。
【0009】
別の実施態様では、本発明は、グロボトリアオシルセラミド(Gb3)のレベルを低減させることによって、ヒト対象における心疾患、心臓病を治療、又は心臓病のリスク因子を軽減する、活性薬理学的又は化学的シャペロン及び1又は2以上の任意の薬学的に許容される賦形剤医薬組成物を記載する。前記活性薬理学的又は化学的シャペロンは、1−デオキシガラクトノジリマイシン(DGJ)、1−デオキシガラクトノジリマイシン塩及び誘導体、イミノ糖及び誘導体、デオキシアザ糖及び誘導体、カリステギンアルカロイド及び誘導体、イソファゴミン、ファゴミン異性体、コンズリトールCエポキシド、ノルトロパンアルカロイド、4−フェニルブチレート、ミガラスタット塩酸塩、基質還元治療に使用される分子(1:http://www.medicalnewstoday.com/articles/71159.php)、上昇したGb3レベルと関連する根本的な後成的修飾を修正するために使用される分子(すなわち、アセチル化修飾、アミノ酸置換によるリン酸化部位の修飾のHDAC阻害剤)、及びα―ガラクトシダーゼAをコードする遺伝子又はGb3の合成遺伝子若しくはGb3シンターゼ等のその前駆体、又はその組み合わせと相互作用する1又は2以上の修飾遺伝子の発現又は機能に影響する分子を含む。
【0010】
本発明の1つの態様において、心疾患又は心臓病は、肥大性心筋症、リズム及び伝導系障害、冠動脈疾患、不整脈、伝導ブロック、及び弁膜症からなる群より選択される。別の1つの態様において、ヒト対象は、健康なヒト対象、非ファブリー病患者、非ファブリー病心臓病患者、又はファブリー病に対する遺伝的素因を有さない対象である。
【0011】
本発明はさらに、以下のステップを含む、ヒト対象における心疾患、心臓病を治療、又は心臓病のリスク因子を軽減する方法を提供する。心疾患、心臓病に対する治療、又は心疾患のリスク因子の軽減を必要とするヒト対象を同定するステップ;活性薬理学的又は化学的シャペロン及び1又は2以上の任意の薬学的に許容される賦形剤を含む薬学的組成物を心疾患、心臓病を治療又は心疾患のリスク因子を軽減するために十分な濃度で投与するステップであって、前記薬理学的又は化学的シャペロンが、1−デオキシガラクトノジリマイシン(DGJ)、1−デオキシガラクトノジリマイシン塩及び誘導体、イミノ糖及び誘導体、デオキシアザ糖及び誘導体、カリステギンアルカロイド及び誘導体、イソファゴミン、ファゴミン異性体、コンズリトールCエポキシド、ノルトロパンアルカロイド、4−フェニルブチレート、ミガラスタット塩酸塩、基質還元治療に使用される分子(1:http://www.medicalnewstoday.com/articles/71159.php)、上昇したGb3レベルと関連する根本的な後成的修飾を修正するために使用される分子(すなわち、アセチル化修飾、アミノ酸置換によるリン酸化部位の修飾のHDAC阻害剤)、α―ガラクトシダーゼAをコードする遺伝子又はGb3若しくはGb3シンターゼ(A4GALT)等の前駆体の合成遺伝子、若しくはその組み合わせと相互作用する1又は2以上の修飾遺伝子の発現及び/又は機能に影響する分子を含むステップ。本発明の方法は、さらに、ヒト対象の尿サンプル中のグロボトリアオシルセラミド(Gb3)のレベルを測定して、心疾患、心臓病の治療又は心臓病のリスク因子の軽減の進展をモニターするステップを含む。
【0012】
本発明の1つの態様において、尿サンプル中のGb3レベルが200ng/ml以下であることが、心疾患又は心臓病の治療の成功、又は心臓病のリスク因子の軽減の成功を示す。別の態様において、心疾患又は心臓病は、肥大性心筋症、リズム及び伝導系障害、冠動脈疾患、不整脈、伝導ブロック、及び弁膜症からなる群より選択される。さらに別の態様において、ヒト対象は、健康なヒト対象、非ファブリー病患者、非ファブリー病心臓病患者、又はファブリー病に対する遺伝的素因を有さない対象である。
【0013】
1つの実施態様において、本発明は、以下のステップを含む、ヒト対象における心疾患又は心臓病を治療、又は心臓病のリスク因子を軽減する方法を提供する。心疾患、心臓病に対する治療、又は心疾患のリスク因子の軽減を必要とするヒト対象を同定するステップ;及びミガラスタット塩酸塩と1又は2以上の任意の薬学的に許容される賦形剤との組成物を心疾患、心臓病を治療又は心疾患のリスク因子を軽減するために十分な濃度で投与するステップ。本発明の方法は、さらに、ヒト対象からの尿サンプル中のグロボトリアオシルセラミド(Gb3)のレベルを測定して、心疾患、心臓病の治療又は心疾患のリスク因子の軽減の進展をモニターするステップを含む。本発明の1つの態様において、尿サンプル中のGb3レベルが200ng/ml以下であることが、心疾患又は心臓病の治療の成功、又は心臓病のリスク因子の軽減の成功を示す。別の態様においては、心疾患又は心臓病は、肥大性心筋症、リズム及び伝導系障害、冠動脈疾患、不整脈、伝導ブロック、及び弁膜症からなる群より選択される。
【0014】
本発明は、以下のステップを含む、ヒト対象からの生体サンプル中の1又は2以上の糖脂質又はスフィンゴ糖脂質の存在を検出する方法をさらに提供する。
(i)前記ヒト対象から前記生体サンプルを入手し、基質に配置するステップであって、前記基質が、ろ過紙、ろ過器、膜、ビーズ、粒子、有機樹脂、マイクロタイタープレート、及びスライドからなる群より選択されるステップ;(ii) 前記基質に配置された前記生体サンプルを乾燥するステップ;(iii) 前記乾燥した生体サンプルを適切な有機溶媒で抽出するステップ;(iv) 前記抽出した生体サンプルの一部を、前記有機溶媒中に既知の濃度の糖脂質又はスフィンゴ糖脂質を有する標準溶液と共にLC−MSシステムに注入するステップ;(v)前記生体サンプル及び前記標準溶液中の前記糖脂質又はスフィンゴ糖脂質を、適切な溶媒勾配で溶出するステップ;(vi) 前記LC−MSシステムの質量スペクトルから、前記生体サンプル及び前記標準溶液中の糖脂質又はスフィンゴ糖脂質の1又は2以上のピークを得るステップ;(vii) 前記生体サンプル及び前記標準溶液中の糖脂質又はスフィンゴ糖脂質の前記1又は2以上のピークの保持時間に対するピーク面積をプロットして、検量線を作成するステップ;及び(viii) 前記検量線から1又は2以上の糖脂質又はスフィンゴ糖脂質の濃度を計算して、前記生体サンプル中の1又は2以上の糖脂質又はスフィンゴ糖脂質の存在を検出するステップ。
【0015】
本発明の1つの態様において、1又は2以上の糖脂質又はスフィンゴ糖脂質は、グロボトリアオシルセラミド(Gb3)、グロボトリアオシルスフィンゴシン(Lyso−Gb3)、ラクトシルセラミド、ガラクトシルセラミド、グルコシルセラミド、中性糖脂質又はその組み合わせを含む。別の態様において、生体サンプルは、血漿、排泄物、喀痰、膵液、胆汁、リンパ液、血液、尿、脳脊髄液、精液、唾液、乳頭吸引物、及び膿汁からなる群より選択される。特別な態様において、スフィンゴ糖脂質はGb3であり、生体サンプルは尿である。
【0016】
さらに別の実施態様において、本発明に記載のヒト対象の尿サンプル中のグロボトリアオシルセラミド(Gb3)の存在を検出する方法は、以下のステップを含む。前記ヒト対象から前記尿サンプルを入手して、ろ過紙に配置するステップ;前記ろ過紙に配置された前記尿サンプルを乾燥するステップ;前記乾燥した尿サンプルをメタノールで抽出するステップ;前記抽出した尿サンプルの一部を、メタノール中に既知のGb3濃度を含む放射標識された標準溶液と共にLC−MSシステムに注入するステップ;前記尿サンプル及び前記標準溶液中のGb3をメタノール/水勾配で溶出するステップ;前記LC−MSシステムの質量スペクトルから、前記尿サンプル及び前記標準溶液中のGb3の1又は2以上のピークを得るステップ;前記生体サンプル及び前記標準溶液中のGb3の前記1又は2以上のピークの保持時間に対するピーク面積をプロットして、検量線を作成するステップ;及び前記検量線からGb3濃度を計算して、前記尿サンプル中のGb3レベルの存在を検出するステップ。
【0017】
本発明の方法は、尿サンプル中のGb3濃度と正常な閾値とを比較して、心疾患、心臓病、心疾患のリスク因子の存在をスクリーニングするステップをさらに含む。前記正常な閾値は、200ng/mlである。1つの態様において、ヒト対象の尿サンプル中でGb3濃度が200ng/mlを超えることが、心疾患、心臓病、心疾患のリスク因子を示す。別の態様において、心疾患又は心臓病は、肥大性心筋症、リズム及び伝導系障害、冠動脈疾患、不整脈、伝導ブロック、及び弁膜症からなる群より選択される。さらに別の態様において、ヒト対象は、健康なヒト対象、非ファブリー病患者、非ファブリー病心臓病患者、又はファブリー病に対する遺伝的素因を有さない対象である。
【図面の簡単な説明】
【0018】
本発明の特徴及び利点をさらに完全に理解するために、添付の図面と共に発明の詳細な説明を参照する。
【0019】
【図1】図1Aは、本発明の研究に参加した心臓病患者から入手可能な全て尿試料におけるGb3の濃度分布を示すグラフである(N=294)。心臓病患者のデータは、ソフトウェアSystatで分析し、カードあたりのGb3をngで示した(尿mL)。図1Bは、図1Aに示す患者のGb3の濃度分布を示すグラフである。濃度分布を明確に示すために、異常値(Gb3>700ng/カード)は除外した。
【図2】図2は、同じ患者群のGb3濃度分布を示す図である。濃度分布を明確に示すために、Gb3<400ng/カードの患者に限定している。
【図3】図3は、正常コントロール群(N=157)のGb3濃度分布を示すグラフである。
【図4】図4は、健康なコントロール(N=157)及び心臓病患者(N=294)のGb3濃度分布を組み合わせた図である。
【発明を実施するための形態】
【0020】
本発明の種々の実施形態の実施及び使用を以下に詳しく論じるが、本発明は、多種多様な特定の状況において具現化され得る多くの適用可能な発明概念を提供することが認識されるべきである。本明細書において論じられる特定の実施形態は、本発明を実施及び使用するための特定の方法を単に説明するだけのものであり、本発明の範囲を定めるものではない。
【0021】
本発明の理解を容易にするために、いくつかの用語を以下に定義する。本明細書において定義されている用語は、本発明に関係のある分野の当業者によって共通に理解されているような意味を有する。「a」、「an」及び「the」などの用語は、単数の物のみに言及することを意図するものではなく、特定の例が説明のために使用され得る一般的なクラスを含む。本明細書における専門用語は、本発明の特定の実施形態を記載するために使用されるが、それらの用法は、特許請求の範囲において概略を述べているもの以外は、本発明の範囲を定めるものではない。
【0022】
本発明は、一般集団(非ファブリー病)における後天的な様々な心臓の障害のリスク因子である、尿中のグロボトリアオシルセラミド(Gb3)レベルの上昇の検出を記載している。尿中Gb3レベルを測定することによって、心疾患のリスクの高い患者をスクリーニングすることを示唆している。本発明者らは、Gb3レベルを低減することが、非ファブリー病の一般集団の心疾患のリスクを低減する方法であることを示唆している。Gb3レベルは、α−ガラクトシダーゼAレベルの低い患者で基質抑制療法又は酵素補充療法として機能する、細胞又は分子中の野生型α−ガラクトシダーゼAのレベルを増加することが知られている薬理シャペロンによって低減することができる。現在は、尿中Gb3レベルの上昇は、ファブリー病と称される遺伝病とだけ関連づけられており、一般的な心臓病集団においては記載されたことがない。
【0023】
Gb3は、ファブリー病で蓄積されるスフィンゴ糖脂質であり、主な原因代謝物であると考えられている。ファブリー病はX染色体に連鎖しており、リソソーム酵素α−ガラクトシダーゼAレベルの不足によって起こり、その結果全ての器官(特に心臓及び腎臓)、及び多くの細胞さらに尿にGb3が蓄積する。この疾患は、特に脳卒中、心疾患(肥大性心筋症、リズム及び伝導系障害、冠動脈疾患、弁の異常等)、及び慢性タンパク尿腎不全のリスクの著しい上昇を伴う。上昇したGb3レベルの原因となっている後天的修飾を修正できる分子(つまり、アセチル化修飾、アミノ酸置換によるリン酸化部位の修飾のHDAC阻害剤)、及び/又はα−ガラクトシダーゼAをコードする遺伝子、Gb3の合成遺伝子、又はGb3シンターゼ(A4GALT)等の前駆体と相互作用することが知られている修飾遺伝子の発現及び/又は機能に影響しうる分子。
【0024】
ファブリー病は稀ではあるが、上記の心合併症、進行性腎疾患及び脳卒中は、一般集団において通常観察されるものと性質的には同じである。グロボトリアオシルスフィンゴシン又はLyso−Gb3も、ファブリー関連原因代謝物となる可能性があり、ファブリー病患者及び心疾患の患者の尿で増加している可能性がある。(2:PNAS, 105(8), 2812-2817)
【0025】
本発明者らは、したがって様々な心臓障害を有する患者の大きな集団に対してファブリー病のスクリーニングを行った。かかる心臓病患者は、尿中Gb3(ファブリー病では上昇することが知られている)、血中α−ガラクトシダーゼ活性及びGLA遺伝子(ファブリー病の遺伝子)のシークエンシングでスクリーニングされる。
【0026】
本発明者らは、心臓疾患の患者は、GLA遺伝子に変異がなくても(ファブリー病患者でなくても)、尿中Gb3のレベルが想定よりも高いことを見い出し、Gb3及びその代謝物が一般的に心臓疾患と関連していることを示唆した。Gb3の異常は、通常よりも低いα−ガラクトシダーゼ活性と、場合によってはGLA遺伝子の非病因性の配列変動(non-disease causing sequence variation)と関連している。器官、組織及び尿中のGb3の上昇と関連している可能性のあるα−ガラクトシダーゼA酵素活性の非遺伝的変異は、以下と関連することができる。(i)翻訳後修飾等の後天的修飾−つまり、原因となっているDNA配列における変化以外のメカニズムによって起こる遺伝子発現における変化−(特にメチル化、ただしアセチル化、ユビキチル化、リン酸化、SUMO化も含む)又は標的プロモータの後天的修飾を介した転写遺伝子発現を調節可能な低分子干渉RNA(siRNA);及び/又は(ii)上位相互作用、リソソーム酵素をコードする遺伝子と相互作用する1又は2以上の別の遺伝子(修飾遺伝子)における遺伝的変異。また、α−ガラクトシダーゼA酵素活性に関連していない未知のメカニズムも役割を果たしているかもしれない。
【0027】
後天的な心臓障害(冠動脈疾患、不整脈、伝導ブロック、及び弁疾患を含む)に罹患した任意抽出の成人患者220人のうち20%以上で、尿中Gb3レベルが上昇していた。正常範囲の上限は、Gb3が200ng/mlであると考えられる。3人の患者の値は、1000以上であった(正常値の上限の5倍以上)。これまでに試験した患者のGb3レベルの上昇は、GLA遺伝子の病因性突然変異とは関連していなかった。心臓病患者と、健康なコントロール集団との尿中Gb3レベル分布を比較すると、心臓病患者の集団と健康なコントロールとは明らかに著しく異なる。
【0028】
尿中グロボトリアオシルセラミドのアッセイ方法
本発明者らは、ろ紙カード上で乾燥した尿中の異なる脂肪酸成分を有するグロボトリアオシルセラミド(Gb3)のアイソフォームの定量に、超高速液体クロマトグラフィ(UPLC)タンデム質量分析(MS/MS)を用いた。5×5cmの表面積のろ紙で乾燥させた1mlの尿を、C17−Gb3を内部標準として用いてメタノールで抽出した。Gb3アイソフォームをクロマトグラフで分離するために、10マイクロリットルをAcquity UPLCに注入した。メタノール/水高速勾配を用いて、C8 BEH、1×50mm、1.7μm UPLCカラム、60℃で、カラム再平衡を含む合計ランタイム3分で行った。多重反応モニタリング転移は、C17−Gb3アイソフォームには、m/z 1060→898であり、m/1046→884、1074→912、1102→940、1128→966、1130→968、1156→994、1158→996、1174→1012が8つの主要なGb3アイソフォームを包含する。Gb3は、エレクトロスプレー陽イオン化法を使用したQuattro Premier MS/MSで分析した。アイソフォームのMRMクロマトグラフィのピーク面積は、尿1mlあたりのGb3ナノグラムを計算するための標準曲線と使用した。
【0029】
研究における心臓病患者の尿試料は、ソフトウェアSystatで分析し、結果は図1Aで示す。カードあたりのGb3をngで示した(1mLの尿)。700ng/mg未満のレベルの患者の結果は、図1B及び表1に示す。
【0030】
【表1】

【0031】
レベルが400ng/mL未満の患者の結果は、図2に示すように表示し、統計分析を表2に示す。
【0032】
【表2】

【0033】
一般集団(N=157)におけるGb3レベルを図3に示す。図4は、心臓病患者集団(N=294)と健康なコントロール群(N=157)から得られた結果を組み合わせて表示している。
【0034】
本明細書中に論じられている任意の実施形態は、任意の方法、キット、試薬又は本発明の組成物に関して実行することができ、その逆もまた同様であることが企図される。その上、本発明の組成物は、本発明の方法を達成するために使用することができる。
【0035】
本明細書に記載されている特定の実施形態は、実例として示されており、本発明の限定として示されているのではないことが理解される。本発明の主な特徴は、本発明の範囲から逸脱することなく、種々の実施形態で用いることができる。当業者であれば、単なる通常の研究手順を使用するだけで、本明細書に記載されている特定の手順に対して非常に多くの相当物を認識するか、又は確認することができる。そのような相当物は、本発明の範囲内であると考えられ、特許請求の範囲によって保護される。
【0036】
本明細書中に記載される全ての出版物、及び特許出願は、本発明の関連する当業者の技術水準を示すものである。全ての出版物及び特許出願は、各出版物及び特許出願が個別に参照により援用されると具体的に記載されていた場合と同様に、参照により援用される。
【0037】
語「a」又は「an」の使用は、特許請求の範囲及び/又は本明細書において、「含む(comprising)」という用語と併せて使用される場合、「1つの(one)」を意味し得るが、「1又は2以上の」、「少なくとも1つの」及び「1又は1を超える」の意味と一致することもある。特許請求の範囲において、「又は」という用語の使用は、本開示が、代替物のみ及び「及び/又は」を指す定義を裏付けるが、代替物のみを指すこと又は代替物が相互に排他的であることを明確に指示されない限り、「及び/又は」を意味するために使用される。本出願全体にわたって、「約」という用語は、デバイスについての誤差の固有変動、値を決定するために用いられる方法の固有変動又は研究課題の中に存在する変動を含む値を示すために使用される。
【0038】
本明細書及び特許請求の範囲において使用される場合、語「含む(comprising)」(並びに「含む(comprise)」及び「含む(comprises)」などのcomprisingの任意の形)、「有する(having)」(並びに「有する(have)」及び「有する(has)」などのhavingの任意の形)、「含む(including)」(並びに「含む(includes)」及び「含む(include)」などのincludingの任意の形)又は「含有する(containing)」(並びに「含有する(contains)」及び「含有する(contain)」などのcontainingの任意の形)は、包括的であるか又は無制限であり、追加の、列挙されていない要素又は方法ステップを除外しない。
【0039】
本明細書に使用されている「又はその組合せ」という用語は、この用語に先立つ掲載品目の全ての順列及び組合せを指す。例えば、「A、B、C又はその組合せ」は、A、B、C、AB、AC、BC又はABCのうちの少なくとも1つを含むことが意図されており、特定の状況において順序が重要である場合には、BA、CA、CB、CBA、BCA、ACB、BAC又はCABのうちからも少なくとも1つを含むことが意図されている。この例を続けると、BB、AAA、MB、BBC、AAABCCCC、CBBAAA、CABABBなどの1又は2以上の品目又は用語の反復を含有する組合せが、明示的に含まれる。当業者であれば、他に状況から明らかでない限り、任意の組合せの中の品目又は用語の数に、典型的に制限は全くないことを理解する。
【0040】
本明細書に開示及び特許請求されている組成物及び/又は方法は全て、本開示に照らし合わせると、不適当な実験をせずに作製及び実行することができる。本発明の組成物及び方法は、好ましい実施形態という言葉で記載されているが、本発明の概念、精神及び範囲から逸脱することなく、改変が、本明細書に記載されている組成物及び/又は方法に並びにステップに又は方法の一連のステップに適用され得ることは、当業者には明らかである。当業者には明らかな、そのような類似の全ての代用例及び変更例が、添付の特許請求の範囲によって定義されている本発明の精神、範囲及び概念の範囲内であるものと見なされる。
【0041】
参考文献
United States Patent No. 7,445,886: Macrophage migration inhibitory factor as a marker for cardiovascular risk.
United States Patent Application No. 20040132688: Plasma glucosylceramide deficiency as risk factor for thrombosis and modulator of anticoagulant protein C.
1 http://www.medicalnewstoday.com/articles/71159.php
2 Johannes M. Aerts, Johanna E. Groener, Sijmen Kuiper, Wilma E. Donker-Koopman Anneke Strijland, Roelof Ottenhoff, Cindy van Roomen, Mina Mirzaian, Frits A. Wijburg, Gabor E. Linthorst, Anouk C. Vedder, Saskia M. Rombach, Josanne Cox-Brinkman, Pentti Somerharju‡, Rolf G. Boot, Carla E. Hollak, Roscoe O. Brady, and Ben J. Poorthuis, (2008), “Elevated globotriaosylsphingosine is a hallmark of Fabry disease”, PNAS, 105(8), 2812-2817.
【特許請求の範囲】
【請求項1】
以下のステップを含む、尿サンプル中のグロボトリアオシルセラミド(Gb3)レベルを計算して、ヒト対象における心疾患、心臓病、又は心疾患のリスク因子の存在をスクリーニングする方法:
前記ヒト対象から前記尿サンプルを入手し、ろ過紙に配置するステップ;
前記ろ過紙に配置した前記尿サンプルを乾燥するステップ;
前記乾燥した尿サンプルをメタノールで抽出するステップ;
前記抽出した尿サンプルの一部を、メタノール中に既知のGb3濃度を含む放射標識された標準溶液と共にLC−MSシステムに注入するステップ;
前記尿サンプル及び前記標準溶液中のGb3をメタノール/水勾配で溶出するステップ;
前記LC−MSシステムの質量スペクトルから、前記尿サンプル及び前記標準溶液中のGb3の1又は2以上のピークを入手するステップ;
前記生体サンプル及び前記標準溶液中のGb3の前記1又は2以上のピークの保持時間に対するピーク面積をプロットして、検量線を作成するステップ;
前記検量線から前記尿サンプル中のGb3レベルを計算するステップ;及び
前記尿サンプル中のGb3のレベルが、正常な閾値を超える場合に、心疾患、心臓病、又は心疾患のリスク因子の存在を判定するステップであって、前記正常な閾値が200ng/mlであるステップ。
【請求項2】
尿中サンプル中のGb3レベルと正常な閾値との比較に基づいて、ヒト対象に、心臓血管系リスク測定基準を与える、又は治療計画を処方するステップをさらに含む、請求項1に記載の方法。
【請求項3】
心臓血管系リスク測定基準が、ヒト対象の尿サンプル中のGb3のレベルに比例する、請求項2に記載の方法。
【請求項4】
心疾患又は心臓病が、肥大性心筋症、リズム及び伝導系障害、冠動脈疾患、不整脈、伝導ブロック、及び弁膜症からなる群より選択される、請求項1に記載の方法。
【請求項5】
ヒト対象が、健康なヒト対象、非ファブリー病患者、非ファブリー病の心臓病患患者、又はファブリー病に対する遺伝的素因を有さない対象である、請求項1に記載の方法。
【請求項6】
活性薬理学的又は化学的シャペロン及び
1又は2以上の任意の薬学的に許容される賦形剤を含む、グロボトリアオシルセラミド(Gb3)のレベルを低減させることによってヒト対象における心疾患、心臓病を治療、又は心臓病のリスク因子を軽減するための薬学的組成物であって、
前記活性薬理学的又は化学的シャペロンが、1−デオキシガラクトノジリマイシン(DGJ)、1−デオキシガラクトノジリマイシン塩及び誘導体、イミノ糖及び誘導体、デオキシアザ糖及び誘導体、カリステギンアルカロイド及び誘導体、イソファゴミン、ファゴミン異性体、コンズリトールCエポキシド、ノルトロパンアルカロイド、4−フェニルブチレート、ミガラスタット塩酸塩、基質還元治療に使用される分子、上昇したGb3レベルと関連する根本的な後成的修飾を修正するために使用される分子、及びα―ガラクトシダーゼAをコードする遺伝子又はGb3の合成遺伝子若しくはその前駆体、又はその組み合わせと相互作用する1又は2以上の修飾遺伝子の発現又は機能に影響する分子を含む、薬学的組成物。
【請求項7】
心疾患又は心臓病が、肥大性心筋症、リズム及び伝導系障害、冠動脈疾患、不整脈、伝導ブロック、及び弁膜症からなる群より選択される、請求項6に記載の組成物。
【請求項8】
ヒト対象が、健康なヒト対象、非ファブリー病患者、非ファブリー病心臓病患者、又はファブリー病に対する遺伝的素因を有さない対象である、請求項6に記載の組成物。
【請求項9】
以下のステップを含む、ヒト対象における心疾患又は心臓病を治療、又は心臓病のリスク因子を軽減する方法:
心疾患、心臓病に対する治療、又は心疾患のリスク因子の軽減を必要とするヒト対象を同定するステップ;
活性薬理学的又は化学的シャペロンと、1又は2以上の任意の薬学的に許容される賦形剤とを含む薬学的組成物を心臓病を治療又は心疾患のリスク因子を軽減するために十分な濃度で投与するステップであって、
前記活性薬理学的又は化学的シャペロンが、1−デオキシガラクトノジリマイシン(DGJ)、1−デオキシガラクトノジリマイシン塩及び誘導体、イミノ糖及び誘導体、デオキシアザ糖及び誘導体、カリステギンアルカロイド及び誘導体、イソファゴミン、ファゴミン異性体、コンズリトールCエポキシド、ノルトロパンアルカロイド、4−フェニルブチレート、ミガラスタット塩酸塩、β−グルコセレブロシダーゼ及びアナログ、基質還元治療に使用される分子、上昇したGb3レベルと関連する根本的な後成的修飾を修正するために使用される分子、α―ガラクトシダーゼAをコードする遺伝子、Gb3の合成遺伝子若しくはその前駆体、又はその組み合わせと相互作用する1又は2以上の修飾遺伝子の発現又は機能に影響する分子を含むステップ。
【請求項10】
ヒト対象の尿サンプル中のグロボトリアオシルセラミド(Gb3)のレベルを測定することによって、心疾患、心臓病の治療、又は心臓病のリスク因子の軽減の進展をモニターするステップをさらに含む、請求項9に記載の方法。
【請求項11】
尿サンプル中のGb3レベルが200ng/ml以下であることが、心疾患又は心臓病の治療の成功、又は心臓病のリスク因子の軽減の成功を示す、請求項9に記載の方法。
【請求項12】
心疾患又は心臓病が、肥大性心筋症、リズム及び伝導系障害、冠動脈疾患、不整脈、伝導ブロック、及び弁膜症からなる群より選択される、請求項9に記載の方法。
【請求項13】
ヒト対象が、健康なヒト対象、非ファブリー病患者、非ファブリー病心臓病患者、又はファブリー病に対する遺伝的素因を有さない対象である、請求項9に記載の方法。
【請求項14】
以下のステップを含む、ヒト対象における心疾患又は心臓病を治療、又は心臓病のリスク因子を軽減する方法:
心疾患、心臓病に対する治療、又は心疾患のリスク因子の軽減を必要とするヒト対象を同定するステップ;及び
ミガラスタット塩酸塩と、1又は2以上の任意の薬学的に許容される賦形剤との組成物を心疾患、心臓病を治療又は心疾患のリスク因子を軽減するために十分な濃度で投与するステップ。
【請求項15】
ヒト対象の尿サンプル中のグロボトリアオシルセラミド(Gb3)のレベルを測定して、心疾患、心臓病の治療又は心臓病のリスク因子の軽減の進展をモニターするステップをさらに含む、請求項14に記載の方法。
【請求項16】
尿サンプル中のGb3レベルが200ng/ml以下であることが、心疾患又は心臓病の治療の成功、又は心臓病のリスク因子の軽減の成功を示す、請求項15に記載の方法。
【請求項17】
心疾患又は心臓病が、肥大性心筋症、リズム及び伝導系障害、冠動脈疾患、不整脈、伝導ブロック、及び弁膜症からなる群より選択される、請求項14に記載の方法。
【請求項18】
以下のステップを含む、ヒト対象の生体サンプル中の1又は2以上の糖脂質又はスフィンゴ糖脂質の存在を検出する方法:
前記ヒト対象から前記生体サンプルを入手し、基質に配置するステップであって、前記基質が、ろ過紙、ろ過器、膜、ビーズ、粒子、有機樹脂、マイクロタイタープレート、及びスライドからなる群より選択されるステップ;
前記基質に配置された前記生体サンプルを乾燥するステップ;
前記乾燥した生体サンプルを適切な有機溶媒で抽出するステップ;
前記抽出した生体サンプルの一部を、前記有機溶媒中に既知の濃度の糖脂質又はスフィンゴ糖脂質を有する標準溶液と共にLC−MSシステムに注入するステップ;
前記生体サンプル及び前記標準溶液中の前記糖脂質又はスフィンゴ糖脂質を、適切な溶媒勾配で溶出するステップ;
前記LC−MSシステムの質量スペクトルから、前記生体サンプル及び前記標準溶液中の糖脂質又はスフィンゴ糖脂質の1又は2以上のピークを得るステップ;
前記生体サンプル及び前記標準溶液中の糖脂質又はスフィンゴ糖脂質の前記1又は2以上のピークの保持時間に対するピーク面積をプロットして、検量線を作成するステップ;
前記検量線から1又は2以上の糖脂質又はスフィンゴ糖脂質の濃度を計算して、前記生体サンプル中の1又は2以上の糖脂質又はスフィンゴ糖脂質の存在を検出するステップ。
【請求項19】
1又は2以上の糖脂質又はスフィンゴ糖脂質が、グロボトリアオシルセラミド(Gb3)、グロボトリアオシルスフィンゴシン(Lyso−Gb3)、ラクトシルセラミド、ガラクトシルセラミド、グルコシルセラミド、中性糖脂質又はその組み合わせを含む、請求項18に記載の方法。
【請求項20】
スフィンゴ糖脂質が、Gb3である、請求項18に記載の方法。
【請求項21】
生体サンプルが、血漿、排泄物、喀痰、膵液、胆汁、リンパ液、血液、尿、脳脊髄液、精液、唾液、乳頭吸引物、及び膿汁からなる群より選択される、請求項18に記載の方法。
【請求項22】
生体サンプルが、尿である、請求項18に記載の方法。
【請求項23】
以下のステップを含む、ヒト対象の尿サンプル中のグロボトリアオシルセラミド(Gb3)の存在を検出する方法;
前記ヒト対象から前記尿サンプルを入手して、ろ過紙に配置するステップ;
前記ろ過紙に配置された前記尿サンプルを乾燥するステップ;
前記乾燥した尿サンプルをメタノールで抽出するステップ;
前記抽出した尿サンプルの一部を、メタノール中に既知のGb3濃度を含む放射標識された標準溶液と共にLC−MSシステムに注入するステップ;
前記尿サンプル及び前記標準溶液中のGb3をメタノール/水勾配で溶出するステップ;
前記LC−MSシステムの質量スペクトルから、前記尿サンプル及び前記標準溶液中のGb3の1又は2以上のピークを得るステップ;
前記生体サンプル及び前記標準溶液中のGb3の前記1又は2以上のピークの保持時間に対するピーク面積をプロットして、検量線を作成するステップ;及び
前記検量線からGb3濃度を計算して、前記尿サンプル中のGb3の存在を検出するステップ。
【請求項24】
尿サンプル中のGb3濃度と正常な閾値とを比較して、心疾患、心臓病、心疾患のリスク因子の存在をスクリーニングするステップであって、前記正常な閾値が200ng/mlであるステップをさらに含む、請求項23に記載の方法。
【請求項25】
心疾患又は心臓病が、肥大性心筋症、リズム及び伝導系障害、冠動脈疾患、不整脈、伝導ブロック、及び弁膜症からなる群より選択される、請求項24に記載の方法。
【請求項26】
ヒト対象の尿サンプル中でGb3濃度が200ng/mlを超えることが、心疾患、心臓病、心疾患のリスク因子を示す、請求項23に記載の方法。
【請求項27】
ヒト対象が、健康なヒト対象、非ファブリー病患者、非ファブリー病心臓病患者、又はファブリー病に対する遺伝的素因を有さない対象である、請求項23に記載の方法。
【請求項1】
以下のステップを含む、尿サンプル中のグロボトリアオシルセラミド(Gb3)レベルを計算して、ヒト対象における心疾患、心臓病、又は心疾患のリスク因子の存在をスクリーニングする方法:
前記ヒト対象から前記尿サンプルを入手し、ろ過紙に配置するステップ;
前記ろ過紙に配置した前記尿サンプルを乾燥するステップ;
前記乾燥した尿サンプルをメタノールで抽出するステップ;
前記抽出した尿サンプルの一部を、メタノール中に既知のGb3濃度を含む放射標識された標準溶液と共にLC−MSシステムに注入するステップ;
前記尿サンプル及び前記標準溶液中のGb3をメタノール/水勾配で溶出するステップ;
前記LC−MSシステムの質量スペクトルから、前記尿サンプル及び前記標準溶液中のGb3の1又は2以上のピークを入手するステップ;
前記生体サンプル及び前記標準溶液中のGb3の前記1又は2以上のピークの保持時間に対するピーク面積をプロットして、検量線を作成するステップ;
前記検量線から前記尿サンプル中のGb3レベルを計算するステップ;及び
前記尿サンプル中のGb3のレベルが、正常な閾値を超える場合に、心疾患、心臓病、又は心疾患のリスク因子の存在を判定するステップであって、前記正常な閾値が200ng/mlであるステップ。
【請求項2】
尿中サンプル中のGb3レベルと正常な閾値との比較に基づいて、ヒト対象に、心臓血管系リスク測定基準を与える、又は治療計画を処方するステップをさらに含む、請求項1に記載の方法。
【請求項3】
心臓血管系リスク測定基準が、ヒト対象の尿サンプル中のGb3のレベルに比例する、請求項2に記載の方法。
【請求項4】
心疾患又は心臓病が、肥大性心筋症、リズム及び伝導系障害、冠動脈疾患、不整脈、伝導ブロック、及び弁膜症からなる群より選択される、請求項1に記載の方法。
【請求項5】
ヒト対象が、健康なヒト対象、非ファブリー病患者、非ファブリー病の心臓病患患者、又はファブリー病に対する遺伝的素因を有さない対象である、請求項1に記載の方法。
【請求項6】
活性薬理学的又は化学的シャペロン及び
1又は2以上の任意の薬学的に許容される賦形剤を含む、グロボトリアオシルセラミド(Gb3)のレベルを低減させることによってヒト対象における心疾患、心臓病を治療、又は心臓病のリスク因子を軽減するための薬学的組成物であって、
前記活性薬理学的又は化学的シャペロンが、1−デオキシガラクトノジリマイシン(DGJ)、1−デオキシガラクトノジリマイシン塩及び誘導体、イミノ糖及び誘導体、デオキシアザ糖及び誘導体、カリステギンアルカロイド及び誘導体、イソファゴミン、ファゴミン異性体、コンズリトールCエポキシド、ノルトロパンアルカロイド、4−フェニルブチレート、ミガラスタット塩酸塩、基質還元治療に使用される分子、上昇したGb3レベルと関連する根本的な後成的修飾を修正するために使用される分子、及びα―ガラクトシダーゼAをコードする遺伝子又はGb3の合成遺伝子若しくはその前駆体、又はその組み合わせと相互作用する1又は2以上の修飾遺伝子の発現又は機能に影響する分子を含む、薬学的組成物。
【請求項7】
心疾患又は心臓病が、肥大性心筋症、リズム及び伝導系障害、冠動脈疾患、不整脈、伝導ブロック、及び弁膜症からなる群より選択される、請求項6に記載の組成物。
【請求項8】
ヒト対象が、健康なヒト対象、非ファブリー病患者、非ファブリー病心臓病患者、又はファブリー病に対する遺伝的素因を有さない対象である、請求項6に記載の組成物。
【請求項9】
以下のステップを含む、ヒト対象における心疾患又は心臓病を治療、又は心臓病のリスク因子を軽減する方法:
心疾患、心臓病に対する治療、又は心疾患のリスク因子の軽減を必要とするヒト対象を同定するステップ;
活性薬理学的又は化学的シャペロンと、1又は2以上の任意の薬学的に許容される賦形剤とを含む薬学的組成物を心臓病を治療又は心疾患のリスク因子を軽減するために十分な濃度で投与するステップであって、
前記活性薬理学的又は化学的シャペロンが、1−デオキシガラクトノジリマイシン(DGJ)、1−デオキシガラクトノジリマイシン塩及び誘導体、イミノ糖及び誘導体、デオキシアザ糖及び誘導体、カリステギンアルカロイド及び誘導体、イソファゴミン、ファゴミン異性体、コンズリトールCエポキシド、ノルトロパンアルカロイド、4−フェニルブチレート、ミガラスタット塩酸塩、β−グルコセレブロシダーゼ及びアナログ、基質還元治療に使用される分子、上昇したGb3レベルと関連する根本的な後成的修飾を修正するために使用される分子、α―ガラクトシダーゼAをコードする遺伝子、Gb3の合成遺伝子若しくはその前駆体、又はその組み合わせと相互作用する1又は2以上の修飾遺伝子の発現又は機能に影響する分子を含むステップ。
【請求項10】
ヒト対象の尿サンプル中のグロボトリアオシルセラミド(Gb3)のレベルを測定することによって、心疾患、心臓病の治療、又は心臓病のリスク因子の軽減の進展をモニターするステップをさらに含む、請求項9に記載の方法。
【請求項11】
尿サンプル中のGb3レベルが200ng/ml以下であることが、心疾患又は心臓病の治療の成功、又は心臓病のリスク因子の軽減の成功を示す、請求項9に記載の方法。
【請求項12】
心疾患又は心臓病が、肥大性心筋症、リズム及び伝導系障害、冠動脈疾患、不整脈、伝導ブロック、及び弁膜症からなる群より選択される、請求項9に記載の方法。
【請求項13】
ヒト対象が、健康なヒト対象、非ファブリー病患者、非ファブリー病心臓病患者、又はファブリー病に対する遺伝的素因を有さない対象である、請求項9に記載の方法。
【請求項14】
以下のステップを含む、ヒト対象における心疾患又は心臓病を治療、又は心臓病のリスク因子を軽減する方法:
心疾患、心臓病に対する治療、又は心疾患のリスク因子の軽減を必要とするヒト対象を同定するステップ;及び
ミガラスタット塩酸塩と、1又は2以上の任意の薬学的に許容される賦形剤との組成物を心疾患、心臓病を治療又は心疾患のリスク因子を軽減するために十分な濃度で投与するステップ。
【請求項15】
ヒト対象の尿サンプル中のグロボトリアオシルセラミド(Gb3)のレベルを測定して、心疾患、心臓病の治療又は心臓病のリスク因子の軽減の進展をモニターするステップをさらに含む、請求項14に記載の方法。
【請求項16】
尿サンプル中のGb3レベルが200ng/ml以下であることが、心疾患又は心臓病の治療の成功、又は心臓病のリスク因子の軽減の成功を示す、請求項15に記載の方法。
【請求項17】
心疾患又は心臓病が、肥大性心筋症、リズム及び伝導系障害、冠動脈疾患、不整脈、伝導ブロック、及び弁膜症からなる群より選択される、請求項14に記載の方法。
【請求項18】
以下のステップを含む、ヒト対象の生体サンプル中の1又は2以上の糖脂質又はスフィンゴ糖脂質の存在を検出する方法:
前記ヒト対象から前記生体サンプルを入手し、基質に配置するステップであって、前記基質が、ろ過紙、ろ過器、膜、ビーズ、粒子、有機樹脂、マイクロタイタープレート、及びスライドからなる群より選択されるステップ;
前記基質に配置された前記生体サンプルを乾燥するステップ;
前記乾燥した生体サンプルを適切な有機溶媒で抽出するステップ;
前記抽出した生体サンプルの一部を、前記有機溶媒中に既知の濃度の糖脂質又はスフィンゴ糖脂質を有する標準溶液と共にLC−MSシステムに注入するステップ;
前記生体サンプル及び前記標準溶液中の前記糖脂質又はスフィンゴ糖脂質を、適切な溶媒勾配で溶出するステップ;
前記LC−MSシステムの質量スペクトルから、前記生体サンプル及び前記標準溶液中の糖脂質又はスフィンゴ糖脂質の1又は2以上のピークを得るステップ;
前記生体サンプル及び前記標準溶液中の糖脂質又はスフィンゴ糖脂質の前記1又は2以上のピークの保持時間に対するピーク面積をプロットして、検量線を作成するステップ;
前記検量線から1又は2以上の糖脂質又はスフィンゴ糖脂質の濃度を計算して、前記生体サンプル中の1又は2以上の糖脂質又はスフィンゴ糖脂質の存在を検出するステップ。
【請求項19】
1又は2以上の糖脂質又はスフィンゴ糖脂質が、グロボトリアオシルセラミド(Gb3)、グロボトリアオシルスフィンゴシン(Lyso−Gb3)、ラクトシルセラミド、ガラクトシルセラミド、グルコシルセラミド、中性糖脂質又はその組み合わせを含む、請求項18に記載の方法。
【請求項20】
スフィンゴ糖脂質が、Gb3である、請求項18に記載の方法。
【請求項21】
生体サンプルが、血漿、排泄物、喀痰、膵液、胆汁、リンパ液、血液、尿、脳脊髄液、精液、唾液、乳頭吸引物、及び膿汁からなる群より選択される、請求項18に記載の方法。
【請求項22】
生体サンプルが、尿である、請求項18に記載の方法。
【請求項23】
以下のステップを含む、ヒト対象の尿サンプル中のグロボトリアオシルセラミド(Gb3)の存在を検出する方法;
前記ヒト対象から前記尿サンプルを入手して、ろ過紙に配置するステップ;
前記ろ過紙に配置された前記尿サンプルを乾燥するステップ;
前記乾燥した尿サンプルをメタノールで抽出するステップ;
前記抽出した尿サンプルの一部を、メタノール中に既知のGb3濃度を含む放射標識された標準溶液と共にLC−MSシステムに注入するステップ;
前記尿サンプル及び前記標準溶液中のGb3をメタノール/水勾配で溶出するステップ;
前記LC−MSシステムの質量スペクトルから、前記尿サンプル及び前記標準溶液中のGb3の1又は2以上のピークを得るステップ;
前記生体サンプル及び前記標準溶液中のGb3の前記1又は2以上のピークの保持時間に対するピーク面積をプロットして、検量線を作成するステップ;及び
前記検量線からGb3濃度を計算して、前記尿サンプル中のGb3の存在を検出するステップ。
【請求項24】
尿サンプル中のGb3濃度と正常な閾値とを比較して、心疾患、心臓病、心疾患のリスク因子の存在をスクリーニングするステップであって、前記正常な閾値が200ng/mlであるステップをさらに含む、請求項23に記載の方法。
【請求項25】
心疾患又は心臓病が、肥大性心筋症、リズム及び伝導系障害、冠動脈疾患、不整脈、伝導ブロック、及び弁膜症からなる群より選択される、請求項24に記載の方法。
【請求項26】
ヒト対象の尿サンプル中でGb3濃度が200ng/mlを超えることが、心疾患、心臓病、心疾患のリスク因子を示す、請求項23に記載の方法。
【請求項27】
ヒト対象が、健康なヒト対象、非ファブリー病患者、非ファブリー病心臓病患者、又はファブリー病に対する遺伝的素因を有さない対象である、請求項23に記載の方法。
【図1】


【図2】


【図3】


【図4】




【図2】


【図3】


【図4】


【公表番号】特表2013−511726(P2013−511726A)
【公表日】平成25年4月4日(2013.4.4)
【国際特許分類】
【出願番号】特願2012−540024(P2012−540024)
【出願日】平成22年11月17日(2010.11.17)
【国際出願番号】PCT/US2010/057112
【国際公開番号】WO2011/063048
【国際公開日】平成23年5月26日(2011.5.26)
【出願人】(509004712)ベイラー リサーチ インスティテュート (38)
【氏名又は名称原語表記】BAYLOR RESEARCH INSTITUTE
【Fターム(参考)】
【公表日】平成25年4月4日(2013.4.4)
【国際特許分類】
【出願日】平成22年11月17日(2010.11.17)
【国際出願番号】PCT/US2010/057112
【国際公開番号】WO2011/063048
【国際公開日】平成23年5月26日(2011.5.26)
【出願人】(509004712)ベイラー リサーチ インスティテュート (38)
【氏名又は名称原語表記】BAYLOR RESEARCH INSTITUTE
【Fターム(参考)】
[ Back to top ]

