心筋毒性検査および心筋細胞評価のための方法および装置
【課題】心筋毒性検査および心筋細胞評価のための方法および装置を提供する。
【解決手段】透明基板1上に心筋細胞集団101〜10nを配置し、心筋拍動細胞に与えた強制拍動刺激に対する心筋細胞の応答から心筋細胞の品質を評価する。透明基板1上に心筋細胞集団101〜10nを配置し、ネットワークを構成する細胞には薬物が作用するように薬物を含む液体の流れに曝す。ネットワークの隣接する心筋拍動細胞の比較から得られるゆらぎ計測から薬物による心毒性の程度を評価する。
【解決手段】透明基板1上に心筋細胞集団101〜10nを配置し、心筋拍動細胞に与えた強制拍動刺激に対する心筋細胞の応答から心筋細胞の品質を評価する。透明基板1上に心筋細胞集団101〜10nを配置し、ネットワークを構成する細胞には薬物が作用するように薬物を含む液体の流れに曝す。ネットワークの隣接する心筋拍動細胞の比較から得られるゆらぎ計測から薬物による心毒性の程度を評価する。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、心筋毒性検査および心筋細胞評価のための方法および装置に関する。
【背景技術】
【0002】
細胞の状態の変化や、細胞の薬物等に対する応答を観察するのに多用されているのはバイオアッセイである。従来のバイオアッセイでは、一般的に培養細胞を用いることが多い。この系では複数の細胞を用いてアッセイを行うので、細胞集団の値の平均値をあたかも1細胞の特性であるかの様に観察してきた。
【0003】
しかし、実際には細胞は集団の中で細胞周期が同調しているものはまれであり、各々の細胞が異なった周期でタンパク質を発現している。このため、刺激に対する応答の結果を解析するときにゆらぎの問題が常に付きまとう。
【0004】
すなわち、細胞の反応機構自体が普遍的に持つ応答のゆらぎが存在するために、常に、平均的なレスポンスしか得ることができない。これらの問題を解決するために、同調培養等の手法が開発されているが、常に同じステージにある細胞群を使用することは、常にそのような細胞を供給し続けなければならないということで、バイオアッセイを広く一般に広める障害となっている。
【0005】
また、細胞に対する刺激(シグナル)は、細胞周辺の溶液に含まれるシグナル物質、栄養、溶存気体の量によって与えられるものと、他の細胞との物理的接触・細胞間インタラクションによるものの2種類があることからも、ゆらぎについての判断が難しいのが実情であった。
【0006】
細胞の物理的接触・細胞間インタラクションの問題は、バイオアッセイを組織断片のような細胞塊で行うことである程度解決できる。しかし、この場合、培養細胞と異なり、常に均一な素性の細胞塊を得ることができない。そのため、得られるデータがばらついたり、集団の中に情報が埋もれてしまったりする問題がある。
【0007】
細胞群の細胞の1つ1つを最小構成単位とする情報処理モデルの計測のために、本願の発明者らは特開2006‐94703(特許文献1)等に示すように、細胞を特定の空間配置の中に閉じ込めておくための複数の細胞培養区画を構成し、隣接する区画間は細胞の通り抜けることができない溝またはトンネルでお互いを連結するとともに、必要に応じて、溝またはトンネルあるいは細胞培養区画に、細胞の電位変化を計測するための複数の電極パターンを持つ構造の集合細胞マイクロアレー(バイオアッセイチップ)を提案した。
【0008】
また、心臓の複雑な機能を反映して取得される心電図の評価法として、通常の非線形ダイナミクス計測に使われている手法を応用して心電図解析をする手法が提案されている。例えば、もっとも一般に使われている心電図解析はポワンカレプロッティング法である(非特許文献1)。プロット中の1点は、隣接する2つの拍動データの情報を示しており例えばX軸にある時点の拍動レートを、Y軸に1つ前の拍動レートを示すこととなる。これによって心臓の拍動のゆらぎについてグラフ上の点の分布を定量化することによって見積もるものである。その他の心臓の拍動のゆらぎを計測する手法としては、相関次元法(correlation dimension)、非線形予測法(nonlinear predictability)(非特許文献2)、近似エントロピー法(非特許文献3)などがある。
【0009】
心毒性の評価については、また、心筋細胞の収縮力、すなわち血液の拍出量が、薬剤の投与に対してどのように変化するかという観点での薬物の副作用の評価があるが、これについては現在、in vivoでの計測が中心となっており、現在のところ、細胞をベースとしたin vitro系でのスクリーニング系は確立していない。
【先行技術文献】
【特許文献】
【0010】
【特許文献1】特開2006‐94703号公報
【非特許文献】
【0011】
【非特許文献1】Brennan M,Palaniswami M, Kamen P. Do existing measures of Poincare plot geometry reflect non-linear features of heart rate variability? Biomedical Engineering, IEEE Transactions on, Proc. IEEE Transactions on Biomedical Engineering, 2001, 48, 1342-1347
【非特許文献2】Kanters JK, Holstein-Rathlou NH, Agner E (1994). "Lack of evidence for low-dimensional chaos in heart rate variability". Journal of Cardiovascular Electrophysiology 5 (7): 591-601.PMID 7987529.
【非特許文献3】Storella RJ, Wood HW, Mills KM et al. (1994). "Approximate entropy and point correlation dimension of heart rate variability in healthy subjects". Integrative Physiological & Behavioral Science 33 (4): 315-20.PMID 10333974.
【発明の概要】
【発明が解決しようとする課題】
【0012】
従来のバイオアッセイでは、細胞を組織断片として扱うか、培養細胞のように1細胞として扱うかのいずれかであった。細胞の数が多すぎると上記従来技術の項で述べたように、得られる情報が平均的なものになってしまい、薬剤などに対するレスポンスが正確に得られない問題がある。細胞を1細胞ずつ用いる場合は、本来、多細胞組織の細胞として機能している細胞を、引き離された独立した状態の細胞として使用するために、細胞同士のインタラクションの影響が現れなくなることとなり、やはり正確な薬剤レスポンスすなわちバイオアッセイデータを得る上で問題がある。
【0013】
心筋細胞および線維芽細胞について見ると隣接する心筋細胞あるいは線維芽細胞からの拍動の伝播が、1細胞単位で細胞電位、細胞形態が正確に計測できるとともに、心筋細胞に対する薬物の毒性検査が1細胞の細胞電位、細胞形態として正確に計測できるデバイスやシステムを開発することが重要である。
【0014】
ヒトiPS細胞あるいはヒトES細胞などのヒト幹細胞から分化誘導した心筋細胞について、これらの細胞を創薬スクリーニングあるいは再生医療に使うためには、この心筋細胞が、ヒト心臓にある心筋細胞と同じ品質であるかどうかを細胞の機能面から定量的に評価する必要がある。
【課題を解決するための手段】
【0015】
本発明はさらに、心筋細胞の電気生理学的特性と力学的特性を同時計測して、これらの関係を定量的に評価して心毒性を評価するために、以下の装置および方法を提供する。
(1)基板、
該基板上に配置した複数個の安定した拍動を行う評価対象の心筋細胞または該心筋細胞および繊維芽細胞等の非心筋細胞を含む細胞集団、
上記基板上に上記細胞集団の周辺を囲むように形成された細胞培養液を満たすための壁、
上記細胞集団の一つの細胞あるいは細胞集団の局所部分を載置している一つ以上の微小電極、
上記壁で囲われた細胞培養液を満たすための領域内に設けられた比較電極、
上記微小電極のそれぞれに接続された引き出し線と上記比較電極に接続された引き出し線とを用いて上記微小電極に載置されている細胞電位を計測する電位計測手段、
上記微小電極へ送る電気刺激を制御し、上記電位計測手段で計測した電位データを記録する、制御/記録手段、
上記細胞集団上または集団内の一カ所以上に空間的に距離を持って配置した、上記心筋細胞を含む細胞集団とは光学特性の異なる粒径約1μm以上約50μm以下の微粒子(例:ポリスチレン微粒子、ガラス微粒子、金微粒子)、
上記微粒子を光学的に計測するための照射用光源、光学顕微鏡および画像取得カメラを含み、上記微粒子の位置および位置変化を、時間的な移動量データおよびその移動方向の角度変化データを含む変位データとして連続的に計測する、光学的計測系、ならびに
上記電位データと上記変位データとを相関付けて記録する記録手段、
を備えた心毒性評価装置。
(2)基板、
該基板上に配置した複数個の安定した拍動を行う評価対象の心筋細胞または該心筋細胞および繊維芽細胞等の非心筋細胞を含む細胞集団、
上記基板上に上記細胞集団の周辺を囲むように形成された細胞培養液を満たすための壁、
上記細胞集団の一つの細胞あるいは細胞集団の局所部分を載置している一つ以上の微小電極、
上記壁で囲われた細胞培養液を満たすための領域内に設けられた比較電極、
上記微小電極のそれぞれに接続された引き出し線と上記比較電極に接続された引き出し線とを用いて上記微小電極に載置されている細胞電位を計測する電位計測手段、
上記微小電極へ送る電気刺激を制御し、上記電位計測手段で計測した電位データを記録する、制御/記録手段、
上記細胞集団上あるいは集団内の一カ所以上に空間的に距離を持って配置した上記心筋細胞を含む細胞集団とは光学特性の異なる粒径約1μm以上約50μm以下の微粒子、
上記微粒子の位置および位置変化を、時間的な移動量データおよびその移動方向の角度変化データを含む変位データとして連続的に計測する、開口数約0.3以下の対物レンズとこの後段にズームレンズ系とを配置した光学的計測手段、ならびに
上記電位データと変位データを相関付けて記録する記録手段、
を備えた心毒性評価装置。
(3)さらに、上記細胞培養液を上記壁で囲われた領域内に供給しおよび/または排出する培養液供給/排出チャネルを備える、上記(1)または(2)記載の心毒性評価装置。
(4)前記微小電極が、細胞を刺激するための刺激電極および細胞電位を測定するための測定電極からなる、上記(1)〜(3)のいずれか記載の心毒性評価装置。
【0016】
また、本発明は、心筋細胞の細胞外電位計測を用いて心毒性を評価するために、以下の装置および方法を提供する。
(5)上記(1)記載の心毒性評価装置を用いて、
計測を行う細胞として、薬剤を添加していない状態で、急激で明確な脱分極に伴った脱分極開始後約20ms以内でのシャープなNaイオンの内向き電流の発生と、その後の脱分極開始後約100ms以内でのゆるやかなCaイオンの内向き電流の発生と、脱分極開始後約100ms以降に観察される顕著なKイオンの外向き電流の発生がある心筋細胞を用いて細胞外電位を計測することを特徴とする心毒性評価方法。
(6)上記(2)記載の心毒性評価装置を用いて、
計測を行う細胞として、薬剤を添加していない状態で、急激で明確な脱分極に伴った脱分極開始後約20ms以内でのシャープなNaイオンの内向き電流の発生と、その後の脱分極開始後約100ms以内でのゆるやかなCaイオンの内向き電流の発生と、脱分極開始後約100ms以降に観察される顕著なKイオンの外向き電流の発生がある心筋細胞を用いて細胞外電位を計測することを特徴とする心毒性評価方法。
(7)上記心毒性評価装置がさらに、上記細胞培養液を上記壁で囲われた領域内に供給しおよび/または排出する培養液供給/排出チャネルを備える、上記(5)または(6)記載の心毒性評価方法。
(8)上記微小電極が、細胞を刺激するための刺激電極および細胞電位を測定するための電位測定電極からなる、上記(5)〜(7)のいずれか記載の心毒性評価方法。
【発明の効果】
【0017】
心筋細胞および線維芽細胞の薬剤に対する応答の変化を細胞のゆらぎ計測から正確に評価することができる。
【0018】
従来、フィールド・ポテンシャル・デュレーション(FPD)(後述の説明を参照)および心筋細胞の隣接する拍動の揺らぎの大きさ(例えば、短期変動:STV: Short-term variability)のそれぞれを独立に指標とすることはあっても、両者を組み合わせて心筋毒性の検査することはなかった。本発明の心筋毒性検査方法に従って、FPD波形の延長だけでなく、心筋細胞の隣接する拍動の揺らぎの大きさ(STV)の増加も組み合わせて評価することにより、より正確な心筋毒性の評価が可能となる。
【0019】
さらに、本発明により、心筋細胞集団の電気生理学的応答と力学的応答をあわせて評価することができるin vitro系が提供され、より個体レベルに近い評価が可能なin vitro心筋細胞レベルでの計測が可能となる。
【図面の簡単な説明】
【0020】
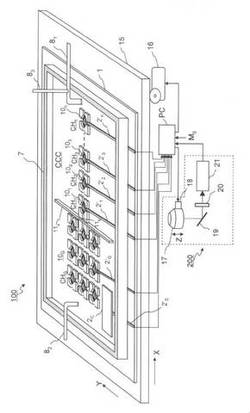
【図1】本発明の実施例に係る心筋毒性検査装置の構造の1例を模式的に示した斜視図である。
【図2】図1に示す心筋毒性検査装置の細胞保持部CHの構成の1例を模式的に示す斜視図である。
【図3】図3は、図1に示す心筋毒性検査装置の細胞保持部CHに保持された細胞を光学的に検出する光学系を説明する図である。
【図4】(a)、(b)および(c)は、細胞電位の計測に関する信号を示す図である。それぞれ、横軸に時間を、縦軸に微小電極2と比較電極2Cとの間に得られる細胞電位を示す。
【図5】(a)、(b)および(c)は、細胞の拍動に伴う体積変化を光学系によって計測した結果に関する信号を示す図である。
【図6】(a)は培養液に薬物が含まれない通常状態における標的細胞のNa+イオン、Ca2+イオン、K+イオン成分の流入出量に伴う細胞電位変化を示す図であり、(b)は培養液に薬物が含まれた状態における標的細胞のNa+イオン、Ca2+イオン、K+イオン成分の流入出量に伴う細胞電位変化を示す図である。
【図7】心筋毒性検査装置の細胞を光学的に検出する光学系および可動電極の配置の一例を説明する図である。
【図8】細胞の電気信号の発生を説明する模式図である。
【図9】(a)は薬剤の添加による細胞電位変化の一例を示す図であり、(b)は各拍動時の細胞電位変化について、隣接した2つの拍動の相同性を評価するポアンカレプロットの一例を示す図である。
【図10】(a)は1細胞レベルでの細胞配置技術を用いた心筋細胞の環状ネットワークによって作成したリエントリー回路の一例を示す模式図であり、(b)は実際に微小電極上に細胞を配置した一例を示す顕微鏡写真である。
【図11】(a)は一定の幅の細胞集団を用いて心筋細胞の環状ネットワークによるリエントリー回路の一例を示す模式図であり、(b)は実際に微小電極上に細胞を配置した一例を示す顕微鏡写真であり、(c)は実際に微小電極アレイ上に環状に細胞集団を配置した一例を示す顕微鏡写真である。
【図12】(a)は環状電極を用いたリエントリー回路計測装置の一例を示す模式図であり、(b)は実際に電極で計測した、正常拍動データと異常拍動データを示したグラフである。
【図13】(a)は1細胞の電位計測を行う電極と細胞の配置の一例を示す模式図であり、(b)は実際に電極で計測した孤立1細胞の電極上の写真とその拍動電気データ、(c)は計測した細胞集団の電極上での写真と細胞集団の中の1細胞の拍動電気データを示したグラフである。
【図14】本発明でカメラ受光素子を1細胞の電位計測に用いた実施例を説明する模式図である。
【図15】本発明の細胞計測システムで複数試料を計測できる機構の一例を説明する模式図である。
【図16】本発明の細胞計測システムで計測できる心臓情報を説明する模式図である。
【図17】本発明の細胞計測システムで計測できる細胞のフィールド・ポテンシャル信号波形の薬物の添加に対する変化を説明するグラフの一例である。
【図18】本発明の細胞計測システムで計測できる細胞のフィールド・ポテンシャル信号波形のカリウムイオン放出のピーク位置のナトリウムイオン放出時間からの経過時間(FPD:フィールド・ポテンシャル・デュレーション)について、カリウムイオンチャンネル阻害剤E4031の添加に対する変化の平均値の一例を説明するグラフの一例である。
【図19】本発明の細胞計測システムで計測できる細胞のフィールド・ポテンシャル信号波形のカリウムイオン放出のピーク位置のナトリウムイオン放出時間からの経過時間(FPD:フィールド・ポテンシャル・デュレーション)について、そのゆらぎの大きさについて隣接する拍動の短期変動をポワンカレプロッティングに基づいて定量的に評価する方法のひとつを説明するグラフおよび式の一例である。
【図20】本発明の細胞計測システムで計測できる細胞のフィールド・ポテンシャル信号波形のカリウムイオン放出のピーク位置のナトリウムイオン放出時間からの経過時間(FPD:フィールド・ポテンシャル・デュレーション)について、そのゆらぎの大きさをポワンカレプロッティングに基づいて定量的に評価する方法のひとつを説明するグラフおよび式の一例である。
【図21】本発明の細胞計測システムで計測できる心筋細胞のフィールド・ポテンシャル信号波形のカリウムイオン放出のピーク位置のナトリウムイオン放出時間からの経過時間(FPD:フィールド・ポテンシャル・デュレーション)について、そのE4031の添加によって起こるゆらぎの大きさの一例をポワンカレプロッティングで表示したもの(a)と、これについてSTVをまとめたもの(b)である。
【図22】本発明の細胞計測システムで計測できる心筋細胞にさまざまな心毒性を持つことが知られている薬剤と比較薬剤を添加した場合のFPDとSTVについて示したものである。
【図23】本発明の細胞計測システムで計測できる心筋細胞ネットワークの形状の違い、ならびに位置の違いによる薬剤添加に対するFPDのポワンカレプロッティングの一例を示したものである。(a)は実際の細胞ネットワークの一例を示した顕微鏡写真、(b)は(a)のA,B,C,Dの点での変化を計測したグラフを示したものである。
【図24】本発明の細胞計測システムで計測できる心筋細胞ネットワークの形状の違い、ならびに位置の違いによる薬剤添加に対するペースメーカー領域から局所への伝達時間のポワンカレプロッティングの一例を示したものである。(a)は実際の細胞ネットワークの一例を示した顕微鏡写真、(b)は(a)のA,B,C,Dの点での変化を計測したグラフを示したものである。(c)は、STVの算出式である。
【図25】本発明の細胞計測システムで計測できる心筋細胞ネットワーク計測において、従来のin vitro計測法、in vivo計測法との関係、1細胞のFP波形と細胞ネットワークのFP合成波形との関係を模式的に示した図である。
【図26】本発明の細胞計測システムで計測できる心筋細胞ネットワーク計測において各電極から得られた細胞のFP波形から細胞電位を見積もる機能と細胞ネットワークのFP合成波形から心電図比較波形を合成する機能を有する装置の構成を模式的に示した図である。
【図27】本発明の細胞計測システムで計測できる心筋細胞ネットワーク計測において、環状に配置した心筋細胞ネットワーク(A)の各電極から得られた細胞のFP波形(B)および、これを合成した合成FP波形(C)の一例を示す。この例では、PM領域から正常に拍動シグナルが伝達する例を示している。
【図28】本発明の細胞計測システムで計測できる心筋細胞ネットワーク計測において、環状に配置した心筋細胞ネットワーク(A)の各電極から得られた細胞のFP波形(B)および、これを合成した合成FP波形(C)の一例を示す。この例では、PM領域から拍動シグナルが異常に伝達する例を示している。
【図29】本発明の細胞計測システムで計測できる心筋細胞ネットワーク計測において、心筋細胞の拍動周波数(Beating Frequency)とFPDの関係一例を示すグラフである。
【図30】本発明の細胞計測システムで計測できる心筋細胞ネットワーク計測において、心筋細胞に強制拍動を与えたときのFPDの時間変化の一例を示すグラフである。
【図31】本発明の細胞計測システムで計測できる心筋細胞ネットワーク計測において、心筋細胞に強制拍動を与えてFPDを計測する場合の細胞ネットワーク配置の例を示す顕微鏡写真である。
【図32】本発明の細胞計測システムで計測できる心筋細胞ネットワーク計測において、心筋細胞のFP計測に微量電極電位のフィードバック制御を用いて微小電極を一定電位に保つ機構を用いた機構の一例を示す模式図である。
【図33】本発明の細胞計測システムで計測できる心筋細胞ネットワーク計測において、心筋細胞集団の一部領域に強制拍動刺激を与えたときの、心筋細胞集団の拍動周期の応答の関係の一例を示すグラフである。
【図34】本発明の細胞計測システムで計測できる心筋細胞ネットワーク計測において、心筋細胞集団の一部領域に強制拍動刺激を与えたときの、FPDの長さの変化の一例を示すグラフである。(a)は、強制拍動刺激によって引き起こされるFP波形の変化とFPDの長さの変化の関係の一例を、(b)は、強制拍動刺激の刺激インターバルの変化に応じたFPDの長さの変化の一例を示すグラフである。
【図35】本発明の細胞計測システムで計測できる心筋細胞ネットワーク計測において、心筋細胞集団の一部領域に強制拍動刺激を与えたときの、細胞集団の応答の一例について図33および図34に示した結果をまとめた表である。
【図36a】本発明の電極電位計測に置けるノイズ除去のための比較電極と微小電極の間の差分回路を模式的に示したものである。(a)原理を示した回路の一例の模式図である。
【図36b】本発明の電極電位計測に置けるノイズ除去のための比較電極と微小電極の間の差分回路を模式的に示したものである。(b)この差分回路を組み込んだ増幅回路の一例の回路図である。
【図36c】本発明の電極電位計測に置けるノイズ除去のための比較電極と微小電極の間の差分回路を模式的に示したものである。(c)回路によってノイズが低減された例を示す図である。
【図37】本発明の心毒性評価法の総合的評価法の例を模式的に示す図である。(a)細胞のFPDのデータからX軸にFPD延長の程度を、Y軸にFPDの時間的ゆらぎの大きさをプロットする。(b)は、その結果の平均をX-Y図にプロットしたものの一例を示す。
【図38】本発明の心毒性を計測するシステムの構成の一例を示す模式図である。
【図39】本発明の心毒性を計測するシステム中の細胞培養計測チャンバーの構成の一例を示す模式図と写真である。
【図40】細胞培養計測プレートの断面を模式的に示した図である。
【図41】多電極基板に配置されている電極配置の電極配線の構成を模式的に説明する図である。
【図42】多電極基板上の電極配置の例を示した模式図である。
【図43】心筋細胞の力学特性と電気特性を同時計測する本発明のシステム構成の一例を示した模式図である。
【図44】心筋細胞の力学特性と電気特性を同時計測する本発明のシステム構成の一例から取得されるデータの一例を示したデータ取得モニター画面の一例である。
【図45】心筋細胞の力学特性と電気特性を同時計測する本発明のシステム構成の一例から取得されたデータの一例である。
【図46】心筋細胞の力学特性と電気特性を同時計測する本発明のシステム構成の一例から取得された細胞変位の方向データの取得の一例を説明する図である。
【図47】心筋細胞の力学特性と電気特性を同時計測する本発明のシステムでの心筋細胞ネットワークの空間配置の例を説明する図である。
【図48】心筋細胞の電気特性を計測する細胞の細胞外電位の波形パターンの例を説明する図である。
【図49】心筋細胞の細胞電位、hERGイオンチャンネルの薬物応答のゆらぎ変化の一例を示す図である。
【図50】刺激電極アレイからの刺激電位重ね合わせによる任意の位置での細胞刺激法の原理を説明する図である。
【図51】微粒子の光学計測について開口数0.3以下の対物レンズとズームレンズ系を組み合わせた場合の効果を説明する図である。
【発明を実施するための形態】
【0021】
図1は本発明の実施例に係る心筋毒性検査装置の構造の1例を模式的に示した斜視図である。図2は、図1に示す心筋毒性検査装置の細胞保持部CHの構成の1例を模式的に示す斜視図である。図3は、図1に示す心筋毒性検査装置の細胞保持部CHに保持された細胞を光学的に検出する光学系を説明する図である。
【0022】
図1および2を参照して、心筋毒性検査装置100は、透明基板1の上に構築されている部品を主体として構成される。透明基板1は光学的に透明な材料、例えば、ガラス基板あるいはシリコン基板である。微小電極2は、例えば、ITOによる透明電極とされ、透明基板1上に配置される。2’は微小電極2の引き出し線である。31,32,33及び34はアガロースゲルによる壁であり、微小電極2の周辺に間隙41,42,43及び44を介して配置される。アガロースゲルによる壁31,32,33及び34は中心部が切り欠かれて細胞収納部となる空間を形成している。アガロースゲルによる壁31,32,33及び34により形成される細胞収納部となる空間の透明基板1上には、必要により、微小電極2が配置される。微小電極2の有無に係らず、細胞収納部に一つの細胞10が収納できる。図2では、アガロースゲルによる壁31,32,33及び34により形成される細胞収納部となる空間の透明基板1上に、微小電極2が配置され、その上に心筋細胞10が収納されている。微小電極2に引き出し線2’が接続されて引き出されている様子を示す。微小電極2の細胞載置面および微小電極2を設けないで透明基板1に、直接、細胞を載置する場合の細胞載置面にはコラーゲン等の細胞が電極表面および透明基板に接着するのを助ける素材を塗っておくのがよい。アガロースゲルによる壁31,32,33及び34により形成される細胞収納部内の細胞は、アガロースゲルは細胞にとっては非接着性であるため、この壁31,32,33及び34の高さを細胞と同程度としても、壁を乗り越えて細胞10が移動することはない。また、アガロースゲルによる壁31,32,33及び34中心部が切り欠かれて形成される細胞収納部の周辺の間隙41,42,43及び44は細胞の大きさより小さいものとされるから、この間隙41,42,43及び44をすり抜けて細胞10が移動することはない。
【0023】
図1において、細胞保持部CH1、CH2、CH3およびCHnはそれぞれ細胞収納部に一つの心筋細胞あるいは線維芽細胞101、102、103および10nを保持するとともに、図では明確でないが、それぞれ、微小電極2を備えていて、引き出し線2’1、2’2、2’3および2’nが引き出されている。これらの心筋細胞または線維芽細胞は直列配列された細胞連絡チャネルCCCを構成する。ここで、nは例えば20である。また、これら20個の直列配列された心筋細胞および線維芽細胞の配分は、ランダムでよいが、細胞保持部CH1の細胞およびCH20の細胞は心筋細胞であったほうがよい。この細胞連絡チャネルCCCの左端には3×3の細胞保持部CHGが形成されていて、それぞれの細胞保持部CHに心筋細胞10が保持されてなる細胞集団10Gを含む心筋細胞集団保持領域が存在する。この細胞集団10Gは安定した拍動を行うペースメーカーとして機能するものである。細胞集団10Gでは、細胞集団10Gの一つの細胞保持部CHのみに微小電極2が備えられ、引き出し線2’Gが引き出されている。また、細胞集団10Gの右側の中央の細胞保持部CHが細胞連絡チャネルCCCの細胞保持部CH1に対向するように構成されている。細胞集団10Gの右側と細胞連絡チャネルCCCの左端部との間に障壁11aが設けられる。この障壁11aの中央部の下部には小さい開口11bが形成される。この開口11bの両側には対向する細胞集団10Gの右側の中央の細胞保持部CHと細胞連絡チャネルCCCの細胞保持部CH1があり、それぞれの細胞収納部の周辺の間隙4を介してそれぞれに保持されている細胞の物理的接触・細胞間インタラクションが可能なように構成されている。細胞集団10Gの下部に比較電極2Cが設けられ、引き出し線2’Cが引き出されている。
【0024】
7は周辺を取り巻く壁であり、細胞集団10G、細胞連絡チャネルCCCおよび比較電極2Cを取り巻いている。81および82は壁7の内部の領域に、細胞の培養液を供給し、および、壁7の内部の領域から、細胞の培養液を排出するためのパイプであり、図の例では、基板1の底面近くまで延伸されたパイプ81から培養液が供給され、基板1の底面近くまで延伸されたパイプ82から培養液が排出される。培養液を供給するパイプ81の培養液の出口の近くにパイプ83が結合され、このパイプ83を介して細胞に作用させたい薬剤が供給される。したがって、細胞10はパイプ81により壁7の内部の領域に供給される細胞の培養液に曝されながら、微小電極2の上に安定して保持される。細胞を培養液に曝す必要がなくなったときは、パイプ82により壁7の内部の領域から培養液を排出すればよい。また、培養液を新しいものと交換するときは、培養液を排出した後、あるいは、排出しながら、培養液を供給すればよい。一方、細胞に薬剤を作用させたいときは、パイプ82により培養液を排出しながら、パイプ83を介して細胞に作用させたい薬剤を培養液に加えて、パイプ81により培養液とともに供給すればよい。このとき、細胞集団10Gと細胞連絡チャネルCCCとの間に障壁11aを設けたことにより、薬剤を含む培養液がパイプ81により壁7の内部の領域に供給されるとき、細胞連絡チャネルCCCの細胞が薬剤の影響を受ける程度に比し、細胞集団10Gの細胞が薬剤の影響を受ける程度は低いものとなる。すなわち、パイプ81により薬剤を含む培養液が供給されるとき、この培養液は障壁11aの両側の壁7との隙間および障壁11aの上面を乗り越えて細胞集団10Gにも供給されるから細胞集団10Gの細胞も薬剤の影響を受ける。しかし、その影響は細胞連絡チャネルCCCの細胞に対するものと比較すれば間接的であるので、ペースメーカーとしての機能に影響を及ぼすほどのものではない。なお、パイプ81、パイプ82およびパイプ83の構成、配置は計測の仕方により任意に変更してよい。例えば、パイプ81およびパイプ83は分離されたものとしてもよいし、パイプ82は省略して、パイプ81を供給、排出の両方に使用するものとしてもよい。
【0025】
PCはパソコン(電位計測手段,制御/記録手段)であり、細胞保持部CHの微小電極2の引き出し線2’と比較電極2Cの引き出し線2’との間で細胞電位を計測し記録する。また、パソコン9には操作者の操作信号Msが加えられる。
【0026】
心筋毒性検査装置100は光学観察装置200のXYステージ15に載せて細胞連絡チャネルCCCの任意の細胞10の拍動を、光学系により観察することが出来る。XYステージ15は、光学的に透明であるとともに、操作者の操作信号Msに応じてパソコンPCが与える信号に応じてX−Y駆動装置16により、任意の位置に移動される。図3では、細胞連絡チャネルCCCの細胞10nの拍動の状態を観察する例を示している。12は培養液を示す。
【0027】
22は位相差顕微鏡あるいは微分干渉顕微鏡の光源であり、一般にハロゲン系のランプが用いられる。23は位相差等の実体顕微鏡観察の光源の光から特定の波長のもののみを透過させるバンドパスフィルタである。例えば細胞10nの観察の場合には、波長700nm近傍の狭帯域の光を用いることで細胞10nの損傷を防ぐことができる。24はシャッターで、XYステージ15を移動させる場合など、画像計測をしていない間は光の照射を遮断する機能を有する。25はコンデンサレンズであり、位相差観察をする場合は位相差リングを導入し、微分干渉観察をする場合は、偏光子を導入する。XYステージ15上には基板1上に形成されている心筋毒性検査装置100が載置されX−Y駆動装置16によって前記XYステージ15を移動させることで前記心筋毒性検査装置100の任意の位置を観察し、計測することができる。前記心筋毒性検査装置100内の細胞10nの拍動の状態は、対物レンズ17で観察される。対物レンズ17の焦点位置はパソコンPCによる信号に応じて駆動装置18によってZ軸方向に移動させることができる。対物レンズ17の倍率は40倍以上のものが使用できる。対物レンズ17で観察されるのは、光源22から透過された光による細胞10nの位相差像あるいは微分干渉像である。前記バンドパスフィルタ23を透過するのと同波長の光を反射するダイクロイックミラー19およびバンドパスフィルタ20によって、位相差顕微鏡像あるいは微分干渉顕微鏡像のみがカメラ21によって観察される。カメラ21によって観察された画像信号はパソコンPCに導入される。また、図示していないが、画像はパソコンと接続されたモニターまたはディスプレイにより表示され得る。
【0028】
図1に示す心筋毒性検査装置100の構造の主要なサイズの例を示すと以下のようである。これは、細胞の大きさを10μmφとした例である。透明基板1の大きさは100mm×150mm、微小電極2は8μm×8μmの大きさ、アガロースゲルによる壁31,32,33及び34の個々の大きさは20μm×20μm×10μm(高さ)、間隙41,42,43及び44の幅2μm、アガロースゲルによる壁31,32,33及び34により形成される細胞収納部となる空間は12μmφの円柱状、壁7の外形は5mm×5mmとし高さは5mmである。障壁11aの高さは1mmである。尚、ここでは、微小電極2は8μm×8μmの正方形としたが、アガロースゲルによる壁31,32,33及び34の全体と間隙41,42,43及び44の幅とで構成する細胞の収納部となる10μmφの円状の電極としてもよい。
【0029】
以下、本発明の心筋毒性検査装置100の構成例とこれを用いた具体的な計測例を説明する。
【0030】
図4(a)、図4(b)および図4(c)は、細胞電位の計測に関する信号を示す図である。それぞれ、横軸に時間を、縦軸に微小電極2と比較電極2Cとの間に得られる細胞電位を示す。図4(a)は細胞集団10Gの拍動による細胞電位である。ここでは、図1に示す細胞集団10Gの一つから引き出された引き出し線2’Gと比較電極2Cから引き出された引き出し線2’Cとの間の電位である。図に示すように、安定した拍動を示し、ペースメーカーとして機能しうることがわかる。図4(b)は培養液に薬物が含まれない通常状態における標的細胞の拍動による細胞電位である。ここでは、計測の標的細胞を細胞連絡チャネルCCCの細胞10nとし、細胞10nから引き出された引き出し線2’nと比較電極2Cから引き出された引き出し線2’Cとの間の電位が計測されている。図4(a)の波形と比較して明らかなように、細胞連絡チャネルCCCの細胞10による拍動の伝達に要する時間Δtだけ遅れていることが観察される。これに対して、図4(c)は培養液に薬物が含まれた状態における標的細胞の拍動による細胞電位である。ここでも、計測の標的細胞を細胞連絡チャネルCCCの細胞10nとし、図4(b)との比較が明確になるようにしている。図4(a)、図4(b)、の波形と比較して明らかなように、細胞連絡チャネルCCCの細胞10による拍動の伝達に要する時間Δtだけの遅れではなく、時間Δt+αの遅れとなっていることが観察される。これは、細胞連絡チャネルCCCの細胞に対する薬物の作用によるNaイオン阻害の大きさが+αの遅
れの増大として表れていることを意味する。すなわち、心筋細胞に対する薬物の毒性をNaイオン阻害として評価することが出来る。
なお、観察に使用する微小電極を観察電極と言う場合がある。
【0031】
図5(a)、図5(b)および図5(c)は、細胞の拍動に伴う体積変化を光学系によって計測した結果に関する信号を示す図である。図5(a)は細胞集団10Gの細胞の拍動に伴う体積変化である。細胞集団10Gの細胞の一つの拍動を図3に示す形で光学的に検出したものである。細胞の拍動に伴う収縮および拡張がパルス状に現れる変化として認められる。この波形の周期は、図4(a)に示す拍動に伴う細胞電位の変化の周期と同じである。図5(b)は培養液に薬物が含まれない通常状態における標的細胞の拍動に伴う体積変化を上段に示し、下段にこれを電気信号として評価するために時間微分値として処理したときの波形を示す。ここでも、計測の標的細胞を細胞連絡チャネルCCCの細胞10nとし、細胞10nの拍動を図3に示す形で光学的に検出したものである。図5(a)の波形と比較して明らかなように、細胞連絡チャネルCCCの細胞10による拍動の伝達に要する時間Δtだけ遅れていることが観察される。これに対して、図5(c)は培養液に薬物が含まれた状態における標的細胞の拍動に伴う体積変化を評価するための説明図であり、図5(a)、図5(b)に比し時間軸を拡大した形で示す。上段は図5(b)の上段の波形に対応する波形であり、図5(a)の波形と比較して明らかなように、細胞連絡チャネルCCCの細胞10による拍動の伝達に要する時間Δtよりもさらにβだけ遅れが増大していることが観察される。標的細胞の拍動に伴う体積変化が薬物により受ける影響は、この遅延の増大以上に体積変化の傾きが小さくなることが特徴的である。図5(c)の下段に参考波形として示した薬物を含まない培養液での体積変化と比較してみるとこのことがよく分かる。図5(c)の中段には、上段の波形を評価するために時間微分値として処理したときの波形を示す。この時間微分値を図5(b)の下段のそれと比較すると分かるように、ピーク値が小さくなるとともに、傾きが緩やかになっている。これは、薬物により心筋の収縮速度が低下して、心拍出量が低下したことを意味する。すなわち、心筋細胞に対する薬物の毒性を収縮速度の低下として評価することが出来る。
【0032】
図6(a)は培養液に薬物が含まれない通常状態における標的細胞のNa+イオン、Ca2+イオン、K+イオン成分の流入出量に伴う細胞電位変化を示す。図6(b)は培養液に薬物が含まれた状態における標的細胞のNa+イオン、Ca2+イオン、K+イオン成分の流入出量に伴う細胞電位変化を示す。図6(a)、図6(b)を対比してすぐ分かるように、QT遅延が表われて波形が時間軸方向に伸びている。さらにK+イオンの流入出に伴い、波形が大きく変形している。これを電気信号として評価するために、図に破線で示した“0”と“100”の間の値に対して、30%、60%および90%の値の継続時間をAPD30,APD60およびAPD90として検出する。ここで、APDとはAction Potential Durationの頭文字からとった表現である。これらの値の大きさおよび比率を評価すれば、その薬物のNa+イオン、Ca2+イオン、K+イオン成分の流入出量に及ぼす影響を評価できる。
【0033】
図7は、心筋毒性検査装置の細胞を光学的に検出する光学系および可動電極の配置の一例を説明する図であり、例えば計測する細胞10nの拍動の状態を観察する例を示している。12は培養液を示す。22は位相差顕微鏡あるいは微分干渉顕微鏡の光源であり、一般にハロゲン系のランプが用いられる。221は細胞の蛍光計測をするための蛍光光源であり、一般に水銀ランプ、単色光レーザー、LED光源などが用いられる。23は位相差等の実体顕微鏡観察の光源の光から特定の波長のもののみを透過させるバンドパスフィルタであり、231は蛍光光源221から特定の蛍光を励起する励起波長の光のみを透過させるバンドパスフィルタである。例えば細胞10nの拍動堆積変化情報のような形状変化の観察の場合には、細胞形状を計測するための波長の光だけを透過させるバンドパスフィルタ20を通過した像をカメラ21でリアルタイム計測するが、計測に波長700nm近傍の狭帯域の光を用いることで細胞10nの損傷を防ぐことができる。24および241はシャッターで、XYステージ15を移動させる場合など、画像計測をしていない間は光の照射を遮断する機能を有する。25はコンデンサレンズであり、位相差観察をする場合は位相差リングを導入し、微分干渉観察をする場合は、偏光子を導入する。蛍光計測の場合は、例えば細胞内カルシウム放出の計測を行う場合は、励起波長500nm程度、蛍光計測波長600nm程度での光を選択的に透過するバンドパスフィルタの組み合わせを用い、蛍光波長の光だけを選択的に透過するバンドパスフィルタ201を通過した蛍光像をカメラ201で計測する。このとき、細胞ネットワーク中での1細胞単位でのカルシウム放出の時間的前後関係を計測して細胞ネットワーク中での信号伝達の経路を計測する場合には、カメラの計測時間分解能は0.1ms以上の高速連続画像が取得できるものとなっている。XYステージ15上には基板1上に形成されている心筋毒性検査装置100が載置されX−Y駆動装置16によって前記XYステージ15を移動させることで前記心筋毒性検査装置100の任意の位置を観察し、計測することができる。前記心筋毒性検査装置100内の細胞10nの拍動の状態は、対物レンズ17で観察される。対物レンズ17の焦点位置はパソコンPCによる信号に応じて駆動装置18によってZ軸方向に移動させることができる。対物レンズ17の倍率は40倍以上のものが使用できる。対物レンズ17で観察されるのは、光源22から透過された光による細胞10nの位相差像あるいは微分干渉像である。前記バンドパスフィルタ23を透過するのと同波長の光を反射するダイクロイックミラー192およびバンドパスフィルタ20によって、位相差顕微鏡像あるいは微分干渉顕微鏡像のみがカメラ21によって観察される。カメラ21によって観察された画像信号はパソコンPCに導入される。また、この実施例では細胞への刺激を行うための可動電極27が配置されており、可動電極の座標がXYステージと同じ平面上の任意の位置のみならず、高さを任意に調節することができる位置制御機構が備わっている。この位置制御機構を用いて細胞ネットワーク中の特定の1細胞あるいは数細胞の位置に可動電極の先端を移動させることで、任意の特定の細胞あるいは数細胞に刺激を与えることができる。可動電極の素材としては、先端部以外の部分は絶縁被覆されている金属電極、先端の開口サイズが5ミクロン程度以下のガラス電極等の、可動電極先端近傍にある特定の細胞あるいは数細胞のみに電気刺激を与えることができる構成の電極を用いることができる。金属電極を用いる場合は、先端部表面に白金黒などを付加することによって効果的に電気刺激を細胞に伝達することができる。可動電極の先端の位置は、電気刺激に対する細胞の応答の程度によって調整するものとし、細胞に接しても良いし、あるいは、細胞のごく近傍に配置しても良い。また、刺激電極の刺激を適切に標的とする特定の細胞に与えるために電気刺激を与える瞬間にスイッチングによって細胞電位計測のための電極2を接地電極として用いても良いし、あるいは、別途、別の接地電極28を配置しても良い。さらに、特定の細胞を刺激するために、既存の微小電極2を刺激電極として用いても良い。その場合には、微小電極が接続されているスイッチング回路29のスイッチングによって、通常は電気信号計測回路30に接続されているものを、刺激を与える瞬間に、スイッチング切り替えによって、電気刺激回路31に接続をして矩形波の刺激信号を微小電極2に与えることができる。また、上記可動電極27を用いて刺激を与える瞬間には、スイッチング回路29を接地にスイッチングすることができる。他方、可動電極も、刺激電極としてだけでなく、細胞の電気信号を計測する電極として用いたり、接地電極として用いることもできる。その場合は、可動電極はスイッチング回路291に接続されており、細胞電位計測、細胞刺激、接地電極としての利用に応じて、それぞれスイッチングによって、電気信号計測回路301に接続されて細胞電位を計測したり、電気刺激回路311に接続をして矩形波の刺激信号を細胞に与えたり、また、接地させることで、接地電極として用いることができる。電気刺激回路31、311が細胞に与える電気刺激のタイミングは、おもに次の2つの用途で用いることができる。ひとつは自律拍動機能を持った細胞ネットワークにおいて、その正常な心筋細胞ネットワークの拍動インターバルの間に、イレギュラーな刺激を与えるものであり、他方は、自律拍動能を有さない心筋細胞ネットワークに対して拍動インターバルを与えるものである。ともに、計測するのは、拍動インターバルの周期(2つの拍動間の時間差)を5ms単位で徐々に短くしていったときの、細胞ネットワークの応答の変化を追跡できるものである。そのために、電気刺激回路31、311は、電気信号計測回路30、301などによって得られた拍動周期情報を解析して、その結果に基づいて刺激のタイミングを決定するフィードバック制御を行うことができる。さらに、可動電極27を電気信号計測のために用いる場合、本システムにおいて微小電極2が無くても同様な計測ができることとなる。これは、システムに構成されている光学計測によって細胞ネットワーク中の各細胞の拍動周期の計測は可能であることから、この拍動周期が安定状態から不整脈などの不安定状態になることはシステムに配置されている光学計測装置のみで計測し、その結果から必要に応じて、可動電極を用いて特定の細胞の電気的特性のデータを取得するものであり、この場合には、システム上に事前に配置している微小電極数の制約を受けず、光学計測できる範囲で、より自由に大きな細胞ネットワークを構築することができる。
【0034】
図8に、細胞の電気信号の発生の一例について模式図で示した。最初に、細胞膜にあるナトリウムイオンチャンネルからのナトリウムイオンの細胞内への流入が発生し細胞電位が急激に下がり、次に、少しの遅延を経て、カルシウムイオンの流入による細胞電位の低下が起き、そして、次のステップとして、カリウムイオンの細胞外への排出が起きることで細胞電位の上昇が起きる。細胞電位の変化は、心筋細胞膜に存在する応答特性の異なるさまざまなイオンチャンネルの特性の違いによって引き起こされる。それぞれのイオンチャンネルに起因して引き起こされる電位変化のピークの位置を、各イオンチャンネルの特性時間として解析すると、薬剤の影響によって各イオンチャンネルがブロックされることで、その薬剤の特性に応じてブロックされたイオンチャンネルの種類に応じた電気信号の波形の変化を計測することができ、それによって薬剤のイオンチャンネルへの阻害効果を見積もることができる。薬剤の評価に特に重要なイオンチャンネルは、FastNa、SlowNa、Ca、IKr、IKsの4つのイオンチャンネルであり、これら4種類のイオンチャンネルのブロックの状態を計測することができる。
【0035】
図9(a)は、図8で示した細胞の電気信号について、実際にカリウムイオンチャンネルを選択的に阻害する試薬E−4031を様々な濃度で添加したときの変化を示したものである。細胞の電位を上げるKイオンの細胞外への排出機能を担うIKrイオンチャンネルを阻害することから、薬剤濃度が高まるにつれて正方向の細胞電位の変化が徐々に遅延することが分かる。図9(a)に示したのは、細胞の応答の特定の1拍動データであるが、実際には隣接する各拍動での応答のゆらぎ幅の大きさが、薬剤の影響を見積もる重要な指標となる。図9(b)がその一例であり、ポアンカレプロットと呼ばれる隣接する拍動データの相関を比較する解析手法である。ここでは、X軸にn回目の拍動時の特定のイオンチャンネルの応答時間の位置を、Y軸に(n+1)回目の拍動時の同じイオンチャンネルの応答時間の位置を置いたプロットを行う。すると、隣接する拍動同士での特性が同じ場合は、グラフ内の点線で描かれたY=X上にプロットが並ぶこととなるが、隣接する拍動同士での応答に大きな揺らぎがある場合は、Y=Xから離れた位置までの大きなプロットの分布が観測されることとなる。実際に、この例では、薬剤を添加しないControlに対して、40nMの添加では応答時間の遅延があるが、隣接した拍動間での相同性は維持されている。他方、400nMまで薬剤の添加をすると応答時間の更なる遅延に加えて、隣接した拍動間での相同性も崩れ、不安定な拍動周期が発生することとなることが本プロットによって明らかにできる。この結果は、心毒性を示すQT延長計測の結果とも一致しており、ポアンカレプロットによって1細胞レベルでの隣接した各拍動のゆらぎの増大の計測を指標にすることでQT延長の発生を見積もることができる。この現象は、特定のイオンチャンネルが薬剤によってブロックされたときに、そのブロックの程度が軽微な場合は、イオンの排出能力の低下という現象が見えるだけで細胞応答の不安定性はまだ発生しないのに対して、さらに、ブロックの程度が重度になると、機能しているイオンチャンネルの数が極端に減少して、そのために細胞のイオン排出能力について同じ細胞でありながら再現性の低い大きな揺らぎを持った結果が出てくることとなる。そして、このゆらぎの大きさがQT延長の発生し易さの指標として用いることができるものである。
【0036】
図10(a)は、1細胞レベルでの細胞配置技術を用いた心筋細胞の環状ネットワークによるリエントリー回路薬剤の一例を示す模式図である。心筋細胞のみで細胞の環状ネットワークを作成したものは、正常ネットワークモデルとなり、心肥大などの病理モデルの場合には、細胞ネットワークの中に線維芽細胞を組み込むことで実現される。そして、ネットワーク中に混在する線維芽細胞が心筋細胞ネットワークの伝達速度の遅延や減衰をもたらし、その結果、期外収縮の発生を予測することができる。図10(b)は、実際に微小電極上に心筋細胞を配置した一例を示す顕微鏡写真である。実際に、この写真に示したように、1細胞単位で微小電極上に配置された場合は、隣接した心筋細胞同士の信号伝達の遅延を計測することができる。そして、この伝達速度は拍動のときに発生する最初の電気信号の大きさに依存することから、Naイオンチャンネルへの阻害効果として、この信号伝達の遅延データを用いることができる。
【0037】
図11(a)は、一定の幅の細胞集団を用いて心筋細胞の環状ネットワークによるリエントリー回路の一例を示す模式図である。図10に示した1細胞単位での環状細胞ネットワークでは、心筋細胞の拍動信号はその通過について一意的であり、図9に示したような細胞自体の拍動のゆらぎが無い限り、同一の特性を維持して細胞は拍動信号を隣接細胞間で伝達する。他方、この図11で示したように、一定の幅で細胞を配置して環状ネットワークを形成した場合、細胞集団はその伝達について実線35、破線36、点線37のように拍動ごとに異なる経路を取る自由度を持つこととなる。特に、図9で説明したように、薬剤の添加によって各心筋細胞の応答特性に大きなゆらぎが発生すると、容易に応答する細胞が環状ネットワークを刺激信号が周回するたびに、その都度異なることから、経路の違いがより顕著となる。これはスパイラル・リエントリーと呼ばれる心臓の致死に至る期外収縮の機構と同じメカニズムとなることから、このような幅を持った細胞集団ベースでの環状ネットワークを特に用いることでスパイラル・リエントリーの計測が可能となる。図11(b)は実際に微小電極上に細胞集団を配置した一例を示す顕微鏡写真であり、心筋細胞60%程度に線維芽細胞40%程度を混ぜた細胞集団を配置している。実際に、このような配置を行うと、隣接電極間での伝達速度の隣接拍動間でのゆらぎは大きくなり、特に薬剤の添加によって、そのゆらぎの増大が顕著となることから、隣接拍動間での伝達速度のゆらぎ幅の変化からスパイラル・リエントリーの発生を見積もることができる。図11(c)は、さらに実際に微小電極アレイ上に環状に細胞集団を配置した一例を示す顕微鏡写真である。実際のスパイラル・リエントリーの計測には、図7に示した高速蛍光計測カメラを用いることで、細胞集団ネットワーク中での各細胞のカルシウム発火を1細胞レベルで見積もることができ、その結果として細胞の信号伝達がどのような経路で進んでいるのか、各周回での経路の変化を実際に解析することができる。
【0038】
図12(a)は環状電極を用いたリエントリー回路計測装置の一例を示す模式図である。この例では、1〜3mmの直径のリング状に形成した電極幅50〜100ミクロンの環状電極38を各96穴ウエルプレート42の底面に1つ配置し、電極表面にのみ41のように細胞集団が環状に配置されるように、電極上の除く周囲の底面については、表面にアガロース等の細胞接着性の無い素材をコートしている。この細胞が接着しないようにコートされた領域に、同心円状に参照電極リング39が配置されており、また、試薬の出入りが行える流路40が配置されている。このような電極を用いることで簡易に心筋細胞の異常拍動を簡便に計測することができる。図12(b)は実際に電極で計測した、正常拍動データと異常拍動データを示したグラフである。本実施例では、環状電極を用いたが、図7で示した光学計測システムを用いることで、本環状電極による効果と同じ、異常拍動を光学的に計測することができるシステムを構築することができる。その場合、電気的信号を計測する場合には、図7で示した移動電極を環状細胞ネットワークに接触させることで、電気信号も取得することができる。
【0039】
図13(a)は1細胞の電位計測を行う微小電極2と細胞の配置の一例を示す模式図であり、直径10ミクロンから50ミクロンの微小電極2上に、計測の対象となる細胞を1細胞だけ配置して計測する手法を示したものである。本実施例でも、他の実施例と同様、電極上の細胞がその場所に保持されるように電極周囲には、細胞接着性を阻害するアガロースなどの素材がコートされている。図13(b)は実際に微小電極2で計測した孤立1細胞の電極上の写真とその拍動電気データを示したものであるが、孤立した一細胞の信号は不安定でありグラフに示したように大きなゆらぎを持って拍動している。他方、図13(c)で示したように、微小電極2上には、図13(b)と同様に1細胞が配置されているが、他の細胞と連結された細胞集団となることで、拍動信号グラフを見てもわかるように、拍動周期の安定性が実現される。実際の1細胞レベルでの拍動計測では、図9でも示したように、隣接した各拍動間のゆらぎの大きさが指標となることから、本実施例で示したような、細胞集団化による安定化を実現しながら、1細胞の拍動データが取得できるように、特定の計測したい1細胞のみ微小電極上に配置され、この特定細胞の安定性を維持するために他の心筋細胞を電極上には載らない形で配置されている構成を用いた計測システムが有用である。
【0040】
図14は、本発明でカメラ受光素子を1細胞の電位計測に用いた実施例を説明する模式図である。通常、カメラ受光素子は、光電変換面で光信号を電気信号に変換して、この電気信号を計測に用いるものであることから、この光電面を除去して、電気信号アレイ部分を用いることで、2次元での電気信号を取得することが可能となる。これによって、1細胞レベルでのサイズの電極アレイを用いることができるため、例えば細胞集団の中の各細胞の電気信号を同時に計測することが必要な、図11で示した一定の幅を持つ細胞集団ネットワーク中での信号伝達経路の変化というスパイラル・リエントリーの発生を計測することが可能となる。実際の計測では、画素の計測インターバルは1万分の1秒程度必要であり、1万分の1秒のシャッタースピードの高速カメラのカメラ受光素子を利用する必要がある。この場合、取得された細胞の信号データは、既存のカメラで用いられている画像処理技術をそのまま適用することができ、画像処理用のFPGAを用いた実時間処理が可能となる。また、その実時間処理によって得られたデータに基づいて刺激電極へのフィードバック刺激を行うことも可能となる。
【0041】
図15は、本発明の細胞計測システムで複数試料を計測できる機構の一例を説明する模式図である。この実施例のシステムは、分析モジュール、多段インキュベーター、電気解析モジュールとオンラインネットワークで接続されたオンライン解析モジュールとからなる。ここで、分析モジュールには、細胞形状の変化を計測する位相差顕微鏡あるいは微分干渉顕微鏡、そして蛍光顕微鏡とカメラ撮影解析による光学的計測、アガロースを顕微鏡システムを利用してミクロンのスケールで局所溶解できるアガロース加工技術からなっている。多段インキュベーターには、複数の細胞培養槽が配置されており、また、細胞培養槽の中には微小電極チップが配置されており、各細胞の電気信号の計測、電気的刺激がインキュベーター中で並列で連続処理できるようになっている。得られた電気信号については、電気解析モジュールで実時間計測を行い、そのデータはオンラインアクセスが可能なストレージに、光学計測のデータと電気計測データの結果が同じ時間スタンプを持った形で記録されており、この記録データにオンラインで解析モジュールが適宜アクセスすることで解析することができる。
【0042】
図16は、本発明の細胞計測システムで計測できる心臓情報を説明する模式図である。微小電極上での1細胞の電気信号計測によって、Na、Ca、IKr、IKsなどのイオンチャンネルの信号データを計測することができ、隣接する心筋細胞間での信号伝達の速度変化の計測からNaイオンチャンネルの阻害を計測することができる。また、1細胞の形状変化の光学計測によって不整脈の発生の計測および心臓の拍出量の見積もりができる。さらに、環状に細胞ネットワークを配置することによってリエントリーの発生を計測することができ、さらに線維芽細胞を細胞配置に加えることで心肥大などの病理心臓モデルとしての計測がすることができる。
【0043】
図17は、本発明の細胞計測システムにおいて、自律拍動している心筋細胞から取得される細胞のフィールド・ポテンシャル(FP)信号波形の薬剤添加に対する変化の一例を例示するグラフである。細胞のフィールド・ポテンシャル信号波形は、図8に示したように細胞に流入するイオン、流出するイオンによって発生する細胞電位の変化を示すものであり、細胞電位の微分値、すなわち単位時間当たりのイオン電流の流れの総和であり、この場合、脱分極に至るプロセスでのナトリウムやカルシウムなどの内向きイオン電流が負に、それに続く再分極プロセスでのカリウムなどの外向きイオン電流が正に取られている。通常、この細胞のFP信号波形については、この図17に示すように隣接する各拍動についての相互の違いに着目するより、複数の隣接する波形を平均化してノイズ成分や隣接した各波形の違いなどの影響を排除した平均値としての1つのFP波形を抽出し、その平均値を反映した1波形の詳細解析によって各イオンチャンネルの状態を見積もるために用いている。しかし、本発明では、隣接するFP信号波形の平均値を取得するのではなく、隣接するFP信号波形の違いのうちイオンチャンネルの応答のゆらぎに依存する部分を比較抽出して、このゆらぎの大きさに基づいてイオンチャンネルのブロックされた量を定量的に推定するものである。これについては、一般にゆらぎの大きさが要素nの平方根の逆数[1/(n)1/2]で示されることから、その意味を理解することができる。すなわち、細胞表面にあるイオンチャンネルの数が、例えば104個機能している場合には、イオンチャンネルの総和としての機能のゆらぎの大きさは1%[1/(104)1/2]となるが、薬剤によってブロックされることで102個まで機能しているイオンチャンネルが減少すれば、その機能のゆらぎの大きさは10%[1/(102)1/2]と急激に増加し、隣接するFP波形は大きな変化を発生させることとなる。すなわち、隣接するFP波形の変化を比較してゆらぎの大きさを見積もることができれば、このゆらぎの大きさからブロックされたイオンチャンネルの総量を見積もることができるのである。
【0044】
この隣接する波形の変化について、特にカリウムイオンの放出によって発生する外向きイオン電流のピークの場所に着目し、例えばナトリウムイオンの細胞内への流入時間を基準(ゼロ)とし、その時間からカリウムイオンの放出のピークまでの時間をフィールド・ポテンシャル・デュレーション(FPD)として定義すると、このFPDの長さの変化は、ナトリウム、カルシュウム等のイオンの出入りに続くカリウムイオンの流入のピークの値となるため、細胞が持っているさまざまなイオンチャンネルが薬剤によってブロックされたことで発生するイオンの出入りの変化の総和としての変化量の指標として着目することができ、また、このFPDの位置のゆらぎは、すべての関係する細胞のイオンチャンネルの隣接するFP波形のゆらぎの総和を反映したものとなる。実際に、図17のFPDの位置(赤矢頭の位置)を確認すると、カリウムイオンチャンネル阻害剤であるE4031の添加によってFPDは添加前には425-450msの間であったものが、10nMの添加で642-645ms、100nMの添加で663-694ms、1μMの添加で746-785msというように阻害剤の添加によって単調にFPDの値は増加してゆき、また、隣接するFPDは同じ値ではなく、ゆらぎを反映した異なる値を取ることとなる。
【0045】
図18は、実際にカリウムイオンチャンネルを特異的に阻害する機能を持つ薬剤E4031によって細胞のカリウムイオンチャンネルが阻害されたときのFPDの延長についてE4031濃度依存の実験結果の一例を示したものである。ここでは、カリウムイオンチャンネルの阻害によってイオンの流出が遅延し、FPDが濃度依存的に延長することが推測できる。この実験結果について、同様に上記ゆらぎ計測をする場合を考える。
【0046】
図19は一般に心電図の拍動ゆらぎを計測するポワンカレプロッティングを、FP波形におけるFPDの値の評価に用いてFPDのゆらぎに着目した場合の、隣接した拍動のFPDがどの程度、相同状態からずれたかを見積もる手法の着目点のうち、隣接する拍動の揺らぎの大きさ(短期変動:STV: Short-term variability)の見積もり方を説明するものである。図19(a)において、X=Yとなる対角線は、隣接した拍動FPDnとFPDn+1がまったく同じFPDの大きさを持つ場合に位置するものとなり、2つのFPDの差(FPDn+1−FPDn)の大きさの対角線からの鉛直距離が基準化された隣接拍動自体のゆらぎの大きさとなり、特にk個のサンプリング数に対しては、図19(b)に示す(式1)のような数式で評価することができる。
【0047】
他方、図20はポワンカレプロッティングを用いてFPDのゆらぎに着目した場合の、隣接した拍動のFPDがどの程度、相同状態からずれたかを見積もる手法の着目点のうち、隣接した各拍動が拍動の平均値(すべてのサンプルの総和でイオンチャンネルの応答の理想値に相当)からどれだけずれているかという観点での拍動の揺らぎの大きさ(長期変動:LTV: Long-term variability)の見積もり方を説明するものである。図20(a)において、X=Yとなる対角線上に配置されたFPDの平均値FPDmeanと隣接した拍動FPDnとFPDn+1それぞれとの距離の2つのFPDの差[(FPDn+1−FPDmean)+(FPDn−FPDmean)]の大きさの対角線からの鉛直距離が基準化されたものでFPDの平均値からのゆらぎの大きさとなり、特にk個のサンプリング数に対しては図20(b)の(式2)のような数式で評価することができる。これはX=−Yの対称性からのずれを示しており、この大きさによって拍動が単なる平均値まわりのゆらぎを行っているのか、あるいは、履歴を持っているものかを見出す指標とすることができる。
【0048】
図21には、実際にE4031を段階的に添加したときの心筋細胞の応答の一例をポワンカレプロッティングで示したFPDのゆらぎと、そのゆらぎを定量的にSTVとしてまとめたものである。イオンチャンネルがE4031の添加に応じてブロックされてゆくことがFPDの時間の長さの延長によって推定されるとともに、特に高濃度の添加によって急激にSTVの値が増加することがわかる。
【0049】
図22は、X軸に従来のQT延長計測に当たるFPDの延長が心筋細胞を用いて観察された割合(%)を、Y軸にはSTVの増加が観察された割合(%)を取り、心毒性があることが知られている薬剤、心毒性が無いことが知られている薬剤について評価を行ったものである。従来の薬剤の毒性検査については、X軸にあるFPDのデータの結果のみによって評価していたが、Y軸にあるSTVの結果を加えて評価を行うと、図からもわかるように2次元のグラフ上のマッピングの中で、心毒性が高い高リスク(High risk)、リスクが低い(Low risk)、リスクなし(No risk)の3つの領域の中に、既知の文献結果と同じ分布をすることがわかる。このことから従来のFPDに加えてSTVを加えることで薬剤の心毒性の可能性についてより的確にかつ容易に推測を行うことが可能となることがわかる。
【0050】
図23は薬剤の添加に対するFPDについてのSTVの応答の違いを示したものである。図23(a)では、その一例として環状に心筋細胞ネットワークを構築した場合の局所のFPDのポワンカレプロッティング(A,B)、ならびに2次元に拡がった心筋シートを構築してその局所のポワンカレプロッティング(C,D)を計測した結果を(b)に示す。この例ではペーメーカー領域PMからB,Dは近傍、A,Cは遠方に位置している。(b)において薬剤添加前には、ポワンカレプロッティングのX=Yの対角線上に分布していたFPDは、低容量の心毒性薬剤添加によって、環状モデル(A,B)ではともに大きなゆらぎが発生しSTVの増加が観察されるが、2次元シートモデル(C,D)ではほとんどゆらぎが発生しない。また中容量の薬剤添加に対しては、環状モデル(A,B)では拍動が細動状態あるいは停止状態に移行するが、2次元シートモデル(C,D)ではPMから遠方の領域CでSTVの増加が見られるが、近傍の領域Dでは、まだSTVの増加量は領域Cより低いことが観察される。この例でもわかるようにFPDのSTV計測による薬物の心毒性の予測に対しては2次元シート状の細胞集団(ネットワーク)より、ペースメーカー領域から線状に配置された細胞集団(ネットワーク)が、より正確に薬物の影響を反映させることがわかる。
【0051】
図24は薬剤の添加に対するPM領域からの拍動刺激の伝達速度(V)についてのSTVの応答の違いを示したものである。これは、心毒性としておこるトルサードポワンツ(TdP)は心筋細胞組織での伝達異常であることから、実際にPM領域からの伝達速度がどの程度のゆらぎとして発生するかを確認することで薬物毒性を見積もる手法である。この場合にはSTVの定義については図24(c)の(式3)に示したように、FPDに変わって、PM領域からの伝達時間T(あるいはPMからの距離をこの伝達時間で割った、その観測点での見かけ上の伝達速度V)を用いて計測することとなる。LTVについても定義はSTVと同様にFPDを、TあるいはVに変更したものとなる。図24(a)では、その一例として環状に心筋細胞ネットワークを構築した場合の局所の伝達時間Tのポワンカレプロッティング(A,B)、ならびに2次元に拡がった心筋シートを構築してその局所のポワンカレプロッティング(C,D)を計測した結果を図24(b)に示す。この例でも図23と同じくペーメーカー領域PMからB,Dは近傍、A,Cは遠方に位置している。図24(b)において薬剤添加前には、ポワンカレプロッティングのX=Yの対角線上に分布していたFPDは、低容量の心毒性薬剤添加によって、環状モデル(A,B)ではともに大きなゆらぎが発生し伝達時間の大きなゆらぎを示すSTVの増加が観察されるが、2次元シートモデル(C,D)ではほとんどゆらぎが発生しない。また中容量の薬剤添加に対しては、環状モデル(A,B)では拍動が細動状態あるいは停止状態に移行するが、2次元シートモデル(C,D)ではPMから遠方の領域CでSTVの増加が見られるが、近傍の領域Dでは、まだSTVの増加量は領域Cより低いことが観察される。この例でもわかるように伝達時間T(あるいは各局所での見かけの伝達速度V)のSTV計測による薬物の心毒性の予測に対しては2次元シート状の細胞集団(ネットワーク)より、ペースメーカー領域から線状に配置された細胞集団(ネットワーク)が、より正確に薬物の影響を反映させることがわかると同時に、より効果的に空間配置依存的なゆらぎの発生を計測できることがわかる。
【0052】
図25は、本発明の心筋細胞ネットワークで各心筋細胞から電気的FP波形を取得するときの、そのFP波形と従来のin vitro計測技術(例えばパッチクランプ法)、従来のin vivo計測技術(例えば心電図)との関係を模式的に図示したものである。本発明の細胞のFP計測で得られた波形は、細胞から出入りする単位時間当たりのイオン流の大きさを示すものであり、細胞の電位変化情報(電気的にはイオン電流)となり、これは、従来の細胞ベースでのin vitro計測で得られる細胞電位とは、図25に描いているように微分・積分の関係となる。次に、各細胞(あるいは細胞ネットワークの局所)から得られた1電極から計測したFP波形を、細胞ネットワークの複数の領域に配置した複数の電極から得られた各々のFP波形を重ね合わせることで細胞ネットワークの合成FP波形を得ることができるが、これは心臓から得られる電位変化信号波形である心電図のうち心室組織部分の応答にあたるQT領域の心電図データと相同性を持っているものである。
【0053】
図26は、上記、図25で説明を行った従来の技術で計測した情報と、本発明の装置で得られたFPデータとの相関関係を見積もるための装置システムの構成を模式的に示したものである。1細胞あるいは細胞ネットワーク上の局所のFPを計測できるように配置された複数の微小電極から1電極単位で取得したFPデータを集積し、その各FPデータを微分して細胞電位を見積もることができる機能を有する演算回路、あるいは、各電極データを重ね合わせることによって、心電図の心室部分の心電図波形(Q−T部分)との比較ができる演算回路を有するものである。特に、重ね合わせ回路を用いて単一の電極のFPデータを解析するだけでなく、例えば直列に配置された細胞ネットワーク上に等間隔で配置された複数の微小電極アレイのデータを合成することは、各電極上の細胞のFPの結果のみならず細胞間を伝達する状態を反映したデータを表示することとなり、特に、心筋細胞間の伝達異常である不整脈を見積もる上では、伝達の異常が合成FP波形に反映されることから、この重ね合わせ回路の結果を期外収縮発生の直接予測機構に情報を移動させて、この結果から心電図解析と同様な予測が可能である。他方の微分回路から得られる細胞電位データについても細胞電位依存的に活性化状態が異なるイオンチャンネルの状態を見積もるために用いられる。
【0054】
図27および図28は、実際に上記図26で述べた演算回路によって各電極からのFPデータを重ね合わせた例を示したものである。図27では、図27(A)に示したように心筋細胞ネットワークが環状に配置されており、そのネットワークに沿って一定間隔で微小電極が配置されている。ペースメーカー(PM)領域が電極R1の位置にある環状心筋細胞ネットワークにおいて拍動シグナルがR2→R8、あるいはL1→L8に伝達するところが図27(B)の各電極のFP波形で見ることができる。そしてこれを重ね合わせた波形が下Sの波形となる。図27(C)は、実際に長期で計測して合成した結果である。これが実際の心電図のQT領域の波形を推定するために必要な、FPの伝達情報が含まれた合成FP波形となる。この図からもわかるようにPM領域から正常に拍動シグナルが伝達する場合には、図27(C)からもわかるように合成波形もなめらかな波形となる。他方、図28は図28(B)からもわかるようにPM領域からの拍動シグナルが規則正しく伝達しなくなる不整脈状態になると、合成FPとなるSも非常に乱れた波形となり、心電図に相当する図28(C)でも不整脈と同様な形状の波形が合成FP波形としてみることができる。ここで特記すべきことは、図28(B)の各微小電極の1電極データのみから不整脈を予測する場合には、観測する電極によっては(例えばL5)顕著な不整脈の発生を予測することは難しく、図28(B)Sあるいは図28(C)に見られるように合成FP波形とすることでより的確に予測することが可能となることがわかる。
【0055】
図29は、心筋細胞の拍動周期に対するFPDの大きさの関係を示したものである。黒丸は、いろいろな自律拍動を持つ心筋細胞でのFPDを本発明の装置システムで計測した結果である。この結果からもわかるように、細胞はその拍動周期に依存してFPDの値を変化させることがわかる。これは自律拍動を用いた心筋細胞による計測を行った場合に、薬剤によって細胞の拍動周
期が変化したり拍動停止したり、あるいは不安定化したときに、この副作用によって本来のイオンチャンネルのブロックではない原因によってFPDが変化する可能性があることを示唆している。また、赤×印は強制拍動によって細胞の拍動周期を強制的に変化させたときのFPDの値を示しており、外部からの連続刺激によって一定時間以上、一定の拍動周期を維持すれば、安定したFPDとなることがわかる。
【0056】
図30は、実際に自律拍動をしている心筋細胞に本発明のシステムを用いて外部から強制拍動刺激を与えたときの心筋細胞のFPDの時間変化の一例を示したものである。この例でもわかるように、自律拍動インターバルが4秒程度であった細胞が1Hzの強制拍動刺激を与えると直後からFPDの値が大きく変化し、刺激開始後およそ30秒ほどで550msの位置で安定化することがわかる。また強制拍動刺激終了後においても異なる自律拍動周期を持ち、また、FPDが徐々に長くなってゆくことも見ることができる。これらの結果からもわかるように、強制拍動刺激を与え始めてからFPDが安定化するまでの刺激開始後30秒後以降に、薬物毒性検査をすることが望ましい。
【0057】
図31は、実際に本発明のシステムを用いて外部から強制拍動刺激を与えてFPD、あるいは伝達時間T、あるいは伝達速度Vを計測する場合の細胞配置の例を示すものである。図31(a)は、少なくとも2つの微小電極を覆うように配置された細胞集団を用いた刺激計測の例である。刺激電極から例えば毎分60拍の一定のインターバルの強制刺激信号を与えながら隣接する計測電極で細胞のFPD、あるいは刺激電極の刺激時間から計測電極上の細胞までの拍動信号の伝達時間T,あるいは計測電極上の細胞までの伝達速度Vを計測するものである。図31(b)は、直線状に配置された心筋細胞ネットワークの端点に配置した刺激微小電極によって強制刺激拍動を与え、この伝達について、一定の間隔で心筋細胞ネットワークに沿って配置された微小電極アレイによって、各電極上の心筋細胞のFPD,T,Vを計測し、刺激電極の刺激信号に対する各電極のデータのみならず、各記録電極のFPの合成FPによる不整脈発生の予測、各電極間でのTとVの関係などについて見積もることができる。ただし、ここで示したのはあくまでも細胞配置の一例であり、上記、図27で示した環状細胞ネットワークのPM領域に強制拍動を与えて同様の計測をすることもできるし、あるいは、刺激電極上の細胞をこの刺激電極を計測電極として用いることで、最小細胞数でのFPDの計測をおこなうことも可能である。
【0058】
またここまでのすべての実施例について、心筋細胞ネットワークについては一部心筋のみについて言及したが、繊維芽細胞を生体組織と同様な性質となるように添加することが含まれるものである。
【0059】
図32は、微小電極2上に配置された細胞のFP計測を行うために、電極2の電位を一定に保つ電位クランプ型のフィードバック制御機構を用いることができることを模式的に示したものである。ここでは、細胞のFPは、従来の電極からの信号を増幅して計測するのではなく、電極2の電位を保つために外部の電源から供給される電流をモニターして、この結果を実時間で解析することで見積もるものである。ここで一定に保つ電位としては、通常はゼロを選ぶが、脱分極電位を変化させるなどの細胞状態を変化される場合には、電位を異なるものに調整することも可能である。
【0060】
図33は、実際にヒトES細胞から心筋細胞に分化させた細胞集団の一部領域に上記記載の本発明のシステムを用いて強制拍動刺激を与えた時の、細胞集団の拍動周期の変化を計測した結果の一例のグラフである。このグラフからもわかるように、正常な心筋細胞集団では、この例のようにたとえば0.6Hzから1.8Hzの強制刺激を与えた時に、この範囲のすべてにおいて線形に、強制刺激に応答して拍動が追従することがわかる。
【0061】
図34(a)は、実際に強制拍動刺激を与えたところで細胞集団の拍動がその強制拍動刺激のインターバルと同じ周期になることから、この強制拍動刺激状態での心筋細胞集団のFPの波形の変化とFPDの長さの変化を示したものである。グラフからもわかるように、強制拍動刺激インターバルを早くすることでFP波形が変化し、FPDの長さが短くなることがわかる。そこで図34(b)に示したように、このFPDの変化をグラフで示すと、この短縮が、強制拍動インターバルの周期(RR)に依存することから、この補正関係について、既知のヒト心臓においてのQTインターバルの長さと心拍との関係の研究(Patrick Davey, How to correct the QT interval for the effects of heart rate in clinical studies. Journal of Pharmacological and Toxicological Methods 48 (2002) 3 - 9)からFredericiaの補正、すなわち拍動の速さの違いによってQTの長さが変化してしまい相対比較できないことから、拍動周期が毎分60拍の心筋拍動時のQTの長さ(QTC)に補正するためにQTC=QT/(RR)1/3として換算するもの、あるいは、Bazettが提唱したQTC=QT/(RR)1/2として換算するものに一致するかどうかが重要となる。これは、上に説明したようにin vivoでのQTの長さは、本システムで計測する細胞ネットワーク全体で計測したFPDの長さの重ね合わせに相当し、それは、すなわち各細胞のFPD自体が、上記、FredericiaあるいはBazettの補正の範疇に入るべきであることを示唆しているが、実際に、図34(b)の結果は、QTC=QT/(RR)1/2.5 となっており、FredericiaあるいはBazettの補正の間にあることがわかる。また、図35は図33および図34のグラフに示したデータを表にしたものである。
【0062】
これらの結果は、実際にスクリーニングや再生医療で使用する心筋細胞の品質の確認に、心筋細胞に対して強制拍動刺激を与えたときの心筋細胞の応答を計測することで対応できることを示している。すなわち
1)心筋細胞あるいは心筋細胞集団に対して強制拍動刺激を与え、細胞あるいは細胞集団がその強制拍動刺激に応答して強制拍動刺激と同じインターバルで応答するかどうかを確認し、かつ、その応答がどの強制拍動刺激の周波数の範囲で対応するかどうかを計測し、拍動が追従できることを確認することで健全な心筋細胞である十分条件の一つを満たしていると判断すること、あるいはさらに具体的に、この応答の追従がたとえば少なくても1.8Hzまで追従することで健全な心筋細胞である十分条件の一つを満たしていると判断すること。
2)上記、強制拍動刺激インターバル(RR)に対して細胞の拍動の追従が確認できた周波数の範疇で、強制拍動刺激に対するFPDの変化が、FPD/(RR)1/3からFPD/(RR)1/2の間にあることを確認することで健全な心筋細胞である十分条件の一つを満たしていると判断すること。
【0063】
上記手順を用いることで、心筋細胞の品質の管理が可能となる。健全な心筋細胞とは、安定した拍動を行うことが可能な細胞である。ここで評価対象となる細胞集団については、分化誘導を行った細胞集団をそのまま用いても良いし、あるいは、分化誘導を行った心筋細胞を分散し1細胞単位で計測評価しても良いし、あるいは、これら分散した心筋細胞を再度細胞集団化して計測しても良いし、あるいは、これら分散した心筋細胞をヒト心臓由来の線維芽細胞と混合して新たな細胞集団として計測評価しても良い。
これらの心筋細胞は、心筋毒性検査に使用することができる。
【0064】
図36(a)は、細胞信号のノイズを電子回路的に低減するために、細胞10が載っている微小電極2と、この微小電極2の近傍に配置された細胞が載っていないむき出しの比較電極2cとの間の電位の差分値を出力する回路を模式的に示したものである。実際に、この回路を図36(b)に示すように、増幅回路の初段に組み込むことで、図36(c)に示したようにノイズが特定の周波数に依存せず低減されることが分かる。このとき、比較電極2cの微小電極に対する位置はより近傍であることが望ましく、たとえば50μmの距離に配置されているものは十分な機能を果たすが1mmの距離までノイズ低減の機能をもたらすことができる。
【0065】
図37は、本発明の心毒性評価の総合的評価法の例を模式的に示した図である。特定の濃度の薬剤を添加した後の心筋細胞の細胞電位計測の結果から得られたFPDの値について、まずFPD延長の程度の集計結果をX軸上の値とし、さらに上述のFPDの時間的ゆらぎの大きさをポワンカレプロッティングからSTVとしてY軸上の値とし、この結果をプロットする。図37(b)は、様々な薬剤についてその結果X-Y図にプロットしたものの一例である。図からわかるように、FPDの延長とゆらぎ(STV)の増大が小さい領域にある薬剤は、QT延長はあるが心毒性は無いと判断でき、FPDの延長とゆらぎ(STV)の増大が同時に起こる場合(X-Y図面で右上)にTdPなどの心毒性があることを予測することができる。
【0066】
図38は、実際に心毒性を計測するためのシステムの構成の一例を示した模式図である。この実施例のシステムは、送液部、細胞培養計測部、細胞解析・刺激部からなっている
【0067】
送液部は、細胞培養計測部の中で培養している各細胞培養チャンバーに培養溶液を連続して送液するシリンジポンプ系あるいはペリスタポンプ系あるいはHPLCポンプ系によって送液することができる。また、送液部の配管の外周には温度調整用の抵抗加熱用配線を巻き付け管内の液温を微小K型熱電対やサーミスタ等の熱検知機構で連続モニターすることで、導入する液温を制御する抵抗加熱の程度を調整して、つねに一定の温度での溶液が導入されるようになっている。また、この送液部には、試験する薬剤を添加するために合流配管や切り替え配管などの機構が配管中に配置されており、これによって希望する濃度の薬剤を各細胞培養チャンバーに導入することができる。また、導入される薬液の濃度を定量的に確認するために、液の導入管の一部が光学的に透明であり波長280nmから800nmの範囲で吸光分光計測によって、定量的な評価が可能な機構が付加されていることが望ましい。また、同様に廃液についても廃液管の一部が光学的に透明であり波長280nmから800nmの範囲で吸光分光計測によって、定量的な評価が可能な機構が付加されていることが望ましい。また薬液の制御温度としては、人体の正常温度に近い温度が通常望ましく、その観点からセ氏30度から45度の範囲での温度制御ができることが望ましい。
【0068】
図39は、本発明の心毒性を計測するシステム中の細胞培養計測チャンバーの構成の一例を示す模式図と写真である。複数の細胞電位計測電極が配置された多電極基板4201(図40を参照)は、培養液の導入機構・排出機構が配置された細胞培養容器4202が接着しており、同時に8検体の計測が可能な細胞培養計測プレートとなっている。図40に細胞培養計測プレートの断面を模式的に示しているように、この細胞培養容器4202において、溶液の導入口は、多電極基板4201に一番近い底面に扇状に広がる形状で配置されており、他方、液の排出機構は、上部の液面の高さ4204を決める位置に液面の界面の方向と同じ向きに扇状に展開している。
【0069】
図41は、多電極基板に配置されている電極配置の電極配線の構成を模式的に説明する図である。本発明では、細胞の形状を観察するために、電極にITOなどの透明電極を用いているが、透明電極の特性として通常の金属電極に比べて高い抵抗値を持っているため、特に多電極基板がプレートなどの大きなものとなると、配線が長くなりインピーダンスが非常に大きくなる。これを回避するために、透明電極上に金属レイヤーを透明電極と同じ配線で配置すれば、金属電極の導電性によって抵抗値を下げることができる。実際には、細胞を培養する領域では、光学的観察をすることからガラス基板4301上の透明電極4302を用いた配線を配置しており、細胞観察をしない領域では透明電極に重なるようにその上に金属レイヤー4303が配置されており、その上面が絶縁膜で被覆されている。ここで用いる金属電極素材としては、たとえば金、プラチナ、チタン、銅、アルミ二ムなどを用いれば良い。
【0070】
図42は、多電極基板上の電極配置の例を示した模式図である。まず、図42(a)では、細胞培養領域4404に直列に配置した心筋細胞ネットワークの一端を局所刺激する刺激電極4401と、この刺激電極によって刺激された心筋細胞の興奮伝導を計測する計測電極4402と、ノイズ除去のための参照電極4403が配置されている。各計測電極4402から得られた心筋細胞ネットワークの複数の局所応答の結果を計測することができるとともに、伝達速度のゆらぎを各計測電極間の伝達毒度の比較解析をすることで求めることができる。図42(b)では、計測電極が一直線に繋がっているものであり、この構成にすることで、心電図のST領域(心室領域)の心電図波形と同様な波形を計測することができる。図42(c)では、上記、図42(b)の一部を切り離して、局所の心筋細胞のFP波形を取得することを容易にしたものである。図42(d)は、リング状電極の上にリング状に細胞を配置して計測するための電極配置の一例である。これらは図11、図12に示したようにリング状に配置した心筋細胞ネットワークを計測するものであるが、リング状の計測電極の一部を欠損させ、その部位に局所強制刺激を与えるための刺激電極を配置し、また、ノイズ除去のための参照電極を配置している。さらに図42(e)では、計測電極も分割して、局所心筋細胞の応答を計測することが可能な配置となっている。
【0071】
図43は心筋細胞の力学特性と電気特性を同時計測する本発明のシステム構成の一例を示した模式図である。本システムは、(1)細胞集団を培養することができ、かつ、集団中の微小領域の細胞電位データを取得できる複数の微小電極が基板上に配置された細胞ネットワークチップと、(2)このチップを固定し細胞刺激・細胞電位計測システムと電気的に接合するチップマウンター、(3)培養する細胞集団の温度や湿度、酸素濃度、二酸化炭素濃度などの環境を制御することができる環境制御容器、(4)細胞集団中の特定の心筋細胞に刺激を与え、また、細胞集団中のさまざまな微小領域の細胞電位を同時連続計測できる微小多電極電位計測システムと、(5)上記、細胞ネットワークチップ中の心筋細胞集団の表面、あるいは細胞集団の中に混入させて培養することによって細胞集団中に配置された粒径が最小で約0.1、0.2μm、0.3μm、0.4μm、0.5μm、0.6、0μm.7μm、好ましくは約0.8μm、より好ましくは約0.9μm、最も好ましくは約1μmから、最大で約500μm、400μm、300μm、好ましくは約200μm、より好ましくは約100μm、最も好ましくは約50μmまでのサイズのポリスチレン微粒子やガラス微粒子、金微粒子などのプラスチック・高分子・ガラス・金属微粒子等の心筋細胞とは輝度や複屈折率が光学顕微鏡によって容易に識別することができる心筋細胞の形状変化を計測するための1個以上の位置座標プローブ微粒子と、(6)上記、微粒子を光学的に計測するための照明用光源と光学顕微鏡と、その画像を取得する画像取得用カメラとからなる光学画像取得系と、(7)電位波形を分析して細胞電位計測を行い、かつ、画像解析によって細胞変位計測を行い、かつ、その解析結果に基づいてフィードバック刺激を行うことが可能な我画像解析・細胞電位解析・刺激制御・統合データ収録用のコンピュータシステムからなる。この装置を用いた計測では、心筋細胞の脱分極を起こすための刺激について、(A)上記心筋細胞集団の自律拍動の伝導を利用した計測を行うこと、(B)上記心筋細胞集団中の特定の細胞に外部から強制電気刺激を与え、この伝導を計測すること、(C)上記心筋細胞集団中の特定の細胞に、計測した細胞電位データに基づいて細胞電位の値と遅延時間の関係を満たす特定のタイミングでフィードバック刺激を与えてその伝導を計測すること、の主に3つの手段から選んで刺激を与えることができる。
【0072】
図44は、心筋細胞の力学特性と電気特性を同時計測する本発明のシステム構成の一例から取得されるデータの一例を示したデータ取得モニター画面の一例である。本実施例では、心筋細胞集団の表面に多数のポリスチレン微粒子を配置し、その中の5個のプローブとすることとしたポリスチレン微粒子についてプローブ微粒子変位観察窓を設定し、その窓の中の微粒子の移動に伴って窓の重心が移動することによって、特定のプローブ微粒子の変位をX軸方向とY軸方向のベクトル時間変化として継続して計測することができる構成となっている。また、ちょうど光学計測をしている位置の特定のターゲット心筋細胞の細胞電位データを計測することで、Naイオンチャンネル、Caイオンチャンネル、Kイオンチャンネルの伝導刺激応答の変化と、細胞形状の変化を相関付けて計測することができる。特に、複数のプローブ微粒子の変位を同時計測することと、変位量の変化に加えて変位方向の変化を計測することができることで、細胞集団の中の各心筋細胞の応答特性のばらつきによって生じる薬剤添加に対する収縮強度の変化が、一様に発生するものか、あるいは不均一に発生するものかを定量的に見積もることも可能となっている。
【0073】
図45は、心筋細胞の力学特性と電気特性を同時計測する本発明のシステム構成の一例から取得されたデータの一例である。図からもわかるように、細胞電位データに加えて、同じ時間での心筋細胞の変位量、そして、この変位量を時間微分した変位速度データを得ることができる。
【0074】
図46は、心筋細胞の力学特性と電気特性を同時計測する本発明のシステム構成の一例から取得された細胞変位の方向データの取得の一例を説明する図である。上段の細胞に配置したプローブ微粒子の時間変化を示す連続画像であるが、この変位データを(X,Y)成分として取得し、これを変位長さrと角度変化θからなる極座標系(r,θ)に変換することで、変位量と角度変化の2つの指標を用いて、薬剤の効果を定量的に見積もることが可能である。下グラフでは、実際に、薬剤の添加によって微粒子の変位の角度変化のゆらぎが増大することが観察される現象の一例を示したものである。
【0075】
図47は、心筋細胞の力学特性と電気特性を同時計測する 本発明のシステムでの心筋細胞ネットワークの空間配置の例を説明する図である。(a)は1微小電極上に1微小心筋細胞クラスターを配置したもの、(b)は2次元に配置された微小電極アレイに対して2次元に広がった心筋細胞シート状に細胞を配置したもの、(c)は直線状に1次元に配置した微小電極アレイ上に心筋細胞を直線状に配置して、端点での心筋細胞の発火が他端に伝導するように配置したもの、(d)はリング状に配置した微小電極アレイ上にリング状に心筋細胞ネットワークを配置したもので、そのリング状に配置された心筋細胞ネットワークを閉ループとなるように接続したものと、あるいはリング状に配置した細胞ネットワークの一部を切断して開ループとなるように配置されたものなどがある。ここで、特に(c)のように直線状に細胞を配置した場合には、心筋細胞の基板表面への接着が十分ではない場合には、(e)に示したように心筋細胞の基板表面への接着に対して、心筋細胞間の収縮力が強すぎるために細胞が徐々に収縮して細胞ネットワークの空間配置が維持できず細胞塊となってしまう。これを回避するためには(d)で示したようなリング状での細胞配置をすることが収縮力を効果的に逃すことができ効果的である。また、基板表面のコラーゲン層に従来のコラーゲンに替わって、コラーゲンビトリゲルを用いることも有効である。
【0076】
図48は、実際によく知られている心筋細胞の細胞電位計測に基づいて分類した、ヒト幹細胞由来心筋細胞の細胞電位(Action Potential)グラフ(上段3種類)と、その細胞電位を時間微分した細胞外電位(Field Potential)グラフ(下段3種類)を示したものである。左のグラフは心房筋型細胞を、中央のグラフは心室筋(プルキンエ細胞)型細胞を、右のグラフは房室結節型細胞を示している。従って、心室筋の薬剤応答、あるいは心室筋での伝導応答計測を行う場合には、中央下段のグラフで示された特徴を細胞外電位で計測された細胞を用いて計測することが望ましい。この特徴は、薬剤を添加していない状態で、急激で明確な脱分極に伴った脱分極開始後20ms以内でのシャープなNaイオンの内向き電流の発生と、その後の脱分極開始後100ms以内でのゆるやかなCaイオンの内向き電流の発生と、脱分極開始後100ms以降に観察される顕著なKイオンの外向き電流の発生があるものである。
【0077】
図49は、心筋細胞の細胞電位、hERGイオンチャンネルの薬物応答のゆらぎ変化の一例を示す図である。図49(A)に示したように、hERGイオンチャンネルを特異的に阻害する薬剤E4031を添加すると、すでに述べたように細胞外電位(Field Potential: FP)はその応答が、隣接拍動周期間で大きなゆらぎを発生させるが(応答の安定性が消失するが)、同様にヒト幹細胞由来心筋細胞を用いて、その細胞電位(Action Potential: AP)についてもFPと同様な傾向と程度のゆらぎを発生させることがわかる。このことから、従来のパッチクランプ法等の電気生理学的細胞電位計測法を用いても、その観察を、各応答の平均値を取るのではなく、取得したデータのゆらぎの程度を定量的に計測することで見積もることも可能である。また、このときに細胞の応答を安定性を調整するために、たとえばパッチクランプ法を用いた計測の場合も、孤立心筋細胞1細胞での計測を行うより、心筋細胞集団中の1細胞を計測することが望ましい。図49(B)には、hERGイオンチャンネルだけを強制的に発現させたCHO細胞について、同様にE4031による阻害に対する細胞全体の細胞電位の変化を計測した結果の一例を示したものである。この結果から分かるように、従来のテールカレント(tail current)計測では計測したデータの平均値を示すが、イオンチャンネルのブロックが進むと電流自体が減少して計測が困難となる。しかし、細胞応答のゆらぎ計測を行うと、そのゆらぎの増大がhERGイオンチャンネルのブロック率が高まったときに急激に増大することから、電流量が大きいときには従来のテールカレント計測を行い、ブロック量が大きくなってカレントに基づいた計測が難しいときには、ゆらぎ計測で計測するという2手法の組み合わせ計測が有効である。
【0078】
図50は、刺激電極アレイからの刺激電位重ね合わせによる任意の位置での細胞刺激法の原理を説明する図である。図50(A)に示したように、隣接する電極間での電極電位と位相を制御することができる多数の刺激電極アレイを基板上に2次元に配置し、各電極から、単独の電極からの刺激では細胞に脱分極を起こすことが無い微弱な電位変化を出力させ、これらを重ね合わせることで細胞刺激を与えるに十分な重ね合わせ電位を2次元面上の特定に位置に特異的に発生させるために、各電極が発生させる必要がある電極の電場強度と位相のパターンをフーリエ合成の規則に基づいて算出し、特定の場所のみに刺激を与えることができる。その一例として、たとえば図50(B)に示したように、円リング状に電極アレイを配置し、これらを上記手法にて制御することで、リングの中央において集束電場による刺激を与えることが可能である。この電極アレイが、細胞培養レイヤーあるXY平面(R軸方向)から空間的にZ軸方向に浮いた形で配置されているとき、具体的には、電極アレイが配置されている平面(R軸方向)と、電場照射方向(Z軸方向)との面内での電場集束時の刺激電極アレイの配置は以下の通りとなる。まず、Z軸上の点Zfに電場を集束させる場合、この焦点ZfからR軸平面に下ろした垂線の足をR0としたとき、R0からZfまでの距離がmλであったとする。ただし、ここでλは各刺激電極から発生させる細胞集団内での伝導速度に基づいた刺激信号波の波長、mは自然数とする。R0の位置に刺激電極を配置した場合、同心円状に配置した微小電極各々の半径は、中心からn番目の同位相の場所の半径をRnとした場合、

と置くことが出来る。ただし、位置Rnは、n番目の刺激電極の同心円の位置を示し、その幅は刺激を与える焦点の位置からの距離に換算して伝導速度換算で高々±λ/4程度とする。当然、R0の位置に基準となる刺激電極が配置されなくても、同心円の焦点位置に特異的に刺激を与えることができるし、また、Zfについても細胞ネットワークが配置された基板と同じ基板上に刺激電極アレイを配置してZf=0としても良い。さらに、焦点位置が円の中心からずれる場合には、そのずれに合わせて各刺激電極の刺激信号の位相を伝導速度から換算して変更することで、刺激リング電極内の任意の特定の位置に刺激を与えることが可能である。上記説明では、心筋細胞ネットワークを例として挙げたが、細胞間の興奮伝導の伝達能力を持つ細胞であれば、すべて同様な処理が可能である。
【0079】
図51に、微粒子の光学計測について開口数0.3以下の対物レンズとズームレンズ系を組み合わせた場合の効果を説明する。通常の光学系では、対物レンズからの像を直接、CCDカメラ等の画像記録素子に結像させて観察しているが、その場合には、対物レンズの開口数(NA)に応じた焦点深度となり、倍率を拡大すると、それに対して像のボケが生じない焦点深度が浅くなる問題があった。これを解決するためには、低倍率(すなわち低開口数)の対物レンズで取得した像を後段に加えたズームレンズ系で拡大すれば良い。開口数によって像の空間分解能は規定されるが、本発明では、すでに形状が既知のプローブ微粒子を用いているため、その微粒子の像がボケなければ、空間分解を多少犠牲にしても正確な微粒子の空間座標を取得できるため問題は無い。図51Aは、本発明の光学系の構成の一例を示したものである。対物レンズの後段にズーム光学系を配置し、その後段にビデオカメラを配置している。図51Bは、実際にさまざまな倍率(開口数)の対物レンズを用いて直接微粒子を観察して、深さ方向で像のボケを観察した結果である。この結果からも分かるように、10倍(開口数0.3)の対物レンズでは、焦点深度15μmまでの像をボケ無く観察することができるが、20倍(開口数0.4)、40倍(開口数0.6)ともに、5μm程度の深さ方向までしかボケが発生しない像を得る事はできない。図51Cは、実際に10倍(開口数0.28)の対物レンズにズーム系を加えた光学系の像の観察結果である。この結果からも分かるように、対物レンズ20倍、対物レンズ40倍と同等の拡大率(位置座標分解能)にズーム系を用いて拡大しても、その焦点深度は25μm程度が維持され、特に収縮運動を行う心筋細胞ネットワークにおいて、深さ方向での大きな変位に対しても、プローブ微粒子の座標を見失う事無く、同様の画像処理を用いて位置座標分解能で追跡することが可能となる。
【産業上の利用可能性】
【0080】
本発明によれば、iPS細胞等の幹細胞から分化させた心筋細胞について、その心筋細胞が創薬スクリーニングあるいは再生医療のために使うことができる健全な心筋細胞であるかどうかを評価できる。
【符号の説明】
【0081】
1…透明基板、2…微小電極、2c…比較電極、2’…微小電極2の引き出し線、31,32,33及び34…アガロースゲルによる壁、41,42,43及び44…間隙、7…周辺を取り巻く壁、81,82,83…パイプ、PC…パソコン、Ms…パソコンの操作信号、10,101,102,103,−−−,10n…心筋細胞あるいは線維芽細胞、15…光学観察装置の透明ステージ、16…X−Y駆動装置、18…Z駆動装置、CH1、CH2、CH3およびCHn…細胞保持部、CCC…細胞連絡チャネル、10G…細胞集団、11a…障壁、11b…開口、19、191、192、193…ダイクロイックミラー、20、201…バンドパスフィルタ、21、211…カメラ、22…光源、221…蛍光光源、23、231…バンドパスフィルタ、24、241…シャッター、25…コンデンサレンズ、26…対物レンズ、27…可動電極、28…接地電極、29、291…スイッチング回路、30、301…電気信号計測回路、31、311…電気刺激回路、32…心筋細胞、33…線維芽細胞、34…細胞配置用ピペット、35…N周回目の伝達経路、36…(N+1)周回目の伝達経路、37…(N+2)周回目の伝達経路、38…測定電極、39…参照電極、40…送液系、41…環状に配置した細胞集団、42…96穴ウエルプレート、43…カメラ受光素子、44…細胞、45…細胞刺激電極、100…心筋毒性検査装置、4201…多電極基板、4202…細胞培養容器、4203…溶液の流れ、4204…液面の高さ、4301…ガラス基板、4302…透明電極、4303…金属レイヤー、4304…絶縁膜、4401…刺激電極、4402…計測電極、4403…参照電極、4404…細胞培養領域。
【技術分野】
【0001】
本発明は、心筋毒性検査および心筋細胞評価のための方法および装置に関する。
【背景技術】
【0002】
細胞の状態の変化や、細胞の薬物等に対する応答を観察するのに多用されているのはバイオアッセイである。従来のバイオアッセイでは、一般的に培養細胞を用いることが多い。この系では複数の細胞を用いてアッセイを行うので、細胞集団の値の平均値をあたかも1細胞の特性であるかの様に観察してきた。
【0003】
しかし、実際には細胞は集団の中で細胞周期が同調しているものはまれであり、各々の細胞が異なった周期でタンパク質を発現している。このため、刺激に対する応答の結果を解析するときにゆらぎの問題が常に付きまとう。
【0004】
すなわち、細胞の反応機構自体が普遍的に持つ応答のゆらぎが存在するために、常に、平均的なレスポンスしか得ることができない。これらの問題を解決するために、同調培養等の手法が開発されているが、常に同じステージにある細胞群を使用することは、常にそのような細胞を供給し続けなければならないということで、バイオアッセイを広く一般に広める障害となっている。
【0005】
また、細胞に対する刺激(シグナル)は、細胞周辺の溶液に含まれるシグナル物質、栄養、溶存気体の量によって与えられるものと、他の細胞との物理的接触・細胞間インタラクションによるものの2種類があることからも、ゆらぎについての判断が難しいのが実情であった。
【0006】
細胞の物理的接触・細胞間インタラクションの問題は、バイオアッセイを組織断片のような細胞塊で行うことである程度解決できる。しかし、この場合、培養細胞と異なり、常に均一な素性の細胞塊を得ることができない。そのため、得られるデータがばらついたり、集団の中に情報が埋もれてしまったりする問題がある。
【0007】
細胞群の細胞の1つ1つを最小構成単位とする情報処理モデルの計測のために、本願の発明者らは特開2006‐94703(特許文献1)等に示すように、細胞を特定の空間配置の中に閉じ込めておくための複数の細胞培養区画を構成し、隣接する区画間は細胞の通り抜けることができない溝またはトンネルでお互いを連結するとともに、必要に応じて、溝またはトンネルあるいは細胞培養区画に、細胞の電位変化を計測するための複数の電極パターンを持つ構造の集合細胞マイクロアレー(バイオアッセイチップ)を提案した。
【0008】
また、心臓の複雑な機能を反映して取得される心電図の評価法として、通常の非線形ダイナミクス計測に使われている手法を応用して心電図解析をする手法が提案されている。例えば、もっとも一般に使われている心電図解析はポワンカレプロッティング法である(非特許文献1)。プロット中の1点は、隣接する2つの拍動データの情報を示しており例えばX軸にある時点の拍動レートを、Y軸に1つ前の拍動レートを示すこととなる。これによって心臓の拍動のゆらぎについてグラフ上の点の分布を定量化することによって見積もるものである。その他の心臓の拍動のゆらぎを計測する手法としては、相関次元法(correlation dimension)、非線形予測法(nonlinear predictability)(非特許文献2)、近似エントロピー法(非特許文献3)などがある。
【0009】
心毒性の評価については、また、心筋細胞の収縮力、すなわち血液の拍出量が、薬剤の投与に対してどのように変化するかという観点での薬物の副作用の評価があるが、これについては現在、in vivoでの計測が中心となっており、現在のところ、細胞をベースとしたin vitro系でのスクリーニング系は確立していない。
【先行技術文献】
【特許文献】
【0010】
【特許文献1】特開2006‐94703号公報
【非特許文献】
【0011】
【非特許文献1】Brennan M,Palaniswami M, Kamen P. Do existing measures of Poincare plot geometry reflect non-linear features of heart rate variability? Biomedical Engineering, IEEE Transactions on, Proc. IEEE Transactions on Biomedical Engineering, 2001, 48, 1342-1347
【非特許文献2】Kanters JK, Holstein-Rathlou NH, Agner E (1994). "Lack of evidence for low-dimensional chaos in heart rate variability". Journal of Cardiovascular Electrophysiology 5 (7): 591-601.PMID 7987529.
【非特許文献3】Storella RJ, Wood HW, Mills KM et al. (1994). "Approximate entropy and point correlation dimension of heart rate variability in healthy subjects". Integrative Physiological & Behavioral Science 33 (4): 315-20.PMID 10333974.
【発明の概要】
【発明が解決しようとする課題】
【0012】
従来のバイオアッセイでは、細胞を組織断片として扱うか、培養細胞のように1細胞として扱うかのいずれかであった。細胞の数が多すぎると上記従来技術の項で述べたように、得られる情報が平均的なものになってしまい、薬剤などに対するレスポンスが正確に得られない問題がある。細胞を1細胞ずつ用いる場合は、本来、多細胞組織の細胞として機能している細胞を、引き離された独立した状態の細胞として使用するために、細胞同士のインタラクションの影響が現れなくなることとなり、やはり正確な薬剤レスポンスすなわちバイオアッセイデータを得る上で問題がある。
【0013】
心筋細胞および線維芽細胞について見ると隣接する心筋細胞あるいは線維芽細胞からの拍動の伝播が、1細胞単位で細胞電位、細胞形態が正確に計測できるとともに、心筋細胞に対する薬物の毒性検査が1細胞の細胞電位、細胞形態として正確に計測できるデバイスやシステムを開発することが重要である。
【0014】
ヒトiPS細胞あるいはヒトES細胞などのヒト幹細胞から分化誘導した心筋細胞について、これらの細胞を創薬スクリーニングあるいは再生医療に使うためには、この心筋細胞が、ヒト心臓にある心筋細胞と同じ品質であるかどうかを細胞の機能面から定量的に評価する必要がある。
【課題を解決するための手段】
【0015】
本発明はさらに、心筋細胞の電気生理学的特性と力学的特性を同時計測して、これらの関係を定量的に評価して心毒性を評価するために、以下の装置および方法を提供する。
(1)基板、
該基板上に配置した複数個の安定した拍動を行う評価対象の心筋細胞または該心筋細胞および繊維芽細胞等の非心筋細胞を含む細胞集団、
上記基板上に上記細胞集団の周辺を囲むように形成された細胞培養液を満たすための壁、
上記細胞集団の一つの細胞あるいは細胞集団の局所部分を載置している一つ以上の微小電極、
上記壁で囲われた細胞培養液を満たすための領域内に設けられた比較電極、
上記微小電極のそれぞれに接続された引き出し線と上記比較電極に接続された引き出し線とを用いて上記微小電極に載置されている細胞電位を計測する電位計測手段、
上記微小電極へ送る電気刺激を制御し、上記電位計測手段で計測した電位データを記録する、制御/記録手段、
上記細胞集団上または集団内の一カ所以上に空間的に距離を持って配置した、上記心筋細胞を含む細胞集団とは光学特性の異なる粒径約1μm以上約50μm以下の微粒子(例:ポリスチレン微粒子、ガラス微粒子、金微粒子)、
上記微粒子を光学的に計測するための照射用光源、光学顕微鏡および画像取得カメラを含み、上記微粒子の位置および位置変化を、時間的な移動量データおよびその移動方向の角度変化データを含む変位データとして連続的に計測する、光学的計測系、ならびに
上記電位データと上記変位データとを相関付けて記録する記録手段、
を備えた心毒性評価装置。
(2)基板、
該基板上に配置した複数個の安定した拍動を行う評価対象の心筋細胞または該心筋細胞および繊維芽細胞等の非心筋細胞を含む細胞集団、
上記基板上に上記細胞集団の周辺を囲むように形成された細胞培養液を満たすための壁、
上記細胞集団の一つの細胞あるいは細胞集団の局所部分を載置している一つ以上の微小電極、
上記壁で囲われた細胞培養液を満たすための領域内に設けられた比較電極、
上記微小電極のそれぞれに接続された引き出し線と上記比較電極に接続された引き出し線とを用いて上記微小電極に載置されている細胞電位を計測する電位計測手段、
上記微小電極へ送る電気刺激を制御し、上記電位計測手段で計測した電位データを記録する、制御/記録手段、
上記細胞集団上あるいは集団内の一カ所以上に空間的に距離を持って配置した上記心筋細胞を含む細胞集団とは光学特性の異なる粒径約1μm以上約50μm以下の微粒子、
上記微粒子の位置および位置変化を、時間的な移動量データおよびその移動方向の角度変化データを含む変位データとして連続的に計測する、開口数約0.3以下の対物レンズとこの後段にズームレンズ系とを配置した光学的計測手段、ならびに
上記電位データと変位データを相関付けて記録する記録手段、
を備えた心毒性評価装置。
(3)さらに、上記細胞培養液を上記壁で囲われた領域内に供給しおよび/または排出する培養液供給/排出チャネルを備える、上記(1)または(2)記載の心毒性評価装置。
(4)前記微小電極が、細胞を刺激するための刺激電極および細胞電位を測定するための測定電極からなる、上記(1)〜(3)のいずれか記載の心毒性評価装置。
【0016】
また、本発明は、心筋細胞の細胞外電位計測を用いて心毒性を評価するために、以下の装置および方法を提供する。
(5)上記(1)記載の心毒性評価装置を用いて、
計測を行う細胞として、薬剤を添加していない状態で、急激で明確な脱分極に伴った脱分極開始後約20ms以内でのシャープなNaイオンの内向き電流の発生と、その後の脱分極開始後約100ms以内でのゆるやかなCaイオンの内向き電流の発生と、脱分極開始後約100ms以降に観察される顕著なKイオンの外向き電流の発生がある心筋細胞を用いて細胞外電位を計測することを特徴とする心毒性評価方法。
(6)上記(2)記載の心毒性評価装置を用いて、
計測を行う細胞として、薬剤を添加していない状態で、急激で明確な脱分極に伴った脱分極開始後約20ms以内でのシャープなNaイオンの内向き電流の発生と、その後の脱分極開始後約100ms以内でのゆるやかなCaイオンの内向き電流の発生と、脱分極開始後約100ms以降に観察される顕著なKイオンの外向き電流の発生がある心筋細胞を用いて細胞外電位を計測することを特徴とする心毒性評価方法。
(7)上記心毒性評価装置がさらに、上記細胞培養液を上記壁で囲われた領域内に供給しおよび/または排出する培養液供給/排出チャネルを備える、上記(5)または(6)記載の心毒性評価方法。
(8)上記微小電極が、細胞を刺激するための刺激電極および細胞電位を測定するための電位測定電極からなる、上記(5)〜(7)のいずれか記載の心毒性評価方法。
【発明の効果】
【0017】
心筋細胞および線維芽細胞の薬剤に対する応答の変化を細胞のゆらぎ計測から正確に評価することができる。
【0018】
従来、フィールド・ポテンシャル・デュレーション(FPD)(後述の説明を参照)および心筋細胞の隣接する拍動の揺らぎの大きさ(例えば、短期変動:STV: Short-term variability)のそれぞれを独立に指標とすることはあっても、両者を組み合わせて心筋毒性の検査することはなかった。本発明の心筋毒性検査方法に従って、FPD波形の延長だけでなく、心筋細胞の隣接する拍動の揺らぎの大きさ(STV)の増加も組み合わせて評価することにより、より正確な心筋毒性の評価が可能となる。
【0019】
さらに、本発明により、心筋細胞集団の電気生理学的応答と力学的応答をあわせて評価することができるin vitro系が提供され、より個体レベルに近い評価が可能なin vitro心筋細胞レベルでの計測が可能となる。
【図面の簡単な説明】
【0020】
【図1】本発明の実施例に係る心筋毒性検査装置の構造の1例を模式的に示した斜視図である。
【図2】図1に示す心筋毒性検査装置の細胞保持部CHの構成の1例を模式的に示す斜視図である。
【図3】図3は、図1に示す心筋毒性検査装置の細胞保持部CHに保持された細胞を光学的に検出する光学系を説明する図である。
【図4】(a)、(b)および(c)は、細胞電位の計測に関する信号を示す図である。それぞれ、横軸に時間を、縦軸に微小電極2と比較電極2Cとの間に得られる細胞電位を示す。
【図5】(a)、(b)および(c)は、細胞の拍動に伴う体積変化を光学系によって計測した結果に関する信号を示す図である。
【図6】(a)は培養液に薬物が含まれない通常状態における標的細胞のNa+イオン、Ca2+イオン、K+イオン成分の流入出量に伴う細胞電位変化を示す図であり、(b)は培養液に薬物が含まれた状態における標的細胞のNa+イオン、Ca2+イオン、K+イオン成分の流入出量に伴う細胞電位変化を示す図である。
【図7】心筋毒性検査装置の細胞を光学的に検出する光学系および可動電極の配置の一例を説明する図である。
【図8】細胞の電気信号の発生を説明する模式図である。
【図9】(a)は薬剤の添加による細胞電位変化の一例を示す図であり、(b)は各拍動時の細胞電位変化について、隣接した2つの拍動の相同性を評価するポアンカレプロットの一例を示す図である。
【図10】(a)は1細胞レベルでの細胞配置技術を用いた心筋細胞の環状ネットワークによって作成したリエントリー回路の一例を示す模式図であり、(b)は実際に微小電極上に細胞を配置した一例を示す顕微鏡写真である。
【図11】(a)は一定の幅の細胞集団を用いて心筋細胞の環状ネットワークによるリエントリー回路の一例を示す模式図であり、(b)は実際に微小電極上に細胞を配置した一例を示す顕微鏡写真であり、(c)は実際に微小電極アレイ上に環状に細胞集団を配置した一例を示す顕微鏡写真である。
【図12】(a)は環状電極を用いたリエントリー回路計測装置の一例を示す模式図であり、(b)は実際に電極で計測した、正常拍動データと異常拍動データを示したグラフである。
【図13】(a)は1細胞の電位計測を行う電極と細胞の配置の一例を示す模式図であり、(b)は実際に電極で計測した孤立1細胞の電極上の写真とその拍動電気データ、(c)は計測した細胞集団の電極上での写真と細胞集団の中の1細胞の拍動電気データを示したグラフである。
【図14】本発明でカメラ受光素子を1細胞の電位計測に用いた実施例を説明する模式図である。
【図15】本発明の細胞計測システムで複数試料を計測できる機構の一例を説明する模式図である。
【図16】本発明の細胞計測システムで計測できる心臓情報を説明する模式図である。
【図17】本発明の細胞計測システムで計測できる細胞のフィールド・ポテンシャル信号波形の薬物の添加に対する変化を説明するグラフの一例である。
【図18】本発明の細胞計測システムで計測できる細胞のフィールド・ポテンシャル信号波形のカリウムイオン放出のピーク位置のナトリウムイオン放出時間からの経過時間(FPD:フィールド・ポテンシャル・デュレーション)について、カリウムイオンチャンネル阻害剤E4031の添加に対する変化の平均値の一例を説明するグラフの一例である。
【図19】本発明の細胞計測システムで計測できる細胞のフィールド・ポテンシャル信号波形のカリウムイオン放出のピーク位置のナトリウムイオン放出時間からの経過時間(FPD:フィールド・ポテンシャル・デュレーション)について、そのゆらぎの大きさについて隣接する拍動の短期変動をポワンカレプロッティングに基づいて定量的に評価する方法のひとつを説明するグラフおよび式の一例である。
【図20】本発明の細胞計測システムで計測できる細胞のフィールド・ポテンシャル信号波形のカリウムイオン放出のピーク位置のナトリウムイオン放出時間からの経過時間(FPD:フィールド・ポテンシャル・デュレーション)について、そのゆらぎの大きさをポワンカレプロッティングに基づいて定量的に評価する方法のひとつを説明するグラフおよび式の一例である。
【図21】本発明の細胞計測システムで計測できる心筋細胞のフィールド・ポテンシャル信号波形のカリウムイオン放出のピーク位置のナトリウムイオン放出時間からの経過時間(FPD:フィールド・ポテンシャル・デュレーション)について、そのE4031の添加によって起こるゆらぎの大きさの一例をポワンカレプロッティングで表示したもの(a)と、これについてSTVをまとめたもの(b)である。
【図22】本発明の細胞計測システムで計測できる心筋細胞にさまざまな心毒性を持つことが知られている薬剤と比較薬剤を添加した場合のFPDとSTVについて示したものである。
【図23】本発明の細胞計測システムで計測できる心筋細胞ネットワークの形状の違い、ならびに位置の違いによる薬剤添加に対するFPDのポワンカレプロッティングの一例を示したものである。(a)は実際の細胞ネットワークの一例を示した顕微鏡写真、(b)は(a)のA,B,C,Dの点での変化を計測したグラフを示したものである。
【図24】本発明の細胞計測システムで計測できる心筋細胞ネットワークの形状の違い、ならびに位置の違いによる薬剤添加に対するペースメーカー領域から局所への伝達時間のポワンカレプロッティングの一例を示したものである。(a)は実際の細胞ネットワークの一例を示した顕微鏡写真、(b)は(a)のA,B,C,Dの点での変化を計測したグラフを示したものである。(c)は、STVの算出式である。
【図25】本発明の細胞計測システムで計測できる心筋細胞ネットワーク計測において、従来のin vitro計測法、in vivo計測法との関係、1細胞のFP波形と細胞ネットワークのFP合成波形との関係を模式的に示した図である。
【図26】本発明の細胞計測システムで計測できる心筋細胞ネットワーク計測において各電極から得られた細胞のFP波形から細胞電位を見積もる機能と細胞ネットワークのFP合成波形から心電図比較波形を合成する機能を有する装置の構成を模式的に示した図である。
【図27】本発明の細胞計測システムで計測できる心筋細胞ネットワーク計測において、環状に配置した心筋細胞ネットワーク(A)の各電極から得られた細胞のFP波形(B)および、これを合成した合成FP波形(C)の一例を示す。この例では、PM領域から正常に拍動シグナルが伝達する例を示している。
【図28】本発明の細胞計測システムで計測できる心筋細胞ネットワーク計測において、環状に配置した心筋細胞ネットワーク(A)の各電極から得られた細胞のFP波形(B)および、これを合成した合成FP波形(C)の一例を示す。この例では、PM領域から拍動シグナルが異常に伝達する例を示している。
【図29】本発明の細胞計測システムで計測できる心筋細胞ネットワーク計測において、心筋細胞の拍動周波数(Beating Frequency)とFPDの関係一例を示すグラフである。
【図30】本発明の細胞計測システムで計測できる心筋細胞ネットワーク計測において、心筋細胞に強制拍動を与えたときのFPDの時間変化の一例を示すグラフである。
【図31】本発明の細胞計測システムで計測できる心筋細胞ネットワーク計測において、心筋細胞に強制拍動を与えてFPDを計測する場合の細胞ネットワーク配置の例を示す顕微鏡写真である。
【図32】本発明の細胞計測システムで計測できる心筋細胞ネットワーク計測において、心筋細胞のFP計測に微量電極電位のフィードバック制御を用いて微小電極を一定電位に保つ機構を用いた機構の一例を示す模式図である。
【図33】本発明の細胞計測システムで計測できる心筋細胞ネットワーク計測において、心筋細胞集団の一部領域に強制拍動刺激を与えたときの、心筋細胞集団の拍動周期の応答の関係の一例を示すグラフである。
【図34】本発明の細胞計測システムで計測できる心筋細胞ネットワーク計測において、心筋細胞集団の一部領域に強制拍動刺激を与えたときの、FPDの長さの変化の一例を示すグラフである。(a)は、強制拍動刺激によって引き起こされるFP波形の変化とFPDの長さの変化の関係の一例を、(b)は、強制拍動刺激の刺激インターバルの変化に応じたFPDの長さの変化の一例を示すグラフである。
【図35】本発明の細胞計測システムで計測できる心筋細胞ネットワーク計測において、心筋細胞集団の一部領域に強制拍動刺激を与えたときの、細胞集団の応答の一例について図33および図34に示した結果をまとめた表である。
【図36a】本発明の電極電位計測に置けるノイズ除去のための比較電極と微小電極の間の差分回路を模式的に示したものである。(a)原理を示した回路の一例の模式図である。
【図36b】本発明の電極電位計測に置けるノイズ除去のための比較電極と微小電極の間の差分回路を模式的に示したものである。(b)この差分回路を組み込んだ増幅回路の一例の回路図である。
【図36c】本発明の電極電位計測に置けるノイズ除去のための比較電極と微小電極の間の差分回路を模式的に示したものである。(c)回路によってノイズが低減された例を示す図である。
【図37】本発明の心毒性評価法の総合的評価法の例を模式的に示す図である。(a)細胞のFPDのデータからX軸にFPD延長の程度を、Y軸にFPDの時間的ゆらぎの大きさをプロットする。(b)は、その結果の平均をX-Y図にプロットしたものの一例を示す。
【図38】本発明の心毒性を計測するシステムの構成の一例を示す模式図である。
【図39】本発明の心毒性を計測するシステム中の細胞培養計測チャンバーの構成の一例を示す模式図と写真である。
【図40】細胞培養計測プレートの断面を模式的に示した図である。
【図41】多電極基板に配置されている電極配置の電極配線の構成を模式的に説明する図である。
【図42】多電極基板上の電極配置の例を示した模式図である。
【図43】心筋細胞の力学特性と電気特性を同時計測する本発明のシステム構成の一例を示した模式図である。
【図44】心筋細胞の力学特性と電気特性を同時計測する本発明のシステム構成の一例から取得されるデータの一例を示したデータ取得モニター画面の一例である。
【図45】心筋細胞の力学特性と電気特性を同時計測する本発明のシステム構成の一例から取得されたデータの一例である。
【図46】心筋細胞の力学特性と電気特性を同時計測する本発明のシステム構成の一例から取得された細胞変位の方向データの取得の一例を説明する図である。
【図47】心筋細胞の力学特性と電気特性を同時計測する本発明のシステムでの心筋細胞ネットワークの空間配置の例を説明する図である。
【図48】心筋細胞の電気特性を計測する細胞の細胞外電位の波形パターンの例を説明する図である。
【図49】心筋細胞の細胞電位、hERGイオンチャンネルの薬物応答のゆらぎ変化の一例を示す図である。
【図50】刺激電極アレイからの刺激電位重ね合わせによる任意の位置での細胞刺激法の原理を説明する図である。
【図51】微粒子の光学計測について開口数0.3以下の対物レンズとズームレンズ系を組み合わせた場合の効果を説明する図である。
【発明を実施するための形態】
【0021】
図1は本発明の実施例に係る心筋毒性検査装置の構造の1例を模式的に示した斜視図である。図2は、図1に示す心筋毒性検査装置の細胞保持部CHの構成の1例を模式的に示す斜視図である。図3は、図1に示す心筋毒性検査装置の細胞保持部CHに保持された細胞を光学的に検出する光学系を説明する図である。
【0022】
図1および2を参照して、心筋毒性検査装置100は、透明基板1の上に構築されている部品を主体として構成される。透明基板1は光学的に透明な材料、例えば、ガラス基板あるいはシリコン基板である。微小電極2は、例えば、ITOによる透明電極とされ、透明基板1上に配置される。2’は微小電極2の引き出し線である。31,32,33及び34はアガロースゲルによる壁であり、微小電極2の周辺に間隙41,42,43及び44を介して配置される。アガロースゲルによる壁31,32,33及び34は中心部が切り欠かれて細胞収納部となる空間を形成している。アガロースゲルによる壁31,32,33及び34により形成される細胞収納部となる空間の透明基板1上には、必要により、微小電極2が配置される。微小電極2の有無に係らず、細胞収納部に一つの細胞10が収納できる。図2では、アガロースゲルによる壁31,32,33及び34により形成される細胞収納部となる空間の透明基板1上に、微小電極2が配置され、その上に心筋細胞10が収納されている。微小電極2に引き出し線2’が接続されて引き出されている様子を示す。微小電極2の細胞載置面および微小電極2を設けないで透明基板1に、直接、細胞を載置する場合の細胞載置面にはコラーゲン等の細胞が電極表面および透明基板に接着するのを助ける素材を塗っておくのがよい。アガロースゲルによる壁31,32,33及び34により形成される細胞収納部内の細胞は、アガロースゲルは細胞にとっては非接着性であるため、この壁31,32,33及び34の高さを細胞と同程度としても、壁を乗り越えて細胞10が移動することはない。また、アガロースゲルによる壁31,32,33及び34中心部が切り欠かれて形成される細胞収納部の周辺の間隙41,42,43及び44は細胞の大きさより小さいものとされるから、この間隙41,42,43及び44をすり抜けて細胞10が移動することはない。
【0023】
図1において、細胞保持部CH1、CH2、CH3およびCHnはそれぞれ細胞収納部に一つの心筋細胞あるいは線維芽細胞101、102、103および10nを保持するとともに、図では明確でないが、それぞれ、微小電極2を備えていて、引き出し線2’1、2’2、2’3および2’nが引き出されている。これらの心筋細胞または線維芽細胞は直列配列された細胞連絡チャネルCCCを構成する。ここで、nは例えば20である。また、これら20個の直列配列された心筋細胞および線維芽細胞の配分は、ランダムでよいが、細胞保持部CH1の細胞およびCH20の細胞は心筋細胞であったほうがよい。この細胞連絡チャネルCCCの左端には3×3の細胞保持部CHGが形成されていて、それぞれの細胞保持部CHに心筋細胞10が保持されてなる細胞集団10Gを含む心筋細胞集団保持領域が存在する。この細胞集団10Gは安定した拍動を行うペースメーカーとして機能するものである。細胞集団10Gでは、細胞集団10Gの一つの細胞保持部CHのみに微小電極2が備えられ、引き出し線2’Gが引き出されている。また、細胞集団10Gの右側の中央の細胞保持部CHが細胞連絡チャネルCCCの細胞保持部CH1に対向するように構成されている。細胞集団10Gの右側と細胞連絡チャネルCCCの左端部との間に障壁11aが設けられる。この障壁11aの中央部の下部には小さい開口11bが形成される。この開口11bの両側には対向する細胞集団10Gの右側の中央の細胞保持部CHと細胞連絡チャネルCCCの細胞保持部CH1があり、それぞれの細胞収納部の周辺の間隙4を介してそれぞれに保持されている細胞の物理的接触・細胞間インタラクションが可能なように構成されている。細胞集団10Gの下部に比較電極2Cが設けられ、引き出し線2’Cが引き出されている。
【0024】
7は周辺を取り巻く壁であり、細胞集団10G、細胞連絡チャネルCCCおよび比較電極2Cを取り巻いている。81および82は壁7の内部の領域に、細胞の培養液を供給し、および、壁7の内部の領域から、細胞の培養液を排出するためのパイプであり、図の例では、基板1の底面近くまで延伸されたパイプ81から培養液が供給され、基板1の底面近くまで延伸されたパイプ82から培養液が排出される。培養液を供給するパイプ81の培養液の出口の近くにパイプ83が結合され、このパイプ83を介して細胞に作用させたい薬剤が供給される。したがって、細胞10はパイプ81により壁7の内部の領域に供給される細胞の培養液に曝されながら、微小電極2の上に安定して保持される。細胞を培養液に曝す必要がなくなったときは、パイプ82により壁7の内部の領域から培養液を排出すればよい。また、培養液を新しいものと交換するときは、培養液を排出した後、あるいは、排出しながら、培養液を供給すればよい。一方、細胞に薬剤を作用させたいときは、パイプ82により培養液を排出しながら、パイプ83を介して細胞に作用させたい薬剤を培養液に加えて、パイプ81により培養液とともに供給すればよい。このとき、細胞集団10Gと細胞連絡チャネルCCCとの間に障壁11aを設けたことにより、薬剤を含む培養液がパイプ81により壁7の内部の領域に供給されるとき、細胞連絡チャネルCCCの細胞が薬剤の影響を受ける程度に比し、細胞集団10Gの細胞が薬剤の影響を受ける程度は低いものとなる。すなわち、パイプ81により薬剤を含む培養液が供給されるとき、この培養液は障壁11aの両側の壁7との隙間および障壁11aの上面を乗り越えて細胞集団10Gにも供給されるから細胞集団10Gの細胞も薬剤の影響を受ける。しかし、その影響は細胞連絡チャネルCCCの細胞に対するものと比較すれば間接的であるので、ペースメーカーとしての機能に影響を及ぼすほどのものではない。なお、パイプ81、パイプ82およびパイプ83の構成、配置は計測の仕方により任意に変更してよい。例えば、パイプ81およびパイプ83は分離されたものとしてもよいし、パイプ82は省略して、パイプ81を供給、排出の両方に使用するものとしてもよい。
【0025】
PCはパソコン(電位計測手段,制御/記録手段)であり、細胞保持部CHの微小電極2の引き出し線2’と比較電極2Cの引き出し線2’との間で細胞電位を計測し記録する。また、パソコン9には操作者の操作信号Msが加えられる。
【0026】
心筋毒性検査装置100は光学観察装置200のXYステージ15に載せて細胞連絡チャネルCCCの任意の細胞10の拍動を、光学系により観察することが出来る。XYステージ15は、光学的に透明であるとともに、操作者の操作信号Msに応じてパソコンPCが与える信号に応じてX−Y駆動装置16により、任意の位置に移動される。図3では、細胞連絡チャネルCCCの細胞10nの拍動の状態を観察する例を示している。12は培養液を示す。
【0027】
22は位相差顕微鏡あるいは微分干渉顕微鏡の光源であり、一般にハロゲン系のランプが用いられる。23は位相差等の実体顕微鏡観察の光源の光から特定の波長のもののみを透過させるバンドパスフィルタである。例えば細胞10nの観察の場合には、波長700nm近傍の狭帯域の光を用いることで細胞10nの損傷を防ぐことができる。24はシャッターで、XYステージ15を移動させる場合など、画像計測をしていない間は光の照射を遮断する機能を有する。25はコンデンサレンズであり、位相差観察をする場合は位相差リングを導入し、微分干渉観察をする場合は、偏光子を導入する。XYステージ15上には基板1上に形成されている心筋毒性検査装置100が載置されX−Y駆動装置16によって前記XYステージ15を移動させることで前記心筋毒性検査装置100の任意の位置を観察し、計測することができる。前記心筋毒性検査装置100内の細胞10nの拍動の状態は、対物レンズ17で観察される。対物レンズ17の焦点位置はパソコンPCによる信号に応じて駆動装置18によってZ軸方向に移動させることができる。対物レンズ17の倍率は40倍以上のものが使用できる。対物レンズ17で観察されるのは、光源22から透過された光による細胞10nの位相差像あるいは微分干渉像である。前記バンドパスフィルタ23を透過するのと同波長の光を反射するダイクロイックミラー19およびバンドパスフィルタ20によって、位相差顕微鏡像あるいは微分干渉顕微鏡像のみがカメラ21によって観察される。カメラ21によって観察された画像信号はパソコンPCに導入される。また、図示していないが、画像はパソコンと接続されたモニターまたはディスプレイにより表示され得る。
【0028】
図1に示す心筋毒性検査装置100の構造の主要なサイズの例を示すと以下のようである。これは、細胞の大きさを10μmφとした例である。透明基板1の大きさは100mm×150mm、微小電極2は8μm×8μmの大きさ、アガロースゲルによる壁31,32,33及び34の個々の大きさは20μm×20μm×10μm(高さ)、間隙41,42,43及び44の幅2μm、アガロースゲルによる壁31,32,33及び34により形成される細胞収納部となる空間は12μmφの円柱状、壁7の外形は5mm×5mmとし高さは5mmである。障壁11aの高さは1mmである。尚、ここでは、微小電極2は8μm×8μmの正方形としたが、アガロースゲルによる壁31,32,33及び34の全体と間隙41,42,43及び44の幅とで構成する細胞の収納部となる10μmφの円状の電極としてもよい。
【0029】
以下、本発明の心筋毒性検査装置100の構成例とこれを用いた具体的な計測例を説明する。
【0030】
図4(a)、図4(b)および図4(c)は、細胞電位の計測に関する信号を示す図である。それぞれ、横軸に時間を、縦軸に微小電極2と比較電極2Cとの間に得られる細胞電位を示す。図4(a)は細胞集団10Gの拍動による細胞電位である。ここでは、図1に示す細胞集団10Gの一つから引き出された引き出し線2’Gと比較電極2Cから引き出された引き出し線2’Cとの間の電位である。図に示すように、安定した拍動を示し、ペースメーカーとして機能しうることがわかる。図4(b)は培養液に薬物が含まれない通常状態における標的細胞の拍動による細胞電位である。ここでは、計測の標的細胞を細胞連絡チャネルCCCの細胞10nとし、細胞10nから引き出された引き出し線2’nと比較電極2Cから引き出された引き出し線2’Cとの間の電位が計測されている。図4(a)の波形と比較して明らかなように、細胞連絡チャネルCCCの細胞10による拍動の伝達に要する時間Δtだけ遅れていることが観察される。これに対して、図4(c)は培養液に薬物が含まれた状態における標的細胞の拍動による細胞電位である。ここでも、計測の標的細胞を細胞連絡チャネルCCCの細胞10nとし、図4(b)との比較が明確になるようにしている。図4(a)、図4(b)、の波形と比較して明らかなように、細胞連絡チャネルCCCの細胞10による拍動の伝達に要する時間Δtだけの遅れではなく、時間Δt+αの遅れとなっていることが観察される。これは、細胞連絡チャネルCCCの細胞に対する薬物の作用によるNaイオン阻害の大きさが+αの遅
れの増大として表れていることを意味する。すなわち、心筋細胞に対する薬物の毒性をNaイオン阻害として評価することが出来る。
なお、観察に使用する微小電極を観察電極と言う場合がある。
【0031】
図5(a)、図5(b)および図5(c)は、細胞の拍動に伴う体積変化を光学系によって計測した結果に関する信号を示す図である。図5(a)は細胞集団10Gの細胞の拍動に伴う体積変化である。細胞集団10Gの細胞の一つの拍動を図3に示す形で光学的に検出したものである。細胞の拍動に伴う収縮および拡張がパルス状に現れる変化として認められる。この波形の周期は、図4(a)に示す拍動に伴う細胞電位の変化の周期と同じである。図5(b)は培養液に薬物が含まれない通常状態における標的細胞の拍動に伴う体積変化を上段に示し、下段にこれを電気信号として評価するために時間微分値として処理したときの波形を示す。ここでも、計測の標的細胞を細胞連絡チャネルCCCの細胞10nとし、細胞10nの拍動を図3に示す形で光学的に検出したものである。図5(a)の波形と比較して明らかなように、細胞連絡チャネルCCCの細胞10による拍動の伝達に要する時間Δtだけ遅れていることが観察される。これに対して、図5(c)は培養液に薬物が含まれた状態における標的細胞の拍動に伴う体積変化を評価するための説明図であり、図5(a)、図5(b)に比し時間軸を拡大した形で示す。上段は図5(b)の上段の波形に対応する波形であり、図5(a)の波形と比較して明らかなように、細胞連絡チャネルCCCの細胞10による拍動の伝達に要する時間Δtよりもさらにβだけ遅れが増大していることが観察される。標的細胞の拍動に伴う体積変化が薬物により受ける影響は、この遅延の増大以上に体積変化の傾きが小さくなることが特徴的である。図5(c)の下段に参考波形として示した薬物を含まない培養液での体積変化と比較してみるとこのことがよく分かる。図5(c)の中段には、上段の波形を評価するために時間微分値として処理したときの波形を示す。この時間微分値を図5(b)の下段のそれと比較すると分かるように、ピーク値が小さくなるとともに、傾きが緩やかになっている。これは、薬物により心筋の収縮速度が低下して、心拍出量が低下したことを意味する。すなわち、心筋細胞に対する薬物の毒性を収縮速度の低下として評価することが出来る。
【0032】
図6(a)は培養液に薬物が含まれない通常状態における標的細胞のNa+イオン、Ca2+イオン、K+イオン成分の流入出量に伴う細胞電位変化を示す。図6(b)は培養液に薬物が含まれた状態における標的細胞のNa+イオン、Ca2+イオン、K+イオン成分の流入出量に伴う細胞電位変化を示す。図6(a)、図6(b)を対比してすぐ分かるように、QT遅延が表われて波形が時間軸方向に伸びている。さらにK+イオンの流入出に伴い、波形が大きく変形している。これを電気信号として評価するために、図に破線で示した“0”と“100”の間の値に対して、30%、60%および90%の値の継続時間をAPD30,APD60およびAPD90として検出する。ここで、APDとはAction Potential Durationの頭文字からとった表現である。これらの値の大きさおよび比率を評価すれば、その薬物のNa+イオン、Ca2+イオン、K+イオン成分の流入出量に及ぼす影響を評価できる。
【0033】
図7は、心筋毒性検査装置の細胞を光学的に検出する光学系および可動電極の配置の一例を説明する図であり、例えば計測する細胞10nの拍動の状態を観察する例を示している。12は培養液を示す。22は位相差顕微鏡あるいは微分干渉顕微鏡の光源であり、一般にハロゲン系のランプが用いられる。221は細胞の蛍光計測をするための蛍光光源であり、一般に水銀ランプ、単色光レーザー、LED光源などが用いられる。23は位相差等の実体顕微鏡観察の光源の光から特定の波長のもののみを透過させるバンドパスフィルタであり、231は蛍光光源221から特定の蛍光を励起する励起波長の光のみを透過させるバンドパスフィルタである。例えば細胞10nの拍動堆積変化情報のような形状変化の観察の場合には、細胞形状を計測するための波長の光だけを透過させるバンドパスフィルタ20を通過した像をカメラ21でリアルタイム計測するが、計測に波長700nm近傍の狭帯域の光を用いることで細胞10nの損傷を防ぐことができる。24および241はシャッターで、XYステージ15を移動させる場合など、画像計測をしていない間は光の照射を遮断する機能を有する。25はコンデンサレンズであり、位相差観察をする場合は位相差リングを導入し、微分干渉観察をする場合は、偏光子を導入する。蛍光計測の場合は、例えば細胞内カルシウム放出の計測を行う場合は、励起波長500nm程度、蛍光計測波長600nm程度での光を選択的に透過するバンドパスフィルタの組み合わせを用い、蛍光波長の光だけを選択的に透過するバンドパスフィルタ201を通過した蛍光像をカメラ201で計測する。このとき、細胞ネットワーク中での1細胞単位でのカルシウム放出の時間的前後関係を計測して細胞ネットワーク中での信号伝達の経路を計測する場合には、カメラの計測時間分解能は0.1ms以上の高速連続画像が取得できるものとなっている。XYステージ15上には基板1上に形成されている心筋毒性検査装置100が載置されX−Y駆動装置16によって前記XYステージ15を移動させることで前記心筋毒性検査装置100の任意の位置を観察し、計測することができる。前記心筋毒性検査装置100内の細胞10nの拍動の状態は、対物レンズ17で観察される。対物レンズ17の焦点位置はパソコンPCによる信号に応じて駆動装置18によってZ軸方向に移動させることができる。対物レンズ17の倍率は40倍以上のものが使用できる。対物レンズ17で観察されるのは、光源22から透過された光による細胞10nの位相差像あるいは微分干渉像である。前記バンドパスフィルタ23を透過するのと同波長の光を反射するダイクロイックミラー192およびバンドパスフィルタ20によって、位相差顕微鏡像あるいは微分干渉顕微鏡像のみがカメラ21によって観察される。カメラ21によって観察された画像信号はパソコンPCに導入される。また、この実施例では細胞への刺激を行うための可動電極27が配置されており、可動電極の座標がXYステージと同じ平面上の任意の位置のみならず、高さを任意に調節することができる位置制御機構が備わっている。この位置制御機構を用いて細胞ネットワーク中の特定の1細胞あるいは数細胞の位置に可動電極の先端を移動させることで、任意の特定の細胞あるいは数細胞に刺激を与えることができる。可動電極の素材としては、先端部以外の部分は絶縁被覆されている金属電極、先端の開口サイズが5ミクロン程度以下のガラス電極等の、可動電極先端近傍にある特定の細胞あるいは数細胞のみに電気刺激を与えることができる構成の電極を用いることができる。金属電極を用いる場合は、先端部表面に白金黒などを付加することによって効果的に電気刺激を細胞に伝達することができる。可動電極の先端の位置は、電気刺激に対する細胞の応答の程度によって調整するものとし、細胞に接しても良いし、あるいは、細胞のごく近傍に配置しても良い。また、刺激電極の刺激を適切に標的とする特定の細胞に与えるために電気刺激を与える瞬間にスイッチングによって細胞電位計測のための電極2を接地電極として用いても良いし、あるいは、別途、別の接地電極28を配置しても良い。さらに、特定の細胞を刺激するために、既存の微小電極2を刺激電極として用いても良い。その場合には、微小電極が接続されているスイッチング回路29のスイッチングによって、通常は電気信号計測回路30に接続されているものを、刺激を与える瞬間に、スイッチング切り替えによって、電気刺激回路31に接続をして矩形波の刺激信号を微小電極2に与えることができる。また、上記可動電極27を用いて刺激を与える瞬間には、スイッチング回路29を接地にスイッチングすることができる。他方、可動電極も、刺激電極としてだけでなく、細胞の電気信号を計測する電極として用いたり、接地電極として用いることもできる。その場合は、可動電極はスイッチング回路291に接続されており、細胞電位計測、細胞刺激、接地電極としての利用に応じて、それぞれスイッチングによって、電気信号計測回路301に接続されて細胞電位を計測したり、電気刺激回路311に接続をして矩形波の刺激信号を細胞に与えたり、また、接地させることで、接地電極として用いることができる。電気刺激回路31、311が細胞に与える電気刺激のタイミングは、おもに次の2つの用途で用いることができる。ひとつは自律拍動機能を持った細胞ネットワークにおいて、その正常な心筋細胞ネットワークの拍動インターバルの間に、イレギュラーな刺激を与えるものであり、他方は、自律拍動能を有さない心筋細胞ネットワークに対して拍動インターバルを与えるものである。ともに、計測するのは、拍動インターバルの周期(2つの拍動間の時間差)を5ms単位で徐々に短くしていったときの、細胞ネットワークの応答の変化を追跡できるものである。そのために、電気刺激回路31、311は、電気信号計測回路30、301などによって得られた拍動周期情報を解析して、その結果に基づいて刺激のタイミングを決定するフィードバック制御を行うことができる。さらに、可動電極27を電気信号計測のために用いる場合、本システムにおいて微小電極2が無くても同様な計測ができることとなる。これは、システムに構成されている光学計測によって細胞ネットワーク中の各細胞の拍動周期の計測は可能であることから、この拍動周期が安定状態から不整脈などの不安定状態になることはシステムに配置されている光学計測装置のみで計測し、その結果から必要に応じて、可動電極を用いて特定の細胞の電気的特性のデータを取得するものであり、この場合には、システム上に事前に配置している微小電極数の制約を受けず、光学計測できる範囲で、より自由に大きな細胞ネットワークを構築することができる。
【0034】
図8に、細胞の電気信号の発生の一例について模式図で示した。最初に、細胞膜にあるナトリウムイオンチャンネルからのナトリウムイオンの細胞内への流入が発生し細胞電位が急激に下がり、次に、少しの遅延を経て、カルシウムイオンの流入による細胞電位の低下が起き、そして、次のステップとして、カリウムイオンの細胞外への排出が起きることで細胞電位の上昇が起きる。細胞電位の変化は、心筋細胞膜に存在する応答特性の異なるさまざまなイオンチャンネルの特性の違いによって引き起こされる。それぞれのイオンチャンネルに起因して引き起こされる電位変化のピークの位置を、各イオンチャンネルの特性時間として解析すると、薬剤の影響によって各イオンチャンネルがブロックされることで、その薬剤の特性に応じてブロックされたイオンチャンネルの種類に応じた電気信号の波形の変化を計測することができ、それによって薬剤のイオンチャンネルへの阻害効果を見積もることができる。薬剤の評価に特に重要なイオンチャンネルは、FastNa、SlowNa、Ca、IKr、IKsの4つのイオンチャンネルであり、これら4種類のイオンチャンネルのブロックの状態を計測することができる。
【0035】
図9(a)は、図8で示した細胞の電気信号について、実際にカリウムイオンチャンネルを選択的に阻害する試薬E−4031を様々な濃度で添加したときの変化を示したものである。細胞の電位を上げるKイオンの細胞外への排出機能を担うIKrイオンチャンネルを阻害することから、薬剤濃度が高まるにつれて正方向の細胞電位の変化が徐々に遅延することが分かる。図9(a)に示したのは、細胞の応答の特定の1拍動データであるが、実際には隣接する各拍動での応答のゆらぎ幅の大きさが、薬剤の影響を見積もる重要な指標となる。図9(b)がその一例であり、ポアンカレプロットと呼ばれる隣接する拍動データの相関を比較する解析手法である。ここでは、X軸にn回目の拍動時の特定のイオンチャンネルの応答時間の位置を、Y軸に(n+1)回目の拍動時の同じイオンチャンネルの応答時間の位置を置いたプロットを行う。すると、隣接する拍動同士での特性が同じ場合は、グラフ内の点線で描かれたY=X上にプロットが並ぶこととなるが、隣接する拍動同士での応答に大きな揺らぎがある場合は、Y=Xから離れた位置までの大きなプロットの分布が観測されることとなる。実際に、この例では、薬剤を添加しないControlに対して、40nMの添加では応答時間の遅延があるが、隣接した拍動間での相同性は維持されている。他方、400nMまで薬剤の添加をすると応答時間の更なる遅延に加えて、隣接した拍動間での相同性も崩れ、不安定な拍動周期が発生することとなることが本プロットによって明らかにできる。この結果は、心毒性を示すQT延長計測の結果とも一致しており、ポアンカレプロットによって1細胞レベルでの隣接した各拍動のゆらぎの増大の計測を指標にすることでQT延長の発生を見積もることができる。この現象は、特定のイオンチャンネルが薬剤によってブロックされたときに、そのブロックの程度が軽微な場合は、イオンの排出能力の低下という現象が見えるだけで細胞応答の不安定性はまだ発生しないのに対して、さらに、ブロックの程度が重度になると、機能しているイオンチャンネルの数が極端に減少して、そのために細胞のイオン排出能力について同じ細胞でありながら再現性の低い大きな揺らぎを持った結果が出てくることとなる。そして、このゆらぎの大きさがQT延長の発生し易さの指標として用いることができるものである。
【0036】
図10(a)は、1細胞レベルでの細胞配置技術を用いた心筋細胞の環状ネットワークによるリエントリー回路薬剤の一例を示す模式図である。心筋細胞のみで細胞の環状ネットワークを作成したものは、正常ネットワークモデルとなり、心肥大などの病理モデルの場合には、細胞ネットワークの中に線維芽細胞を組み込むことで実現される。そして、ネットワーク中に混在する線維芽細胞が心筋細胞ネットワークの伝達速度の遅延や減衰をもたらし、その結果、期外収縮の発生を予測することができる。図10(b)は、実際に微小電極上に心筋細胞を配置した一例を示す顕微鏡写真である。実際に、この写真に示したように、1細胞単位で微小電極上に配置された場合は、隣接した心筋細胞同士の信号伝達の遅延を計測することができる。そして、この伝達速度は拍動のときに発生する最初の電気信号の大きさに依存することから、Naイオンチャンネルへの阻害効果として、この信号伝達の遅延データを用いることができる。
【0037】
図11(a)は、一定の幅の細胞集団を用いて心筋細胞の環状ネットワークによるリエントリー回路の一例を示す模式図である。図10に示した1細胞単位での環状細胞ネットワークでは、心筋細胞の拍動信号はその通過について一意的であり、図9に示したような細胞自体の拍動のゆらぎが無い限り、同一の特性を維持して細胞は拍動信号を隣接細胞間で伝達する。他方、この図11で示したように、一定の幅で細胞を配置して環状ネットワークを形成した場合、細胞集団はその伝達について実線35、破線36、点線37のように拍動ごとに異なる経路を取る自由度を持つこととなる。特に、図9で説明したように、薬剤の添加によって各心筋細胞の応答特性に大きなゆらぎが発生すると、容易に応答する細胞が環状ネットワークを刺激信号が周回するたびに、その都度異なることから、経路の違いがより顕著となる。これはスパイラル・リエントリーと呼ばれる心臓の致死に至る期外収縮の機構と同じメカニズムとなることから、このような幅を持った細胞集団ベースでの環状ネットワークを特に用いることでスパイラル・リエントリーの計測が可能となる。図11(b)は実際に微小電極上に細胞集団を配置した一例を示す顕微鏡写真であり、心筋細胞60%程度に線維芽細胞40%程度を混ぜた細胞集団を配置している。実際に、このような配置を行うと、隣接電極間での伝達速度の隣接拍動間でのゆらぎは大きくなり、特に薬剤の添加によって、そのゆらぎの増大が顕著となることから、隣接拍動間での伝達速度のゆらぎ幅の変化からスパイラル・リエントリーの発生を見積もることができる。図11(c)は、さらに実際に微小電極アレイ上に環状に細胞集団を配置した一例を示す顕微鏡写真である。実際のスパイラル・リエントリーの計測には、図7に示した高速蛍光計測カメラを用いることで、細胞集団ネットワーク中での各細胞のカルシウム発火を1細胞レベルで見積もることができ、その結果として細胞の信号伝達がどのような経路で進んでいるのか、各周回での経路の変化を実際に解析することができる。
【0038】
図12(a)は環状電極を用いたリエントリー回路計測装置の一例を示す模式図である。この例では、1〜3mmの直径のリング状に形成した電極幅50〜100ミクロンの環状電極38を各96穴ウエルプレート42の底面に1つ配置し、電極表面にのみ41のように細胞集団が環状に配置されるように、電極上の除く周囲の底面については、表面にアガロース等の細胞接着性の無い素材をコートしている。この細胞が接着しないようにコートされた領域に、同心円状に参照電極リング39が配置されており、また、試薬の出入りが行える流路40が配置されている。このような電極を用いることで簡易に心筋細胞の異常拍動を簡便に計測することができる。図12(b)は実際に電極で計測した、正常拍動データと異常拍動データを示したグラフである。本実施例では、環状電極を用いたが、図7で示した光学計測システムを用いることで、本環状電極による効果と同じ、異常拍動を光学的に計測することができるシステムを構築することができる。その場合、電気的信号を計測する場合には、図7で示した移動電極を環状細胞ネットワークに接触させることで、電気信号も取得することができる。
【0039】
図13(a)は1細胞の電位計測を行う微小電極2と細胞の配置の一例を示す模式図であり、直径10ミクロンから50ミクロンの微小電極2上に、計測の対象となる細胞を1細胞だけ配置して計測する手法を示したものである。本実施例でも、他の実施例と同様、電極上の細胞がその場所に保持されるように電極周囲には、細胞接着性を阻害するアガロースなどの素材がコートされている。図13(b)は実際に微小電極2で計測した孤立1細胞の電極上の写真とその拍動電気データを示したものであるが、孤立した一細胞の信号は不安定でありグラフに示したように大きなゆらぎを持って拍動している。他方、図13(c)で示したように、微小電極2上には、図13(b)と同様に1細胞が配置されているが、他の細胞と連結された細胞集団となることで、拍動信号グラフを見てもわかるように、拍動周期の安定性が実現される。実際の1細胞レベルでの拍動計測では、図9でも示したように、隣接した各拍動間のゆらぎの大きさが指標となることから、本実施例で示したような、細胞集団化による安定化を実現しながら、1細胞の拍動データが取得できるように、特定の計測したい1細胞のみ微小電極上に配置され、この特定細胞の安定性を維持するために他の心筋細胞を電極上には載らない形で配置されている構成を用いた計測システムが有用である。
【0040】
図14は、本発明でカメラ受光素子を1細胞の電位計測に用いた実施例を説明する模式図である。通常、カメラ受光素子は、光電変換面で光信号を電気信号に変換して、この電気信号を計測に用いるものであることから、この光電面を除去して、電気信号アレイ部分を用いることで、2次元での電気信号を取得することが可能となる。これによって、1細胞レベルでのサイズの電極アレイを用いることができるため、例えば細胞集団の中の各細胞の電気信号を同時に計測することが必要な、図11で示した一定の幅を持つ細胞集団ネットワーク中での信号伝達経路の変化というスパイラル・リエントリーの発生を計測することが可能となる。実際の計測では、画素の計測インターバルは1万分の1秒程度必要であり、1万分の1秒のシャッタースピードの高速カメラのカメラ受光素子を利用する必要がある。この場合、取得された細胞の信号データは、既存のカメラで用いられている画像処理技術をそのまま適用することができ、画像処理用のFPGAを用いた実時間処理が可能となる。また、その実時間処理によって得られたデータに基づいて刺激電極へのフィードバック刺激を行うことも可能となる。
【0041】
図15は、本発明の細胞計測システムで複数試料を計測できる機構の一例を説明する模式図である。この実施例のシステムは、分析モジュール、多段インキュベーター、電気解析モジュールとオンラインネットワークで接続されたオンライン解析モジュールとからなる。ここで、分析モジュールには、細胞形状の変化を計測する位相差顕微鏡あるいは微分干渉顕微鏡、そして蛍光顕微鏡とカメラ撮影解析による光学的計測、アガロースを顕微鏡システムを利用してミクロンのスケールで局所溶解できるアガロース加工技術からなっている。多段インキュベーターには、複数の細胞培養槽が配置されており、また、細胞培養槽の中には微小電極チップが配置されており、各細胞の電気信号の計測、電気的刺激がインキュベーター中で並列で連続処理できるようになっている。得られた電気信号については、電気解析モジュールで実時間計測を行い、そのデータはオンラインアクセスが可能なストレージに、光学計測のデータと電気計測データの結果が同じ時間スタンプを持った形で記録されており、この記録データにオンラインで解析モジュールが適宜アクセスすることで解析することができる。
【0042】
図16は、本発明の細胞計測システムで計測できる心臓情報を説明する模式図である。微小電極上での1細胞の電気信号計測によって、Na、Ca、IKr、IKsなどのイオンチャンネルの信号データを計測することができ、隣接する心筋細胞間での信号伝達の速度変化の計測からNaイオンチャンネルの阻害を計測することができる。また、1細胞の形状変化の光学計測によって不整脈の発生の計測および心臓の拍出量の見積もりができる。さらに、環状に細胞ネットワークを配置することによってリエントリーの発生を計測することができ、さらに線維芽細胞を細胞配置に加えることで心肥大などの病理心臓モデルとしての計測がすることができる。
【0043】
図17は、本発明の細胞計測システムにおいて、自律拍動している心筋細胞から取得される細胞のフィールド・ポテンシャル(FP)信号波形の薬剤添加に対する変化の一例を例示するグラフである。細胞のフィールド・ポテンシャル信号波形は、図8に示したように細胞に流入するイオン、流出するイオンによって発生する細胞電位の変化を示すものであり、細胞電位の微分値、すなわち単位時間当たりのイオン電流の流れの総和であり、この場合、脱分極に至るプロセスでのナトリウムやカルシウムなどの内向きイオン電流が負に、それに続く再分極プロセスでのカリウムなどの外向きイオン電流が正に取られている。通常、この細胞のFP信号波形については、この図17に示すように隣接する各拍動についての相互の違いに着目するより、複数の隣接する波形を平均化してノイズ成分や隣接した各波形の違いなどの影響を排除した平均値としての1つのFP波形を抽出し、その平均値を反映した1波形の詳細解析によって各イオンチャンネルの状態を見積もるために用いている。しかし、本発明では、隣接するFP信号波形の平均値を取得するのではなく、隣接するFP信号波形の違いのうちイオンチャンネルの応答のゆらぎに依存する部分を比較抽出して、このゆらぎの大きさに基づいてイオンチャンネルのブロックされた量を定量的に推定するものである。これについては、一般にゆらぎの大きさが要素nの平方根の逆数[1/(n)1/2]で示されることから、その意味を理解することができる。すなわち、細胞表面にあるイオンチャンネルの数が、例えば104個機能している場合には、イオンチャンネルの総和としての機能のゆらぎの大きさは1%[1/(104)1/2]となるが、薬剤によってブロックされることで102個まで機能しているイオンチャンネルが減少すれば、その機能のゆらぎの大きさは10%[1/(102)1/2]と急激に増加し、隣接するFP波形は大きな変化を発生させることとなる。すなわち、隣接するFP波形の変化を比較してゆらぎの大きさを見積もることができれば、このゆらぎの大きさからブロックされたイオンチャンネルの総量を見積もることができるのである。
【0044】
この隣接する波形の変化について、特にカリウムイオンの放出によって発生する外向きイオン電流のピークの場所に着目し、例えばナトリウムイオンの細胞内への流入時間を基準(ゼロ)とし、その時間からカリウムイオンの放出のピークまでの時間をフィールド・ポテンシャル・デュレーション(FPD)として定義すると、このFPDの長さの変化は、ナトリウム、カルシュウム等のイオンの出入りに続くカリウムイオンの流入のピークの値となるため、細胞が持っているさまざまなイオンチャンネルが薬剤によってブロックされたことで発生するイオンの出入りの変化の総和としての変化量の指標として着目することができ、また、このFPDの位置のゆらぎは、すべての関係する細胞のイオンチャンネルの隣接するFP波形のゆらぎの総和を反映したものとなる。実際に、図17のFPDの位置(赤矢頭の位置)を確認すると、カリウムイオンチャンネル阻害剤であるE4031の添加によってFPDは添加前には425-450msの間であったものが、10nMの添加で642-645ms、100nMの添加で663-694ms、1μMの添加で746-785msというように阻害剤の添加によって単調にFPDの値は増加してゆき、また、隣接するFPDは同じ値ではなく、ゆらぎを反映した異なる値を取ることとなる。
【0045】
図18は、実際にカリウムイオンチャンネルを特異的に阻害する機能を持つ薬剤E4031によって細胞のカリウムイオンチャンネルが阻害されたときのFPDの延長についてE4031濃度依存の実験結果の一例を示したものである。ここでは、カリウムイオンチャンネルの阻害によってイオンの流出が遅延し、FPDが濃度依存的に延長することが推測できる。この実験結果について、同様に上記ゆらぎ計測をする場合を考える。
【0046】
図19は一般に心電図の拍動ゆらぎを計測するポワンカレプロッティングを、FP波形におけるFPDの値の評価に用いてFPDのゆらぎに着目した場合の、隣接した拍動のFPDがどの程度、相同状態からずれたかを見積もる手法の着目点のうち、隣接する拍動の揺らぎの大きさ(短期変動:STV: Short-term variability)の見積もり方を説明するものである。図19(a)において、X=Yとなる対角線は、隣接した拍動FPDnとFPDn+1がまったく同じFPDの大きさを持つ場合に位置するものとなり、2つのFPDの差(FPDn+1−FPDn)の大きさの対角線からの鉛直距離が基準化された隣接拍動自体のゆらぎの大きさとなり、特にk個のサンプリング数に対しては、図19(b)に示す(式1)のような数式で評価することができる。
【0047】
他方、図20はポワンカレプロッティングを用いてFPDのゆらぎに着目した場合の、隣接した拍動のFPDがどの程度、相同状態からずれたかを見積もる手法の着目点のうち、隣接した各拍動が拍動の平均値(すべてのサンプルの総和でイオンチャンネルの応答の理想値に相当)からどれだけずれているかという観点での拍動の揺らぎの大きさ(長期変動:LTV: Long-term variability)の見積もり方を説明するものである。図20(a)において、X=Yとなる対角線上に配置されたFPDの平均値FPDmeanと隣接した拍動FPDnとFPDn+1それぞれとの距離の2つのFPDの差[(FPDn+1−FPDmean)+(FPDn−FPDmean)]の大きさの対角線からの鉛直距離が基準化されたものでFPDの平均値からのゆらぎの大きさとなり、特にk個のサンプリング数に対しては図20(b)の(式2)のような数式で評価することができる。これはX=−Yの対称性からのずれを示しており、この大きさによって拍動が単なる平均値まわりのゆらぎを行っているのか、あるいは、履歴を持っているものかを見出す指標とすることができる。
【0048】
図21には、実際にE4031を段階的に添加したときの心筋細胞の応答の一例をポワンカレプロッティングで示したFPDのゆらぎと、そのゆらぎを定量的にSTVとしてまとめたものである。イオンチャンネルがE4031の添加に応じてブロックされてゆくことがFPDの時間の長さの延長によって推定されるとともに、特に高濃度の添加によって急激にSTVの値が増加することがわかる。
【0049】
図22は、X軸に従来のQT延長計測に当たるFPDの延長が心筋細胞を用いて観察された割合(%)を、Y軸にはSTVの増加が観察された割合(%)を取り、心毒性があることが知られている薬剤、心毒性が無いことが知られている薬剤について評価を行ったものである。従来の薬剤の毒性検査については、X軸にあるFPDのデータの結果のみによって評価していたが、Y軸にあるSTVの結果を加えて評価を行うと、図からもわかるように2次元のグラフ上のマッピングの中で、心毒性が高い高リスク(High risk)、リスクが低い(Low risk)、リスクなし(No risk)の3つの領域の中に、既知の文献結果と同じ分布をすることがわかる。このことから従来のFPDに加えてSTVを加えることで薬剤の心毒性の可能性についてより的確にかつ容易に推測を行うことが可能となることがわかる。
【0050】
図23は薬剤の添加に対するFPDについてのSTVの応答の違いを示したものである。図23(a)では、その一例として環状に心筋細胞ネットワークを構築した場合の局所のFPDのポワンカレプロッティング(A,B)、ならびに2次元に拡がった心筋シートを構築してその局所のポワンカレプロッティング(C,D)を計測した結果を(b)に示す。この例ではペーメーカー領域PMからB,Dは近傍、A,Cは遠方に位置している。(b)において薬剤添加前には、ポワンカレプロッティングのX=Yの対角線上に分布していたFPDは、低容量の心毒性薬剤添加によって、環状モデル(A,B)ではともに大きなゆらぎが発生しSTVの増加が観察されるが、2次元シートモデル(C,D)ではほとんどゆらぎが発生しない。また中容量の薬剤添加に対しては、環状モデル(A,B)では拍動が細動状態あるいは停止状態に移行するが、2次元シートモデル(C,D)ではPMから遠方の領域CでSTVの増加が見られるが、近傍の領域Dでは、まだSTVの増加量は領域Cより低いことが観察される。この例でもわかるようにFPDのSTV計測による薬物の心毒性の予測に対しては2次元シート状の細胞集団(ネットワーク)より、ペースメーカー領域から線状に配置された細胞集団(ネットワーク)が、より正確に薬物の影響を反映させることがわかる。
【0051】
図24は薬剤の添加に対するPM領域からの拍動刺激の伝達速度(V)についてのSTVの応答の違いを示したものである。これは、心毒性としておこるトルサードポワンツ(TdP)は心筋細胞組織での伝達異常であることから、実際にPM領域からの伝達速度がどの程度のゆらぎとして発生するかを確認することで薬物毒性を見積もる手法である。この場合にはSTVの定義については図24(c)の(式3)に示したように、FPDに変わって、PM領域からの伝達時間T(あるいはPMからの距離をこの伝達時間で割った、その観測点での見かけ上の伝達速度V)を用いて計測することとなる。LTVについても定義はSTVと同様にFPDを、TあるいはVに変更したものとなる。図24(a)では、その一例として環状に心筋細胞ネットワークを構築した場合の局所の伝達時間Tのポワンカレプロッティング(A,B)、ならびに2次元に拡がった心筋シートを構築してその局所のポワンカレプロッティング(C,D)を計測した結果を図24(b)に示す。この例でも図23と同じくペーメーカー領域PMからB,Dは近傍、A,Cは遠方に位置している。図24(b)において薬剤添加前には、ポワンカレプロッティングのX=Yの対角線上に分布していたFPDは、低容量の心毒性薬剤添加によって、環状モデル(A,B)ではともに大きなゆらぎが発生し伝達時間の大きなゆらぎを示すSTVの増加が観察されるが、2次元シートモデル(C,D)ではほとんどゆらぎが発生しない。また中容量の薬剤添加に対しては、環状モデル(A,B)では拍動が細動状態あるいは停止状態に移行するが、2次元シートモデル(C,D)ではPMから遠方の領域CでSTVの増加が見られるが、近傍の領域Dでは、まだSTVの増加量は領域Cより低いことが観察される。この例でもわかるように伝達時間T(あるいは各局所での見かけの伝達速度V)のSTV計測による薬物の心毒性の予測に対しては2次元シート状の細胞集団(ネットワーク)より、ペースメーカー領域から線状に配置された細胞集団(ネットワーク)が、より正確に薬物の影響を反映させることがわかると同時に、より効果的に空間配置依存的なゆらぎの発生を計測できることがわかる。
【0052】
図25は、本発明の心筋細胞ネットワークで各心筋細胞から電気的FP波形を取得するときの、そのFP波形と従来のin vitro計測技術(例えばパッチクランプ法)、従来のin vivo計測技術(例えば心電図)との関係を模式的に図示したものである。本発明の細胞のFP計測で得られた波形は、細胞から出入りする単位時間当たりのイオン流の大きさを示すものであり、細胞の電位変化情報(電気的にはイオン電流)となり、これは、従来の細胞ベースでのin vitro計測で得られる細胞電位とは、図25に描いているように微分・積分の関係となる。次に、各細胞(あるいは細胞ネットワークの局所)から得られた1電極から計測したFP波形を、細胞ネットワークの複数の領域に配置した複数の電極から得られた各々のFP波形を重ね合わせることで細胞ネットワークの合成FP波形を得ることができるが、これは心臓から得られる電位変化信号波形である心電図のうち心室組織部分の応答にあたるQT領域の心電図データと相同性を持っているものである。
【0053】
図26は、上記、図25で説明を行った従来の技術で計測した情報と、本発明の装置で得られたFPデータとの相関関係を見積もるための装置システムの構成を模式的に示したものである。1細胞あるいは細胞ネットワーク上の局所のFPを計測できるように配置された複数の微小電極から1電極単位で取得したFPデータを集積し、その各FPデータを微分して細胞電位を見積もることができる機能を有する演算回路、あるいは、各電極データを重ね合わせることによって、心電図の心室部分の心電図波形(Q−T部分)との比較ができる演算回路を有するものである。特に、重ね合わせ回路を用いて単一の電極のFPデータを解析するだけでなく、例えば直列に配置された細胞ネットワーク上に等間隔で配置された複数の微小電極アレイのデータを合成することは、各電極上の細胞のFPの結果のみならず細胞間を伝達する状態を反映したデータを表示することとなり、特に、心筋細胞間の伝達異常である不整脈を見積もる上では、伝達の異常が合成FP波形に反映されることから、この重ね合わせ回路の結果を期外収縮発生の直接予測機構に情報を移動させて、この結果から心電図解析と同様な予測が可能である。他方の微分回路から得られる細胞電位データについても細胞電位依存的に活性化状態が異なるイオンチャンネルの状態を見積もるために用いられる。
【0054】
図27および図28は、実際に上記図26で述べた演算回路によって各電極からのFPデータを重ね合わせた例を示したものである。図27では、図27(A)に示したように心筋細胞ネットワークが環状に配置されており、そのネットワークに沿って一定間隔で微小電極が配置されている。ペースメーカー(PM)領域が電極R1の位置にある環状心筋細胞ネットワークにおいて拍動シグナルがR2→R8、あるいはL1→L8に伝達するところが図27(B)の各電極のFP波形で見ることができる。そしてこれを重ね合わせた波形が下Sの波形となる。図27(C)は、実際に長期で計測して合成した結果である。これが実際の心電図のQT領域の波形を推定するために必要な、FPの伝達情報が含まれた合成FP波形となる。この図からもわかるようにPM領域から正常に拍動シグナルが伝達する場合には、図27(C)からもわかるように合成波形もなめらかな波形となる。他方、図28は図28(B)からもわかるようにPM領域からの拍動シグナルが規則正しく伝達しなくなる不整脈状態になると、合成FPとなるSも非常に乱れた波形となり、心電図に相当する図28(C)でも不整脈と同様な形状の波形が合成FP波形としてみることができる。ここで特記すべきことは、図28(B)の各微小電極の1電極データのみから不整脈を予測する場合には、観測する電極によっては(例えばL5)顕著な不整脈の発生を予測することは難しく、図28(B)Sあるいは図28(C)に見られるように合成FP波形とすることでより的確に予測することが可能となることがわかる。
【0055】
図29は、心筋細胞の拍動周期に対するFPDの大きさの関係を示したものである。黒丸は、いろいろな自律拍動を持つ心筋細胞でのFPDを本発明の装置システムで計測した結果である。この結果からもわかるように、細胞はその拍動周期に依存してFPDの値を変化させることがわかる。これは自律拍動を用いた心筋細胞による計測を行った場合に、薬剤によって細胞の拍動周
期が変化したり拍動停止したり、あるいは不安定化したときに、この副作用によって本来のイオンチャンネルのブロックではない原因によってFPDが変化する可能性があることを示唆している。また、赤×印は強制拍動によって細胞の拍動周期を強制的に変化させたときのFPDの値を示しており、外部からの連続刺激によって一定時間以上、一定の拍動周期を維持すれば、安定したFPDとなることがわかる。
【0056】
図30は、実際に自律拍動をしている心筋細胞に本発明のシステムを用いて外部から強制拍動刺激を与えたときの心筋細胞のFPDの時間変化の一例を示したものである。この例でもわかるように、自律拍動インターバルが4秒程度であった細胞が1Hzの強制拍動刺激を与えると直後からFPDの値が大きく変化し、刺激開始後およそ30秒ほどで550msの位置で安定化することがわかる。また強制拍動刺激終了後においても異なる自律拍動周期を持ち、また、FPDが徐々に長くなってゆくことも見ることができる。これらの結果からもわかるように、強制拍動刺激を与え始めてからFPDが安定化するまでの刺激開始後30秒後以降に、薬物毒性検査をすることが望ましい。
【0057】
図31は、実際に本発明のシステムを用いて外部から強制拍動刺激を与えてFPD、あるいは伝達時間T、あるいは伝達速度Vを計測する場合の細胞配置の例を示すものである。図31(a)は、少なくとも2つの微小電極を覆うように配置された細胞集団を用いた刺激計測の例である。刺激電極から例えば毎分60拍の一定のインターバルの強制刺激信号を与えながら隣接する計測電極で細胞のFPD、あるいは刺激電極の刺激時間から計測電極上の細胞までの拍動信号の伝達時間T,あるいは計測電極上の細胞までの伝達速度Vを計測するものである。図31(b)は、直線状に配置された心筋細胞ネットワークの端点に配置した刺激微小電極によって強制刺激拍動を与え、この伝達について、一定の間隔で心筋細胞ネットワークに沿って配置された微小電極アレイによって、各電極上の心筋細胞のFPD,T,Vを計測し、刺激電極の刺激信号に対する各電極のデータのみならず、各記録電極のFPの合成FPによる不整脈発生の予測、各電極間でのTとVの関係などについて見積もることができる。ただし、ここで示したのはあくまでも細胞配置の一例であり、上記、図27で示した環状細胞ネットワークのPM領域に強制拍動を与えて同様の計測をすることもできるし、あるいは、刺激電極上の細胞をこの刺激電極を計測電極として用いることで、最小細胞数でのFPDの計測をおこなうことも可能である。
【0058】
またここまでのすべての実施例について、心筋細胞ネットワークについては一部心筋のみについて言及したが、繊維芽細胞を生体組織と同様な性質となるように添加することが含まれるものである。
【0059】
図32は、微小電極2上に配置された細胞のFP計測を行うために、電極2の電位を一定に保つ電位クランプ型のフィードバック制御機構を用いることができることを模式的に示したものである。ここでは、細胞のFPは、従来の電極からの信号を増幅して計測するのではなく、電極2の電位を保つために外部の電源から供給される電流をモニターして、この結果を実時間で解析することで見積もるものである。ここで一定に保つ電位としては、通常はゼロを選ぶが、脱分極電位を変化させるなどの細胞状態を変化される場合には、電位を異なるものに調整することも可能である。
【0060】
図33は、実際にヒトES細胞から心筋細胞に分化させた細胞集団の一部領域に上記記載の本発明のシステムを用いて強制拍動刺激を与えた時の、細胞集団の拍動周期の変化を計測した結果の一例のグラフである。このグラフからもわかるように、正常な心筋細胞集団では、この例のようにたとえば0.6Hzから1.8Hzの強制刺激を与えた時に、この範囲のすべてにおいて線形に、強制刺激に応答して拍動が追従することがわかる。
【0061】
図34(a)は、実際に強制拍動刺激を与えたところで細胞集団の拍動がその強制拍動刺激のインターバルと同じ周期になることから、この強制拍動刺激状態での心筋細胞集団のFPの波形の変化とFPDの長さの変化を示したものである。グラフからもわかるように、強制拍動刺激インターバルを早くすることでFP波形が変化し、FPDの長さが短くなることがわかる。そこで図34(b)に示したように、このFPDの変化をグラフで示すと、この短縮が、強制拍動インターバルの周期(RR)に依存することから、この補正関係について、既知のヒト心臓においてのQTインターバルの長さと心拍との関係の研究(Patrick Davey, How to correct the QT interval for the effects of heart rate in clinical studies. Journal of Pharmacological and Toxicological Methods 48 (2002) 3 - 9)からFredericiaの補正、すなわち拍動の速さの違いによってQTの長さが変化してしまい相対比較できないことから、拍動周期が毎分60拍の心筋拍動時のQTの長さ(QTC)に補正するためにQTC=QT/(RR)1/3として換算するもの、あるいは、Bazettが提唱したQTC=QT/(RR)1/2として換算するものに一致するかどうかが重要となる。これは、上に説明したようにin vivoでのQTの長さは、本システムで計測する細胞ネットワーク全体で計測したFPDの長さの重ね合わせに相当し、それは、すなわち各細胞のFPD自体が、上記、FredericiaあるいはBazettの補正の範疇に入るべきであることを示唆しているが、実際に、図34(b)の結果は、QTC=QT/(RR)1/2.5 となっており、FredericiaあるいはBazettの補正の間にあることがわかる。また、図35は図33および図34のグラフに示したデータを表にしたものである。
【0062】
これらの結果は、実際にスクリーニングや再生医療で使用する心筋細胞の品質の確認に、心筋細胞に対して強制拍動刺激を与えたときの心筋細胞の応答を計測することで対応できることを示している。すなわち
1)心筋細胞あるいは心筋細胞集団に対して強制拍動刺激を与え、細胞あるいは細胞集団がその強制拍動刺激に応答して強制拍動刺激と同じインターバルで応答するかどうかを確認し、かつ、その応答がどの強制拍動刺激の周波数の範囲で対応するかどうかを計測し、拍動が追従できることを確認することで健全な心筋細胞である十分条件の一つを満たしていると判断すること、あるいはさらに具体的に、この応答の追従がたとえば少なくても1.8Hzまで追従することで健全な心筋細胞である十分条件の一つを満たしていると判断すること。
2)上記、強制拍動刺激インターバル(RR)に対して細胞の拍動の追従が確認できた周波数の範疇で、強制拍動刺激に対するFPDの変化が、FPD/(RR)1/3からFPD/(RR)1/2の間にあることを確認することで健全な心筋細胞である十分条件の一つを満たしていると判断すること。
【0063】
上記手順を用いることで、心筋細胞の品質の管理が可能となる。健全な心筋細胞とは、安定した拍動を行うことが可能な細胞である。ここで評価対象となる細胞集団については、分化誘導を行った細胞集団をそのまま用いても良いし、あるいは、分化誘導を行った心筋細胞を分散し1細胞単位で計測評価しても良いし、あるいは、これら分散した心筋細胞を再度細胞集団化して計測しても良いし、あるいは、これら分散した心筋細胞をヒト心臓由来の線維芽細胞と混合して新たな細胞集団として計測評価しても良い。
これらの心筋細胞は、心筋毒性検査に使用することができる。
【0064】
図36(a)は、細胞信号のノイズを電子回路的に低減するために、細胞10が載っている微小電極2と、この微小電極2の近傍に配置された細胞が載っていないむき出しの比較電極2cとの間の電位の差分値を出力する回路を模式的に示したものである。実際に、この回路を図36(b)に示すように、増幅回路の初段に組み込むことで、図36(c)に示したようにノイズが特定の周波数に依存せず低減されることが分かる。このとき、比較電極2cの微小電極に対する位置はより近傍であることが望ましく、たとえば50μmの距離に配置されているものは十分な機能を果たすが1mmの距離までノイズ低減の機能をもたらすことができる。
【0065】
図37は、本発明の心毒性評価の総合的評価法の例を模式的に示した図である。特定の濃度の薬剤を添加した後の心筋細胞の細胞電位計測の結果から得られたFPDの値について、まずFPD延長の程度の集計結果をX軸上の値とし、さらに上述のFPDの時間的ゆらぎの大きさをポワンカレプロッティングからSTVとしてY軸上の値とし、この結果をプロットする。図37(b)は、様々な薬剤についてその結果X-Y図にプロットしたものの一例である。図からわかるように、FPDの延長とゆらぎ(STV)の増大が小さい領域にある薬剤は、QT延長はあるが心毒性は無いと判断でき、FPDの延長とゆらぎ(STV)の増大が同時に起こる場合(X-Y図面で右上)にTdPなどの心毒性があることを予測することができる。
【0066】
図38は、実際に心毒性を計測するためのシステムの構成の一例を示した模式図である。この実施例のシステムは、送液部、細胞培養計測部、細胞解析・刺激部からなっている
【0067】
送液部は、細胞培養計測部の中で培養している各細胞培養チャンバーに培養溶液を連続して送液するシリンジポンプ系あるいはペリスタポンプ系あるいはHPLCポンプ系によって送液することができる。また、送液部の配管の外周には温度調整用の抵抗加熱用配線を巻き付け管内の液温を微小K型熱電対やサーミスタ等の熱検知機構で連続モニターすることで、導入する液温を制御する抵抗加熱の程度を調整して、つねに一定の温度での溶液が導入されるようになっている。また、この送液部には、試験する薬剤を添加するために合流配管や切り替え配管などの機構が配管中に配置されており、これによって希望する濃度の薬剤を各細胞培養チャンバーに導入することができる。また、導入される薬液の濃度を定量的に確認するために、液の導入管の一部が光学的に透明であり波長280nmから800nmの範囲で吸光分光計測によって、定量的な評価が可能な機構が付加されていることが望ましい。また、同様に廃液についても廃液管の一部が光学的に透明であり波長280nmから800nmの範囲で吸光分光計測によって、定量的な評価が可能な機構が付加されていることが望ましい。また薬液の制御温度としては、人体の正常温度に近い温度が通常望ましく、その観点からセ氏30度から45度の範囲での温度制御ができることが望ましい。
【0068】
図39は、本発明の心毒性を計測するシステム中の細胞培養計測チャンバーの構成の一例を示す模式図と写真である。複数の細胞電位計測電極が配置された多電極基板4201(図40を参照)は、培養液の導入機構・排出機構が配置された細胞培養容器4202が接着しており、同時に8検体の計測が可能な細胞培養計測プレートとなっている。図40に細胞培養計測プレートの断面を模式的に示しているように、この細胞培養容器4202において、溶液の導入口は、多電極基板4201に一番近い底面に扇状に広がる形状で配置されており、他方、液の排出機構は、上部の液面の高さ4204を決める位置に液面の界面の方向と同じ向きに扇状に展開している。
【0069】
図41は、多電極基板に配置されている電極配置の電極配線の構成を模式的に説明する図である。本発明では、細胞の形状を観察するために、電極にITOなどの透明電極を用いているが、透明電極の特性として通常の金属電極に比べて高い抵抗値を持っているため、特に多電極基板がプレートなどの大きなものとなると、配線が長くなりインピーダンスが非常に大きくなる。これを回避するために、透明電極上に金属レイヤーを透明電極と同じ配線で配置すれば、金属電極の導電性によって抵抗値を下げることができる。実際には、細胞を培養する領域では、光学的観察をすることからガラス基板4301上の透明電極4302を用いた配線を配置しており、細胞観察をしない領域では透明電極に重なるようにその上に金属レイヤー4303が配置されており、その上面が絶縁膜で被覆されている。ここで用いる金属電極素材としては、たとえば金、プラチナ、チタン、銅、アルミ二ムなどを用いれば良い。
【0070】
図42は、多電極基板上の電極配置の例を示した模式図である。まず、図42(a)では、細胞培養領域4404に直列に配置した心筋細胞ネットワークの一端を局所刺激する刺激電極4401と、この刺激電極によって刺激された心筋細胞の興奮伝導を計測する計測電極4402と、ノイズ除去のための参照電極4403が配置されている。各計測電極4402から得られた心筋細胞ネットワークの複数の局所応答の結果を計測することができるとともに、伝達速度のゆらぎを各計測電極間の伝達毒度の比較解析をすることで求めることができる。図42(b)では、計測電極が一直線に繋がっているものであり、この構成にすることで、心電図のST領域(心室領域)の心電図波形と同様な波形を計測することができる。図42(c)では、上記、図42(b)の一部を切り離して、局所の心筋細胞のFP波形を取得することを容易にしたものである。図42(d)は、リング状電極の上にリング状に細胞を配置して計測するための電極配置の一例である。これらは図11、図12に示したようにリング状に配置した心筋細胞ネットワークを計測するものであるが、リング状の計測電極の一部を欠損させ、その部位に局所強制刺激を与えるための刺激電極を配置し、また、ノイズ除去のための参照電極を配置している。さらに図42(e)では、計測電極も分割して、局所心筋細胞の応答を計測することが可能な配置となっている。
【0071】
図43は心筋細胞の力学特性と電気特性を同時計測する本発明のシステム構成の一例を示した模式図である。本システムは、(1)細胞集団を培養することができ、かつ、集団中の微小領域の細胞電位データを取得できる複数の微小電極が基板上に配置された細胞ネットワークチップと、(2)このチップを固定し細胞刺激・細胞電位計測システムと電気的に接合するチップマウンター、(3)培養する細胞集団の温度や湿度、酸素濃度、二酸化炭素濃度などの環境を制御することができる環境制御容器、(4)細胞集団中の特定の心筋細胞に刺激を与え、また、細胞集団中のさまざまな微小領域の細胞電位を同時連続計測できる微小多電極電位計測システムと、(5)上記、細胞ネットワークチップ中の心筋細胞集団の表面、あるいは細胞集団の中に混入させて培養することによって細胞集団中に配置された粒径が最小で約0.1、0.2μm、0.3μm、0.4μm、0.5μm、0.6、0μm.7μm、好ましくは約0.8μm、より好ましくは約0.9μm、最も好ましくは約1μmから、最大で約500μm、400μm、300μm、好ましくは約200μm、より好ましくは約100μm、最も好ましくは約50μmまでのサイズのポリスチレン微粒子やガラス微粒子、金微粒子などのプラスチック・高分子・ガラス・金属微粒子等の心筋細胞とは輝度や複屈折率が光学顕微鏡によって容易に識別することができる心筋細胞の形状変化を計測するための1個以上の位置座標プローブ微粒子と、(6)上記、微粒子を光学的に計測するための照明用光源と光学顕微鏡と、その画像を取得する画像取得用カメラとからなる光学画像取得系と、(7)電位波形を分析して細胞電位計測を行い、かつ、画像解析によって細胞変位計測を行い、かつ、その解析結果に基づいてフィードバック刺激を行うことが可能な我画像解析・細胞電位解析・刺激制御・統合データ収録用のコンピュータシステムからなる。この装置を用いた計測では、心筋細胞の脱分極を起こすための刺激について、(A)上記心筋細胞集団の自律拍動の伝導を利用した計測を行うこと、(B)上記心筋細胞集団中の特定の細胞に外部から強制電気刺激を与え、この伝導を計測すること、(C)上記心筋細胞集団中の特定の細胞に、計測した細胞電位データに基づいて細胞電位の値と遅延時間の関係を満たす特定のタイミングでフィードバック刺激を与えてその伝導を計測すること、の主に3つの手段から選んで刺激を与えることができる。
【0072】
図44は、心筋細胞の力学特性と電気特性を同時計測する本発明のシステム構成の一例から取得されるデータの一例を示したデータ取得モニター画面の一例である。本実施例では、心筋細胞集団の表面に多数のポリスチレン微粒子を配置し、その中の5個のプローブとすることとしたポリスチレン微粒子についてプローブ微粒子変位観察窓を設定し、その窓の中の微粒子の移動に伴って窓の重心が移動することによって、特定のプローブ微粒子の変位をX軸方向とY軸方向のベクトル時間変化として継続して計測することができる構成となっている。また、ちょうど光学計測をしている位置の特定のターゲット心筋細胞の細胞電位データを計測することで、Naイオンチャンネル、Caイオンチャンネル、Kイオンチャンネルの伝導刺激応答の変化と、細胞形状の変化を相関付けて計測することができる。特に、複数のプローブ微粒子の変位を同時計測することと、変位量の変化に加えて変位方向の変化を計測することができることで、細胞集団の中の各心筋細胞の応答特性のばらつきによって生じる薬剤添加に対する収縮強度の変化が、一様に発生するものか、あるいは不均一に発生するものかを定量的に見積もることも可能となっている。
【0073】
図45は、心筋細胞の力学特性と電気特性を同時計測する本発明のシステム構成の一例から取得されたデータの一例である。図からもわかるように、細胞電位データに加えて、同じ時間での心筋細胞の変位量、そして、この変位量を時間微分した変位速度データを得ることができる。
【0074】
図46は、心筋細胞の力学特性と電気特性を同時計測する本発明のシステム構成の一例から取得された細胞変位の方向データの取得の一例を説明する図である。上段の細胞に配置したプローブ微粒子の時間変化を示す連続画像であるが、この変位データを(X,Y)成分として取得し、これを変位長さrと角度変化θからなる極座標系(r,θ)に変換することで、変位量と角度変化の2つの指標を用いて、薬剤の効果を定量的に見積もることが可能である。下グラフでは、実際に、薬剤の添加によって微粒子の変位の角度変化のゆらぎが増大することが観察される現象の一例を示したものである。
【0075】
図47は、心筋細胞の力学特性と電気特性を同時計測する 本発明のシステムでの心筋細胞ネットワークの空間配置の例を説明する図である。(a)は1微小電極上に1微小心筋細胞クラスターを配置したもの、(b)は2次元に配置された微小電極アレイに対して2次元に広がった心筋細胞シート状に細胞を配置したもの、(c)は直線状に1次元に配置した微小電極アレイ上に心筋細胞を直線状に配置して、端点での心筋細胞の発火が他端に伝導するように配置したもの、(d)はリング状に配置した微小電極アレイ上にリング状に心筋細胞ネットワークを配置したもので、そのリング状に配置された心筋細胞ネットワークを閉ループとなるように接続したものと、あるいはリング状に配置した細胞ネットワークの一部を切断して開ループとなるように配置されたものなどがある。ここで、特に(c)のように直線状に細胞を配置した場合には、心筋細胞の基板表面への接着が十分ではない場合には、(e)に示したように心筋細胞の基板表面への接着に対して、心筋細胞間の収縮力が強すぎるために細胞が徐々に収縮して細胞ネットワークの空間配置が維持できず細胞塊となってしまう。これを回避するためには(d)で示したようなリング状での細胞配置をすることが収縮力を効果的に逃すことができ効果的である。また、基板表面のコラーゲン層に従来のコラーゲンに替わって、コラーゲンビトリゲルを用いることも有効である。
【0076】
図48は、実際によく知られている心筋細胞の細胞電位計測に基づいて分類した、ヒト幹細胞由来心筋細胞の細胞電位(Action Potential)グラフ(上段3種類)と、その細胞電位を時間微分した細胞外電位(Field Potential)グラフ(下段3種類)を示したものである。左のグラフは心房筋型細胞を、中央のグラフは心室筋(プルキンエ細胞)型細胞を、右のグラフは房室結節型細胞を示している。従って、心室筋の薬剤応答、あるいは心室筋での伝導応答計測を行う場合には、中央下段のグラフで示された特徴を細胞外電位で計測された細胞を用いて計測することが望ましい。この特徴は、薬剤を添加していない状態で、急激で明確な脱分極に伴った脱分極開始後20ms以内でのシャープなNaイオンの内向き電流の発生と、その後の脱分極開始後100ms以内でのゆるやかなCaイオンの内向き電流の発生と、脱分極開始後100ms以降に観察される顕著なKイオンの外向き電流の発生があるものである。
【0077】
図49は、心筋細胞の細胞電位、hERGイオンチャンネルの薬物応答のゆらぎ変化の一例を示す図である。図49(A)に示したように、hERGイオンチャンネルを特異的に阻害する薬剤E4031を添加すると、すでに述べたように細胞外電位(Field Potential: FP)はその応答が、隣接拍動周期間で大きなゆらぎを発生させるが(応答の安定性が消失するが)、同様にヒト幹細胞由来心筋細胞を用いて、その細胞電位(Action Potential: AP)についてもFPと同様な傾向と程度のゆらぎを発生させることがわかる。このことから、従来のパッチクランプ法等の電気生理学的細胞電位計測法を用いても、その観察を、各応答の平均値を取るのではなく、取得したデータのゆらぎの程度を定量的に計測することで見積もることも可能である。また、このときに細胞の応答を安定性を調整するために、たとえばパッチクランプ法を用いた計測の場合も、孤立心筋細胞1細胞での計測を行うより、心筋細胞集団中の1細胞を計測することが望ましい。図49(B)には、hERGイオンチャンネルだけを強制的に発現させたCHO細胞について、同様にE4031による阻害に対する細胞全体の細胞電位の変化を計測した結果の一例を示したものである。この結果から分かるように、従来のテールカレント(tail current)計測では計測したデータの平均値を示すが、イオンチャンネルのブロックが進むと電流自体が減少して計測が困難となる。しかし、細胞応答のゆらぎ計測を行うと、そのゆらぎの増大がhERGイオンチャンネルのブロック率が高まったときに急激に増大することから、電流量が大きいときには従来のテールカレント計測を行い、ブロック量が大きくなってカレントに基づいた計測が難しいときには、ゆらぎ計測で計測するという2手法の組み合わせ計測が有効である。
【0078】
図50は、刺激電極アレイからの刺激電位重ね合わせによる任意の位置での細胞刺激法の原理を説明する図である。図50(A)に示したように、隣接する電極間での電極電位と位相を制御することができる多数の刺激電極アレイを基板上に2次元に配置し、各電極から、単独の電極からの刺激では細胞に脱分極を起こすことが無い微弱な電位変化を出力させ、これらを重ね合わせることで細胞刺激を与えるに十分な重ね合わせ電位を2次元面上の特定に位置に特異的に発生させるために、各電極が発生させる必要がある電極の電場強度と位相のパターンをフーリエ合成の規則に基づいて算出し、特定の場所のみに刺激を与えることができる。その一例として、たとえば図50(B)に示したように、円リング状に電極アレイを配置し、これらを上記手法にて制御することで、リングの中央において集束電場による刺激を与えることが可能である。この電極アレイが、細胞培養レイヤーあるXY平面(R軸方向)から空間的にZ軸方向に浮いた形で配置されているとき、具体的には、電極アレイが配置されている平面(R軸方向)と、電場照射方向(Z軸方向)との面内での電場集束時の刺激電極アレイの配置は以下の通りとなる。まず、Z軸上の点Zfに電場を集束させる場合、この焦点ZfからR軸平面に下ろした垂線の足をR0としたとき、R0からZfまでの距離がmλであったとする。ただし、ここでλは各刺激電極から発生させる細胞集団内での伝導速度に基づいた刺激信号波の波長、mは自然数とする。R0の位置に刺激電極を配置した場合、同心円状に配置した微小電極各々の半径は、中心からn番目の同位相の場所の半径をRnとした場合、

と置くことが出来る。ただし、位置Rnは、n番目の刺激電極の同心円の位置を示し、その幅は刺激を与える焦点の位置からの距離に換算して伝導速度換算で高々±λ/4程度とする。当然、R0の位置に基準となる刺激電極が配置されなくても、同心円の焦点位置に特異的に刺激を与えることができるし、また、Zfについても細胞ネットワークが配置された基板と同じ基板上に刺激電極アレイを配置してZf=0としても良い。さらに、焦点位置が円の中心からずれる場合には、そのずれに合わせて各刺激電極の刺激信号の位相を伝導速度から換算して変更することで、刺激リング電極内の任意の特定の位置に刺激を与えることが可能である。上記説明では、心筋細胞ネットワークを例として挙げたが、細胞間の興奮伝導の伝達能力を持つ細胞であれば、すべて同様な処理が可能である。
【0079】
図51に、微粒子の光学計測について開口数0.3以下の対物レンズとズームレンズ系を組み合わせた場合の効果を説明する。通常の光学系では、対物レンズからの像を直接、CCDカメラ等の画像記録素子に結像させて観察しているが、その場合には、対物レンズの開口数(NA)に応じた焦点深度となり、倍率を拡大すると、それに対して像のボケが生じない焦点深度が浅くなる問題があった。これを解決するためには、低倍率(すなわち低開口数)の対物レンズで取得した像を後段に加えたズームレンズ系で拡大すれば良い。開口数によって像の空間分解能は規定されるが、本発明では、すでに形状が既知のプローブ微粒子を用いているため、その微粒子の像がボケなければ、空間分解を多少犠牲にしても正確な微粒子の空間座標を取得できるため問題は無い。図51Aは、本発明の光学系の構成の一例を示したものである。対物レンズの後段にズーム光学系を配置し、その後段にビデオカメラを配置している。図51Bは、実際にさまざまな倍率(開口数)の対物レンズを用いて直接微粒子を観察して、深さ方向で像のボケを観察した結果である。この結果からも分かるように、10倍(開口数0.3)の対物レンズでは、焦点深度15μmまでの像をボケ無く観察することができるが、20倍(開口数0.4)、40倍(開口数0.6)ともに、5μm程度の深さ方向までしかボケが発生しない像を得る事はできない。図51Cは、実際に10倍(開口数0.28)の対物レンズにズーム系を加えた光学系の像の観察結果である。この結果からも分かるように、対物レンズ20倍、対物レンズ40倍と同等の拡大率(位置座標分解能)にズーム系を用いて拡大しても、その焦点深度は25μm程度が維持され、特に収縮運動を行う心筋細胞ネットワークにおいて、深さ方向での大きな変位に対しても、プローブ微粒子の座標を見失う事無く、同様の画像処理を用いて位置座標分解能で追跡することが可能となる。
【産業上の利用可能性】
【0080】
本発明によれば、iPS細胞等の幹細胞から分化させた心筋細胞について、その心筋細胞が創薬スクリーニングあるいは再生医療のために使うことができる健全な心筋細胞であるかどうかを評価できる。
【符号の説明】
【0081】
1…透明基板、2…微小電極、2c…比較電極、2’…微小電極2の引き出し線、31,32,33及び34…アガロースゲルによる壁、41,42,43及び44…間隙、7…周辺を取り巻く壁、81,82,83…パイプ、PC…パソコン、Ms…パソコンの操作信号、10,101,102,103,−−−,10n…心筋細胞あるいは線維芽細胞、15…光学観察装置の透明ステージ、16…X−Y駆動装置、18…Z駆動装置、CH1、CH2、CH3およびCHn…細胞保持部、CCC…細胞連絡チャネル、10G…細胞集団、11a…障壁、11b…開口、19、191、192、193…ダイクロイックミラー、20、201…バンドパスフィルタ、21、211…カメラ、22…光源、221…蛍光光源、23、231…バンドパスフィルタ、24、241…シャッター、25…コンデンサレンズ、26…対物レンズ、27…可動電極、28…接地電極、29、291…スイッチング回路、30、301…電気信号計測回路、31、311…電気刺激回路、32…心筋細胞、33…線維芽細胞、34…細胞配置用ピペット、35…N周回目の伝達経路、36…(N+1)周回目の伝達経路、37…(N+2)周回目の伝達経路、38…測定電極、39…参照電極、40…送液系、41…環状に配置した細胞集団、42…96穴ウエルプレート、43…カメラ受光素子、44…細胞、45…細胞刺激電極、100…心筋毒性検査装置、4201…多電極基板、4202…細胞培養容器、4203…溶液の流れ、4204…液面の高さ、4301…ガラス基板、4302…透明電極、4303…金属レイヤー、4304…絶縁膜、4401…刺激電極、4402…計測電極、4403…参照電極、4404…細胞培養領域。
【特許請求の範囲】
【請求項1】
基板、
該基板上に配置した複数個の安定した拍動を行う評価対象の心筋細胞または該心筋細胞および繊維芽細胞等の非心筋細胞を含む細胞集団、
前記基板上に前記細胞集団の周辺を囲むように形成された細胞培養液を満たすための壁、
前記細胞集団の一つの細胞あるいは細胞集団の局所部分を載置している一つ以上の微小電極、
前記壁で囲われた細胞培養液を満たすための領域内に設けられた比較電極、
前記微小電極のそれぞれに接続された引き出し線と前記比較電極に接続された引き出し線とを用いて前記微小電極に載置されている細胞電位を計測する電位計測手段、
前記微小電極へ送る電気刺激を制御し、前記電位計測手段で計測した電位データを記録する、制御/記録手段、
前記細胞集団上または集団内の一カ所以上に空間的に距離を持って配置した、前記心筋細胞を含む細胞集団とは光学特性の異なる粒径約1μm以上約50μm以下の微粒子、
前記微粒子を光学的に計測するための照射用光源、光学顕微鏡および画像取得カメラを含み、前記微粒子の位置および位置変化を、時間的な移動量データおよびその移動方向の角度変化データを含む変位データとして連続的に計測する、光学的計測系、ならびに
前記電位データと前記変位データとを相関付けて記録する記録手段、
を備えた心毒性評価装置。
【請求項2】
基板、
該基板上に配置した複数個の安定した拍動を行う評価対象の心筋細胞または該心筋細胞および繊維芽細胞等の非心筋細胞を含む細胞集団、
前記基板上に前記細胞集団の周辺を囲むように形成された細胞培養液を満たすための壁、
前記細胞集団の一つの細胞あるいは細胞集団の局所部分を載置している一つ以上の微小電極、
前記壁で囲われた細胞培養液を満たすための領域内に設けられた比較電極、
前記微小電極のそれぞれに接続された引き出し線と前記比較電極に接続された引き出し線とを用いて前記微小電極に載置されている細胞電位を計測する電位計測手段、
前記微小電極へ送る電気刺激を制御し、前記電位計測手段で計測した電位データを記録する、制御/記録手段、
前記細胞集団上あるいは集団内の一カ所以上に空間的に距離を持って配置した前記心筋細胞を含む細胞集団とは光学特性の異なる粒径約1μm以上約50μm以下の微粒子、
前記微粒子の位置および位置変化を、時間的な移動量データおよびその移動方向の角度変化データを含む変位データとして連続的に計測する、開口数約0.3以下の対物レンズとこの後段にズームレンズ系とを配置した光学的計測手段、ならびに
前記電位データと変位データを相関付けて記録する記録手段、
を備えた心毒性評価装置。
【請求項3】
さらに、前記細胞培養液を前記壁で囲われた領域内に供給しおよび/または排出する培養液供給/排出チャネルを備える、請求項1または2記載の心毒性評価装置。
【請求項4】
前記微小電極が、細胞を刺激するための刺激電極および細胞電位を測定するための測定電極からなる、請求項1〜3のいずれか記載の心毒性評価装置。
【請求項5】
請求項1記載の心毒性評価装置を用いて、
計測を行う細胞として、薬剤を添加していない状態で、急激で明確な脱分極に伴った脱分極開始後20ms以内でのシャープなNaイオンの内向き電流の発生と、その後の脱分極開始後100ms以内でのゆるやかなCaイオンの内向き電流の発生と、脱分極開始後100ms以降に観察される顕著なKイオンの外向き電流の発生がある心筋細胞を用いて細胞外電位を計測することを特徴とする心毒性評価方法。
【請求項6】
請求項2記載の心毒性評価装置を用いて、
計測を行う細胞として、薬剤を添加していない状態で、急激で明確な脱分極に伴った脱分極開始後20ms以内でのシャープなNaイオンの内向き電流の発生と、その後の脱分極開始後100ms以内でのゆるやかなCaイオンの内向き電流の発生と、脱分極開始後100ms以降に観察される顕著なKイオンの外向き電流の発生がある心筋細胞を用いて細胞外電位を計測することを特徴とする心毒性評価方法。
【請求項7】
前記心毒性評価装置がさらに、前記細胞培養液を前記壁で囲われた領域内に供給しおよび/または排出する培養液供給/排出チャネルを備える、請求項5または6記載の心毒性評価方法。
【請求項8】
前記微小電極が、細胞を刺激するための刺激電極および細胞電位を測定するための電位測定電極からなる、請求項5〜7のいずれか記載の心毒性評価方法。
【請求項1】
基板、
該基板上に配置した複数個の安定した拍動を行う評価対象の心筋細胞または該心筋細胞および繊維芽細胞等の非心筋細胞を含む細胞集団、
前記基板上に前記細胞集団の周辺を囲むように形成された細胞培養液を満たすための壁、
前記細胞集団の一つの細胞あるいは細胞集団の局所部分を載置している一つ以上の微小電極、
前記壁で囲われた細胞培養液を満たすための領域内に設けられた比較電極、
前記微小電極のそれぞれに接続された引き出し線と前記比較電極に接続された引き出し線とを用いて前記微小電極に載置されている細胞電位を計測する電位計測手段、
前記微小電極へ送る電気刺激を制御し、前記電位計測手段で計測した電位データを記録する、制御/記録手段、
前記細胞集団上または集団内の一カ所以上に空間的に距離を持って配置した、前記心筋細胞を含む細胞集団とは光学特性の異なる粒径約1μm以上約50μm以下の微粒子、
前記微粒子を光学的に計測するための照射用光源、光学顕微鏡および画像取得カメラを含み、前記微粒子の位置および位置変化を、時間的な移動量データおよびその移動方向の角度変化データを含む変位データとして連続的に計測する、光学的計測系、ならびに
前記電位データと前記変位データとを相関付けて記録する記録手段、
を備えた心毒性評価装置。
【請求項2】
基板、
該基板上に配置した複数個の安定した拍動を行う評価対象の心筋細胞または該心筋細胞および繊維芽細胞等の非心筋細胞を含む細胞集団、
前記基板上に前記細胞集団の周辺を囲むように形成された細胞培養液を満たすための壁、
前記細胞集団の一つの細胞あるいは細胞集団の局所部分を載置している一つ以上の微小電極、
前記壁で囲われた細胞培養液を満たすための領域内に設けられた比較電極、
前記微小電極のそれぞれに接続された引き出し線と前記比較電極に接続された引き出し線とを用いて前記微小電極に載置されている細胞電位を計測する電位計測手段、
前記微小電極へ送る電気刺激を制御し、前記電位計測手段で計測した電位データを記録する、制御/記録手段、
前記細胞集団上あるいは集団内の一カ所以上に空間的に距離を持って配置した前記心筋細胞を含む細胞集団とは光学特性の異なる粒径約1μm以上約50μm以下の微粒子、
前記微粒子の位置および位置変化を、時間的な移動量データおよびその移動方向の角度変化データを含む変位データとして連続的に計測する、開口数約0.3以下の対物レンズとこの後段にズームレンズ系とを配置した光学的計測手段、ならびに
前記電位データと変位データを相関付けて記録する記録手段、
を備えた心毒性評価装置。
【請求項3】
さらに、前記細胞培養液を前記壁で囲われた領域内に供給しおよび/または排出する培養液供給/排出チャネルを備える、請求項1または2記載の心毒性評価装置。
【請求項4】
前記微小電極が、細胞を刺激するための刺激電極および細胞電位を測定するための測定電極からなる、請求項1〜3のいずれか記載の心毒性評価装置。
【請求項5】
請求項1記載の心毒性評価装置を用いて、
計測を行う細胞として、薬剤を添加していない状態で、急激で明確な脱分極に伴った脱分極開始後20ms以内でのシャープなNaイオンの内向き電流の発生と、その後の脱分極開始後100ms以内でのゆるやかなCaイオンの内向き電流の発生と、脱分極開始後100ms以降に観察される顕著なKイオンの外向き電流の発生がある心筋細胞を用いて細胞外電位を計測することを特徴とする心毒性評価方法。
【請求項6】
請求項2記載の心毒性評価装置を用いて、
計測を行う細胞として、薬剤を添加していない状態で、急激で明確な脱分極に伴った脱分極開始後20ms以内でのシャープなNaイオンの内向き電流の発生と、その後の脱分極開始後100ms以内でのゆるやかなCaイオンの内向き電流の発生と、脱分極開始後100ms以降に観察される顕著なKイオンの外向き電流の発生がある心筋細胞を用いて細胞外電位を計測することを特徴とする心毒性評価方法。
【請求項7】
前記心毒性評価装置がさらに、前記細胞培養液を前記壁で囲われた領域内に供給しおよび/または排出する培養液供給/排出チャネルを備える、請求項5または6記載の心毒性評価方法。
【請求項8】
前記微小電極が、細胞を刺激するための刺激電極および細胞電位を測定するための電位測定電極からなる、請求項5〜7のいずれか記載の心毒性評価方法。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【図15】


【図16】


【図17】


【図18】


【図19】


【図20】


【図21】


【図22】


【図23】


【図24】


【図25】


【図26】


【図27】


【図28】


【図29】


【図30】


【図31】


【図32】


【図33】


【図34】


【図35】


【図36a】


【図36b】


【図36c】


【図37】


【図38】


【図39】


【図40】


【図41】


【図42】


【図43】


【図44】


【図45】


【図46】


【図47】


【図48】


【図49】


【図50】


【図51】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【図15】


【図16】


【図17】


【図18】


【図19】


【図20】


【図21】


【図22】


【図23】


【図24】


【図25】


【図26】


【図27】


【図28】


【図29】


【図30】


【図31】


【図32】


【図33】


【図34】


【図35】


【図36a】


【図36b】


【図36c】


【図37】


【図38】


【図39】


【図40】


【図41】


【図42】


【図43】


【図44】


【図45】


【図46】


【図47】


【図48】


【図49】


【図50】


【図51】


【公開番号】特開2013−94168(P2013−94168A)
【公開日】平成25年5月20日(2013.5.20)
【国際特許分類】
【出願番号】特願2012−152026(P2012−152026)
【出願日】平成24年7月6日(2012.7.6)
【分割の表示】特願2011−237608(P2011−237608)の分割
【原出願日】平成23年10月28日(2011.10.28)
【出願人】(504179255)国立大学法人 東京医科歯科大学 (228)
【出願人】(504296024)一般社団法人オンチップ・セロミクス・コンソーシアム (39)
【Fターム(参考)】
【公開日】平成25年5月20日(2013.5.20)
【国際特許分類】
【出願日】平成24年7月6日(2012.7.6)
【分割の表示】特願2011−237608(P2011−237608)の分割
【原出願日】平成23年10月28日(2011.10.28)
【出願人】(504179255)国立大学法人 東京医科歯科大学 (228)
【出願人】(504296024)一般社団法人オンチップ・セロミクス・コンソーシアム (39)
【Fターム(参考)】
[ Back to top ]

