心肥大及びそれに起因する心疾患を予防または治療するための医薬組成物
【解決手段】本発明は、ヒトの体内では脳を始め、肺、心臓及び骨格筋等に広く存在するプロテインD1が、心筋細胞において心肥大を誘導するシグナルカスケードの中心的役割を担っていることを見いだしたことに基づく。具体的には、本発明はGPCRまたはEGF受容体の心肥大シグナル伝達経路を阻害することによって、心肥大の誘導を抑制する作用を有する心肥大抑制用の医薬組成物を提供する。また本発明は、上記作用に基づいて、心肥大に起因する心疾患、具体的には心不全、虚血性心疾患または不整脈の予防または治療のために用いられる組成物(心肥大に起因する心疾患の予防または治療用組成物)を提供する。さらに本発明は、当該心肥大シグナル伝達経路の阻害メカニズムに基づいて、心肥大またはその前状態にある被験者の心肥大発生やその進展を抑制する方法を提供する。さらにまた本発明は、上記組成物の有効成分をスクリーニングする方法、並びに心肥大病態モデル非ヒト動物を提供する。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は心肥大発生機構、より詳細には心肥大を誘導するシグナル伝達経路に関して新たな知見を提供するものである。さらに本発明は、かかる知見に基づいて、心肥大の発生を抑制するために用いられる組成物(心肥大抑制用組成物)に関する。また本発明は、上記作用に基づいて、心肥大に起因する疾患、具体的には心肥大によって生じる心不全などの心機能障害の発症を予防または治療するために用いられる組成物(心肥大に起因する心疾患の予防または治療用組成物)に関する。
【0002】
さらに本発明は、心肥大発生機構に関する新たな知見に基づいて、被験者について心肥大を抑制する方法、並びに心肥大に起因する心疾患(具体的には心不全等の心機能障害)を予防または治療する方法に関する。
【0003】
さらにまた本発明は、上記組成物(心肥大抑制用組成物、または心肥大に起因する心疾患の予防または治療用組成物)の有効成分をスクリーニングする方法に関する。また本発明は、心肥大の病態を模倣した病態モデル動物に関する。
【背景技術】
【0004】
心臓は個体発生の極めて早期に分化し、分化後すぐに自立拍動を開始する臓器である。心筋細胞は分化後も分裂能を維持し、胎生期の間は活発に分裂増殖を続けるが、出生後はその増殖能は急速に低下する。このため、出生後の心筋細胞には、再生能力がなく、その後の心臓の成長は個々の心筋細胞の大きさが増すという生理的肥大によってのみ行われると考えられている。心臓の肥大(心肥大)は、筋原線維の幅の増加(これは、心筋壁の肥厚化、すなわち「求心性肥大」を生じる)によって引き起こされるか、または筋原線維の長さの増加(これは、室の拡張、すなわち「遠心性肥大」を生じる)によって引き起こされる。これらの対照的な肥大の形態は、それぞれサルコメア(sarcomere)の平行構築(parallel assenbly)及び連続構築(serial assembly)によってもたらされる。
【0005】
心肥大は、出生後の生理学的適応に応じて、または運動によって誘導されるが、この場合は上記求心性肥大と遠心性肥大が同時にバランスよく生じ、要求量の増加に応じて心臓のポンプ輸送能力を増加させるもので、正常な生理学的現象である。
【0006】
一方、病的に生じる心臓への負荷も心肥大を誘導する。具体的には、高血圧症や心弁膜症による心室への負荷の増大、あるいは心筋梗塞、心筋炎や心筋症などによる心筋細胞自体の障害が生じると、心臓は主として心筋細胞を肥大化させることにより心拍出量を保つようにその形態を変え、いわゆる心肥大となる。このような心肥大は、ある程度までは心筋細胞障害や機械的負荷に対する代償現象と考えられるが、過剰な負荷が持続的に加わり心肥大が著しいときには、心臓の収縮機能や拡張機能が破綻し、心拍出量が低下して慢性心不全に至るとともに、虚血性心疾患に陥りやすく、致死性の不整脈も発生しやすくなる。また、こうした心臓への病的な負荷は、その負荷に依存して求心性肥大または遠心性肥大のいずれかが優勢であり、心不全に至らないまでも肥大型心筋症または拡張型心筋症の発症を引き起こす。
【0007】
最近、心肥大は心不全等の心臓疾患への移行の独立危険因子として認識されており、米国の大規模追跡調査であるFramingham Heart Study等により、心肥大があると心不全を始め、狭心症や心筋梗塞などの虚血性心疾患、不整脈など心血管系疾患の発症率が2.5〜3倍に上昇することも判明している(山崎力、矢崎義雄、「心不全」、第37-45頁、篠山重威編、医薬ジャーナル社、1997年)。従って、過度の心肥大の形成を抑制するか、あるいは心肥大を退縮させる薬剤は、慢性心不全を含む心臓病の発症の進展の防御に有効に使用できると考えられる。
【0008】
慢性心不全に対する治療法としては、従来心臓の収縮力を改善し、心拍出量を増大する目的で強心薬が主に用いられてきた。しかしながら、強心薬は急性的に自覚症状改善効果、運動耐容能改善効果を示すものの、慢性心不全治療の最終目標である生命予後の改善、すなわち延命効果の面では効果がなく、むしろ予後を悪化させるという結果が得られている(Pacher et al., N.Engl.J.Med., Vol.325, p.1468, 1991)。
【0009】
一方、心肥大の発生機構に関しては心肥大シグナル伝達経路の存在が指摘されており、刺激因子によって、タンパク質合成、サルコメアの構築及び組織化、並びに遺伝子発現を調節するシグナル伝達経路が活性化されることによって、心肥大が発生し、また進展することが知られている(Chien, K.R., Cell, 98, p555-558, 1999: Nicol,R.L., et al., Ann. Rev. Gen. Gen., 1, p.179-223, 2000: Sugden, P.H. et al, J. Mol. Med., 76, p.725-746, 1998)。
【0010】
上記刺激因子として、例えばプロテインキナーゼ(例えば、ERK、JNK、及びp38MAPK等のmitogenactivated protein kinase[MAPK]ファミリー)、及び液性因子(例えば、アンジオテンシンII、エンドセリン−1などの血管作動物質、エピネフリンなどの神経因子、カルジオトロフィン1,白血病抑制因子[LIF]等のサイトカン、インスリン、IGF−1などの増殖因子)が知られている。上記プロテインキナーゼは、心筋細胞の伸展という機械的な負荷によって活性化される他、液性因子によっても活性化され、かかる活性化反応を介してc-fos、c-myc、c-junなどの転写調節因子が活性化されて、心肥大に関連する蛋白質の誘導が引き起こされると考えられている。また、最近では、機械的刺激やアンジオテンシンII、エンドセリン−1及びエピネフリンなどの刺激によって細胞内カルシウムのレベルが上昇すること、構成的活性型のカルシニューリンを発現するマウスで心肥大が誘導されること(Olson et al., Cell, 93, p.215-223, 1998)等から、心肥大形成におけるカルシウムの役割が注目されている。また、カルモジュリンを強制発現したマウスの心筋において、Ca2+/カルモジュリン依存性プロテインキナーゼII(CaMキナーゼII)活性が約2倍に上昇して、顕著な心肥大が観察されること(Mol Endocrinol 14, p.1125-1136, 2000)、構成的活性型CaMキナーゼIVを心臓特異的に発現したマウスに心肥大が確認されること(J Clin Invest 105, p.1395-1406, 2000)等から、CaMキナーゼII及びIVも、心肥大形成を刺激する因子として考えられている。
【0011】
このため、心肥大の発生を抑制する目的で、これらの刺激因子の産生を阻害するかあるいはこれを介した心肥大シグナル伝達を抑制もしくは遮断する薬剤の開発、並びに臨床応用が進められている(例えば、アンジオテンシンIIの産生阻害剤、α1-遮断薬、エンドセリン受容体拮抗剤等:J. Cardiovasc. Pharmacol., 27, S36-S40, 1996:Br. J. Pharmacol., 118, p.549-556, 1996:Cardiovasc. Res., 23, p.315-333, 1989: Circ. Res., 73, p.887-897, 1993)。しかし、生体内において心肥大の発生機序にはこれらの因子が複数関わっており、単一因子に対する拮抗作用だけでは不十分であることも指摘されている。例えば、アンジオテンシンIIを産生する酵素であるアンジオテンシン変換酵素(ACE)の阻害剤は、モデル動物において心肥大の発症進展を抑制し(Brilla et al.,Circulation, Vol.83, p.1771, 1991)、臨床的にも慢性心不全患者に投与した場合に、心肥大を退縮させ、生命予後を延長することが観察されているが(The save Investigation, N. Engl. J. Med., Vol.327, p.678, 1992)、その効果は未だ十分なものとは云えない。実際に、最先端の治療を行っても、慢性心不全の発症後、5年間の死亡率は現在なお約50%に達している。最近、エンドセリン拮抗薬(Ito et al., Circulation, Vol.89, p.2198, 1994)やバソプレッシン拮抗薬(Tumura et al., Circulation, Vol.94, (Supple. I-264), 1996)がモデル動物において心肥大の形成を抑制することも報告されているが、さらに新しいメカニズムに基づいて、心肥大が抑制できる心疾患予防・治療剤の開発が望まれている。
【0012】
一方、プロテインキナーゼD1(以下、PKD1ともいう)は、アミノ末端領域に制御領域を、またカルボキシ末端領域にセリン・スレオニン特異的プロテインキナーゼをコードする触媒領域を有する、約110KDa(910-920アミノ酸残基)からなる蛋白質である。さらに上記の制御領域には、膜相互作用領域(TM)、連続した亜鉛フィンガー(Cys-rich, Zn-finger like)から構成される2つのCR(Cys-rich)ドメイン、及びPH(Pleckstrin Homology)ドメインが存在している(図1参照)。
【0013】
ヒト由来PKD1は、制御領域のCRドメインと触媒領域との相互作用により分子全体が折り畳まれており、この状態では不活性であると考えられている(不活性型PKD1)。しかし、ホスホイノシタイド依存性キナーゼ1(phosphoinositide-dependent kinase 1:PDK1)が作用すると、PHドメインまたはその近傍に位置する活性ループ部位(Ser-744 [PH内], Ser-748 [PHより少し下流])がリン酸化されて、触媒的に活性化状態に移行する。さらに、CRドメインは、Ca2+、ジアシルグリセロール(DG)またはホルボールエステル(例えばTPA等)に対して高い親和性を有しており、かかるドメインにこれらの成分が結合すると、CRドメインから触媒領域が解離し、一層活性化され、次いでC末端の触媒領域(Ser-916)が自動リン酸化されて分子全体が完全に活性化される(全活性型PKD1)ことが知られている(Van Lint, J., et al., J. Biol. Chem. 3, p.1455-1461, 1995: Zugaza, J.L., et al, EMBO J. 15, p.6220-6230, 1996; Zugaza, J.L., et al, J. Biol. Chem. 272, p.23952-23960, 1997;Iglesias, T., et al., J. Biol. Chem. 273, p.27662-27667, 1998:Iglesias, T., et al., J. Biol. Chem. 273, p.27662-27667, 1998)。
【0014】
PKD1は、同定当初は、その構造的特徴からプロテインキナーゼC(PKC)ファミリーの一つ(PKCμ)として同定されたが、触媒領域のアミノ酸配列がPKCファミリーと相違していること等の理由から(PKCファミリー間ではこの領域のアミノ酸配列は高く保存されている)、今では、PKCとは別個の独自のプロテインキナーゼファミリーに属していると考えられている。また、幾つかのPKCのアイソフォーム(PKCη、PKCε、PKCβI)が、ヒト由来PKD1の活性ループ部位(Ser-744)及びその近傍部位(Ser-748)をリン酸化することによって、PKD1を活性化することが示されている(Maeda, Y., et al., EMBO J. 20, p.5982-90, 2001: Waldron, R.T., et al., J. Biol. Chem. 274, p.9224-9230, 1999; Waldron, R.T., et al., J. Biol. Chem. 276, p.32606-32615, 2001)。
【0015】
PKD1は、ヒト体内では、脳、肺、心臓並びに骨格筋等、心臓を問わず、多くの組織に発現し存在している。PKD1の一部はゴルジ装置に局在しており(Iglesias, T., et al., FEBS Lett. 454, p.53-56, 1999: Jamora, C, et al., Cell. 98, p.59-68, 1999: Liljedahl, M., et al., Cell. 104, p.409-420, 2001)、ゴルジ機能に重要な役目を担っていることが知られている(Van Lint, J., et al., Trends in Cell Biol.12, p.193-200, 2002)。
【0016】
このように、従来、PKD1について、心臓における生理学的な機能や役割については一切知られていなかったのが実情である。
【0017】
またプロテインキナーゼC(以下、PKCともいう)に関しては、心筋においてPKCのアイソフォームの一つであるPKCεが顕著に発現しており、サルコメアZディスクに局在して心肥大に関わっていることが示唆されている(Takeishi, Y., et al., Circ. Res. 86, p.1218-1223, 2000)。更に、構成的に活性なPKCεを遺伝子組換えで強制発現させると心肥大を発生することが報告されている(Mochly-Rosen, D., et al., Circ Res., 86, p.1173-1179, 2000)。
【0018】
しかしながら、心肥大の発症及び進展に関してPKD1が関係していること、並びにPKD1とPKCεとが相互に関係していることについては、一切知られていなかった。
【発明の開示】
【発明が解決しようとする課題】
【0019】
本発明は、第1に、慢性心不全などの心疾患の発症・進展に関わる心肥大の抑制に有効な医薬組成物を提供する。より詳細には、本発明は、心肥大シグナル伝達に関わるPKD1の心筋細胞での機能発現を抑制する物質を有効成分とする心肥大抑制剤(心肥大抑制用医薬組成物)を提供する。第2に、本発明は、かかるPKD1の機能発現を抑制する物質によって心肥大シグナル伝達を遮断もしくは抑制することによって、心肥大に起因する各種心疾患の発症や進展を抑制することのできる医薬組成物を提供する。さらに本発明は、心肥大を抑制して心肥大の発生を予防する方法、並びに当該心肥大に起因して生じる慢性心不全などの各種心疾患の発症や進展を予防しまた治療する方法を提供する。
【0020】
さらにまた、本発明は、新たに見いだされた心肥大発生機構に基づいて、心肥大抑制剤、または心肥大に起因して発症・進展する心疾患の治療若しくは予防に有効な成分を探索し選択する方法を提供し、かかる成分を有効成分とする医薬組成物(心肥大抑制用医薬組成物、心肥大に起因する心疾患予防・治療用の医薬組成物)を提供するものである。
【0021】
また、本発明は、トランスジェニック非ヒト動物、特に心筋細胞においてPKD1を強制発現させることによって心肥大化を促進してなる、心肥大病態モデル非ヒト動物を提供するものである。
【課題を解決するための手段】
【0022】
本発明者らは、心筋細胞における肥大シグナル伝達におけるプロテインキナーゼD1(PKD1)の役割、並びにPKD1とプロテインキナーゼCε(PKCε)との相互作用を調べた。その結果の詳細は後述する実施例に示すが、(1)心筋細胞においてPKD1は著量に発現しており、7回膜貫通型ヘテロ三量体Gタンパク質共役型受容体(GPCR)を介する刺激(例えば、アンジオテンシンII[AngII]やノルエピネフリン[NE]などによる刺激)によって全活性化(リン酸化)されて、サルコメアZディスクに移行して局在化すること、(2)当該PKD1の全活性化(リン酸化)はPKCεの活性化に依存しており、心筋細胞内でPKD1はPKCεと相互作用して、PKCεによって直接活性化されること、(3)全活性型PKD1((リン酸化PKD1)及び活性型PKCεをそれぞれ心筋細胞内で強制発現させると、心筋細胞は心肥大誘導剤で処理した場合と同様な心肥大化状態を示すが、不活性型PKD1(不リン酸化PKD1)を強制発現した後、心肥大誘導処理しても心筋細胞の肥大化は見られないこと等、の結果が得られた。かかる結果は、心肥大化シグナル伝達経路におけるシグナル因子としてPKD1が深く関わっていること、そしてPKD1はPKCεによって直接活性化されて心肥大を引き起こす、PKCεの下流ファクターであることを示す。
【0023】
そしてこれらの結果は、心筋細胞におけるPKD1活性を阻害することで、その経路のシグナル伝達を遮断して心肥大化を抑制もしくは低下させることができ、心肥大抑制剤並びに心疾患予防・治療剤としての臨床的応用が可能であること、また逆に、心筋細胞におけるPKD1活性を増大させることで、心肥大化を促進することができ、心肥大病態モデル動物の作成及び提供が可能であることを示唆するものである。
【0024】
また、ENH1は、心肥大シグナルに関与するシグナル因子(PKC)を心筋細胞サルコメアZディスクにリクルートし、そこに繋ぎ止める足場タンパク質であり、心肥大のシグナリングに関わっていることが知られているが(Nakagawa N, et al., Biochem. Biophys. Res. Commun., 272(2), p.505-512, 2000)、本発明者らは、今回、ENH1のLIMドメインを欠失したスプライス変異体ENH2が、上記ENH1が介する心肥大シグナルを抑制する内在性アンタゴニストであることを見いだした。この結果は、心筋細胞においてENH2を強制発現させることによってENH1が関与する心肥大シグナル伝達を抑制制御することができ、心肥大抑制剤並びに心疾患予防・治療剤としての臨床的応用が可能であることを示唆するものである。
【0025】
本発明はかかる知見に基づいて開発されたものである。具体的には、本発明は下記の態様を包含する:
I.心肥大抑制用医薬組成物
(1)PKD1の心筋細胞における機能発現を抑制する物質を有効成分とする、心肥大抑制用医薬組成物。
(2)有効成分が、心筋細胞におけるPKD1の活性化を抑制する作用を有する物質である、(1)に記載する心肥大抑制用医薬組成物。
(3)有効成分が、ヒト由来のPKD1のSer-744、Ser-748またはSer-916のいずれか少なくとも1つのリン酸化を抑制する作用を有する物質である、(1)または(2)に記載する心肥大抑制用医薬組成物。
(4)有効成分が、心筋細胞において発現可能に制御されたドミナント・ネガティブ型PKD1をコードする塩基配列を有する核酸である、(1)または(2)に記載する心肥大抑制用医薬組成物。
(5)上記核酸が発現ベクター内に含まれている(4)に記載の心肥大抑制用医薬組成物。
(6)上記発現ベクターがプラスミドまたはウイルスベクターである(5)に記載の心肥大抑制用医薬組成物。
(7)上記発現ベクターがウイルス粒子または中空ナノ粒子内に含まれている、(5)に記載の心肥大抑制用医薬組成物。
(8)上記発現ベクターがリポソームで構成される、(5)に記載の心肥大抑制用医薬組成物。
(9)有効成分が、心筋細胞におけるPKD1遺伝子の発現を阻害する物質である、(1)または(2)のいずれかに記載する心肥大抑制用医薬組成物。
(10)有効成分が、PKD1のアンチセンス分子、リボザイムまたはRNAiエフェクターである(9)に記載する心肥大抑制用医薬組成物。
(11)有効成分が、PKD1若しくはリン酸化されていてもよいその断片に対する抗体である(1)または(2)のいずれかに記載する心肥大抑制用医薬組成物。
(12)ENH2をコードする塩基配列を有する核酸を有効成分とする、心肥大抑制用医薬組成物。
(13)上記核酸が発現ベクター内に含まれている(12)に記載の心肥大抑制用医薬組成物。
(14)上記発現ベクターがプラスミドまたはウイルスベクターである(13)に記載の心肥大抑制用医薬組成物。
(15)上記発現ベクターがウイルス粒子または中空ナノ粒子内に含まれている、(13)に記載の心肥大抑制用医薬組成物。
(16)上記発現ベクターがリポソームで構成される、(13)に記載の心肥大抑制用医薬組成物。
(17)心肥大が、7回膜貫通型ヘテロ三量体Gタンパク質共役受容体(GPCR)または上皮成長因子(EGF)受容体を介する肥大シグナル伝達によって生じるものである、(1)乃至(16)のいずれかに記載する心肥大抑制用医薬組成物。
(18)更に、gp130レセプター阻害剤を含有する(1)乃至(16)のいずれかに記載する心肥大抑制用医薬組成物。
【0026】
II.心肥大の抑制、また心肥大発生の予防方法
(1)PKD1の心筋細胞における機能発現を抑制する物質を有効量、心肥大またはその前状態にある被験者に投与することを含む、当該被験者について心肥大を抑制するか、または心肥大の発生を予防する方法。
(2)上記物質が、心筋細胞におけるPKD1の活性化を抑制する作用を有するものである、(1)に記載する方法。
(3)上記物質が、ヒト由来PKD1のSer-744、Ser-748またはSer-916のいずれか少なくとも1つのリン酸化を抑制する作用を有するものである、(1)または(2)に記載する方法。
(4)上記物質が、心筋細胞において発現可能に制御されたドミナント・ネガティブ型PKD1をコードする塩基配列を有する核酸である、(1)または(2)に記載する方法。
(5)上記核酸が発現ベクター内に含まれているものである(4)に記載の方法。
(6)上記発現ベクターがプラスミドまたはウイルスベクターである(5)に記載の方法。
(7)上記発現ベクターがウイルス粒子または中空ナノ粒子内に含まれているものである、(5)に記載の方法。
(8)上記発現ベクターがリポソームで構成される、(5)に記載の方法。
(9)上記物質が、心筋細胞におけるPKD1遺伝子の発現を阻害する物質である、(1)または(2)に記載する方法。
(10)上記物質が、PKD1のアンチセンス分子、リボザイムまたはRNAiエフェクターである(9)に記載する方法。
(11)上記物質が、PKD1もしくはリン酸化されていてもよいPKD1の断片に対する抗体である(1)または(2)に記載する方法。
(12)ENH2をコードする塩基配列を有する核酸を有効量、心肥大またはその前状態にある被験者に投与することを含む、当該被験者について心肥大を抑制するか、または心肥大の発生を予防する方法。
(13)上記核酸が発現ベクター内に含まれている(12)に記載の方法。
(14)上記発現ベクターがプラスミドまたはウイルスベクターである(13)に記載の方法。
(15)上記発現ベクターがウイルス粒子または中空ナノ粒子内に含まれている、(13)に記載の方法。
(16)上記発現ベクターがリポソームで構成される、(13)に記載の方法。
(17)心肥大が、GPCRまたはEGF受容体を介する肥大シグナル伝達によって生じるものである、(1)乃至(16)のいずれかに記載する方法。
(18)更に、gp130レセプター阻害剤を投与することを含む(1)乃至(17)のいずれかに記載する方法。
【0027】
III.心肥大に起因する心疾患の予防または治療用医薬組成物
(1)PKD1の心筋細胞における機能発現を抑制する物質を有効成分とする、心肥大に起因する心疾患の発症を予防または治療するための医薬組成物。
(2)有効成分が、心筋細胞におけるPKD1の活性化を抑制する作用を有する物質である、(1)に記載する医薬組成物。
(3)有効成分が、ヒト由来PKD1のSer-744、Ser-748またはSer-916のいずれか少なくとも1つのリン酸化を抑制する作用を有する物質である、(1)または(2)に記載する医薬用組成物。
(4)有効成分が、心筋細胞において発現可能に制御されたドミナント・ネガティブ型PKD1をコードする塩基配列を有する核酸である、(1)または(2)に記載する医薬組成物。
(5)上記核酸が発現ベクター内に含まれている(4)に記載の医薬組成物。
(6)上記発現ベクターがプラスミドまたはウイルスベクターである(5)に記載の医薬組成物。
(7)上記発現ベクターがウイルス粒子または中空ナノ粒子内に含まれている、(5)に記載の医薬組成物。
(8)上記発現ベクターがリポソームで構成される、(5)に記載の医薬組成物。
(9)有効成分が、心筋細胞におけるPKD1遺伝子の発現を阻害する物質である、(1)または(2)に記載する医薬組成物。
(10)有効成分が、PKD1のアンチセンス分子、リボザイムまたはRNAiエフェクターである(9)に記載する医薬組成物。
(11)有効成分が、PKD1若しくはリン酸化されていてもよいPKD1の断片である(1)または(2)に記載する医薬組成物。
(12)ENH2をコードする塩基配列を有する核酸を有効成分とする、心肥大に起因する心疾患の発症を予防または治療するための医薬組成物。
(13)上記核酸が発現ベクター内に含まれている(12)に記載の医薬組成物。
(14)上記発現ベクターがプラスミドまたはウイルスベクターである(13)に記載の医薬組成物。
(15)上記発現ベクターがウイルス粒子または中空ナノ粒子内に含まれている、(13)に記載の医薬組成物。
(16)上記発現ベクターがリポソームで構成される、(13)に記載の医薬組成物。
(17)心肥大が、GPCRまたはEGF受容体を介する肥大シグナル伝達によって生じるものである、(1)乃至(16)のいずれかに記載する医薬組成物。
(18)心肥大に起因して生じる心疾患が、心不全、虚血性心疾患、または不整脈である(1)乃至(17)のいずれかに記載する医薬組成物。
(19)更に、gp130レセプター阻害剤を含有する(1)乃至(16)及び(18)のいずれかに記載する医薬組成物。
【0028】
IV.心肥大に起因する心疾患の予防または治療方法
(1)PKD1の心筋細胞における機能発現を抑制する物質を有効量、心肥大またはその前状態にある被験者に投与することを含む、当該被験者について心肥大に起因する疾患の発症を予防し、また治療する方法。
(2)上記物質が、心筋細胞におけるPKD1の活性化を抑制する作用を有するものである、(1)に記載する方法。
(3)上記物質が、ヒト由来PKD1のSer-744、Ser-748またはSer-916のいずれか少なくとも1つのリン酸化を抑制する作用を有するものである、(1)または(2)に記載する方法。
(4)上記物質が、心筋細胞において発現可能に制御されたドミナント・ネガティブ型PKD1をコードする塩基配列を有する核酸である、(1)または(2)に記載する方法。
(5)上記核酸が発現ベクター内に含まれているものである(4)に記載の方法。
(6)上記発現ベクターがプラスミドまたはウイルスベクターである(5)に記載の方法。
(7)上記発現ベクターがウイルス粒子または中空ナノ粒子内に含まれているものである、(5)に記載の方法。
(8)上記発現ベクターがリポソームで構成される、(5)に記載の方法。
(9)上記物質が、心筋細胞におけるPKD1遺伝子の発現を阻害する物質である、(1)または(2)に記載する方法。
(10)上記物質が、PKD1のアンチセンス分子、リボザイムまたはRNAiエフェクターである(9)に記載する方法。
(11)上記物質が、PKD1若しくはリン酸化されていてもよいPKD1の断片である(1)または(2)に記載する方法。
(12)ENH2をコードする塩基配列を有する核酸を有効量、心肥大またはその前状態にある被験者に投与することを含む、当該被験者について心肥大に起因する疾患の発症を予防し、また治療する方法。
(13)上記核酸が発現ベクター内に含まれている(14)に記載の方法。
(14)上記発現ベクターがプラスミドまたはウイルスベクターである(13)に記載の方法。
(15)上記発現ベクターがウイルス粒子または中空ナノ粒子内に含まれている、(13)に記載の方法。
(16)上記発現ベクターがリポソームで構成される、(13)に記載の方法。
(17)心肥大が、GPCRまたはEGF受容体を介する心肥大シグナル伝達によって生じるものである、(1)乃至(16)のいずれかに記載する方法。
(18)心肥大に起因して生じる心疾患が、心不全、虚血性心疾患、または不整脈である(1)乃至(17)のいずれかに記載する方法。
(19)心筋細胞におけるPKD1の機能発現を抑制する物質に加えて、更に、gp130レセプター阻害剤を投与することを含む(1)乃至(16)及び(18)のいずれかに記載する方法。
【0029】
V.心肥大シグナル伝達を遮断もしくは抑制する方法
(1)心筋細胞に、PKD1の機能発現を阻害する物質を、有効量投与することを含む、心肥大シグナル伝達を遮断する方法。
(2)上記物質が、心筋細胞におけるPKD1の活性化を抑制する作用を有するものである、(1)に記載する方法。
(3)上記物質が、ヒト由来PKD1のSer-744、Ser-748またはSer-916のいずれか少なくとも1つのリン酸化を抑制する作用を有するものである、(1)または(2)に記載する方法。
(4)上記物質が、心筋細胞において発現可能に制御されたドミナント・ネガティブ型PKD1をコードする塩基配列を有する核酸である、(1)または(2)に記載する方法。
(5)上記核酸が発現ベクター内に含まれているものである(4)に記載の方法。
(6)上記発現ベクターがプラスミドまたはウイルスベクターである(5)に記載の方法。
(7)上記発現ベクターがウイルス粒子または中空ナノ粒子内に含まれているものである、(5)に記載の方法。
(8)上記発現ベクターがリポソームで構成される、(5)に記載の方法。
(9)上記物質が、心筋細胞におけるPKD1遺伝子の発現を阻害する物質である、(1)または(2)に記載する方法。
(10)上記物質が、PKD1のアンチセンス分子、リボザイムまたはRNAiエフェクターである(9)に記載する方法。
(11)上記物質が、PKD1若しくはリン酸化されていてもよいPKD1の断片である(1)または(2)に記載する方法。
(12)心筋細胞に、ENH2をコードする塩基配列を有する核酸を有効量投与することを含む、心肥大シグナル伝達を遮断する方法。
(13)上記核酸が発現ベクター内に含まれている(12)に記載の方法。
(14)上記発現ベクターがプラスミドまたはウイルスベクターである(13)に記載の方法。
(15)上記発現ベクターがウイルス粒子または中空ナノ粒子内に含まれている、(13)に記載の方法。
(16)上記発現ベクターがリポソームで構成される、(13)に記載の方法。
(17)心肥大が、GPCRまたはEGF受容体を介する肥大シグナル伝達によって生じるものである、(1)乃至(16)のいずれかに記載する方法。
(18)更に、gp130レセプター阻害剤を投与することを含む(1)乃至(16)のいずれかに記載する方法。
【0030】
VI.トランスジェニック非ヒト動物
(1)心筋細胞において構成的活性型PKD1が強制発現してなる、トランスジェニック非ヒト動物。
(2)構成的活性型PKD1が、ヒト由来PKD1の PHドメインを欠失してなるもの、ヒト由来PKD1のアミノ酸配列の744位及び748位のセリンがグルタミン酸に置換されてなるもの、及びマウス由来PKD1のアミノ酸配列の744位及び748位のセリンがグルタミン酸に置換されてなるものより選択される少なくとも1つである、(1)に記載するトランスジェニック非ヒト動物。
(3)心肥大の病態モデル動物である、(1)または(2)に記載するトランスジェニック非ヒト動物。
(4)心筋細胞においてドミナント・ネガティブ型PKD1が強制発現してなる、トランスジェニック非ヒト動物。
(5)ドミナント・ネガティブ型プロテインキナーゼD1が、ヒト由来PKD1の アミノ酸配列612位のリジンがトリプトファンに置換されてなるもの、ヒト由来PKD1の アミノ酸配列618位のリジンがアスパラギンに置換されてなるもの、ヒト由来PKD1の アミノ酸配列733位のアスパラギン酸がアラニンに置換されてなるもの、ヒト由来PKD1の アミノ酸配列738位及び742位のセリンがアラニンに置換されてなるもの、マウスPKD1のアミノ酸配列618位のリジンがメチオニンに置換してなるもの、及びマウス由来PKD1の アミノ酸配列744位及び748位のセリンがアラニンに置換されてなるものより選択される少なくとも1つである
、(4)に記載するトランスジェニック非ヒト動物。
【0031】
VII.スクリーニング方法
(1)下記の工程を含む、心肥大抑制剤をスクリーニングする方法:
(a) PKD1を発現し得る細胞に被験物質を接触させる工程、
(b) 上記細胞について、PKD1の発現レベルを測定し、被験物質を接触させない対照の細胞におけるPKD1の発現レベルと対比する工程、及び
(c) 上記(b)の比較結果に基づいて、対照の細胞に比して、PKD1の発現レベルが低下してなる細胞と接触させた被験物質を、心肥大抑制剤として選択する工程。
(2)下記の工程を含む、心肥大抑制剤をスクリーニングする方法:
(a) PKD1を発現し得る細胞に、PKD1活性化剤及び被験物質を接触させる工程、
(b) 上記細胞について、PKD1の活性を測定し、被験物質を接触させない対照の細胞における上記に対応する活性と対比する工程、及び
(c) 上記(b)の比較結果に基づいて、対照の細胞に比して、PKD1の活性が低下してなる細胞に投与した被験物質を、心肥大抑制剤として選択する工程。
(3)下記の工程を含む、心肥大抑制剤をスクリーニングする方法:
(a) 心筋細胞に、GPCRまたはEGF受容体を刺激する心肥大誘導剤と被験物質を接触させる工程、
(b) 上記心筋細胞について、PKD1の活性、サルコメアZディスクにおけるリン酸化PKD1の局在性、またはPKCεとPKD1との2分子間距離を測定し、心肥大誘導剤だけを接触させた対照の心筋細胞における上記に対応する活性、局在性または2分子間距離と対比する工程、及び
(c) 上記(b)の比較結果に基づいて、対照の心筋細胞に比して、PKD1の活性若しくはサルコメアZディスクにおけるリン酸化PKD1の局在性が低下してなるか、またはPKCεとPKD1との2分子間距離が増大してなる心筋細胞に投与した被験物質を、心肥大抑制剤として選択する工程。
(4)下記の工程を含む、心肥大抑制剤をスクリーニングする方法:
(a) 構成的活性型PKCεまたは構成的活性型PKD1を発現し得る心筋細胞に、被験物質を接触させる工程、
(b) 上記心筋細胞について、PKD1の活性、サルコメアZディスクにおけるリン酸化PKD1の局在性、またはPKCεとPKD1との2分子間距離を測定し、被験物質を接触させない対照の心筋細胞における上記に対応する活性、局在性または2分子間距離と対比する工程、及び
(c) 上記(b)の比較結果に基づいて、対照の心筋細胞に比して、PKD1の活性若しくはサルコメアZディスクにおけるリン酸化PKD1の局在性が低下してなるか、またはPKCεとPKD1との2分子間距離が増大してなる心筋細胞に投与した被験物質を、心肥大抑制剤として選択する工程。
(5)構成的活性型PKCεが、ヒト由来PKCεにおいてそのアミノ酸配列の156−162領域が欠失してなるものである(4)記載のスクリーニング方法。
(6)構成的活性型PKD1が、ヒト由来PKD1においてそのアミノ酸配列の744位及び748位のセリンがグルタミン酸に置換されてなるもの、ヒト由来PKD1においてそのPHドメインが欠失してなるもの、及びマウス由来PKD1においてそのアミノ酸配列の744位及び748位のセリンがグルタミン酸に置換されてなるものより選択される少なくとも1つである(4)記載のスクリーニング方法。
(7)被験物質の中から、ヒト由来PKD1のSer-744、Ser-748またはSer-916のいずれか少なくとも1つのリン酸化を抑制する作用を有する物質を選別する方法である(3)乃至(6)のいずれかに記載する方法。
(8)下記の工程を含む、心肥大抑制剤をスクリーニングする方法:
(a) (IV)の(1)〜(3)のいずれかに記載するトランスジェニック非ヒト動物に、被験物質を投与する工程、
(b) 上記非ヒト動物について心肥大の程度を測定し、被験物質を投与しない対照のトランスジェニック非ヒト動物の心肥大の程度と対比する工程、及び
(c) 上記(b)の比較結果に基づいて、心肥大を低下または抑制させる被験物質を心肥大抑制剤として選択する工程。
(9)心肥大に起因する心疾患の予防または治療用医薬組成物の有効成分の取得方法である、(1)乃至(8)のいずれかに記載するスクリーニング方法。
(10)心肥大に起因する心疾患が、心不全、虚血性心疾患、または不整脈である(9)に記載するスクリーニング方法。
【0032】
VIII.使用
(1)PKD1の心筋細胞における機能発現を抑制する物質またはENH2をコードする塩基配列を有する核酸の、心肥大抑制用医薬組成物を製造するための使用。
(2)上記PKD1の心筋細胞における機能発現を抑制する物質が、PKD1の心筋細胞における活性化を抑制する物質であるか、または心筋細胞におけるPKD1遺伝子の発現を阻害する物質である、(1)に記載する使用。
(3)PKD1の心筋細胞における機能発現を抑制する物質またはENH2をコードする塩基配列を有する核酸の、心肥大に起因する心疾患の発症を予防また治療するための医薬組成物を製造するための使用。
(4)上記PKD1の心筋細胞における機能発現を抑制する物質が、上記物質が、PKD1の心筋細胞における活性化を抑制する物質であるか、または心筋細胞におけるPKD1遺伝子の発現を阻害する物質である、(3)に記載する使用。
【発明を実施するための最良の形態】
【0033】
I.心肥大抑制用医薬組成物
心肥大は、運動による負荷亢進のほか、高血圧による圧負荷の亢進や弁膜症による容量負荷の亢進などの病的要因、並びにその他原因不明の病的要因によってもたらされる。本発明が対象とする心肥大は、後者、すなわち病的状態により過剰の血行力学的負荷や液性因子などの種々のストレスが加わることによって、生理的肥大の範囲を超えて容積が増大した心筋の病的状態(例えば、代償性肥大や肥大型心筋症など)を意味する。心臓の負荷がどの部分にかかるかによって左室肥大、右室肥大、両室肥大、心房肥大の部位差が生じるが、これらの肥大形態の別を特に問うものではない。また、心臓にかかる過剰な負荷が圧負荷である場合は壁厚が顕著に増大し内腔は不変若しくは狭小する傾向にあり(求心性肥大)、一方、容量負荷である場合には壁厚はあまり増加せずに内腔が拡大する傾向にある(遠心性肥大)が、本発明においても、これらの別も特に問うものではない。敢えていえば、壁厚の増大形態を示す前者の求心性肥大に対して好適に使用することができる。
【0034】
また本発明が対象とする心肥大は、7回膜貫通型受容体(GPCR)を介したGタンパクの活性化、または上皮成長因子受容体(EGF受容体)を介した受容体型チロシンキナーゼの活性化を通じて生じるシグナル伝達を介して生じるものである。なお、7回膜貫通型ヘテロ三量体Gタンパク共役型受容体(GPCR)は、アンジオテンシンII(AngII)、エンドセリン−1、及びノルエピネフリン(NE)などの液性因子による刺激を受けると、直下流のヘテロ三量体Gタンパク質を活性化し、Ca2+/イノシトールターンオーバーを活性化し、心肥大関連転写因子群を作動させて心筋細胞内のタンパク質合成を促し、心肥大が惹起されると考えられている。
【0035】
本発明の心肥大抑制用医薬組成物は、PKD1の心筋細胞における機能発現を抑制する物質を有効成分とするものである。なお、ここで抑制とはPKD1の機能発現を100%抑制(阻止)する場合と、100%阻止しなくてもPKD1が本来有する機能を低減させる場合の両者を含む。かかる物質としては、結果として心筋細胞におけるPKD1の機能の発現を抑制し得るものであればよく、例えば心筋細胞におけるPKD1の発現または産生を抑制する物質、心筋細胞におけるPKD1の活性化シグナルを遮断若しくは抑制する物質、並びに心筋細胞におけるPKD1の活性化(リン酸化を含む)を抑制する物質を挙げることができる。
【0036】
例えば、心筋細胞におけるPKD1の発現または産生を抑制する物質としては、心筋細胞におけるPKD1の発現または産生において、PKD1遺伝子の転写、RNAプロセッシング、輸送、翻訳、及び/又は安定性を抑制する物質を挙げることできる。こうした物質として具体的には、PKD1をコードする遺伝子の塩基配列にハイブリダイズし、その転写、RNAプロセッシング、輸送、翻訳、及び/又は安定性を抑制し得るアンチセンス分子、リボザイム、及びRNAiエフェクターを例示することができる。
【0037】
本発明で用いられるアンチセンス分子は、PKD1遺伝子のプロモーターまたはその他の制御領域、エキソン、イントロンあるいはエキソン−イントロン境界に結合するように設計される。多くの効果的なアンチセンス分子は、イントロン/エキソン・スプライス接合部とハイブリダイズし得るように設計されている。よって、本発明におけるアンチセンス分子も、PKD1遺伝子のイントロン/エキソン・スプライス接合部の50〜200塩基内の領域にハイブリダイズするように、当該領域に対して実質的に相補的な塩基配列を有するものであることが好ましい。
【0038】
リボザイムは、RNA−タンパク質複合体であり、対象の遺伝子(mRNA)に部位特異的に結合してそれを切断することで、タンパク質への翻訳を阻害し、遺伝子機能の発現を抑制する機能を発揮する物質である。本発明で用いられるリボザイムは、PKD1遺伝子(DNA)から転写されたmRNAの任意領域とハイブリダイズするように当該領域に対して実質的に相補的な塩基配列を有し、そして結合した対象のオリゴヌクレオチド領域内のリン酸エステルを切断して、PKD1への翻訳を阻害するように設計される。
【0039】
RNAiエフェクターは、RNAi(RNA干渉)の機能を発揮することによって、PKD1のDNAもしくはmRNAの上流域にハイブリダイズし、PKD1遺伝子の発現を特異的に抑制するものである。RNAiエフェクターとしては、siRNA(small interfering RNA)、stRNA(small temporally regulated RNA)及びshRNA(short hairpin RNA)等を挙げることができる。なお、RNAiエフェクターを利用したRNAi技術並びにその方法は、多比良和誠ら編,「RNAi実験プロトコール」,羊土社発行,2003年等に詳細に記載されており、その内容は援用により本発明の内容に組み込まれる。
【0040】
また、心筋細胞において発現可能なように制御されたドミナント・ネガティブ型PKD1をコードする核酸もまた、心筋細胞におけるPKD1の発現または産生を抑制する物質として理解することができる。例えばPKD1のATP結合部位(例えば、ヒト由来PKD1の場合は612位のLys残基、マウス由来PKD1の場合は618位のLys残基)における変異は、そのキナーゼ機能を優位に抑制することが知られている。ドミナント・ネガティブ型PKD1としては、具体的にはヒト由来PKD1のアミノ酸配列の618位のリジン(Lys-618)をアスパラギンに置換したもの(K618N PKD1)、ヒト由来PKD1の アミノ酸配列612位のリジン(Lys-612)をトリプトファンに置換したもの、ヒト由来PKD1の アミノ酸配列733位のアスパラギン酸(Asp-733)をアラニンに置換したもの、ヒト由来PKD1の アミノ酸配列738位及び742位のセリンをアラニンに置換したもの、マウスPKD1のアミノ酸配列618位のリジン(Lys-618)をメチオニンに置換したもの、及びマウス由来PKD1の アミノ酸配列744位及び748位のセリン(Ser-744、Ser-748)をアラニンに置換したもの等、を例示することができる。
【0041】
かかるドミナント・ネガティブ型PKD1をコードする核酸は、通常、当該核酸の心筋細胞における発現に必要な機能性DNA配列に、作動可能に結合された状態で用いられる。ここで、機能性DNA配列としては、ドミナント・ネガティブ型PKD1をコードする核酸が心筋細胞において発現するために必要な制御領域や調節エレメントなどを意味し、例えばポリアデニル化シグナル、上流配列ドメイン、プロモーター、エンハンサー、またはターミネーター等を例示することができる。
例えば、プロモーターとして具体的には、SV40初期プロモーター、マウス乳腺腫瘍ウイルスLTRプロモーター、アデノウイルス腫瘍後期プロモーター(Ad MLP)、単純ヘルペスプロモーター、CMVプロモーター(例えば、CMV最初期プロモーター、ラウス肉腫(RSV)プロモーター)、ミオシン軽鎖−2プロモーター、α−アクチンプロモーター、トロポニン1プロモーター、Na+/Ca2+交換プロモーター、ジストロフィンプロモーター、クレアチンキナーゼプロモーター、α7インテグリンプロモーター、脳ナトリウム利尿ペプチドプロモーター、αB−クリスタリン/スモール熱ショックタンパク質プロモーター、αミオシン重鎖プロモーター、ANFプロモーターなどを挙げることができる、これらのプロモーターは、心筋細胞において組織特異的に発現し得るものであることがより好ましい。
【0042】
また、ここで「作動可能に結合する」とは、ドミナント・ネガティブ型PKD1をコードする核酸が、上記各種の機能性DNA配列との結合位置及び方向に係わらず、心筋細胞内で発現し得る状態で存在することを意味する。
【0043】
また上記とは別の心肥大抑制機序に基づいて、本発明は、心筋細胞において発現可能なように制御されたENH2をコードする塩基配列を有する核酸を、心筋細胞内での心肥大シグナルカスケードを抑制制御する物質として提供する。当該核酸も、上記と同様に、通常、当該核酸の心筋細胞における発現に必要な機能性DNA配列に、作動可能に結合された状態で用いられる。なお、ENH2をコードする塩基配列は、Nakagawa N らによって既に公知となっており(Nakagawa N, Hoshijima M, Oyasu M, Saito N, Tanizawa K, Kuroda S. ENH, containing PDZ and LIM domains, heart/skeletal muscle-specific protein, associates with cytoskeletal proteins through the PDZ domain. Biochem. Biophys. Res. Commun., 2000 Jun 7, 272(2), p.505-12.)、当該文献の内容は援用により、本発明の内容に組み込まれる。
【0044】
これらの核酸は、被験者、好ましくはヒトを含む哺乳動物への投与に適した形態を備えていることが好ましい。
【0045】
かかる形態としては、遺伝子治療用の発現ベクターを挙げることができる。当該遺伝子治療に用いられる発現ベクターは、所望の投与経路に応じて当業界で公知の方法で処方することができる。また、発現ベクターが標的器官(心臓、心筋細胞)に到達するまで、当該発現ベクターから目的核酸の放出あるいは吸収を防止するための方法も当業界で公知であり、同様に本発明に適用することができる。また、当該発現ベクターは、他のベヒクル(例えば、リポソームのような脂質ベースの分子、凝集タンパク質、またはトランスポーター分子)などと複合体を形成した状態で使用することもできる。これらの発現ベクターは、冠動脈または冠状静脈洞への注入により心筋細胞に送達することができる(冠動脈を通じた冠内送達、冠動脈内送達または動脈内送達と呼ばれる)(例えば、米国特許第5792453号、同第6100242号公報等参照。これらの文献の内容は援用により本発明の内容に組み込まれる。)。
【0046】
発現ベクターには、プラスミドベクターおよびウイルスベクターが含まれる。ウイルスベクターの場合、ドミナント・ネガティブ型PKD1をコードする核酸またはENH2をコードする核酸は、心筋細胞における発現に必要な機能性DNA配列を作動可能に結合した状態で、ウイルス粒子内に封入された状態で使用される。かかるウイルスベクターとしても当業界で公知のものを任意に使用することができ、例えばアデノウイルス、レトロウイルス、アデノ随伴ウイルス、ワクシニアウイルス、ヘルペスウイルス、及びポリオーマウイルス等を挙げることができる。
【0047】
また、上記ウイルスベクターに代えて、粒子形成能を有する物質に心臓組織若しくは心筋細胞を特異的に認識できる生体認識分子が導入されてなる中空ナノ粒子を用いることもできる。当該中空ナノ粒子は、標的とする細胞及び組織に所望の物質を導入するための運搬体として当業界で公知のものである。当該中空ナノ粒子の詳細は、例えば特開2001−316298号公報に記載されており、その内容は本明細書に援用されて本発明の内容に組み込まれる。
【0048】
また心筋細胞におけるPKD1の活性化を抑制する物質としては、具体的には、PKD1の触媒ドメインからCRドメインの解離を抑制する物質、PKD1のリン酸化を抑制する物質(例えば、ヒト由来PKD1のSer-744、Ser-748またはSer-916のいずれか少なくとも一カ所でのリン酸化を抑制する物質)、PKCεとPKD1との複合体形成を抑制する物質、PKD1の基質結合部位に選択的に結合して酵素活性を抑制する物質、PKD1のサルコメアZディスク局在を抑制する物質〔例えば、PKD1のサルコメアZディスクへのリクルーティングを抑制する物質、またはPKD1のサルコメアZディスク上の足場[例えば、ENH1]への結合を抑制する物質などが例示できる〕などを挙げることができる。
【0049】
かかる物質として、具体的には、PKD1またはその任意の部分と免疫反応性である抗体を挙げることができる。抗体は、ポリクローナル抗体またはモノクローナル抗体のいずれであってもよい。好ましくはモノクローナル抗体である。ポリクローナル抗体並びにモノクローナル抗体の調製方法は、当業界で周知であり、本発明の抗体もこれに準じて調製することができる(例えば、Harlow and Lane, Antibodies; A Laboratory manual, Cold Spring Harbor Laboratry, 1988;米国特許第4,196,265号公報等参照、これらの文献の内容は援用により本発明の内容に組み込まれる)。本発明で好適に用いられる抗体としては、具体的には、抗−PKD1抗体(ポリクローナル抗体、モノクローナル抗体の両方を意味する)、PKD1のCRドメインに対する抗体(抗−PKD1/CRドメイン抗体)、PKD1のPHドメインに対する抗体(抗−PKD1/PHドメイン抗体)、PKD1のリン酸化領域に対する抗体〔例えば、ヒト由来PKD1の場合は、(1)Ser-744、Ser-748またはSer-916の少なくとも1カ所を含むPKD1断片(ペプチド)に対する抗体、または (2)リン酸化されてなるSer-744、Ser-748またはSer-916の少なくとも1カ所を含むPKD1断片(ペプチド)に対する抗体〕、PKD1の触媒領域に対する抗体、抗−不活性型PKD1抗体(不活性型PKD1を安定化する)、抗−全活性型PKD1抗体(活性化状態のPKD1に結合して立体障害により酵素活性を抑える)などを挙げることができる。
【0050】
本発明の心肥大抑制用医薬組成物は、有効量の有効成分(PKD1の心筋細胞における機能発現を抑制する物質またはENH2をコードする核酸)とともに、その種類に応じて、自体公知の薬学的に許容される担体や添加剤を含んでいてもよい。当該医薬組成物は、所望の投与方法、例えば経口投与、静脈内投与、筋肉内投与、皮下投与、経肺投与、経鼻投与、経腸投与、腹腔内投与、または冠動脈もしくは冠状静脈洞投与などによって投与することができ、その投与経路に応じて、錠剤、丸剤、散剤、粉末剤、顆粒剤、及びカプセル剤などの固体投与形態;溶液、懸濁剤、乳剤、シロップ、リポソーム製剤、注射剤、静注剤、点滴剤及びエリキシルなどの液剤投与形態;貼付剤、軟膏、クレーム及び噴霧剤などの外用投与形態に、調合、成形乃至調製することができる。
【0051】
これらの医薬組成物(医薬製剤)の調製に利用される担体としては、製剤の投与形態に応じて通常使用される賦形剤、希釈剤、結合剤、付湿剤、崩壊剤、崩壊抑制剤、吸収促進剤、滑沢剤、溶解補助剤、緩衝剤、乳化剤、懸濁剤などが例示できる。また添加剤としては、製剤の投与形態に応じて通常使用される安定化剤、保存剤、緩衝剤、等張化剤、キレート剤、pH調整剤、界面活性剤、着色剤、香料、風味剤、甘味剤などが例示できる。
【0052】
また本発明の心肥大抑制用医薬組成物には、有効成分であるPKD1の心筋細胞における機能発現を抑制する物質またはENH2をコードする核酸に加えて、7回膜貫通型ヘテロ三量体Gタンパク質共役型受容体(GPCR)または上皮成長因子受容体の刺激を介さない心肥大シグナル経路を遮断する物質、例えばサイトカインレセプターブロッカーやLIF阻害剤などといったgp130レセプターを介する心肥大シグナル経路を遮断する物質(gp130レセプター阻害剤)を配合することもできる。
【0053】
上記医薬組成物中に含有されるべき有効成分の量およびその投与量は、特に限定されず、所望の治療効果、投与法、治療期間、患者の年齢、性別その他の条件などに応じて広範囲より適宜選択される。投与量は、投与経路によっても異なるが、通常、1回投与あたりの有効成分の量に換算して、0.1pg〜100mg/kgの範囲で投与することができる。
【0054】
II.心肥大の抑制方法、心肥大発生もしくはその進展の予防方法
本発明の心肥大の抑制方法は、PKD1の心筋細胞における機能発現を抑制する物質またはENH2をコードする核酸を有効量、心肥大またはその前状態にある被験者に投与することによって達成することができる。また、当該方法は、心肥大またはその前状態にある被験者について、心肥大の発生またはその進展を予防する方法としても有効に使用することができる。
【0055】
ここで心筋細胞におけるPKD1の機能発現を抑制する物質またはENH2をコードする核酸としては、I.で述べるものを同様に挙げることができる。これらの物質は、心肥大の抑制に有効な量を、薬学的に許容される担体若しくはその他の添加剤とともに、医薬組成物の形態で使用することができる。これら医薬組成物の形態、投与経路、投与方法並びに当該医薬組成物の投与用量(有効成分の投与量)もまた、前述I.の通りである。
【0056】
投与対象とする被験者としては、ヒト並びにその他の哺乳動物を挙げることができる。かかる哺乳動物としては、具体的にはラット、マウス、ハムスター、モルモット、イヌ、サル、ウシ、ウマ、ヒツジ、ヤギ、ブタなどを制限されることなく例示することができる。
【0057】
III.心肥大に起因する心疾患の予防または治療用医薬組成物
前述するように、Framingham Heart Study等により、心肥大は、心不全を始め、狭心症や心筋梗塞などの虚血性心疾患、不整脈など心血管系疾患を招く危険因子であることが知られている。ゆえに、前述の心筋細胞におけるPKD1の機能発現を抑制する物質並びにENH2をコードする核酸は、心筋細胞内において心肥大を抑制する作用を発揮することに基づいて、同時に心肥大に起因して生じる各種の心疾患の発症を予防しまた治療する薬物として有効に使用することができる。
【0058】
心肥大に起因して生じる心疾患としては、上記するように心不全(鬱血性心不全、急性左心不全、急性肺性心不全、心原性ショック[心筋梗塞発作、徐脈、頻脈発作]などの収縮不全;肥大型心筋症、アミロイドーシス、収縮性心膜炎、心膜タンポナーデ等の拡張不全)、虚血性心疾患(狭心症や心筋梗塞症)、及び不整脈を例示することができる。
【0059】
有効成分として使用される、心筋細胞におけるPKD1の機能発現を抑制する物質及びENH2をコードする核酸としては、I.で述べるものを同様に挙げることができる。
【0060】
これらの物質は、心肥大に起因する心疾の予防または治療に有効な量を、薬学的に許容される担体若しくはその他の添加剤とともに、医薬組成物の形態で使用することができる。なお、必要に応じて、公知の心疾患治療薬を配合することもできる。かかる心疾患治療薬としては、限定されないが、βブロッカー、抗高血圧剤、強心剤、抗血栓剤、血管拡張剤、エンドセリンレセプターブロッカー、カルシウムチャンネルブロッカー、ホスホジエステラーゼ阻害剤、AngIIレセプターブロッカー、サイトカインレセプターブロッカー、gp130レセプター阻害剤などを例示することができる。
【0061】
医薬組成物の投与形態、投与経路、並びに当該医薬組成物の投与(摂取)用量もまた、前述I.の通りである。
【0062】
IV.心肥大に起因する心疾患の予防または治療方法
本発明の心肥大に起因する心疾患の予防または治療方法は、PKD1の心筋細胞における機能発現を抑制する物質またはENH2をコードする核酸を有効量、心肥大に起因する心疾患またはその前状態にある被験者に投与することによって達成することができる。また、当該方法は、心肥大の被験者について心肥大から心疾患への進展を予防する方法としても有効に使用することができる。
【0063】
ここで心筋細胞におけるPKD1の機能発現を抑制する物質及びENH2をコードする核酸としては、I.で述べるものを同様に挙げることができる。当該物質は、心肥大に起因する心疾患の予防または治療に有効な量を、薬学的に許容される担体若しくはその他の添加剤とともに、医薬組成物の形態で使用することができる。これら医薬組成物の投与形態、投与経路、投与方法並びに当該医薬組成物の投与用量(有効成分の投与量)もまた、前述I.の通りである。なお、必要に応じて、公知の心疾患治療薬を併用投与することもできる。かかる心疾患治療薬としては、限定されないが、βブロッカー、抗高血圧剤、強心剤、抗血栓剤、血管拡張剤、エンドセリンレセプターブロッカー、カルシウムチャンネルブロッカー、ホスホジエステラーゼ阻害剤、AngIIレセプターブロッカー、サイトカインレセプターブロッカー、gp130レセプター阻害剤などを例示することができる。
【0064】
心肥大に起因する心疾患の種類としては、III.に記載する心不全、虚血性心疾患、不整脈を同様に挙げることができる。また投与対象とする被験者としても、IIに記載するヒト並びにその他の哺乳動物(ラット、マウス、ハムスター、モルモット、イヌ、サル、ウシ、ウマ、ヒツジ、ヤギ、ブタなど)を同様に挙げることができる。
【0065】
V.心肥大シグナル伝達を遮断する方法
前述する心肥大抑制方法、並びに心肥大に起因する心疾患の予防または治療方法は、心筋細胞におけるPKD1の機能発現を抑制することによって、または心筋細胞内でENH2を強制発現させることによって行われるが、これは心筋細胞におけるPKD1の機能発現を抑制するか、またはENH2を強制発現させることによって、GPCR若しくはEGF受容体を介する心肥大シグナル伝達またはENH1が関与する心肥大シグナル伝達を阻害することに基づくものである。
【0066】
ゆえに本発明は、別の観点から、心筋細胞における心肥大シグナル伝達を遮断または抑制する方法を提供するものである。なお、ここで対象とする心肥大シグナル伝達は、直接的にはGPCRまたはEGF受容体を介した心肥大シグナル伝達である。当該心肥大シグナル伝達の遮断または抑制は、心筋細胞におけるPKD1の機能発現を阻害する物質またはENH2をコードする核酸を被験対象物に有効量投与することによって達成することができる。当該被験対象物は、心筋細胞またはそれを有する組織であればよく、培養心筋細胞、培養心臓組織、または生体内に存在する心筋細胞または心臓組織であってもよい。なお、ここで心筋細胞及び心臓組織の由来は特に問わず、ヒトまたはその他の哺乳動物(ラット、マウス、ハムスター、モルモット、イヌ、サル、ウシ、ウマ、ヒツジ、ヤギ、ブタなど)を広く挙げることができる。被験対象物に投与する、PKD1の機能発現を阻害する物質またはENH2をコードする核酸、並びにその量としては、I.に前述する物質ならびにその量を同様に挙げることができる。
【0067】
また、PKD1の機能発現を阻害する物質またはENH2をコードする核酸と併せて、サイトカインブロッカー等のgp130レセプターを介する心肥大シグナル経路を遮断する物質(gp130レセプター阻害剤)を投与することもできる。こうすることで、GPCRまたはEGF受容体を介さない別経路の心肥大シグナル伝達をも併せて遮断することが可能となる。
【0068】
VI.トランスジェニック非ヒト動物
本発明は、非ヒト動物の神経細胞内でPKD1関連タンパクが発現するように構築されたトランスジェニック非ヒト動物を提供する。
【0069】
なお、ここで非ヒト動物としては、ラット、マウス、ハムスター、モルモット、ウシ、ウマ、サル、イヌ、ヒツジ、ヤギ、ブタ等の哺乳動物を挙げることができる。
【0070】
トランスジェニック非ヒト動物の一態様として、本発明は、心筋細胞において構成的活性型PKD1を強制発現させてなるトランスジェニック非ヒト動物を提供する。当該トランスジェニック非ヒト動物は、心筋細胞中のPKD1が全活性状態(リン酸化)にあることにより心肥大を発症する。このため当該トランスジェニック非ヒト動物は心肥大の病態を模倣したモデル動物(心肥大病態モデル非ヒト動物)として、心肥大の組織学的研究や心疾患への進展メカニズムの解明、ならびにスクリーニング動物として心肥大の抑制剤や心疾患の予防・治療剤の開発に有効に利用することができる。
【0071】
構成的活性型PKD1は、PKD1の特定領域のアミノ酸残基を欠失させるかまたは点変異等によって置換させることによって作成することができる。具体的には、ヒト由来PKD1の場合は、そのアミノ酸配列中、PHドメインを欠失させる方法または744位及び748位のセリンをグルタミン酸に置換する方法を、マウス由来PKD1の場合は、そのアミノ酸配列中、744位及び748位のセリンをグルタミン酸に置換する方法によって作成することができる。
【0072】
心肥大の病態モデル動物は、具体的には、心筋細胞中に、プロモーター等の機能的DNAの制御下で構成的活性型PKD1をコードする遺伝子を発現可能な状態で有し、これにより心筋細胞中で当該構成的活性型PKD1が発現産生してなるトランスジェニック非ヒト動物である。
【0073】
また別の態様として、本発明は心筋細胞におけるPKD1の機能発現がノックアウトされてなるトランスジェニック非ヒト動物を提供する。当該トランスジェニック非ヒト動物は、心筋細胞中のPKD1が不活性状態(非リン酸化)にあることから、GPCRまたはEGF受容体を介した肥大シグナル伝達が遮断されており、当該GPCRを介した刺激によっても心肥大を発症しない。このため当該トランスジェニック非ヒト動物は、GPCRまたはEGF受容体を介した心肥大シグナルカスケードを遮断したモデル動物として、他の心肥大シグナル経路(例えば、gp130レセプターを介する心肥大シグナル経路)を通じた心肥大メカニズムの解明や心疾患への進展の解明等に有効に利用することができる。
【0074】
心筋細胞におけるPKD1の機能発現がノックアウトされてなるトランスジェニック非ヒト動物は、その心筋細胞においてドミナント・ネガティブ型PKD1を発現させることによって作成することができる。ドミナント・ネガティブ型PKD1は、PKD1の特定領域(例えば、ATP結合領域やリン酸化活性ループ)のアミノ酸残基を欠失させるか、または特定部位(例えば、ATP結合部位やリン酸化活性ループ部位)を点変異等によって置換させることによって作成することができる。具体的には、ヒト由来PKD1の場合は、そのアミノ酸配列中、612位をリジンがトリプトファンに置換する方法、618位のリジンをアスパラギンに置換する方法、733位のアスパラギン酸をアラニンに置換する方法、または738位及び742位のセリンをアラニンに置換する方法によって作成することができる。またマウス由来PKD1の場合は、そのアミノ酸配列中、618位のリジンをメチオニンに置換する方法、または744位及び748位のセリンをアラニンに置換する方法によって作成することができる。
【0075】
かかるトランスジェニック非ヒト動物は、具体的には、心筋細胞中に、プロモーター等の機能的DNAの制御下でドミナント・ネガティブ型PKD1をコードする遺伝子を発現可能な状態で有し、これにより心筋細胞中で当該ドミナント・ネガティブ型PKD1が発現産生してなる動物である。
【0076】
これらのトランスジェニック非ヒト動物を産生するための方法は、一般的に、米国特許第4873191号公報、Brister et al., Proc. Natl. Acad. Sci. USA, 82, p.4438-4442 (1985)、特開2003-55266号公報、並びに「Manipulating the maouse Embryo; A Laboratory Manual」第2版(編集、Hogan, Beddington, Costantimi 及びLong, Cold Spring Harbor Laboratory Press, 1994)に記載されており、本発明もこれに準じて行うことができる。なお、これらの文献の内容は、本明細書で援用されることにより本発明の内容に組み込まれる。典型的な方法として、被験動物に導入される所望の遺伝子を、マイクロインジェクションによりその動物の受精卵に移入する方法を例示することができる。マイクロインジェクションされた受精卵は、雌性宿主に移植され、導入遺伝子の発現を指標として子孫の中から所望のトランスジェニック非ヒト動物が選抜取得できる。
【0077】
V.スクリーニング方法
本発明は、心筋細胞におけるPKD1の機能発現を制御することができる物質をスクリーニングする方法を提供する。特に好ましい物質は、心筋細胞におけるPKD1の機能発現を抑制する作用を有するものである。当該物質は、心筋細胞におけるGCPRを介した肥大シグナル伝達を遮断もしくは抑制することによって、心肥大の発症または進展を抑制することができるものと期待できる。さらに当該物質によれば心肥大に起因する心疾患を予防または治療することができると期待される。すなわち、本発明は、心肥大抑制剤または心肥大に起因する心疾患の予防若しくは治療剤の有効成分をスクリーニングする方法を提供する。
【0078】
当該スクリーニング方法は、基本的には心筋細胞においてPKD1の機能発現を抑制する作用を発揮する物質を探索することからなるが、具体的には、下記のスクリーニング方法(1)〜(4)を例示することができる。
(1)下記の工程を含む、心肥大抑制剤の有効成分をスクリーニングする方法:
(a) PKD1を発現し得る細胞に被験物質を接触させる工程、
(b) 上記細胞について、PKD1の発現レベルを測定し、被験物質を接触させない対照の細胞におけるPKD1の発現レベルと対比する工程、及び
(c) 上記(b)の比較結果に基づいて、対照の細胞に比して、PKD1の発現レベルが低下してなる細胞と接触させた被験物質を、心肥大抑制剤の有効成分として選択する工程。
【0079】
かかる工程により、PKD1の発現及び産生を抑制する作用を有する物質を取得することができる。
【0080】
ここで使用される細胞は、内来性及び外来性を問わず、PKD1遺伝子を発現可能な状態で有するものであり、その由来は特に制限されない。好ましくはヒト由来またはヒト以外の哺乳動物由来のPKD1遺伝子を発現可能な状態で有する細胞である。具体的には、ヒトもしくはヒト以外の哺乳動物に由来する心筋細胞または骨格筋細胞を挙げることができ、心臓または骨格筋から単離調製した培養細胞を好適に使用することができる。また細胞の集合体である組織も当該範疇に含まれる。またヒト由来またはヒト以外の哺乳動物に由来するPKD1遺伝子を発現可能な状態で有する原核細胞または真核細胞(昆虫細胞を含む)を用いることもできる。
【0081】
被験物質としては、制限はされないが、核酸、ペプチド、タンパク質、有機化合物、または無機化合物などであり、スクリーニングは、具体的には、これらの被験物質またはこれらを含む組成物(例えば、細胞抽出物、遺伝子ライブラリーの発現産物等を含む)を対象の細胞と接触させることにより行うことができる。また、スクリーニングに際して採用される被験物質と細胞との接触条件は、特に制限されないが、細胞が死滅せず所望の遺伝子を発現できる培養条件を選択することが好ましい(以下のスクリーニング方法においても同じ)。
【0082】
PKD1の発現レベルは、PKD1の遺伝子の塩基配列において連続する少なくとも15塩基を有するポリヌクレオチド及び/またはその相補的なポリヌクレオチドをプライマーまたはプローブとして用いて、ノーザンブロット法、RT−PCR法、in situハイブリダーゼイション解析法、デファレンシャル・ハイブリダーゼーション法、DNAチップ法、RNase保護アッセイなどの公知の方法を行うことにより測定することができる。また、PKD1の発現レベルは、発現産生されたPKD1(タンパク質)の量を測定することによっても評価することができる。この場合は、PKD1を認識する抗体をマーカーとして用いて、ウエスタンブロット法などの公知の方法で、産生されたPKD1を検出し、定量する。
【0083】
かかるスクリーニング方法による心肥大抑制剤または心肥大に起因する心疾患の予防・治療剤の有効成分(候補物質)の選別は、被験物質を接触させた細胞におけるPKD1の発現レベルが、被験物質を接触させない細胞におけるPKD1の発現レベルに比して、低くなることを指標として行うことができる。
【0084】
実施例で示すように、PKD1はGPCRまたはEGFレセプターを介する心肥大のシグナル伝達において中心的な役割を担う成分である。ゆえに上記スクリーニングで選別されるPKD1の発現及び産生を抑制する物質は、当該心肥大のシグナルカスケードを阻止もしくは抑制することができ、ゆえに心肥大抑制剤の有効成分として、また心肥大に起因する心疾患の予防・治療剤の有効成分として使用することが可能である。
【0085】
(2)下記の工程を含む、心肥大抑制剤の有効成分をスクリーニングする方法:
(a) PKD1を発現し得る細胞に、PKD1活性化剤及び被験物質を接触させる工程、
(b) 上記細胞について、PKD1の活性を測定し、被験物質を接触させない対照の細胞における上記に対応する活性と対比する工程、及び
(c) 上記(b)の比較結果に基づいて、対照の細胞に比して、PKD1の活性が低下してなる細胞に投与した被験物質を、心肥大抑制剤の有効成分として選択する工程。
【0086】
かかる工程により、PKD1の発現及び産生を抑制するか、またはPKD1の活性を阻害する物質を取得することができる。
【0087】
ここでPKD1活性化剤とは、PKD1を全活性化(リン酸化)することができるものであればよく、例えば典型的なものとしてTPA(12-O-テトラデカノイルホルボール 13-アセテート)などのホルボールエステル、ジアシルグリセロール(DG)、PKC(例えば、PKCε)を挙げることができる。
【0088】
PKD1の活性測定は、PKD1のリン酸化に基づく活性(例えば、ヒト由来のPKD1の場合、アミノ酸配列のSer-916位のリン酸化に基づく活性)を評価することによって行うことができる。その方法は特に制限されないが、具体的には特定の基質ペプチド(例えば、Syntide-2 [APLARTLSVAGLPGKK])に対するリン酸化能を評価する方法(リン酸化アッセイ)を例示することができる。当該 リン酸化アッセイは、具体的には、実施例において説明する方法に従って行うことができる。
【0089】
かかるスクリーニング方法による心肥大抑制剤または心肥大に起因する心疾患の予防・治療剤の有効成分(候補物質)の選別は、被験物質を接触させた細胞におけるPKD1の活性が、被験物質を接触させない細胞におけるPKD1の活性に比して、低くなることを指標として行うことができる。
【0090】
実施例で示すように、PKD1は心肥大のシグナル伝達における重要な成分であり、PKD1の活性化を介して更に下流のカスケードが起動して心肥大が誘導される。ゆえに上記スクリーニングで選別される物質は、心肥大のシグナリングを阻止もしくは抑制することができ、心肥大抑制剤の有効成分として、また心肥大に起因する心疾患の予防・治療剤の有効成分として使用することが可能である。
【0091】
(3)下記の工程を含む、心肥大抑制剤の有効成分をスクリーニングする方法:
(a) 心筋細胞に、GPCRまたはEGF受容体を刺激する心肥大誘導剤と被験物質を接触させる工程、
(b) 上記心筋細胞について、PKD1の活性、サルコメアZディスクにおけるリン酸化PKD1の局在性、またはPKCεとPKD1との2分子間距離を測定し、心肥大誘導剤だけを接触させた対照の心筋細胞における上記に対応する活性、局在性または2分子間距離と対比する工程、及び
(c) 上記(b)の比較結果に基づいて、対照の心筋細胞に比して、PKD1の活性若しくはサルコメアZディスクにおけるリン酸化PKD1の局在性が低下してなるか、またはPKCεとPKD1との2分子間距離が増大してなる心筋細胞に投与した被験物質を、心肥大抑制剤の有効成分として選択する工程。
【0092】
かかる工程により、作用メカニズムに拘わらず、心筋細胞におけるPKD1の機能発現を抑制する物質を取得することができる。
【0093】
心筋細胞としては、ヒトまたはヒト以外の哺乳動物に由来する心筋細胞を挙げることができる。かかる細胞としては、好適にはヒトまたはヒト以外の哺乳動物から単離され調製された培養細胞を用いることができる。なお、心筋細胞の集合体である組織もまたこの範疇に含まれる。GPCRまたはEGF受容体を刺激する心肥大誘導剤としては、GPCRまたはまたはEGF受容体を介して心肥大を誘導することが知られている物質を制限なく挙げることができる。例えば、かかる物質として、典型的には、前者としてAngII、エンドセリン−1及びNEが、また後者として上皮成長因子(EGF)が知られている。
【0094】
当該スクリーニング方法では、心筋細胞におけるPKD1活性、サルコメアZディスクにおけるリン酸化PKD1の局在性、またはPKCεとPKD1との2分子間距離の少なくとも1つを指標として、所望の物質が選択される。
【0095】
PKD1活性の測定方法としては、上記(2)に記載する方法を用いることができる。
【0096】
また、サルコメアZディスクにおけるリン酸化PKD1の局在性は、リン酸化PKD1(全活性型PKD1)を特異的に標識し検出できる試薬を用いて心筋細胞を染色し、次いでその試薬に応じた検出方法を用いてリン酸化PKD1の心筋細胞内における挙動を観察することによって調べることができる。リン酸化PKD1を特異的に標識し検出できる試薬としては、リン酸化PKD1を特異的に認識してそれと結合する抗体を挙げることができ、具体的には、ヒト由来のPKD1の場合は、実施例で使用する、ヒト由来PKD1のアミノ酸配列912-918を有するペプチド〔但し、Ser-916位がリン酸化されている〕に対する抗体(抗−全活性型PKD1抗体)を例示することができる。好適には、α−アクチニンのサルコメアに対する特異的抗体、上記リン酸化PKD1(全活性型PKD1)に対する抗体並びに蛍光若しくは化学発光試薬を用いて心筋細胞を処理し、得られた細胞の蛍光像または化学発光像を差異解析する方法を挙げることができる。より具体的な測定方法を実施例に記載する。
【0097】
細胞内におけるPKCεとPKD1の2分子間距離は、蛍光蛋白質を利用したFRET(蛍光エネルギー移動)を解析することによって求めることができる。具体的には、当該方法は例えば浜松ホトニクス社製(日本)の3CCD-FRETイメージングシステム(AQUACOSMOS/ASHURA)を用いて行うことができ、かかる方法によれば異なる蛋白質(PKCεとPKD1)の相互作用を定量的にモニタリングすることができる。
【0098】
かかるスクリーニング方法による心肥大抑制剤または心肥大に起因する心疾患の予防・治療剤の有効成分(候補物質)の選別は、心肥大誘導剤と被験物質とを接触させた心筋細胞におけるPKD1活性が、心肥大誘導剤だけを接触させた(すなわち被験物質は接触させない)対照の心筋細胞におけるPKD1活性に比して低くなること;または心肥大誘導剤と被験物質とを接触させた心筋細胞におけるリン酸化PKD1のサルコメアZディスクへの局在性が、心肥大誘導剤だけを接触させた対照の心筋細胞におけるリン酸化PKD1のサルコメアZディスクへの局在性に比して低下すること;または心肥大誘導剤と被験物質とを接触させた心筋細胞におけるPKCεとPKD1の2分子間距離が、心肥大誘導剤だけを接触させた対照の心筋細胞におけるPKCεとPKD1の2分子間距離に比して大きくなること、を指標として行うことができる。
【0099】
実施例で示すように、PKD1は心肥大のシグナル伝達を担う重要な成分であり、PKD1の活性化を介して更に下流のカスケードが起動して心肥大が誘導される。また、PKD1は活性化されるとサルコメアZディスクに移行してそこに局在する。さらに、PKCεはPKD1の直接のアクチベーターであり、心肥大シグナリングに際してPKCεとPKD1とは互いに複合体を形成している。ゆえに上記スクリーニングで選別される物質は、心肥大のシグナリングを阻止もしくは抑制する作用を有するものであり、心肥大抑制剤の有効成分として、また心肥大に起因する心疾患の予防・治療剤の有効成分として使用することが可能である。
【0100】
(4)下記の工程を含む、心肥大抑制剤の有効成分をスクリーニングする方法:
(a) 構成的活性型PKCεまたは構成的活性型PKD1を発現し得る心筋細胞に、被験物質を接触させる工程、
(b) 上記心筋細胞について、PKD1の活性、サルコメアZディスクにおけるリン酸化PKD1(全活性型PKD1)の局在性、またはPKCεとPKD1との2分子間距離を測定し、被験物質を接触させない対照の心筋細胞における上記に対応する活性、局在性または2分子間距離と対比する工程、及び
(c) 上記(b)の比較結果に基づいて、対照の心筋細胞に比して、PKD1の活性若しくはサルコメアZディスクにおけるリン酸化PKD1の局在性が低下してなるか、またはPKCεとPKD1との2分子間距離が増大してなる心筋細胞に投与した被験物質を、心肥大抑制剤の有効成分として選択する工程。
【0101】
かかる工程により、心筋細胞におけるPKD1の活性化を抑制する物質を取得することができる。
【0102】
ここで心筋細胞は、構成的活性型PKCεまたは構成的活性型PKD1を発現し得るように調製されたものが使用される。構成的活性型PKD1を発現する心筋細胞は、心肥大誘導剤による刺激を要することなく全活性状態(リン酸化)のPKD1を発現している。また構成的活性型PKCεを発現する心筋細胞は、PKCεの活性により、心肥大誘導剤による刺激を要することなくPKD1を全活性化(リン酸化)させることができる。
【0103】
構成的活性型PKCεは、PKCεのN末端の偽基質領域が欠失するか、または特定のアミノ酸残基が点変異によって置換してなるものであって(Schonwasser, D.C., et al., Mol. Cell. Biol. 18, p.790-798, 1998)、ヒト由来PKCεの場合、具体的にはヒト由来PKCεのアミノ酸配列中、156−162領域を欠失してなるタンパク質を例示することができる。
【0104】
構成的活性型PKD1は、PKD1の特定領域のアミノ酸残基が欠失または点変異等によって置換してなるものであって、ヒト由来PKD1の場合、具体的にはそのアミノ酸配列中、PHドメインが欠失してなるもの、または744位及び748位のセリンがグルタミン酸に置換されてなるものを例示することができる。またマウス由来PKD1の場合は、そのアミノ酸配列中、744位及び748位のセリンがグルタミン酸に置換されてなるものを例示することができる。
【0105】
当該構成的活性型PKCεまたは構成的活性型PKD1を発現し得る心筋細胞は、これらのタンパク質をコードする遺伝子を、通常の遺伝子組み換え技術に従って、ヒトまたはその他の哺乳動物に由来する心筋細胞(培養細胞)に導入することによって作成することができる。
【0106】
かかるスクリーニング方法による心肥大抑制剤または心肥大に起因する心疾患の予防・治療剤の有効成分(候補物質)の選別は、被験物質とを接触させた心筋細胞におけるPKD1活性が、被験物質を接触させない対照の心筋細胞におけるPKD1活性に比して低くなること;または被験物質とを接触させた心筋細胞におけるPKD1のサルコメアZディスクへの局在性が、被験物質を接触させない対照の心筋細胞におけるPKD1のサルコメアZディスクへの局在性に比して低下すること;または被験物質とを接触させた心筋細胞におけるPKCεとPKD1の2分子間距離が、被験物質を接触させない対照の心筋細胞におけるPKCεとPKD1の2分子間距離に比して大きくなること、を指標として行うことができる。
【0107】
上記スクリーニングで選別される物質は、心肥大のシグナリングを阻止もしくは抑制する作用を有するものであり、心肥大抑制剤の有効成分として、また心肥大に起因する心疾患の予防・治療剤の有効成分として使用することが可能である。
【0108】
上記のスクリーニング方法によって選別された候補物質は、さらに心肥大を有する心肥大病態モデル非ヒト動物を用いてスクリーニングをかけることもできる。
【0109】
かかる心肥大病態モデル非ヒト動物としては、前述する構成的活性型PKD1を強制発現してなる本発明のトランスジェニック非ヒト動物を例示することができる。かかる心肥大病態モデル非ヒト動物を用いたスクリーニングは下記の工程を経て実施することができる:
(a) 構成的活性型PKD1を強制発現してなるトランスジェニック非ヒト動物(心肥大病態モデル非ヒト動物)に、被験物質を投与する工程、
(b) 上記非ヒト動物について心肥大の程度を測定し、被験物質を投与しない対照のトランスジェニック非ヒト動物の心肥大の程度と対比する工程、及び
(c) 上記(b)の比較結果に基づいて、心肥大を低下または抑制させる被験物質を心肥大抑制剤として選択する工程。
【0110】
なお、心肥大の程度は、心臓の組織学的評価、臨床学的評価(心エコー図、ドプラー超音波検査、冠動脈造影、胸部レントゲン撮影、心電図など)、または心筋細胞における心肥大マーカーであるANPの発現レベルから評価することができる。
【0111】
かくして選別される候補物質は、さらに心肥大病態非ヒト動物を用いた薬効試験、安全性試験、さらに心肥大を有する患者(ヒト)もしくはその前状態にある患者(ヒト)への臨床試験に供してもよく、これらの試験を実施することによって、より実用的な心肥大抑制用組成物または心肥大に起因する心疾患の予防または治療剤の有効成分を選別取得することができる。
【0112】
このようにして選別された物質は、必要に応じて構造解析を行った後、その物質の種類に応じて、化学的合成、生物学的合成(発酵を含む)または遺伝子学的操作によって、工業的に製造することができ、心肥大抑制用医薬組成物または心疾患予防または治療用医薬組成物の調製に使用することができる。
【実施例】
【0113】
以下、本発明を実施例によって更に詳細に説明するが、下記実施例は本発明を何ら限定するものではない。なお、本発明で用いられる遺伝子工学的技術並びに分子生物学的実験操作は、一般に広く用いられている方法、例えばJ.,Sambrook, E., F., Frisch,T.,Maniatis著、モレキュラークローニング第2版(Molecular Cloning 2nd edition)、コールド・スプリング・ハーバーラボラトリー(Cold Spring Harbor Laboratory press)発行、1989年、及びD.,M.,Glover著、DNAクローニング、IRL発行、1985年などに記載されている方法に従って行うことができる。
【0114】
(1)略称
下記の実施例において使用する略称は、特に言及しない限り、次の用語を意味するものとする。
AngII: アンジオテンシンII
ANF: 心房性ナトリウム利尿因子
BrDU: 5-ブロモ-2’-デオキシウリジン
BSA: ウシ血清アルブミン
CA: 構成的活性型
DN: ドミナント・ネガティブ型
FBS: ウシ胎児血清
GFP: 緑色蛍光タンパク質
G protein: グアニンヌクレオチド結合タンパク
GPCR: 7回膜貫通型ヘテロ三量体Gタンパク質共役型受容体
KD:kinase dead
LIF: 白血病阻害因子
NE: ノルエピネフリン
ET1: エンドセリン1
EGF: 上皮成長因子
bFDF: 塩基性繊維芽細胞成長因子
NRC: ラット新生仔由来心筋細胞
PBS: リン酸緩衝生理食塩水
PKC: プロテインキナーゼC
PKD: プロテインキナーゼD
PLC: ホスホリパーゼC
TPA:12-O-テトラデカノイルホルボール 13-アセテート
DMEM: Dulbecco'smodified Eagle's Medium
(2)実験材料
下記の実施例において使用する主な材料は下記の通りである。
(1) Lysis 緩衝液A: 50mM Tris(pH7.4)、150mM NaCl、1.3% Triton X-100、 1mM EDTA、1mM dithiothreitol、50mM NaF、1mM Na3VO4、及びプロテアーゼ・インヒビター・カクテル錠(ロッシュ)1錠(50ml当たり)
(2) 抗体:
1)抗-PKD1/2モノクローナル抗体(LCラボラトリーズ社製)(PKD1及びPKD2の両方に反応性を有する)、
2)抗-サルコメリック-α-アクチニン・モノクローナル抗体(clone EA-53:SIGMA製)、
3)抗-H3ヒストンマウス・モノクローナル抗体(05-499:Up State Biotechnology製)
4)抗-全活性型PKD1ポリクローナル抗体:ヒト由来PKD1のC末領域(Ser-916)がリン酸化されたペプチド(ヒト由来PKD1の912-918アミノ酸領域:SERVpSIL)で免疫化したウサギの血清から調製した
5)抗-不活性型PKD1ポリクローナル抗体:ヒト由来PKD1のC末領域のペプチド(ヒト由来PKD1の904-918アミノ酸領域:EEREMKALSERVSIL)で免疫化したウサギの血清から調製した。
【0115】
なお、ヒト由来PKD1は、最初にホスホイノシチド依存性キナーゼ1(phosphoinositide-dependent kinase 1)(PDK1)により活性ループ部位(Ser-744、Ser-748)がリン酸化され、触媒的に活性となる。それからC末領域(Ser-916)が自己リン酸化され、分子全体が活性型(本明細書では、これを「全活性型」という)となる。従って、Ser-916部位におけるリン酸化は、in vivoにおいてPKD1が活性化(全活性型PKD1)されているか否かの最適な指標となる(Matthews S.A., et al., J. Biol. Chem.274, p.26543-26549)。
【0116】
ゆえに、以下の実験において使用される、リン酸化されたSer-916部位に対する抗体〔具体的にはリン酸化されたSer-916部位を有するPKD1断片(ペプチド)に対する抗体:4)抗-全活性型PKD1ポリクローナル抗体〕は、心筋細胞に存在する全活性型PKD1を特異的に検出するための有効な抗体である。
【0117】
(3) pTB701-HAベクター
NH2末端にHAエピトープを付けた融合タンパクを哺乳細胞内で発現するためのベクターである。発現ベクターpTB701のSV40初期プロモーターの下流に、HAエピトープをコードする塩基配列が挿入されている。
【0118】
(4) 構成的活性型PKC変異体(CA-PKC)
NH2末端の偽基質領域が欠損しているか、または点変異(ポイントミューテーション)していることによって、全活性化状態を示しているものである。Prof. Parkerから入手した(Schonwasser, D.C., et al., Mol. Cell. Biol. 18, p.790-798, 1998)。
【0119】
1)CA-PKCβI:ヒト由来PKCβIのアミノ酸の22-28領域が欠損したもの
2)CA-PKCδ:ヒト由来PKCδのアミノ酸の147位のAlaがGluに置換したもの
−これらはいずれもpCO2ベクターを用いて発現させた。
【0120】
3) CA-PKCε:ヒト由来PKCεのアミノ酸の156-162領域が欠損したもの
−これはpMT2ベクターを用いて発現させた。
【0121】
(5)ドミナント・ネガティブ型PKC変異体 (DN-PKCs)
ATP結合部位のLysをMetに点変異(ポイントミューテーション)することによって、不活性化状態を示しているものである(Kuroda, S., et al., J. Biol. Chem. 271, p.31029-31032, 1996; Kuroda, S., et al., J. Cell Biol. 144,p.403-411, 1999)。
【0122】
1)PKCβI-HAのドミナント・ネガティブ型変異体(K371M PKCβI-HA)
site-directed mutagenesisによって、ラット由来PKCβI の371位のATP結合に必須なLysをMetに置換することによって調製した。
【0123】
2)PKCζ-HAのドミナント・ネガティブ型変異体(K281M PKCζ-HA):
site-directed mutagenesisによって、ラット由来PKCζの281位のATP結合に必須なLysをMetに置換することによって調製した。
【0124】
3)PKCε-HAのドミナント・ネガティブ型変異体(K440M PKCε-HA):
site-directed mutagenesisによって、ラット由来PKCεの440位のATP結合に必須なLysをMetに置換することによって調製した。
【0125】
(6) 構成的活性型PKD1(CA-PKD1)
ヒト由来PKD1のアミノ酸744位及び748位のSerをGluにそれぞれ置換して調製したものであり、この変異に基づいて全活性化状態を示している(S744E/S748E PKD1)(pEGFPC1-PKD-CA)。
【0126】
(7) ドミナント・ネガティブ型PKD1(DN-PKD1)
ヒト由来PKD1のアミノ酸618位のLysをAsnに置換して調製したものであり、この変異に基づいて不活性化状態を示している(SK618N PKD1)(pEGFPC1-PKD-DN)
実施例1 ラット新生仔由来心筋細胞中でのPKD1の発現とその局在
ウエスタンブロット法を用いて、ラット新生仔由来心筋細胞(NRC)内におけるPKD1とPKD2の発現状況、並びにその細胞内における局在(分布)を調べた。なお、PKD2はPKD1と異なる遺伝子産物である(Sturany, S., et al., J. Biol. Chem. 276, p.3310-3318, 2001)。さらに、NRCをTPAで処理して、該処理細胞について同様にPKD1とPKD2の発現並びに細胞内の局在を調べた。
【0127】
なお、TPAはPKC及びPKDのアクチベーターとして知られているホルボールエステルの一種である(Kikkawa U, et al., Adv Cyclic Nucleotide Protein Phosphorylation Res.,17, p.437-42, 1984; Valverde AM, et al., Proc Natl Acad Sci U S A, 30, 91(18), p.8572-6, 1994)。
【0128】
TPAは、また心肥大をも誘導するが(Kinnunen P, et al., Br J Pharmacol., 102 (2), p.453-61, 1991)、その心肥大誘導はあくまでもPKCの活性化によるものであり、その誘導にPKDが介在することは全く知られていなかった。
【0129】
(1)NRCの単離及び初代培養
生後一ヶ月未満のラット新生仔から取り出した心臓を、Goshima(1977)らの方法(Goshima K. et al., J Mol Cell Cardiol., 1977 Jan, 9(1), p.7-23)に準じて培養した。
【0130】
具体的には、ラット新生仔30匹から心臓を取り出し、リン酸緩衝生理食塩水(PBS、Mg2+及びCa2+を含まない)で血液を洗い流した後、血管を除去して4分割し、さらにPBSで洗浄した。次いでその心臓組織0.3gを、0.1w/v%コラゲナーゼ・タイプI(和光純薬工業)水溶液10ml中で37℃、10〜15分間、処理して、心筋細胞を分離・分散させた。このコラゲナーゼ処理を、新しいコラゲナーゼ水溶液に取り替えてさらに2回繰り返した。処理液を遠心分離することによって回収した心筋細胞(分散細胞)を10mlの培地(DMEM+10% FBS)に懸濁し、これを滅菌済みのキムワイプをセットした滅菌フィルターユニット(Millipore製)でろ過して細胞を単離した。得られた心筋細胞を組織培養皿(Falcon製)に移して、50分間、37℃、CO2濃度5%の条件下で培養し、細胞接着力の違いを利用して心筋細胞中に共存する繊維芽細胞をコラーゲン塗布した培養皿基底面に接着させて除去した(a differential adhesion technique)。上清中に存在する心筋細胞をラット新生仔由来心筋細胞(NRC)として使用した。
【0131】
なお、取得したNRCは、0.45%グルコース、10%(v/v)ウシ胎児血清(FBS)、2mM L-グルタミン、100 units/mlペニシリン、100μg/mlストレプトマイシン及び20μM 5-ブロモ-2’-デオキシウリジン(BrDU:sigma)を配合したDMEM中に保存した。
【0132】
(2)TPA処理、及び細胞分画
上記で調製したNRCを、無血清DMEM(ナカライテスク社製)に移し、一晩培養した(CO2濃度5%、37℃)。その後、培地にTPAを終濃度100nMとなるように添加して20分間インキュべーションした。次いで、心筋細胞を回収してPBSで洗浄し、Lysis 緩衝液(Triton X-100が0.1%である以外は、Lysis 緩衝液Aと同じ組成を有する)で処理して細胞を溶菌し、遠心分離(15000rpm、約10分間)にかけて、上清(細胞質画分)と沈殿物とに分画した。沈殿物はさらにLysis 緩衝液Aに溶解した。これを軽く遠心分離し、得られた上清を細胞膜画分として取得した。なお、コントロールとして、TPAで処理しないNRCについても、上記と同様に溶菌処理して、細胞質画分と細胞膜画分とに分画した(未処理物)。
【0133】
(3)ウエスタンブロット法
上記で調製したTPA処理物(細胞質画分と細胞膜画分)及び未処理物(細胞質画分と細胞膜画分)を、それぞれ1レーンに添加するタンパク量が同じになるように10% SDS-ポリアクリルアミドゲル電気泳動(SDS-PAGE)にかけた。泳動後、ポリビニリデン・ジフルオリド(PVDF)膜(Immobilon-P, Millipore製)に転写した。次いで、抗体として、(1)抗-PKD1/2モノクローナル抗体(LCラボラトリーズ社製) 、(2)抗-全活性型PKD1ポリクローナル抗体、(3)抗-不活性型PKD1ポリクローナル抗体、(4)抗-サルコメリック-α-アクチニン・モノクローナル抗体(clone EA-53:SIGMA製)、及び(5)抗-H3ヒストンマウス・モノクローナル抗体(05-499:Up State Biotechnology製)を用いてウエスタンブロッティングを行い、各試料〔TPA処理物(細胞質画分と細胞膜画分)及び未処理物(細胞質画分と細胞膜画分)〕中に含まれるPKD1,PKD2,全活性型PKD1、不活性型PKD1、α-アクチニン、及びヒストンH3をそれぞれ染色した。
【0134】
次いで、第2抗体試薬としてホースラディシュ由来パーオキシダーゼを結合した抗マウスまたはウサギIgG(Amasham pharmacia製)を使用し、化学発光によりブロッティング結果がX線フィルム上で観察できるようにした。
【0135】
(4)結果
結果を図2に示す。各試料〔細胞質画分(Cytoplasm):未処理物(None)とTPA処理物(TPA)、及び細胞膜画分(Membrane):未処理物(None)とTPA処理物(TPA)〕のいずれもほぼ同量のα-アクチニンとヒストンH3が検出された。このことは各レーンに、心筋細胞由来タンパク質量がほぼ均一に存在することを意味する。
【0136】
図2の結果から、心筋細胞にはPKD2は存在せず、PKD1のみ存在することが判明した(なお、本発明者等は既に同様な方法で心筋細胞にはPKD3も存在しないことを確認している。)。全活性型PKD1は、PKD又はPKC活性剤であるTPAで処理した心筋細胞の細胞膜画分に大量に存在しており、TPA処理NRCの細胞質画分にも、またTPA未処理のNRCのいずれも画分にも殆ど発現していなかった(図2の上から2段め参照)。このことは、心筋細胞をTPA処理することによって心筋細胞中のPKD1のSer-916位がリン酸化されて全活性型になること、そして全活性型になったPKD1は、構造が変化することによって膜(あるいは膜画分のタンパク質)への親和性が高まり細胞質から細胞膜へと移動すること(細胞膜への局在化)を示している。
【0137】
実施例2 全活性型PKD1の心筋細胞内での挙動
実施例1(1)に記載する方法と同様な方法で調製したNRCを、ポリ-L-リジンでコーティングしたガラス製の培養皿(35mm径)に移し、無血清DMEM(ナカライテスク社製)中で一晩培養した(CO2濃度5%、37℃)。これに終濃度が20nMとなるようにTPAを添加して、更に18時間(CO2濃度5%、37℃)培養した(約1×103細胞)。培養後、得られた細胞をPBSで2回洗浄し、4w/v%パラホルムアルデヒドで、室温下30分間処理して固定化し、更に0.25v/v%のTriton X-100を含むPBS中で4℃、30分間、浸透処理し、次いでブロッキング緩衝液(3w/v% BSA、2v/v% FBS, 1v/v% 正常ヤギ血清及び0.03v/v% Triton X-100を含むPBS)中でインキュべーションした。
【0138】
更に、得られた細胞を、抗体(抗-全活性型PKD1ポリクローナル抗体、抗-不活性型PKD1ポリクローナル抗体、及び抗-サルコメリック-α-アクチニン・モノクローナル抗体)を含むブロッキング緩衝液中で、4℃で16時間インキュべーションした。これをPBSで2回洗浄し、次いで0.3v/v% Cy3-標識・抗−マウスIgG抗体、及び0.3v/v% Cy2-標識・抗−ウサギIgG抗体(第2抗体)(いずれもAmersham-pharmacia製)を配合したPBS中に移して、室温で1時間インキュべーションした。細胞の蛍光シグナルを共焦点レーザー顕微鏡LSM5 Pascal(Carl Zeiss)で観察した。
【0139】
結果を図3Aに示す。 なお、対照としてTPA処理しない未処理NRC(None)を同様に抗体標識して、細胞の蛍光シグナルを共焦点レーザー顕微鏡LSM5 Pascalで観察した結果を図3Bに示す。
【0140】
心筋細胞中のα-アクチニンは、抗−サルコメリック-α-アクチニン・モノクローナル抗体及び第2抗体(蛍光色素標識抗体)と結合して、赤色の蛍光シグナル画像として観察される(図3Aの左欄、赤のシグナルが心筋細胞のα-アクチニンを示す)。図3Aと図3Bとの対比からわかるように、TPA処理した心筋細胞は、サルコメア構造が形成されており(Zディスクの可視化)、心肥大が誘導されていることが認められた。
【0141】
図3Aの中欄の上段は、心筋細胞を抗−不活性型PKD1ポリクローナル抗体及び第2抗体(蛍光色素標識抗体)、下段は心筋細胞を抗−全活性型PKD1ポリクローナル抗体及び第2抗体(蛍光色素標識抗体)で、それぞれ処理して得られた画像である。すなわち、中欄の上段は不活性型PKD1の細胞内局在を、また下段は全活性型PKD1の細胞内局在をそれぞれ示している。この結果から、不活性型PKD1は心筋細胞の核周辺に留まっているのに対し、全活性型PKD1は、α−アクチニンと同じ画像を示すことから(図3A左欄下段の画像と対比)、心筋細胞のサルコメア(sarcomere)構造のZディスク周囲に集中していることがわかる。なお、図3Aの右欄の画像は、左欄の画像と中欄の画像を重ね合わせたもので、黄色(赤×緑)を呈するほど両者の画像が一致していることを示す。
【0142】
これらの結果から、心筋細胞をTPA処理することによって、心肥大が誘導されること、PKD1が全活性状態になること、並びに当該全活性型PKD1がサルコメアのZディスク領域に移動することがわかった。通常、サルコメアのZディスクに存在するタンパク質が心肥大に関係していると考えられることから、以上の結果はPKD1が心肥大のシグナル伝達に関連していることを示唆するものである。
【0143】
実施例3 心肥大誘導による全活性型PKD1の心筋細胞内での挙動
NE(ノルエピネフリン)、AngII(アンジオテンシンII)及びLIF(白血病阻害因子)は心肥大を引き起こす物質として良く知られている(Fischer JE, et al., Nature. 207, p.951-953, 1965: Sanchez Torres G, et al., Arch Inst Cardiol Mex., 48(3), p.549-561, 1978: Matsui H, et al., Res. Commun. Mol. Pathol. Pharmacol. 93, p.149-162, 1996)。また、上記心肥大誘導剤のうち、NE及びAngIIはPKCを活性化し、特にPKCのサブユニットであるPKCεはAngIIによって活性化されてZディスクに移動することも知られている(Disatnik MH, et al., Exp Cell Res. 1994 Feb, 210(2), p.287-97)。さらに、NEによって、心筋細胞中のPKD1の発現と活性が制御されることが知られている(Fischer JE, et al., Nature, 1965 Aug 28, 207, p.951-953: Haworth, R.S., et al., J. Mol. Cell. Cardiol. 2000, 32, p.1013-1023)。
【0144】
我々は、NRCを各種の心肥大誘導剤(NE,AngII、LIF)で処理し、該心筋細胞における全活性型PKD1の分布(局在)を、実施例2と同様の方法によって調べた。なお、NEはα-アドレナリン様受容体に作用する心肥大誘導剤であり、下記の実験ではプロプラノールを配合してβ-アドレナリン作動性受容体活性をブロックして用いた。
【0145】
具体的には、実施例1(1)に記載する方法と同様な方法で調製したNRCを、ポリ-L-リジンでコーティングしたガラス製の培養皿(35mm径)に移し、無血清DMEM(ナカライテスク社製)中で一晩培養した(CO2濃度5%、37℃)。かかる培養細胞を5試料用意して、(1)100μM(終濃度、以下同じ)のNE(プロプラノールを2μM配合)、(2)100μMのAngII、(3)20nMのLIF、(4)100μMのNE(プロプラノールを2μM配合)+400nMのGF109203X(具体的には、GF109203Xを添加し30分間処理した後に、NEを添加)、(5)20nMのLIF+400nMのGF109203X(具体的には、GF109203Xを添加し30分間処理した後に、LIFを添加)をそれぞれに添加して、更に38時間(CO2濃度5%、37℃)培養した(約1×103細胞)。なお、ここでGF109203Xは、PKDに作用しない選択的なPKC阻害剤である(Zugaza J.L., et al., The EMBO J. 1996, 15, p.6220-6230)。
【0146】
培養後、細胞をPBSで2回洗浄し、4w/v%パラホルムアルデヒドで、室温下30分間処理して固定化し、更に0.25v/v%のTriton X-100を含むPBS中で4℃で30分間、浸透処理し、次いでブロッキング緩衝液(3w/v% BSA、2v/v% FBS, 1v/v% 正常ヤギ血清及び0.03v/v% Triton X-100を含むPBS)中でインキュべーションした。得られた細胞を、抗体(抗-全活性型PKD1ポリクローナル抗体、抗-不活性型PKD1ポリクローナル抗体、及び抗-サルコメリック-α-アクチニン・モノクローナル抗体)を含むブロッキング緩衝液中で、4℃で16時間インキュべーションした。これをPBSで2回洗浄し、次いで0.3v/v% Cy3-標識・抗−マウスIgG抗体、及び0.3v/v% Cy2-標識・抗−ウサギIgG抗体(第2抗体)(いずれもAmersham-pharmacia製)を配合したPBSに移して、室温で1時間インキュべーションした。細胞の蛍光シグナルを共焦点レーザー顕微鏡LSM5 Pascal(Carl Zeiss)で観察した。
【0147】
(1)NE処理、(2)AngII処理、(3)LIF処理、(4)NE+GF109203X処理、及び(5)LIF+GF109203X処理した細胞について得られた結果を、それぞれ図4、5,6,7A及び7Bに示す。
【0148】
図4及び5の結果からわかるように、心肥大誘導剤である(1)NEまたは(2)AngIIで心筋細胞を処理すると、いずれの細胞もサルコメア構造が形成され(Zディスクの可視化)、心肥大化が誘導されていた。また、いずれもPKD1が全活性化(リン酸化)され、心筋細胞のサルコメアのZディスク周囲に移動することが観察された。しかし、いずれの場合も不活性型PKD1は心筋細胞の核周辺に留まっていた。
【0149】
一方、図6で示すように、NE及びAngIIと同じく心肥大を誘導する試薬である(3)LIFで心筋細胞を処理した場合には、サルコメア構造が形成され(Zディスクの可視化)、心肥大化が誘導されたにも関わらず、PKD1の全活性化(リン酸化)もサルコメアZディスクへの移動も観察されなかった。また、図7Aからわかるように、予め心筋細胞をGF109203Xで処理してPKCの活性化を阻害しておくと、心肥大誘導剤(NE)で処理しても心肥大化は生じず、またPKD1の全活性化(リン酸化)並びにそのサルコメアZディスクへの移行も見られなかった。
【0150】
また、ここには示していないが、心肥大化作用を有することが知られているエンドセリン1(ET1)や上皮成長因子(EGF)を作用させた心筋細胞でも、図4及び5で示すNE及びAngIIと同じ観察結果が得られた。一方、心肥大化作用を有することが知られている塩基性繊維芽細胞成長因子(bFGF)を作用させた心筋細胞では、図6で示すLIFと同じ観察結果が得られた。
【0151】
以上の結果から、(a) 心肥大を発生するシグナル伝達経路には、NE、AngII、ET1、及びEGFによって誘導される心肥大シグナル伝達経路と、LIFやbFGFによって誘導される心肥大シグナル伝達経路等の複数の経路があり、PKD1は、そのうち前者によって誘導される心肥大シグナル伝達に関わる一成分であること、(b)当該心肥大シグナル伝達においてPKD1は全活性化(リン酸化)され、心筋細胞のサルコメアのZディスク領域に移行すること、(c)さらに当該心肥大シグナル伝達経路におけるPKD1の全活性化(リン酸化)及びそのZディスクへの移行は、PKCの活性化を介して生じるものであることがわかる。
【0152】
NE、AngII、ET1によって誘導される心肥大は、いずれも7回膜貫通型受容体を介したGタンパク質の活性化を通じて生じると考えられているのに対し、LIFによる心肥大の発生機構はgp130受容体を介するものである。特に、LIF処理ではPKD1が活性化しなかったことを示す上記の結果は、PKD1は7回膜貫通型ヘテロ三量体Gタンパク質共役型受容体(GCPR)シグナル伝達経路を介した心肥大シグナル伝達経路の一成分であって、この経路を介した心肥大発生メカニズムに深く関わっていることを示唆するものである。また、EGFによる心肥大化機構は、GPCRを全く介さない受容体型チロシンキナーゼによるものであるので、PKD1はGPCR経路以外にもEGF受容体下流にも位置することが示唆された。
【0153】
実施例4 PKD1の全活性化(リン酸化)の制御
PKD1の活性は、その選択的基質であるSyntide-2(APLARTLSVAGLPGKK)に対するリン酸化能力を指標として評価することができる(Valverde, A.M., et al., Proc. Natl. Acad. Sci. U S A. 91, 1994, p.8572-8576)。そこで、心肥大を誘導した心筋細胞に内在するPKD1のリン酸化活性を、当該Syntide-2に対するリン酸化能力に基づいて評価した。
【0154】
具体的には、(1)100nM TPA、(2)100μM NE、(3)20nM LIFの各々で20分間処理して肥大を誘導したNRC、並びに(4)400nM GF109203X(PKC阻害剤)、(5)20nM TPA+400nM GF109203X、(6)100μM NE+400nM GF109203X、(7)20nM LIF+400nM GF109203Xの各々で20分間処理したNRCについて、Syntide-2を基質として免疫沈降キナーゼアッセイを行い、各NRC中に内在するPKD1のリン酸化活性を測定した。また、コントロールとして、何も処理しないNRC(未処理NRC)についても同様にして、内在するPKD1のリン酸化活性を測定した。
【0155】
(1)免疫沈降キナーゼアッセイ
実施例1(1)に記載する方法と同様な方法で調製したNRCを無血清DMEM(ナカライテスク社製)を用いて一晩培養した(CO2濃度5%、37℃)。かかる培養細胞に、(1)100nMのTPA、(2)100μMのNE(プロプラノールを2μM配合)、(3)20nMのLIF、(4)400nM GF109203X(PKC阻害剤)、(5)20nM TPA+400nM GF109203X、(6)100μM NE+400nM GF109203X、または(7)20nM LIF+400nM GF109203Xをそれぞれに添加して、20分間処理した。得られた細胞をLysis緩衝液Aで処理して、氷上で60分間、抗−全活性型PKD1ポリクローナル抗体とともにインキュべーションした。これをprotein G Sepharose 4Bで処理して、当該樹脂に結合したタンパク質(Protein G Sepharose 4B結合 PKD1−抗PKD1抗体複合体)を回収した。PKD1免疫沈降物をLysis緩衝液Aで1回洗浄し、さらにNaFを含まないLysis緩衝液Aで2回洗浄した。
【0156】
得られたPKD1免疫沈降物を、NaFを含まないLysis緩衝液A中で、0.5 mg/ml immunizing peptide (抗−全活性型PKD1ポリクローナル抗体作成時に被験動物を免疫化するために接種した抗原ペプチド。このペプチドとProtein G Sepharose 4B結合 PKD1−抗PKD1抗体複合体をインキュベートすると、上記抗原ペプチドと抗PKD1抗体とが結合して、その結果PKD1が遊離取得できる。)100μlとともにインキュべーションすることによって、PKD1を溶出させた。
【0157】
溶出したPKD1(10μl)をアッセイ混合液(15μl Tris/MgCl2 [100mM Tris, 100mM MgCl2]、5μl ATP [800μM]、0.2μl 32γ-ATP、及び40μg Syntide-2)とともに、30℃で5分間インキュべーションした。次いで、液体シンチレーションカウンターで、PKD1のリン酸化活性を測定した(n=9)。
【0158】
(2)結果
結果を図8に示す。棒グラフ中、左から、未処理NRC(ネガティブコントロール)、並びに(1)100nM TPA処理,(2)100μM NE(プロプラノール2μM配合)、(3)20nM LIF、(4)400nM GF109203X(PKC阻害剤)、(5)100nM TPA+400nM GF109203X、(6)100μM NE+400nM GF109203X、及び(7)20nM LIF+400nM GF109203Xで処理したNRCの内在PKD1のリン酸化活性を示す。なお、図中、各NRCの内在PKD1のリン酸化活性は、ネガティブコントロールの測定値(CPM,32P)を100%とした場合の、それに対する相対値(%)で示す。
【0159】
図8に示すように、TPAまたはNEで処理したNRCに内在するPKD1は、いずれも未処理NRC(ネガティブコントロール)並びにLIFで処理したNRCに内在するPKD1に比べて、顕著に高いリン酸化活性を示した。一方、NRCをこれらの心肥大誘導剤(TPA,NE)とPKC阻害剤(GF109203X)とで同時に処理すると、内在性PKD1の活性はネガティブコントロールと同レベルまで抑制された。
【0160】
このことから、心筋細胞においてPKD1のリン酸化は、PKCの活性化に基づいて生じることがわかる。また、LIFで処理した心筋細胞については、内在性PKD1の活性は未処理NRCの活性と殆ど変わらなかった。この結果は、上記実施例3で示したように、PKD1が、LIFによって誘導される心肥大シグナル伝達経路とは別個の、NEによって誘導されるGPCRを介した心肥大シグナル伝達経路に関わる成分であることを裏付けるものである。
【0161】
実施例5 PKD1の活性を制御するPCKのサブタイプ
実施例3及び4から、心肥大に関連して生じるPKD1の全活性化にはPKCの活性化が関わっていることが示された。PKCには複数のサブタイプが存在することが知られているため、ここではPKD1の全活性化にPKCのどのサブタイプが関わっているかについて調べた。
【0162】
この目的のため、具体的にはkinase dead PKCs(PKCα、PKCβI、PKCδ、PKCε、PKCζ)を強制発現させたNRCを、実施例4と同様にして心肥大誘導剤(NE)で処理し、得られたNRCに内在するPKD1のリン酸化活性を免疫沈降キナーゼアッセイで測定した。
【0163】
(1)kinase dead PKCsを発現する心筋細胞の調製
実施例1(1)に記載する方法と同様な方法で10cmプラスティックディッシュに調製したNRCに、形質転換試薬(Duo Fect:Q-biogen)を用いてそのマニュアルに従って、kinase dead PKCs(PKCα、PKCβI、PKCδ、PKCεまたはPKCζ)をコードするDNAを導入し、各kinase dead PKCs(PKCα、PKCβI、PKCδ、PKCεまたはPKCζ)を強制発現するようにNRCを形質転換した。
【0164】
(2)免疫沈降キナーゼアッセイ
上記、各kinase dead PKCs(PKCα、PKCβI、PKCδ、PKCε、またはPKCζ)を強制発現することによって内在性のPKCs活性を抑制したNRCを、各々無血清DMEM(ナカライテスク社製)中で一晩培養した後(CO2濃度5%、37℃)、100μMのNE(プロプラノールを2μM配合)を添加して、20分間処理した。得られた各NRCを実施例4(1)と同様に処理してPKD1を取得した。次いで、得られたPKD1(10μl)を実施例4(1)と同様にアッセイ混合液とともに30℃、5分間インキュべーションし、液体シンチレーションカウンターで、PKD1のリン酸化活性を測定した(n=9)。なお、比較実験として野生型NRCについてNE処理した細胞に内在するPKD1、及びネガティブコントロールとして未処理の野生型NRCに内在するPKD1についても同様にしてリン酸化活性を測定した。
【0165】
(3)結果
結果を図9に示す。棒グラフ中、左から、(1)未処理-野生型NRC(ネガティブコントロール)、(2)野生型NRC+NE処理、(3)kinase dead PKCα強制発現NRC+NE処理、(4)kinase dead PKCβI強制発現NRC+NE処理、(5) kinase dead PKCδ強制発現NRC+NE処理、(6)kinase dead PKCε強制発現NRC+NE処理、及び(7)kinase dead PKCζ強制発現NRC+NE処理した心筋細胞に内在するPKD1のリン酸化活性を示す。
【0166】
図9に示すように、NRCにkinase dead PKCεを導入した場合のみ(すなわち、PKCε活性が抑制してなるNRCだけ)が、細胞中の内在PKD1活性が未処理野生型NRC(ネガティブコントロール)のPKD1活性と同レベルであり、NEで心肥大を誘導してもPKD1が全活性化(リン酸化)されないことがわかった。このことは、PKCのサブユニットのうちPKCεが、心筋細胞(心肥大のシグナル伝達経路)におけるPKD1の上流に位置するアクチベーターであることを示すものである。
【0167】
実施例6 PKCεとPKD1の相互作用
以上の実験結果から、GPCRを介した心肥大のシグナル伝達にPKCεとPKD1の活性化が関わっていること、及びPKCεがPKD1の上流に位置するアクチベーターであることが分かった。そこで次に、心筋細胞におけるPKCεとPKD1との相互作用について、免疫沈降法を用いて調べた。具体的には、下記の方法によって、NE(100μM)で心肥大を誘導したNRC中におけるPKCεとPKD1の相互作用を調べた。
【0168】
(1)免疫沈降法
実施例1(1)に記載する方法に従って調製した初代培養NRCを、実施例3と同様に100μMのNE(プロプラノールを2μM配合)で処理し、当該NE処理NRCをLysis緩衝液Aで処理して、細胞抽出液(Cell Lysate)1mlを得た。そのうち300mlを氷上で60分間、抗−PKD1/2モノクローナル抗体とインキュベートし、これをprotein G Sepharose 4Bで処理して、当該樹脂に結合するタンパク質(抗−PKD1抗体免疫沈降サンプル)を回収した(なお、実施例1に示すようにNRC中にはPKD2は存在しない。)。同じようにして抗−PKDεモノクローナル抗体を用いて、抗−PKDε抗体免疫沈降サンプルを回収した。また、コントロールとして未処理のNRCについても同様に細胞抽出液(Cell Lysate)1mlを取得し、抗−PKDε抗体免疫沈降サンプル及び抗−PKD1抗体免疫沈降サンプルを調製した。
【0169】
次に各NRCについて得られた抗−PKCε抗体免疫沈降サンプル及び細胞抽出液(Cell Lysate)について、第1抗体として抗−PKD1/2モノクローナル抗体、及び第2抗体としてホースラディシュ由来パーオキシダーゼを結合した抗マウスまたはウサギIgG(Amasham pharmacia製)を使用して、ウエスタンブロット法を行った。抗−PKCε抗体免疫沈降サンプルに関する結果を図10の第1パネルに、細胞抽出液に関する結果を第3パネルに示す。
【0170】
また各NRCについて得られた抗−PKD1/2抗体免疫沈降サンプル及び細胞抽出液(Cell Lysate)について、第1抗体として抗−PKCεモノクローナル抗体、及び上記の第2抗体を使用して、ウエスタンブロット法を行った。抗−PKD1/2抗体免疫沈降サンプルに関する結果を図10の第2パネルに、細胞抽出液に関する結果を第4パネルに示す。
【0171】
第1及び3パネルで示されるように、NE処理したNRCの抗−PKD1/2抗体免疫沈降サンプル(すなわち、PKD1を含むサンプル)及びは抗−PKCε抗体免疫沈降サンプル(すなわち、PKCεを含むサンプル)は、それぞれ抗−PKCε抗体及び抗−PKD1/2抗体と反応した。このことから、心肥大を誘導したNRC中で、PKCεとPKD1との複合体が形成されていることがわかる。NE未処理のNRC中にはその存在が認められなかったことから、心肥大化過程(心肥大シグナル伝達過程)において活性化したPKCεがPKD1と反応して複合体を形成すると考えられる。このように、心筋細胞内での肥大過程で、心肥大の誘導に関わることが既に知られているPKCεに、PKD1が相互作用することが確認されたことで、さらにPKD1が心肥大シグナルの主要な構成タンパク質の一つであることが示唆された。
【0172】
なお、PKCεとPKD1は、in vitroで相互反応することが確認されているが(Waldron, R.T., et al., J. Biol. Chem. 1999, 274, p.9224-9230)、これは、単に株化した培養細胞中でPKCεとPKD1を強制発現させて両者の相互作用を見たものにすぎない。上記実施例6の結果は、肥大化した心筋細胞(100μM NE処理)に内在するPKCεとPKD1とが、互いに活性化して相互反応し複合体を形成することを初めて示したものである。
【0173】
実施例7 全活性型PKD1による心肥大誘導
上記の実験結果から、心肥大を生じている心筋細胞中にはPKD1が全活性化(リン酸化)していることが分かった。ここではPKD1を全活性化(リン酸化)することによって心肥大が誘導されるかどうか(全活性型PKD1による心肥大誘導の有無)について調べた。
【0174】
(1)
具体的には、まず、GFP融合−構成的活性型PKD1(GFP-PKD1/CA)をコードするDNA、またはコントロールとしてGFP(GFP)をコードするDNAを組み込んだプラスミドを、それぞれ形質転換試薬(Duo Fect:Q-biogen)を用いてそのマニュアルに従って、NRCに導入して形質転換した。
【0175】
上記で得られた細胞(形質転換体)を、抗体(抗-サルコメリック-α-アクチニン・モノクローナル抗体)を含むブロッキング緩衝液中で、4℃で16時間インキュべーションした。これをPBSで2回洗浄し、次いで0.3v/v% Cy3-標識・抗−マウスIgG抗体(第2抗体)(Amersham-pharmacia製)を配合したPBSに移して、室温で1時間インキュべーションした。細胞の蛍光シグナルを共焦点レーザー顕微鏡LSM5 Pascal(Carl Zeiss製)で観察した。
【0176】
結果を図11Aに示す。全活性型PKD1(GFP-FKD1 CA)を導入したNRC(下パネル)では、コントロール(上パネル)に比して明らかにサルコメア構造(Zディスク)が形成されており、このことから心肥大が誘導されていることが判明した。さらに図11Aの下パネルの結果は、全活性型PKD1がZディスクに自発的に局在することを示しており、これから全活性型PKD1が単独でZディスクの形成を誘導している可能性が示唆される。
【0177】
(2)構成的活性型PKDε(PKDε/CA)をコードするDNAを有するプラスミドを、、製造者の指示に従って、Rat Cardiomyocyte-Neonatal Nucleofector kit(Amaxa GmbH製)を用いてAmaxaエレクトロポレーターによりエレクトロポレーションを行い、細胞に導入した。得られた細胞(形質転換体)を、(1)と同様の方法により、細胞の蛍光シグナルを共焦点レーザー顕微鏡LSM5 Pascal(Carl Zeiss製)で観察した。結果を図11Bに示す。この結果は、活性型PKDεだけが自発的にZディスクに移行することを示している。
【0178】
実施例8 活性型PKCと心肥大誘導との関係
各PKC発現プラスミドを用いて、心肥大を引き起こすPKCアイソフォーム(PKCε、PKCβI及びPKCδ;これらは心臓における主なPKCである)の同定を試みた。
【0179】
具体的には、実施例7と同様にして、構成的活性型PKC変異体(CA-PKCε、CA-PKCβI、CA-PKCδ)、ドミナント・ネガティブ型PKC変異体(K440M PKCε)を組み込んだ発現ベクターをNRCに導入して形質転換し、その形質転換細胞を抗−サルコメリック-α-アクチニン抗体及び第2抗体で染色して、肥大の有無を、共焦点レーザー顕微鏡(LSM5 Pacal:Carl Zeiss)で観察した。なお、ドミナント・ネガティブ型PKC変異体(K440M PKCε)を発現させたNRCは、心肥大誘導剤であるNEまたはLIFで38時間処理し培養した後、免疫染色した。結果を図12に示す。
【0180】
パネルAは構成的活性型PKCε(CA-PKCε)を導入したNRC、パネルBは構成的活性型PKCβI(CA-PKCβI)を導入したNRC、パネルCは構成的活性型PKCδ(CA-PKCβδ)を導入したNRC、パネルDはドミナント・ネガティブ型PKCε(K440R PKCε)を導入したNRCであって100μMのNEで処理した細胞(心肥大誘導処理)、パネルEはドミナント・ネガティブ型PKCε(K440M PKCε)を導入したNRCであって20nMのLIFで処理した細胞(心肥大誘導処理)を、それぞれ抗−サルコメリック-α-アクチニン抗体及び第2抗体と反応させてα−アクチニンを視覚化させた画像を示す。
【0181】
図12からわかるように、構成的活性型PKCεを発現したNRCには、顕著に肥大が生じていることが観察された(パネルA)。一方、ドミナント・ネガティブ型PKCεを発現したNRCは心肥大誘導剤であるNEで処理しても心肥大を生じなかった(パネルD)。このことから、PKCのアイソフォームのうち、PKCεが心肥大のシグナル伝達に関与していることが判明した。
【0182】
実施例9 心肥大を誘導する活性化PKCε及び全活性化PKD
各種形質転換したNRCについて、利尿性ナトリウム因子(ANF、肥大マーカー:Tsuchimochi H, et al., Lancet, 1987 Aug 8. 2 (8554) p.336-7)の発現レベルを比較した。具体的には、実施例7と同様にして、構成的活性型PKCs(CA-PKCε、CA-PKCβI、CA-PKCδ)、kinase dead PKCε(KD- PKCε)、構成的活性型PKD1(CA-PKD1)、ドミナント・ネガティブ型PKD1(DN-PKD1)、またはGFPをコードするDNAを組み込んだプラスミドを、NRCに導入して各種の形質転換体を作成した。得られた形質転換細胞について、またそれをさらに心肥大誘導剤(NE又はLIF)処理した細胞について、実施例7の(2)と同様の方法で、第1抗体として抗−ANF抗体、第2抗体として0.3v/v% Cy2-標識・抗−ラビットIgG抗体(第2抗体)(Amersham-pharmacia製)を用いて、免疫染色を行った。同じ細胞数でNRCが増殖している(105)ディッシュを、各形質転換細胞につき3ディッシュずつ用意し、1デッシュあたり3枚の画像(共焦点レーザー顕微鏡(LSM5 Pacal:Carl Zeiss))を観察し、各細胞の画像データの蛍光レベル(すなわち、各細胞におけるANFの発現レベル)を画像解析ソフトScion image (Scion Corporation社製)を用いて測定した。
【0183】
結果を図13に示す。棒グラフ中、左から、GFP発現+未処理(ネガティブコントロール)、野生型+NE処理(ポジティブコントロール)、CA-PKCε発現+未処理、CA-PKCβI発現+未処理、CA-PKCδ+未処理、KD-PKCε発現+未処理、KD-PKCε発現+NE処理、CA-PKD1発現+未処理、DN-PKD1発現+未処理、DN-PKD1発現+LIF処理、及びDN-PKD1発現+NE処理したNRCのANF発現レベルを示す。その結果、構成的活性型PKD1(CA-PKD1)の導入または構成的活性型PKCε(CA-PKCε)の導入によってPKD1を全活性化させるかまたはPKCεを活性化させた心筋細胞は、肥大化が生じていることが確認された。この結果は、上記実施例7及び8の結果と一致し、PKCεの活性化、PKDの全活性化が、GPCRを介した心肥大シグナルの中心的で必要不可欠なカスケードであることを裏付けるものである。
【0184】
<考察>
以上の実験から、哺乳類の心筋細胞内で、PKD1がPKCεによって直接活性化されることにより心肥大が誘導されることがわかった。
【0185】
具体的には、心筋細胞においてPKD1の全活性化(リン酸化)またはPKCεの活性化によって心肥大が誘導されること(実施例7〜9)、一方、PKD1やPKCεのドミナント・ネガティブ変異体を導入した心筋細胞では、AngIIやNEによる刺激によっても心肥大が誘導されず、肥大シグナルが遮断されること(実施例7〜9)から、PKCεの活性化並びにPKD1の全活性化(リン酸化)が、心筋細胞内でのAngIIやNEによる心肥大シグナル(GPCRを介した心肥大シグナル)の中心的なカスケードであると考えられる。また、心筋細胞内でのPKD1の全活性化及びそれによる心肥大誘導には、PKCεの活性化が必要であり(実施例4及び5)、さらに心肥大した心筋細胞中にはPKCεとPKD1との複合体形成が認められること(実施例6)から、哺乳類の心筋細胞内のGPCRを介した心肥大シグナルにおいて、PKCεはPKD1の上流に位置するアクチベーターであり、PKCεの活性化に伴ってPKD1は活性化され、両者は複合体を形成して心肥大のシグナル伝達を担っていると考えられる。
【0186】
なお、上記実験では、NEやAngIIによって誘導されるGPCRを介した心肥大シグナル伝達経路に着目したが、EGFを作用させた心筋細胞でも同様にPKD1の全活性化並びにそのサルコメアZディスクへの移行が認められたことから、PKD1はEGF受容体下流にも位置するものと考えられ、GPCRを介した心肥大シグナル伝達経路と同様に、PKD1を介したカスケードが、EGFによる心肥大化機構(GPCRを介さない受容体型チロシンキナーゼによる心肥大化機構)に存在すると考えられる。
【0187】
実施例10 ENH2による心肥大化抑制作用
ENH1(Enigma Homologue protein 1) は、PKCβIの制御領域をbaitとした酵母Two-hybridスクリーニングにより、ラット脳由来cDNAライブラリーから単離同定された約60kDaの心臓・骨格筋特異的タンパク質で、N末端側にPDZドメイン、C末端側に3つのLIMドメインを有する。また、LIMドメインを欠失し、そのかわりにT-stretchと呼ばれる相同配列を有するスプライス変異体ENH2(ヒト、マウス、ラット)及びENH3(マウス、ラット)等も複数見出されている(図14参照)。
【0188】
NRCをPKC活性化剤であるホルボールエステル(例えば、TPA等)によって心肥大化状態に誘導させると、ENH1はPDZドメインを介してα−アクチニンと結合し、サルコメアのZディスクにトランスロケートすること、また最近では、ENH1はLIMドメインを介してPKCβをZディスクにリクルートするScaffold (足場) タンパク質であることが報告されている(Nakagawa N, et al., Biochem. Biophys. Res. Commun., 2000, 272(2), p.505-512)。
【0189】
なお、本発明者らは、上記の報告以後、前記の実験結果から直接PKCεによりリン酸化され全活性化することが判明したPKD1が、ENH1と相互することを見いだし、その相互作用領域が、PKD1のC末領域に位置する触媒領域とENH1のLIMドメインであることを同定した。また、GCPRを介する心肥大誘導剤(NE,AngII等)で心肥大を誘導した心筋細胞内で、全活性型PKD1とENH1がサルコメアのZディスクに移行し、そこに局在することを見いだした。一方、LIF等のgp130レセプターを介した心肥大誘導剤では、PKD1は活性化されずZディスクにも移行しない。このことから、PKD1はGPCRを介したシグナルで活性化し、ENH1とともに、心筋細胞サルコメアZディスクに移行し局在することが判明した。さらに本発明者らは、肥大化した心筋細胞内で、活性化したPKD1、PKCε、及びENH1が相互に作用し、心筋細胞サルコメアZディスク上に局在して複合体を形成していることを見いだした(これらはいずれも未発表)。
【0190】
(1)実験
実施例1(1)に記載する方法に従って調製したNRCを、ポリ-L-リジンでコーティングしたガラス底製の培養皿(35mm径)に移し、無血清DMEM(ナカライテスク社製)中で一晩培養した(CO2濃度5%、37℃)。これを商品マニュアルに従って、FLAG融合−ENH1またはFLAG融合−ENH2をコードするDNAを組み込んだプラスミドをそれぞれ形質転換試薬(Duo Fect:Q-biogen)と懸濁し、NRCにその調整液を添加して、心筋細胞を形質転換した。なお、細胞は10%FBSを含むDMEM培地で培養した。形質転換1日後に無血清培地に交換し、それぞれの形質転換細胞(FLAG融合−ENH1発現NRC、FLAG融合−ENH2発現NRC)を2つにわけて、一方を20nM TPAで処理して、TPA処理NRCと未処理のNRCを作成した。
【0191】
約18時間後、各形質転換細胞のTPA処理NRCと未処理NRCを、実施例3と同様な方法を用いて、抗−ANFポリクローナル抗体(T4015, PENINSULA LABORATORIES INC.製)及び抗−FLAGモノクローナル抗体(Sigma製)で、二重染色し、細胞の蛍光シグナルを共焦点レーザー顕微鏡で観察した。
【0192】
(2)結果
結果を図15に示す。図に示すように、ENH1を導入し発現させて心肥大化試薬で処理した場合にはサルコメアが形成され、またANFの発現が増加して心肥大が認められたが、ENH2を導入し発現させたNRCは、心肥大化試薬で処理してもサルコメア形成が見られず、ANF発現量が減少していた。このことから、LIMドメインを持たないスプライス欠失変異体ENH2はENH1によるサルコメアZディスクへのPKCの繋ぎとめを拮抗阻害し、心肥大化シグナルカスケードを抑制ないしは遮断する「内在性抗心肥大アンタゴニスト」であることが示唆された。またこのことから、ENH2と同じくLIMドメインを持たないスプライス欠失変異体ENH3(マウス、ラット)もまた、ENH1によるサルコメアZディスクへのPKCの繋ぎとめを拮抗阻害し、心肥大化シグナルカスケードを抑制ないしは遮断する「内在性抗心肥大アンタゴニスト」として作用すると考えられる。
【0193】
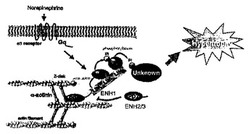
図16に心肥大シグナル制御モデルの概念図を示す。上記の結果から、GPCRを介した心肥大シグナル伝達機構において、心筋細胞が肥大化される時、ENH1はサルコメアZディスク上に心肥大シグナル伝達因子を保持し、該Zディスク上に保持された状態でPKD1はPKCεによって活性化され、リン酸化シグナルがさらに下流に伝達されること、そして、LIMドメインを欠失したENH1の変異体であるENH2は、ENH1が介する心肥大シグナルを抑制し、心肥大化を調節・抑制する内在性アンタゴニストとして機能していることが示唆された。また、これは、心筋細胞内でENH1の発現またはその機能活性を抑制することによって心肥大化シグナルカスケードを抑制ないしは遮断することができ、心肥大を抑制できる可能性を示唆するものでもある。
【産業上の利用可能性】
【0194】
心筋細胞内でのPKD1の機能発現を抑制する物質を有効成分とする本発明の心肥大抑制用組成物は、心肥大のシグナルカスケードにおける中心的役割を担うPKD1の心筋細胞内での機能発現を抑制することによって心肥大の誘導を阻止若しくは抑制することができる。また、ENH2をコードする塩基配列を有する核酸を有効成分とする本発明の心肥大抑制用組成物は、心筋細胞の肥大化に際して心肥大シグナル伝達因子を保持するENH1の機能を阻害することによって、心肥大の誘導を阻止若しくは抑制することができる。このため、本発明の心肥大抑制用組成物は、心肥大の誘導を抑制することによって、心肥大の発生並びに進展を抑制することができ、心肥大に起因する疾患、具体的には心不全や虚血性心疾患、または不整脈などの心疾患を予防または治療するための医薬品組成物として有効に用いることができる。
【0195】
また本発明は、心肥大シグナル経路を介した心肥大の誘導にPKD1が主要成分として深く関わっていること、並びにENH2が心肥大の誘導に関わるENH1の内在性アンタゴニストであることを新たに見いだし、これを提供するものである。よって、本発明が提供する心肥大発生メカニズムに関する知見を利用することにより、心肥大の発生を抑制するための有効成分、または心肥大に起因する心疾患の予防または治療のための有効成分をスクリーニングする方法を構築することができる。そして、当該スクリーニング方法によって取得された心肥大抑制物質を用いることによって、心不全、虚血性心疾患または不整脈等の心疾患の予防または治療のために有効な組成物を調製し、提供することができる。
【0196】
また上記心肥大発生メカニズムに関する知見を利用することにより、心肥大の病態を模倣した心肥大病態モデル非ヒト動物を作成し提供することができる。かかる心肥大病態モデル非ヒト動物は、心肥大の組織学的研究や心疾患への進展メカニズムの解明、ならびに心肥大の抑制剤や心疾患の予防・治療剤の開発のための有効成分のスクリーニングに有効に利用することができる。
【図面の簡単な説明】
【0197】
【図1】図1は、プロテインキナーゼD1のドメイン構造、ならびに不活性型と全活性型の構造的変化を示す概念図である。
【図2】図2は、ラット新生仔由来心筋細胞(以下、NRCともいう)について、TPA(12-O-tetradecanolyphorbol 13-acetate)で処理した場合の、全活性型PKD1(リン酸化PKD1)と不活性型PKD1(未リン酸化PKD1)の細胞内分布(細胞質[Cytoplasm]、細胞膜[Membrane])を、TPAで処理しない細胞(None)と対比した、ウエスタンブロットの結果を示す。なお、TPAはPKC及びPKDを活性化することが知られているホルボールエステルの1種である。上段から、各試料を(1)抗−PKD1/2モノクローナル抗体、(2)抗−全活性型PKD1ポリクローナル抗体、(3)抗−不活性型PKD1ポリクローナル抗体、(4)抗−サルコメリック-α-アクチニン・モノクローナル抗体、及び(5)抗−H3ヒストンマウス・モノクローナル抗体で反応させた結果を示す。TPA処理したNRCの細胞膜画分に、全活性型PKD1(リン酸化PKD1)が局在していることがわかる(実施例1)。
【図3】図3は、TPAで処理したNRC(図A)及び未処理のNRC(図3B)について、α−アクチニン、全活性型PKD1(リン酸化PKD1)、及び不活性型PKD1(不リン酸化PKD1)の細胞内分布を、免疫蛍光法による染色(共焦点レーザー顕微鏡)によって調べた結果を示す図である(実施例2)。図3B(未処理NRC)との対比から、図3A(TPA処理NRC)ではαアクチニン局在からサルコメア構造形成(心肥大状態)が認められ、TPA処理により心肥大が生じることがわかる。またTPA処理により、全活性型PKD1(リン酸化PKD1)だけがサルコメアZディスクに移行して、そこに局在することがわかる。なお、左欄の画像(Merged)は、右欄の画像と中欄の画像を重ね合わせたもので、黄色(赤×緑)を呈するほど、両者の画像が一致することを意味する(以下、図3〜6及び11において同じ)。
【図4】図4は、α-アドレナリン作動性受容体に作用して心肥大を誘導するノルエピネフリン(以下、NEともいう)(プロプラノール(β遮断薬)を加えることでβアドレナリン受容体の作用を抑制している)で処理したNRCについて、α−アクチニン、全活性型PKD1(リン酸化PKD1)、及び不活性型PKD1(不リン酸化PKD1)の細胞内分布を、免疫蛍光法による染色によって調べた結果を示す図である(実施例3)。NE処理によりサルコメア構造の発達(心肥大状態)が認められた。また、NE処理により全活性型PKD1(リン酸化PKD1)だけがサルコメアZディスクに移行して、そこに局在することがわかる。
【図5】図5は、心肥大を誘導するアンジオテンシンII(以下、AngIIともいう)(100nM)で処理したNRCについて、α−アクチニン、全活性型PKD1(リン酸化PKD1)、及び不活性化PKD1(不リン酸化PKD1)の細胞内分布を、免疫蛍光法による染色によって調べた結果を示す図である(実施例3)。AngII処理によりサルコメア構造形成(心肥大状態)が認められた。また、AngII処理により全活性型PKD1(リン酸化PKD1)だけがサルコメアZディスクに移行して、そこに局在することがわかる。
【図6】図6は、心肥大を誘導するLIF(leukemia inhibitory factor:白血病阻害因子)で処理したNRCについて、α−アクチニン、全活性型PKD1(リン酸化PKD1)、及び不活性化PKD1(不リン酸化PKD1)の細胞内分布を、免疫蛍光法による染色によって調べた結果を示す図である(実施例3)。LIF処理によりサルコメア構造形成(心肥大状態)が認められた。しかし、全活性型PKD1(リン酸化PKD1)のサルコメアZディスクへの移行は認められなかった。
【図7】図7Aは、NRCについて、PKCに対する選択的な阻害剤であるGF109203Xで処理した後に、心肥大誘導剤:ノルエピネフリン(NE)(+プロプラノール)で処理した場合の、α−アクチニンと全活性型PKD1(リン酸化PKD1)の細胞内分布を、免疫蛍光法による染色によって調べた結果を示す図である(実施例3)。心肥大状態及び全活性型PKD1(リン酸化PKD1)のサルコメアZディスク上への移行は認められず、GF109203X処理により、NE(+プロプラノール)処理による心肥大状態、及び全活性型PKD1(リン酸化PKD1)のサルコメアZディスク上への移行(図3参照)が阻害されることがわかる。またこのことから、NE(+プロプラノール)によって誘導される心肥大状態、並びにPKD1の活性化及びサルコメアZディスクへの移行は、PKCの活性化に依存していることがわかる。図7Bは、NRCについて、同様にGF109203Xで処理した後に、心肥大誘導剤:LIFで処理した場合の、α−アクチニンと全活性型PKD1(リン酸化PKD1)の細胞内分布を、免疫蛍光法による染色によって調べた結果を示す図である(実施例3)。LIF単独処理と同様に、心肥大状態は認められたが、全活性型PKD1(リン酸化PKD1)のサルコメアZディスク上への移行は認められなかった。このことから、LIF誘導される心肥大状態は、PKCの活性化に依存していないこと、またその心肥大にはPKD1の活性化及びサルコメアZディスクへの移行も関係していないことがわかる。
【図8】図8は、NRCまたは各種の薬剤で処理したNRCに内在するPKD1のリン酸化活性を調べた結果を示す図である(実施例4)。横軸は、各種薬剤で処理した(または処理しない)NRCの種類を示す。左から(1)未処理細胞、(2)TPA処理、(3)ノルエピネフリン(+プロプラノール)(NE)処理細胞、(4)LIF処理細胞、(5)GF109203X処理細胞、(6)GF109203X+TPA処理細胞、(7)GF109203X+NE(+プロプラノール)処理細胞、及び(8)GF109203X+LIF処理細胞を示す。縦軸は、各細胞に内在するPKD1のリン酸化活性(Phosphorylation activity of PKD1 (%))を示す。なお、リン酸化活性(%)は、未処理細胞に内在するPKD1のリン酸化活性を100%とした場合の相対%である。
【図9】図9は、正常NRC、並びに各種のkinase dead PKCs (PKCα、PKCβI、PKCδ、PKCε、PKCζ)を強制発現させてその活性を阻害したNRCについて、NE(+プロプラノール)で処理した場合に、内在するPKD1のリン酸化活性の変化を調べた結果を示す図である(実施例5)。横軸は、NRCの種類を示す。左から(1)薬剤未処理の野生型NRC、(2)NE処理した野生型NRC、(3)NE処理したkinase dead PKCα強制発現NRC、(4)NE処理したkinase dead PKCβI強制発現NRC、(5)NE処理したkinase dead PKCδ強制発現NRC、(6)NE処理したkinase dead PKCε強制発現NRC、及び(7)NE処理したkinase dead PKCζ強制発現NRCを示す。縦軸は、各細胞に内在するPKD1のリン酸化活性(Phosphorylation activity of PKD1 (%))を示す。なお、リン酸化活性(%)は、未処理細胞に内在するPKD1のリン酸化活性を100%とした場合の相対%である。
【図10】図10は、免疫沈降アッセイによって、NE(+プロプラノール)で処理したNRC内で、PKDεとPKD1との存在形態を免疫沈降法とウエスタンブロッティング法により調べた結果を示す図である(実施例6)。
【図11】図11Aは、GFP(Green Fluorescent Protein)-構成的活性型PKD1(GFP-PKD1 CA)(下段)、及びGFP(上段)を導入して強制発現させたNRCについて、α−アクチニンとGFP(すなわち、GFP-PKD1 CA、またはGFP)の細胞内分布を、免疫蛍光法による染色によって調べた結果を示す図である(実施例7)。GFP-PKD1 CAを強制発現させたNRC〔すなわち、全活性型PKD1(リン酸化PKD1)を有するNRC〕だけに、サルコメア構造の形成(心肥大状態))、並びにそのサルコメアZディスクへの移行が認められた。図11Bは、PKCε−CAを導入して強制発現させたNRCについて、α−アクチニンと構成的活性型PKCε(特に、PKCε−CA)の細胞内分布を、免疫蛍光法で染色することによって調べた結果を示す図である。α−アクチニンとPKCεについても免疫蛍光が認められた。
【図12】図12中、パネルAは構成的活性型PKCε(CA-PKCε)を導入して強制発現したNRC、パネルBは構成的活性型PKCβI(CA-PKCβI)を導入して強制発現したNRC、及びパネルCは構成的活性型PKCδ(CA-PKCδ)を導入して強制発現したNRCにおける、α−アクチニンの細胞内分布を、免疫蛍光法による染色によって調べた結果を示す図である(実施例8)。また、パネルD及びEはドミナント・ネガティブ型PKCε(DN-PKCε)を導入して強制発現したNRCについて、それぞれNE(+プロプラノール)及びLIFで処理した細胞におけるα−アクチニンの細胞内分布を、免疫蛍光法による染色によって調べた結果を示す図である(実施例8)。パネルA(CA-PKCε強制発現NRC)、B(CA-PKCβI強制発現NRC)及びE(DN-PKCε強制発現+LIF処理NRC)において、サルコメア構造の形成(心肥大状態)が認められた。
【図13】図13は、各種のNRCについて心肥大のマーカーである、利尿性ナトリウム因子(以下、ANFともいう)の発現レベルを調べた結果を示す図である。横軸の左から、(1)GFP導入NRC+心肥大誘導ナシ(−)(Negative control)、(2)野生型NRC+心肥大誘導アリ(NE処理)、(3)構成的活性型PKCε(CA-PKCε)強制発現NRC+心肥大誘導ナシ(−)、(4)構成的活性型PKCβI(CA-PKCβI)強制発現NRC+心肥大誘導ナシ(−)、(5)構成的活性型PKCδ(CA-PKCδ)強制発現NRC+心肥大誘導ナシ(−)、(6)kinase dead PKCε(KD-PKCε)強制発現NRC+心肥大誘導ナシ(−)、(7)kinase dead PKCε(KD-PKCε)強制発現NRC+心肥大誘導アリ(NE処理)、(8)構成的活性型PKD1(CA-PKD1)強制発現NRC+心肥大誘導ナシ(−)、(9)ドミナント・ネガティブ型PKD1(DN-PKD1)強制発現NRC+心肥大誘導ナシ(−)、(10)ドミナント・ネガティブ型PKD1(DN-PKD1)強制発現NRC+心肥大誘導アリ(LIF処理)、及び(11)ドミナント・ネガティブ型PKD1(DN-PKD1)強制発現NRC+心肥大誘導アリ(NE処理)を示す。縦軸は、各細胞のANFの発現レベルを示す。なお、各細胞のANFの発現レベルは、Negative controlのANFの発現レベルを1とした場合の相対比で示す。
【図14】図14は、マウスENH1(mENH1)(Enigma Homologue 1)のドメイン構造と、そのLIMドメインを欠失したスプライス変異体であるマウスENH2(mENH2)(Enigma Homologue 2)及びマウスENH3(mENH3)(Enigma Homologue 3)のドメイン構造を示す。PDZドメインは全てのENH分子のN末端側に、またLIMドメインはEHN1のC末端側に3つ存在する。“I”(インターナルストレッチ)及び“T”(ターミナルストレッチ)はいずれも機能不明な保存配列である。
【図15】図15は、実施例10の結果を示す図である。NRCに、予めN末端側にFLAGエピトープタグを付加したENH1もしくはENH2を強制発現しておき、心肥大誘導能を有するTPAを20nM作用させたものを、抗FLAG抗体または抗ANF抗体を使用した蛍光抗体法で観察したものである。ENH2を導入したNRCのみ、TPAの心肥大誘導作用が抑制されていることが、心肥大マーカーであるANFの発現抑制結果により判明した。
【図16】図16は、心筋細胞内における7回膜貫通型ヘテロ三量体Gタンパク質共役型受容体(以下、GPCRともいう)を介した心肥大シグナル制御モデルを示す概念図である。当該心肥大シグナル制御には、ENH1、PKCε及びPKD1、並びにENH2が相互関連している。
【技術分野】
【0001】
本発明は心肥大発生機構、より詳細には心肥大を誘導するシグナル伝達経路に関して新たな知見を提供するものである。さらに本発明は、かかる知見に基づいて、心肥大の発生を抑制するために用いられる組成物(心肥大抑制用組成物)に関する。また本発明は、上記作用に基づいて、心肥大に起因する疾患、具体的には心肥大によって生じる心不全などの心機能障害の発症を予防または治療するために用いられる組成物(心肥大に起因する心疾患の予防または治療用組成物)に関する。
【0002】
さらに本発明は、心肥大発生機構に関する新たな知見に基づいて、被験者について心肥大を抑制する方法、並びに心肥大に起因する心疾患(具体的には心不全等の心機能障害)を予防または治療する方法に関する。
【0003】
さらにまた本発明は、上記組成物(心肥大抑制用組成物、または心肥大に起因する心疾患の予防または治療用組成物)の有効成分をスクリーニングする方法に関する。また本発明は、心肥大の病態を模倣した病態モデル動物に関する。
【背景技術】
【0004】
心臓は個体発生の極めて早期に分化し、分化後すぐに自立拍動を開始する臓器である。心筋細胞は分化後も分裂能を維持し、胎生期の間は活発に分裂増殖を続けるが、出生後はその増殖能は急速に低下する。このため、出生後の心筋細胞には、再生能力がなく、その後の心臓の成長は個々の心筋細胞の大きさが増すという生理的肥大によってのみ行われると考えられている。心臓の肥大(心肥大)は、筋原線維の幅の増加(これは、心筋壁の肥厚化、すなわち「求心性肥大」を生じる)によって引き起こされるか、または筋原線維の長さの増加(これは、室の拡張、すなわち「遠心性肥大」を生じる)によって引き起こされる。これらの対照的な肥大の形態は、それぞれサルコメア(sarcomere)の平行構築(parallel assenbly)及び連続構築(serial assembly)によってもたらされる。
【0005】
心肥大は、出生後の生理学的適応に応じて、または運動によって誘導されるが、この場合は上記求心性肥大と遠心性肥大が同時にバランスよく生じ、要求量の増加に応じて心臓のポンプ輸送能力を増加させるもので、正常な生理学的現象である。
【0006】
一方、病的に生じる心臓への負荷も心肥大を誘導する。具体的には、高血圧症や心弁膜症による心室への負荷の増大、あるいは心筋梗塞、心筋炎や心筋症などによる心筋細胞自体の障害が生じると、心臓は主として心筋細胞を肥大化させることにより心拍出量を保つようにその形態を変え、いわゆる心肥大となる。このような心肥大は、ある程度までは心筋細胞障害や機械的負荷に対する代償現象と考えられるが、過剰な負荷が持続的に加わり心肥大が著しいときには、心臓の収縮機能や拡張機能が破綻し、心拍出量が低下して慢性心不全に至るとともに、虚血性心疾患に陥りやすく、致死性の不整脈も発生しやすくなる。また、こうした心臓への病的な負荷は、その負荷に依存して求心性肥大または遠心性肥大のいずれかが優勢であり、心不全に至らないまでも肥大型心筋症または拡張型心筋症の発症を引き起こす。
【0007】
最近、心肥大は心不全等の心臓疾患への移行の独立危険因子として認識されており、米国の大規模追跡調査であるFramingham Heart Study等により、心肥大があると心不全を始め、狭心症や心筋梗塞などの虚血性心疾患、不整脈など心血管系疾患の発症率が2.5〜3倍に上昇することも判明している(山崎力、矢崎義雄、「心不全」、第37-45頁、篠山重威編、医薬ジャーナル社、1997年)。従って、過度の心肥大の形成を抑制するか、あるいは心肥大を退縮させる薬剤は、慢性心不全を含む心臓病の発症の進展の防御に有効に使用できると考えられる。
【0008】
慢性心不全に対する治療法としては、従来心臓の収縮力を改善し、心拍出量を増大する目的で強心薬が主に用いられてきた。しかしながら、強心薬は急性的に自覚症状改善効果、運動耐容能改善効果を示すものの、慢性心不全治療の最終目標である生命予後の改善、すなわち延命効果の面では効果がなく、むしろ予後を悪化させるという結果が得られている(Pacher et al., N.Engl.J.Med., Vol.325, p.1468, 1991)。
【0009】
一方、心肥大の発生機構に関しては心肥大シグナル伝達経路の存在が指摘されており、刺激因子によって、タンパク質合成、サルコメアの構築及び組織化、並びに遺伝子発現を調節するシグナル伝達経路が活性化されることによって、心肥大が発生し、また進展することが知られている(Chien, K.R., Cell, 98, p555-558, 1999: Nicol,R.L., et al., Ann. Rev. Gen. Gen., 1, p.179-223, 2000: Sugden, P.H. et al, J. Mol. Med., 76, p.725-746, 1998)。
【0010】
上記刺激因子として、例えばプロテインキナーゼ(例えば、ERK、JNK、及びp38MAPK等のmitogenactivated protein kinase[MAPK]ファミリー)、及び液性因子(例えば、アンジオテンシンII、エンドセリン−1などの血管作動物質、エピネフリンなどの神経因子、カルジオトロフィン1,白血病抑制因子[LIF]等のサイトカン、インスリン、IGF−1などの増殖因子)が知られている。上記プロテインキナーゼは、心筋細胞の伸展という機械的な負荷によって活性化される他、液性因子によっても活性化され、かかる活性化反応を介してc-fos、c-myc、c-junなどの転写調節因子が活性化されて、心肥大に関連する蛋白質の誘導が引き起こされると考えられている。また、最近では、機械的刺激やアンジオテンシンII、エンドセリン−1及びエピネフリンなどの刺激によって細胞内カルシウムのレベルが上昇すること、構成的活性型のカルシニューリンを発現するマウスで心肥大が誘導されること(Olson et al., Cell, 93, p.215-223, 1998)等から、心肥大形成におけるカルシウムの役割が注目されている。また、カルモジュリンを強制発現したマウスの心筋において、Ca2+/カルモジュリン依存性プロテインキナーゼII(CaMキナーゼII)活性が約2倍に上昇して、顕著な心肥大が観察されること(Mol Endocrinol 14, p.1125-1136, 2000)、構成的活性型CaMキナーゼIVを心臓特異的に発現したマウスに心肥大が確認されること(J Clin Invest 105, p.1395-1406, 2000)等から、CaMキナーゼII及びIVも、心肥大形成を刺激する因子として考えられている。
【0011】
このため、心肥大の発生を抑制する目的で、これらの刺激因子の産生を阻害するかあるいはこれを介した心肥大シグナル伝達を抑制もしくは遮断する薬剤の開発、並びに臨床応用が進められている(例えば、アンジオテンシンIIの産生阻害剤、α1-遮断薬、エンドセリン受容体拮抗剤等:J. Cardiovasc. Pharmacol., 27, S36-S40, 1996:Br. J. Pharmacol., 118, p.549-556, 1996:Cardiovasc. Res., 23, p.315-333, 1989: Circ. Res., 73, p.887-897, 1993)。しかし、生体内において心肥大の発生機序にはこれらの因子が複数関わっており、単一因子に対する拮抗作用だけでは不十分であることも指摘されている。例えば、アンジオテンシンIIを産生する酵素であるアンジオテンシン変換酵素(ACE)の阻害剤は、モデル動物において心肥大の発症進展を抑制し(Brilla et al.,Circulation, Vol.83, p.1771, 1991)、臨床的にも慢性心不全患者に投与した場合に、心肥大を退縮させ、生命予後を延長することが観察されているが(The save Investigation, N. Engl. J. Med., Vol.327, p.678, 1992)、その効果は未だ十分なものとは云えない。実際に、最先端の治療を行っても、慢性心不全の発症後、5年間の死亡率は現在なお約50%に達している。最近、エンドセリン拮抗薬(Ito et al., Circulation, Vol.89, p.2198, 1994)やバソプレッシン拮抗薬(Tumura et al., Circulation, Vol.94, (Supple. I-264), 1996)がモデル動物において心肥大の形成を抑制することも報告されているが、さらに新しいメカニズムに基づいて、心肥大が抑制できる心疾患予防・治療剤の開発が望まれている。
【0012】
一方、プロテインキナーゼD1(以下、PKD1ともいう)は、アミノ末端領域に制御領域を、またカルボキシ末端領域にセリン・スレオニン特異的プロテインキナーゼをコードする触媒領域を有する、約110KDa(910-920アミノ酸残基)からなる蛋白質である。さらに上記の制御領域には、膜相互作用領域(TM)、連続した亜鉛フィンガー(Cys-rich, Zn-finger like)から構成される2つのCR(Cys-rich)ドメイン、及びPH(Pleckstrin Homology)ドメインが存在している(図1参照)。
【0013】
ヒト由来PKD1は、制御領域のCRドメインと触媒領域との相互作用により分子全体が折り畳まれており、この状態では不活性であると考えられている(不活性型PKD1)。しかし、ホスホイノシタイド依存性キナーゼ1(phosphoinositide-dependent kinase 1:PDK1)が作用すると、PHドメインまたはその近傍に位置する活性ループ部位(Ser-744 [PH内], Ser-748 [PHより少し下流])がリン酸化されて、触媒的に活性化状態に移行する。さらに、CRドメインは、Ca2+、ジアシルグリセロール(DG)またはホルボールエステル(例えばTPA等)に対して高い親和性を有しており、かかるドメインにこれらの成分が結合すると、CRドメインから触媒領域が解離し、一層活性化され、次いでC末端の触媒領域(Ser-916)が自動リン酸化されて分子全体が完全に活性化される(全活性型PKD1)ことが知られている(Van Lint, J., et al., J. Biol. Chem. 3, p.1455-1461, 1995: Zugaza, J.L., et al, EMBO J. 15, p.6220-6230, 1996; Zugaza, J.L., et al, J. Biol. Chem. 272, p.23952-23960, 1997;Iglesias, T., et al., J. Biol. Chem. 273, p.27662-27667, 1998:Iglesias, T., et al., J. Biol. Chem. 273, p.27662-27667, 1998)。
【0014】
PKD1は、同定当初は、その構造的特徴からプロテインキナーゼC(PKC)ファミリーの一つ(PKCμ)として同定されたが、触媒領域のアミノ酸配列がPKCファミリーと相違していること等の理由から(PKCファミリー間ではこの領域のアミノ酸配列は高く保存されている)、今では、PKCとは別個の独自のプロテインキナーゼファミリーに属していると考えられている。また、幾つかのPKCのアイソフォーム(PKCη、PKCε、PKCβI)が、ヒト由来PKD1の活性ループ部位(Ser-744)及びその近傍部位(Ser-748)をリン酸化することによって、PKD1を活性化することが示されている(Maeda, Y., et al., EMBO J. 20, p.5982-90, 2001: Waldron, R.T., et al., J. Biol. Chem. 274, p.9224-9230, 1999; Waldron, R.T., et al., J. Biol. Chem. 276, p.32606-32615, 2001)。
【0015】
PKD1は、ヒト体内では、脳、肺、心臓並びに骨格筋等、心臓を問わず、多くの組織に発現し存在している。PKD1の一部はゴルジ装置に局在しており(Iglesias, T., et al., FEBS Lett. 454, p.53-56, 1999: Jamora, C, et al., Cell. 98, p.59-68, 1999: Liljedahl, M., et al., Cell. 104, p.409-420, 2001)、ゴルジ機能に重要な役目を担っていることが知られている(Van Lint, J., et al., Trends in Cell Biol.12, p.193-200, 2002)。
【0016】
このように、従来、PKD1について、心臓における生理学的な機能や役割については一切知られていなかったのが実情である。
【0017】
またプロテインキナーゼC(以下、PKCともいう)に関しては、心筋においてPKCのアイソフォームの一つであるPKCεが顕著に発現しており、サルコメアZディスクに局在して心肥大に関わっていることが示唆されている(Takeishi, Y., et al., Circ. Res. 86, p.1218-1223, 2000)。更に、構成的に活性なPKCεを遺伝子組換えで強制発現させると心肥大を発生することが報告されている(Mochly-Rosen, D., et al., Circ Res., 86, p.1173-1179, 2000)。
【0018】
しかしながら、心肥大の発症及び進展に関してPKD1が関係していること、並びにPKD1とPKCεとが相互に関係していることについては、一切知られていなかった。
【発明の開示】
【発明が解決しようとする課題】
【0019】
本発明は、第1に、慢性心不全などの心疾患の発症・進展に関わる心肥大の抑制に有効な医薬組成物を提供する。より詳細には、本発明は、心肥大シグナル伝達に関わるPKD1の心筋細胞での機能発現を抑制する物質を有効成分とする心肥大抑制剤(心肥大抑制用医薬組成物)を提供する。第2に、本発明は、かかるPKD1の機能発現を抑制する物質によって心肥大シグナル伝達を遮断もしくは抑制することによって、心肥大に起因する各種心疾患の発症や進展を抑制することのできる医薬組成物を提供する。さらに本発明は、心肥大を抑制して心肥大の発生を予防する方法、並びに当該心肥大に起因して生じる慢性心不全などの各種心疾患の発症や進展を予防しまた治療する方法を提供する。
【0020】
さらにまた、本発明は、新たに見いだされた心肥大発生機構に基づいて、心肥大抑制剤、または心肥大に起因して発症・進展する心疾患の治療若しくは予防に有効な成分を探索し選択する方法を提供し、かかる成分を有効成分とする医薬組成物(心肥大抑制用医薬組成物、心肥大に起因する心疾患予防・治療用の医薬組成物)を提供するものである。
【0021】
また、本発明は、トランスジェニック非ヒト動物、特に心筋細胞においてPKD1を強制発現させることによって心肥大化を促進してなる、心肥大病態モデル非ヒト動物を提供するものである。
【課題を解決するための手段】
【0022】
本発明者らは、心筋細胞における肥大シグナル伝達におけるプロテインキナーゼD1(PKD1)の役割、並びにPKD1とプロテインキナーゼCε(PKCε)との相互作用を調べた。その結果の詳細は後述する実施例に示すが、(1)心筋細胞においてPKD1は著量に発現しており、7回膜貫通型ヘテロ三量体Gタンパク質共役型受容体(GPCR)を介する刺激(例えば、アンジオテンシンII[AngII]やノルエピネフリン[NE]などによる刺激)によって全活性化(リン酸化)されて、サルコメアZディスクに移行して局在化すること、(2)当該PKD1の全活性化(リン酸化)はPKCεの活性化に依存しており、心筋細胞内でPKD1はPKCεと相互作用して、PKCεによって直接活性化されること、(3)全活性型PKD1((リン酸化PKD1)及び活性型PKCεをそれぞれ心筋細胞内で強制発現させると、心筋細胞は心肥大誘導剤で処理した場合と同様な心肥大化状態を示すが、不活性型PKD1(不リン酸化PKD1)を強制発現した後、心肥大誘導処理しても心筋細胞の肥大化は見られないこと等、の結果が得られた。かかる結果は、心肥大化シグナル伝達経路におけるシグナル因子としてPKD1が深く関わっていること、そしてPKD1はPKCεによって直接活性化されて心肥大を引き起こす、PKCεの下流ファクターであることを示す。
【0023】
そしてこれらの結果は、心筋細胞におけるPKD1活性を阻害することで、その経路のシグナル伝達を遮断して心肥大化を抑制もしくは低下させることができ、心肥大抑制剤並びに心疾患予防・治療剤としての臨床的応用が可能であること、また逆に、心筋細胞におけるPKD1活性を増大させることで、心肥大化を促進することができ、心肥大病態モデル動物の作成及び提供が可能であることを示唆するものである。
【0024】
また、ENH1は、心肥大シグナルに関与するシグナル因子(PKC)を心筋細胞サルコメアZディスクにリクルートし、そこに繋ぎ止める足場タンパク質であり、心肥大のシグナリングに関わっていることが知られているが(Nakagawa N, et al., Biochem. Biophys. Res. Commun., 272(2), p.505-512, 2000)、本発明者らは、今回、ENH1のLIMドメインを欠失したスプライス変異体ENH2が、上記ENH1が介する心肥大シグナルを抑制する内在性アンタゴニストであることを見いだした。この結果は、心筋細胞においてENH2を強制発現させることによってENH1が関与する心肥大シグナル伝達を抑制制御することができ、心肥大抑制剤並びに心疾患予防・治療剤としての臨床的応用が可能であることを示唆するものである。
【0025】
本発明はかかる知見に基づいて開発されたものである。具体的には、本発明は下記の態様を包含する:
I.心肥大抑制用医薬組成物
(1)PKD1の心筋細胞における機能発現を抑制する物質を有効成分とする、心肥大抑制用医薬組成物。
(2)有効成分が、心筋細胞におけるPKD1の活性化を抑制する作用を有する物質である、(1)に記載する心肥大抑制用医薬組成物。
(3)有効成分が、ヒト由来のPKD1のSer-744、Ser-748またはSer-916のいずれか少なくとも1つのリン酸化を抑制する作用を有する物質である、(1)または(2)に記載する心肥大抑制用医薬組成物。
(4)有効成分が、心筋細胞において発現可能に制御されたドミナント・ネガティブ型PKD1をコードする塩基配列を有する核酸である、(1)または(2)に記載する心肥大抑制用医薬組成物。
(5)上記核酸が発現ベクター内に含まれている(4)に記載の心肥大抑制用医薬組成物。
(6)上記発現ベクターがプラスミドまたはウイルスベクターである(5)に記載の心肥大抑制用医薬組成物。
(7)上記発現ベクターがウイルス粒子または中空ナノ粒子内に含まれている、(5)に記載の心肥大抑制用医薬組成物。
(8)上記発現ベクターがリポソームで構成される、(5)に記載の心肥大抑制用医薬組成物。
(9)有効成分が、心筋細胞におけるPKD1遺伝子の発現を阻害する物質である、(1)または(2)のいずれかに記載する心肥大抑制用医薬組成物。
(10)有効成分が、PKD1のアンチセンス分子、リボザイムまたはRNAiエフェクターである(9)に記載する心肥大抑制用医薬組成物。
(11)有効成分が、PKD1若しくはリン酸化されていてもよいその断片に対する抗体である(1)または(2)のいずれかに記載する心肥大抑制用医薬組成物。
(12)ENH2をコードする塩基配列を有する核酸を有効成分とする、心肥大抑制用医薬組成物。
(13)上記核酸が発現ベクター内に含まれている(12)に記載の心肥大抑制用医薬組成物。
(14)上記発現ベクターがプラスミドまたはウイルスベクターである(13)に記載の心肥大抑制用医薬組成物。
(15)上記発現ベクターがウイルス粒子または中空ナノ粒子内に含まれている、(13)に記載の心肥大抑制用医薬組成物。
(16)上記発現ベクターがリポソームで構成される、(13)に記載の心肥大抑制用医薬組成物。
(17)心肥大が、7回膜貫通型ヘテロ三量体Gタンパク質共役受容体(GPCR)または上皮成長因子(EGF)受容体を介する肥大シグナル伝達によって生じるものである、(1)乃至(16)のいずれかに記載する心肥大抑制用医薬組成物。
(18)更に、gp130レセプター阻害剤を含有する(1)乃至(16)のいずれかに記載する心肥大抑制用医薬組成物。
【0026】
II.心肥大の抑制、また心肥大発生の予防方法
(1)PKD1の心筋細胞における機能発現を抑制する物質を有効量、心肥大またはその前状態にある被験者に投与することを含む、当該被験者について心肥大を抑制するか、または心肥大の発生を予防する方法。
(2)上記物質が、心筋細胞におけるPKD1の活性化を抑制する作用を有するものである、(1)に記載する方法。
(3)上記物質が、ヒト由来PKD1のSer-744、Ser-748またはSer-916のいずれか少なくとも1つのリン酸化を抑制する作用を有するものである、(1)または(2)に記載する方法。
(4)上記物質が、心筋細胞において発現可能に制御されたドミナント・ネガティブ型PKD1をコードする塩基配列を有する核酸である、(1)または(2)に記載する方法。
(5)上記核酸が発現ベクター内に含まれているものである(4)に記載の方法。
(6)上記発現ベクターがプラスミドまたはウイルスベクターである(5)に記載の方法。
(7)上記発現ベクターがウイルス粒子または中空ナノ粒子内に含まれているものである、(5)に記載の方法。
(8)上記発現ベクターがリポソームで構成される、(5)に記載の方法。
(9)上記物質が、心筋細胞におけるPKD1遺伝子の発現を阻害する物質である、(1)または(2)に記載する方法。
(10)上記物質が、PKD1のアンチセンス分子、リボザイムまたはRNAiエフェクターである(9)に記載する方法。
(11)上記物質が、PKD1もしくはリン酸化されていてもよいPKD1の断片に対する抗体である(1)または(2)に記載する方法。
(12)ENH2をコードする塩基配列を有する核酸を有効量、心肥大またはその前状態にある被験者に投与することを含む、当該被験者について心肥大を抑制するか、または心肥大の発生を予防する方法。
(13)上記核酸が発現ベクター内に含まれている(12)に記載の方法。
(14)上記発現ベクターがプラスミドまたはウイルスベクターである(13)に記載の方法。
(15)上記発現ベクターがウイルス粒子または中空ナノ粒子内に含まれている、(13)に記載の方法。
(16)上記発現ベクターがリポソームで構成される、(13)に記載の方法。
(17)心肥大が、GPCRまたはEGF受容体を介する肥大シグナル伝達によって生じるものである、(1)乃至(16)のいずれかに記載する方法。
(18)更に、gp130レセプター阻害剤を投与することを含む(1)乃至(17)のいずれかに記載する方法。
【0027】
III.心肥大に起因する心疾患の予防または治療用医薬組成物
(1)PKD1の心筋細胞における機能発現を抑制する物質を有効成分とする、心肥大に起因する心疾患の発症を予防または治療するための医薬組成物。
(2)有効成分が、心筋細胞におけるPKD1の活性化を抑制する作用を有する物質である、(1)に記載する医薬組成物。
(3)有効成分が、ヒト由来PKD1のSer-744、Ser-748またはSer-916のいずれか少なくとも1つのリン酸化を抑制する作用を有する物質である、(1)または(2)に記載する医薬用組成物。
(4)有効成分が、心筋細胞において発現可能に制御されたドミナント・ネガティブ型PKD1をコードする塩基配列を有する核酸である、(1)または(2)に記載する医薬組成物。
(5)上記核酸が発現ベクター内に含まれている(4)に記載の医薬組成物。
(6)上記発現ベクターがプラスミドまたはウイルスベクターである(5)に記載の医薬組成物。
(7)上記発現ベクターがウイルス粒子または中空ナノ粒子内に含まれている、(5)に記載の医薬組成物。
(8)上記発現ベクターがリポソームで構成される、(5)に記載の医薬組成物。
(9)有効成分が、心筋細胞におけるPKD1遺伝子の発現を阻害する物質である、(1)または(2)に記載する医薬組成物。
(10)有効成分が、PKD1のアンチセンス分子、リボザイムまたはRNAiエフェクターである(9)に記載する医薬組成物。
(11)有効成分が、PKD1若しくはリン酸化されていてもよいPKD1の断片である(1)または(2)に記載する医薬組成物。
(12)ENH2をコードする塩基配列を有する核酸を有効成分とする、心肥大に起因する心疾患の発症を予防または治療するための医薬組成物。
(13)上記核酸が発現ベクター内に含まれている(12)に記載の医薬組成物。
(14)上記発現ベクターがプラスミドまたはウイルスベクターである(13)に記載の医薬組成物。
(15)上記発現ベクターがウイルス粒子または中空ナノ粒子内に含まれている、(13)に記載の医薬組成物。
(16)上記発現ベクターがリポソームで構成される、(13)に記載の医薬組成物。
(17)心肥大が、GPCRまたはEGF受容体を介する肥大シグナル伝達によって生じるものである、(1)乃至(16)のいずれかに記載する医薬組成物。
(18)心肥大に起因して生じる心疾患が、心不全、虚血性心疾患、または不整脈である(1)乃至(17)のいずれかに記載する医薬組成物。
(19)更に、gp130レセプター阻害剤を含有する(1)乃至(16)及び(18)のいずれかに記載する医薬組成物。
【0028】
IV.心肥大に起因する心疾患の予防または治療方法
(1)PKD1の心筋細胞における機能発現を抑制する物質を有効量、心肥大またはその前状態にある被験者に投与することを含む、当該被験者について心肥大に起因する疾患の発症を予防し、また治療する方法。
(2)上記物質が、心筋細胞におけるPKD1の活性化を抑制する作用を有するものである、(1)に記載する方法。
(3)上記物質が、ヒト由来PKD1のSer-744、Ser-748またはSer-916のいずれか少なくとも1つのリン酸化を抑制する作用を有するものである、(1)または(2)に記載する方法。
(4)上記物質が、心筋細胞において発現可能に制御されたドミナント・ネガティブ型PKD1をコードする塩基配列を有する核酸である、(1)または(2)に記載する方法。
(5)上記核酸が発現ベクター内に含まれているものである(4)に記載の方法。
(6)上記発現ベクターがプラスミドまたはウイルスベクターである(5)に記載の方法。
(7)上記発現ベクターがウイルス粒子または中空ナノ粒子内に含まれているものである、(5)に記載の方法。
(8)上記発現ベクターがリポソームで構成される、(5)に記載の方法。
(9)上記物質が、心筋細胞におけるPKD1遺伝子の発現を阻害する物質である、(1)または(2)に記載する方法。
(10)上記物質が、PKD1のアンチセンス分子、リボザイムまたはRNAiエフェクターである(9)に記載する方法。
(11)上記物質が、PKD1若しくはリン酸化されていてもよいPKD1の断片である(1)または(2)に記載する方法。
(12)ENH2をコードする塩基配列を有する核酸を有効量、心肥大またはその前状態にある被験者に投与することを含む、当該被験者について心肥大に起因する疾患の発症を予防し、また治療する方法。
(13)上記核酸が発現ベクター内に含まれている(14)に記載の方法。
(14)上記発現ベクターがプラスミドまたはウイルスベクターである(13)に記載の方法。
(15)上記発現ベクターがウイルス粒子または中空ナノ粒子内に含まれている、(13)に記載の方法。
(16)上記発現ベクターがリポソームで構成される、(13)に記載の方法。
(17)心肥大が、GPCRまたはEGF受容体を介する心肥大シグナル伝達によって生じるものである、(1)乃至(16)のいずれかに記載する方法。
(18)心肥大に起因して生じる心疾患が、心不全、虚血性心疾患、または不整脈である(1)乃至(17)のいずれかに記載する方法。
(19)心筋細胞におけるPKD1の機能発現を抑制する物質に加えて、更に、gp130レセプター阻害剤を投与することを含む(1)乃至(16)及び(18)のいずれかに記載する方法。
【0029】
V.心肥大シグナル伝達を遮断もしくは抑制する方法
(1)心筋細胞に、PKD1の機能発現を阻害する物質を、有効量投与することを含む、心肥大シグナル伝達を遮断する方法。
(2)上記物質が、心筋細胞におけるPKD1の活性化を抑制する作用を有するものである、(1)に記載する方法。
(3)上記物質が、ヒト由来PKD1のSer-744、Ser-748またはSer-916のいずれか少なくとも1つのリン酸化を抑制する作用を有するものである、(1)または(2)に記載する方法。
(4)上記物質が、心筋細胞において発現可能に制御されたドミナント・ネガティブ型PKD1をコードする塩基配列を有する核酸である、(1)または(2)に記載する方法。
(5)上記核酸が発現ベクター内に含まれているものである(4)に記載の方法。
(6)上記発現ベクターがプラスミドまたはウイルスベクターである(5)に記載の方法。
(7)上記発現ベクターがウイルス粒子または中空ナノ粒子内に含まれているものである、(5)に記載の方法。
(8)上記発現ベクターがリポソームで構成される、(5)に記載の方法。
(9)上記物質が、心筋細胞におけるPKD1遺伝子の発現を阻害する物質である、(1)または(2)に記載する方法。
(10)上記物質が、PKD1のアンチセンス分子、リボザイムまたはRNAiエフェクターである(9)に記載する方法。
(11)上記物質が、PKD1若しくはリン酸化されていてもよいPKD1の断片である(1)または(2)に記載する方法。
(12)心筋細胞に、ENH2をコードする塩基配列を有する核酸を有効量投与することを含む、心肥大シグナル伝達を遮断する方法。
(13)上記核酸が発現ベクター内に含まれている(12)に記載の方法。
(14)上記発現ベクターがプラスミドまたはウイルスベクターである(13)に記載の方法。
(15)上記発現ベクターがウイルス粒子または中空ナノ粒子内に含まれている、(13)に記載の方法。
(16)上記発現ベクターがリポソームで構成される、(13)に記載の方法。
(17)心肥大が、GPCRまたはEGF受容体を介する肥大シグナル伝達によって生じるものである、(1)乃至(16)のいずれかに記載する方法。
(18)更に、gp130レセプター阻害剤を投与することを含む(1)乃至(16)のいずれかに記載する方法。
【0030】
VI.トランスジェニック非ヒト動物
(1)心筋細胞において構成的活性型PKD1が強制発現してなる、トランスジェニック非ヒト動物。
(2)構成的活性型PKD1が、ヒト由来PKD1の PHドメインを欠失してなるもの、ヒト由来PKD1のアミノ酸配列の744位及び748位のセリンがグルタミン酸に置換されてなるもの、及びマウス由来PKD1のアミノ酸配列の744位及び748位のセリンがグルタミン酸に置換されてなるものより選択される少なくとも1つである、(1)に記載するトランスジェニック非ヒト動物。
(3)心肥大の病態モデル動物である、(1)または(2)に記載するトランスジェニック非ヒト動物。
(4)心筋細胞においてドミナント・ネガティブ型PKD1が強制発現してなる、トランスジェニック非ヒト動物。
(5)ドミナント・ネガティブ型プロテインキナーゼD1が、ヒト由来PKD1の アミノ酸配列612位のリジンがトリプトファンに置換されてなるもの、ヒト由来PKD1の アミノ酸配列618位のリジンがアスパラギンに置換されてなるもの、ヒト由来PKD1の アミノ酸配列733位のアスパラギン酸がアラニンに置換されてなるもの、ヒト由来PKD1の アミノ酸配列738位及び742位のセリンがアラニンに置換されてなるもの、マウスPKD1のアミノ酸配列618位のリジンがメチオニンに置換してなるもの、及びマウス由来PKD1の アミノ酸配列744位及び748位のセリンがアラニンに置換されてなるものより選択される少なくとも1つである
、(4)に記載するトランスジェニック非ヒト動物。
【0031】
VII.スクリーニング方法
(1)下記の工程を含む、心肥大抑制剤をスクリーニングする方法:
(a) PKD1を発現し得る細胞に被験物質を接触させる工程、
(b) 上記細胞について、PKD1の発現レベルを測定し、被験物質を接触させない対照の細胞におけるPKD1の発現レベルと対比する工程、及び
(c) 上記(b)の比較結果に基づいて、対照の細胞に比して、PKD1の発現レベルが低下してなる細胞と接触させた被験物質を、心肥大抑制剤として選択する工程。
(2)下記の工程を含む、心肥大抑制剤をスクリーニングする方法:
(a) PKD1を発現し得る細胞に、PKD1活性化剤及び被験物質を接触させる工程、
(b) 上記細胞について、PKD1の活性を測定し、被験物質を接触させない対照の細胞における上記に対応する活性と対比する工程、及び
(c) 上記(b)の比較結果に基づいて、対照の細胞に比して、PKD1の活性が低下してなる細胞に投与した被験物質を、心肥大抑制剤として選択する工程。
(3)下記の工程を含む、心肥大抑制剤をスクリーニングする方法:
(a) 心筋細胞に、GPCRまたはEGF受容体を刺激する心肥大誘導剤と被験物質を接触させる工程、
(b) 上記心筋細胞について、PKD1の活性、サルコメアZディスクにおけるリン酸化PKD1の局在性、またはPKCεとPKD1との2分子間距離を測定し、心肥大誘導剤だけを接触させた対照の心筋細胞における上記に対応する活性、局在性または2分子間距離と対比する工程、及び
(c) 上記(b)の比較結果に基づいて、対照の心筋細胞に比して、PKD1の活性若しくはサルコメアZディスクにおけるリン酸化PKD1の局在性が低下してなるか、またはPKCεとPKD1との2分子間距離が増大してなる心筋細胞に投与した被験物質を、心肥大抑制剤として選択する工程。
(4)下記の工程を含む、心肥大抑制剤をスクリーニングする方法:
(a) 構成的活性型PKCεまたは構成的活性型PKD1を発現し得る心筋細胞に、被験物質を接触させる工程、
(b) 上記心筋細胞について、PKD1の活性、サルコメアZディスクにおけるリン酸化PKD1の局在性、またはPKCεとPKD1との2分子間距離を測定し、被験物質を接触させない対照の心筋細胞における上記に対応する活性、局在性または2分子間距離と対比する工程、及び
(c) 上記(b)の比較結果に基づいて、対照の心筋細胞に比して、PKD1の活性若しくはサルコメアZディスクにおけるリン酸化PKD1の局在性が低下してなるか、またはPKCεとPKD1との2分子間距離が増大してなる心筋細胞に投与した被験物質を、心肥大抑制剤として選択する工程。
(5)構成的活性型PKCεが、ヒト由来PKCεにおいてそのアミノ酸配列の156−162領域が欠失してなるものである(4)記載のスクリーニング方法。
(6)構成的活性型PKD1が、ヒト由来PKD1においてそのアミノ酸配列の744位及び748位のセリンがグルタミン酸に置換されてなるもの、ヒト由来PKD1においてそのPHドメインが欠失してなるもの、及びマウス由来PKD1においてそのアミノ酸配列の744位及び748位のセリンがグルタミン酸に置換されてなるものより選択される少なくとも1つである(4)記載のスクリーニング方法。
(7)被験物質の中から、ヒト由来PKD1のSer-744、Ser-748またはSer-916のいずれか少なくとも1つのリン酸化を抑制する作用を有する物質を選別する方法である(3)乃至(6)のいずれかに記載する方法。
(8)下記の工程を含む、心肥大抑制剤をスクリーニングする方法:
(a) (IV)の(1)〜(3)のいずれかに記載するトランスジェニック非ヒト動物に、被験物質を投与する工程、
(b) 上記非ヒト動物について心肥大の程度を測定し、被験物質を投与しない対照のトランスジェニック非ヒト動物の心肥大の程度と対比する工程、及び
(c) 上記(b)の比較結果に基づいて、心肥大を低下または抑制させる被験物質を心肥大抑制剤として選択する工程。
(9)心肥大に起因する心疾患の予防または治療用医薬組成物の有効成分の取得方法である、(1)乃至(8)のいずれかに記載するスクリーニング方法。
(10)心肥大に起因する心疾患が、心不全、虚血性心疾患、または不整脈である(9)に記載するスクリーニング方法。
【0032】
VIII.使用
(1)PKD1の心筋細胞における機能発現を抑制する物質またはENH2をコードする塩基配列を有する核酸の、心肥大抑制用医薬組成物を製造するための使用。
(2)上記PKD1の心筋細胞における機能発現を抑制する物質が、PKD1の心筋細胞における活性化を抑制する物質であるか、または心筋細胞におけるPKD1遺伝子の発現を阻害する物質である、(1)に記載する使用。
(3)PKD1の心筋細胞における機能発現を抑制する物質またはENH2をコードする塩基配列を有する核酸の、心肥大に起因する心疾患の発症を予防また治療するための医薬組成物を製造するための使用。
(4)上記PKD1の心筋細胞における機能発現を抑制する物質が、上記物質が、PKD1の心筋細胞における活性化を抑制する物質であるか、または心筋細胞におけるPKD1遺伝子の発現を阻害する物質である、(3)に記載する使用。
【発明を実施するための最良の形態】
【0033】
I.心肥大抑制用医薬組成物
心肥大は、運動による負荷亢進のほか、高血圧による圧負荷の亢進や弁膜症による容量負荷の亢進などの病的要因、並びにその他原因不明の病的要因によってもたらされる。本発明が対象とする心肥大は、後者、すなわち病的状態により過剰の血行力学的負荷や液性因子などの種々のストレスが加わることによって、生理的肥大の範囲を超えて容積が増大した心筋の病的状態(例えば、代償性肥大や肥大型心筋症など)を意味する。心臓の負荷がどの部分にかかるかによって左室肥大、右室肥大、両室肥大、心房肥大の部位差が生じるが、これらの肥大形態の別を特に問うものではない。また、心臓にかかる過剰な負荷が圧負荷である場合は壁厚が顕著に増大し内腔は不変若しくは狭小する傾向にあり(求心性肥大)、一方、容量負荷である場合には壁厚はあまり増加せずに内腔が拡大する傾向にある(遠心性肥大)が、本発明においても、これらの別も特に問うものではない。敢えていえば、壁厚の増大形態を示す前者の求心性肥大に対して好適に使用することができる。
【0034】
また本発明が対象とする心肥大は、7回膜貫通型受容体(GPCR)を介したGタンパクの活性化、または上皮成長因子受容体(EGF受容体)を介した受容体型チロシンキナーゼの活性化を通じて生じるシグナル伝達を介して生じるものである。なお、7回膜貫通型ヘテロ三量体Gタンパク共役型受容体(GPCR)は、アンジオテンシンII(AngII)、エンドセリン−1、及びノルエピネフリン(NE)などの液性因子による刺激を受けると、直下流のヘテロ三量体Gタンパク質を活性化し、Ca2+/イノシトールターンオーバーを活性化し、心肥大関連転写因子群を作動させて心筋細胞内のタンパク質合成を促し、心肥大が惹起されると考えられている。
【0035】
本発明の心肥大抑制用医薬組成物は、PKD1の心筋細胞における機能発現を抑制する物質を有効成分とするものである。なお、ここで抑制とはPKD1の機能発現を100%抑制(阻止)する場合と、100%阻止しなくてもPKD1が本来有する機能を低減させる場合の両者を含む。かかる物質としては、結果として心筋細胞におけるPKD1の機能の発現を抑制し得るものであればよく、例えば心筋細胞におけるPKD1の発現または産生を抑制する物質、心筋細胞におけるPKD1の活性化シグナルを遮断若しくは抑制する物質、並びに心筋細胞におけるPKD1の活性化(リン酸化を含む)を抑制する物質を挙げることができる。
【0036】
例えば、心筋細胞におけるPKD1の発現または産生を抑制する物質としては、心筋細胞におけるPKD1の発現または産生において、PKD1遺伝子の転写、RNAプロセッシング、輸送、翻訳、及び/又は安定性を抑制する物質を挙げることできる。こうした物質として具体的には、PKD1をコードする遺伝子の塩基配列にハイブリダイズし、その転写、RNAプロセッシング、輸送、翻訳、及び/又は安定性を抑制し得るアンチセンス分子、リボザイム、及びRNAiエフェクターを例示することができる。
【0037】
本発明で用いられるアンチセンス分子は、PKD1遺伝子のプロモーターまたはその他の制御領域、エキソン、イントロンあるいはエキソン−イントロン境界に結合するように設計される。多くの効果的なアンチセンス分子は、イントロン/エキソン・スプライス接合部とハイブリダイズし得るように設計されている。よって、本発明におけるアンチセンス分子も、PKD1遺伝子のイントロン/エキソン・スプライス接合部の50〜200塩基内の領域にハイブリダイズするように、当該領域に対して実質的に相補的な塩基配列を有するものであることが好ましい。
【0038】
リボザイムは、RNA−タンパク質複合体であり、対象の遺伝子(mRNA)に部位特異的に結合してそれを切断することで、タンパク質への翻訳を阻害し、遺伝子機能の発現を抑制する機能を発揮する物質である。本発明で用いられるリボザイムは、PKD1遺伝子(DNA)から転写されたmRNAの任意領域とハイブリダイズするように当該領域に対して実質的に相補的な塩基配列を有し、そして結合した対象のオリゴヌクレオチド領域内のリン酸エステルを切断して、PKD1への翻訳を阻害するように設計される。
【0039】
RNAiエフェクターは、RNAi(RNA干渉)の機能を発揮することによって、PKD1のDNAもしくはmRNAの上流域にハイブリダイズし、PKD1遺伝子の発現を特異的に抑制するものである。RNAiエフェクターとしては、siRNA(small interfering RNA)、stRNA(small temporally regulated RNA)及びshRNA(short hairpin RNA)等を挙げることができる。なお、RNAiエフェクターを利用したRNAi技術並びにその方法は、多比良和誠ら編,「RNAi実験プロトコール」,羊土社発行,2003年等に詳細に記載されており、その内容は援用により本発明の内容に組み込まれる。
【0040】
また、心筋細胞において発現可能なように制御されたドミナント・ネガティブ型PKD1をコードする核酸もまた、心筋細胞におけるPKD1の発現または産生を抑制する物質として理解することができる。例えばPKD1のATP結合部位(例えば、ヒト由来PKD1の場合は612位のLys残基、マウス由来PKD1の場合は618位のLys残基)における変異は、そのキナーゼ機能を優位に抑制することが知られている。ドミナント・ネガティブ型PKD1としては、具体的にはヒト由来PKD1のアミノ酸配列の618位のリジン(Lys-618)をアスパラギンに置換したもの(K618N PKD1)、ヒト由来PKD1の アミノ酸配列612位のリジン(Lys-612)をトリプトファンに置換したもの、ヒト由来PKD1の アミノ酸配列733位のアスパラギン酸(Asp-733)をアラニンに置換したもの、ヒト由来PKD1の アミノ酸配列738位及び742位のセリンをアラニンに置換したもの、マウスPKD1のアミノ酸配列618位のリジン(Lys-618)をメチオニンに置換したもの、及びマウス由来PKD1の アミノ酸配列744位及び748位のセリン(Ser-744、Ser-748)をアラニンに置換したもの等、を例示することができる。
【0041】
かかるドミナント・ネガティブ型PKD1をコードする核酸は、通常、当該核酸の心筋細胞における発現に必要な機能性DNA配列に、作動可能に結合された状態で用いられる。ここで、機能性DNA配列としては、ドミナント・ネガティブ型PKD1をコードする核酸が心筋細胞において発現するために必要な制御領域や調節エレメントなどを意味し、例えばポリアデニル化シグナル、上流配列ドメイン、プロモーター、エンハンサー、またはターミネーター等を例示することができる。
例えば、プロモーターとして具体的には、SV40初期プロモーター、マウス乳腺腫瘍ウイルスLTRプロモーター、アデノウイルス腫瘍後期プロモーター(Ad MLP)、単純ヘルペスプロモーター、CMVプロモーター(例えば、CMV最初期プロモーター、ラウス肉腫(RSV)プロモーター)、ミオシン軽鎖−2プロモーター、α−アクチンプロモーター、トロポニン1プロモーター、Na+/Ca2+交換プロモーター、ジストロフィンプロモーター、クレアチンキナーゼプロモーター、α7インテグリンプロモーター、脳ナトリウム利尿ペプチドプロモーター、αB−クリスタリン/スモール熱ショックタンパク質プロモーター、αミオシン重鎖プロモーター、ANFプロモーターなどを挙げることができる、これらのプロモーターは、心筋細胞において組織特異的に発現し得るものであることがより好ましい。
【0042】
また、ここで「作動可能に結合する」とは、ドミナント・ネガティブ型PKD1をコードする核酸が、上記各種の機能性DNA配列との結合位置及び方向に係わらず、心筋細胞内で発現し得る状態で存在することを意味する。
【0043】
また上記とは別の心肥大抑制機序に基づいて、本発明は、心筋細胞において発現可能なように制御されたENH2をコードする塩基配列を有する核酸を、心筋細胞内での心肥大シグナルカスケードを抑制制御する物質として提供する。当該核酸も、上記と同様に、通常、当該核酸の心筋細胞における発現に必要な機能性DNA配列に、作動可能に結合された状態で用いられる。なお、ENH2をコードする塩基配列は、Nakagawa N らによって既に公知となっており(Nakagawa N, Hoshijima M, Oyasu M, Saito N, Tanizawa K, Kuroda S. ENH, containing PDZ and LIM domains, heart/skeletal muscle-specific protein, associates with cytoskeletal proteins through the PDZ domain. Biochem. Biophys. Res. Commun., 2000 Jun 7, 272(2), p.505-12.)、当該文献の内容は援用により、本発明の内容に組み込まれる。
【0044】
これらの核酸は、被験者、好ましくはヒトを含む哺乳動物への投与に適した形態を備えていることが好ましい。
【0045】
かかる形態としては、遺伝子治療用の発現ベクターを挙げることができる。当該遺伝子治療に用いられる発現ベクターは、所望の投与経路に応じて当業界で公知の方法で処方することができる。また、発現ベクターが標的器官(心臓、心筋細胞)に到達するまで、当該発現ベクターから目的核酸の放出あるいは吸収を防止するための方法も当業界で公知であり、同様に本発明に適用することができる。また、当該発現ベクターは、他のベヒクル(例えば、リポソームのような脂質ベースの分子、凝集タンパク質、またはトランスポーター分子)などと複合体を形成した状態で使用することもできる。これらの発現ベクターは、冠動脈または冠状静脈洞への注入により心筋細胞に送達することができる(冠動脈を通じた冠内送達、冠動脈内送達または動脈内送達と呼ばれる)(例えば、米国特許第5792453号、同第6100242号公報等参照。これらの文献の内容は援用により本発明の内容に組み込まれる。)。
【0046】
発現ベクターには、プラスミドベクターおよびウイルスベクターが含まれる。ウイルスベクターの場合、ドミナント・ネガティブ型PKD1をコードする核酸またはENH2をコードする核酸は、心筋細胞における発現に必要な機能性DNA配列を作動可能に結合した状態で、ウイルス粒子内に封入された状態で使用される。かかるウイルスベクターとしても当業界で公知のものを任意に使用することができ、例えばアデノウイルス、レトロウイルス、アデノ随伴ウイルス、ワクシニアウイルス、ヘルペスウイルス、及びポリオーマウイルス等を挙げることができる。
【0047】
また、上記ウイルスベクターに代えて、粒子形成能を有する物質に心臓組織若しくは心筋細胞を特異的に認識できる生体認識分子が導入されてなる中空ナノ粒子を用いることもできる。当該中空ナノ粒子は、標的とする細胞及び組織に所望の物質を導入するための運搬体として当業界で公知のものである。当該中空ナノ粒子の詳細は、例えば特開2001−316298号公報に記載されており、その内容は本明細書に援用されて本発明の内容に組み込まれる。
【0048】
また心筋細胞におけるPKD1の活性化を抑制する物質としては、具体的には、PKD1の触媒ドメインからCRドメインの解離を抑制する物質、PKD1のリン酸化を抑制する物質(例えば、ヒト由来PKD1のSer-744、Ser-748またはSer-916のいずれか少なくとも一カ所でのリン酸化を抑制する物質)、PKCεとPKD1との複合体形成を抑制する物質、PKD1の基質結合部位に選択的に結合して酵素活性を抑制する物質、PKD1のサルコメアZディスク局在を抑制する物質〔例えば、PKD1のサルコメアZディスクへのリクルーティングを抑制する物質、またはPKD1のサルコメアZディスク上の足場[例えば、ENH1]への結合を抑制する物質などが例示できる〕などを挙げることができる。
【0049】
かかる物質として、具体的には、PKD1またはその任意の部分と免疫反応性である抗体を挙げることができる。抗体は、ポリクローナル抗体またはモノクローナル抗体のいずれであってもよい。好ましくはモノクローナル抗体である。ポリクローナル抗体並びにモノクローナル抗体の調製方法は、当業界で周知であり、本発明の抗体もこれに準じて調製することができる(例えば、Harlow and Lane, Antibodies; A Laboratory manual, Cold Spring Harbor Laboratry, 1988;米国特許第4,196,265号公報等参照、これらの文献の内容は援用により本発明の内容に組み込まれる)。本発明で好適に用いられる抗体としては、具体的には、抗−PKD1抗体(ポリクローナル抗体、モノクローナル抗体の両方を意味する)、PKD1のCRドメインに対する抗体(抗−PKD1/CRドメイン抗体)、PKD1のPHドメインに対する抗体(抗−PKD1/PHドメイン抗体)、PKD1のリン酸化領域に対する抗体〔例えば、ヒト由来PKD1の場合は、(1)Ser-744、Ser-748またはSer-916の少なくとも1カ所を含むPKD1断片(ペプチド)に対する抗体、または (2)リン酸化されてなるSer-744、Ser-748またはSer-916の少なくとも1カ所を含むPKD1断片(ペプチド)に対する抗体〕、PKD1の触媒領域に対する抗体、抗−不活性型PKD1抗体(不活性型PKD1を安定化する)、抗−全活性型PKD1抗体(活性化状態のPKD1に結合して立体障害により酵素活性を抑える)などを挙げることができる。
【0050】
本発明の心肥大抑制用医薬組成物は、有効量の有効成分(PKD1の心筋細胞における機能発現を抑制する物質またはENH2をコードする核酸)とともに、その種類に応じて、自体公知の薬学的に許容される担体や添加剤を含んでいてもよい。当該医薬組成物は、所望の投与方法、例えば経口投与、静脈内投与、筋肉内投与、皮下投与、経肺投与、経鼻投与、経腸投与、腹腔内投与、または冠動脈もしくは冠状静脈洞投与などによって投与することができ、その投与経路に応じて、錠剤、丸剤、散剤、粉末剤、顆粒剤、及びカプセル剤などの固体投与形態;溶液、懸濁剤、乳剤、シロップ、リポソーム製剤、注射剤、静注剤、点滴剤及びエリキシルなどの液剤投与形態;貼付剤、軟膏、クレーム及び噴霧剤などの外用投与形態に、調合、成形乃至調製することができる。
【0051】
これらの医薬組成物(医薬製剤)の調製に利用される担体としては、製剤の投与形態に応じて通常使用される賦形剤、希釈剤、結合剤、付湿剤、崩壊剤、崩壊抑制剤、吸収促進剤、滑沢剤、溶解補助剤、緩衝剤、乳化剤、懸濁剤などが例示できる。また添加剤としては、製剤の投与形態に応じて通常使用される安定化剤、保存剤、緩衝剤、等張化剤、キレート剤、pH調整剤、界面活性剤、着色剤、香料、風味剤、甘味剤などが例示できる。
【0052】
また本発明の心肥大抑制用医薬組成物には、有効成分であるPKD1の心筋細胞における機能発現を抑制する物質またはENH2をコードする核酸に加えて、7回膜貫通型ヘテロ三量体Gタンパク質共役型受容体(GPCR)または上皮成長因子受容体の刺激を介さない心肥大シグナル経路を遮断する物質、例えばサイトカインレセプターブロッカーやLIF阻害剤などといったgp130レセプターを介する心肥大シグナル経路を遮断する物質(gp130レセプター阻害剤)を配合することもできる。
【0053】
上記医薬組成物中に含有されるべき有効成分の量およびその投与量は、特に限定されず、所望の治療効果、投与法、治療期間、患者の年齢、性別その他の条件などに応じて広範囲より適宜選択される。投与量は、投与経路によっても異なるが、通常、1回投与あたりの有効成分の量に換算して、0.1pg〜100mg/kgの範囲で投与することができる。
【0054】
II.心肥大の抑制方法、心肥大発生もしくはその進展の予防方法
本発明の心肥大の抑制方法は、PKD1の心筋細胞における機能発現を抑制する物質またはENH2をコードする核酸を有効量、心肥大またはその前状態にある被験者に投与することによって達成することができる。また、当該方法は、心肥大またはその前状態にある被験者について、心肥大の発生またはその進展を予防する方法としても有効に使用することができる。
【0055】
ここで心筋細胞におけるPKD1の機能発現を抑制する物質またはENH2をコードする核酸としては、I.で述べるものを同様に挙げることができる。これらの物質は、心肥大の抑制に有効な量を、薬学的に許容される担体若しくはその他の添加剤とともに、医薬組成物の形態で使用することができる。これら医薬組成物の形態、投与経路、投与方法並びに当該医薬組成物の投与用量(有効成分の投与量)もまた、前述I.の通りである。
【0056】
投与対象とする被験者としては、ヒト並びにその他の哺乳動物を挙げることができる。かかる哺乳動物としては、具体的にはラット、マウス、ハムスター、モルモット、イヌ、サル、ウシ、ウマ、ヒツジ、ヤギ、ブタなどを制限されることなく例示することができる。
【0057】
III.心肥大に起因する心疾患の予防または治療用医薬組成物
前述するように、Framingham Heart Study等により、心肥大は、心不全を始め、狭心症や心筋梗塞などの虚血性心疾患、不整脈など心血管系疾患を招く危険因子であることが知られている。ゆえに、前述の心筋細胞におけるPKD1の機能発現を抑制する物質並びにENH2をコードする核酸は、心筋細胞内において心肥大を抑制する作用を発揮することに基づいて、同時に心肥大に起因して生じる各種の心疾患の発症を予防しまた治療する薬物として有効に使用することができる。
【0058】
心肥大に起因して生じる心疾患としては、上記するように心不全(鬱血性心不全、急性左心不全、急性肺性心不全、心原性ショック[心筋梗塞発作、徐脈、頻脈発作]などの収縮不全;肥大型心筋症、アミロイドーシス、収縮性心膜炎、心膜タンポナーデ等の拡張不全)、虚血性心疾患(狭心症や心筋梗塞症)、及び不整脈を例示することができる。
【0059】
有効成分として使用される、心筋細胞におけるPKD1の機能発現を抑制する物質及びENH2をコードする核酸としては、I.で述べるものを同様に挙げることができる。
【0060】
これらの物質は、心肥大に起因する心疾の予防または治療に有効な量を、薬学的に許容される担体若しくはその他の添加剤とともに、医薬組成物の形態で使用することができる。なお、必要に応じて、公知の心疾患治療薬を配合することもできる。かかる心疾患治療薬としては、限定されないが、βブロッカー、抗高血圧剤、強心剤、抗血栓剤、血管拡張剤、エンドセリンレセプターブロッカー、カルシウムチャンネルブロッカー、ホスホジエステラーゼ阻害剤、AngIIレセプターブロッカー、サイトカインレセプターブロッカー、gp130レセプター阻害剤などを例示することができる。
【0061】
医薬組成物の投与形態、投与経路、並びに当該医薬組成物の投与(摂取)用量もまた、前述I.の通りである。
【0062】
IV.心肥大に起因する心疾患の予防または治療方法
本発明の心肥大に起因する心疾患の予防または治療方法は、PKD1の心筋細胞における機能発現を抑制する物質またはENH2をコードする核酸を有効量、心肥大に起因する心疾患またはその前状態にある被験者に投与することによって達成することができる。また、当該方法は、心肥大の被験者について心肥大から心疾患への進展を予防する方法としても有効に使用することができる。
【0063】
ここで心筋細胞におけるPKD1の機能発現を抑制する物質及びENH2をコードする核酸としては、I.で述べるものを同様に挙げることができる。当該物質は、心肥大に起因する心疾患の予防または治療に有効な量を、薬学的に許容される担体若しくはその他の添加剤とともに、医薬組成物の形態で使用することができる。これら医薬組成物の投与形態、投与経路、投与方法並びに当該医薬組成物の投与用量(有効成分の投与量)もまた、前述I.の通りである。なお、必要に応じて、公知の心疾患治療薬を併用投与することもできる。かかる心疾患治療薬としては、限定されないが、βブロッカー、抗高血圧剤、強心剤、抗血栓剤、血管拡張剤、エンドセリンレセプターブロッカー、カルシウムチャンネルブロッカー、ホスホジエステラーゼ阻害剤、AngIIレセプターブロッカー、サイトカインレセプターブロッカー、gp130レセプター阻害剤などを例示することができる。
【0064】
心肥大に起因する心疾患の種類としては、III.に記載する心不全、虚血性心疾患、不整脈を同様に挙げることができる。また投与対象とする被験者としても、IIに記載するヒト並びにその他の哺乳動物(ラット、マウス、ハムスター、モルモット、イヌ、サル、ウシ、ウマ、ヒツジ、ヤギ、ブタなど)を同様に挙げることができる。
【0065】
V.心肥大シグナル伝達を遮断する方法
前述する心肥大抑制方法、並びに心肥大に起因する心疾患の予防または治療方法は、心筋細胞におけるPKD1の機能発現を抑制することによって、または心筋細胞内でENH2を強制発現させることによって行われるが、これは心筋細胞におけるPKD1の機能発現を抑制するか、またはENH2を強制発現させることによって、GPCR若しくはEGF受容体を介する心肥大シグナル伝達またはENH1が関与する心肥大シグナル伝達を阻害することに基づくものである。
【0066】
ゆえに本発明は、別の観点から、心筋細胞における心肥大シグナル伝達を遮断または抑制する方法を提供するものである。なお、ここで対象とする心肥大シグナル伝達は、直接的にはGPCRまたはEGF受容体を介した心肥大シグナル伝達である。当該心肥大シグナル伝達の遮断または抑制は、心筋細胞におけるPKD1の機能発現を阻害する物質またはENH2をコードする核酸を被験対象物に有効量投与することによって達成することができる。当該被験対象物は、心筋細胞またはそれを有する組織であればよく、培養心筋細胞、培養心臓組織、または生体内に存在する心筋細胞または心臓組織であってもよい。なお、ここで心筋細胞及び心臓組織の由来は特に問わず、ヒトまたはその他の哺乳動物(ラット、マウス、ハムスター、モルモット、イヌ、サル、ウシ、ウマ、ヒツジ、ヤギ、ブタなど)を広く挙げることができる。被験対象物に投与する、PKD1の機能発現を阻害する物質またはENH2をコードする核酸、並びにその量としては、I.に前述する物質ならびにその量を同様に挙げることができる。
【0067】
また、PKD1の機能発現を阻害する物質またはENH2をコードする核酸と併せて、サイトカインブロッカー等のgp130レセプターを介する心肥大シグナル経路を遮断する物質(gp130レセプター阻害剤)を投与することもできる。こうすることで、GPCRまたはEGF受容体を介さない別経路の心肥大シグナル伝達をも併せて遮断することが可能となる。
【0068】
VI.トランスジェニック非ヒト動物
本発明は、非ヒト動物の神経細胞内でPKD1関連タンパクが発現するように構築されたトランスジェニック非ヒト動物を提供する。
【0069】
なお、ここで非ヒト動物としては、ラット、マウス、ハムスター、モルモット、ウシ、ウマ、サル、イヌ、ヒツジ、ヤギ、ブタ等の哺乳動物を挙げることができる。
【0070】
トランスジェニック非ヒト動物の一態様として、本発明は、心筋細胞において構成的活性型PKD1を強制発現させてなるトランスジェニック非ヒト動物を提供する。当該トランスジェニック非ヒト動物は、心筋細胞中のPKD1が全活性状態(リン酸化)にあることにより心肥大を発症する。このため当該トランスジェニック非ヒト動物は心肥大の病態を模倣したモデル動物(心肥大病態モデル非ヒト動物)として、心肥大の組織学的研究や心疾患への進展メカニズムの解明、ならびにスクリーニング動物として心肥大の抑制剤や心疾患の予防・治療剤の開発に有効に利用することができる。
【0071】
構成的活性型PKD1は、PKD1の特定領域のアミノ酸残基を欠失させるかまたは点変異等によって置換させることによって作成することができる。具体的には、ヒト由来PKD1の場合は、そのアミノ酸配列中、PHドメインを欠失させる方法または744位及び748位のセリンをグルタミン酸に置換する方法を、マウス由来PKD1の場合は、そのアミノ酸配列中、744位及び748位のセリンをグルタミン酸に置換する方法によって作成することができる。
【0072】
心肥大の病態モデル動物は、具体的には、心筋細胞中に、プロモーター等の機能的DNAの制御下で構成的活性型PKD1をコードする遺伝子を発現可能な状態で有し、これにより心筋細胞中で当該構成的活性型PKD1が発現産生してなるトランスジェニック非ヒト動物である。
【0073】
また別の態様として、本発明は心筋細胞におけるPKD1の機能発現がノックアウトされてなるトランスジェニック非ヒト動物を提供する。当該トランスジェニック非ヒト動物は、心筋細胞中のPKD1が不活性状態(非リン酸化)にあることから、GPCRまたはEGF受容体を介した肥大シグナル伝達が遮断されており、当該GPCRを介した刺激によっても心肥大を発症しない。このため当該トランスジェニック非ヒト動物は、GPCRまたはEGF受容体を介した心肥大シグナルカスケードを遮断したモデル動物として、他の心肥大シグナル経路(例えば、gp130レセプターを介する心肥大シグナル経路)を通じた心肥大メカニズムの解明や心疾患への進展の解明等に有効に利用することができる。
【0074】
心筋細胞におけるPKD1の機能発現がノックアウトされてなるトランスジェニック非ヒト動物は、その心筋細胞においてドミナント・ネガティブ型PKD1を発現させることによって作成することができる。ドミナント・ネガティブ型PKD1は、PKD1の特定領域(例えば、ATP結合領域やリン酸化活性ループ)のアミノ酸残基を欠失させるか、または特定部位(例えば、ATP結合部位やリン酸化活性ループ部位)を点変異等によって置換させることによって作成することができる。具体的には、ヒト由来PKD1の場合は、そのアミノ酸配列中、612位をリジンがトリプトファンに置換する方法、618位のリジンをアスパラギンに置換する方法、733位のアスパラギン酸をアラニンに置換する方法、または738位及び742位のセリンをアラニンに置換する方法によって作成することができる。またマウス由来PKD1の場合は、そのアミノ酸配列中、618位のリジンをメチオニンに置換する方法、または744位及び748位のセリンをアラニンに置換する方法によって作成することができる。
【0075】
かかるトランスジェニック非ヒト動物は、具体的には、心筋細胞中に、プロモーター等の機能的DNAの制御下でドミナント・ネガティブ型PKD1をコードする遺伝子を発現可能な状態で有し、これにより心筋細胞中で当該ドミナント・ネガティブ型PKD1が発現産生してなる動物である。
【0076】
これらのトランスジェニック非ヒト動物を産生するための方法は、一般的に、米国特許第4873191号公報、Brister et al., Proc. Natl. Acad. Sci. USA, 82, p.4438-4442 (1985)、特開2003-55266号公報、並びに「Manipulating the maouse Embryo; A Laboratory Manual」第2版(編集、Hogan, Beddington, Costantimi 及びLong, Cold Spring Harbor Laboratory Press, 1994)に記載されており、本発明もこれに準じて行うことができる。なお、これらの文献の内容は、本明細書で援用されることにより本発明の内容に組み込まれる。典型的な方法として、被験動物に導入される所望の遺伝子を、マイクロインジェクションによりその動物の受精卵に移入する方法を例示することができる。マイクロインジェクションされた受精卵は、雌性宿主に移植され、導入遺伝子の発現を指標として子孫の中から所望のトランスジェニック非ヒト動物が選抜取得できる。
【0077】
V.スクリーニング方法
本発明は、心筋細胞におけるPKD1の機能発現を制御することができる物質をスクリーニングする方法を提供する。特に好ましい物質は、心筋細胞におけるPKD1の機能発現を抑制する作用を有するものである。当該物質は、心筋細胞におけるGCPRを介した肥大シグナル伝達を遮断もしくは抑制することによって、心肥大の発症または進展を抑制することができるものと期待できる。さらに当該物質によれば心肥大に起因する心疾患を予防または治療することができると期待される。すなわち、本発明は、心肥大抑制剤または心肥大に起因する心疾患の予防若しくは治療剤の有効成分をスクリーニングする方法を提供する。
【0078】
当該スクリーニング方法は、基本的には心筋細胞においてPKD1の機能発現を抑制する作用を発揮する物質を探索することからなるが、具体的には、下記のスクリーニング方法(1)〜(4)を例示することができる。
(1)下記の工程を含む、心肥大抑制剤の有効成分をスクリーニングする方法:
(a) PKD1を発現し得る細胞に被験物質を接触させる工程、
(b) 上記細胞について、PKD1の発現レベルを測定し、被験物質を接触させない対照の細胞におけるPKD1の発現レベルと対比する工程、及び
(c) 上記(b)の比較結果に基づいて、対照の細胞に比して、PKD1の発現レベルが低下してなる細胞と接触させた被験物質を、心肥大抑制剤の有効成分として選択する工程。
【0079】
かかる工程により、PKD1の発現及び産生を抑制する作用を有する物質を取得することができる。
【0080】
ここで使用される細胞は、内来性及び外来性を問わず、PKD1遺伝子を発現可能な状態で有するものであり、その由来は特に制限されない。好ましくはヒト由来またはヒト以外の哺乳動物由来のPKD1遺伝子を発現可能な状態で有する細胞である。具体的には、ヒトもしくはヒト以外の哺乳動物に由来する心筋細胞または骨格筋細胞を挙げることができ、心臓または骨格筋から単離調製した培養細胞を好適に使用することができる。また細胞の集合体である組織も当該範疇に含まれる。またヒト由来またはヒト以外の哺乳動物に由来するPKD1遺伝子を発現可能な状態で有する原核細胞または真核細胞(昆虫細胞を含む)を用いることもできる。
【0081】
被験物質としては、制限はされないが、核酸、ペプチド、タンパク質、有機化合物、または無機化合物などであり、スクリーニングは、具体的には、これらの被験物質またはこれらを含む組成物(例えば、細胞抽出物、遺伝子ライブラリーの発現産物等を含む)を対象の細胞と接触させることにより行うことができる。また、スクリーニングに際して採用される被験物質と細胞との接触条件は、特に制限されないが、細胞が死滅せず所望の遺伝子を発現できる培養条件を選択することが好ましい(以下のスクリーニング方法においても同じ)。
【0082】
PKD1の発現レベルは、PKD1の遺伝子の塩基配列において連続する少なくとも15塩基を有するポリヌクレオチド及び/またはその相補的なポリヌクレオチドをプライマーまたはプローブとして用いて、ノーザンブロット法、RT−PCR法、in situハイブリダーゼイション解析法、デファレンシャル・ハイブリダーゼーション法、DNAチップ法、RNase保護アッセイなどの公知の方法を行うことにより測定することができる。また、PKD1の発現レベルは、発現産生されたPKD1(タンパク質)の量を測定することによっても評価することができる。この場合は、PKD1を認識する抗体をマーカーとして用いて、ウエスタンブロット法などの公知の方法で、産生されたPKD1を検出し、定量する。
【0083】
かかるスクリーニング方法による心肥大抑制剤または心肥大に起因する心疾患の予防・治療剤の有効成分(候補物質)の選別は、被験物質を接触させた細胞におけるPKD1の発現レベルが、被験物質を接触させない細胞におけるPKD1の発現レベルに比して、低くなることを指標として行うことができる。
【0084】
実施例で示すように、PKD1はGPCRまたはEGFレセプターを介する心肥大のシグナル伝達において中心的な役割を担う成分である。ゆえに上記スクリーニングで選別されるPKD1の発現及び産生を抑制する物質は、当該心肥大のシグナルカスケードを阻止もしくは抑制することができ、ゆえに心肥大抑制剤の有効成分として、また心肥大に起因する心疾患の予防・治療剤の有効成分として使用することが可能である。
【0085】
(2)下記の工程を含む、心肥大抑制剤の有効成分をスクリーニングする方法:
(a) PKD1を発現し得る細胞に、PKD1活性化剤及び被験物質を接触させる工程、
(b) 上記細胞について、PKD1の活性を測定し、被験物質を接触させない対照の細胞における上記に対応する活性と対比する工程、及び
(c) 上記(b)の比較結果に基づいて、対照の細胞に比して、PKD1の活性が低下してなる細胞に投与した被験物質を、心肥大抑制剤の有効成分として選択する工程。
【0086】
かかる工程により、PKD1の発現及び産生を抑制するか、またはPKD1の活性を阻害する物質を取得することができる。
【0087】
ここでPKD1活性化剤とは、PKD1を全活性化(リン酸化)することができるものであればよく、例えば典型的なものとしてTPA(12-O-テトラデカノイルホルボール 13-アセテート)などのホルボールエステル、ジアシルグリセロール(DG)、PKC(例えば、PKCε)を挙げることができる。
【0088】
PKD1の活性測定は、PKD1のリン酸化に基づく活性(例えば、ヒト由来のPKD1の場合、アミノ酸配列のSer-916位のリン酸化に基づく活性)を評価することによって行うことができる。その方法は特に制限されないが、具体的には特定の基質ペプチド(例えば、Syntide-2 [APLARTLSVAGLPGKK])に対するリン酸化能を評価する方法(リン酸化アッセイ)を例示することができる。当該 リン酸化アッセイは、具体的には、実施例において説明する方法に従って行うことができる。
【0089】
かかるスクリーニング方法による心肥大抑制剤または心肥大に起因する心疾患の予防・治療剤の有効成分(候補物質)の選別は、被験物質を接触させた細胞におけるPKD1の活性が、被験物質を接触させない細胞におけるPKD1の活性に比して、低くなることを指標として行うことができる。
【0090】
実施例で示すように、PKD1は心肥大のシグナル伝達における重要な成分であり、PKD1の活性化を介して更に下流のカスケードが起動して心肥大が誘導される。ゆえに上記スクリーニングで選別される物質は、心肥大のシグナリングを阻止もしくは抑制することができ、心肥大抑制剤の有効成分として、また心肥大に起因する心疾患の予防・治療剤の有効成分として使用することが可能である。
【0091】
(3)下記の工程を含む、心肥大抑制剤の有効成分をスクリーニングする方法:
(a) 心筋細胞に、GPCRまたはEGF受容体を刺激する心肥大誘導剤と被験物質を接触させる工程、
(b) 上記心筋細胞について、PKD1の活性、サルコメアZディスクにおけるリン酸化PKD1の局在性、またはPKCεとPKD1との2分子間距離を測定し、心肥大誘導剤だけを接触させた対照の心筋細胞における上記に対応する活性、局在性または2分子間距離と対比する工程、及び
(c) 上記(b)の比較結果に基づいて、対照の心筋細胞に比して、PKD1の活性若しくはサルコメアZディスクにおけるリン酸化PKD1の局在性が低下してなるか、またはPKCεとPKD1との2分子間距離が増大してなる心筋細胞に投与した被験物質を、心肥大抑制剤の有効成分として選択する工程。
【0092】
かかる工程により、作用メカニズムに拘わらず、心筋細胞におけるPKD1の機能発現を抑制する物質を取得することができる。
【0093】
心筋細胞としては、ヒトまたはヒト以外の哺乳動物に由来する心筋細胞を挙げることができる。かかる細胞としては、好適にはヒトまたはヒト以外の哺乳動物から単離され調製された培養細胞を用いることができる。なお、心筋細胞の集合体である組織もまたこの範疇に含まれる。GPCRまたはEGF受容体を刺激する心肥大誘導剤としては、GPCRまたはまたはEGF受容体を介して心肥大を誘導することが知られている物質を制限なく挙げることができる。例えば、かかる物質として、典型的には、前者としてAngII、エンドセリン−1及びNEが、また後者として上皮成長因子(EGF)が知られている。
【0094】
当該スクリーニング方法では、心筋細胞におけるPKD1活性、サルコメアZディスクにおけるリン酸化PKD1の局在性、またはPKCεとPKD1との2分子間距離の少なくとも1つを指標として、所望の物質が選択される。
【0095】
PKD1活性の測定方法としては、上記(2)に記載する方法を用いることができる。
【0096】
また、サルコメアZディスクにおけるリン酸化PKD1の局在性は、リン酸化PKD1(全活性型PKD1)を特異的に標識し検出できる試薬を用いて心筋細胞を染色し、次いでその試薬に応じた検出方法を用いてリン酸化PKD1の心筋細胞内における挙動を観察することによって調べることができる。リン酸化PKD1を特異的に標識し検出できる試薬としては、リン酸化PKD1を特異的に認識してそれと結合する抗体を挙げることができ、具体的には、ヒト由来のPKD1の場合は、実施例で使用する、ヒト由来PKD1のアミノ酸配列912-918を有するペプチド〔但し、Ser-916位がリン酸化されている〕に対する抗体(抗−全活性型PKD1抗体)を例示することができる。好適には、α−アクチニンのサルコメアに対する特異的抗体、上記リン酸化PKD1(全活性型PKD1)に対する抗体並びに蛍光若しくは化学発光試薬を用いて心筋細胞を処理し、得られた細胞の蛍光像または化学発光像を差異解析する方法を挙げることができる。より具体的な測定方法を実施例に記載する。
【0097】
細胞内におけるPKCεとPKD1の2分子間距離は、蛍光蛋白質を利用したFRET(蛍光エネルギー移動)を解析することによって求めることができる。具体的には、当該方法は例えば浜松ホトニクス社製(日本)の3CCD-FRETイメージングシステム(AQUACOSMOS/ASHURA)を用いて行うことができ、かかる方法によれば異なる蛋白質(PKCεとPKD1)の相互作用を定量的にモニタリングすることができる。
【0098】
かかるスクリーニング方法による心肥大抑制剤または心肥大に起因する心疾患の予防・治療剤の有効成分(候補物質)の選別は、心肥大誘導剤と被験物質とを接触させた心筋細胞におけるPKD1活性が、心肥大誘導剤だけを接触させた(すなわち被験物質は接触させない)対照の心筋細胞におけるPKD1活性に比して低くなること;または心肥大誘導剤と被験物質とを接触させた心筋細胞におけるリン酸化PKD1のサルコメアZディスクへの局在性が、心肥大誘導剤だけを接触させた対照の心筋細胞におけるリン酸化PKD1のサルコメアZディスクへの局在性に比して低下すること;または心肥大誘導剤と被験物質とを接触させた心筋細胞におけるPKCεとPKD1の2分子間距離が、心肥大誘導剤だけを接触させた対照の心筋細胞におけるPKCεとPKD1の2分子間距離に比して大きくなること、を指標として行うことができる。
【0099】
実施例で示すように、PKD1は心肥大のシグナル伝達を担う重要な成分であり、PKD1の活性化を介して更に下流のカスケードが起動して心肥大が誘導される。また、PKD1は活性化されるとサルコメアZディスクに移行してそこに局在する。さらに、PKCεはPKD1の直接のアクチベーターであり、心肥大シグナリングに際してPKCεとPKD1とは互いに複合体を形成している。ゆえに上記スクリーニングで選別される物質は、心肥大のシグナリングを阻止もしくは抑制する作用を有するものであり、心肥大抑制剤の有効成分として、また心肥大に起因する心疾患の予防・治療剤の有効成分として使用することが可能である。
【0100】
(4)下記の工程を含む、心肥大抑制剤の有効成分をスクリーニングする方法:
(a) 構成的活性型PKCεまたは構成的活性型PKD1を発現し得る心筋細胞に、被験物質を接触させる工程、
(b) 上記心筋細胞について、PKD1の活性、サルコメアZディスクにおけるリン酸化PKD1(全活性型PKD1)の局在性、またはPKCεとPKD1との2分子間距離を測定し、被験物質を接触させない対照の心筋細胞における上記に対応する活性、局在性または2分子間距離と対比する工程、及び
(c) 上記(b)の比較結果に基づいて、対照の心筋細胞に比して、PKD1の活性若しくはサルコメアZディスクにおけるリン酸化PKD1の局在性が低下してなるか、またはPKCεとPKD1との2分子間距離が増大してなる心筋細胞に投与した被験物質を、心肥大抑制剤の有効成分として選択する工程。
【0101】
かかる工程により、心筋細胞におけるPKD1の活性化を抑制する物質を取得することができる。
【0102】
ここで心筋細胞は、構成的活性型PKCεまたは構成的活性型PKD1を発現し得るように調製されたものが使用される。構成的活性型PKD1を発現する心筋細胞は、心肥大誘導剤による刺激を要することなく全活性状態(リン酸化)のPKD1を発現している。また構成的活性型PKCεを発現する心筋細胞は、PKCεの活性により、心肥大誘導剤による刺激を要することなくPKD1を全活性化(リン酸化)させることができる。
【0103】
構成的活性型PKCεは、PKCεのN末端の偽基質領域が欠失するか、または特定のアミノ酸残基が点変異によって置換してなるものであって(Schonwasser, D.C., et al., Mol. Cell. Biol. 18, p.790-798, 1998)、ヒト由来PKCεの場合、具体的にはヒト由来PKCεのアミノ酸配列中、156−162領域を欠失してなるタンパク質を例示することができる。
【0104】
構成的活性型PKD1は、PKD1の特定領域のアミノ酸残基が欠失または点変異等によって置換してなるものであって、ヒト由来PKD1の場合、具体的にはそのアミノ酸配列中、PHドメインが欠失してなるもの、または744位及び748位のセリンがグルタミン酸に置換されてなるものを例示することができる。またマウス由来PKD1の場合は、そのアミノ酸配列中、744位及び748位のセリンがグルタミン酸に置換されてなるものを例示することができる。
【0105】
当該構成的活性型PKCεまたは構成的活性型PKD1を発現し得る心筋細胞は、これらのタンパク質をコードする遺伝子を、通常の遺伝子組み換え技術に従って、ヒトまたはその他の哺乳動物に由来する心筋細胞(培養細胞)に導入することによって作成することができる。
【0106】
かかるスクリーニング方法による心肥大抑制剤または心肥大に起因する心疾患の予防・治療剤の有効成分(候補物質)の選別は、被験物質とを接触させた心筋細胞におけるPKD1活性が、被験物質を接触させない対照の心筋細胞におけるPKD1活性に比して低くなること;または被験物質とを接触させた心筋細胞におけるPKD1のサルコメアZディスクへの局在性が、被験物質を接触させない対照の心筋細胞におけるPKD1のサルコメアZディスクへの局在性に比して低下すること;または被験物質とを接触させた心筋細胞におけるPKCεとPKD1の2分子間距離が、被験物質を接触させない対照の心筋細胞におけるPKCεとPKD1の2分子間距離に比して大きくなること、を指標として行うことができる。
【0107】
上記スクリーニングで選別される物質は、心肥大のシグナリングを阻止もしくは抑制する作用を有するものであり、心肥大抑制剤の有効成分として、また心肥大に起因する心疾患の予防・治療剤の有効成分として使用することが可能である。
【0108】
上記のスクリーニング方法によって選別された候補物質は、さらに心肥大を有する心肥大病態モデル非ヒト動物を用いてスクリーニングをかけることもできる。
【0109】
かかる心肥大病態モデル非ヒト動物としては、前述する構成的活性型PKD1を強制発現してなる本発明のトランスジェニック非ヒト動物を例示することができる。かかる心肥大病態モデル非ヒト動物を用いたスクリーニングは下記の工程を経て実施することができる:
(a) 構成的活性型PKD1を強制発現してなるトランスジェニック非ヒト動物(心肥大病態モデル非ヒト動物)に、被験物質を投与する工程、
(b) 上記非ヒト動物について心肥大の程度を測定し、被験物質を投与しない対照のトランスジェニック非ヒト動物の心肥大の程度と対比する工程、及び
(c) 上記(b)の比較結果に基づいて、心肥大を低下または抑制させる被験物質を心肥大抑制剤として選択する工程。
【0110】
なお、心肥大の程度は、心臓の組織学的評価、臨床学的評価(心エコー図、ドプラー超音波検査、冠動脈造影、胸部レントゲン撮影、心電図など)、または心筋細胞における心肥大マーカーであるANPの発現レベルから評価することができる。
【0111】
かくして選別される候補物質は、さらに心肥大病態非ヒト動物を用いた薬効試験、安全性試験、さらに心肥大を有する患者(ヒト)もしくはその前状態にある患者(ヒト)への臨床試験に供してもよく、これらの試験を実施することによって、より実用的な心肥大抑制用組成物または心肥大に起因する心疾患の予防または治療剤の有効成分を選別取得することができる。
【0112】
このようにして選別された物質は、必要に応じて構造解析を行った後、その物質の種類に応じて、化学的合成、生物学的合成(発酵を含む)または遺伝子学的操作によって、工業的に製造することができ、心肥大抑制用医薬組成物または心疾患予防または治療用医薬組成物の調製に使用することができる。
【実施例】
【0113】
以下、本発明を実施例によって更に詳細に説明するが、下記実施例は本発明を何ら限定するものではない。なお、本発明で用いられる遺伝子工学的技術並びに分子生物学的実験操作は、一般に広く用いられている方法、例えばJ.,Sambrook, E., F., Frisch,T.,Maniatis著、モレキュラークローニング第2版(Molecular Cloning 2nd edition)、コールド・スプリング・ハーバーラボラトリー(Cold Spring Harbor Laboratory press)発行、1989年、及びD.,M.,Glover著、DNAクローニング、IRL発行、1985年などに記載されている方法に従って行うことができる。
【0114】
(1)略称
下記の実施例において使用する略称は、特に言及しない限り、次の用語を意味するものとする。
AngII: アンジオテンシンII
ANF: 心房性ナトリウム利尿因子
BrDU: 5-ブロモ-2’-デオキシウリジン
BSA: ウシ血清アルブミン
CA: 構成的活性型
DN: ドミナント・ネガティブ型
FBS: ウシ胎児血清
GFP: 緑色蛍光タンパク質
G protein: グアニンヌクレオチド結合タンパク
GPCR: 7回膜貫通型ヘテロ三量体Gタンパク質共役型受容体
KD:kinase dead
LIF: 白血病阻害因子
NE: ノルエピネフリン
ET1: エンドセリン1
EGF: 上皮成長因子
bFDF: 塩基性繊維芽細胞成長因子
NRC: ラット新生仔由来心筋細胞
PBS: リン酸緩衝生理食塩水
PKC: プロテインキナーゼC
PKD: プロテインキナーゼD
PLC: ホスホリパーゼC
TPA:12-O-テトラデカノイルホルボール 13-アセテート
DMEM: Dulbecco'smodified Eagle's Medium
(2)実験材料
下記の実施例において使用する主な材料は下記の通りである。
(1) Lysis 緩衝液A: 50mM Tris(pH7.4)、150mM NaCl、1.3% Triton X-100、 1mM EDTA、1mM dithiothreitol、50mM NaF、1mM Na3VO4、及びプロテアーゼ・インヒビター・カクテル錠(ロッシュ)1錠(50ml当たり)
(2) 抗体:
1)抗-PKD1/2モノクローナル抗体(LCラボラトリーズ社製)(PKD1及びPKD2の両方に反応性を有する)、
2)抗-サルコメリック-α-アクチニン・モノクローナル抗体(clone EA-53:SIGMA製)、
3)抗-H3ヒストンマウス・モノクローナル抗体(05-499:Up State Biotechnology製)
4)抗-全活性型PKD1ポリクローナル抗体:ヒト由来PKD1のC末領域(Ser-916)がリン酸化されたペプチド(ヒト由来PKD1の912-918アミノ酸領域:SERVpSIL)で免疫化したウサギの血清から調製した
5)抗-不活性型PKD1ポリクローナル抗体:ヒト由来PKD1のC末領域のペプチド(ヒト由来PKD1の904-918アミノ酸領域:EEREMKALSERVSIL)で免疫化したウサギの血清から調製した。
【0115】
なお、ヒト由来PKD1は、最初にホスホイノシチド依存性キナーゼ1(phosphoinositide-dependent kinase 1)(PDK1)により活性ループ部位(Ser-744、Ser-748)がリン酸化され、触媒的に活性となる。それからC末領域(Ser-916)が自己リン酸化され、分子全体が活性型(本明細書では、これを「全活性型」という)となる。従って、Ser-916部位におけるリン酸化は、in vivoにおいてPKD1が活性化(全活性型PKD1)されているか否かの最適な指標となる(Matthews S.A., et al., J. Biol. Chem.274, p.26543-26549)。
【0116】
ゆえに、以下の実験において使用される、リン酸化されたSer-916部位に対する抗体〔具体的にはリン酸化されたSer-916部位を有するPKD1断片(ペプチド)に対する抗体:4)抗-全活性型PKD1ポリクローナル抗体〕は、心筋細胞に存在する全活性型PKD1を特異的に検出するための有効な抗体である。
【0117】
(3) pTB701-HAベクター
NH2末端にHAエピトープを付けた融合タンパクを哺乳細胞内で発現するためのベクターである。発現ベクターpTB701のSV40初期プロモーターの下流に、HAエピトープをコードする塩基配列が挿入されている。
【0118】
(4) 構成的活性型PKC変異体(CA-PKC)
NH2末端の偽基質領域が欠損しているか、または点変異(ポイントミューテーション)していることによって、全活性化状態を示しているものである。Prof. Parkerから入手した(Schonwasser, D.C., et al., Mol. Cell. Biol. 18, p.790-798, 1998)。
【0119】
1)CA-PKCβI:ヒト由来PKCβIのアミノ酸の22-28領域が欠損したもの
2)CA-PKCδ:ヒト由来PKCδのアミノ酸の147位のAlaがGluに置換したもの
−これらはいずれもpCO2ベクターを用いて発現させた。
【0120】
3) CA-PKCε:ヒト由来PKCεのアミノ酸の156-162領域が欠損したもの
−これはpMT2ベクターを用いて発現させた。
【0121】
(5)ドミナント・ネガティブ型PKC変異体 (DN-PKCs)
ATP結合部位のLysをMetに点変異(ポイントミューテーション)することによって、不活性化状態を示しているものである(Kuroda, S., et al., J. Biol. Chem. 271, p.31029-31032, 1996; Kuroda, S., et al., J. Cell Biol. 144,p.403-411, 1999)。
【0122】
1)PKCβI-HAのドミナント・ネガティブ型変異体(K371M PKCβI-HA)
site-directed mutagenesisによって、ラット由来PKCβI の371位のATP結合に必須なLysをMetに置換することによって調製した。
【0123】
2)PKCζ-HAのドミナント・ネガティブ型変異体(K281M PKCζ-HA):
site-directed mutagenesisによって、ラット由来PKCζの281位のATP結合に必須なLysをMetに置換することによって調製した。
【0124】
3)PKCε-HAのドミナント・ネガティブ型変異体(K440M PKCε-HA):
site-directed mutagenesisによって、ラット由来PKCεの440位のATP結合に必須なLysをMetに置換することによって調製した。
【0125】
(6) 構成的活性型PKD1(CA-PKD1)
ヒト由来PKD1のアミノ酸744位及び748位のSerをGluにそれぞれ置換して調製したものであり、この変異に基づいて全活性化状態を示している(S744E/S748E PKD1)(pEGFPC1-PKD-CA)。
【0126】
(7) ドミナント・ネガティブ型PKD1(DN-PKD1)
ヒト由来PKD1のアミノ酸618位のLysをAsnに置換して調製したものであり、この変異に基づいて不活性化状態を示している(SK618N PKD1)(pEGFPC1-PKD-DN)
実施例1 ラット新生仔由来心筋細胞中でのPKD1の発現とその局在
ウエスタンブロット法を用いて、ラット新生仔由来心筋細胞(NRC)内におけるPKD1とPKD2の発現状況、並びにその細胞内における局在(分布)を調べた。なお、PKD2はPKD1と異なる遺伝子産物である(Sturany, S., et al., J. Biol. Chem. 276, p.3310-3318, 2001)。さらに、NRCをTPAで処理して、該処理細胞について同様にPKD1とPKD2の発現並びに細胞内の局在を調べた。
【0127】
なお、TPAはPKC及びPKDのアクチベーターとして知られているホルボールエステルの一種である(Kikkawa U, et al., Adv Cyclic Nucleotide Protein Phosphorylation Res.,17, p.437-42, 1984; Valverde AM, et al., Proc Natl Acad Sci U S A, 30, 91(18), p.8572-6, 1994)。
【0128】
TPAは、また心肥大をも誘導するが(Kinnunen P, et al., Br J Pharmacol., 102 (2), p.453-61, 1991)、その心肥大誘導はあくまでもPKCの活性化によるものであり、その誘導にPKDが介在することは全く知られていなかった。
【0129】
(1)NRCの単離及び初代培養
生後一ヶ月未満のラット新生仔から取り出した心臓を、Goshima(1977)らの方法(Goshima K. et al., J Mol Cell Cardiol., 1977 Jan, 9(1), p.7-23)に準じて培養した。
【0130】
具体的には、ラット新生仔30匹から心臓を取り出し、リン酸緩衝生理食塩水(PBS、Mg2+及びCa2+を含まない)で血液を洗い流した後、血管を除去して4分割し、さらにPBSで洗浄した。次いでその心臓組織0.3gを、0.1w/v%コラゲナーゼ・タイプI(和光純薬工業)水溶液10ml中で37℃、10〜15分間、処理して、心筋細胞を分離・分散させた。このコラゲナーゼ処理を、新しいコラゲナーゼ水溶液に取り替えてさらに2回繰り返した。処理液を遠心分離することによって回収した心筋細胞(分散細胞)を10mlの培地(DMEM+10% FBS)に懸濁し、これを滅菌済みのキムワイプをセットした滅菌フィルターユニット(Millipore製)でろ過して細胞を単離した。得られた心筋細胞を組織培養皿(Falcon製)に移して、50分間、37℃、CO2濃度5%の条件下で培養し、細胞接着力の違いを利用して心筋細胞中に共存する繊維芽細胞をコラーゲン塗布した培養皿基底面に接着させて除去した(a differential adhesion technique)。上清中に存在する心筋細胞をラット新生仔由来心筋細胞(NRC)として使用した。
【0131】
なお、取得したNRCは、0.45%グルコース、10%(v/v)ウシ胎児血清(FBS)、2mM L-グルタミン、100 units/mlペニシリン、100μg/mlストレプトマイシン及び20μM 5-ブロモ-2’-デオキシウリジン(BrDU:sigma)を配合したDMEM中に保存した。
【0132】
(2)TPA処理、及び細胞分画
上記で調製したNRCを、無血清DMEM(ナカライテスク社製)に移し、一晩培養した(CO2濃度5%、37℃)。その後、培地にTPAを終濃度100nMとなるように添加して20分間インキュべーションした。次いで、心筋細胞を回収してPBSで洗浄し、Lysis 緩衝液(Triton X-100が0.1%である以外は、Lysis 緩衝液Aと同じ組成を有する)で処理して細胞を溶菌し、遠心分離(15000rpm、約10分間)にかけて、上清(細胞質画分)と沈殿物とに分画した。沈殿物はさらにLysis 緩衝液Aに溶解した。これを軽く遠心分離し、得られた上清を細胞膜画分として取得した。なお、コントロールとして、TPAで処理しないNRCについても、上記と同様に溶菌処理して、細胞質画分と細胞膜画分とに分画した(未処理物)。
【0133】
(3)ウエスタンブロット法
上記で調製したTPA処理物(細胞質画分と細胞膜画分)及び未処理物(細胞質画分と細胞膜画分)を、それぞれ1レーンに添加するタンパク量が同じになるように10% SDS-ポリアクリルアミドゲル電気泳動(SDS-PAGE)にかけた。泳動後、ポリビニリデン・ジフルオリド(PVDF)膜(Immobilon-P, Millipore製)に転写した。次いで、抗体として、(1)抗-PKD1/2モノクローナル抗体(LCラボラトリーズ社製) 、(2)抗-全活性型PKD1ポリクローナル抗体、(3)抗-不活性型PKD1ポリクローナル抗体、(4)抗-サルコメリック-α-アクチニン・モノクローナル抗体(clone EA-53:SIGMA製)、及び(5)抗-H3ヒストンマウス・モノクローナル抗体(05-499:Up State Biotechnology製)を用いてウエスタンブロッティングを行い、各試料〔TPA処理物(細胞質画分と細胞膜画分)及び未処理物(細胞質画分と細胞膜画分)〕中に含まれるPKD1,PKD2,全活性型PKD1、不活性型PKD1、α-アクチニン、及びヒストンH3をそれぞれ染色した。
【0134】
次いで、第2抗体試薬としてホースラディシュ由来パーオキシダーゼを結合した抗マウスまたはウサギIgG(Amasham pharmacia製)を使用し、化学発光によりブロッティング結果がX線フィルム上で観察できるようにした。
【0135】
(4)結果
結果を図2に示す。各試料〔細胞質画分(Cytoplasm):未処理物(None)とTPA処理物(TPA)、及び細胞膜画分(Membrane):未処理物(None)とTPA処理物(TPA)〕のいずれもほぼ同量のα-アクチニンとヒストンH3が検出された。このことは各レーンに、心筋細胞由来タンパク質量がほぼ均一に存在することを意味する。
【0136】
図2の結果から、心筋細胞にはPKD2は存在せず、PKD1のみ存在することが判明した(なお、本発明者等は既に同様な方法で心筋細胞にはPKD3も存在しないことを確認している。)。全活性型PKD1は、PKD又はPKC活性剤であるTPAで処理した心筋細胞の細胞膜画分に大量に存在しており、TPA処理NRCの細胞質画分にも、またTPA未処理のNRCのいずれも画分にも殆ど発現していなかった(図2の上から2段め参照)。このことは、心筋細胞をTPA処理することによって心筋細胞中のPKD1のSer-916位がリン酸化されて全活性型になること、そして全活性型になったPKD1は、構造が変化することによって膜(あるいは膜画分のタンパク質)への親和性が高まり細胞質から細胞膜へと移動すること(細胞膜への局在化)を示している。
【0137】
実施例2 全活性型PKD1の心筋細胞内での挙動
実施例1(1)に記載する方法と同様な方法で調製したNRCを、ポリ-L-リジンでコーティングしたガラス製の培養皿(35mm径)に移し、無血清DMEM(ナカライテスク社製)中で一晩培養した(CO2濃度5%、37℃)。これに終濃度が20nMとなるようにTPAを添加して、更に18時間(CO2濃度5%、37℃)培養した(約1×103細胞)。培養後、得られた細胞をPBSで2回洗浄し、4w/v%パラホルムアルデヒドで、室温下30分間処理して固定化し、更に0.25v/v%のTriton X-100を含むPBS中で4℃、30分間、浸透処理し、次いでブロッキング緩衝液(3w/v% BSA、2v/v% FBS, 1v/v% 正常ヤギ血清及び0.03v/v% Triton X-100を含むPBS)中でインキュべーションした。
【0138】
更に、得られた細胞を、抗体(抗-全活性型PKD1ポリクローナル抗体、抗-不活性型PKD1ポリクローナル抗体、及び抗-サルコメリック-α-アクチニン・モノクローナル抗体)を含むブロッキング緩衝液中で、4℃で16時間インキュべーションした。これをPBSで2回洗浄し、次いで0.3v/v% Cy3-標識・抗−マウスIgG抗体、及び0.3v/v% Cy2-標識・抗−ウサギIgG抗体(第2抗体)(いずれもAmersham-pharmacia製)を配合したPBS中に移して、室温で1時間インキュべーションした。細胞の蛍光シグナルを共焦点レーザー顕微鏡LSM5 Pascal(Carl Zeiss)で観察した。
【0139】
結果を図3Aに示す。 なお、対照としてTPA処理しない未処理NRC(None)を同様に抗体標識して、細胞の蛍光シグナルを共焦点レーザー顕微鏡LSM5 Pascalで観察した結果を図3Bに示す。
【0140】
心筋細胞中のα-アクチニンは、抗−サルコメリック-α-アクチニン・モノクローナル抗体及び第2抗体(蛍光色素標識抗体)と結合して、赤色の蛍光シグナル画像として観察される(図3Aの左欄、赤のシグナルが心筋細胞のα-アクチニンを示す)。図3Aと図3Bとの対比からわかるように、TPA処理した心筋細胞は、サルコメア構造が形成されており(Zディスクの可視化)、心肥大が誘導されていることが認められた。
【0141】
図3Aの中欄の上段は、心筋細胞を抗−不活性型PKD1ポリクローナル抗体及び第2抗体(蛍光色素標識抗体)、下段は心筋細胞を抗−全活性型PKD1ポリクローナル抗体及び第2抗体(蛍光色素標識抗体)で、それぞれ処理して得られた画像である。すなわち、中欄の上段は不活性型PKD1の細胞内局在を、また下段は全活性型PKD1の細胞内局在をそれぞれ示している。この結果から、不活性型PKD1は心筋細胞の核周辺に留まっているのに対し、全活性型PKD1は、α−アクチニンと同じ画像を示すことから(図3A左欄下段の画像と対比)、心筋細胞のサルコメア(sarcomere)構造のZディスク周囲に集中していることがわかる。なお、図3Aの右欄の画像は、左欄の画像と中欄の画像を重ね合わせたもので、黄色(赤×緑)を呈するほど両者の画像が一致していることを示す。
【0142】
これらの結果から、心筋細胞をTPA処理することによって、心肥大が誘導されること、PKD1が全活性状態になること、並びに当該全活性型PKD1がサルコメアのZディスク領域に移動することがわかった。通常、サルコメアのZディスクに存在するタンパク質が心肥大に関係していると考えられることから、以上の結果はPKD1が心肥大のシグナル伝達に関連していることを示唆するものである。
【0143】
実施例3 心肥大誘導による全活性型PKD1の心筋細胞内での挙動
NE(ノルエピネフリン)、AngII(アンジオテンシンII)及びLIF(白血病阻害因子)は心肥大を引き起こす物質として良く知られている(Fischer JE, et al., Nature. 207, p.951-953, 1965: Sanchez Torres G, et al., Arch Inst Cardiol Mex., 48(3), p.549-561, 1978: Matsui H, et al., Res. Commun. Mol. Pathol. Pharmacol. 93, p.149-162, 1996)。また、上記心肥大誘導剤のうち、NE及びAngIIはPKCを活性化し、特にPKCのサブユニットであるPKCεはAngIIによって活性化されてZディスクに移動することも知られている(Disatnik MH, et al., Exp Cell Res. 1994 Feb, 210(2), p.287-97)。さらに、NEによって、心筋細胞中のPKD1の発現と活性が制御されることが知られている(Fischer JE, et al., Nature, 1965 Aug 28, 207, p.951-953: Haworth, R.S., et al., J. Mol. Cell. Cardiol. 2000, 32, p.1013-1023)。
【0144】
我々は、NRCを各種の心肥大誘導剤(NE,AngII、LIF)で処理し、該心筋細胞における全活性型PKD1の分布(局在)を、実施例2と同様の方法によって調べた。なお、NEはα-アドレナリン様受容体に作用する心肥大誘導剤であり、下記の実験ではプロプラノールを配合してβ-アドレナリン作動性受容体活性をブロックして用いた。
【0145】
具体的には、実施例1(1)に記載する方法と同様な方法で調製したNRCを、ポリ-L-リジンでコーティングしたガラス製の培養皿(35mm径)に移し、無血清DMEM(ナカライテスク社製)中で一晩培養した(CO2濃度5%、37℃)。かかる培養細胞を5試料用意して、(1)100μM(終濃度、以下同じ)のNE(プロプラノールを2μM配合)、(2)100μMのAngII、(3)20nMのLIF、(4)100μMのNE(プロプラノールを2μM配合)+400nMのGF109203X(具体的には、GF109203Xを添加し30分間処理した後に、NEを添加)、(5)20nMのLIF+400nMのGF109203X(具体的には、GF109203Xを添加し30分間処理した後に、LIFを添加)をそれぞれに添加して、更に38時間(CO2濃度5%、37℃)培養した(約1×103細胞)。なお、ここでGF109203Xは、PKDに作用しない選択的なPKC阻害剤である(Zugaza J.L., et al., The EMBO J. 1996, 15, p.6220-6230)。
【0146】
培養後、細胞をPBSで2回洗浄し、4w/v%パラホルムアルデヒドで、室温下30分間処理して固定化し、更に0.25v/v%のTriton X-100を含むPBS中で4℃で30分間、浸透処理し、次いでブロッキング緩衝液(3w/v% BSA、2v/v% FBS, 1v/v% 正常ヤギ血清及び0.03v/v% Triton X-100を含むPBS)中でインキュべーションした。得られた細胞を、抗体(抗-全活性型PKD1ポリクローナル抗体、抗-不活性型PKD1ポリクローナル抗体、及び抗-サルコメリック-α-アクチニン・モノクローナル抗体)を含むブロッキング緩衝液中で、4℃で16時間インキュべーションした。これをPBSで2回洗浄し、次いで0.3v/v% Cy3-標識・抗−マウスIgG抗体、及び0.3v/v% Cy2-標識・抗−ウサギIgG抗体(第2抗体)(いずれもAmersham-pharmacia製)を配合したPBSに移して、室温で1時間インキュべーションした。細胞の蛍光シグナルを共焦点レーザー顕微鏡LSM5 Pascal(Carl Zeiss)で観察した。
【0147】
(1)NE処理、(2)AngII処理、(3)LIF処理、(4)NE+GF109203X処理、及び(5)LIF+GF109203X処理した細胞について得られた結果を、それぞれ図4、5,6,7A及び7Bに示す。
【0148】
図4及び5の結果からわかるように、心肥大誘導剤である(1)NEまたは(2)AngIIで心筋細胞を処理すると、いずれの細胞もサルコメア構造が形成され(Zディスクの可視化)、心肥大化が誘導されていた。また、いずれもPKD1が全活性化(リン酸化)され、心筋細胞のサルコメアのZディスク周囲に移動することが観察された。しかし、いずれの場合も不活性型PKD1は心筋細胞の核周辺に留まっていた。
【0149】
一方、図6で示すように、NE及びAngIIと同じく心肥大を誘導する試薬である(3)LIFで心筋細胞を処理した場合には、サルコメア構造が形成され(Zディスクの可視化)、心肥大化が誘導されたにも関わらず、PKD1の全活性化(リン酸化)もサルコメアZディスクへの移動も観察されなかった。また、図7Aからわかるように、予め心筋細胞をGF109203Xで処理してPKCの活性化を阻害しておくと、心肥大誘導剤(NE)で処理しても心肥大化は生じず、またPKD1の全活性化(リン酸化)並びにそのサルコメアZディスクへの移行も見られなかった。
【0150】
また、ここには示していないが、心肥大化作用を有することが知られているエンドセリン1(ET1)や上皮成長因子(EGF)を作用させた心筋細胞でも、図4及び5で示すNE及びAngIIと同じ観察結果が得られた。一方、心肥大化作用を有することが知られている塩基性繊維芽細胞成長因子(bFGF)を作用させた心筋細胞では、図6で示すLIFと同じ観察結果が得られた。
【0151】
以上の結果から、(a) 心肥大を発生するシグナル伝達経路には、NE、AngII、ET1、及びEGFによって誘導される心肥大シグナル伝達経路と、LIFやbFGFによって誘導される心肥大シグナル伝達経路等の複数の経路があり、PKD1は、そのうち前者によって誘導される心肥大シグナル伝達に関わる一成分であること、(b)当該心肥大シグナル伝達においてPKD1は全活性化(リン酸化)され、心筋細胞のサルコメアのZディスク領域に移行すること、(c)さらに当該心肥大シグナル伝達経路におけるPKD1の全活性化(リン酸化)及びそのZディスクへの移行は、PKCの活性化を介して生じるものであることがわかる。
【0152】
NE、AngII、ET1によって誘導される心肥大は、いずれも7回膜貫通型受容体を介したGタンパク質の活性化を通じて生じると考えられているのに対し、LIFによる心肥大の発生機構はgp130受容体を介するものである。特に、LIF処理ではPKD1が活性化しなかったことを示す上記の結果は、PKD1は7回膜貫通型ヘテロ三量体Gタンパク質共役型受容体(GCPR)シグナル伝達経路を介した心肥大シグナル伝達経路の一成分であって、この経路を介した心肥大発生メカニズムに深く関わっていることを示唆するものである。また、EGFによる心肥大化機構は、GPCRを全く介さない受容体型チロシンキナーゼによるものであるので、PKD1はGPCR経路以外にもEGF受容体下流にも位置することが示唆された。
【0153】
実施例4 PKD1の全活性化(リン酸化)の制御
PKD1の活性は、その選択的基質であるSyntide-2(APLARTLSVAGLPGKK)に対するリン酸化能力を指標として評価することができる(Valverde, A.M., et al., Proc. Natl. Acad. Sci. U S A. 91, 1994, p.8572-8576)。そこで、心肥大を誘導した心筋細胞に内在するPKD1のリン酸化活性を、当該Syntide-2に対するリン酸化能力に基づいて評価した。
【0154】
具体的には、(1)100nM TPA、(2)100μM NE、(3)20nM LIFの各々で20分間処理して肥大を誘導したNRC、並びに(4)400nM GF109203X(PKC阻害剤)、(5)20nM TPA+400nM GF109203X、(6)100μM NE+400nM GF109203X、(7)20nM LIF+400nM GF109203Xの各々で20分間処理したNRCについて、Syntide-2を基質として免疫沈降キナーゼアッセイを行い、各NRC中に内在するPKD1のリン酸化活性を測定した。また、コントロールとして、何も処理しないNRC(未処理NRC)についても同様にして、内在するPKD1のリン酸化活性を測定した。
【0155】
(1)免疫沈降キナーゼアッセイ
実施例1(1)に記載する方法と同様な方法で調製したNRCを無血清DMEM(ナカライテスク社製)を用いて一晩培養した(CO2濃度5%、37℃)。かかる培養細胞に、(1)100nMのTPA、(2)100μMのNE(プロプラノールを2μM配合)、(3)20nMのLIF、(4)400nM GF109203X(PKC阻害剤)、(5)20nM TPA+400nM GF109203X、(6)100μM NE+400nM GF109203X、または(7)20nM LIF+400nM GF109203Xをそれぞれに添加して、20分間処理した。得られた細胞をLysis緩衝液Aで処理して、氷上で60分間、抗−全活性型PKD1ポリクローナル抗体とともにインキュべーションした。これをprotein G Sepharose 4Bで処理して、当該樹脂に結合したタンパク質(Protein G Sepharose 4B結合 PKD1−抗PKD1抗体複合体)を回収した。PKD1免疫沈降物をLysis緩衝液Aで1回洗浄し、さらにNaFを含まないLysis緩衝液Aで2回洗浄した。
【0156】
得られたPKD1免疫沈降物を、NaFを含まないLysis緩衝液A中で、0.5 mg/ml immunizing peptide (抗−全活性型PKD1ポリクローナル抗体作成時に被験動物を免疫化するために接種した抗原ペプチド。このペプチドとProtein G Sepharose 4B結合 PKD1−抗PKD1抗体複合体をインキュベートすると、上記抗原ペプチドと抗PKD1抗体とが結合して、その結果PKD1が遊離取得できる。)100μlとともにインキュべーションすることによって、PKD1を溶出させた。
【0157】
溶出したPKD1(10μl)をアッセイ混合液(15μl Tris/MgCl2 [100mM Tris, 100mM MgCl2]、5μl ATP [800μM]、0.2μl 32γ-ATP、及び40μg Syntide-2)とともに、30℃で5分間インキュべーションした。次いで、液体シンチレーションカウンターで、PKD1のリン酸化活性を測定した(n=9)。
【0158】
(2)結果
結果を図8に示す。棒グラフ中、左から、未処理NRC(ネガティブコントロール)、並びに(1)100nM TPA処理,(2)100μM NE(プロプラノール2μM配合)、(3)20nM LIF、(4)400nM GF109203X(PKC阻害剤)、(5)100nM TPA+400nM GF109203X、(6)100μM NE+400nM GF109203X、及び(7)20nM LIF+400nM GF109203Xで処理したNRCの内在PKD1のリン酸化活性を示す。なお、図中、各NRCの内在PKD1のリン酸化活性は、ネガティブコントロールの測定値(CPM,32P)を100%とした場合の、それに対する相対値(%)で示す。
【0159】
図8に示すように、TPAまたはNEで処理したNRCに内在するPKD1は、いずれも未処理NRC(ネガティブコントロール)並びにLIFで処理したNRCに内在するPKD1に比べて、顕著に高いリン酸化活性を示した。一方、NRCをこれらの心肥大誘導剤(TPA,NE)とPKC阻害剤(GF109203X)とで同時に処理すると、内在性PKD1の活性はネガティブコントロールと同レベルまで抑制された。
【0160】
このことから、心筋細胞においてPKD1のリン酸化は、PKCの活性化に基づいて生じることがわかる。また、LIFで処理した心筋細胞については、内在性PKD1の活性は未処理NRCの活性と殆ど変わらなかった。この結果は、上記実施例3で示したように、PKD1が、LIFによって誘導される心肥大シグナル伝達経路とは別個の、NEによって誘導されるGPCRを介した心肥大シグナル伝達経路に関わる成分であることを裏付けるものである。
【0161】
実施例5 PKD1の活性を制御するPCKのサブタイプ
実施例3及び4から、心肥大に関連して生じるPKD1の全活性化にはPKCの活性化が関わっていることが示された。PKCには複数のサブタイプが存在することが知られているため、ここではPKD1の全活性化にPKCのどのサブタイプが関わっているかについて調べた。
【0162】
この目的のため、具体的にはkinase dead PKCs(PKCα、PKCβI、PKCδ、PKCε、PKCζ)を強制発現させたNRCを、実施例4と同様にして心肥大誘導剤(NE)で処理し、得られたNRCに内在するPKD1のリン酸化活性を免疫沈降キナーゼアッセイで測定した。
【0163】
(1)kinase dead PKCsを発現する心筋細胞の調製
実施例1(1)に記載する方法と同様な方法で10cmプラスティックディッシュに調製したNRCに、形質転換試薬(Duo Fect:Q-biogen)を用いてそのマニュアルに従って、kinase dead PKCs(PKCα、PKCβI、PKCδ、PKCεまたはPKCζ)をコードするDNAを導入し、各kinase dead PKCs(PKCα、PKCβI、PKCδ、PKCεまたはPKCζ)を強制発現するようにNRCを形質転換した。
【0164】
(2)免疫沈降キナーゼアッセイ
上記、各kinase dead PKCs(PKCα、PKCβI、PKCδ、PKCε、またはPKCζ)を強制発現することによって内在性のPKCs活性を抑制したNRCを、各々無血清DMEM(ナカライテスク社製)中で一晩培養した後(CO2濃度5%、37℃)、100μMのNE(プロプラノールを2μM配合)を添加して、20分間処理した。得られた各NRCを実施例4(1)と同様に処理してPKD1を取得した。次いで、得られたPKD1(10μl)を実施例4(1)と同様にアッセイ混合液とともに30℃、5分間インキュべーションし、液体シンチレーションカウンターで、PKD1のリン酸化活性を測定した(n=9)。なお、比較実験として野生型NRCについてNE処理した細胞に内在するPKD1、及びネガティブコントロールとして未処理の野生型NRCに内在するPKD1についても同様にしてリン酸化活性を測定した。
【0165】
(3)結果
結果を図9に示す。棒グラフ中、左から、(1)未処理-野生型NRC(ネガティブコントロール)、(2)野生型NRC+NE処理、(3)kinase dead PKCα強制発現NRC+NE処理、(4)kinase dead PKCβI強制発現NRC+NE処理、(5) kinase dead PKCδ強制発現NRC+NE処理、(6)kinase dead PKCε強制発現NRC+NE処理、及び(7)kinase dead PKCζ強制発現NRC+NE処理した心筋細胞に内在するPKD1のリン酸化活性を示す。
【0166】
図9に示すように、NRCにkinase dead PKCεを導入した場合のみ(すなわち、PKCε活性が抑制してなるNRCだけ)が、細胞中の内在PKD1活性が未処理野生型NRC(ネガティブコントロール)のPKD1活性と同レベルであり、NEで心肥大を誘導してもPKD1が全活性化(リン酸化)されないことがわかった。このことは、PKCのサブユニットのうちPKCεが、心筋細胞(心肥大のシグナル伝達経路)におけるPKD1の上流に位置するアクチベーターであることを示すものである。
【0167】
実施例6 PKCεとPKD1の相互作用
以上の実験結果から、GPCRを介した心肥大のシグナル伝達にPKCεとPKD1の活性化が関わっていること、及びPKCεがPKD1の上流に位置するアクチベーターであることが分かった。そこで次に、心筋細胞におけるPKCεとPKD1との相互作用について、免疫沈降法を用いて調べた。具体的には、下記の方法によって、NE(100μM)で心肥大を誘導したNRC中におけるPKCεとPKD1の相互作用を調べた。
【0168】
(1)免疫沈降法
実施例1(1)に記載する方法に従って調製した初代培養NRCを、実施例3と同様に100μMのNE(プロプラノールを2μM配合)で処理し、当該NE処理NRCをLysis緩衝液Aで処理して、細胞抽出液(Cell Lysate)1mlを得た。そのうち300mlを氷上で60分間、抗−PKD1/2モノクローナル抗体とインキュベートし、これをprotein G Sepharose 4Bで処理して、当該樹脂に結合するタンパク質(抗−PKD1抗体免疫沈降サンプル)を回収した(なお、実施例1に示すようにNRC中にはPKD2は存在しない。)。同じようにして抗−PKDεモノクローナル抗体を用いて、抗−PKDε抗体免疫沈降サンプルを回収した。また、コントロールとして未処理のNRCについても同様に細胞抽出液(Cell Lysate)1mlを取得し、抗−PKDε抗体免疫沈降サンプル及び抗−PKD1抗体免疫沈降サンプルを調製した。
【0169】
次に各NRCについて得られた抗−PKCε抗体免疫沈降サンプル及び細胞抽出液(Cell Lysate)について、第1抗体として抗−PKD1/2モノクローナル抗体、及び第2抗体としてホースラディシュ由来パーオキシダーゼを結合した抗マウスまたはウサギIgG(Amasham pharmacia製)を使用して、ウエスタンブロット法を行った。抗−PKCε抗体免疫沈降サンプルに関する結果を図10の第1パネルに、細胞抽出液に関する結果を第3パネルに示す。
【0170】
また各NRCについて得られた抗−PKD1/2抗体免疫沈降サンプル及び細胞抽出液(Cell Lysate)について、第1抗体として抗−PKCεモノクローナル抗体、及び上記の第2抗体を使用して、ウエスタンブロット法を行った。抗−PKD1/2抗体免疫沈降サンプルに関する結果を図10の第2パネルに、細胞抽出液に関する結果を第4パネルに示す。
【0171】
第1及び3パネルで示されるように、NE処理したNRCの抗−PKD1/2抗体免疫沈降サンプル(すなわち、PKD1を含むサンプル)及びは抗−PKCε抗体免疫沈降サンプル(すなわち、PKCεを含むサンプル)は、それぞれ抗−PKCε抗体及び抗−PKD1/2抗体と反応した。このことから、心肥大を誘導したNRC中で、PKCεとPKD1との複合体が形成されていることがわかる。NE未処理のNRC中にはその存在が認められなかったことから、心肥大化過程(心肥大シグナル伝達過程)において活性化したPKCεがPKD1と反応して複合体を形成すると考えられる。このように、心筋細胞内での肥大過程で、心肥大の誘導に関わることが既に知られているPKCεに、PKD1が相互作用することが確認されたことで、さらにPKD1が心肥大シグナルの主要な構成タンパク質の一つであることが示唆された。
【0172】
なお、PKCεとPKD1は、in vitroで相互反応することが確認されているが(Waldron, R.T., et al., J. Biol. Chem. 1999, 274, p.9224-9230)、これは、単に株化した培養細胞中でPKCεとPKD1を強制発現させて両者の相互作用を見たものにすぎない。上記実施例6の結果は、肥大化した心筋細胞(100μM NE処理)に内在するPKCεとPKD1とが、互いに活性化して相互反応し複合体を形成することを初めて示したものである。
【0173】
実施例7 全活性型PKD1による心肥大誘導
上記の実験結果から、心肥大を生じている心筋細胞中にはPKD1が全活性化(リン酸化)していることが分かった。ここではPKD1を全活性化(リン酸化)することによって心肥大が誘導されるかどうか(全活性型PKD1による心肥大誘導の有無)について調べた。
【0174】
(1)
具体的には、まず、GFP融合−構成的活性型PKD1(GFP-PKD1/CA)をコードするDNA、またはコントロールとしてGFP(GFP)をコードするDNAを組み込んだプラスミドを、それぞれ形質転換試薬(Duo Fect:Q-biogen)を用いてそのマニュアルに従って、NRCに導入して形質転換した。
【0175】
上記で得られた細胞(形質転換体)を、抗体(抗-サルコメリック-α-アクチニン・モノクローナル抗体)を含むブロッキング緩衝液中で、4℃で16時間インキュべーションした。これをPBSで2回洗浄し、次いで0.3v/v% Cy3-標識・抗−マウスIgG抗体(第2抗体)(Amersham-pharmacia製)を配合したPBSに移して、室温で1時間インキュべーションした。細胞の蛍光シグナルを共焦点レーザー顕微鏡LSM5 Pascal(Carl Zeiss製)で観察した。
【0176】
結果を図11Aに示す。全活性型PKD1(GFP-FKD1 CA)を導入したNRC(下パネル)では、コントロール(上パネル)に比して明らかにサルコメア構造(Zディスク)が形成されており、このことから心肥大が誘導されていることが判明した。さらに図11Aの下パネルの結果は、全活性型PKD1がZディスクに自発的に局在することを示しており、これから全活性型PKD1が単独でZディスクの形成を誘導している可能性が示唆される。
【0177】
(2)構成的活性型PKDε(PKDε/CA)をコードするDNAを有するプラスミドを、、製造者の指示に従って、Rat Cardiomyocyte-Neonatal Nucleofector kit(Amaxa GmbH製)を用いてAmaxaエレクトロポレーターによりエレクトロポレーションを行い、細胞に導入した。得られた細胞(形質転換体)を、(1)と同様の方法により、細胞の蛍光シグナルを共焦点レーザー顕微鏡LSM5 Pascal(Carl Zeiss製)で観察した。結果を図11Bに示す。この結果は、活性型PKDεだけが自発的にZディスクに移行することを示している。
【0178】
実施例8 活性型PKCと心肥大誘導との関係
各PKC発現プラスミドを用いて、心肥大を引き起こすPKCアイソフォーム(PKCε、PKCβI及びPKCδ;これらは心臓における主なPKCである)の同定を試みた。
【0179】
具体的には、実施例7と同様にして、構成的活性型PKC変異体(CA-PKCε、CA-PKCβI、CA-PKCδ)、ドミナント・ネガティブ型PKC変異体(K440M PKCε)を組み込んだ発現ベクターをNRCに導入して形質転換し、その形質転換細胞を抗−サルコメリック-α-アクチニン抗体及び第2抗体で染色して、肥大の有無を、共焦点レーザー顕微鏡(LSM5 Pacal:Carl Zeiss)で観察した。なお、ドミナント・ネガティブ型PKC変異体(K440M PKCε)を発現させたNRCは、心肥大誘導剤であるNEまたはLIFで38時間処理し培養した後、免疫染色した。結果を図12に示す。
【0180】
パネルAは構成的活性型PKCε(CA-PKCε)を導入したNRC、パネルBは構成的活性型PKCβI(CA-PKCβI)を導入したNRC、パネルCは構成的活性型PKCδ(CA-PKCβδ)を導入したNRC、パネルDはドミナント・ネガティブ型PKCε(K440R PKCε)を導入したNRCであって100μMのNEで処理した細胞(心肥大誘導処理)、パネルEはドミナント・ネガティブ型PKCε(K440M PKCε)を導入したNRCであって20nMのLIFで処理した細胞(心肥大誘導処理)を、それぞれ抗−サルコメリック-α-アクチニン抗体及び第2抗体と反応させてα−アクチニンを視覚化させた画像を示す。
【0181】
図12からわかるように、構成的活性型PKCεを発現したNRCには、顕著に肥大が生じていることが観察された(パネルA)。一方、ドミナント・ネガティブ型PKCεを発現したNRCは心肥大誘導剤であるNEで処理しても心肥大を生じなかった(パネルD)。このことから、PKCのアイソフォームのうち、PKCεが心肥大のシグナル伝達に関与していることが判明した。
【0182】
実施例9 心肥大を誘導する活性化PKCε及び全活性化PKD
各種形質転換したNRCについて、利尿性ナトリウム因子(ANF、肥大マーカー:Tsuchimochi H, et al., Lancet, 1987 Aug 8. 2 (8554) p.336-7)の発現レベルを比較した。具体的には、実施例7と同様にして、構成的活性型PKCs(CA-PKCε、CA-PKCβI、CA-PKCδ)、kinase dead PKCε(KD- PKCε)、構成的活性型PKD1(CA-PKD1)、ドミナント・ネガティブ型PKD1(DN-PKD1)、またはGFPをコードするDNAを組み込んだプラスミドを、NRCに導入して各種の形質転換体を作成した。得られた形質転換細胞について、またそれをさらに心肥大誘導剤(NE又はLIF)処理した細胞について、実施例7の(2)と同様の方法で、第1抗体として抗−ANF抗体、第2抗体として0.3v/v% Cy2-標識・抗−ラビットIgG抗体(第2抗体)(Amersham-pharmacia製)を用いて、免疫染色を行った。同じ細胞数でNRCが増殖している(105)ディッシュを、各形質転換細胞につき3ディッシュずつ用意し、1デッシュあたり3枚の画像(共焦点レーザー顕微鏡(LSM5 Pacal:Carl Zeiss))を観察し、各細胞の画像データの蛍光レベル(すなわち、各細胞におけるANFの発現レベル)を画像解析ソフトScion image (Scion Corporation社製)を用いて測定した。
【0183】
結果を図13に示す。棒グラフ中、左から、GFP発現+未処理(ネガティブコントロール)、野生型+NE処理(ポジティブコントロール)、CA-PKCε発現+未処理、CA-PKCβI発現+未処理、CA-PKCδ+未処理、KD-PKCε発現+未処理、KD-PKCε発現+NE処理、CA-PKD1発現+未処理、DN-PKD1発現+未処理、DN-PKD1発現+LIF処理、及びDN-PKD1発現+NE処理したNRCのANF発現レベルを示す。その結果、構成的活性型PKD1(CA-PKD1)の導入または構成的活性型PKCε(CA-PKCε)の導入によってPKD1を全活性化させるかまたはPKCεを活性化させた心筋細胞は、肥大化が生じていることが確認された。この結果は、上記実施例7及び8の結果と一致し、PKCεの活性化、PKDの全活性化が、GPCRを介した心肥大シグナルの中心的で必要不可欠なカスケードであることを裏付けるものである。
【0184】
<考察>
以上の実験から、哺乳類の心筋細胞内で、PKD1がPKCεによって直接活性化されることにより心肥大が誘導されることがわかった。
【0185】
具体的には、心筋細胞においてPKD1の全活性化(リン酸化)またはPKCεの活性化によって心肥大が誘導されること(実施例7〜9)、一方、PKD1やPKCεのドミナント・ネガティブ変異体を導入した心筋細胞では、AngIIやNEによる刺激によっても心肥大が誘導されず、肥大シグナルが遮断されること(実施例7〜9)から、PKCεの活性化並びにPKD1の全活性化(リン酸化)が、心筋細胞内でのAngIIやNEによる心肥大シグナル(GPCRを介した心肥大シグナル)の中心的なカスケードであると考えられる。また、心筋細胞内でのPKD1の全活性化及びそれによる心肥大誘導には、PKCεの活性化が必要であり(実施例4及び5)、さらに心肥大した心筋細胞中にはPKCεとPKD1との複合体形成が認められること(実施例6)から、哺乳類の心筋細胞内のGPCRを介した心肥大シグナルにおいて、PKCεはPKD1の上流に位置するアクチベーターであり、PKCεの活性化に伴ってPKD1は活性化され、両者は複合体を形成して心肥大のシグナル伝達を担っていると考えられる。
【0186】
なお、上記実験では、NEやAngIIによって誘導されるGPCRを介した心肥大シグナル伝達経路に着目したが、EGFを作用させた心筋細胞でも同様にPKD1の全活性化並びにそのサルコメアZディスクへの移行が認められたことから、PKD1はEGF受容体下流にも位置するものと考えられ、GPCRを介した心肥大シグナル伝達経路と同様に、PKD1を介したカスケードが、EGFによる心肥大化機構(GPCRを介さない受容体型チロシンキナーゼによる心肥大化機構)に存在すると考えられる。
【0187】
実施例10 ENH2による心肥大化抑制作用
ENH1(Enigma Homologue protein 1) は、PKCβIの制御領域をbaitとした酵母Two-hybridスクリーニングにより、ラット脳由来cDNAライブラリーから単離同定された約60kDaの心臓・骨格筋特異的タンパク質で、N末端側にPDZドメイン、C末端側に3つのLIMドメインを有する。また、LIMドメインを欠失し、そのかわりにT-stretchと呼ばれる相同配列を有するスプライス変異体ENH2(ヒト、マウス、ラット)及びENH3(マウス、ラット)等も複数見出されている(図14参照)。
【0188】
NRCをPKC活性化剤であるホルボールエステル(例えば、TPA等)によって心肥大化状態に誘導させると、ENH1はPDZドメインを介してα−アクチニンと結合し、サルコメアのZディスクにトランスロケートすること、また最近では、ENH1はLIMドメインを介してPKCβをZディスクにリクルートするScaffold (足場) タンパク質であることが報告されている(Nakagawa N, et al., Biochem. Biophys. Res. Commun., 2000, 272(2), p.505-512)。
【0189】
なお、本発明者らは、上記の報告以後、前記の実験結果から直接PKCεによりリン酸化され全活性化することが判明したPKD1が、ENH1と相互することを見いだし、その相互作用領域が、PKD1のC末領域に位置する触媒領域とENH1のLIMドメインであることを同定した。また、GCPRを介する心肥大誘導剤(NE,AngII等)で心肥大を誘導した心筋細胞内で、全活性型PKD1とENH1がサルコメアのZディスクに移行し、そこに局在することを見いだした。一方、LIF等のgp130レセプターを介した心肥大誘導剤では、PKD1は活性化されずZディスクにも移行しない。このことから、PKD1はGPCRを介したシグナルで活性化し、ENH1とともに、心筋細胞サルコメアZディスクに移行し局在することが判明した。さらに本発明者らは、肥大化した心筋細胞内で、活性化したPKD1、PKCε、及びENH1が相互に作用し、心筋細胞サルコメアZディスク上に局在して複合体を形成していることを見いだした(これらはいずれも未発表)。
【0190】
(1)実験
実施例1(1)に記載する方法に従って調製したNRCを、ポリ-L-リジンでコーティングしたガラス底製の培養皿(35mm径)に移し、無血清DMEM(ナカライテスク社製)中で一晩培養した(CO2濃度5%、37℃)。これを商品マニュアルに従って、FLAG融合−ENH1またはFLAG融合−ENH2をコードするDNAを組み込んだプラスミドをそれぞれ形質転換試薬(Duo Fect:Q-biogen)と懸濁し、NRCにその調整液を添加して、心筋細胞を形質転換した。なお、細胞は10%FBSを含むDMEM培地で培養した。形質転換1日後に無血清培地に交換し、それぞれの形質転換細胞(FLAG融合−ENH1発現NRC、FLAG融合−ENH2発現NRC)を2つにわけて、一方を20nM TPAで処理して、TPA処理NRCと未処理のNRCを作成した。
【0191】
約18時間後、各形質転換細胞のTPA処理NRCと未処理NRCを、実施例3と同様な方法を用いて、抗−ANFポリクローナル抗体(T4015, PENINSULA LABORATORIES INC.製)及び抗−FLAGモノクローナル抗体(Sigma製)で、二重染色し、細胞の蛍光シグナルを共焦点レーザー顕微鏡で観察した。
【0192】
(2)結果
結果を図15に示す。図に示すように、ENH1を導入し発現させて心肥大化試薬で処理した場合にはサルコメアが形成され、またANFの発現が増加して心肥大が認められたが、ENH2を導入し発現させたNRCは、心肥大化試薬で処理してもサルコメア形成が見られず、ANF発現量が減少していた。このことから、LIMドメインを持たないスプライス欠失変異体ENH2はENH1によるサルコメアZディスクへのPKCの繋ぎとめを拮抗阻害し、心肥大化シグナルカスケードを抑制ないしは遮断する「内在性抗心肥大アンタゴニスト」であることが示唆された。またこのことから、ENH2と同じくLIMドメインを持たないスプライス欠失変異体ENH3(マウス、ラット)もまた、ENH1によるサルコメアZディスクへのPKCの繋ぎとめを拮抗阻害し、心肥大化シグナルカスケードを抑制ないしは遮断する「内在性抗心肥大アンタゴニスト」として作用すると考えられる。
【0193】
図16に心肥大シグナル制御モデルの概念図を示す。上記の結果から、GPCRを介した心肥大シグナル伝達機構において、心筋細胞が肥大化される時、ENH1はサルコメアZディスク上に心肥大シグナル伝達因子を保持し、該Zディスク上に保持された状態でPKD1はPKCεによって活性化され、リン酸化シグナルがさらに下流に伝達されること、そして、LIMドメインを欠失したENH1の変異体であるENH2は、ENH1が介する心肥大シグナルを抑制し、心肥大化を調節・抑制する内在性アンタゴニストとして機能していることが示唆された。また、これは、心筋細胞内でENH1の発現またはその機能活性を抑制することによって心肥大化シグナルカスケードを抑制ないしは遮断することができ、心肥大を抑制できる可能性を示唆するものでもある。
【産業上の利用可能性】
【0194】
心筋細胞内でのPKD1の機能発現を抑制する物質を有効成分とする本発明の心肥大抑制用組成物は、心肥大のシグナルカスケードにおける中心的役割を担うPKD1の心筋細胞内での機能発現を抑制することによって心肥大の誘導を阻止若しくは抑制することができる。また、ENH2をコードする塩基配列を有する核酸を有効成分とする本発明の心肥大抑制用組成物は、心筋細胞の肥大化に際して心肥大シグナル伝達因子を保持するENH1の機能を阻害することによって、心肥大の誘導を阻止若しくは抑制することができる。このため、本発明の心肥大抑制用組成物は、心肥大の誘導を抑制することによって、心肥大の発生並びに進展を抑制することができ、心肥大に起因する疾患、具体的には心不全や虚血性心疾患、または不整脈などの心疾患を予防または治療するための医薬品組成物として有効に用いることができる。
【0195】
また本発明は、心肥大シグナル経路を介した心肥大の誘導にPKD1が主要成分として深く関わっていること、並びにENH2が心肥大の誘導に関わるENH1の内在性アンタゴニストであることを新たに見いだし、これを提供するものである。よって、本発明が提供する心肥大発生メカニズムに関する知見を利用することにより、心肥大の発生を抑制するための有効成分、または心肥大に起因する心疾患の予防または治療のための有効成分をスクリーニングする方法を構築することができる。そして、当該スクリーニング方法によって取得された心肥大抑制物質を用いることによって、心不全、虚血性心疾患または不整脈等の心疾患の予防または治療のために有効な組成物を調製し、提供することができる。
【0196】
また上記心肥大発生メカニズムに関する知見を利用することにより、心肥大の病態を模倣した心肥大病態モデル非ヒト動物を作成し提供することができる。かかる心肥大病態モデル非ヒト動物は、心肥大の組織学的研究や心疾患への進展メカニズムの解明、ならびに心肥大の抑制剤や心疾患の予防・治療剤の開発のための有効成分のスクリーニングに有効に利用することができる。
【図面の簡単な説明】
【0197】
【図1】図1は、プロテインキナーゼD1のドメイン構造、ならびに不活性型と全活性型の構造的変化を示す概念図である。
【図2】図2は、ラット新生仔由来心筋細胞(以下、NRCともいう)について、TPA(12-O-tetradecanolyphorbol 13-acetate)で処理した場合の、全活性型PKD1(リン酸化PKD1)と不活性型PKD1(未リン酸化PKD1)の細胞内分布(細胞質[Cytoplasm]、細胞膜[Membrane])を、TPAで処理しない細胞(None)と対比した、ウエスタンブロットの結果を示す。なお、TPAはPKC及びPKDを活性化することが知られているホルボールエステルの1種である。上段から、各試料を(1)抗−PKD1/2モノクローナル抗体、(2)抗−全活性型PKD1ポリクローナル抗体、(3)抗−不活性型PKD1ポリクローナル抗体、(4)抗−サルコメリック-α-アクチニン・モノクローナル抗体、及び(5)抗−H3ヒストンマウス・モノクローナル抗体で反応させた結果を示す。TPA処理したNRCの細胞膜画分に、全活性型PKD1(リン酸化PKD1)が局在していることがわかる(実施例1)。
【図3】図3は、TPAで処理したNRC(図A)及び未処理のNRC(図3B)について、α−アクチニン、全活性型PKD1(リン酸化PKD1)、及び不活性型PKD1(不リン酸化PKD1)の細胞内分布を、免疫蛍光法による染色(共焦点レーザー顕微鏡)によって調べた結果を示す図である(実施例2)。図3B(未処理NRC)との対比から、図3A(TPA処理NRC)ではαアクチニン局在からサルコメア構造形成(心肥大状態)が認められ、TPA処理により心肥大が生じることがわかる。またTPA処理により、全活性型PKD1(リン酸化PKD1)だけがサルコメアZディスクに移行して、そこに局在することがわかる。なお、左欄の画像(Merged)は、右欄の画像と中欄の画像を重ね合わせたもので、黄色(赤×緑)を呈するほど、両者の画像が一致することを意味する(以下、図3〜6及び11において同じ)。
【図4】図4は、α-アドレナリン作動性受容体に作用して心肥大を誘導するノルエピネフリン(以下、NEともいう)(プロプラノール(β遮断薬)を加えることでβアドレナリン受容体の作用を抑制している)で処理したNRCについて、α−アクチニン、全活性型PKD1(リン酸化PKD1)、及び不活性型PKD1(不リン酸化PKD1)の細胞内分布を、免疫蛍光法による染色によって調べた結果を示す図である(実施例3)。NE処理によりサルコメア構造の発達(心肥大状態)が認められた。また、NE処理により全活性型PKD1(リン酸化PKD1)だけがサルコメアZディスクに移行して、そこに局在することがわかる。
【図5】図5は、心肥大を誘導するアンジオテンシンII(以下、AngIIともいう)(100nM)で処理したNRCについて、α−アクチニン、全活性型PKD1(リン酸化PKD1)、及び不活性化PKD1(不リン酸化PKD1)の細胞内分布を、免疫蛍光法による染色によって調べた結果を示す図である(実施例3)。AngII処理によりサルコメア構造形成(心肥大状態)が認められた。また、AngII処理により全活性型PKD1(リン酸化PKD1)だけがサルコメアZディスクに移行して、そこに局在することがわかる。
【図6】図6は、心肥大を誘導するLIF(leukemia inhibitory factor:白血病阻害因子)で処理したNRCについて、α−アクチニン、全活性型PKD1(リン酸化PKD1)、及び不活性化PKD1(不リン酸化PKD1)の細胞内分布を、免疫蛍光法による染色によって調べた結果を示す図である(実施例3)。LIF処理によりサルコメア構造形成(心肥大状態)が認められた。しかし、全活性型PKD1(リン酸化PKD1)のサルコメアZディスクへの移行は認められなかった。
【図7】図7Aは、NRCについて、PKCに対する選択的な阻害剤であるGF109203Xで処理した後に、心肥大誘導剤:ノルエピネフリン(NE)(+プロプラノール)で処理した場合の、α−アクチニンと全活性型PKD1(リン酸化PKD1)の細胞内分布を、免疫蛍光法による染色によって調べた結果を示す図である(実施例3)。心肥大状態及び全活性型PKD1(リン酸化PKD1)のサルコメアZディスク上への移行は認められず、GF109203X処理により、NE(+プロプラノール)処理による心肥大状態、及び全活性型PKD1(リン酸化PKD1)のサルコメアZディスク上への移行(図3参照)が阻害されることがわかる。またこのことから、NE(+プロプラノール)によって誘導される心肥大状態、並びにPKD1の活性化及びサルコメアZディスクへの移行は、PKCの活性化に依存していることがわかる。図7Bは、NRCについて、同様にGF109203Xで処理した後に、心肥大誘導剤:LIFで処理した場合の、α−アクチニンと全活性型PKD1(リン酸化PKD1)の細胞内分布を、免疫蛍光法による染色によって調べた結果を示す図である(実施例3)。LIF単独処理と同様に、心肥大状態は認められたが、全活性型PKD1(リン酸化PKD1)のサルコメアZディスク上への移行は認められなかった。このことから、LIF誘導される心肥大状態は、PKCの活性化に依存していないこと、またその心肥大にはPKD1の活性化及びサルコメアZディスクへの移行も関係していないことがわかる。
【図8】図8は、NRCまたは各種の薬剤で処理したNRCに内在するPKD1のリン酸化活性を調べた結果を示す図である(実施例4)。横軸は、各種薬剤で処理した(または処理しない)NRCの種類を示す。左から(1)未処理細胞、(2)TPA処理、(3)ノルエピネフリン(+プロプラノール)(NE)処理細胞、(4)LIF処理細胞、(5)GF109203X処理細胞、(6)GF109203X+TPA処理細胞、(7)GF109203X+NE(+プロプラノール)処理細胞、及び(8)GF109203X+LIF処理細胞を示す。縦軸は、各細胞に内在するPKD1のリン酸化活性(Phosphorylation activity of PKD1 (%))を示す。なお、リン酸化活性(%)は、未処理細胞に内在するPKD1のリン酸化活性を100%とした場合の相対%である。
【図9】図9は、正常NRC、並びに各種のkinase dead PKCs (PKCα、PKCβI、PKCδ、PKCε、PKCζ)を強制発現させてその活性を阻害したNRCについて、NE(+プロプラノール)で処理した場合に、内在するPKD1のリン酸化活性の変化を調べた結果を示す図である(実施例5)。横軸は、NRCの種類を示す。左から(1)薬剤未処理の野生型NRC、(2)NE処理した野生型NRC、(3)NE処理したkinase dead PKCα強制発現NRC、(4)NE処理したkinase dead PKCβI強制発現NRC、(5)NE処理したkinase dead PKCδ強制発現NRC、(6)NE処理したkinase dead PKCε強制発現NRC、及び(7)NE処理したkinase dead PKCζ強制発現NRCを示す。縦軸は、各細胞に内在するPKD1のリン酸化活性(Phosphorylation activity of PKD1 (%))を示す。なお、リン酸化活性(%)は、未処理細胞に内在するPKD1のリン酸化活性を100%とした場合の相対%である。
【図10】図10は、免疫沈降アッセイによって、NE(+プロプラノール)で処理したNRC内で、PKDεとPKD1との存在形態を免疫沈降法とウエスタンブロッティング法により調べた結果を示す図である(実施例6)。
【図11】図11Aは、GFP(Green Fluorescent Protein)-構成的活性型PKD1(GFP-PKD1 CA)(下段)、及びGFP(上段)を導入して強制発現させたNRCについて、α−アクチニンとGFP(すなわち、GFP-PKD1 CA、またはGFP)の細胞内分布を、免疫蛍光法による染色によって調べた結果を示す図である(実施例7)。GFP-PKD1 CAを強制発現させたNRC〔すなわち、全活性型PKD1(リン酸化PKD1)を有するNRC〕だけに、サルコメア構造の形成(心肥大状態))、並びにそのサルコメアZディスクへの移行が認められた。図11Bは、PKCε−CAを導入して強制発現させたNRCについて、α−アクチニンと構成的活性型PKCε(特に、PKCε−CA)の細胞内分布を、免疫蛍光法で染色することによって調べた結果を示す図である。α−アクチニンとPKCεについても免疫蛍光が認められた。
【図12】図12中、パネルAは構成的活性型PKCε(CA-PKCε)を導入して強制発現したNRC、パネルBは構成的活性型PKCβI(CA-PKCβI)を導入して強制発現したNRC、及びパネルCは構成的活性型PKCδ(CA-PKCδ)を導入して強制発現したNRCにおける、α−アクチニンの細胞内分布を、免疫蛍光法による染色によって調べた結果を示す図である(実施例8)。また、パネルD及びEはドミナント・ネガティブ型PKCε(DN-PKCε)を導入して強制発現したNRCについて、それぞれNE(+プロプラノール)及びLIFで処理した細胞におけるα−アクチニンの細胞内分布を、免疫蛍光法による染色によって調べた結果を示す図である(実施例8)。パネルA(CA-PKCε強制発現NRC)、B(CA-PKCβI強制発現NRC)及びE(DN-PKCε強制発現+LIF処理NRC)において、サルコメア構造の形成(心肥大状態)が認められた。
【図13】図13は、各種のNRCについて心肥大のマーカーである、利尿性ナトリウム因子(以下、ANFともいう)の発現レベルを調べた結果を示す図である。横軸の左から、(1)GFP導入NRC+心肥大誘導ナシ(−)(Negative control)、(2)野生型NRC+心肥大誘導アリ(NE処理)、(3)構成的活性型PKCε(CA-PKCε)強制発現NRC+心肥大誘導ナシ(−)、(4)構成的活性型PKCβI(CA-PKCβI)強制発現NRC+心肥大誘導ナシ(−)、(5)構成的活性型PKCδ(CA-PKCδ)強制発現NRC+心肥大誘導ナシ(−)、(6)kinase dead PKCε(KD-PKCε)強制発現NRC+心肥大誘導ナシ(−)、(7)kinase dead PKCε(KD-PKCε)強制発現NRC+心肥大誘導アリ(NE処理)、(8)構成的活性型PKD1(CA-PKD1)強制発現NRC+心肥大誘導ナシ(−)、(9)ドミナント・ネガティブ型PKD1(DN-PKD1)強制発現NRC+心肥大誘導ナシ(−)、(10)ドミナント・ネガティブ型PKD1(DN-PKD1)強制発現NRC+心肥大誘導アリ(LIF処理)、及び(11)ドミナント・ネガティブ型PKD1(DN-PKD1)強制発現NRC+心肥大誘導アリ(NE処理)を示す。縦軸は、各細胞のANFの発現レベルを示す。なお、各細胞のANFの発現レベルは、Negative controlのANFの発現レベルを1とした場合の相対比で示す。
【図14】図14は、マウスENH1(mENH1)(Enigma Homologue 1)のドメイン構造と、そのLIMドメインを欠失したスプライス変異体であるマウスENH2(mENH2)(Enigma Homologue 2)及びマウスENH3(mENH3)(Enigma Homologue 3)のドメイン構造を示す。PDZドメインは全てのENH分子のN末端側に、またLIMドメインはEHN1のC末端側に3つ存在する。“I”(インターナルストレッチ)及び“T”(ターミナルストレッチ)はいずれも機能不明な保存配列である。
【図15】図15は、実施例10の結果を示す図である。NRCに、予めN末端側にFLAGエピトープタグを付加したENH1もしくはENH2を強制発現しておき、心肥大誘導能を有するTPAを20nM作用させたものを、抗FLAG抗体または抗ANF抗体を使用した蛍光抗体法で観察したものである。ENH2を導入したNRCのみ、TPAの心肥大誘導作用が抑制されていることが、心肥大マーカーであるANFの発現抑制結果により判明した。
【図16】図16は、心筋細胞内における7回膜貫通型ヘテロ三量体Gタンパク質共役型受容体(以下、GPCRともいう)を介した心肥大シグナル制御モデルを示す概念図である。当該心肥大シグナル制御には、ENH1、PKCε及びPKD1、並びにENH2が相互関連している。
【特許請求の範囲】
【請求項1】
プロテインキナーゼD1の心筋細胞における機能発現を抑制する物質を有効成分とする、心肥大抑制用医薬組成物。
【請求項2】
有効成分が、心筋細胞におけるプロテインキナーゼD1遺伝子の発現またはその産生物の活性化若しくはリン酸化を抑制する作用を有する物質である、請求項1に記載する心肥大抑制用医薬組成物。
【請求項3】
有効成分が、心筋細胞において発現可能に制御されたドミナント・ネガティブ型プロテインキナーゼD1をコードする塩基配列を有する核酸である、請求項1に記載する心肥大抑制用医薬組成物。
【請求項4】
有効成分が、心筋細胞におけるプロテインキナーゼD1遺伝子の発現を抑制するアンチセンス分子、リボザイムまたはRNAiエフェクターである、請求項1に記載する心肥大抑制用医薬組成物。
【請求項5】
ENH2をコードする塩基配列を有する核酸を有効成分とする、心肥大抑制用医薬組成物。
【請求項6】
心肥大が、7回膜貫通型ヘテロ三量体Gタンパク質共役受容体または上皮成長因子受容体を介する肥大シグナル伝達によって生じるものである、請求項1または5に記載する心肥大抑制用医薬組成物。
【請求項7】
プロテインキナーゼD1の心筋細胞における機能発現を抑制する物質を有効量、心肥大またはその前状態にある被験者に投与することを含む、当該被験者について心肥大を抑制するか、または心肥大の発生を予防する方法。
【請求項8】
上記物質が、心筋細胞におけるプロテインキナーゼD1遺伝子の発現またはその産生物の活性化若しくはリン酸化を抑制する作用を有するものである、請求項7に記載する方法。
【請求項9】
上記物質が、心筋細胞において発現可能に制御されたドミナント・ネガティブ型プロテインキナーゼD1をコードする塩基配列を有する核酸である、請求項7に記載する方法。
【請求項10】
上記物質が、心筋細胞におけるプロテインキナーゼD1遺伝子の発現を抑制するアンチセンス分子、リボザイムまたはRNAiエフェクターである、請求項7に記載する方法。
【請求項11】
ENH2をコードする塩基配列を有する核酸を有効量、心肥大またはその前状態にある被験者に投与することを含む、当該被験者について心肥大を抑制するか、または心肥大の発生を予防する方法。
【請求項12】
心肥大が、7回膜貫通型ヘテロ三量体Gタンパク質共役受容体または上皮成長因子受容体を介する肥大シグナル伝達によって生じるものである、請求項7または11のいずれかに記載する方法。
【請求項13】
プロテインキナーゼD1の心筋細胞における機能発現を抑制する物質を有効成分とする、心肥大に起因する心疾患の発症を予防または治療するための医薬組成物。
【請求項14】
有効成分が、心筋細胞におけるプロテインキナーゼD1遺伝子の発現またはその産生物の活性化若しくはリン酸化を抑制する作用を有する物質である、請求項13に記載する医薬組成物。
【請求項15】
有効成分が、心筋細胞において発現可能に制御されたドミナント・ネガティブ型プロテインキナーゼD1をコードする塩基配列を有する核酸である、請求項13に記載する医薬組成物。
【請求項16】
有効成分が、心筋細胞におけるプロテインキナーゼD1遺伝子の発現を抑制するアンチセンス分子、リボザイムまたはRNAiエフェクターである、請求項13に記載する医薬組成物。
【請求項17】
ENH2をコードする塩基配列を有する核酸を有効成分とする、医薬組成物。
【請求項18】
心肥大が、7回膜貫通型ヘテロ三量体Gタンパク質共役受容体または上皮成長因子受容体を介する肥大シグナル伝達によって生じるものである、請求項13または17に記載する医薬組成物。
【請求項19】
プロテインキナーゼD1の心筋細胞における機能発現を抑制する物質を有効量、心肥大またはその前状態にある被験者に投与することを含む、当該被験者について心肥大に起因する疾患の発症を予防し、また治療する方法。
【請求項20】
上記物質が、心筋細胞におけるプロテインキナーゼD1遺伝子の発現またはその産生物の活性化若しくはリン酸化を抑制する作用を有するものである、請求項19に記載する方法。
【請求項21】
上記物質が、心筋細胞において発現可能に制御されたドミナント・ネガティブ型プロテインキナーゼD1をコードする塩基配列を有する核酸である、請求項19に記載する方法。
【請求項22】
上記物質が、心筋細胞におけるプロテインキナーゼD1遺伝子の発現を抑制するアンチセンス分子、リボザイムまたはRNAiエフェクターである、請求項19に記載する方法。
【請求項23】
ENH2をコードする塩基配列を有する核酸を有効量、心肥大またはその前状態にある被験者に投与することを含む、当該被験者について心肥大に起因する疾患の発症を予防し、また治療する方法。
【請求項24】
心肥大が、7回膜貫通型ヘテロ三量体Gタンパク質共役受容体または上皮成長因子受容体を介する肥大シグナル伝達によって生じるものである、請求項19または23のいずれかに記載する方法。
【請求項25】
心筋細胞において構成的活性型プロテインキナーゼD1のいずれか少なくとも1つが強制発現してなる、トランスジェニック非ヒト動物。
【請求項26】
心肥大の病態モデル動物である、請求項25に記載するトランスジェニック非ヒト動物。
【請求項27】
心筋細胞においてドミナント・ネガティブ型プロテインキナーゼD1が強制発現してなる、トランスジェニック非ヒト動物。
【請求項28】
(1)下記の工程を含む、心肥大抑制剤の有効成分をスクリーニングする方法:
(a) プロテインキナーゼD1を発現し得る細胞に被験物質を接触させる工程、
(b) 上記細胞について、プロテインキナーゼD1の発現レベルを測定し、被験物質を接触させない対照の細胞におけるプロテインキナーゼD1の発現レベルと対比する工程、及び
(c) 上記(b)の比較結果に基づいて、対照の細胞に比して、プロテインキナーゼD1の発現レベルが低下してなる細胞と接触させた被験物質を、心肥大抑制剤の有効成分として選択する工程。
【請求項29】
下記の工程を含む、心肥大抑制剤の有効成分をスクリーニングする方法:
(a) プロテインキナーゼD1を発現し得る細胞に、プロテインキナーゼD1活性化剤及び被験物質を接触させる工程、
(b) 上記細胞について、プロテインキナーゼD1の活性を測定し、被験物質を接触させない対照の細胞における上記に対応する活性と対比する工程、及び
(c) 上記(b)の比較結果に基づいて、対照の細胞に比して、プロテインキナーゼD1の活性が低下してなる細胞に投与した被験物質を、心肥大抑制剤の有効成分として選択する工程。
【請求項30】
下記の工程を含む、心肥大抑制剤の有効成分をスクリーニングする方法:
(a) 心筋細胞に、7回膜貫通型ヘテロ三量体Gタンパク質受容体または上皮成長因子受容体を刺激する心肥大誘導剤と被験物質を接触させる工程、
(b) 上記心筋細胞について、プロテインキナーゼD1の活性、α−アクチニンのサルコメアにおけるリン酸化プロテインキナーゼD1の局在性、またはプロテインキナーゼCεとプロテインキナーゼD1との2分子間距離を測定し、心肥大誘導剤だけを接触させた対照の心筋細胞における上記に対応する活性、局在性または2分子間距離と対比する工程、及び
(c) 上記(b)の比較結果に基づいて、対照の心筋細胞に比して、プロテインキナーゼD1の活性若しくはα−アクチニンのサルコメアにおけるリン酸化プロテインキナーゼD1の局在性が低下してなるか、またはプロテインキナーゼCεとプロテインキナーゼD1との2分子間距離が増大してなる心筋細胞に投与した被験物質を、心肥大抑制剤の有効成分として選択する工程。
【請求項31】
下記の工程を含む、心肥大抑制剤の有効成分をスクリーニングする方法:
(a) 構成的活性型プロテインキナーゼCεまたは構成的活性型プロテインキナーゼD1を発現し得る心筋細胞に、被験物質を接触させる工程、
(b) 上記心筋細胞について、プロテインキナーゼD1の活性、α−アクチニンのサルコメアにおけるリン酸化プロテインキナーゼD1の局在性、またはプロテインキナーゼCεとプロテインキナーゼD1との2分子間距離を測定し、被験物質を接触させない対照の心筋細胞における上記に対応する活性、局在性または2分子間距離と対比する工程、及び
(c) 上記(b)の比較結果に基づいて、対照の心筋細胞に比して、プロテインキナーゼD1の活性若しくはα−アクチニンのサルコメアにおけるリン酸化プロテインキナーゼD1の局在性が低下してなるか、またはプロテインキナーゼCεとプロテインキナーゼD1との2分子間距離が増大してなる心筋細胞に投与した被験物質を、心肥大抑制剤の有効成分として選択する工程。
【請求項32】
下記の工程を含む、心肥大抑制剤の有効成分をスクリーニングする方法:
(a) 請求項25に記載するトランスジェニック非ヒト動物に、被験物質を投与する工程、
(b) 上記非ヒト動物について心肥大の程度を測定し、被験物質を投与しない対照のトランスジェニック非ヒト動物の心肥大の程度と対比する工程、及び
(c) 上記(b)の比較結果に基づいて、心肥大を低下または抑制させる被験物質を心肥大抑制剤の有効成分として選択する工程。
【請求項33】
心肥大に起因する心疾患の予防または治療用医薬組成物の有効成分の取得方法である、請求項28〜32のいずれかに記載するスクリーニング方法。
【請求項1】
プロテインキナーゼD1の心筋細胞における機能発現を抑制する物質を有効成分とする、心肥大抑制用医薬組成物。
【請求項2】
有効成分が、心筋細胞におけるプロテインキナーゼD1遺伝子の発現またはその産生物の活性化若しくはリン酸化を抑制する作用を有する物質である、請求項1に記載する心肥大抑制用医薬組成物。
【請求項3】
有効成分が、心筋細胞において発現可能に制御されたドミナント・ネガティブ型プロテインキナーゼD1をコードする塩基配列を有する核酸である、請求項1に記載する心肥大抑制用医薬組成物。
【請求項4】
有効成分が、心筋細胞におけるプロテインキナーゼD1遺伝子の発現を抑制するアンチセンス分子、リボザイムまたはRNAiエフェクターである、請求項1に記載する心肥大抑制用医薬組成物。
【請求項5】
ENH2をコードする塩基配列を有する核酸を有効成分とする、心肥大抑制用医薬組成物。
【請求項6】
心肥大が、7回膜貫通型ヘテロ三量体Gタンパク質共役受容体または上皮成長因子受容体を介する肥大シグナル伝達によって生じるものである、請求項1または5に記載する心肥大抑制用医薬組成物。
【請求項7】
プロテインキナーゼD1の心筋細胞における機能発現を抑制する物質を有効量、心肥大またはその前状態にある被験者に投与することを含む、当該被験者について心肥大を抑制するか、または心肥大の発生を予防する方法。
【請求項8】
上記物質が、心筋細胞におけるプロテインキナーゼD1遺伝子の発現またはその産生物の活性化若しくはリン酸化を抑制する作用を有するものである、請求項7に記載する方法。
【請求項9】
上記物質が、心筋細胞において発現可能に制御されたドミナント・ネガティブ型プロテインキナーゼD1をコードする塩基配列を有する核酸である、請求項7に記載する方法。
【請求項10】
上記物質が、心筋細胞におけるプロテインキナーゼD1遺伝子の発現を抑制するアンチセンス分子、リボザイムまたはRNAiエフェクターである、請求項7に記載する方法。
【請求項11】
ENH2をコードする塩基配列を有する核酸を有効量、心肥大またはその前状態にある被験者に投与することを含む、当該被験者について心肥大を抑制するか、または心肥大の発生を予防する方法。
【請求項12】
心肥大が、7回膜貫通型ヘテロ三量体Gタンパク質共役受容体または上皮成長因子受容体を介する肥大シグナル伝達によって生じるものである、請求項7または11のいずれかに記載する方法。
【請求項13】
プロテインキナーゼD1の心筋細胞における機能発現を抑制する物質を有効成分とする、心肥大に起因する心疾患の発症を予防または治療するための医薬組成物。
【請求項14】
有効成分が、心筋細胞におけるプロテインキナーゼD1遺伝子の発現またはその産生物の活性化若しくはリン酸化を抑制する作用を有する物質である、請求項13に記載する医薬組成物。
【請求項15】
有効成分が、心筋細胞において発現可能に制御されたドミナント・ネガティブ型プロテインキナーゼD1をコードする塩基配列を有する核酸である、請求項13に記載する医薬組成物。
【請求項16】
有効成分が、心筋細胞におけるプロテインキナーゼD1遺伝子の発現を抑制するアンチセンス分子、リボザイムまたはRNAiエフェクターである、請求項13に記載する医薬組成物。
【請求項17】
ENH2をコードする塩基配列を有する核酸を有効成分とする、医薬組成物。
【請求項18】
心肥大が、7回膜貫通型ヘテロ三量体Gタンパク質共役受容体または上皮成長因子受容体を介する肥大シグナル伝達によって生じるものである、請求項13または17に記載する医薬組成物。
【請求項19】
プロテインキナーゼD1の心筋細胞における機能発現を抑制する物質を有効量、心肥大またはその前状態にある被験者に投与することを含む、当該被験者について心肥大に起因する疾患の発症を予防し、また治療する方法。
【請求項20】
上記物質が、心筋細胞におけるプロテインキナーゼD1遺伝子の発現またはその産生物の活性化若しくはリン酸化を抑制する作用を有するものである、請求項19に記載する方法。
【請求項21】
上記物質が、心筋細胞において発現可能に制御されたドミナント・ネガティブ型プロテインキナーゼD1をコードする塩基配列を有する核酸である、請求項19に記載する方法。
【請求項22】
上記物質が、心筋細胞におけるプロテインキナーゼD1遺伝子の発現を抑制するアンチセンス分子、リボザイムまたはRNAiエフェクターである、請求項19に記載する方法。
【請求項23】
ENH2をコードする塩基配列を有する核酸を有効量、心肥大またはその前状態にある被験者に投与することを含む、当該被験者について心肥大に起因する疾患の発症を予防し、また治療する方法。
【請求項24】
心肥大が、7回膜貫通型ヘテロ三量体Gタンパク質共役受容体または上皮成長因子受容体を介する肥大シグナル伝達によって生じるものである、請求項19または23のいずれかに記載する方法。
【請求項25】
心筋細胞において構成的活性型プロテインキナーゼD1のいずれか少なくとも1つが強制発現してなる、トランスジェニック非ヒト動物。
【請求項26】
心肥大の病態モデル動物である、請求項25に記載するトランスジェニック非ヒト動物。
【請求項27】
心筋細胞においてドミナント・ネガティブ型プロテインキナーゼD1が強制発現してなる、トランスジェニック非ヒト動物。
【請求項28】
(1)下記の工程を含む、心肥大抑制剤の有効成分をスクリーニングする方法:
(a) プロテインキナーゼD1を発現し得る細胞に被験物質を接触させる工程、
(b) 上記細胞について、プロテインキナーゼD1の発現レベルを測定し、被験物質を接触させない対照の細胞におけるプロテインキナーゼD1の発現レベルと対比する工程、及び
(c) 上記(b)の比較結果に基づいて、対照の細胞に比して、プロテインキナーゼD1の発現レベルが低下してなる細胞と接触させた被験物質を、心肥大抑制剤の有効成分として選択する工程。
【請求項29】
下記の工程を含む、心肥大抑制剤の有効成分をスクリーニングする方法:
(a) プロテインキナーゼD1を発現し得る細胞に、プロテインキナーゼD1活性化剤及び被験物質を接触させる工程、
(b) 上記細胞について、プロテインキナーゼD1の活性を測定し、被験物質を接触させない対照の細胞における上記に対応する活性と対比する工程、及び
(c) 上記(b)の比較結果に基づいて、対照の細胞に比して、プロテインキナーゼD1の活性が低下してなる細胞に投与した被験物質を、心肥大抑制剤の有効成分として選択する工程。
【請求項30】
下記の工程を含む、心肥大抑制剤の有効成分をスクリーニングする方法:
(a) 心筋細胞に、7回膜貫通型ヘテロ三量体Gタンパク質受容体または上皮成長因子受容体を刺激する心肥大誘導剤と被験物質を接触させる工程、
(b) 上記心筋細胞について、プロテインキナーゼD1の活性、α−アクチニンのサルコメアにおけるリン酸化プロテインキナーゼD1の局在性、またはプロテインキナーゼCεとプロテインキナーゼD1との2分子間距離を測定し、心肥大誘導剤だけを接触させた対照の心筋細胞における上記に対応する活性、局在性または2分子間距離と対比する工程、及び
(c) 上記(b)の比較結果に基づいて、対照の心筋細胞に比して、プロテインキナーゼD1の活性若しくはα−アクチニンのサルコメアにおけるリン酸化プロテインキナーゼD1の局在性が低下してなるか、またはプロテインキナーゼCεとプロテインキナーゼD1との2分子間距離が増大してなる心筋細胞に投与した被験物質を、心肥大抑制剤の有効成分として選択する工程。
【請求項31】
下記の工程を含む、心肥大抑制剤の有効成分をスクリーニングする方法:
(a) 構成的活性型プロテインキナーゼCεまたは構成的活性型プロテインキナーゼD1を発現し得る心筋細胞に、被験物質を接触させる工程、
(b) 上記心筋細胞について、プロテインキナーゼD1の活性、α−アクチニンのサルコメアにおけるリン酸化プロテインキナーゼD1の局在性、またはプロテインキナーゼCεとプロテインキナーゼD1との2分子間距離を測定し、被験物質を接触させない対照の心筋細胞における上記に対応する活性、局在性または2分子間距離と対比する工程、及び
(c) 上記(b)の比較結果に基づいて、対照の心筋細胞に比して、プロテインキナーゼD1の活性若しくはα−アクチニンのサルコメアにおけるリン酸化プロテインキナーゼD1の局在性が低下してなるか、またはプロテインキナーゼCεとプロテインキナーゼD1との2分子間距離が増大してなる心筋細胞に投与した被験物質を、心肥大抑制剤の有効成分として選択する工程。
【請求項32】
下記の工程を含む、心肥大抑制剤の有効成分をスクリーニングする方法:
(a) 請求項25に記載するトランスジェニック非ヒト動物に、被験物質を投与する工程、
(b) 上記非ヒト動物について心肥大の程度を測定し、被験物質を投与しない対照のトランスジェニック非ヒト動物の心肥大の程度と対比する工程、及び
(c) 上記(b)の比較結果に基づいて、心肥大を低下または抑制させる被験物質を心肥大抑制剤の有効成分として選択する工程。
【請求項33】
心肥大に起因する心疾患の予防または治療用医薬組成物の有効成分の取得方法である、請求項28〜32のいずれかに記載するスクリーニング方法。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【図15】


【図16】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【図15】


【図16】


【公表番号】特表2007−528861(P2007−528861A)
【公表日】平成19年10月18日(2007.10.18)
【国際特許分類】
【出願番号】特願2006−519271(P2006−519271)
【出願日】平成16年8月20日(2004.8.20)
【国際出願番号】PCT/JP2004/012336
【国際公開番号】WO2005/018673
【国際公開日】平成17年3月3日(2005.3.3)
【出願人】(504176911)国立大学法人大阪大学 (1,536)
【Fターム(参考)】
【公表日】平成19年10月18日(2007.10.18)
【国際特許分類】
【出願日】平成16年8月20日(2004.8.20)
【国際出願番号】PCT/JP2004/012336
【国際公開番号】WO2005/018673
【国際公開日】平成17年3月3日(2005.3.3)
【出願人】(504176911)国立大学法人大阪大学 (1,536)
【Fターム(参考)】
[ Back to top ]

