急性冠症候群を治療する方法
【課題】急性冠症候群、特に、不安定狭心症及び急性心筋梗塞の治療又は管理のために計画した方法及び組成物の提供。
【解決手段】マクロファージ及び単球を含むが、これらに限定されない食細胞の活性を特異的に低下若しくは阻害、且つ/又は食細胞の量を消失若しくは減少させる1種又は複数の治療薬を含む有効な量の製剤の投与。製剤は、食細胞により特異的に標的にされる。また製剤は不安定狭心症及び急性心筋梗塞などの急性冠症候群に現在罹患している、又は最近罹患した対象に投与される。
【解決手段】マクロファージ及び単球を含むが、これらに限定されない食細胞の活性を特異的に低下若しくは阻害、且つ/又は食細胞の量を消失若しくは減少させる1種又は複数の治療薬を含む有効な量の製剤の投与。製剤は、食細胞により特異的に標的にされる。また製剤は不安定狭心症及び急性心筋梗塞などの急性冠症候群に現在罹患している、又は最近罹患した対象に投与される。
【発明の詳細な説明】
【技術分野】
【0001】
1.発明の分野
本出願は、その全部が参照として組み込まれる2003年6月27日に提出した米国出願番号10/607623の一部継続出願である。
【0002】
本発明は、急性冠症候群(acute coronary syndrome)、特に、不安定狭心症(unstable angina)及び急性心筋梗塞の治療又は管理のために計画した方法及び組成物に関する。本発明の方法は、マクロファージ及び単球を含むが、これらに限定されない食細胞(phagocytic cell)の活性を特異的に低下若しくは阻害、且つ/又はその量を消失若しくは減少させる1種又は複数の治療薬を含む製剤の有効な量の投与を含む。
【背景技術】
【0003】
2.発明の背景
冠動脈疾患は、先進工業国における主な死亡の原因である。米国では、心臓発作の50〜60%が実証された冠動脈疾患を有さない人に発生している。この疾患の病理への主な寄与因子は、アテロームプラークの形成である。アテロームプラークは、コレステロール、増殖平滑筋細胞及び炎症細胞の蓄積に起因した血管壁における肥厚した部分である。
【0004】
アテロームプラーク
一般的に、アテロームプラークは、線維性被膜によって覆われた細胞外脂質の中心コアを有する限局的膨隆部位からなっている。アテロームプラーク内のコアは、結晶性コレステロール、コレステロールエステル、リン脂質、細胞分解産物及びコラーゲン残遺物を含む。線維性被膜は、血管又は動脈の内腔からアテロームプラークのコアを分離し、コラーゲン、エラスチン、プロテオグリカン及び他の細胞外マトリックス物質から構成されている高密度の線維性細胞外マトリックスである結合組織から主として構成されている。線維性被膜は、厚さ、平滑筋細胞及びマクロファージの数並びにコラーゲン含有量が異なる(Vallabhajosula et al., 1997, J. Nucl. Med. 38(11): 1788-1796)。
【0005】
アテロームプラークは、活動性で破裂しやすい(「脆弱若しくは高リスクプラーク」)又は不活動性で比較的安定(「安定プラーク」)と特徴づけることができる。脆弱で、高リスク又は破裂しやすいプラークは、多数の炎症細胞(マクロファージなど)、薄い線維性被膜及び大きい脂質コアを特徴とする。アテロームプラーク内の脂質プールの大きさ及びそれを覆う線維性被膜の厚さは、プラークの安定性を予測する重要な特性である。線維性被膜の縁(肩の部分)は、高い応力がかかる位置であり、一部、プラークの破裂をもたらし得るその部分における炎症細胞(マクロファージなど)の蓄積と線維性被膜を構成する物質の分解を引き起こす酵素の分泌(Moreno et al, Circulation, 1994, 90:775-8; van derWal et al., 1994, Circulation, 89:36-44; Jander et al, 1998, Stroke, 29:1625-1630)のため、破裂しやすい。
【0006】
脂質蓄積プラークの破裂により、高度にトロンボゲン形成性のコア及び動脈壁の内皮下血管平滑筋細胞成分が循環血に曝露される。血小板の活性化、付着及び凝集がこれに続いてほとんど即時に起こる。血小板の付着及び活性化は、凝固因子の放出及び凝固カスケードの開始をもたらす。放出された増殖因子、特に血小板由来増殖因子(PDGF)は、血管平滑筋細胞の増殖と移動を刺激する。血管平滑筋細胞の増殖と移動は、プラークリモデリング及び血管狭窄の増加をもたらし、又は、血小板と相互作用して、血栓形成の増大をもたらし得る(Pasterkamp et al., 2000, J, Clin. Basic Cardiol. 3:81-86)。脆弱プラークによってもたらされる、結果として生ずる血栓症は、不安定狭心症、急性心筋梗塞、脳卒中、末梢動脈疾患の急性悪化又は突然冠動脈死をもたらし得る。
【0007】
不安定狭心症
心臓は、機能するために酸素に富む血液を必要とする。右及び左冠動脈は、大動脈から枝分かれし、酸素化血液を心臓の組織に運ぶ。冠動脈が心臓に十分な量の酸素に富む血液を送ることができない(低酸素と呼ばれる状態)とき、狭心症として一般的に知られている胸痛、圧迫感又は不快感が生ずる。この状態が長引くと、酸素状態の悪化により、可逆的又は非可逆的に心筋自体が損傷を受ける可能性がある(虚血として知られる状態)。
【0008】
狭心症は、重症度及び発生のパターンによって安定又は不安定に大別される。安定狭心症は、身体活動の増加(例えば、道を急ぐ又は長い階段を上る)が酸素に富む血液の要求量を増加させるときに起こる。存在し得る複数の因子(その最も一般的なものは1つ又は複数の閉塞冠動脈)のため、冠血流によってもたらされる供給が需要の増加を満たすことができず、低酸素症が発生する。不安定狭心症は、より低い程度の身体運動で、高い頻度で、又は安静時(すなわち、身体運動なしで)に起こる狭心痛と理解される。安静時に起こる不安定狭心症は、その最も重篤な形の状態である。これは、通常、未破裂プラークの部位の冠動脈内の凝血塊の形成によって引き起こされ、未治療のまま放置すると、心臓発作及び心臓への不可逆性の損傷をもたらす可能性がある。
【0009】
不安定狭心症は、不安定になった脆弱プラークの部分的破裂に起因する可能性がある。プラークの部分的破裂は、血栓を発生させるが、動脈を完全には閉塞しない。内因性抗凝血(clot−fighting)メカニズムが凝血塊を分解する役割を果たすが、時間の経過に伴い、プラークは破裂し続け、凝固エピソードが繰り返される。この患者はまだ心筋梗塞に罹っていなかった可能性があるが、そのリスクは高い(例えば、不安定プラークが完全に破裂する場合、又は内因性凝血闘争メカニズムが動脈の完全閉塞の前に凝血塊を除去できない場合)。不安定狭心症を有する患者から死後に採取した崩壊した線維性被膜は、安定狭心症の症例のプラークより、プラーク破裂部位においてマクロファージによって著しく浸潤されていることが多い。
【0010】
急性心筋梗塞
急性心筋梗塞(「AMI」)は、心筋組織の壊死につながる一般的臨床状態を指す。この状態は、当技術分野でよく知られており、疼痛(ほとんどの症例で胸内)の発生、特徴的な心電図変化及び壊死性心臓組織によって放出される細胞内酵素(クレアチニンホスホキナーゼ及びα−ヒドロキシ酪酸など)又は心臓タンパク質(トロポニン複合体の成分及びミオグロビンなど)の血漿濃度の増加によって特徴づけられる。AMIは、低血圧、循環不全、肺浮腫及び不整脈を伴うことがある。すべてではないが、ほとんどの症例において、AMIは、血管が閉塞した状態になり、次いで、危険にさらされる心筋への血流の障害を引き起こす、冠血管における血管損傷及び血栓症に起因する(Fuster et al., 1992, New Engl. J. Med., 326:242-310)。ほとんどの症例において、冠血管の閉塞の時間は、病歴、心筋酵素の血漿中濃度の経過及び心電図変化から推定することができる。
【0011】
多くの心筋梗塞(心臓発作)の最初の事象は、アテロームプラークの破裂である。そのような破裂は、梗塞区域に血流を供給している冠動脈における血栓又は凝血塊の形成をもたらす可能性がある。梗塞区域又は領域は、一般的に言われているように、血液循環の閉鎖に起因する壊死の領域である。形成された血栓は、フィブリンと血球との組合せからなっている。凝血塊によって引き起こされた閉塞の位置、程度及び持続時間は、梗塞領域の大きさと損傷の程度を決定する。最終的には、冠閉塞によって引き起こされた心筋損傷の程度は、罹患した血管によって血液供給を受けている「領域」、血管の閉塞の程度、側副血管により罹患組織に供給される血液の量及び血液供給が突然制限された心筋の酸素要求量に依存する(Pasternak and Braunwald, 1994, Acute Myocardial Infarction, Harrison's Principles of Internal Medicine, 13thEd., pgs.1066-77)。
【0012】
マクロファージ及び炎症反応
マクロファージは、いくつかの冠症候群の原因及び/又は病理に関与している。プラークの線維性被膜を分解するタンパク質分解タンパク質のマクロファージ分泌は、被膜の厚さを減少させると共にさらなるマクロファージ浸潤を増加させ、それによりプラークの不安定性に寄与する。したがって、マクロファージはプラークの破裂における中心的な役割を有すると考えられ、それらが高濃度で存在することはそのような破裂の予測となると考えられる。実際に、アテロームプラークの線維性被膜の侵食及び/又は破綻は、動脈血栓形成を変化させ、急性虚血性事象の発生につながることが知られている。脆弱アテロームプラークの部位における破裂が、不安定狭心症、心筋梗塞又は突然死などの急性冠症候群の最も頻度の高い原因であることは明らかである。
【0013】
炎症は、急性心筋梗塞の病因並びにAMI後の治癒及び修復に関連づけられている。心筋虚血は、炎症反応を促進する。さらに、AMIの現行の急性療法の主体である再潅流も炎症を促進する。再潅流は、閉塞性血栓の急速な溶解及びその血液供給が遮断された心臓の領域への血流の回復を伴う。虚血性心筋組織における炎症細胞の存在は、損傷に対する病態生理学的反応であると伝統的に信じられてきた。しかしながら、実験的研究により、治癒に不可欠であるが、炎症細胞、具体的には食細胞であるマクロファージの組織への流入は虚血のみによって引き起こされるものを超えた組織損傷をもたらすことが示された。
【0014】
マクロファージ及び他の白血球は、虚血の直後に心筋に浸潤する。マクロファージは、線維芽細胞の増殖を刺激するいくつかのサイトカインを分泌する。しかし、活性化したマクロファージは、心筋損傷を促進するサイトカイン及び他のメディエーターも分泌する。したがって、心筋へのマクロファージの流入は心筋壊死を増加させ、梗塞の区域を拡大させる。したがって、炎症の急性期は治癒過程における必要な反応であるが、持続的活性化は、梗塞領域及びそれを取り囲む領域、すなわち、いわゆる「梗塞周囲区域」に実際に有害である。
【0015】
心筋虚血後の炎症反応は、活性化マクロファージにより引き起こされる結果として生ずる損傷の重症度を判定するうえで非常に重要である。炎症性走化因子(マクロファージ化学誘引タンパク質−1(MCP−1)、マクロファージ炎症性タンパク質−1α(MIP−1α))の血漿中濃度はその後の心不全及び左室不全と相関することが示された(例えば、Parissis, et al., J. Interferon Cytokine Res., 22(2):223-9を参照)。AMI後2及び3日目の末梢単球増加症(単球数の増加)は左室不全及び左室瘤を伴い、再潅流AMI後の左室リモデリングの発生における単球の役割が示唆される(Maekawa Y. et al., 2002, J. Am. Coll. Cardiol., 39(2):241-6)。急性心筋梗塞後の左室リモデリングは、進行性左室拡張が後続する梗塞拡大の過程であり、有害な臨床転帰を伴う。さらに、マクロファージ化学誘引タンパク質−1(MCP−1)の血漿中濃度は、急性心筋梗塞を有する患者において高い。MCP−1は心筋虚血/再潅流損傷によって誘導され、このケモカインの中和は梗塞のサイズを有意に減少させる。
【0016】
いくつかの冠閉塞/再潅流モデルにおける冠閉塞後の非特異的抗炎症複合体による炎症反応の抑制は、梗塞範囲を低減することが示された(例えば、Squadrito, et al., 1997, Eur. J. Pharmacol, 335:185-92; Libby, et al., 1973, J. Clin. Invest., 3:599-607; Spath, et al., 1974, Circ. Res., 35: 44-51を参照)。しかし、これらの非特異的療法は瘢痕形成及び治癒の妨害並びに一部の患者における動脈瘤の発生及び心室壁の破裂などの副作用を伴う。したがって、これらの療法は臨床使用から除外される。しかし、抗炎症性サイトカインであるインターロイキン−10の欠乏に起因するマクロファージ機能を抑制する低い能力を有する動物モデルは、冠閉塞モデルにおける梗塞サイズの増加及び心筋壊死に罹ることが示された(Yang Z. et al., 2000, Circulation, 101:1019-1026)。
【特許文献1】米国出願番号10/607623
【非特許文献1】Vallabhajosula et al., 1997, J. Nucl. Med. 38(11): 1788-1796
【非特許文献2】Moreno et al, Circulation, 1994, 90:775-8
【非特許文献3】van der Wal et al., 1994, Circulation, 89:36-44
【非特許文献4】Jander et al, 1998, Stroke, 29:1625-1630
【非特許文献5】Pasterkamp et al., 2000, J, Clin. Basic Cardiol. 3:81-86
【非特許文献6】Fuster et al., 1992, New Engl. J. Med., 326:242-310
【非特許文献7】Pasternak and Braunwald, 1994, Acute Myocardial Infarction, Harrison's Principles of Internal Medicine, 13thEd., pgs.1066-77
【非特許文献8】Parissis, et al., J. Interferon Cytokine Res., 22(2):223-9
【非特許文献9】Maekawa Y. et al., 2002, J. Am. Coll. Cardiol., 39(2):241-6
【非特許文献10】Squadrito, et al., 1997, Eur. J. Pharmacol, 335:185-92
【非特許文献11】Libby, et al., 1973, J. Clin. Invest., 3:599-607
【非特許文献12】Spath, et al., 1974, Circ. Res., 35: 44-51
【非特許文献13】Yang Z, et al., 2000, Circulation, 101:1019-1026
【発明の開示】
【発明が解決しようとする課題】
【0017】
本発明の1つの目的は、急性冠症候群(特に、不安定狭心症又は/及び心筋梗塞)に罹患している患者における食細胞(特に、マクロファージ及び単球)の蓄積及び/又はそれらからの因子の分泌を含む生物学的機能を阻害することができる治療薬の特定である。
【0018】
本発明の他の目的は、急性冠症候群(特に、不安定狭心症又は/及び心筋梗塞)を治療並びにこれらの症候群に伴うプラークを安定化する方法の開発である。
【課題を解決するための手段】
【0019】
3.発明の概要
本発明は、急性冠症候群、特に、不安定狭心症及び急性心筋梗塞の治療又は管理のために計画した方法及び組成物に関する。本発明の方法は、マクロファージ及び単球を含むが、これらに限定されない食細胞の活性を特異的に阻害し、且つ/又はその量を減少させる1種又は複数の治療薬を含む製剤の有効な量の投与を含む。本発明による1つ又は複数の治療薬を含む製剤の投与は、患者の冠症候群を安定化することを目的とする急性療法としての役割を果たす。1つの実施形態において、1つ又は複数の治療薬を含む製剤を、不安定狭心症に罹患している患者に脆弱又は不安定プラークを安定化するために投与する。他の実施形態において、製剤を、急性心筋梗塞に現在罹患している、又は最近罹患した患者に梗塞のサイズ及び心筋壊死を最小限にするために投与する。
【0020】
好ましい実施形態において、製剤は特に食細胞を標的とする。食細胞は食作用という特有の能力を有するため、これらの実施形態において、製剤は、主として又はもっぱら食作用により細胞に入るような特性の粒子を含むように調製する。製剤は、封入治療薬、包埋治療薬又は微粒子状治療薬を含んでいてよい。食作用を受けたならば、治療薬は製剤から標的食細胞、例えば、マクロファージ及び単球内に放出され、食細胞の機能を阻害し、且つ/又はそれを破壊する。
【0021】
1つの実施形態において、本発明は、それを必要とする個人に封入治療薬を含む製剤の有効な量を投与することによって急性冠症候群を治療する方法に関する。治療薬を特定の大きさの適切な担体に封入する。製剤は、主として又はもっぱら食作用により製剤が取り込まれることを可能にする、例えば、大きさ又は電荷などのその特性により食細胞を特に標的とする。製剤が食細胞により取り込まれたならば、封入された治療薬は放出され、薬剤は食細胞の活性を阻害し、且つ/又はそれを破壊することができる。
【0022】
他の実施形態において、本発明は、それを必要とする個人に包埋治療薬を含む製剤の有効な量を投与することによって急性冠症候群を治療する方法に関する。治療薬を特定の大きさの適切な担体に包埋する。製剤は、主として又はもっぱら食作用により製剤が取り込まれることを可能にする、例えば、大きさ及び/又は電荷などのその特性により食細胞を特に標的とする。食細胞内に入ったならば、埋め込まれた治療薬は放出され、薬剤は食細胞の活性を阻害し、且つ/又はそれを破壊することができる。
【0023】
他の実施形態において、本発明は、それを必要とする個人に微粒子状治療薬を含む製剤の有効な量を投与することによって急性冠症候群を治療する方法に関する。治療薬は、特定の大きさの微粒子に成形する。製剤は、主として又はもっぱら食作用により製剤が取り込まれることを可能にする、例えば、大きさ及び/又は電荷などの微粒子状特性により食細胞を特に標的とする。食細胞内に入ったならば、微粒子状治療薬は食細胞の活性を阻害し、且つ/又はそれを破壊することができる。
【0024】
本発明はまた、それを必要とする個人に封入、包埋又は微粒子状治療薬を含む製剤の有効な量を投与することによって急性冠症候群に伴うプラークを安定化する方法に関する。
【0025】
さらなる実施形態において、本発明は、急性冠症候群の治療用の封入治療薬、包埋治療薬及び微粒子状治療薬からなる群から選択される製剤並びに製薬上許容できる賦形剤、担体、安定化剤又は希釈剤を含む、不安定狭心症及び急性心筋梗塞などの急性冠症候群に現在罹患している、又は最近罹患した対象に投与するための薬剤組成物を含む。
【0026】
本発明の製剤は、好ましくは0.03〜1.0ミクロンの大きさである。しかし、薬剤及び/又は用いる担体の種類によって、より好ましい範囲は、0.07〜0.5ミクロン、0.1〜0.3ミクロン及び0.1〜0.18ミクロンを含むが、これらに限定されない。
【発明を実施するための最良の形態】
【0027】
5.発明の詳細な説明
食細胞、特に、マクロファージ及び単球は、いくつかの冠症候群の原因及び/又は病理に関与している。マクロファージ/単球は、被膜の厚さを減少させるだけでなく、当該部位へのさらなるマクロファージ/単球を動員する役割も果たす種々の物質の分泌によりプラークの線維性被膜を分解する。線維性被膜の分解は、プラークの脂質コアの血液への曝露並びに血栓を生じさせる凝固カスケードの開始につながる。血栓は、内腔を部分的に閉塞して不安定狭心症をきたすことがあり、又は内腔を完全に閉塞して急性心筋梗塞を引き起こすことがある。急性心筋梗塞が発生したならば、マクロファージ/単球は、損傷した心筋組織に動員され、心筋損傷を促進し、それにより虚血のみによって引き起こされる以上の組織損傷をもたらすサイトカイン及び他のメディエーターを分泌し、心筋壊死を増加させて、梗塞の領域を拡大する。食細胞の完全且つ慢性活動不能化及び/又は除去は望ましくないが、食細胞活性及び/又は存在のそのような減少は、患者を安定化し、且つ/又は冠症候群の障害を低減するために、急性冠症候群の罹患中又は後の短い期間には望ましい。
【0028】
本発明は、急性冠症候群(不安定狭心症及び急性心筋梗塞を含むが、これらに限定されない)の治療又は管理のための、急性冠症候群の罹患中若しくは後の急性短期間、食細胞(マクロファージ及び単球を含むが、これらに限定されない)の活性を低下若しくは阻害し、且つ/又はその量を消失若しくは低減するように計画した方法及び組成物に関する。本発明の方法は、患者における食細胞(マクロファージ及び単球を含むが、これらに限定されない)の活性を特異的に低下若しくは阻害し、且つ/又はその量を消失若しくは低減する1つ又は複数の治療薬を含む有効な量の製剤の投与を含む。1つ又は複数の治療薬を含む製剤の投与は、患者の安定化並びに/又は急性冠症候群による即時及び長期障害の最小化を目的とする急性短期療法と考えられる。1つの実施形態において、1つ又は複数の治療薬を含む製剤を不安定狭心症に罹患している患者に脆弱又は不安定プラークを安定化し、急性心筋梗塞の即時の脅威を低減するために投与する。他の実施形態において、1つ又は複数の治療薬を、急性心筋梗塞に現在罹患している、又は最近罹患した患者に梗塞の大きさ及び心筋壊死を最小限にするために投与する。
【0029】
本発明の方法に用いる製剤は、患者における食細胞の活性を特異的に低下若しくは阻害し、且つ/又はその量を消失若しくは低減する。製剤の特異性は、特定の細胞型(例えば、マクロファージ及び/又は単球)のみに対して作用する組成物の能力に起因する。好ましい実施形態において、食細胞に対する製剤の特異性は、食細胞によるインターナリゼーションをもっぱら又は主として受けることができるような製剤の物理化学的特性、例えば、大きさ又は電荷に起因する。食作用を受け、細胞内に入ったならば、治療薬は、食細胞の活性を阻害又は低下させ、且つ/又は食細胞を破壊する。特定の作用機序に束縛されることを意図するものではないが、製剤の治療薬は、食細胞を機能不能にし、且つ/又は破壊する前に、細胞内に入ったときに放出される。
【0030】
本発明の製剤、例えば、封入治療薬、包埋治療薬又は微粒子状治療薬は、炎症反応における重要な引き金である細胞、すなわち、マクロファージ及び/又は単球を一時的に枯渇且つ/又は不活性化することによって炎症反応を抑制する。封入薬剤、包埋薬剤又は微粒子状薬剤は、マクロファージ及び単球によって食作用により取り込まれる。これに対して、非食細胞は、製剤の大きさが大きく、且つ/又は他の物理化学的特性のため、製剤を取り込むことができない。
【0031】
本明細書で用いているように「食作用」という用語は、食細胞内への好ましい侵入の手段を指し、当技術分野で十分に理解されている。しかし、この用語は、同じ作用も実現する他の形のエンドサイトーシスも含むと理解すべきである。特に、飲作用、受容体媒介性エンドサイトーシス及び細胞外から物質を吸収/インターナリゼーションする他の細胞の手段も本発明の方法及び組成物によって包含されることが理解される。
【0032】
本発明は、不安定狭心症及び急性心筋梗塞などの急性冠症候群に現在罹患している、又は最近罹患した対象に投与するための本発明の1つ又は複数の治療薬を含む薬剤組成物も提供する。
【0033】
5.1 治療薬
本発明の製剤及び方法に用いる治療薬は、製剤の大きさ又は電荷などの物理化学的特性により、患者における食細胞の活性を特異的に低下若しくは阻害し、且つ/又は食細胞の量を消失若しくは低減する。治療薬は、マクロファージ又は単球などの食細胞内に入ったならば、もはや正常に機能且つ/又は生存することができないように食細胞を阻害、破壊、抑制、修飾且つ/又は変化させる細胞阻害物質、不活性化物質、トキシン、抑制物質及び/又は細胞増殖抑制/細胞毒性物質であってよい。
【0034】
本明細書で用いている、「治療薬」という用語は、製剤を構成又は製剤の一部を構成し、製剤に不活性化/毒性効力を与える、例えば、食細胞の活性を阻害若しくは低下させ、且つ/又は食細胞を除去若しくはその量を低減する分子を指す。治療薬となり得る化合物には、無機若しくは有機化合物;無機若しくは有機化合物を含むが、これらに限定されない小分子(500ダルトン未満)若しくは大分子;ペプチド、ポリペプチド、タンパク質、翻訳後修飾タンパク質、抗体等を含むがこれらに限定されないタンパク質性分子;2本鎖DNA、1本鎖DNA、2本鎖RNA、1本鎖RNA若しくは三重らせん核酸分子を含むがこれらに限定されない核酸分子が含まれるが、これらに限定されない。化合物は、あらゆる既知の生物(動物、植物、細菌、真菌、原生生物又はウイルスを含むが、これらに限定されない)から、又は合成分子のライブラリーから得られる天然産物であってよい。治療薬は、単量体であっても、重合化合物であってもよい。
【0035】
好ましい実施形態において、好ましい治療薬はビスホスホネート又はその類似体であってよい。本明細書で用いている「ビスホスホネート」という用語は、ジェミナル及び非ジェミナルビスホスホネートを意味する。具体的な実施形態において、ビスホスホネートは次の式(I)を有する。
【0036】
【化1】

式中、R1はH、OH又はハロゲン原子であり、R2はハロゲン、ヘテロアリールで場合によって置換されている線状若しくは分枝C1〜C10アルキル若しくはC2〜C10アルケニル、又はアミノが第一級、第二級若しくは第三級であってよいヘテロシクリルC1〜C10アルキルアミノ若しくはC3〜C8シクロアルキルアミノ、Yが水素、C3〜C8シクロアルキル、アリール若しくはヘテロアリールである−NHYであるか、或いはR2はZがクロロ置換フェニル若しくはピリジニルである−SZ。
【0037】
より具体的な実施形態において、ビスホスホネートは、アレンドロネート又はその類似体である。そのような実施形態において、アレンドロネートは次の式(II)を有する。
【0038】
【化2】

【0039】
他の具体的な実施形態において、さらなるビスホスホネートを本発明の方法に用いることができる。他のビスホスホネートの例は、クロドロネート、チルドロネート、3−(N,N−ジメチルアミノ)−1−ヒドロキシプロパン−1,1−ジホスホン酸、例えば、ジメチル−APD、1−ヒドロキシ−エチリデン−1,1−ビスホスホン酸、例えば、エチドロネート、1−ヒドロキシ−3(メチルペンチルアミノ)−プロピリデン−ビホスホン酸(イバンドロン酸)、例えば、イバンドロネート、6−アミノ−1−ヒドロキシヘキサン−1,1−ジホスホン酸、例えば、アミノ−ヘキシル−BP、3−(N−メチル−N−ペンチルアミノ)−1−ヒドロキシプロパン−1,1−ジホスホン酸、例えば、メチル−ペンチル−APD、1−ヒドロキシ−2−(イミダゾル−1−イル)エタン−1,1−ジホスホン酸、例えば、ゾレンドロン酸、1−ヒドロキシ−2−(3−ピリジル)エタン−1,1−ジホスホン酸(リセドロン酸)、例えば、リセドロネート、3−[N−(2−フェニルチオエチル)−N−メチルアミノ]−1−ヒドロキシプロパン−1,1−ビスホスホン酸、1−ヒドロキシ−3−(ピロリジン−1−イル)プロパン−1,1−ビスホスホン酸、1−(N−フェニルアミノチオカルボニル)メタン−1,1−ジホスホン酸、例えば、FR78844(フジサワ)、5−ベンゾイル−3,4−ジヒドロ−2H−ピラゾール−3,3−ジホスホン酸テトラエチルエステル、例えば、U81581(アップジョン)及び1−ヒドロキシ−2−(イミダゾ[1,2−a]ピリジン−3−イル)エタン−1,1−ジホスホン酸、例えば、YM529又はその類似体を含むが、これらに限定されない。
【0040】
治療薬を含む他の製剤は、ガリウム、金、セレン、ガドリニウム、シリカ、ミトラマイシン、パクリタキセル、シロリムス、エベロリムス及びその他の同様な類似体を含むが、これらに限定されない。一般的に、例えば、5−フルオロウラシル、シスプラチン、アルキル化剤などの化学療法薬、例えば、ステロイド、アスピリンなどの他の抗増殖又は抗炎症化合物及び非ステロイド抗炎症薬も製剤に用いることができる。
【0041】
本発明は、急性冠症候群を管理又は治療するための1つ又は複数の製剤の投与を含むことを意味する。複数の製剤を患者に併用して投与することができる。「併用して」という用語は、正確に同時の製剤の投与に限定されないが、別の方法で投与した場合より高い有効性を得るように、製剤を患者に順に、共に作用することができるような時間内に投与することを意味する。例えば、各製剤を同時に、又は異なる時点にある順序で逐次的に投与することができる。しかし、同時に投与しない場合、所望の治療効果を得るように十分に近い時間で投与すべきである。各製剤を適切な形で、治療薬を適切又は所望の作用部位に効率的に輸送する適切な経路により別個に投与することができる。好ましい投与方法は、静脈内(IV)及び動脈内(IA)などである。他の適切な投与方法は、筋肉内(IM)、皮下(SC)並びに腹腔内(IP)及び経口(PO)などである。そのような投与は、ボーラス注射又は注入であってよい。他の投与方法は、血管周囲送達であってよい。製剤は、直接又は希釈後に投与することができる。上記の投与経路のいずれかの組合せも本発明により用いることができる。
【0042】
種々の実施形態において、製剤を1時間未満の間隔で、約1時間の間隔で、約1時間から約2時間の間隔で、約2時間から約3時間の間隔で、約3時間から約4時間の間隔で、約4時間から約5時間の間隔で、約5時間から約6時間の間隔で、約6時間から約7時間の間隔で、約7時間から約8時間の間隔で、約8時間から約9時間の間隔で、約9時間から約10時間の間隔で、約10時間から約11時間の間隔で、約11時間から約12時間の間隔で、24時間以下の間隔又は48時間以下の間隔で投与する。1つの実施形態において、2つ又はそれを超える製剤を同時に、又は同じ患者来院時の範囲内で投与する。
【0043】
5.1.1 治療薬の特定
本発明は、治療薬として用いることができる化合物をスクリーニングする方法を提供する。特定の作用機序に束縛されることを意図するものではないが、本発明の方法に用いるための治療薬である化合物は、製剤自体の物理化学的特性により食細胞の標的とされるならば、i)食細胞活性を阻害し、ii)食細胞活性を低下させ、iii)循環から、及び/又は急性冠症候群に罹患した領域から食細胞を除去し、且つ/又はiv)循環における、及び/又は急性冠症候群に罹患した領域における食細胞の数を減少させることができる。
【0044】
治療薬をスクリーニングする方法は、一般的に候補化合物を食細胞とともにin vitro又はin vivoでインキュベートし、次いで、食細胞の活性又は寿命の変化(例えば、減少)を測定し、それにより、本発明において用いるための治療薬である化合物を特定することを含む。当技術分野で知られているいずれかの方法を用いて食細胞の活性又は寿命を測定することができる。1つの実施形態において、食細胞活性は、活性化刺激に対する細胞活性化のレベルによって測定する。例えば、マクロファージ/単球活性化は、マクロファージ化学誘引タンパク質−1(MCP−1)、及びマクロファージ炎症性タンパク質−1α(MIP−1α)などの走化因子並びにインターロイキン1β(IL−1β)及び組織壊死因子α(TNF−α)などのマクロファージによって産生される他の物質のレベルを定量することによって測定することができる。他の実施形態において、食細胞の寿命を測定する。例えば、細胞増殖は、3H−チミジン取り込みを測定することにより、直接細胞計数により、癌原遺伝子(例えば、fos、myc)などの既知の遺伝子の転写活性若しくは細胞周期マーカーの変化を検出することにより、又はトリパンブルー染色により測定することができる。当技術分野で知られているいずれかの方法を用いてmRNA転写のレベル(例えば、ノーザンブロット、RT−PCR、Q−PCR等により)又はタンパク質レベル(例えば、ELISA、ウエスタンブロット等)を測定することができる。
【0045】
1つの実施形態において、食細胞の活性を低下させる化合物は、
a)食細胞を、食細胞を活性化する化合物である第1の化合物及び候補化合物である第2の化合物と接触させ、
b)前記接触食細胞における活性化のレベルを測定する
ことにより特定され、前記第2の化合物の非存在下で前記第1の化合物と接触させた食細胞(すなわち、対照細胞)における活性化のレベルと比較して前記接触細胞における活性化が低下することは、前記第2の化合物が食細胞の活性を低下させることを示している。
【0046】
他の実施形態において、食細胞の量を減少させる化合物は、
a)食細胞を化合物と接触させ、
b)前記接触食細胞の生存率を測定する
ことにより特定され、前記化合物と接触させなかった食細胞(すなわち、対照細胞)の生存率と比較して前記接触細胞の生存率が低下することは、前記化合物が食細胞の量を減少させることを示している。
【0047】
他の実施形態において、食細胞の活性又は寿命を治療上望ましい仕方で変化させることが知られている化合物と比べて実質的に同様又は良好に食細胞の活性又は寿命を変化させる候補化合物の能力を測定する。本明細書で用いている「と実質的に同様」は、例示薬剤として食細胞に対する同様の作用を有する薬剤、すなわち、食細胞の活性、機能、運動性及び/又は枯渇を阻害する薬剤を指す。
【0048】
さらに、候補化合物を急性冠症候群の動物モデルに用いて本発明の方法に用いられるその能力を評価することができる。1つの実施形態において、ウサギAMIモデルを用いることができる(例えば、セクション6.1を参照)。
【0049】
5.2 治療薬の製剤
1つ又は複数の治療薬を含む製剤は、もっぱら又は主として食作用によりインターナリゼーションを受けるのに製剤の大きさが十分に大きくなるように調製し、それにより、食細胞に対する特異性を付与することができる。そのような製剤が細胞内に入った場合、非食細胞はそのような製剤の影響を受ける可能性はあるが、非食細胞がこのように調製した製剤をインターナリゼーションするメカニズムは存在しない。1つ又は複数の治療薬に外因性の特異性を付与する製剤の大きさの範囲は、好ましくは0.03〜1.0ミクロン、より好ましくは0.07〜0.5ミクロン、より好ましくは0.1〜0.3ミクロン、より好ましくは0.1〜0.18ミクロンである。
【0050】
当技術分野で知られているいずれかの方法を用いて、もっぱら又は主として食作用によりインターナリゼーションを受けるように治療薬を製剤に組み込むことができる。治療薬の製剤は、標的部位への薬剤の送達を容易にするのに十分な時間治療薬を封鎖することができる。さらに、治療薬の製剤は、標的部位の標的細胞(例えば、食細胞)内に存在するとき粒子から治療薬を放出することができる。
【0051】
1つの実施形態において、治療薬を所望の特性の担体(すなわち、封入剤)に封入する。特定の実施形態において、封入剤はリポソームである。リポソームは、当技術分野で知られているいずれかの方法により調製することができる(例えば、Monkkonen J. et al., 1994, J. Drug Target, 2:209-308; Monkkonen J. et al., 1993, Calcif. Tissue Int., 53:139-145; Lasic DD., Liposomes Technology Inc., Elsevier, 1993, 63-105.(chapter 3); WinterhalterM, Lasic DD, Chem Phys Lipids, 1993 Sep;64(1-3):35-43を参照)。リポソームは、正に荷電、中性又はより好ましくは負に荷電していてよい。リポソームは、脂質単層であってよく、又は多層であってよい。本発明による適切なリポソームは、例えば、ホスファチジルコリンホスホグリセロール及びコレステロールから調製されるような無毒性リポソームであることが好ましい。用いるリポソームの直径は、0.03〜1.0μmである。しかし、食細胞による食作用に適した他のサイズ範囲も用いることができる。
【0052】
他の実施形態において、治療薬を所望の特性の担体(すなわち、包埋剤)に包埋する。包埋する治療薬は、担体内に包埋、封入且つ/又は吸収され、担体マトリックスに分散され、担体表面上に吸着且つ/又は結合され、或いはこれらの形態のいずれかの組合せである治療薬などである。特定の実施形態において、包埋剤(又は担体)は、ミクロ粒子、ナノ粒子、メノスフェア、ミクロスフェア、ミクロカプセル又はナノカプセルである(例えば、M. Donbrow in: Microencapsulation and Nanoparticles in Medicine and Pharmacy, CRC Press, Boca Raton, FL, 347, 1991)。担体という用語は、重合体及び非重合体調製物を含む。特定の実施形態において、包埋剤はナノ粒子である。好ましくは、ナノ粒子は、直径が0.03〜1.0ミクロンであり、球状、非球状又は重合体粒子であってよい。治療薬は、ナノ粒子に包埋され、重合体マトリックスに均一若しくは不均一に分散され、表面上に吸着され、或いはこれらの形態のいずれかの組合せであってよい。好ましい実施形態において、ナノ粒子を製造するために用いる重合体は、ポリ(DL−ラクチドコグリコリド)重合体(PLGA)などの生体適合性且つ生分解性である。しかし、ナノ粒子を製造するために用いることができる別の重合体は、PLA(ポリ乳酸)及びそれらの共重合体、ポリ酸無水物、ポリアルキルシアノアクリレート(ポリイソブチルシアノアクリレート)、ポリエチレングリコール、ポリエチレンオキシド及びそれらの誘導体、キトサン、アルブミン、ゼラチン等を含むが、これらに限定されない。
【0053】
他の実施形態において、治療薬は微粒子状であり、粒子の各々が所望の特性を有する。微粒子状治療薬の形態は、担体内に封入、包埋又は吸収されていない不溶性懸濁又は分散微粒子の形態の治療薬を含む。微粒子状の治療薬は、薬剤の懸濁又は分散コロイド、凝集体、綿状凝集体、不溶性塩、不溶性複合体及び高分子鎖である治療薬を含む。そのような微粒子は、それらが保存/投与される液体(例えば、生理食塩水又は水)並びにそれらがそれらの治療効果を示す液体(例えば、血液又は血清)に不溶性である。一般的に、「不溶性」は10000部を超える溶媒中の1部の微粒子状治療薬の溶解性を指す。微粒子又は凝集体を調製するための当技術分野で知られている方法を用いることができる。好ましくは、微粒子は、直径が0.03〜1.0ミクロンであり、あらゆる微粒子状であってよい。
【0054】
5.2.1 粒子径の測定
治療薬を含む製剤は、製剤の大きさがもっぱら又は主として食作用によりインターナリゼーションを受けるのに十分に大きい、すなわち、0.03ミクロンより大きくなるように調製することが好ましい。好ましい実施形態において、そのような製剤は、好ましくは0.03〜1.0ミクロン、より好ましくは0.07〜0.5ミクロン、より好ましくは0.1〜0.3ミクロン、最も好ましくは0.1〜0.18ミクロンである。それを必要とする患者に投与する前に、当技術分野で知られているいずれかの方法を用いて製剤の大きさを測定することができる。例えば、レーザー光散乱を用いるNicomp Submicron Particle Sizer(model 370、Nicomp、Santa Barbara、CA)を用いることができる。
【0055】
5.3 製剤の投与
有効な量の製剤は、短期の急性療法として考えられ、慢性投与用ではない。投与期間は、それが1ヶ月未満、好ましくは2週間未満、最も好ましくは最長1週間食細胞の阻害/枯渇をもたらすような期間である。経験的には、それを必要とする個体(又はそのような個体の動物モデル)に化合物を投与し、様々な時点で阻害/枯渇のレベルをモニタリングすることによってこれを決定することができる。阻害の時間を適切な所望の臨床効果、例えば、プラークの破裂の急性リスクの低減と相関させることもできる。
【0056】
5.4 治療上の有用性の特性評価
「有効な量」という用語は、所望の治療結果、すなわち、食細胞の活性の阻害若しくは低下、及び/又は食細胞の量の消失若しくは低減を達成するうえで有効な特定の製剤の量を意味する。1つの実施形態において、食細胞の活性の阻害若しくは低下、及び/又は食細胞の量の消失若しくは低減という所望の治療結果は、不安定狭心症に罹患している患者における脆弱又は不安定プラークを安定化する。他の実施形態において、食細胞の活性の阻害若しくは低下、及び/又は食細胞の量の消失若しくは低減という所望の治療結果は、急性心筋梗塞に罹患している患者における梗塞の大きさ及び/又は心筋壊死の量を最小化する。
【0057】
本発明の治療方法の毒性及び有効性は、例えば、LD50(集団の50%に対して致死的な量)、最大無毒性量(NOAEL)及びED50(集団の50%において治療上有効な量)を決定するための細胞培養又は実験動物における標準的な薬剤学的方法によって判断することができる。毒性影響と治療効果の間の用量比は、治療指数であり、LD50/ED50又はNOAEL/ED50の比として表すことができる大きな治療指数を有する製剤が好ましい。毒性副作用を示す製剤を用いることができるが、非罹患細胞への傷害の可能性を最小限にし、それにより、副作用を低減するために、そのような製剤の薬剤の標的を罹患組織の部位に定める送達システムを設計するように注意を払うべきである。
【0058】
細胞培養アッセイ及び動物試験から得られるデータは、ヒトに用いる製剤の用量の範囲の決定に用いることができる。そのような製剤の用量は、ほとんど又は全く毒性を伴わないED50を含む循環濃度の範囲内にあることが好ましい。用量は、用いる剤形及び用いる投与経路によって、この範囲内で変化させることができる。本発明の方法に用いる製剤について、有効な量は最初に細胞培養アッセイから推定することができる。細胞培養において決定されるIC50(すなわち、症状の最大抑制の半分を達成する試験化合物の濃度)を含む循環血漿濃度を達成する用量を動物モデルにおいて定式化することができる。ヒトにおける有用な用量をより正確に決定するために、そのような情報を用いることができる。血漿中濃度は、例えば、高速液体クロマトグラフィーにより測定することができる。
【0059】
本発明のプロトコール及び組成物は、ヒトに使用する前に、所望の治療活性についてin vitroで、次いで、in vivoで試験することが好ましい。そのようなin vitroアッセイの1つの例は、培養中で生育させ、曝露させ、又は別の方法で細胞に投与し、細胞に対するこのアッセイの効果、例えば、活性の阻害若しくは低下及び/又は完全若しくは部分的細胞死について観察する食細胞におけるin vitro細胞培養アッセイである。食細胞は、樹立細胞系から得ることができ、又は初代細胞系として個体から近時に分離することができる。当技術分野における標準的な多くのアッセイを食細胞に対する製剤の活性を測定するのに用いることができる。例えば、マクロファージ/単球活性化は、マクロファージ化学誘引タンパク質−1(MCP−1)、インターロイキン1β(IL−1β)、組織壊死因子α(TNF−α)及びマクロファージ炎症性タンパク質−1α(MIP−1α)などの走化因子のレベルを定量することによって測定することができる。当技術分野における標準的な多くのアッセイを食細胞の生存及び/又は成長を評価するのに用いることができる。例えば、細胞増殖は、3H−チミジン取り込みを測定することにより、直接細胞計数により、癌原遺伝子(例えば、fos、myc)などの既知の遺伝子の転写活性若しくは細胞周期マーカーの変化を検出することにより測定することができ、細胞生存率はトリパンブルー染色により測定することができる。
【0060】
好ましい有効量の選択は、当業者に知られているいくつかの因子の考慮に基づいて当業者が決定することができる(例えば、臨床試験により)。そのような因子としては、管理又は治療する急性冠症候群、随伴する症状、患者の体格、患者の免疫状態及び投与した薬剤組成物の正確さを反映することが当業者に知られている他の因子が挙げられる。
【0061】
5.5 薬剤組成物及び投与経路
本発明の方法に用いるための1つ又は複数の治療薬を含む製剤は、各患者に固有の種々の因子(例えば、患者の障害の重症度及び種類、年齢、体重、反応及び過去の病歴)、製剤中の治療薬の数及び種類、製剤の種類(例えば、封入、包埋、微粒子状等)、組成物の形態(例えば、液体、半液体又は固体)及び/又は投与経路(例えば、経口、静脈内、筋肉内、動脈内、骨髄内、クモ膜下腔内、心室内、経皮、皮下、腹腔内、鼻腔内、腸内、局所、舌下、膣又は直腸)によって、多数の形態であってよい。水、生理食塩溶液、緩衝生理食塩溶液、油(例えば、石油、動物、植物又は合成油)、デンプン、グルコース、ラクトース、スクロース、ゼラチン、麦芽、米、小麦粉、白墨、シリカゲル、ステアリン酸ナトリウム、モノステアリン酸グリセロール、タルク、塩化ナトリウム、乾燥スキムミルク、グリセロール、プロピレン、グリコール、エタノール、デキストロース等を含むが、これらに限定されない薬剤担体、賦形剤、添加剤又は希釈剤を本発明の組成物に含めることができる。所望ならば、組成物は、微量の湿潤又は乳化剤又はpH緩衝剤も含んでいてよい。これらの組成物は、水剤、懸濁剤、乳剤、錠剤、丸剤、カプセル剤、散剤、徐放剤等の形態をとることができる。
【0062】
非経口投与に適する製剤は、水溶液として、好ましくは、ハンクス液、リンゲル液又は生理学的緩衝生理食塩水などの生理学的に適合性のある緩衝液を用いて調製することができる。水性注射懸濁剤は、カルボキシメチルセルロースナトリウム、ソルビトール又はデキストランなどの懸濁剤の粘度を増加させる物質を含んでいてよい。さらに、活性化合物の懸濁剤は、適切な油状注射懸濁剤として調製することができる。適切な親油性溶媒又は賦形剤は、ゴマ油などの脂肪油又はオレイン酸エチル若しくはトリグリセリドなどの合成脂肪酸エステル又はリポソームなどである。場合によって、懸濁剤は、適切な安定化剤又は高度に濃縮された溶液の調製を可能にする化合物の溶解度を増加させる物質も含んでいてよい。
【0063】
薬剤組成物は、塩として提供することができ、塩酸、硫酸、酢酸、乳酸、酒石酸、リンゴ酸、コハク酸等を含むが、これらに限定されない多くの酸を用いて生成させることができる。塩は、対応する遊離塩基形より、水性溶媒又は他のプロトン性溶媒に溶けやすい傾向がある。
【0064】
薬剤組成物は、全身的又は局所的に、例えば、急性冠症候群の病状の部位の近くに投与することができる。さらに、全身投与は、特定の領域又は問題の組織型に標的を定めることができる投与を含むことを意味する。
【0065】
薬剤組成物は、例えば、プラーク破裂に伴う胸痛、肩、腕、歯、顎、腹部若しくは背部に放射される疼痛又は息切れ又は咳、ふらつき感、失神、悪心、嘔吐、発汗又は不安などの急性プラーク破裂の最初の症状の発生時に直ちに投与することが好ましい。他の症状は、当業者及び医師には明らかであり、本発明の薬剤組成物を投与するためのシグナルと言える。代替的に及び/又はさらに、薬剤組成物は、症状の発生直後、例えば、症状の発生の数分以内に投与することができる。代替的に及び/又はさらに、薬剤組成物は、症状の発生後1時間以内に、又は約2時間目に、又は約3時間目若しくは約4時間目に、又は約5時間目若しくは約6時間目、1〜3日以内までに投与することができる。
【0066】
他の療法において、薬剤組成物をプラーク破裂のリスクが高い患者に投与する。例えば、本発明の組成物は、例えば、血管形成術などのプラーク破裂のリスクを増加させる手技の前に患者に投与することができる。組成物をそのような手技の3日前までに投与することが好ましい。また好ましくは、投与は、手技の1〜6時間前又は手技の1時間以内又は手技の1時間未満前又は数分以内であってよい。当業者は、例えば、体重、病歴及び遺伝的素因などの個々の患者に固有の種々の生理的因子及び実施される手技の複雑さなどのプラーク破裂の予想されるリスクに影響を及ぼす種々の因子によって、投与の適切な時期を容易に決定することができる。
【0067】
本明細書で引用したすべての公表論文、単行本、参照手引書及び抄録は、本発明が関係する最先端技術をより十分に記述するためにそれらの全部を参照により本明細書に組み込む。
【0068】
上記の対象について本発明の範囲及び精神から逸脱することなく種々の変更を行うことができるので、上の記述に含まれている、又は添付した特許請求の範囲に規定されているすべての対象は、本発明を記述し、説明するものと解釈されることを意図するものである。本発明の修正及び変形形態は、上の教示に照らして可能である。
【実施例】
【0069】
6.実施例
本明細書に記載する以下の実施例は、本発明を実施する様々な態様を説明し、例示することを意味するものであって、いかなる意味においても本発明を制限することを意図するものではない。
【0070】
6.1 梗塞の領域の大きさに対するリポソームアレンドロネートの効果
梗塞の領域の大きさに対する封入ビスホスフェートの投与の効果をウサギAMIモデルにおいて試験した。直径が約0.150μmのリポソームアレンドロネートを以下の概要を用いて調製した。
a.脂質、DSPC、DSPG及びコレステロールを1/1エタノール/tert−ブタノールに溶解する。
b.アレンドロネートを含む緩衝液を溶媒で希釈して、大きい多層小胞(MLVs)を発生させる。
c.MLVsを200nmポリカーボネートフィルターを通して押出し、大きい単層の150±20nm小胞(LUVs)を得る。
d.LUVsを限外ろ過して、非封入アレンドロネートを除去する。
e.滅菌ろ過する。
【0071】
8匹の体重2.5〜3.5kgのニュージーランドホワイト種雄ウサギに通常の飼料と水を自由に摂取させた。ウサギに生理食塩水(対照)又はリポソームアレンドロネート(3mg/kg、i.v.)を冠動脈閉塞と同時の単回注入として無作為に投与した。ウサギをケタミン/キシラジン(35mg/kg、5mg/kg)及びイソフルランにより麻酔した。実験は、挿管とバランス酸素中イソフルランを用いた機械的換気による呼吸補助並びに連続心エコー図(BCG)及び動脈血圧(耳動脈内カテーテル)モニタリングのもとで実施した。胸部造瘻術を第4肋間隙を通して実施した後、心膜切開術及び心臓周囲クラドルの造設を行った。左冠動脈主幹部を特定し、大側枝を5−0絹縫合糸及びスネアにより取り囲んだ。その後、スネアを30分間締めた。虚血は、ECG変化(ST−T部分上昇)、セグメント呈色の変化及び運動低下によって確認した。30分後に、スネアを開放し、血流の再開を確認した。縫合糸を所定の位置に残し、ゆるめ、胸腔を層ごとに閉鎖した。痛覚脱出のためにブプレネックスをウサギにさらに2〜3日間投与した。ペントタールによる麻酔後に、ウサギを7日後に屠殺し、心臓を採取した。冠動脈を上行大動脈を介して生理食塩水で潅流した後、以前に閉鎖した冠動脈上の縫合糸を締め、0.5%エバンスブルー溶液(Sigma社製)で冠動脈を潅流して、再内皮化の領域を染色した(血液の存在)。エバンスブルーにより非染色の左室領域をリスクのある領域と定義した。次いで、心臓を−20℃で24時間凍結し、2mm間隔の横断切片に切断した。心臓の薄切片を生体染色塩化トリテトラゾリウム(TTC、1%、Sigma社製)中で30分間インキュベートし、10%中性緩衝ホルマリンで固定して、組織の処理前に生存していた細胞を染色した。TTCにより染色されなかった左室領域(白色)は、梗塞の領域と定義した。次いで、染色した切片を写真撮影し、ディジタルプラニメトリ(Photoshop)により処理した。
【0072】
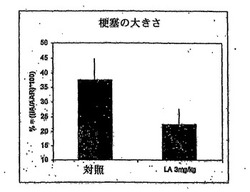
リポソームアレンドロネートを投与したウサギは、リスクのある領域の29.5±6%の梗塞の領域を有していた。これは、リスクのある領域の42±5.5%の梗塞の領域を示した対照ウサギ(リポソームアレンドロネートを投与しなかった)と対照的であった(図1)。したがって、リポソームアレンドロネートは梗塞の領域の低減に有効であった。投与群に副作用は認められなかった。
【0073】
6.2 心筋の形態に対するリポソームアレンドロネートの影響
セクション6.1で処置したウサギは、ヘマトキシリン及びエオシン染色により示されたように心筋の形態の変化を示した。対照ウサギはゆがんだ心筋の形態を有する(図2A)が、リポソームアレンドロネートを投与したウサギはより正常な形態を示している(図2B)。
【0074】
6.3 マクロファージ浸潤に対するリポソームアレンドロネートの影響
セクション6.1で処置したウサギは、リポソームアレンドロネートを投与したウサギにおけるマクロファージ浸潤の低減を示した。ウサギの心臓の代表的な切片をRAM11+マクロファージの免疫染色に供した。リポソームアレンドロネートを投与したウサギの切片(図3B)は、対照ウサギの切片(図3A)より少ない染色を示し、したがって、少ないRAM11+マクロファージ蓄積を有していた。
【0075】
リポソームアレンドロネートは、全身循環単球の数を減少させることも示された。ウサギに生理食塩水(対照)又はリポソームアレンドロネート(3mg/kg、i.v.)を投与した。循環血中の単球のレベルは、CD−14のFACS分析を用いて測定した。リポソームアレンドロネートの注射の48時間後に、血中単球集団は対照群と比較して75〜95%減少した。
【図面の簡単な説明】
【0076】
【図1】ウサギにおける一過性の冠動脈閉塞後の梗塞領域の大きさに対するリポソームアレンドネート投与の効果を示す図である。梗塞領域の大きさは、閉塞動脈によって血液供給され、その後の梗塞のリスクがある左室面積の%値としての梗塞領域の面積として計算した。データは平均値±SDとして表し、nは群当たり4であり、p値はp<0.05である。
【図2A−2B】ウサギにおける可逆性冠閉塞後の心筋の形態に対するリポソームアレンドロネート投与の効果を示す図の対照ウサギに関する図である。対照ウサギ(A)はゆがんだ心筋形態を有するが、リポソームアレンドロネートを投与したウサギ(B)はより正常な心筋形態を有する。
【図3A−3B】ウサギにおける可逆性冠閉塞後のリポソームアレンドロネート投与後のマクロファージ浸潤の減少を示す図の対照ウサギに関する図である。対照ウサギ(A)は、リポソームアレンドロネートを投与したウサギ(B)と比較して梗塞の領域におけるRAM11+マクロファージの蓄積の増加を示している。
【技術分野】
【0001】
1.発明の分野
本出願は、その全部が参照として組み込まれる2003年6月27日に提出した米国出願番号10/607623の一部継続出願である。
【0002】
本発明は、急性冠症候群(acute coronary syndrome)、特に、不安定狭心症(unstable angina)及び急性心筋梗塞の治療又は管理のために計画した方法及び組成物に関する。本発明の方法は、マクロファージ及び単球を含むが、これらに限定されない食細胞(phagocytic cell)の活性を特異的に低下若しくは阻害、且つ/又はその量を消失若しくは減少させる1種又は複数の治療薬を含む製剤の有効な量の投与を含む。
【背景技術】
【0003】
2.発明の背景
冠動脈疾患は、先進工業国における主な死亡の原因である。米国では、心臓発作の50〜60%が実証された冠動脈疾患を有さない人に発生している。この疾患の病理への主な寄与因子は、アテロームプラークの形成である。アテロームプラークは、コレステロール、増殖平滑筋細胞及び炎症細胞の蓄積に起因した血管壁における肥厚した部分である。
【0004】
アテロームプラーク
一般的に、アテロームプラークは、線維性被膜によって覆われた細胞外脂質の中心コアを有する限局的膨隆部位からなっている。アテロームプラーク内のコアは、結晶性コレステロール、コレステロールエステル、リン脂質、細胞分解産物及びコラーゲン残遺物を含む。線維性被膜は、血管又は動脈の内腔からアテロームプラークのコアを分離し、コラーゲン、エラスチン、プロテオグリカン及び他の細胞外マトリックス物質から構成されている高密度の線維性細胞外マトリックスである結合組織から主として構成されている。線維性被膜は、厚さ、平滑筋細胞及びマクロファージの数並びにコラーゲン含有量が異なる(Vallabhajosula et al., 1997, J. Nucl. Med. 38(11): 1788-1796)。
【0005】
アテロームプラークは、活動性で破裂しやすい(「脆弱若しくは高リスクプラーク」)又は不活動性で比較的安定(「安定プラーク」)と特徴づけることができる。脆弱で、高リスク又は破裂しやすいプラークは、多数の炎症細胞(マクロファージなど)、薄い線維性被膜及び大きい脂質コアを特徴とする。アテロームプラーク内の脂質プールの大きさ及びそれを覆う線維性被膜の厚さは、プラークの安定性を予測する重要な特性である。線維性被膜の縁(肩の部分)は、高い応力がかかる位置であり、一部、プラークの破裂をもたらし得るその部分における炎症細胞(マクロファージなど)の蓄積と線維性被膜を構成する物質の分解を引き起こす酵素の分泌(Moreno et al, Circulation, 1994, 90:775-8; van derWal et al., 1994, Circulation, 89:36-44; Jander et al, 1998, Stroke, 29:1625-1630)のため、破裂しやすい。
【0006】
脂質蓄積プラークの破裂により、高度にトロンボゲン形成性のコア及び動脈壁の内皮下血管平滑筋細胞成分が循環血に曝露される。血小板の活性化、付着及び凝集がこれに続いてほとんど即時に起こる。血小板の付着及び活性化は、凝固因子の放出及び凝固カスケードの開始をもたらす。放出された増殖因子、特に血小板由来増殖因子(PDGF)は、血管平滑筋細胞の増殖と移動を刺激する。血管平滑筋細胞の増殖と移動は、プラークリモデリング及び血管狭窄の増加をもたらし、又は、血小板と相互作用して、血栓形成の増大をもたらし得る(Pasterkamp et al., 2000, J, Clin. Basic Cardiol. 3:81-86)。脆弱プラークによってもたらされる、結果として生ずる血栓症は、不安定狭心症、急性心筋梗塞、脳卒中、末梢動脈疾患の急性悪化又は突然冠動脈死をもたらし得る。
【0007】
不安定狭心症
心臓は、機能するために酸素に富む血液を必要とする。右及び左冠動脈は、大動脈から枝分かれし、酸素化血液を心臓の組織に運ぶ。冠動脈が心臓に十分な量の酸素に富む血液を送ることができない(低酸素と呼ばれる状態)とき、狭心症として一般的に知られている胸痛、圧迫感又は不快感が生ずる。この状態が長引くと、酸素状態の悪化により、可逆的又は非可逆的に心筋自体が損傷を受ける可能性がある(虚血として知られる状態)。
【0008】
狭心症は、重症度及び発生のパターンによって安定又は不安定に大別される。安定狭心症は、身体活動の増加(例えば、道を急ぐ又は長い階段を上る)が酸素に富む血液の要求量を増加させるときに起こる。存在し得る複数の因子(その最も一般的なものは1つ又は複数の閉塞冠動脈)のため、冠血流によってもたらされる供給が需要の増加を満たすことができず、低酸素症が発生する。不安定狭心症は、より低い程度の身体運動で、高い頻度で、又は安静時(すなわち、身体運動なしで)に起こる狭心痛と理解される。安静時に起こる不安定狭心症は、その最も重篤な形の状態である。これは、通常、未破裂プラークの部位の冠動脈内の凝血塊の形成によって引き起こされ、未治療のまま放置すると、心臓発作及び心臓への不可逆性の損傷をもたらす可能性がある。
【0009】
不安定狭心症は、不安定になった脆弱プラークの部分的破裂に起因する可能性がある。プラークの部分的破裂は、血栓を発生させるが、動脈を完全には閉塞しない。内因性抗凝血(clot−fighting)メカニズムが凝血塊を分解する役割を果たすが、時間の経過に伴い、プラークは破裂し続け、凝固エピソードが繰り返される。この患者はまだ心筋梗塞に罹っていなかった可能性があるが、そのリスクは高い(例えば、不安定プラークが完全に破裂する場合、又は内因性凝血闘争メカニズムが動脈の完全閉塞の前に凝血塊を除去できない場合)。不安定狭心症を有する患者から死後に採取した崩壊した線維性被膜は、安定狭心症の症例のプラークより、プラーク破裂部位においてマクロファージによって著しく浸潤されていることが多い。
【0010】
急性心筋梗塞
急性心筋梗塞(「AMI」)は、心筋組織の壊死につながる一般的臨床状態を指す。この状態は、当技術分野でよく知られており、疼痛(ほとんどの症例で胸内)の発生、特徴的な心電図変化及び壊死性心臓組織によって放出される細胞内酵素(クレアチニンホスホキナーゼ及びα−ヒドロキシ酪酸など)又は心臓タンパク質(トロポニン複合体の成分及びミオグロビンなど)の血漿濃度の増加によって特徴づけられる。AMIは、低血圧、循環不全、肺浮腫及び不整脈を伴うことがある。すべてではないが、ほとんどの症例において、AMIは、血管が閉塞した状態になり、次いで、危険にさらされる心筋への血流の障害を引き起こす、冠血管における血管損傷及び血栓症に起因する(Fuster et al., 1992, New Engl. J. Med., 326:242-310)。ほとんどの症例において、冠血管の閉塞の時間は、病歴、心筋酵素の血漿中濃度の経過及び心電図変化から推定することができる。
【0011】
多くの心筋梗塞(心臓発作)の最初の事象は、アテロームプラークの破裂である。そのような破裂は、梗塞区域に血流を供給している冠動脈における血栓又は凝血塊の形成をもたらす可能性がある。梗塞区域又は領域は、一般的に言われているように、血液循環の閉鎖に起因する壊死の領域である。形成された血栓は、フィブリンと血球との組合せからなっている。凝血塊によって引き起こされた閉塞の位置、程度及び持続時間は、梗塞領域の大きさと損傷の程度を決定する。最終的には、冠閉塞によって引き起こされた心筋損傷の程度は、罹患した血管によって血液供給を受けている「領域」、血管の閉塞の程度、側副血管により罹患組織に供給される血液の量及び血液供給が突然制限された心筋の酸素要求量に依存する(Pasternak and Braunwald, 1994, Acute Myocardial Infarction, Harrison's Principles of Internal Medicine, 13thEd., pgs.1066-77)。
【0012】
マクロファージ及び炎症反応
マクロファージは、いくつかの冠症候群の原因及び/又は病理に関与している。プラークの線維性被膜を分解するタンパク質分解タンパク質のマクロファージ分泌は、被膜の厚さを減少させると共にさらなるマクロファージ浸潤を増加させ、それによりプラークの不安定性に寄与する。したがって、マクロファージはプラークの破裂における中心的な役割を有すると考えられ、それらが高濃度で存在することはそのような破裂の予測となると考えられる。実際に、アテロームプラークの線維性被膜の侵食及び/又は破綻は、動脈血栓形成を変化させ、急性虚血性事象の発生につながることが知られている。脆弱アテロームプラークの部位における破裂が、不安定狭心症、心筋梗塞又は突然死などの急性冠症候群の最も頻度の高い原因であることは明らかである。
【0013】
炎症は、急性心筋梗塞の病因並びにAMI後の治癒及び修復に関連づけられている。心筋虚血は、炎症反応を促進する。さらに、AMIの現行の急性療法の主体である再潅流も炎症を促進する。再潅流は、閉塞性血栓の急速な溶解及びその血液供給が遮断された心臓の領域への血流の回復を伴う。虚血性心筋組織における炎症細胞の存在は、損傷に対する病態生理学的反応であると伝統的に信じられてきた。しかしながら、実験的研究により、治癒に不可欠であるが、炎症細胞、具体的には食細胞であるマクロファージの組織への流入は虚血のみによって引き起こされるものを超えた組織損傷をもたらすことが示された。
【0014】
マクロファージ及び他の白血球は、虚血の直後に心筋に浸潤する。マクロファージは、線維芽細胞の増殖を刺激するいくつかのサイトカインを分泌する。しかし、活性化したマクロファージは、心筋損傷を促進するサイトカイン及び他のメディエーターも分泌する。したがって、心筋へのマクロファージの流入は心筋壊死を増加させ、梗塞の区域を拡大させる。したがって、炎症の急性期は治癒過程における必要な反応であるが、持続的活性化は、梗塞領域及びそれを取り囲む領域、すなわち、いわゆる「梗塞周囲区域」に実際に有害である。
【0015】
心筋虚血後の炎症反応は、活性化マクロファージにより引き起こされる結果として生ずる損傷の重症度を判定するうえで非常に重要である。炎症性走化因子(マクロファージ化学誘引タンパク質−1(MCP−1)、マクロファージ炎症性タンパク質−1α(MIP−1α))の血漿中濃度はその後の心不全及び左室不全と相関することが示された(例えば、Parissis, et al., J. Interferon Cytokine Res., 22(2):223-9を参照)。AMI後2及び3日目の末梢単球増加症(単球数の増加)は左室不全及び左室瘤を伴い、再潅流AMI後の左室リモデリングの発生における単球の役割が示唆される(Maekawa Y. et al., 2002, J. Am. Coll. Cardiol., 39(2):241-6)。急性心筋梗塞後の左室リモデリングは、進行性左室拡張が後続する梗塞拡大の過程であり、有害な臨床転帰を伴う。さらに、マクロファージ化学誘引タンパク質−1(MCP−1)の血漿中濃度は、急性心筋梗塞を有する患者において高い。MCP−1は心筋虚血/再潅流損傷によって誘導され、このケモカインの中和は梗塞のサイズを有意に減少させる。
【0016】
いくつかの冠閉塞/再潅流モデルにおける冠閉塞後の非特異的抗炎症複合体による炎症反応の抑制は、梗塞範囲を低減することが示された(例えば、Squadrito, et al., 1997, Eur. J. Pharmacol, 335:185-92; Libby, et al., 1973, J. Clin. Invest., 3:599-607; Spath, et al., 1974, Circ. Res., 35: 44-51を参照)。しかし、これらの非特異的療法は瘢痕形成及び治癒の妨害並びに一部の患者における動脈瘤の発生及び心室壁の破裂などの副作用を伴う。したがって、これらの療法は臨床使用から除外される。しかし、抗炎症性サイトカインであるインターロイキン−10の欠乏に起因するマクロファージ機能を抑制する低い能力を有する動物モデルは、冠閉塞モデルにおける梗塞サイズの増加及び心筋壊死に罹ることが示された(Yang Z. et al., 2000, Circulation, 101:1019-1026)。
【特許文献1】米国出願番号10/607623
【非特許文献1】Vallabhajosula et al., 1997, J. Nucl. Med. 38(11): 1788-1796
【非特許文献2】Moreno et al, Circulation, 1994, 90:775-8
【非特許文献3】van der Wal et al., 1994, Circulation, 89:36-44
【非特許文献4】Jander et al, 1998, Stroke, 29:1625-1630
【非特許文献5】Pasterkamp et al., 2000, J, Clin. Basic Cardiol. 3:81-86
【非特許文献6】Fuster et al., 1992, New Engl. J. Med., 326:242-310
【非特許文献7】Pasternak and Braunwald, 1994, Acute Myocardial Infarction, Harrison's Principles of Internal Medicine, 13thEd., pgs.1066-77
【非特許文献8】Parissis, et al., J. Interferon Cytokine Res., 22(2):223-9
【非特許文献9】Maekawa Y. et al., 2002, J. Am. Coll. Cardiol., 39(2):241-6
【非特許文献10】Squadrito, et al., 1997, Eur. J. Pharmacol, 335:185-92
【非特許文献11】Libby, et al., 1973, J. Clin. Invest., 3:599-607
【非特許文献12】Spath, et al., 1974, Circ. Res., 35: 44-51
【非特許文献13】Yang Z, et al., 2000, Circulation, 101:1019-1026
【発明の開示】
【発明が解決しようとする課題】
【0017】
本発明の1つの目的は、急性冠症候群(特に、不安定狭心症又は/及び心筋梗塞)に罹患している患者における食細胞(特に、マクロファージ及び単球)の蓄積及び/又はそれらからの因子の分泌を含む生物学的機能を阻害することができる治療薬の特定である。
【0018】
本発明の他の目的は、急性冠症候群(特に、不安定狭心症又は/及び心筋梗塞)を治療並びにこれらの症候群に伴うプラークを安定化する方法の開発である。
【課題を解決するための手段】
【0019】
3.発明の概要
本発明は、急性冠症候群、特に、不安定狭心症及び急性心筋梗塞の治療又は管理のために計画した方法及び組成物に関する。本発明の方法は、マクロファージ及び単球を含むが、これらに限定されない食細胞の活性を特異的に阻害し、且つ/又はその量を減少させる1種又は複数の治療薬を含む製剤の有効な量の投与を含む。本発明による1つ又は複数の治療薬を含む製剤の投与は、患者の冠症候群を安定化することを目的とする急性療法としての役割を果たす。1つの実施形態において、1つ又は複数の治療薬を含む製剤を、不安定狭心症に罹患している患者に脆弱又は不安定プラークを安定化するために投与する。他の実施形態において、製剤を、急性心筋梗塞に現在罹患している、又は最近罹患した患者に梗塞のサイズ及び心筋壊死を最小限にするために投与する。
【0020】
好ましい実施形態において、製剤は特に食細胞を標的とする。食細胞は食作用という特有の能力を有するため、これらの実施形態において、製剤は、主として又はもっぱら食作用により細胞に入るような特性の粒子を含むように調製する。製剤は、封入治療薬、包埋治療薬又は微粒子状治療薬を含んでいてよい。食作用を受けたならば、治療薬は製剤から標的食細胞、例えば、マクロファージ及び単球内に放出され、食細胞の機能を阻害し、且つ/又はそれを破壊する。
【0021】
1つの実施形態において、本発明は、それを必要とする個人に封入治療薬を含む製剤の有効な量を投与することによって急性冠症候群を治療する方法に関する。治療薬を特定の大きさの適切な担体に封入する。製剤は、主として又はもっぱら食作用により製剤が取り込まれることを可能にする、例えば、大きさ又は電荷などのその特性により食細胞を特に標的とする。製剤が食細胞により取り込まれたならば、封入された治療薬は放出され、薬剤は食細胞の活性を阻害し、且つ/又はそれを破壊することができる。
【0022】
他の実施形態において、本発明は、それを必要とする個人に包埋治療薬を含む製剤の有効な量を投与することによって急性冠症候群を治療する方法に関する。治療薬を特定の大きさの適切な担体に包埋する。製剤は、主として又はもっぱら食作用により製剤が取り込まれることを可能にする、例えば、大きさ及び/又は電荷などのその特性により食細胞を特に標的とする。食細胞内に入ったならば、埋め込まれた治療薬は放出され、薬剤は食細胞の活性を阻害し、且つ/又はそれを破壊することができる。
【0023】
他の実施形態において、本発明は、それを必要とする個人に微粒子状治療薬を含む製剤の有効な量を投与することによって急性冠症候群を治療する方法に関する。治療薬は、特定の大きさの微粒子に成形する。製剤は、主として又はもっぱら食作用により製剤が取り込まれることを可能にする、例えば、大きさ及び/又は電荷などの微粒子状特性により食細胞を特に標的とする。食細胞内に入ったならば、微粒子状治療薬は食細胞の活性を阻害し、且つ/又はそれを破壊することができる。
【0024】
本発明はまた、それを必要とする個人に封入、包埋又は微粒子状治療薬を含む製剤の有効な量を投与することによって急性冠症候群に伴うプラークを安定化する方法に関する。
【0025】
さらなる実施形態において、本発明は、急性冠症候群の治療用の封入治療薬、包埋治療薬及び微粒子状治療薬からなる群から選択される製剤並びに製薬上許容できる賦形剤、担体、安定化剤又は希釈剤を含む、不安定狭心症及び急性心筋梗塞などの急性冠症候群に現在罹患している、又は最近罹患した対象に投与するための薬剤組成物を含む。
【0026】
本発明の製剤は、好ましくは0.03〜1.0ミクロンの大きさである。しかし、薬剤及び/又は用いる担体の種類によって、より好ましい範囲は、0.07〜0.5ミクロン、0.1〜0.3ミクロン及び0.1〜0.18ミクロンを含むが、これらに限定されない。
【発明を実施するための最良の形態】
【0027】
5.発明の詳細な説明
食細胞、特に、マクロファージ及び単球は、いくつかの冠症候群の原因及び/又は病理に関与している。マクロファージ/単球は、被膜の厚さを減少させるだけでなく、当該部位へのさらなるマクロファージ/単球を動員する役割も果たす種々の物質の分泌によりプラークの線維性被膜を分解する。線維性被膜の分解は、プラークの脂質コアの血液への曝露並びに血栓を生じさせる凝固カスケードの開始につながる。血栓は、内腔を部分的に閉塞して不安定狭心症をきたすことがあり、又は内腔を完全に閉塞して急性心筋梗塞を引き起こすことがある。急性心筋梗塞が発生したならば、マクロファージ/単球は、損傷した心筋組織に動員され、心筋損傷を促進し、それにより虚血のみによって引き起こされる以上の組織損傷をもたらすサイトカイン及び他のメディエーターを分泌し、心筋壊死を増加させて、梗塞の領域を拡大する。食細胞の完全且つ慢性活動不能化及び/又は除去は望ましくないが、食細胞活性及び/又は存在のそのような減少は、患者を安定化し、且つ/又は冠症候群の障害を低減するために、急性冠症候群の罹患中又は後の短い期間には望ましい。
【0028】
本発明は、急性冠症候群(不安定狭心症及び急性心筋梗塞を含むが、これらに限定されない)の治療又は管理のための、急性冠症候群の罹患中若しくは後の急性短期間、食細胞(マクロファージ及び単球を含むが、これらに限定されない)の活性を低下若しくは阻害し、且つ/又はその量を消失若しくは低減するように計画した方法及び組成物に関する。本発明の方法は、患者における食細胞(マクロファージ及び単球を含むが、これらに限定されない)の活性を特異的に低下若しくは阻害し、且つ/又はその量を消失若しくは低減する1つ又は複数の治療薬を含む有効な量の製剤の投与を含む。1つ又は複数の治療薬を含む製剤の投与は、患者の安定化並びに/又は急性冠症候群による即時及び長期障害の最小化を目的とする急性短期療法と考えられる。1つの実施形態において、1つ又は複数の治療薬を含む製剤を不安定狭心症に罹患している患者に脆弱又は不安定プラークを安定化し、急性心筋梗塞の即時の脅威を低減するために投与する。他の実施形態において、1つ又は複数の治療薬を、急性心筋梗塞に現在罹患している、又は最近罹患した患者に梗塞の大きさ及び心筋壊死を最小限にするために投与する。
【0029】
本発明の方法に用いる製剤は、患者における食細胞の活性を特異的に低下若しくは阻害し、且つ/又はその量を消失若しくは低減する。製剤の特異性は、特定の細胞型(例えば、マクロファージ及び/又は単球)のみに対して作用する組成物の能力に起因する。好ましい実施形態において、食細胞に対する製剤の特異性は、食細胞によるインターナリゼーションをもっぱら又は主として受けることができるような製剤の物理化学的特性、例えば、大きさ又は電荷に起因する。食作用を受け、細胞内に入ったならば、治療薬は、食細胞の活性を阻害又は低下させ、且つ/又は食細胞を破壊する。特定の作用機序に束縛されることを意図するものではないが、製剤の治療薬は、食細胞を機能不能にし、且つ/又は破壊する前に、細胞内に入ったときに放出される。
【0030】
本発明の製剤、例えば、封入治療薬、包埋治療薬又は微粒子状治療薬は、炎症反応における重要な引き金である細胞、すなわち、マクロファージ及び/又は単球を一時的に枯渇且つ/又は不活性化することによって炎症反応を抑制する。封入薬剤、包埋薬剤又は微粒子状薬剤は、マクロファージ及び単球によって食作用により取り込まれる。これに対して、非食細胞は、製剤の大きさが大きく、且つ/又は他の物理化学的特性のため、製剤を取り込むことができない。
【0031】
本明細書で用いているように「食作用」という用語は、食細胞内への好ましい侵入の手段を指し、当技術分野で十分に理解されている。しかし、この用語は、同じ作用も実現する他の形のエンドサイトーシスも含むと理解すべきである。特に、飲作用、受容体媒介性エンドサイトーシス及び細胞外から物質を吸収/インターナリゼーションする他の細胞の手段も本発明の方法及び組成物によって包含されることが理解される。
【0032】
本発明は、不安定狭心症及び急性心筋梗塞などの急性冠症候群に現在罹患している、又は最近罹患した対象に投与するための本発明の1つ又は複数の治療薬を含む薬剤組成物も提供する。
【0033】
5.1 治療薬
本発明の製剤及び方法に用いる治療薬は、製剤の大きさ又は電荷などの物理化学的特性により、患者における食細胞の活性を特異的に低下若しくは阻害し、且つ/又は食細胞の量を消失若しくは低減する。治療薬は、マクロファージ又は単球などの食細胞内に入ったならば、もはや正常に機能且つ/又は生存することができないように食細胞を阻害、破壊、抑制、修飾且つ/又は変化させる細胞阻害物質、不活性化物質、トキシン、抑制物質及び/又は細胞増殖抑制/細胞毒性物質であってよい。
【0034】
本明細書で用いている、「治療薬」という用語は、製剤を構成又は製剤の一部を構成し、製剤に不活性化/毒性効力を与える、例えば、食細胞の活性を阻害若しくは低下させ、且つ/又は食細胞を除去若しくはその量を低減する分子を指す。治療薬となり得る化合物には、無機若しくは有機化合物;無機若しくは有機化合物を含むが、これらに限定されない小分子(500ダルトン未満)若しくは大分子;ペプチド、ポリペプチド、タンパク質、翻訳後修飾タンパク質、抗体等を含むがこれらに限定されないタンパク質性分子;2本鎖DNA、1本鎖DNA、2本鎖RNA、1本鎖RNA若しくは三重らせん核酸分子を含むがこれらに限定されない核酸分子が含まれるが、これらに限定されない。化合物は、あらゆる既知の生物(動物、植物、細菌、真菌、原生生物又はウイルスを含むが、これらに限定されない)から、又は合成分子のライブラリーから得られる天然産物であってよい。治療薬は、単量体であっても、重合化合物であってもよい。
【0035】
好ましい実施形態において、好ましい治療薬はビスホスホネート又はその類似体であってよい。本明細書で用いている「ビスホスホネート」という用語は、ジェミナル及び非ジェミナルビスホスホネートを意味する。具体的な実施形態において、ビスホスホネートは次の式(I)を有する。
【0036】
【化1】

式中、R1はH、OH又はハロゲン原子であり、R2はハロゲン、ヘテロアリールで場合によって置換されている線状若しくは分枝C1〜C10アルキル若しくはC2〜C10アルケニル、又はアミノが第一級、第二級若しくは第三級であってよいヘテロシクリルC1〜C10アルキルアミノ若しくはC3〜C8シクロアルキルアミノ、Yが水素、C3〜C8シクロアルキル、アリール若しくはヘテロアリールである−NHYであるか、或いはR2はZがクロロ置換フェニル若しくはピリジニルである−SZ。
【0037】
より具体的な実施形態において、ビスホスホネートは、アレンドロネート又はその類似体である。そのような実施形態において、アレンドロネートは次の式(II)を有する。
【0038】
【化2】

【0039】
他の具体的な実施形態において、さらなるビスホスホネートを本発明の方法に用いることができる。他のビスホスホネートの例は、クロドロネート、チルドロネート、3−(N,N−ジメチルアミノ)−1−ヒドロキシプロパン−1,1−ジホスホン酸、例えば、ジメチル−APD、1−ヒドロキシ−エチリデン−1,1−ビスホスホン酸、例えば、エチドロネート、1−ヒドロキシ−3(メチルペンチルアミノ)−プロピリデン−ビホスホン酸(イバンドロン酸)、例えば、イバンドロネート、6−アミノ−1−ヒドロキシヘキサン−1,1−ジホスホン酸、例えば、アミノ−ヘキシル−BP、3−(N−メチル−N−ペンチルアミノ)−1−ヒドロキシプロパン−1,1−ジホスホン酸、例えば、メチル−ペンチル−APD、1−ヒドロキシ−2−(イミダゾル−1−イル)エタン−1,1−ジホスホン酸、例えば、ゾレンドロン酸、1−ヒドロキシ−2−(3−ピリジル)エタン−1,1−ジホスホン酸(リセドロン酸)、例えば、リセドロネート、3−[N−(2−フェニルチオエチル)−N−メチルアミノ]−1−ヒドロキシプロパン−1,1−ビスホスホン酸、1−ヒドロキシ−3−(ピロリジン−1−イル)プロパン−1,1−ビスホスホン酸、1−(N−フェニルアミノチオカルボニル)メタン−1,1−ジホスホン酸、例えば、FR78844(フジサワ)、5−ベンゾイル−3,4−ジヒドロ−2H−ピラゾール−3,3−ジホスホン酸テトラエチルエステル、例えば、U81581(アップジョン)及び1−ヒドロキシ−2−(イミダゾ[1,2−a]ピリジン−3−イル)エタン−1,1−ジホスホン酸、例えば、YM529又はその類似体を含むが、これらに限定されない。
【0040】
治療薬を含む他の製剤は、ガリウム、金、セレン、ガドリニウム、シリカ、ミトラマイシン、パクリタキセル、シロリムス、エベロリムス及びその他の同様な類似体を含むが、これらに限定されない。一般的に、例えば、5−フルオロウラシル、シスプラチン、アルキル化剤などの化学療法薬、例えば、ステロイド、アスピリンなどの他の抗増殖又は抗炎症化合物及び非ステロイド抗炎症薬も製剤に用いることができる。
【0041】
本発明は、急性冠症候群を管理又は治療するための1つ又は複数の製剤の投与を含むことを意味する。複数の製剤を患者に併用して投与することができる。「併用して」という用語は、正確に同時の製剤の投与に限定されないが、別の方法で投与した場合より高い有効性を得るように、製剤を患者に順に、共に作用することができるような時間内に投与することを意味する。例えば、各製剤を同時に、又は異なる時点にある順序で逐次的に投与することができる。しかし、同時に投与しない場合、所望の治療効果を得るように十分に近い時間で投与すべきである。各製剤を適切な形で、治療薬を適切又は所望の作用部位に効率的に輸送する適切な経路により別個に投与することができる。好ましい投与方法は、静脈内(IV)及び動脈内(IA)などである。他の適切な投与方法は、筋肉内(IM)、皮下(SC)並びに腹腔内(IP)及び経口(PO)などである。そのような投与は、ボーラス注射又は注入であってよい。他の投与方法は、血管周囲送達であってよい。製剤は、直接又は希釈後に投与することができる。上記の投与経路のいずれかの組合せも本発明により用いることができる。
【0042】
種々の実施形態において、製剤を1時間未満の間隔で、約1時間の間隔で、約1時間から約2時間の間隔で、約2時間から約3時間の間隔で、約3時間から約4時間の間隔で、約4時間から約5時間の間隔で、約5時間から約6時間の間隔で、約6時間から約7時間の間隔で、約7時間から約8時間の間隔で、約8時間から約9時間の間隔で、約9時間から約10時間の間隔で、約10時間から約11時間の間隔で、約11時間から約12時間の間隔で、24時間以下の間隔又は48時間以下の間隔で投与する。1つの実施形態において、2つ又はそれを超える製剤を同時に、又は同じ患者来院時の範囲内で投与する。
【0043】
5.1.1 治療薬の特定
本発明は、治療薬として用いることができる化合物をスクリーニングする方法を提供する。特定の作用機序に束縛されることを意図するものではないが、本発明の方法に用いるための治療薬である化合物は、製剤自体の物理化学的特性により食細胞の標的とされるならば、i)食細胞活性を阻害し、ii)食細胞活性を低下させ、iii)循環から、及び/又は急性冠症候群に罹患した領域から食細胞を除去し、且つ/又はiv)循環における、及び/又は急性冠症候群に罹患した領域における食細胞の数を減少させることができる。
【0044】
治療薬をスクリーニングする方法は、一般的に候補化合物を食細胞とともにin vitro又はin vivoでインキュベートし、次いで、食細胞の活性又は寿命の変化(例えば、減少)を測定し、それにより、本発明において用いるための治療薬である化合物を特定することを含む。当技術分野で知られているいずれかの方法を用いて食細胞の活性又は寿命を測定することができる。1つの実施形態において、食細胞活性は、活性化刺激に対する細胞活性化のレベルによって測定する。例えば、マクロファージ/単球活性化は、マクロファージ化学誘引タンパク質−1(MCP−1)、及びマクロファージ炎症性タンパク質−1α(MIP−1α)などの走化因子並びにインターロイキン1β(IL−1β)及び組織壊死因子α(TNF−α)などのマクロファージによって産生される他の物質のレベルを定量することによって測定することができる。他の実施形態において、食細胞の寿命を測定する。例えば、細胞増殖は、3H−チミジン取り込みを測定することにより、直接細胞計数により、癌原遺伝子(例えば、fos、myc)などの既知の遺伝子の転写活性若しくは細胞周期マーカーの変化を検出することにより、又はトリパンブルー染色により測定することができる。当技術分野で知られているいずれかの方法を用いてmRNA転写のレベル(例えば、ノーザンブロット、RT−PCR、Q−PCR等により)又はタンパク質レベル(例えば、ELISA、ウエスタンブロット等)を測定することができる。
【0045】
1つの実施形態において、食細胞の活性を低下させる化合物は、
a)食細胞を、食細胞を活性化する化合物である第1の化合物及び候補化合物である第2の化合物と接触させ、
b)前記接触食細胞における活性化のレベルを測定する
ことにより特定され、前記第2の化合物の非存在下で前記第1の化合物と接触させた食細胞(すなわち、対照細胞)における活性化のレベルと比較して前記接触細胞における活性化が低下することは、前記第2の化合物が食細胞の活性を低下させることを示している。
【0046】
他の実施形態において、食細胞の量を減少させる化合物は、
a)食細胞を化合物と接触させ、
b)前記接触食細胞の生存率を測定する
ことにより特定され、前記化合物と接触させなかった食細胞(すなわち、対照細胞)の生存率と比較して前記接触細胞の生存率が低下することは、前記化合物が食細胞の量を減少させることを示している。
【0047】
他の実施形態において、食細胞の活性又は寿命を治療上望ましい仕方で変化させることが知られている化合物と比べて実質的に同様又は良好に食細胞の活性又は寿命を変化させる候補化合物の能力を測定する。本明細書で用いている「と実質的に同様」は、例示薬剤として食細胞に対する同様の作用を有する薬剤、すなわち、食細胞の活性、機能、運動性及び/又は枯渇を阻害する薬剤を指す。
【0048】
さらに、候補化合物を急性冠症候群の動物モデルに用いて本発明の方法に用いられるその能力を評価することができる。1つの実施形態において、ウサギAMIモデルを用いることができる(例えば、セクション6.1を参照)。
【0049】
5.2 治療薬の製剤
1つ又は複数の治療薬を含む製剤は、もっぱら又は主として食作用によりインターナリゼーションを受けるのに製剤の大きさが十分に大きくなるように調製し、それにより、食細胞に対する特異性を付与することができる。そのような製剤が細胞内に入った場合、非食細胞はそのような製剤の影響を受ける可能性はあるが、非食細胞がこのように調製した製剤をインターナリゼーションするメカニズムは存在しない。1つ又は複数の治療薬に外因性の特異性を付与する製剤の大きさの範囲は、好ましくは0.03〜1.0ミクロン、より好ましくは0.07〜0.5ミクロン、より好ましくは0.1〜0.3ミクロン、より好ましくは0.1〜0.18ミクロンである。
【0050】
当技術分野で知られているいずれかの方法を用いて、もっぱら又は主として食作用によりインターナリゼーションを受けるように治療薬を製剤に組み込むことができる。治療薬の製剤は、標的部位への薬剤の送達を容易にするのに十分な時間治療薬を封鎖することができる。さらに、治療薬の製剤は、標的部位の標的細胞(例えば、食細胞)内に存在するとき粒子から治療薬を放出することができる。
【0051】
1つの実施形態において、治療薬を所望の特性の担体(すなわち、封入剤)に封入する。特定の実施形態において、封入剤はリポソームである。リポソームは、当技術分野で知られているいずれかの方法により調製することができる(例えば、Monkkonen J. et al., 1994, J. Drug Target, 2:209-308; Monkkonen J. et al., 1993, Calcif. Tissue Int., 53:139-145; Lasic DD., Liposomes Technology Inc., Elsevier, 1993, 63-105.(chapter 3); WinterhalterM, Lasic DD, Chem Phys Lipids, 1993 Sep;64(1-3):35-43を参照)。リポソームは、正に荷電、中性又はより好ましくは負に荷電していてよい。リポソームは、脂質単層であってよく、又は多層であってよい。本発明による適切なリポソームは、例えば、ホスファチジルコリンホスホグリセロール及びコレステロールから調製されるような無毒性リポソームであることが好ましい。用いるリポソームの直径は、0.03〜1.0μmである。しかし、食細胞による食作用に適した他のサイズ範囲も用いることができる。
【0052】
他の実施形態において、治療薬を所望の特性の担体(すなわち、包埋剤)に包埋する。包埋する治療薬は、担体内に包埋、封入且つ/又は吸収され、担体マトリックスに分散され、担体表面上に吸着且つ/又は結合され、或いはこれらの形態のいずれかの組合せである治療薬などである。特定の実施形態において、包埋剤(又は担体)は、ミクロ粒子、ナノ粒子、メノスフェア、ミクロスフェア、ミクロカプセル又はナノカプセルである(例えば、M. Donbrow in: Microencapsulation and Nanoparticles in Medicine and Pharmacy, CRC Press, Boca Raton, FL, 347, 1991)。担体という用語は、重合体及び非重合体調製物を含む。特定の実施形態において、包埋剤はナノ粒子である。好ましくは、ナノ粒子は、直径が0.03〜1.0ミクロンであり、球状、非球状又は重合体粒子であってよい。治療薬は、ナノ粒子に包埋され、重合体マトリックスに均一若しくは不均一に分散され、表面上に吸着され、或いはこれらの形態のいずれかの組合せであってよい。好ましい実施形態において、ナノ粒子を製造するために用いる重合体は、ポリ(DL−ラクチドコグリコリド)重合体(PLGA)などの生体適合性且つ生分解性である。しかし、ナノ粒子を製造するために用いることができる別の重合体は、PLA(ポリ乳酸)及びそれらの共重合体、ポリ酸無水物、ポリアルキルシアノアクリレート(ポリイソブチルシアノアクリレート)、ポリエチレングリコール、ポリエチレンオキシド及びそれらの誘導体、キトサン、アルブミン、ゼラチン等を含むが、これらに限定されない。
【0053】
他の実施形態において、治療薬は微粒子状であり、粒子の各々が所望の特性を有する。微粒子状治療薬の形態は、担体内に封入、包埋又は吸収されていない不溶性懸濁又は分散微粒子の形態の治療薬を含む。微粒子状の治療薬は、薬剤の懸濁又は分散コロイド、凝集体、綿状凝集体、不溶性塩、不溶性複合体及び高分子鎖である治療薬を含む。そのような微粒子は、それらが保存/投与される液体(例えば、生理食塩水又は水)並びにそれらがそれらの治療効果を示す液体(例えば、血液又は血清)に不溶性である。一般的に、「不溶性」は10000部を超える溶媒中の1部の微粒子状治療薬の溶解性を指す。微粒子又は凝集体を調製するための当技術分野で知られている方法を用いることができる。好ましくは、微粒子は、直径が0.03〜1.0ミクロンであり、あらゆる微粒子状であってよい。
【0054】
5.2.1 粒子径の測定
治療薬を含む製剤は、製剤の大きさがもっぱら又は主として食作用によりインターナリゼーションを受けるのに十分に大きい、すなわち、0.03ミクロンより大きくなるように調製することが好ましい。好ましい実施形態において、そのような製剤は、好ましくは0.03〜1.0ミクロン、より好ましくは0.07〜0.5ミクロン、より好ましくは0.1〜0.3ミクロン、最も好ましくは0.1〜0.18ミクロンである。それを必要とする患者に投与する前に、当技術分野で知られているいずれかの方法を用いて製剤の大きさを測定することができる。例えば、レーザー光散乱を用いるNicomp Submicron Particle Sizer(model 370、Nicomp、Santa Barbara、CA)を用いることができる。
【0055】
5.3 製剤の投与
有効な量の製剤は、短期の急性療法として考えられ、慢性投与用ではない。投与期間は、それが1ヶ月未満、好ましくは2週間未満、最も好ましくは最長1週間食細胞の阻害/枯渇をもたらすような期間である。経験的には、それを必要とする個体(又はそのような個体の動物モデル)に化合物を投与し、様々な時点で阻害/枯渇のレベルをモニタリングすることによってこれを決定することができる。阻害の時間を適切な所望の臨床効果、例えば、プラークの破裂の急性リスクの低減と相関させることもできる。
【0056】
5.4 治療上の有用性の特性評価
「有効な量」という用語は、所望の治療結果、すなわち、食細胞の活性の阻害若しくは低下、及び/又は食細胞の量の消失若しくは低減を達成するうえで有効な特定の製剤の量を意味する。1つの実施形態において、食細胞の活性の阻害若しくは低下、及び/又は食細胞の量の消失若しくは低減という所望の治療結果は、不安定狭心症に罹患している患者における脆弱又は不安定プラークを安定化する。他の実施形態において、食細胞の活性の阻害若しくは低下、及び/又は食細胞の量の消失若しくは低減という所望の治療結果は、急性心筋梗塞に罹患している患者における梗塞の大きさ及び/又は心筋壊死の量を最小化する。
【0057】
本発明の治療方法の毒性及び有効性は、例えば、LD50(集団の50%に対して致死的な量)、最大無毒性量(NOAEL)及びED50(集団の50%において治療上有効な量)を決定するための細胞培養又は実験動物における標準的な薬剤学的方法によって判断することができる。毒性影響と治療効果の間の用量比は、治療指数であり、LD50/ED50又はNOAEL/ED50の比として表すことができる大きな治療指数を有する製剤が好ましい。毒性副作用を示す製剤を用いることができるが、非罹患細胞への傷害の可能性を最小限にし、それにより、副作用を低減するために、そのような製剤の薬剤の標的を罹患組織の部位に定める送達システムを設計するように注意を払うべきである。
【0058】
細胞培養アッセイ及び動物試験から得られるデータは、ヒトに用いる製剤の用量の範囲の決定に用いることができる。そのような製剤の用量は、ほとんど又は全く毒性を伴わないED50を含む循環濃度の範囲内にあることが好ましい。用量は、用いる剤形及び用いる投与経路によって、この範囲内で変化させることができる。本発明の方法に用いる製剤について、有効な量は最初に細胞培養アッセイから推定することができる。細胞培養において決定されるIC50(すなわち、症状の最大抑制の半分を達成する試験化合物の濃度)を含む循環血漿濃度を達成する用量を動物モデルにおいて定式化することができる。ヒトにおける有用な用量をより正確に決定するために、そのような情報を用いることができる。血漿中濃度は、例えば、高速液体クロマトグラフィーにより測定することができる。
【0059】
本発明のプロトコール及び組成物は、ヒトに使用する前に、所望の治療活性についてin vitroで、次いで、in vivoで試験することが好ましい。そのようなin vitroアッセイの1つの例は、培養中で生育させ、曝露させ、又は別の方法で細胞に投与し、細胞に対するこのアッセイの効果、例えば、活性の阻害若しくは低下及び/又は完全若しくは部分的細胞死について観察する食細胞におけるin vitro細胞培養アッセイである。食細胞は、樹立細胞系から得ることができ、又は初代細胞系として個体から近時に分離することができる。当技術分野における標準的な多くのアッセイを食細胞に対する製剤の活性を測定するのに用いることができる。例えば、マクロファージ/単球活性化は、マクロファージ化学誘引タンパク質−1(MCP−1)、インターロイキン1β(IL−1β)、組織壊死因子α(TNF−α)及びマクロファージ炎症性タンパク質−1α(MIP−1α)などの走化因子のレベルを定量することによって測定することができる。当技術分野における標準的な多くのアッセイを食細胞の生存及び/又は成長を評価するのに用いることができる。例えば、細胞増殖は、3H−チミジン取り込みを測定することにより、直接細胞計数により、癌原遺伝子(例えば、fos、myc)などの既知の遺伝子の転写活性若しくは細胞周期マーカーの変化を検出することにより測定することができ、細胞生存率はトリパンブルー染色により測定することができる。
【0060】
好ましい有効量の選択は、当業者に知られているいくつかの因子の考慮に基づいて当業者が決定することができる(例えば、臨床試験により)。そのような因子としては、管理又は治療する急性冠症候群、随伴する症状、患者の体格、患者の免疫状態及び投与した薬剤組成物の正確さを反映することが当業者に知られている他の因子が挙げられる。
【0061】
5.5 薬剤組成物及び投与経路
本発明の方法に用いるための1つ又は複数の治療薬を含む製剤は、各患者に固有の種々の因子(例えば、患者の障害の重症度及び種類、年齢、体重、反応及び過去の病歴)、製剤中の治療薬の数及び種類、製剤の種類(例えば、封入、包埋、微粒子状等)、組成物の形態(例えば、液体、半液体又は固体)及び/又は投与経路(例えば、経口、静脈内、筋肉内、動脈内、骨髄内、クモ膜下腔内、心室内、経皮、皮下、腹腔内、鼻腔内、腸内、局所、舌下、膣又は直腸)によって、多数の形態であってよい。水、生理食塩溶液、緩衝生理食塩溶液、油(例えば、石油、動物、植物又は合成油)、デンプン、グルコース、ラクトース、スクロース、ゼラチン、麦芽、米、小麦粉、白墨、シリカゲル、ステアリン酸ナトリウム、モノステアリン酸グリセロール、タルク、塩化ナトリウム、乾燥スキムミルク、グリセロール、プロピレン、グリコール、エタノール、デキストロース等を含むが、これらに限定されない薬剤担体、賦形剤、添加剤又は希釈剤を本発明の組成物に含めることができる。所望ならば、組成物は、微量の湿潤又は乳化剤又はpH緩衝剤も含んでいてよい。これらの組成物は、水剤、懸濁剤、乳剤、錠剤、丸剤、カプセル剤、散剤、徐放剤等の形態をとることができる。
【0062】
非経口投与に適する製剤は、水溶液として、好ましくは、ハンクス液、リンゲル液又は生理学的緩衝生理食塩水などの生理学的に適合性のある緩衝液を用いて調製することができる。水性注射懸濁剤は、カルボキシメチルセルロースナトリウム、ソルビトール又はデキストランなどの懸濁剤の粘度を増加させる物質を含んでいてよい。さらに、活性化合物の懸濁剤は、適切な油状注射懸濁剤として調製することができる。適切な親油性溶媒又は賦形剤は、ゴマ油などの脂肪油又はオレイン酸エチル若しくはトリグリセリドなどの合成脂肪酸エステル又はリポソームなどである。場合によって、懸濁剤は、適切な安定化剤又は高度に濃縮された溶液の調製を可能にする化合物の溶解度を増加させる物質も含んでいてよい。
【0063】
薬剤組成物は、塩として提供することができ、塩酸、硫酸、酢酸、乳酸、酒石酸、リンゴ酸、コハク酸等を含むが、これらに限定されない多くの酸を用いて生成させることができる。塩は、対応する遊離塩基形より、水性溶媒又は他のプロトン性溶媒に溶けやすい傾向がある。
【0064】
薬剤組成物は、全身的又は局所的に、例えば、急性冠症候群の病状の部位の近くに投与することができる。さらに、全身投与は、特定の領域又は問題の組織型に標的を定めることができる投与を含むことを意味する。
【0065】
薬剤組成物は、例えば、プラーク破裂に伴う胸痛、肩、腕、歯、顎、腹部若しくは背部に放射される疼痛又は息切れ又は咳、ふらつき感、失神、悪心、嘔吐、発汗又は不安などの急性プラーク破裂の最初の症状の発生時に直ちに投与することが好ましい。他の症状は、当業者及び医師には明らかであり、本発明の薬剤組成物を投与するためのシグナルと言える。代替的に及び/又はさらに、薬剤組成物は、症状の発生直後、例えば、症状の発生の数分以内に投与することができる。代替的に及び/又はさらに、薬剤組成物は、症状の発生後1時間以内に、又は約2時間目に、又は約3時間目若しくは約4時間目に、又は約5時間目若しくは約6時間目、1〜3日以内までに投与することができる。
【0066】
他の療法において、薬剤組成物をプラーク破裂のリスクが高い患者に投与する。例えば、本発明の組成物は、例えば、血管形成術などのプラーク破裂のリスクを増加させる手技の前に患者に投与することができる。組成物をそのような手技の3日前までに投与することが好ましい。また好ましくは、投与は、手技の1〜6時間前又は手技の1時間以内又は手技の1時間未満前又は数分以内であってよい。当業者は、例えば、体重、病歴及び遺伝的素因などの個々の患者に固有の種々の生理的因子及び実施される手技の複雑さなどのプラーク破裂の予想されるリスクに影響を及ぼす種々の因子によって、投与の適切な時期を容易に決定することができる。
【0067】
本明細書で引用したすべての公表論文、単行本、参照手引書及び抄録は、本発明が関係する最先端技術をより十分に記述するためにそれらの全部を参照により本明細書に組み込む。
【0068】
上記の対象について本発明の範囲及び精神から逸脱することなく種々の変更を行うことができるので、上の記述に含まれている、又は添付した特許請求の範囲に規定されているすべての対象は、本発明を記述し、説明するものと解釈されることを意図するものである。本発明の修正及び変形形態は、上の教示に照らして可能である。
【実施例】
【0069】
6.実施例
本明細書に記載する以下の実施例は、本発明を実施する様々な態様を説明し、例示することを意味するものであって、いかなる意味においても本発明を制限することを意図するものではない。
【0070】
6.1 梗塞の領域の大きさに対するリポソームアレンドロネートの効果
梗塞の領域の大きさに対する封入ビスホスフェートの投与の効果をウサギAMIモデルにおいて試験した。直径が約0.150μmのリポソームアレンドロネートを以下の概要を用いて調製した。
a.脂質、DSPC、DSPG及びコレステロールを1/1エタノール/tert−ブタノールに溶解する。
b.アレンドロネートを含む緩衝液を溶媒で希釈して、大きい多層小胞(MLVs)を発生させる。
c.MLVsを200nmポリカーボネートフィルターを通して押出し、大きい単層の150±20nm小胞(LUVs)を得る。
d.LUVsを限外ろ過して、非封入アレンドロネートを除去する。
e.滅菌ろ過する。
【0071】
8匹の体重2.5〜3.5kgのニュージーランドホワイト種雄ウサギに通常の飼料と水を自由に摂取させた。ウサギに生理食塩水(対照)又はリポソームアレンドロネート(3mg/kg、i.v.)を冠動脈閉塞と同時の単回注入として無作為に投与した。ウサギをケタミン/キシラジン(35mg/kg、5mg/kg)及びイソフルランにより麻酔した。実験は、挿管とバランス酸素中イソフルランを用いた機械的換気による呼吸補助並びに連続心エコー図(BCG)及び動脈血圧(耳動脈内カテーテル)モニタリングのもとで実施した。胸部造瘻術を第4肋間隙を通して実施した後、心膜切開術及び心臓周囲クラドルの造設を行った。左冠動脈主幹部を特定し、大側枝を5−0絹縫合糸及びスネアにより取り囲んだ。その後、スネアを30分間締めた。虚血は、ECG変化(ST−T部分上昇)、セグメント呈色の変化及び運動低下によって確認した。30分後に、スネアを開放し、血流の再開を確認した。縫合糸を所定の位置に残し、ゆるめ、胸腔を層ごとに閉鎖した。痛覚脱出のためにブプレネックスをウサギにさらに2〜3日間投与した。ペントタールによる麻酔後に、ウサギを7日後に屠殺し、心臓を採取した。冠動脈を上行大動脈を介して生理食塩水で潅流した後、以前に閉鎖した冠動脈上の縫合糸を締め、0.5%エバンスブルー溶液(Sigma社製)で冠動脈を潅流して、再内皮化の領域を染色した(血液の存在)。エバンスブルーにより非染色の左室領域をリスクのある領域と定義した。次いで、心臓を−20℃で24時間凍結し、2mm間隔の横断切片に切断した。心臓の薄切片を生体染色塩化トリテトラゾリウム(TTC、1%、Sigma社製)中で30分間インキュベートし、10%中性緩衝ホルマリンで固定して、組織の処理前に生存していた細胞を染色した。TTCにより染色されなかった左室領域(白色)は、梗塞の領域と定義した。次いで、染色した切片を写真撮影し、ディジタルプラニメトリ(Photoshop)により処理した。
【0072】
リポソームアレンドロネートを投与したウサギは、リスクのある領域の29.5±6%の梗塞の領域を有していた。これは、リスクのある領域の42±5.5%の梗塞の領域を示した対照ウサギ(リポソームアレンドロネートを投与しなかった)と対照的であった(図1)。したがって、リポソームアレンドロネートは梗塞の領域の低減に有効であった。投与群に副作用は認められなかった。
【0073】
6.2 心筋の形態に対するリポソームアレンドロネートの影響
セクション6.1で処置したウサギは、ヘマトキシリン及びエオシン染色により示されたように心筋の形態の変化を示した。対照ウサギはゆがんだ心筋の形態を有する(図2A)が、リポソームアレンドロネートを投与したウサギはより正常な形態を示している(図2B)。
【0074】
6.3 マクロファージ浸潤に対するリポソームアレンドロネートの影響
セクション6.1で処置したウサギは、リポソームアレンドロネートを投与したウサギにおけるマクロファージ浸潤の低減を示した。ウサギの心臓の代表的な切片をRAM11+マクロファージの免疫染色に供した。リポソームアレンドロネートを投与したウサギの切片(図3B)は、対照ウサギの切片(図3A)より少ない染色を示し、したがって、少ないRAM11+マクロファージ蓄積を有していた。
【0075】
リポソームアレンドロネートは、全身循環単球の数を減少させることも示された。ウサギに生理食塩水(対照)又はリポソームアレンドロネート(3mg/kg、i.v.)を投与した。循環血中の単球のレベルは、CD−14のFACS分析を用いて測定した。リポソームアレンドロネートの注射の48時間後に、血中単球集団は対照群と比較して75〜95%減少した。
【図面の簡単な説明】
【0076】
【図1】ウサギにおける一過性の冠動脈閉塞後の梗塞領域の大きさに対するリポソームアレンドネート投与の効果を示す図である。梗塞領域の大きさは、閉塞動脈によって血液供給され、その後の梗塞のリスクがある左室面積の%値としての梗塞領域の面積として計算した。データは平均値±SDとして表し、nは群当たり4であり、p値はp<0.05である。
【図2A−2B】ウサギにおける可逆性冠閉塞後の心筋の形態に対するリポソームアレンドロネート投与の効果を示す図の対照ウサギに関する図である。対照ウサギ(A)はゆがんだ心筋形態を有するが、リポソームアレンドロネートを投与したウサギ(B)はより正常な心筋形態を有する。
【図3A−3B】ウサギにおける可逆性冠閉塞後のリポソームアレンドロネート投与後のマクロファージ浸潤の減少を示す図の対照ウサギに関する図である。対照ウサギ(A)は、リポソームアレンドロネートを投与したウサギ(B)と比較して梗塞の領域におけるRAM11+マクロファージの蓄積の増加を示している。
【特許請求の範囲】
【請求項1】
急性冠症候群を治療するための薬剤の製造における、治療薬を含む、食細胞活性を低下させる有効量の製剤の使用であって、前記治療薬が、ガリウム、金、セレン、ガドリニウム、シリカ、ミトラマイシン、パクリタキセル、シロリムス、エベロリムス、5−フルオロウラシル、シスプラチン、アルキル化剤、ステロイド、及びアスピリンからなる群から選択され、且つ、前記治療薬が、大きさが0.05〜1.0ミクロンの、封入若しくは包埋された、又は微粒子状の治療薬である使用。
【請求項2】
急性冠症候群を治療するための薬剤の製造における、治療薬を含む、食細胞の数を減少させる有効量の製剤の使用であって、前記治療薬が、ガリウム、金、セレン、ガドリニウム、シリカ、ミトラマイシン、パクリタキセル、シロリムス、エベロリムス、5−フルオロウラシル、シスプラチン、アルキル化剤、ステロイド、及びアスピリンからなる群から選択され、且つ、前記治療薬が、大きさが0.05〜1.0ミクロンの、封入若しくは包埋された、又は微粒子状の治療薬である使用。
【請求項3】
急性冠症候群が不安定狭心症である、請求項1又は2に記載の使用。
【請求項4】
急性冠症候群が切迫又は現実プラーク破裂である、請求項1又は2に記載の使用。
【請求項5】
急性冠症候群が急性心筋梗塞である、請求項1又は2に記載の使用。
【請求項6】
治療薬がミクロ粒子、ナノ粒子、ミクロスフェア及びナノスフェアからなる群から選択される担体に包埋されている、請求項1〜5のいずれかに記載の使用。
【請求項7】
治療薬が凝集体、綿状凝集体、コロイド、高分子鎖、不溶性塩及び不溶性複合体からなる群から選択される微粒子として製剤化されている、請求項1〜5のいずれかに記載の使用。
【請求項8】
急性冠症候群を治療するための薬剤の製造における、治療薬を含む、食細胞活性を低下させる有効量の製剤の使用であって、前記治療薬が、ガリウム、金、セレン、ガドリニウム、シリカ、ミトラマイシン、パクリタキセル、シロリムス、エベロリムス、5−フルオロウラシル、シスプラチン、アルキル化剤、ステロイド、及びアスピリンからなる群から選択され、且つ、前記治療薬が、大きさが0.05〜1.0ミクロンのリポソームに封入された治療薬である使用。
【請求項9】
複数の治療薬が製剤に含まれている、請求項1〜8のいずれかに記載の使用。
【請求項10】
急性心筋梗塞を治療するための薬剤の製造における、治療薬を含む、循環単球を阻害する有効量の製剤の使用であって、前記治療薬が、ガリウム、金、セレン、ガドリニウム、シリカ、ミトラマイシン、パクリタキセル、シロリムス、エベロリムス、5−フルオロウラシル、シスプラチン、アルキル化剤、ステロイド、及びアスピリンからなる群から選択され、且つ、前記治療薬が、大きさが0.05〜1.0ミクロンの、封入若しくは包埋された、又は微粒子状の治療薬である使用。
【請求項11】
治療薬がリポソームに封入されている、請求項10に記載の使用。
【請求項12】
治療薬がミクロ粒子、ナノ粒子、ミクロスフェア及びナノスフェアからなる群から選択される担体に包埋されている、請求項10に記載の使用。
【請求項13】
治療薬が凝集体、綿状凝集体、コロイド、高分子鎖、不溶性塩及び不溶性複合体からなる群から選択される微粒子として製剤化されている、請求項10に記載の使用。
【請求項14】
複数の治療薬が製剤に含まれている、請求項10〜13のいずれかに記載の使用。
【請求項15】
大きさが0.05〜1.0ミクロンの封入治療薬、包埋治療薬、及び微粒子状治療薬からなる群から選択される製剤と薬学的に許容される担体とを含む、急性冠症候群を治療するための医薬組成物であって、前記治療薬が、ガリウム、金、セレン、ガドリニウム、シリカ、ミトラマイシン、パクリタキセル、シロリムス、エベロリムス、5−フルオロウラシル、シスプラチン、アルキル化剤、ステロイド、及びアスピリンからなる群から選択され、前記製剤が血中単球又は組織マクロファージを阻害する医薬組成物。
【請求項16】
大きさが0.05〜1.0ミクロンの封入治療薬、包埋治療薬、及び微粒子状治療薬からなる群から選択される製剤と薬学的に許容される担体とを含む、急性心筋梗塞を治療するための医薬組成物であって、前記治療薬が、ガリウム、金、セレン、ガドリニウム、シリカ、ミトラマイシン、パクリタキセル、シロリムス、エベロリムス、5−フルオロウラシル、シスプラチン、アルキル化剤、ステロイド、及びアスピリンからなる群から選択され、前記製剤が血中単球を阻害する医薬組成物。
【請求項17】
治療薬がリポソームに封入されている、請求項15又は16に記載の医薬組成物。
【請求項18】
治療薬がミクロ粒子、ナノ粒子、ミクロスフェア及びナノスフェアからなる群から選択される担体に包埋されている、請求項15又は16に記載の医薬組成物。
【請求項19】
微粒子が凝集体、綿状凝集体、コロイド、高分子鎖、不溶性塩及び不溶性複合体からなる群から選択される、請求項15又は16に記載の医薬組成物。
【請求項1】
急性冠症候群を治療するための薬剤の製造における、治療薬を含む、食細胞活性を低下させる有効量の製剤の使用であって、前記治療薬が、ガリウム、金、セレン、ガドリニウム、シリカ、ミトラマイシン、パクリタキセル、シロリムス、エベロリムス、5−フルオロウラシル、シスプラチン、アルキル化剤、ステロイド、及びアスピリンからなる群から選択され、且つ、前記治療薬が、大きさが0.05〜1.0ミクロンの、封入若しくは包埋された、又は微粒子状の治療薬である使用。
【請求項2】
急性冠症候群を治療するための薬剤の製造における、治療薬を含む、食細胞の数を減少させる有効量の製剤の使用であって、前記治療薬が、ガリウム、金、セレン、ガドリニウム、シリカ、ミトラマイシン、パクリタキセル、シロリムス、エベロリムス、5−フルオロウラシル、シスプラチン、アルキル化剤、ステロイド、及びアスピリンからなる群から選択され、且つ、前記治療薬が、大きさが0.05〜1.0ミクロンの、封入若しくは包埋された、又は微粒子状の治療薬である使用。
【請求項3】
急性冠症候群が不安定狭心症である、請求項1又は2に記載の使用。
【請求項4】
急性冠症候群が切迫又は現実プラーク破裂である、請求項1又は2に記載の使用。
【請求項5】
急性冠症候群が急性心筋梗塞である、請求項1又は2に記載の使用。
【請求項6】
治療薬がミクロ粒子、ナノ粒子、ミクロスフェア及びナノスフェアからなる群から選択される担体に包埋されている、請求項1〜5のいずれかに記載の使用。
【請求項7】
治療薬が凝集体、綿状凝集体、コロイド、高分子鎖、不溶性塩及び不溶性複合体からなる群から選択される微粒子として製剤化されている、請求項1〜5のいずれかに記載の使用。
【請求項8】
急性冠症候群を治療するための薬剤の製造における、治療薬を含む、食細胞活性を低下させる有効量の製剤の使用であって、前記治療薬が、ガリウム、金、セレン、ガドリニウム、シリカ、ミトラマイシン、パクリタキセル、シロリムス、エベロリムス、5−フルオロウラシル、シスプラチン、アルキル化剤、ステロイド、及びアスピリンからなる群から選択され、且つ、前記治療薬が、大きさが0.05〜1.0ミクロンのリポソームに封入された治療薬である使用。
【請求項9】
複数の治療薬が製剤に含まれている、請求項1〜8のいずれかに記載の使用。
【請求項10】
急性心筋梗塞を治療するための薬剤の製造における、治療薬を含む、循環単球を阻害する有効量の製剤の使用であって、前記治療薬が、ガリウム、金、セレン、ガドリニウム、シリカ、ミトラマイシン、パクリタキセル、シロリムス、エベロリムス、5−フルオロウラシル、シスプラチン、アルキル化剤、ステロイド、及びアスピリンからなる群から選択され、且つ、前記治療薬が、大きさが0.05〜1.0ミクロンの、封入若しくは包埋された、又は微粒子状の治療薬である使用。
【請求項11】
治療薬がリポソームに封入されている、請求項10に記載の使用。
【請求項12】
治療薬がミクロ粒子、ナノ粒子、ミクロスフェア及びナノスフェアからなる群から選択される担体に包埋されている、請求項10に記載の使用。
【請求項13】
治療薬が凝集体、綿状凝集体、コロイド、高分子鎖、不溶性塩及び不溶性複合体からなる群から選択される微粒子として製剤化されている、請求項10に記載の使用。
【請求項14】
複数の治療薬が製剤に含まれている、請求項10〜13のいずれかに記載の使用。
【請求項15】
大きさが0.05〜1.0ミクロンの封入治療薬、包埋治療薬、及び微粒子状治療薬からなる群から選択される製剤と薬学的に許容される担体とを含む、急性冠症候群を治療するための医薬組成物であって、前記治療薬が、ガリウム、金、セレン、ガドリニウム、シリカ、ミトラマイシン、パクリタキセル、シロリムス、エベロリムス、5−フルオロウラシル、シスプラチン、アルキル化剤、ステロイド、及びアスピリンからなる群から選択され、前記製剤が血中単球又は組織マクロファージを阻害する医薬組成物。
【請求項16】
大きさが0.05〜1.0ミクロンの封入治療薬、包埋治療薬、及び微粒子状治療薬からなる群から選択される製剤と薬学的に許容される担体とを含む、急性心筋梗塞を治療するための医薬組成物であって、前記治療薬が、ガリウム、金、セレン、ガドリニウム、シリカ、ミトラマイシン、パクリタキセル、シロリムス、エベロリムス、5−フルオロウラシル、シスプラチン、アルキル化剤、ステロイド、及びアスピリンからなる群から選択され、前記製剤が血中単球を阻害する医薬組成物。
【請求項17】
治療薬がリポソームに封入されている、請求項15又は16に記載の医薬組成物。
【請求項18】
治療薬がミクロ粒子、ナノ粒子、ミクロスフェア及びナノスフェアからなる群から選択される担体に包埋されている、請求項15又は16に記載の医薬組成物。
【請求項19】
微粒子が凝集体、綿状凝集体、コロイド、高分子鎖、不溶性塩及び不溶性複合体からなる群から選択される、請求項15又は16に記載の医薬組成物。
【図1】


【図2A−2B】


【図3A−3B】




【図2A−2B】


【図3A−3B】


【公開番号】特開2011−16838(P2011−16838A)
【公開日】平成23年1月27日(2011.1.27)
【国際特許分類】
【出願番号】特願2010−209977(P2010−209977)
【出願日】平成22年9月17日(2010.9.17)
【分割の表示】特願2006−517683(P2006−517683)の分割
【原出願日】平成16年6月24日(2004.6.24)
【出願人】(505163774)バイオレスト リミテッド (3)
【Fターム(参考)】
【公開日】平成23年1月27日(2011.1.27)
【国際特許分類】
【出願日】平成22年9月17日(2010.9.17)
【分割の表示】特願2006−517683(P2006−517683)の分割
【原出願日】平成16年6月24日(2004.6.24)
【出願人】(505163774)バイオレスト リミテッド (3)
【Fターム(参考)】
[ Back to top ]

