患者位置決め方法および患者位置決めシステム
【課題】この発明は、時間や患者の体位の変化により患者体内の腫瘍患部が変形しても、周囲正常組織への影響を低減し、精度良く位置合わせできる患者位置決めシステムを得ることを目的とする。
【解決手段】治療計画時の患者のデータである治療計画時患者データを取得する治療計画時データ取得工程と、この治療計画時患者データを用いて治療計画を行う治療計画工程と、治療時の患者のデータである治療時患者データを取得する治療時データ取得工程と、治療計画時患者データと治療時患者データとにより治療計画時の患者の形状と治療時の患者の形状を比較して解析する形状解析工程と、この形状解析工程において治療計画時の患者の形状と治療時の患者の形状を比較して解析した結果を基に治療台の移動量を演算して治療台を移動させる治療台位置決め処理工程とを備えた。
【解決手段】治療計画時の患者のデータである治療計画時患者データを取得する治療計画時データ取得工程と、この治療計画時患者データを用いて治療計画を行う治療計画工程と、治療時の患者のデータである治療時患者データを取得する治療時データ取得工程と、治療計画時患者データと治療時患者データとにより治療計画時の患者の形状と治療時の患者の形状を比較して解析する形状解析工程と、この形状解析工程において治療計画時の患者の形状と治療時の患者の形状を比較して解析した結果を基に治療台の移動量を演算して治療台を移動させる治療台位置決め処理工程とを備えた。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、放射線や粒子線などを患者の病巣部に照射して治療を行う放射線治療における、好適な患者位置決め方法および患者位置決めシステムに関する。
【背景技術】
【0002】
患者位置決めシステムでは、始めに、断層像撮影装置(例えば、X線CT(Computed Tomography)装置)を用いて患者の病巣部を撮影した治療計画用3次元CTデータを取得し、このCTデータの診断結果に基づいて治療計画を立てる。このとき3次元CTデータに基づいて腫瘍患部の位置や形状を特定し、放射線を照射する方向や照射線量などを決める。次に、決定した治療計画に基づいて放射線治療を行うことになる。しかし、CT撮影時から放射線治療までの間にかなりの時間が経過していると、治療時における治療台の患者の位置や体位が治療計画作成時の患者の位置や体位と異なっていることが多い。そのため放射線治療を行う前に、現在の患者位置と治療計画時の患者位置のずれを補正する必要がある。
【0003】
このずれの補正量を算出するために必要な基準画像を、治療計画時の3次元治療計画用データから再構成して生成し、基準DRR(Digitally Reconstructed Radiograph:デジタル再構成ラジオグラフ)画像とする。一方、現在の患者位置は、X線TV画像撮影装置を用いて取得する。そして、取得したX線TV画像と再構成して得られた基準DRR画像とを比較し、画像処理を施すことによって補正量を算出する。治療ビームが患部の適切な位置を照射するように、算出した補正量に基づいて治療台の3次元位置と姿勢を調整する。以上の処理を行う装置が患者位置決めシステムである。こうした患者位置決めシステムでは、患者位置決めの精度向上や速度向上が要望されている。
【0004】
特に、近年、たとえば粒子線など、体内で線量を集中させることが可能な放射線治療法がある。この治療法では、粒子線ビームのエネルギーを調節して腫瘍の深さ方向の位置に合わせることによって、高い線量部分を腫瘍患部に一致させることが可能である。つまり、腫瘍だけに高い線量を照射しつつ、周囲の正常組織に対する影響を低減できる。この性質を活かすためには、腫瘍患部のみに粒子線を照射するための、高精度な患者の位置決め技術が重要になってくる。
【0005】
このような患者位置決めシステムにおいては、精度向上や速度向上のために、様々な補助的な装置や方式が用いられている。例えば、特許文献1では、治療計画時に患者の特定の人体箇所の基準座標を決定し、治療時に、まず患者の人体箇所の相対位置決め(例えば姿勢)が、基準座標の相対位置決めと合致するように行われ、その後患者単体を基準座標の絶対位置と合致するよう移動させて位置決めする、という技術が開示されている。
【先行技術文献】
【特許文献】
【0006】
【特許文献1】特表2002−528168号公報
【非特許文献】
【0007】
【非特許文献1】矢野、外3名、「CT値から求めた電子密度線量計算への利用について」、日本放射線技術学会誌、昭和56年11月、第37巻第6号、pp729〜737
【発明の概要】
【発明が解決しようとする課題】
【0008】
特許文献1では、患者の回転方向を含む姿勢が、治療時に治療計画時と同じになるように位置決めすれば常に患者内部、すなわち患部も治療計画時と同じ位置になる、という考えで位置決めされる。しかしながら、このような位置決め装置において、治療計画時の腫瘍患部の位置や形状が、時間や患者体位のわずかなずれにより、治療時において異なる可能性がある。その結果、治療計画で決められた放射線を照射する方向や照射線量を精確に実現することが出来ず、治療時に周囲の正常組織に影響を与えてしまう可能性がある。
【0009】
この発明は、上記のような問題点を解決するためになされたものであり、時間や体位の変化により体内の腫瘍患部が変形しても、周囲正常組織への影響を低減し、精度良く位置合わせできる患者位置決めシステムを得ることを目的としている。
【課題を解決するための手段】
【0010】
この発明に係る患者位置決め方法は、治療計画時の患者のデータである治療計画時患者データを取得する治療計画時データ取得工程と、この治療計画時患者データを用いて治療計画を行う治療計画工程と、治療時の患者のデータである治療時患者データを取得する治療時データ取得工程と、治療計画時患者データと治療時患者データとにより治療計画時の患者の形状と治療時の患者の形状を比較して解析する形状解析工程と、この形状解析工程において治療計画時の患者の形状と治療時の患者の形状を比較して解析した結果を基に治療台の移動量を演算して治療台を移動させる治療台位置決め処理工程とを備えたものである。
【発明の効果】
【0011】
この発明によれば、患者の内部組織の形状変化を推定することにより、治療計画時と治療時の腫瘍患部の違いが推定でき、効率的に位置合わせができるとともに、治療における正常組織への影響を低減できる。
【図面の簡単な説明】
【0012】
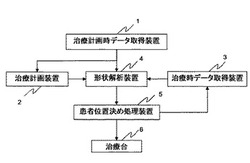
【図1】本発明の実施の形態1による患者位置決めシステムの概略構成を示すブロック図である。
【図2】本発明の実施の形態1による患者位置決めシステムの動作の概略を示すチャート図である。
【図3】本発明の実施の形態1による患者位置決めシステムの形状解析装置の動作を説明するチャート図である。
【図4】本発明の実施の形態1による患者位置決めシステムの統一の空間を示すイメージ図である。
【図5】本発明の実施の形態1による患者位置決めシステムのばねモデルの基本図である。
【図6】本発明の実施の形態1による患者位置決めシステムのばねモデルの詳細図である。
【図7】本発明の実施の形態1による患者位置決めシステムのばねモデルを3次元に展開する説明図である。
【図8】本発明の実施の形態1による患者位置決めシステムのラベル化を説明する図である。
【発明を実施するための形態】
【0013】
実施の形態1.
図1は、本発明の実施の形態1に係る患者位置決めシステムの概略構成を示すブロック図である。患者位置決めシステムは、治療計画時データ取得装置1、治療計画装置2、治療時データ取得装置3、形状解析装置4、患者位置決め処理装置5、治療台6などで構成
される。
【0014】
治療計画時データ取得装置1は、例えば、X線CT(Computed Tomography)装置、ス
テレオカメラで得られる体表面の形状モデルデータ生成装置、体表マーカの位置データを取得する装置、体内に埋め込む事により位置決めに用いられる体内マーカの位置データ取得装置、体内の透視画像であるX線TV画像生成装置、体内の組織状態を取得するための超音波装置、MRI(Magnetic Resonance Imaging)、超音波を改良して得られる体内の弾性情報などを測定する装置、PET(ポジトロン放出型断層撮影:射線経路などが画像として表示できるシステム)など、患者の体表や内部組織の状態などが取得できる装置から選択され、患部の部位などに応じて一つ以上の測定装置により構成される。なお、治療計画時データ取得装置1により治療計画時データ取得工程が形成される。
【0015】
治療計画装置2は、医師などが治療計画時データ取得装置1から得られたデータを用いて、放射線を照射する患部、照射角、照射線量などを計画するための装置である。治療計画装置2により治療計画工程が形成される。
【0016】
治療時データ取得装置3は、治療計画時データ取得装置1と同様、治療時に患者の状態を取得する装置であり、必ずしも治療計画時データ取得装置1で用いられる装置と同じ構成である必要はない。例えば、治療計画時のデータ取得は治療計画室で行い、治療時のデータ取得は粒子線などの放射線治療を行うための治療室で行う、というように、治療計画時と治療時でデータ取得環境が異なる場合が多く、それぞれで備えられた装置が異なる場合が多い。治療時データ取得装置3により治療時データ取得工程が形成される。
【0017】
形状解析装置4は、治療計画時データ取得装置1により得られたデータからデータに応じて体表面、病巣部、骨などの位置や形状を特定しモデル化する。得られるデータの点群や、エッジ処理を行う事により得られるデータをモデル化する。また、治療時データ取得装置3により得られるデータも同様にモデル化する。そして、このモデル化されたデータ群(情報)をもとに、患部の病巣部などの形状変化を解析する。形状解析装置4により形状解析工程が形成される。
【0018】
患者位置決め処理装置5は、形状解析装置4で得られる解析結果を用いて治療台6の移動量を演算するものである。患者位置決め処理装置5により患者位置決め処理工程が形成される。
治療台6は、放射線治療の際に、放射線や粒子線など治療用のビームが患部の適切な位置を照射されるように、3次元位置および姿勢が調整可能な機構を備える。
【0019】
なお、治療計画装置2、形状解析装置4、患者位置決め処理装置5は、計算機によってそれぞれの機能が実行される。これらの装置は、それぞれが別々の計算機によって実行されても良いし、一つの計算機が複数の装置の機能を実行するように構成されても良い。
【0020】
次に、以上の患者位置決めシステムの動作の概要を図2に従って説明する。まず、治療計画室で治療計画時データ取得装置1により患者のデータを取得する(ST101)。この取得したデータを治療計画時患者データと呼ぶことにする。次に医師などが、治療計画時データ取得装置1、特にX線CTにより取得されたデータを用いて、放射線を照射する患部、照射角、照射線量などを決定する治療計画を実施する(ST102)。以上で治療計画時の工程が終了する。
【0021】
次に、放射線を照射して治療するに際して、患者を治療台6に載せて治療計画に従って放射線を照射する位置に患者を位置決めする工程に入る。まず患者を治療台6に載せた状態で治療時データ取得装置3により患者データを取得する(ST103)。この取得した
データを治療時患者データと呼ぶことにする。形状解析装置4において、治療計画時患者データと治療時患者データを、それぞれ一つの統一の空間に統合化処理する(ST104)。なお、治療計画時患者データは、治療計画時データ取得装置1により取得した後治療時までの間に統合化処理しておいても良いのは言うまでもない。
【0022】
次に、形状解析装置4により統合化された治療計画時患者データと治療時患者データをモデル化して比較解析する(ST105)。モデル化および比較解析の内容については、後で詳細に説明する。この比較解析した結果が患者位置決め処理装置5に出力される(ST106)。患者位置決め処理装置5は、受け取った解析結果を基に治療台6の移動量を演算する(ST107)。この演算結果の移動量分治療台6を移動する(ST108)。治療台6の移動後、医師などが、患部が治療計画通りに放射線が照射される位置にあるかどうか、X線TV画面などにより確認し、患部の位置ずれが許容範囲内かどうかを判断する(ST109)。位置ずれが許容範囲内であれば放射線治療を実施する。(ST110)。もし位置ずれが許容範囲を超えていれば、治療台6を微調整して(ST111)、再度X線TV画面などにより位置ずれを確認して許容範囲内かどうかを判断する(ST109)。
【0023】
以下で詳細を説明するように、本発明によれば、治療計画時患者データ取得時と治療時患者データ取得時において、患者の姿勢が異なる、あるいは外部力が異なる、などにより、患部近傍の形状が変化してもその変化の原因を推定して、患部の形状が治療計画時と同じになるように治療台6の姿勢などの位置決めを行うため、上記ST110の判断工程において患部の位置ずれが許容範囲を超えることはほとんどない。したがって医師などによるX線TV画面での確認回数は1回で済むため、患者のX線被ばくが抑制できる。
【0024】
以下、形状解析装置4における比較解析の処理、すなわち図2におけるST104〜ST106の処理について説明する。形状解析装置4の内部処理は概略図3のように、データ統合手段7(図2のST104に相当)、データ解析手段8(図2のST105に相当)、データ出力手段9(図2のST106に相当)で構成されている。
【0025】
まず、データ統合手段7において、異なる測定値のデータを統一した空間により定義する。この統一の空間のイメージ図を図4に示す。例えば、X線CT10により測定された3次元データであるCT値を電子密度で再定義する。CT値から電子密度を求める方法は例えば非特許文献1に記載された方法などを用いる。この電子密度で再定義した3次元空間を電子密度空間13と呼ぶ。この電子密度空間13によれば、体内の脂肪や骨などの密度を3次元空間上の位置ごとに定義できる。ここでは、この電子密度空間13を統一の空間として用いる。
【0026】
また、MRI12やX線TV画像11など、X線CTとは異なる種類の測定値(モダリティ)の2次元データに対しても、フィルタ処理をすることにより2次元データから3次元情報の候補となる特徴量を取得し、その特徴量を電子密度空間13として定義した統一の空間の3次元位置に対応した情報として保存する。超音波15のデータに対しては、プローブに3次元センサを搭載しておくことにより、プローブの位置と取得データの位置情報などが取得でき、電子密度空間13の位置との一対一対応がとれる。さらにステレオカメラで得られる体表面14のデータでは、データの3次元位置が分かっているために、電子密度空間13に対して体表面のデータを容易に対応付けできる。また、上記以外の測定装置であっても患者の体表面や内部組織の2次元データや3次元データが得られる測定装置であれば使用することができる。
【0027】
このように、統一の空間、ここでは電子密度空間13、を用いて異なる測定装置の特徴量データを3次元位置に対応付けできる。このようにして、例えば超音波では超音波で取
得しやすい体内の内部情報、MRIではMRIで取得しやすい乳腺の位置情報など、異なる測定装置によって得られる、それぞれの測定装置での最適な情報を一つの空間で定義することが可能となる。さらに、X線CTでは乳腺を特定することが難しいが、MRIによるデータを統一の空間で定義することにより、乳腺の位置がX線CTのデータから得られた電子密度空間13上でも予測が可能となる。
【0028】
上記の説明では、種々のデータ取得装置を用いたが、実際には、治療部位や準備できるデータ取得装置の種類に応じて、X線CTとMRI、X線CTと超音波とステレオカメラ、といった様に、データ取得装置の種類を決定し、それぞれの組み合わせに応じて適切な処理を行う。
【0029】
次に、データ解析手段8においては、この統一の空間すなわち電子密度空間13でデータ解析を行う。例えばこの電子密度空間13に対してフィルタ処理を行う。また異なるモダリティにおけるデータに対しても、ボリュームデータ(3次元)の特徴解析、2次元データの特徴解析、2次元3次元特徴解析を、それぞれのデータに応じて実施する。例えば3次元のCT、MRIボリュームデータであれば、表面のエッジデータ、骨データの抽出、内部臓器の形状抽出などをおこなう。X線TV画像のような2次元画像データであれば、画像処理による一般的なエッジ処理等による特徴点抽出処理を行う。2次元3次元特徴解析では、2次元データDRRから3次元データの推定を特徴点による解析と解剖学的情報(各臓器や骨などの一般的な位置関係の情報)から算出する。この結果、測定装置で得られるCTやMRIデータを電子密度空間13上に変換できる。この変換により、3次元ボリュームデータ内の表面のエッジデータ、骨データ、内部臓器の形状などを電子密度空間上に対応付けでき、電子密度空間上で表現(定義)できる。例えば、CTとMRIを測定する領域を一致させておくことにより、一方では取得が困難な情報を補間する事が可能となる。そして、他のモダリティである2次元データのX線TV画像から得られる特徴と、2次元3次元情報が得られるDRRでの特徴を、CTやMRI等で得られる特徴と一致するようにデータ取得することにより、電子密度空間上に様々な測定装置の情報を集約できる。このマルチモダリティ(X線CT、MRI・・・など複数のデータから得られる特徴を含んだ情報)の空間を潜在空間と定義する。
【0030】
この得られた特徴点を用いてモデル化を実施する。例えば図5に示すようなばねモデルを定義する。すなわち、体表面の特徴点16(座標(x1,y1,z1))および骨の特徴点17(座標(x2,y2,z2))と腫瘍の特徴点19(座標(x3,y3,z3))の間をそれぞればね18と仮定し、そのばね係数をそれぞれK13、K23とする。例えば、体表面の特徴点16と腫瘍の特徴点19の間のばねによる力FK1,3は、ばね係数K13に変位を乗じたものとな
る。また、モデル化の方法は、ここで示す力学モデルの一種であるばねモデルではなく、他の力学モデルや力学モデル以外の物理モデル、例えば血液の流れなどを用いた血管などの流体モデル、電気信号等による電磁気モデルのようなものでも良く、物理モデルであればなんでもよい。ばねモデルを用いる場合では、例えば数(1)式のように外部からの力をFall(重力、形状変化など全ての因子)としたときに、表面の力F表面と内部の力F
内部の和として定義ができる。ここでの内部の力とは呼吸、脈、心臓などの力を示す。一方表面の力は、外部から体表面が押される力などを示している。従って、数(1)式の定常状態(変化がない状態)では左辺が0であると定義ができる。
【0031】
この数(1)式をばねモデル定義式数(2)式で表す。数(2)式の左辺、右辺の行列の上の矢印は、左辺、右辺がベクトル量であることを示している。左辺の(x,y,z)は体表
面の座標と内部の座標両方を示し、その座標上の力をFi,jと定義する。i=j、すなわ
ちFi,iはi番目の特徴点での力を表し、i≠jの場合はi番目の特徴点とj番目の特徴
点の間に働く力を表す。この左辺の力ベクトルは、外部の力が与えられたら、内部の特徴点間ごとの力ベクトルのトータルが外部の力ベクトルのトータルと一致するように、体内
のばねモデルとして反映させる事を示している。数(2)式の右辺では、ばねモデルの定義により、外部の力が与えられる特徴点や領域から、その周辺の特徴点に力が加わり(派生し)、周辺の特徴点の力に反映されるように定義する。すなわち、数(2)式の右辺はモデル化したばねによる力をFKi,jとして表しており、例えば図5の腫瘍(i=3)と
体表面(i=1)の間に働くばねの力をFK1,3として表している。右辺の対角要素FKi,iは自己相関でありばねの力が無いため通常は0となる。あるいは、次のように対角要素だけで表してもよい。すなわち、対角要素におけるばねの力としての要素であるFK3,3の座標(x3,y3,z3)が、図6の腫瘍の位置であるとすると、FK3,3は近傍のばねの集合として数(3)式のように定義してもよい。数(3)式における引数は移動量(変位)を表している。このように、力を対角要素に集合することで、式を簡単化できるとともに、非剛体の変形する部位に対して、ある領域に外力が加わったときに周辺に与える影響をモデル化することが可能となる。
【0032】
このように定義することにより、一旦ばね係数Kが求まれば、外部の力やずれ量(例えば体の向きが変わる事により重力の向きが変わり、体表面の形状が変るという外部の力などを重力モデルより算出する)を算出することにより内部の形状が推定できる。
【0033】
【数1】

【数2】

【数3】

【0034】
ここでばね係数Kの求め方の一例を説明する。まず、治療計画で式(1)の右辺=0という状態の式を算出する。この=0というのはトータルFall=0を意味し、なにも力が
加わっていない状態である定常状態を表す。つまり治療計画で得られる患者の参照データであり、ベッドに横たわっている状態を表す。この状態で、特徴などを算出し、未知のパラメータであるばね係数Kを計算する。計算には未知のパラメータ数の方程式が必要となる。たとえば、定常状態から少し体を動かして(重心を動かして)ある特徴位置(x,y,z)
が(x’,y’,z’)へと移動した事が分かれば、方程式を得ることができる。未知のパラメ
ータ数の方程式を得ることができると、内部の未知のパラメータKを算出することができ
る。この方法によれば、未知のパラメータ数の方程式を得るため、何回もデータを取る必要があり、CTやMRIの場合は、実用化が難しい。しかし、CTを一回取得し、他のセンサ、例えば、超音波や体表面のデータを時間軸で取得することにより、体位の変化、呼吸の振幅などを取得することができ、複数の特徴点の移動を算出できる。このような方法で、例えば体表面だけのデータを複数取得することにより、ばねパラメータKの未知数分の方程式が得られ、ばねパラメータKの値が算出できる。
【0035】
また、勾配法やScale Conjugate Gradient(パラメータを含んだ勾配法の最適化手法)、IK(Inverse Kinematics)などを用いることにより、重心などを動かさずに、位置移動のデータを取得することも可能である。このような方法で、治療計画データから数(1)式=0を満たす方程式を生成して、ばね係数などの値を算出することもできる。
【0036】
以上では、方程式を得ることでばね係数を求めたが、ばね係数は、ユーザが定義したり、解剖学的な情報をも用いて定義することも可能である。あるいは、ニューラルネットワークなどのモデルと、他のモダリティで得る情報からKを最適化してもよい。または、X線CTより変換されて得られる電子密度空間13では密度に応じてばね係数を定義することもできる。例えば、電子密度が高い領域ではばね定数を大きくし、電子密度が小さい領域では、ばね定数を小さくする。このことにより、ばねモデルの係数が、電子密度に応じた最適なパラメータで評価できるとともに、異なったモダリティにおける情報を統一して評価が可能となる。そして図6の骨や体表面などは特徴解析で得られた特徴点を用いる。またここでのばね方程式だけでなく、重力、体位の変化などの物理モデルで表現してもよい。この処理により、患者の体位の違いにより変形する内部組織をモデル化できる。この結果容易に内部の形状を推定できる。
【0037】
次に、治療時にデータを取得する。このデータから体の重心の位置などが取得できるとともに、特徴が取得できる。これを先ほど算出した数(1)式に代入することにより、取得できなかった内部の状態の特徴の位置を求めることができる。たとえば、図6で示すように、n点の特徴点が求まる(図6では特徴点は7点を図示しているが、図示しない特徴点があるとして7点目をnで表記している。)とする。そのn点の座標を(x1,y1,z1)・・・(xn,yn,zn)と定義し、その間にあるばね係数をそれぞれKi,jとすると(i≦n,j≦n)
となる。そこで数(2)式の左辺では、実際は対角の要素のみ値が入り対角以外の要素の値は0となる。しかし、治療計画で得られた特徴の位置に対して、現在の値の特徴の位置が移動したとすると、この移動量∇分のばねの力をFKi,jにそれぞれ代入して数(2)
式の右辺の力の要素を求める。
【0038】
ここで問題になるのは、現在の特徴点と治療計画の特徴点が実際に特徴と一致しているのかである。そのため、容易に一致できる体表面の特徴点などを予め例えばICPアルゴリズムなどを用いて算出する必要がある。その結果、大まかな、特徴点の移動が算出できるとともに詳細な内部臓器の移動量などを、数(2)式などから、最適化を行う事により算出できる。また計算を簡易化するために、数(2)式の右辺の対角上の力を数(3)式のように簡易的に近似してもよい。数(2)式の対角要素は0である可能性があり、最適化するのに難しい問題があるが、以上のように処理すればこの問題が解決できる。
【0039】
以上の処理を治療計画時データ取得装置1と治療時データ取得装置3で得られるデータ両方におこなう。その結果得られる図7のような3次元空間を用いて腫瘍や、体の変化を推定する。たとえば潜在空間の体表面のデータ14を用いてICP(Iterative Closet Points)マッチングを行う。その結果、電子密度空間13ではその対応点が算出でき、ばねモデルが定義できる。このように他の潜在空間(ここでの潜在空間とは電子密度を生成するX線TV画像、X線CT、超音波などの測定装置における特徴空間)で変化を評価する事により様々な内部臓器を評価できる。これにより、体内の内部の特徴点の間をばねモデルで表現する事により、治療時に体表面や大まかな情報しかえられない状況においても内部の臓器の状態を容易に推定できるようになる。そしてデータ出力手段9で臓器の変化結果について算出する。
【0040】
この内部の情報をもとに、患者位置決め処理装置5にて移動量を算出する。例えば、臓器の変形がなければ、治療計画時の状態と治療時の状態に変化が少ない。そのため特許文献1のような従来の位置合わせ方法を用いて治療計画通りに治療が可能である。しかし、照射ターゲットによっては、図7のように治療計画時から治療時にかけて形状が変化する図7の格子ばねモデルでは、表面しか図示していないが、体表面だけでなく内部もばねモデルとして表現する。そこで、例えば解析結果が図7の治療計画時格子ばねモデル22と治療時格子ばねモデル23のように得られたら、治療時格子ばねモデル23から治療計画時格子ばねモデル22のモデルになるように、外部から力を与える。あるいは、外部から力を与えるのではなく、治療台6を移動させることにより姿勢を変化(体の重心移動)させて、治療時格子ばねモデル23が治療計画時格子ばねモデル22のモデルになるようにする方法もある。また、これら外部から力を与えるのと姿勢を変化させるのとを組み合わせることにより治療時格子ばねモデル23を治療計画時格子ばねモデルに一致させる方法もある。
【0041】
このように、内部臓器をモデル化することにより、外部から与える力や、治療台6の姿勢などによりどのように内部の形状が変化するかを推定でき、この推定結果を基に、患者位置決め処理装置5にて、治療時格子ばねモデルが治療計画時格子ばねモデルになるような治療台6の移動量を演算することができる。この結果、患部が治療計画によって決めた放射線を照射するための所定の位置になるよう位置決めをすることができる。
【0042】
乳がんなど形状変化が大きくなる可能性がある対象の場合、変形する対象に対してカップなどを用いて固定する方法を用いてもよい。さらにカップに吸引する機能などがあれば、IKで得られた制御値を、その吸引の角度や吸引力等に反映させ、治療計画時の形状になるようにする。この内部の状態を確認するためには、DRR(Digital Reconstruct Radiograph)をX線CTから生成して確認を行う。ただし、乳がんなどの形状をX線CTから生成したDRRで表示する事は難しい。そこで、他のモダリティ、例えば、乳腺などの情報が得られるMRI12の測定データから、統一の空間である電子密度空間を用いて位置情報を取得する。取得する方法として、図8で示すように、例えば、MRIで得られる対象部位の3次元位置情報(ラベル24)を保存し、保存した位置が電子密度空間13に写像した時にその写像空間上の点(ラベル25)がMRI上での座標の特徴点を保持する。この処理により電子密度空間やMRIでないモダリティ上で、例えばDRRなどで、乳腺などの位置情報が取得できる。この位置情報を電子密度空間で得るための処理をラベル化と定義する。そのラベル化された特徴点を通過する領域が強調されるようにDRRを生成して形状変化を確認する。このような処理を行うことにより、内部の形状が一致するまで、最適計算をおこなう。以上の結果から、移動量(ターゲットの形状を治療計画に一致できる移動量)を治療台6の姿勢と位置の移動量に反映させる。
【0043】
以上の処理により、治療計画時と治療時との腫瘍患部近傍の形状を比較解析し、その変化から姿勢などの変化が推定でき、効率的に治療計画で決定した放射線照射ができるように患部の位置合わせができるとともに、治療における正常組織への影響を低減できる。
【0044】
実施の形態2.
実施の形態1においては、治療時患者データも、治療計画時患者データと同じ統一の空間で処理を行った。必ずしもこのような処理を行う必要はなく、例えば治療計画時患者データに対して図4の統一の空間を生成する。一方、治療時データは統一の空間で処理を行うのではなく、取得した潜在空間のみで治療計画時データと比較してずれ量を算出する。
この算出方法は、テンプレートマッチングや、ICPなど一般的に用いられている手法で行う。そして、このずれ量は特徴点であるノードに対応して算出されるため、統一の空間である電子密度空間におけるばねモデルを用いて形状の変化を推定でき、治療台の移動量を演算できる。この方法によれば、計算時間が短縮できるとともに、治療時データが少ないモダリティであっても、当該モダリティからずれ量を算出することで形状の変化を推定することができ、治療台の移動量を演算することができる。
【0045】
実施の形態3.
実施の形態1では、統一の空間を、治療計画時データ取得装置1にて得られるデータを用いて生成した。実施の形態3では、直接治療計画時取得データから統一の空間を生成するのではなく、治療計画装置から得られるデータを用いて統一の空間を生成する。すなわち、治療計画装置においては、治療計画時患者データに、例えばがん治療領域などを特定してその癌治療領域の情報を加えて治療計画データとする。このため、治療計画装置から得られるデータを用いて統一の空間を生成すれば、治療計画の情報を付加した状態で形状の変化が推定できる。これにより、患部の特定が容易になり、患部付近の変形をより精度良く推定することができるため、実施の形態1よりもさらに精度良く治療台の移動量を演算できる。
【0046】
実施の形態4.
実施の形態1ではX線CTから得られる電子密度の空間を統一の空間としたが、統一の空間を、電子密度空間ではなく、治療の部位に合わせて別の空間で定義してもよい。治療の部位によっては、X線CTのデータから生成された電子密度空間よりも、他のモダリティのデータから生成した方が適当な場合がある。たとえば、MRIによる測定データによれば乳腺などの情報が良好に得られるため、乳がんの治療においてMRI12のモダリティのデータを統一の空間とすれば患部の特定が容易になる。このように、電子密度空間に限らず、それぞれの目的に合わせて統一の空間を定義することができる。この結果、腫瘍が特定し易いモダリティを基準とする事ができ、最適な内部推定を可能とすることができる。
【0047】
実施の形態5.
実施の形態1ではX線CTの測定データを加工して例えば電子密度のような特定の特徴量により統一の空間を定義したが、測定データを加工して統一の空間を定義するのではなく、Image Fusion(画像融合)を用いてもよい。Image Fusionとは、異なる性質の画像を融合して一つの画像とするものである。例えば、X線CTにより得られるデータを画像データとして、MRIにより得られるデータも画像データとして、これら二つの画像データを画像データのまま融合して一つの画像データとすることにより統一の空間を定義することができる。この融合した画像から特徴点を設定してばねモデルとしてモデル化を行う。この結果、複数のモダリティで得られる異なる特徴量のデータを統合する事ができ、データ量の削減が可能である。
【0048】
実施の形態6.
得られる全ての特徴点に対してSelf Organization Map(SOM、自己組織化マップ)
等によって自動的にグループ化を行ったり、骨や各臓器の一般的な相対位置関係を表す情報である解剖学的情報を用いて最適化されたモデルを用いてもよい。この結果計算量を削減することが可能となり、実用的な計算速度での形状の変化の推定を可能とする。
【0049】
実施の形態7.
実施の形態1におけるばねモデル(数(1)式、数(2)式)において、単純なばねモデルではなく、各位置におけるばね係数以外の情報を含めた情報を用いてモデル化してもよい。たとえば、重力や摩擦の影響を考慮したモデル化や、呼吸、心臓、脈による影響を
含めてモデル化するために、時間による変化を含めたモデル化を行ってもよい。時間による変化を含めたモデル化とは、4次元CTなど時間をも一つのパラメータとして動画のように取得したデータによりモデル化を行うことである。さらに解剖学的情報を数式化してもよい。
【0050】
例えば、呼吸による影響を含める場合、数(1)式においてばね係数Kが位置によって決まるだけではなく、呼吸サイクルの時間tを含み、時間tの変化により特徴点(x,y,z)
の位置が変り、変位が生じることによりFKという力の値が得られる。この結果、患者内部の詳細なモデル化が時間軸を含んだ形で推定が可能となる。
【0051】
実施の形態8.
実施の形態1においては、形状が変化するターゲットに対してDRR画像を用いて変形を確認したが、DRR画像を用いずに他のモダリティにより変形を確認する処理を行うことができる。例えばMRI12や超音波15などにより、確認処理を行ってもよい。MRIや超音波によって得られるデータも統一の空間に対応して位置付けすることができるため、これらX線画像以外のモダリティによっても変形を確認することができる。X線画像により確認を行うのは、確認のためだけで患者にX線被ばくを与えてしまうが、MRIや超音波を用いれば、確認処理のために患者にX線被ばくを与えることがないというメリットがある。また、確認処理のために持ち込める計測装置に応じて位置合わせが可能となる。
【0052】
実施の形態9.
実施の形態1では、治療計画時データ取得装置1により治療計画時患者データを取得して、この治療計画時患者データを用いて治療計画装置2により治療計画を実施した。この治療計画を、形状解析装置4から得られるばねモデル23等のデータを生成した後、この生成したデータを用いて実施してもよい。この結果、例えば患者のわずかな向きのずれによるターゲット患部の変形を推定する事ができ、予めこのずれを反映して治療計画が立てられる。
【0053】
実施の形態10.
実施の形態1においては、治療時格子ばねモデル23を治療計画時格子ばねモデル22に一致するように力を加えたり、治療台を移動したりした。しかし本実施の形態10ではこの変形の処理を、治療計画時格子ばねモデル22から治療時格子ばねモデル23に一致するようにして行う。すなわち、実施の形態1と逆の処理を行う。この処理により、例えばDRRを生成するために必要なX線CT10を、治療時に取得する必要がなくなり、X線TV画像11などで行えるようになる。これにより、取得データの処理や装置の数を削減する事が可能である。ただし本実施の形態10を実施するためには、実施の形態9の処理をおこない、患者の向きのずれ量が治療計画に考慮されているようにしなければならない。
【0054】
実施の形態11.
実施の形態1において、治療計画時格子ばねモデル22と治療時格子ばねモデル23に用いられる特徴点の数は計算コストに依存する。そこで、それぞれの、ばねモデルに用いる特徴点は一般的な画像圧縮方法である画像ピラミッドを生成して特徴量を圧縮して得られる特徴点をばねモデルのノードに用いてもよい。または、得られる特徴点を全て算出し、その特徴点なかで、特徴点らしい特徴点を一般的に用いられる固有値計算により算出し固有値の高い特徴点を用いて評価を行ってもよい。
【0055】
以上各実施の形態で説明した処理は、GPU(Graphic Processing Unit)などを用い
て並列計算処理を行うことができ、高速に処理を行うことができる。
【符号の説明】
【0056】
1:治療計画時データ取得装置1 2:治療計画装置2
3:治療時データ取得装置3 4:形状解析装置4
5:患者位置決め処理装置5 6:治療台
13:統一の空間
【技術分野】
【0001】
本発明は、放射線や粒子線などを患者の病巣部に照射して治療を行う放射線治療における、好適な患者位置決め方法および患者位置決めシステムに関する。
【背景技術】
【0002】
患者位置決めシステムでは、始めに、断層像撮影装置(例えば、X線CT(Computed Tomography)装置)を用いて患者の病巣部を撮影した治療計画用3次元CTデータを取得し、このCTデータの診断結果に基づいて治療計画を立てる。このとき3次元CTデータに基づいて腫瘍患部の位置や形状を特定し、放射線を照射する方向や照射線量などを決める。次に、決定した治療計画に基づいて放射線治療を行うことになる。しかし、CT撮影時から放射線治療までの間にかなりの時間が経過していると、治療時における治療台の患者の位置や体位が治療計画作成時の患者の位置や体位と異なっていることが多い。そのため放射線治療を行う前に、現在の患者位置と治療計画時の患者位置のずれを補正する必要がある。
【0003】
このずれの補正量を算出するために必要な基準画像を、治療計画時の3次元治療計画用データから再構成して生成し、基準DRR(Digitally Reconstructed Radiograph:デジタル再構成ラジオグラフ)画像とする。一方、現在の患者位置は、X線TV画像撮影装置を用いて取得する。そして、取得したX線TV画像と再構成して得られた基準DRR画像とを比較し、画像処理を施すことによって補正量を算出する。治療ビームが患部の適切な位置を照射するように、算出した補正量に基づいて治療台の3次元位置と姿勢を調整する。以上の処理を行う装置が患者位置決めシステムである。こうした患者位置決めシステムでは、患者位置決めの精度向上や速度向上が要望されている。
【0004】
特に、近年、たとえば粒子線など、体内で線量を集中させることが可能な放射線治療法がある。この治療法では、粒子線ビームのエネルギーを調節して腫瘍の深さ方向の位置に合わせることによって、高い線量部分を腫瘍患部に一致させることが可能である。つまり、腫瘍だけに高い線量を照射しつつ、周囲の正常組織に対する影響を低減できる。この性質を活かすためには、腫瘍患部のみに粒子線を照射するための、高精度な患者の位置決め技術が重要になってくる。
【0005】
このような患者位置決めシステムにおいては、精度向上や速度向上のために、様々な補助的な装置や方式が用いられている。例えば、特許文献1では、治療計画時に患者の特定の人体箇所の基準座標を決定し、治療時に、まず患者の人体箇所の相対位置決め(例えば姿勢)が、基準座標の相対位置決めと合致するように行われ、その後患者単体を基準座標の絶対位置と合致するよう移動させて位置決めする、という技術が開示されている。
【先行技術文献】
【特許文献】
【0006】
【特許文献1】特表2002−528168号公報
【非特許文献】
【0007】
【非特許文献1】矢野、外3名、「CT値から求めた電子密度線量計算への利用について」、日本放射線技術学会誌、昭和56年11月、第37巻第6号、pp729〜737
【発明の概要】
【発明が解決しようとする課題】
【0008】
特許文献1では、患者の回転方向を含む姿勢が、治療時に治療計画時と同じになるように位置決めすれば常に患者内部、すなわち患部も治療計画時と同じ位置になる、という考えで位置決めされる。しかしながら、このような位置決め装置において、治療計画時の腫瘍患部の位置や形状が、時間や患者体位のわずかなずれにより、治療時において異なる可能性がある。その結果、治療計画で決められた放射線を照射する方向や照射線量を精確に実現することが出来ず、治療時に周囲の正常組織に影響を与えてしまう可能性がある。
【0009】
この発明は、上記のような問題点を解決するためになされたものであり、時間や体位の変化により体内の腫瘍患部が変形しても、周囲正常組織への影響を低減し、精度良く位置合わせできる患者位置決めシステムを得ることを目的としている。
【課題を解決するための手段】
【0010】
この発明に係る患者位置決め方法は、治療計画時の患者のデータである治療計画時患者データを取得する治療計画時データ取得工程と、この治療計画時患者データを用いて治療計画を行う治療計画工程と、治療時の患者のデータである治療時患者データを取得する治療時データ取得工程と、治療計画時患者データと治療時患者データとにより治療計画時の患者の形状と治療時の患者の形状を比較して解析する形状解析工程と、この形状解析工程において治療計画時の患者の形状と治療時の患者の形状を比較して解析した結果を基に治療台の移動量を演算して治療台を移動させる治療台位置決め処理工程とを備えたものである。
【発明の効果】
【0011】
この発明によれば、患者の内部組織の形状変化を推定することにより、治療計画時と治療時の腫瘍患部の違いが推定でき、効率的に位置合わせができるとともに、治療における正常組織への影響を低減できる。
【図面の簡単な説明】
【0012】
【図1】本発明の実施の形態1による患者位置決めシステムの概略構成を示すブロック図である。
【図2】本発明の実施の形態1による患者位置決めシステムの動作の概略を示すチャート図である。
【図3】本発明の実施の形態1による患者位置決めシステムの形状解析装置の動作を説明するチャート図である。
【図4】本発明の実施の形態1による患者位置決めシステムの統一の空間を示すイメージ図である。
【図5】本発明の実施の形態1による患者位置決めシステムのばねモデルの基本図である。
【図6】本発明の実施の形態1による患者位置決めシステムのばねモデルの詳細図である。
【図7】本発明の実施の形態1による患者位置決めシステムのばねモデルを3次元に展開する説明図である。
【図8】本発明の実施の形態1による患者位置決めシステムのラベル化を説明する図である。
【発明を実施するための形態】
【0013】
実施の形態1.
図1は、本発明の実施の形態1に係る患者位置決めシステムの概略構成を示すブロック図である。患者位置決めシステムは、治療計画時データ取得装置1、治療計画装置2、治療時データ取得装置3、形状解析装置4、患者位置決め処理装置5、治療台6などで構成
される。
【0014】
治療計画時データ取得装置1は、例えば、X線CT(Computed Tomography)装置、ス
テレオカメラで得られる体表面の形状モデルデータ生成装置、体表マーカの位置データを取得する装置、体内に埋め込む事により位置決めに用いられる体内マーカの位置データ取得装置、体内の透視画像であるX線TV画像生成装置、体内の組織状態を取得するための超音波装置、MRI(Magnetic Resonance Imaging)、超音波を改良して得られる体内の弾性情報などを測定する装置、PET(ポジトロン放出型断層撮影:射線経路などが画像として表示できるシステム)など、患者の体表や内部組織の状態などが取得できる装置から選択され、患部の部位などに応じて一つ以上の測定装置により構成される。なお、治療計画時データ取得装置1により治療計画時データ取得工程が形成される。
【0015】
治療計画装置2は、医師などが治療計画時データ取得装置1から得られたデータを用いて、放射線を照射する患部、照射角、照射線量などを計画するための装置である。治療計画装置2により治療計画工程が形成される。
【0016】
治療時データ取得装置3は、治療計画時データ取得装置1と同様、治療時に患者の状態を取得する装置であり、必ずしも治療計画時データ取得装置1で用いられる装置と同じ構成である必要はない。例えば、治療計画時のデータ取得は治療計画室で行い、治療時のデータ取得は粒子線などの放射線治療を行うための治療室で行う、というように、治療計画時と治療時でデータ取得環境が異なる場合が多く、それぞれで備えられた装置が異なる場合が多い。治療時データ取得装置3により治療時データ取得工程が形成される。
【0017】
形状解析装置4は、治療計画時データ取得装置1により得られたデータからデータに応じて体表面、病巣部、骨などの位置や形状を特定しモデル化する。得られるデータの点群や、エッジ処理を行う事により得られるデータをモデル化する。また、治療時データ取得装置3により得られるデータも同様にモデル化する。そして、このモデル化されたデータ群(情報)をもとに、患部の病巣部などの形状変化を解析する。形状解析装置4により形状解析工程が形成される。
【0018】
患者位置決め処理装置5は、形状解析装置4で得られる解析結果を用いて治療台6の移動量を演算するものである。患者位置決め処理装置5により患者位置決め処理工程が形成される。
治療台6は、放射線治療の際に、放射線や粒子線など治療用のビームが患部の適切な位置を照射されるように、3次元位置および姿勢が調整可能な機構を備える。
【0019】
なお、治療計画装置2、形状解析装置4、患者位置決め処理装置5は、計算機によってそれぞれの機能が実行される。これらの装置は、それぞれが別々の計算機によって実行されても良いし、一つの計算機が複数の装置の機能を実行するように構成されても良い。
【0020】
次に、以上の患者位置決めシステムの動作の概要を図2に従って説明する。まず、治療計画室で治療計画時データ取得装置1により患者のデータを取得する(ST101)。この取得したデータを治療計画時患者データと呼ぶことにする。次に医師などが、治療計画時データ取得装置1、特にX線CTにより取得されたデータを用いて、放射線を照射する患部、照射角、照射線量などを決定する治療計画を実施する(ST102)。以上で治療計画時の工程が終了する。
【0021】
次に、放射線を照射して治療するに際して、患者を治療台6に載せて治療計画に従って放射線を照射する位置に患者を位置決めする工程に入る。まず患者を治療台6に載せた状態で治療時データ取得装置3により患者データを取得する(ST103)。この取得した
データを治療時患者データと呼ぶことにする。形状解析装置4において、治療計画時患者データと治療時患者データを、それぞれ一つの統一の空間に統合化処理する(ST104)。なお、治療計画時患者データは、治療計画時データ取得装置1により取得した後治療時までの間に統合化処理しておいても良いのは言うまでもない。
【0022】
次に、形状解析装置4により統合化された治療計画時患者データと治療時患者データをモデル化して比較解析する(ST105)。モデル化および比較解析の内容については、後で詳細に説明する。この比較解析した結果が患者位置決め処理装置5に出力される(ST106)。患者位置決め処理装置5は、受け取った解析結果を基に治療台6の移動量を演算する(ST107)。この演算結果の移動量分治療台6を移動する(ST108)。治療台6の移動後、医師などが、患部が治療計画通りに放射線が照射される位置にあるかどうか、X線TV画面などにより確認し、患部の位置ずれが許容範囲内かどうかを判断する(ST109)。位置ずれが許容範囲内であれば放射線治療を実施する。(ST110)。もし位置ずれが許容範囲を超えていれば、治療台6を微調整して(ST111)、再度X線TV画面などにより位置ずれを確認して許容範囲内かどうかを判断する(ST109)。
【0023】
以下で詳細を説明するように、本発明によれば、治療計画時患者データ取得時と治療時患者データ取得時において、患者の姿勢が異なる、あるいは外部力が異なる、などにより、患部近傍の形状が変化してもその変化の原因を推定して、患部の形状が治療計画時と同じになるように治療台6の姿勢などの位置決めを行うため、上記ST110の判断工程において患部の位置ずれが許容範囲を超えることはほとんどない。したがって医師などによるX線TV画面での確認回数は1回で済むため、患者のX線被ばくが抑制できる。
【0024】
以下、形状解析装置4における比較解析の処理、すなわち図2におけるST104〜ST106の処理について説明する。形状解析装置4の内部処理は概略図3のように、データ統合手段7(図2のST104に相当)、データ解析手段8(図2のST105に相当)、データ出力手段9(図2のST106に相当)で構成されている。
【0025】
まず、データ統合手段7において、異なる測定値のデータを統一した空間により定義する。この統一の空間のイメージ図を図4に示す。例えば、X線CT10により測定された3次元データであるCT値を電子密度で再定義する。CT値から電子密度を求める方法は例えば非特許文献1に記載された方法などを用いる。この電子密度で再定義した3次元空間を電子密度空間13と呼ぶ。この電子密度空間13によれば、体内の脂肪や骨などの密度を3次元空間上の位置ごとに定義できる。ここでは、この電子密度空間13を統一の空間として用いる。
【0026】
また、MRI12やX線TV画像11など、X線CTとは異なる種類の測定値(モダリティ)の2次元データに対しても、フィルタ処理をすることにより2次元データから3次元情報の候補となる特徴量を取得し、その特徴量を電子密度空間13として定義した統一の空間の3次元位置に対応した情報として保存する。超音波15のデータに対しては、プローブに3次元センサを搭載しておくことにより、プローブの位置と取得データの位置情報などが取得でき、電子密度空間13の位置との一対一対応がとれる。さらにステレオカメラで得られる体表面14のデータでは、データの3次元位置が分かっているために、電子密度空間13に対して体表面のデータを容易に対応付けできる。また、上記以外の測定装置であっても患者の体表面や内部組織の2次元データや3次元データが得られる測定装置であれば使用することができる。
【0027】
このように、統一の空間、ここでは電子密度空間13、を用いて異なる測定装置の特徴量データを3次元位置に対応付けできる。このようにして、例えば超音波では超音波で取
得しやすい体内の内部情報、MRIではMRIで取得しやすい乳腺の位置情報など、異なる測定装置によって得られる、それぞれの測定装置での最適な情報を一つの空間で定義することが可能となる。さらに、X線CTでは乳腺を特定することが難しいが、MRIによるデータを統一の空間で定義することにより、乳腺の位置がX線CTのデータから得られた電子密度空間13上でも予測が可能となる。
【0028】
上記の説明では、種々のデータ取得装置を用いたが、実際には、治療部位や準備できるデータ取得装置の種類に応じて、X線CTとMRI、X線CTと超音波とステレオカメラ、といった様に、データ取得装置の種類を決定し、それぞれの組み合わせに応じて適切な処理を行う。
【0029】
次に、データ解析手段8においては、この統一の空間すなわち電子密度空間13でデータ解析を行う。例えばこの電子密度空間13に対してフィルタ処理を行う。また異なるモダリティにおけるデータに対しても、ボリュームデータ(3次元)の特徴解析、2次元データの特徴解析、2次元3次元特徴解析を、それぞれのデータに応じて実施する。例えば3次元のCT、MRIボリュームデータであれば、表面のエッジデータ、骨データの抽出、内部臓器の形状抽出などをおこなう。X線TV画像のような2次元画像データであれば、画像処理による一般的なエッジ処理等による特徴点抽出処理を行う。2次元3次元特徴解析では、2次元データDRRから3次元データの推定を特徴点による解析と解剖学的情報(各臓器や骨などの一般的な位置関係の情報)から算出する。この結果、測定装置で得られるCTやMRIデータを電子密度空間13上に変換できる。この変換により、3次元ボリュームデータ内の表面のエッジデータ、骨データ、内部臓器の形状などを電子密度空間上に対応付けでき、電子密度空間上で表現(定義)できる。例えば、CTとMRIを測定する領域を一致させておくことにより、一方では取得が困難な情報を補間する事が可能となる。そして、他のモダリティである2次元データのX線TV画像から得られる特徴と、2次元3次元情報が得られるDRRでの特徴を、CTやMRI等で得られる特徴と一致するようにデータ取得することにより、電子密度空間上に様々な測定装置の情報を集約できる。このマルチモダリティ(X線CT、MRI・・・など複数のデータから得られる特徴を含んだ情報)の空間を潜在空間と定義する。
【0030】
この得られた特徴点を用いてモデル化を実施する。例えば図5に示すようなばねモデルを定義する。すなわち、体表面の特徴点16(座標(x1,y1,z1))および骨の特徴点17(座標(x2,y2,z2))と腫瘍の特徴点19(座標(x3,y3,z3))の間をそれぞればね18と仮定し、そのばね係数をそれぞれK13、K23とする。例えば、体表面の特徴点16と腫瘍の特徴点19の間のばねによる力FK1,3は、ばね係数K13に変位を乗じたものとな
る。また、モデル化の方法は、ここで示す力学モデルの一種であるばねモデルではなく、他の力学モデルや力学モデル以外の物理モデル、例えば血液の流れなどを用いた血管などの流体モデル、電気信号等による電磁気モデルのようなものでも良く、物理モデルであればなんでもよい。ばねモデルを用いる場合では、例えば数(1)式のように外部からの力をFall(重力、形状変化など全ての因子)としたときに、表面の力F表面と内部の力F
内部の和として定義ができる。ここでの内部の力とは呼吸、脈、心臓などの力を示す。一方表面の力は、外部から体表面が押される力などを示している。従って、数(1)式の定常状態(変化がない状態)では左辺が0であると定義ができる。
【0031】
この数(1)式をばねモデル定義式数(2)式で表す。数(2)式の左辺、右辺の行列の上の矢印は、左辺、右辺がベクトル量であることを示している。左辺の(x,y,z)は体表
面の座標と内部の座標両方を示し、その座標上の力をFi,jと定義する。i=j、すなわ
ちFi,iはi番目の特徴点での力を表し、i≠jの場合はi番目の特徴点とj番目の特徴
点の間に働く力を表す。この左辺の力ベクトルは、外部の力が与えられたら、内部の特徴点間ごとの力ベクトルのトータルが外部の力ベクトルのトータルと一致するように、体内
のばねモデルとして反映させる事を示している。数(2)式の右辺では、ばねモデルの定義により、外部の力が与えられる特徴点や領域から、その周辺の特徴点に力が加わり(派生し)、周辺の特徴点の力に反映されるように定義する。すなわち、数(2)式の右辺はモデル化したばねによる力をFKi,jとして表しており、例えば図5の腫瘍(i=3)と
体表面(i=1)の間に働くばねの力をFK1,3として表している。右辺の対角要素FKi,iは自己相関でありばねの力が無いため通常は0となる。あるいは、次のように対角要素だけで表してもよい。すなわち、対角要素におけるばねの力としての要素であるFK3,3の座標(x3,y3,z3)が、図6の腫瘍の位置であるとすると、FK3,3は近傍のばねの集合として数(3)式のように定義してもよい。数(3)式における引数は移動量(変位)を表している。このように、力を対角要素に集合することで、式を簡単化できるとともに、非剛体の変形する部位に対して、ある領域に外力が加わったときに周辺に与える影響をモデル化することが可能となる。
【0032】
このように定義することにより、一旦ばね係数Kが求まれば、外部の力やずれ量(例えば体の向きが変わる事により重力の向きが変わり、体表面の形状が変るという外部の力などを重力モデルより算出する)を算出することにより内部の形状が推定できる。
【0033】
【数1】

【数2】

【数3】

【0034】
ここでばね係数Kの求め方の一例を説明する。まず、治療計画で式(1)の右辺=0という状態の式を算出する。この=0というのはトータルFall=0を意味し、なにも力が
加わっていない状態である定常状態を表す。つまり治療計画で得られる患者の参照データであり、ベッドに横たわっている状態を表す。この状態で、特徴などを算出し、未知のパラメータであるばね係数Kを計算する。計算には未知のパラメータ数の方程式が必要となる。たとえば、定常状態から少し体を動かして(重心を動かして)ある特徴位置(x,y,z)
が(x’,y’,z’)へと移動した事が分かれば、方程式を得ることができる。未知のパラメ
ータ数の方程式を得ることができると、内部の未知のパラメータKを算出することができ
る。この方法によれば、未知のパラメータ数の方程式を得るため、何回もデータを取る必要があり、CTやMRIの場合は、実用化が難しい。しかし、CTを一回取得し、他のセンサ、例えば、超音波や体表面のデータを時間軸で取得することにより、体位の変化、呼吸の振幅などを取得することができ、複数の特徴点の移動を算出できる。このような方法で、例えば体表面だけのデータを複数取得することにより、ばねパラメータKの未知数分の方程式が得られ、ばねパラメータKの値が算出できる。
【0035】
また、勾配法やScale Conjugate Gradient(パラメータを含んだ勾配法の最適化手法)、IK(Inverse Kinematics)などを用いることにより、重心などを動かさずに、位置移動のデータを取得することも可能である。このような方法で、治療計画データから数(1)式=0を満たす方程式を生成して、ばね係数などの値を算出することもできる。
【0036】
以上では、方程式を得ることでばね係数を求めたが、ばね係数は、ユーザが定義したり、解剖学的な情報をも用いて定義することも可能である。あるいは、ニューラルネットワークなどのモデルと、他のモダリティで得る情報からKを最適化してもよい。または、X線CTより変換されて得られる電子密度空間13では密度に応じてばね係数を定義することもできる。例えば、電子密度が高い領域ではばね定数を大きくし、電子密度が小さい領域では、ばね定数を小さくする。このことにより、ばねモデルの係数が、電子密度に応じた最適なパラメータで評価できるとともに、異なったモダリティにおける情報を統一して評価が可能となる。そして図6の骨や体表面などは特徴解析で得られた特徴点を用いる。またここでのばね方程式だけでなく、重力、体位の変化などの物理モデルで表現してもよい。この処理により、患者の体位の違いにより変形する内部組織をモデル化できる。この結果容易に内部の形状を推定できる。
【0037】
次に、治療時にデータを取得する。このデータから体の重心の位置などが取得できるとともに、特徴が取得できる。これを先ほど算出した数(1)式に代入することにより、取得できなかった内部の状態の特徴の位置を求めることができる。たとえば、図6で示すように、n点の特徴点が求まる(図6では特徴点は7点を図示しているが、図示しない特徴点があるとして7点目をnで表記している。)とする。そのn点の座標を(x1,y1,z1)・・・(xn,yn,zn)と定義し、その間にあるばね係数をそれぞれKi,jとすると(i≦n,j≦n)
となる。そこで数(2)式の左辺では、実際は対角の要素のみ値が入り対角以外の要素の値は0となる。しかし、治療計画で得られた特徴の位置に対して、現在の値の特徴の位置が移動したとすると、この移動量∇分のばねの力をFKi,jにそれぞれ代入して数(2)
式の右辺の力の要素を求める。
【0038】
ここで問題になるのは、現在の特徴点と治療計画の特徴点が実際に特徴と一致しているのかである。そのため、容易に一致できる体表面の特徴点などを予め例えばICPアルゴリズムなどを用いて算出する必要がある。その結果、大まかな、特徴点の移動が算出できるとともに詳細な内部臓器の移動量などを、数(2)式などから、最適化を行う事により算出できる。また計算を簡易化するために、数(2)式の右辺の対角上の力を数(3)式のように簡易的に近似してもよい。数(2)式の対角要素は0である可能性があり、最適化するのに難しい問題があるが、以上のように処理すればこの問題が解決できる。
【0039】
以上の処理を治療計画時データ取得装置1と治療時データ取得装置3で得られるデータ両方におこなう。その結果得られる図7のような3次元空間を用いて腫瘍や、体の変化を推定する。たとえば潜在空間の体表面のデータ14を用いてICP(Iterative Closet Points)マッチングを行う。その結果、電子密度空間13ではその対応点が算出でき、ばねモデルが定義できる。このように他の潜在空間(ここでの潜在空間とは電子密度を生成するX線TV画像、X線CT、超音波などの測定装置における特徴空間)で変化を評価する事により様々な内部臓器を評価できる。これにより、体内の内部の特徴点の間をばねモデルで表現する事により、治療時に体表面や大まかな情報しかえられない状況においても内部の臓器の状態を容易に推定できるようになる。そしてデータ出力手段9で臓器の変化結果について算出する。
【0040】
この内部の情報をもとに、患者位置決め処理装置5にて移動量を算出する。例えば、臓器の変形がなければ、治療計画時の状態と治療時の状態に変化が少ない。そのため特許文献1のような従来の位置合わせ方法を用いて治療計画通りに治療が可能である。しかし、照射ターゲットによっては、図7のように治療計画時から治療時にかけて形状が変化する図7の格子ばねモデルでは、表面しか図示していないが、体表面だけでなく内部もばねモデルとして表現する。そこで、例えば解析結果が図7の治療計画時格子ばねモデル22と治療時格子ばねモデル23のように得られたら、治療時格子ばねモデル23から治療計画時格子ばねモデル22のモデルになるように、外部から力を与える。あるいは、外部から力を与えるのではなく、治療台6を移動させることにより姿勢を変化(体の重心移動)させて、治療時格子ばねモデル23が治療計画時格子ばねモデル22のモデルになるようにする方法もある。また、これら外部から力を与えるのと姿勢を変化させるのとを組み合わせることにより治療時格子ばねモデル23を治療計画時格子ばねモデルに一致させる方法もある。
【0041】
このように、内部臓器をモデル化することにより、外部から与える力や、治療台6の姿勢などによりどのように内部の形状が変化するかを推定でき、この推定結果を基に、患者位置決め処理装置5にて、治療時格子ばねモデルが治療計画時格子ばねモデルになるような治療台6の移動量を演算することができる。この結果、患部が治療計画によって決めた放射線を照射するための所定の位置になるよう位置決めをすることができる。
【0042】
乳がんなど形状変化が大きくなる可能性がある対象の場合、変形する対象に対してカップなどを用いて固定する方法を用いてもよい。さらにカップに吸引する機能などがあれば、IKで得られた制御値を、その吸引の角度や吸引力等に反映させ、治療計画時の形状になるようにする。この内部の状態を確認するためには、DRR(Digital Reconstruct Radiograph)をX線CTから生成して確認を行う。ただし、乳がんなどの形状をX線CTから生成したDRRで表示する事は難しい。そこで、他のモダリティ、例えば、乳腺などの情報が得られるMRI12の測定データから、統一の空間である電子密度空間を用いて位置情報を取得する。取得する方法として、図8で示すように、例えば、MRIで得られる対象部位の3次元位置情報(ラベル24)を保存し、保存した位置が電子密度空間13に写像した時にその写像空間上の点(ラベル25)がMRI上での座標の特徴点を保持する。この処理により電子密度空間やMRIでないモダリティ上で、例えばDRRなどで、乳腺などの位置情報が取得できる。この位置情報を電子密度空間で得るための処理をラベル化と定義する。そのラベル化された特徴点を通過する領域が強調されるようにDRRを生成して形状変化を確認する。このような処理を行うことにより、内部の形状が一致するまで、最適計算をおこなう。以上の結果から、移動量(ターゲットの形状を治療計画に一致できる移動量)を治療台6の姿勢と位置の移動量に反映させる。
【0043】
以上の処理により、治療計画時と治療時との腫瘍患部近傍の形状を比較解析し、その変化から姿勢などの変化が推定でき、効率的に治療計画で決定した放射線照射ができるように患部の位置合わせができるとともに、治療における正常組織への影響を低減できる。
【0044】
実施の形態2.
実施の形態1においては、治療時患者データも、治療計画時患者データと同じ統一の空間で処理を行った。必ずしもこのような処理を行う必要はなく、例えば治療計画時患者データに対して図4の統一の空間を生成する。一方、治療時データは統一の空間で処理を行うのではなく、取得した潜在空間のみで治療計画時データと比較してずれ量を算出する。
この算出方法は、テンプレートマッチングや、ICPなど一般的に用いられている手法で行う。そして、このずれ量は特徴点であるノードに対応して算出されるため、統一の空間である電子密度空間におけるばねモデルを用いて形状の変化を推定でき、治療台の移動量を演算できる。この方法によれば、計算時間が短縮できるとともに、治療時データが少ないモダリティであっても、当該モダリティからずれ量を算出することで形状の変化を推定することができ、治療台の移動量を演算することができる。
【0045】
実施の形態3.
実施の形態1では、統一の空間を、治療計画時データ取得装置1にて得られるデータを用いて生成した。実施の形態3では、直接治療計画時取得データから統一の空間を生成するのではなく、治療計画装置から得られるデータを用いて統一の空間を生成する。すなわち、治療計画装置においては、治療計画時患者データに、例えばがん治療領域などを特定してその癌治療領域の情報を加えて治療計画データとする。このため、治療計画装置から得られるデータを用いて統一の空間を生成すれば、治療計画の情報を付加した状態で形状の変化が推定できる。これにより、患部の特定が容易になり、患部付近の変形をより精度良く推定することができるため、実施の形態1よりもさらに精度良く治療台の移動量を演算できる。
【0046】
実施の形態4.
実施の形態1ではX線CTから得られる電子密度の空間を統一の空間としたが、統一の空間を、電子密度空間ではなく、治療の部位に合わせて別の空間で定義してもよい。治療の部位によっては、X線CTのデータから生成された電子密度空間よりも、他のモダリティのデータから生成した方が適当な場合がある。たとえば、MRIによる測定データによれば乳腺などの情報が良好に得られるため、乳がんの治療においてMRI12のモダリティのデータを統一の空間とすれば患部の特定が容易になる。このように、電子密度空間に限らず、それぞれの目的に合わせて統一の空間を定義することができる。この結果、腫瘍が特定し易いモダリティを基準とする事ができ、最適な内部推定を可能とすることができる。
【0047】
実施の形態5.
実施の形態1ではX線CTの測定データを加工して例えば電子密度のような特定の特徴量により統一の空間を定義したが、測定データを加工して統一の空間を定義するのではなく、Image Fusion(画像融合)を用いてもよい。Image Fusionとは、異なる性質の画像を融合して一つの画像とするものである。例えば、X線CTにより得られるデータを画像データとして、MRIにより得られるデータも画像データとして、これら二つの画像データを画像データのまま融合して一つの画像データとすることにより統一の空間を定義することができる。この融合した画像から特徴点を設定してばねモデルとしてモデル化を行う。この結果、複数のモダリティで得られる異なる特徴量のデータを統合する事ができ、データ量の削減が可能である。
【0048】
実施の形態6.
得られる全ての特徴点に対してSelf Organization Map(SOM、自己組織化マップ)
等によって自動的にグループ化を行ったり、骨や各臓器の一般的な相対位置関係を表す情報である解剖学的情報を用いて最適化されたモデルを用いてもよい。この結果計算量を削減することが可能となり、実用的な計算速度での形状の変化の推定を可能とする。
【0049】
実施の形態7.
実施の形態1におけるばねモデル(数(1)式、数(2)式)において、単純なばねモデルではなく、各位置におけるばね係数以外の情報を含めた情報を用いてモデル化してもよい。たとえば、重力や摩擦の影響を考慮したモデル化や、呼吸、心臓、脈による影響を
含めてモデル化するために、時間による変化を含めたモデル化を行ってもよい。時間による変化を含めたモデル化とは、4次元CTなど時間をも一つのパラメータとして動画のように取得したデータによりモデル化を行うことである。さらに解剖学的情報を数式化してもよい。
【0050】
例えば、呼吸による影響を含める場合、数(1)式においてばね係数Kが位置によって決まるだけではなく、呼吸サイクルの時間tを含み、時間tの変化により特徴点(x,y,z)
の位置が変り、変位が生じることによりFKという力の値が得られる。この結果、患者内部の詳細なモデル化が時間軸を含んだ形で推定が可能となる。
【0051】
実施の形態8.
実施の形態1においては、形状が変化するターゲットに対してDRR画像を用いて変形を確認したが、DRR画像を用いずに他のモダリティにより変形を確認する処理を行うことができる。例えばMRI12や超音波15などにより、確認処理を行ってもよい。MRIや超音波によって得られるデータも統一の空間に対応して位置付けすることができるため、これらX線画像以外のモダリティによっても変形を確認することができる。X線画像により確認を行うのは、確認のためだけで患者にX線被ばくを与えてしまうが、MRIや超音波を用いれば、確認処理のために患者にX線被ばくを与えることがないというメリットがある。また、確認処理のために持ち込める計測装置に応じて位置合わせが可能となる。
【0052】
実施の形態9.
実施の形態1では、治療計画時データ取得装置1により治療計画時患者データを取得して、この治療計画時患者データを用いて治療計画装置2により治療計画を実施した。この治療計画を、形状解析装置4から得られるばねモデル23等のデータを生成した後、この生成したデータを用いて実施してもよい。この結果、例えば患者のわずかな向きのずれによるターゲット患部の変形を推定する事ができ、予めこのずれを反映して治療計画が立てられる。
【0053】
実施の形態10.
実施の形態1においては、治療時格子ばねモデル23を治療計画時格子ばねモデル22に一致するように力を加えたり、治療台を移動したりした。しかし本実施の形態10ではこの変形の処理を、治療計画時格子ばねモデル22から治療時格子ばねモデル23に一致するようにして行う。すなわち、実施の形態1と逆の処理を行う。この処理により、例えばDRRを生成するために必要なX線CT10を、治療時に取得する必要がなくなり、X線TV画像11などで行えるようになる。これにより、取得データの処理や装置の数を削減する事が可能である。ただし本実施の形態10を実施するためには、実施の形態9の処理をおこない、患者の向きのずれ量が治療計画に考慮されているようにしなければならない。
【0054】
実施の形態11.
実施の形態1において、治療計画時格子ばねモデル22と治療時格子ばねモデル23に用いられる特徴点の数は計算コストに依存する。そこで、それぞれの、ばねモデルに用いる特徴点は一般的な画像圧縮方法である画像ピラミッドを生成して特徴量を圧縮して得られる特徴点をばねモデルのノードに用いてもよい。または、得られる特徴点を全て算出し、その特徴点なかで、特徴点らしい特徴点を一般的に用いられる固有値計算により算出し固有値の高い特徴点を用いて評価を行ってもよい。
【0055】
以上各実施の形態で説明した処理は、GPU(Graphic Processing Unit)などを用い
て並列計算処理を行うことができ、高速に処理を行うことができる。
【符号の説明】
【0056】
1:治療計画時データ取得装置1 2:治療計画装置2
3:治療時データ取得装置3 4:形状解析装置4
5:患者位置決め処理装置5 6:治療台
13:統一の空間
【特許請求の範囲】
【請求項1】
患者の患部に放射線を照射して治療を行う放射線治療時に患者を載せる治療台を位置決めする患者位置決め方法において、
治療計画時の患者のデータである治療計画時患者データを取得する治療計画時データ取得工程と、
この治療計画時患者データを用いて治療計画を行う治療計画工程と、
治療時の患者のデータである治療時患者データを取得する治療時データ取得工程と、
上記治療計画時患者データと上記治療時患者データとにより治療計画時の患者の形状と治療時の患者の形状を比較して解析する形状解析工程と、
この形状解析工程において治療計画時の患者の形状と治療時の患者の形状を比較して解析した結果を基に上記治療台の移動量を演算して上記治療台を移動させる治療台位置決め処理工程と
を備えたことを特徴とする患者位置決め方法。
【請求項2】
治療計画時データ取得工程において、複数の種類の患者データを取得し、形状解析工程において、上記複数の種類の患者データのうち一つの種類の患者データから統一の空間を生成し、他の種類の患者データを、上記統一の空間に対応して位置付けすることを特徴とする請求項1に記載の患者位置決め方法。
【請求項3】
形状解析工程において、統一の空間で患者の物理モデルを生成し、この物理モデルを用いて患者の形状を解析することを特徴とする請求項2に記載の患者位置決め方法。
【請求項4】
物理モデルにはばねモデルを含むことを特徴とする請求項3に記載の患者位置決め方法。
【請求項5】
統一の空間を、治療計画工程において治療計画時患者データに治療計画の情報が付加されたデータから生成することを特徴とする請求項2に記載の患者位置決め方法。
【請求項6】
統一の空間は、患者の部位ごとに、異なる種類の患者データから生成されることを特徴とする請求項2に記載の患者位置決め方法。
【請求項7】
複数の種類の患者データをそれぞれ画像データとして表現し、これら複数の画像データを重ね合わせて統一の空間を生成することを特徴とする請求項2に記載の患者位置決め方法。
【請求項8】
形状解析工程において、生成された物理モデルを用いて、治療時患者データから解析される治療時の患者の形状が、治療計画時患者データから解析される治療計画時の患者の形状に一致するための患者の姿勢を算出し、治療台位置決め処理工程において、この患者の姿勢の算出結果を基に治療台の移動量を演算することを特徴とする請求項3に記載の患者位置決め方法。
【請求項9】
形状解析工程において、生成された物理モデルを用いて、治療計画時患者データから解析される治療計画時の患者の形状が、治療時患者データから解析される治療時の患者の形状に一致するための患者の姿勢を算出し、治療計画工程において、この算出された治療時の患者の姿勢を考慮して治療計画を実施することを特徴とする請求項3に記載の患者位置決め方法。
【請求項10】
患者の患部に放射線を照射して治療を行う放射線治療時に患者を載せる治療台を位置決めする患者位置決めシステムにおいて、
治療計画時の患者のデータである治療計画時患者データを取得する治療計画時データ取得装置と、
この治療計画時患者データを用いて治療計画を行う治療計画装置と、
治療時の患者のデータである治療時患者データを取得する治療時データ取得装置と、
上記治療計画時患者データと上記治療時患者データとにより治療計画時の患者の形状と治療時の患者の形状を比較して解析する形状解析装置と、
この形状解析装置により治療計画時の患者の形状と治療時の患者の形状を比較して解析した結果を基に上記治療台の移動量を演算して上記治療台を移動させる治療台位置決め処理装置と
を備えたことを特徴とする患者位置決めシステム。
【請求項11】
治療計画時データ取得装置が複数の種類の患者データを取得するよう構成されており、形状解析装置は、上記複数の種類の患者データのうち一つの種類の患者データから統一の空間を定義し、他の種類の患者データを、上記統一の空間に対応して位置付けすることを特徴とする請求項10に記載の患者位置決めシステム。
【請求項12】
形状解析装置は、統一の空間において患者の物理モデルを生成し、この物理モデルを用いて患者の形状を解析することを特徴とする請求項11に記載の患者位置決めシステム。
【請求項13】
物理モデルにはばねモデルを含むことを特徴とする請求項12に記載の患者位置決めシステム。
【請求項1】
患者の患部に放射線を照射して治療を行う放射線治療時に患者を載せる治療台を位置決めする患者位置決め方法において、
治療計画時の患者のデータである治療計画時患者データを取得する治療計画時データ取得工程と、
この治療計画時患者データを用いて治療計画を行う治療計画工程と、
治療時の患者のデータである治療時患者データを取得する治療時データ取得工程と、
上記治療計画時患者データと上記治療時患者データとにより治療計画時の患者の形状と治療時の患者の形状を比較して解析する形状解析工程と、
この形状解析工程において治療計画時の患者の形状と治療時の患者の形状を比較して解析した結果を基に上記治療台の移動量を演算して上記治療台を移動させる治療台位置決め処理工程と
を備えたことを特徴とする患者位置決め方法。
【請求項2】
治療計画時データ取得工程において、複数の種類の患者データを取得し、形状解析工程において、上記複数の種類の患者データのうち一つの種類の患者データから統一の空間を生成し、他の種類の患者データを、上記統一の空間に対応して位置付けすることを特徴とする請求項1に記載の患者位置決め方法。
【請求項3】
形状解析工程において、統一の空間で患者の物理モデルを生成し、この物理モデルを用いて患者の形状を解析することを特徴とする請求項2に記載の患者位置決め方法。
【請求項4】
物理モデルにはばねモデルを含むことを特徴とする請求項3に記載の患者位置決め方法。
【請求項5】
統一の空間を、治療計画工程において治療計画時患者データに治療計画の情報が付加されたデータから生成することを特徴とする請求項2に記載の患者位置決め方法。
【請求項6】
統一の空間は、患者の部位ごとに、異なる種類の患者データから生成されることを特徴とする請求項2に記載の患者位置決め方法。
【請求項7】
複数の種類の患者データをそれぞれ画像データとして表現し、これら複数の画像データを重ね合わせて統一の空間を生成することを特徴とする請求項2に記載の患者位置決め方法。
【請求項8】
形状解析工程において、生成された物理モデルを用いて、治療時患者データから解析される治療時の患者の形状が、治療計画時患者データから解析される治療計画時の患者の形状に一致するための患者の姿勢を算出し、治療台位置決め処理工程において、この患者の姿勢の算出結果を基に治療台の移動量を演算することを特徴とする請求項3に記載の患者位置決め方法。
【請求項9】
形状解析工程において、生成された物理モデルを用いて、治療計画時患者データから解析される治療計画時の患者の形状が、治療時患者データから解析される治療時の患者の形状に一致するための患者の姿勢を算出し、治療計画工程において、この算出された治療時の患者の姿勢を考慮して治療計画を実施することを特徴とする請求項3に記載の患者位置決め方法。
【請求項10】
患者の患部に放射線を照射して治療を行う放射線治療時に患者を載せる治療台を位置決めする患者位置決めシステムにおいて、
治療計画時の患者のデータである治療計画時患者データを取得する治療計画時データ取得装置と、
この治療計画時患者データを用いて治療計画を行う治療計画装置と、
治療時の患者のデータである治療時患者データを取得する治療時データ取得装置と、
上記治療計画時患者データと上記治療時患者データとにより治療計画時の患者の形状と治療時の患者の形状を比較して解析する形状解析装置と、
この形状解析装置により治療計画時の患者の形状と治療時の患者の形状を比較して解析した結果を基に上記治療台の移動量を演算して上記治療台を移動させる治療台位置決め処理装置と
を備えたことを特徴とする患者位置決めシステム。
【請求項11】
治療計画時データ取得装置が複数の種類の患者データを取得するよう構成されており、形状解析装置は、上記複数の種類の患者データのうち一つの種類の患者データから統一の空間を定義し、他の種類の患者データを、上記統一の空間に対応して位置付けすることを特徴とする請求項10に記載の患者位置決めシステム。
【請求項12】
形状解析装置は、統一の空間において患者の物理モデルを生成し、この物理モデルを用いて患者の形状を解析することを特徴とする請求項11に記載の患者位置決めシステム。
【請求項13】
物理モデルにはばねモデルを含むことを特徴とする請求項12に記載の患者位置決めシステム。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【公開番号】特開2011−200542(P2011−200542A)
【公開日】平成23年10月13日(2011.10.13)
【国際特許分類】
【出願番号】特願2010−72125(P2010−72125)
【出願日】平成22年3月26日(2010.3.26)
【出願人】(000006013)三菱電機株式会社 (33,312)
【Fターム(参考)】
【公開日】平成23年10月13日(2011.10.13)
【国際特許分類】
【出願日】平成22年3月26日(2010.3.26)
【出願人】(000006013)三菱電機株式会社 (33,312)
【Fターム(参考)】
[ Back to top ]

