悪性疾病の診断および予知方法
【課題】細胞原形質膜をヌクレオリンの存在について精査することによって細胞の新生物状態を判定することによる癌の診断方法、そのような検査を実施するためのキット、ならびに、癌を治療するための組成物の提供。
【解決手段】抗ヌクレオリンモノクローナル抗体及び調剤学的に許容される担体を含有する、哺乳類において癌を治療するための組成物。さらに、該抗ヌクレオリンモノクローナル抗体が、毒素に結合している組成物。該抗ヌクレオリンモノクローナル抗体は、原形質膜ヌクレオリン発現細胞を標的として、これを排除する。
【解決手段】抗ヌクレオリンモノクローナル抗体及び調剤学的に許容される担体を含有する、哺乳類において癌を治療するための組成物。さらに、該抗ヌクレオリンモノクローナル抗体が、毒素に結合している組成物。該抗ヌクレオリンモノクローナル抗体は、原形質膜ヌクレオリン発現細胞を標的として、これを排除する。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、ヌクレオリン(nucleolin)の細胞原形質膜発現と新生物細胞の存在および侵略性との間の相関の発見に基づく。即ち、本発明は、前悪性症状および悪性疾病および障害の検出および予知、並びに検出および予知用のキットに関する。
【背景技術】
【0002】
闘いに十分に備えることは成功に至る;障害が癌である場合、早期の検出は、医薬介入が成功する大きな可能性をもたらす。早期段階においては、治療は、多くの場合、病変組織のみをターゲットとし、副作用を軽減し得る。早期で見出せない場合、癌細胞は、身体中に転移拡大し得る。この場合の予後はより悲惨であり、医薬治療は、多くの場合、全身的に施され、癌細胞のみならず大多数の健常細胞も死滅させる。
癌細胞の顕著な特徴は、制御されない増殖である。また、癌細胞は、形態上および機能上の異常も示し得る。癌細胞は、系統的な細胞形態をあまり示さず、例えば、非対称形細胞小器官および適切な細胞機能を可能にする構造的組織化(細胞極性)を喪失する。細胞-細胞間および細胞-基体間接触、正常な機能のためにも必要なその特異性は、多くの場合、変調されあるいは喪失する。機能的には、癌細胞は、野生タイプの機能を例えあったとしても殆ど維持し得ず、また、ホルモン分泌のような正常機能を悪化させ、調節し得ない。そのような細胞は、早期発生期に逆行し、その野生タイプ(即ち、正常)親細胞よりも分化しないようである。
また、癌細胞は、しばしば、誤発現しあるいはたんぱく質類を不適切な細胞画分へ誤ターゲティングする。たんぱく質類はアップ-またはダウン-調節され得、特異的細胞タイプによって通常発現されないたんぱく質でさえも、形質転換された対応物によって発現され得る。たんぱく質誤発現は、膜組成、細胞小器官形成または生理機能における激しい変化を含む過剰な下流細胞作用を有し得る。たんぱく質(および脂質等のような他の分子)の誤ターゲティングも細胞極性の喪失に寄与する。
【発明の概要】
【発明が解決しようとする課題】
【0003】
癌増殖の検出は、たんぱく質誤発現および細胞脱分化のような種々の要因により複雑である。例えば、癌は、次第に進行して、検出するのが困難な少数のみに存在し得る。一般的な診断方法は、癌細胞を正常細胞から識別する“マーカー”としてのある種のたんぱく質の使用である。例えば、前立腺癌の診断は、多くの場合、前立腺特異性抗原(PSA)を使用する。これらのアッセイは、マーカーが限定され、検出因子を有し、且つ容易に入手可能であることを必要とする。しかしながら、殆どではないにしても多くの癌中に存在するマーカーはもっと限定されるべきである。そのようなマーカーは、診断を著しく容易にするであろう。
【課題を解決するための手段】
【0004】
第1の局面において、本発明は、ヒトのような哺乳動物の細胞を含む細胞の原形質膜のヌクレオリンの存在を検出することを特徴とする細胞の新生物状態の判定方法に関し;その細胞は溶解させてもよい。原形質膜ヌクレオリンは、配列番号1〜7;9〜17;19〜31の配列オリゴヌクレオチド類のような抗-ヌクレオリン抗体またはオリゴヌクレオチド類のような抗-ヌクレオリン因子を使用することによって検出する。
第2の局面においては、本発明は、ヒトのような哺乳動物の細胞を含む細胞の原形質膜のヌクレオリンの量を定量することを特徴とする新生物細胞のフェノタイプの判定方法に関し;その細胞は溶解させてもよい。原形質膜ヌクレオリンは、配列番号1〜7;9〜17;19〜31の配列オリゴヌクレオチド類のような抗-ヌクレオリン抗体またはオリゴヌクレオチド類のような抗-ヌクレオリン因子を使用することによって検出する。
もう1つの局面においては、本発明は、抗-ヌクレオリン因子と対照検体を含む、細胞の新生物状態判定用のキットに関する。そのようなキットは、ヌクレオリンに結合する試薬、試薬・ヌクレオリン複合体、並びに固定剤、緩衝液、プラスチック容器、血清、血清アルブミン、無脂肪乳、膜および使用説明書のような他の構成成分も含み得る。
もう1つの局面においては、本発明は、対象者から肺細胞を含む検体を採取し;そして、細胞中の原形質膜ヌクレオリンの存在を検出することを特徴とする対象者の小肺細胞癌腫の検出方法に関する。検体は痰を含み;対象者はヒトであり得る。
さらにもう1つの局面においては、本発明は、細胞を含む対象者からの検体を採取し、検体を検査センターに送り、細胞の新生物状態を、細胞原形質膜ヌクレオリンについて精査することによって判定することを特徴とする腫瘍、前悪性または悪性細胞の診断方法に関する。
【図面の簡単な説明】
【0005】
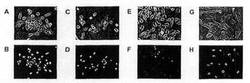
【図1】各種細胞系における核ヌクレオリンの染色を示す。免疫蛍光顕微鏡写真(B、D、F、H)および並行しての位相差顕微鏡写真(A、C、E、G)を示している。分析した細胞系は、DU145前立腺癌細胞(A、B)、MDA-MB-231乳癌細胞(C、D)、HeLa子宮頸癌細胞(E、F)およびHS27正常皮膚細胞(G、H)であった。抗-ヌクレオリン抗体を使用し、各細胞は、染色前に浸透性化して細胞質および核画分への抗体受入れを可能にした。
【図2】図1において示した細胞系における原形質膜ヌクレオリンの染色を示す。免疫蛍光顕微鏡写真(B、D、F、H)および並行しての位相差顕微鏡写真(A、C、E、G)を示している。分析した細胞系は、DU145前立腺癌細胞(A、B)、MDA-MB-231乳癌細胞(C、D)、HeLa子宮頸癌細胞(E、F)およびHS27正常皮膚細胞(G、H)であった。抗-ヌクレオリン抗体を使用した;各細胞は、染色前に浸透性化しないで、原形質膜のみへの抗体受入れを可能にした。
【図3】MTTアッセイにより測定したときの各細胞系の比較増殖速度を示す。四角はDU145であり、菱形はHeLaであり、丸はHS27である。MDA-MB-231はこの試験には含まれていないが、これら4種の細胞系における増殖速度を測定したところ、DU145 > MDA-MB-231 > HeLa > HS27であった。高レベルの原形質膜ヌクレオリンを含む細胞系は、最も速い増殖を示す細胞系に相当することに注目されたい(DU145およびHeLA;図2参照)。
【図4】頭部および頚部の扁平上皮細胞癌を有する患者から切除したパラフィン埋め込み試験標本の位相差画像(B、D)および免疫蛍光画像(A、C)を示す。試験標本は、原形質膜ヌクレオリンに対して染色し、ヨウ化プロピジウムで対向染色して細胞核を示した。画像(C)および(D)は、マークによってオーバーレイしてヌクレオリン染色をより良好に示した画像(A)および(B)を示す。白線で囲まれた領域1は強いヌクレオリン染色を含むが、1以外の領域は、シグナルを殆ど(3)あるいは全く(2)示していない。
【図5】サイトスピナーを使用して顕微鏡スライド上に置いた小細胞(NCI-H82)および非小細胞肺(NCI-H1299)癌細胞系の位相差画像(B、D)および免疫蛍光画像(A、C)を示す。各検体は、原形質膜ヌクレオリンに対して染色し、ヨウ化プロピジウムで対向染色して細胞核を示した。極めて良好に染色された原形質膜を有する細胞は、星印(*)で示している。
【図6】ヒト対象者からの末梢血(A、B)または骨髄(C、DおよびE、F)の位相差画像(B、D、F)および免疫蛍光画像(A、C、E)を示す。各検体は、原形質膜ヌクレオリンに対して染色し、ヨウ化プロピジウムで対向染色して細胞核を示した。ヌクレオリンに対して高度に染色された細胞は、星印(*)でマークしている;これらは、癌腫を患っている患者(A、BおよびC、D)においてのみ観察されるが、健常患者からの細胞は何ら原形質膜ヌクレオリン染色を示していなかった(E,F)。
【発明を実施するための形態】
【0006】
本発明は、ヌクレオリン原形質膜発現と新生物細胞の存在および侵略性との間の相関の発見に基づく。
本発明は、広汎に発現する新生物抗原、即ち、ヌクレオリンを使用する、悪性および前悪性細胞のような新生物細胞を検出するための組成物および方法を提供する。しかしながら、ヌクレオリンの発現は、悪性物を指標するには不十分である(ヌクレオリンはどの核形成細胞にも見出される);しかし、細胞表面上でのヌクレオリンの局在化は暗示的である。銀染色によって可視化されるような増大量の核ヌクレオリンは癌の診断手段として使用されているものの、細胞表面上で見出されるヌクレオリンが前悪性または悪性フェノタイプと相関するという予想外の発見は、癌の診断および予防を容易にし得る。
表面局在化ヌクレオリンを使用する利点は、下記のとおりである:
(1) 改良された正確度。原形質膜ヌクレオリンについてのアッセイは、核ヌクレオリンに対する銀染色に比較して悪性フェノタイプをより正確に同定する。
(2) 特異性。原形質膜ヌクレオリンは、殆どの野生タイプ(正常)細胞の原形質膜中では通常観察されない。即ち、マーカーの量を分析することを必要とする多くの他の診断検査とは異なり、原形質膜ヌクレオリン検出は、定性的に使用し得る。従って、より誤診防止的な“イエス・ノー”タイプの検査が実施可能である。また、この局面は、単一細胞および組織検体双方についての検査も可能にする。
(3) 広汎な応用性。多くの種々の癌を原形質膜ヌクレオリンについて検査することによって検出し得る。
(4) 多機能性。該方法は、予知並びに診断用である:細胞増殖速度は、原形質膜ヌクレオリンレベルに典型的に相関する。
【0007】
非アンチセンスグアノシンリッチオリゴヌクレオチド(GRO)類の癌細胞に対する抗増殖活性の研究中に、そのような抗増殖性GRO類はヌクレオリンに結合してその効果を奏することが判明した(Bates等、1999年;Miller等、WO 00/61597号、2000年)。ヌクレオリン(Bandman等、米国特許第5,932,475号、1999年)は、核小体の豊富な非リボソームたんぱく質、即ち、リボソーム遺伝子転写部位および前リボソームRNAのパッケージングである。この707個のアミノ酸リンたんぱく質は、ヒストン様N-末端からなる多重ドメイン構造、4つのRNA認識モチーフを含有する中央ドメインおよびグリシン/アルギニンリッチC-末端を有し、且つ110 kDの見掛け分子量を有する。その多重ドメイン構造は、この多面的なたんぱく質の著しく多様な機能を反映している(Ginisty等、1999年;SrivastavaおよびPollard、1999年;TutejaおよびTuteja、1998年)。ヌクレオリンは、細胞の生存および増殖の多くの基本的局面に関与している。最も理解されているのは、リボソーム発生におけるヌクレオリンの役割である。他の機能としては、核細胞質輸送、細胞質分裂、核合成およびアポトーシスがあり得る。
ヌクレオリン合成は、細胞分裂(細胞増殖)速度増大と相関する;従って、ヌクレオリン量は、殆どの正常細胞と比較して腫瘍細胞における方が高い(TutejaおよびTuteja、1998年)。ヌクレオリンは核オルガナイザー領域(NOR)たんぱく質の1つであり、銀染色によって測定したときのその量は、細胞増殖のマーカーおよび悪性度のインジケーターとして病理学者によって評価されている(Derenzini、2000年)。
また、リンパ球および内部髄質收集導管細胞のような2、3の細胞タイプ中の細胞原形質膜にも存在し、ヌクレオリンはレセプターとして機能するものと想定されている(例えば、Callebaut等、1998年;SorokinaおよびKleinman、1999年)。しかしながら、原形質膜ヌクレオリンの役割は、良くは理解されていない。さらに、原形質膜ヌクレオリンが核たんぱく質と同一であるのかあるいは原形質膜ヌクレオリンが異なるイソ型またはヌクレオリン様たんぱく質であるのかは明らかではない。しかしながら、原形質膜ヌクレオリンの発現は新生物細胞(悪性または前悪性のような)に特異的である;即ち、原形質膜ヌクレオリンの機能は、診断および予知目的においては知る必要はない。
【0008】
定義
新生物、悪性物、腫瘍、癌細胞
新生物は、新生物細胞、即ち、正常細胞よりも急速且つ制御され得ないで増殖する細胞に由来する異常組織増殖である。通常、部分的にまたは完全に組織破壊性の新生物は、相応する正常組織との機能的連携を欠如する。新生物は、良性(腫瘍)または悪性(癌)のいずれかであり得る明確な組織塊を形成する。
癌細胞は、周囲組織を侵害し、離れた部位に転移し得、試みられた除去後に再発して適切に治療されなかった場合の対象者を死に至らしめるようである。組織破壊性以外にも、癌細胞は、より原始的または未分化状態に逆行する(退形成)が、形態学または生化学的には、癌細胞は、相応する野生タイプの細胞の多くの機能を依然として示し得る。癌腫は上皮に由来する癌であり;肉腫は結合組織に由来する。
癌は、侵略性が大または小であり得る。癌細胞の侵略性フェノタイプは、ヌードマウスにおいて腫瘍を形成し転移する増殖速度と能力を示す。侵略性癌は、侵略性が低い腫瘍よりも急速に、より容易に腫瘍を形成し転移する。
新生物状態
用語“新生物状態”とは、3つの状態、即ち、正常、前悪性および悪性を称する。“正常”は、臨床的に正常(健常)である増殖または細胞を称する。“前悪性”は、悪性物への途上にあるが、検査時においては、通常の方法によっては悪性として分類されないであろう増殖または細胞を称する。“悪性”は、次の特性の少なくとも1つを有する細胞または増殖を称する:局所的に侵害性、破壊性の増殖および転移。
【0009】
GRO類および他のポリペプチド結合性オリゴヌクレオチド類
ヌクレオリン類のようなポリペプチド類に特異的に結合するオリゴヌクレオチド類は、入手可能である。そのような例は、グアノシンリッチオリゴヌクレオチド類であるGRO類である。GRO類の特性としては、下記がある:
(1) 少なくとも1個のGGTモチーフを有する。
(2) 好ましくは、4〜100個のヌクレオチドを有するが、それよりも多いヌクレオチドを有するGROも可能である。
(3) 安定性を改善するための化学修飾を有する。
とりわけ有用なGRO類は、295 nmでの可逆的熱変性/復元プロフィールによって指標されるようなG-四重構造を形成する(Bates等、1999年)。好ましいGRO類は、電気泳動度シフトアッセイにおいて、ターゲット細胞たんぱく質への結合においてテロメアオリゴヌクレオチドと拮抗する。
他のオリゴヌクレオ類はヌクレオリンに対して高い結合特異性を有する場合がある。
抗-ヌクレオリン因子
“抗-ヌクレオリン因子”は、ヌクレオリンに結合する。例としては、抗-ヌクレオリン抗体およびある種のオリゴヌクレオチド類がある。
【0010】
実施態様
以下の実施態様は、本発明を実施するための種々の方法の例として提示する。また、本発明を実施する多くの種々の方法が可能である。
全ての実施態様において、基本的な原理は、原形質膜ヌクレオリンと核ヌクレオリンとを特定的に区別することである。本出願人が発見したような原形質膜ヌクレオリンは、新生物状態にある細胞と相関する;さらにまた、原形質膜ヌクレオリンの量もこれら細胞の侵略性を指標する;即ち、原形質膜ヌクレオリン発現が高いほど、細胞はより侵略性である。種々の方法により、使用者は、核および原形質膜ヌクレオリンを区別するのが可能である。ヌクレオリン検出用試薬が細胞の細胞外成分(従って、細胞原形質膜ヌクレオリン)に対する専用的受入れを有する検出方法、あるいは表面原形質膜および/または表面たんぱく質のいずれかを他の細胞成分および細胞画分から分離する生化学方法も、有用である。
1つの実施態様においては、ヌクレオリンを細胞表面上で直接検出する。細胞を対象者から分離し、原形質膜ヌクレオリンを、ヌクレオリンに結合する因子を使用して検出する。細胞は、任意の公知の方法によって分離し得る。分離した細胞は、新生物状でない細胞を含有する大き目の組織検体を含み得る。検出手順は、細胞外ヌクレオリンエピトープを結合する抗-ヌクレオリン抗体を使用する;これらの抗体は、直接標識化するかあるいは結合させたときに間接的に検出し得る。他の有用な原形質膜ヌクレオリン検出因子としては、ヌクレオリンを特異的に結合するGRO類がある。蛍光活性化細胞選別法(FACS)または免疫蛍光法のような有用な手法は蛍光標識を使用し、一方、組織化学法、免疫組織化学法および他の顕微鏡分析(電子顕微鏡分析(EM)、免疫EM)法のような他の細胞学的方法は、比色分析性または放射性いずれかの各種他の標識を使用する。各種試薬は、キット中に組合せ得る。
【0011】
もう1つの実施態様においては、細胞を対象者から分離し、抽出する。次いで、原形質膜および/またはたんぱく質を分離し(清浄剤抽出細胞の微分抽出、分画物理的細胞破壊、または分画遠心法によるようにして)、その後、ヌクレオリンを結合する因子を使用して、ヌクレオリンを分離した膜中で検出する。一般に、ヌクレオリンを検出する有用な方法は、抽出物を基体上に置き、基体をヌクレオリン検出用試薬によって精査する方法を含む。そのような方法の例としては、ポリペプチドドットブロットおよびウェスタンブロット法、バイオチップ法、たんぱく質アレー法等がある。他の検出方式としては、多様な具現方式の酵素免疫吸着測定法(ELISA)がある(Ausubel等、1987年)。原形質膜表面分子を他の細胞成分および細胞画分の大部分から物理的に分離する実施態様においては、ヌクレオリン結合性因子は、ヌクレオリンのいずれの細胞外成分も特異的に認識する必要はない。各種試薬をキット中に組合せ得る。
さらなる実施態様においては、本発明の方法は、肺小細胞癌腫のような肺癌の検出に関する。原形質膜ヌクレオリン発現は、検出および予知において有用である。
さらにもう1つの実施態様においては、標識として作用する原形質膜ヌクレオリンを活用する、癌および腫瘍細胞を含む新生物状態の細胞の治療方法を提供する。細胞死を刺激するまたは細胞壊死を誘発させる毒素または他の手段に接合させ得る抗-ヌクレオリン抗体の投与は、原形質膜ヌクレオリン発現性細胞の排除をもたらす。
【0012】
本発明の実施
本発明の方法は、一部で、対象者から細胞を採取し、原形質膜ヌクレオリンを検出する工程を含む。以下を、本発明を限定するつもりはないが、本発明を実施する医師の支援のために提示するが、他の方法、技法、細胞、試薬および試みも本発明を実施するのに使用し得る。
細胞
細胞即ち組織検体を対象者から採取する。対象者は、脊椎動物、より好ましくはサル、イヌ、ネコ、ウサギ、ウシ、ブタ、ヤギ、ヒツジ、ウマ、ラット、マウス、モルモット等の哺乳類、最も好ましくはヒトである。所望細胞を採取するには、バイオプシー、外科処置、切屑(頬内部、皮膚等)および採血のような任意の方法を使用し得る。任意の適切な手段を使用してそのような作業は実施し得る。試験個体群(即ち、新生物状態について試験する細胞群)を試験しない細胞および組織群(汚染物質)から分離することは、抽出を含む生化学方法を使用するある種の場合を除いて必要ではない。生化学方法の場合、試験個体群は、汚染物質から完全に分離する必要はないが、主体的または容易に識別可能でなければならない(例えば、形態学的に(組織的に特異性のマーカー)または生化学的に)。
肺癌を分析する方法においては、痰採取物は、魅力的で容易に得られる検体である。用語“痰”とは、本明細書において使用するとき、唾液および呼吸気道からの排出物から構成される吐出物を称する。痰は、はっきりしたゲル様構造を有する高度に複雑な物質である。
痰の採取については、Byrne等(Byrne、1986年)は、患者が数回の深い咳によって生じた物質を蓋付き容器中に採取することを勧めている。また、痰は、気管支鏡を使用しても採取し得る(Kim等、1982年)。特定の装置または薬剤を使用して痰採取を容易にし得る(Babkes等、米国特許第6,325,785号、2001年;KingおよびSpeert、米国特許第6,339,075号、2002年;RubinおよびNewhouse、米国特許第5,925,334号、1999年)。他の痰採取方法も使用し得る。
【0013】
細胞培養
幾つかの場合においては、採取した細胞を培養してその数を増大させて原形質膜ヌクレオリン検出を容易にすることが望ましい。一次培養物を産生させるのに適する培地および条件は周知である。培地および培養条件の選択は、細胞タイプによって変動し得、経験的に決定し得る。例えば、骨格筋、骨、ニューロン類、皮膚、肝臓、および胚幹細胞は、それらの特異性内容物において異なる培地において増殖させる。さらにまた、ある細胞タイプ用の培地は、研究所間および施設間で有意に異なり得る。細胞分裂を保つためには、ウシ胎仔(fetal calf)血清(FCS) (ウシ胎仔(fetal bovine)血清(FBS)としても知られている)のような血清を、細胞または組織のタイプにもよるが、比較的大量に、即ち、5〜30容量%で培地に添加する。他の血清としては、ウシ新生仔血清(NCS)、子ウシ血清(BCS)、成獣ウシ血清(ABS)、ウマ血清(HS)、ヒト、ニワトリ、ヤギ、ブタ、ウサギおよびヒツジの各血清がある。管理プロセス血清代替物タイプ(CPSR;1または3)またはウシ胚液のような血清代替物も使用し得る。特定の精製増殖因子または複数の増殖因子の混合物も添加し得あるいは場合によっては血清と置換え得る。増殖または細胞生存を増進させる特定の因子またはホルモン類も使用し得る。
適切な培養培地の例としては、イスコブ(Iscove's)変性ダルベッコ(Dulbecco's)培地(IMDM)、ダルベッコ変性イーグル(Eagle's)培地(DMEM)、イーグルの最少必須培地(MEM)、イーグルの基本培地(BME)、クリック(Click's)培地、リーボビッツ(Leibovitz)のL-15培地、マッコイ(McCoy's)5A培地、グラスゴー(Glasgow)最少必須培地(GMEM)、NCTC 109培地、ウィリアムス(Williams')培地E、RPMI-1640、および培地199がある。特定の細胞タイプ/系または細胞機能用に特別に開発した培地、例えば、マディン・ダービー(Madin-Darby)ウシ腎臓増殖培地、マディン・ダービーウシ腎臓維持培地、各種ハイブリドーマ培地、内皮基本培地、線維芽基本培地、ケラチノサイト基本培地およびメラノサイト基本培地も既知である。必要に応じて、たんぱく質低減または無たんぱく質および/または無血清培地、および/または既知組成無動物成分培地も使用し得、例えば、CHO、遺伝子治療培地即ちQBSF無血清培地(Sigma Chemical社;ミズーリ州セントルイス)、DMEM栄養混合物F-12 Ham、MCDB (105、110、131、151、153、201および302)、NCTC 135、Ultra DOMA PFまたはHL-1 (双方ともBiowhittaker社から;メリーランド州ウォーカースビル)を使用し得る。
【0014】
培地には、培養する細胞によるが、各種の増殖因子、サイトカイン、血清等を添加し得る。適切な増殖因子の例としては、基本線維芽増殖因子(bFGF)、血管内皮増殖因子(VEGF)、上皮成長因子(EGF)、形質転換成長因子(TGFαおよびTGFβ)、血小板由来増殖因子(PDGF)、肝細胞成長因子(HGF)、インシュリン様成長因子(IGF)、インシュリン、エリスロポイエチン(EPO)、およびコロニー刺激因子(CSF)がある。適切なホルモン添加剤の例は、エストロゲン、プロゲステロン、テストステロンまたはデキサメタゾンのようなグルココルチコイド類である。サイトカイン培地添加剤の例は、インターフェロン類、インターロイキン類または腫瘍壊死因子-α(TNF-α)である。また、アルセバー(Alseverr's)溶液、ダルベッコリン酸塩緩衝塩水(DPBS)、イーグル平衡塩類溶液、ゲイ(Gey's)平衡塩類溶液(GBSS)、ハンク(Hank's)平衡塩類溶液(HBSS)、パック(Puk's)塩水Aおよびタイロード(Tyrode's)塩類溶液のような塩類溶液も培地に添加し得る。必要に応じて、種々の培養条件における添加剤および培養成分は、これらが細胞応答、活性寿命または他のバイオ活性に影響する特性を改変させ得るので最適化し得る。さらに、細胞増殖させる表面は、細胞の生存、増殖および/または分化に寄与する種々の基質でコーティーングし得る。これらの基質としては、限定するものではないが、ラミニン、EHS-マトリックス、コラーゲン、ポリ-L-リシン、ポリ-D-リシン、ポリオルニチンおよびフィブロネクチンがある。立体培養を所望する場合は、細胞外マトリックスゲル、例えば、コラーゲン、EHS-マトリックスまたはゼラチン(変性コラーゲン)を使用し得る。細胞は、そのようなマトリックスの頂部上で増殖させ得、あるいはゲル自体内に注入し得る。
【0015】
必要に応じて、培地には、培養物のアシドーシスを制限する試薬を、例えば、緩衝液(N,N-ビス(2-ヒドロキシエチル)-2-アミノエタンスルホン酸(BES)、ビス(2-ヒドロキシエチル)アミノ-トリス(ヒドロキシメチル)メタン(BIS-Tris)、N-(20ヒドロキシエチル)ピペラジン-N'3-プロパンスルホン酸(EPPSまたはHEPPS)、グリクロリシン(glyclclycine)、N-2-ヒドロキシエチルピペラジン-N'-2-エタンスルホン酸(HEPES)、3-(N-モルホリノ)プロパンスルホン酸(MOPS)、ピペラジン-N,N'-ビス(2-エタン-スルホン酸) (PIPES)、重炭酸ナトリウム、3-(N-トリス(ヒドロキシメチル)-メチル-アミノ)-2-ヒドロキシ-プロパンスルホン酸) (TAPSO)、(N-トリス(ヒドロキシメチル)メチル-2-アミノエタンスルホン酸(TES)、N-トリス(ヒドロキシメチル)メチル-グリシン(トリシン)、トリス(ヒドロキシメチル)-アミノメタン(Tris)等のような)を培地に添加するようにして、さらに添加し得る。頻繁な培地変更および添加CO2(多くの場合、約5%)濃度の変更も、アシドーシスを制御するのに使用し得る。
培養用のガスは、典型的には、約5%の二酸化炭素と残りの窒素であるが、必要に応じて、変動量の酸化窒素(3 ppmほどで低く開始して)、一酸化炭素および他のガス類(共に、不活性であり、生物学的には活性)を含み得る。二酸化炭素濃度は、典型的に5%辺りの範囲であるが、2〜10%で変動し得る。酸化窒素および一酸化炭素は、必要な場合、典型的には、経験的にあるいは文献から決定した極めて少量で(即ち、ppm範囲で)投入する。細胞を最適に増殖させる温度は経験的に決定するが、培養温度は、通常、細胞を分離した動物の正常な生理学的範囲内であろう。
【0016】
ヌクレオリンの検出:抗体系方法
ヌクレオリンは、細胞、組織切片、培養細胞およびその抽出物中でたんぱく質レベルで検出し得る。たんぱく質発現を検出する免疫化学方法は、周知であり、限定するものではないが、ウェスタンブロット法、イムノアフィニティー精製法、免疫沈降法、酵素免疫吸着測定法(ELISA)、ドットまたはスロットブロット法、ラジオイムノアッセイ法(RIA)、免疫組織化学検出法、免疫細胞化学染色法およびフローサイトメトリー法がある。抗体を使用する一般的手順および使用説明書は、良好に対処されている(例えば、HarlowおよびLane、1988年;HarlowおよびLane、1999年)。原形質膜ヌクレオリンを検出するのに有用な選定抗体を下記の表1に示す。
【0017】
表1:抗-ヌクレオリン抗体

【0018】
さらなる抗-原形質膜ヌクレオリン抗体を望む場合、これらさらなる抗体は、周知の方法を使用して産生させ得る(HarlowおよびLane、1988年;HarlowおよびLane、1999年)。例えば、(pAb類)は、表面発現ヌクレオリンの細胞外ドメインのようなイムノゲンおよび必要に応じてのアジュバントの1回以上の注入により哺乳動物宿主中で産生させ得る。典型的には、イムノゲン(およびアジュバント)は、皮下または腹腔内注入により哺乳類に注入する。イムノゲンとしては、ポリペプチド類(分離した、分離していないまたは組換え産生させた)、細胞類または細胞画分のような成分があり得る。アジュバントの例としては、フロイントの完全アジュバントおよびモノホスホリルリピッドA合成トレハロースジコリノマイコレート(MPL-TDM)がある。免疫応答を改善するためには、イムノゲンは、キーホールリンペットヘモシアニン(KLH)、血清アルブミン、ウシサイログロビンまたは大豆トリプシンインヒビターのような、宿主中で免疫原性であるポリペプチドに接合させ得る。また、pAb類は、IgY分子を産生させることによって、ニワトリ中でも調製し得る(Schade等、1996年)。
また、mAb類も、宿主または宿主由来のリンパ球を免疫し、mAb分泌性(または潜在的に分泌性)リンパ球を採取し、これらのリンパ球を不死化細胞(例えば、ミエローマ細胞)に融合させ、所望のmAbを分泌する細胞を選択することによって調製し得る(Goding、1996年)。必要に応じて、mAb類は、培養培地または腹水から、プロテインA-セファロース、ヒドロキシルアパタイトクロマトグラフィー、ゲル電気泳動、透析、硫酸アンモニウム沈降またはアフィニティークロマトグラフィーのような通常の手順により精製し得る(HarlowおよびLane、1988年;HarlowおよびLane、1999年)。
【0019】
上記抗体は、抗体全体およびそのフラグメントまたは誘導体であり得る。例えば、生きた細胞をアッセイする場合、Fabフラグメントの使用は、交叉を排除し、それによって細胞を結合抗体のエンドサイトーシス化から防護する。
抗体を使用して抗原の存在を検出する方法は、下記の工程の全部ではないにしても1以上を含む:
(1) 原形質膜ヌクレオリンについて試験する存在物を緩衝液または水で洗浄することによって調製する
(2) 非特異性抗体結合部位を遮断する
(3) 抗体(例えば、ヌクレオリン)を適用する
(4) 結合抗体を、一次抗体を認識する検出可能な標識化二次抗体または結合(抗-ヌクレオリン)抗体に直接結合または会合させた検出可能な標識のいずれかによって検出する。
基質は、エピトープ構造を干渉しない任意の溶液で洗浄し得る。一般的な緩衝液としては、塩水並びにビシン、トリシンおよびトリスのような生物学的緩衝液がある。
非特異結合部位は、ウシ血清アルブミン(BSA;変性または未変性)、乳たんぱく質、または検出用試薬が二次抗体である場合、種が検出用抗体と同じ起源である非免疫化宿主動物からの正常血清もしくはイムノグロブリンのようなたんぱく質溶液を適用することによって遮断する。例えば、ヤギ中で調製した二次抗体を使用する手順は、正常ヤギ血清(NGS)を使用する。
その後、基質を興味ある抗体と反応させる。抗体は、Fabフラグメントもしくはその誘導体、精製抗体(アフィニティー、沈降法等による)、ハイブリドーマ培養物からの上清、腹水、血清または組換え細胞中で発現させた組換え抗体のような任意の形で適用し得る。抗体は、多くの場合、非特異結合部位を遮断するのに使用した溶液のようなたんぱく質担体によって、緩衝液または培地中で希釈し得;有用な抗体濃度は、経験により通常決定する。一般に、ポリクローナル血清、精製抗体および腹水は、1:50〜1:200,000、より多くの場合は1:200〜1:500に希釈する。ハイブリドーマ上清は、1:0〜1:10に希釈するか、あるいは透析または硫酸アンモニウム沈降(または興味ある抗体は保持するが液体成分および好ましくは塩類のような他の小分子は少なくとも部分的に除去する任意の他の方法)によって濃縮し必要に応じて希釈し得る。抗体とのインキュベーションは、37℃では20分程で短く、室温(約22℃)では2〜6時間、4℃では8時間以上実施し得る。
【0020】
抗体・抗原複合体を検出するには、標識を使用し得る。標識は、結合用抗体または第1抗体を認識する二次抗体に結合させ、一次抗体のインキュベーションおよび十分な洗浄後に検体と一緒にインキュベートする。適切な標識としては、フルオレセインイソチオシアネート;フルオレセインジクロロトリアジンおよびフルオレセインのフッ素化アナログ類;ナフトフルオレセインカルボン酸およびそのスクシンイミジルエステル;カルボキシローダミン 6G;ピリジルオキサゾール誘導体;Cy2、3および5;フィコエリトリン;プロピオン酸スクシンイミジルエステルおよびペンタン酸スクシンイミジルエステルのような、スクシンイミジルエステル類、カルボン酸類、イソチオシアネート類、スルホニルクロライド類およびダンシルクロライド類の蛍光種;カルボキシテトラメチルローダミンのスクシンイミジルエステル類、ローダミンレッド-X (Red-X)スクシンイミジルエステル;テキサスレッド(Texas Red)スルホニルクロライド;テキサスレッド-Xスクシンイミジルエステル;テキサスレッド-Xナトリウムテトラフルオロフェノールエステル;レッド-X;テキサスレッド染料;テトラメチルローダミン;リサミンローダミンB;テトラメチルローダミン;テトラメチルローダミンイソチオシアネート;ナフトフルオレセイン類;クマリン誘導体;ピレン類;ピリジルオキサゾール誘導体;ダポキシル染料類;カスケードブルーおよびイエロー染料類;ベンゾフランイソチオシアネート類;ナトリウムテトラフルオロフェノール類;4,4-ジフルオロ-4-ボラ-3a,4a-ジアゾ-s-インダセンのような蛍光成分がある。さらに、適切な標識としては、アルカリホスファターゼまたはホースラディシュペルオキシダーゼのような酵素成分;35Sまたは135Iラベルのような放射性成分;アビジン(またはストレプタビジン)-ビオチン系検出系(多くの場合、酵素または金シグナル系と結合させる);および金粒子がある。酵素系検出系においては、酵素を適切な基質、例えば、ホースラディシュペルオキシダーゼに対する3,3'-ジアミノベンジジン(DAB)と反応させる;好ましくは、反応生成物は不溶性である。金標識検体は、超微細構造分析用に調製しない場合、化学的に反応させて金シグナルを増強させ得る;この方法は、光学顕微鏡分析においてとりわけ好ましい。標識の選択は、用途、所望する解像力および所望する観察方法による。蛍光標識においては、蛍光体を適切な波長で励起させ、検体を顕微鏡、共焦点顕微鏡またはFACS装置を使用して観察する。放射性標識化の場合には、検体をオートラジオグラフィーフィルムと接触させ、このフィルムを現像する;また、オートラジオグラフィーは、超微細構造方法を使用しても実施し得る。また、放射能は、シンチレーションカウンターを使用しても定量し得る。
【0021】
細胞学的方法:
免疫蛍光/免疫組織化学法
細胞または組織によるたんぱく質発現は、抗原の免疫学的局在決定によって確認し得る。一般的には、細胞または組織を固定化することによって保持し、ヌクレオリンのような興味あるエピトープを認識する抗体に暴露させ、結合抗体を可視化する。
あらゆる細胞、細胞系、組織があるいは生物体全体でさえもが固定化に適している。細胞は、一次培養物、細胞系として生体外培養し得、あるいは組織から採取し機械的にまたは酵素により分離し得る。組織は、任意の器官、植物または動物に由来し得、固定化前または後に採取し得る。固定化は、必要に応じて、任意の公知の手段であり得る;条件は、検出すべきたんぱく質を結合剤(殆どの場合、抗体)が認識的できないようにしないことである。適切な固定剤としては、パラホルムアルデヒド-リシン-パーイオデート、ホルマリン、パラホルムアルデヒド、メタノール、酢酸-メタノール、グルタルアルデヒド、アセトン、カーノフスキー(Karnovsky's)固定剤等がある。固定剤の選択は、興味あるたんぱく質、特定の検出用試薬(抗体のような)の性質、検出方法(蛍光、酵素系)および観察方法(エピフルオレセンス顕微鏡、共焦点顕微鏡、光学顕微鏡、電子顕微鏡等)のような変動要因による。検体は、通常、固定化前に、殆どの場合生物学的緩衝液で最初洗浄する。固定剤は、溶液または生物学的緩衝液中で調製する;多くの固定剤は、検体に適用する直前に調製する。適切な生物学的緩衝液としては、塩水(例えば、リン酸塩緩衝塩水)、N-(カルバモイルメチル)-2-アミノエタンスルホン酸(ACES)、N-2-アセトアミド-2-イミノジ酢酸(ADA)、ビシン、ビス-トリス、3-シクロヘキシルアミノ-2-ヒドロキシ-1-プロパンスルホン酸(CAPSO)、エタノールアミン類、グリシン、N-2-ヒドロキシエチルピペラジン-N'-2-エタンスルホン酸(HEPES)、2-N-モルホリノエタンスルホン酸(MES)、3-N-モルホリノプロパンスルホン酸(MOPS)、3-N-モルホリノ-2-ヒドロキシ-プロパンスルホン酸(MOPSO)、ピペラジン-N,N'-ビス(2-エタンスルホン酸) (PIPES)、トリシン、トリエタノールアミン等がある。適切な緩衝液を、分析する検体、適切なpHおよび検出方法の条件に応じて選択する。有用な緩衝液は、リン酸塩緩衝塩水(PBS)である。固定化後、検体は、固定剤中に、好ましくは新鮮に、あるいは一時的にまたは無限に、約4℃〜約22℃の温度で保存し得る。
【0022】
サンプルサイズ、サンプル厚および固定剤の粘度によるが5分〜1週間の固定化後、検体を緩衝液中で洗浄する。検体が厚いかあるいは切片を望む場合、検体は、適切なマトリックス中に埋め込むことができる。低温切片化においては、サクロースを注入して、OCT Tissue Tek (Andwin Scientific社;カリフォルニア州カノガパーク)またはゼラチンのようなマトリックス中に埋め込む。また、検体は、パラフィンワックス、またはエポキシ系(Araldite、Polybed 812、Durcupan ACM、Quetol、Spurr'sまたはこれらの混合物;Polysciences社、ペンシルベニア州ウォリントン)、アクリレート類(London Resin類(LRホワイト、LRゴールド)、Lowicryl類、Unicryl;Polysciences社)、メチルアクリレート類(JB-4、OsteoBed;Polysciences社)、メラミン(Nanoplast;Polysciences社)およびDGD、Immuno-Bed(Polysciences社)のような他の媒体のような電子顕微鏡用の適切な樹脂中にも埋め込み得、その後重合し得る。とりわけ適切な樹脂としては、親水性物質(Lowicryl類、London Resin類、水溶性Durcupan等のような)がある。その理由は、これらが興味あるたんぱく質を重合中にあまり変性させないようであり、また抗体溶液を反発させないことによる。ワックスまたは樹脂中に埋め込むとき、検体は、これら検体を一連の濃度のエタノールまたはメタノール中に通すことによって脱水される;ある場合には、ポリプロピレンオキサイドのような他の溶媒も使用し得る。埋め込みは検体を検出用薬剤と反応させた後に行い得、あるいは、検体を先ず埋め込み、切片化し(マイクロトーム、サイロトーム(cyrotome)またはウルトラマイクロトームにより)、その後、検出用試薬と反応させてもよい。ある場合には、埋め込み材料は、検出前に部分的にまたは完全に除去して抗原受入れを容易にし得る。
【0023】
ある場合には、抗体が結合するヌクレオリンエピトープ(1個以上)が固定化のために利用し得なくなっている可能性がある。抗原回復法を使用し、抗原を抗体結合において利用可能にすることができる。多くの再生法が利用し得る(例えば、McNicolおよびRichmond、1998年;RobinsonおよびVandre、2001年;Shi等、2001年において検討されている)。一般的な方法は、オートクレーブ、マイクロ波、熱水または緩衝液、圧力釜または他の熱源から供給される熱を使用する。多くの場合、熱源は連続して使用し、検体は、多くの場合、溶液中でなければならない(例えば、マイクロ波処理)。ドデシル硫酸ナトリウム(SDS、0.25%〜1%)または他の変性用清浄剤のような清浄剤処理も、抗原を露出させ得る。化学方法は、強アルカリ類(NaOHのような);水、尿素、ギ酸中での長時間浸漬、および硫酸亜鉛-ホルマリン中での再固定化を含む。他の場合においては、たんぱく質分解酵素処理によって抗原を変性して、抗原を抗体に対して利用し得るようにする。トリプシンのような任意の多くのプロテアーゼを使用し得る。これらの方法は、組合せて最適の結果を得ることもできる。抗原再生方法の選択は、検体、その埋め込み(実施した場合の)および抗-ヌクレオリン抗体次第である。
とりわけ免疫蛍光または酵素生成物系検出の場合には、残留固定剤、たんぱく質交叉結合、たんぱく質沈降または内在性酵素による背景シグナルは、例えば、塩化アンモニウムもしくは水素化ホウ素ナトリウムまたは交絡内在性酵素を失活または消耗させる物質、例えば、ペルオキシダーゼに作用する過酸化水素を使用して失活させ得る。切片化されていない検体中の細胞内たんぱく質を検出するには、検体を浸透性化し得る。浸透性化剤としては、t-オクチルフェノキシポリエトキシエタノール類、ポリオキシエチレンソルビタン類のような清浄剤、およびリシン類、プロテアーゼ類等のような他の薬剤がある。
非特異結合部位は、ウシ血清アルブミン(BSA;変性または未変性)、乳たんぱく質、または好ましくは検出用試薬が抗体である場合、種が検出用抗体と同じ起源である非免疫化宿主動物からの正常血清もしくはIgGのようなたんぱく質溶液を適用することによって遮断する。
【0024】
フローサイトメトリー/フルオレセンス活性化細胞選別法(FACS)
フローサイトメトリーを実施する方法は周知である(OrfaoおよびRuiz-Arguelles、1996年)。原形質膜ヌクレオリンを精査することから、細胞質画分に対する受入れを可能にする細胞浸透性化は望ましくない。採取後、細胞を単一細胞懸濁液として調製する;その後、細胞を、通常非特異結合部位を遮断した後に、抗-ヌクレオリン抗体と一緒にインキュベートする。好ましくは、抗-ヌクレオリン抗体を蛍光マーカーで標識化する。抗体を蛍光マーカーで標識しない場合は、第1抗体と免疫反応性であり且つ蛍光マーカーを含有する第2抗体を使用する。十分に洗浄して過剰のまたは未結合抗体を確実に除去した後、細胞は、フローサイトメトリーに使用可能な状態にある。
【0025】
生化学系方法
これらの方法においては、原形質膜たんぱく質を他の細胞画分から分離することが先ず望ましい。この分離は、単純細胞抽出、微分抽出または機械的破壊およびその後の遠心分離による勾配(サクロースまたはポリデキストランのような)での細胞画分の分離、抽出およびその後の原形質膜特異性抗体による適切な細胞画分の免疫選別等のような任意の多くの方法で実施し得る。そのような方法の例は、Naito等(1988年)およびYao等(1996年b)に記載されている。抽出用試薬は周知である。例えば、メタノールのような溶媒は、場合によっては有用である。それよりも、t-オクチルフェノキシポリエトキシエタノール(ポリエチレングリコールtert-オクチルフェニルエーテルとしても知られている)のような清浄剤は、単純抽出においてとりわけ有用である。また、グルコピラノシド類;マルトピラノシド類;マルトシド類;ポリオキシエチレンエステル類;他のポリオキシエチレンエーテル類;アルギン酸、カプリル酸、コール酸、1-デカンスルホン酸、デオキシコール酸、ジオクチルスルホスクシネート、1-ドデカンスルホン酸、グリココール酸(glyocholic)、グリコデオキシコール酸、1-ヘプタンスルホン酸、1-ヘキサンスルホン酸、N-ラウロイルサクロシン、ラウリル硫酸塩(例えば、SDS)、1-ノナンスルホン酸、1-オクタンスルホン酸、1-ペンタンスルホン酸、タウロコール酸およびタウロデオキシコール酸(tauodexycholic)の塩類;7-エチル-2-メチル-4-ウンデシル硫酸ナトリウム;および2-エチルヘキシル硫酸ナトリウムも有用である。他の有用な清浄剤としては、(3-[(3-コラミドプロピル)ジメチルアンモニオ]-1-プロパン-スルホネート;(3-[(3-コラミドプロピル)ジメチルアンモニオ]-2-ヒドロキシ-1-プロパン-スルホネート;N-デシル-、N-ドデシル-、N-ヘキサデシル-、N-オクタデシル-、N-テトラデシル-N,N-ジメチル-3-アンモニオ-1-プロパンスルホネート類、およびホスファチジルコリンがある。あまり有用ではないが、ある場合に一助になり得るのは、アルキルトリメチルアンモニウムブロマイド、ベンズアルコニウムクロライド、ベンズエトニウムクロライド、ベンジルジメチルドデシルアンモニウムブロマイド、ベンジルジメチルヘキサデシルアンモニウムクロライド、セチルジメチルエチルアンモニウムブロマイド、セチルピリジニウム、デカメトニウムブロマイド、ジメチルジオクタデシルアンモニウムブロマイド、メチルベンズエトニウムクロライド、メチルトリオクチルアンモニウムクロライド、およびN,N',N'-ポリオキシエチレン(10)-N-タロウ-1,3-ジアミノプロパンである。種々の抽出剤を単独または組合せて使用し得る;これらの抽出剤は、単純な水溶液または適切な緩衝液中で調製し得る。
ポリエチレングリコールtert-オクチルフェニルエーテルは、低曇り点を利用して膜たんぱく質を可溶性たんぱく質から2つの異なる相中に分離することにより、微分抽出においてとりわけ有用である。
抽出緩衝液は、アプロチニン、ベンズアミジン、アンチパイン、ペプスタチンおよびイオドアセタミドのようなプロテアーゼインヒビター類を含有し得る。
その後、抽出物をヌクレオリン発現についてアッセイする。表面原形質膜を他の細胞成分(とりわけ、核)から分離する方法においては、ヌクレオリン検出剤は細胞外原形質膜ヌクレオリンエピトープに対し特異性である必要はない。
【0026】
免疫吸着アッセイ(ELISA) (Ausubel等、1987年)
たんぱく質発現を検出するための種々のタイプの酵素免疫吸着測定法(ELISA)が知られており、これらはヌクレオリン検出に応用可能である。一方、他のELISA様アッセイとしては、ラジオイムノアッセイおよび他の非酵素抗体結合アッセイおよび手法がある。これらのアッセイにおいて、上記細胞表面たんぱく質は、細胞調製物中の主たる成分である。
二重抗体サンドイッチELISA法は、とりわけ有用である。二重抗体サンドイッチELISAにおける基本的プロトコールは、次のとおりである:プレートを抗-ヌクレオリン抗体(キャプチャー抗体)でコーティーングする。その後、プレートをBSAにようなブロッキング剤で洗浄して試験プレートへのたんぱく質(抗体または抗原)の非特異結合を遮断する。その後、試験検体を、キャプチャー抗体をコーティーングしたプレート上でインキュベートする。次に、プレートを洗浄し、抗-ヌクレオリン抗体と一緒にインキュベートし、再び洗浄し、特異性抗体標識化接合体と一緒にインキュベートし、シグナルを適切に検出する。
他のELISAにおいては、たんぱく質またはペプチドを選択された表面(その表面表示部分、例えば、特別処理ポリスチレンマイクロタイタープレートのウェルは、たんぱく質に対して親和性を有し得る)上に固定する。洗浄して不完全吸着物質を除去した後、一般的には、ウェル底部上に、BSAまたはカゼインのような、抗-ヌクレオリン抗体とは抗原性的に中性であることが判明している非特異性たんぱく質を結合させるかあるいはコーティーングするのが望ましい。この工程は、固定表面上の非特異吸着部位の遮断を可能にし、従って、抗体の上記表面上への非特異結合によって生ずる背景を減少させる。ポリペプチドをたんぱく質(例えば、BSA)に接合させることによって抗体を動物中で発現させた場合、遮断用たんぱく質に対する複数抗体、即ち、抗体組成物が存在する可能性がある故に、異なるたんぱく質をブロッキング剤として使用する。
ウェルにヌクレオリンを結合させ、非反応性物質てコーティーングして背景を減少させ、洗浄して未結合物質を除去した後、固定表面を、免疫複合体(抗原/抗体)形成を誘発させるような方法で抗-ヌクレオリン抗体組成物と接触させる。そのような条件は、抗体組成物をBSA、ウシγグロブリン(BGG)およびPBS/ポリオキシエチレンソルビタンモノラウレートのような希釈剤で希釈することを含む。また、これらの添加薬剤も非特異背景シグナルの低減を助長する。その後、層化した抗体組成物を25℃〜37℃で例えば2〜4時間インキュベートせしめる。インキュベーション後、抗体組成物接触表面を洗浄して、免疫複合体化していない物質を除去する。1つの洗浄手順は、PBS/ポリオキシエチレンソルビタンモノラウレートまたはホウ酸塩緩衝液による洗浄を含む。
試験検体と抗体間の特異的免疫複合体の形成およびその後の洗浄後、免疫複合体の形成を、抗-ヌクレオリン抗体に対する特異性を有する第2抗体を使用して検出する。検出に当たっては、二次抗体は、酵素または蛍光分子のような検出可能な標識と結合させる。多くのイムノアッセイ法が、米国特許第5,736,348号、第5,192,660号および第4,474,892号に記載されている。
【0027】
ウェスタンブロット法(Ausubel等、1987年)
ウェスタンブロット法は周知である。一般に、たんぱく質検体を、ドデシル硫酸ナトリウム-ポリアクリルアミドゲル電気泳動(SDS-PAGE)に、検体内の各たんぱく質の適切な分離が得られるような条件で供する。その後、各たんぱく質を、各たんぱく質相互の相対的位置を維持するような方法で、膜(例えば、ニトロセルロース、ナイロン等)に移す。
既知の分子量を有する可視化標識たんぱく質を上記ゲルのレーン中に含ませ得る。これらのたんぱく質は、上記各たんぱく質の膜への適切な移動を保証するための対照並びにブロット上の他の各たんぱく質の相対的分子量を測定するための分子量マーカーとして機能する。また、標識していないマーカーたんぱく質(または、幾つかの稀れな場合の無マーカーたんぱく質)は、ブリリアントブルー(GまたはR;Sigma社、ミズーリ州セントルイス)または他のたんぱく質染料で、移した後に検出する。たんぱく質を移した後、膜をブロッキング溶液中に浸漬して一次抗体の非特異結合を防止する。
一次抗体、例えば、抗-ヌクレオリンを標識化して、抗原の存在および分子量を、膜上の特異的位置における標識を検出することにより測定することができる。しかしながら、一次抗体は標識化しなくてもよく、上記ブロットを標識化第2抗体とさらに反応させる。この二次抗体は一次抗体と免疫反応性である;例えば、この二次抗体は、ウサギイムノグロブリンに対する抗体であり得、アルカリホスファターゼによって標識化し得る。ウェスタンブロットを実施する装置および方法は、米国特許第5,567.595号に記載されている。
【0028】
免疫沈降法(Ausubel等、1987年;HarlowおよびLane、1999年)
たんぱく質発現は、免疫沈降法を使用して抗原を分離することによっても測定し定量し得る。免疫沈降法は、米国特許第5,629,197号に記載されている。免疫沈降法は、ターゲット抗原成分を複合体混合物から分離することを含み、微少量のたんぱく質を選別しまたは分離するのに使用する。細胞表面たんぱく質の分離においては、多くの場合、ノニオン性塩類を使用する。
例えば、細胞全体からの免疫沈降は、以下のようにして実施し得る。細胞を、例えば、20mMのTris緩衝液、pH 8.6中の1%t-オクチルフェノキシポリエトキシエタノール/0.1%SDS/150mM NaClのような1種以上の清浄剤(上記参照)で抽出する。抽出(攪拌によって助長し得る)の後、不溶性屑片を遠心機を使用して除去する。抗-ヌクレオリン抗体を抽出物に添加し、次いで、検体を4℃で30分〜1夜インキュベートする。その後、セファロースまたはトリス-アクリルビーズに接合させた黄色ブドウ球菌(Staphylococcus aureus)プロテインAもしくは組換え産生プロテインAまたはC群ブドウ球菌プロテインGを添加する。抗-ヌクレオリン抗体がプロテインAに良好に結合しない場合、抗-ヌクレオリン抗体を産生させた動物の抗体を認識するIgG Ab類を同時に添加する。その後、検体を緩やかに攪拌しながら4℃でおよそ2時間インキュベートする。今や抗体・抗原複合体に結合したビーズ即ち細菌細胞を、通常先ず上記抽出溶液または高塩緩衝液で次いで低塩緩衝液または水で十分に洗浄して非特異結合たんぱく質および残留清浄剤分子を除去する。残留緩衝液を除去した後、ビーズを電気泳動サンプル緩衝液のような緩衝液と一緒にインキュベートし、その後、3〜5分間95℃に供して結合たんぱく質をビーズから溶出させる。その後、検体は、分析およびヌクレオリン検出に使用し得る状態にある。
【0029】
他の方法:
免疫選別法(FACS以外の) (Ausubel等、1987年)
原形質膜ヌクレオリンを発現する細胞は、抗-抗体抗体類をコーティーングしたプラスチックプレート上での“パンニング”によっても容易に分離し得る(WysockiおよびSato、1978年)。パンニングは、他の免疫選別手法を上回る多くの利点を有する:パンニングは、迅速で、効率的であり(107細胞数を2枚の60-mmプラスチックプレート上で30分以内で容易にパンニングし得る)、安価である。
一般的には、単一細胞懸濁液を抗-ヌクレオリン抗体で標識化し、次いで、二次抗体(非特異結合部位を遮断した)でコーティーングした基体上でインキュベートする。室温での1〜3時間のインキュベーション後に、付着していない細胞を洗い落とす。この実施態様においては、結合細胞が、ヌクレオリンが原形質膜中に発現していること指標し、新生物細胞を指標する。
ヌクレオリンの検出:オリゴヌクレオチド系方法
ヌクレオリンを認識し結合するGRO類および他のオリゴヌクレオチド類(Bates等、1999年;Miller等、WO 00/61597号、2000年;Xu等、2001年)を、抗体類と極めて同じ形で使用し得る。適切なアッセイ法の例を以下に示す。幾つかの場合、GROヌクレオチド類のより大きな核酸配列中への組込みは有利であり得る;例えば、GRO核酸の基質への結合をヌクレオリン結合部位を変性させることなく容易にするために。
ヌクレオリンを結合する(さらにまた、癌細胞増殖を抑制する生物学的特性を有する)有用なGRO類は、開示されている(Bates等、1999年;Miller等、WO 00/61597号、2000年;Xu等、2001年)。これらのGRO類は、下記の表2に示すものを含む。対照GRO類は、背景シグナル量を検出するのに有用である。
【表1】

【表2】

【0030】
細胞学的方法:
細胞局在化/標識法(免疫系局在化/標識アッセイ法と同類)
免疫系局在化アッセイ(免疫蛍光法またはFACSのような)について上記で概略述べた手順を、検出用試薬がヌクレオリン結合性GROであるアッセイ法に対しても応用し得る。修正としては、BSAのようなたんぱく質の代りにサケ精子由来の変性DNAを使用して非特異結合を阻止する手順を含む。検出に当っては、上述したのと同様な標識も、GROがある形の標識で誘導され得る限り、有用である。この目的においては、ビオチン-アビジン核酸標識化系が、ジゴキシゲニン系同様に、とりわけ好都合である(Ausubel等、1987年)。ビオチン化ヌクレオチドの合成は記載されている(Langer等、1981年)。水溶性ビタミンであるビオチンは、アリルアミンリンカー鎖によりピリミジン環のC5位置に共有結合し得る;ビオチンは、アビジンまたはストレプタビジンに非共有結合して、容易に標識化し得る。また、ビオチンを、合成中のオリゴヌクレオチドに、末端ヌクレオチドの5'ヒドロキシルに結合させることによって付加させる。ジゴキシゲニン-11-dUTPは、ニックトランスレーションまたはランダムオリゴヌクレオチド感作合成プロトコールのいずれかによってDNA中に組込み得る。ジゴキシゲニンは、標識化抗-ジゴキシゲニン抗体を使用して検出する。好都合なジゴキシゲニン系は、商業的に入手可能である(Roche Molecular Biochemicals社;インディアナ州インディアナポリス)。オリゴヌクレオチド類を使用してたんぱく質類を検出し局在化させる手法の例は、Davis等、1998年において記載されている。
生化学系方法:
また、GRO類は、上述したような生化学方法においてヌクレオリンを検出する抗体類と同様な形でも使用し得る。例えば、“サウスウェスタン”タイプのブロット試験をGRO類において実施し得る(Bates等、1999年;Miller等、WO 00/61597号、2000年)。細胞を適切に抽出した後(例えば、原形質膜たんぱく質を細胞間たんぱく質から特異的に分離するために)、たんぱく質をポリアクリルアミドゲル上で電気泳動に供し、ポリ二フッ化ビニリデン膜のような基体に移す。たんぱく質を、6M グアニジン-HClによる4℃30分間の洗浄、次いで、25M HEPES(pH 7.9)/4mM KCl/3mM MgCl2中3M、1.5Mおよび0.75MグアニジンHCl中での洗浄により変性し再生させる。HEPES緩衝液中の5%無脂肪乾燥乳によって非特異結合部位を遮断させた後、標識化GROを、0.25%のNDM、0.05%のNP-40、400 ng/mlのサケ精子DNA、およびtcgagaaaaa ctctcctctc cttccttcct ctcca;配列番号17のような無関係混合配列オリゴヌクレオチド 100ng/mlを加えたHEPES結合用緩衝液中で4℃で2時間ハイブリッド化する。HEPES結合用緩衝液で洗浄後、シグナルを適切に検出する。
他の方法:
アレー法
チップ上の固定化ヌクレオリン結合試薬のアレー
チップは、分子を含有していない領域または固定化分子をはるかに低い密度でしか含有しない領域によって分けられた固定化分子を含有する領域のアレーである。例えば、たんぱく質チップは、ヌクレオリン結合性抗体を塗布することによって作成する;“アプタマー”様のチップは、ヌクレオリン結合性GRO類を塗布することによって作成する。残りの領域は、被覆しないで残すかあるいは不活性分子で被覆する。アレーを洗浄して特異性固定化ポリペプチドまたは核酸を除く全てを除去する。さらに、複数のヌクレオリン結合性抗体(表1)、核酸(GRO類のような;表2)またはその双方を含有するチップも作成し得、また、ヌクレオリンと非反応性である対照抗体および/または核酸も含有し得る。そのようなアレーは、同時の試験確認、複製および内部統制を可能にする。
抗-ヌクレオリン抗体のようなたんぱく質類は、アミンとカルボン酸との縮合およびジスルフィドの形成のような単純な化学反応により、固形支持体上に固定化し得る。この不活性基体上へのたんぱく質の共有固定化は、非特異吸着による高背景シグナルを阻止する。ビオチンのような他の分子によって誘導された基体も、固定するたんぱく質がアビジンまたはストレプタビジンによって誘導された場合に有用であり、その逆もまた然りである。幾つかの稀れな場合、とりわけ抗-ヌクレオリン抗体コード化核酸配列が入手し得る場合は、抗-ヌクレオリン抗体を含む融合ポリペプチドが基体上への固定化において有利であり得る。
【0031】
ヌクレオリン結合剤を固定化し得る表面は、任意の材料であり得る。例えば、上記表面は、金属、ガラス、セラミック、ポリマー、木材または生物学的組織であり得る。上記表面は、与えられた材料の基体およびこの基体表面の1部または全体上のもう1つの材料の1以上の層を含み得る。上記表面は、GST融合ポリペプチド精製用のグルタチオン固定化において使用される基体のような、アフィニティークロマトグラフィーにおいて使用される一般的な表面のいずれかであり得る。アフィニティークロマトグラフィー用の表面としては、例えば、セファロース、アガロース、ポリアクリルアミド、ポリスチレンおよびデキストランがある。上記表面は、固形体である必要はなく、コロイド、剥離鉱質クレー、脂質単分子層、脂質二分子層、ゲルまたは多孔質材料であり得る。
上記固定化法は、望ましくは、上記表面上でのヌクレオリン結合剤の位置を制御する。例えば、抗体の抗原結合部分を基体に結合しないようにし、一方、非抗原結合部分を基体に定着させる。個々の反応物リガンドの位置を制御することにより、リガンドパターンまたはアレーが形成される。ヌクレオリン結合剤によって占められていない表面部分は、ポリペプチドまたはポリヌクレオチドの非特異吸着を許容しない。
この実施態様においては、対象者からの検体、例えば、血液をヌクレオリン結合性分子を含有するチップ上に通す。その後、表面プラスモン共鳴の変化を検出する機器のようなバイオセンシング装置を使用して結合ヌクレオリンを検出する。BIAcore (Uppsala社、スウェーデン)チップは、有用なチップおよび検出機器の例である。
【0032】
予知アッセイ
さらにまた、診断方法は、ヌクレオリンの表面発現を通常の方法におけるよりも早期に検出し得ることから、疾病発症の早期段階における腫瘍形成を有するあるいはその発症の危険のある対象者を同定するのに使用し得る。予知アッセイは、有害な腫瘍形成、とりわけ癌の家族歴を有するような、腫瘍形成を有するまたはその発症の危険のある対象者を同定するのに使用し得る。そのような個々人の同定方法は、対象者から得られた試験検体およびヌクレオリンの細胞表面局在化についての試験を含むであろう。
もう1つの実施態様においては、原形質膜ヌクレオリンの検出およびその後のヌクレオリン量の定性または定量いずれかの評価(通常、結合ヌクレオリン分子から発生したシグナルにより間接的に)は、原形質膜ヌクレオリンレベルが細胞増殖速度に相関することから、細胞増殖速度を指標し得る。
【0033】
キット
ヌクレオリンプローブおよび検出試薬を実施用の使用説明書と一緒に含むキット、容器、パックまたはディスペンサーを組立て得る。キットとして供給する場合、各種構成成分は、別々の容器内に包装し、使用直前に混合し得る。そのような各構成成分の別々の包装は、活性成分の機能を喪失することなく長期の保存を可能にする。
また、キットは、診断試験のような特定の試験の実施を容易にする別々の容器において各試薬を含む。例えば、非ヌクレオリン結合性GRO類は内部陰性対照用に供給し得、あるいはヌクレオリンとヌクレオリン結合性試薬は内部陽性対照用に供給する。キットの構成成分は、ヌクレオリンについて精査するための抗-ヌクレオリン因子、対照検体、および任意構成成分としてヌクレオリン検出のための組成物である。抗-ヌクレオリン因子の例としては、抗-ヌクレオリン抗体(例えば、表1に示しているような)またはそのフラグメントがある;標識化されている場合、ヌクレオリン結合用検出試薬は不要である。ヌクレオリン結合性オリゴヌクレオチド(例えば、表2に示すような)は、第2標識化試薬(ビオチンのような)が結合し得るように誘導し得る。しかしながら、標識化GRO核酸を使用する場合は、第2標識化試薬は不要である。検出試薬の例としては、標識化二次抗体、例えば、ロバ中で産生させ、その後ローダミンのような蛍光体で標識化した抗-マウスpAb、またはGRO類のようなオリゴヌクレオチド類を検出するための標識化試薬、例えば、プローブをビオチン化した場合のホースラディッシュペルオキシダーゼに結合させたアビジンまたはストレプタビジンがある。対照構成成分としては、二次抗体を産生させた動物からの正常血清;ヌクレオリンポリペプチドまたはヌクレオリン結合性オリゴヌクレオチドを含有する溶液;ヌクレオリン結合性試薬の反応性をアッセイするためのヌクレオリンたんぱく質のドットブロット;または原形質膜中でヌクレオリンを発現する固定化または保存細胞がある。他の構成成分としては、緩衝液、固定剤、ブロッキング用溶液、顕微鏡スライドおよび/またはカバースリップ、またはマイクロタイタープレートのような分析用の他の適切な基体;清浄剤、清浄剤溶液または他の細胞抽出試薬;その他の雑試薬、プロテアーゼインヒビター類、各種容器、およびアッセイを容易にするための雑器具および装置がある。
【0034】
(a) 容器または管類
キットに含ませる試薬は、種々の構成成分の寿命が保持され且つ容器材料によって吸着または変化を受けないような任意の種類の容器内で供給し得る。例えば、密閉ガラスアンプルは、凍結乾燥ヌクレオリン結合用試薬(抗-ヌクレオリン抗体またはヌクレオリン結合性オリゴヌクレオチド)または窒素のような中性で非反応性ガス下で包装した緩衝液を含有し得る。アンプルは、ガラス、有機ポリマー(即ち、ポリカーボネート、ポリスチレン等)、セラミック、金属または試薬類を保持するのに典型的に使用される任意の他の材料のような任意の適切な材料からなり得る。適切な容器の他の例は、アンプルと同様な物質から製造した単純なボトル類およびアルミニウムまたは合金のようなホイルライニング内装を有し得る外装材である。他の容器類としては、試験用チューブ、バイアル、フラスコ、ボトル、シリンジ等がある。容器類は、皮下注射針によって刺し通し得るストッパー付きボトルのような滅菌受入れ口を有し得る。他の容器類は、容易に取外し得る膜によって分離され、膜を取外した時に、各成分の混合を可能にする2つの仕切り室を有し得る。取外し可能な膜は、ガラス、プラスチック、ゴム等であり得る。
(b) 説明材料
また、キットは、説明材料と一緒に供給し得る。使用説明は、紙または他の基体上に印刷し得るし、および/またはフロッピー(登録商標)ディスク、CD-ROM、DVD-ROM、DVD、ビデオテープ、オーディオテープ等のような電子読取り可能な媒体として供給し得る。詳細な説明書は、キットに有形に添付しなくてもよい;代りに、使用者をキットの製造業者または販売業者が特定したインターネットウェブサイトに指向させ得るし、あるいは電子メールとして供給してもよい。
以下の実施例は、本発明を具体的に説明するものであり、限定するものではない。
【実施例】
【0035】
実施例
実施例1:細胞中の原形質膜ヌクレオリンの免疫蛍光標識化
本実施例は、核ヌクレオリンまたは原形質膜ヌクレオリンのみを染色する手順を例示する。
細胞系DU145(ヒト前立腺癌)、MDA-MB-231(ヒト乳癌)、HeLa(ヒト子宮頚癌)およびHS27(正常皮膚線維芽球) (いずれもATCCから入手可能;ヴァージニア州マナサッス)からの各細胞を、培養基質からトリプシンによって放出させ、単一細胞として再懸濁させ、顕微鏡スライド上に置いた。細胞で種付けした各スライドを、顕微鏡を使用しての目視検査により検定したときに良好に付着するまで37℃でインキュベートした。付着細胞をPBSで2分間1回洗浄した後、各細胞を4%ホルムアルデヒド/PBS中で少なくとも15分間22℃で固定した。核ヌクレオリン染色のため、各細胞を、抗体と接触させる前に、1%Triton X-100で浸透性化する。PBSで5分/洗浄の2回洗浄後、非特異結合部位を22℃の1%NGS/PBSで15〜60分間遮断し、次いで、1%NGS/PBSまたはPBS/Tween(0.05%〜0.1%)中に希釈したマウス抗-ヌクレオリン抗体と一緒に4℃で1時間〜1夜インキュベートした。各検体をPBSで各5分間4回洗浄し、その後、PBS中に希釈したFITC標識化二次抗体で標識化したヤギ抗-マウスpAbと一緒に22℃で1時間インキュベートした。再びPBSで各5分間4回洗浄後、各検体をMowiol封入剤中に封入し(封入剤は以下のようにして調製した:9ml/グリセリンと3.36gのMowiol 40-88を22℃で1時間攪拌した。その後、9mlの水を加え、攪拌を22℃で2時間続けた。次に、Tris(0.2M、pH 8.5;18ml)を加え、溶液を、固形分が殆ど完全に溶解するまで50℃で6時間インキュベートした。5,000×gで遠心分離した後、液体相を封入に使用した)、顕微鏡観察し、写真撮影した。
図1および2は、各細胞系における核(図1)および原形質膜(図2)ヌクレオリン染色を示す。免疫蛍光顕微鏡写真(図1および2;パネルB、D、F、H)および並行しての位相差顕微鏡写真(図1および2;パネルA、C、E、G)を示しており;DU145細胞はAおよびBに示しており、MDA-MB-231細胞はCおよびDに示しており、HeLa細胞はEおよびFに示しており、HS27細胞はGおよびHに示している。細胞系全てが明白な核ヌクレオリン染色を示している(図1A、1C、1Eおよび1G)。細胞が浸透性化されず、従って、表面原形質膜への抗体受入れを制限した場合、正常皮膚細胞系、HS27は原形質膜染色において完全に陰性であり(図2H)、一方、各癌細胞は強い染色を示している(図2B、2D、2Fおよび2H)ことに注目されたい。このように、原形質膜ヌクレオリンの染色は、核ヌクレオリンまたは銀染色NOR類に比較して診断および予知における優れた方法である。
【0036】
実施例2:原形質膜ヌクレオリン発現度合と癌侵略性との相関
本試験は、高レベルの原形質膜ヌクレオリンを含む細胞系は最も急速な増殖を伴う細胞系に相当することを実証する。
2つの癌細胞系DU145とHeLa、1つの正常細胞系HS27を増殖速度についてアッセイし、比較した。細胞倍増時間は、MTTアッセイ(生存細胞が3-(van de Loosdrecht等、1994年)-2,5-ジフェニルテトラゾリウムブロマイド(MTT)をホルマザンに還元する能力に基づく;(van de Loosdrecht等、1994年))を使用して一定間隔の細胞密度を測定することによって算出し、トリパンブルー除外を使用して細胞数を計数することによって確認する。
図3は、MTTアッセイにより測定したときのDU145(四角)、HeLa(菱形)およびHS27(丸)の比較増殖速度を示す。培養3日まで、増殖速度は同じようであるが、3日より後は、HeLaとDU145は正常HS27細胞よりも速い割合で増加している。MDA-MB-231はこの試験には含まれていないが、増殖速度は、DU145 > MDA-MB-231 > HeLa > HS27であることを測定している。高レベルの原形質膜ヌクレオリンを含む細胞系(図2参照)は、最も速い増殖を示す細胞系(DU145およびHeLa)に相当することに注目されたい。
【0037】
実施例3:パラフィン埋め込み組織切片中のヌクレオリンの免疫蛍光標識化
本実施例は、埋め込まれている固定化検体中のヌクレオリンを検出し局在化させる適切な方法を提示する。
固定化しパラフィンワックス中に埋め込み顕微鏡スライド上に定着させた細胞切片を、3回交換のキシレン(各2分間)中で洗浄してパラフィンを除去し、アルコール勾配(連続で100%、95%および70%;各2分間)中で水和させ、PBS中に5分間置いた。抗原復元には、低温抗原再生法(LTAR;(Shi等、1997年;Shi等、2001年))を使用した:37℃/5%CO2で15分間PBS中に希釈した0.1%トリプシン-EDTA(容量/容量) (Invitrogen社;カリフォルニア州カールズバッド)で消化した後、各検体を脱イオン水で洗浄し、10mMクエン酸塩緩衝液(pH 6)中で2時間80℃でインキュベートした。冷却後、各スライドを脱イオン水、次いでPBSで洗浄した。
非特異結合部位をPBS中3%BSA中での22℃30分のインキュベーションによって遮断した。その後、各検体を、PBS/1%NGS中に希釈した4μg/mlのマウス抗-ヌクレオリンmAb (Santa Cruz社)と一緒に4℃で1夜インキュベートした。その後、各検体を22℃にし、PBSで5分間4回洗浄し、次いで、50μg/mlのAlexa488接合ヤギ抗-マウスIgG (Molecular Probes社;オレゴン州ユージーン)およびPBS/1%NGS中に希釈した2μg/mlのヨウ化プロピジウムと22℃で1時間反応させた。PBSで5分間4回の洗浄後、検体をNowiol封入剤中に封入し、蛍光顕微鏡で観察した。
図4は、そのような試験の結果を示す。頭部および頚部の扁平上皮細胞癌の臨床検体を調製し、原形質膜ヌクレオリンについて精査した。原形質膜ヌクレオリンシグナルは、悪性新生物細胞に局在していた。図4Aは、ヌクレオリンの精査から得られた免疫蛍光シグナルを示しており;核は、DNA介在性染料によって対向染色されている。図4Bは、並行しての位相差顕微鏡写真を示す。図4Cおよび4Dは、染色領域をより一層良好に示すためにマーキングを加えた以外は、図4Aおよび4Bの複製である。領域1においては、シグナルは細胞上で強力であり(図4Aにおける核染色に対しては弱いシグナル);これら細胞は、漫然と組織化された組織中にあり、あまり濃密には詰ってなく、これらの細胞が悪性であることを示唆している。領域2においては、正常細胞(良好に詰った細胞と組織化された組織によって区分けされているような)、即ち、細胞は原形質膜ヌクレオリンシグナルを示していない。
【0038】
実施例4:肺癌細胞中での原形質膜ヌクレオリン発現
本実施例は、肺癌細胞を、原形質膜ヌクレオリンに対する染色によって容易に同定し得ることを実証する。
NCI-H1299 (H.サピエンスリンパ節から分離された非小細胞肺癌;(Giaccone等、1992年;LinおよびChang、1996年))およびNCI-H82 (小細胞肺癌細胞、H.サピエンス、(Carney等、1985年;Little等、1983年;Takahashi等、1989年))の各細胞を、培養基質からトリプシンによって放出させ、単一細胞として再懸濁させ、顕微鏡スライド上に置いた。各細胞を、顕微鏡を使用する目視検査によって検定したときに良好に付着するまで37℃でインキュベートした。各細胞を、PBSで2分間1回洗浄した後、4%ホルムアルデヒド/PBS中で少なくとも15分間22℃で固定した。PBSで5分間/洗浄の2回洗浄後、非特異結合部位を1%NGS/PBSで15〜60分間22℃で遮断し、次いで、マウス抗-ヌクレオリン抗体と一緒に1時間〜1夜4℃でインキュベートした。各検体をPBS各5分間で4回洗浄し、その後、FITC標識化二次抗体で標識化しヨウ化プロピジウム(核染色のための)を含むPBS中に希釈したヤギ抗-マウスpAbと一緒に22℃で1時間インキュベートした。再度の各5分間のPBSによる4回の洗浄後、各検体をMowiol封入剤中に封入し、顕微鏡観察し、写真撮影した。
図5は、上記2つの肺癌細胞系、NCI-H82(図5A;並行しての位相差画像は5Bに示す)およびNCI-H1299(図5C;並行しての位相差画像は5Dに示す)の原形質膜ヌクレオリンについて精査した全体細胞を示す。両細胞系において、原形質膜ヌクレオリン染色は、強力である;良好に染色された細胞の例は、図5Aおよび5Cにおいて星印(*)で示している。
【0039】
実施例5:臨床試験標本の原形質膜ヌクレオリン染色
腫瘍、前悪性および悪性細胞を診断するためのこの新規な原形質膜ヌクレオリンアッセイ方法の実行性を試験するために、健常対象者および癌を患っている対象者からの臨床試験標本を收集した。末梢血、骨髄および腫瘍バイオプシー検体からのサンプルを入手し、実施例4に述べたようにして原形質膜ヌクレオリンに対して染色した。図6は、末梢血(A、B)または骨髄(C、DおよびE、F)の位相差画像(B、D、F)および免疫蛍光画像(A、C、E)を示す。原形質膜ヌクレオリンに対して高度に染色された細胞は、星印(*)でマークしている;これらは、癌腫を患っている患者(A、BおよびC、D)においてのみ観察されるが、健常患者からの細胞は何ら原形質膜ヌクレオリン染色を示していなかった(E,F)。
【0040】
実施例6:(予知) 原形質膜ヌクレオリン発現度合と癌侵略性との相関
殆どAmerican Type Culture Collection (ヴァージニア州マナッサス)から入手し得る33例の肺癌細胞系を分析する。細胞倍増時間は、MTTアッセイを使用して一定間隔の細胞密度を測定することによって算出し、トリパンブルー除外を使用して細胞数を計数することによって確認する。各試験において、HeLa細胞(Gey等、1952年)を内部対象として含ませる。各値は、複製検体の3つによる少なくとも2つ個々の試験から決定する。核および原形質膜ヌクレオリン量を測定するため、2つの方法を実施する。先ず、核および原形質膜抽出物を、開示されている方法(Ausbel等、1987年;Bates等、1999年;Yao等、1996年a)を使用して、各細胞系から調製する。要するに、細胞を採取し、低張緩衝液中に再懸濁させ、次いで、氷上で数分間膨潤させる。細胞をDounceホモジナイザーを使用して分解し、核を遠心分離により集める。核を高塩緩衝液中に再懸濁させて核たんぱく質を抽出する;その後、塩を透析により除去する。原形質膜たんぱく質は、S-100画分から分離し得、サイトソルたんぱく質および他の細胞小器官からサクロース勾配により遠心分離によって分離する。異なる細胞からの核およびPM抽出物を、抗-ヌクレオリン抗体(Santa Cruz社)を使用してのウェスタンブロット分析(Ausubel等、1987年)およびその後の化学発光可視化により分析する。その後、ヌクレオリン量を、X線フィルム上に記録しHeLa抽出物対照の強度に対して標準化した得られたシグナルのデンシトメトリーにより定量する。ヌクレオリン量を測定する2番目の方法は、各細胞系のヌクレオリンについての免疫蛍光精査を含む。各細胞を、陽性対照としてのDU145細胞(Mickey等、1977年;Stone等、1978年)、陰性対照としてのHS27細胞および参照としてのHeLa細胞と並行して、ヌクレオリン表面発現について精査する(図2参照)。各細胞を写真撮影し、シグナルの度合順にランク付けする;また、このシグナルも定量し得るか(画素を定量するソフトウェアと画像を使用するシステムを使用して;この場合、ビデオ画像を使用する)、あるいは定性的に評価し得る。その後、データを統計分析に供して、細胞増殖度(細胞増殖速度が高いほど、癌細胞は侵略性である)とヌクレオリンシグナル強度との相関を全検体に亘ってまた下位集団内で実証する。
【0041】
実施例7:(予知) 肺癌検出
本実施例においては、患者バイオプシー、痰検体および切除肺組織を原形質膜ヌクレオリンについて精査し、これらの結果を、保存記録およびこの試験における定期的臨床検査標本を利用して、肺癌についての他の診断および予知マーカーと比較する。
方法
気管支バイオプシー、痰検体および切除肺組織を含む試験標本を、健常および肺癌を患っている対象者双方のヒト対象者から入手し、各検体をヌクレオリン精査および観察時に、検体起源が未知であるようにコード化する。
その後、免疫組織化学方法を使用してのこれらの検体の精査を実施する。例えば、原形質膜ヌクレオリンは、表1から選択した1種以上の抗-ヌクレオリンAb類、蛍光体標識化二次Abから発生したシグナル、並びに観察および写真撮影した検体によって精査する。適切な対照としては、二次抗体のみによる精査、抗体無しでの精査、免疫前血清のみによる精査、および分析する細胞タイプとは反応しないことが知られている抗体による精査がある。可視化および局在化測定を容易にするためには、細胞をHoechst 33258またはヨウ化プロピジウム(核を可視化するため)によりおよび/または蛍光標識化ファロイジンまたはファリシジン(アクチン細胞骨格を可視化するため)により対向染色する。各検体を観察し、点数付けし(原形質膜ヌクレオリン発現を指標する表面シグナル)、記録する。
【0042】
参考文献





【0043】
以下、本発明の態様を示す。
1.細胞中の原形質膜ヌクレオリンの存在を検出することを特徴とする、細胞の新生物状態の判定方法。
2.細胞が哺乳動物である、上記1記載の方法。
3.細胞が、サル、イヌ、ネコ、ウサギ、ウシ、ブタ、ヤギ、モルモット、マウス、ラットまたはヒツジである、上記2記載の方法。
4.細胞がヒトである、上記3記載の方法。
5.細胞が溶解されている、上記1記載の方法。
6.前記の検出がヌクレオリン・抗-ヌクレオリン因子複合体を検出することを含む、上記1記載の方法。
7.抗-ヌクレオリン因子がヌクレオリンに特異的に結合するモノクローナル抗体である、上記6記載の方法。
8.前記抗体が、p7-1A4マウスモノクローナル抗体、sc-8031、sc-9893、sc-9892、4E2または3G4B2である、上記7記載の方法。
9.前記抗-ヌクレオリン因子がヌクレオリン結合性オリゴヌクレオチドである、上記6記載の方法。
10.前記オリゴヌクレオチドがグアノシンリッチオリゴヌクレオチドである、上記9記載の方法。
11.前記オリゴヌクレオチドが、配列番号1〜7;9〜17;19〜30または31からなる群から選ばれた配列を含む、上記10記載の方法。
12.前記複合体を、蛍光、酵素または放射能を検出することによって検出する、上記6記載の方法。
13.細胞中の原形質膜ヌクレオリンの量を定量することを特徴とする、細胞の新生物状態の判定方法。
14.細胞が哺乳動物である、上記13記載の方法。
15.細胞が、サル、イヌ、ネコ、ウサギ、ウシ、ブタ、ヤギ、モルモット、マウス、ラットまたはヒツジである、上記14記載の方法。
16.細胞がヒトである、上記15記載の方法。
17.細胞が溶解されている、上記13記載の方法。
18.前記の定量がヌクレオリン・抗-ヌクレオリン因子複合体を定量することを含む、上記13記載の方法。
19.抗-ヌクレオリン因子がモノクローナル抗体である、上記18記載の方法。
20.前記抗体が、p7-1A4マウスモノクローナル抗体、sc-8031、sc-9893、sc-9892、4E2または3G4B2である、上記18記載の方法。
21.前記抗-ヌクレオリン因子がヌクレオリン結合性オリゴヌクレオチドである、上記18記載の方法。
22.前記オリゴヌクレオチドがグアノシンリッチオリゴヌクレオチドである、上記21記載の方法。
23.前記オリゴヌクレオチドが、配列番号1〜7;9〜17;19〜30または31からなる群から選ばれた配列を含む、上記22記載の方法。
24.前記複合体を、蛍光、酵素または放射能を定量することによって定量する、上記23記載の方法。
25.抗-ヌクレオリン因子と対照検体を含む、細胞の新生物状態判定用のキット。
26.ヌクレオリン・抗-ヌクレオリン複合体を検出する第2因子をさらに含む、上記25記載のキット。
27.前記抗-ヌクレオリン因子が抗-ヌクレオリン抗体であり、前記第2因子が標識化二次抗体である、上記26記載のキット。
28.前記標識が酵素、蛍光体、放射性同位元素または金粒子の少なくとも1つである、上記27記載のキット。
29.前記抗-ヌクレオリン因子がビオチンを含み、前記第2因子がアビジンまたはストレプタビジンを含む、上記28記載のキット。
30.前記抗-ヌクレオリン因子がジゴキシゲニンを含み、前記第2因子が標識化抗-ジゴキシゲニン抗体を含む、上記28記載のキット。
31.固定剤、緩衝液、プラスチック容器、血清、血清アルブミン、無脂肪乳、膜および使用説明書からなる群から選ばれた少なくとも1つをさらに含む、上記25記載のキット。
32.前記抗-ヌクレオリン因子が標識化されている、上記25記載のキット。
33.前記標識が酵素、蛍光体、放射性同位元素または金粒子の少なくとも1つである、上記32記載のキット。
34.肺細胞を含む対象者からの検体を採取し;細胞表面のヌクレオリンの存在を検出することを特徴とする、対象者の小肺細胞癌腫の検出方法。
35.前記検体が痰である、上記34記載の方法。
36.対象者がヒトである、上記34記載の方法。
37.肺細胞を含む対象者からの検体を採取し;検体を検査センターに送り;細胞の新生物状態を上記1記載の方法によって判定することを特徴とする、前悪性または悪性細胞の診断方法。
38.対象者がヒトである、上記38記載の方法。
39.前記検体が痰である、上記39記載の方法。
40.前記診断が肺小細胞癌腫の診断である、上記39記載の方法。
【技術分野】
【0001】
本発明は、ヌクレオリン(nucleolin)の細胞原形質膜発現と新生物細胞の存在および侵略性との間の相関の発見に基づく。即ち、本発明は、前悪性症状および悪性疾病および障害の検出および予知、並びに検出および予知用のキットに関する。
【背景技術】
【0002】
闘いに十分に備えることは成功に至る;障害が癌である場合、早期の検出は、医薬介入が成功する大きな可能性をもたらす。早期段階においては、治療は、多くの場合、病変組織のみをターゲットとし、副作用を軽減し得る。早期で見出せない場合、癌細胞は、身体中に転移拡大し得る。この場合の予後はより悲惨であり、医薬治療は、多くの場合、全身的に施され、癌細胞のみならず大多数の健常細胞も死滅させる。
癌細胞の顕著な特徴は、制御されない増殖である。また、癌細胞は、形態上および機能上の異常も示し得る。癌細胞は、系統的な細胞形態をあまり示さず、例えば、非対称形細胞小器官および適切な細胞機能を可能にする構造的組織化(細胞極性)を喪失する。細胞-細胞間および細胞-基体間接触、正常な機能のためにも必要なその特異性は、多くの場合、変調されあるいは喪失する。機能的には、癌細胞は、野生タイプの機能を例えあったとしても殆ど維持し得ず、また、ホルモン分泌のような正常機能を悪化させ、調節し得ない。そのような細胞は、早期発生期に逆行し、その野生タイプ(即ち、正常)親細胞よりも分化しないようである。
また、癌細胞は、しばしば、誤発現しあるいはたんぱく質類を不適切な細胞画分へ誤ターゲティングする。たんぱく質類はアップ-またはダウン-調節され得、特異的細胞タイプによって通常発現されないたんぱく質でさえも、形質転換された対応物によって発現され得る。たんぱく質誤発現は、膜組成、細胞小器官形成または生理機能における激しい変化を含む過剰な下流細胞作用を有し得る。たんぱく質(および脂質等のような他の分子)の誤ターゲティングも細胞極性の喪失に寄与する。
【発明の概要】
【発明が解決しようとする課題】
【0003】
癌増殖の検出は、たんぱく質誤発現および細胞脱分化のような種々の要因により複雑である。例えば、癌は、次第に進行して、検出するのが困難な少数のみに存在し得る。一般的な診断方法は、癌細胞を正常細胞から識別する“マーカー”としてのある種のたんぱく質の使用である。例えば、前立腺癌の診断は、多くの場合、前立腺特異性抗原(PSA)を使用する。これらのアッセイは、マーカーが限定され、検出因子を有し、且つ容易に入手可能であることを必要とする。しかしながら、殆どではないにしても多くの癌中に存在するマーカーはもっと限定されるべきである。そのようなマーカーは、診断を著しく容易にするであろう。
【課題を解決するための手段】
【0004】
第1の局面において、本発明は、ヒトのような哺乳動物の細胞を含む細胞の原形質膜のヌクレオリンの存在を検出することを特徴とする細胞の新生物状態の判定方法に関し;その細胞は溶解させてもよい。原形質膜ヌクレオリンは、配列番号1〜7;9〜17;19〜31の配列オリゴヌクレオチド類のような抗-ヌクレオリン抗体またはオリゴヌクレオチド類のような抗-ヌクレオリン因子を使用することによって検出する。
第2の局面においては、本発明は、ヒトのような哺乳動物の細胞を含む細胞の原形質膜のヌクレオリンの量を定量することを特徴とする新生物細胞のフェノタイプの判定方法に関し;その細胞は溶解させてもよい。原形質膜ヌクレオリンは、配列番号1〜7;9〜17;19〜31の配列オリゴヌクレオチド類のような抗-ヌクレオリン抗体またはオリゴヌクレオチド類のような抗-ヌクレオリン因子を使用することによって検出する。
もう1つの局面においては、本発明は、抗-ヌクレオリン因子と対照検体を含む、細胞の新生物状態判定用のキットに関する。そのようなキットは、ヌクレオリンに結合する試薬、試薬・ヌクレオリン複合体、並びに固定剤、緩衝液、プラスチック容器、血清、血清アルブミン、無脂肪乳、膜および使用説明書のような他の構成成分も含み得る。
もう1つの局面においては、本発明は、対象者から肺細胞を含む検体を採取し;そして、細胞中の原形質膜ヌクレオリンの存在を検出することを特徴とする対象者の小肺細胞癌腫の検出方法に関する。検体は痰を含み;対象者はヒトであり得る。
さらにもう1つの局面においては、本発明は、細胞を含む対象者からの検体を採取し、検体を検査センターに送り、細胞の新生物状態を、細胞原形質膜ヌクレオリンについて精査することによって判定することを特徴とする腫瘍、前悪性または悪性細胞の診断方法に関する。
【図面の簡単な説明】
【0005】
【図1】各種細胞系における核ヌクレオリンの染色を示す。免疫蛍光顕微鏡写真(B、D、F、H)および並行しての位相差顕微鏡写真(A、C、E、G)を示している。分析した細胞系は、DU145前立腺癌細胞(A、B)、MDA-MB-231乳癌細胞(C、D)、HeLa子宮頸癌細胞(E、F)およびHS27正常皮膚細胞(G、H)であった。抗-ヌクレオリン抗体を使用し、各細胞は、染色前に浸透性化して細胞質および核画分への抗体受入れを可能にした。
【図2】図1において示した細胞系における原形質膜ヌクレオリンの染色を示す。免疫蛍光顕微鏡写真(B、D、F、H)および並行しての位相差顕微鏡写真(A、C、E、G)を示している。分析した細胞系は、DU145前立腺癌細胞(A、B)、MDA-MB-231乳癌細胞(C、D)、HeLa子宮頸癌細胞(E、F)およびHS27正常皮膚細胞(G、H)であった。抗-ヌクレオリン抗体を使用した;各細胞は、染色前に浸透性化しないで、原形質膜のみへの抗体受入れを可能にした。
【図3】MTTアッセイにより測定したときの各細胞系の比較増殖速度を示す。四角はDU145であり、菱形はHeLaであり、丸はHS27である。MDA-MB-231はこの試験には含まれていないが、これら4種の細胞系における増殖速度を測定したところ、DU145 > MDA-MB-231 > HeLa > HS27であった。高レベルの原形質膜ヌクレオリンを含む細胞系は、最も速い増殖を示す細胞系に相当することに注目されたい(DU145およびHeLA;図2参照)。
【図4】頭部および頚部の扁平上皮細胞癌を有する患者から切除したパラフィン埋め込み試験標本の位相差画像(B、D)および免疫蛍光画像(A、C)を示す。試験標本は、原形質膜ヌクレオリンに対して染色し、ヨウ化プロピジウムで対向染色して細胞核を示した。画像(C)および(D)は、マークによってオーバーレイしてヌクレオリン染色をより良好に示した画像(A)および(B)を示す。白線で囲まれた領域1は強いヌクレオリン染色を含むが、1以外の領域は、シグナルを殆ど(3)あるいは全く(2)示していない。
【図5】サイトスピナーを使用して顕微鏡スライド上に置いた小細胞(NCI-H82)および非小細胞肺(NCI-H1299)癌細胞系の位相差画像(B、D)および免疫蛍光画像(A、C)を示す。各検体は、原形質膜ヌクレオリンに対して染色し、ヨウ化プロピジウムで対向染色して細胞核を示した。極めて良好に染色された原形質膜を有する細胞は、星印(*)で示している。
【図6】ヒト対象者からの末梢血(A、B)または骨髄(C、DおよびE、F)の位相差画像(B、D、F)および免疫蛍光画像(A、C、E)を示す。各検体は、原形質膜ヌクレオリンに対して染色し、ヨウ化プロピジウムで対向染色して細胞核を示した。ヌクレオリンに対して高度に染色された細胞は、星印(*)でマークしている;これらは、癌腫を患っている患者(A、BおよびC、D)においてのみ観察されるが、健常患者からの細胞は何ら原形質膜ヌクレオリン染色を示していなかった(E,F)。
【発明を実施するための形態】
【0006】
本発明は、ヌクレオリン原形質膜発現と新生物細胞の存在および侵略性との間の相関の発見に基づく。
本発明は、広汎に発現する新生物抗原、即ち、ヌクレオリンを使用する、悪性および前悪性細胞のような新生物細胞を検出するための組成物および方法を提供する。しかしながら、ヌクレオリンの発現は、悪性物を指標するには不十分である(ヌクレオリンはどの核形成細胞にも見出される);しかし、細胞表面上でのヌクレオリンの局在化は暗示的である。銀染色によって可視化されるような増大量の核ヌクレオリンは癌の診断手段として使用されているものの、細胞表面上で見出されるヌクレオリンが前悪性または悪性フェノタイプと相関するという予想外の発見は、癌の診断および予防を容易にし得る。
表面局在化ヌクレオリンを使用する利点は、下記のとおりである:
(1) 改良された正確度。原形質膜ヌクレオリンについてのアッセイは、核ヌクレオリンに対する銀染色に比較して悪性フェノタイプをより正確に同定する。
(2) 特異性。原形質膜ヌクレオリンは、殆どの野生タイプ(正常)細胞の原形質膜中では通常観察されない。即ち、マーカーの量を分析することを必要とする多くの他の診断検査とは異なり、原形質膜ヌクレオリン検出は、定性的に使用し得る。従って、より誤診防止的な“イエス・ノー”タイプの検査が実施可能である。また、この局面は、単一細胞および組織検体双方についての検査も可能にする。
(3) 広汎な応用性。多くの種々の癌を原形質膜ヌクレオリンについて検査することによって検出し得る。
(4) 多機能性。該方法は、予知並びに診断用である:細胞増殖速度は、原形質膜ヌクレオリンレベルに典型的に相関する。
【0007】
非アンチセンスグアノシンリッチオリゴヌクレオチド(GRO)類の癌細胞に対する抗増殖活性の研究中に、そのような抗増殖性GRO類はヌクレオリンに結合してその効果を奏することが判明した(Bates等、1999年;Miller等、WO 00/61597号、2000年)。ヌクレオリン(Bandman等、米国特許第5,932,475号、1999年)は、核小体の豊富な非リボソームたんぱく質、即ち、リボソーム遺伝子転写部位および前リボソームRNAのパッケージングである。この707個のアミノ酸リンたんぱく質は、ヒストン様N-末端からなる多重ドメイン構造、4つのRNA認識モチーフを含有する中央ドメインおよびグリシン/アルギニンリッチC-末端を有し、且つ110 kDの見掛け分子量を有する。その多重ドメイン構造は、この多面的なたんぱく質の著しく多様な機能を反映している(Ginisty等、1999年;SrivastavaおよびPollard、1999年;TutejaおよびTuteja、1998年)。ヌクレオリンは、細胞の生存および増殖の多くの基本的局面に関与している。最も理解されているのは、リボソーム発生におけるヌクレオリンの役割である。他の機能としては、核細胞質輸送、細胞質分裂、核合成およびアポトーシスがあり得る。
ヌクレオリン合成は、細胞分裂(細胞増殖)速度増大と相関する;従って、ヌクレオリン量は、殆どの正常細胞と比較して腫瘍細胞における方が高い(TutejaおよびTuteja、1998年)。ヌクレオリンは核オルガナイザー領域(NOR)たんぱく質の1つであり、銀染色によって測定したときのその量は、細胞増殖のマーカーおよび悪性度のインジケーターとして病理学者によって評価されている(Derenzini、2000年)。
また、リンパ球および内部髄質收集導管細胞のような2、3の細胞タイプ中の細胞原形質膜にも存在し、ヌクレオリンはレセプターとして機能するものと想定されている(例えば、Callebaut等、1998年;SorokinaおよびKleinman、1999年)。しかしながら、原形質膜ヌクレオリンの役割は、良くは理解されていない。さらに、原形質膜ヌクレオリンが核たんぱく質と同一であるのかあるいは原形質膜ヌクレオリンが異なるイソ型またはヌクレオリン様たんぱく質であるのかは明らかではない。しかしながら、原形質膜ヌクレオリンの発現は新生物細胞(悪性または前悪性のような)に特異的である;即ち、原形質膜ヌクレオリンの機能は、診断および予知目的においては知る必要はない。
【0008】
定義
新生物、悪性物、腫瘍、癌細胞
新生物は、新生物細胞、即ち、正常細胞よりも急速且つ制御され得ないで増殖する細胞に由来する異常組織増殖である。通常、部分的にまたは完全に組織破壊性の新生物は、相応する正常組織との機能的連携を欠如する。新生物は、良性(腫瘍)または悪性(癌)のいずれかであり得る明確な組織塊を形成する。
癌細胞は、周囲組織を侵害し、離れた部位に転移し得、試みられた除去後に再発して適切に治療されなかった場合の対象者を死に至らしめるようである。組織破壊性以外にも、癌細胞は、より原始的または未分化状態に逆行する(退形成)が、形態学または生化学的には、癌細胞は、相応する野生タイプの細胞の多くの機能を依然として示し得る。癌腫は上皮に由来する癌であり;肉腫は結合組織に由来する。
癌は、侵略性が大または小であり得る。癌細胞の侵略性フェノタイプは、ヌードマウスにおいて腫瘍を形成し転移する増殖速度と能力を示す。侵略性癌は、侵略性が低い腫瘍よりも急速に、より容易に腫瘍を形成し転移する。
新生物状態
用語“新生物状態”とは、3つの状態、即ち、正常、前悪性および悪性を称する。“正常”は、臨床的に正常(健常)である増殖または細胞を称する。“前悪性”は、悪性物への途上にあるが、検査時においては、通常の方法によっては悪性として分類されないであろう増殖または細胞を称する。“悪性”は、次の特性の少なくとも1つを有する細胞または増殖を称する:局所的に侵害性、破壊性の増殖および転移。
【0009】
GRO類および他のポリペプチド結合性オリゴヌクレオチド類
ヌクレオリン類のようなポリペプチド類に特異的に結合するオリゴヌクレオチド類は、入手可能である。そのような例は、グアノシンリッチオリゴヌクレオチド類であるGRO類である。GRO類の特性としては、下記がある:
(1) 少なくとも1個のGGTモチーフを有する。
(2) 好ましくは、4〜100個のヌクレオチドを有するが、それよりも多いヌクレオチドを有するGROも可能である。
(3) 安定性を改善するための化学修飾を有する。
とりわけ有用なGRO類は、295 nmでの可逆的熱変性/復元プロフィールによって指標されるようなG-四重構造を形成する(Bates等、1999年)。好ましいGRO類は、電気泳動度シフトアッセイにおいて、ターゲット細胞たんぱく質への結合においてテロメアオリゴヌクレオチドと拮抗する。
他のオリゴヌクレオ類はヌクレオリンに対して高い結合特異性を有する場合がある。
抗-ヌクレオリン因子
“抗-ヌクレオリン因子”は、ヌクレオリンに結合する。例としては、抗-ヌクレオリン抗体およびある種のオリゴヌクレオチド類がある。
【0010】
実施態様
以下の実施態様は、本発明を実施するための種々の方法の例として提示する。また、本発明を実施する多くの種々の方法が可能である。
全ての実施態様において、基本的な原理は、原形質膜ヌクレオリンと核ヌクレオリンとを特定的に区別することである。本出願人が発見したような原形質膜ヌクレオリンは、新生物状態にある細胞と相関する;さらにまた、原形質膜ヌクレオリンの量もこれら細胞の侵略性を指標する;即ち、原形質膜ヌクレオリン発現が高いほど、細胞はより侵略性である。種々の方法により、使用者は、核および原形質膜ヌクレオリンを区別するのが可能である。ヌクレオリン検出用試薬が細胞の細胞外成分(従って、細胞原形質膜ヌクレオリン)に対する専用的受入れを有する検出方法、あるいは表面原形質膜および/または表面たんぱく質のいずれかを他の細胞成分および細胞画分から分離する生化学方法も、有用である。
1つの実施態様においては、ヌクレオリンを細胞表面上で直接検出する。細胞を対象者から分離し、原形質膜ヌクレオリンを、ヌクレオリンに結合する因子を使用して検出する。細胞は、任意の公知の方法によって分離し得る。分離した細胞は、新生物状でない細胞を含有する大き目の組織検体を含み得る。検出手順は、細胞外ヌクレオリンエピトープを結合する抗-ヌクレオリン抗体を使用する;これらの抗体は、直接標識化するかあるいは結合させたときに間接的に検出し得る。他の有用な原形質膜ヌクレオリン検出因子としては、ヌクレオリンを特異的に結合するGRO類がある。蛍光活性化細胞選別法(FACS)または免疫蛍光法のような有用な手法は蛍光標識を使用し、一方、組織化学法、免疫組織化学法および他の顕微鏡分析(電子顕微鏡分析(EM)、免疫EM)法のような他の細胞学的方法は、比色分析性または放射性いずれかの各種他の標識を使用する。各種試薬は、キット中に組合せ得る。
【0011】
もう1つの実施態様においては、細胞を対象者から分離し、抽出する。次いで、原形質膜および/またはたんぱく質を分離し(清浄剤抽出細胞の微分抽出、分画物理的細胞破壊、または分画遠心法によるようにして)、その後、ヌクレオリンを結合する因子を使用して、ヌクレオリンを分離した膜中で検出する。一般に、ヌクレオリンを検出する有用な方法は、抽出物を基体上に置き、基体をヌクレオリン検出用試薬によって精査する方法を含む。そのような方法の例としては、ポリペプチドドットブロットおよびウェスタンブロット法、バイオチップ法、たんぱく質アレー法等がある。他の検出方式としては、多様な具現方式の酵素免疫吸着測定法(ELISA)がある(Ausubel等、1987年)。原形質膜表面分子を他の細胞成分および細胞画分の大部分から物理的に分離する実施態様においては、ヌクレオリン結合性因子は、ヌクレオリンのいずれの細胞外成分も特異的に認識する必要はない。各種試薬をキット中に組合せ得る。
さらなる実施態様においては、本発明の方法は、肺小細胞癌腫のような肺癌の検出に関する。原形質膜ヌクレオリン発現は、検出および予知において有用である。
さらにもう1つの実施態様においては、標識として作用する原形質膜ヌクレオリンを活用する、癌および腫瘍細胞を含む新生物状態の細胞の治療方法を提供する。細胞死を刺激するまたは細胞壊死を誘発させる毒素または他の手段に接合させ得る抗-ヌクレオリン抗体の投与は、原形質膜ヌクレオリン発現性細胞の排除をもたらす。
【0012】
本発明の実施
本発明の方法は、一部で、対象者から細胞を採取し、原形質膜ヌクレオリンを検出する工程を含む。以下を、本発明を限定するつもりはないが、本発明を実施する医師の支援のために提示するが、他の方法、技法、細胞、試薬および試みも本発明を実施するのに使用し得る。
細胞
細胞即ち組織検体を対象者から採取する。対象者は、脊椎動物、より好ましくはサル、イヌ、ネコ、ウサギ、ウシ、ブタ、ヤギ、ヒツジ、ウマ、ラット、マウス、モルモット等の哺乳類、最も好ましくはヒトである。所望細胞を採取するには、バイオプシー、外科処置、切屑(頬内部、皮膚等)および採血のような任意の方法を使用し得る。任意の適切な手段を使用してそのような作業は実施し得る。試験個体群(即ち、新生物状態について試験する細胞群)を試験しない細胞および組織群(汚染物質)から分離することは、抽出を含む生化学方法を使用するある種の場合を除いて必要ではない。生化学方法の場合、試験個体群は、汚染物質から完全に分離する必要はないが、主体的または容易に識別可能でなければならない(例えば、形態学的に(組織的に特異性のマーカー)または生化学的に)。
肺癌を分析する方法においては、痰採取物は、魅力的で容易に得られる検体である。用語“痰”とは、本明細書において使用するとき、唾液および呼吸気道からの排出物から構成される吐出物を称する。痰は、はっきりしたゲル様構造を有する高度に複雑な物質である。
痰の採取については、Byrne等(Byrne、1986年)は、患者が数回の深い咳によって生じた物質を蓋付き容器中に採取することを勧めている。また、痰は、気管支鏡を使用しても採取し得る(Kim等、1982年)。特定の装置または薬剤を使用して痰採取を容易にし得る(Babkes等、米国特許第6,325,785号、2001年;KingおよびSpeert、米国特許第6,339,075号、2002年;RubinおよびNewhouse、米国特許第5,925,334号、1999年)。他の痰採取方法も使用し得る。
【0013】
細胞培養
幾つかの場合においては、採取した細胞を培養してその数を増大させて原形質膜ヌクレオリン検出を容易にすることが望ましい。一次培養物を産生させるのに適する培地および条件は周知である。培地および培養条件の選択は、細胞タイプによって変動し得、経験的に決定し得る。例えば、骨格筋、骨、ニューロン類、皮膚、肝臓、および胚幹細胞は、それらの特異性内容物において異なる培地において増殖させる。さらにまた、ある細胞タイプ用の培地は、研究所間および施設間で有意に異なり得る。細胞分裂を保つためには、ウシ胎仔(fetal calf)血清(FCS) (ウシ胎仔(fetal bovine)血清(FBS)としても知られている)のような血清を、細胞または組織のタイプにもよるが、比較的大量に、即ち、5〜30容量%で培地に添加する。他の血清としては、ウシ新生仔血清(NCS)、子ウシ血清(BCS)、成獣ウシ血清(ABS)、ウマ血清(HS)、ヒト、ニワトリ、ヤギ、ブタ、ウサギおよびヒツジの各血清がある。管理プロセス血清代替物タイプ(CPSR;1または3)またはウシ胚液のような血清代替物も使用し得る。特定の精製増殖因子または複数の増殖因子の混合物も添加し得あるいは場合によっては血清と置換え得る。増殖または細胞生存を増進させる特定の因子またはホルモン類も使用し得る。
適切な培養培地の例としては、イスコブ(Iscove's)変性ダルベッコ(Dulbecco's)培地(IMDM)、ダルベッコ変性イーグル(Eagle's)培地(DMEM)、イーグルの最少必須培地(MEM)、イーグルの基本培地(BME)、クリック(Click's)培地、リーボビッツ(Leibovitz)のL-15培地、マッコイ(McCoy's)5A培地、グラスゴー(Glasgow)最少必須培地(GMEM)、NCTC 109培地、ウィリアムス(Williams')培地E、RPMI-1640、および培地199がある。特定の細胞タイプ/系または細胞機能用に特別に開発した培地、例えば、マディン・ダービー(Madin-Darby)ウシ腎臓増殖培地、マディン・ダービーウシ腎臓維持培地、各種ハイブリドーマ培地、内皮基本培地、線維芽基本培地、ケラチノサイト基本培地およびメラノサイト基本培地も既知である。必要に応じて、たんぱく質低減または無たんぱく質および/または無血清培地、および/または既知組成無動物成分培地も使用し得、例えば、CHO、遺伝子治療培地即ちQBSF無血清培地(Sigma Chemical社;ミズーリ州セントルイス)、DMEM栄養混合物F-12 Ham、MCDB (105、110、131、151、153、201および302)、NCTC 135、Ultra DOMA PFまたはHL-1 (双方ともBiowhittaker社から;メリーランド州ウォーカースビル)を使用し得る。
【0014】
培地には、培養する細胞によるが、各種の増殖因子、サイトカイン、血清等を添加し得る。適切な増殖因子の例としては、基本線維芽増殖因子(bFGF)、血管内皮増殖因子(VEGF)、上皮成長因子(EGF)、形質転換成長因子(TGFαおよびTGFβ)、血小板由来増殖因子(PDGF)、肝細胞成長因子(HGF)、インシュリン様成長因子(IGF)、インシュリン、エリスロポイエチン(EPO)、およびコロニー刺激因子(CSF)がある。適切なホルモン添加剤の例は、エストロゲン、プロゲステロン、テストステロンまたはデキサメタゾンのようなグルココルチコイド類である。サイトカイン培地添加剤の例は、インターフェロン類、インターロイキン類または腫瘍壊死因子-α(TNF-α)である。また、アルセバー(Alseverr's)溶液、ダルベッコリン酸塩緩衝塩水(DPBS)、イーグル平衡塩類溶液、ゲイ(Gey's)平衡塩類溶液(GBSS)、ハンク(Hank's)平衡塩類溶液(HBSS)、パック(Puk's)塩水Aおよびタイロード(Tyrode's)塩類溶液のような塩類溶液も培地に添加し得る。必要に応じて、種々の培養条件における添加剤および培養成分は、これらが細胞応答、活性寿命または他のバイオ活性に影響する特性を改変させ得るので最適化し得る。さらに、細胞増殖させる表面は、細胞の生存、増殖および/または分化に寄与する種々の基質でコーティーングし得る。これらの基質としては、限定するものではないが、ラミニン、EHS-マトリックス、コラーゲン、ポリ-L-リシン、ポリ-D-リシン、ポリオルニチンおよびフィブロネクチンがある。立体培養を所望する場合は、細胞外マトリックスゲル、例えば、コラーゲン、EHS-マトリックスまたはゼラチン(変性コラーゲン)を使用し得る。細胞は、そのようなマトリックスの頂部上で増殖させ得、あるいはゲル自体内に注入し得る。
【0015】
必要に応じて、培地には、培養物のアシドーシスを制限する試薬を、例えば、緩衝液(N,N-ビス(2-ヒドロキシエチル)-2-アミノエタンスルホン酸(BES)、ビス(2-ヒドロキシエチル)アミノ-トリス(ヒドロキシメチル)メタン(BIS-Tris)、N-(20ヒドロキシエチル)ピペラジン-N'3-プロパンスルホン酸(EPPSまたはHEPPS)、グリクロリシン(glyclclycine)、N-2-ヒドロキシエチルピペラジン-N'-2-エタンスルホン酸(HEPES)、3-(N-モルホリノ)プロパンスルホン酸(MOPS)、ピペラジン-N,N'-ビス(2-エタン-スルホン酸) (PIPES)、重炭酸ナトリウム、3-(N-トリス(ヒドロキシメチル)-メチル-アミノ)-2-ヒドロキシ-プロパンスルホン酸) (TAPSO)、(N-トリス(ヒドロキシメチル)メチル-2-アミノエタンスルホン酸(TES)、N-トリス(ヒドロキシメチル)メチル-グリシン(トリシン)、トリス(ヒドロキシメチル)-アミノメタン(Tris)等のような)を培地に添加するようにして、さらに添加し得る。頻繁な培地変更および添加CO2(多くの場合、約5%)濃度の変更も、アシドーシスを制御するのに使用し得る。
培養用のガスは、典型的には、約5%の二酸化炭素と残りの窒素であるが、必要に応じて、変動量の酸化窒素(3 ppmほどで低く開始して)、一酸化炭素および他のガス類(共に、不活性であり、生物学的には活性)を含み得る。二酸化炭素濃度は、典型的に5%辺りの範囲であるが、2〜10%で変動し得る。酸化窒素および一酸化炭素は、必要な場合、典型的には、経験的にあるいは文献から決定した極めて少量で(即ち、ppm範囲で)投入する。細胞を最適に増殖させる温度は経験的に決定するが、培養温度は、通常、細胞を分離した動物の正常な生理学的範囲内であろう。
【0016】
ヌクレオリンの検出:抗体系方法
ヌクレオリンは、細胞、組織切片、培養細胞およびその抽出物中でたんぱく質レベルで検出し得る。たんぱく質発現を検出する免疫化学方法は、周知であり、限定するものではないが、ウェスタンブロット法、イムノアフィニティー精製法、免疫沈降法、酵素免疫吸着測定法(ELISA)、ドットまたはスロットブロット法、ラジオイムノアッセイ法(RIA)、免疫組織化学検出法、免疫細胞化学染色法およびフローサイトメトリー法がある。抗体を使用する一般的手順および使用説明書は、良好に対処されている(例えば、HarlowおよびLane、1988年;HarlowおよびLane、1999年)。原形質膜ヌクレオリンを検出するのに有用な選定抗体を下記の表1に示す。
【0017】
表1:抗-ヌクレオリン抗体

【0018】
さらなる抗-原形質膜ヌクレオリン抗体を望む場合、これらさらなる抗体は、周知の方法を使用して産生させ得る(HarlowおよびLane、1988年;HarlowおよびLane、1999年)。例えば、(pAb類)は、表面発現ヌクレオリンの細胞外ドメインのようなイムノゲンおよび必要に応じてのアジュバントの1回以上の注入により哺乳動物宿主中で産生させ得る。典型的には、イムノゲン(およびアジュバント)は、皮下または腹腔内注入により哺乳類に注入する。イムノゲンとしては、ポリペプチド類(分離した、分離していないまたは組換え産生させた)、細胞類または細胞画分のような成分があり得る。アジュバントの例としては、フロイントの完全アジュバントおよびモノホスホリルリピッドA合成トレハロースジコリノマイコレート(MPL-TDM)がある。免疫応答を改善するためには、イムノゲンは、キーホールリンペットヘモシアニン(KLH)、血清アルブミン、ウシサイログロビンまたは大豆トリプシンインヒビターのような、宿主中で免疫原性であるポリペプチドに接合させ得る。また、pAb類は、IgY分子を産生させることによって、ニワトリ中でも調製し得る(Schade等、1996年)。
また、mAb類も、宿主または宿主由来のリンパ球を免疫し、mAb分泌性(または潜在的に分泌性)リンパ球を採取し、これらのリンパ球を不死化細胞(例えば、ミエローマ細胞)に融合させ、所望のmAbを分泌する細胞を選択することによって調製し得る(Goding、1996年)。必要に応じて、mAb類は、培養培地または腹水から、プロテインA-セファロース、ヒドロキシルアパタイトクロマトグラフィー、ゲル電気泳動、透析、硫酸アンモニウム沈降またはアフィニティークロマトグラフィーのような通常の手順により精製し得る(HarlowおよびLane、1988年;HarlowおよびLane、1999年)。
【0019】
上記抗体は、抗体全体およびそのフラグメントまたは誘導体であり得る。例えば、生きた細胞をアッセイする場合、Fabフラグメントの使用は、交叉を排除し、それによって細胞を結合抗体のエンドサイトーシス化から防護する。
抗体を使用して抗原の存在を検出する方法は、下記の工程の全部ではないにしても1以上を含む:
(1) 原形質膜ヌクレオリンについて試験する存在物を緩衝液または水で洗浄することによって調製する
(2) 非特異性抗体結合部位を遮断する
(3) 抗体(例えば、ヌクレオリン)を適用する
(4) 結合抗体を、一次抗体を認識する検出可能な標識化二次抗体または結合(抗-ヌクレオリン)抗体に直接結合または会合させた検出可能な標識のいずれかによって検出する。
基質は、エピトープ構造を干渉しない任意の溶液で洗浄し得る。一般的な緩衝液としては、塩水並びにビシン、トリシンおよびトリスのような生物学的緩衝液がある。
非特異結合部位は、ウシ血清アルブミン(BSA;変性または未変性)、乳たんぱく質、または検出用試薬が二次抗体である場合、種が検出用抗体と同じ起源である非免疫化宿主動物からの正常血清もしくはイムノグロブリンのようなたんぱく質溶液を適用することによって遮断する。例えば、ヤギ中で調製した二次抗体を使用する手順は、正常ヤギ血清(NGS)を使用する。
その後、基質を興味ある抗体と反応させる。抗体は、Fabフラグメントもしくはその誘導体、精製抗体(アフィニティー、沈降法等による)、ハイブリドーマ培養物からの上清、腹水、血清または組換え細胞中で発現させた組換え抗体のような任意の形で適用し得る。抗体は、多くの場合、非特異結合部位を遮断するのに使用した溶液のようなたんぱく質担体によって、緩衝液または培地中で希釈し得;有用な抗体濃度は、経験により通常決定する。一般に、ポリクローナル血清、精製抗体および腹水は、1:50〜1:200,000、より多くの場合は1:200〜1:500に希釈する。ハイブリドーマ上清は、1:0〜1:10に希釈するか、あるいは透析または硫酸アンモニウム沈降(または興味ある抗体は保持するが液体成分および好ましくは塩類のような他の小分子は少なくとも部分的に除去する任意の他の方法)によって濃縮し必要に応じて希釈し得る。抗体とのインキュベーションは、37℃では20分程で短く、室温(約22℃)では2〜6時間、4℃では8時間以上実施し得る。
【0020】
抗体・抗原複合体を検出するには、標識を使用し得る。標識は、結合用抗体または第1抗体を認識する二次抗体に結合させ、一次抗体のインキュベーションおよび十分な洗浄後に検体と一緒にインキュベートする。適切な標識としては、フルオレセインイソチオシアネート;フルオレセインジクロロトリアジンおよびフルオレセインのフッ素化アナログ類;ナフトフルオレセインカルボン酸およびそのスクシンイミジルエステル;カルボキシローダミン 6G;ピリジルオキサゾール誘導体;Cy2、3および5;フィコエリトリン;プロピオン酸スクシンイミジルエステルおよびペンタン酸スクシンイミジルエステルのような、スクシンイミジルエステル類、カルボン酸類、イソチオシアネート類、スルホニルクロライド類およびダンシルクロライド類の蛍光種;カルボキシテトラメチルローダミンのスクシンイミジルエステル類、ローダミンレッド-X (Red-X)スクシンイミジルエステル;テキサスレッド(Texas Red)スルホニルクロライド;テキサスレッド-Xスクシンイミジルエステル;テキサスレッド-Xナトリウムテトラフルオロフェノールエステル;レッド-X;テキサスレッド染料;テトラメチルローダミン;リサミンローダミンB;テトラメチルローダミン;テトラメチルローダミンイソチオシアネート;ナフトフルオレセイン類;クマリン誘導体;ピレン類;ピリジルオキサゾール誘導体;ダポキシル染料類;カスケードブルーおよびイエロー染料類;ベンゾフランイソチオシアネート類;ナトリウムテトラフルオロフェノール類;4,4-ジフルオロ-4-ボラ-3a,4a-ジアゾ-s-インダセンのような蛍光成分がある。さらに、適切な標識としては、アルカリホスファターゼまたはホースラディシュペルオキシダーゼのような酵素成分;35Sまたは135Iラベルのような放射性成分;アビジン(またはストレプタビジン)-ビオチン系検出系(多くの場合、酵素または金シグナル系と結合させる);および金粒子がある。酵素系検出系においては、酵素を適切な基質、例えば、ホースラディシュペルオキシダーゼに対する3,3'-ジアミノベンジジン(DAB)と反応させる;好ましくは、反応生成物は不溶性である。金標識検体は、超微細構造分析用に調製しない場合、化学的に反応させて金シグナルを増強させ得る;この方法は、光学顕微鏡分析においてとりわけ好ましい。標識の選択は、用途、所望する解像力および所望する観察方法による。蛍光標識においては、蛍光体を適切な波長で励起させ、検体を顕微鏡、共焦点顕微鏡またはFACS装置を使用して観察する。放射性標識化の場合には、検体をオートラジオグラフィーフィルムと接触させ、このフィルムを現像する;また、オートラジオグラフィーは、超微細構造方法を使用しても実施し得る。また、放射能は、シンチレーションカウンターを使用しても定量し得る。
【0021】
細胞学的方法:
免疫蛍光/免疫組織化学法
細胞または組織によるたんぱく質発現は、抗原の免疫学的局在決定によって確認し得る。一般的には、細胞または組織を固定化することによって保持し、ヌクレオリンのような興味あるエピトープを認識する抗体に暴露させ、結合抗体を可視化する。
あらゆる細胞、細胞系、組織があるいは生物体全体でさえもが固定化に適している。細胞は、一次培養物、細胞系として生体外培養し得、あるいは組織から採取し機械的にまたは酵素により分離し得る。組織は、任意の器官、植物または動物に由来し得、固定化前または後に採取し得る。固定化は、必要に応じて、任意の公知の手段であり得る;条件は、検出すべきたんぱく質を結合剤(殆どの場合、抗体)が認識的できないようにしないことである。適切な固定剤としては、パラホルムアルデヒド-リシン-パーイオデート、ホルマリン、パラホルムアルデヒド、メタノール、酢酸-メタノール、グルタルアルデヒド、アセトン、カーノフスキー(Karnovsky's)固定剤等がある。固定剤の選択は、興味あるたんぱく質、特定の検出用試薬(抗体のような)の性質、検出方法(蛍光、酵素系)および観察方法(エピフルオレセンス顕微鏡、共焦点顕微鏡、光学顕微鏡、電子顕微鏡等)のような変動要因による。検体は、通常、固定化前に、殆どの場合生物学的緩衝液で最初洗浄する。固定剤は、溶液または生物学的緩衝液中で調製する;多くの固定剤は、検体に適用する直前に調製する。適切な生物学的緩衝液としては、塩水(例えば、リン酸塩緩衝塩水)、N-(カルバモイルメチル)-2-アミノエタンスルホン酸(ACES)、N-2-アセトアミド-2-イミノジ酢酸(ADA)、ビシン、ビス-トリス、3-シクロヘキシルアミノ-2-ヒドロキシ-1-プロパンスルホン酸(CAPSO)、エタノールアミン類、グリシン、N-2-ヒドロキシエチルピペラジン-N'-2-エタンスルホン酸(HEPES)、2-N-モルホリノエタンスルホン酸(MES)、3-N-モルホリノプロパンスルホン酸(MOPS)、3-N-モルホリノ-2-ヒドロキシ-プロパンスルホン酸(MOPSO)、ピペラジン-N,N'-ビス(2-エタンスルホン酸) (PIPES)、トリシン、トリエタノールアミン等がある。適切な緩衝液を、分析する検体、適切なpHおよび検出方法の条件に応じて選択する。有用な緩衝液は、リン酸塩緩衝塩水(PBS)である。固定化後、検体は、固定剤中に、好ましくは新鮮に、あるいは一時的にまたは無限に、約4℃〜約22℃の温度で保存し得る。
【0022】
サンプルサイズ、サンプル厚および固定剤の粘度によるが5分〜1週間の固定化後、検体を緩衝液中で洗浄する。検体が厚いかあるいは切片を望む場合、検体は、適切なマトリックス中に埋め込むことができる。低温切片化においては、サクロースを注入して、OCT Tissue Tek (Andwin Scientific社;カリフォルニア州カノガパーク)またはゼラチンのようなマトリックス中に埋め込む。また、検体は、パラフィンワックス、またはエポキシ系(Araldite、Polybed 812、Durcupan ACM、Quetol、Spurr'sまたはこれらの混合物;Polysciences社、ペンシルベニア州ウォリントン)、アクリレート類(London Resin類(LRホワイト、LRゴールド)、Lowicryl類、Unicryl;Polysciences社)、メチルアクリレート類(JB-4、OsteoBed;Polysciences社)、メラミン(Nanoplast;Polysciences社)およびDGD、Immuno-Bed(Polysciences社)のような他の媒体のような電子顕微鏡用の適切な樹脂中にも埋め込み得、その後重合し得る。とりわけ適切な樹脂としては、親水性物質(Lowicryl類、London Resin類、水溶性Durcupan等のような)がある。その理由は、これらが興味あるたんぱく質を重合中にあまり変性させないようであり、また抗体溶液を反発させないことによる。ワックスまたは樹脂中に埋め込むとき、検体は、これら検体を一連の濃度のエタノールまたはメタノール中に通すことによって脱水される;ある場合には、ポリプロピレンオキサイドのような他の溶媒も使用し得る。埋め込みは検体を検出用薬剤と反応させた後に行い得、あるいは、検体を先ず埋め込み、切片化し(マイクロトーム、サイロトーム(cyrotome)またはウルトラマイクロトームにより)、その後、検出用試薬と反応させてもよい。ある場合には、埋め込み材料は、検出前に部分的にまたは完全に除去して抗原受入れを容易にし得る。
【0023】
ある場合には、抗体が結合するヌクレオリンエピトープ(1個以上)が固定化のために利用し得なくなっている可能性がある。抗原回復法を使用し、抗原を抗体結合において利用可能にすることができる。多くの再生法が利用し得る(例えば、McNicolおよびRichmond、1998年;RobinsonおよびVandre、2001年;Shi等、2001年において検討されている)。一般的な方法は、オートクレーブ、マイクロ波、熱水または緩衝液、圧力釜または他の熱源から供給される熱を使用する。多くの場合、熱源は連続して使用し、検体は、多くの場合、溶液中でなければならない(例えば、マイクロ波処理)。ドデシル硫酸ナトリウム(SDS、0.25%〜1%)または他の変性用清浄剤のような清浄剤処理も、抗原を露出させ得る。化学方法は、強アルカリ類(NaOHのような);水、尿素、ギ酸中での長時間浸漬、および硫酸亜鉛-ホルマリン中での再固定化を含む。他の場合においては、たんぱく質分解酵素処理によって抗原を変性して、抗原を抗体に対して利用し得るようにする。トリプシンのような任意の多くのプロテアーゼを使用し得る。これらの方法は、組合せて最適の結果を得ることもできる。抗原再生方法の選択は、検体、その埋め込み(実施した場合の)および抗-ヌクレオリン抗体次第である。
とりわけ免疫蛍光または酵素生成物系検出の場合には、残留固定剤、たんぱく質交叉結合、たんぱく質沈降または内在性酵素による背景シグナルは、例えば、塩化アンモニウムもしくは水素化ホウ素ナトリウムまたは交絡内在性酵素を失活または消耗させる物質、例えば、ペルオキシダーゼに作用する過酸化水素を使用して失活させ得る。切片化されていない検体中の細胞内たんぱく質を検出するには、検体を浸透性化し得る。浸透性化剤としては、t-オクチルフェノキシポリエトキシエタノール類、ポリオキシエチレンソルビタン類のような清浄剤、およびリシン類、プロテアーゼ類等のような他の薬剤がある。
非特異結合部位は、ウシ血清アルブミン(BSA;変性または未変性)、乳たんぱく質、または好ましくは検出用試薬が抗体である場合、種が検出用抗体と同じ起源である非免疫化宿主動物からの正常血清もしくはIgGのようなたんぱく質溶液を適用することによって遮断する。
【0024】
フローサイトメトリー/フルオレセンス活性化細胞選別法(FACS)
フローサイトメトリーを実施する方法は周知である(OrfaoおよびRuiz-Arguelles、1996年)。原形質膜ヌクレオリンを精査することから、細胞質画分に対する受入れを可能にする細胞浸透性化は望ましくない。採取後、細胞を単一細胞懸濁液として調製する;その後、細胞を、通常非特異結合部位を遮断した後に、抗-ヌクレオリン抗体と一緒にインキュベートする。好ましくは、抗-ヌクレオリン抗体を蛍光マーカーで標識化する。抗体を蛍光マーカーで標識しない場合は、第1抗体と免疫反応性であり且つ蛍光マーカーを含有する第2抗体を使用する。十分に洗浄して過剰のまたは未結合抗体を確実に除去した後、細胞は、フローサイトメトリーに使用可能な状態にある。
【0025】
生化学系方法
これらの方法においては、原形質膜たんぱく質を他の細胞画分から分離することが先ず望ましい。この分離は、単純細胞抽出、微分抽出または機械的破壊およびその後の遠心分離による勾配(サクロースまたはポリデキストランのような)での細胞画分の分離、抽出およびその後の原形質膜特異性抗体による適切な細胞画分の免疫選別等のような任意の多くの方法で実施し得る。そのような方法の例は、Naito等(1988年)およびYao等(1996年b)に記載されている。抽出用試薬は周知である。例えば、メタノールのような溶媒は、場合によっては有用である。それよりも、t-オクチルフェノキシポリエトキシエタノール(ポリエチレングリコールtert-オクチルフェニルエーテルとしても知られている)のような清浄剤は、単純抽出においてとりわけ有用である。また、グルコピラノシド類;マルトピラノシド類;マルトシド類;ポリオキシエチレンエステル類;他のポリオキシエチレンエーテル類;アルギン酸、カプリル酸、コール酸、1-デカンスルホン酸、デオキシコール酸、ジオクチルスルホスクシネート、1-ドデカンスルホン酸、グリココール酸(glyocholic)、グリコデオキシコール酸、1-ヘプタンスルホン酸、1-ヘキサンスルホン酸、N-ラウロイルサクロシン、ラウリル硫酸塩(例えば、SDS)、1-ノナンスルホン酸、1-オクタンスルホン酸、1-ペンタンスルホン酸、タウロコール酸およびタウロデオキシコール酸(tauodexycholic)の塩類;7-エチル-2-メチル-4-ウンデシル硫酸ナトリウム;および2-エチルヘキシル硫酸ナトリウムも有用である。他の有用な清浄剤としては、(3-[(3-コラミドプロピル)ジメチルアンモニオ]-1-プロパン-スルホネート;(3-[(3-コラミドプロピル)ジメチルアンモニオ]-2-ヒドロキシ-1-プロパン-スルホネート;N-デシル-、N-ドデシル-、N-ヘキサデシル-、N-オクタデシル-、N-テトラデシル-N,N-ジメチル-3-アンモニオ-1-プロパンスルホネート類、およびホスファチジルコリンがある。あまり有用ではないが、ある場合に一助になり得るのは、アルキルトリメチルアンモニウムブロマイド、ベンズアルコニウムクロライド、ベンズエトニウムクロライド、ベンジルジメチルドデシルアンモニウムブロマイド、ベンジルジメチルヘキサデシルアンモニウムクロライド、セチルジメチルエチルアンモニウムブロマイド、セチルピリジニウム、デカメトニウムブロマイド、ジメチルジオクタデシルアンモニウムブロマイド、メチルベンズエトニウムクロライド、メチルトリオクチルアンモニウムクロライド、およびN,N',N'-ポリオキシエチレン(10)-N-タロウ-1,3-ジアミノプロパンである。種々の抽出剤を単独または組合せて使用し得る;これらの抽出剤は、単純な水溶液または適切な緩衝液中で調製し得る。
ポリエチレングリコールtert-オクチルフェニルエーテルは、低曇り点を利用して膜たんぱく質を可溶性たんぱく質から2つの異なる相中に分離することにより、微分抽出においてとりわけ有用である。
抽出緩衝液は、アプロチニン、ベンズアミジン、アンチパイン、ペプスタチンおよびイオドアセタミドのようなプロテアーゼインヒビター類を含有し得る。
その後、抽出物をヌクレオリン発現についてアッセイする。表面原形質膜を他の細胞成分(とりわけ、核)から分離する方法においては、ヌクレオリン検出剤は細胞外原形質膜ヌクレオリンエピトープに対し特異性である必要はない。
【0026】
免疫吸着アッセイ(ELISA) (Ausubel等、1987年)
たんぱく質発現を検出するための種々のタイプの酵素免疫吸着測定法(ELISA)が知られており、これらはヌクレオリン検出に応用可能である。一方、他のELISA様アッセイとしては、ラジオイムノアッセイおよび他の非酵素抗体結合アッセイおよび手法がある。これらのアッセイにおいて、上記細胞表面たんぱく質は、細胞調製物中の主たる成分である。
二重抗体サンドイッチELISA法は、とりわけ有用である。二重抗体サンドイッチELISAにおける基本的プロトコールは、次のとおりである:プレートを抗-ヌクレオリン抗体(キャプチャー抗体)でコーティーングする。その後、プレートをBSAにようなブロッキング剤で洗浄して試験プレートへのたんぱく質(抗体または抗原)の非特異結合を遮断する。その後、試験検体を、キャプチャー抗体をコーティーングしたプレート上でインキュベートする。次に、プレートを洗浄し、抗-ヌクレオリン抗体と一緒にインキュベートし、再び洗浄し、特異性抗体標識化接合体と一緒にインキュベートし、シグナルを適切に検出する。
他のELISAにおいては、たんぱく質またはペプチドを選択された表面(その表面表示部分、例えば、特別処理ポリスチレンマイクロタイタープレートのウェルは、たんぱく質に対して親和性を有し得る)上に固定する。洗浄して不完全吸着物質を除去した後、一般的には、ウェル底部上に、BSAまたはカゼインのような、抗-ヌクレオリン抗体とは抗原性的に中性であることが判明している非特異性たんぱく質を結合させるかあるいはコーティーングするのが望ましい。この工程は、固定表面上の非特異吸着部位の遮断を可能にし、従って、抗体の上記表面上への非特異結合によって生ずる背景を減少させる。ポリペプチドをたんぱく質(例えば、BSA)に接合させることによって抗体を動物中で発現させた場合、遮断用たんぱく質に対する複数抗体、即ち、抗体組成物が存在する可能性がある故に、異なるたんぱく質をブロッキング剤として使用する。
ウェルにヌクレオリンを結合させ、非反応性物質てコーティーングして背景を減少させ、洗浄して未結合物質を除去した後、固定表面を、免疫複合体(抗原/抗体)形成を誘発させるような方法で抗-ヌクレオリン抗体組成物と接触させる。そのような条件は、抗体組成物をBSA、ウシγグロブリン(BGG)およびPBS/ポリオキシエチレンソルビタンモノラウレートのような希釈剤で希釈することを含む。また、これらの添加薬剤も非特異背景シグナルの低減を助長する。その後、層化した抗体組成物を25℃〜37℃で例えば2〜4時間インキュベートせしめる。インキュベーション後、抗体組成物接触表面を洗浄して、免疫複合体化していない物質を除去する。1つの洗浄手順は、PBS/ポリオキシエチレンソルビタンモノラウレートまたはホウ酸塩緩衝液による洗浄を含む。
試験検体と抗体間の特異的免疫複合体の形成およびその後の洗浄後、免疫複合体の形成を、抗-ヌクレオリン抗体に対する特異性を有する第2抗体を使用して検出する。検出に当たっては、二次抗体は、酵素または蛍光分子のような検出可能な標識と結合させる。多くのイムノアッセイ法が、米国特許第5,736,348号、第5,192,660号および第4,474,892号に記載されている。
【0027】
ウェスタンブロット法(Ausubel等、1987年)
ウェスタンブロット法は周知である。一般に、たんぱく質検体を、ドデシル硫酸ナトリウム-ポリアクリルアミドゲル電気泳動(SDS-PAGE)に、検体内の各たんぱく質の適切な分離が得られるような条件で供する。その後、各たんぱく質を、各たんぱく質相互の相対的位置を維持するような方法で、膜(例えば、ニトロセルロース、ナイロン等)に移す。
既知の分子量を有する可視化標識たんぱく質を上記ゲルのレーン中に含ませ得る。これらのたんぱく質は、上記各たんぱく質の膜への適切な移動を保証するための対照並びにブロット上の他の各たんぱく質の相対的分子量を測定するための分子量マーカーとして機能する。また、標識していないマーカーたんぱく質(または、幾つかの稀れな場合の無マーカーたんぱく質)は、ブリリアントブルー(GまたはR;Sigma社、ミズーリ州セントルイス)または他のたんぱく質染料で、移した後に検出する。たんぱく質を移した後、膜をブロッキング溶液中に浸漬して一次抗体の非特異結合を防止する。
一次抗体、例えば、抗-ヌクレオリンを標識化して、抗原の存在および分子量を、膜上の特異的位置における標識を検出することにより測定することができる。しかしながら、一次抗体は標識化しなくてもよく、上記ブロットを標識化第2抗体とさらに反応させる。この二次抗体は一次抗体と免疫反応性である;例えば、この二次抗体は、ウサギイムノグロブリンに対する抗体であり得、アルカリホスファターゼによって標識化し得る。ウェスタンブロットを実施する装置および方法は、米国特許第5,567.595号に記載されている。
【0028】
免疫沈降法(Ausubel等、1987年;HarlowおよびLane、1999年)
たんぱく質発現は、免疫沈降法を使用して抗原を分離することによっても測定し定量し得る。免疫沈降法は、米国特許第5,629,197号に記載されている。免疫沈降法は、ターゲット抗原成分を複合体混合物から分離することを含み、微少量のたんぱく質を選別しまたは分離するのに使用する。細胞表面たんぱく質の分離においては、多くの場合、ノニオン性塩類を使用する。
例えば、細胞全体からの免疫沈降は、以下のようにして実施し得る。細胞を、例えば、20mMのTris緩衝液、pH 8.6中の1%t-オクチルフェノキシポリエトキシエタノール/0.1%SDS/150mM NaClのような1種以上の清浄剤(上記参照)で抽出する。抽出(攪拌によって助長し得る)の後、不溶性屑片を遠心機を使用して除去する。抗-ヌクレオリン抗体を抽出物に添加し、次いで、検体を4℃で30分〜1夜インキュベートする。その後、セファロースまたはトリス-アクリルビーズに接合させた黄色ブドウ球菌(Staphylococcus aureus)プロテインAもしくは組換え産生プロテインAまたはC群ブドウ球菌プロテインGを添加する。抗-ヌクレオリン抗体がプロテインAに良好に結合しない場合、抗-ヌクレオリン抗体を産生させた動物の抗体を認識するIgG Ab類を同時に添加する。その後、検体を緩やかに攪拌しながら4℃でおよそ2時間インキュベートする。今や抗体・抗原複合体に結合したビーズ即ち細菌細胞を、通常先ず上記抽出溶液または高塩緩衝液で次いで低塩緩衝液または水で十分に洗浄して非特異結合たんぱく質および残留清浄剤分子を除去する。残留緩衝液を除去した後、ビーズを電気泳動サンプル緩衝液のような緩衝液と一緒にインキュベートし、その後、3〜5分間95℃に供して結合たんぱく質をビーズから溶出させる。その後、検体は、分析およびヌクレオリン検出に使用し得る状態にある。
【0029】
他の方法:
免疫選別法(FACS以外の) (Ausubel等、1987年)
原形質膜ヌクレオリンを発現する細胞は、抗-抗体抗体類をコーティーングしたプラスチックプレート上での“パンニング”によっても容易に分離し得る(WysockiおよびSato、1978年)。パンニングは、他の免疫選別手法を上回る多くの利点を有する:パンニングは、迅速で、効率的であり(107細胞数を2枚の60-mmプラスチックプレート上で30分以内で容易にパンニングし得る)、安価である。
一般的には、単一細胞懸濁液を抗-ヌクレオリン抗体で標識化し、次いで、二次抗体(非特異結合部位を遮断した)でコーティーングした基体上でインキュベートする。室温での1〜3時間のインキュベーション後に、付着していない細胞を洗い落とす。この実施態様においては、結合細胞が、ヌクレオリンが原形質膜中に発現していること指標し、新生物細胞を指標する。
ヌクレオリンの検出:オリゴヌクレオチド系方法
ヌクレオリンを認識し結合するGRO類および他のオリゴヌクレオチド類(Bates等、1999年;Miller等、WO 00/61597号、2000年;Xu等、2001年)を、抗体類と極めて同じ形で使用し得る。適切なアッセイ法の例を以下に示す。幾つかの場合、GROヌクレオチド類のより大きな核酸配列中への組込みは有利であり得る;例えば、GRO核酸の基質への結合をヌクレオリン結合部位を変性させることなく容易にするために。
ヌクレオリンを結合する(さらにまた、癌細胞増殖を抑制する生物学的特性を有する)有用なGRO類は、開示されている(Bates等、1999年;Miller等、WO 00/61597号、2000年;Xu等、2001年)。これらのGRO類は、下記の表2に示すものを含む。対照GRO類は、背景シグナル量を検出するのに有用である。
【表1】

【表2】

【0030】
細胞学的方法:
細胞局在化/標識法(免疫系局在化/標識アッセイ法と同類)
免疫系局在化アッセイ(免疫蛍光法またはFACSのような)について上記で概略述べた手順を、検出用試薬がヌクレオリン結合性GROであるアッセイ法に対しても応用し得る。修正としては、BSAのようなたんぱく質の代りにサケ精子由来の変性DNAを使用して非特異結合を阻止する手順を含む。検出に当っては、上述したのと同様な標識も、GROがある形の標識で誘導され得る限り、有用である。この目的においては、ビオチン-アビジン核酸標識化系が、ジゴキシゲニン系同様に、とりわけ好都合である(Ausubel等、1987年)。ビオチン化ヌクレオチドの合成は記載されている(Langer等、1981年)。水溶性ビタミンであるビオチンは、アリルアミンリンカー鎖によりピリミジン環のC5位置に共有結合し得る;ビオチンは、アビジンまたはストレプタビジンに非共有結合して、容易に標識化し得る。また、ビオチンを、合成中のオリゴヌクレオチドに、末端ヌクレオチドの5'ヒドロキシルに結合させることによって付加させる。ジゴキシゲニン-11-dUTPは、ニックトランスレーションまたはランダムオリゴヌクレオチド感作合成プロトコールのいずれかによってDNA中に組込み得る。ジゴキシゲニンは、標識化抗-ジゴキシゲニン抗体を使用して検出する。好都合なジゴキシゲニン系は、商業的に入手可能である(Roche Molecular Biochemicals社;インディアナ州インディアナポリス)。オリゴヌクレオチド類を使用してたんぱく質類を検出し局在化させる手法の例は、Davis等、1998年において記載されている。
生化学系方法:
また、GRO類は、上述したような生化学方法においてヌクレオリンを検出する抗体類と同様な形でも使用し得る。例えば、“サウスウェスタン”タイプのブロット試験をGRO類において実施し得る(Bates等、1999年;Miller等、WO 00/61597号、2000年)。細胞を適切に抽出した後(例えば、原形質膜たんぱく質を細胞間たんぱく質から特異的に分離するために)、たんぱく質をポリアクリルアミドゲル上で電気泳動に供し、ポリ二フッ化ビニリデン膜のような基体に移す。たんぱく質を、6M グアニジン-HClによる4℃30分間の洗浄、次いで、25M HEPES(pH 7.9)/4mM KCl/3mM MgCl2中3M、1.5Mおよび0.75MグアニジンHCl中での洗浄により変性し再生させる。HEPES緩衝液中の5%無脂肪乾燥乳によって非特異結合部位を遮断させた後、標識化GROを、0.25%のNDM、0.05%のNP-40、400 ng/mlのサケ精子DNA、およびtcgagaaaaa ctctcctctc cttccttcct ctcca;配列番号17のような無関係混合配列オリゴヌクレオチド 100ng/mlを加えたHEPES結合用緩衝液中で4℃で2時間ハイブリッド化する。HEPES結合用緩衝液で洗浄後、シグナルを適切に検出する。
他の方法:
アレー法
チップ上の固定化ヌクレオリン結合試薬のアレー
チップは、分子を含有していない領域または固定化分子をはるかに低い密度でしか含有しない領域によって分けられた固定化分子を含有する領域のアレーである。例えば、たんぱく質チップは、ヌクレオリン結合性抗体を塗布することによって作成する;“アプタマー”様のチップは、ヌクレオリン結合性GRO類を塗布することによって作成する。残りの領域は、被覆しないで残すかあるいは不活性分子で被覆する。アレーを洗浄して特異性固定化ポリペプチドまたは核酸を除く全てを除去する。さらに、複数のヌクレオリン結合性抗体(表1)、核酸(GRO類のような;表2)またはその双方を含有するチップも作成し得、また、ヌクレオリンと非反応性である対照抗体および/または核酸も含有し得る。そのようなアレーは、同時の試験確認、複製および内部統制を可能にする。
抗-ヌクレオリン抗体のようなたんぱく質類は、アミンとカルボン酸との縮合およびジスルフィドの形成のような単純な化学反応により、固形支持体上に固定化し得る。この不活性基体上へのたんぱく質の共有固定化は、非特異吸着による高背景シグナルを阻止する。ビオチンのような他の分子によって誘導された基体も、固定するたんぱく質がアビジンまたはストレプタビジンによって誘導された場合に有用であり、その逆もまた然りである。幾つかの稀れな場合、とりわけ抗-ヌクレオリン抗体コード化核酸配列が入手し得る場合は、抗-ヌクレオリン抗体を含む融合ポリペプチドが基体上への固定化において有利であり得る。
【0031】
ヌクレオリン結合剤を固定化し得る表面は、任意の材料であり得る。例えば、上記表面は、金属、ガラス、セラミック、ポリマー、木材または生物学的組織であり得る。上記表面は、与えられた材料の基体およびこの基体表面の1部または全体上のもう1つの材料の1以上の層を含み得る。上記表面は、GST融合ポリペプチド精製用のグルタチオン固定化において使用される基体のような、アフィニティークロマトグラフィーにおいて使用される一般的な表面のいずれかであり得る。アフィニティークロマトグラフィー用の表面としては、例えば、セファロース、アガロース、ポリアクリルアミド、ポリスチレンおよびデキストランがある。上記表面は、固形体である必要はなく、コロイド、剥離鉱質クレー、脂質単分子層、脂質二分子層、ゲルまたは多孔質材料であり得る。
上記固定化法は、望ましくは、上記表面上でのヌクレオリン結合剤の位置を制御する。例えば、抗体の抗原結合部分を基体に結合しないようにし、一方、非抗原結合部分を基体に定着させる。個々の反応物リガンドの位置を制御することにより、リガンドパターンまたはアレーが形成される。ヌクレオリン結合剤によって占められていない表面部分は、ポリペプチドまたはポリヌクレオチドの非特異吸着を許容しない。
この実施態様においては、対象者からの検体、例えば、血液をヌクレオリン結合性分子を含有するチップ上に通す。その後、表面プラスモン共鳴の変化を検出する機器のようなバイオセンシング装置を使用して結合ヌクレオリンを検出する。BIAcore (Uppsala社、スウェーデン)チップは、有用なチップおよび検出機器の例である。
【0032】
予知アッセイ
さらにまた、診断方法は、ヌクレオリンの表面発現を通常の方法におけるよりも早期に検出し得ることから、疾病発症の早期段階における腫瘍形成を有するあるいはその発症の危険のある対象者を同定するのに使用し得る。予知アッセイは、有害な腫瘍形成、とりわけ癌の家族歴を有するような、腫瘍形成を有するまたはその発症の危険のある対象者を同定するのに使用し得る。そのような個々人の同定方法は、対象者から得られた試験検体およびヌクレオリンの細胞表面局在化についての試験を含むであろう。
もう1つの実施態様においては、原形質膜ヌクレオリンの検出およびその後のヌクレオリン量の定性または定量いずれかの評価(通常、結合ヌクレオリン分子から発生したシグナルにより間接的に)は、原形質膜ヌクレオリンレベルが細胞増殖速度に相関することから、細胞増殖速度を指標し得る。
【0033】
キット
ヌクレオリンプローブおよび検出試薬を実施用の使用説明書と一緒に含むキット、容器、パックまたはディスペンサーを組立て得る。キットとして供給する場合、各種構成成分は、別々の容器内に包装し、使用直前に混合し得る。そのような各構成成分の別々の包装は、活性成分の機能を喪失することなく長期の保存を可能にする。
また、キットは、診断試験のような特定の試験の実施を容易にする別々の容器において各試薬を含む。例えば、非ヌクレオリン結合性GRO類は内部陰性対照用に供給し得、あるいはヌクレオリンとヌクレオリン結合性試薬は内部陽性対照用に供給する。キットの構成成分は、ヌクレオリンについて精査するための抗-ヌクレオリン因子、対照検体、および任意構成成分としてヌクレオリン検出のための組成物である。抗-ヌクレオリン因子の例としては、抗-ヌクレオリン抗体(例えば、表1に示しているような)またはそのフラグメントがある;標識化されている場合、ヌクレオリン結合用検出試薬は不要である。ヌクレオリン結合性オリゴヌクレオチド(例えば、表2に示すような)は、第2標識化試薬(ビオチンのような)が結合し得るように誘導し得る。しかしながら、標識化GRO核酸を使用する場合は、第2標識化試薬は不要である。検出試薬の例としては、標識化二次抗体、例えば、ロバ中で産生させ、その後ローダミンのような蛍光体で標識化した抗-マウスpAb、またはGRO類のようなオリゴヌクレオチド類を検出するための標識化試薬、例えば、プローブをビオチン化した場合のホースラディッシュペルオキシダーゼに結合させたアビジンまたはストレプタビジンがある。対照構成成分としては、二次抗体を産生させた動物からの正常血清;ヌクレオリンポリペプチドまたはヌクレオリン結合性オリゴヌクレオチドを含有する溶液;ヌクレオリン結合性試薬の反応性をアッセイするためのヌクレオリンたんぱく質のドットブロット;または原形質膜中でヌクレオリンを発現する固定化または保存細胞がある。他の構成成分としては、緩衝液、固定剤、ブロッキング用溶液、顕微鏡スライドおよび/またはカバースリップ、またはマイクロタイタープレートのような分析用の他の適切な基体;清浄剤、清浄剤溶液または他の細胞抽出試薬;その他の雑試薬、プロテアーゼインヒビター類、各種容器、およびアッセイを容易にするための雑器具および装置がある。
【0034】
(a) 容器または管類
キットに含ませる試薬は、種々の構成成分の寿命が保持され且つ容器材料によって吸着または変化を受けないような任意の種類の容器内で供給し得る。例えば、密閉ガラスアンプルは、凍結乾燥ヌクレオリン結合用試薬(抗-ヌクレオリン抗体またはヌクレオリン結合性オリゴヌクレオチド)または窒素のような中性で非反応性ガス下で包装した緩衝液を含有し得る。アンプルは、ガラス、有機ポリマー(即ち、ポリカーボネート、ポリスチレン等)、セラミック、金属または試薬類を保持するのに典型的に使用される任意の他の材料のような任意の適切な材料からなり得る。適切な容器の他の例は、アンプルと同様な物質から製造した単純なボトル類およびアルミニウムまたは合金のようなホイルライニング内装を有し得る外装材である。他の容器類としては、試験用チューブ、バイアル、フラスコ、ボトル、シリンジ等がある。容器類は、皮下注射針によって刺し通し得るストッパー付きボトルのような滅菌受入れ口を有し得る。他の容器類は、容易に取外し得る膜によって分離され、膜を取外した時に、各成分の混合を可能にする2つの仕切り室を有し得る。取外し可能な膜は、ガラス、プラスチック、ゴム等であり得る。
(b) 説明材料
また、キットは、説明材料と一緒に供給し得る。使用説明は、紙または他の基体上に印刷し得るし、および/またはフロッピー(登録商標)ディスク、CD-ROM、DVD-ROM、DVD、ビデオテープ、オーディオテープ等のような電子読取り可能な媒体として供給し得る。詳細な説明書は、キットに有形に添付しなくてもよい;代りに、使用者をキットの製造業者または販売業者が特定したインターネットウェブサイトに指向させ得るし、あるいは電子メールとして供給してもよい。
以下の実施例は、本発明を具体的に説明するものであり、限定するものではない。
【実施例】
【0035】
実施例
実施例1:細胞中の原形質膜ヌクレオリンの免疫蛍光標識化
本実施例は、核ヌクレオリンまたは原形質膜ヌクレオリンのみを染色する手順を例示する。
細胞系DU145(ヒト前立腺癌)、MDA-MB-231(ヒト乳癌)、HeLa(ヒト子宮頚癌)およびHS27(正常皮膚線維芽球) (いずれもATCCから入手可能;ヴァージニア州マナサッス)からの各細胞を、培養基質からトリプシンによって放出させ、単一細胞として再懸濁させ、顕微鏡スライド上に置いた。細胞で種付けした各スライドを、顕微鏡を使用しての目視検査により検定したときに良好に付着するまで37℃でインキュベートした。付着細胞をPBSで2分間1回洗浄した後、各細胞を4%ホルムアルデヒド/PBS中で少なくとも15分間22℃で固定した。核ヌクレオリン染色のため、各細胞を、抗体と接触させる前に、1%Triton X-100で浸透性化する。PBSで5分/洗浄の2回洗浄後、非特異結合部位を22℃の1%NGS/PBSで15〜60分間遮断し、次いで、1%NGS/PBSまたはPBS/Tween(0.05%〜0.1%)中に希釈したマウス抗-ヌクレオリン抗体と一緒に4℃で1時間〜1夜インキュベートした。各検体をPBSで各5分間4回洗浄し、その後、PBS中に希釈したFITC標識化二次抗体で標識化したヤギ抗-マウスpAbと一緒に22℃で1時間インキュベートした。再びPBSで各5分間4回洗浄後、各検体をMowiol封入剤中に封入し(封入剤は以下のようにして調製した:9ml/グリセリンと3.36gのMowiol 40-88を22℃で1時間攪拌した。その後、9mlの水を加え、攪拌を22℃で2時間続けた。次に、Tris(0.2M、pH 8.5;18ml)を加え、溶液を、固形分が殆ど完全に溶解するまで50℃で6時間インキュベートした。5,000×gで遠心分離した後、液体相を封入に使用した)、顕微鏡観察し、写真撮影した。
図1および2は、各細胞系における核(図1)および原形質膜(図2)ヌクレオリン染色を示す。免疫蛍光顕微鏡写真(図1および2;パネルB、D、F、H)および並行しての位相差顕微鏡写真(図1および2;パネルA、C、E、G)を示しており;DU145細胞はAおよびBに示しており、MDA-MB-231細胞はCおよびDに示しており、HeLa細胞はEおよびFに示しており、HS27細胞はGおよびHに示している。細胞系全てが明白な核ヌクレオリン染色を示している(図1A、1C、1Eおよび1G)。細胞が浸透性化されず、従って、表面原形質膜への抗体受入れを制限した場合、正常皮膚細胞系、HS27は原形質膜染色において完全に陰性であり(図2H)、一方、各癌細胞は強い染色を示している(図2B、2D、2Fおよび2H)ことに注目されたい。このように、原形質膜ヌクレオリンの染色は、核ヌクレオリンまたは銀染色NOR類に比較して診断および予知における優れた方法である。
【0036】
実施例2:原形質膜ヌクレオリン発現度合と癌侵略性との相関
本試験は、高レベルの原形質膜ヌクレオリンを含む細胞系は最も急速な増殖を伴う細胞系に相当することを実証する。
2つの癌細胞系DU145とHeLa、1つの正常細胞系HS27を増殖速度についてアッセイし、比較した。細胞倍増時間は、MTTアッセイ(生存細胞が3-(van de Loosdrecht等、1994年)-2,5-ジフェニルテトラゾリウムブロマイド(MTT)をホルマザンに還元する能力に基づく;(van de Loosdrecht等、1994年))を使用して一定間隔の細胞密度を測定することによって算出し、トリパンブルー除外を使用して細胞数を計数することによって確認する。
図3は、MTTアッセイにより測定したときのDU145(四角)、HeLa(菱形)およびHS27(丸)の比較増殖速度を示す。培養3日まで、増殖速度は同じようであるが、3日より後は、HeLaとDU145は正常HS27細胞よりも速い割合で増加している。MDA-MB-231はこの試験には含まれていないが、増殖速度は、DU145 > MDA-MB-231 > HeLa > HS27であることを測定している。高レベルの原形質膜ヌクレオリンを含む細胞系(図2参照)は、最も速い増殖を示す細胞系(DU145およびHeLa)に相当することに注目されたい。
【0037】
実施例3:パラフィン埋め込み組織切片中のヌクレオリンの免疫蛍光標識化
本実施例は、埋め込まれている固定化検体中のヌクレオリンを検出し局在化させる適切な方法を提示する。
固定化しパラフィンワックス中に埋め込み顕微鏡スライド上に定着させた細胞切片を、3回交換のキシレン(各2分間)中で洗浄してパラフィンを除去し、アルコール勾配(連続で100%、95%および70%;各2分間)中で水和させ、PBS中に5分間置いた。抗原復元には、低温抗原再生法(LTAR;(Shi等、1997年;Shi等、2001年))を使用した:37℃/5%CO2で15分間PBS中に希釈した0.1%トリプシン-EDTA(容量/容量) (Invitrogen社;カリフォルニア州カールズバッド)で消化した後、各検体を脱イオン水で洗浄し、10mMクエン酸塩緩衝液(pH 6)中で2時間80℃でインキュベートした。冷却後、各スライドを脱イオン水、次いでPBSで洗浄した。
非特異結合部位をPBS中3%BSA中での22℃30分のインキュベーションによって遮断した。その後、各検体を、PBS/1%NGS中に希釈した4μg/mlのマウス抗-ヌクレオリンmAb (Santa Cruz社)と一緒に4℃で1夜インキュベートした。その後、各検体を22℃にし、PBSで5分間4回洗浄し、次いで、50μg/mlのAlexa488接合ヤギ抗-マウスIgG (Molecular Probes社;オレゴン州ユージーン)およびPBS/1%NGS中に希釈した2μg/mlのヨウ化プロピジウムと22℃で1時間反応させた。PBSで5分間4回の洗浄後、検体をNowiol封入剤中に封入し、蛍光顕微鏡で観察した。
図4は、そのような試験の結果を示す。頭部および頚部の扁平上皮細胞癌の臨床検体を調製し、原形質膜ヌクレオリンについて精査した。原形質膜ヌクレオリンシグナルは、悪性新生物細胞に局在していた。図4Aは、ヌクレオリンの精査から得られた免疫蛍光シグナルを示しており;核は、DNA介在性染料によって対向染色されている。図4Bは、並行しての位相差顕微鏡写真を示す。図4Cおよび4Dは、染色領域をより一層良好に示すためにマーキングを加えた以外は、図4Aおよび4Bの複製である。領域1においては、シグナルは細胞上で強力であり(図4Aにおける核染色に対しては弱いシグナル);これら細胞は、漫然と組織化された組織中にあり、あまり濃密には詰ってなく、これらの細胞が悪性であることを示唆している。領域2においては、正常細胞(良好に詰った細胞と組織化された組織によって区分けされているような)、即ち、細胞は原形質膜ヌクレオリンシグナルを示していない。
【0038】
実施例4:肺癌細胞中での原形質膜ヌクレオリン発現
本実施例は、肺癌細胞を、原形質膜ヌクレオリンに対する染色によって容易に同定し得ることを実証する。
NCI-H1299 (H.サピエンスリンパ節から分離された非小細胞肺癌;(Giaccone等、1992年;LinおよびChang、1996年))およびNCI-H82 (小細胞肺癌細胞、H.サピエンス、(Carney等、1985年;Little等、1983年;Takahashi等、1989年))の各細胞を、培養基質からトリプシンによって放出させ、単一細胞として再懸濁させ、顕微鏡スライド上に置いた。各細胞を、顕微鏡を使用する目視検査によって検定したときに良好に付着するまで37℃でインキュベートした。各細胞を、PBSで2分間1回洗浄した後、4%ホルムアルデヒド/PBS中で少なくとも15分間22℃で固定した。PBSで5分間/洗浄の2回洗浄後、非特異結合部位を1%NGS/PBSで15〜60分間22℃で遮断し、次いで、マウス抗-ヌクレオリン抗体と一緒に1時間〜1夜4℃でインキュベートした。各検体をPBS各5分間で4回洗浄し、その後、FITC標識化二次抗体で標識化しヨウ化プロピジウム(核染色のための)を含むPBS中に希釈したヤギ抗-マウスpAbと一緒に22℃で1時間インキュベートした。再度の各5分間のPBSによる4回の洗浄後、各検体をMowiol封入剤中に封入し、顕微鏡観察し、写真撮影した。
図5は、上記2つの肺癌細胞系、NCI-H82(図5A;並行しての位相差画像は5Bに示す)およびNCI-H1299(図5C;並行しての位相差画像は5Dに示す)の原形質膜ヌクレオリンについて精査した全体細胞を示す。両細胞系において、原形質膜ヌクレオリン染色は、強力である;良好に染色された細胞の例は、図5Aおよび5Cにおいて星印(*)で示している。
【0039】
実施例5:臨床試験標本の原形質膜ヌクレオリン染色
腫瘍、前悪性および悪性細胞を診断するためのこの新規な原形質膜ヌクレオリンアッセイ方法の実行性を試験するために、健常対象者および癌を患っている対象者からの臨床試験標本を收集した。末梢血、骨髄および腫瘍バイオプシー検体からのサンプルを入手し、実施例4に述べたようにして原形質膜ヌクレオリンに対して染色した。図6は、末梢血(A、B)または骨髄(C、DおよびE、F)の位相差画像(B、D、F)および免疫蛍光画像(A、C、E)を示す。原形質膜ヌクレオリンに対して高度に染色された細胞は、星印(*)でマークしている;これらは、癌腫を患っている患者(A、BおよびC、D)においてのみ観察されるが、健常患者からの細胞は何ら原形質膜ヌクレオリン染色を示していなかった(E,F)。
【0040】
実施例6:(予知) 原形質膜ヌクレオリン発現度合と癌侵略性との相関
殆どAmerican Type Culture Collection (ヴァージニア州マナッサス)から入手し得る33例の肺癌細胞系を分析する。細胞倍増時間は、MTTアッセイを使用して一定間隔の細胞密度を測定することによって算出し、トリパンブルー除外を使用して細胞数を計数することによって確認する。各試験において、HeLa細胞(Gey等、1952年)を内部対象として含ませる。各値は、複製検体の3つによる少なくとも2つ個々の試験から決定する。核および原形質膜ヌクレオリン量を測定するため、2つの方法を実施する。先ず、核および原形質膜抽出物を、開示されている方法(Ausbel等、1987年;Bates等、1999年;Yao等、1996年a)を使用して、各細胞系から調製する。要するに、細胞を採取し、低張緩衝液中に再懸濁させ、次いで、氷上で数分間膨潤させる。細胞をDounceホモジナイザーを使用して分解し、核を遠心分離により集める。核を高塩緩衝液中に再懸濁させて核たんぱく質を抽出する;その後、塩を透析により除去する。原形質膜たんぱく質は、S-100画分から分離し得、サイトソルたんぱく質および他の細胞小器官からサクロース勾配により遠心分離によって分離する。異なる細胞からの核およびPM抽出物を、抗-ヌクレオリン抗体(Santa Cruz社)を使用してのウェスタンブロット分析(Ausubel等、1987年)およびその後の化学発光可視化により分析する。その後、ヌクレオリン量を、X線フィルム上に記録しHeLa抽出物対照の強度に対して標準化した得られたシグナルのデンシトメトリーにより定量する。ヌクレオリン量を測定する2番目の方法は、各細胞系のヌクレオリンについての免疫蛍光精査を含む。各細胞を、陽性対照としてのDU145細胞(Mickey等、1977年;Stone等、1978年)、陰性対照としてのHS27細胞および参照としてのHeLa細胞と並行して、ヌクレオリン表面発現について精査する(図2参照)。各細胞を写真撮影し、シグナルの度合順にランク付けする;また、このシグナルも定量し得るか(画素を定量するソフトウェアと画像を使用するシステムを使用して;この場合、ビデオ画像を使用する)、あるいは定性的に評価し得る。その後、データを統計分析に供して、細胞増殖度(細胞増殖速度が高いほど、癌細胞は侵略性である)とヌクレオリンシグナル強度との相関を全検体に亘ってまた下位集団内で実証する。
【0041】
実施例7:(予知) 肺癌検出
本実施例においては、患者バイオプシー、痰検体および切除肺組織を原形質膜ヌクレオリンについて精査し、これらの結果を、保存記録およびこの試験における定期的臨床検査標本を利用して、肺癌についての他の診断および予知マーカーと比較する。
方法
気管支バイオプシー、痰検体および切除肺組織を含む試験標本を、健常および肺癌を患っている対象者双方のヒト対象者から入手し、各検体をヌクレオリン精査および観察時に、検体起源が未知であるようにコード化する。
その後、免疫組織化学方法を使用してのこれらの検体の精査を実施する。例えば、原形質膜ヌクレオリンは、表1から選択した1種以上の抗-ヌクレオリンAb類、蛍光体標識化二次Abから発生したシグナル、並びに観察および写真撮影した検体によって精査する。適切な対照としては、二次抗体のみによる精査、抗体無しでの精査、免疫前血清のみによる精査、および分析する細胞タイプとは反応しないことが知られている抗体による精査がある。可視化および局在化測定を容易にするためには、細胞をHoechst 33258またはヨウ化プロピジウム(核を可視化するため)によりおよび/または蛍光標識化ファロイジンまたはファリシジン(アクチン細胞骨格を可視化するため)により対向染色する。各検体を観察し、点数付けし(原形質膜ヌクレオリン発現を指標する表面シグナル)、記録する。
【0042】
参考文献





【0043】
以下、本発明の態様を示す。
1.細胞中の原形質膜ヌクレオリンの存在を検出することを特徴とする、細胞の新生物状態の判定方法。
2.細胞が哺乳動物である、上記1記載の方法。
3.細胞が、サル、イヌ、ネコ、ウサギ、ウシ、ブタ、ヤギ、モルモット、マウス、ラットまたはヒツジである、上記2記載の方法。
4.細胞がヒトである、上記3記載の方法。
5.細胞が溶解されている、上記1記載の方法。
6.前記の検出がヌクレオリン・抗-ヌクレオリン因子複合体を検出することを含む、上記1記載の方法。
7.抗-ヌクレオリン因子がヌクレオリンに特異的に結合するモノクローナル抗体である、上記6記載の方法。
8.前記抗体が、p7-1A4マウスモノクローナル抗体、sc-8031、sc-9893、sc-9892、4E2または3G4B2である、上記7記載の方法。
9.前記抗-ヌクレオリン因子がヌクレオリン結合性オリゴヌクレオチドである、上記6記載の方法。
10.前記オリゴヌクレオチドがグアノシンリッチオリゴヌクレオチドである、上記9記載の方法。
11.前記オリゴヌクレオチドが、配列番号1〜7;9〜17;19〜30または31からなる群から選ばれた配列を含む、上記10記載の方法。
12.前記複合体を、蛍光、酵素または放射能を検出することによって検出する、上記6記載の方法。
13.細胞中の原形質膜ヌクレオリンの量を定量することを特徴とする、細胞の新生物状態の判定方法。
14.細胞が哺乳動物である、上記13記載の方法。
15.細胞が、サル、イヌ、ネコ、ウサギ、ウシ、ブタ、ヤギ、モルモット、マウス、ラットまたはヒツジである、上記14記載の方法。
16.細胞がヒトである、上記15記載の方法。
17.細胞が溶解されている、上記13記載の方法。
18.前記の定量がヌクレオリン・抗-ヌクレオリン因子複合体を定量することを含む、上記13記載の方法。
19.抗-ヌクレオリン因子がモノクローナル抗体である、上記18記載の方法。
20.前記抗体が、p7-1A4マウスモノクローナル抗体、sc-8031、sc-9893、sc-9892、4E2または3G4B2である、上記18記載の方法。
21.前記抗-ヌクレオリン因子がヌクレオリン結合性オリゴヌクレオチドである、上記18記載の方法。
22.前記オリゴヌクレオチドがグアノシンリッチオリゴヌクレオチドである、上記21記載の方法。
23.前記オリゴヌクレオチドが、配列番号1〜7;9〜17;19〜30または31からなる群から選ばれた配列を含む、上記22記載の方法。
24.前記複合体を、蛍光、酵素または放射能を定量することによって定量する、上記23記載の方法。
25.抗-ヌクレオリン因子と対照検体を含む、細胞の新生物状態判定用のキット。
26.ヌクレオリン・抗-ヌクレオリン複合体を検出する第2因子をさらに含む、上記25記載のキット。
27.前記抗-ヌクレオリン因子が抗-ヌクレオリン抗体であり、前記第2因子が標識化二次抗体である、上記26記載のキット。
28.前記標識が酵素、蛍光体、放射性同位元素または金粒子の少なくとも1つである、上記27記載のキット。
29.前記抗-ヌクレオリン因子がビオチンを含み、前記第2因子がアビジンまたはストレプタビジンを含む、上記28記載のキット。
30.前記抗-ヌクレオリン因子がジゴキシゲニンを含み、前記第2因子が標識化抗-ジゴキシゲニン抗体を含む、上記28記載のキット。
31.固定剤、緩衝液、プラスチック容器、血清、血清アルブミン、無脂肪乳、膜および使用説明書からなる群から選ばれた少なくとも1つをさらに含む、上記25記載のキット。
32.前記抗-ヌクレオリン因子が標識化されている、上記25記載のキット。
33.前記標識が酵素、蛍光体、放射性同位元素または金粒子の少なくとも1つである、上記32記載のキット。
34.肺細胞を含む対象者からの検体を採取し;細胞表面のヌクレオリンの存在を検出することを特徴とする、対象者の小肺細胞癌腫の検出方法。
35.前記検体が痰である、上記34記載の方法。
36.対象者がヒトである、上記34記載の方法。
37.肺細胞を含む対象者からの検体を採取し;検体を検査センターに送り;細胞の新生物状態を上記1記載の方法によって判定することを特徴とする、前悪性または悪性細胞の診断方法。
38.対象者がヒトである、上記38記載の方法。
39.前記検体が痰である、上記39記載の方法。
40.前記診断が肺小細胞癌腫の診断である、上記39記載の方法。
【特許請求の範囲】
【請求項1】
抗ヌクレオリンモノクローナル抗体及び調剤学的に許容される担体を含有する、哺乳類において癌を治療するための組成物。
【請求項2】
抗ヌクレオリンモノクローナル抗体が、毒素に結合している、請求項1の組成物。
【請求項3】
哺乳類がヒトである、請求項1又は2の組成物。
【請求項4】
哺乳類において癌を治療する医薬を調製するための、抗ヌクレオリンモノクローナル抗体及び調剤学上許容される担体の使用。
【請求項5】
抗ヌクレオリンモノクローナル抗体が、毒素に結合している、請求項4の使用。
【請求項6】
哺乳類がヒトである、請求項4又は5の使用。
【請求項7】
抗ヌクレオリンモノクローナル抗体が、原形質膜ヌクレオリン発現性細胞を標的とする請求項4の使用。
【請求項8】
癌が腫瘍を含む、請求項4の使用。
【請求項9】
抗ヌクレオリンモノクローナル抗体が、原形質膜ヌクレオリン発現細胞を標的として、これを排除する、請求項7又は8の使用。
【請求項1】
抗ヌクレオリンモノクローナル抗体及び調剤学的に許容される担体を含有する、哺乳類において癌を治療するための組成物。
【請求項2】
抗ヌクレオリンモノクローナル抗体が、毒素に結合している、請求項1の組成物。
【請求項3】
哺乳類がヒトである、請求項1又は2の組成物。
【請求項4】
哺乳類において癌を治療する医薬を調製するための、抗ヌクレオリンモノクローナル抗体及び調剤学上許容される担体の使用。
【請求項5】
抗ヌクレオリンモノクローナル抗体が、毒素に結合している、請求項4の使用。
【請求項6】
哺乳類がヒトである、請求項4又は5の使用。
【請求項7】
抗ヌクレオリンモノクローナル抗体が、原形質膜ヌクレオリン発現性細胞を標的とする請求項4の使用。
【請求項8】
癌が腫瘍を含む、請求項4の使用。
【請求項9】
抗ヌクレオリンモノクローナル抗体が、原形質膜ヌクレオリン発現細胞を標的として、これを排除する、請求項7又は8の使用。
【図3】


【図1】


【図2】


【図4】


【図5】


【図6】




【図1】


【図2】


【図4】


【図5】


【図6】


【公開番号】特開2013−100295(P2013−100295A)
【公開日】平成25年5月23日(2013.5.23)
【国際特許分類】
【出願番号】特願2012−266961(P2012−266961)
【出願日】平成24年12月6日(2012.12.6)
【分割の表示】特願2011−127396(P2011−127396)の分割
【原出願日】平成15年4月8日(2003.4.8)
【出願人】(504378135)ユニヴァーシティ オブ ルイスヴィル リサーチ ファウンデイション インコーポレイテッド (2)
【Fターム(参考)】
【公開日】平成25年5月23日(2013.5.23)
【国際特許分類】
【出願日】平成24年12月6日(2012.12.6)
【分割の表示】特願2011−127396(P2011−127396)の分割
【原出願日】平成15年4月8日(2003.4.8)
【出願人】(504378135)ユニヴァーシティ オブ ルイスヴィル リサーチ ファウンデイション インコーポレイテッド (2)
【Fターム(参考)】
[ Back to top ]

