情報取得方法
【課題】生体組織および細胞等を含む検体中に含まれる対象物質を高感度に検出して、この対象物質の二次元分布情報を精度良く取得する方法を提供する。
【解決手段】(1)基板上に規則的に設けた複数の突起物上に、検体を固定化する工程と、(2)固定化した検体上に試薬を滴下することにより、検体から下記工程(3)の質量分析法で分析可能な対象物質を生じさせる工程と、(3)質量分析法により、対象物質を測定する工程と、を有することを特徴とする情報取得方法。
【解決手段】(1)基板上に規則的に設けた複数の突起物上に、検体を固定化する工程と、(2)固定化した検体上に試薬を滴下することにより、検体から下記工程(3)の質量分析法で分析可能な対象物質を生じさせる工程と、(3)質量分析法により、対象物質を測定する工程と、を有することを特徴とする情報取得方法。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、生体組織、細胞等の検体の情報取得方法に関するものである。
【背景技術】
【0002】
近年のゲノム(genome)解析の進展により、生体内に存在する遺伝子産物であるタンパク質の解析の重要性が急速にクローズアップされてきている。従来から、タンパク質の発現及び機能解析の重要性が指摘されており、その解析手法の開発が進められている。これらの手法は、(1)二次元電気泳動や高速液体クロマトグラフ(HPLC)による分離精製と、(2)放射線分析、光学的分析、質量分析等の検出系、の組み合わせを基本としている。
【0003】
タンパク質解析技術の基盤はプロテオーム(proteome)解析と呼ばれるもので、これは遺伝子(gene)から作り出され実際に生体内で働いているタンパク質を解析するものである。このプロテオーム解析は、細胞の機能や疾患の原因を究明することを目的としている。その代表的な解析手法としては、下記第一の方法と、非特許文献1(磯辺俊明、高橋信弘編「実験医学別冊 プロテオーム解析」、羊土社、2000年)に記載の第二の方法を挙げることができる。
【0004】
第一の方法:
(1)対象とする生体組織や細胞からのタンパク質の抽出。
(2)二次元電気泳動によるタンパク質の分離。
(3)MALDI法(マトリクス支援レーザー脱離−飛行時間型質量分析法:MALDI−TOFMS)などの質量分析によるタンパク質又はその断片の分析。
(4)ゲノムプロジェクトなどのデータベースを利用したタンパク質の同定。
【0005】
第二の方法:
(1)対象とする生体組織や細胞からのタンパク質の抽出。
(2)抽出したタンパク質の消化(または変性)。
(3)液体クロマトグラフ(LC)とイオントラップ型質量分析計(Ion−trap MS)を組み合わせたシステムを用いた上記消化(または変性)タンパク質の分析。
(4)データベースの構築及びタンパク質の同定。
【0006】
これらのプロテオーム解析により、癌を例に挙げれば、再発や転移に関わるタンパク質が明らかになりつつあるなど、既に成果が出始めている。例えば、このプロテオーム解析を用いることにより、癌細胞など特定の病変細胞の中に含まれるタンパク質、又は癌細胞に隣接する細胞中に含まれるタンパク質、さらにはその両者を同定することが可能となる。この結果、診断デバイスや創薬(薬剤候補スクリーニング)デバイスの開発に寄与できることになる。また、プロテオーム解析では、原理的には、初期の癌細胞や癌組織について、転移や再発に関わるタンパク質の有無を直接、調べることが可能になり、新たな予後診断方法にもなり得る。
【0007】
一方、特許文献1及び2(特許第3658397号明細書、特開2006−010658号公報)に記載のように、本願発明者は以前に、飛行時間型二次イオン質量分析法(以下、「TOF−SIMS法」と略す)を用いた情報取得手法を提案した。この手法では、インクジェット法などを用い、イオン化促進物質及び/又は消化酵素を、上記のプロテインチップや生体組織切片に付与する。そして、TOF−SIMS法により、タンパク質の種類に関する情報(消化酵素により限定分解されたペプチドの情報を含む)を、位置情報を保持したまま可視化するというものである。
【0008】
また、本願発明者は、更に上記手法を発展させた手法・装置を提案した。すなわち、本願発明者は、特許文献3(特開2006−153493号公報)に記載のように、分析で使用する水溶液のpHを工夫した手法を提案した。また、本願発明者は、特許文献4(特開2006−184197号公報)に記載のように、細胞内代謝物質を検出するための工夫をした手法を提案した。更に、特許文献5(特開2006−201149号公報)に記載のように、電気泳動法や薄層クロマトグラフィーなどの分離精製手法を併用してタンパク質の識別能を高めた手法を提案した。
【0009】
また、従来から、TOF−SIMS法において、検出感度を向上させる方法として金属微粒子を使用する方法が提案されている。例えば、非特許文献2(A. Marcus and N. Winograd, Anal. Chem., 78, 141−148 (2006).)には、金や銀のナノ粒子をサブモノレイヤー程度、サンプル表面に成膜(deposition)することでTOF−SIMSの検出感度が向上することが報告されている。また、非特許文献3(Y. P. Kim et al., Anal. Chem., 78, 1913−1920 (2006).)には、金ナノ粒子上に配置したペプチド分子の、TOF−SIMS法におけるイオン化効率が、金ナノ粒子の効果により向上することを報告されている。また、非特許文献4(S. G. Ostrowski et al., “Single−Cell Level Mass Spectrometric Imaging”, Dekker Encyclopedia of Nanoscience and Nanotechnology, pages 1−11 (2006).)には、個々の細胞を対象としたSIMS分析の例が開示されている。
【非特許文献1】磯辺俊明、高橋信弘編「実験医学別冊 プロテオーム解析」、羊土社、2000年
【非特許文献2】A. Marcus and N. Winograd, Anal. Chem., 78, 141−148 (2006).
【非特許文献3】Y. P. Kim et al., Anal. Chem., 78, 1913−1920 (2006).
【非特許文献4】S. G. Ostrowski et al., “Single−Cell Level Mass Spectrometric Imaging”, Dekker Encyclopedia of Nanoscience and Nanotechnology, pages 1−11 (2006).
【特許文献1】特許第3658397号明細書
【特許文献2】特開2006−010658号公報
【特許文献3】特開2006−153493号公報
【特許文献4】特開2006−184197号公報
【特許文献5】特開2006−201149号公報
【発明の開示】
【発明が解決しようとする課題】
【0010】
しかしながら、従来のプロテオーム解析は、特定の生体組織や体液、血液などを対象としたものであり、大きさが10〜数10μm径の細胞を直接、対象としたものではなかった。
【0011】
一方、本願発明者が提案した情報取得方法は、細胞レベルでのタンパク質に関する情報(消化酵素により限定分解されたペプチドの情報を含む)を取得できる。しかし、検体の種類・測定条件によっては、その検出感度が十分でない場合があった。
【0012】
また、非特許文献4に記載の方法では、SIMS法における空間分解能を高めることで質量情報を用いた細胞レベルのイメージングを可能としたが、質量/電荷(m/z)比の上限が500程度という制限があった。すなわち、特許文献2に記載の本願発明者が提案した、消化分解ペプチドからの分解前のタンパク質の決定方法では、「m/z比が500〜5000程度の特徴的なフラグメントイオン」を検出していた。しかしながら、非特許文献4に記載の方法では質量/電荷(m/z)比が約500以下であるため、特許文献2に記載の方法に有効に適用することができなかった。
【0013】
更に、非特許文献2及び3には、金ナノ粒子を共存させる(成膜させるか、又は被検出分子の下部に配置する)ことが、TOF−SIMS法の検出感度を向上させることが開示されている。しかしながら、これらの方法は、モデル系のサンプルを対象としたものであるため、検出感度及び位置情報保持の点から、これらの方法を生体組織や細胞を含む検体中のタンパク質イメージングに適用することは難しかった。
【課題を解決するための手段】
【0014】
上記課題を解決するため、本発明は、以下の構成を有することを特徴とする。
1.(1)基板上に規則的に設けた複数の突起物上に、検体を固定化する工程と、
(2)固定化した前記検体上に試薬を滴下することにより、前記検体から下記工程(3)の質量分析法で分析可能な対象物質を生じさせる工程と、
(3)質量分析法により、前記対象物質を測定する工程と、
を有することを特徴とする情報取得方法。
【0015】
2.前記検体が、生体組織、細胞及び細胞の一部からなる群から選択された少なくとも一種であることを特徴とする上記1に記載の情報取得方法。
3.前記対象物質が、タンパク質及びペプチドの少なくとも一方であることを特徴とする上記1又は2に記載の情報取得方法。
【0016】
4.全ての前記突起物の表面が、導電性物質で被覆されていることを特徴とする上記1から3の何れか1項に記載の情報取得方法。
5.全ての前記突起物が、導電性物質からなることを特徴とする上記1から3の何れか1項に記載の情報取得方法。
【0017】
6.前記導電性物質が、金又は銀であることを特徴とする上記4又は5に記載の情報取得方法。
7.前記突起物の相当直径が、10nm以上、1000nm以下であることを特徴とする上記1から6の何れか1項に記載の情報取得方法。
【0018】
8.前記突起物間のピッチ幅が、10nm以上、1000nm以下であることを特徴とする上記1から7の何れか1項に記載の情報取得方法。
9.前記工程(1)と(2)の間に更に、前記突起物上に固定化した検体を光学的に検出して、前記基板上の検体の位置を測定する位置測定工程を有し、
前記工程(2)において、前記位置測定工程により測定した前記検体の位置情報を元にして、前記検体上に試薬を滴下することを特徴とする上記1から8の何れか1項に記載の情報取得方法。
【0019】
10.前記工程(3)において、
前記質量分析法が、飛行時間型二次イオン質量分析法であることを特徴とする上記1から9の何れか1項に記載の情報取得方法。
11.前記工程(3)において、
前記質量分析法により、前記基板上の、前記対象物質の二次元分布情報を得ることを特徴とする上記1から10の何れか1項に記載の情報取得方法。
【発明の効果】
【0020】
本発明では、検体中の生体組織及び細胞等に含まれるタンパク質等の対象物質を高感度で同定し、対象物質の情報を精度良く取得することができる。
【発明を実施するための最良の形態】
【0021】
本発明の情報取得方法は、以下の工程を有する。
(1)基板上に規則的に設けた複数の突起物上に、検体を固定化する工程。
(2)固定化した検体上に試薬を滴下することにより、検体から下記工程(3)の質量分析法で分析可能な対象物質を生じさせる工程。
(3)質量分析法により、対象物質を測定する工程。
【0022】
本発明では、工程(1)で突起物上に検体が固定化されているため、工程(3)で質量分析法を実施する際には、電界が突起物の先端で局所化して増幅されている。また、工程(2)では、試薬を用いて検体から、工程(3)の質量分析法で分析可能な対象物質を生じさせている。従って、高感度で対象物質の測定を行うことができる。なお、「工程(3)の質量分析法で分析可能な対象物質」とは、質量分析法で分析可能な質量/電荷(m/z)比である500以上、2000以下の対象物質を表す。
以下、各工程について詳細に説明する。
【0023】
工程(1)
本発明の方法では、工程(1)でまず、複数の突起物を設けた基板を準備する。この「基板」とは平板状のものであり、一方の面上には複数の突起物が設けられている。なお、「突起物」とは、基板の表面からその上方に突出した微少な突起状のものを表し、全ての突起物は基板表面から同じ高さとなっている。突起物の最上部は基板の表面と平行な面を有し、この平行な面上に検体を固定化することが可能なようになっている。
【0024】
突起物の最上部(基板の表面と平行な面)の形状は、検体の固定化が可能なものであれば、特に限定されない。典型的には、突起物の最上部の形状は、円形、四角形、n角形、その他、直線・曲線で表される形状を有している。また、この突起物は基板上に規則的に設けられている。なお、「規則的」とは、突起物間が一定の間隔となるように、基板上に配置されていることを表す。
【0025】
また、本発明の突起物は、下記(A)又は(B)の構成を有することが好ましい。
(A)全ての突起物の表面が、導電性物質で被覆されている。
(B)全ての突起物が、導電性物質からなる。
上記(A)又は(B)の構成を有することによって、突起物先端での電界の局所化及び増幅の程度をより大きくでき、測定感度をより向上させることができる。
【0026】
更に、上記(A)又は(B)の場合、導電性物質として、金又は銀を用いることが好ましい。金又は銀を用いることによって、より高精度・高感度な対象物質の測定が可能となる。
【0027】
また、突起物の高さは10nm以上が好ましく、その相当直径と高さの比であるアスペクト比は1以上が好ましい。なお、「突起物の高さ」とは、基板表面からその上方に向かって、突起物の最上部(基板表面に平行な面)までの長さを表す。例えば、図2では、この「突起物の高さ」は、符号7で表される。
【0028】
突起物の相当直径及びピッチ幅は特に限定されるわけではなく、基板上の測定を行う部分の面積、及び分析者が所望する空間分解能により適宜、選択することができる。
ただ、生体組織においてμmオーダーの細胞1個又は複数個をイメージングする場合、μmオーダーの空間分解能でイメージを取得することが好ましい。このような場合には、突起物の相当直径が10nm以上、100nm以下であることが好ましい。また、突起物間のピッチ幅が、10nm以上、1000nm以下であることが好ましい。
【0029】
なお、「突起物の相当直径」とは、突起物の基板表面に平行な断面の直径を表す。なお、一つの突起物は、どの高さで見た断面(基板表面に平行な面)も同一形状・面積となるように構成されているため、突起物の相当直径を測定する際には、突起物の基板表面に平行などの断面を測定しても良い。また、この断面形状が円形以外の形状の場合は、円相当径(その断面の断面積と同じ面積の円を想定した場合の、その円の直径を「円相当径」とする)を測定する。例えば、図2では、この「突起物の相当直径」は、符号5で表される。
【0030】
なお、「突起物のピッチ幅」とは、互いに隣同士となる第1の突起物の断面の重心と、第2の突起物の断面の重心の間の距離を表す。この場合、第1と第2の突起物の断面は共に、基板表面から同じ高さの断面を表す。例えば、図2では、この「突起物のピッチ幅」は、符号6で表される。
【0031】
また、この工程(1)では、突起物の最上部(基板表面に平行な表面)上に検体が固定化されることとなる。この突起物上に検体を固定化する方法としては、生体組織より検体を切り出すために用いる凍結ミクロトーム内に、予め突起物の基板を設置する。そして、ミクロトームにより切断された検体を先端の鋭利なもの(例えば睫毛など)を用いて端をすくい上げ、突起物上に分析面が上になるよう付着させるなどの方法を挙げることができる。
【0032】
検体の種類は特に限定されるわけではないが、生体組織、細胞及び細胞の一部からなる群から選択された少なくとも一種であることが好ましい。生体組織、細胞及び細胞の一部は、適切な試薬を選択することにより所定の質量/電荷(m/z)比の対象物質を分解、遊離させることが容易であり、質量分析法により高精度で測定を行うことができる。
【0033】
工程(2)
次に、工程(2)では、固定化した検体上に試薬を滴下することにより、検体から工程(3)の質量分析法で分析可能な対象物質を生じさせる。なお、この試薬の滴下方法としては、インクジェット法を挙げることができる。インクジェット法は、微小な試薬の液滴を目的の位置に高精度で滴下させることができる。
【0034】
また、「工程(3)の質量分析法で分析可能な対象物質」とは、検体から質量分析が可能な、質量/電荷(m/z)比が500以上、2000以下の対象物質を表す。
【0035】
工程(2)で使用する試薬の種類は、固定化した検体・対象物質の種類、及び対象物質の質量/電荷(m/z)比に応じて適宜、選択し、分析感度を向上できるものであれば、特に限定されない。典型的には、検体上に試薬を滴下(付与)することによって、検体の一部を分解して対象物質を生じさせるか、又は検体内から対象物質を遊離させることができる。なお、予め予備試験を行って、試薬の種類・使用量と検体から生じる対象物質の質量/電荷(m/z)比を調べても良い。
【0036】
例えば、検体として生体組織、細胞及び細胞の一部を用いた場合には、試薬としてタンパク質分解酵素(消化酵素)、及びイオン化を促進させるイオン化促進物質の少なくとも一方を用いることができる。イオン化促進物質としては、MALDIで利用するマトリックス剤や、金(Au)又は銀(Ag)を含む水溶液、並びに酸を含むpH6以下の水溶液などを挙げることができる。これらの試薬を用いることにより、生体組織、細胞及び細胞の少なくとも一部を分解又は遊離させて、対象物質としてタンパク質及びペプチドの少なくとも一方を生じさせることができる。
【0037】
工程(3)
次に、工程(3)では、質量分析法により、工程(2)で検体の分解、又は検体からの遊離によって生じた対象物質を測定する。この際、本発明では、突起物を設けた基板を用いるため、基板と質量分析装置との間の電界が突起物の先端に局所化されており、分析感度が飛躍的に向上する。このため、通常の質量分析法のオペレーションを実施することにより、高感度な二次イオンの検出が可能となり、結果的に高感度で対象物質を測定することができる。なお、この質量分析法としては特に限定されるわけではない。
【0038】
例えば、質量分析法を行う質量分析装置は一般的に、試料のイオン化を行う試料導入部と、イオン化した試料を分析する分析部とを有し、この分析部の方式によって様々な質量分析法に分類できる。
【0039】
ここで、試料導入部でのイオン化の方法としては、以下の方法を挙げることができる。
・一次イオンを用いる方法。
・FAB(Fast Atom Bombardment、高速原子衝突)法。
・MALDI(Matrix Assisted Laser Desorption Ionization、マトリックス支援レーザー脱離イオン化)法。
【0040】
ここで、FAB法とは、試料をマトリックスに混ぜ、ここに高速で中性原子を衝突させてイオン化する方法である。
また、MALDI法とは、試料をマトリックス中に混ぜて結晶を作り、これにレーザーを照射することでイオン化する方法である。
【0041】
また、分析部の方式としては、以下の方法を挙げることができる。
(a)四重極型。
(b)磁場偏向型。
(c)フーリエ変換イオンサイクロトロン共鳴型。
(d)イオントラップ型。
(e)飛行時間型二次イオン質量分析(TOF−SIMS)型。
(f)タンデム型。
【0042】
ここで、(a)四重極型とは、イオンを4本の電極内に通し、電極に高周波電圧を印加することで試料に摂動をかけて、目的とするイオンのみを通過させる分析法である。
(b)磁場偏向型とは、イオンを磁場中に通し、その際に受けるローレンツ力による飛行経路の変化を利用する分析法である。
(c)フーリエ変換イオンサイクロトロン共鳴型では、イオンを静電場と静磁場のかかったセルに導入し、イオン運動を励起するための高周波電圧を印加してイオンの周回周期を検出する。そして、サイクロトロン条件から質量を算出する分析法である。
(d)イオントラップ型とは、イオンを電極からなるトラップ室に保持し、この電位を変化させることで選択的にイオンを放出することで分離を行う分析法である。
また、(f)タンデム型は、上記の分析法を複数組み合わせる方法である。
【0043】
上記の何れの質量分析法を用いた場合であっても、本発明では工程(2)で質量分析に好適な対象物質が調整されているため、高精度で対象物質(検体)の測定を行うことができる。
【0044】
好ましくは、イオン化に一次イオンを用いる、(e)飛行時間型二次イオン質量分析法(TOF−SIMS法)を使用するのが良い。このTOF−SIMS法は、質量分析法の中でも微量な試料を高精度で測定できる方法である。また、一次イオンをパルス状に試料表面に照射することによって、試料のイオン化を行うため、試料へのダメージを少なくすることができ、目的の対象物質の分布情報を高精度で正確に得ることができる。
【0045】
TOF−SIMS法では、試料のイオン化は一次イオンを照射することによって行う。この一次イオン種としては、イオン化効率、質量分解能等の観点からGa+などの一般的な液体金属イオンの他、Au3+やBi3+などのクラスターイオンを用いることができる。なお、Biイオンを用いると、極めて高感度の分析が可能となる点で好ましい。その際、Biイオンのみならず、ビスマスの多原子イオンである、Bi2イオン、Bi3イオンを用いることができ、この順で感度が上昇する場合が多く、金の多原子イオンの利用はさらに好ましい形態となる。
【0046】
このTOF−SIMS法では、一次イオンの入射により、対象物質の表面から二次イオンが発生する。ここで、TOF−SIMS法の分析中は、対象物質と飛行時間型二次イオン質量分析計との間に数kVの電界がかけられており、二次イオンはこの電界により検出器へ取り込まれて分析される。
【0047】
TOF−SIMSを用いてイメージングを行う場合には、質量分解能、分析面積、測定条件の一次イオンパルス周波数、一次イオンビームエネルギー、一次イオンパルス幅等の条件が、イメージング能力と密接に関係している。このため、好ましい分析条件は一義的には簡単に決まらない。しかしながら、分析可能であるという観点から、前記測定条件の各設定値はある範囲であることが必要となる。
【0048】
これらの観点から、本発明では、一次イオンビームパルス周波数は1kHz〜50kHzの範囲であることが好ましい。また、一次イオンビームエネルギーは、12keV〜25keVの範囲であること、さらには、一次イオンビームパルス幅は0.5ns〜10nsの範囲であることが好ましい。
【0049】
また、対象物質の二次元分布情報を得るための、一次イオンビームによるスキャンのエリアは他の要因と関係するので一義的には決まらないが、50μm×50μm〜500μm×500μmの範囲に選択することが好ましい。
【0050】
本発明では、工程(1)と(2)の間に更に、突起物上に固定化した検体を光学的に検出して、基板上の検体の位置を測定する位置測定工程を有することが好ましい。また、この場合、工程(2)において、位置測定工程により測定した検体の位置情報を元にして、検体上に試薬を滴下することが好ましい。この場合、位置測定工程によって検体の位置を正確に把握することにより、工程(2)で目的となる検体上に正確・効率的に試薬を滴下(付与)することが可能となる。
【0051】
なお、上記位置測定工程としては例えば、下記(I)又は(II)の方法を挙げることができる。
(I)光学的な検出を行う検出手段として光学顕微鏡を用いる。そして、検体を固定化した基板を設置したプレートを手動で動かしながら、検体の位置をxy座標上の点として記録することにより、基板上の検体の位置を測定する。
(II)まず、光学顕微鏡観察により、検体を固定化した基板のデジタル画像を得る。次に、このデジタル画像のコントラスト差等により基板上の検体を自動的に検出できるように設定する。そして、このようにして設定した条件に従って、基板上の検体の位置をxy座標の点として記録する。
【0052】
なお、上記方法を用いることにより、基板上の検体の位置だけでなく、突起物の最上部(基板表面と平行な断面)の面積を正確に測定することができる。このため、この断面積の測定結果から突起物の相当直径及びピッチ幅を正確に測定できる。そして、この測定した相当直径及びピッチ幅が分析に適していない場合、好適な相当直径及びピッチ幅の突起物を設けた基板に交換することができる。
【0053】
本発明では、質量分析法により、基板上の、対象物質の二次元分布情報を得ることが好ましい。すなわち、この方法では、本発明の工程(1)及び(2)の処理を行った基板上の検体上を二次元状に走査しながら質量分析を行う。これにより、この基板上の位置毎の二次イオンの質量情報を得ることができ、この質量情報により検体から生じた対象物質を識別して、対象物質の二次元分布情報を得ることができる。
【実施例】
【0054】
(実施例1)
以下に、病変組織切片サンプルにおける病変細胞を検体に用いた場合の、TOF−SIMS法による測定例を示す。
なお、この検体は病変組織切片であり、冷凍下でミクロトームにより薄片化されたものである。
【0055】
まず、複数の突起物を規則的に設けた基板として、石英製ナノプリント用モールド(NIM−100D RESO(商品名);NTTアドバンステクノロジー株式会社製)を用いた。この突起物の相当直径は100nm、ピッチ幅は200nmであり、突起物の基板表面からの高さは100nmである。
【0056】
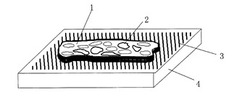
この基板を、アセトン、エタノール及び脱イオン水の順で洗浄した後、十分に乾燥した。次に、このように清浄した基板及び突起物の表面に、金を20nm、成膜した。次に、前記のように薄片化された切片を、図1に示すように、基板の突起物上に固定化した(工程(1))。この際、切片をヒトの睫毛により端からすくい上げ、ミクロトーム内に予め設置した基板の突起物上に、分析面が上になるよう付着させることにより固定した。
【0057】
図2は、図1の基板の突起物上に固定化した切片の一部を表す断面図である。なお、図1及び図2において、1は病変組織切片(検体)、2は該病変組織切片(検体)内の細胞、3は突起物、4は基板、5は突起物の相当直径、6は突起物のピッチ幅、7は突起物の高さを表す。
【0058】
本実施例では、上記のように基板上に固定化した切片を光学顕微鏡により観察して、図3に示すデジタル画像を得た。なお、図3において、8は病変組織切片、9は該病変組織切片内の細胞を示している。このようにして得られたデジタル画像のコントラスト差から、図4に示すように、分析目的とする細胞を自動認識して、細胞の輪郭及び中心点のxy座標を記録した。なお、図4において、9は分析対象となる病変細胞、10はこの病変細胞の中心点を示している。
【0059】
次に、上記のようにして認識された位置に存在する細胞に対して、インクジェット法により、試薬を滴下(付与)した。なお、この際、試薬を付与する位置は、図4の中心点10として認識した位置、又は位置10の所定範囲の近傍とすることができる。なお、インクジェット法による試薬の付与には、市販のCANON社製 バブルジェットプリンタPIXUS990i(商品名)を使用した。このプリンタに装備されているプリントヘッドより吐出される液滴(試薬)1滴中に含まれる水溶液量は4plとなる。
【0060】
まず、この試薬には、第1の試薬として、消化酵素トリプシンを0.4Mに希釈した水溶液を用い、これをプリンタのインクタンクに充填した。なお、試薬には、後のTOF−SIMS分析により検出可能な質量/電荷(m/z)比となるように、この消化酵素(試薬)には目的細胞中に含まれるタンパク質をペプチドに分解することが可能なものを用いた。すなわち、上記消化酵素により分解されたペプチドの質量/電荷(m/z)比は、500〜2000の範囲となり、TOF−SIMS法による分析が可能となる。上記のようにしてインクジェット法により消化酵素の付与処理を行った後、室温、湿度80%下で30分間、保持した。
【0061】
次に、インクジェット法により、第2の試薬として、トリフルオロ酢酸(TFA)0.1質量%水溶液(イオン化促進物質)を目的細胞(検体)上に付与した。なお、この際の付与条件は、消化酵素を付与した際の条件と同様とした。このように、イオン化促進物質の付与を行った後、室温、湿度80%下で30分間、保持した。そして、この処理により検体から対象物質としてペプチドを生じさせた(工程(2))。
【0062】
次に、上記処理を施した切片を基板ごと取り出してTOF−SIMS分析を実施した(工程(3))。このTOF−SIMS分析には、ION TOF社製 TOF−SIMS V型装置(商品名)を用いた。また、TOF−SIMS分析時には、基板と飛行時間型質量分析計の二次イオン取り込み口との間に2kVの電界を印加した。
【0063】
上記TOF−SIMS分析により得られた、病変組織切片の病変細胞内に存在する特定タンパク質由来のペプチドのイメージを図5に示す。なお、図5において、11がペプチド(対象物質)を示す。
【0064】
このように、本実施例では、突起物を有する基板を使用することで、ペプチドの位置情報、及びこれに基づく特定タンパク質の二次元分布情報を精度良く得ることができた。
【0065】
(比較例1)
以下に、病変組織切片サンプルにおける病変細胞について、平坦基板を用いたときの、TOF−SIMS法によるイメージング検出例を示す。
検体としては、実施例1と同様、冷凍下でミクロトームにより薄片化した病変組織切片を用いた。また、基板としては、不純物を含まないシリコン(Si)をアセトン、エタノール、脱イオン水の順で洗浄し、乾燥させたものに、金(Au)を20nm、成膜させたものを用いた。
【0066】
次に、上記病変細胞を含む切片を、基板上に配置した。
次に、実施例1と同様にして、光学顕微鏡観察、分析目的細胞の自動認識、試薬による前処理及びTOF−SIMS分析を行った。このようにして得た病変細胞に存在する特定タンパク質由来のペプチドのイメージを、図6に示す。
【0067】
(実施例1と比較例1の評価)
図5の突起物を有する基板を使用した場合と、図6の平坦基板を使用した場合とを比較すると、前者のほうがより明瞭なイメージとなっていることが分かる。この理由は、平坦基板では基板表面に一様に電界が分布しているのに対して、突起物を有する基板では電界が突起物先端において局所化することで増幅されるためと考えられる。すわなち、同じ質量分析条件とした場合であっても、突起物を設けた基板を用いると、突起物先端で増幅された局所電界によりスパッタリングで発生する中性分子への電荷移動又は二次イオンの表面からの脱離が促進される。このため、平坦基板を用いるよりも突起物を設けた基板を用いた方が、二次イオン検出感度が向上したものと考えられる。
【0068】
また、このとき、検体と突起物との接触面が均一に分布しており、かつ相当直径及びピッチ幅が小さいため、装置本来の空間分解能を損なわずにイメージングが可能となる。
【0069】
以上のように、実施例1及び比較例1により、突起物を有する基板の使用により、病変細胞に存在する特定タンパク質の二次元分布状態に関する情報を、より正確に得られることが確認できた。
【図面の簡単な説明】
【0070】
【図1】本発明の情報取得方法の一例において、基板の突起物上に病変細胞切片が固定化された状態を表す図である。
【図2】図1の、基板の突起物上に病変細胞切片が固定化された状態の一部を表す図である。
【図3】本発明の情報取得方法の一例において、検体(病変細胞)を光学的に観察して自動的に認識した像を表す図である。
【図4】本発明の情報取得方法の一例において、インクジェット法により、病変細胞に試薬を付与する着弾中心点を表す概念図である。
【図5】本発明の情報取得方法の一例により得られた、病変細胞に含まれるタンパク質由来のペプチドのTOF−SIMSイメージを表す図である。
【図6】従来の情報取得方法の一例により得られた、病変細胞に含まれるタンパク質由来のペプチドのTOF−SIMSイメージを表す図である。
【符号の説明】
【0071】
1 検体
2 検体内の細胞
3 突起物
4 基板
5 突起物の相当直径
6 突起物のピッチ幅
7 突起物の高さ
8 検体
9 病変細胞
10 病変細胞の中心点
11 ペプチド
【技術分野】
【0001】
本発明は、生体組織、細胞等の検体の情報取得方法に関するものである。
【背景技術】
【0002】
近年のゲノム(genome)解析の進展により、生体内に存在する遺伝子産物であるタンパク質の解析の重要性が急速にクローズアップされてきている。従来から、タンパク質の発現及び機能解析の重要性が指摘されており、その解析手法の開発が進められている。これらの手法は、(1)二次元電気泳動や高速液体クロマトグラフ(HPLC)による分離精製と、(2)放射線分析、光学的分析、質量分析等の検出系、の組み合わせを基本としている。
【0003】
タンパク質解析技術の基盤はプロテオーム(proteome)解析と呼ばれるもので、これは遺伝子(gene)から作り出され実際に生体内で働いているタンパク質を解析するものである。このプロテオーム解析は、細胞の機能や疾患の原因を究明することを目的としている。その代表的な解析手法としては、下記第一の方法と、非特許文献1(磯辺俊明、高橋信弘編「実験医学別冊 プロテオーム解析」、羊土社、2000年)に記載の第二の方法を挙げることができる。
【0004】
第一の方法:
(1)対象とする生体組織や細胞からのタンパク質の抽出。
(2)二次元電気泳動によるタンパク質の分離。
(3)MALDI法(マトリクス支援レーザー脱離−飛行時間型質量分析法:MALDI−TOFMS)などの質量分析によるタンパク質又はその断片の分析。
(4)ゲノムプロジェクトなどのデータベースを利用したタンパク質の同定。
【0005】
第二の方法:
(1)対象とする生体組織や細胞からのタンパク質の抽出。
(2)抽出したタンパク質の消化(または変性)。
(3)液体クロマトグラフ(LC)とイオントラップ型質量分析計(Ion−trap MS)を組み合わせたシステムを用いた上記消化(または変性)タンパク質の分析。
(4)データベースの構築及びタンパク質の同定。
【0006】
これらのプロテオーム解析により、癌を例に挙げれば、再発や転移に関わるタンパク質が明らかになりつつあるなど、既に成果が出始めている。例えば、このプロテオーム解析を用いることにより、癌細胞など特定の病変細胞の中に含まれるタンパク質、又は癌細胞に隣接する細胞中に含まれるタンパク質、さらにはその両者を同定することが可能となる。この結果、診断デバイスや創薬(薬剤候補スクリーニング)デバイスの開発に寄与できることになる。また、プロテオーム解析では、原理的には、初期の癌細胞や癌組織について、転移や再発に関わるタンパク質の有無を直接、調べることが可能になり、新たな予後診断方法にもなり得る。
【0007】
一方、特許文献1及び2(特許第3658397号明細書、特開2006−010658号公報)に記載のように、本願発明者は以前に、飛行時間型二次イオン質量分析法(以下、「TOF−SIMS法」と略す)を用いた情報取得手法を提案した。この手法では、インクジェット法などを用い、イオン化促進物質及び/又は消化酵素を、上記のプロテインチップや生体組織切片に付与する。そして、TOF−SIMS法により、タンパク質の種類に関する情報(消化酵素により限定分解されたペプチドの情報を含む)を、位置情報を保持したまま可視化するというものである。
【0008】
また、本願発明者は、更に上記手法を発展させた手法・装置を提案した。すなわち、本願発明者は、特許文献3(特開2006−153493号公報)に記載のように、分析で使用する水溶液のpHを工夫した手法を提案した。また、本願発明者は、特許文献4(特開2006−184197号公報)に記載のように、細胞内代謝物質を検出するための工夫をした手法を提案した。更に、特許文献5(特開2006−201149号公報)に記載のように、電気泳動法や薄層クロマトグラフィーなどの分離精製手法を併用してタンパク質の識別能を高めた手法を提案した。
【0009】
また、従来から、TOF−SIMS法において、検出感度を向上させる方法として金属微粒子を使用する方法が提案されている。例えば、非特許文献2(A. Marcus and N. Winograd, Anal. Chem., 78, 141−148 (2006).)には、金や銀のナノ粒子をサブモノレイヤー程度、サンプル表面に成膜(deposition)することでTOF−SIMSの検出感度が向上することが報告されている。また、非特許文献3(Y. P. Kim et al., Anal. Chem., 78, 1913−1920 (2006).)には、金ナノ粒子上に配置したペプチド分子の、TOF−SIMS法におけるイオン化効率が、金ナノ粒子の効果により向上することを報告されている。また、非特許文献4(S. G. Ostrowski et al., “Single−Cell Level Mass Spectrometric Imaging”, Dekker Encyclopedia of Nanoscience and Nanotechnology, pages 1−11 (2006).)には、個々の細胞を対象としたSIMS分析の例が開示されている。
【非特許文献1】磯辺俊明、高橋信弘編「実験医学別冊 プロテオーム解析」、羊土社、2000年
【非特許文献2】A. Marcus and N. Winograd, Anal. Chem., 78, 141−148 (2006).
【非特許文献3】Y. P. Kim et al., Anal. Chem., 78, 1913−1920 (2006).
【非特許文献4】S. G. Ostrowski et al., “Single−Cell Level Mass Spectrometric Imaging”, Dekker Encyclopedia of Nanoscience and Nanotechnology, pages 1−11 (2006).
【特許文献1】特許第3658397号明細書
【特許文献2】特開2006−010658号公報
【特許文献3】特開2006−153493号公報
【特許文献4】特開2006−184197号公報
【特許文献5】特開2006−201149号公報
【発明の開示】
【発明が解決しようとする課題】
【0010】
しかしながら、従来のプロテオーム解析は、特定の生体組織や体液、血液などを対象としたものであり、大きさが10〜数10μm径の細胞を直接、対象としたものではなかった。
【0011】
一方、本願発明者が提案した情報取得方法は、細胞レベルでのタンパク質に関する情報(消化酵素により限定分解されたペプチドの情報を含む)を取得できる。しかし、検体の種類・測定条件によっては、その検出感度が十分でない場合があった。
【0012】
また、非特許文献4に記載の方法では、SIMS法における空間分解能を高めることで質量情報を用いた細胞レベルのイメージングを可能としたが、質量/電荷(m/z)比の上限が500程度という制限があった。すなわち、特許文献2に記載の本願発明者が提案した、消化分解ペプチドからの分解前のタンパク質の決定方法では、「m/z比が500〜5000程度の特徴的なフラグメントイオン」を検出していた。しかしながら、非特許文献4に記載の方法では質量/電荷(m/z)比が約500以下であるため、特許文献2に記載の方法に有効に適用することができなかった。
【0013】
更に、非特許文献2及び3には、金ナノ粒子を共存させる(成膜させるか、又は被検出分子の下部に配置する)ことが、TOF−SIMS法の検出感度を向上させることが開示されている。しかしながら、これらの方法は、モデル系のサンプルを対象としたものであるため、検出感度及び位置情報保持の点から、これらの方法を生体組織や細胞を含む検体中のタンパク質イメージングに適用することは難しかった。
【課題を解決するための手段】
【0014】
上記課題を解決するため、本発明は、以下の構成を有することを特徴とする。
1.(1)基板上に規則的に設けた複数の突起物上に、検体を固定化する工程と、
(2)固定化した前記検体上に試薬を滴下することにより、前記検体から下記工程(3)の質量分析法で分析可能な対象物質を生じさせる工程と、
(3)質量分析法により、前記対象物質を測定する工程と、
を有することを特徴とする情報取得方法。
【0015】
2.前記検体が、生体組織、細胞及び細胞の一部からなる群から選択された少なくとも一種であることを特徴とする上記1に記載の情報取得方法。
3.前記対象物質が、タンパク質及びペプチドの少なくとも一方であることを特徴とする上記1又は2に記載の情報取得方法。
【0016】
4.全ての前記突起物の表面が、導電性物質で被覆されていることを特徴とする上記1から3の何れか1項に記載の情報取得方法。
5.全ての前記突起物が、導電性物質からなることを特徴とする上記1から3の何れか1項に記載の情報取得方法。
【0017】
6.前記導電性物質が、金又は銀であることを特徴とする上記4又は5に記載の情報取得方法。
7.前記突起物の相当直径が、10nm以上、1000nm以下であることを特徴とする上記1から6の何れか1項に記載の情報取得方法。
【0018】
8.前記突起物間のピッチ幅が、10nm以上、1000nm以下であることを特徴とする上記1から7の何れか1項に記載の情報取得方法。
9.前記工程(1)と(2)の間に更に、前記突起物上に固定化した検体を光学的に検出して、前記基板上の検体の位置を測定する位置測定工程を有し、
前記工程(2)において、前記位置測定工程により測定した前記検体の位置情報を元にして、前記検体上に試薬を滴下することを特徴とする上記1から8の何れか1項に記載の情報取得方法。
【0019】
10.前記工程(3)において、
前記質量分析法が、飛行時間型二次イオン質量分析法であることを特徴とする上記1から9の何れか1項に記載の情報取得方法。
11.前記工程(3)において、
前記質量分析法により、前記基板上の、前記対象物質の二次元分布情報を得ることを特徴とする上記1から10の何れか1項に記載の情報取得方法。
【発明の効果】
【0020】
本発明では、検体中の生体組織及び細胞等に含まれるタンパク質等の対象物質を高感度で同定し、対象物質の情報を精度良く取得することができる。
【発明を実施するための最良の形態】
【0021】
本発明の情報取得方法は、以下の工程を有する。
(1)基板上に規則的に設けた複数の突起物上に、検体を固定化する工程。
(2)固定化した検体上に試薬を滴下することにより、検体から下記工程(3)の質量分析法で分析可能な対象物質を生じさせる工程。
(3)質量分析法により、対象物質を測定する工程。
【0022】
本発明では、工程(1)で突起物上に検体が固定化されているため、工程(3)で質量分析法を実施する際には、電界が突起物の先端で局所化して増幅されている。また、工程(2)では、試薬を用いて検体から、工程(3)の質量分析法で分析可能な対象物質を生じさせている。従って、高感度で対象物質の測定を行うことができる。なお、「工程(3)の質量分析法で分析可能な対象物質」とは、質量分析法で分析可能な質量/電荷(m/z)比である500以上、2000以下の対象物質を表す。
以下、各工程について詳細に説明する。
【0023】
工程(1)
本発明の方法では、工程(1)でまず、複数の突起物を設けた基板を準備する。この「基板」とは平板状のものであり、一方の面上には複数の突起物が設けられている。なお、「突起物」とは、基板の表面からその上方に突出した微少な突起状のものを表し、全ての突起物は基板表面から同じ高さとなっている。突起物の最上部は基板の表面と平行な面を有し、この平行な面上に検体を固定化することが可能なようになっている。
【0024】
突起物の最上部(基板の表面と平行な面)の形状は、検体の固定化が可能なものであれば、特に限定されない。典型的には、突起物の最上部の形状は、円形、四角形、n角形、その他、直線・曲線で表される形状を有している。また、この突起物は基板上に規則的に設けられている。なお、「規則的」とは、突起物間が一定の間隔となるように、基板上に配置されていることを表す。
【0025】
また、本発明の突起物は、下記(A)又は(B)の構成を有することが好ましい。
(A)全ての突起物の表面が、導電性物質で被覆されている。
(B)全ての突起物が、導電性物質からなる。
上記(A)又は(B)の構成を有することによって、突起物先端での電界の局所化及び増幅の程度をより大きくでき、測定感度をより向上させることができる。
【0026】
更に、上記(A)又は(B)の場合、導電性物質として、金又は銀を用いることが好ましい。金又は銀を用いることによって、より高精度・高感度な対象物質の測定が可能となる。
【0027】
また、突起物の高さは10nm以上が好ましく、その相当直径と高さの比であるアスペクト比は1以上が好ましい。なお、「突起物の高さ」とは、基板表面からその上方に向かって、突起物の最上部(基板表面に平行な面)までの長さを表す。例えば、図2では、この「突起物の高さ」は、符号7で表される。
【0028】
突起物の相当直径及びピッチ幅は特に限定されるわけではなく、基板上の測定を行う部分の面積、及び分析者が所望する空間分解能により適宜、選択することができる。
ただ、生体組織においてμmオーダーの細胞1個又は複数個をイメージングする場合、μmオーダーの空間分解能でイメージを取得することが好ましい。このような場合には、突起物の相当直径が10nm以上、100nm以下であることが好ましい。また、突起物間のピッチ幅が、10nm以上、1000nm以下であることが好ましい。
【0029】
なお、「突起物の相当直径」とは、突起物の基板表面に平行な断面の直径を表す。なお、一つの突起物は、どの高さで見た断面(基板表面に平行な面)も同一形状・面積となるように構成されているため、突起物の相当直径を測定する際には、突起物の基板表面に平行などの断面を測定しても良い。また、この断面形状が円形以外の形状の場合は、円相当径(その断面の断面積と同じ面積の円を想定した場合の、その円の直径を「円相当径」とする)を測定する。例えば、図2では、この「突起物の相当直径」は、符号5で表される。
【0030】
なお、「突起物のピッチ幅」とは、互いに隣同士となる第1の突起物の断面の重心と、第2の突起物の断面の重心の間の距離を表す。この場合、第1と第2の突起物の断面は共に、基板表面から同じ高さの断面を表す。例えば、図2では、この「突起物のピッチ幅」は、符号6で表される。
【0031】
また、この工程(1)では、突起物の最上部(基板表面に平行な表面)上に検体が固定化されることとなる。この突起物上に検体を固定化する方法としては、生体組織より検体を切り出すために用いる凍結ミクロトーム内に、予め突起物の基板を設置する。そして、ミクロトームにより切断された検体を先端の鋭利なもの(例えば睫毛など)を用いて端をすくい上げ、突起物上に分析面が上になるよう付着させるなどの方法を挙げることができる。
【0032】
検体の種類は特に限定されるわけではないが、生体組織、細胞及び細胞の一部からなる群から選択された少なくとも一種であることが好ましい。生体組織、細胞及び細胞の一部は、適切な試薬を選択することにより所定の質量/電荷(m/z)比の対象物質を分解、遊離させることが容易であり、質量分析法により高精度で測定を行うことができる。
【0033】
工程(2)
次に、工程(2)では、固定化した検体上に試薬を滴下することにより、検体から工程(3)の質量分析法で分析可能な対象物質を生じさせる。なお、この試薬の滴下方法としては、インクジェット法を挙げることができる。インクジェット法は、微小な試薬の液滴を目的の位置に高精度で滴下させることができる。
【0034】
また、「工程(3)の質量分析法で分析可能な対象物質」とは、検体から質量分析が可能な、質量/電荷(m/z)比が500以上、2000以下の対象物質を表す。
【0035】
工程(2)で使用する試薬の種類は、固定化した検体・対象物質の種類、及び対象物質の質量/電荷(m/z)比に応じて適宜、選択し、分析感度を向上できるものであれば、特に限定されない。典型的には、検体上に試薬を滴下(付与)することによって、検体の一部を分解して対象物質を生じさせるか、又は検体内から対象物質を遊離させることができる。なお、予め予備試験を行って、試薬の種類・使用量と検体から生じる対象物質の質量/電荷(m/z)比を調べても良い。
【0036】
例えば、検体として生体組織、細胞及び細胞の一部を用いた場合には、試薬としてタンパク質分解酵素(消化酵素)、及びイオン化を促進させるイオン化促進物質の少なくとも一方を用いることができる。イオン化促進物質としては、MALDIで利用するマトリックス剤や、金(Au)又は銀(Ag)を含む水溶液、並びに酸を含むpH6以下の水溶液などを挙げることができる。これらの試薬を用いることにより、生体組織、細胞及び細胞の少なくとも一部を分解又は遊離させて、対象物質としてタンパク質及びペプチドの少なくとも一方を生じさせることができる。
【0037】
工程(3)
次に、工程(3)では、質量分析法により、工程(2)で検体の分解、又は検体からの遊離によって生じた対象物質を測定する。この際、本発明では、突起物を設けた基板を用いるため、基板と質量分析装置との間の電界が突起物の先端に局所化されており、分析感度が飛躍的に向上する。このため、通常の質量分析法のオペレーションを実施することにより、高感度な二次イオンの検出が可能となり、結果的に高感度で対象物質を測定することができる。なお、この質量分析法としては特に限定されるわけではない。
【0038】
例えば、質量分析法を行う質量分析装置は一般的に、試料のイオン化を行う試料導入部と、イオン化した試料を分析する分析部とを有し、この分析部の方式によって様々な質量分析法に分類できる。
【0039】
ここで、試料導入部でのイオン化の方法としては、以下の方法を挙げることができる。
・一次イオンを用いる方法。
・FAB(Fast Atom Bombardment、高速原子衝突)法。
・MALDI(Matrix Assisted Laser Desorption Ionization、マトリックス支援レーザー脱離イオン化)法。
【0040】
ここで、FAB法とは、試料をマトリックスに混ぜ、ここに高速で中性原子を衝突させてイオン化する方法である。
また、MALDI法とは、試料をマトリックス中に混ぜて結晶を作り、これにレーザーを照射することでイオン化する方法である。
【0041】
また、分析部の方式としては、以下の方法を挙げることができる。
(a)四重極型。
(b)磁場偏向型。
(c)フーリエ変換イオンサイクロトロン共鳴型。
(d)イオントラップ型。
(e)飛行時間型二次イオン質量分析(TOF−SIMS)型。
(f)タンデム型。
【0042】
ここで、(a)四重極型とは、イオンを4本の電極内に通し、電極に高周波電圧を印加することで試料に摂動をかけて、目的とするイオンのみを通過させる分析法である。
(b)磁場偏向型とは、イオンを磁場中に通し、その際に受けるローレンツ力による飛行経路の変化を利用する分析法である。
(c)フーリエ変換イオンサイクロトロン共鳴型では、イオンを静電場と静磁場のかかったセルに導入し、イオン運動を励起するための高周波電圧を印加してイオンの周回周期を検出する。そして、サイクロトロン条件から質量を算出する分析法である。
(d)イオントラップ型とは、イオンを電極からなるトラップ室に保持し、この電位を変化させることで選択的にイオンを放出することで分離を行う分析法である。
また、(f)タンデム型は、上記の分析法を複数組み合わせる方法である。
【0043】
上記の何れの質量分析法を用いた場合であっても、本発明では工程(2)で質量分析に好適な対象物質が調整されているため、高精度で対象物質(検体)の測定を行うことができる。
【0044】
好ましくは、イオン化に一次イオンを用いる、(e)飛行時間型二次イオン質量分析法(TOF−SIMS法)を使用するのが良い。このTOF−SIMS法は、質量分析法の中でも微量な試料を高精度で測定できる方法である。また、一次イオンをパルス状に試料表面に照射することによって、試料のイオン化を行うため、試料へのダメージを少なくすることができ、目的の対象物質の分布情報を高精度で正確に得ることができる。
【0045】
TOF−SIMS法では、試料のイオン化は一次イオンを照射することによって行う。この一次イオン種としては、イオン化効率、質量分解能等の観点からGa+などの一般的な液体金属イオンの他、Au3+やBi3+などのクラスターイオンを用いることができる。なお、Biイオンを用いると、極めて高感度の分析が可能となる点で好ましい。その際、Biイオンのみならず、ビスマスの多原子イオンである、Bi2イオン、Bi3イオンを用いることができ、この順で感度が上昇する場合が多く、金の多原子イオンの利用はさらに好ましい形態となる。
【0046】
このTOF−SIMS法では、一次イオンの入射により、対象物質の表面から二次イオンが発生する。ここで、TOF−SIMS法の分析中は、対象物質と飛行時間型二次イオン質量分析計との間に数kVの電界がかけられており、二次イオンはこの電界により検出器へ取り込まれて分析される。
【0047】
TOF−SIMSを用いてイメージングを行う場合には、質量分解能、分析面積、測定条件の一次イオンパルス周波数、一次イオンビームエネルギー、一次イオンパルス幅等の条件が、イメージング能力と密接に関係している。このため、好ましい分析条件は一義的には簡単に決まらない。しかしながら、分析可能であるという観点から、前記測定条件の各設定値はある範囲であることが必要となる。
【0048】
これらの観点から、本発明では、一次イオンビームパルス周波数は1kHz〜50kHzの範囲であることが好ましい。また、一次イオンビームエネルギーは、12keV〜25keVの範囲であること、さらには、一次イオンビームパルス幅は0.5ns〜10nsの範囲であることが好ましい。
【0049】
また、対象物質の二次元分布情報を得るための、一次イオンビームによるスキャンのエリアは他の要因と関係するので一義的には決まらないが、50μm×50μm〜500μm×500μmの範囲に選択することが好ましい。
【0050】
本発明では、工程(1)と(2)の間に更に、突起物上に固定化した検体を光学的に検出して、基板上の検体の位置を測定する位置測定工程を有することが好ましい。また、この場合、工程(2)において、位置測定工程により測定した検体の位置情報を元にして、検体上に試薬を滴下することが好ましい。この場合、位置測定工程によって検体の位置を正確に把握することにより、工程(2)で目的となる検体上に正確・効率的に試薬を滴下(付与)することが可能となる。
【0051】
なお、上記位置測定工程としては例えば、下記(I)又は(II)の方法を挙げることができる。
(I)光学的な検出を行う検出手段として光学顕微鏡を用いる。そして、検体を固定化した基板を設置したプレートを手動で動かしながら、検体の位置をxy座標上の点として記録することにより、基板上の検体の位置を測定する。
(II)まず、光学顕微鏡観察により、検体を固定化した基板のデジタル画像を得る。次に、このデジタル画像のコントラスト差等により基板上の検体を自動的に検出できるように設定する。そして、このようにして設定した条件に従って、基板上の検体の位置をxy座標の点として記録する。
【0052】
なお、上記方法を用いることにより、基板上の検体の位置だけでなく、突起物の最上部(基板表面と平行な断面)の面積を正確に測定することができる。このため、この断面積の測定結果から突起物の相当直径及びピッチ幅を正確に測定できる。そして、この測定した相当直径及びピッチ幅が分析に適していない場合、好適な相当直径及びピッチ幅の突起物を設けた基板に交換することができる。
【0053】
本発明では、質量分析法により、基板上の、対象物質の二次元分布情報を得ることが好ましい。すなわち、この方法では、本発明の工程(1)及び(2)の処理を行った基板上の検体上を二次元状に走査しながら質量分析を行う。これにより、この基板上の位置毎の二次イオンの質量情報を得ることができ、この質量情報により検体から生じた対象物質を識別して、対象物質の二次元分布情報を得ることができる。
【実施例】
【0054】
(実施例1)
以下に、病変組織切片サンプルにおける病変細胞を検体に用いた場合の、TOF−SIMS法による測定例を示す。
なお、この検体は病変組織切片であり、冷凍下でミクロトームにより薄片化されたものである。
【0055】
まず、複数の突起物を規則的に設けた基板として、石英製ナノプリント用モールド(NIM−100D RESO(商品名);NTTアドバンステクノロジー株式会社製)を用いた。この突起物の相当直径は100nm、ピッチ幅は200nmであり、突起物の基板表面からの高さは100nmである。
【0056】
この基板を、アセトン、エタノール及び脱イオン水の順で洗浄した後、十分に乾燥した。次に、このように清浄した基板及び突起物の表面に、金を20nm、成膜した。次に、前記のように薄片化された切片を、図1に示すように、基板の突起物上に固定化した(工程(1))。この際、切片をヒトの睫毛により端からすくい上げ、ミクロトーム内に予め設置した基板の突起物上に、分析面が上になるよう付着させることにより固定した。
【0057】
図2は、図1の基板の突起物上に固定化した切片の一部を表す断面図である。なお、図1及び図2において、1は病変組織切片(検体)、2は該病変組織切片(検体)内の細胞、3は突起物、4は基板、5は突起物の相当直径、6は突起物のピッチ幅、7は突起物の高さを表す。
【0058】
本実施例では、上記のように基板上に固定化した切片を光学顕微鏡により観察して、図3に示すデジタル画像を得た。なお、図3において、8は病変組織切片、9は該病変組織切片内の細胞を示している。このようにして得られたデジタル画像のコントラスト差から、図4に示すように、分析目的とする細胞を自動認識して、細胞の輪郭及び中心点のxy座標を記録した。なお、図4において、9は分析対象となる病変細胞、10はこの病変細胞の中心点を示している。
【0059】
次に、上記のようにして認識された位置に存在する細胞に対して、インクジェット法により、試薬を滴下(付与)した。なお、この際、試薬を付与する位置は、図4の中心点10として認識した位置、又は位置10の所定範囲の近傍とすることができる。なお、インクジェット法による試薬の付与には、市販のCANON社製 バブルジェットプリンタPIXUS990i(商品名)を使用した。このプリンタに装備されているプリントヘッドより吐出される液滴(試薬)1滴中に含まれる水溶液量は4plとなる。
【0060】
まず、この試薬には、第1の試薬として、消化酵素トリプシンを0.4Mに希釈した水溶液を用い、これをプリンタのインクタンクに充填した。なお、試薬には、後のTOF−SIMS分析により検出可能な質量/電荷(m/z)比となるように、この消化酵素(試薬)には目的細胞中に含まれるタンパク質をペプチドに分解することが可能なものを用いた。すなわち、上記消化酵素により分解されたペプチドの質量/電荷(m/z)比は、500〜2000の範囲となり、TOF−SIMS法による分析が可能となる。上記のようにしてインクジェット法により消化酵素の付与処理を行った後、室温、湿度80%下で30分間、保持した。
【0061】
次に、インクジェット法により、第2の試薬として、トリフルオロ酢酸(TFA)0.1質量%水溶液(イオン化促進物質)を目的細胞(検体)上に付与した。なお、この際の付与条件は、消化酵素を付与した際の条件と同様とした。このように、イオン化促進物質の付与を行った後、室温、湿度80%下で30分間、保持した。そして、この処理により検体から対象物質としてペプチドを生じさせた(工程(2))。
【0062】
次に、上記処理を施した切片を基板ごと取り出してTOF−SIMS分析を実施した(工程(3))。このTOF−SIMS分析には、ION TOF社製 TOF−SIMS V型装置(商品名)を用いた。また、TOF−SIMS分析時には、基板と飛行時間型質量分析計の二次イオン取り込み口との間に2kVの電界を印加した。
【0063】
上記TOF−SIMS分析により得られた、病変組織切片の病変細胞内に存在する特定タンパク質由来のペプチドのイメージを図5に示す。なお、図5において、11がペプチド(対象物質)を示す。
【0064】
このように、本実施例では、突起物を有する基板を使用することで、ペプチドの位置情報、及びこれに基づく特定タンパク質の二次元分布情報を精度良く得ることができた。
【0065】
(比較例1)
以下に、病変組織切片サンプルにおける病変細胞について、平坦基板を用いたときの、TOF−SIMS法によるイメージング検出例を示す。
検体としては、実施例1と同様、冷凍下でミクロトームにより薄片化した病変組織切片を用いた。また、基板としては、不純物を含まないシリコン(Si)をアセトン、エタノール、脱イオン水の順で洗浄し、乾燥させたものに、金(Au)を20nm、成膜させたものを用いた。
【0066】
次に、上記病変細胞を含む切片を、基板上に配置した。
次に、実施例1と同様にして、光学顕微鏡観察、分析目的細胞の自動認識、試薬による前処理及びTOF−SIMS分析を行った。このようにして得た病変細胞に存在する特定タンパク質由来のペプチドのイメージを、図6に示す。
【0067】
(実施例1と比較例1の評価)
図5の突起物を有する基板を使用した場合と、図6の平坦基板を使用した場合とを比較すると、前者のほうがより明瞭なイメージとなっていることが分かる。この理由は、平坦基板では基板表面に一様に電界が分布しているのに対して、突起物を有する基板では電界が突起物先端において局所化することで増幅されるためと考えられる。すわなち、同じ質量分析条件とした場合であっても、突起物を設けた基板を用いると、突起物先端で増幅された局所電界によりスパッタリングで発生する中性分子への電荷移動又は二次イオンの表面からの脱離が促進される。このため、平坦基板を用いるよりも突起物を設けた基板を用いた方が、二次イオン検出感度が向上したものと考えられる。
【0068】
また、このとき、検体と突起物との接触面が均一に分布しており、かつ相当直径及びピッチ幅が小さいため、装置本来の空間分解能を損なわずにイメージングが可能となる。
【0069】
以上のように、実施例1及び比較例1により、突起物を有する基板の使用により、病変細胞に存在する特定タンパク質の二次元分布状態に関する情報を、より正確に得られることが確認できた。
【図面の簡単な説明】
【0070】
【図1】本発明の情報取得方法の一例において、基板の突起物上に病変細胞切片が固定化された状態を表す図である。
【図2】図1の、基板の突起物上に病変細胞切片が固定化された状態の一部を表す図である。
【図3】本発明の情報取得方法の一例において、検体(病変細胞)を光学的に観察して自動的に認識した像を表す図である。
【図4】本発明の情報取得方法の一例において、インクジェット法により、病変細胞に試薬を付与する着弾中心点を表す概念図である。
【図5】本発明の情報取得方法の一例により得られた、病変細胞に含まれるタンパク質由来のペプチドのTOF−SIMSイメージを表す図である。
【図6】従来の情報取得方法の一例により得られた、病変細胞に含まれるタンパク質由来のペプチドのTOF−SIMSイメージを表す図である。
【符号の説明】
【0071】
1 検体
2 検体内の細胞
3 突起物
4 基板
5 突起物の相当直径
6 突起物のピッチ幅
7 突起物の高さ
8 検体
9 病変細胞
10 病変細胞の中心点
11 ペプチド
【特許請求の範囲】
【請求項1】
(1)基板上に規則的に設けた複数の突起物上に、検体を固定化する工程と、
(2)固定化した前記検体上に試薬を滴下することにより、前記検体から下記工程(3)の質量分析法で分析可能な対象物質を生じさせる工程と、
(3)質量分析法により、前記対象物質を測定する工程と、
を有することを特徴とする情報取得方法。
【請求項2】
前記検体が、生体組織、細胞及び細胞の一部からなる群から選択された少なくとも一種であることを特徴とする請求項1に記載の情報取得方法。
【請求項3】
前記対象物質が、タンパク質及びペプチドの少なくとも一方であることを特徴とする請求項1又は2に記載の情報取得方法。
【請求項4】
全ての前記突起物の表面が、導電性物質で被覆されていることを特徴とする請求項1から3の何れか1項に記載の情報取得方法。
【請求項5】
全ての前記突起物が、導電性物質からなることを特徴とする請求項1から3の何れか1項に記載の情報取得方法。
【請求項6】
前記導電性物質が、金又は銀であることを特徴とする請求項4又は5に記載の情報取得方法。
【請求項7】
前記突起物の相当直径が、10nm以上、1000nm以下であることを特徴とする請求項1から6の何れか1項に記載の情報取得方法。
【請求項8】
前記突起物間のピッチ幅が、10nm以上、1000nm以下であることを特徴とする請求項1から7の何れか1項に記載の情報取得方法。
【請求項9】
前記工程(1)と(2)の間に更に、前記突起物上に固定化した検体を光学的に検出して、前記基板上の検体の位置を測定する位置測定工程を有し、
前記工程(2)において、前記位置測定工程により測定した前記検体の位置情報を元にして、前記検体上に試薬を滴下することを特徴とする請求項1から8の何れか1項に記載の情報取得方法。
【請求項10】
前記工程(3)において、
前記質量分析法が、飛行時間型二次イオン質量分析法であることを特徴とする請求項1から9の何れか1項に記載の情報取得方法。
【請求項11】
前記工程(3)において、
前記質量分析法により、前記基板上の、前記対象物質の二次元分布情報を得ることを特徴とする請求項1から10の何れか1項に記載の情報取得方法。
【請求項1】
(1)基板上に規則的に設けた複数の突起物上に、検体を固定化する工程と、
(2)固定化した前記検体上に試薬を滴下することにより、前記検体から下記工程(3)の質量分析法で分析可能な対象物質を生じさせる工程と、
(3)質量分析法により、前記対象物質を測定する工程と、
を有することを特徴とする情報取得方法。
【請求項2】
前記検体が、生体組織、細胞及び細胞の一部からなる群から選択された少なくとも一種であることを特徴とする請求項1に記載の情報取得方法。
【請求項3】
前記対象物質が、タンパク質及びペプチドの少なくとも一方であることを特徴とする請求項1又は2に記載の情報取得方法。
【請求項4】
全ての前記突起物の表面が、導電性物質で被覆されていることを特徴とする請求項1から3の何れか1項に記載の情報取得方法。
【請求項5】
全ての前記突起物が、導電性物質からなることを特徴とする請求項1から3の何れか1項に記載の情報取得方法。
【請求項6】
前記導電性物質が、金又は銀であることを特徴とする請求項4又は5に記載の情報取得方法。
【請求項7】
前記突起物の相当直径が、10nm以上、1000nm以下であることを特徴とする請求項1から6の何れか1項に記載の情報取得方法。
【請求項8】
前記突起物間のピッチ幅が、10nm以上、1000nm以下であることを特徴とする請求項1から7の何れか1項に記載の情報取得方法。
【請求項9】
前記工程(1)と(2)の間に更に、前記突起物上に固定化した検体を光学的に検出して、前記基板上の検体の位置を測定する位置測定工程を有し、
前記工程(2)において、前記位置測定工程により測定した前記検体の位置情報を元にして、前記検体上に試薬を滴下することを特徴とする請求項1から8の何れか1項に記載の情報取得方法。
【請求項10】
前記工程(3)において、
前記質量分析法が、飛行時間型二次イオン質量分析法であることを特徴とする請求項1から9の何れか1項に記載の情報取得方法。
【請求項11】
前記工程(3)において、
前記質量分析法により、前記基板上の、前記対象物質の二次元分布情報を得ることを特徴とする請求項1から10の何れか1項に記載の情報取得方法。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】




【図2】


【図3】


【図4】


【図5】


【図6】


【公開番号】特開2008−304366(P2008−304366A)
【公開日】平成20年12月18日(2008.12.18)
【国際特許分類】
【出願番号】特願2007−152736(P2007−152736)
【出願日】平成19年6月8日(2007.6.8)
【出願人】(000001007)キヤノン株式会社 (59,756)
【Fターム(参考)】
【公開日】平成20年12月18日(2008.12.18)
【国際特許分類】
【出願日】平成19年6月8日(2007.6.8)
【出願人】(000001007)キヤノン株式会社 (59,756)
【Fターム(参考)】
[ Back to top ]

